— гемоглобин, его типы — Биохимия
Гемоглобин входит в состав группы белков гемопротеины, которые сами являются подвидом хромопротеинов и подразделяются на неферментативные белки (гемоглобин, миоглобин) и ферменты (цитохромы, каталаза, пероксидаза). Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
Строение гемоглобина
Строение гемоглобина А
Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями, при этом они взаимодействуют не произвольно, а определенным участком – контактной поверхностью. Этот процесс высокоспецифичен, контакт происходит одновременно в десятках точек по принципу комплементарности. Взаимодействие осуществляют разноименно заряженные группы, гидрофобные участки, неровности на поверхности белка.
Белковые субъединицы в нормальном гемоглобине могут быть представлены различными типами полипептидных цепей: α, β, γ, δ, ε, ξ (соответственно, греч. — альфа, бета, гамма, дельта, эпсилон, кси). В состав молекулы гемоглобина входят по две цепи двух разных типов.
Гем соединяется с белковой субъединицей, во-первых, через остаток гистидина координационной связью железа, во-вторых, через гидрофобные связи пиррольных колец и гидрофобных аминокислот. Гем располагается как бы «в кармане» своей цепи и формируется гемсодержащий протомер.
Нормальные формы гемоглобина
Существует несколько нормальных вариантов гемоглобина:
- HbР (primitive) – примитивный гемоглобин, содержит 2ξ- и 2ε-цепи, встречается в эмбрионе между 7-12 неделями жизни,
- HbF (foetal) – фетальный гемоглобин, содержит 2α- и 2γ-цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев,
- HbA (adult) – гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина,
- HbA2 – гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи,
- HbO2 – оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98% от всего количества гемоглобина,
- HbCO2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
Патологические формы гемоглобина
HbS – гемоглобин серповидно-клеточной анемии.
MetHb – метгемоглобин, форма гемоглобина, включающая трехвалентный ион железа вместо двухвалентного. Такая форма образуется спонтанно, при взаимодействии молекулы O2 и гемового Fe2+, но обычно ферментативных мощностей клетки хватает на его восстановление. При использовании сульфаниламидов, употреблении нитрита натрия и нитратов пищевых продуктов, при недостаточности аскорбиновой кислоты ускоряется переход Fe
Hb-CO – карбоксигемоглобин, образуется при наличии СО (угарный газ) во вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях, но его доля может колебаться от условий и образа жизни.
Угарный газ является активным ингибитором гем-содержащих ферментов, в частности, цитохромоксидазы, 4-го комплекса дыхательной цепи.
Карбоксигемоглобин присутствует и в норме в количестве 0,5-1,5%, в сельской местности меньше, чем в городе. У курильщиков концентрация Hb-CO возрастает, в зависимости от количества сигарет в день, до 8-9%.
HbA1С – гликозилированный гемоглобин. Концентрация его нарастает при хронической гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени (время жизни эритроцита, 3-4 месяца).
Биохимия форменных элементов крови.
1.Эритроцит:особенности структуры,химического состава мембраны и цитозоля,функции.





2.Особенности метаболизма веществ в эритроците:обмен метгемоглобина,связь с гликолизом.
MetHb – метгемоглобин, форма гемоглобина, включающая трехвалентный ион железа вместо двухвалентного. Такая форма образуется спонтанно, при взаимодействии молекулы O2 и гемового Fe2+, но обычно ферментативных мощностей клетки хватает на его восстановление. При использовании сульфаниламидов, употреблении нитрита натрия и нитратов пищевых продуктов, при недостаточности аскорбиновой кислоты ускоряется переход Fe2+ в Fe3+. Образующийся metHb не способен связывать кислород и возникает гипоксия тканей. Для восстановления Fe3+ в Fe2+ в клинике используют аскорбиновую кислоту и метиленовую синь.
В зрелых эритроцитах углеводы не синтезируются. Катаболизм углеводов происходит на 90% в анаэробном гликолизе и на 10% в ПФШ, основной субстрат – глюкоза. Глюкоза поступает в эритроциты путём облегчённой диффузии с помощью ГЛЮТ-2. Наряду с глюкозой эритроцит может использовать фруктозу, маннозу, галактозу, а также инозин, ксилит и сорбит.
В процессе гликолиза с участием фосфоглицераткиназыипируваткиназыобразуется АТФ, а с участием3-ФГА дегидрогеназывосстанавливается НАДН2. В окислительной стадии ПФШ с участиемглюкозо-6-фосфат дегидрогеназыи6-фосфоглюконат дегидрогеназы восстанавливается НАДФН2.
Конечный продукт анаэробного гликолиза лактат выходит в плазму крови и направляется преимущественно в печень для глюконеогенеза.


3.Механизмы свободно-радикального окисления(сро) и антиоксидантная защита в эритроцитах(аоз).Самый еб*утый вопрос,надеюсь он никому не попадется)

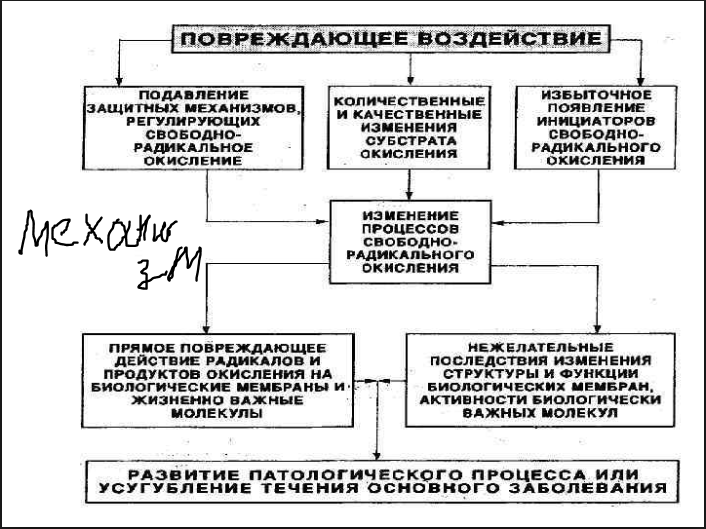
В то же самое время в норме содержание продуктов свободнорадикального окисления невысоко, что достигается существованием постоянно функционирующего в организме комплекса биологических механизмов эндогенной системы антиоксидантной защиты (АОЗ). Эндогенная система антиоксидантной защиты ограничивает процесс свободнорадикального окисления липидов и белков практически во всех его звеньях и поддерживает эти реакции на относительно постоянном уровне. Строгая регламентация реакций свободнорадикального окисления обеспечивается согласованным функционированием ферментативных и неферментативных звеньев эндогенной системы антиоксидантной защиты, контролирующей уровень в организме активных форм кислорода (супероксидный анион-радикал, гидроксильный радикал, синглетный кислород), свободных радикалов и молекулярных продуктов СРО липидов и белков. Функционирующие в каждой клетке, органах, тканях и в организме в целом ферментативные и неферментативные звенья эндогенной системы антиоксидантной защиты играют исключительную роль в поддержании гомеостаза при взаимодействии организма с изменяющимися условиями внешней и внутренней среды для обеспечении его жизнедеятельности.

4.Гемоглобин строение,функции,типы.Талассемии.Миоглобин:строение,функции,отличие от гемоглобина.
Гемоглобин входит в состав группы белков гемопротеины, которые сами являются подвидом хромопротеинов и подразделяются на неферментативные белки (гемоглобин, миоглобин) и ферменты (цитохромы, каталаза, пероксидаза). Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
Строение гемоглобина
Строение гемоглобина А
Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями по принципу комплементарности. При этом они взаимодействуют не произвольно, а определенным участком — контактной поверхностью. Этот процесс высокоспецифичен, контакт происходит одновременно в десятках точек
Белковые субъединицы в нормальном гемоглобине могут быть представлены различными типами полипептидных цепей: α, β, γ, δ, ε, ξ (соответственно, греч. — альфа, бета, гамма, дельта, эпсилон, кси). В состав молекулы гемоглобина входят по две цепи двух разных типов.
Гем соединяется с белковой субъединицей, во-первых, через остаток гистидинакоординационной связью железа, во-вторых, через гидрофобные связи пиррольных колец и гидрофобных аминокислот. Гем располагается как бы «в кармане» своей цепи и формируется гемсодержащий протомер.



Нормальные формы гемоглобина
Существует несколько нормальных вариантов гемоглобина:
HbР – примитивный гемоглобин, содержит 2ξ- и 2ε-цепи, встречается в эмбрионе между 7-12 неделями жизни,
HbF – фетальный гемоглобин, содержит 2α- и 2γ-цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев,
HbA – гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина,
HbA2 – гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи,
HbO2 – оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98% от всего количества гемоглобина,
HbCO2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
Патологические формы гемоглобина
HbS – гемоглобин серповидно-клеточной анемии.
MetHb – метгемоглобин, форма гемоглобина, включающая трехвалентный ион железа вместо двухвалентного. Такая форма образуется спонтанно, при взаимодействии молекулы O2 и гемового Fe2+, но обычно ферментативных мощностей клетки хватает на его восстановление. При использовании сульфаниламидов, употреблении нитрита натрия и нитратов пищевых продуктов, при недостаточности аскорбиновой кислоты ускоряется переход Fe2+ в Fe3+. Образующийся metHb не способен связывать кислород и возникает гипоксия тканей. Для восстановления Fe3+ в Fe2+ в клинике используют аскорбиновую кислоту и метиленовую синь.
Hb-CO – карбоксигемоглобин, образуется при наличии СО (угарный газ) во вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях, но его доля может колебаться от условий и образа жизни.
Угарный газ является активным ингибитором гем-содержащих ферментов, в частности, цитохромоксидазы, 4-го комплекса дыхательной цепи.
HbA1С – гликозилированный гемоглобин. Концентрация его нарастает при хронической гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени (время жизни эритроцита, 3-4 месяца).

Гемопротеины. Миоглобин, его биологические функции и структурная организация. Кинетика оксигенирования
Российская Федерация
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
Федеральное Государственное
бюджетное образовательное
Тюменский государственный университет
ИНСТИТУТ БИОЛОГИИ
Кафедра анатомии и физиологии человека и животных
Реферат на тему:
Гемопротеины. Миоглобин, его биологические функции и структурная организация. Кинетика оксигенирования.
Тюмень, 2013
Содержание:
Гемопротеины – миоглобин и гемоглобин………………………..……3-4
Миоглобин………………………………………………………
Биологическая функция миоглобина…………………………….
Первичная структура и
распределение аминокислот……………
Вторичная и третичная
структура миоглобина……………………….
Влияние гема на конформацию миоглобина……………………………..9
Пространственная ориентация атома железа, проксимального и дистального остатков гистидина в молекуле миоглобина…………….……9-10
Расположение атома железа……………
Лиганды………………………………………………………….
Кинетика оксигенирования миоглобина…………………………..…12-13
Анализ крови на миоглобин…………………………………..………13-
Миоглобин и митохондрии………………… …………………..…….14-16
Список литературы…………………………………
Гемопротеины – миоглобин и гемоглобин.
На примере миоглобина и гемоглобина очень чётко прослеживается связь между структурой и функцией белков вообще и глобулярных белков в особенности. Эти два сложных белка содержат в качестве простетической группы гем – циклический тетрапиррол, присутствием которого объясняется и красный цвет этих белков, и их способность запасать кислород (миоглобин) и обеспечивать его транспорт (гемоглобин). Тетрапирролы состоят из четырёх молекул пиррола (рис. 1), связанных четырьмя α-метиленовыми мостиками с образованием плоской кольцевой структуры. Что при этом образуется – гемм или какое-то родственное соединение – зависит от природы β-заместителей в пиррольных кольцах. Замещающими группами в гемме являются метильная (М), винильная (V) и пропионатная (Pr) группы, расположенные в таком порядке: М, V, M, V, M, Pr, Pr, M (рис. 2). В центре плоского кольца находится один атом железа в ферро-состоянии (Fe2+). Тетрапиррольные простетические группы и связанные с ними ионы металлов содержат и другие белки: цитохромы (Fe2+ и Fe3+), некоторые ферменты, например каталаза, триптофанпирролаза и хлорофиллсодержащие белки (Mg2+). В цитохромах происходит попеременное окисление и восстановление атома железа, играющее определяющую роль в их функционирования (транспорт электронов). Напротив, в миоглобине и гемоглобине окисление Fe2+ приводит к потере их биологической активности[1].
Рис. 1. Пиррол. Атомы α-углерода соединены метиленовыми мостиками с образованием тетрапиррола. При атомах β-углерода находятся заместители, характерные для того или иного тетрапиррола, в частности гема.
Рис. 2. Гем. Пиррольные
кольца и атомы углерода, участвующие
в образовании метиленовых
Миоглобин.
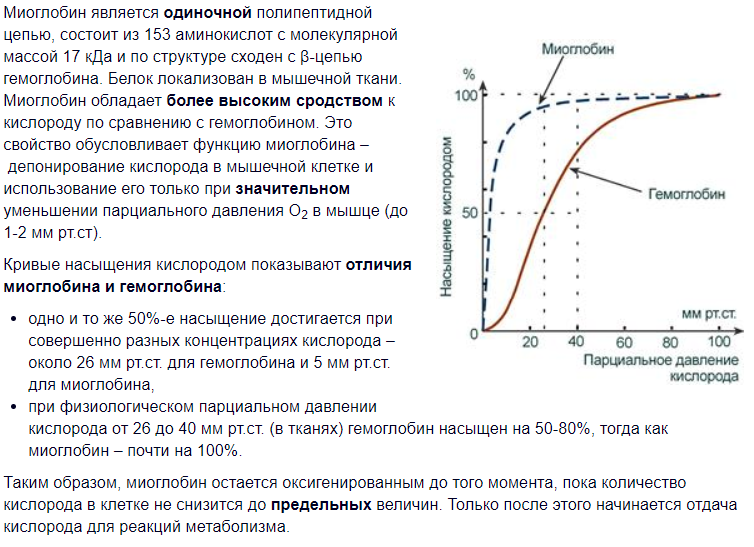
Глобулярный белок, осуществляющий в мышцах запасание (депонирование) молекулярного кислорода и передачу его окислительным системам клеток. Миоглобин — первый белок, структура которого выяснена методом рентгеноструктурного анализа (Дж. Кендрю и сотрудниками, 1957). Состоит из одной полипептидной цепи (около 70 % из 153 остатков аминокислот включено в спирализованные участки). Как и в гемоглобине, активным центром молекулы миоглобина, связывающим O2, является гем. Молекулярная масса миоглобина 17 000. По пространственной структуре миоглобин сходен с β-цепью гемоглобина (схема). Обратимое связывание миоглобина с O2 происходит уже при низких парциальных давлениях кислорода Pо2. Это имеет большое физиологическое значение: при сокращении мышц Pо2 резко падает в результате сжатия капилляров; именно в этот момент происходит высвобождение из миоглобина кислорода, необходимого работающей мышце[2,3].
Схема пространственной структуры миоглобина (справа) и бета-цепи гемоглобина (слева). Чёрными кружками указано положение каждого десятого остатка аминокислоты, прямые тяжи — спирализованные участки; группа гема представлена в виде диска.
Биологическая функция миоглобина.
Миоглобин содержится в красных мышцах и участвует в запасании кислорода. В условиях кислородного голодания (например, при сильной физической нагрузке) кислород высвобождается из комплекса с миоглобином и поступает в митохондрии мышечных клеток, где осуществляется синтез АТР (окислительное фосфорилирование).
Миоглобин имеет такую
же кислородную емкость, как и
гемоглобин крови, но обладает значительно
большим сродством к нему. Так,
сродство миоглобина лошади к кислороду
в 6 раз превышает сродство гемоглобина.
Миоглобин соединяется с
Функция миоглобина имеет
особое значение при первоначальных
нарушениях кровоснабжения и аноксиях
различного происхождения. Потребность
мышцы в кислороде появляется
через 0,2 секунды после начала ее
сокращения и к этому времени
миоглобин отдает свой кислород. Наряду
с миоглобином особо важное значение
имеют флавиновые ферменты, в том
числе и цитохромы. Это видно
из того, что под влиянием цитохрома
С (10 мг/кг) у крыс с экспериментальной
аноксией, вызванной параличом дыхания,
все изменения наступали
Первичная структура и распределение аминокислот.
Миоглобин состоит из единичной
полипептидной цепи с мол. Массой
17000; никаких особенностей в характере
составляющих его 153 аминокислотных остатков
не обнаруживается. При анализе же
их пространственного
Вторичная и третичная структура миоглобина.
Как показывает рентгеноструктурный анализ, миоглобин представляет собой компактную, примерно сферическую молекулу размером 4,5 × 3,5 × 2,5 нм (рис.3). Примерно 75% остатков образуют восемь правых α-спиралей, содержащих от 7 до 20 остатков. Начиная с N-конца, спирали обозначают буквами от А до Н. Участки, соединяющие спирали, обозначают двумя буквами, указывающими соответствующие спирали. Индивидуальным остаткам присваивают букву, указывающую спираль, в которой они находятся, и порядковый номер, отсчитываемый от N-конца спирали. Например, His F8 – восьмой остаток в спирали F, им является гистидин. Остатки, далеко отстоящие друг от друга вдоль цепи ( например, принадлежащие разным спиралям), могут быть пространственно сближены; например, довольно близко находятся остатки гистидина F8 (проксимальный) и Е7 (дистальный) (рис. 4).
Рис.3. Модель молекулы миоглобина. Контуры – это очертания, наблюдаемые при низком разрешении. Изображены в основном только атомы α-углерода и гем.
Ряд данных свидетельствует
о том, что в растворе вторичная
и третичная структуры
Влияние гема на конформацию миоглобина.
При понижении рН до 3,5 образуется апомиоглобин (миоглобин, не содержащий гема), и содержание α-спиралей резко падает, а последующее добавление мочевины к апомиоглобину при нейтральном рН приводит к почти полному их исчезновению. Последующее удаление мочевины диализом и добавление гема полностью восстанавливает число α-спиралей, а добавление Fe2+, приводит к полному восстановлению биологической (кислородсвязывающей) активности. Таким образом, информация, содержащаяся в первичной структуре апомиоглобина, в присутствии гема однозначно детерминирует свёртывание молекулы белка с образованием нативной, биологически активной конформации. Это важное положение распростроняется и на другие белки: первичная структура белка определяет его вторичную и третичную структуру[7].
Пространственная ориентация атома железа, проксимального и дистального остатков гистидина в молекуле миоглобина.
Гем в молекуле миоглобина расположен в щели между спиралями Е и F; его полярные пропионатные группы ориентированы к поверхности глобулы. А остальная часть находится внутри структуры и окружена неполярными остатками, за исключением His F8 и His F7. Пятое координационное положение атома железа занято атомом азота гетероциклического кольца проксимального гистидина His F8 (рис. 4). Дистальный гистидин (His E7) расположен по другую сторону гемового кольца, почти напротив His F8, но шестое координационное положение атома железа His E7 остаётся свободным (рис. 4)[1].
Рис. 4. Положение молекулы кислорода в гемме после оксигенирования. Изображены также имидазольные кольца двух важных остатков гистидина в глобиновой цепи, которые располагаются рядом с атомом железа.
Расположение атома железа.
В неоксигенированном миоглобине атом железа на 0,03 нм выступает из плоскости кольца в направлении His F8. В оксигенированном миоглобине атом кислорода занимает шестое координационное положение атома железа, а сам атом железа выступает из плоскости гема только на 0,01 нм. Таким образом, оксигенирование миоглобина сопровождается смещением атома железа и , следовательно, His F8 и ковалентно связанных с ним остатков в направлении плоскости кольца; в результате эта область белковой глобулы принимает новую конформацию[7].
Лиганды.
Связь, образующаяся между атомом кислорода и атомом Fe2+, при оксигенировании миоглобина направлена перпендикулярно плоскости кольца гема. Второй атом кислорода удалён от дистального гистидина, и связь между атомами кислорода образует относительно плоскости гема угол 121º(рис. 5)[7,8].
Рис. 5. Предпочтительные ориентации молекул кислорода и окиси углерода, связанных с атомом железа изолированного гема (тёмные полоски).
Окись углерода (СО) связывается с изолированным гемом примерно в 25000 раз более прочно, чем кислород. Поскольку атмосферный воздух содержит следы СО и ещё небольшое количество СО образуется в ходе нормального катаболизма гема, возникает вопрос: почему же шестое координвционное положение железа в миоглобине занято не СО, а молекулой О2? Связано это со стерическими ограничениями, возникающими в миоглобине. Молекула СО, связываясь с гемом, стремится принять такую ориентацию, при которой все три атома (Fe, C, O) находятся вдоль линии, перпендикулярной плоскости кольца гема ( рис. 6). Поэтому СО связывается в менее благоприятной конфигурации; что понижает прочность связи СО с гемом более чем на два порядка, так что она становится всего лишь в 200 раз прочнее, чем связь гем– О2. Тем не менее небольшая часть молекул миоглобина ( около 1%) в нормальных условиях связывает СО[1,7,8].
Рис. 6. Ориентация молекул кислорода и окиси углерода, связанных с атомом железа гема в составе миоглобина. Дистальный гистидинин Е7 препятствует связыванию СО в предпочтительной для этой молекулы ориентации – под углом 90º к плоскости гемового кольца.
Кинетика оксигенирования миоглобина.
Почему миоглобин неспособен транспортировать кислород, но зато эффективно его запасает? Количество кислорода, связывающегося с миоглобином («процент насыщения»), зависит от концентрации кислорода в среде, непосредственно окружающей молекулу белка ( эту концентрацию выражают как Ро2 – парциальное давление кислорода). Зависимость между количеством связанного кислорода и Ро2 можно представить графически в виде кривой насыщения миоглобина кислородом (кривой диссоциации кислорода). Для миоглобина изотерма адсорбции кислорода имеет форму гиперболы (рис. 7).
— гемоглобиновые болезни — Биохимия
Серповидно-клеточная анемия
HbS – гемоглобин серповидно-клеточной анемии. При этом нарушении в ДНК в результате точковой мутации триплет ЦТТ заменен на триплет ЦАТ, что влечет за собой включение в 6-м положении β-цепи вместо глутамата аминокислоты валина. Изменение свойств β-цепи влечет изменение свойств всей молекулы и формирование на поверхности гемоглобина «липкого» участка. При дезоксигенации гемоглобина участок «раскрывается» и связывает одну молекулу дезоксигемоглобина S с другими подобными. Результатом является полимеризация гемоглобиновых молекул и образование крупных белковых тяжей, вызывающих деформацию эритроцитов и, при прохождении ими капилляров, гемолиз.
Схема отличия гемоглобина S от гемоглобина А и его полимеризация
Нарушение синтеза гемоглобина
Порфирии
Порфирии – это группа гетерогенных наследственных заболеваний, возникающих в результате нарушения синтеза гема и повышения содержания порфиринов и их предшественников в организме. Выделяют наследственные и приобретенные формы порфирии.
Приобретенные формы порфирий носят токсический характер и вызываются действием гексахлорбензола, солей свинца и других тяжелых металлов (ингибирование порфобилиногенсинтазы, феррохелатазы и др.), лекарственными препаратами (антигрибковый антибиотик гризеофульфин).
При наследственных формах дефект фермента имеется во всех клетках организма, но проявляется только в одном типе клеток. Можно выделить две большие группы порфирий:
1. Печеночные – группа заболеваний с аутосомно-доминантными нарушениями ферментов различных этапов синтеза протопорфирина IX.
Наиболее ярким заболеванием этой группы является перемежающаяся острая порфирия, при которой у гетерозигот активность уропорфириноген-I-синтазы снижена на 50%. В результате больные экскретируют с мочой большие количества порфобилиногена и аминолевулиновой кислоты. На свету порфобилиноген окисляется в окрашенные соединения и моча темнеет. Симптомами заболевания являются острые боли в животе, нервно-психические расстройства (полиневриты, тетрапарез, галлюцинации), сердечно-сосудистые нарушения.
Заболевание проявляется после достижения половой зрелости из-за повышенной потребности гепатоцитов в цитохроме Р450 для обезвреживания половых стероидов, обострение состояния также часто бывает после приема лекарственных препаратов, метаболизм которых требует участия цитохрома Р450. Снижение концентрации гема, используемого для синтеза цитохрома Р450, активирует аминолевулинат синтазу.2. Эритропоэтические – аутосомно-рецессивные нарушения некоторых ферментов синтеза протопорфирина IX в эритроидных клетках. При этом при синтезе уропорфириногенов баланс реакций смещается в сторону синтеза уропорфириногена I. Примером может служить болезнь Гюнтера (частота<1:1000000), при которой развиваются высокая фоточувствительность кожи (ожоги под солнечным светом) и ее поражение, гемолиз, эритродонтия (окрашивание зубов в красный цвет), разрушение хрящей, в том числе носа и ушей.
Талассемии
Для талассемий характерно снижение синтеза α-цепей гемоглобина (α-талассемия) или β-цепей (β-талассемия). Это приводит к нарушению эритропоэза, гемолизу и тяжелым анемиям.
— катаболизм гема — Биохимия
За сутки у человека распадается около 9 г гемопротеинов, в основном это гемоглобин эритроцитов.
Эритроциты в норме живут 90-120 дней, после чего лизируются в клетках ретикулоэндотелиальной системы – макрофагах селезенки (главным образом), купферовских клетках печени и макрофагах костного мозга. При разрушении эритроцитов в кровеносном русле высвобождаемый гемоглобин образует комплекс с белком-переносчиком гаптоглобином (фракция α2-глобулинов крови) и также переносится в клетки РЭС селезенки, печени и костного мозга.
Синтез билирубина
В клетках РЭС гем в составе гемоглобина окисляется молекулярным кислородом. В реакциях последовательно происходит разрыв метинового мостика между 1-м и 2-м пиррольными кольцами гема с их восстановлением, отщеплением железа и белковой части и образованием оранжевого пигмента билирубина. Высвобождаемое железо может либо запасаться в клетке в комплексе с ферритином, либо выделяться наружу и связываться с трансферрином.
Реакции распада гемоглобина и образования билирубина
Билирубин – токсичное, жирорастворимое вещество, способное разобщать окислительное фосфорилирование в клетках. Особенно чувствительны к нему клетки нервной ткани.
Строение билирубина
Выведение билирубина
Из клеток ретикуло-эндотелиальной системы билирубин попадает в кровь. Здесь он находится в комплексе с альбумином плазмы, в гораздо меньшем количестве – в комплексах с металлами, аминокислотами, пептидами и другими малыми молекулами. Образование таких комплексов не позволяет выделяться билирубину с мочой. Билирубин в комплексе с альбумином называется свободный (неконъюгированный) или непрямой билирубин.
Этапы метаболизма билирубина в организме
Из сосудистого русла в гепатоциты билирубин попадает с помощью белка-переносчика (транспортный белок органических анионов) или по механизму флип-флоп. Далее при участии цитозольного связывающего белка лигандина (Y-протеин) билирубин транспортируется в ЭПР, где протекает реакция связывания билирубина с УДФ-глюкуроновой кислотой, при этом образуются моно- и диглюкурониды. Кроме глюкуроновой кислоты, в реакцию конъюгации могут вступать сульфаты, фосфаты, глюкозиды.
Билирубин-глюкуронид получил название связанный (конъюгированный) или прямой билирубин.
Реакции синтеза билирубин-диглюкуронида |
Строение билирубин-диглюкуронида
|
После образования билирубин-глюкурониды АТФ-зависимым переносчиком секретируются в желчные протоки и далее в кишечник, где при участии бактериальной β-глюкуронидазы превращаются в свободный билирубин. Одновременно, даже в норме (особенно у взрослых), некоторое количество билирубин-глюкуронидов может попадать из желчи в кровь по межклеточным щелям.
Таким образом, в плазме крови обычно присутствуют две формы билирубина: свободный (непрямой), попадающий сюда из клеток РЭС (80% и более всего количества), и связанный (прямой), попадающий из желчных протоков (в норме не более 20%).
Термины «связанный«, «конъюгированный«, «свободный«, «несвязанный» отражают взаимодействие билирубина и глюкуроновой кислоты (но не билирубина и альбумина!).
Термины «прямой» и «непрямой» введены, исходя из возможности химической реакции билирубина с диазореактивом Эрлиха. Связанный билирубин реагирует с реактивом напрямую, без добавления дополнительных реагентов, т.к. является водорастворимым. Несвязанный (жирорастворимый) билирубин требует добавочных реактивов, реагирует не прямо.
Превращение в кишечнике
В кишечнике билирубин подвергается восстановлению под действием микрофлоры до мезобилирубина и мезобилиногена (уробилиногена). Часть уробилиногена всасывается и с кровью портальной вены попадает в печень, где либо распадается до моно-, ди- и трипирролов, либо окисляется до билирубина и снова экскретируется. При этом при здоровой печени в общий круг кровообращения и в мочу мезобилирубин и уробилиноген не попадают, а полностью задерживаются гепатоцитами.
Оставшаяся в кишечнике часть пигментов ферментами бактериальной флоры толстого кишечника восстанавливается до стеркобилиногена. Далее
- малая часть стеркобилиногена может всасываться и катаболизировать в печени, подобно уробилиногену,
- незначительное количество стеркобилиногена через геморроидальные вены попадает в большой круг кровообращения, отсюда в почки и в мочу. После окисления на воздухе из стеркобилиногена образуется стеркобилин мочи,
- однако основное количество стеркобилиногена достигает нижних отделов толстого кишечника и выделяется. В прямой кишке и на воздухе стеркобилиноген окисляется в стеркобилин, окрашивая кал,
- аналогично уробилиноген, появляющийся в моче при патологии печени, окисляется в уробилин.
Очень часто стеркобилиноген, содержащийся в нормальной моче, называют уробилиногеном. И в клинической практике обычно не проводят различий между стеркобилиногеном и уробилиногеном мочи, их рассматривают как один пигмент – урохромы (уробилиноиды), что может создавать некоторую путаницу при оценке результатов анализа.
— синтез гема — Биохимия
Гем является небелковой частью многих гемопротеинов:
Строение и синтез гема
Гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
Строение гема
Синтез гема в основном идет в предшественниках эритроцитов, в клетках печени, почек, слизистой кишечника и в остальных тканях. Первая реакция синтеза с участием δ-аминолевулинат-синтазы (греч. δ — «дельта») происходит в митохондриях. Следующая реакция при участии аминолевулинатдегидратазы (порфобилиноген-синтазы) протекает в цитозоле, здесь из двух молекул δ‑аминолевулиновой кислоты образуется циклический порфобилиноген (монопиррол).
Синтез порфобилиногена
После синтеза порфобилиногена четыре его молекулы конденсируются в гидроксиметилбилан, который далее превращается в уропорфириноген типа I и уропорфириноген типа III. В синтезе обоих видов порфиринов принимает участие уропорфириноген I-синтаза, в образовании уропорфириногена III дополнительно принимает участие фермент уропорфириноген III-косинтаза.
Судьба обоих типов уропорфириногена двояка: они могут окисляться до уропорфирина (на рисунке не показано) или декарбоксилироваться до копропорфириногена соответствующего типа.
Синтез гема из порфобилиногена
Копропорфириноген III возвращается в митохондрии и окисляется в протопорфириноген IX и далее в протопорфирин IX. Последний после связывания с железом образует гем, реакцию катализирует феррохелатаза (гемсинтаза).
Скорость синтеза глобиновых цепей зависит от наличия гема, он ускоряет биосинтез «своих» белков.
Названия пигментов (уропорфирины и копропорфирины) были даны веществам по источнику их первоначального выделения, при этом восстановленные бесцветные формы называют порфириногенами. Для порфиринов характерно наличие изомерии вследствие различного расположения радикалов, что нашло отражение в порядковых номерах изомеров.
Регуляция синтеза гема
Основным регуляторным ферментом синтеза гема является аминолевулинатсинтаза.
1. Гем :
- напрямую оказывает отрицательный аллостерический эффект на фермент,
- влияет на транскрипцию фермента. После взаимодействия с молекулой белка-репрессора формирует активный репрессорный комплекс, связывается с ДНК и подавляет транскрипцию, мРНК для фермента не образуется и синтез фермента прекращается.
Регуляция синтеза аминолевулинатсинтазы
2. Ионы железа. Их достаточное количество оказывает положительный эффект при синтезе молекулы аминолевулинатсинтазы.
В клетке имеется железосвязывающий белок (англ. IRP, iron-responsive element-binding proteins – белок, связывающий железочувствительный элемент), который в отсутствии ионов железа обладает сродством к железочувствительному участку IRE (англ. iron-responsive element ) на матричной РНК фермента. Это связывание блокирует трансляцию мРНК в рибосоме, т.е. подавляет синтез белковой цепи.
При наличии ионов железа они связываются с железосвязывающим белком, образуя с ним неактивный комплекс, и это инициирует синтез фермента.
3. Положительным модулятором аминолевулинатсинтазы служит внутриклеточная гипоксия, которая в эритропоэтических тканях индуцирует синтез фермента.
4. В печени повышению активности аминолевулинатсинтазы способствуют различные соединения, усиливающие работу микросомальной системы окисления (жирорастворимые вещества, стероиды) – при этом возрастает потребление гема для образования цитохрома Р450, и снижается внутриклеточная концентрация свободного гема. В результате происходит усиление синтеза фермента.
Вопросы по БИОХИМИИ
№1 Общая характеристика хромопротеидов. Гемоглобин, структурная характеристика. Зависимость биологической активности белков от четвертичной структуры: кооперативные изменения конформации протомеров (на примере гемоглобина в сравнении с миоглобином).
Общая хар-ка хромопротеидов: Хромопротеины содержат окрашенные простетические группы. К этим белкам относят гемопротеины (содержат гем),ретинальпротеины (содержат витамин А), флавопротеины (содержат витамин В2), кобамидпротеины (содержат витамин В12).
Гемопротеины 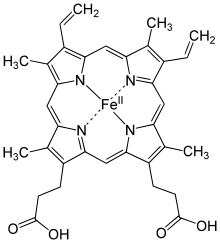 подразделяются
на неферментативные (гемоглобин,
миоглобин) и ферменты (цитохромы,
каталаза, пероксидаза). Небелковой
частью их является гем –
структура, включающая в себя порфириновое
кольцо (состоящее из 4 пиррольных колец)
и иона Fe2+.
Железо связывается с порфириновым
кольцом двумя координационными и двумя
ковалентными связями.
подразделяются
на неферментативные (гемоглобин,
миоглобин) и ферменты (цитохромы,
каталаза, пероксидаза). Небелковой
частью их является гем –
структура, включающая в себя порфириновое
кольцо (состоящее из 4 пиррольных колец)
и иона Fe2+.
Железо связывается с порфириновым
кольцом двумя координационными и двумя
ковалентными связями.
Цитохромы отличаются аминокислотным составом пептидных цепей и числом цепей и разделяются на типы а, b, с, d. Все они неспособны связывать кислород, кроме цитохрома а3, который содержит ионы меди. Цитохромы находятся в составе дыхательной цепи и цепи микросомального окисления.
Флавопротеины являются ферментами окислительно-восстановительных реакций, содержат производные витамина В2 флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД).
.Гемоглобин структур хар-ка: имеет 4-ную структуру,4 соединенные цепи образуют правильную форму шара,где каждая α-цепь контактирует с двумя β-цепями. Т.к. в обл.контакта м\у этими цепями находится мног гидрофоб.радикалов,то м\у ними формируется сильное соед-е за счет возникновения гидрофоб и ионных и водородных связей.в рез-те обр димеры, м\у этими димерами в молекуле возникают в основном полярные связи.кроме того димеры могут перемещаться относительно друг-друга.так пов-ть протомеров не ровная, полипептидные цепи в центральной обл. не могут плотно прилегать др к др в рез-те формир центральная полость проходящая сквозь молекулу гемоглобина.
кооперативные изменения конформации протомеров (на примере гемоглобина в сравнении с миоглобином):кооперативную работу можно наблюдать на кривых диссоциации. Кривая диссоциации О2 для миоглобина имеет вид простой гиперболы. Это указывает на то, что миоглобин обратимо связ-ся с лигандом,и на это не оказ-т влияние никакие посторонние факторы: Мв+О2↔МвО2 процессы обр и распада оксимиоглобина находятся в равновесии и это равновесие смещ-ся влево или вправо в зависимости от того,добав-я или удал-я кислород из системы.миоглобин связ-т О2 который в капиллярах тканей высвобождает гемоглобин,и сам миоглобин может высвоб-ть о2 в ответ на возрастание потребностей в нем мыш.тк и при физ нагрузке. Миоглобин имеет выс сродство к О2. Даже при парциальном давлении О2 равном 1-2 мм.рт.ст миоглобин остается связанным с О2 на 50%.
Кривая диссоциации О2 для гемоглобина:гемоглобин имеет низкое сродство к О2,полунасыщение гемоглобина наступает при более высоком давлении О2(около 26 мм.рт.ст.)кривая диссоциации имеет S-образную форму,это указывает на то,что протомеры гемоглобина работают кооперативно:чем больше О2 отдают протомеры,тем легче идет отщепление молекул О2.в капиллярах покоящихся мышц большая часть О2 возвращается в составе оксигемоглобина в легкие.при физ.работе давление О2 в капиллярах падает до 10-20 мм.рт.ст. именно в этой обл.располагается крутая часть S-образной кривой,где больше проявляется св-во кооперативной работы протомеров. Каждый из белков способен выполнять свою функ-ю. миоглобин-присоед-ть О2 высвобождаемый гемоглобином,накап-ть и высвобождать при крайних необходимостях. Гемоглобин-присоединять О2 в легких,где его насыщение доходит до 100% и отдавать его в капиляры тк.в зависимости от изменения в них давления О2.
№2 Типы гемоглобинов в процессе онтогенеза и их биологическое значение. Особенности структуры.
Гемоглобин А-основной Г.взрослого организма,составляет около 98% от общего кол-ва гемоглобина,тетрамер,состоит из 2 полипептидных цепей α и 2β (2α2β)протомеры гемоглобина,так же как и апомиоглобин,состоят из 8 спиралей,свернутых в плотную глобулярную структуру содержащую внутреннее гидрофобное ядро и карман для связывания гема.
Гемоглобин А2-находится в организме взрослого человека в меньшей концентрации,на его долю приходится около 2% общего гемоглобина.он состоит из 2α и 2δ цепей.
Гемоглобин А 1с— гемоглобин А, модифицированный ковалентным присоединением к нему глюкозы(гликозилированный гемоглобин)
Эмбриональный гемоглобин-синтезируется в эмбриональном желточном мешке через несколько недель после оплодотворения. Представляет собой тетрамер 2ξ2ε. Через 3 недели после формирования печени плода в ней начинает синтезироваться гемоглобин F, который к 6 мес замещает эмбриональный гемоглобин.
Гемоглобин F-фетальный гемоглобин,синтезируется в печени костном мозге плода до периода его рождения. Имеет тетрамерную структуру, состоящую из 2α и 2ϒ цепей. После рождения ребенка постепенно замещается на гемоглобин А, который начинает синтезироваться в клетках костного мозга уже на 8-м месяце развития плода.
№3 Вариации первичной структуры и свойств гемоглобина человека. Серповидно-клеточная анемия, биохимические основы нарушений функции.
Альфа-полипептидная цепь заканчивается комбинацией аминокислот валина-лейцина, а бета-полипептидная цепь — комбинацией валина-гистидина-лейцина. Альфа- и бета-полипептидные цепи в гемоглобиновой молекуле не размещены линейно, как это выглядит на первый взгляд из данных, это первичная структура .
В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают «слипаться», образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа.
В оксигемоглобине S комплементарный участок «замаскирован» в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина S друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение рН, условия высокогорья, полёт на самолёте).
Так как «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли «даже некроз клеток в данной области.
Серповидно-клеточная анемия — гомозиготное рецессивное заболевание; проявляется только в том случае, когда от обоих родителей наследуются 2 мутантных гена бета-цепей глобина. После рождения ребёнка болезнь не проявляется до тех пор, пока значительные количества HbF не заместятся на HbS. У больных выявляют клинические симптомы, характерные для анемии: головокружение и головные боли, одышка, учащённое сердцебиение, боли в конечностях, повышенную восприимчивость к инфекционным заболеваниям.
Гетерозиготные индивидуумы, имеющие один нормальный ген НЬА, а другой ген HbS, в крови имеют лишь следовые количества серповидных клеток и нормальную продолжительность жизни; клинические симптомы болезни у них обычно не проявляются.
№4 Гемоглобин плода и его физиологическое значение. Роль 2.3-дифосфоглицерата в регуляции сродства гемоглобина к кислороду
Олигомерный белок гемоглобин, в отличие от мономерного родственного белка миоглобина, способен присоединять к специфическим участкам 4 различных лиган-да: О2, Н+, СО2 и БФГ. Все эти лиганды присоединяются к пространственно разобщённым участкам, но конформационные изменения белка в месте присоединения одного лиганда передаются на весь олигомерный белок и изменяют сродство к нему других лигандов. Так, количество поступающего в ткани О2 зависит не только от парциального давления О2, но и концентрации аллостерических лигандов, что увеличивает возможность регуляции функций гемоглобина. в капиллярах работающей мышцы увеличение концентрации СО2 и Н+ уменьшает сродство гемоглобина к О2 и увеличивает отдачу его в ткани. При длительной гипоксии усиливается синтез 2,3-БФГ в эритроцитах, что также снижает сродство гемоглобина к О2 и при том же парциальном давлении О2 увеличивает его транспорт в ткани.
Следовательно, благодаря воздействию регуляторных лигандов олигомерные белки способны приспосабливать свою конформацию и фунцию к изменениям, происходящим в окружающей среде.
№5 Буферная роль гемоглобина
Гемоглобиновая буферная система – самая мощная буферная система крови. На ее долю приходится 75% от всей буферной емкости крови.
Участие гемоглобина в регуляции рН крови связано с его ролью в транспорте кислорода и углекислого газа. Константа диссоциации кислотных групп гемоглобина меняется в зависимости от его насыщения кислородом. При насыщении кислородом гемоглобин становится более сильной кислотой (ННbО2). Гемоглобин, отдавая кислород, превращается в очень слабую органическую кислоту (ННb).
Итак, гемоглобиновая буферная система состоит из неионизированного гемоглобина ННb (слабая органическая кислота, донор протонов) и калиевой соли гемоглобина КНb (сопряженное основание, акцептор протонов). Точно так же может быть рассмотрена оксигемоглобиновая буферная система. Система гемоглобина и система оксигемоглобина являются взаимопревращающимися системами и существуют как единое целое. Буферные свойства гемоглобина прежде всего обусловлены возможностью взаимодействия кисло реагирующих соединений с калиевой солью гемоглобина с образованием эквивалентного количества соответствующей калийной соли кислоты и свободного гемоглобина:
КНb + Н2СO3—> КНСO3 + ННb.
Именно таким образом превращение калийной соли гемоглобина эритроцитов в свободный ННb с образованием эквивалентного количества бикарбоната обеспечивает поддержание рН крови в пределах физиологически допустимых величин, несмотря на поступление в венозную кровь огромного количества углекислого газа и других кисло реагирующих продуктов обмена.
Гемоглобин (ННb), попадая в капилляры легких, превращается в окси-гемоглобин (ННbО2), что приводит к некоторому подкислению крови, вытеснению части Н2СО3 из бикарбонатов и понижению щелочного резерва крови.
№6 Гемоглобинопатии, биохимические основы нарушений.
Гемоглобинопатия — наследственное или врождённое изменение или нарушение структуры белка гемоглобина, обычно приводящее к клинически или лабораторно наблюдаемым изменениям в его кислород-транспортирующей функции либо в строении и функции эритроцитов.
Серповидноклеточная анемия — тяжёлое наследственное заболевание, обусловленное точечной мутацией гена, кодирующего структуру β-цепи гемоглобина. В результате в эритроцитах больных присутствует HbS, β-цепи которого в шестом положении вместо гидрофильной глутаминовой кислоты содержат гидрофобную аминокислоту валин. Появление гидрофобной аминокислоты недалеко от начала молекулы способствует возникновению нового центра связывания, поэтому при низком парциальном давлении кислорода тетрамеры дезокси-HbS ассоциируют, образуя длинные микротрубчатые образования, которые полимеризуются внутри эритроцитов. Полимеризация приводит к нарушению структуры эритроцитов, они приобретают серповидную форму и легко разрушаются. При этом заболевании отмечают анемию, прогрессирующую слабость, отставание в развитии и желтуху.
Талассемии — наследственные заболевания, обусловленные отсутствием или снижением скорости синтеза α- или β-цепей гемоглобина. В результате несбалансированного образования глобиновых цепей образуются тетрамеры гемоглобина, состоящие из одинаковых протомеров. Это приводит к нарушению основной функции гемоглобина — транспорту кислорода к тканям. Нарушение эритропоэза и ускоренный гемолиз эритроцитов и клеток-предшественников при талассемиях приводит к анемии.
При β-талассемии не синтезируются β-цепи гемоглобина. Это вызывает образование нестабильных тетрамеров, содержащих только α-цепи. При этом заболевании в костном мозге из-за преципитации нестабильных α-цепей усиливается разрушение эритробластов, а ускорение разрушения эритроцитов в циркулирующей крови приводит к внутрисосудистому гемолизу. Как известно, для образования фетального гемоглобина р-цепи не требуются, поэтому клинически β-талассемия не проявляется до рождения, после чего происходит переключение синтеза HbF на НbА.
В случае α-талассемии недостаток образования α-глобиновых цепей приводит к нарушению образования HbF у плода. Избыточные γ-цепи образуют тетрамеры, называемые гемоглобином Барта. Этот гемоглобин при физиологических условиях имеет повышенное сродство к кислороду и не проявляет кооперативных взаимодействий между протомерами. В результате гемоглобин Барта не обеспечивает развивающийся плод необходимым количеством кислорода, что приводит к тяжёлой гипоксии. При α-талассемии отмечают высокий процент внутриутробной гибели плода. Выжившие новорождённые при переключении с γ- на β-ген синтезируют β-тетрамеры или НbН, который, подобно гемоглобину Барта, имеет слишком высокое сродство к кислороду, менее стабилен, чем НbА и быстро разрушается. Это ведёт к развитию у больных тканевой гипоксии и к смерти вскоре после рождения.
Наследственный сфероцитоз. Причиной этой патологии чаще всего является дефект белков цитоскелета эритроцитов — спектрина или ан-кирина, которые обеспечивают поддержание двояковогнутой формы клетки и эластичности мембраны. Эритроциты приобретают шарообразную форму, что приводит к уменьшению площади их поверхности и снижению скорости газообмена. Потеря эластичности клеточной мембраны приводит к повышению хрупкости и травматичности клеток и, как следствие, к ускорению их разрушения в сосудистом русле и селезёнке. Заболевание сопровождается анемией и желтухой. Удаление селезёнки (спленэктомия) при наследственном сфероцитозе улучшает состояние больных, так как предотвращает разрушение сфероцитов в селезёнке.
Мегалобластная (макроцитарная) анемия развивается при дефиците фолиевой кислоты или витамина В12. Фолиевая кислота в виде кофермента (Н4-фолата) участвует в синтезе нуклеотидов. Недостаток фолиевой кислоты приводит к снижению скорости синтеза ДНК в быстроделящихся клетках, и в первую очередь в предшественниках эритроцитов. Клетки дольше пребывают в интерфазе, синтезируя гемоглобин, и становятся крупнее. Кроме того, из-за недостатка нуклеотидов они реже делятся, и количество эритроцитов снижается, а крупные мегалобласты быстрее разрушаются. Всё это в конечном итоге приводит к развитию анемии.
Персистенция фетального гемоглобина — наследственная гемоглобинопатия, при которой после рождения ребёнка не происходит постепенной замены фетального гемоглобина на гемоглобин А, обладающий большей функциональной стабильностью в широком интервале pH, хотя и меньшей кислород-связывающей способностью. При этом, поскольку фетальный гемоглобин менее стоек и стабилен, у страдающих этой формой гемоглобинопатии укорочен срок жизни эритроцитов, повышен гемолиз и повышено разрушение эритроцитов в селезёнке, со всеми вытекающими последствиями в виде перегрузки организма железом и желчными пигментами и хронического «перенапряжения» эритроцитарного ростка костного мозга.
№7 Метаболизм эритроцита. Транспорт кислорода кровью. Транспорт двуокиси углерода кровью. Эффект Бора.
Эритроциты — высокоспециализированные клетки, которые переносят кислород от лёгких к тканям и диоксид углерода, образующийся при метаболизме, из тканей к альвеолам лёгких. Транспорт О2 и СО2 в этих клетках осуществляет гемоглобин, составляющий 95% их сухого остатка. Организм взрослого человека содержит около 25×1012 эритроцитов, при этом каждые сутки обновляется примерно 1% этого количества клеток, т.е. в течение одной секунды в кровоток поступает около 2 млн эритроцитов.
Транспорт кислорода кровью. Кровь ежедневно должна переносить из лёгких в ткани около 600 л ,О2. Так как О2 плохо растворим в воде, то практически весь кислород в крови связан с гемоглобином эритроцитов.
От способности гемоглобина насыщаться О2 в лёгких и относительно легко отдавать его в капиллярах тканей зависят количество получаемого тканями О2 и интенсивность метаболизма. С другой стороны, О2 — сильный окислитель, избыток поступления О2 в ткани может привести к повреждению молекул и нарушению структуры и функций клеток. Поэтому важнейшая характеристика гемоглобина — его способность регулировать сродство к О2 в зависимости от тканевых условий.
Основная функция гемоглобина — доставка О2 от лёгких к тканям. Олигомерная структура гемоглобина обеспечивает быстрое насыщение его кислородом в лёгких (образование оксигемоглобина — Нb(О2)4), возможность отщепления кислорода от гемоглобина в капиллярах тканей при относительно высоком парциальном давлении О2, а также возможность регуляции сродства гемоглобина к О2 в зависимости от потребностей тканей в кислороде.
О2 связывается с протомерами гемоглобина через Fe2+ , который соединён с четырьмя атомами азота пиррольных колец гема и атомом азота Гис F8 белковой части протомера. Связывание О2 с оставшейся свободной координационной связью Fe2+ происходит по другую сторону от плоскости гема в области Гис Е7. Гис Е7 не взаимодействует с О2, но обеспечивает оптимальные условия для его связывания.
В дезоксигемоглобине благодаря ковалентной связи с белковой частью атом Fe2+ выступает из плоскости гема в направлении Гис F8. Присоединение О2 к атому Fe2+одного протомера вызывает его перемещение в плоскость гема, за ним перемещаются остаток Гис F8 и полипептидная цепь, в состав которой он входит. Происходит изменение конформации всего белка. Конформационные изменения, произошедшие в других протомерах, облегчают присоединение следующей молекулы О2, что вызывает новые конформационные изменения в белке и ускорение связывания следующей молекулы О2.
Аналогичным образом в тканях диссоциация каждой молекулы О2 изменяет конформацию всех протомеров и облегчает отщепление последующих молекул О2.
Гемоглобин способен присоединять О2 в лёгких, где его насыщение доходит до 100%, и отдавать О2 в капиллярах тканей в зависимости от изменения в них давления О2
Перенос Н+ и С02 из тканей в лёгкие с помощью гемоглобина. Эффект Бора
Окисление органических веществ с целью получения энергии происходит в митохондриях клеток с использованием О2, доставляемого гемоглобином из лёгких. В результате окисления веществ образуются конечные продукты распада — СО2 и Н2О, количество которых пропорционально интенсивности процессов окисления. СО2, образовавшийся в тканях, транспортируется в эритроциты. Там под действием фермента карбангидразы происходит увеличение скорости образования Н2СО3. Слабая угольная кислота может диссоциировать на Н+ и НСО3—
СО2 + Н2О — H2CO 3 — H+ + HCO3—.
Равновесие реакции в эритроцитах, находящихся в капиллярах тканей, смещается вправо, так как образующиеся в результате диссоциации угольной кислоты протоны могут присоединяться к специфическим участкам молекулы гемоглобина: к радикалам Гис146 двух β-цепей, радикалам Гис122 и концевым α -аминогруппам двух α -цепей. Все эти 6 участков при переходе гемоглобина от окси- к дезоксиформе приобретают большее сродство к Н+ в результате локального изменения аминокислотного окружения вокруг этих участков (приближения к ним отрицательно заряженных карбоксильных групп аминокислот).
Присоединение 3 пар протонов к гемоглобину уменьшает его сродство к О2 и усиливает транспорт О2 в ткани, нуждающиеся в нём . Увеличение освобождения О2 гемоглобином в зависимости от концентрации Н+ называют эффектом Бора.
В капиллярах лёгких высокое парциальное давление О2 приводит к оксигенированию гемоглобина и удалению 6 протонов. Реакция СО2 + Н2О — Н2СО3 — Н+ + НСО3—сдвигается влево и образующийся СО2 выделяется в альвеолярное пространство и удаляется с выдыхаемым воздухом.
Следовательно, молекула гемоглобина в ходе эволюции приобрела способность воспринимать и реагировать на информацию, получаемую из окружающей среды. Увеличение концентрации протонов в среде снижает сродство О2 к гемоглобину и усиливает его транспорт в ткани.
Большая часть СО2 транспортируется кровью в виде бикарбоната НСО3—. Небольшое количество СО2 (около 15-20%) может переноситься в лёгкие, обратимо присоединяясь к неионизированным концевым α -аминогруппам. R-NH2+ СО2 = R-NH-COO + Н+, в результате образуется карбогемоглобин, где R — полипептидная цепь гемоглобина. Присоединение СО2 к гемоглобину также снижает его сродство к О2.
2,3-Бифосфоглицерат — аллостертеский регулятор сродства гемоглобина к О2
2,3-Бифосфоглицерат (БФГ) — вещество, синтезируемое в эритроцитах из промежуточного продукта окисления глюкозы 1,3-бифосфоглицерата.
В нормальньж условиях 2,3-бифосфоглицерат присутствует в эритроцитах примерно в той же концентрации, что и гемоглобин. БФГ, присоединяясь к гемоглобину, также может менять его сродство к О2.
В центре тетрамерной молекулы гемоглобина есть полость, образованная аминокислотными остатками всех четырёх протомеров.
Центральная полость — место присоединения БФГ.
Размеры центральной полости могут меняться: отщепление О2 от оксигемоглобина вызывает его конформационные изменения, которые способствуют образованию дополнительных ионных связей между димерами α 1 β 1 и α 2 β 2. В результате пространственная структура дезоксигемоглобина становится более жёсткой, напряжённой, а центральная полость расширяется.
В расширенную полость дезоксигемоглобина БФГ, имеющий сильный отрицательный заряд, присоединяется с помощью ионных связей, образующихся с положительно заряженными функциональными группами двух β -цепей гемоглобина. Присоединение БФГ ещё сильнее стабилизирует жёсткую структуру дезоксигемоглобина и снижает сродство белка к О2. Присоединение БФГ к дезоксигемоглобину происходит в аллостерическом центре.
В лёгких высокое парциальное давление О2 приводит к оксигенированию гемоглобина. Разрыв
ионных связей между димерами α 1 β 1 и α 2 β 2 приводит к «расслаблению» белковой молекулы, уменьшению центральной полости и вытеснению БФГ.
№8 Карбоксигемоглобин. Метгемоглобин. Анемические гипоксии.
Карбоксигемоглобин (COHb) — трудноразъединимое соединение гемоглобина и угарного газа. Переизбыток в крови карбоксигемоглобина приводит к кислородному голоданию, головокружению, тошноте, рвоте или даже смерти, т.к. угарный газ, связанный с гемоглобином, лишает его возможности присоединять к себе кислород.
Карбоксигемоглобин искусственно разъединяется медицинским путём, также он может распасться естественным путём, период полураспада — 4-6 часов. Это возможно, если его содержание в крови мало, и жизнедеятельность организма не нарушается.
Карбоксигемоглобин, HbCO, продукт присоединения CO (углерода окись, угарный газ) с гемоглобином (Hb). Растворы карбоксигемоглобина ярко-красного цвета, их спектр поглощения характеризуется максимумами при длине волны 570 и 539 ммк.
Расщепление карбоксигемоглобина на Hb и CO происходит в 10 000 раз медленнее, чем расщепление оксигемоглобина на Hb и O2. Поэтому при наличии во вдыхаемом воздухе CO кислород постепенно вытесняется из гемоглобина. Уже при концентрации 0,1 % CO в воздухе больше половины Hb крови превращается в карбоксигемоглобин; в результате нарушается перенос кислорода от лёгких к тканям и развивается так называемое угарное отравление, химическое соединение, образующееся при взаимодействии окиси углерода с красящим пигментом крови гемоглобином.
Карбоксигемоглобин образуется очень быстро, поскольку способность присоединяться к гемоглобину у угарного газа примерно в 200 раз выше, чем у кислорода. Карбоксигемоглобин не способен переносить кислород к тканям организма, поэтому при отравлении окисью углерода у человека может быстро наступить смерть. В больших количествах карбоксигемоглобин образуется при отравлении окисью углерода, а в небольших всегда присутствует в крови всех курильщиков и жителей огромных городов. СО может быть частично вытеснен из гема при повышении парциального давления кислорода в легких.
Метгемоглобин, MtHb (HbOH), гемиглобин, ферригемоглобин, форма гемоглобина, в которой железо гема находится в трёхвалентном состоянии; не способен переносить кислород. Метгемоглобин легко образуется из свободного гемоглобина под действием различных окислителей, а в организме — при некоторых отравлениях. MtHb может выделяться с мочой (метгемоглобинурия), иногда повреждая почки. Лечение метгемоглобинемии: введение противоядий (метиленовая синь, аскорбиновая кислота), кислородная терапия.
Гипоксия анемическая — кислородная недостаточность, развивающаяся из-за уменьшения количества эритроцитов или снижения в них гемоглобина. Типы анемической гипоксии (отравление СО, кровяные яды) – токсические анемии.
.№9 Миоглобин его строение и функции. Маршевая миоглобинурия. Содержит небелковую часть — гем и белковую — апомиоглобин. Гем- молекула имеет структуру циклического тетрапиррола, где 4 пиррольных кольца соеденины метиленовыми мостиками и содержат 4 метильные,2 винильные и 2 пропионатные боковые цепи. Эта часть называется протопорфирином. В геме 4 атома азота пиррольных колец протопорфирина связаны с Fe2+, находящегося в центре молекулы. Апомиоглобин- белговая часть,первичная структрура из 153 аминокислот,кот во вторичной структуре уложены в 8 a-спиралей.a-спирали обознач. лат. буквами от А до Н,начиная с N конца полип. цепи и содержат от 7 до 23 аминокислот. для обозначен. аминокисл. используют либо порядков. номер (Гис 64) либо букву а-спирали и номер в этой спирали (Гис F8). Третичн. структура имеет вид компактной глобулы. Гем специфический лиганд апомиоглобина,присоединяется между F и E спиралями. Атом Fe2+ в геме имеет 6 координационных,4 из них связаны с атомами азота в пиррольном кольце,удерживают его в центре протопорфирина, 5 связана с Гис F8,6 связыв. с О2. Гис Е7 необходим для правильной ориентации и присоединении О2.Основная функция-связывание кислор. в мышцах.Миоглобин связывает О2,кот в капиллярах тканей высвобождает гемоглобин и сам может освобождать О2 при интенсивной физич нагрузке,возрастании потребности в мышечн. ткани. Имеет очень высокое сродство к О2. Маршевая миоглобинурия возникает при больших физических нагрузках на мышцы, преимущественно связанных с занятием спортом: интенсивная ходьба, кросс, длительные переходы, бег, лыжные гонки, плавание, езда на велосипеде. Развивается травматический миозит с повреждением клеточных мембран и выходом миоглобина в кровь, а затем миоглобинурия. Характерны выраженный мышечный болевой синдром, отечность, припухлость пораженных мышц, судороги (крампи), повышение температуры, увеличение СОЭ, высокий лейкоцитоз, сгущение крови. Поражаются почки и печень. Темно-коричневый цвет мочи. Это связано с высоким содержанием в моче миоглобина. Почечные канальцы забиваются распавшимся миоглобином и перестают функционировать,в итоге- острая почечная недостаточность.
