Гранулематоз Вегенера — справочник болезней — ЗдоровьеИнфо
При ранней диагностике и правильно подобранном лечении вы можете справиться с гранулематозом Вегенера в течение нескольких месяцев. Возможно, вам придется продолжать принимать назначенные лекарственные препараты в течение длительного времени, чтобы предотвратить рецидив. Даже если лечение может быть прекращено, вам необходимо регулярно посещать врача, чтобы он продолжал внимательно следить за вашим состоянием.
Лекарственные препараты
Обсудите с врачом, какие лекарственные препараты и в каких комбинациях могут быть назначены вам, и каковы возможные побочные эффекты. Ваше лечение зависит от того, какие органы поражены и насколько серьезны ваше состояние. Ваш врач может назначить:
- Кортикостероиды, позволяющие контролировать воспаление. Лекарственные препараты, такие как преднизолон, угнетают иммунную систему и уменьшают воспаление кровеносных сосудов.
- Другие препараты, подавляющие иммунную систему
Некоторые другие препараты могут угнетать функцию клеток иммунной системы, вызывающих воспаление. К ним относятся циклофосфамид, азатиоприн (Азасан, Имуран) и метотрексат (Реуматрекс, Трексолл).
К ним относятся циклофосфамид, азатиоприн (Азасан, Имуран) и метотрексат (Реуматрекс, Трексолл).
- Ритуксимаб (Ритуксан) является еще одним вариантом лечения гранулематозп Вегенера. Этот препарат может быть столь же эффективным, как циклофосфамид, в лечении тяжелых случаев заболевания, но с меньшим количеством побочных эффектов.
Даже после того, как состояние будет стабилизировано, вам придется продолжить прием некоторых препаратов на длительный срок, чтобы предотвратить развитие рецидива. К ним относятся ритуксимаб, метотрексат, азатиоприн и мофетил (Селлсепт). Исследование, в котором приняли участие около 150 человек, страдавших гранулематозом Вегенера, показало, что те, кто прекратил прием лекарственных препаратов или применял более низкие дозы, чем было назначено, имели более высокую частоту рецидивов.
Побочные лечения эффект
Препараты, используемые для лечения гранулематоза Вегенера могут вызывать серьезные побочные эффекты, такие как снижение способности вашего организма бороться с инфекцией. Ваш врач будет следить за вашим состоянием, в то время как вы принимаете их, и, возможно, назначит вам препараты, позволяющие предотвратить побочные эффекты, например:
Ваш врач будет следить за вашим состоянием, в то время как вы принимаете их, и, возможно, назначит вам препараты, позволяющие предотвратить побочные эффекты, например:
- Сульфаметоксазол/триметоприм (Бактрим, Септра) для предотвращения некоторых легочных инфекций
- Бисфосфонаты (Фосамакс), позволяющий предотвратить потерю костной ткани (остеопороз), связанную использованием преднизолона
- Фолиевую кислоту – синтетическую форму одного из витамином группы B, – чтобы предотвратить поражение кожи и другие симптомы, связанные со снижением содержания фолиевой кислоты в организме при использовании метотрексата.
Другие методы лечения
- Плазмаферез (плазмообмен). При этой процедуре удаляют жидкую часть крови (плазму), которая содержит различные патологические вещества. Ее замещают донорской плазмой или раствором белка, который вырабатывается печенью (альбумин). При тяжелом течении гранулематоза Вегенера проведение плазмафереза позволяет восстановить функцию почек.

- Трансплантация почки. Если заболевание прогрессирует, вам может понадобиться трансплантация почки для восстановления нормальной функции почек. Обсудите с врачом, показана ли вам эта операция. Это будет зависеть, в частности, от того, как другие органы пострадали от заболевания.
Вегенера гранулематоз › Болезни › ДокторПитер.ру
Гранулематоз Вегенера – заболевание из группы системных васкулитов. При этом заболевании поражаются верхние дыхательные пути, легкие и почки. Также это заболевание известно как некротическая гранулема верхних дыхательных путей с нефритом или болезнь Вегенера.
Признаки
Страдающие гранулематозом Вегенера обычно жалуются на затруднения носового дыхания, насморк, заложенность ушей, боли в ушах и снижение слуха. Это заболевание может проявляться кровотечениями из носа, ранками вокруг ноздрей, разрушением носового хряща. Из-за разрушения хряща форма носа меняется, он становится седловидным. Возможна перфорация мягкого и твердого нёба.
Со стороны легких заболевание проявляется кашлем, возможно с мокротой и кровью, болью в груди и одышкой.
У 80-90 % страдающих этим заболеванием поражаются почки. Это проявляется гематурией (кровью в моче), однако очевидных симптомов может и не быть. Часто факт поражения почек можно установить только по результатам анализов мочи (в моче у таких пациентов повышенное содержание белка), крови (азотемия) и биопсии почки, при которой выявляются некротические изменения клубочков. Гипертонии при поражении почек в этом случае нет.
У 50 % пациентов обнаруживаются поражения глаз – покраснение, двоение, боль в глазах, снижение зрения.
Примерно половину пациентов беспокоят боли в мышцах и суставах, припухлость суставов. Преимущественно поражаются крупные суставы.
На коже страдающих гранулематозом Вегенера образуются небольшие красные или фиолетовые язвы. Иногда они болят, но чаще безболезненны. Высыпания эти образуются над пораженными сосудами.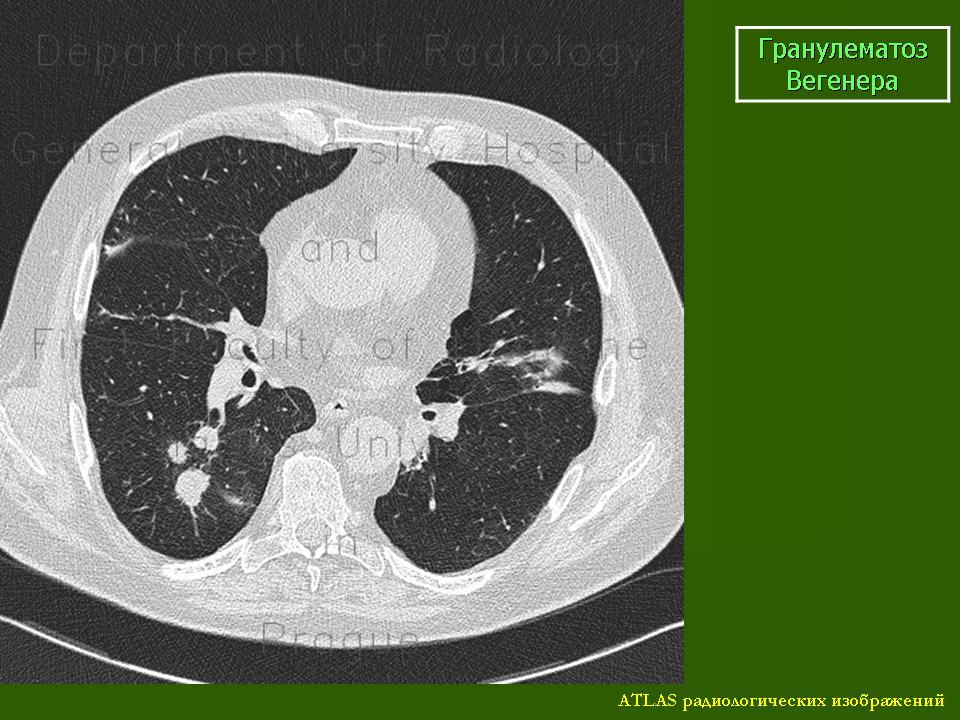
Все это сопровождается слабостью, лихорадкой, потерей аппетита, снижением веса, повышенным потоотделением по ночам. Возможны диарея, боли в области пупка и кишечные кровотечения.
Описание
Впервые это заболевание описал немецкий врач Фридрих Вегенер в 1930 году. Это редкое заболевание, точная его частота неизвестна. Обычно оно обнаруживается у европейцев в возрасте 30-40 лет, однако может начаться и в более раннем возрасте. Мужчины страдают этим заболеванием в 1,5-2 раза чаще, чем женщины.
Почему возникает гранулематоз Вегенера, неизвестно. Врачи предполагают, что это заболевание аутоиммунной природы, при котором организм сам борется со своими же тканями. Зато известно, что при этом заболевании воспаляются кровеносные сосуды. При этом на ограниченном участке сосудистой стенки образуются скопления клеток с патологической структурой – гранулемы. Из-за воспаления сосудов нарушается приток крови к органам, что в конечном итоге приводит к нарушению их работы.
Заболевание обычно протекает в четыре стадии. На начальной стадии развивается гранулематозно-некротическое воспаление верхних дыхательных путей.
На пульмональной стадии патологический процесс распространяется на трахею и бронхи.
На стадии генерализации патологический процесс распространяется на легкие, почки, селезенку, кожу, центральную нервную систему, кишечник, иногда на сердце, печень, щитовидную и предстательную железы.
Для терминальной стадии характерна почечная недостаточность без повышения артериального давления. Летальный исход наступает из-за легочной недостаточности, нарушения кровообращения, уремии и крайнего истощения.
Заболевание обычно возникает после перенесенного ОРВИ, бактериальной инфекции, вакцинации, антибиотикотерапии, переохлаждения. Но известны случаи, когда гранулематоз Вегенера развивался у здоровых людей.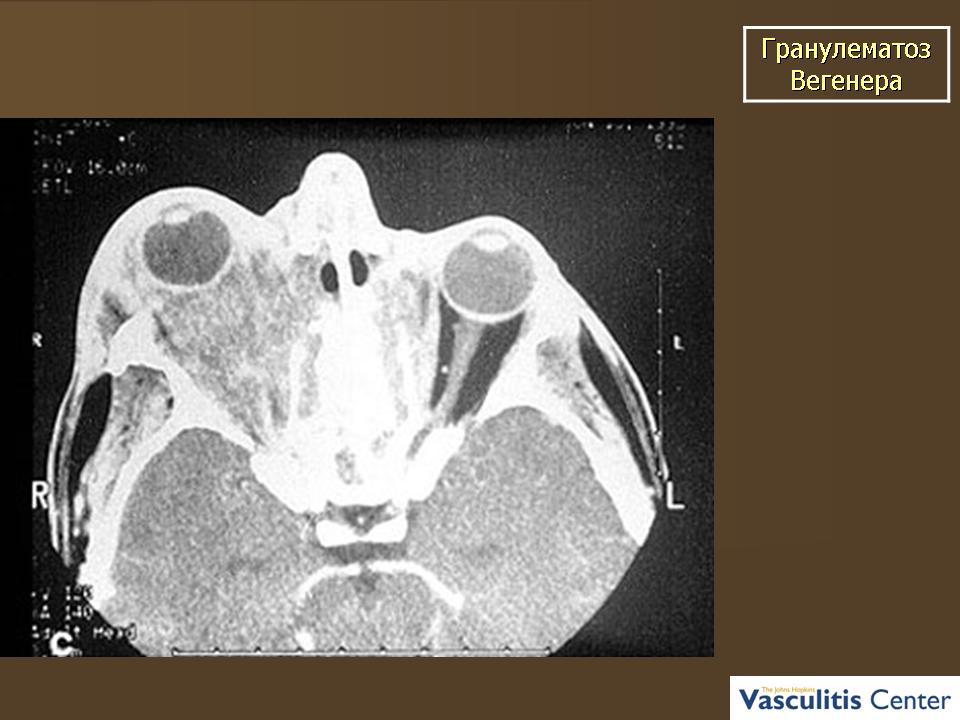
Выделяют две формы заболевания – локализованную, при которой поражаются лор-органы и/или глаза, и генерализованную, при которой поражаются и лор-органы, и глаза, и кожа, и почки, и сердце.
Течение этого заболевания может быть острым и подострым. При подостром течении все симптомы развиваются медленно. При остром же болезнь развивается быстро, генерализация процесса наступает через несколько недель.
Диагностика
Диагноз «гранулематоз Вегенера» ставит ревматолог. Для его подтверждения нужно собрать полную клиническую картину заболевания и пройти тщательное обследование.
Общий и биохимический анализы крови не подтверждают наличие гранулематоза Вегенера, а лишь исключают другие возможные заболевания.
Анализ мочи подтверждает или исключает поражение почек.
Часто назначается рентгенография грудной клетки и придаточных пазух, но компьютерная томография (КТ) более информативна, позволяет гораздо четче увидеть проявления этого заболевания.
Окончательный диагноз ставится после получения результатов биопсии. На анализ берут ткань из носа или горла с помощью бронхоскопа. Кроме того, делают биопсию почки и легких.
Лечение
Полностью вылечить гранулематоз Вегенера невозможно. Но с помощью правильно подобранных лекарств можно обеспечить длительную ремиссию. Для лечения обычно используют кортикостероиды, цитостатики и препараты, подавляющие иммунитет. К сожалению, у этих препаратов серьезные побочные эффекты и важно правильно подобрать лекарства так, чтобы свести побочные эффекты к минимуму.
Некротизированные (отмершие) участки тканей удаляют хирургическим путем.
При развитии почечной недостаточности назначают диализ или пересадку почек. Часто диализ приходится делать пожизненно.
Для лечения этого заболевания можно использовать методы экстракорпоральной гемокоррекции – плазмаферез, каскадную фильтрацию плазмы крови.
© Доктор Питер
Клиническое наблюдение пациентки с гранулематозом Вегенера Текст научной статьи по специальности «Клиническая медицина»
НАБЛЮДЕНИЯ ИЗ ПРАКТИКИ
УДК 616. 2-002.72-07-08
2-002.72-07-08
DOI: mЛ2737/artide_5a24d1a5eЮ0L09080009
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ ПАЦИЕНТКИ С ГРАНУЛЕМАТОЗОМ ВЕГЕНЕРА
В.В.Войцеховский1, М.В.Погребная1, Н.Д.Гоборов’, О.П.Фомина2, С.АХорячева1
1Федеральное государственное бюджетное образовательное учреждение высшего образования «Амурская государственная медицинская академия» Министерства здравоохранения Российской Федерации,
675000, г. Благовещенск, ул. Горького, 95 2Государственное автономное учреждение здравоохранения Амурской области «Амурская областная клиническая больница», 675027, г. Благовещенск, ул. Воронкова, 26
РЕЗЮМЕ
Приведен краткий обзор литературы, посвященный особенностям клинической картины, диагностики и лечения гранулематоза Вегенера. Продемонстрировано клиническое наблюдение пациентки с гранулематозом Вегенера из личной практики авторов. Проводился сложный дифференциальный диагноз между пневмониями различной этиологии, туберкулезом, раком легкого и грануле-матозным заболеванием. С учетом анамнеза и клинической картины заболевания (острого начала с лихорадкой, артралгиями, поражением слизистой носа и ротовой полости, легких, почек, синдрома Рейно, геморрагических высыпаний, дигитального васкулита), данных гистологического исследования материала трансбронхиальной биопсии ткани легкого, выставлен диагноз: гранулематоз Вегенера, генерализованная форма, с поражением верхних дыхательных путей, трахеобронхиального дерева, легких, сердца, почек, острое течение. Несмотря на адекватное лечение, заболевание прогрессировало с присоединением различных осложнений и был констатирован летальный исход.
Продемонстрировано клиническое наблюдение пациентки с гранулематозом Вегенера из личной практики авторов. Проводился сложный дифференциальный диагноз между пневмониями различной этиологии, туберкулезом, раком легкого и грануле-матозным заболеванием. С учетом анамнеза и клинической картины заболевания (острого начала с лихорадкой, артралгиями, поражением слизистой носа и ротовой полости, легких, почек, синдрома Рейно, геморрагических высыпаний, дигитального васкулита), данных гистологического исследования материала трансбронхиальной биопсии ткани легкого, выставлен диагноз: гранулематоз Вегенера, генерализованная форма, с поражением верхних дыхательных путей, трахеобронхиального дерева, легких, сердца, почек, острое течение. Несмотря на адекватное лечение, заболевание прогрессировало с присоединением различных осложнений и был констатирован летальный исход.
Ключевые слова: гранулематоз Вегенера, диагностика, лечение.
SUMMARY
CLINICAL OBSERVATION OF THE PATIENT WITH WEGENER’S GRANULOMATOSIS
V.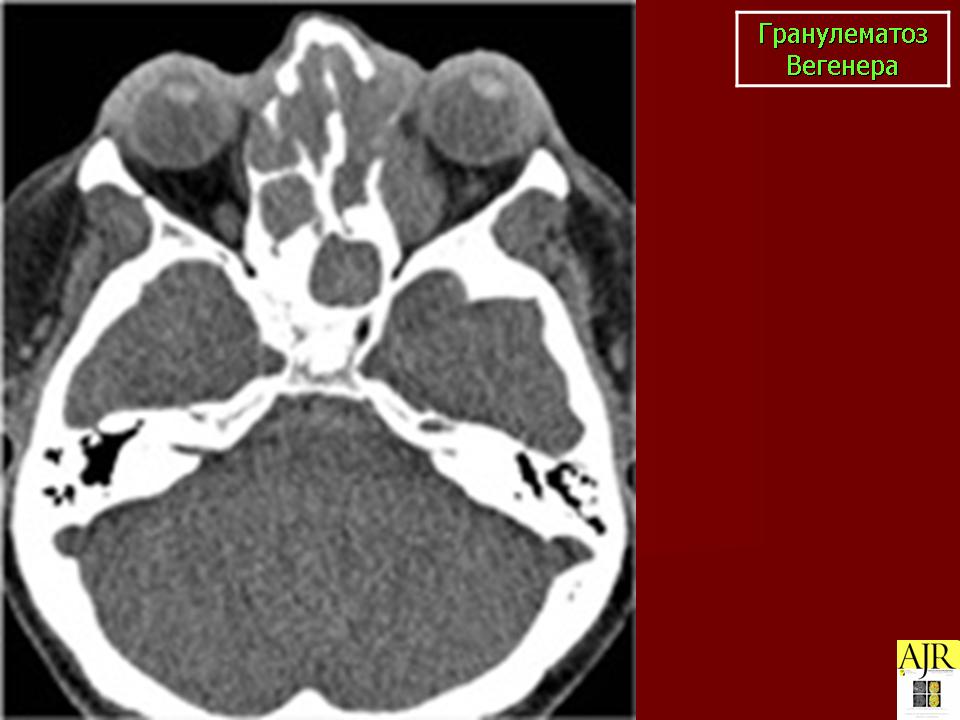
‘Amur State Medical Academy, 95 Gor’kogo Str., Blagoveshchensk, 675000, Russian Federation 2Amur Regional Clinical Hospital, 26 Voronkova Str., Blagoveshchensk, 675028, Russian Federation
A brief review of the literature is devoted to the peculiarities of the clinical picture, diagnosis and treatment of Wegener’s granulomatosis. The clinical observation of the patient with Wegener’s granulomatosis is made from the personal practice of the authors. A complex differential diagnosis was made between pneumonia of different etiology, tuberculosis, lung cancer and granulomatous disease. Taking into account anamnesis and clinical picture of the disease (acute onset with fever, arthralgia, nasal and oral mucosa damage, lungs, kidneys, Raynaud’s syndrome, hemorrhagic eruptions, digital vasculitis), histological examination of transbronchial lung tissue biopsy material diagnosed: Wegener’s granulomatosis, a generalized form, with the lesions of the upper respiratory tract, tracheobronchial tree, lungs, heart, kidneys, an acute course.
Key words: Wegener’s granulomatosis, diagnosis, treatment.
Гранулематоз Вегенера (ГВ) — аутоиммунное грану-
лематозное воспаление стенок сосудов, захватывающее мелкие и средние кровеносные сосуды — капилляры, венулы, артериолы и артерии, с вовлечением верхних дыхательных путей, глаз, почек, легких и других органов [10, 11]. Относится к системным некроти-зирующим васкулитам.
Первое сообщение об этом заболевании принадлежит H.Klinger. В 1939 г. F.Wegener детально описал синдром, включающий язвенно-некротические поражения верхних дыхательных путей и кожи, быстропро-грессирующий гломерулонефрит.
Точных данных о распространенности ГВ в Российской Федерации нет [13]. В США распространенность ГВ в популяции составляет 25-60 случаев на 1 млн населения, заболеваемость — 3-12 случаев на 1 млн человек [16]. ГВ может быть диагностирован в любом возрасте, но чаще в 40-65 лет. Очень редко выявляется в детском возрасте [17]. Считается, что заболевание одинаково часто встречается у мужчин и женщин [1]. В Европе ГВ несколько чаще выявляется у мужчин, чем у женщин 1,5:1 [21]. По данным С.В.Клименко [3] ГВ наблюдался в 1,6 раза чаще у женщин, чем у мужчин.
В США распространенность ГВ в популяции составляет 25-60 случаев на 1 млн населения, заболеваемость — 3-12 случаев на 1 млн человек [16]. ГВ может быть диагностирован в любом возрасте, но чаще в 40-65 лет. Очень редко выявляется в детском возрасте [17]. Считается, что заболевание одинаково часто встречается у мужчин и женщин [1]. В Европе ГВ несколько чаще выявляется у мужчин, чем у женщин 1,5:1 [21]. По данным С.В.Клименко [3] ГВ наблюдался в 1,6 раза чаще у женщин, чем у мужчин.
Причины развития этого злокачественного некротического васкулита до настоящего времени неизвестны. Выявлена генетическая предрасположенность пациентов, но роль наследственности в настоящее время не доказана. Придают значение развитию острой носоглоточной инфекции, длительному лечению антибиотиками, наличию очагов хронической инфекции. Роль инфекции бесспорна в качестве стимула рецидивов заболевания. Чаще всего они возникают при заражении пациента стафилококками, вирусами.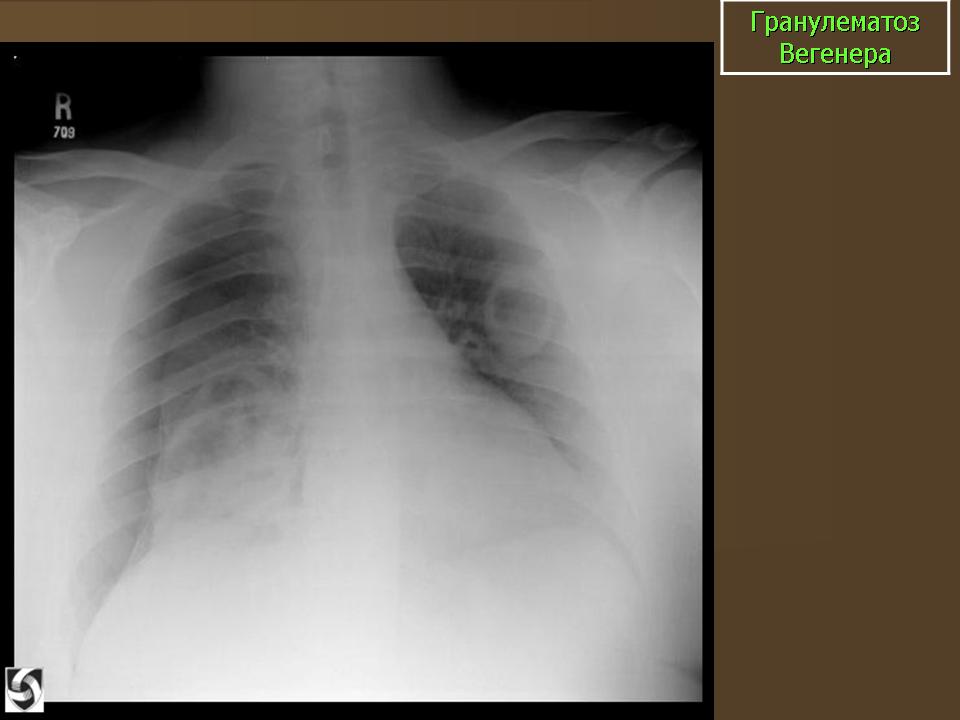 Высказывается предположение, что существует сложное взаимодействие между факторами окружающей среды и организмом человека [4]. Повреждение тканей ассоциируется с активацией клеточных иммунных реакций и воспалительных процессов.
Высказывается предположение, что существует сложное взаимодействие между факторами окружающей среды и организмом человека [4]. Повреждение тканей ассоциируется с активацией клеточных иммунных реакций и воспалительных процессов.
Важнейшим звеном патогенеза ГВ являются процессы, связанные с синтезом антител к цитоплазме нейтрофилов (АНЦА). АНЦА — это гетерогенная популяция аутоантител, реагирующих с различными ферментами цитоплазмы нейтрофилов, в первую очередь, с протеиназой-3 (эта разновидность антител выявляется при васкулите Вегенера чаще) и миелоперок-сидазой (при выявлении которой прогноз хуже) [18].
Протеиназа-3 и миелопероксидаза непосредственно связываются с нейтрофилами и моноцитами, циркулирующими в кровотоке. На мембранах последних локализованы рецепторы для связи с указанными иммуноглобулинами. Когда антитело связывается с рецептором, клетки становятся очень активными, они приобретают высокую протеолитическую активность. Данный факт обеспечивает воспаление и некротическую деструкцию сосудистой стенки. Эти процессы сопровождаются увеличением концентрации провоспалительных цитокинов, которые, в свою очередь, поддерживают воспалительный процесс, вовлекая новые клеточные и гуморальные элементы.
Данный факт обеспечивает воспаление и некротическую деструкцию сосудистой стенки. Эти процессы сопровождаются увеличением концентрации провоспалительных цитокинов, которые, в свою очередь, поддерживают воспалительный процесс, вовлекая новые клеточные и гуморальные элементы.
Морфологический субстрат заболевания — гранулёмы, сопровождающиеся некрозом.
ГВ — тяжелое, быстро прогрессирующее заболевание и без своевременно начатого лечения приводящее к смертельному исходу в течение 6-12 мес. [11]. Подразделяется на две формы: локальную и генерализованную. При локальной форме поражаются ЛОР органы (90% случаев) и глаза (15% случаев) с развитием ринита, назофарингита, синусита, евстахиита, отита, склерита, эписклерита, а также увеита [10, 11]. При генерализованной форме к вышеуказанным симптомам присоединяется поражение легких (80% случаев) в виде легочного гранулематозного васкулита, обычно заканчивающегося образованием легочных гранулём [10, 11]. Гранулёмы подвержены распаду с образованием каверн, что нередко сопровождается легочным кровотечением. У 2/3 пациентов наблюдается поражение почек в виде некротизирующего быстро-прогрессирующего гломерулонефрита [10, 11]. Достаточно часто ГВ протекает с развитием кожного васкулита (у 40% пациентов) и поражения периферической нервной системы (15%) с развитием асимметричной полинейропатии [10, 11]. У 5% больных описан перикардит [10, 11]. Заболевание начинается с общей слабости, пониженного аппетита и похудания. В последующем присоединяются лихорадка, артралгии и ми-алгии. Иногда выявляют симптомы реактивных артритов.
Гранулёмы подвержены распаду с образованием каверн, что нередко сопровождается легочным кровотечением. У 2/3 пациентов наблюдается поражение почек в виде некротизирующего быстро-прогрессирующего гломерулонефрита [10, 11]. Достаточно часто ГВ протекает с развитием кожного васкулита (у 40% пациентов) и поражения периферической нервной системы (15%) с развитием асимметричной полинейропатии [10, 11]. У 5% больных описан перикардит [10, 11]. Заболевание начинается с общей слабости, пониженного аппетита и похудания. В последующем присоединяются лихорадка, артралгии и ми-алгии. Иногда выявляют симптомы реактивных артритов.
Основной морфологический признак ГВ — гранулёмы, определяется только при гистологическом исследовании после биопсии пораженной ткани. Начальные изменения обнаруживаются в мелких артериях и венах. В результате последовательного чередования стадий отека, фибриноидного некроза в стенке сосуда и в окружающих тканях скапливаются гигантские многоядерные клетки. Они образуют особую структуру -гранулёму. ГВ характеризуется наличием васкулита малых и средних сосудов, «географическим» некрозом и гранулематозным воспалением, особенно дыхательных путей. Предполагается, что основу начального патологического поражения (гранулёмы) составляют клеточные иммунные процессы [1, 19].
Они образуют особую структуру -гранулёму. ГВ характеризуется наличием васкулита малых и средних сосудов, «географическим» некрозом и гранулематозным воспалением, особенно дыхательных путей. Предполагается, что основу начального патологического поражения (гранулёмы) составляют клеточные иммунные процессы [1, 19].
Поражение глаз. При ГВ воспалительный процесс затрагивает в основном белочную и радужную оболочку глаз. Нередко развитие увеита, иридоциклита, эписклерита, склерита, приводящих к перфорации роговицы и слепоте. Возможно образование периорби-тальной гранулёмы и экзофтальма.
Поражение лёгких. В легких образуются гранулёмы, нередко распадающиеся, что приводит к кровохарканью и развитию дыхательной недостаточности. У 1/3 пациентов гранулёмы клинически ничем себя не проявляют [12]. Возможно развитие плеврита, аускуль-тативно проявляющегося шумом трения плевры. Также может наблюдаться выпотной плеврит.
Гранулематозное воспаление альвеолярных капилляров и артериол легких приводит к развитию тяжелого легочного капиллярита. Развиваются инфильтраты, которые подвергаются деструкции с об-
разованием полостей, что способствует появлению кровохарканья и легочного кровотечения. Инфильтраты, которые могут расти и уменьшаться, часто вначале ошибочно принимают за пневмонию. При рентгенологическом исследовании наряду с инфильтратами может быть картина легочной диссеминации. Одностороннее выявление теней мелких узелков часто ошибочно интерпретируют как рак легкого. Как правило, отмечаются множественные узелки, расположенные билатерально и часто с наличием полости. Кроме того, установлено, что венозный тромбоз (в частности, тромбозы глубоких вен) и тромбоэмболии легочной артерии являются частым осложнением ГВ [1, 9]. Поэтому у пациентов с ГВ, предъявляющих жалобы на одышку, боль в груди или другие характерные симптомы, следует исключить тромбоэмболию легочной артерии [2, 9].
При определении степени поражения легких значительные преимущества имеют данные компьютерной томографии по сравнению с рентгенографией грудной клетки [2, 5]. Пациентам с подозрением на ГВ в числе основных исследований необходимо проведение компьютерной томографии (КТ) грудной клетки. При КТ у пациентов с ГВ выявляются различные изменения (за редким исключением прикорневых лимфоузлов и средостения), включая плевральный выпот и неспецифические инфильтраты. В легких, как правило, определяются множественные и двусторонние узелки и полости распада. Изменения часто располагаются на периферии легких и могут иметь клиновидную или округлую форму, что может быть ошибочно расценено как тромбоэмболия легочной артерии или злокачественное новообразование. [1].
Поражение верхних дыхательных путей, ротовой полости и органов слуха. Проявляется в виде упорного насморка с гнойно-геморрагическим отделяемым. В последующем развивается изъязвление слизистой оболочки. Возможна перфорация перегородки с развитием седловидной деформации носа (рис. 4). Помимо язвенно-некротического ринита возможно поражение трахеи, гортани, придаточных пазух носа, слуховых труб и ушей. Нередко возникновение язвенного стоматита.
В последующем развивается изъязвление слизистой оболочки. Возможна перфорация перегородки с развитием седловидной деформации носа (рис. 4). Помимо язвенно-некротического ринита возможно поражение трахеи, гортани, придаточных пазух носа, слуховых труб и ушей. Нередко возникновение язвенного стоматита.
Поражение нервной системы. Протекает в виде асимметричной полинейропатии.
Поражение кожи. Наблюдается кожный васкулит с язвенно-геморрагическими высыпаниями.
Поражение почек. Одной из излюбленных локализаций ГВ являются почечные клубочки. Гломерулонеф-рит проявляется гематурией и протеинурией, нередко имеет быстропрогрессирующее течение и приводит к быстро нарастающей почечной недостаточности. Бы-стропрогрессирующий нефрит является показанием к проведению биопсии почки. Поражение почек — третий главный признак ГВ, отмечаемый у 80-90% больных [7]. При этом в дебюте болезни симптомы почечной патологии присутствуют менее чем у 20% пациентов. В острую фазу заболевания размеры почек нормальные или несколько увеличены, их поверхность часто имеет
При этом в дебюте болезни симптомы почечной патологии присутствуют менее чем у 20% пациентов. В острую фазу заболевания размеры почек нормальные или несколько увеличены, их поверхность часто имеет
мелкие кровоизлияния; паренхима бледная, отёчная. При аутопсии примерно в 20% случаев отмечают папиллярный некроз, который клинически не был диагностирован [7]. Для острой стадии ГВ характерна картина фокального сегментарного некротизирующего гломерулонефрита с полулуниями. В наиболее тяжёлых случаях отмечают поражение практически всех клубочков, в которых, как правило, выявляют сегментарный некроз, охватывающий отдельные капиллярные петли, хотя возможен и тотальный некроз клубочковых капилляров. Количество клубочков с по-лулуниями варьирует в зависимости от тяжести процесса от 10 до 100%. По характеру расположения в клубочке, полулуния могут быть сегментарными, занимающими менее 50% окружности капсулы, или циркулярными. У 15-50% больных ГВ с поражением почек, по данным разных авторов, в биоптатах обнаруживают гранулематозные полулуния, содержащие мно-начисленные эпителиоидные и гигантские клетки. У некоторых больных гранулематозные полулуния сочетаются с обычными клеточными. В хронической стадии патологического процесса отмечают сегментарный или диффузный гломерулосклероз, фиброзные полулу-ния. В связи с быстрой эволюцией морфологических изменений явления гломерулосклероза могут сосуществовать с активным гломерулитом [7].
У некоторых больных гранулематозные полулуния сочетаются с обычными клеточными. В хронической стадии патологического процесса отмечают сегментарный или диффузный гломерулосклероз, фиброзные полулу-ния. В связи с быстрой эволюцией морфологических изменений явления гломерулосклероза могут сосуществовать с активным гломерулитом [7].
Тубулоинтерстициальные изменения при ГВ у небольшого числа больных могут быть представлены типичными интерстициальными гранулёмами. При аутопсийном исследовании примерно в 20% случаев выявляют васкулит восходящих vasa recta с развитием сосочкового некроза, который практически невозможно выявить при помощи чрескожной пункционной нефробиопсии и который, по-видимому, развивается чаще, чем диагностируется [8]. Хроническая стадия процесса характеризуется атрофией канальцев и фиброзом интерстиция. При иммуногистохимическом исследовании не обнаруживают депозитов иммуноглобулинов в сосудах и клубочках почек, что служит характерной особенностью малоиммунных васкулитов и гломерулонефрита, ассоциированных с наличием АНЦА [8].
Поражение оболочек сердца. Проявляется в виде различных видов перикардита. Поражение миокарда и эндокарда нехарактерно.
Диагностика. Критериями диагностики ГВ согласно Американской Коллегии Ревматологов являются: 1) воспаление носа и ротовой полости, развитие болезненных или безболезненных язв полости рта, гнойные или кровянистые выделения из носа; 2) патологические изменения на рентгенограмме легких, наличие узелков, фиксированных инфильтратов или полостей распада; 3) изменение мочевого осадка -микрогематурия или эритроцитарные цилиндры; 4) гранулематозное воспаление при биопсии, гистологические изменения в виде гранулематозного воспаления в пределах сосудистой стенки артерии или в перивас-кулярной или экстравазальной области (артерий или артериол) [16]. Необходимо наличие двух критериев
[16].
Исследование АНЦА. В настоящее время для выявления АНЦА широко используется методы имму-нофлюоресценции и иммуноферментного анализа. В диагностике ГВ оба исследования являются взаимодополняющими и их рекомендуется применять при подозрении на это заболевание [2, 14]. Отрицательные тесты АНЦА не исключают диагноз ГВ. Однако следует учитывать, что до 10% пациентов с активным не-леченным генерализованным ГВ при тестировании на АНЦА могут иметь отрицательные результаты, а при ограниченном ГВ в 30% и более случаев АНЦА могут не определяться [2, 15].
В настоящее время для выявления АНЦА широко используется методы имму-нофлюоресценции и иммуноферментного анализа. В диагностике ГВ оба исследования являются взаимодополняющими и их рекомендуется применять при подозрении на это заболевание [2, 14]. Отрицательные тесты АНЦА не исключают диагноз ГВ. Однако следует учитывать, что до 10% пациентов с активным не-леченным генерализованным ГВ при тестировании на АНЦА могут иметь отрицательные результаты, а при ограниченном ГВ в 30% и более случаев АНЦА могут не определяться [2, 15].
Для окончательного подтверждения диагноза ГВ требуется биопсия пораженного органа. Среди органов, поражение которых обычно происходит при ГВ, наиболее часто проводят биопсию следующих тканей: легкие, почки и верхние дыхательные пути (нос или его пазухи). При ГВ зоны некроза тканей часто настолько обширны, что их иногда называют «географическим некрозом». При этом даже при наличии всех трех патологических признаков (гранулематозного воспаления, васкулита и некроза) диагноз ГВ требует тщательной интеграции с клинической симптоматикой, лабораторными и радиологическими данными. Далеко не во всех случаях ГВ результаты биопсии дают положительный результат. Это зависит от стадии болезни, предшествующей терапии и частого присоединения инфекции. Так, полная диагностическая триада при биопсии верхних дыхательных путей (носа, придаточных пазух носа и подсвязочной области) определяется лишь в 15% случаев [13]. Однако биопсия верхних дыхательных путей, как правило, безопаснее, чем легких или почек. При типичной симптоматике ГВ отрицательные результаты гистологического исследования не опровергают клинического диагноза. Но даже выявление нескольких признаков триады при биопсии носа или синусов подтверждает диагноз ГВ только при условии наличия других признаков заболевания. При биопсии легкого у больных с ГВ патологический процесс представлен наиболее полно, что связано с забором большего количества ткани [13].
Далеко не во всех случаях ГВ результаты биопсии дают положительный результат. Это зависит от стадии болезни, предшествующей терапии и частого присоединения инфекции. Так, полная диагностическая триада при биопсии верхних дыхательных путей (носа, придаточных пазух носа и подсвязочной области) определяется лишь в 15% случаев [13]. Однако биопсия верхних дыхательных путей, как правило, безопаснее, чем легких или почек. При типичной симптоматике ГВ отрицательные результаты гистологического исследования не опровергают клинического диагноза. Но даже выявление нескольких признаков триады при биопсии носа или синусов подтверждает диагноз ГВ только при условии наличия других признаков заболевания. При биопсии легкого у больных с ГВ патологический процесс представлен наиболее полно, что связано с забором большего количества ткани [13].
При ГВ некротизирующий васкулит характеризуется возможным вовлечением артерий, вен и капилляров с наличием или без признаков гранулёмы. Некроз сосудов начинается со скопления нейтрофилов в стенке кровеносных сосудов (микроабсцессы), происходит перерождение тканей стенки сосуда с окружением из гистиоцитов. Слияние таких нейтрофильных микроабсцессов приводит к географическим некрозам. Однако результаты биопсии легкого далеко не всегда диагностически значимы, а тяжесть состояния больных может не позволить провести торакотомию; более показана трансбронхиальная биопсия с исследованием слизистой оболочки бронхов при их поражении [4]. Данные биопсии почки при ГВ являются неспецифичными (результаты могут быть подобны другим формам аутоиммунного гломерулонефрита). Обычно наблюдается некротизирующий гломерулит или гломерулонеф-
Некроз сосудов начинается со скопления нейтрофилов в стенке кровеносных сосудов (микроабсцессы), происходит перерождение тканей стенки сосуда с окружением из гистиоцитов. Слияние таких нейтрофильных микроабсцессов приводит к географическим некрозам. Однако результаты биопсии легкого далеко не всегда диагностически значимы, а тяжесть состояния больных может не позволить провести торакотомию; более показана трансбронхиальная биопсия с исследованием слизистой оболочки бронхов при их поражении [4]. Данные биопсии почки при ГВ являются неспецифичными (результаты могут быть подобны другим формам аутоиммунного гломерулонефрита). Обычно наблюдается некротизирующий гломерулит или гломерулонеф-
рит. Описаны случаи капиллярного некроза [20]. Пятилетняя выживаемость 18 больных ГВ с быстропро-грессирующим гломерулонефритом составила 67% [6].
Терапия. Комбинированная терапия системными глюкокортикоидами (СГК) и циклофосфамидом — основа лечения ГВ. Стандартная терапия основана на пе-роральном приеме циклофосфамида (2-3 мг/кг/сут) в сочетании с преднизолоном (1 мг/кг/сут). Лечение СГК в этой дозе продолжают до развития иммуносупрес-сивного эффекта цитостатика (около 4 недель), затем дозу преднизолона постепенно снижают (по 5 мг каждые 2 недели) или переводят больного на альтернирующий прием препарата (60 мг через день). Длительность такой терапии СГК зависит от индивидуального ответа пациента на нее.
Стандартная терапия основана на пе-роральном приеме циклофосфамида (2-3 мг/кг/сут) в сочетании с преднизолоном (1 мг/кг/сут). Лечение СГК в этой дозе продолжают до развития иммуносупрес-сивного эффекта цитостатика (около 4 недель), затем дозу преднизолона постепенно снижают (по 5 мг каждые 2 недели) или переводят больного на альтернирующий прием препарата (60 мг через день). Длительность такой терапии СГК зависит от индивидуального ответа пациента на нее.
У больных с быстропрогрессирующим заболеванием начальная доза цитостатика составляет не менее 3-5 мг/кг/сут. Одновременно назначаются СГК (2-15 мг/кг/сут). Такое лечение проводится в течение нескольких дней с последующим переводом больного на стандартный режим терапии.
Эффективной является ежемесячная пульс-терапия циклофосфамидом, особенно в течение первых месяцев от начала заболевания.
В последнее время для лечения больных ГВ без угрожающих для их жизни осложнений используют метотрексат (0,15-0,3 мг/кг/нед) в сочетании с высокими дозами преднизолона (1 мг/кг/сут). Низкие дозы метотрексата (0,3 мг/кг в/в 1 раз в нед) во многих случаях позволяют эффективно поддерживать индуцированную циклофосфамидом ремиссию у больных ГВ, но не могут использоваться в качестве основного метода лечения у пациентов с тяжелыми проявлениями заболевания.
Низкие дозы метотрексата (0,3 мг/кг в/в 1 раз в нед) во многих случаях позволяют эффективно поддерживать индуцированную циклофосфамидом ремиссию у больных ГВ, но не могут использоваться в качестве основного метода лечения у пациентов с тяжелыми проявлениями заболевания.
В последние годы для лечения ГВ используют ри-туксимаб [11].
При субглоточном стенозе гортани развитие угрожающих жизни осложнений может потребовать экстренной трахеотомии или плановой хирургической коррекции в сочетании с местным введением глюко-кортикоидов. Развитие острой дыхательной недостаточности на фоне диффузных альвеолярных геморрагий может потребовать искусственной вентиляции легких.
Учитывая значительную редкость заболевания, приводим клиническое наблюдение из личной практики авторов.
Больная Б., 1960 г. р. поступила в пульмонологическое отделение Амурской областной клинической больницы (АОКБ). Жалобы при поступлении: на выраженную слабость, повышение температуры тела до 39°С, кашель с мокротой слизистого характера, боли в горле и грудной клетке, усиливающиеся при кашле, одышку при незначительной физической нагрузке. Считает себя больной с июня 2010 г., когда стали беспокоить заложенность носа, боли в левой половине лица, глазах, отмечалось повышение температуры тела до 38°С. В июле 2010 г. была госпитализирована в гинекологическое отделение го-
р. поступила в пульмонологическое отделение Амурской областной клинической больницы (АОКБ). Жалобы при поступлении: на выраженную слабость, повышение температуры тела до 39°С, кашель с мокротой слизистого характера, боли в горле и грудной клетке, усиливающиеся при кашле, одышку при незначительной физической нагрузке. Считает себя больной с июня 2010 г., когда стали беспокоить заложенность носа, боли в левой половине лица, глазах, отмечалось повышение температуры тела до 38°С. В июле 2010 г. была госпитализирована в гинекологическое отделение го-
родской больницы, где проведено диагностическое выскабливание и рекомендовано оперативное лечение по поводу миомы матки. Операция была отсрочена в связи с нарушением сердечного ритма (экстрасисто-лия). Жалобы со стороны ЛОР-органов и лихорадка сохранялись. Получала лечение по поводу нарушения ритма в кардиохирургическом цетре, ритм восстановился, но сохранялись боли в области лица, носа и лихорадка до 38°С. Амбулаторно лечилась у ЛОР-врача, неоднократно проводились пункции гайморовых пазух, сопровождающиеся носовыми кровотечениями. В августе 2010 г. лечилась в ЛОР-отделении с диагнозом «хронический гайморит». Получала антибиотики, физиолечение. Отмечалось незначительное улучшение, уменьшились боли в области носа и лица, временно нормализовалась температура.
Амбулаторно лечилась у ЛОР-врача, неоднократно проводились пункции гайморовых пазух, сопровождающиеся носовыми кровотечениями. В августе 2010 г. лечилась в ЛОР-отделении с диагнозом «хронический гайморит». Получала антибиотики, физиолечение. Отмечалось незначительное улучшение, уменьшились боли в области носа и лица, временно нормализовалась температура.
В октябре 2010 г. после сильного переохлаждения повысилась температура тела, появились озноб, сухой кашель. Лечилась самостоятельно, принимала парацетамол, аспирин, но температура не понижалась, появились боли в горле и грудной клетке, кашель с мокротой слизистого характера, одышка при незначительной физической нагрузке, выраженная слабость. Самостоятельно обратилась в ЦРБИвановского района, где после рентгенографии органов грудной клетки был выставлен диагноз «двусторонняя пневмония», назначены антибиотики пенициллинового ряда, ами-ногликозиды. На фоне лечения состояние не улучшалось, и в ноябре 2010 г. больная была госпитализирована в пульмонологическое отделение АОКБ в крайне тяжелом состоянии (наблюдались выраженная слабость, снижение массы тела, гектиче-ская лихорадка, кровохарканье, одышка до 26 дыханий в минуту). При осмотре: бледность кожного покрова, единичные подкожные кровоизлияния в области предплечий, правой ягодицы, пастозность голеней, стоп. В легких дыхание везикулярное, слева под ключицей -бронхиальное, хрипов нет. Границы относительной тупости сердца в пределах нормы, тоны сердца ритмичные, ЧСС 114 уд/мин., АД 130 и 80 мм рт. ст. Живот при пальпации мягкий, безболезненный, нижний край печени не выступает из-под реберной дуги, селезенка не увеличена. Симптом поколачивания отрицательный с обеих сторон.
больная была госпитализирована в пульмонологическое отделение АОКБ в крайне тяжелом состоянии (наблюдались выраженная слабость, снижение массы тела, гектиче-ская лихорадка, кровохарканье, одышка до 26 дыханий в минуту). При осмотре: бледность кожного покрова, единичные подкожные кровоизлияния в области предплечий, правой ягодицы, пастозность голеней, стоп. В легких дыхание везикулярное, слева под ключицей -бронхиальное, хрипов нет. Границы относительной тупости сердца в пределах нормы, тоны сердца ритмичные, ЧСС 114 уд/мин., АД 130 и 80 мм рт. ст. Живот при пальпации мягкий, безболезненный, нижний край печени не выступает из-под реберной дуги, селезенка не увеличена. Симптом поколачивания отрицательный с обеих сторон.
Клинический анализ крови: гемоглобин — 77 г/л, эритроциты — 2,68*1012/л, СОЭ — 30 мм/час, лейкоциты — 16,8* 109/л, палочкоядерные — 3%, сегменто-ядерные — 72%, эозинофилы — 12%, лимфоциты — 8%, моноциты — 7%, тромбоциты — 540*109/л.
Биохимический анализ крови: глюкоза — 5,0 ммоль/л, билирубин общий — 8,6 мкм/л, непрямой — 7,0 мкм/л, прямой — 1,4 мкм/л, АЛАТ — 2,8, АСАТ — 9,5, мочевина — 3,2 ммоль/л, креатинин — 135 ммоль/л, сиаловые кислоты — 160, церулоплазмин — 183, тимоловая проба -1,0, холестерин — 5,5 ммоль/л, щелочная фосфатаза -160, фибриноген — 4652 г/л, ПТИ-100%. Общий анализ мочи: белок — 1275 г/л, сахар — нет, эритроциты -много, лейкоциты — до 15 в поле зрения. Анализ мочи по Нечипоренко: лейкоциты — 16200, эритроциты —
125100.
Посев крови на гемокультуру (трехкратно) — стерильная. Общий анализ мокроты: характер — слизистый, вязкая, плоский эпителий — сплошь, КУМ (трехкратно) — не обнаружены. Посев мокроты на микрофлору и чувствительность к антибиотикам: пневмококк xlÜ8, клебсиелла xlO8, чувствительные к пенициллинам, цефалоспоринам, аминогликозидам.
ЭКГ: Синусовая тахикардия, 100уд. в мин., эл. ось расположена горизонтально, повышена нагрузка на правый желудочек.
На рентгенограмме органов грудной клетки: справа, на фоне диффузного усиления легочного рисунка, в средних и нижних отделах определяются мелкоочаговые множественные тени, сливающиеся между собой; снижена пневматизация легочной ткани нижних отделов левого легкого за счет инфильтрации, корни легких расширены (рис. 1).
При КТ (кроме изменений, выявленных на рентгенограммах) — признаки шаровидного инфильтрата нижней доли (S10) левого легкого с явлениями распада, как проявление основного заболевания (рис. 2).
Учитывая, что у пациентки уже с сентября 2010 г. наблюдались изменения в легких при отсутствии выраженных клинических проявлений, больная была осмотрена фтизиатром. Резистентность к антибактериальной терапии позволила заподозрить в данном случае туберкулез легких, в связи с чем пациентка была переведена в областной противотуберкулезный диспансер для проведения терапии ex juvantibus. На фоне лечения противотуберкулезными препаратами положительной динамики не отмечалось, состояние больной прогрессивно ухудшалось, появились боли в коленных суставах, дистальных фалангах пальцев кистей рук, цианотичная окраска ногтевой фаланги III пальца правой кисти и II-III — левой, рентгенологически — отрицательная динамика, увеличение инфильтрации легочной ткани. Заключение КЭК: по клинико-лабораторным, рентгенологическим данным — активного туберкулеза легких нет.
Резистентность к антибактериальной терапии позволила заподозрить в данном случае туберкулез легких, в связи с чем пациентка была переведена в областной противотуберкулезный диспансер для проведения терапии ex juvantibus. На фоне лечения противотуберкулезными препаратами положительной динамики не отмечалось, состояние больной прогрессивно ухудшалось, появились боли в коленных суставах, дистальных фалангах пальцев кистей рук, цианотичная окраска ногтевой фаланги III пальца правой кисти и II-III — левой, рентгенологически — отрицательная динамика, увеличение инфильтрации легочной ткани. Заключение КЭК: по клинико-лабораторным, рентгенологическим данным — активного туберкулеза легких нет.
Больная вновь переведена в пульмонологическое отделение АОКБ. При бронхоскопии: слизистая трахеи и всех бронхов гиперемирована, истончена, с участками изъязвлений; на слизистой, в основном, правых бронхов, мелкобугристые образования, покрытые фибрином, с гнойным налетом; заключение: язвенный эн-добронхит, преимущественно справа, ИВ II ст.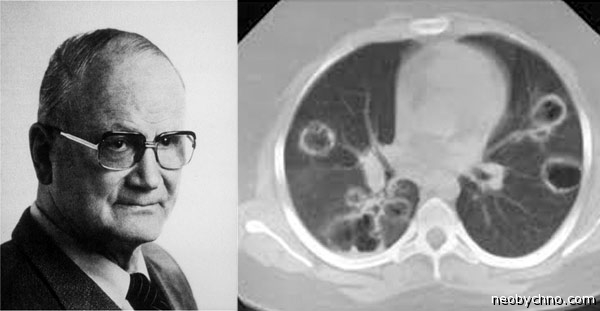 По данным трансбронхиальной браш-биопсии выявлены клетки, подозрительные на низкодифференцирован-ный рак.
По данным трансбронхиальной браш-биопсии выявлены клетки, подозрительные на низкодифференцирован-ный рак.
Однако клиническая картина заболевания с его по-лисиндромностью, вовлечением в патологический процесс многих систем организма, не укладывалась в данный диагноз, в связи с чем была проведена повторная трансбронхиальная биопсия. Гистологическое исследование биоптата: на фоне некротических масс, увеличенного количества лимфоцитов имеется выраженная пролиферации цилиндрического эпителия, большая часть клеток изменена, обнаружена поли-
морфноклеточная гранулёма с многоядерными гигантскими клетками.
ЭхоКГ: Камеры сердца не расширены, сократительная способность миокарда сохранена, небольшое количество свободной жидкости в полости перикарда.
УЗИ: размеры печени в пределах нормы, дополнительных образований в паренхиме не выявлено, структурные изменения поджелудочной железы, в левой плевральной полости — свободная жидкость.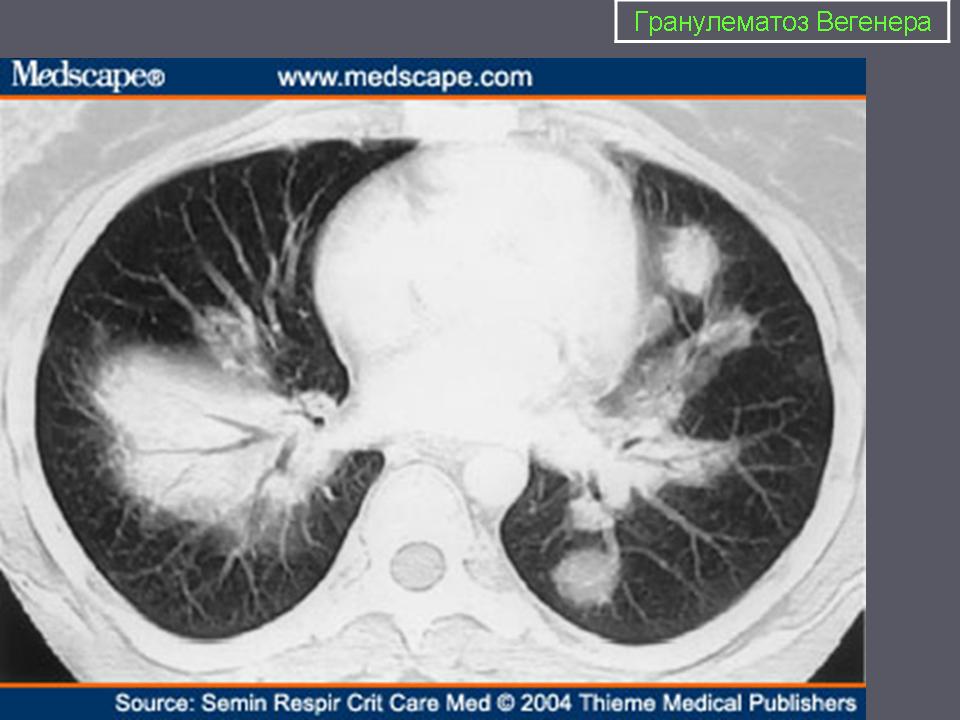
Учитывая жалобы на боли в горле и полости носа, пациентка осмотрена ЛОР-врачом, на поверхности языка, задней стенке глотки, носовой перегородки отмечены язвенно-некротические участки с кровоточивостью.
Консультация офтальмолога: глазное дно — диск зрительного нерва бледно-розового цвета, границы четкие, соотношение сосудов сохранено, очаговых изменений нет. УЗИ орбит: структура ретробульбар-ной клетчатки неоднородная, больше справа, дополнительных образований нет.
С учетом анамнеза и клинической картины заболевания, острого начала с лихорадкой, артралгиями, поражения слизистой носа и ротовой полости, легких, почек, синдрома Рейно, геморрагических высыпаний, дигитального васкулита, данных гистологического исследования материала трансбронхиальной биопсии ткани легкого выставлен диагноз: Гранулематоз Ве-генера, генерализованная форма, с поражением верхних дыхательных путей, трахеобронхиального дерева, легких, сердца, почек, острое течение. Вторичная двусторонняя пневмония, ДН II-III ст.
Вторичная двусторонняя пневмония, ДН II-III ст.
Назначено лечение: преднизолон — 60 мг/сут. per os, 90 мг — в/в №5, циклофосфан — 200 мг/сут в/в, ципроф-локсацин — 400 мг/сут в/в, пентоксифиллин — 5,0 в/в, панангин — 10,0 в/в, дезинтоксикационная и другая симптоматическая терапия. В стационаре у пациентки развилась клиника сухой гангрены концевой фаланги IV пальца правой кисти (рис. 3), в связи с чем была произведена экзартикуляция фаланги. В дальнейшем, на фоне проводимой терапии наблюдалась положительная динамика, уменьшились одышка, кашель, боли в грудной клетке, нормализовалась температура тела, улучшилось общее самочувствие.
В клиническом анализе крови нормализовались показатели гемоглобина, эритроцитов, уменьшились СОЭ и лейкоцитоз, в анализах мочи снизилась проте-инурия до 50 г/л. Отмечена также положительная динамика при бронхоскопии, рентгенологическая динамика — в виде уменьшения инфильтрации легочной ткани, количества жидкости в плевральной полости. В связи с улучшением состояния больная была выписана из стационара с дальнейшим лечением по месту жительства, рекомендована доза преднизолона — 60 мг в сутки, с последующим снижением до поддерживающей, циклофосфан — 200 мг 2 раза в неделю.
В связи с улучшением состояния больная была выписана из стационара с дальнейшим лечением по месту жительства, рекомендована доза преднизолона — 60 мг в сутки, с последующим снижением до поддерживающей, циклофосфан — 200 мг 2 раза в неделю.
В течение последующего времени больная наблюдалась ревматологом АОКП, терапевтом по месту жительства, находилась на плановом лечении в ревматологическом отделении АОКБ. Получала поддер-
живающую дозу циклофосфана 200 мг 1 раз в 2 недели, затем — 1 раз в месяц, преднизолон в дозе 5 мг/сут. Получала также нестероидные противовоспалительные препараты, препараты кальция, калия — курсами, симптоматическую терапию. На фоне проводимого лечения отмечалась непродолжительная временная положительная динамика. Однако в дальнейшем гранулематозный процесс рецидивировал. Со временем сформировалась седловидная деформация носовой перегородки (рис. 4).
В дальнейшем присоединился двусторонний экссу-дативный плеврит.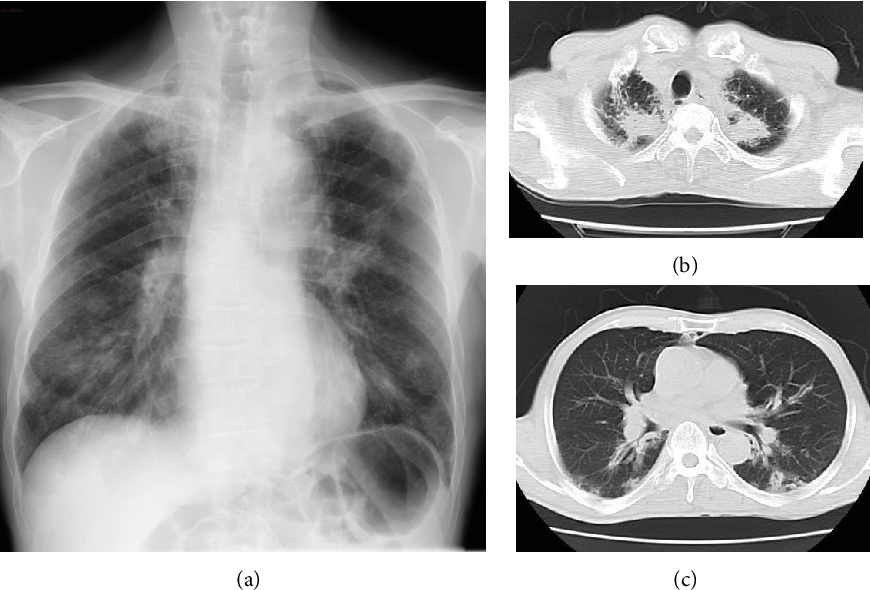 Анализ плевральной жидкости: геморрагического характера, мутная, уд. вес — 1016, белок 1,65%, проба Ривальта положительная; цитологическое исследование: в мазках на фоне эритроцитов определяется большое количество лимфоцитов -98%.
Анализ плевральной жидкости: геморрагического характера, мутная, уд. вес — 1016, белок 1,65%, проба Ривальта положительная; цитологическое исследование: в мазках на фоне эритроцитов определяется большое количество лимфоцитов -98%.
В феврале 2012 г. в связи с появлением одышки при незначительной физической нагрузке, сердцебиения, повышения температуры тела до 38-39°С, больная была госпитализирована в ревматологическое отделение АОКБ, где при проведении рентгенографии, эхо-кардиографии был выявлен выпот в полости перикарда (60-70 мл). В анализе крови: анемия, лейкоцитоз, эозинофилия (25%), увеличение СОЭ, увеличение АСАТ. В анализах мочи — протеинурия, гематурия. В связи с этим было решено увеличить дозу циклофос-фана до 200 мг через день, преднизолона — до 30 мг в сутки. К лечению был присоединен ритуксимаб. В начале 2012 г. появились боли в правом тазобедренном суставе, усиливающиеся вечером, повышение АД до 140 и 100 мм рт. ст. Рентгенограмма тазобедренных суставов: умеренное сужение суставной щели в правом тазобедренном суставе, стушеванность контуров головки и нижнего отдела суставной впадины, в головке бедренной кости справа — участки просветления размерами до 11 мм. Заключение: рентгенологические признаки асептического некроза головки правой бедренной кости. Двусторонний коксартроз II ст. Консультирована ортопедом: Асептический некроз головки бедренной кости справа. Двусторонний коксартроз, R-II ст., НФСII. Оперативное лечение не показано.
Заключение: рентгенологические признаки асептического некроза головки правой бедренной кости. Двусторонний коксартроз II ст. Консультирована ортопедом: Асептический некроз головки бедренной кости справа. Двусторонний коксартроз, R-II ст., НФСII. Оперативное лечение не показано.
Заболевание прогрессировало, присоединялись новые осложнения ГВ. В 2012 г. диагноз звучал так: Гранулематоз Вегенера, активность III степени, генерализованная форма, с поражением верхних дыхательных путей (атрофический ринит, в слизистой носа гранулематозное воспаление, поражение носовой перегородки с формированием седловидной деформации носа, рецидивирующие носовые кровотечения), глаз (двусторонний экзофтальм), сердца (перикардит), печени (гранулематозный процесс), легких (прогрессирующий гранулематозный процесс в обоих легких с формированием инфильтратов и образованием очагов деструкции и полостей распада, двусторонний плеврит), слизистой полости рта (генерализованный катаральный гингивит), околоушных желёз (двусторонний паротит), суставов и
костной ткани (сухая гангрена концевой фаланги IV пальца правой кисти, олигоартрит, асептический некроз головки бедренной кости), почек (прогрессирующий гломерулонефрит). Осложнения: Хроническая почечная недостаточность; анемия хронического заболевания, тяжелой степени.
Осложнения: Хроническая почечная недостаточность; анемия хронического заболевания, тяжелой степени.
Рис. 1. Больная Б., гранулематоз Вегенера. Обзорная рентгенограмма. Справа легочный рисунок диф-фузно усилен, в средних и нижних отделах определяются мелкоочаговые множественные тени, сливающиеся между собой. В нижних отделах левого легкого снижена пневматизация легочной ткани за счет инфильтрации. Корни легких расширены.
Рис. 3. Больная Б., гранулематоз Вегенера. Сухая гангрена концевой фаланги IV пальца правой кисти.
Данный случай представляет сложности диагностики редкого некротизирующего васкулита — грануле-матоза Вегенера. Проводился сложный дифференциальный диагноз между пневмониями различной этиологии, туберкулезом, раком легкого и гра-нулематозным заболеванием. С учетом анамнеза и клинической картины заболевания, острого начала с лихорадкой, артралгиями, поражением слизистой носа
Несмотря на проводимую терапию, заболевание прогрессировало.10) левого легкого с явлениями распада.
Рис. 4. Больная Б., гранулематоз Вегенера. Седловидная деформация носа.
и ротовой полости, легких, почек, синдрома Рейно, геморрагических высыпаний, дигитального васкулита, данных гистологического исследования материала трансбронхиальной биопсии ткани легкого, был выставлен диагноз: гранулематоз Вегенера, генерализованная форма, с поражением верхних дыхательных путей, трахеобронхиального дерева, легких, сердца, почек, острое течение. Несмотря на адекватное лече-
ние, заболевание прогрессировало с присоединением различных осложнений, и был констатирован летальный исход. Авторы выражают надежду, что изложение данного клинического случая гранулематоза Вегенера окажет помощь коллегам при необходимости диагностики и дифференциальной диагностики некротизи-рующих васкулитов.
ЛИТЕРАТУРА
1. Беловол А.Н., Князькова И.И., Шаповалова Л.В. Гранулематоз Вегенера (гранулематоз с полиангиитом) // Практична ангюлопя. 2012. №1-2. С.27-36. URL: https://angiology.com.ua/ua-issue-article-464#Granulema-toz-Vegenera-granulematoz-s-poliangiitom-
2. Войцеховский В.В., Ландышев Ю.С., Целуйко С.С., Лысенко А.В. Лейкемоидные реакции и эритро-цитозы. Благовещенск: Зея, 2013. 250 с.
3. Клименко С.В. Гранулематоз Вегенера: клинические особенности современного течения, прогностические факторы, исходы: автореф. дис. … канд. мед. наук. М., 2006. 20 с.
4. Коган Е.А., Корнев Б.М., Попова Е.Н., Фомин В.В. Гранулематоз Вегенера // Интерстициальные болезни легких / под ред. Н.А.Мухина. М.: Литтерра, 2007. С.386-399.
5. Ландышев Ю.С., Леншин А.В. Руководство по пульмонологии. Благовещенск: РИО, 2003. 183 с.
6. Мухин Н.А., Семенкова Е.Н., Макарьянц М.Л. Быстропрогрессирующий нефрит при гранулематозе Вегенера // I Съезд нефрологов России: сб. тезисов. Казань, 1994. С.85.
7. Нефрология. Национальное руководство / под ред. Н.А.Мухина. М.: ГЭОТАР-Медиа, 2009. 720 с.
8. Патология органов дыхания / под ред. В.С.Пау-кова. М.: Литтерра, 2013. 272 с.
9. Пульмонология. Национальное руководство / под ред. А.Г.Чучалина. М.: ГЭОТАР-Медиа, 2009. 960 с.
10. Ревматология. Национальное руководство / под ред. Е.Л.Насонова, В.А.Насоновой. М.: ГЭОТАР-Медиа, 2008. 714 с.
11. Ревматология. Российские клинические рекомендации / под ред. Е.Л.Насонова. М.: ГЭОТАР-Медиа, 2017. 464 с.
12. Респираторная медицина: в 2-х т. / под ред. А.Г.Чучалина. М.:ГЭОТАР-Медиа, 2007. Т. 1,2.
13. Смульская О.А. Гранулематоз Вегенера // Дис-семинированные заболевания легких / под ред. М.М.Ильковича. М.:ГЭОТАР-Медиа, 2011. С.137-195.
14. Csernok E.A., Ahlquist D., Ullrich S., Gross W.L. A critical evaluation of commercial immunoassays for an-tineutrophil cytoplasmic antibodies directed against proteinase 3 and myeloperoxidase in Wegener’s granulomatosis and microscopic polyangiitis // Rheumatology (Oxford). 2002. Vol.41, №11. P.1313-1317.
15. Finkielman J.D., Lee A.S., Hummel A.M., Viss M.A., Jacob G.L., Homburger H.A., Peikert T., Hoffman G.S., Merkel P. A., Spiera R., St Clair E.W., Davis J.C. Jr, McCune W.J., Tibbs A.K., Ytterberg S.R., Stone J.H., Specks U. ANCA are detectable in nearly all patients with
active severe Wegener’s Granulomatosis // Am. J. Med. 2007. Vol.120. №7. P.9-14.
16. Hunder G.G., Arend W.P., Bloch D.A., Calabrese L.H., Fauci A.S., Fries J.F., Leavitt R.Y., Lie J.T., Lightfoot R.W. Jr, Masi A.T., et al. The American College of Rheumatology 1990 criteria for the classification of vasculitis. Introduction // Arthritis and Rheum. 1990. Vol.33, №8.P. 1065-1067.
17. Lane S.E., Watts R., Scott D.G.I. Epidemiology of systemic vasculitis // Curr Rheumatol. Rep. 2005. Vol.7, №4. P.270-275.
18. Mareen P., Van De Walle S., Bernaert P., Van-houteghem H., Dierick J. Antineutrophil cytoplasmic antibodies (ANCA) and small vessel vasculitis // Acta Clin. Belg. 2003. Vol.58, №3. P.193-200
19. Savige J., Davies D., Falk R.J., Jennette J.C., Wiik A. Antineutrophil cytoplasmic antibodies and associated diseases: a review of the clinical and laboratory features // Kidney Int. 2000. Vol.57, №3. P.846-862.
20. Watanabe T., Nagafuchi Y., Yoshikawa Y., Toyoshima H. Renal papillary necrosis associated with Wegener’s granulomatosis // Hum. Pathol. 1983. Vol.14, №6. P.551-557.
21. Watts R.A., Lane S.E., Scott D.G., Koldingsnes W., Nossent H., Gonzalez-Gay M.A., Garcia-Porrua C., Ben-tham G.A. Epidemiology of vasculitis in Europe // Ann. Rheum. Dis. 2001. 60(12). P. 1156-1157.
REFERENCES
1. Belovol A.N., Knyaz’kova L.V., Shapovalova L.V., Wegener’s granulomatosis (granulomatosis with polyangi-itis). Praktichna angiologiya 2012; 1-2:27-36 (in Russian). Available at: www.angiology.com.ua/ua-issue-article-464#Granulematoz-Vegenera-granulematoz-s-poliangi-itom-
2. Voytsekhovskiy V.V., Landyshev Yu.S., Tseluyko S.S., Lysenko A.V. Leukemoid response and erythrocy-toses. Blagoveshchensk: Zeya; 2013 (in Russian).
3. Klimenko S.V. Wegener’s granulomatosis: clinical features of the current flow, prognostic factors, outcomes: abstract of PhD thesis. Moscow; 2006 (in Russian).
4. Kogan E.A., Kornev B.M., Popova E.N., Fomin VV Wegener’s granulomatosis. In: Mukhin N.A., editor. Interstitial lung diseases. Moscow: Litterra; 2007:386-399 (in Russian).
5. Landyshev Yu.S., Lenshin A.V. Manual on Pul-monology. Blagoveshchensk: RIO; 2003 (in Russian).
6. Mukhin N.A., Semenkova E.N., Makaryants M.L. Rapidly progressive nephritis with Wegener’s granulo-matosis. In: I Congress of Nephrologists of Russia: a collection of abstracts. Kazan’; 1994: 85 (in Russian).
7. Mukhin N.A. Nephrology. National guidelines. Moscow: GEOTAR-Media; 2009 (in Russian).
8. Paukov VS., editor. Pathology of the respiratory system. Moscow: Litterra; 2013 (in Russian).
9. Chuchalin A.G., editor. Pulmonology. National guidelines. Moscow: GEOTAR-Media; 2009 (in Russian).
10. Nasonov E.L., Nasonova V.A., editors. Rheumatology. National guidelines. Moscow: GEOTAR-Media; 2008
(in Russian).
11. Nasonov E.L., editor. Rheumatology. Russian clinical guidelines. Moscow: GEOTAR-Media, 2017 (in Russian).
12. Chuchalin A.G., editor. Respiratory medicine. Moscow: GEOTAR-Media; 2007 (in Russian).
13. Smulskaya O.A. Wegener’s granulomatosis. In: Ilkovich M.M., editor. Disseminated lung diseases. Moscow: GEOTAR-Media; 2011:137-195 (in Russian).
14. Csernok E.A., Ahlquist D., Ullrich S., Gross W.L. A critical evaluation of commercial immunoassays for an-tineutrophil cytoplasmic antibodies directed against proteinase 3 and myeloperoxidase in Wegener’s granulomatosis and microscopic polyangiitis. Rheumatology (Oxford) 2002; 41(11):1313-1317.
15. Finkielman J.D., Lee A.S., Hummel A.M., Viss M.A., Jacob G.L., Homburger H.A., Peikert T., Hoffman G.S., Merkel P.A., Spiera R., St Clair E.W., Davis J.C. Jr, McCune W.J., Tibbs A.K., Ytterberg S.R., Stone J.H., Specks U. ANCA are detectable in nearly all patients with active severe Wegener’s Granulomatosis. Am. J. Med. 2007; 120(7):643.e9-14.
16. Hunder G.G., Arend W.P., Bloch D.A., Calabrese L.H., Fauci A.S., Fries J.F., Leavitt R.Y., Lie J.T., Lightfoot
R.W. Jr, Masi A.T., et al. The American College of Rheumatology 1990 criteria for the classification of vasculitis. Introduction. Arthritis and Rheum. 1990; 33(8):1065-1067.
17. Lane S.E., Watts R., Scott D.G.I. Epidemiology of systemic vasculitis. Curr. Rheumatol. Rep. 2005; 7(4):270-275.
18. Mareen P., Van De Walle S., Bernaert P., Van-houteghem H., Dierick J. Antineutrophil cytoplasmic antibodies (ANCA) and small vessel vasculitis. Acta Clin. Belg. 2003; 58(3):193-200.
19. Savige J., Davies D., Falk R.J., Jennette J.C., Wiik A. Antineutrophil cytoplasmic antibodies and associated diseases: a review of the clinical and laboratory features. Kidney Int. 2000; 57(3):846-862.
20. Watanabe T., Nagafuchi Y., Yoshikawa Y., Toyoshima H. Renal papillary necrosis associated with Wegener’s granulomatosis. Hum. Pathol. 1983; 14(6):551-557.
21. Watts R.A., Lane S.E., Scott D.G., Koldingsnes W., Nossent H., Gonzalez-Gay M.A., Garcia-Porrua C., Ben-tham G.A. Epidemiology of vasculitis in Europe. Ann. Rheum. Dis. 2001; 60(12):1156-1157.
Поступила 01.11.2017
Контактная информация Валерий Владимирович Войцеховский, доктор медицинских наук, доцент, заведующий кафедрой госпитальной терапии с курсом фармакологии,
Амурская государственная медицинская академия, 675000, г. Благовещенск, ул. Горького, 95.
Е-mail: voitsehovsckij@yandex. ru Correspondence should be addressed to Valeriy V. Voytsekhovskiy,
MD, PhD, DSc, Associate Professor, Head of Department of Hospital Therapy with Pharmacology Course,
Amur State Medical Academy, 95 Gorkogo Str., Blagoveshchensk, 675000, Russian Federation.
Е-mail: voitsehovsckij@yandex. ru
Лечение гранулематоза вегенера — стоимость приема, запись к врачу на DocDoc.ru
Лоры (отоларингологи) Москвы — последние отзывы
По телефону договорился на конкретное время с клиникой, пришлось ждать почти 2 часа!!(и это был всего лишь 1 клиент). Когда попал на осмотр — врач выслушала, но не поняла с чем я пришел. Начала меня спрашивать вообще обо всех болячках, заполняя карту, вместо того чтобы обратить внимание на проблему с горлом. Предложила за доп оплату сделать анализы, которые впринципе ничего не скажут особо полезного. Горло осмотреть с первого раза нормально не вышло, из за рвотного рефлекса, но повторно я предложил — отказалась, хотя очевидно что не было видно ничего нормально. На вопросы о том что с горлом — переводила тему и говорила что всë не страшно, спасибо что хоть успокоила. Но дальше начался треш — минут 40 врач сидела в абсолютно допотопном ПК и пыталась найти что еще предложить на оплату — несмотря на мои протесты(я реально сидел почти час просто так!). На мои вопросы про горло не обращала вообще никакого внимания. Затем вручила мне талон на исследования по желанию, не объяснила когда анализы будут, что у меня, и что делать- просто позвала на ресепшен. Там отдала им чек, и собиралась уходить, как вспомнила что не выписала мне лекарства и не отдала бумагу(хорошо ещё что вообще спросила об этом). Оплатить оказалось тоже реально невесело — по телефону говорили что есть оплата картой, а по факту её нету — лишь сбер перевод на какие то карты по номерам. В итоге — купил все лекарства из списка, оплатил посещение и анализы — вышло 10000р, а пользы ноль, потому что как оказалось лекарства выписанные мне противопоказаны (и я четко говорил о аллергии на эти компоненты), просто по сути потратил деньги чтобы тебе сказали что ‘всë хорошо’. Да и в добромед этот я больше ни за что — ужасная клиника.
Аноним, 23 июня 2021
Доктор внимательный, хороший и не торопливый. Мне даже скорая ни чем не помогла. Она правильно определила болезнь, назначила мне грамотные лекарства, которые помогли снять ужасный болевой синдром. Специалист не навязывала мне лишние услуги. Сказала, что можно сдать анализы как в их клинике так и в другой. Я обращусь к ней повторно. Врач очень помогла!
Елена, 23 июня 2021
Мне понравился врач. У меня был фурункул. Он меня осмотрел, удалил фурункул и рассказал, что делать дальше. Специалист сделал все быстро и хорошо. Врач также перезвонил мне через пару дней и уточнил как все заживает. Профессиональный, внимательный и вежливый доктор. Я бы обратилась к нему порно, потому что знаю, что он хорошо работает.
Лена, 22 июня 2021
Приятный и компетентный врач. Он вызвал у меня позитивные эмоции. Доктор все доступно мне объяснил, провел аудиограмму, выявил дефекты и прописал лекарства.
Дмитрий, 21 июня 2021
Доктор удалила из ушей серные пробки и дала мне рекомендации. Она была профессиональная и приятная. Я узнал о враче через сберздоровья.
Леонид, 17 июня 2021
Хороший и профессиональный доктор. Она внимательно ко мне отнеслась, выслушала жалобы, подумала, приняла решение и выдала рекомендации. Я получил необходимую информацию.
Максим, 31 мая 2021
Хороший, отзывчивый и доброжелательный доктор. Она провела полную диагностику, назначила анализы и составила мне дальнейший план лечения. Меня немного огорчает, что доктор не выписала мне полноценное направление, потому что сейчас я немного блуждаю по клинкам, которые делают компьютерную томографию. Мне всегда навязывают две компьютерные томографии: лицевой части и мозга. Хотя по факту нужно было лицевой части. Меня очень хорошо проверили, и я доволен приемом. Я созвонился с врачом, и она мне сказала, что именно надо. Мне оперативно дали обратную связь.
Сергей, 29 мая 2021
Хороший, компетентный, профессиональный, добрый и опытный специалист. Мы много куда обращались. Она высказала свое мнение, которое отличалось от других. Надеюсь нам поможет лечение, которое нам прописали. Специалист отвлекала ребенка во время приема.
Павел, 21 мая 2021
Понравился профессионализм врача! Смог помочь и дать полезные рекомендации, провел необходимые процедуры. Ожидания оправдались. Спасибо вам!
Александр, 16 мая 2021
Доктор очень приятная, вежливая и участливая. Сделала все что можно было в условиях клиники, назначенное лечение принесло результаты.
Дарья, 22 апреля 2021
Показать 10 отзывов из 14361Гранулематоз Вегенера — причины, симптомы, диагностика и лечение
Гранулематоз Вегенера – системный некротический васкулит мелких вен и артерий с образованием гранулем в сосудистых стенках и окружающих тканях дыхательных путей, почек и др. органов. Гранулематоз Вегенера характеризуется язвенно-некротическим ринитом, изменениями гортани, придаточных пазух, инфильтрацией легочной ткани с распадом, быстропрогрессирующим гломерулонефритом, полиморфными высыпаниями на коже, полиартралгиями. Диагностика основана на оценке клинико-лабораторных, рентгенологических данных, результатов биопсии. При гранулематозе Вегенера показана гормональная и цитостатическая терапия; прогноз развития заболевания при генерализованной форме неблагоприятный.
Общие сведения
Заболеваемость гранулематозом Вегенера одинаково распространена среди мужчин и среди женщин в возрастной группе около 40 лет.
Классификация
С учетом распространенности патологических изменений гранулематоз Вегенера может протекать в локализованной либо генерализованной форме.
В развитии гранулематоза Вегенера выделяются 4 прогрессирующие стадии. Первая стадия гранулематозно-некротического васкулита, или риногенный гранулематоз, протекает с клиникой гнойно-некротического или язвенно-некротического риносинусита, ларингита, назофарингита, деструктивными изменениями костно-хрящевого остова носовой перегородки и глазницы. На следующей стадии (легочной) в патологический процесс вовлекается паренхима легких. При третьей стадии развиваются генерализованные поражения с заинтересованностью нижних дыхательных путей, ЖКТ, сердечно-сосудистой системы, почек. Последняя, терминальная стадия гранулематоза Вегенера характеризуется легочно-сердечной либо почечной недостаточностью, приводящей к гибели пациента в ближайший год от начала ее развития.
Симптомы
Общая симптоматика гранулематоза Вегенера включает лихорадку, ознобы, повышенное потоотделение, слабость, потерю массы тела, миалгии, артралгии, артриты. Ведущим проявлением заболевания, встречающимся у 90% пациентов, служит поражение верхних отделов дыхательных путей. Для клиники гранулематоза Вегенера типично упорное течение ринита, гнойно-геморрагическое отделяемое из носа, изъязвление слизистых оболочек вплоть до перфорации носовой перегородки, седловидная деформация носа. Гранулематозно-некротические изменения развиваются также в полости рта, гортани, трахее, слуховых ходах, придаточных пазухах носа.
У 75% пациентов с гранулематозом Вегенера определяются инфильтративные изменения в легочной ткани, деструктивные полости в легких, кашель с кровохарканьем, свидетельствующий о развитии плеврита плевральный выпот. Вовлечение почек проявляется развитием гломерулонефрита с явлениями гематурии, протеинурии, нарушений выделительной функции. Стремительно прогрессирующее течение гломерулонефрита при гранулематозе Вегенера приводит к острой почечной недостаточности. Изменения со стороны кожи проявляются геморрагической сыпью с последующей некротизацией элементов.
Поражение органов зрения включает развитие эписклерита (воспаления поверхностных тканей склеры), образование орбитальных гранулем, экзофтальм, ишемию зрительного нерва с ухудшением функции зрения вплоть до ее полной утраты. При гранулематозе Вегенера поражаются нервная система, коронарные артерии, миокард.
Локализованная форма гранулематоза Вегенера протекает с преимущественным поражением верхних дыхательных путей – упорным насморком, затруднением носового дыхания, носовыми кровотечениями, образованием кровянистых корочек в носовых ходах, осиплостью голоса. Генерализованная форма характеризуется различными системными проявлениями – лихорадкой, суставно-мышечными болями, геморрагиями, полиморфной сыпью, приступообразным надсадным кашлем с кровянисто-гнойной мокротой, абсцедирующей пневмонией, нарастанием сердечно-легочной и почечной недостаточности.
Диагностика гранулематоза Вегенера
Комплекс диагностических процедур при гранулематоза Вегенера включает консультацию ревматолога, лабораторные анализы, диагностические операции, рентгенологические исследования. Клиническое исследование крови обнаруживает нормохромную анемию, ускорение СОЭ, тромбоцитоз, общий анализ мочи – протеинурию, микрогематурию. При биохимическом анализе крови определяется повышение γ-глобулина, креатинина (при почечном синдроме), мочевины, фибрина, серомукоида, гаптоглобина. Иммунологическими маркерами гранулематоза Вегенера служат антигены класса HLA: DQW7, DR2, B7, B8; наличие антинейтрофильных антител, снижение уровня комплемента.
При рентгенографии легких в их ткани определяются инфильтраты, полости распада, плевральный экссудат. Проводят бронхоскопию с биопсией слизистых верхних дыхательных путей. При исследовании биоптатов выявляются морфологические признаки гранулематозно-некротизирующего васкулита.
Лечение гранулематоза Вегенера
При ограниченной и генерализованной форме гранулематоза Вегенера назначается иммуносупрессивная терапия циклофосфамидом в комбинации с преднизономом. Быстро прогрессирующее течение альвеолита или гломерулонефрита служит показанием к проведению комбинированной пульс-терапии высокими дозами метилпреднизолона и циклофосфамида. При переходе течения гранулематоза Вегенера в стадию ремиссии дозы циклофосфамида и преднизолона постепенно снижают; на длительный (до 2-х лет) срок назначают метотрексат.
Генерализация процесса при гранулематозе Вегенера (кровохарканье, гломерулонефрит, наличие антител к нейтрофильным лейкоцитам) требует проведения экстракорпоральной гемокоррекции — криоафереза, плазмафереза, каскадной фильтрации плазмы, экстракорпоральной фармакотерапии. При лечении рецидивирующего гранулематоза Вегенера эффективно проведение внутривенной иммуноглобулиновой терапии. С целью продления ремиссии может проводиться терапия ритуксимабом. Стенозирующие изменения гортани при гранулематозе Вегенера требуют наложения трахеостомы и реанастомоза.
Осложнения и прогноз
Течение и прогрессирование гранулематоза Вегенера может приводить к деструкции лицевых костей, глухоте вследствие стойкого отита, развитию некротических гранулем в легочной ткани, кровохарканью, трофическим и гангренозным изменениям стопы, почечной недостаточности, вторичным инфекциям на фоне приема иммуносупрессоров. При отсутствии терапии прогноз течения гранулематоза Вегенера неблагоприятный: 93% пациентов погибает в период от 5 месяцев до 2-х лет.
Локальная форма гранулематоза Вегенера протекает более доброкачественно. Проведение иммуносупрессивной терапии способствует улучшению состояния у 90 и стойкой ремиссии у 75% пациентов. Период ремиссии в среднем продолжается около года, после чего у 50% пациентов наступает новое обострение. Прогрессирующее течение ограниченного гранулематоза Вегенера, несмотря на иммуносупрессивную терапию, отмечается у 13% заболевших. Мероприятий по профилактике гранулематоза Вегенера не разработано.
Особенности течения некротизирующего респираторного гранулематоза у девочки 13 лет :: ТРУДНЫЙ ПАЦИЕНТ
И.Е.Колтунов1, М.Г.Кантемирова,В.А.Артамонова, Д.Ю.Овсянников, М.С.Савенкова, Л.В.Груздева, М.Халед, Ю.Ю.Новикова, П.С.Рогаткин, Л.Г.Кузьменко
Морозовская ДГКБ
РУДН
РНИМУ им.Н.И.Пирогова, Москва
Гранулематоз Вегенера (ГВ) или некротизирующий гранулематозный васкулит – это АНЦА-ассоциированный системный васкулит, встречающийся в основном у взрослых. Выделяют две формы ГВ: локализованную, которая чаще развивается у детей, и генерализованную. При генерализованной форме поражение легких у детей встречается исключительно редко. В представленном клиническом примере особенностями течения ГВ являлись: развитие генерализованной формы заболевания у девочки 13 лет с поражением кожи и слизистых, гломерулонефритом и быстро прогрессирующий инфильтративнодеструктивный процесс в легких.
Ключевые слова: гранулематоз Вегенера, системный васкулит, антинейтрофильные цитоплазматические антитела, детский возраст, генерализованная форма, гломерулонефрит, инфильтративно-деструктивные изменения в легких.
Peculiarities of necrotizing respiratory granulomatous in the 13 year old girl
I.E.Koltunov1, M.G.Kantemirova1,2, V.A.Artamonova2, D.Y.Ovsyannikov1,2, M.S.Savenkova3, L.V. Gruzdeva1, M.Haled2, Y.Y.Novikova2, P.S.Rogatkin1, L.G. Kuzmenko2
1Morozov Children City Hospital
2PFUR
3N.I.Pirogov RNRMU
Wegener’s granulomatosis (WG) or necrotizing granulomatous vasculitis – is ANCA-associated systemic vasculitis, which occurs mostly in adults. There are two forms of WG: the localized one, which usually occurs in children, and the generalized one. The generalized form of lung disease in children is extremely rare. In the illustrated example, clinical features of the flow WG were: a generalized form of the disease, the 13 year old girl with lesions of the skin and mucous membranes, rapidly progressive glomerulonephritis and infiltrative-destructive process in the lung.
Key words: Wegener’s granulomatosis, systemic vasculitis, anti-neutrophil cytoplasmic antibodies, child age, generalized form, glomerulonephritis, infiltrative-destructive changes in the lungs.
Сведения об авторах:
Колтунов И.Е. – главный врач ГБУЗ города Москвы «Морозовской детской городской клинической больницы Департамента здравоохранения города Москвы», д.м.н., профессор, Заслуженный врач Российской Федерации.
Кантемирова М.Г. – к.м.н., доцент кафедры педиатрии РУДН.
Согласно модифицированной классификации васкулитов у детей (S.Ozen et.al., 2006) [1], некротизирующий респираторный гранулематоз, или Гранулематоз Вегенера (ГВ), относится к группе васкулитов преимущественно мелких сосудов (артерий и вен).
ГВ, наряду с микроскопическим полиартериитом, – это «АНЦА-ассоциированный васкулит». Антинейтрофильные цитоплазматические антитела (АНЦА) выявляются у 89% больных и являются специфичным серологическим маркером данного васкулита. Заболевание характеризуется некротическим гранулематозом верхних и нижних дыхательных путей, глазной орбиты и гломерулонефритом [2, 3].
Пик заболеваемости ГВ приходится на 50–60 лет [4, 5]. В детском возрасте этот системный васкулит встречается редко, только 15% из заболевших лица моложе 19 лет [2]. У детей выделяют две клинические формы ГВ, различающиеся по наличию поражения почек: локализованную и генерализованную [2]. Риск развития генерализованной формы заболевания возрастает с увеличением возраста пациента [6]. При генерализованной форме наряду с гранулематозом дыхательных путей или глазной орбиты наблюдаются легочный, кожный, почечный синдромы. Однако вовлечение легких у детей в отличие от взрослых отмечается исключительно редко [2].
Приводим клиническое наблюдение течения ГВ у девочки К. 13 лет, поступившей в Морозовскую детскую городскую клиническую больницу г. Москвы 04.01.2012 г. При поступлении основными жалобами были боли в суставах и повышение температуры до 38,7°С, ребенок был направлен на госпитализацию с диагнозом: реактивный артрит. Из анамнеза жизни известно, что девочка родилась от 6-й беременности, протекавшей без осложнений, 4-х родов (1-я и 2-я беременности – мед.аборт, 3-и, 4-е, 5-е – роды). Масса тела – 3200 г, рост – 52 см, по шкале Апгар – 8–9 баллов. Раннее развитие без особенностей. Приложена к груди в 1-е сутки, выписана из роддома на
5-е сутки. Физическое и психомоторное развитие по возрасту. Профилактические прививки проводились в соответствии с принятым календарем, реакции не было. Последняя проба Манту от 31.10.2011 г. – 7 мм. Перенесенные заболевания: в 2 года – сальмонеллез, в 4 года – ветряная оспа, ОРЗ 4–5 раз в год. Аллергических проявлений не было, семейный анамнез без особенностей.
Первые признаки заболевания отмечались с начала декабря 2011 г., когда появилась немотивированная слабость, вялость, снижение аппетита, боли в коленных суставах. Ухудшение состояния возникло в первых числах января 2012 г.: высокая лихорадка, сильные боли в суставах.
При поступлении в стационар состояние расценивалось как среднетяжелое. Отмечались интоксикация, лихорадка – 38–39°С. Кожные покровы бледные, чистые. Носовое дыхание затруднено, зев умеренно гиперемирован. Отчетливой дефигурации суставов не выявлялось, имели место боли в покое и при физической нагрузке в коленных и левом лучезапястном суставах, движения в этих суставах болезненны, ограничены. Периферические лимфоузлы не увеличены. В легких везикулярное дыхание, хрипов нет. Границы сердца в пределах нормы, тоны громкие, ритмичные. Живот мягкий, безболезненный. Печень и селезенка не увеличены. Стул оформлен, окрашен. Мочеиспускание не нарушено. Менингеальных знаков нет.
При поступлении в крови отмечалась умеренная анемия (Нв – 106 г/л, эр. – 4,06×1012/л), лейкоцитоз (14,1×109), нейтрофилез (п/я нейтрофилы 1%, с/я – 89%), ускоренная СОЭ (24 мм/ч). В анализе мочи: протеинурия (белок – 0,126 г/л), микрогематурия (эритроциты – 3–5 в п/зр.). В сыворотке крови повышено содержание серомукоида (0,506 ед.), СРБ
(0,114 г/л при норме – Литература
1. Ozen S., Ruperto N., Dillon M.J. et.al. EULAR/PRes endorsed consensus criteria for the classification of childhood vasculitides. Ann.Phem.Dis. 2006; 65: 936–941.
2. Руководство по детской ревматологии / Под ред. Н.А. Геппе, Н.С. Подчерняевой, Г.А. Лыскиной. М.: ГЭОТАР-Медиа, 2011.
3. Finkielman J.D. et al. ANCA are detectable in nearly all patients with active severe Wegener’s granulomatosis. The American Journal of Medicine. 2007; 120: 7: 643: e9–e14.
4. Mahr A, Guillevin L, Poissonnet M, Ayme S. Prevalences of polyarteritis nodosa, microscopic polyangiitis,Wegener’s granulomatosis, and Churg-Strauss syndrome in a French urban multiethnic population in 2000: a capture-recapture estimate. Arthritis Rheum 2004; 51 (1): 92–99.
5. Reinhold-Keller E, Herlyn K, Wagner-Bastmeyer R, Gross WL. Stable incidence of primary systemic vasculitides over five years: results from the German vasculitis register. Arthritis Rheum. 2005; 53 (1): 93–99.
6. Akikusa J.D., R. Schneider R., Harvey E.A. et al. Clinical Features and Outcome of Pediatric Wegener’s Granulomatosis Arthritis & Rheumatism (Arthritis Care & Research). 2007; 57: 5: 15: 837–844.
Поражение верхних дыхательных путей при АНЦА-ассоциированных васкулитах. Клиническая фармакология и терапия
АНЦА-ассоциированные васкулиты (ААВ) – это группа системных аутоиммунных заболеваний, характеризующихся воспалительным некротизирующим поражением стенок преимущественно мелких (капилляры и венулы) и, существенно реже, средних сосудов различных органов , а также частым наличием антинейтрофильных цитоплазматических аутоантител (АНЦА) в сыворотке крови. К первичным ААВ относят гранулематоз с полиангиитом (ГПА), микроскопический полиангиит (МПА) и эозинофильный гранулематоз с полиангиитом (ЭГПА), а также АНЦА-ассоциированный васкулит с изолированным поражением почек [1]. Выделяют также вторичные васкулиты, которые могут сопровождаться образованием АНЦА, например, лекарственный васкулит, вызванный приемом кокаина, смешанного с левамизолом [2]. Язвенно-некротическое поражение кожи возникает спустя несколько дней после употребления левамизола, при этом гистологически определяется лейкоцитокластический васкулит с фибриноидным некрозом сосудистых стенок и фибриновыми тромбами в мелких сосудах кожи. Поражение слизистой оболочки ВДП связано в первую очередь не с васкулитом, а с местным раздражающим действием кокаина в составе смеси.
Поражение верхних дыхательных путей встречается при всех ААВ, а у части пациентов может быть первым и в течение длительного времени единственным проявлением системного заболевания. Так, по данным J. Wojciechowska и соавт., от появления первых симптомов поражения ВДП до установления диагноза ГПА или МПА в среднем проходит 14,5 месяцев [3].
Варианты поражения ВДП при ААВ
Гранулематоз с полиангиитом. ГПА (ранее гранулематоз Вегенера) – это системный васкулит, характеризующийся наличием гранулематозного воспаления и развитием некротического поражения мелких и средних сосудов [4]. Заболевание может поражать все органы, однако наиболее частыми мишенями оказываются верхние и нижние дыхательные пути, а также почки [5]. ГПА обычно развивается у людей среднего и старшего возраста (40–50 лет), в равной степени у мужчин и женщин [6], хотя среди российских пациентов преобладали женщины (60%). Средний возраст больных на момент начала заболевания не превышает 40 лет [7].
Заболеваемость ГПА зависит от географического региона. Например, в Великобритании заболеваемость ГПА составляет 14 случаев на один миллион населения в год, а распространенность – 134,9 случаев на миллион населения [8]. В Новой Зеландии заболеваемость ГПА находится на том же уровне – 15 случаев на миллион населения [9]. В странах Азии заболеваемость ГПА в целом ниже и варьируется от 0,37 до 2,1 случаев на миллион населения в год, а распространенность заболевания в Китае составляет 19,4 случая на миллион [10]. К сожалению, имеющихся на данный момент российских данных по эпидемиологии ААВ недостаточно для объективной оценки заболеваемости и распространенности в нашей стране.
При ГПА поражение органов головы и шеи, включая ЛОР-органы, отмечается в 80-95% случаев и чаще всего является первым симптомом васкулита [11]. По данным исследования A. Fauci и соавт., за 21 год наблюдения поражение ВДП развилось у 95% пациентов с ГПА [12]. Вовлечение в патологический процесс носа и околоносовых пазух отмечается у 60-90% пациентов с ГПА, в странах Азии этот показатель составляет 79-91% [10]. В российской когорте пациентов с ГПА поражение ВДП наблюдалось более чем в 80% случаев [7]. Зачастую поражение ВДП указывает на высокую активность системного васкулита [13]. Кроме того, у 25% пациентов с ГПА развивается локальная форма заболевания, ограничивающаяся исключительно симптомами поражения носа и околоносовых пазух [14].
Основные проявления активного ГПА с поражением ВДП включают в себя наличие корок в носовых ходах (69%), симптомы хронического риносинусита (61%), затруднение носового дыхания (58%) и кровянистые выделения из носа (52%) [15,16], а также неприятно пахнущие выделения из носа, рецидивирующие носовые кровотечения, гипосмию и аносмию, слезотечение, вызванное обструкцией носослезных протоков. В ретроспективном 20-летнем исследовании C. MoralesAngulo и соавт. представлены несколько иные данные: поражение носа и придаточных пазух наблюдалось у 52% пациентов с ГПА и в основном было представлено хроническим риносинуситом (32%) [17]. Заложенность носа часто является первым симптомом поражения ВДП, а гипосмия или аносмия обычно развиваются уже при наличии обширного отека слизистой оболочки [18]. Слезотечение также нередко отмечается в начале заболевания и может быть вызвано как гранулематозным поражением носослезного протока и слезного мешка, так и присоединением инфекции [19,20].
Неприятно пахнущие гнойные выделения из носа могут быть следствием роста Staphylococcus aureus или Pseudomonas aeruginosa. Влияние носительства S. aureus на патогенез, течение и частоту развития рецидивов ГПА долгие годы было предметом активного изучения [21-23]. С.В. Клименко в 2006 году подтвердила, что носительство S. aureus в полости носа ассоциировано с достоверным увеличением частоты рецидивов ГПА [24]. В 2010 году Laudien и соавт. показали, что частота носительства S. aureus среди пациентов с ГПА (72%) была несколько выше, чем в группе больных ревматоидным артритом (46%) и среди здоровых сотрудников клиники, на базе которой проходило исследование (58%). При этом риск рецидивов ГПА был выше у носителей стафилококка [25]. Однако при анализе микробиоты носа методом секвенирования 16s рРНК было установлено, что носительство стафилококков у пациентов с ГПА встречается не чаще, чем у здоровых людей [26]. Кроме того, негативное влияние носительства S. aureus на частоту рецидивов ГПА остается спорным. Например, по данным E. Besada и соавт., у пациентов, получавших иммунодепрессанты, как носительство, так и элиминация S. aureus не оказывали никакого влияния на частоту как обострений ГПА, так и гипогаммаглобулинемии [19].
При высокой активности ГПА с поражением ВДП слизистая оболочка носа покрыта диффузными кровоизлияниями, появляются гнойные выделения и корки, что вызывает дополнительное затруднение носового дыхания. Однако симптомы воспаления слизистой оболочки могут быть и менее выраженными, в таких случаях на активность процесса может указывать боль в области носа [18]. Прогрессирование патологического процесса приводит к вовлечению не только слизистой оболочки, но и костно-хрящевого скелета носа. При этом хрящевые структуры наружного носа и перегородки, как правило, поражаются в большей степени, чем костная спинка носа и костная перегородка. Пер форация хрящевой перегородки носа происходит в 33% случаев [16] и может вызывать потерю ее поддерживающей функции. Преимущественно поражается передняя часть носовой перегородки [18], поскольку в ней расположено сосудистое сплетение, обеспечивающее кровоснабжение хряща. В некоторых случаях отек слизистой оболочки и образование корок настолько сильно выражены, что перфорацию носовой перегородки удается визуализировать только после достижения ремиссии, регресса воспалительных изменений и уменьшения объема мягких тканей [27]. Дальнейшее прогрессирование заболевания приводит к увеличению числа перфораций передней части носовой перегородки [28], что влечет за собой значительное разрушение хрящевого скелета: деформации варьируются от потери высоты спинки носа до уменьшения ее длины с нарушением проекции кончика носа и последующим втягиванием носогубного угла. Потеря поддержки кончика приводит к укорочению носа с характерной седловидной деформацией, которая развивается у 23% пациентов с ГПА (рис. 1) [16]. Одновременно с развивающейся седловидной деформацией кожа носа может приобретать синеватую окраску, что связано с нарушением кровоснабжения этой области [29].
Рис. 1. Седловидная деформация носа у пациентки с ГПАB. D’Anza и соавт. выделили основные варианты поражения ВДП при ГПА, которые могут быть визуализированы при компьютерной (КТ) и магнитно-резонансной (МРТ) томографии: утолщение слизистой оболочки (87,7%), костная деструкция (59,9%) и эрозии носовой перегородки (59,4%) [30]. В острую фазу воспаления диагностическое значение поражения придаточных пазух носа в рамках ГПА может быть несколько переоценено, поскольку КТ и МРТ не позволяют дифференцировать гранулематозное воспаление при васкулите от инфекционного гранулематозного воспаления. В хронической же стадии заболевания, особенно после нескольких рецидивов, околоносовые пазухи постепенно заполняются рубцовой тканью, а верхнечелюстные пазухи часто уменьшаются в объеме, что нередко сочетается с прогрессирующей костной деструкцией и может быть легко обнаружено при помощи КТ и МРТ [31].
Поражение гортани при ГПА наиболее часто проявляется в виде подскладочного стеноза. Это потенциально жизнеугрожающее состояние развивается у 15-25% пациентов с ГПА [6]. При гистологическом исследовании выявляют неспецифический фиброз и инфильтрацию тканей гортани нейтрофилами и эпителиоидными гистиоцитами без явных признаков васкулита [32]. Помимо гортани, в патологический процесс часто вовлекаются бронхи и реже – трахея. Симптомы стеноза трахеи развиваются постепенно и включают в себя сухой кашель, осиплость голоса и одышку. Безусловно, следует учитывать и другие причины возникновения этих жалоб: дифференциальная диагностика проводится между врожденными, травматическими, инфекционными и опухолевыми заболеваниями, ни одно из которых, однако, не сопровождается системными проявлениями, характерными для ААВ.
Микроскопический полиангиит. МПА преимущественно поражает мелкие сосуды почек и легких и не сопровождается развитием гранулематозного воспаления или эозинофилии [33]. По данным Е.М. Щеголевой и соавт., поражение почек наблюдалось у 93,1% больных МПА, легких – у 78,4% [34]. Причиной смерти в 65% случаев становится диффузное альвеолярное кровотечение и/или прогрессирование почечной недостаточности до терминальной стадии, а в 18% – инфекционные осложнения [35]. Среди пациентов с МПА, обследованных в клинике им. Е.М. Тареева, диффузное альвеолярное кровотечение, было зафиксировано в 30,4% случаев, а быстропрогрессирующий гломерулонефрит – в 53% [34].
Распространенность МПА, как и ГПА, также значительно отличается в зависимости от региона. Например, в Японии она составляет 18,2 случаев на миллион населения в год, а Великобритании – 6,5 случаев на миллион населения в год. Средний возраст на момент установления диагноза составил 69 лет в Японии и 60 лет в Великобритании [36], а в России был ниже – 48-51 год [34,37].
Поражение носа и придаточных пазух у пациентов с МПА встречается реже, чем у пациентов с ГПА или ЭГПА, тем не менее, в большинстве исследований частота вовлечения ВДП у больных МПА была достаточно высокой. По данным зарубежных авторов она варьировалась от 9% до 30% [11,62,65], а России составляла от 13,7% по данным Е.М. Щеголевой и соавт. [34] до 54% в исследовании Т.В. Бекетовой [37]. В отличие от ГПА, при МПА не формируются очаги костной деструкции, а при биопсии слизистой оболочки отсутствует гранулематозное воспаление [36].
Несмотря на довольно высокую частоту, подробный анализ различных проявлений поражения ВДП при МПА в литературе практически не представлен. В недавно опубликованном исследовании [3] вовлечение ВДП было выявлено у 57% пациентов с МПА, в том числе изменения придаточных пазух – у 52%, хронический риносинусит – у 26%, рецидивирующие носовые кровотечения – у 26%, перфорация носовой перегородки – у 8,7%. Следует отметить, что если диагноз МПА не был морфологически верифицирован, наличие выраженных проявлений со стороны ВДП у таких пациентов указывает на необходимость пересмотра диагноза в пользу возможного ГПА.
Эозинофильный гранулематоз с полиангиитом. ЭГПА характеризуется наличием эозинофильного и некротизирующего гранулематозного воспаления, затрагивающего в том числе дыхательные пути, некротизирующего васкулита, преимущественно поражающего сосуды малого и, реже, среднего калибра, и бронхиальной астмы с эозинофилией [1]. Ежегодная заболеваемость ЭГПА оценивается в 0,5-4,2 случаев на миллион населения в год, а распространенность составляет 11-14 случаев на миллион населения [38-40].
Приблизительно у половины пациентов с ЭГПА наблюдается аллергический ринит с затруднением носового дыхания и хроническим полипозным риносинуситом (рис. 2) [41]. A. Bacciu и соавт. наблюдали полипоз носа и аллергический ринит у 76,1% и 42,8% из 28 больных ЭГПА, соответственно, а хронический риносинусит в анамнезе – у 14,2% [42]. В другом исследовании частота полипоза носа у 29 пациентов с ЭГПА составила 58,6% [43]. Среди 93 пациентов с ЭГПА, обследованных в клинике им. Е.М. Тареева, частота поражения ЛОР-органов, в том числе ринита, синусита или полипоза носа, достигла 88,2% случаев и не зависела от наличия АНЦА [44].
Рис. 2. КТ-картина носовых раковин и придаточных пазух носа при ЭГПА.A. Cottin и соавт. [45] выявили хронический риносинусит у 114 (73%) из 157 пациентов с ЭГПА, в том числе аллергический – у 21% и неаллергического типа – у 52%. При КТ признаки синусита имелись у 66% пациентов, однако образование корок в носовых ходах при осмотре было выявлено только у 15% пациентов. Полипоз носа был диагностирован у 53% больных, причем более половины из них нуждались в оперативном лечении, а частота возникновения рецидивов после оперативного вмешательства составила 50%. В исследовании Y. Nakamaru и соавт. хронический риносинусит был диагностирован на ранних стадиях ЭГПА более чем у 80% пациентов [46]. При проведении цитологического исследования мазка со слизистой оболочки носа у больных ЭГПА с симптомами хронического риносинусита V. Seccia и соавт. обнаружили гиперэозинофилию в 17 из 28 случаев [47]. При гистологическом исследовании обычно выявляют некротическое гранулематозное воспаление в сочетании с тканевой эозинофилией [1,48,49].
Полипоз носа при ЭГПА нередко оказывается устойчивым к лечению глюкокортикостероидами и часто рецидивирует после хирургического вмешательства, что может потребовать назначения иммунодепрессантов [50]. При диагностике ЭГПА следует учитывать высокую частоту (до 50%) обнаружения риносинусита и полипов полости носа при бронхиальной астме [51].
H. Andersen и соавт. не выявили взаимосвязи между активностью ЭГПА и выраженностью проявлений со стороны ЛОР-органов [52]. Ранее сходные данные были получены V. Seccia и соавт. [47]. По мнению авторов, полученные результаты могут указывать на развитие независимого аутоиммунного воспалительного процесса в области ВДП и органа слуха, подобного локальным формам ГПА, что обосновывает необходимость долгосрочного наблюдения и междисциплинарного подхода к лечению.
Недавно B. Saha и соавт. впервые описали деструктивное поражение ВДП при ЭГПА в виде эрозивного хондрита и седловидной деформации носа [53]. Поражение гортани при ЭГПА практически не описано в литературе, однако еще в одном исследовании V. Seccia и соавт. обнаружили локальные признаки воспаления гортани без формирования подскладочного стеноза у 72% из 43 пациентов с ЭГПА [54]. Тем не менее, авторы склонны связывать высокую частоту вовлечения гортани не с первичным поражением в рамках ЭГПА, а с гастроэзофагеальной рефлюксной болезнью, возникающей вследствие приема глюкокортикостероидов.
Диагностика
При развитии симптомов поражения ВДП в дебюте ААВ, особенно до присоединения системных проявлений, оториноларинголог становится первым специалистом, к которому обращается пациент с системным васкулитом, поэтому от него зависит своевременность постановки диагноза и начала патогенетического лечения заболевания.
Диагностические и классификационные критерии. В настоящее время четкие критерии диагностики ААВ отсутствуют. Общепринятыми по-прежнему остаются классификационные критерии ГПА и ЭГПА, предложенные Американской коллегией ревматологов (АКР) еще в 1990 году. Они были разработаны на основании данных, полученных при обследовании пациентов с предположительным диагнозом системного васкулита [55]. Классификационные критерии МПА в то время не были предложены, поскольку заболевание было выделено в отдельную нозологическую форму только в 1994 г. [56].
В классификационные критерии ГПА входят четыре показателя: воспаление слизистой оболочки носа или рта, патологические изменения по данным рентгенографии грудной клетки, аномальный мочевой осадок и наличие гранулематозного воспаления по данным биопсии. При выявлении двух из четырех признаков заболевание может быть классифицировано как ГПА. Эти критерии обладает чувствительностью 88,2% и специфичностью 92% [57].
В критерии диагноза ЭГПА входят бронхиальная астма, эозинофилия крови >10%, риносинусит, легочные инфильтраты (иногда преходящие), гистологические признаки васкулита с внесосудистым расположением эозинофилов и моно- или полинейропатия [1,5]. При наличии 4 из 6 критериев заболевание может быть классифицировано как ЭГПА с чувствительностью 85% и специфичностью 99,7%.
В 2016 году V. Cottin и соавт. предложили пересмотреть подход к диагностике ЭГПА и классифицировать случаи бронхиальной астмы с гиперэозинофилией более 1500 в мкл при отсутствии признаков васкулита и АНЦА в циркуляции как отдельную нозологическую форму – гиперэозинофильную астму с системными проявлениями (Hypereosinophilic asthma with systemic manifestations, HASM). При этом прежнюю номенклатуру ЭГПА было предложено использовать для тех случаев, когда имеются достоверные проявления или несколько суррогатных критериев васкулита [58].
Классификации критерии МПА отсутствуют, а проявления этого васкулита со стороны ВДП во многом сходны с таковыми ГПА. Это создает определенные трудности, если проведение биопсии носа невозможно или если ее результаты сомнительные. Тем не менее, это заболевание имеет характерные отличия: как уже указано выше, поражение ЛОР-органов при МПА встречается гораздо реже, а локальные формы болезни не описаны, поэтому чаще всего поражение ВДП при МПА сочетается с поражением легких по типу диффузного альвеолярного кровотечения или с поражением почек.
Для установления диагноза МПА принято руководствоваться алгоритмом Европейского агентства по лекарствам (EMA), который основывается на определениях, сформулированных на конференциях в ЧапелХилле [59,60]. В отечественной работе с участием 251 пациента этот алгоритм также был признан эффективным методом определения нозологической принадлежности ААВ [61]. На основании очень крупного международного исследования DCVAS (The Diagnostic and Classification Criteria for Vasculitis) недавно были разработы новые классификационные критерии ААВ, однако они пока не опубликованы.
Роль АНЦА в диагностике и прогнозе ААВ. Наличие в крови АНЦА не входит в “старые» классификационные критерии ААВ. Действительно, существуют так называемые “АНЦА-отрицательные» варианты морфологически доказанного васкулита, при которых выявить эти антитела в крови не удается. Тем не менее, проведение биопсии не всегда бывает доступным и информативным методом диагностики, поэтому наличие АНЦА способствует подтверждению диагноза и рассматривается как дополнительный диагностический признак.
Почти в 90% случаев АНЦА-ассоциированного ГПА определяются антитела к протеиназе-3 (ПР3), в то время как антитела к миелопероксидазе (МПО) присутствует менее чем в 5% случаев [62]. Сходные данные приводит Т.В. Бекетова: у 95% пациентов с ГПА были выявлены антитела к ПР3 и лишь у 7% – антитела к МПО [63]. Интересно, что в китайской популяции наблюдалась обратная картина: антитела к МПО были обнаружены у 70,9% пациентов с ГПА, а к ПР3 – у 29,1% [64].
При МПА частота выявления АНЦА составляет 95%. В 70% случаев определяются антитела к МПО, в остальных – антитела к ПР3. В то же время у пациентов с ЭГПА частота обнаружения АНЦА значительно ниже – примерно 30% (чаще всего к МПО) [58,65]. В исследовании, проводившемся в клинике им. Е.М. Тареева, АНЦА были выявлены у 37 (39,8%) больных ЭГПА, в том числе к МПО – у 34 и к ПР-3 – у 3 [44].
Основным методом типирования и количественного определения АНЦА является иммуноферментный анализ (ИФА). Следует отметить, что предварительное проведение реакции непрямой иммунофлюоресценции перед антиген-специфическим ИФА в настоящее время не является обязательным условием для обеспечения максимальной диагностической точности, что было доказано Европейской группой по изучению васкулитов (EUVAS) [66].
Влияние наличия и типа АНЦА на течение и прогноз заболевания. В настоящее время активно изучается влияние наличия и типа АНЦА на течение и исход заболевания. Например, при ГПА повышенный уровень антител к ПР-3 во время ремиссии ассоциируется с увеличением риска развития рецидивов у пациентов с тяжелым поражением почек или альвеолярным кровотечением в анамнезе, а также у больных, получающих ритуксимаб [67]. В исследовании MAINRITSAN сохранение повышенного уровня АНЦА в крови после 12-месячной поддерживающей терапии было фактором риска развития рецидива ААВ [68]. При МПА повторное повышение титра антител к МПО при условии их предшествующего исчезновения на фоне лечения также ассоциироваось с риском возникновения рецидива [69]. В исследовании С. Durel и соавт. наличие АНЦА у больных ЭГПА коррелировало с более частым поражением почек и нервной системы [70].
Обсуждалась возможность использования АНЦА с целью выделения различных форм ЭГПА – с преимущественно гранулематозным поражением или признаками васкулита [65,71]. Тем не менее, наличие АНЦА недостаточно для выделения таких групп пациентов, так как они присутствуют не более чем у 50% больных ЭГПА, а у одной трети АНЦА-позитивных пациентов не удается выявить прямых или косвенных признаков васкулита [58].
Классификация ААВ в зависимости от серотипа АНЦА. В последние годы некоторые авторы предлагали классифицировать ААВ в соответствии с типом циркулирующих АНЦА, т.е. ПР3-АНЦА или МПО-АНЦА ассо циированный васкулит. В исследовании S. Lionaki и соавт. было доказано, что наличие антител к ПР3 позволяет предсказать более частые рецидивов ААВ. В той же работе было продемонстрировано, что поражение ВДП при наличии ПР3-АНЦА развивается значительно чаще, чем при наличии МПО-АНЦА. Например, деструктивное поражение носового скелета в 94% случаев сопровождалось присутствием антител к ПР3 [72]. Данные клиники им. Е.М. Тареева также свидетельствуют о том, что наличие ПР3-АНЦА ассоциируется с более частым поражением ВДП по сравнению с МПОАНЦА ассоциированными вариантами васкулита [73]. J. Schirmer и соавт. пришли к выводу, что наличие антител к МПО обусловливает более частое формирование подскладочного стеноза и локальной формы ГПА [74], в то время как E. Miloslavsky и соавт. продемонстрировали, что возраст, клинические проявления и риск рецидива больше зависят от типа ААВ, чем от типа циркулирующих антител [75]. Недавно S. Deshayes и соавт. также показали, что наличие антител к ПР3 или к МПО не оказывают существенного влияния на клиническую картину и прогноз ААВ [76].
Тем не менее, генетические исследования методом полногеномного поиска ассоциаций (genome-wide association studies, GWAS) показывают, что с теми или иными генами первично ассоциирован именно тип АНЦА, а не клинические синдромы, на которых основана традиционная классификация ААВ [77]. Это означает, что необходимы дальнейшие многоцентровые исследования, конечной целью которых будет совершенствование формулировки диагноза ААВ для эффективного прогнозирования течения и возникновения рецидивов.
Особенности ранней диагностики поражения ВДП
Симптомы поражения ВДП на ранних стадиях ААВ или при их локальных формах демонстрирует широкую клиническую вариабельность и не обладают специфичностью. В этих случаях спектр дифференциально-диагностического поиска должен включать хронические инфекции (спирохетозы, микобактериозы, аспергиллезы) и другие воспалительные состояния (саркоидоз, другие васкулиты, последствия интраназального употребления кокаина), а также онкологические заболевания (NK/T-клеточная лимфома, назофарингеальная карцинома) [78,79], которые подобно ААВ могут быстро прогрессировать, вовлекая соседние структуры, в том числе ткани орбиты и основание черепа [80]. Раннее подозрение на ААВ позволяет ускорить начало лечения и предотвратить развитие системных проявлений заболевания, включая жизнеугрожающее поражение легких и почек. Кроме того, изолированное поражение ВДП в рамках ААВ без адекватной терапии может привести к значительной деструкции костно-хрящевых структур и мягких тканей головы [49].
Исключать ААВ следует у всех пациентов с персистирующими симптомами воспалительного поражения ВДП, не отвечающих на антибактериальную и местную противовоспалительную терапию. В таких случаях необходимо провести общие анализы крови и мочи, биохимическое исследование крови, включая креатинин и С-реактивный белок, компьтерную томографию легких при наличии показаний, а также определить АНЦА. В то же время следует учитывать, что титр АНЦА не коррелирует с тяжестью заболевания [49], а отрицательные результаты теста не исключают наличия васкулита [3]. Гистологическое исследование имеет очень важное значение для дифференциальной диагностики ААВ, однако оно возможно далеко не всегда, а интерпретация полученных данных в значительной степени зависит как от взятого образца ткани, так и от квалификации и опыта патологоанатома. По данным A. Masiak и соавт., только в 32% из из 25 биоптатов слизистой оболочки носа больных ГПА были выявлены изменения, характерные для этого васкулита [81]. K. Devaney и соавт., изучившие 126 биоптатов органов головы и шеи у 70 пациентов с ГПА, также показали невысокую самостоятельную диагностическую ценность гистологического исследования: наличие васкулита, некроза и гранулематозного воспаления одновременно было обнаружено лишь в 16% случаев, а два из указанных признаков – в 23% [82]. Эти данные свидетельствуют о том, что отсутствие АНЦА в сыворотке крови или отрицательные или неоднозначные данные биопсии при подозрении на ААВ могут существенно увеличить время до установления диагноза [83,84].
Наибольшую трудность представляет распознавание изолированных форм ААВ, не сопровождающихся повышенным титром АНЦА в сыворотке крови. По данным A. Knopf и соавт., отсутствие как ПР3-АНЦА, так и МПО-АНЦА в крови является характерной особенностью локального поражения ВДП при ГПА [49]. J. Wojciechowska и соавт. также наблюдали эту тенденцию [3]. Кроме того, обе группы исследователей отмечают более молодой возраст пациентов с серонегативным статусом и локальным поражением ВДП. В этих случаях высокая настороженность ЛОР-врача и, как результат, проведение биопсии имеют ключевое значение для диагностики ААВ и своевременного начала лечения. Интересно, что в противоположной ситуации, т.е. при повышенном титре АНЦА и отсутствии четких признаков поражения ВДП, некоторые исследователи также рекомендуют проведение биопсии макроскопически неизмененной слизистой оболочки носа для подтверждения диагноза [49].
Лечение
Иммуносупрессивная терапия. Подход к терапии ААВ значительно изменился за последние два десятилетия. В настоящее время лечение разделяют на две фазы: индукцию ремиссии, во время которой проводят терапию высокими дозами глюкокортикостероидов (ГКС) в сочетании с сильнодействующими иммуносупрессивными средствами (циклофосфамидом, ритуксимабом и др.), и поддерживающую терапию, когда иммуносупрессивное лечение продолжают для сохранения достигнутой ремиссии. Фаза поддержания ремиссии остается предметом многочисленных клинических исследований, в которых изучают эффективность различных лекарственных препаратов и оптимальную продолжительность лечения, достаточную для успешного предотвращения рецидивов. Для выбора оптимального объема лечения каждому пациенту необходимо проводить оценку активности и тяжести заболевания с помощью Бирмингемской шкалы активности васкулита (Birmingham Vasculitis Activity Score, BVAS) [85,86].
При тяжелых формах заболевания ГКС назначают в дозе 1 мг/кг преднизолона в сутки (не более 60 мг/сут), которую постепенно снижают до поддерживающей. Выбор иммунодепрессанта зависит от тяжести течения заболевания. При поражении жизненно важных органов назначают циклофосфамид внутривенно в режиме “пульс»-терапии, которая более предпочтительна, чем пероральный прием, в связи с более низкой кумуля тивной дозой препарата и меньшим количеством осложнений, связанных с токсическим поражением мочевыводящей системы. В качестве альтернативы циклофосфамиду может быть использован ритуксимаб, который не вызывает бесплодие, что обосновывает его применение у пациентов репродуктивного возраста.
В соответствии с рекомендациями Европейской антиревматической лиги (EULAR)/Европейской почечной ассоциации и Европейской ассоциации диализа и трансплантации (ERA-EDTA) 2015 г. для индукции ремиссии ААВ, не сопровождающего жизнеугрожающими проявлениями, может быть использована комбинация ГКС и метотрексата или микофенолата мофетила [87]. Пациентам с нормальной функцией почек и изолированным поражением ВДП без костных эрозий, разрушения хряща и обонятельной дисфункции, можно назначать метотрексат (20-25 мг/нед перорально или парентерально). По эффективности этот препарат не уступал циклофосфамиду, хотя для достижения ремиссии в некоторых случаях требовалось больше времени, а риск рецидивов был выше [88]. Использование микофенолата мофетила (в дозе 1,5-2 г/сут) имеет меньшую доказательную базу. По данным некоторых исследований, он по эффективности значительно уступает циклофосфамиду [89]. Следует отметить, что время достижения клинической ремиссии при изолированном поражении ВДП и системных формах заболевания по некоторым данным достоверно не отличается [49], что еще раз подчеркивает необходимость не менее серьезного подхода к лечению ограниченных форм ААВ.
Более низкие дозы лекарственных препаратов используются у пожилых людей и пациентов с высоким риском осложнений иммуносупрессивной терапии. При возникновении рецидива и необходимости повторной индукции ремиссии следует принимать во внимание опыт предыдущего лечения, кумулятивную дозу препаратов, степень повреждения органов и риск возникновения инфекций.
Для предотвращения рецидивов после достижения ремиссии назначают поддерживающую терапию. Было доказано, что полная отмена ГКС является самостоятельным предиктором рецидива, поэтому распространенной практикой является применение низких доз ГКС в качестве одного из компонентов поддерживающей терапии ААВ [90].
Согласно рекомендациям EULAR/ERA-EDTA, азатиоприн и метотрексат одинаково эффективны для поддержания ремиссии [87]. Применение ритуксимаба по сравнению с азатиоприном позволяет добиться снижения частоты рецидивов заболевания за 28 месяцев наблюдения при сопоставимой частоте развития тяжелых нежелательных явлений [91]. Микофенолата мофетил менее эффективен для поддержания ремиссии, чем другие препараты, поэтому применяется только в тех случаях, когда альтернативные схемы оказываются неэффективными или не могут быть использованы [92].
Комбинация триметоприма с сульфаметоксазолом в дозе 800/160 мг два раза в день может эффективно снизить риск возникновения рецидивов, особенно у пациентов с изолированным поражением носа и придаточных пазух [93]. Поддерживающую терапию всех ААВ следует продолжать в течение не менее 2 лет после достижения ремиссии [87].
Приведенных общих принципов индукционной и поддерживающей иммуносупрессивной терапии рекомендуется придерживаться при всех трех нозологических формах ААВ. Однако в отношении лечения ЭГПА уровень доказанности и степень рекомендаций ниже, чем для других ААВ. Пациентам, не соответствующим критериям тяжелого течения заболевания, внутривенное введение циклофосфамида не рекомендовано. Кроме того, при ЭГПА единственным иммуносупрессивным препаратом, рекомендуемым для поддержания ремиссии, является азатиоприн [87]. Оценка эффективности ритуксимаба для индукции ремиссии у пациентов с ЭГПА в настоящее время проводится Французской группой по исследованию васкулитов в исследовании REOVAS. Недавно для лечения ЭГПА было одобрено применение меполизумаба – моноклональных антител к интерлейкину-5 [94].
Хирургическое лечение. При позднем начале патогенетической терапии ГПА прогрессирующая деструкция костной и хрящевой ткани наружного носа может приводить к появлению седловидной деформации носа, которая является заметным косметическим дефектом и может оказывать значительное влияние на качество жизни больных. Тем не менее, до настоящего времени остается распространенной позиция отказа от выполнения хирургических вмешательств у пациентов с ГПА [18,95,96]. Выбор консервативной тактики ведения нередко продиктован опасениями, что хирургическое лечение может привести к обострению как локальных, так и системных проявлений ГПА. Однако эта настороженность основана на анализе лишь отдельных клинических наблюдений. A. Coordes и соавт. обобщили 41 случай хирургического лечения деформаций наружного носа и перфорации носовой перегородки у пациентов с ГПА со средним периодом наблюдения 2,6 года [28]. В большинстве случаев использовались аутотрансплантаты костей черепа или реберных хрящей, однако в некоторых исследованиях применялись аллотрансплантаты. По данным анализа, хирургическое лечение седловидной деформации носа у пациентов с ГПА при отсутствии или минимальной активности локального воспаления не было сопряжено с более высокой частотой послеоперационных осложнений (инфекций раны, смещением или резорбцией трансплантата) по сравнению с таковой при подобных операциях у пациентов, не страдающих ГПА. Тем не менее, реконструкция наружного носа при ГПА ассоциировалась с некоторым увеличением частоты ревизионных операций. Некото рые исследователи отмечают, что результаты оперативных вмешательств при локальной форме ГПА в целом лучше, чем при вовлечении в патологический процесс нескольких систем органов [97].
При поражения гортани под голосовыми складками и трахеи стратегия ведения пациентов заключается в использовании трех компонентов лечения: системная иммуносупрессивная терапия, антибактериальные и антигрибковые препараты, а также местная терапия [98]. К последней относятся баллонная дилатация, лазерная терапия и криотерапия, аргоноплазменная коагуляция, диатермокоагуляция, местное использование ГКС, митомицина С и алемтузумаба (моноклонального антитела к антигену лимфоцитов CD52) [33].
Когда хронический воспалительный процесс в стенках гортани приводит к формированию стойкого стеноза, хирургическое лечение может быть необходимым, чтобы избежать установки постоянной трахеостомы [99]. Если стеноз локализован в области перстневидного хряща, могут быть использованы различные методики трансплантации тканей для ларингопластики [18,100]. C. Costantino и соавт. описали 11 случаев ларинготрахеальной резекции и реконструкции у пациентов с ГПА с последующим наблюдением в течение 10 лет [32]. В 55% случаев понадобилось проведение дополнительных дилатаций после хирургического лечения стеноза, при этом лишь в одном случае была установлена постоянная трахеостома. Высокая вероятность развития стеноза нижних дыхательных путей (18%) обосновывает проведение регулярного и, как правило, пожизненного контроля состояния после проведенной операции.
В целом объективно оценить эффективность и безопасность хирургических вмешательств при ААВ достаточно сложно. Тем не менее, иногда их проведение необходимо, а наиболее значимыми факторами, позволяющими снизить число осложнений, являются минимизация местного воспаления тканей в оперируемой области и дополнительного повреждения тканей в результате процедуры [80].
Местная терапия. Использование топических лекар ственных препаратов для лечения поражений слизистой оболочки ВДП при ААВ заслуживает отдельного внимания вследствие своей простоты и эффективности. В исследовании B. Hofauer и соавт. было отмечено, что среди 20 пациентов с вовлечением ВДП в рамках ААВ, несмотря на проведение адекватной иммуносупрессивной терапии, в 61,1% случаев отмечалось лишь незначительное уменьшение симптомов поражения ВДП или отсутствие положительной динамики [48]. Разрушение реснитчатого эпителия носа изменяет транспорт слизи и способствует персистированию хронической инфекции в носовых ходах и образованию слизисто-гнойных корок, которые могут быть устранены с помощью промывания носа различными солевыми растворами в сочетании с применением назальных мазей для смягчения корок [18]. B. Hofauer и соавт. предложили применять локальную липосомальную терапию с использованием спреев с фосфолипидами, которые стабилизируют липидный слой и поддерживают естественную защитную функцию слизистой оболочки носа. Использование этого метода в течение двух месяцев позволило значительно уменьшить выраженность симптомов со стороны ВДП, причем как по стандартизованным оценочным шкалам BVAS, так и по данным анкетирования пациентов [48].
Влияния поражения ВДП на прогноз заболевания
В 1996 году L. Guillevin и соавт. разработали шкалу (Five-Factor Score, FFS), предназначенную для прогнозирования течения васкулита на основании числа органов и систем, вовлеченных в патологический процесс [101]. Первоначальная версия этой шкалы была предназначена для оценки трех некротизирующих васкулитов – узелкового полиартериита, МПА и ЭГПА. В 2009 году FFS была пересмотрена, что сделало возможным ее применение при трех типах ААВ, включая ГПА. По данным нового исследования, поражение ВДП и органа слуха при ГПА, даже при генерализованном варианте болезни, ассоциировалось с более низким относительным риском смерти, а их отсутствие – наоборот, ухудшало общий прогноз [102].
В 2016 году C. Durel и соавт. в многоцентровом исследовании у пациентов с ЭГПА подтвердили, что поражение ВДП является не только предиктором лучшей выживаемости, но и связано с меньшей частотой поражения почек и сердца в рамках системного аутоиммунного процесса [70]. Недавно M. Felicetti и соавт. получили сходные данные у пациентов с ГПА: поражение ВДП было ассоциировано с более высокими показателями пятилетней выживаемости, а также служило независимым предиктором благоприятного исхода заболевания [103].
Таким образом, поражение ВДП не только является одним из ключевых симптомов АНЦА-ассоциированных васкулитов, но и, по мнению некоторых авторов, может указывать на более благоприятное течение ААВ и более низкий риск смерти независимо от наличия или отсутствия АНЦА.
| ГПА | МПА | ЭГПА | |
|---|---|---|---|
| Характер поражения ВДП | Геморрагические и гнойно-геморрагические корки в носовых ходах, носовые кровотечения, хронический риносинусит, перфорация носовой перегородки, седловидная деформация носа, подскладочный стеноз гортани |
Хронический риносинусит, носовые кровотечения | Хронический риносинусит, полипоз носа |
| Гистологические особенности | Гранулематозное воспаление | Васкулит сосудов мелкого калибра без гранулематозного воспаления | Гранулематозное воспаление, тканевая эозинофилия |
| Преобладающий тип АНЦА | ПР3-АНЦА, реже МПО-АНЦА | МПО-АНЦА, реже ПР3-АНЦА | МПО-АНЦА (редко) |
Основные различия между ААВ в отношении характерных вариантов поражения ВДП, гистологической картины и преобладающего серотипа АНЦА были объединены нами в сводную (табл. 1.)
Заключение
Поражение ВДП часто встречается при ААВ и в течение длительного времени может оставаться единственным симптомом заболевания. Хотя выживаемость пациентов с ААВ определяется в основном вовлечением легких и почек, а поражение ВДП ассоциировано с более благоприятным прогнозом, хроническое воспаление в ЛОРорганах может привести к необратимому повреждению лицевого скелета и значительно ухудшает качество жизни больных, а вовлечение в патологический процесс гортани и трахеи прямо связано с риском развития жизнеугрожающих осложнений. Ранняя диагностика васкулита и своевременное начало иммуносупрессивной терапии позволяют избежать необратимых изменений ЛОР-органов и существенно улучшить прогноз заболевания в целом. В связи с этим особое значение приобретает информированность и настороженность в отношении ААВ врачей различных специальностей, в первую очередь оториноларингологов.
Гранулематоз с полиангиитом (GPA, ранее назывался Wegener’s)
Обзор
Что такое гранулематоз с полиангиитом (GPA, ранее называвшийся синдромом Вегенера)?
Гранулематоз с полиангиитом (GPA, ранее называвшийся болезнью Вегенера) — редкое заболевание неизвестной причины.Это результат воспаления в тканях, называемого гранулематозным воспалением и воспалением кровеносных сосудов («васкулит»), которое может повредить системы органов. Области, наиболее часто поражаемые GPA, включают пазухи, легкие и почки, но может быть поражен любой участок.
Что такое васкулит?
Васкулит — это общий термин, обозначающий воспаление кровеносных сосудов. При воспалении кровеносный сосуд может ослабнуть и растянуться, образуя аневризму, или стать настолько тонким, что разорвется, что приведет к кровотечению в ткани.Васкулит также может вызвать сужение кровеносных сосудов до полного закрытия сосуда. Это может привести к повреждению органов из-за потери кислорода и питательных веществ, поступающих с кровью.
Каковы особенности гранулематоза с полиангиитом (ГПА)?
GPA в первую очередь влияет на верхние дыхательные пути (пазухи, нос, трахею [верхний воздуховод]), легкие и почки. Также может быть поражен любой другой орган в организме.
Симптомы GPA и их тяжесть у разных пациентов различаются.Общие признаки заболевания могут включать:
- Потеря аппетита
- Похудание
- Лихорадка
- Усталость
Большинство пациентов сначала замечают симптомы в дыхательных путях. Симптомы могут включать:
- Постоянный насморк (также называемый ринореей) или образование корок и язв в носу
- Боль в носу или лице
- Носовое кровотечение или необычные выделения из носа, вызванные воспалением носа или пазух
- Кашель, который может включать кровавую мокроту, вызванную воспалением верхних или нижних дыхательных путей (легких)
- Дискомфорт в груди с одышкой или без нее
- Воспаление среднего уха (также называемое средним отитом), боль или потеря слуха
- Изменение голоса, хрипы или одышка, вызванные воспалением трахеи
Другие возможные функции:
- Воспаление глаза и / или давление за глазом, затрудняющее движение глаз, с потерей зрения или без нее
- Боль в суставах (артрит) или боль в мышцах
- Сыпь или кожные язвы
- Воспаление почек (хотя воспаление почек является обычным явлением, обычно оно не связано с такими симптомами, как боль).
Кто страдает гранулематозом с полиангиитом (ГПА)?
GPA может быть у людей любого возраста. Пиковая возрастная группа заболевания — от 40 до 60 лет. Похоже, это одинаково влияет на мужчин и женщин.
Симптомы и причины
Что вызывает гранулематоз при полиангиите (ГПА)?
Причина GPA неизвестна.GPA не является формой рака, не заразен и обычно не возникает в семьях. Данные исследовательских лабораторий убедительно подтверждают идею о том, что иммунная система играет решающую роль в GPA, так что иммунная система вызывает воспаление и повреждение кровеносных сосудов и тканей.
Диагностика и тесты
Как диагностируется гранулематоз с полиангиитом (ГПА)?
GPA имеет симптомы, схожие с рядом других расстройств, что может затруднить диагностику.Однако для наиболее эффективного и успешного лечения критически важна ранняя диагностика.
При подозрении на диагноз ГПД часто выполняется биопсия (образец ткани) пораженного участка, чтобы попытаться подтвердить наличие васкулита. Биопсия рекомендуется только для тех участков органов, в которых обнаружены отклонения от нормы при осмотре, лабораторных исследованиях или визуализации.
Это сочетание симптомов, результатов медицинского осмотра, лабораторных тестов, рентгеновских лучей, а иногда и биопсии (образца) пораженной ткани (кожи, носовых оболочек, пазух, легких, почек или других участков), которые вместе подтверждают диагноз. GPA.После лечения эти факторы также имеют решающее значение при оценке активности заболевания или ремиссии.
Положительный анализ крови на антинейтрофильные цитоплазматические антитела (ANCA) может подтвердить подозрение на диагноз заболевания. Однако этот анализ крови сам по себе не подтверждает диагноз ГПД и не определяет активность заболевания.
GPA часто поражает легкие. У пациентов с ГПД, у которых нет легочных симптомов (кашель или одышка), визуализирующие тесты (обычные рентгеновские снимки или компьютерная томография) выявляют аномалии легких примерно в одной трети случаев.Следовательно, важно выполнять снимки легких при подозрении на активный ГПД, даже если у вас нет никаких симптомов заболевания легких.
Ведение и лечение
Как лечится гранулематоз с полиангиитом (ГПА)?
Поскольку GPA часто представляет собой опасное для жизни заболевание, его лечат различными мощными лекарствами, которые, как было доказано, спасают жизнь.Лекарства, подавляющие иммунную систему, составляют основу лечения GPA. Степень тяжести заболевания в каждом отдельном случае определяет, какие иммуносупрессивные препараты используются. Существует множество иммуносупрессивных препаратов, которые используются при GPA, каждое из которых имеет индивидуальные побочные эффекты.
Людей с ГПД с поражением критических систем органов обычно лечат кортикостероидами в сочетании с другими иммуносупрессивными препаратами, такими как циклофосфамид (Cytoxan®) или ритуксимаб (Rituxan®).У пациентов с менее тяжелым ГПД вначале можно использовать кортикостероиды и метотрексат. Цель лечения — остановить все травмы, возникающие в результате GPA. Если активность болезни можно полностью «выключить», это называется «ремиссией». Как только становится очевидным, что болезнь улучшается, врачи постепенно снижают дозу кортикостероидов и в конечном итоге надеются полностью отменить ее. Когда используется циклофосфамид, его назначают только до момента ремиссии (обычно от 3 до 6 месяцев), после чего его переключают на другой иммунодепрессант, такой как метотрексат, азатиоприн (Imuran®) или микофенолятмофетил (Cellcept®). ) для поддержания ремиссии.Продолжительность лечения поддерживающими иммуносупрессивными препаратами может варьироваться в зависимости от человека. В большинстве случаев его назначают как минимум в течение 2 лет, прежде чем будет рассмотрен вопрос о медленном снижении дозы до прекращения приема.
Все эти лекарства также используются для лечения других заболеваний. Азатиоприн и микофенолят мофетил используются для предотвращения отторжения трансплантата органов. Метотрексат используется для лечения ревматоидного артрита и псориаза. И циклофосфамид, и метотрексат назначаются в высоких дозах для лечения определенных типов рака и поэтому иногда называются «химиотерапией».«При лечении рака эти лекарства работают, убивая или замедляя рост быстро размножающихся раковых клеток. При васкулите эти лекарства вводятся в дозах, которые в 10-100 раз ниже, чем те, которые используются для лечения рака, и их основной эффект заключается в воздействии на поведение иммунной системы таким образом, что приводит к иммуносупрессии. Ритуксимаб относится к классу лекарств, называемых биологическими агентами, которые нацелены на определенный элемент иммунной системы. Недавние исследования показали, что ритуксимаб был так же эффективен, как циклофосфамид, для лечения тяжелого активного GPA.
Какие побочные эффекты связаны с лечением гранулематоза с полиангиитом (ГПА)?
Поскольку эти лекарства подавляют иммунную систему, существует повышенный риск развития серьезных инфекций. Каждый иммунодепрессивный препарат также имеет уникальный набор потенциальных побочных эффектов. Мониторинг побочных эффектов, связанных с каждым лекарством, имеет решающее значение для предотвращения или минимизации их возникновения. Кроме того, тот факт, что пациент может изначально переносить лечение, не гарантирует, что переносимость останется неизменной с течением времени.
Независимо от того, какое лекарство используется, постоянный мониторинг лабораторной работы пациента имеет важное значение при лечении этих заболеваний. Метотрексат, азатиоприн и циклофосфамид могут подавлять способность пациента вырабатывать клетки крови. Если пациент проходит регулярные лабораторные исследования, за которыми тщательно наблюдают, это подавление производства клеток будет обнаружено, и доза лекарства может быть скорректирована или отменена в зависимости от степени тяжести. Циклофосфамид также имеет важные побочные эффекты, такие как снижение фертильности у более молодых пациентов, а также повышенный риск развития рака мочевого пузыря.Использование ритуксимаба в редких случаях связано с повышенным риском инфекции головного мозга, которая может быть опасной для жизни.
Перспективы / Прогноз
Каковы перспективы у людей с гранулематозом и полиангиитом (ГПД)?
После достижения ремиссии возможно повторение GPA (часто называемое «рецидивом»).Рецидивы могут быть похожи на те, которые испытывал пациент во время постановки диагноза, или симптомы могут отличаться. Вероятность серьезного рецидива можно свести к минимуму, если незамедлительно сообщать врачу о любых новых симптомах, регулярно осматривать врача и проводить постоянный мониторинг с помощью лабораторных тестов и визуализации. Подход к лечению рецидивов аналогичен лечению недавно диагностированного заболевания.
GPA — очень серьезное заболевание, лечение которого сопряжено со значительными рисками. Однако лечение может спасти жизнь, если диагноз поставлен своевременно и начато соответствующее лечение.
До того, как в 1970-е годы была признана эффективная терапия, половина всех пациентов с этим заболеванием умерла в течение 5 месяцев после постановки диагноза. Сегодня более 80% пролеченных пациентов живы по крайней мере восемь лет спустя. Многие люди со средним баллом успеваемости продемонстрировали долгосрочное выживание, когда многие из них могут вести относительно нормальный образ жизни. Если прошлое является прелюдией к будущему, текущие исследования приведут к дальнейшим открытиям и даже лучшему лечению.
Гранулематоз с полиангиитом (GPA, ранее назывался Wegener’s)
Обзор
Что такое гранулематоз с полиангиитом (GPA, ранее называвшийся синдромом Вегенера)?
Гранулематоз с полиангиитом (GPA, ранее называвшийся болезнью Вегенера) — редкое заболевание неизвестной причины.Это результат воспаления в тканях, называемого гранулематозным воспалением и воспалением кровеносных сосудов («васкулит»), которое может повредить системы органов. Области, наиболее часто поражаемые GPA, включают пазухи, легкие и почки, но может быть поражен любой участок.
Что такое васкулит?
Васкулит — это общий термин, обозначающий воспаление кровеносных сосудов. При воспалении кровеносный сосуд может ослабнуть и растянуться, образуя аневризму, или стать настолько тонким, что разорвется, что приведет к кровотечению в ткани.Васкулит также может вызвать сужение кровеносных сосудов до полного закрытия сосуда. Это может привести к повреждению органов из-за потери кислорода и питательных веществ, поступающих с кровью.
Каковы особенности гранулематоза с полиангиитом (ГПА)?
GPA в первую очередь влияет на верхние дыхательные пути (пазухи, нос, трахею [верхний воздуховод]), легкие и почки. Также может быть поражен любой другой орган в организме.
Симптомы GPA и их тяжесть у разных пациентов различаются.Общие признаки заболевания могут включать:
- Потеря аппетита
- Похудание
- Лихорадка
- Усталость
Большинство пациентов сначала замечают симптомы в дыхательных путях. Симптомы могут включать:
- Постоянный насморк (также называемый ринореей) или образование корок и язв в носу
- Боль в носу или лице
- Носовое кровотечение или необычные выделения из носа, вызванные воспалением носа или пазух
- Кашель, который может включать кровавую мокроту, вызванную воспалением верхних или нижних дыхательных путей (легких)
- Дискомфорт в груди с одышкой или без нее
- Воспаление среднего уха (также называемое средним отитом), боль или потеря слуха
- Изменение голоса, хрипы или одышка, вызванные воспалением трахеи
Другие возможные функции:
- Воспаление глаза и / или давление за глазом, затрудняющее движение глаз, с потерей зрения или без нее
- Боль в суставах (артрит) или боль в мышцах
- Сыпь или кожные язвы
- Воспаление почек (хотя воспаление почек является обычным явлением, обычно оно не связано с такими симптомами, как боль).
Кто страдает гранулематозом с полиангиитом (ГПА)?
GPA может быть у людей любого возраста. Пиковая возрастная группа заболевания — от 40 до 60 лет. Похоже, это одинаково влияет на мужчин и женщин.
Симптомы и причины
Что вызывает гранулематоз при полиангиите (ГПА)?
Причина GPA неизвестна.GPA не является формой рака, не заразен и обычно не возникает в семьях. Данные исследовательских лабораторий убедительно подтверждают идею о том, что иммунная система играет решающую роль в GPA, так что иммунная система вызывает воспаление и повреждение кровеносных сосудов и тканей.
Диагностика и тесты
Как диагностируется гранулематоз с полиангиитом (ГПА)?
GPA имеет симптомы, схожие с рядом других расстройств, что может затруднить диагностику.Однако для наиболее эффективного и успешного лечения критически важна ранняя диагностика.
При подозрении на диагноз ГПД часто выполняется биопсия (образец ткани) пораженного участка, чтобы попытаться подтвердить наличие васкулита. Биопсия рекомендуется только для тех участков органов, в которых обнаружены отклонения от нормы при осмотре, лабораторных исследованиях или визуализации.
Это сочетание симптомов, результатов медицинского осмотра, лабораторных тестов, рентгеновских лучей, а иногда и биопсии (образца) пораженной ткани (кожи, носовых оболочек, пазух, легких, почек или других участков), которые вместе подтверждают диагноз. GPA.После лечения эти факторы также имеют решающее значение при оценке активности заболевания или ремиссии.
Положительный анализ крови на антинейтрофильные цитоплазматические антитела (ANCA) может подтвердить подозрение на диагноз заболевания. Однако этот анализ крови сам по себе не подтверждает диагноз ГПД и не определяет активность заболевания.
GPA часто поражает легкие. У пациентов с ГПД, у которых нет легочных симптомов (кашель или одышка), визуализирующие тесты (обычные рентгеновские снимки или компьютерная томография) выявляют аномалии легких примерно в одной трети случаев.Следовательно, важно выполнять снимки легких при подозрении на активный ГПД, даже если у вас нет никаких симптомов заболевания легких.
Ведение и лечение
Как лечится гранулематоз с полиангиитом (ГПА)?
Поскольку GPA часто представляет собой опасное для жизни заболевание, его лечат различными мощными лекарствами, которые, как было доказано, спасают жизнь.Лекарства, подавляющие иммунную систему, составляют основу лечения GPA. Степень тяжести заболевания в каждом отдельном случае определяет, какие иммуносупрессивные препараты используются. Существует множество иммуносупрессивных препаратов, которые используются при GPA, каждое из которых имеет индивидуальные побочные эффекты.
Людей с ГПД с поражением критических систем органов обычно лечат кортикостероидами в сочетании с другими иммуносупрессивными препаратами, такими как циклофосфамид (Cytoxan®) или ритуксимаб (Rituxan®).У пациентов с менее тяжелым ГПД вначале можно использовать кортикостероиды и метотрексат. Цель лечения — остановить все травмы, возникающие в результате GPA. Если активность болезни можно полностью «выключить», это называется «ремиссией». Как только становится очевидным, что болезнь улучшается, врачи постепенно снижают дозу кортикостероидов и в конечном итоге надеются полностью отменить ее. Когда используется циклофосфамид, его назначают только до момента ремиссии (обычно от 3 до 6 месяцев), после чего его переключают на другой иммунодепрессант, такой как метотрексат, азатиоприн (Imuran®) или микофенолятмофетил (Cellcept®). ) для поддержания ремиссии.Продолжительность лечения поддерживающими иммуносупрессивными препаратами может варьироваться в зависимости от человека. В большинстве случаев его назначают как минимум в течение 2 лет, прежде чем будет рассмотрен вопрос о медленном снижении дозы до прекращения приема.
Все эти лекарства также используются для лечения других заболеваний. Азатиоприн и микофенолят мофетил используются для предотвращения отторжения трансплантата органов. Метотрексат используется для лечения ревматоидного артрита и псориаза. И циклофосфамид, и метотрексат назначаются в высоких дозах для лечения определенных типов рака и поэтому иногда называются «химиотерапией».«При лечении рака эти лекарства работают, убивая или замедляя рост быстро размножающихся раковых клеток. При васкулите эти лекарства вводятся в дозах, которые в 10-100 раз ниже, чем те, которые используются для лечения рака, и их основной эффект заключается в воздействии на поведение иммунной системы таким образом, что приводит к иммуносупрессии. Ритуксимаб относится к классу лекарств, называемых биологическими агентами, которые нацелены на определенный элемент иммунной системы. Недавние исследования показали, что ритуксимаб был так же эффективен, как циклофосфамид, для лечения тяжелого активного GPA.
Какие побочные эффекты связаны с лечением гранулематоза с полиангиитом (ГПА)?
Поскольку эти лекарства подавляют иммунную систему, существует повышенный риск развития серьезных инфекций. Каждый иммунодепрессивный препарат также имеет уникальный набор потенциальных побочных эффектов. Мониторинг побочных эффектов, связанных с каждым лекарством, имеет решающее значение для предотвращения или минимизации их возникновения. Кроме того, тот факт, что пациент может изначально переносить лечение, не гарантирует, что переносимость останется неизменной с течением времени.
Независимо от того, какое лекарство используется, постоянный мониторинг лабораторной работы пациента имеет важное значение при лечении этих заболеваний. Метотрексат, азатиоприн и циклофосфамид могут подавлять способность пациента вырабатывать клетки крови. Если пациент проходит регулярные лабораторные исследования, за которыми тщательно наблюдают, это подавление производства клеток будет обнаружено, и доза лекарства может быть скорректирована или отменена в зависимости от степени тяжести. Циклофосфамид также имеет важные побочные эффекты, такие как снижение фертильности у более молодых пациентов, а также повышенный риск развития рака мочевого пузыря.Использование ритуксимаба в редких случаях связано с повышенным риском инфекции головного мозга, которая может быть опасной для жизни.
Перспективы / Прогноз
Каковы перспективы у людей с гранулематозом и полиангиитом (ГПД)?
После достижения ремиссии возможно повторение GPA (часто называемое «рецидивом»).Рецидивы могут быть похожи на те, которые испытывал пациент во время постановки диагноза, или симптомы могут отличаться. Вероятность серьезного рецидива можно свести к минимуму, если незамедлительно сообщать врачу о любых новых симптомах, регулярно осматривать врача и проводить постоянный мониторинг с помощью лабораторных тестов и визуализации. Подход к лечению рецидивов аналогичен лечению недавно диагностированного заболевания.
GPA — очень серьезное заболевание, лечение которого сопряжено со значительными рисками. Однако лечение может спасти жизнь, если диагноз поставлен своевременно и начато соответствующее лечение.
До того, как в 1970-е годы была признана эффективная терапия, половина всех пациентов с этим заболеванием умерла в течение 5 месяцев после постановки диагноза. Сегодня более 80% пролеченных пациентов живы по крайней мере восемь лет спустя. Многие люди со средним баллом успеваемости продемонстрировали долгосрочное выживание, когда многие из них могут вести относительно нормальный образ жизни. Если прошлое является прелюдией к будущему, текущие исследования приведут к дальнейшим открытиям и даже лучшему лечению.
Гранулематоз с полиангиитом (GPA, ранее назывался Wegener’s)
Обзор
Что такое гранулематоз с полиангиитом (GPA, ранее называвшийся синдромом Вегенера)?
Гранулематоз с полиангиитом (GPA, ранее называвшийся болезнью Вегенера) — редкое заболевание неизвестной причины.Это результат воспаления в тканях, называемого гранулематозным воспалением и воспалением кровеносных сосудов («васкулит»), которое может повредить системы органов. Области, наиболее часто поражаемые GPA, включают пазухи, легкие и почки, но может быть поражен любой участок.
Что такое васкулит?
Васкулит — это общий термин, обозначающий воспаление кровеносных сосудов. При воспалении кровеносный сосуд может ослабнуть и растянуться, образуя аневризму, или стать настолько тонким, что разорвется, что приведет к кровотечению в ткани.Васкулит также может вызвать сужение кровеносных сосудов до полного закрытия сосуда. Это может привести к повреждению органов из-за потери кислорода и питательных веществ, поступающих с кровью.
Каковы особенности гранулематоза с полиангиитом (ГПА)?
GPA в первую очередь влияет на верхние дыхательные пути (пазухи, нос, трахею [верхний воздуховод]), легкие и почки. Также может быть поражен любой другой орган в организме.
Симптомы GPA и их тяжесть у разных пациентов различаются.Общие признаки заболевания могут включать:
- Потеря аппетита
- Похудание
- Лихорадка
- Усталость
Большинство пациентов сначала замечают симптомы в дыхательных путях. Симптомы могут включать:
- Постоянный насморк (также называемый ринореей) или образование корок и язв в носу
- Боль в носу или лице
- Носовое кровотечение или необычные выделения из носа, вызванные воспалением носа или пазух
- Кашель, который может включать кровавую мокроту, вызванную воспалением верхних или нижних дыхательных путей (легких)
- Дискомфорт в груди с одышкой или без нее
- Воспаление среднего уха (также называемое средним отитом), боль или потеря слуха
- Изменение голоса, хрипы или одышка, вызванные воспалением трахеи
Другие возможные функции:
- Воспаление глаза и / или давление за глазом, затрудняющее движение глаз, с потерей зрения или без нее
- Боль в суставах (артрит) или боль в мышцах
- Сыпь или кожные язвы
- Воспаление почек (хотя воспаление почек является обычным явлением, обычно оно не связано с такими симптомами, как боль).
Кто страдает гранулематозом с полиангиитом (ГПА)?
GPA может быть у людей любого возраста. Пиковая возрастная группа заболевания — от 40 до 60 лет. Похоже, это одинаково влияет на мужчин и женщин.
Симптомы и причины
Что вызывает гранулематоз при полиангиите (ГПА)?
Причина GPA неизвестна.GPA не является формой рака, не заразен и обычно не возникает в семьях. Данные исследовательских лабораторий убедительно подтверждают идею о том, что иммунная система играет решающую роль в GPA, так что иммунная система вызывает воспаление и повреждение кровеносных сосудов и тканей.
Диагностика и тесты
Как диагностируется гранулематоз с полиангиитом (ГПА)?
GPA имеет симптомы, схожие с рядом других расстройств, что может затруднить диагностику.Однако для наиболее эффективного и успешного лечения критически важна ранняя диагностика.
При подозрении на диагноз ГПД часто выполняется биопсия (образец ткани) пораженного участка, чтобы попытаться подтвердить наличие васкулита. Биопсия рекомендуется только для тех участков органов, в которых обнаружены отклонения от нормы при осмотре, лабораторных исследованиях или визуализации.
Это сочетание симптомов, результатов медицинского осмотра, лабораторных тестов, рентгеновских лучей, а иногда и биопсии (образца) пораженной ткани (кожи, носовых оболочек, пазух, легких, почек или других участков), которые вместе подтверждают диагноз. GPA.После лечения эти факторы также имеют решающее значение при оценке активности заболевания или ремиссии.
Положительный анализ крови на антинейтрофильные цитоплазматические антитела (ANCA) может подтвердить подозрение на диагноз заболевания. Однако этот анализ крови сам по себе не подтверждает диагноз ГПД и не определяет активность заболевания.
GPA часто поражает легкие. У пациентов с ГПД, у которых нет легочных симптомов (кашель или одышка), визуализирующие тесты (обычные рентгеновские снимки или компьютерная томография) выявляют аномалии легких примерно в одной трети случаев.Следовательно, важно выполнять снимки легких при подозрении на активный ГПД, даже если у вас нет никаких симптомов заболевания легких.
Ведение и лечение
Как лечится гранулематоз с полиангиитом (ГПА)?
Поскольку GPA часто представляет собой опасное для жизни заболевание, его лечат различными мощными лекарствами, которые, как было доказано, спасают жизнь.Лекарства, подавляющие иммунную систему, составляют основу лечения GPA. Степень тяжести заболевания в каждом отдельном случае определяет, какие иммуносупрессивные препараты используются. Существует множество иммуносупрессивных препаратов, которые используются при GPA, каждое из которых имеет индивидуальные побочные эффекты.
Людей с ГПД с поражением критических систем органов обычно лечат кортикостероидами в сочетании с другими иммуносупрессивными препаратами, такими как циклофосфамид (Cytoxan®) или ритуксимаб (Rituxan®).У пациентов с менее тяжелым ГПД вначале можно использовать кортикостероиды и метотрексат. Цель лечения — остановить все травмы, возникающие в результате GPA. Если активность болезни можно полностью «выключить», это называется «ремиссией». Как только становится очевидным, что болезнь улучшается, врачи постепенно снижают дозу кортикостероидов и в конечном итоге надеются полностью отменить ее. Когда используется циклофосфамид, его назначают только до момента ремиссии (обычно от 3 до 6 месяцев), после чего его переключают на другой иммунодепрессант, такой как метотрексат, азатиоприн (Imuran®) или микофенолятмофетил (Cellcept®). ) для поддержания ремиссии.Продолжительность лечения поддерживающими иммуносупрессивными препаратами может варьироваться в зависимости от человека. В большинстве случаев его назначают как минимум в течение 2 лет, прежде чем будет рассмотрен вопрос о медленном снижении дозы до прекращения приема.
Все эти лекарства также используются для лечения других заболеваний. Азатиоприн и микофенолят мофетил используются для предотвращения отторжения трансплантата органов. Метотрексат используется для лечения ревматоидного артрита и псориаза. И циклофосфамид, и метотрексат назначаются в высоких дозах для лечения определенных типов рака и поэтому иногда называются «химиотерапией».«При лечении рака эти лекарства работают, убивая или замедляя рост быстро размножающихся раковых клеток. При васкулите эти лекарства вводятся в дозах, которые в 10-100 раз ниже, чем те, которые используются для лечения рака, и их основной эффект заключается в воздействии на поведение иммунной системы таким образом, что приводит к иммуносупрессии. Ритуксимаб относится к классу лекарств, называемых биологическими агентами, которые нацелены на определенный элемент иммунной системы. Недавние исследования показали, что ритуксимаб был так же эффективен, как циклофосфамид, для лечения тяжелого активного GPA.
Какие побочные эффекты связаны с лечением гранулематоза с полиангиитом (ГПА)?
Поскольку эти лекарства подавляют иммунную систему, существует повышенный риск развития серьезных инфекций. Каждый иммунодепрессивный препарат также имеет уникальный набор потенциальных побочных эффектов. Мониторинг побочных эффектов, связанных с каждым лекарством, имеет решающее значение для предотвращения или минимизации их возникновения. Кроме того, тот факт, что пациент может изначально переносить лечение, не гарантирует, что переносимость останется неизменной с течением времени.
Независимо от того, какое лекарство используется, постоянный мониторинг лабораторной работы пациента имеет важное значение при лечении этих заболеваний. Метотрексат, азатиоприн и циклофосфамид могут подавлять способность пациента вырабатывать клетки крови. Если пациент проходит регулярные лабораторные исследования, за которыми тщательно наблюдают, это подавление производства клеток будет обнаружено, и доза лекарства может быть скорректирована или отменена в зависимости от степени тяжести. Циклофосфамид также имеет важные побочные эффекты, такие как снижение фертильности у более молодых пациентов, а также повышенный риск развития рака мочевого пузыря.Использование ритуксимаба в редких случаях связано с повышенным риском инфекции головного мозга, которая может быть опасной для жизни.
Перспективы / Прогноз
Каковы перспективы у людей с гранулематозом и полиангиитом (ГПД)?
После достижения ремиссии возможно повторение GPA (часто называемое «рецидивом»).Рецидивы могут быть похожи на те, которые испытывал пациент во время постановки диагноза, или симптомы могут отличаться. Вероятность серьезного рецидива можно свести к минимуму, если незамедлительно сообщать врачу о любых новых симптомах, регулярно осматривать врача и проводить постоянный мониторинг с помощью лабораторных тестов и визуализации. Подход к лечению рецидивов аналогичен лечению недавно диагностированного заболевания.
GPA — очень серьезное заболевание, лечение которого сопряжено со значительными рисками. Однако лечение может спасти жизнь, если диагноз поставлен своевременно и начато соответствующее лечение.
До того, как в 1970-е годы была признана эффективная терапия, половина всех пациентов с этим заболеванием умерла в течение 5 месяцев после постановки диагноза. Сегодня более 80% пролеченных пациентов живы по крайней мере восемь лет спустя. Многие люди со средним баллом успеваемости продемонстрировали долгосрочное выживание, когда многие из них могут вести относительно нормальный образ жизни. Если прошлое является прелюдией к будущему, текущие исследования приведут к дальнейшим открытиям и даже лучшему лечению.
Лечение гранулематоза Вегенера Бангалор | Васкулит Бангалор
Что такое гранулематоз Вегенера?
Гранулематоз с полиангиитом (ГПА), ранее известный как гранулематоз Вегенера, является редкой формой васкулита.При этом заболевании мелкие кровеносные сосуды в носу, пазухах, ушах, легких и почках воспаляются и повреждаются. В некоторых случаях могут быть затронуты и другие области. Он также может вызывать воспалительную ткань, известную как гранулема, которая обнаруживается вокруг кровеносных сосудов. Гранулемы могут разрушать нормальные ткани.
Гранулематоз Вегенера чаще всего встречается у взрослых среднего возраста, средний возраст начала составляет от 40 до 65 лет. Он редко встречается у детей, но был замечен у младенцев в возрасте 3 месяцев.У белых чаще, чем у чернокожих, развивается гранулематоз Вегенера.
Гранулематоз Вегенера вызывает
Точная причина неизвестна, но это аутоиммунное заболевание. Аутоиммунное заболевание возникает, когда иммунная система организма атакует и по ошибке разрушает здоровые ткани тела.
Симптомы гранулематоза Вегенера
Симптомы носовых пазух и легких наиболее распространены при GPA. Другие ранние симптомы включают лихорадку, ночную потливость, утомляемость и общее плохое самочувствие (недомогание).У некоторых людей болезнь ограничивается респираторной системой и не затрагивает почки. Поражение почек обычно не вызывает симптомов на ранней стадии заболевания. Его можно определить только по анализам крови и мочи. Со временем часто возникает почечная недостаточность и анемия.
Признаки и симптомы могут включать:
- Боль и воспаление носовых пазух
- Насморк с гнойными выделениями
- Носовое кровотечение
- Лихорадка
- Общее недомогание (недомогание)
- Непреднамеренная потеря веса
- Инфекции уха
- Кашель
- Боль в груди
- При кашле с кровью
- Одышка
- Боли и отеки в суставах
- Кровь в моче
- Язвы на коже
- Покраснение, жжение или боль глаз
Диагностика гранулематоза Вегенера
Врач ставит подозреваемый диагноз на основании сочетания симптомов, результатов физикального обследования, лабораторных тестов и рентгеновских лучей.Для подтверждения этого обычно используется биопсия.
Могут быть выполнены следующие тесты:
- ANCA. Анализ крови ищет белки, называемые антинейтрофильными цитоплазматическими антителами (ANCA), которые могут присутствовать у людей с этим заболеванием.
- Анализ мочи. Признаки заболевания почек можно обнаружить в моче.
- Биопсия. Будет взят небольшой образец пораженной ткани (с кожи, носовых оболочек, пазух, легких, почек или других участков) и изучен под микроскопом для подтверждения диагноза.
Другие тесты, которые могут быть выполнены на основе симптомов:
- Бронхоскопия с биопсией
- Биопсия почки
- Биопсия слизистой оболочки носа
- Открытая биопсия легкого
- Биопсия кожи
- Биопсия верхних дыхательных путей
- КТ синуса
- КТ грудной клетки
- Рентген грудной клетки
Лечение гранулематоза Вегенера
Быстрое лечение необходимо при GPA, потому что болезнь может быть смертельной.Однако после лечения прогноз для большинства пациентов хороший. Лечение включает кортикостероиды для быстрого уменьшения воспаления, а также другие лекарства для замедления иммунного ответа. Лекарства для лечения аутоиммунного ответа включают азатиоприн, циклофосфамид и метотрексат. Другие лекарства, которые иногда используются для лечения этого состояния, включают бисфосфонат для предотвращения потери костной массы, вызванной преднизоном, фолиевую кислоту для борьбы с побочными эффектами метотрексата и триметоприм / сульфаметоксазол для предотвращения инфекций легких.
Самопомощь при гранулематозе Вегенера
Следование программе лечения имеет важное значение при GPA, потому что нелеченное или недолеченное заболевание может привести к тяжелым осложнениям и смерти. Заболевание может вернуться в течение 2 лет после прекращения лечения примерно у половины всех пациентов.
Гранулематоз с полиангиитом (GPA), ранее известный как гранулематоз Вегенера | Эозинофильный гранулематоз с полиангиитом (ЭГПА)
,00Гранулематоз с полиангиитом (ГПА) — это васкулит (воспаление кровеносных сосудов), характеризующийся поражением сосудов малого и среднего размера и некротизирующими гранулемами (рассеянные сферические области разрушения тканей).Причина неизвестна, хотя в настоящее время проводится расследование по нескольким теориям. Считается, что это тип аутоиммунного заболевания, при котором собственные иммунные клетки пациента по ошибке начинают атаковать кровеносные сосуды и окружающие ткани. Это заболевание ранее называлось гранулематоз Вегенера до изменения номенклатуры Американского колледжа ревматологии в 2011 году. Известно, что заболевание поражает кровеносные сосуды и прилегающие ткани в основном в ушах, носу, горле, легких и почках.Этим заболеванием страдает каждый 33000 человек. Средний возраст начала заболевания — 55 лет. Большинство пострадавших (> 90%) — белые. Это заболевание может быть смертельным, если его не лечить. Существуют две основные формы GPA: 1) ограниченная (затрагивающая только уши, нос и горло) и 2) генерализованная (затрагивающая уши, нос, горло, легкие и почки).
Большинство пациентов с ГПД обращаются к врачу-отоларингологу (ЛОР) (часто до того, как им будет поставлен диагноз ГПД) из-за симптомов уха, носа или горла.Наиболее частые симптомы, с которыми сталкиваются пациенты с GPA, включают заложенность носа, снижение обоняния, насморк, кровотечение из носа, чрезмерное слезотечение из глаз и заметное уплощение переносицы. Когда пациенты с GPA проходят обследование в ЛОР-кабинете или клинике, у них могут быть такие результаты обследования, как 1) седловидная деформация носа (уплощение переносицы из-за разрушения хряща в носу), 2) перфорация перегородки (целая средняя стенка носа из-за разрушения хряща), 3) образование кровянистой корки в носу, 4) грануляционная ткань (толстая, красная, кровоточащая ткань, выстилающая внутреннюю часть носа) и 5) гнойный синусит ( гной, вытекающий из носовых пазух и бегущий из носа или в глотку).Чтобы определить, есть ли у пациента GPA, ЛОР-врач проведет тщательный осмотр ушей, носа и горла, эндоскопию носа и назначит или выполнит тесты для поиска конкретных маркеров GPA. Эти тесты могут включать рентген грудной клетки, компьютерную томографию носовых пазух, анализ мочи, забор крови и возможную биопсию воспаленных тканей внутри носа. Точно диагностировать средний балл может быть сложно из-за того, что анализ крови и маркеры биопсии, которые мы ищем для постановки диагноза, могут присутствовать только в 50% случаев, когда присутствует заболевание.
Для лечения ГПД обычно требуется как ревматолог (специалист по воспалительным и аутоиммунным заболеваниям), так и ЛОР. Если ЛОР-врач может поставить диагноз (или сильно подозрительно относится к диагнозу), необходимо направление к ревматологу. Пациентов часто лечат лекарствами, которые подавляют иммунную систему, так что иммунные клетки в кровотоке замедляют атаку на кровеносные сосуды и ткани пациента. Они могут включать циклофосфамид, метотрексат, преднизон и ритуксимаб.Долгосрочное применение супрессивной дозы антибиотика триметоприм-сульфаметоксазола также показало пользу пациентам с ГПД. ЛОР-врачи часто используют солевые ирригации, местные стероиды для носа, местные назальные антибиотики и периодическую очистку инфицированной слизистой и корок из носа для облегчения симптомов носа и пазух при GPA. Некоторым пациентам также может быть полезно установка ушных трубок, стентов слезного протока или процедуры на дыхательных путях. ГПД — это хроническое заболевание, излечения от которого не существует.Симптомы можно лечить и часто контролировать, но для этого требуются длительные отношения с ревматологом и отоларингологом.
Список литературы
- Erickson V, Hwang, P. Current Opinion in Otolaryngology & Head and Neck Surgery 2007, 15: 170 — 176
- Borner et al. Американский журнал ринологии и аллергии. 26 (6): 475-80, ноябрь-декабрь 2012 г.
- Вениг Б.Атлас патологии головы и шеи; 2-е изд.
Эозинофильный гранулематоз с полиангиитом (ЭГПА)
Эозинофильный гранулематоз с полиангиитом (EGPA) — это васкулит, характеризующийся эозинофильным воспалением сосудов малого и среднего размера. По своей природе он похож на гранулематоз с полиангиитом (GPA), но основным лейкоцитом, участвующим в воспалении, является эозинофил.EGPA встречается гораздо реже, чем GPA, а EGPA связан с аллергией, астмой и полипами носа.
1990 Критерии диагностики EGPA, принятые Американским колледжем ревматологов
Перед постановкой диагноза EGPA
- Астма
- Эозинофилия крови> 10%
- Аномалия околоносовых пазух (чаще всего выявляется при компьютерной томографии носовых пазух)
- Легочные инфильтраты (чаще всего обнаруживаются при рентгенографии грудной клетки или компьютерной томографии грудной клетки)
- Мононеврит или полинейропатия
- Биопсия ткани, показывающая васкулит с внесосудистыми эозинофилами
Гранулематоз с полиангиитом — обзор
Патологические признаки
GPA характеризуется наличием множественных двусторонних легочных узелков, часто с кавитацией 49 (рис.11,7; см. также рис. 11.6). Типичные находки — сплошные узелковые зоны консолидации с участками точечного или географического некроза (рис. 11.8 и 11.9). GPA редко может проявляться одиночным поражением легких, но солитарная гранулематозная болезнь, скорее всего, имеет инфекционное происхождение. 50 При работе с одиночным гранулематозным узлом в легком перед постановкой диагноза должна присутствовать комбинация классической гистологии и типичных клинических или серологических результатов GPA. 44 Даже если специальные окрашивания для микроорганизмов и культур отрицательны, большинство этих одиночных поражений представляют собой старую грибковую или микобактериальную инфекцию.Редко поражения GPA могут преимущественно поражать бронхи. При сильном остром легочном кровотечении поверхность разреза легкого кровянистая и темно-красная.
При сканирующем увеличении легочные поражения GPA имитируют их рентгенологический вид (рис. 11.8). Классические находки состоят из узловых областей консолидации с различными зонами некроза. Основные диагностические критерии, представленные во вставке 11.2, включают некроз паренхимы (рис. 11.9), васкулит (рис. 11.10) и гранулематозное воспаление (рис.11.11). Другой важной особенностью является смешанный воспалительный инфильтрат, состоящий из нейтрофилов, лимфоцитов, плазматических клеток, макрофагов, гигантских клеток и эозинофилов (рис. 11.12). Паренхиматозный некроз может принимать форму нейтрофильных микроабсцессов (рис. 11.13) или больших зон географического некроза (рис. 11.9). Нейтрофильные микроабсцессы почти патогномоничны для заболевания и могут быть обнаружены в смешанном воспалительном инфильтрате или в волокнистой соединительной ткани, включая адвентициальный коллаген более крупных артерий и вен и плевры.Ранние микроабсцессы могут состоять из небольшого скопления нейтрофилов, окружающих очаг дегенерированного, часто гиперэозинофильного, коллагена. 49
Как показано на рис. 11.9, классический географический некроз GPA обычно является базофильным из-за присутствия множества некротических нейтрофилов. В некротических центрах очагов поражения GPA часто отсутствует призрачное изображение структуры легких, что является диагностическим признаком, полезным в случае с атипичными признаками (рис. 11.14). Вероятно, это происходит потому, что некротические зоны GPA обычно не являются результатом инфаркто-подобного зонального паренхиматозного некроза, а скорее возникают в результате прогрессирующего распространения некроза коллагена.
Гранулематозное воспаление GPA обычно включает гигантские клетки, разбросанные случайным образом или в рыхлых агрегатах. Также обычно наблюдаются палисадные гистиоциты (рис. 11.15), гигантские клетки, выстилающие границы географического некроза или микроабсцессов, и микрогранулемы, состоящие из небольших очагов палисадных гистиоцитов, расположенных в виде колеса тележки вокруг центрального очага некроза (рис. 11.16). 49 Присутствие плотно сплетенных саркоидоподобных гранулем очень редко при GPA и предполагает инфекцию или некротический саркоид.Кроме того, наличие гранулем без сопутствующего некроза свидетельствует в пользу инфекционной этиологии по сравнению с GPA. 2,23,49
Васкулит GPA обычно поражает мелкие артерии и вены до 5 мм в диаметре. Когда васкулит выявляется при хирургической биопсии, он чаще всего возникает в плотном воспалительном инфильтрате, окружающем узловые или географические области некроза (рис. 11.17). Васкулит при GPA может включать множество воспалительных клеток, включая острое или хроническое воспаление стенок, некротические звездчатые гранулемы, ненекротические звездчатые гранулемы и гигантские клетки. 49 Рубцовые изменения, состоящие из фиброза стенок или облитерации просвета, могут наблюдаться в образцах после терапии. Часто наблюдается разрушение сосудистых эластических пластинок (рис. 11.18). Иногда воспаление ограничивается эндотелием (эндотелиалит) и субэндотелиальной стороной стенки сосуда. Несмотря на эти потенциальные сосудистые изменения, если некротический васкулит рассматривается как требование для диагностики, многие случаи GPA будут упущены.
Как уже упоминалось, в GPA могут встречаться все типы воспалительных клеток, включая нейтрофилы, лимфоциты, плазматические клетки, эозинофилы, гистиоциты и гигантские клетки.Иногда воспалительный инфильтрат состоит в основном из лимфоидных клеток, но это необычно. В таких случаях отличить ГПД от лимфоматоидного гранулематоза может быть сложно.
Еще одним характерным сосудистым проявлением ГПА является капиллярит (рис. 11.19). Во многих случаях капиллярит выявляется только очагово при биопсии. 49 Когда капиллярит выражен, он легко распознается. В редком случае ГПД с преобладанием капиллярита следует провести тщательный поиск в остальной части биопсии для выявления более типичных результатов ГПД, таких как гранулемы, очаги некроза (например, нейтрофильные микроабсцессы), многоядерные гигантские клетки и васкулит, поражающий артериолы. или вены.
В дополнение к этим основным гистологическим признакам могут встречаться различные второстепенные гистологические особенности (вставка 11.3), включая альвеолярное кровоизлияние, интерстициальный фиброз, липоидную пневмонию, органическую пневмонию, лимфоидную гиперплазию, внесосудистые тканевые эозинофилы и ксантоматозные поражения. ГПА также может поражать дыхательные пути, вызывая хронический бронхиолит, острый бронхиолит или бронхопневмонию, гистологический паттерн организации пневмонии (см. Ниже), бронхоцентрический гранулематоз, фолликулярный бронхиолит и стеноз бронхов. 49,51 Иногда одно из этих незначительных повреждений может быть основным результатом биопсии легкого. 49 Диффузное легочное кровотечение — серьезное опасное для жизни проявление ГПД. Бронхоцентрический гранулематоз — еще одно редкое проявление ГПА, встречающееся в 1% случаев. 49,51 Организационная пневмония (рис. 11.20) может быть замечена в 70% биопсий легких пациентов с GPA 49 ; в редких случаях он может быть достаточно доминирующим, чтобы некоторые назвали это проявление облитерирующим бронхиолитом, вызывающим пневмонию (BOOP) вариант GPA. 49,52 Это не следует путать с идиопатической сущностью BOOP (криптогенная организующая пневмония), но следует признать неспецифическую вторичную организацию после альвеолярного повреждения, связанного с поражением, лежащим в основе GPA.
Результаты биопсии легких у пациентов с ГПД могут не отражать классические гистологические данные, особенно если биопсия пациентов проводится на очень ранних стадиях заболевания или после терапии. 49,53 Интерстициальный фиброз (иногда с разбросанными гигантскими клетками, но без некроза) (рис.11.21), бронхиальные или бронхиолярные рубцы и рубцовые сосудистые изменения (рис. 11.22) часто встречаются при биопсиях легких пациентов, прошедших терапию. 49,53 Клиновидная биопсия обеспечивает наилучшие результаты для точной диагностики ГПД. Трансбронхиальная биопсия редко дает диагностическую информацию, хотя в соответствующем клиническом контексте наличие нескольких нейтрофильных микроабсцессов, гигантских клеток или капиллярита может быть полезным для подтверждения диагноза. При трансторакальной биопсии иглой могут иногда обнаруживаться признаки, позволяющие предположить диагноз GPA.
Гранулематоз Вегенера | Thorax
Гранулематоз Вегенера (WG) — это некротизирующий гранулематозный васкулит, который имеет клиническую предрасположенность к поражению верхних дыхательных путей, легких и почек. Причина WG остается неясной, хотя недавние исследования начали проливать свет на иммунные механизмы, которые могут играть роль в патофизиологии заболевания. Терапевтические вмешательства в РГ были в значительной степени неэффективными до тех пор, пока не было введено комбинированное лечение циклофосфамидом и глюкокортикоидами, которое резко улучшило исход пациентов.Хотя рецидив заболевания и токсичность лекарств остаются проблемой при использовании этого режима, он дал нам возможность для более длительного наблюдения за пациентами, от которых мы получили более глубокое понимание болезни.
Эпидемиология
Распространенность WG в Соединенных Штатах оценивается как минимум три на 100 000 с соотношением мужчин и женщин примерно 1: 1. Большинство пациентов (80–97%) составляют европеоид, в то время как афроамериканцы составляют около 2–8% от большинства когорт. Средний возраст на момент постановки диагноза составляет около 40–55 лет, хотя могут пострадать люди любого возраста.1 Существуют ли значительные различия в начале заболевания в разные сезоны или в осаждении болезни в результате вдыхания определенных твердых или газообразных материалов или инфекции, остается предметом разногласий. Недавние исследования не подтвердили идею сезонных колебаний независимо от того, получены ли данные из восприятия пациентом начала заболевания, медицинских записей или национальных обследований при выписке из больницы1. 2
В исследовании случай-контроль, в котором сравнивали пациентов с РГ, здоровых людей из контрольной группы, людей с идиопатическими воспалительными заболеваниями легких и различными ревматологическими заболеваниями, оценивалось воздействие твердых частиц окружающей среды и газообразных веществ.2 Более 75% пациентов во всех группах отметили воздействие вдыхаемых материалов из окружающей среды в течение года до начала заболевания (или даты интервью для здоровых людей из контрольной группы). Отсутствие разительной разницы между пациентами с WG и контрольными субъектами, редкость семейных случаев и отсутствие доминантного генотипа HLA среди пациентов с WG подтверждают представление о том, что приобретенная восприимчивость хозяина играет важную роль в этиологии заболевания.
Клинические особенности
Более 90% пациентов с ГВ в первую очередь обращаются за медицинской помощью по поводу симптомов со стороны верхних и / или нижних дыхательных путей.3 Заболевания носа и пазух характеризуются заложенностью и носовым кровотечением из-за рыхлости слизистой оболочки, изъязвления и утолщения. Перфорация носовой перегородки и / или седловидная деформация могут возникнуть в результате разрушения носового хряща. Подсвязочный стеноз наблюдается примерно у 20% пациентов и может вызвать опасное для жизни нарушение проходимости дыхательных путей. Высокий индекс подозрения важен для обнаружения этого поражения, поскольку он часто впервые диагностируется при отсутствии других признаков активной WG и имеет неспецифические симптомы, такие как одышка, изменения голоса и кашель.4 Несмотря на то, что заболевание подсвязочного канала оптимально диагностируется с помощью отоларингологической визуализации, внегрудная непроходимость можно предположить по изменениям петли поток-объем (рис. 1).
фигура 1Петля потока-объема у пациента с гранулематозом Вегенера с подсвязочным диаметром 2 мм. Уплощение наблюдается как на вдохе, так и на выдохе, что соответствует фиксированной внегрудной обструкции.
В нижних дыхательных путях WG может поражать паренхиму легких, бронхи и, в редких случаях, плевру.Рентгенограммы грудной клетки должны быть получены у всех пациентов с подозрением на ГВ, так как 34% случаев с рентгенологическими аномалиями оказались бессимптомными.3 Хотя двусторонние узловые инфильтраты являются обычным явлением, можно наблюдать широкий спектр рентгенологических характеристик, включая единичные узелки / инфильтраты. , полостное заболевание и диффузное альвеолярное кровотечение (рис. 2). Было обнаружено, что воспаление и стеноз эндобронхиальных дыхательных путей (рис. 3) наблюдается по крайней мере у 15% пациентов с поражением легких.5 6 Эндобронхиальное заболевание может проявляться кашлем, хрипом, одышкой, кровохарканьем или симптомами, связанными с коллапсом легких или постобструктивной инфекцией.
фигура 2Различный спектр рентгенографических аномалий, затрагивающих легочную паренхиму при гранулематозе Вегенера, по данным компьютерной томографии: (A) двусторонние узловые инфильтраты, (B) полостная болезнь, (C) легочное кровотечение.
Рисунок 3Сужение эндобронхиальных дыхательных путей при гранулематозе Вегенера.
Гломерулонефрит является одним из наиболее серьезных проявлений болезни WG, поскольку он может быстро прогрессировать до полной почечной недостаточности при отсутствии симптомов.5 Обнаружение обычно осуществляется по аномальным лабораторным результатам, таким как протеинурия, активный осадок мочи с микроскопической гематурией. цилиндры эритроцитов и потенциально снижение функции почек, о чем свидетельствует повышение сывороточного креатинина или снижение клиренса креатинина. Постоянная бдительность в отношении гломерулонефрита имеет важное значение, поскольку он присутствует при диагностике только у 20% пациентов, но развивается у 80% пациентов в какой-то момент в течение их заболевания.3
Хотя классически считается, что WG включает триаду системы органов верхних дыхательных путей, легких и почек, она может поражать практически любой участок (таблица 1). Среди участков, которые имеют значительный потенциал заболеваемости, находятся глаза и нервная система. В WG наблюдался широкий спектр глазных проявлений, которые могут угрожать зрению, воздействуя непосредственно на глаз или участвуя в его смежных структурах.7 К таким проявлениям относятся эписклерит, склерит, конъюнктивит, кератит, увеит, васкулит сетчатки, неврит зрительного нерва и ретро -глазничная псевдоопухоль.Множественный мононеврит наблюдался у 15% пациентов и 8% имели заболевание центральной нервной системы8
Таблица 1Гранулематоз Вегенера: клинический профиль поражения органов1-150
Диагностика и клиническое использование ANCA
Дифференциальный диагноз WG часто основан на участках поражения органов и часто включает инфекции, новообразования, заболевания соединительной ткани и другие гранулематозные заболевания. Поскольку лекарства, используемые для лечения WG, потенциально токсичны и могут ухудшить эти другие состояния, окончательный диагноз имеет важное значение.
Диагноз WG обычно ставится на основании гистологической демонстрации васкулита, гранулематозного воспаления и некроза9 в клинически совместимых условиях (рис. 4). Эти гистологические особенности часто неоднородны по распределению, при этом вероятность получения положительного результата биопсии зависит от участка органа и, в частности, от количества полученной ткани10. 11 Решение о том, из какого места следует взять образец биопсии, должно основываться на индивидуальных факторах, включая тяжесть заболевания, инвазивность процедуры, вероятность положительного результата на основе данных из литературы и срочность начала лечения.
Рисунок 4Паренхима легких, показывающая гистологические признаки гранулематоза Вегенера: некроз, гранулематозное воспаление и васкулит.
Антинейтрофильные цитоплазматические антитела (ANCA) были впервые описаны в 1982 году12, а в 1985 году было обнаружено, что они имеют высокую степень ассоциации с активными WG.13 С момента их описания были обнаружены два основных типа иммунофлуоресцентного окрашивания ANCA — цитоплазматический образец (c- ANCA) и перинуклеарный паттерн (p-ANCA). c-ANCA обнаружен у 70–90% пациентов с активной WG; его антигеном-мишенью является протеиназа-3, сериновая протеаза массой 29 кДа, обнаруженная в азурофильных гранулах нейтрофилов.14 p-ANCA имеет более широкий спектр ассоциаций с заболеванием и антигенной специфичности, но наблюдается у 5–10% пациентов с WG, где он обычно направлен против миелопероксидазы, другого компонента нейтрофильных гранул. 16
Сообщается, что чувствительность ANCA для WG колеблется от 28% до 92% 13. 17-19 Этот широкий спектр частично отражает различные критерии, которые применялись для постановки диагноза WG. Несколько серий продемонстрировали высокую специфичность c-ANCA для WG в диапазоне от 80% до 100%.Такая высокая степень чувствительности и специфичности c-ANCA для WG вызвала интерес к вопросу о том, можно ли его использовать в качестве средства диагностики. Несмотря на эти результаты, на полезность ANCA в качестве диагностического теста также влияет вероятность заболевания до теста, которая будет низкой в большинстве клинических ситуаций, учитывая необычный характер WG. Сообщалось также о положительных результатах теста ANCA при других заболеваниях, которые являются частью дифференциальной диагностики WG16. 20 Таким образом, хотя положительный результат теста c-ANCA может быть полезен для предположения о возможности WG, его обычно не следует использовать вместо образца биопсии для постановки диагноза.21 год
Поскольку титры ANCA будут меняться в течение болезни и, как было установлено, при активном заболевании выше, чем при неактивном, 13 17-19 некоторые авторы сомневаются в том, можно ли использовать последовательные титры ANCA для прогнозирования рецидива заболевания и принятия решений о лечении.22 Однако в одной серии, в которой пациенты наблюдались последовательно в течение 18 месяцев, у 44% пациентов наблюдалось четырехкратное повышение ANCA. У титра не наблюдалось последующего увеличения клинической активности заболевания. 23 Учитывая возможность того, что обострение заболевания может не произойти, а токсичность лечения может быть значительной, повышение титра ANCA само по себе не должно использоваться в качестве основы для возобновления или увеличения лечения.Однако такой вывод должен побудить к тщательной оценке любых объективных свидетельств активного заболевания и частому наблюдению за пациентом.
Лечение
Необработанная WG исторически имела неблагоприятный исход со средним временем выживания в пять месяцев.9 Глюкокортикоиды были первым лечением, которое было опробовано в WG, и, хотя они замедляли смертность, среднее время выживания оставалось всего 12,5 месяцев.24 циклофосфамид и глюкокортикоиды были важным достижением.3 5 По этой схеме пациенты получали циклофосфамид в дозе 2 мг / кг / день в течение одного года после ремиссии, которая затем снижалась и прекращалась. Наряду с этим был начат прием преднизона в дозе 1 мг / кг / сут. Эта доза продолжалась в течение одного месяца, после чего, если наступало улучшение, ее снижали по графику через день до прекращения приема, что обычно происходило через 6–12 месяцев. Из 133 пациентов, которые получали это лечение и находились под наблюдением от 6 месяцев до 24 лет (всего 1229 пациенто-лет), у 91% наблюдалось заметное улучшение их заболевания, 75% достигли полной ремиссии, а выживаемость составила 80%. наблюдаемый.3 Этот режим остается наиболее эффективным методом лечения активной ГВ, и любого пациента с непосредственно угрожающим жизни заболеванием или быстро прогрессирующим гломерулонефритом следует лечить ежедневным циклофосфамидом и глюкокортикоидами, если нет серьезных противопоказаний. Несмотря на преимущества этого лечения, рецидив заболевания был обнаружен у 50% пациентов, а заболеваемость от токсичности, связанной с лекарством, наблюдалась у 42%. В частности, переходно-клеточная карцинома мочевого пузыря развивалась у 6% пациентов, получавших циклофосфамид. По оценкам Каплана-Мейера, заболеваемость составляет 16% через 15 лет после первого воздействия препарата на пациента.25 Другие злокачественные новообразования, которые чаще наблюдаются у пациентов, получавших циклофосфамид, включают миелопролиферативные заболевания и возможное увеличение случаев рака кожи. 26 Хотя некоторые побочные эффекты циклофосфамида могут быть уменьшены путем периодического приема препарата, проспективные стандартизированные испытания, которые были выполнены на сегодняшний день, предполагают, что прерывистое дозирование связано с более высокой вероятностью рецидива.27-29 По этой причине мы остаемся неизменными. рекомендация о том, что циклофосфамид следует вводить ежедневно для WG.
Использование низких доз метотрексата и глюкокортикоидов изучалось у пациентов, у которых не было непосредственно угрожающего жизни заболевания или у которых развилось токсическое действие, связанное с циклофосфамидом. 30-32 При этом режиме пациенты получали метотрексат 20-25 мг один раз в неделю плюс преднизон, который был назначен. сужается по графику, аналогичному описанному для циклофосфамида. Метотрексат назначали в течение одного года после наступления ремиссии, затем его уменьшили и отменили.Из 42 пациентов, получавших эту схему, 33 (79%) достигли ремиссии с рецидивом, наступившим у 19 (58%) в среднем через 29 месяцев.32 Только три пациента не ответили на лечение, и произошло три смертельных исхода, ни один из которых васкулит. Pneumocystis carinii пневмония была наиболее часто наблюдаемым тяжелым побочным эффектом, поэтому мы рекомендуем профилактическое лечение триметопримом 160 мг / сульфаметоксазол 800 мг три раза в неделю для всех пациентов с ГВ, у которых нет аллергии на сульфаниламиды и которые получают цитотоксические средства и ежедневные глюкокортикоиды. .Эти данные подтверждают использование метотрексата в качестве приемлемой альтернативы для начального лечения отобранных пациентов, у которых нет немедленного опасного для жизни заболевания или у которых наблюдались значительные побочные эффекты, связанные с циклофосфамидом. Было также обнаружено, что метотрексат успешно поддерживает ремиссию у пациентов, которым был индуцирован циклофосфамид.33 Хотя время последующего наблюдения в этой серии было слишком коротким, чтобы полностью оценить частоту рецидивов, он предоставляет дополнительные доказательства относительной эффективности и безопасности метотрексата в РГ. .
Данные о других иммуносупрессивных и цитотоксических средствах ограничены, они поступают из отчетов о случаях заболевания и небольших серий. Такие препараты следует рассматривать только в качестве начального лечения, если есть противопоказания к циклофосфамиду или метотрексату. Было обнаружено, что азатиоприн не эффективен для индукции ремиссии, но может играть полезную роль в поддержании ремиссии у пациентов, у которых развивается токсичность в отношении циклофосфамида.5 Хлорамбуцил и циклоспорин имели переменную эффективность в отчетах небольшого числа пациентов, но их способность вызывать злокачественные новообразования и нефротоксичность, соответственно, необходимо учитывать.34 Хотя сообщалось о положительных результатах внутривенного введения иммуноглобулина 35, в одной серии исследований не было обнаружено положительных результатов у пациентов с заболеваниями основных органов36.
Несколько авторов сообщили о пользе использования триметоприма / сульфаметоксазола при лечении WG, ограниченного верхними и / или нижними дыхательными путями, 37 38, хотя методологические проблемы усложнили интерпретацию этих результатов. У ряда пациентов с подтвержденной биопсией WG, у которых инфекция была исключена, а другие виды лечения не добавлялись или не увеличивались в течение предыдущих трех месяцев, триметоприм / сульфаметоксазол оказал незначительное влияние на предотвращение прогрессирования заболевания или не оказал никакого влияния.3 Триметоприм / сульфаметоксазол можно рассматривать у пациентов с заболеванием, изолированным от верхних дыхательных путей, но он не рекомендуется для лечения заболеваний нижних дыхательных путей и никогда не должен использоваться отдельно при гломерулонефрите. Может ли триметоприм / сульфаметоксазол уменьшить рецидивы заболевания, также изучалось в исследовании Stegeman et al . 39, в которых пациенты были рандомизированы для приема комбинации препаратов или плацебо, когда их заболевание находилось в стадии ремиссии во время или после лечения глюкокортикоидами и циклофосфамидом.Через 24 месяца у 82% пациентов в группе триметоприма / сульфаметоксазола была ремиссия по сравнению с 60% пациентов, получавших плацебо. Однако при разбивке по типу рецидива только рецидив заболевания верхних дыхательных путей был значительно снижен в группе лечения, при этом не наблюдалось разницы в рецидивах основных систем органов. В качестве предостережения, хотя пациенты, принимающие метотрексат, могут безопасно получать триметоприм / сульфаметоксазол три раза в неделю для профилактики пневмонии Pneumocystis , их не следует лечить триметопримом / сульфаметоксазолом два раза в день, поскольку эта комбинация связана с серьезным подавлением костного мозга.32
В то время как наличие заболевания, поражающего основной орган (легкие, почки, нервную систему), требует лечения глюкокортикоидами и цитотоксическими агентами, не все проявления WG могут потребовать системной иммуносупрессивной терапии или ответить на нее. Изолированные симптомы носовых пазух можно лечить поэтапно, начиная с антибиотиков, орошения и назальных стероидов. Если это неэффективно и инфекция отсутствует, можно рассмотреть возможность применения пероральных глюкокортикоидов и / или метотрексата.Пациенты, которых лечат таким образом, должны находиться под тщательным наблюдением для подтверждения активности заболевания в других органах, поскольку такое поражение может быть бессимптомным и потребует другого терапевтического подхода.
Подсвязочный стеноз, связанный с WG, часто не проходит медикаментозно. Один из подходов, который оказался эффективным, заключается в сочетании механического расширения трахеи с интратрахеальной инъекцией глюкокортикоида длительного действия.4 Учитывая невосприимчивость этого поражения к медикаментозному лечению, пациенты, которым требуется иммуносупрессивное лечение по поводу других проявлений, должны проходить эту процедуру одновременно. .Тем не менее, при отсутствии активности основных заболеваний органов, субгортальный стеноз, связанный с WG, можно эффективно лечить, используя только этот метод.
Патогенез
Хотя причина WG остается неясной, несколько различных направлений исследований начали исследовать механизмы, которые могут играть роль в заболевании, и определить возможные области для терапевтического вмешательства в будущем.
За последние 15 лет все больше косвенных доказательств подтверждают мнение о том, что ANCA может усиливать иммуно-воспалительные явления, которые способствуют развитию WG и связанного с ним расстройства, микроскопического полиангиита.Хотя большинство пациентов с WG, вырабатывающих ANCA, обладают специфичностью антител к протеиназе-3 (PR-3), 40-42 не все пациенты являются ANCA-положительными. В исследовании Hauschild et al Было протестировано 40 более 23 700 образцов сыворотки у более 13 600 пациентов, из которых 445 имели ГВ. У тех людей, у которых была ограниченная WG без наличия гломерулонефрита, ANCA был положительным в 55%. Однако у пациентов с заболеванием, включающим гломерулонефрит, ANCA присутствовал в 88%. Похоже, что чем тяжелее заболевание, включая наличие гломерулонефрита, тем больше вероятность того, что тест ANCA будет положительным.Важным моментом этого и многих других исследований является то, что ANCA не всегда присутствует у всех пациентов с WG. Попытки идентифицировать иммунные комплексы, содержащие антитела к PR-3 и комплемент в пораженных тканях, как правило, были безрезультатными. Таким образом, за исключением ограничений чувствительности теста, отсутствие ANCA у значительного меньшинства пациентов с активным заболеванием может указывать на то, что, если он играет определенную роль, это не является существенной ролью. Тем не менее, большое количество данных указывает на то, что ANCA, обычно со специфичностью к PR-3, а иногда и к миелопероксидазе (MPO), может способствовать активации и повреждению кровеносных сосудов.
Активированные нейтрофилы экспрессируют множество цитоплазматических антигенов на своей клеточной поверхности, многие из которых являются ферментами.43-45 Связывание антител с отображаемой протеиназой-3, МПО и множеством других цитоплазматических ферментов нейтрофилов усиливает активацию нейтрофилов, дегрануляцию и производство супероксида. Цитоплазматические ферменты нейтрофилов могут также связываться с эндотелиальными клетками, где они могут непосредственно вызывать повреждение, а также усиливать активацию эндотелиальных клеток (46). 47 В исследованиях in vitro связывание анти-PR-3 с эндотелиальными клетками приводит к увеличению выработки эндотелиальными клетками IL-8, чрезвычайно мощного хемотаксического агента нейтрофилов.48 Одновременно с этими событиями эндотелиальные клетки, подвергшиеся воздействию анти-PR-3, также последовательно увеличивают продукцию IL-1α и тканевого фактора, основного инициатора каскада свертывания.49 Моноцит, как и нейтрофил, также продуцирует PR- 3, и при активации и воздействии анти-PR-3 они также значительно увеличивают продукцию IL-8, дополнительно создавая основу для усиленного хемотаксиса нейтрофилов.50 Если эндотелиальные клетки также были способны продуцировать и экспрессировать PR-3, дальнейшее усиление сосудистого повреждения последует.В то время как некоторые исследователи продемонстрировали продукцию PR-3 эндотелиальными клетками, другие — нет, и противоречивые результаты являются предметом значительных разногласий.51-54 Эффекты ANCA, которые приводят к усилению активации нейтрофилов и эндотелиальных клеток и повреждению, суммированы в Рис. 5. Вкратце, эти данные представляют собой убедительные косвенные доказательства, указывающие на роль ANCA в патогенезе WG и микроскопического полиангиита. Хотя эти наблюдения демонстрируют способность ANCA усиливать повреждение сосудов, они не объясняют избирательность органа.Гипотезы, основанные на ANCA, были бы более интригующими, если бы было показано, что исследования, которые включали преимущественно пораженные органы в WG, такие как дыхательные пути и почки, обеспечивали среду, благоприятствующую опосредованному ANCA повреждению.
Рисунок 5.(A) При активации нейтрофилы подвергаются дегрануляции и выбросу супероксида. Некоторые цитоплазматические антигены / ферменты могут затем связываться с мембраной нейтрофилов, включая протеиназу-3 (PR-3), бактерицидный белок, увеличивающий проницаемость (BPI), миелопероксидазу (MPO) и лактоферрин (LF).Когда один из этих антигенов связывается подходящим антителом, таким как анти-PR-3, степень активации нейтрофилов и всплеска супероксида увеличивается. (B) После высвобождения белки, такие как PR-3, могут связываться с эндотелиальными клетками (ЭК), где они могут вызывать повреждение и активацию эндотелиальных клеток. Антитела, связанные с PR-3 на эндотелиальной поверхности, могут затем привести к усиленной экспрессии молекул адгезии, увеличению продукции IL-8 и привлечению нейтрофилов, связыванию и дальнейшему повреждению эндотелиальных клеток.(C) Через эти механизмы могут быть задействованы различные пути, все из которых приводят к повреждению сосудов. В настоящее время эти механизмы неадекватно объясняют преимущественное нацеливание на органы при таких заболеваниях, как WG, когда наибольшая степень повреждения происходит в верхних дыхательных путях, нижних дыхательных путях и почках. Воспроизведено с разрешения Хоффмана и Спекс 42.
Потенциальная роль инфекции в инициировании и стимулировании развития РГ остается областью повышенного интереса. Пациенты с WG и другими васкулитами часто имеют клинические признаки, указывающие на инфекционное заболевание.В WG следует особо отметить, что дыхательные пути почти всегда изначально задействованы. В исследованиях бронхоальвеолярного лаважа участвовали пациенты с недавно диагностированным заболеванием и те, у кого возникла реактивация заболевания, а также люди в стадии ремиссии. Даже в тех случаях, когда клинические признаки активного заболевания дыхательных путей отсутствуют, пациенты обычно имеют нейтрофильный альвеолит в начале болезни и реактивации болезни.55-57 Было высказано предположение, что стимуляция дыхательных путей, вызывающая нейтрофильный ответ у иммунологически восприимчивого хозяина, может вызвать системные события, которые мы распознаем как WG.На сегодняшний день гистопатологические исследования образцов биопсии дыхательных путей, включая специальные окрашивания для микроорганизмов и культуры на бактерии, микобактерии, грибы, микоплазмы и респираторные вирусы, не смогли выявить возбудителя инфекции. Однако в большинстве попыток использовались обычные лабораторные методы. Более сложные молекулярные методы, включая полимеразную цепную реакцию (ПЦР), позволили идентифицировать инфекционные агенты при других заболеваниях, при которых требования к культивированию были необычайно требовательными, а окрашивание специальных тканей было недостаточно чувствительным.
Дальнейшее изучение инфекционной этиологии следует поощрять по нескольким причинам. Известно, что некоторые инфекции связаны с определенными типами васкулита. Болезнь Марека, ускоренная форма атеросклероза и воспаления сосудов, вызывается вирусом куриного птичьего герпеса. Болезнь может уничтожить целые стада животных, и ее можно предотвратить с помощью иммунизации58. Сообщалось, что у человека васкулит возникает в связи с гепатитом B, гепатитом C, вирусом Эпштейна-Барра, парво-B19 и ВИЧ-инфекциями.Однако у большинства пациентов, страдающих этими инфекциями, развиваются различные клинические проблемы, и только у <1% инфицированных людей развивается васкулит. Это наблюдение предполагает уникальную аномалию хозяина, которая приводит к этой особой форме проявления болезни. Несколько исследований на животных подтвердили эту гипотезу. Например, у множества иммунологически дефектных мышей с нормальным внешним видом разовьется васкулит после инфекций, вызванных гамма-вирусом герпеса. Васкулит у этих животных особенно очевиден на фоне генетической недостаточности гамма-интерферона или рецептора гамма-интерферона.59 60
Некоторые полагают, что стойкая инфекция как стимул к васкулиту неприемлема, потому что в большинстве случаев иммуносупрессивная терапия спасает жизнь, и пациенты не умирают от обширной инфекции. Пациенты с гепатитом B или ассоциированным с гепатитом C васкулитом часто значительно улучшаются, однако при иммуносупрессивной терапии у них увеличивается вирусная нагрузка. Подобный сценарий хорошо задокументирован для норки, зараженной вирусом алеутской болезни. Различные штаммы вирусов вызывают заболевание разной степени тяжести, и, хотя все норки восприимчивы, алеутские норки особенно восприимчивы к инфекции.У инфицированных животных вырабатываются циркулирующие иммунные комплексы, и у них развивается летальная форма васкулита, которую можно предотвратить путем лечения циклофосфамидом, хотя виремия сохраняется.61 62
Эти животные модели, в которых васкулит и инфекция встречаются вместе, показывают сходство с васкулитом у людей. Поражение органов и сосудов обычно неоднородно с многочисленными участками «скиповых поражений». Не все организмы вызывают одинаковую картину васкулита. В модели мышей с инфекцией гамма-вирусом герпеса заболевание возникает в основном в крупных артериях, таких как аорта и ее основные ветви, тогда как в случае болезни алеутской норки поражения обнаруживаются в основном в сосудах малого и среднего размера.Возможно, что уникальные свойства инфекционных агентов, такие как сродство к определенным тканевым субстратам, очаговые свойства тканей, гемодинамические характеристики органа и уникальный иммунный ответ различных участков, могут быть важны для «нацеливания» васкулита на орган. Недавние исследования на человеке показывают, что инфицирование Chlamydia pneumoniae или цитомегаловирусом может усиливать воспалительный компонент атеросклероза. Могут ли эти организмы вызывать усиленный воспалительный ответ у иммунологически дефектного хозяина, аналогично тому, как это происходит у животных? Мы надеемся, что по крайней мере некоторые из идиопатических васкулитов будут иметь инфекционную этиологию и, следовательно, будут иметь потенциал для лечебной терапии.
Другая область исследований была сосредоточена на попытке понять механизмы, лежащие в основе развития гранулем в WG. Было обнаружено, что при других заболеваниях гранулематозное воспаление является процессом, опосредованным сенсибилизированными CD4 + Т-клетками, которые продуцируют цитокины Th2 (IL-2, IFN-γ, TNF-α). Присутствие аналогичного воспаления в WG поднимает вопрос, могут ли повреждение тканей и васкулит быть опосредованными аберрантным иммунным ответом Th2. Поддержка этого механизма была получена в результате нескольких исследований.Как количественные, так и качественные отклонения в продукции цитокинов были описаны в WG и связанных с ними васкулитных синдромах. Повышенные сывороточные уровни IL-1, IL-2, IL-6 и TNF-α63. 64 и повышенная продукция TNF-α циркулирующими мононуклеарными клетками65 сообщалось у пациентов с WG. Более поздние исследования были сосредоточены на продукции провоспалительных цитокинов при активных васкулитах in situ. Повышенная продукция IL-1 и TNF-α была обнаружена в почечных клубочках пациентов с WG и активным гломерулонефритом с использованием полимеразной цепной реакции с обратной транскрипцией (RT-PCR), гибридизации in situ и иммуногистохимических методов.66 Используя аналогичный подход, Weyand и его коллеги67 обнаружили мРНК для IL-1, TNF-α, IL-6, IL-2, IFN-γ и TGF-β в срезах височных артерий пациентов с гигантоклеточным артериитом, еще одним гранулематозом. синдром васкулита. В параллельных исследованиях гистологически нормальных височных артерий у пациентов с ревматической полимиалгией была обнаружена мРНК для IL-1, TNF-α, IL-6 и IL-2, но образцы тканей не содержали последовательности IFN-γ, что позволяет предположить, что IFN-γ может быть вовлечен в развитие явного артериита.
Недавние данные Ludviksson и соавт. предоставили наиболее убедительные на сегодняшний день доказательства того, что Т-клетки, связанные с гранулематозным воспалением WG, смещены в сторону цитокинового паттерна Th2.68 Исследования лимфоцитов периферической крови у пациентов с активными WG показали, что CD4 + Т-клетки продуцировали в 10-20 раз более высокие уровни IFN-γ и значительно больше TNF-α, чем CD4 + T-клетки из нормального контроля. Напротив, не было разницы в уровне Th3-ассоциированных цитокинов (IL-4, IL-5 или IL-10), продуцируемых Т-клетками пациентов с WG, по сравнению с контрольными субъектами.Обнаружение того, что поражения WG связаны с T-клетками, смещенными в сторону дифференцировки Th2-клеток, подразумевает нарушение регуляции IL-12, первичного индуктора T-клеток, продуцирующих IFN-γ. Хотя самые высокие уровни продукции IL-12 были получены с моноцитами от пациентов с активным заболеванием, Ludviksson et al наблюдали, что моноциты от пациентов с неактивным заболеванием также производили повышенное количество IL-12,68. Это предполагает увеличение продукции IL-12. не является вторичным эффектом воспалительного процесса, а, скорее, первичным признаком WG.
На основании этих наблюдений было выдвинуто предположение, что воздействие на пациентов с WG вредных воздействий окружающей среды (таких как инфекции) и / или аутоантигенов вызывает чрезмерный ответ макрофагов на IL-12, приводящий к несбалансированной продукции цитокинов Th2. Такая аберрантная продукция TNF-α и INF-γ может инициировать и поддерживать гранулематозное воспалительное поражение сосудов, которое характеризует WG. На этот процесс может дополнительно влиять ANCA, который может усиливать активацию нейтрофилов, эндотелиальных клеток и моноцитов.Однако, как отмечалось ранее, поскольку значительная часть пациентов с WG является ANCA-отрицательной, существенная роль ANCA в этом процессе маловероятна. Эти результаты имеют потенциально важное значение для лечения WG. В частности, они предполагают, что подходы, которые подавляют путь Th2 и продукцию IL-12, могут остановить воспаление. Это подтверждается открытием, что добавление экзогенного IL-10 вызывает дозозависимую блокаду продукции INF-γ мононуклеарными клетками периферической крови пациентов с активным WG.68
Выводы
WG — это системный васкулит, который может быть связан со значительной заболеваемостью и смертностью в результате заболевания или его лечения. Многое остается неизвестным о факторах, которые инициируют и поддерживают воспалительный процесс WG, хотя в последние годы были достигнуты значительные успехи. По мере достижения дальнейшего понимания может стать возможным воздействовать на терапевтически важные элементы в патофизиологических механизмах, лежащих в основе WG, тем самым устраняя риски агентов, которые связаны с неселективной иммуносупрессией.

