Э — Энтерококки . Азбука антибиотикотерапии. Видаль справочник лекарственных препаратов
Автор: Трубачева Е.С., врач – клинический фармаколог
Темой сегодняшнего разговора будут одни из наиболее распространенных микроорганизмов из семейства Enterobacteriaceae — энтерококки, которые являются грамположительными кокками и факультативными анаэробами.
Микробиологические аспекты
Энтерококки входят в состав нормальной микрофлоры кишечника, обитают в основном в тонкой кишке и при этом, обнаруживаясь за пределами своей естественной среды обитания, являются возбудителями множества социально-значимых заболеваний. Наибольшее клиническое значение имеют E.faecalis и E.faecium.
Отличительным свойством энтерококков является их способность к образованию биопленок. О биопленках достаточно подробно мы рассуждали в статье, посвященной синегнойной палочке. И специфика течения многих заболеваний, вызванных энтерококками, объясняется именно пленкообразованием.
Одной из отличительных особенностей этого класса является изначальная природная устойчивость энтерококков к целому ряду антибактериальных препаратов, особенно это касается такого представителя как E.faecium, — большинство бета-лактамов цефалоспоринового ряда против него бессильны. Хотя и фекальный энтерококк пытаться истреблять цефалоспоринами тоже не стоит. Помимо наличия природной устойчивости к антибактериальным препаратам, одним из значимых событий стало появление ванкомицин-резистентных штаммов энтерококка (ВРЭ) не только в условиях специализированных онкогематологических стационаров, но и в общей клинической практике. Причем на данный момент уровень резистентности к ванкомицину у E.faecium составляет порядка 80%, что приводит к тому, что без микробиологической детекции и определения чувствительности к антибиотикам данный препарат не может быть использован в рутинной практике. У E.faecalis уровень резистентности к ванкомицину пока не превышает 7%.
Клинические аспекты
Наиболее частым возбудителем внебольничных инфекций является E.faecalis — сюда относятся инфекции мочевыводящих путей и инфекционные эндокардиты у внутривенных наркозависимых пациентов.
E.faecium наиболее часто выявляется при нозокомиальных инфекциях — здесь преобладают так же инфекции мочевыводящих путей, но связанные с проведением инструментальных методов исследования, а также всевозможные виды бактеремий, связанных с медицинскими вмешательствами.
Когда мы можем думать о состояниях, вызванных энтерококками?
- Менингиты, как следствие черепно-мозговых травм, нейрохирургических вмешательств и при наличии антомических дефектов центральной нервной системы
- Перитониты любой этиологии
- Пельвиоперитониты (в составе микст-флоры)
- У пациентов с диабетической стопой
- У пациентов с инфекциями мочевыводящих путей, особенно в случаях их катетеризации
- Уросепсис
- У внутривенных наркозависимых — наравне с зеленящими стрептококками — энтерококки являются одними из наиболее частых возбудителей, а потому эмпирическая антибактериальная терапия должна перекрывать оба эти возбудителя
- Холангиты и инфекции билиарного тракта
- Катетер-ассоциированные инфекции (наряду с эпидермальными стафилококками)
Существуют следующие факторы риска инфицирования энтерококками:
- Длительные и неоднократные госпитализации
- Пациенты старшего возраста
- Пациенты с иммунодефицитами различной этиологии
- Лица, страдающие хроническими заболеваниями, такими как рак и диабет
- Пациенты с установленными мочевыми катетерами
- Пациенты на гемодиализе
- Пациенты с нейтропениями
- Наличие центральных венозных катетеров и дефекты ухода за оными
- Использование в стационарах антибиотиков широкого спектра действия (срабатывает принцип «свято место пусто не бывает», и энтерококки получают селективное преимущество на поле боя, где полегла остальная микрофлора)
- Недавно прооперированные пациенты или пациенты с открытыми ранами и язвами (высокий риск внутрибольничного инфицирования)
- Пациенты с установленными дренажами, а также интубированные пациенты (риск внутрибольничного инфицирования)
Как мы можем заметить, основную роль в развитии заболеваний, вызванных энтерококками, играет человеческий, точнее ятрогенный фактор.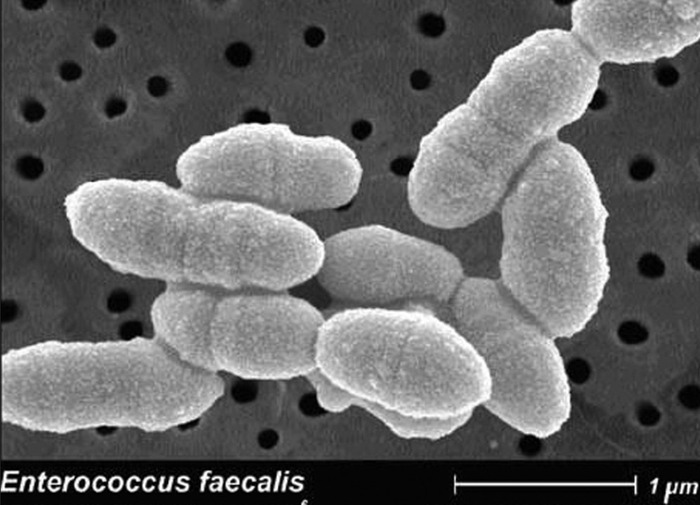
Аспекты лечения
Их можно разделить на лекарственные и нелекарственные.
К нелекарственным аспектам относятся замена всех катетеров и дренажей, а также повторная хирургическая обработка ран. Это связано с тем, что энтерококки умеют образовывать биопленки, и пока эти пленки физически не будут удалены, все остальные лекарственные мероприятия будут почти бессмысленны, так как редкий антибиотик может пробиться сквозь полимерную структуру пленки, ведь это все равно что вылить препарат на целлофановый пакет — сверху, может быть, что-то и умрет, и то не факт, а внутри жизнь как бурлила, так и бурлит, что приведет к дальнейшему отшнуровыванию новых энтерококков и продолжающемуся развитию инфекционного процесса.
Аспекты медикаментозного лечения
Здесь автор отступит от правила и не отправит изучать вопрос по книжкам и таблицам, а попытается расписать антибактериальную терапию более подробно. Это связано и со спецификой самого возбудителя, и со спецификой контингента, имеющего заболевания, им вызванные.
- Инфекционный эндокардит
Как уже упоминалось ранее, наряду с зеленящим стрептококком, а вообще намного чаще, энтерококк является основным возбудителем инфекционного эндокардита у лиц с внутривенной наркотической зависимостью. Проще говоря, если перед вами наркозависимый, и у него эндокардит трикуспидального клапана, то первое, о чем вы должны подумать, — это энтерококк, и эмпирическую терапию назначать с учетом этого знания. Конечно, могут быть варианты в виде того же зеленящего стрептококка или даже золотистого стафилококка, но эти возбудители более присущи пациентам с несанированной ротовой полостью и на митральном клапане (зеленящий) или после кардиохирургического вмешательства (золотистый стафилококк). Также на стафилококковый, а не энтерококковый характер поражения будет намекать снимок органов грудной клетки в прямой проекции, подозрительно напоминающий решето (один раз увидев стафилококковую метастатическую пневмонию ее уже ни с чем не перепутаешь).
Проще говоря, если перед вами наркозависимый, и у него эндокардит трикуспидального клапана, то первое, о чем вы должны подумать, — это энтерококк, и эмпирическую терапию назначать с учетом этого знания. Конечно, могут быть варианты в виде того же зеленящего стрептококка или даже золотистого стафилококка, но эти возбудители более присущи пациентам с несанированной ротовой полостью и на митральном клапане (зеленящий) или после кардиохирургического вмешательства (золотистый стафилококк). Также на стафилококковый, а не энтерококковый характер поражения будет намекать снимок органов грудной клетки в прямой проекции, подозрительно напоминающий решето (один раз увидев стафилококковую метастатическую пневмонию ее уже ни с чем не перепутаешь).
Чем будем лечить?
Как ни странно это прозвучит в современных условиях, но препаратами выбора будут представители аминопенициллинового ряда — ампициллин (дешевле) или амоксициллин (в разы дороже) в обязательной комбинации с аминогликозидом — гентамицином (этот дешевле) или амикацином. Поэтому если вы работаете в стационаре скорой помощи и у вас попадаются пациенты данной категории — ампициллин для инъекций крайне рекомендуется иметь на полках аптеки в достаточных количествах. Это до сих пор дешево, сердито и очень эффективно в случаях терапии энтерококковых инфекций почти любой этиологии, и главное правильно рассчитать дозу, так как аминопенициллины относятся к так называемым время-зависимым препаратам (читаем первую и вторую часть здесь).
Поэтому если вы работаете в стационаре скорой помощи и у вас попадаются пациенты данной категории — ампициллин для инъекций крайне рекомендуется иметь на полках аптеки в достаточных количествах. Это до сих пор дешево, сердито и очень эффективно в случаях терапии энтерококковых инфекций почти любой этиологии, и главное правильно рассчитать дозу, так как аминопенициллины относятся к так называемым время-зависимым препаратам (читаем первую и вторую часть здесь).
Повторимся еще раз — аминопенициллины в данном случае должны использоваться только в комбинации с аминогликозидами ввиду их синергетического действия в отношении энтерококков и ввиду вероятности микст-инфекции у подобной категории пациентов.
Вопрос по эмпирическому использованию ванкомицина остается дискуссионным — если в случае E.faecalis его можно назначать на уровне эмпирической терапии, когда у пациента имеется документированная аллергия на пенициллины (если конечно вам покрасили мазок по Граму или ваш стационар настолько крут, что имеет свой масс-спектрометр), то в случае E. faecium даже начинать не стоит — сразу зовите специально обученного человека, пусть он думает, что дальше делать.
faecium даже начинать не стоит — сразу зовите специально обученного человека, пусть он думает, что дальше делать.
Как уже было выше упомянуто, цефалоспорины назначать не стоит — энтерококки к ним природно устойчивы. А для того чтобы рука потянулась к карбопенемам, вам надо иметь доказанную мульти-резистентность возбудителя.
Итак, исходя из вышесказанного, в типичной ситуации бактериального эндокардита (особенно трикуспидального клапана у наркозависимых), а также менингита или энтерококкового сепсиса на фоне нейтропении, препаратами выбора до сего дня остаются — ампициллин в комбинации с гентамицином:
- Ампициллин назначается в дозировке 2 грамма каждые 4 часа внутривенно (6 раз в сутки, так как препарат создает времязависимую подавляющую концентрацию), либо, если уж совсем денег нет, то можно использовать пенициллин в дозировке 18-24 млн ЕД в сутки в виде суточной инфузии, если в отделении есть инфузомат (если нет, то делим на шесть введений).
 Таблетированными формами ампициллина пользоваться нельзя, и не только в таких серьезных ситуациях — у таблеток большие проблемы с биодоступностью (менее 40%), то есть создать бактерицидную концентрацию почти не реально.
Таблетированными формами ампициллина пользоваться нельзя, и не только в таких серьезных ситуациях — у таблеток большие проблемы с биодоступностью (менее 40%), то есть создать бактерицидную концентрацию почти не реально. - Гентамицин рассчитывается на килограмм массы тела (1 мг/кг/сут) и вводят однократно внутримышечно (так как он относится к дозозависимым антибиотикам). Стоит отдельно отметить, что правило отмены через 7-10 суток в отношении гентамицина в случае жизнеугрожающих инфекций не действуют, так как польза превышает возможный вред, и препараты назначаются на весь срок лечения под контролем клиренса креатинина, который берется до начала лечения и далее каждые три дня.
В случае развития резистентности к ампициллину используется его защищенная форма в виде ампициллина/сульбактама в комбинации с гентамицином. Дозировки рассчитываются по ампициллину.
Если совсем не повезло и лаборатория дала мультирезистентного фекального энтерококка, то используется комбинация ванкомицин (15 мг/кг/сут) в комбинации с гентамицином (8 мг/кг/сут) под жесточайшим контролем функции почек. Кроме того, в случае мультирезистентного возбудителя может быть использована комбинация имипенема с ампициллином, если, конечно, сможете обосновать ее для страховой компании — автор обосновывала, необходимый эффект получала, пациент не только выживал, но и выздоравливал. Только призывать к такого рода схемам, описанным, в основном, в американской литературе, автор ни в коем случае не будет, особенно в нынешние неспокойные времена. Сейчас наши основные документы по назначению любого вида терапии располагаются здесь.
Кроме того, в случае мультирезистентного возбудителя может быть использована комбинация имипенема с ампициллином, если, конечно, сможете обосновать ее для страховой компании — автор обосновывала, необходимый эффект получала, пациент не только выживал, но и выздоравливал. Только призывать к такого рода схемам, описанным, в основном, в американской литературе, автор ни в коем случае не будет, особенно в нынешние неспокойные времена. Сейчас наши основные документы по назначению любого вида терапии располагаются здесь.
В случае обнаружения резистентного E.faecium препаратом выбора становится линезолид и, не побоюсь этого слова, молитва, так как срок лечения не менее 8 недель, а кто нам столько препарата выдаст, да и прогноз при применении бактериостатика как-то не очень.
- Катетер-ассоциированные инфекции: помимо удаления катетера и обязательного исследования оного в микробиологической лаборатории, установки нового катетера в новом месте, также используется ампициллин в комбинации с гентамицином (в тех же дозировках, что описаны выше) либо ванкомицин (15 мг/кг/сут), если пациент демонстрирует аллергическую реакцию на оные, либо линезолид 600 мг каждые 12 часов, либо даптомицин 6 мг/кг/сут (если сможете его добыть).

- Инфекции мочевыводящих путей — здесь предпочтение стоит отдать пероральному амоксициллину в комбинации с клавулановой кислотой дважды в день. Вызвана сия рекомендации тем, что это чаще всего эта инфекция, присущая амбулаторному этапу, будет вызвана дикой и непуганой флорой, и заодно прикроетесь от вероятной кишечной палочки как второго возбудителя. Если ситуация развилась в стационаре — смотрим пункт первый и лечим по той же схеме.
- Отдельного упоминания требует лечение ванкомицин-резистентных энтерококков, так как видят их уже практически все доктора хирургического и реанимационного профиля. Арсенал наш в этом случае крайне беден — это, по сути, только линезолид да даптомицин. Линезодид является бактериостатиком, дающим высокие риски миелосупресии и тромбоцитопении через 2 недели от начала применения, которое должно составлять не менее 8 недель, но это, по сути, единственный шанс для пациента с энтероккоковым менингитом, устойчивым к ванкомицину, так как даптомицин, который надо найти, и как-то убедить его купить (стоит он просто безбожных денег), в мозговые оболочки не проникает в виду размера самой молекулы.
 Можно также упомянуть о тигециклине (100 мг нагрузочная и далее по 50 мг каждые 12 часов), но он тоже стоит как самолет. Поэтому самым лучшим вариантом лечения ванкомицин-устойчивых энтерококковых инфекций является их недопущение в принципе, то есть СанПин, СанПин и еще раз СанПин. А уж если такой пациент все-таки приключился, то необходима немедленная изоляция оного в отдельную палату, а еще лучше в изолятор, чтобы от него не переинфицировать всех вокруг, если вдруг кто-то про обработку рук забудет.
Можно также упомянуть о тигециклине (100 мг нагрузочная и далее по 50 мг каждые 12 часов), но он тоже стоит как самолет. Поэтому самым лучшим вариантом лечения ванкомицин-устойчивых энтерококковых инфекций является их недопущение в принципе, то есть СанПин, СанПин и еще раз СанПин. А уж если такой пациент все-таки приключился, то необходима немедленная изоляция оного в отдельную палату, а еще лучше в изолятор, чтобы от него не переинфицировать всех вокруг, если вдруг кто-то про обработку рук забудет.
На этом краткий обзор энтерококковых инфекций закончим, и из кишечной микрофлоры у нас останется только королева внтурибольничных инфекций — ее величество Klebsiella, о которой мы поговорим в одной из следующих публикаций.
Поделиться с друзьями
Пожалуйста, заполните поля e-mail адресов и убедитесь в их правильности
Роль факторов патогенности Enterococcus faecalis в развитии пиелонефрита у детей Текст научной статьи по специальности «Клиническая медицина»
УДК 616. егососсш faecalis в развитии пиелонефрита у детей
егососсш faecalis в развитии пиелонефрита у детей
Е.А. Зайцева1, Е.В. Крукович1, Е.А. Мельникова1, 2, В.Н. Лучанинова3, Т.С. Коменкова1, Н.С. Вайсеро2
1 Тихоокеанский государственный медицинский университет (690950, г. Владивосток, пр-т Острякова, 2),
2 Краевая детская клиническая больница № 1 (690078, г. Владивосток, пр-т Острякова, 27), 3 Северо-Западный государственный медицинский университет им. И.И. Мечникова (191015, г. Санкт-Петербург, ул. Кирочная, 41)
Представлены результаты микробиологического исследования культур Enterococcus faecalis, изолированных из мочи детей с патологией мочевыделительной системы. Исследуемые культуры показали фенотипическую неоднородность биологических свойств, в том числе факторов вирулентности. Установлено, что преобладающий в клинической картине интоксикационный синдром обусловлен комплексом патогенных факторов фекального энтерококка, вызывающих токсическое повреждение тканей..jpg) Выявлена корреляционная связь между степенью адгезии, гемолитической, желати-назной и лецитиназной активностями с симптомами поражения верхних мочевых путей, что свидетельствует о важном значении микробной адгезии и определенных факторов вирулентности E. faecalis в патогенезе инфекционно-воспали-тельного процесса.
Выявлена корреляционная связь между степенью адгезии, гемолитической, желати-назной и лецитиназной активностями с симптомами поражения верхних мочевых путей, что свидетельствует о важном значении микробной адгезии и определенных факторов вирулентности E. faecalis в патогенезе инфекционно-воспали-тельного процесса.
Ключевые слова: энтерококк фекальный, уропатогенность, инфекция мочевой системы, показатели адгезии.
В последние годы все большее значение среди этиологических факторов инфекционных заболеваний приобретают грамположительные кокки, в том числе фекальный энтерококк (Enterococcus faecalis). Частота его регистрации как причины инфекции мочевой системы (ИМС) за последние 15 лет увеличилась и составляет, по данным разных авторов, от 5 до 14,2 %, а при нозокомиальной ИМС — от 10 до 16 % [2, 10, 15].
Усиление значимости фекального энтерококка в развитии поражений мочевой системы, в том числе пиелонефрита, обусловлено многими причинами: факторами патогенности микроорганизма (в т. ч. множественной антибиотикорезистентностью), увеличением числа лиц с иммунодефицитными состояниями и др. [3]. ИМС — это результат бактериально-госталь-ных взаимоотношений, зависящих как от генетически детерминированных фенотипических признаков (уропатогенности) бактериальных агентов, так и от состояния макроорганизма. К последним относят нарушения уродинамики, аномалии мочевой системы, нарушение резистентности организма у детей и пожилых, беременных и пациентов с сахарным диабетом, лиц с иммунодефицитами (в т.ч. после пересадки почки) [4, 6, 11].
ч. множественной антибиотикорезистентностью), увеличением числа лиц с иммунодефицитными состояниями и др. [3]. ИМС — это результат бактериально-госталь-ных взаимоотношений, зависящих как от генетически детерминированных фенотипических признаков (уропатогенности) бактериальных агентов, так и от состояния макроорганизма. К последним относят нарушения уродинамики, аномалии мочевой системы, нарушение резистентности организма у детей и пожилых, беременных и пациентов с сахарным диабетом, лиц с иммунодефицитами (в т.ч. после пересадки почки) [4, 6, 11].
Уропатогенность, как частное проявление пато-генности бактерий — полидетерминантное свойство микроорганизмов, отражающее их способность формировать эндогенные очаги инфекции, проникать в почки и уротракт, колонизировать органы мочевой системы и инициировать в них воспалительный процесс [1, 7]. Энтерококки синтезируют большое количество факторов патогенности, способствующих развитию инфекционного процесса. К ним относят факторы агрегации и феромоны, интенсифицирующие
К ним относят факторы агрегации и феромоны, интенсифицирующие
Зайцева Елена Александровна — д-р мед. наук, профессор кафедры микробиологии и вирусологии ТГМУ; e-mail: [email protected]
процессы генетического обмена у этих микроорганизмов, внеклеточные металлопептидазы, гидролизиру-ющие коллаген, гемоглобин и другие белки, а также цитолизины — бактериоцины, разрушающие про- и эу-кариотические клетки, и др. [3, 9]. Наибольшее количество факторов патогенности выявлено у E. faecalis, выделенных из мочи [14]. Высокая протеолитическая активность данного микроорганизма (гидролиз желатина, казеина, коллагена) вызывает токсическое повреждение тканей и способствует формированию рубцовых изменений в почках при ИМС [3, 8, 11, 14]. Однако, несмотря на частую встречаемость E. faecalis среди возбудителей ИМС у детей, его свойства как уропатогена изучены и описаны недостаточно, хотя именно от них зависят характер поражения органов мочевой системы, степень тяжести и прогноз заболевания.
Цель работы: анализ факторов вирулентности у E. faecalis, изолированных из мочи детей с пиелонефритом, для оценки их патогенного потенциала.
Материал и методы
В работе исследовано 57 культур E. faecalis, выделенных из мочи 57 детей в возрасте от 3 дней до 16 лет с патологией мочевыделительной системы, находившихся на лечении в Краевой детской клинической больнице № 1. Анализировалась клиника заболевания. Микробиологическое исследование мочи проводилось согласно приказу МЗ СССР № 535 от 22 апреля 1985 г. Морфологические, культуральные и биохимические свойства оценивали общепринятыми методами. Адгезивную активность энтерококков определяли по В.И. Брилис и др. (1986). Для оценки адгезивных свойств использовали средний показатель адгезии (СПА) и индекс адгезивности микроорганизма (ИАМ).
PMJ 2017 No. 2
2
Original Researches
59
Полученные данные обрабатывались с применением метода параметрического и непараметрического анализа. Из показателей описательной статистики рассчитывались средние арифметические и их ошибки. Для оценки степени взаимосвязи проводился корреляционный анализ Пирсона с расчетом коэффициента (К) и достоверности корреляции (при 0,2<К<0,5 — корреляция считалась слабой, при 0,5<К<0,7 — средней, при 0,7<К<0,9 — сильной и при 0,9<К<1 — очень сильной).
Результаты исследования
Большинство культур Е./аесаШ продемонстрировали типичные морфологические и культуральные свойства, были каталазоотрицательными, и 35,0±10,9 % из них имели капсулу. Установлено фенотипическое разнообразие различных факторов вирулентности. У большинства культур (85,0±8,2 %) определялась липоли-тическая активность, чаще по отношению к твину-20 и твину-80: 94,6±3,7 и 96,3±3,7 % из этих культур, соответственно. У 82,9±5,9 % уропатогенных энтерококков (47 культур) отмечалась протеолитическая активность. Наиболее частым свойством Е. /аесаШ (41 культура) была ферментация молока, тогда как желатиназная активность зарегистрирована только у 18 культур. При этом ферментация и молока, и желатина выявлялась у 14 культур Е./аесаШ (табл.).
У большинства культур (85,0±8,2 %) определялась липоли-тическая активность, чаще по отношению к твину-20 и твину-80: 94,6±3,7 и 96,3±3,7 % из этих культур, соответственно. У 82,9±5,9 % уропатогенных энтерококков (47 культур) отмечалась протеолитическая активность. Наиболее частым свойством Е. /аесаШ (41 культура) была ферментация молока, тогда как желатиназная активность зарегистрирована только у 18 культур. При этом ферментация и молока, и желатина выявлялась у 14 культур Е./аесаШ (табл.).
52,6±6,6 % уропатогенных Е./аесаШ обладали гемолитической активностью. При этом обнаруживались два варианта гемолиза — а- и в-типа (табл.).
При анализе адгезивных свойств энтерококков все исследуемые культуры разделились на две группы -со средним и высоким уровнем адгезии. Было установлено, что у Е. /аесаШ со средним уровнем адгезии (СПА=2-4) реже отмечалась протеолитическая (12,5 % культур разжижали желатин), лецитиназная (12,5 %) и липазная (75 %) активности, а также определялась гемолитическая активность а-типа (35,7 %). Энтерококки с высоким показателем адгезии (СПА>4) с большей частотой ферментировали желатин (50 % культур) и молоко (91,7 % культур), обладали лецитиназной (50 % культур) и липазной (91,7 % культур) активностями, 58,3 % из них демонстрировали гемолиз в-типа. Выявлено пять культур Е. /аесаШ со значениями СПА выше 5,5, среди которых три были изолированы из
Энтерококки с высоким показателем адгезии (СПА>4) с большей частотой ферментировали желатин (50 % культур) и молоко (91,7 % культур), обладали лецитиназной (50 % культур) и липазной (91,7 % культур) активностями, 58,3 % из них демонстрировали гемолиз в-типа. Выявлено пять культур Е. /аесаШ со значениями СПА выше 5,5, среди которых три были изолированы из
Таблица
Ферментативная активность 57 изолятов Е. /аесаН$, связанная с патогенностью
Фактор патогенности Кол-во культур
абс. M±m, %
Гемолитическая а-тип 14 24,6±5,7
активность р-тип 16 28,1±5,9
Протеолитиче- желатин 18 31,6±6,1
ская активность молоко 39 68,4±6,2
мочи от новорожденных с пневмонией.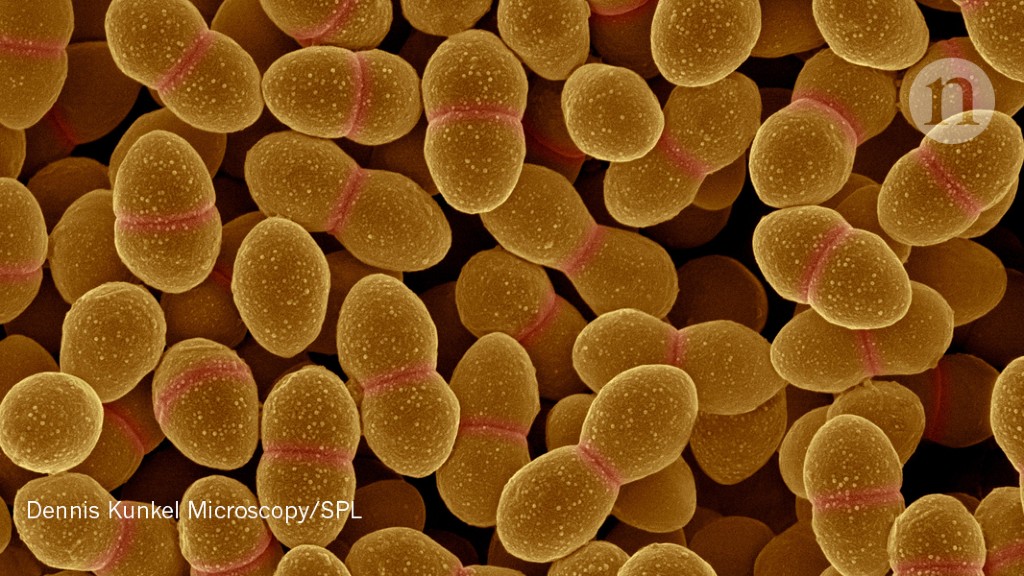 Эти культуры отличались от других тем, что у них определялся целый комплекс факторов патогенности: протеолитическая, гемолитическая (в-типа), липолитическая и лецити-назная активности, а также выявлялась капсула.
Эти культуры отличались от других тем, что у них определялся целый комплекс факторов патогенности: протеолитическая, гемолитическая (в-типа), липолитическая и лецити-назная активности, а также выявлялась капсула.
Среди клинических симптомов пиелонефрита эн-терококковой этиологии преобладала интоксикация (85,9±2,7 % случаев) разной степени выраженности. Гипертермический синдром (в диапазоне 37,1-39 °С) был выявлен у 51,7±4,0 % пациентов (с превалированием фебрильной гипертермии в 77,9 % наблюдений). Другие симптомы были менее выражены.
Обсуждение полученных данных
Способность бактерий паразитировать в почках определяется комплексом свойств, поскольку на разных этапах инфекционно-воспалительного процесса от них требуется экспрессия разных патогенетически значимых признаков и/или их сочетаний. В исследованиях Л.Г. Мироненко и других авторов отмечено, что клинические изоляты фекальных энтерококков обладают более выраженной протеолитической активностью в сравнении с культурами, выделенными из кишечника здоровых людей [5, 8]. На нашем материале также отмечена высокая протеолитическая активность у культур Е. /аесаШ, изолированных из мочи у детей с ИМС.
На нашем материале также отмечена высокая протеолитическая активность у культур Е. /аесаШ, изолированных из мочи у детей с ИМС.
Пусковой механизм любого инфекционного процесса — адгезия, которая создает условия для последующей инвазии микроорганизмов в ткани хозяина. В мочевыводящих путях адгезия позволяет бактериям противостоять току мочи, скапливаться на поверхности мочевых путей и проникать в их ткани [2]. У исследованных культур отмечен средний и высокий уровень адгезии. Выявлена прямая корреляционная достоверная связь между СПА и гемолитической активностью в-типа (К=0,61), желатиназ-ной (К=0,6) и лецитиназной (К=0,43) активностями, что свидетельствует о важном значении микробной адгезии и определенных факторов вирулентности Е. /аесаШ в патогенезе инфекционно-воспалитель-ного процесса.
Симптомы пиелонефрита, ассоциированного с Е./аесаШ, не отличались от проявлений пиелонефритов другой этиологии. Но в клинической картине у пациентов с ИМС энтерококковой этиологии преобладал интоксикационный синдром, и в половине случаев отмечалась гипертермия (как его проявление). Определена сильная корреляционная связь между ИАМ и гипотрофией (К=0,99), которая служит одним из симптомов пиелонефрита и маркером интоксикационного синдрома у детей раннего возраста. Отмечена и прямая корреляционная связь ИАМ энтерококков с клинико-лабораторными проявлениями поражения верхних мочевых путей: анемией (К=0,37), пиелоэк-тазией (К=0,46) и палочкоядерным сдвигом (К=0,78).
Но в клинической картине у пациентов с ИМС энтерококковой этиологии преобладал интоксикационный синдром, и в половине случаев отмечалась гипертермия (как его проявление). Определена сильная корреляционная связь между ИАМ и гипотрофией (К=0,99), которая служит одним из симптомов пиелонефрита и маркером интоксикационного синдрома у детей раннего возраста. Отмечена и прямая корреляционная связь ИАМ энтерококков с клинико-лабораторными проявлениями поражения верхних мочевых путей: анемией (К=0,37), пиелоэк-тазией (К=0,46) и палочкоядерным сдвигом (К=0,78).
Это подтверждает значение E. faecalis с выраженными адгезивными свойствами в восходящем инфицировании тубулярного аппарата и чашечно-лоханочной системы почек.
Между лецитиназной активностью E. faecalis, направленной на клеточные мембраны, и палочкоядер-ным сдвигом в клиническом анализе крови выявлена прямая достоверная корреляционная связь (К=0,34). Также определена зависимость между протеолитиче-ской активностью микроорганизма и лабораторными показателями, свидетельствующими о его участии в поражении верхних отделов мочевыделительной системы: обратная корреляционная связь с уровнем про-теинурии (К=-0,36) и удельным весом мочи (К=-0,02).
Также определена зависимость между протеолитиче-ской активностью микроорганизма и лабораторными показателями, свидетельствующими о его участии в поражении верхних отделов мочевыделительной системы: обратная корреляционная связь с уровнем про-теинурии (К=-0,36) и удельным весом мочи (К=-0,02).
Установленная на нашем материале прямая корреляция гемолитической активности E. faecalis с симптомами интоксикации (К=0,36) и лейкоцитарным индексом эндогенной интоксикации (К=0,33) удостоверяла данные о том, что продукция цитолитических ферментов, в том числе гемолизина, у клинических изолятов энтерококков ассоциируется с повышением тяжести инфекционного процесса [4]. Кроме того, нами отмечено, что интоксикационный синдром более выражен у пациентов грудного возраста, что доказывалось обратной корреляцией между протеолити-ческой активностью E. faecalis и возрастом ребенка (К=-0,27). Гемолизин способствует слущиванию эпителия и проникновению патогенов в более глубокие слои слизистой оболочки [12, 13]. Для данного патогена определена корреляционная связь между гемолитической активностью (ß-гемолиз) и гидролизом желатина (К=0,58), что свидетельствует о сочетанном воздействии этих патогенных факторов на определенном этапе (альтерации) воспалительного процесса. Скорее всего этим объясняется прямая корреляция между гемолитической активностью E. faecalis и эхопризнаками уплотнения чашечно-лоханочной системы (К=0,41).
Для данного патогена определена корреляционная связь между гемолитической активностью (ß-гемолиз) и гидролизом желатина (К=0,58), что свидетельствует о сочетанном воздействии этих патогенных факторов на определенном этапе (альтерации) воспалительного процесса. Скорее всего этим объясняется прямая корреляция между гемолитической активностью E. faecalis и эхопризнаками уплотнения чашечно-лоханочной системы (К=0,41).
Капсула, которая на нашем материале обнаруживалась в трети наблюдений, — один из важных факторов патогенности бактерий [4]. В то же время связи между ее наличием, показателями адгезии и клиническими симптомами не определялось. Вероятнее всего, капсула у уропатогенных Е. faecalis выполняет в основном защитную функцию. В то же время имелась прямая связь между наличием капсулы и уровнем гемоглобина (К=0,34). Установлена обратная зависимость между наличием капсулы и гемолизом а-типа (К=-0,3), а также ферментацией молока (К=-0,31). Кроме того, выявлена прямая достоверная связь между обнаружением капсулы у уропатогенных энтерококков и диагностическим титром микроорганизма в моче (К=0,33). Была определена и обратная корреляционная связь между наличием капсулы и чувствительностью Е. faecalis к гента-мицину и эритромицину (К=-0,33). Таким образом, наличие капсулы у уропатогенных энтерококков может способствовать более длительному паразитированию бактерий в почках, и тем самым — рецидивирующему течению пиелонефрита.
Кроме того, выявлена прямая достоверная связь между обнаружением капсулы у уропатогенных энтерококков и диагностическим титром микроорганизма в моче (К=0,33). Была определена и обратная корреляционная связь между наличием капсулы и чувствительностью Е. faecalis к гента-мицину и эритромицину (К=-0,33). Таким образом, наличие капсулы у уропатогенных энтерококков может способствовать более длительному паразитированию бактерий в почках, и тем самым — рецидивирующему течению пиелонефрита.
Выводы
1. Уропатогенные штаммы E. faecalis обладают комплексом факторов вирулентности, позволяющих им реализовать свой патогенный потенциал на всех этапах воспалительного процесса в мочевой системе.
2. Преобладающий в клинической картине интоксикационный синдром обусловлен комплексом патогенных факторов фекального энтерококка, вызывающих токсическое повреждение тканей.
3. Выявленная корреляционная связь между определенными факторами патогенности свидетельствует об их взаимодействии в реализации воспалительного процесса.
Литература
1. Андреева Т. С., Мельникова Е.А., Лучанинова В.Н. [и др.]. Особенности инфекции мочевой системы, ассоциированной с Enterococcus faecalis, у детей // Тихоокеанский медицинский журнал. 2016. № 3, прил. С. 4.
2. Антимикробная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов: федеральные клинические рекомендации / под ред. Н.А. Лопат-кина, О.И. Аполихина, Д.Ю. Пушкаря [и др.]. М., 2015. 72 с.
3. Бондаренко В.М., Суворов А.И. Симбиотические энтерококки и проблема энтерококковой оппортунистической инфекции. М., 2007. 30 с.
М., 2007. 30 с.
4. Бухарин О.В., Гриценко В.А., Вялкова А.А. Факторы уропа-тогенности бактерий: роль в патогенезе и значение в диагностике пиелонефрита // Нефрология и диализ. 2001. Т. 3, № 4. С. 469-475.
5. Бухарин О.В., Валышева И.В, Карташова О.Л., Сычева О.М. Характеристика вирулентного потенциала клинических изолятов энтерококков // Журнал микробиологии, эпидемиологии и иммунобиологии. 2013. № 3. С. 12-18.
6. Валышев А.В., Герцен Н.В. Факторы патогенности энтерококков кишечной микрофлоры человека // Журнал микробиологии, эпидемиологии и иммунобиологии. 2012. № 4. С.41-44.
7. Гриценко В.А., Дерябин Д.Г., Брудастов Ю.А., Бухарин О.В. Механизмы уропатогенности бактерий // Журнал микробиологии 1998. № 6. С. 93-98.
8. Мироненко Л. Г., Перетятько Е.Г. Изучение желатиназной активности на генетическом и фенотипическом уровне у Enterococcus, выделенных из разных экотопов // Вкник проблем бюлоги i медицини. 2014. Т. 1, вип. 4. С. 239-242.
Г., Перетятько Е.Г. Изучение желатиназной активности на генетическом и фенотипическом уровне у Enterococcus, выделенных из разных экотопов // Вкник проблем бюлоги i медицини. 2014. Т. 1, вип. 4. С. 239-242.
9. Сидоренко С.В. Инфекционный процесс как «диалог» между хозяином и паразитом // Клиническая микробиология и антимикробная химиотерапия. 2001. Т. 3, № 4. С. 301-315.
10. Чащина И.Л., Таточенко В.К., Баркадзе М.Д. Место цефа-лоспоринов в терапии инфекций мочевыводящих путей у детей // Вопросы современной педиатрии. 2012. Т. 11, № 1. С. 158-161.
11. Шишкин А.Н. Инфекция мочевых путей // Новые Санкт-Петербургские врачебные ведомости. 2010. № 3. С. 39-45.
12. Щуплова Е.А., Герцен Н.В., Фадеев С.Б., Валышев А.В. Ан-тигемоглобиновая активность энтерококков // Вестник ОГУ 2014. № 13. С. 139-141.
№ 13. С. 139-141.
13. Flores-Mireles A.L., Walker J.N., Caparon M., Hultren S.I. Urinary tract infections: epidemiology, mechanism of infection and treatment options // Nature Reviews Microbiology. 2015. Vol. 13. P. 269-284.
14. Cosetino S., Podda G.S., Corda A. [et al.]. Molecular detection of virulence factors and antibiotic resistance pattern in clinical Enterococcus faecalis strains in Sardinia // J. Prev. Med. Hyg. 2010. Vol. 51. Р. 31-36.
15. Jawad Kadhum T. AL-Khafaji, Sameer F. Samaan, Mohammed S. AL-Saeed. Virulence Factors of Enterococcus faecalis // Medical Journal of Babylon. 2010. Vol. 7, No. 4-3. Р. 579-583.
PMJ 2017 No. 2
Methods
61
Поступила в редакцию 21. 02.2017.
02.2017.
THE ROLE OF PATHOGENICITY FACTORS OF Enterococcus faecalis IN THE DEVELOPMENT OF PYELONEPHRITIS IN CHILDREN
E.A. Zaitseva1, E.V. Krukovich2, E.A. Melnikova1′ 2, V.N. Luchaninova3, T.S. Komenkova1, N.S. Vaysero2 1 Pacific State Medical University (2 Ostryakova Ave. Vladivostok 690950 Russian Federation), 2 1 Regional Children’s Clinical Hospital (27 Ostryakova Ave. Vladivostok 690078 Russian Federation), 3 North-Western State Medical University named after I.I. Mech-nikov (41 Kirochnaya St. Saint Petersburg 191015 Russian Federation)
Objective. In recent years, the frequency of occurrence of Enterococcus faecalis as an etiological factor of infection of the urinary system has increased, according to different authors, up to 14.216 %. It has been established that enterococci synthesize a large number of virulence factors that contribute to the development of the infectious process.
Methods. 57 cultures of E. faecalis isolated from the urine of children with a urinary tract pathology were studied, the cases were analyzed.
Results. Cultures of enterococci showed a phenotypic heterogeneity of biological properties, including virulence factors. It was established that the intoxication syndrome prevailing in the clinical picture is caused by a complex of pathogenic factors of fecal enterococcus causing toxic tissue damage. Conclusions. A correlation between the degree of adhesion, hemolytic, gelatinase and lecithinase activity was revealed with symptoms associated with upper urinary tract damage, which indicates the importance of microbial adhesion and certain pathogenicity factors of E. faecalis in the pathogenesis of the infectious inflammatory process.
Keywords: fecal enterococcus, uropathogenicity, urinary tract infection, degree of adhesion.
Pacific Medical Journal, 2017, No. 2, p. 58-61.
УДК 617.758.1-089.844
Э01: 10.17238/РшД609-1175.2017.2.61-62
Оптимизация хирургической коррекции косоглазия
Л.В. Алишунин
Приморский центр микрохирургии глаза (690080, г. Владивосток, ул. Борисенко, 100е)
Проведена оценка клинической эффективности авторской методики модифицированной миопластики в коррекции косоглазия. Показано статистически значимое улучшение результатов лечения косоглазия при больших углах девиации по сравнению с традиционным способом оперирования. Предложенная методика уменьшает травматичность и число этапов хирургической коррекции косоглазия.
Ключевые слова: экстраокулярные мышцы, угол девиации, модифицированная миопластика.
Патология глазодвигательного аппарата имеет высокую медико-социальную значимость [6, 9, 10]. Хирургическая коррекция, как основной способ исправления косоглазия, требует оптимизации хирургической травмы за счет уменьшения количества оперируемых мышц и этапов вмешательства, что позволяет значительно сократить время зрительной и социальной реабилитации пациентов [4, 8]. В клинической структуре косоглазия в подавляющем большинстве случаев угол девиации составляет 15° и более. При коррекции такой девиации традиционной хирургической техникой вмешательство выполняется на нескольких мышцах и в несколько этапов [5]. Сегодня все шире используются методики миотомии, миопластики и тенопластики, которые обладают выраженным ослабляющим эффектом. Однако эти методики не получили широкого распространения из-за сложности хирургического исполнения, а также потому, что они ведут к нарушению динамики глазного яблока — смещению мышечной плоскости с развитием цикло- или вертикальной девиации, а также увеличивают риск развития астигматизма [7].
Цель исследования: оценить клиническую эффективность собственного способа модифицированной миопластики в коррекции косоглазия.
Алишунин Леонид Валерьевич — заведующий детским отделением ПЦМГ; e-mail: [email protected]
Материалы и методы
Проведен ретроспективный анализ историй болезни 86 пациентов с содружественной неаккомодационной интропией, которые были разделены на две группы. В I группу вошел 41 человек (19 мужчин и 22 женщины в возрасте 6-20 лет), всем была проведена хирургическая коррекция косоглазия с применением предложенной нами модифицированной миопластики. Во II группу вошли 45 человек (18 мужчин и 27 женщин в возрасте 5-23 лет). В зависимости от величины угла девиации, оцененного по Гиршбергу, в каждой группе выделено три подгруппы: А — 15-17°, В — 17-25°, С — 25-45° (табл. ). Срок наблюдения 3-18 месяцев.
). Срок наблюдения 3-18 месяцев.
При модифицированной миопластике предварительно выделенная внутренняя прямая мышца косящего глаза продольно разделялась на три равные порции. Нижняя иссекалась на 5-6 мм, верхняя — отсекалась от склеры, а средняя порция пересекалась на необходимом расстоянии от места прикрепления к склере. Вмешательство завершалось наложением непрерывного Х-образного шва с одним погружным узлом и сшиванием верхней и нижней порций мышцы «край — в край» [2, 3].
В подгруппе 1А (18 человек) всем пациентам выполнялась пластика одной мышцы. В подгруппе 1В (15 человек) пластика одной мышцы дополнялась срединной дубликатурой мышцы-антагониста.
Роль факторов патогенности Enterococcus faecalis в развитии пиелонефрита у детей | Зайцева
1. Андреева Т.С., Мельникова Е.А., Лучанинова В.Н. [и др.]. Особенности инфекции мочевой системы, ассоциированной с Enterococcus faecalis, у детей // Тихоокеанский медицинский журнал. 2016. № 3, прил. С. 4.
Андреева Т.С., Мельникова Е.А., Лучанинова В.Н. [и др.]. Особенности инфекции мочевой системы, ассоциированной с Enterococcus faecalis, у детей // Тихоокеанский медицинский журнал. 2016. № 3, прил. С. 4.
2. Антимикробная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов: федеральные клинические рекомендации / под ред. Н.А. Лопаткина, О.И. Аполихина, Д.Ю. Пушкаря [и др.]. М., 2015. 72 с.
3. Бондаренко В.М., Суворов А.И. Симбиотические энтерококки и проблема энтерококковой оппортунистической инфекции. М., 2007. 30 с.
4. Бухарин О.В., Гриценко В.А., Вялкова А.А. Факторы уропатогенности бактерий: роль в патогенезе и значение в диагностике пиелонефрита // Нефрология и диализ. 2001. Т. 3, № 4. С. 469-475.
5. Бухарин О.В., Валышева И.В, Карташова О.Л., Сычева О.М. Характеристика вирулентного потенциала клинических изолятов энтерококков // Журнал микробиологии, эпидемиологии и иммунобиологии. 2013. № 3. С. 12-18.
Бухарин О.В., Валышева И.В, Карташова О.Л., Сычева О.М. Характеристика вирулентного потенциала клинических изолятов энтерококков // Журнал микробиологии, эпидемиологии и иммунобиологии. 2013. № 3. С. 12-18.
6. Валышев А.В., Герцен Н.В. Факторы патогенности энтерококков кишечной микрофлоры человека // Журнал микробиологии, эпидемиологии и иммунобиологии. 2012. № 4. С. 41-44.
7. Гриценко В.А., Дерябин Д.Г., Брудастов Ю.А., Бухарин О.В. Механизмы уропатогенности бактерий // Журнал микробиологии 1998. № 6. С. 93-98.
8. Мироненко Л.Г., Перетятько Е.Г. Изучение желатиназной активности на генетическом и фенотипическом уровне у Enterococcus, выделенных из разных экотопов // Вісник проблем біологіі і медицини. 2014. Т. 1, вип. 4. С. 239-242.
9. Сидоренко С.В. Инфекционный процесс как «диалог» между хозяином и паразитом // Клиническая микробиология и антимикробная химиотерапия. 2001. Т. 3, № 4. С. 301-315.
Сидоренко С.В. Инфекционный процесс как «диалог» между хозяином и паразитом // Клиническая микробиология и антимикробная химиотерапия. 2001. Т. 3, № 4. С. 301-315.
10. Чащина И.Л., Таточенко В.К., Баркадзе М.Д. Место цефалоспоринов в терапии инфекций мочевыводящих путей у детей // Вопросы современной педиатрии. 2012. Т. 11, № 1. С. 158-161.
11. Шишкин А.Н. Инфекция мочевых путей // Новые Санкт-Петербургские врачебные ведомости. 2010. № 3. С. 39-45.
12. Щуплова Е.А., Герцен Н.В., Фадеев С.Б., Валышев А.В. Ан-тигемоглобиновая активность энтерококков // Вестник ОГУ. 2014.№ 13. С. 139-141.
13. Flores-Mireles A.L., Walker J.N., Caparon M., Hultren S.I. Urinary tract infections: epidemiology, mechanism of infection and treatment options // Nature Reviews Microbiology. 2015. Vol. 13. P. 269-284.
2015. Vol. 13. P. 269-284.
14. Cosetino S., Podda G.S., Corda A. [et al.]. Molecular detection of virulence factors and antibiotic resistance pattern in clinical Enterococcus faecalis strains in Sardinia // J. Prev. Med. Hyg. 2010. Vol. 51. Р. 31-36.
15. Jawad Kadhum T. AL-Khafaji, Sameer F. Samaan, Mohammed S. AL-Saeed. Virulence Factors of Enterococcus faecalis // Medical Journal of Babylon. 2010. Vol. 7, No. 4-3. Р. 579-583.
A 1.5 Hour Procedure for Identification of Enterococcus Species Directly from Blood Cultures
1. Коллекция образцов и подготовка
- Сбор венозной крови от пациентов с подозрением на сепсис и поставить на два BACTEC (BD, Sparks, MD) бутылки посев крови, один аэробных и анаэробных один, а в составе одного крови культуре множество.

- Место бутылок в 9240 BACTEC инструментом при температуре 35 ° C.
- Инкубируйте пока прибор срабатывает сигнал тревоги в связи с ростом организмов в бутылке культуры крови.
- Удалите бутылку из инструмента культуры крови.
2. Подготовка реагентов До окрашивания
- Подготовка промывочного раствора путем добавления 4 мл 60x промывочного раствора затем 240 мл свежей деионизированной или дистиллированной воды непосредственно к Окрашивание антенны.
- Положите окрашивания блюдо в 55 ° С водяной бане до теплого.
- Храните оставшийся концентрат на 2-8 ° C.
- Удалить Монтаж Средний из холодильника и нагреться до комнатной температуры.
3. Грамм окрашивания
- Аккуратно водоворот бутылка крови культуры.
- Использование игл и шприцев или субкультивирования аппарата, удаления крови (приблизительно 5 мл) из бутылки и поместить в стерильный винт ограничен трубки.
- Использование стерильной пипетки, место одной большой капли крови на микроскопический слайд стекла.

- Воздух сухой слайд и исправить в метаноле в течение 10 секунд.
- Разрешить слайд высохнуть на воздухе.
- Выполните по Граму мазке крови, чтобы определить морфологию организма растет в бутылке культуры крови.
- Использование линз нефти погружения, просматривать слайд. Грамположительные кокки в парах и короткие цепочки наблюдается на Граму является наиболее соответствует энтерококков видов.
- Это Граму результат затем проходит выбор надлежащего комплекта FISH зонда ПНА использовать для бактериальных идентификации. Эта кровь культуры будет окрашивали Е. фекальный / OE ПНА FISH пятно.
4. ПНА FISH пятно
- Смешайте трубки, содержащей кровь мягко закрученной до мазка подготовки.
- Поместите одну каплю Фиксация Решение о яме стекло микроскопа FISH ПНА.
- Передача 10 мкл или одна маленькая капля из трубки с положительной культуры крови к фиксации решения и аккуратно перемешать для эмульгирования.
- Fix мазков при помощи их нагревания в течение 20 мин.
 при 55 ° С на нагревательной пластине.
при 55 ° С на нагревательной пластине.
5. Материал контроля качества
Одним из положительных и один отрицательный слайд контроля качества должны быть проверены с каждой серией слайдов для окрашивания.
- Используйте Е. фекальный / OE управления Слайды приобрести у AdvanDx для этой цели или готовить мазки из жидкой культуры ведения штаммов E. фекальный и E. faecium в качестве положительного контроля либо на отдельных слайдов или смешанный на один слайд и бактерии рода стафилококки или стрептококки, как негативного материала управления.
Результаты контроля качества должны быть в состоянии контролировать соответствующие условия для тестирования, особенно те, которые затрагивают строгости гибридизации и проникновения клеточной стенки, так как ПНА методология призвана оптимизировать проникновение клеточной стенки
6. Гибридизация
- Добавьте одну каплю Е. фекальный / OE ПНА хорошо на предметное стекло с мазком.

- Добавить покровное. Избегайте воздушных пузырьков.
- Инкубировать 30 ± 5 мин. при 55 ± 1 ° С при нагреве пластины
- После инкубации место слайдов в слайд перевозчика
7. Строгие Вымойте
- Погрузите перевозчика слайда в разогретой промывочного раствора при 55 ° С и тщательно удалить покровное. Часто, покровное соскальзывает, осторожно агитацию слайда в промывочного раствора. Иногда, покровное должно быть мягко оттолкнулся щипцами.
- Инкубируйте в промывочного раствора в течение 30 ± 5 мин. при 55 ± 1 ° C.
- Удалить слайды из промывочного раствора
- Разрешить слайд высохнуть на воздухе
8. Монтаж
- Добавьте одну каплю Монтаж среднего до каждого слайда
- Добавить покровное. Избегайте воздушных пузырьков.
- Изучить скользить по флуоресцентного микроскопа в течение 2 часов.
- Не подвергайте слайды прямых солнечных лучей или других сильных источников света, так как это может привести к тушению флуоресценции.

9. Интерпретация результатов
Флуоресцентный микроскоп используется для слайд экспертизы должны быть оборудованы AdvanDx Двойной Фильтр полосы и 60x или 100x нефти цели. QC слайды должны быть рассмотрены первые подтвердить, что гибридизация имели место. E. фекальный должен выглядеть ярко-зеленого флуоресцентного кокки в нескольких полях зрения и faecium Э. появится как ярко-красный кокки. Номера для энтерококков управления слайд должен появиться nonfluorescent. После подтверждения система контроля, пациент слайды могут быть рассмотрены. Сначала кровь филм появится красноватый, но яркий красный и зеленый кокки будет вполне очевидной.
Рисунок 1. Типичными примерами зеленый-положительных Е. фекальный (слева), красный положительный E. faecium (в центре) и отрицательных (справа) результаты испытаний.
10. Представитель Результаты
Три учреждения были включены в многоцентровое клиническое исследование оценки этой рыбы ПНА пятна и сравнивая 2,5 часа протокола к укороченной 1,5 часа протокол, который только что был рецензирован. В общей сложности 152 рутинных грамположительных кокков в парах и цепи (ГПХ) положительные бутылки культуры крови были включены в исследования. Существовал 100% (152/152) соглашение между результатами модифицированы и оригинальная методика анализа для E. фекальный / OE ПНА FISH: 41/41 E. фекальный; 33/33 других энтерококков и других GPC 78/78 (табл. 1). Этот метод окрашивания был изысканной чувствительностью и специфичностью в течение этого клинического исследования (табл. 2).
В общей сложности 152 рутинных грамположительных кокков в парах и цепи (ГПХ) положительные бутылки культуры крови были включены в исследования. Существовал 100% (152/152) соглашение между результатами модифицированы и оригинальная методика анализа для E. фекальный / OE ПНА FISH: 41/41 E. фекальный; 33/33 других энтерококков и других GPC 78/78 (табл. 1). Этот метод окрашивания был изысканной чувствительностью и специфичностью в течение этого клинического исследования (табл. 2).
| Рутинные методы | Э. фекальный / OE ПНА FISH Стандартная процедура | Э. фекальный / OE ПНА FISH Короткая процедура | |
| Э. фекальный | 41 | 41 (Зеленый Положительные) | 41 (Зеленый Положительные) |
| E. faecium | 27 | 27 (Красный Положительные) | 27 (Красный Положительные) |
Е. casseliflavus casseliflavus | 2 | 2 (Красный Положительные) | 2 (Красный Положительные) |
| Е. gallinarum | 2 | 2 (Красный Положительные) | 2 (Красный Положительные) |
| Другие Enterococcus sрр. | 2 | 2 (Красный Положительные) | 2 (Красный Положительные) |
| С. пневмонии | 17 | 17 (Negative) | 17 (Negative) |
| С. viridans | 33 | 33 (Negative) | 33 (Negative) |
| С. Mitis | 1 | 1 (Negative) | 1 (Negative) |
| S. pyogenes | 3 | 3 (Negative) | 3 (Negative) |
| С. Bovis | 2 | 2 (Negative) | 2 (Negative) |
С. salivarius salivarius | 1 | 1 (Negative) | 1 (Negative) |
| С. sanguinis | 2 | 2 (Negative) | 2 (Negative) |
| С. agalagtae | 7 | 7 (Negative) | 7 (Negative) |
| Другие стрептококки. | 7 | 7 (Negative) | 7 (Negative) |
| Abiotrophia sрр. | 3 | 3 (Negative) | 3 (Negative) |
| Peptostrepococcus sрр. | 2 | 2 (Negative) | 2 (Negative) |
| Общий | 152 | 152/152 100% Соглашения | 152/152 100% Соглашения |
Таблица 1. Листинг бактерий испытания с использованием как стандартных (2.5hr) и быстрый (1,5 часа) протоколу.
Чувствительность E. faecalis faecalis | Чувствительность Другие Enterococcus sрр. | Специфичность |
| 100% (41/41) 95% доверительный интервал (93.0-100) | 100% (33/33) 33/33 95% доверительный интервал (91.3-100) | 100% (78/78) 95% доверительный интервал (96.2-100) |
Таблица 2. Чувствительность и специфичность 1,5 часа протокол FISH ПНА.
СОВРЕМЕННОЕ СОСТОЯНИЕ АНТИБИОТИКОРЕЗИСТЕНТНОСТИ И СОСТАВ ВОЗБУДИТЕЛЕЙ ИНФЕКЦИЙ МОЧЕВЫХ ПУТЕЙ У БЕРЕМЕННЫХ | Локшин
Введение
Инфекции мочевых путей (ИМП) являются одной из самых частых причин обращения беременных женщин к урологу. Основным компонентом лечения бессимптомной бактериурии, острого цистита и острый острого пиелонефрита у беременных является антибиотикотерапия, которая у большинства пациенток назначается эмпирически. Очевидно, что для успешного выбора препарата необходимо знание как структуры возбудителей, так и актуального профиля их антибиотикорезистентности. В результате ранее проведённых многочисленных исследований установлено, что внебольничные инфекции мочевых путей как у беременных, так и у небеременных женщин, как правило (в 70-90% случаев) вызываются кишечной палочкой и другими представителями семейства Enterobacteriacaeae, а остальные возбудители встречаются значительно реже [1][2][3][4][5]. В то же время, состав уропатогенов в отдельных странах и даже городах может не только иметь значительные отличия, но и меняться с течением времени. В России наиболее крупным и авторитетным исследованием эпидемиологии уропатогенов (в т.ч. у беременных) является исследование «ДАРМИС», опубликованное в 2012 году и показавшее микробный пейзаж внебольничных ИМП в стране по состоянию на 2010-2011 гг. [6]. В исследовании были представлены характеристики 152 штаммов-возбудителей ИМП у беременных, собранных по всей стране. По нашим сведениям, подобных по объему и качеству исследований ИМП у беременных в московском регионе в последние годы не проводилось.
В результате ранее проведённых многочисленных исследований установлено, что внебольничные инфекции мочевых путей как у беременных, так и у небеременных женщин, как правило (в 70-90% случаев) вызываются кишечной палочкой и другими представителями семейства Enterobacteriacaeae, а остальные возбудители встречаются значительно реже [1][2][3][4][5]. В то же время, состав уропатогенов в отдельных странах и даже городах может не только иметь значительные отличия, но и меняться с течением времени. В России наиболее крупным и авторитетным исследованием эпидемиологии уропатогенов (в т.ч. у беременных) является исследование «ДАРМИС», опубликованное в 2012 году и показавшее микробный пейзаж внебольничных ИМП в стране по состоянию на 2010-2011 гг. [6]. В исследовании были представлены характеристики 152 штаммов-возбудителей ИМП у беременных, собранных по всей стране. По нашим сведениям, подобных по объему и качеству исследований ИМП у беременных в московском регионе в последние годы не проводилось.
Следует, однако подчеркнуть, что знание актуального состава уропатогенов недостаточно для подбора оптимальной эмпирической анти- биотикотерапии. Не меньшее значение имеет современный профиль их антибиотикорезистентности, который также не только меняется с течением времени, но может существенно отличаться от региона к региону. Во всем мире, включая Россию, отмечается тенденция к снижению чувствительности возбудителей ИМП к наиболее часто используемым антибактериальным препаратам. Если уровень резистентности к какому- либо антибиотику в регионе составляет более 1020%, это требует ограничения его использования в качестве эмпирической терапии [7].
Отсутствие актуальных данных по составу и чувствительности возбудителей ИМП у беременных в московском регионе создало предпосылки для проведения нашего исследования.
Материал и методы
В рамках ретроспективного исследования состава и антибиотикорезистентности возбудителей ИМП нами были проанализированы клинические данные и результаты бактериологического исследования у 104 беременных, наблюдавшихся и проходивших лечение в Клиническом госпитале Лапино в период с 2016 по 2017 гг. В исследование включены только беременные с неосложненными ИМП. Критерием исключения являлось наличие таких факторов риска резистентной флоры, как камни в мочевых путях, тяжёлые сопутствующие заболевания (например, сахарный диабет, почечная недостаточность), дренирование/катетеризация мочевых путей, урологические вмешательства в гестационном анамнезе, длительная (3 и более дней) госпитализация и/ или прием каких-либо антибактериальных препаратов в период 3 месяца до установки диагноза ИМП.
В исследование включены только беременные с неосложненными ИМП. Критерием исключения являлось наличие таких факторов риска резистентной флоры, как камни в мочевых путях, тяжёлые сопутствующие заболевания (например, сахарный диабет, почечная недостаточность), дренирование/катетеризация мочевых путей, урологические вмешательства в гестационном анамнезе, длительная (3 и более дней) госпитализация и/ или прием каких-либо антибактериальных препаратов в период 3 месяца до установки диагноза ИМП.
Источником клинических данных по пациенткам (симптомы, анамнез, результаты физикального, лабораторного обследования, данные УЗИ) была электронная история болезни медицинской информационной системы «Медиалог».
Биологическим материалом для бактериологических исследований являлась средняя порция мочи, полученная после туалета половых органов. Бактериологическое исследование клинического материала проводилось в локальной микробиологической лаборатории. В соответствии с клиническими рекомендациями Европейской Ассоциации Урологов (ЕАУ) клинически значимым титром возбудителей при бессимптомной бактериурии считалось КОЕ 105 и более, при остром цистите — 103 и более, при остром пиелонефрите — 104 и более [8]. Чувствительность патогенов к антибактериальным препаратам определялась диффузионно-дисковым методом в соответствии с критериями EUCAST (European Committee on Anbmicrobial Suscepbbility Tesbng) [9].
Чувствительность патогенов к антибактериальным препаратам определялась диффузионно-дисковым методом в соответствии с критериями EUCAST (European Committee on Anbmicrobial Suscepbbility Tesbng) [9].
Статистические расчеты проводились в программе MedCalc Stabsbcal Software version 17.0.4 (MedCalc Software bvba, Ostend, Belgium; https://www.medcalc.org; 2017).
Результаты
В исследовании проанализированы результаты положительных бактериологических посевов мочи, полученной у 104 беременных с различными инфекциями мочевых путей, не имевших известных факторов риска резистентной флоры. У 90 пациенток диагностирована бессимптомная бактериурия, у 10 — острый цистит и у 4 — острый гестационный пиелонефрит.
В результате бактериологического исследования идентифицировано 148 штаммов, при этом единственный возбудитель выявлен у 60 (57,7%) пациенток, а два возбудителя обнаружены у 44 (42,3%) пациенток. В случае выявления двух микроорганизмов, в подавляющем большинстве случаев (у 42 из 44 пациенток) это был Enterococcus faecalis. Кишечная палочка была самым часто выявляемым возбудителем — она была обнаружена у 70 (67,3%) пациенток. В целом, представители семейства Enterobacteriaceae были идентифицированы у 88,46% пациенток. Вторым по выявляемости микроорганизмом был фекальный энтерококк — он получен у 52 (50%) пациенток. Структура выявленных возбудителей представлена в таблице 1.
Кишечная палочка была самым часто выявляемым возбудителем — она была обнаружена у 70 (67,3%) пациенток. В целом, представители семейства Enterobacteriaceae были идентифицированы у 88,46% пациенток. Вторым по выявляемости микроорганизмом был фекальный энтерококк — он получен у 52 (50%) пациенток. Структура выявленных возбудителей представлена в таблице 1.
Таблица 1. Структура возбудителей внебольничных инфекций мочевых путей, выделенных у беременных
Table 1. Pathogens of nosocomial urinary tract infections, isolated from pregnant women
Возбудитель Pathogen | Количество выделенных штаммов Number of isolated strains | % от общего количества штаммов Percentage from total of strains |
|---|---|---|
| E.coli | 70 | 47,30 % |
| Enterococcus faecalis | 52 | 35,14 % |
| Klebsiella pneumoniae | 18 | 12,16 % |
Proteus spp. | 3 | 2,02 % |
| Staphylococcus spp. | 2 | 1,35 % |
| Streptococcus spp. | 2 | 1,35 % |
| Enterobacter cloacae | 1 | 0,68 % |
| Всего / Total | 148 | 100,00 % |
Следует отметить, что клиническое значение фекального энтерококка при ИМП вообще и у беременных, в частности, весьма спорное. В нашей когорте пациенток в подавляющем большинстве случаев (в 42 из 52 — в 80,8%) он выявлялся вторым микроорганизмом, при этом, первым патогеном всегда был представитель Enterobacteriaceae. Лишь в 10 посевах фекальный энтерококк был выявлен, как единственный возбудитель: у 9 пациенток с бессимптомной бактериурией и у 1 пациентки с симптомами цистита, но без лейкоцитурии. У всех выявленных энтерококков был сходный профиль резистентности со 100% чувствительностью к ампициллину, нитрофурантоину, карбопенемам и ванкомицину.
Основной интерес, по нашему мнению, представляют данные по чувствительности к антибиотикам кишечной палочки и всех идентифицированных представителей семейства Enterobacteriaceae (E. coli, Klebsiella pneumoniae, Proteus spp. и Enterobacter cloacae). Данные по чувствительности кишечной палочки к основным группам антибиотиков представлены в таблице 2.
coli, Klebsiella pneumoniae, Proteus spp. и Enterobacter cloacae). Данные по чувствительности кишечной палочки к основным группам антибиотиков представлены в таблице 2.
Таблица 2. Чувствительность кишечной палочки к основным группам антибиотиков
Table 2. The sensitivity of E. coli to the main groups of antibiotics
Группы антибактериальных препаратов Groups of antibacterial drugs | % чувствительной E. coli Percentage of sensitive E. coli |
|---|---|
Цефалоспорины 2 поколения (цефуроксим) Cephalosporins of the 2rd generations (cefuroxime) | 74,3 % |
Цефалоспорины 3 поколения (цефиксим, цефтазидим, цефотаксим, цефтриаксон) Cephalosporins of the 3rd generation (cefixime, ceftazidime, cefotaxime, ceftriaxone) | 75,7 % |
Фторхинолоны 2 поколения (ципрофлоксацин, норфлоксацин, офлоксацин) Fluoroquinolones of the 2nd generation (ciprofloxacin, norfloxacin, ofloxacin) | 82,9 % |
Фторхинолоны 3 поколения (левофлоксацин) Fluoroquinolones of the 3rd generation (levofloxacin) | 82,9 % |
Ампициллин Ampicillin | 36,4 % |
Амоксициллина клавуланат Amoxicillin clavulanate | 76,8 % |
Фосфомицин Phosphomycine | 98,5 % |
Нитрофурантоин Nitrofurantoine | 84,7 % |
Карбапенемы Carbapenems | 100,0 % |
Гентамицин Gentamicine | 81,3 % |
Триметаприм/сульфаметоксазол Trimetaprim / sulfamethoxazole | 72,6 % |
Тетрациклины Tetracyclines | 84,8 % |
Налидиксовая кислота Nalidixic acid | 79,3 % |
Как видно из таблицы, у беременных имеет место очень высокая частота выделения резистентных штаммов E. coli к ампициллину (63,6%).
coli к ампициллину (63,6%).
Также, устойчивость кишечной палочки более 20% выявлена к амоксициллину/клавуланату (23,2%), к триметоприму/сульфаметоксазолу (27,4%), к налидиксовой кислоте (20,7%), а также к цефалоспоринам 2 и 3 поколения (соответственно, 25,7% и 24,3%). Резистентность E. coli в пределах 10-20% выявлена у фторхинолонов 2 и 3 поколения (17,1%), у нитрофурантоина (15,3%), у гентамицина (18,75%) и тетрациклинов (15,3%). Выделение устойчивой кишечной палочки менее 10% отмечено только по отношению к фосфомицину (1,5%) и карбапенемам (0%).
Данные по чувствительности семейства Enterobacteriaceaе к основным группам антибиотиков представлены в таблице 3.
Таблица 3. Чувствительность представителей семейства Enterobacteriaceae к основным группам антибиотиков
Table 3. Sensitivity representatives of the Enterobacteriaceae family to the main groups of antibiotics
Группы антибактериальных препаратов Groups of antibacterial drugs | % чувствительной флоры семейства Enterobacteriaceae Family Enterobacteriaceae representatives sensitivity (%) |
|---|---|
Цефалоспорины 2 поколения (цефуроксим) Cephalosporins of the 2rd generations (cefuroxime) | 78,3 % |
Цефалоспорины 3 поколения (цефиксим, цефтазидим, цефотаксим, цефтриаксон) Cephalosporins of the 3rd generation (cefixime, ceftazidime, cefotaxime, ceftriaxone) | 80,4 % |
Фторхинолоны 2 поколения (ципрофлоксацин, норфлоксацин, офлоксацин) Fluoroquinolones of the 2nd generation (ciprofloxacin, norfloxacin, ofloxacin) | 85,9 % |
Фторхинолоны 3 поколения (левофлоксацин) Fluoroquinolones of the 3rd generation (levofloxacin) | 85,9 % |
Ампициллин Ampicillin | 29,9 % |
Амоксициллина клавуланат Amoxicilline clavulanate | 81,3 % |
Фосфомицин Phosphomycin | 96,5 % |
Нитрофурантоин Nitrofurantoine | 80,0 % |
Карбапенемы Carbapenems | 100,0 % |
Гентамицин Gentamicine | 85,5 % |
Триметаприм/сульфаметоксазол Trimetaprim / sulfamethoxazole | 75,6 % |
Тетрациклины Tetracyclines | 87,2 % |
Налидиксовая кислота Nalidixic acid | 83,1 % |
Таким образом, у беременных самая высокая частота выделения резистентных штаммов семейства Enterobacteriacaeae отмечена к ампициллину (70,1%).
Устойчивость более 20% штаммов выявлена, к триметоприму/сульфаметоксазолу (24,4%), к налидиксовой кислоте (20,7%), а также к цефалоспоринам 2 поколения (21,7%). Резистентность представителей Enterobacteriacaeae в пределах 10-20% выявлена к амоксициллину/клавуланату (18,7%), к цефалоспоринам 3 поколения (19,6%), к фторхинолонам 2 и 3 поколения (14,1%), к нитрофурантоину (20%), к гентамицину (14,5%) и тетрациклинам (12,8%). Выделение устойчивых энтеробактерий менее 10% отмечено только по отношению к фосфомицину (3,5%) и карбапенемам (0%).
Обсуждение
Для достижения максимальной эффективности антибиотикотерапии ИМП при выборе препарата необходимо учитывать его способность накапливаться в мочи и органах мишенях, тяжесть основного и сопутствующих заболеваний, и возможные нежелательные явления. Однако для выбора оптимальной стартовой эмпирической терапии в первую очередь важно знать чувствительность уропатогенов в своем регионе.
В клинических рекомендациях ЕАУ 2018 года [8] в качестве препаратов выбора для лечения острых неосложненных циститов и бессимптомной бактериурии у беременных указаны фосфомицин и нитрофурантоин. В качестве альтернативных препаратов рассматриваются цефалоспорины и сульфаметаксозол/триметоприм; а амоксициллина клавуланат упоминается, как препарат «для отдельных категорий больных».
В качестве альтернативных препаратов рассматриваются цефалоспорины и сульфаметаксозол/триметоприм; а амоксициллина клавуланат упоминается, как препарат «для отдельных категорий больных».
Применимость в России рекомендаций ЕАУ следует рассматривать через призму современных данных по антибиоикорезистентности уропатогенов как в целом в нашей стране, так и в отдельных ее регионах. Как уже отмечалось выше, при уровне резистентности к какому-либо антибиотику более 10-20%, требуется ограничение его использования в качестве эмпирической терапии [7]. В исследовании ДАРМИС (2010-2011 гг.), у беременных из пероральных препаратов наибольшей активностью в отношении E.
coli обладали фосфомицин, нитрофурантоин и цефтибутен — 97,0, 99,0 и 91,0%. В нашей когорте пациенток, и пероральных препаратов максимальную чувствительность E.coli сохранила только к фосфомицину (98,5%). Всё семейство Enterobacteriaceae также имело максимальную чувствительность только к фосфомицину (96,5%). Других пероральных препаратов, чувствительность к которым превышала бы 90% порог, в нашей когорте беременных пациенток не было.
В исследовании ДАРМИС чувствительность к различным цефалоспоринам варьировала в диапазоне 82,0-91,0% для штаммов E. coli и 81,4-88,8% для штаммов семейства Enterobacteriaceae. В нашем исследовании чувствительность к цефалоспоринам у E. coli к варьирует между 74,3-75,7%, а у всех штаммов Enterobacteriaceae — 78,3-80,4%. Таким образом, в сравнении с данными исследования ДАРМИС, имеет место существенный рост резистентности энтеробактерий к цефалоспоринам.
Также, по сравнению с данными от 2010-2011 гг., мы отметили умеренный рост резистентностности E.coli к нитрофурантоину, Чувствительность к нему кишечной палочки в настоящее время составила 84,7% (по сравнению с 99% ранее). Интересно, что чувствительность штаммов всех представителей Enterobacteriaceae к нитрофурантоину за эти годы не изменилась и составила 80%.
Практически не изменилась у беременных чувствительность E. coli и штаммов семейства Enterobacteriaceae к фторхинолонам: если ранее она составляла, соответственно, 85% и 86,7%, то в настоящее время — 82,9% и 85,9%.
По сравнению с данными ДАРМИС, у наших пациенток отмечен рост чувствительности энтеробактерий в амоксициллин клавуланату с 57-64% до 76-81%. Тем не менее, мы считаем важным отметить, что такой уровень чувствительности является пограничным для использования препарата в качестве стартовой эмпирической антибиотикотерапии.
Мы не выявили ни одного штамма энтеробактерий, устойчивого к карбапенемам. В нашем исследовании чувствительностью к гентамицину обладали 81,3% (в ДАРМИС — 89,0%) штаммов E. coli и 85,5% (в ДАРМИС — 88,2%) всех штаммов семейства Enterobacteriaceae. Существенного изменения чувствительности энтеробактерий к данному антибиотику, по нашему мнению, не произошло.
Самой низкой чувствительностью, по нашим данным, энтеробактерии обладали по отношению к ампициллину (29,9-36,4%) и триметапри- му/сульфометаксозолу (72,6-75,6%), что не позволяет их использовать в качестве препаратов для эмпирической терапии ИМП у беременных.
Выводы
Основными возбудителями инфекций мочевых путей у беременных по-прежнему являются бактерии семейства Enterobacteriaceae, в первую очередь, кишечная палочка и клебсиелла. Хотя фекальный энтерококк выявляется более чем в 35% случаев, у подавляющего большинства пациенток он «соседствует» с энтеробактериями и сам по себе едва ли обладает клинически-значимым патогенным потенциалом при ИМП у беременных.
Хотя фекальный энтерококк выявляется более чем в 35% случаев, у подавляющего большинства пациенток он «соседствует» с энтеробактериями и сам по себе едва ли обладает клинически-значимым патогенным потенциалом при ИМП у беременных.
Как кишечная палочка, так и все семейство Enterobacteriaceae, по нашим данным, самую высокую чувствительность сохраняют к фосфомицину и карбапенемам. По сравнению с данными исследования ДАРМИС от 2010-2011 гг., мы отметили существенный рост резистентности уропатогенов у беременных к цефалоспоринам и нитрофурантоину, относительно низкую и неизменную резистентность к фторхинолонам и гентамици- ну, а также умеренное снижение устойчивости энтеробактерий к амоксициллина клавуланату. По-прежнему, высокой остаётся резистентность штаммов Enterobacteriaceae к ампициллину и триметоприму/сульфометаксозолу.
Полученные актуальные данные, по составу и профилю чувствительности уропатогенов при инфекциях мочевых путей у беременных, представляется целесообразным учитывать при выборе стартовой эмпирической антибиотикотерапии.
Энтерококки (Еnterococcus). — Удмуртский ветеринарно-диагностический центр
Энтерококки – это широко распространенные микробы, активно живущие в окружающей среде и даже «одомашненные» и «прирученные» человеком. Но среди энтерококков все-таки встречаются потенциально опасные и зловредные особи, которые могут вызывать у детей или взрослых различные заболевания и патологические состояния.
Энтерококками — возбудителями пищевых токсикоинфекций являются стрептококки, относящиеся к серологической группе D.
Различают 5 видов и разновидностей энтерококков, а именно: Str. faecalis, Str. faecalis var. zymogenes, Str. faecalis var. liquefaciens, Str. faecium var. duraus.
Энтерококки отличаются большой устойчивостью к окружающей среде, способны расти при температуре от 10 до 45°, сохраняются при содержании 6,5% хлорида натрия в пищевых продуктах. При pH 9,6 выдерживают нагревание до + 60° С в течение 30 мин, при
+ 85° С в течение 10 мин погибают. Устойчивы к высыханию, длительно переносят низкие температуры, обладают выраженной галофильностью (растут в присутствии повышенной концентрации соли), размножаясь в средах с содержанием хлорида натрия до 17%, растут в средах с большим диапазоном pH — от 3 до 12.
Эпидемиология. Возбудителями пищевых токсикоинфекций являются только такие штаммы энтерококков, которые обладают энтеротоксическими свойствами.
Энтерококки, как представители нормальной микрофлоры кишечника человека и теплокровных животных, в большом количестве попадают в окружающую среду: в почву, воздух, воду, растения, пищевые продукты. Источником инфекции являются человек и теплокровные животные. На пищевых предприятиях источником инфекции могут быть больные или бактерионосители из числа лиц обслуживающего персонала.
Пища может быть инфицирована энтерококками в результате попадания в нее кишечного содержимого, а также воздушно-капельным путем. В колбасных изделиях, готовых блюдах и полуфабрикатах, полученных из гастрономических магазинов и магазинов кулинарных изделий, энтерококки обнаруживаются в 31% случаев. Присутствие этих микроорганизмов чаще отмечается в студнях, салатах, винегретах.
Энтерококки быстро и интенсивно размножаются на самых разнообразных пищевых продуктах при комнатной температуре и достигают максимальной концентрации уже в первые сутки.
Клиника. Развитие заболевания зависит от ряда факторов, в частности наличия строго определенного вида энтерококка, количества живых микробов в пищевом продукте, срока хранения штаммов, а также индивидуальной чувствительности людей. Для возникновения заболеваний необходимо попадание в организм значительного количества живых энтерококков, обладающих энтеротоксичными свойствами.
Клинические проявления токсикоинфекций, обусловленных энтерококками, мало характерны. Продолжительность инкубационного периода 3—18 ч. Чаще всего заболевание длится от нескольких часов до суток, редко затягивается до 3 сут. У больных отмечается тошнота, рвота, боли в животе, понос.
Профилактика. Профилактика пищевых токсикоинфекций энтерококковой этиологии такая же, как и других пищевых токсикоинфекций, и заключается в соблюдении требований, предъявляемых к правильному хранению, транспортировке, реализации и приготовлению пищевых продуктов и готовой пищи, выполнению правил личной гигиены обслуживающим персоналом предприятий пищевой промышленности и общественного питания.
ИЦ
симптомы, лечение взрослых и детей
Время на чтение: 3 минуты
АА
При беременности необходимо следить за возникновением фекального энтерококка в моче. В этот период организм испытывает сильные нагрузки, за счёт чего довольно ослаблен и не может противостоять в достаточной мере многим возникающим проблемам. Число бактерий может резко увеличиваться и вызывать серьезные болезни, которые вредят беременности и здоровью женщины.
Загрузка …К энтерококкам относят более 15 видов различных бактерий, но самыми популярными и известными являются фекальный и фаециум (Enterococcus faecium). В течение длительного времени энтерококк фекальный относился к большой группе, но относительно недавно его выделили в отдельный тип. С этого времени началось исследование этой микрофлоры патогенной категории, которая стала называться фекальным энтерококком или энтерококк фекалис (от латинского Enterococcus faecalis).
Для человека его организма эти бактерии очень важны, без их нормальной деятельности многие органы и системы не могут правильно работать. Но, как и во всём, важно соблюсти меру, поскольку их превышенная концентрация очень опасна.
Врачи рекомендуют женщинам проходить регулярные проверки на баланс микрофлоры, поскольку именно они страдают от превышения фекального энтерококка. Его интенсивное размножение может вызвать болезни и патологии мочеполовой системы, к которым можно отнести пиелонефриты, аднекситы, уретриты и циститы.
Фекальный энтерококк
Чтобы не столкнуться с неприятными последствиями Enterococcus faecalis, особенно во время ожидания ребёнка, важно регулярно отслеживать свое состояние и проводить профилактику. Выявить бактерии энтерококка можно по наличию симптомов, а также при ежемесячной сдаче анализов при посещении гинеколога.
Причины появления фекального энтерококка
Микроорганизмы энтерококка всегда в наличии в организме человека в некотором количестве. Если их концентрация невелика, они приносят пользу, но при превышении допустимых показателей могут вызвать серьезные болезни. Чаще всего от подобных проблем страдают женщины, но появиться он может и у мужчин.
Кроме того, во время ожидания ребёнка женский организм страдает от многих изменений, в том числе и от повышенной концентрации бактерий энтерококка фекального типа в моче. Именно по этой причине беременные часто жалуются на уретриты и циститы, хотя внешних симптомов этих болезней нет. Enterococcus faecalis в моче у ребенка указывает на инфицирование мочевыводящей системы.
Рост числа клеток Enterococcus faecalis свидетельствует о дисбактериозе. Это серьезная проблема с неприятными последствиями, которые чаще всего возникают при неправильном приеме антибиотиков или чрезмерном выполнении гигиенических процедур. Также на это влияет изменение гормонального фона.
К негативным факторам можно отнести и выполняемое спринцевание – если микрофлора во влагалище неким образом нарушается, то в ней размножаются различные микроорганизмы и бактерии, в числе которых оказывается и фекальный энтерококк, обнаруживаемый в анализах мочи.
Признаки патологии
Если количество фекального энтерококка нормальное, то никаких неприятных симптомов не возникает. Но как только его количество микроорганизмов возрастает и превышает допустимую норму, это провоцирует возникновение болезней в мочеполовой системе.
Чаще всего это уретрит и цистит, но может возникнуть и пиелонефрит. Появление такой болезни неприятно, а в случае беременности ещё и опасно. Поэтому прежде чем лечить заболевание, его нужно грамотно диагностировать.
Главным симптомом увеличение числа патогенных бактерий является болезненность при деуринации, выделения непонятной этиологии, которые характеризуются необычным цветом и неприятным резким запахом. Также пациентки отмечают дискомфорт внизу живота, повышенную утомляемость, общую слабость и пониженный иммунитет.
Необходимо отметить, что при увеличении бактерий Enterococcus faecalis организм женщины работает с нарушениями в разных системах. Это оказывает влияние на половое влечение, которое снижается, а также на комфорт и ощущения во время секса. Такие же симптомы возникают и у мужчин.
Диагностика
Диагностирование Enterococcus faecalis состоит из забора биоматериала и его дальнейшего анализа через бактериологический посев. На анализ сдают кровь, экскременты и мочу. Для всех пациентов бактериями занимаются инфекционисты, но у мужчин обследование начинается с уролога, который выписывает направления на анализы.
У мужчин берутся следующие виды анализов:
- мазок из уретрального канала;
- мазок из анального отверстия;
- анализ мочи и крови;
- спермограмма, особенно при отсутствии либидо;
- бактериологический посев частиц секрета простаты.
Энтерококк у беременных женщин
Беременные должны как можно чаще сдавать анализы мочи, как минимум перед каждым посещением врача. Это необходимо для того чтобы доктор имел возможность отслеживать протекание беременности и общее самочувствие и состояние организма будущей матери. Минимум раз в месяц – такая регулярность необходимо женщине при сдаче анализов для протекания беременности без осложнений.
Часто в лабораториях находят при обследовании мочи различные бактерии. Организм женщины в период вынашивания плода работает с перегрузками, что опасно возникновением и развитием патологии. В общем случае, наличие микроорганизмов в моче не считается превышением нормы и вполне допустимо.
Но если бактерии обнаруживаются выше нормальных показателей, врачом ставится диагноз бактериурии, который которая образуется внезапно. Для пациентки этот результат очень неожиданный, поскольку никаких симптомов не проявляется.
Отклонением от нормы принято считать концентрацию бактерий более 100000 единиц на 1 кубический сантиметр жидкости. Если бактериурия протекает бессимптомно, то её диагностируют как асимптоматическую. Около 20% случаев бактериурии у женщин в положении возникает из-за фекального энтерококка.
Для нормального протекания беременности это неприятная ситуация, поскольку заболевание необходимо лечить, а число микроорганизмов снижать до нормы. Проводимому лечению может помешать изменение гормонального фона женщины и слабый иммунитет, поэтому для беременных всегда выбирается особая терапия.
Обнаружив энтерококк в моче при беременности, врач должен учесть, что назначаемая медикаментозная схема не должна навредить развитию плода и здоровью будущих детей.
Лечение патологии
Если не лечить подобное заболевание или игнорировать схему лечения, назначенную доктором, то по окончании беременности можно получить осложнение в виде проблем при родах. Ситуация опасна из-за возможности выкидышей. Все лечебные процедуры назначает гинеколог, знающий анамнез пациентки и проводящие регулярные осмотры.
Как правило, для борьбы с фекальным энтерококком специалистами назначается антибактериальное лечение Ампициллином, Цефтриаксоном или Гентамицином. Более того, в дополнение назначают витаминные комплексы, поддерживающие иммунную систему будущей матери. К ним можно отнести Компливит, Витрум, Прегнавит, Виталюкс и Элевит.
Если появляется симптом дисбактериоза или цистита, необходимо применять средства только местного действия. Мне можно отнести мази и гели антибактериального эффекта, также бактериофаги, принимаемые жидкостью натощак до приема еды. Такие бактериофаги являются безопасными для беременных женщин, в том числе их назначают и детям в виде клизмы. Медики считают, что бактериофаги нельзя сравнить с антибактериальными средствами, но, тем не менее, их побочные эффекты минимальны и подходят для беременных женщин.
Вред и польза энтерококков
В человеческом организме есть множество различных видов бактерий. Часть из них полезны, остальные вредны. Есть и те виды бактерий, которые приносят пользы в разы больше, чем наносят вреда, но только при условии, если их число не превышает допустимых показателей. К таким можно отнести именно фекальный энтерококк в моче. Если его концентрация в организме небольшая, то они просто необходимы организму.
Энтерококки участвуют в выделении молочной кислоты, перерабатывают углеводы и укрепляют иммунитет. Но если число бактерий данного вида начинает расти, это может вызвать неприятные заболевания мочеполовой системы. Также действие энтерококков сказывается и на легочной системе, поэтому все последствия их превышение нормы и дисбактериоза нужно устранять.
При беременности женщины должны обязательно наблюдать свое состояние, и как только появляется жжение во время деуринации, выделения желтого или зеленого цвета, боли в животе и другие симптомы, необходимо обратиться к терапевту или гинекологу.
Бактериурия и рост уровня Enterococcus faecalis часто вызывает маточно-плацентарную недостаточность, что провоцирует отхождение вод задолго до окончания беременности. Это опасно занесением инфекции в формирующийся плод или преждевременными родами.
Фекальный энтерококк в анализах мочи также может стать причиной патологии внутриутробного развития, поэтому лучше не допускать его превышения, а при возникновении проблем с его количеством устранять их в соответствие с рекомендациями лечащего врача.
YouTube responded with an error: The request cannot be completed because you have exceeded your <a href="/youtube/v3/getting-started#quota">quota</a>.
Рейтинг автора
Написано статей
Загрузка…индикаторов: энтерококки | Национальные исследования водных ресурсов
Что такое энтерококки?
Энтерококки — это бактерии, обитающие в кишечных трактах теплокровных животных, включая человека, и поэтому указывают на возможное загрязнение ручьев и рек фекальными отходами. Источники фекальных индикаторных бактерий, таких как энтерококки, включают сточные воды очистных сооружений, протекающие септические системы, ливневые стоки, сточные воды, сбрасываемые или сбрасываемые с прогулочных лодок, отходы домашних животных и диких животных, неправильное внесение навоза или сточных вод на землю, а также стоки с площадок хранения навоза. пастбища, пастбища и откормочные участки.Существуют также естественные нефекальные источники фекальных индикаторных бактерий, включая растения, песок, почву и отложения, которые способствуют определенному фоновому уровню в окружающих водах и варьируются в зависимости от местных экологических и метеорологических условий.
Сканирующая электронная микрофотография энтерококков. Фото: Лисак Марк, Служба охраны рыболовства и дикой природы США,
.Почему важно оценивать энтерококки?
Энтерококки являются индикаторами наличия фекалий в воде и, следовательно, возможного присутствия болезнетворных бактерий, вирусов и простейших.Эти патогены могут вызывать заболевание у пловцов и других людей, которые используют реки и ручьи для отдыха или едят сырых моллюсков или рыбу. Другие потенциальные последствия для здоровья могут включать заболевания кожи, глаз, ушей и дыхательных путей. Употребление в пищу рыбы или моллюсков, выловленных из вод с фекальными загрязнениями, также может привести к заболеванию человека.
Что энтерококки могут сказать нам о состоянии воды?
Энтерококки обычно не считаются вредными для человека, но их присутствие в окружающей среде может указывать на присутствие других болезнетворных агентов, таких как вирусы, бактерии и простейшие.Значительное количество энтерококков в водоеме может отрицательно повлиять на рекреационную и экономическую ценность водных ресурсов. Избыток фекальных бактерий в воде может стать причиной закрытия пляжей, запретов на плавание и катание на лодках, а также закрытия районов рыбной ловли и моллюсков.
Enterococci — обзор | ScienceDirect Topics
2.4.3.2 Гидролитическая активность энтерококков
Известно, что энтерококки продуцируют три типа ферментов, которые способствуют их условно-патогенному воздействию: гиалуронидаза, желатиназа и сериновая протеаза [JET 94, SEM 03, FIS 09].Гиалуронидаза, кодируемая хромосомным геном hyl , разрушает главный компонент внеклеточного матрикса клеток-хозяев, гиалуроновую кислоту, облегчая тканевую инвазию и распространение токсинов [KAY 04].
Желатиназа, кодируемая хромосомным геном gelE , представляет собой металлопротеиназу цинка, активную в отношении желатина, но также и в отношении коллагена, казеина, гемоглобина, β-инсулина и других биологически активных пептидов [FIS 09, KOC 04]. Этот фермент также способствует процессу образования биопленки, которая может способствовать колонизации тканей и сохранению их в местах инфицирования [DEL 07], [AND 16].Сериновая протеаза, кодируемая геном sprE , расположенная выше gelE и транскрибируемая с последним, также участвует в патогенезе, разрушая ткани хозяина [FIS 09].
Энтерококки способствуют развитию аромата сыра во время созревания из-за их протеолитической и липолитической активности и их способности производить летучие или длинноцепочечные жирные кислоты, диацетил, ацетоин и другие летучие соединения [FRA 99, JEN 75, SAR 01, JEN 75, ORD 78, TRO 87, CEN 96, CEN 99, CAS 97, FRA 03, SAR 01, SAR 02a].Согласно [SAR 02a], E. faecium участвует в развитии вкуса, аромата, цвета и текстуры. Следовательно, он способствует общему сенсорному профилю некоторых сыров. Эти качества также делают его предпочтительным вариантом для других ферментированных продуктов, таких как овощи или мясо [GIR 02, FRA 99].
В то время как протеолитическая активность молочнокислых бактерий хорошо описана в литературе по ферментированным продуктам, активность энтерококков менее известна [FRA 03, SUZ 00, CAR 92, SOM 69, WAL 70, HEG 90, DE 91b, MOR 06].В них довольно мало молочных продуктов, за исключением некоторых штаммов E. faecalis [SAR 01, DOV 70 ARI 97, MAC 97, SUZ 00, AND 01] . Согласно [CAR 92], внутри этого рода уровень протеолитической активности зависит от вида и от штамма внутри одного и того же вида. Лучше всего описанные протеазы способны гидролизовать казеин, а также β-лактоглобулин и α-лактальбумин [SAR 01, AND 01, SOM 69, WAL 70, HEG 90, DE 91a, DE 91b, VIL 94]. Многие исследования [JEN 95, CEN 99, CAS 97, GAR 97, OUM 01] показывают, что сыры, полученные из молока, инокулированного E.faecalis обладают более высокой протеолитической активностью, чем сыры, произведенные без этих ферментов. Работа [VIL 94] по выращиванию 24 штаммов E. faecium и 60 штаммов E. faecalis в обезжиренном молоке при 37 ° C показывает, что протеолитическая активность E. faecalis намного превосходит таковые из E. faecium . Эти результаты подтверждаются [AND 01] и [SAR 01a] для молочных продуктов и [MIL 10] для энтерококков, выделенных из пастеризованного жидкого цельного яйца и ответственных за их порчу.
Считается, что последующее разложение аминокислот имеет большое влияние на развитие аромата сыров. Протеолитическая активность также может быть ответственна за образование биогенных аминов энтерококками из аминокислот, которые они (или другие типы бактерий) высвободили [GIR 02, [OGI 08, BEN 16]. На рис. 2.6 показаны различные биогенные амины, потенциально образующиеся в испорченных пищевых продуктах.
Рисунок 2.6. Образование биогенных аминов в пищевых матрицах в ответ на микробиологическую метаболическую активность.Серые стрелки представляют реакции декарбоксилирования, непосредственно ведущие к образованию биогенных аминов, пунктирные линии указывают на биогенные амины, продуцируемые метаболическими путями, которые отличаются от реакций одностадийного декарбоксилирования.
(Рисунок взят из [BEN 16], адаптирован согласно [RUI 04])Гистамин, тирамин, фенилэтиламин и кадаверин продуцируются одностадийной реакцией декарбоксилирования из их соответствующих предшественников гистидина, тирозина, фенилаланина и лизина.Производство этих биогенных аминов с последующей их секрецией требует (1) активных транспортных систем аминокислот-предшественников, (2) декарбоксилирования и (3) систем выделения аминов, возникающих в результате этих декарбоксилирований. Транспорт обычно включает белок, который обменивает аминокислоту-предшественник на амин, возникающий в результате его декарбоксилирования. Попадая в клетку, аминокислота подвергается декарбоксилированию, катализируемому определенной декарбоксилазой (карбокси-лиаза EC 4.1.1.1.) В присутствии пиридоксальфосфата.Наиболее изученными декарбоксилазами являются гистидиндекарбоксилаза (HDC), тирозиндекарбоксилаза (TDC) и лизиндекарбоксилаза (LDC), соответственно, кодируемые генами hdcA , tdcA и cadA . Позднее они организуются в опероны с другими генами, участвующими в других стадиях процесса производства биогенных аминов, таких как транспорт и созревание. Специфичность этих декарбоксилаз давно обсуждается, и в настоящее время хорошо установлено, что декарбоксилаза может декарбоксилировать несколько субстратов.Например, Enterococcus TDC может декарбоксилировать фенилаланин и тирозин с образованием фенилэтиламина и тирамина соответственно [COL 11, MAR 06, MAR 12]. Путресцин, агматин, спермидин и спермин синтезируются различными путями, катализируемыми группами генов, которые могут быть специфичными для данного вида или штамма, поскольку они потенциально могут быть получены путем горизонтального переноса [MAR 12, LAD 11, LIN 11, WUN 14].
Энтерококки описаны как способные вызывать декарбоксилазную активность, ответственную за производство биогенных аминов в ферментированных пищевых продуктах.Они даже признаны обладающими самой сильной тирозиновой и фенилаланиндекарбоксилазной активностью в мире бактерий [SUZ 03]. Молочнокислые бактерии в эндогенной флоре ферментированного мяса, такого как колбасы, признаны основными продуцентами тирамина [ANS 02]. Сыры [THA 90, GIR 95, GAR 01] и некоторые мясные продукты [BOV 01] могут быть подходящими субстратами для производства 2-фенилэтиламина, тирамина, гистидина или других аминов. Следовательно, эти штаммы несут гены или опероны, кодирующие декарбоксилазы или другие ферменты, участвующие в синтезе биогенных аминов или в их катаболизме [BEN 16, WUN 14, KOM 08, NOU 94, KOU 10].Что касается морепродуктов, синтез биогенных аминов не связан с энтерококками [VAL 10]. В то время как термостойкие бактерии, такие как энтерококки, которые являются основными бактериями, участвующими в производстве биогенных аминов в молочных продуктах [LAD 11, SPA 10], только частично уничтожаются пастеризацией, термическая обработка снижает уровень биогенных аминов. Это явление может быть связано с уменьшением уровня загрязнения пищевых продуктов и / или с тем фактом, что важный кофактор декарбоксилирования был денатурирован пастеризацией [BEN 16].
Хотя молочнокислые бактерии не очень активны по отношению к липидам, известно, что они участвуют во вкусовых качествах сыров либо путем преобразования короткоцепочечных жирных кислот в кетоны или метилированные лактоны, либо путем образования альдегидов в результате окисления ненасыщенных жирными кислотами и ответственными за развитие прогорклого запаха и вкуса либо путем сольватации ароматических соединений, образующихся из липидов, но также из белков и лактозы [FOU 06]. Согласно [TSA 94b, TAV 98] и [HEM 98], энтерококки обладают эстеразной активностью, которая часто выше, чем у других молочнокислых бактерий.Среди энтерококков эти активности также изменчивы, и исследования [SAR 01a] показывают, что они сильнее у E. faecalis , чем у E. faecium . Другие исследования [SUZ 00, DUR 01] показывают, что липолитическая активность энтерококков варьируется не в зависимости от вида, а от типа сыра, из которого происходит штамм [FOU 06].
Еще в 1965 году [LUN 65] продемонстрировал активность эстеразы, выраженную штаммами E. faecalis и E. faecium .[DOV 70] показывает, что энтерококки были более активны в отношении триглицеридов, чем штаммы Streptococcus , и что скорость гидролиза снижалась с увеличением длины углеродной цепи высвобожденных жирных кислот (трипропионин> трибутирин> трикаприн> трикаприлин). Они подчеркивают отсутствие активности триолеина. [VIL 94] показывают, что энтерококки проявляют низкую липолитическую активность при помещении в питательную среду, содержащую цельное молоко. Работа [MAR 76] показывает гидролиз трибутирина, выраженный E.faecium и E. faecal — , выделенный из сыра, однако эти штаммы не активны в отношении липидов молока. [CHA 79a, CHA 79b] показывают, что липаза E. faecalis также более активна в отношении трибутирина, чем в отношении трикапроина, трикаприлина и триолеина. Однако, согласно [CAR 92], способность энтерококков гидролизовать липиды молока сильно варьируется от одного штамма к другому. Некоторые штаммы не проявляют липолитической активности, тогда как другие проявляют высокую активность в отношении широкого спектра жирных кислот. Работа [TSA 93], выполненная на синтетических субстратах (4-нитрофенилацилы), показывает E.faecium активность в отношении жирных кислот, длина цепи которых составляет от 2 до 18 атомов углерода. В последующих исследованиях [TSA 94] эти же авторы показали, что внутриклеточная эстераза E. faecium , in vitro , проявляет активность в отношении 4-нитрофенилацилов, длина цепи которых составляет от 2 до 12 атомов углерода, с оптимальным в присутствии 4-нитрофенилбутирата (C2) [TSA 94]. Работа [SAR 01a] показывает, что большинство испытанных штаммов энтерококков (90%, N = 129) способны гидролизовать гомогенные триглицериды, содержащие жирные кислоты с длиной цепи от 4 до 18 атомов углерода, причем активность снижается с увеличением углеродной цепи. длина.Все протестированные штаммы (100%) в этом же исследовании показывают активность на синтетических субстратах, от 4-нитрофенилацетата (C2) до 4-нитрофенилстеарата (C18), причем активность также снижается за счет увеличения длины жировой ткани. кислотная углеродная цепь.
Среди немногих опубликованных исследований гидролитической активности, которая может быть вовлечена в порчу яичных продуктов, есть исследования [MIL 10], которые показывают липолитическую активность, выраженную штаммами E. faecium и, в частности, E.faecalis , выделенный из испорченных пастеризованных жидких цельных яичных продуктов. Работа [TEC 15] показывает, что липазная активность также обнаружена для половины штаммов Enterococcus , полученных из промышленных яичных белков, и проверена на их способность портить один из основных компонентов десертов на плавучих островах, заварного крема.
Enterococcus faecalis: инфекции, передача и лечение
Энтерококк — это тип бактерий, который обычно присутствует в кишечнике и кишечнике.
В некоторых случаях эту бактерию можно также найти во рту или во влагалище.
У здоровых людей или в нормальных количествах Enterococcus обычно не вызывает проблем.
Но если он распространяется на другие части тела, он может вызвать опасные для жизни инфекции. Люди, находящиеся в больницах или имеющие сопутствующие заболевания, подвергаются более высокому риску развития инфекции.
Хотя существует 17 или более видов Enterococcus , у человека обычно встречаются только два: E.faecalis и E. faecium .
В этой статье основное внимание уделяется E. faecalis , ассоциированным с ним инфекциям, способам его передачи и вариантам лечения.
Поделиться на Pinterest Бактерии энтерококка faecalis. Первоначально эта бактерия была связана со стрептококком.Изображение предоставлено: Дженис Хейни Карр, CDC / Пит Уорделл.
До 1984 года E. faecalis был известен как Streptococcus faecalis . Ученые ранее относили бактерии к роду Streptococcus .
По данным Центров по контролю и профилактике заболеваний (CDC), E. faecalis является причиной примерно 80 процентов случаев заражения людей.
Бактерии могут вызывать инфекцию у людей при попадании в раны, кровь или мочу. Особому риску подвержены люди с ослабленной иммунной системой, например, те, кто:
- имеют слабый иммунитет из-за болезни или хирургического вмешательства
- проходят курс лечения рака
- находятся на диализе
- получают трансплантацию органов
- имеют ВИЧ или СПИД
- имели корневой канал
Люди в больницах особенно уязвимы для E.faecalis , поскольку у госпитализированных пациентов обычно снижен иммунитет. Обычное использование внутрисосудистых и мочевых катетеров также может способствовать распространению инфекции, поскольку эти инструменты часто содержат бактерии E. faecalis .
E. faecalis считается одной из трех основных причин внутрибольничных инфекций.
Поделиться на PinterestИнфекция мочевыводящих путей может быть вызвана E. faecalis, а инфекция, вызванная этим типом бактерий, может вызвать болезненные ощущения при мочеиспускании.E. faecalis способствует ряду инфекций у людей, некоторые из которых могут быть опасными для жизни.
Бактерии могут вызывать:
- бактериемию, наличие бактерий в крови
- инфекции брюшной полости и таза
- инфекции мочевыводящих путей
- инфекции полости рта, особенно корневых каналов
- сепсис или заражение крови
- раневые инфекции
- эндокардит, инфекция внутренней оболочки сердца
- энтерококковый менингит, необычная форма менингита
Симптомы E.faecalis зависит от локализации инфекции. К ним могут относиться:
- усталость
- болезненное мочеиспускание
- спазмы желудка
- рвота
E. faecalis обладает как естественным, так и приобретенным иммунитетом от лечения антибиотиками. В результате это один из наиболее устойчивых к антибиотикам типов бактерий.
Бактерии также могут переносить различные условия. Он может выжить в диапазоне температур и в кислой или щелочной среде.
E. faecalis может противостоять лечению многими антибиотиками из-за:
- образования биопленки : бактерии могут связываться друг с другом, образуя тонкий, но прочный слой, известный как биопленка, который может прочно прилипать к поверхности.
- Потребности в питании : E. faecalis может выдерживать длительные периоды времени без источника питания. Он даже может использовать сыворотку крови в качестве источника питания.
- Пенициллин-связывающие белки (PBP) : эти белки составляют E.faecalis от природы устойчив к пенициллину. Пенициллин подавляет активность E. faecalis , но не разрушает бактериальные клетки.
- Поглощение фолиевой кислоты в окружающей среде : Бактериям для роста требуется фолиевая кислота. Большинство из них не может поглотить его из окружающей среды, поэтому вынуждены делать это самостоятельно. Лекарства, которые препятствуют выработке фолиевой кислоты, часто могут уничтожить бактериальные инфекции. Однако E. faecalis может поглощать фолиевую кислоту из окружающей среды, поэтому эти лекарства малоэффективны.
Энтерококки чаще всего передаются из-за плохой гигиены.
Поскольку он естественным образом присутствует в желудочно-кишечном тракте, E. faecalis обнаруживается в фекалиях. Неправильная чистка предметов, содержащих фекалии, или отказ от мытья рук после использования туалета могут увеличить риск передачи бактерий.
Повседневные предметы, такие как телефоны, дверные ручки, полотенца и мыло, также могут содержать E. faecalis .
Бактерии могут распространяться по больницам, если медицинские работники не моют руки между пациентами.Без тщательной очистки катетеры или диализные порты также могут передавать инфекцию.
Соблюдение правил гигиены, особенно в условиях больницы, может помочь предотвратить распространение инфекции E. faecalis .
Профилактические меры включают:
- тщательное мытье рук, включая кончики пальцев и большие пальцы рук, после посещения туалета
- мытье рук перед едой или питьем
- обеспечение того, чтобы медицинские работники мыли руки перед контактом с внутривенными инъекциями, катетерами и повязками.
- обеспечение того, чтобы медицинские работники тщательно мыли руки между пациентами
- избегая использования чужих предметов личной гигиены, таких как мыло, мочалки, полотенца и бритвы
- избегая сидения на кроватях других пациентов
- избегая использования туалетов другие пациенты, а также туалеты, которые выглядят грязными или грязными
- регулярная уборка туалетов и туалетов
- протирка дверных ручек, пультов дистанционного управления, телефонов и других предметов общего пользования
- частое мытье рук пациентами, персоналом и посетителями больницы
Из-за своих механизмов лекарственной устойчивости инфекция Enterococcus представляет собой серьезную проблему лечения для медицинских работников.
Перед лечением врачи часто берут образцы бактерий у пациентов. Они определяют чувствительность образца к различным видам лечения, включая ампициллин, пенициллин и ванкомицин.
Неосложненную инфекцию часто можно лечить одним антибиотиком.Если резистентности к антибиотикам нет, предпочтительным лекарством является ампициллин.
Другие варианты лекарств включают:
- ампициллин с сульбактамом
- даптомицин
- линезолид
- нитрофурантоин
- тигециклин
- ванкомицин
сепсис. Для лечения этих инфекций может потребоваться комбинация агента, действующего на клеточную стенку, и класса антибиотиков, известных как аминогликозиды.
Агенты, действующие на клеточную стенку, представляют собой антибиотики, которые воздействуют на бактериальную клеточную стенку, подавляя рост клеток. Примеры включают ампициллин, ванкомицин и аминогликозиды, в том числе гентамицин и стрептомицин.
При более серьезной инфекции лечение может длиться несколько недель.
Энтерококковые инфекции обычно возникают у уже больных людей. Это может затруднить определение того, является ли бактериальная инфекция причиной любого последующего заболевания или смерти.
Некоторые исследования показывают, что прогноз для людей с E.faecalis связана с состоянием их здоровья, а не с наличием бактериальных штаммов.
Другие исследования показали, что пациенты с инфекцией, вызванной штаммами устойчивых к ванкомицину Enterococcus , имели более высокий уровень смертности, чем пациенты со штаммами, чувствительными к антибиотику.
Инфекции, вызванные устойчивыми к антибиотикам бактериями, как правило, приводят к более длительному пребыванию в больнице, более высоким расходам на здравоохранение и более высокому уровню смертности по сравнению с инфекциями, вызванными чувствительными к антибиотикам бактериями.
Надлежащая гигиена — лучший способ предотвратить передачу инфекции E. faecalis .
Бактерии — Beachapedia
Эта страница доступна на нескольких языках:Бактерии (английский)
Bacteria-Esp (Español)
Введение
Бактерии часто называют причинами болезней человека и животных, но существуют также доброкачественные и даже полезные бактерии, которые необходимы для здоровья человека, а также для здоровья почвы, растений и животных.
Когда мы думаем о бактериях, особенно в отношении качества воды на пляже и пляжного песка, нас обычно беспокоят бактерии, вызывающие инфекции и болезни. Некоторые примеры вредоносных бактерий включают Leptospira , которые могут вызывать серьезное заболевание лептоспироз как у домашнего скота, так и у людей; и патогенные штаммы Escherichia coli («E. coli»), которые могут вызвать тяжелое заболевание из-за воссоздания или потребления загрязненной воды и употребления зараженной пищи.
Кроме того, некоторые бактерии, актиномицеты, производят антибиотики, такие как стрептомицин и нокардицин. Другие живут симбиотически в кишечнике животных (включая людей) или где-то еще в их телах или на корнях определенных растений, превращая азот в пригодную для использования форму. Бактерии помогают расщеплять мертвые органические вещества и составляют основу пищевой сети во многих средах.
В этой статье обсуждаются «индикаторные бактерии», которые могут быть или не быть патогенными (вызывать заболевание), но чье присутствие в воде коррелирует с присутствием других бактерий, вирусов или простейших, вызывающих заболевание.Исторически для мониторинга качества воды использовалось несколько классов бактерий, в том числе общая колиформная, фекальная колиформная, кишечная палочка и энтерококк.
Колиформные бактерии
Тестер бактерий группы кишечной палочки
Качество морских и других рекреационных вод обычно определяется путем тестирования на наличие одной или нескольких «индикаторных бактерий». Наиболее часто исследуемые индикаторные бактерии называются «колиформными бактериями». Колиформные бактерии происходят из почв, растений и отходов человека и животных.Хотя не все колиформные бактерии вредны для человека, наличие большого количества колиформ в водоеме является хорошим показателем того, что вода может быть загрязнена вредными микроорганизмами и вирусами.
Фекальные колиформные бактерии
Фекальные колиформные бактерии — это особый вид колиформных бактерий, которые встречаются в основном в кишечном тракте млекопитающих и птиц. Эти бактерии попадают в окружающую среду через фекалии человека и животных. Присутствие фекального загрязнения может происходить из-за ливневых стоков, домашних и диких животных, а также сточных вод человека.Если они присутствуют в высоких концентрациях в рекреационных водах и попадают в организм во время плавания или попадают на кожу через порезы или язвы, они могут вызвать заболевание человека (в первую очередь гастроэнтерит), инфекции или сыпь.
Одним из видов фекальных колиформных бактерий является печально известная бактерия E. coli, конкретный штамм которой был связан с многочисленными вспышками болезней пищевого происхождения в Соединенных Штатах.
Ряд других бактерий в сочетании составляют группу фекальных колиформ.Другими словами, кишечная палочка не является прямым заменителем фекальных колиформ. E. coli может составлять от 5% до 90% фекальных колиформ в воде.
При совместном использовании общие уровни колиформных и фекальных колиформных бактерий являются важным инструментом, который помогает ученым определить, безопасно ли заниматься серфингом и плавать на пляже. Эти индикаторные бактерии были основой мониторинга воды в США и других странах в течение нескольких десятилетий. В последние годы исследования здоровья указали на E.coli и энтерококк, поскольку они более тесно связаны с заболеванием, чем общие и фекальные колиформные бактерии.
Энтерококк
Группа энтерококков — это подгруппа фекальных стрептококковых бактерий. Часть энтерококков группы стрептококков является ценным бактериальным индикатором для определения степени фекального загрязнения рекреационных поверхностных вод. Исследования в морской и пресной воде показывают, что энтерококки являются одним из лучших бактериальных индикаторов качества воды. Энтерококк — это бактерия, обнаруженная в кишечнике человека, и поэтому он является хорошим индикатором отходов жизнедеятельности человека.
Согласно исследованиям, проведенным EPA, энтерококки имеют большую корреляцию с желудочно-кишечными заболеваниями, связанными с плаванием, как в морской, так и в пресной воде, чем другие бактериальные индикаторные организмы, и с меньшей вероятностью «погибнут» в соленой воде. В 1986 году EPA установило основанные на здоровье национальные стандарты качества воды для рекреационных целей: 35 колониеобразующих единиц (КОЕ) на 100 миллилитров (мл) взятой пробы воды с пляжа (среднее за 30 дней) или 104 КОЕ на 100 мл (стандарт для одной пробы). Общественность должна была быть уведомлена, если значения превышали эти пределы.Примечание. Тесты IDEXX сообщают о результатах как наиболее вероятное число (MPN) на 100 мл, что эквивалентно КОЕ на 100 мл.
В конце 2012 года EPA опубликовало новое руководство по критериям качества рекреационной воды, в котором энтерококки оставались предпочтительными индикаторными бактериями, но были изменены 30-дневные средние и максимальные пороговые значения для одного образца, что позволило штатам устанавливать свои собственные из множества вариантов.
Целевая группа Surfrider’s Blue Water проводит тесты пляжной воды на общие колиформные бактерии и E.coli (подгруппа фекальных колиформных бактерий) с использованием теста Колилерта IDEXX или на энтерококк с помощью теста Enterolert от IDEXX для оценки уровней этих индикаторных бактерий в рекреационных водах. Результаты делятся онлайн с местными сообществами и местными агентствами по проверке качества воды.
Отметим, что были проведены исследования, позволяющие выявить высокую плотность энтерококков и колиформных бактерий в тропических почвах, даже без потенциальных фекальных источников. Существует пробел в исследованиях рисков, связанных с этими экологическими источниками энтерококков и колиформ.Как утверждают Бьяппанахалли и др. В своей статье 2012 года, «растущее количество доказательств широко распространенных внекишечных источников и резервуаров энтерококков демонстрирует универсальность рода Enterococcus и приводит доводы в пользу необходимости лучшего понимания их экологии в естественной среде обитания. как их роль в качестве условно-патогенных микроорганизмов и индикаторов патогенов человека ».
Узнать больше
Чтобы узнать о мониторинге бактерий энтерококков и кишечной палочки в прибрежных штатах, в том числе о том, какие пороговые значения бактерий используются для определения безопасности качества воды на пляже, ознакомьтесь с программами мониторинга качества воды на пляже в прибрежных штатах.Также смотрите наши статьи об эпидемиологических исследованиях и угрозах здоровью из-за загрязненных прибрежных вод.
Эта статья является частью серии статей о чистой воде, в которой рассматриваются различные угрозы качеству воды в наших океанах, а также негативное воздействие, которое загрязненные воды могут оказывать на окружающую среду и здоровье человека.
Для получения информации о законах, политиках, программах и условиях, влияющих на качество воды в конкретном штате, посетите отчет Surfrider о состоянии пляжа, чтобы найти отчет штата для этого штата, и щелкните ссылку индикатора «Качество воды».
Сравнительная геномика Enterococcus spp. выделен из фекалий крупного рогатого скота | BMC Microbiology
Статистика секвенирования
Сводная статистика секвенирования для 21 Enterococcus spp. геномы можно найти в Таблице 1. Размер геномов варьировался от 2,60 до 3,64 Мб, причем E. thailandicus демонстрировали самый маленький и E. casseliflavus самый большой геном. Размер геномов E. hirae значительно варьировался, что свидетельствует о больших различиях в размере хромосомы между штаммами и / или наличии / отсутствии плазмид.
Филогения
Филогенетические деревья были построены на основе анализа однонуклеотидных вариантов (SNV) основных генов. Филогенетическое дерево было построено с использованием всех 21 секвенированных Enterococcus spp. геномов, а также 27 полных геномов энтерококков, загруженных из базы данных NCBI (рис. 1). 27 конкурирующих геномов из NCBI включали: E. hirae (2 штамма; ATCC 9790, R17), E. faecium (13 штаммов; Aus0004, Aus0085, T110, 6E6, VRE001, E1, E745, E39, UW8175, NRRL B2354, ATCC 700221, EFE10021), E.faecalis (9 штаммов; LD33, L12, KB1, 62, D32, V583, DENG1, OG1RF, ATCC 29212), E. durans (1 штамм; KLDS6_0933), E. gallinarum (1 штамм; FDAARGOS163), и E. casseliflavus (1 штамм; EC20). Пробиотический штамм Enterococcus faecium T110 был использован в качестве эталона для внешней группы (рис. 1). Собранное дерево соответствовало дендрограмме профиля PFGE, полученной в нашем предыдущем исследовании [10]. Как и ожидалось, кластеризация наблюдалась для геномов одного и того же вида, дополнительно подтверждая идентичность каждого вида на основании предыдущего видообразования спейсера groES-EL [10].
Рис. 1 Филогенетическое дерево, построенное на основе анализа однонуклеотидных полиморфизмов (SNP) основных генов 48 геномов энтеркокков, включая 21 изолят, полученный из бычьих фекалий в настоящем исследовании. Entercoccus faecalis , Entercoccus faecium , Enterococcus hirae , Entercoccus durans , Entercoccus casseliflavus и Entercoccus gallinarum в качестве эталонного штамма Tc 49 E. Филогенетический анализ был также проведен внутри видов для E.hirae , E. faecalis и E. faecium. Для E. hirae , поскольку геном из клинического изолята не был доступен и происхождение типового штамма ATCC 9790 было неизвестно, штамм E. hirae R17 (BioSample SAMN04892752), выделенный из розничного сырого мяса, использовался в качестве внешней группы. справку (рис. 2а). Были идентифицированы две различные клады, при этом большинство из E. hirae составляли одну кладу и два генома во второй ( E. hirae 4 и E.хираэ 9). Единственный изолят E. faecalis , секвенированный в этом исследовании, E. faecalis _17, тесно сгруппирован с клиническим изолятом человека, устойчивым к ванкомицину, штаммом E. faecalis V583 (рис. 2b). Другие штаммы, включенные в анализ, имели клиническое происхождение от людей, людей, свиней и мышей и имели отношение к молочным продуктам. Для понимания степени родства клинических и бычьих изолятов необходимы сравнительные филогенетические исследования с более чем изолятами E. faecalis из коровьего происхождения. Филогенетические деревья а Entercoccus hirae и b Entercoccus faecalis последовательностей генома из настоящего исследования и полных последовательностей генома из базы данных NCBI на основе анализа однонуклеотидных вариантов (SNV) основных генов. Происхождение изолятов указано на рисунках Все три E.Геномы faecium , секвенированные в этом исследовании, были более тесно связаны с геномами NCBI из комменсальных, пробиотических и молочных изолятов по сравнению с клиническими изолятами (рис. 3a). Чтобы исследовать это дальше, мы сосредоточили наш филогенетический анализ на наличии или отсутствии дополнительных генов, что еще больше усилило различение этих двух кластеров (Рис. 3b). Три полных генома NCBI E. faecalis из неклинических источников, включая человека, свиней, пробиотик и молочные продукты, сгруппированные вместе с изолятами фекалий крупного рогатого скота, полученными в текущем исследовании.Все остальные изоляты, включенные в анализ дерева родства, были получены из различных клинических источников на людях и сформировали отдельный кластер. В процессе эволюции бактерии дополнили свои геномы ДНК других бактерий с помощью мобильных генетических элементов (MGE), включая плазмиды, транспозоны, геномные острова и бактериофаги. Дополнительный геном на основе MGE предлагает бактериям очень полезный ресурс для улучшения их приспособленности и адаптации в различных средах, возможно, за счет развития патогенности и вирулентности.Предполагается, что большинство дополнительных генов E. faecium , вносящих вклад в отчетливую кластеризацию клинических и комменсальных изолятов в настоящем исследовании, могут быть плазмидными или хромосомными MGE. Необходимы дальнейшие исследования, чтобы идентифицировать эти дополнительные гены, чтобы понять их роль в обеспечении адаптации энтерококков к определенным условиям. a Филогенетическое дерево последовательностей генома Entercoccus faecium из настоящего исследования и полные последовательности генома из базы данных NCBI на основе анализа однонуклеотидных вариантов (SNV) основных генов. b Дерево родства последовательностей генома E. faecium из настоящего исследования и полных последовательностей генома из базы данных NCBI на основе анализа матрицы корреляционного сходства Пирсона дополнительных генов. Происхождение изолятов указано на рисунках BLAST-атласы были сконструированы с использованием геномов изолированных E. hirae и E. faecium и эталонных геномов E. hirae ATCC 9790 и E.faecium DO из базы данных NCBI (рис. 4a и b). Из штаммов E. hirae , E. hirae 7 проявили наивысшее родство с эталонным штаммом. E. hirae 7 и E. hirae 8 также имели общие гены, связанные с фагом, с эталонным штаммом (рис. 4a). Было также показано, что несколько локусов, связанных с транспозонами, являются общими с эталонным геномом. Среди штаммов E. hirae было идентифицировано несколько вариабельных областей, что свидетельствует об их сходстве по содержанию генов.Аналогичным образом, содержание генов среди штаммов E. faecium также было очень сходным. Однако несколько локусов, связанных с фагами и транспозонами, из эталонного штамма, по-видимому, отсутствуют в комменсальных штаммах, но присутствуют в клинических штаммах (рис. 4b). Это наблюдение дополнительно подтверждает их отчетливую сегрегацию на независимые клады. a Blast-атлас 10 штаммов Enterococcus hirae, штаммов, выделенных из фекалий крупного рогатого скота, и штаммов E.hirae , штамм R17, картированный против E. hirae ATCC9790. b Бластный атлас геномов 3 изолятов Entercoccus faecium, из фекалий крупного рогатого скота и 12 полных геномов E. faecium из базы данных NCBI, сопоставленных с эталонной последовательностью E. faecium DO. Взрывные атласы были созданы с помощью программного обеспечения пакета GView Java [28] с использованием как длины выравнивания, так и значений отсечения процентной идентичности, равных 80%. На основе эталонных геномов области / локусы, относящиеся к фагам и транспозонам, указаны на диаграмме altas Схема систем CRISPR-Cas, идентифицированных при анализе последовательности всего генома 21 Enterococcus spp. геномы. a Функциональный разделитель массива CRISPR и организация прямого повтора. Ромбы представляют собой прямые повторы, чередующиеся с цифрами, обозначающими разделители. Номера разделителей соответствуют последовательностям, отображаемым в Дополнительном файле 1: Таблица S6. b Сиротский спейсер CRISPR и организация прямого повтора. Ромбы представляют собой прямые повторы, чередующиеся с цифрами, обозначающими разделители.Номера разделителей соответствуют последовательностям, отображаемым в Дополнительном файле 1: Таблица S6. c Нумерованные прямые повторы. Числа соответствуют последовательностям, отображаемым в Дополнительном файле 2: Таблица S5 Clusters of Orthologous Groups (COGs) — это широкие функциональные категории, используемые для определения белков, связанных по функциям [32]. Функциональная категоризация белков по различным COG (дополнительный файл 2: рисунок S1) выявила различия в функциональном профиле среди Enterococcus spp., но процент COG, назначенных для контроля клеточного цикла, деления клеток, разделения хромосом; внеклеточные структуры; и внутриклеточный транспорт, секреция и везикулярный транспорт были сходными у разных видов. Процент COG, отнесенных к подвижности клеток, был наибольшим для E. gallinarum и E. casseliflavus , двух видов Enterococcus , которые, как известно, являются подвижными [12]. Процент COG для подвижности клеток был низким для всех других неподвижных видов энтерококков [33].Функциональный профиль штаммов одного и того же вида отличался незначительно, за исключением категории мобилома: профаги, транспозоны, в которой наблюдалась межвидовая изменчивость. Два штамма E. hirae , E. hirae 4 и E. hirae 9, сгруппированные вместе (рис. 2a), два штамма E. faecium ( E. faecium 11 и E. faecium 12) и штамм E. villorum , E. faecalis и E. casseliflavus ( E.villorum 16, E. faecalis 17 и E. casseliflavus 20 соответственно) показали наибольший процент белков, отнесенных к фагам и транспозазам. Используя функцию сравнения геномов, доступную на платформе IMG, мы составили обзор профиля численности для подсчета генов для различных COG для всех 21 Enterococcus spp. геномы (дополнительный файл 1: таблица S2). Ван Шайк и др. [14] провели функциональное сравнение на основе COG между E.faecium и E. faecalis в попытке определить характеристики, которые отличают эти два вида. В своем анализе они выявили различия в метаболизме сахаров пентозы арабинозы. Они обнаружили, что COG, ответственные за метаболизм (COG2160 и COG3957), поглощение (COG4213 и COG4214) и деградацию (COG3940) арабинозы, присутствуют в E. faecium и отсутствуют в E. faecalis , что объясняет неспособность E. faecalis для метаболизма арабинозы [34].Гены этих COG, за исключением COG4214 в E. faecium 12, присутствовали в штаммах E. faecium , исследованных в этом исследовании, и отсутствовали в нашем штамме E. faecalis . Гены этих COG также присутствовали в штаммах E. gallinarum и E. casseliflavus , что позволяет предположить, что эти виды Enterococcus также обладают способностью метаболизировать арабинозу (Дополнительный файл 1: Таблица S2). Ford et al. [35] ранее задокументировали, что штаммы E.gallinarum и E. casseliflavus , которые они исследовали, были способны метаболизировать арабинозу, но продемонстрировали слабый рост по сравнению с E. faecium . В текущем исследовании у E. hirae , E. villorum , E. durans и E. thailandicus отсутствовали гены этих COG, что позволяет предположить, что они не обладают способностью метаболизировать арабинозу, результат, который был биохимически подтверждено другими [36–38]. Арабиноза является субъединицей растительного полисахарида гемицеллюлозы и, следовательно, будет в изобилии в желудочно-кишечном тракте крупного рогатого скота [14].Несмотря на то, что E. faecium может использовать арабинозу в качестве источника энергии, этот признак, по-видимому, не обеспечивает конкурентного преимущества этому виду для размножения в желудочно-кишечном тракте крупного рогатого скота, учитывая, что E. hirae является преобладающим идентифицированным видом [ 10]. Van Schaik et al. [14] исследовали другие COG, участвующие в метаболизме источников углерода из растений, включая COG4677, который, как предполагается, участвует в метаболизме пектина, и COG3479, который участвует в расщеплении кумаровой кислоты и других компонентов лигноцеллюлозы.В нашем исследовании COG4677 присутствовал в E. faecium , E. durans и E. casseliflavus и отсутствовал в E. hirae , E. thailandicus , E. villorum , E. faecalis. и E. gallinarum , тогда как COG3479 присутствовал в E. hirae , E. faecium , E. villorum и E. durans и отсутствовал в E. faecalis , E. thaicus , E. gallinarum и E.casseliflavus . Эти авторы также выделили ряд COG, присутствующих в E. faecalis , которые отсутствовали в E. faecium , включая COG для использования этаноламина в качестве источника углерода. В текущем исследовании E. faecalis обладали COG для утилизации этаноламина, которые, как было подтверждено, отсутствуют у E. faecium . Утилизация этаноламина была продемонстрирована для E. faecalis [39], но не для других видов Enterococcus .В текущем исследовании эти COG были также идентифицированы у E. gallinarum , что позволяет предположить, что этот вид Enterococcus также может использовать этаноламин в качестве источника энергии, но, насколько нам известно, это не было подтверждено биохимически. Понятно, что разные Enterococcus spp. обладают способностью использовать различные источники углерода, что позволяет им жить и выживать во многих разнообразных средах, включая желудочно-кишечный тракт крупного рогатого скота. Из этого исследования не было очевидно, что E.hirae обладает специфическими особенностями углеводного обмена, которые могут способствовать его распространению в желудочно-кишечном тракте крупного рогатого скота по сравнению с другими видами Enterococcus spp. Van Schaik et al. [14] также исследовали белки, участвующие в защите от окислительного стресса. Они определили, что фермент каталаза (COG0753) присутствует в E. faecalis и отсутствует в E. faecium . Исследование различных видов Enterococcus spp. в этом исследовании подтвердили, что каталаза специфична для E.faecalis , поскольку он отсутствовал у всех других видов. В присутствии гема E. faecalis проявляет каталазную активность [40]. Предполагается, что продукция каталазы играет роль в вирулентности патогенных бактерий, включая Staphylococcus aureus [41, 42]. E. faecalis может подвергаться окислительному стрессу как часть защиты хозяина от инвазии [40]. Продукция каталазы может обеспечивать некоторую защиту от окисления во время инвазии, что способствует вирулентности E.faecalis . Другие механизмы в E. faecium могут играть роль в реакции на окислительный стресс, включая продукцию глутатионпероксидазы (COG0386) [14]. За исключением E. faecalis, этот COG присутствовал у всех видов Enterococcus , исследованных в этом исследовании, демонстрируя различные стратегии Enterococcus spp. использовать для борьбы с окислительным стрессом . Мультилокусное типирование последовательностей (MLST) было использовано для изучения популяционной структуры и эволюции E.faecium и E. faecalis [43, 44]. Этот метод включает секвенирование и анализ генов домашнего хозяйства и определение типа последовательности (ST) [44, 45]. В текущем исследовании E. faecium 11, E. faecium 12 и E. faecium 13 были классифицированы как ST214, неизвестно и ST955, соответственно, и E. faecalis 17 как ST242 (Таблица 1). Отсутствие присвоения ST для E. faecium 12 предполагает, что есть ST, которые еще не определены в базе данных MLST.ST могут быть отнесены к клональному комплексу (CC) на основании их сходства с центральным аллельным профилем [46]. MLST-анализ популяционной структуры E. faecium выявил, что большинство штаммов, ассоциированных с внутрибольничными инфекциями, принадлежат к клональному комплексу 17 (CC17) [43]. Для E. faecalis оказалось, что два комплекса, CC2 и CC9, представляют собой больничные штаммы [44, 47]. ST, присвоенные E. faecium и E. faecalis , идентифицированные в настоящем исследовании, были описаны ранее [47–50] и не связаны с комплексами штаммов, полученных из больниц.В настоящее время нет доступной схемы типирования для других видов Enterococcus spp. Гены вирулентности вносят вклад в патогенность организма. В этом исследовании гены вирулентности были обнаружены только у E. faecium и E. faecalis . Все три штамма E. faecium содержали гены efaA и acm , в то время как E. faecalis содержали ряд генов вирулентности, включая efaA , ace , ebp гели геля E 348, 348 фсрБ .Гены acm и ace , описанные в E. faecium и E. faecalis , соответственно, важны для облегчения адгезии клеточной стенки к тканям хозяина [51, 52]. Ген efaA , обнаруженный как в E. faecalis , так и в E. faecium , также играет роль в прикреплении к тканям хозяина и является фактором вирулентности, участвующим в эндокардите [53, 54] . Гены пилей ebp , описанные в E. faecalis , состоящие из ebpA, ebpB и ebpC , способствуют прикреплению и образованию биопленок [55].Ген gelE в E. faecalis кодирует желатиназу, которая гидролизует желатин, коллаген, казеин и гемоглобин [56]. Его экспрессия регулируется двухкомпонентной системой fsr , с генами gelE и fsr , важными для образования биопленок [57-59] . Помимо этих генов вирулентности, у E. faecalis также присутствовал ряд генов бактериальных половых феромонов, включая cad , camE, cCF10 и cOB1 .Некоторые конъюгативные плазмиды, обнаруженные в E. faecalis , отвечают на секрецию бактериальных генов половых феромонов из свободных от плазмид энтерококков, вызывая их перенос [60]. Плазмиды ответа на половые феромоны редко были описаны у других Enterococcus spp, но некоторые были описаны для E. faecium [61, 62]. Бактериальные половые феромоны, обнаруженные в геноме E. faecalis , нацелены на плазмиды половых феромонов pAD1, pAM373, pCF10 и pOB1 соответственно.Некоторые из этих плазмид кодируют признаки, которые могут способствовать вирулентности, такие как pAD1 и pOB1, оба кодируют бактериоцин и гемолизин, и pCF10, кодирующий устойчивость к тетрациклину [63]. Ген липопротеина , предшественника феромона cAD1, и ген cad был обнаружен во всех Enterococcus spp. изоляты, секвенированные в этом исследовании, с 98–59% аминокислотной идентичностью штамму E. faecalis FA2-2. Присутствие липопротеина-предшественника cAD1 в этих Enterococcus spp.увеличивает их потенциал получения высококонъюгативной реагирующей на феромон плазмиды pAD1. Было показано, что гемолизин / бактериоцин (цитолизин), кодируемый этой плазмидой, способствует вирулентности на животных моделях [64]. Следовательно, приобретение этой плазмиды этими Enterococcus spp. может увеличить их вирулентность. Необходим дальнейший анализ, чтобы определить, способен ли этот предшественник полового феромона индуцировать перенос pAD1 на Enterococcus spp. кроме E. faecalis . Гены вирулентности в основном охарактеризованы у E. faecalis и E. faecium , при этом имеется мало информации о природе этих генов у других видов энтерококков. Целый оперон цитолизина был обнаружен у E. durans , а гены цитолизина были идентифицированы у ассоциированных с молочными продуктами E. hirae и E. gallinarum. Другие гены вирулентности также часто обнаруживались в E. durans , такие как ген esp , который важен для адгезии [65].За исключением E. faecalis и E. faecium , гены вирулентности не были обнаружены в последовательности других изолятов Enterococcus из желудочно-кишечного тракта крупного рогатого скота. Помимо клинических энтерококков человека, гены вирулентности были идентифицированы у энтерококков из неклинических условий [65–67], причем E. faecalis имеют более высокую распространенность генов вирулентности, чем E. faecium [68, 69], наблюдение, которое согласуется с нашим исследованием. Энтерококки могут проявлять устойчивость к ряду антибиотиков, частично из-за их врожденной устойчивости ко многим широко используемым антибиотикам, таким как пенициллин, но также из-за их способности успешно приобретать устойчивость посредством горизонтального обмена ARG на MGE [ 70].В этом исследовании мы проверили 21 геном Enterococcus по базам данных ResFinder и CARDs на наличие генов устойчивости (Таблица 2). Гены устойчивости к ванкомицину были обнаружены только в геномах E. gallinarum и E. casseliflavus , где присутствовал оперон van C. Оперон van C присущ этим видам Enterococcus и обеспечивает устойчивость к низким концентрациям ванкомицина [71, 72]. Из изолятов, исследованных в этом исследовании, только штаммов E.casseliflavus _20 показал фенотипическую устойчивость к ванкомицину (дополнительный файл 1: таблица S3). Внутренняя устойчивость E. casseliflavus и E. gallinarum может обеспечить защиту от концентраций ванкомицина до 32 мкг / мл [73]. Ванкомицин присутствовал в количестве 30 мкг на дисках, используемых для тестирования чувствительности [10], концентрации, достаточной для подавления роста E. gallinarum _18 и E. casseliflavus _21, несмотря на оперон van C в этих дисках. изолирует.Однако van C в E. casseliflavus -20 обеспечивал адекватную устойчивость, позволяющую выращивать этот изолят в присутствии ванкомицина. Отсутствие генов устойчивости к ванкомицину у Enterococcus , выделенного из бычьих фекалий, не было неожиданностью, поскольку авопарцин, гликопептид, родственный ванкомицину, не использовался у крупного рогатого скота в Северной Америке [74]. гены устойчивости к макролидам присутствовали в ряде секвенированных геномов Enterococcus , это открытие совпадает с тем фактом, что коровам в рацион вводили тилозинфосфат [10]. Erm (B) придает устойчивость к антибиотикам из группы макролид-линкозамид-стрептограмин B (MLS B ) и обнаружен в изолятах E. hirae , E. faecium , E. villorum , E. gallinarum и E. casseliflavus . Напротив, msrC , насос для оттока макролидов, был обнаружен только у E. faecium (таблица 2). Это согласуется с данными Portillo et al. [75], которые описали erm (B) как преобладающий ген, придающий устойчивость к эритромицину у Enterococcus spp.и msrC в E. faecium . Наличие этих генов устойчивости соответствует фенотипической устойчивости, наблюдаемой у этих изолятов (дополнительный файл 1: таблица S3). Интересно, что E. hirae _6, E. durans _19 и E. casseliflavus _20 проявили устойчивость к макролидам, хотя ни один из генов устойчивости к макролидам не соответствовал генам в базах данных ResFinder или CARDs. Ранее мы сообщали, что изолят E. thailandicus , секвенированный в этом исследовании, проявлял промежуточную устойчивость к эритромицину (дополнительный файл 1: таблица S3) [10, 76].Хотя явных генов устойчивости к макролидам не было, было выявлено несколько генов, обладающих множественными функциями оттока лекарств, которые, возможно, способствовали промежуточной устойчивости к эритромицину [76]. Также есть вероятность, что этот фенотип был результатом неизвестного гена, который кодирует устойчивость к эритромицину. Гены, придающие устойчивость к высоким концентрациям аминогликозидов, не были обнаружены ни в одном из геномов. Чувствительность к высоким концентрациям аминогликозидов была подтверждена отсутствием фенотипической устойчивости к гентамицину и стрептомицину (дополнительный файл 1: таблица S3).Энтерококки по своей природе устойчивы к низким концентрациям аминогликозидов, что обеспечивается генами aac (6 ′) — Ii , aac (6 ′) — Iid и aac (6 ′) — Iih , присутствующими в E. faecium. , E. durans и E. hirae соответственно (таблица 2) [77, 78]. Гены, кодирующие устойчивость к тетрациклину, были обнаружены в ряде геномов, включая E. hirae , E. faecium и E. villorum (Таблица 2). Tet (L) кодирует белок оттока, тогда как tet (M) и tet (O) кодируют белки защиты рибосом [79]. Андерсон и др. [80] обнаружили, что tet (O) был наиболее распространенным геном, кодирующим устойчивость к тетрациклину у энтерококков, выделенных от крупного рогатого скота, и это открытие согласуется с нашими. Андерсон и др. [80] сообщили о E. hirae как о преобладающем виде, выделенном от крупного рогатого скота, а tet (O) был только детерминантой устойчивости, связанной с E.hirae в текущем исследовании. Обнаружение tet (M) и tet (L) в других изолятах не является неожиданным, поскольку оба гена также часто обнаруживаются в энтерококках животных, включая домашнюю птицу, свиней, собак, кошек, кроликов, барсуков, диких кошек и птиц [81 –83]. Тест на чувствительность диска показал, что изоляты, содержащие tet (M), были устойчивы к доксициклину, в то время как изоляты, содержащие tet (L) или tet (O), были чувствительными (дополнительный файл 1: таблица S3).Возможно, что изоляты, чувствительные к доксициклину, чувствительны к другим членам семейства тетрациклинов. В целом бактерии, устойчивые к доксициклину, также устойчивы к тетрациклину и окситетрациклину [84, 85]. Только некоторые из выбранных геномов содержали ARG к двум или более антибиотикам. Особый интерес представлял E. faecium -11, который содержал по меньшей мере 11 ARG, как следует из анализа последовательностей генома (таблица 2), включая те, которые придают устойчивость к аминогликозиду, MLS B , плевромутилину, стрептограину A, тетрациклину и стрептотрицину. Мобильные генетические элементы (MGE) играют важную роль в горизонтальном переносе генов (HGT) ARG внутри и между бактериями от человека и / или животного-хозяина [86–88]. MGE включают плазмиды, мобильные элементы, профаги и различные геномные островки, такие как интегративные и конъюгативные элементы (ICE) [89]. У энтерококков был описан ряд MGE, включая транспозоны, плазмиды и бактериофаги [90]. Хорошо известный транспозон, подобный Tn 3 , Tn 917 , который широко распространен в энтерококках, был идентифицирован в нескольких секвенированных геномах.Четыре штамма E. hirae ( E. hirae 1, E. hirae 2, E. hirae 3 и E. hirae 4) и один штамм E. faecium ( E. faecium 11) имел высокую гомологию последовательности (> 95%) с транспозоном Tn 917 , ранее описанным в E. faecalis [91]. Все эти штаммы проявляли устойчивость к эритромицину (Дополнительный файл 1: Таблица S3) [10], обусловленную геном устойчивости erm (B), присутствующим в Tn 917 .Другие отличительные особенности этого транспозона включают транспозазу (TnpA) и резольвазу (TnpR), участвующие в репликативном режиме транспозиции [92]. Ген erm (B) присутствовал в ряде других геномов, включая E. hirae _5, E. villorum _16, E. gallinarum _18 и E. casseliflavus _21. Однако он не совпал с транспозоном Tn 917 . В E. hirae _5 ген erm (B) был обнаружен в контиге, связанном с хромосомными генами.Ген устойчивости к тетрациклину tet (O) также был обнаружен рядом с erm (B). Основываясь на информации о последовательности, erm (B) в трех других геномах оказались плазмидно-опосредованными. В E. villorum _16 гены erm (B) и tet (L) были обнаружены на контигах, связанных с плазмидной последовательностью из штамма E. faecium UW8175 (номер доступа в GenBank CP011830.1). . В E. gallinarum_ 18 и E. casseliflavus_ 21 ген erm (B) был обнаружен на контигах, связанных с последовательностью плазмиды pRE25 из E.faecalis (инвентарный номер GenBank X92945.2). Гены устойчивости к тетрациклину tet (L) и tet (M), обнаруженные в E. hirae_ 1, были расположены на контиге, который имел 21 418 идентичных п.н. с 25 963 п.н. транспозоном Tn 6248 из E. faecium , штамм E506 (номер доступа в GenBank KP834592). Гены, ответственные за транспозицию ( tnpA ), вставку и удаление Tn 6248 ( tndX ), отсутствовали, как и ген хлорамфениколацетилтрансферазы ( cat ).Этот же контиг также оказался ассоциированным с плазмидной последовательностью в штамме E. hirae R17 (номер доступа в GenBank CP015517.1), что позволяет предположить, что этот остаточный транспозон может находиться в плазмиде. Интегративно-сопряженные элементы (ICE) — это самопередающиеся элементы, которые содержат модули для их обслуживания, распространения и регулирования [93]. У основных грамположительных патогенов человека (например, Enterococcus spp., Staphylococcus spp. И Streptococcus spp.), устойчивость к тетрациклину, как известно, возникает в результате приобретения ICE семейства Tn 916 , несущего ген tet (M). Синтения гена в этом семействе ICE хорошо законсервирована, но существуют различия в последовательностях генов интегразы ( int ) и эксцизионазы ( xis ), специфичности сайта вставки и диапазоне хозяев среди членов семейства [94–96]. Tn 916 ICE был первоначально идентифицирован как конъюгативный транспозон размером 18 т.п.н. в E. faecalis DS16 [97, 98].Варианты некоторых членов Tn9 16 — tet (M), включая Tn 916 , Tn 5397 , Tn 6000 или Tn 5801 , широко распространены среди нескольких родов в пределах Фирмикутов, что предполагает широкое распространение этих элементов. Многие Tn 916 -подобные ICE имеют широкий круг хозяев и ответственны за распространение устойчивости к тетрациклину через tet (M) в грамположительных бактериях, связанных с людьми и животными [88, 98, 99].Недавно почти идентичные геномные островки типа Tn 5801 были идентифицированы у разных грамположительных видов бактерий домашних животных ( Staphylococcus pseudintermedius ) и человека ( E. faecalis , S. aureus , Staphylococcus agalactiae). происхождения, предполагая горизонтальный перенос этих элементов [100]. В нашем исследовании два ICE, принадлежащих к семейству Tn 916 , были идентифицированы у E. faecium _11. Эти ICE проявляли гомологию с Tn 916 и Tn 5801 , каждый из которых содержал вариант tet (M), и, по-видимому, располагался в хромосоме.В группе B Streptococcus подавляющее большинство Tn 916 и Tn 5801 вставлены в основной геном [101]. Считается, что после вставки в геном Tn 916 и Tn 5801 сохраняются, поскольку они оказывают минимальное влияние на биологическую пригодность бактерий-хозяев [88, 101, 102]. Кластер генов aadE — sat4 — aphA — 3 , кодирующий устойчивость к стрептомицину, стрептотрицину и канамицину, ранее описанную в E.faecium [103], также был обнаружен в E. faecium -11, связанных с контигами, родственными плазмиде. Этот кластер генов также был описан в Tn 5405 в S. aureus [104] и Tn 1545 из Streptococcus pneumoniae [105], что позволяет предположить, что он широко распространен среди грамположительных бактерий. Бактериофаги-опосредованная трансдукция устойчивости к антибиотикам была продемонстрирована у энтерококков [106], а потенциальные детерминанты вирулентности были идентифицированы у фага, связанного с E.faecalis [107]. Фаги, обнаруженные в энтерококках, обычно принадлежат к Podoviridae , Siphoviridae или Myoviridae , но другие, включая Inoviridae , Leviviridae , Guttaviridae, также были зарегистрированы и 109348 [Fujifilidae и 109348]. Все секвенированные геномы Enterococcus содержали по крайней мере один предполагаемый фаг размером от 8,0 до 70,3 т.п.н. (Дополнительный файл 1: Таблица S4). Всего в 21 секвенированном геноме было идентифицировано 37 интактных профагов. E. hirae и E. faecium содержали от одного до трех интактных профагов, тогда как E. faecalis и E. gallinarum каждый содержали по два интактных профага, а E. durans содержали один интактный профаг. E. villorum и E. casseliflavus содержали до четырех интактных профагов, в то время как интактные профаги не были обнаружены у E. thailandicus . Обнаруженные интактные профаги принадлежали к семействам Siphoviridae , Myoviridae или Podoviridae , причем профаг из семейства Siphoviridae наиболее распространен среди всех исследованных видов (дополнительный файл 1: Таблица S4).Профаги семейства Phycodnaviridae были идентифицированы у E. faecium и E. villorum . Его статус был неизменным только для одного из штаммов E. faecium , в то время как он был сомнительным или неполным для других (дополнительный файл 1: таблица S4). Насколько нам известно, фаг из семейства Phycodnaviridae еще не описан у видов энтерококков. Однако их присутствие в микробиоме рубца было обнаружено после метагеномного анализа [110]. Кластеры с регулярным расположением коротких палиндромных повторов (CRISPR) и CRISPR-ассоциированные (Cas) гены представляют собой тип адаптивного иммунного ответа, описанный у бактерий против вторжения генетических элементов, таких как фаг и плазмиды [111]. Локус CRISPR включает массив CRISPR, фланкированный различными генами cas , при этом массив состоит из коротких прямых повторов, чередующихся с короткими вариабельными последовательностями ДНК, называемыми «спейсерами» [111]. Описаны три типа систем CRISPR-Cas, отличающиеся наличием различных генов Cas, а именно cas3 для типа I, cas9 для типа II и cas10 для типа III [112].Недавно к этой системе классификации были предложены два дополнительных типа, которые включают тип IV и тип V [111]. Системы CRISPR-Cas, обычно описываемые для энтерококков, относятся к типу II. Однако недавнее сообщение идентифицировало систему типа I у Enterococcus cecorum [113, 114]. Все штаммов E. hirae содержали массивы CRISPR, за исключением E. hirae _8. Массивы CRISPR были также обнаружены у E. thailandicus , E. villorum и E.durans (Дополнительный файл 1: Таблица S5). Массивы CRISPR из этих геномов фланкированы генами Cas, состоящими из cas9 , ca s 1 , cas2 и csn2 , за исключением E. villorum , в котором отсутствует ген csn2 . Массивы CRISPR, фланкированные этими четырьмя генами Cas, классифицируются как система типа II-A, и предполагается, что они будут функциональными, на что указывает присутствие основных генов Cas cas1 и cas2 [112, 115].Следуя той же номенклатуре, система CRISPR-Cas, идентифицированная в E. villorum , также будет классифицирована как система типа II, но ее подтип неясен. В бактериальных геномах часто можно обнаружить несколько массивов CRISPR. Однако не все массивы CRISPR могут сопровождаться генами Cas. Предполагается, что эти массивы лежат в спящем состоянии или что гены Cas из других подобных массивов могут быть достаточными для их активности [116] . Орфанные массивы CRISPR (без генов Cas) [114] были идентифицированы с помощью CRISPRdb в ряде геномов, включая два E.hirae и в E. thailandicus , E. faecalis и E. durans (Дополнительный файл 1: Таблица S4). Функциональные массивы CRISPR не были обнаружены для E. faecium , E. faecalis , E. gallinarum или E. casseliflavus . Сравнение массивов CRISPR, фланкированных генами Cas, выявило уникальные массивы между видами Enterococcus , но некоторые массивы были общими для штаммов одного и того же вида (рис.5). Среди девяти штаммов E. hirae присутствовали только четыре уникальных массива. Массивы, идентифицированные в E. villorum , были идентичны для обоих штаммов. Самый крупный массив был идентифицирован у E. thailandicus . Массивы, идентифицированные в секвенированных геномах Enterococcus , содержали от трех до десяти последовательностей прямых повторов (DR), чередующихся со спейсерными последовательностями (рис. 5; дополнительный файл 1: таблица S6). Всего было идентифицировано 26 уникальных последовательностей спейсеров, связанных с функциональными массивами CRISPR, и еще 38 уникальных спейсеров, связанных с потерянными массивами CRISPR (дополнительный файл 1: таблица S7). У энтерококков предполагается, что отсутствие систем CRISPR-Cas связано с повышенной устойчивостью к антибиотикам у изолятов E. faecium и E. faecalis [117]. В этом исследовании у E. faecium 11 отсутствовал CRISPR-Cas и он содержал несколько генов устойчивости к антибиотикам, что отражает эту ассоциацию. Палмер и Гилмор [117] обнаружили идентичность между последовательностями спейсеров CRISPR и последовательностями известных феромон-чувствительных плазмид и фагов, предполагая, что системы CRISPR-Cas обеспечивают защиту от этих вторгающихся генетических элементов.Авторы предположили, что отсутствие систем CRISPR-Cas привело к нарушению защиты генома, что сделало возможным приобретение ARG на MGE. Палмер и Гилмор [117] не обнаружили спейсерные последовательности, идентичные транспозонам, и предположили, что системы CRISPR-Cas не могут обеспечивать защиту от транспозонов. Несколько штаммов E. hirae в текущем исследовании содержали функциональные системы CRISPR-Cas и ген устойчивости erm (B) на транспозоне, подобном Tn 3 , что подтверждает эту теорию. Функциональные массивы CRISPR и интактный профаг были идентифицированы в большинстве геномов, секвенированных в этом исследовании, за исключением E. thailandicus . Неудивительно, что эти геномы содержали профаг, поскольку бактериофаги разработали стратегии, позволяющие избежать регуляции CRISPR посредством разработки систем анти-CRISPR, обеспечивающих интеграцию в геном [118]. В случае E. thailandicus спейсеры, идентифицированные в массивах CRISPR, выровнены с неполными последовательностями профага со 100% сходством последовательностей и, возможно, могут объяснить отсутствие интактного профага в этом геноме.Спейсер 60 выровнен с обеими областями 3 и 4 профага E. thailandicus , в то время как спейсер 12 выровнен с областью 4. Ни один из оставшихся спейсеров, идентифицированных в массивах CRISPR, не имел никакого сходства последовательности с идентифицированным профагом. Бактериоцины представляют собой синтезируемые рибосомами антимикробные пептиды, продуцируемые грамположительными и грамотрицательными бактериями, которые обладают антимикробной активностью против близкородственных бактерий [119]. У грамположительных бактерий они подразделяются на три основных класса.Класс I состоит из термостабильных модифицированных пептидов или лантибиотиков, класс II описывает термостабильные немодифицированные немодифицированные нелантибиотики, а класс III состоит из крупных белков, которые нестабильны при нагревании [119, 120]. Считается, что производство бактериоцинов бактериями обеспечивает конкурентное преимущество для их выживания в определенных экологических нишах [121]. Предполагаемые лантибиотики были идентифицированы у E. hirae , E. thailandicus и E. gallinarum , в то время как у E.faecium , E. villorum , E. faecalis , E. durans или E. casseliflavus . Предполагаемые бактериоцины класса II были идентифицированы в семи штаммах E. hirae ( E. hirae_ 3, E. hirae _4, E. hirae _5, E. hirae _6, E. hirae_ 8, E. hirae_ 9, E. hirae_ 10), два штамма E. faecium ( E. faecium _11, E. faecium _13), E.thailandicus , E. villorum и E. durans . Предполагаемый бактериоцин, идентифицированный в E. faecium _11 и E. faecium _13, имел аминокислотную идентичность на 99% с энтероцином A (номер доступа в Genbank AAF44686.1). Энтероцин А был впервые описан в штамме E. faecium , выделенном из ферментированной испанской колбасы [122]. Энтероцин А подавляет широкий спектр грамположительных бактерий, включая виды Clostridium , Propionibacterium , Listeria и Staphylococcus [123]. До недавнего времени терпены в основном считались вторичными метаболитами, связанными с растениями и грибами, и были описаны у прокариот лишь в нескольких случаях. Эти соединения служат ряду целей, в том числе действуют как антибиотики, гормоны, компоненты вкуса или запаха и пигменты [124]. С момента появления геномного секвенирования у бактерий был обнаружен ряд предполагаемых генов терпенсинтазы [125]. Предполагаемые терпены были идентифицированы у всех E. hirae , E.Villorum , E. gallinarum , E. durans и E. casseliflavus , секвенированные в этом исследовании. Ни один из них не был предсказан в геномах E. faecium , E. thailandicus и E. faecalis . Роль терпенов в энтерококках остается неясной. Enterococcus spp.Обнаружение, подсчет и идентификация Если вы не меняете настройки браузера, вы соглашаетесь с этим. Я понимаю Род Enterococcus включает местные комменсальные бактерии, обнаруженные в кишечнике человека и животных, а также в ротовой полости и влагалище людей, где они адаптировались к богатой питательными веществами, обедненной кислородом и экологически сложной среде (Fisher and Phillips, 2009 г.). В кишечнике человека род Enterococcus может составлять до 1% от общей бактериальной микробиоты у здоровых людей, причем наиболее распространенными видами являются Enterococcus faecium и Enterococcus faecalis (Sghir et al., 2000). В отличие от своей комменсальной роли, за последние десятилетия E. faecium и E. faecalis также стали возбудителями нозокомиальных инфекций, таких как эндокардит, бактериемия, менингит, инфекции ран и мочевыводящих путей (Guzman Prieto et al., 2016). Кроме того, другие виды энтерококков, включая Enterococcus durans, Enterococcus avium, Enterococcus gallinarum, Enterococcus casseliflavus, Enterococcus raffinosus и Enterococcus hirae , время от времени были связаны с инфекциями у людей (Klein, 2003). Большинство инфекций E. faecium и E. faecalis являются условно-патогенными и их все труднее лечить из-за высокого уровня устойчивости к β-лактамам, аминогликозидам и ванкомицину, которые в основном связаны с инфекциями E.faecium (Cattaneo et al., 2010). Подобно генам устойчивости, гены вирулентности также часто кодируются на мобильных элементах, и поэтому считается, что они часто распространяются посредством внутри- и межвидового горизонтального переноса генов в пределах рода Enterococcus (Laverde Gomez et al., 2011). И E. faecium , и E. faecalis могут нести множество генов, которые способствуют вирулентности у пациента с ослабленным иммунитетом. Для E. faecalis они включают гены, кодирующие вещество агрегации ( asa1 ) (Galli and Wirth, 1991), цитолизин ( cyl ) (Jett et al., 1992) и энтерококкового поверхностного белка ( esp-fs ) (Vankerckhoven et al., 2004), тогда как для E. faecium гены , связанные с вирулентностью, кодируют предполагаемую гиалорунидазу ( hyl ) (Klare et al., 2005) и энтерококковый поверхностный белок ( esp-fm ) (Hendrickx et al., 2013) и другие. Исследования с использованием множественного определения последовательности локусов (MLST) показали, что существует значительная разница в структуре популяции между E. faecalis и E.faecium (Palmer et al., 2014). Филогения E. faecalis не выявила кластеризацию штаммов в соответствии с их источником, например, человеческие, клинические или животные штаммы (Guzman Prieto et al., 2016). Напротив, у E. faecium существуют клональные комплексы высокого риска, которые демонстрируют высокий уровень устойчивости к антибиотикам и в значительной степени связаны с клиническими инфекциями у госпитализированных пациентов (Leavis et al., 2006; Willems et al., 2012 ). Секвенирование генома подтвердило, что большинство клинических изолятов образуют отдельную субпопуляцию E.faecium (Lebreton et al., 2013). Недавно Тедим и др. (2015) изучали популяционную биологию кишечных изолятов Enterococcus от госпитализированных и не госпитализированных лиц в разных возрастных группах. Они обнаружили, что популяций E. faecium различаются по наблюдаемым клональным линиям между госпитализированными пациентами и людьми, проживающими в сообществах. Более того, предыдущая идентификация с помощью полногеномного секвенирования изолятов E. faecium различных госпитальных (A1) и комменсальных (B) клад предполагает, что существует различный эволюционный фон между комменсальными и клиническими изолятами (Palmer et al., 2012). Аналогичным образом Мурузабал-Лекумберри и др. (2015) сообщили о высокой распространенности E. faecalis типа последовательности (ST) 6 (CC2) у пациентов, подвергающихся селективной дезактивации пищеварительного тракта, и указали, что необходимо быстрое обнаружение, чтобы избежать распространения за пределы отделений интенсивной терапии (ОИТ). . Пациенты в отделении интенсивной терапии подвержены высокому риску развития внутрибольничных инфекций, вызванных бактериями с множественной лекарственной устойчивостью, и часто подвергаются сильному селективному давлению антибиотиков (Streit et al., 2004). Несколько исследований показали, что воздействие на пациентов антибиотиков широкого спектра действия в сочетании с длительным пребыванием в больнице может привести к колонизации энтерококками с множественной лекарственной устойчивостью, что приводит к внутрибольничной передаче и инфекции (Austin et al., 1999; Carmeli et al., 2002). Профилактическая терапия избирательной деконтаминации пищеварительной системы (SDD) направлена на предотвращение вторичной инфекции условно-патогенными микроорганизмами, включая Enterobacteriaceae, Staphylococcus aureus и дрожжи, у пациентов в отделении интенсивной терапии и снижение смертности (de Smet et al., 2009). Предыдущие исследования показали, что терапия SDD может способствовать колонизации кишечника энтерококками (Humphreys et al., 1992; de Smet et al., 2009; Benus et al., 2010). Недавний мета-анализ van der Bij et al. (2016) определили уровень антибиотикорезистентности грамположительных кокков в крови и респираторных образцах в 42 голландских отделениях интенсивной терапии в период с 2008 по 2013 год, указав, что профилактическая терапия не была связана с повышением устойчивости грамположительных кокков к антибиотикам.В этом исследовании мы охарактеризовали изолятов Enterococcus , колонизирующих кишечник пациентов ОИТ, получающих терапию SDD, и для более подробной оценки генетического родства изолятов E. faecalis и E. faecium , используя MLST и байесовский анализ Структура населения (BAPS). Кроме того, мы определили носительство генов, кодирующих детерминанты устойчивости к противомикробным препаратам и вирулентности в этой популяции. Пациенты были отобраны в рамках одобренного исследования для определения влияния профилактической антибиотикотерапии на устойчивость к антибиотикам (Buelow et al., 2014). Критерии включения включали пациентов, выписанных из отделения интенсивной терапии, которые получали SDD не менее 96 часов. Критерии исключения включали пребывание в больнице и / или лечение антибиотиками до поступления в ОИТ и прекращение SDD перед выпиской из ОИТ. Все пациенты, включенные в это исследование, были старше 18 лет. Протокол SDD был рассмотрен и одобрен институциональным наблюдательным советом Университетского медицинского центра Утрехта (Утрехт, Нидерланды). Протокол SDD включал устное применение 0.5 г пасты, содержащей 2% тобрамицина, 2% полимиксина E и 2% амфотерицина B, вводить четыре раза в день. Кроме того, 10 мл суспензии, содержащей 80 мг тобрамицина, 100 мг полимиксина E и 500 мг амфотерицина B, вводили через желудочный зонд четыре раза в день, а цефотаксим (4 × 1000 мг) вводили внутривенно в течение первых 4 дней после поступления в ОИТ. . образцов кала были собраны в разные моменты времени во время госпитализации в ОИТ, а также у пяти пациентов после выписки из ОИТ и прекращения SDD.Все образцы были деидентифицированы, получили код образца и впоследствии были классифицированы в соответствии со временем сбора для последующих анализов: пребывание в ОИТ (включая образцы, собранные во время госпитализации в ОИТ на срок до 40 дней, n = 27) и после -ICU (образцы, взятые после выписки из интенсивной терапии и прекращения SDD, n = 7) (Таблица 1). Образцы собирали после дефекации и хранили при 4 ° C от 30 минут до 4 часов. Собирали две аликвоты по 0,5 г фекального материала, одну аликвоту хранили непосредственно при -80 ° C для выделения фекальной ДНК, а другую аликвоту суспендировали в 5 мл 20 мМ аноксического фосфатного буфера (pH 7.0) с 40% глицерина и переносили на -80 ° C для дальнейшего анализа. Таблица 1. Обзор видов Enterococcus , выделенных и охарактеризованных для каждого пациента в разные моменты времени (пребывание в ОИТ и после ОИТ). энтерококков выделяли на желчно-эскулиновом агаре (BEA) (Oxoid B.V., Landsmeer, Нидерланды). Колонии, растущие на среде BEA, были отобраны на основе морфологии колонии (до пяти колоний на чашку) для фенотипической характеристики (Winn et al., 2006). Гемолиз определяли путем культивирования на кровяном агаре с добавлением 5% овечьей крови (Oxoid) после инкубации при 37 ° C в течение 24 часов. Изоляты, которые показали фенотипические различия в моделях устойчивости к антибиотикам (см. Ниже), были отобраны для дальнейшей характеристики. выполняли с использованием протокола для грамположительных бактерий из набора QIAamp ® DNA Mini Kit (Qiagen Benelux B.V., Венло, Нидерланды). ДНК использовали для идентификации изолятов и обнаружения генов устойчивости к антибиотикам и вирулентности с помощью полимеразной цепной реакции (ПЦР), как описано ниже.Кроме того, экстракцию тотальной бактериальной ДНК проводили из 0,5 г фекального материала с использованием модифицированного метода повторного взбивания шариков, описанного ранее (Salonen et al., 2010), и использовали для количественного определения популяции энтерококков, как описано ниже. Полный ген бактериальной 16S рибосомной РНК (рРНК) амплифицировали из геномной ДНК с использованием праймеров T7prom-Bact-27-F и Uni-1492-R, как описано ранее (Rajilić-Stojanović et al., 2009). Амплифицированные фрагменты отбирали для частичного анализа последовательности гена 16S рРНК (~ 800 п.н.) с использованием праймера 16S-1392R 5′-ACGGGCGGTGTGTRC -3 ‘(GATC Biotech, Кельн, Германия). Неполные последовательности гена 16S рРНК изолятов, отнесенных к другим видам Enterococcus , полученные в этом исследовании, были депонированы в GenBank под номерами доступа KX577731, KX577732, KX577733, KX577734. Популяция энтерококков, присутствующая в фекальном материале, была количественно определена с помощью кПЦР с использованием специфичных для энтерококков праймеров, нацеленных на ген 16S рРНК, описанных Matsuda et al.(2009). Стандартная кривая была построена для бактериальной геномной ДНК ( E. faecium E5) с использованием серии 10-кратных разведений (1,0 × 10 1 -1,0 × 10 9 копий ДНК, мкл -1 ). Стандартная кривая имела коэффициент корреляции R = 0,97–0,99 и эффективность усиления между 97,2 и 103,1%. КПЦР выполняли с помощью набора для ПЦР SYBR-Green (Roche Applied Science). Общий реакционный объем составлял 10 мкл: 5 мкл SYBR-Green I, по 0,2 мкл каждого прямого и обратного праймеров, 1.6 мкл стерилизованной воды, свободной от нуклеаз, и 3 мкл экстрагированной ДНК (1 нг / мкл). Программа амплификации включала этап начальной денатурации при 94 ° C в течение 5 минут, за которым следовали 40 циклов денатурации в течение 20 секунд при 94 ° C, отжиг в течение 20 секунд при 60 ° C и удлинение в течение 50 секунд при 72 0 C. Анализ кривой плавления проводили путем медленного нагрева образца от 60 до 95 ° C (0,5 ° C за 15 с) с одновременным контролем флуоресценции. Все реакции проводили в двух экземплярах в 384-луночном планшете для ПЦР, запечатанном оптической герметизирующей лентой (Bio-Rad) на системе обнаружения ПЦР в реальном времени iQ5. Однофакторный дисперсионный анализ ANOVA был использован для статистического анализа, чтобы указать на значимые различия численности энтерококков во время и после терапии SDD, с поправкой Бонферони ( p <0,05) для множественного тестирования. Устойчивость энтерококков к ванкомицину проверяли на агаре Мюллера-Хинтона (MHA) (Oxoid), содержащем 6 мкг / мл ванкомицина. Колонии, растущие на этой среде, были протестированы с помощью E-test (Biomerieux) для определения минимальной ингибирующей концентрации (MIC) ванкомицина в соответствии с рекомендациями CLSI (CLSI, 2013).Кроме того, метод дисковой диффузии использовался для проверки чувствительности к ампициллину (10 мкг) и тетрациклину (30 мкг) (CLSI, 2013). Гены устойчивости к антибиотикам были обнаружены с помощью мультиплексной ПЦР для генов устойчивости к ванкомицину van (A), van (B) и van (C) ( van (C1) — van (C2 ) / ван ( C3 )) (Депардье и др., 2004) и одиночная ПЦР для генов erm (A), erm (B), erm (C) и mef (A) / mef (E) (Zou et al. , 2011). Продукты ПЦР генов mef (A) и mef (E) были выделены рестрикционным анализом BamHI, поскольку только mef (A) несет единственный сайт рестрикции, давая фрагменты длиной 284 и 64 п.н., как описано ранее. (Клаассен и Мутин, 2005). Гены, кодирующие факторы вирулентности, i.е., энтерококковый поверхностный белок ( esp-fm, esp-fs ), вещество агрегации ( asa1 ), цитолизин ( cyl (B)) и гиалорунидаза ( hyl ) были выбраны для обнаружения с помощью ПЦР. как описано ранее (Vankerckhoven et al., 2004; Hällgren et al., 2009). E. faecalis ATCC29212, E. faecium E5 и E. faecalis E507 (Отделение медицинской микробиологии, Утрехтский медицинский центр, UMC, Нидерланды) и E.gallinarum HSIEG1 (van den Bogert et al., 2013) (Лаборатория микробиологии, Университет Вагенингена, Нидерланды) использовали в качестве положительного контроля для выявления генов, кодирующих устойчивость к антибиотикам и фактор вирулентности. Ампликоны визуализировали электрофорезом в агарозном геле. Чтобы установить клональное родство изолятов Enterococcus , мы применили схемы MLST, предложенные Ruiz-Garbajosa et al.(2006) и Homan et al. (2002) или E. faecalis и E. faecium соответственно. сравнивались с опубликованными аллелями, а типы последовательностей (ST) были назначены с использованием базы данных MLST (http://pubmlst.org/efaecium/ и http://pubmlst.org/efaecalis/). Группы BAPS определяли, как описано ранее (Willems et al., 2012). E. faecalis и E. faecium Продукты MLST хранились в базе данных MLST (http://pubmlst.org/efaecium/ и http: // pubmlst.org / efaecalis). Под наблюдением находились девять госпитализированных пациентов в отделениях интенсивной терапии, которым была проведена профилактическая антибактериальная терапия SDD. У этих пациентов было собрано 34 пробы фекалий. Помимо SDD, семи пациентам вводили дополнительные антибиотики для контроля инфекций и / или в качестве средства для ускорения перистальтики желудка во время пребывания в отделении интенсивной терапии (Pilot, 1994; Galligan et al., 2005). Энтерококки были выделены из 23 из 34 образцов фекалий; количество изолятов на одного пациента варьировало от 2 (пациенты 6, 9) до 8 (пациенты 4, 8) (таблица 1). Тридцать шесть изолятов были классифицированы на уровне видов энтерококков с помощью секвенирования гена 16S рРНК и продуктов MLST. Наиболее часто встречающимися видами были E. faecium (23 изолята) и E. faecalis (13 изолятов). Остальные пять изолятов энтерококков, все из которых были выделены только во время фазы после ОИТ (рис. 1, таблица 1), не могли быть однозначно идентифицированы до видового уровня с помощью секвенирования гена 16S рРНК.У шести пациентов, получавших SDD, развились внутрибольничные энтерококковые инфекции во время пребывания в отделении интенсивной терапии (Рисунок 1), в том числе одна плевральная инфекция, вызванная E. faecium , шесть инфекций мочевыводящих путей (два эпизода у одного пациента), вызванные E. faecalis (пять случаев) ) и E. faecium (один случай), и одна инфекция, связанная с катетером центральной линии, вызванная E. faecalis (два эпизода у одного пациента). Однако, к сожалению, соответствующие клинические изоляты не были доступны для дальнейшего анализа. Рисунок 1. Обзор динамики колонизации видами Enterococcus и носительства генов устойчивости к антибиотикам и вирулентности во время и после госпитализации в ОИТ. Черные точки указывают дни, когда во время госпитализации брались образцы кала. Линии прекращения (//) указывают образцы, собранные в период после ОИТ. Различные изолированные виды обозначены точками разного цвета: оранжевыми ( E. faecalis ), зелеными ( E.faecium ), темно-серый ( E.sp ). Изоляты, не связанные с черной точкой, были получены из ближайшего слева образца. Присутствие генов устойчивости к антибиотикам обозначается красными ( erm B) и фиолетовыми точками ( van C1). Факторы вирулентности показаны в семиугольной форме (a- asa 1), (e- esp-fm и esp-fs ), (h- hyl ). Пациенты, у которых развились внутрибольничные инфекции во время ОИТ, остаются с E. faecalis и E.faecium обозначены зеленым ( E. faecium ) и оранжевым ( E. faecalis ) треугольниками. Серые прямоугольники указывают на системные антибиотики, назначаемые по клиническим показаниям в конкретный указанный момент времени (ERY, эритромицин; VAN, ванкомицин; CPR, ципрофлоксацин; CTR, цефтриаксон; CAZ, цефтазидим; CZL, цефазолин; MER, меропенем; FLX, флукоксацилин; AMX, AMX). амоксациллин; CLN, клиндамицин; MTZ, метронидазол; MUP, мупирозин), желтые прямоугольники указывают на системные антибиотики, назначаемые по клиническим показаниям в течение всего пребывания в ОИТ (CRX, цефуроксим; COT, котримоксазол). Количественная оценка популяции энтерококков, основанная на кПЦР, нацеленной на ген 16S рРНК энтерококков, показала значительное увеличение времени от пребывания в ОИТ до пост ОИТ (6,0 × 10 6 по сравнению с 2,0 × 10 7 Log копий ДНК / г кала. ; p <0,05) у семи из 9 пациентов. У пациентов в период госпитализации наблюдались существенные сдвиги в абсолютном количестве копий гена 16S рРНК энтерококка (рис. 2). Рисунок 2. Нацеленная на ген 16S рРНК количественная оценка популяции энтерококков, присутствующих на пациента в образцах, взятых в разные моменты времени [во время интенсивной терапии (D) и после интенсивной терапии (P)], на основе количественной ПЦР, нацеленной на ген 16S рРНК. Все изоляты были чувствительны к ванкомицину (МИК 0,5–2 мкг / мл), за исключением одного изолята, устойчивого к ванкомицину (МИК 16 мкг / мл), тесно связанного с E. gallinarum ( E.sp _3) (99% идентичность нуклеотидов). Устойчивость к ампициллину была обнаружена у 25 из 41 изолята, при этом наибольшая распространенность резистентных штаммов была обнаружена среди изолятов E. faecium [21 (91%) E. faecium , три (23%) E. faecalis ). и один (20%) E.sp ( E.sp _5)]. Устойчивость к тетрациклину была обнаружена у 19 из 41 изолята [9 E. faecalis , семи E. faecium и трех E. spp . ( E.sp _1, E.sp _2, E.sp _4)], большая часть которых была получена во время пребывания в отделении интенсивной терапии и у одного пациента в течение первых 72 часов после поступления. Наличие четырех генов, кодирующих устойчивость к макролид-линкозамид-стрептограмин (MLS), а именно erm (A), erm (B), erm (C) и mef (A) / Гены mef (E), кодирующие переносчик главного фасилитатора суперсемейства (MFS), придающий устойчивость к эритромицину, анализировали с помощью детекции на основе ПЦР.Наши результаты выявили наличие гена erm (B) в 30 из 41 изолята энтерококков, полученных за весь период исследования. Никаких других генов устойчивости к MLS B или генов переносчиков MFS обнаружено не было. Из группы протестированных генов устойчивости к ванкомицину ген van (C1) был идентифицирован в единственном изоляте, который также оказался устойчивым к ванкомицину (рисунок 1, таблица 1). Были обнаружены три из четырех целевых генов, кодирующих факторы вирулентности энтерококков.Ген asa1 часто присутствовал в изолятах E. faecalis ( n = 7/13), тогда как ген esp чаще обнаруживался в изолятах E. faecium ( n = 17/23). ). Ген esp также присутствовал в двух E. sp . изолирует. Наконец, ген hyl был обнаружен после ICU в единственном изоляте E. faecium и в единственном изоляте, близком к E. gallinarum (идентичность нуклеотидов 99%).Все изоляты показали альфа-гемолиз в кровяном агаре. Ген cyl (B), который может вызывать бета-гемолитический фенотип (Semedo et al., 2003; Abriouel et al., 2008), не был обнаружен ни в одном из изолятов (рис. 1). Используя MLST, мы установили клональное родство всех изолятов E. faecium и E. faecalis , полученных в этом исследовании. Всего среди E.faecium (рисунок 3, таблица 2). Дальнейший анализ их популяционной структуры показал, что эти ST принадлежали к трем (под) группам BAPS, которые ранее были связаны с госпитализированными пациентами (Willems et al., 2012). Большинство ST принадлежало к группе 2.1a BAPS (18 изолятов), и 15 из них были устойчивы к ампициллину (ST117 n = 12, ST78 n = 2 и ST730 n = 1). Другие наблюдаемые подгруппы включали BAPS 1.2 (2 изолята), а также BAPS 3.3a2 (3 изолята). У четырех пациентов мы выявили два или более разных ST у одного и того же пациента во время госпитализации (рис. 3). Рис. 3. Типы последовательностей (ST), идентифицированные для каждого образца, на пациента во время и после SDD-терапии. Разноцветные точки обозначают вид: оранжевый ( E. faecalis ), зеленый ( E. faecium ). Цифры указывают типы последовательностей. Черные точки указывают момент времени (дни), когда образцы были взяты во время госпитализации.Если было выделено и охарактеризовано несколько штаммов, они показаны справа от каждой указанной временной точки. Таблица 2. Анализ типа последовательности (ST) и BAPS изолятов Enterococcus faecalis и Enterococcus faecium . Среди изолятов E. faecalis мы идентифицировали три ST (ST6, ST81 и ST16), которые ранее были обнаружены среди госпитализированных пациентов (Willems et al., 2012), а также новый ST (ST589), представленный четырьмя изолятами (рис. 3, табл. 2).Все изоляты, принадлежащие к ST589, были чувствительны к ампициллину и были получены от одного пациента из образцов, взятых на протяжении всего исследования. Три из этих четырех изолятов ST589 несли ген ermB . Из группы изолятов E. faecalis , принадлежащих к ST6 ( n = 6), три несли гены ermB, asa и esp и были чувствительны к ампициллину, тогда как другие три изолята показали устойчивость к ампициллину. . Кластерный анализ BAPS разделил E.faecalis разделены на группы BAPS 1 (восемь изолятов) и 3 (один изолят) (таблица 2). В отличие от ситуации с изолятами E. faecium , мы не обнаружили одновременного присутствия нескольких ST E. faecalis или клональной замены с течением времени у отдельных пациентов. В настоящем исследовании мы охарактеризовали группу из видов Enterococcus , выделенных из образцов фекалий пациентов интенсивной терапии, получавших терапию SDD.Мы наблюдали пул различных видов энтерококков, среди которых E. faecium и E. faecalis — наиболее распространенные виды, которые ранее были идентифицированы как важные патогены человека, связанные с внутрибольничными инфекциями (Cattaneo et al., 2010). У трех пациентов эти два вида были обнаружены в образцах, собранных в течение первых 72 часов, что может свидетельствовать о том, что эти пациенты были колонизированы восстановленными штаммами до поступления в ОИТ. Это согласуется с предыдущими исследованиями, недавно проведенными Гусманом Прието и соавторами, которые показали, что энтерококки присутствуют как у здоровых людей, так и в окружающей среде, и что количество генов устойчивости и мобильных элементов быстро увеличивается и способствует колонизации и колонизации. последующая инфекция у госпитализированных пациентов (Guzman Prieto et al., 2016). Клинические изоляты, вызывающие внутрибольничные инфекции у пациентов, включенных в наше исследование, не были доступны для дальнейшего анализа, что ограничивало возможность уточнить, были ли инфекции, происходящие от изолятов, колонизирующих пациента в этот период, и соответствуют ли изоляты, полученные из фекального материала, к внутрибольничному приобретению или отбору штаммов, которые присутствовали в микробиоте кишечника этих пациентов до госпитализации. Другие изоляты энтерококков не удалось идентифицировать до уровня вида ( n = 5), хотя следует отметить, что они были обнаружены только после ОИТ.Одно из возможных объяснений может заключаться в том, что из-за прекращения терапии SDD и, таким образом, снижения соответствующего селективного давления антибиотиков во время пребывания в отделении интенсивной терапии, другие виды, кроме E. faecalis и E. faecium , смогли колонизировать кишечник. . Из этих изолятов три изолята были тесно связаны с видами E. gallinarum и E. avium . Оба вида были идентифицированы в образцах фекалий животных и здоровых людей (Layton et al., 2010; Silva et al., 2011) и нечасто связаны с энтерококковыми инфекциями человека (Tan et al., 2010; Varun et al., 2016). Мы не можем исключить, что эти другие виды присутствовали в образцах фекалий, взятых в более ранние временные точки при очень небольшом размере популяции, и, таким образом, избежали обнаружения с помощью методов, используемых в этом исследовании. Кроме того, мы смогли выделить более одного вида энтерококков на образец у пяти из девяти пациентов. Это подчеркивает важность анализа нескольких колоний на культуру для адекватного анализа разнообразия популяции энтерококков.Более того, анализ КПЦР показал увеличение количества энтерококков у семи из девяти пациентов. Этот сдвиг может быть связан с приемом антибиотиков и изменениями в составе микробиоты кишечника из-за селективного давления антибиотиков. Это соответствует предыдущим исследованиям, основанным на анализе количественной ПЦР, которые показали, что популяция энтерококков увеличилась у госпитализированных пациентов, получающих антибиотики, по сравнению с госпитализированными пациентами без антибиотиков и здоровыми добровольцами (Bartosch et al., 2004). Колонизация устойчивым к ампициллину Enterococcus faecium (ARE) часто связана с предыдущим воздействием селективных антибиотиков, а устойчивость к ампициллину является специфической чертой для нозокомиальных изолятов (de Regt et al., 2012). В нашем исследовании самая высокая распространенность устойчивости к ампициллину была обнаружена у изолятов E. faecium по сравнению с изолятами E. faecium , не устойчивыми к ампициллину. Об аналогичных результатах сообщил Руис-Гарбахоса П., и другие. (2012); это указывает на то, что это увеличенное население наиболее существенно способствует передаче и распространению энтерококковой устойчивости в отделениях интенсивной терапии. В нашем исследовании устойчивость к ванкомицину не была обнаружена среди изолятов E. faecalis и E. faecium . Это соответствует ранее зарегистрированной распространенности (<1% для E. faecium и E. faecalis ) устойчивости к ванкомицину среди энтерококков при клинических инфекциях в Нидерландах, как показано в Европейской системе надзора за устойчивостью к противомикробным препаратам ( EARSS) (ecdc.europa.eu/en/activities/surveillance/EARS-Net). Единственный устойчивый к ванкомицину изолят был идентифицирован как близкородственный E. gallinarum (МИК ванкомицина 16 мкг / мл), который несет ген van (C1), который в природе присутствует у этого вида (Toye et al. , 1997). Устойчивость к тетрациклину была обнаружена у 46% из всех 41 изолята ( n = 19) и преимущественно у изолятов E. faecalis , что соответствует результатам предыдущих исследований (Templer et al., 2008). Более того, присутствие гена устойчивости к макролидам erm (B) было обнаружено у 30 из этих изолятов (73%). Однако мы не можем исключить, что в этих изолятах присутствовали и другие гены устойчивости к эритромицину. Хотя в текущем исследовании не наблюдались устойчивые к ванкомицину популяции E. faecalis и E. faecium , наши результаты подчеркивают важность проведения периодического наблюдения во время терапии SDD у пациентов в отделении интенсивной терапии для выявления устойчивых Enterococcus spp.штаммы и предотвратить их распространение в качестве профилактической меры инфекционного контроля. Более того, мы заметили, что пул различных видов энтерококков, идентифицированных в этом исследовании, также содержит множество генов вирулентности, которые могут способствовать развитию инфекций у пациентов с ослабленным иммунитетом. Ген esp был наиболее распространенной детерминантой вирулентности, обнаруженной на протяжении всего периода исследования, за ним следует ген asa1 , обнаруженный в основном во время пребывания в отделении интенсивной терапии, включая два E.faecium и семь изолятов E. faecalis и один изолят, тесно связанный с E. avium . О подобных результатах сообщалось ранее (Billström et al., 2008; Hällgren et al., 2009; Sharifi et al., 2013). Кроме того, мы обнаружили присутствие гена hyl в одном изоляте E. faecium и одном изоляте, тесно связанном с E. gallinarum , только после ОИТ. Однако следует отметить, что ген hyl идентифицирован не только у E.faecium и E. faecalis , но также и у E. casseliflavus , E. mundtii и E. durans , выделенных из пищевых продуктов (Триведи и др., 2011), что показывает, что ген hyl может присутствовать в разновидности Enterococcus spp. Кроме того, мы не можем исключить, что полученные изоляты содержат другие гены вирулентности, которые не были затронуты в настоящем исследовании. Наконец, клональные отношения и структура популяции (группы BAP) обнаружены у E.faecium и E. faecalis изолятов показали, что подавляющее большинство наших изолятов E. faecium сгруппированы в подгруппы 2.1a и 3.3a2, представляющие отдельные больничные клоны, принадлежащие кладе A1, которая содержит большинство внутрибольничных изолятов E. faecium . (Willems et al., 2012). Эти группы BAPS нечасты у здоровых людей (de Regt et al., 2012), что позволяет предположить, что эти изоляты были приобретены во время госпитализации. Мост E.faecalis (62%) сгруппированы в группу BAPS 1, большинство из которых принадлежало к ST 6, который ранее был обнаружен как у госпитализированных, так и у негоспитализированных пациентов (Willems et al., 2012; Tedim et al., 2015). В нашем исследовании мы наблюдали одновременное присутствие ST и клональную замену с течением времени среди изолятов E. faecium во время пребывания в ОИТ, тогда как в случае E. faecalis это не наблюдалось. Однако на основании текущих данных неясно, наблюдалась ли клональная замена у E.faecium был вызван нозокомиальными штаммами или популяциями, которые ранее присутствовали в более низкой численности. Для проверки этой гипотезы потребуются дальнейшие исследования. Распространенность Enterococcus у госпитализированных пациентов в ОИТ в сочетании с носительством генов устойчивости к антибиотикам и вирулентности, описанных в этом исследовании, подчеркивает важность этой группы организмов как потенциальной причины внутрибольничных инфекций у тяжелобольных пациентов. Особое внимание необходимо уделять пациентам интенсивной терапии во время терапии SDD, с особым акцентом на усиление колонизации энтерококками даже в неэндемичных странах, учитывая, что при терапии SDD популяция энтерококков не является целевой группой.Было показано, что SDD не только снижает смертность и заболеваемость, но также вызывает изменения в составе кишечной микробиоты пациентов (Benus et al., 2010; Buelow et al., 2014). Здесь мы показали, что это может увеличить распространенность и степень колонизации энтерококками и дать представление о разнообразии штаммов энтерококков, которые колонизируют этих пациентов. TdJBG и PP: разработали и провели эксперименты, проанализировали и интерпретировали данные и написали статью.RW, JT и WvS: провели анализ MLST и критически пересмотрели работу с точки зрения интеллектуального содержания. HS и MWJvP: курировали проект, внесли существенный вклад в его критический пересмотр и окончательное утверждение версии, которая будет опубликована. Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов. Это исследование было поддержано Нидерландской организацией исследований и разработок в области здравоохранения ZonMw (приоритетная лекарственная устойчивость к противомикробным препаратам; грант 205100015) и Седьмой рамочной программой Европейского союза (FP7-HEALTH-2011-single-stage) «Развитие и передача устойчивости к антибиотикам »(EvoTAR) по грантовому соглашению № 282004.Мы благодарны Тому ван ден Богерту и Ане Софии Тедим Педроса за их советы и предложения. Абриуэль, Х., Омар, Н. Б., Молинос, А. К., Лопес, Р. Л., Гранде, М. Дж., Мартинес-Вьедма, П. и др. (2008). Сравнительный анализ генетического разнообразия и встречаемости факторов вирулентности и устойчивости к антибиотикам среди популяций энтерококков из сырых фруктов и овощей, воды и почвы, а также клинических образцов. Внутр. J. Food Microbiol. 123, 38–49.DOI: 10.1016 / j.ijfoodmicro.2007.11.067 PubMed Аннотация | CrossRef Полный текст | Google Scholar Остин Д. Дж., Бонтен М. Дж., Вайнштейн Р. А., Слотер С. и Андерсон Р. М. (1999). Устойчивые к ванкомицину энтерококки в больницах интенсивной терапии: динамика передачи, стойкость и влияние программ инфекционного контроля. Proc. Natl. Акад. Sci. США 96, 6908–6913. DOI: 10.1073 / pnas.96.12.6908 PubMed Аннотация | CrossRef Полный текст | Google Scholar Бартош, С., Файт, А., Макфарлейн, Г. Т., и Мак-Мердо, М. Е. Т. (2004). Характеристика бактериальных сообществ в фекалиях здоровых пожилых добровольцев и госпитализированных пожилых пациентов с помощью ПЦР в реальном времени и влияние лечения антибиотиками на фекальную микробиоту. Заявл. Environ. Microbiol. 70, 3575–3581. DOI: 10.1128 / AEM.70.6.3575-3581.2004 PubMed Аннотация | CrossRef Полный текст | Google Scholar Бенус, Р. Ф., Хармсен, Х. Дж., Веллинг, Г. У., Спанджерсберг, Р., Зейлстра, Дж.Г., Дегенер, Дж. Э. и др. (2010). Влияние деконтаминации пищеварительной системы и ротоглотки на микробиоту кишечника у пациентов интенсивной терапии. Intensive Care Med. 36, 1394–1402. DOI: 10.1007 / s00134-010-1826-4 PubMed Аннотация | CrossRef Полный текст | Google Scholar Бильстрём, Х., Салливан, А., и Лунд, Б. (2008). Перекрестная передача клинического Enterococcus faecium в отношении esp и устойчивости к антибиотикам. J. Appl. Microbiol. 105, 2115–2122.DOI: 10.1111 / j.1365-2672.2008.03983.x PubMed Аннотация | CrossRef Полный текст | Google Scholar Бюлоу Э., Белло Гонзз Т. д. J., Fuentes, S., de Steenhuijsen Piters, W. A. A., Lahti, L., Bayjanov, J. R., et al. (2017). Сравнительная микробиота кишечника и профили резистома у пациентов интенсивной терапии, получающих селективную деконтаминацию пищеварительного тракта, и у здоровых субъектов. Микробиом 5:88. DOI: 10.1186 / s40168-017-0309-z PubMed Аннотация | CrossRef Полный текст | Google Scholar Бюлоу, Э., Gonzalez, T. B., Versluis, D., Oostdijk, E. A., Ogilvie, L.A., van Mourik, M. S., et al. (2014). Влияние избирательной деконтаминации пищеварительной системы (SDD) на резистом кишечника. J. Antimicrob. Chemother. 69, 2215–2223. DOI: 10.1093 / jac / dku092 PubMed Аннотация | CrossRef Полный текст | Google Scholar Кармели Ю., Элиопулос Г. М. и Самор М. Х. (2002). Предшествующее лечение различными антибиотиками как фактор риска развития резистентности к ванкомицину Enterococcus . Emerg. Заразить. Дис. 8, 802–807. DOI: 10.3201 / eid0805.010418 PubMed Аннотация | CrossRef Полный текст | Google Scholar Каттанео, К., Касари, С., Бракки, Ф., Синьорини, Л., Равиццола, Г., Борленги, Э. и др. (2010). Недавнее увеличение количества энтерококков, стрептококков viridans, Pseudomonas spp . и полирезистентные штаммы среди гематологических больных, что отрицательно сказывается на исходе. Результаты трехлетнего эпиднадзора в одном учреждении. Сканд.J. Infect. Дис. 42, 324–332. DOI: 10.3109 / 003655406569 PubMed Аннотация | CrossRef Полный текст | Google Scholar CLSI (2013). Стандарты эффективности испытаний на чувствительность к противомикробным препаратам . 22-е информационное приложение. Уэйн, Пенсильвания: CLSI. де Регт, М. Дж., Ван Шайк, В., ван Луит-Асбрук, М., Деккер, Х. А., ван Дуйкерен, Э., Конинг, К. Дж. И др. (2012). Больничные и общественные, устойчивые к ампициллину Enterococcus faecium эволюционно тесно связаны, но диверсифицировались за счет адаптации к нише. PLoS ONE 7: e30319. DOI: 10.1371 / journal.pone.0030319. PubMed Аннотация | CrossRef Полный текст | Google Scholar де Смет, А. М., Клюйтманс, Дж. А., Купер, Б. С., Маскини, Э. М., Бенус, Р. Ф., ван дер Верф, Т. С. и др. (2009). Обеззараживание пищеварительного тракта и ротоглотки у пациентов интенсивной терапии. N. Engl. J. Med. 360, 20–31. DOI: 10.1056 / NEJMoa0800394 PubMed Аннотация | CrossRef Полный текст | Google Scholar Депардье, Ф., Перишон, Б., и Курвалин, П. (2004). Обнаружение алфавита Ван и идентификация энтерококков и стафилококков на уровне видов с помощью мультиплексной ПЦР. J. Clin. Microbiol. 42, 5857–5860. DOI: 10.1128 / JCM.42.12.5857-5860.2004 PubMed Аннотация | CrossRef Полный текст | Google Scholar Галли Д. и Вирт Р. (1991). Сравнительный анализ плазмид половых феромонов Enterococcus faecalis идентифицирует единственную гомологичную область ДНК, которая кодирует агрегационное вещество. Дж. Бактериол . 173, 3029–3033. DOI: 10.1128 / jb.173.9.3029-3033.1991 PubMed Аннотация | CrossRef Полный текст | Google Scholar Галлиган Дж. Дж. И Ваннер С. (2005). Фундаментальная и клиническая фармакология новых средств, стимулирующих моторику. Нейрогастроэнтерол. Мотил. 17, 643–653. DOI: 10.1111 / j.1365-2982.2005.00675.x PubMed Аннотация | CrossRef Полный текст | Google Scholar Гусман Прието, А. М., ван Шайк, В., Роджерс, М. Р. К., Coque, T. M., Baquero, F., Corander, J., et al. (2016). Глобальное появление и распространение энтерококков как внутрибольничных патогенов: атака на клонов? Фронт. Microbiol. 7: 788. DOI: 10.3389 / fmicb.2016.00788 PubMed Аннотация | CrossRef Полный текст | Google Scholar Хеллгрен, А., Клаессон, К., Саиди, Б., Монштейн, Х. Дж., Ханбергер, Х., и Нильссон, Л. Е. (2009). Молекулярное определение вещества агрегации, энтерококкового поверхностного белка и генов цитолизина и in vitro адгезии к мочевым катетерам Enterococcus faecalis и E.faecium клинического происхождения. Внутр. J.Med. Microbiol. 299, 323–332. DOI: 10.1016 / j.ijmm.2008.10.001 PubMed Аннотация | CrossRef Полный текст | Google Scholar Хендрикс, А. П., ван Шайк, В., и Виллемс, Р. Дж. (2013). Архитектура клеточной стенки Enterococcus faecium : от устойчивости к патогенезу. Future Microbiol. 8, 993–1010. DOI: 10.2217 / fmb.13.66 PubMed Аннотация | CrossRef Полный текст | Google Scholar Homan, W.L., Tribe, D., Poznanski, S., Li, M., Hogg, G., Spalburg, E., et al. (2002). Схема мультилокусного типирования последовательности для Enterococcus faecium . J. Clin. Microbiol. 40, 1963–1971. DOI: 10.1128 / JCM.40.6.1963-1971.2002 PubMed Аннотация | CrossRef Полный текст | Google Scholar Хамфрис, Х., Уинтер, Р., и Пик, А. (1992). Влияние избирательной дезактивации пищеварительного тракта на колонизацию желудочно-кишечного тракта энтерококками у пациентов с ITU. Intensive Care Med. 18, 459–463. DOI: 10.1007 / BF01708581 PubMed Аннотация | CrossRef Полный текст | Google Scholar Джетт, Б. Д., Дженсен, Х. Г., Нордквист, Р. Э. и Гилмор, М. С. (1992). Вклад цитолизина, кодируемого pAD1, в тяжесть экспериментального эндофтальмита Enterococcus faecalis . Заражение. Иммунная . 60, 2445–2452. Google Scholar Клаассен, К. Х. У., и Мутин, Дж. У. (2005). Молекулярное обнаружение гена оттока макролидов: различать или не различать mef (A) и mef ( E). Антимикробный. Агенты Chemother. 49, 1271–1278. DOI: 10.1128 / AAC.49.4.1271-1278.2005 PubMed Аннотация | CrossRef Полный текст | Google Scholar Klare, I., Konstabel, C., Mueller-Bertling, S., Werner, G., Strommenger, B., Kettlitz, C., et al. (2005). Распространение устойчивого к ампициллину / ванкомицину Enterococcus faecium эпидемически-вирулентного клонального комплекса-17, несущего гены esp и hyl , в больницах Германии. Eur. Дж.Clin. Microbiol. Заразить. Дис. 24, 815–825. DOI: 10.1007 / s10096-005-0056-0 PubMed Аннотация | CrossRef Полный текст | Google Scholar Кляйн, Г. (2003). Таксономия, экология и устойчивость к антибиотикам энтерококков из пищевых продуктов и желудочно-кишечного тракта. Внутр. J. Food Microbiol. 88, 123–131. DOI: 10.1016 / S0168-1605 (03) 00175-2 PubMed Аннотация | CrossRef Полный текст | Google Scholar Лаверде Гомес, Дж. А., Хендрикс, А. П., Виллемс, Р.J., Top, J., Sava, I., Huebner, J., et al. (2011). Внутри- и межвидовой геномный перенос острова патогенности Enterococcus faecalis . PLoS ONE 6: e16720. DOI: 10.1371 / journal.pone.0016720 PubMed Аннотация | CrossRef Полный текст | Google Scholar Лейтон, Б. А., Уолтерс, С. П., Лам, Л. Х., и Бём, А. Б. (2010). Enterococcus Распределение видов среди людей и животных-хозяев с использованием мультиплексной ПЦР. J. Appl. Microbiol. 109, 539–547. DOI: 10.1111 / j.1365-2672.2010.04675.x. PubMed Аннотация | CrossRef Полный текст | Google Scholar Ливис, Х. Л., Бонтен, М. Дж., И Виллемс, Р. Дж. (2006). Выявление клональных комплексов энтерококков высокого риска: глобальная дисперсия и устойчивость к антибиотикам. Curr. Opin. Microbiol. 9, 454–460. DOI: 10.1016 / j.mib.2006.07.001 PubMed Аннотация | CrossRef Полный текст | Google Scholar Лебретон, Ф., ван Шайк, В., Макгуайр, А.М., Годфри П., Григгс А., Мазумдар В. и др. (2013). Возникновение эпидемического штамма Enterococcus faecium с множественной лекарственной устойчивостью от штаммов животных и комменсалов. MBio 20, 1–10. DOI: 10.1128 / mBio.00534-13 CrossRef Полный текст | Google Scholar Мацуда, К., Цудзи, Х., Асахара, Ю., Мацумото, К., Такада, Т., и Номото, К. (2009). Создание аналитической системы для фекальных микробов человека, основанной на количественном нацеливании на многокопийные молекулы рРНК с помощью обратной транскрипции. Заявл. Environ. Microbiol. 75, 1961–1969. DOI: 10.1128 / AEM.01843-08 PubMed Аннотация | CrossRef Полный текст | Google Scholar Мурузабал-Лекумберри, И., Гирбау, К., Канут, А., Алонсо, Р., и Фернандес-Асторга, А. (2015). Распространение клона типа 6 (CC2) последовательности Enterococcus faecalis у пациентов, подвергающихся селективной дезактивации пищеварительного тракта. APMIS 123, 245–251. DOI: 10.1111 / apm.12336 PubMed Аннотация | CrossRef Полный текст | Google Scholar Палмер, К.Л., Годфри, П., Григгс, А., Кос, В. Н., Цукер, Дж., Дежарден, К. и др. (2012). Сравнительная геномика энтерококков: вариация Enterococcus faecalis , структура клады E. faecium и определяющие характеристики E. gallinarum и E. casseliflavus . MBio 3: e00318-11. DOI: 10.1128 / mBio.00318-11 PubMed Аннотация | CrossRef Полный текст | Google Scholar Палмер, К. Л., ван Шайк, В., Виллемс, Р. Дж.Л., Гилмор М. С. и Enterococcal Genomics (2014). Энтерококки: от знакомых до основных причин лекарственно-устойчивой инфекции [Интернет] . Бостон, Массачусетс: Массачусетский глазной и ушной лазарет. Google Scholar Rajilić-Stojanović, M., Heilig, H., Molenaar, D., Kajander, K., Surakka, A., Smidt, H., et al. (2009). Разработка и применение чипа кишечного тракта человека, филогенетического микрочипа: анализ универсально консервативных филотипов в многочисленной микробиоте молодых и пожилых людей. Environ. Microbiol. 11, 1736–1751. DOI: 10.1111 / j.1462-2920.2009.01900.x PubMed Аннотация | CrossRef Полный текст | Google Scholar Руис-Гарбахоса, П., Бонтен, М. Дж., Робинсон, Д. А., Топ, Дж., Наллапаредди, С. Р., Торрес, К. и др. (2006). Схема мультилокусного типирования последовательности для Enterococcus faecalis выявляет адаптированные к больнице генетические комплексы на фоне высокой скорости рекомбинации. J. Clin. Microbiol. 44, 2220–2228. DOI: 10.1128 / JCM.02596-05 PubMed Аннотация | CrossRef Полный текст | Google Scholar Руис-Гарбахоса, П., де Регт, М., Бонтен, М., Бакеро, Ф., Коке, Т. М., Кантон, Р. и др. (2012). Колонизация фекалий высокой плотности Enterococcus faecium у госпитализированных пациентов связана с наличием поликлонального подкластера CC17. Eur. J. Clin. Microbiol. Заразить. Дис. 31, 519–522. DOI: 10.1007 / s10096-011-1342-7 PubMed Аннотация | CrossRef Полный текст | Google Scholar Салонен, А., Никкила, Дж., Яланка-Туовинен, Дж., Иммонен, О., Райилич-Стоянович, М., Кекконен, Р.А., и др. (2010). Сравнительный анализ методов выделения фекальной ДНК с филогенетическим микрочипом: эффективное восстановление бактериальной и архейной ДНК с помощью механического лизиса клеток. J. Microbiol. Методы 81, 127–134. DOI: 10.1016 / j.mimet.2010.02.007 PubMed Аннотация | CrossRef Полный текст | Google Scholar Семедо, Т., Алмейда Сантос, М., Мартинс, П., Сильва Лопес, М. Ф., Фигейредо Маркес, Дж.J., Tenreiro, R., et al. (2003). Сравнительное исследование с использованием типовых штаммов, клинических и пищевых изолятов для изучения гемолитической активности и наличия цил оперона в энтерококках. J. Clin. Microbiol. 41, 2569–2576. DOI: 10.1128 / JCM.41.6.2569-2576.2003 PubMed Аннотация | CrossRef Полный текст | Google Scholar Сгир, А., Грамет, Г., Суау, А., Виолайн, Р., Покхарт, П., и Дор, Дж. (2000). Количественная оценка бактериальных групп в фекальной флоре человека путем гибридизации олигонуклеотидного зонда. Заявл. Environ. Microbiol. 66, 2263–2266. DOI: 10.1128 / AEM.66.5.2263-2266.2000 PubMed Аннотация | CrossRef Полный текст | Google Scholar Шарифи Ю., Хасани А., Готаслоу Р., Нагили Б., Агазаде М., Милани М. и др. (2013). Вирулентность и устойчивость к противомикробным препаратам энтерококков, выделенных при инфекциях мочевыводящих путей. Adv. Pharm. Бык. 3, 197–201. DOI: 10.5681 / apb.2013.032 PubMed Аннотация | CrossRef Полный текст | Google Scholar Силва, Н., Игрехас, Г., и Гонсалвес, А. (2011). Комменсальные кишечные бактерии: распространение видов Enterococcus и преобладание видов Escherichia coli пилогенетических групп у животных и людей в Португалии. Ann. Microbiol. 62, 449–459. DOI: 10.1007 / s13213-011-0308-4 CrossRef Полный текст | Google Scholar Streit, J. M., Jones, R. N., Sader, H. S., and Fritsche, T. R. (2004). Оценка встречаемости патогенов и профилей резистентности среди инфицированных пациентов в отделении интенсивной терапии: отчет программы SENTRY Antimicrobial Surveillance Programme (Северная Америка, 2001). Внутр. J. Antimicrob. Агенты 24, 111–118. DOI: 10.1016 / j.ijantimicag.2003.12.019 PubMed Аннотация | CrossRef Полный текст | Google Scholar Tan, C.K., Lai, C.C., Wang, J.Y., Lin, S.H., Liao, C.H., Huang, Y.T., et al. (2010). Бактериемия, вызванная non-faecalis и non-faecium Enterococcus видов в Медицинском центре на Тайване, 2000–2008 гг. J. Infect. 61, 34–43. DOI: 10.1016 / j.jinf.2010.04.007 PubMed Аннотация | CrossRef Полный текст | Google Scholar Тедим, А.П., Руис-Гарбахоса, П., Корандер, Дж., Родригес, К. М., Кантон, Р., Виллемс, Р. Дж. И др. (2015). Популяционная биология кишечных изолятов Enterococcus от госпитализированных и не госпитализированных лиц в разных возрастных группах. Заявл. Environ. Microbiol. 81, 1820–1831. DOI: 10.1128 / AEM.03661-14 PubMed Аннотация | CrossRef Полный текст | Google Scholar Темплер, С. П., Ронер, П., Баумгартнер, А. (2008). Связь изолятов Enterococcus faecalis и Enterococcus faecium из пищевых продуктов и клинических образцов. J. Food Prot. 71, 2100–2104. DOI: 10.4315 / 0362-028X-71.10.2100 PubMed Аннотация | CrossRef Полный текст | Google Scholar Тойе Б., Шимански Дж., Бобровска М., Вудс В. и Рамотар К. (1997). Клиническое и эпидемиологическое значение энтерококков, внутренне резистентных к ванкомицину (обладающих генотипом van C). J. Clin. Microbiol. 35, 3166–3170. Google Scholar van den Bogert, B., Boekhorst, J., Смид, Э. Дж., Зетендал, Э. Г., и Клеребезем, М. (2013). Проект последовательности генома Enterococcus sp. штамм HSIEG1, выделенный из тонкого кишечника человека. Genome Announc. 1, 1–2. DOI: 10.1128 / genomeA.01013-13 PubMed Аннотация | CrossRef Полный текст | Google Scholar ван дер Бий, А. К., Френц, Д., и Бонтен, М. (2016). Грамположительные кокки в голландских отделениях интенсивной терапии с избирательной деконтаминацией ротоглотки и пищеварительного тракта и без: ретроспективный анализ базы данных. J. Antimicrob. Chemother. 71, 816–820. DOI: 10.1093 / jac / dkv396 PubMed Аннотация | CrossRef Полный текст | Google Scholar Vankerckhoven, V., Van Autgaerden, T., VAel, C., Lammens, C., Chapelle, S., Rossi, R., et al. (2004). Разработка мультиплексной ПЦР для обнаружения генов asa 1, gel E, cyl A, esp и hyl в энтерококках и исследование детерминант вирулентности среди изолятов European Hospital изолятов Enterococcus faecium . J. Clin. Microbiol. 42, 4473–4479. DOI: 10.1128 / JCM.42.10.4473-4479.2004 PubMed Аннотация | CrossRef Полный текст | Google Scholar Варун, Г., Динеш, К., Раджендра, К., Пурва, М., и Сарман, С. (2016). Внебольничные энтерококковые инфекции мочевыводящих путей и профиль устойчивости к антибиотикам в Северной Индии. J. Lab. Phys. 8, 50–54. DOI: 10.4103 / 0974-2727.176237 CrossRef Полный текст | Google Scholar Виллемс, Р. Дж., Топ, Дж., van Schaik, W., Leavis, H., Bonten, M., Sirén, J., et al. (2012). Ограниченный поток генов среди госпитальных субпопуляций Enterococcus faecium . MBio 3, 1–10. DOI: 10.1128 / mBio.00151-12 PubMed Аннотация | CrossRef Полный текст | Google Scholar Winn, C. W., Allen, S. D., Janda, W. M., Koneman, E. W., Procop, G. W., Schreckenberger, P. C., et al. (2006). «Грамположительные кокки. Часть II: Стрептококки, энтерококки и «подобные стрептококкам» бактерии », в Атлас цветов Конемана и учебник по диагностической микробиологии, 6-е изд., Изд. , изд. J.Б. Липпинкотт (Нью-Йорк, Нью-Йорк: Липпинкотт Уильямс и Уилкинс), 697–733. Zou, L. K., Wang, H. N., Zeng, B., Li, J. N., Li, X. T., Zhang, A. Y., et al. (2011). Гены устойчивости к эритромицину и вирулентности у Enterococcus faecalis свиней в Китае. New Microbiol. 34, 73–80. PubMed Аннотация | Google Scholar BLAST atlas
Clusters of Orthologous Groups (COGs)
Мультилокусное типирование последовательностей (MLST)
Гены вирулентности
Гены устойчивости к антибиотикам
Мобильные генетические элементы
Бактериофаги
CRISPR-Cas
Вторичные метаболиты
Фекальные стрептококки (энтерококки). — IVAMI
Фекальные стрептококки (энтерококки). — ИВАМИ
Информация 2011-04-29 ..
Enterococcus faecalis, E. faecium, E. durans и E. hirae в воде обнаруживаются и количественно определяются методами, описанными в ISO 7899-2: .. 2001 (Определение качества воды и подсчет кишечных энтерококков, часть 2: Метод мембранной фильтрации). Кроме того, они могут иногда определять другие виды Enterococcus и Streptococcus (особенно S.bovis и S. equinus). Эти виды Streptococcus долго выживают в воде и вряд ли могут быть определены количественно.
При анализе воды энтерококки можно рассматривать как индикаторы фекального загрязнения. Однако полезно отметить, что некоторые энтерококки, обнаруженные в воде, могут иногда поступать из других мест обитания.
Стандарт ISO 7899-2: 2001 определяет метод обнаружения и подсчета кишечных энтерококков в воде с помощью мембранной фильтрации.Это правило особенно подходит для анализа питьевой воды, воды плавательных бассейнов и другой чистой или дезинфицированной воды. В любом случае, этот метод можно применять ко всем типам вод, за исключением тех, которые содержат большое количество взвешенных веществ или мешающих микробов. Он особенно подходит для исследования больших объемов воды с низким содержанием кишечных энтерококков.
Получение результатов
Минимум, необходимый для перевозки сельскохозяйственных культур (обычно от 48 до 72 часов).
Форма с характеристиками продукта и переменными для тестирования
Если вы подаете заявку на проведение тестов с продуктом, вы должны отправить соответствующую заполненную форму, в которой указаны характеристики продукта и переменные в выбранном вами случае.
Требуемый объем воды составляет 100 мл, за исключением бутилированной воды, подлежащей фильтрации 250 мл
Сохранение и транспортировка образца:
Охлажденный (предпочтительно) в течение максимального времени 24 часа.
Стоимость теста: Проконсультируйтесь по адресу [email protected] ПРИМЕЧАНИЕ! Этот сайт использует файлы cookie и аналогичные технологии.
границ | Характеристика изолятов энтерококка, колонизирующих кишечник у пациентов отделения интенсивной терапии, получающих селективную деконтаминацию пищеварительного тракта
Введение
Материалы и методы
Отбор пациентов
Сбор образцов
Условия бактериальной культуры и начальная характеристика
Идентификация и классификация изолятов
Количественное определение популяции энтерококков
Чувствительность к противомикробным препаратам
Обнаружение генов, кодирующих факторы устойчивости к антибиотикам и вирулентности
Клональное родство и анализ структуры населения
Результаты
Идентификация кишечных
изолятов энтерококка от пациентов интенсивной терапии, получающих SDD Количественное определение популяции энтерококков
Чувствительность к противомикробным препаратам
Обнаружение генов, кодирующих факторы устойчивости к антибиотикам и вирулентности
Клональное родство и анализ структуры населения
Обсуждение
Авторские взносы
Заявление о конфликте интересов
Благодарности
Список литературы

 Таблетированными формами ампициллина пользоваться нельзя, и не только в таких серьезных ситуациях — у таблеток большие проблемы с биодоступностью (менее 40%), то есть создать бактерицидную концентрацию почти не реально.
Таблетированными формами ампициллина пользоваться нельзя, и не только в таких серьезных ситуациях — у таблеток большие проблемы с биодоступностью (менее 40%), то есть создать бактерицидную концентрацию почти не реально.
 Можно также упомянуть о тигециклине (100 мг нагрузочная и далее по 50 мг каждые 12 часов), но он тоже стоит как самолет. Поэтому самым лучшим вариантом лечения ванкомицин-устойчивых энтерококковых инфекций является их недопущение в принципе, то есть СанПин, СанПин и еще раз СанПин. А уж если такой пациент все-таки приключился, то необходима немедленная изоляция оного в отдельную палату, а еще лучше в изолятор, чтобы от него не переинфицировать всех вокруг, если вдруг кто-то про обработку рук забудет.
Можно также упомянуть о тигециклине (100 мг нагрузочная и далее по 50 мг каждые 12 часов), но он тоже стоит как самолет. Поэтому самым лучшим вариантом лечения ванкомицин-устойчивых энтерококковых инфекций является их недопущение в принципе, то есть СанПин, СанПин и еще раз СанПин. А уж если такой пациент все-таки приключился, то необходима немедленная изоляция оного в отдельную палату, а еще лучше в изолятор, чтобы от него не переинфицировать всех вокруг, если вдруг кто-то про обработку рук забудет.

 при 55 ° С на нагревательной пластине.
при 55 ° С на нагревательной пластине.
