Дилатационная кардиомиопатия — причины, симптомы, диагностика и лечение

Дилатационная кардиомиопатия – это миокардиальное поражение, характеризующееся расширением полости левого или обоих желудочков и нарушением сократительной функции сердца. Дилатационная кардиомиопатия проявляется признаками застойной сердечной недостаточности, тромбоэмболическим синдромом, нарушениями ритма. Диагностика дилатационной кардиомиопатии основывается на данных клинической картины, объективного обследования, ЭКГ, фонокардиографии, ЭхоКГ, рентгенографии, сцинтиграфии, МРТ, биопсии миокарда. Лечение дилатационной кардиомиопатии проводится ингибиторами АПФ, β-адреноблокаторами, диуретиками, нитратами, антикоагулянтами и антиагрегантами.
Общие сведения
Дилатационная кардиомиопатия (застойная, конгестивная кардиомиопатия) – клиническая форма кардиомиопатии, в основе которой лежит растяжение полостей сердца и систолическая дисфункцией желудочков (преимущественно левого). В современной кардиологии на долю дилатационной кардиомиопатии приходится около 60% всех кардиомиопатий. Дилатационная кардиомиопатия чаще манифестирует в возрасте 20-50 лет, однако встречается у детей и пожилых людей. Среди заболевших преобладают лица мужского пола (62-88%).

Дилатационная кардиомиопатия
Причины дилатационной кардиомиопатии
В настоящее время существует несколько теорий, объясняющих развитие дилатационной кардиомиопатии: наследственная, токсическая, метаболическая, аутоиммунная, вирусная. В 20–30 % случаев дилатационная кардиомиопатия является семейным заболеванием, чаще с аутосомно-доминантным, реже – с аутосомно-рецессивным или Х-сцепленным (синдром Барта) типом наследования. Синдром Барта, кроме дилатационной кардиомиопатии, характеризуется множественными миопатиями, сердечной недостаточностью, фиброэластозом эндокарда, нейтропенией, задержкой роста, пиодермиями. Семейные формы дилатационной кардиомиопатии и имеют наиболее неблагоприятное течение.
В анамнезе у 30% пациентов с дилатационной кардиомиопатией отмечается злоупотребление алкоголем. Токсическое воздействие этанола и его метаболитов на миокард выражается в повреждении митохондрий, уменьшении синтеза сократительных белков, образовании свободных радикалов и нарушении метаболизма в кардиомиоцитах. Среди других токсических факторов выделяют профессиональный контакт со смазочными материалами, аэрозолями, промышленной пылью, металлами и пр.
В этиологии дилатационной кардиомиопатии прослеживается влияние алиментарных факторов: недостаточного питания, дефицита белка, гиповитаминоза В1, нехватки селена, дефицита карнитина. На базе этих наблюдений основывается метаболическая теория развития дилатационной кардиомиопатии. Аутоиммунные нарушения при дилатационной кардиомиопатии проявляются наличием органоспецифических кардиальных аутоантител: антиактина, антиламинина, антимиозина тяжелых цепей, антител к митохондриальной мембране кардиомиоцитов и др. Однако аутоиммунные механизмы являются лишь следствием фактора, который пока не установлен.
С помощью молекулярно-биологических технологий (в т. ч. ПЦР) в этиопатогенезе дилатационной кардиомиопатии доказана роль вирусов (энтеровируса, аденовируса, вируса герпеса, цитомегаловируса). Часто дилатационная кардиомиопатия служит исходом вирусного миокардита.
Факторами риска послеродовой дилатационной кардиомиопатии, развивающейся у ранее здоровых женщин в последнем триместре беременности или вскоре после родов, считаются возраст старше 30 лет, негроидная раса, многоплодная беременность, наличие в анамнезе более 3-х родов, поздний токсикоз беременности.
В некоторых случаях этиология дилатационной кардиомиопатии остается неизвестной (идиопатическая дилатационная кардиомиопатия). Вероятно, дилатация миокарда возникает при воздействии ряда эндогенных и экзогенных факторов, преимущественно у лиц с генетической предрасположенностью.
Патогенез
Под действием причинных факторов уменьшается количество функционально полноценно кардиомиоцитов, что сопровождается расширением камер сердца и снижением насосной функции миокарда. Дилатация сердца приводит к диастолической и систолической дисфункции желудочков и обусловливает развитие застойной сердечной недостаточности в малом, а затем и в большом круге кровообращения.
На начальных стадиях дилатационной кардиомиопатии компенсация достигается благодаря действию закона Франка–Старлинга, увеличению ЧСС и уменьшению периферического сопротивления. По мере истощения резервов сердца прогрессирует ригидность миокарда, нарастает систолическая дисфункция, уменьшается минутный и ударный объем, нарастает конечное диастолическое давление в левом желудочке, что приводит к еще большему его расширению.
В результате растяжения полостей желудочков и клапанных колец развивается относительная митральная и трикуспидальная недостаточность. Гипертрофия миоцитов и формирование заместительного фиброза приводят к компенсаторной гипертрофии миокарда. При уменьшении коронарной перфузии развивается субэндокардиальная ишемия.
Вследствие снижения сердечного выброса и уменьшения почечной перфузии активизируются симпатическая нервная и ренин-ангиотензиновая системы. Выброс катехоламинов сопровождается тахикардией, возникновением аритмий. Развивающиеся периферическая вазоконстрикция и вторичный гиперальдостеронизм приводят к задержке ионов натрия, увеличению ОЦК и развитию отеков.
У 60 % пациентов с дилатационной кардиомиопатией в полостях сердца формируются пристеночные тромбы, вызывающие в дальнейшем развитие тромбоэмболического синдрома.
Симптомы дилатационной кардиомиопатии
Дилатационная кардиомиопатия развивается постепенно; длительное время жалобы могут отсутствовать. Реже она манифестирует подостро, после ОРВИ или пневмонии. Патогномоничными синдромами дилатационной кардиомиопатии являются сердечная недостаточность, нарушения ритма и проводимости, тромбоэмболии.
Клинические проявления дилатационной кардиомиопатии включают быструю утомляемость, одышку, ортопноэ, сухой кашель, приступы удушья (сердечная астма). Около 10 % пациентов предъявляют жалобы на ангинозные боли — приступы стенокардии. Присоединение застойных явлений в большом круге кровообращения характеризуется появлением тяжести в правом подреберье, отеков ног, асцита.
При нарушениях ритма и проводимости возникают пароксизмы сердцебиения и перебоев в работе сердца, головокружение, синкопальные состояния. В некоторых случаях дилатационная кардиомиопатия впервые заявляет о себе тромбоэмболией артерий большого и малого кругов кровообращения (ишемический инсульт, ТЭЛА), что может послужить причиной внезапной смерти больных. Риск эмболии увеличивается при мерцательной аритмии, которая сопутствует дилатационной кардиомиопатии в 10—30% случаев.
Течение дилатационной кардиомиопатии может быть быстро прогрессирующим, медленно прогрессирующим и рецидивирующим (с чередованием обострений и ремиссий заболевания). При быстро прогрессирующем варианте дилатационной кардиомиопатии терминальная стадия сердечной недостаточности наступает в течение 1,5 лет от появления первых признаков заболевания. Чаще всего встречается медленно прогрессирующее течение дилатационной кардиомиопатии.
Диагностика
Диагностика дилатационной кардиомиопатии представляет существенные трудности ввиду отсутствия специфических критериев. Диагноз устанавливается путем исключения других заболеваний, сопровождающихся дилатацией полостей сердца и развитием недостаточности кровообращения.
Объективными клиническими признаками дилатационной кардиомиопатии служат кардиомегалия, тахикардия, ритм галопа, шумы относительной недостаточности митрального и трикуспидального клапанов, увеличение ЧД, застойные хрипы в нижних отделах легких, набухание вен шеи, увеличение печени и др. Аускультативные данные подтверждаются с помощью фонокардиографии.
На ЭКГ выявляются признаки перегрузки и гипертрофии левого желудочка и левого предсердия, нарушения ритма и проводимости по типу фибрилляции предсердий, мерцательной аритмии, блокады левой ножки пучка Гиса, АВ – блокады. С помощью ЭКГ-мониторирования по Холтеру определяются угрожающие для жизни аритмии и оценивается суточная динамику процессов реполяризации.
Эхокардиография позволяет обнаружить основные дифференциальные признаки дилатационной кардиомиопатии – расширение полостей сердца, уменьшение фракции выброса левого желудочка. При ЭхоКГ исключаются другие вероятные причины сердечной недостаточности — постинфарктный кардиосклероз, пороки сердца и т. д.; обнаруживаются пристеночные тромбы и оценивается риск развития тромбоэмболии.
Рентгенологически может выявляться увеличение размеров сердца, гидроперикард, признаки легочной гипертензии. Для оценки структурных изменений и сократительной способности миокарда выполняются сцинтиграфия, МРТ, ПЭТ сердца. Биопсия миокарда используется для дифференциальной диагностики дилатационной кардиомиопатии с другими формами заболевании.
Лечение дилатационной кардиомиопатии
Лечебная тактика при дилатационной кардиомиопатии заключается в коррекции проявлений сердечной недостаточности, нарушений ритма, гиперкоагуляции. Больным рекомендуется постельный режим, ограничение потребления жидкости и соли.
Медикаментозная терапия сердечной недостаточности включает назначение ингибиторов АПФ (эналаприла, каптоприла, периндоприла и др.), диуретиков (фуросемида, спиронолактона). При нарушениях ритма сердца используются b-адреноблокаторы (карведилол, бисопролол, метопролола), с осторожностью – сердечные гликозиды (дигоксин). Целесообразен прием пролонгированных нитратов (венозных вазодилататоров — изосорбида динитрата, нитросорбида), снижающих приток крови к правым отделам сердца.
Профилактика тромбоэмболических осложнений при дилатационной кардиомиопатии проводится антикоагулянтами (гепарин подкожно) и антиагрегантами (ацетилсалициловая кислота, пентоксифиллин, дипиридамол). Радикальное лечение дилатационой кардиомиопатии подразумевает проведение трансплантации сердца. Выживаемость свыше 1 года после пересадки сердца достигает 75–85 %.
Прогноз и профилактика
В целом течение дилатационной кардиомиопатии неблагоприятное: 10-летняя выживаемость составляет от 15 до 30%. Средняя продолжительность жизни после появления симптомов сердечной недостаточности составляет 4–7 лет. Гибель пациентов в большинстве случаев наступает от фибрилляции желудочков, хронической недостаточности кровообращения, массивной легочной тромбоэмболии.
Рекомендации кардиологов по профилактике дилатационной кардиомиопатии включают медико-генетическое консультирование при семейных формах заболевания, активное лечение респираторных инфекций, исключение употребления алкоголя, сбалансированное питание, обеспечивающее достаточное поступление витаминов и минералов.
Симптомы и лечение. Журнал Медикал
Кардиомиопатия — это группа воспалительных заболеваний мышечной ткани сердца с различной причиной. Устаревшее название этой группы заболеваний — миокардиодистрофия. Это заболевание поражает людей разных возрастных групп и не имеет предпочтений в половой принадлежности. Долгое время врачи не могли определить истинную причину развития кардиомиопатии, а 2006 году Американская Кардиологическая Ассоциация приняла решение понимать под причиной группу причин, которые при определенных условиях и обстоятельствах вызывают поражение миокарда.
Выделяются: гипертрофическая кардиомиопатия, дилатационная кардиомиопатия, рестрикивная кардиомиопатия. Эти разновидности кардиомиопатии имеют свои характерные особенности воздействия на сердечную мышцу, но принципы лечения одинаковы и направлены в основном на устранение причин кардиомиопатии и лечение хронической сердечной недостаточности.
Гипертрофическая кардиомиопатия (ГКМП) — заболевание, характеризующееся гипертрофией (утолщением) стенки левого и/или изредка правого желудочка сердца.

На рисунке здоровое сердце и сердце больного гипертрофической кардиомиопатией
Дилатационная кардиомиопатия (ДКМП) — заболевание миокарда, характеризующееся развитием дилатации полостей сердца (увеличены объемы всех камер сердца), с возникновением систолической дисфункции, но без увеличения толщины стенок.
Рестриктивная кардиомиопатия встречается достаточно редко и характеризуется жесткостью стенок сердца, плохой способностью переходить в фазу расслабления. В результате затрудняется доставка крови и кислорода в левый желудочек сердца, нарушается кровообращение во всем организме. В ряде случаев наблюдается рестриктивная кардиомиопатия у детей, обусловленная наследственными факторами.
Причины кардиомиопатии
Поражение миокарда при кардиомиопатии может быть первичным или вторичным процессом вследствие системных заболеваний и сопровождается развитием сердечной недостаточности и в редких случаях внезапной смертью.
Существует три группы основных причин развития первичной кардиомиопатии: врожденная, смешанная, и приобретенная. К вторичным относятся кардиомиопатии вследствие какого-либо заболевания. Как уже было сказано выше, причин данной патологии очень много, но при развитии кардиомиопатии симптомы будут схожи вне зависимости от причины, вызвавшей данное состояние.
Врождённая патология сердца развивается вследствие нарушения закладки тканей миокарда во время эмбриогенеза. Причин очень много, начиная от вредных привычек будущей матери и заканчивая стрессами и неправильным питанием. Так же известны кардиомиопатии беременных и воспалительные кардиомиопатии, которые по существу можно назвать миокардитом.
К вторичным формам относятся следующие виды.
Кардиомиопатия накопления или инфильтративная. Для нее характерно накопление между клетками или в клетках патологических включений.
Токсическая кардиомиопатия. Тяжесть поражения сердечной мышцы при взаимодействии с лекарственными препаратами, особенно противоопухолевыми, бывает различной: от бессимптомных изменений на ЭКГ до молниеносной сердечной недостаточности и смерти. Длительное употребление алкоголя в больших количествах, может привести к развитию воспаления в сердечной мышце (алкогольная кардиомиопатия), данная причина стоит на первом месте в нашей стране, как наиболее часто выявляемая.
Эндокринная кардиомиопатия (метаболическая кардиомиопатия, дисметаболическая кардиомиопатия) возникает вследствие нарушения обмена веществ в сердечной мышце, часто приводит к дистрофии стенок и нарушениям сократительной способности сердечной мышцы. Причины — заболевания эндокринной системы, климакс, ожирение, несбаллансированное питание, заболевания желудка и кишечника. Если кардиомиопатия развивается вследствие заболеваний щитовидной железы и сахарного диабета, имеет место гипертрофическая кардиомиопатия.
Алиментарная кардиомиопатия образуется в результате нарушения питания, а в частности при длительных диетах с ограничением мясных продуктов или голодании, сказывается на сердце недостаток потребления витамина В1 селена, карнитина.
Симптомы кардиомиопатии, которые могут появиться у больного.
Симптомы могут появиться в любом возрасте, обычно они не сильно заметны для пациента и не вызывают у него волнения до определенного момента. Больные с кардиомиопатией достигают нормальной продолжительности жизни и доживают до глубокой старости. Тем не менее, течение заболевания может осложниться развитием грозных осложнений.
Симптомы довольно распространенные и спутать их с другими заболеваниями достаточно легко. К ним относится одышка, которая в начальной стадии возникает только при выраженной физической нагрузке; боль в грудной клетке, головокружение, слабость. Данные симптомы возникают из-за дисфункции сократительной способности сердца.
Возникает вопрос, когда же обратится за помощью к врачу? Многие из перечисленных симптомов могут являться физиологической особенностью каждого из нас или иметь не серьезный характер, как проявление хронической патологии. Стоит задуматься, если боль в груди носит длительный «ноющий» характер и сочетается с выраженной одышкой. Если имеются отеки ног, чувство нехватки воздуха во время физической нагрузки и расстройство сна. Необъяснимые обмороки, которые могут возникать из-за нехватки кровоснабжения головного мозга. Не стоит ждать развития дальнейших осложнений обратитесь к врачу.
Диагностические мероприятия.
- Необходимо, чтоб ваш врач детально расспросил вас о том, были ли у вас в семье заболевания сердца, есть ли родственники, умершие внезапно, особенно в молодом возрасте.
- Необходимо провести тщательный осмотр с выслушиванием сердечных тонов, так как по частоте и количеству шумов можно с полной уверенностью сказать о той или иной патологии сердца.
- С целью исключения другой сердечной патологии, необходимо провести биохимическое исследование крови (маркеры некроза миокарда, электролитный состав крови, глюкоза сыворотки и липидный спектр).
- Необходимо уделить особое внимание функциональным показателям, отражающим состояние почек, печени. Общеклинические исследования крови и мочи.
- Рентгенография органов грудной клетки помогает обнаружить у большинства больных признаки увеличения левых отделов сердца, что свидетельствует о перегрузке. Однако, в ряде случаев, на рентгенографии может отсутствовать какая-либо патология.
- Необходимо выполнить электрокардиографию всем больным с подозрением на кардиомиопатию. Вас могут попросить записать Холтеровское мониторирование электрокардиограммы, которое выполняют для оценки нарушений ритма сердца и влияние нервной системы.
- Ультразвуковое исследование является «золотым» стандартом в диагностики кардиомиопатий.
- Магнитно-резонансная томография показана всем больным перед оперативным вмешательством. Метод обладает лучшей, чем ЭхоКГ, разрешающей способностью, позволяет оценить особенности строения миокарда и увидеть патологические изменения.
Понять самостоятельно, какое заболевание из большого разнообразия схожих именно у вас, не возможно. Правильную диагностику может провести только врач кардиолог. Необходимо дифференцировать заболевания, сопровождающиеся увеличение миокарда левых отделов: аортальным стенозом, гипертрофией миокарда на фоне артериальной гипертензии, амилоидозом, спортивным сердцем, генетической патологией. Для исключения генетических заболеваний и синдромов необходимо консультироваться у специалиста по генетическим нарушениям. Консультация кардиохирурга необходима если: имеется выраженное увеличение толщины стенки левого отдела сердца, повышенное давление в выходных отделах левого желудочка, неэффективность лечения лекарственными препаратами. Также необходимо пройти консультирование у аритмолога.
Лечение кардиомиопатии.
Лечение кардиомиопатии достаточно сложное и продолжительное. Это связано в полиэтилогичностью данной патологии. В то время, как лечение кардиомиопатии зависит от конкретной причины, цель лечения состоит в максимальном увеличении сердечного выброса и предотвращении дальнейшего нарушения функции сердечной мышцы. В лечение очень важно соблюдать все мероприятия, которые прописывает вам врач.
Очень важно обратить внимания на моменты, которые пациент должен самостоятельно ликвидировать. При выраженной массе тела очень важно придерживаться диет и образа жизни для постепенного и эффективного снижения массы тела. Вредные привычки, такие как алкоголь и курение, в наименьшей степени влияют на развитие заболеваний сердца, чем прямые факторы риска. Интенсивные физические нагрузки и алкоголь должны быть полностью исключены из образа жизни, дабы снизить нагрузку на сердце. В некоторых случаях на ранних этапах заболевания эти мероприятия могут облегчить лечение и предупредить его развитие.
Медикаментозное лечение назначают больным людям, у которых появились ярко выраженные клинические проявления кардиомиопатии. Препараты из группы β-адреноблакаторов, представителями которой являются Атенолол и Бисопролол.
При наличии нарушений ритма необходимо назначение антикоагулянтов из-за повышенного риска развития тромбоэмболических осложнений.
При планировании хирургического вмешательства и для профилактики развития инфекционного эндокардита необходим прием антибиотиков.
Препарат Верапамил можно назначать при отсутствие эффекта от основной группы лечебных средств. Препарат оказывает благоприятное влияние на симптомы кардиомиопатии за счет уменьшения выраженности дисфункции сердечной мышцы.
Хирургическое вмешательство производится по строгим показаниям и при неэффективности медикаментозного лечения. Если кардиомиопатия связана с нарушениями ритма, в этом случае необходимо имплантировать кардиостимулятор, который будет поддерживать ритм сердца в правильной частоте. Если имеется риск развития внезапной смерти (были эпизоды в семье) необходима имплантация дефибриллятора. Данное устройство может распознавать фибрилляцию желудочков, неправильный ритм, который не дает сердцу работать в правильном режиме и послать импульс для как бы перезагрузки сердца для правильной скоординированной работы.
Тяжелые варианты кардиомиопатии, не поддающиеся коррекции хирургических методов, можно рассматривать как потенциальный вариант для трансплантации сердца. Но такие операции проводятся только в высокоспециализированных клиниках.
Некоторые успехи получены в лечении кардиомиопатии стволовыми клетками.
После прохождения одного из способов лечения необходимо наблюдение у врача терапевта или врача общей практики, обязательны консультации кардиолога кардиологического центра или диспансера. Кратность наблюдения 1 – 2 раза в год, при наличии показаний – чаще. Повторные исследования должны проводится при ухудшении общего состояния или при планировании изменения курса лечения. Больным с жизнеугрожающими нарушениями ритма в анамнезе необходимо ежегодно выполнять Холтеровское мониторирование ЭКГ. Для успешного лечения и улучшения качества жизни больным необходимо: снизить избыточную массу тела, отказаться от курения и алкоголя, контролировать артериальное давление, ограничить интенсивные физические нагрузки.
Осложнения кардиомиопатии и прогноз.
- Сердечная недостаточность. Кардиомиопатия может привести к снижению притока крови из левого желудочка, что приводит к сердечной недостаточности.
- Клапанная дисфункция. Расширение левого желудочка может затруднить прохождение крови через клапаны, в результате чего образуется обратный ток крови. Это заставляет сердце менее эффективно сокращаться.
- Отеки. Кардиомиопатия может вызвать скопление жидкости в легких, тканях живота, ног и ступней, потому что ваше сердце не сможет перекачивать эффективно кровь, как здоровое сердце.
- Нарушения сердечного ритма (аритмии). Изменения в структуре сердца и изменения в давлении на камеры сердца может вызвать проблемы с сердечным ритмом.
- Внезапная остановка сердца. Кардиомиопатия может вызвать внезапную остановку сердца.
- Эмболия. Объединение крови (стаз) в левом желудочке может привести к образованию сгустков крови, которые могут попадать в кровоток, отрезать приток крови к жизненно важным органам, и вызвать инсульт, сердечный приступ или повреждения других органов.
Прогноз зависит от многих факторов, как эффективно вы будете лечиться и соблюдать все предписания врача, какая степень выраженности симптомов у вас на этапе первичного выявления. Эффективных способов профилактики данной патологии не разработано. Поэтому активный образ жизни, правильное питание это залог Вашего здоровья!
Врач терапевт Жумагазиев Е.Н.
что это такое, лечение и прогноз жизни
Дилатационная кардиомиопатия — это клинический вариант врожденного или чаще приобретенного порока сердца, характеризуется расширением камер при неизменном объеме миокарда.
Более того, мышечный слой может истончаться по причине компрессии, растяжения и последующего нарушения питания.
Проявляется болезнь не сразу, спустя годы возникают какие-то симптомы. Но они неспецифичны. Человек может списывать отклонения на проблемы с желудком и пищеварительной системой, погоду, на что угодно, но не подозревать о проблеме.
Драгоценное время утекает, органический дефект оказывается все стабильнее и больше, угнетая кардиальную деятельность. Итог — внезапная смерть от остановки сердца.
Всегда ли сценарий столь пессимистичен? Конечно, нет. Все зависит от пациента и его отношения к собственному здоровью.
Механизм развития патологии
Суть анатомического дефекта кроется в расширении одной, но чаще сразу нескольких камер.
В ходе развития отмечается скопление крови в кардиальных структурах. Отсюда возникновение постепенного застоя и растяжения предсердий и/или желудочков.

Основной процесс имеет свойство прогрессировать, обычно это недостаточность аортального, митрального клапана, бывает, что в сочетании. Объем жидкой соединительной ткани, остающейся в кардиальных структурах, увеличивается постепенно.

Сердце растет дальше, однако объем мышечной массы сохраняется прежним, поскольку сократительная способность до определенного момента не страдает (это главное отличие кардиомиопатии дилатационной от прочих форм).
Более того, слой функциональных клеток истончается. Рост объема органа приводит к растяжению ткани, возникновению хронической сердечной недостаточности, третичной ишемии и постепенной дистрофии.
В конечном итоге падает объем выброса, страдают все системы, само же сердце перестает работать достаточно активно по причине слабости миокарда, что только усугубляет процессы.

Исход — смерть от остановки работы мышечного органа или полиорганной недостаточности. Что наступит раньше — большой вопрос, но в отсутствии терапии летальный исход неминуем.
От момента появления первых симптомов до фатального результата проходит 5-15 лет.
Процесс прогрессирует постепенно, время на диагностику и лечение есть. Исключения составляют возможные неотложные состояния, спровоцированные гипоксией (кардиогенный шок, асистолия, инфаркт, инсульт).
Причины расширения камер
Дилатационная кардиомипатия (сокращенно ДКМП) имеет собственный код по МКБ-10: I42.1. Факторы развития патологического процесса всегда кардиальные. Состояние не бывает первичным почти никогда, оно вторично, то есть, обусловлено прочими заболеваниями.
Среди возможных:
- Врожденные и приобретенные аномалии развития сердца. Существуют десятки генетических и фенотипических синдромов, обусловленных нарушениями перинатального периода.
Закладывание сердечнососудистой системы происходит на 2 неделе беременности, уже тогда возможны проблемы. Задача матери — обеспечить нормальную среду для развития эмбриона, а потому и плода. Первый триместр особенно ответственный.
Приобретенные патологии определяются неправильным образом жизни, перенесенными болезнями. Симптомами часто не проявляются ни те, ни другие (не считая генетических отклонений).
Залог сохранения здоровья и жизни — регулярный скрининг по определенной индивидуальной программе. Достаточно 1-2 раза в год проходить профилактическое обследование.
- Миокардит. Воспаление сердечных структур инфекционного (грибкового, вирусного, бактериального) происхождения. Симптомы достаточно специфичны и интенсивны, чтобы побудить человека отправиться к врачу.
Восстановление проводится в стационаре с применением антибиотиков, кортикостероидов и протекторных препаратов. В отсутствии терапии возникает деструкция мышц, предсердий, что снижает сократительную способность.

- Генетический фактор. Если в роду был человек, страдавший какой-либо формой кардиомиопатии, присутствует риск, что патологическое отклонение проявится в фенотипе у потомка.
Для более конкретных выводов рекомендуется опросить старших членов семьи и обратиться за консультацией к генетику. Вероятность варьируется в широких пределах.
По разным оценкам, наличие одного родственника определяет риск в 25%, двух — в 40%. Но это не приговор.
Если соблюдать профилактические меры, есть шансы не встретиться с проблемой. С другой стороны, даже диагностированный процесс не гарантирует летального исхода.
На ранних этапах патологию можно обуздать и прожить долго, без какой либо симптоматики и существенных ограничений.
- Аутоиммунные процессы. Ревматизм, системная красная волчанка, тиреоидин Хашимото и прочие. В определенный момент влекут генерализованные поражения всех систем.
- Метаболические нарушения в результате диет, анорексии и осознанного голодания. Возникают в рамках длительного процесса. Примерные сроки — 1-2 месяца с начала изнурения организма. Восстановление проводится осторожно, тело ослаблено, возможны непредсказуемые последствия, вплоть до остановки сердца или же разрыва истонченного желудка при обильном потреблении пищи.
- Длительно текущая артериальная гипертензия. На первой стадии ГБ осложнения крайне редки, возникают не более, чем в 3-7% случаев. 2 и 3 этапы особенно опасны. Показатели тонометра закрепляются на высоких уровнях, повышается нагрузка на сердце, миокард.
Расширение камер — компенсаторный механизм, когда кардиальные структуры не справляются с сократительным объемом, жидкая соединительная ткань застаивается, возникает расширение.
- Ишемическая болезнь длительного характера. Приводит к выраженным дистрофическим процессам в мышечном слое сердца. Следующий эволюционный шаг развития патологии — инфаркт.
- Инфаркт. Крайняя степень коронарной недостаточности. Отмечается некроз клеток-миоцитов, замещение последних рубцовой, не активной тканью.
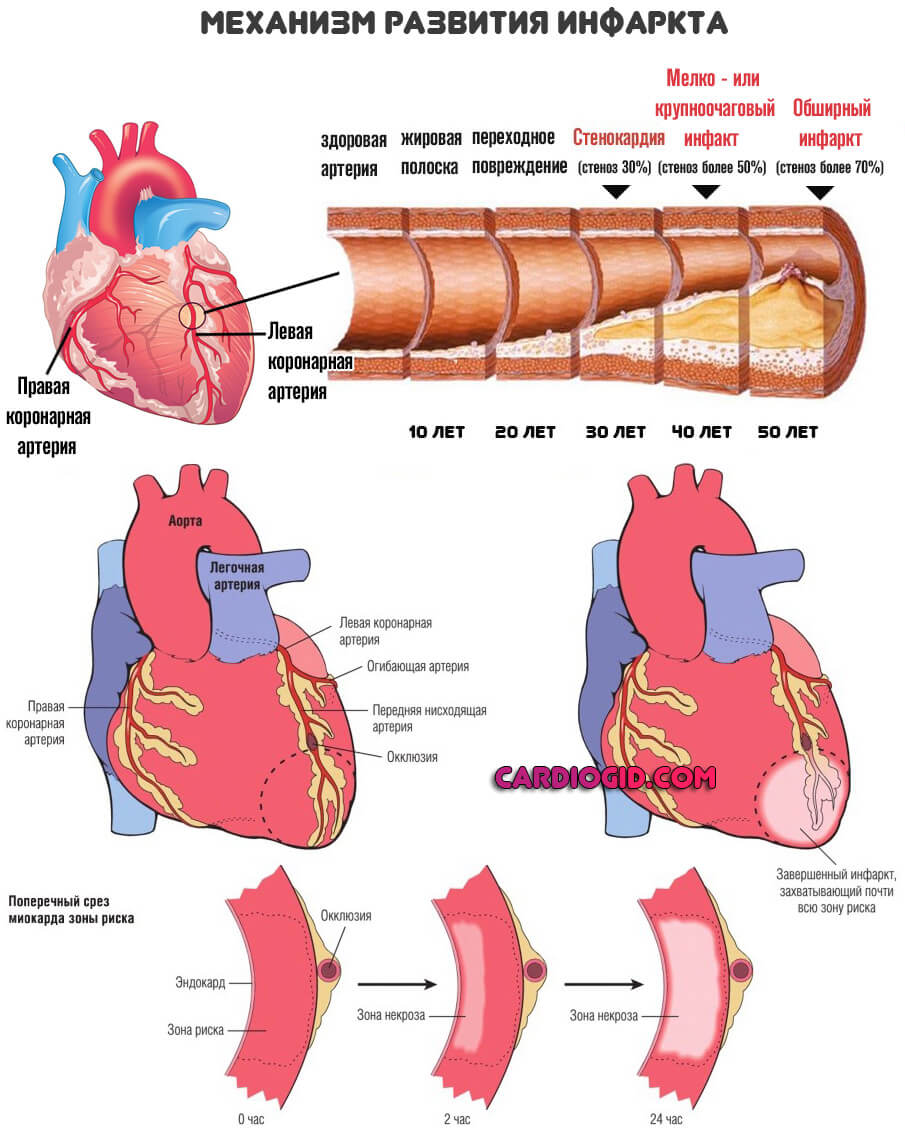
- Токсические поражения в результате злоупотребления алкоголем, контакте с солями тяжелых металлов, опасных ядовитых веществ. Также сказывается постоянный прием гликозидов (они подстегивают сократительную активность миокарда без оглядки на функциональный запас органа).
В отсутствии данных за органические патологии констатируют идиопатическую дилатационную кардиомиопатию. В таком случае лечение симптоматическое, направлено на поддержание работы сердца, также приостановку прогрессирования.
Как уже сказано, первичной патология бывает только в случае врожденного порока, либо генетического заболевания. Все прочие ситуации — вторичны.
Симптомы
Перечень проявлений зависит от степени тяжести процесса. Общепринятой классификации и стадирования, однако, не существует. Потому определение запущенности явления проводится по интенсивности признаков и характеру органических дефектов.
Примерная клиническая картина выглядит следующим образом:
- Боли в грудной клетке неясного происхождения. Диффузные, точная локализация пациенту не понятна. Отдают в живот, спину, руки, лицевую область. Интенсивность разнится от незначительного покалывания до невыносимого, мучительного приступа. Симптом неспецифичен, также по силе болевого синдрома невозможно судить о характере процесса. Диагностической роли этот признак не играет.
- Одышка. При интенсивных физических нагрузках (бег, поднятие тяжестей в течение длительного времени) на первой стадии. Затем же нарушение становится постоянным спутником человека. Больной не может подняться по лестнице, а затем и вовсе не способен даже встать с постели без одышки. Это качественный признак, указывающий на степень нарушения газообмена.
- Аритмия. По типу тахикардии, либо обратного явления. Ускорение или замедление сердечной деятельности может сочетаться с отклонениями в интервалах между сокращениями. Экстрасистолия, фибрилляция предсердий как возможные варианты. Несут опасность для жизни.
- Слабость, чувство отсутствия сил, апатичность, снижение работоспособности. На поздних стадиях нет возможности выполнять трудовые обязанности, что сказывается на социальной жизни пациента.
- Цианоз носогубного треугольника. Посинение области вокруг рта.
- Повышенная потливость. Особенно в ночное время.
- Бледность кожных покровов.
- Головная боль. В затылке или темени. Тюкающая, стреляющая, длительно текущая. Проявляется регулярно, периодически проходит или затихает.
- Вертиго. Нарушения нормальной ориентации в пространстве.
- Психические расстройства: от нервозности, раздражительности, тревожности до галлюцинаторно-бредовых вариантов, онейроидных сосудистых эпизодов, депрессий.
Последние три симптома говорят об ишемии церебральных структур. Это опасно, вероятен инсульт.

Диагностика
Проводится под контролем кардиолога. Участки профильного хирурга возможно, но показано в крайних случаях. Оперативным путем кардиомиопатия не лечится, устраняются таким способом этиологические факторы (пороки).
Примерная схема:
- Устный опрос, объективизация жалоб, симптомов.
- Сбор анамнеза. Учитывается образ жизни, давность течения болезни, наличие соматических патологий, семейная история, лечение (определенное влияние на сердце оказывают кортикостероиды, антипсихотики, транквилизаторы и нормотимики).
- Измерение артериального давления. Также частоты сердечных сокращений. Для выявления возможных отклонений функциональных показателей.
- Суточное мониторирование по Холтеру. Используется для динамического наблюдения за теми же уровнями. Однократного измерения недостаточно. Назначается как в амбулаторных условиях (предпочтительно), так и в стационаре.
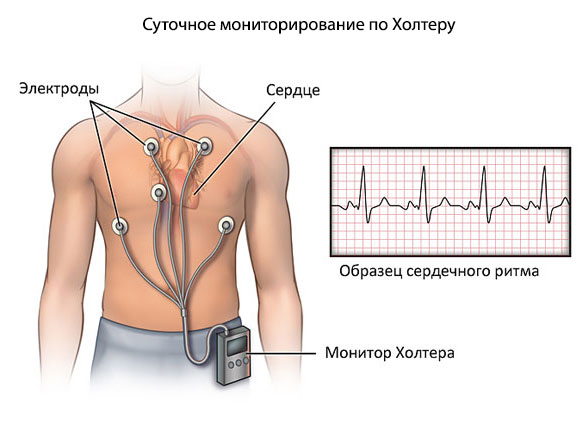
- Электрокардиография. Методика оценки функциональной активности сердца. Показывает малейшие отклонения в ритме. Важно, чтобы врач имел достаточную квалификацию для расшифровки.
- Эхокардиография. Профильный диагностический способ. Показывает все органические (анатомические) дефекты даже незначительного характера. Подходит для ранней оценки состояния сердца, также степени отклонений в поздний период и прогнозирования.

- КТ или МРТ для более детального рассмотрения анатомических структур.
- Коронография.
- Анализ крови.
Возможно проведение не всех представленных исследований, вопрос решается на усмотрение специалиста. Установление происхождения процесса относительно трудно.
Лечение
Имеет двойственный характер. Требуется этиотропное воздействие, то есть устранение основного заболевания, влекущего анатомические дефекты.
Симптоматическая терапия направлена на редукцию проявлений и приостановку патологического процесса. Такая схема может проводиться на протяжении многих лет и даже всей жизни. Основу мероприятий составляет консервативная методика.
Применяются препараты нескольких фармацевтических типов:
- Антиаритмические на фоне нарушения сократительной способности миокарда. Хиндин или Амиодарон. Возможно использование аналогов.
- Противогипертонические. Существует несколько групп медикаментов. Ингибиторы АПФ, бета-локаторы, антагонисты кальция как основных. Классическая схема: Верапамил или Дилтиазем + Периндоприл в разных торговых формах + Моксонидин или Физиотенз.
- Противотромбические. Одна из основных причин смерти пациентов с дилатационной кардиомиопатией — эмболия сгустками крови. Легочная артерия закупоривается, летальный исход вероятен в течение 2-3 минут или считанных секунд. Применяется Аспирин Кардио для восстановления реологических свойств крови.
- Статины. Для лечения атеросклероза на ранних стадиях.
- Витаминно-минеральные комплексы и средства на основе калия, магния (Аспаркам и прочие).
- Кардиопротекторы.
Гликозиды используются редко ввиду возможности спровоцировать остановку сердца или инфаркт.
Хирургическое лечение проводится по показаниям. Для восстановления анатомической целостности сердечных структур (воспаления, ревматизм, пороки) — протезирования, установки кардиостимулятора.

Крайняя мера — трансплантация органа. Проводится редко ввиду сложности найти донора, опасности методики. Назначается, если другого выхода нет и это реальный шанс на выживание (не всегда даже столь радикальным методом можно решить вопрос).
На протяжении периода терапии, а значит, скорее всего, жизни, показано изменение бытовых и прочих привычек.
- Нужно отказаться от курения, алкоголя, психоактивных веществ.
- Сон 8 часов минимум, больше 10 также не рекомендуется, возможны застойные процессы.
- Минимальная полезная физическая активность. Прогулки или ЛФК. Не более. Изнурение для здоровых людей опасно, стоит ли говорить, какие последствия ждут сердечника?
- Питьевой режим — 1.5-2 литра в сутки.
- Соль — 7 граммов, не свыше того.
- Коррекция рациона. Больше витаминов, минералов, белка, меньше углеводов, никакого фаст-фуда, консервов и полуфабрикатов. Также жирного, жареного, копченостей.
При успешном лечении есть шансы на долгую жизнь. Но ограничения станут непременным условием, хотя изменив к ним отношение, возможно переносить новую парадигму с радостью, а не как тяжелую повинность.
Шансы и осложнения
Прогноз жизни при дилатационной кардиомиопатии на ранних стадиях условно-благоприятный. В отсутствии органических причин продолжительность неопределенно долгая.
Неблагоприятные факторы:
- Старческий возраст.
- Наличие семейного компонента.
- Генетические патологии в анамнезе.
- Вредные привычки.
- Повышенная масса тела.
- Недостаточный отклик на лечение.
- Артериальная гипертензия, сахарный диабет в качестве сопутствующих проблем.
Вероятность летального исхода без медицинской помощи — 60% в перспективе пары лет. При условии терапии — 10-20%.
Осложнения:
- Внезапная смерть в результате остановки сердца.
- Кардиогенный шок.
- Инфаркт.
- Инсульт.
- Полиорганная недостаточность.
- Тромбоэмболия.
В заключение
Дилатационная кардиомиопатия — расширение камер органа по врожденным или приобретенным причинам. При постоянных профилактических осмотрах пропустить начало болезни невозможно, что ассоциировано с хорошим общим прогнозом.
Диагностика минимальна, проблем с верификацией обычно нет. Лечение консервативное, на протяжении всей жизни.
Хирургическая методика применяется редко, только по показаниям. На фоне кардиомиоапатии вмешательство несет большие риски. Все решается на усмотрении специалиста при учете мнения человека.
Гипертрофическая кардиомиопатия — причины, симптомы, диагностика и лечение

Гипертрофическая кардиомиопатия – первичное изолированное поражение миокарда, характеризующееся гипертрофией желудочков (чаще левого) при уменьшенном или нормальном объеме их полостей. Клинически гипертрофическая кардиомиопатия проявляется сердечной недостаточностью, болью в грудной клетке, нарушениями ритма, синкопальными состояниями, внезапной смертью. Диагностика гипертрофической кардиомиопатии включает проведение ЭКГ, суточного ЭКГ-мониторирования, ЭхоКГ, рентгенологического исследования, МРТ, ПЭТ сердца. Лечение гипертрофической кардиомиопатии проводится b-адреноблокаторами, блокаторами кальциевых каналов, антикоагулянтами, антиаритмическими препаратами, ингибиторами АПФ; в ряде случаев прибегают к кардиохирургической операции (миотомии, миоэктомии, протезированию митрального клапана, двухкамерной электрокардиостимуляции, имплантации кардиовертер-дефибриллятора).
Общие сведения
В кардиологии различают первичные (идиопатические) кардиомиопатии (гипертрофическую, констриктивную, дилатационную, рестриктивную, аритмогенную дисплазию правого желудочка) и специфические вторичные кардиомиопатии (алкогольную, токсическую, метаболическую, климактерическую и ряд других).
Гипертрофическая кардиомиопатия – самостоятельное, не зависящее от других сердечно-сосудистых заболеваний, значительное утолщение миокарда левого (реже правого) желудочка, сопровождающееся уменьшением его полости, нарушением диастолической функции с развитием нарушений сердечного ритма и сердечной недостаточности.
Гипертрофическая кардиомиопатия развивается у 0,2-1,1% населения, чаще мужского пола; средний возраст пациентов составляет от 30 до 50 лет. Коронарный атеросклероз среди больных гипертрофической кардиомиопатией встречается в 15-25 % случаев. Внезапная смерть, вызванная с тяжелыми желудочковыми аритмиями (пароксизмальной желудочковой тахикардией), наступает у 50% пациентов с гипертрофической кардиомиопатией. У 5-9 % больных заболевание осложняется инфекционным эндокардитом, протекающим с поражением митрального или аортального клапана.

Гипертрофическая кардиомиопатия
Причины гипертрофической кардиомиопатии
Гипертрофическая кардиомиопатия – заболевание с аутосомно-доминантным типом наследования, поэтому обычно носит семейный характер, что не исключает, однако, возникновение спорадических форм.
В основе семейных случаев гипертрофической кардиомиопатии лежат передаваемые по наследству дефекты генов, кодирующих синтез сократительных белков миокарда (гена тяжелой цепи b-миозина, гена сердечного тропонина Т, гена а-тропомиозина, гена, кодирующего сердечную изоформу миозин-связывающего белка). Спонтанные мутации этих же генов, происходящие под воздействием неблагоприятных факторов среды, обусловливают развитие спорадических форм гипертрофической кардиомиопатии.
Гипертрофия миокарда левого желудочка при гипертрофической кардиомиопатии не связана с врожденными и приобретенными пороками сердца, ИБС, гипертонической болезнью и другими заболеваниями, которые обычно приводят к подобным изменениям.
Патогенез
В патогенезе гипертрофической кардиомиопатии ведущая роль принадлежит компенсаторной гипертрофии сердечной мышцы, обусловленной одним из двух возможных патологических механизмов — нарушением диастолической функции миокарда или обструкцией выходного тракта левого желудочка. Диастолическая дисфункция характеризуется поступлением в желудочки недостаточного количества крови в диастолу, что связано с плохой растяжимостью миокарда, и обусловливает быстрый подъем конечного диастолического давления.
При обструкции выходного отдела левого желудочка имеет место утолщение межжелудочковой перегородки и нарушение движения передней створки митрального клапана. В связи с этим в период изгнания возникает перепад давления между полостью левого желудочка и начальным отрезком аорты, что сопровождается повышением конечного диастолического давления в левом желудочке. Возникающая в этих условиях компенсаторная гиперфункция сопровождается гипертрофией, а затем и дилатацией левого предсердия, в случае же декомпенсации развивается легочная гипертензия.
В ряде случаев гипертрофической кардиомиопатии сопутствует ишемия миокарда, обусловленная снижением вазодилататорного резерва коронарных артерий, увеличением потребности гипертрофированного миокарда в кислороде, сдавлением во время систолы интрамуральных артерий, сопутствующим атеросклерозом венечных артерий и т. д.
Макроскопическими признаками гипертрофической кардиомиопатии служит утолщение стенок левого желудочка при нормальных или уменьшенных размерах его полости, гипертрофия межжелудочковой перегородки, дилатация левого предсердия. Микроскопическая картина гипертрофической кардиомиопатии характеризуется беспорядочным расположением кардиомиоцитов, замещением мышечной ткани на фиброзную, аномальным строением интрамуральных венечных артерий.
Классификация
В соответствии с локализацией гипертрофии выделяют гипертрофическую кардиомиопатию левого и правого желудочков. В свою очередь, гипертрофия левого желудочка может быть асимметричной и симметричной (концентрической). В большинстве случаев выявляется асимметричная гипертрофия межжелудочковой перегородки на всем протяжении или в ее базальных отделах. Реже встречается асимметричной гипертрофия верхушки сердца (апикальная гипертрофическая кардиомиопатия), задней или переднебоковой стенки. На долю симметричной гипертрофии приходится около 30 % случаев.
С учетом наличия градиента систолического давления в полости левого желудочка различают обструктивную и необструктивную гипертрофическую кардиомиопатию. Симметричная гипертрофия левого желудочка, как правило, представляет собой необструктивную форму гипертрофической кардиомиопатии.
Асимметричная гипертрофия может являться как необструктивной, так и обструктивной. Так, синонимом асимметричной гипертрофии межжелудочковой перегородки служит понятие «идиопатический гипертрофический субаортальный стеноз», гипертрофии средней части межжелудочковой перегородки (на уровне папиллярных мышц) – «мезовентрикулярная обструкция». Верхушечная гипертрофия левого желудочка, как правило, представлена необструктивным вариантом.
В зависимости от степени утолщения миокарда выделяют умеренную (15-20 мм), среднюю (21-25 мм) и выраженную (более 25 мм) гипертрофию.
На основании клинико-физиологической классификации выделяют IV стадии гипертрофической кардиомиопатии:
- I — градиент давления в выходном тракте левого желудочка (ВТЛЖ) не более 25 мм рт. ст.; жалобы отсутствуют;
- II — градиент давления в ВТЛЖ возрастает до 36 мм рт. ст.; появляются жалобы при физической нагрузке;
- III — градиент давления в ВТЛЖ увеличивается до 44 мм рт. ст.; появляются стенокардия, одышка;
- IV — градиент давления в ВТЛЖ выше 80 мм рт. ст.; развиваются выраженные нарушения гемодинамики, возможна внезапная сердечная смерть.
Симптомы гипертрофической кардиомиопатии
Длительное время течение гипертрофической кардиомиопатии остается бессимптомным, клиническая манифестация чаще происходит в возрасте 25–40 лет. С учетом преобладающих жалоб выделяют девять клинических форм гипертрофической кардиомиопатии: малосимптомную, вегетодистоническую, кардиалгическую, инфарктоподобную, аритмическую, декомпенсационную, псевдоклапанную, смешанную, молниеносную. Несмотря на то, что каждый клинический вариант характеризуется определенными признаками, всем формам гипертрофической кардиомиопатии присущи общие симптомы.
Необструктивная форма гипертрофической кардиомиопатии, не сопровождающаяся нарушением оттока крови из желудочка, обычно малосимптомна. В этом случае жалобы на одышку, перебои в работе сердца, неритмичный пульс могут отмечаться при выполнении физической нагрузки.
Типичными симптомами обструктивной гипертрофической кардиомиопатии служат приступы ангинозных болей (70%), выраженная одышка (90%), головокружения и обморочные состояния (25-50%), преходящая артериальная гипотензия, нарушения ритма сердца (пароксизмальная тахикардия, фибрилляция предсердий, экстрасистолия). Возможно возникновение приступов сердечной астмы и отека легких. Нередко первым эпизодом проявления гипертрофической кардиомиопатии служит внезапная смерть.
Диагностика
При диагностическом поиске обнаруживается систолический шум, высокий, скорый пульс, смещение верхушечного толчка. Инструментальные методы обследования при гипертрофической кардиомиопатии включают ЭхоКГ, ЭКГ, ФКГ, рентгенографию грудной клетки, холтеровское мониторирование, поликардиографию, ритмокардиографию. С помощью эхокардиографии выявляется гипертрофия МЖП, стенок миокарда желудочка, увеличение размеров левого предсердия, наличие обструкции ВТЛЖ, диастолическая дисфункция левого желудочка.
ЭКГ-признаки гипертрофической кардиомиопатии малоспецифичны и требуют дифференциальной диагностики с очаговыми изменениями миокарда, гипертонической болезнью, ИБС, аортальным стенозом и другими заболеваниями, осложняющимися гипертрофией левого желудочка. Для оценки тяжести гипертрофической кардиомиопатии, прогноза и выработки рекомендаций по лечению используются нагрузочные пробы (велоэргометрия, тредмил-тест).
Суточное мониторирование ЭКГ позволяет документировать пароксизмальные эпизоды желудочковой экстрасистолии и тахикардии, фибрилляции и трепетания предсердий. На фонокардиограмме регистрируется систолический шум различной степени выраженности, сохранность амплитуды I и II тонов. Сфигмография демонстрирует двухвершинную кривую каротидного пульса, характеризующуюся дополнительной волной на подъеме.
При рентгенологическом исследовании изменения контуров сердца (увеличение левых отделов сердца, расширение восходящей части аорты, выбухание ствола и расширение ветвей легочной артерии) обнаруживаются только в развернутой стадии гипертрофической кардиомиопатии. Для получения дополнительных данных за гипертрофическую кардиомиопатию прибегают к проведению зондирования левых отделов сердца, вентрикулографии, коронарографии, сканированию сердца с радиоизотопом таллия, МРТ, ПЭТ сердца.
Лечение гипертрофической кардиомиопатии
Пациентам с гипертрофической кардиомиопатией (особенно с обструктивной формой) рекомендуется ограничение физических нагрузок, которые могут спровоцировать увеличение градиента давления «левый желудочек-аорта», аритмии сердца и обмороки.
При умеренно выраженных симптомах гипертрофической кардиомиопатии назначают b-адреноблокаторы (пропранолол, атенолол, метопролол) или блокаторы кальциевых каналов (верапамил), уменьшающие ЧСС, удлиняющие диастолу, улучшающие пассивное наполнение левого желудочка и снижающие давление наполнения. В связи с наличием высокого риска развития тромбоэмболий необходим прием антикоагулянтов. При развитии сердечной недостаточности показаны диуретики, ингибиторы АПФ; при нарушениях желудочкового ритма — антиаритмические препараты (амиодарон, дизопирамид).
При обструктивной гипертрофической кардиомиопатии проводится профилактика инфекционного эндокардита, т. к. в результате постоянной травматизации передней створки митрального клапана на ней могут появляться вегетации. Кардиохирургическое лечение гипертрофической кардиомиопатии целесообразно при градиенте давления между левым желудочком и аортой >50 мм рт.ст. В этом случае может выполняться септальная миотомия или миоэктомия, а при структурных изменениях митрального клапана, вызывающих значительную регургитацию, — протезирование митрального клапана.
Для уменьшения обструкции ВТЛЖ показана имплантация двухкамерного электрокардиостимулятора; при наличии желудочковых нарушений ритма — имплантация кардиовертер-дефибриллятора.
Прогноз гипертрофической кардиомиопатии
Течение гипертрофической кардиомиопатии вариабельно. Необструктивная форма гипертрофической кардиомиопатии протекает относительно стабильно, однако при длительном стаже заболевания все же развивается сердечная недостаточность. У 5–10% пациентов возможен самостоятельный регресс гипертрофии; у такого же процента больных отмечается переход гипертрофической кардиомиопатии в дилатационную; еще столько же пациентов сталкивается с осложнением в виде инфекционного эндокардита.
Без лечения летальность при гипертрофической кардиомиопатии составляет 3–8 %, при этом в половине подобных случаев возникает внезапная смерть вследствие фибрилляции желудочков, полной атриовентрикулярной блокады, острого инфаркта миокарда.
Алкогольная кардиомиопатия — причины, симптомы, диагностика и лечение

Алкогольная кардиомиопатия — это поражение сердечной мышцы, которое формируется на фоне чрезмерного употребления спиртных напитков, проявляется разнообразными морфологическими, функциональными, клиническими нарушениями. Пациенты жалуются на боль за грудиной, одышку, отеки, похолодание нижних конечностей. Возможно развитие сердечной недостаточности, смертельно опасных нарушений ритма, тромбоэмболии. Алкогольная кардиомиопатия диагностируется с помощью ЭКГ, Эхо-КГ, рентгенографии. Лечение консервативное, при необратимых изменениях органа показана пересадка сердца.
Общие сведения
Алкогольное поражение миокарда — частая причина кардиомиопатии. Встречаемость определяется распространенностью алкоголизма в популяции. Заболевание чаще развивается у людей среднего возраста, систематически употребляющих алкоголь на протяжении длительного времени. Среди пациентов отмечается преобладание лиц мужского пола. Вероятность патологии увеличивается при курении, стрессах, наличии других факторов, способствующих возникновению болезней сердца и сосудов. На алкогольную кардиомиопатию приходится не менее 30% случаев дилатационной кардиомиопатии.

Алкогольная кардиомиопатия
Причины
Главным этиофактором является продолжительное употребление большого количества спиртных напитков, обычно – в эквиваленте 100 мл чистого этанола каждый день в течение 10-20 лет (по данным статистики, в России среднее потребление алкоголя в год на одного человека составляет от 11 до 14 литров или около 35-40 мл в день). Заболевание диагностируется у 50% хронических алкоголиков. К факторам, способствующим возникновению кардиомиопатии, относят наследственную предрасположенность, иммунные нарушения, нерациональное питание, хронические стрессы, переутомление, курение.
Патогенез
Негативное влияние на миокард, прежде всего, оказывают токсические продукты метаболизма алкоголя, преимущественно – ацетальдегид. Это вещество образуется клетками печени после расщепления этанола и затем поступает в кровоток. Достигая сердца, оно вызывает структурные и функциональные нарушения: негативно влияет на воспроизводство сократительных белков сердечной мышцы, снижает ее силу, нарушает метаболизм внутри кардиомиоцитов (транспорт липидов, калия, кальция).
Расстройства метаболизма и нарушения электролитного баланса становятся причиной аритмий, снижения функциональной активности сердца, развития фиброзных изменений. Существуют данные, свидетельствующие о том, что ацетальдегид влияет на синтез некоторых соединений, в частности – стимулирует продукцию провоспалительных цитокинов и белков, способных спровоцировать аутоиммунный ответ. Кроме того, при высоком содержании в крови прямое токсическое действие на сердце может оказывать непосредственно этанол и различные вещества, добавляемые в алкогольные напитки — примеси металлов (например, кобальта), красители, консерванты.
Классификация
Систематизация видов алкогольной кардиомиопатии осуществляется с учетом особенностей клинической симптоматики, степени выраженности тех или иных проявлений. Деление достаточно условно, поскольку признаки заболевания отличаются вариабельностью — симптомы, соответствующие разным типам болезни, могут выявляться у одного больного. Выделяют четыре формы патологии:
- Классическая. В клинической картине доминирует сердечная недостаточность. При прекращении употребления алкоголя отмечается положительная клиническая и эхокардиографическая динамика, чем дольше длится период воздержания – тем лучше становится состояние пациента. Возобновление приема приводит к быстрому ухудшению состояния, повторному появлению и усугублению симптомов.
- Псевдоишемическая. Основное проявление — колющие или ноющие боли в кардиальной области при наличии изменений ЭКГ, свойственных ишемической болезни сердца. Кардиалгии возникают после употребления алкоголя, не связаны с физическими нагрузками, не купируются нитроглицерином. Выраженность симптоматики постепенно прогрессирует.
- Аритмическая. В клинике преобладают нарушения сердечного ритма. У 20% пациентов обнаруживается мерцательная аритмия, реже выявляется экстрасистолия, тахикардия, трепетания или фибрилляция предсердий. Особенностью аритмий алкогольной этиологии является их возникновение после массивного приема этанолсодержащих напитков. Нарушения ритма могут быть первым и нередко единственным симптомом кардиомиопатии.
- Смешанная. Сочетает проявления всех предыдущих вариантов поражения миокарда. Считается наиболее неблагоприятной, поскольку симптомы взаимно усугубляют друг друга, что значительно ухудшает прогноз заболевания. У 30-40% пациентов с данным видом кардиомиопатии на ЭКГ определяются признаки, свидетельствующие о предрасположенности к тяжелым желудочковым нарушениям ритма, внезапной сердечной смерти.
Симптомы алкогольной кардиомиопатии
Начало заболевания характеризуется неспецифическими проявлениями, возникающими вследствие функциональных нарушений деятельности различных органов и систем через 4-5 лет после систематического употребления больших объемов спиртных напитков. Больные жалуются на быструю утомляемость после незначительных физических нагрузок, слабость, сонливость, повышенное потоотделение. При интенсивной нагрузке возможны продолжительные боли в грудной клетке, в области затылка. Нарушения ритма представлены экстрасистолией, тахикардией, ощущением замирания сердца. Вегетативные расстройства включают чувство жара, дрожание рук, покраснение кожи лица, возбужденность или заторможенность. Обычно симптомы появляются на следующий день после алкогольного эксцесса. В период воздержания от алкоголя интенсивность проявлений снижается. Симптоматика может сохраняться до 10 лет.
При продолжении систематического потребления этанолсодержащих напитков развивается гипертрофия миокарда, быстро сменяющаяся дилатацией. Камеры сердца расширяются, их сократительная способность снижается, что становится причиной сердечной недостаточности, застоя крови в малом и большом круге кровообращения. Наблюдается постоянная одышка, к клинической картине заболевания добавляются приступы удушья в ночное время, отеки нижних конечностей, кашель (сухой или с небольшим количеством светлой мокроты). Может выявляться синюшность, похолодание рук, ног.
При отсутствии лечения на фоне кардиомиопатии развиваются необратимые структурные изменения внутренних органов. Из-за расстройств циркуляции нарушается работа почек, в организме накапливаются токсичные продукты обмена, негативно влияющие на деятельность ЦНС и внутренних органов. Поражение нервной системы ведет к энцефалопатии, проявляющейся снижением когнитивных функций, немотивированной агрессией, озлобленностью, неуверенной походкой, нарушениями сна. На терминальной стадии наблюдаются грубые нарушения со стороны нервной системы, прогрессирование сердечной, почечной и печеночной недостаточности, приводящее к гибели больного.
Осложнения
При алкогольном поражении миокарда отмечается высокий риск возникновения осложнений, в том числе – жизнеугрожающих. Наиболее распространенным последствием является критическое нарушение ритма — фибрилляция желудочков, которая характеризуется неэффективными сокращениями и без медицинской помощи приводит к остановке сердца. На фоне функциональной недостаточности сердечной мышцы замедляется движение крови в камерах, нарушаются ее реологические свойства, повышается вероятность тромбоэмболических осложнений с развитием инсульта, инфаркта миокарда, острой почечной недостаточности, некроза различных отделов ЖКТ.
Диагностика
Диагностику данной патологии осуществляет терапевт или кардиолог. Поскольку пациенты часто скрывают факт злоупотребления спиртными напитками, при подозрении на кардиомиопатию алкогольного генеза опрашивают родственников больных, при выявлении соответствующей этиологии назначают консультацию нарколога для выбора оптимальной тактики лечения зависимости. Перечень диагностических мероприятий включает:
- Объективное обследование. Может обнаруживаться беспокойное или заторможенное поведение, синюшность кончиков пальцев, носа, ушей, верхней части грудной клетки. При пальпации отмечается повышенная потливость, отеки и похолодание конечностей, набухание и пульсация сосудов шеи. Увеличение размеров сердца при перкуссии свидетельствует о гипертрофии или дилатации его камер. Аускультативно определяются патологические шумы, характерные для структурных изменений миокарда, клапанов.
- Электрокардиография. Является базовым инструментальным методом исследования, позволяет выявить нарушения ритма, получить данные об органическом поражении миокарда, предположить его токсическую этиологию. ЭКГ может дополняться суточным мониторированием по Холтеру. При отсутствии противопоказаний назначают велоэргометрию.
- Эхокардиография. ЭхоКГ применяется для оценки состояния коронарных артерий и клапанного аппарата, обнаружения гипертрофии и дилатации миокарда, снижения скорости кровотока, определения давления в камерах. Выполняется для дифференциальной диагностики кардиомиопатии и перикардитов.
- Рентгенография ОГК. На рентгенограммах грудной клетки визуализируются признаки увеличения камер сердца, реже дилатация восходящей аорты. Методика используется для уточнения состояния других крупных сосудов, выявления патологических образований. На основании снимков можно заподозрить пороки клапанов.
Дифференциальная диагностика кардиомиопатии алкогольной этиологии проводится с заболеваниями со сходной клинической картиной: стенокардией, ишемической болезнью сердца, инфарктом миокарда, расслаивающейся аневризмой аорты, плевритом, пневмонией. Исключаются другие виды кардиомиопатий: рестриктивная, гипертрофическая, аритмогенная дисплазия правого желудочка.
Лечение алкогольной кардиомиопатии
Комплексная терапия заболевания включает прекращение употребления этанолсодержащих напитков, борьбу с сердечной недостаточностью, коррекцию расстройств метаболизма, восстановление функций других органов. Положительный эффект от курсового лечения возможен на ранней стадии болезни при отсутствии необратимых нарушений. На поздних этапах необходим непрерывный прием лекарственных препаратов. Выделяют следующие направления лечения кардиомиопатии:
- Изменение образа жизни. Предусматривает полный отказ от алкоголя, исключение курения. Назначается диета с большим количеством белка, ограничением соли и жиров. Предпочтение отдается приготовленным на пару, тушеным или отварным блюдам, питание осуществляется небольшими порциями 4-6 раз в день. Суточное потребление жидкости составляет не более 1,5 литров. Важны достаточные физические нагрузки, здоровый сон, снижение уровня стресса.
- Медикаментозная терапия. Является основой лечения заболевания, предусматривает использование нескольких групп препаратов, которые назначаются индивидуально с учетом симптоматики. Для нормализации артериального давления применяются антигипертензивные средства, для предотвращения нарушений ритма — антиаритмики, для устранения отеков – мочегонные, для снижения уровня холестерина крови — статины. При тяжелом течении план лечения дополняют сердечными гликозидами для купирования приступов тахиаритмий, антиагрегантами и антикоагулянтами для предотвращения тромбоэмболических осложнений.
- Хирургическое вмешательство. При неэффективности консервативной терапии, быстром прогрессировании алкогольной кардиомиопатии с высоким риском развития опасных осложнений рассматривается вопрос о трансплантации сердца. Метод обеспечивает высокую 10-летнюю выживаемость (порядка 75%), применяется при удовлетворительном состоянии организма, отсутствии грубых психических и интеллектуальных нарушений. Недостатками методики являются травматичность, высокая стоимость, дефицит донорских органов.
Прогноз и профилактика
На ранних стадиях заболевания при условии полного отказа от алкоголя и своевременном начале лечения прогноз благоприятный. При развитии необратимых изменений сердечной мышцы отмечается существенное сокращение продолжительности жизни. Профилактика кардиомиопатии является не только медицинской, но и социальной задачей, включает в себя меры по борьбе с алкоголизмом: информирование населения об основных принципах здорового образа жизни, ограничение рекламы алкогольных напитков и их распространения среди молодежи на законодательном уровне. Превентивные меры также предполагают доведение до общественности сведений о последствиях длительной алкогольной интоксикации, ее влиянии на сердце, другие органы и системы.
Аритмогенная правожелудочковая кардиомиопатия — причины, симптомы, диагностика и лечение

Аритмогенная правожелудочковая кардиомиопатия – заболевание предположительно генетической природы, характеризующееся структурными изменениями правого желудочка и развитием аритмии. Варианты течения варьируются от бессимптомных форм до форм с выраженной тахиаритмией, экстрасистолией, кардиалгией и сердечной недостаточностью. Диагностика осуществляется при помощи эхокардиографических, электрокардиографических, магнитно-резонансных исследований, а также биопсии миокарда. Специфическое лечение отсутствует, терапия сводится к устранению аритмии и застойной сердечной недостаточности. При отсутствии эффекта медикаментозной терапии применяют имплантацию кардиовертер-дефибриллятора.
Общие сведения
Аритмогенная правожелудочковая кардиомиопатия (аритмогенная дисплазия правого желудочка, аритмогенная болезнь правого желудочка, АП КМП) – заболевание, поражающее стенку правого желудочка, при котором в толще миокарда формируются патологические очаги жировой и фибринозной инфильтрации, иногда с присоединением воспаления (миокардит). Патология была описана под названием «аритмогенная дисплазия правого желудочка» в 1977 году G. Fontaine, после этого исследования продолжил F. I. Marcus, который в 1982 году дал заболеванию современное название.
Встречаемость в различных регионах колеблется в пределах 1-6:10000 жителей; среди обнаруженных больных подавляющее большинство составляют мужчины младше 40 лет, половое распределение — 4:1. Имеет тенденцию к наследственной передаче, поэтому в настоящее время большинство форм АП КМП определяют как аутосомно-доминантное заболевание с неполной пенетрантностью. Интерес к заболеванию резко возрос в связи с выявлением его роли в развитии внезапной сердечной смерти. Так, гистологические исследования миокарда у детей и подростков до 20 лет, причиной смерти которых явилась сердечно-сосудистая патология, показали, что изменения, ассоциированные с АП КМП, были обнаружены в 26% случаев.

Аритмогенная правожелудочковая кардиомиопатия
Причины
В настоящий момент общепризнанной точки зрения на причины развития АП КМП нет ввиду гетерогенности проявлений заболевания. Возможно, АП КМП объединяет в себе несколько схожих по проявлениям патологий с различной этиологией. Но единственной документально подтвержденной теорией на сегодняшний день является наследственная, объясняющая возникновение аритмогенной правожелудочковой кардиомиопатии генетической мутацией.
При изучении генома больных АП КМП были выявлены аномалии генов в 12-й, 14-й, 17-й и 18-й хромосомах – указанные гены кодируют такие белки миокарда как альфа-актин, десмоплакин, плакоглобин, плакофиллин и другие. Нарушения структуры этих белков ведут к понижению устойчивости кардиомиоцитов к повреждающим факторам, что и приводит со временем к жировой инфильтрации. Однако главную роль в развитии аритмии при АП КМП играет нарушение функций белка десмосом, в результате чего распространение возбуждения по миокарду изменяется.
В некоторых случаях вместо очаговой жировой инфильтрации стенок правого желудочка наблюдается фибринозная, имеющая воспалительный характер и в целом напоминающая картину при вирусном миокардите, вызванном вирусом Коксаки и др. Такая форма имеет тенденцию к распространению на левый желудочек и характеризуется тяжелым течением, часто приводящим к смерти больного. С точки зрения наследственной теории развития АП КМП, считается, что мутации генов повышают предрасположенность миокарда к поражению вирусами.
Большинство мутаций наследуются по аутосомно-доминантному типу с пенетрантностью 30-50%. Одна крайне редкая форма аритмогенной правожелудочковой кардиомиопатии (болезнь Наксоса — описано всего 25 случаев) имеет аутосомно-рецессивный характер и высокую пенетрантность – более 90%. Гомозиготы по мутантному гену страдают от злокачественной желудочковой аритмии и часто умирают в детстве или подростковом возрасте.
Классификация
Ввиду выраженной гетерогенности клинических форм АП КМП неоднократно принимались попытки систематизировать и классифицировать виды этого заболевания. В настоящее время выделяют следующие типы аритмогенной правожелудочковой кардиомиопатии:
- Чистая, или эталонная, форма.
- Болезнь Наксоса, характеризующая аутосомно-рецессивным наследованием и злокачественными желудочковыми аритмиями.
- Венецианская кардиомиопатия – нередко распространяется на стенку левого желудочка, имеет выраженный наследственный характер (пенетрантность около 50%), больные могут умереть в детском возрасте.
- Болезнь Покури – форма АП КМП, выявленная в Японии, служит причиной внезапной сердечной смерти подростков.
- Тахикардия, вызванная очагом возбуждения в правом желудочке без экстрасистол или проявлений сердечной недостаточности.
- Редкие желудочковые экстрасистолы, источник которых – очаг возбуждения в стенке правого желудочка, ассоциируемый с участком воспаления. Такая форма АП КМП может осложняться миокардитом с летальным исходом.
- Аномалия Уля – редкая форма АП КМП, характеризующая нарастанием сердечной недостаточности и смертью. При гистологическом исследовании сердца обнаруживается полное замещение кардиомиоцитов жировой и фибринозной тканью.
- Неаритмогенная форма – в большинстве случаев ничем себя не проявляет, именно с ней ассоциируют бессимптомные случаи внезапной сердечной смерти.
Симптомы аритмогенной кардиомиопатии
Клинические формы АП КМП разделяются на четыре основные группы. При бессимптомной форме патология никак не проявляет себя при жизни больного, в том числе и при электрокардиографических исследованиях. Аритмическая форма характеризуется развитием тахиаритмии, желудочковой экстрасистолии и появлением других электрокардиографических признаков. Субъективные симптомы, как правило, отсутствуют. При развитии выраженной клинической формы на фоне тахиаритмий возникают кардиалгии, приступы сердцебиения, головокружения. Наиболее тяжелым типом клинических проявлений АП КМП является развитие сердечной недостаточности по правожелудочковому типу с характерным симптомокомплексом – венозным застоем, отеками, асцитом. При этом сердечная недостаточность может протекать как на фоне нарушения ритма сердца, так и без него.
В некоторых случаях эти группы отражают стадийность развития нарушений, обусловленных аритмогенной правожелудочковой кардиомиопатией. Однако у одних больных развитие патологии может длиться годами, тогда как у других от бессимптомной формы до сердечной недостаточности может пройти менее месяца. Кроме того, при любой из форм или любом этапе АП КМП возможен летальный исход из-за фибрилляции желудочков, аномалии Уля или молниеносного вирусного миокардита.
Диагностика
Для диагностики АП КМП в кардиологии используется весь спектр современных методик исследования функции сердца. На ЭхоКГ определяется конечный диастолический размер (КДР) и конечный систолический размер (КСР) желудочков, после чего эти данные сравниваются между собой. Если отношение КДР правого желудочка к КДР левого составляет 0,5 и более, это свидетельствует в пользу наличия АП КМП. К ЭКГ-признакам аритмогенной правожелудочковой кардиомиопатии относятся удлинение желудочкового комплекса свыше 110 мс на отведении V1, эпсилон-волна на сегменте ST в отведениях V1-V3, инверсия зубца Т в грудных отведениях из-за замедления деполяризации правого желудочка, а также наличие тахиаритмии и желудочковых экстрасистол.
На рентгеноконтрастной вентрикулографии можно определить дилятацию правого желудочка, причем в ряде случаев прямо визуализируется выпячивание (аневризма) в области очага фибролипозной дисплазии миокарда. В последние годы для специфической диагностики АП КМП применяется магнитно-резонансная томография с гадолиниевым контрастированием, позволяющая не только получить трехмерное изображение сердца, но и дифференцировать жировые и фибринозные очаги от неизмененного миокарда. Для уточнения диагноза практикуют биопсию миокарда с последующим гистологическим изучением тканей – при АП КМП будет наблюдаться жировая инфильтрация, изменение цвета и формы десмосом, а также уменьшение их количества.
Важным признаком является семейный характер симптомов или наличие у больного родственников, скончавшихся от внезапной сердечной смерти или фибрилляции желудочков. Дифференциальную диагностику производят с идиопатическими формами желудочковых тахиаритмий.
Лечение аритмогенной правожелудочковой кардиомиопатии
Медикаментозное лечение АП КМП включает в себя антиаритмические препараты (амиодарон, соталол). Снижение выраженности тахиаритмий играет важную роль в сохранении жизни пациента, контроль эффективности препаратов кардиолог производит при помощи холтеровского мониторинга. В тех случаях, когда медикаментозная терапия малоэффективна, прибегают к имплантации кардиовертер-дефибриллятора или кардиостимулятора. При развитии сердечной недостаточности используют ингибиторы АПФ, карведилол.
Разрабатываются техники хирургического лечения аритмогенной правожелудочковой кардиомиопатии (вентрикулотомия), которые сводятся к удалению патологических очагов с ушиванием миокарда. Первые результаты таких операций оптимистичны, однако рецидивы возникают в 30-40% случаев. При выраженной сердечной недостаточности эффективным методом лечения будет трансплантация сердца.
Прогноз и профилактика
Прогноз неопределенный по причине высокой вариабельности проявлений АП КМП. Фибрилляция желудочков с летальным исходом может развиться в любой момент, особенно при отсутствии лечения. При регулярной антиаритмической терапии риск летального исхода снижается примерно на треть. Наилучшие результаты показывает сочетание кардиостимуляторов и медикаментозной терапии, которое снижает риск возникновения летальной фибрилляции практически до нуля. При развитии сердечной недостаточности прогноз, как правило, неблагоприятный.
Диабетическая кардиомиопатия — причины, симптомы, диагностика и лечение

Диабетическая кардиомиопатия ‒ это совокупность патологических изменений в сердце, обусловленных метаболическими, сосудистыми и электролитными нарушениями при сахарном диабете. Клиника данного состояния разнообразна ‒ от бессимптомного течения до выраженной сердечной недостаточности с одышкой, отеками, кардиалгией, акроцианозом. Диагностика включает электрокардиографию, эхокардиографию, сцинтиграфию миокарда с таллием-201, функциональные пробы. Лечение комплексное, с обязательной коррекцией уровня глюкозы в крови и применением кардиопротективных средств, препаратов калия, тиазолидиндионов и статинов.
Общие сведения
Диабетическая кардиомиопатия (ДК) выделена как отдельное заболевание в 1973 году. Она может возникать при любом типе сахарного диабета (СД), а также диагностироваться у детей, если при беременности их матери страдали гипергликемией. Нередко это состояние регистрируется спустя 10-15 лет после выявления повышенного уровня сахара. Однако срок развития патологии очень вариабелен, так как зависит от ряда факторов ‒ типа диабета, схемы его лечения, диеты, наличия иных предрасполагающих факторов. По статистике, поражение сердца служит причиной летального исхода примерно у 20-25% больных со стойкой гипергликемией. Но данные цифры часто оспариваются, поскольку четко разграничить причины кардиомиопатии у пациентов с диабетом не всегда удается.

Диабетическая кардиомиопатия
Причины
Недостаточная выработка инсулина (1-й тип СД) или ослабление его воздействия на ткани (2-й тип СД) пагубно влияют на сердечно-сосудистую систему, что является важнейшей причиной развития кардиомиопатии. Существуют определенные предпосылки, увеличивающие вероятность поражения сердца при диабете, обусловленные как внешними, так и внутренними факторами. Это объясняет тот факт, что ДК развивается не у всех больных сахарным диабетом, а только у их части. Выделяют три основные группы причин возникновения данной патологии:
- Нарушение режима лечения и питания. Пренебрежение рекомендациями врача-эндокринолога является наиболее распространенным фактором развития ДК. В случае несоблюдения диеты концентрация глюкозы периодически повышается, что способствует повреждению кардиомиоцитов. Аналогично неправильное использование гипогликемических средств может нарушать микроциркуляцию в тканях сердца, приводя к их ишемии.
- Декомпенсация сахарного диабета. В тяжелых случаях при стойком повышении уровня глюкозы развивается поражение миокарда. Расстройство работы иных органов и систем (например, печени, почек, нейровегетативной системы) опосредованно также приводит к увеличению нагрузки на сердце. Поэтому при прогрессирующем диабете практически всегда возникает ДК, осложняя общую картину заболевания.
- Диабетическая эмбриофетопатия. При наличии у беременной женщины декомпенсированного диабета может поражаться сердце плода – возникает достаточно редкое детское заболевание, характеризующееся врожденной кардиомегалией и аритмией. Это происходит как из-за гипергликемии, так и из-за воздействия инсулина и гипогликемических препаратов на развитие ребенка
Кроме того, сахарный диабет является одним из факторов риска возникновения атеросклероза, поражающего коронарные сосуды. Однако многими авторами ишемическая болезнь сердца, развивающаяся из-за диабета и атеросклероза, не относится к истинной диабетической кардиомиопатии. Редкой причиной ДК выступают также повреждения сердца в результате использования некачественных гипогликемических средств (например, плохо очищенных препаратов инсулина).
Патогенез
В развитии диабетической кардиомиопатии принимают участие три патогенетических механизма – метаболический, ангиопатический и нейровегетативный. Наиболее значим первый вариант ‒ инсулиновая недостаточность приводит к энергетическому дефициту внутри кардиомиоцитов, которые компенсируют его процессами протеолиза и липолиза.
В результате внутри сердечной мышцы происходит накопление продуктов распада липидов и аминокислот, что влечет за собой увеличение выработки NO и других медиаторов воспаления. Кислотно-основное равновесие в тканях смещается к ацидозу, изменяя трансмембранный потенциал и концентрацию неорганических ионов. Это снижает автоматизм и приводит к нарушению проводимости в сердце. Одновременно в тканях увеличивается количество гликозилированных белков и протеогликанов, затрудняющих доставку кислорода к клеткам и усугубляющих недостаток энергии.
Ангиопатический механизм повреждения миокарда при диабете может развиваться как изолированно, так и в сочетании с метаболическими расстройствами. Резкие колебания уровня инсулина стимулируют рецепторы, активизирующие пролиферацию гладкомышечного слоя коронарных сосудов. Это приводит к их сужению и дополнительному снижению перфузии миокарда. Итогом данного процесса является микроангиопатия, осложняющаяся повреждением эндотелия и усугубляющая ишемические явления. Также происходит разрастание аномального коллагена в тканях сердечной мышцы, что изменяет ее плотность и эластичность.
Дистрофия нейровегетативной системы, затрагивающая сердце, возникает на конечных этапах развития ДК. Как правило, прямое поражение кардиомиоцитов и сосудов развивается раньше. В результате гипергликемии, а также диабетического гепатоза (при глубокой декомпенсации сахарного диабета) происходит повреждение вегетативной нервной системы. Ее волокна демиелинизируются, а центры могут повреждаться в результате недостатка глюкозы и кетоацидоза. На этом фоне возникает вагусная денервация сердца, проявляющаяся нарушением ритма его сокращений. Совокупность этих процессов приводит к ишемической болезни, увеличению объема миокарда и в конечном итоге ‒ к сердечной недостаточности.
Классификация
В практической кардиологии выделяют несколько разновидностей диабетической кардиомиопатии, классификация основана на этиологических и патогенетических особенностях заболевания. Несмотря на то, что в развитии патологии задействованы сразу несколько механизмов, обычно один из них выражен сильнее остальных. Знание ведущего сценария патогенеза позволяет специалисту скорректировать лечение для большей его эффективности у конкретного больного. В настоящее время известно три формы ДК:
- Первичная форма. При этом варианте основную роль в поражении миокарда играют метаболические расстройства, связанные с накоплением в тканях продуктов метаболизма жиров и гликозилированных протеинов. Является распространенным видом болезни, но зачастую характеризуется бессимптомным течением и случайно выявляется при обследовании пациента, страдающего сахарным диабетом.
- Вторичная форма. Может возникать изначально или в результате прогрессирования метаболических нарушений. При этом типе поражаются коронарные артериолы, ухудшается микроциркуляция, снижается перфузия, и появляется ишемия миокарда. Некоторые кардиологи относят к этому варианту и коронарный атеросклероз диабетической этиологии.
- Эмбриофетопатический тип. Редкая форма, диагностирующаяся у детей, матери которых страдали от сахарного диабета. Многими специалистами оспаривается отношение данной патологии к диабетической кардиомиопатии.
Симптомы диабетической кардиомиопатии
С момента начала поражения сердца до первых симптомов заболевания может пройти длительное время ‒ от нескольких месяцев до 4-6 лет. Чаще всего больные жалуются на боли в области сердца, напоминающие ишемические ‒ давящее ощущение в левой половине грудной клетки. Однако их выраженность намного слабее, нежели при стенокардии, также не характерна иррадиация в шею, зону лопатки, левую руку. Первоначально кардиалгия появляется после физической нагрузки или пропуска приема инсулина, но в дальнейшем может возникать и в спокойном состоянии. Важным диагностическим признаком является отсутствие реакции на прием нитратов ‒ нитроглицерин не устраняет болевые ощущения.
У части пациентов болевой синдром не развивается, но имеет место одышка, акроцианоз, головокружение ‒ они также возникают как на фоне нагрузок, так и без таковых. Длительность приступа составляет от нескольких минут до 1-3 часов, после чего (на начальных этапах заболевания) кардиальные симптомы ослабевают. При запущенных формах ДК больные указывают на практически постоянную боль в груди, слабость, головокружение и головные боли. Даже самые слабые нагрузки (подъем по лестнице, ускоренный шаг) вызывают сильную одышку, кашель и усиление неприятных ощущений.
Осложнения
При отсутствии лечения, продолжении нарушения пищевого режима, некорригируемой гипергликемии диабетическая кардиомиопатия приводит к нарастающей сердечной недостаточности застойного характера. В результате этого может развиваться кардиогенный отек легких и дистрофия печени. Данные явления значительно усугубляют течение сахарного диабета и угрожают жизни больного. Слабость миокарда также способствует нарушению микроциркуляции, особенно на дистальных участках конечностей, что в комплексе с микроангиопатией ведет к образованию трофических язв и гангрены. Хроническая ишемия миокарда значительно облегчает развитие инфаркта, мелко- и крупноочагового кардиосклероза.
Диагностика
Для успешного лечения диабетической кардиомиопатии важна ранняя диагностика, поскольку это значительно снижает риск осложнений и замедляет прогрессирование патологии. С этой целью больным сахарным диабетом следует регулярно проходить обследование у кардиолога даже при отсутствии субъективных симптомов. В клинической практике используют множество методик, позволяющих дифференцировать ДК от иных сердечно-сосудистых заболеваний и определить тип и стадию болезни для разработки эффективной схемы лечения. Наиболее часто при кардиомиопатии применяют следующие диагностические техники:
- Электрокардиография. Простой и эффективный метод мониторинга сердечной активности и выявления ранних изменений в сердечной мышце. У больных с ДК картина ЭКГ схожа с ишемической болезнью ‒ смещение сегмента ST, сглаживание комплекса QRS, деформация зубца Т. По мере прогрессирования патологии также возможно снижение вольтажа, изменение электрической оси сердца, аритмия.
- Эхокардиография. При ЭхоКГ выявляется утолщение стенок желудочков, увеличение общей массы сердца и изменение плотности миокарда. Одновременно обнаруживается снижение сократительной способности сердечной мышцы и объема выброса крови. При длительном течении патологии возможно увидеть признаки дилатационной кардиомиопатии или очагового кардиосклероза.
- Радиосцинтиграфия. Радионуклидное изучение поступления крови к тканям сердца производится при помощи РФП, содержащих таллий-201. Перфузионная сцинтиграфия миокарда позволяет выявить наиболее ранние признаки коронарной микроангиопатии (вторичной ДК) на основании снижения поступления препарата в миокард. Однако на ранних этапах первичной диабетической кардиомиопатии результаты теста могут быть неоднозначными.
При легких формах заболевания нередко назначают велоэргометрию для обнаружения изменений на ЭКГ в период физических нагрузок, что позволяет уточнить диагноз. Также больным проводится биохимический анализ крови, в рамках которого определяется уровень глюкозы, липопротеидов, сердечных и печеночных ферментов. Коронарография необходима при подозрении на атеросклероз сосудов сердца. Все эти методики позволяют отличить ДК от ишемической болезни и других состояний, прямо не связанных с сахарным диабетом.
Лечение диабетической кардиомиопатии
Терапия этого состояния многокомпонентная и неразрывно связана с лечением основного заболевания ‒ сахарного диабета. Адекватная диета, постоянный контроль уровня сахара в крови, устранение резких скачков уровня инсулина даже без приема сердечных препаратов способны значительно улучшить состояние больного. Но в ряде случаев ДК обнаруживается уже в довольно запущенном состоянии, требующем вмешательства врача-кардиолога. Для замедления прогрессирования и лечения кардиомиопатии при диабете используют следующие группы препаратов:
- Тиазолидиндионы. Эти гипогликемические препараты избирательно замедляют деление гладкомышечных клеток коронарных артериол, препятствуя уменьшению их просвета и ухудшению перфузии миокарда. Однако их допустимо использовать лишь при доказанном поражении микроциркуляторной сети сердца – в редких случаях они могут вызывать кардиопатическое воздействие, причины которого неясны.
- Препараты калия. При ДК следствием метаболических расстройств является нехватка ионов калия в кардиомиоцитах. Его дефицит также может быть обусловлен повышенным диурезом, что нередко наблюдается при диабете, нарушением диеты, приемом некоторых лекарств. Препараты калия пополняют количество микроэлемента в организме, нормализуя электролитный состав и мембранный потенциал клеток миокарда.
- Статины. У ряда больных наблюдается гиперлипидемия, которая повышает риск развития атеросклероза, осложняющего течение кардиомиопатии. Данные средства, например, аторвастатин, снижают уровень опасных ЛПНП, а также способствуют элиминации из тканей сердца продуктов расщепления жиров. В долгосрочной перспективе использование статинов увеличивает продолжительность жизни больных диабетом и резко уменьшает риск инфарктов и инсультов.
- Бета-адреноблокаторы. Их назначают при выраженных ишемических изменениях в миокарде или развитии тахиаритмии. Они снижают частоту сердечных сокращений и уменьшают потребность миокарда в кислороде, улучшая его метаболизм. Особенно актуально использование бета-блокаторов при дистрофии вегетативных нервов, которые в норме способствуют снижению частоты сердечных сокращений.
По показаниям могут применяться различные гипогликемические средства (особенно при диабете 2-го типа), ингибиторы АПФ, блокаторы кальциевых каналов, антиоксиданты. При наличии застойной сердечной недостаточности и развитии отеков назначают диуретические препараты с постоянным контролем ионного состава плазмы крови. В качестве поддерживающего лечения при сложных формах кардиомиопатии используют сердечные гликозиды.
Прогноз и профилактика
Прогностические перспективы диабетической кардиомиопатии тесно связаны с течением основного заболевания. При адекватной гипогликемической терапии, включающей как прием препаратов, так и образ жизни больного, скорость прогрессирования патологии существенно замедляется, а использование кардиопротективных средств помогает устранить кардиальные симптомы. В то же время, игнорирование болезни и пренебрежение к пищевому режиму на фоне сахарного диабета может привести к тяжелой сердечной недостаточности.
Профилактика ДК сводится к недопущению повышения уровня глюкозы и предотвращению развития декомпенсации диабета, регулярному наблюдению у эндокринолога. Особенно важно соблюдать эти правила беременным женщинам ‒ их дети могут получить внутриутробное поражение сердца.
