Антитромбин III в Москве недорого
Антитромбин III — это белок, который препятствует процессу свертывания крови. Этот лабораторный показатель крови применяют для детального анализа состояния системы гомеостаза в организме человека. Любые сбои в ее работе приводят к эмболиям, тромбозам, кровотечениям. Антитромбин в качестве естественного коагулянта позволяет постоянно поддерживать кровь в жидком состоянии.
Активность антитромбина резко повышается при взаимодействии с гепарином и подобными ему молекулами. Также увеличение его активности может быть связано с менструальным кровотечением, процедурой трансплантации почек, вирусным гепатитом, панкреатитом, раком поджелудочной железы, приемом стероидов и не прямых антикоагулянтов.
Снижение количества антитромбина III является:
- одним из вариантов аномалии — снижения чувствительности белка к гепарину,
- врожденным дефицитом данного элемента,
- следствием перенесенных множественных травм, ДВС-синдрома, заболеваний печени, тромбоэмболии, карциномы легких,
- следствием тяжелых родов и гестоза
- следствием приема кортикостероидов, оральных контрацептивов.

Антитромбин, норма которого в крови является гарантией нормального функционирования всего организма, является одним из важнейших показателей при диагностике общего состояния организма.
Кому назначается анализ на антитромбин 3?
Определение уровня активности АТ 3 осуществляется в рамках коагулограммы. Такой лабораторный анализ назначается пациентам:
- при беременности, когда у женщины есть трудности с нормальным вынашиванием ребенка,
- при планировании оперативного вмешательства,
- в случае выявления врожденного дефицита антитромбина III,
- для мониторинга эффективности лечения с использованием гормональных контрацептивов или гепарина,
- для диагностики сбоев в работе системы гомеостаза после инсульта или инфаркта, а также при тромбозе вен.
Антитромбин 3: норма в крови.
Для каждого возраста норма антитромбина 3 в крови у женщин и мужчин отличается, поэтому вашему лечащему врачу стоит уделить особое внимание расшифровке результатов анализа. Их вы можете лично забрать из клиники или получить на свой адрес электронной почты — мы делаем все возможное, чтобы прохождение лабораторных исследований было для наших клиентов максимально комфортным.
Их вы можете лично забрать из клиники или получить на свой адрес электронной почты — мы делаем все возможное, чтобы прохождение лабораторных исследований было для наших клиентов максимально комфортным.
ОБЩИЕ ПРАВИЛА ПОДГОТОВКИ К АНАЛИЗАМ КРОВИ
Кровь берется из вены. Необходимо соблюдать общие рекомендации:
- кровь сдается утром натощак или не ранее, чем через 2–4 часа после приема пищи;
- допускается употребление воды без газа;
- накануне анализа следует отказаться от алкоголя, исключить физическое и эмоциональное перенапряжение;
- отказаться от курения за 30 минут до исследования;
- не стоит сдавать кровь в период приема медикаментов, если врач не назначил иное.
Антитромбин III у критически больных пациентов
Актуальность
Антитромбин это маленькая белковая частица, вырабатываемая печенью. Он дезактивирует некоторые вещества, которые влияют на способность крови образовывать тромбы. Его активность многократно увеличивается под действием гепарина — лекарства, которое повышает связывание антитромбина с факторами свертывания крови так, что кровь не образовывает сгустки (тромбы). Антитромбин также уменьшает воспаление в организме человека. Воспаление является попыткой организма к самозащите, чтобы удалить вредоносные раздражители и начать процессы заживления. Следовательно, воспаление не всегда является плохим процессом.
Его активность многократно увеличивается под действием гепарина — лекарства, которое повышает связывание антитромбина с факторами свертывания крови так, что кровь не образовывает сгустки (тромбы). Антитромбин также уменьшает воспаление в организме человека. Воспаление является попыткой организма к самозащите, чтобы удалить вредоносные раздражители и начать процессы заживления. Следовательно, воспаление не всегда является плохим процессом.
Этот обновленный обзор оценил эффекты антитромбина у людей, выздоравливающих после перенесённых критических заболеваний. Наша основная цель заключалась в изучении вопроса: изменилось ли число умерших при введении антитромбина. Мы также исследовали, было ли больше осложнений среди людей, леченных этим лекарством, степень кровотечений и объём крови, введённый критически больным людям. Наконец, мы изучили влияние антитромбина на продолжительность респираторной терапии, длительность пребывания в отделениях интенсивной терапии и в больнице в целом.
Характеристика исследований
В этот обновленный обзор мы включили 30 клинических испытаний с 3933 участниками (3882 в наши расчеты данных).![]() Мы расценили качество клинических испытаний в целом как низкое, с малой информацией о том, как эти эксперименты проводились. Результаты были ограничены, и включенные в обзор испытания были в основном небольшие. В большинстве испытаний был высокий риск вводящей в заблуждение информации. Поэтому, эти результаты следует интерпретировать с осторожностью. Доказательства актуальны на 28 августа 2015 года.
Мы расценили качество клинических испытаний в целом как низкое, с малой информацией о том, как эти эксперименты проводились. Результаты были ограничены, и включенные в обзор испытания были в основном небольшие. В большинстве испытаний был высокий риск вводящей в заблуждение информации. Поэтому, эти результаты следует интерпретировать с осторожностью. Доказательства актуальны на 28 августа 2015 года.
Источники финансирования исследований
Три из 30 включенных испытаний сообщали о получении денег от фармацевтических компаний.
Основные результаты
В нашем обзоре мы не могли определить явное преимущество антитромбина для задач, которые мы исследовали, в целом или среди различных типов пациентов или подгрупп. В нашем исследовании событий, связанных с кровотечениями, однако, мы обнаружили повышенный риск кровотечений у пациентов, лечённых антитромбином.
Качество доказательств
В целом качество доказательств из этих исследований было средним для всех результатов. Мы пришли к выводу, что существует необходимость в широкомасштабных клинических испытаниях с низким риском смещения (вводящей в заблуждение информации) по исследованию преимуществ и вреда этого лекарства у критически больных пациентов.
Мы пришли к выводу, что существует необходимость в широкомасштабных клинических испытаниях с низким риском смещения (вводящей в заблуждение информации) по исследованию преимуществ и вреда этого лекарства у критически больных пациентов.
Антитромбин III (определение уровня в плазме крови)
Значение анализов
Антитромбин III (антитромбин, ATIII) – белок крови, предотвращающий избыточное свертывание.
Где образуетсяАнтитромбин синтезируется в клетках печени и эндотелия сосудов.
На что действует
Действует как антикоагулянт (противосвертывающее действие) путем прямого связывания и инактивирования факторов свертывания крови (VIIа, XIa, Xа, IXа, XIIа, тромбина). Одной из основных мишеней является тромбин (что отражено в названии анти-тромбин).
При самостоятельном действии антитромбина III его эффект нарастает медленно.
Гепарин связывает антитромбин III, что вызывает изменение его структуры. Это приводит к усилению связывания антимтромбина III и факторов свертывания крови в 1000 и более раз. Связанные факторы не принимают участия в каскаде свертывания крови.
Это приводит к усилению связывания антимтромбина III и факторов свертывания крови в 1000 и более раз. Связанные факторы не принимают участия в каскаде свертывания крови.
Дефицит антитромбина III
Дефицит ATIII может быть наследственным или приобретенным. Наиболее частым клиническим проявлением наследственного дефицита ATIII является развитие тромбоза глубоких вен и, как следствие этого, тромбоэмболии легкого. Вероятность развития тромботических осложнений у больных с дефицитом ATIII увеличивается с возрастом.
- Врожденный дефицит синтеза антитромбина III
- Прием оральных контрацептивов
- Третий триместр беременности
- Потеря белка при нефротическом синдроме
- Введение гепарина
- Печеночная недостаточность, цирроз печени, хронический активный гепатит
- ДВС-синдром
- Обширный тромбоз
- Повышенный уровень катаболизма белка
Врожденный дефицит с аутосомно-доминантным типом наследования, встречается не часто, только в виде гетерозиготного варианта. Выделяют различные виды этого состояния: дефицит может быть связан с уменьшением количества синтезируемого белка, или ненормальным выполнением функции при сохранении количества.
Выделяют различные виды этого состояния: дефицит может быть связан с уменьшением количества синтезируемого белка, или ненормальным выполнением функции при сохранении количества.
Повышение уровня антитромбина III менее значимо, наблюдается в следующих случаях:
- Воспалительные процессы
- Острый гепатит
- Холестаз
- Дефицит витамина К
- Прием антикоагулянтов
- Патология поджелудочной железы (тяжелый панкреатит, рак)
- Применение анаболических препаратов
К чему ведет дефицит антитромбина III
При дефиците антитромбина III усиливается коагуляционный каскад, в связи с чем возрастает риск развития венозных тромбозов. Низкий уровень антитромбина III в начале беременности может быть причиной развития тромботических поражений плаценты, нарушения плацентарной функции.
Анализ на антитромбин III
Антитромбин III определяется по ингибированию тромбина.
Антитромбин III входит в базовую гемостазиограмму. В этом анализе оцениваются следующие звенья гемостаза:
- Внешний и внутренний пути свертывания крови (протромбиновые показатели, АЧТВ, тромбиновое время)
- Количество фибриногена (фибриноген)
- Оценка антикоагулянтной системы (антитромбин III).
В дополнение к базовой гемостазиограмме могут быть назначены D-димеры(оценка фибринолиза), протеин С (дополнительный тест для оценки антикоагулянтной способности плазмы). Важным при назначении лекарственных средств, влияющих на свертывание крови, является оценка агрегации тромбоцитов с разными индукторами.
Какой уровень антитробина в норме?
Референсные интервалы антитромбина III в Лабораториях ЦИР: 80-120%
В разных лабораториях референсные интервалы могут отличаться.
Основные показания к сдаче анализа на антитромбин III
- Применение или планирование антикоагулянтной терапии
- Планирование беременности
- Подбор оральных контрацептивов
- Планирование серьезных хирургических вмешательств
- Выявление наследственного или приобретенного дефицита антитромбина III
Не забывайте: при склонности к тромбозу надолго сохранить здоровье помогают физическая активность, прекращение курения, правильное питание и своевременное обследование. Все исследования и консультации Вы можете пройти в наших клиниках, а в центре Москвы наш медицицинский центр с фитнес-залом.
Условия сдачи анализа
Натощак (не менее 8 часов).Антитромбин III человеческий инструкция по применению: показания, противопоказания, побочное действие – описание Antithrombin III human лиофилизат д/пригот.
 р-ра д/инф. 1000 МЕ: фл. 1 шт. в компл. с растворителем и набором д/разведен. и введен. (18046)
р-ра д/инф. 1000 МЕ: фл. 1 шт. в компл. с растворителем и набором д/разведен. и введен. (18046)Лечение следует начинать под контролем врача, имеющего опыт лечения пациентов с недостаточностью антитромбина.
При врожденной недостаточности дозу следует подбирать для каждого пациента индивидуально, принимая во внимание семейный анамнез в отношении тромбоэмболических состояний, существующие клинические факторы риска и результаты лабораторных исследований.
В случаях приобретенной недостаточности дозы и продолжительность заместительной терапии зависят от уровня антитромбина в плазме, наличия признаков повышенного метаболизма антитромбина, а также от основного заболевания и степени тяжести клинического состояния. Доза и частота введения всегда устанавливаются на основании клинической эффективности и результатах лабораторных исследований в каждом конкретном случае.
Количество единиц вводимого антитромбина выражается в ME, которые рассчитываются по отношению к действующему стандарту ВОЗ для антитромбина.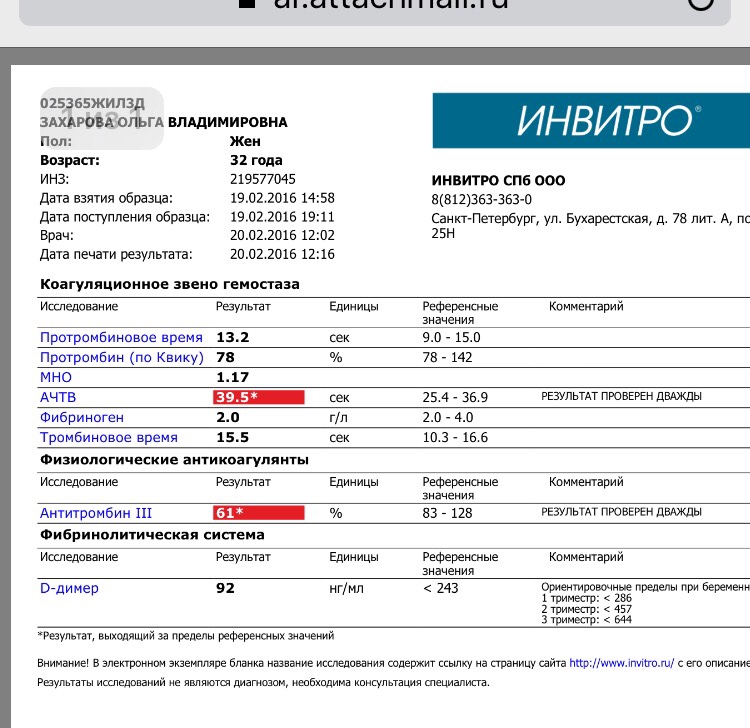 Активность антитромбина в плазме выражают либо в процентах (по отношению к нормальной плазме человека) либо в МЕ (по отношению к международному стандарту антитромбина в плазме).
Активность антитромбина в плазме выражают либо в процентах (по отношению к нормальной плазме человека) либо в МЕ (по отношению к международному стандарту антитромбина в плазме).
1 ME активности антитромбина эквивалентна активности антитромбина в 1 мл нормальной человеческой плазмы. Расчет необходимой дозы антитромбина основан на эмпирических данных о том, что 1 ME антитромбина на 1 кг массы тела повышает активность антитромбина в плазме приблизительно на 2%.
Начальная доза рассчитывается по следующей формуле:
Необходимая доза (ME) = масса тела (кг) × (целевой уровень — исходный уровень активности [%]) × 0.5
Начальная целевая активность антитромбина зависит от клинической ситуации. Если установлено показание заместительной терапии, доза должна быть достаточной для достижения целевой активности антитромбина, а также для поддержания эффективного уровня. Дозу следует определять и контролировать на основании лабораторных измерений активности антитромбина, которые необходимо проводить, по крайней мере, 2 раза в день, предпочтительно непосредственно перед следующим введением. Дозу следует корректировать при наличии лабораторных и клинических признаков повышенного метаболизма антитромбина. Активность антитромбина следует поддерживать на уровне выше 80% на всем протяжении курса лечения, если только клинические особенности не будут указывать на необходимость поддержания другого эффективного уровня.
Дозу следует корректировать при наличии лабораторных и клинических признаков повышенного метаболизма антитромбина. Активность антитромбина следует поддерживать на уровне выше 80% на всем протяжении курса лечения, если только клинические особенности не будут указывать на необходимость поддержания другого эффективного уровня.
Обычно начальная доза при врожденной недостаточности составляет 30-50 МЕ/кг. Впоследствии доза и интервал между введениями, а также длительность лечения должны быть адаптированы к данным биохимических исследований и клинической ситуации.
Применение антитромбина III у детей младше 6 лет изучено недостаточно.
Правила приготовления и введения раствора
Препарат вводят в/в. Максимальная скорость введения составляет 5 мл/мин.
Растворяют содержимое флакона с препаратом Антитромбин III человеческий непосредственно перед введением. С этой целью необходимо использовать только прилагаемый набор для растворения и введения. Полученный раствор необходимо использовать сразу после растворения, т. к. препарат не содержит консервантов. Перед введением раствор необходимо визуально исследовать на наличие посторонних включений или изменение цвета. Не следует использовать мутные растворы или растворы с осадком. Неиспользованный раствор подлежит утилизации в соответствии с установленными правилами.
к. препарат не содержит консервантов. Перед введением раствор необходимо визуально исследовать на наличие посторонних включений или изменение цвета. Не следует использовать мутные растворы или растворы с осадком. Неиспользованный раствор подлежит утилизации в соответствии с установленными правилами.
Приготовление раствора:
1. Подогреть закрытый флакон с растворителем до комнатной температуры (не выше 37°C).
2. Удалить защитные крышечки с флаконов с лиофилизатом и растворителем и продезинфицируйте резиновые пробки на обоих флаконах.
3. Провернуть и затем снять защитный колпачок с одного конца прилагаемой иглы-переходника. Проткнуть свободным концом иглы пробку флакона с растворителем.
4. Удалить защитный колпачок с другого конца иглы-переходника, не прикасаясь к самой игле.
5. Перевернуть флакон с растворителем и проткнуть пробку флакона с лиофилизатом свободным концом иглы. Растворитель перетечет во флакон с лиофилизатом под действием вакуума.
6. Разъединить флаконы, удалив иглу из флакона с препаратом. Легкое покачивание или вращение флакона ускорит растворение порошка.
7. После полного растворения препарата для осаждения пены следует проткнуть пробку флакона с препаратом. Затем удалить воздуховодную иглу.
Введение полученного раствора:
8. Провернуть и затем снять защитный колпачок с прилагаемой иглы-фильтра и наденьте иглу на стерильный одноразовый шприц. Набрать раствор в шприц.
9. Отсоединить иглу-фильтр от шприца и медленно (максимальная скорость введения 5 мл/мин) ввести раствор в/в, используя прилагаемую одноразовую иглу (иглу-«бабочку»).
Антитромбин III (АТ3) — цена анализа в Днипро в ИНВИТРО
Исследуемый материал Плазма (цитрат)
Метод определения Кинетический колориметрический (инактивация FХа, использование хромогенного субстрата).
Анализ антитромбин 3 входит в группу исследований свертываемости крови. Белок антитромбин Ш является основным антикоагулянтом крови, веществом, которое удерживает кровь в жидком состоянии. Образуется в печени, а также в эндотелии сосудов.
Белок антитромбин Ш является основным антикоагулянтом крови, веществом, которое удерживает кровь в жидком состоянии. Образуется в печени, а также в эндотелии сосудов.
Белок ограничивает протекание тромбообразования, предотвращает избыточное сворачивание крови.
Приобретенный или врожденный дефицит антитромбина значительно повышает риск венозного тромбоза.
Для чего сдают анализ Антитромбин III
Кровь на антитромбин Ш сдается для
- определения причины избыточного тромбообразования;
- выявления приобретенного или врожденного дефицита антитромбина.
В диагностике синдрома ДВС (диссеминированного внутрисосудистого свертывания), вместе с другими тестами, используется АЧТВ (активированное частичное тромбопластиновое время).
Анализ оценивает активность белка и его количество.
Нормы активности:
- новорожденные 40-90%
- дети 75-135%
- взрослые 80-125%
Если уровень белка повышен, это может свидетельствовать о таких заболеваниях, как дефицит витамина К, острый холестаз, гепатит, трансплантация почек.
У мужчин с возрастом уровень антитромбина снижается, а у женщин он меньше в период менопауз. При беременности дефицит антитромбина увеличивает риск ее прерывания.
Пониженное содержание Антитромбина III
Низкое содержание данного белка в крови вызывается высоким потреблением или нарушением выработки его в печени:
- глубокий венозный тромбоз,
- ДВС-синдром,
- сепсис,
- синдром Бадда-Киари,
- нефротический синдром,
- тромбоэмболия легочной артерии и так далее.
Уровень белка в крови будет снижен в случае воспалительного процесса в организме, и показатели не отобразят реальную картину. Поэтому, сдавать анализ при симптомах какого-либо заболевания, не рекомендовано.
Антитромбин при тромбофилии понижен, однако, данное состояние как таковым заболеванием не является. Можно сказать, что это значит увеличение вероятности возникновения тромбов. Многие люди, у которых тромбофилия, в течение жизни могут не испытывать негативных последствий.
Что делать в данной ситуации расскажет врач, существуют препараты для профилактики образования кровяных сгустков, которые можно купить по приемлемой цене. В инструкции по применению препарата указан способ его приема.
Цена на фраксипарин (препарат для профилактики тромбоэмболического осложнения) из-за нестабильной ситуации часто пересматривается, поэтому ее нужно уточнять.
Кровь на исследование сдается натощак, и в течение 4-6 часов она должна быть в лаборатории. Современная лаборатория ИНВИТРО всегда рада помочь вам в проведении качественного анализа. У нас лучшее оборудование, а, соответственно, достоверные результаты, которые помогут вам в вашем выздоровлении.
Анализ крови на Антитромбин III
Как известно, свертывающая система крови активируется в норме при повреждении сосуда, и в этом месте происходит образование кровяного сгустка.
Также в этом случае активируются и другие механизмы, препятствующие этому процессу, и поэтому образование этого сгутка ограничивается определенной областью и не происходит на протяжении всего сосуда.
Вещества, которые за это отвечают, называются физиологическими антикоагулянтами.
К ним относятся — антитромбин III, протеин С и протеин S.
Антитромбин III — наиболее важный физиологический антикоагулянт, участвующий в поддержании жидкого состояния крови. Он является основным плазматическим белком в механизме инактивации тромбина и других факторов свертывания крови — Xа, XIIа, IXа. АТ III синтезируется в клетках печени и сосудистом эндотелии.
В случае гепаринотерапии АТ III совместно с гепарином образует комплекс, который оказывает быстрое действие. В случае значительного снижения антитромбина III гепарин почти не выполняет свое антикоагулянтное действие, что влечет за собой повышенный риск возникновения тромбов.
Поэтому крайне важно определить активность антитромбина III при терапии гепарином.
Существует как наследственный дефицит АТ III, так и приобретенный в случае ряда причин, которые сопровождаются либо снижением синтеза АТ III, либо повышенным выведением АТ III из организма.
Это такие состояния, как атеросклероз, патология печени — хронические гепатиты, циррозы печени (причем, чем тяжелее и дольше протекает заболевание печени, тем больше снижается АТ III), прием пероральных контрацептивов и эстрогенов, беременность, оперативные вмешательства, нефротический синдром и др.
Наследственный дефицит АТ III может быть двух типов — качественным и количественным. У таких пациентов будет наблюдаться резистентность к лечению гепарином.
При острых гепатитах и панкреатитах, раке поджелудочной железы, застое желчи, дефиците витамина К и хронических воспалительных процессах активность АТ III повышается.
Натощак (спустя 8-14 часового периода ночного голодания, чистую негазированную воду пить можно), избегать повышенных психоэмоциональных и физических нагрузок, прием алкоголя, а курения за 30-60 минут до сдачи.
Проводится стандартная процедура забора крови из вены.
АТ III – Антитромбин III — ОВУМ – медицинская лаборатория в Кемерοво
Описание
Антитромбин III (АТ III)- один из важнейших белков противосвертывающей системы. Он инактивирует III, XII, XI, X, IX факторы свертывания крови, в результате фибриноген не может превращаться в фибрин и образовывать сгустки. Действие антитромбина III многократно усиливается в присутствие гепарина.
Он инактивирует III, XII, XI, X, IX факторы свертывания крови, в результате фибриноген не может превращаться в фибрин и образовывать сгустки. Действие антитромбина III многократно усиливается в присутствие гепарина.
Уменьшение образования в организме антитромбина III происходит при наследственной предрасположенности. Гетерозиготное носительство встречается у 0,1-0,3% здорового населения, что повышает риск тромбообразования в 5-10 раз.
Синтез антитромбина также снижен при заболеваниях печени. При заболеваниях почек может происходить потеря антитромбина III из организма.
При снижение в организме у пациента уровня антитромбина III на 50% от нормы возникает риск развития тромбозов и эмболий. При всех формах дефицита антитромбина III возникает ДВС- синдром.
Возможные причины изменения уровня антитромбина III:
Увеличение значений АТ III:
-Воспалительные процессы.
-Острый гепатит.
-Заболевания поджелудочной железы.
-Менструация.
-Прием анаболических препаратов.
Уменьшение значений АТ III:
-Врожденный дефицит АТ III.
-Хронические заболевания печени и печеночная недостаточность.
-Нефротический синдром.
-Последний триместр беременности.
-Прием пероральных контрацептивов.
-Длительное введение гепарина.
-Острый ДВС-синдром.
-Тромбоэмболия.
-Сепсис.
-Атеросклероз.
При снижении активности АТ III до 40-60 % наблюдаются спонтанные тромбозы и эмболии.
Референтные интервалы АТIII в плазме крови: 80-120%
Правила подготовки
- Необходимо исключить факторы, влияющие на результаты исследований: физическую нагрузку (бег, подъем по лестнице, подъем тяжестей), тепловые процедуры (посещение бани, сауны), эмоциональное возбуждение.
- Перед забором крови следует отдохнуть 10-15 минут в приемной, успокоиться.
- Исключить прием алкоголя за 1-2 дня до исследования.
- За 1 час до исследования исключить курение.
- Кровь не следует сдавать после рентгенографии, физиотерапевтических воздействий, после проведения диагностических или лечебных процедур.
- Анализ сдают натощак. «Натощак» — это когда между последним приемом пищи и взятием крови проходит не менее 8 ч (желательно — не менее 12 ч). Можно только пить воду. Накануне исследования следует избегать пищевых перегрузок.
- При исследовании крови учитывают влияние принимаемых лекарственных препаратов. Если прием лекарственного средства обязателен и исследование проводится на фоне приема препарата, об этом необходимо делать отметку на направлении
Антитромбин (ATIII) — Diapharma
Антитромбин (AT, Antithrombin III, ATIII) — это небольшой гликопротеин, продуцируемый печенью, который инактивирует несколько ферментов системы свертывания крови.
α-Антитромбин является доминирующей формой антитромбина, обнаруживаемой в плазме крови, и имеет олигосахарид, занимающий каждый из четырех участков гликозилирования. Единственный сайт гликозилирования остается неизменно незанятым в минорной форме антитромбина, β-антитромбине.
Активность антитромбина усиливается антикоагулянтом гепарином, который усиливает связывание антитромбина с фактором II и фактором X.
Антитромбин представляет собой серпин (ингибитор сериновой протеазы), сходный по структуре с другими ингибиторами протеазы плазмы, такими как альфа-1-антихимотрипсин, альфа-2-антиплазмин и кофактор гепарина II.
Антитромбин нацелен на протеазы пути контактной активации (внутренний путь), активированные формы фактора X (Xa), фактора IX (IXa), фактора XI (XIa), фактора XII (XIIa), фактора II (тромбина) (IIa) и фактор VII (VIIa) пути тканевого фактора (внешний путь). Ингибитор также инактивирует калликреин и плазмин, которые также участвуют в свертывании крови.Он инактивирует сериновые протеазы, которые не участвуют в коагуляции, такие как трипсин и субъединицу C1s фермента C1, участвующего в пути комплемента.
Дефицит антитромбина — фактор риска венозного тромбоза
Введение
Биохимия антитромбина
Клинические аспекты антитромбина
Методы определения антитромбина
Продукты
Введение
Антитромбин — это циркулирующий белок плазмы, который функционирует как важный регулятор свертывания крови.Он инактивирует несколько ферментов каскада свертывания, в частности тромбин и фактор Ха. С тех пор, как в 1965 году была установлена связь между наследственным дефицитом антитромбина и тромбозом, возрос клинический интерес к антитромбину и потребность в простом и точном определении. В настоящее время доступны анализы на основе хромогенных пептидных субстратов, позволяющие фотометрическим определять активность антитромбина в плазме.
Тромбин — ключевой фермент свертывания крови. Он свертывает кровь, превращая фибриноген в мономеры фибрина, образующие сгустки, и активирует фактор XIII, что приводит к укреплению сгустка крови за счет сшивания.Тромбин также активирует тромбоциты и кофакторы, фактор V и фактор VIII, тем самым ускоряя его собственное образование и обеспечивая быструю реакцию на повреждение. Однако автокаталитическая природа тромбина также влечет за собой определенные опасности. Полное образование тромбина всего в одном миллилитре плазмы, если его не регулировать, приведет к свертыванию крови взрослого человека в течение нескольких минут. Таким образом, очевидно, что активность тромбина необходимо тщательно контролировать, чтобы предотвратить аномальное отложение фибрина в сосудистой сети.Ингибирующая регуляция тромбина в основном достигается двумя принципиально разными механизмами. Когда тромбин связывается с мембранным белком тромбомодулином, присутствующим на поверхности неповрежденного эндотелия сосудов, он теряет все свои прокоагулянтные свойства. Вместо этого тромбомодулин резко увеличивает скорость, с которой тромбин активирует протеин C. Затем активированный протеин C расщепляет факторы Va и VIIIa, эффективно препятствуя дальнейшему образованию тромбина.
Другой механизм регуляции активности тромбина, возникающий при свертывании крови, обеспечивается группой ингибиторов циркулирующих ферментов.Антитромбин (также называемый антитромбином III) является основным ингибитором, на его долю приходится примерно 80% ингибирующей активности тромбина в плазме.
Данные о антитромбине человека
| Имя: | Антитромбин |
| Синонимы: | AT, антитромбин III, ATIII, кофактор гепарина I, ингибитор тромбина I |
| История: | Обнаружен Моравицем в 1905 году |
| Концентрация в плазме: | 150 мг / л |
| Молекулярный вес: | 58 200 дальтон |
| Первичная структура: | 432 аминокислотных остатка |
| Содержание углеводов: | 15% |
| Биологический период полураспада: | 55-70 часов |
| Ген: | 13.5 т.п.н., 7 экзонов, 6 интронов расположение хромосомы 1 в 1q 23-25 |
| Тип: | Принадлежит к суперсемейству из примерно 40 ингибиторов сериновых протеаз (серпинов), которые произошли от общей предковой молекулы. |
| Функция: | Подавляет тромбин, фактор Ха и другие протеазы. Кофактор гепарина. |
| Важность: | Дефицит антитромбина связан с повышенным риском развития тромбоэмболического расстройства |
Ингибиторы тромбина в плазме
| Ингибиторы | Целевая протеаза (ы) |
| Антитромбин | Тромбин, IXa, Xa, другие |
| 2-макроглобулин | Неспецифический |
| Ингибитор трипсина | Нейтрофильная эластаза, тромбин, прочие |
| Кофактор гепарина II | Тромбин |
Каскад коагуляции
Свертывание крови инициируется повреждением сосудов и приводит к взрывному образованию тромбина, который свертывает кровь.Факторы свертывания крови представлены римскими цифрами (а = активирован). Сокращения: HMWK = высокомолекулярный кининоген, PK = прекалликреин, K = калликреин, TF = тканевой фактор, TFPI = ингибитор пути тканевого фактора, PF3 = фосфолипид, TM = тромбомодулин, PC = протеин C, APC = активированный протеин C, PCI = ингибитор протеина C, TI = ингибитор трипсина, a 2 -M = a 2 -макроглобулин, FDP = продукты распада фибрина. Примечания: Фактор V недавно был идентифицирован как второй кофактор APC.
Факторы свертывания плазмы и регуляторные белки
| Фактор | Имя | Размер [кДа] | Концентрация [мг / мл] |
| I | Фибриноген | 340 | 3000 |
| II | Протромбин | 69 | 100 |
| III | Фактор ткани | 47 | – |
| IV | Кальций | – | – |
| В | Proaccelerin | 330 | 10 |
| VI | – | – | – |
| VII | Проконвертин | 48 | 0.5 |
| VIII | Антигемофильный фактор | 330 | 0,1 |
| IX | Фактор Рождества | 55 | 5 |
| х | Фактор Стюарта-Проуэра | 59 | 8 |
| XI | Предыдущий тромбопластин | 160 | 5 |
| XII | Фактор Хагемана | 80 | 30 |
| XIII | Фибринстабилизирующий | 320 | 10 |
| – | Фактор ткани | 37 | – |
| – | Белок C | 57 | 4 |
| – | Белок S | 75 | 25 |
| – | Антитромбин | 58 | 150 |
| – | Кофактор гепарина II | 66 | 91 |
Обзор антитромбиновых мишеней в ферментных системах плазмы.Коагуляция (слева), фибринолиз (в центре), система комплемента (внизу) и система калликреин-кинин (справа).
Биохимия антитромбина
Конструкция
Антитромбин представляет собой одноцепочечный гликопротеин плазмы 58 кДа и член семейства серпиновых ингибиторов сериновых протеаз. Он синтезируется в печени и встречается в нормальной плазме в концентрации около 150 мг / л с периодом полувыведения 3 дня. Первичная структура антитромбина человека в плазме состоит из 432 аминокислотных остатков, шесть из которых представляют собой цистеин, образующий три межмолекулярные дисульфидные связи.Молекула также содержит четыре боковые углеводные цепи, которые составляют около 15% от молекулярной массы.
Функция
Антитромбин является основным ингибитором тромбина, фактора IXa и фактора Ха в плазме, но он также инактивирует другие сериновые протеазы внутреннего пути свертывания крови, факторы XIa и XIIa, а также некоторые несвертывающиеся сериновые протеазы, такие как плазмин, калликреин. и фермент комплемента C1. Большинство протеаз инактивируются намного медленнее, чем тромбин.Ингибирование антитромбином включает образование стабильного комплекса 1: 1 между активным доменом сериновой протеазы и реактивным сайтом антитромбина, который протеазы первоначально распознают как субстрат. Во время расщепления связи реактивного сайта в антитромбине (расположенном в Arg393-Ser394) в ингибиторе, который захватывает протеазу, происходит конформационное изменение.
Взаимодействие с гепарином
Взаимодействия протеаза-антитромбин медленные, хотя резко усиливаются в присутствии определенных сульфатированных полисахаридов, известных как гликозаминогликаны (ГАГ).Считается, что сосудистые ГАГ, в первую очередь гепарансульфат, связывают антитромбин и тромбин и тем самым катализируют реакцию антитромбин-тромбин. Это позволило бы избирательно усилить действие антитромбина на границах раздела кровяных клеток, где генерируются ферменты свертывания.
Упрощенная модель, описывающая, как гепарин катализирует реакцию антитромбина и тромбина. Условные обозначения: AT; антитромбин, IIa; тромбин, [H] = сайт связывания гепарина, [R] = реактивный сайт, [P] = сегмент связывания антитромбина
Коммерческий гепарин представляет собой смесь ГАГ, экстрагируемых в основном из слизистой оболочки кишечника крупного рогатого скота или свиней, и используется в качестве важного антитромботического препарата.И гепарин, и гепарансульфат катализируют действие антитромбина, вызывая конформационные изменения в молекуле антитромбина в реактивном сайте.
Упрощенная модель, описывающая, как гепарин катализирует образование необратимого комплекса между тромбином (IIa) и антитромбином (AT). [H] символизирует сайт связывания гепарина, а [R] является реактивным сайтом в антитромбине, обычно в неблагоприятной конформации для ингибирования протеазы. [P] — уникальный антитромбин-связывающий сегмент гепарина. Связывание с [P] вызывает изменение конформации антитромбина, что облегчает его реакцию с тромбином. Тромбин неспецифично связывается с гепарином и «скользит» по цепи, пока не встретит связанный антитромбин. Сродство гепарина к комплексу тромбин-антитромбин (ТАТ) намного ниже, чем к свободному антитромбину. Таким образом, гепарин будет отделяться от комплекса ТАТ, который быстро удаляется из кровотока рецепторами в печени (t1 / 2 <5 мин).Инактивация фактора Ха также усиливается гепарином, хотя механизм скольжения не имеет отношения к этому ферменту, поскольку требуется только изменение конформации.
Иллюстрация повышенного риска тромбоза у лиц с дефицитом антитромбина. Дефицит антитромбина может передаваться по наследству или возникать как приобретенное состояние и представляет собой состояние гиперкоагуляции, синдром, вызванный нарушением хрупкого баланса между прокоагулянтами и антикоагулянтами в организме.При серьезной травме, такой как операция или инфекция, обычно потребляется значительное количество антитромбина, поэтому сочетание начального дефицита антитромбина и травмы может быть пагубным.
Недостаток антитромбина
Тромбофилия
Венозный тромбоз — серьезная медицинская проблема, от которой ежегодно страдает 1 человек из 1000, вызывая значительную заболеваемость и смерть из-за тромбоэмболии легочной артерии. Патогенез заболевания многофакторен, и было идентифицировано несколько косвенных, а также генетических факторов риска.
Тромбофилия — это термин, используемый для обозначения семейных или приобретенных дефектов механизма гемостаза, которые увеличивают склонность к образованию тромбов. Этот термин включает предрасположенность как к венозному, так и к артериальному тромбозу, хотя у большинства пациентов венозный тромбоз нижних конечностей является преобладающей клинической проблемой. Дефицит антитромбина, протеина C, протеина S и недавно обнаруженная наследственная устойчивость к активированному протеину C (APC-резистентность) являются наиболее распространенными известными генетическими причинами тромбоза.Вместе они составляют около 60-70% случаев, диагностированных как наследственная тромбофилия, и могут выступать в качестве предрасполагающих факторов примерно у одной трети всех больных тромбозом.
Лабораторная диагностика этих пациентов чрезвычайно важна, поскольку может помочь определить тип и продолжительность лечения.
Клинические аспекты антитромбина
Наследственный дефицит антитромбина
Наследственная недостаточность антитромбина была первой признанной наследственной тромбофилией.Об этом сообщил в 1965 году Эгеберг, описавший норвежскую семью с повторяющимися эпизодами венозной тромбоэмболии.
С тех пор во многих странах были обнаружены семьи с наследственной недостаточностью антитромбина, и теперь четко установлена связь между недостаточностью антитромбина и тромбозом. Тип наследования обычно аутосомно-доминантный (не связанный с полом) с уровнями функционально активного белка около 40-70% от нормы.
Распространенность
Распространенность симптоматической наследственной недостаточности антитромбина оценивается в пределах от 1 на 2 000 до 1 на 5 000 среди населения в целом, хотя общая распространенность, т.е.е. симптоматические и бессимптомные люди могут быть намного выше. Согласно недавним исследованиям здоровых доноров крови, частота наследственного дефицита антитромбина составляет от 1 на 250 до 1 на 500.
До 5% пациентов с венозным тромбозом в анамнезе, поступивших с тромбозом в возрасте до 40-45 лет, имеют наследственную недостаточность антитромбина. В неотобранной группе пациентов с острым венозным тромбозом распространенность составляет около 1%.
Классификация
Были обнаружены различные мутации, вызывающие наследственный дефицит антитромбина, которые классифицированы на несколько различных типов.Наиболее распространенная схема делит дефицит антитромбина на два типа на основе результатов функциональных и иммунологических анализов. Дефицит антитромбина I типа является «классической» формой нарушения и характеризуется снижением на 50% как антигенной, так и функциональной активности. Дефицит типа II охватывает те случаи, когда примерно половина антитромбина в плазме представляет собой вариантный белок с пониженной активностью. Дефицит типа II подразделяется на: мутации, влияющие на реактивный сайт (RS), мутации, влияющие на сайт связывания гепарина (HBS), и плейотропные (множественные) эффекты (PE).Недавно была предложена более точная схема классификации, основанная на молекулярных дефектах.
Риски и клинические особенности
Риск тромбоэмболии у лиц с симптоматической недостаточностью антитромбина составляет в среднем примерно 1% в год жизни. Однако риск, по-видимому, связан с возрастом, поскольку пик заболеваемости приходится на возраст от 15 до 40 лет.
Около одной трети тромботических эпизодов происходит спонтанно, в то время как в оставшиеся две трети идентифицируемые факторы риска включают беременность или роды, длительную иммобилизацию, пероральные контрацептивы, содержащие эстроген, и серьезные травмы.
Наиболее частым проявлением недостаточности антитромбина является венозный тромбоз нижних конечностей. Рецидивный тромбоз в анамнезе встречается примерно у 60% пациентов и является клиническим признаком, который обычно побуждает искать дефицит антитромбина.
Клиника наследственной недостаточности антитромбина
- Тромботический эпизод в раннем возрасте
- В семейном анамнезе венозный тромбоз
- Рецидивирующий венозный тромбоз
- Тромбоэмболия на необычной локализации
- Тромбоз при беременности
- Устойчивость к гепарину
Классификация, распространенность и риск тромбоза наследственной недостаточности антитромбина.
| Классификация | Деятельность | Антиген | Распространенность * | Риск тромбоза ** |
| Тип I | Низкий | Низкий | 1: 4200 | Высокая |
| Тип II | Низкий | Нормальный | 1: 280 | высокий (RS), низкий (HBS) |
| * Распространенность среди 4200 доноров крови на западе Шотландии.5 ** Дефицит типа I связан с высоким риском рецидива тромбоэмболической болезни, тогда как риск, связанный с дефицитом типа II, зависит от локализации мутации. Люди с мутациями в реактивном сайте (RS) или рядом с ним имеют высокий риск тромбоза. Напротив, гетерозиготные люди с мутациями, затрагивающими сайт связывания гепарина (HBS), подвергаются относительно низкому риску. | ||||
Приобретенный дефицит антитромбина
Приобретенный дефицит антитромбина связан либо со снижением синтеза (например,грамм. заболевания печени, недоношенные новорожденные), повышенная потеря (например, нефротический синдром), повышенное потребление (например, ДВС-синдром) или лекарственные препараты (например, гепарин, L-аспарагиназа). Поскольку приобретенный дефицит антитромбина обычно сопровождается снижением других белков свертывания крови, трудно оценить тромботический риск, основываясь только на одном антитромбине. Однако в некоторых случаях приобретенное состояние с недостаточностью антитромбина влечет за собой такой же риск тромбоза, как и наследственное состояние, поэтому важно раннее распознавание.
ДВС-синдром
Ряд первичных событий, таких как травма, шок, ожоги, инфекция, рак, осложненная беременность (преэклампсия), могут вызвать слабо определяемый синдром, называемый диссеминированным внутрисосудистым свертыванием (ДВС). Синдром характеризуется плохо контролируемой активностью протеаз, что приводит к ускоренному образованию и лизису фибрина, что в конечном итоге приводит к повреждению нескольких органов. Это происходит, когда большое количество травмированной или некротической ткани в организме выделяет тканевой фактор в кровь.Лабораторные показания включают пролонгированное АЧТВ, тромбоцитопению, гипофибриногенемию и увеличение количества продуктов распада фибрина и фибриногена. Обнаружение низкого уровня антитромбина также предполагает ДВС-синдром, особенно если это значение со временем снижается. При остром ДВС потребление антитромбина значительно превышает скорость синтеза, и организм не может достаточно быстро заменить антитромбин. В этих случаях уровень антитромбина полезен в качестве диагностической помощи и для оценки терапии. Сильное начальное снижение уровня антитромбина является сильным предиктором смерти и полиорганной недостаточности у пациентов с септическим ДВС-синдромом.Уровни антитромбина у новорожденных. Активность антитромбина у здоровых доношенных новорожденных составляет примерно 50% от уровня у взрослых, с повышением до нормального диапазона примерно через 6 месяцев после рождения. Ингибитор α2-макроглобулина играет более важную роль в это время, что частично объясняет, почему тромбоз редко встречается у здоровых новорожденных. Уровни антитромбина в плазме у здоровых недоношенных новорожденных составляют около 35%, но могут дополнительно снижаться при таких осложнениях, как респираторный дистресс, сепсис или ДВС-синдром. Сообщается, что у больных грудных детей с очень низким уровнем антитромбина выше уровень смертности, с более высокой частотой тромботических и геморрагических осложнений.
Эффекты, вызванные лекарствами
Терапия гепарином снижает уровень антитромбина в плазме за счет увеличения печеночного клиренса антитромбина. В некоторых случаях при критически низком уровне антитромбина может развиться явление, называемое резистентностью к гепарину.
Состояния, которые могут привести к приобретенному снижению уровня антитромбина
Физиологическая недостаточность
- Недоношенные и новорожденные
- Старость
Коагулопатии потребления
- DIC
- Преэклампсия
- Хирургические вмешательства и послеоперационный период
- Острый миелоидный лейкоз
- Массивный венозный тромбоз
- Больные, недоношенные и новорожденные
Болезнь почек
- Нефротический синдром
- Гемолитико-уремический синдром
Заболевание печени
- Острая печеночная недостаточность
- Хроническая болезнь печени
Заболевания желудочно-кишечного тракта
- Воспалительный процесс кишечника
- Белковая энтеропатия
Лекарственные препараты
- Гепарин
- L-аспарагиназа
- Эстрогены, тамоксифен
Эффекты разведения
- Гемодиализ
- Плазмаферез
- Искусственное кровообращение
Прочие условия
- Диабет
- Болезнь Бехчета
- Недоедание
Ведение дефицита антитромбина
Уровни антитромбина
Предполагается, что нормальный диапазон антитромбина составляет 80–120%, 23 хотя трудно точно знать, что составляет нижнюю границу нормального диапазона и каково значение уровней чуть выше или около этого предела.Из-за этого исследование антитромбина всегда должно включать лабораторные результаты, а также историю болезни пациента. Более высокие концентрации, чем обычно, не имеют клинического значения.
Профилактика и лечение
Роль профилактики для лиц с наследственной недостаточностью антитромбина в настоящее время неясна и противоречива. Однако все согласны с тем, что людям с симптоматической наследственной недостаточностью антитромбина следует предлагать профилактические антикоагулянты в ситуациях, которые представляют общепризнанный риск тромбоза (например,грамм. беременность, иммобилизация и хирургия). Следует попытаться классифицировать тип дефицита как у лиц с симптомами, так и у бессимптомных лиц, чтобы должным образом оценить риск тромбоза и необходимость профилактики. В целом, пациенты с дефицитом антитромбина I и II типа (RS) подвержены высокому риску тромбоза.
Гепарин
Гепарин — это первая линия лечения острого тромбоза у пациентов с недостаточностью антитромбина. Сообщалось о резистентности к гепарину и распространении тромбозов, хотя в целом это не является серьезной проблемой.Вероятно, неэкономично давать замену антитромбина пациентам, нуждающимся в гепарине, чтобы преодолеть предполагаемую резистентность к гепарину.
Варфарин
При отсутствии противопоказаний (например, геморрагический диатез, тяжелая гипертензия, беременность) в качестве долгосрочного профилактического средства выбирается пероральный антикоагулянт варфарин. Варфарин является антагонистом витамина К
и вмешивается в зависимый от витамина К биосинтез нескольких факторов свертывания крови, снижая их прокоагулянтную активность.
Антитромбиновые концентраты
Хотя плазма может использоваться в качестве источника антитромбина, большой объем, необходимый для терапевтического замещения, представляет собой серьезное ограничение. В отличие от плазмы, чистый концентрат антитромбина может восстановить баланс несбалансированной системы. Концентраты антитромбина обычно получают с помощью аффинной хроматографии и тщательно обрабатывают для уничтожения инфекционных агентов.
Несколько групп сообщили об успешном использовании концентратов антитромбина в качестве профилактических средств во время хирургических процедур или при лечении различных туберкулезных коагулопатий.Однако окончательное преимущество использования концентратов антитромбина до сих пор не доказано должным образом.
Из-за умеренного времени выживания антитромбина в кровообращении обычно необходимы инфузии концентратов антитромбина через день. Уровни в плазме следует регулярно контролировать для достижения эффективного лечения при разумных затратах.
Уровни антитромбина при различных клинических состояниях
| Состояние | Диапазон | Арт. |
| Болезнь печени | 25–135% | 25 |
| DIC | 31–137% | 26 |
| Гепарин * | 40-78% | 32 |
| Нормальный | 84-116% | 23 |
| Здоровые новорожденные | 39-87% | 28 |
| Наследственная деф. | 40-70% | 19 |
| * Непрерывное введение терапевтической дозы | ||
Методы определения антитромбина
Анализы антитромбина
Хромогенные синтетические пептидные субстраты имитируют сайты расщепления природного субстрата.Вверху: протромбин природного субстрата, который может расщепляться фактором Ха в двух местах. Внизу: субстрат хромогенного фактора Ха.
Диагностика недостаточности антитромбина
Диагноз дефицита антитромбина в первую очередь основан на определении уровней антитромбина в плазме с использованием анализа функциональной активности или иммунологического анализа. Для целей скрининга наиболее актуальны функциональные анализы антитромбина, поскольку они могут обнаруживать оба типа наследственной недостаточности антитромбина.
Уровни активности обычно выражаются относительно пула нормальной плазмы с заданным значением 100%, что соответствует одной единице антитромбина в одном миллилитре контрольной плазмы.
Анализы активности
Функциональные анализы основаны на способности образца плазмы ингибировать известное количество либо тромбина, либо фактора Ха, добавленного в избытке, в присутствии гепарина (анализ кофактора гепарина) или в отсутствие гепарина (анализ прогрессивной активности).Остаточный фермент измеряется методом свертывания крови или с использованием хромогенных пептидных субстратов.
Анализ кофактора гепарина
В отсутствие гепарина уровни ингибирования являются медленными, и на прогрессивные тесты антитромбина влияют другие ингибиторы плазмы, такие как ингибитор трипсина и α2-макроглобулин. Поэтому эти анализы используются в основном для подтверждающих целей.
Введение гепарина в анализ кофактора гепарина ускоряет скорость реакции и делает ее более специфичной и практичной.Антитромбин часто определяют путем измерения его активности в присутствии избытка тромбина. Хотя анализы кофактора гепарина, в которых в качестве целевой протеазы используется человеческий тромбин, могут завышать концентрацию антитромбина из-за кофактора гепарина II; тромбин-специфический серпин с кофакторной способностью гепарина. Он присутствует в плазме в концентрации примерно вдвое меньше, чем антитромбин, и в присутствии высоких уровней гепарина может составлять до 20% ингибирующей активности тромбина в плазме.Таким образом, влияние кофактора гепарина II особенно заметно при анализе плазмы пациентов, получавших гепарин. Использование бычьего тромбина, низких концентраций гепарина или фактора Ха в качестве субстрата вместо тромбина сводит к минимуму влияние.
Принципиальная структура синтетических пептидных субстратов
Анализы хромогенного кофактора гепаринаНаиболее часто применяемым рутинным методом измерения активности антитромбина является анализ кофактора гепарина на основе хромогенных пептидных субстратов.Они имитируют либо сайт расщепления фибриногена, расщепляемого тромбином, либо протромбин, расщепляемый фактором Ха. Учитывая влияние кофактора гепарина II на анализы, основанные на ингибировании тромбина, можно ожидать, что анализы на основе хромогенного фактора Ха в ближайшем будущем будут полностью доминировать.
Хромогенные пептиды состоят из 3-4 аминокислот с хромогенной группой 4-нитроанилин (pNA), присоединенной к концу. Когда пептид инкубируют с активной протеазой, он расщепляется и выделяется pNA (желтый цвет).Высвобождение измеряют при 405 нм либо во время реакции в кювете для фотометра, либо периодически, останавливая реакцию уксусной или лимонной кислотой. Фотометрический сигнал, то есть изменение оптической плотности, обратно пропорционален активности антитромбина.
- Chromogenix S-2222 ™ Bz-Ile-Glu- (γ-OR) -Gly-Arg-pNA
- Chromogenix S-2765 ™ Z-D-Arg-Gly-Arg-pNA
- Chromogenix S-2772 ™ Ac-D-Arg-Gly-Arg-pNA
- Chromogenix S-2238 ™ H-D-Phe-Pip-Arg-pNA
Хромогенные субстраты для фактора Ха (Chromogenix S-2222 ™, Chromogenix S-2765 ™, Chromogenix S-2772 ™) и тромбина (Chromogenix S-2238 ™).Сокращения: Bz = бензоил, Z = бензилоксикарбонил, Ac = ацетил, Pip = пипеколиновая кислота, Arg = аргинин, Glu = глутаминовая кислота, Gly = глицин, Ile = изолейцин, Phe = фенилаланин, pNA = пара-нитроанилин. Chromogenix S-2222 ™; R = H (50%) и CH 3 (50%).
Анализ коагулометрического кофактора гепарина
Как следует из названия, тесты на свертывание крови основаны на способности антитромбина продлевать время свертывания крови и плазмы.
Анализы свертывания зависят от манипуляций с образцом плазмы (дефибринация) с использованием длительной термообработки или анкрода.Дефибринированную плазму инкубируют с фиксированным избытком тромбина и добавляют гепарин для ускорения реакции инактивации. Затем эту смесь добавляют к раствору фибриногена и измеряют время свертывания, которое прямо пропорционально активности антитромбина. В некоторых анализах вместо тромбина используется фактор Ха.
Хотя анализы свертывания крови можно использовать для точного измерения активности антитромбина, хромогенные анализы предпочтительнее, так как они более быстрые и не требуют этапа дефибринации.
Иммунологические анализы
Иммунологические анализы антитромбина, такие как метод радиальной иммунодиффузии Манчини и метод электроиммунодиффузии Лорелла, определяют количество антитромбинового антигена, присутствующего в плазме. Молярная концентрация белкового материала антитромбина в нормальной плазме, определенная этими методами, составляет приблизительно 4 ммоль / л.
Иммунологический метод в сочетании с хромогенным методом может использоваться для диагностики и классификации состояний дефицита.Если уровни антигена и активности снижены, можно предположить количественный (тип I) дефицит. Они также могут предоставить важную информацию о потреблении антитромбина в связи с тромботическим событием.
Продукты
Диагностические комплекты от Chromogenix
Разработка первого хромогенного пептидного субстрата S-2160 ™ в начале семидесятых положила начало внедрению фотометрии в гематологии. Сегодня существует множество тестов, основанных на хромогенных субстратах на факторы свертывания крови.Эти тесты могут выполняться вручную или в автоматизированных аналитических системах с высокой специфичностью, чувствительностью и точностью.
Важные продукты, не содержащие хромогенов, включают наборы для определения устойчивости к APC (APTT-тест).
Антитромбиновые наборы
Chromogenix предлагает хорошо документированные хромогенные тест-наборы для определения активности антитромбина в плазме крови человека. Первым разработанным коммерческим набором был Coatest® Antithrombin (производство прекращено), который с годами стал признанным во всем мире.Наборы Coamatic® Antithrombin — последняя разработка в линейке хромогенных продуктов. Основным преимуществом является то, что они основаны на факторе Ха, а не на тромбине, что устраняет риск завышения уровня антитромбина из-за влияния кофактора гепарина II. Все наборы предлагают широкий диапазон измерений и хорошую стабильность реагентов.
Chromogenix Coamatic® Антитромбин
Chromogenix Coamatic® Antithrombin — это анализ хромогенного кофактора гепарина для специфического определения активности антитромбина в плазме.Использование фактора Xa устраняет помехи со стороны кофактора гепарина II и позволяет точно определять антитромбин у пациентов, получающих терапию гепарином. Анализ также лучше различает людей с дефицитом антитромбина и людей без дефицита антитромбина по сравнению с обычным анализом на основе тромбина. Набор адаптирован для использования с широким спектром автоматических анализаторов, обеспечивая сопоставимые условия реакции на разных анализаторах.
Принцип измерения
Разбавленная плазма инкубируется с избытком фактора Ха в присутствии гепарина.Остаточное количество фактора Ха определяется скоростью гидролиза хромогенного субстрата S-2765 ™. Высвобождение pNA, измеренное при 405 нм, обратно пропорционально уровню антитромбина в диапазоне 0-125% от нормальной плазмы.
Специфичность и мешающие факторы
Не влияет кофактор гепарина II, α2-макроглобулин или ингибитор трипсина. Не сообщалось о вмешательстве наркотиков
Контактная активация плазмы может привести к недооценке антитромбина.Билирубин, гемоглобин и плазма пациентов с гиперлипемией влияют на показания абсорбции в остановленном методе. В этих случаях необходимы индивидуальные заготовки плазмы.
Chromogenix Coamatic® LR Антитромбин
Chromogenix Coamatic® LR (жидкие реагенты) Антитромбин — это хромогенный кофактор гепарина для определения активности антитромбина в неразбавленной плазме. Реагенты набора находятся в жидком виде. Использование фактора Ха устраняет влияние кофактора гепарина II и позволяет точно определять антитромбин у пациентов, получающих терапию гепарином.
Принцип измерения
Плазма инкубируется с избытком фактора Ха в присутствии гепарина. Остаточная активность фактора Ха определяется скоростью гидролиза хромогенного субстрата S-2772 ™. Высвобождение pNA, измеренное при 405 нм, обратно пропорционально уровню антитромбина в диапазоне 0-125% от нормальной плазмы.
Специфичность и мешающие факторы
Не влияет кофактор гепарина II.Не сообщалось о вмешательстве наркотиков
Реагенты антитромбиновые
Посмотреть наш:
Антитромбин | Лабораторные тесты онлайн
Источники, использованные в текущем обзоре
Харпер, Дж. (Обновлено 10 июля 2015 г.). Дефицит антитромбина III. Спасательные препараты и болезни. [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/954688-overview#showall. Дата обращения 06.04.16.
Теруя Дж., Костоусов В. (обновлено 30 января 2014 г.).Антитромбин III. Наркотики и болезни, помогающие избежать [он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/2084978-overview. Дата обращения 06.04.16.
Миттон Б. и Стейнек А. (обновлено 21 октября 2015 г.). Дефицит антитромбина. Спасательные препараты и болезни. [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/198573-overview#showall. Дата обращения 06.04.16.
Chen, Y. (обновлено 29 мая 2014 г.). Анализ крови на антитромбин III. Медицинская энциклопедия MedlinePlus [Он-лайн информация].Доступно в Интернете по адресу https://www.nlm.nih.gov/medlineplus/ency/article/003661.htm. Дата обращения 06.04.16.
(© 1995–2016). Антитромбиновая активность, плазма. Клиника Мэйо Медицинские лаборатории Мэйо [Он-лайн информация]. Доступно в Интернете по адресу http://www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/9030. Дата обращения 06.04.16.
(© 1995–2016). Антитромбиновый антиген, плазма. Клиника Мэйо Медицинские лаборатории Мэйо [Он-лайн информация]. Доступно в Интернете по адресу http: //www.mayomedicallaboratories.ru / test-catalog / Clinical + and + Interpretive / 9031. Дата обращения 06.04.16.
Heikal, N. et. al. (Обновлено за апрель 2016 г.). Состояния гиперкоагуляции — тромбофилия. ARUP Consult [Он-лайн информация]. Доступно в Интернете по адресу https://arupconsult.com/content/hypercoagulable-states/?tab=tab_item-2. Дата обращения 06.04.16.
Источники, использованные в предыдущих обзорах
Томас, Клейтон Л., редактор (1997). Циклопедический медицинский словарь Табера. Компания F.A. Davis, Филадельфия, Пенсильвания [18-е издание].
Пагана, Кэтлин Д. и Пагана, Тимоти Дж. (2001). Антитромбин III с. 100-101. Справочник по диагностическим и лабораторным испытаниям Мосби, 5-е издание: Mosby, Inc., Сент-Луис, Миссури.
Брозе, М. (1 июня 2003 г., обновлено). Антитромбин III. Медицинская энциклопедия MedlinePlus [Он-лайн информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/003661.htm.
Коэн, Э. (28 октября 2003 г., обновлено). Врожденный дефицит антитромбина III. Медицинская энциклопедия MedlinePlus [Он-лайн информация].Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/000558.htm.
(19 ноября 2002 г., обновлено). Антитромбин. Массачусетская больница общего профиля, Служба патологии Лаборатория медицины Coag Test Handbook [Электронная информация]. Доступно в Интернете по адресу http://www.mgh.harvard.edu/labmed/lab/coag/handbook/CO000300.htm.
(сентябрь 2003 г., с изменениями). Функциональный анализ антитромбина III и антиген. Медицинский центр Университета Дьюка, Лаборатория клинической коагуляции, Описание тестов на коагуляцию [Он-лайн информация].Доступно в Интернете по адресу http://pathology.mc.duke.edu/coag/TestDes.htm.
(весна 2003 г.). Современные подходы к лечению гиперкоагуляции: дефицит антитромбина. Колледж американских патологов, Newspath V 17 (2). Доступно в Интернете по адресу http://www.cap.org/apps/docs/newspath/spring_2003/clinical.html.
(© 2004) Антитромбин, Антиген. Руководство ARUP по клиническим лабораторным исследованиям [он-лайн информация]. Доступно в Интернете по адресу http://www.arup-lab.com/guides/clt/tests/clt_al65.jsp № 3952516.
Rodgers, G. et. al. (© 2004) Гемостаз / Тромбоз, Общая информация. Руководство ARUP по клиническим лабораторным исследованиям [он-лайн информация]. Доступно в Интернете по адресу http://www.arup-lab.com/guides/clt/tests/clt_fro8.jsp#1238723.
(© 2004). Антитромбин, ферментативный (активность). Руководство ARUP по клиническим лабораторным исследованиям [он-лайн информация]. Доступно в Интернете по адресу http://www.arup-lab.com/guides/clt/tests/clt_al66.jsp#3952541.
(26 июня 2001 г., обновлено).Дефицит антитромбина. Университет Иллинойса — Урбана / Шампейн, Онкологический центр Карла, Ресурсная страница по гематологии, Ресурсы для пациентов [Он-лайн информация]. Доступно в Интернете по адресу http://www-admin.med.uiuc.edu/matology/PtAntithrombin.htm.
Пагана, Кэтлин Д. и Пагана, Тимоти Дж. (© 2007). Справочник по диагностическим и лабораторным испытаниям Мосби, 8-е издание: Mosby, Inc., Сент-Луис, Миссури. С. 104-105.
Кларк В. и Дюфур Д. Р., редакторы (2006). Современная практика клинической химии, AACC Press, Вашингтон, округ Колумбия.Стр. 231.
Ву, А. (2006). Клиническое руководство по лабораторным исследованиям Титца, четвертое издание. Сондерс Эльзевир, Сент-Луис, Миссури. С. 138-139.
Левин М. (обновлено 9 марта 2007 г.). Антитромбин III. Медицинская энциклопедия MedlinePlus. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus. Доступно 3/9/08.
Нанда, Р. (27 апреля 2007 г.). Тромбоз глубоких вен. Медицинская энциклопедия MedlinePlus. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus. Доступно 3/9/08.
Харпер, Дж. (16 августа 2007 г.). Дефицит антитромбина III. eMedicine. Доступно на сайте http://www.emedicine.com. Доступно 3/9/08.
Дагдейл, Д. (Обновлено 5 июня 2012 г.). Антитромбин III. Медицинская энциклопедия MedlinePlus [Он-лайн информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/003661.htm. По состоянию на сентябрь 2012 г.
Дагдейл, Д. (Обновлено 28 февраля 2011 г.). Врожденный дефицит антитромбина III. Медицинская энциклопедия MedlinePlus [Он-лайн информация].Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/000558.htm. По состоянию на сентябрь 2012 г.
Харпер, Дж. (Обновлено 1 августа 2011 г.). Дефицит антитромбина III. Справочник по Medscape [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/954688-overview. По состоянию на сентябрь 2012 г.
Hart, K. et. al. (Обновлено ноябрь 2011 г.). Состояния гиперкоагуляции — тромбофилия. ARUP Consult [Он-лайн информация]. Доступно в Интернете по адресу http: //www.arupconsult.com / Topics / Thrombophilia.html? client_ID = LTD # tabs = 0. По состоянию на сентябрь 2011 г.
(© 1995–2012). Код единицы 9030: Антитромбиновая активность, плазма. Клиника Мэйо Медицинские лаборатории Мэйо [Он-лайн информация]. Доступно в Интернете по адресу http://www.mayomedicallaboratories.com/test-catalog/Overview/9030. По состоянию на сентябрь 2012 г.
(© 1995–2012). Код единицы 9031: Антитромбиновый антиген, плазма. Клиника Мэйо Медицинские лаборатории Мэйо [Он-лайн информация]. Доступно в Интернете по адресу http: //www.mayomedicallaboratories.ru / test-catalog / Обзор / 9031. По состоянию на сентябрь 2012 г.
Луски, К. (сентябрь 2010 г.). В коагуляции свое дело решают алгоритмы рефлексивного тестирования. CAP Today [Он-лайн информация]. Доступно в Интернете по адресу http://www.cap.org. По состоянию на сентябрь 2012 г.
Пагана, К. Д. и Пагана, Т. Дж. (© 2011). Справочник по диагностическим и лабораторным испытаниям Мосби, 10-е издание: Mosby, Inc., Сент-Луис, Миссури. С. 105-107.
(10 января 2012 г.) Rajun A, et. al. Дефицит антитромбина.Ссылка на Medscape. Доступно в Интернете по адресу http://emedicine.medscape.com/article/198573-overview. По состоянию на сентябрь 2012 г.
Biochemistry, Antithrombin III — StatPearls
Введение
Антитромбин — это гликопротеин плазмы, состоящий из 432 аминокислотных остатков, участвующих в регуляции процесса свертывания крови во время кровотечения. Антитромбин, прежде всего, связывается с сериновыми протеазами, фактором II (тромбином), фактором IXa и фактором Xa, который ингибирует процесс свертывания крови, участвующий в пути каскада свертывания.Как часть нормальной физиологической реакции на кровотечение, тромбоциты, циркулирующие в плазме, сначала активируются множеством факторов, продуцируемых эндотелиальными клетками, чтобы агрегировать и образовывать пробку. Циркулирующий фибриноген затем превращается в фибрин тромбином посредством серии активаций протеаз, которые составляют реакции пути каскада коагуляции. Фибрин стабилизирует начальную пробку, образованную тромбоцитами, которая определяет завершение образования сгустка. [1]
Антитромбин входит в число регуляторных механизмов каскада свертывания, который обеспечивает механизм противодействия образованию сгустков.Он служит до 80% компонента, ингибирующего образование тромбина, а также ингибирования фактора IXa и фактора Xa [2]. Дефицит антитромбина имеет клиническую связь с повышенным риском тромбоза, тромбоэмболии и связанных с ними осложнений, связанных с состоянием гиперкоагуляции. [3] Эта деятельность направлена на обеспечение общего понимания биохимических свойств антитромбина, представление обзора его структуры в корреляции с его функцией в отношении взаимодействия с сериновыми протеазами и гепарином.
Molecular
Антитромбин является частью семейства ингибиторов сериновых протеаз, известных как серпины. Серпины обычно состоят из высококонсервативной структуры аминокислотных цепей, организованных в три бета-листа, девять альфа-листов и петлю реактивного центра (RCL), обозначенную как последовательность аминокислот, которая служит реактивным сайтом для взаимодействия протеаз [4] . Петля RCL в антитромбине существует вдоль последовательности аминокислотной цепи на 393 остатке аргинина и 394 остатке серина рядом с карбоксильным концом аминокислотной последовательности.Это область внутри антитромбина, которая создает комплекс антитромбин-протеаза для ингибирования. [4]
Синтез антитромбина первоначально происходит в печени в виде незрелой белковой цепи, состоящей из 464 аминокислотных остатков. Затем аминокислотная цепь расщепляется на N-конце 32 аминокислотами, тем самым создавая зрелый белок с 432 аминокислотной последовательностью. Зрелый белок содержит три дисульфидные связи, которые межмолекулярно связывают вместе шесть остатков цистеина. Эта конфигурация позволяет четырем потенциальным сайтам гликозилирования существовать в молекуле.[4] В зависимости от количества занятых сайтов гликозилирования антитромбин подразделяется на две изоформы: альфа-антитромбин и бета-антитромбин. [5]
Альфа-антитромбин относится к антитромбину, в котором олигосахариды связывают все четыре сайта гликозилирования. Это преобладающая конфигурация антитромбина, составляющая около 90% антитромбина в плазме [6]. Бета-антитромбин, однако, относится к антитромбину, у которого три из четырех сайтов заняты, а олигосахаридная цепь у Asn135 отсутствует.[6] Это изменение конфигурации увеличивает сродство связывания бета-антитромбина с гепарином в обозначенном гепарин-связывающем домене. [7] Связывание гепарина резко увеличивает сродство антитромбина к связыванию сериновой протеазы, повышая функциональную эффективность антитромбина для ингибирования образования сгустков.
Механизм
Антитромбин имеет два специфических сайта связывания — реактивный сайт, состоящий из петли реактивного центра (RCL), которая связывает протеазы, такие как тромбин, фактор Xa, IXa, и гепарин-связывающий домен, который, как следует из названия, связывает гепарин.[8]
Петля реактивного центра антитромбина, расположенная у остатка аргинина на 393 и серинового остатка на 394, рядом с карбоксильными концевыми функциями для связывания с активным сайтом протеаз посредством сложного механизма, включающего конформационное изменение реактивного антитромбина. сайт. [8] Нити из бета-листа A антитромбинового сайта разделяются на полпути по своей длине, и RCL впоследствии перестраивается в точке входа в лист A вместе с различными другими конформационными изменениями, которые служат для увеличения подвижности RCL.Повышенная подвижность обеспечивает место стыковки протеазы, что, в свою очередь, создает необратимый комплекс. [8]
Затем комплекс ингибитор-протеаза быстро удаляется из кровотока не более чем через 5 минут после образования, что удаляет тромбин из кровотока, нарушая свертывающий эффект каскада свертывания. Хотя точный механизм все еще не ясен, данные могут свидетельствовать о том, что рецепторы гепатоцитов участвуют в удалении комплекса из плазмы.[8]
Образование комплекса антитромбин-протеаза необратимо, но по своей природе является медленной и неэффективной реакцией. Процесс может быть быстро увеличен до 1000 раз при наличии сульфатированных полисахаридов в форме гепарина и гепарансульфата. [8] Гепарин содержит уникальную пентасахаридную последовательность в своей гликозаминогликановой цепи, состоящую из отрицательно заряженных сульфатных групп, которая отвечает за его высокое сродство к антитромбиновому гепарин-связывающему домену.
Гепарин-связывающий домен, расположенный на поверхности антитромбина, с другой стороны, содержит положительно заряженные аргинин и лизин, которые связываются с отрицательно заряженными доменами последовательности пентасахарида гепарина посредством частично аллостерического механизма. [9]
Успешное связывание гепарина активирует конформационные изменения в антитромбине, что увеличивает его сродство к протеазе, способствует образованию комплекса антитромбин-протеаза и, в конечном итоге, ингибирует свертывание крови.[10]
Аллостерическая активация антитромбиновой серпиновой структуры, индуцированная гепарином, была объектом обширных исследований, и, хотя кинетика реакции довольно сложна, обычно аллостерическая активация антитромбина вызывает структурные изменения в RCL, гепарин- сайт связывания и гидрофобное ядро, составляющее антитромбин. Точные взаимодействия, вовлеченные в конформационные изменения, все еще являются предметом исследования и пересмотра. [9]
Клиническая значимость
Предполагаемая распространенность наследственной недостаточности антитромбина обычно составляет от 1 на 2000 до 1 на 5000.[8] Те, у кого есть венозный тромбоз, имеют заболеваемость от 1 из 20 до 1 из 200. [11] Наследственный дефицит антитромбина подразделяется на тип I или тип II. Тип I приводит к полному дефициту продуктов гена антитромбина в гомозиготном состоянии. Гетерозиготный генотип дает примерно 50% функциональной активности антитромбина. Для дефицита типа II характерно производство измененного белка антитромбина, что приводит к потере его функции [11]. Наблюдается снижение общей активности антитромбина, но снижение уровня антитромбинового антигена менее вероятно.Место, в котором происходит изменение белка, может повлиять на реактивный сайт, гепарин-связывающий домен или и то, и другое. Отсутствие активности или выработки антитромбина чаще всего проявляется в виде тромбоза глубоких вен. Однако существует повышенный риск повторного неспровоцированного тромбоза в необычных местах, таких как церебральные или брыжеечные вены. [11] Первый случай тромбоза возникает в относительно молодом возрасте, при этом риск тромбоза достигает пика в возрасте от 15 до 40 лет. Первоначальным лечением тромбоза у этих пациентов является гепарин, а поддерживающее лечение обычно продолжается пероральными антикоагулянтами.При бессимптомных случаях первичная профилактика в настоящее время не рекомендуется из-за повышенного риска смертельного кровотечения при длительной антикоагулянтной терапии по сравнению с меньшим риском смертельной ВТЭ [11].
Приобретенный дефицит антитромбина обычно связан либо со снижением выработки как части нарушения синтеза в случае острой печеночной недостаточности, цирроза, недоедания, прямой потерей антитромбина при состояниях, включая нефротический синдром, либо с увеличением потребления.[11] Антитромбин теряется из-за коагулопатий потребления, включая синдром диссеминированного внутрисосудистого свертывания (ДВС), микроангиопатии с тромбозом, злокачественные новообразования и гематологические реакции на переливание крови. Уровни антитромбина менее 50–60% при сепсисе обычно приводят к ухудшению прогнозов, а уровни менее 20% коррелируют с летальным исходом [11]. Потеря антитромбина при сепсисе частично связана с увеличением плазменного обмена и снижением выработки антитромбина.Степень дефицита также коррелирует с тяжестью заболевания. Влияние антитромбина на организм обширно, и понимание структуры и функции этой молекулы дает фундаментальные знания для интеграции методов лечения и клинической практики для пациентов с нарушениями антитромбина. [8]
Дополнительное образование / Контрольные вопросы
Ссылки
- 1.
- О’Доннелл Дж. С., О’Салливан Дж. М., Престон Р. Дж. Успехи в понимании молекулярных механизмов, поддерживающих нормальный гемостаз.Br J Haematol. 2019 июл; 186 (1): 24-36. [PubMed: 30919939]
- 2.
- Бэ Дж, Десаи У. Р., Первин А., Колдуэлл Э., Вейлер Дж. М., Линхардт Р. Дж.. Взаимодействие гепарина с синтетическими аналогами пептида антитромбина III. Biochem J. 1 июля 1994; 301 (Pt 1): 121-9. [Бесплатная статья PMC: PMC1137151] [PubMed: 8037658]
- 3.
- Браво-Перес К., Висенте В., Коррал Дж. Управление дефицитом антитромбина: обновление для клиницистов. Эксперт Рев Гематол. 2019 июн; 12 (6): 397-405. [PubMed: 31116611]
- 4.
- Ersdal-Badju E, Lu A, Zuo Y, Picard V, Bock SC. Идентификация сайта связывания антитромбина III с гепарином. J Biol Chem. 1997, 1 августа; 272 (31): 19393-400. [PubMed: 9235938]
- 5.
- Karlaftis V, Sritharan G, Attard C, Corral J, Monagle P, Ignjatovic V. Активность бета (β) -антитромбина у детей и взрослых: значение для терапии гепарином у младенцев и детей. J Thromb Haemost. 2014 июл; 12 (7): 1141-4. [PubMed: 24801362]
- 6.
- Поль-Фачин Л., Франко Беккер К., Алмейда Гимарайнш Дж., Верли Х.Влияние гликозилирования на связывание гепарина и активацию антитромбина гепарином. Белки. 2011 сентябрь; 79 (9): 2735-45. [PubMed: 21769943]
- 7.
- Амирал Дж., Сегатчиан Дж. Возвращение к антитромбину при лечении и болезнях, врожденных недостатках и генетических вариантах, а также лабораторных исследованиях α и β форм. Transfus Apher Sci. 2018 Апрель; 57 (2): 291-297. [PubMed: 29784539]
- 8.
- Перри, ди-джей. Антитромбин и его наследственные недостатки. Blood Rev.1994 Март; 8 (1): 37-55.[PubMed: 8205009]
- 9.
- Roth R, Swanson R, Izaguirre G, Bock SC, Gettins PG, Olson ST. Насыщенный мутагенез остатка P14 петли реактивного центра антитромбина поддерживает трехступенчатый механизм аллостерической активации гепарина, включающий промежуточные и полностью активированные состояния. J Biol Chem. 2015 20 ноября; 290 (47): 28020-36. [Бесплатная статья PMC: PMC4653662] [PubMed: 26359493]
- 10.
- van Amsterdam RG, Vogel GM, Visser A, Kop WJ, Buiting MT, Meuleman DG. Синтетические аналоги антитромбин III-связывающей пентасахаридной последовательности гепарина.Прогнозирование времени пребывания in vivo. Артериосклер Thromb Vasc Biol. 1995 Апрель; 15 (4): 495-503. [PubMed: 7749861]
- 11.
- Maclean PS, Tait RC. Наследственный и приобретенный дефицит антитромбина: эпидемиология, патогенез и варианты лечения. Наркотики. 2007; 67 (10): 1429-40. [PubMed: 17600391]
Анализ крови на антиген антитромбина III
Категории
Анализ крови на антиген антитромбина III используется для выяснения причины повторяющегося несоответствующего свертывания крови или для диагностики недостаточности антитромбина.
Код теста: 5158
Также известен как: функциональный антитромбин III; AT III
Методология: нефелометрия с фиксированной скоростью
Приготовление: Требуется 10-12 часов голодания. Избегайте анаболических стероидов, гемфиброзила, варфарина (Coumadin®), терапии гепарином, аспарагиназы, эстрогенов, гестодена и оральных контрацептивов в течение 3 дней до сбора образцов. Проконсультируйтесь с врачом, прежде чем прекращать прием любых лекарств.
Результаты тестов: 8-12 дней. Может занять больше времени в зависимости от погоды, праздников или задержек в лаборатории.
Описание
Тестирование на антитромбин, наряду с другими тестами на чрезмерные нарушения свертываемости, в первую очередь назначается для исследования причины повторяющегося образования тромбов (тромбоза). Ранее называемый «антитромбином III», антитромбиновый антиген является ингибитором нескольких факторов свертывания крови. Пациенты с низкими концентрациями антитромбинового антигена могут иметь наследственное или приобретенное протромботическое состояние.Антигенный тест позволяет дифференцировать дефицит типа I от дефицита типа II.
Тест на антитромбин III также используется, когда человек не реагирует на антикоагулянтную терапию гепарином, как ожидалось, и когда для достижения желаемого уровня антикоагуляции необходимы необычно высокие дозы гепарина.
Примеры нарушений и состояний, связанных с повышенным свертыванием крови, включают тромбоз глубоких вен, флебит (воспаление вен) и легочную эмболию (сгусток крови, перемещающийся в легкие).
Если ваш уровень антитромбина ниже нормы, вероятно, у вас дефицит антитромбина. Это подвергает вас повышенному риску развития ТГВ и других состояний, в том числе:
- флебит или воспаление вен
- тромбофлебит или воспаление вен, вызывающее образование сгустка
- тромбоэмбол легочной артерии или сгусток крови в легком
- сердечный приступ, если тромб попадает в артерии сердца
- инсульт, если тромб попадает в артерии головного мозга
THROMBATE III (антитромбин III [человеческий])
Ссылки: 1. THROMBATE III [Назначение информации]. Парк Исследовательского Треугольника, Северная Каролина: Grifols Therapeutics LLC. 2 . Маклин П.С., Тейт Р.С. Наследственный и приобретенный дефицит антитромбина: эпидемиология, патогенез и варианты лечения. Наркотики. 2007; 67 (10): 1429-1440. 3. Li W, Johnson DJ, Esmon CT, Huntington JA. Nat Struct Mol Biol. 2004; 11 (9): 857-862. 4. Джеймс А.Х., Конкл Б.А., Бауэр К.А. Профилактика и лечение венозной тромбоэмболии у беременных и у пациенток с наследственной недостаточностью антитромбина. Int J Womens Health. 2013; 5: 233-241. 5. Wolberg AS. Blood Rev. 2007; 21 (3): 131-142. 6. Davi G, Patrono C. N Engl J Med. 2007; 357 (24): 2482-2494. 7. Коттке-Марчант К., Дункан А. Дефицит антитромбина: проблемы лабораторной диагностики. Arch Pathol Lab Med. 2002; 126 (11): 1326-1336. 8. Миттон Б.А., Стейнек А. Дефицит антитромбина. eMedicine от WebMD. http://emedicine.medscape.com/article/198573-overview.Обновлено 22 августа 2019 г. Проверено 4 сентября 2020 г. 9. Патнаик М.М., Молл С. Унаследованный дефицит антитромбина: обзор. Гемофилия. 2008; 14 (6): 1229-1239. 10. Пабингер I, Шнайдер Б. Тромботический риск при наследственном антитромбиновом III протеине C или дефиците протеина S. Arteroscler Thromb Vasc Biol. 1996; 16 (6): 742-748. 11. Рануччи М. Антитромбин III: ключевой фактор экстракорпорального кровообращения. Минерва Анестезиол. 2002; 68 (5): 454-457. 12. Фой П., Молл С. Тромбофилия: обновление 2009 г.. Варианты лечения Curr Cardiovasc Med. 2009; 11 (2): 114-128. 13. AABB, Американский Красный Крест, Центры крови Америки, Программа крови вооруженных сил. Информационный проспект по использованию человеческой крови и компонентов крови. Октябрь 2017 г. http://www.aabb.org/tm/coi/Documents/coi1017.pdf. По состоянию на 4 сентября 2020 г. 14. Wells PS, Blajchman MA, Henderson P, et al. Am J Hematol. 1994; 45: 321-324. 15. Бюро переписи населения США, Отдел народонаселения. Часы народонаселения США и мира. http://www.census.gov/ popclock /. Доступ 13 февраля 2020 г. 16. Khawar H, Kelley W, Guzman N. Свежезамороженная плазма. В: StatPearls. https://www.ncbi.nlm.nih.gov/books/NBK513347/. Обновлено 7 октября 2019 г. По состоянию на 10 февраля 2020 г. 17. Hellgren M, Tengborn T, Abildgaard U. Беременность у женщин с врожденным дефицитом антитромбина III: опыт лечения гепарином и антитромбином. Gynecol Obstet Invest. 1982; 14: 127-141. 18. Франкини М., Венери Д., Сальваньо Г.Л., Манзато Ф., Липпи Г. Унаследованная тромбофилия. Crit Rev Clin Lab Sci. , 2006; 43 (3): 249-290. 19. Роджерс GM. Роль антитромбинового концентрата в наследственной недостаточности антитромбина: обновленная информация. Thromb Haemost. 2009; 101 (5): 806-812. 20. Ди Минно MND, Dentali F, Lupoli R, Ageno W. Легкий дефицит антитромбина и риск рецидива венозной тромбоэмболии. Тираж. 2014; 129 (4): 497-503. 21. Bucciarelli P, Passamonti SM, Biguzzi E, et al. Низкие пограничные уровни антитромбина, протеина C и протеина S в плазме являются факторами риска венозной тромбоэмболии. J Thromb Haemost. 2012; 10 (9): 1783-1791. 22. Центры по контролю и профилактике заболеваний. Венозная тромбоэмболия при госпитализации взрослых — США, 2007-2009 гг. MMWR Morb Mortal Wkly Rep. 2012; 61 (22): 401-404. 23. Финли А., Гринберг К.Обзорная статья: Чувствительность и резистентность к гепарину: управление во время искусственного кровообращения. Anesth Analg. 2013; 116 (6): 1210-1222. 24. Ковач Б., Берецкий З., Олах З. и др. Превосходство анализа анти-FXa над анализом анти-FIIa в обнаружении недостаточности антитромбина в сайте связывания гепарина. Am J Clin Pathol. 2013; 140 (5): 675-679. 25. Олсон Э., Уитни М., Фридман Б. и др. In vivo флуоресцентная визуализация атеросклеротических бляшек с активируемыми проникающими в клетки пептидами, нацеленными на активность тромбина, Integrative Biology, 2012; 4 (6): 595-605. 26. Ллойд-Джонс Д., Адамс Р.Дж., Браун TM и др .; от имени Статистического комитета Американской кардиологической ассоциации и Подкомитета по статистике инсульта. Тираж. 2010; 121: e46-e215.
Как я лечу пациентов с наследственной недостаточностью антитромбина | Кровь
Антитромбин (AT; SERPINC1 ) — природный антикоагулянт, который инактивирует тромбин, фактор Ха и, в меньшей степени, другие факторы свертывания крови, такие как фактор IXa 1-4 .Кофакторами AT являются гепарины, повышающие его ферментативную активность в ≥1000 раз. 5,6 Дефицит AT был впервые описан в 1965 г. Олавом Эгебергом. 7 С тех пор тромбофилия, термин, впервые введенный Найгаардом и Брауном 8 в 1937 году для описания чрезмерных артериальных тромбозов, стала огромной областью исследований, особенно при венозной тромбоэмболии (ВТЭ). В настоящее время тестирование на тромбофилию широко доступно и чрезмерно используется в повседневной жизни, зачастую не на основании научных данных.В последние годы тестирование на тромбофилию, включая тестирование на дефицит AT, подверглось критической переоценке. 9 Дефицит АТ наблюдается нечасто даже в популяции пациентов с ВТЭ. Среди пациентов с дефицитом АТ существует большая вариабельность в отношении генетического фона, подтипа и клинической тяжести подтипа. Кроме того, другие генетические предрасположенности к ВТЭ, такие как фактор V Leiden 10,11 или вариация протромбина G20210A в 3′-нетранслируемой области, 12 , оказались ограниченно важными с точки зрения прогнозирования первого или повторного тромбоз. 13,14 Однако пациенты с недостаточностью АТ имеют высокий риск развития ВТЭ и повышенную частоту рецидивов по сравнению с пациентами с легкой тромбофилией. 15,16 У них может быть тяжелая тенденция к тромбообразованию, включая детский тромбоз 17 и осложнения при беременности. 17-19 Хотя не было продемонстрировано четкой связи между гетерозиготной недостаточностью AT и артериальным тромбозом, 20,21 носители гомозиготной мутации AT имеют повышенный риск артериального тромбоза. 17,22 Наследственная недостаточность AT в большинстве случаев передается как аутосомно-доминантное заболевание с переменной пенетрантностью и равным распределением между полами. Различают количественные (тип 1) и качественные (тип 2) дефекты АТ. У пациентов с дефектами типа 1 уровень и активность антигена AT также снижаются. При дефиците АТ 2 типа уровни антигена в норме, но молекула АТ дисфункциональна, и, следовательно, активность АТ снижена. В зависимости от локализации мутации дефекты АТ 2-го типа подразделяются на 3 варианта: дефекты реактивного сайта, при которых нарушается связывание тромбина с АТ; дефекты сайта связывания гепарина (HBS); и мутации с плейотропным эффектом, затрагивающие реактивный сайт, а также HBS.
Дефекты HBS 2 типа встречаются относительно часто, по крайней мере, в Европе, но связаны с низким риском ВТЭ, за исключением случаев гомозиготности, при которых часто встречаются очень тяжелые тромботические события и осложнения беременности. 18,22-24 Дефицит AT типа 1 обычно вызван бессмысленными или нулевыми мутациями SERPINC1 (что объясняет их фенотип) или дефектами сплайсинга. 25 Дефицит типа 2 почти исключительно вызван миссенс-мутациями. 1,26,27
Предполагаемая распространенность недостаточности AT составляет от ~ 0,02% до 0,2% в общей популяции и от ~ 1% до 5% у пациентов с ВТЭ. 3,28-32 У пациентов с наследственной недостаточностью АТ около 60% случаев ВТЭ возникают спонтанно, а 40% — вторично по отношению к временному фактору риска. 33,34 В ретроспективном анализе было обнаружено, что у ~ 50% пациентов с дефицитом АТ к 50-летнему возрасту развилась ВТЭ. 35-37
Когда мы принимаем решение о диагностическом или терапевтическом лечении, мы обычно полагаемся на данные интервенционных исследований. Это невозможно у пациентов с дефицитом АТ. Однако мы очень старались основывать наши предложения на ограниченных данных, имеющихся в литературе, и на нашем собственном опыте.
Женщина 22 лет поступила с двусторонним тромбозом глубоких вен (ТГВ) тазовых и бедренных вен и тромбоэмболией легочной артерии (ТЭЛА).Она обратилась с жалобой на одышку, которая продолжалась в течение 4 недель, и массивный отек, изменение цвета и боль в обеих ногах, которые продолжались в течение нескольких дней. История ее семьи была весьма заметной. Ее дедушка по отцовской линии, дедушка и тетя (в послеродовом периоде) умерли от тромбоза / ПЭ. У ее отца в 50 лет после операции на позвоночнике развилась опасная для жизни ПЭ, и он постоянно получал антикоагулянты. У другой тети по отцовской линии также был рецидив тромбоза. Восемь месяцев назад пациент начал принимать комбинированные оральные контрацептивы (ОК) эстроген / гестаген.У пациентки была 17-летняя сестра, у которой не было тромботических событий.
Сначала ей назначили низкомолекулярный гепарин (НМГ). Интересно, что ее уровень анти-Ха достигал только терапевтических уровней при 200 МЕ / кг массы тела (МТ) НМГ два раза в день. Антифосфолипидные антитела, фактор V Лейдена и вариация протромбина G20210A были исключены. AT, протеин C и протеин S не определялись при постановке диагноза.После 2 недель приема НМГ ей назначили ривароксабан.
Через три месяца после диагноза ВТЭ она обратилась в амбулаторное отделение тромбоза и гемостаза нашей больницы. Во время приема 20 мг ривароксабана один раз в день у нее было сильное менструальное кровотечение, поэтому ее перевели на 2,5 мг апиксабана два раза в день. У нее продолжались отек и боль в правой ноге, совместимые с посттромботическим синдромом. В то время тестирование на тромбофилию было неполным, поэтому ее попросили прекратить прием апиксабана на 3 дня и назначили профилактическую дозу НМГ.Скрининг на тромбофилию выявил активность АТ 44% (нормальный диапазон 80–120%). При повторном измерении ее активность AT составила 54% через 4 часа после приема 2,5 мг апиксабана, а антиген AT составил 48%. Ей посоветовали продолжить прием апиксабана по 5 мг два раза в день. Генетический анализ показал мутацию гена SERPINC1 (экзон 2: c.282_283insA, p.Tyr95IIfs * 10 в гетерозиготной форме), что соответствует дефициту 1 типа.
Мы не проводим тестирование на тромбофилию у большинства пациентов с ВТЭ. 14,38 Однако мы считаем, что у всех пациентов с ВТЭ необходимо тщательно регистрировать семейный анамнез. На основании индивидуального анамнеза, включая семейный анамнез, мы решаем, следует ли этому пациенту пройти дополнительное обследование на наличие дефицита АТ или других факторов риска тромбоза. Мы считаем, что тестирование AT целесообразно у пациентов со спонтанной ВТЭ в молодом возрасте (<40 лет), особенно у тех, у кого есть родственники первой степени родства с ВТЭ, или у маленьких пациентов или детей с множественными тромбозами или тромбозами в атипичных местах.По нашему мнению, использование ОК или беременность во время ВТЭ не делают ненужным тестирование на тромбофилию у молодых женщин с положительным семейным анамнезом. Известно, что женщины с недостаточностью АТ подвержены особенно высокому риску ВТЭ во время приема ОК 39 и беременности. 40
Функциональные анализы активности AT являются основой диагностики наследственной недостаточности AT. Мы суммировали практический подход к диагностике наследственной недостаточности AT на Рисунке 1.По нашему опыту и согласно литературным данным, уровни АТ у пациентов с недостаточностью АТ обычно явно ниже нормального диапазона (т. Е. <80%; у большинства уровни <70%) 17,41 ; однако у пациентов с дефектами типа 1 также могут быть уровни до 72% или даже 78%. 17,42 Активность АТ <70% свидетельствует о недостаточности АТ, и одного измерения достаточно для дальнейшего лечения пациентов с ВТЭ в острой фазе, особенно при положительном семейном анамнезе.Подтверждающее измерение AT должно быть выполнено через несколько недель после первого измерения. В случае пограничного уровня активности АТ (70–80%) следует по возможности рассмотреть вопрос о генетическом тестировании или подтверждении дефицита у другого члена семьи (если это еще не сделано). Однако, помимо определения активности АТ, дальнейшие диагностические исследования не кажутся обязательными, поскольку обычно не меняют решения о лечении. Дальнейшая дифференциация между различными типами дефицита AT возможна только в узкоспециализированных и / или исследовательских лабораториях; диагностическая процедура была предложена Muszbeck et al. 1 В таблице 1 перечислены антикоагулянты для лечения дефицита AT и их влияние на определение AT. Было высказано предположение, что варфарин может повышать уровни АТ у пациентов с дефицитом, но в 2 сообщениях уровни оставались <80% от нормы. 43,44 В недавнем исследовании оценивали уровни АТ у недефицитных пациентов, получавших варфарин; их уровни AT были измерены до и во время лечения, и не было обнаружено никаких изменений. 45 Не совсем ясно, по-разному ли ведут себя уровни AT у пациентов с дефицитом AT на VKA.Следует отметить, что во время лечения DOAC уровни AT могут быть ложно высокими, и, таким образом, дефицит может быть скрыт.
Рисунок 1.
Алгоритм диагностики наследственной недостаточности АТ. * Причины приобретенного дефицита АТ: острый тромбоз, диссеминированное внутрисосудистое свертывание, заболевание печени, нефротический синдром, экстракорпоральная мембранная оксигенация, гемодиализ, хирургическое вмешательство или травма, терапия аспарагиназой, терапия гепарином, прием ОК / эстрогенов (умеренно).† Рассмотрите возможность подтверждения генетическим анализом или наличие дефицита у другого члена семьи.
Рисунок 1.
Алгоритм диагностики наследственной недостаточности АТ. * Причины приобретенного дефицита АТ: острый тромбоз, диссеминированное внутрисосудистое свертывание, заболевание печени, нефротический синдром, экстракорпоральная мембранная оксигенация, гемодиализ, хирургическое вмешательство или травма, терапия аспарагиназой, терапия гепарином, прием ОК / эстрогенов (умеренно). † Рассмотрите возможность подтверждения генетическим анализом или наличие дефицита у другого члена семьи.
Таблица 1.Антикоагулянты для профилактики и лечения дефицита АТ
| Класс . | Наркотик . | Особое внимание . | |
|---|---|---|---|
| Диагностическое определение АКПП . | Профилактика и лечение * . | ||
| UFH | Снижение АТ при продолжительной инфузии 43 | Возможна устойчивость к гепарину; если нет адекватного увеличения при обычной дозе НФГ, увеличьте дозу или рассмотрите возможность замены АТ; помните о риске кровотечения при высоких дозах НФГ и заместительной терапии АТ | |
| НМГ | Далтепарин, эноксапарин, тинзапарин, надропарин, бемипарин | Снижение маловероятно, но нельзя полностью исключить 50 | В настоящее время часто используется; кажется эффективным по опыту; доза не проверялась в клинических испытаниях; Измерение анти-Ха может не отражать антикоагулянтный эффект, но использовался |
| Непрямой ингибитор фактора Ха | Фондапаринукс | Нет опыта | Почти нет данных |
| VKA | Варфарин, аценокумарол, фенпрокумон | Все тесты на АТ возможно | Эффективно |
| DOAC | |||
| Ингибитор тромбина | Дабигатран | Ложно высокие уровни при тестировании с помощью анализов на основе FIIa 80 | Наиболее вероятно эффективно; нет данных |
| Ингибитор фактора Ха | Апиксабан, эдоксабан, ривароксабан | Ложно высокие уровни при тестировании с помощью анализов на основе FXa 81 | Скорее всего, эффективны; только в редких случаях |
| Класс . | Наркотик . | Особое внимание . | |
|---|---|---|---|
| Диагностическое определение АКПП . | Профилактика и лечение * . | ||
| UFH | Снижение АТ при продолжительной инфузии 43 | Возможна устойчивость к гепарину; если нет адекватного увеличения при обычной дозе НФГ, увеличьте дозу или рассмотрите возможность замены АТ; помните о риске кровотечения при высоких дозах НФГ и заместительной терапии АТ | |
| НМГ | Далтепарин, эноксапарин, тинзапарин, надропарин, бемипарин | Снижение маловероятно, но нельзя полностью исключить 50 | В настоящее время часто используется; кажется эффективным по опыту; доза не проверялась в клинических испытаниях; Измерение анти-Ха может не отражать антикоагулянтный эффект, но использовался |
| Непрямой ингибитор фактора Ха | Фондапаринукс | Нет опыта | Почти нет данных |
| VKA | Варфарин, аценокумарол, фенпрокумон | Все тесты на АТ возможно | Эффективно |
| DOAC | |||
| Ингибитор тромбина | Дабигатран | Ложно высокие уровни при тестировании с помощью анализов на основе FIIa 80 | Наиболее вероятно эффективно; нет данных |
| Ингибитор фактора Ха | Апиксабан, эдоксабан, ривароксабан | Ложно высокие уровни при тестировании с помощью анализов на основе FXa 81 | Скорее всего, эффективны; только в редких случаях |
Если возможно генетическое тестирование, обнаружение мутации в SERPINC1 подтверждает дефицит AT и указывает диагноз подтипа. 46 Миссенс-мутации, по-видимому, связаны с более низким риском ВТЭ по сравнению с нулевыми мутациями. 27 Это случай гетерозиготных мутаций HBS 2 типа, которые часто возникают из-за эффекта основателя. 47 Специфические мутации могут возникать только на региональном уровне, например, мутация с дефицитом типа 2 в Финляндии, которая приводит к повышенному риску ювенильного инсульта, а также к осложнениям беременности. 48 В нашем учреждении мы проводим генетическое тестирование в случаях со сниженным уровнем активности AT после исключения состояний приобретенного дефицита AT, чтобы подтвердить диагноз дефицита и определить подтип.
Что касается лечения антикоагулянтами пациентов с дефицитом АТ, выбранные препараты и их дозировки требуют тщательного рассмотрения различных факторов, которые суммированы в Таблице 1. АТ сам по себе является медленным ингибитором тромбина, фактора Ха и фактора IXa, и только в присутствии гепарина он проявляет свой полный антикоагулянтный потенциал. 49 Напротив, низкие уровни AT в плазме влияют на антикоагулянтный эффект гепаринов, включая НМГ.
Что касается изменений уровня АТ во время лечения НФГ и НМГ, было замечено, что АТ снижалось во время лечения НФГ, но во время лечения НМГ АТ оставалось практически неизменным. 50 Это важно не только для диагностики, но и для лечения пациентов с дефицитом АТ. Давно известно, что пациенты с дефицитом АТ могут проявлять резистентность к гепарину, ситуация, при которой пациенты нуждаются в необычно высоких дозах НФГ (> 35 000 ЕД в день) для достижения терапевтически активированного частичного тромбопластинового времени. 51 Устойчивость к гепарину может быть устранена концентратом АТ у пациентов, перенесших операцию искусственного кровообращения, 52 , но аналогичные сравнительные исследования с заменой АТ недоступны для врожденной недостаточности АТ. Тем не менее, замена АТ может рассматриваться в случаях лабораторной устойчивости к гепарину или раннего рецидива или распространения тромбоза, несмотря на антикоагулянтную терапию, что можно рассматривать как клиническую устойчивость к гепарину.
Помимо возможно более низкой эффективности гепарина и фондапаринукса у пациентов с дефицитом АТ, измерение уровней анти-Ха активности также связано с неопределенностью.Многие анализы анти-Ха коммерчески доступны, некоторые с добавлением АТ. Другие полагаются на эндогенный АТ плазмы пациента. 53 В исследовании пациентов с дефицитом AT и контрольной группы с нормальным уровнем AT Croles et al. 54 добавили в образцы НФГ и НМГ, стремясь достичь анти-Ха активности 0,8 МЕ / мл. Средняя анти-Ха-активность с НМГ у лиц с дефицитом АТ, измеренная с помощью анализа, не содержащего экзогенного АТ, составляла только две трети активности у контрольных лиц.Ожидаемые уровни анти-Ха после добавления НМГ были обнаружены у всех недефицитных участников, но только у одной четверти участников с дефицитом. Это исследование ясно демонстрирует, что снижение активности АТ влияет на уровни анти-Ха, и, таким образом, стандартные дозы НМГ могут привести к недостаточному лечению у лиц с дефицитом АТ. Для мониторинга уровней НМГ у пациентов с дефицитом АТ мы предлагаем использовать реагенты без экзогенного АТ, поскольку это может лучше отражать антикоагулянтный потенциал.
В течение десятилетий АВК использовались для лечения пациентов с ВТЭ, в том числе с дефицитом АТ, и общепринято считать, что АВК являются эффективными антикоагулянтами для пациентов с дефицитом АТ.Можем ли мы использовать DOAC? Мы нашли только единичные сообщения об успешном применении апиксабана, 55 эдоксабана, 56 или ривароксабана. 57 Таким образом, клинические доказательства использования DOAC у пациентов с дефицитом AT отсутствуют. Однако, поскольку DOAC действуют независимо от AT, эти препараты могут приобретать значение при лечении острой ВТЭ и в качестве вторичной профилактики у пациентов с дефицитом AT. Это подтверждается экспериментальными данными Fukuda et al. 58 , показывающими, что эдоксабан был одинаково эффективен у мышей дикого типа и гетерозиготных AT-дефицитных мышей на модели тромбоза нижней полой вены.Мы посоветовали нашему пациенту продолжить антикоагулянтную терапию 5 мг апиксабана два раза в день. Неизвестно, могут ли 2,5 мг два раза в день быть полностью защитными при дефиците AT, как показано в общей популяции тромбозов в исследовании AMPLIFY-EXT, 59 . Мы уменьшим количество апиксабана только в том случае, если менструальное кровотечение у нашей пациентки снова ухудшится.
Семейный анамнез нашего пациента сильно свидетельствует о наследственной тромбофилии.Поскольку диагноз дефицита АТ в дальнейшем влияет на ожидаемую частоту рецидивов и на ведение пациентов во время беременности, а также в пери- и послеродовой период, по нашему мнению, важно либо подтвердить, либо исключить такой диагноз. Поэтому мы поддержали тестирование на тромбофилию, в частности определение AT, у этого пациента.
Возникли дополнительные вопросы относительно будущего ведения нашего пациента. Во-первых, следует ли ей посоветовать продолжить антикоагулянтную терапию, даже если во время использования ОК произошел тромбоз? Два факта привели нас к решению предложить пролонгированную антикоагулянтную терапию: вероятная повышенная частота рецидивов у пациентов с дефицитом АТ и тяжелое и опасное для жизни проявление.В недавнем метаанализе оценивались риски первых и повторных тромботических событий. 16 Годовой риск рецидива составлял 8,8% у пациентов с дефицитом по сравнению с 4,3% у пациентов без дефицита; отношение шансов для частоты рецидива было 2,1 с 95% вероятным интервалом от 0,4 до 4,0. Провести различие между спровоцированными и неспровоцированными событиями не представлялось возможным. Поскольку интервенционных исследований продолжительности антикоагулянтной терапии у пациентов с дефицитом АТ нет, каждое решение о длительной антикоагуляции должно приниматься в зависимости от конкретного случая, учитывая индивидуальный риск рецидива ВТЭ и риск кровотечения.Во-вторых, для молодой женщины важны советы по контрацепции. Не было данных, которые могли бы помочь в принятии обоснованного решения. Однако из-за высокого риска ВТЭ при комбинированном применении ОК 39,60 мы не предлагали продолжения, а скорее выступали за варианты с меньшим риском, такие как внутриматочные спирали, в том числе с левоноргестрелом, или таблетки, содержащие только прогестерон.
Еще один важный вопрос касается тестирования членов семьи.Если бы у младшей сестры также был дефицит АТ, ее годовой риск первого ВТЭ составил бы 1,2% согласно недавнему метаанализу 16 и, таким образом, явно выше по сравнению с человеком без дефицита (отношение шансов, 14,0; 95% вероятный интервал, 5.5-29.0). Если бы сестра также использовала комбинированный ОК, ее годовой риск ВТЭ составил бы от 2% до> 10%. 39,60 Можно предположить, что абсолютный риск ВТЭ, связанного с беременностью, достигает 16%. 61 Поэтому мы предложили сообщить сестре о возможности тестирования на дефицит АТ.Если бы у пациента был брат, мы бы, в этой конкретной семье, также посоветовали бы пройти тестирование после тщательного консультирования. Хотя никогда не было доказано, что тестирование улучшает исход, 62 и смертность в настоящее время не увеличивается у пациентов с тромбофилией, 63 , мы предпочитаем индивидуальный подход к этому редко встречающемуся заболеванию. Возможные преимущества — это ранняя диагностика ВТЭ, как только появляются симптомы ТГВ или ТЭЛА, и более строгая и индивидуальная профилактика тромбоза в ситуациях риска. 33 Тем не менее, следует обратить внимание членов семьи на то, что у лиц с недостаточным уровнем здоровья также может быть повышенный риск тромбоза 64 и что тестирование на тромбофилию может отрицательно повлиять на страховое покрытие.
Пациенту 35 лет была запланирована лапароскопическая холецистэктомия. Его история болезни показала, что в возрасте 19 лет у него во время инфекции развился левосторонний проксимальный ТГВ и сопутствующая двусторонняя сегментарная ТЭЛА.Уровни антигена AT и уровни активности, которые были измерены в острой фазе и повторены дважды после этого, постоянно демонстрировали снижение антигена AT и значения активности в диапазоне от 40% до 50% (нормальный диапазон, 80% -120%). У матери пациентки после операции на бедре развилась ТЭЛА, а также у нее был дефицит АТ 1 типа. После первоначального лечения НФГ были начаты и продолжены ВАК без кровотечений или рецидивов ВТЭ.
Пациент направлен для планирования периоперационного лечения; международное нормализованное отношение (INR) по-прежнему составляло 2.5, хотя VKA уже были приостановлены на 5 дней. После введения 5 мг витамина К на следующий день МНО составляло 1,3, и утром вводили однократную дозу далтепарина из расчета 100 МЕ / кг МТ. На следующий день перед вмешательством и на следующий день после него было введено 3000 МЕ концентрата АТ, полученного из плазмы, который, как ожидалось, повысил уровни АТ до нормальных значений (80% -120%; BW, 81 кг), и далтепарин. была снижена до профилактической дозы. На второй послеоперационный день дальтепарин снова был повышен до 100 МЕ / кг МТ один раз в день одновременно с повторным введением АВК до достижения целевого МНО.Кровотечения или ВТЭ не было.
Не проводились рандомизированные контролируемые испытания, оценивающие необходимость замены АТ или дозы НМГ, которые должны использоваться в периоперационных условиях у пациентов с наследственной недостаточностью АТ. Однако было показано, что у пациентов с наследственной тромбофилией примерно половина всех событий ВТЭ происходит в ситуациях преходящего риска. 33 Кажется разумным заменить АТ, когда хирургические процедуры с повышенным риском ВТЭ проводятся у пациентов с наследственной недостаточностью и тромбозом в личном и / или семейном анамнезе. 3,65,66 В таких ситуациях мы предлагаем увеличить АТ до нормальных уровней (80% -120%) и назначать НМГ в обычной профилактической дозе, что, по нашему мнению, более безопасно в отношении кровотечения, чем увеличение дозы. НМГ. Для периоперационной профилактики ВТЭ Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США одобрило использование полученных из плазмы и рекомбинантных концентратов AT 67 ; в Европе доступны только концентраты, полученные из плазмы. Если используются концентраты АТ, полученные из плазмы, можно применять болюсные дозы, аналогичные используемым в нашем случае.Пациентам, перенесшим операцию с очень высоким риском тромбоза (например, хирургия рака), или женщинам, перенесшим кесарево сечение, мы предлагаем длительный период замены АТ (например, 5 дней) и регулярные измерения минимальных уровней АТ с попыткой поддерживайте минимальный уровень АТ> 70%. Если используется рекомбинантный AT, необходимо ввести начальный болюс с последующей непрерывной инфузией, поскольку рекомбинантный AT имеет гораздо более короткий период полувыведения (~ 10 часов), чем AT, полученный из плазмы (~ 2-3 дня). График дозирования для замены АТ был предложен Bauer et al. 66 При небольших хирургических вмешательствах с низким риском ВТЭ мы не предлагаем замену АТ. У пациентов с безболезненным личным и семейным анамнезом, у пациентов с гетерозиготным дефицитом HBS AT типа 2 и у пациентов с незначительным снижением уровней AT (например, 70-80%) мы обычно не рассматриваем периоперационную замену AT.
31-летняя женщина, у которой развился проксимальный ТГВ в возрасте 21 года при использовании ОК, лечилась АВК в течение 6 месяцев.В возрасте 24 лет у нее развился рецидив ВТЭ, тогда как неспровоцированный ТГВ и симптоматическая ТЭЛА. Тест на тромбофилию выявил уровень АТ 56% (уровень антигена 54%; нормальный диапазон 80–120%), что соответствует дефициту типа 1. Ее семейный анамнез был положительным в отношении тромботических проявлений; у ее матери развился вызванный беременностью ТГВ и рецидив через несколько лет после первой ВТЭ, а у ее сестры после родов возникла первая ВТЭ, а затем также рецидивирующий ТГВ. В обоих случаях был подтвержден тип дефицита АТ 1; кроме того, сообщалось о тромбозе у деда по материнской линии.После второго события пациенту была назначена длительная антикоагулянтная терапия с помощью АВК. Четыре года назад она обратилась за советом по поводу запланированной беременности. Консультации включали информацию о повышенном риске ВТЭ во время беременности и после родов, а также о потенциальном эмбриотоксическом действии АВК, особенно когда АВК не прекращают до 6 недели. 68 Поскольку у нее было 2 тромботических события, второе неспровоцированное, она находилась на АВК, и ее гинеколог проинструктировал ее внимательно наблюдать за ее менструальным циклом и проводить тест на беременность, как только у нее задерживается менструальное кровотечение.
Она недавно забеременела и прекратила АВК до шестой недели беременности; ее масса тела составляла 63 кг. Гинеколог немедленно начал принимать эноксапарин в дозе 150 МЕ / кг МТ один раз в день (пик анти-Ха, 0,48 МЕ / мл); на 12-й неделе беременности доза была увеличена до 100 МЕ / кг дважды в день (пик анти-Ха, 0,65 МЕ / мл; измерение AT с помощью анализа без AT в реагенте). Мы предоставили письменную рекомендацию акушеру и самой пациентке с заявлениями относительно антикоагуляции и замены АТ в пери- и послеродовом периодах и номером телефона круглосуточной службы тромбоза и гемостаза для управления непредвиденными ситуациями.Замена АТ примерно во время родов будет начинаться с дозы, которая приведет к увеличению уровней АТ до нормального диапазона (50 Ед / кг МТ), и мы планируем поддерживать минимальные уровни на уровне не менее 70% в течение первых 5 дней. дней после доставки. В течение этого времени будут вводиться только профилактические препараты НМГ. На 2-й день после родов будет повторно инициирована АВК, варфарин или аценокумарол, 69 , параллельно с заменой НМГ и АТ, при условии отсутствия послеродового кровотечения. В случае кесарева сечения мы начнем замену AT перед операцией.Замена АТ не является противопоказанием к эпидуральной анестезии; однако необходимо учитывать временной интервал до последнего введения НМГ. Мы прекращаем профилактическую антикоагуляцию за 12 часов и терапевтическую антикоагуляцию за 24 часа до кесарева сечения и вводим первую профилактическую дозу НМГ как можно скорее через ≥4 часов после удаления эпидурального катетера. 70
Девочка 13 лет обратилась с жалобой на боль и отек в правой ноге в течение 4 дней и повышение температуры тела в течение 2 дней.Три недели назад она была прикована к постели в течение 3 дней из-за гриппоподобной инфекции. У нее не было других заболеваний, и ее семейный анамнез не выявил ВТЭ. Дуплексная сонография показала проксимальный тромбоз от бедренной кости до нижней полой вены. При компьютерной томографии были обнаружены дополнительные тромбозы воротной и верхней брыжеечных вен и множественные коллатерали. Лабораторные тесты показали, что активность AT составляет всего 14%, что свидетельствует о серьезном дефиците AT, степень которого не может быть объяснена потреблением AT от тромбоза.Она родилась в Вене, Австрия, в семье рома; ее родители родились в Сербии.
Лечение было начато с повышения значений AT путем замены (целевое значение, 80% активности AT) и начала непрерывного НФГ. Через 3 дня НФГ был переведен на терапевтические дозы НМГ. Было начато лечение АВК, а замена AT и НМГ была прекращена, как только МНО стало в пределах терапевтического диапазона. После этого лечения опухоль ее правой ноги почти полностью исчезла, а визуализация воротной и брыжеечной вен показала почти полное исчезновение тромбов.
Результаты генетического тестирования выявили наличие гомозиготного дефицита HBS AT типа 2, также называемого AT Budapest 3 77 (c.391C> T p.Leu131Phe). Антиген AT составил 72%. Оба родителя и брат были гетерозиготными носителями. Она не постоянно соблюдала режим лечения, и через 8 лет у нее развился проксимальный ТГВ левой ноги (субтерапевтическое МНО). В то время целевой INR был увеличен до 2.От 5 до 3,5, но вскоре антикоагулянтная терапия была переведена на 5 мг апиксабана два раза в день, и с тех пор пациентка лечилась без осложнений.
Дефекты HBS AT типа 2 являются наиболее частыми, но наименее протромботическими из мутаций AT. Соответственно, у родителей нашего пациента никогда не было случая ВТЭ. Однако из-за гомозиготности у нашего пациента развилась ВТЭ в раннем возрасте в ситуации незначительного риска. 78 Немедленная диагностика дефицита AT и нормализация уровней AT вместе с терапевтическими антикоагулянтами привели к быстрому улучшению. Возможные сомнения относительно перехода антикоагулянтов с АВК на апиксабан после рецидива могут возникнуть в результате фундаментального отсутствия клинических данных, подтверждающих использование ДОАК у пациентов с дефицитом АТ. Однако наше решение было основано на логических соображениях, которые обсуждаются в деле 1.
Следует отметить, что HBS с гомозиготной недостаточностью AT типа 2 может приводить к очень тяжелым венозным и артериальным тромботическим явлениям (например, массивному инсульту) у новорожденных и детей; поэтому необходимы ранняя диагностика и лечение. 22,79 Согласно литературным данным, большинство пациентов с HBS типа 2 происходят из Балканского региона, и мы знаем об эффекте основателя мутации Budapest 3. 47 В большинстве случаев их функциональный уровень АТ <35%. 18,19 У этих женщин также исключительно высокий риск выкидыша и гибели плода. Успешные исходы беременности редки и наблюдаются только у женщин, принимающих антикоагулянты. Даже у женщин с сопутствующей заменой НМГ и АТ во время беременности риск потери беременности составлял 50%. 18,19
Дефицит антитромбина — Консультант по терапии рака
Краткий обзор
Дефицит антитромбина — это наследственное венозное тромботическое заболевание. Наличие в анамнезе необъяснимого венозного тромбоза у пациента младше 50 лет с семейным анамнезом венозного тромбоза должно побуждать к рассмотрению дефицита антитромбина. Во-первых, венозный тромбоз с дефицитом антитромбина обычно возникает у здоровых людей примерно в возрасте 30 лет.Тромбоз может быть спровоцирован операцией, травмой, беременностью или длительной иммобилизацией, например, поездкой на автомобиле или самолете более 8 часов. Венозный тромбоз, связанный с дефицитом антитромбина, может возникать в необычных местах, таких как воротная вена, брыжеечная вена, верхний сагиттальный синус или вены руки, и одновременно в нескольких венах. Любой из этих признаков необычного венозного тромбоза должен побуждать к рассмотрению дефицита антитромбина.
Дефицит антитромбина встречается примерно у 1 из 1000 человек.Пациенты с дефицитом антитромбина, как правило, являются гетерозиготами с 1 аномальным и 1 нормальным геном антитромбина, что приводит к аутосомно-доминантному типу наследственности (мужское и женское, каждое поколение демонстрирует нарушение).
Какие тесты мне следует запросить, чтобы подтвердить мой клинический Dx? Кроме того, какие дополнительные тесты могут быть полезны?
Наиболее полезным тестом для оценки возможной недостаточности антитромбина является анализ активности антитромбина. Антитромбиновая активность предпочтительнее, чем анализы антитромбинового антигена, поскольку анализы активности выявляют как низкие уровни продукции антитромбина, так и аномальный или дисфункциональный антитромбин, который приводит к низкой активности, даже если уровни антигена могут быть нормальными.Обычно активность антитромбина менее примерно 75% от нормы предполагает возможный дефицит антитромбина. Если активность антитромбина низкая, ее следует повторить для подтверждения результатов до установления диагноза недостаточности антитромбина.
Если у пациента подтверждена низкая активность антитромбина, можно определить уровни антитромбинового антигена, чтобы определить, есть ли у пациента дефицит антитромбина 1-го типа (то есть низкие уровни активности и антигена, указывающие на снижение выработки антитромбина) или 2-го типа (т.е. низкие уровни активности с нормальным антигеном, указывающие на аномальную молекулу антитромбина).
Существуют ли факторы, которые могут повлиять на результаты лабораторных исследований? В частности, принимает ли ваш пациент какие-либо лекарства — безрецептурные или травяные — которые могут повлиять на результаты лабораторных исследований?
Уровни антитромбина не следует измерять у пациентов, получающих гепарин, терапию низкомолекулярным гепарином или терапию аспарагиназой, поскольку эти препараты могут снижать уровень антитромбина до 30%, что приводит к ошибочно заниженным оценкам исходной активности антитромбина.Подождите не менее 10 дней после прекращения приема лекарств, прежде чем измерять активность антитромбина.
Уровни антитромбина также могут временно снижаться у пациентов с обширным венозным тромбозом, тромбозом воротной вены или диссеминированным внутрисосудистым свертыванием (ДВС) из-за потребления антитромбина в процессе свертывания крови. Перед измерением активности антитромбина подождите, пока пациент не оправится от текущего тромботического эпизода. У пациентов с тяжелым гепатоцеллюлярным заболеванием печени или нефротическим синдромом может наблюдаться снижение уровня антитромбина, соответственно, из-за снижения выработки или потери белка с мочой.
Пациенты, принимающие варфарин или прямые ингибиторы тромбина, такие как аргатробан, бивалирудин или дабигатран, могут иметь ложно высокие уровни антитромбина, поэтому перед измерением активности антитромбина лучше подождать, пока пациент не прекратит прием этих лекарств и у него будет нормальное протромбиновое время.
Уровни антитромбина у всех людей очень похожи. Концентрация антитромбина в крови не меняется в значительной степени в зависимости от времени суток, расы, возраста, пола или менструального цикла.
Какие лабораторные результаты являются полностью подтверждающими?
Генетическое тестирование мутаций антитромбина обычно не проводится, так как существует множество различных мутаций, которые могут вызывать дефицит антитромбина, стоимость тестирования высока, клиническая доступность низкая, а окончательный диагноз плохой, если мутация не была хорошо описана и известна заранее быть связано с дефицитом и повышенным риском венозного тромбоза.
Активность антитромбина менее 60% от нормы у пациента, не принимающего гепарин, низкомолекулярный гепарин, варфарин или аспарагиназу, без продолжающегося тромбоза, заболевания печени или нефротического синдрома, вероятно, будет иметь наследственный дефицит антитромбина.
Предсказывает ли дефицит антитромбина начальный или рецидивирующий венозный тромбоз или измените рекомендации по антитромботической терапии?
Пациенты с дефицитом антитромбина имеют примерно в пять-десять раз повышенный риск развития венозного тромбоза по сравнению с людьми без наследственной тромбофилии и имеют тенденцию к развитию венозного тромбоза в более молодом возрасте, но у большинства людей с дефицитом антитромбина венозный тромбоз никогда не развивается. Дефицит антитромбина связан с повышенным риском потери плода и венозного тромбоза во время беременности.Тестирование на дефицит антитромбина на практике не позволяет выявить людей, у которых определенно разовьется рецидив венозного тромбоза, снизить частоту рецидивов венозного тромбоза или в большинстве случаев изменить антитромботическую терапию.
Дополнительные клинические проблемы
Дефицит антитромбина, как правило, не связан с повышенным риском тромбоза у детей до полового созревания, если только они не имеют других факторов риска венозного тромбоза, таких как рак, инфекция или внутрисосудистые катетеры.
Уровни активности антитромбина иногда измеряются у пациентов с «резистентностью к гепарину» или необъяснимой слабой реакцией на стандартные дозы нефракционированного гепарина с использованием тестов с активированным частичным тромбопластиновым временем или активированным временем свертывания крови.
Активность антитромбина или уровни антигена измеряются у некоторых пациентов при длительном применении экстракорпоральных мембранных оксигенаторов (ЭКМО), поскольку они могут со временем потреблять антитромбин, снижая эффект гепарина, используемого для предотвращения свертывания крови в контуре оксигенатора.
Нет значимой клинической связи между дефицитом антитромбина и артериальным тромбозом.
Ошибки при выборе и интерпретации тестов
Активность антитромбина предпочтительнее, чем анализы антитромбинового антигена, поскольку анализы активности обнаруживают как низкие уровни продукции антитромбина, так и аномальный или дисфункциональный антитромбин, который приводит к низкой активности, даже если уровни антигена могут быть нормальными. Оптимальный анализ активности антитромбина использует бычий тромбин, а не человеческий тромбин или фактор Ха, для измерения антитромбиновой активности.
Наиболее частой ошибкой при интерпретации результатов активности антитромбина является ложный диагноз наследственной недостаточности антитромбина из-за приобретенных низких уровней активности антитромбина, связанных с терапией гепарином или продолжающимся тромбозом. Поскольку распространенность дефицита антитромбина в популяции низкая (вероятность предварительного тестирования низкая), вероятны ложноположительные результаты, если результат близок к нижней границе референсного диапазона.

