Анализы в KDL. Альфа-амилаза
Альфа-амилаза – фермент, помогающий организму усваивать сложные углеводы. Синтезируется в разных тканях и органах, главным образом в слюнных и поджелудочной железах. Слюнная фракция фермента участвует в начальном этапе пищеварения, а панкреатическая выводится в двенадцатиперстную кишку, где происходит основной этап расщепления углеводов, избыток фермента выделяется из организма с мочой. В небольшом количестве амилаза постоянно присутствует в моче и крови, однако отклонения от нормы свидетельствуют о нарушениях со стороны поджелудочной или слюнных желез.
Повышение амилазы в организме может быть вызвано заболеваниями поджелудочной железы, нарушениями оттока желчи, патологией слюнных желез. Наиболее опасным из таких состояний является острый панкреатит, при котором происходит массовое повреждение клеток поджелудочной железы. При этом амилаза в крови может повышаться в 6-10 раз в сравнении с нормой; одновременно повышается липаза — другой фермент поджелудочной железы.
Если концентрация амилазы в крови растет, а в моче остается в норме, причиной может быть макроамилаземия – состояние, при котором амилаза связывается с крупными белками или углеводами, и перестает проходить через почечный барьер.
В каких случаях обычно назначают исследование?
- При наличии симптомов панкреатита – острая, опоясывающая боль, рвота, потеря аппетита, повышение температуры;
- При подозрении на нарушение оттока желчи;
- Для оценки работы слюнных желез;
- При лечении опухолей поджелудочной железы;
- После удаления желчных камней для оценки состояния желчного протока.
Что именно определяется в процессе анализа?
Происходит измерение концентрации общей амилазы в сыворотке крови или моче колориметрическим методом.
Что означают результаты теста?
При остром панкреатите происходит резкий скачок амилазы в крови с одновременным ростом липазы; обычно в сочетании с сильной опоясывающей болью, рвотой, потерей аппетита.
Другими причинами повышения амилазы в крови могут быть нарушения работы слюнных желез, затруднения оттока желчи вплоть до закупорки желчного протока камнем или растущей опухолью, травмы поджелудочной железы, макроамилаземия, декомпенсированный сахарный диабет, непроходимость кишечника. Также рост уровня амилазы возможен при беременности и приеме некоторых лекарств — фуросемид, ибупрофен, наркотические обезболивающие, каптоприл, кортикостероиды, оральные контрацептивы.
Уровень амилазы ниже нормы наблюдается при муковисцидозе, недостаточности поджелудочной железы или ее удалении, тяжелых формах гепатита, повышенном холестерине, а также в младенческом возрасте.
Сроки выполнения теста.
Обычно результат анализа можно получить через 1-2 дня после сдачи крови.
Как подготовиться к анализу?
Следует придерживаться общих правил подготовки к взятию крови из вены. Можно сдавать кровь натощак или не ранее, чем через 3 часа после еды.
Можно сдавать кровь натощак или не ранее, чем через 3 часа после еды.
Альфа-амилаза общая биохимический анализ крови на фосфор сдать платно в Воронеже
Описание
Альфа-амилаза – это фермент, основную часть которого вырабатывает поджелудочная железа и слюнные железы. Амилаза играет важную роль в углеводном обмене веществ, регулирует работу пищеварительной системы, а также отвечает за расщепление и усвоение крахмала и сложных углеводов. Повышенная концентрация этого фермента типична для широкого круга заболеваний, имеющих схожую с панкреатитом клиническую картину. Амилаза в самых больших концентрациях находится в поджелудочной железе и слюнных железах. Амилаза удаляется из плазмы почками и экскретируется с мочой. Рост активности амилазы имеет самое большое значение при диагностике болезней поджелудочной железы.
Диагностические возможности тестов на альфа-амилазу
Анализ крови на альфа-амилазу включает в себя определение суммарной активности панкреатической и слюнной амилаз. Из-за ограниченного количества специфических клинических проявлений, сопровождающих болезни поджелудочной железы, именно общий анализ амилазы имеет важнейшее значение в их диагностике и мониторинге, особенно это касается острых панкреатитов.
Из-за ограниченного количества специфических клинических проявлений, сопровождающих болезни поджелудочной железы, именно общий анализ амилазы имеет важнейшее значение в их диагностике и мониторинге, особенно это касается острых панкреатитов.
Помимо панкреатитов гиперамилаземия наблюдается при ряде других заболеваний:
- сахарный диабет любого типа;
- травматические поражения брюшной полости;
- перфоративная язва желудка;
- рак поджелудочной железы;
- кишечная непроходимость;
- острый аппендицит;
- тромбоз брыжеечных сосудов;
- почечная недостаточность;
- перитонит;
- паротит;
- злоупотребление алкоголем;
- камни в желчном пузыре и протоках.
Низкий уровень альфа-амилазы в крови характерен для следующих состояний:
- послеоперационный период после удаления поджелудочной железы;
- повышенный уровень холестерина;
- токсикоз во время беременности;
- острые и хронические гепатиты, а также другие патологии печени;
- гепатоз;
- кистозный фиброз;
- нарушения в работе поджелудочной железы;
- осложнения при остром панкреатите;
- тиреотоксикоз.

Перечисленные заболевания – это только часть наиболее типичных случаев, сопровождающихся повышением или снижением уровня альфа-амилазы. Отклонения от нормы по концентрации в крови этого фермента должны трактоваться только лечащим врачом с учетом анамнеза, результатов других анализов и обследований, поскольку активность альфа-амилазы имеет свою специфику.
Наивысшая концентрация амилаза проявляется в течение нескольких часов после повреждения клеток и сохраняется на таком уровне до пяти дней, что наиболее характерно для острого панкреатита. Но нередко даже при таком состоянии концентрация фермента может быть в норме или лишь незначительно ее превышать, кроме того эти данные не дают возможности определить степень поражения железы. Поэтому при расшифровке результатов большое значение имеет общая клиническая картина.
Несмотря на информативность для диагностики широко спектра заболеваний, основными показаниями к назначению исследования на эти ферменты являются: заболевания поджелудочной и слюнных желез, муковисцидоз и синдром острого живота.
О приеме любых медикаментозных средств, перед тем как сдать кровь нужно предупредить врача, а при возможности их прием лучше отменить, поскольку на уровень этих ферментов влияет широкий спектр препаратов: анаболические стероиды, эстрогены, фуросемид, ибупрофен, пероральные контрацептивы, тетрациклин и др.
«Детский доктор» – сеть современных клиник в Воронеже с собственной лабораторией, где мы среди прочего проводим тестирование на уровень альфа-амилазы. Мы работаем как с детьми, так и со взрослыми и гарантируем высокое качество тестирования, диагностики и лечения.
Альфа амилаза в крови и моче
Альфа амилаза в крови и моче | Медицинская клиника «МЕДЭКСПЕРТ»Альфа-амилаза (диастаза) – фермент, который участвует в расщеплении полисахаридов (крахмал и гликоген) до дисахаридов (мальтоза) и моносахаридов (глюкоза). Он вырабатывает в поджелудочной и слюнных железах.
Норма альфа амилазы в крови:
- дети до 1 года: 5-65 Ед/л;
- 1 – 70 лет: 25-125 Ед/л;
- старше 70 лет: 20-160 Ед/л.

Норма альфа амилазы в моче – 10-124 Ед/л (или 1-17 Ед/ч).
У здорового человека в крови и моче содержится незначительное количество этого фермента. При этом выделяют 2 фракции (изоферменты):
- панкреатическая альфа-амилаза (P-тип) – вырабатывается в поджелудочной железе;
- слюнная альфа-амилаза (S-тип) – вырабатывается в слюнных железах.
В норме доля панкреатической диастазы в крови составляет 40%, а слюнной – 60%.
Услуги медэксперт
Записаться на прием
ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. НЕОБХОДИМА КОНСУЛЬТАЦИЯ СПЕЦИАЛИСТА
Оформление заявки
×Вызвать врача на дом
×Результаты анализов
×Оставить отзыв
× Казань, ул. Муштари, д.12а
Казань, ул. Муштари, д.12аРежим работы: 08:00 — 20:00, суббота: 08:00 — 15:00, воскресенье — выходной
Адрес: г. Казань, ул. Сиб. Хакима, д. 52
Режим работы: 08:00 — 20:00, суббота: 8.00 — 15.00, воскресенье — выходной
Адрес: г. Казань, ул. Сиб. Хакима, д. 50
Режим работы: 08:00 — 20:00, суббота: 8.00 — 15.00, воскресенье — выходной
Сдать анализ на альфа-амилазу (диастазу)
Метод определения Энзиматический колориметрический (рекомендованный IFCC).
Исследуемый материал Сыворотка крови
Доступен выезд на дом
Онлайн-регистрацияСинонимы: Диастаза; Сывороточная амилаза; Альфа-амилаза; Амилаза сыворотки.
Alpha-amylase; α-Amylase; Amy; AML; Diastase; 1,4-α-D-glucanohydralase; Serum amylase; Blood amylase.
Краткая характеристика определяемого вещества альфа-амилаза
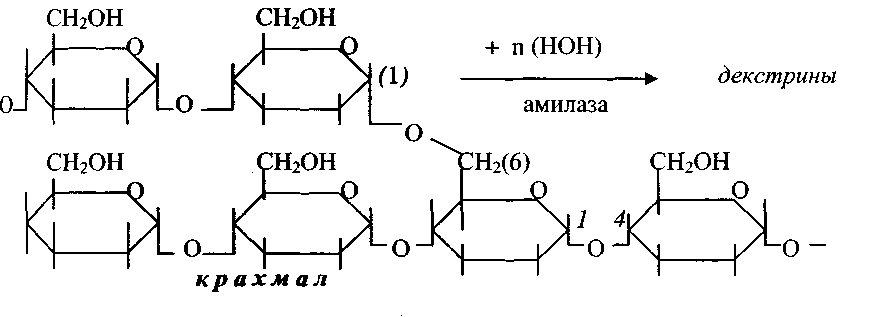
Фермент, участвующий в расщеплении углеводов. Амилаза – гидролитический фермент, разлагает крахмал и гликоген до мальтозы.
Амилаза образуется преимущественно в слюнных железах и поджелудочной железе, поступает затем соответственно в полость рта или просвет двенадцатиперстной кишки и участвует в переваривании углеводов пищи.
В сыворотке крови выделяют соответственно панкреатический и слюнной изоферменты амилазы. Значительно более низкой амилазной активностью обладают также такие органы как яичники, фаллопиевы трубы, тонкий и толстый кишечник, печень.
С какой целью определяют уровень альфа-амилазы в крови
Исследование амилазы в сыворотке крови применяют преимущественно в целях диагностики и контроля лечения острого панкреатита, а также других видов патологии поджелудочной железы.
Особенность аналита, которая может повлиять на результат теста «Альфа-Амилаза»
Фермент выводится почками. Следовательно, увеличение сывороточной активности амилазы приводит к повышению активности амилазы в моче.
Амилаза может образовывать крупные по размеру комплексы с иммуноглобулинами и другими белками плазмы, поэтому не проходит через почечные клубочки, а содержание её в сыворотке возрастает, в моче наблюдается нормальная активность амилазы.
Медицинские анализы — Альфа-Амилаза
Альфа-амилазы – это гидролитические ферменты, разлагающие крахмал до мальтозы. В организме человека альфа-амилазы имеют различное происхождение: панреатическая амилаза производится поджелудочной железой и выходит в кишечный тракт, слюнная амилаза синтезируется в слюнных железах и секретируется в слюну. Присутствующая в крови амилаза выходит через почки и экскретируется в мочу. В основном, измерение альфа-амилазы в сыворотке и в моче используется для диагностики нарушений работы поджелудочной железы и для обнаружения развития осложнений. При острых панкреатитах активность амилазы повышается в течении нескольких часов после начала болей в животе, примерно через 12 часов достигает пика и возвращается к нормальным значениям по прошествии 5и дней. Специфичность альфа-амилазы для болезней поджелудочной железы не очень высока, поскольку повышенные уровни также наблюдаются при различных болезнях, не связанных с поджелудочной железой, например, паротите и почечной недостаточности. Поэтому для подтверждения острого панкреатита необходимо дополнительно проводить измерение активности липазы.
При острых панкреатитах активность амилазы повышается в течении нескольких часов после начала болей в животе, примерно через 12 часов достигает пика и возвращается к нормальным значениям по прошествии 5и дней. Специфичность альфа-амилазы для болезней поджелудочной железы не очень высока, поскольку повышенные уровни также наблюдаются при различных болезнях, не связанных с поджелудочной железой, например, паротите и почечной недостаточности. Поэтому для подтверждения острого панкреатита необходимо дополнительно проводить измерение активности липазы.
Референтные значение
| Возраст | Активность альфа-амилазы Ед/мл |
| Новорожденные от 2 до 4 дней | 5 – 65 |
| Взрослые | 27 – 131 |
| Взрослые в возрасте от 60 до 90 лет | 24 — 151 |
Факторы, вызывающие искажение результата: гемолиз пробы крови.
Факторы, увеличивающие активность
- Прием алкоголя.

- Вещества, вызывающие сокращение сфинктера Одди (например, бетанехол, дифеноксилат, наркотические анальгетики), секретин.
Некоторые препараты могут вызывать повышение активности амилазы в сыворотке и, возможно, панкреатит:
Аспарагиназа, Азатиоприн, Каптоприл, Циметидин, Клофибрат, Кортикостероиды, Ципрогептадин, Диданозин, Эстроген, Этакриновая кислота, Фуросемид, Ибупрофен, Индометацин, Мефенаминовая кислота, Метилдофа, Нитрофурантоин, Пероральные контрацептивы, Пентамидин, Фенилбутазон, Сульфонамиды, Сулиндак, Тетрациклины, Тиазидные диуретики, Вальпроевая кислота, Зальцитабин, Загрязнение образца или реакционной смеси слюной.
Факторы, уменьшающие активность
Анаболические стероиды, Липемия, Оксалаты, Цитрат, Фторид, ЭДТА.
Увеличение активности
- Панкреатит (при остром панкреатите активность повышается более чем в 5 раз)
- Паротит
- Обтурационная и странгуляционная непроходимость или инфаркт кишки
- Эктопическая беременность
- Заболевания желчных путей всех типов
- Диабетический кетоацидоз
- Киста или псевдокиста поджелудочной железы, как осложнения острого панкреатита (при панкреатической псевдокисте активность амилазы не возвращается к норме после острого приступа более длительный срок)
- Перитонит
- Макроамилаземия
- Некоторые опухоли легких и яичников
- Почечная недостаточность
- Эндоскопическая ретроградная холангиопанкреатография
- Абдоминальная травма
- Повреждение черепа
- Вирусные инфекции
- Состояние после операции, алкоголь
Уменьшение активности
- Недостаточность поджелудочной железы
- Выраженный муковисцидоз
- Тяжелое поражение печени
- Хирургическое удаление поджелудочной железы
Анализ крови на альфа-амилазу сдать в Москве
Альфа-амилаза — фермент, разлагающий крахмал и гликоген до мальтозы. Синтезируется главным образом в поджелудочной и слюнных железах. Данный тест применяют, как правило, для диагностики и контроля лечения панкреатита и других заболеваний поджелудочной железы.
Синтезируется главным образом в поджелудочной и слюнных железах. Данный тест применяют, как правило, для диагностики и контроля лечения панкреатита и других заболеваний поджелудочной железы.
Фермент является составляющей частью панкреатического сока. Он поступает в двенадцатиперстную кишку, где используется организмом для пищеварения.
В норме концентрация амилазы незначительная. Присутствие небольшого количества фермента объясняется естественным обновлением клеток. Значительное количество фермента попадает в кровь при повреждении поджелудочной, а также в случае наличия препятствий для свободного тока сока в виде новообразований либо камней.
Тест назначается в ходе диагностики панкреатита, а также ряда других заболеваний, для которых характерно вовлечение поджелудочной. В таких случаях вместе с ним назначается анализ на количество липазы. Также тест используется для контроля лечения онкологии, затрагивающей железу.
Повышение альфа-амилазы возможно по различными причинами. При хроническом панкреатите показатели могут превышать норму в 6-10 раз. Это воспалительное заболевание, характеризующееся поражением тканей поджелудочной. Оно развивается при нарушении оттока панкреатического сока. Содержащиеся в нем ферменты оказывают повреждающее воздействие на окружающие ткани. При острой форме воспалительный процесс развивается стремительно. Без своевременной медицинской помощи возможен летальный исход.
При хроническом панкреатите показатели могут превышать норму в 6-10 раз. Это воспалительное заболевание, характеризующееся поражением тканей поджелудочной. Оно развивается при нарушении оттока панкреатического сока. Содержащиеся в нем ферменты оказывают повреждающее воздействие на окружающие ткани. При острой форме воспалительный процесс развивается стремительно. Без своевременной медицинской помощи возможен летальный исход.
Амилаза обычно повышается через несколько часов после повреждения клеток. Высокие показатели сохраняются до 5-ти дней. Значительное увеличение показателей при наличии сильной боли с высокой долей вероятности указывает на острый панкреатит. В некоторых случаях при таком заболевании концентрация фермента ненамного превышает норму или остается в ее пределах. Уровень фермента не позволяет судить о том, насколько сильно поражена железа. Если большая часть клеток, синтезирующих фермент, гибнет, его количество остается в пределах нормы. Поэтому при интерпретации результатов анализа крови на альфа-амилазу учитывается анамнез, клиническая картина и другие факторы.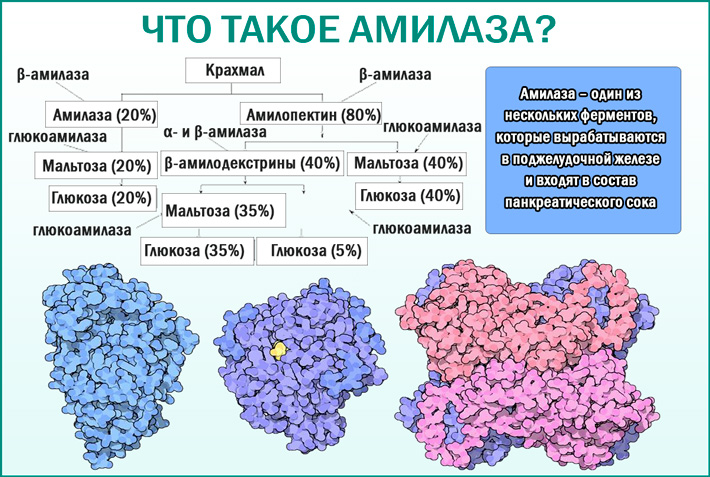
Хроническая форма характеризуется периодическими обострениями. Во время ремиссии существенные жалобы обычно отсутствуют. По мере прогрессирования заболевания функциональные ткани замещаются соединительной, которая не способная синтезировать ферменты и выполнять другие функции. Железа постепенно теряет способность продуцировать вещества, необходимые для нормального процесса пищеварения. Очередное обострение может быть вызвано нарушением рекомендованной врачом диеты. Без своевременной диагностики и адекватного лечения патологические изменения со временем приобретают необратимый характер. Показатели амилазы при хронической форме заболевания сначала повышаются, а по мере прогрессирования патологического процесса могут постепенно приходить в норму. Для грамотной интерпретации результатов теста и назначения лечения необходимо обращаться к врачу.
Помимо панкреатита высокое количество фермента может быть вызвано и другими причинами:
- декомпенсацией диабета;
- онкологией поджелудочной или ее травмой;
- острым аппендицитом;
- камнями в панкреатическом протоке;
- острым холециститом;
- кишечной непроходимостью;
- макроамилаземией;
- разрывом аневризмы аорты.

Низкие показатели амилазы наблюдаются при муковисцидозе, снижении функций поджелудочной, после ее удаления. Иногда причиной этого может быть повышенный холестерин. Прием ряда лекарственных препаратов может приводить к повышению активности фермента. У грудных детей в норме активность амилазы низкая. Она постепенно повышается и к году достигает тех же значений, что и у взрослых.
Альфа-амилаза (S-Amyl) – SYNLAB Eesti
Aмилаза – одна из составляющих сока поджелудочной железы, секретируется в клетках ацинуса поджелудочной железы, при попадании в двенадцатиперстную кишку участвует в переваривании крахмала.
Хотя амилаза является чувствительным анализом по отношению к патологии поджелудочной железы, она неспецифична, так как секреция амилазы происходит еще в слюнных железах.
Показания:
- Диагностика панкреатита и наблюдение за его течением (как острого, так и хронического)
- Диагностика кисты или псевдокисты поджелудочной железы
- Диагностика других гастроинтестинальных патологий
- Диагностика паротита (свинки)
Метод анализа: Фотометрия
Референтное значение: <100 U/L
Интерпретация результата:
Высокие значения амилазы:
- Повреждение клеток ацинуса поджелудочной железы (панкреатит)
- Обструкция протока поджелудочной железы (опухоль поджелудочной железы, камень в общем желчном протоке)
Вышеперечисленные болезни способствуют попаданию энзима во внутреннюю лимфатическую систему поджелудочной железы и перитонеальную полость. Через сосуды, абсорбирующие лимфу, амилаза попадает в общее кровообращение. Ненормально высокое содержание амилазы возникает в течение 12 часов от начала заболевания. Поскольку ами- лаза выводится из организма через почки очень быстро (клиренс за 2 часа), то содержание амилазы нормализуется в течение 48-72 часов после ликвидации причины обструкции. При персистирующем панкреатите, закрытии протока или псевдокисте (подтекании через проток) значения амилазы остаются высокими в течение длительного времени.
Через сосуды, абсорбирующие лимфу, амилаза попадает в общее кровообращение. Ненормально высокое содержание амилазы возникает в течение 12 часов от начала заболевания. Поскольку ами- лаза выводится из организма через почки очень быстро (клиренс за 2 часа), то содержание амилазы нормализуется в течение 48-72 часов после ликвидации причины обструкции. При персистирующем панкреатите, закрытии протока или псевдокисте (подтекании через проток) значения амилазы остаются высокими в течение длительного времени.
Например, при перфорации желудка, когда желудочное содержимое попадает в перитонеальное пространство, амилаза с помощью перитонеальных кровеносных сосудов попадает в кровообращение, в результате чего ее содержание в сыворотке крови повышается. При пенетрации язвы в поджелудочную железу также возникает повышение содержания амилазы в крови.
- Воспаление слюнной железы, например, паротит (свинка)
- Эктопическая беременность, диабетический кетоацидоз и некоторые опухоли
Содержание амилазы может быть невысоким по причине малого количества клеток, способ- ных вырабатывать этот энзим, например, при хроническом панкреатите, когда повреждена большая часть клеток поджелудочной железы и при массивном геморрагическом некрозе.
Альфа-амилаза — обзор | ScienceDirect Topics
4.5.4.2 Амилазы
α-амилазы (EC 3.2.1.1) катализируют эндогидролиз длинных цепей α-1,4-глюкана, таких как крахмал и гликоген. Амилазы обычно очищают путем образования комплекса гликоген-амилаза с последующим осаждением в холодном этаноле или, альтернативно, с помощью аффинной хроматографии в гелевой матрице, связанной с ингибитором протеинамилазы. Последовательно изоамилазы можно разделить с помощью анионообменной хроматографии (Terra and Ferreira, 1994).
Большинство амилаз насекомых имеют молекулярную массу в диапазоне 48–60 кДа, значения pI 3,5–4,0 и значения Km с растворимым крахмалом около 0,1%. Оптимумы pH обычно соответствуют pH, преобладающему в средней кишке, из которой были выделены амилазы. Амилазы насекомых являются кальций-зависимыми ферментами и активируются хлоридом при смещении оптимума pH. Активация также происходит с анионами, отличными от хлорида, такими как бромид и нитрат, и, по-видимому, зависит от размера иона (Terra and Ferreira, 1994).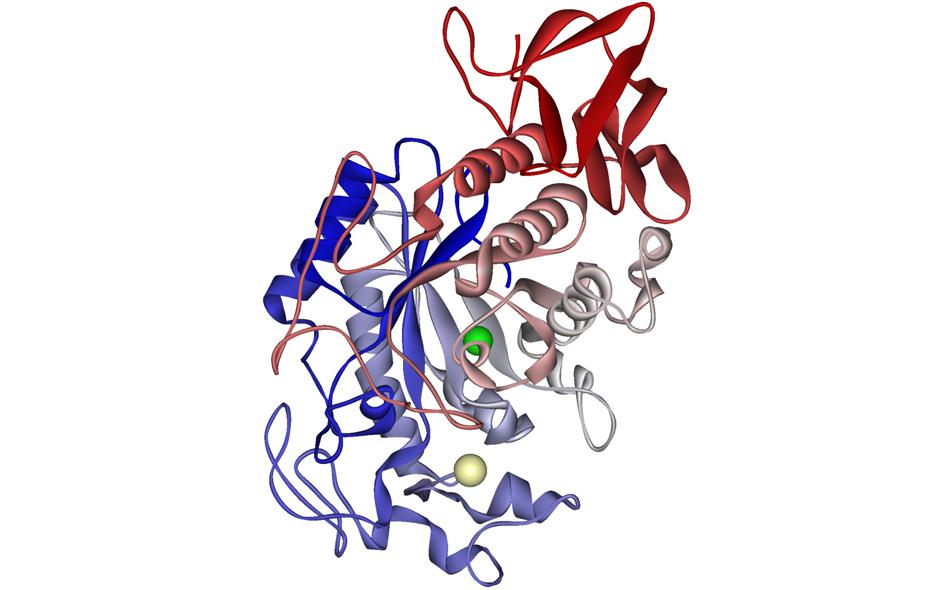
Самая известная α-амилаза насекомых и единственная, трехмерная структура которой была определена, — это α-амилаза средней кишки личинок Tenebrio molitor . Фермент имеет три домена. Центральный домен (домен A) представляет собой (β / α) 8 -бочку, которая составляет ядро молекулы и включает каталитические аминокислотные остатки (Asp 185, Glu 222 и Asp 287) ( T. molitor нумерация α-амилазы повсюду). Домены B и C почти противоположны друг другу, по обе стороны от домена A.Сайт связывания субстрата расположен в длинной V-образной щели между доменами A и B. Там могут быть размещены шесть сахаридных единиц, при этом сахарная цепь расщепляется между третьим и четвертым связанными остатками глюкозы. Ион кальция находится в домене B и координируется с помощью Asn 98, Arg 146 и Asp 155. Этот ион важен для структурной целостности фермента и, по-видимому, также важен из-за его контакта с His 189. Этот остаток взаимодействует с четвертый сахар субстрата связывается в активном центре, образуя петлю между каталитическим центром и сайтом связывания Ca 2+ . Ион хлорида координируется с помощью Arg 183, Asn 285 и Arg 321 в домене A (Strobl et al ., 1998a). Домен C расположен в C-концевой части фермента, содержит так называемый мотив «греческого ключа» и не имеет четкой функции (рис. 5). Эти структурные особенности являются общими для всех известных α-амилаз (Nielsen and Borchert, 2000), хотя не все α-амилазы имеют сайт связывания хлоридов (Strobl et al ., 1998a). Наиболее разительным различием между α-амилазами млекопитающих и насекомых является наличие дополнительных петель вблизи активного сайта ферментов млекопитающих (Strobl et al ., 1998а).
Ион хлорида координируется с помощью Arg 183, Asn 285 и Arg 321 в домене A (Strobl et al ., 1998a). Домен C расположен в C-концевой части фермента, содержит так называемый мотив «греческого ключа» и не имеет четкой функции (рис. 5). Эти структурные особенности являются общими для всех известных α-амилаз (Nielsen and Borchert, 2000), хотя не все α-амилазы имеют сайт связывания хлоридов (Strobl et al ., 1998a). Наиболее разительным различием между α-амилазами млекопитающих и насекомых является наличие дополнительных петель вблизи активного сайта ферментов млекопитающих (Strobl et al ., 1998а).
Рис. 5. Консервативные остатки в первичных структурах основных пищеварительных ферментов насекомых. AMY (амилаза) соответствует Tenebrio molitor нумерации амилазы; CHI (хитиназа), жидкость для линьки Manduca sexta Нумерация хитиназы. TRY (трипсин) и CHY (химотрипсин) соответствуют нумерации бычьего химотрипсина; CAL (катепсин L), нумерация папаина: APN (аминопептидаза N) не имеет согласованной нумерации; CPA (карбоксипептидаза A), нумерация CPA млекопитающих.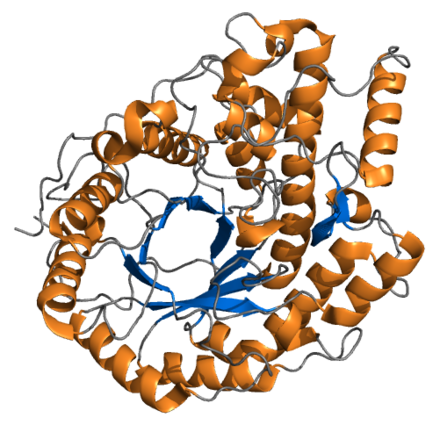
Asp 287 консервативен во всех α-амилазах.Сравнительные исследования показали, что Glu 222 является донором протонов, а Asp 185 нуклеофилом, и что Asp 287 является важным, но не прямым участником катализа. Предполагается, что его роль заключается в повышении p K a донора протонов (Nielsen and Borchert, 2000).
Хлорид-ион является аллостерическим активатором α-амилаз, приводящим к изменению конформации фермента, изменяющему среду донора протона. Это изменение вызывает увеличение p K a донора протонов, таким образом смещая оптимум pH фермента и увеличивая его V max (Levitzki and Steer, 1974).Согласно Strobl и др. . (1998a), увеличение V max является следствием близости хлорид-иона к молекуле воды, которая, как предполагалось, инициирует расщепление цепи субстрата. Нуклеофильность этой молекулы воды может быть усилена отрицательным зарядом иона.
В GenBank зарегистрирована 21 полная последовательность α-амилаз насекомых (по состоянию на май 2003 г. ), за исключением всех последовательностей Drosophila .Последовательности соответствуют 18 видам, обнаруженным в четырех отрядах. Примеры можно найти среди перепончатокрылых (Ohashi et al ., 1999; Da Lage et al ., 2002), жесткокрылых (Strobl et al ., 1997; Titarenko and Chrispeels, 2000), двукрылых (Grossmann et al. al ., 1997; Charlab et al. ., 1999) и Lepidoptera (Da Lage et al ., 2002). Все последовательности имеют каталитическую триаду (Asp 185, Glu 222 и Asp 287), субстрат-связывающие остатки гистидина (His 99, His 189 и His 286) и координирующие остатки Ca 2+ (Asn 98 , Arg 146 и Asp 155) (Рисунок 5).Из остатков, участвующих в связывании хлоридов, Arg 183 и Asn 285 являются консервативными, тогда как положение 321 варьируется. Согласно D’Amico et al . (2000), все известные хлорид-активированные α-амилазы имеют остаток аргинина или лизина в положении 321. Последовательности α-амилазы насекомых имеют аргинин в положении 321, за исключением последовательностей Zabrotes subfasciatus и Anthonomus grandis , которые содержат лизин, и α-амилазы чешуекрылых, содержащие глутамин.
), за исключением всех последовательностей Drosophila .Последовательности соответствуют 18 видам, обнаруженным в четырех отрядах. Примеры можно найти среди перепончатокрылых (Ohashi et al ., 1999; Da Lage et al ., 2002), жесткокрылых (Strobl et al ., 1997; Titarenko and Chrispeels, 2000), двукрылых (Grossmann et al. al ., 1997; Charlab et al. ., 1999) и Lepidoptera (Da Lage et al ., 2002). Все последовательности имеют каталитическую триаду (Asp 185, Glu 222 и Asp 287), субстрат-связывающие остатки гистидина (His 99, His 189 и His 286) и координирующие остатки Ca 2+ (Asn 98 , Arg 146 и Asp 155) (Рисунок 5).Из остатков, участвующих в связывании хлоридов, Arg 183 и Asn 285 являются консервативными, тогда как положение 321 варьируется. Согласно D’Amico et al . (2000), все известные хлорид-активированные α-амилазы имеют остаток аргинина или лизина в положении 321. Последовательности α-амилазы насекомых имеют аргинин в положении 321, за исключением последовательностей Zabrotes subfasciatus и Anthonomus grandis , которые содержат лизин, и α-амилазы чешуекрылых, содержащие глутамин. Это согласуется с наблюдением, что большинство α-амилаз насекомых активируются хлоридом, за исключением амилаз чешуекрылых (Terra and Ferreira, 1994).Немногочисленные α-амилазы жесткокрылых и перепончатокрылых, не подверженные действию хлорида (Terra and Ferreira, 1994), заслуживают повторного исследования. Возможно, что другой анион заменяет хлорид в качестве активатора, как показано для некоторых амилаз гемиптерановых (Hori, 1972).
Это согласуется с наблюдением, что большинство α-амилаз насекомых активируются хлоридом, за исключением амилаз чешуекрылых (Terra and Ferreira, 1994).Немногочисленные α-амилазы жесткокрылых и перепончатокрылых, не подверженные действию хлорида (Terra and Ferreira, 1994), заслуживают повторного исследования. Возможно, что другой анион заменяет хлорид в качестве активатора, как показано для некоторых амилаз гемиптерановых (Hori, 1972).
Схема действия относится к количеству связей, гидролизуемых за время жизни определенного комплекса фермент-субстрат. Если после первой стадии гидролиза гидролизуется более одной связи, говорят, что картина действия является процессной.Степень множественной атаки — это среднее количество гидролизованных связей после разрыва первой связи. Амилаза Rhynchosciara americana имеет степень множественной атаки между амилазой Bacillus subtilis (1.7) и поджелудочной железой свиньи (6). Амилазы личинок и взрослых особей Sitophilus zeamais , S. granarius и S. oryzae и личинок Bombyx mori имеют паттерны действия, сходные с таковой амилазы поджелудочной железы свиньи (Terra and Ferreira, 1994).Эти исследования необходимо продолжить, включая определение аффинностей, соответствующих каждому субсайту в активном центре. Такие исследования, особенно в сочетании с кристаллографическими данными, могут детально описать молекулярные причины, по которым амилазы по-разному действуют в отношении крахмалов различного происхождения.
granarius и S. oryzae и личинок Bombyx mori имеют паттерны действия, сходные с таковой амилазы поджелудочной железы свиньи (Terra and Ferreira, 1994).Эти исследования необходимо продолжить, включая определение аффинностей, соответствующих каждому субсайту в активном центре. Такие исследования, особенно в сочетании с кристаллографическими данными, могут детально описать молекулярные причины, по которым амилазы по-разному действуют в отношении крахмалов различного происхождения.
Существует множество природных соединений, влияющих на амилазы, включая многие ингибиторы растительных белков (Franco et al ., 2002). Кристаллографические данные показали, что эти белковые ингибиторы всегда занимают активный центр амилазы (Strobl et al ., 1998b; Nahoum et al ., 1999). В случае ингибитора α-амилазы Amaranth сравнение комплекса амилазы T. molitor – ингибитор с смоделированным комплексом между α-амилазой поджелудочной железы свиньи и ингибитором выявило шесть водородных связей, которые могут образовываться только в цепи . Комплекс амилазы T. molitor – ингибитор (Pereira et al ., 1999). Это было первое успешное объяснение того, как белковый ингибитор специфически ингибирует α-амилазы насекомых, но не млекопитающих.Как будет подробно описано для трипсинов (см. Раздел 4.5.5.2.1.), Специфические амилазы индуцируются, когда личинок насекомых скармливают рационом, содержащим ингибитор α-амилазы (Silva et al ., 2001). Механизмы, лежащие в основе этой индукции, неизвестны и в настоящее время изучаются (C.P. Silva, личное сообщение).
Комплекс амилазы T. molitor – ингибитор (Pereira et al ., 1999). Это было первое успешное объяснение того, как белковый ингибитор специфически ингибирует α-амилазы насекомых, но не млекопитающих.Как будет подробно описано для трипсинов (см. Раздел 4.5.5.2.1.), Специфические амилазы индуцируются, когда личинок насекомых скармливают рационом, содержащим ингибитор α-амилазы (Silva et al ., 2001). Механизмы, лежащие в основе этой индукции, неизвестны и в настоящее время изучаются (C.P. Silva, личное сообщение).
Альфа-амилаза — обзор | ScienceDirect Topics
3 ингибитора амилазы
α-амилаза (1,4-α-d-глюкан-глюканогидролаза, EC3.2.1.1) — эндоглюканаза, которая катализирует гидролиз эндо α- (1,4) гликозидных связей в крахмале и родственных полисахаридах.Гидролиз крахмала сначала катализируется α-амилазой, присутствующей в слюне человека, а затем панкреатической амилазой в двенадцатиперстной кишке. Человеческая α-амилаза поджелудочной железы (HPA) является важной фармакологической мишенью для лечения диабета 2 типа. Однако стоимость HPA относительно высока для исследовательских целей. Вместо α-амилазы поджелудочной железы свиньи (PPA) используется измерение пищеварения in vitro . PPA состоит из 496 аминокислотных остатков и на 83% идентичен своему человеческому аналогу HPA (Pasero, Mazzéi-Pierron, Abadie, Chicheportiche, & Marchis-Mouren, 1986).PPA представляет собой амилазу эндотипа и катализирует гидролиз внутренних α- (1,4) гликозидных связей в амилозе и амилопектине посредством множественной атаки на невосстанавливающий конец (Robyt & French, 1970). Продуктами гидролиза α-амилазы поджелудочной железы свиней в основном являются мальтоза, мальтотриоза и мальтотетраоза (Yook & Robyt, 2002). PPA имеет два изомера PPA isozyme-I (PPA-I) и PPA-II, которые имеют одинаковую молекулярную массу, но незначительно отличаются по аминокислотному составу и изоэлектрической точке (Pasero et al., 1986).
Однако стоимость HPA относительно высока для исследовательских целей. Вместо α-амилазы поджелудочной железы свиньи (PPA) используется измерение пищеварения in vitro . PPA состоит из 496 аминокислотных остатков и на 83% идентичен своему человеческому аналогу HPA (Pasero, Mazzéi-Pierron, Abadie, Chicheportiche, & Marchis-Mouren, 1986).PPA представляет собой амилазу эндотипа и катализирует гидролиз внутренних α- (1,4) гликозидных связей в амилозе и амилопектине посредством множественной атаки на невосстанавливающий конец (Robyt & French, 1970). Продуктами гидролиза α-амилазы поджелудочной железы свиней в основном являются мальтоза, мальтотриоза и мальтотетраоза (Yook & Robyt, 2002). PPA имеет два изомера PPA isozyme-I (PPA-I) и PPA-II, которые имеют одинаковую молекулярную массу, но незначительно отличаются по аминокислотному составу и изоэлектрической точке (Pasero et al., 1986).
Встречающиеся в природе ингибиторы α-амилазы включают белковые ингибиторы и вторичные метаболиты. Первые выходят за рамки данной статьи, потому что они имеют тенденцию денатурировать при термической или кислотной (кислотность желудка) обработке и теряют свою активность при достижении тонкой кишки. Здесь мы суммируем самые последние литературные данные по ингибиторам α-амилазы. Перечислены также методы, используемые для измерения их ингибирующей активности, поскольку разные методы могут давать разные значения IC 50 .По сравнению с α-глюкозидазой, меньше сообщений обнаружено в отношении α-амилазы, и большинство исследований посвящено полифенолам.
Первые выходят за рамки данной статьи, потому что они имеют тенденцию денатурировать при термической или кислотной (кислотность желудка) обработке и теряют свою активность при достижении тонкой кишки. Здесь мы суммируем самые последние литературные данные по ингибиторам α-амилазы. Перечислены также методы, используемые для измерения их ингибирующей активности, поскольку разные методы могут давать разные значения IC 50 .По сравнению с α-глюкозидазой, меньше сообщений обнаружено в отношении α-амилазы, и большинство исследований посвящено полифенолам.
Изооканин ( 57 ) (рис. 3.8), выделенный из испанских игл, Bidens bipinnata , продемонстрировал умеренную ингибирующую активность в отношении HPA (IC 50 0,447 мг / мл или 156 мкМ), измеренной с помощью йодометрического анализа (Yang и др., 2012). Следует отметить, что изооканин содержит две катехолические единицы, и поэтому ожидается, что он будет хорошим восстановителем, который может снижать содержание йода, вызывая ложноположительные результаты.
Рисунок 3.8. Химические структуры ингибиторов амилазы, соединения 57 — 59 , 5-кофеилхиновая кислота и 4,5-дикаффеоилхиновая кислота.
Из листа воды нанесите ( Syzygium aqueum ) лист, мирицетин-3- O -рамнозид ( 9 ) и европетин-3- O -рамнозид ( 10 ) (рис. 3.2). были изолированы, и ингибирующая активность в отношении ингибирования α-амилазы была измерена с использованием анализа DNSA, чтобы быть 10-кратным (EC 50 из ~ 2.0 мкМ) сильнее, чем акарбоза (EC 50 19 мкМ). Такая высокая активность довольно редко наблюдается в полифенольных соединениях и требует дальнейшего изучения, в частности, механизма ингибирования и селективности, когда эти соединения подвергаются воздействию сложной пищевой матрицы. Мирицетин является сильным поглотителем радикалов, поэтому стабильность 9 и 10 также вызывает беспокойство. Авторы сообщили, что кверцетин имел сравнимую ЕС 50 (17 мкМ) с ЕС акарбозы (19 мкМ). Используя анализ мутности, который мы разработали в нашей лаборатории, мы не смогли обнаружить какую-либо ингибирующую активность кверцетина против панкреатической α-амилазы с использованием акарбозы в качестве эталона (Huang et al., Неопубликованные результаты). Следовательно, необходимо проверить, зависит ли указанное значение EC 50 от метода, чтобы исключить потенциальный артефакт (Manaharan et al., 2012). Cleistocalyx operculatus также принадлежит к семейству миртовых. Ху, Луо, Ли, Джоши и Лу (2012) выделили и очистили 2’4′-дигидрокси-6′-метокси-3’5′-диметилхалкон (DMC) из высушенных цветочных бутонов C.operculatus . Соединение продемонстрировало неконкурентный механизм ингибирования PPA (Hu et al., 2012).
Используя анализ мутности, который мы разработали в нашей лаборатории, мы не смогли обнаружить какую-либо ингибирующую активность кверцетина против панкреатической α-амилазы с использованием акарбозы в качестве эталона (Huang et al., Неопубликованные результаты). Следовательно, необходимо проверить, зависит ли указанное значение EC 50 от метода, чтобы исключить потенциальный артефакт (Manaharan et al., 2012). Cleistocalyx operculatus также принадлежит к семейству миртовых. Ху, Луо, Ли, Джоши и Лу (2012) выделили и очистили 2’4′-дигидрокси-6′-метокси-3’5′-диметилхалкон (DMC) из высушенных цветочных бутонов C.operculatus . Соединение продемонстрировало неконкурентный механизм ингибирования PPA (Hu et al., 2012).
Тилирозид ( 58 ) (рис. 3.8), выделенный из семян шиповника, Rosa canina L., ингибирует PPA с IC 50 280 мМ, и кинетические исследования показывают, что это неконкурентоспособный ингибитор. с K i значениями 84,2 мкМ, определенными количественно с использованием p -нитрофенил-альфа-d-пентаглюкозида в качестве субстрата.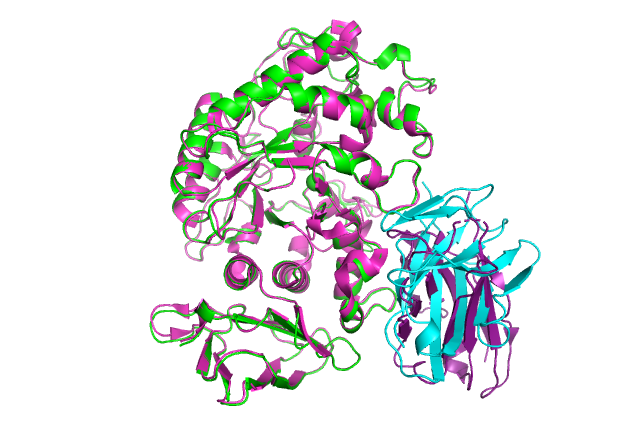 В отличие от акарбозы тилирозид не проявляет ингибирующей активности в отношении α-глюкозидазы.Возможно, из-за его слабой ингибирующей активности α-амилазы на животной модели тилирозид в высоких дозах (600 мг / кг) необходим для снижения концентрации глюкозы в плазме после приема пищи у мышей, получавших крахмал в дозе 2 г / кг. Тилирозид может проявлять антигипергликемию за счет ингибирования как натрийзависимого транспортера глюкозы 1, так и транспортера глюкозы 2, опосредованного захватом глюкозы энтероцитами (Goto et al., 2012).
В отличие от акарбозы тилирозид не проявляет ингибирующей активности в отношении α-глюкозидазы.Возможно, из-за его слабой ингибирующей активности α-амилазы на животной модели тилирозид в высоких дозах (600 мг / кг) необходим для снижения концентрации глюкозы в плазме после приема пищи у мышей, получавших крахмал в дозе 2 г / кг. Тилирозид может проявлять антигипергликемию за счет ингибирования как натрийзависимого транспортера глюкозы 1, так и транспортера глюкозы 2, опосредованного захватом глюкозы энтероцитами (Goto et al., 2012).
Куркумин и его производные считаются многоцелевыми соединениями, которые обладают очень широким спектром преимуществ для здоровья.В качестве потенциального агента для снижения скорости переваривания крахмала бисдеметоксикуркумин ( 59 ) (рис. 3.8) из корневища Curcuma longa обладает активностью ингибирования HPA и PPA со значениями IC 50 приблизительно 25 мкМ с использованием анализа DNSA. Кинетическое исследование показывает, что это неконкурентоспособный ингибитор HPA с кажущимся K и 3,0 мкМ (Ponnusamy et al. , 2012).
, 2012).
Моно- и двузамещенные кофеилхиновые кислоты являются основными полифенольными соединениями, содержащимися в зеленых кофейных зернах.Из-за присутствия трех вторичных гидроксильных групп в кольце хинной кислоты существует три изомера в положении взаимного превращения монозамещенных кофеилхиновых кислот и три дикаффеоилхиновых кислот, которые все были очищены из зеленых кофейных зерен. Их ингибирующая активность в отношении PPA-I (Narita & Inouye, 2011) измерялась с использованием p -нитрофенил-диглюкозида, который при гидролизе дает p -нитрофенол и мальтозу. Примечательно, что ингибирующая активность в значительной степени зависит от положения кофейных групп в монокафеоилхиновой кислоте.5-Кофеоилхиновая кислота (или обычно известная как хлорогеновая кислота) (рис. 3.8) имеет более высокую ингибирующую активность с IC 50 , равным 80 мкМ, по сравнению с таковой 4-кофеоилхиновой кислоты (120 мкМ) и 3-кофеоилхиновой кислоты (230 мкМ). мкМ). Для трех изомеров дикаффеоилхиновой кислоты ингибирующая активность намного выше и не так чувствительна к положению сложноэфирных групп, поскольку 3,4- и 4,5-дикаффеоилхиновые кислоты (рис. 3.8) имеют одинаковую IC 50. (20 мМ), и 4,5-дикаффеоилхиновая кислота имеет IC 50 30 мкМ (Narita & Inouye, 2011).
3.8) имеют одинаковую IC 50. (20 мМ), и 4,5-дикаффеоилхиновая кислота имеет IC 50 30 мкМ (Narita & Inouye, 2011).
Альфа-амилаза слюны — Salimetrics
Альфа-амилаза слюны — SalimetricsТехническое резюме
| Сводка аналитов | |
|---|---|
| Аналит: | Альфа-амилаза |
| Прозвища: | α-Амилаза |
| Соотношение сыворотка-слюна: | NA |
| Оптимальный объем сбора: | 25 мкл * |
* Добавьте 300 мкл к общему объему всех тестов для работы с жидкостью
| Мешающие факторы |
|---|
| α-амилаза зависит от местоположения α-амилаза имеет суточный ритм α-амилаза может зависеть от скорости потока |
| Сводка анализа | |
|---|---|
| Методология: | Кинетическая реакция |
| Чувствительность: | 0. 4 Ед / мл 4 Ед / мл |
| Диапазон анализа: | 2-400 Ед / мл |
| Тип анализа: | Количественный |
| Примеры диапазонов α-амилазы слюны * | |||
|---|---|---|---|
| Группа | Число | Среднее значение (Ед / мл) | AbsoluteRange (мкг / дл) |
| Взрослый | 75 | 92.4 | 3,1–423,1 |
* Только для справки. Каждая лаборатория должна установить свой собственный диапазон.
Сбор образцов слюны
РАССМОТРЕНИЕ СБОРА АЛЬФА-АМИЛАЗЫ СЛИВЫ
Лучшие результаты начинаются с лучшего сбора слюны. Этот протокол сбора содержит общие рекомендации по максимальному анализу альфа-амилазы слюны.Используйте этот протокол сбора аналитов, чтобы спланировать методологию сбора и схемы отбора проб.
ОДОБРЕННЫЕ МЕТОДЫ ЗАБОРА АЛЬФА-АМИЛАЗЫ С СЛИВАРИЙ
Тестовые образцы слюны
@ Salimetrics
Salimetrics SalivaLab — просто и точно
| Код заказа (лаборатория): | 5420 |
| Требования для транспортировки: | Корабль на сухом льду |
@ Ваша собственная лаборатория
Наборы для анализа салиметрии — лучшие результаты
Добавить анализ ДНК в мое исследование
Рекомендации по добавлению ДНК слюны к аналитам Исследования:
Вы можете комбинировать аналиты слюны с простым, точным и доступным геномным тестированием с помощью Salimetrics SalivaLab и того же образца, который вы уже собираете — не требуются специальные устройства для сбора слюны или дополнительные образцы.
Не знаете, какие SNP вам подходят? Команда ДНК SalivaLab специализируется на услугах генетического тестирования. Мы рекомендуем вам Запросить консультацию ДНК (бесплатно), чтобы узнать больше о таких общих соображениях, как количество образцов, этническая принадлежность участников и разрешение IRB.
Все службы ДНК
Экстракция и нормализация ДНК
Однонуклеотидный полиморфизм (SNP) Генотипирование
Анализ VNTR и STR
Ссылки и исследования альфа-амилазы слюны
- Грейнджер Д.А., Кивлиган, К.Т., Эль-Шейх, М., Гордис, Э., и Страуд, Л.Р. (2007). Альфа-амилаза слюны в биоповеденческих исследованиях: последние разработки и приложения. Ann N Y Acad Sci, 1098, 122-44.
- Хрусос, Г. И Голд, П. (1992). Концепции стресса и системных расстройств стресса: Обзор физического и поведенческого гомеостаза. JAMA, 267 (9), 1244-52. Исправление в JAMA (1992), 268 (2), 200.

- Киршбаум, К., Рид, Г. Ф., и Хеллхаммер, Д. Х. (1994). Оценка гормонов и лекарств в слюне в биоповеденческих исследованиях.Геттинген: Hogrefe & Huber.
- Scannapieco, F.A., Torres, G., & Levine, M.J. (1993). Α-амилаза слюны: роль в образовании зубного налета и кариеса. Crit Rev Oral Biol Med, 4 (3/4), 301-7.
- Роджерс, Д.Д., Палмер, Р.Дж., мл., Коленбрандер, П.Е., и Сканнапеко, Ф.А. (2001). Роль белка А, связывающего амилазу Streptococcus gordonii, в адгезии к гидроксиапатиту, метаболизме крахмала и формировании биопленок. Infect Immun, 69 (11), 7046-56.
- Чаттертон, Р.Т., мл., Vogelsong, K.M., Lu, Y.C., Ellman, A.B., & Hudgens, G.A. (1996). Альфа-амилаза слюны как мера эндогенной адренергической активности. Clin Physiol, 16 (4), 433-48.
- Натер, У.М., & Роледер, Н. (2009). Альфа-амилаза слюны как неинвазивный биомаркер симпатической нервной системы: текущее состояние исследований. Психонейроэндокринология, 34 (4), 486-96.
- Спирс, Р.
 Л., Херринг, Дж., Купер, У.Д., Харди, С.С., & Хинд, К.Р. (1974). Влияние симпатической активности и изопреналина на секрецию амилазы околоушной железой человека.Arch Oral Biol, 19 (9), 747-52.
Л., Херринг, Дж., Купер, У.Д., Харди, С.С., & Хинд, К.Р. (1974). Влияние симпатической активности и изопреналина на секрецию амилазы околоушной железой человека.Arch Oral Biol, 19 (9), 747-52. - van Stegeren, A., Rohleder, N., Everaerd, W., & Wolf, O.T. (2006). Альфа-амилаза слюны как маркер адренергической активности во время стресса: эффект бета-блокады. Психонейроэндокринология, 31 (1), 137-41.
- Галлахер, Д.В. И Петерсен, О. (1983). Связь стимул-секреция в слюнных железах млекопитающих. Int Rev Physiol, 28, 1-52.
- Роледер, Н., Вольф, Дж. М., Мальдонадо, Э. Ф., и Киршбаум, К.(2006). Повышение альфа-амилазы в слюне, вызванное психосоциальным стрессом, не зависит от скорости слюноотделения. Психофизиология, 43 (6), 645-52.
- Bosch, J.A., Veerman, E.C., de Geus, E.J., & Proctor, G.B. (2011). α-Амилаза как надежный и удобный измеритель симпатической активности: пока не начинайте слюноотделение! Психонейроэндокринология, 36 (4), 449-53.

- Тома, М.В., Киршбаум, К., Вольф, Дж. М., и Роледер, Н. (2012). Острый стрессовый ответ альфа-амилазы слюны предсказывает повышение уровня норадреналина в плазме.Биол Психология, 91 (3), 342–48.
- Грейнджер, Д. А., Кивлиган, К. Т., Блэр, К., Эль-Шейх, М., Мизе, Дж., Лизонби, Дж. А., Бакхальт, Дж. А. и др. (2006). Интеграция измерения альфа-амилазы в слюне в исследования здоровья, развития и социальных отношений детей. J Soc Pers Relat, 23 (2), 267-90.
- Сегал, С.К., и Кэхилл, Л. (2009). Эндогенная норадренергическая активация и память на эмоциональный материал у мужчин и женщин. Психонейроэндокринология, 34 (9), 1263-71.
- Сусман, Э.Дж., Докрей, С., Грейнджер, Д. А., Блейдс, К. Т., Рандаццо, В., Хитон, Дж. А., и Дорн, Л. Д. (2010). Реактивность кортизола и альфа-амилазы и время полового созревания: уязвимости для антисоциального поведения у молодых подростков. Психонейроэндокринология, 35 (4), 557-69.
- Валленфельс, К., Фолди, П., Нирманн, Х.
 , Бендер, Х., Линдер, Д. (1978). Ферментативный синтез путем трансглюкозилирования гомологического ряда гликозидно замещенных мальтоолигосахаридов и их использование в качестве субстратов амилазы.Карбогид Рес, 61 (1), 359-68.
, Бендер, Х., Линдер, Д. (1978). Ферментативный синтез путем трансглюкозилирования гомологического ряда гликозидно замещенных мальтоолигосахаридов и их использование в качестве субстратов амилазы.Карбогид Рес, 61 (1), 359-68. - Вайнер Д., Леви Ю., Ханкин Е.В., Резник А.З. (2008). Подавление активности амилазы слюны альдегидами сигаретного дыма. J. Physiol Pharmacol., 59 (Приложение 6), 727-37.
- Кляйн, Л.С., Беннет, Дж. М., Ветцель, К. А., Грейнджер, Д. А., и Риттер, Ф. Э. (2010). Кофеин и стресс изменяют активность α-амилазы в слюне у молодых мужчин. Human Psychopharmacol, 25 (5), 359-67.
- Натер, У.М., Роледер, Н., Шольц, В., Элерт, У., и Киршбаум, К.(2007). Детерминанты суточного течения альфа-амилазы слюны. Психонейроэндокринология, 32 (4), 392-401.
- Маки, Д.А. И Пэнгборн, Р. (1990). Жевание и его влияние на слюноотделение человека и секрецию альфа-амилазы. Physiol Behav, 47 (3), 593-95.
- Ло Пипаро, Э., Шейб, Х., Фрей, Н., Уильямсон, Г.
 , Григоров, М., и Чжоу, С.Дж. (2008). Флавоноиды для контроля переваривания крахмала: структурные требования для ингибирования человеческой α-амилазы. J Med Chem, 51 (12), 3555-61.
, Григоров, М., и Чжоу, С.Дж. (2008). Флавоноиды для контроля переваривания крахмала: структурные требования для ингибирования человеческой α-амилазы. J Med Chem, 51 (12), 3555-61. - Хара К., Охара М., Хаяси И., Хино Т., Нисимура Р., Ивасаки Ю., Огава Т. и др. (2012). Галлат полифенола и эпигаллокатехина зеленого чая осаждает белки слюны, включая альфа-амилазу: биохимические последствия для здоровья полости рта. Eur J Oral Sci, 120 (2), 132-39.
- Белцер, E.K., Фортунато, C.K., Гуадеррама, M.M., Пекинс, M.K., Гаррамоне, B.M., & Granger, D.A. (2010). Слюноотделение и альфа-амилаза: метод сбора, продолжительность и тип ротовой жидкости.Physiol Behav, 101 (2), 289-96.
- Хармон, А.Г., Тау-Гудман, Н.Р., Фортунато, К.К., и Грейнджер, Д.А. (2008). Различия в месте сбора слюны и различия в исходных и суточных ритмах альфа-амилазы: предварительное предупреждение. Horm Behav, 54 (5), 592-96.
Альфа-амилаза слюны как биомаркер стресса в поведенческой медицине
McEwen BS.Нейробиология стресса: от интуиции к клинической значимости. Brain Res. 2000. 886 (1-2): 172–89. https://doi.org/10.1016/s0006-8993(00)02950-4.
CAS Статья PubMed Google Scholar
McEwen BS. Стресс, адаптация и болезнь. Аллостаз и аллостатическая нагрузка. Ann N Y Acad Sci. 1998; 840: 33–44. https://doi.org/10.1111/j.1749-6632.1998.tb09546.x.
CAS Статья PubMed Google Scholar
Натер У.М., Гааб Дж, Риф В., Элерт У. Последние тенденции в поведенческой медицине. Curr Opin Psychiatry. 2006. 19 (2): 180–3. https://doi.org/10.1097/01.yco.0000214345.37002.77.
Артикул PubMed Google Scholar
Штернберг Э.М. Нервная регуляция врожденного иммунитета: скоординированный неспецифический ответ хозяина на патогены. Nat Rev Immunol. 2006. 6 (4): 318–28. https://doi.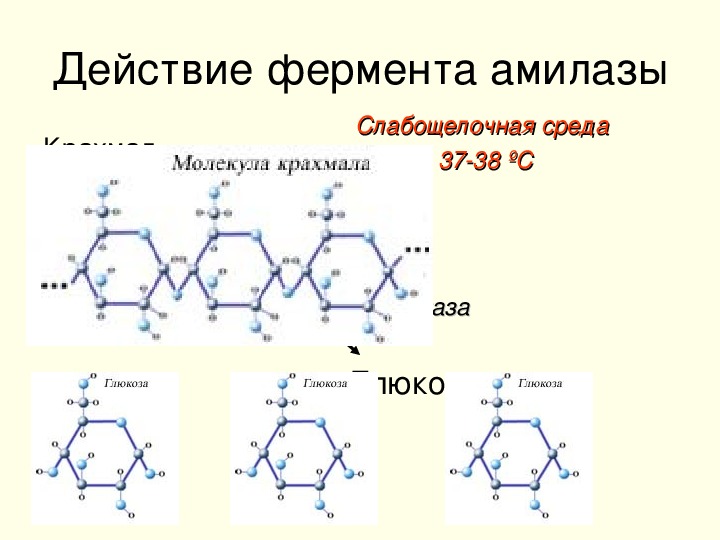 org/10.1038/nri1810.
org/10.1038/nri1810.
CAS Статья PubMed PubMed Central Google Scholar
Hellhammer DH, Wust S, Kudielka BM. Кортизол слюны как биомаркер в исследованиях стресса. Психонейроэндокринология. 2009. 34 (2): 163–71. https://doi.org/10.1016/j.psyneuen.2008.10.026.
CAS Статья PubMed Google Scholar
Грасси Г., Эслер М. Как оценить симпатическую активность у людей. J Hypertens. 1999. 17 (6): 719–34.
CAS Статья Google Scholar
Маркес А.Х., Сильверман М.Н., Штернберг Е.М. Оценка систем стресса с применением неинвазивных методологий: измерения нейроиммунных биомаркеров в поте, вариабельности сердечного ритма и кортизола в слюне. Нейроиммуномодуляция. 2010. 17 (3): 205–8. https://doi.org/10.1159/000258725.
CAS Статья PubMed PubMed Central Google Scholar
Quintana DS, Heathers JA. Соображения при оценке вариабельности сердечного ритма в биоповеденческих исследованиях.Front Psychol. 2014; 5: 805. https://doi.org/10.3389/fpsyg.2014.00805.
Артикул PubMed PubMed Central Google Scholar
Натер У.М., Роледер Н. Альфа-амилаза слюны как неинвазивный биомаркер симпатической нервной системы: текущее состояние исследований. Психонейроэндокринология. 2009. 34 (4): 486–96. https://doi.org/10.1016/j.psyneuen.2009.01.014.
CAS Статья PubMed Google Scholar
Warren CM, van den Brink RL, Nieuwenhuis S, Bosch JA. Блокатор транспортеров норэпинефрина атомоксетин увеличивает альфа-амилазу слюны. Психонейроэндокринология. 2017; 78: 233–6. https://doi.org/10.1016/j.psyneuen.2017.01.029.
CAS Статья PubMed Google Scholar
Ehlert U, Erni K, Hebisch G, Nater U. Уровни альфа-амилазы в слюне после введения йохимбина у здоровых мужчин. J Clin Endocrinol Metab. 2006. 91 (12): 5130–3.https://doi.org/10.1210/jc.2006-0461.
CAS Статья PubMed Google Scholar
Kuebler U, von Kanel R, Heimgartner N, et al. Инфузия норэпинефрина с альфа-адренергической блокадой фентоламином и без нее увеличивает альфа-амилазу слюны у здоровых мужчин. Психонейроэндокринология. 2014; 49: 290–8. https://doi.org/10.1016/j.psyneuen.2014.07.023.
CAS Статья PubMed Google Scholar
Ditzen B, Ehlert U, Nater UM. Связь между альфа-амилазой слюны и катехоламинами — многоуровневый подход к моделированию. Biol Psychol. 2014; 103: 15–8. https://doi.org/10.1016/j.biopsycho.2014.08.001.
Артикул PubMed Google Scholar
Натер У.М., Роледер Н., Шлотц В., Элерт У., Киршбаум К. Детерминанты суточного течения альфа-амилазы в слюне. Психонейроэндокринология. 2007. 32 (4): 392–401. https: // doi.org / 10.1016 / j.psyneuen.2007.02.007.
CAS Статья PubMed Google Scholar
Strahler J, Skoluda N, Kappert MB, Nater UM. Одновременное измерение кортизола и альфа-амилазы в слюне: применение и рекомендации. Neurosci Biobehav Rev.2017; 83: 657–77. https://doi.org/10.1016/j.neubiorev.2017.08.015.
CAS Статья PubMed Google Scholar
Остин С.Б., Розарио М., Маклафлин К.А. и др. Сексуальная ориентация и суточные ритмы альфа-амилазы слюны в когорте молодых людей США. Психонейроэндокринология. 2018; 97: 78–85. https://doi.org/10.1016/j.psyneuen.2018.07.006.
CAS Статья PubMed PubMed Central Google Scholar
Вингенфельд К., Шульц М., Дамкрегер А., Филиппсен С., Роуз М., Дриссен М. Суточный курс альфа-амилазы в слюне у медсестер: исследование потенциальных факторов, влияющих на стресс, и ассоциаций со стрессом.Biol Psychol. 2010. 85 (1): 179–81. https://doi.org/10.1016/j.biopsycho.2010.04.005.
Артикул PubMed Google Scholar
Маршан А., Джастер Р.П., Люпьен С.Дж., Дюран П. Психосоциальные детерминанты суточной альфа-амилазы среди здоровых рабочих Квебека. Психонейроэндокринология. 2016; 66: 65–74. https://doi.org/10.1016/j.psyneuen.2016.01.005.
CAS Статья PubMed Google Scholar
Ландольт К., Маруфф П., Хоран Б., Кингсли М., Кинселла Дж., О’Халлоран П.Д. и др. Снижение профессиональной эффективности связано с притуплением реакции пробуждения альфа-амилазы в слюне. Physiol Behav. 2019; 199: 292–9. https://doi.org/10.1016/j.physbeh.2018.11.038.
CAS Статья PubMed Google Scholar
Роледер Н., Марин Т.Дж., Ма Р., Миллер Г.Е. Биологическая стоимость ухода за больным раком: нарушение регуляции про- и противовоспалительных сигнальных путей.J Clin Oncol. 2009. 27 (18): 2909–15. https://doi.org/10.1200/JCO.2008.18.7435.
Артикул PubMed Google Scholar
Лю Ю., Грейнджер Д.А., Ким К., Кляйн Л.С., Алмейда Д.М., Зарит Ш. Суточная динамика альфа-амилазы в слюне у лиц, осуществляющих уход за членами семьи деменции. Health Psychol. 2017; 36 (2): 160–8. https://doi.org/10.1037/hea0000430.
Артикул PubMed Google Scholar
Wolf JM, Nicholls E, Chen E. Хронический стресс, кортизол в слюне и альфа-амилаза у детей с астмой и здоровых детей. Biol Psychol. 2008. 78 (1): 20–8. https://doi.org/10.1016/j.biopsycho.2007.12.004.
Артикул PubMed Google Scholar
Ян СиДжей, Лю Д., Сюй З.С., Ши С.Х., Ду ЙДж. Провоспалительные цитокины, кортизол слюны и альфа-амилаза связаны с генерализованным тревожным расстройством (ГТР) у пациентов с астмой.Neurosci Lett. 2017; 656: 15–21. https://doi.org/10.1016/j.neulet.2017.07.021.
CAS Статья PubMed Google Scholar
Гисбрехт Г.Ф., Грейнджер Д.А., Кэмпбелл Т., Каплан Б., команда APS. Альфа-амилаза слюны во время беременности: суточный ход и ассоциации с акушерским анамнезом, демографическими данными матери и настроением. Dev Psychobiol. 2013; 55 (2): 156–67. https://doi.org/10.1002/dev.21008.
CAS Статья PubMed Google Scholar
Натер У.М., Роледер Н., Гааб Дж., Бергер С., Джуд А., Киршбаум С. и др. Реактивность альфа-амилазы слюны человека в парадигме психосоциального стресса. Int J Psychophysiol. 2005; 55 (3): 333–42. https://doi.org/10.1016/j.ijpsycho.2004.09.009.
Артикул PubMed Google Scholar
Fischer S, Nater UM, Strahler J, Skoluda N, Dieterich L, Oezcan O, et al. Психобиологическое влияние этнической дискриминации на турецких иммигрантов, проживающих в Германии.Стресс. 2017; 20 (2): 167–74. https://doi.org/10.1080/10253890.2017.1296430.
CAS Статья PubMed Google Scholar
de Vente W, van Amsterdam JG, Olff M, Kamphuis JH, Emmelkamp PM. Выгорание связано со снижением парасимпатической активности и сниженной реактивностью оси HPA, преимущественно у мужчин. Biomed Res Int. 2015; 2015: 431725. https://doi.org/10.1155/2015/431725.
CAS Статья PubMed PubMed Central Google Scholar
Alsalman OA, Tucker D, Vanneste S. Связанные со стрессом слюны реакции на шум в ушах: предварительное исследование у молодых мужчин с тиннитусом. Front Neurosci. 2016; 10: 338. https://doi.org/10.3389/fnins.2016.00338.
Артикул PubMed PubMed Central Google Scholar
Brown NJ, Kimble RM, Rodger S, Ware RS, McWhinney B, Ungerer JP, et al. Биологические маркеры стресса при острой ожоговой травме у детей. Бернс. 2014; 40 (5): 887–95.https://doi.org/10.1016/j.burns.2013.12.001.
Артикул PubMed Google Scholar
Лимм Х., Гундель Х., Хайнмюллер М. и др. Вмешательства по управлению стрессом на рабочем месте улучшают стресс-реактивность: рандомизированное контролируемое исследование. Occup Environ Med. 2011. 68 (2): 126–33. https://doi.org/10.1136/oem.2009.054148.
CAS Статья PubMed Google Scholar
Арч Дж. Дж., Браун К. В., Дин Д. Д., Лэнди Л. Н., Браун К. Д., Лауденслагер М. Л.. Тренинг самосострадания модулирует альфа-амилазу, вариабельность сердечного ритма и субъективные реакции на социальную оценочную угрозу у женщин. Психонейроэндокринология. 2014; 42: 49–58. https://doi.org/10.1016/j.psyneuen.2013.12.018.
CAS Статья PubMed PubMed Central Google Scholar
Duchemin AM, Steinberg BA, Marks DR, Vanover K, Klatt M.Небольшое рандомизированное пилотное исследование вмешательства, основанного на осознанности на рабочем месте, для персонала хирургического отделения интенсивной терапии: влияние на уровни альфа-амилазы в слюне. J Occup Environ Med. 2015; 57 (4): 393–9. https://doi.org/10.1097/JOM.0000000000000371.
Артикул PubMed PubMed Central Google Scholar
Haslam A, Wirth MD, Robb SW. Взаимосвязь между глубиной медитации и секрецией альфа-амилазы слюной при бодрствовании у постоянных инструкторов MBSR.Стресс здоровье. 2017; 33 (3): 298–306. https://doi.org/10.1002/smi.2706.
Артикул PubMed Google Scholar
Lipschitz DL, Kuhn R, Kinney AY, Donaldson GW, Nakamura Y. Снижение уровней альфа-амилазы в слюне после вмешательства разума и тела у выживших после рака — исследовательское исследование. Психонейроэндокринология. 2013. 38 (9): 1521–31. https://doi.org/10.1016/j.psyneuen.2012.12.021.
CAS Статья PubMed PubMed Central Google Scholar
Киба Т., Канбара К., Бан I, Като Ф, Кавасима С., Сака Й и др. Амилаза слюны как мера симпатического изменения, вызванного аутогенной тренировкой у пациентов с функциональными соматическими синдромами. Appl Psychophysiol Biofeedback. 2015; 40 (4): 339–47. https://doi.org/10.1007/s10484-015-9303-z.
Артикул PubMed Google Scholar
de Brouwer SJ, Kraaimaat FW, Sweep FC, Donders RT, Eijsbouts A, van Koulil S, et al. Психофизиологические реакции на стресс после тренинга по управлению стрессом у пациентов с ревматоидным артритом.PLoS One. 2011; 6 (12): e27432. https://doi.org/10.1371/journal.pone.0027432.
CAS Статья PubMed PubMed Central Google Scholar
de Weerth C, Buitelaar JK. Реактивность физиологического стресса при беременности человека — обзор. Neurosci Biobehav Rev.2005; 29 (2): 295–312. https://doi.org/10.1016/j.neubiorev.2004.10.005.
Артикул PubMed Google Scholar
Хаясе М., Шимада М. Влияние йоги для беременных на вегетативную нервную систему во время беременности. J Obstet Gynaecol Res. 2018; 44 (10): 1887–95. https://doi.org/10.1111/jog.13729.
Артикул PubMed Google Scholar
Кусака М., Мацузаки М., Шираиси М., Харуна М. Немедленное снижение стресса в результате занятий йогой во время беременности: одно групповое предварительное тестирование. Рождение женщины. 2016; 29 (5): e82 – e8. https://doi.org/10.1016/j.wombi.2016.04.003.
Артикул PubMed Google Scholar
Holt-Lunstad J, Бирмингем, Вашингтон, Лайт, KC. Влияние вмешательства по усилению поддержки «теплого прикосновения» среди супружеских пар на амбулаторное кровяное давление, окситоцин, альфа-амилазу и кортизол. Psychosom Med. 2008. 70 (9): 976–85. https://doi.org/10.1097/PSY.0b013e318187aef7.
CAS Статья PubMed Google Scholar
Inagaki TK, Eisenberger NI. Оказание поддержки другим снижает реакцию симпатической нервной системы на стресс. Психофизиология. 2016; 53 (4): 427–35. https://doi.org/10.1111/psyp.12578.
Артикул PubMed Google Scholar
Цумура Х., Шимада Х., Моримото Х., Хинума С., Кавано Ю. Влияние отвлечения внимания на негативное поведение и альфа-амилазу слюны при умеренно стрессовых медицинских процедурах для детей, находящихся на кратковременном стационарном лечении.J Health Psychol. 2014. 19 (8): 1079–88. https://doi.org/10.1177/135
Артикул PubMed Google Scholar
Pruessner JC, Али Н. Нейроэндокринные механизмы регуляции стресса у людей. Нейроэндокринол Стресс. 2015: 121–42.
Хармон АГ, Тау-Гудман Н.Р., Фортунато СК, Грейнджер Д.А. Различия в месте сбора слюны и различия в исходных и суточных ритмах альфа-амилазы: предварительное предупреждение.Horm Behav. 2008. 54 (5): 592–6. https://doi.org/10.1016/j.yhbeh.2008.05.019.
CAS Статья PubMed Google Scholar
Beltzer EK, Fortunato CK, Guaderrama MM, Peckins MK, Garramone BM, Granger DA. Слюноотделение и альфа-амилаза: метод сбора, продолжительность и тип ротовой жидкости. Physiol Behav. 2010. 101 (2): 289–96. https://doi.org/10.1016/j.physbeh.2010.05.016.
CAS Статья PubMed Google Scholar
Роблес Т.Ф., Шарма Р., Харрелл Л., Элашофф Д.А., Ямагути М., Шетти В. Метод отбора проб слюны влияет на работу биосенсора слюнной альфа-амилазы. Am J Hum Biol. 2013; 25 (6): 719–24. https://doi.org/10.1002/ajhb.22438.
Артикул PubMed Google Scholar
Дэвис Е.П., Грейнджер Д.А. Различия в развитии реакции альфа-амилазы и кортизола слюны младенца на стресс. Психонейроэндокринология. 2009. 34 (6): 795–804.https://doi.org/10.1016/j.psyneuen.2009.02.001.
CAS Статья PubMed PubMed Central Google Scholar
Натер УМ. Многомерность стресса и его оценка. Иммунное поведение мозга. 2018; 73: 159–60. https://doi.org/10.1016/j.bbi.2018.07.018.
Артикул PubMed Google Scholar
Али Н., Прюсснер Дж. Отношение альфа-амилазы к кортизолу в слюне как маркер для оценки нарушения регуляции стрессовых систем.Physiol Behav. 2012; 106 (1): 65–72. https://doi.org/10.1016/j.physbeh.2011.10.003.
CAS Статья Google Scholar
Mandel AL, Peyrot des Gachons C, Plank KL, Alarcon S, Breslin PA. Индивидуальные различия в количестве копий гена AMY1, уровнях альфа-амилазы в слюне и восприятии орального крахмала. PLoS One. 2010; 5 (10): e13352. https://doi.org/10.1371/journal.pone.0013352.
CAS Статья PubMed PubMed Central Google Scholar
Фальчи М., Эль-Сайед Мустафа Дж. С., Такусис П. и др. Низкое количество копий гена амилазы слюны предрасполагает к ожирению. Нат Жене. 2014. 46 (5): 492–7. https://doi.org/10.1038/ng.2939.
CAS Статья PubMed PubMed Central Google Scholar
Peyrot des Gachons C, Breslin PA. Амилаза слюны: пищеварение и метаболический синдром. Curr Diab Rep.2016; 16 (10): 102. https://doi.org/10.1007/s11892-016-0794-7.
CAS Статья PubMed Google Scholar
Применение микробной α-амилазы в промышленности — обзор
Braz J Microbiol.Октябрь-декабрь 2010 г .; 41 (4): 850–861.
Departamento de Ciências Farmacêuticas, Faculdade de Ciências da Saúde, Universidade de Brasília, Brasília, DF, Brasil
* Соответствующий автор. Почтовый адрес: Departamento de Ciências Farmacêuticas, Faculdade de Ciências da Saúde, Universidade de Brasília, Campus Darcy Ribeiro, Asa Norte, Brasília, DF, Brasil .; E-mail: rb.bnu@azuosaluapПоступило 23 марта 2010 г .; Пересмотрено 30 марта 2010 г .; Принято 24 мая 2010 г.
Copyright © Sociedade Brasileira de MicrobiologiaВсе содержимое журнала, если не указано иное, находится под лицензией Creative Commons License
. Эта статья цитируется другими статьями в PMC.Abstract
Амилазы — один из основных ферментов, используемых в промышленности. Такие ферменты гидролизуют молекулы крахмала до полимеров, состоящих из единиц глюкозы. Амилазы имеют потенциальное применение во многих промышленных процессах, таких как пищевая, ферментационная и фармацевтическая промышленность. α-Амилазы можно получить из растений, животных и микроорганизмов. Однако ферменты из грибковых и бактериальных источников преобладают в промышленных секторах. Производство α-амилазы необходимо для превращения крахмалов в олигосахариды.Крахмал является важной составляющей рациона человека и основным продуктом хранения многих экономически важных сельскохозяйственных культур, таких как пшеница, рис, кукуруза, тапиока и картофель. Ферменты, превращающие крахмал, используются в производстве мальтодекстрина, модифицированных крахмалов или сиропов глюкозы и фруктозы. Большое количество микробных α-амилаз находят применение в различных отраслях промышленности, таких как пищевая, текстильная, бумажная и детергентная. Производство α-амилаз обычно осуществляется с использованием глубокой ферментации, но системы твердофазной ферментации являются многообещающей технологией.Свойства каждой α-амилазы, такие как термостабильность, профиль pH, стабильность pH и независимость от кальция, важны для развития процесса ферментации. В этом обзоре основное внимание уделяется производству бактериальных и грибковых α-амилаз, их распределению, структурно-функциональным аспектам, физическим и химическим параметрам, а также использованию этих ферментов в промышленных целях.
Ключевые слова: α-амилазы, продукция ферментов, бактериальная и грибковая амилаза, крахмал
ВВЕДЕНИЕ
α-амилазы (E.C.3.2.1.1) представляют собой ферменты, которые катализируют гидролиз внутренних α-1,4-гликозидных связей в крахмале в низкомолекулярных продуктах, таких как глюкоза, мальтоза и мальтотриоза (29, 42, 66). Амилазы являются одними из наиболее важных ферментов и имеют большое значение для биотехнологии, составляя класс промышленных ферментов, на долю которых приходится примерно 25% мирового рынка ферментов (66, 68). Их можно получить из нескольких источников, таких как растения, животные и микроорганизмы. Сегодня в продаже имеется большое количество микробных амилаз, которые почти полностью заменили химический гидролиз крахмала в промышленности по переработке крахмала.Амилазы микроорганизмов имеют широкий спектр промышленного применения, поскольку они более стабильны, чем полученные с растительными и животными α-амилазами (81). Основным преимуществом использования микроорганизмов для производства амилаз является экономичность массового производства и тот факт, что микробами легко манипулировать для получения ферментов с желаемыми характеристиками. α-Амилаза была получена из нескольких грибов, дрожжей и бактерий. Однако ферменты из грибковых и бактериальных источников преобладают в промышленных секторах (29).
α-Амилазы имеют потенциальное применение в большом количестве промышленных процессов, таких как пищевая, ферментационная, текстильная, бумажная, моющая и фармацевтическая промышленность. Грибковые и бактериальные амилазы могут быть потенциально полезны в фармацевтической и тонкой химической промышленности. Однако с достижениями биотехнологии применение амилазы расширилось во многих областях, таких как клиническая, медицинская и аналитическая химия, а также их широкое применение при осахаривании крахмала и в текстильной, пищевой, пивоваренной и дистилляционной промышленности (29, 42, 61).
α-Амилазы — одна из самых популярных и важных форм промышленных амилаз, и в настоящем обзоре указаны микроорганизмы, которые продуцируют эти ферменты.
СТРУКТУРНЫЕ И ФУНКЦИОНАЛЬНЫЕ ХАРАКТЕРИСТИКИ α-АМИЛАЗЫ
α-амилаза (α-1,4-глюкан-4-глюканогидролаза) может быть обнаружена в микроорганизмах, растениях и высших организмах (42). Α-амилаза принадлежит к семейству эндоамилаз, которые катализируют начальный гидролиз крахмала до более коротких олигосахаридов посредством расщепления α-D- (1–4) гликозидных связей (9, 36, 42, 80).Ни концевые остатки глюкозы, ни α -1,6-связей не могут расщепляться α -амилазой (88). Конечными продуктами действия α-амилазы являются олигосахариды различной длины с α-конфигурацией и α-предельные декстрины (86), которые представляют собой смесь мальтозы, мальтотриозы и разветвленных олигосахаридов из 6-8 единиц глюкозы, которые содержат α -1,4 и α -1,6 связи (88). Другие амилолитические ферменты участвуют в процессе расщепления крахмала, но вклад α-амилазы является наиболее важным для инициации этого процесса (80).
Амилаза имеет трехмерную структуру, способную связываться с субстратом и под действием высокоспецифичных каталитических групп способствовать разрыву гликозидных связей (36). Человеческая α-амилаза — классический кальцийсодержащий фермент, состоящий из 512 аминокислот в одной олигосахаридной цепи с молекулярной массой 57,6 кДа (88). Белок содержит 3 домена: A, B и C (). Домен A является самым большим и представляет собой типичную бочкообразную (β / α) супраструктуру 8 .Домен B вставлен между доменами A и C и прикреплен к домену A дисульфидной связью. Домен C имеет β-листовую структуру, связанную с доменом A простой полипептидной цепью, и, по-видимому, является независимым доменом с неизвестной функцией. Активный сайт (связывание с субстратом) α-амилазы расположен в длинной щели, расположенной между карбоксильным концом доменов A и B. Кальций (Ca 2+ ) расположен между доменами A и B и может действовать в стабилизации трехмерной структуры и как аллостерический активатор.Связывание аналогов субстрата позволяет предположить, что Asp206, Glu230 и Asp297 участвуют в катализе (56). Сайт связывания субстрата содержит 5 субсайтов с каталитическим сайтом, расположенным в субсайте 3. Субстрат может связываться с первым остатком глюкозы в субсайте 1 или 2, позволяя происходить расщеплению между первым и вторым или вторым и третьим остатками глюкозы (88).
Структура α-амилазы. Домен A показан красным цветом, домен B — желтым, а домен C — фиолетовым. В каталитическом центре ион кальция показан синей сферой, а хлорид-ион — желтой сферой.Зеленые структуры связаны с активным сайтом и с сайтами связывания на поверхности (62).
КРАХМАЛ
Крахмал является важным компонентом рациона человека и для этой цели используется химически и ферментативно, перерабатывается в различные продукты, такие как гидролизаты крахмала, сиропы глюкозы, фруктоза, производные мальтодекстрина или циклодекстрины, используемые в пищевых продуктах. промышленность. В дополнение к этому, произведенный сахар можно ферментировать для получения этанола. Несмотря на большое количество заводов, способных производить крахмал, лишь несколько заводов важны для промышленной переработки крахмала.Основными промышленными источниками являются кукуруза, тапиока, картофель и пшеница, но такие ограничения, как низкое сопротивление сдвигу, термическое сопротивление, термическое разложение и высокая тенденция к ретроградации, ограничивают его использование в некоторых промышленных пищевых приложениях (1, 28, 86). Среди углеводных полимеров крахмал в настоящее время пользуется повышенным вниманием из-за его полезности в различных пищевых продуктах. Крахмал вносит большой вклад в текстурные свойства многих пищевых продуктов и широко используется в пищевых продуктах и в промышленности в качестве загустителя, коллоидного стабилизатора, гелеобразователя, наполнителя и агента, удерживающего воду (37).
Крахмал — это полимер глюкозы, связанный с другим полимером гликозидной связью. В крахмале присутствуют два типа полимеров глюкозы: амилоза и амилопектин (и). Амилоза и амилопектин имеют разные структуры и свойства. Амилоза представляет собой линейный полимер, состоящий из 6000 единиц глюкозы с α-1,4-гликозидными связями. Амилопектин состоит из коротких α-1,4, связанных с линейными цепями из 10-60 единиц глюкозы, и α-1,6, связанных с боковыми цепями с 15–45 единицами глюкозы. Связанная с гранулами синтаза крахмала может удлинить мальтоолигосахариды с образованием амилозы и считается ответственной за синтез этого полимера.Считается, что растворимая синтаза крахмала отвечает за синтез единичных цепей амилопектина. α-Амилаза способна расщеплять α-1,4-гликозидные связи, присутствующие во внутренней части амилозы или амилопектиновой цепи (56, 78, 84, 86).
В крахмале присутствуют два типа полимеров глюкозы: амилоза (A) представляет собой линейный полимер, состоящий из до 6000 единиц глюкозы с α-1,4-гликозидными связями (56), а амилопектин (B) состоит из коротких α-1, 4 связаны с линейными цепями из 10–60 единиц глюкозы и α-1,6 связаны с боковыми цепями из 15–45 единиц глюкозы (56).
Крахмал гидролизуется на более мелкие олигосахариды с помощью α-амилазы, которая является одним из наиболее важных коммерческих ферментных процессов. Амилазы находят применение во всех промышленных процессах, таких как продукты питания, моющие средства, текстильная промышленность и бумажная промышленность, для гидролиза крахмала (29, 47, 81). Состав сахарида, полученный после гидролиза крахмала, сильно зависит от воздействия температуры, условий гидролиза и происхождения фермента. Специфичность, термостабильность и pH-реакция ферментов являются критическими свойствами для промышленного использования (42).
ПРОИЗВОДСТВО α-АМИЛАЗЫ
Производство α-амилазы путем глубокой ферментации (SmF) и твердофазной ферментации (SSF) было исследовано и зависит от множества физико-химических факторов. SmF традиционно использовался для производства промышленно важных ферментов из-за простоты контроля различных параметров, таких как pH, температура, аэрация, перенос кислорода и влажность (16, 22).
Системы SSF кажутся многообещающими из-за природного потенциала и преимуществ, которые они предлагают.SSF напоминает естественную среду обитания микроорганизмов и, следовательно, является предпочтительным выбором для микроорганизмов для роста и производства полезных продуктов с добавленной стоимостью. SmF можно рассматривать как нарушение их естественной среды обитания, особенно грибов (74). Согласно теоретической концепции активности воды, грибы и дрожжи считались подходящими микроорганизмами для SSF, тогда как бактерии считались неподходящими. Однако опыт показал, что бактериальные культуры можно хорошо контролировать и манипулировать ими для процессов SSF (60).Есть и другие преимущества SSF по сравнению с SmF, включая превосходную производительность, более простую технику, меньшие капитальные вложения, более низкое энергопотребление и меньший выход воды, лучшее восстановление продукта и отсутствие образования пены, кроме того, как сообщается, это наиболее подходящий процесс для разработки страны. Недавно исследователи оценили, является ли SSF лучшей системой для производства ферментов. Они обнаружили, что SSF подходит для производства ферментов и других термолабильных продуктов, особенно когда можно получить более высокие выходы по сравнению с SmF (16, 82).
Оптимизация условий ферментации, в частности физических и химических параметров, важна при разработке процессов ферментации из-за их влияния на экономичность и практичность процесса (21). Роль различных факторов, включая pH, температуру, ионы металлов, источник углерода и азота, поверхностно-активные агенты, фосфат и перемешивание, изучалась для производства α-амилазы. Свойства каждой α-амилазы, такие как термостабильность, профиль pH, стабильность pH и независимость от кальция, должны соответствовать ее применению.Например, α-амилазы, используемые в крахмальной промышленности, должны быть активными и стабильными при низком pH, но при высоких значениях pH при производстве моющих средств. Наиболее важными среди них являются состав питательной среды, pH среды, концентрация фосфата, возраст посевного материала, температура, аэрация, источник углерода и источник азота (16, 69). Физико-химические параметры α-амилаз бактерий и грибов широко изучены и описаны (29). проявляет свойства некоторых амилаз из микроорганизмов.
Таблица 1
Свойства бактериальных и грибковых α-амилаз
| Микроорганизм | Ферментация | Оптимальный pH / стабильность | Оптимальная температура / стабильность | Молекулярная масса (кДа) | 37Ингибиторы | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Бактерии | |||||||||||||
| Bacillus amyloliquefaciens | SmF | 7.0 | 33 ° C | — | — | (82) | |||||||
| Chromohalobacter sp. TVSP 101 | SSF | 7,0 — 9,0 | 65 ° C | 72 | — | (63) | |||||||
| Caldimonas taiwanensis sp. ноя | 7,0 | 55 ° C | — | Галактоза, малат, малонат, сахароза и ацетат | (12) | ||||||||
| Halobacillus sp MA-2 | SmF 75 — 8,5 | 50 ° C | — | Cd 2+ , Cu 2+ | (4) | ||||||||
| Haloarcula hispânica | 6,5 | ЭДТА | (34) | ||||||||||
| Bacillus sp. I-3 | SmF | 7,0 | 70 ° C | — | ЭДТА, HgCl2 | (28) | |||||||
| Bacillus sp. PN5 | SmF | 10 | 60 ° C | — | NH 4 Cl | (71) | |||||||
| Bacillus sp.PS-7 | SSF | 6,5 | 60 ° C | 71 | — | (76) | |||||||
| Bacillus subtilis | SSF | 7,0 | (8) | ||||||||||
| Bacillus subtilis DM-03 | SSF | 6.0–10.0 | 50 ° C | — | — | (54) | 5us Bacillis 9010tilis 09 90CCСмФ | 6.5 | 37 ° C | — | — | (66) | |
| Bacillus sp. KCA102 | 71 | 57,5 ° C | — | — | (1) | ||||||||
| Bacillus sp. AS-1 | SSF | 6,5 | 50 ° C | — | — | (77) | |||||||
| Bacillus subtilis JS-2004 | SmF | Co 2+ , Cu 2+ , Hg 2+ Mg 2+ , Zn 2+ , Ni 2+ , Fe 2+ и Mn 2+ | (6) | ||||||||||
| Bacillus sp.IMD 435. | SmF | 6,0 | 65 ° C | глюкоза, фруктоза | (30) | ||||||||
| Bacillus subtilis | SmF14 | 7,0 — | (46) | ||||||||||
| Bacillus caldolyticus DSM405 | SmF | 5.0-6.0 | 70 ° C | — | — | (73) | 908acillus 9Фердоусикус4,5 | 70 ° C | 53 | Hg 2+ , Zn 2+ и ЭДТА | (7) | ||
59 Halomonas meridiana 90F7 902 902,0 37 ° C | — | Глюкоза | (15) | ||||||||||
| Rhodothermus marinus | SmF | 6,5 — 7 | 85 ° C | — | 7 | — | 7 902 Bacillus sp.KR-8104 | 4,0 — 6,0 | 70-75 ° C | 59 | — | (69) | |
| Bacillus licheniformis GCBU-8 | 7,57 SmF | — | — | (35) | |||||||||
| Bacillus subtilis | 6.5 | 135 ° C | — | — | ac10 (47) | ||||||||
| 6.1 | 60 ° C | 80 | Zn 2+ и Cd 2+ | (18) | |||||||||
| Nocardiopsis sp. | 5,0 | 70 ° C | — | — | (79) | ||||||||
| Geobacillus thermoleovorans | 7,0 | 70 ° C | |||||||||||
| Lactobacillus fermentum Ogi E1 | 5.0 | 30 ° C | — | — | (11) | ||||||||
| Lactobacillus manihotivorans LMG 18010T | SmF | 5.5 | 55 ° C | 2+ , Hg 2+ , Fe 3+ и Al 3+(2) | |||||||||
| Грибы и дрожжи | 57 Thermomyces lanuginosus ATCC 58160 | SSF | 6.0 | 50 ° C | — | — | (48) | ||||||
| Thermomyces lanuginosus ATCC 200065 | 6.0 | 50 ° C | 514- | 908||||||||||
| Aspergillus niger | SSF | 5.5 | 70 ° C | — | — | (85) | |||||||
| Aspergillus sp. AS-2 | SSF | 6.0 | 50 ° C | — | — | (77) | |||||||
| Aspergillus niger UO-1 | SmF | 4.95 | 50 ° C | Cu 2+ , Hg 2+ и Zn 2+ | (32) | ||||||||
| Aspergillus niger ATCC 16404 | SmF | 30 ° C | — | — | (19) | ||||||||
| Aspergillus oryzae | 5,0 — 9,0 | 25-352 ° C | |||||||||||
| Aspergillus oryzae CBS570.64 | SSF | 7,0 | 35 ° C | — | — | (65) | |||||||
| Aspergillus oryzae NRRL 6270 | SSF | 902 908 | (21) | ||||||||||
| Aspergillus oryzae CBS 125-59 | SSF | 6,0 | 30 ° C | (55) | |||||||||
| 30 ° C | — | — | (27) | ||||||||||
| Aspergillus kawachii | 3,0 | 30 ° C | 108 | — Cryptococcus flavus | 5,5 | 50 ° C | 75 | Hg 2+ , Fe 2+ и Cu 2+ | (87) | СмФ | 6.5 | 30 ° C | — | — | (43) |
| Pycnoporus sanguineus | SmF | 7.0 | |||||||||||
| Pycnoporus sanguineus | SSF | 5,0 | 37 ° C | — | — | (75) | |||||||
| Mucor sp. | 5,0 | 60 ° C | — | ЭДТА | (51) | ||||||||
| Saccharomyces kluyveri YKM5 | 5.0 | 30 ° C | — | — | (52) |
БАКТЕРИАЛЬНЫЕ АМИЛАЗЫ
α-амилаза может продуцироваться различными видами микроорганизмов, но для коммерческого применения α-амилаза в основном происходит род Bacillus . α-Амилазы, полученные из Bacillus licheniformis , Bacillus stearothermophilus и Bacillus amyloliquefaciens , находят потенциальное применение в ряде промышленных процессов, таких как пищевая, ферментационная, текстильная и бумажная промышленность (46, 61).
Термостабильность — желательная характеристика большинства промышленных ферментов. Термостабильные ферменты, выделенные из термофильных организмов, нашли ряд коммерческих применений из-за их стабильности. Поскольку ферментативное разжижение и осахаривание крахмала осуществляются при высоких температурах (100–110 ° C), в настоящее время исследуются термостабильные амилолитические ферменты для улучшения промышленных процессов разложения крахмала и представляют большой интерес для производства ценных продуктов, таких как глюкоза, кристаллическая декстроза. , сироп декстрозы, мальтоза и мальтодекстрины (6, 26, 79). Bacillus subtilis , Bacillus stearothermophilus , Bacillus licheniformis и Bacillus amyloliquefaciens , как известно, являются хорошими продуцентами термостабильной α-амилазы, и они широко используются для коммерческого производства фермента для различных целей (64) . Сообщалось о термостабильных α-амилазах из нескольких бактериальных штаммов, и они были получены с использованием SmF, а также SSF (83). Однако было обнаружено, что использование SSF более выгодно, чем SmF, и позволяет более дешевое производство ферментов (76).Продукция α-амилазы SSF ограничена родом Bacillus и B. subtilis , B. polymyxia , B.mesentericus , B. vulgarus , B. megaterium и B. .licheniformis были использованы для продукции α-амилазы в SSF (8). В настоящее время термостабильные амилазы Bacillus stearothermophilus или Bacillus licheniformis используются в отраслях по переработке крахмала (26).
Ферменты, продуцируемые некоторыми галофильными микроорганизмами, обладают оптимальной активностью при высокой солености и поэтому могут использоваться во многих тяжелых промышленных процессах, где используемые концентрированные солевые растворы в противном случае ингибировали бы многие ферментативные превращения (4, 63).Кроме того, большинство галобактериальных ферментов в значительной степени термотолерантны и остаются стабильными при комнатной температуре в течение длительного времени (51). Галофильные амилазы были охарактеризованы из галофильных бактерий, таких как Chromohalobacter sp. (63), Halobacillus sp. (4), Haloarcula hispanica (34), Halomonas meridiana (15) и Bacillus dipsosauri (18).
АМИЛАЗЫ ГРИБОВ
Большинство сообщений о грибах, продуцирующих α-амилазу, ограничено несколькими видами мезофильных грибов, и были предприняты попытки определить условия культивирования и выбрать лучшие штаммы гриба для производства в промышленных масштабах. (29).Источники грибов ограничены наземными изолятами, в основном Aspergillus и Penicillium (43).
Виды Aspergillus продуцируют большое количество внеклеточных ферментов, и амилазы имеют наиболее важное промышленное значение (32). Нитчатые грибы, такие как Aspergillus oryzae и Aspergillus niger , производят значительные количества ферментов, которые широко используются в промышленности. A. oryzae привлекает повышенное внимание как благоприятный хозяин для продукции гетерологичных белков из-за его способности секретировать огромное количество ценных белков и промышленных ферментов, например.грамм. α-амилаза (39). Aspergillus oryzae широко используется в производстве пищевых продуктов, таких как соевый соус, органических кислот, таких как лимонная и уксусная кислоты, и коммерческих ферментов, включая α-амилазу (41). Aspergillus niger обладает важной гидролитической способностью в производстве α-амилазы и, благодаря устойчивости к кислотности (pH <3), позволяет избежать бактериального заражения (19).
Нитчатые грибы являются подходящими микроорганизмами для твердофазной ферментации (SSF), особенно потому, что их морфология позволяет им колонизировать и проникать в твердый субстрат (65).Грибковые α-амилазы предпочтительнее других микробных источников из-за их более общепризнанного статуса GRAS (общепризнанного безопасного) (29).
Термофильный гриб Thermomyces lanuginosus — отличный продуцент амилазы. Дженсен (38) и Кунамнени (48) очистили α-амилазу, доказав ее термостабильность.
ОЧИСТКА α-АМИЛАЗЫ
Промышленные ферменты, производимые в больших количествах, обычно не требуют дополнительной обработки и, следовательно, являются относительно сырыми препаратами.Коммерческое использование -амилазы обычно не требует очистки фермента, но для применения ферментов в фармацевтическом и клиническом секторах требуются амилазы высокой чистоты. Фермент в очищенной форме также является необходимым условием при изучении структурно-функциональных взаимосвязей и биохимических свойств (29). Были исследованы различные стратегии очистки ферментов с использованием конкретных характеристик целевой биомолекулы. Очистка в лабораторном масштабе от α-амилазы включает различные комбинации ионного обмена, гель-фильтрации, гидрофобных взаимодействий и обращенно-фазовой хроматографии.В качестве альтернативы были предложены протоколы экстракции α-амилазы с использованием органических растворителей, таких как этанол, ацетон и осаждение сульфатом аммония (25, 31, 44) и ультрафильтрация (53). Эти традиционные многоступенчатые методы требуют дорогостоящего оборудования на каждом этапе, что делает их трудоемкими, трудоемкими, практически не воспроизводимыми и может привести к увеличению потерь желаемого продукта (5). Однако жидкостно-жидкостная экстракция представляет собой интересную альтернативу очистки, поскольку несколько функций ранних стадий обработки могут быть объединены в одну операцию.Жидкостно-жидкостная экстракция — это перенос определенных компонентов из одной фазы в другую, когда несмешивающиеся или частично растворимые жидкие фазы контактируют друг с другом. Этот процесс широко используется в химической промышленности из-за его простоты, низкой стоимости и легкости масштабирования. Очистка биомолекул с использованием жидкостно-жидкостной экстракции успешно проводится в крупных масштабах уже более десяти лет. Преимущества использования этой системы — более низкая вязкость, более низкая стоимость химикатов и более короткое время разделения фаз.Необходимо изучить и понять динамическое поведение этих систем, чтобы улучшить контроль непрерывной жидкостной экстракции на предприятии и оценить риски для безопасности и окружающей среды на самой ранней стадии проектирования (49).
ПРОМЫШЛЕННОЕ ПРИМЕНЕНИЕ α-АМИЛАЗЫ
Превращение крахмала
Наиболее широко α-амилазы применяются в крахмальной промышленности, которая используется для гидролиза крахмала в процессе разжижения крахмала, который превращает крахмал в фруктозу и сиропы глюкозы (57) .Ферментативное превращение всего крахмала включает: желатинизацию, которая включает растворение гранул крахмала с образованием вязкой суспензии; разжижение, которое включает частичный гидролиз и потерю вязкости; и осахаривание, включающее производство глюкозы и мальтозы путем дальнейшего гидролиза (29, 64). Первоначально использовалась α-амилаза Bacillus amyloliquefaciens , но она была заменена на α-амилазу Bacillus stearothermophilus или Bacillus licheniformis (86).Ферменты видов Bacillus представляют особый интерес для крупномасштабных биотехнологических процессов из-за их замечательной термостабильности и потому, что для этих ферментов доступны эффективные системы экспрессии (64).
Производство моющих средств
Производство моющих средств является основными потребителями ферментов как по объему, так и по стоимости. Использование ферментов в составах моющих средств улучшает способность моющих средств удалять стойкие пятна и делает их экологически безопасными.Амилазы — это второй тип ферментов, используемых в рецептуре ферментных моющих средств, и 90% всех жидких моющих средств содержат эти ферменты (29, 33, 50). Эти ферменты используются в моющих средствах для стирки и автоматической посуды для разложения остатков крахмалистых продуктов, таких как картофель, подливы, заварной крем, шоколад и т. Д., До декстринов и других более мелких олигосахаридов (54, 58). Амилазы обладают активностью при более низких температурах и щелочном pH, поддержание необходимой стабильности в условиях детергента, а окислительная стабильность амилаз является одним из наиболее важных критериев их использования в детергентах, где среда стирки является очень окислительной (13, 45).Удаление крахмала с поверхностей также важно для обеспечения белизны, поскольку крахмал может быть аттрактантом для многих типов твердых частиц. Примеры амилаз, используемых в индустрии моющих средств, происходят от Bacillus или Aspergillus (50).
Производство топливного спирта
Этанол является наиболее используемым жидким биотопливом. Для производства этанола крахмал является наиболее часто используемым субстратом из-за его низкой цены и легкодоступного сырья в большинстве регионов мира (14).В этом производстве крахмал должен быть солюбилизирован, а затем подвергнут двум ферментативным стадиям для получения сбраживаемых сахаров. Биоконверсия крахмала в этанол включает разжижение и осахаривание, при котором крахмал превращается в сахар с использованием амилолитических микроорганизмов или ферментов, таких как α -амилаза, с последующей ферментацией, при которой сахар превращается в этанол с использованием ферментирующих этанол микроорганизмов, таких как дрожжи . Saccharomyces cerevisiae (53, 59). Производство этанола дрожжевым брожением играет важную роль в экономике Бразилии (17).Чтобы получить новый штамм дрожжей, который может непосредственно производить этанол из крахмала без необходимости отдельного процесса осахаривания, слияние протопластов было выполнено между амилолитическими дрожжами Saccharomyces fibuligera и S. cerevisiae (14). Среди бактерий на первом этапе гидролиза суспензий крахмала используется α-амилаза, полученная из терморезистентных бактерий, таких как Bacillus licheniformis , или из сконструированных штаммов Escherichia coli или Bacillus subtilis (70).
Пищевая промышленность
Амилазы широко используются в пищевой промышленности, такой как выпечка, пивоварение, приготовление пищевых добавок, производство тортов, фруктовых соков и крахмальных сиропов (16). -Амилазы широко используются в хлебопекарной промышленности. Эти ферменты можно добавлять в хлебное тесто для разложения крахмала в муке на более мелкие декстрины, которые впоследствии ферментируются дрожжами. Добавление α-амилазы в тесто приводит к увеличению скорости ферментации и снижению вязкости теста, что приводит к улучшению объема и текстуры продукта.Кроме того, в тесте образуется дополнительный сахар, что улучшает вкус, цвет корочки и жареные качества хлеба. Помимо образования ферментируемых соединений, α-амилазы также обладают эффектом против черенкования при выпечке хлеба и улучшают сохранение мягкости выпечки, увеличивая срок хранения этих продуктов (29, 86). В настоящее время термостабильная мальтогенная амилаза Bacillus stearothermophilus коммерчески используется в хлебопекарной промышленности (86). Амилазы также используются для осветления пива или фруктовых соков или для предварительной обработки кормов для животных с целью улучшения усвояемости клетчатки (23, 24, 86).
Текстильная промышленность
Амилазы используются в текстильной промышленности для шлифования. Проклеивающие вещества, такие как крахмал, наносятся на пряжу перед производством ткани, чтобы обеспечить быстрый и безопасный процесс ткачества. Крахмал имеет очень привлекательный размер, потому что он дешев, легко доступен в большинстве регионов мира и довольно легко удаляется. Позже крахмал удаляется из тканого материала мокрым способом в текстильной отделочной промышленности. Дизайн включает удаление крахмала с ткани, который служит упрочняющим агентом, предотвращающим обрыв нити основы в процессе ткачества.Α-амилазы избирательно удаляют размер и не атакуют волокна (3, 20, 29). Амилаза из красителя Bacillus использовалась в текстильной промышленности довольно давно.
Бумажная промышленность
Использование α-амилаз в целлюлозно-бумажной промышленности предназначено для модификации крахмала мелованной бумаги, то есть для производства крахмала с низкой вязкостью и высоким молекулярным весом (29, 86). Обработка покрытия позволяет сделать поверхность бумаги достаточно гладкой и прочной, чтобы улучшить качество письма на бумаге.В этом применении вязкость природного крахмала слишком высока для проклейки бумаги, и ее можно изменить путем частичного разложения полимера α-амилазами в периодических или непрерывных процессах. Крахмал — хороший проклеивающий агент для отделки бумаги, улучшающий качество и стираемость, а также хорошее покрытие для бумаги. Размер увеличивает жесткость и прочность бумаги (10, 29). Примеры амилаз, полученных из микроорганизмов, используемых в бумажной промышленности, включают Amizyme® (PMP Fermentation Products, Пеория, США), Termamyl®, Fungamyl, BAN® (Novozymes, Дания) и α-амилазу G9995® (Enzyme Biosystems, США) (72) .Заключение. коммерческое производство. Поиск новых микроорганизмов, которые можно использовать для производства амилазы, — это непрерывный процесс. Совсем недавно многие авторы представили хорошие результаты в разработке методов очистки α-амилазы, которые позволяют применять их в фармацевтическом и клиническом секторах, где требуются амилазы высокой чистоты.
БЛАГОДАРНОСТИ
Это исследование было поддержано грантами Координационного совета по повышению квалификации выпускников (Кейпс — Бразилия), Национального совета по научному и технологическому развитию (CNPq — Бразилия) и Фонда поддержки федеральных исследований штата Дистрито (FAPDF — Бразилия) .
ССЫЛКИ
1. Agrawal M., Pradeep S., Chandraraj K., Gummadi S.N. Гидролиз крахмала амилазой из Bacillus sp. KCA102: статистический подход. Биохимия процессов.2005; 40: 2499–2507. [Google Scholar] 2. Агилар Г., Морлон-Гайот Дж., Трехо-Агилар Б., Гайот Дж. П. Очистка и характеристика внеклеточной альфа-амилазы, продуцируемой Lactobacillus manihotivorans LMG 18010 (T), амилолитической молочнокислой бактерией. Enzyme Microb Technol. 2000. 27: 406–413. [PubMed] [Google Scholar] 3. Ахлават С., Дхиман С.С., Баттан Б., Мандхан Р.П., Шарма Дж. Производство пектиназы Bacillus subtilis и ее потенциальное применение в биопрепарате хлопка и микрополиэтиленовой ткани.Биохимия процессов. 2009; 44: 521–526. [Google Scholar] 4. Амоозегар М.А., Малекзаде Ф., Малик К.А. Продукция амилазы вновь выделенным умеренным галофилом, Halobacillus sp. штамм МА-2. J Microbiol Methods. 2003. 52: 353–359. [PubMed] [Google Scholar] 5. Арауза Л.Дж., Йозалаа А.Ф., Маццолаб П.Г., Пенна Т.С.В. Биотехнологическое производство и применение низина: обзор. Trends Food Sci Technol. 2009. 20: 146–154. [Google Scholar] 6. Asgher M., Asad M.J., Rahman S.U., Legge R.L. Термостабильная α-амилаза из умеренно термофильного штамма Bacillus subtilis для обработки крахмала.J Food Process Eng. 2007. 79: 950–955. [Google Scholar] 7. Asoodeh A., Chamani J., Lagzian M. Новая термостабильная ацидофильная альфа-амилаза из новой термофильной « Bacillus sp. Ferdowsicous », выделенный из горячего минерального источника Фердоус в Иране: очистка и биохимическая характеристика. Int J Biol Macromol. 2010. 46: 289–297. [PubMed] [Google Scholar] 8. Байсал З., Уяр Ф., Айтекин С. Твердотельная ферментация для производства α-амилазы термотолерантным Bacillus subtilis из воды горячего источника.Биохимия процессов. 2003. 38: 1665–1668. [Google Scholar] 9. Brayer G.D., Luo Y., Withers S.G. Структура альфа-амилазы поджелудочной железы человека при разрешении 1,8 A и сравнение с родственными ферментами. Protein Sci. 1995; 4: 1730–1742. [Бесплатная статья PMC] [PubMed] [Google Scholar] 10. Bruinenberg P.M., Hulst A.C., Faber A., Voogd R.H. Процесс проклейки поверхности или покрытия бумаги. В: Европейская заявка на патент. 1996 [Google Scholar] 11. Кальдерон М., Луазо Г., Гайо Дж. Ферментация с помощью Lactobacillus fermentum Ogi E1 различных комбинаций углеводов, встречающихся в естественных условиях в зерновых: последствия для энергии роста и производства альфа-амилазы.Int J Food Microbiol. 2003. 80: 161–169. [PubMed] [Google Scholar] 12. Chen W.M., Chang J.S., Chiu C.H., Chang S.C., Chen W.C., Jiang C.M. Caldimonas taiwanensis sp. nov., бактерия-продуцент α-амилазы, выделенная из горячего источника. Syst Appl Microbiol. 2005. 28: 415–420. [PubMed] [Google Scholar] 13. Chi M., Chen Y., Wu T., Lo H., Lin L. Разработка усеченной α-амилазы Bacillus sp. штамм ТС-23 для одновременного повышения термической и окислительной стабильности. J. Biosci.Bioeng. 2009 г .; хх: ххх – ххх. [PubMed] [Google Scholar] 14. Чи З., Чи З., Лю Г., Ван Ф., Цзюй Л., Чжан Т. Saccharomycopsis fibuligera и его применение в биотехнологии. Biotechnol Adv. 2009. 27: 423–431. [PubMed] [Google Scholar] 15. Coronado M., Vargas C., Hofemeister J., Ventosa A., Nieto J.J. Производство и биохимическая характеристика альфа-амилазы из умеренного галофила Halomonas meridiana . FEMS Microbiol Lett. 2000. 183: 67–71. [PubMed] [Google Scholar] 16.Couto S.R., Sanromán M.A. Применение твердофазной ферментации в пищевой промышленности — обзор. Журнал пищевой инженерии. 2006. 76: 291–302. [Google Scholar] 17. де Мораес Л.М., Астольфи-Филхо С., Оливер С.Г. Разработка штаммов дрожжей для эффективного использования крахмала: оценка конструкций, которые экспрессируют альфа-амилазу и глюкоамилазу отдельно или в виде бифункциональных слитых белков. Appl Microbiol Biotechnol. 1995; 43: 1067–1076. [PubMed] [Google Scholar] 18. Deutch C.E. Характеристика солеустойчивой внеклеточной α-амилазы из Bacillus dipsosauri .Lett Appl Microbiol. 2002; 35: 78–84. [PubMed] [Google Scholar] 19. Джекриф-Дахмуш С., Гериби-Аоулми З., Мераихи З., Беннамун Л. Применение статистического дизайна для оптимизации культуральной среды для продукции α-амилазы с помощью Aspergillus niger ATCC16404, выращенного на оранжевых отходах. J Food Process Eng. 2006. 73: 190–197. [Google Scholar] 20. Фейткенхауэр Х. Анаэробное сбраживание очищенных сточных вод: влияние предварительной обработки и анионного поверхностно-активного вещества на разложение и промежуточное накопление.Enzyme Microb. Technol. 2003. 33: 250–258. [Google Scholar] 21. Фрэнсис Ф., Сабу А., Нампотири К.М., Рамачандран С., Гош С., Сакач Г., Панди А. Использование методологии поверхности отклика для оптимизации параметров процесса производства α-амилазы Aspergillus oryzae . Biochem. Англ. J. 2003; 15: 107–115. [Google Scholar] 22. Гангадхаран Д., Сиварамакришнан С., Нампотири К.М., Сукумаран Р.К., Пандей А. Методология поверхности отклика для оптимизации продукции альфа-амилазы Bacillus amyloliquefaciens .Биоресур Технол. 2008. 99: 4597–4602. [PubMed] [Google Scholar] 23. Гаврилеску М., Чисти Ю. Биотехнология — устойчивая альтернатива химической промышленности. Biotechnol Adv. 2005; 23: 471–499. [PubMed] [Google Scholar] 24. Гораи С., Баник С.П., Верма Д., Чоудхури С., Мукерджи С., Ховала С. Биотехнология грибов в производстве пищевых продуктов и кормов. Food Res. Int. 2009. 42: 577–587. [Google Scholar] 25. Глимф Дж. Л., Штутценбергер Ф. Дж. Производство, очистка и характеристика альфа-амилазы из Thermomonospora curvata.Appl Environ Microbiol. 1977; 34: 391–397. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Гомес И., Гомес Дж., Штайнер В. Высокотермостабильная амилаза и пуллуланаза крайне термофильных эубактерий Rhodothermus marinus : получение и частичная характеристика. Биоресур Технол. 2003; 90: 207–214. [PubMed] [Google Scholar] 27. Гото С.Е., Барбоса Е.П., Кистнер Л.С., Морейра Ф.Г., Ленартович В., Перальта Р.М. Производство амилазы Aspergillus fumigatus с использованием альфа-метил-D-гликозида, синтетического аналога мальтозы, в качестве субстрата.FEMS Microbiol Lett. 1998. 167: 139–143. [PubMed] [Google Scholar] 28. Гоял Н., Гупта Дж. К., Сони С. К. Новая термостабильная α-амилаза, переваривающая сырой крахмал, из Bacillus sp. I-3 и его использование в прямом гидролизе сырого картофельного крахмала. Enzyme Microb. Technol. 2005; 37: 723–734. [Google Scholar] 29. Гупта Р., Гиграс П., Мохапатра Х., Госвами В.К., Чаухан Б. Микробные α-амилазы: биотехнологическая перспектива. Process Biochem. 2003. 38: 1599–1616. [Google Scholar] 30. Гамильтон Л.М., Келли К.Т., Фогарти В. Получение и свойства сырой переваривающей крахмал α-амилазы Bacillus sp. IMD 435. Process Biochem. 1999; 35: 27–31. [Google Scholar] 31. Гамильтон Л.М., Келли К.Т., Фогарти В.М. Очистка и свойства сырой крахмал-амилазы Bacillus sp. IMD434. Biotechnol. Lett. 1999; 21: 111–115. [Google Scholar] 32. Эрнандес М.С., Родригес М.Р., Герра Н.П., Розес Р.П. Производство амилазы Aspergillus niger при глубинном культивировании на двух отходах пищевой промышленности.J Food Process Eng. 2006; 73: 93–100. [Google Scholar] 33. Хмидет Н., Эль-Хадж Али Н., Хаддар А., Канун С., Аля С., Насри М. Щелочные протеазы и термостабильная α-амилаза, продуцируемые совместно Bacillus licheniformis Nh2: характеристика и потенциальное применение в качестве моющей добавки . Журнал биохимической инженерии. 2009; 47: 71–79. [Google Scholar] 34. Хатчеон Г.В., Васишт Н., Болхуис А. Характеристика высокостабильной альфа-амилазы из галофильных архей Haloarcula hispanica .Экстремофилы. 2005; 9: 487–495. [PubMed] [Google Scholar] 35. Икрам уль Х., Ашраф Х., Икбал Дж., Кадир М.А. Производство альфа-амилазы Bacillus licheniformis с использованием экономичной среды. Биоресур Технол. 2003. 87: 57–61. [PubMed] [Google Scholar] 36. Юлек Дж., Франко О.Л., Сильва М., Сливински К.Т., Блох К., мл., Ригден Д.Д., Гросси де Са М.Ф. Очистка, биохимическая характеристика и частичная первичная структура нового ингибитора альфа-амилазы из Secale cereale (рожь) Int J Biochem Cell Biol.2000. 32: 1195–1204. [PubMed] [Google Scholar] 37. Джасприт Сингха Дж., Каурб Л., Маккарти О.Дж. Факторы, влияющие на физико-химические, морфологические, термические и реологические свойства некоторых химически модифицированных крахмалов для пищевых продуктов — обзор. Пищевые гидроколлоиды. 2007; 21: 1–22. [Google Scholar] 38. Дженсен Б., Небелонг П., Олсен Дж., Реслев М. Производство ферментов при непрерывном культивировании термофильными грибами, Thermomyces lanuginosus . Письма о биотехнологии. 2002; 24: 41–45.[Google Scholar] 39. Джин Б., ван Лиувен Х. Дж., Патель Б., Ю. К. Использование сточных вод после обработки крахмала для производства белка микробной биомассы и грибковой α-амилазы с помощью Aspergillus oryzae . Биоресурсы. Technol. 1998. 66: 201–206. [Google Scholar] 40. Кадзивара Ю., Такбшима Н., Охба Х., Омори Т., Симода М., Вада Х. Производство кислотоустойчивой α-амилазы Aspergillus во время производства ячменя Shochu-Koji . J. Ferment. Bioeng. 1997. 84: 224–227. [Google Scholar] 41.Каммун Р., Наили Б., Бежар С. Применение статистического дизайна для оптимизации параметров и культуральной среды для продукции альфа-амилазы с помощью Aspergillus oryzae CBS 819.72, выращенного на кашице (побочный продукт измельчения пшеницы) Bioresour Technol. 2008. 99: 5602–5609. [PubMed] [Google Scholar] 42. Кандра Л. α-амилазы медицинского и промышленного значения. Журнал молекулярной структуры (Theochem) 2003: 666–667. 487–498. [Google Scholar] 43. Катиресан К., Маниваннан С. Продукция α-амилазы Penicillium fedutanum , выделенным из почвы ризосферы мангровых зарослей.Afr. J. Biotechnol. 2006; 5: 829–832. [Google Scholar] 44. Ху С.Л., Амирул А.А., Камарузаман М., Назалан Н., Азизан М.Н. Очистка и характеристика альфа-амилазы из Aspergillus flavus. Folia Microbiol (Praha) 1994; 39: 392–398. [PubMed] [Google Scholar] 45. Кирк О., Борхерт Т.В., Fuglsang C.C. Применение промышленных ферментов. Curr Opin Biotechnol. 2002; 13: 345–351. [PubMed] [Google Scholar] 46. Консула З., Лиакопулу-Кириакидес М. Совместное производство альфа-амилазы и бета-галактозидазы Bacillus subtilis в сложных органических субстратах.Биоресур Технол. 2007. 98: 150–157. [PubMed] [Google Scholar] 47. Консула З., Лиакопулу-Кириакидес М. Гидролиз крахмалов под действием α-амилазы из Bacillus subtilis . Process Biochem. 2004; 39: 1745–1749. [Google Scholar] 48. Кунамнени А., Пермаул К., Сингх С. Производство амилазы при твердофазной ферментации термофильным грибком Thermomyces lanuginosus . J Biosci Bioeng. 2005; 100: 168–171. [PubMed] [Google Scholar] 49. Маццола П.Г., Лопес А.М., Хасманн Ф.А., Jozala A.F., Penna T.C.V., Magalhaes P.O., Rangel-Yagui C.O., Pessoa A. Жидкостно-жидкостная экстракция биомолекул: обзор и обновление основных методов. J Chem Technol Biotechnol. 2008. 83: 143–157. [Google Scholar] 50. Митидиери С., Соуза Мартинелли А.Х., Шранк А., Вайнштейн М.Х. Ферментативный детергентный состав, содержащий амилазу из Aspergillus niger : сравнительное исследование с коммерческими детергентными составами. Биоресур Технол. 2006; 97: 1217–1224. [PubMed] [Google Scholar] 51.Mohapatra B.R., Banerjee U.C., Bapuji M. Характеристика грибковой амилазы из Mucor sp. Ассоциируется с морской губкой Spirastrella sp. J. Biotechnol. 1998. 60: 113–117. [Google Scholar] 52. Моллер К., Шариф М.З., Олссон Л. Производство грибковой альфа-амилазы Saccharomyces kluyveri при культивировании с ограничением глюкозы. J Biotechnol. 2004; 111: 311–318. [PubMed] [Google Scholar] 53. Moraes L.M.P., Filho S.A., Ulhoa C.J. Очистка и некоторые свойства слитого белка α-амилазы и глюкоамилазы из Saccharomyces cerevisiae .World J. Microbiol. Biotechnol. 1999; 15: 561–564. [Google Scholar] 54. Мукерджи А.К., Бора М., Рай С.К. Изучить влияние различных компонентов ферментируемых субстратов на индукцию внеклеточного синтеза α-амилазы Bacillus subtilis DM-03 при твердофазной ферментации и изучить возможность включения α-амилазы в составы моющих средств для стирки. Biochem. Англ. J. 2009; 43: 149–156. [Google Scholar] 55. Мурадо М.А., Гонзфилес М.П., Торрадо А., Пастрана Л.М. Производство амилазы твердофазным культивированием Aspergillus oryzae на пенополиуретане.Некоторые механистические подходы на основе эмпирической модели. Process Biochem. 1997; 32: 35–42. [Google Scholar] 56. Мураликришна Г., Нирмала М. Зерновые α-амилазы — обзор. Углеводные полимеры. 2005. 60: 163–173. [Google Scholar] 57. Нильсен Дж. Э., Борхерт Т. В. Белковая инженерия бактериальных альфа-амилаз. Biochim Biophys Acta. 2000; 1543: 253–274. [PubMed] [Google Scholar] 58. Олсен Х.С.О., Фалхольт П. Роль ферментов в современных моющих средствах. Журнал поверхностно-активных веществ и моющих средств. 1998; 1: 555–567. [Google Scholar] 59.Öner E.T. Оптимизация производства этанола из крахмала амилолитическим ядерным штаммом petite Saccharomyces cerevisiae . Дрожжи. 2006; 23: 849–856. [PubMed] [Google Scholar] 60. Пандей А. Твердотельное брожение. Biochem. Англ. J. 2003; 13: 81–84. [Google Scholar] 61. Панди А., Нигам П., Соккол С.Р., Соккол В.Т., Сингх Д., Мохан Р. Достижения в области микробных амилаз. Biotechnol Appl Biochem. 2000. 31 (Pt 2): 135–152. [PubMed] [Google Scholar] 62. Паян Ф. Структурная основа ингибирования альфа-амилаз млекопитающих и насекомых ингибиторами растительного белка.Biochim Biophys Acta. 2004; 1696: 171–180. [PubMed] [Google Scholar] 63. Пракаш Б., Видьясагар М., Мадхукумар М.С., Мураликришна Г., Шрирамулу К. Получение, очистка и характеристика двух чрезвычайно галотолерантных, термостабильных и щелочно-устойчивых α-амилаз из Chromohalobacter sp. TVSP 101. Process Biochem. 2009. 44: 210–215. [Google Scholar] 64. Пракаш О., Джайсвал Н. Альфа-амилаза: идеальный представитель термостабильных ферментов. Appl Biochem Biotechnol. 2009 [PubMed] [Google Scholar] 65.Rahardjo Y.S.P., Weber F.J., Haemers S., Tramper J., Rinzema A. Воздушный мицелий Aspergillus oryzae ускоряет производство α-амилазы в модельной твердотельной ферментационной системе. Enzyme Microb. Technol. 2005; 36: 900–902. [Google Scholar] 66. Раджагопалан Г., Кришнан С. Производство альфа-амилазы из катаболита, лишенного репрессии Bacillus subtilis KCC103, с использованием гидролизата жома сахарного тростника. Биоресур Технол. 2008. 99: 3044–3050. [PubMed] [Google Scholar] 67. Рао Дж.Л.У.М., Сатьянараяна Т.Улучшение производства гипертермостабильной и высокомальтозообразующей α-амилазы экстремальным термофилом Geobacillus thermoleovorans с использованием методологии поверхности отклика и ее приложений. Биоресурсы. Technol. 2007. 98: 345–352. [PubMed] [Google Scholar] 68. Редди Н.С., Ниммагадда А., Самбасива Рао К. Обзор микробного семейства α-амилазы. Afr. J. Biotechnol. 2003. 2: 645–648. [Google Scholar] 69. Саджеди Р.Х., Надери-Манеш Х., Хадже К., Ахмадванд Р., Ранджбар Б., Асудех А., Морадиан Ф.Са-независимая α-амилаза, активная и стабильная при низком pH из Bacillus sp. КР-8104. Enzyme Microb. Technol. 2005; 36: 666–671. [Google Scholar] 70. Санчес О.Дж., Кардона К.А. Тенденции биотехнологического производства топливного этанола из разного сырья. Биоресур Технол. 2008. 99: 5270–5295. [PubMed] [Google Scholar] 71. Саксена Р.К., Датт К., Агарвал Л., Найяр П. Высокотермостабильная щелочная амилаза из Bacillus sp. PN5. Биоресур Технол. 2007. 98: 260–265.[PubMed] [Google Scholar] 72. Саксена Р.К., Малхотра Б., Батра А. Коммерческое значение некоторых грибковых ферментов. В: Арора Д.К., редактор. Справочник по грибковой биотехнологии. Нью-Йорк, США: Марсель Деккер; 2004. С. 287–298. [Google Scholar] 73. Schwab K., Bader J., Brokamp C., Popovic M.K., Bajpai R., Berovic M. Стратегия двойного кормления для производства альфа-амилазы Bacillus caldolyticus с использованием сложных сред. N Biotechnol. 2009; 26: 68–74. [PubMed] [Google Scholar] 74. Сингхания Р.Р., Патель А.К., Соккол С.Р., Пандей А. Последние достижения в твердотельной ферментации. Biochem. Англ. J. 2009; 44: 13–18. [Google Scholar] 75. Siqueira E.M.A., Mizuta K., Giglio J.R. Pycnoporus sanguineus : новый источник α-амилазы. Mycol. Res. 1997; 101: 188–190. [Google Scholar] 76. Содхи Х.К., Шарма К., Гупта Дж.К., Сони С.К. Получение термостабильной α-амилазы из Bacillus sp. PS-7 путем твердофазной ферментации и его синергетическое использование при гидролизе солодового крахмала для производства спирта.Process Biochem. 2005; 40: 525–534. [Google Scholar] 77. Сони С.К., Каур А., Гупта Дж. К. Система бактериальной α-амилазы и грибной глюкоамилазы на основе твердофазной ферментации и ее пригодность для гидролиза пшеничного крахмала. Process Biochem. 2003. 39: 185–192. [Google Scholar] 78. Соренсен Дж. Ф., Краг К. М., Сиббесен О., Делькур Дж., Гезарт Х., Свенссон Б., Тахир Т. А., Бруфау Дж., Перес-Вендрелл А. М., Беллинкампи Д., Д’Овидио Р., Камарделла Л., Джоване А. ., Боннин Э., Джуге Н. Возможная роль ингибиторов гликозидазы в промышленных биотехнологических приложениях.Biochim Biophys Acta 1696. 2004: 275–287. [PubMed] [Google Scholar] 79. Стэмфорд Т.Л., Стэмфорд Н.П., Коэльо Л.С., Араужо Дж.М. Получение и характеристика термостабильной альфа-амилазы из Nocardiopsis sp. эндофит фасоли ямса. Биоресур Технол. 2001. 76: 137–141. [PubMed] [Google Scholar] 80. Tangphatsornruang S., Naconsie M., Thammarongtham C., Narangajavana J. Выделение и характеристика гена альфа-амилазы в маниоке ( Manihot esculenta ) Plant Physiol Biochem.2005. 43: 821–827. [PubMed] [Google Scholar] 81. Таньилдизи М.С., Озер Д., Элибол М. Оптимизация продукции α-амилазы Bacillus sp . с использованием методологии поверхности отклика. Process Biochem. 2005; 40: 2291–2296. [Google Scholar] 82. Таньилдизи М.С., Озер Д., Элибол М. Производство бактериальной α-амилазы B. amyloliquefaciens при ферментации твердого субстрата. Biochem. Англ. J. 2007; 37: 294–297. [Google Scholar] 83. Теодоро С.Е.С., Мартинс М.Л.Л. Условия культивирования для продукции термостабильной амилазы Bacillus sp.Braz. J. Microbiol. 2000. 31: 298–302. [Google Scholar] 84. Тестер Р.Ф., Каркалас Дж., Ци X. Крахмал — состав, тонкая структура и архитектура. J. Cereal Sci. 2004. 39: 151–165. [Google Scholar] 85. Угуру Г.С., Акиньяуджу Дж. А., Сани А. Использование кожуры ямса для роста локально изолированного Aspergillus niger и продукции амилазы. Enzyme Microb. Technol. 1997; 21: 46–51. [Google Scholar] 86. ван дер Маарел М.Дж., ван дер Вин Б., Уитдехааг Дж. К., Лемхус Х., Дийкхейзен Л. Свойства и применение ферментов, превращающих крахмал, из семейства альфа-амилаз.J Biotechnol. 2002. 94: 137–155. [PubMed] [Google Scholar] 87. Вандерли К.Дж., Торрес Ф.А., Мораес Л.М., Ульхоа К.Дж. Биохимическая характеристика альфа-амилазы дрожжей Cryptococcus flavus . FEMS Microbiol Lett. 2004. 231: 165–169. [PubMed] [Google Scholar] 88. Whitcomb D.C., Lowe M.E. Пищеварительные ферменты поджелудочной железы человека. Dig Dis Sci. 2007; 52: 1–17. [PubMed] [Google Scholar]амилазы | Определение, функция и факты
Амилаза , любой член класса ферментов, катализирующих гидролиз (расщепление соединения путем добавления молекулы воды) крахмала на более мелкие молекулы углеводов, такие как мальтоза (молекула, состоящая из двух молекулы глюкозы).Три категории амилаз, обозначаемые альфа, бета и гамма, различаются тем, как они атакуют связи молекул крахмала.
Альфа-амилаза широко распространена среди живых организмов. В пищеварительной системе человека и многих других млекопитающих альфа-амилаза, называемая птиалином, вырабатывается слюнными железами, тогда как амилаза поджелудочной железы секретируется поджелудочной железой в тонкий кишечник. Оптимальный pH альфа-амилазы 6,7–7,0.
Птиалин смешивают с пищей во рту, где он действует на крахмал.Хотя пища остается во рту лишь на короткое время, действие птиалина продолжается в желудке до нескольких часов — до тех пор, пока пища не смешается с желудочными секретами, высокая кислотность которых инактивирует птиалин. Пищеварительное действие птиалина зависит от количества кислоты в желудке, от того, как быстро содержимое желудка опорожняется и насколько тщательно пища смешалась с кислотой. В оптимальных условиях от 30 до 40 процентов съеденных крахмалов может быть расщеплено птиалином до мальтозы во время пищеварения в желудке.
Когда пища попадает в тонкий кишечник, остатки молекул крахмала катализируются в основном до мальтозы под действием амилазы поджелудочной железы. Этот этап переваривания крахмала происходит в первом отделе тонкой кишки (двенадцатиперстной кишке), области, в которую выводятся соки поджелудочной железы. Побочные продукты гидролиза амилазы в конечном итоге расщепляются другими ферментами на молекулы глюкозы, которые быстро всасываются через стенку кишечника.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.Подпишитесь сейчасБета-амилазы присутствуют в дрожжах, плесени, бактериях и растениях, особенно в семенах. Они являются основными компонентами смеси, называемой диастазой, которая используется для удаления крахмалистых проклеивающих веществ с текстильных изделий и для превращения зерна злаков в сбраживаемые сахара. Бета-амилаза имеет оптимальный pH 4,0–5,0.
Гамма-амилазы известны своей эффективностью в расщеплении определенных типов гликозидных связей в кислой среде. Оптимальный pH гамма-амилазы — 3.0.
Что такое фермент альфа-амилазы? Использование альфа-амилазы
Что такое фермент альфа-амилазы и его применение?
Амилаза, любой член категории ферментов, катализирующих химическую реакцию (расщепление соединения путем добавления молекулы воды) крахмала на более мелкие молекулы сахарида, такие как мальтоза (молекула, состоящая из двух молекул глюкозы).
Два класса амилаз, обозначенные альфа и бета, различаются по способу, которым они атакуют связи молекул крахмала.Альфа-амилаза широко распространена среди живых организмов.
Промышленное применение фермента альфа-амилазы
Конверсия крахмала
Наиболее широко альфа-амилазы применяются в крахмальной промышленности, которая используется для гидролиза крахмала в процессе разжижения крахмала, который превращает крахмал в сиропы фруктозы и глюкозы. Превращение всего крахмала в супермолекулы включает желатинизацию, которая включает растворение гранул крахмала с образованием вязкой суспензии; фазовый переход, включающий частичную химическую реакцию и потерю в организме; и осахаривание, включающее сборку альдогексозы и дисахарида посредством любой реакции.
Первоначально использовалась альфа-амилаза эубактерий amyloliquefaciens, однако она была заменена ферментом альфа-амилазой эубактерий stearothermophilus или eubacteria licheniformis.
Ферменты из видов эубактерий представляют собой группу интересов для крупномасштабных биотехнологических процессов из-за их исключительной термостабильности и того, что для этих ферментов предлагаются экономичные системы экспрессии.
Производство моющих средств
Промышленные предприятия по производству моющих средств являются первыми покупателями ферментов с точки зрения объема и цены.
Использование ферментов в составах моющих средств улучшает способность моющих средств избавляться от стойких пятен и делает моющее средство экологически безопасным.
Амилазы — это второй тип ферментов, используемых в составе белковых моющих средств, и девяностая часть всех жидких моющих средств содержит эти ферменты.
Эти ферменты используются в моющих средствах для стирки и автоматической промывки для разложения остатков крахмалистых продуктов, таких как картофель, подливки, заварной крем, шоколад и т. Д.на декстрины и альтернативные более мелкие олигосахариды.
Амилазы обладают активностью при более низких температурах и шкале pH, образующей основание, поддерживая требуемую стабильность ниже условий моющего средства, и поэтому аэрофильная стабильность амилаз является одним из важнейших жизненно важных критериев для их использования в моющих средствах, где окружающая среда прачечной является невероятно окислительной.
Удаление крахмала с поверхностей также важно для улучшения белизны, поскольку крахмал может быть аттрактантом для многих типов твердых частиц.
Примеры амилаз, используемых в производстве моющих средств, получены из эубактерий или аспергилл.
Производство топливного спирта
Этанол — наиболее используемое жидкое биотопливо. Для производства этанола крахмал является наиболее часто используемым субстратом из-за его низкой цены и легкодоступного сырья в большинстве регионов мира. В этом производстве крахмал должен быть солюбилизирован, а затем подвергнут двум ферментативным стадиям для получения сбраживаемых сахаров.
Биоконверсия крахмала в спирт включает естественный процесс и осахаривание, когда крахмал перерождается в сахар с помощью амилолитического микроорганизма или ферментов, таких как альфа-амилаза, с последующей ферментацией, при которой сахар превращается в этанол с помощью ферментирующего этанол микроорганизма, такого как дрожжи Saccharomyces cerevisiae.Производство этанола дрожжевым брожением играет важную роль в экономике Бразилии. Чтобы получить новый штамм дрожжей, который может непосредственно производить этанол из крахмала без необходимости в отдельном процессе осахаривания, было выполнено слияние протопластов между амилолитическими дрожжами Saccharomyces fibuligera и S. cerevisiae. Среди микроорганизмов α-амилаза, полученная из устойчивых к термосам микроорганизмов, таких как настоящие бактерии licheniformis, или из встроенных штаммов Escherichia coli или Bacillus subtilis, используется на первом этапе гидролиза суспензий крахмала.
Пищевая промышленность
Амилазы широко используются в производстве пищевых продуктов, таких как выпечка, пивоварение, приготовление пищевых добавок, производство тортов, фруктовых соков и крахмальных сиропов. Α-амилазы широко используются в хлебопекарном бизнесе. Эти ферменты можно добавлять в хлебное тесто для разложения крахмала в муке на более мелкие декстрины, которые впоследствии ферментируются дрожжами. Добавление α-амилазы в тесто приводит к увеличению скорости ферментации и снижению вязкости теста, что приводит к улучшению объема и текстуры продукта.
Кроме того, он образует дополнительный сахар в тесте, что улучшает вкус, цвет корочки и поджариваемость хлеба.
Помимо образования возможных соединений, α-амилазы также обладают эффектом против черноты при выпечке хлеба и улучшают сохранение мягкости хлебобулочных изделий, увеличивая срок хранения этих продуктов.
В настоящее время термостабильный мальтогенный фермент эубактерии stearothermophilus коммерчески используется в пекарнях.
Амилазы также используются для осветления пива или фруктовых соков или для предварительной обработки кормов для животных с целью улучшения усвояемости клетчатки.
Текстильная промышленность
Амилазы используются в текстильной промышленности для измельчения. Проклеивающие вещества, такие как крахмал, наносятся на пряжу перед производством материала, чтобы обеспечить быстрый и надежный метод ткачества. Крахмал имеет очень привлекательный размер, потому что он дешев, легко доступен в большинстве регионов мира и довольно легко удаляется.
Позднее крахмал стал далек от тканого материала в исключительно мокром процессе отделки текстиля.
Обесцвечивание включает удаление крахмала из материала, который является упрочняющим агентом, чтобы предотвратить разрыв нити основы на протяжении всего метода ткачества. Альфа-амилазы отбирают путем выбора размеров и не атакуют волокна.
Амилаза от истинного бактериального окрашивания использовалась в текстильной промышленности довольно долгое время.
Бумажная промышленность
Использование α-амилаз в целлюлозно-бумажной промышленности предназначено для модификации крахмала мелованной бумаги, т.е.е. для сборки крахмала с низкой вязкостью и высоким молекулярным весом.
Обработка покрытия позволяет сделать поверхность бумаги достаточно гладкой и прочной, чтобы улучшить качество письма на бумаге. Во время этого применения консистенция натурального крахмала очень высока для размера бумаги, и это может быть изменено путем частичного разложения химического соединения α-амилазами во время периодических или непрерывных процессов.
Крахмал может быть разумным наполнителем для отделки бумаги, улучшающим качество и стираемость, а также хорошим покрытием для бумаги.Размер увеличивает жесткость и прочность бумаги.
Заключение
Использование α-амилазы в крахмальной промышленности было распространено в течение многих десятилетий, и существует ряд микробных источников для эффективного производства этого фермента, но только несколько выбранных штаммов грибов и бактерий соответствуют факторам для коммерческого производства.
Поиск новых микроорганизмов, которые можно использовать для производства амилазы, — это непрерывный процесс. Совсем недавно несколько авторов привели разумные доводы в пользу разработки методов очистки α-амилазы, которые изменяют применение в фармацевтических и клинических секторах, где требуются амилазы высокой чистоты.
Infinita Biotech — один из лучших производителей ферментов в Гуджарате, Индия. Чтобы узнать больше о ферментах и их использовании в различных секторах, посетите Infinita Biotech .



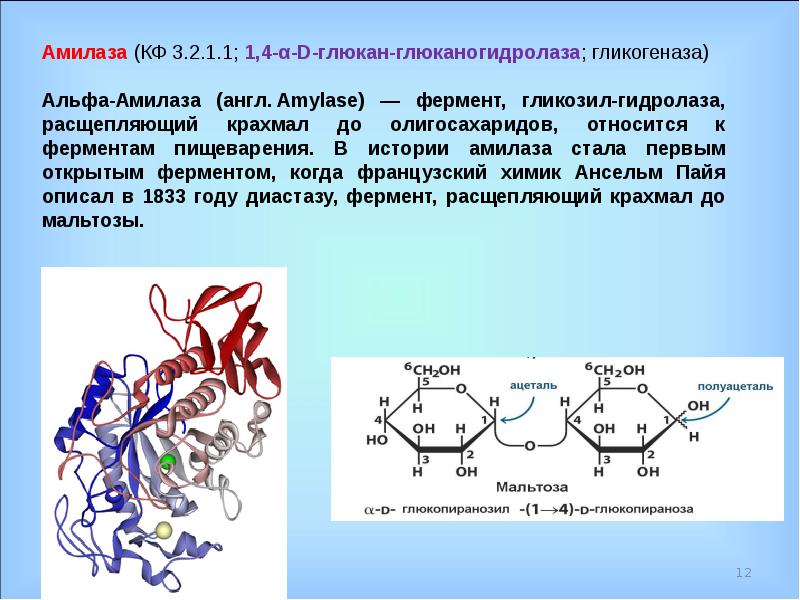


 Л., Херринг, Дж., Купер, У.Д., Харди, С.С., & Хинд, К.Р. (1974). Влияние симпатической активности и изопреналина на секрецию амилазы околоушной железой человека.Arch Oral Biol, 19 (9), 747-52.
Л., Херринг, Дж., Купер, У.Д., Харди, С.С., & Хинд, К.Р. (1974). Влияние симпатической активности и изопреналина на секрецию амилазы околоушной железой человека.Arch Oral Biol, 19 (9), 747-52.
 , Бендер, Х., Линдер, Д. (1978). Ферментативный синтез путем трансглюкозилирования гомологического ряда гликозидно замещенных мальтоолигосахаридов и их использование в качестве субстратов амилазы.Карбогид Рес, 61 (1), 359-68.
, Бендер, Х., Линдер, Д. (1978). Ферментативный синтез путем трансглюкозилирования гомологического ряда гликозидно замещенных мальтоолигосахаридов и их использование в качестве субстратов амилазы.Карбогид Рес, 61 (1), 359-68.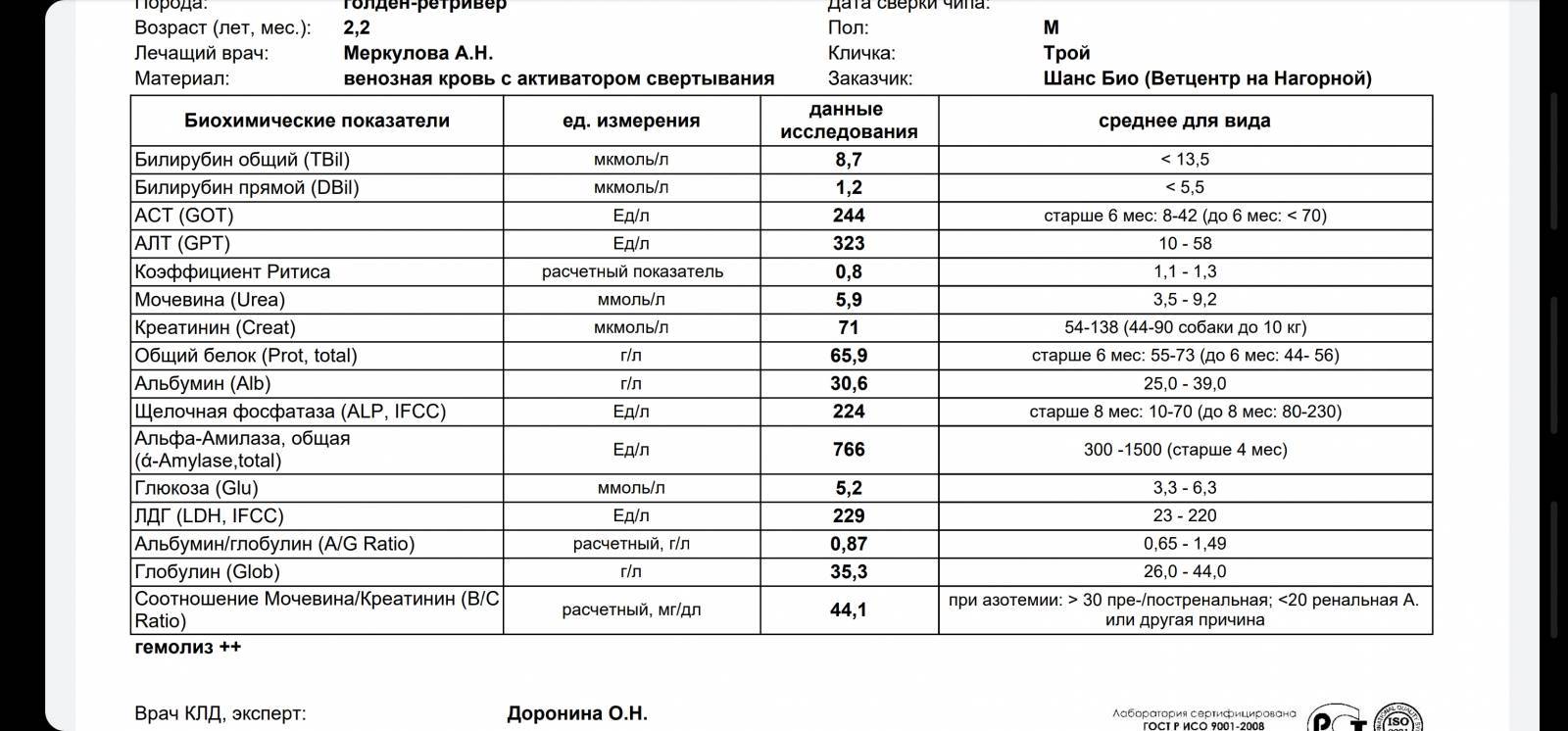 , Григоров, М., и Чжоу, С.Дж. (2008). Флавоноиды для контроля переваривания крахмала: структурные требования для ингибирования человеческой α-амилазы. J Med Chem, 51 (12), 3555-61.
, Григоров, М., и Чжоу, С.Дж. (2008). Флавоноиды для контроля переваривания крахмала: структурные требования для ингибирования человеческой α-амилазы. J Med Chem, 51 (12), 3555-61.