Гемолитико-уремический синдром (ГУС) у детей
ГЕМОЛИТИКО-УРЕМИЧЕСКИЙ СИНДРОМ (ГУС) является одной из частых причин острой почечной недостаточности (ОПН) у детей.
ТРИАДА СИМПТОМОВ:
- Гемолитическая анемия (снижение уровня гемоглобина и эритроцитов в крови, с наличием фрагментированных эритроцитов – шизоцитов)
- Тромбоцитопения – снижение уровня тромбоцитов в крови
- Острая почечная недостаточность
У большинства (90-95%) детей отмечается так называемый типичный или постдиарейный ГУС (Д+ГУС).
Другая форма ГУС, называемая атипичный (аГУС), встречается гораздо реже (5-10 % всех случаев) и является результатом аномалии (чаще генетической) белков, регулирующих процесс активации комплементов.
Д+ГУС ИЛИ ПОСТДИАРЕЙНЫЙ ГУС
Д+ГУС развивается вследствие кишечной инфекции вызванная Е coli (кишечная палочка) которая продуцируют токсин – шигатоксин (STEC).
тмечается в основном в возрасте до 3 лет и редко до 6 месяцев.
Симптомы
- диарея (разжиженный стул, понос) в течение нескольких дней (у 90-95%). Иногда бывает кровь в стуле. ЕСЛИ ВЫ ЗАМЕТИЛИ КРОВЬ В СТУЛЕ, НЕЗАМЕДЛИТЕЛЬНО ОБРАТИТЕСЬ К ВРАЧУ.
- рвота (у 30-60%) и боли в животе
Манифестация ГУС начинается в среднем через 6 (в среднем 2-14) дней. Бледность, общее недомогание, слабость, изменение поведения, небольшая желтушность, уменьшение количества мочи после (кровавой) диареи должны насторожить врача в отношении ГУС.
ЕСЛИ У ВАШЕГО РЕБЕНКА КИШЕЧНАЯ ИНФЕКЦИЯ И ЧЕРЕЗ НЕСКОЛЬКО ДНЕЙ ВЫ ЗАМЕТИЛИ ТЕМНУЮ МОЧУ (КРАСНУЮ) С УМЕНЬШЕНИЕМ ЕЕ КОЛИЧЕСТВА, ИЛИ ЗАМЕТИЛИ ПАСТОЗНЫЕ ВЕКИ ИЛИ ОТЕК ЛИЦА, БЛЕДНОСТЬ С ЖЕЛТУШНОСТЬЮ НЕ ЗАМЕДЛЕТЕЛЬНО ОБРАТИТЕСЬ К ВРАЧУ!
РАЗВЕРНУТАЯ КАРТИНА ГУС
- гемолитическая анемия (снижение гемоглобина, шизоциты)
- тромбоцитопения
- лейкоцитоз
ОПН с повышением уровня сывороточного креатинина и азота мочевины. Приблизительно половина пациентов имеют тяжелую олигурию (снижение количества мочи) или анурию (полное отсутствие мочи), 50-60% нуждаются в остром диализе. При наличии хоть какого-нибудь количества мочи постоянно определяются микро- или макрогематурия (кровь в моче) и протеинурия (белок в моче).
ВНЕПОЧЕЧНЫЕ ОСЛОЖНЕНИЯ
- поражение центральной нервной системы
- поражение желудочно-кишечного тракта (воспаление толстого кишечника – колит и др.)
- отек поджелудочной железы
- поражение печени
- сердечные осложнения
Для уточнения диагноза срочно должны быть проведены соответствующие лабораторные исследования и незамедлительно начать лечение.
ПРОГНОЗ
В большинстве случаев в течение менее чем 1-2х недель исчезают гемолитическая анемия и тромбоцитопения, нормализуется диурез. 10% детей в среднем в течение 4-х месяцев достигают терминальной ХПН. Смертность в основном в результате поражения ЦНС (центральной нервной системы).
СОВЕТЫ РОДИТЕЛЯМ
ПРЕДОТВРАЩЕНИЯ ИНФИЦИРОВАНИЯ STEC (кишечная палочка содержащий шигатоксин) и развития ГУС
- рубленая говядина должна быть хорошо прожарена до приобретения на разрезе серого цвета
- дети до 3 лет не должны употреблять непастеризованные продукты (молоко, сыр, фруктовые соки)
- до приготовления пищи, особенно после манипуляций с рубленой говядиной, необходимо мыть руки
- дети, которые прикасались к крупному рогатому скоту и другим животным, должны после этого умыться, а также перед едой.
- для предотвращения контаминации мяса кишечным содержимым необходим контроль убоя скота. Важен надлежащий надзор и уход за водоснабжения
- антибиотики? Многочисленные исследования показали, что антибиотикотерапия в период диареи увеличивает риск развития ГУС, возможно в связи с освобождением шигатоксина в результате лизиса бактерий. Тем не менее, этот риск пока не доказан.
Для получения больше информации звоните врачам отделения: + 7(499) 134-07-43
Гемолитико-уремический синдром (атипичный и острый) у детей и взрослых
Гемолитико-уремический синдром (гус) – это патологический процесс, который проявляется в виде трех основных симптомов: гемолитическая анемия, при которой наблюдается низкий уровень гемоглобина и склеивание эритроцитов, тромбоцитопения, то есть уровень тромбоцитов резко понижается, и острая почечная недостаточность. Как показывает статистика, синдром проявляется у детей до трехлетнего возраста. У взрослых заболевание развивается очень медленно. К сожалению, в пятидесяти процентах случаев патологический процесс заканчивается летальным исходом.
Если затронуть тему об эпидемиологии, то гус встречается по всему миру. Каждый год от синдрома страдает несколько детей до пятилетнего возраста. Если говорить о сезонной тенденции заболеваемости, то она приходится на теплую пору года, это с июня по сентябрь месяц.
Прежде чем рассмотреть, как лечить гемолитико-уремический синдром, необходимо понять основные причины этого недуга, а также то, как он развивается.
Что приводит к развитию синдрома?
Существуют основные причины развития гемолитико-уремического синдрома, а именно:
- наследственный фактор;
- в качестве осложнения ДВС-синдрома, который, в свою очередь, может быть результатом инфекционных процессов. В этом случае прогнозы наиболее благоприятны;
- осложнение заболеваний соединительной ткани системного характера;
- ВИЧ-инфекция;
- новообразования;
- прием некоторых лекарственных средств;
- осложнение после беременности.
Симптомы
Острый гемолитико-уремический синдром развивается в три основные стадии, к ним можно отнести:
- продромальный период, длительность которого составляет около двух недель;
- разгар патологического процесса – до трех недель;
- реконвалесценция либо летальный исход.
- болезненные ощущения в брюшной полости;
- понос;
- тошнота и рвота;
- лихорадка;
- катаральные явления;
- слабость и апатия;
- появление крови в кале;
- сильное обезвоживание организма;
- сонливость;
- бледность;
- судороги;
- отеки.

В продромальный период резко снижается количество выделяемой мочи
Период разгара развивается таким образом:
- бледность кожных покровов сочетается с желтушностью;
- носовые кровотечения;
- высыпания на коже геморрагического характера;
- вялость и апатия;
- человек может впасть в кому;
- увеличение размеров печени, селезенки, камер сердца;
- нервозность;
- одышка;
- артериальная гипертензия;
- тахикардия;
- в тяжелых случаях наблюдается следующее: отек легких, некроз кишечника, отек мозга, перитонит.
Если говорить о восстановительном периоде, то в пятидесяти-семидесяти процентах случаев наступает нормализация состояния пациента. Постепенно нарушенные функциональные способности органов полностью или хотя бы частично приходят в норму: моча начинает выделяться в полном объеме, а примерно через месяц нормализуется уровень гемоглобина и тромбоцитов.
Диагностическое обследование
Диагностика – это первый этап лечебного процесса при синдроме гассера. Обследование включает в себя следующее:
- общий и биохимический анализ мочи;
- общее исследование мочи;
- гистоморфологическое исследование;
- гемостазиограмма.
Атипичный гемолитико-уремический синдром
Атипичный гемолитико-уремический синдром у детей возникает даже в младенческом возрасте. Прогноз осложнен тем, что не существует лекарственного препарата, который бы со стопроцентной вероятностью избавил от недуга.
Атипичный ГУС является редким системным заболеванием с неблагоприятным прогнозом. Пол, место проживания, раса – все это не влияет на возникновение заболевания. В семидесяти процентах случаев гус развивается ассоциированный с диареей, а у детей старше четырех лет и взрослых встречается синдром, который не связан с развитием диареи.
Заболевание делится на два типа:
- легкая форма. Включает в себя вышеупомянутую триаду симптомов, а также анурию, которая длится более суток;
- тяжелая. В этом случае анурия имеет более длительный характер. Кроме того, появляется судорожный синдром и артериальная гипертензия.

Целью специалистов является выведение человека из почечной недостаточности, если же этого не удается сделать, то пациент погибает
Катализатором развития недуга может послужить банальная диарея или инфекция верхних дыхательных путей. Хотя инфекция при гусе передается от одного человека другому, сам синдром появляется лишь в единичных случаях.
Как утверждают специалисты, часто состояние усугублялось тем, что диарею у детей лечили такими препаратами: гентамицин, амоксициллин, сульфаниламиды. Аутоиммунные процессы также играют важную роль в развитии недуга.
ГУС, ассоциированный с диареей – это типичная форма, а атипичная не связана с кишечными расстройствами. К неинфекционным факторам развития заболевания у взрослых и детей старшего возраста можно отнести следующее:
- употребление кокаина;
- длительное применение оральных контрацептивов;
- пересадка костного мозга;
- системная красная волчанка;
- период беременности;
- онкология;
- склеродермия;
- гломерулонефрит.
Что происходит в организме при ГУС?
После того как человек употребил зараженную пищу или воду, болезнетворный микроорганизм начинает связывать с рецепторами, расположенными в толстой кишке. Далее он размножается и вызывает гибель клеток. В результате возникает диарея, а при поражении кровеносных сосудов слизистой оболочки кишки может возникать геморрагический колит. Проникая в кровоток, токсические вещества, высвобождаемые болезнетворными микроорганизмами, поражают жизненно важные органы и системы.

Часто ставится диагноз «ГУС» с невыясненной этиологией, то есть для врачей причина так и остается неизвестной
Продолжительность заболевания может быть разной, и зависит это во многом от тяжести патологического процесса. Среднетяжелое течение не влияет на суточный диурез и вызывает лишь умеренные нарушения в почках.
Борьба с недугом
Лечение ГУСа включает в себя целый комплекс мероприятий, а именно:
- правильное питание, которое включает в себя высококачественную диету;
- при выраженной анемии переливают эритроцитарную массу;
- перинотальный диализ;
- гемодиализ;
- если речь идет о терминальной стадии, то хронический диализ с перспективой проведения трансплантации почки.
Рассмотрим основные лекарственные средства, назначаемые специалистами:
- гепарин. Он является прямым антикоагулянтом;
- преднизолон. Это системный ГКС;
- дипиридамол является антитромботическим средством.
Если говорить о лечении детей, то им назначается при рвоте и диарее внутривенное введение жидкости. Это необходимо для восстановления водно-электролитного баланса.
Гемотрансфузия назначается в тяжелых случаях при критических анемиях. Стоит отметить, что взрослые гораздо тяжелее переносят данный недуг, и для их лечения нужны более агрессивные методики.

Назначается поддерживающее лечение
Может понадобиться плазмаферез. Как утверждают специалисты, именно химическое вещество, находящееся в плазме, может и вызывать патологическое образование тромбоцитов. Поэтому замещение донорской плазмы поможет устранить проблему. Больным показана консультация нефролога и гематолога.
Лечение при ГУС направлено на достижение следующих задач:
- сохранение гематокрита в приемлемых пределах;
- нормализация электролитов;
- поддержание водного баланса;
- борьба с судорогами и артериальной гипертензией.

При отечном синдроме назначают диуретические средства
Исходы и прогнозы
Исходом острой стадии ГУС при благоприятном течении будет полиурическая фаза острой почечной недостаточности. Длится полиурическая стадия примерно полтора-два месяца. Летальные случаи составляют от пяти до пятнадцати процентов при адекватной помощи, а в слаборазвитых странах этот процент достигает отметки семьдесят.
Если же заболевание имеет наследственный характер, тогда процент летального исхода может достигать девяноста процентов. Причиной смерти у пациентов является поражение центральной нервной системы, а также сердечная и полиорганная недостаточность.
Как показывают исследования пациентов, восстановление функциональной активности почек происходит в семидесяти-восьмидесяти процентах случаев. Сохранение артериальной гипертензии и протеинурии через год после проводимого лечения значительно увеличивает риски возникновения хронической почечной недостаточности.
Как известно, заболевание лучше предотвратить, чем потом его лечить. Что касается профилактики ГУС, то она включает в себя качественную кулинарную обработку пищевых продуктов, особенно это касается мясной пищи. Кроме того, в должной мере должны соблюдаться правила гигиены: тщательное мытье рук с мылом, а также отказ от купания в грязных водоемах. Также профилактика в себя включает уменьшение рисков фекального загрязнения мяса во время и после убоя.
Итак, гемолитико-уремический синдром – это серьезный недуг, который при неграмотном и несвоевременном лечении может привести к летальному исходу. Заболевание возникает как у детей, так и у взрослых, для которых гус будет протекать гораздо сложнее. Заболевание может протекать в типичной или атипичной форме. Лечение включает в себя множество серьезных методик, требующих помощи квалифицированных специалистов.
Гемолитический уремический синдром: Симптомы, Причины развития, Лечение
Гемолитический уремический синдром (ГУС) — это состояние, нарушающее работу эритроцитов и почек. ГУС развивается вследствие инфицирования пищеварительной системы и выделения токсинов, разрушающих эритроциты. Поврежденные клетки впоследствии блокируют фильтрующую систему почек и могут привести к почечной недостаточности.
Что такое гемолитический уремический синдром?
Гемолитический уремический синдром (ГУС) — это состояние, нарушающее работу эритроцитов и почек. ГУС развивается вследствие инфицирования пищеварительной системы и выделения токсинов, разрушающих эритроциты. Поврежденные клетки впоследствии блокируют фильтрующую систему почек и могут привести к почечной недостаточности.
Для диагностирования гемолитического уремического синдрома инфекция должна вызвать 3 нарушения:
- гемолитическую анемию (недостаток эритроцитов)
- тромбоцитопению (недостаток тромбоцитов)
- почечную недостаточность.
Большинство случаев ГУС происходят вследствие инфицирования бактерией E. coli (кишечная палочка). Это одна из наиболее распространенных бактерий, в норме обитающих в пищеварительной системе человека. Однако определенные ее штаммы выделяют токсины, которые уничтожают эритроциты и наносят ущерб почкам.
Заразиться ГУС, в принципе, может любой человек, но чаще всего он встречается у детей и пожилых людей. Во многих случаях инфицирование кишечной палочкой не приводит к развитию гемолитического уремического синдрома.
Симптомы
Первыми симптомами гемолитического уремического синдрома являются рвота и диарея, в некоторых случаях кровавая. Примерно на 5-10 день после начала диареи у ребенка могут появиться симптомы анемии. Анемия развивается из-за недостатка эритроцитов, способных донести кислород до клеток. Ее симптомы включают:
- кровавую диарею
- слабость и апатичность
- раздражительность
- повышенную температуру.
Позже могут проявиться и другие симптомы, а именно:
- бледность кожи
- беспричинное возникновение синяков и кровотечений
- отек лица, рук, ног или другой части тела
- редкое мочеиспускание
- отсутствие мочеиспускания
- судороги (встречается редко).
Если у ребенка наблюдается кровавая диарея на фоне редкого мочеиспускания, необъяснимых гематом, необычного кровотечения или сильной усталости, немедленно вызывайте скорую помощь.
Причины и факторы риска
В большинстве случаев ГУС развивается вследствие инфицирования кишечной палочкой. Произойти это может при:
- Употреблении полусырого говяжьего фарша (к примеру, если котлета для гамбургера была розоватой внутри).
- Употреблении загрязненной воды.
- Употреблении непастеризованного (сырого) молока.
- Употреблении немытых или загрязненных сырых овощей и фруктов.
- Работе с крупным рогатым скотом.
Даже у здоровых представителей мясного и молочного скота могут переносить кишечную палочку в пищеварительной системе. При забивании животных и перекручивании мяса в фарш бактерия может легко попасть в продукт. Как правило, термическая обработка (приготовление) убивает опасные микроорганизмы.
Самым распространенным способом инфицирования является употребление в пищу полусырого фарша. Случиться это может из-за недостаточно высокой температуры или недостаточного времени приготовления. Когда вы употребляете полусырое мясо, бактерии попадают в желудок и кишечник.
Пруды и озера также могут быть загрязнены кишечной палочкой. Если вы контактировали с такой водой, возможно инфицирование. Иногда загрязненную воду используют для орошения посевов, тем самым повышая риск заражения овощами и фруктами.
Также бактерии могут передаваться при прямом контакте от одного человека к другому в домах престарелых и детских садах. При инфицировании тщательно мойте руки с мылом после посещения туалета. В противном случае вы можете заразить других людей при контакте с различными объектами, особенно с пищей.
К менее распространенным причинам ГУС относятся прием определенных препаратов, некоторые инфекции и беременность.
Диагностика
Врач проведет осмотр и назначит сдачу анализов, в частности, крови и мочи. Эти анализы покажут наличие признаков анемии и почечной недостаточности. К более сложным процедурам относятся анализ кала и почечная биопсия.
Профилактика
Если вы или ваш ребенок инфицированы кишечной палочкой, вы уже ничего не можете сделать для предотвращения развития вашего состояния в ГУС. Поэтому ключевым аспектом профилактики является избегание инфекции. Для снижения риска:
- Тщательно мойте руки с мылом перед началом приготовления пищи.
- Готовьте мясной фарш до того момента, пока в нем не останется розовых вкраплений.
- Не пробуйте фарш в процессе приготовления.
- Не кладите готовые котлеты на поверхность, где до этого лежал сырой фарш.
- Температура приготовления мясного фарша должна составлять не менее 70°С. Для удобства применяйте мясной термометр.
- В ресторанах заказывайте только тщательно прожаренные котлеты и стейки, в которых нет розовых вкраплений.
- Размораживайте мясо в холодильнике или микроволновой печи. Не кладите мясо для разморозки на столешницу при комнатной температуре.
- Храните сырое мясо и дичь отдельно от других продуктов. Для мытья разделочных досок и тарелок, контактировавших с сырым мясом и дичью, используйте горячую воду и мыло.
- Тщательно мойте чистой водой все фрукты и овощи перед употреблением.
- Пейте только очищенную воду.
- Не пейте сырое молоко.
- Либо замораживайте остатки пищи сразу же, либо выбрасывайте их.
- При диарее необходимо часто мыть руки горячей водой с мылом на протяжении как минимум 30 секунд.
- Люди, работающие в детских садах и домах престарелых, также должны регулярно мыть руки.
- Откажитесь от купания в грязных озерах и реках. Не купайтесь при диарее.
- Тщательно мойте руки после контакта с сельскохозяйственными животными.
В группу повышенного риска входят дети до 5 лет и пожилые люди старше 75 лет.
Лечение
У большинства людей инфицирование кишечной палочкой не разовьется в гемолитический уремический синдром. Если это все же произошло, вам необходима госпитализация. Врач проверит функцию почек и убедиться в отсутствии обезвоживания.
Вот лишь некоторые методы лечения для детей и взрослых людей:
- Переливание эритроцитов для обращения симптомов.
- Переливание тромбоцитов для нормализации свертывания.
- Диализ при почечной недостаточности. В рамках этой процедуры специальное устройство выводит шлаки из крови. В то же время, диализ показан лишь при очень тяжелых формах гемолитического уремического синдрома, и обычно он требуется лишь временно. Однако при существенном и необратимом повреждении почек проведение этой процедуры может растянуться на длительное время.
Последствия
Большинству людей с диагностированным гемолитическим уремическим синдромом удается в результате полностью восстановиться от болезни. В то же время, это довольно тяжелая инфекция. Если почкам был нанесен существенный ущерб, вам или вашему ребенку могут потребоваться регулярные переливания или диализ. Без должного лечения ГУС может привести к смерти. Коэффициент смертности вследствие этой болезни среди детей ниже, чем среди взрослых людей.
Вопросы, которые следует задать врачу
- Каким образом я заразился кишечной палочкой?
- Нужно ли мне принимать препараты?
- Нужен ли мне диализ?
- Нужно ли проверить остальных членов семьи на предмет возможного инфицирования?
- Может ли заболевание нанести необратимый ущерб почкам?
- Какие изменения в рационе мне необходимо внести?
- Я работаю в детском саду. Нужно ли сообщить руководству о том, что я инфицирован кишечной палочкой?
- Нужно ли полностью отказаться от употребления фарша?
- Как часто следует мыть руки?
 Loading…
Loading…у взрослых, детей и беременных
 Гемолитико-уремический синдром характеризуется поражением почек, появлением анемии и тромбоцитопении.
Гемолитико-уремический синдром характеризуется поражением почек, появлением анемии и тромбоцитопении.
Данная патология протекает тяжело, особенно у взрослых пациентов.
Риск заболеть существует у любого человека.
По этой причине каждому потенциальному пациенту, особенно родителям маленьких детей, необходимо иметь представление об этиологических факторах, симптоматике и методах профилактики данного заболевания.
Содержание статьи
Общая информация
 Гемолитико-уремический синдром, или болезнь Гассера, в большинстве случаев поражает детей младше 5 лет.
Гемолитико-уремический синдром, или болезнь Гассера, в большинстве случаев поражает детей младше 5 лет.
Заболевание в основном диагностируется в летний период по всему земному шару.
Гемолитико-уремический синдром характеризуется наличием 3 симптомов – тромбоцитопения в общем анализе крови, почечная недостаточность, гемолитическая анемия.
Причины возникновения
 Острые кишечные инфекции являются самыми частыми причинами развития заболевания, особенно у детей. Этиологическим фактором могут выступать инфекции органов дыхания, но диагностируется подобное достаточно редко.
Острые кишечные инфекции являются самыми частыми причинами развития заболевания, особенно у детей. Этиологическим фактором могут выступать инфекции органов дыхания, но диагностируется подобное достаточно редко.
У пациентов взрослого возраста заболевание развивается на фоне патологий неинфекционного характера: например, на фоне приема некоторых лекарственных препаратов (иммунодепрессантов), в период беременности, в результате трансплантации органов.
Патология способна ассоциироваться с гломерулонефритом, ревматическими и опухолевыми болезнями.
Чаще всего гемолитико-уремический синдром обусловлен веротоксином, который вырабатывается особым видом кишечной палочки. Данный токсин способен ассоциироваться с клетками сосудов почек. Возникает воспалительный процесс, клетки гибнут, что приводит к гибели тромбоцитов и эритроцитов.
На стенках сосудов происходит отложение фибрина, это является причиной микротромбозов.
Гибель сосудов почек приводит к ишемии органа и нарушению его функционирования.
Именно так выглядит патофизиологический механизм болезни Гассера.
Важно отметить, что веротоксин — самая частая причина заболевания, но не единственная. Кроме него, болезнь Гассера может быть спровоцирована токсином бактерий из рода шигелл, стрептококков. Любой агент, способный разрушать почечную ткань, способен вызывать данную патологию.
Классификация заболевания
Гемолитико-уремический синдром классифицируется по нескольким признакам. Выглядит это следующим образом:
 Инфекционный и неинфекционный в зависимости от причины развития.
Инфекционный и неинфекционный в зависимости от причины развития.- Ассоциированный или неассоциированный с диареей. Первая разновидность называется типичной, вторая – атипичной. Типичная форма заболевания обычно диагностируется у детей первых лет жизни и на определенной территории (средняя полоса России). Атипичная болезнь Гассера характерна для более старших детей, подростков и взрослых. Связи с определенной территорией не существует.
- По характеру течения выделяют гемолитико-уремический синдром легкой, средней и тяжелой степени. Классификация зависит от клинической симптоматики патологии. Для легкого течения характерно наличие 3 классических симптомов. При форме средней степени тяжести отмечается наличие повышения артериального давления, появления судорог. При тяжелом течении заболевания к перечисленным выше симптомам присоединяется задержка мочи.
Важно отметить, что гемолитико-уремический синдром может быть идиопатическим, то есть причина остается невыясненной. Также предрасположенность к данной патологии передается по наследству.
Особенности у взрослых
У пациентов взрослого возраста болезнь Гассера нечасто обуславливается острыми кишечными инфекциями. Обычно она развивается в результате наличия вируса иммунодефицита, приема некоторых лекарственных средств, на фоне системных и опухолевых заболеваний. Прогноз в таких случаях неблагоприятный.
У детей
У пациентов детского возраста заболевание в большинстве случаев развивается в результате острых кишечных инфекций.
Заражение происходит после употребления в пищу недостаточно прожаренного мяса, не прошедших пастеризацию молочных продуктов, неочищенной воды.
Отмечается, что у детей гемолитико-уремический синдром во многих ситуациях рассматривается как отдельная нозологическая единица, в то время как у взрослых патология развивается как проявление других заболеваний.
У беременных
Беременность является предрасполагающим фактором к возникновению данной болезни. Клинически это проявляется эклампсией и угрозой выкидыша. Проблема устраняется проведением родоразрешения. После родов патология может проявляться тяжелой почечной недостаточностью, эмболией, сепсисом.
Проявление клинической картины
Симптомы гемолитико-уремического синдрома имеет характерные черты. Выглядит следующим образом:
 В течении заболевания выделяется продромальный период, длительность которого может составлять до 14 дней (в большинстве случаев – 7 суток). Под данным термином подразумевается время от проникновения возбудителя в организм до появления первых клинических симптомов. В продромальный период может наблюдаться единичный эпизод кровавой диареи.
В течении заболевания выделяется продромальный период, длительность которого может составлять до 14 дней (в большинстве случаев – 7 суток). Под данным термином подразумевается время от проникновения возбудителя в организм до появления первых клинических симптомов. В продромальный период может наблюдаться единичный эпизод кровавой диареи.- Постепенно у пациентов появляются жалобы на появление общей слабости, достаточно часто происходит повышение температуры тела. Кожный покров становится бледным, наблюдается отечность нижних конечностей. Диагностируется уменьшение количества выделяемой мочи, наблюдается повышение артериального давления.
- Затем присоединяются симптомы, характерные для острых кишечных инфекций, — тошнота, рвота, боли в животе, кровавая диарея.
- При тяжелом течении заболевания происходит нарушение функционирования большого числа органов. У пациентов могут диагностироваться судороги, аритмии, гепатит, панкреатит, перфорации стенок кишечника. Заболевание способно осложняться отеком легких и головного мозга, различными кровотечениями, хронической почечной недостаточностью.
- Анемия возникает внезапно, способна в течение короткого времени достигать критично низких показателей. Тромбоцитопения может приводить к мелким точечным кровоизлиянием, но обычно она быстро проходит.
Средняя продолжительность болезни Гессера составляет 10-14 дней. Показатель зависит от тяжести течения. Восстановление организма происходит медленнее, в течении полутора месяцев.
Диагностические меры
 Пациенту важно обратиться вовремя к врачу. Это может быть терапевт или педиатр, уролог, гастроэнтеролог, инфекционист. Любой врач может определить заболевание и отправить больного на госпитализацию. Алгоритм диагностики:
Пациенту важно обратиться вовремя к врачу. Это может быть терапевт или педиатр, уролог, гастроэнтеролог, инфекционист. Любой врач может определить заболевание и отправить больного на госпитализацию. Алгоритм диагностики:
- проводится общий осмотр пациента с анализом жалоб и сбором анамнеза;
- в общем анализе крови диагностируется анемия, эритроциты разной формы и содержат в себе различные включения, показатель тромбоцитов ниже нормы, лейкоцитов – выше;
- в биохимическом анализе крови отмечается увеличение количества билирубинов, мочевины, креатинина, происходит нарушение водно-электролитного баланса;
- моча приобретает мутный оттенок, в ней могут находиться примеси в виде крови, диагностируется высокое содержание белка;
- обязательно поведение бактериологического посева каловых масс с целью определения возбудителя.
Важно отметить, инструментальная диагностика зависит от характера осложнений.
Пациентам может понадобиться проведение электрокардиографии, ультразвукового исследования сердца или брюшной полости, компьютерная или магнитно-резонансная томография.
Методы терапии
Лечение гемолитико-уремический синдром зависит от характера течения патологии. Важно обратиться к врачу как можно раньше, это обеспечит успешное выздоровление и убережет от развития тяжелых осложнений.
Медикаментозные способы
 Во время терапии происходит контроль гематокрита. Для этого нередко требуется переливание эритроцитарной массы. Также проводится лечение антиагрегантными препаратами (гепарином). Для улучшения периферического кровообращения пациентам назначается пентоксифиллин.
Во время терапии происходит контроль гематокрита. Для этого нередко требуется переливание эритроцитарной массы. Также проводится лечение антиагрегантными препаратами (гепарином). Для улучшения периферического кровообращения пациентам назначается пентоксифиллин.
Для лечения используются растворы, нормализующие водно-электролитный баланс организма. Также вводятся витамины А и Е.
Многие пациенты нуждаются в проведении плазмефереза и гемодиализа, которые позволяют избавиться от токсических продуктов обмена веществ.
Для устранения отеков используются мочегонные препараты, учащенного сердцебиения – бета-блокаторы. С целью снизить давление назначаются препараты, содержащие нитропруссид натрия.
Обязателен постоянный контроль показаний артериального давления.
Если врачам удается определить возбудителя, проводиться исследование на антибиотико-чувствительность, на основе результатов которого назначается соответствующая терапия.
Лечение детей и беременных
Принципы лечения детей не имеют существенных отличий от таковых у взрослых. Разница состоит в дозировках используемых лекарственных средств.
Что касается беременных, вопрос более сложный. В большинстве случаев необходимо проводить родоразрешение, поскольку консервативная терапия в редких случаях оказывается эффективной.
Народная медицина
Не существует методов народной медицины, которые способны бороться с гемолитико-уремическим синдромом. Пациентам необходимо как можно быстрее обратиться к врачу и не заниматься самолечением.
Только после выздоровления для нормализации функции почек можно принимать курсами урологические фитосборы, которые обладают противовоспалительным и антисептическим действиями.
Диетические предписания
В период лечения и восстановления пациентам важно соблюдать специальную диету. Необходимо исключить из рациона соль.
Питаться нужно продуктами с высоким содержанием белка – куриное и говяжье мясо, молочные изделия, гречневая крупа, определенные сорта рыбы. Прием пищи должен быть небольшими порциями, 5 раз в день.
Прогноз и профилактика
Заболевание очень серьезное, способно привести к летальному исходу. Чем раньше пациент обратился к врачу, тем лучше для него. Среди детей смертность составляет около 5%, некоторые приобретают нарушение функционирования почек.
У взрослых прогноз неблагоприятнее, поскольку гемолитико-уремический синдром является проявлением других заболеваний, что отражается на его течении (часто диагностируется тяжелая форма).
Профилактика патологии сводится к соблюдению всех правил личной гигиены, обязательно мыть руки перед едой. Продукты должны проходить тщательную термическую обработку, овощи и фрукты необходимо хорошо мыть.
Гемолитико-уремический синдром является очень серьезной патологией, способной приводить не только к почечной, но и полиорганной недостаточности. Поэтому важно выполнять все рекомендации по гигиене питания и в случае подозрений на заболевание немедленно обращаться за медицинской помощью.
что это такое, у детей, взрослых, симптомы, лечение
Гемолитико-уремический синдром, который известный многим специалистам как болезнь Гессера, может проявляться в виде острого гемоколита, спровоцированного микроангиопатической анемией, болезнью тромбоцитопения или же почечной дисфункцией. Согласно статистике, этот недуг встречается среди малышей в возрасте от 1 до 4 лет в 2-3 случаях на 100 000 в год. Гемолитико-уремический синдром у детей от 4-х и до 18 лет проявляется в 1-2 случаях на 100 000. Полное или частичное восстановление функции почек наблюдается только в 70% случаях. При наличии наследственной или спорадической болезни Гессера, прогноз, как правило, плачевный: в 25% — летальный исход, в 50%случаев может происходить отек головного мозга.
У маленьких детей грудного возраста этот недуг проявляется как четко приставленное заболевание. Гемолитико-уремический синдром у взрослых может провоцировать различные симптомы.
Характеристика
Сегодня мнения большинства докторов сходятся в том, что болезнь Гессера характеризуется поражением организма в трех направлениях. Как уже выше упоминалось, гемолитико-уремический синдром может проявляться в виде:
- Гемолитической анемии. Начинается распад эритроцитов в крови.
- Тромбоцитопении. Может возникать множество кровотечений.
- Уремии. Проявляется острая почечная недостаточность.
Как правило, гемолитико-уремический синдром у детей выражена уремией, которая со временем проходит. После выздоровления, малышам необходимо регулярно проходить особую поддерживающую терапию, для того, чтобы избежать осложнений.
У детей постарше, ремиссия вряд ли наступит без специального лечения. В некоторых случаях, гемолитико-уремический синдром может провоцировать поражения сосудов человека. В результате этого, болезнь еще больше усугубляется.
 Поражение сосудов крови
Поражение сосудов кровиПричины
К большому сожалению, на сегодня, специалисты не могут, точно назвать основной причины возникновения недуга Гессера, который поражает множество участков организма.
Мнения многих специалистов сошлось в том, что болезнь Гессера может быть спровоцирована как вирусными инфекциями, так и неинфекционными возбудителями. В первом случаи, внутрь нашего организма попадают специфические бактерии, которые могут провоцировать различные расстройства желудка. Например, диарею. В ответ, реагирует наша иммунная система вследствие чего, и возникают симптомы заболевания Гессера.
Иные случаи, которые не связанные с попаданием этих бактерий внутрь нашего организма относятся к неинфекционным. Как правило, симптомы гемолитико-уремический синдрома могут возникнуть как побочный эффект от некоторых препаратов, иногда при беременности или проявиться как сопутствующий недуг какого-то другого заболевания. Также заболевания может передаваться и наследственно.
В медицине принято выделять две формы прохождения болезни Гессера:
- Типичное развитие. Характеризуется расстройствами желудка. Как правило, такая форма течения спровоцирована кишечной палочкой (Escherichia coli), анабиозом (Shigella dysenteriae), бактерия Френкеля (Streptococcus pneumoniae).
- Атипичное развитие. Диарея для этого случая – не характерна. Развития болезни спровоцировано приемом противоопухолевых лекарств, разных иммунодепрессантов. Также атипическое развитие болезни Гессера, может проявиться во время беременности или же после нее. Симптомы гемолитико-уремического синдрома при атипичной форме проявляются и больных на ВИЧ, красную волчанку, склеродермию и других. Как правило, этот недуг свидетельствует об осложнении основного заболевания. Проявляется в виде кровавого поноса, кровь в кале. По статистике атипичная форма болезни встречается достаточно редко, только у 10% от всех случаев.
Патогенетические свойства
Что же происходит после того как внутрь организма попала бактерия? Как иммунная система реагирует на раздражитель? Давайте поэтапно рассмотрим, что и зачем происходит внутрь нашего организма.
После попадания в организм кишечная палочка или бактерия Френкеля может провоцировать образования огромного количества веротоксина. В результате его накопления и размножения в желудке или толстой кишке может возникать диарея. Происходит деформация эндотелиальных клеток. Вследствие чего токсин попадает в печень, где происходит он метаболизируется.
Затем болезнь, словно по мишеням внедряется и в другие органы. Как правило, печень или легкие. В результате патологического процесса происходит свертывания крови в полости сосудов, тромбоциты соединяются в кучки, и происходит агрегация. На этом фоне их количество значительно падает.
Опасность таких процессов заключается в том, что может возникнуть ишемия сосудов в поврежденных или даже здоровых органах, которая приводит к опасным состояниям больного. В результате свертывание крови в сосудах, капилляры сужаются, и возникает нарушения нормальной работы почек. Под угрозой также могут быть легкие, сердце, печень или даже мозг. Это спровоцировано сбоем прохождения эритроцитов по нитям фибрина в крови у поврежденных сосудов.
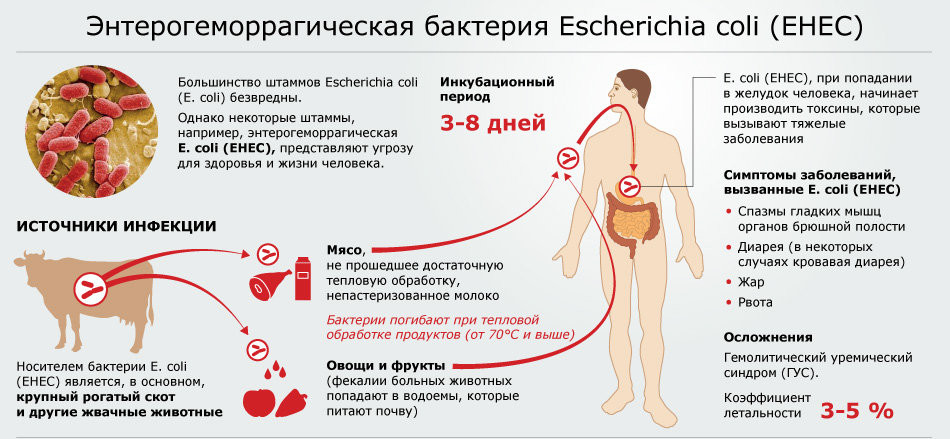 Механизм попадания кишечной палочки в организм
Механизм попадания кишечной палочки в организмПрогресс атипичной формы болезни Гессера происходит из-за нарушения работы системы комплимента, которая входит в состав иммунной системы и защищает наше тело от чужеродных бактерий.
Когда недуг поражает наш организм, происходит дисфункция этой системы, проявляется значительное повреждение эндотелия. В результате чего иммунная система начинает уничтожать здоровые органы. Из-за беспрерывной активации тромбоцитов возникает тромбообразование и сбой в работе поврежденных органов.
Стадии и симптомы
Симптомы и лечение гемолитико-уремического синдрома у детей и взрослых значительно отличается. Это можно объяснить тем, что у ребятишек 4-10 лет недуг выражается в типичной форме, а у взрослых, как правило, прогрессирует как атипичная.
На начальных стадиях у больных наблюдается острая диарея, которую вызывает кишечная палочка. Не взирая на лечения болезни, самочувствие больного не улучшается. У детей поднимается температура тела, и присутствует чувство хронической усталости. Их кожа приобретает бледноватый оттенок, в некоторых случаях — желтоватый.
У ребенка значительно уменьшается количество мочи. В результате чего возникает сильный отек в районе век или голеней. Появляется сбой в работе центральной нервной системе. Могут возникать судороги. Затем, под воздействия этого патологического процесса, втягиваются и остальные органы. Необходимо, как можно быстрее, провести специальную терапию.
В некоторых случаях, гемолитико-уремический синдром может пройти самостоятельно, без дальнейшего проявления, и полного излечения почек. Как правило, это может, происходит у маленьких детей или младенцев. Но все же не стоит забивать о лечении, ведь запущенная форма болезни может привести к непоправимому исходу.
Как правило, атипическое протекания гемолитико-уремического синдрома проявляется серьезными симптомами и бурным течением. После диареи и общей слабости на протяжении 6 дней наблюдается значительное уменьшение оттока мочи, неврологические осложнение, гипертензия, отек ног, и т.д.
В некоторых случаях. недуг может поражать сердечно-сосудистую систему или даже желудочно-кишечную, провоцируя аритмии, инфаркт сердца. Но практически всегда болезнь образовывает дисфункцию почек, и, невзирая на лечения, в большинстве случаев, развивается почечная недостаточность.
 Общее ухудшение самочувствия
Общее ухудшение самочувствияДиагностика
Диагностику проводят, опираясь на результаты анализов крови и мочи, которые сопоставляют из выявленными симптомами.
Опасаться стоит, если у вас выявили:
- В моче кровь или же белок.
- Гемолитическую анемию.
- Уремию.
- Патогенные бактерии в кале.
Параллельно к этому специалисты изучают общее состояния больного. Сложность заключается в дифференциации атипичной формы недуга ввиду того, что может проявляться смешанность симптомом и других болезней.
Лечение
Независимо от формы развития болезни, необходимо провести специальную поддерживающую терапию. С ее помощью происходит сохранения количества эритроцитов в крови, поддерживаются показатели электролитов. После проведенной терапии приходит в норму водный баланс в организме, исчезают судороги и гипертензия.
В тяжелых случаях доктор может назначить гемодиализ, выписать много мочегонных препаратов и прописать специальную высококалорийную диету с минимальным количеством соли.
Профилактика
Профилактика гемолитико-уремический синдрома возможна только для типичной формы. В первую очередь нужно придерживаться правил личной гигиены. Не рекомендуется купаться в сомнительных водоемах. При готовке мясных продуктов необходимо придерживаться технологии их обработки.
Прогноз ГУС
Делать положительный прогноз при гемолитико-уремического синдрома можно только после проведенной терапии. Как правило, для маленьких детей, в которых болезнь спровоцирована кишечной бактерией, — прогноз х, в большинстве случаев, хороший. Но, тем не менее, необходимо контролировать показатели артериального давления и вовремя сдавать анализы мочи, кала и крови.
У многих развитых странах выздоровления у пациентов (старше 18 лет) с типичной формой, можно наблюдать у 90% случаев. Прогноз при атипичных формах все же остается негативным. Если болезнь передалась наследственно, то летальный исход наступает практически у 90% случаев.
К большому сожалению, пациенты, выздоровевшие после гемолитико-уремического синдрома, умирают на протяжении 2-3 лет в 80%случаев из-за проблем с почками.
Современные представления об атипичном гемолитико-уремическом синдроме — Норильская межрайонная детская больница
А.В. Попа, В.И. Лифшиц, ХМ. Эмирова, Т.Ю. Абасеева, Д.В. Зверев, Т.Е. Панкратенко
В настоящее время гемолитико-уремический синдром (ГУС) является основной причиной острой почечной недостаточности (ОПН) у детей в возрасте младше 5 лет. Несмотря на то, что с момента описания ГУС Гассером прошло более 50 лет, вопросы этиологии, патогенеза, диагностики и лечения ГУС остаются до настоящего времени недостаточно изученными и практически важными для клинической педиатрии. Исследования последнего десятилетия доказывают, что в основе механизма повреждения клеток эндотелия сосудов лежит чаще всего генетически обусловленная разбалан-сировка системы комплемента, что приводит к ее резкой активизации. Лечение атипичного ГУС остается малоэффективным. Прогноз, по-прежнему, неблагоприятен.
В настоящее время гемолитико-уремический синдром (ГУС) является основной причиной острой почечной недостаточности (ОПН) у детей в возрасте младше 5 лет. До настоящего времени вопросы этиологии, патогенеза, диагностики и лечения ГУС остаются недостаточно изученными и важными для клинической педиатрии.
Выделяют типичный или постдиарейный ГУС (Stx-HUS) и атипичный ГУС (аГУС; Non-Stx-HUS). Если результаты лечения типичного ГУС успешны, то последствия атипичного ГУС остаются весьма неблагоприятными [1].
Non-Stx-HUS (аГУС) относится к группе тромботических микроангиопатий (ТМА), при которой почки являются основной мишенью в результате массивного повреждения эндотелия сосудов. Заболевание характеризуется микроангиопатической гемолитической анемией (МАГА) с тромбоцитопенией и почечной недостаточностью и отличается от Stx-HUS возрастом пациентов (<6 месяцев и >5 лет). Дебют аГУС может напоминать классическую тромботическую тромбоцитопеническую пурпуру (ТТП) — заболевание, при котором комбинация ТМА с тромбоцитопенией нередко сочетается с неврологическими симптомами, но обычно менее тяжелым поражением почек.
Развитие ТТП связывают с дефицитом протеазы фактора фон Виллебранда (ADAMTS 13), чаще в результате наличия антител, реже врожденной недостаточности энзима. Атипичный ГУС встречается в 5-10% от всех случаев ГУС, относится к тяжелым состояниям, склонным к рецидивам, с высокой летальностью и реальным риском развития терминальной стадии хронической почечной недостаточности (тХПН) [2, 3].
Несмотря на многообразие классификаций ГУС, в последнее время широко используется вариант, учитывающий отношение к шига-токсину (табл. 1) [1].
Симптомокомплекс аГУС имеет мультифакториальную природу, включая различные возбудители, не продуцирующие шигатоксин, а также вирусы, лекарственные препараты, злокачественные новообразования, трансплантацию, беременность, склеродермию, волчанку, антифосфолипидный синдром. Диарея у этих пациентов встречается редко. Результаты лечения этих форм неудовлетворительны. По разным данным, аГУС в 25% случаев заканчивается летально, в 50% — развивается тХПН или необратимое поражение ЦНС [4-7].
Спорадическая форма аГУС, развившаяся на фоне инфекции Streptococcus pneumonia, составляет около 40% случаев non-Stx-HUS и 4,7% всех случаев ГУС у детей в США [6]. Фермент нейраминидаза, продуцируемый S. pneumonia, удаляет сиаловые кислоты с клеточных мембран и обнажает антиген Thomsen-Friedenreich, тем самым, обеспечивая воздействие на него циркулирующих IgM, что приводит к агрегации тромбоцитов и повреждению эндотелия [8, 9]. Это тяжелое заболевание, сопровождающееся респираторным дистресс-синдромом, тяжелыми неврологическими расстройствами, при котором летальность достигает 50% [9].
Описано развитие non-Stx-HUS, вызванное противоопухолевыми (митомицин, цисплатин, блеомицин, гемцитабин), иммуносупрессивными (циклоспорин А, такролимус, ОКТЗ, хинидин) и антитромбоцитарными (тиклопидин, клопидогель) препаратами [10].
В литературе имеются сообщения о двух видах посттрансплантационного ГУС [2, 11]. Один из них возникает у пациентов впервые (de novo), другой — с тХПН, развившейся в результате перенесенного ГУС. Причинами развития посттрансплантационного ГУС, возникшего de novo, может служить применение ингибиторов кальцинейрина или отторжение по гуморальному типу (С4Ь-поло-жительное). Эта форма ГУС после трансплантации почки возникает у 5-15% пациентов, получающих циклоспорин А, и у 1% пациентов, получающих такролимус [12].
На фоне беременности при преэклапсии как осложнение могут развиться ГУС и поражение печени (HELLP-синдром), что служит показанием к экстренному родоразрешению, после которого наступает полная ремиссия [13]. Послеродовый ГУС, как правило, развивается в первые 3 месяца после родов. Летальность при этой форме составляет 50-60% [14].
Семейные формы аГУС составляют менее 3% всех случаев. Существует аутосомно-доминантная и аутосомно-рецессивная формы наследования [15]. При аутосомно-рецессивной форме аГУС дебютирует в раннем детском возрасте с рецидивирующим течением и высокой летальностью -60-70%. При аутосомно-доминантной форме в большинстве случаев заболевание начинается во взрослом возрасте, прогноз также неблагоприятный. Общий показатель смертности и тХПН составляет от 50 до 90% [15, 16].Около 50% случаев спорадического аГУС не позволяют обнаружить явного пускового момента (идиопатический ГУС) [2].
Патогенез
Исследованиями последнего времени документально подтверждено, что аГУС связан с генетическими нарушениями системы комплемента [5] (табл. 2).
Первые сообщения в мировой литературе о роли в патогенезе аГУС третьего компонента комплемента (СЗ) при семейной и спорадической формах появились еще в 1974 г. [16, 17]. Низкий уровень СЗ отражает его повышенное потребление в микроциркуляторном русле, что подтверждается обнаружением гранулярных отложений СЗ в клубочках и артериолах [18, 19]. Четвертая фракция комплемента (С4) находится в пределах нормы [16]. Описано снижение СЗ у здоровых родственников пациентов, страдающих семейным аГУС, что свидетельствует о наличии врожденного дефекта, приводящего к повышенной активации комплемента [16].
Выделяют три пути активации комплемента: классический, лектиновый и альтернативный (см. рисунок) [20, 21].
Поверхностные молекулы микроорганизмов активируют эти механизмы с образованием комплексов протеаз и СЗ конвертаз, расщепляющих СЗ до СЗЬ. Классическая и лектиновая конвертазы образуются из фрагментов С2 и С4, а конвертаза альтернативного пути требует СЗ. В случаях с низким уровнем СЗ и нормальным уровнем С4, которые чаще всего встречаются у пациентов с аГУС, можно сделать вывод об альтернативном пути активации комплемента у этих больных [16].
Альтернативный путь требует непрерывного контроля активности, так как находится в состоянии постоянной аутоактивации. Последовательность протеолитических шагов, вовлекающих СЗ, факторы В и D, усиливает активацию комплемента. Активация С5 приводит к образованию мембраноатакующего комплекса и лизису клетки. Активация контролируется ингибиторными белками, фактором Н и мембрано-связанным кофакторным протеином (МСР, известного как CD46). Фактор I является сериновой протеазой, которая инактивирует СЗЬ и С4Ь с кофакторами фактором Н и С4Ь-связывающим протеином. Нарушения были описаны в генах для большинства компонентов (фактор Н — у 30% больных, CD46 — у 10-15%, фактор I — в 10% случаев, фактор В, СЗ, фактор Н-связанные белки 1-5, тромбомодулин).
В 1998 г. P.Warwicker и соавт. [22] опубликовали результаты развития аГУС в трех семьях из-за связи с кластером генов на хромосоме Iq32, кодирующих ряд регуляторных белков комплемента. Первым изученным геном этого участка хромосомы стал фактор Н (HFI) [23, 24]. Фактор Н является мультифункциональным одноцепочечным гликопротеином плазмы крови с молекулярной массой 150 кДа, играет важную роль в регуляции альтернативного пути активации комплемента. HFI служит кофактором для фактора I (FI), регулирующего деградацию вновь образованных молекул СЗЬ, и контролирует разрушение, образование и стабильность СЗЬ-конвертазы (СЗЬВЬ).
В результате вирусной или бактериальной инфекции повреждается эндотелий сосудов с активацией комплемента и образованием СЗЬ. В случае отсутствия мутации HFI превращает СЗЬ в неактивную форму iC3b. В субэндотелиальном матриксе отсутствуют регуляторы комплемента, поэтому контроль за активацией комплемента в этой структуре полностью зависит от HFI. В инактивации СЗЬ участвует и МСР, расщепляя его до iC3b под действием FI [25, 26].
Мутантный HFI обладает нормальной кофакторной активностью в жидкой фазе. Однако мутация затрагивает участок взаимодействия с полианионами на С-конце HFI, что приводит к снижению способности данного фактора к связыванию с протеогликанами на поверхности эндотелиальных клеток и в субэндотелиальном матриксе. Тем самым увеличивается количество СЗЬ, получающего доступ к поверхности эндотелиальных клеток, так что концентрация МСР становится недостаточной для адекватного контроля активности комплемента на клеточной мембране. Кроме того, СЗЬ, откладываемый на обнаженном внеклеточном матриксе, не разрушается и образует СЗ-конвертазу альтернативного пути активации комплемента, усиливающую расщепление СЗ с образованием СЗЬ [25, 26].
Тогда как большинство мутаций приводят к дефектной функции регуляторных белков, мутации с усилением функции приводят к сверхактивации этого пути (суперфактор В). Мутантный фактор В приобретает способность связываться с инактивированным СЗЬ, что дает совершенно новый функциональный iC3Bb (СЗ конвертаза). Таким образом, даже если клеткам хозяина удалось заполучить фактор I для инактивации по¬верхностных отложений СЗЬ, мутантный фактор В будет использовать инактивированный СЗЬ для дальнейшей активации комплемента, приводя к клеточному повреждению [26].
В детском возрасте встречается и так называемый DEAP-HUS (Дефицит фактор Н-связанных плазменных белков и аутоантитело позитивная форма гемолитико-уремического синдрома), ключевыми признаками которого является наличие аутоантител к фактору Н и отсутствие фактор Н-связанных белков 1 и 3, обусловленное делецией 84-kbp фрагмента хромосомы 1. Лечение этого вида ГУС основывается на снижении титра антител с использованием плазматерапии, стероидов и иммуносупрессии.
Дефицит МСР также предрасполагает к развитию аГУС. Мутации МСР приводят к снижению поверхностной экспрессии или способности связывать СЗЬ. В обоих случаях мембраносвязанный СЗЬ инактивируется малоэффективно, что вызывает недостаточное усиление образования СЗЬ и отложение его на поврежденные эндотелиальные клетки посредством образования СЗ-конвертазы [25, 26].
В последнее время описывают еще один механизм регуляции активации комплемента — это мутации гена МСР, кодирующего мембранный кофакторный белок — связанный с клеткой регулятор комплемента [27, 28]. МСР является широко распространенным трансмембранным гликопротеином, выполняющим функцию кофактора для FI, расщепляющего СЗЬ и С4Ь на поверхности клеток хозяина [29-32]. В почках отмечается высокий уровень МСР, который обнаруживается на поверхности эндотелиальных клеток почечных клубочков [33-35]. По-видимому, МСР играет основную роль в защите гломерулярного эндотелия от активации СЗ. В настоящее время при аГУС изучается роль тромбомодулина-эндотелиального гликопротеина, обладающего антикоагулянтной, противовоспалительной и цитопротективной активностью.
In vitro тромбомодулин связывает СЗЬ и HFI, ингибируя активность комплемента и усиливая FI-обусловленную инактивацию СЗЬ в присутствии кофакторов — HFI и С4Ь-связывающего белка. Способствуя активации плазменной прокарбокси-пептидазы В, тромбомодулин усиливает инактивацию анафилатоксинов СЗЬ и С5а. Мутантный тромбомодулин обладает сниженной активностью к инактивации СЗЬ и в меньшей степени защищает от безудержной активации комплемента. По полученным данным, нарушение функции тромбомодулина встречается у 5% больных с аГУС [36].
Клиническая картина
ГУС клинически проявляется неиммунной МАГА, тромбоцитопенией и ОПН. Stx-HUS, как правило, развивается на исходе инфекционного гастроэнтероколита [2]. Средний промежуток времени между проникновением в организм инфекционного агента и развитием инфекционного процесса составляет от 1 до 8 суток [1, 37]. Кишечная инфекция манифестирует болями в животе, жидким водянистым стулом, часто со слизью и зеленью, в 70% случаев через 1-2 суток развивается гемоколит, более чем в 50% — повторная рвота [1, 37]. Фебрильная лихорадка встречается в 30-80% случаев.
Начало Stx-ГУС чаще всего наблюдается на фоне уменьшения степени выраженности диареи и проявляется резкой бледностью кожного покрова, петехиями, наличием пастозности, снижением объема мочи или ее полным отсутствием. Ребенок становится вялым, сонливым, резко снижается аппетит. В 25% случаев энцефалопатия проявляется клонико-тоническими судорогами, сопором, комой [1, 38, 39]. В патогенезе энцефалопатии играют важную роль одновременно несколько факторов: отек мозга, гипоксия, геморрагии.
Массивное внутрисосудистое потребление тромбоцитов может спровоцировать развитие коагулопа-тии потребления и развернутого ДВС-синдрома: гипер- или гипокоагуляция, гипопротромбинемия, гипофибриногенемия, повышение уровня продуктов деградации фибрина, Д-димера, замедленный фибринолиз, нарушение агрегации тромбоцитов.
В лабораторных показателях практически всегда обнаруживается анемия (Нв 40-90 г/л), тром-боцитопения (<150 000*109/л), гиперазотемия (мочевина >8 ммоль/л, креатинин >110 мкмоль/л), повышение уровня лактатдегидрогеназы; в мазке периферической крови: лейкоцитоз, фрагменти-рованные эритроциты (шизоциты), анизоцитоз, пойкилоцитоз, умеренно выраженный ретикулоцитоз. Для подтверждения неиммунного характе¬ра анемии выполняется реакция Кумбса, являющаяся отрицательной при ГУС [1, 40].
Учитывая, что патоморфологической основой ГУС является ТМА, в клинической картине могут присутствовать симптомы полиорганной недостаточности: поражение поджелудочной
железы, желудочно-кишечного тракта, легких, миокарда.
Атипичный ГУС манифестирует в раннем возрасте: при мутации FI — в возрасте 2 месяцев, HFI — 6 месяцев, МСР — старше года. Провоцирующим фактором к дебюту аГУС являются инфекционные агенты, в дальнейшем рецидивы возникают у 2/з больных независимо от генетического варианта. Причем промежуток между рецидивами может колебаться от нескольких недель до нескольких лет. Экстраренальные проявления при аГУС — чаще поражение ЦНС — выявляются в 20% случаев. Клинические проявления аналогичны таковым при Stx-HUS, но исход и прогноз значительно хуже и зависят от варианта мутации.
Диагностика
Установление диагноза аГУС обычно вызывает определенные затруднения в связи с тем, что не существует достоверных клинических отличий его от типичного ГУС и ТТП. Таким образом, для проведения дифференциальной диагностики пациенты с ГУС при поступлении в лечебное учреждение нуждаются в определении концентрации СЗ и фактора ADAMTS 13. В случае обнаружения дефицита фактора ADAMTS 13 в первую очередь нужно думать о ТТП. Однако нормальный уровень СЗ не исключает дисфункцию комплемента. Более чувствительным тестом является определение повышенного показателя отношения C3d/C3 в плазме крови и наличие отложения СЗ в биоптате почек [18, 19].
Для достоверной диагностики аГУС необходимо определение уровней факторов Н, I, В, D. Измерение уровня HFI в сыворотке крови позволяет выявить тех немногочисленных пациентов с мутациями HFI, вызывающими снижение уровня HFI. Снижение показателя СН50 и концентрации фактора В можно найти у некоторых, но не у всех пациентов с мутациями HFI или МСР. Второй этап состоит в поиске мутаций по генам HFI и МСР. Поиск мутаций фактора I следует проводить у пациентов с пониженным уровнем его в сыворотке крови [25, 26].
Лечение
Специфической терапии ГУС не существует. Лечение пациентов с Stx-HUS заключается в проведении заместительной почечной терапии (ЗПТ) в тех случаях, когда она показана с целью поддержания гомеостаза и обеспечения жизненно важных функций. Параллельно проводится посиндромная терапия, включающая регуляцию водно-электролитного баланса, коррекцию коагулопатии (трансфузии свежезамороженной плазмы — СЗП, антикоагулянты), коррекцию анемии (трансфузии эритроцитов). Причем применение СЗП также не является доказанно необходимым [21].
Зато применение тромбоцитной массы с заместительной целью во всех публикациях считается
неоправданным. Доказано, что трансфузии тромбоцитов способствуют и без того высокой склонности к образованию микротромбов и усилению ишемии тканей. Особенно значительно сказывается мик-ротромбообразование на состоянии ЦНС, усиливая неврологическую симптоматику. Трансфузии тромбоцитной массы считаются оправданными только в случае сочетания выраженной тромбоци-топении с профузным кровотечением.
По поводу антибактериальной терапии в литературе существует определенная дискуссия. Одни авторы [41] сообщают об увеличении риска развития ГУС в случае применения антибиотиков для лечения инфекции, вызванной Stx-E. coli, другие [42] публикуют результаты исследований, которые подобные факты не подтверждают. Представляется рациональным внутривенное введение антибактериальных препаратов широкого спектра действия для профилактики бактериальной инфекции при катетеризации центральных вен, имплантации перитонеального катетера и других оперативных вмешательствах, а также при наличии явного очага инфекции.
Неэффективным также признано внутривенное введение фибринолитиков, иммуноглобулинов, кортикостероидов, антиоксидантов и антитромбоцитарных препаратов [39] в острой фазе заболевания.
Были попытки использовать пероральный препарат SYNSORB, механизм действия которого основан на связывании шига-токсина [43]. Но проведенные клинические исследования не подтвердили достоверную эффективность этого препарата. В то же время многие авторы [44, 45] сообщают о снижении частоты развития тХПН после ГУС у детей, получавших малобелковую диету и ингибиторы ангиотензинпревращающего фермента (иАПФ). У этих детей отмечены уменьшение протеинурии, нормализация артериального давления и оптимизация скорости клубочковой фильтрации. В случае развития тХПН выполняется трансплантация почки. Риск развития повторного ГУС в этом случае составляет не более 10% [46].
Лечение пациентов с non-Stx-HUS отличается от лечения пациентов с типичным ГУС. Практически все источники сообщают об эффективности использования СЗП [47, 48]. Ежедневная доза СЗП колеблется от 20 до 40 мл/кг, трансфузии производятся до достижения ремиссии [2, 49]. В последнее время все большее распространение получает точка зрения об эффективности заменного плазмафереза. Многие авторы доказывают необходимость ежедневного плазмафереза длительное время [50].
В случае развития non-Stx-HUS, вызванного Streptococcus pneumonia, трансфузии СЗП противопоказаны из-за наличия в плазме взрослого человека антител против антигена Tromsen-
Friedenreich, которые утяжеляют течение процесса[1]. Если ГУС развивается на фоне приема циклоспорина или такролимуса необходимо отменить препарат.
Трансплантация почки в случае non-Stx-HUS малоэффективна. У 50% пациентов после трансплантации развивается ГУС в трансплантате [46]. В случае развития рецидива ГУС в трансплантате повторная трансплантация не производится.
Перспективные направления терапии
В настоящее время есть несколько направлений борьбы с ГУС. Одно из направлений — это создание препаратов, предупреждающих воздействие шига-токсина на организм. Есть сообщения об использовании в эксперименте на животных (мыши) рекомбинантных бактерий, на поверхности которых расположен рецептор к шига-токсину, связывающий токсин в кишечнике [51].
Другим перспективным направлением борьбы с ГУС является путь воздействия на систему комплемента, играющую важную роль в патогенезе ТМА. В настоящее время разрабатываются моноклональные антитела против фактора С5.
Пекселизумаб и Экулизумаб блокируют активацию компонентов комплемента. Проводятся клинические испытания растворимых форм ингибитора СЗ/С5-конвертазы, рецептора комплемента I (CRI) [52].
Для варианта с дефицитом HFI разрабатывается рекомбинантный HFI, а также возможность использования донорской плазмы, богатой HFI [25].Некоторые молодые больные (около 10%) имеют аутоантитела против фактора Н, особенно при наличии предрасполагающих мутаций в других компонентах комплемента. Некоторые больные с аГУС имеют дефицит ADAMTS 13. Эти результаты привели к разработке новых рекомендаций для диагностики и лечения с использованием ингибиторов альтернативного пути активации комплемента.
В настоящее время открыты новые горизонты терапии. Моноклональные антитела против С5, экулизумаб, показали свою эффективность в некоторых случаях ГУС (Gruppo RA). Другие терапевтические стратегии, которые исследуются в настоящее время, включают концентрат фактора Н, синтетический регулятор комплемента.
Прогноз
Действительно, одной из важных клинических проблем является определение критериев прогноза заболевания. Так как около 50% выживших после острого периода в дальнейшем нуждаются в ЗПТ и трансплантации почки, то и прогноз в значительной степени определяется риском возврата аГУС после трансплантации. Такой риск чрезвычайно высок у пациентов с мутациями CFH (-80%), CFI и СЗ (>50%). Описаны результаты 3 трансплантаций у пациентов с мутацией CFB — у всех отмечена гибель трансплантата в результате возвратного аГУС [53]. В случае мутации МСР подобного осложнения не происходит из-за отсутствия мутированного белка в трансплантате. Поскольку CFH, CFI, CFB и СЗ синтезируются в печени, рекомендуют осуществлять комбинированную трансплантацию печени и почки или изолированную трансплантацию печени в случае отсутствия почечной недостаточности.
Заключение
Атипичный ГУС — тяжелое состояние с очень высокой смертностью и большим риском развития ХПН. Наиболее эффективным методом терапии признано проведение заменного плазмафереза в начале острого периода. Некоторое улучшение результатов лечения пациентов с аГУС обусловлено активным изучением патогенеза этого тяжелого заболевания в последние годы.
Источник: http://www.evrika.ru/article/775

 Инфекционный и неинфекционный в зависимости от причины развития.
Инфекционный и неинфекционный в зависимости от причины развития. В течении заболевания выделяется продромальный период, длительность которого может составлять до 14 дней (в большинстве случаев – 7 суток). Под данным термином подразумевается время от проникновения возбудителя в организм до появления первых клинических симптомов. В продромальный период может наблюдаться единичный эпизод кровавой диареи.
В течении заболевания выделяется продромальный период, длительность которого может составлять до 14 дней (в большинстве случаев – 7 суток). Под данным термином подразумевается время от проникновения возбудителя в организм до появления первых клинических симптомов. В продромальный период может наблюдаться единичный эпизод кровавой диареи.