Хронические лейкозы
Определение понятия. Хронические лейкозы – это такие формы лейкозов, при которых морфологическим субстратом опухолевых (лейкозных) разрастании являются более зрелые, чем бластные, клетки крови, достигшие определенного уровня дифференцировки. Все ХЛ характеризуются длительным течением доброкачественной стадии и коротким терминальной (злокачественной). Среди ХЛ выделяют миелопролиферативные и лимфопролиферативные заболевания.
К хроническим миелопролиферативным процессам относятся хронический миелолейкоз, эритремия, алейкемический миелоз. При этих заболеваниях наблюдается мутация на уровне полипотентной стволовой клетки, далее продуцирующийся на классе олигопотентных стволовых клеток, которые дают начало трем линиям миелоидного кроветворения: эритроцитарного, гранулоцитарного и мегакариоцитарного.
Хронический миелоидный лейкоз
ХМЛ – опухоль кроветворной системы, развивающаяся из клеток-предшественниц миелопоэза, диффернцирующихся до зрелых клеток. ХМЛ — наиболее распространенный из всех ХЛ (20% от всех лейкозов взрослых и 5% детей), чаще встречается в возрасте 30-70 лет, отмечается некоторое преобладание мужчин. При ХМЛ клетки опухоли сохраняют способность к дифференцировке, наблюдается повышенное образование гранулоцитов: нейтрофилов, промиелоцитов, миелоцитов, метамиелоцитов, базофилов, эозинофилов. В костном мозге может повышаться продукция мегакариоцитов, в крови — тромбоцитов. Причиной патологического роста клеток является мутация клетки-предшественницы миелопоэза, происходит делеция (утрата) ½ длинного плеча у одной из хромосом 21-22 пары и транаслокация её на длинное плечо 9 или другой пары. Такая патологическая хромосома получила название филадельфийской (Рh) и обнаруживается у большинства больных ХМЛ почти во всех клетках костного мозга. В течение заболевания выделяют три стадии: начальную, развернутую и терминальную. В начальной стадии клинические признаки отсутствуют, и диагноз может быть заподозрен при случайном исследовании крови. Развернутая стадия характеризуется клиническими признаками, связанными с лейкемическим процессом, её началом может быть внезапно появившийся астенический синдром (слабость, утомляемость), обусловленный повышенным клеточным распадом, в связи с которым в крови и моче увеличивается содержание мочевой кислоты. Клинические признаки заболевания обусловлены разрастанием лейкозной ткани в костном мозге, селезенке, в меньшей степени в печени. Больных беспокоит слабость, повышенная потливость, субфебрильная температура. Часто отмечаются боли в левом подреберье, иногда очень сильные, приступообразные. Боли вызываются спленомегалией (миелоидная метаплазия селезенки) и развитием инфарктов селезенки. Объективным важнейшим симптомом является выраженное увеличение селезенки, она плотная, временами очень болезненная. Гепатомегалия менее выражена. Геморрагического синдрома в развернутой стадии практически не бывает, но в терминальной он проявляется обязательно. Увеличение лимфоузлов нехарактерно. Средняя продолжительность этой стадии около 4 лет. В терминальной стадии опухолевый процесс распространяется за пределы костного мозга. Поражается кожа, подкожная клетчатка, в них обнаруживаются лейкозные инфильтраты (лейкемиды). Состояние больного прогрессивно ухудшается, нарастает интоксикация, похудание, боли в животе, костях, лихорадка; прогрессивно увеличиваются печень и селезенка; важнейшим признаком является развитие толерантности к проводимой терапии. Лейкемическая инфильтрация нервных корешков вызывает радикулярные боли.
Кроме того, в течение патологического процесса можно выделить моноклоновую стадию, когда существует один клон опухолевых клеток, и поликлоновую, когда вследствие клеточных мутаций появляются новые клоны и процесс приобретает характер острого лейкоза. Нарастают проявления геморрагического синдрома и инфекционные осложнения.
Изменения в периферической крови и костном мозге. В крови лейкоцитоз, часто гиперлейкоцитоз, в лейкоцитарной формуле определяются молодые формы нейтрофилов вплоть до миелоцитов, увеличивается также содержание базофилов и эозинофилов (базофильно-эозинофильная ассоциация). В костном мозге в развернутой стадии определяется резкое увеличение гранулоцитарного ростка с преобладанием зрелых форм. В терминальной стадии начинают преобладать молодые формы нейтрофилов и появляются бластные клетки. Развивается анемия и тромбоцитопения. В лейкозных клетках в моноклоновую стадию закономерно определяется филадельфийская хромосома. УЗИ органов брюшной полости позволяет определить увеличить увеличение селезёнки, печени, абдоминальных лимфоузлов.
Дифференциальная диагностика проводится с лейкемоидными реакциями нейтрофильного типа.
Принципы лечения. Основным принципом терапии ХМЛ является первично-сдерживающая терапия. Основной ее задачей является сдерживание роста клона опухолевых лейкозных клеток. С этой целью используются гидроксимочевина, α-интерферон, миелобромол. При больших размерах селезенки и частых инфарктах показано облучение селезенки и значительно реже спленэктомия. Радикальное лечение ХМЛ проводится путем применения интенсивной химиотерапии или с последующей пересадкой костного мозга. В последние годы появился новый препарат гливек — блокатор мутантной тирозинкиназы.
Прогноз.Продолжительность жизни больных ХМЛ составляет от 3 до 8 лет. Больные находятся на диспансерном наблюдении у гематолога. Вторичная профилактика ХМЛ заключается в предупреждении обострений (контроль анализов, поддерживающая терапия, исключение простудных заболеваний.
ЛЕЙКОЗЫ
3
ОПУХОЛИ СИСТЕМЫ КРОВИ (ГЕМОБЛАСТОЗЫ)
Гемобластозы – опухолевые процессы кроветворной ткани. Разделяют две группы гемобластозов:
лейкозы (лейкемия) – системные опухолевые заболевания кроветворной ткани.
лимфомы – регионарные опухолевые заболевания кроветворной и лимфоидной ткани.
ОБЩАЯ ХАРАКТЕРИСТИКА ЛЕЙКОЗОВ
Лейкозы (лейкемия) характеризуются системным (во всех органах кроветворения одновременно) разрастанием злокачественных клеток из кроветворной ткани – лейкозных клеток. Это происходит следующим образом:
сначала лейкозные клетки разрастаются в органах кроветворения (красный костный мозг, селезенка, лимфоузлы),
на следующем этапе, который рассматривается как метастазирование, лейкозные клетки из крови попадают в органы и образуют лейкозные инфильтраты по ходу сосудов, в строме, что ведет к атрофии и дистрофии органа. Органы при этом увеличиваются в размерах и функция их уменьшается.
лейкозные клетки вытесняют нормальные клетки крови (эритроциты, лейкоциты, тромбоциты), количество которых в крови резко уменьшается. Это ведет к анемии (снижение эритроцитов в крови), геморрагическому синдрому (снижение тромбоцитов крови), снижению иммунной защиты (снижение лейкоцитов) и развитие инфекционных заболеваний.
Классификация лейкозов.
По количеству лейкозных клеток в крови разделяют варианты лейкозов:
лейкемические лейкозы (от 25 тыс. и выше в 1 мкл крови),
сублейкемические лейкозы (не более 15-25 тыс. в 1 мкл крови),
лейкопенические лейкозы (менее 4 тыс. в 1 мкл крови),
алейкемические лейкозы (лейкозных клеток в периферической крови нет).
Чаще лейкозы протекают по первому варианту (лейкемический лейкоз), но на фоне лечения у одного больного может наблюдаться переход одного варианта лейкоза в другой.
По степени дифференцировки (зрелости) лейкозных клеток выделяют лейкозы:
острые или бластные лейкозы,
хронические или цитарные лейкозы.
Для острого
лейкоза характерны пролиферация недифференцированных
бластных клеток крови и быстрое течение
болезни, для
По гистогенезу (происхождению) выделяют гистогенетические формы как острого, так и хронического лейкоза.
Острые лейкозы:
недифференцированный,
миелобластный,
лимфобластный,
монобластный и другие.
Хронические лейкозы:
хронический миелоидный лейкоз,
хронический лимфолейкоз,
парапротеинемические лейкозы.
ОБЩАЯ ХАРАКТЕРИСТИКА ОСТРЫХ ЛЕЙКОЗОВ
При остром лейкозе возникают изменения в крови – анемия, тромбоцитопения, лейкемический провал – это резкое увеличение в крови бластных клеток, отсутствие созревающих клеток и незначительное число зрелых клеток.
Диагноз острого лейкоза ставят на основании обнаружения в костном мозге (пункция грудины или подвздошной кости) бластных клеток. Гистогенетическая форма острого лейкоза устанавливается на основании гистохимических реакций (окраска на липиды, ШИК-реакция и другие), т.к. под микроскопом все бластные клетки выглядят одинаково и различия можно определить только с помощью гистохимии. При недифференцированном остром лейкозе все реакции отрицательные, при остром лимфобластном лейкозе – ШИК+реакция, при остром миелобластном лейкозе – реакция на липиды положительная и ШИК+ реакция.
Морфология. Острые лейкозы характеризуются замещением костного мозга бластными клетками и инфильтрация ими селезенки, печени, лимфоузлов, почек, мозговых оболочек.
Причины смерти при острых лейкозах:
геморрагический синдром, который проявляется кровоизлияниями во внутренних органах, головном мозге. Геморрагический синдром развивается вследствие:
тромбоцитопении (понижение уровня тромбоцитов в крови),
анемии, что повышает проницаемость сосудов,
инфильтрации сосудов лейкозными клетками, что повышает сосудистую проницаемость.
тяжелые инфекционные осложнения (пневмонии, сепсис), возникающие в связи с ослаблением иммунной системы,
язвенно-некротические осложнения,
анемия.
Особенности острых лейкозов у детей:
Встречаются значительно чаще, чем у взрослых.
Чаще встречаются узловатые лейкозные инфильтраты, особенно в области тимуса.
Среди всех лейкозов у детей чаще встречается острый лимфобластный лейкозё
Патоморфоз (изменение морфологии и течения) острых лейкозов:
Патоморфоз острых лейкозов связан с лечением их цитостатиками.
Увеличилась продолжительность жизни больных до нескольких лет.
Реже встречается и менее выражен геморрагический синдром.
Менее выражены язвенно-некротические изменения в полости рта.
ОБЩАЯ ХАРАКТЕРИСТИКА ХРОНИЧЕСКИХ ЛЕЙКОЗОВ
Для хронических лейкозов характерна пролиферация дифференцированных лейкозных клеток. Это цитарные лейкозы с относительно доброкачественным течение. Среди хронических лейкозов по гистогенезу выделяют:
хронические лейкозы миелоцитарного происхождения:
хронический миелоидный лейкоз,
эритремия,
хронический эритромиелоз.
хронические лейкозы лимфоцитарного происхождения:
хронический лимфолейкоз,
парапротеинемические лейкозы (миеломная болезнь).
хронические лейкозы моноцитарного происхождения.
Хронический миелоидный лейкоз. Этот лейкоз протекает в две стадии: моноклоновую (доброкачественная) и поликлоновую (злокачественная).
Первая стадия, которая длится несколько лет, характеризуется увеличением нейтрофилов в крови (нейтрофильный лейкоцитоз) и появлением в крови созревающих клеток крови. Клетки костного мозга содержат филадельфийскую хромосому. Эта хромосома – маркер хронического миелоидного лейкоза.
Вторая стадия, длится от 3 до 6 мес. происходить смена моноклоновости (один вид клеток) поликлоновостью (много видов клеток). В результате этого в крови появляются бластные формы клеток (миелобластны, эритробласты, недифференцированные клетки), число которых нарастает в крови и костном мозге. Такое состояние называется бластный криз, что говорит о переходе лейкоза в злокачественную стадию.
Морфология. Костный мозг пиоидный (гноевидный). Резко увеличены размеры и масса селезенки и печени вследствие их лейкозной инфильтрации. В органах – паренхиматозная белковая и жировая дистрофия. Лейкозная инфильтрация выражена также в лимфоузлах, лимфоидной ткани кишечника, почках, мозговых оболочках (нейролейкоз). Часты лейкозные тромбы, инфаркты органов, геморрагии.
Хронический лимфолейкоз.
У детей как Т-лимфоцитарный лейкоз, у взрослых чаще как В-лимфоцитарный лейкоз. В крови резко увеличивается содержание лимфоцитов (лимфоцитарный лейкоцитоз). Для него характерно длительное доброкачественное течение, но возможен бластный криз и переход в злокачественную стадию.
Морфология. При обоих видах лимфолейкоза увеличенные лимфоузлы образуют пакеты, резко увеличена селезенка, печень и почки, что связано с лейкозной инфильтрацией. Паренхиматозная дистрофия печени, миокарда, почек. Лейкозные инфильтраты часто имеют узловой характер. Часты инфекционные осложнения.
Причины смерти при хронических лейкозах:
анемия,
геморрагический синдром,
вторичные инфекции (пневмония).
Миеломная болезнь особая разновидность хронического лейкоза лимфоцитарного происхождения. Для миеломной болезни характерна выработка лейкозными клетками патологических белков – парапротеинов, что приводит отложению парапротеинов в органах.
Острые лейкозы
ОСТРЫЕ ЛЕЙКОЗЫ. (ОЛ)
ОЛ — это заболевание из группы гемобластозов, злокачественная опухоль кроветворной ткани, исходящая из костного мозга, патоморфологическим субстратом которой являются лейкозные бластные клетки, соответствующие родоначальным элементам одного из ростков кроветворения.
Диагноз ОЛ впервые был поставлен русским и немецким врачами Славянским (1867) и Freidveich 1857, которые сообщили о быстро прогрессирующем течении лейкозного процесса. Однако они трактовали быстрый исход заболевания как тяжелую острую форму хронического лейкоза. Лишь в 1889 после анализа 17 наблюдений Epstein ОЛ был признан самостоятельной нозологической формой. В дальнейшем в соответствии с развитием морфологических методов исследования термины «ОСТРЫЙ» И «ХРОНИЧЕСКИЙ» лейкоз стали отражать не временные а цитоморфологические различия. Способность лейкозной бластной клетки при хроническом лейкозе к пролиферации и дифференцировке до зрелой клетки, а при остром лейкозе – способность клетки к быстрому делению без созревания до зрелой клетки, иногда с частичной дифференцировкой до промежуточных форм.
В последнее десятилетия сформировались понятия об опухолевой природе лейкозов, но до 1948 г отсутствовали действенные методы лечения, терапия складывалась из симптоматических мер, продолжительность жизни больных острым лейкозом не превышала 2 мес.
С 1948 г – открылась цитостатическая эра. Современный этап развития проблемы характеризуется многочисленными исследованием достижений фармакологии (используется программы с новейшими цитостатиками, которые позволили достигать полных ремиссий у 80% взрослых), вирусологии, цитологии, иммунологии.
В 1975 г гематологами Франции, США и Англии была создана ФАБ – классификация ОЛ.
Нелимфобластные миелогенные (миелоидные) лейкозы, подразделяющиеся на 6 основных типов
лимфобластные – 3 типа.
миелопоэтические дисплазии или миелодиспластический синдром (МДС) — 4 Типа.
Нелимфобластные ОЛ включают:
М1 — острый миелобластный лейкоз без признаков созревания клеток (бластные клетки пероксидазопозитивные).
М2 — острый миелобластный лейкоз с признаками вызревания клеток (морфологические и цитохимические характеристики бластных клеток такие же, имеет место созревание до промиелоцитов и более зрелых форм, типичная цитогенетическая аномалия t (8,21).
М3 — острый промиелоцитарный лейкоз (бластные клетки с обильной базофильной зернистостью, реакция на пероксидазу резко (+), типичная цитогенетическая аномалия t (15,17).
М4 — острый миеломонобластный лейкоз (бластные клетки имеют морфоцитохимические характеристики как миело- так и монобластов, аберрация inv16.
М5 — острый монобластый лейкоз (бластные клетки беззернисты, имеют моноцитоидные ядра, пероксидаза отсутствует, содержится фторидингибируемая неспецифическая эстераза, различные хромосомные аберрации в II паре).
М6 — острый эритролейкоз (эритромиелоз), бластные клетки представлены молодыми формами эритроидного ряда.
В последние годы авторы ФАБ – классификации выделили еще два варианта ОЛ:
М0 — острый недифференцированный лейкоз
М7 — острый мегакариобластный лейкоз.
Из всех упомянутых подвариантов ОЛ наиболее чисто встречается М2 и М4.
Острые лимфобластные лейкозы делятся на 3 типа в зависимости от цитологической характеристики бластов:
Л1 — острый микролимфобластный лейкоз, преобладают малые лимфоидные клетки, иногда без ядрышка и без иммунологических маркеров. Эта форма выявляется у 65% детей и у 5-10% взрослых больных.
Л2 — острый лимфобластный лейкоз с типичный лимфобластами, чаще у взрослых.
Л3 — острый макро- или пролимфобластный лейкоз, преобладают весьма крупные клетки.
Кроме цитоморфологической, существует иммунологическая классификация острого лимфобластного лейкоза: Т — лимфобластный вариант, В — лимфобластный вариант и нуль- лимфобластный, или ни Т- ни В- острый лимфобластный лейкоз.
Заболеваемость острым лейкозом на территории СНГ остается приблизительно 1 случай на 100.000 населения в год.
ЭТИОЛОГИЯ.
ОЛ занимают ведущее место в структуре заболеваемости гемобластозами, составляя приблизительно 1\3 их общего числа. Мужчины болеют чаще, чем женщины. При этом всеми исследователями отмечается 2 пика заболеваемости: в 3-4 и 60-69 лет.
Данные эпидемиологических исследований позволяют утверждать, что в семьях лиц, больных ОЛ, риск заболеваемости повышается почти в 3-4 раза. Об определенном значении генетических факторов свидетельствует увеличение заболеваемости при некоторых генетических нарушениях и аномалиях развития (болезнь Дауна, синдром Клайнфельтера и др). При наличии ОЛ у одного из монозиготных близнецов вероятность заболевания другого составляет 25%. Считается, что роль генетических факторов ограничивается формированием предрасположенности к лейкозу, а затем реализуется под воздействием лучевых , химических факторов. Повышение мутабельности может быть вызвано наследственной нестабильностью генетического аппарата под воздействием онкогенных факторов.
В качестве возможной причины мутации кроветворной клетки рассматривается воздействие ионизирующей радиации. Например, доказанное увеличение числа ОЛ после атомного взрыва в Японии, причем частота острого лимфобластного лейкоза среди лиц, находящихся на расстоянии до 1,5 км от эпицентра взрыва почти в 45 раз больше, чем среди лиц находившихся за пределами этой зоны. Не вызывает сомнения развитие так называемых вторичных лейкозов после лучевой терапии. Обсуждение ятрогенных онкогенных факторов привело к разумному ограничению рентгенодиагностических процедур, изъятием радиоактивного фосфора, ограничению применения лучевой терапии у неонкологических больных.
Ряд авторов указывают на причастность к развитию ОЛ некоторых лекарственных препаратов (бутадион, левомицитин, цитостатики), а также контакт с некоторыми химическими веществами , лаками, красками, пестицидами, бензолом.
Широко обсуждается вирусная теория. У некоторых животных вирусная теория лейкозов доказана путем введения вируса: вирус Гросса мышей, вирус Рауса у кур, которые способны вызывать опухолевый процесс и у обезьян и трансформировать в культуре ткани гемопоэтической клетки человека.
В 1982 был выделен ретро-вирус от больного лейкозом – человеческий Т-клеточный вирус I-HTLV 1. Как и другие ретровирусы (I-HTLV 2 — волосатоклеточный лейкоз, I-HTLV 3 — вирус СПИД) вирус с помощью реверсионной транскриптазы способствует внедрению вирусного гормона в ДНК клетки хозяина, в результате чего клетка получает новую генетическую информацию, непрерывно пролиферирует без дифференцироваки (мутация).
При ОЛ у большинства больных при цитогенетических исследованиях выявляют изменения состояния хромосомного аппарата, заключающиеся не только в изменении количества хромосом, но и в различных нарушениях целостности хромосом. Эти нарушения специфичны для каждого лейкоза, при нелимфобластном лейкозах аномалии кариотипа наблюдаются чаще в 8,21 паре, при остром лимфобластном лейкозе чаще в 4,11 или 1,19 парах хромосом. В настоящее время нет оснований рассматривать хромосомные аномалии как прямую причину заболевания. Скорее всего речь идет о нестабильности клеточного генетического аппарата при ОЛ.
Таким образом, один из лейкозогенных агентов (вирус, ионизирующая радиация, хим вещество) возможно, при условии наследственной нестабильности генетического аппарата, вызывает мутацию гемопоэтической клетки 1,2 или 3 класса, родоначальницы опухолевого клона.
Цитопатогенез ОЛ-зов:
по законам моноклонального роста одна мутировавшая гемопоэтическая клетка дает начало образованию опухолевого клона в костном мозге. Лейкозные опухолевые клетки обнаруживают каратогенные свойства: снижение колониеобразующей способности, асинхронизм процессов пролиферации и дифференцировки, при этом чаще блокада дифференцировки. Отмечается удлинение митотического цикла, продолжительности жизни клеток. В лейкозном бластном клоне обнаруживают наличие 2х клеточных популяций «растущих» и «дремлющих» клеток (78-90%). Одна мутировавшая клетка дает после деления огромное количество клеток (за 3 мес 1012 клеток) массой 1 кг и начинаются клинические проявления. Процесс этот сложен, в основе его лежат конкурентные взаимоотношения нормальных и опухолевых клеток. Злокачественные клетки избирательно угнетают нормальные клетки, сами более активно влияют на ростовые факторы. При такой ситуации фракция пролиферирующих нормальных клеток-предшественников постепенно истощается. Торможение нормального гемопоэза усиливается пр принципу обратной связи – из-за нарастающей величины общей клеточной массы. Поэтому внешней особенностью прогрессирования гемобластозов является угнетение нормальных ростков кроветворения. По мере развития ОЛ клетки обретают способность расти вне органов кроветворения: в коже, почках, мозговых оболочках.
Клиника ОЛ:
Клинические проявления ОЛ являются следствием пролиферации и накопления злокачественных лейкозных бластных клеток. количественно превышающих условный рубеж (более 1000 млрд) за которым истощаются компенсаторные возможности организма.
Основной клинической симптоматикой \ОЛ служат процессы гиперплазии опухолевой ткани (бластная трансформация костного мозга, увеличение лимфатических узлов, органов, появление опухолевых инфильтратов и т.д,) и признаки подавления нормального кроветворения. Клиническая симптоматика развернутой стадии ОЛ складывается из 5 основных синдромов:
гиперпластического
геморрагического
анемического
интоксикационного
инфекционный осложнений
Гиперпластический синдром проявляется умеренным и безболезненным увеличением лимфоузлов, печени, селезенки (30-50%), у 1\4 больных — увеличение миндалин, лимфоузлов средостения с симптомами сдавления. появляются кожные лейкозные инфильтраты (лейкемиды) в виде красновато-синеватых бляшек.
Лейкозная гиперплазия и инфильтрация костного мозга приводят к угнетению нормального кроветворения, в результате чего развивается анемия и тромбоцитопения. тяжелая анемия с гемоглобином ниже 60 г\л, эритроциты менее 1-1,3х1012 отмечается у 30%. Глубокая тромбоцитопения (ниже 50х109\л) служит основной причиной одного из самых коварных клинических синдромов — геморрагического, который наблюдается у 50-60% больных. Геморрагические проявления весьма вариабельны: от мелкоточечных и мелкопятнистых единичных высыпаний на коже и слизистых оболочках до обширных кровоизлияний и профузных кровотечений — носовых, маточных, желудочно-кишечных и др.
Кровоизлияния очень часто сопровождаются неврологическими нарушениями, острыми расстройствами мозгового кровообращения.
инфекционные процессы., наблюдаемые у 80-85% больных ОЛ, являются грозным, труднокупируемым осложнением. Наиболее многочисленная группа инфекционных осложнений бактериального происхождения 70-80%, включающая пневмонии, сепсис, гнойные процессы. Тяжелые инфекционные осложнения вирусного и грибкового генеза наблюдаются реже у 4-18 и 18-30% больных. В последнее время уменьшилась роль стафилококковой инфекции и возросло значение грамотрицательной флоры. количество грибковых инфекций обнаруживает тенденцию к увеличению До20%. Вирусные инфекции стали протекать тяжелее, участились случаи цитомегаловирусной инфекции, герпеса.
Клиническим проявлением локализации лейкозного процесса в оболочках и веществе головного мозга является синдром нейролейкоза. клиническая симптоматика нейролейкоза развивается постепенно и складывается из симптомов повышения внутричерепного давления и локальной симптоматики: менингоэнцефалический синдром, псевдотуморозный, расстройства функций черепно-мозговых нервов, поражение периферических нервов.
картина крови в развернутой стадии острого лейкоза весьма характерна. Помимо анемии и тромбоцитопении отмечается изменение числа лейкоцитов в довольно широких пределах: от 0,1х109\л До 100х109\л с преобладанием форм с нормальным и сниженным лейкопеническим (38%) или сублейкимическим (44%) числом лейкоцитов. Лишь у 18% больных количество лейкоцитов превышает 50х109\л. У 30% больных бластные клетки в гемограмме отсутствуют. У большинства больных количество бластных форм составляет от нескольких процентов Дорошев80-90%. Клеточный состав гемограммы часто бывает мономорфным, представленный в основном бластными клетками.Зрелые гранулоциты выявляются в виде единичных палочкоядерных и сегментоядерных нейтрофилов. Между бластными клетками и зрелыми гранулоцитами почти нет промежуточных форм, что отражает провал в кроветворении — лейкемическое зияние (hiatus leukemicus). При нелимфобластных острых лейкозах в гемограмме могут обнаруживаться незрелые гранулоциты: промиелоциты, миелоциты, метамиелоциты, однако их количество невелико (Не более 10%).
основное диагностическое значение имеет исследование костного мозга. Основу диагностики ОЛ составляет обнаружение в пунктате костного мозга более 30% бластных клеток. В отличии от четких критериев ОЛ в миелограмме, изменения в анализах периферической крови (наличие бластных клеток, лейкоцитов или лейкопения, анемия, тромбоцитопения) являются частой но Нефедов абсолютно обязательной и в разной степени выраженной лабораторной находкой.
Стадии ОЛ:
1 стадия. Первая атака заболевания – это стадия развернутых клинических проявлений, первый острый период, охватывающий время от первых клинических симптомов, установления диагноза, начала лечения до получения эффекта от лечения. Начальная стадия при ОЛ не очерчена. Небольшие симптомы интоксикации – повышенная утомляемость, слабость — неопределенны, наблюдаются не у всех больных.
2 стадия. Ремиссия. Полной клинико-гематологической ремиссией называется состояние, характеризующиеся полной нормализацией, клинической симптоматики (не менее 1 мес), анализов крови и костного мозга с наличием в миелограмме не более 5% бластных клеток и не более 30% лимфоцитов, м.б. незначительная анемия (не ниже 100г\л), небольшая тромбоцитопения (не менее 100х109\л).
Не полная клинико-гематологическая ремиссия — это состояние, при котором нормализуется клиническое показатели и гематограмма, но в пунктате костного мозга сохраняется не более 20% бластных клеток.
3 стадия. Рецидив заболевания . обусловлен реверсией лейкозного процесса к прежним показателям в результате выхода остаточной лейкозной клеточной популяцией из-под контролирующего действия цитостатической терапии. Клиника более выражена, чем в 1 стадии и труднее поддается терапии. В костном мозге нарастает бластоз, в периферическом крови — цитопения.
В соответствии с числом ремиссий м.б несколько рецидивов.
Полные клинико-гемотологические ремиссии более 5 лет (4 стадия) многие авторы расценивают как выздоровление однако рецидивы лейкоза отмечены и после 5, 7 и даже 10 лет ремиссии.
Терминальная стадия лейкоза может выделяться как завершающий этап опухолевой прогрессии при полном истощении нормального кроветворения, резистентности к цитостатической терапии.
ЛЕЧЕНИЕ ОЛ.
Современный этап химиотерапии отличается применением программ, составленных в зависимости от патоморфологических форм, особенностей течения заболевания. Эти программы позволили добиться ремиссии у 80-95% детей и 60-80% взрослых. Основное в лечении – цитостатическая терапия, направленная на максимальное уничтожение опухолевых клеток.
Разработка программ цитостатической терапии согласуется с данными клеточной кинетики при ОЛ. Известно, что пролиферирующие клетки проходят фазы митотического цикла: фаза митоза М, самая короткая, характеризуется образованием 2 дочерних клеток, постмитотическая фаза G1 — отражает период стабилизации, отдыха, фаза синтеза S — характеризуется синтезом, удвоением ДНК, премитотическая фаза G2, когда клетка готова к делению.
С позиций клеточной кинетики все химиопрепараты делятся на 2 группы.
Первая группа – это химические агенты, специфически действующие на клеточный цикл. Вторая — вещества действию которых проявляется независимо от цикла (циклонеспецифические).
Основные группы противолейкозных препаратов.
глюкокортикостероиды — нециклоспецифические, блок g1,s
антиметаболиты: 6-меркаптопурин, 6-тиогуанин, метотрексат — циклоспецифические, вступают в конкурентные отношения с метаболитами, с предшествниками нуклеиновых кислот. Цитозин — арабинозид (цитозар) — антикистаболит, блокирует синтез ДНК — циклоспецифичен.
растительные алкалоиды, атимитотические средства — винкристин, винбластин — нециклоспецифичены, в больших дозах блок g2\т.
алкилирующие средства — циклофосфан — нециклоспецифичен, блок G фазы.
производные нитромочевины – циклоспецифичны, лигибируют рост лейкозных клеток.
противоопухолевые антибиотики (даунорубицин, рубиномицин, адренамицин) — ингибируют рост лейкозных клеток, подавляя синтез ДНК, РНК
ферменты (L-аспирагиназа, этапозид), L-аспирагиназа нециклоспецифична, блок в G1, S фазе (разлагает аспирин). Этапозид действует в G2 фазе.
анракиноины (митоксантрон, амсакрин) — фазовонеспецифичны.
Необходимо учитывать следующие принципиальные положения:
сочетание цитостатических препаратов оказывает большее цитостатическое действие, причем комбинировать необходимо препараты различной фазово- и циклоспецифичности с нециклоспецифическими препаратами, чтобы охватить большее количество лейкозных клеток.
соблюдение цикличности и прерывистости в применении препаратов
длительность , упорность , достаточная активность терапии
В комбинированной цитостатической терапии различают следующие этапы:
индукция ремиссии
консолидация ремиссии
профилактика нейролейкемии
лечение в ремиссию
постиндукционная терапии
индукция ремиссии заключается в проведении курсовой цитостатической терапии по эффективным программам при условии развития ремиссии следующим этапом является консолидация (закрепление) ремиссии. Допустимо повторное индукционной терапии или проведение более агрессивных схем.
Задачей лечения в период ремиссии является дальнейшая максимальная редукция бластных клеток. В этот период осуществляют непрерывную низкодозную поддерживающую терапию и\или периодические курсы реиндукции.
Лечение нелимфобластных (острых миелоидных) лейкозов:
современная терапия острых миелодных лейкозов (ОМЛ) включает как химиотерапию так и трансплантацию костного мозга.
Первичная доза лечения называется индукционной химиотерапией. Наиболее эффективными препаратами являются цитарабин (ара-Д.) и антрациклин (даунорубицин). Базисная программа «7+3» заключается в использовании ара-Д. В дозе 100 мг\м2\сутки в течении 7 дней и даунорубицина в дозе 45 мг\м2\сутки в течении 3 дней при непрерывной инфузии.
В последние 15 лет с целью повышения эффективности производилась многочисленные попытки модификации основной программы терапии острых нелимфобластных лейкозов. Однако увеличение доз продолжительности курса, добавление препаратов других групп не привели к существенному улучшению результатов индукционной терапии.
Схема лечения «5+2» дает на 10% ремиссий меньше (цитозар 100мг\м2 5 дней, рубомицин 60мг\м2 2 дня.
Схема ОАН — онковин 2мг\день в\в, цитозар 100 мг\м2 7дней, преднизолон 100 мг внутрь 5 дней.
Схема ДАТ ( схема 7+3+ тиогуанин) 100мг\м2 внутрь ежедневно
сразу после констатации полной ремиссии проводят несколько (обычно 3) курсов консолидации по программе индукции или близкой к ней. Но наиболее современным подходом к проблеме постиндукционной терапии является проведение нескольких курсов терапии, интенсивность которых превышает индукционную, для этой цели используется программы терапии, включающие так называемые высокие дозы цитозара (до 3 г\м2 каждые 12 часов)
При сохранении полной ремиссии переходят к следующему этапу – поддерживающей терапии в ремиссии: курсы «5+2» проводят с интервалом 2,5-3 недели в течении 5 лет. Другой вариант терапии в ремиссию: ежемесячные введения Ара с 200мг\м2 5 дней в сочетании с другими противоопухолевыми препаратами: 1 мес 6-меркаптопурин 75 мг\м2 каждые 12 часов 5 дней, 2 мес — циклофосфан 1000 мг\м2 1 день курса, 3 мес — производные нитромочевины 75 мг\м2 1 день, 4 мес — рубомицин 45 мг\м2 1,2 день курса, 5 мес — винкристин 2 мг 1 день курса. Затем препараты меняются в отраженном порядке.
По данным многих авторов, риск рецидива после химиотерапии от 60-90%, а пятилетняя выживаемость 10-50% больных острыми нелимфобластными лейкозами. Проведение трансплантации костного мозга (ТКМ), особенно у молодых лиц (моложе 20) дает пятилетнюю выживаемость после ТКМ наблюдается в 40-60% случаев. У больных старше 30 лет строгих преимуществ ТКМ не существует : длительная выживаемость достигается в 30-40% случаев после ТКМ и в 20-40% случаев после химиотерапии. Для подготовки больных к ТКМ применяют высокие дозы циклофосфана или цитозара и тотальное терапевтическое облучение тела. Нормальные костномозговые клетки должны быть получены от HLA- идентичного донора — сиблинга. Для ТКМ требуется несколько игл большого диаметра для аспирации костного мозга. Донору дают наркоз и помещают в положение на животе. Из обеих задних подвздошных остей делают примерно 200 аспираций. Набирают примерно 1 литр костного мозга, который затем фильтруют и вводят в\в реципиенту. Инфузированные клетки находят дорогу в костный мозг и в течении 3-4 недель, восстанавливают кроветворение. После трансплантации костного мозга рецидивы наступают у немногих больных, а основной причиной смерти являются осложнения трансплантации: отторжение трансплантата, реакция трансплантат против хозяина, иммунодефицит.
Химиотерапия больных острыми лимфобластными лейкозами (ОЛЛ):
прогресс в развитии противолейкозной терапии особенно демонстративен при ОЛЛ. Количество полных ремиссии достигается до 90% детей и 70-80% у взрослых.
Для индукции ремиссии используется следующие программы:
ВПР
винкристин 1.5 мг\м2 1 и 3-й дни
рубомицин 60 мг\м2 3-4-5-й дни
преднизолон 40 мг\м2 ежедневно 8 дней
ЛА-ВРП
L-аспарагиназа 15000 ЕД\м2 1-5
8-12
15-19
22-26 дни
VcR 2 мг в\в 8,15,22 дни
RmC 30-60 мг\м2 8,15.22 дни
преднизолон 40 мг\м2 8-12
15-19
22-26 дни
АЦОП (СНОР)
адриабластин 50 мг\м2 1 день
циклофосфан 750 мг\м2 1 день
онковин 2 мг 1 день
преднизолон 100 мг\м2 1 5 день
Этап консолидации ремиссии осуществляется построением индукционных программ или интенсификация их.
(СНОР, РОМР, СОАР)
СОАР
циклофосфан 50 мг\м2 каждые 8 часов 4 дня
винкристин 2 мг 1 день в\в
(онковир)
цитозар 50 мг\м2 каждые 8 часов
преднизолон 60 мг\м2 внутрь 4 дня.
Поддерживающая терапия в ремиссии ОЛЛ — признанный и необходимый этап терапии (начинается через 7-10 дней после консолидации)
6-меркаптопурин 75 мг\м2 внутрь ежедневно 5 дней в неделю
метотрексат 20 мг\м2 1 раз в неделю на 6 дней
циклофосфан 200 мг\м2 1 раз в неделю 7 дней.
Каждые 2-3 мес проводят курсы усиления (СОАР, РОМР, СНОР).
Профилактика и лечение нейролейкемии:
Профилактика нейролейкоза должна начинаться рано — в периоде индукционной терапии. Многие зарубежные гематологи предпочитают комбинированный метод, включающий облучение головы в суммарной дозе 18-24 Гр и эндолюбальное введение метотрексата 12,5 мг\м2 4-6 раз интервалом 3-5 дней, возможно сочетание метотрексата и цитозара (30 мг\м2 ). Тестом, подтверждающим диагноз, является исследование ликвора, глазного дна, ЭЭГ, присоединение неврологической симптоматики, для лечения — наиболее универсальным средством является интратекальное введение метотрексата в дозе 12,5 мг\м2 каждые 5 дней.
Помимо метотрексата, можно вводить и другие цитостатические препараты: цитозар (30 мг\м2 ), циклофосфан (80-100 мг\м2 ). В случае недостаточного эффекта целесообразно использовать лучевую терапию в локальной разовой дозе 50-200 Гр через 1-2 дня, курс продолжают до клинического эффекта. Лечение нейролейкоза следует продолжать до полной санации ликвора.
Симптоматическая (вспомогательная) терапия ОЛ:
наличие прогрессирующего злокачественного лейкозного процесса, проведение цитостатической терапии, сопровождающейся тяжелым токсическим действием, глубокое нарушение и депрессия нормального гемопоэза на фоне самого процесса, усиливаемые цитостатической терапией, ведут к различной степени декомпенсации клинического состояния больных. Это определяет необходимый объем лечебных мероприятий , называемых зарубежными гематологами поддерживающей (вспомогательной) терапией, терапией прикрытия.
Вспомогательная терапия включает трансфузионную заместительную терапию, дезинтаксикационное лечение, иммунотерапию, лечение инфекционных осложнений, профилактика и лечение нейролейкемии.
Трансфузионная терапия предполагает заместительное лечение переливаниями недостающих компонентов крови? При прогрессирующем снижении содержания гемоглобина ( 60 г\л и менее) показаны переливания эритроцитарной массы, трансфузии концентрата тромбоцитов показаны больным при снижении тромбоцитов ниже 20х109 или при развитии геморрагического синдрома. Трансфузия тромбоцитов обеспечивают остановку кровотечений и понижение тромбоцитов над критическим уровнем, летальность от геморрагического синдрома снижается почти в 3 раза. В борьбе с геморрагическим синдромом используется Е-аминокапроновая кислота, дицинон, адроксон, плазма. Причиной геморрагического синдрома может быть не только тромбоцитопения, но и развитие ДВС-синдрома, который чаще развивается при остром промиелоцитарном лейкозе (М3). Наличие в клетках М3 большого количества гранул, содержащих кислые мукополисахариды, обуславливает развитие ДВС-синдрома, клинически выражающегося в тяжелой кровоточивости. До разработки современных методов лечения М3 основной причиной смерти являлись кровоизлияния в мозг. В настоящее время для купирования геморрагических осложнений при М3 одновременно с химиотерапией применяется гепарин 1,503,0 мг\кг м.т.\сут , большие дозы тромбоцитов (1-2 Ед\10 кг м.т.) и свежезамороженная плазма.
Наиболее эффективными дезинтаксикационными средствами являются гемодез, растворы альбумина, реополиглюкин, солевые растворы, 20% раствор сорбита или 15% раствор маннита.
Управляемая гемодилюция снижает концентрацию токсических веществ в плазме, а последующий форсированный диурез обеспечивает их удаление их организма. Эффективны экстракорпоральные методы: гемосорбция, плазмаферез, плазмосорбция, бластаферез.
Цель иммунотерапии — снятие иммунологической противоопухолевой толерантности , организация активного иммунологического ответа.
Существует активная иммунотерапия, пассивная и адоптивная. Активная иммунотерапия может быть специфической и не специфической. Специфическая — заключается в иммунизации аутологичными или аллогенными клетками другого больного с аналогичным заболеванием . с целью неспецифической активной иммунологической применяется вакцина БЦЖ и др. Пассивная иммунотерапия состоит в введении сывороток, иммуноглобулинов. Адаптивная терапия — это пересадка костного мозга, лимфоидных органов, введение лейкоцитов.
Классификация лейкозов: виды, формы и стадии
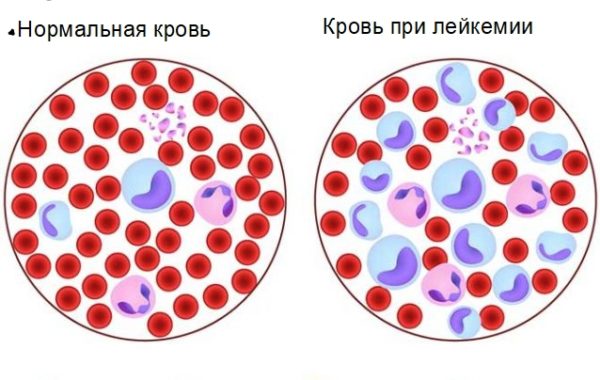
Онкологическими и другими патологическими процессами в организме человека занимается патанатомия. Патофизиология изучает причины возникновения, течение и исход патологического состояния организма. Лейкемия или лейкоз – это злокачественный процесс в костном мозге, нарушающий произведение и деление лейкоцитов. Недозревшая клетка беспорядочно делится и распространяется, при этом заменяет здоровую. По организму расходятся лейкемические инфильтраты.
При лейкозе развивается систёмное поражение организма. Страдают кровеносная, кроветворная и лимфатическая системы, печень, селезёнка и центральная нервная система. Заболевание характеризуют слабость, потеря веса, боли и ломота в теле, присоединение острых инфекционных процессов и т.д. Диагноз подтверждается с помощью лабораторно-инструментальных исследований. Лечение проводят курсами химиотерапии или при помощи трансплантации костного мозга. Болезнь чаще встречается у детей, чем у взрослых. В основном поражает лиц сильного пола.
Аномальные клетки отличаются продолжительной жизнью и активным делением, при этом они не могут быть дифференцированы. Бласты заменяют места других клеток крови.
Причины возникновения болезни
Этиология заболевания заключается в генетических нарушениях человеческого организма, основная причина которых – межхромосомные и внутрихромосомные отклонения. Лейкемия может развиваться на любой стадии кроветворения как первичное моноклоновое заболевание или как вторичное вследствие бесконтрольного разрастания нестабильного клона лейкоза.
Лейкемическая болезнь обычно развивается на фоне других генетических заболеваний, к примеру, при синдроме Дауна или первичном иммунодефиците. Опухолевый процесс может встречаться у людей, чьи близкие родственники имеют в анамнезе онкологическое заболевание.
Состав крови меняется при воздействии на человека радиации, электромагнитных полей, канцерогенных веществ, лучевой и химиотерапии во время лечения других патологий. Механизм развития лейкемии заключается в нарушении нуклеопротеидного обмена. Патогенез обусловлен внедрением в костный мозг опухолевой ткани, которая изменяет нормальный состав крови. Развиваются цитопении, лежащие в основе неясных кровотечений и снижения защитных функций организма.
Классификация лейкозов
Формы лейкоза бывают хронического и острого течения. Острые патологии от лейкозов хронического характера отличает активный рост и деление кроветворных недоразвитых клеток с малой дифференцировкой. В соответствии с цитогенезом выделяют следующие разновидности лейкемии.
Типы острых лейкозов:
- Лимфобластная лейкемия диагностируется у детей в 85% случаев. Состоит из недоразвитых лимфоцитов пролиферативного ростка.
- Миелобластный лейкоз представлен миелобластами и другими видами бластных клеток. Выражен частыми простудными заболеваниями и процессами инфекционного характера.
- Моноцитарная лейкемия основана на предшественниках моноцитов.
- Основа миеломонобластного лейкоза – предшественники моноцитов и гранулоцитов.
- Эритромиелобластный лейкоз представлен повышенным уровнем эритробластов.
- Мегакариобластная форма рака развивается благодаря предшественникам тромбоцитов.
- Недифференцированная опухоль выражена клетками-предшественниками, не имеющими опознавательных признаков, основа которых стволовые и полустволовые клетки.

Виды хронических патологий:
- Миелоцитарные формы рака:
- При миелоцитарном лейкозе в костном мозге и крови накапливаются миелоидные клетки.
- Нейтрофильный лейкоз характеризуется сверхростом клеток костного мозга из-за деления нейтрофильных гранулоцитов.
- Хроническая эозинофильная лейкемия представлена аномальным делением бластных клеток эозинофилов.
- Для базофильного рака характерна группа аномальных клеток из базофилов и миелобластов.
- При миелофиброзе происходит замещение клеток костного мозга волокнистой соединительной тканью.
- При диагнозе «Истинная полицитемия» наблюдается гиперплазия клеток костного мозга.
- Эссенциальный тромбоцитоз представлен атипичным ростом тромбоцитов.
- Лимфоцитарное происхождение:
- При лимфолейкозе происходит скопление аномальных зрелых В-лимфоцитов.
- Миеломная болезнь – опухоль из плазматических клеток.
- Первичную макроглобулинемию Вальденстрема характеризует высокомолекулярный вязкий белок, продуцируемый злокачественными плазматическими клетками.
- Болезнь тяжёлых цепей Франклина представлена парапротеинемическими гемобластозами.
- Болезнь Сезари является лимфоцитомой кожи.
- Моноцитарные формы:
- При моноцитарном лейкозе периферическая кровь содержит преобладающее количество моноцитов.
- Для хронической миеломоноцитарной лейкемии характерны бласты, моноциты, кольцевые сидеробласты и палочки Ауэра в тканях костного мозга и в крови.
- Гистиоцитоз X формирует рубцовую ткань в лёгких и костях благодаря делению гистиоцитов и эозинофилов.


Стадии лейкоза
Классификация лейкозов проводится по количеству лейкоцитов и бластов в крови:
- Лейкемический;
- Сублейкемический;
- Лейкопенический;
- Алейкемический.
По гистогенезу выделяют такие виды рака:
- Недифференцированная лейкемия;
- Миелобластный рак;
- Лимфобластная опухоль;
- Монбластный лейкоз;
- Хроническая миелоидная форма рака;
- Лимфолейкоз;
- Парапротеинемическая лейкемия.
Лейкемия имеет следующую классификацию по ВОЗ:
- Миелопролиферативная опухоль;
- Миелоидная/лимфоидная опухоль с эозинофилией и перестройкой определённых генов;
- Миелодиспластический синдром;
- Острый миелоидный лейкоз (ОМЛ) и родственные опухоли;
- Измененный ОМЛ вследствие миелодисплазии;
- Миелоидные терапевтические опухоли;
- Неуточнённые ОМЛ;
- Саркома миелоидная;


Миелоидная саркома глаза
- Миелоидные новообразования на фоне синдрома Дауна;
- Острые лейкозы неопределённого происхождения;
- В-клеточная лимфома;
- Т-клеточная лимфома.
По международной классификации ФАБ рак крови бывает:
- Острый лимфобластный;
- Острый миелоидный;
- Острый недифференцированный.
По Боброву Н.Н. определяется 5 видов лейкемии:
- Нейтрофильно-эозинопеническая, при которой развиваются воспалительные и гнойные процессы.
- Нейтрофильно-эозинофильная наблюдается при скарлатине, туберкулезе и узелковом периартериите.
- Нейтропеническая фаза угнетения встречается при вирусных инфекциях.
- Протозойная форма диагностировалась при малярии.
- Моноцитарно-лимфоцитарный рак характеризует инфекционные заболевания, к примеру, мононуклеоз и лимфоцитоз.
Патогенетическая классификация связывает рак крови с дисгемопоэтической и гемолитической анемией.
Незлокачественные процессы кроветворения
Лейкемоидные реакции при анализе крови имеют схожие результаты с лейкемией. В сыворотке крови возникают незрелые клетки. Отличия в том, что этот процесс носит непостоянный характер. Развернутая картина заболевания указывает на перенесенные воспалительные процессы или отравления.


Созревание эритроцита
Стадии развития злокачественного процесса
Этапы развития болезни состоят из 7 пунктов:
- Стадия зарождения онкологии;
- Проявление симптомов;
- Вхождение в ремиссию;
- Период отсутствия болезни;
- Вторичный рак;
- Терминальная стадия.
При остром течении болезни больной отмечает слабость, высокую температуру тела, лихорадку, ломоту в костях и суставах, судороги, кровоточивость десен, носовые кровотечения, розовую сыпь, увеличение селезёнки, резкое похудение.
Симптомы проявляются в зависимости от степени поражения организма и наличия вторичных очагов.
По мере развития болезни отмечается воспаление лимфатических узлов на шее, в паху и в подмышечных впадинах, увеличение слюнных желез. Для болезни характерны воспалительные процессы ротовой полости, к примеру, стоматиты и гингивиты, которые не поддаются классическому лечению. Язвы на слизистой оболочке могут увеличиваться и предоставлять больному дискомфорт и боль при приёме пищи.
Последняя стадия рака представлена рвотой, ухудшением зрения, отсутствием речи, болями в суставах и костях, головокружениями, обмороками. У пациента нарушается память, путается сознание, развивается паралич. Злокачественный процесс поражает сердце, головной мозг, лёгкие, органы желудочно-кишечного тракта, почки, органы мочеполовой системы и кожу.


Хроническая форма может развиваться от 4 до 12 лет. Симптомы отсутствуют или слабо выражены. Пик появления признаков приходится на развернутую и терминальную стадии. Атипичные клетки выходят за пределы костного мозга и метастазируют во все органы тела. Больной резко теряет килограммы, внутренние органы увеличиваются, отмечается болевой синдром. Лимфоузлы выпирают над поверхностью кожи. Гнойничковая сыпь распространяется по кожным покровам.
Для миеломы характерно поражение и разрушение костной ткани позвоночника, бедра, рёбер и черепа. Пациент испытывает ломоту и боль в пораженной области. Возникают патологические переломы и кровотечения.
Пациент может скончаться на любом этапе развития болезни, потому что есть риск развития кровотечения внутренних органов, острой сердечной недостаточности или сепсиса.
Лечение проводят с помощью введения в кровоток пациента химиопрепаратов. Интенсивность и продолжительность курсов зависит от стадии и формы заболевания. Для достижения максимального эффекта рекомендовано проведение трансплантации костного мозга.
Хронический лейкоз у взрослых
Лейкоз (лейкемия) является злокачественным заболеванием лейкоцитов (белых кровяных телец). Он возникает в костном мозге и затем поражает кровь, лимфатические узлы, селезенку, печень, центральную нервную систему (ЦНС) и другие органы. Лейкоз может развиваться как у взрослых, так и детей.
Лейкоз подразделяется на многие типы и подтипы, которые имеют свои особенности клинического течения, лечения и прогноза (исхода).
Для лучшего понимания различных типов лейкоза необходимо иметь основные представления о кровеносной и лимфатической системах.
Костный мозг расположен внутри костей. В нем образуются различные клетки крови.
Ранние (молодые, или незрелые) клетки крови носят название стволовых. Эти клетки созревают и превращаются в эритроциты (красные кровяные тельца), лейкоциты и тромбоциты.
Эритроциты переносят кислород из легких в другие ткани и организма. Они же выводят углекислый газ – продукт жизнедеятельности клеток. Уменьшение числа эритроцитов (анемия) приводит к слабости, одышке и повышенной утомляемости.
Лейкоциты помогают в борьбе против вирусов и бактерий. Различают несколько типов и подтипов лейкоцитов, каждый из которых играет особую роль в защите против инфекций.
Выделяют три основных типа лейкоцитов: гранулоциты, моноциты и лимфоциты.
Тромбоциты предотвращают кровотечения при порезах и ушибах.
Лимфатическая система включает в себя лимфатические сосуды, лимфатические узлы и лимфу.
Лимфатические сосуды напоминают вены, но переносят не кровь, а лимфу – прозрачную жидкость, содержащую тканевую жидкость, продукты жизнедеятельности организма и клетки иммунной системы.
Лимфатические узлы располагаются вдоль лимфатических сосудов и накапливают в себе клетки иммунной системы. При воспалении и некоторых других заболеваниях они могут увеличиваться в размерах.
Типы лейкозов
Различают:
острый и хронический лейкозы
лимфоцитарный (лимфобластный) и миелоидный лейкозы
При остром лейкозе болезнь быстро прогрессирует, и хотя клетки растут быстро, они не способны к созреванию.
При хроническом лейкозе опухолевые клетки напоминают нормальные, но отличаются от них. Они живут слишком долго и мешают образованию некоторых видов лейкоцитов.
Лимфоцитарный и миелоидный лейкозы получили свое название в соответствии с клетками, из которых они возникли.
| Острый лимфоцитарный лейкоз (ОЛЛ) (лимфобластный) | Острый миелоидный лейкоз (ОМЛ) (нелимфоцитарный, ОНЛЛ) |
| Встречается чаще у детей, чем у взрослых и составляет более 50% лейкозов детей. | Возникает у детей и взрослых, составляя менее половины всех случаев лейкозов детского возраста. |
| Хронический лимфоцитарный лейкоз (ХЛЛ) | Хронический миелоидный лейкоз (ХМЛ) |
| Поражает взрослых и встречается в 2 раза чаще ХМЛ. | Выявляется преимущественно у взрослых и очень редко у детей и встречается в 2 раза реже ХЛЛ. |
Как часто встречается хронический лейкоз у взрослых?
Хронический лимфоцитарный лейкоз (лимфолейкоз) – наиболее распространенный вид лейкоза в странах Европы и Северной Америки. На его долю приходится 30% среди всех лейкозов.
Ежегодная заболеваемость ХЛЛ в этих странах составляет 3-3,5 на 100 тыс. населения, а среди лиц старше 65 лет – до 20 на 100 тыс.населения.
Около 70% пациентов заболевают между 50 и 70 годами. Средний возраст к началу заболевания составляет 55 лет. Только менее 10% заболевают в возрасте моложе 40 лет.
Мужчины болеют в 2 раза чаще женщин.
Хронический миелоидный лейкоз составляет около 20% среди всех лейкозов. В странах Европы и Северной Америки по частоте распространения ХМЛ занимает 3 место после острых лейкозов и ХЛЛ. Ежегодная заболеваемость составляет 1-1,5 на 100 тыс. населения во всех странах и остается практически стабильной на протяжении последних 50 лет.
Мужчины заболевают несколько чаще женщин, составляя 55-60% больных. Половина пациентов заболевают в возрасте 30-50 лет, чаще всего между 30-40 годами. У детей типичный ХМЛ встречается редко, составляя не более 1-2% случаев детских лейкозов.
Причины возникновения хронического лейкоза и возможность его предотвращения
В настоящее время известны некоторые факторы риска, связанные с развитиемразвитием хронического лейкоза. Так, воздействие высоких доз радиации при взрыве атомной бомбы или аварии на атомном реакторе повышает риск хронического миелоидного лейкоза, но не хронического лимфоцитарного лейкоза.
Длительный контакт с гербицидами или пестицидами среди сельских жителей может повысить риск возникновения хронического лимфоцитарного лейкоза.
Высоковольтные линии передач, возможно, являются фактором риска развития лейкоза.
У большинства больных лейкозом не выявлены факторы риска, поэтому не существует способов предотвращения этого заболевания. Исключение составляет курение, которое повышает риск возникновения лейкоза.
Диагностика хронического лейкоза
В настоящее время еще не разработаны методы раннего выявления хронического лейкоза. При появлении у необычных симптомов необходимо срочно обратиться к врачу.
У 50% больных хроническим лейкозом отсутствуют какие-либо симптомы в момент выявления заболевания. У этих пациентов заболевание диагностируется по данным анализа крови, выполненного по другому поводу.
Общие симптомы хронического лейкоза могут включать повышенную утомляемость, слабость, потерю веса, повышение температуры и боли в костях. Большинство из этих симптомов связаны со снижением количества клклеток крови.
Анемия (малокровие) возникает в результате уменьшение количества эритроцитов, что приводит к одышке, повышенной утомляемости и бледности кожи.
Снижение числа нормальных лейкоцитов повышает риск инфекционных заболеваний. У больных лейкозом количество лейкоцитов может быть значительно повышено, однако эти опухолевые клетки не защищают от инфекции.
Уменьшение числа тромбоцитов сопровождается кровоизлияниями, кровотечениями из носа и десен.
Распространение лейкоза из костного мозга в другие органы и центральную нервную систему может привести к головной боли, слабости, судорогам, рвоте, нарушению зрения.
Лейкоз может сопровождаться увеличением лимфатических узлов, печени и селезенки.
Методы диагностики
Анализ крови. По количеству клеток крови и их виду под микроскопом можно заподозрить лейкоз. У большинства больных хроническим лейкозом имеется повышенное количество лейкоцитов, снижение числа эритроцитов и тромбоцитов.
Биохимический анализ крови помогает уточнить функцию почек и состав крови.
Исследование костного мозга дает возможность установить диагноз лейкоза и оценить эффективность лечения.
Спинно-мозговая пункция позволяет выявить опухолевые клетки в спинно-мозговой жидкости и провести лечение путем введения химиопрепаратов.
С целью уточнения типа лейкоза используются специальные методы исследования: цитохимия, проточная цитометрия, иммуноцитохимия, цитогенетика и молекулярно-генетическое исследование.
Рентгенологические исследования грудной клетки и костей позволяют выявить поражение лимфатических узлов средостения, костей и суставов.
Компьютерная томография (КТ) дает возможность обнаружить поражение лимфатических узлов в грудной полости и животе.
Магнитно-резонансная томография (МРТ) особенно показана при исследовании головного и спинного мозга.
Ультразвуковое исследование (УЗИ) позволяет отличить опухолевые и кистозные образования, выявить поражение почек, печени и селезенки, лимфатических узлов.
Стадии хронического лейкоза
В зависимости от степени распространения заболевания при большинстве злокачественных опухолей определяется стадия – от 1 до 4.
Однако, лейкоз является системным заболеванием, при котором к моменту диагностики имеется поражение костного мозга и других органов, поэтому при лейкозе стадия не определяется.
Для оценки прогноза (исхода) заболевания учитываются другие характеристики, влияющие на выбор тактики лечения.
Лечение хронического лейкоза
Лечение больных хроническим лейкозом зависит от типа заболевания и прогностических факторов.
Лекарственный метод является основным при лечении хронического лейкоза.
Выбор тактики лечения больных ХЛЛ зависит как от распространенности опухолевого процесса, так и от наличия определенных симптомов. С учетом этих факторов, а также клеточных и хромосомных изменений, больные подразделяются на группы риска.
Группа низкого риска.
Прогноз (исход) заболевания у пациентов этой группы благоприятный. Средняя выживаемость составляет 20-25 лет. Обычно лечение не назначается, а рекомендуется тщательное наблюдение. Лишь в случае дальнейшего развития болезни или появления неприятных симптомов применяется лечение.
Группа промежуточного и высокого риска.
У больных при отсутствии симптомов от лечения можно временно воздержаться. При появлении признаков прогрессирования заболевания или новых симптомов может быть назначена терапия.
Химиоптерапия проводится, как правило, противоопухолевым препаратом хлорамбуцилом. При появлении выраженных побочных эффектов этот препарат может быть заменен на циклофосфамид. Иногда используются стероидные препараты (преднизон).
У некоторых больных применяют комбинированную химиотерапию с включением циклофосфамида, доксорубицина, винкристина.
Флюдарабин применяется обычно при рецидиве (возврате) заболевания после лечения комбинацией препаратов. У молодых больных этот препарат можно применять в самом начале лечения. При увеличении селезенки или лимфатических узлов возможно назначение лучевой терапии в низких дозах. В случае появления выраженных симптомов, связанных со значительным увеличением селезенки, выполняется удаление селезенки.
Больным с большим количеством лейкоцитов, нарушающим кровоток, до химиотерапии показан лейкаферез (удаление избытка лейкоцитов, включая опухолевые клетки). Эффект наступает быстро, но бывает временным.
В редких случаях применяется трансплантация стволовых клеток, однако эффективность данного метода еще не доказана.
Иногда ХЛЛ может трансформироваться (превращаться) в острый лейкоз или агрессивную неходжкинскую лимфому (лимфосаркому).
Лечение хронического миелоидного лейкоза (миелолейкоза) в зависимости от фазы заболевания.
Выбор тактики лечения больных с ХМЛ зависит от фазы заболевания (хроническая, акселерации, бластный криз), возраста больного, прогностических факторов и наличия подходящего донора.
Хроническая фаза.
Применение препарата гливек (иматиниб) приводит к достижению полного эффекта у 90% больных ХМЛ.
До этого использовалась химиотерапия высокими дозами препаратов в сочетании с тотальным облучением и трансплантацией стволовых клеток.
Фаза обострения.
Применение гливека может привести к достижению ремиссии (отсутствию признаков болезни), однако период улучшения длится недолго. Использование интерферона также не позволяет получать длительные ремиссии. У 20% больных отмечается положительный ответ на химиотерапию, но он длится не более 6 месяцев.
Приблизительно 15% больных в этой фазе ХМЛ живут в течение нескольких лет после трансплантации стволовых клеток. Эту процедуру лучше выполнять молодым больным после эффективной химиотерапии.
Бластный криз.
В этой фазе болезни опухолевые клетки напоминают таковые при остром миелоидном лейкозе (ОМЛ), причем они мало чувствительны к химиотерапии. Если же и достигается положительный эффект, то он бывает кратковременным. В этом случае возможно применение трансплантации стволовых клеток.
У некоторых больных опухолевые клетки напоминают клетки острого лимфобластного лейкоза (ОЛЛ), которые более чувствительны к химиотерапии. Поэтому использование винкристина, доксорубицина и преднизона может привести к ремиссии.
При поражении центральной нервной системы у больных ХМЛ применяется цитарабин, вводимый в спинномозговой канал, или облучение головного мозга.
-Лекция №4 ГЕМОБЛАСТОЗЫ
Лекция 4
ГЕМОБЛАСТОЗЫ
• Гемобластозы — опухолевые заболевания кроветворной и лимфатической ткани. Гемобластозы подразделяют на системные заболевания — лейкозы, а также регионарные — лимфомы.
Отличия между лейкозами и лимфомами заключаются не только в наличии или отсутствии системности поражения. Известно, что в терминальной стадии лимфомы дают обширное мета-стазирование, в том числе и в костный мозг. Другим важным отличием лейкозов от лимфом является то, что при лейкозах опухоль первично возникает на «территории» костного мозга, а при лимфомах костный мозг поражается вторично в результате ме-тастазирования.
При лейкозах опухолевые клетки, как правило, обнаруживаются в крови, поэтому в литературе используется термин для обозначения лейкозов, предложенный еще Р.Вирховым, «лейкемия».
В последние годы в литературе широко обсуждается вопрос о существовании предопухолевой стадии лейкозов и лимфом. Предлагаются термины «предлейкоз» и «предлимфома» для обозначения состояний с различными качественными и количественными изменениями кроветворной ткани, нередко предшествующими развитию гемобластозов.
Эпидемиология. Опухоли кроветворной и лимфоидной ткани в числе пяти самых распространенных опухолей человека. Среди опухолей детей первых 5 лет жизни на их долю приходится 30 % случаев.
Этиология. Как все опухоли, гемобластозы могут вызываться разнообразными мутагенными факторами экзогенного и эндогенного происхождения, действующими на стволовые и полустволовые клетки-предшественницы. Большое значение в возникновении ряда гемобластозов имеет наследственный фактор.
Роль ионизирующей радиации в возникновении гемобласто-юв доказывается наблюдениями за пациентами, заболевшими
311
лейкозами и лимфомами через определенное время после атомной бомбардировки Японии, аварий на АЭС, ядерных испытаний. Описаны случаи заболеваний у людей, получавших радиотерапию, а также у врачей-радиологов. Известен цитогенетический маркер радиационного поражения — кольцевидная хромосома. Достоверно установлена связь между радиационным поражением и развитием острого и хронического миелолейкоза, острого эри-тромиелоза и острого лимфобластного лейкоза у детей.
Роль химических канцерогенов доказывается данными экспериментов, наблюдениями за пациентами, работавшими на вредных предприятиях с использованием бензола, а также за больными, получавшими цитостатическую терапию по поводу других онкологических заболеваний. Использование таких цитостатиче-ских препаратов, как мелфалан, азатиоприн, лейкеран, миелосан, антибиотика левомицетина, может приводить к возникновению острого и хронического миелолейкоза, острого миеломонобласт-ного лейкоза и эритромиелоза.
Роль вирусов в качестве этиологического фактора гемобла-стозов трактуется неоднозначно. В развитии гемобластозов человека доказано участие лишь двух вирусов: вируса Эпштейна — Барр (африканская лимфома Беркитта) и Т-лимфоцитарного вируса лейкоза человека первого типа (Т-клеточная лимфома и Т-клеточные лейкозы). Имеются экспериментальные данные, доказывающие прямое канцерогенное действие вирусов на гемопо-этические клетки посредством вирусных онкогенов. Однако в большинстве ситуаций внедрение вирусов в клетку вызывает лишь иммортализацию (бессмертие) последней, на фоне которой возникают дополнительные перестройки генома, ведущие к злокачественной трансформации (многоступенчатый канцерогенез).
Роль наследственности в развитии гемобластозов подтверждается частым развитием лейкозов у людей с наследственными заболеваниями со спонтанными разрывами хромосом (болезни Дауна, Блума, анемия Фанкони), с нерасхождением половых хро мосом (болезни Клайнфелтера, Тернера), а также существовани ем «лейкозных семей». Нередко лейкозы развиваются у пациен тов с наследственными дефектами иммунитета (атаксия-телеан гиэктазия, или синдром Луи-Бар, синдром Вискотта — Олдрид жа, болезнь Братона).
Патогенез. Множество этиологических факторов, воздейст вуя на стволовые и полустволовые гемопоэтические клетки, при водят к одинаковым результатам — злокачественной трансфор мации. Следовательно, существует так называемое узкое место через которое могут осуществлять свое воздействие различные агенты. Такое место, вероятнее всего, находится в геноме кле
312
ток, где располагаются протоонкогены и антионкогены. При этом могут происходить усиление экспрессии, амплификация, точечная мутация или другие изменения протоонкогенов, превращение их в клеточные онкогены, что приводит к развитию опухоли. Хромосомные перестройки могут привести к передислокации протоонкогена в зону влияния гена-энхансера, превращению его в клеточный онкоген и усилению экспрессии. Так, при лим-фоме Беркитта происходит реципрокная транслокация между хромосомами 8 и 14q32. Клеточный онкоген с-тус из хромосомы 8 перемещается на хромосому 14 и попадает в зону действия генов, регулирующих синтез тяжелых цепочек иммуноглобулинов. Описанные изменения сочетаются также с точечной мутацией N-ras.
При хроническом миелолейкозе нередко встречается филадельфийская хромосома, образовавшаяся в результате реципрок-ной транслокации между хромосомами 9 и 22. Образуется новый ген-гибрид c-abl-bcr, белковый продукт которого обладает тиро-зинкиназной активностью. Онкогены обычно встраиваются в разрывы хромосом. Так, при В-лимфоцитарных лимфомах и лейкозах происходят разрывы в хромосоме 14 в локусе 32q, где локализуются гены тяжелых цепочек иммуноглобулинов. При Т-лим-фоцитарных лейкозах и лимфомах — в локусе llq гена а-цепо-чек рецепторов Т-лимфоцитов.
Морфогенез. Развитие гемобластозов начинается с малигни-зации одной стволовой или полустволовой клетки, дающей пул опухолевых клеток. Это означает, что все гемобластозы имеют моноклоновое происхождение. Моноклоновость происхождения подтверждается экспериментальными и клиническими данными по обнаружению во всех опухолевых клетках одного и того же больного клоновой метки — хромосомной или изоферментной. Например, во всех опухолевых клетках при хроническом миелолейкозе присутствует филадельфийская хромосома.
Стволовые клетки составляют примерно 0,01—0,001 % всей популяции костномозговых клеток. Рост и дифференцировка стволовых и полустволовых клеток-предшественниц управляются факторами роста (схема 34) и стромальным микроокружением, что подтверждается экспериментами с клеточными культурами, где рост и дифференцировка клеток происходят только в присутствии факторов роста или стромальных клеток. Стро-мальные клетки, вероятно, также выделяют факторы роста, свя-заные с их клеточными мембранами, а также гепарансульфата-ми стромы, обеспечивая тем самым локальный рост.
313
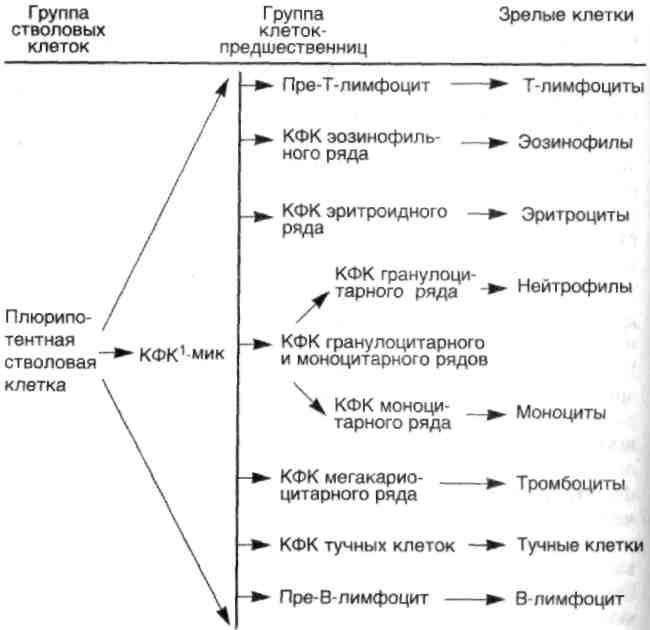
Схема 34. Структура гемопоэтической системы
1 Колониеформирующая клетка, син, колониеобразующая клетка (КОЕ).Результаты работ по изучению морфологии и клеточной кинетики гемобластозов, в первую очередь лейкозов, показали, что при развитии опухолей происходит не только малигнизация на уровне стволовых и полустволовых клеток-предшественниц, но также развивается блок дифференцировки в пуле опухолевых клеток.
ЛЕЙКОЗЫ
При лейкозах опухолевая ткань первоначально разрастается на «территории» костного мозга и постепенно замещает нормальные ростки кроветворения. Механизмы этого явления мало изучены. Вероятно, речь идет не о простом механическом вытеснении, а скорее о подавлении нормальных ростков клоном лей-козных клеток с участием особых факторов и контактного тор
314
можения. В результате этого процесса у больных лейкозами закономерно развиваются различные варианты цитопений — анемия, тромбоцитопения, лимфоцитопения, гранулоцитопения, что приводит к повышенной кровоточивости, кровоизлияниям, подавлению иммунитета с присоединением инфекционных осложнений.
Метастазирование при лейкозах сопровождается появлением лейкозных инфильтратов в различных органах — печени, селезенке, лимфатических узлах и др. В органах могут развиваться изменения, обусловленные обтурацией сосудов опухолевыми клетками — инфаркты, язвенно-некротические осложнения.
Принципы классификации лейкозов. Выделяют пять основных принципов классификации: по характеру течения лейкозов; по степени дифференцировки опухолевых клеток; в соответствии с цитогенезом; на основе иммунного фенотипа опухолевых клеток; по общему числу лейкоцитов и наличию бластных клеток в периферической крови.
По характеру течения выделяют острые, протекающие менее года, и хронические, существующие длительное время.
По степени дифференцировки опухолевых клеток выделяют недифференцированные, властные и цитарные лейкозы.
При высоком блоке дифференцировки лейкозные клетки могут напоминать стволовые и бластные клетки первых четырех классов клеток-предшественниц [Чертков И.Л., Воробьев А.И., 1993]. Поэтому по степени дифференцировки эти лейкозы называют властными и недифференцированными. Поскольку они протекают остро, то можно говорить, что острые лейкозы — это бластные и недифференцированные лейкозы.
При низком блоке дифференцировки лейкозные клетки напоминают процитарные и цитарные клетки-предшественницы, лейкозы протекают менее злокачественно, хронически и называются цитарными.
Цитогенетические варианты лейкозов основываются на представлениях о кроветворении (см. схему 34). Острые лейкозы по цитогенезу подразделяются на лимфобластный, миелобластный, монобластный, миеломонобластный, эритроми-елобластный, мегакариобластный, недифференцированный. Хронические лейкозы представлены лейкозами миелоцитарного происхождения (хронический миелоцитарный лейкоз, хронический нейтрофильный лейкоз, хронический эозинофильный лейкоз, хронический базофильный лейкоз, миелосклероз и др.), лим-фоцитарного происхождения (хронический лимфолейкоз, пара-протеинемические лейкозы: миеломная болезнь, первичная мак-роглобулинемия Вальденстрема, болезнь тяжелых цепей Франк-
315
лина; лимфоматоз кожи — болезнь Сезари и др.), моноцитарно-го происхождения (хронический моноцитарный лейкоз, гистио-цитоз X).
Иммунный фенотип опухолевых клеток.В настоящее время стало возможным проводить более точное ти-пирование опухолевых клеток в зависимости от их иммунного фенотипа по экспрессии CD 19, CD20, CD5, легких цепочек иммуноглобулинов и других антигенных маркеров.
По общему числу лейкоцитов в периферической крови и наличию лейкозных клеток выделяют лейкемические (более 50—80 • 109/л лейкоцитов, в том числе бластов), сублейкемические (50—80 • 109/л, в том числе бласты), лейкопенические (содержание лейкоцитов в периферической крови ниже нормы, но есть бласты), алейкемические (содержание лейкоцитов в периферической крови ниже нормы, бласты отсутствуют).
Морфологическое исследование имеет большое значение в диагностике лейкозов. Основными методами прижизненной морфологической диагностики являются исследования мазков периферической крови и биоптатов костного мозга, которые получают при трепанации гребешка подвздошной кости или пункции грудины, а также других органов.
Острые лейкозы
Различные формы острого лейкоза имеют стереотипные морфологические проявления: лейкозная инфильтрация костного мозга в виде очаговых и диффузных инфильтратов из клеток с крупными светлыми ядрами, содержащими по нескольку ядрышек. Размеры и очертания ядер, а также ширина ободка цитоплазмы могут варьировать. Бласты составляют 10—20 % костномозговых клеток. Цитогенетическую принадлежность бластов, как правило, можно выявить только с помощью специальных методов исследования — цитохимических и иммуногистохимиче-ских. Применяются реакции на пероксидазу, окраска на липиды Суданом черным, ШИК-реакция, гистоферментохимические реакции на выявление неспецифической эстеразы, хлорацетатэсте-разы, кислой фосфатазы, Иммуногистохимически возможно определение маркеров В-, Т-лимфоцитов, клеток миелоидного и моноцитарного рядов.
В периферической крови и в костном мозге описывается феномен лейкемического провала («hiatus leucemicus»), развивающийся за счет наличия только бластных и дифференцированных клеток и отсутствия промежуточных форм.
В костномозговой ткани происходят вытеснение нормальных клеток гемопоэза опухолевыми, истончение и резорбция ретику-
лярных волокон, нередко развивается миелофиброз. При цито-статической терапии происходит опустошение костного мозга с гибелью бластных форм, увеличивается число жировых клеток и разрастается соединительная ткань.
Лейкозные инфильтраты в виде диффузных или очаговых скоплений обнаруживаются в лимфатических узлах, селезенке и печени. Это приводит к увеличению размеров этих органов. В печени характерно развитие жировой дистрофии. В связи с лейкоз-ной инфильтрацией слизистых оболочек полости рта и ткани миндалин появляются некротический гингивит, тонзиллит — некротическая ангина. Иногда присоединяется вторичная инфекция и развивается сепсис, приводящий больных к смерти.
В результате тромбоцитопении, повреждения печени и стенок сосудов у больных острыми лейкозами нередко возникает геморрагический синдром вплоть до развития смертельных осложнений — кровоизлияний в головной мозг и желудочно-кишечных кровотечений.
Использование активной цитостатической терапии повлияло на течение острых лейкозов, т.е. привело к индуцированному лекарственному патоморфозу. В связи с этим в настоящее время выделяют следующие клинические стадии заболевания: первая атака, ремиссия (полная или неполная), рецидив (первый, повторный).
Наибольшее значение среди острых лейкозов имеют острый лимфобластный и острый миелобластный лейкозы.
Острый лимфобластный лейкоз. Самый распространенный лейкоз в детском и юношеском возрасте. Пик заболеваемости приходится на возраст от 1 года до 6 лет. Протекает с поражением костного мозга, лимфатических узлов, селезенки, вилочковой железы, а также других органов. Центральная нервная система обычно вовлекается при рецидивах заболевания после химиотерапии. В костном мозге, периферической крови и в других органах обнаруживаются опухолевые клетки типа лимфобластов с ШИК-положительными гранулами в цитоплазме, не дающие реакций на пероксидазу, эстеразы и не содержащие липиды.
В 2/3 случаев в опухолевых клетках обнаруживаются цитоге-нетические нарушения в виде полиплоидии, филадельфийской хромосомы и реципрокной транслокации между хромосомами 8 и 14.
Цитогенез острого лимфобластного лейкоза связан с предшественниками Т- и В-лимфоцитов. На Т-клеточные лейкозы в странах Европы приходится 10—15 % наблюдений. Преобладают В-клеточные лейкозы.
Руководствуясь иммунологическими фенотипами опухолевых клеток, выделяют несколько форм лимфобластного лейкоза, что имеет значение для выбора терапии и прогноза. Преобладающие
316
317
В-лимфобластные лейкозы представлены ранним, промежуточным и поздним вариантами, отличающимися по экспрессии пара-глобулина CD 10, поверхностного иммуноглобулина и активности терминальной диоксинуклеотидтрансферазы. Маркерами Т-лимфобластного лейкоза являются антигены CD7 и Т-рецепто-ров.
У детей преобладает промежуточный вариант, у взрослых — ранний и промежуточный. Прогноз у детей значительно лучше, чем у взрослых. Выживаемость составляет соответственно 60 и 30 %. Наихудший прогноз при Т-лимфобластном лейкозе.
Острый миелобластный лейкоз. Наиболее частая форма заболевания у взрослых с относительно хорошим прогнозом — ремиссии наступают у 70—80 % больных, полные ремиссии — у 25 % больных.
Описываются наблюдения развития острого миелобластного лейкоза у людей, подвергшихся радиационному воздействию, контактирующих с бензолом (кожевенная индустрия в Турции, производство синтетических клеев и др.), принимавших цитоста-тические препараты, а также у страдающих наследственными заболеваниями — болезнью Дауна, анемией Фанкони, синдромом Блума.
Опухолевые клетки имеют типичные для миелобластов цитохимические маркеры: ШИК-положительную диффузно окрашенную цитоплазму, содержат липиды, пероксидазу, эстеразы. Опухолевые клетки инфильтрируют костный мозг, приобретающий макроскопически пиоидный вид, селезенку, печень, лимфатические узлы, слизистую оболочку желудочно-кишечного тракта, что сопровождается язвенно-некротическими и геморрагическими осложнениями. В 1/3 случаев лейкозные инфильтраты обнаруживаются в легких («лейкозный пневмонит»), в 114 — в оболочках мозга («лейкозный менингит»). По иммунологическим фенотипам выделяют 6 вариантов заболевания.
Больные умирают от кровоизлияний в головной мозг, желудочно-кишечных кровотечений и инфекционных осложнений. Лечение цитостатиками изменило проявления заболевания, удлинило жизнь больным.
Хронические лейкозы
Хронические лейкозы отличаются от острых цитарной диф-ференцировкой опухолевых клеток, более длительным стадийным течением.
Первая стадия заболеваний характеризуется присутствием одного клона опухолевых клеток, течет годами, относительно доброкачественно, хронически и называется м о н о -клоновой, доброкачественной.
318
ь Вторая стадия обусловлена появлением вторичных опухолевых клонов, характеризуется быстрым, злокачественным течением с появлением множества бластов и называется злокачественной, поликлоновой стадией, или стадией властного криза. 80% больных хроническими лейкозами погибают в стадии властного криза.
Результаты цитогенетических исследований показали, что злокачественная трансформация кроветворных клеток при хронических лейкозах может происходить на очень ранних стадиях — на стадиях стволовых клеток. Цитарный характер лейкозов обусловлен низким блоком дифференцировки в опухолевых клетках.
При хронических лейкозах лейкозные инфильтраты обнаруживаются в костном мозге, где в связи с длительными течением и цитостатической терапией нередко развивается миелофиброз в печени, селезенке и лимфатических узлах, которые иногда достигают значительных размеров.
Хронические лимфоцитарные лейкозы. Эти формы лейкозов объединяются в две группы. Первая — хронический лимфолей-коз и примыкающие к нему болезнь Сезари (лимфоматоз кожи), Т-клеточный лимфоцитарный лейкоз, пролимфоцитарный лейкоз (В-клеточный), волосато-клеточный лейкоз (В-клеточный). Вторая группа — парапротеинемические лейкозы. Наибольшее значение имеет хронический лимфолейкоз.
Хронический лимфолейкоз. Встречается обычно у лиц старше 40 лет, чаще в пожилом возрасте. Мужчины болеют в два раза чаще женщин. Заболеваемость достигает 6 случаев на 100 000 населения.
Цитогенез — в 95 % случаев из ранних В-клеток. Опухолевые клетки напоминают пролимфоциты и малые лимфоциты и экс-прессируют параглобулины CD 19, CD20, CD5.
В клинической картине преобладают лимфаденопатия, анемия (нередко аутоиммунная), тромбоцитопения, гранулоцитопе-ния, имеются выраженная иммунодепрессия и предрасположенность к инфекционным осложнениям. Прогноз относительно хороший, заболевание протекает длительно с высокими показателями выживаемости. Однако в финале может развиться властный криз.
Лейкозные инфильтраты диффузно поражают костный мозг, лимфатические узлы, которые могут достигать значительных размеров, образуя мягкие или плотноватые пакеты, а также сдавливать соседние органы. Селезенка резко увеличена, в отдельных случаях ее масса составляет несколько килограммов. Печень увеличена в меньшей степени.
Больные умирают обычно от инфекционных осложнений. Описаны наблюдения трансформации хронического лимфолеи-коза в неходжкинские лимфомы.
319
Парапротеинемические лимфолейкозы.В эту группу входят три заболевания — миеломная болезнь, первичная макроглобулинемия Вальденстрема и болезнь тяжелых цепей Франклина. Особенностью парапротеинемических лейкозов, которые также называются злокачественными иммунопро-лиферативными заболеваниями, является способность опухолевых клеток синтезировать однородные иммуноглобулины или их фрагменты — парапротеины, что связано с цитогенезом опухолевых клеток. Опухолевые клетки при парапротеинемических лейкозах дифференцируются по плазмоцитарному типу, сохраняя в извращенной форме особенность плазматических клеток синтезировать иммуноглобулины.
Наибольшее значение среди парапротеинемических лейкозов имеет миеломная болезнь.
Миеломная болезнь (болезнь Рустицкого — Калера, множественная миелома, генерализованная плазмоцитома) встречается в основном у взрослых. Описаны единичные наблюдения у людей моложе 30 лет. Свое название заболевание и опухолевая клетка получили в связи с преимущественной локализацией процесса на «территории» костного мозга (миелон — костный мозг).
Выделяют несколько вариантов миеломной болезни в зависимости от характера распространения миеломных инфильтратов в костном мозге, от характера миеломных клеток и от типа синтезируемого парапротеина.
По характеру распространенности опухолевого инфильтрата в костном мозге выделяют диффузную, диффузно-узловатую, множественно-узловатую формы миеломы; по клеточному составу — плазмоцитарную, плазмобластную, полиморфно-клеточную и мелкоклеточную миелому [Струков А.И., 1959].
В зависимости от способности секретировать различные типы парапротеинов различают несколько вариантов миеломной болезни: несекретирующие, диклоновые миеломы, миелому Бенс-Джонса, G-, А-, М-миеломы. Наиболее часто встречаются G-, А-миелома, миелома Бенс-Джонса, на долю которых приходится 75, 20 и 15 % наблюдений соответственно.
Опухолевая ткань разрастается преимущественно в плоских костях (череп, ребра, таз) и в позвоночнике, инициируя в них ос-теолизис, остеопороз. На рентгенограмме очаги поражения имеют вид гладкостенных пробоин. Полости образуются в местах роста миеломных клеток за счет активации ими остеокластов, осуществляющих лизис и резорбцию костной ткани (пазушное рассасывание). Высказываются предположения, что в качестве активирующих остеокласты субстанций могут выступать интер-лейкин-1 и бета-трансформирующий фактор роста, выделяемые миеломными клетками. Помимо костного мозга, опухолевые ин-фильтраты могут обнаруживаться и в других органах.
Осложнения миеломной болезни развиваются вследствие деструкции костной ткани — патологические переломы, боли в ко-
320
стях, а также из-за продукции парапротеинов — амилоидоз (AL-амилощоз), парапротеинемическая кома и парапротеиноз органов.
Хронические миелоцитарные лейкозы. Группа лейкозов, содержащих опухолевые клетки типа процитарных и цитарных предшественников миелоидного ряда. В эту группу входят хронический миелоцитарный лейкоз с или без филадельфийской хромосомы, ювенильный хронический миелоцитарный лейкоз, хронический нейтрофильный лейкоз, хронический эозинофильный лейкоз, первичный миелофиброз (мегакариоцитарная диффе-ренцировка опухолевых клеток). Разнообразие форм хронических миелоцитарных лейкозов обусловлено существованием общей клетки-предшественницы гранулоцитарного, моноцитарно-го, мегакариоцитарного, эозинофильного и базофильного ростков. При развитии всех этих форм злокачественная трансформация, вероятно, происходит на уровне плюрипотентной стволовой клетки миелоидного ростка, так как цитогенетические маркеры можно обнаружить во всех ветвях этого ростка.
Хронический миелолейкоз представляет наибольший практический интерес. Это нередкое заболевание, на долю которого приходится 15 % всех случаев лейкоза. В США ежегодно регистрируется 2500 новых случаев. Встречается в любом возрасте, немного чаще у лиц мужского пола. В развитии заболевания имеют значение те же этиологические факторы, что и при остром миелобластном лейкозе.
Цитогенетическим маркером заболевания является филадельфийская хромосома, свидетельствующая также и о плохом прогнозе.
Заболевание протекает в две или даже три стадии: хроническая стадия, промежуточная (выделяется клиницистами, так как требует особых терапевтических мероприятий) и бласттранс-формации.
Хроническая стадия длится 3—4 года, нередко не имеет клинических проявлений. Морфологически в эту стадию обнаруживают сплено- и гепатомегалию, анемию. В костном мозге, периферической крови, в селезенке, печени и лимфатических узлах обнаруживают увеличение про- и цитарных форм миелоидного ростка, имеющих маркеры одного опухолевого клона.
Промежуточная стадия сопровождается нарастанием слабости, повышением температуры тела, появлением клеток с новыми цитогенетическими отклонениями, резистентных к применявшимся ранее цитостатикам, прогрессированием сплено- и гепато-мегалии. Эта стадия длится несколько месяцев, но при правильно назначенном лечении может быть пролонгирована.
Стадия бласттрансформации — властного криза — заканчивается смертью больных, несмотря на проводимую терапию, в
321
очень короткие сроки. В инфильтратах в костном мозге и во внутренних органах, а также в периферической крови появляются бластные формы (12—25 %), опухолевые клоны с новыми цито-генетическими нарушениями.
У 10 % больных заболевание заканчивается миелофиброзом, обусловленным действием цитостатиков. Другой причиной мие-лофиброза может быть двухростковая пролиферация клеток типа цитарных предшественников грануло- и мегакариоцитарного ростков. Последние продуцируют фактор роста тромбоцитов, активирующий фибробласты.
На аутопсии имеются характерные изменения внутренних органов: пиоидный костный мозг, значительные сплено- и генато-мегалия, умеренное увеличение лимфатических узлов.
ЛИМФОМЫ
• Лимфомы — регионарные злокачественные опухоли лимфо-идной ткани. Имеют моноклоновое происхождение, что используется при их диагностике и дифференциальной диагностике с реактивными гиперпластическими процессами в лимфоидной ткани.
Диагноз лимфом устанавливается прежде всего при биопсии
лимфатических узлов.
Классификация. В настоящее время используется несколько классификаций лимфом: H.Rappoport (1966), R.G.Lukes — R.D.Collins (1973—1974), R.E.A.L., кильская и ВОЗ, включающая в себя обе эти классификации.
Классификация лимфом [R.E.A.L. и кильская, 1996]
Лейкозы острый лейкоз
Определение. Острый лейкоз – миелопролиферативная опухоль, субстратом которой являются бласты, лишенные способности дифференцироваться в зрелые клетки крови.
МКБ10: С91.0 – Острый лимфобластный лейкоз.
С92.0 – Острый миелоидный лейкоз.
С93.0 – Острый моноцитарный лейкоз.
Этиология. Латентная вирусная инфекция, предрасполагающая наследственность, воздействие ионизирующей радиации способны вызывать соматические мутации в кроветворной ткани. Среди мутантных полипотентных клеток, близких к стволовой клетке, может сформироваться клон нечувствительный к иммунорегуляторным воздействиям. Из мутантного клона формируется интенсивно пролиферирующая и метастазирующая за пределы костного мозга опухоль, состоящая из бластов одного вида. Отличительной особенностью опухолевых бластов является неспособность к дальнейшей дифференциации в зрелые клетки крови.
Патогенез. Важнейшим звеном патогенеза острого лейкоза является конкурентное метаболическое подавление аномальными бластами функциональной активности нормальной кроветворной ткани и вытеснение ее из костного мозга. В результате возникают апластическая анемия, агранулоцитоз, тромбоцитопения с характерными геморрагическим синдромом, тяжелыми инфекционными осложнениями вследствие глубоких нарушений во всех звеньях иммунитета, глубокими дистрофическими сдвигами в тканях внутренних органов.
Согласно классификации FAB (кооперативная группа гематологов Франции, Америки и Британии, 1990 г.) выделяют:
Острые лимфобластные лейкозы подразделяются на 3 типа:
L1 — острый микролимфобластный тип. Антигенные маркеры бластов соответствуют нулевым («ни Т, ни В») или тимусзависимым (Т) линиям лимфопоэза. Встречается главным образом у детей.
L2 — острый лимфобластный. Его с субстрат — типичные лимфобласты, антигенные маркеры которых такие же как и при L1 типе острого лейкоза. Чаще встречается у взрослых.
L3 — острый макролимфоцитарный и пролимфоцитарный лейкоз. Бласты имеют антигенные маркеры В-лимфоцитов, морфологически схожи с клетками лимфомы Беркитта. Этот тип встречается редко. Отличается очень плохим прогнозом.
Острые нелимфобластные (миелогенные) лейкозы делятся на 6 типов:
М0 — острый недифференцированный лейкоз.
М1 — острый миелобластный лейкоз без вызревания клеток.
М2 — острый миелобластный лейкоз с признаками вызревания клеток.
М3 — острый промиелоцитарный лейкоз.
М4 — острый миеломонобластный лейкоз.
М5 — острый монобластный лейкоз.
М6 — острый эритромиелоз.
Клиническая картина. В клиническом течении острых лейкозов выделяют следующие стадии:
Начальный период (первично-активная стадия).
В большинстве случаев начинается остро, часто в виде «гриппа». Внезапно повышается температура тела, появляются озноб, боли в горле, артралгии, резко выраженная общая слабость. Реже заболевание может впервые проявиться тромбоцитопенической пурпурой, рецидивирующими носовыми, маточными, желудочными кровотечениями. Иногда ОЛ начинается с постепенного ухудшения состояния больного, появления не выраженных артралгий, болей в костях, кровоточивости. В единичных случаях возможно бессимптомное начало заболевания.
У многих больных в начальный период ОЛ выявляется увеличение периферических лимфоузлов, умеренная спленомегалия.
Стадия развернутых клинико-гематологических проявлений (первая атака).
Характеризуется резким ухудшением общего состояния больных. Типичны жалобы на выраженную общую слабость, высокую лихорадку, боли в костях, в левом подреберье в области селезенки, кровоточивость. На этой стадии формируются клинические синдромы, типичные для ОЛ:
Гиперпластический (инфильтративный) синдром.
Увеличение лимфатических узлов и селезенки одно из самым типичных проявлений диссеминации лейкозной опухоли. Лейкозная инфильтрация нередко вызывает подкапсульные кровоизлияния, инфаркты, разрывы селезенки.
Печень и почки также бывают увеличенными вследствие лейкозной инфильтрации. Лейкозные фильтраты в легких, плевре, медиастинальных лимфоузлах проявляются симптомами пневмонии, экссудативного плеврита.
Лейкемическая инфильтрация десен с их набуханием, гиперемией, изъязвлениями обычное явление для острого моноцитарного лейкоза.
Локализованные опухолевые массы (лейкемиды) в коже, глазных яблоках, в других местах возникают при нелимфобластных (миелоидных) формах лейкоза на поздних стадиях заболевания. При некоторых миелобластных лейкозах лейкемиды могут иметь зеленоватый цвет («хлорома») из-за присутствия в бластных клетках опухоли миелопероксидазы.
Анемический синдром.
Лейкозная инфильтрация и метаболическое угнетение нормальных ростков костномозгового кроветворения приводят к возникновению апластической анемии. Обычно анемия нормохромная. При остром эритромиелозе она может иметь гиперхромный мегалобластоидный характер с умеренно выраженным гемолитическим компонентом. При выраженной спленомегалии может возникать гемолитическая анемия.
Геморрагический синдром.
Обусловлен тромбоцитопенией, ДВС-синдромом. Проявляется подкожными кровоизлияниями (тромбоцитопеническая пурпура), кровоточивостью десен, носовыми, маточными кровотечениями. Возможны желудочно-кишечные, легочные кровотечения, макрогематурия. Наряду с геморрагиями нередко возникают тромбофлебиты, тромбоэмболии, другие гиперкоагуляционные нарушения, обусловленные ДВС-синдромом. Это одно из характерных проявлений острого промиелоцитарного и миеломонобластного лейкозов.
Синдром иммунодефицита.
Формирование иммунодефицитного состояния обусловлено вытеснением лейкозными бластами нормальных клонов иммунокомпетентных клеток из костного мозга. Клинически проявляется лихорадкой, нередко гектического типа. Появляются очаги хронической инфекции разной локализации. Характерно возникновение язвенно-некротической ангины, перитонзиллярных абсцессов, некротического гингивита, стоматита, пиодермии, параректальных абсцессов, пневмонии, пиелонефрита. Генерализация инфекции с развитием сепсиса, множественных абсцессов в печени, почках, гемолитической желтухи, ДВС-синдрома часто является причиной смерти больного.
Синдром нейролейкемии.
Характеризуется метастатическим распространением очагов бластной пролиферации в мозговые оболочки, вещество головного мозга, структуры спинного мозга, нервные стволы. Проявляется менингиальными симптомами — головной болью, тошнотой, рвотой, нарушениями зрения, ригидностью затылочных мышц. Формирование крупных опухолевидных лейкозных инфильтратов в головном мозге сопровождается очаговой симптоматикой, параличами черепно-мозговых нервов.
Ремиссия, достигнутая в результате проводимого лечения.
Под влиянием проводимого лечения происходит угасание (неполная ремиссия) или даже полное исчезновение (полная ремиссия) всех клинических проявлений заболевания.
Рецидив (вторая и последующие атаки).
В результате продолжающихся мутаций возникает клон опухолевых бластов, способный «уклониться» от воздействия цитостатических препаратов, используемых для поддерживающего лечения. Возникает обострение заболевания с возвратом всех синдромов, типичных для стадии развернутых клинико-гематологических проявлений ОЛ.
Под влиянием противорецидивной терапии может вновь быть достигнута ремиссия. Оптимальная тактика лечения может привести к выздоровлению. При нечувствительности к проводимому лечению ОЛ переходит в терминальную стадию.
Выздоровление.
Больного считают выздоровевшим, если полная клиническая и гематологическая ремиссия сохраняется более 5 лет.
Терминальная стадия.
Характеризуется недостаточностью или полным отсутствием терапевтического контроля над разрастанием и метастазированием лейкозного клона опухоли. В результате диффузной инфильтрации костного мозга, внутренних органов лейкозными бластами тотально подавляется система нормального кроветворения, исчезает инфекционный иммунитет, возникают глубокие нарушения в системе гемостаза. Смерть наступает от диссеминированных инфекционных поражений, некупируемого кровотечения, тяжелой интоксикации.
Клинические особенности морфологических типов острого лейкоза.
Острый недифференцированный лейкоз (М0). Встречается редко. Очень быстро прогрессирует с усугублением тяжелой апластической анемии, выраженного геморрагического синдрома. Ремиссии достигаются редко. Средняя продолжительность жизни менее 1 года.
Острый миелобластный лейкоз (М1-М2). Наиболее распространенный вариант острого нелимфобластного лейкоза. Чаще болеют взрослые. Отличается тяжелым, упорно прогрессирующим течением с выраженными анемическим, геморрагическим, иммунодепрессивным синдромами. Характерны язвенно-некротические поражения кожи, слизистых оболочек. Добиться ремиссии оказывается возможным у 60-80% больных. Средняя продолжительность жизни около 1 года.
Острый промиелоцитарный лейкоз (М3). Один из наиболее злокачественных вариантов. Характеризуется выраженным геморрагическим синдромом, который чаще всего и приводит больного к смерти. Бурные геморрагические проявления связывают с ДВС-синдромом, причиной которого является повышение тромбопластиновой активности лейкозных промиелоцитов. На их поверхности и в цитоплазме содержится в 10-15 раз больше тромбопластина чем у нормальных клеток. Своевременное лечение позволяет достичь ремиссии почти у каждого второго больного. Средняя продолжительность жизни достигает 2 лет.
Острый миеломонобластный лейкоз (М4). Клиническая симптоматика этой формы заболевания близка к острому миелобластному лейкозу. Отличия заключаются в большей склонности к некрозам. Чаще возникает ДВС-синдром. У каждого десятого больного имеет место нейролейкоз. Болезнь быстро прогрессирует. Часто возникают тяжелые инфекционные осложнения. Средняя продолжительность жизни и частота стойких ремиссий в два раза меньше чем при остром миелобластном лейкозе.
Острый монобластный лейкоз (М5). Редкая форма. По клиническим проявлениям мало отличается от миеломонобластного лейкоза. Отличается большей склонностью к быстрому и упорному прогрессированию. Поэтому средняя продолжительность жизни больных с этой формой лейкоза еще меньше — около 9 месяцев.
Острый эритромиелоз (М6). Редкая формы. Отличительной особенностью этой формы является упорная, глубокая анемия. Анемия гиперхромная с явлениями нерезко выраженного гемолиза. В лейкозных эритробластах выявляются мегалобластоидные отклонения. Большинство случаев острого эритромиелоза резистентно к проводимой терапии. Продолжительность жизни больных редко превышает 7 месяцев.
Острый лимфобластный лейкоз (L1,L2,L3). Эта форма характеризуется умеренно прогрессирующим течением. Сопровождается увеличением периферических лимфоузлов, селезенки, печени. Геморрагический синдром, язвенно-некротические осложнения бывают редко. Продолжительность жизни при остром лимфобластном лейкозе от 1,5 до 3 лет.
Диагностика.
Общий анализ крови: уменьшение числа эритроцитов, лейкоцитов, тромбоцитов. Анемия чаще нормоцитарная, нормохромная, но у больных с острым эритромиелозом могут наблюдаться макроцитоз, появление в крови ядерных форм с признаками мегалобластоза. Мегалобластоподобные отклонения не исчезают при лечении цианкобаламином. Выявляются бластные клетки. Для лейкоцитарной формулы характерен феномен «лейкемического провала» — наличие бластов и зрелых форм лейкоцитов при отсутствии («провале») клеток промежуточных степеней дифференциации. Это свидетельствует о наличии одновременно двух линий размножающихся клеток. Одна линия нормальная, завершающаяся зрелыми клеточными формами. Другая линия — опухолевый клон бластных клеток, не способных к дальнейшей дифференциации. В зависимости от содержания лейкоцитов и количества бластных клеток в периферической крови выделяют три формы лейкоза: лейкемический — при высоком, до 100*109/л лейкоцитозе и большом количестве бластов; сублейкемический, когда число бластов незначительно превышает нормальное содержание лейкоцитов в крови; алейкемический — при отсутствии бластов в периферической крови. В последнем случае обычно отмечается панцитопения — лейкопения, анемия, тромбоцитопения.
Стернальный пунктат: В костном мозге нелеченных больных бласты составляют более 50% всех ядросодержащих клеток. Подавлены эритроцитарный, гранулоцитарный, мегакариоцитарный ростки. Выявляются признаки мегалобластного эритрогенеза.
Исследование спинномозговой жидкости: высокий цитоз, выявляются бластные клетки, повышено содержание белка.
Гистохимическое исследование бластов: определяется морфологический вариант нелимфобластного ОЛ.
Иммунотипирование лейкозных клеток: выявляется принадлежность лимфобластов к популяциям Т- или В-лимфоцитов, или к неопределенному (ни Т, ни В) типу.
Обоснование диагноза ОЛ.
Клинические проявления в виде анемического, геморрагического, иммунодефицитного синдромов, менингеальных явлений позволяют заподозрить заболевание и служат поводом для проведения стернальной пункции. Диагноз ОЛ основывается на обнаружении при стернальной пункции и/или трепанобиопсии крыла подвздошной кости бластной инфильтрации костного мозга.
Дифференциальный диагноз. Дифференциальный диагноз проводится в первую очередь с лейкемоидными реакциями, агранулоцитозом, апластическими анемиями.
При лейкемоидных реакциях, возникающих у больных с тяжелыми инфекционными заболеваниями, злокачественными новообразованиями, может возникнуть выраженный лейкоцитоз со сдвигов формулы влево до появления единичных бластов. Однако, в отличие от ОЛ при этих состояниях нет«лейкемического провола» — отсутствия клеточных форм промежуточной дифференциации между бластом и зрелым лейкоцитом. Для лейкемоидных реакций не типичны анемия и тромбоцитопения. В костном мозге и в периферической крови отсутствует значительное повышение содержания бластных клеток.
При выходе из агранулоцитоза, вызванного токсическими или иммунными факторами, в периферической крови появляются бластные клетки. Может возникнуть ситуация, когда в мазке будут видны единичные зрелые лейкоциты и бласты без промежуточных клеточных форм. Однако при динамическом исследовании мазков крови будет наблюдаться появление следующих за бластами промежуточных форм, чего никогда не наблюдается у больных ОЛ. При агранулоцитозе в отличие от ОЛ нет избыточного содержания бластных клеток в костном мозге.
В отличие от ОЛ для апластических анемий не характерно увеличение лимфатических узлов, селезенки. В противоположность ОЛ при апластических анемиях имеет место обеднение костного мозга, большое содержание в нем жировой ткани. В костном мозге резко снижено количество бластов, чего не бывает при ОЛ.
План обследования.
Общий анализ крови.
Стернальная пункция и/или трепанобиопсия крыла подвздошной кости.
Иммунотипирование популяционной (В или Т) принадлежности лейкозных лимфобластов.
Гистохимическое типирование бластов для определения морфологического варианта нелимфобластного лейкоза.
Лечение.
Применяются методы химиотерапии, и трансплантация костного мозга.
Химиотерапия острых лейкозов проводится следующими этапами:
Индукция ремиссии.
Консолидация ремиссии.
Поддерживающая терапия.
Профилактика нейролейкемии.
На 1 этапе (индукция ремиссии) наиболее эффективной программой медикаментозной терапии оказалась схема «7+3», с введением цитозара и рубомицина: Цитозар 100 мг/м2 в сутки внутривенно в течение 7 дней. Рубомицин 45 мг/м2 внутривенно в первые три дня недели.
На 2 этапе (консолидация ремиссии): При нелимфобластных лейкозах проводятся 2 курса химиотерапии по схеме «7+3».
На 3 этапе (поддерживающая терапия) в течение 5 лет больным нелимфобластным лейкозом непрерывно вводят препараты по схеме «5+2»: Цитозар 100 мг/м2 внутривенно каждые 12 часов в течение 5 дней. Тиогуанин 100 мг/м2 внутрь каждые 12 часов в течение 5 дней.
На 4 этапе (профилактика нейролейкоза) сразу после морфологической верификации диагноза острого лейкоза, затем спустя 2 недели от начала лечения и, далее, через каждые 2 недели до наступления ремиссии в спинномозговой канал вводят метотрексат в дозе 12,5 мг/м2. Химиотерапию комбинируют с локальным облучением головы. Суммарная доза 24 Гр. В фазу ремиссии метотрексат вводят эндолюмбально 1 раз в 3 месяца.
Пересадка костного мозга производится в фазе первой ремиссии острого нелимфобластного лейкоза и второй ремиссии острого лимфобластного лейкоза.
Перед аллогенной трансплантацией костного мозга, тщательно подобранного по антигенам гистосовместимости, проводится химиотерапевтическая и лучевая подготовка больного с целью тотального уничтожения всех ростков его собственного кроветворения. Парентерально вводят сублетальные дозы циклофосфана (60-120 мг/кг). Затем тотально облучают все тело гамма-источником дозой в 10 грей. У донора берут около 800 мл взвеси костного мозга путем множественной аспирации из гребня подвздошной кости. К взвеси добавляют питательную среду, ее гепаринизируют, фильтруют и переливают больному через подключичный катетер.
Кроме аллогенной трансплантации, можно выполнить и аутологичную трансплантацию костного мозга. В период полной клинико-гематологической ремиссии у больного производится забор его собственного костного мозга из гребня подвздошной кости. Полученная взвесь костного мозга подвергается очистке от опухолевых клонов. Для этого она разделяется на сепараторе, где выделяются стволовые клетки, обрабатывается раствором 4-гидропероксициклофосфамидом или подвергается иммунологической обработке моноклональными антителами. Затем костный мозг замораживают. Проводят стандартную предварительную подготовку больного назначением высоких доз циклофосфамида и тотального облучения. Через 48 часов после этой процедуры размораживают костный мозг и возвращают его пациенту через подключичный катетер.
С целью лечения и профилактики инфекционных осложнений ОЛ назначают антибиотики широкого спектра действия, противогрибковые препараты. Парентерально вводят альфа-интерферон в дозе 50 млн. МЕ/сутки в течение недели.
При тяжело протекающем обострении осуществляют дезинтоксикационную терапию с парентеральным введением реополиглюкина. С этой же целью применяют плазмоферез, гемосорбцию.
Для купирования кровоточивости, вызванной тромбоцитопенией, проводят трансфузии тромбоцитов, полученных от доноров – близких родственников больного. Дефицит плазменных факторов свертывания, возникающий при ДВС-синдроме, купируют внутривенным струйным введением свежезамороженной плазмы.
Прогноз. При естественном (без лечения) течении острых лейкозов продолжительность жизни больных не превышает 3 месяцев. Химиотерапия позволяет достичь продолжительности жизни 5 и более лет у более чем 60% больных с лимфобластной формой лейкоза. В первую очередь это касается детей. При нелимфобластных формах стойкая ремиссия достигается труднее. Только 10-20% таких больных живут больше 1 года. Лучшие результаты дает трансплантация костного мозга. После аллогенной пересадки костного мозга ремиссия длительностью более 5 лет наступает у 70% больных с лимфобластным, и у 50-60% больных с нелимфобластным ОЛ. У 45% больных перенесших аутологичную трансплантацию костного мозга также возникает стойкая, многолетняя ремиссия. Эти операции наиболее эффективны у больных с острым нелимфобластным лейкозом, у которых химиотерапия не дает удовлетворительных результатов.
