Вирусный гепатит В (HBV), количественный
Вирусный гепатит В (HBV), количественный
Вирусный гепатит В (HBV), количественный- исследование для выявления возбудителя гепатита B (HBV), в ходе которого с помощью метода полимеразной цепной реакции в реальном времени (РТ-ПЦР) определяется наличие генетического материала (ДНК) вируса и его количество (вирусная нагрузка) в образце крови. Вирусный гепатит В (ВГВ) – инфекционное заболевание печени, вызванное ДНК-содержащим вирусом гепатита В (HBV). Среди всех причин развития острого гепатита и хронической вирусной инфекции вирус гепатита В считается одной из самых распространенных в мире. Полимеразная цепная реакция отличается высокой чувствительностью и специфичностью. Методом ПЦР можно определить ДНК вируса качественно или количественно. Количественное определение вирусной нагрузки позволяет оценить интенсивность развития болезни, эффективность проводимой терапии или развитие устойчивости к противовирусным препаратам.
Существует зависимость между концентрацией вируса в крови и исходом острого вирусного гепатита В. При низком уровне виремии вероятность перехода инфекции в хроническую форму близка к нулю, а инфицированный человек неопасен для окружающих. При высокой вирусной нагрузке (< 105 копий/мл) хронизация возникает часто и больной является потенциальным источником инфекции. Эффективность противовирусной терапии оценивается по уменьшению количества ДНК вируса в крови. Через 3-6 месяцев после начала лечения вирусная нагрузка при адекватном терапевтическом ответе должна уменьшиться на 1-2 порядка. Отсутствие уменьшения количества вируса или его увеличение на фоне проводимого лечения требует пересмотра и изменения терапии. Количественное определение ДНК вируса гепатита В совместно с клинической картиной заболевания и биохимическими показателями, маркерами инфекции, а также результатом пункционной биопсии печени позволяет дать прогноз заболевания и оценить необходимость противовирусной терапии.
 7 МЕ/мл).
7 МЕ/мл).На результаты могут влиять
загрязнение биоматериала;
наличие в образце ингибиторов – химических и белковых субстанций, влияющих на различные компоненты ПЦР;
присутствие в крови гепарина.
Уровень вирусной нагрузки крови не указывает на степень повреждения печени и тяжесть заболевания. Для их оценки необходимо исследовать биохимические показатели и материалы биопсии.
Количественное определение ДНК вируса гепатита В является обязательным исследованием до назначения противовирусной терапии. Во время курса лечения анализ необходимо повторить через 3-6 месяцев.
Вирусный гепатит В нередко сочетается с вирусным гепатитом D.
Назначается в комплексе с
HBsAg
anti-HBc, антитела
anti-HBe, антитела
HBеAg
HBV, ДНК [ПЦР качественный]
anti-HDV, антитела
Anti-HCV, антитела, ИФА
Биохимический анализ крови при заболеваниях ЖКТ
Коагулограмма базовая
Высокая вирусная нагрузка при гепатите С — ГепаГид
Поделиться статьей
Вирусная нагрузка – это количество возбудителя инфекции в крови у пациента. Если говорить о гепатите С, то под вирусной нагрузкой имеется в виду общее число вирусной РНК самого вируса в венозной крови пациента. Определение количества вируса у больного является обязательной и очень важной процедурой, потому что в зависимости от количества вирусной РНК в крови гепатолог составляет лечение и подбирает препараты.
Если говорить о гепатите С, то под вирусной нагрузкой имеется в виду общее число вирусной РНК самого вируса в венозной крови пациента. Определение количества вируса у больного является обязательной и очень важной процедурой, потому что в зависимости от количества вирусной РНК в крови гепатолог составляет лечение и подбирает препараты.
Когда пациенту ставят диагноз «вирусный гепатит С», ему необходимо пройти еще несколько проверок, чтобы выявить генотип заболевания и, соответственно, вирусную нагрузку. Как правило, оба эти показателя выявляются при помощи ПЦР-диагностики. Вирусная нагрузка оказывает влияние на течение заболевания, на его агрессивность и даже определяет дальнейший прогноз лечения. Высокая вирусная нагрузка показывает, что вирус содержится в крови в большом количестве. При этом значительно возрастает угроза возникновения фиброза печени высокой степени. В целом, высокая вирусная нагрузка является отрицательным показателем, негативно влияющим на прогноз лечения и значительно увеличивающим его продолжительность.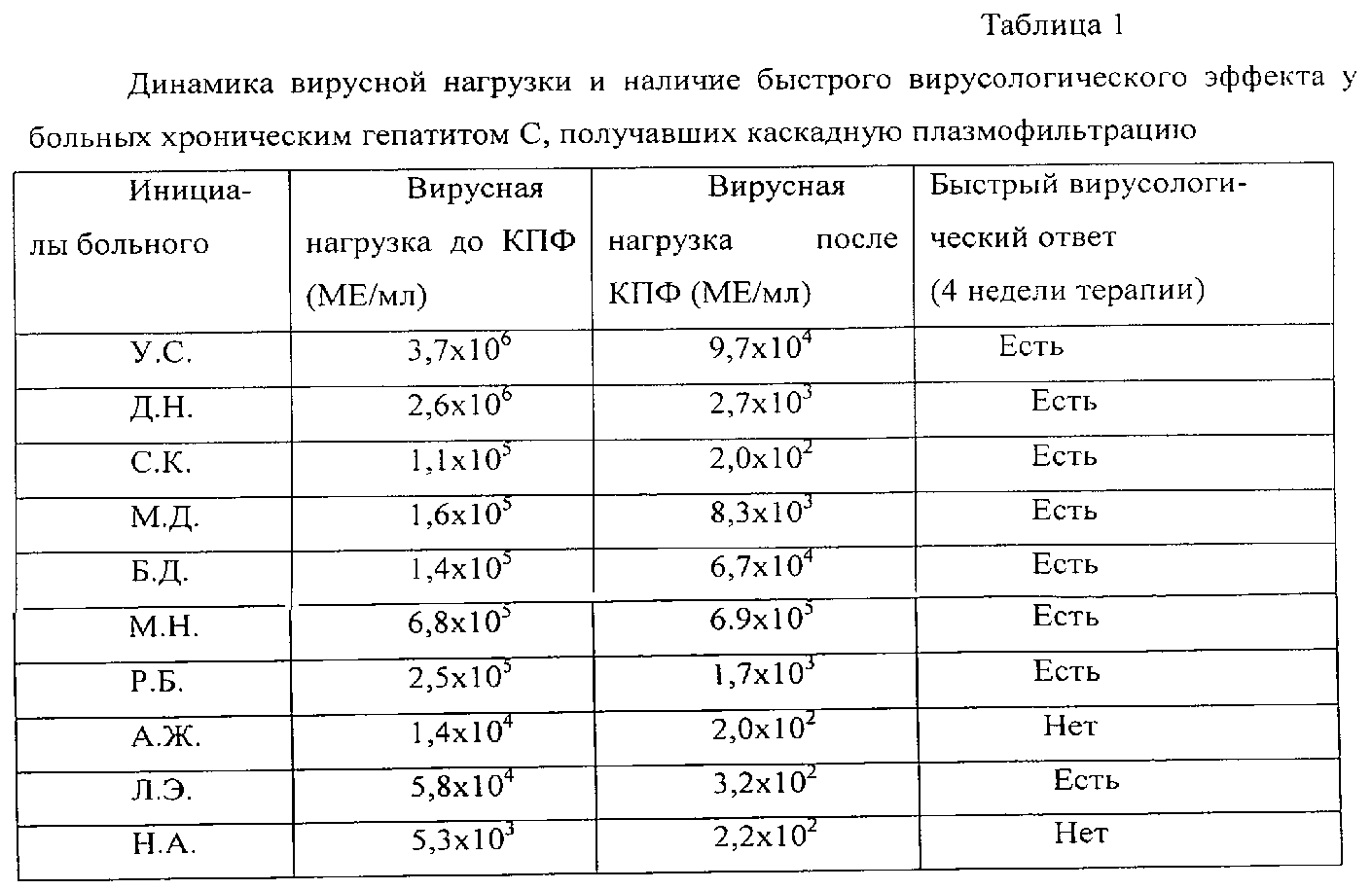
Низкая вирусная нагрузка, наоборот, является хорошим прогнозом для пациентов, так как чем меньше вируса содержится в крови, тем легче и быстрее сможет выздороветь больной.
Уровень вирусной нагрузки необходимо постоянно отслеживать и контролировать, особенно во время лечения. Если в процессе терапии не наблюдается никаких изменений в уровне содержания гепатита С в крови, это говорит о том, что лечение не действует и его нужно изменить полностью, либо внести какие-то коррективы.
Самым эффективным способом определения количества вирусной РНК в крови человека является ПЦР-диагностика. При помощи данной методики можно выявить вирусный гепатит С даже при минимальном содержании возбудителя в крови. Методика ПЦР включает в себя три разных обследования, на определение вирусной нагрузки направлен качественный анализ. Если пациент не заражен, его результат: «не обнаружен», однако может быть и результат «ниже диапазона измерений» в том случае, когда вирусная РНК была найдена, но ее точное количество установить не удалось.
Расшифровкой результатов анализа занимается непосредственно лечащий врач. Как правило, результаты представлены на бланке в виде таблицы с указанными значениями по каждому показателю. Высокой вирусной нагрузкой считается более 800 000 МЕ/мл, а низкой вирусной нагрузкой принято считать до 400 000 МЕ/мл. При высокой вирусной нагрузке существует большая вероятность развития опасных заболеваний печени – цирроза, рака, поэтому начинать лечение необходимо как можно скорее. Если во время лечения не наблюдается снижение уровня РНК в крови, следует приостановить терапию, повторно сдать анализы и разрабатывать курс лечения, исходя из новых результатов.
Определение вирусной нагрузки у пациента играет очень важную роль. В случае, когда она минимальная, с лечением можно повременить, если, к примеру, у пациента нет возможности или желания лечиться. Что касается высокой вирусной нагрузки, то ее нужно лечить сразу, потому что вирус, присутствуя в организме в большем количестве, в несколько раз быстрее воздействует на клетки и ткани печени, провоцируя развитие различных патологий, которые в итоге могут стать причиной летального исхода у пациента.
количественное определение РНК вируса и генотипирование (Hepatitis C Virus (HCV) RNA, Quantitative PCR and Genotyping)
Определение вирусной нагрузки и генотипа (1, 2, 3) вируса гепатита С (ВГС).
Гепатит С – вирусное заболевание печени, которое часто переходит в хроническую форму (55-85% инфицированных). У части таких пациентов (15-30%) хронический гепатит в течение 20 лет может приводить к циррозу печени и повышению риска развития карциномы печени. Прогноз заболевания и эффективность противовирусной терапии зависят от генотипа вируса, применяемой терапии, индивидуальных характеристик пациента.
Гепатит С не всегда требует лечения. У некоторых людей, благодаря иммунной реакции, а также в зависимости от штамма вируса, инфекция самопроизвольно прекращается. У части пациентов с хронической инфекцией существенного повреждения печени не происходит. В лечении гепатита С в настоящее время достигнут значительный прогресс, разработаны новые противовирусные препараты. Стандарты лечения пациентов с гепатитом С быстро меняются. Для выбора оптимального подхода к терапии, определения схемы и длительности лечения пациента рекомендуется провести некоторые дополнительные лабораторные исследования, прежде всего, исследование генотипа вируса. Согласно рекомендациям Минздрава РФ от 3 сентября 2014 г., генотипирование вируса гепатита С должно выполняться всем пациентам до начала противовирусной терапии в целях планирования ее продолжительности, прогнозирования эффективности, в отдельных случаях – для расчета дозы противовирусных препаратов (см. также тест №2447 «Интерлейкин 28 бета – IL28B, генотипирование»).
Стандарты лечения пациентов с гепатитом С быстро меняются. Для выбора оптимального подхода к терапии, определения схемы и длительности лечения пациента рекомендуется провести некоторые дополнительные лабораторные исследования, прежде всего, исследование генотипа вируса. Согласно рекомендациям Минздрава РФ от 3 сентября 2014 г., генотипирование вируса гепатита С должно выполняться всем пациентам до начала противовирусной терапии в целях планирования ее продолжительности, прогнозирования эффективности, в отдельных случаях – для расчета дозы противовирусных препаратов (см. также тест №2447 «Интерлейкин 28 бета – IL28B, генотипирование»).
Различают шесть основных генотипов (1, 2, 3, 4, 5, 6) и множественные субтипы (1a, 1b, 1c и т. п.) вируса гепатита С (ВГС). ВГС 1 генотипа является преобладающим по частоте встречаемости и труднее поддается лечению. ВГС генотипов 2 и 3 менее агрессивен и легче поддается лечению. ВГС генотипов 4, 5 и 6 в нашей стране практически не встречается.
Эффективность лечения оценивают по вирусологическому ответу, который определяют по динамике изменения концентрации вируса в крови. Поэтому до начала лечения необходимо установить исходную вирусную нагрузку (концентрацию вирусных частиц в крови). Целью терапии является полное излечение, т. е. элиминация вируса.
Поэтому до начала лечения необходимо установить исходную вирусную нагрузку (концентрацию вирусных частиц в крови). Целью терапии является полное излечение, т. е. элиминация вируса.
Аналитические показатели: метод позволяет количественно определить присутствие РНК вируса гепатита С (субтипы 1a, 1b, 2a, 2b, 2c, 2i, 3, 4, 5a, 6) и идентифицировать генотипы 1, 2, 3. Чувствительность количественного определения РНК ВГС – 60 МЕ/мл. Чувствительность выявления генотипов РНК ВГС – 1600 МЕ/мл. Специфичность – 100%.
специальной подготовки не требуется.
Исследование целесообразно проводить пациентам с установленным диагнозом хронического гепатита C (при положительном результате исследования РНК вируса гепатита С в крови) до начала проведения противовирусной терапии:
- в целях прогноза течения, вероятного ответа на терапию, выбора тактики лечения пациентов с хроническим гепатитом С;
- для установления исходной вирусной нагрузки перед началом терапии хронического гепатита C с целью последующего контроля эффективности лечения.

Интерпретация результатов исследования содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
Единицы измерения и форма представления результатов:
РНК ВГС, количественное определение – единицы измерения МЕ/мл. РНК ВГС, 1, 2, 3 генотипы – качественный формат, результат выдается в терминах «не обнаружено» или «обнаружено» по каждому исследованному генотипу.
Для предоставления вирусной нагрузки в копиях РНК ВГС на мл следует применять соотношение 1 МЕ = 2,5 копии РНК ВГС ( по данным National Institute of Biological Standarts and Control для WHO international standard for Hepatitis C virus NIBSC Code: 96/798).
Интерпретация результатов
Результат | Интерпретация |
| Не обнаружено | РНК HCV не выявлена или концентрация ниже границы чувствительности метода. |
| < 102 МЕ/мл. | РНК HCV обнаружена в концентрации менее 102 МЕ/мл. Полученное значение ниже нижнего предела линейности измеряемого диапазона и не может быть точно измерено. |
| Цифровое значение от 102 до 1х108 МЕ/мл. | РНК HCV обнаружена. Полученное значение находится в пределах линейного диапазона измерения |
| >108МЕ/мл | РНК HCV обнаружена в концентрации более 108МЕ/мл. Полученное значение выше верхнего предела линейности измеряемого диапазона и не может быть точно измерено |
Результат | Интерпретация |
| Обнаружено | Выявлена РНК HCV соответствующего генотипа |
| Не типируется. Исследовались генотипы 1, 2, 3 | Обнаружена РНК HCV, но генотип вируса не относится к генотипам 1 (1а, 1b), 2 (2a, 2b, 2c, 2i), 3 (3a, 3b). |
| Концентрация РНК HCV в образце недостаточна для установления генотипа ВГС (менее 1,6х103 МЕ/мл). | Концентрация РНК HCV в пробе недостаточна для проведения генотипирования |
расшифровка, таблица с нормой и отклонениями
Важным показателем при определении гепатита С считается вирусная нагрузка. Она способна оценить скорость развития болезни и степень поражения печени. С помощью оценки вирусной нагрузки возможно рассчитать приблизительную продолжительность жизни с патологией.
Для определения показателей сдают анализ крови с последующим повторением через полгода.
Читайте также дополнительные материалы, это важно знать.Характеристика Hepatitis C Virus
Вирусную нагрузку провоцирует Hepatitis С Virus (HCV). Он способен глубоко навредить клеткам печени, нарушить их функционирование, понизив работоспособность органа.
Типы вирусной нагрузки
Различают два вида вирусной нагрузки на организм: хроническую и острую.
При острой форме больной человек наблюдает динамику улучшения самочувствия, вплоть до выздоровления. Улучшение отмечается при своевременном диагностировании и терапии на начальной стадии обнаружения патологии.
Хронический вид вирусной нагрузки практически не поддаётся лечению по причине слабого иммунитета, не способного защитить поражённые клетки.
Пути заражения
Вирус гепатита С не живёт на предметах и оборудовании. Им заражаются только через кровь при не стерильности или повторном использовании шприца, донорстве, манипуляциях в стоматологическом кабинете. Патология грозит при контакте открытой раны с инфицированной кровью заражённого, при частой смене сексуальных партнёров и гомосексуализме.
Опасность представляют салоны пирсинга и набивания татуировок на теле.
Вирус гепатита С человека
Клиническая картина
Инкубация вируса длится до трёх месяцев без очевидных признаков инфицирования. Симптомы размытые, схожие с другими заболеваниями.
- Постоянная усталость и ломота в теле.
- Раздражительность и нервозность.
- Плохой сон.
- Отсутствие аппетита.
Полагается проконсультироваться с доктором для определения правильного диагноза. При подтверждении не следует откладывать терапевтические процедуры, лечение начинают немедленно. HCV – опаснейшая инфекция, вред от вируса приводит к серьёзному нарушению и выходу из строя работы печени. Возможно развитие онкологии.
Побочным эффектом лекарственной борьбы с инфекцией становится депрессивное состояние пациента. Влияние на центральную нервную систему оказывают принимаемые препараты. Это состояние проходит при прекращении терапии либо подавляется с помощью медикаментозного вмешательства в виде таблеток.
Продолжительность жизни
Факторы, влияющие на продолжительность жизни при инфицировании гепатитом С:
- Возрастная категория.
- Присутствие сопутствующих хронических болезней в анамнезе.
- Реакция иммунитета на вторжение вируса.

По статистике, продолжительность жизни с гепатитом С не превышает десяти лет. Не исключено, что летальный исход может наступить в два раза раньше указанного срока.
Отличия Hepatitis C Virus от других видов гепатита
- Основным осложнением протекания заболевания становится рак печени, который диагностируется в подавляющем большинстве хронических случаев.
- Гепатит С плохо поддаётся лечению.
- Человек, переболевший единожды, сможет инфицироваться вновь, защитные антитела против болезни практически не вырабатываются иммунитетом.
- Острую форму гепатита лечит врач-инфекционист, а хроническую – гастроэнтеролог или гепатолог.
- Дорогостоящее лечение не по карману среднестатистическому человеку.
- Отсутствуют признаки инфицирования на начальном инкубационном периоде заражения. Желтушности кожи не наблюдается, нет боли со стороны правого подреберья.
Гепатит типа С у человека
Понятие вирусной нагрузки
Вирусная нагрузка способна определить содержание и количественный показатель рибонуклеиновых кислот вируса в крови инфицированного. С помощью анализа определяется этап, на котором происходит развитие болезни, насколько она смогла навредить печени и как справляется иммунная система с подобным ударом микроорганизмов.
С помощью анализа определяется этап, на котором происходит развитие болезни, насколько она смогла навредить печени и как справляется иммунная система с подобным ударом микроорганизмов.
Этот тест проходят пациенты, у которых выявляются антитела к гепатиту С.
Вирусная нагрузка делится на низкую и высокую. При низкой отмечаются прогнозы на выздоровление без последствий и осложнений. Высокая нагрузка гасит способность иммунитета справляться с недугом, что приводит к плохой результативности лечения.
Диагностические методы определения
Особенностью Hepatitis C Virus является его мутирующее преобразование в разные формы. Научными исследованиями выявлено девять штаммов вируса С и их возможность формировать до четырёх генотипов. Иммунная система не в силах справиться с быстрыми изменениями в организме, и заболевание набирает обороты агрессивного развития. Это невозможно вылечить лекарственными препаратами.
Рибонуклеиновая кислота (РНК) вируса несёт генетический материал, содержащийся в ядре. Чем РНК выше показателей нормы, тем активнее развивается болезнь.
Чем РНК выше показателей нормы, тем активнее развивается болезнь.
РНК вируса гепатита С
Если заметно сильное отклонение при HCV от нормативных показателей в сторону увеличения, прогнозы плохие. Предстоит повторить анализ на РНК через месяц, чтобы проверить, идёт ли терапия в сторону улучшения. Для этого используют дополнительную ПЦР-диагностику и ТМА.
Диагностика с помощью полимеразной цепной реакции
Полимеразная цепная реакция (ПЦР) выявляет провокатора болезни при его минимальном преобладании в сыворотке крови. С помощью ПЦР-исследования результаты покажут наличие вируса даже спустя пять дней после инфицирования.
За указанный период иммунитет ещё не успеет настроиться на выработку антител, а результат уже будет положительным. Анализ проводится, чтобы не терять время и немедленно приступить к лечению.
Показатели, которые превышают 800000 ме/мл, считаются завышенными, а заниженными – менее 400000 ме/мл. При отсутствии болезни молекулы РНК не обнаруживаются.
Анализ обязательно проводится с утра натощак, забирается кровь из вены. За 8 часов до исследования запрещается пить, кушать и курить. За сутки следует ограничить физические нагрузки и свести к минимуму стрессовое состояние.
Причины неверных показателей
Неправильная норма показателя ПЦР может говорить о следующих факторах:
- Нестерильное взятие и хранение крови, были нарушены нормы санитарии.
- Применение медикаментов, изменяющих состав кровяных антител.
- Содержание отдельных химических элементов.
ПЦР при беременности
Всем беременным в обязательном порядке нужно сдать этот анализ. ПЦР определит, есть ли вероятность передачи гепатита С от матери к плоду.
Для профилактических мер предосторожности беременную положат в больницу и проведут терапевтическое лечение. Результаты зависят от реакции иммунитета на процедуры. Важна степень запущенности инфекционного заболевания в организме.
Диагностика методом изучения молекул дезоксирибонуклеиновой кислоты
Анализ на диагностику разветвленной дезоксирибонуклеиновой кислоты (ДНК) является самым распространённым и доступным для диагностирования HCV. Его плюсом считается быстрое определение результатов.
Его плюсом считается быстрое определение результатов.
Минусом в расшифровке анализов на начальной стадии выступает отрицательный показатель вирусной нагрузки при гепатите С. Это объясняется тем фактом, что диагностирование методом ДНК возможно, если концентрация вирусных микроорганизмов в крови более 500 ме/мл.
Диагностирование тромботической микроангиопатии
Диагностирование тромботической микроангиопатии (ТМА) – популярный способ, в котором влияние вирусной нагрузки определяется при минимальной концентрации в сыворотке крови. Достоверность анализа достигает 98 процентов, характеризуется невысокой ценой и часто используется для выявления HCV.
Как расшифровать анализы
Различают высокую, низкую, нормальную и предельную вирусную нагрузку при гепатите С. В каждом медицинском заведении установлены свои индивидуальные нормы, так как таблица результатов норм исследований создается в зависимости от оснащенности и мощности оборудования лабораторий, определяющих качественный результат.
- Высокая вирусная нагрузка. Расшифровка показывает больше 8*105 ме/мл. Показатели говорят о прогрессировании процесса инфицирования. Пациента кладут в больницу и корректируют состояние медикаментозными препаратами.
- Низкая вирусная нагрузка. Показатель до 3*104 ме/мл говорит о положительной динамике к выздоровлению. Полагается продолжать назначенное лечение в подобранных дозировках.
- Нормальная. Показатель нормы не превышает 800000 ме/мл. Считается, что иммунитет адекватно реагирует на лечение и способствует борьбе с вирусом гепатита С, дополнительной корректировки лечения не требуется.
- Предельная вирусная нагрузка – от 400000 до 800000 ме/мл, определяет успешное лечение. Отклонение от нормы свидетельствует о неэффективном и недостаточном лечении.
Риски неправильного диагностирования
По некоторым причинам анализы могут быть недостоверны. Виной тому станут определённые обстоятельства.
- Не соблюдены стандарты хранения сыворотки крови, её замораживания.

- Нарушены нормы санитарии при заборе крови.
- Биологический материал оказался загрязнён белковыми и химическими веществами.
- Пациент не смог соблюсти правильные условия для подготовки к анализу.
В таких случаях для подтверждения достоверности результатов исследования предстоит их переделать не менее чем через три недели. Это важно для проверки используемой терапии и того, как прописанное количество препарата влияет на организм, есть ли необходимость изменения тактики лечения при отклонениях от нормы.
Терапия при вирусной нагрузке и её корректировка
Вирусная нагрузка гепатита С в крови способна мутировать в ряд видов и подвидов штаммов. Сложность заключается в правильном и адекватном подборе стратегии лечения, чтобы улучшить переносимость терапевтических процедур пациентом. Ведётся тщательный подбор препаратов и наблюдение за состоянием.
Противовирусный эффект достигается средствами: Пегинтерферон, Роферон, Рибавирин, Ремантадин или Ламивудин. Возможно одновременное сочетание нескольких лекарств, за динамикой наблюдает врач. При ухудшении состояния они заменяются другими.
К противовирусным средствам подбираются иммуномодуляторы для поддержания иммунитета на должном уровне. Самые распространённые среди них – Гепон, Глутоксим и Имунофан. Также восстанавливается функциональность печени применением гепатопротекторов, таких как Фосфоглив, Силимар или Эссенциале форте.
Гепатит С – один из самых опасных видов инфекционного гепатита. По статистике, 80 процентов заболевших умирает. Крайне важным фактором является наблюдение за вирусной нагрузкой, которая не должна превышать установленные нормы. Так удастся снизить риск осложнений, понять, насколько эффективно проводится лечение, и требуется ли терапевтическая корректировка.
Количественное определение ДНК вируса гепатита В
Определение концентрации ДНК ВГВ в крови (вирусная нагрузка) при ГВ измеряется в международных единицах на мл (МЕ/мл), может измеряться и в копиях/ мл. Соотношение между копии/МЕ в наборах реагентов разных производителей различно – от 1,5 до 8 (в среднем – 5). В настоящее время границей между высокой и низкой вирусной нагрузкой ВГВ принято считать 2 000 МЕ/мл (10 000 копий/мл).
Определение концентрации ДНК ВГВ в крови используется для определения различных стадий при хронической инфекции, вызванной ВГВ (Табл. 6) и мониторинга эффективности противовирусной терапии (Табл. 7). Поскольку при ХГВ полная эрадикация вируса практически не возможна, целью лечения является снижение риска развития неблагоприятных исходов заболевания (цирроз печени или гепатоцеллюлярная карцинома), что может быть достигнуто при стойком подавлении репликации вируса. Именно поэтому измерение концентрации ДНК ВГВ в крови, которая отражает активность вирусной репликации, становится основным критерием оценки ответа на лечение.
7). Поскольку при ХГВ полная эрадикация вируса практически не возможна, целью лечения является снижение риска развития неблагоприятных исходов заболевания (цирроз печени или гепатоцеллюлярная карцинома), что может быть достигнуто при стойком подавлении репликации вируса. Именно поэтому измерение концентрации ДНК ВГВ в крови, которая отражает активность вирусной репликации, становится основным критерием оценки ответа на лечение.
Показания к обследованию
- Лица, у которых выявлен HBsAg;
- больные ХГВ до начала противовирусной терапии и во время ее проведения:
-
- при использовании препаратов с низким генетическим барьером (ламивудин, телбивудин): на 12, 24, 48 неделях лечения и далее каждые 3 месяца при продолжении терапии;
- при использовании препаратов с высоким генетическим барьером (энтекавир, тенофовир) или медленным развитием резистентности (адефовир): на 12, 48 неделях лечения и далее каждые 6 месяцев при продолжении терапии;
- больные ХГВ, находящиеся на противовирусной терапии, с подозрением на вирусологический рецидив, тестируются через 1 мес после возрастания концентрации ДНК ВГВ без отмены противовирусного препарата.

Особенности интерпретации результатов
Диагностика инфицированных ВГВ Вирусная нагрузка в плазме крови в совокупности с другими маркерами позволяет определить стадию хронической инфекции, вызванной ВГВ (Табл.6).
Мониторинг эффективности противовирусного лечения ХГВ Количественное исследование ДНК ВГВ в плазме крови является обязательным исследованием до начала и в процессе противовирусного лечения для оценки его эффективности. В зависимости от полученных результатов (Табл. 7) терапия выбранным препаратом продолжается, или проводится корректировка схемы лечения.
ЗНАЧЕНИЕ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ДНК ВИРУСА ГЕПАТИТА В И РНК ВИРУСА ГЕПАТИТА С СРЕДИ ЛИЦ РАЗЛИЧНОЙ ЭТНИЧЕСКОЙ ПРИНАДЛЕЖНОСТИ И БОЛЬНЫХ ГЕПАТИТОМ В И С + «
Автореферат диссертации по теме «ЗНАЧЕНИЕ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ДНК ВИРУСА ГЕПАТИТА В И РНК ВИРУСА ГЕПАТИТА С СРЕДИ ЛИЦ РАЗЛИЧНОЙ ЭТНИЧЕСКОЙ ПРИНАДЛЕЖНОСТИ И БОЛЬНЫХ ГЕПАТИТОМ В И С»
ЛДЕЛЬ ЖУМАНАВАД
У
ЗНАЧЕНИЕ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ДНК ВИРУСА ГЕПАТИТА В И РНК ВИРУСА ГЕПАТИТА С СРЕДИ ЛИЦ РАЗЛИЧНОЙ ЭТНИЧЕСКОЙ ПРИНАДЛЕЖНОСТИ И БОЛЬНЫХ ГЕПАТИТОМ ВИС
03. 00.15 — генетика 14 00 30 — эпидемиология
00.15 — генетика 14 00 30 — эпидемиология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени кандидата медицинских наук
□03454Э72
Москва-2008 г.
003454972
Работа выполнена на кафедре микробиологии медицинского факультета ГОУ ВПО «Российский Университет дружбы народов» и в лаборатории эпидемиологии вирусных гепатитов Учреждения Российской академии медицинских наук «Институт полиомиелита и вирусных энцефалитов им М.П. Чумакова РАМН»
Научный руководитель: доктор медицинских наук, профессор
Официальные оппоненты: доктор медицинских наук, профессор доктор медицинских наук, профессор
Михайлов Михаил Иванович
Семененко Татьяна Анатольевна Щипков Валерий Петрович
Ведущая организация: ГУ ВПО Московская медицинская академия им. И.М. Сеченова
Защита состоится « 17» декабря 2008 г в 15 часов на заседании совета по защите докторских и кандидатских диссертации Д 212.203. _2008 г.
_2008 г.
Ученый секретарь диссертационного совета / /у/ кандидат биологических наук, доцент /уГ /
Гагани Ольга Борисовна
На правах рукописи
АДЕЛЬ ЖУМАН АВАД
КАЧЕНИЕ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ДНК ВИРУСА
ГЕПАТИТА В И РНК ВИРУСА ГЕПАТИТА С :РЕДИ ЛИЦ РАЗЛИЧНОЙ ЭТНИЧЕСКОЙ ПРИНАДЛЕЖНОСТИ И БОЛЬНЫХ ГЕПАТИТОМ В II С
03 00.15 — генетика 14.00.30 — эпидемиология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени кандидата медицинских наук
Москва-2008 г.
Общая характеристика работы Актуальность темы исследования В 2004-2007 гг проявления эпидемического процесса гепатита В (ГВ) и гепатита С (ГС) в Российской Федерации приобрели принципиально новый качественный характер, продолжающееся снижение заболеваемости острыми формами сочетается с увеличением регистрации клинически выраженного хронического ГВ (ХГВ) и ГС (ХГС) и сохранением высокого уровня и активно выявляемых скрытых форм инфекции Важнейшим из маркеров ВГВ и ВГС является вирусная нагрузка данных вирусов в плазме или сыворотке крови пациентов Определение вирусной нагрузки вирусов гепатита В и С (ВГВ и ВГС), т. е концентрации вирусной ДНК и РНК в плазме или сыворотке крови, крайне важно в клинической практике, поскольку широкомасштабные когортные исследования показали роль высоких значений вирусной нагрузки ВГВ и ВГС как прогностического маркера неблагоприятного исхода заболевания — цирроза гтречени (ЦП) и гепатоцеллюлярной карциномы — ГЦК (С J Chu с соавт, 2002; С J Chen с соавт, 2006, U H Iloeje с соавт, 2006) Количественное определение ДНК ВГВ и РНК ВГС, наряду с биохимическими показателями, служит основным инструментом мониторинга противовирусной терапии и оценки ее эффективности (W О Cooksley с соавт, 2004, H В Keeffe с соавт, 2004), а также прогноза успеха лечения (Л Lok с соавт, 2004, А Л Van der Eijk с соавт, 2006) Величина вирусной нагрузки ВГВ и ВГС также является важным фактором, определяющим риск перинатальной передачи этих вирусов (А Soderstrom, 2003), и критерием допуска инфицированных медицинских работников к инвазивиым процедурам (EJ Buster, 2003) Учитыва» важность определения вирусной нагрузки ВГВ и ВГС в клинической практике, одним из основных требований к диагностикам для количественного определения ДНК ВГВ и РНК ВГС является точность и воспроизводимость анализа В лабораторной практике используется целый ряд тестов для количественного определения ДНК ВГВ и РНК ВГС, преимущественно основанных на методе полимеразной реакции (ПЦР) в реальном времени и методе разветвленных цепей ДНК (рДНК) Однако не установлен единый алгоритм определения вирусной нагрузки ВГВ и ВГС с помощью данных тестов Показано, что заболеваемость ЦП и ГЦК у среди лиц, проживающих в гиперэндемичных по ВГВ и ВГС территориях, значительно превышает аналогичные показатели в общей популяции Так, среди коренного населенля Аляски заболеваемость ГЦК в 5 раз превышает заболеваемость среди белого населения США (В J McHalon с соавт, 2001) Более высокие уровни заболеваемости ЦП и ГЦК связаны с высокой распространенностью ВГВ и ВГС в данных популяциях При этом установлено, что с повышенным риском карцшогенеза связаны определенные факторы
е концентрации вирусной ДНК и РНК в плазме или сыворотке крови, крайне важно в клинической практике, поскольку широкомасштабные когортные исследования показали роль высоких значений вирусной нагрузки ВГВ и ВГС как прогностического маркера неблагоприятного исхода заболевания — цирроза гтречени (ЦП) и гепатоцеллюлярной карциномы — ГЦК (С J Chu с соавт, 2002; С J Chen с соавт, 2006, U H Iloeje с соавт, 2006) Количественное определение ДНК ВГВ и РНК ВГС, наряду с биохимическими показателями, служит основным инструментом мониторинга противовирусной терапии и оценки ее эффективности (W О Cooksley с соавт, 2004, H В Keeffe с соавт, 2004), а также прогноза успеха лечения (Л Lok с соавт, 2004, А Л Van der Eijk с соавт, 2006) Величина вирусной нагрузки ВГВ и ВГС также является важным фактором, определяющим риск перинатальной передачи этих вирусов (А Soderstrom, 2003), и критерием допуска инфицированных медицинских работников к инвазивиым процедурам (EJ Buster, 2003) Учитыва» важность определения вирусной нагрузки ВГВ и ВГС в клинической практике, одним из основных требований к диагностикам для количественного определения ДНК ВГВ и РНК ВГС является точность и воспроизводимость анализа В лабораторной практике используется целый ряд тестов для количественного определения ДНК ВГВ и РНК ВГС, преимущественно основанных на методе полимеразной реакции (ПЦР) в реальном времени и методе разветвленных цепей ДНК (рДНК) Однако не установлен единый алгоритм определения вирусной нагрузки ВГВ и ВГС с помощью данных тестов Показано, что заболеваемость ЦП и ГЦК у среди лиц, проживающих в гиперэндемичных по ВГВ и ВГС территориях, значительно превышает аналогичные показатели в общей популяции Так, среди коренного населенля Аляски заболеваемость ГЦК в 5 раз превышает заболеваемость среди белого населения США (В J McHalon с соавт, 2001) Более высокие уровни заболеваемости ЦП и ГЦК связаны с высокой распространенностью ВГВ и ВГС в данных популяциях При этом установлено, что с повышенным риском карцшогенеза связаны определенные факторы
организма и вируса — генотип вируса, возвращение к HBeAg-позитивному стаггусу после периода сероконверсии по анги-НВе и старший возраст (S Е Livingston с соавт, 2007) Однако недоказанный остается предположение о том, что с повышенным риском развития ЦП и ГЦК при ГВ и ГС могут быть связаны определенные генетические факторы Учигывая, что связь между высокими значениями вирусной нагрузки ВГВ и ВГС и риском развития ЦП и ГЦК в настоящее время подтверждена, вполне возможным представляется существование различий между уровнями вирусной нагрузки ВГВ и ВГС среди инфицированных этими вирусами лип, принадлежащих к различным генетическим группам и проживающих в регионах с разными уровнями эвдемичности по ВГВ и ВГС
Цель исследован/ля
Целью настоящего исследования являлось определение значимости количественного выявления ДНК ВГВ и РНК ВГС в регионах с различными уровнями эндемичности по гепатитам В и С
Задачи исследования:
1 сравнить методы и диагностические препараты для количественного определения ДНК ВГВ и РНК ВГС,
2. разработать алгоритм применения тестов для определения вирусной нагрузки ВГВ и ВГС,
разработать алгоритм применения тестов для определения вирусной нагрузки ВГВ и ВГС,
3 определить уровни вирусной нагрузки ВГВ и ВГС в разных группах населения — у пациентов с ХГВ и ХГС, проживающих в региона)! с умеренным (Московская область) и высоким (Республика Тыва) уровнями эндемичности,
4 проанализировать клиническое значение количественного определения ДНК ВГВ и РНК ВГС
Научная новизна
1 Впервые показана более высокая воспроизводимость результатов определения вирусной нагрузки, полученных методом анализа разветвленные цепей ДНК (рДНК) по сравнению с методом ПЦР в реальном времени
2 Впервые в России предложен алгоритм определения вирусной нагрузки ВГВ и ВГС, основанный на ■ последовательном применении иммунологических и молекулярно-биологических тестов
3 Впервые в России показано отсутствие значимых различий между средними значениями вирусной нагрузки ВГВ и ВГС и долей лиц с высокими и низкими уровнями виремии среди пациентов с ХГВ и ХГС, проживающими в регионах с высокой и низкой степенью эндемичности по данным инфекциям
4 Впервые в России на основании когортного исследования и разбора клинических случаев установлена роль уровней виремии ВГВ и ВГС в прогрессировании заболевания печени и их влияния на степень гистологической активности при ВГВ- и ВГС-ассоциированном ХГ
Практическая значимость полученных новых научных знаний
1 Предложенный алгоритм определения вирусной нагрузки ВГВ и ВГС
может применяться как в клинической практике, так и при исследованиях, посвященных значимости определения вирусной нагрузки при вирусных ГВ и ГС
2 Установленное влияние уровней виремии ВГВ и ВГС на степень гистологической активности при ВГВ- и ВГС-ассоциированном ХГ и на прогрессирование заболевания печени доказывает необходимость применения тестов для количественного определения ДНК ВГВ и РНК ВГС в клинической практике
3 Доказанное отсутствие влияния на уровни вирусной нагрузки ВГВ и ВГС генетического (этнической принадлежности) и эпидемиологического (степени эндемичности территории проживания по ГВ и ГС) факторов позволяют унифицировать подходы к мониторингу вирусной нагрузки у пациентов с ГВ и ГС, что имеет большое значение для клинической практики
Апробация работы и публикации по теме диссертации Основные положения, выводы и практические рекомендации представлены на V Конференции молодых ученых России с международным участием «Фундаментальные науки и прогресс клиническои медицины», Москва, 2006 г, VII Российской международно-практической конференции с международным участием «Вирусные гепатиты — эпидемиология, диагностика, лечеиие и профилактика», Москва, 2007 г, IV съезде российского общества биохимиков и молекулярных биологов, Новосибирск, 2008 г Апробация работы проведена на заседании отдела вирусных гепатитов Института полиомиелита и вирусных энцефалитов им М П Чумакова РАМН
По теме диссертации опубликовано 5 научных работ, из них статей в центральной печати — одна, тезисов — четыре
Структура и объем диссертации
Диссертационная работа состоит из введения, обзора литературы, описания материалов и методов, собственных результатов и их обсуждения, выводов и списка литературы, включающего 12 источников отечественных и 124 зарубежных авторов Работа изложена на 131 страницах машинописного текста, включая 15 таблиц, 29 рисунков, 2 клинических наблюдения
Основные положения, выносимые на защиту
1 Показана высокая специфичность тест-систем для определения вирусной нагрузки вируса ГВ — «VERSANT HBV 3 0» (метод разветвленных цепей ДНК) и «Биотитр-В» (метод ПЦР в реальном времени) и согласованность результатов, полученных с помощью данных тестов
2 Для теста «VERSANT HBV 3 0» (метод разветвленных цепей ДНК) установлена более высокая степень воспроизводимости результатов по сравнению с тестом «Биотитр-В» (метод полимеразной цепной реакции — ПЦР в реальном времени), максимальное значение коэффициента вариации для двух тест-систем составило 2,79% и 10,69% соответственно
3 Показано отсутствие значимых различий между средними значениями вирусной нагрузки ВГВ и ВГС и долей лиц с высокими и низкими уровнями виремии среди пациентов с ХГВ и ХГС, проживающими в регионе с высокой степенью эндемичности (Республика Тыва) и регионе с низкой степенью эндемичности (Московская область)
4 Установлено, что такой генетический фактор, как этническая принадлежность, и такой эпидемиологический фактор, как проживание на территории с высокой или низкой степенью эндемичности по ГВ и ГС, не оказывают влияние на уровни виремии этих вирусов
5 Анализ клинического значения количественного определения ДНК ВГВ и РНК ВГС, проведенный среда пациентов с ХГВ и ХГС, показал отсутствие статистически значимой взаимосвязи между биохимическими показателями и уровнями виремии ВГВ и ВГС, однако была выявлена тенденция к повышению уровней активности аминотрасфераз (AJIT и ACT) у пациентов с высокой вирусной нагрузкой ВГВ и ВГС
Содержание работы Материалы и методы исследования Для определения уровней вирусной нагрузки ВГВ и ВГС у нативных пациентов (не получавших противовирусной терапии) с ХГВ и ХГС, проживающих в регионах с умеренным и высоким уровнями эндемичности С этой целью обследовали 54 пациента с ХГ, проживающих в Республике Тыва (гиперэндемичный район) и 127 пациентов — с ХГ, проживающих в Московской области (умеренная степень эндемичности) На момент обследования у всех пациенюв отсутствовала тяжёлая патология внутренних органов, злокачественные заболевания, ожирение, а также не была зафиксирована алкогольная шш наркотическая зависимость В исследование не включались беременные и кормящие грудью женщины, пациенты с аутоиммунными заболеваниями печени
Диагноз ХГВ и ХГС устанавливали на основании клинических данных, наличия маркеров инфицирования ВГВ и ВГС (HBsAg, ДНК ВГВ, анти-ВГС, РНК ВГС) и
повышения уровня сывороточных аминотрансфераз (AJIT и ACT) в течение последних 6 месяцев В план обследования включен анализ анкет для выявления потенциальных факторов риска инфицирования вирусами гепатитов с парентеральной передачей Распределение больных по полу, возрасту и нозологическим формам представлено в таблице 1.
Таблица 1. Характеристика обследованных больных с ХГВ и ХГС
Регион Нозологическая форма м/ж Средний возраст годы, X+SD Предполагаемая длительность заболевания, годы, X±SD
Московская область ХГВ, п=64 34/30 44±24 5 4±3 7
ХГС, п=63 33/30 44±27 4 6±2 8
Республика Тыва ХГВ, п = 6 2/4 30*23 негустановлена
ХГС,п = 33 10/23 42 ±28 4 8+3 1
Биохимические показатели активности АЛТ и ACT, фракции билирубина, протромбиновый индекс, креатинин, общий белок определялись на многофункциональном биохимическом анализаторе «Labsystem-M2340» (Финляндия)
С целью обнаружения вирионов в печени и их идентификации часть биопсийного материала от двух клинических случаев, анализировавшихся в работе, изучалась с помощью электронной микроскопии в лаборатории патоморфологии вирусных заболеваний ГУ ИПВЭ РАМН (зав лаб — профессор И А Морозов) срезы изучали в световом микроскопе с целью сопоставления с морфологической картиной, полученной на клинической базе (ГКБ N° 12 г Москвы) кафедры госпитальной терапии № 2 лечебного факультета РГМУ (зав кафедрой — академик РАМН, профессор Г И Сторожаков)
Для определения серологических маркеров ГВ и ГС были использованы коммерческие тест-системы производства ЗАО «Веетор-Бест» «Вектогеп В- HBs — антиген-стрип», с заявленной чувствительностью 0,1 нг/мл для выявления HBsAg, «Вектогеп В — HBs -антиген- подтверждающий тест стрип» с чувствительностью 0,1 нг/мл — для подтверждения в реакции нейтрализации позитивных результатов выявления HBsAg , «ГепаБест аши-HBc-IgG-CTpnn» и «BeKToHBcAg-IgM — стрип» — для выявления иммуноглобулинов класса IgG и IgM к core антигену вируса гепатита В, «BeieroHBsAg-антитела» — для количественного определения антител к HBsAg в диапазоне от 0 до 200мМЕ/мл, «РекомбиБЕСТ- анти-ВГС-стрип» — для выявления иммуноглобулинов классов G и М к вирусу гепатита С, «РекомбиБЕСТ- анги-ВГС подтверждающий тест» — с целью подтверждения положительных результатов ИФА, полученных при скрининге. Все постановки выполняли в соответствии с протоколами производителя
Все постановки выполняли в соответствии с протоколами производителя
При анализе молекулярных маркеров ГВ и ГС проводили выделение тотальных нуклеиновых кислот из образцов сыворотки крови с помощью набора для выделения ДНК/РНК из сыворотки или плазмы крови ООО НПФ «ЛИТЕХ» в соответствии с инструкцией производителя Определение ДНК ВГВ проводили в ПЦР с праймерами к консервативному участку ргесоге/соге генома ВГВ с чувствительностью не менее 100 копий/мл по результатам тестирования серии предельных разведений образцов с извгстной концентрацией ДНК ВГВ. РНК ВГС определяли методом обрагной транскрипции — ПЦР (ОТ-ПЦР) с праймерами к консервативному участку 5′-нетранслируемой области (5′-НТО) с чувствительностью не менее 100 копий/мл по результатам тестирования серии предельных разведений образцов с известной концентрацией РНК ВГС Генотип ВГС определяли методом ОТ-ПЦР с генотип-специфичными праймерами, предложенными Т ОИлоиМ Mizokami, 1998.
Для количественного определения ДНК-ВГВ и РНК-ВГС были использованы наборы «Биотитр-В» и «Биотитр-С», соответственно, производства ООО НПФ «ЛИТЕХ» Постановку данных тестов проводили проводи, ш в соответствии с инструкцией производителя в анализаторе TaqMan 48 (Roche)
В процессе сравнительных испытаний двух методов количественного определения ДНК ВГВ в сыворотке и плазме крови человека — ‘»VERSANT HBV 3 0″ (Bayer, метод разветвленных цепей ДНЮ, и «Биотитр-В» (ООО НПФ «ЛИТЕХ», Россия, ПЦР в реальном ^ремепи) проводили тестирование образцов сыворотки крови, полученных от пациентов с клинически подтвержденной ВГВ-инфекцией (п = 56) Среди обследованных пациентов у 33 (58,9%) был ХГВ, у 15 (26,8%) — «носительство» HBsAg, у 2 (3,6%) — ВГВ-ассошшрованный ЦП, у 3 (5,4%) — коинфекция ВГВ и ВГС, у 2 (3,6%) — коинфекция ВГВ и вируса гепатита дельта (НГО), и у I (1,8%) — коинфекция ВГВ, ВГС и ВГВ Образцы сыворогкн крови, полученные от данных пациентов, тестировали однократно, параллельно в тестах «VERSANT HBV 3 0» и «Биетитр-В» Для образцов, значения которых находились в линейном диапазоне для обоих тестов, «VERSANT HBV 3 0″ и «Биотитр-В», соответственно, проводили определение корреляции полученных значений по Пирсону Чувствительность и воспроизводимость результатов количественного определения ДНК ВГВ в тесте ‘VERSANT HBV 5 0» в сравнении с дизгностикумом «Биотитр-В» (ООО НПФ «ЛИТЕХ») определяли с помощью панели разведений стандарта ДНК ВГВ Панель представляла собой рат ведения стандарта, содержащего рекомбинантную ДНК ВГВ (производитель «Авиценна», Россия) в ВГВ-негативной человеческой плазме Панель содержала 5 разведении с шагом 1 lg копий ДНК ВГВ/мл, с концентрациями от 7 lg копий ДНК ВГВ/мл до 3 lg копий ДНК ВГВ/мл В каждом тесте
проводили трехкратное определение для каждой концет рации стандарта Для анализа клинической специфичности двух тестов проводили тестирование ВГВ-негативных образцов сыворотки крови, полученных от доноров крови, нереактивных по HBsAg и анти-НВс в ИФА (п = 60)
Статистические методы Для обработки полученных результатов использовали общепринятые методы вариационной статистики, включая oi ределение коэффициента корреляции по Пирсону и коэффициента вариации (CV%) Оценку достоверности различий между сравниваемыми величинами осуществляли на основании t-критерия Стьюдента (различия оценивались как достоверные при вероятности 95% — р <0,05)
Результаты н их обсуждение Сравнительная характеристика двух тестов, предназначенных для определения вирусной нагрузки ВГВ в сыворотке крови и плате, основанных на применении двух разных методов детекции
Оценка воспроизводимости тестов с помощью панели разведений рекомбинантней ДНК ВГВ показала более высокую воспроизводимость теста «VERSANT HBV 3 0» -коэффициент вариации колебался от 0,79% до 2,79%, тогда как значения коэффициента вариации для референс-теста «Биотитр-В» составляли от 2,39% до 10,69% (табл 2) Для каждого разведения панели — 103 Konmt/мл, 104 копий/мл, Ю5 копий/мл, 10° копий/мл и 107 копий/мл значения коэффициента вариации были ниже при использовании теста «VERSANT HBV 3 0» но сравнению с референс-тестом
Таблица 2. Результаты количественного определения ДНК ВГВ в панели разведений _стандарта ВГВ (рекомбинантиая ДНК ВГВ), «Авиценна» _ __,
Результаты количественного определения ДНК ВГВ в панели разведений _стандарта ВГВ (рекомбинантиая ДНК ВГВ), «Авиценна» _ __,
Концентрация ДНК HBV (копии ДНК HBV) 10» 10″ 105 il? п 10J
Средний титр в «VERSANT HBV 3 0» (lg когшй/мл) 1,7×10″ 6,23 5,7 х 10′ 5,76 5,3×104 4,72 3,0 х 10J 3,48
Коэффициент вариации (CV%) 2,54% 1,34% 0,79% 2,77%
Средний титр в «Биотитр-В» (lg копий/мл) 6,2 х 10″ 6,79 6,6 х 10′ 5,S2 9,4 х 104 4,97 5,5 х 104 3,74 0
Коэффициент вариации (CV%) 4,36% 10,69% 2,39% 5,67% -
Клиническую специфичность двух тсегов оценивали с помощью анализа ВГВ-негативных образцов сыворотки крови, полученных от доноров крови, нереактивных по
HBsAg и анти-НВс в ИФА (п = 60) Тестирование 60 образцов сыворотки крови, полученных от ВГВ-нереактивных допоров крови, показало, что все образцы были негативны по ДНК ВГВ в тестах «VERSANT HBV 3 0» и «Биотитр-В». Таким образом, клиническая специфичность обоих тестов составила 100%
Сопоставление результатов, полученных в тестах «VERSANT HBV 3 0» и «Биотитр-В», проводили для образцов сыворотки крови, полученных от пациетов с клинически подтвержденной ВГВ-инфекцией (п = 56)
Образцы сыворотки крови, полученные от данных пациентов, тестировали однократно, параллельно в тестах «VERSANT HBV 3 0» и «Биотитр-В» Дискордантными считали результаты, полученные в двух тестах, если они различались не менее чем на 1 lg копт! ДНК ВГВ/мл. Для образцов, значения которых находились в линейном диапазоне для обоих тестов, «VERSANT HBV 3 0» и «Биотитр-В», соответственно, проводили определение корреляции полученных значений по Пирсону
Для образцов, значения которых находились в линейном диапазоне для обоих тестов, «VERSANT HBV 3 0» и «Биотитр-В», соответственно, проводили определение корреляции полученных значений по Пирсону
Среди 56 образцов, полученных от пациентов с подтвержденной ВГВ-инфекцией, дискордантные результаты при тестировании в «VERSANT HBV 3 0» и «Биотитр-В» были получены для 4 образцов, что составило 7,1% от общего числа протестированных образцов Все 4 образца с дискордантными результатами были получены от пациентов с ХГВ и имели высокую вирусную нагрузку (более 106 копий/мл в обоих тестах) В пределы линейных диапазонов обоих тестов (2х103 — Ю8 копий ДНК ВГВ/мл для «VERSANT HBV 3 0» и 103 — 107 копий ДНК ВГВ/мл для «Биотитр-В», соответственно) укладывались значения, полученные для 30 образцов (53,6%) (рис 1) Значение коэффициента корреляции по Пирсону для результатов, полученных в «VERSANT HBV 3 0» и тесте •чБиотитр-В», и находящихся в линейном диапазоне для обоих тестов, составило 0,712.
=> s
3 4 5 6 7 S
HBV |0 копиий^ми, Бмотигр-В
Рис. 2000 копай/мл) или средними (<10′ копий/мл) У пациента с коинфекцией ВГВ, ВГТ) и ВГС вирусная нагрузка ВГВ была < 2000 копий/мл Среди пациентов с ХГВ преобладали средние уровни вирусной нагрузки ВГВ (20/33; t0,6%), однако у 7/33 (21,2%) регистрировали высокие уровни виремии (>106 копий/мл), а у 6/33 (18,2%) — низкие уровни виремии ВГВ (< 2000 копий/мл)
Полученные данные свидетельствуют о высокой специфичности изучавшихся тестов и согласованности полученных в >ых результатов, однако для теста «VERSANT HBV 3 0» (метод разветвленных цепей ДНК) показана более высокая степень воспроизводимости по сравнению с тестом «Биотитр-В» ( метод ПЦР в реальном времени)
Таким образом, было сделало заключение о возможности применения с равной эффективностью двух данных методов для дальнейших исследований по определению значимости количественного выявления ДНК ВГВ и РНК ВГС в регионах с различными уровнями эндемичносги по ГВ и ГС Однако, учитывая расхождения в воспроизводимости двух анализировавшихся тест-систем, очевидно, что для получеши сопоставимых результатов в разных когортах пациентов такие исследования необходимо проводить каким-либо одним методом Учитывая большею доступность, для решения последующих задач исследования, включая определение уровней вирусной нагрузки ВГВ и ВГС у пациентов сХГВ и ХГС, проживающих в регионах с умеренным и высоким уровнями эндемичности, и анализ клинического значения количественного определения ДНК ВГВ и РНК ВГС. нами были выбраны системы «Биотитр-В» и «Биотитр-С», к основе которых лежит технология ПЦР в реальном времени
На основании полученных данных, для проведения исспедований, посвященных, значимости определения вирусной нагрузки при вирусных ГВ и ГС, нами был предложен алгоритм применения тестов для определения вирусной нагрузки ВГВ и ВГС Ниже приведена последовательность действий, представляющая данный алгоритм
1 Тестирование серологических маркеров ГВ и ГС — HBsAg и анти-ВГС, соответственно, с сертифицированными чувствительными ИФА тсст-системами
2 Определение в качественном ГЩР-тесте, обладающем чувствительностью 100 копий/мл, ДНК ВГВ и РНК ВГС в образцах сыворотки/плазмы крови, положительных по HBsAg и анти-ВГС соответственно
3 Проведение количественного анализа ДНК ВГВ и РНК ВГС в образцах сыворотки/плазмы крови с вирсмией ВГВ и ВГС соответственно, выявленной в чувствительном качественном ГЩР-тесте Количественное определение ДНК ВГВ и Р’ЯК
ВГС должно проводиться во всех исследуемых образцах одним методом, с использованием одной тест-системы
Уровни вирусной нагрузки ВГВ и ВГС у пациентов е регионах с умеренным и высоким уровнями эндемичности
Для исследований по анализу уровней вирусной нагрузки ВГВ и ВГС у пациентов с ХГВ и ХГС, проживающих на территориях с умеренными и высокими уровнями эндемичности, были выбраны два региона Российской Федерации — Московская область и Республика Тыва Республика Тыва, по данным регистрации заболеваемости ГВ, является гиперэндемичным регионом по ВГВ-инфекции В 2007 г показатели заболеваемости ХГВ достигли 22,01 на 100 тыс населения, что в 1,6 раза превышает показатель для Российской Федерации (РФ) — 14,0 на 100 тыс нас и в 5,3 раза — показатели для Московской области (4,13 на 100 тыс населения) Показатель заболеваемости острым гепатитом В (ОГВ), по данным за 2007 г, в Республике Тыва (9,39 на 100 тыс населения) также значительно превышают средний показатель по РФ (5,28 на 100 тыс населения) и показатель по Московской области (7,65 на 100 тыс населения)
Показатели заболеваемости ХГС в Республике Тыва, по данным за 2007 г, в 5,4 раза ниже, чем в РФ (соответственно 6,8 и 37,01 на 100 тыс населения), и почти в 2 раза ниже по сравнению с показателем заболеваемости ХГС в Московской области (12,94 на 100 тыс населения) Также в Московской области в 2007 г заболеваемость ОГС превышала средний показатель по РФ — 6,96 на 100 тыс населения против 3,58 на 100 тыс населения, тогда как аналогичный показатель в Республике Тыва составил всего 0,97 на 100 тыс населения
Таким образом, в нашем исследовании Республика Тыва является регионом с высоким уровнем эндемичности по ГВ, а Московская область — регионом с низким уровнем эндемичности rio ГВ По ГС ситуация обратная — Московская область является регионом, эндемичным по ГС, тогда как для Республики Тыва характерен низкий уровень эндемичиости по ГС
Результаты анкетирования, проведенного с целью выяснения демографических данных пациентов, предполагаемой продолжительности заболевания, источников инфицирования, факторов риска, показали, что две анализируемых когорты — пациенты с ХГВ и ХГС, проживающие в Московской области и Республике Тыва, достоверно не различались по возрасту, средней продолжительности заболевания и распределению
факторов риска инфицирования, что является хорошей предпосылкой для изучения влияния генетических факторов и региона проживания на величину вирусной ншрузки ВГВ и ВГС
Среди 64 пациентов с ХГВ, проживающих в Московской области, ДНК ВГВ была выявлена в сыворотке крови у всех пациентов Значения вирусной нагрузки ВГВ у пациентов с ХГВ, проживающих в этом регионе, колебались от 1 х 103 до 1 х 107 копий/мл, составляя в среднем 1,0 х 105 копий/мл При этом доля лиц с вирусной нагрузкой ВГВ, не превышавшей среднее значение, выявлена у 48,4% (31/64) обследованных, а доля лиц с вирусной нагрузкой ВГВ более 1,0 х 105 копий/мл — у 51,6% (33/64)(табл 3)
Таким образом, распределение в когорте пациентов с ХГВ, проживающих в Московской области, лиц с высокой и низкой вирусной нагрузкой ВГВ было практически равным Среди 6 пациентов с ХГВ, проживающих в Республике Тыва, определяемые уровни ДНК ВГВ были выявлены всего у 2 пациентов, остальные являлись отрицательными по ДНК ВГВ У двух пациентов с виремией ВГВ вирусная нагрузка составила 1 х 104 копий/мл и 1 х 107 копий/мл (в среднем — 5х 10′ копий/мл) Выявление вирусной ДНК только у двух из 6 пациентов с ХГВ, проживающих в Республике Тыва, не позволяют проводить корректное сопоставление значений вирусной нафузки ВГВ у пациентов, проживающих в двух обследованных регионах Однако средние значения ВГВ, полученные для пациентов, положительных по вирусной ДНК в сыворотке крови, указывают на тенденцию к отсугствию различий эюго показателя у пациентов разной расовой принадлежности-, проживающих на территориях с разными уровнями эндемичности по ВГВ
Среди 63 пациентов с ХГС, проживающих в Московской области. РНК ВГС в сыворогке крови была выявлена во всех слу чаях, при этом значения вирусной нагрузки ВГС в дайной группе пациентов варьировали 01 2.4 х 104 копий/мл до 1 х 107 копий/мл. Средняя величина вирусной нагрузки ВГС у пациентов, проживающих в Московской области, не превышала 5,0 х 106 копий/мл, при эгом доля лиц с низкой вирусной нагрузкой (менее 5,0 х 10б) составила 56,0% (34/63), а лиц с высокой вирусной нагрузкой -46,0% (29/63) (табл 3) Статистически значимые различия по частоте выявления высокой и низкой вирусной нагрузки ВГС среди пациентов Московской области отсутствовали (р>0,05)
Таким образом, доли больных с высокими и низкими уровнями виремии ВГС в данной когорте были сходными Анализ генотипов ВГС у наблюдавшихся пациентов
показал, что генотип 1Ь встречался у 46% (29/63) пациентов, генотип За — у 54% (34/63) пациентов.
Среди 33 пациентов с ХГС, проживающих в Республике Тыва, РНК ВГС была выявлена у всех пациентов Генотип ВГС 1Ь был устаповлен у 17 (51%) пациентов, генотип ВГС За — у 16 (48%) пациентов, т е распределение генотипов ВГС среди пациентов с ХГС. проживающих в республике Тыва, было сходным с наблюдавшимся среди пациентов ;;з Московской области Уровни вирусной нагрузки колебались от 3,5 х 104 до 1 х 107 копий/мл, составив в среднем 5,0 х 106 копий/мл Данный показатель был идентичен значению, полученному при анализе вирусной нагрузки ВГС у пациентов с ХГС, проживающих в Московской области
Таблица 3. Распределение лиц с низкой и высокой вирусной нагрузкой ВГВ у пациентов, проживающих в регионах с разными уровнями эндемичности
по ВГВ и ВГС
Регион Средние значения вирусной нагрузки, копии/мл
ВГВ ВГС
<1,0×10′ > 1,0 х 10′ <5,0х 10″ > 5,0 х 106
Московская область 31/64 (48,4%) 33/64 (51,6%) 56,0% (34/63) 46,0% (29/63)
Республика Тыва 1/2 1/2 42,4% (14/33) 57,6% (19/33)
Доля лиц с концентрациями РНК ВГС в сыворотке крови, превышающими среднее значение (высокая вирусная нагрузка), составила 57,6% (19/33), доля лиц с низкой вирусной нагрузкой (ниже среднего значения) — 42,4% (14/33) (табл 3) Распределение лиц с высокой и низкой вирусной нагрузкой ВГС среди пациентов с ХГС, проживающих в Республике Тыва, как и среди лиц, проживающих в Московской области, было примерно равным
Таким образом, две группы пациентов с ХГС, проживающих в регионах с разной степенью эндемичности по ГС, не различались по доле лиц с высокими и низкими уровнями виремии ВГС Средние значения в.’фусной нагрузки ВГС также были одинаковыми в этих двух группах — 5,0 х 106 копий/мл Полученные результаты продемонстрировали, что в двух группах пациешов с ХГС, имеющих разную расовую принадлежность, и как следствие, различающихся по генетическим факторам организма, проживающих в регионах с разными уровнями эндемичности по ГС, отмечены одинаковые средние уровни виремии ВГС и сходное распределение лиц с высокой и низкой вирусной нагрузкой ВГС Полученные результаты свидетельствуют об отсутствии влияния уровня эндемичности региона проживания и этнической принадлежности пациента на уровни вирусной нагрузки ВГВ и ВГС соответственно
14
Анализ клинического значения количественного определения ДНК ВГВ и РНК вгс
Задачей данного этапа исследован™ явилось изучение особенностей клинического течения хронического вирусного гепатита в зависимости от вида вирусов — ВГВ, ВГС, их генотипов и уровня виремии Исследования проводили среди 127 пациентов с ХГВ (п = 64) и ХГС (п = 63), проживающих в Московской области
Больные ХГ вирусной этиологии были разделены на 2 группы, с высокой (1а и На) и низкой (16 и Нб) вирусной нагрузкой ВГВ и ВГС соответственно На основании результатов определения средних значений вирусной нагрузки ВГВ и ВГС, приведенных выше, для ГВ в качестве показателя, разделяющего уровни нагрузки на высокий и низкий, была выбрана концентрация ДНК ВГВ, равная 1,0х105 копий/мл, для ГС — концентрация РНК ВГС, равная 5,0х106 копий/мл (табл 4)
Генотшшрование ВГВ показало принадлежность изолятов, выделенных от HBsAg-позитивных пациентов, к генотипу Э У больных ХГС выявлены генопипы ВГС 1Ь и За у 29 пациентов с высокой вирусной нагрузкой ВГС (> 5,0 х 10′ копий/мл) Из них генотип 1Ь был выявлен у 13 (44,8%) человек, генотип За — у 16 (55,2%) Среди 34 пациентов с низкой вирусной нагрузкой ВГС (<5,0 х 106 копий/мл) генотип 1Ь был обнаружен у 16 (47,1%) обследованных, генотип За-у 18 (52,9%) (табл 5) Таким образом, распределение генотипов ВГС было сходным в группах пациентов с высоким и низким уровнями виремии
Таблица 4. Распределение больных с хроническими вирусными гепатитами в
Вирусная нагрузка, копии/мл
ХГВ (I группа) ХГС (11 группа)
1а 16 Па Нб
>1,0×10′ < 1,0 х Ю3 > 5,0 х 10ь < 5,0 х Ю6
(п=33) (п=31) (п=29) (п=34)
Таблица 5. Распределение генотипов ВГВ н ВГС у обследованных больных
Генотипы ВГВ и ВГС
ХГВ (1 группа) ХГС (11 группа)
]я 16 Па Иб
(11=33) (ч=31) (п=13) (п=16) (п=16) (п=18)
Б О 1Ь За 1Ь За
Клинические проявления у больных с наличием маркеров репликации ВГВ и ВГС соответствовали астеническому и болевому синдромам Жалобы на боли и/или чувство
15
тяжести в правом подреберье отмечали 46 (70%) и 46 (70%) больных ХГВ и ХГС, соответственно Слабость, быстрая утомляемость наблюдались у 26 (39,4%) при ХГВ и у 26 (39,4%) — ХГС В меньшем проценте случаев больные отмечали тошноту — 7 (10,6%) и 7 (10,6%), отрыжку — 2 (3%) и 2 (3%), нарушение стула — 9 (13,6%) и 9 (13,6%) больных ХГВ и ХГС, соответственно
«Малых» печеночных знаков не выявлено Желтушность склер при осмотре была обнаружена у 2 больных ХГВ, что составило (3,1 %) У 26 (39,4%) пациентов с ХГВ и у 26 (39,4%) обследованных с ХГС печень выступала из-под края реберной дуги по срединно-юпочичной линии на 0,5-4 см (в среднем — 2,2±0,5 см) Размеры селезенки были не изменены.
По данным УЗИ органов брюшной полости, признаки диффузного поражения печени выявлены у 42 и 34 больных ХГВ и ХГС, что составило 65,6% и 54,0% соответственно Гепатомегалия отмечена у 32 (50,0%) и 32 (50,8%) при ХГВ и ХГС соответственно, повышение эхогенности ткани печени — у 62 (96,9%) и 62 (98,4%), ослабление видимости сосудистых структур — у 10 (15,6%) и 10 (15,9%) — при ХГВ и ХГС соответственно Признаков портальной гипертензии по результатам УЗИ и эндоскопии верхних отделов пищеварительного тракта получено не было Частота выявления клинических признаков поражения печени была сходной у больных ХГВ и ХГС
С целью оценки функционального состояния печени у данных пациентов с ХГВ и ХГС. анализировали показатели активности АЛТ, ACT и содержание билирубина в сыворотке крови в зависимости от вирусной нагрузки ВГВ и ВГС (табл 6)
Анализ биохимических показателей у больных ХГВ с высокой (>1,0 х 105 копий/мл, п=33) и низкой вирусной нагрузкой ВГВ (<1,0 х 105 копий/мл, п=31) показал отсутствие статистически достоверных различий активности АЛТ, ACT и билирубина в этих двух группах Однако была отмечена тенденция к повышению уровня показателей в группе пациентов с высокой вирусной нагрузкой ВГВ
Таблица 6. Биохимические показатели (М±80) у больных ХГВ и ХГС _с высоким и низким уровнем вирусной нагрузки, п=127_
Вирусная нагрузка, копии/мл АЛТ, МЕ/мл ACT, МЕ/мл Билирубин, мкмоль/л
ДНК ВГВ, >1,0 х 10″ (п=33) 53,61 ± 35,92 45,89 ±27,85 14,67 ± 9,47
ДНК ВГВ, <1,0 х 105(п=31) 38,70 ±27,31 36,81 ±26,41 13,39 ±6,70
РНК ВГС, >5,0 х 106(п=29) 73,65 ± 55,09 62,39 ± 52,30 10,6 ± 4,87
РНК ВГС, <5,0 х Ю6(п=34) 62,63 ±38,97 40,96 ±22,31 13,59 ±8,40
fíe были выявлены статистически достоверные различия активности АЛТ, ACT и билирубина в группах пациентов с высокой (>5,0 х 106 копий/мл, п=29) и низкой (<5,0 х 106 копий/мл, п=34) вирусной нагрузкой ВГС Эта закономерность сохранялась и при тенденции к повышению показателей активности АЛТ и ACT в группе пациентов с высоким уровнем РНК ВГС
Таким образом, полученные результаты свидетельствуют об отсутствии значимых различий по уровням вирусной нагрузки ВГВ и ВГС, а также доле лиц с высокой и низкой вирусной нагрузкой, среди пациентов с хроническими гепатитами В и С, относящихся к различным этническим группам и проживающих в регионах, различающихся степенью эндемичности по ВГВ и ВГС Установлено, что генетический фактор — этническая принадлежность, и эпидемиологический фактор — проживание на территории с высокой или низкой степенью риска многократной встречи с возбудителем не оказывают влияние на уровни виремии этих вирусов и, соответственно на активность репликации ВГВ и ВГС Анализ клинического значения количественного определения ДНК ВГВ и РНК ВГС, проведенный среди пациентов с ХГВ и ХГС, проживающих в нсэндемичном по данным инфекциям регионе (Московская область), показал отсутствие статистически значимой взаимосвязи между биохимическими показателями и величиной вирусной нагрузки ВГВ и ВГС, однако была показана тенденция к повышению таких биохимических показателей, как уровни активности АЛТ и ACT у пациентов с высокой вирусной нагрузкой
Результаты гистологического обследования и глубокого морфологического анализа, проведенного с помощью электронной микроскопии, на конкретных клинических примерах пациентов с высокой и низкой вирусной нагрузкой ВГВ и ВГС, соответственно, подтверждают данные о роли уровней виремии в прогрессировании заболевания печени и их влиянии на степень гистологичской активности при ВГВ- и ВГС-ассоциированном хроническом гепатите
Выводы
1 Показана высокая специфичность тест-систем для определения вирусной нагрузки вируса гепатита В — «VERSANT HBV 3.0» (метод разветвленных цепей ДНК) и «Биотитр-В» (метод ПЦР в реальном времени) и согласованность результатов, полученных с помощью данных тестов
2 Показано отсутствие значимых различий между средними значениями вирусной нагрузки ВГВ и ВГС и долей лиц с высокими и низкими уровнями виремии среди пациентов с хроническими гепатитами В и С, проживающими в регионе с высокой
степенью эндемичносги (Республике Тыва) и регионе с низкой степенью эндемичносги (Московская область)
3. Для теста «VERSANT HBV 3 0» (метод разветвленных цепей ДНК) установлена более высокая степень воспроизводимости результатов по сравнению с тестом «Биотитр-В» (метод ПЦР в реальном времени), максимальное значение коэффициента вариации для двух тест-систем составило 2,79% и 10,69% соответственно
4. Установлено, что такой генетический фактор, как этническая принадлежность, и такой эпидемиологический фактор, как проживание на территории с высокой или низкой степенью эндемичносги по гепатиту В и С, не оказывают влияние на уровни виремии этих вирусов.
5. Анализ клинического значения количественного определения ДНК ВГВ и РНК ВГС, проведенный среди пациентов с ХГВ и ХГС, показал отсутствие статистически значимой взаимосвязи между биохимическими показателями и уровнями виремии ВГВ и ВГС, однако была выявлена тенденция к повышению уровней активности АЛТ и ACT у пациентов с высокой вирусной нагрузкой ВГВ и ВГС
Практические рекомендации
1. Для оптимизации количественного определения ДНК ВГВ и РНК ВГС в образцах сыворотки и плазме крови рекомендуется соблюдать последовательность действий, включающую тестирование серологических маркеров ГВ (HBsAg) и ГС (анти-ВГС), детекцию ДНК ВГВ и РНК ВГС в качественном ПЦР-тесте с чувствительностью не менее 100 копий/мл с последующей оценкой уровня виремии
2 Выявленная взаимосвязь между уровнем вирусной нагрузки и степенью активности некровоспалителыюго процесса печени сгидетельствует о необходимости осуществления клинико-вирусологического обследования больных с вирусными гепатитами В и С в динамике с целью своевременного выявления прогрессирования заболевания
3 Отсутствие влияния генетических и эпидемиологических факторов на уровни виремии
ВГВ и ВГС подтверждает целесообразность проведения универсального вирусологического мошггоринга вне зависимости от этнической принадлежности пациентов и распространенности вирусных гепатитов на территориях их проживания
Публикации, содержаi.’iiie основные научные результаты диссертации
1 Жуман Авад А Молекулярная характеристика изоиятов вируса гепатита В, выделенных от пациентов со скрытым гепат.’том В / Ганина А А, Кюрегян К К, Исаева О В.,
Дмитриев П Н , Жумаи Авад А, Михайлов МИ// Тезисы V Конференции молодых ученых России с международным участием «Фундаментальные науки и прогресс клинической медицины», Москва, 2006 С 101
2 Жумаи Авад А Частота выявления и генотипическое разнообразие ОВУ-С среди ВИЧ инфицированных пациентов / Дмитриев П Н , Цыкина М Н , Моисеева А В , Серков И Л , Пронин А Ю , Жумаи Авад А и др // Тезисы V Конференции молодых ученых России с международным участием «Фундаментальные науки и прогресс клинической медицины», Москва, 2006 С 132-133
3 Жуман Авад А Сравнительная характеристика двух тестов, предназначенных для количественного определения ДНК вируса гепатита В в сыворогке крови и плазме, основанных на применении двух разных методов детекции // Жумаи Авад А , Кюрегян К К , Исаева О В., Михайлов М И . Материалы VII Российской международно-практической конференции с международным участием «Вирусные гепатиты -эпидемиология, диагностика, лечение и профилактика», Москва, 2007 С 23-25
4 Жуман Авад А Сравнительная характеристика двух тестов, предназначенных для количественного определения ДНК вируса гепатита В в сыворотке крови и плазме, основанных на применении двух разных методов детекции // Жуман Авад А, Кюрегян К К, Исаева О В , Михайлов М И Бюллетень экспериментальной биологии и медицины, 2008, Том 146, №8 С 213-216
5 Жуман Авад А Изучение вирусов, вызывающих гепатиты, с помощью молекулярно-биологических методов / Исаева О В , Кюрегян К К , Попова О Е , Ганина А А , Дмитриев ПН, Жуман Авад А, Михайлов МИ // Сборник трудов IV съезда российского общества биохимиков и молекулярных биологов, Новосибирск, 2008 С 356
АДЕЛЬ ЖУМАН АВАД БИНСААД (ЙЕМЕН) ЗНАЧЕНИЕ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ДНК ВИРУСА ГЕПАТИТА В И РНК ВИРУСА ГЕПАТИТА С СРЕДИ ЛИЦ РАЗЛИЧНОЙ ЭТНИЧЕСКОЙ ПРИНАДЛЕЖНОСТИ И БОЛЬНЫХ ГЕПАТИТОМ ВИС
В работе изучены характеристики двух тестов, предназначенных для количественного определения ДНК ВГВ и РНК ВГС в сыворотке и плазме крови человека — «VERSANT HBV 3 0», основанного на методе разветвленных цепей ДНК (рДНК), и «Биотитр-В», основанного на методе полимеразной цепной реакции (ПЦР) в реальном времени Разработан алгоритм применения тестов для определения вирусной нагрузки ВГВ и ВГС Определены уровни вирусной нагрузки ВГВ и ВГС у пациентов с ХГВ и ХГС,
проживающих в регионах с умеренным (Московская область) и высоким (Республика Тыва) уровнями эндемичности по гепатитам В и С Проанализировано клиническое значение количественного определения ДНК ВГВ и РНК ВГС
Полученные результаты свидетельствуют о высокой специфичности изучавшихся тестов и согласованности, полученных в них результатов, однако для теста «VERSANT HBV 3 0» показана более высокая степень воспроизводимости по сравнению с тестом «Биотитр-В»
Показано отсутствие значимых различий между средними значениями вирусной нагрузки у пациентов с хроническими гепатитами В и С, проживающими в регионе с высокой степенью эндемичности (Республике Тыва) и регионе с низкой степенью эндемичности (Московская область)
Установлено, что генетический фактор, как эпическая принадлежность, и эпидемиологический фактор, не оказывают влияние на уровни виремии этих вирусов. Показана отсутствие взаимосвязи между биохимическими показателями и уровнями виремии, однако была выявлена тенденция к повышению уровней активности AJIT и ACT у пациентов с высокой вирусной нагрузкой ВГВ и ВГС
ADEL GUMAAN AWADH BINSAAD (YEMEN)
SIGNIFICANCE OF QUANTITATIVE MEASUREMENT OF DNA OF HEPATITIS В VIRUS AND RNA OF HEPATITIS С VIRUS AMONG PERSONS WITH ARIOUS ETHNICITY AND PATIENTS WITH HEPATITIS В AND С
It has been studied the characteristics of two tests for quantitative detection of HBV DNA and RNA HCV m human serum or plasma «VERSANT HBV 3 0» — based on branched DNA technology, and «Biotiter-B» — based on real-time PCR The algorithm of application of these tests is developed to determine viral load of HBV and HCV Levels of viral load of HBV and HCV in different patients with CHB and CHC, living in regions with low ( Moscow area) and high (Republic Tyva) levels of endemicity are determined Clinical significance of quantitative measurement of DNA of HBV and RNA of HCV is analyzed
The out put of the study proved about higher specificity of applied tests and concurrence of the results of quantitation of viral load, although the results reproducibility was higher for «VERSANT HBV 3 0» compared to «Biotiter-B»
It is indicated that ar. absence of significant distinctions between average values of viral load of HBV and HCV among patients with chronic hepatitis В and С with high and low levels of viremia. living in regions with high (Republic Tyva) and low ( Moscow area) levels of endemicity
It is established, that genetic factor, as an ethnicity, and epidemiological factor, do not influence on viremia caused by HBV and HCV It has shown absence of significant interrelation between biochemical parameters and level of viremia, however was revealed tendency of increasing the levels of ALT and AST of patients with high viral load of HBV and HCV
Отпечатано в издательстве «Химия и Бизнес» Формат А5, тираж 100 экз заказ № 209
Библиография Диссертация по биологии, кандидата медицинских наук, Авад, Бин Саад Адель Жуман (Йемен), Москва
1. Блюгер А. Ф., Залцман В.К., Картманова О.Я. Ультраструктурная патология печени. Рига: «Зинатне», 1989.
2. Гурская Т.Ю., Никитин И.Г., Размахнина Н.И., Попединский Н.М. К вопросу о вертикальной передаче HCV-инфекции // Мир вирусн. гепат. 2005. — № Ю. — С. 2 — 5.
3. Жебрун А.Б., Шляхтенко Л.И., Мукомолов С.Л. Вирусные гепатиты в Российской Федерации. Аналитический обзор, 6 выпуск СПб., — 2006. -С. 11-27.
4. Казанцев А.П., Зубик Т.М. Дифференциальная диагностика инфекционных болезней М.ЮОО «МИА», 1999.- С. 482.
5. Кюрегян К.К., Геворкян М.Г. Метод разветвленных цепей ДНК (bDNA) для обнаружения ДНК вируса гепатита В и РНК вируса гепатита С // Мир вирусных гепатитов. 2005. — № 9. — С. 2 — 4.
6. Лакина Е.И., Масалова О.В., Абдулмеджидова А.А., Кущ А.А. Вирусная нагрузка и тяжесть заболевания гепатитом С: есть ли связь? // Бюллетень НИИ вирусологии им. Д.И. Ивановского РАМН М., 2001. -С. 24-36.
7. Михайлов М.И. Вирусы гепатитов // Сб. тр. ИПВЭ им. М.П. Чумакова РАМН: Мед. вирусол. М., 2007. — Т. XXIV. — С. 205-223.
8. Морозов И.А., Княженцева А.К., Ильченко Л.Ю., Гордейчук И.В.
9. Электронная микроскопия в диагностике латентных (скрытых) форм HBV-инфекции // Мат. 14 РГН в РЖГГК / Прилож. к журн. РЖГГК. № 32. — С. 96.
10. Хлопова И. Н., Самохвалов Е. И. Частота обнаружения РНК вируса гепатита G у больных вирусными гепатитами // Гепатит В, С, D и G: проблемы изучения, диагностики, лечения и профилактики: Тезисы докл. II Российск. конф. М., 1997. — С. 234.
11. Шахгильдян И.В., Михайлов М.И., Онищенко Г.Г. Парентеральные вирусные гепатиты (эпидемиология, диагностика, профилактика).- М.: ФГОУ «ВУНМЦ Роздрава», 2003. С. 22-27.
12. Adinolfi L.E, Andreana A., Utili R. HCV RNA levels in serum, liver, and peripheral blood mononuclear cells of chronic hepatitis С patients and their relationship to liver injury // Am. J. Gastroenterol. 1998. — Vol. 93. — P. 2162-2166.
13. Adinolfi L.E., Utili R., Andredna A. Serum HCV RNA Levels Correlate with histological liver damage and concur with steatosis in progression of chronic hepatitis С // Dig. Dis. Sci. 2001. — Vol. 46. — P. 1677-1683.
14. Arase Y., Chayama K., Murashima N. Fluctuation patters of HCV-RNA serum level in patients with chronic hepatitis С // J. Gastroenter. 2000. -Vol. 35.-P. 221-225.
15. Ballardini G., Manzin A., Giostra F. Quantitative liver parametrs of HCV infection relation to HCV genotypes, viremia and response to interferon treatment // J. Hepat. — 1997. — Vol. 26. — P. 779-786.
16. Banerjee K., Sarin S.K, Naik S.R. et al. Polymerase chain reaction based diagnostic assay for identification of hepatitis В virus // Indian. J. Med. Res. 1992.-Vol. 95.-P. 173 — 178.
17. Birkenmeyer L.G. Detection of hepatitis А, В and D virus by the polymerase chain reaction // J. Virol. Methods. 1994. — Vol. 49. — P. 101 -112.
18. Caspari G., Gerlich W. Mandatory hepatitis В virus testing for doctors // Lancet 1998. — Vol. 352. — P. 991.
19. Castera L., Vergniol J., Foucher J. Prospective comparison of transient elastography, Fibrotest, APRI, and liver biopsy for the assessment of firsis in chronic hepatitis С // Gastroenter. 2005. — Vol. 128. — P. 343-350.
20. Carbonell N., Thiers V., Pol S. et al. Non А, В, C, D chronic hepatitis (CH): natural history, HGV prevalence // J. Hepatol. 1997. — Vol. 26. — P. 196.
21. Chang Т., Gish R., De Man R. et al. A comparison of entecavir and lamivudine for HBeAg-positive chronic hepatitis В // N. Engl. J. Med. -2006. Vol. 354. — P. 1001-1010.
22. Chen G., Lin W., Shen F. et al. Past HBV viral load as predictor of mortality and morbidity from HCC and chronic liver disease in a prospective study //Am. J. Gastroenterol. 2006. — Vol. 101. — P. 1797-1803.
23. Chen С J., Yang H.I, Su J. Risk of Hepatocellular Carcinoma Across a Biological Gradient of Serum Hepatitis В virus DNA Level // JAMA. -2006.-Vol. 295.-P. 65-73.
24. Chien R.N., Liaw Y.F. Chien R.N., Liaw YF. Short-term lamivudine therapy in HBeAg-negative chronic active hepatitis В in Taiwan // Antivir. Ther. 2006. Vol. 11. — P. — 947-952.
25. Chevalie S., Pawlotsky J. Hepatitis С virus Serological and virological tests and clinical diagnosis of HCV-Related Liver Disease // Int. J. Med. Sci.2006.-Vol.3.-P. 35-40.
26. Chu C.J, Hussain M., Lok A.S. Quantitative serum HBV DNA levels during different stages of chronic hepatitis В infection // Hepat. 2002. -Vol. 36. — P. 1408-1415.
27. Cho S.W., Hwang S.G., Han D.S. In situ detection of hepatitis С virus RNA in liver tissue using a digoxigenin-labeled probe created during a polimerase chain reaction // J. Med. Virol. -1996. Vol. 48, N 3. — P. 327-333.
28. Coelho-Little M.E., Jeffers L.J., Bernstein D.E. et al. Hepatitis С virus in alcoholic patients with and without clinically apparent liver disease // Alcohol. Clin. Exp. Res. 1995. — Vol. 19. — P. 1173-1176.
29. Colombatto P., Randone A., Civico G. et al. Hepatitis G virus RNA in the serum of patients with elevated gamma glutamyl transpeptidase and alkaline phosphatase: a specific liver disease // J. Viral. Hepatitis. 1996. — Vol. 3. — P. 301-306.
30. Colonno R.J., Rose R.E., Baldick C.J. et al. Entecavir resistance is rare invnuclroside naive patients with hepatitis В IIJ. Hepatol. 2007. — Vol. 44. — P. 1656-1665
31. Cooksley W.G. Treatment of hepatitis В with interferon and combination therapy // Clin. Liv. Dis. 2004. — Vol. 8. — P. 353-370.
32. Corey L., Gretch D., Wilson J. Acessment of hepatitis С virus RNA levels by quantitative competitive RNA polymerase chain reaction: high-titer viremia correlates with advanced stage of disease // J. Infect. Dis. -1994. -Vol. I 69.-P. 1219-1225.
33. Dalgard O., Bj0ro K., Helium K.B. Treatment with pegylated interferon and ribavirin in HCV infection with genotype 2 or 3 for 14 weeks: a pilot study // Hepat. 2004. — Vol. 40. — P. 1260-1265.
34. Davis G.L., Lau J.Y. Factors predictive of a beneficial response to therapy of hepatitis С // Hepat. 1997. — Vol. 26. — P. 122-127.
35. Davis G.L., Wong J.B., McHutchison J.G. Early virologic response treatment with peginterferon alfa-2b plus ribavirin in patients with chronichepatitis С // Hepat. 2003. — Vol. 38. — P. 645-652.
36. De Moliner L., Pontisso P., De Salvo G.L. Serum and liver HCV RNA levels in patients with chronic hepatitis C: correlation with clinical and histological features // Gut 1998. — Vol. 42. — P. 856-860.
37. Desmet V.J., Gerber M., Hoofnagle J.H. Classification of chronic hepatitis: diagnosis, grading and staging. // Hepat. -1994. Vol. I 9. — P. 1513-1520.
38. Deutsche Vereinigung zur Bekampfung der Viruskrankheiten. Empfehlungen zur Verhutung der Ubertragung von Hepatitis-B-Virus durch infiziertes Personal im Gesundheitsdienst // Epid. Bull. 1999. -Vol. 30. — P. 222-223.
39. Di Bisceglie A.M., Chung Y.W., Dailey P.J. et al. Hepatitis С Viral (HCV) markers in serum and Liver of chronically infected patients // Hepatol. -1994.-Vol. 20.-P. 236A.
40. Di Martino V., Saurini F., Samuel D. Long-term longitudinal study of intrahepatic hepatitis С virus replication after liver transplantation // Hepatol. 1997. — Vol. 26. — P. 1343-1350.
41. Dries V., von Both I., Muller M. Detection of hepatitis С virus in paraffin-embedded liver biopsies of patients negative for viral RNA in serum //! Hepat. 1999. — Vol. 28. — P. 223-229.
42. EASL Jury. EASL International Consensus Conference on Hepatitis B. 1314 September, 2002: Geneva, Switzerland. Consensus statement (short version) // J. Hepatol. 2003. — Vol. 39. — P. 3-25.
43. Erker J. C., Leary T. P., Desialet S. M. et al. Analyses of TT virus full-length genomic sequences // J. Gen. Virol. 1999. — Vol. 80. — P. 1743 — 1750.
44. Esteban J.I., Cordoba J., Sauleda S. The clinical picture of acute and chronic hepatitis C// Hepatitis С Virus / Ed.W. Reesink, Basel, Switzerland: Karger, 1998.-P.102-118.
45. Fabrizi F., Mangano S., Alongi G. Influence of hepatitis В virus virema upon serum aminotransferase activity in dialysis population // Int. J. Artif.
46. Organs. 2003. — Vol. 26. — P. 1048-1055.
47. Fattovich G. Natural history and prognosis of hepatitis В // Semin. Liv. Dis. -2003.-Vol. 23.-P. 47-58.
48. Feray C., Samuel D., Thiers V. Reinfection of liver graft by hepatitis С virus after liver transplantation // J. Clin. Invest. 1992. — Vol. 89. — P. 13611366.
49. Fried M.W., Shiftman M.L., Reddy K.R. Peginterferon alfa-2a plus ribavirin for chronic hepatitis С virus infection // N. Engl. J. Med. 2002. -Vol. 347. — P. 975-982.
50. Ghany M., Liang T.J. Drug targets and molecular mechanisms of drug resistance in chronic hepatitis В // Gastroenterol. 2007. — Vol. 132. — P. -1574-1585.
51. Gil В., Quian C., Riezu-Boj J.I. Hepatic and extra-hepatic HCV RNA strands in chronic hepatitis C: different patterns of response to interferon treatment // Hepat. 1993. — Vol. 18. — P. 1050-1054.
52. Gosalvez J., Rodriguez-Inigo E., Ramiro-Dias J. Relative quantification and mapping of hepatitis С virus by in situ hybridization and digital image analysis // Hepatol. 1998. — Vol. 27. — P. 1428-1434.
53. Gretch D., Corey L., Wilson J. et al. Acessment of hepatitis С virus RNA levels by quantitative competitive RNA polymerase chain reaction: high-titer viremia correlates with advanced stage of disease // J. Infect. Dis. -1994.-Vol. 169.-P. 1219-1225.
54. Halfon P., Bourliere M., Raab J. et al. Molecular analysis of sexual or intrafamilian transmission of hepatitis-G virus in HCV-infected couplies // J. Hepatol. 1997. — Vol. 26. — P. 1694-1696.
55. Hassoba H. M., Terrault N. A., el-Gohary А. М. Antibody to GBV-C second envelope glycoprotein (anti — GBV-C E2): is it a marker for immunity? // J. Med. Virol. 1997. — Vol. 53. — P. 354-360.
56. Hepatitis В infected health care workers. Health Service Circular, 2000. -http://www.doh.gov.uk/.
57. Heringlake S., Ockenda J., Tillmann H. L. et al. GB virus C/hepatitis G virus infection: a favorable prognostic factor in human immunodeficiency virus-infected patients? // J. Infect. Dis. 2003. — Vol. 187. — P. 504-507.
58. Heyward W.L., Lanier A.P., Bender T.R. et al. Primary hepatocellular carcinoma in Alaskan natives, 1969-1979 // Int. J. Cancer. 1981. — Vol. 28. — P. 47-50.
59. Hillemanns P., Dannecker C., Kimmiq R. Obstetric risks and vertical transmission of hepatitis С virus infection in pregnancy // Acta Obstet. Gynecol. Scand. 2000. — Vol. 79. — P. 543-547.
60. Hoofngale J. H., Di Biscegli A. M. Serologic diagnosis of acute and chronic viral hepatitis // Semin. Liver. Dis. 1991. — Vol. 11. — P. 73-83.
61. Hu K.Q. A Practical Approach to Management of Chronic Hepatitis // Int. J. Med. Sci. 2005. — Vol. 2. — P. 17-23.
62. IGZ bulletin Preventie Iatrogene Hepatitis B, 2002. -www.igz.nl/32601/2002bulletinpreventie
63. Iloeje U., Yang H., Jen C. Risk and Predictors of Mortality Associated With Chronic Hepatitis В Infection // Clin. Gastroenter. Hepatol. 2005. — Vol. 5. -P. 921-931.
64. Iloeje U.H., Yang H., Su J. Baseline HBV viral load and excess mortality associated with chronic hepatitis В infection: The REVEAL-HBV study // 57th AASLD October 27- 31, 2006, Boston. — A 949.
65. Jamal M.M., Soni A., Quinn P.G. Clinical features of hepatitis C-infected patients with persistently normal alanine transaminase levels „ in the Southwesten United States //Hepat. -1999. Vol. 30. — P. 1307-1311.
66. Kaneko S., Kobayashi K., Miller R.H. Detection of hepatitis В virus DNA using the polymerase chain reaction technique // J. Clin. Lab. Anal. 1990. -Vol. 4. — P. 479-482.
67. Keeffe E.B., Dieterich D.T., Han S-H.B. et al. A treatment algorithm for the management of chronic hepatitis В virus infection in the United States: an update // Clin. Gastroenterol. Hepatol. 2006. — Vol. 4. — P. 1-27.
68. Keeffe E.B., Zeuzem S., Koff R.S. et al. Report of an international workshop: roadmap for management of patients receiving oral therapy for chronic hepatitis В // Clin. Gastroenterol. Hepatol. 2007. — Vol. 5. — . 890897.
69. Knodell R.G., Ishak K.G., Black W.C. et al. Formulation and application of a numerical scoring system for assessing histological activity in asymptomatic chronic active hepatitis // Hepatol. 1981. — Vol. 1. — P. 431
70. Langley D.R., Walsh A.W., Baldick C.J. Inhibition of hepatitis В virus polymerase by entecavir // J. Virol. 2007. — Vol. 81. — P. 3992-4001.
71. Lai C.L., Shouval D., Lok A.S. et al. Entecavir versus lamivudine for patients with HBeAg-negative chronic hepatitis В // N. Engl. J. Med. 2006. -Vol. 354.-P. 1011-1026.
72. Lau G.K.K., Fang J.V.C., Wu P.S. Detection of hepatitis С virus genome in formalin-fixed parafin-embedded liver tissue by in situ reverse transcription polymerase chain reaction // J. Med. Virol. 1994. — Vol. 44, N 5. — P. 406409.
73. Lau J.Y., Davis G.L., Kniffen J. et al. Significance of serum hepatitis С virus RNA levels in chronic hepatitis С // Lancet. 1993. — Vol. 41. — P. 501-504.
74. Le Guen В., Squadrito G., Nalpas B. Hepatitis С virus Genome Complexity correlates with response to interferon therapy: a study in French patients with chronic hepatitis С // Hepat. 1997. — Vol. 25. — P. 1250-1253.
75. Livingston S.E., Simonetti J.P., McMahon B.J. et al. Hepatitis b virus genotypes in Alaska native people with hepatocellular carcinoma: preponderance of genotype F // J. Infect. Dis. — 2007. — Vol. 195. — P. 5-11.
76. Lok A.S., Chien D., Choo Q.L. Antibody response to core, envelope and nonstructural hepatitis С virus antigens: comparison of immunocompetent and immunosuppressed patients // Hepat. 2003. — Vol. 18. — P. 497-502.
77. Lok A.S-F. Navigating the maze of hepatitis В treatments // Gastroenterol. -2007. Vol. 132. — P. 1586-1594.
78. Manns M.P., McHutchison J.G., Gordon S.C. Peginterferon alfa-2b plus ribavirin compared with interferon alfa-2b plus ribavirin for initial treatment of chronic hepatitis C: a randomised trial // Lancet 2001. — Vol. 358. — P. 958-965.
79. Martin J., Navas S., Quiroga J. A. Quantification of hepatitis С virus in liverand peripheral blood mononuclear cells from patients with chronic hepatitis С virus infection // J. Med. Virol. 1998. — Vol. 54. — P. 265-270.
80. Martin I., Poljak M., Seme K. et al. Comparative evaluation of semiautomated COBAS AMPLICOR HBV Monitor Test and manual microwell plate-based AMPLICOR HBV MONITOR Test // J. Clin. Microbiol. 2001. — Vol. 2. — P. 758-761.
81. Marzano A., Gaia S., Ghisetti V. Viral load at the time of liver transplantation and risk of hepatitis В virus recurrence // Liver Transpl. -2005.-Vol. 11.-P. 402-409.
82. McHalon BJ, Hoik P, Bulkow L et al. Serologic and clinical outcomes of 1536 Alaska natives chronically infected with hepatitis В virus // Ann. Intern. Med. 2001. — Vol. 35. — P. 759-768.
83. McGuinnes PH., Bishop G.A., Painter D.M. Intrahepatic hepatitis С RNA levels do not correlate with degree of liver injury in patients with chronic hepatitis С // Hepat. 1996. — Vol. 23. — P. 676-687.
84. McMahon В J. The natural history of chronic hepatitis В virus infection // Semin. Liv. Dis. 2004. — Vol. 24. — P. 17-21.
85. Mellor J., Haydon G., Blair C. Low level or absent in vivo replication of hepatitis С virus and hepatitis G virus / GB virus С in peripheral blood mononuclear cells // J. Gen. Virol. 1998. — Vol. 79. — P. 705-714.
86. Mizokami M., Nakano Т., Orito E. Hepatitis В virus genotype assignment using restrction fragment lengh polymorphism patterns // FEBS Lett. 1999. -Vol. 450.-P. 66-71.
87. Moaven L.D., Tennakoon P.S., Badwen D.S. et al. Mother-to-baby transmission of hepatitis G virus // Med. J. Aust. 1996. — Vol. 165. — P. 8485.
88. Morozov I. A., Knjazhentseva A.K. Hepatocyte ultrastructure and virus-dependent lesions under chronic HBV hepatitis // Falk symp. 167, 20-21 Sept. 2008, Mainz.-A. 81.
89. Mushahwar I. K.5 Erker J. C.5 Muerhoff A. S. et al. Molecular and biophysical characterization of TT virus: Evidence for a new virus family infecting humans // P.N.A.S. USA — 1999. — Vol. 96. — P. 3177-3182.
90. Negro F., Giostra E., Krawczynski K. Detection of intrahepatic hepatitis С virus replication by strand-specific semi-quantitative RT-PCR: preliminary application to the liver transplantation model // J. Hepatol. 1998. — Vol. 29. -P. 1-11.
91. NIH Consensus Statemet on Management of Hepatitis C: 2002 // NIH Consens State Sci Statements. 2002. — Vol. 19. — P. 1-46.
92. Ohno Т., Mizokami M. Genotyping with type-specific primers that can type HCV types 1-6. Methods in molecular medicine // Hepatitis С protocols. 1998. — Vol. 19. — P. 159-164.
93. Okumura A., Yoshioka K., Aiyama T. Different constitution of hepatitis С virus population in peripheral blood mononuclear cells and plasma in patients with type С chronic liverdisease // Dig. Dis. Sci. 1998. — Vol. 43. -P. 377-383.
94. Onto E., Mizokami M., Nakano T. et al. Serum hepatitis С virus RNA level as a predictor of subsequent response to interferon alpha therapy in Japanese patients with chronic hepatitis С // J. Med. Virol. 1994. — Vol. 44.-P. 410-414.
95. Pawlotsky J-M. Use and interpretation of virological tests for hepatitis С // Hepat. 2002. — Vol. 36. — P. 65-73.
96. Pawlotsky J-M., Ben Yahia M., Andre C. et al. Immunological disorders in С virus chronic active hepatitis: a prospective case-control study // Hepatol. 1994. — Vol. 19. — P. 841 — 848.
97. Persico M., Persico E., Gesue L. et al. Etiology and clinical relevance of hepatitis G virus in viral hepatitis // J. Hepatol. 1997. — Vol. 26 (Suppl.l). -P. 201.
98. Poynard Т., Imbert-Bismut F., Munteanu M. FibroTest-FibroSURE: towards a universal biomarker of liver fibrosis? // Expert. Rev. Mol. Diagn. 2005. — Vol. 5. — P. 15-21.
99. Poynard Т., McHutchison J., Manns M. Impact of pegylated interferon alfa-2b and ribavirin on liver fibrosis in patients with chronic hepatitis С // Gastroenter. 2002. — Vol. 122. — P. 1303-1313.
100. Rapti B.I., Dimou E., Mitsoula P., Hadziyannis S.J. Adding-on versus switching-to adefovir therapy in lamivudine-resistant HBeAg-negative chronic В // Hepatol. 2007. — Vol. 45. -P. 266-268.
101. Reddy K.R., Wright T.L., Pockros P. Efficacy and safety of pegylated (40-kd) interferon alpha-2a compared with interferon alpha-2a in noncirrhotic patients with chronic hepatitis С // Hepat. 2001. — Vol. 33. — P. 433-438.
102. Rey D., Fraize S., Vidnic J. et al. High prevalence of GB virus C/hepatitis G virus RNA in patients infected with human immunodeficiency virus // J. Med. Virol. 1999. — Vol. 57. — P. 75-79.
103. Robinson D.M., Scott L.J., Plosker G.L. Entecavir. A review of its use in chronic hepatitis В // Drugs 2006. — Vol. 66. — P. 1605-1622.
104. Rodriguez-Inigo E., Bartolome J., de Lucas S. Histological damage in chronic hepatitis С is not related to the extent of infection in the liver // Am. J. Pathol. 1999. — Vol. 54. — P. 1877-1881.
105. Sato S., Yamada M., Miyazaki Y. et al. Relationship between molecular state of serum HBV DNA and clinical features of hepatitis В virus carriers // Tohoku J. Exp. Med. 1993. — Vol. 171. — P. 309-317.
106. Seidi S., Koenig В., Reinhardt G. Higher detection rate of hepatitis G and С virus RNA in liver tissue than in serum of deceased injection drug users // Int. J. Legal. Med. 1999. — Vol. 112. — P. 35-38.
107. Shaw Т., Bartholomeusz A., Locarnini S. HBV drug resistance: Mechanisms, detection and interpretation // Hepatol. 2006. — Vol. 44. — P. 593-606.
108. Shibuya A., Tareuchi A., Kamata K. et al. Prevalence of hepatitis G virus RNA and anti — E2 in a Japanese haemodialysis population // Nephrol. Dial. Transplant. 1998. — Vol. 13. — P. 2033-2036.
109. Soderstrom A., Norkrans G., Lindh M. Hepatitis В virus DNA during pregnancy and post partum: aspects on vertical transmission // Scand. J. Infect. Dis.-2003.-Vol. 11-12. P. 814-819.
110. Sugano M., Hayashi J., Joon S. Quantification of hepatitis С viral RNA in liver and serum samples using competitive polymerase chain reaction // J. Clin. Pathol. 1995. — Vol. 48. — P. 820-825.
111. Tanaka E., Alter H. J., Nakatsuji Y. et al. Effect of hepatitis G virus infection on chronic hepatitis С // Ann. Int. Med. 1996. — Vol. 125. — P. 740-743.
112. Terrault N.A., Dailey P.J., Ferrell L. et al. Hepatitis С virus: quantitation and distribution in liver // J. Med. Virol. 1997. — Vol. 51. — P. 217-224.
113. Terrdult N.A., Pawlotsky J-M., McHutchison J. Clinical utility of Viral Load Measurements in individuals with Chronic Hepatitis С infection on antiviral therapy // J. Vir. Hepat. 2005. — Vol. 12. — P. 465-472.
114. Tillmann H.L. Antiviral therapy and resistance with hepatitis В virus infection. World J. Gastroenterol. 2007. — Vol. 13. — P. 125-140.
115. Tillmann H. L., Heiken H., Knapik-Botor A. et al. Infection with GB virus С and reduced mortality among patients with HIV infection // N. Engl. J. Med. 2001. — Vol. 345. — P. 715-724.
116. Tram T.T, Martin P. Hepatitis B: epidemiology and natural history // Clin. Liver Dis. 2004. — Vol. 8. — P. 255-266.
117. Wejstal R., Manson A. Perinatal transmission of Hepatitis G Virus and Hepatitis С Virus infections // Clin. Infect. Dis. 1999. — Vol. 28. — P. 816837.
118. Wilber J.C., Urdea M.S. Quantification of HCV RNA in clinical specimens by branched DNA(bDNA) technology // Methods in Molecular Medicine Hepatitis C. 1998. — Vol. 19. — P. 71-78.
119. Xiang J., Wunschmann S., Dickema D. J. et al. Effect of coinfection with GB virus С on survival among patients with HIV infection // N. Engl. J. Med. 2001. — Vol. 345. — P. 707-714.
120. Yeo W., Mo F.K., Chan S.L. et al. Hepatitis В viral load predicts survival of HCC patients undergoing systemic chemotherapy // Hepatol. 2007. -Vol. 45.-P. 1382-1389.
121. Young K.C., Chang T.T, Liou T.C. Detection of hepatitis С vims RNA in peripheral blood mononuclear cells and in saliva. // J. Med. Virol. 1993.1. Vol. 41.-Р. 55-60.
122. Zeuzem S. Overview of commercial HBV Assay Systems. Methods in molecular Medicine // Hepatitis В and D Protocols 2004. — Vol. 95. — P. 313.
123. Zeuzem S., Buti M., Ferenci P. Efficacy of 24 weeks treatment with peginterferon alfa-2b plus ribavirin in patients with chronic hepatitis С infected with genotype 1 and low pretreatment viremia // J. Hepatol. 2006. -Vol. 44.-P. 97-103.
124. Zignego A.L., De Carli M., Monti M. Hepatitis С vims infection of mononuclear cells from peripheral blood and liver infiltrates in chronically infected patients // J. Med. Virol. 1995. — Vol. 47. — P.58-64.
Вирусная нагрузка при гепатите С: расшифровка, таблица
Гепатит С — трудно диагностируемое заболевание, его наличие проверяется посредством сразу нескольких анализов. Определение вирусной нагрузки по количеству рибонуклеиновых кислот в крови позволяет не только установить наличие болезни, но и выяснить стадию ее развития. Расскажем, каким образом происходит трактовка анализа и какие методики используются в данном случае.
Методика определения вирусной нагрузки
Для проведения анализа необходимо взять венозную кровь, в которой при помощи разнообразных лабораторных процедур вычисляется наличие или отсутствие РНК вируса в крови.
Есть взаимосвязь количественного показателя со стадией заболевания. Чем выше содержание РНК вируса, тем более запущенным считается заболевание.
Выделяют две разновидности анализа на вирусную нагрузку:
- качественный, при котором определяется присутствие или отсутствие вируса в крови;
- количественный, когда в расчет берется именно число клеток вируса в крови.
Для проведения вычислений используется следующее:
- Высокоточная полимеразная цепная реакция, которая позволяет выявить болезнь даже на самых ранних стадиях развития.
- Метод раздвоенной ДНК считается более доступным в смысле стоимости, но куда менее точным. Такой анализ может показать отсутствие вируса при его наличии.
- Транскрипционная амплификация позволяет выявить вирус на ранних стадиях. Главным достоинством методики считается ее относительная доступность.
Обычно врачи в государственных медицинских учреждениях используют первые две методики, поскольку стоит их проведение гораздо дешевле.
Однако вне зависимости от выбранного способа для установления степени вирусной нагрузки нужна немалая точность. Именно поэтому проведение анализа можно доверять лишь хорошему врачу-диагносту.
Расшифровка полученных данных в таблице
Важно знать, как расшифровывается вирусная нагрузка при гепатите с. Расшифровка в таблице, представленной ниже, позволяет не только определить стадию болезни, но и понять, прогрессирует ли она.
| Показатели анализа | Значение |
| Отсутствие РНК вируса в крови | Данный результат означает, что человек абсолютно здоров. |
| Значение ниже 180 МЕ/л | Результат означает, что концентрация вируса минимальна, возможно диагностирование болезни на самой ранней стадии. |
| Значение от 300 до 800 МЕ/л | Наличие вируса гепатита С, стремительное развитие болезни, возможность хронической стадии. |
| Значение выше 800 МЕ/л | Данный показатель свидетельствует о том, что болезнь вышла на финальный уровень развития, наблюдаются серьезные поражения печени. |
Важно понимать, что данный анализ порой оказывается неточным. Вероятность наличия ложного положительного или отрицательного результата крайне высока.
Стоит принять некоторые меры, чтобы минимизировать риск получения ложного результата:
- Перед сдачей анализа следует не употреблять алкоголь в течение 48 часов.
- Также не рекомендуется принимать таблетки за двое суток до похода к врачу.
- Сдавать анализ лучше всего с утра и на голодный желудок.
- Не рекомендуется сдавать анализ на РНК вируса, если человек болен каким-либо инфекционным заболеванием.
- Важно, чтобы медицинский работник следил за чистотой пробирки. При наличии посторонних веществ в ней риск получения ложного результата заметно повышается.
В деле выяснения вирусной нагрузки важна правильная подготовка к сдаче анализа, квалификация врача-диагноста. При отсутствии у него достаточной квалификации риск постановки неправильного диагноза заметно повышается.
Частота сдачи анализа
Еще один важный вопрос, возникающий у пациентов, касается частоты сдачи анализа для определения уровня вирусной нагрузки.
Многие пошибочно полагают, что достаточно сдать анализ лишь однажды, чтобы определить заболевание. Однако врачи настаивают на том, что следует проходить обследование на первой, четвертой, шестой и двенадцатой неделе лечения.
Все дело в том, что по концентрации РНК вируса в крови удается определить степень развития болезни, а также действенность прописанного лечения.
Так, по анализу на вирусную нагрузку врач может сделать следующие выводы:
- эффективно ли прописанное лечение, ведь если количество РНК вируса в крови не уменьшается, велик риск прописывания неподходящих медикаментов;
- в какой стадии находится болезнь, ведь если количество РНК вируса увеличивается, речь идет о возможном развитии цирроза и печеночной недостаточности;
- если количество РНК вируса снижается до минимума и удерживается на одной величине, можно говорить о стадии ремиссии.
Врачи с помощью такой методики диагностирования могут не только сделать вывод о присутствии или отсутствии вируса в крови, но и отследить динамику развития болезни.
Если значение вирусной нагрузки падает, врачи прописывают поддерживающую терапию, после чего отслеживают РНК-вируса раз в 1-2 месяца. С помощью такой диагностики удается вовремя заметить рецидив и предотвратить возникновение неприятных последствий для самочувствия.
С помощью качественного и количественного анализов можно определить, насколько эффективной окажется медикаментозная терапия.
Чаще всего людям с таким диагнозом прописываются «Рибавирин» и «Интерферон-альфа». Однако иногда на эти медикаменты возникает аллергическая реакция, а дозировка оказывается недостаточной, чтобы снизить количество РНК вируса в крови.
Полностью победить гепатит С с помощью современных методик лечения практически невозможно. Однако врачам удается притормозить его развитие. В половине случаев заболевание переходит в хроническую стадию развития, что оборачивается необходимостью постоянного лечения, риском развития цирроза и печеночной недостаточности. Однако при организации правильного лечения врачам удается продлить жизнь пациента на 10-15 лет.
Идентификация транскриптов, связанных со спонтанным клиренсом ВГС у лиц, коинфицированных ВИЧ и ВГС
Профиль мРНК плазмы ВИЧ-инфицированных лиц с клиренсом ВГС и лиц с хронической инфекцией
Анализ транскриптомов плазмы проводился у лиц, инфицированных ВГС, которые очищались вируса и тех, кто остался хронически инфицированным. Схематическая диаграмма подходов к измерению дифференциально экспрессируемых генов в образцах плазмы пациентов, собранных до и после инфицирования ВГС, у тех, у кого ВГС вылечили, и у тех, кто остался хронически инфицированным, показана на рис.. Сравнение транскриптомов до инфицирования ВГС между группой клиренса ВГС (TR1B, рис.) И группой, инфицированной хроническим ВГС (TR 2B, рис.), Показало, что уровни экспрессии 32 генов были значительно выше (в 5–563 раза) и экспрессия уровень одного гена (LL22NC03–63E9.3) был значительно ниже в группе клиренса (таблица). Для дальнейшей оценки кластеризации субъектов в хронических группах и группах клиренса, а также между группами, иерархическая кластеризация была проведена с использованием дифференциально экспрессируемых генов (рис.). Четыре из восьми хронически инфицированных участников сгруппировались вместе, что указывало на различный паттерн экспрессии генов, тогда как другие четыре образца не демонстрировали подобного паттерна. С другой стороны, трое из пяти участников в группе очистки сгруппировались в кластеры, что указывает на аналогичную экспрессию генов, а у остальных двух субъектов была различная экспрессия генов. И в группе клиренса, и в хронической группе характеристики образцов, которые не агрегировались с остальными образцами в соответствующих группах, не различались в отношении вирусной нагрузки ВИЧ или полиморфизма IL28B .Это предполагает, что вирусная нагрузка ВИЧ и полиморфизм IL28B могут не иметь независимого влияния на характер экспрессии гена.
Схематическая диаграмма дифференциально экспрессируемых генов из образцов плазмы пациентов, собранных до и после инфицирования HCV. Последовательности, сгенерированные из РНК плазмы пациентов, оценивались с помощью CLC Genomics Workbench 7 и статистически анализировались с использованием Bioconductor Edge R
Таблица 2
DEG в плазме до инфицирования ВГС в группе клиренса по сравнению с таковыми в хронически инфицированной группе
| DEGs a | Генная функция | Разность складок | P значение | FDR | |
|---|---|---|---|---|---|
| AD000091.2 | Без характеристики | 563,4 | 2,83E – 07 | 0,001188912 | |
| C11orf95 | Открытая рамка считывания 95 хромосомы 11. Заболевания, связанные с C11orf95, включают эпендимому и хондроидную липому. | 100,9 | 5.80E – 07 | 0,001188912 | |
| LPAR1 | Рецептор лизофосфатидной кислоты 1. Его родственные пути представляют собой сигнальный путь PI3K-Akt и сигнальный путь Ras. | 20 | 6.66E – 07 | 0,001188912 | |
| LBR | Рецептор ламина B. Связанные с ним пути — метаболизм и метаболизм. | 20,6 | 2,85E – 06 | 0,003815476 | |
| GNAI1 | Белок, связывающий гуанин-нуклеотид (G-белок), полипептид 1 с ингибирующей альфа-активностью. Его родственными путями являются путь GPCR и путь GPCR. | 7,6 | 9,21E – 06 | 0,008563212 | |
| HOXD13 | Homeobox D13.Этот ген связан с последовательностью специфической ДНК-связывающей активностью фактора транскрипции и связыванием хроматина. | 231,4 | 9,61E – 06 | 0,008563212 | |
| EARS2 | Глутамил-тРНК синтетаза 2, митохондриальная. Связанные с ним пути — это метаболизм и экспрессия генов. | 22,6 | 1,17E-05 | 0,008563212 | |
| PRDM13 | PR-домен, содержащий 13. Этот ген связан с активностью метилтрансферазы. | 30,4 | 1,28E – 05 | 0,008563212 | |
| RAB11FIP5 | Взаимодействующий белок 5 семейства RAB11 (класс I). Связанные с ним пути — это эндоцитоз и трафик Delta508-CFTR / ER-to-Golgi при CF. | 23 | 2,52E – 05 | 0,013834245 | |
| CTC-504A5.1 | Аффилирован с классом нкРНК | 16,6 | 2,58E – 05 | 0,013834245 | |
| CHST10 | Карборансгидрат .Связанные с ним пути — это другие типы биосинтеза O-гликанов и биологическое окисление. | 8,9 | 4,28E – 05 | 0,0198 | |
| PRPSAP1 | Фосфорибозилпирофосфатсинтетаза-ассоциированный белок 1. Этот ген связан с связыванием ионов магния и активностью ингибитора фермента. | 10 | 4,46E – 05 | 0,0198 | |
| TLX3 | Гомеобокс Т-клеточного лейкоза 3.Связанные с ним пути — это неправильная регуляция транскрипции при раке и пути восприимчивости к СВДС. | 103,6 | 5.11E – 05 | 0,021040208 | |
| RP11-259G18.1 | Uncharacterized | 21,7 | 7.50E – 05 | 0,024582733 | |
| DAZ4 | Удалено в azoos Связанные с этим геном, включают связывания РНК, и связывания нуклеотидов. | 7 | 7.68E – 05 | 0,024582733 | |
| TMEM52 | Трансмембранный белок 52 | 50,8 | 7,68E – 05 | 0,024582733 | |
| AC007879,2 | Без характеристик | 0537 13,32738 43 0,02438 43 0,93E | |||
| PCMTD2 | Белок-L-изоаспартат (D-аспартат) O-метилтрансферазный домен, содержащий 2. Этот ген связан с протеин-L-изоаспартат (D-аспартат) O-метилтрансферазной активностью. | 10,4 | 8,26E-05 | 0,024582733 | |
| HNF1A-AS1 | HNF1A антисмысловая РНК 1, аффилированная с классом антисмысловых РНК. | 13,6 | 8,86E – 05 | 0,024984166 | |
| SUV420h3_1 | Uncharacterized | 21,7 | 9,76E – 05 | 0,026140534 1338 | |
| ATP6V1G2 | osomal + транспортировка G2. Мультисубъединичный фермент, который опосредует подкисление внутриклеточных компартментов эукариотических клеток.27,3 | 1,06E – 04 | 0,027114541 | ||
| TCP10L | Т-комплекс 10-подобный. Важным паралогом этого гена является TCP10L2. | 13,9 | 1,23E – 04 | 0,028632706 | |
| MCU | Митохондриальный унипортер кальция. Это связано с активностью кальциевых каналов, и активностью унипортера . | 7,8 | 1,23E – 04 | 0,028632706 | |
| ZFHX3 | Homeobox с цинковыми пальцами 3.Связанные с ним пути — это транскрипционная регуляторная сеть в эмбриональных стволовых клетках. | 8 | 1,59E – 04 | 0,035570625 | |
| RP11-508 M8.1 | Без характеристик | 10,7 | 1,85E – 04 | 0,039536736 | |
| CCL3 | Хемокин (мотив CC) 3. Связанные с ним пути — это передача сигналов через GPCR и путь TGF-Beta. | 31 | 2.13E – 04 | 0,0437 | |
| LL22NC03-63E9.3 | Неохарактеризованный LOC648691, относящийся к классу нкРНК. | −22,2 | 2.30E – 04 | 0,045120747 | |
| RP11-180P8.3 | Без характеристик | 46,1 | 2.36E – 04 | 0,045120747 | |
| RP11-213h25.3 | Uncharacter | 11,1 | 2,56E – 04 | 0,046011494 | |
| IL17D | Интерлейкин 17D. Связанные с ним пути — это сигнальные пути семейства IL-17 и сигнальные пути семейства IL-17. | 40 | 2,58E – 04 | 0,046011494 | |
| AC016831.7 | Неохарактеризованный | 5,8 | 2,71E – 04 | 0,04688832 | |
| NFKBIL1 | Ядерный фактор генерации каппа-света Подобный ингибитору В-клеток 1 | 8 | 2.98E – 04 | 0,04 | 52 |
| SLC2A6 | Семейство носителей растворенного вещества 2, член 6. Его родственными путями являются путь PAK и путь HIF1Alpha. | 7,9 | 3,03E – 04 | 0,04 | 52 |
Гены, экспрессирующиеся по-разному до инфицирования ВГС в группе клиренса, по сравнению с группой хронической. a Тепловая карта была создана с использованием статистически дифференциально экспрессируемых генов между группой клиренса и хронической группой до инфицирования HCV. Цифры на оси X представляют отдельных субъектов. Зеленый цвет обозначает группу исключения, а синий — группу хронического заболевания. b Круговая диаграмма иллюстрирует процентное содержание DEG, которые кодируют белки, участвующие в различных функциях
Из 33 генов, которые дифференциально экспрессировались (DEG) до инфицирования HCV, 19 DEG имели известные биологические функции (База данных генов человека с генами (http : // www.genecards.org/)): шесть генных продуктов (18%) (ATP6V1G2, LPAR1, GNAI1, CCL3, IL17D, SLC2A6) связаны с путями передачи сигналов и врожденным иммунным ответом. восемь генных продуктов (24%) (LBR, EARS2, RAB11FIP5, CHST10, PRPSAP1, PCMTD2, MCU, PRDM13) участвуют в метаболизме и перемещении белков, а пять генных продуктов (15%) (ZFHX3, DAZ4, TLX3, HOXD13, NFKBIL1 ) представляют собой связывающие РНК / ДНК белки, участвующие в регуляции генов (рис.).
Чтобы определить характер дифференциальной экспрессии генов в ответ на инфекцию ВГС, аналогичный анализ был проведен между транскриптомами в группе клиренса (TR1A, рис.) и группу хронической инфекции (TR2A, рис.), после инфицирования ВГС (рис.). Уровни экспрессии 56 генов были значительно выше, а уровень экспрессии одного гена был значительно ниже в TR1A по сравнению с TR2A (таблица). Иерархическая кластеризация DEGs показала, что гены от пяти пациентов с хронической инфекцией сгруппированы вместе, в то время как такой паттерн кластеризации не наблюдался в группе клиренса (рис.).
Таблица 3
DEG в плазме после инфицирования HCV в группе клиренса по сравнению с таковыми в хронически инфицированной группе
| DEG a | Функция | Разница в кратности | P значение | FDR | |
|---|---|---|---|---|---|
| MIXL1 | Смесь парных гомеобоксов.Среди связанных с ним путей — дифференцировка сердечных предшественников и адипогенез. | 142,7 | 3,52E – 07 | 0,00142576 | |
| SLC30A3 | Семейство носителей растворенных веществ 30 (транспортер цинка), член 3. Связанные с ним пути — транспорт глюкозы и других сахаров, солей желчных кислот и органических кислот, ионов металлов и аминовые соединения и Транспорт глюкозы и других сахаров, желчных солей и органических кислот, ионов металлов и аминовых соединений. | 23,8 | 5.32E – 07 | 0.00142576 | |
| SFRP5 | Секретируемый Frizzled-связанный белок 5. Связанные с ним пути представляют собой сигнальный путь Wnt (KEGG) (белки Wnt представляют собой секретируемые морфогены, которые необходимы для основных процессов развития) и некононический путь Wnt. . | 53,4 | 2,05E – 06 | 0,00365475 | |
| AC007879.2 | Без характеристик | 13,8 | 1.45E – 05 | 0,00595947 | |
| AD000091.2 | Uncharacterized | 283,2 | 1.05E – 05 | 0.00595947 | |
| C12orf44 | Связано с аутофагией 101 | 18.9 | 8.91E – 06 | 0.00595947 | |
| HNF1A-AS | HNF1A-AS | HNF1A-AS 1, относящийся к классу антисмысловых РНК. | 48,4 | 1,32E – 05 | 0,00595947 |
| LBR | Рецептор ламина B. Связанные с ним пути — метаболизм и метаболизм. | 70,9 | 1,36E-05 | 0,00595947 | |
| MTMR1 | Миотубулярный белок 1. Связанные с ним пути — это метаболизм и метаболизм. | 20,4 | 1,44E – 05 | 0,00595947 | |
| NLRP13 | Семейство NLR, пириновый домен, содержащий 13 | 10,9 | 5,86E – 06 | 0,00595947 | |
| PPP1R3G | 1 Регуляторный белок фосфата субъединица 3G.Это связано со связыванием протеинфосфатазы и гликогена . | 82,1 | 1,25E – 05 | 0,00595947 | |
| PRPSAP1 | Белок, связанный с фосфорибозилпирофосфатсинтетазой 1. Этот ген связан со связыванием ионов магния и активностью ингибитора ферментов. | 56,8 | 1,29E – 05 | 0,00595947 | |
| RAB11FIP5 | Взаимодействующий белок 5 семейства RAB11 (класс I). Связанные с ним пути — это эндоцитоз и трафик Delta508-CFTR / ER-to-Golgi при CF. | 53,4 | 1.01E – 05 | 0.00595947 | |
| RP11-436F21.1 | Uncharacterized | 9.6 | 1.93E – 05 | 0.00740049 | |
| C11orf95 | Chromosome 11 открытая рамка считывания. Заболевания, связанные с C11orf95, включают эпендимому и хондроидную липому. | 119,4 | 2,56E – 05 | 0,003 | |
| HOXD13 | Homeobox D13. Этот ген связан с последовательностью специфической ДНК-связывающей активностью фактора транскрипции и связывания хроматина. | 96 | 3.07E – 05 | 0.01028157 | |
| RP11-508M8.1 | Без характеристики | 14.6 | 3.46E – 05 | 0,0109017 | |
| CTC-504A5.1 | Аффилированный с Класс нкРНК | 9.9 | 3.82E – 05 | 0,01135634 | |
| IRS4 | Субстрат рецептора инсулина 4. Связанные с ним пути — это передача сигналов посредством GPCR и сигнальный каскад рецепторов инсулина. | 54.4 | 5,62E – 05 | 0,01466991 | |
| MANEAL | Маннозидаза, эндо-альфа-подобная. Это связано с гидролазной активностью . | 14,7 | 5,95E – 05 | 0,01466991 | |
| MCU | Митохондриальный унипортер кальция. Это связано с активностью кальциевых каналов и унипортерной активностью. | 11,9 | 6.03E – 05 | 0,01466991 | |
| SUV420h3_1 | Без характеристики | 18.4 | 5.71E – 05 | 0,01466991 | |
| SLC25A18 | Семейство 25 носителей растворенного вещества (носитель глутамата), член 18. Он связан с этим геном, включая активность симпортера. | 86,7 | 6,39E-05 | 0,01489091 | |
| GNAI1 | Белок, связывающий гуанин-нуклеотид (G-белок), полипептид 1 с ингибирующей альфа-активностью. Его родственными путями являются путь GPCR и путь GPCR. | 10,8 | 6,69E – 05 | 0.014 | |
| ADPRHL1 | ADP-рибозилгидролаза, подобная 1. Она связана со связыванием ионов магния и активностью ADP-рибозиларгинингидролазы. | 7,3 | 9,39E – 05 | 0,01676156 | |
| CMTM4 | CKLF-подобный трансмембранный домен MARVEL, содержащий 4. Он связан с активностью цитокинов. | 16 | 9.17E – 05 | 0,01676156 | |
| F10 | Фактор коагуляции X. Он связан с путями гемостаза и образования фибринового сгустка (каскад свертывания). | 11,4 | 8,76E – 05 | 0,01676156 | |
| LPAR1 | Рецептор лизофосфатидной кислоты 1. Его связанные пути представляют собой сигнальный путь PI3K-Akt и сигнальный путь Ras. | 9,6 | 8.50E – 05 | 0,01676156 | |
| LYSMD4 | LysM, предполагаемый пептидогликан-связывающий домен, содержащий 4 | 10,3 | 8.30E – 05 | 0,01676156 | |
| Без характеристики | 9.3 | 9,38E – 05 | 0,01676156 | ||
| ATP12A | АТФаза, H + / K + транспортный, негастральный, альфа-полипептид. Это связано с путями транспорта ионных каналов и транспорта глюкозы и других сахаров, солей желчных кислот и органических кислот, ионов металлов и аминовых соединений. | 10,2 | 1,22E – 04 | 0,01943478 | |
| POU4F1-AS1 | Антисмысловая РНК RNF219 1 | 8,1 | 1,23E – 04 | 0.01943478 | |
| PRDM13 | PR-домен, содержащий 13. Этот ген связан с активностью метилтрансферазы. | 30,5 | 1,23E-04 | 0,01943478 | |
| ZXDA | Цинковый палец, X-связанный, дублированный A. он связан с последовательностью-специфической активностью связывающего ДНК фактора транскрипции и связыванием домена цинкового пальца C2h3. | 45,3 | 1,17E – 04 | 0,01943478 | |
| AC009495.4 | Без характеристики | 8.9 | 1,59E – 04 | 0,02368413 | |
| RP11–410N8.1 | Без характеристик | 29,8 | 1,55E – 04 | 0,02368413 | |
| ANKRD34B | Повторяющийся домен анкирина 4 | 2.00E – 04 | 0,02675171 | ||
| DPY19L3 | Dpy-19-подобный 3. Это связано с активностью трансферазы, переносящей гликозильные группы. | 5,2 | 2,08E – 04 | 0.02675171 | |
| LINC00609 | длинная межгенная небелковая кодирующая РНК 609 | 8,9 | 2,08E – 04 | 0,02675171 | |
| RP11–180P8.3 | Без характеристик 04 | 96,5 | 96,5 | 0,02675171 | |
| RP11–492E3.2 | Без характеристики | −8,3 | 2,05E – 04 | 0,02675171 | |
| TLX3 | Гомеобокс Т-клеточного лейкоза 3.Связанные с ним пути — это неправильная регуляция транскрипции при раке и пути восприимчивости к СВДС. | 83,1 | 1,96E-04 | 0,02675171 | |
| ZFHX3 | Гомеобокс с цинковым пальцем 3. Связанные с ним пути представляют собой транскрипционную регуляторную сеть в эмбриональных стволовых клетках. | 12,5 | 2.11E-04 | 0,02675171 | |
| SOHLh2 | Основная спираль-петля-спираль, специфичная для сперматогенеза и оогенеза 1. Это связано с последовательностью-специфической активностью связывающего ДНК фактора транскрипции и активностью димеризации белков. | 15,2 | 2,54E – 04 | 0,03086759 | |
| SLC51A | Семейство 51 носителя растворенного вещества, альфа-субъединица. Это связано с секрецией желчи и индукцией лекарственного пути желчных кислот. | 7,6 | 2,60E – 04 | 0,03093234 | |
| TCF15 | Фактор транскрипции 15 (основная спираль-петля-спираль). Это связано с сигнальными путями ERK и ERK. | 8,8 | 2,74E – 04 | 0,031 | |
| RP11–118B18.1 | Uncharacterized | 6.5 | 3.08E – 04 | 0,03504717 | |
| ATP6V1G2 | АТФаза, транспортировка H +, лизосомальная 13 кДа, субъединица G2 V1. Мультисубъединичный фермент, который опосредует подкисление внутриклеточных компартментов эукариотических клеток. | 23,3 | 3,68E – 04 | 0,04059745 | |
| RP11–435M3.2 | Без характеристик | 15,9 | 3.71E – 04 | 0,04059745 | |
| C4orf37 | A Кодирующий ген .4 | 4.10E – 04 | 0,04218642 | ||
| ZC3H8 | Цинк-палец типа CCCH, содержащий 8. Он связан с последовательностью-специфической активностью связывающего ДНК фактора транскрипции и специфическим для последовательности связыванием ДНК. | 7 | 3.94E – 04 | 0,04218642 | |
| ZXDB | Ген, кодирующий белок. Это связано со связыванием нуклеиновых кислот. | 32,1 | 4,03E – 04 | 0,04218642 | |
| CHST10 | Углеводная сульфотрансфераза 10.Связанные с ним пути — это другие типы биосинтеза O-гликанов и биологическое окисление. | 6,6 | 4,38E – 04 | 0,04421968 | |
| RP11–7F17,5 | Без характеристик | −5,1 | 4,50E – 04 | 0,04426996 | |
| TMEM52 | Трансмембранный белок 9 52 | 4.55E – 04 | 0,04426996 | ||
| NEURL | Ген, кодирующий белок. Это связано с путями передачи сигналов через GPCR и болезнь. | 6 | 4.68E – 04 | 0,0447815 | |
| AP3B1 | Ген, кодирующий белок. Это связано с путем образования везикул, происходящих из лизосом и клатрина. | 7,8 | 5,28E-04 | 0,04960697 |
Гены, экспрессирующиеся по-разному после инфицирования ВГС в группе клиренса, по сравнению с группой хронической. a Тепловая карта была создана с использованием статистически дифференциально экспрессируемых генов между группой клиренса и хронической группой после инфицирования HCV.Цифры на оси X представляют отдельных субъектов. Зеленый цвет обозначает группу исключения, а синий — группу хронического заболевания. b Круговая диаграмма показывает процентное содержание DEG, которые кодируют белки, участвующие в различных функциях.
Известно, что из 56 DEG в группе клиренса HCV 34 кодируют биологически функциональные белки. Известно, что из этих 34 генов 14 продуктов генов DEG (25%) (MIXL1, SLC30A3, SFRP5, NLRP13, IRS4, GNAI1, CMTM4, F10, LPAR1, ATP12A, TLX3, ATP6V1G2, NEURL, AP3B1) участвуют в быть связанными с путями передачи сигнала и врожденными иммунными ответами, двенадцать продуктов гена DEG (21%) (LBR, MTMR1, PPP1R3G, PRPSAP1, RAB11FIP5, MANEAL, MCU, ADPRHL1, PRDM13, DPY19L3, SLC51A, CHST10) участвуют в метаболизме и трафик белков и восемь продуктов гена DEG (14%) (ZFHX3, SOHLh2, TCF15, ZC3H8, ZXDB, TLX3, HOXD13, ZXDA ) являются белками, связывающими РНК / ДНК, участвующими в регуляции генов (рис.). Однако DEG не был идентифицирован между образцами плазмы, проанализированными до и после инфицирования HCV, независимо от того, были ли они из группы клиренса (TR1B против TR1A) или из хронической группы (TR 2B против TR 2A) (фиг.).
Анализы пересечений между DEG, идентифицированными в группе клиренса до инфицирования HCV (DEG-B, фиг.) И после инфицирования HCV (DEG-A, фиг.), Показывают, что 12 DEG были однозначно экспрессированы в группе клиренса до инфицирования HCV и 36 DEGs. были однозначно экспрессированы после инфицирования HCV (рис.). У этих двух групп был 21 DEG. Анализ IPA этих уникальных 12 генов, экспрессированных до инфицирования HCV, показывает, что ряд этих генов и их вышестоящие регуляторы связаны с врожденным иммунным ответом в группе клиренса (рис. И). Среди них 14% участвуют в переносе иммунных клеток, 14% участвуют в гуморальном иммунном ответе и 14% участвуют в клеточно-опосредованном иммунном ответе, что позволяет предположить, что большинство уникальных ДЭГ в группе клиренса до инфекции могут играть роль в защите от вирус (рис.). Например, передача сигналов цитокинов (таких как IL-1, IL-4, IL-6, IL-8, IL-9, IL-10, TNFR1, интерферон), передача сигналов Toll-подобного рецептора (TLR), передача сигналов MAPK, NF- Может быть задействована передача сигналов κB и связь между клетками врожденного и адаптивного иммунитета (рис.). Аналогичные анализы с 36 DEG после инфицирования HCV показали, что эти гены участвуют в передаче сигналов рецептора глюкокортикоидов, передаче сигналов апоптоза, опосредованной myc, передаче сигналов аксонами, передаче сигналов IGF1, передаче сигналов MAPK, передаче сигналов p53, передаче сигналов PI3K / AKT и передаче сигналов острой фазы ответа.
Перекрестный анализ дифференциально экспрессируемых генов до и после инфицирования ВГС в группе клиренса и хронической группе. Диаграмма была построена с использованием статистически дифференциально экспрессируемых генов между группой клиренса и хронической группой до и после инфицирования HCV
Развитие физиологической системы и функция уникального DEG в группе клиренса до инфицирования. круговая диаграмма демонстрирует, что большинство DEG, наблюдаемых до инфицирования HCV в группе клиренса, сгруппированы в иммуно-опосредованных путях. b Прогнозируемые сети взаимодействия мРНК и ассоциированные пути были идентифицированы с использованием DEG в клиренсе по сравнению с хронической группой до инфицирования HCV. Взаимодействия между генами были идентифицированы с помощью анализа пути изобретательности
Что это может вам сказать?
Ваша вирусная нагрузка — это количество вируса гепатита С (ВГС) в вашей крови. Ваш начальный уровень может дать ключ к разгадке ваших шансов на успех в лечении. Изменения вирусной нагрузки также могут сказать вашему врачу, продолжаете ли вы терапию и принимаете ли вы достаточно лекарств, чтобы контролировать свое заболевание.
Но ваша вирусная нагрузка измеряет только то, что происходит в вашей крови, а не фактические клетки печени. Таким образом, он не может очень хорошо показать, насколько серьезен ваш гепатит С, как быстро он может ухудшиться или насколько эффективно ваше лечение. Он также ничего не говорит о количестве повреждений или рубцов в вашей печени.
Тесты на вирусную нагрузку
Они проверяют вашу кровь на генетические следы ВГС. Если они обнаружены, это означает, что у вас активный гепатит С и ваши вирусы размножаются. Тесты на вирусную нагрузку бывают двух типов:
Качественные : Это может подтвердить, есть ли у вас гепатит С или нет.Положительный результат теста означает, что в вашей крови обнаружен генетический код HCV. Отрицательный означает, что вирус не обнаружен. Качественные тесты очень чувствительны, а это означает, что если у вас есть текущая инфекция гепатита С, они почти всегда ее обнаружат.
Количественный : Это часто называют тестом на РНК гепатита С. Он измеряет, сколько ВГС содержится в капле крови. Большинство лабораторий теперь сообщают цифры в международных единицах на миллилитр (МЕ / мл).
Чтение результатов
Цель терапии гепатита С — снизить количество вирусов настолько, чтобы их нельзя было обнаружить.Если это произойдет через 3 месяца после окончания лечения, вы выздоровели. Это происходит более чем у 90% людей, получающих рекомендованное лечение.
Высокая вирусная нагрузка : Это когда ваше количество превышает 800 000 МЕ / мл. Если вначале у вас высокий уровень вируса, то для вашего лечения может быть трудно или невозможно полностью избавиться от вируса. Некоторые исследователи считают, что высокие уровни превышают 400 000 МЕ / мл.
Низкая вирусная нагрузка : Это количество ниже 800 000 МЕ / мл.Ваши шансы на то, что лечение приведет к исчезновению всего или большей части ВГС, выше, чем при высокой вирусной нагрузке.
Продолжение
Неопределяемая вирусная нагрузка : Это не обязательно означает, что у вас нет вирусов. Неопределяемые уровни могут отличаться в зависимости от того, насколько точен ваш тест, от лаборатории, которую вы используете, и от того, как она обрабатывала образец крови. У вас все еще могут быть вирусы, но их слишком мало, чтобы тесты могли уловить их.
Продолжение
Два новых теста — транскрипционно-опосредованная амплификация (ТМА) и полимеразная цепная реакция (ПЦР) — позволяют измерять всего 5–10 МЕ / мл.Третья, называемая ДНК с разветвленной цепью (бДНК), может пропускать вирусную нагрузку ниже 615 МЕ / мл.
Устойчивый вирусологический ответ : Это когда наиболее чувствительные тесты не обнаруживают следов ВГС в вашей крови через 12 недель после прекращения лечения. Его также называют лекарством от вирусов. Это означает, что ваше заболевание находится в стадии ремиссии, и ваш гепатит С больше не активен. Ваша печень может начать заживать, и ваши шансы на печеночную недостаточность и рак печени уменьшатся. Для подтверждения вам может потребоваться повторить тест или пройти качественный тест, который проверяет, отрицательны ли вы на какие-либо следы вирусного генетического материала.
Вирусные нагрузки во время лечения
Проверка количества вирусов до, во время и после лечения поможет врачу узнать, действуют ли и насколько хорошо ваши лекарства. Рост вирусной нагрузки не всегда означает, что вам становится хуже, и снижение количества вирусов не является признаком того, что вы выздоравливаете.
Продолжение
В отличие от ВИЧ, где более низкое количество вирусов обычно означает более долгую и здоровую жизнь, вирусная нагрузка ВГС мало что говорит о том, насколько быстро прогрессирует ваш гепатит С или чем может закончиться ваше заболевание.Для этого вашему врачу нужно будет проверить ферменты печени и ткани печени, а также провести другие тесты.
Обычно лечение гепатита С будет одинаковым, независимо от того, насколько высока или низка ваша вирусная нагрузка. Ваш врач будет использовать ваши уровни вируса, чтобы контролировать вашу реакцию на лекарство. Назначенные вам лекарства будут зависеть не столько от количества вирусов, сколько от вашего общего состояния здоровья, генетической структуры вируса гепатита С и других факторов.
Клинические рекомендации по медицинскому ведению гепатита С
Д.Диагноз
1. Тестирование на инфекцию ВГС
Рекомендации по тестированию основаны на опубликованных доказательствах и мнениях экспертов. 22,23 Существует множество вариантов тестирования на ВГС, и по мере внедрения новых диагностических технологий тестирование на ВГС должно стать более рационализированным. Кроме того, у некоторых поставщиков будет ограниченный выбор для тестирования из-за протоколов лабораторных исследований и проблем с компенсацией. Провайдерам рекомендуется проконсультироваться со своими лабораториями для получения информации о доступных тестах и протоколах тестирования.
Рекомендации
Все пациенты с подозрением на инфекцию ВГС должны быть проверены на антитела к ВГС (анти-ВГС) с помощью скринингового теста EIA (иммуноферментный анализ). У пациентов из группы низкого риска с положительным результатом теста EIA следует проводить подтверждающее тестирование с помощью рекомбинантного иммуноблоттинга (RIBA). Пациентам из группы низкого риска с положительными результатами EIA и RIBA следует проводить подтверждающее тестирование с помощью качественной ПЦР для выявления РНК HCV.
Для пациентов с умеренным или высоким риском и / или необъяснимым повышенным значением сывороточной аланинаминотрансферазы (АЛТ) положительный результат ИФА должен сопровождаться качественным тестом на РНК ВГС в крови.
Для пациентов с ослабленным иммунитетом из группы высокого риска с необъяснимым повышенным значением АЛТ и отрицательным скрининговым ИФА необходимо провести качественный тест на определение РНК ВГС для диагностики инфекции ВГС.
Нет рекомендаций для серийного или периодического скрининга, если не было повторного или продолжающегося поведения, связанного с высоким риском. Пациентам-кандидатам на противовирусную терапию следует проводить количественные ПЦР-тесты на РНК HCV.
2.Тестирование на хроническую инфекцию ВГС
Первоначальный скрининговый тест, который следует использовать при любых обстоятельствах, — это тест на антитела к вирусным белкам гепатита С (анти-HCV). Эти тесты становятся положительными уже через 8-10 недель после заражения, будут положительными у 97% пациентов через 6 месяцев после заражения и, вероятно, сохранятся на всю жизнь. Наличие анти-HCV не определяет активности инфекции. До 25% пациентов излечивают инфекцию спонтанно, но при этом у них по-прежнему обнаруживаются анти-HCV.Тесты на антитела, рекомендуемые в настоящее время для скрининга на анти-ВГС, включают тест EIA и более специфический RIBA; последний используется для подтверждения положительного результата теста EIA в некоторых ситуациях (например, для подтверждения положительности EIA у пациентов из группы низкого риска). Эти тесты на антитела очень надежны для определения инфекции ВГС в какой-то момент в прошлом.
Обнаружение РНК ВГС в крови в настоящее время является признанным «золотым стандартом» диагностики активной инфекции ВГС. Тесты на РНК ВГС бывают как качественными, так и количественными, различаются по техническим аспектам и по-разному сообщают значения.
3. Характеристики тестов на антитела для диагностики хронической инфекции ВГС
Доступные в настоящее время тесты EIA очень чувствительны и полезны для скрининга. Однако среди населения с низким риском даже высокочувствительный тест не обеспечивает желаемой прогностической ценности положительного теста. Чем ниже вероятность заражения, тем выше риск ложноположительного теста. И наоборот, чем выше риск гепатита С в популяции, тем больше вероятность того, что положительный скрининговый тест EIA указывает на инфекцию.В группах населения с необъяснимым повышением АЛТ и по крайней мере одним основным фактором риска гепатита С прогностическая ценность положительного результата ИФА составляет не менее 95%. Это значение снижается до менее 50% для пациентов с нормальным уровнем АЛТ и минимальными факторами риска или без них. 38
Были использованы две стратегии, чтобы уменьшить вероятность «ложноположительных» тестов EIA:
- Повторная калибровка значения теста EIA, названного «положительным», позволила повысить степень положительного прогноза для теста в целом.Это дает тесту EIA отличные характеристики для использования в соответствующих группах населения и упрощает использование подтверждающих тестов.
- Подтверждающее тестирование на более специфические антитела к вирусу гепатита С. Рекомендуемый тест — RIBA для подтверждения положительного результата теста EIA у пациента с низким риском гепатита C.
Относительно небольшая часть населения, которое считается подверженным риску, может иметь ложноотрицательный результат скринингового теста. В эти группы входят пациенты с продвинутой стадией ВИЧ, пациенты на гемодиализе и пациенты с выраженной иммуносупрессией в результате трансплантации солидных органов. 39 Также включены пациенты, инфицированные и прошедшие скрининг вскоре после воздействия, когда уровень антител еще не установлен. Когда другие клинические или лабораторные данные подтверждают возможный диагноз гепатита C, целесообразно качественное тестирование РНК HCV с помощью ПЦР или анализа с опосредованной транскрипцией (ТМА). (см. Таблицу 2).
4. Тестирование на острый гепатит C
Через 1-8 недель после передачи гепатита С РНК ВГС становится обнаруживаемой с помощью ПЦР-тестирования.Хотя у большинства пациентов через 6–12 недель после передачи будут наблюдаться некоторые отклонения в тесте функции печени (LFT), только около четверти пациентов будут иметь синдром недомогания, боли в животе и желтуху, которые характерны для острого гепатита C. К 12 неделям после развития виремии гепатита С до 25% пациентов спонтанно и навсегда избавляются от вируса. 40 Спонтанный клиренс, по-видимому, гораздо чаще встречается у пациентов с синдромом острого гепатита C, чем у пациентов с бессимптомной виремией. 41 Выработка антител к гепатиту С происходит уже через 8-10 недель после передачи. 42 У некоторых людей с ослабленным иммунитетом могут не развиваться антитела к гепатиту С, несмотря на наличие виремии. 43
| Качественный | Метод; Производитель | Динамический диапазон (МЕ / мл) * |
|---|---|---|
| Тест Amplicor HCV 2.0 | ПЦР; Roche | ≥50 |
| Тест COBAS Amplicor на ВГС 2.0 | ПЦР; Roche | ≥50 |
| VERSANT анализ РНК HCV | TMA; Bayer | ≥5 |
| Количественный | Метод; Производитель | Динамический диапазон (МЕ / мл) * |
| Versant tm РНК HCV 3,0 | бДНК; Bayer | 615 — 77,7 x10 6 |
| §COBAS Amplicor HCV Monitor tm | КПЦР; Roche | 600 — 7 x 10 5 |
| COBAS TaqMan tm HCV | КПЦР; Roche | 10 — 2 х 10 8 |
| Celera HCV QT ASR | КПЦР; Эбботт | 25-5 x 10 8 |
| * Результаты могут отличаться на нижнем пределе обнаружения в зависимости от лаборатории, проводящей тест § Только для исследований — Не одобрено для использования пациентами бДНК: ДНК с разветвленной цепью ПЦР: полимеразная цепная реакция КПЦР: количественная полимеразная цепная реакция TMA: опосредованный транскрипцией анализ ASR: реагент, специфичный для аналита Использование патентованных наименований не означает одобрения со стороны Министерства здравоохранения штата Нью-Йорк. | ||
5. Обзор доступных тестов для скрининга на ВГС
Сравнение доступных в настоящее время тестов на РНК ВГС показано в таблице 2, а алгоритм тестирования показан на рисунке 1.
- EIA — это воспроизводимый и недорогой тест, подходящий для скрининга. Этот тест определяет наличие антител к HCV. Доступные в настоящее время тесты третьего поколения обладают высокой специфичностью и чувствительностью более 99%. 22,23 Высокая чувствительность и специфичность могут устранить необходимость подтверждающего иммуноблоттинга у пациентов с клиническими проявлениями заболевания печени, особенно у пациентов с высоким риском гепатита С.
- RIBA определяет наличие антител к вирусу гепатита C. Этот тест очень чувствителен и надежен, и его можно использовать в качестве подтверждающего теста EIA. Положительный RIBA не является диагностическим признаком активной инфекции HCV, так как до 25% пациентов избавляются от HCV спонтанно после острой инфекции, но остаются положительными по анти-HCV. Диагноз активной инфекции HCV требует дополнительного тестирования.
- ПЦР-тестирование используется для определения наличия РНК HCV и является признаком активной инфекции.Существует два типа ПЦР-тестов, обычно называемых тестами на вирусную нагрузку: качественные и количественные (см. Таблицу 2).
- Качественный анализ ПЦР или ТМА определяет наличие ВГС или его отсутствие. Традиционно качественные тесты были более чувствительными с нижним пределом обнаружения 5 МЕ / мл. Качественные результаты испытаний могут быть положительными или отрицательными и не указываются в числовом виде. Единичный отрицательный качественный тест не исключает виремию, поскольку вирусная нагрузка может временно снижаться.Отрицательный результат теста может свидетельствовать о том, что вирусная нагрузка в этот конкретный момент времени была ниже уровня, определяемого анализом.
- Количественная ПЦР определяет количество присутствующего вируса. Нижний предел обнаружения для более ранних версий этих тестов составлял около 600 МЕ / мл. Более поздние версии более чувствительны с более широким динамическим диапазоном от примерно 5-25 МЕ / мл до> 108 МЕ / мл, в зависимости от лаборатории.
Рисунок 1
Эти новые технологии могут помочь упростить процесс тестирования при использовании для подтверждения анти-HCV, терапевтического мониторинга и тестирования излечения.
- Тестирование генотипа широко доступно и полезно при планировании лечения, а также для определения продолжительности и возможных ответов на лечение. Тестирование генотипа должно проводиться как часть первоначальной оценки пациента после подтверждения ХГС.
- Биохимический анализ печени, хотя и недорогой, является нечувствительным средством оценки активности заболевания. Повышение уровня АЛТ и аспартатаминотрансферазы (АСТ) может указывать на наличие заболевания печени, но не определяет тип заболевания печени, причину его возникновения или степень повреждения печени.
6. Биопсия печени
Рекомендации
У пациентов с генотипом 1 или 4 перед лечением следует проводить биопсию печени, чтобы оценить вероятность устойчивого вирусологического ответа (УВО).
У пациентов с генотипом 2 или 3 может не потребоваться биопсия печени.
Биопсия печени остается единственным окончательным тестом для оценки стадии фиброза, а стадия фиброза является наиболее надежным средством оценки прогноза и предоставления информации для принятия решений о необходимости начала терапии.Поскольку до 80% пациентов с заболеванием HCV генотипа 2 или 3 положительно реагируют на противовирусную терапию, решение о лечении является более простым, и биопсия печени перед лечением может не потребоваться для пациентов с заболеванием генотипа 2 или 3. В случае выполнения биопсии печени должны быть оценены патологами, имеющими подготовку и опыт в области гистологии печени.
Биопсия печени считалась важным параметром, помогающим направлять ведение и лечение, особенно в то время, когда ответ на лечение был низким.В последнее время, в связи с повышением эффективности лечения, ценность биопсии печени подверглась сомнению из-за потенциальных рисков, связанных с этой процедурой, и из-за ошибки при взятии проб. Это побудило некоторых оспорить необходимость биопсии и предположить, что процедура может быть необязательной до лечения. В настоящее время Американская ассоциация по изучению заболеваний печени (AASLD) рекомендует проводить биопсию печени независимо от уровня АЛТ, если результаты будут влиять на то, рекомендуется ли лечение.Однако биопсия не является обязательной для начала терапии. 22
7. Неинвазивное тестирование для оценки фиброза печени
Рекомендация
Использование неинвазивных тестов для оценки фиброза печени пока не рекомендуется.
Различные неинвазивные тесты исследуются для определения стадии фиброза печени. Эти тесты могут использоваться при принятии решения о том, следует ли начинать противовирусную терапию, и для мониторинга эффектов такой терапии.44 Множество таких тестов было бы весьма желательно, если бы они были надлежащим образом валидированы, поскольку биопсия печени может быть недоступна ввиду большого количества больных гепатитом С, рисков, связанных с выполнением биопсии печени, и проблемы ошибки выборки биопсия, позволяющая недооценить цирроз печени в 10-30% случаев.
Стандартные биохимические тесты печени, измерения функции печени, такие как исследования коагуляции, и радиологическая визуализация печени могут быть достаточно чувствительны для диагностики запущенного цирроза, но не являются точными при определении развивающегося фиброза печени и ранних стадий цирроза. 44 Был опубликован ряд исследований с использованием различных косвенных маркеров фиброза печени (Fibrosure и Fibrostat), включая стандартные химические характеристики печени, количество тромбоцитов, протромбиновый индекс и концентрации липопротеина A1. Эти тесты получили признание в Европе как альтернатива биопсии печени. 45, 46 Однако полезность этих тестов требует дальнейшей проверки в проспективных исследованиях.
Также изучаются прямые маркеры фиброза печени, включая ряд анализов сыворотки или мочи, которые, как считается, напрямую отражают отложение или удаление внеклеточного матрикса, участвующего в формировании фиброзной ткани в печени. 44 Подобно косвенным маркерам, эти тесты, такие как тесты на коллаген IV типа и гиалуроновую кислоту, могут помочь идентифицировать пациентов со значительным фиброзом и циррозом печени. Также могут быть идентифицированы пациенты с ранним фиброзом. Однако ограничение как прямых, так и непрямых серологических маркеров по-прежнему не позволяет точно определить промежуточные стадии фиброза печени.44
Текущие исследования должны помочь решить эту проблему и поместить эти исследования в надлежащий контекст для ведения пациентов с гепатитом С.Необходима соответствующая стандартизация и доступность этих тестов, прежде чем они станут полезными для клинициста при принятии решений о необходимости биопсии печени и о начале или прекращении терапии. Дальнейшая работа должна определить идеальный алгоритм для оптимального использования серологических тестов или тестов для включения в клиническую практику. При надлежащей валидации возможно, что такие тесты могут быть равны биопсии печени или превосходить ее при оценке степени фиброза печени.
8. Скрининг гепатоцеллюлярной карциномы
Рекомендация
Пациенты с циррозом печени должны проходить скрининг на гепатоцеллюлярную карциному (ГЦК) с тестированием на альфа-фетопротеин (AFP) и ультразвуковым сканированием печени не реже одного раза в год.
Гепатит С является наиболее распространенным предрасполагающим фактором для развития ГЦК в США. 47, 48 Резекция и местная абляционная терапия уже давно используются для лечения пациентов с ГЦК. Трансплантация печени все чаще становится вариантом для пациентов с ранней стадией ГЦК, которым хирургическая резекция вряд ли поможет. 49 Несмотря на то, что эти методы лечения достигают определенного успеха, скрининг на ГЦК вызывает споры. 50 Скрининг чаще всего выполняется с помощью регулярной визуализации с помощью ультразвукового исследования или компьютерной томографии и определения сывороточного АФП.Одно только тестирование на АФП имеет относительно низкую чувствительность и специфичность в отношении ГЦК. В недавнем исследовании 357 пациентов с ХГС, но без ГЦК, у 23% был повышенный уровень сыворотки крови. Уровень AFP, который был независимо связан с фиброзом печени III / IV стадии, повышенным уровнем AST и увеличенным международным нормализованным соотношением (INR). 51
Ультразвук печени имеет большую чувствительность, чем тест на АФП, но связан со значительной долей ложноположительных результатов, особенно при регенеративных узелках, связанных с циррозом.Небольшое количество исследований свидетельствует о том, что скрининг на ГЦК улучшает выживаемость. Например, проспективное рандомизированное исследование, проведенное в Китае, и ретроспективный анализ пациентов с циррозом и хроническим заболеванием печени в Италии показали, что выживаемость улучшилась благодаря эпиднадзору за ГЦК, вероятно, потому, что опухоли были идентифицированы на более ранней стадии. 52, 53 Однако этиология цирроза в этих исследованиях была неоднородной. В настоящее время, несмотря на отсутствие убедительных доказательств эффективности эпиднадзора, стандартной практикой остается скрининг на ГЦК с тестированием на АФП и ультразвуковой визуализацией печени; однако оптимальный интервал для скрининг остается неопределенным.Недавнее исследование показывает, что двухгодичное УЗИ / ОВП является экономически эффективным. 54 Существует большая потребность в более чувствительных и специфических скрининговых тестах. Следует также учитывать, можно ли ожидать, что пациент, проходящий скрининг, получит пользу от лечения ГЦК и перенесет его. Необходимы дальнейшие исследования, чтобы лучше определить надежность, преимущества, а также стандарт лечения в отношении частоты скрининга на ГЦК.
| Предыдущая | Далее |
Идентификация транскриптов, связанных со спонтанным клиренсом ВГС у лиц, коинфицированных ВИЧ и ВГС | BMC Infectious Diseases
Эль-Сераг HB. Гепатоцеллюлярная карцинома и гепатит С в США. Гепатология. 2002; 36 (5 Приложение 1): S74–83.
Артикул PubMed Google Scholar
Шерман К.Э., Рустер С.Д., Чанг Р.Т., Раджич Н. Распространенность вируса гепатита С среди пациентов, инфицированных вирусом иммунодефицита человека: перекрестный анализ Группы клинических испытаний СПИДа среди взрослых в США. Clin Infect Dis. 2002. 34 (6): 831–7.
Артикул PubMed Google Scholar
Ghosn J, Deveau C, Goujard C, Garrigue I, Saichi N, Galimand J, Nagy Z, Rouzioux C., Meyer L, Chaix ML. Увеличение заболеваемости вирусом гепатита С у ВИЧ-1-инфицированных пациентов, находящихся под наблюдением после первичного инфицирования. Половая трансмиссия. 2006. 82 (6): 458–60.
CAS Статья PubMed PubMed Central Google Scholar
Урбанус А.Т., ван де Лаар Т.Дж., Столте И.Г., Шинкель Дж., Хейман Т., Коутиньо Р.А., Принс М. Инфекции вируса гепатита С среди ВИЧ-инфицированных мужчин, имеющих половые контакты с мужчинами: растущая эпидемия.СПИД. 2009; 23 (12): F1–7.
Артикул PubMed Google Scholar
Micallef JM, Kaldor JM, Dore GJ. Спонтанный вирусный клиренс после острой инфекции гепатита С: систематический обзор продольных исследований. J Viral Hepat. 2006. 13 (1): 34–41.
CAS Статья PubMed Google Scholar
Вебер Р., Сабин К.А., Фриис-Моллер Н., Рейсс П., Эль-Садр В.М., Кирк О., Дабис Ф., Ло М.Г., Прадье С., Де Вит С. и др.Связанные с печенью смерти людей, инфицированных вирусом иммунодефицита человека: исследование D: A: D. Arch Intern Med. 2006. 166 (15): 1632–41.
Артикул PubMed Google Scholar
Lewden C, Salmon D, Morlat P, Bevilacqua S, Jougla E, Bonnet F, Heripret L, Costagliola D, May T, Chene G, et al. Причины смерти среди взрослых, инфицированных вирусом иммунодефицита человека (ВИЧ), в эпоху мощной антиретровирусной терапии: растущая роль гепатита и рака, постоянная роль СПИДа.Int J Epidemiol. 2005. 34 (1): 121–30.
Артикул PubMed Google Scholar
Сахасрабуддхе В.В., Шилс М.С., МакГлинн К.А., Энгельс Э.А. Риск гепатоцеллюлярной карциномы среди людей с синдромом приобретенного иммунодефицита в США. Рак. 2012. 118 (24): 6226–33.
Артикул PubMed PubMed Central Google Scholar
Сиберг Е.С., Витт, доктор медицины, Якобсон Л.П., Детелс Р., Ринальдо С.Р., Марголик Дж. Б., Янг С., Фейр Дж. П., Тио К.Спонтанное избавление от вируса гепатита С среди мужчин, практикующих секс с мужчинами. Clin Infect Dis. 2015; 61 (9): 1381–8.
CAS Статья PubMed PubMed Central Google Scholar
Witt MD, Seaberg EC, Darilay A, Young S, Badri S, Rinaldo CR, Jacobson LP, Detels R, Thio CL. Случаи инфицирования вирусом гепатита С у мужчин, практикующих секс с мужчинами: проспективный когортный анализ, 1984–2011 гг. Clin Infect Dis. 2013. 57 (1): 77–84.
Артикул PubMed PubMed Central Google Scholar
Alric L, Fort M, Izopet J, Vinel JP, Bureau C, Sandre K, Charlet JP, Beraud M, Abbal M, Duffaut M. Исследование факторов, связанных с хозяином и вирусом, связанных со спонтанным гепатитом C очистка от вирусов. Тканевые антигены. 2000. 56 (2): 154–8.
CAS Статья PubMed Google Scholar
Balagopal A, Thomas DL, Thio CL.IL28B и борьба с инфекцией вируса гепатита С. Гастроэнтерология. 2010. 139 (6): 1865–76.
CAS Статья PubMed PubMed Central Google Scholar
Мосбрюгер Т.Л., Дуггал П., Годерт Дж.Дж., Кирк Г.Д., Хутс В.К., Тоблер Л.Х., Буш М., Петерс М.Г., Розен Х.Р., Томас Д.Л. и др. Масштабный анализ генов-кандидатов спонтанного избавления от вируса гепатита С. J Infect Dis. 2010. 201 (9): 1371–80.
CAS Статья PubMed PubMed Central Google Scholar
Beinhardt S, Aberle JH, Strasser M, Dulic-Lakovic E, Maieron A, Kreil A, Rutter K, Staettermayer AF, Datz C, Scherzer TM, et al. Уровень IP-10 в сыворотке увеличивает прогностическую ценность полиморфизма IL28B для спонтанного избавления от острой инфекции HCV. Гастроэнтерология. 2012. 142 (1): 78–85 – e72.
Артикул Google Scholar
Биберт С., Роджер Т., Каландра Т., Бохуд М., Черни А., Семмо Н., Дуонг Ф.Х., Герлах Т., Малинверни Р., Морадпур Д. и др.Экспрессия IL28B зависит от нового полиморфизма TT / -G, который улучшает прогноз клиренса HCV. J Exp Med. 2013. 210 (6): 1109–16.
CAS Статья PubMed PubMed Central Google Scholar
Thomas DL, Thio CL, Martin MP, Qi Y, Ge D, O’Huigin C, Kidd J, Kidd K, Khakoo SI, Alexander G, et al. Генетическая изменчивость IL28B и спонтанное избавление от вируса гепатита С. Природа. 2009. 461 (7265): 798–801.
CAS Статья PubMed PubMed Central Google Scholar
Tillmann HL, Thompson AJ, Patel K, Wiese M, Tenckhoff H, Nischalke HD, Lokhnygina Y, Kullig U, Gobel U, Capka E, et al. Полиморфизм около IL28B связан со спонтанным избавлением от вируса острого гепатита С и желтухой. Гастроэнтерология. 2010. 139 (5): 1586–92. 1592 е1581.
CAS Статья PubMed Google Scholar
Нанда С., Хаверт М.Б., Кальдерон Г.М., Томсон М., Якобсон С., Кастнер Д., Лян Т.Дж. Анализ печеночного транскриптома инфекции вируса гепатита С у шимпанзе позволяет определить уникальные паттерны экспрессии генов, связанные с клиренсом вируса.PLoS One. 2008; 3 (10): e3442.
Артикул PubMed PubMed Central Google Scholar
Мартин М.П., Кэррингтон М. Иммуногенетика ВИЧ-инфекции. Immunol Rev.2013; 254 (1): 245–64.
Артикул PubMed PubMed Central Google Scholar
Chen YJ, Zhu JM, Wu H, Fan J, Zhou J, Hu J, Yu Q, Liu TT, Yang L, Wu CL и др. Циркулирующие микроРНК как отпечаток цирроза печени.PLoS One. 2013; 8 (6): e66577.
CAS Статья PubMed PubMed Central Google Scholar
Oloomi M, Bouzari S, Mohagheghi MA, Khodayaran-Tehrani H. Молекулярные маркеры в периферической крови иранских женщин с раком груди. Cancer Microenviron. 2013. 6 (1): 109–16.
CAS Статья PubMed Google Scholar
Шэнь Дж, Ван Х, Вэй Дж, Ю Л, Се Л, Цянь Х, Цзоу З, Лю Б., Гуань В.Уровни мРНК тимидилатсинтазы в плазме и опухоли как потенциальные прогностические биомаркеры чувствительности к ралтитрекседу при раке желудка. Int J Cancer. 2012; 131 (6): E938–945.
CAS Статья PubMed Google Scholar
Tzimagiorgis G, Michailidou EZ, Kritis A, Markopoulos AK, Kouidou S. Восстановление циркулирующей внеклеточной или бесклеточной РНК из жидкостей организма. Cancer Epidemiol. 2011; 35 (6): 580–9.
CAS Статья PubMed Google Scholar
Wang W, Zhang X, Xu Y, Di Bisceglie AM, Fan X. Классификация вирусов и их открытие в человеческом обращении с помощью секвенирования транскриптомов. Biochem Biophys Res Commun. 2013. 436 (3): 525–9.
CAS Статья PubMed PubMed Central Google Scholar
Каслоу Р.А., Острув Д.Г., Детелс Р., Фейр Дж. П., Полк Б.Ф., Ринальдо-младший ЧР. Многоцентровое когортное исследование СПИДа: обоснование, организация и избранные характеристики участников.Am J Epidemiol. 1987. 126 (2): 310–8.
CAS Статья PubMed Google Scholar
Soto-Rivera J, Patterson BK, Chen Y, Shen C, Ratner D, Ding M, Tumne A, Gupta P. Изучение передачи ВИЧ-1 через слизистую шейки матки в клетки ткани миндалин с использованием органной культуры. Am J Reprod Immunol. 2013; 69 (1): 52–63.
CAS Статья PubMed Google Scholar
Riva A, Laird M, Casrouge A, Ambrozaitis A, Williams R, Naoumov NV, Albert ML, Chokshi S. Усеченный CXCL10 связан с неспособностью достичь спонтанного избавления от острой инфекции гепатита C. Гепатология. 2014. 60 (2): 487–96.
CAS Статья PubMed Google Scholar
Su AI, Pezacki JP, Wodicka L, Brideau AD, Supekova L, Thimme R, Wieland S, Bukh J, Purcell RH, Schultz PG, et al. Геномный анализ ответа хозяина на инфекцию вирусом гепатита С.Proc Natl Acad Sci U S. A. 2002; 99 (24): 15669–74.
CAS Статья PubMed PubMed Central Google Scholar
O’Sullivan T., Saddawi-Konefka R, Gross E, Tran M, Mayfield SP, Ikeda H, Bui JD. Интерлейкин-17D опосредует отторжение опухоли за счет привлечения естественных клеток-киллеров. Cell Rep.2014; 7 (4): 989–98.
Артикул PubMed PubMed Central Google Scholar
Oeckinghaus A, Hayden MS, Ghosh S. Перекрестные помехи в сигнальных путях NF-kappaB. Nat Immunol. 2011; 12 (8): 695–708.
CAS Статья PubMed Google Scholar
Робертсон MJ. Роль хемокинов в биологии естественных клеток-киллеров. J Leukoc Biol. 2002. 71 (2): 173–83.
CAS PubMed Google Scholar
Zhang Y, Guo D, Zhao Y, Chen X, Ma L, Jin Y, Yan H, Wu H, Wei L, Dong T и др.Влияние цитокиновых профилей на вирусный ответ на повторное лечение у пациентов с хронической инфекцией вируса гепатита С, получавших антивирусные препараты. Antiviral Res. 2011. 92 (2): 247–54.
CAS Статья PubMed Google Scholar
Клиническое влияние вирусной нагрузки на развитие гепатоцеллюлярной карциномы и смертность от заболеваний печени у пациентов с вирусной инфекцией гепатита С
Цель . Это исследование было направлено на оценку клинического воздействия вирусной нагрузки гепатита С на развитие гепатоцеллюлярной карциномы (ГЦК) и связанную с печенью смертность у пациентов, инфицированных ВГС. Методы . Всего в эту ретроспективную когорту были включены 111 субъектов с хронической инфекцией ВГС, которые были доступны для количественного определения РНК ВГС в сыворотке. Модели пропорциональных рисков Кокса использовались для расчета отношения рисков (HR) развития ГЦК и связанной с печенью смертности в соответствии с титрами РНК ВГС в сыворотке. Результаты . За период наблюдения ГЦК развился у 14 пациентов. Кумулятивный риск развития ГЦК был выше у субъектов с высоким титром РНК ВГС (log IU РНК HCV / мл> 6), чем у субъектов с низким титром (log IU РНК HCV ≦ 6) (HR = 4.63,), что дает показатель заболеваемости 474,1 и 111,5 на 10 000 человеко-лет соответственно. Другими независимыми факторами риска развития ГЦК были пожилой возраст (HR = 9,71), сопутствующий цирроз печени (HR = 19,34) и низкое количество тромбоцитов (HR = 13,97). Смерть от печени наступила у 7 пациентов. Сопутствующий цирроз (HR = 6,13) и низкий уровень альбумина (HR = 9,17), но не титр РНК HCV, были значимыми факторами риска, связанными с летальностью, связанной с печенью. Заключение . Титр сывороточной РНК HCV может рассматриваться как независимый фактор риска развития ГЦК, но не смертность, связанная с печенью.
1. Введение
Инфекция, вызванная вирусом гепатита С (ВГС), является одной из ведущих причин хронического гепатита во всем мире, а также основным фактором риска прогрессирования заболевания до запущенных состояний, таких как цирроз печени, печеночная декомпенсация и гепатоцеллюлярная карцинома ( HCC) [1, 2]. По оценкам ВОЗ, приблизительно 3% мирового населения или 170 миллионов человек могут быть инфицированы ВГС [3, 4]. После внедрения программы вакцинации против вируса гепатита В (ВГВ) бремя болезней, связанных с ВГС, постепенно увеличивалось в эндемичных по ВГВ районах [5, 6].В Корее на хронические заболевания печени, включая хронический гепатит, цирроз печени и ГЦК, приходилось примерно 7,1% от общего числа смертей в 2010 году при уровне смертности 46,3 на 100 000 человек. Это основная причина смерти мужчин в возрасте от сорока до пятидесяти лет, а смертность от ГЦК составляет 15,6% от общего числа смертей от рака [7]. Есть несколько факторов, влияющих на клиническое течение пациентов, инфицированных вирусом гепатита: факторы хозяина, вирусологические факторы и факторы окружающей среды. Среди них вирусологические факторы в значительной степени исследованы в случаях цирроза печени или ГЦК, связанного с вирусом гепатита.У HBV-инфицированных пациентов клинических последствий сывороточных уровней ДНК HBV для прогрессирования заболевания печени достаточно, чтобы их можно было распознать. Было установлено, что ступенчатое повышение уровня ДНК HBV в сыворотке крови связано с соответствующим линейным увеличением кумулятивной заболеваемости HCC, а также с прогрессированием связанного с HBV заболевания печени до цирроза печени или печеночной декомпенсации, независимо от активности трансаминаз в сыворотке, гепатита. Серостатус B e-антигена (HBeAg) и текущее наличие цирроза [8–10].Также хорошо известно, что неактивные носители HBV все еще подвержены риску ГЦК и смерти, связанной с печенью [11]. Кроме того, известно, что спонтанное серологическое очищение ДНК HBV является наиболее значительным фактором снижения риска развития ГЦК в будущем [12]. А именно, уровень ДНК HBV в сыворотке крови сам по себе является основным независимым фактором риска, влияющим на развитие ГЦК и смертность, связанную с печенью. Однако влияние ВГС на развитие ГЦК и смерть, связанную с печенью, у пациентов, инфицированных ВГС, остается неопределенным. В частности, еще предстоит определить, зависит ли прогрессирование заболевания печени от титра РНК HCV.Поэтому мы попытались оценить клиническое влияние вирусной нагрузки ВГС на развитие ГЦК и связанную с печенью смертность у пациентов с хронической инфекцией ВГС.
2. Методы
2.1. Субъекты исследования
Это исследование было проведено ретроспективно путем изучения медицинских записей. В период с января 2003 г. по июнь 2009 г. мы выявили 266 пациентов с серопозитивными антителами к вирусу гепатита С в больнице Университета Данкук в Корее. Из них 155 пациентов были исключены по следующим критериям исключения: (1) 105 пациентов, чьи количественные тесты сывороточной РНК ВГС не были оценены, (2) 8 пациентов с коинфекцией HBV, (3) 33 пациента, которые не находились под наблюдением. регулярно в течение как минимум 3 лет, и (4) 9 пациентов с первичным диагнозом ГЦК.В конечном итоге в эту ретроспективную когорту были отобраны 111 пациентов, инфицированных HCV, у которых были доступные данные количественного определения РНК HCV в сыворотке. Схема набора участников исследования показана на рисунке 1. Клинические характеристики и демографические данные включенных пациентов, включая возраст, пол, сопутствующий цирроз печени во время набора, и продолжительность наблюдения после набора были получены из медицинских записей. В анализ этого исследования были включены лабораторные данные, такие как тесты печени, сывороточный титр РНК HCV и генотип HCV.Мы также выяснили, проводилась ли противовирусная терапия и был ли достигнут устойчивый вирусологический ответ в течение периода последующего наблюдения. Настоящее исследование было проведено в соответствии с этическими принципами Хельсинкской декларации 1975 года.
2.2. Лабораторные исследования, связанные с ВГС
антитела против ВГС были обнаружены с помощью иммунорадиометрического анализа (Shin Jin Medics, Inc., Коян, Корея) на основе рекомбинантных белков генома ВГС, чувствительность которого составила 98.5% и специфичность 99,7%. Титры РНК ВГС в сыворотке количественно определяли с помощью полимеразной цепной реакции (ПЦР) в реальном времени с использованием количественного теста COBAS TaqMan HCV, версия 2.0 (Roche Molecular Systems, Inc., Бранчбург, Нью-Джерси, США) с линейным диапазоном от 43 до 6
00 МЕ / мл. В настоящем исследовании мы классифицировали пациентов на две группы с высокой или низкой вирусной нагрузкой на основе уровня РНК HCV в сыворотке крови на момент начала исследования. Пороговый лог-титр уровней РНК HCV составлял 6: (1) высокая вирусная нагрузка> 6 log титра РНК HCV IU / мл и (2) низкая вирусная нагрузка 6 log титр РНК HCV IU / мл.Генотипирование HCV выполняли с помощью ПЦР с обратной транскрипцией и анализа секвенирования с использованием генетического анализатора ABI PRISM 3130 (Life Technologies, Карлсбад, Калифорния, США).
2.3. Установление ГЦК и смерти, связанной с печенью
Гепатоцеллюлярная карцинома подтверждена гистологией. Случаи, недоступные для гистологической оценки, были диагностированы с использованием негистологических критериев, в основном в зависимости от радиологической визуализации на основе хронических заболеваний печени. Рентгенологические данные, типичные для диагноза ГЦК, представляют собой увеличение узелка в печени в артериальной фазе с вымыванием в воротной или отсроченной венозной фазе.Негистологические критерии диагноза ГЦК были приняты двумя методами динамического изображения (например, компьютерная томография брюшной полости и магнитно-резонансная томография), подходящими для радиологических данных о ГЦК, упомянутых выше, или одним методом визуализации, подходящим для ГЦК плюс уровень α -фетопротеина в сыворотке ≧ 400 нг / мл [13]. У пациентов с высоким риском цирроза печени критерии динамической визуализации, обновленные в рекомендациях Американской ассоциации по изучению заболеваний печени от 2010 г., также применялись для подтверждения развития ГЦК путем анализа медицинских записей и методов визуализации [14].Смерть, связанная с печенью, была определена как основная причина смерти из-за осложнений цирроза печени, печеночной недостаточности или ГЦК.
2.4. Статистический анализ
Совокупная частота случаев ГЦК и смерти, связанной с печенью, была рассчитана по методу Каплана-Мейера с использованием лог-рангового теста для проверки значимости. Человеко-годы наблюдения для каждого субъекта рассчитывались как период времени от даты базового клинического обследования при включении в исследование до даты диагноза ГЦК, даты смерти или даты последнего наблюдения или по крайней мере в июне. 30 августа 2012 г., в зависимости от того, что произойдет раньше.Регрессия пропорциональных рисков Кокса использовалась для одномерного и многофакторного анализа для определения наиболее значимых и независимых переменных, связанных с развитием ГЦК и смертности, связанной с печенью. Отношения рисков (HR) и соответствующие 95% доверительные интервалы (95% CI) были рассчитаны для оценки степени связи между переменными риска и развитием ГЦК или смерти, связанной с печенью. Статистический анализ проводился с использованием SPSS Statistics версии 18.0. П <0.05 считались значимым значением.
3. Результат
3.1. Характеристики пациентов
Клинические характеристики 111 пациентов, инфицированных HCV (54 мужчины, 57 женщин), перечислены в таблице 1. Средний возраст на момент включения в исследование составлял 53 ± 13 лет. У 29 (26,1%) пациентов изначально был цирроз печени. Число пациентов с высокой вирусной нагрузкой (log-титр РНК HCV IU / мл> 6) и низкой вирусной нагрузкой (log-титр HCV RNA IU / мл 6), основанное на титре сывороточной РНК HCV, составило 52 (46.8%) и 59 (53,2%) соответственно. Тридцать девять (52%) из 75 пациентов, которым можно было провести генотипирование ВГС, имели генотип 1, наиболее распространенный в Корее. В течение периода наблюдения 43 (38,7%) пациента получали противовирусную терапию с общим протоколом лечения пегинтерфероном и рибавирином в качестве стандарта лечения. А именно, пациенты с генотипом 1 HCV получали комбинированное лечение пегинтерфероном-альфа и рибавирином в течение 48 недель, а пациенты с генотипом HCV не 1 получали тот же режим в течение 24 недель. Среди них 31 (72%) получил устойчивый вирусологический ответ.После включения в исследование все пациенты находились под наблюдением в среднем 54 ± 16 месяцев.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Данные представлены в виде числа (в процентах) или среднего значения стандартное отклонение. HCV: вирус гепатита С. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.2. Развитие ГЦК
ГЦК впервые развился у 14 пациентов в течение периода наблюдения. При однофакторном анализе, пожилой возраст (≥50 лет), исходное наличие цирроза, высокая вирусная нагрузка сывороточной РНК HCV (> 6 log титр РНК HCV МЕ / мл), низкое количество тромбоцитов (<130000 / мм 3 ) и низкий уровень сывороточного альбумина (<3,0 г / дл) были значительными факторами риска, связанными с развитием ГЦК. Клинические факторы со значением менее 0.05 по одномерному анализу были включены в многомерный анализ. Риск развития ГЦК был выше у субъектов с высокой вирусной нагрузкой РНК ВГС, чем у субъектов с низкой вирусной нагрузкой (HR = 4,63) (Таблица 2). Пятилетний кумулятивный уровень заболеваемости ГЦК у пациентов с высокой вирусной нагрузкой составил 6,8%, что значительно отличается от 1,7% пациентов с низкой вирусной нагрузкой (рис. 2). Старость (HR = 9,71, P = 0,014), исходное наличие цирроза (HR = 19,34,) и низкое количество тромбоцитов (HR = 13.97,) были другими независимыми факторами риска кумулятивной заболеваемости ГЦК (таблица 2). В таблице 3 показаны показатели заболеваемости ГЦК на 10 000 человеко-лет по значимым факторам риска, проанализированным выше. Уровень заболеваемости ГЦК на 10 000 человеко-лет у пациентов с высокой вирусной нагрузкой был выше, чем у пациентов с низкой вирусной нагрузкой (474,1 против 111,5).
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Значимые переменные в одномерном анализе были включены в многомерный анализ. HCV: вирус гепатита С. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ВГС: вирус гепатита С. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.3. Развитие смерти, связанной с печенью
Всего за период наблюдения умерло восемь пациентов. Среди них смерть, связанная с печенью, произошла у 7 пациентов, а оставшийся пациент умер от осложнения, связанного с лимфомой. Причинами смерти, связанной с печенью, были 3 случая печеночной недостаточности, 3 случая ГЦК и 1 случай кровотечения из варикозно расширенных вен пищевода. Первоначальное наличие цирроза, низкое количество тромбоцитов (<130000 / мм 3 ) и низкий уровень сывороточного альбумина (<3,0 г / дл) были значительными факторами риска, связанными с летальностью, связанной с печенью, при однофакторном анализе.Однако вирусная нагрузка сывороточной РНК HCV не была значительной. Многофакторный анализ с использованием моделей пропорциональных рисков Кокса, наконец, указал на исходное присутствие цирроза (HR = 6,13,) и низкий уровень сывороточного альбумина (HR = 9,17,) как значимые факторы риска смерти, связанной с печенью (Таблица 4). Не было различий в совокупной смертности, связанной с печенью, в зависимости от уровня РНК HCV в сыворотке крови. В этом исследовании вирусная нагрузка гепатита С сама по себе не влияла на смертность, связанную с печенью (рис. 3).
Значимые переменные в одномерном анализе были включены в многомерный анализ. | HCV: вирус гепатита С. 4. ОбсуждениеВ этом ретроспективном когортном исследовании мы намеревались оценить клиническое влияние вирусной нагрузки гепатита С на развитие ГЦК и связанную с печенью смертность у пациентов, инфицированных ВГС.В результате настоящее исследование показало, что количественный уровень сывороточной РНК ВГС является независимым фактором риска развития ГЦК, хотя вирусная нагрузка ВГС сама по себе не влияет на смерть, связанную с печенью. Было высказано предположение, что более высокие титры РНК ВГС могут привести к более высокой заболеваемости ГЦК. Однако, насколько нам известно, влияние вирусной нагрузки гепатита С на развитие ГЦК было спорным в предыдущих исследованиях. Кроме того, мало что было сообщено о клинических последствиях вирусной нагрузки гепатита С в отношении смерти, связанной с печенью.Влияние вирусной нагрузки гепатита С на заболеваемость ГЦК было исследовано на крупномасштабной популяционной когорте в Японии [15]. Результат продемонстрировал, что виремия ВГС была тесно связана с возникновением ГЦК без зависимости от титра вируса. Но поскольку для количественной оценки ВГС измеряли коровой антиген ВГС, а не РНК ВГС, в этом исследовании нельзя было точно оценить клиническое воздействие на основе нуклеиновых кислот. В долгосрочном последующем исследовании на уровне сообщества, проведенном на Тайване, риск ГЦК постепенно увеличивался от субъектов, серонегативных по РНК ВГС, до субъектов с низким титром РНК ВГС и субъектов с высоким титром РНК ВГС, что указывало на серьезные последствия для ведение хронической инфекции ВГС на основе повышенного уровня РНК ВГС в сыворотке как независимого предиктора риска ГЦК [16].Однако в нескольких предыдущих исследованиях не удалось найти связи между уровнем РНК ВГС в сыворотке и риском ГЦК [17–19]. Наши результаты показали, что совокупный риск развития ГЦК был выше у пациентов с высоким титром РНК ВГС, чем у пациентов с низким титром, что дает показатель заболеваемости 474,1 и 111,5 на 10 000 человеко-лет, соответственно. В результате мы рассматриваем сывороточный титр РНК ВГС как независимый фактор риска развития ГЦК. Очень важно определить пороговое значение вирусной нагрузки, связанное с повышенным риском долгосрочных неблагоприятных исходов у пациентов, инфицированных ВГС.В настоящее время клинические исследования предельного уровня вирусной нагрузки гепатита С в сыворотке, имеющего отношение к развитию ГЦК, вызванного ВГС, проводятся редко. В одном исследовании средние выявляемые уровни РНК ВГС в сыворотке (3,5 × 10 5 Ед / мл) на момент начала исследования были основаны на классификации участников исследования на субъектов с высокой или низкой вирусной нагрузкой [16]. Другое исследование разделило участников на две группы: с высокой (10 5 копий / мл) и низкой (<10 5 копий / мл) вирусной нагрузкой [20]. В нашем анализе средний логарифмический титр сывороточного уровня РНК ВГС (МЕ / мл) у 111 пациентов, инфицированных ВГС, составил 5.7. На основе среднего логарифмического титра РНК ВГС мы классифицировали субъектов исследования на две группы: группу с высокой вирусной нагрузкой (> 6 log титра РНК ВГС) и группу с низкой вирусной нагрузкой (логарифмический титр РНК ВГС ≥ 6), в результате получение аналогичных размеров выборки и отсутствие различий в исходных характеристиках между двумя группами. Помимо вирусной нагрузки РНК ВГС, в настоящем исследовании было обнаружено, что пожилой возраст, низкое количество тромбоцитов и наличие цирроза являются значимыми и независимыми факторами риска развития ГЦК.Хотя возраст пациента ≥50 на момент включения в исследование был связан с развитием ГЦК, период от момента установления диагноза инфекции ВГС будет более важным, чем возраст пациента при включении в исследование, как показано в случае инфекции ВГВ. Однако было трудно точно определить период времени от инфицирования ВГС до включения в исследование субъектов из-за врожденных ограничений этого ретроспективного исследования. Несколько исследований продемонстрировали, что генотип 1b HCV более тесно связан с развитием HCC, чем генотип не-1b [15, 16, 21–24], но по этому аспекту существуют разногласия [25–27].В настоящем исследовании генотип 1b не анализировался как независимый фактор риска ГЦК анализом модели пропорциональных рисков Кокса, даже если генотип 1b имел тенденцию приводить к более частому развитию ГЦК, чем генотип, отличный от 1b (HR = 0,32,). Этот результат следует дополнительно оценить, поскольку генотипы ВГС в нашем исследовании изучались у небольшой части испытуемых, которые нуждались в терапии против ВГС. Метаанализ контролируемых исследований показал, что противовирусная терапия снижает скорость развития ГЦК у пациентов с циррозом печени типа C [28].Предыдущие отчеты показали, что устойчивый вирусологический ответ (УВО) подавляет возникновение ГЦК у пациентов с циррозом печени и хроническим гепатитом, связанным с ВГС [29–31]. Недавно в других исследованиях сообщалось, что противовирусная терапия на основе пегинтерферона не снижает частоту ГЦК у пациентов с запущенным хроническим заболеванием печени, вызванным ВГС, которые не достигли УВО, даже несмотря на то, что ожидалась потенциальная клиническая польза от длительной супрессивной терапии [32–34 ]. В настоящем исследовании клиническое влияние в зависимости от того, была ли получена противовирусная терапия и впоследствии достигнут УВО, не достигло статистической значимости, указывающей на независимые факторы риска развития ГЦК.Этот вывод должен быть подтвержден в крупномасштабном проспективном исследовании с участием субъектов, принимающих участие в терапии против ВГС. Известно, что УВО связан не только с ингибированием развития ГЦК, но также с контролем смертности от всех причин и смертности, связанной с печенью, у пациентов с хроническим гепатитом С [35, 36]; кроме того, сообщалось, что низкая вирусная нагрузка HCV позволяет прогнозировать лучшие долгосрочные результаты, включая 5-летнюю выживаемость у пациентов, перенесших резекцию HCC, независимо от серологической эрадикации HCV [37].Однако нет данных о причинно-следственной связи между титром РНК ВГС в сыворотке крови и смертью, связанной с печенью. В этом исследовании факторами, влияющими на смерть, связанную с печенью, были уровень сывороточного альбумина и начальное наличие цирроза печени, но не вирусная нагрузка ВГС, что указывает на то, что связанная с печенью смертность у пациентов, инфицированных ВГС, по-видимому, в основном связана с резервной функцией печени. Фактически, причины смерти в случаях смертности в этом исследовании были вызваны гепатоцеллюлярной недостаточностью или портальной гипертензией, такими как печеночная недостаточность, ГЦК и кровотечение из варикозно расширенных вен пищевода.Недавно Cramp et al. [38] предположили, что при нынешней лечебной практике количество пациентов, у которых развивается цирроз, вызванный ВГС, декомпенсация функции печени и ГЦК, существенно возрастет, а смерть печени из-за ВГС, вероятно, удвоится к 2030 году. Пришло время бросить вызов диагностике и диагностике. терапевтические стратегии для оптимизации снижения бремени заболеваний, связанных с ВГС. Было несколько ограничений, которые нельзя было избежать в этом исследовании. Во-первых, это одноцентровое когортное исследование на базе больниц с небольшим размером выборки и относительно коротким периодом наблюдения.Таким образом, для усиления и обобщения результатов исследования необходимы многоцентровые, популяционные долгосрочные данные последующего наблюдения. Во-вторых, поскольку исследование было ретроспективным по своей природе, мы не могли избежать неизмеренных или незарегистрированных клинических данных, проводя статистический анализ. В-третьих, мы не могли учитывать предполагаемые исходные характеристики, такие как индекс массы тела, количество употребляемого алкоголя или наличие сахарного диабета, которые считаются значительными факторами риска, предсказывающими развитие ГЦК у пациентов с хронической инфекцией ВГС.В-четвертых, уровень РНК ВГС в сыворотке крови является динамическим параметром у пациентов с хроническим гепатитом С; однако мы представили измерение вирусной нагрузки с момента начала исследования во времени, что не могло дать полной картины ассоциации тяжести заболевания печени на основе серологических колебаний вирусной нагрузки. Хотя влияние этих ограничений на наши результаты не будет существенным, эти соображения указывают на необходимость осторожности при интерпретации этих результатов. 5.ЗаключениеЭто ретроспективное когортное исследование показало, что сывороточный титр РНК ВГС может рассматриваться как независимый фактор риска, влияющий на развитие ГЦК, но не связанный с печенью смертности у пациентов, инфицированных ВГС. Хотя любая интерпретация этих результатов требует тщательного рассмотрения, установление факторов риска ГЦК, таких как вирусная нагрузка гепатита С, может быть полезным при определении стратегии последующего наблюдения за пациентами, инфицированными ВГС. Кроме того, необходимы крупномасштабные долгосрочные последующие исследования, чтобы оценить, можно ли обобщить настоящие результаты или являются ли они репрезентативными для других групп населения. Сокращения
Конкурирующие интересыАвторы заявляют об отсутствии конфликта интересов в отношении публикации этой статьи. БлагодарностиНастоящее исследование было проведено исследовательским фондом Университета Данкук в 2015 году. Тропизм геномных последовательностей вируса гепатита С в гемопоэтических клетках in vivo: влияние вирусной нагрузки, вирусного генотипа и клеточного фенотипа | КровьГенотип заражающих штаммов анализировали на основе сывороток, общих PBMC или подмножеств гемопоэтических клеток инфицированных пациентов с использованием трех различных анализов.Два анализа основаны на ПЦР: коммерческий анализ INNO-LIPA HCV (INNOGENETICS, Гент, Бельгия) и анализ CAP-PCR. В последнем анализе используются праймеры, специфичные для генотипа из области нуклеокапсида (CAP), и он был адаптирован из оригинальной методики Окамото.22 Мы разработали ряд оригинальных праймеров, включая 186 NTER, 132 N, 104 IIa, 134 N, 104 IIIa, 339N. , и 104Va. Синтез комплементарной ДНК (кДНК) выполняли с использованием праймера 186NTER (ATAGAGAAAGAGCAACCGGG) и смыслового праймера 256, как описано.22 Амплифицированный продукт (1/50) использовали для второй (вложенной) ПЦР с использованием смеси из 10 праймеров, специфичных для амплификации 4 различных генотипов HCV: 1 (a и b), 2, 3 (a) и 4 Обнаружение генотипов 5 и 6 с помощью этого метода невозможно. Были использованы четыре смысловых праймеров, 104 AGGAAGACTTCCGAGCGGTC, 104 Па AGGAAGACTTCGGAGCGGTC, 104 IIIa CGTAAAACTTCTGAACGGTC, и 104 IVa CGAAAGACTTCGGAGCGGTC, и шесть антисмысловых праймеров, 132-бис GCAGCCCTCATTGCCATA, 133-бис GCCATCCTGCCCACCCCATG, 134 Nbis1 ACTTGCCAGTGGAGCGCCG, 134 Nbis2 ATTTGCCAGTGGAGCGCCG, 339N GCTGAGCCCAGGACCGGCCR и 465 TCCCGTCCTCCACAGCCCRG.Комбинации праймеров, ожидаемый размер продуктов и соответствующие обнаруженные генотипы / подтипы были следующими: 104 / 132N, 125 п.н., 1a; 104/133, 141 п.н., 1b; 104 IIa / 134N, 75 п.н., 2; 104IIIa / 339N, 87 п.н., 3a; и 104 IVa / 465, 336 п.н., 4a. Иллюстрация результатов, полученных с помощью этого метода, показана на рис. 1. Третий тест, тест MUREX 1-6 (MUREX Inc, Дартфорд, Великобритания), основан на обнаружении генотип-специфичных антител.Все генотипы, представленные в исследовании, были выведены из согласованных результатов, полученных по крайней мере в двух из трех проведенных анализов. Распределение различных генотипов / подтипов было: 1a, n = 5; 1б, n = 14; 2a / c, n = 4; 3а, n = 7; 4, n = 2; и 1a + 2 a / c, n = 5; 1b + 2 к / с, n = 1. Полностью автоматизированный быстрый количественный анализ РНК вируса гепатита С в плазме и сыворотке человека с помощью встроенной ОТ-кПЦР и капиллярного электрофорезаПраймеры ОТ-кПЦР на ВГССелективная амплификация мишени РНК ВГС на основе 92 из образцов пациентов была достигнута путем использования пары праймеров, специфичных для высококонсервативной 5′-нетранслируемой области (UTR) 14 генома HCV среди всех генотипов (прямой праймер: 5′-TAMRA-ACTGCCTGATAGGGTGCTTG [TAMRA-HCV-267F ]; обратный праймер: CKTTTGGTTTTTCTTTGAGGT, K = G + T [HCV358R]).На 5′-конце прямого праймера был нанесен флуоресцентный краситель карбокситетраметилродомин (TAMRA), который позволял метить ампликон HCV для обнаружения флуоресценции. Международный стандарт ВОЗ на ВГС и синтетический положительный контроль ВГСПятый международный стандарт ВОЗ на ВГС (код NIBSC 14/150) был приобретен в Национальном институте биологических стандартов и контроля (Хартфордшир, Англия, Великобритания) и восстановлен в 1,1 мл воды, свободной от нуклеаз, до 100000 МЕ / мл (5.00 log 10 МЕ / мл). Положительный контроль на ВГС, приготовленный на месте, представляет собой неинфекционную рекомбинантную инкапсидируемую конструкцию MS2, содержащую ту же целевую последовательность из 92 оснований, полученную из генотипа 1а ВГС, и может амплифицироваться тем же набором специфичных для ВГС праймеров для анализа. Концентрация положительного контроля HCV была откалибрована в соответствии с 5-м Международным стандартом ВОЗ для HCV. Панель генотипа РНК HCVКвалификационная панель AccuTrak ™ по генотипу РНК HCV (2400-0182) была получена от SeraCare Life Sciences (Милфорд, Массачусетс, США).Панель состоит из 8 образцов плазмы, положительных по РНК HCV, представляющих шесть генотипов и 4 подтипа (1a, 1b, 2a, 2b, 3, 4, 5, 6) и отрицательный контроль плазмы. Титр образцов колеблется от 6,82 × 10 4 до 4,33 × 10 5 МЕ / мл. Неконкурентный внутренний контроль MS2 (MS2 IC)MS2 IC представляет собой неинфекционный рекомбинантный фаг MS2, полученный на собственном производстве, так что он содержит ген зрелой MS2 и покрывающего белка и усеченный ген репликазы MS2. Он не содержит последовательности РНК HCV и может быть амплифицирован парой праймеров, специфичных для гена репликазы MS2.MS2 IC использовался в качестве подготовки образца и неконкурентного внутреннего контроля RT-qPCR и был добавлен к образцу в начале подготовки образца для мониторинга всего процесса анализа, включая выделение РНК, обратную транскрипцию, амплификацию ПЦР и обнаружение. Количество внутреннего контроля, добавляемого в образец, было оптимизировано таким образом, чтобы как мишени MS2 IC, так и РНК HCV независимо амплифицировались в одной и той же реакции, не мешая друг другу. Кроме того, это позволило MS2 IC поддерживать значение Cq с низкой вариабельностью при различных целевых концентрациях.Поскольку анализатор MS2 IC прошел через весь процесс преобразования образца в результат, задержка в его заранее определенном значении Cq может указывать на то, что один или несколько этапов процесса могут быть нарушены и что анализ необходимо будет повторить. ПриборыµTASWako g1 Полностью автоматизированный генетический анализатор представляет собой интегрированную систему, содержащую компоненты и механизмы для выполнения экстракции нуклеиновых кислот, подготовки реакционной смеси для амплификации, одновременной амплификации мишени и капиллярного электрофореза на микрожидкостном чипе и обнаружения амплификации в реальном времени продукты.Сердцем системы является одноразовый микрожидкостный чип из высокоточного литого поликарбоната, содержащий 25-мкл ПЦР-камеру, соединенную с сетью микрожидкостных каналов 15 . В конце каждого цикла ПЦР незначительное количество продуктов ПЦР, меченных флуоресцентным красителем, вводится из камеры для ПЦР в основной канал разделения CE для анализа, создавая таким образом кривую амплификации ПЦР, которая отражает количественное накопление ампликона для каждой мишени. . Общее время анализа для обнаружения РНК HCV в плазме или сыворотке с ЭДТА человека в системе составляет менее 120 минут.Все реагенты, расходные материалы и микрофлюидный чип предназначены для одноразового использования. Автоматическая экстракция РНКMS2 IC вводили в 1 мл образца сыворотки или EDTA-плазмы, содержащей вирус HCV. Смесь обрабатывали протеиназой К и хаотропным реагентом при повышенной температуре для высвобождения нуклеиновых кислот. Высвобожденную и защищенную РНК захватывали на мембране из диоксида кремния в колонке в присутствии изопропанола и промывали промывочным буфером для удаления примесей и потенциальных ингибиторов RT-qPCR.Захваченную РНК затем элюировали из колонки элюирующим раствором для последующей RT-qPCR на чипе. Автоматическая встроенная RT-qPCR и обнаружение CEКонструкция микрожидкостного чипа qPCR-CE и интегрированная на кристалле ПЦР и CE для быстрого обнаружения и количественного определения ампликонов в реальном времени были описаны ранее. 15 . Для RT-qPCR РНК HCV элюированную РНК смешивали с буфером, содержащим праймеры HCV, праймеры MS2 IC, обратную транскриптазу и ДНК-полимеразу. 25 мкл реакционной смеси добавляли в камеру для ПЦР микрофлюидного чипа qPCR / CE.Последовательности праймеров для обнаружения MS2 IC представляют собой 5′-ATTGCTTACTTAAGGGACGAATTG-3 ‘и 5′-GCTACGGATGCTGGTTTGT-3′ для прямого и обратного соответственно, а 5’-конец обратного праймера был помечен красителем TAMRA. Давление воздуха (138 кПа) было приложено к камере ПЦР и лункам с реагентами через коллектор для подавления испарения и образования пузырьков во время RT-qPCR 15 . Обратную транскрипцию проводили в течение 15 минут при 50 ° C, после чего следовала стадия денатурации и активации горячего старта в течение 4 минут при 95 ° C.Затем были выполнены девять коротких циклов ПЦР (6 с при 96 ° C, 14 с при 58 ° C и 8 с при 80 ° C). После этого было проведено 29 дополнительных циклов ПЦР с более длительным временем продления (38 с при 80 ° C) с одной инъекцией КЭ из камеры ПЦР для каждого последующего цикла для анализа накопленных целевых ампликонов. Сбор и анализ данныхКривая амплификации ПЦР для каждого ампликона была построена путем построения графика зависимости высоты пика (относительная единица флуоресценции) от номера цикла на основе роста целевого пика по мере продвижения ПЦР 15 .Значения количественного цикла (Cq) определяли из кривых амплификации, используя высоту порогового пика, равную 5. Значения Cq затем переводили в МЕ / мл на основе предварительно определенной калибровочной кривой, соответствующей 5-му международному стандарту ВОЗ для HCV. Анализ проводился с использованием фирменного программного обеспечения, разработанного для прибора μTASWako g1. Клинические образцы от лиц, инфицированных ВГСАнализ был подтвержден с использованием 202 клинических образцов сыворотки от пациентов с хронической инфекцией ВГС, полученных в муниципальной больнице Огаки, Япония.Все пациенты дали положительный результат на антитела к ВГС, а инфекция ВГС была подтверждена тестом на РНК ВГС. Среди 202 образцов 99 образцов были получены от пациентов во время терапии анти-ВГС на основе интерферона (ИФН), а 37 образцов были взяты у пациентов во время терапии без ИФН против ВГС с противовирусными агентами прямого действия (ПППД). Остальные 66 образцов были получены от пациентов, не получавших никакого лечения. Уровни РНК ВГС в 202 образцах, измеренные с помощью теста Roche cobas AmpliPrep / cobas TaqMan HCV, версия 2.0, варьировался от отрицательного (цель не обнаружена), <15 МЕ / мл (положительный и не поддается количественной оценке) до 7,8 log 10 МЕ / мл. Отрицательный образец РНК ВГС, всего 21 образец, был получен от пациентов, проходящих терапию против ВГС. Образцы были собраны у 82 мужчин и 120 женщин со средним возрастом 66 лет. Генотип HCV был 1b у 126, 2a у 61 и 2b у 15 пациентов. Других генотипов не обнаружено, так как они очень редки в популяции Японии 16 . Ни у одного из пациентов не было коинфекции вирусом гепатита В или вирусом иммунодефицита человека.Информация о пациентах представлена в дополнительной таблице 1. Протокол этого исследования был одобрен наблюдательным советом муниципальной больницы Огаки и проводился в соответствии с Хельсинкской декларацией. Письменное информированное согласие было получено от всех участников на использование их клинических и лабораторных данных, а также сохраненных образцов сыворотки. Клинические образцы хранили при -80 ° C и замораживали во время транспортировки с сухим льдом перед тестированием. ВГС-отрицательная EDTA-плазма и сыворотка60 индивидуальных HCV-отрицательных EDTA-плазмы и HCV-отрицательных образцов сыворотки были получены из Американского Красного Креста (Пало-Альто, Калифорния, США).Объединенная нормальная человеческая плазма с ЭДТА была продуктом Golden West Biosolutions (Темекула, Калифорния, США), а объединенная нормальная человеческая сыворотка была получена от Golden West Diagnostics (Темекула, Калифорния, США). Статистический анализВариабельность между повторными тестами описывалась с использованием стандартного отклонения log 10 -преобразованных значений. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||





