Сайт учителей биологии МБОУ Лицей № 2 города Воронежа
Тромбоциты. Свёртывание крови
Кровяные пластинки, или тромбоциты (греч. thrombos — сгусток крови и cytos (kytos) — клетка), — это форменный элемент, участвующий в свёртывании крови и необходимый для поддержания целостности сосудистой стенки. Представляет собой округлое или овальное безъядерное образование диаметром 2 — 5 мкм. Тромбоциты образуются в красном костном мозге. В 1 мкл (мм3) у человека в норме содержится 180 — 320 тыс. тромбоцитов.
Свойства тромбоцитов
1. Амёбоидная подвижность.
2. Способность к фагоцитозу и образованию ложноножек.
3. Способность прилипать к чужеродной поверхности и склеиваться между собой.
4. Лёгкая разрушаемость.
5. Способность выделять и поглощать различные биологически активные вещества, в том числе участвующие в свёртывании крови.
Функции тромбоцитов
1. Участие в процессах свёртывания крови и растворения кровяного сгустка.
2. Участие в остановке кровотечения.
3. Защитная функция — склеивание микробов и фагоцитоз.
4. Транспорт различных веществ, необходимых для сохранения структуры сосудистой стенки.
Свёртывание крови, или гемостаз (греч. haima — кровь, stasis — неподвижное состояние), — это процесс остановки движения крови по кровеносному сосуду, то есть остановка кровотечения.
При повреждении мелких сосудов с низким давлением крови достаточно спазма сосуда и образования тромбоцитарной пробки. При повреждении крупных сосудов с высоким давлением этого оказывается недостаточно, поэтому запускаются реакции, приводящие к свёртыванию крови. Эти реакции происходят в три этапа.1. Образование протромбиназы (фермента, необходимого для последующих этапов). При повреждении стенки сосуда, меняется её заряд, поэтому к повреждённому месту притягиваются тромбоциты и эритроциты, которые прилипают к месту повреждения и разрушаются. Из осколков этих форменных элементов при участии ионов кальция и специальных белков (факторов свёртывания), которые синтезируются в печени при участии витамина К и всегда присутствуют в крови, образуется протромбиназа.
2. Образование тромбина. Тромбин — это белок, который образуется из протромбина (всегда присутствует в крови, куда он поступает из печени) под действием протромбиназы и ионов кальция.3. Образование фибрина. Фибрин — это
нерастворимый белок, который образуется из растворённого в крови фибриногена под
влиянием тромбина и ионов кальция. Фибрин выпадает в виде тонких нитей,
образующих сеть, в которой задерживаются форменные элементы. Сеть из волокон
нерастворимого фибрина и опутанные ею эритроциты, лейкоциты и тромбоциты
образуют кровяной сгусток. После образования фибринового сгустка происходит его
уплотнение —
Таким образом, свёртывание крови — это цепной ферментативный процесс, в котором последующие реакции катализируются результатами предыдущих реакций.
Время свёртывания капиллярной крови 3 — 5 мин., венозной — 5 — 10 мин.
Аудиофрагмент «Кровь» (5:34)
Как тромбоциты ускоряют свёртывание крови
Кирилл Стасевич, биолог
«Наука и жизнь» №10, 2016
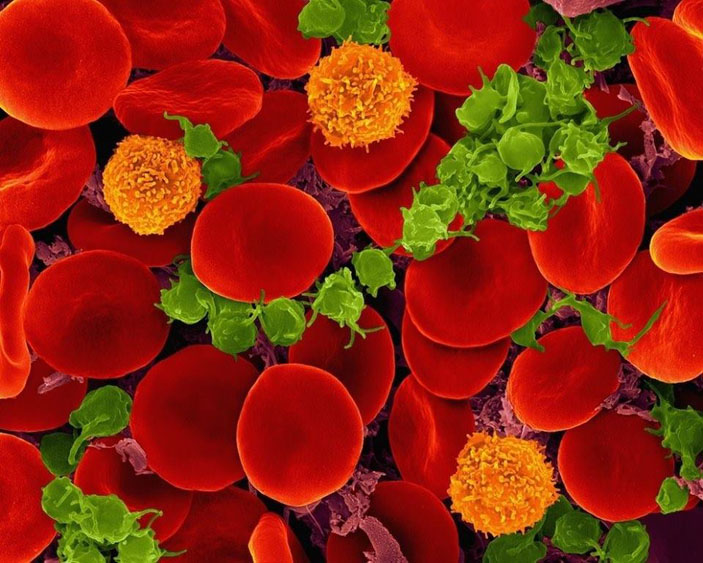

Если посмотреть на каплю крови в микроскоп (пусть это будет световой микроскоп, но достаточно мощный), то можно увидеть клетки трёх типов: многочисленные эритроциты, или красные кровяные тельца, немногочисленные, но довольно крупные лейкоциты и мельчайшие тромбоциты, которые удаётся разглядеть с некоторым трудом. Эритроциты, плотно набитые белком гемоглобином, переносят кислород: гемоглобин связывает его в лёгких и отдаёт в тканях и органах, которые в нём нуждаются. Лейкоциты — клетки иммунной системы, и они вместе с иммунными белками защищают нас от инфекций и от некоторых неинфекционных заболеваний, например от рака. Лейкоцитов существует несколько типов, отличающихся в том числе и по численности; возможно, из лейкоцитов нам попадутся Т-лимфоциты, которые целенаправленно распознают и сами уничтожают как чужеродные, так и наши собственные клетки, которым не повезло заболеть. Наконец, тромбоциты. Про тромбоциты мы знаем, что они нужны для свёртывания крови.
Кто не представляет, как работает система свёртывания крови? Уколовши палец, мы наблюдаем, как он сначала кровоточит, а потом перестаёт — образовавшийся тромб остановил кровь. Если бы кровь не свёртывалась, то разбитый нос мог бы оказаться смертельным ранением. Но, наверно, едва ли не более важная функция механизма свёртывания — предотвращение внутренних кровотечений, которые часто случаются при различных заболеваниях (например, при тяжёлой инфекции или при злокачественной опухоли). При этом система свёртывания должна быть очень точно сбалансирована: если она будет работать плохо, то пойдут неостанавливаемые кровотечения, внутренние и наружные; если же механизм свёртывания будет слишком активным, начнут формироваться тромбы, грозящие закупоркой сосудов и остановкой кровоснабжения. В медицине есть масса примеров, когда процессы свёртывания крови и тромбообразования идут не так, как надо, и не там, где надо. Причиной тому могут быть либо другие болезни, и тогда нарушения системы свёртывания крови — это просто сопутствующий симптом, либо же сами эти нарушения представляют собой отдельные, самостоятельные заболевания (вроде небезызвестной гемофилии или болезни Виллебранда).
Бороться с аномалиями системы свёртывания можно по-разному, и сейчас есть медицинские средства, которые позволяют эффективно регулировать её работу. Но чтобы такие средства работали ещё лучше, чтобы сделать их ещё более совершенными, нужно как можно точнее знать, как на молекулярно-клеточном уровне устроен механизм свёртывания крови. Его изучают уже более ста лет, и сейчас его схему можно найти в любом школьном учебнике; правда, схему эту большинство из нас старается забыть, как страшный сон: ещё бы, около двух десятков белков, соединённых стрелками, — кто-то кого-то активирует, кто-то кого-то ингибирует. Однако если рассматривать свёртывание по этапам, то всё становится более или менее понятно.
Стоит сразу сказать, что собственно свёртывание — лишь часть более общего процесса гемостаза (от греч.
Одновременно с формированием тромбоцитарной пробки происходит процесс собственно свёртывания крови — свёртывания в строгом смысле слова. В нём участвует множество белков плазмы крови, большинство из них — ферменты-протеазы, то есть белки, отщепляющие куски от других белков. Если до расщепления «жертва» протеазы была неактивным белком-ферментом, то после расщепления фермент активируется и, если он сам протеаза, тоже может кого-то расщепить. Суть ферментативных реакций, которые идут во время свёртывания, в том, что белки активируют друг друга, и в итоге всё заканчивается появлением активного белка фибрина, который быстро полимеризуется, превращаясь в нити — фибриллы. Из нитей фибрина формируется фибриновый сгусток, дополнительно укрепляющий тромбоцитовую «затычку», — образуется тромбоцитарно-фибриновый тромб. Когда сосуд восстанавливается, тромб рассасывается.
Оба этапа — и формирование тромбоцитарной пробки, и свёртывание крови с участием плазматических факторов-ферментов — подчиняются множеству регуляторов. Для организма важно, чтобы система гемостаза работала как можно более точно, и многостадийность как раз помогает выполнять тонкую настройку: на каждом этапе, на каждой реакции ферменты и другие молекулы, задействованные в процессе, проверяют, не ложный ли сигнал к ним пришёл и действительно ли есть необходимость в тромбе. Естественно, тромбоциты и факторы свёртывания теснейшим образом связаны друг с другом и тромбоциты нужны не только для того, чтобы первыми заткнуть брешь в сосуде. Во-первых, они также выделяют белки, которые ускоряют восстановление стенки сосуда. Во-вторых, что особенно важно, кровяные пластинки нужны ещё для того, чтобы ферменты свёртывания продолжали работать.
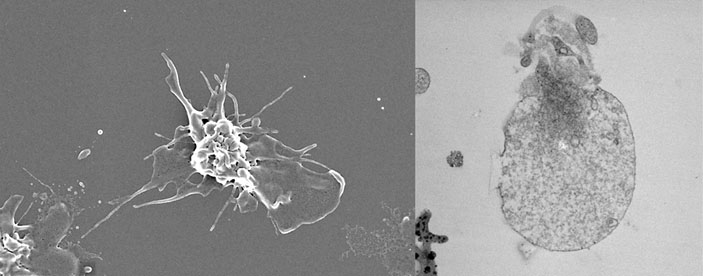
После запуска процесса гемостаза мембрана некоторых тромбоцитов изменяется особым образом, так что теперь на неё могут садиться ферменты реакций свёртывания: после приземления на такие тромбоциты они начинают работать намного быстрее. Что при этом происходит, удалось выяснить лишь относительно недавно. Активированные тромбоциты, то есть те, которые почувствовали повреждение сосуда, бывают двух форм: простые (агрегирующие) и сверхактивированные (прокоагулянтные). Простые агрегирующие тромбоциты отчасти похожи на амёбы: они образуют выпячивания мембраны, похожие на ножки, которые помогают им лучше сцепляться друг с другом, и становятся более плоскими, как бы растекаясь по поверхности. Такие клетки формируют основное тело тромба. Сверхактивированные тромбоциты ведут себя иначе: они приобретают сферическую форму и увеличиваются в несколько раз, становясь похожими на воздушные шарики. Они не просто укрепляют тромб, но и стимулируют реакцию свёртывания, почему их и называют прокоагулянтными.

Как одни тромбоциты становятся простыми, а другие — сверхактивированными? Известно, что в прокоагулянтных тромбоцитах очень высок уровень кальция (ионы кальция вообще один из главных регуляторов гемостаза) и что у них выходят из строя митохондрии. Связаны ли эти изменения в клеточной физиологии со сверхактивацией тромбоцитов?
В прошлом году Фазли Атауллаханов*, директор Центра теоретических проблем физико-химической фармакологии РАН, вместе с Михаилом Пантелеевым, заведующим лабораторией молекулярных механизмов гемостаза центра и профессором кафедры медицинской физики физического факультета МГУ, опубликовали в журнале Molecular BioSystems статью с описанием модели митохондриального некроза как особой формы клеточной смерти. Мы знаем, что клетка может погибнуть в результате апоптоза, включив программу самоуничтожения (при апоптозе всё происходит по плану и с минимальным беспокойством для клеток-соседей), или в результате некроза, когда гибель случается быстро и незапланированно, например из-за разрыва наружной мембраны или из-за масштабных внутренних неприятностей, вроде вирусной или бактериальной инфекции.
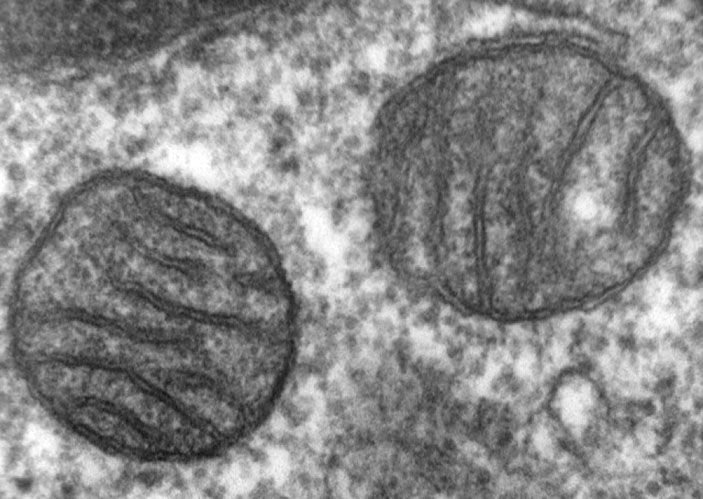
В чём особенность митохондриального некроза? Митохондрии, как известно, служат источниками энергии для любой нашей клетки: в митохондриях происходит кислородное окисление «питательных» молекул, а освобождённая при этом энергия запасается в удобной для клетки форме. Побочным продуктом при работе с кислородом оказываются агрессивные кислородные радикалы, которые могут испортить любую биомолекулу. Сами митохондрии стараются уменьшать концентрацию радикалов и не выпускать их из себя в клеточную цитоплазму.
При митохондриальном некрозе происходит следующее: митохондрии вбирают в себя кальций, и в какой-то момент, когда кальция становится слишком много, они разрушаются, выплёскивая в цитоплазму и кальций, и активные формы кислорода. В результате в клетке распадается внутриклеточный белковый скелет и клетка сильно увеличивается в объёме, превращаясь в шар. (Как мы помним, шарообразная форма характерна для сверхактивированных тромбоцитов.) Кроме того, и ионы кальция, и активные формы кислорода активируют фермент скрамблазу, который перебрасывает фосфатидилсерин — один из липидов цитоплазматической мембраны — из внутреннего слоя мембраны в наружный. И вот на такую модифицированную мембрану округлившихся тромбоцитов, обогащённую фосфатидилсерином, прилипают некоторые важные факторы свёртывания: здесь они собираются в комплексы, активируются, и в результате реакция свёртывания ускоряется в 1000–10 000 раз.
В новой статье, опубликованной в июне этого года в Journal of Thrombosis and Haemostasis, Михаил Пантелеев, Фазли Атауллаханов и их коллеги описывают эксперименты, которые полностью подтверждают такую модель активации тромбоцитов: кровяные пластинки стимулировали тромбином, одним из белков системы свёртывания, после чего митохондрии наполнялись ионами кальция, а в митохондриальных мембранах появлялись поры. Проницаемость митохондрий увеличивалась, и в какой-то момент, когда изменение проницаемости делалось необратимым, весь запасённый кальций оказывался в цитоплазме и запускал процесс «переформатирования» наружной мембраны.
Получается следующая картина: тромбоциты, подчиняясь внешним активаторам, впитывают кальций. Из их цитоплазмы кальций переходит в митохондрии. В самой цитоплазме уровень ионов кальция то повышается, то понижается (осциллирует), но в митохондриях он неуклонно растёт, и наступает момент, когда они уже не могут удерживать кальциевые ионы внутри себя. Весь кальций (с кислородными окислителями) выходит в цитоплазму и включает фермент, перебрасывающий липиды в цитоплазматической мембране тромбоцита. В результате на поверхности сверхактивированного и, очевидно, доживающего свои последние минуты тромбоцита собираются ферментативные комплексы, ускоряющие реакцию свёртывания.
Почему же не все тромбоциты становятся сверхактивированными — прокоагулянтными? Вероятно, потому, что для активации требуется сумма сигналов от разных регуляторов. Мы уже сказали, что тромбоциты чувствительны к тромбину, который плавает в плазме крови, а в начале статьи говорили, что одним из первых активирующих сигналов для кровяных пластинок служит коллаген из повреждённой стенки сосуда. Коллаген и тромбин действительно сильные активаторы, но кроме них тромбоциты «прислушиваются» и к некоторым другим молекулам. Степень активации зависит от количества разных входных сигналов, и превращение в прокоагулянтную форму, очевидно, происходит тогда, когда суммарный сигнал извне оказывается для конкретного тромбоцита особенно сильным.
Практические аспекты полученных результатов понятны каждому: чем больше подробностей узнаем про свёртывание крови, тем скорее научимся управлять этим процессом, ускоряя или замедляя его в соответствии с медицинскими показаниями.
*Интервью с Фазли Атауллахановым, «Наука и жизнь» № 1, 2011 г.
Как тромбоциты ускоряют свёртывание крови
Если посмотреть на каплю крови в микроскоп (пусть это будет световой микроскоп, но достаточно мощный), то можно увидеть клетки трёх типов: многочисленные эритроциты, или красные кровяные тельца, немногочисленные, но довольно крупные лейкоциты и мельчайшие тромбоциты, которые удаётся разглядеть с некоторым трудом. Эритроциты, плотно набитые белком гемоглобином, переносят кислород: гемоглобин связывает его в лёгких и отдаёт в тканях и органах, которые в нём нуждаются. Лейкоциты — клетки иммунной системы, и они вместе с иммунными белками защищают нас от инфекций и от некоторых неинфекционных заболеваний, например от рака. Лейкоцитов существует несколько типов, отличающихся в том числе и по численности; возможно, из лейкоцитов нам попадутся Т-лимфоциты, которые целенаправленно распознают и сами уничтожают как чужеродные, так и наши собственные клетки, которым не повезло заболеть. Наконец, тромбоциты. Про тромбоциты мы знаем, что они нужны для свёртывания крови.
Поперечный срез через митохондрии клетки лёгкого. Митохондрии выглядят как цистерны, окружённые двойной мембраной; поперечные полосы на снимке — впячивания их внутренней мембраны, на которой сидят ферменты энергетического обмена веществ.
Почувствовав, что стенка кровеносного сосуда повреждена, тромбоциты активируются. Обычные активированные тромбоциты (слева; фото со сканирующего электронного микроскопа) делаются плоскими и образуют, подобно амёбам, многочисленные выросты мембраны.
‹
›
Кто не представляет, как работает система свёртывания крови? Уколовши палец, мы наблюдаем, как он сначала кровоточит, а потом перестаёт — образовавшийся тромб остановил кровь. Если бы кровь не свёртывалась, то разбитый нос мог бы оказаться смертельным ранением. Но, наверно, едва ли не более важная функция механизма свёртывания — предотвращение внутренних кровотечений, которые часто случаются при различных заболеваниях (например, при тяжёлой инфекции или при злокачественной опухоли). При этом система свёртывания должна быть очень точно сбалансирована: если она будет работать плохо, то пойдут неостанавливаемые кровотечения, внутренние и наружные; если же механизм свёртывания будет слишком активным, начнут формироваться тромбы, грозящие закупоркой сосудов и остановкой кровоснабжения. В медицине есть масса примеров, когда процессы свёртывания крови и тромбообразования идут не так, как надо, и не там, где надо. Причиной тому могут быть либо другие болезни, и тогда нарушения системы свёртывания крови — это просто сопутствующий симптом, либо же сами эти нарушения представляют собой отдельные, самостоятельные заболевания (вроде небезызвестной гемофилии или болезни Виллебранда).
Бороться с аномалиями системы свёртывания можно по-разному, и сейчас есть медицинские средства, которые позволяют эффективно регулировать её работу. Но чтобы такие средства работали ещё лучше, чтобы сделать их ещё более совершенными, нужно как можно точнее знать, как на молекулярно-клеточном уровне устроен механизм свёртывания крови. Его изучают уже более ста лет, и сейчас его схему можно найти в любом школьном учебнике; правда, схему эту большинство из нас старается забыть, как страшный сон: ещё бы, около двух десятков белков, соединённых стрелками, — кто-то кого-то активирует, кто-то кого-то ингибирует. Однако если рассматривать свёртывание по этапам, то всё становится более или менее понятно.
Стоит сразу сказать, что собственно свёртывание — лишь часть более общего процесса гемостаза (от греч. haimatos — кровь, stasis — остановка). И этот процесс начинается как раз с тромбоцитов. Они происходят от мегакариоцитов — гигантских клеток костного мозга. От зрелых мегакариоцитов «отшнуровываются» куски цитоплазмы, которые и становятся безъядерными клетками тромбоцитами (хотя, учитывая их происхождение и отсутствие ядра, более корректно называть их просто тельцами крови или кровяными пластинками). Тромбоциты циркулируют по крови, пока не «заметят» брешь в сосуде. Сигналом для них служит соединительнотканный белок коллаген. Он обычно спрятан внутри стенки сосуда, но при её повреждении оказывается лицом к лицу с тромбоцитами и другими белками крови. На мембране тромбоцитов есть специальный рецептор, который хватает коллаген и заставляет кровяные пластинки прилипнуть к месту повреждения. Тут в дело вступает один из факторов свёртывания под названием «фактор фон Виллебранда». Это гликопротеин (его молекула состоит из белковой и углеводной частей), который помогает другим рецепторам тромбоцитов зацепиться за торчащий из стенки сосуда коллаген. Благодаря фактору фон Виллебранда тромбоциты не только прочнее взаимодействуют с местом повреждения, но и дополнительно активируются — подают молекулярные сигналы другим тромбоцитам и белкам свёртывания, меняют внешнюю форму и активно слипаются друг с другом. В результате на стенке кровеносного сосуда появляется затычка из тромбоцитов.
Одновременно с формированием тромбоцитарной пробки происходит процесс собственно свёртывания крови — свёртывания в строгом смысле слова. В нём участвует множество белков плазмы крови, большинство из них — ферменты-протеазы, то есть белки, отщепляющие куски от других белков. Если до расщепления «жертва» протеазы была неактивным белком-ферментом, то после расщепления фермент активируется и, если он сам протеаза, тоже может кого-то расщепить. Суть ферментативных реакций, которые идут во время свёртывания, в том, что белки активируют друг друга, и в итоге всё заканчивается появлением активного белка фибрина, который быстро полимеризуется, превращаясь в нити — фибриллы. Из нитей фибрина формируется фибриновый сгусток, дополнительно укрепляющий тромбоцитовую «затычку», — образуется тромбоцитарно-фибриновый тромб. Когда сосуд восстанавливается, тромб рассасывается.
Оба этапа — и формирование тромбоцитарной пробки, и свёртывание крови с участием плазматических факторов-ферментов — подчиняются множеству регуляторов. Для организма важно, чтобы система гемостаза работала как можно более точно, и многостадийность как раз помогает выполнять тонкую настройку: на каждом этапе, на каждой реакции ферменты и другие молекулы, задействованные в процессе, проверяют, не ложный ли сигнал к ним пришёл и действительно ли есть необходимость в тромбе. Естественно, тромбоциты и факторы свёртывания теснейшим образом связаны друг с другом и тромбоциты нужны не только для того, чтобы первыми заткнуть брешь в сосуде. Во-первых, они также выделяют белки, которые ускоряют восстановление стенки сосуда. Во-вторых, что особенно важно, кровяные пластинки нужны ещё для того, чтобы ферменты свёртывания продолжали работать.
После запуска процесса гемостаза мембрана некоторых тромбоцитов изменяется особым образом, так что теперь на неё могут садиться ферменты реакций свёртывания: после приземления на такие тромбоциты они начинают работать намного быстрее. Что при этом происходит, удалось выяснить лишь относительно недавно. Активированные тромбоциты, то есть те, которые почувствовали повреждение сосуда, бывают двух форм: простые (агрегирующие) и сверхактивированные (прокоагулянтные). Простые агрегирующие тромбоциты отчасти похожи на амёбы: они образуют выпячивания мембраны, похожие на ножки, которые помогают им лучше сцепляться друг с другом, и становятся более плоскими, как бы растекаясь по поверхности. Такие клетки формируют основное тело тромба. Сверхактивированные тромбоциты ведут себя иначе: они приобретают сферическую форму и увеличиваются в несколько раз, становясь похожими на воздушные шарики. Они не просто укрепляют тромб, но и стимулируют реакцию свёртывания, почему их и называют прокоагулянтными.
Как одни тромбоциты становятся простыми, а другие — сверхактивированными? Известно, что в прокоагулянтных тромбоцитах очень высок уровень кальция (ионы кальция вообще один из главных регуляторов гемостаза) и что у них выходят из строя митохондрии. Связаны ли эти изменения в клеточной физиологии со сверхактивацией тромбоцитов?
В прошлом году Фазли Атауллаханов*, директор Центра теоретических проблем физико-химической фармакологии РАН, вместе с Михаилом Пантелеевым, заведующим Лабораторией молекулярных механизмов гемостаза центра и профессором кафедры медицинской физики физического факультета МГУ, опубликовали в журнале «Molecular BioSystems» статью с описанием модели митохондриального некроза как особой формы клеточной смерти. Мы знаем, что клетка может погибнуть в результате апоптоза, включив программу самоуничтожения (при апоптозе всё происходит по плану и с минимальным беспокойством для клеток-соседей), или в результате некроза, когда гибель случается быстро и незапланированно, например из-за разрыва наружной мембраны или из-за масштабных внутренних неприятностей, вроде вирусной или бактериальной инфекции.
В чём особенность митохондриального некроза? Митохондрии, как известно, служат источниками энергии для любой нашей клетки: в митохондриях происходит кислородное окисление «питательных» молекул, а освобождённая при этом энергия запасается в удобной для клетки форме. Побочным продуктом при работе с кислородом оказываются агрессивные кислородные радикалы, которые могут испортить любую биомолекулу. Сами митохондрии стараются уменьшать концентрацию радикалов и не выпускать их из себя в клеточную цитоплазму.
При митохондриальном некрозе происходит следующее: митохондрии вбирают в себя кальций, и в какой-то момент, когда кальция становится слишком много, они разрушаются, выплёскивая в цитоплазму и кальций, и активные формы кислорода. В результате в клетке распадается внутриклеточный белковый скелет и клетка сильно увеличивается в объёме, превращаясь в шар. (Как мы помним, шарообразная форма характерна для сверхактивированных тромбоцитов.) Кроме того, и ионы кальция, и активные формы кислорода активируют фермент скрамблазу, который перебрасывает фосфатидилсерин — один из липидов цитоплазматической мембраны — из внутреннего слоя мембраны в наружный. И вот на такую модифицированную мембрану округлившихся тромбоцитов, обогащённую фосфатидилсерином, прилипают некоторые важные факторы свёртывания: здесь они собираются в комплексы, активируются, и в результате реакция свёртывания ускоряется в 1000—10 000 раз.
В новой статье, опубликованной в июне этого года в «Journal of Thrombosis and Haemostasis», Михаил Пантелеев, Фазли Атауллаханов и их коллеги описывают эксперименты, которые полностью подтверждают такую модель активации тромбоцитов: кровяные пластинки стимулировали тромбином, одним из белков системы свёртывания, после чего митохондрии наполнялись ионами кальция, а в митохондриальных мембранах появлялись поры. Проницаемость митохондрий увеличивалась, и в какой-то момент, когда изменение проницаемости делалось необратимым, весь запасённый кальций оказывался в цитоплазме и запускал процесс «переформатирования» наружной мембраны.
Получается следующая картина: тромбоциты, подчиняясь внешним активаторам, впитывают кальций. Из их цитоплазмы кальций переходит в митохондрии. В самой цитоплазме уровень ионов кальция то повышается, то понижается (осциллирует), но в митохондриях он неуклонно растёт, и наступает момент, когда они уже не могут удерживать кальциевые ионы внутри себя. Весь кальций (с кислородными окислителями) выходит в цитоплазму и включает фермент, перебрасывающий липиды в цитоплазматической мембране тромбоцита. В результате на поверхности сверхактивированного и, очевидно, доживающего свои последние минуты тромбоцита собираются ферментативные комплексы, ускоряющие реакцию свёртывания.
Почему же не все тромбоциты становятся сверхактивированными — проко-агулянтными? Вероятно, потому, что для активации требуется сумма сигналов от разных регуляторов. Мы уже сказали, что тромбоциты чувствительны к тромбину, который плавает в плазме крови, а в начале статьи говорили, что одним из первых активирующих сигналов для кровяных пластинок служит коллаген из повреждённой стенки сосуда. Коллаген и тромбин действительно сильные активаторы, но кроме них тромбоциты «прислушиваются» и к некоторым другим молекулам. Степень активации зависит от количества разных входных сигналов, и превращение в прокоагулянтную форму, очевидно, происходит тогда, когда суммарный сигнал извне оказывается для конкретного тромбоцита особенно сильным.
Практические аспекты полученных результатов понятны каждому: чем больше подробностей узнаем про свёртывание крови, тем скорее научимся управлять этим процессом, ускоряя или замедляя его в соответствии с медицинскими показаниями.
Комментарии к статье
* Интервью с Фазли Атауллахановым см. «Наука и жизнь» № 1, 2011 г.
Тромбоциты. Свертывание и переливание крови
Тромбоциты
1. Представляют собой периферические участки цитоплазмы гигантских клеток мегакариоцитов, которые формируются в красном костном мозге.
2. Не имеют ядер.
3. Содержание тромбоцитов в крови колеблется от 200 до 400 тысяч на 1 кубический миллиметр.
4. Живут тромбоциты недолго, 9-10 суток, разрушаются в селезенке.
Свертывание крови
1. Сразу после разрыва стенки сосуда тромбоциты «бегут» к месту травмы и, при наличии ионов кальция, выделяют тромбопластин.
2. Тромбопластин — это белково-липидный комплекс, один из важнейших факторов свертывания крови.
3. Тромбопластин в присутствии кальция вступает во взаимодействие с белком протромбином, в результате чего образуется белок-фермент тромбин. Протромбин — неактивный предшественник фермента тромбина.
4. Тромбин помогает превращению фибриногена в фибрин. Фибриноген — растворимый в плазме белок, в этом его ключевого отличие от нерастворимого фибрина.
5. Нити фибрина, сокращаясь, делают тромб плотным, и он, словно заглушка, останавливает кровь.
6. В норме свертывание крови длится 3–8 минут.
7. Некоторые заболевания, например, антифосфолипидный синдром, способствуют высокому свертыванию крови, что чревато возникновением тромбов.
8. Для свертывания необходим также витамин К.
Некоторые факты об образовании и свертывании крови
1. Фибриноген и протромбин синтезируются в почках. Следовательно, в почках образуется не только эритропоэтин.
2. Хлорид кальция вводят при сильных кровотечениях, что способствует свертыванию крови.
3. У эмбриона поначалу нет костей, поэтому кровь образуется в желточном мешке, а у плода возрастом 4–8 месяцев — уже в селезенке.
4. При повышении температуры скорость свертывания крови растет.
Переливание крови. Группы крови
1. В плазме крови могут присутствовать агглютинины α и β (антитела), на поверхности эритроцитов — агглютиногены A и B (антигены), причём из белков A и α содержится один и только один, то же самое характерно для белков B и β.
2. Итак, в наличии всего четыре допустимые комбинации. То, какая из них характерна для конкретного человека, определяет его группу крови:
· α и β: первая (0)
· A и β: вторая (A)
· α и B: третья (B)
· A и B: четвёртая (AB)
Правило переливания крови
1. Самое главное — нельзя переливать кровь донора, в которой присутствуют антигены, комплементарные антителам реципиента. Это правило было неизвестно при первых опытах по переливанию, из-за чего немало пациентов погибало.
2. Несовместимость групп крови приводит к склеиванию (агглютинации) эритроцитов донора в организме реципиента.
3. Комплементарные антигены и антитела — А и а, В и b.
Резус-фактор
1. Резус-фактор — это белок-антиген, присутствующий в эритроцитах. Он обнаружен у 85 процентов людей, а также у обезьян вида макак-резус. Его жизненно необходимо учитывать при переливании крови.
2. Если женщина с отрицательным резусом забеременела плодом с резусом положительным, в ее крови образуются антитела. При повторных беременностях они могут привести к тому, что плод на любом сроке погибнет или произойдет его отторжение, выкидыш. В случае рождения ребенка у него может возникнуть гемолитическая болезнь новорожденных, чреватая дальнейшими патологиями (желтуха, анемия, кислородное голодание и пр.). Сегодня эти факты хорошо известны, поэтому женщина с отрицательным резусом в ходе беременности неоднократно сдает кровь на наличие антител.
3. Ей на определенных сроках вводится антирезусный иммуноглобулин. Он действует решительно, как врач-реаниматолог, — быстро разрушает попавшие в организм матери эритроциты плода, еще до того, как на них начала реагировать ее иммунная система. В процессе родов кровь матери и младенца может смешаться, поэтому женщине в течение короткого времени после родов вводятся иммуноглобулины, предотвращающие развитие конфликта при следующих беременностях.
4. Возможен ли конфликт групп крови? Да, и он тоже может привести к развитию гемолитической желтухи. К счастью, он встречается редко и, как правило, протекает для ребенка без особых последствий. Наиболее опасно рождение у матери с I группой крови ребенка со II или III группой. При возникновении тяжелых проблем ребенку могут назначить переливание крови.
Хочешь сдать экзамен на отлично? Жми сюда — подготовка к ОГЭ по биологии онлайнТромбоциты. Свёртывание крови — Bio-learn.com
Тромбоциты
Тромбоциты (кровяные пластинки) — очень маленькие (диаметром 3–4 мкм), безъядерные (у человека) плоские клетки неправильной формы. Они постоянно образуются в красном костном мозге и живут всего несколько суток. Число их в крови человека колеблется от 200 до 400 тыс. в 1 мм³. Основная функция тромбоцитов — способствовать остановке кровотечения. Они обладают свойством изменять свою форму (распластываться, сжиматься и т. п.), обеспечивая образование кровяного сгустка (тромба).
Свёртывание крови
Свертывание крови — крайне сложный и во многом еще загадочный биохимический процесс, который запускается при повреждении кровеносной системы и ведет к превращению плазмы крови в студенистый сгусток, затыкающий рану и останавливающий кровотечение. Нарушения этой системы крайне опасны и могут привести к кровотечению, тромбозу или другим патологиям, которые совместно отвечают за львиную долю смертности и инвалидности в современном мире. Здесь мы рассмотрим устройство этой системы и расскажем о самых современных достижениях в ее изучении.
Каждый, кто хоть раз в жизни получал царапину или рану, приобретал тем самым замечательную возможность наблюдать превращение крови из жидкости в вязкую нетекучую массу, приводящее к остановке кровотечения. Этот процесс называется свертыванием крови и управляется сложной системой биохимических реакций.
Иметь какую-нибудь систему остановки кровотечения — абсолютно необходимо для любого многоклеточного организма, имеющего жидкую внутреннюю среду. Свертывание крови является жизненно необходимым и для нас: мутации в генах основных белков свертывания, как правило, летальны. Увы, среди множества систем нашего организма, нарушения в работе которых представляют опасность для здоровья, свертывание крови также занимает абсолютное первое место как главная непосредственная причина смерти: люди болеют разными болезнями, но умирают почти всегда от нарушений свертывания крови. Рак, сепсис, травма, атеросклероз, инфаркт, инсульт — для широчайшего круга заболеваний непосредственной причиной смерти является неспособность системы свертывания поддерживать баланс между жидким и твердым состояниями крови в организме.
Если причина известна, почему же с ней нельзя бороться? Разумеется, бороться можно и нужно: ученые постоянно создают новые методы диагностики и терапии нарушений свертывания. Но проблема в том, что система свертывания очень сложна. А наука о регуляции сложных систем учит, что управлять такими системами нужно особым образом. Их реакция на внешнее воздействие нелинейна и непредсказуема, и для того, чтобы добиться нужного результата, нужно знать, куда приложить усилие.
Вплоть до самого последнего времени свертывание крови успешно сопротивлялось попыткам исследователей понять его работу, и лишь в последние годы тут произошел качественный скачок. В данной статье мы расскажем об этой замечательной системе: как она устроена, почему ее так сложно изучать, и — самое главное — поведаем о последних открытиях в понимании того, как она работает.
Нарушения свёртываемости крови
Отсутствие в крови факторов ее свертывания или же нарушение их образования в организме приводит к тяжелым заболеваниям. Одно из них — гемофилия. У больного гемофилией кровь не свёртывается, и человек может погибнуть от кровотечения при самых незначительных повреждениях сосудов. Гемофилией страдают исключительно мужчины (т.к. в организме человека за ее развитие отвечает ген, находящийся в мужской половой хромосоме). Но подверженность же этой болезни в роду передается по женской линии.
5 фактов о крови – подборки от ПостНауки
Кардиолог Ярослав Ашихмин о причинах, симптомах и лечении анемииУ клеток крови был эволюционный предшественник
Кровь человека и других позвоночных состоит из жидкой среды — плазмы и взвешенных в ней клеток: эритроцитов, тромбоцитов и лейкоцитов. Эритроциты переносят кислород, лейкоциты защищают организм от внешних и внутренних патогенных агентов, а тромбоциты закупоривают повреждения на стенках сосудов и участвуют в свертывании крови. Хотя разница между ними колоссальна, в процессе кроветворения (гемопоэза) они создаются из одного предшественника — гемопоэтических стволовых клеток костного мозга. В ходе эволюции клетки крови эволюционировали из амебоцитов — бесцветных клеток в организме беспозвоночных.
Первые организмы на Земле были одноклеточными. Когда появились многоклеточные, возникла потребность в доставке питательных веществ к каждой клетке тела. Одни организмы прокачивали через свое тело жидкость, другие старались быть максимально плоскими. Самый эффективный вариант — жидкая внутренняя среда, которая разносит питательные вещества и уносит отходы жизнедеятельности. Но есть одна проблема: как защититься от вытекания и вторжения инородных тел и организмов при ранениях? В ответ на эти угрозы развились специальные клетки — амебоциты, которые есть у многих беспозвоночных.
Амебоциты плавают в жидкой среде, атакуют, захватывают и переваривают инородные частицы и микробов и занимаются регенерацией поврежденных тканей. Но эти клетки не разносят кислород: у насекомых за доставку кислорода отвечают трахеи, а у многих других организмов пигмент-носитель просто растворен в крови. Позвоночные не могут так жить: у них слишком высокие скорости потока и давление, и защитные клетки не могут сами приплыть к месту повреждения. Иммунная система эволюционировала, и понадобилась более продвинутая система противодействия внешним и внутренним патогенам. Кроме этого, позвоночным нужно много кислорода, и просто растворить носитель кислорода в жидкости не получится: ведь среда будет слишком густой. Поэтому его нужно во что-то упаковать. В результате у позвоночных амебоциты разделились на несколько непохожих друг на друга ветвей и стали клетками крови.
Биофизик Михаил Пантелеев о выращивании клеток крови из стволовых
Эритроциты не клетки
Эритроциты — красные кровяные тельца, переносящие кислород. Упрощая, их часто называют клетками крови, хотя с научной точки зрения это не так. Эритроциты, как и тромбоциты, лишены ядер, поэтому их относят не к клеткам, а к так называемым постклеточным элементам. Они представляют собой двояковогнутые диски и переносят кислород благодаря наличию в них белка гемоглобина: чем его больше, тем больше кислорода может перенести кровь. Увеличение количества эритроцитов отмечается у людей, которые живут в горах, а также у тех, кто страдает особым типом болезни крови, так называемым эритроцитозом, и у тех, кто принимает допинг в виде гормона эритропоэтина, ускоряющего образование эритроцитов.
Кардиолог Ярослав Ашихмин о том, из каких элементов состоит кровь и как разобраться в анализах
Плазменное свертывание крови похоже на приготовление холодца
Наш организм имеет несколько уровней защиты против кровотечений и кровоизлияний. Один уровень — это сосудистый гемостаз. Сокращение мышц в определенных ситуациях способно привести к сужению сосудов (вазоконстрикции) и замедлению или даже прекращению какого-то слабого кровотечения. Следующий слой — тромбоцитарный гемостаз. В нашей крови присутствуют специальные клетки — тромбоциты, которые в случае повреждения слепляются и затыкают место повреждения. Тромбоцитов немного, их примерно в 10 раз меньше, чем эритроцитов, и по размеру (если считать на объем) они на порядок-другой меньше. Поэтому внешне кажется, что тромбоцитов не очень много. Тем не менее они жизненно важны для остановки кровотечений. Третий уровень — система свертывания крови — хитрый каскад реакций в плазме крови, который завершается тем, что специализированный белок фибрин начинает полимеризоваться и создает трехмерную сетку. Такая трехмерная сетка на микроуровне может удержать внутри себя количество воды, которое в тысячу раз превосходит ее по массе. Этот процесс похож на приготовление холодца или удерживание жидкости в детских подгузниках: перестроение небольшого количества молекул делает вещество более вязким.
Свертывание крови — довольно сложный биохимический процесс. В него входит 60–70 белков и 200–300 реакций, среди которых одна обеспечивает желирование крови в месте повреждения, а все остальные регулируют его. До сих пор до конца не ясно, зачем одна и та же функция распределена между разными системами, для чего одновременно нужны тромбоциты и плазменное свертывание.
Биофизик Михаил Пантелеев о свертывании крови
Тромбоциты устроены сложнее, чем эритроциты
Активную роль в свертывании крови играют тромбоциты — безъядерные плоские бесцветные форменные элементы крови. Уменьшение количества тромбоцитов наблюдается при различных тяжелых заболеваниях, в том числе онкологических. Норма тромбоцитов — 180,0–320,0 × 109/л. Падение их ниже 100×109 чревато тяжелыми кровотечениями. Увеличение числа тромбоцитов также является спутником самых разных патологических состояний.
2.6. Тромбоциты. Свертывающая и противосвертывающая системы крови
Третьим видом форменных элементов крови являются тромбоциты, или кровяные пластинки. Это плоские клетки неправильной округлой формы без ядра. Период пребывания их в кровотоке – 5 – 11 дней. Образуются в красном костном мозге, разрушаются в печени, костном мозге, селезенке. Количество тромбоцитов в норме у человека составляет 200 – 400 x 109/л. Увеличение количества тромбоцитов называется тромбоцитозом, уменьшение – тромбоцитопенией. Число их возрастает при пищеварении, тяжелой мышечной работе, беременности.
Функции тромбоцитов:
1. Создают барьер между стенкой сосуда и кровью.
2. Обеспечивают сосудисто-тромбоцитарный гемостаз за счет того, что они способны к агрегации и образованию тромбов.
3. Ангиотрофическая функция (около 15 % тромбоцитов в сутки разрушается, обеспечивая питание сосудов).
4. Накапливают и выделяют такие биологически активные вещества, как серотонин, гистамин, АТФ, факторы свертывания. Серотонин и гистамин регулируют величину просвета и проницаемость мелких кровеносных сосудов.
Тромбоцитарная недостаточность приводит к микроизлияниям или кровоподтекам вследствие увеличения ломкости капилляров. Тромбоциты также обладают способностью фагоцитировать вирусы и иммунные комплексы.
Гемостаз – остановка кровотечения. Это защитная реакция организма при повреждении стенки сосуда, проявляющаяся в спазме кровеносных сосудов и появлении тромба – кровяного сгустка.
В реакции гемостаза у млекопитающих и человека принимают участие окружающая сосуд ткань, стенка сосуда, плазменные факторы свертывания и тромбоциты.
В интактном организме факторы свертывания находятся в неактивном состоянии. При повреждении сосуда вытекающая из него кровь начинает сворачиваться, образуя через 3 – 4 минуты плотный сгусток. Свертывание связано с превращением находящегося в плазме крови растворимого белка фибриногена в нерастворимый фибрин. Процесс свертывания крови протекает с участием веществ, находящихся в плазме крови (плазменные факторы), и клеточных факторов. Плазменные факторы обозначают римскими цифрами от I до XV. Например, фактор I – это фибриноген, фактор II – протромбин, фактор III – тромбопластин, фактор IV – ионы Са2+, факторы VIII и IX – так называемые антигемофильные факторы, фактор XII – контактный фактор, активность которого повышается при повреждении стенки сосуда.
Клеточные факторы. Кроме перечисленных факторов свертывания, есть еще 12 факторов, которые находятся в тромбоцитах и клетках эндотелия. Их обозначают арабскими цифрами. Например, фактор 3 – тромбоцитарный тромбопластин, который высвобождается после разрушения тромбоцитов; фактор 4 – антигепариновый, ускоряющий процесс свертывания крови; фактор 10 – сосудосуживающий (серотонин).
Схема свертывания крови. Повреждение сосуда или клеток крови приводит к активации факторов свертывания, причем активация одного ведет к активации следующего и т.д. и получается каскадная реакция, приводящая к образованию фибриновых нитей и сети тромба.
В зависимости от степени повреждения и вида сосудов различают два основных механизма гемостаза:
1) сосудисто-тромбоцитарный;
2) коагуляционный.
Сосудисто-тромбоцитарный механизм наблюдается в мелких сосудах с низким кровяным давлением. При этом механизме в месте повреждения сосуда происходит активация тромбоцитов, которые выделяют клеточные факторы свертывания и, склеиваясь, образуют рыхлую пробку, которая затем уплотняется, превращаясь в тромб, закрепляющийся в поврежденном сосуде. Выделяющийся из тромбоцитов серотонин способствует спазму сосуда, и таким образом заканчивается кровотечение.
Коагуляционный механизм имеет место в более крупных сосудах, при этом включается II этап – ферментативного свертывания крови. При этом вначале под действием других плазменных факторов происходит активация тромбопластина, который способствует образованию активного тромбина из протромбина, а тромбин, в свою очередь, приводит к образованию фибриногена в фибрин. Далее сеть фибрина уплотняется, и в ней задерживаются тромбоциты, лейкоциты, эритроциты и белки плазмы, образуя сгусток, или фибриновый тромб.
Однако образование фибрина – это еще не конец свертывания крови. Через некоторое время нити фибрина начинают уплотняться, сыворотка удаляется – происходит ретракция сгустка, тромб плотнее закупоривает сосуд и сближает края раны. Одновременно с ретракцией, но с меньшей скоростью, начинается фибринолиз – постепенное ферментативное растворение образовавшегося фибрина под влиянием фибринолизина, который в норме находится в плазме в неактивном состоянии. Под влиянием естественных активаторов плазмы он превращается в фибринолизин, растворяющий фибрин. Активаторы фибринолизина возникают в плазме особенно активно после усиленной мышечной работы, эмоций, а также после смерти организма, в результате чего кровь остается жидкой в течение нескольких часов.
Гемофилия – наследственное заболевание, проявляющееся частыми и длительными кровотечениями, возникающими в результате пониженной способности крови к свертыванию. Оно встречается исключительно у мужчин, хотя передают его женщины. Данное заболевание обусловлено недостатком плазменных факторов
VIII либо IX, которые поэтому и называют антигемофильными.
Противосвертывающая система крови. Кровь в организме находится в жидком состоянии, хотя в ней есть все компоненты для свертывания. Это объясняется наличием специальных противосвертывающих механизмов.
Противосвертывающие вещества, или антикоагулянты, – это вещества, которые растворяют тромбы или препятствуют свертыванию крови. Они подразделяются на:
I. Антикоагулянты естественного происхождения:
1) антитромбопластин;
2) гепарин, содержащийся в базофилах и тучных клетках (печень, мышцы, легкие), который замедляет превращение протромбина в тромбин, образование тромбопластина и фибрина;
3) антитромбины, находящиеся в крови и разрушающие тромбин.
II. Искусственные антикоагулянты:
1) прямого действия, которые непосредственно нарушают
свертывание крови (чаще всего за счет связывания Cа2+): лимонная кислота, щавелевая кислота;
2) непрямого действия, блокирующие синтез факторов свертывания в печени.
