Разница между гемоглобином и миоглобином
Основное отличие — гемоглобин против миоглобина
Гемоглобин и миоглобин являются двумя типами глобиновых белков, которые служат в качестве связывающих кислород белков. Оба белка способны увеличивать количество растворенного кислорода в биологических жидкостях позвоночных, а также у некоторых беспозвоночных. Органические простетические группы со сходными характеристиками участвуют в связывании кислорода в обоих белках. Но трехмерная ориентация в пространстве или стереоизомерия гемоглобина и миоглобина различны. Из-за этой разницы количество кислорода, которое может связываться с каждой из молекул белка, также различно. Гемоглобин способен плотно связываться с кислородом в то время как миоглобин неспособен к прочному связыванию с кислородом. Это различие между гемоглобином и миоглобином приводит к их различным функциям; гемоглобин находится в кровотоке, транспортируя кислород от легких к остальной части тела в то время как миоглобин находится в мышцах, выделяя необходимый кислород.
Ключевые области покрыты
1. Что такое гемоглобин
— определение, структура и состав, функция
2. Что такое миоглобин
— определение, структура и состав, функция
3. Сходство между гемоглобином и миоглобином
— очертить сходство
4. В чем разница между гемоглобином и миоглобином
— Сравнение основных различий
Ключевые термины: гемоглобин, миоглобин, кислород, гем, белки, глобиновый белок, кровь
Что такое гемоглобин
Гемоглобин — это многочастичный глобулярный белок с четвертичной структурой. Он состоит из двух α и двух β субъединиц, расположенных в тетраэдрической структуре. Гемоглобин является железосодержащим металлопротеином. Каждая из четырех глобулярных белковых субъединиц связана с небелковой протезной гемовой группой, которая связывается с одной молекулой кислорода. Производство гемоглобина происходит в костном мозге. Глобиновые белки синтезируются рибозомами в цитозоле. Гемовая часть синтезируется в митохондриях. Заряженный атом железа удерживается в порфириновом кольце путем ковалентного связывания железа с четырьмя атомами азота в одной плоскости. Эти атомы N принадлежат имидазольному кольцу остатка гистидина F8 каждой из четырех субъединиц глобина. В гемоглобине железо существует как Fe2+, придавая красный цвет эритроцитам.
У людей есть три типа гемоглобина: гемоглобин А, гемоглобин А2
и гемоглобин Ф. Гемоглобин А это распространенный тип гемоглобина, который кодируется HBA1, HBA2, а также ГБД Гены. Четыре субъединицы гемоглобина А состоят из двух α и двух субъединиц β (α2β2). Гемоглобин А2 и гемоглобин F редки и состоят из двух α и двух субъединиц δ и двух α и двух субъединиц γ соответственно. У младенцев тип гемоглобина Hb F (α2γ2).Поскольку молекула гемоглобина состоит из четырех субъединиц, она может связываться с четырьмя молекулами кислорода. Таким образом, гемоглобин обнаружен в эритроцитах, как переносчик кислорода в крови. Из-за присутствия в структуре четырех субъединиц связывание кислорода увеличивается, когда первая молекула кислорода связывается с первой гем-группой. Этот процесс определяется как кооперативное связывание кислорода. Гемоглобин составляет 96% сухого веса эритроцитов. Некоторая часть углекислого газа также связана с гемоглобином для транспортировки из тканей в легкие. 80% углекислого газа транспортируется через плазму. Структура гемоглобина показана на
Рисунок 1: Структура гемоглобина
Функция гемоглобина
Что такое миоглобин
Миоглобин является кислородсвязывающим белком в мышечных клетках позвоночных, придающим мышцам отчетливый красный или темно-серый цвет. Это исключительно выражено в скелетных мышцах и сердечных мышцах. Миоглобин составляет 5-10% цитоплазматических белков в мышечных клетках. Поскольку аминокислотные изменения в полинуклеотидных цепях гемоглобина и миоглобина являются консервативными, как гемоглобин, так и миоглобин имеют сходную структуру. Кроме того, миоглобин представляет собой мономер, состоящий из одной полинуклеотидной цепи, состоящей из одной гем-группы. Следовательно, он способен связываться с одной молекулой кислорода. Таким образом, в миоглобине не происходит кооперативного связывания кислорода. Но аффинность связывания миоглобина является высокой по сравнению с таковой гемоглобина. В результате миоглобин служит белком, запасающим кислород в мышцах. Миоглобин выделяет кислород, когда мышцы функционируют. 3-D структура гемоглобина показана на фигура 2.
Рисунок 2: Миоглобин
Сходства между гемоглобином и миоглобином
- И гемоглобин, и миоглобин являются связывающими кислород глобулярными белками.
- Оба они содержат кислородсвязывающий гем в качестве протезной группы.
- И гемоглобин, и миоглобин дают красный цвет крови и мышцам соответственно.
Разница между гемоглобином и миоглобином
Определение
Гемоглобин: Гемоглобин — это красный белок, который отвечает за транспортировку кислорода в крови позвоночных.
Миоглобин: Миоглобин — это красный белок с гемом, который переносит и запасает кислород в мышечных клетках.
Молекулярный вес
Гемоглобин: Молекулярная масса гемоглобина составляет 64 кДа.
Миоглобин: Молекулярн
Миоглобин, строение — Справочник химика 21
При расшифровке третичной структуры белков решающую роль сыграл рентгенографический метод, который в 1957 г. позволил английскому исследователю Кендрью впервые определить третичную структуру миоглобина. В дальнейшем рентгеноструктурный анализ позволил установить пространственное строение многих других белков и связать его с их биологической функцией. Так, молекула лизоцима — фермента, расщепляющего полисахариды — имеет трехмерную структуру, показанную на рис. 67. Стрелкой показана впадина, представляющая собой активный центр фермента сюда подходит молекула полисахарида, подвергающегося расщеплению. [c.642]
СТРОЕНИЕ И СВОЙСТВА МИОГЛОБИНА И ГЕМОГЛОБИНА [c.421]
Однако существенно удалось продвинуться в изучении структуры миоглобина и гемоглобина, химическое строение которых сравнительно мало изучено. [c.546]
Молекулярное строение белков удалось выяснить только недавно. Первый рентгеноструктурный анализ белка, миоглобина, был завершен в 1959 г., а структура первого фермента, лизоцима, была установлена в 1964 г. Исследования крупных ферментов, переносчиков электронов и антител, быстро прогрессируют. В настоящее время известна подробная картина молекулярного строения более 90 белков. В этой области биохимия незаметно переходит в родственную науку, молекулярную биологию. [c.318]
Расшифрованы первичные структуры миоглобина человека (153 аминокислотных остатка), а-цепи (141) и 3-цепи (146) гемоглобина человека, цитохрома С из сердечной мышцы человека (104), лизоцима молока человека (130), химотрипсиногена быка (245) и многих других белков, в том числе ферментов и токсинов. На рис. 1.14 представлена последовательность аминокислотных остатков проинсулина. Видно, что молекула инсулина (выделена темными кружками), состоящая из двух цепей (А-21 и В-30 аминокислотных остатков), образуется из своего предшественника-проинсулина (84 аминокислотных остатка), представленного одной полипептидной цепью, после отщепления от него пептида, состоящего из 33 аминокислотных остатков. Строение молекулы инсулина (51 аминокислотный остаток) схематически можно представить следующим образом
В результате Джон Кендрью очень скоро понял, что едва ли я помогу ему выяснить строение миоглобина. Ему не удавалось вырастить большие кристаллы миоглобина лошади, и он рассчитывал сначала, что у меня рука окажется счастливой. Но не требовалось особой проницательности, чтобы заметить, насколько неискусны мои лабораторные манипуляции. Недели через две после моего приезда в Кембридж мы отправились на местную бойню, чтобы получить сердце лошади для изготовления нового препарата миоглобина. Если бы нам повезло, то немедленное замораживание сердца бывшего скакуна воспрепятствовало бы повреждению молекул миоглобина, которое мешало кристаллизации. Однако и мои попытки кристаллизации оказались не более успешными, чем попытки Джона. Я даже почувствовал определенное облегчение если бы я добился успеха, Джон мог бы засадить меня за съемку рентгенограмм. [c.36]
Приближались рождественские каникулы, а особой надежды на то, что кому-нибудь по эту сторону Атлантики удастся раскрыть строение ДНК, не было. Хотя Фрэнсис и вернулся к белкам, ему вовсе не хотелось делать одолжение Брэггу, работая над своей диссертацией. Вместо этого, после нескольких дней относительного молчания, он начал разглагольствовать о сверхспиральном расположении самой а-спирали. Для разговоров о ДНК оставалось только обеденное время. К счастью, Джон Кендрью, почувствовав, что вето, наложенное на работу с ДНК, не распространяется на размышления о ней, не пытался возродить мой интерес к миоглобину. И я тратил холодные, темные декабрьские дни на изучение теоретической химии или же листал журналы в надежде найти какой-нибудь забытый ключ к проблеме ДНК. А старательнее всего я штудировал принадлежащий Френсису экземпляр Природы химической связи . Все чаще Фрэнсис, когда ему надо было посмотреть длину какой-нибудь связи, обнаруживал эту книгу на той четверти лабораторного стола, которую Джон отвел для моих экспериментов. Я надеялся, что где-то на страницах шедевра Полинга удастся найти разгадку тайны. Вот почему, когда Фрэнсис подарил мне другой экземпляр книги, я усмотрел в этом доброе предзнаменование. На титульном листе он написал Джиму от Фрэнсиса. Рождество, 1951 . И христианские обычаи бывают полезными.
С другой стороны, считалось, что молекулярный вес ВТМ составляет около 40 миллионов, и поначалу казалось, что понять устройство ВТМ будет неизмеримо труднее, чем строение гораздо меньших молекул миоглобина и гемоглобина, над которыми Джон Кендрью и Макс Перутц бились много лет, так и не получив никаких интересных для биолога результатов. [c.67]
Если гемоглобин и миоглобин —это единоличные представители, участвующие в процессе Оз-поглощения, то цитохромы и хлорофиллы представлены несколькими десятками соединений каждой группы. Цитохромы варьируются в незначительной степени от строения порфиринового цикла и в большей степени — от полипептидного окружения от их количества, строения и способа связывания с гемом — ковалентное или нековалентное). Хлорофиллы различаются между собой степенью гидрирования порфиринового цикла и набором заместителей при ном [c.265]
Гемоглобин по своему строению гомологичен миоглобину и практически представляет собой тетрамер миоглобина — оба белка действуют взаимосвязанно в биологических системах. Такая кооперация в действии, помимо проч
ответы на экзамен по бх / Билет 92
К группе гемопротеидов относятся гемоглобин и его производные, миоглобин и ферменты – цитохромная система, каталаза и пероксидаза.
Все хромопротеиды содержат различные по составу и структуре белки. Небелковый компонент обладает структурным сходством.
Строение гемоглобина.
В молекуле гемоглобина белковый компонент представлен белком глобином, небелковый компонент – гем.
Глобин состоит из 4
субъединиц 2 и 2
и 2 .
Каждая
.
Каждая  -цепь
содержит по 141 аминокислотному остатку,
а
-цепь
содержит по 141 аминокислотному остатку,
а 
Внутри каждой субъединицы имеется гидрофобный «карман», в котором располагается гем.
Гем представляет собой плоскую молекулу, содержащую 4 пиррольных цикла и соединенный с ними атом железа:
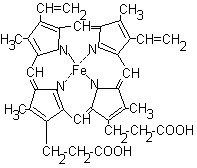
Гем соединяется с белковой частью (глобином) гидрофобными связями между пиррольными циклами и гидрофобными радикалами аминокислот. Между атомом железа и имидазольным кольцом одного из остатков гистидина в глобине имеется координационная связь. За счет еще одной координационной связи к атому железа может присоединяться молекула кислорода с образованием оксигемоглобина.
Пиррольные кольца
гема расположены в одной плоскости, а
атом железа выступает из этой плоскости.
Присоединение кислорода «выпрямляет»
молекулу гема: железо перемещается в
плоскость пиррольных колец и это вызывает
изменение конформации белка. В молекуле
гемоглобина имеется 4 протомера, каждый
из которых содержит гем и может
присоединять кислород. Присоединение
первой молекулы кислорода изменяет
конформацию протомера. Изменение
конформации одного протомера изменяет
конформацию остальных протомеров.
Изменение конформации протомеров
облегчает присоединение остальных
молекул кислорода. Это явление называется
кооперативным действием. Сродство
гемоглобина к четвертой молекуле О
Функция гемоглобина.
Состоит в связывании и переносе кислорода от легких к тканям. Гемоглобин, связанный кислородом, называется оксигемоглобином.
Производные гемоглобина.
Молекула гемоглобина имеет большое сродство к оксиду углерода (II) СО. Это карбоксигемоглобин. Сродство СО к гемоглобину примерно в 300 раз выше, чем к кислороду. Это свидетельствует о высокой токсичности угарного газа, поэтому при отравлении СО необходимо, пострадавшего вынести на воздух, чтобы увеличить поступление кислорода.
Гемоглобин связывает также СО2 с образованием карбгемоглобина.
Типы гемоглобинов.
Различают физиологические и аномальные гемоглобины.
Физиологические гемоглобины образуются на разных этапах нормального развития организма, а аномальные – вседствие нарушений последовательности аминокислот в глобине.
Физиологические типы гемоглобина.
Примитивный – HbP (относятся гемоглобины, называемые Говер 1 и Говер 2)
Фетальный гемоглобин HbF (гемоглобин плода).
Гемоглобин взрослых: HbА1, HbА2, HbА3.
HbР появляется на ранних стадиях развития эмбриона. Примитивные гемоглобины заменяются на HbF. На поздних стадиях развития плода появляются гемоглобины взрослых – HbА1, HbА2.
В крови взрослого человека примерно 95-96% HbА1, 2-3% HbА3, 0,1-0,2% HbF.
Гемоглобин А1 содержит по 2 и
и  цепи. Гемоглобин А2 – по 2
цепи. Гемоглобин А2 – по 2  и
и  -цепи.
Гемоглобин F – по 2
-цепи.
Гемоглобин F – по 2  и
и  -цепи.
Гемоглобин Говер 1 содержит 4
-цепи.
Гемоглобин Говер 1 содержит 4 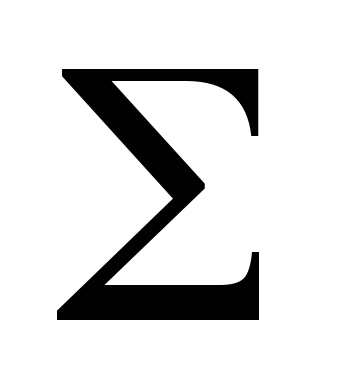 цепи, Говер 2 – 2
цепи, Говер 2 – 2 и 2
и 2 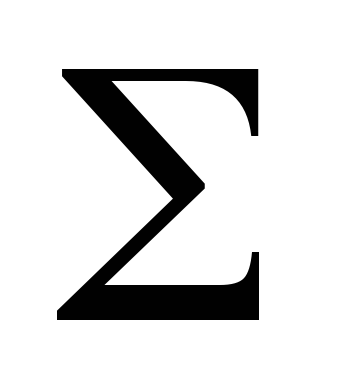 цепи
по мере созревания плода
цепи
по мере созревания плода  -цепи
заменяются
-цепи
заменяются 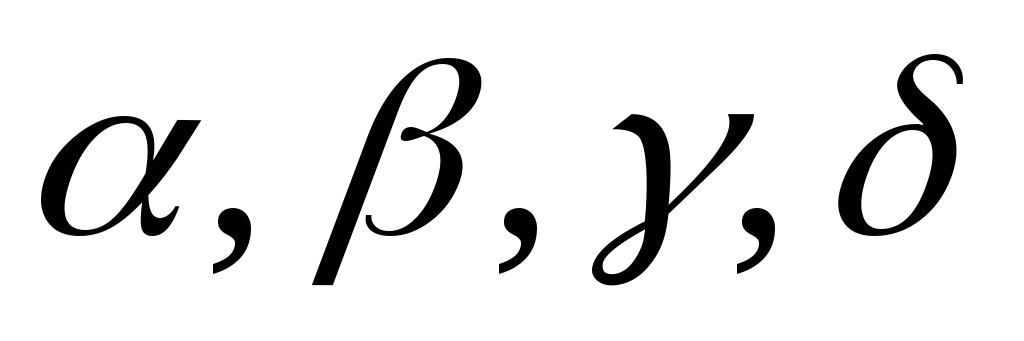 -цепями.
-цепями.
Аномальные типы гемоглобина
В крови человека открыто около 150 типов мутантных гемоглобинов. Аномальные гемоглобины различаются по форме, химическому составу, величине заряда. Выделены аномальные гемоглобины при помощи методов электрофореза и хроматографии. Передающиеся по наследству изменения – результат мутации единственного триплета, который приводит к замене одной аминокислоты на другую (с резко отличающимися свойствами – пример серповидноклеточная анемия – глу заменен на вал).
Патология обмена гемоглобина.
Болезни гемоглобинов (их около 200) называют гемоглобинозами.
Гемоглобинозы делят на:
Гемоглобинопатии – в основе лежат наследственные изменения структуры какой-либо цепи нормального гемоглобина («молекулярные болезни»).
Талассемии – нарушение синтеза какой-либо цепи гемоглобина.
Железодефицитные анемии.
Классическим примером
наследственной гемоглобинпатии является
серповидноклеточная анемия. Глу в 6-м
положении в  -цепи
заменен на вал. Эритроциты в условиях
низкого парциального давления кислорода
принимают форму серпа. Такой гемоглобин
после отдачи кислорода превращается в
плохо растворимую форму и начинает
выпадать в осадок в виде веретенообразных
кристаллоидов, которые деформируют
клетку и вызывают массивный гемолиз.
-цепи
заменен на вал. Эритроциты в условиях
низкого парциального давления кислорода
принимают форму серпа. Такой гемоглобин
после отдачи кислорода превращается в
плохо растворимую форму и начинает
выпадать в осадок в виде веретенообразных
кристаллоидов, которые деформируют
клетку и вызывают массивный гемолиз.
Талассемии – генетически
обусловленной нарушение синтеза одной
из нормальных цепей гемоглобина.
Угнетение синтеза  -цепей
вызывает развитие
-цепей
вызывает развитие  -талассемии,
угнетение синтеза
-талассемии,
угнетение синтеза  -цепей
—
-цепей
—  -талассемия.
При
-талассемия.
При  -талассемии
появляется до 15% HbA2,
повышается до 15-60% содержание фетального
гемоглобина. Болезнь характеризуется
гиперплазией и разрушением костного
мозга, поражением печени, деформацией
черепа и тяжелой гемолитической анемией.
Эритроциты имеют мишеневидную форму.
Механизм изменения формы эритроцитов
не выяснен. Название связано с тем, что
возникает у людей, живущих на побережье
Средиземного моря.
-талассемии
появляется до 15% HbA2,
повышается до 15-60% содержание фетального
гемоглобина. Болезнь характеризуется
гиперплазией и разрушением костного
мозга, поражением печени, деформацией
черепа и тяжелой гемолитической анемией.
Эритроциты имеют мишеневидную форму.
Механизм изменения формы эритроцитов
не выяснен. Название связано с тем, что
возникает у людей, живущих на побережье
Средиземного моря.
Порфирии.
Порфирии – группа заболеваний с наследственной предрасположенностью, возникающих в результате блокирования начальных стадий синтеза гема и сопровождающихся увеличением содержащихся порфиринов в организме.
Г лицин Сукцинил-КоА
лицин Сукцинил-КоА
 -аминолевуленовая
кислота
-аминолевуленовая
кислота

порфобилиноген

уропорфириноген

копропорфириноген

протопорфирин IX

 феррохелатаза
феррохелатаза
Гем
Блок – 1 – острая
перемеживающая порфирия. Накапливается  -АМК
и порфобилиноген
-АМК
и порфобилиноген
Блок – 2 – приводит к накоплению всех предшествующих продуктов. Молекулярный механизм неизвестен.
Болк – 3 – эритропоэтическая протопорфирия связана с отсутствием фермента феррохелатазы, каторая присоединяет к молекуле протопорфирина IX Fe2+.
Распад гема
За сутки в организме распадается около 9 г гемопротеидов. Период жизни эритроцитов 120 дней, разрушаются они в кровеносном русле или в селезенке. Гемоглобин связывается с гаптоглобином и в виде комплекса гаптоглобин-гемоглобин поступает в клетки ретикулоэндотелиальной системы селезенки. Комплекс гаптоглобин-гемоглобин распадается и гаптоглобин переходит в кровь, а гемоглобин окисляется в метгемоглобин (Fe3+).
В РЭС селезенки гемоглобин под действием гемоксигеназы превращается в вердоглобин. Вердоглобин теряет Fe, которое связывается трансферином и доставляется кровью в костный мозг. Вердоглобин отдает белок глобин и превращается в биливердин. При восстановлении биливердина НАДФ Н2 образуется билирубин.
Билирубин – плохо растворимое соединение и в крови связывается с альбумином. В виде комплекса альбумин-билирубин идет транспорт билирубина кровью в клетки печени. В печени билирубин соединяется с глюкуроновой кислотой с образованием моно (20%) и диклюкуронидов (80%), они хорошо растворимы в воде. Этот вид билирубина называется конъюгированным билирубином (связан с глюкуроновой кислотой), а также называется связанным прямым, т.к. может быть прямо обнаружен с помощью реактива Эрлиха.
Билирубинглюкурониды в незначительных количествах диффундируют в кровеносный капилляр. В плазме крови присутствуют 2 формы билирубина: неконъюгированный (непрямой, свободный) и конъюгированный (прямой, связанный) – 25% от общего билирубина. Билирубинглюкурониды с желчью поступают в кишечник, где от них отщепляется глюкуроновая кислота и вновь образуется неконъюгированный билирубин. В тонком кишечнике небольшая часть билирубина может всосаться и через портальную вену вновь поступать в печень. Остальной билирубин подвергается действию кишечных бактерий и в тонком кишечнике билирубин превращается в уробилиноген. Уробилиноген всасывается в тонком кишечнике и через воротную вену поступает в печень, где уробилиноген разрушается до моно- дипирролов.
Не разрушенный уробилиноген вновь с желчью поступает в кишечник и восстанавливается до стеркобилиногена (бесцветен). Стеркобилиноген окисляется до стеркобилина и выделяется с фекалиями. Небольшое количество стеркобилиногена поступает в почки, затем окисляется до стеркобилина и выделяется с мочой.
В норме содержание общего билирубина в сыворотке крови составляется 8-20 мкмоль/л.
4
4.Гемоглобин, строение, свойства, биологическая роль
Гемоглобин взрослого организма является тетрамером, состоящим из двух α- и двух β-субьединиц с молекулярными массами примерно 16 кДа. α- и β-цепи отличаются аминокислотной последовательностью, но имеют сходную конформацию. Каждая субъединица несет группу гема с ионом двухвалентного железа в центре. Содержание Hb в крови составляет 140-180 г/л у мужчин и 120-160 г/л у женщин, т. е. вдвое выше по сравнению с белками плазмы (50-80 г/л). Поэтому Hb вносит наибольший вклад в образование рН-буферной емкости крови.
Гемоглобин в качестве белкового компонента содержит глобин, а небелкового – гем. Видовые различия гемоглобина обусловлены глобином, в то время как гем одинаков у всех видов гемоглобина. Основу структуры простетической группы большинства гемосодержащих белков составляет порфириновое кольцо, являющееся в свою очередь производным тетрапиррольного соединения – порфирина.
Атом железа расположен в центре гема-пигмента, придающего крови характерный красный цвет. Каждая из 4 молекул гема «обернута» одной полипептидной цепью. В молекуле гемоглобина взрослого человека HbА содержатся четыре полипептидные цепи, которые вместе составляют белковую часть молекулы – глобин. Две из них, называемые α-цепями, имеют одинаковую первичную структуру и по 141 аминокислотному остатку. Две другие, обозначаемые β-цепями, также идентично построены и содержат по 146 аминокислотных остатков. Таким образом, вся молекула белковой части гемоглобина состоит из 574 аминокислот. Во многих положениях α- и β-цепи содержат разные аминокислотные последовательности, хотя и имеют почти одинаковые пространственные структуры. Получены доказательства, что в структуре гемоглобинов более 20 видов животных 9 аминокислот в последовательности оказались одинаковыми, консервативными (инвариантными), определяющими функции гемоглобинов; некоторые из них находятся вблизи гема, в составе участка связывания с кислородом, другие – в составе неполярной внутренней структуры глобулы.
Hb= α2β2
2α цепи и 2β цепи-96%
4 гема-4%
3.Особенности строения, развития и метаболизма эритроцита.
Эритроциты — высокоспециализированные клетки, которые переносят кислород от лёгких к тканям и диоксид углерода, образующийся при метаболизме, из тканей к альвеолам лёгких. Транспорт О2 и СО2 в этих клетках осуществляет гемоглобин, составляющий 95% их сухого остатка.
Дифференцировка эритроцитов-эритроцит готовится стать собой 2 недели.
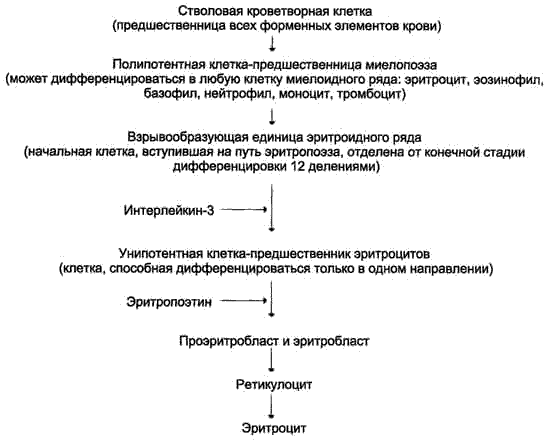
Интерлейкин-3 синтезируется Т-лимфоцитами, а также клетками костного мозга. Это низкомолекулярный белок группы цитокинов — регуляторов роста и дифференцировки клеток.
Дальнейшую пролиферацию и дифференцировку унипотентной клетки эритроидного ряда регулирует синтезирующийся в почках гормон эритропоэтин.
В процессе дифференцировки на стадии эритробласта происходят интенсивный синтез гемоглобина, конденсация хроматина, уменьшение размера ядра и его удаление. Образующийся ретикулоцит ещё содержит глобиновую мРНК и активно синтезирует гемоглобин. Циркулирующие в крови ретикулоциты лишаются рибосом, ЭР, митохондрий и в течение двух суток превращаются в эритроциты.
Строение.Строение спектрина (А), околомембранного белкового комплекса (Б) и цитоскелета эритроцитов (В). Каждый димер спектрина состоит из двух антипараллельных, нековалентносвязанных между собой α- и β-полипептидных цепей (А). Белок полосы 4.1 образует со спетрином и актином «узловой комплекс», который посредством белка полосы 4.1 связывается с цитоплазматическим доменом гликофорина. Анкирин соединяет спектрин с основным интегральным белком плазматической мембраны — белком полосы 3 (Б). На цитоплазматической поверхности мембраны эритроцита имеется гибкая сетеобразная структура, состоящая из белков и обеспечивающая пластичность эритроцита при прохождении им через мелкие капилляры (В).
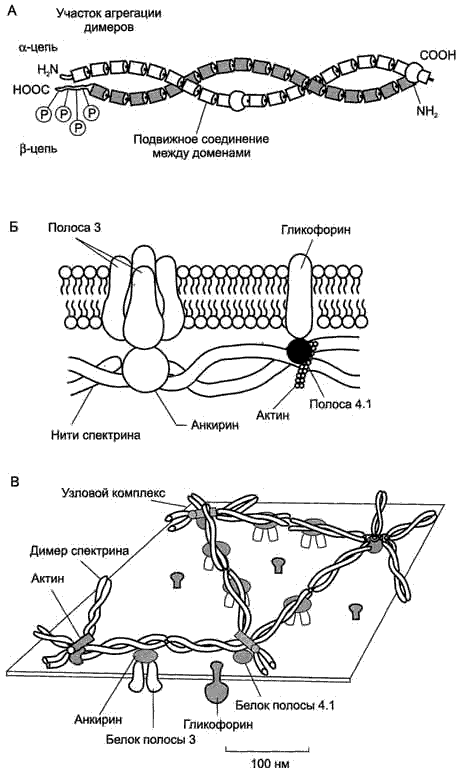
Важненько:Интегральный гликопротеин гликофорин присутствует только в плазматической мембране эритроцитов. К N-концевой части белка, расположенной на наружной поверхности мембраны, присоединено около 20 олигосахаридных цепей. Олигосахариды гликофорина — антигенные детерминанты системы групп крови АВО.
Спектрин — периферический мембранный белок, нековалентно связанный с цитоплазматической поверхностью липидного бислоя мембраны,является основным белком цитоскелета эритроцитов. Спектрин состоит из α- и β-полипептидных цепей, имеющих доменное строение; α- и β-цепи димера расположены антипараллельно, перекручены друг с другом и нековалентно взаимодействуют во многих точках. Спектрин может прикрепляться к мембране и с помощью белка анкирина. Этот крупный белок соединяется с β-цепью спектрина и цитоплазматическим доменом интегрального белка мембраны — белка полосы 3(белок-переносчик ионов С1- и НСО3- через плазматическую мембрану эритроцитов по механизму пассивного антипорта). Анкирин не только фиксирует спектрин на мембране, но и уменьшает скорость диффузии белка полосы 3 в липидном слое.
Метаболизм
Метаболизм глюкозы
Эритроциты лишены митохондрий, поэтому в качестве энергетического материала они могут использовать только глюкозу. Глюкоза поступает в эритроциты путём облегчённой диффузии с помощью ГЛЮТ-2. Около 90% поступающей глюкозы используется в анаэробном гликолизе, а остальные 10% — в пентозофосфатном пути.
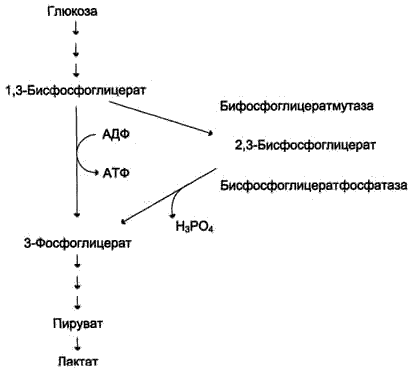
Важная особенность анаэробного гликолиза в эритроцитах по сравнению с другими клетками — присутствие в них фермента бисфосфоглицератмутазы. Бисфосфоглицератмутаза катализирует образование 2,3-бисфосфоглицерата(служит важным аллостерическим регулятором связывания кислорода гемоглобином) из 1,3-бисфосфоглицерата..
Глюкоза в эритроцитах используется и в пентозофосфатном пути, окислительный этап которого обеспечивает образование кофермента NADPH, необходимого для восстановления глутатиона .
Обезвреживание кислорода
Большое содержание кислорода в эритроцитах определяет высокую скорость образования супероксидного анион-радикала (О2-), пероксида водорода (Н2О2) и гидроксил радикала (ОН.). Эритроциты содержат ферментативную систему, предотвращающую токсическое действие активных форм кислорода и разрушение мембран эритроцитов. Постоянный источник активных форм кислорода в эритроцитах — неферментативное окисление гемоглобина в метгемоглобин:
Метгемоглобинредуктазная сисгема состоит из цитохрома B5 и флавопротеина цитохром B5 редуктазы, донором водорода для которой служит NADH, образующийся в глицеральдегиддегидрогеназной реакции гликолиза
Цитохром B5 восстанавливает Fe3+ метгемог-лобина в Fe2+:
Hb-Fe3+ + цит. b5 восст. → HbFe2+ + цит. b5 ок. .
Окисленный цитохром B5 далее восстанавливается цитохром B5 редуктазой:
Цит. B5 ок + NADH → цит. B5 восст. + NAD+.
Супероксидный анион с помощью фермента супероксидцисмутазы превращается в пероксид водорода:
O2- + O2- + Н+ → h3О2 + O2 .
Пероксид водорода разрушается каталазой и содержащим селен ферментом глутатионпероксидазой. Донором водорода в этой реакции служит глутатион — трипептид глутамилцистеинилглицин (GSH) (см. раздел 12).
2Н2О → 2Н2О + О2; 2GSH + 2Н2О2 → GSSG + 2Н2О .
Окисленный глутатион (GSSG) восстанавливается NADPH-зависимой глутатионредуктазой. Восстановление NADP для этой реакции обеспечивают окислительные реакции пентозофосфатного пути (см. раздел 7).
Структурно-функциональные особенности строения миоглобина и гемоглобина
Они относятся к классу гемсодержащих белков, т.е содержащих простетическую группу – гем.
Миоглобин является мономерным белком. Молекула миоглобина имеет третичную структуру и представляет собой одну полипептидную цепь, соединённую с гемом. А гемоглобин относится к олигомерным, т.е состоящим из нескольких мономеров. Гемоглобин имеет четвертичную структуру и состоит из 4-х субъединиц: двух альфа- и двух бэта-цепей.
Смена типов гемоглобина в онтогенезе
HbP примитивный гемоглобин– синтезируется в эмбриональном желточном мешке через несколько недель после оплодотворения. Состоит из двух α- и двух ε-цепей
Через две недели после формирования печени плода в ней начинает синтезироваться HbF, который к шести месяцам полностью замещает НbР.
HbF – фетальный гемоглобин ( у новорожденных) – синтезируется в печени и костном мозге плода до периода его рождения. Состоит из двух α- и двух γ-цепей (2α, 2γ)
HbA, HbA2, HbA3 – гемоглобин взрослых. HbA состоит из двух α- и двух β-цепей.
Ингибирование ферментов: обратимое и необратимое
К ингибиторам следует относить вещества, вызывающие снижение активности фермента.
Ингибиторы способны взаимодействовать с ферментами с разной степенью прочности. На основании этого различают обратимое и необратимое ингибирование. Обратимые ингибиторы связываются с ферментом слабыми нековалентными связями и при определённых условиях легко отделяются от фермента.
Необратимое ингибирование наблюдают в случае образования ковалентных стабильных связей между молекулой ингибитора и фермента. Чаще всего модификации подвергается активный центр фермента, В результате фермент не может выполнять каталитическую функцию. К необратимым ингибиторам относят ионы тяжёлых металлов, например ртути (Hg2+), серебра (Ag+) и мышьяка (As3+), которые в малых концентрациях блокируют сульфгидрильные группы активного центра. Субстрат при этом не может подвергаться химическому превращению.
4.Коферментная функция витаминов. Характеристика и биохимические функции витамина В1.
Витамины входят в состав коферментов – молекул, играющих роль активного центра или простетической группы молекулы фермента .Кофермент имеет 2 функциональных участка, один из которых отвечает за связь с апоферментом, а другой принимает непосредственное участие в каталитическом акте. Как правило, активная форма витаминов принимает участие именно в катализе.
Витамин B1 участвует в окислительном декарбоксилированиипирувата. Входит в состав коферменат ТПФ (тиаминдифосфата). Суточная норма 1.2-2.2 мг. Недостаток витамина приводит к нарушениям периферической нервной системы (полиневриты, энцефалопатия), сердечно-сосудистой, заболеванию бери-бери. Источником служат дрожжи, пшеница, хлеб из муки грубого помола, соя.ю фасоль, горох, морковь, печень.
Билет 7
1. Кооперативныеизмененияконформациипротомеров.
Изменение конформации (а следовательно и функциональных свойств) всех протомеров олигомерного белка при присоединении лиганда только к одному из них носит название кооперативных изменений конформациипротомеров.
2.
Способность к регуляции делает ферменты важными участниками и своеобразными организаторами клеточных процессов в организме человека. Регуляция скорости ферментативных реакций в клетке — основной механизм не только контроля и координации метаболических путей, но и роста и развития клетки, а также ее ответа на изменение окружающей среды.
Существует два основных способа контроля скорости ферментативных реакций:
— Контроль количества фермента.
Количество фермента в клетке определяется соотношением скоростей его синтеза и распада. Этот способ регуляция скорости ферментативной реакции является более медленным процессом (проявляется спустя несколько часов), чем регуляция активности фермента (практически мгновенный ответ).
— Контроль активности фермента.
Активность фермента может регулироваться путем взаимодействия с определенными веществами, изменяющими конформацию активного центра.
Широко распространенный способ химической модификации ферментов фосфорилирование/дефосфорилирование белков осуществляют ферменты протеинкиназы (класс трансферазы). Они катализируют образование сложноэфирной связи между фосфатной группой и ОН-группой аминокислотных остатков серина, треонина и тирозина. Донором фосфатной группы является АТФ.
В результате фосфорилирования происходит изменение заряда, конформации фермента, конформации активного центра фермента. повышается сродство фермента к субстрату и возрастает скорость ферментативной реакции.
Например – триацилглицерол-липаза (ТАГ-липаза) – внутриклеточный фермент жировой ткани. В дефосфорилированной форме фермент неактивен. Под действием специфической протеинкиназы А фермент фосфорилируется и переходит в активную форму.
2. Коферменты. Витамин В2.
Способы поступления витаминов в организм
Экзогенный. В этом случае витамины поступают в наш организм извне – с пищей.
Эндогенный, или внутренний. Витамины поступают в результате синтеза бактерий в кишечнике.
Причины недостаточного поступления витаминов из продуктов питания
— Неудовлетворительное качество продуктов. Ведь среда обитания и экология изменились, и в результате сельскохозяйственные культуры не получают в полном объеме всех необходимых питательных элементов. Загрязняющие же вещества еще больше истощают и без того скромные запасы. Рацион питания человека становится все более скуден. В итоге не всегда получается составить свою меню так, чтобы полностью обеспечить организм необходимыми ему веществами.
— Витамины пропадают при термической обработке продуктов.
Содержится: мясо, почки, молоко, дрожжи
Билет 8
1. Нативность белка. Денатурация, ее механизмы.
НАТИВНОСТЬ — это уникальный комплекс физических, физико-химических, химических и биологических свойств белковой молекулы, который принадлежит ей, когда молекула белка находится в естественном, природном (нативном) состоянии.
ДЕНАТУРАЦИЯ — это лишение белка его природных, нативных свойств, сопровождающееся разрушением четвертичной (если она была), третичной, а иногда и вторичной структуры белковой молекулы
Факторы, вызывающие денатурацию белков
Факторы, которые вызывают денатурацию белков, можно разделить на физические и химические.
Физические факторы
1. Высокие температуры. Для разных белков характерна различная чувствительность к тепловому воздействию. Часть белков подвергается денатурации уже при 40-500С. Такие белки называют термолабильными. Другие белки денатурируют при гораздо более высоких температурах, они являются термостабильными.
2. Ультрафиолетовое облучение
3. Рентгеновское и радиоактивное облучение
4. Ультразвук
5. Механическое воздействие (например, вибрация).
Химические факторы
1. Концентрированные кислоты и щелочи. Например, трихлоруксусная кислота (органическая), азотная кислота (неорганическая).
2. Соли тяжелых металлов (например, CuSO4).
3. Органические растворители (этиловый спирт, ацетон)
4. Растительные алкалоиды.
5. Мочевина в высоких концентрациях
Если же денатурированный белок поместить в условия, близкие к нативным, то он может ренатурировать, но очень медленно, и такое явление характерно не для всех белков.
2. Первичные энзимопатии. Биохимические механизмы развития патологий. Примеры заболеваний.
Первичные энзимопатии связаны с генетически обусловленной недостаточностью одного или нескольких ферментов.
Механизмы развития:
— Недостаток конечного продукта определенного метаболического пути (при отсутствии других альтернативных путей синтеза) может приводить к развитию клинических симптомов, характерных для данного заболевания. В качестве примера можно рассмотреть альбинизм.
— При недостаточности определенного фермента (Ех) будут накапливаться метаболиты, а также во многих случаях и предшествующие соединения, которые в цепи метаболических превращений образуются до уровня расположения поврежденного энзима Ех. Увеличение концентрации субстратов – предшественников дефектного фермента является ведущим звеном развития данных заболеваний. В качестве примера можно привести алкаптонурию.
— Отмечают заболевания, когда одновременно недостаток конечного продукта и накопление исходного субстрата формируют клиническую картину. Их примером является болезнь Гирке
3. Коферментные функции витаминов. Витамин РР.
Продукты животного происхождения, содержащие витамин РР: говяжья печень, свинина, сыр, рыба, молоко, яйца, почки, белое мясо курицы.
Основная роль витамина РР в организме – участие в окислительно-восстановительных процессах. Витамин РР способствует нормальному росту тканей, оказывает благотворное влияние на жировой обмен, участвует в преобразовании сахара и жиров в энергию, снижает в крови уровень «плохого» холестерина.
Благодаря витамину РР человек защищён от сердечно-сосудистых заболеваний, тромбозов, гипертонии и диабета. Без витамина РР невозможна нормальная работа нервной системы. Такое сложное заболевание, как мигрень, можно облегчить или предупредить, принимая дополнительно витамин РР.
Билет №9
Задание 1.
Индивидуальные белки различаются по своим физико-химическим свойствам: форме молекул, молекулярной массе, суммарному заряду молекулы, соотношению полярных и неполярных групп на поверхности нативной молекулы белка, растворимости белков, а также степени устойчивости к воздействию денатурирующих агентов.
|
|
МИОГЛОБИН (от греч.
mys, род. падеж myos- мышца и лат. globus-шар), белок мышц позвоночных животных
и человека, связывающий переносимый гемоглобином О2 и передающий
его окислит. системам клетки. Состоит из одной полипептидной
цепи, содержащей 153 аминокислотных остатка (мол. м. 17800), к-рая уложена в
плотную глобулу размером 4,5 х 2,5 нм. В спец. полости миоглобина («кармане»)
помещается гем, к-рый связан с остальной частью молекулы (глобином), как в гемоглобине.
Ок. 75% полипептидной цепи находится в конформации a-спирали (все a-спирали
правозакрученные). Между областями спи-рализации находятся 5 неспирализованных
участков; такие же участки находятся на концах цепи. Внутр. область молекулы
состоит гл. обр. из неполярных остатков лейцина, валина, метионина, фенилаланина
и не содержит боковых полярных цепей глутаминовой и аспарагиновой к-т, глута-мина,
аспарагина, лизина и аргинина. На наружной стороне молекулы расположены как
полярные, так и неполярные аминокислотные остатки. Атом железа гема может
находиться в 4 состояниях: в физиологически активном пентакоординир. высокоспиновом
ферросостоянии (дезоксимиоглобин, Fe2+ , спиновое число
2), в гексакоординир. высокоспиновом феррисостоя-нии (метмиоглобин, Fe3+ , 6-й лиганд Н2О, спиновое число 5/2)
и в низкоспиновых ферро- и феррисостояниях (соотв. Fe2+ и
Fe3+ , спиновое число О и 1/2). Низкоспиновые
формы образуются из высокоспиновых при взаимод. атома железа гема с нек-рыми
лигандами (у дезоксимиоглобина с О2, СО, NO и др.; у метмиоглобина
с CN—, N—3 и ими-дазолом). Для феррисостояния
возможна смесь высокоспиновой и низкоспиновой форм (лиганды ОН—,
NO—2, NCS—). Связывание лигандов сопровождается
конформац. изменениями белка, и, наоборот, конформац. изменения вблизи гема
изменяют его электронное состояние и реакц. способность (т.наз. электронно-конформац.
взаимод.). Ф-ция миоглобина запасать О2 в мышцах при его избытке и освобождать
при недостатке основана на способности иона Fe2+ обратимо связывать
молекулу О2 с образованием оксимио-глобина. Высвобождение из оксимиоглобина
молекулы О2, необходимого работающей мышце, происходит в момент сокращения
последней, когда в результате сжатия капилляров парциальное давление О2
резко падает. Белок выполняет роль водорастворимого носителя гема, предохраняет
Fe2+ от окисления при его взаимод. с О2 и регулирует величину
сродства к О2. При одном и том же геме и способе его связывания
с белком константа равновесия р-ции оксимио-глобиндезоксимиоглобин
+ О2 для миоглобина из разных организмов изменяется в пределах от
0,2.106 до 2,2.106 М-1 (давление
О2, соответствующее полунасыщению, от 2,7 до 0,5 мм рт. ст.). Метмиоглобин
обладает также слабыми пероксидазной и каталазной активностями. В больших кол-вах миоглобин содержится
в мышцах морских млекопитающих-дельфинов и тюленей (соотв. 3,5 и 7,7% от массы
тела). Миоглобин кашалота был первым
белком, для к-рого Дж. Кендрю с сотрудниками в 1957-60 определили пространств.
структуру молекулы методом рентгеноструктурного анализа. Страница «МИОГЛОБИН» подготовлена по материалам химической энциклопедии. Еще по теме: |
96. Гемоглобины человека, структура. Транспорт кислорода и диоксида углерода. Гемоглобин плода и его физиологическое значение. Гемоглобинопатии.
Дыхательный пигмент, содержащийся в эритроцитах, с помощью которого осуществляется транспорт молекулярного кислорода из легких к тканям. Относится к сложным белкам — хромопротеидам. Молекула гемоглобина состоит из двух частей: простетической группы (гема), в состав которой входит атом железа, и белка типа альбуминов — глобина. На долю гема приходится 4 % молекулы гемоглобина, а глобина — 96 %. Гем относится к порфиринам, он содержит 4 пирроловые группы, соединенные в центре атомом железа. При потере железа гем превращается в гематопорфирин. Как в оксигемоглобине, так и в редуцированном гемоглобине железо находится в двухвалентной закисной форме. Трехвалентная (окисная) форма железа, не способная переносить молекулярный кислород, может образовываться при окислении в метгемоглобин. При разрушении эритроцитов (гемоглобина) в конечном счете в печени образуются желчные пигменты — билирубин и биливердин; в течение суток 3,6 г гемоглобина превращается в желчные пигменты. В капиллярах легких гемоглобин (гем) вступает с кислородом в непрочное соединение, образуя оксигемоглобин, а в капиллярах тканей происходит отщепление кислорода и восстановление гемоглобина. Последний вновь легко вступает в соединение с кислородом. Нарушение дыхательной функции крови может наблюдаться при уменьшении количества гемоглобина, эритроцитов в крови (анемии) и изменении качества гемоглобина: образовании карбоксигемоглобина (отравлении окисью углерода), метгемоглобина (отравлении гемолитическими ядами) сульфгемоглобина.
Типы нормального гемоглобина
С помощью физико-химических методов исследования (электрофорез, хроматография) удалось установить неоднородность человеческого гемоглобина, существование различных его типов как в нормальных, так и в патологических условиях. В настоящее время известны три формы нормального гемоглобина:
Примитивный гемоглобин (гемоглобин Р)
Это гемоглобин, который может быть обнаружен у трехсантиметрового зародыша, характеризуется высокой щелочной резистентностью и малой электрофоретической подвижностью. Находится в эритроцитах зародыша до 18 — недельного возраста (в основном между 7 — й и 12 — й неделями), затем сменяется фетальным гемоглобином.
Фетальный гемоглобин (гемоглобин F)
Представляет собой основную массу гемоглобина с 9 — 13 недельного возраста эмбриона. После третьего месяца — основной гемоглобин плода. Затем содержание его постепенно уменьшается за счет образования с 13 — й недели гемоглобина А. К моменту рождения гемоглобина F остается около 20 %, а 80 % приходится на гемоглобин А. К 4 — 5 месяцу жизни гемоглобина F остается всего 1 — 2 %. Существует метод цитологической дифференцировки гемоглобина F путем обработки мазка крови лимоннокислофосфатной буферной смесью с рН = 3,4. В этих условиях эритроциты, содержащие преимущественно гемоглобин А, подвергаются гемолизу и представляются на препарате в виде теней (стром). Эритроциты, в которых преобладает гемоглобин F, оказываются резистентными и контрастно окрашиваются.
Гемоглобин взрослых (гемоглобин А)
Представляет основную массу гемоглобина взрослых людей. С помощью электрофореза на крахмале установлено наличие нескольких фракций гемоглобина А:
гемоглобин A1 (основная фракция, на долю которой приходится 96 — 98 % всей массы гемоглобина).
гемоглобин A2 (2 — 5 %).
гемоглобин A3 (содержание менее 1 %).
Содержание гемоглобина F в крови взрослого человека составляет 1 — 2 %. Повышение этих величин возможно в условиях патологии. Преобладание того или иного типа гемоглобина совпадает во времени с периодами эмбрионального кроветворения: гемоглобин Р характерен для периода желточного кроветворения, гемоглобин F — для печеночного, гемоглобин А — для периода костномозгового кроветворения.
Аномальные гемоглобины
Наличие в эритроцитах людей аномальных или патологических гемоглобинов определяет состояния, обозначаемые как гемоглобинозы, или гемоглобинопатии. Это наследственные аномалии кроветворения, при которых молекулы патологических гемоглобинов имеют измененную структуру, поэтому подобные заболевания относятся к группе так называемых молекулярных болезней. Аномальные гемоглобины различаются своими физико — химическими свойствами (электрофоретической подвижностью, резистентностью к щелочам, растворимостью, изоэлектрической точкой), а также по молекулярной структуре глобиновой части (по одному из пептидов, в котором изменена последовательность аминокислот). Появление аномальных гемоглобинов объясняется мутационной теорией, передача потомкам аномального гена осуществляется по законам наследственности. У гетерозиготных особей (Аа) заболевание отсутствует или обнаруживаются субклинические признаки, у гомозиготных (от брака гетерозиготных особей) наблюдается развитие тяжелых анемий гемолитического типа. В настоящее время установлено более 200 аномальных гемоглобинов: B (S), С, D, Е, G, J, I, К, L, M, N, О, Р, Q и других, а также возможные их комбинации (SC, SD и др.). На XVI Международном конгрессе гематологов (Япония, 1976 г.) сделаны сообщения о новых аномальных гемоглобинах: Hb Beth (Nagel, США), Hb Austin (Moo-Peen, США), Hb Djelfa (Labie, Франция), Hb Hrosaki (Ohba, Япония), Hb Waco (Moo-Peen, США). Гемоглобинозы в гетерозиготной и гомозиготной форме имеют распространение в экваториальной Африке, странах, омываемых Средиземным морем, на Аравийском полуострове, в Южной Индии, на острове Шри-Ланка, в Юго-Восточной Азии, Южном Китае, южных районах США. Причину появления аномальных гемоглобинов объясняет малярийная гипотеза, согласно которой мутации в гене, контролирующем образование гемоглобина, возникли в странах с широким распространением тропической малярии. Было установлено, что наличие аномального гена в гетерозиготной форме повышает устойчивость людей к заболеванию, создает иммунитет к малярии, так как изменения молекулы гемоглобина препятствуют использованию его малярийным плазмодием.
Гемоглобин S
Отличается от гемоглобина А строением четвертого пептида, в котором на шестом месте вместо глутаминовой кислоты находится электрически нейтральный валин. Гемоглобин S менее растворим, нейтрален по заряду, электрофоретически менее подвижен. В капиллярах при отдаче кислорода гемоглобин S выпадает в осадок в форме веретенообразных кристаллоидов (тактоидов), которые растягивают оболочку и ведут к распаду эритроцитов. У гетерозиготов содержание гемоглобина S равняется 20 — 45 %, у гомозиготов — 60 — 90 %. Гетерозиготная форма аномалии протекает бессимптомно или сопровождается легкой гемолитической анемией. У гомозиготных особей уже с первых месяцев жизни развивается тяжелая форма серповидноклеточной анемии.
Гемоглобин F
Характерный для крови плода фетальный гемоглобин может быть обнаружен в повышенных количествах в эритроцитах крови недоношенных детей, при коклюше, серповидноклеточной анемии, талассемии, врожденной микроцитарной анемии, пернициозной анемии, острых и хронических лейкозах, миеломной болезни. Наибольшее содержание (до 97 %) наблюдается при большой талассемии.
Гемоглобин С
Отличается строением четвертого пептида молекулы гемоглобина, в котором на шестом месте вместо глутаминовой кислоты находится лизин. Центр распространения гена С — северная часть Ганы. Частота гетерозиготности по данным одних авторов, до 15 %, по данным других, — 16,5 — 28 %, среди негров США — 1,8 — 3% на Ямайке — 2,7 % (В. П. Эфроимсон). Наличие гена С в гомозиготном состоянии ведет к развитию выраженной спленомегалии, умеренной микроцитарной анемии с наличием эритроцитов мишеневидной формы. При наличии комбинации гемоглобинов С и S анемия оказывается более тяжелой.
Гемоглобин D
Обнаружен у 2 % берберов Марокко и у 0,4 % негров США. У гомозиготов наблюдается микроцитоз, слабый анизо- и пойкилоцитоз и мишеневидность эритроцитов. Описано несколько гемоглобинов D (в северо-западной Индии, среди сикхов в Индии, на острове Кипр, в Турции).
Гемоглобин Е
Обнаружен у жителей Юго-Восточной Азии: в Кампучии, Таиланде, Бирме, Бенгалии, у веддов Шри-Ланки, в северо-восточной Малайе, у населения Калимантана и Сулавеси. Частота распространения гена С в разных местностях колеблется от 1 — 3 до 13 (Таиланд) — 20 (Бирма) — 28 — 37 % (Кампучия). У гомозиготов ЕЕ наблюдается микроцитоз, компенсируемый развитием эритроцитоза (до 7 — 8 x 1012 /л). Отмечены комбинации генов ES и ЕТ, дающие сублетальный эффект. Клинические проявления при других гемоглобинозах выражены слабо, а распространение более ограниченное (гены G, I, J, К, L, M, N, О, Р, Q).
Гемоглобинопатии
Серповидноклеточная анемия — тяжёлое наследственное заболевание, обусловленное точечной мутацией гена, кодирующего структуру β-цепи гемоглобина (см. раздел 4). В результате в эритроцитах больных присутствует HbS, β-цепи которого в шестом положении вместо гидрофильной глутаминовой кислоты содержат гидрофобную аминокислоту валин. Появление гидрофобной аминокислоты недалеко от начала молекулы способствует возникновению нового центра связывания, поэтому при низком парциальном давлении кислорода тетрамеры дезокси-HbS ассоциируют, образуя длинные микротрубчатые образования, которые полимеризуются внутри эритроцитов. Полимеризация приводит к нарушению структуры эритроцитов, они приобретают серповидную форму и легко разрушаются. При этом заболевании отмечают анемию, прогрессирующую слабость, отставание в развитии и желтуху.
Носители гена серповидноклеточной анемии чаще всего встречаются среди африканского населения, так как они приобретают некоторое преимущество при заболевании малярией, часто встречающейся в странах с тропическим климатом. Причина сохранения гена серповидноклеточной анемии в популяции связана с тем, что в эритроцитах гетерозигот хуже развивается малярийный плазмодий, часть жизненного цикла которого проходит в эритроцитах человека. В связи с этим гетерозиготные носители дефектного
гена выживали при эпидемиях малярии, однако четверть их потомства погибала от серповиднок-леточной анемии.
Талассемии — наследственные заболевания, обусловленные отсутствием или снижением скорости синтеза α- или β-цепей гемоглобина. В результате несбалансированного образования глобиновых цепей образуются тетрамеры гемоглобина, состоящие из одинаковых протомеров. Это приводит к нарушению основной функции гемоглобина — транспорту кислорода к тканям. Нарушение эритропоэза и ускоренный гемолиз эритроцитов и клеток-предшественников при талассемиях приводит к анемии.
При β-талассемии не синтезируются β-цепи гемоглобина. Это вызывает образование нестабильных тетрамеров, содержащих только α-цепи. При этом заболевании в костном мозге из-за преципитации нестабильных α-цепей усиливается разрушение эритробластов, а ускорение разрушения эритроцитов в циркулирующей крови приводит к внутрисосудистому гемолизу. Как известно, для образования фетального гемоглобина р-цепи не требуются (см. раздел 4), поэтому клинически β-талассемия не проявляется до рождения, после чего происходит переключение синтеза HbF на НBА.
В случае α-талассемии недостаток образования α-глобиновых цепей приводит к нарушению образования HbF у плода. Избыточные γ-цепи образуют тетрамеры, называемые гемоглобином Барта. Этот гемоглобин при физиологических условиях имеет повышенное сродство к кислороду и не проявляет кооперативных взаимодействий между протомерами. В результате гемоглобин Барта не обеспечивает развивающийся плод необходимым количеством кислорода, что приводит к тяжёлой гипоксии. При α-талассемии отмечают высокий процент внутриутробной гибели плода. Выжившие новорождённые при переключении с γ- на β-ген синтезируют β-тетрамеры или НBН, который, подобно гемоглобину Барта, имеет слишком высокое сродство к кислороду, менее стабилен, чем НBА и быстро разрушается. Это ведёт к развитию у больных тканевой гипоксии и к смерти вскоре после рождения.
Наследственный сфероцитоз. Причиной этой патологии чаще всего является дефект белков цитоскелета эритроцитов — спектрина или ан-кирина, которые обеспечивают поддержание двояковогнутой формы клетки и эластичности мембраны. Эритроциты приобретают шарообразную форму, что приводит к уменьшению площади их поверхности и снижению скорости газообмена. Потеря эластичности клеточной мембраны приводит к повышению хрупкости и травматичности клеток и, как следствие, к ускорению их разрушения в сосудистом русле и селезёнке. Заболевание сопровождается анемией и желтухой. Удаление селезёнки (спленэктомия) при наследственном сфероцитозе улучшает состояние больных, так как предотвращает разрушение сфероцитов в селезёнке.
Мегалобластная (макроцитарная) анемия развивается при дефиците фолиевой кислоты или витамина В12.
Фолиевая кислота в виде кофермента (Н4-фолата) участвует в синтезе нуклеотидов. Недостаток фолиевой кислоты приводит к снижению скорости синтеза ДНК в быстроделящихся клетках, и в первую очередь в предшественниках эритроцитов. Клетки дольше пребывают в интерфазе, синтезируя гемоглобин, и становятся крупнее. Кроме того, из-за недостатка нуклеотидов они реже делятся, и количество эритроцитов снижается, а крупные мегалобласты быстрее разрушаются. Всё это в конечном итоге приводит к развитию анемии.
Аналогичная симптоматика развивается при недостатке в организме витамина В12. Этот витамин участвует в переносе метальной группы с N5-метил-Н4-фолата на гомоцистеин с образованием метионина и Н4-фолата (см. раздел 10). Недостаточность витамина В12 приводит к накоплению N5-метил-Н4-фолата в клетках. Дефицит Н4-фолата приводит к нарушению деления клеток и развитию анемии.
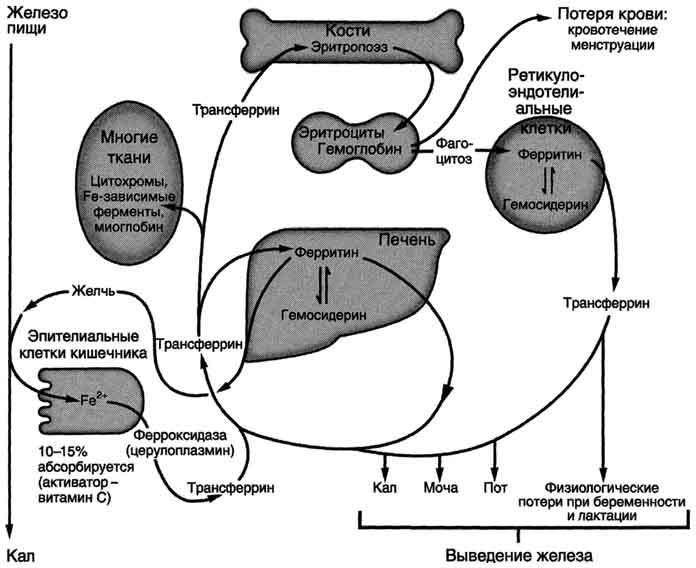
97. Биосинтез гема. Схема процесса, химизм первых двух реакций, место протекания. Регуляция активности ферментов АЛК-синтазы и АЛК-дегидратазы. Источники железа для синтеза гема, всасывание железа, транспорт в крови, депонирование.
Гем синтезируется во всех тканях, но с наибольшей скоростью в костном мозге и печени (рис. 13-2). В костном мозге гем необходим для синтеза гемоглобина в ретикулоцитах, в гепатоцитах — для образования цитохрома Р450.
Рис. 13-2. Синтез гема. Цифрами на схеме указаны ферменты: 1 — аминолевулинатсинтаза; 2 — аминолевулинатдегидратаза; 3 — порфобилиногендезаминаза; 4 — уропорфириноген III косинтаза; 5 — уропорфириногендекарбоксилаза; 6 — копропорфи-риноген III оксидаза; 7 — протопорфириногеноксидаза; 8 — феррохелатаза. Буквами обозначены заместители в пиррольных кольцах: М — метил, В — винил, П — остатки пропионовой кислоты, А — ацетил, ПФ — пиридоксальфосфат. Донором железа служит депонирующий железо в клетках белок ферритин.
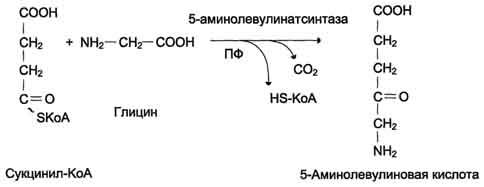
Рис. 13-3. Реакция образования 5-аминолевулиновой кислоты.
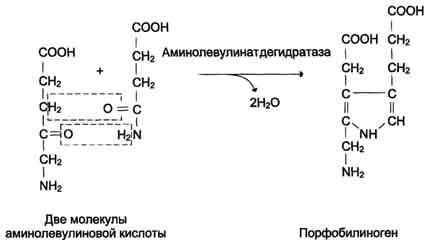
Реакция образования порфобилиногена.
В. Регуляция биосинтеза гема
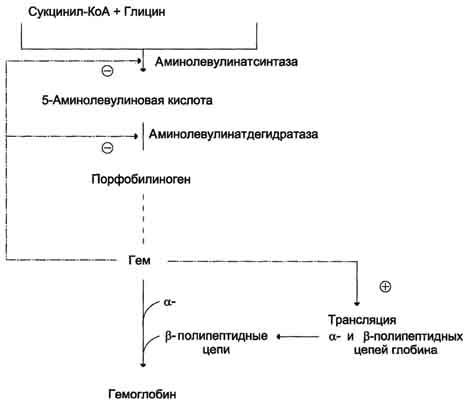
Регуляция синтеза гема и гемоглобина. Гем по принципу отрицательной обратной связи ингибирует аминолевулинатсинтазу и аминолевулинатдегидратазу и является индуктором трансляции α- и β-цепей гемоглобина.
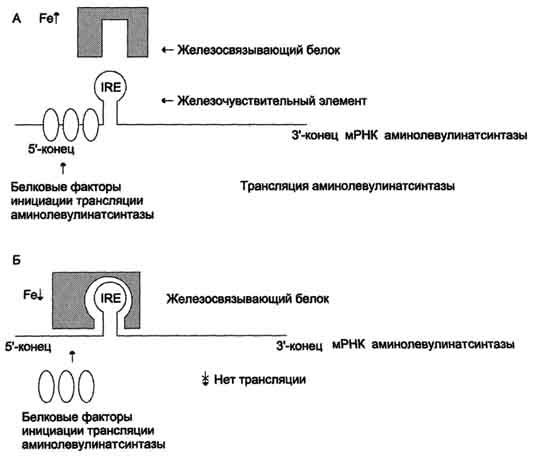
Регуляция синтеза аминолевулинатсинтазы. А — при высокой концентрации железа в ретикулоцитах оно присоединяется к железосвязывающему белку и снижает сродство этого белка к железочувствительному элементу (IRE) матричной РНК, кодирующей аминолевулинатсинтазу. Белковые факторы инициации трансляции связываются с мРНК и инициируют трансляцию аминолевулинатсинтазы. Б — при низком содержании железа в ретикулоцитах железосвязывающий белок обладает высоким сродством к IRE и взаимодействует с ним. Белковые факторы инициации трансляции не могут присоединиться к мРНК, и трансляция прекращается.
Аминолевулинатдегидратаза также аллостерически ингибируется гемом, но так как активность этого фермента почти в 80 раз превышает активность аминолевулинатсинтазы, то это не имеет большого физиологического значения.
Дефицит пиридоксальфосфата и лекарственные препараты, которые являются его структурными аналогами, снижают активность аминолевулинатсинтазы.