Лечение описторхоза в Новосибирске | отзывы, записаться, цена
В России более двух миллионов человек, у которых диагностировано заболевание описторхозом. Наибольшее распространение данное заболевание получило в Западной Сибири и в Приднепровье. Новосибирская область входит в тройку лидеров по этому заболеванию. Кандидат медицинских наук, гастроэнтеролог «ЕвроМед клиники» Мосеенко Елена Евгеньевна рассказывает об этом заболевании.
По данным Всемирной организации здравоохранения (ВОЗ) описторхоз – это одна из причин возникновения рака печени.
Паразиты достигают длины до 10 мм, живут в желчных протоках, желчном пузыре, протоках поджелудочной железы как людей, так и животных: белок, кошек, лис и др. Промежуточными «хозяевами» описторхов являются моллюски и рыбы семейства карповых: сазан, лещ, вобла, язь, чебак, елец, плотва, красноперка и линь.
Заражение происходит при употреблении рыбы (сырой, копченой, сушёной, мороженой, жареной или вареной). Если рыба была плохо термически обработана в кишечник попадают личинки вредителей. Потом они проникают в желчевыводящие протоки печени человека, а там начинают расти. Спустя несколько недель они достигают половой зрелости и начинают яйцевыделение. Описторхи, вопреки распространённому мнению, не размножаются. Новые паразиты могут появиться в организме человека только с повторными порциями рыбы.
Описторхоз оказывает активное негативное воздействие на организм: непосредственно повреждаются желчные протоки и протоки поджелудочной железы, что может вызвать нарушение тока желчи и сока поджелудочной железы, появляются кисты и новообразования в ткани этих органов. Часто повышается уровень аллергизации организма в целом, снижаются общий тонус организма и работоспособность.
Симптомы
Заболевание имеет весьма разнообразные варианты проявления, за это его даже прозвали «хамелеоном» медицины.
Клиническая картина болезни от момента попадания паразита в организм человека развивается в течение 3-4 недели.
При остром течении болезни отмечаются повышенная температура, боли как в мышцах, так и в суставах, расстройство стула, рвота, боли в области печени и ее увеличение, необоснованные аллергические высыпания на коже. С развитием болезни все симптомы могут значительно усилиться. Также при описторхозе могут беспокоить бессонница и раздражительность. Возможно и легкое, почти без симптомов, течение описторхоза.
При длительном хроническом течении возможно присоединение вторичной бактериальной инфекции с развитием холецистита, холангита, панкреатита.
Наличие описторхоза в организме человека ухудшает и продлевает течение всех уже имеющихся у него заболеваний.
Диагностика
Наличие у пациентов описторхоза достоверно определяется только нахождением яиц описторхов при микроскопии кала, в том числе после его обогащения различными способами, и микроскопии желчи, получаемой при дуоденальном зондировании. Для качественной диагностики крайне важна высокая квалификация врача-лаборанта, проводящего исследование.
Способы лечения
Для лечения описторхоза проводится комплексная терапия, которая включает в себя противогельминтные средства, а также препараты, направленные на нормализацию функции желудочно-кишечного тракта, детоксикацию (очищение от токсических, ядовитых веществ), десенсибилзацию (уменьшение повышенной чувствительности организма к аллергену).
Прежде всего, врач-гастроэнтеролог назначает обследование, по результатам которого корректирует диету больного и назначает лекарственные препараты. Лечение дополняется физиотерапией. Подготовительный период занимает от одной до нескольких недель. Лишь убедившись в эффективности проводимой терапии, врач назначает антигельминтный препарат.
На данный момент единственным препаратом с доказанным противоописторхозным эффектом является «Празиквантел». Применение этого лекарства должно производится под обязательным контролем врача, суточная доза для каждого пациента рассчитывается индивидуально. Врачебный контроль очень важен, поскольку гибель паразитов может вызвать непредвиденную реакцию организма: аллергическую, токсическую.
Врачебный контроль очень важен, поскольку гибель паразитов может вызвать непредвиденную реакцию организма: аллергическую, токсическую.
После приема данного препарата проводится восстанавительный курс лечения, который так же планируется в индивидуальном порядке. На этом этапе лечения для некоторых пациентов целесообразно проведение плазмафереза с целью удаления токсинов, аллергенов, продуктов жизнедеятельности и распада описторхов. Через 3 и 6 месяцев после начала лечения контролируется его эффективность – исследуется дуоденальное содержимое и/или кал.
Эффективность правильно проводимой антипаразитарной терапии с помощью препарата «Празиквантел» составляет около 95-97%.
Описторхоз – тяжёлое заболевание из группы гельминтозов, поражающих печень и поджелудочную железу
В мире около 21 миллиона человек инфицированы описторхами, из них 2/3 – жители России. В Западной Сибири сформировался природный очаг, в котором присутствуют три хозяина необходимых для развития двуустки.
Окончательный хозяин и основной источник инвазии – больной человек и животные домашние (собаки, свиньи, кошки) и дикие (лисы, выдры, песцы), употребившие в пищу зараженную рыбу семейства карповых. Все с калом выделяют яйца возбудителей, которые с талыми водами попадают в водоемы, где их заглатывают улитки – промежуточный хозяин. В них развиваются тысячи личинок –церкариев. Из моллюсков личинки выходят, свободно плавают в воде, но не являются опасными для человека, поэтому через воду описторхозом заразиться нельзя. Церкарии проникают в карповых рыб – дополнительных хозяев (карп, карась, жерех, язь, елец, плотва, лещ, линь, чебак, красноперка, уклея, гольян, подуст). Личинки описторхисов внедряются под кожу только рыбы карповых пород и становятся инвазионными, т.е. способными вызвать заражение человека. Сырок относится к виду сиговых, поэтому не опасен в отношении описторхоза!
Человек заражается при употреблении в пищу рыбы карповых пород в необезвреженном виде: сырой, недостаточно прожаренной и слабопросоленной рыбы. Проникшие в желчевыводящую систему и поджелудочную железу метацеркарии через 3 – 4 недели достигают половой зрелости и начинают откладывать яйца. Полный цикл развития возбудителя описторхоза длится 4 – 4,5 месяца, живут паразиты 20 – 25 лет.
Проникшие в желчевыводящую систему и поджелудочную железу метацеркарии через 3 – 4 недели достигают половой зрелости и начинают откладывать яйца. Полный цикл развития возбудителя описторхоза длится 4 – 4,5 месяца, живут паразиты 20 – 25 лет.
Личинки паразитов находятся в мышцах речной рыбы. При ее разделке происходит загрязнение разделочного инвентаря и возможно обсеменение других продуктов.
Описторхисы чрезвычайно прожорливы, разрушают печень, желчный пузырь, поджелудочную железу. Они питаются слизью желчных протоков, ротовой присоской засасывают, отрывают и поедают клетки слизистых оболочек; остаётся кровоточащая поверхность, паразиты заглатывают и кровь. Органы, где «расселяются оккупанты», зарастают рубцовой тканью, перерождаются, а в случае слабой иммунной защиты – развиваются злокачественные опухоли. Скопление паразитов в желчных протоках способствует их закупорке, нарушается отток желчи, и протоки деформируются.
Острый описторхоз длится от нескольких дней до 4 – 8 недель и сопровождается лихорадкой, головной болью, недомоганием, сыпью, ломотой в мышцах и суставах, тошнотой, рвотой. При тяжелом течении возможно развитие аллергического миокардита, эозинофильной мелкоочаговой пневмонии. Острая фаза может напоминать течение брюшного тифа, вирусных гепатитов, астмоидного бронхита.
Хронический описторхоз продолжается 15 – 25 лет и даже пожизненно, проявляется симптомами хронического холецистита, гастродуоденита, панкреатита, гепатита. Описторхозная инвазия приводит к нарушению нервной, иммунной систем. Серьезное последствие описторхоза – аллергические реакции в результате отравления организма продуктами обмена веществ и распада описторхисов и собственных тканей, травмированных паразитами. Скопление описторхисов, их яиц, слизи в желчных протоках, протоках поджелудочной железы создает препятствие для оттока желчи и панкреатического секрета, вызывая их застой.
К тяжелым осложнениям описторхоза относятся: желчный перитонит, абсцессы печени, цирроз печени, острый деструктивный панкреатит, рак печени и поджелудочной железы.
Для лечения описторхоза применяют препараты, действующие на плоских червей. Препараты применяются в медицинских учреждениях округа строго по назначению и под наблюдением врача.
После успешной дегельминтизации в организме могут оставаться необратимые последствия описторхоза в виде хронического гепатита, холангита, холецистита, гастрита, дисбаланс в иммунной системе.
ОПИСТОРХОЗ ЛЕГЧЕ ПРЕДУПРЕДИТЬ, ЧЕМ ЛЕЧИТЬ!
Меры личной профилактики просты:
• варить рыбу не менее 15 минут после закипания,
• жарить в распластанном виде в жире 20 минут,
• солить: мелкую рыбу 14 дней, крупную (более 25 см) 40 дней с добавлением соли 2 кг на 10 кг рыбы,
• после обработки рыбы тщательно мыть и ошпаривать кипятком ножи и разделочные доски.
Помните: нельзя скармливать сырую рыбу и рыбные отходы домашним животным.
Врач терапевт Габибова П.Р.
Это заболевание лечить нужно. Описторхоз
Окружному месячнику профилактики краевой патологии посвящается…
Это заболевание вылечить можно и даже нужно
Описторхозом болеют люди всех возрастов. Досадно, когда мы выявляем описторхоз у маленьких детей. Некоторые считают, что описторхозом можно заразиться через сырую воду. Это не верно. А вот не соблюдение правил гигиены при разделке рыбы и приготовлении детского питания может привести к заражению ребенка через разделочную доску или нож, которым резали рыбу, а потом, не достаточно промыв, другие продукты питания. Признаки описторхоза разнообразны. Заболевание может протекать в острой и хронической формах. Острая стадия протекает чаще всего, как острый аллергоз, проявляется через 2-6 недель после употребления зараженной рыбы. Острое начало описторхоза в детском возрасте встречается редко. Заподозрить наличие инвазии можно, если ребенок стал часто болеть ОРЗ, так как под воздействием гельминта угнетается иммунная система.
При ОРЗ часто наблюдается астмоидный компонент, появляются аллергические высыпания на коже, эозинофилия в крови, неустойчивый стул, непостоянные боли в животе. В результате воздействия червей и продуктов их жизнедеятельности в печени, желчном пузыре и поджелудочной железе возникает вначале острое воспаление, а спустя 2-3 месяца – хроническое. Больных беспокоят тяжесть и боли в правом подреберье, в области желудка, снижение аппетита, изжога, отрыжка, тошнота, вздутие живота, расстройства стула. При прогрессе воспалительного процесса у больных хроническим описторхозом могут возникнуть различные осложнения: кисты печени и поджелудочной железы, рубцовые сужения протоков, камнеобразование, механическая желтуха, в запущенных случаях рак печени, при которых показано хирургическое лечение. Лечение необходимо. Обязательно.
Лечение необходимо. Обязательно.
Среди населения бытует мнение, что лечить описторхоз, пока живешь на Севере, не обязательно. Это совершенно ошибочное мнение. Лечить описторхоз необходимо и у взрослых, и в особенности, у детей. Причем, чем раньше проводится лечение, тем оно эффективнее и легче переносится. Лечение описторхоза назначает врач-педиатр или врач-инфекционист. Для дегельминтизации применяется препарат, который парализует мышечную систему гельминта, в результате чего он открепляется от стенки желчных протоков и выводится с желчью. Через 3-4 месяца после лечения необходимо провести контроль излеченности методом исследования кала на яйца глист 3-х кратно. Контрольное обследование на яйцевыделение необходимо также повторить через 6 и 12 месяцев после дегельминтизации, так как за этот период при несоблюдении правил обработки и приготовления рыбы возможно повторное заражение описторхозом. Предупрежден – значит вооружен. Рыба – прекрасный продукт, богатый кальцием, фосфором, которые так необходимы для растущего организма, и есть её можно и нужно, только надо правильно приготовить.
Причиной большинства случаев заражения описторхозом является употребление соленого или вяленого язя, вяленых чебачков. Заражение широким лентецом происходит при употреблении рыбы хищных пород: щуки, окуня, налима, ерша. Особенно опасна слабосоленая щучья икра. Чтобы избежать заражения этими паразитами необходимо соблюдать следующие меры профилактики: • Рыбу готовить мелкими кусками, прожаривать небольшие куски или котлеты из рыбного фарша не менее 20 минут в большом количестве жира. • В ухе рыбу варить также небольшими кусками в течение 15- 20 минут с момента закипания. • Выпекать рыбные пироги не менее 45-60 минут. • Солить рыбу следует в течение 14 дней с использованием 2 кг соли на 10 кг рыбы. Крупная рыба (более 25 см) должна просаливаться 40 суток. Посол икры производить в течение 12 часов при количестве соли 6% к весу икры (60гр. соли на 1 кг. икры).• Вялить мелкую рыбу карповых пород необходимо в течение 3-х недель с предварительным трехдневным крепким посолом. Чем крупнее рыба, тем дольше она должна находиться в рассоле и затем дольше вялиться. • Нельзя употреблять строганину из свежезамороженной и свежевыловленной рыбы. Нужно помнить, что при замораживании рыбы в бытовых холодильниках, личинки описторхоза остаются жизнеспособными. • При приготовлении рыбы обязательно нужно соблюдать правила санитарии: иметь отдельный разделочный инвентарь, тщательно мыть ножи, разделочные доски и руки после обработки рыбы. А если все-таки болезнь не обошла Вас стороной, не тяните, обратитесь к врачу за консультацией и лечением.
Описторхоз в клинической практике врача-инфекциониста | #06/13
Описторхоз — внекишечный природно-очаговый биогельминтоз, вызываемый трематодами из семейства Opisthorchidae, характеризующийся полиморфизмом клинических проявлений, обусловленных паразитированием этих гельминтов в желчных протоках печени и протоках поджелудочной железы и длительным течением.
История изучения и распространение описторхоза
Возбудитель описторхоза был открыт и описан S. Rivolta в 1884 г. у кошек и назван Opisthorchis (Distomum) felineus. В 1891 г. профессор Томского университета К. Н. Виноградов при вскрытии трупа человека обнаружил подобного же гельминта, подробно описал его и назвал Distomum sibiricum (сибирская двуустка) [4]. В 1894 г. M. Braun доказал идентичность Distomum felineum Rivolta (1884 г.) и Distomum sibiricum Winogradov (1891 г.) [1, 2].
Описторхоз занимает доминирующее место в краевой инфекционной патологии Западной Сибири, где существует самый напряженный в мире очаг этой инвазии. В низовьях Иртыша и среднего течения Оби пораженность местного населения достигает 70–80% и даже 90% [1].
Очаги описторхоза расположены также в бассейнах рек Днестра, Немана, Волги, Днепра. Имеются данные о наличии очагов с низким уровнем экстенсивности в притоках Енисея, в бассейне Урала, Северной Двины и Бирюсы. За рубежом очаги описторхоза зарегистрированы в Италии, Германии, Франции, Болгарии и других странах [1].
Имеются данные о наличии очагов с низким уровнем экстенсивности в притоках Енисея, в бассейне Урала, Северной Двины и Бирюсы. За рубежом очаги описторхоза зарегистрированы в Италии, Германии, Франции, Болгарии и других странах [1].
Жизненный цикл паразита
Описторхисы относятся к классу трематод, семейству Opisthorchidae. O. felineus — плоский гельминт ланцетовидной формы, длиной 4–20 мм и шириной 1–4 мм. Яйца описторхисов с уже сформированными личинками выделяются с фекалиями во внешнюю среду, и дальнейшее развитие происходит в пресноводных водоемах, где обитает промежуточный хозяин описторхисов — пресноводные моллюски Codiella inflata и Codiella troscheli. Моллюск с пищей заглатывает яйцо, из которого выходят мирацидии, превращающиеся в спороцисту, редию и хвостатую личинку — церкария. Церкарий покидает тело моллюска, выходит в водоем и в силу хемо- и фототаксиса прикрепляется к телу своего дополнительного хозяина — рыбы семейства карповых. К семейству карповых относится 23 вида рыб (язь, лещ, карп, чебак, елец, линь, красноперка, сазан, пескарь и др.). Проникшие в мышечную и соединительную ткань рыбы церкарии инцистируются и превращаются в метацеркарий. Метацеркарии достигают инвазионной стадии через 6 недель. В организм окончательного хозяина — человека и животных — метацеркарии попадают при употреблении в пищу инвазированной необезвреженной рыбы. Круг дефинитивных хозяев паразита насчитывает 34 вида рыбоядных млекопитающих (кошка, собака, свинья, лисица, волк, корсак, песец, бурый медведь, росомаха, хорь, бобр и др.). В желудке окончательного хозяина происходит переваривание наружной капсулы, а под действием дуоденального сока метацеркарии освобождаются от своей внутренней оболочки и через ампулу дуоденального сосочка мигрируют в общий желчный проток и внутрипеченочные желчные протоки. У 20–40% зараженных лиц описторхисы также обнаруживаются и в протоках поджелудочной железы, куда они проникают по вирсунгову протоку [3]. Проникшие в гепатобилиарную систему и поджелудочную железу метацеркарии через 3–4 нед достигают половой зрелости и начинают продуцировать яйца. Число паразитов у одного человека может быть от единиц до десятков тысяч. Весь цикл развития описторхиса от яйца до половозрелой стадии длится 4–4,5 мес.
Число паразитов у одного человека может быть от единиц до десятков тысяч. Весь цикл развития описторхиса от яйца до половозрелой стадии длится 4–4,5 мес.
Патогенез
В патогенезе описторхоза, как и многих других гельминтозов, прослеживается 2 фазы: ранняя и поздняя. Ранняя фаза, или острый описторхоз, длится от нескольких дней до 4–8 и более недель и связана с проникновением эксцистированных метацеркариев паразита в гепатобилиарную систему и поджелудочную железу. Поздняя фаза или хронический описторхоз продолжается многие годы.
Молодые описторхисы повреждают стенки желчных протоков своими шипиками, а половозрелые — присосками, отрывая эпителий желчных протоков, которым они питаются, чем определяется развитие множественных кровоточащих эрозий и бурной регенеративно-гиперпластической реакции эпителия. Это эволюционно сформировавшееся качество описторхисов, направленное на создание оптимальных условий для их жизнедеятельности и поддержание вида. В условиях этого процесса чрезвычайно велика возможность мутации, что в сочетании с иммуносупрессорным влиянием описторхисов значительно повышает риск канцерогенеза [4]. Скопление в желчных и панкреатических протоках гельминтов, их яиц, слизи, слущенного эпителия создает препятствие для оттока желчи и секрета, что способствует развитию пролиферативного холангита и каналикулита поджелудочной железы, сопровождающихся различной степенью фиброза этих органов.
Механическое раздражение стенок желчных протоков печени и панкреатических протоков приводит к развитию патологических висцеро-висцеральных рефлексов, ведущих к нарушению моторной и секреторной функции органов желудочно-кишечного тракта.
Альтеративные изменения в органах локализации и других органах обусловлены и влиянием продуктов метаболизма описторхисов, которые преодолевают эпителиальный барьер и поступают в кровеносное русло, оказывая токсическое воздействие на организм человека.
Пролиферативные процессы в желчных протоках, а также сами гельминты, слизь, слущенный эпителий, создают условия для развития желчной гипертензии, способствуют формированию дискинезии желчевыводящих путей, стазу желчи, созданию благоприятных условий для развития вторичной инфекции (кишечная палочка, стафилококки, дрожжеподобные грибки и различные микробные ассоциации).
Клиническая картина заболевания
Клиническая картина описторхоза полиморфна и варьирует от бессимптомных форм до тяжелых проявлений, обусловленных развитием гнойного холангита, абсцесса печени и др.
Общепризнанной классификации описторхоза не существует. Выделяют раннюю фазу (острый описторхоз) и позднюю (хронический описторхоз). Острый описторхоз длится от нескольких дней до 4–8 и более недель и связан с проникновением личинок паразита в гепатобилиарную систему и поджелудочную железу. В ранней фазе описторхоза ведущим звеном в патогенезе является развитие аллергических реакций и органных поражений в ответ на воздействие продуктов метаболизма паразита. В патогенезе хронической стадии описторхоза большую роль играют повторные заражения с обострением воспалительного процесса, фиброзом билиарных путей, поджелудочной железы, дистрофией паренхимы печени, дискинезией желчевыводящих путей, холестазом. Хронический описторхоз продолжается многие годы.
Инкубационный период равняется в среднем 2–3 нед.
Клинические варианты острого описторхоза разнообразны — от латентных до генерализованных аллергических реакций с множественными поражениями.
В эндемичных по описторхозу очагах у коренных жителей и у длительно проживающих в течение нескольких поколений местных жителей чаще не выявляется клинически выраженная острая фаза болезни, в то время как у вновь прибывших из благополучных по описторхозу местностей острая фаза описторхоза наблюдается почти всегда. Причина этого явления заключается в том, что у аборигенов (иммунное население) формируется иммунологическая толерантность супрессорного типа. Иммунологическая толерантность к описторхозному антигену формируется в связи с поступлением описторхозного антигена в организм на ранних стадиях эмбриогенеза. После рождения уже зрелый организм воспринимает этот антиген как «свое» [5, 6].
Инаппарантная (субклиническая) форма описторхоза выявляется случайно, когда при исследовании периферической крови отмечается большая эозинофилия.
При клинически выраженном остром описторхозе у больных наблюдается лихорадка — от субфебрильной до фебрильной длительностью от 3–4 дней до нескольких недель, интоксикационный синдром, умеренные артралгии и миалгии, экзантема различного характера, гепатобилиарный синдром: боли в правом подреберье (тупые, ноющие, давящие, жгучие), желтуха — от субиктеричности до интенсивной, кожный зуд, гепатомегалия, у части больных выявляются положительные пузырные симптомы. Характерны симптомы диспепсического характера (тошнота, рвота, изжога). Более чем у 80% больных выявляется цитолитический синдром с повышением активности аминотрансфераз (аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ)) в 2–7 раз по сравнению с нормой, часто холестаз (повышение уровня гамма-глутамилтранспептидазы (ГГТП) и щелочной фосфатазы (ЩФ)), развивается мезенхимально-воспалительный печеночный синдром [7]. Одним из проявлений острого описторхоза может быть бронхолегочный синдром: катаральные проявления со стороны верхних дыхательных путей (гиперемия зева, зернистость задней стенки глотки, насморк), астматоидный бронхит, эозинофильные инфильтраты в легких и экссудативные плевриты [8]. Реже наблюдается гастроэнтероколитический синдром, характеризующийся субфебрильной лихорадкой, умеренно выраженный интоксикацией и преобладанием симптомов поражения желудочно-кишечного тракта (боли в эпигастрии, изжога, тошнота, рвота, частый жидкий стул, иногда с примесью слизи).
Описанные синдромы острой фазы описторхоза не исчерпывают всего разнообразия клиники этого гельминтоза, и при любом варианте общие и локальные симптомы тесно переплетаются, что обусловливает полиморфизм клинических проявлений и индивидуальную неповторимость этих сочетаний у каждого больного.
У больных в острую фазу описторхоза могут развиваться и очень тяжелые токсико-аллергическиие проявления, такие как острый эпидермальный некролиз (синдром Лайелла), синдром Стивена–Джонсона, острый миокардит, отек Квинке, крапивница.
Большое значение для диагностики острого описторхоза имеет исследование периферической крови. У всех больных наблюдается лейкоцитоз до 20–60 × 109 л, умеренно повышенная скорость оседания эритроцитов (СОЭ) и эозинофилия — 20–40%, иногда до 90%.
С переходом заболевания в хроническую фазу симптоматика существенно изменяется и характеризуется, прежде всего, устранением лихорадки и нормализацией гематологических показателей.
Латентное течение описторхоза чаще наблюдается у коренного и местного населения в очагах этой инвазии, а также нередко у лиц молодого возраста, инвазированных описторхисами.
Проявления клинически выраженного хронического описторхоза неспецифичны, полиморфны и не укладываются в какой-либо один синдром. Холангит при описторхозе является абсолютно обязательным звеном патогенеза. Некоторые исследователи [7, 9] не относят желчный пузырь к числу органов постоянного пребывания описторхисов и считают, что паразиты в желчный пузырь попадают случайно с током желчи. Учитывая функционально-морфологические связи внутрипеченочных желчных протоков и желчного пузыря, сочетанное поражение этих органов у больных описторхозом наблюдается очень часто, и синдромы холангита и холецистита относится к наиболее распространенным (80–87% случаев) [7, 9]. Проявления этих синдромов зависят от длительности и интенсивности инвазии. Так, в первые 3 года после заражения у 86% больных наблюдается гиперкинетический тип дискинезии желчевыводящих путей, у 11% — нормокинетический и у 3% — гипокинетический. Спустя 5–7 лет в 87% случаев выявляется гипокинетический тип дискинезии, в 6% — нормокинетический, в 7% — гиперкинетический [9]. У 50–85% больных отмечается гепатомегалия, у 30–40% — положительные пузырные симптомы [7].
У 13–17% больных хроническим описторхозом наблюдается гепатит, основными проявлениями которого являются боли в правом подреберье, тошнота, рвота, отрыжка, артралгии, нередко — кожный зуд, гепатомегалия, при обострении развивается желтуха различной интенсивности [7–9].
У части больных развивается панкреатит, отличающийся волнообразным течением с частой сменой периодов обострений и ремиссий, и редко наблюдается прогрессирующее течение [10]. Чаще всего панкреатит протекает в виде болевой формы. Редкими формами панкреатита являются хронический псевдоопухолевый панкреатит и описторхозные кисты поджелудочной железы.
У больных описторхозом отмечаются и поражения органов, не являющихся местом постоянной локализации возбудителя. Так, у 45–50% больных описторхозом отмечаются различные формы гастродуоденальной патологии (гастриты, дуодениты, язвенная болезнь желудка и двенадцатиперстной кишки) [10–11]. Поражение кишечника у больных хроническим описторхозом отмечается довольно часто, и основным его проявлением является кишечная диспепсия. При изучении состава микрофлоры фекалий у них выявляется дисбактериоз, который характеризуется отсутствием или резким снижением количества бифидобактерий, уменьшением количества эшерихий, нередко в сочетании с угнетением их ферментативных свойств, и повышенным содержанием факультативной условно-патогенной микрофлоры (S. epidermidis, S. aureus и др.) [7].
Изменения со стороны сердечно-сосудистой системы проявляются сердцебиениями, болями в области сердца, наклонностью к гипотонии, диффузными дистрофическими изменениями миокарда по данным электрокардиографии (ЭКГ).
Описторхозная инвазия может приводить к нарушению деятельности центральной и вегетативной нервной системы, о чем свидетельствуют частые жалобы больных на повышенную утомляемость, раздражительность, бессонницу, головную боль, головокружение [3, 9]. Наблюдаются признаки лабильности вегетативной нервной системы: потливость (часто локальная — потные руки), слюнотечение, выраженный дермографизм, тремор век, языка, пальцев рук, проявления вазомоторных сосудистых реакций, субфебрильная температура. В ряде случаев неврологическая симптоматика выступает на первый план, и больным ставят диагноз нейроциркуляторной дистонии, вегетативного невроза и т. д.
д.
Аллергический синдром при хроническом описторхозе может проявляться кожным зудом, крапивницей, рецидивирующим отеком Квинке, артралгией, пищевой аллергией, умеренной эозинофилией.
Лабораторная диагностика
- Гельминтоовоскопические методы: микроскопия дуоденального содержимого, копроовоскопия.
- Иммунодиагностика: выявление противоописторхозных антител в сыворотке крови в реакции иммуноферментного анализа (ИФА) с описторхозным антигеном. Диагностическая ценность ИФА довольно высока в острую фазу описторхоза — более чем у 90% больных он положительный, и титр антител достаточно высок (1:400–1:800). В случаях хронических форм титры противоописторхозных антител существенно ниже, и реакция может быть отрицательной. Положительная реакция ИФА отмечается лишь у 51,6% больных хроническим описторхозом [7]. Кроме того, до сих пор неизвестно, как долго сохраняются антитела после устранения инвазии, поэтому использовать эту реакцию для диагностики паразитологического выздоровления нельзя.
Лечение
При назначении лечения больным описторхозом необходимо учитывать фазу болезни, вариант ее течения с учетом всех клинических синдромов, степень тяжести и особенности организма (возраст, сопутствующие заболевания и т. д.), возможность супер- и реинвазии.
Лечение описторхоза включает 3 этапа.
1-й этап — подготовительная патогенетическая терапия, направленная на обеспечение должного оттока из желчевыводящих путей и протоков поджелудочной железы; восстановление моторно-кинетической функции желчевыделительной системы; купирование аллергического, интоксикационного синдромов, воспалительных процессов в желчевыводящих путях и желудочно-кишечном тракте.
В качестве противоаллергических средств рекомендуется применение блокаторов Н1-гистаминовых рецепторов, которые назначаются во время курса подготовительной патогенетической терапии, при проведении этиотропной терапии и по показаниям — в период реабилитации.
При наличии воспалительных процессов в желчевыводящих путях показаны коротким курсом (чаще всего 5-дневным) антибиотики широкого спектра действия.
Желчегонная и спазмолитическая терапия должна осуществляться дифференцированно, с учетом типа дискинезии желчевыводящих путей в течение 1–3 месяцев.
Классификация желчегонных препаратов
I. Препараты, стимулирующие желчеобразовательную функцию печени — истинные желчегонные (холеретики):
- Препараты, содержащие желчные кислоты.
- Синтетические препараты (гидроксиметилникотинамид, Оксафенамид, Холонертон, Циквалон).
- Комбинированные холерики (Аллохол, Дигестал, Фестал, Холензим).
- Препараты растительного происхождения (Галстена, Куренар, Фламин, Фуметерре, Холагогум, Холагол, Холосас, Холафлукс).
- Препараты, увеличивающие секрецию желчи за счет ее водного компонента (гидрохолеретики).
II. Препараты, стимулирующие желчевыведение:
- Холекинетики, повышающие тонус желчного пузыря и снижающие тонус желчных путей (берберина бисульфат, ксилит, магния сульфат, сорбит, Циквалон, Олиметин, Холагол).
- Холеспазмолитики, вызывающие расслабление тонуса желчных путей (атропина сульфат, платифиллин, теофиллин).
Из спазмолитических средств можно использовать традиционные препараты (Но-шпа, дротаверин, Бускопан), но предпочтительнее применение селективных препаратов (мебеверина гидрохлорид (Дюспаталин)), ввиду их преимуществ селективности в отношении желудочно-кишечного тракта, отсутствия побочных эффектов; двойного механизма действия (снижение тонуса и уменьшение сократительной активности гладкой мускулатуры), высокой тропности к сфинктеру Одди.
При явлениях холестаза назначаются препараты урсодезоксихолевой кислоты (Урсофальк, Урсосан), Гептрал.
По показаниям применяются прокинетики (метоклопрамид, домперидон — Мотилиум, Мотилак), ферментные препараты (Мезим форте, Креон, Панкреофлат, Пензитал и др. ), пре- и пробиотики, средства эрадикационной терапии
), пре- и пробиотики, средства эрадикационной терапии
Показано физиотерапевтическое лечение (микроволновая терапия, магнитотерапия, электрофорез с 10% раствором сернокислой магнезии), оказывающее спазмолитическое, десенсибилизирующее, микроциркуляторное действия.
2-й этап лечения описторхоза предусматривает проведение специфической химиотерапии. В настоящее время эффективным средством специфической терапии описторхоза является празиквантел. Фармакокинетика празиквантела и его аналогов связана с повышением проницаемости клеточных мембран паразитов для ионов кальция, сокращением мускулатуры паразитов, переходящим в спастический паралич. Препараты празиквантела назначаются из расчета 50–60 мг на 1 кг массы тела больного в 3 приема с интервалом между приемами 4–6 часов. А. И. Пальцев [6] предлагает щадящую методику применения празиквантела, когда указанная суточная доза делится на двое суток. При щадящей методике применения празиквантеля курсовую дозу делят на 6 приемов в течение 2 сут: 3 приема в первые сутки с интервалом 4 ч и 3 — на вторые сутки. По данным автора, антигельминтная эффективность при этом остается такой же.
Противопоказаниями к приему препаратов празиквантела являются повышенная чувствительность к препарату, цистицеркоз глаз и печени, первый триместр беременности, лактация, детский возраст до 4 лет, печеночная недостаточность.
Необходимо отметить, что наличие описторхоза не является абсолютным показанием к дегельминтизации. Например, ее нужно назначать с осторожностью лицам пожилого и старческого возраста. Назначение антигельминтиков больным с тяжелой сопутствующей патологией (декомпенсированные пороки сердца, тяжелые поражения почек и печени и др.) также должно проводиться с известной осторожностью. Лечение препаратами празиквантела рекомендуется начинать не ранее 3-й недели от начала болезни и при уровне эозинофилии не более 20%.
После приема препарата могут возникать побочные явления: головная боль, головокружение, слабость, нарушение координации, тошнота, усиление или возобновление болей в правом подреберье. В большинстве случаев побочные реакции кратковременны и исчезают в течение суток. В части случаев в первые 2–3 недели после лечения больные отмечают общую слабость, усиление болей в животе и диспептических проявлений, возможно появление эозинофилии, ухудшение показателей функциональных проб печени, высыпания на коже типа крапивницы. Эти симптомы обусловлены в основном дополнительным антигенным воздействием в результате гибели гельминтов.
В большинстве случаев побочные реакции кратковременны и исчезают в течение суток. В части случаев в первые 2–3 недели после лечения больные отмечают общую слабость, усиление болей в животе и диспептических проявлений, возможно появление эозинофилии, ухудшение показателей функциональных проб печени, высыпания на коже типа крапивницы. Эти симптомы обусловлены в основном дополнительным антигенным воздействием в результате гибели гельминтов.
На 2-й день после приема празиквантела назначают дуоденальное зондирование или слепое зондирование с минеральной водой, сорбитом, ксилитом для эвакуации продуктов жизнедеятельности и распада описторхисов. Для увеличения пассажа желчи можно рекомендовать электростимуляцию правого диафрагмального нерва, импульсное магнитное поле.
3-й этап лечения — реабилитационная патогенетическая терапия, направленная на максимальное выведение продуктов жизнедеятельности и распада паразитов: желчегонная терапия, адекватная типу дискинезии желчевыводящих путей, беззондовое дуоденальное зондирование (тюбажи с ксилитом, сорбитом, сернокислым магнием, минеральной водой) 2–3 раза в течение 1-й недели, далее 1–2 раза в неделю (до 3 мес), сорбенты (Лактофильтрум, Энтеросгель, Полифепан и др.), пре- и пробиотики — для восстановления биоценоза кишечника.
При усилении аллергических реакций, интоксикационного синдрома, связанных с дополнительным антигенным воздействием при гибели гельминтов, требуется назначение десенсибилизирующей (антигистаминные препараты, при необходимости — глюкокортикоиды) и дезинтоксикационной (инфузии растворов, сорбенты) терапии.
Комплекс реабилитационных мероприятий включает также прием гепатопротекторов, отваров желчегонных трав в течение 3–4 месяцев (табл.), по показаниям применяют спазмолитики, антихолестатические препараты и другие патогенетические средства.
Контроль эффективности дегельминтизации проводится через 1, 3 и 6 месяцев после лечения: выполняются гельминтоовоскопические исследования фекалий не менее 3 раз в каждый из указанных сроков и исследование дуоденального содержимого. Необходимо подчеркнуть, что паразитологическое выздоровление далеко не всегда сопровождается клиническим выздоровлением: у лиц, страдавших описторхозом более 5 лет, жалобы и объективные изменения, имевшие место в период хронической фазы, сохраняются [4, 6]. Объясняется это наличием глубоких морфологических изменений в органах, сформировавшихся в хроническую фазу болезни. Вопрос же о тактике лечения резидуальных форм описторхоза остается до сих пор нерешенным.
Необходимо подчеркнуть, что паразитологическое выздоровление далеко не всегда сопровождается клиническим выздоровлением: у лиц, страдавших описторхозом более 5 лет, жалобы и объективные изменения, имевшие место в период хронической фазы, сохраняются [4, 6]. Объясняется это наличием глубоких морфологических изменений в органах, сформировавшихся в хроническую фазу болезни. Вопрос же о тактике лечения резидуальных форм описторхоза остается до сих пор нерешенным.
Литература
- Беэр С. А. Биология возбудителя описторхоза. М., 2005. 336 с.
- Виноградов К. Н. О новом виде двуустки (Distomum sibiricum) в печени человека. Отдельный оттиск // Труды Томского общества естествоиспытателей. Томск, 1881. 15 с.
- Яблоков Д. Д. Описторхоз человека. Томск, 1979. 237 с.
- Bouvard V., Baan R., Straif K., Grosse Y., Secretan B., El Ghissassi F., Benbrahim-Tallaa L., Guha N., Freeman C., Galichet L., Cogliano V. A review of human carcinogens–Part B: biological agents // Lancet Oncol. 2009; 10: 321–322. WHO International Agency for Research on Cancer Monograph Working Group.
- Парфенов С. Б., Озерецковская Н. Н., Золотухин В. А. Сравнительная характеристика клинико-иммунологических показателей разных контингентов больных описторхозом в очаге. Сообщение 2. Коренное население // Мед. паразитология и паразитар. болезни. 1989. № 2. С. 42–45.
- Парфенов С. Б., Озерецковская Н. Н., Шуйкина Э. Е. Сравнительная характеристика клинико-иммунологических показателей различных контингентов больных описторхозом в гиперэндемичном очаге. Сообщение 4. Трансплацентарная передача антигенов Opisthorchis felineus // Мед. паразитология и паразитар. болезни. 1991. № 3. С. 42–44.
- Кузнецова В. Г. Патогенетические механизмы и особенности клиники последствий перенесенного описторхоза: Автореф. дис. … док. мед. наук. Новосибирск, 2000.
 31 с.
31 с. - Николаева Н. И., Николаева В. П., Гигилева А. В. Описторхоз. Этиология, клиника, диагностика, лечение // Российский паразитологический журнал. 2005. № 5. С. 23–26.
- Пальцев А. И. Хронический описторхоз с позиций системного подхода. Клиника, диагностика, патоморфоз, лечение // РМЖ. 2005. № 2. С. 96–101.
- Калюжина М. И. Состояние органов пищеварения у больных в резидуальный период хронического описторхоза: Автореф. дис. … докт. мед. наук. Томск, 2000. 53 с
- Святенко И. А., Белобородова Э. И. Особенности клинико-эндоскопической картины гастроэзофагеальной рефлюксной болезни при хроническом описторхозе // Сибирский медицинский журнал. 2010. № 1. С. 41–44.
В. Г. Кузнецова, доктор медицинских наук, профессор
Е. И. Краснова1, доктор медицинских наук, профессор
Н. Г. Патурина, кандидат медицинских наук
ГБОУ ВПО НГМУ МЗ РФ, Новосибирск
1 Контактная информация: [email protected]
11.08.2017 Чем опасен описторхоз?
Описторхоз – одно из самых распространенных паразитарных заболеваний человека. Это гельминтное заболевание, вызываемое плоскими паразитическими червями класса сосальщиков или, как их ещё называют, двуустками. У человека поражаются печень и желчевыводящие пути. Дело может дойти до инфекционных заболеваний, например, до гепатита. Или даже до онкологии. Заразиться можно, съев сырую, термически плохо обработанную речную рыбу, икру.
За семь месяцев текущего года в нашей поликлинике выявлено три больных описторхозом. Заразившиеся были выявлены в ходе проведения профилактического осмотра – по результатам анализа кала.
Как пояснила врач-инфекционист поликлиники Елена Шестакова, для нашей области описторхоз — актуальное заболевание. Заразиться можно и привозной рыбой семейства карповых, и выловленной в местных водоемах. Для нашей местности характерно употребление в пищу такой рыбы, как карп, карась, красноперка, щука, язь и других. Вся эта рыба может представлять опасность. Поэтому крайне важно знать об особенностях заболевания, его признаках, а самое главное – о мерах профилактики. Обо всем этом и рассказала Елена Евгеньевна.
Заразиться можно и привозной рыбой семейства карповых, и выловленной в местных водоемах. Для нашей местности характерно употребление в пищу такой рыбы, как карп, карась, красноперка, щука, язь и других. Вся эта рыба может представлять опасность. Поэтому крайне важно знать об особенностях заболевания, его признаках, а самое главное – о мерах профилактики. Обо всем этом и рассказала Елена Евгеньевна.
Как же паразиты попадают к человеку?
Ленточные черви с длиной тела от 8 до 18 мм и шириной от 1 до 2 мм сначала находятся в моллюсках и речной рыбе, а затем переходят к постоянным носителям — человеку или домашним животным. Источником размножения паразитов в реке являются улитки. А затем двуустка заселяется в рыбу. Человек съедает зараженную рыбу, и паразиты попадают в желчный пузырь, а потом в печень. Приблизительно через две недели они становятся половозрелыми и приступают к откладыванию яиц.
Как болезнь протекает
Это заболевание может протекать в средней, легкой и тяжелой форме. Легкая форма характеризуется плохим самочувствием, слабостью, обильной потливостью и незначительным повышением температуры. Средняя форма заболевания протекает с повышением температуры тела до 40 градусов и выше и с симптомами поражения верхних дыхательных путей. Признаки тяжелой формы заболевания проявляются резко: больной чувствует сильный озноб, общую слабость, может появиться сыпь, наблюдаются расстройства органов пищеварения, головная боль, ломота в мышцах и суставах, кашель, резкие боли в животе, температура тела повышается до 40 градусов. Спустя 2-4 недели состояние больного стабилизируется. Это связано с тем, что наступает хронический описторхоз. Это сопровождается серьезным поражением желчевыводящих путей, печени. Могут развиться панкреатит, холецистит и гастрит. Может произойти нарушение работы сердечно-сосудистой и нервной систем. Хронический описторхоз может сопровождаться и сильнейшей аллергией.
Надо помнить, что описторхоз – хроническое заболевание. Когда болезнь только начинается, то её очень сложно распознать, а переход из одной формы в другую происходит очень быстро.
Когда болезнь только начинается, то её очень сложно распознать, а переход из одной формы в другую происходит очень быстро.
Уберечься от последствий можно, если вовремя распознать проживание паразита в организме и немедленно приступить к квалифицированному лечению под строгим наблюдением врачей. Лечение описторхоза требует комплексного подхода. Наряду с приемом специфических противогельминтных средств врач предпринимает меры, направленные на восстановление нарушенной работы органов желудочно-кишечного тракта.
Как избежать заболевания
Но лечение этого заболевания – дело сложное и длительное. Поэтому важно предпринять все профилактические меры, чтобы избежать заражения. Для этого надо правильно рыбу приготовить.
Не менее важно, покупая рыбу, тщательно ее осмотреть и убедиться, что внутри нет паразитов, а запах и вид -нормальные.
Употреблять в пищу можно только хорошо прожаренную и проваренную, а также тщательно просоленную рыбу. Кроме того, следует обеззараживать продукт при помощи его глубокой заморозки.
Варить, жарить рыбу семейства карповых следует порционными кусками. Время ее приготовления должно быть не менее 20 минут с момента закипания бульона, начала жарки. И готовить рыбу в кастрюле или на сковороде лучше с закрытой крышкой. Рыбные пельмени необходимо варить дольше 5 минут. В процессе жарки котлет из карпа или его кусков необходимо следить за тем, чтобы каждая сторона продукта находилась в кипящем жиру не менее ¼ часа. Мелкую рыбу можно обрабатывать на плите в целом виде также не менее 15-25 минут. Рыбные пироги желательно выпекать около часа.
Для соления на 1 килограмм рыбы нужно брать не менее 300 грамм соли. Тёплым раствором рыбу солят не менее двух недель. Вяленую рыбу нужно засолить, а после выдерживать не менее трёх недель
Ни в коем случае нельзя употреблять в пищу сырую рыбу или пробовать рыбный фарш. Недопустимым является и кормление домашних питомцев сырой рыбой.
Во время разделки рыбы надо пользоваться специально отведёнными для этих целей кухонными принадлежностями.
Категорически запрещается выбрасывать на мусорные свалки и в водоемы отходы переработки рыбы, а также скармливать их животным, в том числе домашним, без предварительного обеззараживания.
Сегодня в мире выявлено более 21 миллиона человек, болеющих описторхозом. В нашей стране насчитывается более двух миллионов людей, пораженных этим паразитозом. Без соответствующего лечения организм человека приобретает множество сопутствующих болезней, победить которые не так просто. Однако своевременное выявление паразитов и качественное лечение поможет полностью избавиться от этой болезни. Но лучше всего вовсе постараться избежать этого заболевания. Сделать это можно, соблюдая перечисленные нами санитарно-гигиенические требования и правила.
Осторожно – описторхоз!
Реки и озера Тюменской области богаты рыбой. Являясь ценным продуктом питания, она может передавать тяжелое заболевание – описторхоз.
Описторхоз – паразитарное заболевание, вызываемое плоскими червями – описторхами. Они живут в печени, поджелудочной железе, желчном пузыре человека и ряда домашних и диких животных (кошки, собаки, водяной полевки, лисицы, ондатры).
Особенностью описторхоза является хроническое течение. В большинстве случаев развитие заболевания не сопровождается развитием острых симптомов. Описторхоз часто маскируется под другие заболевания, например аллергию, астму, вегетососудистую дистонию. Человек может годами лечить больные суставы, а истинной причиной его недуга является описторхоз. Самые опасные осложнения нелеченного описторхоза — кисты поджелудочной железы, цирроз и злокачественная опухоль печени.
Сначала возбудители описторхоза вызывают отравление организма продуктами своей жизнедеятельности и аллергию. Затем повреждает желчные протоки — образуется множество кровоточащих, длительно незаживающих эрозий. Описторхоз создает благоприятные условия для развития вторичной инфекции. Похожие изменения происходят и в поджелудочной железе.
Заражение описторхозом происходит только при употреблении в пищу сырой или недостаточно проваренной, прожаренной, просоленной рыбы семейства карповых (язь, лещ, плотва, сорога, вобла, линь, пескарь, гольян, красноперка, жерех, голавль, верховка, уклея, густера, чехонь, белоглазка, синец и другие). В каждой рыбе может содержаться до нескольких тысяч личинок. Заразиться можно и при однократном употреблении необработанной рыбы. Иногда оказывается достаточным для заражения случайного попадания в пищу мелких кусочков рыбы, оставшихся на руках и кухонных предметах после разделки рыбы.
Малосоленая или слабовяленная рыба, приготовленная в домашних условиях, основная причина заражения описторхозом. При такой обработке личинки сохраняют жизнеспособность в ней в течение 2-3 недель.
К сожалению, вокруг описторхоза витает немало «легенд»: возможность заражения через воду, от больной кошки, при употреблении карася, сырка, щуки и других видов рыб, а также о вреде лечения. Все это не имеет никакого научного обоснования.
Заболевание отрицательно влияет на развитие организма. Больные описторхозом дети отстают в физическом развитии, отличаются слабой нервной системой, что проявляется в повышенной раздражительности, быстрой умственной утомляемости. У женщин, болеющих описторхозом с детства, могут быть осложнения в беременности и родах. Описторхоз является причиной развития аллергических заболеваний, хронических дерматозов (экзема, нейродермит), дисбактериозов, являются причиной развития бронхиальной астмы, снижают сопротивляемость организма к инфекционным заболеваниям.
Для того чтобы уберечься от заражения описторхозом, рекомендуем:
- Не приобретать рыбу в местах стихийных рынков, в точках несанкционированной торговли.
- Строго соблюдать правила обработки рыбы семейства карповых:
- Жарить рыбу мелкими кусками в течение 15-20 минут.
- Варить не менее 15-20 минут с момента закипания воды с рыбой.

- Рыбные пироги выпекать не менее часа.
- Солить, выдерживая в течение 14 суток, из расчета на 10 кг рыбы 2 кг соли.
- Вялить рыбу 3 недели, с предварительным трехсуточным посолом.
- Нельзя пробовать сырой рыбный фарш, а также рыбу во время посола, вяления.
- Разделочные доски и ножи после обработки рыбы нужно обязательно вымыть с мылом и ошпарить кипятком.
Замораживание при температуре минус 28°C убивает личинок через 41 час, при температуре минус 35°C– через 10 часов. При хранении рыбы в морозильной камере бытового холодильника личинки остаются жизнеспособными в течение месяца.
Важную роль в подтверждении диагноза имеет лабораторное исследование кала или желчи. При появлении признаков заболевания обязательно обращайтесь к врачу. В настоящее время медицина располагает эффективными средствами для лечения описторхоза.
Ваше здоровье в Ваших руках! Берегите себя и своих близких, и будьте здоровы!
Заместитель начальника ЦГСЭН МСЧ-врач Е.А.Лебедева
симптомы, лечение, причины болезни, первые признаки
Описание
Описторхозом называют паразитарное заболевание, которое вызывается плоским червем из класса сосальщиков.
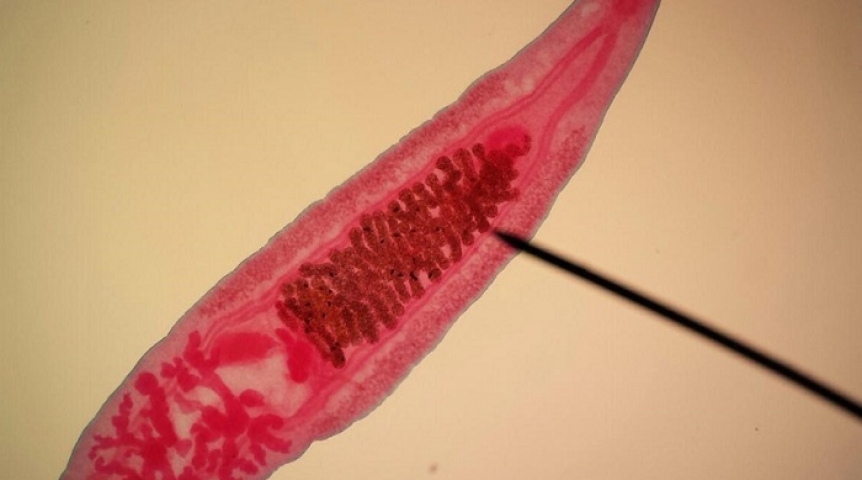
Внешне, червь небольших размеров: длина 4-20 мм, ширина 1-4 мм. Тело сосальщика окрашено в ярко-коричневый цвет. Имеет ланцетовидную форму. На теле у него находятся две присоски (брюшная и ротовая), с помощью которые он прикрепляется к тканям внутренних органов хозяина. Описторхи являются гермафродитами, поэтому для размножения достаточно всего двух червей. По достижению половой зрелости, описторхи способны выделять до 900 яиц в сутки.
Черви проходят сложный цикл развития, который включает в себя смену хозяев и несколько этапов развития. Источником паразита является зараженный человек или животное. С калом они выделяют яйца паразита, которые, попав воду, проглатываются моллюсками. Внутри моллюсков из яиц выходит личинка паразита, которая впоследствии выходит в открытый водоём, где проглатывается рыбами семейства карповых (карп, краснопёрка, язь, лещ, линь, сазан, пескарь и др. ). Личинка в рыбах закрепляется в мышечной и соединительной ткани, после чего превращается в метацеркарию – личинка, окруженная двуслойной оболочкой. В таком виде, спустя 6 недель, паразит способен к заражению животного. В организм человека и животных червь попадает при употреблении в пищу сырой, либо недостаточно термически обработанной рыбы. Попадая в желудок, капсула вокруг личинки растворяется, и червь проникает по ходу желудочно-кишечного тракта в желчные протоки, в том числе внутрипеченочные и поджелудочную железу. В гепатобилиарной системе черви питаются эпителием стенок протоков. Спустя месяц взрослые черви достигают половой зрелости и начинают выделять яйца, которые по ходу желудочно-кишечного тракта выделяются в окружающую среду.
). Личинка в рыбах закрепляется в мышечной и соединительной ткани, после чего превращается в метацеркарию – личинка, окруженная двуслойной оболочкой. В таком виде, спустя 6 недель, паразит способен к заражению животного. В организм человека и животных червь попадает при употреблении в пищу сырой, либо недостаточно термически обработанной рыбы. Попадая в желудок, капсула вокруг личинки растворяется, и червь проникает по ходу желудочно-кишечного тракта в желчные протоки, в том числе внутрипеченочные и поджелудочную железу. В гепатобилиарной системе черви питаются эпителием стенок протоков. Спустя месяц взрослые черви достигают половой зрелости и начинают выделять яйца, которые по ходу желудочно-кишечного тракта выделяются в окружающую среду.
Заболевание распространено на всей территории Евразии. Заболеваемость носит очаговый характер, с наибольшей концентрацией у водоёмов, которые заселены моллюсками С. inflata и C. troschelli, которые выступают в роли промежуточного хозяина. Непосредственно человек поражается тремя видами червей:
- Opisthorchis felineus – распространён в бассейнах рек на территории всей Европы и России до р. Обь.
- Opisthorchis felineus arvicola – распространён в Казахстане в бассейне реки Шидерты.
- Opisthorchis viverrini – встречается в странах Южной и Юго-Восточной Азии.
Симптомы
Фото: mc-n.ru
По форме, выделяют две формы заболевания: острая и хроническая.
Симптомы острого описторхоза начинают проявляться от нескольких дней до двух месяцев после заражения. Начало заболевания резкое, на фоне полного благополучия. Среди симптомов, как правило, на первый план выходит один из синдромов, поэтому необходимо проводить дифференциальную диагностику с инфекционными заболеваниями ЖКТ, лёгких и печени, а также болезнями хирургического профиля. Для острого описторхоза характерны следующие синдромы:
- Лихорадка, причем повышение температуры может быть разной степени выраженности (от 37° и до 40° по Цельсию).
 Лихорадочный синдром может сохраняться от нескольких дней до месяца.
Лихорадочный синдром может сохраняться от нескольких дней до месяца. - Гепатобиллиарный синдром. Проявляется болью в правом подреберье, вздутием живота, увеличением печени, тошнотой, рвотой, желтушностью кожных покровов. Желтуха часто сочетается с кожным зудом. Также будут наблюдаться явные изменения в биохимическом анализе крови. Гепатобиллиарный синдром связан с закупоркой глистами, слизью и слущенным эпителием выводных протоков печени и поджелудочной железы.
- Гастроэнтеральный синдром. Характеризуется изжогой, частым жидким стулом, урчанием в животе. Возможна локализованная боль по ходу кишечника.
- Бронхолегочной синдром. В начале заболевания возможны катаральные выделения из верхних дыхательных путей, к которым присоединяются покраснение зева, кашель с мокротой.
- Интоксикационный синдром. Больной чувствует слабость, недомогание, снижение аппетита, потливость, возможен озноб.
- Могут наблюдаться болевые синдромы различных локализаций: мышечная боль, суставная.
- Возможны высыпания мелкоточечного характера, красно-розового цвета, преимущественно на верхних конечностях, груди, животе и спине. После появления, сыпь держится около 10 дней, после чего бесследно исчезает.
- В отдельных случаях возможно развитие тяжелых осложнения токсико-аллергического характера – синдром Лайела, синдром Стивена-Джонсона, острый миокардит. Подобные проявления требуют немедленной специализированной медицинской помощи, поскольку могут привести к летальному исходу.
Хронический описторхоз характерен для лиц, длительное время проживающих в эпидемических очагах и молодых людей с хорошим иммунитетом. Зачастую, в хроническую стадию описторхоз переходит из острой, но возможно и скрытое начало заболевания. Проявления хронического описторхоза разнообразны, неспецифичны и не укладываются в какой-то один синдром. При переходе в хроническую стадию описторхоза в первую очередь пропадают симптомы интоксикации: температура нормализуется, проходят слабость, потливость, сыпь, суставные и мышечные боли беспокоят намного меньше или вовсе исчезают.
Из-за длительной инвазии червями, формируется аллергическая реакция, которая может проявляться кожным зудом, крапивницей, повторяющимся отеком Квинке, появлением аллергии на продукты питания, болью в суставах. Желтуха выражена у больных в разной степени и связана с развитием дискинезии желчевыводящих путей.
Самые частые жалобы связаны с периодически возникающим чувством тяжести и боли в правом подреберье, увеличением печени, отрыжкой, тошнотой и рвотой, не приносящей облегчения, особенно после употребления жирной пищи, вздутие живота, поносы. Боли в правом подреберье носят различный характер: тупые, давящие, колющие, постоянные или приступообразные, иногда сходны с коликой при желчекаменной болезни.
При длительной глистной инвазии возможно развитие панкреатита с развитием кист в поджелудочной железе. Спустя несколько лет, у людей с хроническим описторхозом, из-за длительного выделения продуктов жизнедеятельности в организм, могут наблюдаться изменения со стороны центральной и вегетативной нервных систем. Такой человек становится раздражительным, плаксивым, нарушается сон, появляются с заметной частотой вегето-сосудистые кризы. Со стороны психики отмечаются ипохондрический, депрессивный и психопатические синдромы. В отдельных случаях, психоневрологические симптомы выходят на первый план, что ведет к несвоевременной диагностике и неверному лечению. Среди осложнений хронического описторхоза выделяют абсцесс печени, перитонит и гепатоцеллюлярный рак.
Диагностика
Фото: parazity.com
В диагностике описторхоза важно уточнить у больного, занимается ли он рыбалкой, выезжал ли в последнее время в речные районы, употреблял ли в пищу плохо обработанную или сырую рыбу и наличие заболевания у лиц, с которыми больной контактирует. При общем осмотре можно выявить сыпь в типичных местах (верхняя часть туловища, верхние конечности), желтушность кожи и иктеричность склер, увеличение печени и болезненность при пальпации в правом подреберье и эпигастрии.
Лабораторная диагностика заключается в выявлении в общем анализе крови увеличение лейкоцитов, эозинофилии (маркер аллергических реакций и гельминтной инвазии), нарастание скорости оседания эритроцитов. В биохимическом анализе крови явное повышение печеночных ферментов (АЛТ, АСТ, ЩФ, ГГТ) и билирубина.
Важную роль играет проведение серологических проб. С помощью иммуноферментного анализа с использованием описторхозного антигена в сыворотке крови больных выявляются противоописторхозные антитела классов G и M. В некоторых случаях возможны ложноположительные результаты анализа, при наличии у больного других паразитарных заболеваний (эхинококкоз, дифиллоботриоз, аскаридоз и т. д.)
Специальные методы исследования для исключения глистной инвазии называются гельминтоовоскопическими. Суть методики заключается в поиске яиц глистов в отделяемых жидкостях. Непосредственно для описторхоза, имеет значение поиск яиц под микроскопом с использованием специальных красителей в кале и дуоденальном содержимом, забор которого делают во время ФГДС.
Для уточнения диагноза назначаются методы инструментальной диагностики. Фиброгастродуоденоскопия показывает функциональное состояние желудка, луковицы двенадцатиперстной кишки и сфинктера Одди (место в просвете двенадцатиперстной кишки, где выходит общий желчный проток)
Ультразвуковое исследование используется для уточнения состояния и наличия воспаления желчевыводящих протоков.
При неясной клинической картине могут потребоваться проведение рентгенографии, МРТ, КТ органов брюшной полости.
Лечение
Фото: s3.amazonaws.com
Лечение включает в себя три этапа. На подготовительном этапе устраняют симптомы аллергической реакции, холестаза, диспепсических нарушений и прочих симптомов, вызваных глистной инвазией. На этом этапе большое значение имеет восстановление нормального функционирования желчевыделительной системы. Длительность подготовительного этапа определяется тяжестью заболевания, его формой и длительностью, а также наличием сопутствующих заболеваний.
Второй этап лечения – специфическая химиотерапия. На этом этапе больному дают препарат, который фатально действует исключительно на глистов. В результате лечения, черви погибают и благодаря перистальтике кишечника выходят из организма. К сожалению, при гибели, глисты выделяют различные вещества в организм, из-за чего появляются симптомы интоксикации и аллергии.
Третий этап – реабилитация. В течение 3-4 месяцев проводят мероприятия, направленные на восстановление функции гепатобилиарной системы и желудочно-кишечного тракта. Производят периодический контроль кала на наличие яиц гельминтов.
Критериями выздоровления считаются трёхкратные отрицательные исследования кала или дуоденального содержимого на яйца гельминтов и стойкое снижение антител в серологическом анализе.
Лекарства
Фото: expertdent.net
Для устранения аллергической реакции применяют препараты группы блокаторов Н1-гистаминовых рецепторов (Лоратадин, Цитеризин, Клемастин, Хлороперамин).
Для устранения спазма желчевыводящих путей и связанного с ним болевого синдрома применяют спазмолитические (Дротаверин, Папаверин, Метамизол, Мебеверин), желчегонные препараты (Урсодезоксихолевая кислота, Адеметионин). Такие препараты назначаются с начала лечения и применяют не менее трёх месяцев.
При наличии показаний, возможно назначение препаратов, усиливающих перистальтику кишечника (Метоклопрамид, Домперидон), а также ферментов поджелудочной железы (Креон, Панкреатин), пробиотических препараты (Линекс, Бифиформ, Хилак) и препаратов для эрадикационной терапии.
Для химиотерпии используют противогельминтное средство — Прозиквантел. Препарат широкого спектра действия, применяется не только при описторхозе, но и при иных глистных инвазиях. Воздействует на мускулатуру паразитов, вызывая паралич. Курс лечения 2 дня, за которые пациент принимает 6 доз препарата. Противопоказанием к назначению являются беременность и острые осложнения описторхоза.
В реабилитационный период назначаются пробиотики, гепатопротекторы (Фосфолипиды, Тиоктовая кислота, Адеметионин), минеральные лечебно-столовые воды. Период реабилитации нацелен на полное восстановление организма.
Период реабилитации нацелен на полное восстановление организма.
Народные средства
Фото: alcogolizm.com
Для профилактики заражения рекомендуем следовать следующим советам, чтобы обеззаразить рыбу:
- Не употреблять в пищу сырую рыбу, особенно из незнакомых водоёмов;
- Варить рыбу в кипящей воде не менее 20 минут;
- Жарить в большом количестве масла не менее 15 минут на каждой стороне, желательно небольшими кусками;
- Блюда из рыбного фарша (тефтели, котлеты и т. д.) кипятить и жарить не менее 15 минут, выпекать в духовом шкафу минимум 1 час;
- Засаливать рыбу следует из расчёта 200 грамм соли на 1 килограмм рыбы, не менее двух недель;
- Вялить рыбу следует также из расчёта 200 грамм соли на кг рыбы, не менее двух недель, вне зависимости от вымачивания;
- При замораживании рыбы весом до 1 килограмма при температуре -28оС обеззараживание происходит в течение полутора суток, при температуре -35оС потребуется 10 часов. В бытовых холодильниках, к сожалению, личинки паразитов сохраняют жизнеспособность более месяца;
- Для горячего копчения необходима температура +75-80оС в течение минимум 2 часов.
Ваши комментарии о симптомах и лечении
Описторхоз — Инфекционные болезни — Справочник Merck Professional Edition
Описторхоз — это инфекция, вызванная Opisthorchis viverrini (печеночная двуустка из Юго-Восточной Азии) или O. felineus (кошачья двуустка), которые заражаются зараженной сырой или недоваренной рыбой.
Сосальщики — это плоские черви-паразиты, которые поражают различные части тела (например, кровеносные сосуды, желудочно-кишечный тракт, легкие, печень) в зависимости от вида.
Описторхоз, вызванный O.viverrini встречается в основном на северо-востоке Таиланда, Лаоса и Камбоджи; O. felineus встречается в основном в Европе и Азии, включая бывший Советский Союз.
Жизненный цикл Opisthorchis требует как улиток, так и рыб. Болезнь человека напоминает клонорхоз и передается при употреблении в пищу сырой или недоваренной пресноводной рыбы, содержащей инфекционные метацеркарии (стадия инцистирования). Собаки, кошки и другие рыбоядные млекопитающие также являются окончательными хозяевами. После проглатывания метацеркарии удаляются и поднимаются через ампулу Фатера в желчные протоки, где они прикрепляются к слизистой оболочке и созревают.Взрослые двуустки вырастают до 5-10 мм на 1-2 мм ( O. viverrini ) или от 7 до 12 мм на 2-3 мм ( O. felineus ).
Большинство инфекций носят субклинический характер. Симптомы описторхоза включают неопределенный желудочно-кишечный дискомфорт, диарею и запор. При хронической инфекции симптомы могут быть более серьезными; может присутствовать гепатомегалия и недостаточное питание. Редкие осложнения включают холецистит, холангит и холангиокарциному (рак желчных протоков [1]). Ветераны Вьетнама, у которых развивается холангиокарцинома, могли быть инфицированы О.viverrini или Clonorchis sinensis , когда они служили в Юго-Восточной Азии (2).
Диагноз — описторхоз при обнаружении яиц в кале. Ультрасонография, КТ, МРТ, холангиография или эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ) могут показать аномалии желчевыводящих путей.
Препарат для лечения описторхоза является одним из следующих вариантов:
Празиквантел 25 мг / кг перорально 3 раза в день в течение 2 дней
Альбендазол 10 мг / кг перорально 1 раз в сутки в течение 7 дней
Инфекцию можно предотвратить, приготовив пресноводную рыбу.
Общие ссылки
1. Xia J, Jiang SC, Peng HJ: Связь между инфекцией печеночного двуустника и патологическими изменениями гепатобилиарной системы: систематический обзор и метаанализ. PLoS One 10 (7): e0132673, 2015. doi: 10.1371 / journal.pone.0132673. eCollection 2015.
2. Псевдос Г., Форд Ф.М., Хонг С.Т.: Проверка ветеранов Вьетнама США на заражение печеночной двуусткой через 5 десятилетий после окончания войны.Инфекционные болезни в клинической практике 26 (4): 208–210, 2018. DOI: 10.1097 / IPC.0000000000000611.
Лекарственные средства, указанные в этой статье
| Название лекарства | Выберите Торговлю |
|---|---|
Празиквантел | БИЛЬТРИЦИД |
Альбендазол | АЛЬБЕНЗА |
Щелкните здесь для обучения пациентов
Описторхоз — обзор | Темы ScienceDirect
124.1 Описторхоз и клонорхоз
Введение
Описторхоз и клонорхоз вызываются печеночными двуустками из рода Opisthorchiadae и Clonorchiadae . Тремя наиболее распространенными видами, вызывающими заболевания у людей, являются Opisthorchis viverrini, O. felineus и Clonorchis sinensis .
Эпидемиология
Opisthorchis viverrini является эндемиком Юго-Восточной Азии, в основном Таиланда, Лаосской Народно-Демократической Республики, южной части Вьетнама и Камбоджи.Распространенность на северо-востоке Таиланда составляла 90% в 1980-х годах и остается около 20%, несмотря на меры контроля. Opisthorchis felineus эндемичен в России и Восточной Европе, а C. sinensis распространен в Корее, Китае и северном Вьетнаме. В эндемичных районах дети в возрасте от 1 года были инфицированы O. viverrini .
Естествознание, патогенез и патология
Люди являются случайным хозяином O. viverrini, O.felineus и Clonorchis sinensis . Употребление в пищу сырых или недоваренных карповых рыб (например, карпа), содержащих метацеркарию — инфекционную стадию этих сосальщиков, — приводит к инфицированию. Метацеркария, выделяющаяся в кишечнике, перемещается через ампулу Фатера в общий желчный проток к желчному пузырю и периферическим желчным протокам в печени и превращается во взрослых червей (рис. 124.1). Взрослые черви выделяют яйца, которые выводятся с калом. Попав в пресную воду, из яиц вылупляются мирацидии, которые поглощаются улитками, в которых происходит размножение паразитов.Церкарии выходят из улиток и заражают восприимчивых пресноводных рыб, инцистируя их как метацеркарии.
Присутствие взрослых червей в желчных протоках вызывает хроническое раздражение; черви также выделяют токсичные метаболические вещества. Иммунный ответ приводит к инфильтрации эозинофилами и мононуклеарными клетками в перидуктальных областях; могут возникнуть вторичные бактериальные инфекции. Наблюдается десквамация эпителиальных клеток желчных протоков, гиперплазия эпителиальных клеток и пролиферация желез (рис. 124.2). Внутрипеченочные желчные протоки расширяются с появлением булавы на дистальной части и кистозными изменениями.Желчный пузырь может быть расширен и содержать белесую желчь [1], а на его стенке могут быть видны гипертрофированные эпителиальные клетки. Степень тяжести патологии зависит как от интенсивности, так и от продолжительности инфекции. Хронические изменения в сочетании с эндогенными и экзогенными канцерогенами, особенно с нитрозаминами, вызывают мутагенные изменения в эпителии желчных протоков и могут привести к холангиокарциноме.
Клинические признаки
Острые симптомы чаще встречаются при инфекции C. sinensis и O. felineus и редко встречаются при инфекции O.viverrini . Высокая температура, артралгия, миалгия, увеличение лимфатических узлов, эозинофилия и, иногда, отек лица могут возникать через 2–3 недели инфекции во время миграции и развития глистов [2]. Поскольку черви еще не созрели, на этой стадии яйцеклетки в кале обнаруживаться не будут. Заболевание обычно длится 1-2 недели. Иногда наблюдается аллергический гепатит, особенно в тяжелых случаях.
Хронические инфекции обычно протекают бессимптомно. Большинство инфекций обнаруживается при обычном осмотре кала.В симптоматических случаях жалобами являются неспецифические симптомы, такие как усталость, анорексия, метеоризм, дискомфорт в животе, плохой аппетит и периодический жидкий стул. Своеобразное ощущение жара в правой верхней части живота — характерный симптом, обнаруживаемый при инфекции O. viverrini . При обследовании обнаруживается субфебрильная температура и гепатомегалия [3].
Осложнения, такие как рецидивирующий холангит или абсцесс, вызванные вторичными бактериальными инфекциями, часто встречаются при запущенной инфекции.Пациенты обращаются с лихорадкой, желтухой и болями в животе с гепатомегалией и увеличенным желчным пузырем. Холангиокарцинома тесно связана с инфекцией описторхиса и клонорхиса [4], особенно в сочетании с диетой с высоким содержанием нитрозаминов. Исследования на животных документально подтвердили, что у хомяков, инфицированных O. viverrini , развилась холангиокарцинома, когда они получали диету с высоким содержанием нитрозаминов [5].
Оценка пациента и дифференциальный диагноз
Поскольку пациенты с ранней или легкой инфекцией могут протекать бессимптомно, диагноз обычно основывается на обычном осмотре кала.Люди в эндемичных регионах, которые едят сырую рыбу и имеют неспецифические абдоминальные симптомы, должны ежегодно проходить обследование стула на предмет Opisthorchis или Clornorchis ova. Однако эти яйцеклетки трудно отличить от сосальщиков, присутствующих в тонком кишечнике [6]. Пациенты с инфекцией кишечного сосальщика обычно страдают хронической водянистой диареей.
Острый описторхоз или клонорхоз отличаются от острого фасциолеза, острого шистосомоза и других тканевых паразитов по анамнезу и эпидемиологии.
На поздних стадиях заболевания пациенты могут иметь механическую желтуху, холангит или холангиокарциному; другие причины механической желтухи, такие как камни желчных путей, должны быть исследованы.
Диагноз
Обследование кала на Opisthorchis или Clonorchis ova — стандарт для диагностики. Другие образцы, которые можно использовать для обнаружения яйцеклеток, — это двенадцатиперстная жидкость или желчь, взятые с помощью эндоскопической ретроградной холангиопанкреатографии (ЭРХПГ) или во время операции.
Серология может использоваться для диагностики острой инфекции, но не помогает при хронической инфекции или повторном инфицировании в эндемичных районах, так как положительные антитела сохранятся после лечения. Обнаружение со-проантигена можно использовать как «тест на излечение» после лечения.
ПЦР позволяет обнаружить ДНК Opisthorchis в образцах фекалий и отличить ее от кишечных сосальщиков с высокой чувствительностью и специфичностью. Это также полезно для эпидемиологических обследований [7].
Ультрасонография печени и желчного пузыря на ранних стадиях инфекции обычно показывает увеличенный нефункционирующий желчный пузырь с осадком.Инфекции на более поздних стадиях могут проявляться расширением внутрипеченочных желчных протоков или образованием. Новообразование в печени с расширением желчных протоков внутри очага поражения свидетельствует о холангиокарциноме. Холангиография проводилась до того, как стала доступна компьютерная томография (КТ) или магнитно-резонансная томография (МРТ). Могут быть визуализированы расширенные внутрипеченочные желчные протоки с дистальной булавой (рис. 124.3), а также случайные дефекты наполнения из-за наличия взрослых сосальщиков (рис. 124.4). КТ или МРТ полезны для определения стадии холангиокарциномы.
Лечение
Opisthorchis viverrini
Празиквантел — препарат выбора. При дозе 25 мг / кг массы тела перорально три раза в течение 1-2 дней показатель излечения составил 100% [8]. Однократная доза 40 мг / кг перед сном дала 91–95% излечение, тогда как доза 50 мг / кг дала 97% излечение, но с более высокой частотой нежелательных явлений [9, 10]. Поэтому для массового лечения рекомендуется празиквантел в дозе 40 мг / кг.
Альбендазол в дозе 400 мг два раза в день в течение 3–7 дней показал частоту излечения только 40–63% [11].
Clonorchis sinensis
Празиквантел эффективен при клонорхозе. Двадцать пять мг / кг три раза в день в течение 1 дня дают 85% излечение, в то время как та же доза, вводимая в течение 2 дней, излечивает до 100%. Однократная доза 40 мг / кг дала только 25% излечение [12].
Пациенты со вторичным холангитом должны лечиться противомикробными препаратами. При раннем обнаружении холангиокарцинома может быть удалена. Однако при позднем обнаружении паллиативное лечение путем оттока желчи может помочь облегчить симптомы механической желтухи.Прогноз для этих пациентов плохой, поскольку химиотерапия или лучевая терапия обычно не эффективны при холангиокарциноме.
Профилактика и контроль
Тщательное приготовление рыбы — лучший способ предотвратить заражение. Это должно быть обеспечено посредством непрерывного санитарного просвещения в эндемичных районах. Меры борьбы с помощью программ массового лечения и улучшения санитарии могут снизить распространенность.
Описторхоз: упущенная опасность
Образец цитирования: Огородова Л.М., Федорова О.С., Срипа Б., Мордвинов В.А., Катохин А.В., Кейзер Дж. И др.(2015) Описторхоз: упущенная опасность. PLoS Negl Trop Dis 9 (4): e0003563. https://doi.org/10.1371/journal.pntd.0003563
Редактор: Малкольм К. Джонс, Университет Квинсленда, АВСТРАЛИЯ
Опубликовано: 2 апреля 2015 г.
Авторские права: © 2015 Огородова и другие. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника
Финансирование: Международная научная конференция «Описторхоз» .Незаметная опасность »(14-15 апреля 2014 г .; Томск, Российская Федерация) при поддержке ООО« Пфайзер », Российского фонда фундаментальных исследований (грант № 14-04-060094; грант НК 14-04-31752 / 14) и Правительство Томской области. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Я ознакомился с политикой журнала, и у авторов этой рукописи есть следующие конкурирующие интересы: OYK работает в коммерческой компании Pfizer LLC.Это не влияет на нашу приверженность всем политикам PLOS NTD в отношении обмена данными и материалами.
Предпосылки
Группа гельминтозов, вызванных печеночными двуустками семейства трематод Opisthorchiidae, недавно стала предметом обсуждения на встрече, на которой ученые из России, Юго-Восточной Азии, Европы и США собрались в городе Томск на западе страны. Сибирь (Россия) создаст Томский консорциум по профилактике орхоза (TOPIC). Эта инициатива запускает платформу для повышения осведомленности, усиления комплексного контроля и проведения исследований забытого инфекционного заболевания, поражающего население не только в тропических регионах Восточной Азии, но также в умеренных и полуарктических регионах Европы и Азии [1 ].
Важными для человека Opisthorchiidae являются Opisthorchis felineus , Opisthorchis viverrini и Clonorchis sinensis , каждое из которых имеет дискретное, хотя и иногда перекрывающееся, географическое распространение: O . felineus является эндемиком Европы и России; С . sinensis в Китае, Республике Корея и северном Вьетнаме; и O . viverrini в Юго-Восточной Азии. Вместе они затрагивают более 45 миллионов человек во всем мире [2].Заражение человека O . felineus возникает в результате употребления в пищу сырой или недоваренной пресноводной рыбы, несущей метацеркарии паразита. Проглоченные личинки развиваются дальше и мигрируют в желчные протоки посредством хемотаксиса, где взрослые черви питаются желчным эпителием и содержимым желчи. Взрослые черви сбрасывают яйца, которые попадают в желудочно-кишечный тракт и выбрасываются с фекалиями во внешнюю среду. Пресноводные улитки семейства Bithyniidae глотают яйца, и после выхода мирацидиев из яиц внутри улитки проходит несколько стадий развития до тех пор, пока не разовьются церкарии.Распадающиеся церкарии могут проникать в пресноводных рыб, где они проникают в кожу или плоть [3].
В пределах рода Opisthorchis , O . felineus — это вид с наивысшим зоонозным потенциалом, который имеет важное значение не только для ветеринарии, но и для поддержания передачи вируса человеку даже при высоких гигиенических стандартах, при которых риск заражения пресной воды человеческими фекалиями низок [4]. Заболевания, связанные с описторхозом, в основном гепатобилиарны, в частности, возникают из-за фиброза желчных протоков и холангита, и выражаются в различных проявлениях, таких как механическая желтуха, гепатомегалия, боли в животе и тошнота [5].Важно отметить, что есть исследования на животных моделях, подтверждаемые другими эпидемиологическими данными, которые указывают, что O . viverrini и C . Инфекции sinensis могут привести к холангиокарциноме, обычно неизлечимому и, следовательно, смертельному раку желчных протоков [6,7], что привело к отнесению этих паразитов к канцерогенам Группы 1 Международным агентством по изучению рака [1 , 8,9]. Несмотря на неоспоримую важность этих инфекций для общественного здравоохранения, как с точки зрения числа инфицированных людей во всем мире, так и с точки зрения клинического воздействия, органы здравоохранения, грантовые агентства и фармацевтическая промышленность уделяют им относительно мало внимания.После плодотворной работы в Таиланде, Корее, а позже в Китае, Лаосе и Камбодже, где ряд исследований прояснили ситуацию в отношении эпидемиологии, патогенеза и контроля, произошел постепенный рост осведомленности. Примечательно, что информация о последовательности генома этих печеночных двуусток становится все более доступной, например, на сайте www.trematode.net [10]. Однако остаются важные пробелы и, в частности, мало информации относительно O . кошачий .
Поэтому была предпринята инициатива организовать встречу в Томске, городе, расположенном в регионе Западной Сибири, который является высоко эндемичным по O . felineus [4,11], и объединяет многопрофильных исследователей, работающих над Opisthorchiidae и инфекциями, вызываемыми этими переносимыми рыбами печеночными двуустками. Это событие приветствовала многонациональная фармацевтическая компания Pfizer, которая поддержала встречу и признала важность заражения O . felineus как запущенная угроза здоровью в России. Встреча была направлена на то, чтобы осветить текущую деятельность общественного здравоохранения и исследования болезней, вызываемых Opisthorchiidae, и, в частности, выявить пробелы в наших знаниях об эпидемиологии, клиническом профиле, лечении и фундаментальных механизмах взаимодействия паразит-хозяин.
Ученые, представившие и обсудившие результаты своих исследований, охватили широкий спектр тем, включая эпидемиологию и клинические аспекты этих инфекций, а также аспекты взаимодействия паразита и хозяина и молекулярную биологию этих паразитов.
Эпидемиология, клинические признаки и лечение
Объем имеющихся данных по эпидемиологии Opisthorchiidae в основном основан на исследованиях, проведенных на инфекциях, вызванных O . viverrini , и все чаще с C . sinensis , в котором собирались и собираются надежные данные в Юго-Восточной Азии для картирования эндемичных регионов и количественной оценки степени заболеваемости, связанной с инфекциями [2]. Питер Одерматт из Швейцарского института тропиков и общественного здравоохранения обсудил важность этой инфекции в сельских районах Таиланда, Лаоса, Камбоджи и Вьетнама [12].В частности, инфекция широко распространена в Лаосе, где инфицировано более половины населения; в высокоэндемичных деревнях инфицировано 70% населения. На основании микроскопии установлено, что 50% населения некоторых деревень Лаоса инфицировано O . viverrini , частота инфицирования возрастает с возрастом [13]. Была обнаружена тесная корреляция между потреблением рыбы и преобладанием O . viverrini в общинах в сельских районах Лаоса, где могут быть инфицированы 23 различных вида рыб в этом регионе, а в некоторых деревнях до 60% некоторых из этих видов рыб несут метацеркарии [14].Обследование кошек и собак, которые часто являются совместным проживанием в домохозяйствах, показало, что 30% этих домашних животных были инфицированы O . viverrini и, таким образом, может способствовать усилению передачи этих паразитов человеку. Более того, глубоко укоренившаяся в культуре привычка к употреблению блюд из сырой рыбы является серьезной проблемой для общественного здравоохранения [15].
Данные, собранные о клинических симптомах, предоставили исчерпывающее представление о заболеваниях, связанных с O . viverrini , в котором сообщается, что увеличение интенсивности инфекции и многопаразитарной инфекции было связано с увеличением зарегистрированных симптомов дискомфорта в животе и болезней в эндемичных сообществах [16–18]. Использование ультразвукового исследования в полевых условиях позволило провести широкомасштабное обследование жителей пострадавших деревень, чтобы точно определить аномалии, связанные с инфекцией [19]. В обследованной инфицированной популяции нормальные гепатобилиарные изображения обычно не наблюдались, тогда как легкая и тяжелая патология с расширением желчных протоков была зарегистрирована у значительной части взрослого населения в сельской местности [20].
Связь между O . viverrini и холангиокарцинома, или рак желчных протоков, обсуждались Банчобом Срипой из Университета Кхон Каен, Таиланд. Мало того, что самый высокий уровень заболеваемости этим раком желчных протоков в мире наблюдается в Северо-восточном Таиланде, где O . viverrini высоко эндемичен, но есть также убедительные доказательства на моделях с экспериментальным заражением лабораторных грызунов, демонстрирующие тесную связь между печеночной двуусткой и раком [21].Принимая во внимание, что есть также значительные доказательства ассоциации C . sinensis и рак желчного протока, пока неизвестно, является ли O . felineus разделяет эту особенность, и в этой области необходимы дальнейшие исследования [1].
Продолжаются попытки понять факторы риска развития тяжелой заболеваемости, включая рак желчных протоков: может иметь значение коинфекция с другими паразитарными или вирусными (печеночными) инфекциями или курением.Для точного картирования паразитарной инфекции и факторов риска заболеваемости, включая биомаркеры холангиокарциномы, необходимы крупные многоцентровые и межстрановые исследования. Дистанционное зондирование и пространственная байесовская статистика, позволяющая картировать инфекцию на основе геофизических характеристик эндемичных районов, являются важными инструментами, позволяющими выявить социально-демографические и экологические факторы и, следовательно, подготовить крупномасштабные карты корреляции различных факторов риска и заболеваемости, в том числе желчи. рак протока [13].На биологическом уровне метаболический фенотип субъектов с риском развития холангиокарциномы с использованием биологических жидкостей объяснил Олег Майборода из Медицинского центра Лейденского университета, Нидерланды. Использование эффективных аналитических технологий, таких как масс-спектрометрия (МС) и спектроскопия ядерного магнитного резонанса (ЯМР), которые теперь более доступны, чем раньше, может быть полезным для раннего обнаружения, а также для понимания механизмов, которые приводят к развитию рака у инфицированных субъектов. .Другой областью применения технологий является идентификация метаболических профилей, специфичных для Opisthorchiidae, как это уже было сделано для других паразитарных инфекций [22–24], что затем может позволить разработать простые применимые в полевых условиях быстрые тесты.
В настоящее время лечение Opisthorchiidae основано на применении празиквантела в дозе 40 мг / кг массы тела. Данные, представленные Питером Одерматтом, указывают на то, что может потребоваться увеличение дозы празиквантела до 75 мг / кг, но при этом существует риск усиления побочных эффектов, что является важным фактором для соблюдения режима лечения в сообществе [25].Поиск новых методов лечения, которые были бы более эффективными и позволяющими снизить количество побочных эффектов, привел к появлению потенциальных новых лекарств, таких как трибендимидин [26–28].
Взаимодействие хозяин-паразит
Был обсужден ряд основных механизмов взаимодействия паразит-хозяин в отношении патологии и персистенции. Banchob Sripa представил данные о способности ряда паразитических молекул управлять неконтролируемым ростом клеток-хозяев и, таким образом, объяснить возможную связь между O . viverrini и рак желчного протока. Такие молекулы, как гранулин паразитарного происхождения, который приводит к пролиферации желчных и других клеток млекопитающих [29], или ферменты паразитарного происхождения тиоредоксин (TRX) и тиоредоксинпероксидаза (TPX), которые предотвращают апоптоз, могут быть вовлечены в стимуляцию неконтролируемого роста клетки-хозяева [3]. Более того, есть данные, указывающие, что O . viverrini Экстракты способны стимулировать воспалительные цитокины, такие как IL-6 и IL-8, холангиоцитами человека, мононуклеарными клетками периферической крови, и что более высокий уровень IL-6 наблюдается у инфицированных пациентов с раком желчных протоков по сравнению с таковыми. без [30–32].Вместе эти данные поднимают вопрос о том, обладают ли другие Opisthorchiidae сильными провоспалительными свойствами, которые объясняют повышенный риск рака при заражении этими трематодами и открывают возможности для профилактики.
Связан с воспалительным ответом, индуцированным O . viverrini , Пол Бриндли из Университета Джорджа Вашингтона, Вашингтон, округ Колумбия, США, обсудил изменение микробиома кишечника и желчи инфицированных хозяев. Он представил результаты, которые показывают, что инфекция O . viverrini модифицировал микробиом кишечника хомяков. Это исследование обнаружило неожиданное присутствие сообществ очень избранных видов бактерий в желчи инфицированных хомяков. Интересно, что ряд видов экологических бактерий, которых не ожидается в микрофлоре кишечника, по всей видимости, попали в желчь вместе с O . Виверрини . Могут ли эти микробы играть важную роль в развитии хронического воспаления желчных путей? Эти виды бактерий не похожи на эндосимбиотические виды Neorickettsia , которые, как известно, связаны с трематодами в целом [33].Тем не менее, учитывая, что лабораторное загрязнение может повлиять на анализ микробиома на основе последовательностей, особенно при анализе биологических жидкостей, отличных от содержимого кишечника и фекалий, и там, где микробиота может быть скудной [34], эти результаты необходимо будет подтвердить в других условиях. Если действительно O . viverrini метацеркарии и / или развивающихся взрослых двуусток переносят экологические или экзотические микробы в желчное дерево, стойкие воспалительные реакции на эту микробиоту, связанную с двуустками, могут быть ключевым фактором в развитии рака [3,19,21,35].Этот отчет подготовил почву для исследований на людях, чтобы проверить, могут ли действовать аналогичные механизмы.
Основной иммунологический профиль людей, инфицированных этими паразитами, был предметом презентаций Ольги Федоровой из Сибирского государственного медицинского университета и Марии Язданбахш из Медицинского центра Лейденского университета, Нидерланды. По сравнению с другими паразитическими гельминтами, относительно мало сделано для иммунологического профилирования людей, инфицированных Opisthorchiidae, особенно за пределами O . viverrini инфекций [30]. Иммуноэпидемиологические исследования в Томской области сравнивали субъектов, инфицированных и инфицированных O . felineus указал, что существует перекос Th3, о чем свидетельствует повышенный уровень IgE у инфицированных субъектов по сравнению с неинфицированными, но что уровни намного ниже, чем те, которые были обнаружены в исследованиях зараженных гельминтами субъектов в Гане, где широко распространен шистосомоз, или в Индонезии в сообщества с геогельминтными инфекциями.Это могло быть следствием того, что интенсивность заражения у O ниже. felineus инфицированных субъектов и что в полуарктических регионах Западной Сибири коинфекций с другими гельминтами гораздо меньше. Однако также возможно, что антигенный состав O . felineus менее способен вызывать ответы Th3. Некоторые доказательства этого получены в исследованиях in vitro, в которых дендритные клетки человека культивировали с O . felineus приводит к меньшему перекосу Th3 по сравнению с тем, когда дендритные клетки культивировали с антигенами Schistosoma mansoni [36].
Искажение иммунных ответов в отношении Th2, Th3 и регуляторных Т-клеток может иметь важное значение для понимания иммунопатологических процессов, а также развития рака, связанного с инфекцией. Ряд исследований людей, хронически инфицированных, например, шистосомами или геогельминтами, показал индукцию регуляторных Т [37,38] и В-клеток [39] этими паразитами. Эти иммунные регуляторные клетки могут участвовать в подавлении ответов на неродственные антигены [40,41].Исследование, проведенное в Томской области, показало обратную связь между O . felineus и ответы на аллергены [11], подтверждая мнение о том, что было бы целесообразно исследовать, способны ли Opisthorchiidae индуцировать регуляторные клетки. Это особенно важно также из-за возможной связи с развитием рака. Прогноз рака плохой, если в опухолях обнаружены регуляторные Т-клетки, а ряд исследований на экспериментальных моделях показал, что регуляторные Т-клетки связаны с более быстрым ростом опухоли [42,43].Ли O . viverrini и C . sinensis несут молекулы, которые способны индуцировать регуляторные Т- или В-клетки. Недавно было показано, что экскреторные / секреторные (E / S) антигены нематоды Heligmosomoides polygyrus вызывают сильные регуляторные Т-клеточные ответы. Нейтрализация этих E / S антигенов привела к полной элиминации червей [44]. Этот захватывающий подход также можно рассматривать для создания иммунитета к Opisthorchiidae, а также для борьбы с ассоциированным раком желчных протоков.
Презентация Тирумалайсами Велавана, представителя Института тропической медицины Тюбингенского университета, Германия, указала на важность исследований, касающихся врожденных иммунных компонентов системы комплемента и его взаимодействия с Opisthorchiidae. О . felineus имеет внешний синцитиальный цитоплазматический слой в качестве тегументов, как и у других трематод. Более ранние исследования показали, что эти оболочки трематод состоят из остатков D-маннозы / D-глюкозы, N-ацетил-D-глюкозамина / сиаловой кислоты, D-галактозы и остатков N-ацетил-D-галактозамина на гликокаликсе взрослого человека. тегумент и выражены на всех этапах развития.Эти гликоконъюгаты служат в качестве патоген-ассоциированных молекулярных паттернов (PAMP) для иммунного распознавания и последующего опосредованного комплементом уничтожения [45–47]. Ранее было показано, что два элемента распознавания врожденного иммунитета системы комплемента, маннозо-связывающий лектин и фиколины, влияют на исход инфекции в S . haematobium , вызывающий рак мочевого пузыря [48,49]. Кроме того, было установлено, что функциональные варианты этих генов MBL2, и FCN2 модулируют уровни циркулирующей сыворотки и способность связывания с поверхностью паразита, что приводит к нарушению распознавания [50].Следовательно, исследование белков лектинового пути во время инфекции Opisthorchis может помочь лучше понять взаимодействия между хозяином и паразитом во время установления активной инфекции.
Действительно, вопрос генетической регуляции восприимчивости к Opisthorchiidae и генетического контроля развития ассоциированной патологии требует внимания. Максим Фрейдин из Научно-исследовательского института медицинской генетики, Россия, и Королевского госпиталя Бромптон, Великобритания, представил результаты пилотного исследования взаимодействия генов с окружающей средой в Томской популяции, в результате которого было идентифицировано O . felineus как важный модификатор ассоциаций между Th2 / Th3-регулирующими генами и аллергическим заболеванием. В частности, было показано, что O . Инфекция felineus снижает риск атопической бронхиальной астмы, связанной с полиморфизмом генов SOCS5, и IFNG [4]. Было обнаружено, что экспрессия аллель-специфического гена изменена присутствием O . felineus , тем самым обеспечивая функциональный ключ к механизмам идентифицированного взаимодействия ген-среда.Эти исследования образуют парадигму для оценки того, контролируется ли тканевая патология / развитие рака воспалением в результате взаимодействия генов и окружающей среды.
Диагностика
Попытки использовать молекулярные подходы для обнаружения O . felineus в исследованиях на базе больниц в Европе, где инфекции обнаруживаются спорадически [51]. Презентация Василия Петренко из Медико-биологического союза и Института цитологии и генетики, Новосибирск, Россия, показала многообещающие результаты по обнаружению четырех двуусток Opisthorchiidae, O . felineus , в частности, методом ПЦР в реальном времени на основе Taqman с высокой степенью чувствительности и специфичности при работе с фекалиями хомяков, инфицированных местными штаммами. Эти результаты требуют крупномасштабных валидационных исследований, аналогичных текущей деятельности по молекулярной диагностике O . viverrini и C . sinensis и надежное распознавание O . felineus инфекция [2]. Применимость этих тестов в полевых условиях обсуждалась с точки зрения предоставления диагностических тестов в местах оказания медицинской помощи.Тирумалайсами Велаван представил новый молекулярный диагностический подход для быстрого обнаружения паразитов с использованием метода изотермической амплификации, опосредованной петлей (LAMP) [52]. Эти методики были установлены для O . viverrini нацеливается на внутренний транскрибируемый спейсер 1 (ITS1) в рибосомной ДНК для специфической амплификации [53]. Методики LAMP просты, чувствительны, специфичны и быстрее, чем ПЦР, требуют минимальной обработки и инструментов, а результаты доступны при считывании невооруженным глазом.Разработка такой методологии LAMP для O . felineus в настоящее время устанавливается.
Биология паразитов и лекарственные мишени
Исследовательская группа Института цитологии и генетики в Новосибирске под руководством Алексея Катохина провела филогеографические генетические исследования двуусток Opisthorchiidae с целью сравнения их генетического разнообразия и истории видов [54]. Эти исследования нацелены на объяснение выраженных различий в способности трех сосальщиков паразитировать у разных млекопитающих и пролить свет на степень зооноза у разных видов [2].Эти исследования могут помочь интегрированным программам контроля и углубить наше фундаментальное понимание биологических процессов.
Мария Пахарукова и Вячеслав Мордвинов из Института цитологии и генетики Новосибирска представили данные о структуре и функциональной организации системы биотрансформации ксенобиотиков в O . felineus [55]. Система участвует, вероятно, в О . felineus метаболизм и транспорт эндогенных и экзогенных субстратов.Важно отметить, что цитохром P450 дифференциально экспрессируется в течение жизненного цикла O . felineus и присутствует в O . felineus в большем количестве, чем O . Виверрини . Вопрос в том, может ли это иметь какое-либо отношение к синтезу провоспалительных и потенциально канцерогенных соединений, например оксистерин-подобных, катехол-эстроген-хиноноподобных и т. Д., Выделяемых сосальщиками [56,57]. Были также представлены новые данные об исследованиях эффектов празиквантела в O . felineus модель хомяка и in vitro на молодых и взрослых червях, в частности, о подвижности паразитов, жизнеспособности и повреждении тегумента после обработки празиквантелом.
Заключительные замечания: призыв к расширению консорциума
Представленные и обсужденные данные привели нас к выводу, что существует множество групп с совпадающими интересами и соответствующими знаниями, которые готовы работать вместе для достижения общей цели борьбы с инфекциями, вызываемыми двуусткой печени, и связанными с ними инфекциями. патологии по всему миру.Самое главное, было подчеркнуто, что это отправная точка для приглашения других групп, активно работающих в области исследований печеночных двуусток, присоединиться к Томскому консорциуму по описторхозу, связавшись с Людмилой Огородовой из Сибирского государственного медицинского университета, Томск, Россия (topic.consortium@gmail .com). В частности, поскольку было ограниченное обсуждение текущего состояния исследований в области клонорхоза, специалисты в этой области также будут особенно приветствоваться.
Лаборатория исследования тропических болезней Университета Кхон Каен имеет успешную программу контроля, так называемую «модель Лава», основанную на использовании подхода EcoHealth в районе озера Лава на северо-востоке Таиланда [58].Было решено, что эта модель контроля будет взята за образец и модифицирована в соответствии с местными системами здравоохранения и культурными особенностями в других эндемичных районах, но не будет отличаться по сути с привлечением трансдисциплинарного участия и участия заинтересованных сторон на всех уровнях.
Один из первых вопросов, который необходимо решить, — это понять пробел в знаниях о распространенности O . felineus в России и масштабы связанной с ней заболеваемости; в частности, является ли O .Инфекция felineus связана с повышенным риском рака желчных протоков. Параллельно с этим проводятся мероприятия, которые способствуют более быстрой разработке проверенных диагностических тестов для точного обнаружения O . Инфекция felineus будет стимулироваться, а эффективность лечения применяемыми в настоящее время лекарствами будет проверена, а группы будут работать вместе, чтобы укрепить научные и технические навыки, необходимые для понимания взаимодействия паразита и хозяина с точки зрения иммунопатогенеза и регуляции.Наконец, всеобъемлющие фундаментальные молекулярно-биологические усилия по выявлению новых мишеней для лекарств или новых профилактических и терапевтических мер будут стимулироваться путем объединения опыта и обмена биологическим материалом, доступным в рамках Консорциума.
Консорциум должен работать и расширяться в рамках нескольких параллельных совместных исследовательских мероприятий / рабочих пакетов, изображенных в дорожной карте высокого уровня (рис. 1), таких как: бремя / серьезность и контроль со стороны сообщества; клинические исследования; биология и экология паразитов; взаимодействие паразит-хозяин; передача знаний / технологий.
Рис. 1. График / мероприятия высокого уровня консорциума.
1. Сибирский государственный медицинский университет, Томск, Российская Федерация, 2. Центр протеомики и метаболомики, Медицинский центр Лейденского университета, Лейден, Нидерланды, 3. Кафедра паразитологии и Лейденской группы иммунологии паразитов, Медицинский центр Лейденского университета, Лейден, Нидерланды, 4. Медицинский центр Университета Джорджа Вашингтона, США, 5. Институт цитологии и генетики СО РАН, Новосибирск, Российская Федерация, 6.Институт тропической медицины Тюбингенского университета, Германия, 7. Университет Кхон Каен, Кхон Каен, Таиланд, 8. Pfizer LLC, Москва, Российская Федерация, 9. Фонд ReMedys, Женева, Швейцария, 10. Королевский госпиталь Бромптон, Великобритания; Научно-исследовательский институт медицинской генетики, Томск, Российская Федерация, 11. Швейцарский институт тропиков и общественного здравоохранения, Базель, Швейцария.
https://doi.org/10.1371/journal.pntd.0003563.g001
Эти мероприятия подробно описаны в плане проекта, находящегося в стадии разработки.Успех Консорциума будет измеряться по результатам исследований, а в долгосрочной перспективе — по применимости этих результатов в обществе. Таким образом, необходимо уделять внимание передаче технологий через все доступные и возможные механизмы, сокращая разрыв между фундаментальными исследованиями и индустриализацией. Чтобы обеспечить планирование, создание, координацию, продвижение, достижение основных этапов и, наконец, передачу результатов знаний / технологий, приоритетное внимание будет уделяться наличию на борту опыта в области управления программами и индустриализации.Это может быть сделано через организации с промышленным опытом, такие как Pfizer и ReMedys Foundation, которые уже входят в число учредителей Консорциума. (Pfizer стремится положительно влиять на здоровье людей во всем мире. Стратегия корпоративных социальных инвестиций Pfizer направлена на использование всего спектра ресурсов компании — людей, навыков, опыта и финансирования — для расширения доступа к лекарствам и улучшения медицинского обслуживания населения. малообеспеченные люди во всем мире [http: // www.pfizer.com/responsibility/global_health/global_health]. ReMedys — это некоммерческая организация, основанная экспертами в области биофармацевтической промышленности, которая намеревается внедрить новый, основанный на сотрудничестве подход, устраняющий разрыв между трансляционными исследованиями и разработками [R&D]. ReMedys выступает в качестве переводческого подразделения НИОКР и центра для ведущих исследовательских институтов, групп пациентов и клиницистов. Создавая и координируя индивидуальные союзы, ориентированные на пациента, ReMedys объединяет все ресурсы, необходимые для развития, и делает доступными для пациентов с высокими неудовлетворенными потребностями многообещающие терапевтические проекты [http: // correys.нетто].)
Члены-основатели Консорциума подписали Меморандум о взаимопонимании, который будет доступен для подписания исследовательским группам, заинтересованным в том, чтобы стать новыми членами.
Общая программа должна регулироваться соглашением о Консорциуме, которое находится в стадии разработки, к которому должны быть приглашены новые члены для присоединения и участия. Финансирование Консорциума должно быть обеспечено за счет мероприятий, связанных с национальными и международными грантами, участниками. Как описано, Консорциум стремится участвовать в стратегическом совместном исследовании серьезного, но крайне запущенного инфекционного заболевания, которое несет ответственность за тяжелое социально-экономическое бремя, включая рак.Исследование также должно быть сосредоточено на уязвимых группах населения, таких как дети, и, следовательно, ожидается, что результаты будут иметь большое социально-экономическое воздействие. Таким образом, Консорциум с соответствующими инструментами может повысить осведомленность общественности через пациента, врача, исследователя, спонсора гранта и правительство. Такое понимание должно способствовать его финансированию также через общественные, благотворительные, международные НПО; партнерство с корпоративной ответственностью; и так далее. Следует изучить другие механизмы финансирования, такие как краудфандинг, в которых могут участвовать все члены Консорциума.
Ссылки
- 1. Обзор канцерогенов человека. Монографии МАИР по оценке канцерогенных рисков для человека / Всемирная организация здравоохранения, Международное агентство по изучению рака IARC (2012) Биологические агенты. Том 100 Б. 100: 1–441. pmid: 23193840
- 2. Petney TN, Andrews RH, Saijuntha W., Wenz-Mücke A, Sithithaworn P (2013) Зоонозные, переносимые рыбами печеночные двуустки Clonorchis sinensis , Opisthorchis felineus и Opisthorchis viverrini .Int J Parasitol 43: 1031–46. pmid: 23978669
- 3. Срипа Б., Бриндли П.Дж., Малвенна Дж., Лаха Т., Смаут М.Дж., Майианг Э. и др. (2012) Онкогенный печеночный сосальщик Opisthorchis viverrini — множественные пути к раку. Trends Parasitol 28: 395–407. pmid: 22947297
- 4. Салтыкова И.В., Огородова Л.М., Брагина Е.Ю., Пузырев В.П., Фрейдин М.Б. (2014) Инвазия печеночной двуустки Opisthorchis felineus — фактор окружающей среды, изменяющий генетический риск атопической бронхиальной астмы.Acta Trop 139: 53–56. pmid: 25017311
- 5. Кейзер Дж., Утцингер Дж. (2009) Трематодозы пищевого происхождения. Clin Microbiol Rev 22: 466–483. pmid: 19597009
- 6. Thunyaharn N, Promthet S, Wiangnon S, Suwanrungruang K, Kamsa-ard S (2013) Выживаемость пациентов с холангиокарциномой на северо-востоке Таиланда после поддерживающего лечения. APJCP 14: 7029–32. pmid: 24377644
- 7. Лим JH (2011) Печеночные двуустки: болезнь, которой не уделяется должного внимания. Корейский журнал J Radiol 12: 269–79.pmid: 21603286
- 8. Bouvard V, Baan R, Straif K, Grosse Y, Secretan B и др. (2009) Обзор канцерогенов человека. Часть B: биологические агенты. The Lancet Oncology 10: 321–322. pmid: 19350698
- 9. де Мартель С., Ферли Дж., Франчески С., Винья Дж., Брей Ф., Форман Д. и др. (2012) Глобальное бремя рака, связанного с инфекциями, в 2008 г .: обзор и синтетический анализ. Ланцет Онкол 13: 607–615. pmid: 22575588
- 10. Мартин Дж., Роза Б.А., Озерский П., Холлсворт-Пепин К., Чжан Х, Бхонагири-Палсикар В. и др.(2015) Helminth.net: дополнения к Nematode.net и введение в Trematode.net. Nucleic Acids Res. 28 января; 43 (выпуск базы данных): D698–706. pmid: 253
- 11. Огородова Л.М., Фрейдин М.Б., Сазонов А.Е., Федорова О.С., Гербек И.Е., Черевко Н.А. и др. (2007) Пилотный скрининг распространенности атопических состояний и описторхоза и их взаимосвязи у жителей Томской области. Parasitol Res 101: 1165–1168. pmid: 17549516
- 12. Сититаворн П., Эндрюс Р.Х., Ван Де Н, Вонгсарой Т., Синуон М., Одерматт П. и др.(2012) Текущее состояние описторхоза и клонорхоза в бассейне реки Меконг. Паразитол Инт 61: 10–6. pmid: 218
- 13. Форрер А, Вунацу П., Саясон С., Вонгхачак Й., Буакхасит Д., Фогт С. и др. (2012) Пространственное распределение и факторы риска инфекции Opisthorchis viverrini в Южном Лаосе. PloS Negl Trop Dis 6: e1481. pmid: 22348157
- 14. Sayasone S, Odermatt P, Phoumindr N, Vongsaravane X, Sensombath V, Phetsouvanh R и др.(2007) Эпидемиология Opisthorchis viverrini в сельском районе южной части Лаосской Народно-Демократической Республики. Trans R Soc Trop Med Hyg 101: 40–7. pmid: 16828134
- 15. Xayaseng V, Phongluxa K, van Eeuwijk P, Akkhavong K, Odermatt P (2013) Потребление сырой рыбы в эндемичных для печеночных двуусток районах в сельской местности на юге Лаоса. Acta Trop 127: 105–111. pmid: 23567553
- 16. Sayasone S, Vonghajack Y, Vanmany M (2009) Разнообразие кишечных гельминтозов человека в Лаосской Народно-Демократической Республике. Trans R Soc Trop Med Hyg 103: 247–54.pmid: 111
- 17. Sayasone S, Mak TK, Vanmany M, Rasphone O, Vounatsou P, Utzinger J, et al. (2011) Гельминтозы и кишечные простейшие инфекции, множественный паразитизм и факторы риска в провинции Тямпасак, Лаосская Народно-Демократическая Республика. PLoS Negl Trop Dis 5: e1037. pmid: 21532735
- 18. Sayasone S, Rasphone O, Vanmany M, Vounatsou P, Utzinger J, Tanner M и др. (2012) Тяжелая заболеваемость, вызванная инфекцией Opisthorchis viverrini и Schistosoma mekongi в Лаосской Народно-Демократической Республике.Clin Infect Dis 55: e54–7. pmid: 22670046
- 19. Майианг Э., Лаха Т., Бетони Дж. М., Думхамроп Б., Кеукес С., Сититхаворн П. и др. (2012) Ультрасонографическая оценка патологий гепатобилиарной системы у 3359 пациентов с инфекцией Opisthorchis viverrini в эндемичных районах Таиланда. Parasitol Int 61: 208–211. pmid: 21771664
- 20. Ayé Soukhathammavong P, Rajpho V, Phongluxa K, Vonghachack Y, Hattendorf J, Hongvanthong B и др. (2015) От легкой до тяжелой гепатобилиарной заболеваемости, связанной с инфекцией Opisthorchis viverrini в Южном Лаосе.Acta Trop 141: 303–9. pmid: 25275346
- 21. Sripa B, Kaewkes S, Sithithaworn P, Mairiang E, Laha T, Smout M и др. (2007) Печеночная двуустка вызывает холангиокарциному. PLoS Med 4: e201. pmid: 17622191
- 22.
Ольшевский К.Л., Морриси Дж. М., Вилински Д., Бернс Дж. М., Вайдья А. Б., Рабиновиц Дж. Д. и др. (2009) Взаимодействие паразит-хозяин, выявленное метаболомикой Plasmodium falciparum . Клеточный микроб-хозяин 5: 191–9. pmid: 1
89 - 23. Ли Дж. В., Холмс Э., Сарич Дж., Кейзер Дж., Дирнхофер С., Утцингер Дж. И др.(2009) Метаболическое профилирование инфекции Schistosoma mansoni в тканях мышей с использованием спектроскопии ядерного магнитного резонанса с вращением под магическим углом. Int J Parasitol 39: 547–58. pmid: 1
18- 24. Балок К.И., Мейснер А., Горалер С., Бладергроен М.Р., Веннервальд Б.Дж., Майборода О.А. и др. (2011) Метабономическое исследование инфекции человека Schistosoma mansoni . Мол Биосист 7: 1473–80. pmid: 21336380
- 25. Ловис Л., Мак Т.К., Фонглюкса К., Айе Соукхатаммавонг П., Вонгхачак Ю., Кейзер Дж. И др.(2012) Эффективность празиквантела против Schistosoma mekongi и Opisthorchis viverrini : рандомизированное слепое исследование сравнения доз. PLoS Negl Trop Dis 6: e1726. pmid: 22848766
- 26. Soukhathammavong P, Odermatt P, Sayasone S, Vonghachack Y, Vounatsou P, Hatz C и др. (2011) Эффективность и безопасность мефлохина, артесуната, мефлохина-артесуната, трибендимидина и празиквантела у пациентов с Opisthorchis viverrini : рандомизированное исследовательское открытое исследование фазы 2.J Lancet Infect Dis 11: 110–8. pmid: 21111681
- 27. Keizer J, Adelfio R, Vargas M, Odermatt P, Tesana S (2013) Активность комбинированной терапии трибендимидина и празиквантела против печеночного двуустника Opisthorchis viverrini in vitro и in vivo. J Helminthol 87: 252–6. pmid: 228
- 28. Qian MB, Yap P, Yang YC, Liang H, Jiang ZH, Li W и др. (2013) Эффективность и безопасность трибендимидина против Clonorchis sinensis . Clin Infect Dis 56: e76–82.pmid: 23223597
- 29. Смаут М.Дж., Лаха Т., Малвенна Дж., Срипа Б., Суттипрапа С., Джонс А. и др. (2009) Гранулиноподобный фактор роста, секретируемый канцерогенными печеночными двуустками, Opisthorchis viverrini , способствует пролиферации клеток-хозяев. PLoS Pathog 5: e1000611. pmid: 19816559
- 30. Sripa B, Mairiang E, Thinkhamrop B, Laha T, Kaewkes S, Sithithaworn P и др. (2009) Расширенный перидуктальный фиброз в результате инфицирования канцерогенным печеночным двуустком человека Opisthorchis viverrini коррелирует с повышенным уровнем интерлейкина-6.Гепатология 50: 1273–1281. pmid: 19676135
- 31. Sripa B, Thinkhamrop B, Mairiang E, Laha T, Kaewkes S, Sithithaworn P и др. (2012) Повышенный уровень IL-6 в плазме связан с повышенным риском развития фиброза и холангиокарциномы у лиц, инфицированных Opisthorchis viverrini . PLoS Negl Trop Dis 6: e1654. pmid: 22629477
- 32. Ninlawan K, O’Hara SP, Splinter PL, Yongvanit P, Kaewkes S, Surapaitoon A и др. (2010) Opisthorchis viverrini экскреторные / секреторные продукты вызывают активацию толл-подобного рецептора 4 и продукцию интерлейкина 6 и 8 в холангиоцитах.Parasitol Int 59: 616–21. pmid: 20887801
- 33. Воан Дж. А., Ткач В. В., Грейман С. Е. (2012) Неориккетсиальные эндосимбионты дигенеи: разнообразие, передача и распространение. Adv Parasitol 79: 253–97. pmid: 22726644
- 34. Солтер С.Дж., Кокс М.Дж., Турек Е.М., Калус С.Т., Куксон В.О. и др. (2014) Загрязнение реагентов и лабораторий может критически повлиять на анализ микробиома, основанный на последовательностях. BMC Biol 12:87 pmid: 25387460
- 35. Плискатт Дж. Л., Динонпо Р., Малвенна Дж. П., Краузе Л., Срипа Б., Бетони Дж. М. и др.(2013) Инфекция канцерогенным печеночным сосальщиком Opisthorchis viverrini изменяет микробиом кишечника и желчных путей. FASEB J 27: 4572–4584. pmid: 234
- 36. Эвертс Б., Хуссаартс Л., Дриссен Н.Н., Мивиссен М.Х., Шрамм Г., ван дер Хам А.Дж. и др. (2012) Полученные из шистосом омега-1 стимулируют поляризацию Th3, подавляя синтез белка после интернализации рецептором маннозы. J Exp Med 24 209: 1753–67. pmid: 22966004
- 37. Watanabe K, Mwinzi PN, Black CL, Muok EM, Karanja DM, Secor WE и др.(2007) Уровни Т-регуляторных клеток снижаются у людей, инфицированных Schistosoma mansoni , при эффективном лечении. Am J Trop Med Hyg 77: 676–82. pmid: 17978070
- 38. Ваммес Л.Дж., Хамид Ф., Вириа А.Е., де Гье Б., Сартоно Э., Майзелс Р.М. и др. (2010) Регуляторные Т-клетки при геогельминтной инфекции человека подавляют иммунные ответы на БЦЖ и Plasmodium falciparum . Eur J Immunol 40: 437–42. pmid: 20063313
- 39. Finlay CM, Walsh KP, Mills KH (2014) Индукция регуляторных клеток паразитами гельминтов: использование для лечения воспалительных заболеваний.Immunol Rev 259: 206–30. pmid: 24712468
- 40. Майзельс Р.М., Язданбахш М. (2003) Иммунная регуляция паразитами-гельминтами: клеточные и молекулярные механизмы. Nat Rev Immunol 3: 733–44. pmid: 12949497
- 41. ван дер Влугт Л.Е., Лабуда Л.А., Озир-Фазалалихан А., Ливерс Э., Глодеманс А.К., Лю К.Ю. и др. (2012) Шистосомы индуцируют регуляторные функции в CD1d (hi) B-клетках человека и мыши: ингибирование аллергического воспаления с помощью IL-10 и регуляторных Т-клеток. PLoS One 7: e30883.pmid: 22347409
- 42. Chang WJ, Du Y, Zhao X, Ma LY, Cao GW (2014) Факторы, связанные с воспалением, предсказывающие прогноз рака желудка. Всемирный журнал J Gastroenterol 20: 4586–4596. pmid: 24782611
- 43. Номура Т., Сакагучи С. (2005) Естественно возникающие CD25 + CD4 + регуляторные Т-клетки в опухолевом иммунитете. Curr Top Microbiol Immunol 293: 287–302. pmid: 15981485
- 44. Ey PL (1988) Heligmosomoides polygyrus : задержка развития и задержка роста личинок антителами, специфичными к экскреторным / секреторным антигенам.Exp Parasitol 65: 232–43. pmid: 3350103
- 45. Апинхасмит В., Собхон П., Тарасуб С., Мотонг В., Сайтонгди П., Сретаругса П. и др. (2000) Opisthorchis viverrini : ультраструктура и цитохимия гликокаликса тегумента. J Helminthol 74: 23–29. pmid: 10831050
- 46. Klabunde J, Berger J, Jensenius JC, Klinkert MQ, Zelck UE, Kremsner PG и др. (2000) Schistosoma mansoni : адгезия маннан-связывающего лектина к поверхностным гликопротеинам церкарий и взрослых червей.Exp Parasitol 95: 231–239. pmid: 11038306
- 47. Talabnin K, Aoki K, Saichua P, Wongkham S, Kaewkes S, Boons GJ и др. (2013) Стадийно-специфическая экспрессия и антигенность гликанов гликопротеинов, выделенных из печеночной двуустки человека, Opisthorchis viverrini . Int J Parasitol 43: 37–50. pmid: 23174105
- 48. Ouf EA, Ojurongbe O, Akindele AA, Sina-Agbaje OR, Van Tong H, Adeyeba AO и др. (2012) Уровни фиколина-2 и генетический полиморфизм FCN2 как фактор восприимчивости при шистосомозе.Журнал Infect Dis 206: 562–70. pmid: 226
- 49. Энтони Дж.С., Оджуронгбе О, ван Тонг Х., Оуф Э.А., Энглейтнер Т., Акинделе А.А. и др. (2013) Лектин, связывающий маннозу, и восприимчивость к шистосомозу. J Infect Dis 207: 1675–1683. pmid: 23448728
- 50. Мэдсен Х.О., Гарред П., Тиль С., Курцхалс Дж. А., Ламм Л. Ю., Райдер Л. П. и др. (1995) Взаимодействие между промотором и вариантами структурного гена контролирует базальный сывороточный уровень маннан-связывающего белка. J Immunol 155: 3013–3020.pmid: 7673719
- 51. Pozio E, Armignacco O, Ferri F, Gomez Morales MA (2013) Opisthorchis felineus , новая инфекция в Италии и ее последствия для Европейского союза. Acta Trop 126: 54–62. pmid: 23337391
- 52. Port JR, Nguetse C, Adukpo S, Velavan TP (2014) Надежный и быстрый метод молекулярного обнаружения малярийных паразитов с использованием микроволнового излучения и петлевой изотермической амплификации. Малар Дж. 13: 454. pmid: 25421401
- 53.Arimatsu Y, Kaewkes S, Laha T, Hong SJ, Sripa B (2012) Быстрое обнаружение копро-ДНК Opisthorchis viverrini с использованием петлевой изотермической амплификации (LAMP). Parasitol Int 61: 178–82. pmid: 21871581
- 54. Брусенцов И.И., Катохин А.В., Брусенцова И.В., Шеховцов С.В., Боровиков С.Н., Гончаренко Г.Г. и др. (2013) Низкое генетическое разнообразие широко распространенного евразийского печеночного двуустки Opisthorchis felineus предполагает особую демографическую историю этого вида трематод.PLoS One 8: e62453. pmid: 23634228
- 55. Vale N, Gouveia MJ, Botelho M, Sripa B, Suttiprapa S, Rinaldi G и др. (2013) Канцерогенные оксистерины печеночного двуустки Opisthorchis viverrini , обнаруженные с помощью ЖХ-МС / МС-анализа растворимой фракции экстракта паразитов. Parasitol Int 62: 535–42. pmid: 23973383
- 56. Пахарукова М.Ю., Ершов Н.И., Воронцова Е.В., Катохин А.В., Меркулова Т.И., Мордвинов В.А. (2012) Цитохром P450 двуустки Opisthorchis felineus : идентификация и характеристика.Mol Biochem Parasitol 181: 190–4. pmid: 22115821
- 57. Коррейя да Коста Ж.М., Вале Н., Гувейя М.Дж., Ботельо М.С., Срипа Б., Сантос Л.Л. и др. (2014) Катехол-эстрогены, полученные из шистосом и печеночных двуусток, и раковые заболевания, связанные с гельминтами. Фронт Жене. 2014 23 декабря; 5: 444. pmid: 25566326
- 58. Sripa B, Tangkawattana S, Laha T., Kaewkes S, Mallory FF, Smith JF и др. (2015) К комплексной борьбе с описторхозом в Северо-Восточном Таиланде: проект Lawa. Acta Trop 141: 361–367.pmid: 25102053
[Полный текст] Описторхоз и холангиокарцинома в Юго-Восточной Азии: неразрешенная проблема
Thomas Hughes, 1, * Thomas O’Connor, 1, * Anchalee Techasen, 2,3 Nisana Namwat, 2,3 2,3 2,3 2,3 Watcharin Loilome, 2,3 Ross H Andrews, 2–4 Narong Khuntikeo, 3,5 Puangrat Yongvanit, 3,6 Paiboon Sithithaworn, 3,7 Simon D Taylor-Robinson 1
1 Отделение здоровья пищеварительной системы, Отделение хирургии и рака, Имперский колледж Лондона, Лондон, Великобритания; 2 Кафедра биохимии, медицинский факультет, Центр печеночной двуустки и холангиокарциномы, 3 Программа скрининга и лечения холангиокарциномы (CASCAP), Университет Хон Каен, Кхон Каен, Таиланд; 4 Медицинский факультет, кампус Святой Марии, Имперский колледж, Лондон, Великобритания; 5 Кафедра хирургии, 6 Кафедра биохимии, 7 Кафедра паразитологии, Медицинский факультет, Центр болезни печени и холангиокарциномы, Университет Кхон Каен, Кхон Каен, Таиланд
Резюме: Распространенность холангиокарциномы CCA) в Юго-Восточной Азии намного выше, чем в других регионах мира.Употребление в пищу сырых, ферментированных или недоваренных карповых рыб, инфицированных печеночной двуусткой, Opisthorchis viverrini sensu lato (sl), приводит к хроническому воспалению желчных путей, перидуктальному фиброзу и повышению риска рака. Может быть сопутствующий гломерулонефрит. Процесс заражения трудно прервать, потому что оказалось чрезвычайно трудно изменить привычки питания, а жизненный цикл двуустки не может быть нарушен из-за высокой распространенности у собак и кошек-резервуарных хозяев. Для диагностики описторхоза можно использовать анализ кала и иммуноферментный анализ.Диагностика ОСА является сложной, отчасти из-за отсутствия точных характеристик визуализации, но также из-за сложности получения образцов для цитологии или гистологии. Доказано, что этот рак устойчив к обычным химиотерапевтическим методам лечения, поэтому два возможных метода лечения — это хирургическая резекция и трансплантация печени, которые требуют раннего обнаружения опухоли для достижения наилучших шансов на успех. Позднее проявление симптомов снижает шансы на успешное хирургическое вмешательство.Хотя инфекции печеночного двуустки можно лечить с помощью празиквантела, люди часто инфицируются повторно, и множественные повторные инфекции могут быть более опасными, чем единичная длительная инфекция. Для ранней диагностики необходимы ключевые исследования по обнаружению и характеристике новых биомаркеров на всех этапах канцерогенного пути.
Ключевые слова: Opisthorchis viverrini , CCA, Таиланд, Лаос, лечение, паразиты, канцероген, общественное здравоохранение, гельминты
Биология Opisthorchis viverrini
Opisthorchis viverrini sl — это печеночная двуустка человека, которая в настоящее время поражает 10 миллионов человек в Северо-Восточном Таиланде и в Лаосской Народно-Демократической Республике. 1,2 Это комплекс видов, включающий множество генетически различных криптических видов (некоторые из которых морфологически идентичны), которые инфицируют различные генетические популяции улиток, связанные с конкретными речными заболоченными территориями. Таким образом, он упоминается как Opisthorchis viverrini sensu lato (sl) или O. viverrini sl. 3,4 Первыми промежуточными хозяевами в жизненном цикле (рис.1) являются улитка Bithynia , видовой комплекс, включающий по крайней мере 11 криптических видов, соответствующих O.viverrini sl. Следовательно, существует высокая степень генетической изменчивости в обоих комплексах видов, связанных с географическим положением (например, между водно-болотными угодьями реки Чи и водно-болотными угодьями реки Нам Нгум) 5 (Рисунок 2; Таблица 1).
Рисунок 1 Жизненный цикл Opisthorchis viverrini sensu lato.
Примечание: Предоставлено Nadda Kiatsopit.
Рис. 2 Карта речных водно-болотных угодий, показывающая географическое распределение скрытых видов улиток Bithynia .
Примечания: В таблице 1 перечислены места, отмеченные сокращениями. Воспроизведено с разрешения Saijuntha W., Sithithaworn P, Wongkham S, et al. Свидетельства видового комплекса трематоды пищевого происхождения Opisthorchis viverrini и возможной совместной эволюции с их первыми промежуточными хозяевами. Инт Дж Паразитол . 2007. 37 (6): 695–703. 3
Таблица 1 Подробная информация о местонахождении, из которого были обнаружены загадочные виды Bithynia
Примечания: Местоположение показано на Рисунке 2.Воспроизведено с разрешения Saijuntha W., Sithithaworn P, Wongkham S, et al. Свидетельства видового комплекса трематоды пищевого происхождения Opisthorchis viverrini и возможной совместной эволюции с их первыми промежуточными хозяевами. Инт Дж Паразитол . 2007. 37 (6): 695–703. 3
Эти улитки, Bithynia siamensis goniomphalos , Bithynia siamensis и Bithynia funiculata (Рисунок 1), являются первыми промежуточными хозяевами O.viverrini sl, до 8,37% которых могут быть инфицированы, хотя в большинстве регионов этот показатель составляет <1%. 5–8 После развития зрелых церкарий (личинок трематодных червей) они выходят из улитки-хозяина в воду и активно ищут вторичного промежуточного хозяина, рыб семейства Cyprinidae . 9 В течение 3 недель церкарии превращаются в инфекционные метацеркарии (инцистированные личинки). 10–12 Рыбы накапливают инфекционные метацеркарии, особенно в области головы и плавников, и имеют гораздо более высокую распространенность инфекции — от 42.От 9% (у Henicorhynchus lineatus ) до 100% (у Amblyrhynchichthys усекает ). 13 Люди могут заразиться, если они едят инфицированную карповую рыбу без достаточного нагревания мяса в сырых, частично приготовленных или ферментированных блюдах, таких как Koi Pla . 14,15 Блюда, подобные этому, имеют социальное и культурное значение, что затрудняет поощрение изменений в режимах питания. 16 Таким образом, повторное инфицирование является обычным явлением, несмотря на простоту лечения инфекции с помощью празиквантела. 17
Проглоченные метацеркарии вылупляются в двенадцатиперстной кишке, а затем перемещаются через общий желчный проток в дистальный желчный проток, где они созревают в течение 2 месяцев. 10,11 Собаки и представители семейства кошачьих действуют как резервуарные хозяева. Кошки, по-видимому, имеют более высокую распространенность инфекции, чем собаки (36,4% по сравнению с 3,8%), и это может быть связано со способом передачи. 18 Этих животных часто кормят остатками пищи (что соответствует традиционному образу жизни семей, поедающих сырую рыбу), и кошки, по-видимому, более склонны есть рыбьи головы и плавники, оставленные им. 18 Взрослые печеночные двуустки производят яйца в желчном пузыре, желчных протоках и протоках поджелудочной железы, которые попадают в пищеварительную систему с желчью и выводятся вместе с калом. Фекальное загрязнение воды, содержащей улиток Bithynia , является большой проблемой и вызывает завершение жизненного цикла (рис. 1). Хотя плохая санитария может быть основной причиной попадания фекалий человека в пресную воду, улучшения, скорее всего, не предотвратят продолжение передачи O. viverrini sl, поскольку резервуарные хозяева кошек и собак будут продолжать передавать яйца (Рисунок 1).
Путь холангиокарциномы (CCA), индуцированной Opisthorchis viverrini
Всемирная организация здравоохранения классифицировала O. viverrini sl как канцероген группы один из-за его роли в индукции CCA. 19,20 Первоначально инфекции, вызванные двуусткой, вызывают острое воспаление крупных желчных протоков и портальной соединительной ткани. 21 Однако было показано, что хронические инфекции и воспаление являются факторами риска развития множественных стадий канцерогенеза. 22 Несмотря на простоту лечения и массовое распространение противоглистного препарата, празиквантела, множественное повторное инфицирование является обычным явлением, а инфекции, как правило, носят хронический характер. 15
При хронических инфекциях в эпителии желчных протоков могут наблюдаться гиперплазия, аденоматозные образования и гранулематозное воспаление. 21 Они вызваны механическими травмами и продуктами обмена веществ двуустки. Оральные и вентральные присоски двуустки вызывают механические повреждения в процессе питания и миграции, что приводит к изъязвлению перидуктальной ткани.Это позволяет яйцам двуустки проникать в ткань, что, в свою очередь, вызывает гранулематозное воспаление ткани вокруг них. 15 Продукты метаболизма Fluke могут быть токсичными или иммуногенными и могут взаимодействовать с эпителием желчных протоков, вызывая гиперплазию. 23 Инфильтрация воспалительных клеток была связана с присутствием антигенов O. viverrini sl, в том числе в областях, где сами печеночные сосальщики не обнаружены (например, желчные протоки слишком малы в диаметре, чтобы они могли проникнуть). 15,21 Было высказано предположение, что это воспаление может быть опосредовано паразитоспецифическим воспалительным цитокином интерлейкином (ИЛ) -6, а позже было продемонстрировано, что повышенные уровни ИЛ-6 до O. связан с повышенным на 63% риском развития прогрессирующей PDF (симптом хронической инфекции O. viverrini sl и индикатор высокого риска развития CCA), и что у лиц в третьем квартиле по выработке IL-6 уровень выработки IL-6 на 127% выше риск развития продвинутой PDF, чем люди в первом квартиле производства IL-6. 17 В настоящее время хорошо известно, что хроническое воспаление, вызванное длительными или повторяющимися инфекциями, вызванными O. viverrini sl, играет большую роль в развитии многих факторов и событий, которые приводят к ОСА, в первую очередь повышенного производства оксид азота (NO). 24–27
NO, а также другие кислородные радикалы, такие как супероксид (O 2 — ), образуются в хронически воспаленных тканях (с использованием индуцибельной NO-синтазы или iNOS в случае NO) как иммунный ответ, направленный на уничтожение паразита. 25 Паразитоспецифические Т-клетки и цитокины активируют такие клетки, как макрофаги, тучные клетки, эозинофилы и эпителиальные клетки, для синтеза NO, который является цитотоксичным (повреждает клетки) и генотоксичным (повреждает ДНК). 28 Это в значительной степени является результатом образования активных форм кислорода и активных форм азота (ROS / RNS). NO может реагировать с супероксидом с образованием пероксинитрита (ONOO —), молекулы с высокой реакционной способностью, которая может вызывать окислительное и нитратное повреждение ДНК за счет образования аддуктов ДНК, таких как 8-оксо-7,8-дигидро-2′-дезоксигуанозин ( 8oxodG) и 8-нитрогуанин. 26 Это результирующее повреждение ДНК было связано с увеличением пролиферации клеток, вызванным накоплением ядерного антигена пролиферирующих клеток (PCNA) в эпителии желчных протоков (особенно при повторных инфекциях). 29 Также было показано, что NO дополнительно увеличивает возможность канцерогенеза за счет ингибирования репарации ДНК и ингибирования апоптоза. 30–32 Избыточное производство NO в результате длительной инфекции и воспаления O. viverrini sl может также увеличить потенциал эндогенного синтеза N-нитрозаминов, таких как канцерогенный N-диметилнитрозамин (NDMA ).Было показано, что эта реакция возникает в воспаленном желчном протоке. 28,33,34 Уровни NDMA были связаны с лимфопролиферативным ответом на антигены O. viverrini sl и могут быть обнаружены в моче инфицированных людей. 35
Другой эффект связанных с воспалением ROS / RNS — перекисное окисление липидов. Продукты окисления липидов (такие как транс-4-гидрокси-2-ноненаль) могут реагировать с основаниями ДНК с образованием аддуктов этено-ДНК 1, N 6 -этено-2′-дезоксиаденозин (εdA) и 3, N 4 -этено-2′-дезоксицитидин (εdC). 36 Эти поражения могут инициировать канцерогенез посредством специфических замен пар оснований и, как было показано, накапливаются в лейкоцитах O. viverrini sl-инфицированных индивидуумов вместе с 8-oxodG. 36 Присутствие аддуктов ДНК, 8oxodG и 8-нитрогуанина, в эпителии желчных протоков и присутствие NDMA в моче у O. viverrini sl-инфицированных людей исчезают с лечением празиквантелом, что сильно усиливает связь между ними. эффекты и О.viverrini sl инфекция. 35,37 Количество аддуктов ДНК, εdA и εdC, также значительно снижается при лечении противопаразитарными препаратами, и их также можно измерить в моче. 36 Было показано, что без лечения празиквантелом 8-нитрогуанин и 8-oxodG остаются в эпителии хомяков через 180 дней после заражения. 29 Однако было показано, что повторное инфицирование увеличивает скорость инфильтрации воспалительных клеток, экспрессию iNOS в эпителии, выработку NO и образование 8-нитрогуанина и 8oxodG при каждой повторной инфекции, что в конечном итоге увеличивает повреждение ДНК и риск развития рака. 29 Возникает вопрос, лучше ли лечить празиквантелом людей с высоким риском повторного заражения, поскольку он может принести больше вреда, чем пользы. У этого вопроса много социальных и моральных сложностей, но дополнительные исследования эффектов препарата и повторного заражения могут помочь приблизиться к поиску ответа.
Снижение иммунного ответа на хроническую инфекцию O. viverrini sl может частично помочь объяснить, почему множественное повторное инфицирование может быть более разрушительным, чем одна хроническая инфекция, но также предполагает, что происходит иммуносупрессия. 38 Со временем можно увидеть постепенное уменьшение воспаления с соответствующим увеличением PDF — одной из ключевых стадий и индикаторов риска развития ОСО. 29 На протяжении всего инфекционного процесса воспаления происходит прогрессирующее разрушение и ремоделирование эпителия желчных протоков, а также усиление синтеза коллагена типа I и типа III. 17,39 Связь PDF с повышенным риском развития CCA означает, что в Северо-восточном Таиланде наличие PDF используется для определения группы риска для расширенного планирования ультразвукового сканирования. 40
Взаимодействие между факторами риска
Риски для здоровья, связанные с образом жизни, и генетические полиморфизмы могут взаимодействовать с эффектами инфекции O. viverrini sl, усиливая потенциальные канцерогенные эффекты. На животных моделях инфекций O. viverrini sl было показано, что нитрозамины являются важным элементом холангиоканцерогенеза. 41 Диета в Северо-Восточном Таиланде, обычно содержащая ферментированную, сушеную или соленую рыбу и свинину, с высоким содержанием предварительно образованных нитрозаминов и, следовательно, может быть ключевой причиной высокой распространенности CCA, помимо риска содержания метацеркарий. 42 В Северо-восточном Таиланде также часто наблюдается высокий уровень их в колодезной воде. 43 Алкоголь и курение, особенно в сочетании друг с другом, могут усиливать канцерогенный эффект инфекции O. viverrini sl. Курение дополнительно вводит в организм нитрозамины, а также многие другие известные канцерогенные вещества. 44 Алкоголь влияет на метаболизм, распределение и канцерогенное действие нитрозаминов, тем самым создавая больший риск канцерогенеза для людей с высоким потреблением нитрозаминов. 45 Генетические полиморфизмы, такие как нулевой вариант фермента глутатион-S-трансферазы (GSTM1), также могут повышать риск рака в сочетании с инфекцией O. viverrini sl. Считается, что неэффективная форма этого фермента, выводящего канцерогены, приводит к увеличению выработки эндогенного нитрозамина у инфицированных O. viverrini sl — и к усилению канцерогенного эффекта. 43 Существует множество других заболеваний, поражающих желчевыводящие пути, которые связаны с заболеваемостью ОСА, например, первичный склерозирующий холангит, врожденный фиброполикистоз печени, аденомы желчных протоков, билиарный папилломатоз, гепатолитиаз и цирроз, и есть даже слабые связи с гепатитом. B и C. 46 Однако существует очень мало опубликованных исследований комбинированных эффектов, которые они могут иметь при инфекции O. viverrini sl. Еще одним новым фактором риска для CCA является воздействие асбеста. 47 Было бы интересно изучить степень воздействия, которое это могло оказать на Юго-Восточную Азию, особенно в связи с инфекцией O. viverrini sl. Дальнейшие исследования могут дать более полное представление о влиянии комбинации факторов риска на риск O.viverrini sl и, возможно, поможет сформировать образование и политику в этой области в Юго-Восточной Азии.
Коморбидность почек
Установлено, что почечные патологии развиваются вторично по отношению к гепатобилиарным патологиям. В исследовании с участием хомяков, инфицированных O. viverrini sl, мезангиопролиферативная гломерулопатия развивалась через 8 недель, за которой следовали тубулярная атрофия и фиброз, а также отложение амилоида, что совпало с PDF и CCA. 48 Одно исследование обнаружило иммуноглобулины к O.viverrini sl в моче, что свидетельствует о гломерулонефрите, и заключил, что IgG против O. viverrini sl может иметь потенциал в качестве биомаркера из-за положительной корреляции с прогрессированием заболевания. 49 Считается, что это вызвано отложением иммунных комплексов, приводящим к хемоаттракции лейкоцитов и воспалению, таким образом увеличивая размер пор клубочков. Чем больше размер пор, тем больше IgG достигает мочи до такого уровня, что он перегружает реабсорбционную способность проксимального канальца. 50,51 Этот аспект описторхоза заслуживает дополнительных исследований, чтобы можно было правильно диагностировать заболевание и лечить его как синдром.
Диагноз
Метод осаждения с помощью формалина и этилацетата (FECT) в настоящее время считается золотым стандартом для определения инфекции O. viverrini sl и использует микроскоп для подсчета любых яиц, присутствующих в фекалиях, и количественной оценки интенсивности инфекции в организме. яйца на грамм (epg). 52,53
FECT — это простая неинвазивная процедура, но требует наличия опытного микроскописта из-за частой низкой яйценоскости отдельных особей, а также нескольких образцов и повторов для уменьшения количества ложноотрицательных результатов. 52 Этот метод также основан на том, что паразиты достигли уровня зрелости, необходимого для выпуска яиц в желудочно-кишечный тракт, что приводит к низкой специфичности, поскольку яйца могут отсутствовать, несмотря на инфекцию O. viverrini sl. Кроме того, яйца O. viverrini sl можно легко спутать с яйцами других паразитов, таких как мелкие кишечные сосальщики, что приводит к ложноположительным результатам. 54 Таким образом, FECT часто используется вместе с твердофазным иммуноферментным анализом на основе моноклональных антител (mAb) (ELISA) или непрямым ELISA на антитела.
ИФАmAb выявляет антигенов O. viverrini sl в кале или копроантигены и является более чувствительным, чем FECT. Он не перекрестно реагирует с сосальщиками, в отличие от непрямого ELISA на антитела, но выявляет только текущие инфекции, тогда как непрямой ELISA на антитела может обнаруживать прошлые инфекции, поскольку антитела сохраняются в жидкостях организма после лечения празиквантелем. 55 Те, у кого в прошлом были инфекции, все еще подвержены риску CCA, поэтому непрямой иммуноферментный анализ антител полезен для идентификации этой когорты.
Непрямой иммуноферментный анализ антител используется, когда доступен только образец крови или мочи. Хотя уровни антител в сыворотке выше, моча является неинвазивной альтернативой, не требующей быстрой обработки или квалифицированного флеботомиста. 56 Оба теста ELISA более чувствительны к скудным инфекциям O. viverrini sl, чем FECT. Распространенность инфекции O. viverrini sl означает, что некоторые люди, вероятно, инфицированы глистами, которые еще не достигли зрелости и поэтому не выделяют яйца, что демонстрирует необходимость использования ELISA для подтверждения результата FECT и предотвращения ложноотрицательные. 57
Следующим шагом будет определение степени заболевания. Имеющиеся симптомы ОСО не могут обеспечить дифференциальный диагноз, поэтому для диагностики PDF и ОСА часто используются методы визуализации и эндоскопии. 58 Ультразвук является основным инструментом визуализации в Юго-Восточной Азии из-за его низкой стоимости и портативности. Он чувствителен к расширению желчных протоков и может обнаруживать PDF, но не злокачественные новообразования. Поэтому при обнаружении аномалий в больнице проводят МРТ и КТ. 59 И КТ, и МРТ могут определять злокачественность, но МРТ обеспечивает превосходное разрешение мягких тканей, может определять перидуктальную инфильтрацию и степень локализации опухоли, а также может идентифицировать небольшие поражения в большей степени, чем КТ. 60,61 Однако компьютерная томография стоит дешевле и поэтому широко используется в Юго-Восточной Азии в качестве альтернативы. 62 Эндоскопическая ретроградная холангиопанкреатография (ERCP) используется для визуализации билиарного дерева, а также получения желчных щеток и образцов желчи для гистопатологии и цитологии. 63,64 Однако фиброзная природа опухоли может привести к низкому результату сбора образцов, а ряд других ошибок выборки и интерпретации снижает специфичность этого метода. 65,66 Существует также терапевтическая ценность, поскольку можно использовать пластиковые или саморасширяющиеся металлические стенты, чтобы обеспечить дренаж желчных путей. 67 Магнитно-резонансная холангиопанкреатография (MRCP) — это сканирование с помощью магнитно-резонансной томографии, оптимизированное для желчевыводящих и панкреатических протоков, и его все чаще предпочитают в качестве диагностического теста выбора из-за его неинвазивной природы в отличие от ERCP. 68 Использование высокого содержания воды в желчи в качестве контрастного вещества, это отличный метод для оценки обструкции желчных путей и локализации поражений, но ERCP по-прежнему часто требуется для биопсии и установки стентов. 69
Всем доступным в настоящее время биомаркерам не хватает специфичности и чувствительности, поэтому настоящее исследование сосредоточено на надежных биомаркерах, позволяющих проводить ранний мониторинг описторхоза. 70,71
Биомаркеры
Визуализация PDF-файла чрезвычайно субъективна; следовательно, необходимы биомаркеры для определения лиц, подверженных риску развития ОСО, для мониторинга заболевания. 72 CCA имеет несколько путей, и поэтому в идеале необходимо несколько биомаркеров, чтобы охватить все пути, что требует различных направлений исследования. 73
В одном из таких подходов использовалась магнитно-резонансная спектроскопия для анализа химического состава желчи у лиц с ОСА в сравнении с контрольной группой и оценки того, можно ли использовать какие-либо отличающиеся молекулы в качестве биомаркеров. Используя многомерный анализ распознавания образов, образцы CCA были успешно выделены для образцов без CCA с чувствительностью 80% и специфичностью 95%, при этом фосфатидилхолин, желчные кислоты H-18 и желчные кислоты, конъюгированные с таурином, были наиболее полезными метаболитами для дифференциация образцов. 69 Было обнаружено, что содержание глицин-конъюгированных желчных кислот значительно повышается в желчи пациентов с ОСА, что позволяет сделать вывод о том, что первичные желчные кислоты, а также желчные кислоты, конъюгированные с глицином, могут иметь потенциал для использования в качестве биомаркеров. 69
Продукты, вызванные окислительным повреждением ДНК, часто могут использоваться в качестве биомаркеров. Было показано, что хомяки, инфицированные O. viverrini sl, экспрессируют iNOS в эпителиальных клетках желчных протоков и воспалительных клетках, что приводит к избытку ROS / RNS и образованию ДНК-аддуктов, таких как 8-нитрогуанин и 8-oxodG . 74 Было обнаружено, что уровни двух аддуктов ДНК увеличиваются с увеличением числа повторных инфекций. 29 8-oxodG был обнаружен в лейкоцитах и значительно коррелировал с уровнями в моче и с прогрессированием заболевания. 75
Одно исследование показало, что уровни 8-oxodG в моче значительно различались между контрольными людьми (здоровые и тяжелые PDF-отрицательные — APF–) и люди с прогрессирующим гепатобилиарным заболеванием (CCA и расширенный PDF-положительный — APF +).Не было значительной разницы между пациентами с CCA и APF.
Площадь под кривой (AUC) кривой рабочих характеристик приемника для диагностики APF составляла 0,74 и 0,88 для CCA. 76 Таким образом, 8-oxodG был классифицирован как надежный, точный, воспроизводимый и стабильный; однако, поскольку уровни повышаются при некоторых других формах рака, способность 8-oxodG действовать как биомаркер снижается. 77,78
Иммуноглобулины против O. viverrini sl антигенов значительно усиливаются в процессе канцерогенеза, и уровни коррелируют с прогрессированием заболевания. 29 Почечные аномалии, которые возникают наряду с гепатобилиарными патологиями, означают, что чем более запущено заболевание, тем выше повреждение клубочков, что позволяет большему количеству IgG проникать в мочу. 47 Одно исследование показало, что> 60% людей, которые были APF +, и все люди с CCA, дали положительный результат на IgG против O. viverrini sl антиген в моче, но почти у всех людей он был в крови. Это означает, что только у лиц с прогрессирующими гепатобилиарными патологиями развились почечные осложнения, достаточно значительные для присутствия IgG в моче.Уровни IgG в моче против O. viverrini sl были значительно выше у лиц с гепатобилиарными аномалиями по сравнению с контрольной группой, были способны различать ОСА и другие стадии описторхоза и могли различать легкую и тяжелую O. viverrini sl инфекции. 48
Мутации ДНК
CpG-островки являются потенциальным источником биомаркеров и часто метилируются при раке, что приводит к подавлению транскрипции. 79,80 Одно исследование было направлено на поиск гиперметилирования в определенных локусах для поиска прогностических или диагностических биомаркеров. 81 Для анализа данных был создан индекс метилирования (MI), который представлял собой отношение количества метилированных островков CpG к общему количеству изученных островков CpG. 82 В результате ИМ для ОСА (0,12) был значительно выше, чем для нормальных тканей (0,02). Опиоид-связывающий белок / молекула клеточной адгезии, подобная гену (OPCML), была наиболее часто метилированной (72.5%). 80 Он не был обнаружен метилированным в нормальных тканях и был связан с менее дифференцированным CCA, что привело к худшему прогнозу и увеличению вероятности метастазирования. 83,84
OPCML является геном-супрессором опухоли и метилирован при некоторых других раковых заболеваниях, таких как рак яичников, и поэтому мало пригоден при использовании отдельно. 85 PTEN, HIC1 и SFRP1 также часто были сильно метилированы и, как полагают, играют роль в увеличении пролиферации и выживаемости, а также обладают антиапоптотическим эффектом.Было обнаружено, что пациенты с метилированием в локусе DcR1 имеют более длительную выживаемость, чем пациенты без него, что позволяет предположить, что DcR1 может использоваться для определения прогноза пациентов с CCA. 80
MicroRNA
Многие виды рака вызывают повышенную / понижающую регуляцию определенных miRNA, которые могут быть обнаружены в жидкостях организма. 86 В CCA было обнаружено изменение уровней нескольких miRNA, таких как miR-141, которая увеличивается, miR-370, которая уменьшается, и miR-21, которая, как было обнаружено, коррелирует с прогрессированием заболевания у хомяков. 71,87,88 Одно исследование показало, что уровни miR-192 в сыворотке у пациентов с CCA были значительно выше, чем у здоровых субъектов, с AUC 0,803, но не были значительно увеличены по мере прогрессирования описторхоза.
Несмотря на это, увеличение уровней miR-192 на всем пути канцерогенеза означает, что это повышение вызвано воспалением, управляемым паразитами. Высокие уровни также имеют значительную корреляцию с метастазами в лимфатические узлы и снижением выживаемости, что означает, что их можно использовать в качестве прогностического маркера. 89
Использование miR-192 в качестве биомаркера при обнаружении в моче также было исследовано вместе с miR-21. В моче уровни miR-192 значительно различались у здоровых и инфицированных O. viverrini sl, здоровых и PDF и здоровых и CCA. Не только это, но и уровень miRNA-192 между здоровыми и другими воспалительными заболеваниями не был значительным и поэтому может быть описан как специфический для заболевания. Было обнаружено, что miR-21 значительно выше для PDF, CCA и других воспалительных заболеваний, чем у здоровых субъектов, что делает его полезным потенциальным биомаркером, хотя он не является уникальным для CCA.Когда две miRNA были объединены, результаты дифференциации между индивидуумами улучшились и устранили проблему того, что miR-21 не является специфичной для заболевания. 90
Текущее лечение
Празиквантел — дешевый и эффективный противогельминтный препарат для лечения инфекций O. viverrini sl и использовался для массового введения лекарств в Таиланде в начале 1980-х годов для предотвращения ОАС. Это эффективно снизило распространенность с 80% до 15-20% к 1997 году. 91 Хотя празиквантел остановит паразитарную инфекцию, любое воспаление и фиброз в желчных протоках, которые останутся, будут фактором риска развития ОСО.Еще одна проблема состоит в том, что многие люди будут повторно инфицированы O. viverrini sl, что может увеличить риск CCA из-за острой воспалительной фазы повторного инфицирования, в отличие от хронического воспаления. 92 Таким образом, повторное введение лекарств может увеличить риск холангиоканцерогенеза, если люди продолжают есть сырую рыбу и повторно заражаются после лечения празиквантелом.
Эффективное лечение CCA ограничено, демонстрирует устойчивость к химиотерапии, с очень низким уровнем ответа. 93 Одно исследование потенциально нашло будущее применение химиотерапии: для предотвращения резистентности к TRAIL (лиганд, индуцирующий фактор некроза опухоли). При использовании в сочетании с рекомбинантными TRAIL или агонистическими моноклональными антителами к рецепторам TRAIL, это потенциально является селективным лечением CCA, поскольку опухолевые клетки намного более чувствительны, чем нормальные клетки, к TRAIL-индуцированному апоптозу. 80
Тем не менее, в Юго-Восточной Азии единственными действующими эффективными методами лечения являются хирургическая резекция и трансплантация печени.К моменту появления ОСА прогноз обычно плохой, так как опухоль слишком развита для удаления. В то время как внутригрудные опухоли можно агрессивно лечить с помощью портальной эмболизации наряду с резекциями печени и воротной вены, внепеченочный рост опухоли является противопоказанием для хирургического вмешательства. Отчеты показывают, что из тех, у кого была «успешная» резекция, то есть резекция R0, 5-летняя выживаемость все еще составляла всего 25–30%, снижаясь до 0–12% для пациентов с положительными границами. 94,95 Исследовательской группе из Северо-Восточного Таиланда удалось получить многообещающую частоту резекции R0 в 64% у 83 пациентов.5-летняя выживаемость для всей группы составила 21%, а для группы R0 — 30%. 96 Несмотря на плохой общий прогноз, при использовании неоадъювантной химиотерапии можно достичь 65% излечения в случаях перихилярной ОСА. 97
Если резекция не является вариантом для внутрипеченочного ОСА, пациенты без внепеченочного роста могут иметь право на трансплантацию печени. 93 В прошлом трансплантация печени рассматривалась как неэффективная при лечении ОСА с 5-летней выживаемостью 0–20% в опубликованных сериях из Королевского колледжа Лондона и Ганновера. 98,99 Однако недавние исследования возобновили интерес к трансплантации печени: в одном из центров США 5-летняя выживаемость составила> 70% при использовании неоадъювантной химиотерапии в тщательно отобранной группе. 100 Другая группа из Скандинавии достигла 50% 5-летней выживаемости, опять же при очень строгом отборе пациентов. 101 Обычно эти случаи связаны с очень маленькими опухолями, которые считаются неоперабельными и возникают в перихилярной области печени. Лишь несколько процентов от числа рассмотренных считаются правомочными.Эти исследования показывают, что вместо того, чтобы рассматривать трансплантацию печени как плохую альтернативу, руководящие принципы, по которым пациенты имеют право, должны быть более строгими.
Иммунотерапия — это новый многообещающий метод лечения, который будет использоваться в качестве дополнения к хирургическому вмешательству и / или химиотерапии. Наличие лейкоцитов в инфицированных участках позволяет использовать иммунную систему для борьбы с опухолью. 102 Персональные пептидные вакцины, которые иммунизируют пациента против хозяина антигенов, и дендритные вакцины, которые иммунизируют против одного антигена без необходимости обработки и сниженного аутоиммунитета, значительно более эффективны при адъювантном применении с химиотерапией по сравнению с одной химиотерапией. 103 Как и при химиотерапии, дендритные вакцины обеспечивали среднее время выживания 17,4 месяца при введении вместе с хирургическим вмешательством по сравнению с 7,7 месяцами при использовании только хирургического вмешательства. 104 Метаанализ показал, что более высокая экспрессия иммунных активных факторов привела к значительно лучшему прогнозу ( P <0,00001) и что изменение микросреды опухоли для увеличения инфильтрации Т-клеток значительно увеличивало 6-месячное прогрессирование - коэффициент свободной выживаемости ( P <0.05). 101 Цитотоксический Т-лимфоцитарный антиген 4 и взаимодействие между запрограммированной гибелью клеток 1 (PD1) и его лигандом (PDL1) являются путями, которые опухоль использует для уклонения от иммунной системы. Пассивная иммунотерапия использует моноклональные антитела, чтобы блокировать эти взаимодействия, чтобы иммунная система могла бороться с опухолью. Однако, хотя это было сделано при других злокачественных новообразованиях, таких как меланома, опубликованных данных об эффективности против CCA нет. 105
Когда опухоль слишком развита для лечения, единственным другим вариантом является паллиативная помощь.В Северо-Восточном Таиланде более 95% случаев имеют ОСО 4 стадии, поэтому 70–80% пациентов получают паллиативное лечение с использованием стентов для дренажа желчных путей. 106,107 Большое количество случаев ОСО 4 стадии подчеркивает необходимость исследования более ранней диагностики, чтобы выявить случаи на более раннем этапе их прогрессирования.
Резюме
Высокий уровень инфицирования O. viverrini sl в Юго-Восточной Азии привел к тому, что Северо-Восточный Таиланд имеет самый высокий уровень заболеваемости ОАС в мире.Инфекцию печеночной двуусткой можно легко диагностировать с помощью FECT или ELISA, при этом в качестве лечения используется празиквантел. Однако из-за того, что пациенты с CCA остаются бессимптомными до последних стадий заболевания, уровень излечения без ранней диагностики и вмешательства ужасен. Таким образом, в настоящее время ультразвук обычно используется для скрининга людей на потенциально ранние стадии ОСО или лиц из группы риска с PDF. МРТ и КТ используются в дальнейшем для оценки потенциального злокачественного новообразования, а ERCP могут использоваться для дальнейшего подтверждения. O. viverrini sl также вовлечен в почечную патологию, вызванную иммунным ответом, приводящим к гломерулонефриту. Образующийся в результате IgG, обнаруженный в моче, может использоваться в качестве синдромного биомаркера. В настоящее время проводятся исследования биомаркеров различных аспектов канцерогенного пути для выявления CCA на ранних стадиях и повышения шансов на успешное вмешательство.
Заключение
Чтобы лучше всего бороться с CCA в Юго-Восточной Азии в краткосрочной перспективе, исследования должны быть сосредоточены на ранней и более точной диагностике CCA и ее тревожных признаках.Продолжение усилий по созданию ряда биомаркеров для различных стадий канцерогенного пути может привести к резкому снижению уровня смертности и улучшению прогнозов для пациентов. Следует продолжать внедрять и расширять долгосрочные программы государственного просвещения, такие как программы, организованные Программой скрининга и лечения холангиокарциномы (CASCAP), чтобы информировать население об опасностях употребления в пищу определенных видов сырой, частично приготовленной или ферментированной рыбы. и, возможно, со временем разовьются практики, касающиеся «грубого отношения». 14 Исследование недостаточно изученных почечных эффектов описторхоза также может помочь понять сложный эффект долгосрочной инфекции O. viverrini и то, как с ней бороться как с синдромом.
Выражение признательности
Все авторы выражают признательность Центру биомедицинских исследований Национального института медицинских исследований при Имперском колледже Лондона за поддержку инфраструктуры. SDT-R имеет гранты Совета медицинских исследований Соединенного Королевства.Сотрудничество было поддержано грантом Wellcome Trust ISSF Имперскому колледжу Лондона. PS и RHA были поддержаны грантами Таиландского исследовательского фонда (TRF). Авторы хотели бы поблагодарить доктора Шахида Кхана и Мэри Кросси за их помощь и советы по содержанию этого обзора, а также Надду Киацопит за создание рисунка 1.
Раскрытие
Авторы сообщают об отсутствии конфликта интересов в этой работе.
Ссылки
1.
Keizer J, Utzinger J.Трематодозы пищевого происхождения. Clin Microbiol Rev. 2009; 22 (3): 466–483.
2.
Andrews RH, Sithithaworn P, Petney TN. Opisthorchis viverrini: недооцененный паразит в мировом здравоохранении. Trends Parasitol. , 2008; 24 (11): 497–501.
3.
Saijuntha W., Sithithaworn P, Wongkham S, et al. Свидетельства видового комплекса трематоды пищевого происхождения Opisthorchis viverrini и возможной совместной эволюции с их первыми промежуточными хозяевами. Int J Parasitol. 2007; 37 (6): 695–703.
4.
Сититаворн П., Эндрюс Р. Х., Петни Т. Н., Сайджунта В., Лаопром Н. Систематика и популяционная генетика Opisthorchis viverrini sensu lato: значение для паразитарной эпидемиологии рака желчных протоков. Parasitol Int. 2012; 61 (1): 32–37.
5.
Kiatsopit N, Sithithaworn P, Saijuntha W., Petney TN, Andrews RH. Opisthorchis viverrini : последствия систематики первых промежуточных хозяев, Bithynia видов улиток в Таиланде и Лаосской НДР. Infect Genet Evol. 2013; 14: 313–319.
6.
Brockelman WY, Upatham ES, Viyanant V, Ardsungnoen S, Chantanawat R. Полевые исследования передачи человеческой печеночной двуустки, Opisthorchis viverrini , на северо-востоке Таиланда: изменения в населении промежуточного хозяина улитки. Int J Parasitol. 1986; 16 (5): 545–552.
7.
Намсанор Дж., Сититаворн П., Кополрат К. и др. Сезонная передача Opisthorchis viverrini sensu lato и лецитодендриидных трематод у улиток Bithynia siamensis goniomphalos на северо-востоке Таиланда. Am J Trop Med Hyg. 2015; 93 (1): 87–93.
8.
Kiatsopit N, Sithithaworn P, Saijuntha W, et al.Исключительно высокая распространенность инфекции Bithynia siamensis goniomphalos и Opisthorchis viverrini cercariae на различных водно-болотных угодьях в Таиланде и Лаосской Народно-Демократической Республике. Am J Trop Med Hyg. 2012; 86 (3): 464–469.
9.
Haas W, Granzer M, Brockelman CR. Opisthorchis viverrini : поиск и распознавание рыбы-хозяина по церкариям. Exp Parasitol. 1990; 71 (4): 422–431.
10.
Sithithaworn P, Yongvanit P, Duenngai K, Kiatsopit N, Pairojkul C. Роль инфекции двуусткой печени как фактора риска холангиокарциномы. J Hepatobiliar Pancreat Sci. 2014; 21 (5): 301–308.
11.
Sithithaworn P, Haswell-Elkins M. Эпидемиология Opisthorchis viverrini . Acta Trop. 2003; 88 (3): 187–194.
12.
Kopolrat K, Sithithaworn P, Kiatsopit N, et al. Сравнение инфекционности, метацеркарии и смертности хозяев, вызванных Opisthorchis viverrini sensu lato cercariae из Лаосской НДР, по сравнению с Таиландом у карповых рыб, Barbonymus gonionotus . Trans R Soc Trop Med Hyg. 2016; 110 (1): 46–54.
13.
Donthaisong C, Arunsan P, Suwannatrai K, et al. Экспериментальное заражение Opisthorchis viverrini cercariae карповым рыбам, Barbonymus gonionotus . Acta Trop. 2014; 136: 118–122.
14.
Гранди-Уорр К., Эндрюс Р.Х., Сититаворн П. и др. Грубые отношения, культура водно-болотных угодий, жизненные циклы: социокультурная динамика, относящаяся к Opisthorchis viverrini в бассейне Меконга. Parasitol Int. 2012; 61 (1): 65–70.
15.
Sripa B, Kaewkes S, Sithithaworn P, et al. Печеночная двуустка вызывает холангиокарциному. PLoS Med. 2007; 4 (7): e201.
16.
Macpherson CN. Поведение человека и эпидемиология паразитарных зоонозов. Int J Parasitol. 2005; 35 (11–12): 1319–1331.
17.
Sripa B, Mairiang E, Thinkhamrop B и др. Развитый перидуктальный фиброз в результате инфицирования канцерогенным печеночным двуустком человека Opisthorchis viverrini коррелирует с повышенным уровнем интерлейкина-6. Гепатология. 2009; 50 (4): 1273–1281.
18.
Enes JE, Wages AJ, Malone JB, Tesana S. Распространенность инфекции Opisthorchis viverrini у собак и кошек в трех деревнях, провинция Хон Каен, северо-восток Таиланда. J Trop Med Public Health Юго-Восточной Азии. 2010; 41 (1): 36–42.
19.
Янг Н.Д., Кэмпбелл Б.Э., Холл Р.С. и др.Разблокирование транскриптомов двух канцерогенных паразитов, Clonorchis sinensis и Opisthorchis viverrini . PLoS Negl Trop Dis. 2010; 4 (6): e719.
20.
Всемирная организация здравоохранения. Биологические агенты — обзор канцерогенов человека. IARC Monogr Eval Carcinog Risks Hum. 2014; 100B: 341–371.
21.
Bhamarapravati N, Thammavit W, Vajrasthira S.Изменения печени у хомяков, инфицированных печеночной двуусткой человека, Opisthorchis viverrini . Am J Trop Med Hyg. , 1978; 27 (4): 787–794.
22.
Mantovani A, Allavena P, Sica A, Balkwill F. Воспаление, связанное с раком. Природа. 2008; 454 (7203): 436–444.
23.
Пунгпак С., Чалермрут К., Харинасута Т. и др. Opisthorchis viverrini Инфекция в Таиланде: симптомы и признаки инфекции — популяционное исследование. Trans R Soc Trop Med Hyg. 1994; 88 (5): 561–564.
24.
Holzinger F, Z’Graggen K, Buchler MW. Механизмы канцерогенеза желчевыводящих путей: патогенетический многоступенчатый каскад к холангиокарциноме. Ann Oncol. 1999; 10 Дополнение 4: 122–126.
25.
Охима Х., Бартч Х. Хронические инфекции и воспалительные процессы как факторы риска рака: возможная роль оксида азота в канцерогенезе. Mutat Res. 1994; 305 (2): 253–264.
26.
Иноуэ С., Каваниши С. Окислительное повреждение ДНК, вызванное одновременным образованием оксида азота и супероксида. FEBS Lett. 1995; 371 (1): 86–88.
27.
Каваниши С., Хираку Ю. Окислительное и нитратное повреждение ДНК как биомаркер канцерогенеза с особым упором на воспаление. Антиоксидный редокс-сигнал. 2006; 8 (5–6): 1047–1058.
28.
Йонгванит П., Пинлаор С., Барч Х. Окислительное и нитративное повреждение ДНК: ключевые события в канцерогенезе, вызванном описторхозом. Parasitol Int. 2012; 61 (1): 130–135.
29.
Pinlaor S, Sripa B, Sithithaworn P, Yongvanit P. Изменения гепатобилиарной системы, ответ антител и изменение ферментов печени у хомяков, повторно инфицированных Opisthorchis viverrini . Exp Parasitol. 2004; 108 (1-2): 32-39.
30.
Jaiswal M, LaRusso NF, Burgart LJ, Gores GJ. Воспалительные цитокины вызывают повреждение ДНК и ингибируют репарацию ДНК в клетках холангиокарциномы по механизму, зависимому от оксида азота. Cancer Res. 2000; 60 (1): 184 — 190.
31.
Jaiswal M, LaRusso NF, Shapiro RA, Billiar TR, Gores GJ.Опосредованное оксидом азота ингибирование репарации ДНК усиливает окислительное повреждение ДНК в холангиоцитах. Гастроэнтерология. 2001; 120 (1): 190–199.
32.
Torok NJ, Higuchi H, Bronk S, Gores GJ. Оксид азота подавляет апоптоз после высвобождения цитохрома С путем нитрозилирования каспазы 9. Cancer Res. 2002; 62 (6): 1648–1653.
33.
Srivatanakul P, Ohshima H, Khlat M, et al. Opisthorchis viverrini инвазия и эндогенные нитрозамины как факторы риска холангиокарциномы в Таиланде. Int J Cancer. , 1991; 48 (6): 821–825.
34.
Сатаруг С., Хасвелл-Элкинс М.Р., Цуда М. и др. Нитрозирование, не зависящее от тиоцианата, у людей с канцерогенной паразитарной инфекцией. Канцерогенез. 1996; 17 (5): 1075–1081.
35.
Сатаруг С., Хасвелл-Элкинс М.Р., Сититаворн П. и др.Связь между синтезом N-нитрозодиметиламина и иммунным ответом на хроническую инфекцию канцерогенным паразитом, Opisthorchis viverrini , у мужчин. Канцерогенез. 1998; 19 (3): 485–491.
36.
Dechakhamphu S, Pinlaor S, Sitthithaworn P, Nair J, Bartsch H, Yongvanit P. Перекисное окисление липидов и аддукты этено-ДНК в лейкоцитах пациентов, инфицированных печеночным двуустником: защита с помощью альфа-токоферол плазмы и празиквантел. Биомаркеры эпидемиологии рака Пред. 2010; 19 (1): 310–318.
37.
Pinlaor S, Hiraku Y, Yongvanit P, et al. iNOS-зависимое повреждение ДНК через экспрессию NF-kappaB у хомяков, инфицированных Opisthorchis viverrini , и его подавление антигельминтным препаратом празиквантел. Int J Cancer. 2006; 119 (5): 1067–1072.
38.
Sripa B, Kaewkes S.Связь между паразитоспецифическими реакциями антител и интенсивностью инфекции Opisthorchis viverrini у хомяков. Parasite Immunol. 2000; 22 (3): 139–145.
39.
Chotigeat W., Ruenwongsa P. Типы коллагена в Opisthorchis viverrini инфицированной печени хомяка. Mol Biochem Parasitol. 1986; 18 (3): 377–387.
40.
Mairiang E, Elkins DB, Mairiang P, et al.Взаимосвязь между интенсивностью инфекции Opisthorchis viverrini и гепатобилиарной болезнью, обнаруженной при ультразвуковом исследовании. J Gastroenterol Hepatol. 1992; 7 (1): 17–21.
41.
Thamavit W, Bhamarapravati N, Sahaphong S, Vajrasthira S, Angsubhakorn S. Влияние диметилнитрозамина на индукцию холангиокарциномы у золотисто-оптической карциномы в сирийском гриппе . Cancer Res. 1978; 38 (12): 4634–4639.
42.
Srivatanakul P, Sukaryodhin S, Ohshima H, et al. Opisthorchis viverrini инвазия и эндогенные нитрозамины как факторы риска холангиокарциномы в Таиланде. Инт Дж. Рак . 1991; 48: 821–825.
43.
Honjo S, Srivatanakul P, Sriplung H, et al. Генетические и экологические детерминанты риска холангиокарциномы через Opisthorchis viverrini в густо зараженной местности в Накхонпханом, северо-восток Таиланда. Инт Дж. Рак . 2005; 117: 854–860.
44.
Трикер AR. N-нитрозосоединения и человек: источники воздействия, эндогенное образование и наличие в жидкостях организма. Eur J Cancer Назад . 1997. 6 (3): 226–268.
45.
Суонн П.Ф. Влияние этанола на метаболизм и распределение нитрозаминов. Значение роли нитрозаминов в развитии рака у человека и влияние употребления алкоголя на заболеваемость раком. IARC Sci Publ. , 1984; (57): 501–512.
46.
Хан С.А., Толедано МБ, Тейлор-Робинсон С.Д. Эпидемиология, факторы риска и патогенез холангиокарциномы. HPB . 2008; 10: 77–82.
47.
Brandi G, Di Girolamo S, Farioli A, et al. Асбест: скрытый игрок в росте холангиокарциномы? Результаты анализа случай-контроль. Контроль причин рака. 2013; 24 (5): 911–918.
48.
Boonpucknavig S, Boonpucknavig V, Tanvanich S, Doungchawee G, Thamavit W. Развитие иммунного комплексного гломерулонефрита и амилоидоза у сирийских золотистых хомяков, инфицированных Opinchorini. J Med Assoc Thai. 1992; 75 (Дополнение 1): 7–19.
49.
Saichua P, Sithithaworn P, Jariwala AR, et al.Микропротеинурия во время инфекции Opisthorchis viverrini : биомаркер поздних почечных и гепатобилиарных патологий, вызванных хроническим описторхозом. PLoS Negl Trop Dis. 2013; 7 (5): e2228.
50.
D’Amico G, Bazzi C. Патофизиология протеинурии. Kidney Int. 2003; 63 (3): 809–825.
51.
Левинский Р.Дж. Роль циркулирующих иммунных комплексов при заболеваниях почек. J Clin Pathol. 1981; 34 (11): 1214–1222.
52.
CDC-DPDx. DPDx — Лабораторная идентификация паразитарных заболеваний, вызывающих озабоченность общественного здравоохранения. DPDx — Лабораторная идентификация паразитарных заболеваний, вызывающих озабоченность общественного здравоохранения 2016; DPDx — Лабораторная идентификация паразитарных заболеваний, вызывающих озабоченность общественного здравоохранения. По состоянию на 19 марта 2016 г.
53.
Johansen MV, Lier T, Sithithaworn P.На пути к улучшенной диагностике запущенных зоонозных трематод с использованием подхода «Единое здоровье». Acta Trop. 2015; 141 (Pt B): 161–169.
54.
Утцингер Дж., Браттиг Н.В., Леонардо Л., Чжоу X. Н., Бергквист Р. Прогресс в исследованиях, контроле и ликвидации гельминтозов в Азии. Acta Trop. 2015; 141 (Pt B): 135–145.
55.
Джаморнтханьяват Н. Диагностика описторхоза человека. J Trop Med Public Health Юго-Восточной Азии. 2002; 33 Дополнение 3: 86–91.
56.
Савангсода П., Сититаворн Дж., Тесана С. и др. Диагностические значения определения паразитоспецифических антител в слюне и моче по сравнению с сывороткой при описторхозе. Parasitol Int. 2012; 61 (1): 196–202.
57.
Worasith C, Kamamia C, Yakovleva A, et al. Достижения в диагностике описторхоза человека: разработка обнаружения антигена Opisthorchis viverrini в моче. PLoS Negl Trop Dis. 2015; 9 (10): e0004157.
58.
Накиб А., Питт Х.А., Сон Т.А. и др. Холангиокарцинома. Спектр внутрипеченочных, перихилярных и дистальных опухолей. Ann Surg. , 1996 г., 224 (4): 463–473; обсуждение 473–465.
59.
Заброн А., Эдвардс Р.Дж., Хан С.А. Проблема холангиокарциномы: анализ молекулярных механизмов коварного рака. Dis Model Mech. 2013; 6 (2): 281–292.
60.
Chamadol N, Pairojkul C, Khuntikeo N, et al. Гистологическое подтверждение перидуктального фиброза при ультразвуковой диагностике у пациентов с холангиокарциномой. J Hepatobiliar Pancreat Sci. 2014; 21 (5): 316–322.
61.
Wadsworth CA, Lim A, Taylor-Robinson SD, Khan SA. Факторы риска и диагностика холангиокарциномы. Hepatol Int. 2013; 7 (2): 377–393.
62.
Ибрагим Р. С., Мазли М., Амризал М., Альджунид С. Стоимость магнитно-резонансной томографии (МРТ) и компьютерной томографии (КТ) в УКГМК. BMC Health Serv Res. 2012; 12 (1): 11.
63.
Хан С.А., Дэвидсон Б.Р., Голдин Р. и др. Рекомендации по диагностике и лечению холангиокарциномы: согласованный документ. Gut. 2002; 51 Приложение 6: VI1–9.
64.
Боберг К.М., Джебсен П., Клаузен О.П., Фосс А., Обаккен Л., Шрампф Э. Диагностическая польза цитологии желчных протоков при холангиокарциноме при первичном склерозирующем холангите. J Hepatol. 2006; 45 (4): 568–574.
65.
Weber A, von Weyhern C, Fend F, et al. Эндоскопическая транспапиллярная щеточная цитология и щипцовая биопсия у пациентов с внутригрудной холангиокарциномой. World J Gastroenterol. 2008; 14 (7): 1097–1101.
66.
Бесплатный словарь. Чистка желчевыводящих путей; 2016. Доступно по ссылке: http://medical-dictionary.thefreedictionary.com/bilary+brushing. По состоянию на 7 сентября 2016 г.
67.
Содерлунд С., Линдер С. Покрытые металлические стенты в сравнении с пластиковыми при злокачественном стенозе общего желчного протока: проспективное, рандомизированное, контролируемое исследование. Gastrointest Endosc. , 2006; 63 (7): 986–995.
68.
Прасад С.Р., Сахани Д., Саини С. Клинические применения магнитно-резонансной холангиопанкреатографии. J Clin Gastroenterol. 2001; 33 (5): 362–366.
69.
Romagnuolo J, Bardou M, Rahme E, Joseph L, Reinhold C, Barkun AN. Магнитно-резонансная холангиопанкреатография: метаанализ результатов теста при подозрении на заболевание желчевыводящих путей. Ann Intern Med. 2003; 139 (7): 547–557.
70.
Шариф А.В., Уильямс Х.Р., Лампехо Т. и др. Метаболический профиль желчи при холангиокарциноме с использованием магнитно-резонансной спектроскопии in vitro. HPB (Оксфорд). , 2010; 12 (6): 396–402.
71.
Альваро Д. Сывороточные и желчные биомаркеры холангиокарциномы. Curr Opin Gastroenterol. 2009; 25 (3): 279–284.
72.
Yongvanit P, Pinlaor S, Loilome W. Биомаркеры риска для оценки и химиопрофилактики холангиокарциномы, связанной с двуусткой печени. J Hepatobiliar Pancreat Sci. 2014; 21 (5): 309–315.
73.
Kelloff GJ, Boone CW, Crowell JA, et al. Биомаркеры риска и современные стратегии химиопрофилактики рака. J Cell Biochem Suppl. 1996; 25: 1–14.
74.
Pinlaor S, Yongvanit P, Hiraku Y, et al. Образование 8-нитрогуанина в печени хомяков, инфицированных Opisthorchis viverrini . Biochem Biophys Res Commun. 2003; 309 (3): 567–571.
75.
Танан Р., Мурата М., Пинлаор С. и др. 8-оксо-7,8-дигидро-2′-дезоксигуанозин в моче у пациентов с паразитарной инфекцией и действие противопаразитарных препаратов в отношении холангиоканцерогенеза. Биомаркеры эпидемиологии рака Пред. 2008; 17 (3): 518–524.
76.
Сайчуа П., Яковлева А., Камамиа С. и др. Уровни 8-oxodG позволяют прогнозировать гепатобилиарную патологию в Opisthorchis viverrini эндемичных условиях в Таиланде. PLoS Negl Trop Dis. 2015; 9 (7): e0003949.
77.
Европейский комитет по стандартам в отношении поражения мочевыводящих путей A, Evans MD, Olinski R, Loft S, Cooke MS.К консенсусу в анализе 8-оксо-7,8-дигидро-2’-дезоксигуанозина в моче как неинвазивного биомаркера окислительного стресса. FASEB J. 2010; 24 (4): 1249–1260.
78.
Габриелли А., Свеглиати С., Морончини Г., Амико Д. Новое понимание роли окислительного стресса в фиброзе склеродермии. Open Rheumatol J. 2012; 6: 87–95.
79.
Иллингворт Р.С., Берд А.П.Острова CpG — «приблизительный ориентир». FEBS Lett. 2009; 583 (11): 1713–1720.
80.
Esteller M. Epigenetics обеспечивает новое поколение онкогенов и генов-супрессоров опухолей. Br J Рак. 2006; 94 (2): 179–183.
81.
Sriraksa R, Zeller C, El-Bahrawy MA, et al. Исследование метилирования CpG-островка холангиокарциномы, связанной с двуусткой печени. Br J Рак. 2011; 104 (8): 1313–1318.
82.
Gutierrez MI, Siraj AK, Khaled H, Koon N, El-Rifai W., Bhatia K. Метилирование островков CpG при раке мочевого пузыря, связанном с шистосомой и не-шистосомой. Mod Pathol. 2004; 17 (10): 1268–1274.
83.
Накадзима Т., Кондо Й, Миядзаки М., Окуи К. Гистопатологическое исследование 102 случаев внутрипеченочной холангиокарциномы: гистологическая классификация и способы распространения. Hum Pathol. 1988; 19 (10): 1228–1234.
84.
Всемирная организация здравоохранения. Патология и генетика опухолей пищеварительной системы. 1 изд. Лион: IARC Press; 2000.
85.
Теодоридис Дж. М., Холл Дж., Марш С. и др. CpG-островное метилирование генов ответа на повреждение ДНК при распространенном раке яичников. Cancer Res. 2005; 65 (19): 8961–8967.
86.
Косака Н., Игучи Х., Очия Т. Циркуляция микроРНК в жидкости организма: новый потенциальный биомаркер для диагностики и прогноза рака. Cancer Sci. 2010; 101 (10): 2087–2092.
87.
Менг Ф, Хенсон Р., Ланг М. и др. Участие микро-РНК человека в росте и ответе на химиотерапию в клеточных линиях холангиокарциномы человека. Гастроэнтерология. 2006; 130 (7): 2113–2129.
88.
Менг Ф., Вехбе-Янек Х., Хенсон Р., Смит Х., Патель Т. Эпигенетическая регуляция микроРНК-370 интерлейкином-6 в злокачественных холангиоцитах человека. Онкоген. 2008; 27 (3): 378–386.
89.
Silakit R, Loilome W, Yongvanit P и др. Циркуляция miR-192 у пациентов с холангиокарциномой, ассоциированной с двуусткой печени: проспективный прогностический индикатор. J Hepatobiliar Pancreat Sci. 2014; 21 (12): 864–872.
90.
Silakit R, Loilome W, Yongvanit P и др. МикроРНК-192 и микроРНК-21 в моче как потенциальные индикаторы для группы риска холангиокарциномы, ассоциированной с двуустками печени. Parasitol Int. 2015; 66 (4): 479–485.
91.
Jongsuksuntigul P, Imsomboon T. Борьба с описторхозом в Таиланде. Acta Trop. 2003; 88 (3): 229–232.
92.
Kamsa-Ard S, Luvira V, Pugkhem A, et al. Связь между лечением празиквантелом и холангиокарциномой: исследование методом случай-контроль на базе стационара. BMC Рак. 2015; 15: 776.
93.
Scheithauer W. Обзор применения гемцитабина при раке желчных путей. Semin Oncol. 2002; 29 (6 Suppl 20): 40–45.
94.
Холангиокарцинома Фримана С. — современные варианты лечения. Scand J Surg. 2011; 100 (1): 30–34.
95.
Jang JY, Kim SW, Park DJ и др. Фактический отдаленный исход рака внепеченочного желчного протока после хирургической резекции. Ann Surg. 2005; 241 (1): 77–84.
96.
Lang H, Sotiropoulos GC, Sgourakis G, et al.Операции по поводу внутрипеченочной холангиокарциномы: единичный опыт 158 пациентов. J Am Coll Surg. 2009; 208 (2): 218–228.
97.
Luo X, Yuan L, Wang Y, Ge R, Sun Y, Wei G. Результаты выживаемости и прогностические факторы хирургической терапии для всех потенциально резектабельных внутрипеченочных холангиокарцином: большая одиночная- центральное когортное исследование. J Gastrointest Surg. 2014; 18 (3): 562–572.
98.
Ringe B, Wittekind C, Bechstein WO, Bunzendahl H, Pichlmayr R. Роль трансплантации печени в гепатобилиарной злокачественности. Ретроспективный анализ 95 пациентов с особым учетом стадии опухоли и рецидива. Ann Surg. 1989; 209 (1): 88–98.
99.
O’Grady JP, RJ .; Роллс, К .; Уильямс, Р. Трансплантация печени при злокачественных заболеваниях. Ann Surg. 1988; 207 (4): 7.
100.
Rosen CB, Heimbach JK, Gores GJ. Трансплантация печени при холангиокарциноме. Transpl Int. 2010; 23 (7): 692–697.
101.
Friman S, Foss A, Isoniemi H, et al. Трансплантация печени при холангиокарциноме — выбор необходим для получения приемлемых результатов. Сканд Дж Гастроэнтерол . 2011. 46 (3): 370–375.
102.
Wang Y, Ding M, Zhnag Q и др. Активация или подавление медиаторов иммунного ответа у пациентов с раком желчных путей (BTC): систематический обзор и метаанализ. J Рак. 2017; 8 (1): 74–84.
103.
Marks EI, Yee NS. Иммунотерапевтические подходы при карциноме желчных путей: текущее состояние и новые стратегии. World J Gastrointest Oncol. 2015; 7 (11): 338–346.
104.
Такахаши Р., Йошитоми М., Ютани С. и др. Современное состояние иммунотерапии для лечения рака желчных путей. Hum Vaccin Immunother. 2013; 9 (5): 1069–1072.
105.
Gubin MM, Zhang X, Schuster H, Caron E. Контрольные точки блокируют иммунотерапию рака, нацеленную на опухолеспецифические мутантные антигены. Природа. 2014; 515 (7528): 577–581.
106.
Wiangnon S, Kamsa-ard S, Suwanrungruang K и др. Тенденции заболеваемости гепатоцеллюлярной карциномой, 1990-2009 гг., Кхон Каен, Таиланд. Азиатский Pac J Cancer Prev. 2012; 13 (3): 1065–1068.
107.
Martin RC, Vitale GC, Reed DN, Larson GM, Edwards MJ, McMasters KM. Сравнение стоимости эндоскопического стентирования и хирургического лечения неоперабельной холангиокарциномы. Surg Endosc. 2002; 16 (4): 667–670.
Причины, симптомы, диагностика и лечение. —
ОпределениеОписторхоз — это инфекция, вызываемая одним из двух паразитических червей, кошачьей печеночной двуусткой, которую в науке называют Opisthorchis felineus (также известный как Opisthorchis tenuicollis ) или печеночной двуусткой Юго-Восточной Азии (называемой Opisthorchis viver). . Термин «двуустка» означает камбалу, поскольку эти паразиты плоские.
Описторхоз по рыбе ИсторияВ основных текстах говорится, что симптомы заболевания человека описторхоз были впервые описаны в 1875 году. В 1884 году паразит Opisthorchis felineus был впервые обнаружен в печени кошек в Северной Италии. В 1891 году русский ученый К. Н. Виноградов обнаружил этого паразита у человека и назвал его «сибирской печеночной двуусткой».
Opisthorchis viverrini — единственный паразит, вызывающий описторхоз в сильно зараженном районе Таиланда.Первый случай описторхоза в Таиланде был обнаружен в 1911 году при вскрытии.
ЭпидемиологияОписторхоз распространен там, где сырые карповые рыбы являются основным продуктом питания. Распространенность повышается с возрастом; дети в возрасте до 5 лет редко заражаются Opisthorchis viverrini. Мужчины могут пострадать больше, чем женщины. По оценкам ВОЗ, трематодозы пищевого происхождения (заражение червями или «сосальщиками», в основном видами Clonorchis, Opisthorchis, Fasciola и Paragonimus) поражают 56 миллионов человек во всем мире, а 750 миллионов находятся в группе риска заражения.Восемьдесят миллионов подвержены риску описторхоза, 67 миллионов — от инфекции Opisthorchis viverrini в Юго-Восточной Азии и 13 миллионов — от Opisthorchis felineus в Казахстане, России, включая Сибирь, и на Украине. В низовьях бассейна реки Меконг это заболевание очень эндемично, особенно в низинах, с распространенностью до 60% в некоторых районах северо-востока Таиланда. Однако оценки с использованием новейших диагностических методов, основанных на полимеразной цепной реакции, показывают, что распространенность, вероятно, сильно недооценена.В одном исследовании 1980-х годов распространенность более 90% была обнаружена у лиц старше 10 лет в небольшой деревне недалеко от Кхон Каен на северо-востоке Таиланда в регионе, известном как Исаан. О спорадических случаях сообщалось в отчетах о случаях из Малайзии, Сингапура и Филиппин. Хотя общая распространенность снизилась после первоначальных обследований в 1950-х годах, увеличение с 1990-х годов в некоторых районах, по-видимому, связано со значительным ростом аквакультуры.
Факторы риска описторхоза
К факторам риска описторхоза относятся:
- Люди, которые едят пресноводную рыбу, сырую, недовареную, маринованную или необработанную (даже если импортированную), содержащую паразитических червей, подвергаются высокому риску заражения описторхозом.
- Обитание вблизи пресноводных водоемов, таких как реки, пруды или озера, в эндемичных регионах Восточной Европы, России, Таиланда или Лаоса, где эти паразиты широко распространены, и потребляющие сырую рыбу
Важно отметить, что наличие фактора риска не означает, что человек заболеет этим заболеванием. Фактор риска увеличивает шансы получить заболевание по сравнению с человеком без факторов риска. Некоторые факторы риска важнее других.
ПричиныПричины описторхоза включают:
- Описторхоз — это инфекция пищевого происхождения, вызываемая печеночной двуусткой кошек или печеночной двуусткой Юго-Восточной Азии, паразитическим червем, который растет и обитает в желчных протоках печени у людей и млекопитающих, питающихся рыбой.Он приобретается при употреблении в пищу пресноводной рыбы, содержащей личинки двуустки
- Яйца Opisthorchis попадают в улитки, обитающие в пресных водах. Эти яйца вылупляются, и инфицированные улитки выпускают микроскопических личинок, которые попадают в пресноводную рыбу (которая служит промежуточным хозяином). Люди (или млекопитающие), которые являются последними хозяевами, заражаются, когда они едят сырую или недоваренную рыбу, содержащую цисты
- Попадая в организм человека, киста попадает в кишечник, а затем перемещается в печень и находится в желчных протоках, где они превращаются во взрослых червей.Взрослый червь откладывает и высиживает яйца, которые попадают в кишечник, а затем в кал
- Opisthorchis felineus обычно паразитирует у кошек, собак, свиней и китов, а Opisthorchis viverrini обычно встречается у собак и кошек
Взрослые двуустки откладывают полностью развитые яйца, которые выводятся с фекалиями.
- После проглатывания подходящей улиткой (первый промежуточный хозяин)
- Яйца выпускают мирацидии Номер
2 (a) Которые проходят у улитки несколько стадий развития (спороцисты
2 (b) Rediae Номер
2 (c) Церкарии Число
2 (d) Церкарии выпущены из улитки
- И проникают в пресноводных рыб (второй промежуточный хозяин), проникая в виде метацеркарий в мышцы или под чешую
- Окончательный хозяин среди млекопитающих (кошки, собаки и различные рыбоядные млекопитающие, включая человека) заражаются при поедании недоваренной рыбы, содержащей метацеркарии.После приема пищи происходит эксцист метацеркарии в двенадцатиперстной кишке
- И поднимаются через ампулу Фатера в желчные протоки, где они прикрепляются и развиваются во взрослых особей, откладывающих яйца через 3-4 недели
- Взрослые двуустки ( O. viverrini : от 5 до 10 мм от 1 мм до 2 мм; O. felineus : от 7 до 12 мм от 2 мм до 3 мм) проживают в желчных и панкреатических протоках млекопитающее-хозяин, где они прикрепляются к слизистой оболочке.
У большинства людей, инфицированных описторхозом, отсутствуют какие-либо симптомы.Лица, инфицированные длительно (хронически), могут заболеть тяжелым заболеванием. Длительное воспаление или повторное инфицирование желчных протоков может привести к рубцеванию желчных протоков и воспалению печени.
Признаки и симптомы описторхоза могут включать:
- Боль в животе, тошнота и диарея
- Любая патология (инфекция) желчного протока и прилегающих органов может вызвать боль в животе (особенно под грудной клеткой справа), желтуху, лихорадку или озноб
- Образование камней желчных путей (желчекаменная болезнь): воспаление и рубцевание желчных протоков приводит к застою (снижению оттока) желчи, что может привести к образованию камней.
- Из-за желчных камней и изменений сужения у пострадавших может появиться следующее:
- Желтуха
- Прерывистая обструкция желчных протоков может вызвать боль в животе (желчная колика)
- Холангит — инфекция и воспаление желчного протока
- Холецистит — инфекция и воспаление желчного пузыря
- Панкреатит (воспаление поджелудочной железы) из-за непроходимости трубки (протока), который является общим для желчных протоков печени и поджелудочной железы
К осложнениям описторхоза могут относиться:
- Рубцевание желчного протока или образование желчных камней, которое может привести к таким заболеваниям, как
- Холецистит (инфекция желчного пузыря)
- Холангит (инфекция желчных протоков)
- Гепатит (воспаление печени)
- Холангиокарцинома — злокачественное образование в одном из протоков, по которому желчь переносится из печени в тонкий кишечник
- Исследователи считают, что О.viverrini (печеночная двуустка из Юго-Восточной Азии) может вызывать холангиокарциному, особенно в присутствии пищевых нитрозаминов (которые используются в качестве консерванта).
Для диагностики описторхоза можно использовать следующие тесты и процедуры:
- Тщательная оценка истории болезни человека и полное физическое обследование, особенно брюшной полости
- Во время сбора анамнеза врач может пожелать узнать следующее:
- Когда появились симптомы и ухудшаются ли они
- Информация о пищевых привычках (особенно о потреблении сырой рыбы), истории поездок и местах проживания
- Диагноз описторхоз или клонорхоз (аналогичное заболевание) подозревается, когда человек привык есть сырую рыбу и имеет признаки и симптомы, относящиеся к правой стороне живота
- Может потребоваться консультация гастроэнтеролога и / или инфекциониста
- Анализы крови:
- Общий анализ крови может показать эозинофилию — повышенный уровень эозинофилов лейкоцитов в периферической крови.Обычно наблюдается при паразитарных инфекциях
- Тесты для проверки уровня антител к паразиту
- Для подтверждения диагноза может быть проведено исследование образца стула на наличие яиц описторхиса.
- Для выявления активности заболевания желчных протоков, печени, желчного пузыря или протока поджелудочной железы могут быть выполнены визуализирующие обследования.
- Можно проводить УЗИ, КТ или МРТ печени, желчного пузыря, желчных протоков и протоков поджелудочной железы
- Эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ) может быть проведена для проверки патологий желчных и поджелудочных протоков
- Многие клинические состояния могут иметь похожие признаки и симптомы.Ваш лечащий врач может провести дополнительные тесты, чтобы исключить другие клинические состояния и поставить окончательный диагноз.
Варианты лечения описторхоза включают:
- Всемирная организация здравоохранения (ВОЗ) рекомендует инфицированным людям лекарство от глистов празиквантел. Празиквантел можно назначать людям в качестве профилактической меры; лицам, не имеющим признаков заболевания, но проживающим в эндемичных регионах
- Операция может потребоваться, если непроходимость желчного протока сохраняется, несмотря на лечение празиквантелом для удаления глистов и / или камней
- Лечение осложнений при необходимости с помощью внутривенных антибиотиков и хирургического вмешательства
- Правильное приготовление рыбы..
- Замороженная рыба, предназначенная для потребления в сыром виде.
- Использование моллюскицидов — наиболее частое вмешательство общественного здравоохранения, поскольку оно предотвращает передачу многих других трематод, включая Schistosoma spp.
- Применена обработка животных для уменьшения потерь водоема и поголовья.
- Профилактическое применение празиквантела.
Печеночные, кишечные и легочные двуустки
ОБЗОР: Что нужно знать каждому врачу
Название и классификация паразита
Существует три основных типа печеночных двуусток, патогенных для человека: Clonorchis sinensis, различные виды Opisthorchis (viverrini, felineus) и виды Fasciola (hepatica и gigantica).Все сосальщики являются трематодами, разновидностью плоскогельминтов (плоских червей).
Есть много видов кишечных сосальщиков, поражающих людей, в первую очередь в Азии. Из них основными патогенами человека, обсуждаемыми здесь, будут Fasciolopis buski, Heterophyes heterophyes и Metagonimus yokogawai.
Известно, что восемь легочных двуусток из рода Paragonimus являются патогенными для человека. Из них наиболее распространен P. westermanii, эндемик Дальнего Востока.Другие, менее распространенные виды встречаются в Азии, Африке, Южной, Центральной и Северной Америке.
Какое лечение лучше всего?
Празиквантел — препарат выбора для лечения клонорхов и описторхов. Это также терапия первой линии от всех кишечных сосальщиков и инфекции Paragonimus.
Празиквантел вызывает спастический паралич червей и изменение и разрушение оболочки червя за счет не до конца изученных механизмов.
Празиквантел вводят в дозе 25 мг / кг перорально три раза в день в течение двух дней. Доза для детей такая же. Сообщенные показатели излечения составляют более 80%.
Наблюдаемые побочные эффекты включают головокружение, сонливость, головную боль и диарею, но обычно носят временный характер.
Празиквантел одобрен FDA, но считается экспериментальным для лечения кишечных сосальщиков.
При церебральном заболевании можно назначить короткий курс кортикостероидов с празиквантелом, чтобы минимизировать воспалительную реакцию на умирающих сосальщиков.
Триклабендазол является препаратом первой линии для лечения инфекций печени, вызванных F. (фасциолез). Применяется однократная пероральная доза 10 мг / кг. Две дозы с интервалом 12-24 часа также могут быть назначены при тяжелых инфекциях. Триклабендазол недоступен в США для использования человеком, но его можно получить в Центре контроля заболеваний. Фасциолазерологический тест может использоваться для оценки ответа на терапию. Серореверсия (потеря определяемых антител) обычно отмечается через 6–12 месяцев после излечения.
Есть ли проблемы с противоинфекционной устойчивостью?
Клинически важная устойчивость печеночных двуусток к празиквантелу не наблюдалась, но сообщалось о низких показателях излечения от шистосомоза, что указывает на возможность развития устойчивости в будущем.
Какие существуют альтернативные методы лечения?
Opisthorchis и Clonorchis: можно использовать альбендазол в дозе 10 мг / кг / день в течение 10 дней, если празиквантел недоступен или противопоказан, но не одобрен FDA для этого показания. Однократная доза трибендимина в 400 мг также оказалась высокоэффективной в начальных клинических испытаниях против C. sinensis и O. viverrini, но пока еще не доступна в США.
Парагонимус также можно лечить триклабендазолом в дозе 10 мг / кг в виде однократной пероральной дозы, которую можно повторять.
При инфекции фасциолой также может быть эффективен нитазоксанид, но это не доказано. Дозировка нитазоксанида для взрослых составляет 500 мг перорально 2 раза в день в течение 7 дней во время еды.
Каковы клинические проявления заражения этим организмом?
Клонорхис и Описторхис
Острая инфекция, вызванная C. sinensis и O. viverrini, обычно протекает бессимптомно. Вскоре после заражения C. sinensis может развиться крапивница, боль в правом верхнем квадранте живота и жар.После инфицирования О. felineus могут возникнуть сильная лихорадка, артралгия и лимфаденопатия, а также боль в животе. Хронические симптомы включают боль и дискомфорт в животе, потерю веса и анорексию.
Гепатомегалия и болезненность в правом подреберье могут наблюдаться как в острой, так и в хронической форме.
Фасциола
Отчетливые синдромы связаны с острой и хронической фазами инфекции:
Острая фаза может длиться несколько месяцев и наступает в течение нескольких недель после заражения.Симптомы связаны с миграцией личинок паразита через паренхиму печени (см. Жизненный цикл ниже) и включают боль в животе, кашель, крапивницу и лихорадку. Симптомы хронической инфекции незначительны и аналогичны тем, которые наблюдаются у клонорхов и описторхисов, описанных выше.
Кишечные двуустки
Большинство инфекций протекает бессимптомно.
Тяжелые инфекции могут быть связаны с лихорадкой, потерей веса, болями в животе, диареей, анасаркой и непроходимостью.
Легочные сосальщики
Преобладающие симптомы включают хронический кашель, кровохарканье и выделение коричневой мокроты.
Боль в груди и одышка являются обычными явлениями.
Острая инфекция может сопровождаться болью в животе, диареей и крапивницей или протекать бессимптомно.
Внелегочная миграция может вызывать симптомы, зависящие от места поражения. Поражение ЦНС может привести к головной боли, судорогам, другим неврологическим нарушениям или менингиту.
Имитируют ли другие заболевания его проявления?
Симптомы, вызванные другими причинами воспаления печени или массовых поражений, могут имитировать симптомы инфекции печеночного двуустки и включают амебный и бактериальный абсцесс печени, шистосомоз, холецистит, холангит и острый гепатит.
Туберкулез легких, другие грибковые и хронические бактериальные пневмонии или злокачественные новообразования могут с радиологической точки зрения напоминать парагонимоз.
Внелегочное поражение, особенно парагонимус, может напоминать опухоль центральной нервной системы (ЦНС) или другие инфекции, включая абсцесс мозга или нейроцистицеркоз.
Какие лабораторные исследования следует заказать и что ожидать?
Печеночные и кишечные сосальщики
Наиболее полезным тестом для диагностики печеночных двуусток Clonorchis и Opisthorchis является обнаружение яиц в кале при микроскопическом исследовании. Препараты влажного животного исследуют на наличие характерных яиц. Яйца Clonorchis имеют овальную форму, 27–35 мкм на 11–20 мкм и имеют крышку или крышку на меньшем конце овального яйца.Небольшая ручка или крючок часто выступает из другого конца. Яйца описторхиса визуально практически идентичны.
Взрослых гельминтов иногда можно идентифицировать по образцам, полученным хирургическим или эндоскопическим путем. Виды Clonorchis и Opisthorchis имеют размеры приблизительно 5-25 мм X 2-5 мм, тогда как взрослые черви Fasciola больше и составляют приблизительно 30 мм X 15 мм. Черви F. gigantica более крупные, достигая 75 мм.
Ультразвуковое исследование желчных путей и желчного пузыря может иногда визуализировать подвижных червей.Компьютерная томография (КТ) брюшной полости часто выявляет небольшие гиподенсированные узелки и линейные дорожки в паренхиме печени, вызванные миграцией Fasciola hepatica. Также сообщалось о характерных результатах магнитно-резонансной томографии (МРТ) F. hepatica, которые могут повысить чувствительность.
Периферическая эозинофилия является обычным явлением, особенно при остром фасциолезе и парагонимозе. Плевральная жидкость при парагонимозе обычно содержит множество эозинофилов.
Серологические тесты полезны для диагностики F.hepatica, особенно на ранних стадиях инфекции, до того, как обнаруживается выделение яиц, но они не широко доступны. CDC может предоставить информацию о серологическом тестировании, включая тесты, доступные в США за пределами CDC.
Диагностика кишечных сосальщиков проводится по клинической картине и микроскопическому обнаружению яиц в кале, хотя яйца Fasciolopsis морфологически неотличимы от яиц F. hepatica, тогда как яйца Heterophyes и Metagonimus аналогичны яйцам Clonorchis и Opisthorchis.Конкретный диагноз возможен путем выявления взрослых червей, которые попали в стул после лечения.
Легочные сосальщики
Обнаружение яиц в мокроте и стуле может быть трудным и малочувствительным.
EIA и Вестерн-блоттинг очень чувствительны и специфичны, и их можно получить в Центре контроля заболеваний. Уровни серопозитивности снижаются при лечении и могут использоваться для мониторинга терапии. Другие виды Paragonimus могут быть пропущены имеющимися тестами P. westermanii.
Рентгенография грудной клетки и КТ могут показать широкий спектр легочных аномалий, включая кистозные поражения, узелки, инфильтраты или плевральный выпот.Рентгенологическая картина может указывать на туберкулез или злокачественное новообразование.
Какие визуализационные исследования будут полезны при постановке или исключении диагноза заражения двуустками?
При инфекции печеночного сосальщика ультразвуковое исследование и компьютерная томография брюшной полости могут быть полезны для оценки наличия осложнений, требующих хирургического вмешательства или антибактериальной терапии.
МРТ печени может также повысить чувствительность диагностики F. hepatica.
Визуализация легких часто наводит на размышления, хотя и не специфична для инфекции Paragonimus.
Какие осложнения могут быть связаны с этой паразитарной инфекцией, и существуют ли дополнительные методы лечения, которые могут помочь облегчить эти осложнения?
Сосальщики печеночные
Долгосрочные осложнения, связанные с хронической инфекцией всех видов печеночных сосальщиков, включают боль в правом верхнем квадранте, потерю аппетита и потерю веса.
Кроме того, осложнения, связанные с тяжелым бременем глистов, воспалением и непроходимостью, включают холецистит, холангит, абсцесс печени и панкреатит.
Холангиокарцинома связана с хронической инфекцией Opisthorchis и Clonorchis.
Эктопическая миграция личинки F. hepatica во время начальной острой фазы может привести к образованию узелков и симптомов воспаления практически в любом органе.
Кишечные сосальщики
Илеус и непроходимость могут возникнуть при большом количестве червей.Редко сообщалось, что эмболизация яиц через кровоток вызывает серьезные осложнения со стороны ЦНС.
Легочные сосальщики
Церебральная инвазия мигрирующими личинками — наиболее частое и серьезное внелегочное проявление инфекции P. westermanii
Каков жизненный цикл паразита и как этот жизненный цикл объясняет заражение людей?
Виды Clonorchis и Opisthorchis имеют сходный жизненный цикл, для которого требуются три разных хозяина: млекопитающее, улитка и рыба или ракообразное (см. Рисунок 1).Взрослые черви, обитающие в желчном дереве, производят до 2500 зародышевых яиц в день, которые выделяются со стулом. Когда эти яйца достигают пресной воды, их поедают определенные виды улиток, из которых вылупляются яйца, и каждое яйцо выделяет мирацидий. Мирацидии проходят несколько стадий созревания, сначала становясь спороцистами, каждая из которых выделяет 20-50 редий, каждая из которых высвобождает до 50 церкарий. Таким образом, каждое яйцо приводит к высвобождению приблизительно тысячи свободно плавающих церкарий. Когда церкарии встречаются с подходящей рыбой-промежуточным хозяином, они проникают в кожу и энцисты в виде метацеркарий.Эти метацеркарии сохраняют жизнеспособность в мышцах рыб до года. При употреблении в пищу человеком метацеркарии изгибаются и выпускают личинок в двенадцатиперстную кишку, где они быстро перемещаются через ампулу Фатера, чтобы поселиться в желчном дереве и начать производить яйца. Зрелые черви могут жить десятилетиями.
Рисунок 1.
Жизненный цикл видов Clonorchis и Opisthorchis. Из DPDx, веб-сайта лабораторной диагностики паразитарных заболеваний Отдела паразитарных заболеваний, Национальных центров инфекционных заболеваний, Центров по контролю и профилактике заболеваний, Атланта, Джорджия [http: // www.dpd.cdc.gov/DPDx).
Fasciola hepatica имеет жизненный цикл, аналогичный жизненному циклу Clonorchis и Opisthorchis, но не имеет промежуточных рыб-хозяев (см. Рис. 2). Взрослые черви, обитающие в желчных древах овец и крупного рогатого скота, производят незрелые яйца, которые зарождаются в воде и выделяют свободно плавающие мирацидии, вторгающиеся в улиток. Дальнейшее развитие через стадии спороцист, редий и церкарий происходит у улитки. Свободноплавающие церкарии энцисты в виде метацеркарий на водных растениях, таких как кресс-салат, которые употребляются в пищу крупным рогатым скотом, овцами или людьми.Метацеркарии эксцисты в двенадцатиперстной кишке, а затем проникают в стенку кишечника, мигрируют через брюшину и проедают паренхиму печени, пока не достигнут крупных желчных протоков, где происходит созревание взрослых червей и яйцекладка.
Рисунок 2.
Жизненный цикл Fasciola hepatica. Из DPDx, веб-сайта лабораторной диагностики паразитарных заболеваний Отдела паразитарных заболеваний, Национальных центров инфекционных заболеваний, Центров по контролю и профилактике заболеваний, Атланта, Джорджия [http: // www.dpd.cdc.gov/DPDx).
Кишечные двуустки обитают в тонком кишечнике млекопитающего-хозяина (см. Рисунок 3 и рисунок 4)). Яйца выводятся со стулом и развиваются в пресной воде. Яйца либо поглощаются улитками в случае фасциолопсиса, либо мирацидии высвобождаются и вторгаются в промежуточного хозяина улитки в случае гетерофитов и метагонимуса. Церкарии, выпущенные улиткой, либо поражают рыб и энцисты (Heterophyes and Metagonimus), либо энцисты водных растений (Fasciolopsis) и впоследствии потребляются людьми.Личинка эксцистируется и поселяется в стенке тонкой кишки, где они развиваются во взрослых червей-откладывающих яйца. Взрослые особи фасциолопсиса имеют размеры от 20 до 75 мм на 8-20 мм, тогда как гетерофии и метагонимусы намного меньше (от 1,0 до 2,5 мм, от 0,4 до 0,75 мм). Свиньи также заражаются фасциолопсисом при употреблении в пищу растений и служат в качестве окончательного хозяина, тогда как кошки, собаки и птицы, которые едят рыбу, могут являться убежищем для других кишечных сосальщиков.
Рисунок 3.
Жизненный цикл фасциолопсиса.Из DPDx, веб-сайта лабораторной диагностики паразитарных заболеваний Отдела паразитарных заболеваний, Национальных центров инфекционных заболеваний, Центров по контролю и профилактике заболеваний, Атланта, Джорджия [http://www.dpd.cdc.gov/DPDx
Рисунок 4.
Жизненный цикл мелких кишечных сосальщиков (Heterphyes и Metagonimus). Из DPDx, веб-сайта лабораторной диагностики паразитарных заболеваний Отдела паразитарных заболеваний, Национальных центров инфекционных заболеваний, Центров по контролю и профилактике заболеваний, Атланта, Джорджия [http: // www.dpd.cdc.gov/DPDx
Легочные сосальщики обитают в кистозных полостях легких человека (см. Рис. 5). Яйца либо отхаркиваются с мокротой, либо выводятся с калом. Достигнув пресной воды, яйца подвергаются эмбрионированию и высвобождают свободноживущие мирацидии, которые находят подходящего хозяина улитки и вторгаются в него. Развитие через последовательные стадии, подобные таковым у печеночных сосальщиков, приводит к высвобождению церкарий, которые вторгаются во второго промежуточного хозяина, ракообразных из семейств крабов или раков, где они энцистизируются с образованием метацеркарий.Метацеркарии попадают в организм человека, который употребляет в пищу неправильно приготовленных или маринованных ракообразных. Эксцистация происходит в двенадцатиперстной кишке, и личинка мигрирует через стенку кишечника, брюшину и диафрагму, чтобы в конечном итоге достичь паренхимы легких. В легких личинка инкапсулируется и развивается во взрослых червей, которые начинают откладывать яйца через 65-90 дней.
Где распространены эти инфекции?
C. sinensis является эндемиком в Азии, включая Корею, Китай, Тайвань и Вьетнам, при этом 15-20 миллионов инфицированы и 200 миллионов подвержены риску заражения.O. viverriniis встречается в основном на северо-востоке Таиланда, Лаоса и Кампучии. O. felineusis встречается в основном в Европе и Азии, включая бывший Советский Союз. По крайней мере, десять миллионов человек инфицированы видами Opisthorchis только в Лаосе и Таиланде. Распространенность инфекции в эндемичных районах может достигать 25%.
F. hepatica встречается во всем мире, особенно в Боливии, Перу, Египте, Иране, Португалии и Франции, и инфицировано около 3 миллионов человек.
Кишечные двуустки встречаются в Египте, на Ближнем и Дальнем Востоке (Heterophyes), на Дальнем Востоке, а также в Сибири, Маньчжурии, балканских государствах, Израиле и Испании (Metagonimus), а также в Азии и на Индийском субконтиненте (Fasciolopsis ).
P. westermanii встречается в Азии, включая Китай, Филиппины, Японию, Вьетнам, Южную Корею, Тайвань и Таиланд. Другие виды встречаются в Африке, Центральной и Южной Америке. Несколько случаев заражения P. kellicottii описано на Среднем Западе США.
Как передается инфекция?
Потребление сырой или неправильно приготовленной рыбы является основным фактором риска заражения Clonorchis и Opisthorchis в эндемичных районах.Редкие случаи в США возникают из-за употребления импортной рыбы.
Заражение фасциолой происходит при употреблении в пищу свежей растительности, включая кресс-салат, петрушку и т. Д.
Заражение фасциолопсисом происходит при употреблении в пищу свежей растительности, а другие кишечные сосальщики обнаруживаются в сырой рыбе.
Заражение Pargonimus передается при употреблении в пищу сырых или маринованных продуктов, крабов и раков.
Профилактика
Избегание сырой, маринованной или копченой рыбы, ракообразных или сырых овощей в эндемичных районах — единственный способ предотвратить инфекцию.Следующие методы убивают метацеркарии в рыбных продуктах: Приготовление рыбы надлежащим образом (до внутренней температуры не менее 145 ° F [~ 63 ° C]). Замораживание при -4 ° F (-20 ° C) или ниже в течение 7 дней (общее время) или при -31 ° F (-35 ° C) или ниже до твердого состояния и хранение при -31 ° F (-35 ° C) или ниже в течение 15 часов, или при -31 ° F (-35 ° C) или ниже до твердого состояния и хранении при -4 ° F (-20 ° C) или ниже в течение 24 часов.
Разнообразные стратегии по совершенствованию практики аквакультуры и лечения инфицированных популяций находятся в стадии разработки, но на сегодняшний день они имеют ограниченный успех.
Рисунок 5.
Жизненный цикл Paragonimus. Из DPDx, веб-сайта лабораторной диагностики паразитарных заболеваний Отдела паразитарных заболеваний, Национальных центров инфекционных заболеваний, Центров по контролю и профилактике заболеваний, Атланта, Джорджия [http://www.dpd.cdc.gov/DPDx).
КАКИЕ ДОКАЗАТЕЛЬСТВА для конкретных рекомендаций по ведению и лечению?
Furst, TU, Duthaler, B, Sripa, J, Utzinger, JK. «Трематодные инфекции: печеночные и легочные сосальщики». Infect Dis Clin North Am. т. 26. 2012. С. 399-419. (Описывает основные инфекции печени и легочных двуусток, включая эпидемиологию, жизненный цикл, клинические проявления, диагностику и подходы к профилактике, лечению и контролю.)
Hong, ST, Fang, Y. «Clonorchis sinensis и клонорхоз, обновление». Parasitol Int. т. 61. 2012. С. 17-24. (Всесторонний обзор эпидемиологии, биологии, клинических проявлений и текущих исследований инфекций Clonorchis.)
Лю, К.Ф., Вэй, В.Л., Ян, С., Чжан, X. «Парагонимоз: важный зооноз пищевого происхождения в Китае». Trends Parasitol. т. 24. 2008. С. 318-323. (Всесторонний обзор, который включает подробную информацию об осложнениях и внелегочных поражениях, замеченных при заражении Paragonimus.)
Mairiang, E., Mairiang, P. «Клинические проявления описторхоза и лечение». Acta Trop. т. 88. 2003. pp. 221-227. (Подробное изложение проблемы описторхоза в Азии.)
Мас-Кома, S, Баргес, Мэриленд, Валеро, Массачусетс. «Фасциолез и другие трематодные зоонозы, передаваемые растениями». Int J Parasitol. т. 35. 2005. pp. 1255–1278. (Обзор кишечных и печеночных двуусток, передаваемых через растительную пищу.)
Pozio, E, Armignacco, O, Ferri, F, Morales, MAG. «Opisthorchis felineus, новая инфекция в Италии и ее последствия для Европейского Союза». Acta Trop. т. 126. 2013. С. 54–62. (Интересное описание уникальных клинических и эпидемиологических аспектов O.felineus в Европе.)
Copyright © 2017, 2013 ООО «Поддержка принятия решений в медицине». Все права защищены.
Ни один спонсор или рекламодатель не участвовал, не одобрял и не платил за контент, предоставляемый Decision Support in Medicine LLC. Лицензионный контент является собственностью DSM и защищен авторским правом.
Окончательный диагноз — Дело 297
Окончательный диагноз — Дело 297ОКОНЧАТЕЛЬНАЯ ДИАГНОСТИКА:
Холангиокарцинома, вторичная по отношению к инфекции печеночных двуусток (Clonorchis sinensis или Opisthorchis viverrini)
ОБСУЖДЕНИЕ:
На Дальнем Востоке печеночные двуустки — одна из основных причин проблем со здоровьем.Clonorchis sinensis в основном встречается в Китае, Корее и Японии, тогда как Opisthorchis viverrini встречается только в Северо-Восточном Таиланде, Лаосе и Камбодже. В последнее время увеличилось количество сообщений об инфекции печеночной двуусткой в Северной Америке, что отражает увеличение числа иммигрантов из этих эндемичных районов.
Жизненные циклы C. sinensis и O. viverrini похожи и могут рассматриваться вместе. Люди заражаются при употреблении в пищу сырой или недоваренной рыбы, содержащей инцистированные личинки (метацеркарии).После эксцистации в двенадцатиперстной кишке незрелые сосальщики попадают в желчные протоки и дифференцируются во взрослых особей. Взрослые гермафродиты производят яйца, которые выводятся с калом. Достигнув пресной воды, яйца поедаются улитками, вылупляются в кишечнике и дифференцируются в церкарии. Свободно плавающие церкарии проникают в чешую рыб и энцистируют в виде метацеркарий, которые затем поедаются людьми. Следует отметить, что продолжительность жизни взрослой двуустки составляет более 20 лет, что объясняет стойкую инфекцию.
Имеются убедительные эпидемиологические доказательства того, что инфицирование печеночными двуустками связано с хроническим заболеванием желчных путей и в конечном итоге приводит к развитию холангиокарциномы. Например, распространенность холангиокарциномы значительно выше в районах, эндемичных по инфекции печеночного двуустника, чем в неэндемичных районах. Кроме того, экспериментальные исследования показали, что у животных, инфицированных C. sinensis или O. viverrini, развиваются изменения эпителия желчных путей, аналогичные таковым у людей, с прогрессированием до холангиокарциномы.Было высказано предположение, что присутствие паразитов может вызывать повреждение ДНК и мутации в результате образования канцерогенов или свободных радикалов и вызывать пролиферацию клеток в желчных протоках, что играет решающую роль в онкогенезе.
Диагноз инфекции печеночного двуустки обычно устанавливается при микроскопическом исследовании стула яйцеклеток или взрослых особей. Иногда диагноз ставится путем анализа желчной жидкости, как показано в этом случае. Яйцеклетка C.sinensis и O. viverrini очень похожи друг на друга по морфологии и размеру. На практике они неотличимы. Различие между этими двумя сосальщиками возможно путем сравнения морфологических различий у взрослых форм или с помощью серологических методов.
Была предпринята попытка раннего выявления холангиокарциномы для улучшения прогноза и снижения смертности. Одна из возможностей — использовать опухолевые маркеры, такие как CA19-9 и CEA, для выявления ранних форм рака. Недостаток в том, что у них очень низкая специфичность.Возможность использования анти-C. sinensis или анти-O. В настоящее время изучаются также антитела к viverrini для выявления лиц из группы высокого риска с последующим ультразвуковым исследованием.
Ранняя диагностика и лечение инфекции печеночного двуустника имеют решающее значение для снижения частоты холангиокарциномы, особенно в этих эндемичных районах. Успешный контроль требует сосредоточения внимания на лицах, подверженных наибольшему риску, повторного лечения (предпочтительный препарат: празиквантел) и изменения традиционных режимов питания, хотя последнее оказалось довольно устойчивым.Также было доказано, что улучшенные меры общественного здравоохранения эффективны в ограничении этих заболеваний. В развитых странах, таких как США, важно распознавать этих паразитов и связанные с ними осложнения у иммигрантов и путешественников из эндемичных регионов.
ССЫЛКИ:
- Koneman, E., et al. Цветовой атлас и учебник диагностической микробиологии. 5-е изд. 1997 г. Паркин Д. и др. Холангиокарцинома: эпидемиология, механизмы канцерогенеза и профилактика.Биомаркеры эпидемиологии рака Пред. 2 (6): 537-544, 1993.
- Чепмен Р.В. Факторы риска канцерогенеза желчевыводящих путей. Энн Онкол. 10 (Дополнение 4): 308-311, 1999. Папилло Дж. Л. и др. Цитологический диагноз заражения печеночными двуустками у пациента с впоследствии задокументированной холангиокарциномой. Acta Cytol. 33 (6): 865-869, 1989.
- Шварц DA. Холангиокарцинома, связанная с инфекцией печеночной двуустки: предотвратимый источник заболеваемости иммигрантами из Азии. Am J Gastroenterol.81 (1): 76-79, 1986.
- Дули-младший, Нефи, округ Колумбия. Трематоды (глава 2): клонорхоз и описторхоз, страницы 509-516.

 • Вялить мелкую рыбу карповых пород необходимо в течение 3-х недель с предварительным трехдневным крепким посолом. Чем крупнее рыба, тем дольше она должна находиться в рассоле и затем дольше вялиться. • Нельзя употреблять строганину из свежезамороженной и свежевыловленной рыбы. Нужно помнить, что при замораживании рыбы в бытовых холодильниках, личинки описторхоза остаются жизнеспособными. • При приготовлении рыбы обязательно нужно соблюдать правила санитарии: иметь отдельный разделочный инвентарь, тщательно мыть ножи, разделочные доски и руки после обработки рыбы. А если все-таки болезнь не обошла Вас стороной, не тяните, обратитесь к врачу за консультацией и лечением.
• Вялить мелкую рыбу карповых пород необходимо в течение 3-х недель с предварительным трехдневным крепким посолом. Чем крупнее рыба, тем дольше она должна находиться в рассоле и затем дольше вялиться. • Нельзя употреблять строганину из свежезамороженной и свежевыловленной рыбы. Нужно помнить, что при замораживании рыбы в бытовых холодильниках, личинки описторхоза остаются жизнеспособными. • При приготовлении рыбы обязательно нужно соблюдать правила санитарии: иметь отдельный разделочный инвентарь, тщательно мыть ножи, разделочные доски и руки после обработки рыбы. А если все-таки болезнь не обошла Вас стороной, не тяните, обратитесь к врачу за консультацией и лечением.
 31 с.
31 с.
 Лихорадочный синдром может сохраняться от нескольких дней до месяца.
Лихорадочный синдром может сохраняться от нескольких дней до месяца.