Коронавирус | Журнал Популярная Механика
Недавно появившийся в Южной Корее коронавирус MERS застал врасплох южнокорейские власти и заставил их принимать срочные эпидемиологические меры. Гендиректор ВОЗ Маргарет Чен была вынуждена констатировать, что «новый коронавирус — угроза всему миру». И эти слова применимы не только к MERS, но и к другим новым и неизвестным инфекциям.
Предполагается, что общее число вирусных частиц на порядок выше количества всех клеток всех организмов на Земле. Вирусы окружают нас повсюду в живой природе, и каждая клетка каждого живого организма несет в себе следы прошлых встреч с ними.
Генетическое разнообразие вирусов, их умение меняться и приспосабливаться поражает воображение. Миллионы лет назад ретроэлементы генома и ретровирусы участвовали в эволюции, выступая в качестве генетического резервуара для создания новых генов и усложнения видов. И сейчас вирусы могут выступать как одно из «орудий» эволюции, регулируя численность и жизнеспособность популяций.
 Строение вириона ВИЧ Вирусы не проявляют никаких признаков жизни, пока не встретятся с клеткой-хозяином. В результате этой встречи образуется комплекс «вирус-клетка», который способен жить и производить новые вирионы. Гликопротеины. C их помощью вирус прикрепляется к рецептору CD4 на поверхности лимфоцитов.
Суперкапсид. Двухслойная мембрана из фосфолипидов, позаимствованных у клетки-хозяина, от которой вирус отпочковался. РНК. Две идентичные нити, в которых запрограммирована вся генетическая информация о вирусе. Капсид. Белковый контейнер в форме усеченного конуса, в котором хранится РНК и важнейшие ферменты: обратная транскриптаза, интеграза, протеаза. Обратная транскриптаза. Фермент, модифицирующий ДНК клетки-хозяина по матрице РНК вируса. Называется обратной, потому что в большинстве случаев РНК синтезируется по матрице ДНК, а не наоборот.
Строение вириона ВИЧ Вирусы не проявляют никаких признаков жизни, пока не встретятся с клеткой-хозяином. В результате этой встречи образуется комплекс «вирус-клетка», который способен жить и производить новые вирионы. Гликопротеины. C их помощью вирус прикрепляется к рецептору CD4 на поверхности лимфоцитов.
Суперкапсид. Двухслойная мембрана из фосфолипидов, позаимствованных у клетки-хозяина, от которой вирус отпочковался. РНК. Две идентичные нити, в которых запрограммирована вся генетическая информация о вирусе. Капсид. Белковый контейнер в форме усеченного конуса, в котором хранится РНК и важнейшие ферменты: обратная транскриптаза, интеграза, протеаза. Обратная транскриптаза. Фермент, модифицирующий ДНК клетки-хозяина по матрице РНК вируса. Называется обратной, потому что в большинстве случаев РНК синтезируется по матрице ДНК, а не наоборот.
Из письменных источников нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного недуга по всей Римской империи погибло несколько миллионов человек.
С тех пор европейский континент регулярно подвергался опустошающим нашествиям эпидемий, в первую очередь чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на далекие расстояния людьми, опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.

Вирус натуральной оспы стал первым известным инфекционным носителем, представляющим угрозу для всего человеческого рода. Начав свое «черное» шествие по миру около 2000 лет назад, он уложил в могилу огромное количество людей на всех континентах и просуществовал до 1980 года, пока человечество объединенными усилиями не победило его. Сегодня этот вирус под строгим контролем сохраняется в двух лабораториях, в России и США.

В поле зрения ученых вирусы попали в начале XVIII века. Тогда европейские врачи заинтересовались феноменом непроизвольной вакцинации, когда зараженные в легкой форме коровьей оспой люди были не подвержены оспе натуральной, то есть человеческой. Прорыв в этом вопросе произошел в 1796 году, когда английский врач и ученый Эдвард Дженнер произвел публично первую прививку от оспы.
В 1892 году был описан первый вирус. Звание первооткрывателя вирусов по праву принадлежит российскому микробиологу Дмитрию Иосифовичу Ивановскому, который в конце XIX века сумел описать вирус, вызывавший мозаичную болезнь растения табака. И вслед за этим открытием началось лавинообразное изучение вирусов, которые не перестают нас удивлять и преподносить неожиданные сюрпризы.
Как устроен вирус?
Латинское слово virus означает яд. Полноценная вирусная частица, вирион, состоит из белковой оболочки, капсида, и внутреннего содержимого: нескольких специальных белков и нуклеиновой кислоты, кодирующей вирусные гены.
 С помощью интерферонов клетка, пораженная вирусом, передает сигнал тревоги соседним клеткам, чтобы те были готовы к встрече с вредоносными агентами. Этот механизм предполагает гибель всех клеток, столкнувшихся с вирусом, зато размножение вируса и дальнейшее распространение заразы блокируется.
С помощью интерферонов клетка, пораженная вирусом, передает сигнал тревоги соседним клеткам, чтобы те были готовы к встрече с вредоносными агентами. Этот механизм предполагает гибель всех клеток, столкнувшихся с вирусом, зато размножение вируса и дальнейшее распространение заразы блокируется.
Полноценная вирусная частица, вирион, состоит из нуклеиновой кислоты и нескольких специальных белков, заключенных в белковую оболочку, капсид. Все вирусы принято делить на две большие группы по виду содержащейся в них нуклеиновой кислоты: ДНК- и РНК-вирусы. С практической точки зрения наибольший интерес для всех нас представляет группа РНК-содержащих вирусов, так как именно к ним относятся самые опасные на сегодняшний день инфекционные возбудители: вирус гриппа, коронавирусы и самый сложный из всех вирусов, ВИЧ.
Почти все из известных науке вирусов имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляются. Этот механизм предопределяет, какие именно клетки пострадают от вируса. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам, а вирус гепатита — к клеткам печени. Вирус иммунодефицита избирает своей мишенью целый ряд клеток. В первую очередь это клетки иммунной системы (Т-лимфоциты-хелперы, макрофаги). А также эозинофилы и тимоциты (подвиды лейкоцитов), дендритные клетки, астроциты (вид вспомогательных клеток нервной ткани) и другие клетки, несущие на своей мембране специфический рецептор СD4 и CXCR4-корецептор. Почти все они имеют самое непосредственное отношение к иммунитету.

Как работает иммунитет?
В идеале у здорового организма существует весьма надежная многоуровневая система защиты от проникновения всевозможных «чужаков». За ее описание и расшифровку в разное время, начиная с 1901 года, было вручено шесть Нобелевских премий.
После того как вирус проникает внутрь, уже в слизистой оболочке иммунные клетки, макрофаги (греч. «пожиратели»), поглощают часть вирусных частиц. Эти клетки способны захватывать и переваривать бактерии, остатки погибших клеток и другие чужеродные частицы, в том числе и вирионы.
 Фагоциты человека делятся на два класса, которые называют «профессиональными» и «непрофессиональными». Профессиональные фагоциты более активны и имеют рецепторы, позволяющие различать «своих» и «чужих». К профессиональным фагоцитам относятся макрофаги.
Фагоциты человека делятся на два класса, которые называют «профессиональными» и «непрофессиональными». Профессиональные фагоциты более активны и имеют рецепторы, позволяющие различать «своих» и «чужих». К профессиональным фагоцитам относятся макрофаги.
Когда вирус проникает в кровь, на бой с ним выходят лейкоциты, в том числе их три основных вида: Т-хелперы, B-лимфоциты и Т-киллеры. Т-хелперы (от английского helper — помощник) с помощью рецепторов CD4 распознают антигены — так называют любые молекулы, способные связываться с антителами. Название «антиген» происходит от слов «антитело» и «генератор». Такие молекулы есть и в составе вирусных частиц.
Т-хелперы дают стимулирующий сигнал «убийцам» вирусов — B-лимфоцитам и Т-киллерам, попутно перенося к ним антигены. Активированные B-лимфоциты образуют антитела, которые находят свободные антигены вирусов и связываются с ними. Тандем «вирус-антитело» захватывается и уничтожается макрофагами. Мишени Т-киллеров — это собственные клетки организма, пораженные вирусом. Эти лимфоциты осуществляют лизис, то есть растворение поврежденных клеток с помощью специальных ферментов. На завершающем этапе иммунной реакции клетки Т-супрессоры гасят активность иммунного ответа, прекращая агрессивное действие Т-киллеров и B-лимфоцитов, чтобы те, разойдясь, не уничтожили и здоровые клетки.

Одновременно в организме реализуется еще один молекулярный защитный механизм: пораженные вирусом клетки начинают производить специальные белки, интерфероны, способные выходить из клетки и взаимодействовать с соседними клетками, снижая уровень белкового синтеза и препятствуя размножению вируса. Поражается как сам вирус, так и клетка-хозяин, зато распространение заразы блокируется.
Попутно интерфероны активируют ряд механизмов иммунной системы. Интерферон-альфа (ИФ-α) стимулирует синтез лейкоцитов, участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производит клетки соединительной ткани, фибробласты, и обладает тем же действием, что и ИФ-α, но с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) усиливает выработку Т-клеток, Т-хелперов и С08+Т-лимфоцитов, что придает ему свойство иммуномодулятора.

Король вирусов
Каждый из нас встречал людей крепкого здоровья, устойчивых перед всевозможными сезонными вирусами вроде ОРВИ или гриппа. Даже вирус оспы не убивал всех без исключения заразившихся, даже лихорадка Эбола, наводящая сегодня ужас на жителей Африки, оставляет в живых четверть заразившихся.
И лишь по отношению к одной-единственной инфекции иммунная система оказывается бессильна в 100% случаев заражения. Ни один из 50 млн инфицированных ВИЧ не доживет до глубокой старости. Возможности, даже теоретической, противостоять ВИЧ и СПИДу пока не обнаружено.
Проблема борьбы с ВИЧ включает в себя несколько факторов. Так, иммунная система человека, вместо того чтобы бороться с вирусом, иногда помогает ему. Этот феномен получил название «антителозависимое усиление инфекции» (ADE): антитела, которые вырабатываются в организме в ответ на вирусную атаку, облегчают проникновение вируса в клетку, выступая для миниатюрных вирионов своеобразным поводырем. Подобным вирусным механизмом пользуются также вирусы лихорадки Денге и Эбола.

В 1991 году клеточные биологи из Мэриленда, изучая иммунный ответ на ВИЧ-вакцину, обнаружили феномен антигенного импринтинга. Оказалось, что иммунная система запоминает лишь один, самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд ученых, стоит препятствием перед созданием эффективной вакцины против ВИЧ.
Но и это еще не все уловки в арсенале смертоносной инфекции. В нашем организме существуют специальные антиретровирусные системы, которые должны противостоять всем ретровирусам, в том числе и ВИЧ (подробнее о ретровирусах можно прочитать в июльском номере журнала). Таких систем сегодня известно две: AID/APOBEC и TRIM5-α. Но, как выяснилось, вместо того чтобы бороться с ВИЧ, эти антивирусные системы стали его «опричниками» — они защищают вирус иммунодефицита от дефектных копий и других вирусов.

По одной из версий, причина в том, что древние ретроэлементы, от которых произошли ретровирусы, в процессе эволюции становились частью нашего собственного генома. Поэтому иммунная система «по старой памяти» может принимать вирусы «за своих».
Мы построили им рай
Пожалуй, главное оружие вирусов — это способность чрезвычайно быстро меняться. В частности, у ВИЧ это свойство обусловлено тем, что фермент обратная транскриптаза делает ошибки при копировании вируса в организме. Как будто полиция ищет преступника по фотороботу и отпечаткам, а он каждый день меняет свой облик. У других вирусов есть свои механизмы изменчивости. Благодаря им, к примеру, вирус Эбола за двадцать лет с момента открытия изменился на целую четверть.
 Наш эксперт Евгений Комаровский, врач-педиатр, инфекционист, телеведущий: «Главная сложность лечения вирусных инфекций состоит в том, что некий лекарственный препарат должен проникнуть внутрь клетки человеческого организма и уничтожить вирус, не повредив при этом саму клетку и ее соседей. Поэтому действие противовирусных препаратов, как правило, направлено на замедление размножения вируса и активизацию собственного иммунитета. Лучшая стратегия противодействия вирусам — профилактика. 1. Прививки. Введение в организм ослабленного вируса приводит к выработке вполне полноценных антител, защищающих человека от конкретной вирусной инфекции (кори, краснухи, полиомиелита, гепатита В, гриппа, клещевого энцефалита и проч.). 2. Предотвращение или ограничение контактов с вероятным источником инфекции (отдельная комната для больного острой респираторной инфекцией и маски для его родственников, «разборчивая» половая жизнь для предотвращения СПИДа и т. д.). 3. Образ жизни и система воспитания, формирующие нормальный иммунитет».
Наш эксперт Евгений Комаровский, врач-педиатр, инфекционист, телеведущий: «Главная сложность лечения вирусных инфекций состоит в том, что некий лекарственный препарат должен проникнуть внутрь клетки человеческого организма и уничтожить вирус, не повредив при этом саму клетку и ее соседей. Поэтому действие противовирусных препаратов, как правило, направлено на замедление размножения вируса и активизацию собственного иммунитета. Лучшая стратегия противодействия вирусам — профилактика. 1. Прививки. Введение в организм ослабленного вируса приводит к выработке вполне полноценных антител, защищающих человека от конкретной вирусной инфекции (кори, краснухи, полиомиелита, гепатита В, гриппа, клещевого энцефалита и проч.). 2. Предотвращение или ограничение контактов с вероятным источником инфекции (отдельная комната для больного острой респираторной инфекцией и маски для его родственников, «разборчивая» половая жизнь для предотвращения СПИДа и т. д.). 3. Образ жизни и система воспитания, формирующие нормальный иммунитет».
Сегодня не только ВИЧ представляет опасность для человечества. Мало кто знает о мировой эпидемии, вызванной вирусом гепатита С. Он был открыт в 1989 году, и сейчас по всему миру насчитывается 150 млн человек — его носителей. И 400 000 человек ежегодно умирает от вызванных им осложнений. Атипичная пневмония, лихорадка Эбола, «птичий» грипп, коронавирус MERS и другие, неизвестные пока инфекции при определенных обстоятельствах могут вызвать эпидемии с большими человеческими жертвами. Природный резервуар «запчастей» для вирусов огромен, и они могут складываться в опасные формы.
Этот процесс называется рекомбинацией вирусов — вирусы обмениваются своими генами друг с другом, создавая новые виды. Такая рекомбинация может происходить как между разными ДНК, так и разными РНК. Причем участвует в обмене генетический материал не только вирусов, но и их носителей — к примеру, может соединяться вирус животного и человека. Именно так появляются новые опасные формы вирусов.

Но почему именно сегодня новые вирусы появляются все чаще? Профессор Института молекулярной биологии и генетики, академик Виталий Кордюм называет несколько основных причин, главные из них — сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и возможность быстрого перемещения носителей вируса. Благодаря научному и техническому прогрессу носитель опасной инфекции за несколько суток может добраться с одного континента на другой. Этот же прогресс стал причиной того, что последние 70 лет происходит односторонняя миграция населения из сел и малых городов в крупные города, что привело к возникновению компактных многомиллионных поселений.
Очевидно, что наш современный «урбанистический» образ жизни играет в процессах стремительной эволюции вирусов не последнюю роль. Человек, устраивая свою жизнь с комфортом и переделывая все вокруг на свой вкус, вдруг забыл, что он обычный биологический вид, и перестал жить по законам природы. А вирусы напоминают нам об этом.
Статья «Золотой век вирусов» опубликована в журнале «Популярная механика» (№9, Сентябрь 2015).Коронавирусы — Википедия
| Коронавирусы | |||||
|---|---|---|---|---|---|
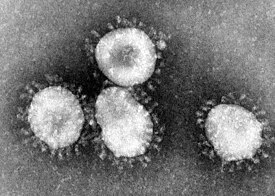 Коронавирусы под микроскопом | |||||
промежуточные ранги
| |||||
Coronaviridae | |||||
IV: (+)оцРНК-вирусы | |||||
Коронавирусы (лат. Coronaviridae) — семейство, включающее на январь 2020 года 40 видов РНК-содержащих вирусов, объединённых в два подсемейства[2], которые поражают человека и животных. Название связано со строением вируса, шиповидные отростки которого напоминают корону[3]. Назначение «короны» у коронавирусов связано с их специфическим механизмом проникновения через мембрану клетки путём имитации «фейковыми молекулами» молекул, на которые реагируют трансмембранные рецепторы клеток. После того как рецептор захватывает фейковую молекулу с «короны», он продавливается вирусом в клетку и за ним РНК вируса входит в клетку[4][5].
К коронавирусам относят:
Эпидемиология
Коронавирусы вызывают заболевания млекопитающих (у кошек, собак, свиней, крупного рогатого скота) и птиц.
Коронавирус человека впервые был выделен в 1965 году от больных ОРВИ. В последующее время коронавирусы почти не привлекали внимание исследователей, пока в Китае в 2002—2003 годах не была зафиксирована вспышка атипичной пневмонии или тяжёлого острого респираторного синдрома (ТОРС, SARS). Заболевание было вызвано вирусом SARS-CoV. В результате болезнь распространилась на другие страны, всего заболело 8273 человека, 775 умерло (летальность 9,6 %). Вирус MERS-CoV является возбудителем ближневосточного респираторного синдрома (MERS), первые случаи которого были зарегистрированы в 2012 году[6]. В 2015 году в Южной Корее произошла вспышка ближневосточного респираторного синдрома, в ходе которой заболело 183 человека, умерло 33. В декабре 2019 года в Китае началась вспышка пневмонии, вызванная свежеобнаруженным вирусом 2019-nCoV. Вскоре она распространилась на другие страны.
 Схема строения вириона коронавируса в разрезе
Схема строения вириона коронавируса в разрезеИсточниками коронавирусных инфекций могут быть больной человек, животные. Возможные механизмы передачи: воздушно-капельный, воздушно-пылевой, фекально-оральный, контактный. Заболеваемость растёт зимой и ранней весной. В структуре ОРВИ госпитализированных больных коронавирусная инфекция составляет в среднем 12 %. Иммунитет после перенесённой болезни непродолжительный, как правило, не защищает от реинфекции. О широкой распространённости коронавирусов свидетельствуют специфичные антитела, выявленные у 80 % людей[7][8]. Некоторые коронавирусы заразны до проявления симптомов[9][10].
Этиология
Геном представлен одноцепочечной (+)РНК. Нуклеокапсид окружён белковой мембраной и липосодержащей внешней оболочкой, от которой отходят булавовидные шиповидные отростки, напоминающие корону, за что семейство и получило своё название. Культивируют на культуре тканей эмбриона человека.
Жизненный цикл вируса и назначение «короны»
 Момент прикрепления коронавируса к рецептору клетки: сцепка S-белка «короны» вируса и рецептора
Момент прикрепления коронавируса к рецептору клетки: сцепка S-белка «короны» вируса и рецептораКоронавирусы имеют весьма специфический способ проникновения в клетки, что снижает эффективность обычной защиты мембран клеток против вирусов[4][5].
 Жизненный цикл короновируса
Жизненный цикл короновирусаКоронавирусы не проникают через мембрану клетки в произвольных местах, как многие другие вирусы. «Корона» у коронавирусов служит для атаки на трансмембранные рецепторы клеток путём имитации важных для жизнедеятельности клеток молекул S-протеинами, закреплёнными на «короне». Что также усложняет и распознание самого вируса системой иммунитета, так как корона вируса имитирует полезные для организма вещества.
Процесс окончания сборки короновируса в цитоплазме инфицированной клетки. Вокруг РНК вируса идет построение капсидаКонкретно коронавирусы с помощью S-протеинов на короне имитируют молекулу, которые распознают трансмембранные рецепторы ACE2 (цель вируса SARS-CoV, возбудителя атипичной пневмонии) и DPP4 (цель вируса MERS-CoV, возбудителя ближневосточного респираторного синдрома). Циркулярный рецептор ACE2 распознает у клетки молекулы ангиотензинпревращающего фермента 2. Сотовый рецептор DPP4 распознает у мембраны клетки молекулы дипептидилпептидазы-4. Новая мутация коронавирусов 2019-nCoV использует S-белок на короне для прикрепления к рецептору ангиотензинпревращающего фермента 2 (ACE2) как и вирус SARS-CoV (атипичной пневмонии)[11]. Отличие 2019-nCoV от SARS-CoV, что он более устойчив и более легко прикрепляется к рецептору, то есть более заразен, но менее фатален, чем «атипичная пневмония» в плане смертности[12].
Вне зависимости от типа короновируса, далее жизненный цикл их протекает одинаково. «Обманутые» рецепторы клетки сами надёжно прикрепляют вирус к мембране клетки, сцепляясь с фейковыми молекулами из S-протеинов «короны». Затем коронавирус «открепляет» рецептор от мембраны и продавливает его внутрь клетки, затем РНК вируса впрыскивается в цитоплазму клетки.
РНК вируса имеет 5′-метилированное начало и 3′-полиаденилированное окончание. Это позволяет вирусу инициировать сборки своих белков и копий в рибосоме клетки, которая не в состоянии определить это РНК вируса или РНК для белков самой клетки.
Коронавирусы имеют РНК около 26-30 килобаз, это означает, что коронавирусы обладают крупнейшей несегментированной РНК среди всех известных вирусов, то есть являются сложнейшими по структуре среди известных вирусов. Геном вируса состоит из более чем 20,000 нуклеотидов и кодирует два репликативных полипротеина pp1a и pp1ab[13][14] из которых в следующий проход репликации/трансляции формируется копия РНК вируса, а также 8 отдельных мРНК-шаблонов для белков вирусов, которые бесконечно их генерируют. Генерация белков вируса из мРНК происходит в эндоплазматическом ретикулуме и аппарате Гольджи.
После получения РНК вируса и необходимых его белков, вирусные нуклеокапсиды собираются из геномной РНК вируса и N-белка в цитоплазме. Вирионы затем высвобождаются из инфицированной клетки через экзоцитоз. После выхода вирионов из клетки она погибает.
Клиника
У людей коронавирусы вызывают острые респираторные заболевания, атипичную пневмонию и гастроэнтериты. У детей возможны бронхиты и пневмония. Особо опасны для человека вирусы рода Betacoronavirus.
 Поражённые коронавирусом ткани легких. Зелёные точки показывают инфицированные клетки
Поражённые коронавирусом ткани легких. Зелёные точки показывают инфицированные клеткиРезистентность
Наличие «короны» из S-белков обуславливает сравнительно низкую живучесть вируса в открытом пространстве. Свободный доступ кислорода и других окислителей приводит к денатурации S-белков. Коронавирусы сохраняют инфекционную активность в течение нескольких лет в лиофилизированном состоянии (при +4 °С), в замороженном состоянии (при −70 °С). УФ-излучение инактивирует вирусы за 15 минут, органические жирорастворители и детергенты — в течение нескольких минут. Во внешней среде инактивируются при +33 °С за 16 часов, при +56 °С за 10 минут. Для коронавирусов человека оптимальна зона pH 7,0—7,5. Сохраняются в составе аэрозоля 8-10 часов, в воде — до 9 суток[8].
Различные исследования воздействия антисептиков на коронавирусы показывают несколько варьирующиеся результаты. Исследование итальянских учёных показывает, что 70 % этанол и 1 % хлоргексидин очень быстро (менее 2 минут) повреждают капсид вируса и он не может размножаться, хотя геном вируса остаётся целостным до 30 минут после обработки[15] В другом исследовании[16] тестировались популярные обеззараживатели рук на основе 45 % изопропанола, 30 % н-пропанола и 0,2 % мезетрония этилсульфата; на основе на 80 % этанола; гель на основе 85 % этанола; антивирусный гель на основе 95 % этанола. Все средства обработки рук в течение 30 секунд уничтожали вирус ниже порога обнаружения. Таким образом, использование средств для обеззараживания рук эффективно против коронавирусов. ВОЗ рекомендует использовать спиртосодержащие антисептики для рук против коронавирусов[17].
Против аэрозолей короновируса эффективно ультрафиолетовое облучение «кварцевыми лампами». Для уничтожения вирусов с одноцепочечной РНК как коронавирусы необходима доза облучения 339—423 мкВт*с/см2 ультрафиолета с длиной волны 254 нм, что даёт 90 % дезинфекцию воздуха[18]. Таким образом, время уничтожения вируса УФ лампой зависит от её мощности и обычно составляет от 2 до 15 минут[15][8].
Важным вопросом является резистентность короновируса в посылках миллионами доставляемых из Китая. Если носитель вируса во время кашля выделит вирус в качестве аэрозоля на предмет и он будет после этого герметично упакован в посылку, то время жизни вируса может быть в самых благоприятных условиях до 48 часов[19]. Однако время доставки посылок по международной почте намного больше, поэтому ВОЗ и Роспотребнадзор считают, что посылки из КНР полностью безопасны вне зависимости от того, имелся с ними контакт инфицированных коронавирусом лиц или нет[20][21].
Таксономия

Семейство коронавирусов (лат. Coronaviridae) включает в себя 2 подсемейства и около 40 видов[22]:
Примечания
- ↑ Таксономия вирусов (англ.) на сайте Международного комитета по таксономии вирусов (ICTV).
- ↑ Таксономия вирусов (англ.) на сайте Международного комитета по таксономии вирусов (ICTV). (Проверено 19 июля 2019).
- ↑ Атлас по медицинской микробиологии, вирусологии и иммунологии : Учебное пособие для студентов медицинских вузов / под ред. А. А. Воробьева, А. С. Быкова. — М. : Медицинское информационное агентство, 2003. — С. 121. — ISBN 5-89481-136-8.
- ↑ 1 2 Figure 1: The life cycle of SARS-CoV in host cells.Severe acute… (англ.). ResearchGate. Дата обращения 3 февраля 2020.
- ↑ 1 2 Figure 2. The life cycle of SARS-CoV and MERS-CoV in host cells…. (англ.). ResearchGate. Дата обращения 3 февраля 2020.
- ↑ Коротяев А. И., Бабичев С. А. Медицинская микробиология, иммунология и вирусология. — СПб : СпецЛит, 2008.
- ↑ Пульмонология: национальное руководство. — М. : ГЭОТАР-Медиа, 2009.
- ↑ 1 2 3 Широбоков В. П. Медицинская микробиология, вирусология и иммунология. — Винница : Нова Книга, 2015. — С. 504—505.
- ↑ Эпидемия коронавируса достигнет пика в середине февраля, он может быть заразнее атипичной пневмонии Что нового узнали ученые за неделю // Meduza. — 2020. — 30 января.
- ↑ SARSкий брат из Уханя // Алла Астахова.Ru.
- ↑ Xintian Xu, Ping Chen, Jingfang Wang, Jiannan Feng, Hui Zhou. Evolution of the novel coronavirus from the ongoing Wuhan outbreak and modeling of its spike protein for risk of human transmission (англ.) // SCIENCE CHINA Life Sciences. — 2020-01-21. — ISSN 1869-1889. — DOI:10.1007/s11427-020-1637-5.
- ↑ Воронин, Николай. Ученые: вакцина от атипичной пневмонии может остановить новый коронавирус, BBC News Русская служба (4 февраля 2020). Дата обращения 4 февраля 2020.
- ↑ Thiel V (editor). Coronaviruses: Molecular and Cellular Biology (англ.). — 1st. — Caister Academic Press (англ.)русск., 2007. — ISBN 978-1-904455-16-5.Шаблон:Page needed
- ↑ [[1] в «Книгах Google» Coronaviridae] // Virus Taxonomy (неопр.) / King, Andrew M.Q.; Adams, Michael J.; Carstens, Eric B.; Lefkowitz, Elliot J.. — 2012. — С. 806—828. — ISBN 978-0-12-384684-6. — DOI:10.1016/B978-0-12-384684-6.00068-9.
- ↑ 1 2 Filippo Ansaldi, F Banfi, P Morelli, L Valle, Paolo Durando. SARS-CoV, influenza A and syncitial respiratory virus resistance against common disinfectants and ultraviolet irradiation // Journal of Preventive Medicine and Hygiene. — 2004-03-01. — Т. 45.
- ↑ H. F. Rabenau, G. Kampf, J. Cinatl, H. W. Doerr. Efficacy of various disinfectants against SARS coronavirus (англ.) // Journal of Hospital Infection. — 2005-10-01. — Т. 61, вып. 2. — С. 107–111. — ISSN 1532-2939 0195-6701, 1532-2939. — DOI:10.1016/j.jhin.2004.12.023.
- ↑ Рекомендации ВОЗ для населения в связи c распространением нового коронавируса (2019-нКоВ) (рус.). www.who.int. Дата обращения 5 февраля 2020.
- ↑ Christopher M. Walker, GwangPyo Ko. Effect of Ultraviolet Germicidal Irradiation on Viral Aerosols (англ.). — 2007-08-01. — DOI:10.1021/es070056u.s001.
- ↑ Вирусолог оценил вероятность «доставки» вируса в Россию в посылках с AliExpress (неопр.). lenta.ru. Дата обращения 4 февраля 2020.
- ↑ ВОЗ заявила о безопасности посылок из Китая (неопр.). РБК. Дата обращения 4 февраля 2020.
- ↑ Оценка ВОЗ (рус.). Interfax.ru. Дата обращения 4 февраля 2020.
- ↑ Virus Taxonomy: 2018 Release // International Committee on Taxonomy of Viruses (ICTV). — 2018. — 1 October.
Ссылки
ДНК-содержащие вирусы — Википедия
ДНК-содержащие вирусы — вирусы, геном которых представлен дезоксирибонуклеиновой кислотой и репликация идёт посредством ДНК-зависимой ДНК-полимеразы, без использования промежуточного звена-посредника РНК.
Геномная ДНК этих вирусов может быть двуцепочечной или одноцепочечной и иметь линейную или кольцевую форму.
Группа I — вирусы, содержащие двуцепочечную ДНК[править | править код]
- Порядок Caudovirales
- Семейство Ackermannviridae
- Семейство Herelleviridae
- Семейство Myoviridae — включает бактериофаг T4 энтеробактерий
- Семейство Podoviridae
- Семейство Siphoviridae — включает бактериофаг λ энтеробактерий
- Порядок Herpesvirales
- Семейство Alloherpesviridae
- Семейство Herpesviridae (Герпесвирусы)
- Семейство Malacoherpesviridae
- Порядок Ligamenvirales
- Семейство Lipothrixviridae
- Семейство Rudiviridae
- Неклассифицируемые семейства
- Семейство Adenoviridae (Аденовирусы)
- Семейство Ampullaviridae
- Семейство Ascoviridae
- Семейство Asfarviridae (Асфаровирусы)
- Семейство Bicaudaviridae
- Семейство Baculoviridae (Бакуловирусы)
- Семейство Clavaviridae
- Семейство Corticoviridae
- Семейство Fuselloviridae
- Семейство Globuloviridae
- Семейство Guttaviridae
- Семейство Hytrosaviridae
- Семейство Iridoviridae
- Семейство Lavidaviridae (Вирофаги)
- Семейство Marseilleviridae
- Семейство Mimiviridae — включает Mimivirus
- Семейство Nimaviridae
- Семейство Papillomaviridae (Папилломавирусы)
- Семейство Phycodnaviridae
- Семейство Plasmaviridae
- Семейство Pleolipoviridae
- Семейство Polydnaviridae
- Семейство Polyomaviridae (Полиомавирусы)
- Семейство Portogloboviridae
- Семейство Poxviridae (Поксвирусы)
- Семейство Sphaerolipoviridae
- Семейство Tectiviridae
- Семейство Tristromaviridae
- Семейство Turriviridae
- Неклассифицируемые роды
- Dinodnavirus
- Tupanvirus
Группа II — вирусы, содержащие одноцепочечную ДНК[править | править код]
- Неклассифицируемые семейства бактериофагов
- Семейство Inoviridae
- Семейство Microviridae
- Неклассифицируемые семейства
- Семейство Anelloviridae
- Семейство Bacilladnaviridae
- Семейство Bidnaviridae
- Семейство Geminiviridae
- Семейство Genomoviridae
- Семейство Circoviridae
- Семейство Nanoviridae
- Семейство Parvoviridae (Парвовирусы)
- Семейство Smacoviridae
- Семейство Spiraviridae
 | Это заготовка статьи по вирусологии. Вы можете помочь проекту, дополнив её. |
| I: дцДНК-вирусы |
|
|---|---|
| II: оцДНК-вирусы |
|
| III: дцРНК-вирусы |
|
| IV: (+)оцРНК-вирусы |
|
| V: (-)оцРНК-вирусы |
|
| VI: оцРНК-ОТ-вирусы |
|
| VII: дцДНК-ОТ-вирусы |
|
| |
Вирус Норуолк — Википедия
| Вирус Норуолк | |||||
|---|---|---|---|---|---|
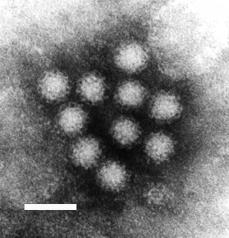 Фотография вирусов Норуолк, полученная с помощью трансмиссионного электронного микроскопа. Разрешение 50 нм | |||||
| |||||
Norwalk virus | |||||
IV: (+)оцРНК-вирусы | |||||
Вирус Норуолк[2] или вирус Норфолк[3] (англ. Norwalk virus), — вид РНК-содержащих вирусов из семейства калицивирусов (Caliciviridae), единственный в роде норовирусов[2][3] (Norovirus)[4]. Примерно в 90 % случаев этот вирус является причиной эпидемий желудочно-кишечных заболеваний небактериальной природы во всём мире[5][6][7], а в США отвечает за возникновение 50 % случаев заболевания гастроэнтеритом[8]. Вирусам Норуолк могут быть подвержены люди всех возрастов. Вирусы передаются при прямом контакте с больным и гораздо реже — фекально-оральным способом через заражённую еду либо воду[9]. Часто норовирусную инфекцию называют кишечным или желудочным гриппом.
У переболевшего человека иммунитет вырабатывается обычно не до конца и носит временный характер[10]. Существует врождённая предрасположенность к инфекции. Люди с первой группой крови заболевают чаще[5][11], в то время как третья и четвёртая группа крови менее восприимчивы к возбудителю.
Вспышки болезней, вызываемые вирусами Норуолк, чаще возникают в закрытых либо полузакрытых учреждениях, таких как лечебные учреждения для хронических больных, больницы, тюрьмы, общежития и круизные лайнеры, где однажды вирус появился, и инфекция распространяется очень быстро от человека к человеку либо через заражённую пищу[12]. Во многих случаях норовирус передавался через еду, стоило только одному инфицированному человеку к ней прикоснуться[13].
Вирус Норуолк можно быстро деактивировать нагреванием или при обработке хлоросодержащими дезинфицирующими веществами. Он более устойчив к обработке спиртом и детергентами из-за того, что его частицы не имеют липидной оболочки[14].
Различают несколько геногрупп вируса Норуолк, и большинство поражающих человека классифицированы в геногруппы GI и GII[15].
Вид с момента регистрации называется Norwalk virus по местности Норуолк, Огайо, где в ноябре 1968 года была зарегистрирована вспышка острого гастроэнтерита среди школьников одной начальной школы. В 1972 году в результате иммунноэлектронной микроскопии консервированных проб фекалий был обнаружен вирус, который получил название вирус Норуолк. С тех пор были зарегистрированы многочисленные заболевания с подобными симптомами. Клонирование и секвенирование генома вируса Норуолк показало, что эти вирусы имеют такую же геномную организацию, как и у вирусов семейства Caliciviridae[16]. Название рода Norovirus было утверждено Международным комитетом по таксономии вирусов в 2002 году[17].
К типичным заболеваниям, вызываемым вирусами Норуолк, относят болезни ЖКТ в осенне-зимний период, одним из симптомов которых является тошнота, вирусный гастроэнтерит[18], а также известный в народе «желудочный грипп» — список может быть дополнен и заболеваниями, связанными с воспалением желудка и возникшими от других вирусов и бактерий.
Для обозначения вируса в разное время использовали и другие названия: SRSVs (мелкие круглые вирусы), вирус типа Саппоро (Sapporo) и типа Снежных гор (Snow Mountain)[19].
Инкубационный период составляет от 10 до 72 часов, в большинстве случаев симптомы проявляются через 1—2 суток. Это, как правило, самоизлечивающаяся болезнь, и её характерные признаками являются тошнота[20], рвота, диарея, а также боли в области живота, в некоторых случаях — потеря вкусовой чувствительности. У детей, как правило, в симптоматике преобладает рвота, у взрослых — диарея. Может наблюдаться сонливость, вялость, мышечная боль и слабое проявление лихорадки. Симптомы могут продолжаться несколько дней, и если игнорировать и не бороться с обезвоживанием организма, заболевание чревато опасными для жизни последствиями. В группу риска входят дети, пожилые люди и пациенты с ослабленной иммунной системой. Норовирус, попав в организм человека, реплицируется в тонкой кишке[9].
Обычно норовирус диагностируют при помощи полимеразной цепной реакции (ПЦР) либо по анализам ПЦР в реальном времени, которые показывают результат уже через несколько часов. Данные анализы достаточно чувствительны и могут определять концентрацию до 10 вирусных частиц[21].
Такие тесты как иммуноферментный анализ (ИФА) с использованием антител против разных штаммов норовируса доступны на коммерческой основе, но они обладают недостаточной точностью и чувствительностью[22].
Профилактика и инфекционный контроль[править | править код]
Мытьё рук по-прежнему остаётся одним из наиболее эффективных средств для предотвращения распространения болезнетворных микроорганизмов (в данном случае норовируса). Норовирус может попасть в воздух через рвотные массы больного. Все поверхности в местах, где может присутствовать Норовирус, желательно продезинфицировать[23].
В целях профилактики внутрибольничной инфекции в медицинских учреждениях проводится ряд мероприятий, в том числе ежедневная влажная уборка. В медицинских учреждениях, где распыление хлористых и других едких соединений негативно сказывается на медицинской электронике, применяются NAV-CO2 системы[24].
Компания Ligocyte занималась разработкой вакцины, однако, первая фаза клинических испытаний закончилась неудачно[25].
Вирусы Норуолк передаются при прямом контакте с больным или опосредованно через загрязнённую воду или пищу. В докладе Центра контроля заболеваний (CDC), объектами которого стали 11 вспышек в штате Нью-Йорк, говорится, что предположительно в 7 случаях заболевание передавалось от человека к человеку, в 2 случаях — через пищу, в 1 случае — через воду, а причина ещё одного случая неизвестна. Заражённая вода попадает в организм человека несколькими путями: как водопроводная вода, вода из колодца, вода из открытых общественных водоёмов, бассейнов и вода из автоматов с кубиками льда[26].
Морепродукты и ингредиенты салатов — еда, которая чаще всего влечёт за собой вспышки Норуолка. Употребление сырых или недостаточно обработанных термически моллюсков и устриц также представляет большой риск инфицирования этим вирусом. Другие продукты питания могут быть заражены от больного во время приготовления им пищи[27][23].
В США по количеству зарегистрированных обращений к врачу вирусный гастроэнтерит уступает только обычной простуде. Несмотря на то, что причиной вирусного гастроэнтерита могут быть множество различных вирусов, считается, что около в 1/3 случаев возбудителем заболевания у младенцев от 6 до 24 месяцев были вирусы Норуолк. В развивающихся странах процент людей, у которых развился иммунитет в раннем возрасте, очень высокий. В США процент со временем постепенно увеличивается и достигает отметки 50 % населения старше 18 лет. Тем не менее, постинфекционный иммунитет непродолжителен и не исключает повторное заражение. Согласно современным исследованиям, третья и четвёртая группы крови обладают частичной защитой от симптоматической инфекции[28][29].
Вирус Норуолк вызывает острый гастроэнтерит. Инкубационный период продолжается от 24 до 48 часов, чаще 33—36 часов, заболевание длится 24—60 часов[9]. Осложнения наблюдаются редко: чаще всего пациенты проходят лечение в приёмных отделениях скорой помощи и практически не направляются в обычные больницы. По оценкам специалистов каждый год в США около 300 больных умирают от этой инфекции, прежде всего жертвами становятся дети раннего возраста, люди пожилого возраста и лица с ослабленной иммунной системой.
Стандартные исследования по выявлению вируса Норуолк (РНК-содержащий вирус) в съедобных моллюсках и устрицах по результатам полимеразной цепной реакции с обратной транскриптазой запрашиваются государственными лабораториями, такими как FDA (комиссией по контролю за лекарствами и питательными веществами) в США. При этом стандартные методы определения наличия вируса в продуктах питания не всегда приемлемы из-за неоднородного происхождения разных продуктов, влияющего на концентрацию и экстрагирование вируса, и наличия факторов, которые делают методы анализа ПЦР (полимеразной цепной реакции) неэффективными[30].
 Фотография частиц вируса Норуолк в фекалиях, полученная с помощью трансмиссионного микроскопа
Фотография частиц вируса Норуолк в фекалиях, полученная с помощью трансмиссионного микроскопаВирус Норуолк — вирус без внешней оболочки из семейства Caliciviridae, геном которых представлен одноцепочечной (+)РНК, различают несколько генетических групп[31]. Согласно Международному комитету по таксономии вирусов род норовирусов имеет одну разновидность — вирус Норуолк (Norwalk virus), сокращенно «NV». Серотипы, штаммы и изоляты включают:
- вирус Пустыни Шилд (Desert Shield virus) [U04469] (Hu/NLV/DSV395/1990/SR)
- вирус Лордсдейл (Lordsdale virus) [X86557] (Hu/NLV/LD/1993/UK)
- вирус Мексико (Mexico virus)[U22498] (Hu/NLV/MX/1989/MX)
- вирус Норуолк (Norwalk virus) [M87661] (Hu/NLV/NV/1968/US)
- вирус Гавайи (Hawaii virus) [U07611] (Hu/NLV/HV/1971/US)
- вирус Снежных гор (Snow Mountain virus)[L23831] (Hu/NLV/SMV/1976/US)
- вирус Саут-хэмптон (Southampton virus) [L07418] (Hu/NLV/SHV/1991/UK).
Во всём мире вирусы Норуолк являются основной причиной острого гастроэнтерита, часто заболевание проявляется групповыми вспышками в учреждениях. Норовирусы крайне заразны, уже 10 вирусных частиц способны вызвать инфекцию. Заболевание передаётся через заражённую пищу или воду и от человека к человеку. Механизм передачи главным образом фекально-оральный, но есть вероятность заразиться и воздушно-капельным путём, когда возбудители попадают в воздух с капельками рвотных масс. Норовирусы подразделяют на 5 геногрупп: геногруппа I (GI) включает вирус Норволк, вирус Пустыни Шилд и вирус Саут-хэмптон, и группа II (GII) — вирус Бристоль, вирус Лордсдейл, вирус Торонто, вирус Мексико, вирус Гавайи и вирус Снежных гор.
Геногруппы подразделяются на разные кластеры или генотипы. Например, геногруппа II, наиболее превалирующая «человеческая» геногруппа, до настоящего времени содержит 19 генотипов. Геногруппы I, II и IV вызывают поражения у человека, а геногруппа III инфицирует рогатый скот. Геногруппа V недавно была обнаружена у мышей[32].
Норовирусы геногруппы II, генотип 4 (сокращённо GII4) являются причиной большинства вспышек гастроэнтерита у взрослых и часто перемещаются по всей планете. Недавние образцы содержат US95/96-US-штамм, который имеет отношение к глобальным вспышкам середины и конца 90-х, вирус Фармингтон Хиллс (Farmington Hills) ассоциируется со вспышками в Европе и Соединённых Штатах в 2002 году, а вирус Хантер (Hunter virus) — со вспышками в Европе, Японии и Австралазии 2004 года. В 2006 году наблюдалась очередная мировая волна норовирусной инфекции[33]. В декабре 2007 была зарегистрирована вспышка в загородном клубе на севере Калифорнии, где были инфицированы от 80 до 100 человек. Два новых варианта GII4 стали причиной около 80 % ассоциированных с вирусом Норуолк вспышек. Они были названы 2006a и 2006b. В недавних отчётах говорится о связи между группой крови и восприимчивостью к норовирусной инфекции[34][35][36].
Учёные медицинского факультета университета Вашингтона в Сент-Луисе предположили, что белок MDA-5 может быть первичным иммунным сенсором, который выявляет наличие вирусов Норуолк в организме[37]. Любопытно, что некоторые люди имеют общие вариации MDA-5-гена, что делает их более восприимчивыми к норовирусной инфекции[38].
Геном вируса Норуолк представляет собой одноцепочечную (+)РНК размером приблизительно 7,5 тыс. нуклеотидов, содержащую 3 открытые рамки считывания, кодирующие неструктурный полипептид, претерпевающий автопротеолиз с образованием 5 активных белков, главный структурный белок (VP1) в пределах 58~60 кДа и минорный капсидный белок (VP2)[39]. При рассмотрении в электронный микроскоп вирусные частицы демонстрируют аморфное строение поверхности; размер вирусных частиц — между 27 и 38 нм[40].
- ↑ Таксономия вирусов (англ.) на сайте Международного комитета по таксономии вирусов (ICTV).
- ↑ 1 2 Пиневич А. В., Сироткин А. К., Гаврилова О. В., Потехин А. А. Вирусология : учебник. — СПб. : Издательство Санкт-Петербургского университета, 2012. — С. 355. — ISBN 978-5-288-05328-3.
- ↑ 1 2 Сергеев В. А., Непоклонов Е. А., Алипер Т. И. Вирусы и вирусные вакцины. — М. : Библионика, 2007. — С. 462—463. — ISBN 5-98685-012-2.
- ↑ Таксономия вирусов (англ.) на сайте Международного комитета по таксономии вирусов (ICTV). (Проверено 18 апреля 2019).
- ↑ 1 2 Lindesmith L., Moe C., Marionneau S., et al. Human susceptibility and resistance to Norwalk virus infection (англ.) // Nat. Med. : journal. — 2003. — Vol. 9, no. 5. — P. 548—553. — DOI:10.1038/nm860. — PMID 12692541.
- ↑ Norovirus: Technical Fact Sheet (неопр.). National Center for Infectious Diseases, CDC. Архивировано 24 марта 2012 года.
- ↑ Ahmed S. M., Hall A. J., Robinson A. E., Verhoef L., Premkumar P., Parashar U. D., Koopmans M., Lopman B. A. Global prevalence of norovirus in cases of gastroenteritis: a systematic review and meta-analysis. (англ.) // The Lancet infectious diseases. — 2014. — Vol. 14, no. 8. — P. 725—730. — DOI:10.1016/S1473-3099(14)70767-4. — PMID 24981041. [исправить]
- ↑ Widdowson M. A., Sulka A., Bulens S. N., et al. Norovirus and foodborne disease, United States, 1991-2000 (англ.) // Emerging Infect. Dis. : journal. — 2005. — Vol. 11, no. 1. — P. 95—102. — PMID 15705329.
- ↑ 1 2 3 Goodgame R. Norovirus gastroenteritis (неопр.) // Curr Gastroenterol Rep. — 2006. — Т. 8, № 5. — С. 401—408. — DOI:10.1007/s11894-006-0026-4. — PMID 16968608.
- ↑ Lindesmith L., Moe C., Lependu J., Frelinger J. A., Treanor J., Baric R. S. Cellular and humoral immunity following Snow Mountain virus challenge (англ.) // J. Virol. : journal. — 2005. — Vol. 79, no. 5. — P. 2900—2909. — DOI:10.1128/JVI.79.5.2900-2909.2005. — PMID 15709009.
- ↑ Hutson A. M., Atmar R. L., Graham D. Y., Estes M. K. Norwalk virus infection and disease is associated with ABO histo-blood group type (англ.) // Journal of Infectious Diseases : journal. — 2003. — July (vol. 188, no. 1). — P. 176—177.
- ↑ Noda M., Fukuda S., Nishio O. Statistical analysis of attack rate in norovirus foodborne outbreaks (англ.) // Int J Food Microbiol : journal. — 2007. — Vol. 122. — P. 216. — DOI:10.1016/j.ijfoodmicro.2007.11.073. — PMID 18177970.
- ↑ Koopmans M., Duizer E. Foodborne viruses: an emerging problem (неопр.) // Int. J. Food Microbiol.. — 2004. — Т. 90, № 1. — С. 23—41. — DOI:10.1016/S0168-1605(03)00169-7. — PMID 14672828.
- ↑ Jimenez L., Chiang M. Virucidal activity of a quaternary ammonium compound disinfectant against feline calicivirus: a surrogate for norovirus (англ.) // Am J Infect Control : journal. — 2006. — Vol. 34, no. 5. — P. 269—273. — DOI:10.1016/j.ajic.2005.11.009. — PMID 16765204.
- ↑ Vinjé J., Green J., Lewis D. C., Gallimore C. I., Brown D. W., Koopmans M. P. Genetic polymorphism across regions of the three open reading frames of «Norwalk-like viruses» (англ.) // Arch. Virol. : journal. — 2000. — Vol. 145, no. 2. — P. 223—241. — PMID 10752550.
- ↑ Kapikian A. Z. Overview of viral gastroenteritis (неопр.) // Arch. Virol. Suppl.. — 1996. — Т. 12. — С. 7—19. — PMID 9015097.
- ↑ ICTVdB Management (2006). 00.012.0.03. Norovirus. In: ICTVdB — The Universal Virus Database, version 4. Büchen-Osmond, C. (Ed), Columbia University, New York, USA
- ↑ Goodgame R. Norovirus gastroenteritis (неопр.) // Curr Gastroenterol Rep. — 2006. — Т. 8, № 5. — С. 401—408. — DOI:10.1007/s11894-006-0026-4. — PMID 16968608.
- ↑ Appleton H. Small round viruses: classification and role in food-borne infections (англ.) // Ciba Found. Symp. : journal. — 1987. — Vol. 128. — P. 108—125. — PMID 3036438.
- ↑ В лагере «Зеркальный» дети заразились норовирусом.
- ↑ Marshall J. A., Bruggink L. D. Laboratory diagnosis of norovirus (неопр.) // Clin. Lab.. — 2006. — Т. 52, № 11—12. — С. 571—581. — PMID 17175887.
- ↑ Wilhelmi de Cal I., Revilla A., del Alamo J. M., Román E., Moreno S., Sánchez-Fauquier A. Evaluation of two commercial enzyme immunoassays for the detection of norovirus in faecal samples from hospitalised children with sporadic acute gastroenteritis (англ.) // Clin. Microbiol. Infect. : journal. — 2007. — Vol. 13, no. 3. — P. 341—343. — DOI:10.1111/j.1469-0691.2006.01594.x. — PMID 17391396.
- ↑ 1 2 CDC Preventing Norovirus Infection
- ↑ Chadwick P. R., Beards G., Brown D., Caul E. O., Cheesbrough J., Clarke I., Curry A., O’Brien S., Quigley K., Sellwood J., Westmoreland D. Management of hospital outbreaks of gastro-enteritis due to small roundstructured viruses (англ.) // J. Hosp. Infect. : journal. — 2000. — Vol. 45, no. 1. — P. 1—10. — DOI:10.1053/jhin.2000.0662. — PMID 10833336.
- ↑ Takeda’s norovirus vaccine misses endpoint in early-phase trial — FierceVaccines.
- ↑ Hedberg C. W., Osterholm M. T. Outbreaks of food-borne and waterborne viral gastroenteritis (англ.) // Microbiology and Molecular Biology Reviews (англ.)русск. : journal. — American Society for Microbiology (англ.)русск., 1993. — Vol. 6, no. 3. — P. 199—210. — PMID 8395330.
- ↑ Parashar U. D., Monroe S. S. «Norwalk-like viruses» as a cause of foodborne disease outbreaks (англ.) // Rev. Med. Virol. : journal. — 2001. — Vol. 11, no. 4. — P. 243—252. — DOI:10.1002/rmv.321. — PMID 11479930.
- ↑ Norwalk Virus Infection and Disease Is Associated with ABO Histo-Blood Group Type, The Journal of Infectious Diseases. Дата обращения 5 февраля 2007.
- ↑ Harrington P. R., Lindesmith L., Yount B., Moe C. L., Baric R. S. Binding of Norwalk virus-like particles to ABH histo-blood group antigens is blocked by antisera from infected human volunteers or experimentally vaccinated mice. (англ.) // Journal of virology. — 2002. — Vol. 76, no. 23. — P. 12335—12343. — PMID 12414974. [исправить]
- ↑ Shieh Y., Monroe S. S., Fankhauser R. L., Langlois G. W., Burkhardt W., Baric R. S. Detection of norwalk-like virus in shellfish implicated in illness (англ.) // J. Infect. Dis. : journal. — 2000. — Vol. 181 Suppl 2. — P. S360—S366. — PMID 10804149.
- ↑ Department of Health and Ageing Norovirus laboratory case definition.
- ↑ Ramirez S., Giammanco G. M., De Grazia S., Colomba C., Martella V., Arista S. Genotyping of GII.4 and GIIb norovirus RT-PCR amplicons by RFLP analysis (англ.) // J. Virol. Methods : journal. — 2008. — Vol. 147, no. 2. — P. 250—256. — DOI:10.1016/j.jviromet.2007.09.005. — PMID 17953996.
- ↑ Tu E. T., Bull R. A., Greening G. E., Hewitt J., Lyon M. J., Marshall J. A., McIver C. J., Rawlinson W. D., White P. A. Epidemics of gastroenteritis during 2006 were associated with the spread of norovirus GII.4 variants 2006a and 2006b (англ.) // Clin. Infect. Dis. : journal. — 2008. — Vol. 46, no. 3. — P. 413—420. — DOI:10.1086/525259. — PMID 18177226.
- ↑ Huang P., Farkas T., Marionneau S., Zhong W., Ruvoën-Clouet N., Morrow A. L., Altaye M., Pickering L. K., Newburg D. S., LePendu J., Jiang X. Noroviruses bind to human ABO, Lewis, and secretor histo-blood group antigens: identification of 4 distinct strain-specific patterns (англ.) // J. Infect. Dis. : journal. — 2003. — Vol. 188, no. 1. — P. 19—31. — DOI:10.1086/375742. — PMID 12825167.
- ↑ Huang P., Farkas T., Zhong W., Tan M., Thornton S., Morrow A. L., Jiang X. Norovirus and histo-blood group antigens: demonstration of a wide spectrum of strain specificities and classification of two major binding groups among multiple binding patterns (англ.) // J. Virol. : journal. — 2005. — Vol. 79, no. 11. — P. 6714—6722. — DOI:10.1128/JVI.79.11.6714-6722.2005. — PMID 15890909.
- ↑ Rockx B. H., Vennema H., Hoebe C. J., Duizer E., Koopmans M. P. Association of histo-blood group antigens and susceptibility to norovirus infections (англ.) // J. Infect. Dis. : journal. — 2005. — Vol. 191, no. 5. — P. 749—754. — DOI:10.1086/427779. — PMID 15688291.
- ↑ McCartney S. A., Thackray L. B., Gitlin L., Gilfillan S., Virgin Iv H. W., Colonna M. MDA-5 recognition of a murine norovirus. (неопр.) // PLoS Pathog. — 2008. — 18 July. — PMID 18636103.
- ↑ Researchers Discover Primary Sensor That Detects Stomach Viruses Newswise, Retrieved on July 20, 2008.
- ↑ Clarke I. N., Lambden P. R. Organization and expression of calicivirus genes (неопр.) // J. Infect. Dis.. — 2000. — Т. 181 Suppl 2. — С. S309—S316. — PMID 10804143.
- ↑ Prasad B. V., Crawford S., Lawton J. A., Pesavento J., Hardy M., Estes M. K. Structural studies on gastroenteritis viruses (неопр.) // Novartis Found. Symp.. — 2001. — Т. 238. — С. 26—37; discussion 37—46. — PMID 11444031.
Астровирусы — Википедия
Материал из Википедии — свободной энциклопедии
Астровирусы[2] (лат. Astroviridae) — семейство вирусов, обнаруженных в 1975 году при помощи электронной микроскопии в стуле человека[3].
Наряду с Picornaviridae и Caliciviridae[en], астровирусы являются третьим семейством безоболочечных вирусов с одноцепочечной геномной (+)РНК[4][5]. Астровирусы человека являются одной из причин гастроэнтеритов у детей раннего периода[4].
У детей и взрослых вызывают гастроэнтериты. Ключевые симптомы — диарея, тошнота, рвота, недомогание и боли в животе. Инфицированные не нуждаются в госпитализации так как симптомы заболевания проходят сами собой в течение короткого периода[6].
Электронная микроскопия, ИФА, иммунофлуоресценция, ПЦР позволяют выявить вирусные частицы, антигены или нуклеиновые кислоты в фекалиях инфицированных людей[7].
Метод ПЦР в реальном времени позволяет обнаружить все генотипы астровирусов человека[8].
Не существует вакцины или противовирусных средств против астровирусной инфекции. Личная гигиена снижает вероятность заболевания.
Вирионы астровирусов имеют размер около 28—35 нм в диаметре, икосаэдрическую форму, а также звездчатую поверхность, с пятью или шестью отростками. Вирусы не содержат оболочки, геном представлен РНК[9].
Семейство астровирусов включает два рода: Mamastrovirus (19 видов), инфицирующие млекопитающих, и Avastrovirus (3 вида), инфицирующие птиц. Виды также разделяются на серовары[10].
- ↑ Таксономия вирусов (англ.) на сайте Международного комитета по таксономии вирусов (ICTV).
- ↑ Атлас по медицинской микробиологии, вирусологии и иммунологии : Учебное пособие для студентов медицинских вузов / Под ред. А. А. Воробьева, А. С. Быкова. — М. : Медицинское информационное агентство, 2003. — С. 121. — ISBN 5-89481-136-8.
- ↑ Madeley C. R., Cosgrove B. P. Letter: 28 nm particles in faeces in infantile gastroenteritis (англ.) // The Lancet : journal. — Elsevier, 1975. — Vol. 2, no. 7932. — P. 451—452. — DOI:10.1016/S0140-6736(75)90858-2. — PMID 51251.
- ↑ 1 2 Brown D. W., Gunning K. B., Henry D. M., et al. A DNA oligonucleotide microarray for detecting human astrovirus serotypes (англ.) // Journal of Virological Methods : journal. — 2008. — January (vol. 147, no. 1). — P. 86—92. — DOI:10.1016/j.jviromet.2007.07.028. — PMID 17905448.
- ↑ Matsui S. M., Kiang D., Ginzton N., Chew T., Geigenmüller-Gnirke U. Molecular biology of astroviruses: selected highlights (англ.) // Novartis Found. Symp. : journal. — 2001. — Vol. 238. — P. 219—233; discussion 233—236. — DOI:10.1002/0470846534.ch23. — PMID 11444028.
- ↑ Madeley C. R. Virus diarrhoea in hospital (неопр.) // J. Hosp. Infect.. — 1988. — Т. 12, № 3. — С. 145—149. — DOI:10.1016/0195-6701(88)90001-1. — PMID 2904454.
- ↑ Guix S., Bosch A., Pintó R. M. Human astrovirus diagnosis and typing: current and future prospects (англ.) // Lett. Appl. Microbiol. : journal. — 2005. — Vol. 41, no. 2. — P. 103—105. — DOI:10.1111/j.1472-765X.2005.01759.x. — PMID 16033504. Архивировано 18 января 2013 года.
- ↑ Royuela E., Negredo A., Sánchez-Fauquier A. Development of a one step real-time RT-PCR method for sensitive detection of human astrovirus (англ.) // Journal of Virological Methods : journal. — 2006. — April (vol. 133, no. 1). — P. 14—19. — DOI:10.1016/j.jviromet.2005.10.012. — PMID 16321452.
- ↑ Krishna N.K. Identification of structural domains involved in astrovirus capsid biology (англ.) // Viral Immunol. : journal. — 2005. — Vol. 18, no. 1. — P. 17—26. — DOI:10.1089/vim.2005.18.17. — PMID 15802951.
- ↑ Lukashov V. V., Goudsmit J. Evolutionary relationships among Astroviridae (англ.) // Journal of General Virology (англ.)русск.. — Microbiology Society (англ.)русск., 2002. — Vol. 83, no. Pt 6. — P. 1397—1405. — PMID 12029155. Архивировано 13 января 2013 года.
Вирусная оболочка — Википедия
Материал из Википедии — свободной энциклопедии
Ви́русная оболо́чка, или суперкапси́д, — дополнительная оболочка, покрывающая капсид многих вирусов (в том числе вируса гриппа и многих вирусов животных)[1].
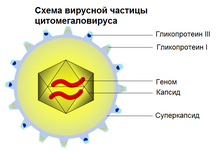
Оболочка, как правило, состоит из фрагментов хозяйских клеточных мембран (фосфолипидов и белков), но также содержит и вирусные гликопротеины. Вирусная оболочка используется для облегчения проникновения вируса в хозяйскую клетку. Гликопротеины на поверхности оболочки служат для идентификации и связи вируса со специфическим клеточным рецептором на мембране клетки-хозяина. Позже вирусная оболочка сливается с хозяйской мембраной, давая возможность капсиду и вирусному геному проникнуть внутрь и заразить хозяина.
Как правило, клетка, от которой вирус отпочковывается сам, или погибает, или значительно ослабляется и длительное время выпускает новые вирусные частицы. Липидный бислой оболочки этих вирусов довольно чувствителен к высыханию, повышенной температуре и дезинфицирующим агентам, поэтому такие вирусы легче поддаются стерилизации, чем непокрытые вирусы, хуже выживают вне хозяйской клетки и обычно передаются от хозяина к хозяину. Но оболочечные вирусы имеют огромную приспособляемость, быстро изменяются и могут в короткое время уйти от иммунной системы. Оболочечные вирусы могут вызывать возобновляющиеся инфекции.
Классы оболочечных вирусов, среди которых есть и патогены человека:
ДНК-содержащие вирусы[править | править код]
РНК-содержащие вирусы[править | править код]
Также к оболочечным вирусам относят ретровирусы.
ВИРУСЫ • Большая российская энциклопедия
ВИ́РУСЫ (от лат. virus – яд), мельчайшие биологич. объекты (обычно размером от сотых до десятых долей мкм). Важнейшая особенность В. – их неспособность к самостоятельному размножению, что связано с отсутствием у них механизмов для синтеза белков и производства энергии. Ранее считалось, что В. могут размножаться только в живых клетках (что обычно и имеет место), и это свойство входило в их науч. определение. Сейчас доказана принципиальная возможность размножения некоторых В. и в разрушенных клетках, но, несмотря на это, считается, что В. – облигатные (безусловные) внутриклеточные паразиты.
Строение вирусов

Схемы строения представителей некоторых семейств вирусов. РНК-содержащие вирусы: 1 – гиповирус; 2 – реовирус; 3 – рабдовирус; 4 – парамиксовирус; 5 – клостеровирус; 6 &nd…
Вирусные частицы, или вирионы, могут иметь сферическую, нитевидную, палочковидную и более сложные формы. Одни В. (их иногда называют простыми) представлены только нуклеокапсидом – геномом В., заключённым в белковую оболочку (капсид), обычно построенную из множества молекул белка одного и того же или разных типов, уложенных по закономерностям кубической или спиральной симметрии. У других (сложных) В. нуклеокапсид окружён наружной оболочкой (мембраной), обычно состоящей из липидов с вкраплениями белков и гликопротеинов. Геном В. представлен либо молекулой ДНК (ДНК-содержащие В.), либо одной или несколькими молекулами РНК (РНК-содержащие В.), причём у разных В. эти молекулы могут быть однонитевыми или двунитевыми, линейными или кольцевыми. Размеры генома варьируют обычно от нескольких тысяч до 30 тыс. нуклеотидов у РНК-содержащих В. и до нескольких сотен тысяч нуклеотидов у ДНК-содержащих. Самые мелкие геномы имеют всего неск. генов, которые кодируют белок (белки) вирусной оболочки и некоторые ферменты, принимающие участие в синтезе вирусных нуклеиновых кислот. В более крупных геномах (особенно у ДНК-содержащих В.) закодирована дополнительная информация, не всегда обязательная для сохранения жизнеспособности В., но обеспечивающая их более эффективное и независимое от внутриклеточных условий размножение. Напр., в ДНК-геноме мимивируса, поражающего амёб, заключено ок. 1200 генов, т. е. больше, чем в ДНК некоторых паразитич. микроорганизмов. Существуют т. н. дефектные В. (напр., В. гепатита дельта), которых называют паразитами «вдвойне»; у них нарушены те или иные системы репродукции, поэтому для образования потомства им требуется не только внутриклеточная среда, но и помощь со стороны др. полноценного В. (в данном случае – В. гепатита B). Для некоторых парвовирусов в качестве помощника выступают аденовирусы. В. могут поражать все живые организмы. В. бактерий называют бактериофагами (фагами). Описано неск. тысяч В. Их относят к десяткам семейств, среди которых выделяют роды и виды.
Размножение вирусов
Размножение вирусов протекает в неск. стадий. Сначала В. прикрепляется к клетке, что обычно требует наличия химич. сродства между поверхностью вирусной частицы и тем или иным компонентом клеточной поверхности (рецептором). Это взаимодействие весьма специфично, что является одной из причин высокой избирательности взаимодействия В. с клеткой (напр., В. полиомиелита или В. иммунодефицита человека – ВИЧ в естеств. условиях инфекционны только для человека). Но есть В. и с широким спектром хозяев, заражающие, напр., млекопитающих и насекомых (так, В. клещевого энцефалита размножается в организме человека и клеща). В клетки растений В. может проникать только после механич. повреждения (напр., насекомыми) клеточной стенки, т. к. она служит для них непреодолимым барьером. После взаимодействия В. с рецептором его геном (в свободном виде или в комплексе с белками) проникает внутрь клетки, где начинается синтез вирусных нуклеиновых кислот и белков (структурных компонентов вириона, а также вирусных ферментов и др. молекул, способствующих эффективному размножению вируса благодаря их взаимодействию с вирусными или клеточными макромолекулами). Последовательность образования этих двух типов молекул у разных В. варьирует. Однако всегда синтез вирусных белков направляется вирусными нуклеиновыми кислотами и происходит на рибосомах клетки. Синтез же вирусных нуклеиновых кислот осуществляется при участии либо вирусных, либо клеточных ферментов, нередко и тех и других. Затем вирусные нуклеиновые кислоты и структурные белки объединяются с образованием дочерних вирионов, которые покидают клетку, разрушая её или сохраняя целостность. Клеточная плазматическая мембрана сохраняется, напр., если В. покидает клетку путём т. н. почкования: «незрелый» вирион сначала обволакивается клеточной мембраной, включающей некоторые из вирусных белков, затем «отшнуровывается», а целостность клеточной мембраны восстанавливается. Т. о., для построения оболочки В. могут использоваться клеточные липиды и углеводы. Инфекц. процесс, инициированный одним вирионом, может приводить к образованию до 103–105 дочерних вирусных частиц.
Выделяют неск. осн. типов взаимодействия В. и клетки. При продуктивной литической инфекции заражённая клетка после образования вирусного потомства гибнет. В случае хронической персистентной (стойкой) инфекции заражённая клетка продолжает жить и делиться, постоянно поддерживая размножение В., хотя её функции могут претерпевать некоторые изменения. Такая инфекция может продолжаться длительное время без заметных внешних проявлений, не вызывая признаков заболевания, хотя могут иметь место определённые изменения регуляции клеточных процессов. Особый тип взаимодействия с клеткой наблюдается у т. н. умеренных В., к числу которых относятся бактериофаг лямбда и ряд В. человека и животных (напр., ВИЧ). Их геном ковалентно встраивается (интегрируется) в клеточную хромосому, превращаясь в элемент клеточного генома, и теряет способность к автономной репликации. В таком состоянии В. называют провирусом, а бактериофаг – профагом. У умеренных РНК-содержащих вирусов (ретровирусы) геном предварительно переходит в ДНК-форму. Экспрессия вирусных генов происходит так же, как и у генов клетки, а кодируемые ими белки могут влиять на свойства клетки, напр. на регуляцию её деления. В некоторых случаях встраивание вирусного генома в геном клетки может приводить к почти полному угнетению экспрессии клеточных генов. При этом клетка сохраняет жизнеспособность, но её свойства могут существенно меняться (напр., может произойти её злокачественная трансформация). Патологич. изменения клетки могут быть также связаны с угнетением синтеза РНК и клеточных белков, нарушением мембранной проницаемости и др. процессами, заканчивающимися во мн. случаях смертью клетки (цитопатический эффект).
В клетке и в целом организме существуют механизмы, препятствующие размножению В. и развитию вирус-индуцированной патологии, в т. ч. врождённый (напр., индукция интерферонов) и приобретённый (напр., образование антител) иммунитет. В свою очередь, мн. В. располагают механизмами, противодействующими клеточной защите. Так, некоторые В. подавляют секрецию интерферона заражённой клеткой, облегчая тем самым заражение соседних клеток вирусным потомством. Исход инфекции и судьба заражённой клетки и организма зависят от баланса противоположно направленных активностей В. и клетки. Поражение клеток в заражённом организме ведёт к нарушению работы соответствующих органов и тканей, проявляющихся в виде вирусных заболеваний. Некоторые из них имеют характер массовых эпидемий и даже пандемий и могут сопровождаться значительной смертностью (в т. ч. СПИД, грипп, ящур и др.). Важнейшим средством профилактики вирусных заболеваний является специфическая вакцинация.
Генетическая изменчивость вирусов, их эволюция
Изменчивость В. объясняет их способность «уходить» от иммунного ответа заражённого им организма (напр., в случае В. гриппа) и легко образовывать варианты, резистентные к лекарственным препаратам. Результатом изменчивости может быть также приобретение способности вызывать заболевания человека В., ранее патогенными только для животных. Нередко обнаруживается явное родство между отд. белками (напр., ферментами, осуществляющими синтез нуклеиновых кислот) у В., которые, на первый взгляд, не имеют между собой ничего общего. В ряде случаев заметно сходство между вирусными и клеточными белками. Из этого следует, что в ходе эволюции происходил (и, по-видимому, происходит) обмен генетич. информацией как между разными В., так и между В. и клеточными организмами. Ярким примером явления трансдукции – способности В. переносить гены или их фрагменты от одного организма к другому – может служить бактерия дифтерийная палочка, которая начинает вырабатывать токсин только после заражения её определённым фагом. Такой перенос генов (его называют горизонтальным) пытаются использовать для генной терапии путём создания на основе В. искусств. конструкций – векторов, способных вводить в заражаемую клетку здоровые или корректирующие гены.
Особую категорию составляют т. н. эндогенные В. Их геном в виде двунитевой ДНК, соответствующей геному ретровирусов, постоянно находится в составе клеточной хромосомы и функционирует как набор клеточных генов. Эндогенные В. могут быть полноценными, и тогда их экспрессия приводит к образованию В., способного заражать др. клетки (напр., В. рака молочных желёз мышей). В большинстве случаев, однако, эндогенные В. имеют дефектный геном, в котором некоторые вирусные гены отсутствуют или повреждены. Генетич. материал разнообразных эндогенных В. составляет весьма значительную долю хромосомной ДНК животных, в т. ч. человека. Они обнаружены и у растений. Считается, что эндогенные В. возникли в результате заражения половых клеток и последующей интеграции вирусной и клеточной ДНК. Такое заражение в процессе эволюции могло происходить многократно, и многие эндогенные В. считаются весьма древними.
Ввиду огромного разнообразия В. построение их эволюционного «древа» весьма затруднено. Среди мн. предположений о происхождении В. наибольшего внимания заслуживают два: или они возникли из обособившихся («одичавших») элементов клеточного генома, или в какой-то форме существовали уже на доклеточной стадии биологич. эволюции.
В. сыграли и продолжают играть выдающуюся роль как удобные модельные объекты для изучения общих закономерностей молекулярной биологии. Именно при изучении В. были расшифрованы важнейшие закономерности синтеза белков и нуклеиновых кислот и регуляции этих процессов, сформулированы мн. понятия молекулярной биологии и молекулярной генетики. См. также ст. Вирусология и лит. при ней.
