Тромбоцитопенічна Пурпура (хвороба Верльгофа) лікування
Тромбоцитопенічна Пурпура (синонім хвороба Верльгофа) — захворювання, що характеризується множинними крововиливами в шкіру і кровотечами зі слизових оболонок, зумовленими тромбоцитопенією (див.). Частіше спостерігається у жінок. Суть захворювання полягає в зниженні вироблення тромбоцитів мегакариоцитами кісткового мозку внаслідок їх функціональної неповноцінності. Виникає тромбоцитопенія, а також порушення проникності судинної стінки зумовлюють появу крововиливів і кровотеч.
В даний час патогенез деяких тромбоцитопений пов’язують з утворенням в організмі (переважно в селезінці) та накопиченням у крові антитромбоцитарних ізо — або аутоантитіл, що руйнують тромбоцити хворого (імунна форма). Імунний характер тромбоцитопений встановлюють на підставі відповідних лабораторних тестів (виявлення антитромбоцитарних антитіл).
Клінічна картина. Крововиливи в шкірні покриви і кровотечі з слизових оболонок розвиваються спонтанно або під впливом незначних травм. Найбільш часто бувають кровотечі з носа, ясен і порожнини рота, іноді — із внутрішніх органів; у жінок переважають маткові кровотечі. Селезінка не збільшена. Картина крові у стадії ремісії або у випадках, протікають з одними підшкірними крововиливами, нормальна, за винятком тромбоцитопений. При крововтратах розвивається постгеморагічна анемія, нейтрофільний лейкоцитоз. Найбільш характерні в цей період глибока тромбоцитопенія, різке порушення ретракції (скорочення) кров’яного згустку, різке подовження часу кровотечі (до 5 хв. і більше). У більшості випадків позитивні симптоми джгута і щипка (див. Кончаловського — Румпеля — Лееде симптом). Костномозговое кровотворення характеризується гіперплазією мегакаріоцитів; при прогресуючої анемії — гіперплазією клітин червоного паростка, гіперплазією червоного кісткового мозку в плоских кістках і розвитком вогнищ червоного кісткового мозку в діафизах трубчастих кісток. Протягом тромбоцитопенічної пурпури циклічне, періоди рецидивів змінюються ремісією. Питання про збереження вагітності у хворих на тромбоцитопенічну пурпуру вирішується строго індивідуально. При тяжкій формі з частими кровотечами збереження вагітності не показано, при спокійному перебігу захворювання вагітність може бути збережена. Хвора повинна перебувати не тільки під наглядом акушера, але і терапевта-гематолога.
Лікування. У період кровотеч призначають місцеві (див. Тромбін і Гемостатична губка) і загальні кровоспинні засоби: 0,5-1 г аскорбінової кислоти в 10 мл 10% розчину хлориду кальцію внутрішньовенно, вітамін Р-цитрин по 0,05 г і рутин по 0,025 г 3-4 рази в день, переливання крові (за призначенням та під контролем лікаря) у дозах 100-150 мл або переливання тромбоцитной маси (по 40-60 мл). При імунній формі тромбоцитопенічної пурпури застосовують кортикостероїди (за призначенням лікаря). Радикальним методом лікування тромбоцитопенічної пурпури вважається спленектомія (див.), показанням до якої служать наполегливі тромбоцитопенические кровотечі. Симптоматична тромбоцитопенічна пурпура зустрічається при різних патологічних станах (анеміях, лейкозах, інфекційних захворюваннях і ін).
Тромбоцитопенічна Пурпура (синонім: доброякісна тромбоцитопенія, хвороба Верльгофа) — захворювання, що характеризується множинними крововиливами в шкіру і кровотечами зі слизових оболонок, зумовленими тромбоцитопенією. Спостерігається частіше у жінок в період перебудови нейроендокринної системи — в 15-20 і 40-50 років. Відомі випадки сімейних захворювань. По частоті П. т. займає перше місце серед різних форм геморагічних діатезів.
Етіологія. Розрізняють хвороба Верльгофа як самостійну нозологічну форму і симптомокомплекс Верльгофа, обумовлений різними етіологічними факторами. До хвороби Верльгофа відноситься так звана ідіопатична, нерідко сімейна тромбоцитопенічна пурпура, характеризується відносно доброякісним, хронічним рецидивуючим перебігом. Симптомокомплекс Верльгофа може спостерігатися як придбане захворювання при різних патологічних станах.
Радіаційні тромбоцитопенії зустрічаються у людей, що піддаються впливу променистої енергії,- рентгенологів, радіологів, а також у хворих, які отримували рентгено — та радіотерапію. Хоча зниження кількості кров’яних пластинок у цих випадках зазвичай не досягає «критичної» цифри (30 000) і не супроводжується геморагічними явищами, воно повинно служити сигналом тривоги, так як подальше застосування рентгенівських опромінень (або радіоактивних ізотопів) може призвести до розвитку важкого геморагічного діатезу, що означає перехід кісткового мозку в гіпо — або апластическое стан.
Патогенез. Як показали спостереження, тромбоцитопенія при хворобі Верльгофа залежить від функціонального ураження мегакаріоцитів, що виражається в порушеному процесі «отшнурования» кров’яних пластинок (рис. 1).
Рис. 1. Зрілий мегакариоцит в пунктаті кісткового мозку при тромбоцитопенічній пурпурі (до спленектомії). Гігантська клітина морфологічно нормальна, але функціонально недеятельна (не відбувається утворення кров’яних пластинок).
В даний час патогенез більшості функціональних тромбоцитопений (не пов’язаних з органічної аплазією кісткового мозку) розглядають у світлі иммуногематологии як захворювання аутоімунної, рідше изоиммунной природи. Поруч авторів виділені при тромбоцитопенічній пурпурі аутоімунні антитромбоцитарні антитіла, серед яких розрізняють: 1) тромбоагглютинины; 2) неповні антитромбоцитарні антитіла, які виявляються за допомогою проб Кумбса; 3) «алергічні» антитромбоцитарні антитіла, які діють лише в присутності медикаменту або інших речовин, до яких сенсибилизирован хворий.
Иммуноаллергический характер тромбоцитопенії встановлюють на підставі відповідних лабораторних тестів (виявлення антитромбоцитарних антитіл, позитивні проби Кумбса). На користь імунологічного характеру захворювання говорить і сприятливий ефект лікування кортикостероїдними гормонами.
У генезі тромбоцитопенічна кровотеч слід враховувати і загальні чинники, що ведуть до підвищення проникності капілярної стінки, зокрема С-авітаміноз.
Патологічна анатомія. На розтині померлих від тромбоцитопенічна кровотеч виявляють множинні крововиливи на слизових і серозних оболонках, шкірі, жировій клітковині, паренхіматозних органах, оболонках головного мозку і речовині мозку.
При профузних кровотечах в порожнини і порожнинні органи (черевна, плевральної порожнини, порожнину малого тазу, шлунково-кишковий тракт) в них знаходять велику кількість вилилась крові. Якщо хворий загинув від масивної крововтрати, то на розтині виявляється недокрів’я органів поряд з гіперплазією червоного кісткового мозку в плоских кістках і розвитком вогнищ червоного кісткового мозку в діафизах трубчастих кісток (стегно). Відзначається також помірна гіперплазія селезінки за рахунок елементів пульпи. Мікроскопічно в кістковому мозку — гіперплазія мегакаріоцитів (останні відсутні при гіпопластичні станах кровотворення).
Клінічна картина. Основними клінічними симптомами тромбоцитопенічної пурпури є крововиливи в шкірні покриви і кровотечі з слизових оболонок, які розвиваються як би спонтанно, під впливом дрібних, ледь помітних травм. Крововиливи в шкіру відрізняються як за величиною (від шпилькової головки до блюдця), так і за кольором: в залежності від давності крововилив змінює свою первісну пурпурне забарвлення, набуваючи послідовно ліловий, синій, зелений, бурий або жовтий відтінок, одночасно стаючи все блідіше.
Улюбленими місцями розташування екхімози і петехій на шкірі є передня поверхня тулуба і кінцівок; рідше спостерігаються крововиливи на обличчі.
анемії. Друге місце за частотою посідають кровотечі з ясен і порожнини рота; вони не досягають великої інтенсивності, якщо тільки вони не викликані травмою. Особливо небезпечні екстракції зубів і тонзилектомія (відомі випадки смертельних кровотеч після цих операцій), між тим більші оперативні втручання — апендектомія або спленектомія — не викликають великих кровотеч.
Нерідкі при тромбоцитопенічній пурпурі кровотечі з внутрішніх органів (шлунково-кишкові, легеневі, ниркові) і крововилив у плевру, черевну порожнину, мозок, склеру і сітківку ока.
У жінок в клінічній картині хвороби нерідко домінують маткові кровотечі — мено — і метрорагії. Крововилив в очеревину в зв’язку з овуляцією може імітувати картину позаматкової вагітності. У дівчаток тромбоцитопенічна пурпура нерідко виявляється з появою перших місячних, приймають характер профузної кровотечі.
Селезінка не збільшена. У рідкісних випадках буває збільшена селезінка за рахунок перенесеної малярії або який-небудь інший тривалої інфекції; збільшення селезінки не можна пов’язувати з тромбоцитопенічну пурпуру. Значні розміри селезінки при геморагічному діатезі і тромбоцитопенії змушують думати про лейкоз, хвороби Гоше і т. п.
Картина крові. В стадії ремісії, а також у випадках, проявляються лише підшкірними (або подслизистыми) крововиливами без зовнішніх або внутрішніх кровотеч, картина крові нормальна. У зв’язку з крововтратами розвивається постгеморагічна анемія. При тривалих і повторних кровотечах анемія набуває гипорегенераторный і навіть гіпопластична характер. З боку білої крові при звичайному перебігу хвороби не спостерігається змін; при крововтраті — нейтрофільний лейкоцитоз до 10 000; з розвитком гипорегенераторного (гіпопластичного) стану кровотворення відзначається лейкопенія (за рахунок гранулоцитопенії).
Геморагічний синдром. Тромбоцитопенія — найбільш постійний симптом. У періоди кровотеч кількість кров’яних пластинок у препараті падає до одиниць і навіть до нуля. У періоди ремісії кількість пластинок збільшується, але, як правило, не досягає норми.
Ретракція кров’яного згустку різко порушена; на висоті тромбоцитопенічна кровотеч згусток повністю втрачає здатність до ретракції і залишається пухким — сироватка не відділяється. У періоди ремісії ретракція згустку стає нормальною.
Час кровотечі в період загострення тромбоцитопенічної пурпури різко продовжений (до 30 хв. і більше). Згортання крові може бути сповільнена за рахунок дефіциту третього тромбопластического фактора пластинок; у період ремісії, а також після спленектомії згортання крові стає нормальною.
Симптом джгута в більшості випадків тромбоцитопенічної пурпури позитивний. З великою постійністю при тромбоцитопенічній пурпурі спостерігається симптом щипка — на місці легкого щипка через кілька хвилин виявляється наростаючий екстравазат.
Протягом. Хвороба Верльгофа характеризується циклічністю. Під час ремісії кількість кров’яних пластинок у крові збільшується, досягаючи в деяких випадках нижньої межі норми (100 000 в 1 мм3) або повної норми. Рецидив тромбоцитопенічної пурпури може бути спровокований інфекційним захворюванням, операцією, аліментарної інтоксикацією, З-гіповітамінозом.
Діагноз і диференціальний діагноз. Тромбоцитопенічна пурпура діагностується на підставі типової клінічної картини і характерного геморагічного синдрому при повній цілості і навіть гіперплазії мегакариоцитарного апарату кісткового мозку (рис. 2 і 3). Особливі труднощі може уявити диференціальна діагностика тромбоцитопенічної пурпури з апластическими та системними захворюваннями крові. Так, гострий лейкоз нерідко починається з явищ тромбоцитопенічної пурпури, що неодноразово було причиною помилкового діагнозу і навіть направлення хворих на операцію спленектомії. У цих випадках важливе діагностичне значення набувають наступні симптоми: 1) збільшена щільна селезінка — ознака, більш характерний для системних захворювань крові (лейкоз), ніж для П. т.; 2) анемія, особливо макроцитарного типу, не адекватна крововтраті.
Рис. 2. Пунктат кісткового мозку при тромбоцитопенічній пурпурі. Гіперплазія гігантських клітин.
Рис. 3. Пунктат кісткового мозку при тромбоцитопенічній пурпурі. Мегакаріоцити в лічильній камері.
Диференціальний діагноз з іншими формами геморагічного діатезу — гемофілію, геморагічними васкулітами, скорбутом, шлунково-кишковими кровотечами при тромбофлебитической спленомегалії з гипотромбоцитозом — не представляє труднощів при обліку даних дослідження геморагічного синдрому.
При маткових кровотечах у молодих дівчат в першу чергу слід диференціювати хвороба Верльгофа від дизовариальных (так званих ювенільних) кровотеч.
Прогноз щодо життя в переважній більшості випадків сприятливий. Летальність становить приблизно 4% після разової (первинної) геморагічної атаки і 8% у випадках багаторазових (повторних) атак. Смертельний результат наступає в результаті крововиливу в мозок або від різкої анемії на ґрунті кровотеч.
Хвороба Верльгофа — Вікіпедія
Матеріал з Вікіпедії — вільної енциклопедії.
Хвороба Верльгофа (тромбоцитопенічна пурпура ідіопатична або набута) — об’єднана назва групи захворювань, що характеризується зниженням числа тромбоцитів у крові та підвищеною кровоточивістю.
У її розвитку мають значення імунні розлади: зниження числа тромбоцитів зумовлене вкороченням їхнього життя внаслідок наявності антитіл до них або впливу інших причин, що зумовлюють їхній лізис. Не виключають можливість того, що частина випадків виникає через дію герпесвірусу людини 6-го типу, який спричинює відповідну інфекцію.
Відокремлюють імунну та неімунну тромбоцитопенію.
При імунних формах основою патогенезу є аглютинація тромбоцитів антитілами. Разом з цим, антитіла можуть пригнічувати процес відшнурування кров’яних пластинок мегакаріоцитами кісткового мозку. У цю групу не входять лікарські тромбоцитопенії, при яких антитіла виникають під впливом різних медикаментів.
Причина неімунних форм захворювання може бути пов’язана з дефіцитом «тромбоцитопоетичного фактору», необхідного для диференціювання та відшнурування від мегакаріоцитів тромбоцитів.
Хвороба перебігає із загостреннями. Поза ними число тромбоцитів може бути нормальним. Кровоточивість з’являється при зниженні їхнього числа до 40-109/л. Найчастіше відбуваються носові кровотечі, рідше — шлунково-кишкові (мелена, з ясен, гематурія). Кровотечі приводять до розвитку постгеморагічних анемій. При огляді шкіри та слизових оболонок можуть виявлятися петехії та поширені екхімози. Селезінка зазвичай збільшена. Позитивні симптоми «щипка» та джгута, подовжений час кровотечі, порушена ретракція кров’яного згустку.
Лікування складається із заходів, які направлені на зменшення проникності судин та пригнічення імунологічних реакцій.
Призначення глюкокортикостероїдних препаратів у середніх дозах з наступним поступовим зменшенням та тривалим лікуванням підтримуючими дозами.
За відсутності ефекту цього лікування може бути застосовано оперативне видалення селезінки (спленектомія).
- Довідник дільничого терапевта по фармакотерапії/під ред. М. В. Бочкарьова та Є. А. Мухіна. — Кишинів: Картя молдовеняске, 1986.
форми, симптоми у дітей і дорослих, лікування
Точна причина розвитку цієї проблеми до кінця не вивчена. Провокуючими факторами вважаються інфекції, гормональні кризи і ін. Виділяють імунний і неімунной механізми розвитку хвороби.
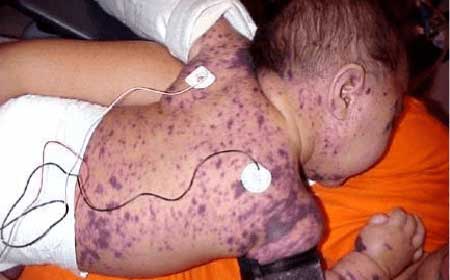
фото 2
Ідіопатична тромбоцитопенічна пурпура (ІТП), друга назва хвороба Верльгофа — це одне з перших відомих геморагічних захворювань. Слово «тромбоцитопенія» говорить про те, що при цій патології відбувається зниження кількості тромбоцитів. Це клітини згортання крові, які беруть участь в реакціях тромбоутворення і зупинки кровотечі.
Термін «ідіопатична» означає, що причина, яка запустила цей процес, невідома. Фактором, який ініціює початок ІТП, може стати травма, надмірна дія ультрафіолету, стрес, ліки, щеплення та ін., Але у більшою третини пацієнтів хвороба розвивається без видимої причини.
Що відбувається при цієї патології?
Імунна система людини починає рахувати власні тромбоцити чужорідним речовиною. У відповідь вона виробляє спеціальні антитромбоцитарні імунні комплекси, які осідають на тромбоцитах.
У селезінці відбувається руйнування і загибель таких помічених імунними комплексами тромбоцитів і поглинання їх макрофагами. У крові падає вміст тромбоцитів і організм починає їх посилено виробляти, що поступово призводить до виснаження запасу цих клітин і їх якісної деформації.
Виходить своєрідне зачароване коло: з одного боку імунна система сама знищує тромбоцити, і сама ж намагається відновити їх число шляхом посиленого синтезу, що призводить до сумних наслідків.
Види тромбоцитопенічна пурпура у людини
За механізмом розвитку виділяють дві форми патології:
- Аутоіммунна тромбоцитопенічна пурпура. Протікає хронічно з частими рецидивами, причина розвитку неясна. На власні незмінені тромбоцити виробляються антитіла. Крім цього, такі антитіла можуть атакувати і попередників цих клітин, а також інші формені елементи крові і стовбурові клітини.
- Гетероімунная. У цих випадках антитіла атакують тільки ті тромбоцити, які змінили свою структуру під впливом вірусів, бактерій, алергенів або дії ліки. Така імунна тромбоцитопенічна пурпура має більш сприятливий перебіг, оскільки після усунення причинного фактора все нормалізується і антитіла припиняють вироблятися. Саме ця форма зазвичай зустрічається у дітей.
Захворювання може протікати в гострій (до півроку) і хронічній формі (понад півроку). Хронічна форма буває з частими і рідкісними рецидивами. Хоча тромбоцитопенічна пурпура у дорослих найчастіше гостра, зустрічається постійно рецидивуюча хронічна форма ІТП.
Залежно від кількості тромбоцитів і клінічних симптомів виділяють легку, середню і важку ступеня тяжкості хвороби. Крім цього, за клінічними ознаками її ділять на:
- «суху» переважають підшкірні крововиливи;
- «вологу» поєднання кровотеч і крововиливів.
тромбоцитопенічна пурпура у дітей
пурпура тромбоцитопенічна, фото у дітей
у більшості випадків тромбоцитопенічна пурпура в дитячому віці починається гостро. Перші прояви хвороби можуть бути не помічені батьками, оскільки діти в силу віку дуже рухливі і схильні отримувати травми і садна.
Після того як доктор починає збирати анамнез, вдається встановити, що ознаки патології і пошкодження неадекватні травм траплялися у дитини вже давно.
Клінічно хвороба проявляє себе:
1. Шкірний геморагічний синдром. Його ознаки:
- Мимовільне поява підшкірних крововиливів (геморрагий). Утворюються вони зазвичай ночами під дією мінімальних травмуючих сил: легке здавлення, перетискання, забій;
- Різноманітність розмірів таких геморрагий: від точкових до великих, які зливаються між собою;
- Невідповідність розмірів і характеру ушкодження травмуючої силі, тобто незначний забій може викликати великий крововилив;
- У деяких пацієнтів зустрічаються крововиливи в слизові оболонки або склери. Це є несприятливою ознакою, оскільки зростає ризик важкого ускладнення ІТП — крововиливи в мозок;
- Поліхромність це означає, що їх виникнення розрізняється за давністю появи: зустрічаються свіжі яскраво-червоні елементи і синьо-зелені на стадії зворотного розвитку;
- Утворюються вони практично скрізь, улюблених місць локалізації геморагій немає.
2. Кровотечі. Їх характеристика:
- Розвиваються спільно з шкірними геморагічними проявами;
- Часто зустрічаються носові, ясенні і маткові кровотечі, рідше стравоходу, шлункові, ниркові. У дівчаток хвороба може проявитися тривалими, надмірними менструаціями;
- Крововилив в головний мозок і інші важкі кровотечі можуть стати причиною летального результату.
Важливо! Серйозну небезпеку становлять кровотечі після видалення зубів у пацієнтів з недіагностованою тромбоцитопенической пурпурой. Такі кровотечі починаються відразу після втручання і не припиняються протягом тривалого часу, викликаючи розвиток гострої анемії.
Крім такої схильності до підвищеної кровоточивості, загальний стан дитини не порушується. У нього немає ні лихоманки, ні ознобу, ні інших ознак інтоксикації. В окремих випадках спостерігається збільшення розмірів селезінки і печінки.
Крім цього, при частих тривалих кровотечах розвиваються симптоми анемії, яку вдається усунути прийомом відповідних препаратів.
Залежно від періоду виділяють дві форми хвороби:
1. Гостра (геморагічний криз). Виражений геморагічний синдром і змінені лабораторні показники крові.
2. Ремісія:
клінічна. За лабораторними даними є зниження кількості тромбоцитів, але клінічних проявів хвороби немає;
клінічно-гематологічна. Немає ні симптомів хвороби, ні змін в аналізах крові.
Діагностику проводять на підставі даних анамнезу, лабораторних показників і виключення інших можливих варіантів тромбоцитопеній.
Лікування тромбоцитопенічна пурпура
Лікування тромбоцитопенічна пурпура залежить від форми і етапи захворювання. У гостру фазу рекомендують постільний режим і заходи, спрямовані на зупинку кровотечі: трансфузии крові, гемостатики і ін.
У період ремісії все заходи спрямовані на профілактику розвитку чергового кровотечі.
Одним зі спірних способів лікування була і залишається спленектомія (видалення селезінки).Вважається, що в цьому органі виробляються антитіла, які викликають загибель тромбоцитів, однак цей момент досі до кінця не вивчений.
- Операцію виконують тільки в період ремісії.
Тромбоцитопенічна пурпура: діагностика та лікування
Тромбоцитопенічна пурпура характеризується підвищеною кровоточивістю, яка виникає із-за дуже малої кількості таких формених елементів крові, тромбоцити. Патологія також називається хворобою Верльгофа. Це найбільш поширене захворювання з усіх існуючих геморагічних діатезів.
За статистикою на 1 млн осіб припадає 10-125 дорослих і дітей, що страждають даним захворюванням. Здебільшого ця недуга починає маніфестувати ще з раннього дитинства. У дівчаток і хлопчиків, які не досягли десятирічного віку, патологія зустрічається практично з однаковою частотою. Серед підлітків і дорослих людей ця хвороба найчастіше діагностується у жінок.
Причина виникнення
Виникнення тромбоцитопенічної пурпури пов’язано з тим, що організм чинить вплив на тромбоцити, генеруючи антитіла до цих форменим елементам крові. Ці особливі речовини з’являються через 1-3 тижні після припинення дії на організм різних лікарських препаратів, якщо у хворого відзначається непереносимість, і бактеріальних або вірусних інфекцій. Також подібна реакція може виникати після отриманих травм, хірургічного втручання або переохолодження. Конкретну причину виникнення тромбоцитопенічної пурпури виявити складно.
Справа в тому, що антигени входять до складу лікарських препаратів, вакцин, вірусів, осідають на частини клітин крові і провокують реакцію організму у вигляді вироблення антитіл. Подібні антитіла належать до класу IgG. На зовнішній поверхні кров’яних пластинок відбувається хімічна реакція антиген — антитіло. Тривалість існування пошкоджених тромбоцитів знижується всього до кількох годин. Передчасне знищення кров’яних пластинок здебільшого відбувається в селезінці.
Кровоточивість виникає через зниження кількості тромбоцитів, що відповідають за функцію згортання крові. До того ж із-за недостатнього забезпечення ангиотрофической функції, за яку відповідають ці клітини крові, на судинній стінці виникають вторинні ушкодження. Ця патологія може проявитися внаслідок погіршення скоротливої здатності кровоносних судин внаслідок низького вмісту в крові такої речовини, як серотонін. Спостерігається утруднення нормального ретракції кров’яного згустку — процесу його зменшення або відділення від плазми.
Прояви патології
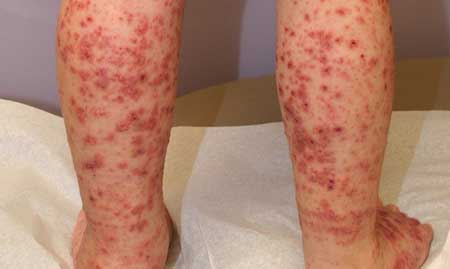
Ідіопатична тромбоцитопенічна пурпура розвивається поступово або різко. Проявляється виникненням геморагічного синдрому. Характерна синячковая або петехиально-плямиста різновид кровоточивості. Якщо порівнювати симптоми, то можна виділити два види патології захворювання. У першому випадку спостерігаються часті крововиливи, а також кровотечі, у другому — переважно геморагічні утворення на шкірі. Якщо ці ознаки відсутні, правильність встановленого діагнозу може викликати сумніви.
Пурпура — це патогномонічний симптом, який проявляється крововиливами у шкіру, а також слизові оболонки. Такі шкірні прояви називають екхимозами. Уражаються різні частини тіла. Діаметр крововиливів звичайно перевищує 3 мм. Кількість екхімози може бути невеликим або досить значним.
До головних ознак геморагічного синдрому при виникненні тромбоцитопенічної пурпури відносяться:
Хвороба не супроводжується серйозними змінами в роботі внутрішніх органів. Не характерне підвищення температури тіла. Час від часу виявляється тахікардія, а при проведенні аускультації може визначатися систолічний шум у точці Боткіна і в області верхівки серця. Збільшення селезінки швидше свідчить про відсутність цього захворювання.
Форми захворювання
За характером перебігу фахівці визначають гостру (до 6 місяців) і хронічну (більше 6 місяців) форми захворювання.
Виділяють кілька варіантів патології:
Діагностика та лікування
Діагностика тромбоцитопенічної пурпури грунтується на скаргах пацієнтів, а також на даних анамнезу хвороби. При загальному огляді обстежується весь шкірний покрив хворого, а також слизові оболонки. Проводиться проба щипка або тест з накладенням джгута для виявлення крововиливів, що виникли в результаті тиску на шкіру.
Аналіз анамнезу патології:
Крім перерахованих вище способів, пурпура діагностується за допомогою проведення лабораторних досліджень:
У практиці лікування цього захворювання розроблений спеціальний алгоритм. Може використовуватися плазмаферез, щоб зменшити рівень антитіл. Це дає можливість досягти тривалої ремісії у половини пацієнтів. Але лікування завжди починається з призначення гормонів, дози яких поступово знижуються.
Іноді після проведення повторних курсів гормональної терапії позитивних результатів не спостерігається, а виникають кровотечі представляють собою загрозу для життя пацієнтів. У таких ситуаціях практикується видалення селезінки. Якщо особливого ефекту це не дає, то застосовуються імунодепресанти.
Тромбоцитопенічна пурпура є дуже серйозним захворюванням, і при його виявленні кожен хворий повинен перебувати під постійним наглядом лікарів. При правильному лікуванні в більшості випадків вдається досягти тривалої ремісії.
Пурпура ідіопатична тромбоцитопенічна | Довідник хвороб
Пурпура ідіопатична тромбоцитопенічна — хвороба, яка характеризується схильністю до кровоточивості і зумовлена тромбоцитопенією при нормальній або підвищеній кількості мегакаріоцитів.Етіологія ідіопатичної тромбоцитопенічної пурпури
Етіологія захворювання не з’ясована. Розвитку тромбоцитопенії можуть передувати гостра вірусна або бактерійна інфекція, профілактичні щеплення. Часто виявляють спадкову або набуту функціональну неповноцінність тромбоцитів.Клініка ідіопатичної тромбоцитопенічної пурпури
Основними клінічними симптомами хвороби є крововиливи в шкіру і слизові оболонки, які розвиваються спонтанно або під впливом дрібних, ледь помітних травм, частіше вночі. Крововиливи у шкірі мають різний характер як за величиною (від крапки до великого синяка — блюдця), так і за забарвленням, яке залежить від давності крововиливу (лілове, синс, зелене, буре, жовте). Частіше екхімози і петехії виникають на передній поверхні тулуба, кінцівок, рідше — на обличчі, підошвах, долонях (кров’яні мозолі). Великі екхімози частіше спостерігаються в місцях ін’єкцій. Однією з особливостей захворювання є кровотечі із слизових оболонок: профузні носові, що щжзводять до анемії, кровотечі із ясен, після екстракції зуба або ж після тонзилектомії. Можуть виникати кровотечі з шлунка, кишок, легень, нирок, у плевру, черевну порожнину, мозок, склеру, сітківку, маткові. В разі зниження кількості тромбоцитів до нуля кровотечі набувають профузного характеру. Рідко з’являються кровотечі з вух, кров’янисті піт і сльози, краплі крові з-під нігтів. У новонароджених спостерігається мелена. В період загострення проби джгута, щипка, молоточкова тощо позитивні.При лабораторному дослідженні виявляють зниження кількості тромбоцитів, інколи до 0, зменшується також кількість їх зрілих і дегенеративних форм. При дослідженні пунктату кісткового мозку відзначається незмінена кількість мегакаріоцитів або їх підвищення. Відбувається зниження ретракції кров’яного згустка. Час кровотечі за Дюком подовжується до ЗО хв і більше.
Лікування ідіопатичної тромбоцитопенічної пурпури
Лікування розпочинають з призначення глюкокортикоїдів (преднізолон — по 1 мг/кг на добу). Якщо протягом 1 тиж немає ефекту, дозу збільшують в 1,5-2 рази. Тривалість курсу 3-4 тиж, надалі дозу знижують. У разі неефективності гормональної терапії показана спленектомія, а якщо вона не дає ефекту, то призначають цитостатичну терапію (азатіоприн, циклофосфан та ін.).Профілактика ідіопатичної тромбоцитопенічної пурпури
Профілактика полягає в запобіганні рецидиву захворювання. Школярів звільняють від занять фізкультурою. Протипоказані гіперінсоляція, призначення лікарських засобів, які порушують агрегаційні властивості тромбоцитів (бутадіон, індометацин, барбітурати тощо).Диспансерний нагляд здійснює дільничний педіатр. Контрольні аналізи крові з підрахунком тромбоцитів проводять спочатку 2 рази на місяць, потім щомісяця. Обов’язково контролюють кількість тромбоцитів у крові після будь-якого перенесеного захворювання.
Тромботическая тромбоцитопеническая пурпура и гемолитико-уремический синдром — этиология, патогенез, лечение
Тромботическая тромбоцитопеническая пурпура (ТТП) — тяжелое, редко встречающееся заболевание, характеризующееся следующими основными синдромами: микроангиопатической гемолитической анемией, тромбоцитопенией, неврологическими нарушениями и лихорадкой [G.Neid, 1994]. При нем также наблюдается поражение почек и развитие легочной недостаточности.Первое описание в литературе ТТП представлено в 1924 году E.Moschcowitz. В течение нескольких десятилетий обсуждался вопрос о включении ТТП в группу системных васкулитов, но изменения, выявляемые при гистологическом исследовании пораженных сегментов сосудов, не укладываются в общепринятые представления о васкулитах. В настоящее время это заболевание относят к группе васкулопатий, а некоторые авторы рассматривают его среди болезней крови.
Гемолитико-уремический синдром (ГУС) впервые был описан в 1955 году C.Gasser и соавторами. Его основными клиническими проявлениями являются гематологические нарушения, характерные для тромботической тромбоцитопенической пурпуры, в сочетании с поражением почек [G.Neid, 1994].
По своей сущности ТТП очень близка к гемолитико-уремическому синдрому, и для обозначение этой патологии часто используют термин ТТП/ГУС.
Клинические формы тромботической тромбоцитопенической пурпуры и гемолитико-уремического синдрома
Выделяют первичную (идиопатическую) и вторичную формы ТТП. Последняя осложняет течение вирусных и бактериальных инфекций, ревматических и опухолевых заболеваний, а также отмечается на фоне приема некоторых лекарственных веществ. Заболевание может начинаться в любом возрасте, но наиболее часто — в сорок—шестьдесят лет. Отмечается преобладание заболевших женщин над мужчинами (соотношение 2:1). Ежегодно регистрируется 0,1 нового случая ТТП на 100 тыс. населения.В настоящее время принято выделять и две формы ГУС: с нарушением функции кишечника (диарея) и без таковой. При первой (эпидемической) форме, встречающейся в основном у детей в возрасте до 5 лет, началу заболевания предшествует кровавая диарея. Второй вариант наиболее часто развивается у взрослых (средний возраст 40 лет), преимущественно у женщин (соотношение с мужчинами 3:1).
Этиология
В качестве возможных этиологических факторов формы ГУС, ассоциированного с диареей, наибольшее значение придается 1-му серотипу Shigellia dysenteria и серотипу 0157:Н7 E.coli, которые продуцируют шигеллоподобные экзотоксины 1 и 2 [S.Ashkenazi,1993].В норме в организме человека синтезируется достаточное количество антител, нейтрализующих эти токсины. Структурные единицы (В-части) токсина шигелл способны высокоаффинно связываться с мембранами эндотелиальных клетое (ЭК) почек и других сосудистых бассейнов. Этот процесс опосредован через дисахаридный компонент (глоботриозилцерамид — Gb3).
При поступлении токсинов в кровоток происходит их взаимодействие через Gb3 или другие рецепторы с эндотелиальными клетками капилляров клубочков почек. Отмечается набухание последних, активация и продукция ими фактора фон Виллебранда (ФВ) и других субстанций. Кроме того, наблюдается связывание В-единицы токсинов с рецепторами эритроцитов (Р1 антиген), имеющих гомологию с ними в конечной части молекулы.
В опытах in vitro показано, что токсин шигелл обладает прямым цитотоксическим действием на пролиферирующие ЭК. При этом липополисахариды (ЛПС), интерлейкины (ИЛ)-1 и факторы некроза опухоли (ФНО)-а увеличивают экспрессию на поверхности эндотелия Gb3 и тем самым потенцируют эффект экзотоксинов [N. Van de Kar et al.,1990]. Кроме того, вырабатываются антитела, направленные на поврежденные структуры эндотелия, а также имеет место активация нейтрофилов с высвобождением ими кислородных радикалов и протеолитических ферментов.
Причины другой формы ГУС до конца неясны. Описаны случаи его развития на фоне лечения митомицином, циклоспорин А (ЦсА), хинидином, при приеме гормональных контрацептивов, во время беременности или вирусных инфекций. В последнее время появились сообщения о начале гемолитико-уремического синдрома после инфекций желудочно-кишечного тракта [G.Neild,1994].
Как у детей, так и взрослых обнаружены семейные случаи заболевания. При этом у различных представителей одной семьи клинические проявления трактовались или как ГУС, или как ТТП. Полагают, что в патогенезе этих заболеваний важное значение имеют генетические дефекты, возможно связанные с дефицитом плазменного фактора, стимулирующего выработку простациклина ЭК, либо с их гиперреактивностью.
Наличие сходных клинических и гистологических проявлений при ГУС и тромботической тромбоцитопенической пурпуре часто делает затруднительным дифференциальную диагностику между этими двумя заболеваниями. Как ТТП, так и ГУС часто развиваются после приема лекарственных препаратов, во время беременности и при инфекции ВИЧ. Оба заболевания могут начинаться с внутрисосудистой агрегации тромбоцитов.
Полагают, что если имеет место генерализованная агрегация тромбоцитов и преимущественное поражение ЦНС, то заболевание расценивается как ТТП; если же агрегация тромбоцитов менее выражена и патологические изменения затрагивают только почки — то его относят к гемолитико-уремическому синдрому [J.Moake, 1994]. По мнению G.H.Neild (1994), термином ТТП следует именовать патологический процесс, имеющий черты ГУС, но в сочетании с лихорадкой, поражением кожи и ЦНС, развивающийся только у взрослых, особенно у женщин.
Морфологическая характеристика
Основным типом патологии при тромботической тромбоцитопенической пурпуре и ГУС является тромботическая микроангиопатия [P.Ruggenentti & G.Rernuzzi, 1996].При ТТП практически во всех органах и системах наблюдаются сегментарные окклюзии артериол, капилляров и венул гиалиновыми тромбами. Депозиты гиалина выявляются и в субэндотелии. Они соединены с тромбом, расположенным в просвете сосуда. Не наблюдается воспалительно-клеточной инфильтрации стенок сосуда и периваскулярного пространства.
Тромботические массы содержат осколки тромбоцитов, PAS-положительные эндотелиальные фибриллы, IgG [R. Bukowski, 1982]. Кроме того, в их составе обнаруживается избыточное количество ФВ и незначительное фибриногена или фибрина [Y.Asada et а1.,1985]. Наибольшие изменения встречаются в головном мозге, сердце, селезенке. Окклюзии сосудов приводят к развитию преходящей ишемии органов, а временами и инфарктов.
Поражение сосудов при ГУС неоднородно и зависит от формы заболевания. При гемолитико-уремическом синдроме у детей, ассоциированном с диареей, не отмечается признаков активации, пролиферации или отслойки эндотелия, что, напротив, характерно Для этого заболевания у взрослых или для ТТП [Х.Моаке, 1994].
При ГУС, развившемся после поражения желудочно-кишечного тракта, наблюдаются внутрисосудистые тромбоцитарные тромбы с небольшим количеством фибрина, окклюзирующие капилляры и приносящие артериолы клубочков. При другой его форме тромбы выявляются только в артериолах и мелких артериях почек.
Гистологические данные, отсутствие нарушений свертывания крови, тромбоцитопения свидетельствуют о том, что патология эндотелия и агрегация тромбоцитов в микрососудах почек лежат в основе патогенеза ГУС. Полагают, что при этом заболевании активация свертывания крови и образование фибрина являются вторичными. Полная закупорка сосудов может приводить к некрозу клубочков и канальцев с развитием артериальной гипертензии и хронической почечной недостаточности.
Патогенез
Еще в конце 40-х годов существовала гипотеза о том, что при ТТП патологические изменения в основном затрагивают эндотелий и субэндотелиальное пространство [I.Gore & N. Friedrnan,1948; I.Feldman et al.,1966]. По мнению J.Moake (1994), развитие клинических проявлений тромботической тромбоцитопенической пурпуры — результат диссеминированной агрегации тромбоцитов в микрососудах ЦНС и других органов.Установлено, что в плазме больных присутствует вещество, вызывающее спонтанную агрегацию тромбоцитов. Это белок — с молекулярной массой около 37—59 кд. Он оказался Сазависимой протеазой, имеющей в составе своего активного центра цистеин и расщепляющей мультимеры ФВ на фрагменты, обладающие высокой способностью связываться с тромбоцитами.
Кроме того, под воздействием этого белка из ФВ образуются необычно большие его формы [J.Moake, P.McPherson,1989]. Известно, что мономеры фактора фон Виллебранда связаны между собой дисульфидными мостиками в мультимеры, имеющие различную молекулярную массу (от нескольких сотен тысяч до миллиона kd).
Мультимеры ФВ синтезируются мегакариоцитами, эндотелием, сохраняются в а-гранулах тромбоцитов и тельцах Wiebel—Palade ЭК. Плазменный пул ФВ в основном вырабатывается эндотелиальные клетки. В норме наибольшее количество ФВ циркулирует в виде мультимеров, однако присутствуют и необычно большие его формы.
Последние более эффективно связываются с мембранными рецепторами тромбоцитов (GPIb-IX, GPIIb-IIIа). В плазме содержатся и вещества, которые расщепляют эти гигантские формы, однако они не действуют на фактор фон Виллебранда, секретируемый ЭК в субэндотелиальное пространство [J.Frangos et al.,1989].
Bo время обострения ТТП происходит интенсивная стимуляция ЭК, сопровождающаяся увеличением выработки ими в плазму крови избыточного количества больших форм ФВ. Последние, не подвергаясь расщеплению, взаимодействуют с рецепторами тромбоцитов, вызывая как их агрегацию, так и их прикрепление к субэндотелию.
Установлено, что мультимеры ФВ исчезают из кровотока при прогрессировании заболевания или при развитии тромбоцитопении. Они также не обнаруживаются и в ремиссию болезни. В межприступный период их наличие в кровотоке, как правило, свидетельствует о продолжающейся стимуляции ЭК, что является неблагоприятным фактором последующих обострений заболевания.
Возможно, что в основе рецидивирующей формы ТТП лежит наследственный дефект выработки мультиформ ФВ. Полагают, что вначале они связываются с GPIbTX-рецепторами неактивированных тромбоцитов и обеспечивают их адгезию к субэндотелию.
Затем в процессе активации этих клеток мультимеры фактора фон Виллебранда взаимодействуют и с другими рецепторами тромбоцитов, ответственными за их агрегацию (GPIIb-IIIa). Установлено, что экзотоксины шигелл способны стимулировать эндотелиальные клетки без их повреждения, вызывая увеличение продукции ими мультиформ ФВ.
При этом в микрососудах почек создаются условия, благоприятные для взаимодействия последних с тромбоцитами (сужение просвета сосудов набухшими ЭК, контакт с субэндотелием и мезангиальными клетками). Все это способствует агрегации тромбоцитов, их адгезии к субэндотелию и образованию тромбов в микрососудах [J.Moake, 1994]. Подобные механизмы могут лежать и в основе ГУС.
Среди других возможных механизмов патогенеза тромботической тромбоцитопенической пурпуры и гемолитико-уремического синдрома обсуждается также уменьшение синтеза ЭК как простациклина, так и вещества, стимулирующего его выработку. Кроме того, при этих заболеваниях обнаружено уменьшение концентрации свободного белка S, увеличение выработки ингибитора тканевого активатора плазминогена и локальные нарушения фибринолиза.
Полагают, что в основе развития микроангиопатической гемолитической анемии при ТТП и ГУС лежит несколько взаимосвязанных механизмов. Так, повреждение эритроцитов может иметь место при их прохождении через окклюзированные сосуды. С другой стороны, в этом процессе принимают участие ФВ и эндотелиальные клетки.
Установлено, что на мембранах молодых эритроцитов находятся рецепторы, подобные тромбоцитарным, с которыми также взаимодействуют мультиформы ФВ. Кроме того, на их мембранах располагаются рецепторы, связывающие тромбоспондин, секретирующийся а-гранулами тромбоцитов.
При этом на мембранах ЭК находятся подобные рецепторы (GPIb,GPIIb-IIa) для фактора фон Виллебранда, способные также контактировать с тромбоспондином [К. Sugihara et al.,1992; T.Wick et al.,1993]. Таким образом, ретрикулоциты и другие юные формы эритроцитов, прикрепляясь к ЭК через мультимеры ФВ или тромбоспондин, могут быстрее подвергаться разрушению, а также участвовать в тромбообразовании [J.Moake, 1994].
В недавних исследованиях было показано, что плазма больных ТТП и спорадической формой ГУС способна индуцировать апоптоз микрососудистого эндотелия, полученного из кожи, почек и мозга, а также экспрессию на их мембране Fas (С095)-молекулы, связанной с апоптозом [D.Mitra et al., 1997].
Сходные данные получены при изучении больных с идиопатической и ВИЧ-ассоциированной формами тромботической тромбоцитопенической пурпуры [J.Laurence et al., 1996]. Примечательно, что эндотелиальные клетки легочных и печеночных микрососудов устойчивы к данным изменениям. Эти результаты позволяют объяснить причины редкого поражения сосудов легких и печени при ТТП/ГУС. Имеются сведения о том, что токсины (вероцитотоксин-1), принимающие участие в патогенезе гемолитико-уремического синдрома, ассоциированного с диареей, также вызывают апоптоз микрососудистого эндотелия in vitro [J.Mahan et al.,1996].
Клинические проявления
Течение заболевания у большинства больных ТТП острое, но в 10% случаев оно может носить хронический характер. В дебюте болезни отмечаются лихорадка (98%), геморрагии (96%), резкая бледность кожных покровов (96%), желтуха (42%) и слабость (34%). Изменения со стороны опорно-двигательного аппарата встречаются редко (7%) и в большинстве случаев носят характер артралгии.Ведущим синдромом в клинической картине заболевания является поражение головного мозга, которое встречается практически у всех больных (92%). Характерны головные боли, судороги, парестезии, нарушение речи и зрения, психозы и более тяжелые нарушения сознания, вплоть до комы.
Обычно их длительность не превышает двух-трех суток, но почти в половине случаев отмечаются их повторные эпизоды. Полагают, что в основе этих клинических проявлений лежит нарушение кровотока по сосудам, кровоснабжающим кору головного мозга. Окклюзии сосудов приводят к развитию диффузных инфарктов и геморрагии.
У части больных имеет место поражение глаз в виде отека сетчатки и кровоизлияний в нее.
Анемия при ТТП, как правило, тяжелая, с классическими микроангиопатическими изменениями, включая фрагментацию эритроцитов (шизоцитоз), сфероцитоз и ретикулоцитоз. Выраженность тромбоцитопении также значительна. Среднее количество тромбоцитов колеблется от 8 до 40х10 9/л. Отмечается также сокращение средней продолжительность жизни тромбоцитов.
Поражение почек встречается почти у 70% больных тромботической тромбоцитопенической пурпурой и наиболее часто проявляется умеренной протеинуриеи, микрогематурией, как правило, без значительного нарушения функции почек. Редко отмечается острая почечная недостаточность.
Множественный тромбоз сосудов микроциркуляторного русла часто приводит к диффузным изменениям в миокарде. У 10—25% больных в патологический процесс вовлекаются сосуды желудочно-кишечного тракта, что проявляется болями в животе, кишечными кровотечениями, иногда картиной острого живота. Увеличение печени и селезенки нехарактерно.
Клиническая картина ГУС во многом сходна с наблюдаемой при ТТП. У детей заболевание чаще, чем у взрослых, дебютирует с лихорадки и кишечных нарушений. Со стороны кожных покровов и слизистых наблюдаются изменения в виде геморрагии и синяков.
Тяжесть неврологической симптоматики при ГУС выражена меньше, чем при ТТП. В основном преобладают нарушения речи и умственных способностей, но могут встречаться и нарушения сознания, вплоть до комы. Поражение ЦНС при ГУС, наряду с патологическими изменениями в сосудах головного мозга (тромбоз, геморрагии), может быть связано с нарушением функции почек или с тяжелой артериальной гипертензией.
Для ТТП и спорадической формы гемолитико-уремического синдрома нехарактерно поражение сосудов легких и печени. Но в то же время тромбоз легочных микрососудов часто встречается у детей с ГУС, ассоциированным с диареей, а также при заболевании, вызванном приемом лекарственных препаратов.
Клинически ГУС отличается от тромботической тромбоцитопенической пурпуры только более частым поражением при нем почек с развитием острой или хронической почечной недостаточности, артериальной гипертензии и признаков внутрисосудистого гемолиза.
Лабораторные изменения
Лабораторные нарушения при ТТП/ГУС включают тромбоцитопению, Кумбс-отрицательную гемолитическую анемию, изменение формы эритроцитов (фрагментацию), а также ретикулоцитоз. В 60% случаев отмечается умеренный нейтрофильный лейкоцитоз.Биохимические нарушения заключаются в умеренном повышении концентрации непрямого билирубина и лактатдегидрогеназы. Изменения со стороны свертывающей системы крови не выражены и носят вторичный характер.
Редко наблюдается появление в плазме крови продуктов деградации фибриногена, растворимых фибрин-мономерных комплексов. Отмечается уменьшение концентрации продуктов метаболизма простациклина и, напротив, повышение уровня тромбоксана А2. У 1—5% больных обнаруживаются ложно положительная реакции Вассермана (ЛПРВ), криофибриногенемия, антитела, реагирующие с фосфолипидами (аФЛ) или антитела к ВИЧ.
Лечение
Одним из основных методов лечения ТТП является переливание свежезамороженной плазмы. Оно оказывает положительный эффект на течение заболевания почти у 70% больных.Полагают, что это связано с введением большого количества нормального фактора VIII и ФВ, а также коррекцией гематологических нарушений. Обычно в течение первых дней суточная доза составляет от 20 до 40 мл/кг массы тела.
Инфузии плазмы проводятся до восстановления нормального количества тромбоцитов, отсутствия признаков гемолиза эритроцитов, нормализации уровня лактатдегидрогеназы и восстановления функций ЦНС [W.Bell et al.,1991]. В большинстве случаев клинический эффект от такого лечения наступает через несколько дней (2—3) от ее начала. Иногда требуется более длительное введение плазмы (до одного месяца).
Плазмаферез по эффективности (70%) не уступает использованию плазмы. Лечение начинают с удаления в сутки 50—60 мл/кг плазмы. Общий объем эксфузий зависит от состояния больного.
Повторные процедуры плазмафереза, особенно в сочетании с введением свежезамороженной плазмы, применяются в тяжелых случаях заболевания. Особенно они показаны при развитии у больных острой почечной недостаточности [G.Rjck et al.,1991]. Эффективность такой терапии при ТТП доходит до 80%.
На ранней стадии заболевания положительный эффект могут оказать повторные внутривенные инфузии простациклина (в дозе 2—5 нг/кг/сутки), которые назначаются вместе с плазмаферезом или с введением свежезамороженной плазмы. Изолированное применение простациклина менее предпочтительно. Следует отметить, что у детей простациклин может усилить диарею, что отрицательно сказывается на последующем течении заболевания.
При ТТП/ГУС монотерапия дезагрегантами неэффективна почти у 60%) больных. Применение этих препаратов, как и простациклина, наиболее оправдано в начальной стадии заболевания, в сочетании с перечисленными выше методами лечения. На более поздних этапах заболевания их эффективность сомнительна.
В некоторых случаях ведение больных тромботической тромбоцитопенической пурпурой сочетают с применением глюкокортикоидов (ГК) (преднизолон 1 мг/кг/сутки). Иногда проводят пульс-терапию. Однако изолированное их назначение неэффективно почти в 90%) случаев. Редко в схему ведения больных с ТТП/ГУС включают цитостатики (азатиоприн 100—150 мг/сутки), как правило, вместе с преднизолоном и повторными курсами плазмафереза.
При ТТП не оправдано проведение спленэктомии или гемодиализа.
Для предотвращения ранних эпизодов обострения в течение первых шести месяцев от момента начала заболевания показан прием дезагрегантов (аспирин, дипиридамол).
Терапия гемолитико-уремического синдрома мало чем отличается от ведения больных с ТТП. Основным методом его лечения как у детей, так и у взрослых является применение плазмафереза в сочетании с заместительной терапией компонентами крови (свежезамороженная плазма, эритроцитарная масса). У взрослых чаще, чем у детей, возникает потребность в повторных процедурах плазмафереза или даже в гемодиализе.
ГК, прямые антикоагулянты (гепарин), дезагреганты обычно неэффективны при ГУС у детей. Напротив, у взрослых имеются сообщения об эффективности комбинированной терапии дезагрегантами. На ранней стадии заболевания положительное воздействие оказывают повторные внутривенные инфузии простациклина (в дозе 2—5 нг/кг/сутки). В эту стадию также показано применение дезагрегантов и антикоагулянтов, эффективность которых сомнительна в более позднем периоде.
В случаях стойкого нарушения функции почек решается вопрос о программном гемодиализе или пересадке почек.
Прогноз
Без лечения прогноз при тромботической тромбоцитопенической пурпуре крайне неблагоприятный: около 80% больных погибает уже в течение первых трех месяцев от начала заболевания. Однако применение плазмафереза и переливание свежезамороженной донорской плазмы позволяют добиться выздоровления в 80—90% случаев.У детей с гемолитико-уремическим синдромом прогноз благоприятен в 90% случаев. У взрослых, несмотря на проведение адекватной терапии, в 40% случаев наблюдаются смертельные исходы.
Насонов Е.Л., Баранов А.А., Шилкина Н.П.
Опубликовал Константин Моканов
