Перимембранозный дефект межжелудочковой перегородки сердца
 Перимембранозный дефект межжелудочковой перегородки составляет около четверти от всех врожденных пороков сердца и вызывается множеством причин, в числе которых не только наследственный фактор, но и вредные привычки.
Перимембранозный дефект межжелудочковой перегородки составляет около четверти от всех врожденных пороков сердца и вызывается множеством причин, в числе которых не только наследственный фактор, но и вредные привычки.
Формирующаяся на пятой неделе внутриутробного развития межжелудочковая перегородка необходима для сокращения и расслабления сердечной мышцы.
Если мжп остается открытым, то новорожденному диагностируют дмжп, по международной классификации аномалия имеет код Q21.0.
Впс может встречаться как в изолированном виде, так и в сочетании с другими аномалиями, например, с открытым овальным отверстием.
Причины дефекта:
- генетическая предрасположенность;
- поздняя первая беременность у матери;
- токсикоз;
- алкоголизм матери;
- передозировка лекарственных средств;
- сахарный диабет;
- эндокринные нарушения у беременной;
- инфекционные и вирусные заболевания матери.
 Негативные факторы первого триместра развития особенно влияют на формирование аномального строения сердца у ребенка.
Негативные факторы первого триместра развития особенно влияют на формирование аномального строения сердца у ребенка.
Перимембранозный дефект – это не только врожденная аномалия, в некоторых случаях нарушение поражает сердце пожилых людей после инфаркта.
Симптомы аномалии
Тяжесть симптомов зависит от размеров отверстия. Признаки могут проявиться через несколько лет после рождения ребенка, это зависит от направления потока крови и размера дефекта.
Непосредственно после появления новорожденного на свет неонатолог может услышать сильный шум во время систолы в районе четвертого межреберья.
Такого малыша направляют на УЗИ для диагностики и уточнения причин сердечного шума.

- синеватый цвет кожи;
- одышка;
- вялость.
У больного малыша увеличена печень и прослушиваются хрипы в легких. В дальнейшем ребенок, не получивший лечения, начинает отставать в физическом развитии, так как тяжесть симптомов постепенно нарастает.
Существует риск возникновения легочной гипертензии. Небольшие дефекты могут закрываться со временем.
Осложнения и клинические проявления
 Осложнение, характерное для ДМЖП – эндокардит инфекционный, поражающий клапаны и внутреннюю оболочку сердца. Заболевание опасно, если его не начать своевременно лечить.
Осложнение, характерное для ДМЖП – эндокардит инфекционный, поражающий клапаны и внутреннюю оболочку сердца. Заболевание опасно, если его не начать своевременно лечить.
На фоне компенсаторных процессов клинические проявления уменьшаются, но развивается легочная гипертензия, перерастающая в склероз легочных сосудов.
Это может привести к таким проблемам: тромбоэмболия; стеноз инфундибулярный; регургитация аортальная. Прогноз в этих случаях плохой, вплоть до летального исхода.
Диагностика ДМЖП
Детей с подозрением на дефект межжелудочковой перегородки направляют на УЗИ. Метод ультразвукового исследования эффективен и на стадии внутриутробного развития плода, во втором и третьем триместре.
 Новорожденных принимает неонатолог, в его обязанность входит прослушивание сердца ребенка. Для уточнения диагноза малыша могут направить на УЗИ с допплером и на рентген.
Новорожденных принимает неонатолог, в его обязанность входит прослушивание сердца ребенка. Для уточнения диагноза малыша могут направить на УЗИ с допплером и на рентген.
Рентгенография необходима для уточнения границ сердца, а также для обследования легочной артерии.
Всем детям делают электрокардиограмму, позволяющую оценить работу сердца по специальной кривой. При подозрении на тяжелый порок сердца ребенка направляют на катетеризацию ангиокардиогарфию.
По показаниям проводят магнитно-резонансную томографию.
Лечение ДМЖП
Небольшие дефекты, до 3 мм, могут зарасти к трем годам жизни малыша, по мере роста и развития организма маленькие отверстия должны закрыться мышечной массой. Вероятность закрытия больших отверстий невелика.
Если кровообращение не нарушено, но отверстие не закрывается, ребенка ставят на учет к кардиологу для постоянного наблюдения, он должен регулярно проходить Эхо и Узи.
Медикаментозное лечение:
- Фуросемид;
- Кардонат;
- Фосфаден;
- Строфантин;
- Дигоксин;
- Эуфиллин.
Препарат Эуфиллин предназначен для снятия отека легких и бронхоспазма.
 Большой порок, нарушающий гемодинамику организма, закрывают хирургическим путем. Обычно это субтрикуспидальный дефект или замещение трехстворчатого клапана мембраной. При этом применяются два метода оперативного лечения:
Большой порок, нарушающий гемодинамику организма, закрывают хирургическим путем. Обычно это субтрикуспидальный дефект или замещение трехстворчатого клапана мембраной. При этом применяются два метода оперативного лечения:
- эндоваскулярное;
- реконструкция.
Эндоваскулярное хирургическое вмешательство проводят в рентгеноперационной, открытый дефект закрывают окклюдером или спиралью.
Окклюдер устанавливают при мышечных пороках, спираль – при мембранозных, подается он в трубочке, при этом грудная клетка не разрезается.
Пациенту прокалывают бедро и катетер вводит окклюдер прямо в сердечную полость. Операция проводится под контролем рентгеновского аппарата на специальном столе.
Операция по реконструкции мжп осуществляется в условиях остановки сердца, ребенок находится на искусственном кровообращении. Отверстие ушивают или закрывают заплатой из перикарда.
 Послеоперационный прогноз благоприятен, летальный исход – не более двух процентов от всех прооперированных детей.
Послеоперационный прогноз благоприятен, летальный исход – не более двух процентов от всех прооперированных детей.
Умирают чаще всего пациенты, состояние которых осложнено дополнительными пороками сердца и тяжелой сердечной недостаточностью.
Дети после операции считаются практически здоровыми, однако небольшие шумы в сердце все-таки будут прослушиваться, так как остаточное давление между артерией легкого и правым желудочком не всегда удается убрать.
Техника оперативного вмешательства в условиях аппарата искусственного кровообращения
 Операцию проводят новорожденным с массой тела менее четырех килограмм.
Операцию проводят новорожденным с массой тела менее четырех килограмм.
Прооперированные дети получают хороший шанс для полного восстановления здоровья.
Во время хирургического вмешательства после установки искусственного кровообращения артериальный проток перевязывают.
В условиях пережатого кровеносного сосуда вводят кадиоплегический раствор, затем венозная канюля удаляется.
Чаще всего перимембранозный дефект устраняют через правое предсердие, некоторые виды порока доступны только через клапан аорты или через саму аорту.
Дефекты межжелудочковой перегородки у плода
 В развитии аномалии играет большую роль фактор наследственности, но не только, влиять на формирование сердца плода могут интоксикации, инфекции, вирусные заболевания, неблагоприятная экологическая среда.
В развитии аномалии играет большую роль фактор наследственности, но не только, влиять на формирование сердца плода могут интоксикации, инфекции, вирусные заболевания, неблагоприятная экологическая среда.
Чаще всего порок обнаруживается на УЗИ, проведенном на двадцатой неделе развития.
Если аномалия не совместима с жизнью, матери предлагают прервать вынашивание ребенка.
При легкой степени порока шанс выжить есть у девяноста процентов детей, при условии правильного ведения родов и адекватной терапии.
Лечение пороков межжелудочковой перегородки только оперативное, хирургическое вмешательство проводят в первые три месяца жизни новорожденного, если дефект большого размера.
При окне средней величины и угрожающем нарастании давления кровообращения в малом круге малолетнего пациента оперируют на шестом месяце жизни.
При сравнительно небольшом отверстии с операцией можно подождать и до года.
Послеоперационная реабилитация
 Реабилитация после перенесенной операции по реконструкции мжп – длительный процесс, если она была сложной, то определенный образ жизни придется вести постоянно.
Реабилитация после перенесенной операции по реконструкции мжп – длительный процесс, если она была сложной, то определенный образ жизни придется вести постоянно.
Это отказ от вредных привычек, правильное питание, физкультура, режим дня.
Важные нюансы послеоперационной реабилитации:
- Ребенка еще некоторое время будут беспокоить: тахикардия, слабость, одышка.
- Перенёсшему операцию нельзя перенапрягаться, показана только лечебная физкультура и массаж. Детей, прооперированных в старшем возрасте, может беспокоить сердечная недостаточность.
- На протяжении нескольких лет после хирургической операции возможно развитие болезней легких, а также эндокардита бактериального.
- Диастолическое и систолическое давление в артериях нормализуется через несколько лет после реконструкции.
- Половина пациентов после хирургического вмешательства еще некоторое время страдают от аритмий и блокад.
Прооперированные дети в свое время идут в обычный детский сад, а затем в школу.
 В это время качество жизни ребенка зависит от регулярного приема выписанных медицинских препаратов, соблюдения диеты, а также от сложности неврологических и физических проблем, с которыми придется столкнуться в течение жизни.
В это время качество жизни ребенка зависит от регулярного приема выписанных медицинских препаратов, соблюдения диеты, а также от сложности неврологических и физических проблем, с которыми придется столкнуться в течение жизни.
Родители должны проинформировать персонал заведения, где обучается ребенок, о существующих проблемах, что позволяет найти к малышу правильный подход.
Советы родителям:
- Не стоит изолировать ребенка, в страхе, что болезнь начнет прогрессировать.
- Воспитатели и учителя общаются с малышом каждый день, поэтому они лучшие союзники в социальной жизни ребенка.
- Правильно поданная одноклассникам информация о заболевании подростка спасет его от общественной изоляции.
Детям в период послеоперационной реабилитации и далее, показано санаторное лечение в кардиоревматологических медицинских учреждениях (от 50 до 130 дней), один раз в год.
 Очень часто дети проходят лечение в санаториях еще в дооперационный период, что помогает им быстрее восстановиться после хирургического вмешательства.
Очень часто дети проходят лечение в санаториях еще в дооперационный период, что помогает им быстрее восстановиться после хирургического вмешательства.
Противопоказания к санаторному лечению:
- тяжелое нарушение кровообращения;
- сердечная недостаточность четвертой степени;
- подострый бактериальный эндокардит;
- ОРЗ и ОРВИ.
Послеоперационное выхаживание
- При неожиданном скачке температуры, после выписки из стационара, следует немедленно вызвать врача на дом или связаться с кардиохирургом из отделения.
- Температура в первые сутки после операции снижается парацетамолом или нурофеном, врач может назначить антибиотики.
- При постоянной температуре выше 37 градусов Цельсия, ребенку прописывают иммунотерапию.
 Противопоказания к прививкам:
Противопоказания к прививкам:
- цианотические пороки;
- тяжелая сердечная недостаточность;
- неострый бактериальный эндокардит.
Родители прооперированных детей всегда должны быть на связи с кардиологом, иметь под руками все необходимые контакты и телефоны.

Перимембранозный дефект межжелудочковой перегородки у новорожденного — Про сосуды
Skip to contentMain Menu
- Главная
- Расшифровка
- Медицина
- Анемия
- Аорта
- Артерия
- Болезнь
- Варикоз
- Вид
- Вопросы
Свежие записи
- Как получить сотрясение мозга в домашних условиях
- Вдс симптомы
- Анализ на липидный спектр что это
- Окс кардиология
- Лимфома как диагностировать
Содержание
- 1 Что такое дефект межжелудочковой перегородки?
- 2 Причины возникновения и факторы риска
- 3 Типы и симптомы
- 4 Опасность и осложнения патологии
- 5 Когда нужно обращаться к врачу?
- 6 Диагностические методы
- 7 Способы лечения
- 8 Прогнозы и профилактические меры
- 9 Причины развития патологии
- 10 Диагностика
- 11 Медикаментозное лечения
- 12 Оперативное вмешательство и прогноз
- 13 Описание
- 14 Причины и факторы риска
- 15 Классификация
- 16 Опасность и осложнения
- 17 Симптомы
- 18 Когда обращаться к врачу
- 19 Диагностика
- 20 Лечение
- 21 Прогнозы и профилактика
- 22 Что собой представляет дефект межжелудочковой перегородки
- 23 Клинические проявления
- 24 Причины возникновения
- 25 Разновидности дефектов
- 26 Симптомы
- 27 Методы диагностики
- 28 Как лечить
- 29 Прогноз и возможные осложнения
- 30 Профилактика
- Артериальная гипертензи
Дефект межжелудочковой перегородки — Википедия
 Дефект межжелудочковой перегородки
Дефект межжелудочковой перегородкиДефект межжелудочковой перегородки (ДМЖП) — врожденный порок сердца, характеризующийся наличием дефекта между правым и левым желудочками сердца.
Видео с субтитрамиДефект межжелудочковой перегородки (ДМЖП) — встречается наиболее часто, причём как в изолированном виде, так и в составе многих других пороков сердца. Среди ВПС частота данного порока варьирует от 27,7 до 42 %.[3] Одинаково часто встречается как у мальчиков, так и у девочек. Существуют данные об аутосомно-доминантном и рецессивном типах наследования. В 3,3 % случаев у прямых родственников больных с ДМЖП также обнаруживают этот порок.[4]
В межжелудочковой перегородке выделяют 3 отдела: верхняя часть — мембранозная, прилегает к центральному фиброзному телу, средняя часть — мышечная, и нижняя — трабекулярная. Соответственно этим отделам называют и дефекты межжелудочковой перегородки, однако большинство из них имеют перимембранозную локализацию (до 80 %). На долю мышечных ДМЖП приходится 20 %[3][5].
По размерам дефекты подразделяют на большие, средние и малые. Для правильной оценки величины дефекта его размер надо сравнивать с диаметром аорты. Мелкие дефекты размером 1-2 мм, расположенные в мышечной части межжелудочковой перегородки, называются болезнью Толочинова-Роже. Вследствие хорошей аускультативной картины и отсутствия гемодинамических нарушений для их характеристики уместно выражение: «много шума из ничего». Отдельно выделяют множественные большие дефекты межжелудочковой перегородки, по типу «швейцарского сыра», имеющие неблагоприятное прогностическое значение[5].
Внутрисердечные гемодинамические нарушения при ДМЖП начинают формироваться спустя некоторое время после рождения, как правило, на 3—5 сутки жизни.[6] В раннем неонатальном периоде шум в сердце может отсутствовать вследствие одинакового давления в правом и левом желудочках из-за так называемой неонатальной легочной гипертензии. Постепенное падение давления в системе легочной артерии и в правом желудочке создаёт разность (градиент) давлений между желудочками, вследствие чего появляется сброс крови слева направо (из области высокого давления в область низкого давления). [7][8] Дополнительный объём крови, поступающий в правый желудочек и легочную артерию, приводит к переполнению сосудов малого круга кровообращения, где развивается легочная гипертензия.
Выделяют три стадии легочной гипертензии по В. И. Бураковскому.
- Застой крови (гиперволемическая стадия легочной гипертензии) может приводить к отёку легких, частому присоединению инфекции, развитию пневмоний, манифестирующих в ранние сроки жизни, имеющих тяжелое течение и плохо поддающихся лечению. Если с гиперволемией не удается справиться консервативными методами, в таких случаях проводят паллиативную операцию — сужение легочной артерии по Мюллеру. Суть операции заключается в создании временного искусственного стеноза легочной артерии, который препятствует попаданию в МКК избыточного количества крови. Однако повышенная нагрузка, падающая при этом на правый желудочек, диктует в дальнейшем (спустя 3—6 месяцев) необходимость проведения радикальной операции.[9]
- При естественном течении порока со временем в сосудах малого круга кровообращения срабатывает рефлекс Китаева (спазмирование в ответ на перерастяжение), что приводит к развитию переходной стадии лёгочной гипертензии. В этот период ребёнок перестает болеть, становится более активным, начинает прибавлять в весе. Стабильное состояние пациента в эту фазу является лучшим периодом для проведения радикальной операции.[9] Давление в легочной артерии (и соответственно в правом желудочке) в эту фазу колеблется в пределах от 30 до 70 мм рт. ст. Аускультативная картина характеризуется уменьшением интенсивности шума при появлении акцента II тона над лёгочной артерией.[5]
- В дальнейшем, если хирургическая коррекция ВПС не проводится, начинают формироваться процессы склерозирования сосудов легких (высокая легочная гипертензия — синдром Эйзенменгера). Этот патологический процесс не имеет обратного развития и приводит к значительному повышению давления в легочной артерии (иногда до 100—120 мм рт. ст.).[5]
Аускультативно можно выслушать резко выраженный акцент II тона над легочной артерией («металлический» оттенок).[10] Систолический шум становится слабо-интенсивным, а в некоторых случаях может совсем отсутствовать. На этом фоне можно зафиксировать появление нового диастолического шума, обусловленного недостаточностью клапанов лёгочной артерии (шум Грехема-Стилла).[10] В клинической картине заболевания отмечается множество патологических признаков: сердечный «горб», расширение границ относительной сердечной тупости, больше вправо. Над легкими выслушиваются участки ослабленного и жесткого дыхания, могут встречаться свистящие хрипы. Самым характерным признаком синдрома Эйзенменгера является постепенное нарастание цианоза, — сначала периферического, а в дальнейшем и диффузного. Это происходит вследствие перекрестного сброса крови в области дефекта межжелудочковой перегородки, который при превышении давления в правом желудочке становится право-левым, то есть меняет своё направление. Наличие у пациента третьей стадии легочной гипертензии может стать основным мотивом отказа кардиохирургов от проведения операции.[6]
Клиническая картина при ДМЖП заключается в симптомокомплексе сердечной недостаточности, развивающейся, как правило, на 1-3 месяцах жизни (в зависимости от размеров дефекта).[8] Кроме признаков сердечной недостаточности ДМЖП может манифестировать ранними и тяжелыми пневмониями. При осмотре ребёнка можно выявить тахикардию и одышку, расширение границ относительной сердечной тупости, смещение верхушечного толчка вниз и влево. В ряде случаев определяется симптом «кошачьего мурлыканья». Систолический шум, как правило, интенсивный, выслушивается над всей областью сердца, хорошо проводится на правую сторону грудной клетки и на спину с максимальной интенсивностью в IV межреберье слева от грудины. При пальпации живота определяется гепатомегалия и спленомегалия. Изменения периферической пульсации не характерны. У детей с ДМЖП как правило быстро развивается гипертрофия.
Диагностика любого порока сердца складывается из рентгенологического исследования органов грудной полости, электрокардиографии и двухмерной допплерэхокардиографии.
При рентгенологическом исследовании органов грудной клетки описывают форму сердца и состояние легочного рисунка, определяют размер кардио-торакального индекса (КТИ). Все эти показатели имеют свои особенности при разных степенях лёгочной гипертензии. В первой, гиперволемической стадии, выявляется сглаженность талии и погруженность верхушки сердца в диафрагму, увеличение КТИ. Со стороны легочного рисунка отмечается его усиление, нечеткость, размытость. Крайней степенью гиперволемии в лёгких является отёк лёгких. В переходной стадии лёгочной гипертензии отмечается нормализация лёгочного рисунка, некоторая стабилизация размеров КТИ. Для склеротической стадии лёгочной гипертензии характерно значительное увеличение размеров сердца, причем в основном за счёт правых отделов, увеличение правого предсердия (формирование прямого атрио-вазального угла), выбухание дуги лёгочной артерии (индекс Мура более 50 %), приподнятость верхушки сердца, которая образует с диафрагмой острый угол. Со стороны лёгочного рисунка часто описывается симптом «обрубленного дерева»: яркие, чёткие, увеличенные корни, на фоне которых лёгочный рисунок прослеживается только до определённого уровня. На периферии имеет место признаки эмфиземы. Грудная клетка имеет вздутую форму, ход ребер горизонтальный, диафрагма уплощена, стоит низко.[9]
ЭКГ имеет свои закономерности, тесно связанные с фазой течения ВПС и степенью лёгочной гипертензии. Сначала выявляются признаки перегрузки левого желудочка — повышение его активности, затем развитие его гипертрофии. С течением времени присоединяются признаки перегрузки и гипертрофии правых отделов сердца — как предсердия, так и желудочка, — это свидетельствует о высокой лёгочной гипертензии. Электрическая ось сердца всегда отклонена вправо. Могут встречаться нарушения проводимости — от признаков неполной блокады правой ножки пучка Гиса до полной атрио-вентрикулярной блокады.[10]
При допплер-ЭхоКГ уточняется место расположения дефекта, его размер, определяется давление в правом желудочке и лёгочной артерии. В первой стадии лёгочной гипертензии давление в ПЖ не превышает 30 мм.рт.ст., во второй стадии — от 30 до 70 мм.рт.ст., в третьей — более 70 мм.рт.ст.[6]
Лечение данного порока подразумевает консервативную терапию сердечной недостаточности и хирургическую коррекцию порока сердца. Консервативное лечение складывается из препаратов инотропной поддержки (симпатомиметики, сердечные гликозиды), мочегонных препаратов, кардиотрофиков.[8] В случаях высокой легочной гипертензии назначаются ингибиторы ангиотензинпревращающего фермента — капотен или каптоприл.
Оперативные вмешательства подразделяются на паллиативные операции (в случае ДМЖП — операция суживания лёгочной артерии по Мюллеру) и радикальную коррекцию порока — пластика дефекта межжелудочковой перегородки заплатой из листков перикарда в условиях искусственного кровообращения, кардиоплегии и гипотермии.[5]
- ↑ Disease Ontology release 2019-05-13 — 2019-05-13 — 2019.
- ↑ Monarch Disease Ontology release 2018-06-29sonu — 2018-06-29 — 2018.
- ↑ 1 2 Шарыкин. Врожденные пороки сердца. — Теремок, 2005. — 384 с.
- ↑ http://www.mma.ru/article/id34653 Дефект межжелудочковой перегородкм. Медицинская энциклопедия ММА
- ↑ 1 2 3 4 5 Прахов А.В. Неонатальная кардиология. — НГМА, 2008. — 388 с.
- ↑ 1 2 3 Банкл Г. Врожденные пороки сердца и крупных сосудов. — 1980. — 312 с.
- ↑ Вишневский А.А., Галанкин Н.К. Врожденные пороки сердца и крупных сосудов. — 1962. — 210 с.
- ↑ 1 2 3 Белозеров Ю.М. Детская кардиология. — МЕДпресс-информ, 2004. — 600 с.
- ↑ 1 2 3 Белоконь Н.А., Подзолков В.П. Врожденные пороки сердца. — 1991. — 352 с.
- ↑ 1 2 3 Василенко В.Х.,Фельдман С.Б., Могилевский Э.Б. Пороки сердца. — 1983. — 366 с.
- 1.Банкл Г. Врожденные пороки сердца и крупных сосудов. — 1980. — 312 с.
- 2. Белозеров Ю.М. Детская кардиология. — МЕДпресс-информ, 2004. — 600 с.
- 3. Белоконь Н.А., Подзолков В.П. Врожденные пороки сердца. — 1991. — 352 с.
- 4. Василенко В.Х.,Фельдман С.Б., Могилевский Э.Б. Пороки сердца. — 1983. — 366 с.
- 5. Вишневский А.А., Галанкин Н.К. Врожденные пороки сердца и крупных сосудов. — 1962. — 210 с.
- 6. Имре Литтманн, Рене Фоно. Врожденные пороки сердца и крупных сосудов. — 1954. — 232 с.
- 7. Прахов А.В. Неонатальная кардиология. — НГМА, 2008. — 388 с.
- 8. Шарыкин. Врожденные пороки сердца. — Теремок, 2005. — 384 с.
Дмжп перимембранозный в аневризме
Спонтанное закрытие дефекта происходит в 70% случаев, обычно в первые три года. У 25% дефект уменьшается, но полностью не закрывается.
Что Вы думаете по этому поводу?
Уважаемые Доктор Довгань и Софья Михайловна! Разрешите, с Вашего позволения, выложить протокол УЗИ сердца моей доченьки. Сделано оно было, когда ей было 13 дней. Прокомментируйте его пожалуйста — какие все же перспективы у нас? И сколько в нашем случае можно ждать?
Вот последний протокол УЗИ сердца, сделанный 3.02.2011 (а родились мы 22.01.2011)
Чсс-161 уд. в мин.
Аорта — 10, 3мм, легочная артерия — 1, 9 мм, левое предсердие — 11 мм, правое предсердие — 14, 8 мм, межжелудочковая перегородка — 2,9 мм, правый желудочек — 11 мм, задняя стенка ЛЖ — 2,7мм, толщина стенок ПЖ — 2 мм, левый желудочек: КДР 19,5 мм, КСР — 11,8 мм, фракция выброса — 70,5%
Межпредсердная перегородка — ООО — 4,5 мм с умеренным сбросом (39,5 %)
Межжелуд. перегородка — дефект перимембранозный 3,5 мм с градиентом сброса 15 мм. рт. ст. вправо
Аортальный клапан без особенностей, систолическое расхождение створок нормальное (7,6 мм), регургитации нет, скорость кровотока 0,96 м/с. Клапан легочного ствола без особ-тей, регургитация — 1 степень, скорость кровотока 1, 34 м/с
СГД =90/187=0,48-11,4 мм. рт. ст.
Митральный клапан без особ-тей, регургитация — 0-1 степень.
Трикуспидальный клапан без=особ-тей, регургитация — 0-1 ст.
Перикард — без особ-тей.
Нижняя полая вена — 4 мм
Брюшной отдел аорты — тип магистральный
Не исключается ОАП. Нитевидные структуры в полости Л. Ж.
В динамике — мышечный ДМЖП не определяется. Перимембранозный ДМЖП — 3,5 мм. ООО — 4,5 мм. Без перегрузок правых отделов сердца. Ускорение кровотока в стволе ЛА. ДХЛЖ.
Дефект межжелудочковой перегородки один из наиболее распространенных пороков сердца. Его обнаруживают у 10-30% детей с врожденными пороками сердца. Согласно данным медицинской статистики, на каждую тысячу родов рождается два ребенка с дефектом межжелудочковой перегородки. Межжелудочковая перегородка соответственно своему названию, разделяет левый и правый желудочки сердца. В норме в этой перегородке, отсутствуют какие бы то, ни было отверстия.
Если в межжелудочковой перегородке имеется отверстие, то это создает возможность для проникновения крови из одного желудочка в другой. Давление в левом желудочке всегда больше, поскольку он отвечает за выброс крови в большой круг кровообращения, а значит, его мускулатура развита лучше. Поэтому при наличии дефекта межжелудочковой перегородки происходит проникновение крови в правый желудочек из левого, то есть из большого круга кровообращения в малый. Объем крови в нем возрастает по сравнению с нормой, это влечет за собой его перегрузку. Постоянное высокое напряжение стенок сосудов приводит к развитию их спазма, они уплотняются под влиянием развивающегося склероза. Все это приводит к повышению давления в малом круге кровообращения до такой степени, что оно начинает превышать давление в большом круге. И тогда процесс становится обратным: происходит сброс крови из правого желудочка в левый. На этом этапе у больного развивается цианоз — посинение губ и носогубных складок (т.н.носогубный треугольник), ногтевых пластинок.
Дефект межжелудочковой перегородки относится к числу пороков, которые нередко устраняются самопроизвольно. Так, в первый месяц жизни ребенка закрывается до 80% отверстий от общего числа этой патологии. В более поздние сроки также возможно закрытие дефекта, хотя это отмечается реже. Закрытие дефекта межжелудочковой перегородки осуществляется за счет мышечного слоя межжелудочковой перегородки, это наиболее характерно для тех отверстий, которые расположены на перегородке ниже аорты.
Локализация отверстия имеет большое значение, поскольку оказывает влияние на функцию окружающих структур и электропроводящей системы сердца. Центральная часть межжелудочковой перегородки имеет мембранозную (соединительнотканную) структуру, окруженную мышечной тканью. В перегородке разделяют несколько зон: входная (приточная) зона, трабекулярная зона и отточная или выходная зона.
Наиболее распространенный вид дефектов. Локализован в мышечной части перегородки, окружающей мембранозную часть. Дефицит мышечной ткани может возникнуть в любом отделе, однако один из краев отверстия непременно образован соединительной тканью. Как правило, это часть перепончатого кольца аортального клапана. Эти дефекты могут образовываться в любой части перегородки.
Как следует из названия, в этом случае отверстие в межжелудочковой перегородке расположено под створками клапанов аорты и легочной артерии, в выходной части перегородки
Их края полностью состоят из мышечной ткани. Они могут образовываться в любой части перегородки, бывают множественными и/или сочетаются с перепончатыми дефектами
Что касается размеров дефекта межжелудочковой перегородки, то они измеряются по отношению к диаметру аорты. Если размер отверстия не превышает ¼ диаметра аорты, то такой дефект считается малым. При размерах, сопоставимых с половиной диаметра главного кровеносного сосуда, дефект относится к средним, а все, которые превышают этот размер, классифицируются как большие дефекты межжелудочковой перегородки. Естественно, что чем меньше отверстие, тем меньший вред наносится здоровью пациента.
Малые дефекты межжелудочковой перегородки , не превышающие 1 см в диаметре, имеют склонность к самостоятельному закрытию. Их доля в общем количестве дефектов межжелудочковой перегородки составляет 30-40%. Такие дефекты получили название болезнь Толочинова-Руже. У детей с малыми дефектами межжелудочковой перегородки уже на первой неделе жизни может выслушиваться грубый систолический шум. Тем не менее, физиологическое развитие таких детей протекает нормально. В старшем возрасте возможны жалобы на повышенную утомляемость при физических нагрузках.
На ЭКГ могут отсутствовать признаки патологии, или наблюдаться симптомы повышенной нагрузки на левый желудочек. В диагностических целях применяют ультразвуковое исследование, которое выявляет поток крови между желудочками. В сомнительных случаях или с целью уточнения диагноза проводят катетеризацию сердца, ангиографию.
При этом виде порока прогноз благоприятный. Иногда происходит самостоятельное закрытие дефекта, когда ребенок достигает возраста 4-5 лет. Такие пациенты должны находиться под наблюдением кардиолога. Хирургическое лечение в подобных случаях, как правило, не проводится.
Большие дефекты межжелудочковой перегородки могут создавать опасность для жизни ребенка уже в первые недели его жизни, поскольку развивается сердечная недостаточность: наблюдается отставание в развитии, возникают трудности при кормлении, нарушения сосательного рефлекса, одышка. Ребенок подвержен частым простудным заболеваниям со склонностью развития пневмонии. В области сердца при осмотре обнаруживается характерное выпячивание грудной клетки, при пальпации ощущается своеобразное дрожание во время систолы (сокращения сердечной мышцы). Постепенно одышка возникает и в покое, функциональные изменения легких ярко выражены, появляются нарушения работы печени, отеки на нижних конечностях.
Лечение дефектов межжелудочковой перегородки хирургическое. Если у ребенка имеются признаки сердечной недостаточности, то операцию производят как можно раньше, в первый три месяца его жизни. В случае если состояние ребенка позволяет подождать, то показания к операции рассматривают, исходя из показателей давления в малом круге кровообращения. В случаях, когда давление в легочных артериях не высокое, операцию стараются отложить до 1 года, поскольку есть шансы на самостоятельное заращение дефекта межжелудочковой перегородки. Иногда существует возможность отложить операцию до возраста 5 лет.
Радикальная операция проводится с применением аппарата искусственного кровообращения. Наиболее щадящий подход к межжелудочковой перегородке осуществляется через правое предсердие. В тех случаях, когда это неосуществимо, хирурги используют возможность доступа через левое предсердие, аорту или легочную артерию. В зависимости от размеров дефекта производится сшивание отверстия. В качестве “заплаты” применяют синтетический материал или лоскут, взятый из ткани собственного перикарда пациента. Закрепление заплаты производится с помощью П-образных швов. Обшиваются все края дефекта. С помощью специальной аппаратуры проверяется герметичность заплаты.
В некоторых случаях операция осуществляется в частичном объеме. Такой подход называется паллиативным. Целью данного метода является сужение просвета легочной артерии. Вскрыв грудную клетку, через перикард открывают доступ к легочному столбу, накладывают на него лигатуру (толстую шелковую нить) и перевязывают ее, сужая диаметр легочного ствола. Процедура напоминает наложение манжеты. Степень сужения легочного ствола определяется показателями давления крови в нем, общего кровяного давления, а также путем наблюдений за установившимся в результате манипуляции режимом кровообращения.
Операции по устранению дефектов межжелудочковой перегородки проводятся только в крупных кардиоцентрах, обладающих богатым опытом, накопленным высококвалифицированными хирургами. Кардиологический центр медицинского центра «Шиба» подобные операции выполняет в большом количестве, что позволило наработать большой и успешный практический опыт.
Результаты оперативного лечения благоприятные как в ближайшем, так и в отдаленном периоде.
В процессе эмбриогенеза общая предсердная полость сначала разделяется первичной перегородкой на правое и левое предсердие. Первичная перегородка распространяется от основания сердца по направлению к эндокардиальным подушкам. Просвет между ними называется первичным отверстием (ostium primum).
После слияния эндокардиальных подушек и первичной перегородки происходит фенестрация последней. Получающееся в результате сообщение между двумя предсердиями носит название вторичного отверстия (ostium secundum). Затем вторичная перегородка распространяется по правой стороне первичной перегородки и покрывает собой часть вторичного отверстия. Сохраняющееся в результате сообщение между предсердиями называется овальным окном, заслонка которого представляет собой нижнюю часть первичной перегородки.
Поэтому дефекты, расположенные близко к эндокардиальным подушкам, называются первичными дефектами, а те, которые локализуются в области овального окна, обозначаются как вторичные дефекты. Вторичные септальные пороки наиболее распространены и встречаются с частотой 0,07 случаев на 1000 детей. Первичный дефект межпредсердной перегородки (ДМПП) является наиболее простой формой атриовентрикулярного септального дефекта и будет рассмотрен ниже.
Вторичные ДМПП наиболее часто встречаются изолированно, но могут входить в состав других пороков сердца, которые характеризуются межпредсердным шунтированием крови (таких, как атрезия митрального, легочного, трикуспидального или аортального клапанов). Иногда ДМПП являются частью некоторых синдромов, в частности синдрома Холта-Орама (Holt-Oram) (для которого могут быть характерны вторичный ДМПП, гипоплазия большого пальца кисти и лучевой кости, трехфаланговый большой палец кисти, абрахия и фокомелия).
Хотя в литературе встречаются сообщения о пренатальном выявлении вторичных ДМПП, установление этого диагноза остается трудной задачей, поскольку наличие овального окна у плода является физиологичным. Наиболее вероятно, что достоверно можно выявлять только очень большие дефекты такого типа.
Наличие дефектов межпредсердной перегородки не приводит к нарушению функции сердца плода во внутриутробном периоде, поскольку шунтирование справа налево больших объемов крови на уровне предсердий является физиологическим состоянием у плода. В связи с этим большинство детей с такими пороками могут не иметь какой-либо клинической симптоматики даже в неонатальном периоде.


Дефекты межжелудочковой перегородки (ДМЖП), очевидно, являются самыми частыми врожденными пороками сердца. В зависимости от того, какая часть перегородки поражена, их подразделяют, на перимембранозные, приточные, трабекулярные и отточные. Перимембранозные дефекты (80%) называются так потому, что они захватывают не только мембранозную часть перегородки ниже аортального клапана, но и распространяются в той или иной степени на ее прилежащую мышечную часть.
Приточные дефекты располагаются в области приносящего тракта правого желудочка, нарушая прикрепление септальных хорд трикуспидального клапана. Трабекулярные дефекты возникают в мышечной части перегородки, а отточные дефекты — в области выносящего тракта (инфундибулярном отделе) правого желудочка. Трабекулярные ДМЖП (5-20%) до сих пор не удавалось обнаруживать при пренатальной эхокардиографии, поскольку обычно они состоят из мелких отверстий. В целом, небольшой изолированный дефект межжелудочковой перегородки трудно диагностировать во внутриутробном периоде, при этом возможны как ложноположительные, так и ложноотрицательные заключения.
Эхокардиографическая диагностика ДМЖП основана на выявлении участка без эхосигналов, отраженных от межжелудочковой перегородки. Перимембранозные и субаортальные дефекты, составляющие большинство ДМЖП, наилучшим образом выявляются при детальном осмотре выносящего тракта левого желудочка. Дефекты менее 1 -2 мм находятся за пределами разрешающей способности современного ультразвукового оборудования, и поэтому не обнаруживаются. При поиске ДМЖП следует использовать многоплоскостное сканирование. Перимембранозные дефекты лучше всего видны при исследовании четырехкамерного среза сердца.
Мышечные дефекты, которые обнаруживаются с трудом, лучше всего искать при сканировании по коротким осям, пытаясь зарегистрировать область аномального сообщения между двумя желудочками.
Данных о том, что ДМЖП приводят к внутриутробным гемодинамическим нарушениям, при обследовании плодов выявлено не было. Даже крупные дефекты, вызывающие сообщение полостей правого и левого желудочков, вероятно, вызывают только небольшое двунаправленное шунтирование потоков крови у плода, что может объясняться, как предполагается в настоящее время, одинаковым внутрижелудочковым давлением во внутриутробном периоде. Вопросы, касающиеся возможности выявления шунтирования через такие дефекты с помощью цветового допплеровского картирования, пока остаются спорными.
У подавляющего большинства детей ДМЖП в неонатальном периоде не проявляются какой-либо клинической симптомтикой. Редким исключением из этого правила являются очень крупные дефекты, связанные с массивным шунтированием слева направо, которое приводит к застойной сердечной недостаточности вскоре после рождения. Приблизительно 25% мелких трабекулярных дефектов закрываются спонтанно, аналогичные явления были выявлены для небольшого числа перимембранозных дефектов.
Дефект межжелудочковой перегородки (ДМЖП) — Кардиолог
Общие сведения
Клинические проявления
Лечение
Последствия и осложнения
Дефекты межжелудочковой перегородки (ДМЖП) — самые частые врожденные пороки сердца, составляющие от 30 до 60% всех врожденных пороков сердца у доношенных; распространенность составляет 3—6 на 1 000 новорожденных. Это не считая 3—5% новорожденных с мелкими мышечными дефектами межжелудочковой перегородки, которые обычно самостоятельно закрываются в течение первого года.
Дефекты межжелудочковой перегородки обычно бывают изолированными, но могут сочетаться и с другими пороками сердца. Поскольку дефекты межжелудочковой перегородки уменьшают поток крови через перешеек аорты, при тяжелой сердечной недостаточности у грудных детей с этим пороком всегда следует исключать коарктацию аорты. Дефекты межжелудочковой перегородки нередко встречаются при других пороках сердца. Так, они бывают при корригированной транспозиции магистральных артерий, при этом часто сопровождаются и другими нарушениями (см. ниже).
Дефекты межжелудочковой перегородки всегда имеются при общем артериальном стволе и двойном отхождении магистральных артерий от правого желудочка; в последнем случае (если отсутствует стеноз клапана легочной артерии) клинические проявления будут такими же, как при изолированном дефекте межжелудочковой перегородки.
Дефекты межжелудочковой перегородки могут возникать в любой ее части. При рождении около 90% дефектов локализуется в мышечной части перегородки, но поскольку большинство из них самостоятельно закрывается в течение 6— 12 мес, в последующем преобладают перимембранозные дефекты. Размеры ДМЖП могут быть самыми разными: от крошечных отверстий до полного отсутствия всей межжелудочковой перегородки (единственный желудочек). Большинство трабекулярных (за исключением множественных дефектов типа «швейцарского сыра») и перимембранозных дефектов межжелудочковой перегородки закрываются самостоятельно, чего нельзя сказать про крупные дефекты приносящей части межжелудочковой перегородки и инфундибулярные дефекты (субаортальные, как при тетраде Фалло, подлегочные или расположенные под обоими полулунными клапанами). Инфундибулярные дефекты, особенно подлегочные и расположенные под обоими полулунными клапанами, часто прикрываются за счет пролабирования в них перегородочной створки аортального клапана, что приводит к аортальной недостаточности; последняя развивается лишь у 5% белых, но у 35% японцев и китайцев с этим пороком. При спонтанном закрытии перимембранозных дефектов межжелудочковой перегородки часто образуется псевдоаневризма межжелудочковой перегородки; ее выявление говорит о высокой вероятности спонтанного закрытия дефекта.
Клинические проявления
При сбросе крови слева направо через дефект межжелудочковой перегородки перегрузке объемом подвергаются оба желудочка, поскольку избыточный объем крови, прокачиваемый левым желудочком и сбрасываемый в сосуды малого круга, попадает в них через правый желудочек.
Систолический шум при дефекте межжелудочковой перегородки обычно грубый и лентовидный. При небольшом сбросе шум может быть слышен только в начале систолы, однако по мере увеличения сброса он начинает занимать всю систолу и заканчивается одновременно с аортальным компонентом II тона. Громкость шума может быть непропорциональна величине сброса, иногда громкий шум может быть слышен при гемодинамически незначимом сбросе (болезнь Роже). Громкий шум часто сопровождается систолическим дрожанием. Шум обычно лучше всего слышен снизу у левого края грудины, проводится во все стороны, но сильнее всего в направлении мечевидного отростка. Однако при высоком подлегочном дефекте межжелудочковой перегородки шум может лучше всего выслушиваться посередине или сверху у левого края грудины и проводиться вправо от грудины. В редких случаях при очень маленьких дефектах шум может быть веретенообразным и высокочастотным, напоминая функциональный систолический шум. При большом сбросе крови слева направо, когда отношение легочного кровотока к системному превышает 2:1, на верхушке или медиальнее ее может появляться рокочущий мезодиастолический шум, а также III тон. Пропорционально величине сброса усиливается пульсация в области сердца.
При небольших дефектах межжелудочковой перегородки выраженной легочной гипертензии нет и легочный компонент II тона остается нормальным или лишь слегка усиливается. При легочной гипертензии появляется акцент II тона над легочным стволом. На рентгенограмме грудной клетки увеличиваются размеры левого желудочка и левого предсердия, а также усиливается легочный рисунок, однако при небольшом сбросе эти изменения могут быть очень незначительными или отсутствовать вовсе; при большой величине сброса появляются признаки венозного застоя в сосудах малого круга. Поскольку кровь сбрасывается на уровне желудочков, восходящая аорта не расширена. ЭКГ остается нормальной при небольших дефектах, однако при большом сбросе на ней появляются признаки гипертрофии левого желудочка, а при легочной гипертензии и правого. Размеры и расположение дефекта межжелудочковой перегородки определяют с помощью ЭхоКГ.
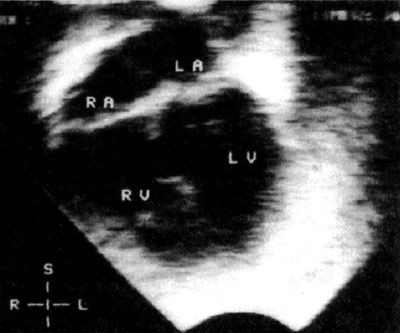
Рисунок: Мышечный дефект задней части межжелудочковой перегородки при ЭхоКГ в четырехкамерной позиции из апикального доступа. Диаметр дефекта около 1 см. LA — левое предсердие; LV — левый желудочек; RA — правое предсердие; RV — правый желудочек.
Допплеровское исследование позволяет локализовать по нарушению кровотока в правом желудочке, а при цветном допплеровском исследовании можно увидеть даже множественные дефекты межжелудочковой перегородки. При наиболее тяжелой форме дефекта межжелудочковой перегородки — единственном желудочке получить представление об анатомии сердца можно с помощью МРТ.
При большом сбросе крови слева направо появляются признаки перегрузки объемом и сердечной недостаточности. У доношенных это обычно происходит между 2 и 6 мес, а у недоношенных может происходить и раньше. Хотя сброс крови слева направо должен достигать максимума к 2—3 мес, когда легочное сосудистое сопротивление достигает своего минимума, иногда сердечная недостаточность у доношенных детей развивается уже на первом месяце жизни. Это обычно бывает при сочетании дефекта межжелудочковой перегородки с анемией, большим сбросом крови слева направо на уровне предсердий или через открытый артериальный проток или с коарктацией аорты. Кроме того, сердечная недостаточность может развиться раньше ожидаемого срока при дефектах межжелудочковой перегородки в сочетании с двойным отхождением магистральных артерий от правого желудочка. Возможно, это происходит потому, что до рождения легкие плода получают кровь с повышенным содержанием кислорода и в результате легочное сосудистое сопротивление после рождения оказывается более низким.
Лечение
Изолированные дефекты межжелудочковой перегородки — самые частые врожденные пороки сердца, поэтому все педиатры должны знать, что делать при их обнаружении. В таблице показан алгоритм принятия решений, а цифры в скобках расшифровываются ниже.
| ДМЖП, выявленный по шуму | |||||||
(1) Бессимптомное течение
|
Симптоматическое течение
|
||||||
| ↓ | ↓ | ||||||
| Наблюдение в течение 1 года | ЭхоКГ | ||||||
| ↓ | ↓ | ↓ | ↓ | ||||
| Шума нет Других симптомов нет Вывод: спонтанное закрытие |
Шум остается | Сопутствующих пороков нет | Сопутствующие пороки есть | ||||
| ↓ | ↓ | ↓ | ↓ | ↓ | |||
| Наблюдение не требуется | ЭхоКГ | Субаортальный, подлегочный или субтрикуспидальный дефект |
Трабекулярный или перимембранозный дефект |
Лечение сопутствующих пороков Возможно закрытие ДМЖП |
|||
| ↓ | ↓ | ||||||
| Инфундибулярный ДМЖП ← | Операция | Консервативное лечение |
→ | (2) Результаты лечения удовлетворительные или хорошие | |||
| ↓ | ↓ | ↓ | ↓ | ||||
| Консультация кардиолога Возможна операция |
Мышечный или перимембранозный ДМЖП | Консервативное лечение неэффективно |
Консервативное лечение |
||||
| ↓ | ↓ | ↓ | ↓ | ||||
| Наблюдение Профилактика инфекционного эндокардита |
Операция | (3) Рецидивирует сердечная недостаточность Частые пневмонии Синдром Дауна |
Результаты лечения удовлетворительные или хорошие | ||||
| ↓ | ↓ | ||||||
| Операция | Консервативное лечение | ||||||
| (4) Социальные показания← | |||||||
| ↓ | ↓ | ||||||
| Операция | Социальных показаний к операции нет | ||||||
| ↓ | |||||||
| (5) Окружность головы увеличивается медленно← | Консервативное лечение | ||||||
| ↓ | ↓ | ||||||
| Операция | (6) Окружность головы увеличивается нормально | ||||||
| ↓ | |||||||
| (7) Остается большой сброс крови слева направо← | Продолжать консервативное лечение до 1 года | ||||||
| ↓ | |||||||
| Операция | (8)Сброс крови слева направо уменьшился | ||||||
| ↓ | |||||||
| ЭхоКГ | |||||||
| ↓ | ↓ | ↓ | |||||
| (9)Большой ДМЖП Легочная гипертензия |
(10) Большой ДМЖП Обструкция выносящего тракта правого желудочка |
ДМЖП уменьшился Легочной гипертензии нет | |||||
| ↓ | ↓ | ↓ | |||||
| Операция | Операция | Профилактика инфекционного эндокардита | |||||
1. Небольшие дефекты межжелудочковой перегородки ветречаются у 3—5% новорожденных, в большинстве случаев они самостоятельно закрываются к 6—12 мес. Проводить ЭхоКГ только для подтверждения таких дефектов не нужно. Важно отметить, что при больших дефектах межжелудочковой перегородки у новорожденных в родильном доме шума не слышно, поскольку из-за высокого легочного сосудистого сопротивления сброс крови через такой дефект очень незначителен и не образует турбулентного тока крови. Поэтому шумы, указывающие на дефект межжелудочковой перегородки, выявленные в родильном доме, почти всегда вызваны маленькими дефектами.
2. Поскольку перимембранозные и трабекулярные дефекты очень часто закрываются самостоятельно, до 1 года таких детей можно вести консервативно в надежде, что операция не понадобится. Спонтанное закрытие дефектов межжелудочковой перегородки может происходить несколькими путями: за счет роста и гипертрофии мышечной части дефекта, смыкания дефекта из-за пролиферации эндокарда, встраивания в дефект перегородочной створки трехстворчатого клапана и пролабирования в дефект створки аортального клапана (в последнем случае бывает аортальная недостаточность). При уменьшении дефекта систолический шум может сначала усиливаться, однако при дальнейшем уменьшении дефекта он стихает, укорачивается, становится веретенообразным, высокочастотным и свистящим, что обычно предвещает его полное закрытие. Спонтанное закрытие дефекта происходит в 70% случаев, обычно в первые три года. У 25% дефект уменьшается, но полностью не закрывается; гемодинамически он при этом может быть почти незначим. В связи с этим, если дефект уменьшается, хирургическое лечение следует отложить в надежде на спонтанное закрытие дефекта. В таблице перечислены ситуации, в которых следует подумать о хирургическом лечении, не дожидаясь спонтанного закрытия дефекта.
3. При синдроме Дауна (трисомии по 21-й хромосоме) сосуды легких поражаются очень рано, поэтому, если дефект остается большим, операцию не откладывают.
4. В редких случаях операцию проводят по социальным показаниям. К ним относится невозможность постоянного врачебного наблюдения из-за проживания в отдаленных местностях или халатности родителей. Кроме того, за некоторыми из этих детей очень трудно ухаживать. Их необходимо кормить каждые два часа, и они требуют столько внимания, что часто страдают другие дети; иногда это приводит даже к распаду семьи.
5. При больших дефектах межжелудочковой перегородки всегда происходит задержка роста, вес обычно составляет ниже 5-го, а рост ниже 10-го процентиля. Однако после спонтанного или хирургического закрытия дефекта происходит резкий скачок роста. У большинства детей окружность головы нормальная, но иногда ее увеличение резко замедляется к 3—4 мес. При закрытии дефекта в этом возрасте окружность головы достигает нормальных значений, но если операция откладывается на 1—2 года, этого не происходит.
6. В отсутствие перечисленных выше причин, требующих раннего хирургического лечения, операцию можно отложить до 1 года в надежде, что дефект закроется или станет меньше.
7. Если к 1 году остается большой сброс крови слева направо, хирургическую коррекцию не проводят только при наличии особых обстоятельств, поскольку в дальнейшем значительно возрастает риск необратимого повреждения сосудов легких. К 2 годам необратимое повреждение сосудов легких происходит у трети детей.
8. При уменьшении сброса крови состояние улучшается; ослабевает пульсация в области сердца, уменьшаются размеры сердца, ослабевает или исчезает мезодиастолический шум, ослабевает или изменяется систолический шум, уменьшается и исчезает тахипноэ, улучшается аппетит, ускоряется рост, снижается потребность в медикаментозном лечении. Однако следует помнить, что улучшение может быть вызвано не только уменьшением дефекта межжелудочковой перегородки, но и поражением сосудов легких и, реже, обструкцией выносящего тракта правого желудочка. Для определения дальнейшей тактики на этой стадии необходимо провести ЭхоКГ, а иногда и катетеризацию сердца.
9. Тяжелое поражение сосудов легких при дефекте межжелудочковой перегородки редко развивается в возрасте до 1 года. Однако иногда такое возможно, поэтому, если сброс крови слева направо снижается, необходимо провести обследование. При поражении сосудов легких сброс крови слева направо отсутствует или очень мал, при этом в течение нескольких лет может не быть и сброса крови справа налево. Однако обычно к 5—6 годам усиливается цианоз, особенно во время физической нагрузки (синдром Эйзенменгера). При развитии тяжелой легочной гипертензии легочный ствол заметно расширяется, а легочный сосудистый рисунок, образованный периферическими сосудами, беднеет. В некоторых случаях поражение сосудов легких может прогрессировать очень быстро, вызывая необратимую легочную гипертензию к 12—18 мес; допустить это нельзя ни в коем случае. При любом неясном изменении клинической картины проводят ЭхоКГ и, при необходимости, катетеризацию сердца; при больших дефектах катетеризацию можно проводить планово в возрасте 9 и 12 мес для выявления бессимптомного поражения сосудов легких.
10. Гипертрофия и обструкция выносящего тракта правого желудочка развивается обычно довольно быстро, поэтому сброс крови слева направо может наблюдаться очень короткое время. Затем появляется цианоз, сначала при физической нагрузке, а потом и в покое; клиническая картина может напоминать тетраду Фалло. При обструкции выносящего тракта правого желудочка вероятность спонтанного закрытия дефекта межжелудочковой перегородки мала. Сброс крови справа налево может осложниться тромбозами и эмболиями сосудов головного мозга и абсцессами мозга, а гипертрофия выносящего тракта усложняет операцию; поэтому закрытие дефекта, а при необходимости — резекцию фиброзной и мышечной ткани выносящего отдела правого желудочка проводят по возможности рано.
При первичном хирургическом закрытии дефектов межжелудочковой перегородки летальность очень низка. Если первичное закрытие невозможно из-за множественных мышечных дефектов или других осложняющих обстоятельств, проводят хирургическое сужение легочного ствола, что уменьшает сброс крови слева направо, снижает легочный кровоток и давление в легочной артерии и устраняет сердечную недостаточность. При сужении легочного ствола бывают осложнения, кроме того, устранение сужения легочного ствола при последующем закрытии дефекта межжелудочковой перегородки повышает летальность этой операции.
Последствия и осложнения
У некоторых детей при спонтанном закрытии дефекта межжелудочковой перегородки в середине или конце систолы могут появляться щелчки. Эти щелчки возникают из-за выбухания в правый желудочек аневризматически расширенной мембранозной части межжелудочковой перегородки или встроившейся в дефект створки трехстворчатого клапана. Через небольшое отверстие, остающееся на верхушке этой псевдоаневризмы, сохраняется незначительный сброс крови слева направо. Обычно дефект окончательно закрывается и псевдоаневризма постепенно исчезает, однако изредка она может увеличиваться. Псевдоаневризму можно увидеть при ЭхоКГ.
При дефектах межжелудочковой перегородки, особенно при инфундибулярных, часто формируется аортальная недостаточность. Створка аортального клапана пролабирует в дефект, синус Вальсальвы при этом аневризматически расширяется; в результате может происходить разрыв аневризмы синуса Вальсальвы или створки клапана. Считается, что аортальная недостаточность развивается в результате давления на створку, не поддержанную межжелудочковой перегородкой, а также присасывающего действия струи крови, текущей через дефект. Даже при небольшом или почти закрывшемся дефекте межжелудочковой перегородки наличие аортальной недостаточности требует хирургического закрытия дефекта, поскольку иначе пролабирование створки аортального клапана может усилиться. При инфундибулярных дефектах может быть оправданной заблаговременная коррекция порока, до появления признаков аортальной недостаточности.
Другое осложнение дефекта межжелудочковой перегородки — инфекционный эндокардит. Он может возникать даже после спонтанного закрытия дефекта. Если инфекционный эндокардит возникает на створке трехстворчатого клапана, закрывающей дефект, ее разрыв может приводить к появлению прямого сообщения между левым желудочком и правым предсердием. В связи с этим профилактику инфекционного эндокардита следует продолжать даже при очень маленьких дефектах; при полном спонтанном закрытии дефекта профилактику инфекционного эндокардита прекращают.
Хирургическое лечение ДМЖП в Беларуси — европейское качество за разумную цену
Литература:
«Детская кардиология» под ред. Дж. Хоффмана, Москва 2006

Дефект межжелудочковой перегородки — причины, симптомы, диагностика и лечение
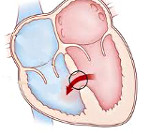
Дефект межжелудочковой перегородки – врожденная внутрисердечная аномалия, характеризующаяся наличием сообщения между правым и левым желудочками. Дефект межжелудочковой перегородки проявляется одышкой, отставанием в физическом развитии, быстрой утомляемостью, учащенным сердцебиением, наличием «сердечного горба». Инструментальная диагностика дефекта межжелудочковой перегородки включает проведение ЭКГ, ЭхоКГ, рентгенографии органов грудной клетки, вентрикулографии, аортографии, катетеризации камер сердца, МРТ. При дефектах межжелудочковой перегородки проводят радикальные (закрытие дефекта) и паллиативные (сужение легочной артерии) вмешательства.
Общие сведения
Дефект межжелудочковой перегородки (ДМЖП) – отверстие в перегородке, разделяющей полости левого и правого желудочка, наличие которого приводит к патологическому шунтированию крови. В кардиологии дефект межжелудочковой перегородки – наиболее часто встречающийся врожденный порок сердца (9–25% от всех ВПС). Частота критических состояний при дефекте межжелудочковой перегородки составляет около 21%. С одинаковой частотой порок обнаруживается у новорожденных мальчиков и девочек.
Дефект межжелудочковой перегородки может быть единственной внутрисердечной аномалией (изолированный ДМЖП) или входить в структуру сложных пороков (тетрады Фалло, общего артериального ствола, транспозиции магистральных сосудов, атрезии трехстворчатого клапана и др.). В ряде случаев межжелудочковая перегородка может отсутствовать полностью — такое состояние характеризуется как единственный желудочек сердца.
Дефект межжелудочковой перегородки
Причины дефекта межжелудочковой перегородки
Чаще всего дефект межжелудочковой перегородки является следствием нарушения эмбрионального развития и формируется у плода при нарушениях закладки органов. Поэтому дефекту межжелудочковой перегородки часто сопутствуют другие сердечные пороки: открытый артериальный проток (20%), дефект межпредсердной перегородки (20%), коарктация аорты (12%), стеноз устья аорты (5%), аортальная недостаточность (2,5—4,5%), недостаточность митрального клапана (2%), реже — аномальный дренаж легочных вен, стеноз легочной артерии и др.
В 25-50% случаев дефект межжелудочковой перегородки сочетается с пороками развития внесердечной локализации — болезнью Дауна, аномалиями развития почек, расщелиной твердого неба и заячьей губой.
Непосредственными факторами, вызывающими нарушение эмбриогенеза, выступают вредные воздействия на плод в I триместре гестации: заболевания беременной (вирусные инфекции, эндокринные нарушения), алкогольная и лекарственная интоксикации, ионизирующая радиация, патологическое течение беременности (выраженные токсикозы, угроза самопроизвольного прерывания беременности и пр.). Имеются данные о наследственной этиологии дефекта межжелудочковой перегородки. Приобретенные дефекты межжелудочковой перегородки могут являться осложнением инфаркта миокарда.
Особенности гемодинамики при дефекте межжелудочковой перегородки
Межжелудочковая перегородка образует внутренние стенки обоих желудочков и составляет примерно 1/3 площади каждого из них. Межжелудочковая перегородка представлена мембранозным и мышечным компонентами. В свою очередь, мышечный отдел состоит из 3-х частей — приточной, трабекулярной и отточной (инфундибулярной).
Межжелудочковая перегородка, наряду с другими стенками желудочков, принимает участие в сокращении и расслаблении сердца. У плода она полностью формируется к 4-5-ой неделе эмбрионального развития. Если этого по каким-либо причинам не происходит, в межжелудочковой перегородке остается дефект. Нарушения гемодинамики при дефекте межжелудочковой перегородки обусловлены сообщением левого желудочка с высоким давлением и правого желудочка с низким давлением (в норме в период систолы давление в левом желудочке в 4 — 5 раз выше, чем в правом).
После рождения и установления кровотока в большом и малом кругах кровообращения из-за дефекта межжелудочковой перегородки возникает лево-правый сброс крови, объем которого зависит от размеров отверстия. При небольшом объеме шунтируемой крови давление в правом желудочке и легочных артериях остается нормальным либо незначительно повышается. Однако при большом поступлении крови через дефект в малый круг кровообращения и ее возврате в левые отделы сердца, развивается объемная и систолическая перегрузка желудочков.
Значительное повышение давления в малом круге кровообращения при больших дефектах межжелудочковой перегородки способствует возникновению легочной гипертензии. Повышение легочно-сосудистого сопротивления взывает развитие сброса крови из правого желудочка в левый (обратного или перекрестного шунтирования), что приводит к артериальной гипоксемии (синдром Эйзенменгера).
Многолетняя практика кардиохиругов показывает, что наилучших результатов закрытия дефекта межжелудочковой перегородки можно добиться при сбросе крови слева направо. Поэтому при планировании операции тщательно учитываются гемодинамические параметры (давление, сопротивление и объем сброса).
Классификация дефекта межжелудочковой перегородки
Размер дефекта межжелудочковой перегородки оценивается, исходя из его абсолютной величины и сопоставления с диаметром аортального отверстия: маленький дефект составляет 1-3 мм (болезнь Толочинова–Роже), средний – равен примерно 1/2 диаметра аортального отверстия, большой – равен или превышает его диаметр.
С учетом анатомического расположения дефекта выделяют:
- перимембранозные дефекты межжелудочковой перегородки — 75% (приточные, трабекулярные, инфундибулярные) расположены в верхней части перегородки под аортальным клапаном, могут закрываться самопроизвольно;
- мышечные дефекты межжелудочковой перегородки – 10% (приточные, трабекулярные) — расположены в мышечном отделе перегородки, на значительном удалении от клапанной и проводящей систем;
- надгребневые дефекты межжелудочковой перегородки — 5% — расположены выше наджелудочкового гребня (мышечного пучка, отделяющего полость правого желудочка от его выносящего тракта), самопроизвольно не закрываются.
Симптомы дефекта межжелудочковой перегородки
Клинические проявления больших и малых изолированных дефектов межжелудочковой перегородки различны. Малые дефекты межжелудочковой перегородки (болезнь Толочинова—Роже) имеют диаметр менее 1 см и встречаются в 25-40% от числа всех ДМЖП. Проявляются нерезко выраженной утомляемостью и одышкой при нагрузке. Физическое развитие детей, как правило, не нарушено. Иногда у них определяется слабо выраженное куполообразное выпячивание грудной клетки в области сердца — «сердечный горб». Характерным клиническим признаком малых дефектов межжелудочковой перегородки служит аускультативно выявляемое наличие грубого систолического шума над областью сердца, который фиксируется уже на первой неделе жизни.
Большие дефекты межжелудочковой перегородки, имеющие размеры более 1/2 диаметра устья аорты или более 1 см, проявляются симптоматически уже в первые 3 месяца жизни новорожденных, приводя в 25-30% случаев к развитию критического состояния. При больших дефектах межжелудочковой перегородки отмечается гипотрофия, одышка при физической нагрузке или в покое, повышенная утомляемость. Характерны затруднения при кормлении: прерывистое сосание, частые отрывы от груди, одышка и бледность, потливость, пероральный цианоз. В анамнезе у большинства детей с дефектом межжелудочковой перегородки — частые респираторные инфекции, затяжные и рецидивирующие бронхиты и пневмонии.
В возрасте 3-4-лет, по мере нарастания сердечной недостаточности, у таких детей появляются жалобы на сердцебиение и боли в области сердца, склонность к носовым кровотечениям и обморокам. Транзиторный цианоз сменяется постоянным пероральным и акроцианозом; беспокоит постоянная одышка в покое, ортопноэ, кашель (синдром Эйзенменгера). На наличие хронической гипоксии указывают деформация фаланг пальцев и ногтей («барабанные палочки», «часовые стекла»).
При обследовании выявляется «сердечный горб», развитый в меньшей или большей степени; тахикардия, расширение границ сердечной тупости, грубый интенсивный пансистолический шум; гепатомегалия и спленомегалия. В нижних отделах легких выслушиваются застойные хрипы.
Диагностика дефекта межжелудочковой перегородки
К методам инструментальной диагностики дефекта межжелудочковой перегородки относятся ЭКГ, ФКГ, рентгенография грудной клетки, ЭхоКС, катетеризация камер сердца, ангиокардиография, вентрикулография.
Электрокардиограмма при дефекте межжелудочковой перегородки отражает перегрузку желудочков, наличие и степень выраженности легочной гипертензии. У взрослых больных могут регистрироваться аритмии (экстрасистолия, мерцание предсердий), нарушения проводимости (блокада правой ножки пучка Гиса, синдром WPW). Фонокардиография фиксирует высокочастотный систолический шум с максимумом в III-IV межреберье слева от грудины.
Эхокардиография позволяет выявить дефект межжелудочковой перегородки или заподозрить его по характерным нарушениям гемодинамики. Рентгенография органов грудной клетки при больших дефектах межжелудочковой перегородки обнаруживает усиление легочного рисунка, усиленную пульсацию корней легких, увеличение размеров сердца. Зондирование правых полостей сердца выявляет повышение давления в легочной артерии и правом желудочке, возможность проведения катетера в аорту, повышенную оксигенацию венозной крови в правом желудочке. Аортография проводится для исключения сопутствующих ВПС.
Дифференциальная диагностика дефекта межжелудочковой перегородки проводится с открытым атриовентрикулярным каналом, общим артериальным стволом, дефектом аортолегочной перегородки, изолированным стенозом легочной артерии, стенозом аорты, врожденной митральной недостаточностью, тромбоэмболией.
Лечение дефекта межжелудочковой перегородки
Асимптомное течение дефекта межелудочковой перегородки при его небольших размерах позволяет воздержаться от хирургического вмешательства и осуществлять динамическое наблюдение за ребенком. В ряде случаев возможно спонтанное закрытие дефекта межжелудочковой перегородки к 1-4 годам жизни или в более позднем возрасте. В остальных случаях показано хирургическое закрытие дефекта межжелудочковой перегородки, как правило, после достижения ребенком 3-х лет.
При развитии сердечной недостаточности и легочной гипертензии проводится консервативное лечение с помощью сердечных гликозидов, мочегонных препаратов, ингибиторов ангиотензинпревращающего фермента, кардиотрофиков, антиоксидантов.
Кардиохирургическое лечение дефекта межжелудочковой перегородки может быть радикальным и паллиативным. К радикальным операциям относятся ушивание малых дефектов межжелудочковой перегородки П-образными швами; пластика больших дефектов синтетической (тефлон, дакрон и др.) заплатой или биологической (консервированный ксеноперикард, аутоперикард) тканью; рентгенэндоваскулярная окклюзия дефекта межжелудочковой перегородки.
У грудных детей с выраженной гипотрофией, большим лево-правым шунтированием крови и множественными дефектами предпочтение отдается паллиативной операции, направленной на создание искусственного стеноза легочной артерии с помощью манжетки. Данный этап позволяет подготовить ребенка к радикальной операции по устранению дефекта межжелудочковой перегородки в более старшем возрасте.
Течение беременности при дефекте межжелудочковой перегородки
Женщины с небольшим дефектом межжелудочковой перегородки, как правило, в состоянии нормально выносить и родить ребенка. Однако, при больших размерах дефекта, аритмии, сердечной недостаточности или легочной гипертензии риск осложнений во время беременности значительно повышается. Наличие синдрома Эйзенменгера является показанием для искусственного прерывания беременности. У женщин с дефектом межжелудочковой перегородки имеется повышенная вероятность рождения ребенка с аналогичным или другим врожденным пороком сердца.
Перед планированием беременности пациентке с пороком сердца (оперированным или нет) необходимо проконсультироваться с акушером-гинекологом, кардиологом, генетиком. Ведение беременности у категории женщин с дефектом межжелудочковой перегородки требует повышенного внимания.
Прогноз при дефекте межжелудочковой перегородки
Естественное течение дефекта межжелудочковой перегородки в целом не позволяет надеяться на благоприятный прогноз. Продолжительность жизни при данном пороке зависит от величины дефекта и составляет в среднем около 25 лет. При больших и средних дефектах 50-80% детей умирают в возрасте до 6 мес. или 1 года от сердечной недостаточности, застойной пневмонии, бактериального эндокардита, нарушений ритма сердца, тромбоэмболических осложнений.
В редких случаях ДМЖП не оказывает существенного влияния на продолжительность и качество жизни. Спонтанное закрытие дефекта межжелудочковой перегородки наблюдается в 25-40% случаев, преимущественно при его малом размере. Однако даже в этом случае больные должны находиться под наблюдением кардиолога в связи с возможными осложнениями со стороны проводящей системы сердца и высоким риском возникновения инфекционного эндокардита.
Перимембранозный дефект межжелудочковой перегородки у новорожденного
Почему возникает перимембранозный дефект межжелудочковой перегородки?
Среди всех заболеваний сердечно-сосудистой системы врожденные пороки сердца составляют около 25%. Наиболее распространенным является дефект межжелудочковой перегородки. Что же представляет собой данная патология?
Причины развития патологии

ДМЖП – самые частые врожденные пороки сердца
Межжелудочковая перегородка участвует в сокращении и расслаблении сердца. Ее формирование происходит на 4-5 неделе развития плода, но под действием определенных факторов может полностью не затянуться. При рождении ставят диагноз ДМЖП – дефект межжелудочковой перегородки. Это врожденный порок сердца, который может встречаться отдельно или в сочетании с другими патологиями сердца.
Для этого дефекта характерно незакрытое отверстие между желудочками. Дефект может наблюдаться в перимембранозной, мышечной и надгребневой части. Чаще всего отверстие располагается в перимембранозном отделе, т.е. в верхней части межжелудочковой перегородки под аортальным клапаном. Из перимембранозных выделяют 2 разновидности дефекта: субаортальные и субтрикуспидальные.
Дефект может быть разного размера и обычно колеблется от 1 мм до 3 см.
Появление дефекта может быть обусловлено наследственной предрасположенностью, однако такие случаи очень редки. В большинстве случаев патология развивается при закладке органов, когда определенные негативные факторы оказывают тератогенное воздействие на плод.
Основные причины развития ДМЖП у ребенка при рождении:
- Поздняя беременность.
- Ранний токсикоз.
- Употребление запрещенных лекарств.
- Употребление алкогольных напитков.
- Диабет.
- Эндокринные заболевания.
- Перенесенные инфекции.
Воздействие указанных негативных факторов в первом триместре на плод увеличивает риск развития врожденного ДМЖП. Приобретенный дефект наблюдается очень редко на фоне перенесенного инфаркта миокарда.
Признаки дефекта и осложнения

Симптомы зависят от размера дефекта
Первые признаки дефекта могут появляться после рождения или спустя некоторое время. Это зависит не только от размера самого дефекта, но и направления выброса крови.
Если дефект малого размера, то он никак не влияет на развитие малыша. При рождении можно услышать грубый шум во время сердечного сокращения в четвертом или пятом межреберье. Это единственный симптом, который не оказывает влияния на самочувствие ребенка.
При дефектах большого размера в мембранозной части возникает одышка, мраморный рисунок на коже, синюшность кожи. Также появляется систолическая вибрация, хрипы внизу легких, печень увеличивается в размерах. Циркуляция крови по большому кругу кровообращения снижается, на фоне этого ребенок может отставать в развитии.
Симптоматика ДМЖП увеличивается с возрастом:
- Дети 3-4 лет могут жаловаться на тахикардию, боль в груди в области сердца.
- У взрослых на фоне приобретенного ДМЖП появляются признаки сердечной недостаточности: одышка, аритмия, кашель, боль в сердце.
У детей дефекты малых размеров могут закрыться с возрастом. Одним из осложнений ДМЖП является инфекционный эндокардит, т.е. поражение внутренней оболочки и клапанов сердца. Эта патология развивается при травмировании эндокарда.
ДМЖП большого размера представляет большую опасность, если вовремя не начать лечение.
Клинические проявления могут уменьшиться на фоне поражения легочных сосудов. В результате начнет прогрессировать легочная гипертензия, при которой происходит утолщение стенок артерий и артериол. К школьному возрасту легочная гипертензия сопровождается склерозом сосудов легких.
Если не провести своевременно операцию могут наблюдаться такие тяжелые последствия, как:
- Аортальная регургитация.
- Тромбоэмболия.
- Инфундибулярный стеноз.
Эти осложнения могут привести к инвалидности, а в более тяжелых случаях к необратимым последствиям.
Диагностика

УЗИ – эффективная и безопасная диагностика патологий сердца
Обнаружить заболевания сердечно-сосудистой системы можно еще до рождения малыша при ультразвуковом обследовании. Крупные дефекты можно обнаружить во втором и третьем триместре.
После рождения малыша осматривает неонатолог и выслушивает сердце. При шумах в сердце новорожденного отправляют на дальнейшее обследование.
Для уточнения диагноза проводятся следующие диагностические мероприятия:
- УЗИ с допплером. Один из информативных методов исследования сердечной патологии. Благодаря отраженной ультразвуковой волне, можно определить не только размер отверстия, но и его месторасположение. При этом красный цвет отражает поток крови, движущийся к датчику, а синий цвет указывает на противоположное движение крови. На первой стадии давление в желудочках составляет около 30 мм рт. ст., на второй не превышает 70 рт. ст., а на третьей существенно повышается — более 70 рт. ст.
- Рентген грудной клетки. Исследование помогает выявить увеличение границ сердца и легочной артерии, жидкость в легких. При первой стадии ДМЖП сердце увеличено, сосуды на снимке размытые. Далее идет переходная стадия, на которой орган имеет нормальные размеры, а сосуды четко прослеживаются. Третья стадия характеризуется склеротическими изменениями в органе: увеличение легочной артерии и сердца с правой стороны, горизонтальное расположение ребер и опущение диафрагмы.
- Электрокардиография. Данный метод регистрирует энергетические потенциалы во время работы сердца. Они выводятся на бумагу в виде кривой линии. Состояние сердца определяют по высоте зубцов и их форме.
- Катетеризация сердца. Этот способ диагностики позволяет измерить давление, а также определить уровень насыщения кислородом.
- Ангиокардиография. Процедура заключается в введении катетера в оба отдела сердца. Во время исследования можно оценить кровяное давление, получить изображение правого и левого желудочка, взять кровь на исследование.
- При необходимости проводится магнитно-резонансная томография. После комплексного обследования и постановки диагноза назначается лечение.
Медикаментозное лечения

Медикаментозная терапия позволяет уменьшить проявление симптомов дефекта
Дефекты небольшого размера во многих случаях закрываются самостоятельно с возрастом обычно к 1-3 годам. Сердце растет и увеличивается в размерах, а сообщение между желудочками маленькое, поэтому крупные мышечные волокна замещают зону отверстия.
Если дефект не закрывается, при этом не выявляются нарушения циркуляции крови, то проводится динамическое наблюдение и периодическое выполнение ЭхоКГ.
- При этом проводится медикаментозное лечение для нормализации оттока крови и уменьшения отека. Детям назначают мочегонные препараты (Фуросемид). Дозировка составляет на 1 кг веса ребенка 2-5 мг. Принимают 1-2 раза в день.
- Для улучшения работы сердечной мышцы и обмена веществ в организме используют кардиометаболические средства: Кардонат, Фосфаден и др. Из сердечных гликозидов назначают Дигоксин, Строфантин.
- Если наблюдается отек легких и спазм бронхов, то назначают внутривенное введение раствора Эуфиллина.
Обычно врачи оттягивают время и дают шанс самостоятельно закрыться отверстию.
Оперативное вмешательство и прогноз

При большом дефекте показано хирургическое вмешательство, в ходе которого выполняется закрытие отверстия
Способ лечения врач выбирает в каждом случае индивидуально, исходя из степени легочной гипертензии. Существует два способа проведения хирургической операции:
- Эндоваскулярное лечение.
- Открытая реконструктивная операция.
Первый вариант проводится в условиях рентгеноперационной. Закрытие проводится с помощью окклюдера или спиралей. Окклюдер обычно применяется при мышечных дефектах, а спирали при перимембранозных. Устройство расположено в тоненькой трубочке. Оно небольшого размера и находится в сложенном состоянии. В ходе операции не будет разреза в грудной клетки и можно обойтись без аппарата искусственного кровообращения. Прокол выполняется на бедре и окклюдер вводится с помощью катетера по ходу сосудов в полость сердца.
Вся манипуляция выполняется все время под контролем соответствующего оборудования. Устанавливается устройство так, что один диск будет находиться в левом желудочке, а другой – в правом. В результате отверстие полностью закрывается заплаткой. При правильном установлении устройства катетер извлекается. При смещении окклюдера процесс установки повторяется. Продолжительность операции составляет около 2 часов. Через полгода устройство покрывается собственными клетками сердца.
Полезное видео — Дефект межпредсердной перегородки у ребенка:
Такое оперативное вмешательство не проводится при близком расположении клапанов сердца к дефекту, нарушении свертываемости крови, других внутрисердечных патологий.
Открытая операция на сердце проводится с его остановкой и требует подключение аппарата искусственного кровообращения. Реконструктивная операция проводится при ДМЖП в сочетании с другими пороками. Это более травматичный вариант, который требует подготовки и выполняется под общим наркозом. Прогноз после успешно проведенной операции благоприятный. Кровь между желудочками не смешивается, циркуляция и гемодинамика восстанавливается, давление в легочной артерии снижается.
http://diagnozlab.com/analysis/immunolog/perimembranoznyj-defekt-mezhzheludochkovoj-peregorodki.html
Перимембранозный ДМЖП: клиническая картина, причины, диагностика, осложнения

Перимембранозный дефект межжелудочковой перегородки составляет около четверти от всех врожденных пороков сердца и вызывается множеством причин, в числе которых не только наследственный фактор, но и вредные привычки.
Формирующаяся на пятой неделе внутриутробного развития межжелудочковая перегородка необходима для сокращения и расслабления сердечной мышцы.
Если мжп остается открытым, то новорожденному диагностируют дмжп, по международной классификации аномалия имеет код Q21.0.
Впс может встречаться как в изолированном виде, так и в сочетании с другими аномалиями, например, с открытым овальным отверстием.
- генетическая предрасположенность;
- поздняя первая беременность у матери;
- токсикоз;
- алкоголизм матери;
- передозировка лекарственных средств;
- сахарный диабет;
- эндокринные нарушения у беременной;
- инфекционные и вирусные заболевания матери.

Негативные факторы первого триместра развития особенно влияют на формирование аномального строения сердца у ребенка.
Перимембранозный дефект – это не только врожденная аномалия, в некоторых случаях нарушение поражает сердце пожилых людей после инфаркта.
Симптомы аномалии
Тяжесть симптомов зависит от размеров отверстия. Признаки могут проявиться через несколько лет после рождения ребенка, это зависит от направления потока крови и размера дефекта.
Непосредственно после появления новорожденного на свет неонатолог может услышать сильный шум во время систолы в районе четвертого межреберья.
Такого малыша направляют на УЗИ для диагностики и уточнения причин сердечного шума.

Если окно большое, у новорожденного диагностируют такие симптомы:
У больного малыша увеличена печень и прослушиваются хрипы в легких. В дальнейшем ребенок, не получивший лечения, начинает отставать в физическом развитии, так как тяжесть симптомов постепенно нарастает.
Существует риск возникновения легочной гипертензии. Небольшие дефекты могут закрываться со временем.
Осложнения и клинические проявления

Осложнение, характерное для ДМЖП – эндокардит инфекционный, поражающий клапаны и внутреннюю оболочку сердца. Заболевание опасно, если его не начать своевременно лечить.
На фоне компенсаторных процессов клинические проявления уменьшаются, но развивается легочная гипертензия, перерастающая в склероз легочных сосудов.
Это может привести к таким проблемам: тромбоэмболия; стеноз инфундибулярный; регургитация аортальная. Прогноз в этих случаях плохой, вплоть до летального исхода.
Диагностика ДМЖП
Детей с подозрением на дефект межжелудочковой перегородки направляют на УЗИ. Метод ультразвукового исследования эффективен и на стадии внутриутробного развития плода, во втором и третьем триместре.

Новорожденных принимает неонатолог, в его обязанность входит прослушивание сердца ребенка. Для уточнения диагноза малыша могут направить на УЗИ с допплером и на рентген.
Рентгенография необходима для уточнения границ сердца, а также для обследования легочной артерии.
Всем детям делают электрокардиограмму, позволяющую оценить работу сердца по специальной кривой. При подозрении на тяжелый порок сердца ребенка направляют на катетеризацию ангиокардиогарфию.
По показаниям проводят магнитно-резонансную томографию.
Лечение ДМЖП
Небольшие дефекты, до 3 мм, могут зарасти к трем годам жизни малыша, по мере роста и развития организма маленькие отверстия должны закрыться мышечной массой. Вероятность закрытия больших отверстий невелика.
Если кровообращение не нарушено, но отверстие не закрывается, ребенка ставят на учет к кардиологу для постоянного наблюдения, он должен регулярно проходить Эхо и Узи.
Препарат Эуфиллин предназначен для снятия отека легких и бронхоспазма.

Большой порок, нарушающий гемодинамику организма, закрывают хирургическим путем. Обычно это субтрикуспидальный дефект или замещение трехстворчатого клапана мембраной. При этом применяются два метода оперативного лечения:
Эндоваскулярное хирургическое вмешательство проводят в рентгеноперационной, открытый дефект закрывают окклюдером или спиралью.
Окклюдер устанавливают при мышечных пороках, спираль – при мембранозных, подается он в трубочке, при этом грудная клетка не разрезается.
Пациенту прокалывают бедро и катетер вводит окклюдер прямо в сердечную полость. Операция проводится под контролем рентгеновского аппарата на специальном столе.
Операция по реконструкции мжп осуществляется в условиях остановки сердца, ребенок находится на искусственном кровообращении. Отверстие ушивают или закрывают заплатой из перикарда.
Послеоперационный прогноз благоприятен, летальный исход – не более двух процентов от всех прооперированных детей.
Умирают чаще всего пациенты, состояние которых осложнено дополнительными пороками сердца и тяжелой сердечной недостаточностью.
Дети после операции считаются практически здоровыми, однако небольшие шумы в сердце все-таки будут прослушиваться, так как остаточное давление между артерией легкого и правым желудочком не всегда удается убрать.
Техника оперативного вмешательства в условиях аппарата искусственного кровообращения

Операцию проводят новорожденным с массой тела менее четырех килограмм.
Прооперированные дети получают хороший шанс для полного восстановления здоровья.
Во время хирургического вмешательства после установки искусственного кровообращения артериальный проток перевязывают.
В условиях пережатого кровеносного сосуда вводят кадиоплегический раствор, затем венозная канюля удаляется.
Чаще всего перимембранозный дефект устраняют через правое предсердие, некоторые виды порока доступны только через клапан аорты или через саму аорту.
Дефекты межжелудочковой перегородки у плода

В развитии аномалии играет большую роль фактор наследственности, но не только, влиять на формирование сердца плода могут интоксикации, инфекции, вирусные заболевания, неблагоприятная экологическая среда.
Чаще всего порок обнаруживается на УЗИ, проведенном на двадцатой неделе развития.
Если аномалия не совместима с жизнью, матери предлагают прервать вынашивание ребенка.
При легкой степени порока шанс выжить есть у девяноста процентов детей, при условии правильного ведения родов и адекватной терапии.
Лечение пороков межжелудочковой перегородки только оперативное, хирургическое вмешательство проводят в первые три месяца жизни новорожденного, если дефект большого размера.
При окне средней величины и угрожающем нарастании давления кровообращения в малом круге малолетнего пациента оперируют на шестом месяце жизни.
При сравнительно небольшом отверстии с операцией можно подождать и до года.
Послеоперационная реабилитация

Реабилитация после перенесенной операции по реконструкции мжп – длительный процесс, если она была сложной, то определенный образ жизни придется вести постоянно.
Это отказ от вредных привычек, правильное питание, физкультура, режим дня.
Важные нюансы послеоперационной реабилитации:
- Ребенка еще некоторое время будут беспокоить: тахикардия, слабость, одышка.
- Перенёсшему операцию нельзя перенапрягаться, показана только лечебная физкультура и массаж. Детей, прооперированных в старшем возрасте, может беспокоить сердечная недостаточность.
- На протяжении нескольких лет после хирургической операции возможно развитие болезней легких, а также эндокардита бактериального.
- Диастолическое и систолическое давление в артериях нормализуется через несколько лет после реконструкции.
- Половина пациентов после хирургического вмешательства еще некоторое время страдают от аритмий и блокад.
Прооперированные дети в свое время идут в обычный детский сад, а затем в школу.

В это время качество жизни ребенка зависит от регулярного приема выписанных медицинских препаратов, соблюдения диеты, а также от сложности неврологических и физических проблем, с которыми придется столкнуться в течение жизни.
Родители должны проинформировать персонал заведения, где обучается ребенок, о существующих проблемах, что позволяет найти к малышу правильный подход.
- Не стоит изолировать ребенка, в страхе, что болезнь начнет прогрессировать.
- Воспитатели и учителя общаются с малышом каждый день, поэтому они лучшие союзники в социальной жизни ребенка.
- Правильно поданная одноклассникам информация о заболевании подростка спасет его от общественной изоляции.
Детям в период послеоперационной реабилитации и далее, показано санаторное лечение в кардиоревматологических медицинских учреждениях (от 50 до 130 дней), один раз в год.

Очень часто дети проходят лечение в санаториях еще в дооперационный период, что помогает им быстрее восстановиться после хирургического вмешательства.
Противопоказания к санаторному лечению:
- тяжелое нарушение кровообращения;
- сердечная недостаточность четвертой степени;
- подострый бактериальный эндокардит;
- ОРЗ и ОРВИ.
Послеоперационное выхаживание
- При неожиданном скачке температуры, после выписки из стационара, следует немедленно вызвать врача на дом или связаться с кардиохирургом из отделения.
- Температура в первые сутки после операции снижается парацетамолом или нурофеном, врач может назначить антибиотики.
- При постоянной температуре выше 37 градусов Цельсия, ребенку прописывают иммунотерапию.

Противопоказания к прививкам:
- цианотические пороки;
- тяжелая сердечная недостаточность;
- неострый бактериальный эндокардит.
Родители прооперированных детей всегда должны быть на связи с кардиологом, иметь под руками все необходимые контакты и телефоны.
http://vseoserdce.ru/defect/perimembranoznyj-dmzhp.html
Дефект межжелудочковой перегородки у новорождённых

В наше время здоровье ребёнка очень часто зависит от состояния здоровья его родителей, а также от особенностей протекания беременности. Сейчас даже самые благоприятные условия зачатия и вынашивания не могут гарантировать рождение здорового малыша. Здоровье плода напрямую зависит от гормональных особенностей матери, процесса созревания и т. д.
На практике дефект межжелудочковой перегородки, проявляется у 4–7 новорождённых из 1000, но все же является самым частым из пороков сердца у новорождённых.
Что такое ДМЖП у новорождённого и как он возникает?
Нужно понимать что эта врождённая патология развития сердца, заключается в сообщении между правым и левым желудочком Разность давления в желудочках кардинально разная, в левом более мощное, а в правом слабее и тоньше. Аномалия приводит к тому что кровь, перетекает из левой в правую тем самым нарушая межжелудочковый баланс.
Степень тяжести патологии обычно определятся размером дефекта, а также его месторасположением. Единичные и мелкие разрыва редко диагностируются, и исчезают в первые дни после рождения малыша. Это связано с началом активной работы сердца. При наличии более крупных рубцов и разрывов, может наблюдаться постоянный впрыск крови в правый желудочек, уменьшается общий объем крови, а также растягивается и увеличивается в объёме правый желудочек. В результате этого, у малыша начинаются проблемы с дыханием, перебои в работе сердца.
Чаще всего аномалия диагностируется в первую неделю после рождения. При обнаружении ДМЖП новорождённого сразу готовят к оперативному хирургическому вмешательству. Диагноз требует постоянного наблюдения специалистов. Однако ДМЖП не всегда удаётся диагностировать сразу, т. к. патология сразу не проявляется, а также из-за халатности медперсонала может быть диагностирована не сразу. Поэтому молодым маме и папе важно знать симптоматику самого распространённого и опасного порока сердечно сосудистой системы у новорождённых.
Причины возникновения патологии
Дефект межжелудочковой перегородки или дмжп у плода – очень опасная аномалия, возникает у плода со 2 по 10 неделю внутриутробного развития. Первый триместр беременности самый опасный для плода, если в это время беременная мама подвергнется негативному воздействию внешних или внутренних факторов, у плода возникает риск развития заболеваний сердечно сосудистой системы.
К причинам заболевания относят:
-

Наследственность — риск дмжп у плода возрастает во много раз, если среди родственников были люди с болезнями пороками сердца.
- перенесённые мамой во время беременности вирусные инфекции, в числе самых опасных значатся краснуха, герпес, корь и герпес.
- Приём мамой во время беременности антибиотиков разного спектра действия, а также химических лекарственных препаратов, т. к. большинство аптечных лекарственных препаратов имеют ярко выраженные эмбриотоксичные свойств и их бесконтрольное употребление вовремя беременности приводит к развитию патологий сердечно-сосудистой системы у плода. Антибиотики, антиэпилептические средства, а также гормональные препараты считаются самыми опасными для плода.
- Употребление наркотиков, алкоголя и курение во время беременности – доказано, что.употребление беременной женщиной алкоголя в 3 раза увеличивает опасность рождения ребёнка с пороками сердечно-сосудистой системы.
- заболевания соматического характера у беременной – водянка, тиреотоксикоз, сахарный диабет.
Клинические проявления ДМЖП
Напрямую зависит от расположения и размера появление первых симптомов ДМЖП у новорожденного. При маленьких дефектах мембранной части перегородки и сопутствующих тканей, патология обычно протекает бессимптомно. Впервые может проявиться и начать беспокоить во время ускоренного роста ребёнка в 1.5–2 года. Крупные же дефекты чаще диагностируют ещё во время исследований внутриутробного развития плода в роддоме.
Самыми опасными являются большие отверстия, который расположенные в нижней части межжелудочковой перегородки и сопутствующих тканях. Крупные дефекты в первые дни также себя не проявляют клинически, однако, со временем у малыша начали появляются первые признаки дыхательной и сердечной недостаточности.
Сейчас часто здоровье зависит от знания симптоматики и внимательности молодых родителей. Родители должны своевременно заподозрить заболевание, а после обнаружения обязательно обратиться к врачу.
-

Кожные покровы у малыша очень бледные и приобретают голубоватый оттенок при плаче или напряжении, а также у малыша синеют губы и носогубный треугольник. Становятся кисти рук и стопы.
- Утомляется ребёнок очень быстро, плохо ест, отказывается от груди и медленно набирает в весе.
- возникновение одышки, обычно при плаче и движениях;
- Новорожденный спит помногу , мало двигается и начинает отставать в нервно-психическом развитии;
- Новорожденный часто болеет простудой или ОРЗ, а также встречается плохо поддающаяся лечению пневмония.
- Если мама замечает появление подобных признаков у малыша следует провести подробное обследование.
Для диагностики ДМЖП у новорождённых проводят общий осмотр и аускультацию малыша. Далее, проводится ЭКГ, рентгенография грудной клетки, а также УЗИ сердца с допплерометрией. После всех процедур проводят катетеризацию сосудов сердца. На основе этих анализов и процедур ставится диагноз.
Лечение и прогноз при дефекте, ровно как и обнаружение напрямую зависит от расположения и размера дефекта. Мелкие дефекты как уже упоминалось часто закрываются без врачебного вмешательства. Если этого не случилось, врачам следует внимательно наблюдать за состоянием малыша. Если признаки лёгочной гипертензии отсутствуют и не наблюдается симптомов сердечной недостаточности то врачи рекомендуют провести только медикаментозное лечение.
Крупные же дефекты, при которых опционально происходит сброс крови в правый желудочный – это первый признак надобности хирургического вмешательства. Коррекция дефекта проводится путём сшивания отверстия. Также, существует операция пластики отверстия.

Чтобы отток крови из лёгких можно было нормализовать, специалисты прописываю медикаментозное лечение при дефекте межжелудочковой перегородки у новорождённых.
Прописываются мочегонные аптечные препараты: Фуросемид.
Мочегонное уменьшить объем крови в сосудах, тем самым уменьшая давления и отёк лёгких. Детям препарат прописывают для приёма 1 раз в день, до обеда, из расчёта 2–5 мг/кг.
Кардиометаболические препарат: Фосфиден, Кокарбоксилаз, Кардинат
Питание сердечной мышцы улучшается с помощью препаратов, кислородное голодание проходит. Препарат прописывают для приёма 1 раз в день, после еды. Препараты растворять в подслаженой воде. Курс длится обычно от трёх недель до трехмесяцев.
Гликозиды сердечного спектра: Строфинтин, Дигоксан
Сердце малыша имеет более мощные сокращения, что приводит к более эффективному перекачиванию крови по сосудам. Новорождённым назначают раствор 0,05% строфантина расчёта 0,01 мг/кг веса, а дигоксин 0,03 мг/кг.
Снятие лёгочного и бронхиального спазма: Эуфиллин
При отёке лёгких и бронхиальном спазме, или когда трудности с дыхание у малыша, прописывают 2% раствор эуфиллина. Препарат вводят внутривенно в расчёте по 1 мл на год жизни.
Последствия ДМПЖ
Небольшие рубцы не влияют на состояние малыша и не мешаю нормальному развитию, а также полноценной жизни крохи. Дефекты больших размеров деформированными краями возникает риск развития многих заболеваний, в том числе хронических:
Следует помнить про дмжп у плода – очень страшная и серьёзная патология и что прогноз заболевания напрямую зависит от заботы и внимания молодых родителей. Малыш с заболеванием ДМПЖ требует специального ухода, строгого соблюдения особого режима, специализированной диеты, лечебной гимнастики и так далее.
При появлении первых подозрений дефект межжелудочковой перегородки у новорождённого срочно следует обратиться за консультацией к педиатру, потому что высококвалифицированный специалист сможет правильно и своевременно оценить состояние ребёнка. Специалист должен назначить необходимое лечение в зависимости от тяжести заболевания – медикаментозное или оперативное.
Следует отметить грустные факты. Смертность в первый год жизни среди детей, страдающих ДМЖП с большими дефектам, достигает более 50%. Около 27 лет составляет средня продолжительность больных с этой патологией.
Когда состояние малыша позволяет провести оперативное вмешательство, врачи советуют не откладывать процедуру. Хотя специалисты считают что возраст между 1 и 2,5 годами самый походящий. В этот период ребёнок уже окреп и легче перенесёт процедуру, а также малышу будет легче забыть операцию. В таком случае психологическую травму ребёнок не испытает.
Показания для оперативного вмешательства.
Наличие крупного отверстия.
Кровь забрасывается из левого в правый желудочек.
Увеличение или отёк правого желудочка или предсердия.
Противопоказания к оперативному вмешательству.
Необратимые изменения в лёгочных сосудах лёгких.
Сепсис — Внутреннее заражение крови.
Оперативное вмешательство.
Операция проводится в два этапа. Детский хирург с помощью специальной тесьмы или толстой шелковой нити перевязывает несущую кровь от сердца к лёгким артерия, чтобы в лёгкие кровь временно не поступала. Эта процедура является подготовительным этапом перед операцией полного закрытия дефекта.
О


