Острый лейкоз мкб 10 — Здоровье феникса
MKБ 10 или международная классификация всех заболеваний 10 созыва имеет в себе практически все короткие обозначения известных патологий, в том числе и онкологических. Лейкоз коротко по МКБ 10 имеет две точные кодировки:
- С91 — Лимфоидная форма.
- С92 — Миелоидная форма или миелолейкоз.
Но также нужно учитывать и характер заболевания. Для обозначения используют подгруппу, которая пишется после точки.
Содержание статьи:
Лимфолейкоз
| Кодировка | Лимфоидный лейкоз |
| C 91.0 | Острый лимфобластный лейкоз при Т или В клеток предшественников. |
| C 91.1 | Лимфоплазматическая форма, Синдром Рихтера. |
| C 91.2 | Подострый лимфоцитарный (в данной время код не используется) |
| C 91.3 | Пролимфоцитарный В-клеточный |
| C 91.4 | Волосатоклеточный и лейкемический ретикулоэндотелиоз |
| C 91.5 | Т-клеточная лимфома или лейкемия взрослых с параметром HTLV-1-ассоциированная. Варианты: Тлеющий, острый, лимфоматоидный, тлеющий. |
| C 91.6 | Пролимфоцитарный T-клеточный |
| C 91.7 | Хронический из больших зернистых лимфоцитов. |
| C 91.8 | Зрелый B-клеточный (Беркитта) |
| C 91.9 | Неутонченная форма. |
Миелолейкоз
Включает в себя гранулоцитарный и миелогенный.
| Коды | Миелоидный лейкоз |
| C 92.0 | Острый миелобластный лейкоз (ОМЛ) с низким показателем дифференцировки, а также форма с созреванием. (AML1/ETO, AML M0, AML M1, AML M2, AML с t (8 ; 21), AML ( без FAB классификации ) БДУ) |
| С 92.1 | Хроническая форма (ХМЛ) [CML], BCR/ABL-положительный. Филадельфийская хромосома (Ph2) положительная. t (9 : 22) (q34 ;q11). С бластным кризом. Исключения: неклассифицированное миелопролиферативное заболевание; атипичный, BCR / ABL-отрицательный; Хронический миеломоноцитарный лейкоз. |
| C 92.2 | Атипичный хронический, BCR/ABL-отрицательный. |
| С 92.3 | Миелоидная саркома в которой новообразование состоит из незрелыз атипичных мелеоилных клеточек. Также в нее входит гранулоцитарная саркома и хлорома. |
| C 92.4 | Острый промиелоцитарный лейкоз [PML] с параметрами: AML M3 и AML M3 с t (15 ; 17). |
| С 92.5 | Острый миеломоноцитарный с параметрами AML M4 и AML M4 Eo с inv (16) or t(16;16) |
| C 92.6 | С 11q23-аномалией и с вариацией MLL хромосомы. |
| С 92.7 | Другие формы. Исключение — гиперэозинофильный синдром или хронический эозинофильный. |
| C 92.8 | С многолинейной дисплазией. |
| С 92.9 | Неутонченные формы. |
Причины
Напомним, что точной причины из-за чего происходит развитие рака крови не известно. Именно поэтому врачам, так сложно бороться с этим недугом и предотвращать его. Но есть ряд факторов, которые могут увеличивать шанс возникновения онкологии красной жидкости.
- Повышенная радиация
- Экология.
- Плохое питание.
- Ожирение.
- Чрезмерное употребление лекарственных средств.
- Лишний вес.
- Курение, алкоголь.
- Вредная работа, связанная с пестицидами и химическими реагентами, которые могут влиять на кроветворную функцию.
Симптомы и аномалии
- Анемия возникает в результате угнетения эритроцитов из-за чего кислород до здоровых клеток доходит не в полном объеме.
- Сильные и частые головные боли. Начинается с 3 стадии, когда возникает интоксикация из-за злокачественной опухоли. Также может быть результатом запущенной анемии.
- Постоянная простуда и инфекционные и вирусные заболевания с продолжительным периодом. Бывает, когда здоровые лейкоциты заменяются на атипичные. Они не выполняют свою функцию и организм становится менее защищенным.
- Боль в суставах и ломка.
- Слабость, утомляемость, сонливость.
- Систематическая субфебрильная температура без причины.
- Изменение запаха, вкусов.
- Потеря веса и аппетита.
- Долгие кровотечения при снижении количество тромбоцитов в крови.
- Болезненность воспаление лимфатических узлов по всему телу.
Диагностика
Точный диагноз можно поставить, только после проведения тщательного обследования и сдачи определенного перечня анализов. Чаще всего людей ловят на аномальных показателях при биохимическом и общем анализе крови.
Для более точного диагноза делают пункцию костного мозга из тазовой кости. Позже клетки отправляют на биопсию. Также врач-онколог проводит полный осмотри тела: МРТ, УЗИ, КТ, рентген, для выявления метастазов.
Лечение, терапия и прогноз
Основным типом лечения используется химиотерапия, когда в кровь вводят химические яды, которые направлены на уничтожение аномальных клеток крови. Опасность и малоэффективность данного типа лечения в том, что также уничтожаются и здоровые клетки крови, коих и так мало.
При выявлении первичного очага, врач может назначить химию для полного уничтожения костного мозга в данной зоне. После проведения процедуры также могут проводить и облучение для уничтожения остатков раковых клеток. В процессе происходит пересадка стволовых клеток от донора.
 Загрузка…
Загрузка…
Source: OncoVed.ru
Читайте также
симптомы, прогноз жизни, методы лечения, диагностика и клинические рекомендации
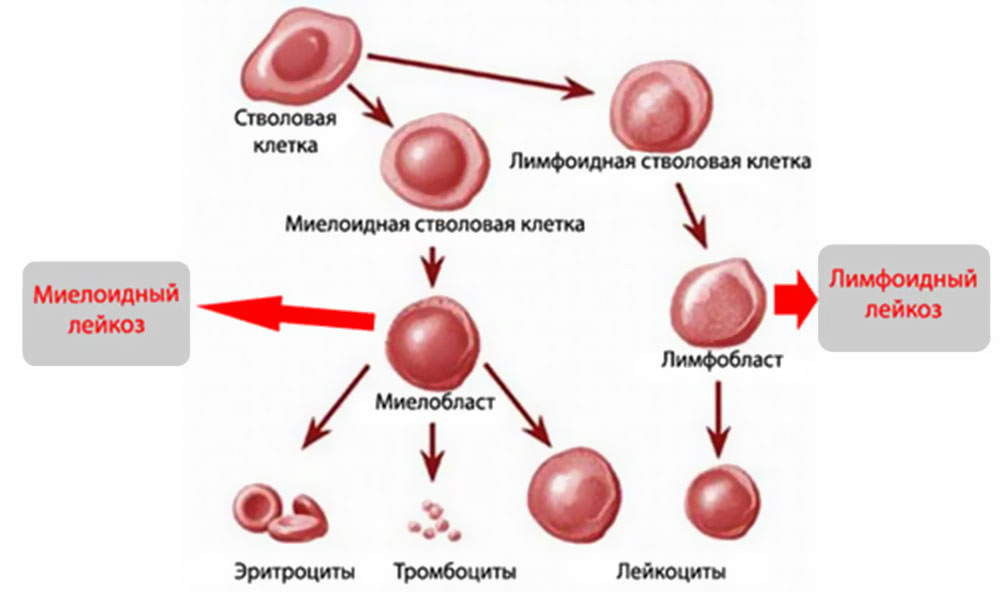
Лейкоз в переводе с греческого означает «белый». Отсюда произошло название «белокровие». Лейкемия представляет широкое понятие и делится на типы. Носит хронический и острый характер. Хроническое заболевание развивается дольше 10 лет. Отличается вялым течением и длительным отсутствием симптомов.
Острый лейкоз – это заболевание кроветворной системы, при котором происходят нарушения в работе костного мозга человека. Лейкоциты заменяются незрелыми клетками. Нарушается формула крови. Поражаются ткани и органы всего организма. От хронического течения отличается скоростью прогрессирования патологии и по морфологическим признакам. Болезнь наиболее распространенная среди онкогематологических процессов.
Острая форма заболевания делится на 2 основные формы:
- Острый миелобластный лейкоз. Код по МКБ-10 – С92. Диагностируется у взрослых. Представлен миелоцитами.
- Лимфобластный рак крови. Код по МКБ-10 – С91. Выявляется у детей. Представлен предшественниками лимфоцитов.
Для острого течения болезни характерны следующие виды рака крови:
- Монобластный лейкоз развивается из недоразвитых моноцитов.
- Мегакариобластный рак возникает, когда незрелый тромбоцит начинает делиться.
- Миеломонобластный злокачественный процесс формируют предшественники гранулоцитов и моноцитов.
- Недифференцированный рак развивается на основе стволовой клетки, продуцирующей предшественников, не поддающихся дифференцировке.
- Промиелоцитарный лейкоз является разновидностью миелобластной патологии. Возникает из молодых гранулоцитов. Промиелоцитная клетка отличается крупным размером и содержанием в ядре хроматина.
- Плазмобластный вид рака может быть первичный, при этом пациент не имел проблем со здоровьем до начала болезни, и вторичным, когда патология развивается на фоне миеломной болезни.
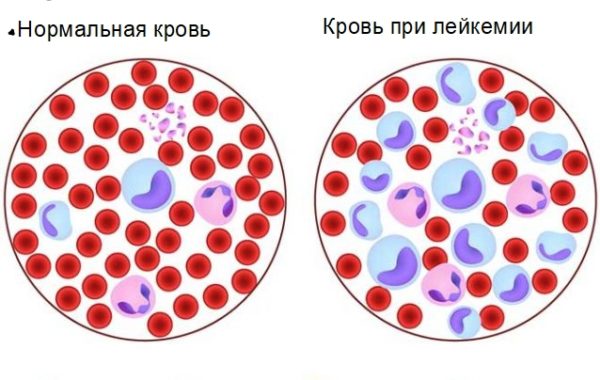

Этиология заболевания
Острый процесс развивается на фоне возникновения опухолевого клона, получившегося из-за сложных мутаций в костном мозге. Нормальная клетка не дозревает и выпускается в кровоток неполноценной. Начинается деление и распространение бластов, которые поражают костный мозг и другие органы человека. Происходит лейкемическая инфильтрация.
Точные причины, почему происходит мутация, неизвестны. Гематологи отмечают взаимосвязь вспышки заболевания с определёнными факторами:
- Основная предполагаемая причина развития рака крови – результат генетических мутаций в эмбриональном периоде. Дети с врождёнными синдромами наиболее подвержены развитию острого лейкоза.
- Наследственная предрасположенность провоцирует онкологический процесс у человека, чьи кровные родственники страдали от лейкемии.
- Радиационное облучение может поражать кроветворные органы, нарушать их функции и изменять вид кровяных телец.
- Профессиональные издержки, при которых человек вынужден контактировать с тяжёлыми химическими элементами.
- Лечение других онкологических болезней химиопрепаратами и ионизирующим излучением вызывает данное заболевание.
- Лейкоз может возникать на фоне тяжёлых вирусных патологий, которые угнетают иммунитет.


Поражённые раком лейкоциты под микроскопом
Классификация болезни
Онкологические процессы крови классифицируют по FAB:
- Острые лимфобластные патологии в любом возрасте имеют формы:
- Пре-В;
- В;
- Пре-Т;
- Т;
- Ни Т, ни В.
- Острый миелоидный лейкоз характеризуется следующими видами:
- Миелобластный рак вызван предшественниками гранулоцитов;
- При миеломонобластной патологии основные злокачественные клетки – монобласты;
- При лейкозе мегакариобластном отмечаются недифференцированные предшественники тромбоцитов;
- Эритробластный вид представлен делением незрелых эритроцитов.
- Острая недифференцированная лейкемия.
При острых лейкозах патология развивается в течение 3-х стадий:
- Этап зарождения болезни, когда клетка подвергается первой мутации. Показатели крови изменяются. Возникают первые симптомы.
- На развернутой стадии симптомы ярко выражены. Происходит метастазирование в органы и лимфатическую систему. При лечении возможна неполная или стойкая ремиссия, после которой может возникнуть рецидив или полное выздоровление.
- При терминальной стадии максимально поражается кроветворная система. Мутационный процесс необратим.
Отличия хронической формы лейкоза от острой заключаются в том, что лейкоциты дозревают, но лишаются способности защищать организм от внешних воздействий. Поэтому анализ крови может долго содержать сформировавшиеся клетки. Хронический рак развивается от 4-х до 12-ти лет.
Острый процесс никогда не сможет перейти в хронический и наоборот.
Клиническая картина
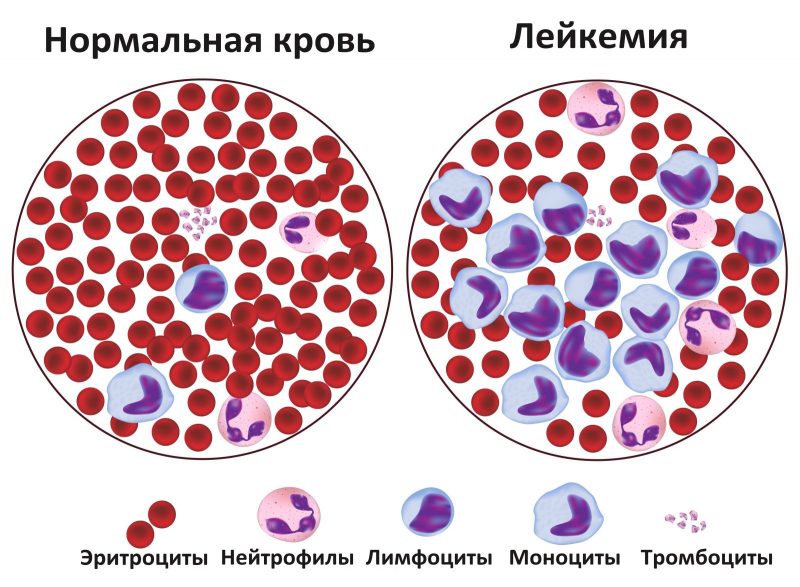
Симптомы острого лейкоза взрослых и детей схожи между собой. На начальной стадии больной отмечает признаки простуды. Затем развиваются воспалительные процессы в ротовой полости (стоматит, гингивит), не поддающиеся лечению. При этой болезни возникают недомогание, утомляемость, боль в костях и суставах, обильное потоотделение, повышение температуры тела, тошнота, рвота с кровью. Больной отказывается от еды, быстро теряет вес. Кожные покровы приобретают серый бледный цвет. Обнаружить процесс может гемограмма, выполняемая для диагностики другого заболевания.
Нарушается процесс создания эритроцитов, развивается анемия. Больной жалуется на кровоточивость слизистых оболочек. Кожные покровы бледнеют, отмечается учащённое сердцебиение, больному тяжело двигаться из-за слабости в теле и головокружения, начинают выпадать волосы. Ухудшается состояние зубов и ногтей. Организм поражают грибки и бактерии.
Клиника заболевания развивается стремительно:
- Тело больного покрывается синяками и кровоподтеками. Часто возникают носовые и желудочные кровотечения. Воспаляются лимфатические узлы и миндалины. Происходит метастазирование в органы и позвоночник. Кожа покрывается инфильтратами. Лёгкие, сердце и почки перестают нормально функционировать.
- Поражается головной мозг. Развиваются эпилептические припадки, помутнение рассудка, нарушение зрения и речи. Продолжительность жизни резко сокращается.
Способы диагностики
К определению проблемы врачи подходят с особым вниманием. Разновидности лейкоза требуют индивидуального лечения. Диагноз ставится на основе результатов лабораторных анализов и инструментальных диагностик.


Важна диагностика периферической крови и ликвора:
- При остром лейкозе результат анализа крови покажет сильное снижение гемоглобина, тромбоцитов, повышенный показатель СОЭ. Лейкоцитарный индекс значительно изменен. Обнаруживаются бласты.
- Исследование костного мозга, миелограмма обнаруживает увеличенное количество бластов, лимфоцитов и полное или частичное отсутствие гигантских клеток – мегакариоцитов.
Для диагностики острого лейкоза смешанного фенотипа используют 4-цветную проточную цитометрию.
Метастазы обнаруживают с помощью ультразвуковой диагностики, магнитно-резонансной и компьютерной томографии, эхокардиографии и рентгенографии.
Проводят диагностику и исключение заболеваний, подавляющих иммунитет человека. ВИЧ, цитомегаловирус, инфекционный мононуклеоз и лейкемоидные реакции при инфекционных заболеваниях имеют одинаковую симптоматику с острым лейкозом.
Лечебная тактика
Лечение проводят в стерильных условиях стационара, потому что пациент особо подвержен бактериям и инфекциям. Необходима обработка ротовой полости, половых органов и пролежней для предотвращения присоединения патогенной микрофлоры.
Клинические рекомендации основываются на соблюдении высококалорийной богатой витаминами диете. Пища не должна вызывать брожения. Исключаются жирные сорта мяса, копчёная и жареная пища. Строго запрещено употребление спиртосодержащих напитков. Разрешено есть растительную пищу после термической обработки, варёную рыбу и птицу, каши и травяные чаи.
Основное лечение заключается в проведении комплексной химиотерапии, продолжительность которой занимает до 6-ти недель. После достижения ремиссии курс приёма препаратов продолжается в домашних условиях. Следующие 3 года пациент принимает противорецидивные лекарства.
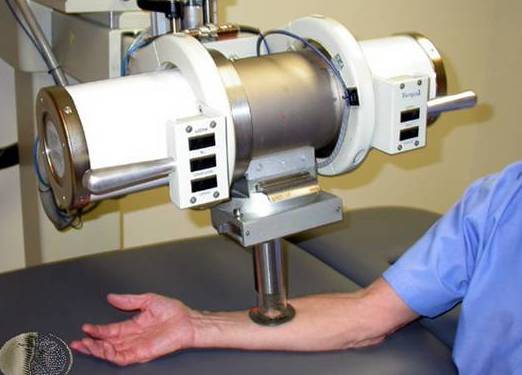

Облучение раковой опухоли на руке
При вторичных новообразованиях применяют лучевую терапию. Метод уничтожает аномальные клетки и устраняет болевые ощущения в теле больного.
Действия врачей направлены на достижение ремиссии, закрепление результата и поддержание эффекта.
Масштабное развитие атипичных клеток и полное поражение костного мозга требует трансплантации донорского материала. Метод проводят путём интенсивной химиотерапии, направленной на уничтожение собственного кроветворного органа. В этот период человек лишается иммунитета и организм не в силах бороться с простейшими инфекциями. Поэтому пациента содержат в специализированном стерильном блоке, доступ в который имеет только медперсонал. Помещение обрабатывается дезинфицирующими средствами. Малейший контакт с внешним миром может стать причиной скоропостижной смерти.
Забор донорского материала проводят из кости бедра или ребра. Введение новых клеток происходит как при переливании крови. Катетер вводят в артерию.
Донорами могут стать близкие родственники или посторонние люди, однако подходящий биоматериал тяжело найти. Для этой роли лучше всего подходят однояйцевые близнецы.
Процент выживших после проведения трансплантации – 50%. Организм остальных пациентов не принимает чужой материал, и развиваются осложнения.
Прогнозы на жизнь
Лейкоз даёт непредвиденные осложнения. Жизненно важные органы могут включиться в раковый процесс в любой момент. Постоянное наблюдение врачей и нахождение в стационаре в период лечения способствуют предотвращению опасных ситуаций.
После трансплантации костного мозга и его приживления формируется новый иммунитет и здоровые клетки крови. Человек возвращается к нормальной жизни. После подготовительного этапа, на котором были уничтожены раковые клетки, риск возникновения вторичного заболевания сводится к нулю. Пациент наблюдается у онкогематолога следующие 5 лет. Если за это время не возникает жалоб и симптомов, человек считается здоровым.
Прогноз на жизнь при остром лейкозе положительный при вовремя начатом лечении. Терапевтические действия оказывают положительное влияние в 80% случаев. 20% пациентов полностью выздоравливают.
Острый лимфобластный лейкоз у детей (первичный) > Клинические протоколы МЗ РК
Примечание*: при назначении глюкокортикоидов рацион обогащают продуктами, содержащими много солей калия и кальция. При агранулоцитозе абактериальная (термически обработанная) пища.
2 Примечание*: пациенты с В-зрелоклеточным вариантом ОЛЛ получают терапию по протоколу Неходжкинской лимфомы (В-зрелоклеточная лимфома)
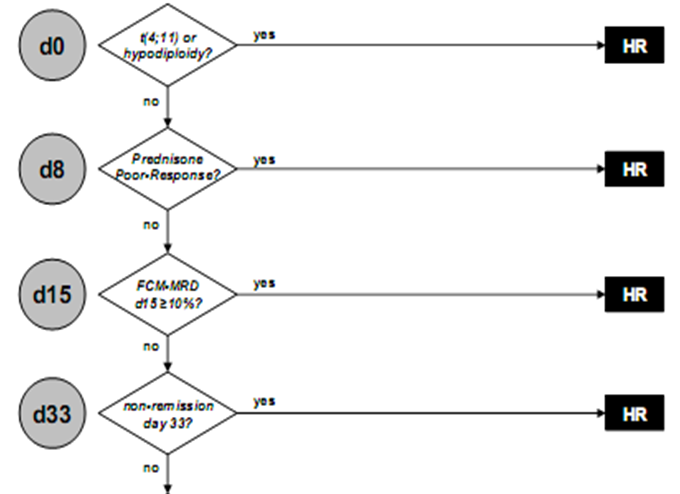
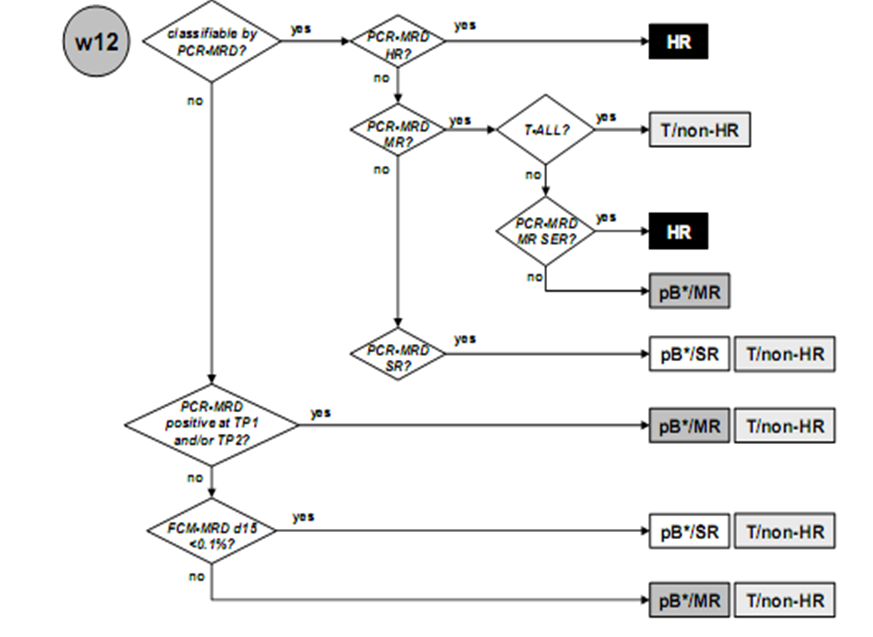
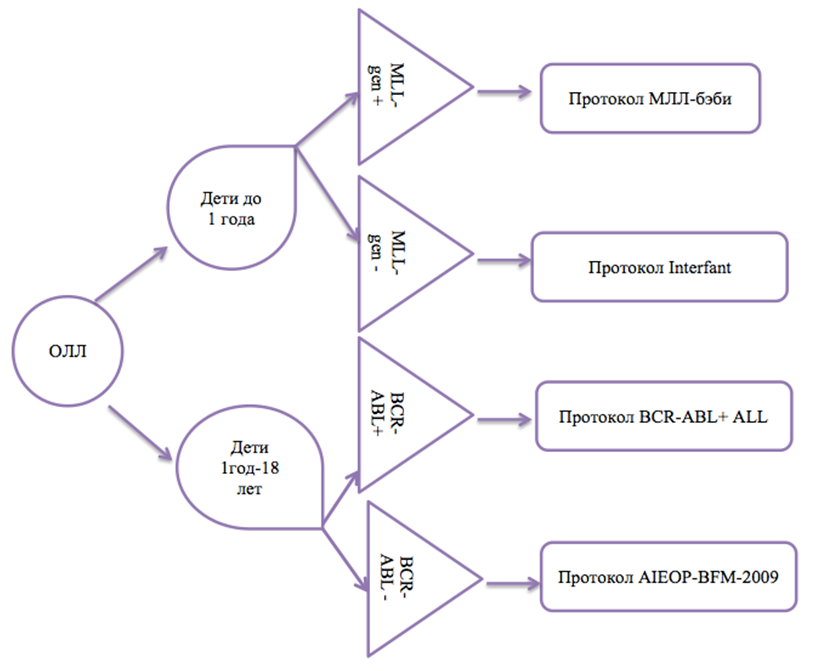
Рандомизация детей по общим протоколам в зависимости от возраста и наличия специфических мутаций.
Острый лимфобластный лейкоз у детей раннего возраста характеризуется большой экстрамедуллярной массой опухоли, гиперлейкоцитозом, нередко инициальным поражением ЦНС, преобладанием очень раннего В-линейного фенотипа (CD10–), коэкспрессией миелоидных маркеров (CD15, CD65, CD33, CD13 и ряда других), наличием характерных аномалий длинного плеча хромосомы 11 и/или реарранжировок с участием Mixed Lineage Leukemia (MLL) гена и одного из его многочисленных партнерских генов. Течение заболевания агрессивное, с высокой частотой развития очень ранних и ранних, преимущественно изолированных костномозговых рецидивов, что очень часто приводит к безнадежным исходам. Чем младше ребенок, тем хуже прогноз.
Для детей до 1 года используются 2 возможные схемы терапии: Interfant и MLL-Baby-2006. В основе протокола Interfant лежат исследования о возможной гибридной природе ОЛЛ у младенцев, а, следовательно, более высокая чувствительность MLL(+) лейкемических клеток к цитозина арабинозиду (ARA-C). Включение транс-ретиноевой кислоты (ATRA) в протокол MLL-Baby обусловлено тем, что ATRA обладает способностью снимать блок дифференцировки и вызывать истощающее созревание клеток.
По схеме протокола MLL—Baby получают лечение [10]:
· пациенты в возрасте от 0 до 365 дней с впервые установленным диагнозом острого лимфобластного лейкоза с наличием аномалии региона 11q23 и/или ее молекулярного эквивалента (MLL-реанжировки), в том числе пациенты с синдромом Дауна;
Стратификация по группам риска: в рамках MLL-Baby выделяются 2 группы риска:
· Группа высокого риска (HRG):
— все пациенты с t(4;11) (q21;23) и/или аббер6атным клоном MLL/AF-4;
— все пациенты не достигшие клинико-гематологической ремиссии к 36 дню терапии;
— отсутствие молекулярной ремиссии не явлется основанием для перевода в группу высокого риска.
· Группа промежуточного риска (MRG):
— все пациенты, включая болных с любыми 11q23 аномалияи и MLL-перестройками, кроме t(4;11)(q21;23) или MLL/AF-4, достигшие клинико-гематологической ремиссии к 36 или 43 (при наличии гипорегенераторной картины в КМ на 36 день) дню.
Расчет доз химиопрепаратов и дексаметазона проводитьсяс коррекцией в соответствии с возрастом пациента на момент проведения каждого этапа лечения. Перед каждым этапом проводится перерасчет площади поверхности тела.
· за основу берется терапевтическая доза на 1 м2 поверхности тела;
· в зависимости от возраста пациента вводимая доза рассчитывается по схеме:
— дети <6 месяцев – 2/3 от расчетной дозы;
— дети ≥6 месяцев и <12 месяцев – ¾ от расчетной дозы;
— дети ≥12 месяцев – полная терапевтическая доза.
Интратекальное введение препаратов:
Для эндолюмбального введения используются три препарата одновременно (триплеты): метотрексат+цитозина арабинозид+преднизолон (MTX+ARA-C+Pred i.th.). Дозирование препаратов вводимых интратекально зависит только от возраста ребенка и не зависит от площади поверхности тела (Таблица 4).
Дозы препаратов, вводимых эндолюмбально, в зависимости от возраста пациента.
| Препарат | < 1 года | ≥ 1 года |
| метотрексат | 6мг | 8мг |
| цитозина арабинозид | 20мг | 30мг |
| преднизолон | 6мг | 8мг |
После люмбальной пункции пациента размещают в функциональной кровати с опущенным головным концом.
Индукционная терапия
Рандомизация по группам риска для протокола индукционной терапии не предусмотрена.
Индукционная терапия по протоколу MLL-Baby-2006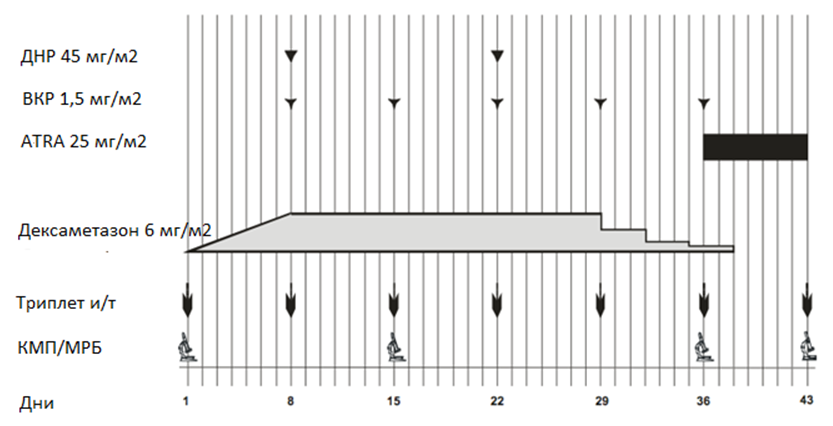
Циторедуктивная профаза начинается с дексаметазона. Терапевтическая доза составляет 6 мг/м2, назначается в 2-3 приема внутрь или внутривенно в дни 1-7 с кореркцией дозы по возрасту. К началу циторедуктивной фазы обеспечивается надежный венозный доступ и начата инфузионная сопроводительная терапия: 0,9% раствор натрия хлорида и 5% декстроза в соотношении 1:2 в объеме 3000 мл/м2. Контроль диуреза (взвешивание подгузников) с подсчетом гидробаланса каждые 6 часов и измерением рН мочи.
С целью профилактики синдрома острого лизиса опухоли доза дексаметазона может меняться. Чем выше инициальный лейкоцитоз, тем ниже доза дексаметазона.
Стартовая доза дексаметазона в зависимости от уровня инициального лейкоцитоза
| Инициальный лейкоцитоз | Доза дексаметазона |
| 50-100´109/л | 1,5 мг/м2 |
| 100-250´109/л | 1 мг/м2 |
| >250´109/л | 0,5 мг/м2 |
Полная терапевтическая доза должна быть достигнута не позднее 5 дня циторедуктивной профазы. Суммарная доза к 7 дню должна составить не менеее 21 мг/м2 (оптимально 42 мг/м2) с коррекцией по возрасту пациента. В случае продолжающегося роста лейкоцитов на 3-4 сутки допускается дополнительное введение циклофосфамида в дозе 100-120мг/м2 в пересчете по возрасту пациента + МЕСНА.
Во время циторедуктивной фазы проводится ежедневная оценка клинической динамики и лабораторных показателей:
— сокращение размеров экстрамедуллярной опухоли в сантиметрах;
— редукция опухоли по картине периферической крови: уровень лейкоцитов, % бластов;
— каждые 13 часов проводится мониторинг основных биохимических показателей: общий белок, альбумин, мочевая кислота, креатинин, мочевина, электролиты крови – К+, Na+, Ca++, Ph++, Mg++.
Продолжение индукционной терапии.
После циторедуктивной профазы индукционная терапия продолжается дексаметазоном из расчета 6мг/м2 в 2-3 приема внутрь по возрасту до 28 дня протокола включительно, затем с 29 начинается постепенное снижение дозы по схеме: 29-31 дни – 3 мг/м2, 32-34 дни – 1,5 мг/м2, 35-37 дни – 0,75 мг/м2, затем полная отмена.
· винкристин (VCR) вводится в/в струйно из расчета 1,5мг/м2 на 8, 15, 22, 29 и 36 дни протокола. При развитии тяжелой винкристиновой нейротоксичности или при развитии синдрома неадекватной секреции антидиуретического гормона (АДГ) последнее введение винкристина отменить;
· даунорубомицин (DNR) 45мг/м2 вводится в/в капельно за 6 часов в 8 и 22 дни протокола. Перед каждым введением даунорубомицина проводится контроль ЭКГ и ЭхоКГ. Если сердечная функция нарушена, то есть фракция выброса (FS) левого желудочка менее 27%, то введение даунорубомицина следует отложить. При фракции 27-30% или выше вводится полная доза препарата;
· Третиноин 25мг/м2 внутрь назначается ежедневно с 36 по 43 дни терапии в 1 или 2 приема во время кормления грудным молоком/адаптированной смесью. К этому времени уже должно произойти снижение уровня лейкоцитов, если лейкоциты выше 10´109/л от назначения третиноина на этом этапе следует воздержаться.
При невозможности проглотить капсулу – лекарственное вещество извлекается из капсулы, содержимое которой вводится per os (стерильной иглой).
Алгоритм ведения больных на терапии третиноина приведен в Приложении 1 данного КП.
Проведение люмбальных пункций с введением триплета: МТХ+ARA-C+Pred осуществляется всем больным в еженедельном режиме до 43 дня терапии включительно: в 1, 8, 15, 22, 29, 36 и 43 дни. У детей с отсутствием полной санации ликвора после 43 дня еженедельные интратекальные введения продолжаются до нормализации клеточного состава спинномозговой жидкости. При наличии инициальной нейролейкемии с высоким цитозом ликвора ≥ 1×105 /мл, спинно-мозговая жидкость направляется на исследование МРБ и выполняется количественная ПЦР на установленную у данного пациента MLL-реарранжировку.
Периферическая кровь в обязательном порядке исследуется в 1, 8, 15, 36 и 43 дни терапии. Образцы крови направляются на исследование МРБ.
Костномозговые пункции проводятся в 1, 15, 36 и 43 дни терапии. Аспирационный материал направляется на исследование МРБ.
Терапия консолидации промежуточного риска (MRG)
Рандомизация в рамках консолидации также не предусмотрена.
Пересчет площади поверхности тела и доз препаратов проводится перед началом каждого курса консолидации и перед каждым реиндукционным курсом, все дозы химиопрепаратов и дексаметазона корректируются по возрасту.
Консолидация состоит из трех курсов I, II и III. Каждый курс представляет собой 6-ти недельную терапию меркаптопурином, метотрексатом и аспарагиназой, с последующей 2-х недельной реиндукцией Дексаметазон+Винкристин+ATRA и интратекальным введением 3-х препаратов в первый день каждой реиндукции. Во время консолидации I предусмотрено 3 введения даунорубомицина, во время консолидации II предусмотрено 2 введения даунорубомицина, во время консолидации III даунорубомицин не вводится.
Терапия консолидации I
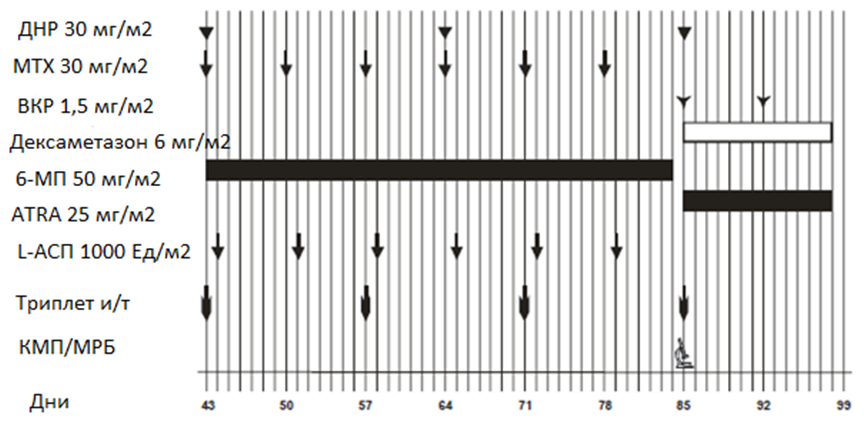
Начало консолидации возможно только при соблюдении следующих условий:
· полная клинико-гематологическая ремиссия;
· удовлетворительное общее состояние пациента;
· отсутствие тяжелой инфекции;
· лейкоциты более 2,5×109/л;
· гранулоциты более 750 /мкл;
· тромбоциты более 70×109/л;
· уровень общего билирубина менее 40 мкмоль/л: L-аспарагиназа и 6-меркаптопурин при уровне общего билирубина 40 мкмоль/л и выше не вводится.
Терапия консолидации II
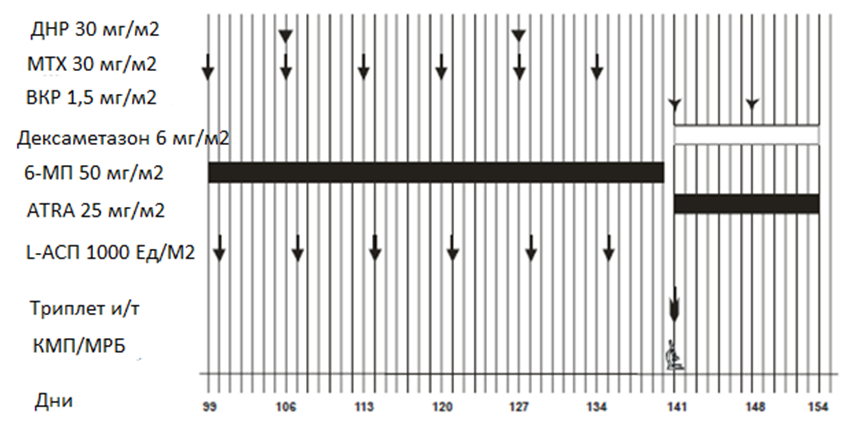
Терапия консолидации III
Острый миелоидный лейкоз — Википедия
Острый миелоидный лейкоз (также ОМЛ, острый нелимфобластный лейкоз, острый миелогенный лейкоз) — это злокачественная опухоль миелоидного ростка крови, при которой быстро размножаются изменённые белые кровяные клетки. Накапливаясь в костном мозге, они подавляют рост нормальных клеток крови, что приводит к снижению количества эритроцитов, тромбоцитов, и нормальных лейкоцитов. Болезнь проявляется быстрой утомляемостью, одышкой, частыми мелкими повреждениями кожи, повышенной кровоточивостью, частыми инфекционными поражениями. До сих пор явная причина заболевания неизвестна, однако некоторые факторы риска его возникновения выявлены. ОМЛ является острым заболеванием, развивается быстро и без лечения приводит к смерти больного за несколько месяцев, иногда — недель.
Это самый распространённый вид острого лейкоза у взрослых, заболеваемость им с возрастом увеличивается. Хотя острый миелоидный лейкоз заболевание относительно редкое — на его долю приходится лишь 1,2 % смертельных случаев злокачественных опухолей в США[3], — ожидается его учащение вместе с постарением населения.
Встречаются несколько разновидностей ОМЛ, лечение и прогноз для них оказывается разным. Уровень выживаемости на протяжении пяти лет колеблется между 15 и 70 %, а частота ремиссии — от 78 до 33 % в зависимости от подвида заболевания. В начале ОМЛ лечат химиопрепаратами для того, чтобы добиться ремиссии; затем может проводиться поддерживающее химиолечение, или проводится пересадка кроветворных стволовых клеток. Последние исследования на генетическом уровне позволили разработать тесты, с помощью которых можно довольно точно определить вероятность выживания больного и эффективность того или иного лекарства для индивидуального случая ОМЛ.[источник не указан 796 дней]
Самые часто используемые схемы классификации ОМЛ — это давняя франко-американо-британская (ФАБ) система и более современная система Всемирной организации здравоохранения (ВОЗ).
Классификация острого миелоидного лейкоза по системе Всемирной системы здравоохранения[править | править код]
Система классификации острого миелоидного лейкоза ВОЗ разработана с учётом системы ФАБ и имеет целью более эффективное клиническое применение и учитывает наиболее прогностически значимые признаки заболевания. Каждый из видов (категорий) ОМЛ по классификации ВОЗ включает в себя несколько подвидов (подкатегорий) описательного характера, представляющих интерес для гематологов и онкологов; однако, бо́льшая часть клинически важной информации в классификации ВОЗ взаимосвязана через распределение по перечисленным ниже подвидам.
Подвиды острого миелоидного лейкоза по классификации ВОЗ:[4]
| Название подвида | Описание | МКБ-О |
|---|---|---|
| ОМЛ с характерными генетическими изменениями | Включает: | Несколько |
| ОМЛ с изменениями, связанными с миелодисплазией | Этот подвид включает больных с предшествующим миелодиспластическим синдромом (МДС) или миелопролиферативной болезнью (МПБ) или с характерными для него цитогенетическими изменениями. Этот подвид ОМЛ чаще встречается у пожилых людей и отличается неблагоприятным прогнозом. Включает в себя ОМЛ со следующими изменениями:
| M9895/3 |
| ОМЛ и МДС, связанные с предыдущим лечением | Этот подвид ОМЛ включает больных, получавших химиотерапию и/или лучевое лечение, после которых возник ОМЛ или МДС. При этих лейкозах могут быть характерные изменения в хромосомах, прогноз при них часто бывает хуже. | M9920/3 |
| Миелоидная саркома | Этот подвид включает больных с миелоидной саркомой | |
| Миелопролиферативные заболевания, связанные с Синдромом Дауна | Этот подвид включает больных как с кратковременными (преходящими) миелопролиферативными состояниями на фоне синдрома Дауна, так и с ОМЛ на фоне синдрома Дауна | |
| Бластная плазмацитоидная дендритноклеточная опухоль | Этот подвид включает больных с бластными дендритноклеточными опухолями | |
| ОМЛ, не подпадающие под признаки перечисленных подвидов | Включает подвиды ОМЛ, не входящие в перечисленные выше, в том числе: | M9861/3 |
Бывают такие подвиды острого лейкоза, при которых изменённые лейкоциты невозможно определить как лимфоциты или гранулоциты, или когда присутствуют злокачественно изменённые клетки обоих ростков. Такие лейкозы иногда называют бифенотипными острыми лейкозами.
Франко-американско-британская классификация[править | править код]
Франко-американско-британская классификационная (ФАБ) система разделяет ОМЛ на 9 подвидов, от М0 по M8, основываясь на типах клеток — предшественниц лейкоцитов, и на степени зрелости изменённых клеток. Определение злокачественных клеток проводят на основании внешних признаков при световой микроскопии и/или цитогенетически, выявляя лежащие в основе отклонений изменения в хромосомах. У разных подвидов ОМЛ разные прогноз и ответ на лечение. Несмотря на преимущества классификации ВОЗ, система ФАБ до сих пор широко применяется. По ФАБ существует девять подтипов ОМЛ.
Необычные фенотипы острого миелоидного лейкоза[править | править код]
Морфологические подтипы ОМЛ включают многие исключительно редкие подтипы не включённые в классификацию ФАБ. Все они, за исключением острого миелоидного дендритноклеточного лейкоза включены в классификацию ВОЗ. В списке ниже перечислены эти подтипы.
 Инфильтрированная лейкоцитами печень при миелолейкозе
Инфильтрированная лейкоцитами печень при миелолейкозеБо́льшая часть симптомов ОМЛ вызывается замещением нормальных клеток крови лейкозными клетками. Недостаточное образование лейкоцитов обусловливает высокую восприимчивость больного к инфекциям — несмотря на то, что лейкемические клетки происходят от предшественников лейкоцитов, способность противостоять инфектам у них отсутствует.[5] Снижение количества красных кровяных телец (анемия) может вызывать усталость, бледность, и одышку. Недостаток тромбоцитов может привести к легкой повреждаемости кожи и повышенной кровоточивости.
Ранние признаки ОМЛ часто неопределённы и неспецифичны, и могут походить на признаки гриппа или других распространённых болезней. Вот некоторые общие симптомы ОМЛ: лихорадка, усталость, потеря веса или снижение аппетита, одышка, анемия, повышенная повреждаемость кожи и слизистых оболочек и кровоточивость, петехии (плоские, размером с булавочную головку пятнышки внутри кожи на месте кровоизлияний), гематомы, боль в костях и суставах, и стойкие или частые инфекции.[5]
При ОМЛ может быть увеличение селезёнки но обычно оно незначительно и бессимптомно. Увеличение лимфоузлов при ОМЛ случается нечасто, в отличие от острого лимфобластного лейкоза. В 10 % случаев развиваются изменения кожи в виде кожного лейкоза. Изредка при ОМЛ возникает Синдром Свита, он же паранеопластический синдром — воспаление кожи вокруг поражённых хлоромой участков.[5]
У некоторых больных ОМЛ появляется припухлость дёсен из-за инфильтрации тканей лейкозными клетками. Изредка первым признаком лейкоза оказывается хлорома — плотная лейкемическая масса за пределами костного мозга. Иногда заболевание протекает бессимптомно, и лейкоз выявляется общим анализом крови в ходе профилактического осмотра.[6]
Был выявлен ряд факторов, способствующих возникновению ОМЛ — иные расстройства системы кроветворения, воздействие вредных веществ, ионизирующее излучение, и генетическое влияние.
Пре-лейкоз[править | править код]
«Пре-лейкозные нарушения кроветворения, такие, как миелодиспластический синдром или миелопролиферативный синдром могут привести к ОМЛ; вероятность заболевания зависит от формы миелодиспластического или миелопролиферативного синдрома.[7]
Воздействие химических веществ[править | править код]
Противоопухолевое химиотерапевтическое воздействие, особенно алкилирующими веществами, может увеличивать вероятность возникновения ОМЛ в последующем. Наивысшая вероятность заболевания приходится на 3—5 лет после химиотерапии.[8] Другие химиотерапевтические препараты особенно эпиподофилотоксины и антрациклины, также связываются с постхимиотерапевтическими лейкозами. лейкозы такого вида часто объясняют специфическими изменениями в хромосомах лейкозных клеток.[9]
Воздействие бензола и других ароматических органических растворителей, связанное с профессиональной деятельностью, в качестве возможной причины ОМЛ остаётся спорным. Бензол и многие его производные проявляют канцерогенные свойства in vitro. Данные некоторых наблюдений подтверждают возможность влияния профессиональных контактов с этими веществами на вероятность развития ОМЛ, однако другие исследования подтверждают, что если и существует такая опасность, то она является лишь добавочным фактором.[10][11]
Ионизирующее излучение[править | править код]
Воздействие ионизирующего излучения повышает вероятность заболеваня ОМЛ. У переживших атомную бомбардировку Хиросимы и Нагасаки заболеваемость ОМЛ повышена,[12] так же как у рентгенологов, получивших высокие дозы рентгеновского излучения в то время, когда меры радиологической защиты были недостаточными.[13]
Генетические факторы[править | править код]
Вероятно, существует наследственно повышенная вероятность заболевания ОМЛ. Есть большое количество сообщений о множестве семейных случаев ОМЛ, когда заболеваемость превышала среднестатистическую.[14][15][16][17] Вероятность возникновения ОМЛ у ближайших родственников больного втрое выше.[18]
Ряд врождённых состояний может повышать вероятность ОМЛ. Чаще всего это синдром Дауна, при котором вероятность ОМЛ повышена в 10 — 18 раз.[19]
Изменения соотношения клеточных элементов в общем анализе крови — первое, что наводит на мысль о возможности ОМЛ. Наиболее частым оказывается лейкоцитоз- повышение общего количества лейкоцитов, иногда с появлением бластных (незрелых) форм, но бывает так, что ОМЛ проявляется изолированным снижением тромбоцитов, эритроцитов, а количество лейкоцитов может оказаться даже сниженным (лейкопения).[20] Предварительный диагноз ОМЛ может быть определён в случае выявления в мазках периферической крови бластных форм лейкоцитов, но для окончательного диагноза должны быть выявлены соответствующие изменения в анализе аспирационного биоптата костного мозга.
Костный мозг и кровь исследуют световым микроскопированием и поточной цитометрией для установления диагноза и дифференцирования ОМЛ от других лейкозов, например, от острого лимфобластного лейкоза, а также для уточнения подтипа ОМЛ. Образец крови или костного мозга обычно проверяют на присутствие хромосомных транслокаций обычными цитогененитческими способами, или способом флуоресцентной гибридизации in situ. Генетические исследования проводят и для выявления характерных мутаций, которые могут влиять на исход заболевания — например, в FLT3, в нуклеоплазмине, или в KIT.[21]
Цитохимические красители для мазков крови и костного мозга оказываются очень полезными для дифференциальной диагностики ОМЛ и ОЛЛ, а также для выделения подтипов ОМЛ. Сочетание миелопероксидазы или красителя Суданский чёрный и неспцифического эстеразного красителя обеспечивает получение нужной информации в большинстве случаев. Реакции миелопероксидазы или Суданского чёрного оказываются самыми полезными для установления диагноза ОМЛ и его дифференцирования от ОЛЛ. Неспецифический краситель эстеразы используется для моноцитаронй составляющей острых миелолейкозов и для дифференцирования от незрелой формы монобластного лейкоза от ОЛЛ.[4]
Диагноз и классификация ОМЛ может оказаться непростой задачей, этим должен должен заниматься квалифицированный гематопатолог или гематолог. В явных случаях наличие некоторых характерный морфологических признаков, таких, как тельца Ауэра, или специфическия для АМЛ результаты поточной цитометрии дают возможность надёжно отделять ОМЛ от других лейкозов; однако при отсутствии такх явных признаков диагностика существенно осложняется.[22]
В соответствии с широко используемыми критериями классификации ВОЗ диагноз ОМЛ устанавливаетсяв том случае, если доказано если в крови и/или костном мозге более 20 % клеток представлены миелобластами.[23] ОМЛ следует тщательно дифференцировать от так называемых прелейкозных состояний, в частности, от миелодиспластического синдрома или миелопролиферативного синдрома, которые лечатся по-разному.
Поскольку острый промиелоцитарный лейкоз (ОПЛ), требуя уникального способа лечения очень хорошо ему поддаётся, очень важно быстро подтвердить или отвергнуть этот подвид лейкоза. Для этого часто используют флюоресцентную гибридизацию in situ, выполненную на крови или костном мозге, поскольку ею легко выявляется хромосомная транслокация (t[15;17]) специфичная для ОПЛ.[24]
Злокачественными клетками при ОМЛ выступают миелобласты. В нормальном гемопоэзе миелобласты являются незрелыми предшественниками лейкоцитов миелоидного ряда;нормальные миелобласты постепенно созревают, превращаясь в нормальные лейкоциты. Однако при ОМЛ в каком — то из миелобластов накапливаются генетические изменения, которые «замораживают» клетку в незрелом состоянии, останавливая процесс клеточной дифференциации. [25] Сама по себе такая мутация не вызывает лейкоз, но когда «остановка дифференциации» сочетается с другими мутациями, которые приводят к утрате генетического контроля над ростом клеток, результатом оказывается неуправляемое размножение незрелого клеточного клона, определяющего клиническую сущность ОМЛ.[26]
Большое разнообразие и генетическая неоднородность ОМЛ происходит от того, что лейкозная трансформация может возникнуть на множестве этапов дифференциации клетки.[27] Современные схемы классификации ОМЛ признают факт зависимости свойств и поведения лейкозных клеток, а также течения лейкоза от того, на каком этапе остановилась дифференциация.
Специфические цитогенетическиеотклонения обнаруживаются у многих больных ОМЛ. Виды изменений хромосом часто прогностически значимы.[28] Хромосомные транслокации кодируют синтез гибридных белков, чаще всего, факторов транскрипции — вспомогательных белков — помощников РНК-полимераз, изменённые свойства которых могут привести к останову дифференциации.[29] Например, при остром промиелоцитарном лейкозе транслокация t(15; 17) вызывает синтез гибридного протеина PML-RARα, который связывается с рецептором ретиноевой кислоты в промоторах некоторых специфических для миелоидных клеток генов и останавливает в этих клетках дифференциацию.[30]
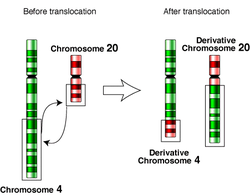 Схема транслокации хромосом.
Схема транслокации хромосом.Клинические проявления и симптомы ОМЛ возникают потому что, умножаясь, клетки лейкозного клона мешают деятельности нормальных клеток и стремятся вытеснить их из костного мозга.[31] Это приводит к нейтропении, анемии, и тромбоцитопении. Чаще всего симптомы ОМЛ определяются недостаточностью нормальных клеток крови. В редких случаях у больных развиваются хлоромы — плотные опухоли из лейкозных клеток за прелами костного мозга, которые могут вызывать различные симптомы в зависимости от локализации хлоромы.[5]
Лечение ОМЛ состоит в основном из химиотерапии, и делится на два этапа: индукция и постремиссионное лечение(или консолидация). Цель индукционной терапии является достижение полной ремиссии за счет уменьшения количества лейкозных клеток до не обнаруживаемого уровня; цель консолидирующей терапии заключается в ликвидации остаточных, не обнаруживаемых современными методами остатками болезни и излечение.[32]
Индукция[править | править код]
Для всех подтипов ОМЛ за исключением M3 по классификации ФАБ, обычно используют индукционную химиотерапию цитарабином и антрациклиновым антибиотиком (например, даунорубицином или идарубицином).[33] Этот способ индукционной химиотерапии известен под названием «7+3». Название происходит от того, что в этом режиме предусматриваются 7 дней непрерывного инфузионного вливания цитарабина, при этом в первые три дня одновременно болюсно вводится антрациклиновый антибиотик. При таком способе лечения ремиссия наступает почти у 70 % больных ОМЛ.[34] Могут применяться и другие способы индукционного лечения, включая режимы FLAG, DAT, ADE и подобные, или монотерапию высокими дозами цитарабина, или лечение препаратами, находящимися на стадии исследования.[35][36] Вследствие токсического воздействия лечения, в том числе подавления миелоидного ростка и повышения вероятности инфекционных осложнений очень старым больным индукционная химиотерапия не предлагается, и назначается менее интенсивное паллиативное лечение химиопрепаратами. Подвид ОМЛ M3, также известный под названием острый промиелоцитарный лейкоз, почти во всех случаях лечится препаратом ПТРК (полностью транс- ретиноевая кислота) в дополнение к индукционной терапии.[37][38][39] При лечении острого промиелоцитарного лейкоза нужно учитывать возможность развития синдрома диссеминированного внутрисосудистого свёртывания вследствие поступления содержимого гранул промиелоцитов в периферическую кровь. Лечение острого промиелоцитарного лейкоза исключительно эффективно, это достоверно доказано множеством документированных случаев лечения.
3 августа 2017 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США(FDA) одобрило к применению VYXEOS (Jazz Pharmaceuticals, Inc) для лечения взрослых с недавно диагностированными двумя подвидами ОМЛ (t- AML и AML-MRC). VYXEOS представляет собой липосомальную комбинацию цитарабина и даунорубицина и показало себя намного эффективнее при лечении этих двух подтипов , чем применение стандартной 7+3 комбинации. Лекарство продемонстрировало среднюю общую выживаемость 9,6 месяцев по сравнению с 5,9 месяцами при комбинации 7+3 [40]
В 2018 году FDA одобрила применение гласдегиба (glasdegib) в комбинации с низкодозным цитарабином для лечения пациентов в возрасте старше 75 лет, которым невозможно провести интенсивную химиотерапию. Одобрение препарат получил с условием размещения в инструкции предупреждения о высоком риске токсичности для плода.[41]
Целью индукционного этапа лечения является достижение полной ремиссии. Полная ремиссия не означает, что заболевание полностью вылечено. Скорее, состояние полной ремиссии говорит о невозможности обнаружить спящую болезнь существующими способами диагностики.[33] Полная ремиссия достигается у 50-70 % взрослых больных с впервые выявленным ОМЛ, разница зависит от прогностических факторов, о которых сказано выше.[42] Длительность ремиссии зависит от прогностических качеств исходного лейкоза. В основном, все случаи ремиссии без дополнительного, консолидирующего лечения закачиваются рецидивом.[43]
Консолидационное лечение[править | править код]
Даже после достижения полной ремиссии вероятно, немногие лейкозные клетки всё же выживают. Их так мало, что обнаружить их пока невозможно. В случае не проведения послеремиссионного, или консолидационного лечения почти у всех больных в конце — концов возникает рецидив.[44] Поэтому для того, чтобы избавиться от неопределимых больных клеток и предотвратить рецидив — то есть, достичь полного излечения, нужна дополнительная терапия. Вид лечения после достижения ремиссии определяется индивидуально в зависимости от прогностических факторов и общего состояния здоровья больного. При прогностически благоприятных подвидах лейкозов (например, при inv(16), t(8;21) и t(15;17) обычно назначают 3-5 дополнительных курса интенсивной химиотерапии, известной как консолидационное лечение. Больным с высоким риском рецидива (например, при наличии цитогенетических изменений, сопутствующего миелодиспластического синдрома, или при ОМЛ, связанном с предшествующим лечением обычно рекомендуется транплантация аллогенных стволовых клеток гемопоэтического ряда, если позволяет общее состояние и есть подходящий донор.[45][46] При ОМЛ со средней вероятностью рецидива (при нормальных цитогенетических показателях или с такими цитогенетическими изменениями, которые не попадают в группы риска)вопрос консолидационного лечения не столь ясен и определяется рядом специфических показателей — возрастом больного, общим состоянием его здоровья, системой ценностей, и наконец, наличием донора подходящих стволовых клеток.[46]
Тем больным, которым пересадка стволовых клеток после консолидационного лечения не показана, проводят иммунотерапию комбинацией гистамина гидрохлорида (цеплена) и пролейкина. Такое лечение позволяет снизить вероятность рецидива на 14 %, удлиняя ремиссию на 50 %.[47]
Таким образом, стандартной терапией ОМЛ признаны высокоинтенсивная химиотерапия (ВХТ) и трансплантация костного мозга.[48]
Однако результаты лечения, несмотря на относительно высокие ответы у молодых, остаются неудовлетворительными у лиц старше 65 лет (30-50%) связанные с ранней летальностью (10%) и непродолжительностью ремиссии. Больше половины с ОМЛ – это больные старшего возраста и/или со значимой сопутствующей патологией, которые, как правило, не могут получать высокотоксичные схемы химиотерапии, поэтому для их терапии применяют низкие дозы цитарабина цитарабина и поддерживающее лечение: антибиотики и гемотрансфузии.
С 2010 года в США для лечения ОМЛ рекомендовано применять гипометилирующие агенты (5-азацитидин, децитабин) у пациентов, которые не подходят для трансплантации костногомозговых клеток/интенсивной химиотерапии.[49] В процессе метилирования ДНК гипометилирующие агенты ковалентно связываются с ДНК-метилтрансферазой, что приводит к реактивации генов, после чего восстанавливается дифференцировка гемопоэтических клеток-предшественников и нормальное кроветворение. 5-азацитидин обладает двойным механизмом действия. Он встраивается не только в молекулу ДНК, но и в молекулу РНК. Тем самым 5-азацитидин понижает количество РНК в клетках, что приводит к цитостатическому эффекту вне зависимости от клеточной фазы.
На основании результатов исследования 3 фазы AZA-001 — международное, мультицентровое, контролируемое исследование в параллельных группах, в котором пациенты МДС высокого риска/ОМЛ (ВОЗ критерии) сравнивались со стандартно используемой терапией (сопроводительная терапия, интенсивная химиотерапия, низкие дозы цитарабина), азацитидин был зарегистрирован, в том числе и в РФ, для лечения этих групп больных. Было показано, что азацитидин в 2,5 раза увеличивает общую выживаемость пациентов с ОМЛ (критерии ВОЗ).[50]
Рецидив ОМЛ[править | править код]
При рецидиве ОМЛ единственным испытанным способом лечения, который может оказаться действенным, оказывается пересадка стволовых клеток при условии, если она ещё не применялась.[51][52][53]
При рецидиве ОМЛ больным, которым не планируется пересадка стволовых гемопоэтических клеток, или в случае рецидива после пересадки стволовых клеток можно предложить лечение в рамках клинического испытания, поскольку выбор среди обычных способов лечения весьма ограничен. В настоящее время проходит клинические испытания цитостатическое вещество клофарабин, также испытываются различные способы прицельной терапии с использованием ингибиторов фарнезилтрансферазы, децитабина и ингибиторов белка множественной лекарственной устойчивости, ингибиторы гистондеацетилазы цитарабина, блокаторы ангиогенеза, аналоги дезоксиаденозина. Иногда ограниченное количество методов терапии рецидивов ОМЛ вынуждает обращаться к паллиативному лечению.
После клинических испытаний триоксида мышьяка Управление по контролю за качеством пищевых продуктов и лекарственных препаратовСША одобрило его применение в качестве паллиативного средства лечения рецидивирующего острого промиелоцитарного лейкоза (ОПЛ). Также как и ПТРК триоксид мышьяка неэффективен при других подвидах ОМЛ.[54]
В 2000 году в США для лечения рецидивов ОМЛ у больных старше 60-ти лет, которых нельзя лечить высокими дозами химиопрепаратов, было разрешено применять гемтузумаб озогамицин (Милотарг), препарат, в котором, как предполагалось, цитотоксическое вещество — противоопухолевый антибиотик калихимицин — связан с моноклональным антителом, обеспечивающим доставку антибиотика точно в лейкозную клетку.[55]
20 июля 2018 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США(FDA) зарегистрировала первый ингибитор гена IDh2 ивосидениб (ivosidenib), предназначенный для лечения пациентов с рецидивом ОМЛ и обладающих мутацией онкогена IDh2. Терапия с применением ivosidenib позволяет пациентам достичь полной ремиссии ОМЛ, а так же снизить потребность в трансфузиях эритроцитов и тромбоцитов. В исследовании препарата ивосидениб участвовали 125 взрослых пациентов. КИ показали полный положительный ответ на лечение у 30,4% испытуемых (также ответ с частичным гематологическим восстановлением 8,8% пациентов, у которых количество лейкозных клеток находилось на умеренно низком уровне). Препарат стал первым лекарственным средством для лечения острого миелоидного лейкоза, одобренный в США. Регистрационное свидетельство на препарат было выдано компании Agios Pharmaceuticals.[56][57]
Хромосомная транслокация, (9;11), сочетающаяся с ОМЛОстрый миелоидный лейкоз — излечимое заболевание. Вероятность выздоровления каждого пациента разная, поскольку определяется множеством прогностических факторов.[58]
Цитогенетика[править | править код]
Самым значимым для ОМЛ прогностическим фактором оказывается фактор цитогенетический, то есть «конструкция» хромосом лейкозных клеток. Некоторые цитогенетические отклонения связаны с весьма благоприятными исходами (например, транслокация 15;17 при остром промиелоцитарном лейкозе. Примерно у половины больных ОМЛ цитогенетическое состояние выглядит нормальным, таких пациентов относят к группе со средним вероятностью рецидива. Ряд цитогенетических изменений связан с неблагоприятным прогнозом и высокой вероятностью рецидива после лечения.[59][60][61]
Первая публикация, рассматривающая связь цитогенетических изменений с прогнозом появилась в отчёте Совета медицинских исследований в 1998 году.[62]
| Исход | Отклонения | 5-летнее выживание | Частота рецидивов |
|---|---|---|---|
| Благоприятный | t(8;21), t(15;17), inv(16) | 70 % | 33 % |
| Удовлетворительный | Не выявлено, +8, +21, +22, del(7q), del(9q), Нарушения 11q23, все остальные структурные или численные изменения | 48 % | 50 % |
| Неблагоприятный | −5, −7, del(5q), Нарушения 3q, Комбинированные цитогенетические нарушения | 15 % | 78 % |
Позже Юго-западная онкологическая группа и Восточная кооперативная онкологическая группа,[63] а затем и Группа Б по исследованию рака и лейкозов опубликовали другие, в основном совпадающие перечни прогностических цитогенетических изменений при лейкозах.[64]
Предшествующий миелодиспластический синдром и прогноз ОМЛ[править | править код]
У ОМЛ, развивающегося на фоне миелодиспластического синдрома или миелопролиферативного синдрома (так называемый вторичный ОМЛ) прогноз хуже, чем у ОМЛ, связанного с предшествующим лечением, который возникает после химиотерапии другого предшествующего злокачественного заболевания. Оба эти состояния связаны с высокой частотой неблагоприятных цитогенетических изменений.[65][66][67]
Другие прогностические признаки ОМЛ[править | править код]
Некоторые исследования связывают возраст после 60 лет и повышенный уровень лактатдегидрогеназы с повышенной вероятностью неблагоприятного исхода.[68] Как и при большинстве других злокачественных заболеваний общий соматический статус (то есть общее физическое состояние больного и его жизненная активность) тоже имеют большое прогностическое значение.
Доказано, что внутреннее тандемное удвоение FLT3-тирозинкиназы ухудшает прогноз ОМЛ.[69] Более агрессивное лечение таких больных, в частности, пересадкой стволовых клеток в первой ремиссии не увеличивало длительность выживания, поэтому в качестве благоприятного прогностического признака удвоение FLT3-тирозинкиназы определённого клинического значения не имеет.[70] Внутреннее тандемное удвоение FLT3-тирозинкиназы может быть связано с лейкостазом.[71]
Сейчас широко распространены исследования клинического значения мутаций гена CD117, ответственного за синтез рецептора фактора роста стволовых клеток c-KIT при ОМЛ. Важность этих исследований определяется появлением в клинической практике ингибиторов тирозинкиназы, таких, как иматиниб и сунитиниб, обладающих способностью останавливать действие рецептора c-KIT.[72]
Кроме этого, в качестве прогностических факторов и объектов лечебного воздействия изучаются гены CEBPA, BAALC, ERG и NPM1.
Общая оценка результатов лечения[править | править код]
Эффективность лечения в клинических испытаниях колеблется от 20 до 45 %.[73][74] Однако следует отметить, что в клинических испытаниях участвуют молодые больные, и также те, кто в состоянии перенести агрессивные методы лечения. Эффективность лечения для всех больных, включая престарелых и тех, кому агрессивное лечение противопоказано, скорее всего, ниже. В случае острого промиелоцитарного лейкоза эффективность лечения может достигать 98-ми%.
