Скорая медицинская помощь. Квалификационные тесты (2019 год) с ответами
содержание .. 13 14 15
ТЕМА №15. НЕОТЛОЖНЫЕ СОСТОЯНИЯ, ИНТЕНСИВНАЯ ТЕРАПИЯ И РЕАНИМАЦИЯ В ПЕДИАТРИИ
15.001.У ребенка 12 лет с неспецифическим язвенным колитом (НЯК) появилась резкая боль в животе, нарастающая интоксикация, парез кишок, АД=110/70 мм.рт. ст. Сформулируйте диагноз:
а) профузное кишечное кровотечение;
б) перфорация язв толстой кишки;
в) токсическая дилятация толстой кишки;
г) инвагинация кишок.
15.002.У ребенка с острой деструктивной пневмонией внезапно развилась выраженная одышка, цианоз, тахикардия, ослабление дыхания и тимпанит на больной стороне. Ваш диагноз:
а) напряженный пневмоторакс;
б) тампонада сердца;
в) пиоторакс;
г) медиастинит;
д) парциальный пневмоторакс.
15.003.При развитии судорожного синдрома у новорожденного ребенка в возрасте 5-6 суток следует исключить в первую очередь:
а) родовую травму ЦНС;
б) порок развития головного мозга;
в) метаболические нарушения;вирусный энцефалит
г) гнойный менингит.
15.004.Для энтеровирусной инфекции, вызванной вирусом Коксаки, характерно осложнение:
а) хориоретинит;
б) катаракта;
в) миокардит;
г) геморрагический синдром.
15.005.У ребенка 10 лет
внезапно появилась многократная кровавая рвота, слабость, головокружение,
кратковременная потеря сознания. В течение последних 1,5 лет отмечались периодические
боли в животе неопределенной локализации, незначительные диспептические
явления.
а) ангиоматоз желудка;
б) язвенная болезнь 12-перстной кишки;
в) портальная гипертензия;
г) геморрагический гастрит.
15.006.Характер мокроты на ранних стадиях хронического бронхита:
а) скудная слизистая;
б) слизисто-гнойная;
в) гнойная;
г) гнойная с прожилками крови;
д) обильная слизисто-гнойная
15.007.В детском возрасте гиперурикемия наиболее часто встречается при:
а) приеме цитостатиков;
б) приеме мочегонных тиазидового ряда;
в) подагре;
г) нервно-артритическом типе конституции.
15.008.Состояние алкалоза у детей характерно при наличии:
а) пиелонефрита;
б) сахарного диабета;
в) опухоли мозга с рецидивирующей рвотой;
г) массивной пневмонии.
15.009.У родившегося в срок ребенка в первую неделю жизни нарастала желтуха, которая стабильно сохранялась в течение 4 недель, появились запоры, брадикардия. Ваш предварительный диагноз?
а) сепсис;
б) гипотиреоз;
в) АВО-гемолитическая болезнь;
г) пилоростеноз.
15.010.Достоверным признаком врожденной цитомегалии является
а) микрофтальм и хориоретинит;
б) кальцификаты в веществе мозга;
в) менингоэнцефалит
г) обнаружение характерных клеток в осадке мочи, слюне, ликворе.
15.011.Мальчику 6 лет, у которого сегодня появились отеки век, голеней, мало мочится, целесообразно назначить диету:
а) стол гипохлоридный;
б) фруктово-сахарный;
в) стол вегетарианский;
г) стол без соли, мяса.
15.012.У девочки 3-х лет полиурия, дефицит веса 10%, кожа и язык
сухие, гиперемия щек, запах ацетона в выдыхаемом воздухе, печень+3см. Гликемия
натощак -12,8ммоль/л. В моче 6%сахара при суточном диурезе 2,5л. Ваш
предварительный диагноз:
Гликемия
натощак -12,8ммоль/л. В моче 6%сахара при суточном диурезе 2,5л. Ваш
предварительный диагноз:
а) почечная глюкозурия
б) инсулинозависимый сахарный диабет
в) несахарный диабет
г) нарушение толерантности к углеводам
15.013.У ребенка 11-ти лет боль в горле, невозможность открывать рот, повышенное слюноотделение. Одна небная миндалина значительно больше другой, гиперемирована, отечна, голос гнусавый. Ваш предварительный диагноз:
а) заглоточный абсцесс;
б) тонзиллит;
в) ангина;
г) паратонзиллярный абсцесс.
15.014.У ребенка 2-х лет температура 38,9°С, беспокойство, отказ от еды, шумное хрипящее дыхание. Болен в течение 4-х дней респираторной инфекцией. Какое осложнение развилось у ребенка. Ваш предварительный диагноз:
а) круп;
б) ангина;
в) заглоточный абсцесс;
г) паратонзиллярный абсцесс.
15.015.Укажите, в каком случае частота пульса не соответствует возрастной норме
а) 1 мес — 120-140 уд/мин
б) 6 мес — 130 уд/мин
в) 1 год — 90 уд/мин
г) 5 лет — 100 уд/мин
д) 10 лет — 80 уд/мин
15.016.Неспецифический паротит отличается от эпидемического по одному из перечисленных признаков:
а) острое начало заболевания;
б) двусторонний характер поражения;
в) рецидивирование процесса;
г) выраженный инфильтрат в околоушно-жевательной области.
15.017.Укажите, в каком случае почасовой диурез снижен из-за гиповолемии
а) 1 мес — 10-15 мл/час
б) 6 мес — 20-25 мл/час
в) 1 год — 30-40 мл/час
г) 5 лет — 25-30 мл/час
д) 10 лет — 75-90 мл/час
15.018.При каких формах туберкулеза у матери можно сохранить грудное вскармливание?
а) туберкулез легких в фазе кальцинации;
б) туберкулез молочной железы;
в) диссеминированный туберкулез;
г) активный туберкулез легких
при наличии бактериовыделения.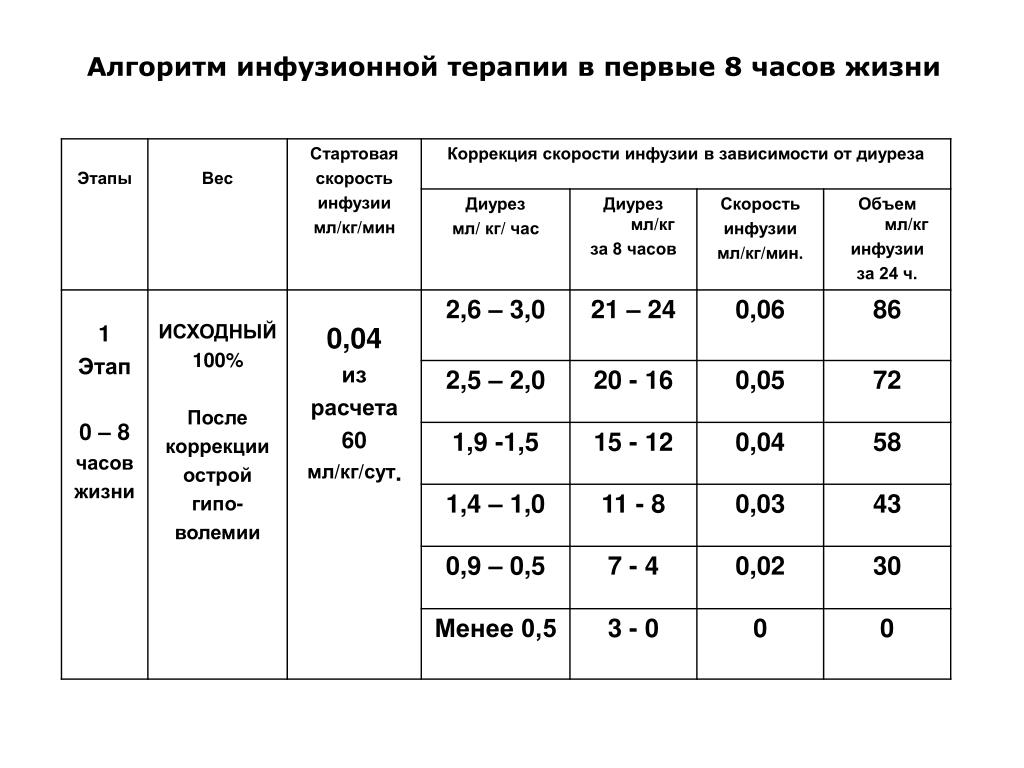
15.019.Укажите, в каком случае артериальное давление является отклонением от возрастной нормы:
а) 1 мес — 95-100/40 мм рт. ст.
б) 6 мес — 85/45 мм рт. ст.
в) 1 год — 90/50 мм рт. ст.
г) 5 лет — 100/50 мм рт. ст.
д) 10 лет — 110/65 мм рт. ст.
15.020.При гемофилии А следует вводить гемопрепарат:
а) прямое переливание крови от матери;
б) концентрат VIII фактора;
в) прямое переливание крови от донора;
г) переливание крови длительного хранения.
15.021.Укажите основные компоненты первичного туберкулезного комплекса:
а) первичный легочный аффект, лимфаденит, лимфангоит;
б) лимфангоит, лимфаденит;
в) первичный легочный аффект;
г) лимфангоит.
15.022.Возможно ли найти противопоказания для экстренной госпитализации ребенка из предложенных ниже состояний?
а) декомпенсация жизненно важных органов и систем
б) пневмония у новорожденного вне зависимости от степени дыхательной недостаточности
в) подозрение на необходимость неотложной хирургической помощи
г) опасность неправильной оценки состояния ребенка
д) все перечисленные состояния требуют экстренной госпитализации
15.023.Здоровый 6-ти месячный ребенок внезапно начал кричать. Температура нормальная, живот напряжен, стула нет, после ректального исследования на пальце кровь. Ваш диагноз:
а) острый аппендицит;
б) острый панкреатит;
в) острый гастроэнтерит;
г) инвагинация.
15.024.На первое введение антигена начинают продуцироваться антитела
а) через 2-4 суток;
б) через 2 суток;
в) на 5-7 день;
г) через 14 дней.
15.025.При краснухе не встречается развитие клинических проявлений в виде:
а) субфебрильной лихорадки, легких катаральных явлений;
б) мелкопятнистой сыпи;
в) увеличения и болезненности заднешейных и затылочных лимфоузлов;
г) крупа
15.026.Тактика врача скорой помощи при вызове к ребенку со стенозом гортани II-III степени неясного генеза исключает:
а) выяснения анамнеза
б) срочную госпитализацию
в) попытку удаления инородного тела (при инородном теле ротоглотки)
г) транспортировку сидя или лежа с оксигенацией
д) отказ от госпитализации
15.027.Показатель пограничной артериальной гипертензии у юношей в возрасте от 15 до 17 лет:
а) 140/80 мм рт. ст.;
б) 141-145/80-85 мм рт. ст.;
в) 146-150/89-95 мм рт. ст.;
г) 151-155/94-97 мм.рт.ст.;
д) 156-160/95-100 мм.рт.ст.
15.028.Типичной локализацией сыпи при краснухе является:
а) лицо, туловище, разгибательные поверхности конечностей, ягодицы;
б) боковые поверхности туловища, внутренняя поверхность бедер, сгибательные поверхности конечностей;
в) поэтапное распространение сыпи на лице, туловище, конечностях;
г) туловище, конечности с концентрацией элементов на столах, кистях
и вокруг суставов.
15.029.Какие физиологические особенности строения и функционирования дыхательной системы у детей не приводят к быстрому развитию у них признаков ОДН
а) повышенное потребление кислорода на килограмм массы тела (в 3-4 раза)
б) узость и обильность васкуляризации всех дыхательных путей
в) быстрая утомляемость дыхательных мышц
г) мягкая и податливая грудная клетка
д) высокая кислородная емкость крови (240 мл/л против 190 мл/л взрослых)
15. 030.Какой признак следует
исключить при постановке диагноза ОДН, стадия декомпенсации дыхания?
030.Какой признак следует
исключить при постановке диагноза ОДН, стадия декомпенсации дыхания?
а) отсутствие дыхательных движений
б) брадипноэ, появление патологических ритмов дыхания
в) «распад дыхательного центра» — отсутствие координации
г) разлитой цианоз, переходящий в бледность
д) сухой надсадный непродуктивный кашель
15.031.Какой признак не относится к анатомо-физиологическим особенностям строения органов кровообращения у детей
а) ЧСС у новорожденного практически в 2 раза больше, чем у взрослого
б) потребление кислорода у детей больше
в) артериальное давление у новорожденного в 2 раза ниже
г) ОЦК новорожденного составляет около 1/10-1/15 от взрослого
д) ЧД у новорожденных до 40 в минуту
15.032.В каком случае допустимо лечение острой пневмонии в домашних условиях:
а) неосложненная форма у ребенка в возрасте до 1 года;
б) пневмония, осложненная кардиоваскулярным синдромом;
в) неосложненная форма пневмонии у ребенка 4 лет;
г) пневмония у ребенка из социально неблагополучной семьи.
15.033.1%димедрол детям вводится из расчета:
а) 0,1 мл на 1 год жизни
б) 0,2 мл на 1 год жизни
в) 0,1 мг на 1 кг веса
г) 0,01 мг на 1 кг веса
15.034.Соотношение искусственной вентиляции легких и массажа сердца при реанимации новорожденных составляет:
а) 1:2
б) 1:3
в) 1:4
г) 1:5
15.035.Искусственная вентиляция легких новорожденным и детям грудного возраста проводится методом:
а) изо рта в рот
б) изо рта в нос
в) изо рта в рот и нос
15. 036.Объем воздуха при
проведении искусственной вентиляции легких новорожденному ребенку составляет:
036.Объем воздуха при
проведении искусственной вентиляции легких новорожденному ребенку составляет:
а) объем раздутых щек
б) 80-100 мл
в) 150-200 мл
г) 200-500 мл
15.037.Количество жидкости, для промывания желудка ребенку рассчитывается:
а) 1 литр на 1 кг веса
б) 1 литр на 1 год жизни, но не более 10 литров
в) 1 литр на 10 кг веса
15.038.Массаж сердца детям до года проводится с частотой:
а) 120 р. в мин.
б) 100 р. в мин.
в) 80 р. в мин.
г) 60 р. в мин.
15.039.Весной у ребенка 10 месяцев с признаками рахита на фоне острой респираторной вирусной инфекции, протекающей с нормальной температурой, внезапно развилась одышка с затрудненным вдохом, затем остановка дыхания, цианоз, кратковременные клонические судороги. Затем глубокий шумный вдох и ребенок уснул. Ваш диагноз:
а) гипопаратиреоз.
б) спазмофилия;
в) аффективные судороги;
г) эпилепсия;
д) фебрильные судороги.
15.040.Годовалый ребенок остро заболел. Высокая температура, быстро нарастающая с последующим падением. Крупная геморрагическая сыпь. Тахикардия, снижение АД, олигурия. Ваш диагноз:
а) грипп, нейротоксикоз, ОПН;
б) гемолитико-уремический синдром;
в) менингококовая инфекция:менингококкцемия, инфекционно-токсический шок.
15.041.50%анальгин детям вводится из расчета:
а) 0,1 мл на 1 год жизни
б) 0,2 мл на 1 год жизни
в) 0,01 мл на 1 кг веса
г) 0,02 мл на 1 кг веса
Ответы
|
15. |
в |
|
15.002 |
а |
|
15.003 |
г |
|
15.004 |
в |
|
15.005 |
б |
|
15.006 |
а |
|
15.007 |
г |
|
15.008 |
в |
|
15.009 |
б |
|
15.010 |
г |
|
15.011 |
г |
|
15.012 |
б |
|
15. |
б |
|
15.014 |
а |
|
15.015 |
в |
|
15.016 |
б |
|
15.017 |
г |
|
15.018 |
а |
|
15.019 |
а |
|
15.020 |
г |
|
15.021 |
а |
|
15.022 |
д |
|
15.023 |
г |
|
15.024 |
а |
|
15. |
г |
|
15.026 |
д |
|
15.027 |
б |
|
15.028 |
а |
|
15.029 |
д |
|
15.030 |
д |
|
15.031 |
д |
|
15.032 |
в |
|
15.033 |
а |
|
15.034 |
г |
|
15.035 |
в |
|
15.036 |
а |
|
15. |
б |
|
15.038 |
а |
|
15.039 |
б |
|
15.040 |
в |
|
15.041 |
а |
содержание .. 13 14 15
Расчет гидробаланса. Онлайн калькулятор.
Об этом калькуляторе
*Этот калькулятор позволяет рассчитать гидробаланс за сутки как с операционными и другими потерями, так и без них.
Гидробаланс — это соотношение введенной и выделенной организмом жидкости за определенный промежуток времени (сутки, 12 часов, 6 часов, время операции).
Введенная жидкость — сумма объема внутривенной инфузии и энтерально (per os, в зонд) введенной жидкости
Выделенная организмом организмом жидкость может быть представлена физиологическими и патологическими потерями.
Физиологическая потребность (ФП) — потребность организма в жидкости в единицу времени (сутки). Зависит от возраста: до 65 лет — 30 мл/кг/сут., 65-75 лет — 25 мл/кг/сут., старше 75 лет — 20 мл/кг/сут.
Физиологические потери:
- Нормальное дыхание
- Перспирация через кожу
- Нормальный стул
- Физиологический диурез
В целом, физиологические потери составляют около 40% от физилогической потребности, а диурез в сутки примерно равен 60% от нее, или 20 мл/кг/сутки.
Патологические потери
- Потери с лихорадкой: 3 мл/кг/сут. (10% ФП) на каждый градус выше 37,5 oC. Также теряются электролиты.
- Потери с одышкой: 10 мл/кг/сут. на каждые 10 дыханий в минутут выше 25.
- Потери при ИВЛ без согревания и увлажнения газовой смеси: 1000 мл/сут.
- Потери при ИВЛ с согреванием и увлажнением газовой смеси: 0 мл/сут.
- Интраоперационные потери
- Перспирация из раны во время операции с минимальной травматизацией: 2 мл/кг/час.
- Перспирация из раны во время операции со средней травматизацией: 4 мл/кг/час.
- Перспирация из раны во время операции с тяжелой травматизацией: 6 мл/кг/час.
- Рвота, отделяемое по зондам
- Другие потери. Это могут быть наружные и внутренние кровотечения, диарея, полиурия и другое.
Формула
Гидробаланс = Внутривенная инфузия + Энтеральное введение — Диурез — Физиологические внепочечные потери — Патологические потери
Состав инфузии
Физиологические потребности в жидкости обеспечиваются солевыми растворами и глюкозой в равном соотношении (1:1).
Потери по дренажам, зонду, рвота — солевыми растворами и глюкозой (1:1).
Потери с дыханием и при ИВЛ без согревания и увлажнения смеси — только глюкозой.
Если объем инфузии превышает 2400 мл/сутки, не менее 1/3 ее объема должны составить коллоидные растворы.
Дополнительные сведения
С точки зрения электролитного соcтава коллоидные растворы, растворы аминокислот, эмульсии липидов рассматриваются как кристаллоиды.
5% — й раствор глюкозы рассматривается как источник свободной воды.
10% — й растовр глюкозы рассматривается как источник свободной воды и энергетический донатор. 1200 мл 10% — ой глюкозы обеспечивают минимальный белок сберегающий эффект.
Диагностическая скрининг-программа — КиберПедия
| Клинические признаки | Степень тяжести шока | ||
| I (легкий) | II (средний) | III (тяжелый) | |
| превышает возрастную норму | |||
| ЧСС | на 10% | на 20% | на 30% |
| АД | норма | норма или повышено | снижено |
| ЦВД | норма или снижено | от 20 до 0 | ниже 0 |
| Hb г/л | 120-140 | 140-160 | более 160 |
| Htв ед. | до 0,45 | 0,45-0,50 | более 0,50 |
| Почасовой диурез | снижен по сравнению с возрастной нормой | ||
| до 1/3 | от 1/3 до 1/2 | более 1/2 |
Оценка тяжести шока будет достоверна, если одновременно учитывается не менее 3 признаков.
Возрастные показатели ЧСС, ЧД, почасового диуреза у детей
| Возраст | ЧСС, уд./мин. | ЧД в 1 мин. | Диурез мл/(кг*ч.) |
| 1 мес. | 120-140 | 10-15 | |
| 6 мес. | 20-25 | ||
| 1 год | 30-40 | ||
| 5 лет | 40-5- | ||
| 10 лет | 60-70 | ||
| 14 лет | 60-70 |
Расчетные величины уровня АД у здоровых детей.
Минимальное систолическое АД = 70 + 2 * (возраст в годах)
Минимальное диастолическое АД = 2/3 систолического АД.
Приложение №3
Возрастные нормы у детей
| Возраст | Вес (кг) | Потребность | Диурез (мл) | ЦВД (мм вод.ст.) | |
| В жидкости (мл/кг/сут.) | В ионах К+ (ммоль/кг/сут.) | ||||
| 3 мес. | 5,4 | 2,0 | 10-15 | ||
| 6 мес. | 1,9 | 15-20 | |||
| 9 мес. | 8,4 | 1,85 | 20-30 | ||
| 1 год | 1,8 | 30-40 | |||
| 2 года | 1,8 | 40-50 | |||
| 4 года | 1,7 | 50-60 | |||
| 6 лет | 1,6 | 60-70 | |||
| 8 лет | 1,65 | 70-80 | |||
| 10 лет | 1,5 | 90-100 | |||
| 14 лет | 1,4 | 100-120 |
Приложение №4
Инотропная поддержка у детей
| Рабочий раствор | Эффект |
| Дофамин 0,5% 4,0 : 50,0 Допмин 4% 1,0 : 100,0 | 0,3 мл/кг/час – сосудорасширяющий 0,6 мл/кг/час – кардиотонический 1,2 мл/кг/час — сосудосуживающий |
| На 5% растворе глюкозы, физиологическом растворе натрия хлорида |
Приложение №5
Клинические признаки карбоксигемоглобинемии
| УровеньHbCO в крови | Клиническая картина |
| 0,3-0,7% (до 1%) | Нормальная величина (эндогенная окись углерода), у курильщиков может доходить до 5-10%.
|
| 4-5% | Избирательное увеличение кровотока в отдельных жизненно важных органах. |
| 5-9% | Повышение порога восприятия света. |
| 10-30% | Головная боль, одышка при физическом усилии, спутанность сознания, нарушение мелкой моторики. |
| 30-50% | Сильная головная боль, тошнота и рвота, увеличение ЧСС и ЧД, нарушение зрения, потеря памяти, атаксия, потеря сознания. |
| 50-70% | Судороги, кома, тяжелая сердечно — сосудистая и дыхательная недостаточность. |
| Более 70% | Как правило, летальный исход. |
Вопросы для самоконтроля:
1. Приведите классификацию ожогов по глубине.
2. Определите площадь повреждения, пользуясь правилом «девяток». Перечислите основные звенья патогенеза ожогового шока.
3. Назовите критерии госпитализации в ОИТАР больных с ожоговой травмой.
4. Назовите признаки наличия у больного ожога верхних дыхательных путей.
5. Укажите особенности ведения больных с ожогами ВДП.
6. Какая формула используется для расчета объема инфузии у пациентов с ожоговым шоком?
7. Каковы клинические признаки ожогового шока?
8. Перечислите мероприятия догоспитальной помощи при тяжелой ожоговой травме.
9. Обоснуйте качественный состав инфузионной терапии, применяемый у больных с тяжелой ожоговой травмой.
10. Приведите классификацию термоингаляционной травмы по степени поражения трахеобронхиального дерева.
11. Каковы показания к переводу на ИВЛ пациентов с термической травмой?
12. Основные принципы ИВЛ при термоингаляционной травме.
13. Особенности ведения пациентов с отравлением угарным газом.
14. Каковы особенности лечения электроожогов?
15. Каковы особенности лечения химических ожогов?
Каковы особенности лечения химических ожогов?
16. Каковы принципы интенсивной терапии при ожоговом шоке?
17. Правила транспортировки ожоговых больных.
18. Перечислите особенности течения ожогового шока у детей.
19.Каковы особенности анестезиологического пособия у обожженных?
20.Каковы критерии эффективности терапии ожогового шока?
Ситуационные задачи
Задача №1
Бригада скорой помощи вызвана на дом к мальчику 1,5 лет. Ребенок находился на кухне без присмотра и опрокинул на себя кастрюлю с кипятком. При осмотре: ребенок в сознании, выраженное психомоторное возбуждение, крик. На переднее — боковой поверхности грудной клетки и туловища слева обширные участки гиперемии и пузыри, наполненные светлым содержимым. На коже предплечья, кисти левой руки и левого бедра эрозивные участки. АД — 90/40 мм рт.ст., ЧД — 40 в 1 мин., ЧСС — 128 ударов в 1 минуту. Дыхание при выслушивании легких везикулярное, тоны сердца звучные, ритмичные. Живот при пальпации мягкий. Т тела 36,9 С.
Вопросы:
1. Диагноз?
2. Первая врачебная помощь.
3. Дальнейшая тактика лечения.
4. Показана ли госпитализация? Если да, то каковы условия транспортировки?
5. Применимо ли правило «девяток»?
6. Особенности течения данного вида повреждения кожи у детей.
7. При какой площади поражения кожи в зависимости от возраста ребенка развивается ожоговый шок?
8. Вероятные осложнения и их профилактика у данного пациента.
9. Особенности обезболивания в зависимости тяжести ожога и ожогового шока.
10. Ведущий патологический синдром, определяющий тяжесть состояния у ребенка.
11. При какой степени тяжести ожогового шока на догоспитальном этапе начинают инфузионную терапию?
Задача №2
Бригада скорой помощи вызвана на дом к девочке 3-х лет. Мать ребенка оставила сковородку с растительным маслом разогреваться на плите, а сама вышла из комнаты..gif) Девочка оставалась на кухне без присмотра. Через 2 минуты мама услышала крик ребенка. Увидев пузыри на коже, вызвала скорую помощь, которая прибыла через 10 минут. При осмотре: ребенок в сознании, несколько заторможена, слабый крик. На коже лица, шеи, передней поверхности грудной клетки и правой руки -участки гиперемии. Местами отмечается гибель эпидермиса с образованием пузырей. АД — 70/50 мм рт.ст., частота дыхания — 40 в 1 мин., пульс — 160 уд. 1 мин.
Девочка оставалась на кухне без присмотра. Через 2 минуты мама услышала крик ребенка. Увидев пузыри на коже, вызвала скорую помощь, которая прибыла через 10 минут. При осмотре: ребенок в сознании, несколько заторможена, слабый крик. На коже лица, шеи, передней поверхности грудной клетки и правой руки -участки гиперемии. Местами отмечается гибель эпидермиса с образованием пузырей. АД — 70/50 мм рт.ст., частота дыхания — 40 в 1 мин., пульс — 160 уд. 1 мин.
Вопросы:
1. Диагноз?
2. Первая врачебная помощь.
3. Дальнейшая тактика лечения.
4. Показана ли госпитализация? Если да, то каковы условия транспортировки?
5. Вероятные осложнения и их профилактика у данной пациентки.
6. Применимо ли правило «девяток»?
7. Особенности течения данного вида повреждения кожи у детей.
8. При какой площади поражения кожи в зависимости от возраста ребенка развивается ожоговый шок?
9. Особенности обезболивания в зависимости тяжести ожога и ожогового шока.
10. Ведущий патологический синдром, определяющий тяжесть состояния у данной пациентки.
11. При какой степени тяжести ожогового шока на догоспитальном этапе начинают трансфузионную терапию?
Задача №3
Женщина кипятила белье. В воду добавила стиральный порошок и отбеливатель. При снятии емкости с плиты по неосторожности опрокинула ее на себя, получила ожоги. Передняя поверхность туловища, предплечья и кисти гиперемированы, раневая поверхность -белесоватая с плохой болевой чувствительностью.
Вопросы:
1. Сформулируйте диагноз.
2. Определите степень и площадь ожога.
3. Тактика врача первого контакта.
Задача №4
В палату интенсивной терапии и реанимации доставлен пострадавший в состоянии ожогового шока. Площадь поражения -50% поверхности тела. Масса тела больного 80 кг. Ожог получен около часа назад. На догоспитальном этапе медицинская помощь не оказана.
Вопросы:
1.Рассчитайте объем инфузионной терапии.
2.Какой стартовый препарат для инфузионной терапии?
3.Каков качественный состав инфузионной терапии?
4.С какой скоростью будете вводить растворы в первые сутки?
Задача №5
Больная с ожогом II — III степеней, обеих нижних конечностей кипятком (площадь ожога — 30 %) поступила в клинику через 20 минут после несчастного случая. АД-150/90 мм рт.ст. Пульс-120 ударов в минуту, ритмичный.
Вопросы:
1.Стадия ожоговой болезни?
2. План лечебных мероприятий?
Задача №6
В ожоговое отделение поступил больной 56 лет с термической травмой пламенем I-II-III АБ ст. S-40 (25)% п.т. Из анамнеза: за 1 час до поступления получил ожог пламенем в результате возгорания бензина. При поступлении температура тела -35,7ºС. АД – 130/80 мм рт.ст. Пульс – 98 в 1 минуту, удовлетворительного наполнения и напряжения в периферических артериях.
Вопросы:
1.Сформулируйте предварительный диагноз.
2. Составьте план обследования и лечения данного больного.
Задача №7
В отделение комбустиологии поступил больной 25 лет с термическим ожогом I-II-III АБ степеней. S-40 (15)% поверхности тела. Шок тяжелой степени. Через 6 часов от начала противошоковой терапии у больного наблюдается нарушение функции желудочно-кишечного тракта в виде острого кровотечения.
Какие лечебно-диагностические мероприятия необходимо провести?
Задача №8
В отделение комбустиологической реанимации поступил больной 24 лет с диагнозом: «Электротравма. Электроожог обеих верхних конечностей I-II-III АБ-IV степеней. S-8 (5)% п.т.». Локально: имеются «метки» тока на ладонной поверхности обеих кистей. На сгибательной поверхности верхней конечности в области локтевого сустава имеются ожоговые раны III АБ степени, отек и напряжение мягких тканей в области предплечья и кисти. Пульсация над a.radialis ослаблена.
1.Какова Ваша тактика?
2. Особенности расчета инфузионной терапии.
Задача №9
В ожоговое отделение поступил больной 42 лет с термическим поражением пламенем лица, шеи, туловища, верхних и нижних конечностей I-II-III АБ степеней. S-50 (25)% п.т. Термоингаляционная травма II степени. Шок тяжелой степени.
1.Какие анамнестические и объективные данные могут свидетельствовать о наличии у обожженного термоингаляционной травмы?
2. Какова терапевтическая тактика?
Задача №10
У больного ребенка 6 лет с химическим ожогом неизвестной жидкостью в области правой верхней конечности имеется раневая поверхность, покрытая коричневым некротическим струпом с тромбированными сосудами пораженного участка. Болевая чувствительность отсутствует.
1.На основании вышеуказанных определите природу химического агента и глубину поражения.
2. Объем помощи на догоспитальном этапе.
Задача №11
У больного имеются термические ожоги пламенем I-II-III А степеней на площади 35% поверхности тела. Ожоговые раны локализованы на лице, шее, передней поверхности туловища. На лице, шее имеется отек мягких тканей. Дыхание через нос и рот затрудненное, шумное. Видны опаленные волосы в носовых ходах.
1.Тактика врача-реаниматолога.
2. Выполнение каких диагностических мероприятий необходимо для установления клинического диагноза?
Задача №12
В ожоговое отделение поступил ребенок в возрасте 2 лет. Из анамнеза: за 1,5 часа до поступления ребенок остался без внимания и выпил горячую жидкость. Отмечаются явления гиперсаливации, рвота, осиплость голоса.
Сформулируйте правильный диагноз и определите необходимый объем лечения.
Задача №13
В отделение комбустиологической реанимации поступил ребенок в возрасте 3 лет с диагнозом: «Термический ожог горячей жидкостью лица, шеи, туловища, обеих верхних и нижних конечностей I-II-III А степеней. S-50% п.т. Индекс Франка-50 единиц. Шок III степени».
S-50% п.т. Индекс Франка-50 единиц. Шок III степени».
Определите объем инфузионной терапии на 1 сутки.
Задача №14
Больной 28 лет поступил в отделение ожоговой реанимации с термическим ожогом I-II-III АБ степеней общей площадью 45% п.т., площадь глубокого ожога составляет 15% п.т. Через 48 часов констатированы выход из шокового состояния и начало стадии острой ожоговой токсемии.
На основании каких параметров констатирован выход больного из состояния ожогового шока?
Задача №15
Больной 42 лет с термическим поражением пламенем лица, шеи, туловища, верхних и нижних конечностей I-II-III АБ степеней. S-50 (25)% п.т., термоингаляционной травмой I степени. В ЦРБ проводилась противошоковая терапия в течение 3-х суток. Предстоит транспортировка пациента в региональный ожоговый центр.
1. Какие параметры свидетельствуют о выходе пациента из состояния ожогового шока?
2. Перечислите правила транспортировки ожоговых больных.
Задача №16
Больной 38 лет поступил в отделение ожоговой реанимации с тяжелой комбинированной травмой: термический ожог I-II-III АБ степеней общей площадью 35% п.т., площадь глубокого ожога составляет 15% п.т.; кататравма, тупая травма живота, разрыв селезенки, внутрибрюшное кровотечение, травматический шок 3 ст. Пострадавшему предстоит экстренное оперативное вмешательство.
Определите анестезиологическую тактику.
Список использованной литературы:
1. Интенсивная терапия. Национальное руководство. Том 1. ГЭОТАР- МЕДИА. 2009.
2. Интенсивная терапия. Национальное руководство. Том 2. ГЭОТАР-МЕДИА. 2009.
3. Анестезиология. Национальное руководство. Под ред. академика РАМН А.А. Бунятяна. М. «ГЭОТАР — МЕДИА». 2011г.
4. Сумин С.А. Неотложные состояния. ООО Мединформагентство. 2010г.
5. Руководство по скорой медицинской помощи. Под ред. С.Ф. Багненко, А.П. Верткина и др. М.: ГЭОТАР-МЕДИА. 2010 г. – 816с.
2010 г. – 816с.
6. Анестезиология и реаниматология: Руководство/ Под редакцией профессора Ю. С. Полушина.-СПб.: «ЭЛБИ-СПб»,2004-720 с.
7. Анестезия и интенсивная терапия у детей. 2-е издание, пер. и доп./В.В. Курек.-М.: Мед.лит.,2010.-448 с.
8. Неотложная помощь при термической травме / Н.В. Островский, В.Б. Бабкин, И.Б. Белянина и др. — Саратов: Изд-во СМУ, 2006. — 35 с.
9. Патогенез типовых реакций организма на травму / Н.П. Чеснокова, П.В. Глыбочко, В.Ю. Барсуков и др. — Саратов: Изд-во СМУ, 2011. — С. 146-222. 1. Алексеев А.А. с соавт. Проблемы организации и состояние специализированной помощи обожженным в России // Материалы I съезда комбустиологов России. Москва, 2005, С. 3.
Диурис
Пользователи также искали:
диурез у детей,
форсированный диурез,
ночной диурез,
почасовой диурез норма,
положительный диурез,
суточный диурез как записывать,
суточный диурез таблица образец,
суточный диурез у детей,
диурез,
детей,
суточный,
диурез у детей,
суточный диурез у детей,
положительный диурез,
ночной диурез,
форсированный диурез,
почасовой диурез норма,
образец,
положительный,
ночной,
форсированный,
почасовой,
норма,
таблица,
записывать,
суточный диурез как записывать,
Диурис,
суточный диурез таблица образец,
диурис,
биологические статьи без itis. диурис,
диурис,
…
%d0%b4%d0%b8%d1%83%d1%80%d0%b5%d0%b7%20%d1%81%d1%83%d1%82%d0%be%d1%87%d0%bd%d1%8b%d0%b9 — со всех языков на все языки
Все языкиАбхазскийАдыгейскийАфрикаансАйнский языкАканАлтайскийАрагонскийАрабскийАстурийскийАймараАзербайджанскийБашкирскийБагобоБелорусскийБолгарскийТибетскийБурятскийКаталанскийЧеченскийШорскийЧерокиШайенскогоКриЧешскийКрымскотатарскийЦерковнославянский (Старославянский)ЧувашскийВаллийскийДатскийНемецкийДолганскийГреческийАнглийскийЭсперантоИспанскийЭстонскийБаскскийЭвенкийскийПерсидскийФинскийФарерскийФранцузскийИрландскийГэльскийГуараниКлингонскийЭльзасскийИвритХиндиХорватскийВерхнелужицкийГаитянскийВенгерскийАрмянскийИндонезийскийИнупиакИнгушскийИсландскийИтальянскийЯпонскийГрузинскийКарачаевскийЧеркесскийКазахскийКхмерскийКорейскийКумыкскийКурдскийКомиКиргизскийЛатинскийЛюксембургскийСефардскийЛингалаЛитовскийЛатышскийМаньчжурскийМикенскийМокшанскийМаориМарийскийМакедонскийКомиМонгольскийМалайскийМайяЭрзянскийНидерландскийНорвежскийНауатльОрокскийНогайскийОсетинскийОсманскийПенджабскийПалиПольскийПапьяментоДревнерусский языкПортугальскийКечуаКвеньяРумынский, МолдавскийАрумынскийРусскийСанскритСеверносаамскийЯкутскийСловацкийСловенскийАлбанскийСербскийШведскийСуахилиШумерскийСилезскийТофаларскийТаджикскийТайскийТуркменскийТагальскийТурецкийТатарскийТувинскийТвиУдмурдскийУйгурскийУкраинскийУрдуУрумскийУзбекскийВьетнамскийВепсскийВарайскийЮпийскийИдишЙорубаКитайский
Все языкиАбхазскийАдыгейскийАфрикаансАйнский языкАлтайскийАрабскийАварскийАймараАзербайджанскийБашкирскийБелорусскийБолгарскийКаталанскийЧеченскийЧаморроШорскийЧерокиЧешскийКрымскотатарскийЦерковнославянский (Старославянский)ЧувашскийДатскийНемецкийГреческийАнглийскийЭсперантоИспанскийЭстонскийБаскскийЭвенкийскийПерсидскийФинскийФарерскийФранцузскийИрландскийГалисийскийКлингонскийЭльзасскийИвритХиндиХорватскийГаитянскийВенгерскийАрмянскийИндонезийскийИнгушскийИсландскийИтальянскийИжорскийЯпонскийЛожбанГрузинскийКарачаевскийКазахскийКхмерскийКорейскийКумыкскийКурдскийЛатинскийЛингалаЛитовскийЛатышскийМокшанскийМаориМарийскийМакедонскийМонгольскийМалайскийМальтийскийМайяЭрзянскийНидерландскийНорвежскийОсетинскийПенджабскийПалиПольскийПапьяментоДревнерусский языкПуштуПортугальскийКечуаКвеньяРумынский, МолдавскийРусскийЯкутскийСловацкийСловенскийАлбанскийСербскийШведскийСуахилиТамильскийТаджикскийТайскийТуркменскийТагальскийТурецкийТатарскийУдмурдскийУйгурскийУкраинскийУрдуУрумскийУзбекскийВодскийВьетнамскийВепсскийИдишЙорубаКитайский
При составлении программы инфузионной терапии следует определить режим ИТ.

1.Гипоинфузионный режим или режим дегидратации (уменьшение объема вводимой жидкости при ОСН застойного типа, отеке мозга, отеке легких. Важной частью терапии при этом режиме является использование диуретиков. Каждый час количество введенной жидкости должно быть равно объему мочи, выделенному в предыдущий час. В этом случае ребенок не будет перегружен жидкостью, так как образуется разница между величиной диуреза и объемом инфузии за счет потерь на перспирацию.
РДГ 50-75% от физиологической потребности.
2.Нормоинфузионный режим или режим нормогидратации (исходя из ФП ( физиологические потери) = (почасовой диурез + объем на перспирацию) + патологические потери.
3.Гиперинфузионный режим или режим регидратации (у ребенка обезвоживание, необходимо определить дополнительные потребности с учетом Ht).
РГГ= ФП+ПП + суточный диурез (составляет 70% от ФП)
Гематокрит- отношение объема форменных элементов крови к объему плазмы. Гематокритное число дает представление об общем объеме эритроцитов, характеризует степень гемоконцентрации или гемоделюции.
Дефицит H2O = Ht (больного)- Ht (норма)
: Ht (норма) х масса х % внеклеточной жидкости.
Дефицит H2O = Натрий (больного)- натрий (норма): Натрий (норма) х масса тела ребенка х % внеклеточной жидкости.
Дефицит жидкости можно определить по острому снижению массы, но надо знать исходный уровень массы, что не всегда представляется возможным.
Процент внеклеточной жидкости:
Новорожденный 50%
грудной 40%
от 2 до 5 лет- 30%
старше 5 лет 20%
Гематокритная величина у детей различного возраста. MM Wintrobe (1962)
| Возраст | Гематокритная величина |
| 1 день | 0.54 |
| 2-3 день | 0.535 |
| 4-8 день | 0. 525 525
|
| 9-13 день | 0.49 |
| 14-60 день | 042 |
| 3-5 мес. | 0.36 |
| 6-11 мес. | 0355 |
| 1 год | 0.35 |
| 3 года | 0.36 |
| 4-5 лет | 0.37 |
| 10-15 лет | 0.39 |
В настоящее время лучшим методом для поддержания и стабилизации кровообращения при различных неотложных состояниях признается гемодилюция. Она основана на увеличении ОЦК за счет плазменного компонента с помощью переливания разных инфузионных сред. Цель снизить гематокрит и улучшить текучесть крови, за счет снижения ее вязкости, улучшении реологических свойств крови. Снижение гематокрита до 30% является разумным компромиссом между улучшением текучести и уменьшением способности к переносу кислорода. Улучшается микроциркуляция, уменьшается ОПСС и облегчается работа сердца.
Определение скорости введения жидкости.
Большое значение в проведении ИТ имеет поддержание оптимальной скорости введения жидкости.
Если используются специальные устройства, то определяется часовая нагрузка. Например, нужно ввести 1000 мл за 20 часов, то скорость будет 50 мл\час. Соответственно в каплях
N= V : 3х T; 1200 (10 кг): 20 часов = 60 мл\час: 3= 20 кап\мин.
Скорость инфузионной терапии не есть (константа) величина постоянная, она может меняться в зависимости от ситуаций: возрастают ПП, скорость инфузии возрастает. Ребенок начал пить жидкость, возможен вариант уменьшения инфузионной терапии.
Частная инфузионная терапия.
Инфузионная терапия при сердечной недостаточности.
Ограничения жидкости при острой сердечной недостаточности. Объем определяется степенью декомпенсации.
При 1 степени — ФП. Инфузионная терапия проводится при невозможности энтерального введения.
Инфузионная терапия проводится при невозможности энтерального введения.
при 2 степени – 80% от ФП
при 3 степени- 50% от ФП. (препараты 10% глюкозы)
Острая почечная недостаточность.
Объем инфузии при олигоурии = диурез + величина перспирационных потерь 25мл\кг\сутки (1,2мл\кг\час)
Объем инфузии при анурии= перспирационные потери (препараты глюкозы).
Метод форсированного диуреза (возможно использование как объема так и использованиемочегонных препаратов) — увеличение водной нагрузки (зондовое или внутривенное введение жидкости) при одновременном использовании диуретиков для выведения лекарственных препаратов, ядов и их метаболитов с мочой. Метод используется только при отсутствии почечной недостаточности.
Форсированный диурез осуществляется в трех режимах:
1.дегитратация
2.нормогидратация
3.регидратация: (диурез за предыдущий час + потери на перспирацию+ ПП + дефицит внеклеточной жидкости ) : 24
Дефицит внеклеточной жидкости по Л.Рачеву.
Для проведения форсированного диуреза основными растворами являются 5-10 % глюкоза, физ. раствор, раствор Рингера, дисоль, ацесоль, лактосоль и другие изотонические растворы кристаллоидов. Соотношение 5% глюкозы и физ.раствора 1:1.
Скорость введения жидкости при легкой степени отравления 5-6 мл\кг\час (зондовое введение), среднетяжелой степени отравления 7-10 мл\кг\час (50% зонодовое и 50% в\венное), тяжелой степени отравления 10-15-20 мл\кг\час.
Стимуляция диуреза (лазикс, фуросемид) дозы 2-3 мг\кг и более каждые 4-6-8 часов.
Ощелачивание мочи гидрокарбонатом натрия (рН > 8), например, при отравлении барбитуратами. Программа лечения рассчитана на первые сутки (чаще 12-18 часов).
Что-то типа методики расчета докорма по объему мочи: meridian_30 — LiveJournal
В зарубежной литературе есть такие критерии достаточности высасываемого ребенком молока:от 0 до 6 недель
— ребенок нормально набирает
что такое «нормальный» набор я писала здесь.
 Помним, что нормальный набор, это не только то, что выше зеленой линии, но и то, что ниже ее)
Помним, что нормальный набор, это не только то, что выше зеленой линии, но и то, что ниже ее)— ребенок мочит более 5-6 подгузников в сутки
под мокрым подгузником зарубежные источники недвусмысленно имеют ввиду 45 мл мочи, то есть как минимум 225-270 мл мочи в сутки
это для ребенка старше недели
Вот, тут все понятно. А вот что с ребенком старше 6 недель… уже не так понятно. Информации по суточному объему мочи практически никакой, что в наших источниках, что в зарубежных.
[Нашла вот такие цифры]
Суточный диурез. Составляет 60-70% от ФП человека в воде и для взрослого человека равен 1500-1800 мл. Кроме того, у детей суточный диурез можно рассчитать по следующим формулам:
До 1 года = 300 + 25 х (n – 1), где n – число месяцев.
До 5 лет = 600 + 100 х п, где п – число лет.
После 5 лет = 400 + 100 х п, где п – число лет.
Почасовой диурез в мл/час и на 1 кг массы тела (мл/кг/час):
1 мес – 15,0(3,0) 7 лет – 45,0(2,0)
6 мес – 20,0(3,0) 10 лет – 55,0(1,5)
1 год – 30,0(2,5) 14 лет – 60,0(1,2)
3 года – 30,0(2,0) Взросл. – 80,0 (1,2)
Нарушения диуреза. Проявляются олигурией, олигоанурией и анурией:
— олигурия: диурез менее 50% возрастной нормы (меньше 0,5-1,5 кг/ ч)
ИсточникТо есть имея, к примеру, 5 месячного ребенка весом 5200 (да, это небольшая девочка, но ведь не зря же мама думает о докорме) прикинем, сколько бы она должна писать
по возрасту
300 + 25 х (5-1) = 400 мл
по весу
3 х 5.2 х 24 = 374 мл
Цифры похожие и это хорошо)
Но это — средние цифры, а не минимальные. Минимальные соответственно 200 и 187 мл.
Вероятно, если мы вводим докорм, то диурез должен быть где-то посредине. Не крайний минимум, но и не обязательно все 400 мл.
Я бы остановилась на цифре 300.
Предположим, что у девочки в наличии 250 мл в сутки.
Итого 50 мл не хватает, чтоб мама была спокойна.
Если диурез составляет 60-70% от полученой жидкости, расчитаем, сколько этой самой жидкости надо получить, чтобы на выходе было 50 мл
дополнительной мочи.
50мл = 60%
х = 100%
Нехитрая пропорция: 50х100/60=85мл жидкости
В грудном молоке 87% жидкости. Предполагаю, что в смеси где-то столько же.
Итак, еще одна нехитрая пропорция по расчету количества смеси.
85мл = 87%
х = 100%
85х87/100=97мл смеси
Все вышенаписанное — это расчет вполне конкретной практической задачки.
Имеется мама, которая переживает о количестве молока.
Имеется девочка, которая немного набирает.
Девочка писает нормальное количество раз, но маму волнует объем мочи.
Девочка нормально развивается, но мама все равно волнуется.
Маме интересно откуда берутся цифры докорма. Мне тоже интересно.
Так как я не знаю, как это принято делать в консультантской практике, то попробовала посчитать с точки зрения обычной логики.
Посему я буду очень рада любым комментариям и замечаниям.
Определение почасового диуреза влияет на зарегистрированную частоту и стадию острого повреждения почек | BMC Nephrology
При использовании только SCr частота ОПП при кардиохирургии (все стадии) составила 23,8%, что соответствует опубликованным исследованиям. Недавний метаанализ, охватывающий период с 2004 по 2014 год, показал аналогичную заболеваемость 22,3% (13,6% стадия 1, 3,8% стадия 2 и 2,7% стадия 3) с 2,3% пациентов, нуждающихся в ЗПТ [18]. Частота ОПП в отделениях интенсивной терапии с использованием SCr была ниже, чем можно было бы предсказать из опубликованных данных.В исследовании AKI-EPI изучались международные данные для оценки заболеваемости ОПП, сообщалось о частоте чуть менее 60% у пациентов в критическом состоянии [1]. Заболеваемость ОПП в популяции нашего отделения интенсивной терапии составила всего 32%. Это может быть объяснено тем, что наша когорта ОИТ включает 21% нейрохирургических пациентов, поскольку известно, что в этой подгруппе частота ОПП относительно низка по сравнению с обычными взрослыми пациентами ОИТ.
Когда UO был включен в диагностические критерии ОПП, заболеваемость возросла в обеих группах. Больший эффект был замечен в кардиохирургии.Существовала значительная разница в зависимости от того, какой метод измерения UO использовался. UO против привел к небольшому увеличению ОПП в обеих группах. Несмотря на увеличение заболеваемости ОПП при использовании UO и , было лишь небольшое отклонение от опубликованной заболеваемости в кардиохирургии; в ОИТ заболеваемость поднялась до уровня, сопоставимого с опубликованными данными. Когда использовалось среднее значение UO , частота ОПП в кардиохирургии резко возросла; общая заболеваемость превысила 70%, что значительно выше, чем в большинстве опубликованных исследований.Этот вывод согласуется с результатами, полученными Koeze et al. которые обнаружили, что использование UO вместе с SCr может увеличить частоту ОПП до 50% [4]. Это говорит о том, что среднее значение для UO значительно переоценивает частоту ОПП в кардиохирургии. Подобный рост заболеваемости ОПП также присутствует, хотя и в меньшей степени, в группе ОИТ, когда критерии UO дополнительно рассматриваются вместе с SCr. Взятые вместе, эти данные позволяют предположить, что использование среднего диуреза может привести к гипердиагностике посткардиальной хирургии ОПП.Хотя эта группа пациентов была тщательно изучена в отношении ОПН, несколько исследований включали критерии UO для определения и определения стадии ОПН. Это может объяснить отсутствие этого открытия в литературе и подчеркивает важность использования конкретных и последовательных критериев UO.
Воздействие использования UO было особенно очевидным, когда диагноз AKI был стратифицирован по стадиям AKI. И UO cons , и UO среднее значение привели к увеличению заболеваемости KDIGO стадии 1, но UO cons оказали незначительное влияние на заболеваемость KDIGO стадии 2–3 AKI в любой группе.Повышенная частота 1 стадии KDIGO оказывает меньшее клиническое воздействие, поскольку связана с меньшим количеством и менее серьезными неблагоприятными исходами и иногда исключается из крупных клинических исследований ОПП, таких как TRIBE-AKI [19]. UO означает повышенную частоту ОПП 2 стадии по KDIGO в обеих группах, причем больший эффект снова наблюдается в группе кардиохирургических вмешательств. Это, по-видимому, приводит к гипердиагностике AKI 2 стадии по KDIGO. В отделениях интенсивной терапии это коррелировало со снижением числа людей с диагнозом ОПП 1 стадии по KDIGO.Это говорит о том, что UO , среднее значение , не только ведет к гипердиагностике ОПП, но и может привести к ошибочной классификации как стадии 2 по KDIGO. Кроме того, поскольку диурез является критерием результата, скорректированным с учетом веса тела, то точное измерение веса тела, скорее, чем оценка «идеальной» массы тела, также может увеличить заболеваемость ОПП в определенных клинических условиях, таких как ОИТ [20]. Возможные последствия этого могут включать несоответствующее начало ЗПТ и неправильную классификацию в клинических исследованиях ОПП.Важно, чтобы этот риск был признан, поскольку средний UO — единственный способ измерения UO у большинства медицинских пациентов, у которых нет мочевого катетера in situ, и в палатах, где UO можно измерять реже, чем ежечасно.
UO означает повышенную частоту ОПП 2 стадии по KDIGO в обеих группах, причем больший эффект снова наблюдается в группе кардиохирургических вмешательств. Это, по-видимому, приводит к гипердиагностике AKI 2 стадии по KDIGO. В отделениях интенсивной терапии это коррелировало со снижением числа людей с диагнозом ОПП 1 стадии по KDIGO.Это говорит о том, что UO , среднее значение , не только ведет к гипердиагностике ОПП, но и может привести к ошибочной классификации как стадии 2 по KDIGO. Кроме того, поскольку диурез является критерием результата, скорректированным с учетом веса тела, то точное измерение веса тела, скорее, чем оценка «идеальной» массы тела, также может увеличить заболеваемость ОПП в определенных клинических условиях, таких как ОИТ [20]. Возможные последствия этого могут включать несоответствующее начало ЗПТ и неправильную классификацию в клинических исследованиях ОПП.Важно, чтобы этот риск был признан, поскольку средний UO — единственный способ измерения UO у большинства медицинских пациентов, у которых нет мочевого катетера in situ, и в палатах, где UO можно измерять реже, чем ежечасно.
Наши результаты демонстрируют, что любой метод UO, использованный независимо от сывороточного креатинина, не помогал идентифицировать AKI. Это согласуется с данными метаанализа TRIBE-AKI, который обнаружил, что AUROC для послеоперационной UO в качестве маркера AKI был всего 0.59 [19]. Использование UO независимо от SCr также неэффективно для прогнозирования исходов, связанных с продолжительностью пребывания в стационаре, потребностью в ЗПТ и смертностью [9]. В то время как UO cons менее вероятно, чем UO mean для переоценки заболеваемости ОПП, на чувствительность влияют клинические факторы, влияющие на UO, такие как жидкие болюсы или диуретики. Пациенты с истинной олигурией могут иметь временное увеличение UO, что означает, что они больше не соответствуют критериям почасовой активности. Отсутствие олигурии само по себе не исключает ОПП, поскольку неолигурическая ОПП (например,грамм. контрастно индуцированная ОПП) является обычным явлением [12].
контрастно индуцированная ОПП) является обычным явлением [12].
Повышенная чувствительность и высокая частота ложных срабатываний при использовании среднего UO могут также зависеть от клинических факторов, таких как непроходимость мочевыводящих путей или недостаточная инфузия жидкости, которые могут повлиять на UO независимо от функции почек или повреждения. Это наблюдение было также сделано Ралибом и др., Которые критиковали критерии KDIGO UO как слишком либеральные [8]. Чтобы отразить клубочковую фильтрацию, пациент должен получить адекватную гидратацию, прежде чем UO может быть полезен.Классификация AKIN учитывает этот момент, но на практике трудно определить «адекватную» гидратацию [21]. Изменения UO могут быть физиологическими и представлять не заболевание, а скорее саморегулирующую реакцию [22]. Исследование, проведенное Соломоном в отделении интенсивной терапии Великобритании, показало, что 22% младших врачей страдали физиологической олигурией и были более склонны к олигурии, чем их пациенты [23].
Различные эффекты в кардиохирургии и интенсивной терапии двух методов измерения UO предполагают, что на UO влияют клинические переменные в разных группах пациентов.Важно, чтобы это было признано, особенно с учетом того факта, что средний UO обычно используется в большинстве медицинских учреждений из-за практических аспектов ведения пациентов (избегание ненужной катетеризации мочи), клинического персонала и финансовых ограничений. Насколько нам известно, ни одно из предыдущих исследований не сравнивало использование UO в отделениях интенсивной терапии с пациентами, перенесшими кардиохирургические операции для диагностики ОПП.
Ограничения этого исследования включали его ретроспективный дизайн (как часть обсервационного исследования по изучению новых биомаркеров ОПП) и тот факт, что оно проводилось в одном центре, хотя изучались две отдельные клинические когорты.Использование SCr в качестве золотого стандарта для определения ОПП является хорошо задокументированным ограничением большинства исследований заболеваемости ОПП, поскольку SCr считается поздним и плохим маркером ОПП. Кроме того, использование диуретиков было относительно высоким при кардиохирургических операциях. Доза и частота приема диуретиков могут затруднить анализ диуреза. Мы не сравнивали наши результаты с маркерами повреждения канальцев или функцией «биомаркеров ОПП», потому что они были подтверждены только в определенных клинических условиях и еще не используются в повседневной практике.
Кроме того, использование диуретиков было относительно высоким при кардиохирургических операциях. Доза и частота приема диуретиков могут затруднить анализ диуреза. Мы не сравнивали наши результаты с маркерами повреждения канальцев или функцией «биомаркеров ОПП», потому что они были подтверждены только в определенных клинических условиях и еще не используются в повседневной практике.
Калькулятор диуреза
Наш калькулятор диуреза покажет вам простой способ вычисления суточного диуреза. Наш инструмент снабдит вас балансом жидкости вашего пациента и диурез в мл / кг / час .
В статье ниже мы поговорим о значении нормального диуреза в час, , обезвоживании и общем объеме воды в организме. Мы также научим вас рассчитывать диурез в мл / кг / час. 💧
Как пользоваться калькулятором диуреза?
Для расчета количества диуреза вам понадобятся следующие данные:
возраст вашего пациента ;
вес вашего пациента ;
Период время , в течение которого была собрана моча;
Моча диурез — объем мочи, собранной за данный период времени;
потребление жидкости вашим пациентом за заданный период времени; и
Готово! Наш калькулятор предоставит вам как баланс жидкости , так и показатель диуреза вашего пациента! 🚰
Вы получите уведомление , если количество мочи вашего пациента за час указывает на острое повреждение почек .
Наш калькулятор сообщит вам , если ваш пациент страдает олигурией (писает меньше обычного) или полиурией (слишком часто пропускает воду).
Теперь пора пойти еще на один шаг :
Как рассчитать диурез в мл / кг / час?
Если вы хотите быть лучше нашего калькулятора мл / кг / час, вам нужно практиковать ! Следуйте нашей подробной инструкции и примерам расчета диуреза:
Определите вес вашего пациента, возраст, диурез и период, в течение которого собиралась моча.
 Нашему пациенту 20 лет, он весит 80 кг, и 2e собрал 3 л (3000 мл) мочи в течение 24-часового периода наблюдения.
Нашему пациенту 20 лет, он весит 80 кг, и 2e собрал 3 л (3000 мл) мочи в течение 24-часового периода наблюдения.Используйте следующее уравнение, чтобы вычислить, сколько мочи выделяется в час:
Диурез (мл / кг / час) = Собранная моча / (Вес * Время)
Где,
- Масса указана в килограммах (кг) ;
- Собранная моча дается в миллилитрах (мл) ; и
- Время указано в часах
Данные нашего пациента:
x = 3000 / (80 * 24) = 3000/1920
х = 1.56 мл / кг / час
- Используйте возраст пациента, чтобы определить, находится ли диурез в пределах нормы.
Посмотрите нашу таблицу со значениями диуреза, характерными для здорового человека и человека с поли / олигурией.
Пациенту больше 18 лет — диурез 1,56 мл / кг / час, что в пределах нормы.
Эй, молодец! 🎉
Баланс жидкости
Баланс жидкости информирует вас, поддерживает ли ваш пациент общий объем воды в организме.Он позволяет корректировать потребление жидкости как перорально, так и внутривенно. В случае обезвоживания значение баланса жидкости отрицательное . Обычный человек испытывает симптомы обезвоживания после потери примерно 7% общего количества воды в организме или 5% своего веса.
Баланс жидкости = Потребление жидкости - Собранная моча
Все переменные указаны в миллилитрах (мл) .
Вы также можете проверить:
| 💡 Помните, что ваш пациент может потерять значительное количество воды через легкие, кожу и стул — особенно при повышенной температуре тела. |
Каков нормальный почасовой диурез?
Каков минимальный диурез в час у здоровых взрослых и детей? Узнайте с помощью одной из таблиц ниже!
| Моча (мл / кг / ч) | Значение | ||
| <0,5 | Олигоурия | ||
| 0,5 — 5 | Здоровый человек |
| Диурез (мл / кг / ч) | Значение |
| <1 | Олигурия |
| Полиурия |
Определение почасового диуреза для отчета о заболеваемости ОПП
Острое повреждение почек (ОПП) определяется как повышение уровня креатинина в сыворотке и / или снижение диуреза как суррогатные маркеры снижения скорости клубочковой фильтрации. Начиная с 2012 года, критерии из Руководства по клинической практике острой почечной недостаточности по заболеванию почек: улучшение глобальных результатов (KDIGO) стали стандартом для определения и определения стадии ОПП. Определение KDIGO включает олигурию, определяемую как объем мочи <0,5 мл / кг в час в течение 6 часов.
Начиная с 2012 года, критерии из Руководства по клинической практике острой почечной недостаточности по заболеванию почек: улучшение глобальных результатов (KDIGO) стали стандартом для определения и определения стадии ОПП. Определение KDIGO включает олигурию, определяемую как объем мочи <0,5 мл / кг в час в течение 6 часов.
Поскольку с помощью диуреза (ММ) можно обнаружить ОПП раньше, результаты предыдущего исследования показали, что ОПП может обнаружить ОПП на 11 часов раньше, чем креатинин сыворотки. Нет четкого консенсуса относительно того, следует ли измерять UO с использованием последовательных почасовых показаний или среднего выхода, что делает определение KDIGO UO и стадию AKI потенциально несовместимыми. Jennifer C. Allen и его коллеги провели исследование, чтобы определить, влияет ли на заболеваемость и стадию ОПП способ определения UO. Результаты исследования были опубликованы в Интернете в BMC Nephrology [doi.org/10.1186/s12882-019-1678-2].
Исследователи провели ретроспективный анализ двух одноцентровых наблюдательных исследований с целью изучения новых биомаркеров мочи. В анализ были включены пациенты, поступившие в отделение интенсивной терапии сердца после кардиохирургической операции или в отделение общей интенсивной терапии (ОИТ), чтобы определить, влияют ли различные методы измерения UO на зарегистрированную частоту ОПП, стратифицированную по стадиям (этапы 1-3).Креатинин сыворотки был использован как золотой стандарт классификации ОПП.
Исследователи проанализировали данные 151 пациента, перенесшего операцию на сердце, и 150 пациентов, поступивших в отделение интенсивной терапии. Кардиохирургические процедуры включали операцию клапана (45%), коронарного шунтирования (АКШ; 30%), АКШ без помпы (11%), комбинированного клапана и АКШ (11%), хирургии корня аорты (2%) и другие операции (1%). Из 151 процедуры 62% были обычными, а 38% — срочными.
Из 150 госпитализированных отделений интенсивной терапии 34% были медицинскими, 21% — нейрохирургическими, 17% — травматическими, 15% — плановыми хирургическими и 14% — неотложными хирургическими вмешательствами.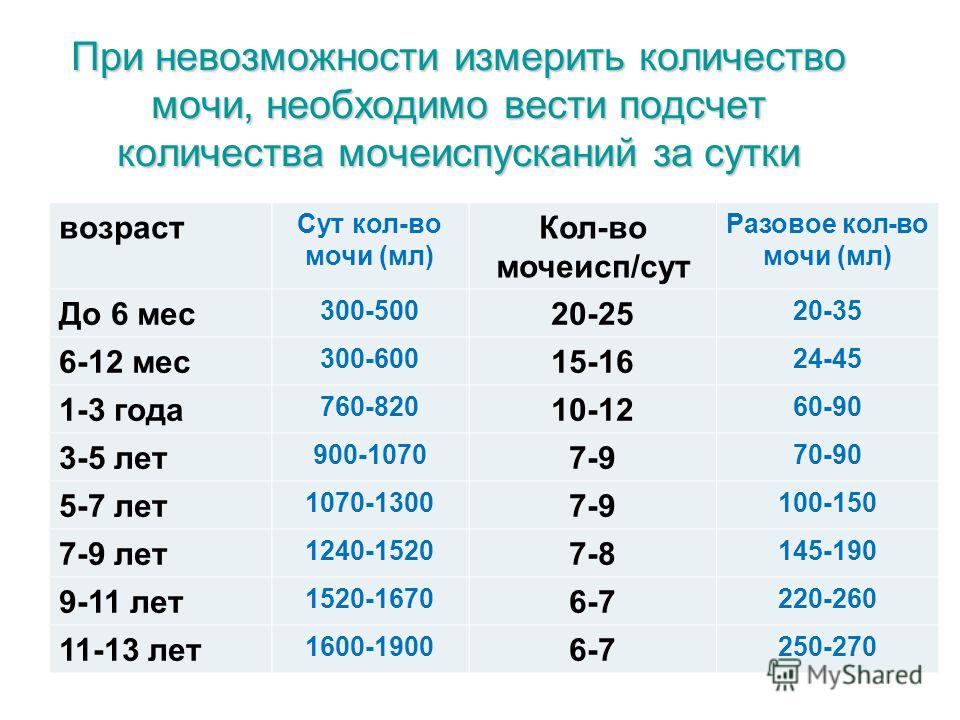 По сравнению с пациентами, поступившими в отделение интенсивной терапии, пациенты из кардиохирургической группы были старше ( P, <0,001) и имели более высокую частоту хронической болезни почек ( P, <0,001) и других сопутствующих заболеваний. Курение было обычным явлением в обеих группах, и примерно 50% курили какое-то время. Частота сепсиса была значительно выше у пациентов в отделении интенсивной терапии по сравнению с таковыми в группе кардиохирургических вмешательств (27,3% против 1,3%; P <0,001).
По сравнению с пациентами, поступившими в отделение интенсивной терапии, пациенты из кардиохирургической группы были старше ( P, <0,001) и имели более высокую частоту хронической болезни почек ( P, <0,001) и других сопутствующих заболеваний. Курение было обычным явлением в обеих группах, и примерно 50% курили какое-то время. Частота сепсиса была значительно выше у пациентов в отделении интенсивной терапии по сравнению с таковыми в группе кардиохирургических вмешательств (27,3% против 1,3%; P <0,001).
Наблюдались значительные различия в частоте возникновения ОПН в соответствии с используемым определением ОПН.На основании только сывороточного креатинина / заместительной почечной терапии у 23,8% кардиохирургических пациентов развился ОПП (все стадии). В отделении интенсивной терапии, используя то же определение, у 32% пациентов развился ОПП. Когда диагноз включал UO, а также креатинин сыворотки, частота ОПП значительно увеличивалась.
Наибольший эффект был отмечен среди пациентов кардиохирургической группы. Частота ОПП у кардиохирургических пациентов выросла с 23,8% при использовании только креатинина сыворотки до 39,8% при использовании UO cons (почасовой диурез, при котором каждый последующий час соответствовал критериям KDIGO) и до 72.9% с использованием UO означает (средняя часовая производительность, измеряемая каждые 6, 12 и 24 часа). Среди пациентов в отделении интенсивной терапии наблюдалось аналогичное увеличение заболеваемости ОПП: с 32% до 51,4% при использовании UO против и до 69,3% при использовании среднего значения UO .
Когда UO использовался в сочетании с сывороткой креатинина / заместительной почечной терапией для стратификации ОПП по степени тяжести, наблюдалось значительное изменение доли пациентов, распределенных на каждую стадию среди пациентов в группе кардиохирургии по сравнению с группой ICU.В обеих клинических условиях, при использовании только креатинина сыворотки, наиболее распространенной категорией была ОПП 1 стадии (15,9% в кардиохирургии против 14,6% в ОИТ). Когда UO был добавлен к диагностическим критериям с использованием UO против , частота ОПП 1 стадии удвоилась в обеих группах.
Когда UO был добавлен к диагностическим критериям с использованием UO против , частота ОПП 1 стадии удвоилась в обеих группах.
Не было различий в группе кардиохирургических вмешательств в частоте ОПП 1 стадии между UO cons и UO в среднем . В отделении интенсивной терапии частота ОПП 1 стадии была снижена при использовании UO , среднее значение (UO , среднее значение 19.3% против UO против 28%).
В обеих группах частота ОПП 2 стадии была низкой при использовании креатинина сыворотки (1,9% при кардиохирургии против 7,3% в отделении интенсивной терапии). Когда применялся UO cons , наблюдалось умеренное увеличение частоты ОПП 2 стадии (3,3% в кардиохирургии, 12,7% в отделении интенсивной терапии). Было отмечено резкое увеличение частоты ОПП 2 стадии при использовании UO , среднее значение : увеличение на 33,8% в кардиохирургических операциях и на 29,4% в отделениях интенсивной терапии. Не было различий в частоте возникновения ОПН 3 стадии при кардиохирургических вмешательствах с использованием любого метода измерения UO; в отделениях интенсивной терапии наблюдался небольшой рост ОПП 3 стадии (2.6%) при использовании UO среднее значение .
Исследователи указали на некоторые ограничения исследования, включая ретроспективный и одноцентровый дизайн, использование сывороточного креатинина в качестве золотого стандарта для определения ОПП и относительно высокое использование диуретиков среди кардиохирургической группы.
Таким образом, исследователи заявили: «Наше исследование демонстрирует, что зарегистрированная частота ОПН различается в зависимости от метода, используемого для документирования UO, и что степень этого эффекта варьируется между различными клиническими группами.Разъяснение метода расчета UO важно как для клинических, так и для исследовательских целей. Это одноцентровое исследование обеспечивает обоснование для проведения более крупного многоцентрового исследования с целью установления более конкретных критериев для определения ОПП ».
Пункты выноса
- Исследователи провели одноцентровый ретроспективный анализ двух одноцентровых наблюдательных исследований, чтобы выяснить, влияет ли способ измерения диуреза на частоту и стадию острого повреждения почек (ОПП).
- При использовании только креатинина сыворотки частота ОПП составила 23,8% среди пациентов, перенесших операцию на сердце, и 32% среди пациентов в отделении интенсивной терапии (ОИТ).
- Когда учитывался диурез, частота ОПП увеличивалась в обеих группах.
(PDF) Определение почасового диуреза влияет на зарегистрированную частоту и стадию острого повреждения почек.
. Классификация AKIN обращалась к этому пункту
, но на практике трудно определить «адекватную» влажность
[21].Изменения в UO могут быть физиологическими, и
не представляют собой заболевание, а скорее являются ауторегулирующими реакциями
[22]. Исследование, проведенное Соломоном в отделении интенсивной терапии Великобритании
, показало, что 22% младших врачей имели физио-
логическую олигурию и были более склонны к олигурии, чем
их пациентов [23].
Различные эффекты в кардиохирургии и интенсивной терапии двух методов измерения UO
позволяют предположить, что UO зависит от клинических переменных в разных группах пациентов.
важно, чтобы это было признано, особенно с учетом
того факта, что средний UO обычно используется в большинстве медицинских учреждений
из-за практических соображений ведения пациентов —
мент (предотвращение ненужной катетеризации мочи),
клинический персонал и ограничения по стоимости. Насколько нам известно
, ни одно из предыдущих исследований не сравнивало использование UO в отделении интенсивной терапии
с пациентами, перенесшими кардиохирургические операции, с целью
диагностики ОПП.
Ограничения этого исследования включали его ретроспективный признак de-
(как часть обсервационного исследования, изучающего новые биомаркеры
ОПП) и тот факт, что оно проводилось в одном центре
, хотя две отдельные клинические группы составляли
учился. Использование SCr в качестве золотого стандарта для определения AKI составляет
, что является хорошо задокументированным ограничением большинства исследований заболеваемости AKI
dence, поскольку SCr считается поздним и плохим маркером
AKI.Кроме того, использование диуретиков было относительно высоким в условиях кардиохирургии
. Доза и частота введения диуретика
могут затруднить анализ результатов анализа мочи
. Мы не сравнивали наши результаты с маркерами
повреждения канальцев или функцией как «биомаркеры AKI’be-
», потому что они были подтверждены только в определенных клинических исследованиях —
и еще не используются в повседневной практике.
Выводы
Наше исследование демонстрирует, что зарегистрированная частота ОПП
различается в зависимости от метода, использованного для документирования UO
, и что степень этого эффекта варьируется между различными клиническими группами
.Разъяснение метода расчета UO
важно как в клинических, так и в исследовательских целях.
Это одноцентровое исследование обеспечивает обоснование для проведения более крупного многоцентрового исследования с целью установления
более конкретных критериев для определения ОПП.
Сокращения
ОПП: острое повреждение почек; CICU: отделение интенсивной терапии сердца; ОИТ: отделение интенсивной терапии
; KDIGO: Заболевание почек: улучшение глобальных результатов; SCr: сыворотка
, креатинин; UO: диурез
Благодарности
Авторы благодарят исследовательскую группу DREEAM и персонал кардиологического отделения интенсивной терапии
Трент Кардиологического центра за их помощь в сборе данных.
Вклад авторов
Это исследование разработали JCA и MAJD; JCA, DSG и MAJD разработали исследование
и написали рукопись; DSG провела статистический анализ; JCA,
DSG, HS, DH, AS и MAJD получили данные, отредактировали и утвердили рукопись
.
Финансирование
В данной публикации представлены независимые исследования, проведенные при поддержке программы «Изобретения для инноваций» (i4i) Национального института исследований в области здравоохранения
(NIHR)
(II-LB-0216-20008).Выраженные взгляды принадлежат авторам, а не
обязательно взглядам NHS, NIHR или Министерства здравоохранения и
Social Care. Работа проводилась при поддержке благотворительных организаций Nottingham
University Hospitals и Nottinghamshire Kidney Units Appeal.
Ни один из спонсоров не участвовал и не влиял на дизайн исследования или
сбор, анализ и интерпретацию данных или написание рукописи.
Доступность данных и материалов
Исходные данные этого исследования доступны в Ноттингемском университете.
Архив ePrints по адресу http: // eprints.nottingham.ac.uk/
Утверждение этики и согласие на участие
Утверждение этики для 2 исследований было предоставлено Национальной службой здравоохранения по исследованиям в области здравоохранения
Комитет по этике научных исследований Ист-Мидлендс — Ноттингем 1,
ссылки 15 / EM / 0451 и 15 / EM / 0452. Письменное согласие было получено от
всех участников, способных его предоставить. ИЭК дал разрешение на набор
пациентов с ограниченными возможностями после обсуждения с консультантом пациента.
Согласие на публикацию
Не применимо.
Конкурирующие интересы
Авторы заявляют, что у них нет конкурирующих интересов.
Сведения об авторе
1
Nottingham Renal and Transplant Unit, Nottingham University Hospitals
NHS Trust, City Campus, Nottingham NG5 1PB, UK.
2
Медицинский факультет и
Медицинские науки, Школа ветеринарной медицины и науки, Университет
Ноттингем, кампус Саттон-Бонингтон, Лестершир LE12 5RD, Великобритания.
3
Трент
Кардиологический центр, Больницы Ноттингемского университета NHS Trust, Городской кампус,
Nottingham NG5 1PB, UK.
4
Департамент интенсивной терапии, Ноттингем
Университетские больницы NHS Trust, Городской кампус, Nottingham NG5 1PB, Великобритания.
Получено: 19 мая 2019 г. Принято: 30 декабря 2019 г.
Источники
1. Hoste EA, et al. Эпидемиология острого повреждения почек у пациентов в критическом состоянии:
, международное исследование AKI-EPI.Intensive Care Med. 2015; 41 (8): 1411–23.
2. Хваджа А. Руководство по клинической практике КДИГО при остром повреждении почек.
Nephron Clin. 2012; 120 (4): c179–84.
3. Деннен П., Парих ЧР. Биомаркеры острого повреждения почек: можно ли заменить
креатинином сыворотки? Clin Nephrol. 2007. 68 (5): 269–78.
4. Koeze J, et al. Частота, время и исход ОПП у пациентов в критическом состоянии
варьируются в зависимости от используемого определения и добавления критериев диуреза.
БМК Нефрол. 2017; 18 (1): 70.
5. Leedahl DD, et al. Определение пороговых значений диуреза, которые определяют очень высокий риск ОПП у пациентов с септическим шоком. Clin J Am Soc Nephrol. 2014;
9 (7): 1168–74.
6. Macedo E, et al. Олигурия является ранним предиктором более высокой смертности у
больных в критическом состоянии. Kidney Int. 2011; 80 (7): 760–7.
7. Kellum JA, et al. Классификация ОПП по диурезу и уровню креатинина
в сыворотке.J Am Soc Nephrol. 2015; 26 (9): 2231–8.
8. Md Ralib A, et al. Определение диуреза при остром повреждении почек слишком велико. Crit Care. 2013; 17 (3): R112.
9. Howitt SH, et al. Руководство KDIGO по острой травме почек для кардиохирургических
пациентов, находящихся в отделении интенсивной терапии: валидационное исследование. BMC Nephrol. 2018; 19 (1): 149.
10. Хусейн-Сайед Ф., Ронко К. Одиссея стратификации риска при острой почечной недостаточности
. Нат Рев Нефрол. 2018; 14: 660–2.
11. Макрис К., Спаноу Л. Острое повреждение почек: диагностические подходы и споры
. Clin Biochem Rev.2016; 37 (4): 153.
12. Macedo E, et al. Определение критерия диуреза при остром повреждении почек у
тяжелобольных. Пересадка нефрола Dial. 2011; 26 (2): 509–15.
13. Selby NM, et al. Стандартизация раннего выявления острого повреждения почек:
Национальное предупреждение безопасности пациентов Национальной службы здравоохранения Англии. Нефрон. 2015; 131 (2): 113–7.
Allen et al. BMC Nephrology (2020) 21:19 Стр. 7 из 8
Содержимое любезно предоставлено Springer Nature, применяются условия использования. Права защищены.
Протокол реанимации ожога | Медицинская школа Макговерна
| Исходная дата: 07/2017 Заменено: 10/2019 Дата последнего пересмотра: 1/2021 | Цель: Стандартизировать реанимацию взрослых ожоговых больных. |
Рекомендации
- Горение <20% TBSA
- Нет формальная жидкостная реанимация.
- Однако некоторым пациентам может потребоваться внутривенное введение жидкости из-за гиповолемии до травмы (например, алкогольной интоксикации, гипергликемии).
- Если у пациента есть фактор риска необходимости реанимации жидкостью внутривенно, установите катетер Фолея.
- Обеспечьте внутривенное введение жидкости по мере необходимости для поддержания диуреза 30-50 мл / час.
- Если диурез менее 30 см3 / час в течение двух часов подряд, сообщите об этом лечащему врачу.
- Ожог 20-29% TBSA
- Используемый кристаллоид: Isolyte
- Начальная скорость: 2 мл / кг /% TBSA
- Целевой диурез: 30-50 мл / час
- Титрование: каждый час
- Моча <30 мл / час - увеличение жидкости на 20%
- Диурез 30-50 мл / час — поддерживать текущую норму
- Моча> 50 мл / час — уменьшение жидкости на 20%
- Болюсы жидкости: не вводить болюсы
Пример: Мужчина весом 70 кг поступает в отделение неотложной помощи с ожогом 25% TBSA.Необходимое количество жидкостей рассчитывается следующим образом:
| 2 мл | Х | Вес 70 кг | Х | % TBSA 25% | = | Расчетная общая потребность в жидкости за первые 24 часа 3500 мл |
Затем оценочная сумма делится пополам, чтобы получить начальную ставку.
| Период времени | Том | Оценка | Округлить до ближайшего 10 мл |
| Первые 8 часов | 3500 мл / 2 = 1750 мл | 1750 мл / 8 часов = 218.75 мл / час | 220 мл / час |
- Ожог ≥30% TBSA
- Выбор реанимационных жидкостей:
- Изолит, плазмалит или лактатные звонаги
- Свежезамороженная плазма (СЗП)
- Начальная ставка:
- Жидкость: 2 мл / кг /% TBSA
- FFP: 0,5 мл / кг /% TBSA / 24 часа
- Целевой диурез: 30-50 мл / час
- Титрование: каждый час
- Диурез <30 мл / час - поддерживайте текущую скорость кристаллоидов и увеличивайте СЗП на 50 мл / час
- Диурез 30-50 мл / час — поддерживать текущую норму кристаллоидов и СЗП
- Диурез> 50 мл / час — уменьшить количество кристаллоидов на 20% и поддерживать текущую скорость FFP.
— Начните снижать количество FFP / альбумин на 20% после достижения минимального уровня кристаллоидов.
- Болюсы жидкости: не вводите болюсные кристаллоиды; однако в случаях гипотензии или значительной гиповолемии можно рассмотреть возможность быстрого введения пациенту 1 или 2 единиц СЗП для коррекции гипотонии, вызванной гиповолемией.
- Выбор реанимационных жидкостей:
Пример: Мужчина весом 70 кг поступает в отделение неотложной помощи с ожогом 50% TBSA. Как и выше, количество жидкости рассчитывается следующим образом:
| 2 мл | Х | Вес 70 кг | Х | % TBSA 50% | = | Расчетная общая потребность в жидкости за первые 24 часа 7000 мл |
Затем оценочная сумма делится пополам, чтобы получить начальную ставку.
| Период времени | Том | Оценка | Округлить до ближайшего 10 мл |
| Первые 8 часов | 7000 мл / 2 = 3500 мл | 3500 мл / 8 часов = 437,5 мл / час | 440 мл / час |
Количество FFP, которое должно быть дано в дополнение к указанному выше объему жидкости, будет рассчитано следующим образом:
| 0,5 мл | Х | Вес 70 кг | Х | % TBSA 50% | = | Расчетное количество СЗП за первые 24 часа 1750 мл |
Затем оценочная сумма делится на 24, чтобы получить скорость FFP.
| Период времени | Оценка | Округлить до ближайшего 10 мл |
| Первые 24 часа | 1750 мл / 24 = 72,9 мл | 80 мл / час |
Итак, этому пациенту следует начать с жидкости со скоростью 440 мл / час и СЗП со скоростью 80 мл / час. СЗП следует перевести на 5% альбумин с той же скоростью через 24 часа реанимации. Титрование альбумина такое же, как и для FFP.
- Другие рекомендации во время реанимации после ожога> 20% TBSA
- Мониторинг давления в мочевом пузыре — уведомить лечащего врача, если давление в мочевом пузыре ≥15 мм рт. Ст. В любое время
- Контроль уровня глюкозы — уведомить лечащего врача, если у пациента уровень глюкозы> 200, для двух последовательных проверок
- Размещение центральной линии — внутренняя яремная и подключичная области предпочтительнее бедренной
- Размещение артериальной линии — учитывать при ожоге TBSA 20-30%, обязательно при TBSA> 30%
Заказ СЗП для реанимационных мероприятий при серьезных ожогах (≥30% TBSA)
- Этот «протокол ожога» должен быть активирован до того, как можно будет продолжить переливание крови.Активация может быть произведена лечащим врачом по телефону службы банка крови TMC по телефону 4-3640 в дополнение к заказу плазмы EMR. Банк крови также должен быть уведомлен о предполагаемом общем необходимом объеме плазмы.
- Банк крови будет использовать время телефонного разговора как начало 24-часового периода времени протокола.
- Банк крови попытается подготовить гигантские единицы плазмы для активированных случаев, чтобы уменьшить воздействие на доноров, если это позволит инвентарь.
- Переливание плазмы в таком случае будет считаться клинически оправданным на основании одобрения Комитета по контролю крови пациентов больницы и не будет требоваться для дальнейшей ежедневной проверки использования крови патологоанатомической бригадой.
- Клиническая бригада должна заказывать только единицы плазмы, необходимые в следующие шесть часов периода времени, чтобы провести соответствующую клиническую корректировку в режиме реального времени.
- Медсестра пациента должна запросить только количество единиц плазмы, которое они планируют заполнить во время ее / его смены и в течение 6 часов у постели больного. Вместе с выпущенными плазменными установками будет выпущен кулер.
- Только единицы плазмы при переливании должны быть вне холодильника, а оставшиеся единицы плазмы должны храниться в охладителе.Как правило, рекомендуется использовать только одну единицу плазмы на фазе переливания, если это разрешено клиническими условиями.
- Поскольку охладитель необходимо повторно замораживать каждые 6 часов, клиническая бригада должна вернуть / повторно заморозить охладитель, когда новая партия плазмы (для следующей 6-часовой обработки) будет запрошена из банка крови.
- Банк крови подаст сигнал напоминания о повторном замораживании холодильника, если охладитель не был возвращен за 15 минут до 6 часов с момента запуска холодильника.
- Даже если есть существующие заказы на плазму, выпуск установки для плазменной резки будет прекращен по истечении 24-часового периода.Любое дополнительное переливание плазмы через 24 часа должно соответствовать установленным показаниям для переливания. Расширение протокола требует общения и обсуждения между лечащим врачом ожоговой службы и патологом службы банка крови.
- Клиническая бригада должна взять на себя ответственность вернуть оставшиеся единицы плазмы и холодильник, если переливание прекращено, как можно скорее, чтобы свести к минимуму возможные потери.
- Этот «протокол ожога» должен быть активирован до того, как можно будет продолжить переливание крови.Активация может быть произведена лечащим врачом по телефону службы банка крови TMC по телефону 4-3640 в дополнение к заказу плазмы EMR. Банк крови также должен быть уведомлен о предполагаемом общем необходимом объеме плазмы.
Особая ситуация:
- Плазма типа AB — это универсальный компонент крови, который можно использовать для оказания неотложной медицинской помощи. Плазма типа AB составляет всего 4-5% населения, поэтому плазмы типа AB обычно не хватает.Если ожоговый пациент относится к типу AB, банк крови проверит инвентаризацию как внутри компании, так и у поставщика крови. Клиническая бригада будет уведомлена, если запаса плазмы недостаточен для покрытия всех 24-часовых потребностей.
- Плазма типа A с низким титром использовалась во время реанимации для пациентов типа B и типа AB в соответствии с протоколом массивной трансфузии в больнице, обычно не более 18 единиц на пациента в течение 24 часов. Наша служба банка крови не предлагает использовать в этом «протоколе ожога» единицы плазмы, несовместимые с ABO, если только клиническая группа не определит их использование на основе клинического состояния пациента.Для такого заказа требуется согласие на подпись.
- Во время чрезвычайной экологической ситуации этот протокол может быть отключен в зависимости от подачи плазмы. Руководитель группы будет проинформирован о состоянии кровоснабжения.
- При возникновении реакции переливания текущее переливание должно быть отложено до завершения исследования реакции переливания. Расследование реакции на переливание крови должно быть начато как можно скорее.
Предпосылки
Целью ожоговой реанимации является поддержание оксигенации и перфузии тканей в условиях потери внутрисосудистого объема из-за повышенной проницаемости капилляров из-за ожогового шока.В отличие от геморрагического шока, ожоговый шок вызывает медленную и устойчивую непрерывную потерю внутрисосудистой жидкости (плазмы), которая происходит сначала в термически поврежденную ткань, а затем по всему телу.
Лучший способ контролировать эту потерю жидкости — это медленное и устойчивое восполнение внутрисосудистого объема путем продолжающейся реанимации в течение первых 24 часов с тщательным мониторингом реакции пациента (т. Е. Диуреза). Классическое учение в области ожоговой хирургии заключается в том, что пациенты с ожогами> 20% TBSA — единственные, кому требуется формальная внутривенная инфузионная реанимация.
В целом, термически травмированным пациентам с ожогами <20% TBSA не требуется формальная внутривенная реанимация жидкостью, поскольку воспалительная реакция на ожоги такого размера часто не вызывает значительной утечки капилляров. Эти пациенты могут часто пополнять свой внутрисосудистый объем за счет перорального приема жидкости, и самое большее могут нуждаться в внутривенном введении жидкости с поддерживающей скоростью для дополнения приема пероральной жидкости.
Однако могут быть случаи, когда у пациентов наблюдается гиповолемия (дегидратация) при поступлении из-за снижения потребления перорального введения (т.е. работа на улице весь день в жару), алкогольное опьянение или гипергликемия вызывают диурез. В этих случаях пациенту следует начать внутривенное введение жидкостей на основе приведенной ниже формулы (2 мл / кг /% TBSA) и установить катетер Фолея для строгих I и O, если пациент не может помочь в мониторинге своего диуреза. Внутривенные жидкости следует титровать 10-20% в час, чтобы поддерживать диурез 30-50 мл / час.
Для пациентов с ожоговыми травмами> 20% TBSA начальная скорость внутривенного введения жидкости определяется по формуле консенсуса, которая составляет 2 мл / кг /% TBSA .Рекомендуемая жидкость для внутривенного вливания в соответствии с курсом расширенного ожогового жизнеобеспечения Американской ожоговой ассоциации — это лактатные рингеры, но вместо этого можно использовать изолит / плазмалит. Эта формула оценивает количество кристаллоидов для внутривенного введения, которое может потребоваться пациенту в первые 24 часа после термической травмы.
Моделирование жидкостной реанимации путем определения скорости инфузии и диуреза у взрослых пациентов с тяжелым термическим ожогом: ретроспективное когортное исследование
Острые ожоговые травмы являются одними из самых разрушительных форм травм и приводят к значительной заболеваемости и смертности.Соответствующая жидкостная реанимация после тяжелого ожога, особенно в течение первых 48 часов после травмы, считается самым важным терапевтическим вмешательством при лечении ожогов. Хотя было разработано множество формул для оценки необходимого количества жидкости у пациентов с тяжелыми ожогами, многие доказательства показали, что пациенты по-прежнему получают гораздо больше жидкости, чем рекомендуют формулы. Чрезмерная реанимация, известная как «текучесть жидкости», стала одной из наиболее важных проблем на начальном этапе лечения ожогов.Если титрование жидкости можно будет персонализировать и автоматизировать во время фазы реанимации, можно будет ожидать более эффективного лечения ожогов и результатов. В настоящем исследовании модель прогнозирования скорости инфузии на основе динамического диуреза была разработана и проверена в течение первых 48 часов у взрослых пациентов с тяжелым термическим ожогом. Результаты экспериментов продемонстрировали, что разработанная модель динамической жидкостной реанимации может значительно уменьшить общий объем жидкости за счет точного прогнозирования почасового диуреза и может помочь при введении жидкости пациентам с тяжелыми ожогами.
1. Введение
Острые ожоговые травмы, уносящие почти 330 000 смертей в год, относятся к наиболее разрушительным формам травм и приводят к значительной заболеваемости и смертности в мире [1, 2]. Термическое повреждение нарушает нормальный гомеостаз и приводит к высвобождению медиаторов воспаления, которые увеличивают проницаемость капилляров и приводят к утечке жидкости из кровотока в интерстициальное пространство и к испарению [3–5]. Неспособность скорректировать потери жидкости приведет к снижению сердечного выброса, острой почечной недостаточности, ишемии сосудов, сердечно-сосудистому коллапсу и даже смерти [6].Поэтому соответствующая жидкостная реанимация после тяжелого ожога, особенно в течение первых 48 часов после травмы, считается наиболее важным терапевтическим вмешательством при лечении ожогов [7].
Многие формулы / протоколы жидкостной реанимации были введены в качестве руководящих принципов управления жидкостями, когда общая площадь поверхности тела (TBSA), вовлеченная в ожоговые подходы, составляет 20%, например, Parkland, модифицированный Parkland, Brooke, модифицированный Brooke, Evans, Muir -Barclay, Monafo, формула Хайфы и протокол Третьего военно-медицинского университета (TMMU) [5, 8, 9].Эти формулы дают рекомендуемый объем инфузии и скорость, необходимую для реанимации пациента, в зависимости от массы тела и сожженного TBSA. Хотя абсолютного консенсуса в отношении формулы реанимации достичь не удалось, важный вопрос, не подлежащий обсуждению, заключается в том, что формулы используются только в качестве отправной точки для жидкостной реанимации, поскольку каждый пациент по-разному реагирует на ожоговую травму и реанимацию [10]. В результате схемы введения жидкости не основываются исключительно на фиксированных формулах, но регулярно корректируются на основании клинических признаков адекватной перфузии органов у пациента, что определяется по диурезу (UOP), равному 0.5–1,0 мл / кг / час [11].
Феномен недостаточной инфузионной недостаточной реанимации значительно уменьшился с развитием догоспитальной помощи и обучения ожоговой реанимации за последние десятилетия. Однако появляется все больше свидетельств того, что пациенты с серьезными ожогами получали гораздо больше жидкости, чем рекомендуют формулы [12–14]. Чрезмерная реанимация, известная как «текучесть жидкости», стала одной из наиболее важных проблем на начальном этапе лечения ожогов [14–17]. Два метаанализа потребности в жидкости при ожоговой травме показали, что общий введенный объем превысил расчетную формулу, а средний UOP был выше верхнего предела целевого уровня [18, 19].Так же, как неадекватная жидкостная реанимация может привести к гиповолемическому шоку, органной недостаточности и синдрому системной воспалительной реакции, а чрезмерная жидкостная реанимация может привести к повышенному риску инфекционных осложнений, острого респираторного дистресс-синдрома, синдрома брюшной полости и даже смерти [10, 12, 19– 23].
Трудно поддерживать тонкий баланс между слишком малым или слишком большим количеством жидкости, и для этого требуются клиницисты с большим опытом ожогов. Многие врачи жаловались, что существующие формулы слишком громоздки, чтобы им следовать [24].Следовательно, если титрование жидкости можно будет персонализировать и автоматизировать во время фазы реанимации, можно будет ожидать более эффективного лечения ожогов и результатов.
В этом ретроспективном исследовании была разработана модель динамической жидкостной реанимации путем определения UOP и скорости инфузии на основе данных наблюдений, записанных в течение первых 48 часов после травмы у взрослых пациентов с тяжелыми ожогами. Затем модель была проверена на другой популяции ожоговых пациентов. Мы предположили, что модель титрования жидкости, основанная на прогнозе UOP, может предложить надежное управление жидкостью.
2. Материалы и методы
2.1. Сбор данных
Это исследование было одобрено этическим комитетом Southwest Hospital. Комитет отказался от информированного согласия, поскольку это было ретроспективное и наблюдательное исследование, и данные были проанализированы анонимно. В исследование были включены пациенты, госпитализированные в Исследовательский институт ожогов Юго-Западной больницы в период с января 2011 года по декабрь 2013 года. Критериями включения в это исследование были все пациенты, которые обратились в течение 12 часов после термической травмы, с ожогами более 30%, а также взрослые пациенты в возрасте от 16 до 60 лет.Пациенты с электрическими или химическими ожогами, а также с комбинированными травмами, такими как ингаляционная травма, острое повреждение почек, застойная сердечная недостаточность, травма или кровопотеря, алкогольная интоксикация и принимающие какие-либо мочегонные средства, седативные препараты или механическую вентиляцию легких, а также эшаротомию / хирургическое вмешательство в первые 48 лет. часы были исключены.
Реанимацию пациентов проводили в соответствии с протоколом TMMU, разработанным в 1960-х годах и наиболее широко используемым для жидкостной реанимации в Китае для лечения пациентов с тяжелыми ожогами [9, 25, 26].Этот протокол предполагает, что взрослым ожоговым пациентам вводится 1 мл раствора Рингера с лактатом и 0,5 мл плазмы на процент площади ожога TBSA и на килограмм массы тела (мл / кг /% TBSA) в первые 24 часа после травмы. Кроме того, взрослым ежедневно добавляли 2 л воды (в виде 5% раствора глюкозы). В течение первых 24 часов половину рассчитанного количества жидкости следует ввести в течение первых 8 часов после ожога, а оставшуюся часть равномерно ввести в течение следующих 16 часов.В течение следующих 24 часов после травмы взрослым или детям протокол рекомендует вводить половину количества кристаллоидного раствора и коллоида, использованного в течение первых 24 часов, и давать 2 л воды. Скорость инфузии регулировали ежечасно в соответствии с измерением UOP. Если UOP составлял менее 30 мл / час или более 60 мл / час, применялось увеличение или уменьшение на 20–30%.
Жидкость вводили через инфузионный насос (TE-171, TERUMO Corporation, Токио, Япония), а UOP собирали с помощью чешуйчатого мешка для мочи (SL125, Senlin Medical Products, Чаншу, Китай) во время периода реанимации после ожога.Клинические данные, включая почасовую скорость инфузии и UOP, были проспективно собраны обученными медсестрами и подтверждены независимым врачом. Данные за 2011 год использовались в качестве вывода, а данные за 2012 и 2013 годы использовались для проверки предложенной модели.
2.2. Разработка модели
Блок-схема предлагаемой модели динамического управления текучей средой показана на рисунке 1. Определенные переменные и конкретные уравнения, используемые для расчета этих параметров, перечислены в таблице 1. Средние скорости инфузии в каждый час после сжигания были проанализированы при выводе. группа, чтобы определить базовую скорость инфузии для этой когорты.Для определения эмпирической скорости инфузии использовался набор методов подбора кривой. Потенциальные факторы, такие как масса тела и ожог TBSA, которые могут повлиять на модель, были использованы в качестве кандидатов для корректировки базовой скорости инфузии. Корректирующий фактор был определен как средняя скорость инфузии каждого пациента в течение первых 48 часов, деленная на среднюю скорость инфузии всех пациентов в наборе данных для деривации.
| |||||||||||||||||||||||||||||||||||||||||||||
Модель прогнозирования UOP состоит из двух основных частей.Одна часть представляла собой общий ответ общего количества жидкости на продукцию мочи, рассчитанный как общее количество UOP, деленное на всю введенную жидкость. Другой частью было мгновенное влияние инфузии жидкости за текущий час на UOP, представленное как отношение ежечасной инфузии к измеренной UOP. Набор методов линейной регрессии использовался как для долгосрочного, так и для краткосрочного ответа на инфузию жидкости для прогнозирования UOP на следующий час и, следовательно, для оценки реакции пациента перед инфузией.
Эмпирическая скорость инфузии будет сохранена, если прогнозируемая UOP будет в пределах принятого целевого диапазона.В противном случае оптимальная скорость инфузии будет дана в соответствии с моделью прогнозирования UOP. Фактическое потребление жидкости в текущий час и UOP затем использовались для обновления параметров для прогноза на следующий час.
2.3. Оценка предложенной модели
Предложенная модель была оценена с использованием набора данных проверки. Для целей прогнозирования UOP прогнозируемый UOP сравнивался с измеренным UOP каждый час для каждого пациента. Были рассчитаны и сообщены абсолютные и относительные абсолютные ошибки прогноза.Абсолютная ошибка предсказания была определена как абсолютное значение между предсказанной и фактической UOP, а относительная абсолютная ошибка предсказания была определена как абсолютная ошибка предсказания, деленная на фактическую UOP. Также были рассчитаны чувствительность, специфичность и точность для прогнозирования UOP за пределами диапазона, поскольку цель прогнозирования UOP заключалась в выявлении потенциально неправильного управления жидкостью. Чувствительность определялась как доля UOP за пределами допустимого диапазона, и прогноз был положительным для этого. Специфичность определялась как доля UOP, которая находилась в допустимом диапазоне, и прогноз был для нее отрицательным.Точность — это вероятность получить правильный прогноз. Для прогнозирования скорости инфузии были выполнены сравнения экспериментальных и теоретических результатов, включая общий объем инфузионной жидкости и среднюю скорость инфузии в течение первых и вторых 24 часов. Сравнительные результаты использовались для оценки того, может ли модель прогнозирования скорости инфузии снизить общий объем жидкости и коэффициент реанимации или предотвратить чрезмерное вливание жидкости.
2.4. Статистический анализ
Оценка кривой и регрессионный анализ использовались для оценки параметров модели прогнозирования и функции корректировки.Коэффициент корреляции Пирсона использовался, чтобы проиллюстрировать связь между потенциальной регулирующей переменной и корректирующим фактором. Чтобы сравнить средние значения между экспериментальными и теоретическими результатами, для анализа использовался тест на парных выборках. Значение двусторонней вероятности менее 0,05 считалось значимым.
3. Результаты
За исследуемый период в институт поступило 5 240 пациентов, 37 из которых соответствовали критериям включения. Тринадцать пациентов получили лечение в 2011 г., 10 — в 2012 г. и 14 — в 2013 г.Средняя площадь ожога составила 51,6% TBSA, минимум 30,2% и максимум 97,0%. Демографические данные и данные жидкостной реанимации представлены в таблице 2. Не наблюдалось значительных различий между группами по возрасту, массе тела, ожогу TBSA, площади ожога полной толщины, общему количеству введенной жидкости и общему измерению UOP. Для разработки модели были доступны данные о 541 часах пациента, включая почасовую скорость инфузии и UOP. В то же время для проверки были собраны данные о 975 часах пациентов.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Не было очевидной разницы между общим потреблением жидкости и предложенным объемом протокола TMMU в течение первых 48 часов (по сравнению с L для отведения; по сравнению с L для проверки) .На рисунке 2 показано среднее потребление жидкости и измеренное UOP в час в течение периода реанимации. Как данные вывода, так и данные проверки показали сходные закономерности; то есть скорость инфузии уменьшается, в то время как скорость UOP увеличивается с течением времени. Среднее количество жидкости, введенной в течение вторых 24 часов, было значительно ниже, чем в первые 24 часа для пациентов в 2011 году (по сравнению с мл / час) и в 2012-2013 годах (по сравнению с мл / час). С другой стороны, среднее значение UOP было заметно выше в течение вторых 24 часов по сравнению с таковым в первые 24 часа как в группах отведения (по сравнению с мл / час), так и в группах проверки (по сравнению с мл / час).Расчетный нижний предел составлял мл / час, а верхний предел — мл / час в этой популяции на основе рекомендованного UOP 0,5–1,0 мл / кг / час для обеспечения адекватной реанимации.
3.1. Модель базовой скорости инфузии и функция регулировки
Общая картина жидкости, вводимой за час, указывает на непрерывный характер распада в течение всех 48 часов. Экспериментальные результаты показали, что модель экспоненциального распада со следующим форматом лучше всего подходит для скоростей инфузии: Здесь,, представлены коэффициенты функции распада и было через час после ожога.
Коэффициент корреляции между значением TBSA и поправочным коэффициентом () составил 0,888, а между весом и поправочным коэффициентом () был равен –0,267. Таким образом, сожженный TBSA использовался в качестве модификатора, и с помощью регрессионного анализа была получена следующая функция модификатора:
Базовая скорость инфузии затем представлена как
Базовая модель инфузии была оценена со средними скоростями инфузии в наборе данных валидации. Никаких существенных различий не наблюдалось, когда почасовая прогнозируемая базовая скорость инфузии сравнивалась с фактическим потреблением (по сравнению с мл / час).Средняя абсолютная ошибка прогноза составляла мл / час, а относительная абсолютная ошибка прогноза составляла%.
3.2. Модель прогнозирования UOP
На рис. 3 показано общее отношение и мгновенное отношение, полученные из набора данных деривации. Два соотношения, отражающие долгосрочное и краткосрочное влияние введенной жидкости на выработку мочи, были вычислены как и где и представляли измеренное почасовое значение UOP и фактическое потребление жидкости к концу времени. Так как « и были известны как параметры в начале часа, UOP ближайшего часа можно было оценить с помощью регрессионной модели, основанной на модели, полученной из базовой модели скорости инфузии (уравнение (3)): Коэффициенты, постоянны и обозначаются ошибка прогнозирования, которая была рекурсивно оценена на основе ошибки прогнозирования предыдущего часа и скорости изменения UOP: эти два параметра были выбраны, потому что корреляционный анализ показал, что ошибка прогнозирования текущего часа была линейно коррелирована с ошибкой прогнозирования предыдущего часа (;) и изменением скорости измерения UOP ( ;).
Поскольку для модели требуются данные за предыдущие 2 часа для прогнозирования UOP следующего часа, в общей сложности было выполнено 927 прогнозов с использованием набора данных проверки. Не было значительных различий (рис. 4 (а)) между почасовым измерением UOP и прогнозом, за исключением относительно более низкого прогноза при 10 (мл / час по сравнению с мл / час) и 40 (мл / час по сравнению с мл / час) час. после ожога, когда проводился парный -тест. Абсолютная ошибка прогноза составила мл, а относительная абсолютная ошибка составила% за весь период реанимации.Чувствительность, специфичность и точность для прогнозирования UOP за пределами диапазона составляли 85,2%, 65,0% и 77,0%, когда целевая UOP была определена как 30–60 мл / час.
3.3. Модель прогнозирования скорости инфузии
Комбинация почасовой базовой оценки скорости инфузии и алгоритма прогнозирования UOP привела к созданию окончательной модели управления текучей средой. Если прогнозируемое почасовое UOP было больше, чем верхний предел или меньше, чем нижний предел целевого значения, скорость инфузии была бы заменена следующим уравнением: где было среднее значение нижнего и верхнего предела ожидаемого целевого UOP.В противном случае, если прогнозируемая UOP находилась в пределах допустимого диапазона целевых настроек, скорость инфузии, вычисленная из модели базовой скорости, была бы сохранена: где и были нижнее и верхнее предельное значение целевого UOP.
Условная скорость инфузии и общая необходимая жидкость были рассчитаны с использованием окончательной модели управления инфузией для 24 пациентов в 2012–2013 годах. Вместо использования использовалась фактическая скорость инфузии, когда прогнозируемая почасовая UOP находилась в пределах целевого уровня для целей проверки.Рисунок 4 (b) иллюстрирует фактическую и прогнозируемую скорость инфузии, когда целевая UOP была установлена на 30–60 мл / час. Прогнозируемая скорость инфузии, очевидно, может быть уменьшена в 42,1% случаев в течение первых 24 часов (мл / час по сравнению с мл / час) и 91,7% времени в течение вторых 24 часов (мл / час по сравнению с мл / час). . Условные объемы инфузии могут быть значительно уменьшены в течение первых 24 часов (L по сравнению с L) и будут дополнительно уменьшены в течение следующих 24 часов (L по сравнению с L) после ожога.
4. Обсуждение
В настоящем исследовании была разработана динамическая модель управления флюидом, сочетающая оценку скорости инфузии почасово и прогноз UOP, которая оценивалась с использованием отдельных наборов данных. Основные результаты заключаются в следующем: среднечасовая UOP была значительно выше в течение вторых 24 часов по сравнению с начальными 24 часами после ожога, даже несмотря на то, что скорость инфузии была относительно ниже при использовании протокола TMMU; модель прогнозирования UOP дала разумное объяснение увеличения UOP в течение вторых 24 часов и могла надежно предсказать потенциальную продукцию UOP за пределами диапазона во время периода реанимации; Модель управления жидкостью может значительно снизить количество жидкости, необходимой для реанимации, особенно в течение вторых 24 часов после травмы.
Чтобы понять массообмен после термического ожога, было предложено и протестировано несколько математических моделей, описывающих распределение и обмен жидкости и растворенных веществ после травмы [27–30]. Эти модели массообмена полезны для понимания сложных физиологических изменений, последствий различных режимов жидкостной реанимации и механистических эффектов лекарств. Однако сложность этих моделей препятствовала их потенциальному клиническому применению.Для единообразной реанимации и оптимизации титрования жидкости было разработано и исследовано несколько алгоритмов определения скорости инфузии и управления ею [19, 31–33]. Bowman и Westenskow [31] представили систему инфузии жидкости на основе микрокомпьютера для реанимации жидкости с измерением в реальном времени введенной жидкости и UOP. Система управляла инфузией жидкости с помощью алгоритма пропорционально-интегрально-производной (PID). Salinas et al. [19] разработали автоматизированную систему мониторинга баланса жидкости, основанную на модели PID.В недавнем клиническом исследовании Salinas et al. [33] оценили эффективность компьютерной системы поддержки принятия решений (CDSS), которая объединила PID-модель, вспомогательные алгоритмы принятия решений и замкнутый контур. Хотя требуемый объем инфузии был статистически уменьшен, а результат был значительно улучшен в группе CDSS по сравнению с исторической когортой, сотрудники еще не были убеждены в положительной корреляции между технологией CDSS и результатами для пациентов. Нейтральный ответ на вопросы, касающиеся доверия к рекомендации, удовлетворенной системой, не только отразил потенциальное несоответствие, существующее между успехом новой технологии и доверием к рекомендации CDSS, но также показал, что лежащие в основе модели, используемые для управления текучими средами, заслуживают дальнейшей проверки [34 ].
В текущем исследовании мы предложили усовершенствованную модель управления флюидом, основанную на моделях массообмена и реакции флюида. Модель сначала рассчитывает почасовую эмпирическую скорость инфузии в соответствии с уравнением экспоненциального затухания. Результат соответствовал отчету Салинаса, хотя использовался другой протокол реанимации [33]. Чтобы компенсировать внутрибольничные вариации сожженной TBSA и массы тела, был определен корректирующий фактор, который коррелировал с сожженной TBSA и массой тела.Интересно, что статистический анализ показал, что сожженный TBSA был значительным модификатором, в то время как масса тела — нет. Это может быть связано с относительно небольшим стандартным отклонением массы тела для этой популяции. Но его можно легко включить в модель, если учесть широкий диапазон массы тела населения. Для получения оптимального результата и соответствующей корректировки скорости инфузии была разработана модель прогнозирования UOP для прогнозирования UOP в следующие часы с использованием эмпирической скорости инфузии, общего и мгновенного соотношений продукции мочи.Общее соотношение, которое было вычислено из общего количества измеренного UOP и количества жидкости, введенной после травмы, предполагается, что оно отражает количество мочи, вырабатываемой всей кровью, доступной в системе кровообращения после ожоговой травмы, на основе модели массообмена [30] . С другой стороны, мгновенное соотношение, которое было рассчитано на основе потребления жидкости в предыдущий час и измерения UOP, может отражать непосредственный эффект инфузии жидкости на выработку мочи в соответствии с моделью реакции жидкости [19, 33].Эти предположения были физиологически разумными, и, что более важно, увеличенное соотношение мгновенных растворов могло объяснить увеличение часовой UOP в течение секунд 24 часов по сравнению с начальными 24 часами, даже несмотря на то, что применялась относительно более низкая скорость инфузии. Кроме того, введение оценки ошибки для предсказания UOP на основе ошибки предсказания предыдущего часа и изменения скорости UOP может компенсировать влияние потерь жидкости через экссудацию и испарение на образование мочи. Поскольку точность прогноза UOP играет важную роль в этой модели управления текучей средой, мы проверили эффективность алгоритма прогнозирования UOP с данными о 927 пациенто-часах.Когда нижний предел был установлен на 30 мл / час, а верхний предел был установлен на 60 мл / час, общая точность составила 77,0%, и можно было точно спрогнозировать UOP на 85,2% пациенто-часов за пределами диапазона. Еще одним важным усовершенствованием модели управления жидкостью было то, что прогнозируемый UOP служил критерием для корректировки скорости инфузии на следующий час. Если прогнозируемая UOP находилась в пределах допустимого диапазона, например 30–60 мл / час или 0,5–1,0 мл / кг / час, эмпирическая скорость инфузии не изменится. Но если прогнозируемое значение UOP выходит за пределы допустимого диапазона, скорость инфузии будет скорректирована в соответствии с моделью прогнозирования UOP.Соответственно, следует избегать чрезмерного вливания жидкости, особенно в течение вторых 24 часов. Однако мы заметили, что корреляция между рассчитанной и расчетной скоростью UOP и инфузией была лучше в первые 24 часа, чем позже, по мере продвижения реанимации. Вторые 24 часа могли быть связаны с периодом, когда пациенты входили в диуретическую фазу ожоговой реанимации, и диурез не всегда определялся почасовой скоростью инфузии в течение периода мобилизации жидкости после завершения активной реанимации.Следовательно, определение конечной точки активной реанимации для каждого пациента и моделирование жидкостной реанимации и мобилизации как отдельных объектов может быть практическим решением для повышения прогнозирующей ценности жидкостной терапии.
Мы признали, что в исследовании необходимо учитывать несколько ограничений. Во-первых, пациенты были реанимированы по протоколу TMMU; Необходимо изучить влияние различных формул жидкостной реанимации на предсказуемость UOP. Во-вторых, ошибка измерения, возникающая при записи вручную, может повлиять на общую производительность прогнозирования.Мы ожидали, что использование автоматического инфузионного насоса и измерителя мочи повысит точность прогнозов. В-третьих, в исследование были исключены пациенты с острым повреждением почек, ингаляционным повреждением, травмой, введением диуретиков или седативных средств, а также использованием искусственной вентиляции легких. Влияние этих сопутствующих состояний и обстоятельств на прогнозирование диуреза до сих пор было неизвестно и будет изучено в наших будущих исследованиях. Кроме того, не исследовалось, может ли использование гемодинамического мониторинга, такого как частота сердечных сокращений и среднее артериальное давление в модели, улучшить характеристики модели.В-четвертых, это было ретроспективное исследование; Может ли быть уменьшено общее количество введенной жидкости и может ли быть достигнута более эффективная реанимация с использованием предложенной модели управления жидкостью, все еще требует дальнейшей проверки.
5. Выводы
В этом ретроспективном исследовании превышение диапазона UOP в основном наблюдалось в течение вторых 24 часов после травмы. При использовании динамической модели реанимации можно надежно спрогнозировать превышение допустимого диапазона UOP, а общий объем жидкости может быть значительно уменьшен.Таким образом, предложенная модель может помочь при введении жидкости пациентам с тяжелыми ожогами.
Конфликт интересов
У авторов нет конфликта интересов в связи с публикацией данной статьи.
Вклад авторов
Цичжи Луо и Вэй Ли внесли равный вклад в эту работу.
Благодарности
Это исследование было поддержано Национальным фондом естественных наук Китая (NSFC81271656, Yongqin Li) и Фондом авторов национальной отличной докторской диссертации Китая (FANEDD201060, Yongqin Li).
Важность непрерывного мониторинга оттока мочи у пациентов в критических состояниях
РЕФЕРАТ
В этом обзоре обсуждается важность непрерывного мониторинга потока мочи в режиме реального времени у пациентов с интенсивной терапией и его потенциальная роль при острой почечной недостаточности (ОПН) и контроле жидкости в различных клинических условиях. Надежный мониторинг потока мочи в режиме реального времени позволяет врачам обнаруживать ранние признаки повреждения почек и облегчает как раннее лечение, так и прогнозирование прогрессирования ОПП.Кроме того, он предоставляет информацию, которая важна для расчета баланса жидкости и оценки реакции на жидкости и диуретики. Непрерывный и надежный мониторинг потока мочи с электронными предупреждениями об аномальных уровнях в режиме реального времени может улучшить клиническое ведение и результаты пациентов в отделении интенсивной терапии (ICU).
ВЫХОД МОЧИ ЯВЛЯЕТСЯ СИЛЬНЫМ ПРОГНОЗОМ ОПП
Острая почечная недостаточность (ОПН) развивается более чем у 55% пациентов в ОИТ. Это часто связано с высоким риском хронической болезни почек, дисфункции других органов и может привести к летальности до 50% [1, 2].Увеличенная продолжительность пребывания в ОИТ из-за ОПП и связанные с этим расходы хорошо известны и обсуждались в научной литературе [3, 4].
Хотя диурез и креатинин сыворотки являются ключевыми диагностическими индикаторами ОПП в соответствии с критериями RIFLE *, AKIN * и KDIGO *, несколько исследований подтвердили, что диурез сам по себе является более сильным прогностическим фактором ОПП, чем креатинин [5, 6, 7]. Фактически, недавние исследования устанавливают абсолютную необходимость оценки диуреза у пациентов для диагностики и определения стадии ОПП [8].
В одноцентровом проспективном исследовании 339 пациентов в отделении интенсивной терапии, в котором у 41,6% пациентов развилось ОПП, 38% были идентифицированы как имеющие ОПП с использованием только критериев диуреза; это более чем вдвое превышает те, которые выявляются только по повышенному уровню креатинина в сыворотке [9]. В недавнем многонациональном проспективном исследовании 4683 пациентов в педиатрических отделениях интенсивной терапии только уровни креатинина в плазме не смогли выявить ОПП у 67,2% пациентов с низким диурезом. Авторы пришли к выводу, что даже если это означает, что пациенты будут дольше находиться в катетеризации, мониторинг диуреза имеет решающее значение для раннего выявления ОПП [10].
«Моча является чувствительным и ранним маркером ОПП и ассоциируется с неблагоприятными исходами у пациентов отделения интенсивной терапии. Скорость потока мочи является чувствительным и специфическим биомаркером, который обеспечивает ранний предупреждающий сигнал о надвигающейся почечной дисфункции [11] ».
* ВИНТОВКА: Риск, травма, отказ, потеря функции почек, терминальная стадия заболевания почек
* AKIN: Сеть острых травм почек
* KDIGO: Заболевание почек: улучшение глобальных результатов
ВОССТАНОВЛЕНИЕ МОЧИ ТЕРАПИЯ (ЗПТ)
Заместительная почечная терапия (ЗПТ) проводится для лечения пациентов с тяжелым ОПП, часто с полиорганной недостаточностью, а также для удаления жидкости у пациентов с перегрузкой жидкостью, в том числе с острой сердечной недостаточностью и отеком легких.У пациентов с тяжелым ОПП ЗПТ является краеугольным камнем лечения. Хотя в этой области был достигнут значительный прогресс, многие вопросы остаются без ответа. Например, нет единого мнения о том, когда начинать RRT. Несмотря на то, что раннее начало ЗПТ явно не связано с пользой, отказ от ЗПТ или ее отсрочка связаны с более высокой смертностью и увеличением продолжительности пребывания в больнице / ОИТ [12].
Начало и прекращение RRT
Стресс-тест на фуросемид (FST), состоящий из однократного внутривенного введения фуросемида с последующим измерением 2-часового диуреза, был недавно введен в качестве эффективного метода прогнозирования прогрессирования заболевания. на ранней стадии ОПП и для облегчения принятия решений относительно оптимального времени начала ЗПТ [13].В недавнем исследовании диурез FST значительно превосходил биохимические биомаркеры для прогнозирования прогрессирующего ОПП, необходимости ЗПТ и смертности в стационаре [14].
Хотя также отсутствует консенсус относительно оптимального времени для прекращения ЗПТ, диурез оказался наиболее значимым предиктором успешного прекращения [15, 16, 17].
ВЫХОД МОЧИ, БАЛАНС ЖИДКОСТИ И РИСК ОПП В ОИТ
В ОИТ существует ряд клинических состояний, которые считаются причинами или тесно связаны с ОПП.В этих условиях потребность в оптимальном приеме жидкости имеет первостепенное значение для минимизации риска ОПП, а также общей заболеваемости и смертности. Для пациентов с этими сложными состояниями постоянный мониторинг потока мочи в режиме реального времени имеет решающее значение для отслеживания перегрузки объемом и оценки реакции на терапию [18]. Ниже представлены образцы этих состояний и роль мониторинга потока мочи.
Перегрузка жидкостью
Перегрузка жидкостью, возникающая либо в результате реанимационных мероприятий, либо в результате чрезмерного использования, в настоящее время признается основным фактором риска осложнений в отделении интенсивной терапии.Появляется все больше доказательств, указывающих на роль перегрузки жидкостью как причинного фактора ОПН, полиорганной недостаточности и смертности [19]. Недавние исследования показали, что положительный жидкостный баланс в первые 24 часа после поступления в ОИТ был связан со значительным риском ОПП в смешанной популяции с тяжелыми заболеваниями [20]. Кроме того, данные диуреза, полученные в течение этих первых 24 часов у смешанной группы пациентов в ОИТ, оказались независимым предиктором смертности [21]. Непрерывный, надежный мониторинг потока мочи, по-видимому, имеет важное значение сразу после поступления в отделение интенсивной терапии для раннего выявления повышенного риска ОПП и смертности.
Сепсис
Сепсис — наиболее частая причина ОПН в отделениях интенсивной терапии, встречающаяся примерно у 40% тяжелобольных пациентов. Внутривенное введение жидкости является важным компонентом лечения сепсиса, и начало ЗПТ до появления явных осложнений ОПП и значительной перегрузки жидкостью может быть связано с улучшением выживаемости
[22, 23]. Тщательный мониторинг диуреза важен для облегчения успешного отведения жидкости и оценки реакции на лечение.
Операция после кардиопульмонального обходного анастомоза
ОПП возникает у 30% пациентов, перенесших операцию на сердце, из-за ряда факторов риска, специфичных для их анестезиологического, хирургического вмешательства и ведения интенсивной терапии [24]. Прогноз для этой подгруппы пациентов плохой, с повышенным риском смертности, превышающим 60% по сравнению с общим уровнем смертности 2-8% после кардиохирургического вмешательства [25]. Хотя нет единого мнения относительно моделей прогнозирования ОПН после кардиохирургии, недавние исследования показали, что низкий диурез во время искусственного кровообращения является предиктором ОПН у пациентов после аортокоронарного шунтирования [26, 27].Инициирование мониторинга потока мочи в режиме реального времени во время катетеризации в операционной может потенциально выявить пациентов с шунтированием сердца с олигурией за несколько часов до их перевода в отделение интенсивной терапии.
Лечение ожогов
Соответствующая жидкостная реанимация, особенно в течение первых 48 часов после травмы, считается самым важным терапевтическим вмешательством при лечении тяжелых ожогов. Хотя было разработано множество формул для оценки оптимального количества жидкости для пациентов с тяжелыми ожогами, чрезмерная реанимация (или «выделение жидкости») в настоящее время является одной из наиболее серьезных проблем на начальном этапе оказания помощи при ожогах.В результате ожоговые эксперты разрабатывают сложные модели жидкостной реанимации для предотвращения этой проблемы, некоторые из которых включают тщательный мониторинг диуреза для проведения реанимационных мероприятий [28].
НЕОБХОДИМОСТЬ НАДЕЖНЫХ ИЗМЕРЕНИЙ ПОТОКА МОЧИ В РЕАЛЬНОМ ВРЕМЕНИ В ОИТ
Сегодня в отделениях интенсивной терапии почти все основные физиологические функции пациентов находятся под электронным контролем и круглосуточно отображаются. Медицинский и медперсонал интенсивной терапии обычно полагается на устройства, которые контролируют важные функции, такие как частота сердечных сокращений, артериальное давление, газы крови и т. Д., предупреждая их о нарушениях и позволяя им ежеминутно оказывать жизненно важную помощь пациентам интенсивной терапии. Точно так же точный мониторинг диуреза в реальном времени может улучшить клиническое ведение пациентов в отделении интенсивной терапии, позволяя клиницистам выявлять ранние признаки изменений функции почек.
«Рассмотрение потока мочи как непрерывной физиологической переменной вместо параметра интервала предоставит больше временных точек для обнаружения ОПП [29]».
Удивительно, но несмотря на то, что постоянный или частый мониторинг мочи может предоставить важную информацию относительно нарушения функции почек и / или баланса жидкости, диурез все еще регистрируется вручную и с перерывами.
Ручные измерения потока мочи ненадежны
Ручные измерения потока мочи отнимают много времени, требуют манипулирования счетчиками мочи, визуальной оценки и кропотливой записи данных. Эти трудности с измерением, мониторингом и точной записью диуреза ставят под сомнение надежность показаний мешка с мочой с точки зрения частоты, регулярности и точности. В современной клинической практике получить надежные почасовые измерения диуреза слишком сложно.В результате не существует стандартизированного подхода к раннему выявлению таких изменений, как олигурия [30, 31].
Оповещения в реальном времени
«В идеале было бы предпочтительнее иметь устройства, записывающие диурез в реальном времени, которые отображают информацию с предупреждениями, когда уровень снижается ниже установленного порога [32]».
Исследования электронных предупреждений (электронных предупреждений) о раннем или приближающемся ОПП в режиме реального времени с использованием электронных медицинских карт и систем клинической информации показали противоречивые результаты [33].В рандомизированном исследовании с участием 664 пациентов с ОПП электронная система оповещения, основанная только на уровне креатинина в сыворотке в реальном времени, оказалась неэффективной [34]. Однако в проспективном исследовании 951 пациента ОИТ автоматические предупреждения в реальном времени об ухудшении критериев RIFLE (90% из которых были диагностированы на основании низкого диуреза), как было показано, увеличивают количество и своевременность раннего терапевтического вмешательства [35] . Необходимы дополнительные исследования с электронными предупреждениями в реальном времени с использованием только уровней диуреза.
ЗАКЛЮЧЕНИЕ
Важность непрерывного и надежного мониторинга потока мочи при ОПП и инфузии у тяжелобольных пациентов подчеркивалась ведущими нефрологами и экспертами по интенсивной терапии. Наличие точной информации о потоке мочи в режиме реального времени может облегчить раннюю оценку риска ОПП, определение стадии и раннее вмешательство, а также улучшить мониторинг баланса жидкости и оценку реакции на диуретики у пациентов с перегрузкой жидкостью. Электронные оповещения в режиме реального времени, основанные на аномальном уровне диуреза, могут улучшить уход за пациентами и снизить заболеваемость и смертность.
Ссылки
1.Hoste EAJ, Bagshaw SM, et. al. Эпидемиология острого повреждения почек у пациентов в критическом состоянии: международное исследование AKI-EPI. Intensive Care Med (2015) 41: 1411–1423.
2.Case J, Khan S, Khalid R, Khan A. Эпидемиология острого повреждения почек в отделении интенсивной терапии. Crit Care Res Pract (2013) 2013: 479730-479742.
3.Lewington AJP, Cerdá J, Mehta RL. Повышение осведомленности об острой травме почек. Глобальный взгляд на тихого убийцу.Kidney Int (2013) 84: 457-467.
4.Халперн Н.А., Гольдман Д.А., Тан К.С., Пасторез С.М. Тенденции в отношении коек для интенсивной терапии и их использования среди групп населения и получателей программ Medicare и Medicaid в Соединенных Штатах: 2000-2010 гг. Crit Care Med (2016) 44: 149.
5.Fornia LG, Chawlab L, Ronco C. Точность и улучшение результатов при остром повреждении почек: индивидуальный подход. Журнал интенсивной терапии (2017) 37: 244–245.
6. Дипа К., Муралидхар К. Заместительная почечная терапия в отделениях интенсивной терапии.J. Anaesthesiol Clin Pharmacol (2012) 28: 386-396.
7. Маседо Э., Мальхотра Р., Клауре-Дель Гранадо Р. и др. Определение критерия диуреза при остром повреждении почек у тяжелобольных. Пересадка нефрола Dial Transplant (2011) 26: 509–515.
8.Маседо Э. Оценка диуреза как клиническая мера качества. Нефрон (2015) 131: 252–254.
9. Салахуддин Н., Саммани М., Хамдан А., Джозеф М. и др. Перегрузка жидкостью является независимым фактором риска острого повреждения почек у тяжелобольных пациентов: результаты когортного исследования.BMC Nephrology (2017) 18: 45-53.
10. Каддура А., Басу Р.К., Багшоу С.М., Гольдштейн С.Л., для сотрудников AWARE. * Эпидемиология острого повреждения почек у тяжелобольных детей и молодых людей. N Engl J Med (2017) 376: 11-20.
11.Macedo E, Malhotra R, Bouchard J, Wynn SK et al. Олигурия — один из первых предикторов более высокой смертности у тяжелобольных. Kidney Int (2011) 80: 760–767.
12. Ронко С., Риччи З., Де Бакер Д., Келлум Дж. А. и др. Заместительная почечная терапия при остром повреждении почек: разногласия и консенсус.Реанимационная помощь (2015) 19: 146-157.
13. Чавла Л.С., Дэвисон Д.Л., Браша-Митчелл Э., Койнер Дж. Л. и др. Разработка и стандартизация стресс-теста на фуросемид для прогнозирования тяжести острого повреждения почек. Crit Care (2013) 17: R207-215.
14.Koyner JL, Davison DL, Brasha-Mitchell E, Chalikonda DM et al. Фуросемидный стресс-тест и биомаркеры для прогнозирования тяжести ОПП. J Am Soc Nephrol (2015) 26: 2023-31.
15.Неги С., Кореда Д., Кобаяши С., Ивашита Ю. и др.Заместительная почечная терапия при остром повреждении почек. Заместительная почечная терапия (2016) 2: 31-38.
16. Чавла (2013).
17. Дипа К., Муралидхар К. Заместительная почечная терапия в отделениях интенсивной терапии. J Anaesthesi Clin Pharmacol (2012) 28: 386–396.
18. Маседо (2015).
19. Дин X, Ченг З., Цянь К. Внутривенные жидкости и острое повреждение почек. Очистка крови (2017) 43: 163-172.
20. Салахуддин (2017).
21. Чжан З., Сюй Х, Ни Х, Дэн Х. Выход мочи при поступлении в ОИТ связан с больничной летальностью у неотобранных пациентов в критическом состоянии.Дж. Нефрол (2014) 27: 65-71.
22. Хост (2015).
23. Алобаиди Р., Басу Р.К., Гольдштейн С.Л., Багшоу С.М. Острое повреждение почек, связанное с сепсисом. Семин Нефрол (2015) 35: 2–11.
24. О’Нил Дж. Б., Шоу А. Д., Биллингс Ф. Острое повреждение почек после кардиохирургии: текущее понимание и будущие направления. Critical Care (2016) 20: 187-201.
25.Хуэн С., Парих ЧР. Прогнозирование острого повреждения почек после кардиохирургии: систематический обзор. Ann Thorac Surg. (2012) 93: 337–347.
26. Йылмаз М., Аксой Р., Кылыч Йылмаз В., Балджи С. и др. Диурез во время искусственного кровообращения позволяет прогнозировать острое повреждение почек после аортокоронарного шунтирования. Форум кардиохирургии (2016) 19: E289-E293.
27.Song Y, Kim DW, Kwak YL, Kim BS et al. Диурез во время искусственного кровообращения позволяет прогнозировать острое повреждение почек после кардиохирургического вмешательства. Единый центр ретроспективного анализа. Медицина (Балтимор) (2016) 95: e3757.
28. Луо Кью, Ли В, Цзоу Х, Данг И и др. Моделирование жидкостной реанимации путем определения скорости инфузии и диуреза у взрослых пациентов с тяжелым термическим ожогом: ретроспективное когортное исследование.

 001
001 013
013 025
025 037
037 Нашему пациенту 20 лет, он весит 80 кг, и 2e собрал 3 л (3000 мл) мочи в течение 24-часового периода наблюдения.
Нашему пациенту 20 лет, он весит 80 кг, и 2e собрал 3 л (3000 мл) мочи в течение 24-часового периода наблюдения.