Незрелые гранулоциты повышены – что это значит?
Наверное, даже самые опытные исследователи и врачи сразу не смогут назвать все существующие компоненты крови и их нормы. Разных кровяных телец существует очень много. И изменение количества каждого из них свидетельствует о нарушениях в работе организма. Если вы знаете, что это значит, когда повышены незрелые гранулоциты, будет гораздо проще расшифровать свои результаты анализов и при необходимости ускорить встречу со специалистом.
Что такое — повышенные незрелые гранулоциты в крови?
Гранулоциты являются подгруппой зернистых лейкоцитов. К ним принято относить базофилы, нейтрофилы и эозинофилы. Название кровяных телец объясняется их структурой – под микроскопом отчетливо просматриваются небольшие гранулы или зернышки. За выработку гранулоцитов отвечает костный мозг. После выхода в организм эти частички живут совсем недолго – не более трех дней.
Нормально, если в крови содержится от одного до пяти процентов молодых нейтрофилов, эозинофилов и базофилов.
Причины повышения незрелых гранулоцитов
Незначительное повышение этого показателя считается нормальным для беременных и новорожденных. Результат анализа также может быть искажен, если кровь взята сразу после приема пищи, физической нагрузки или у пациента, переживающего состояние сильного стресса. Во всех остальных случаях повышенные незрелые гранулоциты в крови – явление нездоровое. И указывать оно может на такие патологии:
- подагра;
- гангрена;
- псориаз;
- гепатит;
- туберкулез;
- малярия;
- разные виды дерматита;
- холера;
- сепсис;
- ангина;
- ожоги;
- острые кровотечения;
- менингит;
- пиелонефрит;
- сывороточная болезнь;
- инфаркт миокарда;
- интоксикации, вызванные укусами насекомых, отравлениями химикатами;
- хронические миелопластические заболевания;
- грипп;
- краснуха;
- отит;
- холецистит;
- скарлатина;
- перитонит;
- пневмония;
- аппендицит.

У некоторых людей повышенное содержание незрелых гранулоцитов в крови наблюдается на фоне приема препаратов, содержащих литий, или глюкокорикостероидов.
При гнойных процессах скачок показателя значительно больший, чем во всех остальных случаях.
Нейтрофіли та онкогенез
Резюме. 2007/mir/8/3.png) Описано основні функціональні молекули нейтрофілів, такі як нейтрофільна еластаза, катепсин, матриксна металопротеїназа-9, аргіназа 1 та ін., з якими зв’язуються протуморогенні властивості Н2 нейтрофілів. Багато процесів, викликані як Н1, так і Н2 нейтрофілами, ще недостатньо вивчені. Коротко зазначається про існування сьогодні багатьох підходів до генерації та активації нейтрофілів з протипухлинними властивостями і гальмування нейтрофілів, які стимулюють ріст пухлин.
Описано основні функціональні молекули нейтрофілів, такі як нейтрофільна еластаза, катепсин, матриксна металопротеїназа-9, аргіназа 1 та ін., з якими зв’язуються протуморогенні властивості Н2 нейтрофілів. Багато процесів, викликані як Н1, так і Н2 нейтрофілами, ще недостатньо вивчені. Коротко зазначається про існування сьогодні багатьох підходів до генерації та активації нейтрофілів з протипухлинними властивостями і гальмування нейтрофілів, які стимулюють ріст пухлин.
Резюме. В обзоре приведены данные о роли нейтрофилов периферической крови и нейтрофилов, инфильтрирующих опухоли, в противоопухолевых и опухольстимулирующих процессах, которые происходят при развитии многих видов раков. Приведена характеристика двух основных фенотипов Н1 и Н2 клеток, обсуждаются их функции и механизмы перехода от Н1 клеток с противоопухолевой активностью в Н2 клетки, стимулирующие пролиферацию опухолевых клеток, ангиогенез и метастазирования. Представлены данные о функционально важных цитокинах и хемокинах, выделяемых опухолевыми клетками, микроокружением, лимфоцитами и самими нейтрофилами, которые стимулируют выработку костным мозгом нейтрофилов и обусловливают накопление этих клеток в опухолевом очаге, развитие нейтрофилии в крови.
Получено 09.02.2018
Принято в печать 16.03.2018
Введение
Общеизвестно, что нейтрофилы являются наиболее распространенными лейкоцитами крови и считаются первой линией защиты при воспалении и инфекциях [1]. Проникшие в организм микроорганизмы вызывают воспалительную реакцию, которая привлекает нейтрофилы из кровообращения в ткани. Там нейтрофилы разрушают микроорганизм с помощью ряда механизмов, главным образом за счет фагоцитоза, высвобождения противомикробных веществ и образования внеклеточных ловушек нейтрофилов [1, 2].
Помимо этой классической роли нейтрофилов в антимикробной защите, также выявлено накопление нейтрофилов во многих типах опухолей. Первоначально считалось, что эти связанные с опухолью нейтрофилы (опухольинфильтрирующие нейтрофилы — ОН) являются простыми свидетелями, потому что трудно представить, что нейтрофилы, будучи короткоживущими клетками, могут влиять на такое хроническое и прогрессирующее заболевание, как рак. Однако в последнее время стало известно, что ОН играют важную роль при злокачественных новообразованиях. Этот частично объясняется признанием того, что развитие воспаления, с одной стороны, в организме связано с нейтрофилами, а с другой, является важной характеристикой многих опухолей [6, 7].
Однако большее число клинических наблюдений и лабораторных исследований показали, что наличие нейтрофилов в опухолях часто коррелирует с плохим прогнозом. Это хорошо доказано при целом ряде опухолей, в частности при бронхоальвеолярной карциноме [10], почечно-клеточной карциноме [12] и плоскоклеточной карциноме головы и шеи [13], а также меланоме [11]. Во всех этих случаях нейтрофилы проявляют другой фенотип, который может быть неблагоприятным для исхода заболевания. Механизмы формирования и реализации этого фенотипа нейтрофилов только начинают выяснять, но предполагается, что некоторые из них связаны с генотоксичностью, ангиогенезом и иммуносупрессией [8].
Стимуляция образования нейтрофилов. У многих пациентов с распространенным раком выявлены повышенные уровни нейтрофилов в крови. Как опухоли индуцируют нейтрофилию, окончательно неизвестно, но синтез опухолевыми клетками гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF), возможно, является одним из механизмов стимуляции продукции нейтрофилов костным мозгом [19]. Кроме того, и другие цитокины, такие как интерлейкин (IL)-1 и IL-6, продуцируемые также опухолями, по-видимому, способствуют увеличению числа нейтрофилов в крови [7, 20]. Эта нейтрофилия связана с плохим прогнозом при нескольких типах рака, таких как рак легкого, меланома и почечная карцинома [11, 21, 22]. В соответствии с этим наличие большого количества нейтрофилов в определенных типах опухолей также является показателем неблагоприятного прогноза. Поскольку нейтрофилия в крови часто ассоциируется с воспалительными реакциями на инфекцию и повреждение тканей, то в опухолевом очаге она представляет собой одно из доказательств концепции о роли воспаления в онкогенезе и индуцированного им прогрессирования роста опухоли [7].
В соответствии с этим наличие большого количества нейтрофилов в определенных типах опухолей также является показателем неблагоприятного прогноза. Поскольку нейтрофилия в крови часто ассоциируется с воспалительными реакциями на инфекцию и повреждение тканей, то в опухолевом очаге она представляет собой одно из доказательств концепции о роли воспаления в онкогенезе и индуцированного им прогрессирования роста опухоли [7].
Предполагается, что отношение числа нейтрофилов в крови к другим типам лейкоцитов служит фактором прогноза для больных раком. Так, например, отношение нейтрофилов к лимфоцитам (НЛО) было введено как прогностический фактор для больных колоректальным раком [25]. Из-за своей простоты определения НЛО показало, что является легкодоступным и недорогим биомаркером для многих типов опухолей, включая немелкоклеточный рак легкого [26], гепатоцеллюлярную карциному [24], карциному носоглотки [27], колоректальный рак [26], меланому [11] и рак грудной железы [28, 29]. Высокий уровень НЛО коррелирует с неблагоприятной общей выживаемостью при многих солидных опухолях [30–32].
В то же время, несмотря на данные многих исследований, часть которых упомянута выше, нейтрофилия (большее количество нейтрофилов в крови как следствие повышенного выхода клеток из костного мозга) не всегда является плохим показателем прогрессирования рака. При некоторых типах опухолей, например раке желудка, повышенный уровень нейтрофилов в крови сопряжен с положительным прогнозом [33]. Это означает, что нейтрофилы могут в некоторых случаях контролировать развитие рака. Способность нейтрофилов непосредственно убивать опухолевые клетки как in vitro, так и in vivo зарегистрирована давно [34–36]. Также сообщалось, что нейтрофилы от животных с экспериментальными опухолями обладают повышенной цитотоксической активностью [7]. Нейтрофилы, выделенные из крови здоровых людей, оказывают прямое цитотоксическое действие на некоторые линии опухолевых клеток [40]. Таким образом, точная роль нейтрофилов в развитии опухолевого роста различных типов рака является спорным вопросом [7, 14, 37] и не до конца изученной, что требует дальнейших исследований.
Типы нейтрофилов. В дополнение к увеличенному количеству нейтрофилов в крови отмечено повышение уровня в крови незрелых миелоидных клеток на ранних стадиях дифференцировки, что выявлено в нескольких типах опухолей [38], включая пациентов с терминальной стадией рака легкого, грудной железы и желудочно-кишечного тракта [39]. Эти незрелые клетки костномозгового происхождения, представляющие гетерогенную популяцию, фенотипически разделяли на гранулоцитарные (G-MDSC) и моноцитарные (Mo-MDSC) подгруппы [40–42]. Их выявляют в большом количестве в селезенке экспериментальных животных с опухолями, где они представляют иммунодепрессивный фенотип, что приводит к прогрессированию опухолей [43, 44]. G-MDSC характеризуются незрелой морфологией нейтрофилов и фенотипом CD33/CD11b/HLA-DR/CD15 у людей [45]. Они выявлены в периферической крови пациентов с глиобластомой [46], множественной миеломой, лимфомой Ходжкина [47], раком головы и шеи [48].
Эти G-MDSC могут осуществлять иммуносупрессию различными механизмами. Основной механизм включает в себя производство активных форм кислорода (АФК) при дыхательной вспышке этих клеток. У больных онкологического профиля пероксид водорода (H2O2), продуцируемый активированными гранулоцитами, снижал экспрессию CD3 цепи Т-клеточного рецептора и уменьшал выработку цитокинов Т-клетками пациентов [49]. Эти окисленные Т-клетки человека имели дефектный хемотаксис. Более того, АФК, продуцируемые MDSC, могут приводить к блокаде также CD8 T-клеток и с помощью другого механизма, в частности пероксинитрита [50].
Основной механизм включает в себя производство активных форм кислорода (АФК) при дыхательной вспышке этих клеток. У больных онкологического профиля пероксид водорода (H2O2), продуцируемый активированными гранулоцитами, снижал экспрессию CD3 цепи Т-клеточного рецептора и уменьшал выработку цитокинов Т-клетками пациентов [49]. Эти окисленные Т-клетки человека имели дефектный хемотаксис. Более того, АФК, продуцируемые MDSC, могут приводить к блокаде также CD8 T-клеток и с помощью другого механизма, в частности пероксинитрита [50].
Как отмечалось выше, в зависимости от фенотипа нейтрофилы можно классифицировать как Н1 или Н2 [15], и подобно инфильтрирующим опухоль макрофагам (M1) клетки Н1 проявляют провоспалительную и противоопухолевую функции. Напротив, клетки M2 и Н2 обладают протуморогенной активностью [16]. Установлено, что ОН отличаются от циркулирующих нейтрофилов, а также от G-MDSC в костном мозге и селезенке мышей. Мышиные CD11b/Ly6G нейтрофилы, выделенные из опухоли и активированные трансформирующим фактором роста бета (TGF-β), были гиперсегментированы и более цитотоксичны к опухолевым клеткам, экспрессировали более высокие уровни провоспалительных цитокинов [15]. Напротив, истощение этих нейтрофилов из крови угнетало рост опухоли и сопровождалось активацией внутриопухолевых CD8 Т-клеток [15]. В подтверждение идеи о разных фенотипах нейтрофилов проведены исследования на двух моделях рака у мышей (карцинома легкого Льюиса и мезотелиома AB12), у которых нейтрофилы были выявлены прежде всего на периферии опухолевого узла на ранних стадиях развития опухоли. Эти ОН были более цитотоксичны по отношению к опухолевым клеткам и продуцировали более высокие уровни фактора некроза опухоли альфа (TNF-α), NO и H2O2. Напротив, ОН на поздних стадиях развития этих опухолей уже не проявляли таких свойств и демонстрировали протуморогенный фенотип [51]. Эти результаты исследований свидетельствуют, что нейтрофилы, попадая в опухоль, со временем становятся клетками, способными стимулировать рост опухолей [51]. Следовательно, ОН, полученные от мышей с растущими опухолями, могут иметь как противоопухолевый (Н1), так и протуморогенный (Н2) фенотип, который способен поддерживать рост опухоли и подавлять противоопухолевые иммунные реакции [14, 37], зависящие от микроокружения опухоли [17].
Напротив, истощение этих нейтрофилов из крови угнетало рост опухоли и сопровождалось активацией внутриопухолевых CD8 Т-клеток [15]. В подтверждение идеи о разных фенотипах нейтрофилов проведены исследования на двух моделях рака у мышей (карцинома легкого Льюиса и мезотелиома AB12), у которых нейтрофилы были выявлены прежде всего на периферии опухолевого узла на ранних стадиях развития опухоли. Эти ОН были более цитотоксичны по отношению к опухолевым клеткам и продуцировали более высокие уровни фактора некроза опухоли альфа (TNF-α), NO и H2O2. Напротив, ОН на поздних стадиях развития этих опухолей уже не проявляли таких свойств и демонстрировали протуморогенный фенотип [51]. Эти результаты исследований свидетельствуют, что нейтрофилы, попадая в опухоль, со временем становятся клетками, способными стимулировать рост опухолей [51]. Следовательно, ОН, полученные от мышей с растущими опухолями, могут иметь как противоопухолевый (Н1), так и протуморогенный (Н2) фенотип, который способен поддерживать рост опухоли и подавлять противоопухолевые иммунные реакции [14, 37], зависящие от микроокружения опухоли [17].
Несмотря на эту классификацию ОН у мышей, природа и функция ОН, находящихся в опухолях человека, остаются еще малоизученными, но уже получены результаты, подтверждающие такое деление ОН. Так, в исследованиях биопсийного материала опухоли легкого человека ОН составляли 5–25% всех клеток в опухоли [65]. Эти ОН представляли активированный фенотип (CD62L/CD54) с экспрессией отчетливого репертуара рецепторов хемокинов, которые включали CCR5, CCR7, CXCR3 и CXCR4 [65]. Кроме того, ОН продуцировали большее количество провоспалительных факторов MCP-1, IL-8, MIP-1α и IL-6, чем нейтрофилы в крови. ОН также стимулировали пролиферацию Т-клеток и выделение интерферона-гамма (IFN-γ). Эти результаты показывают, что на ранних стадиях рака легкого ОН не являются иммунодепрессантами, а скорее всего стимулируют ответы Т-клеток [52]. В исследовании [53] изучена роль хронического воспаления, в частности IL-23 и IL-17, при раке толстой кишки человека. Авторы выявили, что врожденные γδT (γδT17) клетки являются основным клеточным источником IL-17 при колоректальном раке. Эти активированные клетки индуцировали клетки γδT17 секретировать IL-8, TNF-α и GM-CSF, что приводит к накоплению нейтрофилов в опухоли. Эти ОН характеризовались CD45/Lin/HLADR/CD11b/CD33/CD66b и имели типичную полиморфноядерную морфологию. Они были описаны как G-MDSC [66]. Эти ОН (G-MDSC) продуцировали намного больше аргиназы-1 (ARG1) и АФК, чем аутологичные нейтрофилы в крови, и ингибировали пролиферацию активированных аутологичных Т-клеток и продукцию IFN-γ [53]. Результаты приведенных исследований указывают, что и в опухолях человека могут быть нейтрофилы с двойной функцией. В ранних стадиях развития опухоли ОН, по-видимому, способны стимулировать противоопухолевые иммунные реакции, особенно Т-клеток [52], на поздних этапах роста опухоли ОН уже становятся иммунодепрессивными клетками [54]. Сегодня остается еще много неясных вопросов. Например, являются ли ОН в ранних стадиях роста опухолей незрелыми нейтрофилами с противоопухолевыми свойствами, или ОН — это зрелые нейтрофилы, которые меняют фенотип со временем при прогрессировании опухоли, как предполагают ряд исследователей [17, 51].
Эти активированные клетки индуцировали клетки γδT17 секретировать IL-8, TNF-α и GM-CSF, что приводит к накоплению нейтрофилов в опухоли. Эти ОН характеризовались CD45/Lin/HLADR/CD11b/CD33/CD66b и имели типичную полиморфноядерную морфологию. Они были описаны как G-MDSC [66]. Эти ОН (G-MDSC) продуцировали намного больше аргиназы-1 (ARG1) и АФК, чем аутологичные нейтрофилы в крови, и ингибировали пролиферацию активированных аутологичных Т-клеток и продукцию IFN-γ [53]. Результаты приведенных исследований указывают, что и в опухолях человека могут быть нейтрофилы с двойной функцией. В ранних стадиях развития опухоли ОН, по-видимому, способны стимулировать противоопухолевые иммунные реакции, особенно Т-клеток [52], на поздних этапах роста опухоли ОН уже становятся иммунодепрессивными клетками [54]. Сегодня остается еще много неясных вопросов. Например, являются ли ОН в ранних стадиях роста опухолей незрелыми нейтрофилами с противоопухолевыми свойствами, или ОН — это зрелые нейтрофилы, которые меняют фенотип со временем при прогрессировании опухоли, как предполагают ряд исследователей [17, 51]. Уже идентифицировано несколько субпопуляций нейтрофилов в крови как мышей с опухолями, так и людей, больных раком, и описывается несколько вариантов взаимосвязей этих клеток в связи с прогрессированием рака [54]. Показано, что циркулирующие в крови нейтрофилы от животных с опухолями распределяли на субпопуляции (фракции) при разделении их в различных градиентах плотности фиколла. Одна субпопуляция состояла из «нормальных» нейтрофилов с высокой плотностью, которую выделяли на градиенте с высокой плотностью фиколла. Другая субпопуляция имела нейтрофилы с меньшей плотностью, которые находились вместе со слоем мононуклеарных лимфоидных клеток низкой плотности [55]. У здоровых мышей, не имеющих опухоли, большинство нейтрофилов были высокой плотности, а у животных с опухолями прогрессивно возрастало количество нейтрофилов с низкой плотностью, и они становились доминирующим типом нейтрофилов в циркуляции [54]. Эти нейтрофилы обладали меньшей цитотоксичностью и имели меньшую экспрессию различных хемокинов (CXCL1, CXCL2, CXCL10, CCL2 и CCL3) и хемокиновых рецепторов (CXCR2 и CCR5), что свидетельствовало о снижении их провоспалительных возможностей.
Уже идентифицировано несколько субпопуляций нейтрофилов в крови как мышей с опухолями, так и людей, больных раком, и описывается несколько вариантов взаимосвязей этих клеток в связи с прогрессированием рака [54]. Показано, что циркулирующие в крови нейтрофилы от животных с опухолями распределяли на субпопуляции (фракции) при разделении их в различных градиентах плотности фиколла. Одна субпопуляция состояла из «нормальных» нейтрофилов с высокой плотностью, которую выделяли на градиенте с высокой плотностью фиколла. Другая субпопуляция имела нейтрофилы с меньшей плотностью, которые находились вместе со слоем мононуклеарных лимфоидных клеток низкой плотности [55]. У здоровых мышей, не имеющих опухоли, большинство нейтрофилов были высокой плотности, а у животных с опухолями прогрессивно возрастало количество нейтрофилов с низкой плотностью, и они становились доминирующим типом нейтрофилов в циркуляции [54]. Эти нейтрофилы обладали меньшей цитотоксичностью и имели меньшую экспрессию различных хемокинов (CXCL1, CXCL2, CXCL10, CCL2 и CCL3) и хемокиновых рецепторов (CXCR2 и CCR5), что свидетельствовало о снижении их провоспалительных возможностей. Предполагается, что нейтрофилы с низкой плотность являются незрелыми нейтрофилами. Важно отметить, что TGF-β способен индуцировать трансформацию нейтрофилов с высокой плотностью от мышей с опухолями в нейтрофилы с низкой плотностью, и в то же время этот фактор не влиял на нейтрофилы крови животных без опухолей [54]. Это указывает на то, что для такого изменения ОН у животных с раком необходимы и другие стимулы, помимо TGF-β. На основании этих результатов авторы предложили гипотезу, согласно которой три субпопуляции нейтрофилов могут присутствовать в крови при раке: нормальные нейтрофилы высокой плотности, незрелые нейтрофилы низкой плотности (G-MDSC) и крупные зрелые нейтрофилы низкой плотности. Эти типы клеток обладают разной функциональностью и пластичностью. Так, нейтрофилы с высокой плотностью являются противоопухолевыми, а низкой — клетками, способными стимулировать рост опухоли [67], они могут изменяться под влиянием различных хемокинов и цитокинов в микроокружении опухоли [17].
Предполагается, что нейтрофилы с низкой плотность являются незрелыми нейтрофилами. Важно отметить, что TGF-β способен индуцировать трансформацию нейтрофилов с высокой плотностью от мышей с опухолями в нейтрофилы с низкой плотностью, и в то же время этот фактор не влиял на нейтрофилы крови животных без опухолей [54]. Это указывает на то, что для такого изменения ОН у животных с раком необходимы и другие стимулы, помимо TGF-β. На основании этих результатов авторы предложили гипотезу, согласно которой три субпопуляции нейтрофилов могут присутствовать в крови при раке: нормальные нейтрофилы высокой плотности, незрелые нейтрофилы низкой плотности (G-MDSC) и крупные зрелые нейтрофилы низкой плотности. Эти типы клеток обладают разной функциональностью и пластичностью. Так, нейтрофилы с высокой плотностью являются противоопухолевыми, а низкой — клетками, способными стимулировать рост опухоли [67], они могут изменяться под влиянием различных хемокинов и цитокинов в микроокружении опухоли [17].
Очевидно, высокий уровень нейтрофилов в опухоли происходит под действием нейтрофил-притягивающих хемокинов, которые могут продуцироваться не только иммунными клетками, но и опухолевыми клетками, в частности интерлейкином-8 (IL-8/CXCL8). Другим хемокином, который также участвует в рекрутировании нейтрофилов в опухоли, является хемокин GCP-2/CXCL6. В мышиной модели меланомы специфические моноклональные антитела против CXCL6 уменьшали количество ОН, а также размер опухоли [56]. Кроме того, из карциноматозных опухолей человека выделен и идентифицирован фактор ингибирования миграции (MIF), уровень которого был высокий в опухолях с бóльшим содержанием ОН и низкой выживаемостью этих пациентов [57]. Используя те же рецепторы CXCR1 и CXCR2, нейтрофилы могут также реагировать и на другие хемокины, такие как CXCL1, CXCL2, CXCL5, CXCL6 и CXCL7 [58]. Не исключено, что нейтрофилы активируют сами себя по механизму положительной обратной связи, высвобождая нейтрофильные хемокины, которые привлекают больше нейтрофилов в опухоль, подобно миграции нейтрофилов в очаги инфекции [59]. При исследовании 919 пациентов с гепатоцеллюлярной карциномой выявлено, что CXCL5 сверхэкспрессируется у пациентов с рецидивирующими опухолями, уровни CXCL5 коррелировали с большим накоплением в опухоли нейтрофилов и с меньшей общей выживаемостью [60].
Другим хемокином, который также участвует в рекрутировании нейтрофилов в опухоли, является хемокин GCP-2/CXCL6. В мышиной модели меланомы специфические моноклональные антитела против CXCL6 уменьшали количество ОН, а также размер опухоли [56]. Кроме того, из карциноматозных опухолей человека выделен и идентифицирован фактор ингибирования миграции (MIF), уровень которого был высокий в опухолях с бóльшим содержанием ОН и низкой выживаемостью этих пациентов [57]. Используя те же рецепторы CXCR1 и CXCR2, нейтрофилы могут также реагировать и на другие хемокины, такие как CXCL1, CXCL2, CXCL5, CXCL6 и CXCL7 [58]. Не исключено, что нейтрофилы активируют сами себя по механизму положительной обратной связи, высвобождая нейтрофильные хемокины, которые привлекают больше нейтрофилов в опухоль, подобно миграции нейтрофилов в очаги инфекции [59]. При исследовании 919 пациентов с гепатоцеллюлярной карциномой выявлено, что CXCL5 сверхэкспрессируется у пациентов с рецидивирующими опухолями, уровни CXCL5 коррелировали с большим накоплением в опухоли нейтрофилов и с меньшей общей выживаемостью [60]. В частности, известно, что активированные Т-клетки продуцируют GM-CSF, CXCL1, CXCL2, TNF-α и IFN-γ [59]. Эти факторы могут прямо или косвенно привлекать больше нейтрофилов к опухоли. Хотя конкретные механизмы влияния активированных Т-клеток на миграцию нейтрофилов в опухоль изучены недостаточно.
В частности, известно, что активированные Т-клетки продуцируют GM-CSF, CXCL1, CXCL2, TNF-α и IFN-γ [59]. Эти факторы могут прямо или косвенно привлекать больше нейтрофилов к опухоли. Хотя конкретные механизмы влияния активированных Т-клеток на миграцию нейтрофилов в опухоль изучены недостаточно.
Нейтрофильные молекулы. Большой объем клинических данных показывает, что нейтрофилы участвуют в развитии рака и прогрессировании опухолей. В большинстве случаев увеличенное количество ОН ассоциируется с прогрессирующей болезнью и плохим прогнозом для больных онкологического профиля. Установлено, что такая отрицательная ассоциация характерна для ряда солидных опухолей, таких как меланома, гепатоцеллюлярная карцинома, немелкоклеточная карцинома легкого, глиома, аденокарцинома и рак толстой кишки [37, 61]. Предполагается, что в стимуляцию онкогенеза включаются те же молекулы, которые нейтрофилы используют для уничтожения микроорганизмов и модуляции воспаления [7]. Важными молекулами, которые могут влиять на темп роста и инвазивность опухолей, являются гранулярные белки, деградирующие в матриксе протеиназы, реактивные виды кислорода, хемокины и цитокины [7]. В последнее время появились сообщения, описывающие, как ОН используют эти молекулы для воздействия на пролиферацию опухолевых клеток, ангиогенез, метастазы и иммунный надзор. Среди этих молекул следует выделить такие, как нейтрофильная эластаза (NE), катепсин, матриксная металлопротеиназа (MMP)-9 и др.
В последнее время появились сообщения, описывающие, как ОН используют эти молекулы для воздействия на пролиферацию опухолевых клеток, ангиогенез, метастазы и иммунный надзор. Среди этих молекул следует выделить такие, как нейтрофильная эластаза (NE), катепсин, матриксная металлопротеиназа (MMP)-9 и др.
NE представляет собой основной белок азурофильных гранул, который выделяется при клеточной дегрануляции нейтрофилов. NE — сериновая протеаза с широким спектром субстратов. Помимо своей роли в воспалении и уничтожении бактерий, NE проявляет различные протуморогенные эффекты как in vivo, так и in vitro [62]. Выявлено, что NE непосредственно стимулирует пролиферацию опухолевых клеток A459, когда мышиные нейтрофилы культивировали вместе с клеточной линией карциномы легкого [62, 63]. Кроме того, также установлено, что NE стимулирует миграцию опухолевых клеток. Нейтрофилы человека при культивировании с клетками аденокарциномы поджелудочной железы стимулировали миграцию клеток опухоли из монослоя. NE также повышала миграционную способность раковых клеток пищевода [64].
NE также повышала миграционную способность раковых клеток пищевода [64].
Катепсин G представляет собой пептидазу из азурофильных гранул, которая участвует в деградации фагоцитированных микроорганизмов и ремоделировании белков внеклеточного матрикса [98]. Кроме того, катепсин G может стимулировать ангиогенез и миграцию опухолевых клеток [65–67]. На модели метастазирования рака грудной железы в костную ткань также показано, что катепсин G усиливает передачу сигналов TGF-β и повышает уровень сосудистого эндотелиального фактора роста (VEGF) для стимуляции ангиогенеза [66].
MMP-9 — желатиназа B — высвобождается из вторичных (специфических) гранул и, как установлено, приводит к пролиферации опухолей кожи человека вирусом папилломы человека 16-го типа (HPV-16). Кроме того, иммуногистохимическое исследование MMP-9 в плоскоклеточных опухолях карциномы показало, что MMP-9 присутствовала только в опухолевых инфильтрирующих лейкоцитах, а не в самих опухолевых клетках. Показано, что MMP-9 ингибирует апоптоз опухолевых клеток при раке легкого [68]. Таким образом, ММП-9 ответственна за усиление роста опухоли как за счет увеличения пролиферации клеток, так и уменьшения их апоптоза. Другим важным эффектом MMP-9, который поддерживает рост опухоли, является ангиогенез. Протеолитическое высвобождение VEGF из тканевого матрикса при действии MMPs считается необходимым условием ангиогенеза in vivo [68, 69]. Ангиогенный эффект MMP-9 зарегистрирован в нескольких моделях рака — меланоме, аденокарциноме поджелудочной железы [70–72].
Таким образом, ММП-9 ответственна за усиление роста опухоли как за счет увеличения пролиферации клеток, так и уменьшения их апоптоза. Другим важным эффектом MMP-9, который поддерживает рост опухоли, является ангиогенез. Протеолитическое высвобождение VEGF из тканевого матрикса при действии MMPs считается необходимым условием ангиогенеза in vivo [68, 69]. Ангиогенный эффект MMP-9 зарегистрирован в нескольких моделях рака — меланоме, аденокарциноме поджелудочной железы [70–72].
Прямое доказательство того, что нейтрофилы являются основным, ассоциированным с опухолью лейкоцитарным типом, экспрессирующим MMP-9, предоставлено в исследовании с использованием человеческих ксенотрансплантатов и сингенных опухолей в эксперименте на мышах [73]. Когда опухоли или изолированные из них макрофаги или нейтрофилы были дважды окрашены для выявления MMP-9 и соответствующих антигенов макрофагов или нейтрофилов, только ОН содержали большое количество MMP-9 [74, 75]. Кроме того, подсчитано, что 1•10 нейтрофилов в крови или ОН могут высвобождать приблизительно 100–200 нг проМMP-9 в течение 1–2 ч инкубации. Напротив, для макрофагов 1•10 потребуется несколько недель для получения такого же количества проММР-9 [73, 74]. Следовательно, MMP-9, полученная из нейтрофилов, ответственна за усиление ангиогенеза за счет высвобождения VEGF из внеклеточного матрикса, что отмечается при многих типах опухолей. С внеклеточным матриксом связывают и другие процессы онкогенеза, например метастазирование опухолей [75, 76].
Напротив, для макрофагов 1•10 потребуется несколько недель для получения такого же количества проММР-9 [73, 74]. Следовательно, MMP-9, полученная из нейтрофилов, ответственна за усиление ангиогенеза за счет высвобождения VEGF из внеклеточного матрикса, что отмечается при многих типах опухолей. С внеклеточным матриксом связывают и другие процессы онкогенеза, например метастазирование опухолей [75, 76].
Нейтрофилы являются эффективными производителями АФК для уничтожения микроорганизмов. АФК также может косвенно способствовать росту опухоли. Во-первых, нейтрофилы генерируют пероксид водорода (H2O2), который затем превращается в гипохлорид (HOCl) с помощью миелопероксидазы. HOCl затем может активировать несколько MMPs, включая MMP-2, -7, -8 и -9. Кроме того, HOCl может блокировать ингибитор МMP-1 и таким образом потенцировать протеолитическую активность MMPs [77, 78].
Выделенная из гранул нейтрофилов ARG1 способна разрушать внеклеточный аргинин, незаменимую аминокислоту для активации Т-клеток. Таким образом, дегрануляция нейтрофилов может оказывать иммуносупрессивный эффект в опухолях, ингибируя опухольинфильтрирующие Т-клетки таким же образом, как описано для G-MDSC [79]. Показано, что истощение ОН у опухольсодержащих животных увеличило число активированных CD8 T-клеток, способствовало уменьшению размера опухолей и удлиняло время жизни животных [15].
Таким образом, дегрануляция нейтрофилов может оказывать иммуносупрессивный эффект в опухолях, ингибируя опухольинфильтрирующие Т-клетки таким же образом, как описано для G-MDSC [79]. Показано, что истощение ОН у опухольсодержащих животных увеличило число активированных CD8 T-клеток, способствовало уменьшению размера опухолей и удлиняло время жизни животных [15].
Нейтрофилы могут также продуцировать цитокины или факторы роста, которые увеличивают туморогенный потенциал раковых клеток [5]. Это пока что установлено для двух цитокинов — онкостатина-M [79–81] и для фактора роста гепатоцитов [10, 82, 83]. Раковые клетки грудной железы могут стимулировать нейтрофилы к выделению онкостатина-М, IL-6-подобного цитокина. Онкостатин-М, в свою очередь, стимулировал клетки рака грудной железы секретировать VEGF [84]. Аналогично, клетки гепатоцеллюлярной карциномы стимулировали нейтрофилы высвобождать фактор роста гепатоцитов (HGF). В свою очередь, этот фактор стимулировал инвазивный рост опухолевых клеток [85].
Нейтрофилы также могут влиять на миграционный потенциал раковых клеток. При нескольких типах рака показано, что нейтрофилы способствуют метастазированию плоскоклеточного рака кожи [86], меланомы [87], аденокарциномы [88] и рака грудной железы [89]. Способ, которым нейтрофилы повышают миграционную активность опухолевых клеток, может включать несколько различных механизмов. Циркулирующие опухолевые клетки непосредственно прилипают к сосудистому эндотелию, приводя к экстравазации для создания новых метастазов. В месте образования метастатического очага клетками рака легкого отмечалась их тесная связь с нейтрофилами [90]. В этом процессе нейтрофилы усиливают задержку опухолевых клеток, и, как следствие, возникает больше метастазов [91]. Показано прямое взаимодействие между клетками нейтрофилов и клетками карциномы грудной железы путем взаимодействия молекул адгезии ICAM-1 в опухолевых клетках и β2-интегринов на нейтрофилах. Нейтрофилы связывали опухолевые клетки с участием интегринов и индуцировали кластеризацию ICAM-1 в опухолевой клетке [91]. Это активировало в опухолевой клетке сигнальный путь с участием фокальной адгезии киназы (FAK) и p38-MAPK, что привело к усиленной миграции [89]. Вследствие этого повышенная миграция, как показано in vivo, приводила к увеличению количества метастазов в печени [92]. Раковые клетки непосредственно прикреплялись поверх адгезированных нейтрофилов, которые выступали в качестве мостика при взаимодействии между опухолевыми клетками и паренхимой печени, что ускоряло развитие метастазов [93].
Это активировало в опухолевой клетке сигнальный путь с участием фокальной адгезии киназы (FAK) и p38-MAPK, что привело к усиленной миграции [89]. Вследствие этого повышенная миграция, как показано in vivo, приводила к увеличению количества метастазов в печени [92]. Раковые клетки непосредственно прикреплялись поверх адгезированных нейтрофилов, которые выступали в качестве мостика при взаимодействии между опухолевыми клетками и паренхимой печени, что ускоряло развитие метастазов [93].
Несмотря на большое количество доказательств отрицательной роли нейтрофилов во время прогрессирования опухоли, имеются также четкие свидетельства положительной роли нейтрофилов в канцерогенезе. Как упоминалось ранее, нейтрофилы могут проявлять противоопухолевую активность в различных формах. Фактически, противоопухолевая способность нейтрофилов установлена давно, более трех десятилетий назад. Нейтрофилы могут непосредственно уничтожать опухолевые клетки как in vitro [36], так и in vivo [37]. Нейтрофилы потенцируют этот противоопухолевый эффект, когда они активированы. Важность ОН типа Н1 в противоопухолевых реакциях также подчеркивается экспериментальными исследованиями о том, что истощение уровня нейтрофилов в крови приводит к увеличению роста опухоли [15, 93, 94]. Очевидно, что нейтрофилы обладают потенциалом непосредственного уничтожения опухолевых клеток. Механизмы, посредством которых нейтрофилы выполняют эту функцию, многочисленны и еще не полностью изучены, но они включают в себя многие уже известные механизмы антиинфекционной защиты [7].
Нейтрофилы потенцируют этот противоопухолевый эффект, когда они активированы. Важность ОН типа Н1 в противоопухолевых реакциях также подчеркивается экспериментальными исследованиями о том, что истощение уровня нейтрофилов в крови приводит к увеличению роста опухоли [15, 93, 94]. Очевидно, что нейтрофилы обладают потенциалом непосредственного уничтожения опухолевых клеток. Механизмы, посредством которых нейтрофилы выполняют эту функцию, многочисленны и еще не полностью изучены, но они включают в себя многие уже известные механизмы антиинфекционной защиты [7].
ЗАКЛЮЧЕНИЕ
Таким образом, согласно представленным выше кратким сведениям подчеркивается двойной противоопухолевый и протуморальный потенциал нейтрофилов и предполагается, что нейтрофилы могут быть использованы для усиления различных противоопухолевых реакций в организме.
Хотя во многих случаях наличие нейтрофилов в опухолях оказывает негативное влияние на течение раковой болезни, эти клетки, несомненно, обладают способностью разрушать опухолевые клетки. Сегодня рассматривается около десяти новых терапевтических стратегий и подходов для усиления противоопухолевого потенциала нейтрофилов или блокирования доступа ОН к растущим опухолям, такие как активация нейтрофилов интерфероном, синтез и накопление высоких уровней провоспалительных цитокинов в опухоли, которые могут убивать опухолевые клетки, блокирование инфильтрации нейтрофилами опухоли и многие другие. Как указывалось выше, в некоторых опухолях образуются хемокины, главным образом IL-8, которые привлекают нейтрофилы в опухолевый очаг. Показано, что применение антагонистов IL-8 (таких как полностью гуманизированное нейтрализующее моноклональное антитело ABX-IL8) к IL-8 уменьшает рост опухоли, метастазы и ангиогенез меланомы и рака легкого [95]. Наличие двух фенотипов Н1 и Н2 нейтрофилов, предполагает также, что, влияя на микроокружение опухоли, можно манипулировать ОН и генерировать большее количество противоопухолевых нейтрофилов. Также получены многообещающие результаты с использованием моноклональных терапевтических антител, индуцирующих нейтрофилы для выполнения антителозависимой цитотоксичности и высвобождения цитокинов, которые модулируют иммунный противоопухолевый ответ [96, 97].
Сегодня рассматривается около десяти новых терапевтических стратегий и подходов для усиления противоопухолевого потенциала нейтрофилов или блокирования доступа ОН к растущим опухолям, такие как активация нейтрофилов интерфероном, синтез и накопление высоких уровней провоспалительных цитокинов в опухоли, которые могут убивать опухолевые клетки, блокирование инфильтрации нейтрофилами опухоли и многие другие. Как указывалось выше, в некоторых опухолях образуются хемокины, главным образом IL-8, которые привлекают нейтрофилы в опухолевый очаг. Показано, что применение антагонистов IL-8 (таких как полностью гуманизированное нейтрализующее моноклональное антитело ABX-IL8) к IL-8 уменьшает рост опухоли, метастазы и ангиогенез меланомы и рака легкого [95]. Наличие двух фенотипов Н1 и Н2 нейтрофилов, предполагает также, что, влияя на микроокружение опухоли, можно манипулировать ОН и генерировать большее количество противоопухолевых нейтрофилов. Также получены многообещающие результаты с использованием моноклональных терапевтических антител, индуцирующих нейтрофилы для выполнения антителозависимой цитотоксичности и высвобождения цитокинов, которые модулируют иммунный противоопухолевый ответ [96, 97].
На развитие опухоли оказывают влияние многие типы клеток организма, в том числе ОН. Точная роль ОН до конца не установлена, и ее предстоит еще выяснить. В настоящее время широко изучаются разные способы привлечения их в опухоль и превращения Н1 нейтрофилов в противоопухолевые эффекторные клетки. Научиться переворачивать «монеты» нейтрофилов на «выигрышную сторону», как считают E. Uribe-Querol и C. Rosales [98], а именно, заставить действовать их как противоопухолевые эффекторные клетки, является вызовом и задачей для будущих исследований, что, возможно, позволит усовершенствовать существующие методы лечения рака.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Borregaard N. (2010) Neutrophils, from marrow to microbes. Immunity, 33(5): 657–670. doi: 10.1016/j.immuni.2010.11.011.
2. Kolaczkowska E., Kubes P. (2013) Neutrophil recruitment and function in health and inflammation. Nat. Rev. Immunol., 13(3): 159–175. doi: 10.1038/nri3399.
3. Pham C.T.N. (2006) Neutrophil serine proteases: specific regulators of inflammation. Nat. Rev. Immunol., 6(7): 541–550. doi: 10.1038/nri1841.
Nat. Rev. Immunol., 6(7): 541–550. doi: 10.1038/nri1841.
4. Scapini P., Lapinet-Vera J.A., Gasperini S. et al. (2000) The neutrophil as a cellular source of chemokines. Immunol. Rev., 177: 195–203. doi: 10.1034/j.1600-065x.2000.17706.
5. Tecchio C., Scapini P., Pizzolo G., Cassatella M.A. (2013) On the cytokines produced by human neutrophils in tumors. Sem. Cancer Biol., 23(3): 159–170. doi: 10.1016/j.semcancer.2013.02.004.
6. Mantovani A., Allavena P., Sica A., Balkwill F. (2008) Cancer-related inflammation. Nature, 454 (7203): 436–444. doi: 10.1038/nature07205.
7. Бережная Н.М., Чехун В.Ф. (2005) Иммунология злокачественного роста. Наукова думка, Киев, 791 с.
8. Gregory A.D., Houghton A.M. (2011) Tumor-associated neutrophils: new targets for cancer therapy. Cancer Res., 71(7): 2411–2416. doi: 10.1158/0008-5472.can-10-2583.
9. Mantovani A., Cassatella M.A., Costantini C., Jaillon S. (2011) Neutrophils in the activation and regulation of innate and adaptive immunity. Nat. Rev. Immunol., 11(8): 519–531. doi: 10.1038/nri3024.
Nat. Rev. Immunol., 11(8): 519–531. doi: 10.1038/nri3024.
10. Wislez M., Rabbe N., Marchal J. et al. (2003) Hepatocyte growth factor production by neutrophils infiltrating bronchioloalveolar subtype pulmonary adenocarcinoma: role in tumor progression and death. Cancer Res., 63(6): 1405–1412.
11. Schmidt H., Bastholt L., Geertsen P. et al. (2005) Elevated neutrophil and monocyte counts in peripheral blood are associated with poor survival in patients with metastatic melanoma: a prognostic model. Brit. J. Cancer, 93(3): 273–278. doi: 10.1038/sj.bjc.6602702.
12. Jensen H.K., Donskov F., Marcussen N. et al. (2009) Presence of intratumoral neutrophils is an independent prognostic factor in localized renal cell carcinoma. J. Clin. Oncol., 27(28): 4709–4717. doi: 10.1200/jco.2008.18.9498.
13. Trellakis S., Bruderek K., Dumitru C.A. et al. (2011) Polymorphonuclear granulocytes in human head and neck cancer: enhanced inflammatory activity, modulation by cancer cells and expansion in advanced disease. Int. J. Cancer, 129(9): 2183–2193. doi: 10.1002/ijc.25892.
Int. J. Cancer, 129(9): 2183–2193. doi: 10.1002/ijc.25892.
14. Fridlender Z.G., Albelda S.M. (2012) Tumor-associated neutrophils: friend or foe? Carcinogenesis, 33(5): 949–955. doi: 10.1093/carcin/bgs123.
15. Fridlender Z.G., Sun J., Kim S. et al. (2009) Polarization of tumor-associated neutrophil phenotype by TGF-β: ‘N1’ versus ‘N2’ TAN. Cancer Cell, 16(3): 183–194. doi: 10.1016/j.ccr.2009.06.017. [PMC free article].
16. Galdiero M.R., Garlanda C., Jaillon S. et al. (2013) Tumor associated macrophages and neutrophils in tumor progression. J. Cell. Physiol., 228(7): 1404–1412. doi: 10.1002/jcp.24260.
17. Sionov R.V., Fridlender Z.G., Granot Z. (2014) The multifaceted roles neutrophils play in the tumor microenvironment. Cancer Microenviron., 1–34. doi: 10.1007/s12307-014-0147-5.
18. Swierczak A., Mouchemore K.A., Hamilton J.A., Anderson R.L. (2015) Neutrophils: important contributors to tumor progression and metastasis. Cancer and Metastasis Rev., 34(4): 735–751. doi: 10.1007/s10555-015-9594-9.
doi: 10.1007/s10555-015-9594-9.
19. McGary C.T., Miele M.E., Welch D.R. (1995) Highly metastatic 13762NF rat mammary adenocarcinoma cell clones stimulate bone marrow by secretion of granulocyte-macrophage colony-stimulating factor/interleukin-3 activity. Am. J. Pathol., 147(6): 1668–1681.
20. Lechner M.G., Liebertz D.J., Epstein A.L. (2010) Characterization of cytokine-induced myeloid-derived suppressor cells from normal human peripheral blood mononuclear cells. J. Immunol., 185(4): 2273–2284. doi: 10.4049/jimmunol.1000901.
21. Atzpodien J., Reitz M. (2008) Peripheral blood neutrophils as independent immunologic predictor of response and long-term survival upon immunotherapy in metastatic renal-cell carcinoma. Cancer Biother. Radiopharm., 23(1): 129–134. doi: 10.1089/cbr.2007.0429.
22. Bellocq A., Antoine M., Flahault A. et al. (1998) Neutrophil alveolitis in bronchioloalveolar carcinoma: induction by tumor-derived interleukin-8 and relation to clinical outcome. Am. J. Pathol., 152(1): 83–92.
Am. J. Pathol., 152(1): 83–92.
23. Reid M.D., Basturk O., Thirabanjasak D. et al. (2011) Tumor-infiltrating neutrophils in pancreatic neoplasia. Modern Pathol., 24(12): 1612–1619. doi: 10.1038/modpathol.2011.113.
24. Halazun K.J., Hardy M.A., Rana A.A. et al. (2009) Negative impact of neutrophil-lymphocyte ratio on outcome after liver transplantation for hepatocellular carcinoma. Ann. Surg., 250(1): 141–151. doi: 10.1097/SLA.0b013e3181a77e59.
25. Walsh S.R., Cook E.J., Goulder F. et al. (2005) Neutrophil-lymphocyte ratio as a prognostic factor in colorectal cancer. J. Surg. Oncol., 91(3): 181–184. doi: 10.1002/jso.20329.
26. Peng B., Wang Y.-H., Liu Y.-M., Ma L.-X. (2015) Prognostic significance of the neutrophil to lymphocyte ratio in patients with non-small cell lung cancer: a systemic review and meta-analysis. Int. J. Clin. Exp. Med., 8(3): 3098–3106.
27. Malietzis G., Giacometti M., Kennedy R.H. et al. (2014) The emerging role of neutrophil to lymphocyte ratio in determining colorectal cancer treatment outcomes: a systematic review and meta-analysis. Ann. Surg. Oncol., 21(12): 3938–3946. doi: 10.1245/s10434-014-3815-2.
Ann. Surg. Oncol., 21(12): 3938–3946. doi: 10.1245/s10434-014-3815-2.
28. Krenn-Pilko S., Langsenlehner U., Thurner E.-M. et al. (2014) The elevated preoperative derived neutrophil-to-lymphocyte ratio predicts poor clinical outcome in breast cancer patients. Brit. J. Cancer, 110(10): 2524–2530. doi: 10.1038/bjc.2014.163.
29. Pistelli M., De Lisa M., Ballatore Z. et al. (2015) Pre-treatment neutrophil to lymphocyte ratio may be a useful tool in predicting survival in early triple negative breast cancer patients. BMC Cancer, 15, article 195. doi: 10.1186/s12885-015-1204-2.
30. Guthrie G.J.K., Charles K.A., Roxburgh C.S.D. et al. (2013) The systemic inflammation-based neutrophil-lymphocyte ratio: experience in patients with cancer. Crit. Rev. Oncol. Hematol., 88(1): 218–230. doi: 10.1016/j.critrevonc.2013.03.010.
31. Templeton A.J., McNamara M.G., Šeruga B. et al. (2014) Prognostic role of neutrophil-to-lymphocyte ratio in solid tumors: a systematic review and meta-analysis. J. Nat. Cancer Institute, 106(6). doi: 10.1093/jnci/dju124.dju124.
J. Nat. Cancer Institute, 106(6). doi: 10.1093/jnci/dju124.dju124.
32. Paramanathan A., Saxena A., Morris D.L. (2014) A systematic review and meta-analysis on the impact of pre-operative neutrophil lymphocyte ratio on long term outcomes after curative intent resection of solid tumours. Surg. Oncol., 23(1): 31–39. doi: 10.1016/j.suronc.2013.12.001.
33. Caruso R.A., Bellocco R., Pagano M. et al. (2002) Prognostic value of intratumoral neutrophils in advanced gastric carcinoma in a high-risk area in Northern Italy. Modern Pathol., 15(8): 831–837. doi: 10.1097/01.mp.0000020391.98998.6b.
34. Pickaver A.H., Ratcliffe N.A., Williams A.E., Smith H. (1972) Cytotoxic effects of peritoneal neutrophils on a syngeneic rat tumour. Nature: New biology, 235(58): 186–187.
35. Gerrard T.L., Cohen D.J., Kaplan A.M. (1981) Human neutrophil-mediated cytotoxicity to tumor cells. J. Natl Cancer Inst., 66(3): 483–488 (19820701) 50:160;62::aid-cncr282050011362;3.0.co;2-0.
36. Katano M., Torisu M. (1982) Neutrophil-mediated tumor cell destruction in cancer ascites. Cancer, 50(1): 62–68. doi: 10.1002/1097-0142.
Katano M., Torisu M. (1982) Neutrophil-mediated tumor cell destruction in cancer ascites. Cancer, 50(1): 62–68. doi: 10.1002/1097-0142.
37. Brandau S., Dumitru C.A., Lang S. (2013) Protumor and antitumor functions of neutrophil granulocytes. Seminars in Immunopathology, 35(2): 163–176. doi: 10.1007/s00281-012-0344-6.
38. Almand B., Clark J.I., Nikitina E. et al. (2001) Increased production of immature myeloid cells in cancer patients: a mechanism of immunosuppression in cancer. J. Immunol., 166(1): 678–689. doi: 10.4049/jimmunol.166.1.678.
39. Choi J., Suh B., Ahn Y. et al. (2012) CD15+/CD16 human granulocytes from terminal cancer patients: granulocytic myeloid-derived suppressor cells that have suppressive function. Tumor Biology, 33(1): 121–129. doi: 10.1007/s13277-011-0254-6.
40. Peranzoni E., Zilio S., Marigo I. et al. (2010) Myeloid-derived suppressor cell heterogeneity and subset definition. Curr. Opin. Immunol., 22(2): 238–244. doi: 10.1016/j.coi.2010. 01.021.
01.021.
41. Raber P.L., Thevenot P., Sierra R. et al. (2014) Subpopulations of myeloid-derived suppressor cells impair T cell responses through independent nitric oxide-related pathways. Int. J. Cancer, 134(12): 2853–2864. doi: 10.1002/ijc.28622.
42. Youn J.-I., Nagaraj S., Collazo M., Gabrilovich D.I. (2008) Subsets of myeloid-derived suppressor cells in tumor-bearing mice. J. Immunol., 181(8): 5791–5802. doi: 10.4049/jimmunol.181.8.5791.
43. Gabrilovich D.I., Nagaraj S. (2009) Myeloid-derived suppressor cells as regulators of the immune system. Nat. Rev. Immunol., 9(3): 162–174. doi: 10.1038/nri2506.
44. Nagaraj S., Schrum A.G., Cho H.-I. et al. (2010) Mechanism of T cell tolerance induced by myeloid-derived suppressor cells. J. Immunol., 184(6): 3106–3116. doi: 10.4049/jimmunol.0902661.
45. Favaloro J., Liyadipitiya T., Brown R. et al. (2014) Myeloid derived suppressor cells are numerically, functionally and phenotypically different in patients with multiple myeloma. Leukemia & Lymphoma, 55(12): 2893–2900. doi: 10.3109/10428194.2014.904511.
Leukemia & Lymphoma, 55(12): 2893–2900. doi: 10.3109/10428194.2014.904511.
46. Raychaudhuri B., Rayman P., Huang P. et al. (2015) Myeloid derived suppressor cell infiltration of murine and human gliomas is associated with reduction of tumor infiltrating lymphocytes. J. Neuro-Oncology, 122: 293–301. doi: 10.1007/s11060-015-1720-6.
47. Gallamini A., Di Raimondo F., La Nasa G. et al. (2013) Standard therapies versus novel therapies in Hodgkin lymphoma. Immunol. Letters, 155(1–2): 56–59. doi: 10.1016/j.imlet.2013.09.011.
48. Trellakis S., Bruderek K., Hütte J. et al. (2013) Granulocytic myeloid-derived suppressor cells are cryosensitive and their frequency does not correlate with serum concentrations of colony-stimulating factors in head and neck cancer. Innate Immunity, 19(3): 328–336. doi: 10.1177/1753425912463618.
49. Schmielau J., Finn O.J. (2001) Activated granulocytes and granulocyte-derived hydrogen peroxide are the underlying mechanism of suppression of T-cell function in advanced cancer patients. Cancer Res., 61(12): 4756–4760.
Cancer Res., 61(12): 4756–4760.
50. Nagaraj S., Gupta K., Pisarev V. et al. (2007) Altered recognition of antigen is a mechanism of CD8+ T cell tolerance in cancer. Nat. Med., 13(7): 828–835. doi: 10.1038/nm1609.
51. Mishalian I., Bayuh R., Levy L. et al. (2013) Tumor-associated neutrophils (TAN) develop pro-tumorigenic properties during tumor progression. Cancer Immunol., Immunother., 62(11): 1745–1756. doi: 10.1007/s00262-013-1476-9.
52. Eruslanov E.B., Bhojnagarwala P.S., Quatromoni J.G. et al. (2014) Tumor-associated neutrophils stimulate T cell responses in early-stage human lung cancer. J. Clin. Invest., 124(12): 5466–5480. doi: 10.1172/JCI77053.
53. Wu P., Wu D., Ni C. et al. (2014) γδT17 cells promote the accumulation and expansion of myeloid-derived suppressor cells in human colorectal cancer. Immunity, 40(5): 785–800. doi: 10.1016/j.immuni.2014.03.013.
54. Sagiv J.Y., Michaeli J., Assi S. et al. (2015) Phenotypic diversity and plasticity in circulating neutrophil subpopulations in cancer. Cell Reports, 10(4): 562–573. doi: 10.1016/j.celrep.2014.12.039.
Cell Reports, 10(4): 562–573. doi: 10.1016/j.celrep.2014.12.039.
55. García-García E., Uribe-Querol E., Rosales C. (2013) A simple and efficient method to detect nuclear factor activation in human neutrophils by flow cytometry. J. Vis. Exp. (74). doi: 10.3791/50410.e50410 [PMC free article] [PubMed] [Cross Ref10.1016/j.celrep.2014.12.039].
56. Verbeke H., Struyf S., Berghmans N. et al. (2011) Isotypic neutralizing antibodies against mouse GCP-2/CXCL6 inhibit melanoma growth and metastasis. Cancer Letters, 302(1): 54–62. doi: 10.1016/j.canlet.2010.12.013.
57. Dumitru C.A., Gholaman H., Trellakis S. et al. (2011) Tumor-derived macrophage migration inhibitory factor modulates the biology of head and neck cancer cells via neutrophil activation. Int. J. Cancer, 129(4): 859–869. doi: 10.1002/ijc.25991. [PubMed] [Cross Ref.].
58. Lazennec G., Richmond A. (2010) Chemokines and chemokine receptors: new insights into cancer-related inflammation. Trends Mol. Med., 16(3): 133–144. doi: 10.1016/j.molmed.2010.01.003. [PMC free article] [PubMed] [Cross Ref.].
doi: 10.1016/j.molmed.2010.01.003. [PMC free article] [PubMed] [Cross Ref.].
59. Kobayashi Y. (2008) The role of chemokines in neutrophil biology. Front. Bioscie., 13(7): 2400–2407. doi: 10.2741/2853. [PubMed] [Cross Ref.].
60. Okabe H., Beppu T., Ueda M. et al. (2012) Identification of CXCL5/ENA-78 as a factor involved in the interaction between cholangiocarcinoma cells and cancer-associated fibroblasts. Int. J. Cancer, 131(10): 2234–2241. doi: 10.1002/ijc.27496.
61. Dumitru C.A., Moses K., Trellakis S. et al. (2012) Neutrophils and granulocytic myeloid-derived suppressor cells: immunophenotyping, cell biology and clinical relevance in human oncology. Cancer Immunol., Immunother., 61(8): 1155–1167. doi: 10.1007/s00262-012-1294-5.
62. Houghton A.M., Rzymkiewicz D.M., Ji H. et al. (2010) Neutrophil elastase-mediated degradation of IRS-1 accelerates lung tumor growth. Nat. Med., 16(2): 219–223. doi: 10.1038/nm.2084.
63. Wada Y., Yoshida K., Tsutani Y. et al. (2007) Neutrophil elastase induces cell proliferation and migration by the release of TGF-α, PDGF and VEGF in esophageal cell lines. Oncol. Reports, 17(1): 161–167.
(2007) Neutrophil elastase induces cell proliferation and migration by the release of TGF-α, PDGF and VEGF in esophageal cell lines. Oncol. Reports, 17(1): 161–167.
64. Segal A.W. (2005) How neutrophils kill microbes. Ann. Rev. Immunol., 23: 197–223. doi: 10.1146/annurev.immunol.23.021704.115653.
65. Morimoto-Kamata R., Mizoguchi S.-I., Ichisugi T., Yui S. (2012) Cathepsin G induces cell aggregation of human breast cancer MCF-7 cells via a 2-step mechanism: Catalytic site-independent binding to the cell surface and enzymatic activity-dependent induction of the cell aggregation. Mediators Inflamm., 2012: 13. doi: 10.1155/2012/456462.456462.
66. Wilson T.J., Nannuru K.C., Futakuchi M., Singh R.K. (2010) Cathepsin G-mediated enhanced TGF-β signaling promotes angiogenesis via upregulation of VEGF and MCP-1. Cancer Letters, 288(2): 162–169. doi: 10.1016/j.canlet.2009.06.035.
67. Yui S., Osawa Y., Ichisugi T., Morimoto-Kamata R. (2014) Neutrophil cathepsin G, but not elastase, induces aggregation of MCF-7 mammary carcinoma cells by a protease activity-dependent cell-oriented mechanism. Mediators Inflamm., 2014: 12. doi: 10.1155/2014/971409.971409.
Mediators Inflamm., 2014: 12. doi: 10.1155/2014/971409.971409.
68. Acuff H.B., Carter K.J., Fingleton B. et al. (2006) Matrix metalloproteinase-9 from bone marrow-derived cells contributes to survival but not growth of tumor cells in the lung microenvironment. Cancer Res., 66(1): 259–266. doi: 10.1158/0008-5472.can-05-2502.
69. Ebrahem Q., Chaurasia S.S., Vasanji A. et al. (2010) Cross-talk between vascular endothelial growth factor and matrix metalloproteinases in the induction of neovascularization in vivo. Am. J. Pathol., 176(1): 496–503. doi: 10.2353/ajpath.2010.080642.
70. Hawinkels L.J.A.C., Zuidwijk K., Verspaget H.W. et al. (2008) VEGF release by MMP-9 mediated heparan sulphate cleavage induces colorectal cancer angiogenesis. Eur. J. Cancer, 44(13): 1904–1913. doi: 10.1016/j.ejca.2008.06.031.
71. Coillie E.V., Aelst I.V., Wuyts A. et al. (2001) Tumor angiogenesis induced by granulocyte chemotactic protein-2 as a countercurrent principle. Am. J. Pathol., 159(4): 1405–1414. doi: 10.1016/s0002-9440(10)62527-8.
Pathol., 159(4): 1405–1414. doi: 10.1016/s0002-9440(10)62527-8.
72. Bergers G., Brekken R., McMahon G. et al. (2000) Matrix metalloproteinase-9 triggers the angiogenic switch during carcinogenesis. Nat. Cell Biol., 2(10): 737–744. doi: 10.1038/35036374.
73. Deryugina E.I., Zajac E., Juncker-Jensen A. et al. (2014) Tissue-infiltrating neutrophils constitute the major in vivo source of angiogenesis-inducing MMP-9 in the tumor microenvironment. Neoplasia, 16(10): 771–788. doi: 10.1016/j.neo.2014.08.013.
74. Deryugina E.I., Quigley J.P. (2015) Tumor angiogenesis: MMP-mediated induction of intravasation- and metastasis-sustaining neovasculature. Matrix Biology, 44.
75. Бережная Н.М., Чехун В.Ф. (2016) Физиологическая система соединительной ткани и онкогенез. Экстрацеллюлярный матрикс и метастазирование. Онкология, 18(3): 164–176.
76. Чехун В.Ф., Бережная Н.М. (2017) Физиологическая система соединительной ткани и онкогенез. Формирование резистентности к химиопрепаратам. Онкология, 19(3): 156–170.
Онкология, 19(3): 156–170.
77. De Larco J.E., Wuertz B.R.K., Furcht L.T. (2004) The potential role of neutrophils in promoting the metastatic phenotype of tumors releasing interleukin-8. Clin. Cancer Res., 10(15): 4895–4900. doi: 10.1158/1078-0432.ccr-03-0760.
78. Shabani F., McNeil J., Tippett L. (1998) The oxidative inactivation of tissue inhibitor of metalloproteinase-1 (TIMP-1) by hypochlorous acid (HOCl) is suppressed by anti-rheumatic drugs. Free Radical Res., 28(2): 115–123. doi: 10.3109/10715769809065797.
79. Cross A., Edwards S.W., Bucknall R.C., Moots R.J. (2004) Secretion of oncostatin M by neutrophils in rheumatoid arthritis. Arthritis Rheum., 50(5): 1430–1436. doi: 10.1002/art.20166.
80. Goren I., Kämpfer H., Müller E. et al. (2006) Oncostatin M expression is functionally connected to neutrophils in the early inflammatory phase of skin repair: implications for normal and diabetes-impaired wounds. J. Invest. Dermatol., 126(3): 628–637. doi: 10.1038/sj. jid.5700136.
jid.5700136.
81. Grenier A., Combaux D., Chastre J. et al. (2001) Oncostatin M production by blood and alveolar neutrophils during acute lung injury. Lab. Invest., 81(2): 133–141. doi: 10.1038/labinvest.3780220.
82. Grenier A., Chollet-Martin S., Crestani B. et al. (2002) Presence of a mobilizable intracellular pool of hepatocyte growth factor in human polymorphonuclear neutrophils. Blood, 99(8): 2997–3004. doi: 10.1182/blood.v99.8.2997.
83. Matsushima A., Ogura H., Koh T. et al. (2004) Hepatocyte growth factor in polymorphonuclear leukocytes is increased in patients with systemic inflammatory response syndrome. J. Trauma, 56(2): 259–264. doi: 10.1097/01.ta.0000111752.60500.da.
84. Queen M.M., Ryan R.E., Holzer R.G. et al. (2005) Breast cancer cells stimulate neutrophils to produce oncostatin M: potential implications for tumor progression. Cancer Res., 65(19): 8896–8904. doi: 10.1158/0008-5472.can-05-1734.
85. Imai Y., Kubota Y., Yamamoto S. et al. (2005) Neutrophils enhance invasion activity of human cholangiocellular carcinoma and hepatocellular carcinoma cells: an in vitro study. J. Gastroenterol. Hepatol., 20(2): 287–293. doi: 10.1111/j.1440-1746.2004.03575.x.
J. Gastroenterol. Hepatol., 20(2): 287–293. doi: 10.1111/j.1440-1746.2004.03575.x.
86. Loukinova E., Dong G., Enamorado-Ayalya I. et al. (2000) Growth regulated oncogene-alpha expression by murine squamous cell carcinoma promotes tumor growth, metastasis, leukocyte infiltration and angiogenesis by a host CXC receptor-2 dependent mechanism. Oncogene, 19(31): 3477–3486. doi: 10.1038/sj.onc.1203687.
87. Schaider H., Oka M., Bogenrieder T. et al. (2003) Differential response of primary and metastatic melanomas to neutrophils attracted by IL-8. Int. J. Cancer, 103(3): 335–343. doi: 10.1002/ijc.10775.
88. Welch D.R., Schissel D.J., Howrey R.P., Aeed P.A. (1989) Tumor-elicited polymorphonuclear cells, in contrast to ‘normal’ circulating polymorphonuclear cells, stimulate invasive and metastatic potentials of rat mammary adenocarcinoma cells. Proceedings of the National Academy of Sciences of the United States of America, 86(15): 5859–5863. doi: 10.1073/pnas.86.15.5859.
89. Strell C., Lang K., Niggemann B. et al. (2010) Neutrophil granulocytes promote the migratory activity of MDA-MB-468 human breast carcinoma cells via ICAM-1. Exp. Cell Res., 316(1): 138–148. doi: 10.1016/j.yexcr.2009.09.003.
Strell C., Lang K., Niggemann B. et al. (2010) Neutrophil granulocytes promote the migratory activity of MDA-MB-468 human breast carcinoma cells via ICAM-1. Exp. Cell Res., 316(1): 138–148. doi: 10.1016/j.yexcr.2009.09.003.
90. Crissman J.D., Hatfield J., Schaldenbrand M. et al. (1985) Arrest and extravasation of B16 amelanotic melanoma in murine lungs. A light and electron microscopic study. Lab. Invest., 53(4): 470–478.
91. Huh S.J., Liang S., Sharma A. et al. (2010) Transiently entrapped circulating tumor cells interact with neutrophils to facilitate lung metastasis development. Cancer Res., 70(14): 6071–6082. doi: 10.1158/0008-5472.can-09-4442.
92. Spicer J.D., McDonald B., Cools-Lartigue J.J. et al. (2012) Neutrophils promote liver metastasis via Mac-1-mediated interactions with circulating tumor cells. Cancer Res., 72(16): 3919–3927. doi: 10.1158/0008-5472.CAN-11-2393.
93. Kousis P.C., Henderson B.W., Maier P.G., Gollnick S.O. (2007) Photodynamic therapy enhancement of antitumor immunity is regulated by neutrophils. Cancer Res., 67(21): 10501–10510. doi: 10.1158/0008-5472.can-07-1778.
Cancer Res., 67(21): 10501–10510. doi: 10.1158/0008-5472.can-07-1778.
94. Suttmann H., Riemensberger J., Bentien G. et al. (2006) Neutrophil granulocytes are required for effective Bacillus Calmette-Guérin immunotherapy of bladder cancer and orchestrate local immune responses. Cancer Res., 66(16): 8250–8257. doi: 10.1158/0008-5472.can-06-1416.
95. Huang S., Mills L., Mian B. et al. (2002) Fully humanized neutralizing antibodies to interleukin-8 (ABX-IL8) inhibit angiogenesis, tumor growth, and metastasis of human melanoma. Am. J. Pathol., 161(1): 125–134. doi: 10.1016/s0002-9440(10)64164-8.
96. Otten M.A., Leusen J.H.W., Rudolph E. et al. (2007) FcR γ-chain dependent signaling in immature neutrophils is mediated by FcαRI, but not by FcγRI. J. Immunol., 179(5): 2918–2924. doi: 10.4049/jimmunol.179.5.2918.
97. Bakema J.E., Ganzevles S.H., Fluitsma D.M. et al. (2011) Targeting FcαRI on polymorphonuclear cells induces tumor cell killing through autophagy. J. Immunol. , 187(2): 726–732. doi: 10.4049/jimmunol.1002581.
, 187(2): 726–732. doi: 10.4049/jimmunol.1002581.
98. Uribe-Querol E., Rosales C. (2015) Neutrophils in Cancer: Two Sides of the Same Coin. J. Immunol. Res., 2015: 983698. Pub. online 2015 Dec. 24. doi: 10.1155/2015/983698.
Адрес:
Лисяный Николай Иванович
04050, Киев, ул. П. Майбороды, 32
ГУ «Институт нейрохирургии
им. акад. А.П. Ромоданова НАМН Украины»
Тел.: (044) 483-01-93
E-mail: [email protected]
Correspondence:
Lisyaniy Mykola
32 P. Mayborody str., Kyiv 04050
SI «Institute of Neurosurgery named after acad. A.P. Romodanov
NAMS of Ukraine»
Tel.: 044 483-01-93
E-mail: [email protected]
Кухонные хитрости — Здоровая Россия
Несколько кухонных хитростей, которые позволят снизить калорийность рациона
В деле здорового питания и здорового снижения веса все уловки хороши. Сегодня мы хотим предложить вам несколько вполне очевидных «кухонных лайфхаков», которые помогут сэкономить время, деньги и похудеть.
Сегодня мы хотим предложить вам несколько вполне очевидных «кухонных лайфхаков», которые помогут сэкономить время, деньги и похудеть.
Одна из самых больших ошибок, которую делают люди, собирающиеся контролировать калорийность рациона, – это неправильное определение размера порций. Вряд ли кто-то задумывается о том, чтобы точно взвесить те же овсяные хлопья – их просто насыпают в миску и заливают кипятком. А в дневник питания честно заносится «одна порция каши», когда, на самом деле, съедено в два-три раза больше.
Чтобы правильно отмерить нужное количество крупы или других сыпучих продуктов, лучше закупить набор мерных ложек. И повесить их на видном месте. А лучше разложить такие ложечки в прозрачные контейнеры, выяснив предварительно, сколько именно каждого продукта содержится в той или иной мерной емкости. Кстати, под герметичной крышкой ваши продукты не только лучше сохранятся, но и контроль за их количеством станет намного проще. Да, и еще один лайфхак: если в окрестных магазинах дефицит мерных ложек, вместо них можно использовать пластиковые емкости из-под йогурта.
Еще один прекрасный способ уменьшить размер порции – убрать подальше все огромные тарелки и оставить в кухонной сушке блюдца и маленькие пиалы. Несколько научных исследований показали, что небольшие тарелки, на которые помещаются маленькие порции, позволяют не только меньше есть, но и тщательнее пережевывать. Особенно в компании – для того, чтобы не прослыть «голодным торопыгой». Конечно, одна только смена посуды сама по себе похудеть не поможет. Но почему бы не попробовать? В самом худшем случае, вы сэкономите на средстве для мытья посуды.
Как часто вы заглядываете в холодильник, чтобы посмотреть на его содержимое, даже если не голодны? Если вы ведете себя, как большинство обладателей этой бытовой техники, то у вас есть шанс перекусывать слишком часто, особенно вечером. Удержаться от этого практически невозможно, а обмотанный цепью холодильник выглядит весело только на карикатурах. Но есть прекрасный способ немного себя обмануть, потратив всего пять минут. Переместите все жирные и калорийные продукты к задней стенке холодильника, а ближе «к выходу» разместите все, что может пригодиться для низкокалорийного перекуса, – ваши обезжиренные йогурты, отварное мясо, овощи и фрукты. Еще лучше разложить все эти продукты в небольшие контейнеры на одну порцию: во-первых, за контейнерами не очень видно то, что осталось в недрах холодильника, во-вторых, вы сразу будете понимать, сколько сможете съесть. Только не забудьте попросить домочадцев уважать вашу «зону здоровой пищи» и не устраивать в холодильнике перестановку. А вашими легкими перекусами пусть угощаются – может, привыкнут.
Еще лучше разложить все эти продукты в небольшие контейнеры на одну порцию: во-первых, за контейнерами не очень видно то, что осталось в недрах холодильника, во-вторых, вы сразу будете понимать, сколько сможете съесть. Только не забудьте попросить домочадцев уважать вашу «зону здоровой пищи» и не устраивать в холодильнике перестановку. А вашими легкими перекусами пусть угощаются – может, привыкнут.
Никак не в силах отказаться от котлеток, тефтелек и фрикаделек? И постный фарш совсем «не идет»? Полезный лайфхак: до половины объема фарша можно заменить перемолотыми грибами. Во-первых, это вкусно. Во-вторых, грибы богаты белком. Особенно актуальны грибы в фарше из куриной грудки и индейки, блюда из которого получаются несколько суховатыми.
Кстати, ваш овощной гарнир можно не жарить в масле, а тушить. В курином или индюшачьем бульоне, например. Его можно наварить заранее, снять жир и заморозить в формочках для льда. Несколько бульонных кубиков растапливаете на сковороде с антипригарным покрытием и тушите в нем овощи. И не только их – на небольшом количестве бульона отлично готовится омлет, карамелизуется лук и чеснок. В результате готовое блюдо приобретает приятный «мясной» аромат и съедается с большим удовольствием.
И не только их – на небольшом количестве бульона отлично готовится омлет, карамелизуется лук и чеснок. В результате готовое блюдо приобретает приятный «мясной» аромат и съедается с большим удовольствием.
Чтобы оставить комментарий — необходимо быть авторизованным пользователем
Войти в личный кабинет Зарегистрироваться
Лейкоцитарная формула (дифференцированный подсчет лейкоцитов, лейкоцитограмма, Differential White Blood Cell Count) с обязательной «ручной» микроскопией мазка крови
Интерпретация результатов исследования содержит информацию для лечащего врача и не является диагнозом.
Информацию из этого раздела нельзя использовать для самодиагностики и самолечения.
Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза,
результатов других обследований и т. д.
д.
Концентрация лейкоцитов (WBC, White Blood Cells)
Клетки с ядрами, обеспечивающие выполнение функции защиты. Образуются в красном костном мозге и органах лимфатической системы. Функции и время жизни зависят от того, к какой популяции (нейтрофилы, лимфоциты, моноциты, эозинофилы или базофилы) относится лейкоцит.
Единицы измерения в Независимой лаборатории ИНВИТРО: тыс./мкл (103 клеток/мкл).
Альтернативные единицы измерения: 109 клеток/л.
Коэффициенты пересчета: 109 клеток/л = 103 клеток/мкл = тыс./мкл.
Референсные значения:
| Возраст | Концентрация лейкоцитов тыс./мкл (103 клеток/мкл) |
| 1 день — 12 месяцев | 6,0 — 17,5 |
| 12 месяцев — 2 года | 6,0 — 17,0 |
| 2 года — 4 года | 5,5 — 15,5 |
| 4 года — 6 лет | 5,0 — 14,5 |
| 6 лет — 10 лет | 4,50 — 13,5 |
| 10 лет — 16 лет | 4,50 — 13,0 |
| 16 лет — 120 лет | 4,50 — 11,0 |
Интерпретация результатов
Повышение значений:
- Физиологический лейкоцитоз (эмоциональные и физические нагрузки, воздействие солнечного света, холода, прием пищи, беременность, менструация).

- Воспалительные процессы.
- Вирусные и бактериальные инфекции.
- Состояния после перенесенных операционных вмешательств.
- Интоксикации.
- Ожоги и травмы.
- Инфаркты внутренних органов.
- Злокачественные новообразования.
- Гемобластозы.
- Вирусные и некоторые хронические инфекции.
- Прием лекарственных препаратов (антибиотиков, цитостатиков, нестероидных противовоспалительных средств, тиреостатиков и др.).
- Аутоиммунные заболевания.
- Воздействие ионизирующего излучения.
- Истощение и кахексия.
- Анемии.
- Спленомегалия.
- Гемобластозы.
Различные виды лейкоцитов выполняют разные функции, поэтому при отклонении количества лейкоцитов в ту или иную сторону от референсных значений наиболее важным является то, какая (или какие) из субпопуляций лейкоцитов ответственна за это отклонение. Однако следует принимать во внимание, что изменения лейкоцитарной формулы не являются специфичными: они могут иметь сходный характер при разных заболеваниях, или, напротив, могут встречаться непохожие изменения при одной и той же патологии у разных пациентов.
Лейкоцитарная формула имеет возрастные особенности, поэтому ее сдвиги должны оцениваться с позиции возрастной нормы (что особенно важно при обследовании детей). При интерпретации результатов также следует помнить, что повышение или понижение значений может быть как абсолютным (меняется именно количество лейкоцитов, относящихся к данной популяции), так и относительным (меняется процентное соотношение клеток в лейкоцитарной формуле из-за изменения количества клеток, относящихся к другим субпопуляциям).
Для того чтобы получить представление об абсолютном количестве клеток, относящихся к какой-либо субпопуляции, необходимо произвести расчет, исходя из процентного содержания клеток данной субпопуляции и общей концентрации лейкоцитов (например, при общей концентрации лейкоцитов 10 тыс./мкл и относительном содержании нейтрофилов 60%, абсолютное количество нейтрофилов составит 6 тыс./мкл).
Нейтрофилы (общее число)
Клетки с сегментированным ядром и нейтрофильными гранулами в цитоплазме. Основная их функция – защита от бактериальных инфекций, а именно распознавание, захват и уничтожение бактерий. Среднее время жизни составляет 15 суток, большую часть из них нейтрофилы проводят в костном мозге, при выходе из него в кровеносном русле – 8-10 часов, после чего поступают в периферические ткани. Примерно половина нейтрофилов, находящихся в кровеносном русле, обратимо прилипает к эндотелиальным клеткам внутренней поверхности кровеносного сосуда (пристеночный пул). При стимуляции (контакт с инфекционным агентом, стресс, физическая нагрузка, гипоксия и др.) концентрация нейтрофилов в кровеносном русле может резко возрастать за счет ускорения выхода нейтрофилов из костного мозга, а также за счет мобилизации пристеночного пула, поэтому количество нейтрофилов может значительно меняться даже в течение нескольких часов.
Основная их функция – защита от бактериальных инфекций, а именно распознавание, захват и уничтожение бактерий. Среднее время жизни составляет 15 суток, большую часть из них нейтрофилы проводят в костном мозге, при выходе из него в кровеносном русле – 8-10 часов, после чего поступают в периферические ткани. Примерно половина нейтрофилов, находящихся в кровеносном русле, обратимо прилипает к эндотелиальным клеткам внутренней поверхности кровеносного сосуда (пристеночный пул). При стимуляции (контакт с инфекционным агентом, стресс, физическая нагрузка, гипоксия и др.) концентрация нейтрофилов в кровеносном русле может резко возрастать за счет ускорения выхода нейтрофилов из костного мозга, а также за счет мобилизации пристеночного пула, поэтому количество нейтрофилов может значительно меняться даже в течение нескольких часов.
Нейтрофилией (значимым повышением количества нейтрофилов) считают повышение абсолютного количества нейтрофилов более 7,5 тыс. в микролитре, нейтропенией (значимым снижением абсолютного количества нейтрофилов) считается снижение абсолютного количества ниже 1,8 тыс. в микролитре. Снижение абсолютного количества нейтрофилов менее 500 в микролитре может вести к существенным сбоям в иммунной защите организма.
в микролитре. Снижение абсолютного количества нейтрофилов менее 500 в микролитре может вести к существенным сбоям в иммунной защите организма.
Единицы измерения в Независимой лаборатории ИНВИТРО: %.
Референсные значения:
| Возраст | Процентное соотношение нейтрофилов, % |
| 1 день — 15 дней | 31,0 — 56,0 |
| 15 дней — 12 месяцев | 17,0 — 51,0 |
| 12 месяцев — 2 года | 29,0 — 54,0 |
| 2 года — 5 лет | 33,0 — 61,0 |
| 5 лет — 7 лет | 39,0 — 64,0 |
| 7 лет — 9 лет | 42,0 — 66,0 |
| 9 лет — 11 лет | 44,0 — 66,0 |
| 11 лет — 15 лет | 46,0 — 66,0 |
| 15 лет и старше | 48,0 — 78,0 |
Интерпретация результатов
Повышение значений:
- Большинство заболеваний, вызванных бактериальными инфекциями.

- Воспалительные процессы.
- Стресс.
- Физическое перенапряжение.
- Инфаркты внутренних органов.
- Состояния после перенесенных оперативных вмешательств.
- Прием лекарственных препаратов (кортикостероидов, гепарина, ацетилхолина).
- Эндогенные интоксикации.
- Злокачественные новообразования.
- Некоторые инфекции, вызванные бактериями (брюшной тиф и паратифы, бруцеллез, туберкулез), вирусами (грипп, корь, ветряная оспа, вирусный гепатит, краснуха), простейшими (малярия), риккетсиями (сыпной тиф), затяжные инфекции у пожилых и ослабленных людей.
- Прием лекарственных препаратов (антибиотиков, противовирусных, психотропных, антигистаминных, противосудорожных препаратов, нестероидных противовоспалительных средств).
- Анемии.
- Гиперспленизм.
- Врожденные нейтропении.
- Анафилактический шок.
- Тиреотоксикоз.
- Воздействие цитостатиков, противоопухолевых препаратов.

Лимфоциты
Небольшие клетки с несегментированным округлым ядром. Продолжительность жизни составляет от нескольких дней до нескольких лет, в зависимости от выполняемых функций. В их числе: распознавание различных антигенов благодаря экспрессии на поверхности клеток уникальных антигенных рецепторов, формирование гуморального иммунного ответа путем синтеза антител к чужеродным белкам (иммуноглобулинов различных классов), обеспечение клеточного иммунитета – уничтожение разных клеток непосредственно эффекторными цитотоксическими лимфоцитами (отторжение трансплантата, противоопухолевый иммунитет, иммунитет против внутриклеточных паразитов, в том числе противовирусный). Часть лимфоцитов является клетками памяти, которые сохраняют информацию о ранее встречавшемся антигене. Они быстро пролиферируют и продуцируют большие количества антител при повторной встрече с известным антигеном.
Лимфоциты обладают способностью синтезировать и секретировать в кровь различные белковые регуляторы – цитокины, посредством которых осуществляют координацию и регуляцию иммунного ответа.
Лимфоцитозом (значимым повышением количества лимфоцитов) считается повышение абсолютного количества лимфоцитов более 5 тыс. в микролитре, лимфопенией (значимым снижением абсолютного количества лимфоцитов) считается снижение абсолютного количества менее 1 тыс. в микролитре.
Единицы измерения: в Независимой лаборатории ИНВИТРО: %Референсные значения:
| Возраст | Процентное содержание лимфоцитов, % |
| 1 день — 15 дней | 22,0 — 55,0 |
| 15 дней — 12 месяцев | 45,0 — 70,0 |
| 12 месяцев — 2 года | 37,0 — 60,0 |
| 2 года — 5 лет | 33,0 — 55,0 |
| 5 лет — 9 лет | 30,0 — 50,0 |
| 9 лет — 12 лет | 30,0 — 46,0 |
| 12 лет — 15 лет | 30,0 — 45,0 |
| 15 лет — 120 лет | 19,0 — 37,0 |
Интерпретация результатов
Повышение значений:
- Большинство заболеваний, вызванных вирусными инфекциями.

- Действие некоторых лекарственных препаратов: леводопы, фенитоина, вальпроевой кислоты, наркотических анальгетиков и др.
- Заболевания системы крови: хронический лимфолейкоз; лимфомы в период лейкемизации, болезнь тяжелых цепей.
- Отравление тетрахлорэтаном, свинцом, мышьяком, дисульфидом углерода.
- Острый период воспалительных заболеваний.
- Прием лекарственных препаратов (глюкокортикоидов, цитостатиков).
- Апластическая анемия.
- Иммунодефицитные состояния.
- Почечная недостаточность.
- Потеря лимфы через кишечник.
- Системная красная волчанка.
- Воздействие рентгеновского облучения.
- Терминальная стадия онкологических заболеваний.
- Милиарный туберкулез.
- Лимфогранулематоз.
Крупные клетки с несегментированным бобовидным ядром. Продолжительность жизни в кровотоке составляет около суток, после чего моноцит переходит в ткани, где дифференцирует в тканеспецифичный макрофаг. Время жизни этих клеток может достигать нескольких лет.
Время жизни этих клеток может достигать нескольких лет.
Выполняют функции, сходные с функциями гранулоцитов, а именно: распознавание, захват и уничтожение бактерий и грибов, однако их фагоцитарная активность выше. В очаге воспаления макрофаги фагоцитируют микроорганизмы, погибшие лейкоциты, поврежденные клетки воспаленной ткани, очищая очаг воспаления и подготавливая его для регенерации. Макрофаги более эффективны, чем нейтрофилы, в фагоцитозе микобактерий, грибков и макромолекул.
Моноцитозом (значимым повышением количества моноцитов) считается повышение абсолютного количества моноцитов более 1000 в микролитре.
Единицы измерения: в Независимой лаборатории ИНВИТРО: %.
Референсные значения:
| Возраст | Процентное содержание моноцитов, % |
| от 1 до 15 дней | 5 — 15 |
| от 15 дней до 12 месяцев | 4 — 10 |
| 12 месяцев — 2 года | 3 — 10 |
| 2 года — 15 лет | 3 — 9 |
| 15 лет и старше | 3 — 11 |
Интерпретация результатов
Повышение значений:
- Острые и хронические инфекционные и воспалительные процессы.

- Cостояния после перенесенного инфекционного заболевания. Аутоиммунные заболевания.
- Злокачественные новообразования.
- Онкогематологические заболевания.
- Отравление тетрахлорэтаном, фосфором.
- Прием лекарственных препаратов (глюкокортикоидов, цитостатиков).
- Пиогенные инфекции.
- Апластическая анемия.
- Шоковые состояния.
- Онкогематологические заболевания.
Клетки с сегментированным ядром и заполненной однородными гранулами цитоплазмой. Подобно нейтрофилам, способны к хемотаксису и фагоцитозу, однако основная их роль – борьба с паразитами и контроль аллергических реакций. В циркулирующей крови находятся не более часа, после чего поступают в ткани. Эозинофилией (значимым повышением количества эозинофилов) считается повышение их абсолютного количества более 700 в микролитре. В том случае, когда абсолютное количество эозинофилов стабильно сохраняется не менее 1500 в микролитре на протяжении длительного времени, возможно возникновение поражения внутренних органов, вызванного эозинофильной инфильтрацией и воздействием токсических продуктов кислорода и гранулярных белков.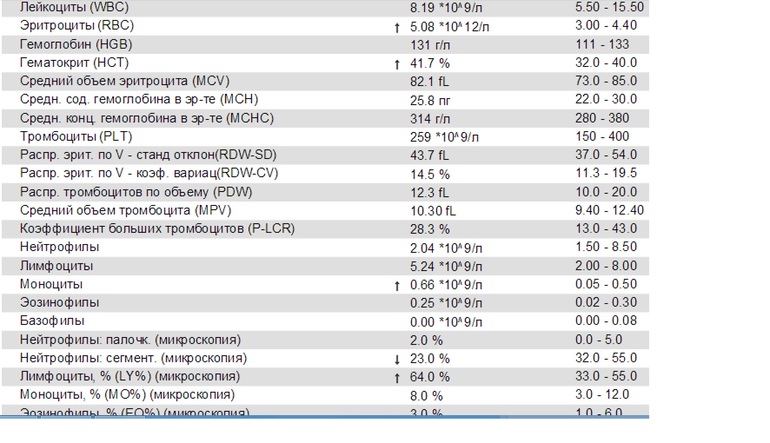 Эозинопенией (значимым снижением количества эозинофилов) считается снижение их абсолютного числа менее 200 в микролитре.
Эозинопенией (значимым снижением количества эозинофилов) считается снижение их абсолютного числа менее 200 в микролитре.
Единицы измерения: в Независимой лаборатории ИНВИТРО: %.
Референсные значения:
| Возраст | Процентное содержание эозинофилов, % |
| 1 день — 15 дней | 1,0 — 6,0 |
| 15 дней — 12 месяцев | 1,0 — 5,0 |
| 12 месяцев — 2 года | 1,0 — 7,0 |
| 2 года — 5 лет | 1,0 — 6,0 |
| 5 лет — 120 лет | 1,0 — 5,0 |
Интерпретация результатов
Повышение значений:
- Аллергические состояния, в том числе лекарственные аллергии.

- Заболевания кожи (дерматит, экзема).
- Паразитарные инвазии.
- Острый период некоторых инфекционных заболеваний (скарлатины, ветряной оспы, туберкулеза, инфекционного мононуклеоза, гонореи).
- Системные воспалительные заболевания.
- Заболевания легких: саркоидоз, легочная эозинофильная пневмония, гистиоцитоз из клеток Лангерганса, эозинофильный плеврит, легочный эозинофильный инфильтрат (болезнь Лефлера).
- Онкогематологические заболевания.
- Злокачественные новообразования.
- Начальная стадия воспалительного процесса.
- Тяжелые гнойные инфекции.
- Шоковые состояния.
- Отравления тяжелыми металлами.
Клетки с сегментированным ядром и крупными, разнородными по размеру и форме гранулами в цитоплазме. Время нахождения в кровотоке составляет 2,5 дня. Основная их функция – участие в аллергических реакциях различного типа. Базофилией (значимым повышением количества базофилов) считается повышение их абсолютного количества более 150 в микролитре.
Единицы измерения: в Независимой лаборатории ИНВИТРО: %.
Референсные значения: 0 — 120 лет: < 1,0 (процентное содержание базофилов).
Интерпретация результата
Повышение значений:
- Аллергические состояния, в том числе лекарственные аллергии.
- Язвенный колит.
- Хронические гемолитические анемии.
- Некоторые инфекционные заболевания (грипп, ветряная оспа, туберкулез).
- Злокачественные новообразования.
- Онкогематологические заболевания.
Дополнительные субпопуляции клеток
Атипичные мононуклеары – клетки лимфоидной природы с разнообразной морфологией. Возникают в ответ на вирусные инфекции, чаще всего на инфицирование вирусом Эпштейна-Барр (инфекционный мононуклеоз), но могут обнаруживаться и при других вирусных заболеваниях.
Плазматические клетки – антителообразующие клетки лимфоидной природы. Обычно находятся в лимфатических узлах и селезенке. Могут появляться в кровотоке при инфекционных заболеваниях. Присутствие 1-2% плазматических клеток можно считать вариантом нормы. Присутствие большого количества плазматических клеток (более 10%) характерно для ряда онкогематологических заболеваний.
Присутствие 1-2% плазматических клеток можно считать вариантом нормы. Присутствие большого количества плазматических клеток (более 10%) характерно для ряда онкогематологических заболеваний.
Палочкоядерные нейтрофилы – «молодые» нейтрофилы с несегментированным ядром. В норме их количество составляет от 1 до 6% от общего количества лейкоцитов. Повышение содержания палочкоядерных нейтрофилов обычно свидетельствует о наличии инфекционного или воспалительного процесса.
Юные миелоциты – незрелые клетки гранулоцитарного ряда, предшественники палочкоядерных нейтрофилов. Их присутствие также может свидетельствовать о наличии инфекционного или воспалительного процесса. Могут появляться при приеме некоторых лекарственных препаратов. Как вариант нормы возможно их присутствие в небольшом количестве у беременных женщин и новорожденных детей.
Присутствие значительного количества незрелых гранулоцитов в сочетании с бластами характерно для ряда онкогематологических заболеваний. Бласты – незрелые недифференцированные клетки. В норме в кровотоке не встречаются. Их присутствие характерно для онкогематологических заболеваний.
В норме в кровотоке не встречаются. Их присутствие характерно для онкогематологических заболеваний.
Незрелые гранулоциты повышены — что это значит?
Наверное, даже самые опытные исследователи и врачи сразу же позвонят всем необходимым компонентам крови и их нормы. Разных кровяных телец существует очень много. И изменение количества каждого из них свидетельствует о нарушении в работе организма. При необходимости ускорить встречу со специалистом будет намного проще расшифровать свои результаты анализов.
Что такое — повышенные незрелые гранулоциты в крови?
Гранулоциты являются подгруппой зернистых лейкоцитов. К ним принято относить базофилы, нейтрофилы и эозинофилы. Название кровяных телец объясняется их структурой — под микроскопом просматриваются просматриваются небольшие гранулы или зернышки. За выработку гранулоцитов отвечает костный мозг. После выхода в организм эти частички живут совсем недолго — не более трех дней.
Нормально, если в крови содержится от одного до пяти процентов молодых нейтрофилов, эозинофилов и базофилов. Если же незрелые гранулоциты повышены, вероятнее всего, в организме развивается воспалительная инфекция или патологический процесс. При этом активно начинают вырабатывать нейтрофилы. А соответственно, увеличение количества кровяных телец — результат реакции иммунной системы.
Если же незрелые гранулоциты повышены, вероятнее всего, в организме развивается воспалительная инфекция или патологический процесс. При этом активно начинают вырабатывать нейтрофилы. А соответственно, увеличение количества кровяных телец — результат реакции иммунной системы.
Причины повышения незрелых гранулоцитов
Незначительное повышение этого показателя нормальным для беременных и новорожденных. Результат анализа также может быть искажен, если взята сразу после приема пищи, физической нагрузки или у пациента, переживающего состояние сильного стресса.Во всех остальных случаях повышенные незрелые гранулоциты в крови — явление нездоровое. И указывать оно может на такие патологии:
- подагра;
- гангрена;
- псориаз;
- гепатит;
- туберкулез;
- малярия;
- разные виды дерматита;
- холера;
- сепсис;
- ангина;
- ожоги;
- острые кровотечения;
- менингит;
- пиелонефрит;
- сывороточная болезнь;
- инфаркт миокарда;
- интоксикации, вызванные укусами насекомых, отравлениями химикатами;
- хронические миелопластические заболевания;
- грипп;
- краснуха;
- отит;
- холецистит;
- скарлатина;
- перитонит;
- пневмония;
- аппендицит.

У некоторых людей повышенное содержание незрелых гранулоцитов в крови наблюдается на фоне приема препаратов, препаратов литий, или глюкокорикостероидов.
При гнойных процессах показателя показателя значительно больший, чем во всех остальных случаях.
Общий анализ кровинутый (Метод проточной цитофлюориметрии)
Общий анализ кровинутый (Метод проточной цитофлюориметрии)
Общий анализ кровинутый (Метод проточной цитофлюориметрии)
Общий анализ крови — это развернутое исследование показателей крови, которое проводится на уникальном высокотехнологичном гематологическом анализаторе серии XN.Данный прибор исследует форменные элементы крови с помощью инновационной технологии проточной цитофлюориметрии, концепция которого заключается в том, что клетки периферической крови оцениваются не только по внешним параметрам — размер, объем и т.д., но и по внутренним, т.е. внутренне содержание клеток, ядра, ДНК. Кроме того, подсчет клеток идет не в поле зрения, а в объеме крови. Это позволяет более точный качественный и количественный счетчик клеток крови. Данный анализ крови включает в себя основные стандартные показатели гемограммы, такие как ядросодержащие эритроциты (NRBC) и незрелые гранулоциты (IG).Показатель Незрелые гранулоциты, IG, незрелые гранулоциты — это сумма метамиелоцитов, миелоцитов и промиелоцитов, подсчитанных отдельной популяцией от нейтрофилов. Присутствие незрелых гранулоцитов в периферической крови, за исключением крови беременных женщин и новорожденных, свидетельствует о реакции иммунной системы на инфекцию, воспаление или другой возбудитель со стороны костного мозга. Незрелые гранулоциты (IG) (метамиелоциты, миелоциты и промиелоциты) появляются в (патогенетический сдвиг влево) под вызывающе-воспалительных или злокачественных (миелопролиферативных) процессов.Использование IG позволяет наиболее точно выявлять воспалительные заболевания, вести мониторинг терапии. Ядросодержащие эритроциты (NRBC) — это незрелые эритроциты, которые в основном локализуются в костном мозге.
Кроме того, подсчет клеток идет не в поле зрения, а в объеме крови. Это позволяет более точный качественный и количественный счетчик клеток крови. Данный анализ крови включает в себя основные стандартные показатели гемограммы, такие как ядросодержащие эритроциты (NRBC) и незрелые гранулоциты (IG).Показатель Незрелые гранулоциты, IG, незрелые гранулоциты — это сумма метамиелоцитов, миелоцитов и промиелоцитов, подсчитанных отдельной популяцией от нейтрофилов. Присутствие незрелых гранулоцитов в периферической крови, за исключением крови беременных женщин и новорожденных, свидетельствует о реакции иммунной системы на инфекцию, воспаление или другой возбудитель со стороны костного мозга. Незрелые гранулоциты (IG) (метамиелоциты, миелоциты и промиелоциты) появляются в (патогенетический сдвиг влево) под вызывающе-воспалительных или злокачественных (миелопролиферативных) процессов.Использование IG позволяет наиболее точно выявлять воспалительные заболевания, вести мониторинг терапии. Ядросодержащие эритроциты (NRBC) — это незрелые эритроциты, которые в основном локализуются в костном мозге. В норме существует в периферической крови новорожденных. У взрослых в норме количество ядросодержащих эритроцитов должно равняться нулю. Измерение NRBC важно для всех реанимационных пациентов, поскольку обнаружение ядросодержащих эритроцитов может указывать на повышенный риск смерти, а также для пациентов с состояниями, вызывающими стресс гемопоэтической системы: тяжелая инфекция, гипоксия или массивное острое кровотечение.Ядросодержащие эритроциты могут также присутствовать в крови при талассемических синдромах, поражении костного мозга метастазами солидных опухолей, экстрамедуллярном гемопоэзе и других стрессовых состояниях гемопоэтической системы, таких как сепсис или сильное кровотечение. В ситуации присутствия их зависит от тяжести заболевания. Наблюдения показывают, что сам факт присутствия ядросодержащих эритроцитов в периферической крови и его длительность неблагоприятным прогнозом ряда гематологических и негематологических заболеваний.
В норме существует в периферической крови новорожденных. У взрослых в норме количество ядросодержащих эритроцитов должно равняться нулю. Измерение NRBC важно для всех реанимационных пациентов, поскольку обнаружение ядросодержащих эритроцитов может указывать на повышенный риск смерти, а также для пациентов с состояниями, вызывающими стресс гемопоэтической системы: тяжелая инфекция, гипоксия или массивное острое кровотечение.Ядросодержащие эритроциты могут также присутствовать в крови при талассемических синдромах, поражении костного мозга метастазами солидных опухолей, экстрамедуллярном гемопоэзе и других стрессовых состояниях гемопоэтической системы, таких как сепсис или сильное кровотечение. В ситуации присутствия их зависит от тяжести заболевания. Наблюдения показывают, что сам факт присутствия ядросодержащих эритроцитов в периферической крови и его длительность неблагоприятным прогнозом ряда гематологических и негематологических заболеваний.
Подготовка к исследованию
Вода можно пить через 4 часа после легкого приема пищи

Показания к исследованию
Гематологические заболевания.
Воспалительные заболевания.
Инфекционные заболевания.
Онкологические заболевания
Интерпретация
Референсные значения
Референсные значения основных стандартных параметров в Общем анализе данных.
| IG № | 0-0,06 клеток / л |
| IG% | 0-0,6% |
Повышение: метамиелоциты, миелоциты и промиелоциты появляются в крови (патологический сдвиг влево) под действием инфекционно-воспалительных и / или миелопролиферативных (повышены) процессов. Использование IG позволяет наиболее точно выявлять воспалительные заболевания, вести мониторинг терапии.Показано, что IG является дополнительным маркером диагностики и прогноза исхода сепсиса (> 3%).
| NRBC № | 0 х109 / л |
| NRBC% | 0% |
Повышение: талассемия, тяжелая инфекция, гипоксия, массивное кровотечение, поражение костного мозга метастазами солидных опухолей, повышенный риск смерти у реанимационных пациентов.
На результаты могут влиять
Пол, возраст, раса, беременность, наличие сопутствующих заболеваний, применение лекарственных средств.
Результаты теста должны интерпретироваться в контексте обычных характеристик каждого конкретного человека;
наиболее точная информация может быть получена при динамическом наблюдении изменений показателей крови;
результаты теста следует интерпретировать с учетом всех анамнестических, клинических и других лабораторных данных ..
Назначается в комплексе с
Биохимический анализ кровинутый
Норма общего анализа крови во время беременности.Гемоглобин, тромбоциты, гематокрит, эритроциты и лейкоциты при беременности. Клинический анализ крови во время беременности. Гематологические изменения при беременности.
Перевод материалов сайта UpTodate.com
Нормально протекающая беременность характеризуется значительными изменениями почти во время работы органов и систем для приспособления к требованиям фетоплацентарного комплекса, в том числе во время беременности меняются показатели крови.
Нормы анализа крови при беременности: краткое содержание статьи
- Значимыми гематологическими изменениями в течение беременности является физиологическая анемия, нейтрофилия, умеренная тромбоцитопения, повышение факторов свертывания крови и снижение фибринолиза.
- К 6-12 неделям беременности объем плазмы крови повышается примерно на 10-15%. Самые быстрые темпы увеличения плазмы крови отмечаются в период с 30 по 34 недели беременности, после чего объем плазмы изменяются незначительно.
- Количество эритроцитов увеличивается на 8-10 недель беременности и к концу беременности увеличивается на 20-30% (250-450 мл) нормального уровня для небеременных женщин к концу беременности Значительное увеличение объема плазмы относительно увеличения количества гемоглобина и объема эритроцитов приводит к умеренному снижение уровня гемоглобина (физиологическая анемия беременных), что наблюдается у здоровых беременных.
- У беременных женщин возможно незначительное снижение количества тромбоцитов по со здоровымиеременными женщинами.

- Количество нейтрофилов начинает расти на втором месяце беременности и стабилизируется во втором месяце или третьем триместрах, в это время количество лейкоцитов. Абсолютное количество лимфоцитов не изменяется.
- Уровень некоторых факторов свертывания крови меняется в течение беременности.
В данной статье являются гематологические изменения, происходящие во время беременности, наиболее важными из которых являются:
- Повышение объема плазмы крови и уменьшение гематокрита
- Физиологическая анемия, низкий гемоглобин
- Повышенные лейкоциты при беременности
- Нейтрофилия
- Умеренная тромбоцитопения
- Повышение прокоагулянтных факторов
- Уменьшение фибринолиза
Анализы, упоминаемые в статье
Как сдать анализы крови и получить скидку 5%? Зайдите в интернет-магазин лабораторий ЦИР!Объем плазмы крови
К 6-12 неделям беременности объем плазмы крови повышается примерно на 10-15%. Самые быстрые темпы увеличения плазмы крови отмечаются в период с 30 по 34 недели беременности, после чего объем плазмы изменяются незначительно. В среднем объем плазмы крови увеличивается на 1100-1600 мл в триместр, и в результате объем плазмы за беременность увеличивается до 4700-5200 мл, что на 30 до 50% выше объема плазмы у небеременных женщин.
Самые быстрые темпы увеличения плазмы крови отмечаются в период с 30 по 34 недели беременности, после чего объем плазмы изменяются незначительно. В среднем объем плазмы крови увеличивается на 1100-1600 мл в триместр, и в результате объем плазмы за беременность увеличивается до 4700-5200 мл, что на 30 до 50% выше объема плазмы у небеременных женщин.
В течение периода активности ренина плазмы крови тенденцию повышаться, при этом уровне предсердного натрийуретического пептида несколько снижается.Это говорит о том, что увеличение объема плазмы вызвано недостаточностью сосудистой системы, к которой приводит системная вазодилатация (расширение сосудов во всем организме) и увеличение сосудистой емкости. Так как увеличивается объем плазмы крови, то его воздействие на почечные и предсердные рецепторы приводит к сопоставимым воздействиям на гормональный фон (снижение активности, ренина, плазмы и увеличение натрийуретического пептида). Увеличивает изображение Эта гипотеза также увеличивает увеличение плазмы крови.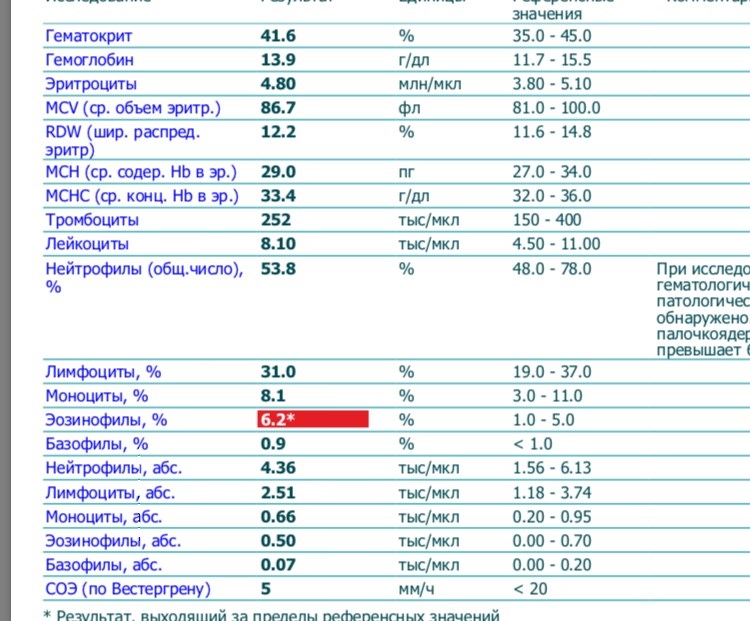
После родов объем плазмы сразу снижается, но вновь повышается через 2-5 дней, возможно из-за увеличения секреции альдостерона, происходящей в это время. Затем объем плазмы постепенно снижается: через 3 недели после родов он все ещё повышен на 10-15% относительно нормального уровня для небеременных недель, но обычно полностью приходит норме через 6 недель после родов.
Эритроциты при беременности, СОЭ при беременности
Количество эритроцитов увеличивается на 8-10 недель беременности, а к концу беременности увеличивается на 20-30% (250-450 мл) нормального уровня для небеременных, в особенности у женщин, принимавших препараты железа во время беременности.Среди беременных, не принимавших препараты железа, количество эритроцитов может увеличиваться только на 15-20%. Продолжительность жизни эритроцитов немного снижается в течение нормальной жизни.
Уровень эритропоэтина при нормальной беременности повышается на 50% и его изменение зависит от наличия осложнений беременности. Повышение эритропоэтина в плазме приводит к увеличению количества эритроцитов, которые частично обеспечивают метаболические требования в кислороде в течение беременности.
Повышение эритропоэтина в плазме приводит к увеличению количества эритроцитов, которые частично обеспечивают метаболические требования в кислороде в течение беременности.
У женщин, не принимающих препараты железа, средний объем эритроцитов снижается во время беременности и в третьем триместре в среднем составляет 80-84 фл. Однако у здоровых беременных и у беременных с умеренным дефицитом железа средний объем эритроцитов увеличивается примерно на 4 фл.
СОЭ при беременности увеличивается, что не имеет значения.
Анемия при беременности, гемоглобин при беременности, гематокрит при беременности, низкий гемоглобин при беременности
Снижение гемоглобина при беременности
Значительное увеличение плазмы относительно увеличения количества гемоглобина и объема эритроцитов приводит к умеренному снижению уровня гемоглобина (физиологическая анемия или низкий гемоглобин у здоровых беременных), что наблюдается у здоровых беременных.Самая большая разница между темпами роста плазмы крови и количества эритроцитов в материнском кровотоке, формируется в течение конца второго начала третьего триместра (снижение гемоглобина обычно происходит в 28-36 недель беременности). Концентрация гемоглобина повышается благодаря прекращению увеличения плазмы и продолжения повышения количества гемоглобина. Наоборот, отсутствие появления физиологической анемии является фактором мертворождения.
Концентрация гемоглобина повышается благодаря прекращению увеличения плазмы и продолжения повышения количества гемоглобина. Наоборот, отсутствие появления физиологической анемии является фактором мертворождения.
Анемия при беременности
Установление четкого определения анемии у беременных женщин достаточно сложно, т.к. оно складывается из связанных с беременностью изменений в объеме крови и количества эритроцитов, физиологическими различиями в дозах гемоглобина междуми женщина и мужчинами и помогает использования препаратов железа при беременности.
- Центр профилактики и контроля заболеваний определил анемию, как уровень гемоглобина меньше, чем 110 г / л (гематокрит меньше 33%) в первом и третьем триместрах и менее, чем 105 г / л (гематокрит менее 32%) во втором триместре.
- ВОЗ определила анемию у беременных, как снижение гемоглобина меньше на 110 г / л (11 г / дл) или гематокрит меньше на 6,83 ммоль / л или на 33%.Тяжелая анемия беременных уровнем гемоглобина меньше 70 г / л и нуждается в медицинском лечении.
 Очень тяжелая анемия определяется уровнем гемоглобина меньше 40 г / л и нуждается в неотложной медицинской помощи в связи с риском застойной сердечной недостаточности.
Очень тяжелая анемия определяется уровнем гемоглобина меньше 40 г / л и нуждается в неотложной медицинской помощи в связи с риском застойной сердечной недостаточности.
Женщины со значениями гемоглобина ниже этих уровней должны подвергаться стандартным анализам (общий анализ с оценкой мазка периферической, подсчет ретикулоцитов, сывороточное железо, ферритин, трансферрин).Если при обследовании отклонений не выявлено, то гемоглобин сниженный до уровня 100 г / л можно считать физиологической анемией с большим разнообразием факторов, влияющих на нормальный уровень гемоглобина у конкретного человека.
Хроническая тяжелая анемия наиболее распространена у женщин в различных странах. Снижение материнского гемоглобина ниже 60 г / л приводит к уменьшению объема амниотической жидкости, вазодилатации мозговых сосудов плода и изменение частоты сердечного ритма плода.Также повышается риск преждевременных родов, самопроизвольных выкидышей, рождения детей с весом и мертворождения. Кроме того, тяжелая анемия (гемоглобин меньше 70 г / л) увеличивает риск материнской смертности. Нет данных, что анемия повышает риск врожденных аномалий плода.
Кроме того, тяжелая анемия (гемоглобин меньше 70 г / л) увеличивает риск материнской смертности. Нет данных, что анемия повышает риск врожденных аномалий плода.
Тяжелая хроническая анемия обычно связана с недостаточным запасом железа (из-за недостаточного потребления пищи или кишечных глистных инвазий), дефицитом фолатов (из-за недостаточного потребления и хронических гемолитических состояний, таких как малярия).Таким образом, предупреждение хронической анемии и улучшение исход беременности возможно при пищевых добавках и использовании мер контроля за инфекциями.
Проведение переливания крови и эритроцитарной массы (в тех местах, где доступно безопасное переливание крови) является разумным агрессивным лечением тяжелой анемии, особенно если есть признаки гипоксии плода.
Признаки физиологической анемии беременных исчезают через 6 недель после родов, когда объем плазмы возвращается к норме.
Потребность в железе
При одноплодной беременности потребность в железе составляет 1000 мг за беременность: примерно 300 мг для плода и плаценты и, примерно, 500, если таковые имеются, для увеличения количества гемоглобина. 200 мг теряется через кишечник, мочу и кожу. Обычно назначают в составе мультивитаминов, или как отдельный элемент. В целом, у женщин, принимающих препараты железа, гемоглобина выше на 1 г / дл, чем у женщин, не принимающих железо.
200 мг теряется через кишечник, мочу и кожу. Обычно назначают в составе мультивитаминов, или как отдельный элемент. В целом, у женщин, принимающих препараты железа, гемоглобина выше на 1 г / дл, чем у женщин, не принимающих железо.
Потребность в фолатах
Ежедневная потребность в фолатах для небеременных женщин составляет 50-100 мкг. Повышение количества эритроцитов во время приводит к увеличению количества кислоты в пищевых продуктах до 400-800 мкг в сутки, для предотвращения дефектов нервной трубки у плода.
Тромбоциты при беременности
В большинстве случаев количество тромбоцитов во время неосложненной беременности остается в пределах нормы для небеременных женщин, но так же у беременных женщин возможно снижение количества тромбоцитов по сравнению со здоровыми небеременными женщинами.Количество тромбоцитов начинает расти сразу после родов и продолжает расти в течение 3-4 недель, пока не вернется к нормальным значениям.
Тромбоцитопения при беременности
Наиболее важное в акушерстве изменение в физиологии тромбоцитов при беременности — это тромбоцитопения, которая может быть связана с осложнениями беременности (тяжелая преэклампсия, HELLP-синдром), медикаментозными расстройствами (иммунная тромбоцитопения), либо являться гестационной тромбоцитопенией. 9 / л.Количество лейкоцитов снижается до референсного интервала для небеременных женщин к шестому дню после родов.
9 / л.Количество лейкоцитов снижается до референсного интервала для небеременных женщин к шестому дню после родов.
В периферической крови у беременных женщин может быть количество миелоцитов и метамиелоцитов. По данным некоторых исследований наблюдается увеличение количества юных форм нейтрофилов во время беременности. Тельца Доли (голубое окрашивание цитоплазматических включений в гранулоцитах) считается нормой у беременных женщин.
У здоровых женщин при неосложненной беременности не происходит изменения абсолютного количества лимфоцитов и нет значительных изменений в относительном количестве Т- и В-лимфоцитов.Число моноцитов обычно не изменяется, число базофилов может немного снижаться, а число эозинофилов может несколько повышаться.
Факторы свертывания крови и ингибиторы
При нормальном развитии происходит следующие изменения уровней свертывания крови, приводящие к физиологической гиперкоагуляции:
- Из-за гормональных изменений при беременности снижается активность общего протеина S антигена, свободного протеина S антигена и протеина S.

- Устойчивость к активированному протеину С повышенным во втором и третьем триместрах.Данные изменения были выявлены при проведении тестов первого поколения с использованием чистой плазмы крови (т.е. не лишенного фактора V), однако этот тест редко применяется клинически и имеет лишь исторический интерес.
- Фибриноген и факторы II, VII, VIII, X, XII и XIII повышаются на 20-200%.
- Повышается фактор фон Виллебранда.
- Повышенная активность ингибиторов фибринолиза, TAF1, PAI-1 и PAI-2. Так же заметно повышается уровень PAI-1.
- Уровни антитромбина III, протеина С, фактор V и фактор IX чаще остаются без изменений или повышенных незначительно.
Конечный данных изменений — повышение тенденции к тромбообразованию, увеличение вероятности венозных тромбозов в течение и беременности, особенно, в послеродовый период. Наряду с сокращением миометрия и повышением уровня децидуального тканевого фактора, гиперкоагуляция защищает беременную от чрезмерного кровотечения во время родов и отделения плаценты.
АЧТВ остается в норме в течение беременности, но может немного снижаться. Протромбиновое время может укорачиваться. Время кровотечения не изменяется.
Сроки нормализации активности свертывания крови в послеродовый период могут изменить в зависимости от факторов, но все должно вернуться в нормальные рамки через 6-8 недель после родов. Гемостазиограмму не нужно оценивать ранее, чем через 3 месяца после родов и после завершения лактации для исключения факторов беременности.
Влияние фактора наследственной тромбофилии на беременность является сферой для исследований.
Послеродовый период
Гематологические изменения, связанные с беременностью, возвращаются в нормальные рамки через 6-8 недель после родов. Скорость и характер изменений, связанных с беременностью, конкретными гематологическими показателями показателей выше в разделе, посвященном каждому параметру.
Гематологические осложнения при беременности
- Железодефицитная анемия.

- Тромбоцитопения.
- Неонатальная аллоиммунная тромбоцитопения.
- Приобретенная гемофилия А.
- Венозные тромбозы.
- Резус- и не резус-аллоиммунизация. Для диагностики проводится анализ на резус-антитела и антигрупповые антитела.
- Проявление ранее нераспознанного нарушения свертывающей системы, такое как болезнь фон Виллебранда, наиболее часто манифестирует у женщин в период беременности и родов.Для скрининга болезни фон Виллебранда сдается анализ для оценки агрегации тромбоцитов с ристоцетином.
- Апластическая анемия.
Кухонные хитрости — Здоровая Россия
Несколько кухонных хитростей, которые позволяют снизить калорийность рациона
В деле здорового питания и здорового снижения веса все уловки хороши.Сегодня мы хотим предложить вам несколько вполне очевидных «кухонных лайфхаков», которые помогут сэкономить время, деньги и похудеть.
Одна из самых больших ошибок, которую делают люди, собираются контролировать калорийность рациона, — это неправильное определение размера порций. Вряд ли кто-то задумывается о том, чтобы точно взвесить те же овсяные хлопья — их просто насыпают в миску и заливают кипятком. А в дневник питания честно заносится «одна порция каши», когда, на самом деле, съедено в два-три раза больше.
Чтобы правильно отмерить нужное количество крупы или других сыпучих продуктов, лучше закупить набор мерных ложек. И повесить их на видном месте. А лучше разложить такие ложечки в искусственных контейнерах. Кстати, под герметичной крышкой ваши продукты не только лучше сохранятся, но контроль за их станет намного проще. Да, и еще один лайфхак: если в магазинах дефицит мерных ложек, вместо них можно использовать пластиковые емкости из-под йогурта.
Еще один прекрасный способ уменьшить размер порции — убрать подальше все огромные тарелки и оставить в кухонной сушке блюдца и маленькие пиалы. Несколько научных исследований показывают, что небольшие тарелки, которые помещаются маленькие порции, позволяют не только меньше есть, но и тщательнее пережевывать. Особенно в компании — для того, чтобы не прослыть «голодным торопыгой». Конечно, одна только смена посуды сама по себе похудеть не поможет. Но почему бы не попробовать? В самом худшем случае, вы сэкономите на средстве для мытья посуды.
Как часто вы заглядываете в холодильник, чтобы посмотреть его содержимое, даже если не голодны? У вас есть возможности перекусывать слишком часто, особенно вечером. Удержаться от этого практически невозможно, а обмотанный цепью холодильник выглядит весело только на карикатурах. Но есть прекрасный способ немного себя обмануть, потратив всего пять минут. Переместите все жирные и калорийные продукты к задней стенке холодильника, а ближе «к выходу» разместите все, что может пригодиться для низкокалорийного перекуса, — ваши обезжиренные йогурты, отварное мясо, овощи и фрукты.Еще лучше разложить все эти продукты в небольшие контейнеры на одну порцию: во-первых, за контейнерами не очень видно, что осталось в недрах холодильника, во-вторых, вы сразу будете понимать, сколько съесть. Только не забудьте попросить домочадцев уважать вашу «зону здоровой пищи» и не устраивать в холодильнике перестановку. А вашими легкими перекусами угощаются — может, привыкнут.
Никак не в силе отказаться от котлеток, тефтелек и фрикаделек? И постный фарш совсем «не идет»? Полезный лайфхак: до размера фарша можно заменить перемолотыми грибами.Во-первых, это вкусно. Во-вторых, грибы богаты белком. Особенно актуальны грибы в фарше из куриной грудки и индейки, блюда из которых получаются несколькими суховатыми.
Кстати, ваш овощной гарнир можно не жарить в масле, а тушить. В курином или индюшачьем бульоне, например. Его можно наварить заранее, снять жир и заморозить в формочках для льда. Несколько бульонных кубиков растапливаете на сковороде с антипригарным покрытием и тушите в нем овощи. И не только их — в небольшом количестве бульона отлично готовится омлет, карамелизуется лук и чеснок.В результате готовое блюдо приобретает приятный «мясной» аромат и съедается с большим удовольствием.
Чтобы оставить комментарий — необходимо быть авторизованным пользователем
Войти в личный кабинет Зарегистрироваться
Нейтрофіли та онкогенез
Резюме. В зависимости от того, какую роль играет нейтрофилы периферической крови и нейтрофилы, які інфільтрируют пухлини, протипухлинних и пухлиностимулюючих процесы, які відбуваються при обращении за видохией.Наведено характеристику двохосновных фенотипов Н1 и Н2 клітин, обговорюються их функції і механізми переходу від Н1 клітин с протипухлинною активностью в Н2-клітини, стимулированием їх функції і механізми переходу від Н1-клітини, протипухлинною активністю в Н2-клітини, средствах стимулирования ініфераціанніюпухлиній клітин. Наведено дані про функціонально важные цитокины и хемокины, так как виділяються пухлинними клітинами, мікрооточеннями, лімфоцитами и самими нейтрофилами, способствующими стимулированию распространения нейтрофилов, индуцирующих распространение нейтрофилов, вызывающих накопление мозговых вирусов, индуцирующих накопление вирусов в крови, сприминирование иммунной системы.Описано основні функціональні молекули нейтрофилов, такі як нейтрофільна еластаза, катепсин, матриксна металопротеїназа-9, аргіназа 1 и ін., З якими зв’язуються протуморогені властивості Н2 нейтрофілів. Багато процесів, викликані як Н1, так и Н2 нейтрофілами, ще недостатньо вивчені. Коротко зазначаться про появление новых вирусов для генерации и активации нейтрофилов с протипухлинными полномочиями и гальмування нейтрофилов, стимулирования пухлинга.
Резюме. Данные роли нейтрофилов периферической крови и нейтрофилов, инфильтрирующих опухоли, противоопухолевых и опухольстимулирующих процессов, которые проходят при развитии многих видов раков. Приведены характеристики двух основных фенотипов Н1 и Н2 клеток, обсуждаются их функции и механизмы передачи Н1 клеток с противоопухолевой активностью, клетки Н2, стимулирующие пролиферацию опухолевых клеток, ангиогенез и метастазирования. Представлены о функционально важных цитокинах и хемокинах, выделенных опухолевыми клетками, микроокружением, лимфоцитами и самими нейтрофилами, которые стимулируют выработку костным мозгом данных нейтрофилов и обусловливают накопление этих клеток в опухолевом очаге, развитие нейтрофилии в крови.Приведены основные функциональные молекулы нейтрофилов, такие как нейтрофильная эластаза, катепсин, матриксная металлопротеиназа-9, аргиназа 1 и др., С связывают протуморогенные свойства Н2 нейтрофилов. Многие процессы, вызываемые в опухолевом очаге как Н1, так и Н2 нейтрофилами, еще не до конца изучены. Кратко отмечается о существовании сегодня многих подходов к генерации и активации нейтрофилов с противоопухолевыми способностями и подавлению опухольстимулирующих нейтрофилов.
Получено 09.02.2018
Принято в печати 16.03.2018
Введение
Общеизвестно, что нейтрофилы являются наиболее распространенными лейкоцитами крови и считаются первой линией защиты при инфекциях и инфекциях [1]. Проникшие в организме микроорганизмы вызывают воспалительную реакцию, которая привлекает нейтрофилы из кровообращения в ткани. Там нейтрофилы разрушают микроорганизм с помощью механизмов, главным образом за счет фагоцитоза, высвобождения противомикробных веществ и внеклеточных ловушек нейтрофилов [1, 2].Активированные нейтрофилы также выделяют различные протеиназы в ткань, вызывая повреждения возбудителей и часто собственных тканей [3]. Кроме того, нейтрофилы способны продуцировать множество цитокинов и хемокинов, которые могут влиять на воспалительные реакции, а также иммунный ответ [4, 5].
Помимо этой классической роли нейтрофилов в антимикробной защите, также обнаружено накопление нейтрофилов во многих типах опухолей. Первоначально считалось, что эти связанные с опухолью нейтрофилы (опухольинфильтрирующие нейтрофилы — ОН) являются простыми свидетелями, потому что невозможно представить, что нейтрофилы были короткоживущими клетками.Однако в последнее время стало известно, что ОН играет важную роль при качественных новообразованиях. Этот частично объясняется анатомией опухолей [6, 7]. Показано, что нейтрофилы могут быть активными эффекторными клетками с противоопухолевыми функциями [8]. Различные противомикробные и цитотоксические соединения, содержащиеся в их гранулах, могут разрушать злокачественные клетки, а цитокины и хемокины, секретируемые нейтрофилами, могут также активировать другие клетки с противоопухолевой активностью [5, 7, 9].
Однако большее число клинических наблюдений и лабораторных исследований показывает, что наличие нейтрофилов в опухолях часто коррелирует с плохим прогнозом. Это хорошо доказано при целом ряде опухолей, в частности бронхоальвеолярной карциноме [10], почечно-клеточной карциноме [12] и плоскоклеточной карциноме головы и шеи [13], а также меланоме [11]. Во всех этих случаях нейтрофилы проявляют другой фенотип, который может быть неблагоприятным для исхода заболевания. Механизмы создания и реализации этого фенотипа нейтрофилов только начинают вызывать, но уведомляют, что некоторые из них связаны с генотоксичностью, ангиогенезом и иммуносупрессией [8].Следовательно, ОН могут быть полезны или вредны для хозяина [14]. Эти два типа нейтрофилов, четко описанные у мышей, были названы Н1 и Н2 [15] противоопухолевым и опухольстимулирующим макрофагам (М1 и М2) [16]. Положение о том, что нейтрофилы действительно важными клетками в развитии рака у человека, детально обсуждается в ряде обзоров [16–18].
Стимуляция образования нейтрофилов. У многих пациентов с распространенным раком выявлены повышенные уровни нейтрофилов в крови.Как опухоли индуцируют нейтрофилию, окончательно неизвестно, синтез опухолевыми клетками гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF), возможно, является одним из механизмов стимуляции продукции нейтрофилов костным мозгом [19]. Кроме других цитокинов, таких как интерлейкин (IL) -1 и IL-6, продуцируемые также опухолями, по-видимому, способствуют увеличению числа нейтрофилов в крови [7, 20]. Эта нейтрофилия связана с плохим прогнозом при нескольких типах рака, таких как рак легкого, меланома и почечная карцинома [11, 21, 22].В соответствии с этим показателем неблагоприятного прогноза является наличие большого количества нейтрофилов в определенных типах опухолей. «Нейтрофилия в крови» ассоциируется с воспалительными реакциями инфекций и повреждением тканей, то есть в опухолевом очаге, она представляет собой одно из доказательств концепции воспаления в онкогенезе и индуцированном им прогрессировании роста опухоли [7].
Предполагается, что отношение числа нейтрофилов в крови к другим лейкоцитов является фактором прогноза для больных раком.Так, например, отношение нейтрофилов к лимфоцитам (НЛО) было введено как прогностический фактор для больных колоректальным раком [25]. Из-за своей простоты определения НЛО, что является легкодоступным и недорогим биомаркером для многих типов, включая немелкоклеточный рак легкого [26], гепатоцеллюлярную карциному [24], карциному носоглотки [27], колоректальный рак [26], меланому [11] и рак грудной железы [28, 29]. Высокий уровень НЛО коррелирует с неблагоприятной общей выживаемостью при многих солидных опухолях [30–32].
. Невысокое количество нейтрофилов в крови, увеличивающее выход клеток из костного мозга, не всегда является плохим показателем прогрессирования рака. При некоторых типах опухолей, например, раке желудка, повышенный уровень нейтрофилов в крови, сопряжен с положительным прогнозом [33]. Это означает, что нейтрофилы в некоторых случаях контролируют развитие рака. Способность нейтрофилов непосредственно убивать опухолевые клетки как in vitro, , так и in vivo, действует давно [34–36].Также сообщалось, что нейтрофилы от животных с экспериментальными опухолями обладают повышенной цитотоксической активностью [7]. Нейтрофилы, выделенные из крови здоровых людей, осуществляют прямое цитотоксическое действие на некоторые линии опухолевых клеток [40]. Таким образом, точная роль нейтрофилов в развитии различных видов рака является спорным вопросом [7, 14, 37] и не до конца изученной, что требует дальнейших исследований.
Типы нейтрофилов. В дополнение к увеличенному количеству нейтрофилов в крови повышение уровня в крови незрелых миелоидных клеток на ранних стадиях дифференцировки, выявленных в нескольких типах опухолей [38], включая терминальную стадию рака легкого, грудной железы и желудочно-кишечного тракта [39] .Эти незрелые клетки костномозгового происхождения, представляющие гетерогенную популяцию, фенотипически разделяли на гранулоцитарные (G-MDSC) и моноцитарные (Mo-MDSC) подгруппы [40–42]. Их выявляют в большом количестве в селезенке экспериментальных животных с опухолями, где они проявляют иммунодепрессивный фенотип, что приводит к прогрессированию опухолей [43, 44]. G-MDSC характеризуются незрелой морфологией нейтрофилов и фенотипом CD33 / CD11b / HLA-DR / CD15 у людей [45]. Они выявлены периферической крови пациентов с глиобластомой [46], множественной миеломой, лимфомой Ходжкина [47], раком головы и шеи [48].
Эти G-MDSC могут осуществлять иммуносупрессию различными механизмами. Основной механизм включает в себя производство активных форм кислорода (АФК) при дыхательной вспышке этих клеток. У больных онкологического профиля пероксид водорода (H 2 O 2 ) продуцируемый активированными гранулоцитами, снижающий экспрессию CD3 цепи Т-клеточного рецептора и уменьшал выработку цитокинов Т-клетками пациентов [49]. Эти окисленные Т-клетки человека имели дефектный хемотаксис. Более того, АФК, продуцируемые MDSC, могут приводить к блокаде, в том числе CD8 Т-клеток и с помощью другого механизма, в частности пероксинитрита [50].
Как отмечалось выше, в зависимости от фенотипа нейтрофилы можно классифицировать как Н1 или Н2 [15], и подобно инфильтрирующим опухоль макрофагам (M1) клетки Н1 проявляют провоспалительную и противоопухолевую функцию. Напротив, клетки M2 и Н2 обладают протуморогенной активностью [16]. Установлено, что ОН отличаются от циркулирующих нейтрофилов, а также от G-MDSC в костном мозге и селезенке мышей. Мышиные нейтрофилы CD11b / Ly6G, выделенные из опухоли и активированные трансформирующие факторы роста бета (TGF-β), были гиперсегментированы и более цитотоксичны к опухолевым клеткам, экспрессировали более высокие уровни провоспалительных цитокинов [15].Напротив, истощение этих нейтрофилов из крови угнетало рост опухоли и сопровождалось активацией внутриопухолевых Т-клеток CD8 [15]. В подтверждении идеи о разных фенотипах нейтрофилов проведены исследования на двух моделях рака мышей (карцинома легкого Льюиса и мезотелиома AB12), у которых нейтрофилы были выявлены всего на периферии опухолевого узла на ранних стадиях развития опухоли. Эти ОН были более цитотоксичны по отношению к опухолевым клеткам и продуцировали более высокие уровни фактора некроза опухоли альфа (TNF-α), NO и H 2 O 2 .Напротив, ОН на поздних стадиях развития этих опухолей уже не проявляет таких свойств и демонстрировал протуморогенный фенотип [51]. Эти результаты исследований показывают, что нейтрофилы, стимулируют рост опухолей [51]. Следовательно, ОН, полученные от мышей с растущими опухолями, могут иметь противоопухолевый (Н1), так и протуморогенный (Н2) фенотип, поддерживающий рост опухоли и подавлять противоопухолевые иммунные реакции [14, 37], зависящие от микроокружения опухоли [17] .
, несмотря на эту классификацию ОН у мышей, природа и функция ОН, оставшиеся в опухолях человека, остаются еще малоизученными, но уже получены, подтверждающие такое деление ОН. Так, в исследованиях биопсийного материала опухоли легкого человека, составляющих 5–25% всех клеток опухоли [65]. Эти ОН представляют активированный фенотип (CD62L / CD54) с экспрессией отчетливого репертуара рецепторов хемокинов, которые включают CCR5, CCR7, CXCR3 и CXCR4 [65]. Кроме того, ОН продуцировали большее количество провоспалительных факторов MCP-1, IL-8, MIP-1α и IL-6, чем нейтрофилы в крови.ОН также стимулировали пролиферацию Т-клеток и выделение интерферона-гамма (IFN-γ). Эти результаты показывают, что на ранних стадиях рака легкого ОН не являются иммунодепрессантами, а скорее всего стимулируют ответы Т-клеток [52]. В исследовании [53] изучена роль хронического воспаления, в частности IL-23 и IL-17, при раке толстой кишки человека. Авторы выявили, что врожденные γδT (γδT17) являются основным клеточным IL-17 при колоректальном раке. Эти активированные клетки индуцировали клетки γδT17, секретирующие IL-8, TNF-α и GM-CSF, что приводит к накоплению нейтрофилов в опухоли.Эти ОН характеризовались CD45 / Lin / HLADR / CD11b / CD33 / CD66b и имели типичную полиморфноядерную морфологию. Они были хороши как G-MDSC [66]. Эти ОН (G-MDSC) продуцировали намного больше аргиназы-1 (ARG1) и АФК, чем аутологичные нейтрофилы в крови, и ингибировали пролиферацию активированных аутологичных Т-клеток и продукцию IFN-γ [53]. Результаты приведенных исследований указывают, что и в опухолях человека быть нейтрофилами с двойной функцией. В ранних стадиях развития опухоли ОН, по-видимому, может стимулировать противоопухолевые реакции, особенно Т-клеток [52], на поздних этапах развития опухоли ОН уже становятся иммунодепрессивными клетками [54].Сегодня остается еще много неясных вопросов. Например, являются ранними стадиями роста опухолей незрелыми нейтрофилами с противоопухолевыми свойствами, или ОН — это зрелые нейтрофилы, которые меняют фенотип со временем при прогрессировании опухоли, как предполагают ряд исследователей [17, 51]. Уже идентифицировано несколько вариантов субпопуляций нейтрофилов в крови как мышей с опухолями, так и людей, больных раком, и описывается несколько вариантов взаимосвязей этих клеток в связи с прогрессированием рака [54].Показано, что циркулирующие в крови нейтрофилы от животных с опухолями распределяются на субпопуляции (фракции) при разделении их в различных градиентах плотности фиколла. Одна субпопуляция состояла из «нормальных» нейтрофилов с высокой плотностью, которую выделяли на градиенте с высокой плотностью фиколла. Другая субпопуляция нейтрофилов с меньшей плотностью, которые находились вместе со слоем мононуклеарных лимфоидных клеток низкой плотности [55]. У здоровых мышей, не имеющих опухоли высокой плотности, у животных с высокой плотностью, у животных прогрессивно возрастало количество нейтрофилов с низкой плотностью, и они становились доминирующим типом нейтрофилов в циркуляции [54].Эти нейтрофилы обладают меньшей цитотоксичностью и имеют меньшую экспрессию различных хемокинов (CXCL1, CXCL2, CXCL10, CCL2 и CCL3) и хемокиновых рецепторов (CXCR2 и CCR5), что свидетельствует о снижении их провоспалительных возможностей. Предполагается, что нейтрофилы с низкой плотностью являются незрелыми нейтрофилами. Важно отметить, что TGF-β способен индуцировать трансформацию нейтрофилов с высокой плотностью от мышей с опухолями в нейтрофилы с низкой плотностью, и в то же время этот фактор не влияет на нейтрофилы крови животных без опухолей [54].Это указывает на то, что для такого изменения животных с раком необходимы стимулы, помимо TGF-β. На основании этих результатов предложили гипотезу, согласно которой в крови присутствуют: нормальные нейтрофилы высокой плотности, незрелые нейтрофилы низкой плотности (G-MDSC) и крупные зрелые нейтрофилы низкой плотности. Эти типы клеток обладают разной функциональностью и пластичностью. Так, нейтрофилы с высокой плотностью обеспечивают рост опухоли [67], они могут изменяться под различными хемокиновыми и цитокиновыми в микроокружении опухоли [17].
Высокий уровень нейтрофилов в опухоли происходит под воздействием нейтрофил-притягивающих хемокинов, которые могут продуцироваться не только иммунными клетками, но и опухолевыми клетками, в частности интерлейкином-8 (IL-8 / CXCL8). Другим хемокином, который также участвует в нейтрофилов в опухоли, является рекрутированием GCP-2 / CXCL6. В мышиной модели меланомы специфические моноклональные антитела против CXCL6 уменьшали количество ОН, а также размер опухоли [56]. Кроме того, из карциноматозных опухолей выделен и идентифицирован фактор ингибирования человека (MIF), уровень которого был высоким в опухолях с повышенным содержанием ОН и низкой выживаемостью этих [57].Используя те же рецепторы CXCR1 и CXCR2, нейтрофилы могут также реагировать и на другие хемокины, такие как CXCL1, CXCL2, CXCL5, CXCL6 и CXCL7 [58]. Не вызывающие нейтрофилы активируют сами себя по механизму положительной обратной связи, высвобождая нейтрофил-хемокины, которые вызывают больше нейтрофилов в опухоль, напоминающие нейтрофилов в очаги инфекции [59]. При исследовании 919 пациентов с гепатоцеллюлярной карциномой выявлено, что CXCL5 сверхэкспрессируется у пациентов с рецидивирующими опухолями, уровни CXCL5 коррелировали с большим накоплением в опухоли нейтрофилов и с меньшей общей выживаемостью [60].В частности, известно, что активированные Т-клетки продуцируют GM-CSF, CXCL1, CXCL2, TNF-α и IFN-γ [59]. Эти факторы могут прямо или косвенно привлекать больше нейтрофилов к опухоли. Несмотря на то, что эффективны механизмы активированных Т-клеток, на миграцию нейтрофилов в опухоль изучены недостаточно.
Нейтрофильные молекулы. Большой объем клинических данных показывает, что нейтрофилы участвуют в развитии рака и прогрессировании опухолей. В большинстве случаев увеличенное количество ОН ассоциируется с прогрессирующей болезнью и плохим прогнозом для больных онкологического профиля.Установлено, что такая отрицательная ассоциация характерна для ряда солидных опухолей, таких как меланома, гепатоцеллюлярная карцинома, немелкоклеточная карцинома легкого, глиома, аденокарцинома и рак толстой кишки [37, 61]. Предполагается, что в стимуляцию онкогенеза включаются те же молекулы, которые нейтрофилы используют для уничтожения микроорганизмов и модуляции воспаления [7]. Важными молекулами, которые могут влиять на темп роста и инвазивность опухолей, являются гранулярные белки, деградирующие в матриксе протеиназы, реактивные клетки кислорода, хемокины и цитокины [7].В последнее время появились описывающие, как ОН используют эти молекулы для воздействия на пролиферацию опухолевых клеток, ангиогенез, метастазы и иммунный надзор. Среди этих молекул следует выделить такие, как нейтрофильная эластаза (NE), катепсин, матриксная металлопротеиназа (MMP) -9 и др.
NE представляет собой основной белок азурофильных гранул, который выделяется приочной дегрануляции нейтрофилов. NE — сериновая протеаза с широким спектром субстратов. Помимо своей роли в воспалении и уничтожении бактерий, NE проявляет различные протуморогенные эффекты как in vivo, , так и in vitro, [62].Выявлено, что NE непосредственно стимулирует пролиферацию опухолевых клеток A459, когда мышиные нейтрофилы культивировали вместе с клеточной линией карциномы легкого [62, 63]. Кроме того, также установлено, что NE стимулирует миграцию опухолевых клеток. Нейтрофилы человека при культивировании с клетками аденокарциномы поджелудочной железы стимулировали миграцию клеток опухоли из монослоя. NE также повышала миграционную способность раковых клеток пищевода [64].
Катепсин G представляет собой себятидазу из азурофильных гранул, который участвует в деградации фагоцитированных микроорганизмов и ремоделировании белков внеклеточного матрикса [98].Кроме того, катепсин G может стимулировать ангиогенез и миграцию опухолевых клеток [65–67]. На модели метастазирования рака груди в костной ткани также показано, что катепсин G усиливает передачу сигналов TGF-β и повышает уровень сосудистого эндотелиального фактора роста (VEGF) для стимуляции ангиогенеза [66].
MMP-9 — желатиназа B — высвобождается из вторичных (специфических) гранул и, как установлено, вызывает пролиферации опухолей кожи человека вирусом папилломы 16-го типа (HPV-16).Кроме того, иммуногистохимическое исследование MMP-9 в плоскоклеточных опухолях карциномы показало, что MMP-9 присутствовала только в опухолевых инфильтрирующих лейкоцитах, а не в опухолевых клетках. Показано, что MMP-9 ингибирует апоптоз опухолевых клеток при раке легкого [68]. Таким образом, ММП-9 ответственна за увеличение роста опухоли, как за счет увеличения пролиферации клеток, так и уменьшения их апоптоза. Другим эффектом MMP-9, который поддерживает ростоли, является ангиогенез.Протеолитическое высвобождение VEGF из тканевого матрикса приии MMP считается условием ангиогенеза in vivo [68, 69]. Ангиогенный эффект ММП-9 зарегистрирован в нескольких моделях рака — меланоме, аденокарциноме поджелудочной железы [70–72].
Прямое доказательство того, что нейтрофилы являются основным, ассоциированным с опухолью лейкоцитарным типом, экспрессирующим MMP-9, предоставлено в исследовании с использованием человеческих ксенотрансплантатов и сингенных опухолей в эксперименте на мышах [73].Когда опухоли или изолированные из них макрофаги или нейтрофилы были дважды окрашены для них MMP-9 и соответствующих антигенов макрофагов или нейтрофилов, только ОН содержали большое количество MMP-9 [74, 75]. Кроме того, подсчитано, что 1 • 10 нейтрофилов в крови или ОН могут высвобождать приблизительно 100–200 нг проМMP-9 в течение 1–2 ч инкубации. Напротив, для макрофагов 1 • 10 потребуется несколько недель для получения такого же количества проММР-9 [73, 74]. Следовательно, MMP-9, полученная из нейтрофилов, ответственна за усиление ангиогенеза за счет высвобождения VEGF из внеклеточного матрикса, что наблюдается при многих типах опухолей.С внеклеточным матриксом связывают и другие процессы онкогенеза, например метастазирование опухолей [75, 76].
Нейтрофилы являются эффективными производителями АФК для уничтожения микроорганизмов. АФК также может косвенно рост опухоли. Во-первых, нейтрофилы генерируют пероксид водорода (H 2 O 2 ), который затем превращается в гипохлорид (HOCl) с помощью миелопероксидазы. HOCl затем может активировать несколько MMP, включая MMP-2, -7, -8 и -9.Кроме того, HOCl может блокировать ингибитор ММП-1 и таким образом потенцировать протеолитическую активность ММП [77, 78].
Выделенная из гранул нейтрофилов ARG1 способна разрушать внеклеточный аргинин, незаменимую аминокислоту для активации Т-клеток. Таким образом, дегрануляция нейтрофилов может иметь иммуносупрессивный эффект в опухолях, ингибируя опухольинфильтрирующие Т-клетки таким же образом, как описано для G-MDSC [79]. Показано, что истощение ОН у опухольсодержащих животных увеличило число активированных Т-клеток CD8, способствовало уменьшению размера опухолей и удлиняло время жизни животных [15].
Нейтрофилы могут также продуцировать цитокины или факторы роста, которые увеличивают туманный потенциал раковых клеток [5]. Это пока что установлено для двух цитокинов — онкостатина-M [79–81] и фактор роста гепатоцитов [10, 82, 83]. Раковые клетки грудной железы стимулируют нейтрофилы к выделению онкостатина-М, IL-6-подобного цитокина. Онкостатин-М, в свою очередь, стимулирует клетки грудной железы секретировать VEGF [84]. Аналогично, клетки гепатоцеллюлярной карциномы стимулируют рост гепатоцитов (HGF).В свою очередь, этот фактор стимулирования инвазивного роста опухолевых клеток [85].
Нейтрофилы также могут влиять на мигающие возможности раковых клеток. При нескольких типах лечения, нейтрофилы способствуют метастазированию плоскоклеточного рака кожи [86], меланомы [87], аденокарциномы [88] и рака грудной железы [89]. Способ, которым нейтрофилы повышают миграционную активность опухолевых клеток, может включать несколько механизмов. Циркулирующие опухолевые клетки непосредственно прилипают к сосудистому эндотелию, приводя к экстравазации для создания новых метастазов.В месте образования метастатического очага клетками рака легкого отмечалась их тесная связь с нейтрофилами [90]. В этом процессе нейтрофилы усиливают задержку опухолевых клеток, как следствие, больше метастазов [91]. Показано прямое взаимодействие между клетками нейтрофилов и карцином грудной железы путем взаимодействия молекул адгезии ICAM-1 в опухолевых клетках и β 2 -интегринов на нейтрофилах. Нейтрофилы связывают опухолевые клетки с интегринов и индуцировали кластеризацию ICAM-1 в опухолевой клетке [91].Это активировало в опухолевой клетке сигнальный путь с участием фокальной адгезии киназы (FAK) и p38-MAPK, что привело к усиленной передаче [89]. Вследствие этого повышенная миграция, как показано in vivo , приводит к увеличению количества метастазов в печени [92]. Раковые клетки непосредственно прикреплялись поверх адгезированных нейтрофилов, которые ускоряют развитие метастазов [93].
Несмотря на большое количество доказательств отрицательной роли нейтрофилов во время прогрессирования опухоли, имеются также четкие свидетельства положительной роли нейтрофилов в канцерогенезе. Как упоминалось ранее, нейтрофилы могут проявлять противоопухолевую активность в различных формах. Фактически, противоопухолевая способность нейтрофилов установлена давно, более трех десятилетий назад. Нейтрофилы могут непосредственно уничтожать опухолевые клетки как in vitro [36], так и in vivo [37].Нейтрофилы потенцируют этот противоопухолевый эффект, когда они активированы. Важность ОН типа Н1 в противоопухолевых реакциях также подчеркивается экспериментальными исследованиями о том, что истощение уровня нейтрофилов в крови приводит к увеличению роста опухоли [15, 93, 94]. Что нейтрофилы обладают потенциалом непосредственного уничтожения опухолевых клеток. Механизмы, которыми уже известны способы нейтрофилы, посредством этой функции, многочисленны еще не полностью изучены, включают в себя многие известные механизмы антиинфек защиты [7].
ЗАКЛЮЧЕНИЕ
Таким образом, представленным выше кратким сведениям представлен двойной противоопухолевый и нейтрофиловый потенциал, использованный для усиления противоопухолевых факторов в организме.
Хотя во многих случаях нейтрофилов в опухолях оказывает негативное влияние на раковые болезни, эти клетки, обладают способностью разрушать опухолевые клетки. Сегодня рассматриваются около десяти терапевтических стратегий и подходов для усиления противоопухолевого потенциала нейтрофилов или блокирования доступа ОН к растущим опухолям, таких как активация нейтрофилов интерфероном, синтез и накопление высоких провоспалительных цитокинов в опухоли, которые могут убивать опухолевые клетки, блокирующие инфильтрации нейтрофилов опухоли и многие клетки другие.Как указывалось выше, в некоторых опухолях образуются хемокины, главным образом IL-8, которые привлекают нейтрофилы в опухолевый очаг. Показано, что применение антагонистов IL-8 (таких как полностью гуманизированное нейтрализующее моноклональное антитело ABX-IL8) к IL-8 уменьшает рост опухоли, метастазы и ангиогенез меланомы и рака легкого [95]. Наличие двух фенотипов Н1 и Н2 нейтрофилов, предполагает также, что, влияя на микроокружение опухоли, можно манипулировать ОН и генерировать большее количество противоопухолевых нейтрофилов.Также получены многообещающие результаты с использованием моноклональных терапевтических антител, индуцирующих нейтрофилы для выработки антителозависимой цитотоксичности и высвобождения цитокинов, модулирующих иммунный противоопухолевый ответ [96, 97].
На развитие опухоли оказывают влияние на клетки организма, в том числе ОН. Точная роль ОН до конца не установлена, и ее предстоит еще выяснить. В настоящее время широко изучаются разные способы привлечения их в опухоль и превращения Н1 нейтрофилов в противоопухолевые эффекторные клетки.Научиться переворачивать «монеты» нейтрофилов на «выигрышную сторону», как считают Э. Урибе-Керол и К. Розалес [98], заставить действовать их как противоопухолевые эффекторные клетки, является вызовом и рекомендуется для будущих исследований, что, возможно, позволит усовершенствовать методы лечения рака.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Borregaard N. (2010) Нейтрофилы, от костного мозга до микробов. Иммунитет, 33 (5): 657–670. DOI: 10.1016 / j.immuni.2010.11.011.
2. Kolaczkowska E., Kubes P. (2013) Рекрутинг и функция нейтрофилов при здоровье и воспалении. Nat. Rev. Immunol., 13 (3): 159–175. DOI: 10.1038 / nri3399.
3. Pham C.T.N. (2006) Нейтрофильные сериновые протеазы: специфические регуляторы воспаления. Nat. Rev. Immunol., 6 (7): 541–550. DOI: 10.1038 / nri1841.
4. Скапини П., Лапинет-Вера Дж. А., Гасперини С. и др. (2000) Нейтрофил как клеточный источник хемокинов. Иммунол. Rev., 177: 195–203. DOI: 10.1034 / j.1600-065x.2000.17706.
5. Теккио К., Скапини П., Пиццоло Г., Кассателла М.А. (2013) О цитокинах, продуцируемых нейтрофилами человека в опухолях. Сем. Биология рака, 23 (3): 159–170. DOI: 10.1016 / j.semcancer.2013.02.004.
6. Мантовани А., Аллавена П., Сика А., Балквилл Ф. (2008) Воспаление, связанное с раком. Природа, 454 (7203): 436–444. DOI: 10,1038 / природа07205.
7. Бережная Н.М., Чехун В.Ф. (2005) Иммунология злокачественного роста. Наукова думка, Киев, 791 с.
8. Грегори А.Д., Хоутон А.М. (2011) Нейтрофилы, ассоциированные с опухолью: новые мишени для лечения рака. Cancer Res., 71 (7): 2411–2416. DOI: 10.1158 / 0008-5472.can-10-2583.
9. Mantovani A., Cassatella M.A., Costantini C., Jaillon S. (2011) Нейтрофилы в активации и регуляции врожденного и адаптивного иммунитета. Nat. Rev. Immunol., 11 (8): 519–531. DOI: 10.1038 / NRI3024.
10. Wislez M., Rabbe N., Marchal J. et al. (2003) Производство фактора роста гепатоцитов нейтрофилами, инфильтрирующими бронхиолоальвеолярную аденокарциному легких подтипа: роль в прогрессировании опухоли и смерти.Cancer Res., 63 (6): 1405–1412.
11. Schmidt H., Bastholt L., Geertsen P. et al. (2005) Повышенное количество нейтрофилов и моноцитов в периферической крови связано с плохой выживаемостью у пациентов с метастатической меланомой: прогностическая модель. Брит. J. Cancer, 93 (3): 273–278. DOI: 10.1038 / sj.bjc.6602702.
12. Дженсен Х.К., Донсков Ф., Маркуссен Н. и др. (2009) Наличие внутриопухолевых нейтрофилов является независимым прогностическим фактором при локализованной почечно-клеточной карциноме. J. Clin.Онкол., 27 (28): 4709–4717. DOI: 10.1200 / jco.2008.18.9498.
13. Trellakis S., Bruderek K., Dumitru C.A. и другие. (2011) Полиморфноядерные гранулоциты при раке головы и шеи человека: усиленная воспалительная активность, модуляция раковых клеток и распространение при запущенном заболевании. Int. J. Cancer, 129 (9): 2183–2193. DOI: 10.1002 / ijc.25892.
14. Фридлендер З.Г., Альбельда С.М. (2012) Нейтрофилы, связанные с опухолью: друг или враг? Канцерогенез, 33 (5): 949–955. DOI: 10,1093 / carcin / bgs123.
15. Фридлендер З.Г., Сан Дж., Ким С. и др. (2009) Поляризация опухолево-ассоциированного нейтрофильного фенотипа с помощью TGF-β: «N1» по сравнению с «N2» TAN. Раковые клетки, 16 (3): 183–194. DOI: 10.1016 / j.ccr.2009.06.017. [Бесплатная статья PMC].
16. Galdiero M.R., Garlanda C., Jaillon S. et al. (2013) Макрофаги и нейтрофилы, ассоциированные с опухолью, в развитии опухоли. J. Cell. Physiol., 228 (7): 1404–1412. DOI: 10.1002 / jcp.24260.
17. Сионов Р.В., Фридлендер З.Г., Гранот З. (2014) Многогранная роль нейтрофилов в микроокружении опухоли.Cancer Microenviron., 1–34. DOI: 10.1007 / s12307-014-0147-5.
18. Swierczak A., Mouchemore K.A., Hamilton J.A., Anderson R.L. (2015) Нейтрофилы: важные факторы, способствующие прогрессированию опухоли и метастазированию. Рак и метастазы Rev., 34 (4): 735–751. DOI: 10.1007 / s10555-015-9594-9.
19. McGary C.T., Miele M.E., Welch D.R. (1995) Высокометастатические клоны клеток аденокарциномы молочной железы крысы 13762NF стимулируют костный мозг путем секреции колониестимулирующего фактора гранулоцитов-макрофагов / активности интерлейкина-3.Am. J. Pathol., 147 (6): 1668–1681.
20. Lechner M.G., Liebertz D.J., Epstein A.L. (2010) Характеристика индуцированных цитокинами миелоидных супрессорных клеток из нормальных мононуклеарных клеток периферической крови человека. J. Immunol., 185 (4): 2273–2284. DOI: 10.4049 / jimmunol.1000901.
21. Atzpodien J., Reitz M. (2008) Нейтрофилы периферической крови как независимый иммунологический предиктор ответа и долгосрочной выживаемости при иммунотерапии при метастатической почечно-клеточной карциноме. Биотермия рака.Радиофарм., 23 (1): 129–134. DOI: 10.1089 / cbr.2007.0429.
22. Беллок А., Антуан М., Флао А. и др. (1998) Нейтрофильный альвеолит при бронхиолоальвеолярной карциноме: индукция интерлейкином-8 опухолевого происхождения и связь с клиническим исходом. Am. J. Pathol., 152 (1): 83–92.
23. Рид М.Д., Бастурк О., Тирабанджасак Д. и др. (2011) Нейтрофилы, инфильтрирующие опухоль при неоплазии поджелудочной железы. Современная патология, 24 (12): 1612–1619. DOI: 10.1038 / modpathol.2011.113.
24. Халазун К.Дж., Харди М.А., Рана А.А. и другие. (2009) Отрицательное влияние соотношения нейтрофилов и лимфоцитов на исход после трансплантации печени по поводу гепатоцеллюлярной карциномы. Анна. Хирургия, 250 (1): 141–151. DOI: 10.1097 / SLA.0b013e3181a77e59.
25. Walsh S.R., Cook E.J., Goulder F. et al. (2005) Соотношение нейтрофилов и лимфоцитов как прогностический фактор при колоректальном раке. J. Surg. Онкол., 91 (3): 181–184. DOI: 10.1002 / jso.20329.
26. Пэн Б., Ван Ю.-Х., Лю Ю.-М., Ма Л.-Х. (2015) Прогностическое значение отношения нейтрофилов к лимфоцитам у пациентов с немелкоклеточным раком легкого: системный обзор и метаанализ.Int. J. Clin. Exp. Мед., 8 (3): 3098–3106.
27. Малицис Г., Джакометти М., Кеннеди Р. Х. и др. (2014) Растущая роль соотношения нейтрофилов и лимфоцитов в определении результатов лечения колоректального рака: систематический обзор и метаанализ. Анна. Surg. Онкол., 21 (12): 3938–3946. DOI: 10.1245 / s10434-014-3815-2.
28. Кренн-Пилько С., Лангсенленер У., Турнер Э.-М. и другие. (2014) Повышенное предоперационное отношение нейтрофилов к лимфоцитам предсказывает плохой клинический исход у пациентов с раком груди.Брит. J. Cancer, 110 (10): 2524–2530. DOI: 10.1038 / bjc.2014.163.
29. Пистелли М., Де Лиза М., Баллаторе З. и др. (2015) Отношение нейтрофилов к лимфоцитам до лечения может быть полезным инструментом для прогнозирования выживаемости у пациентов с ранним тройным отрицательным раком груди. BMC Cancer, 15, статья 195. doi: 10.1186 / s12885-015-1204-2.
30. Guthrie G.J.K., Charles K.A., Roxburgh C.S.D. и другие. (2013) Отношение нейтрофилов-лимфоцитов на основе системного воспаления: опыт пациентов с раком.Крит. Преподобный Онкол. Гематол., 88 (1): 218–230. DOI: 10.1016 / j.critrevonc.2013.03.010.
31. Темплтон А.Дж., Макнамара М.Г., Шеруга Б. и др. (2014) Прогностическая роль соотношения нейтрофилов и лимфоцитов в солидных опухолях: систематический обзор и метаанализ. J. Nat. Институт рака, 106 (6). DOI: 10.1093 / jnci / dju124.dju124.
32. Параманатан А., Саксена А., Моррис Д.Л. (2014) Систематический обзор и метаанализ влияния предоперационного соотношения нейтрофильных лимфоцитов на отдаленные результаты после радикальной резекции солидных опухолей.Surg. Онкол., 23 (1): 31–39. DOI: 10.1016 / j.suronc.2013.12.001.
33. Карузо Р.А., Беллокко Р., Пагано М. и др. (2002) Прогностическое значение внутриопухолевых нейтрофилов при запущенной карциноме желудка в зоне высокого риска в Северной Италии. Современная патология, 15 (8): 831–837. DOI: 10.1097 / 01.mp.0000020391.98998.6b.
34. Пикавер А.Х., Рэтклифф Н.А., Уильямс А.Е., Смит Х. (1972) Цитотоксические эффекты перитонеальных нейтрофилов на сингенную опухоль крыс. Природа: Новая биология, 235 (58): 186–187.
35. Джеррард Т.Л., Коэн Д.Дж., Каплан А.М. (1981) Опосредованная нейтрофилами человека цитотоксичность опухолевых клеток. J. Natl Cancer Inst., 66 (3): 483–488 (19820701) 50: 160; 62 :: aid-cncr282050011362; 3.0.co; 2-0.
36. Катано М., Торису М. (1982) Опосредованное нейтрофилами разрушение опухолевых клеток при раковом асците. Рак, 50 (1): 62–68. DOI: 10.1002 / 1097-0142.
37. Брандау С., Думитру С.А., Ланг С. (2013) Протопухолевые и противоопухолевые функции нейтрофильных гранулоцитов. Семинары по иммунопатологии, 35 (2): 163–176.DOI: 10.1007 / s00281-012-0344-6.
38. Альманд Б., Кларк Дж. И., Никитина Е. и др. (2001) Повышенное производство незрелых миелоидных клеток у онкологических больных: механизм иммуносупрессии при раке. J. Immunol., 166 (1): 678–689. DOI: 10.4049 / jimmunol.166.1.678.
39. Choi J., Suh B., Ahn Y. et al. (2012) CD15 + / CD16 человеческие гранулоциты от неизлечимых больных раком: супрессорные клетки, происходящие из гранулоцитарного миелоида, которые обладают подавляющей функцией. Биология опухолей, 33 (1): 121–129. DOI: 10.1007 / s13277-011-0254-6.
40. Перанзони Э., Зилио С., Мариго И. и др. (2010) Гетерогенность и подгруппа клеток-супрессоров миелоидного происхождения. Curr. Мнение. Иммунол., 22 (2): 238–244. DOI: 10.1016 / j.coi.2010.01.021.
41. Raber P.L., Thevenot P., Sierra R. et al. (2014) Субпопуляции миелоидных супрессорных клеток нарушают Т-клеточные ответы через независимые пути, связанные с оксидом азота. Int. J. Cancer, 134 (12): 2853–2864. DOI: 10.1002 / ijc.28622.
42. Юн Дж.-И., Нагарадж С., Коллазо М., Габрилович Д.И. (2008) Подмножества миелоидных супрессорных клеток у мышей с опухолями. J. Immunol., 181 (8): 5791–5802. DOI: 10.4049 / jimmunol.181.8.5791.
43. Габрилович Д.И., Нагарадж С. (2009) Клетки-супрессоры миелоидного происхождения как регуляторы иммунной системы. Nat. Rev. Immunol., 9 (3): 162–174. DOI: 10,1038 / NRI2506.
44. Нагарадж С., Шрам А.Г., Чо Х.-И. и другие. (2010) Механизм толерантности Т-клеток, индуцированный миелоидными клетками-супрессорами.J. Immunol., 184 (6): 3106–3116. DOI: 10.4049 / jimmunol.0
1.45. Фавалоро Дж., Лиядипития Т., Браун Р. и др. (2014) Миелоидные супрессорные клетки численно, функционально и фенотипически различаются у пациентов с множественной миеломой. Лейкемия и лимфома, 55 (12): 2893–2900. DOI: 10.3109 / 10428194.2014.
1.
46. Raychaudhuri B., Rayman P., Huang P. et al. (2015) Инфильтрация миелоидных клеток-супрессоров в мышиных и человеческих глиомах связана с уменьшением инфильтрирующих опухоль лимфоцитов.J. Neuro-Oncology, 122: 293–301. DOI: 10.1007 / s11060-015-1720-6.
47. Галламини А., Ди Раймондо Ф., Ла Наса Г. и др. (2013) Стандартные методы лечения: против новых методов лечения лимфомы Ходжкина. Иммунол. Letters, 155 (1–2): 56–59. DOI: 10.1016 / j.imlet.2013.09.011.
48. Trellakis S., Bruderek K., Hütte J. et al. (2013) Гранулоцитарные миелоидные супрессорные клетки криочувствительны, и их частота не коррелирует с концентрацией колониестимулирующих факторов в сыворотке крови при раке головы и шеи.Врожденный иммунитет, 19 (3): 328–336. DOI: 10,1177 / 1753425
3618.49. Schmielau J., Finn O.J. (2001) Активированные гранулоциты и перекись водорода, полученная из гранулоцитов, являются основным механизмом подавления функции Т-клеток у пациентов с запущенным раком. Cancer Res., 61 (12): 4756–4760.
50. Нагарадж С., Гупта К., Писарев В. и др. (2007) Измененное распознавание антигена является механизмом толерантности CD8 + Т-клеток при раке. Nat. Мед., 13 (7): 828–835. DOI: 10,1038 / нм1609.
51.Мишалян И., Баюх Р., Леви Л. и др. (2013) Нейтрофилы, ассоциированные с опухолью (TAN), проявляют проканкогенные свойства во время прогрессирования опухоли. Cancer Immunol., Immunother., 62 (11): 1745–1756. DOI: 10.1007 / s00262-013-1476-9.
52. Ерусланов Э. Б., Бходжнагарвала П. С., Кватромони Дж. Г. и другие. (2014) Нейтрофилы, связанные с опухолью, стимулируют Т-клеточные ответы при ранней стадии рака легких у человека. J. Clin. Инвест., 124 (12): 5466–5480. DOI: 10,1172 / JCI77053.
53. Wu P., Wu D., Ni C. et al.(2014) клетки γδT17 способствуют накоплению и размножению миелоидных супрессорных клеток при колоректальном раке человека. Иммунитет, 40 (5): 785–800. DOI: 10.1016 / j.immuni.2014.03.013.
54. Sagiv J.Y., Michaeli J., Assi S. et al. (2015) Фенотипическое разнообразие и пластичность циркулирующих субпопуляций нейтрофилов при раке. Cell Reports, 10 (4): 562–573. DOI: 10.1016 / j.celrep.2014.12.039.
55. Гарсия-Гарсия Э., Урибе-Керол Э., Розалес К. (2013) Простой и эффективный метод обнаружения активации ядерного фактора в нейтрофилах человека с помощью проточной цитометрии.J. Vis. Exp. (74). doi: 10.3791 / 50410.e50410 [Бесплатная статья PMC] [PubMed] [Cross Ref10.1016 / j.celrep.2014.12.039].
56. Вербеке Х., Струйф С., Бергманс Н. и др. (2011) Изотипические нейтрализующие антитела против GCP-2 / CXCL6 мыши подавляют рост и метастазирование меланомы. Письма о раке, 302 (1): 54–62. DOI: 10.1016 / j.canlet.2010.12.013.
57. Dumitru C.A., Gholaman H., Trellakis S. et al. (2011) Фактор ингибирования миграции макрофагов, происходящий из опухоли, модулирует биологию раковых клеток головы и шеи посредством активации нейтрофилов.Int. J. Cancer, 129 (4): 859–869. DOI: 10.1002 / ijc.25991. [PubMed] [Перекрестная ссылка].
58. Lazennec G., Richmond A. (2010) Хемокины и хемокиновые рецепторы: новый взгляд на воспаление, связанное с раком. Тенденции Мол. Мед., 16 (3): 133–144. DOI: 10.1016 / j.molmed.2010.01.003. [Бесплатная статья PMC] [PubMed] [Перекрестная ссылка].
59. Кобаяши Ю. (2008) Роль хемокинов в биологии нейтрофилов. Фронт. Bioscie., 13 (7): 2400–2407. DOI: 10,2741 / 2853. [PubMed] [Перекрестная ссылка].
60.Окабе Х., Беппу Т., Уэда М. и др. (2012) Идентификация CXCL5 / ENA-78 как фактора, участвующего во взаимодействии между клетками холангиокарциномы и фибробластами, связанными с раком. Int. J. Cancer, 131 (10): 2234–2241. DOI: 10.1002 / ijc.27496.
61. Dumitru C.A., Moses K., Trellakis S. et al. (2012) Нейтрофилы и гранулоцитарные миелоидные супрессорные клетки: иммунофенотипирование, клеточная биология и клиническое значение в онкологии человека. Cancer Immunol., Immunother., 61 (8): 1155–1167. DOI: 10.1007 / s00262-012-1294-5.
62. Houghton A.M., Rzymkiewicz D.M., Ji H. et al. (2010) Опосредованная нейтрофильной эластазой деградация IRS-1 ускоряет рост опухоли легких. Nat. Мед., 16 (2): 219–223. DOI: 10,1038 / нм.2084.
63. Wada Y., Yoshida K., Tsutani Y. et al. (2007) Нейтрофильная эластаза индуцирует пролиферацию и миграцию клеток за счет высвобождения TGF-α, PDGF и VEGF в клеточных линиях пищевода. Онкол. Доклады, 17 (1): 161–167.
64. Сегал А.В. (2005) Как нейтрофилы убивают микробы.Анна. Rev. Immunol., 23: 197–223. DOI: 10.1146 / annurev.immunol.23.021704.115653.
65. Моримото-Камата Р., Мизогучи С.-И., Ичисуги Т., Юи С. (2012) Катепсин G индуцирует агрегацию клеток рака молочной железы человека MCF-7 с помощью двухступенчатого механизма: независимый от каталитического сайта связывание с поверхностью клетки и индукция агрегации клеток, зависящая от ферментативной активности. Медиаторы Inflamm., 2012: 13. DOI: 10.1155 / 2012 / 456462.456462.
66. Уилсон Т.Дж., Наннуру К.С., Футакучи М., Сингх Р.К. (2010) Опосредованная катепсином G усиленная передача сигналов TGF-β способствует ангиогенезу за счет активации VEGF и MCP-1. Письма о раке, 288 (2): 162–169. DOI: 10.1016 / j.canlet.2009.06.035.
67. Yui S., Osawa Y., Ichisugi T., Morimoto-Kamata R. (2014) Нейтрофильный катепсин G, но не эластаза, индуцирует агрегацию клеток карциномы молочной железы MCF-7 посредством клеточно-ориентированного механизма, зависимого от активности протеазы . Медиаторы Inflamm., 2014: 12. DOI: 10.1155 / 2014 / 971409.971409.
68. Акафф Х.Б., Картер К.Дж., Финглтон Б. и др. (2006) Матричная металлопротеиназа-9 из клеток костного мозга способствует выживанию, но не росту опухолевых клеток в микроокружении легких. Cancer Res., 66 (1): 259–266. DOI: 10.1158 / 0008-5472.can-05-2502.
69. Ebrahem Q., Chaurasia S.S., Vasanji A. et al. (2010) Перекрестный разговор между фактором роста эндотелия сосудов и матриксными металлопротеиназами в индукции неоваскуляризации in vivo . Am. J. Pathol., 176 (1): 496–503. DOI: 10.2353 / ajpath.2010.080642.
70. Hawinkels L.J.A.C., Zuidwijk K., Verspaget H.W. и другие. (2008) Высвобождение VEGF в результате опосредованного MMP-9 расщепления гепарансульфатом индуцирует ангиогенез колоректального рака. Евро. J. Cancer, 44 (13): 1904–1913. DOI: 10.1016 / j.ejca.2008.06.031.
71. Coillie E.V., Aelst I.V., Wuyts A. et al. (2001) Ангиогенез опухоли, индуцированный хемотаксическим белком-2 гранулоцитов, как принцип противотока. Am. J. Pathol., 159 (4): 1405–1414. DOI: 10,1016 / s0002-9440 (10) 62527-8.
72. Бергерс Г., Бреккен Р., МакМахон Г. и др. (2000) Матричная металлопротеиназа-9 запускает ангиогенный переключатель во время канцерогенеза. Nat. Cell Biol., 2 (10): 737–744. DOI: 10,1038 / 35036374.
73. Дерюгина Е.И., Заяц Э., Юнкер-Йенсен А. и др. (2014) Нейтрофилы, инфильтрирующие ткань, составляют основной in vivo источник индуцирующей ангиогенез ММП-9 в микроокружении опухоли. Неоплазия, 16 (10): 771–788. DOI: 10.1016 / j.neo.2014.08.013.
74.Дерюгина Е.И., Куигли Дж. П. (2015) Опухолевый ангиогенез: ММП-опосредованная индукция неоваскулярной сети, поддерживающей интравазацию и метастазирование. Матричная биология, 44.
75. Бережная Н.М., Чехун В.Ф. (2016) Физиологическая система соединительной ткани и онкогенез. Экстрацеллюлярный матрикс и метастазирование. Онкология, 18 (3): 164–176.
76. Чехун В.Ф., Бережная Н.М. (2017) Физиологическая система соединительной ткани и онкогенез. Формирование резистентности к химиопрепаратам. Онкология, 19 (3): 156–170.
77. De Larco J.E., Wuertz B.R.K., Furcht L.T. (2004) Потенциальная роль нейтрофилов в стимулировании метастатического фенотипа опухолей, выделяющих интерлейкин-8. Clin. Cancer Res., 10 (15): 4895–4900. DOI: 10.1158 / 1078-0432.ccr-03-0760.
78. Shabani F., McNeil J., Tippett L. (1998) Окислительная инактивация тканевого ингибитора металлопротеиназы-1 (TIMP-1) хлорноватистой кислотой (HOCl) подавляется противоревматическими препаратами. Free Radical Res., 28 (2): 115–123. DOI: 10.3109 / 1071576980
97.
79. Кросс А., Эдвардс С.В., Бакнелл Р.С., Мутс Р.Дж. (2004) Секреция онкостатина М нейтрофилами при ревматоидном артрите. Arthritis Rheum., 50 (5): 1430–1436. DOI: 10.1002 / art.20166.
80. Горен И., Кемпфер Х., Мюллер Э. и др. (2006) Экспрессия онкостатина М функционально связана с нейтрофилами в ранней воспалительной фазе восстановления кожи: последствия для нормальных и больных диабетом ран. J. Invest. Dermatol., 126 (3): 628–637. DOI: 10,1038 / sj.jid.5700136.
81.Grenier A., Combaux D., Chastre J. et al. (2001) Производство онкостатина М кровью и альвеолярными нейтрофилами во время острого повреждения легких. Лаборатория. Инвест., 81 (2): 133–141. DOI: 10.1038 / labinvest.3780220.
82. Гренье А., Шолле-Мартин С., Крестани Б. и др. (2002) Наличие мобилизуемого внутриклеточного пула фактора роста гепатоцитов в полиморфно-ядерных нейтрофилах человека. Кровь, 99 (8): 2997–3004. DOI: 10.1182 / blood.v99.8.2997.
83. Мацусима А., Огура Х., Ко Т. и др. (2004) Фактор роста гепатоцитов в полиморфноядерных лейкоцитах повышен у пациентов с синдромом системной воспалительной реакции.J. Trauma, 56 (2): 259–264. DOI: 10.1097 / 01.ta.0000111752.60500.da.
84. Queen M.M., Ryan R.E., Holzer R.G. и другие. (2005) Клетки рака груди стимулируют выработку нейтрофилов онкостатина М: потенциальные последствия для прогрессирования опухоли. Cancer Res., 65 (19): 8896–8904. DOI: 10.1158 / 0008-5472.can-05-1734.
85. Имаи Ю., Кубота Ю., Ямамото С. и др. (2005) Нейтрофилы усиливают инвазионную активность клеток холангиоцеллюлярной карциномы человека и гепатоцеллюлярной карциномы: исследование in vitro .J. Gastroenterol. Гепатол., 20 (2): 287–293. DOI: 10.1111 / j.1440-1746.2004.03575.x.
86. Лукинова Е., Донг Г., Энаморадо-Аяля И. и др. (2000) Регулируемая ростом экспрессия онкогена-альфа плоскоклеточной карциномой мышей способствует росту опухоли, метастазированию, инфильтрации лейкоцитов и ангиогенезу посредством механизма, зависимого от рецептора CXC-2 хозяина. Онкоген, 19 (31): 3477–3486. DOI: 10.1038 / sj.onc.1203687.
87. Schaider H., Oka M., Bogenrieder T. et al. (2003) Дифференциальный ответ первичной и метастатической меланомы на нейтрофилы, привлекаемые IL-8.Int. J. Cancer, 103 (3): 335–343. DOI: 10.1002 / ijc.10775.
88. Велч Д. Р., Шиссель Д. Дж., Хоури Р. П., Эид П. А. (1989) Вызванные опухолью полиморфноядерные клетки, в отличие от «нормальных» циркулирующих полиморфно-ядерных клеток, стимулируют инвазивные и метастатические потенциалы клеток аденокарциномы молочной железы крысы. Слушания Национальной академии наук Соединенных Штатов Америки, 86 (15): 5859–5863. DOI: 10.1073 / pnas.86.15.5859.
89. Strell C., Lang K., Niggemann B. et al.(2010) Нейтрофильные гранулоциты способствуют миграционной активности клеток карциномы молочной железы человека MDA-MB-468 через ICAM-1. Exp. Cell Res., 316 (1): 138–148. DOI: 10.1016 / j.yexcr.2009.09.003.
90. Криссман Дж. Д., Хэтфилд Дж., Шальденбранд М. и др. (1985) Арест и экстравазация амеланотической меланомы B16 в легких мыши. Световое и электронно-микроскопическое исследование. Лаборатория. Инвест., 53 (4): 470–478.
91. Huh S.J., Liang S., Sharma A. et al. (2010) временно захваченные циркулирующие опухолевые клетки взаимодействуют с нейтрофилами, способствуя развитию метастазов в легких.Cancer Res., 70 (14): 6071–6082. DOI: 10.1158 / 0008-5472.can-09-4442.
92. Спайсер Дж. Д., Макдональд Б., Кулс-Лартиг Дж. Дж. и другие. (2012) Нейтрофилы способствуют метастазированию в печень за счет опосредованного Mac-1 взаимодействия с циркулирующими опухолевыми клетками. Cancer Res., 72 (16): 3919–3927. DOI: 10.1158 / 0008-5472.CAN-11-2393.
93. Kousis P.C., Henderson B.W., Maier P.G., Gollnick S.O. (2007) Повышение противоопухолевого иммунитета с помощью фотодинамической терапии регулируется нейтрофилами. Cancer Res., 67 (21): 10501–10510.DOI: 10.1158 / 0008-5472.can-07-1778.
94. Suttmann H., Riemensberger J., Bentien G. et al. (2006) Нейтрофильные гранулоциты необходимы для эффективной иммунотерапии Bacillus Calmette-Guérin рака мочевого пузыря и для управления местными иммунными ответами. Cancer Res., 66 (16): 8250–8257. DOI: 10.1158 / 0008-5472.can-06-1416.
95. Хуанг С., Миллс Л., Миан Б. и др. (2002) Полностью гуманизированные нейтрализующие антитела к интерлейкину-8 (ABX-IL8) ингибируют ангиогенез, рост опухоли и метастазирование меланомы человека.Am. J. Pathol., 161 (1): 125–134. DOI: 10,1016 / s0002-9440 (10) 64164-8.
96. Otten M.A., Leusen J.H.W., Rudolph E. et al. (2007) Зависимая от γ-цепи передача сигналов FcR в незрелых нейтрофилах опосредуется FcαRI, но не FcγRI. J. Immunol., 179 (5): 2918–2924. DOI: 10.4049 / jimmunol.179.5.2918.
97. Бакема Дж. Э., Ганзевлес С. Х., Флуитсма Д. М. и другие. (2011) Нацеливание FcαRI на полиморфно-ядерные клетки вызывает уничтожение опухолевых клеток посредством аутофагии. J. Immunol., 187 (2): 726–732. DOI: 10.4049 / jimmunol.1002581.
98. Урибе-Керол Э., Розалес К. (2015) Нейтрофилы в раке: две стороны одной монеты. J. Immunol. Res., 2015: 983698. Pub. онлайн, 2015 г. 24 декабря. doi: 10.1155 / 2015/983698.
Адрес:
Лисяный Николай Иванович
04050, Киев, ул. П. Майбороды, 32
ГУ «Институт нейрохирургии
им. акад. А.П. Ромоданова НАМН Украины »
Тел .: (044) 483-01-93
E-mail: [email protected]
для корреспонденции:
Лисяный Николай
32 П.Ул. Майбороды, г. Киев 04050
ГУ «Институт нейрохирургии им. Акад. Ромоданов А.П.
НАМН Украины »
Тел .: 044 483-01-93
E-mail: [email protected]
Лейкоцитарная формула (дифференцированный подсчет лейкоцитов, лейкоцитограмма, дифференциальный подсчет лейкоцитов) с обязательной «ручной» микроскопией мазка крови
Интерпретация результатов исследования содержит информацию для лечащего врача и не является диагнозом.Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результаты других обследований и т.д.
Концентрация лейкоцитов (WBC, лейкоциты)
Клетки с ядрами, обеспечивающие выполнение функций защиты. Образуются в красном костном мозге и органах лимфатической системы.Функции и время жизни зависит от того, какой поп (нейтрофилы, лимфоциты, моноциты, эозинофилы или базофилы) относится лейкоцит.
Единицы измерения в Независимой лаборатории ИНВИТРО: тыс. / Мкл (10 3 клеток / мкл).
Альтернативные единицы измерения: 10 9 клеток / л.
коэффициенты пересчета: 10 9 клеток / л = 10 3 клеток / мкл = тыс. / Мкл.
Референсные значения:
| Возраст | Концентрация лейкоцитов тыс. руб./ мкл (10 3 клеток / мкл) |
| 1 день — 12 месяцев | 6,0 — 17,5 |
| 12 месяцев — 2 года | 6,0 — 17,0 |
| 2 года — 4 года | 5,5 — 15,5 |
| 4 года — 6 лет | 5,0 — 14,5 |
| 6 лет — 10 лет | 4,50 — 13,5 |
| 10 лет — 16 лет | 4,50 — 13,0 |
| 16 лет — 120 лет | 4,50 — 11,0 |
Интерпретация результатов
Повышение значений:
- Физиологический лейкоцитоз (эмоциональные и физические нагрузки, воздействие солнечного света, холода, прием пищи, беременность, менструация).
- Воспалительные процессы.
- Вирусные и бактериальные инфекции.
- Состояния после перенесенных вмешательств.
- Интоксикации.
- Ожоги и травмы.
- Инфаркты внутренних органов.
- Злокачественные новообразования.
- Гемобластозы.
- Вирусные и некоторые хронические инфекции.
- Прием лекарственных препаратов (антибиотиков, цитостатиков, нестероидных противовоспалительных средств, тиреостатиков и др.).
- Аутоиммунные заболевания.
- Воздействие ионизирующего излучения.
- Истощение и кахексия.
- Анемии.
- Спленомегалия.
- Гемобластозы.
Различные виды лейкоцитов выполняют разные функции, поэтому при отклонении количества лейкоцитов в ту или иную сторону от референсных значений наиболее важным является то, какая (или какие) из субпопуляций лейкоцитов ответственна за это отклонение. Следует принимать во внимание, что изменения лейкоцитарной формулы не являются специфичными: они должны иметь сходный характер при разных заболеваниях, или, напротив, встречаться непохожие изменения при одной и той же патологии у разных пациентов.
Лейкоцитарная формула имеет возрастные особенности, поэтому ее сдвиги должны оцениваться с позиции возрастной нормы (что особенно важно при обследовании детей). При интерпретации результатов также помнить, что повышение или понижение значений может быть как абсолютным (меняется именно лейкоцитов, относящихся к данной популяции), так и относительным (меняется соотношение клеток в лейкоцитарной формуле из-за изменений количества клеток, относящихся к другим субпопуляциям) ).
Для получения представления об абсолютном количестве клеток, относящихся к какой-либо субпопуляции, необходимо произвести расчет, исходя из процента содержания клеток данной субпопуляции и общей лейкоцитов (например, при общей концентрации лейкоцитов 10 тыс. / Мкл и относительном содержании нейтрофилов 60% , абсолютное количество нейтрофилов составит 6 тыс. / мкл).
Нейтрофилы (общее число)
Клетки с сегментированным ядром и нейтрофильными гранулами в цитоплазме.Основная функция их — защита от бактериальных инфекций, а именно распознавание, захват и уничтожение бактерий. Среднее время жизни составляет 15 суток, большую часть из них нейтрофилы проводят в костном мозге, при выходе из него в кровеносном русле — 8-10 часов, после чего поступают в периферические ткани. Примерно половина нейтрофилов, находящихся в кровеносном русле, обратимо прилипает к эндотелиальным клеткам внутренней поверхности кровеносного сосуда (пристеночный пул). При стимуляции (контакт с инфекционным агентом, стресс, физическая нагрузка, гипоксия и др.) повышения нейтрофилов в кровеносном русле может резко возрастать за счет ускорения выхода нейтрофилов из костного мозга, а также за счет мобилизации пристеночного пула, поэтому количество нейтрофилов может значительно меняться даже в течение нескольких часов.
Нейтрофилией (значимым повышением количества нейтрофилов) повышение верхнего предельного количества нейтрофилов более 7,5 тыс. Руб. в микролитре, нейтропенией (значимым снижением абсолютного количества нейтрофилов) считается снижение абсолютного количества ниже 1,8 тыс.в микролитре. Снижение абсолютного количества нейтрофилов 500 в микролитре может вести к значительным сбоям иммунной защиты организма.
Единицы измерения в Независимой лаборатории ИНВИТРО:%.
Референсные значения:
| Возраст | Процентное соотношение нейтрофилов,% |
| 1 день — 15 дней | 31,0 — 56,0 |
| 15 дней — 12 месяцев | 17,0 — 51,0 |
| 12 месяцев — 2 года | 29,0 — 54,0 |
| 2 года — 5 лет | 33,0 — 61,0 |
| 5 лет — 7 лет | 39,0 — 64,0 |
| 7 лет — 9 лет | 42,0 — 66,0 |
| 9 лет — 11 лет | 44,0 — 66,0 |
| 11 лет — 15 лет | 46,0 — 66,0 |
| 15 лет и старше | 48,0 — 78,0 |
Интерпретация результатов
Повышение значений:
- Большинство заболеваний, вызванных бактериальными инфекциями.
- Воспалительные процессы.
- Стресс.
- Физическое перенапряжение.
- Инфаркты внутренних органов.
- Состояния после перенесенных оперативных вмешательств.
- Прием лекарственных препаратов (кортикостероидов, гепарина, ацетилхолина).
- Эндогенные интоксикации.
- Злокачественные новообразования.
- Некоторые инфекции, вызванные бактериями (брюшной тиф и паратифы, бруцеллез, туберкулез), вирусами (грипп, корь, ветряная оспа, вирусный гепатит, краснуха), простейшими (малярия), риккетсиями (сыпной тифой), затяжными инфекциями у старых и ослабленных людей.
- Прием лекарственных препаратов (антибиотиков, противовирусных, психотропных, антигистаминных, противосудорожных препаратов, нестероидных противовоспалительных средств).
- Анемии.
- Гиперспленизм.
- Врожденные нейтропении.
- Анафилактический шок.
- Тиреотоксикоз.
- Воздействие цитостатиков, противоопухолевых препаратов.
Лимфоциты
Небольшие клетки с несегментированным округлым ядром.Продолжительность жизни составляет от нескольких дней до нескольких лет, в зависимости от выполняемых функций. В их числе: распознавание различных антигенов экспрессии на поверхности клеток уникальных антигенных белков, формирование гуморального рецепта иммунного ответа путем синтеза к чужеродным белкам (иммуноглобулинов различных классов), обеспечение клеточного иммунитета — уничтожение разных клеток непосредственно эффекторными цитотоксическими лимфоцитами (отторжение трансплантата, противоопухолевый иммунитет, иммунитет против внутриклеточных паразитов, в том числе противовирусный).Часть лимфоцитов является клетками памяти, которые сохраняют информацию о ранее встречавшемся антигене. Они быстро пролиферируют и продуцируют большие количества антител при повторной встрече с известным антигеном.
Лимфоциты обладают способностью синтезировать и контролировать в крови различные белковые регуляторы — цитокины, посредством которых осуществляют координацию и регуляцию иммунного ответа.
Лимфоцитозом (значимым повышением количества лимфоцитов) считается повышение абсолютного количества лимфоцитов более 5 тыс.в микролитре, лимфопенией (значимым снижением абсолютного количества лимфоцитов) считается снижение абсолютного количества менее 1 тыс. в микролитре.
Единицы значения измерения: в Независимой лаборатории ИНВИТРО:%Референсные:
| Возраст | Процентное содержание лимфоцитов,% |
| 1 день — 15 дней | 22,0 — 55,0 |
| 15 дней — 12 месяцев | 45,0 — 70,0 |
| 12 месяцев — 2 года | 37,0 — 60,0 |
| 2 года — 5 лет | 33,0 — 55,0 |
| 5 лет — 9 лет | 30,0 — 50,0 |
| 9 лет — 12 лет | 30,0 — 46,0 |
| 12 лет — 15 лет | 30,0 — 45,0 |
| 15 лет — 120 лет | 19,0 — 37,0 |
Интерпретация результатов
Повышение значений:
- Большинство заболеваний, вызванных вирусными инфекциями.
- Действие некоторых лекарственных препаратов: леводопы, фенитоина, вальпроевой кислоты, наркотических анальгетиков и др.
- Заболевания системы крови: хронический лимфолейкоз; лимфомы в период лейкемизации, болезнь тяжелых цепей.
- Отравление тетрахлорэтаном, свинцом, мышьяком, дисульфидом углерода.
- Острый период воспалительных заболеваний.
- Прием лекарственных препаратов (глюкокортикоидов, цитостатиков).
- Апластическая анемия.
- Иммунодефицитные состояния.
- Почечная недостаточность.
- Потеря лимфы через кишечник.
- Системная красная волчанка.
- Воздействие рентгеновского облучения.
- Терминальная стадия онкологических заболеваний.
- Милиарный туберкулез.
- Лимфогранулематоз.
Крупные клетки с несегментированным бобовидным ядром. Продолжительность жизни в кровотоке составляет около суток, после чего моноцит переходит в ткани, где дифференцирует в тканеспецифичный макрофаг.Время жизни этих клеток может достигать нескольких лет.
Выполняют функции, сходные функции гранулоцитов, а именно: распознавание, захват и уничтожение бактерий и грибов, однако их фагоцитарная активность выше. В очаге воспаления макрофаги фагоцитируют микроорганизмы, погибшие лейкоциты, поврежденные клетки воспаленной ткани, очищенная очаг воспаления и подготавливая его для регенерации. Макрофаги более эффективны, чем нейтрофилы, в фагоцитозе, микобактерий, грибков и макромолекул.
Моноцитозом (значимым повышением количества моноцитов) считается повышение абсолютного количества моноцитов более 1000 в микролитре.
Единицы измерения: в Независимой лаборатории ИНВИТРО:%.
Референсные значения:
| Возраст | Процентное содержание моноцитов,% |
| от 1 до 15 дней | 5–15 |
| от 15 дней до 12 месяцев | 4–10 |
| 12 месяцев — 2 года | 3–10 |
| 2 года — 15 лет | 3–9 |
| 15 лет и старше | 3–11 |
Интерпретация результатов
Повышение значений:
- Острые и хронические инфекционные и воспалительные процессы.
- Состояние после перенесенного инфекционного заболевания. Аутоиммунные заболевания.
- Злокачественные новообразования.
- Онкогематологические заболевания.
- Отравление тетрахлорэтаном, фосфором.
- Прием лекарственных препаратов (глюкокортикоидов, цитостатиков).
- Пиогенные инфекции.
- Апластическая анемия.
- Шоковые состояния.
- Онкогематологические заболевания.
Клетки с сегментированным ядром и заполненной однородными гранулами цитоплазмой. Подобно нейтрофилам, способные к хемотаксису и фагоцитозу, однако основная их роль — борьба с паразитами и контроль аллергических факторов. В циркулирующей крови находятся не более часа, после чего поступают в ткани. Эозинофилией (значимым повышением количества эозинофилов) считается повышение их абсолютного количества более 700 в микролитре. В том случае, когда абсолютное количество эозинофилов стабильно сохраняется не менее 1500 в микролитре на протяжении длительного времени, возможно возникновение поражения внутренних органов, вызванного эозинофильной инфильтрацией и воздействием токсических продуктов кислорода и гранулярных белков.Эозинопенией (значимым снижением количества эозинофилов) считается снижение их абсолютного числа менее 200 в микролитре.
Единицы измерения: в Независимой лаборатории ИНВИТРО:%.
Референсные значения:
| Возраст | Процентное содержание эозинофилов,% |
| 1 день — 15 дней | 1,0 — 6,0 |
| 15 дней — 12 месяцев | 1,0 — 5,0 |
| 12 месяцев — 2 года | 1,0 — 7,0 |
| 2 года — 5 лет | 1,0 — 6,0 |
| 5 лет — 120 лет | 1,0 — 5,0 |
Интерпретация результатов
Повышение значений:
- Аллергические состояния, в том числе лекарственные аллергии.
- Заболевания кожи (дерматит, экзема).
- Паразитарные инвазии.
- Острый период инфекционных заболеваний (скарлатины, ветряной оспы, туберкулеза, инфекционного мононуклеоза, гонореи).
- Системные воспалительные заболевания.
- Заболевания легких: саркоидоз, легочная эозинофильная пневмония, гистиоцитоз из клеток Лангерганса, эозинофильный плеврит, легочный эозинофильный инфильтрат (болезнь Лефлера).
- Онкогематологические заболевания.
- Злокачественные новообразования.
- Начальная стадия воспалительного процесса.
- Тяжелые гнойные инфекции.
- Шоковые состояния.
- Отравления тяжелыми металлами.
Клетки с сегментированным ядром и крупными, разнородными по размеру и форме гранулами в цитоплазме. Время нахождения в кровотоке составляет 2,5 дня. Основная функция их — участие в аллергических реакциях различного типа.Базофилией (значимым повышением количества базофилов) считается повышение их абсолютного количества более 150 в микролитре.
Единицы измерения: в Независимой лаборатории ИНВИТРО:%.
Референсные значения: 0 — 120 лет: <1,0 (процентное содержание базофилов).
Интерпретация результата
Повышение значений:
- Аллергические состояния, в том числе лекарственные аллергии.
- Язвенный колит.
- Хронические гемолитические анемии.
- Некоторые инфекционные заболевания (грипп, ветряная оспа, туберкулез).
- Злокачественные новообразования.
- Онкогематологические заболевания.
Дополнительные субпопуляции клеток
Атипичные мононуклеары — клетки лимфоидной природы с разнообразной морфологией. Возникают в ответ на вирусные инфекции, чаще всего заражают вирусом Эпштейна-Барр (инфекционный мононуклеоз), но могут обнаруживаться и при других вирусных заболеваниях.
Плазматические клетки — антителообразующие клетки лимфоидной природы. Обычно находятся в лимфатических узлах и селезенке. Могут появляться в кровотоке при инфекционных заболеваниях. Присутствие 1-2% плазматических клеток можно считать нормой. Присутствие большого количества плазматических клеток (более 10%) характерно для ряда онкогематологических заболеваний.
Палочкоядерные нейтрофилы — «молодые» нейтрофилы с несегментированным ядром. В норме их количество составляет от 1 до 6% от общего количества лейкоцитов.Повышение содержания палочкоядерных нейтрофилов обычно свидетельствует о наличии инфекционного или воспалительного процесса.
Юные миелоциты — незрелые клетки гранулоцитарного ряда, предшественники палочкоядерных нейтрофилов. Их присутствие также может свидетельствовать о наличии инфекционного или воспалительного процесса. Могут появляться при приеме некоторых лекарственных препаратов. Как вариант нормы возможно их присутствие в небольшом количестве у беременных женщин и новорожденных детей.
Присутствие значительного количества незрелых гранулоцитов в сочетании с бластами характерно для ряда онкогематологических заболеваний. Бласты — незрелые недифференцированные клетки. В норме в кровотоке не встречаются. Их присутствие характерно для онкогематологических заболеваний.
Лейкоцитоз при беременности, лечение и симптомы
Если у вас совпадает больше 80% перечисленных симптомов, то рекомендуем вам обратиться к врачу за консультацией.
Лейкоцитоз при беременности (классификация по МКБ-10 R70-R79) — состояние организма, при котором в кровяном русле повышается уровень белых клеток крови (лейкоцитов). Каждая беременная женщина регулярно сдаёт анализ крови, который показывает не только уровень гемоглобина, но и количество лейкоцитов — важно, чтобы лейкоциты в крови не были повышены или понижены, что является свидетельством патологии. В норме уровня белых клеток крови может колебаться — от 4 до 8,8 × 109 / л, но у беременных считается нормальным повышение лейкоцитов в крови до 11 × 109 / л.
Незначительное повышение скорости оседания эритроцитов крови, свидетельствующее об активации иммунитета. В тех случаях, когда лейкоциты в крови повышаются, развивается лейкоцитоз, который свидетельствует о наличии у беременных воспалительных процессов или других патологий, требующих немедленного лечения.
Причины лейкоцитоза
Лейкоцитоз может развиваться у беременных по разным причинам.Самые распространенные причины такого нарушения, это: ОРВИ, ОРЗ и другие заболевания, вызывающие заболевание во время беременности; тяжёлые патологии, такие как вирусная пневмония или ветряная оспа, опасная не для самой женщины, а для ребёнка в её утробе; аллергическая реакция на некоторые назначаемые врачом медицинские препараты; получение травм, ожогов и других травматических повреждений (царапин с нагноением, абсцессов, переломов и прочих).
Также причины того, что у женщины развился лейкоцитоз, связаны с тяжёлыми процессами в её организме, например, с распадом злокачественных опухолей или внутренних кровотечений.В некоторых случаях у беременных развивается на фоне повышенной психоэмоциональной нагрузки. Поэтому врачи рекомендуют женщинам в положении стрессов, а также физических и психических переутомлений. Классификация лейкоцитозов Иногда лейкоцитоз бывает физиологическим, не патологическим, то есть реакция на действие некоторых окружающих факторов.
Повышены лейкоциты при беременности: возможные причины
Лейкоцитоз может иметь физиологическую природу, такое повышение лейкоцитов не является признаком наличия какого-либо заболевания.
Повышение количества лейкоцитов в происходит:
- При стрессе, переживаниях
- Во время второго триместра беременности
- После приема горячей ванны
- Спустя три часа после приема пищи
Чтобы избежать ложных результатов анализа крови, необходимо строго натощак в первой половине дня, а также во время забора крови пациентка максимально расслаблена и спокойна.
Более опасными причинамикоцитоза могут служить:
- Бактериальная или вирусная инфекция. Это может быть инфекционное заболевание дыхательных путей — пневмония или бронхит. Обычно такие заболевания сопровождаются повышением температуры и кашлем. Возможна и острая бактериальная инфекция — пиелонефрит и другие.
- Воспалительные процессы, происходящие в организме. Например, при обострении хронического гастрита или артрита может повышаться уровень лейкоцитов в крови.
- Разнообразные травмы кожи, ожоги и так далее.
- Аллергические реакции или астма.
- Развитие различных урогенитальных инфекций.
- Большие кровопотери.
- Злокачественные опухоли, метастазы.
Все вышеперечисленные виды негативного влияния не только на организм будущей матери, но и на развитие плода. Поэтому они требуют немедленного начала лечения. Наибольшая опасность лейкоцитоза оказывается в его стремительном развитии.Развиваясь за несколько часов, лейкоцитоз может вызвать внутренние кровотечения. Именно по этой причине лечения этого заболевания должно происходить под строгим наблюдением врача, который в первую очередь должен установить и устранить его причины.
В практике чаще всего случаев лейкоцитоза у беременных вызваны медленно протекающими в организме воспалительными процессами, аллергическими реакциями, бесконтрольным приемом лекарственных препаратов, почечными коликами, а также обострениями хронических заболеваний.
Еще одной из причин повышения уровня лейкоцитов в крови является скопление лейкоцитов крови в подслизистой оболочке матки. Чтобы предотвратить попадание какой-либо инфекции в плоду, предотвращение заражения какой-либо инфекцией в матке, а также для стимулирования сократительной функции матки, специального во время родов.
Например, лейкоциты в крови беременных повышаться, если они слишком горячую или слишком холодную ванну.Также количество лейкоцитов в крови может возрасти из-за ошибок в питании беременной женщины, что требует от врача коррекции её диеты. Занятие тяжёлой физической работой тоже может спровоцировать лейкоцитоз, однако важно помнить, что такой лейкоцитоз показывает анализы только в том случае, если они находятся в ближайшее время после воздействия на женщину неблагоприятного фактора.
Если же лейкоцитоз связан в крови у беременной по истечении продолжительного времени после такого воздействия, речь уже идёт о патологическом состоянии.Самые серьёзные причины, способные вызвать повышение уровня лейкоцитов в крови беременных, это: абсцессы; перитонит; сепсис. Эти состояния опасны не только для ребёнка, но и для жизни матери, поэтому своевременно не проведена диагностика и не назначено лечение, ребёнок в утробе беременной женщины и она сама погибнуть.
Несколько слов следует сказать о причинах снижения лейкоцитов в крови беременных.
К ним относ:
Эти заболевания опасны сами по себе, но также их опасность заключается в том, что они могут спровоцировать развитие уродств у плода, а также вызвать преждевременные роды.Поэтому на данные вирусы и инфекции беременных регулярно обследуют — многие из них входят в комплекс обследований на TORCH-инфекции. Низкий уровень лейкоцитов в крови может отмечаться при воздействии на женщину радиационного излучения, также при воздействии на ее организм некоторых вредных химических веществ, при истощении.
Диагностика и лечение лейкоцитоза
Установить количество лейкоцитов в крови у беременных можно с помощью обычного анализа крови. Лечение начинается с причины развития лейкоцитоза.Для этого иногда приходится проводить полное обследование женщины. Когда же диагноз установлен, врач-гинеколог, ведущий беременность женщины, принимает решение относительно дальнейшего лечения.
Препараты, которые используются, должны быть безвредными как для матери, так и для ребёнка. Но, к сожалению, не во всех случаях есть возможность устранить лейкоцитоз и патологию, вызвавшую его, не навредив здоровью беременной и малыша в ее утробе. Поэтому иногда, при тяжёлых патологических состояниях, врач может принять решение о прерывании беременности и спасении жизни самой женщины.
Статьи и научные исследования в России
В статье Подробнее
В статье Подробнее
Статьи и научные исследования зарубежом
В статье Подробнее
В статье Подробнее
Презентации
Отзывы
Дарья 10.05.2017
Девочки, кому нибудь ставили при беременности? Какие последствия? Нашли ли причину и намного ли были повышены лейкоциты?
Илюшина Мама 19.05.2017
Мне не ставили, но повышены были в 3 раза. Потом прочитала, что такое может быть при беременности
Елена Лиукконен 22.06.2017
У меня с начала беременности и до 22 недели лейк.были в пределах 14. А резко увеличились соэ. Гинеколог назначила анализ на с-реактивный белок и он в норме. Тогда сказали, что повышение лейк.и соэ на беременность, воспаления нет.
Шапка, 25.06.2017
Привет всем! Пишу прям с больничной палаты! Меня 17 числа положили на сохранение (срок 28 недель) с угрозой преждевременных родов! Покапали магнезию 5 дней и уколы 7 дней и вот остальное время я просто лежу без процедур! Выписывать не хотят, т.к. говорят, что у меня повышенное количество лейкоцитов (лейкоцитоз) .Его никак не лечат и на все вопросы орут, что меня здесь никто не держит и я могу уходить, но там каких-то денег не заплатят и больничный не дадут! про этот лейкоцитоз, потому что в интернете ничего толком не нашла!
Видео










 Очень тяжелая анемия определяется уровнем гемоглобина меньше 40 г / л и нуждается в неотложной медицинской помощи в связи с риском застойной сердечной недостаточности.
Очень тяжелая анемия определяется уровнем гемоглобина меньше 40 г / л и нуждается в неотложной медицинской помощи в связи с риском застойной сердечной недостаточности.
