Структура и функции миоглобина — Студопедия
Миоглобин относят к классу гемсодержащих белков, т.е. он содержит простетическую группу — гем, довольно прочно связанную с белковой частью. Миоглобин относят к глобулярным белкам; он имеет только одну полипептидную цепь.
1. Клеточная локализация и функция
Миоглобин содержится в красных мышцах и участвует в запасании кислорода. В условиях интенсивной мышечной работы, когда парциальное давление кислорода в ткани падает, О2 освобождается из комплекса с миоглобином и используется в митохондриях клеток для получения необходимой для работы мышц энергии.
2. Строение миоглобина
Миоглобин содержит небелковую часть (гем) и белковую часть (апомиоглобин).
· Гем — молекула, имеющая структуру циклического тетрапиррола, где 4 пиррольных кольца соединены метиленовыми мостиками и содержат 4 метальные, 2 винильные и 2 пропионатные боковые цепи. Эта органическая часть тема называется протопорфирином. Возможны 15 вариантов расположения боковых цепей, но в составе гемопротеинов присутствует только один изомер, называемый протопорфирин IX. В теме 4 атома азота пиррольных колец протопорфирина IX связаны четырьмя координационными связями с Fe
· Апомиоглобин— белковая часть миоглобина; первичная структура представлена последовательностью из 153 аминокислот, которые во вторичной структуре уложены в 8 ?-спиралей. ?-Спирали обозначают латинскими буквами от А до Н, начиная с N-конца полипептидной цепи, и содержат от 7 до 23 аминокислот. Для обозначения индивидуальных аминокислот в первичной структуре апомиоглобина используют либо написание их порядкового номера от N-конца (например, Гис64, Фен138), либо букву ?-спирали и порядковый номер данной аминокислоты в этой спирали, начиная с N-конца (например, Гис F8).
· Третичная структура имеет вид компактной глобулы (внутри практически нет свободного места), образованной за счёт петель и поворотов в области неспирализованных участков белка. Внутренняя часть молекулы почти целиком состоит из гидрофобных радикалов, за исключением двух остатков Гис, располагающихся в активном центре.
3.Связывание гема с апомиоглобтом
Гем — специфический лиганд апомиоглобина, присоединяющийся к белковой части в углублении

Рис. 1-29. Строение тема, входящего в состав миоглобина и гемоглобина.
между двумя ?-спиралями F и Е. Центр связывания с гемом образован преимущественно гидрофобными остатками аминокислот, окружающими гидрофобные пиррольные кольца тема. Две боковые группы пропионовых кислот, ионизированные при физиологических значениях рН, выступают на поверхности молекулы.
В активный центр апомиоглобина кроме гидрофобных аминокислот входят также 2 остатка Гис (Гис
Гис Е7 хотя и не связан с гемом, но необходим для правильной ориентации и присоединения другого лиганда — О2 к миоглобину.
Аминокислотное окружение тема создаёт условия для довольно прочного, но обратимого связывания О2 с Fe2+ миоглобина. Гидрофобные остатки аминокислот, окружающие гем, препятствуют проникновению в центр связывания миоглобина воды и окислению Fe 2+ в Fe3+. Трёхвалентное железо в составе тема не способно присоединять О2.
Миоглобин — Википедия с видео // WIKI 2
Миоглоби́н — кислородосвязывающий белок скелетных мышц и мышцы сердца. Функция миоглобина заключается в создании в мышцах кислородного резерва, который расходуется по мере необходимости, восполняя временную нехватку кислорода.
Миоглобин скелетных мышц и миоглобин миокарда (сердечной мышцы) слегка различны по аминокислотной последовательности. В практической медицине этот факт используется для определения диагноза инфаркта миокарда по появлению специфического «сердечного» изотипа миоглобина (равно как и «сердечных» изотипов некоторых мышечных ферментов) в крови.
В нормальных условиях, в отсутствие повреждения или воспаления мышечной ткани, миоглобин в кровь не попадает.
Подобно гемоглобину, миоглобин высокотоксичен при его нахождении в свободном состоянии в плазме крови: крупные молекулы миоглобина могут закупоривать канальцы почек и приводить к их некрозу; конкурируя с гемоглобином эритроцитов за связывание с кислородом в лёгких и не выполняя функцию передачи кислорода тканям, свободный миоглобин ухудшает кислородное снабжение тканей и приводит к развитию тканевой гипоксии.
Самоотравление организма свободным миоглобином и как следствие острая почечная недостаточность и тканевая гипоксия — одна из главных причин смерти при синдроме длительного сдавления (краш-синдром), встречающемся при тяжёлых травмах со сдавлением или размозжением значительных количеств мышечной ткани.
Миоглобин кашалота — первый белок, у которого была исследована третичная структура.
Энциклопедичный YouTube
1/3
Просмотров:72 962
1 859
20 870
✪ Вреден ли каннибализм? [AsapSCIENCE]
✪ КАКОЙ вкус у МЯСА ДИНОЗАВРА? #ИФ
-
✪ Myoglobin — Structure and Function
Примечания
 Эта страница в последний раз была отредактирована 12 февраля 2020 в 09:54.
Эта страница в последний раз была отредактирована 12 февраля 2020 в 09:54.Миоглобин скелетных мышц
Дано определение миоглобина и описаны его структура и функции. Приведены данные о концентрации миоглобина в скелетных мышцах человека и животных, а также в плазме крови человека. Приведен сравнительный анализ гемоглобина и миоглобина.
Миоглобин скелетных мышц
Определение
Миоглобин (Mb) – белок, который связывает кислород в скелетных мышцах и миокарде (сердечной мышце) почти всех млекопитающих, в том числе и человека. Молекулярная масса миоглобина – 17,2 кДа (1Да=1,66 10-24 г.).
Структура миоглобина
Первичная структура миоглобина представлена одной полипептидной цепью, состоящей из 146-154 аминокислотных остатков. Вторичная структура — α-спираль. Третичная структура миоглобина представлена свернутой в шар α-спиралью (глобулой) и небелковой частью – гемом (рис.1). Присутствие гема придает миоглобину красный цвет. В геме имеется железо, которое связывает кислород. В 1957 году Джон Кендрю посредством рентгеновской кристаллографии впервые определил пространственное расположение полипептидной цепи в молекуле белка миоглобина, а в 1959 году установил его детальное строение, подтвердив наличие в нём α-спиралей, которое еще в 1951 году предсказал Лайнус Полинг.
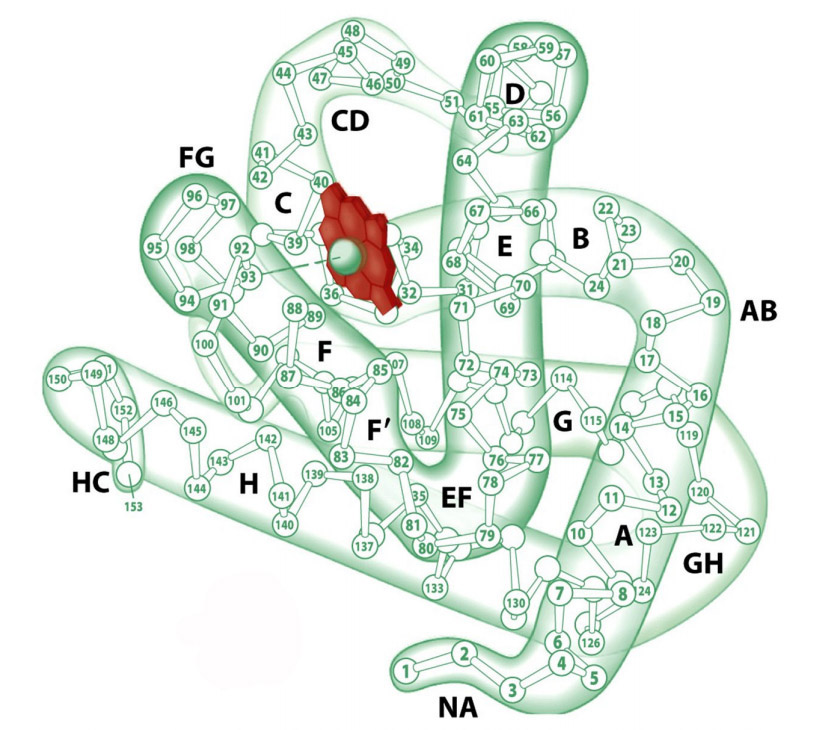
Рис.1. Структура миоглобина. Красным цветом выделен гем (illustration I. Geis)
Функции миоглобина
В мышечных волокнах миоглобин выполняет следующие функции:
- Депонирует кислород. Мышцы, поглощая кислород из крови, накапливают его в мышечных волокнах в вида оксимиоглобина. Таким образом создается резерв миоглобина, который используется для усиления окислительных процессов при тяжелой физической работе. Депонирование происходит в период покоя, расход в момент сокращения мышц. Однако емкость этого депо невелика. Оно может обеспечить снабжение кислородом скелетные мышцы в течение 8 с, а миокард в течение 15-20 с (Стародуб Р.Ф., Коробов В.Н., Назаренко В.И., 1992).
- Переносит кислород от плазматической мембраны к митохондриям. Тем самым обеспечивая функционирование тканевого дыхания.
- Связывает и освобождает оксид азота (NO) – одну из главных сигнальных молекул, играющих критическую роль в контроле поглощения кислорода, вазодилятации (расширения) сосудов и защиты мышечных волокон от активных форм кислорода (Кулева Н.В., Красовская И.Е., 2016).
Более подробно строение и функции мышц описаны в моих книгах «Гипертрофия скелетных мышц человека» и «Биомеханика мышц»
Концентрация миоглобина в мышечных волокнах
В мышечных волокнах скелетных мышц человека концентрация миоглобина составляет 0,4-0,5 мM (0,25 мг на 1 г ткани). Миоглобин присутствует во всех типах мышечных волокон, однако в разных концентрациях. В мышечных волокнах типа I его концентрация в 1,5 раза выше, чем в мышечных волокнах типа IIB. Именно поэтому мышечные волокна типа I имеют более красную окраску по сравнению с мышечными волокнами типа II. У морских млекопитающих концентрация миоглобина в мышечных волокнах может достигать 3,8 мM. Установлена значительная корреляция между концентрацией миоглобина в мышцах морских животных и глубиной ныряния. Установлено также, что концентрация миоглобина в мышечных волокнах коррелирует с объемной плотностью митохондрий и плотностью кровеносных капилляров.
Концентрация миоглобина в крови
В обычных условиях концентрация миоглобина в крови настолько низка (100 нг/мл), что он не определяется лабораторными методами. Однако при сильных повреждениях мышечных волокон скелетных мышц (краш-синдроме, синдроме позиционной ишемии) миоглобин может попасть в кровь. Так как молекулы миоглобина достаточно крупные, они могут закупоривать канальцы почек и приводить к их некрозу. В результате возникает острая почечная недостаточность и тканевая гипоксия. Это может привести к смерти человека.
При тяжелых силовых и аэробных тренировках (например при марафонском беге), также происходит частичное повреждение мышечных волокон скелетных мышц и миоглобин поступает в кровь.
При остром инфаркте миокарда концентрация миоглобина в крови повышается через 2-4 часа. Поэтому его относят к неспецифическим маркерам этого заболевания (Тереньев А.А., 2016).
Гемоглобин и миоглобин
Миоглобин похож на гемоглобин (Hb) – кислородсвязывающий белок в эритроцитах крови. Гемоглобин осуществляет транспорт кислорода от легких к тканям (в том числе и мышцам), а миоглобин – депонирование и транспорт кислорода внутри мышечных волокон. Структура гемоглобина более сложная, чем миоглобина. Молекула гемоглобина состоит из четырех полипептидных цепочек и гема, а молекула миоглобина – из одной полипепдиной цепочки и гема. Молекулярная масса гемоглобина человека 66,8 кДа. Миоглобин человека обладает большим сродством к кислороду, чем гемоглобин, и способен связывать до 14% от общего количества кислорода в организме.
Литература
- Кулева Н.В., Красовская И.Е. Новая роль миоглобина в функционировании сердечной и скелетной мышц // Молекулярная биофизика, 2016.– Т. 61., Вып. 5.– С. 861-864.
- Стародуб Р.Ф., Коробов В.Н., Назаренко В.И. Миоглобин: структура, свойства, синтез и биологическая роль.– Киев: Наукова думка, 1992.– 281 с.
- Терентьев А.В. Биохимия мышечной ткани: Учебное пособие.– М.: ФГБОУ ВО РНИМУ им. Н.И.Пирогова Минздрава России, 2019.– 2019 с.
С уважением, А.В. Самсонова
Роль миоглобина в сердечной деятельности — Циклопедия
Рис.1. Пространственная структура миоглобина (слева) и его активного центра (справа)
Роль миоглобина в сердечной деятельности — совокупность сведений об участии гемоглобина и его влиянии на деятельность сердца.
Миоглобин — специфический белок, осуществляющий транспорт кислорода в скелетных мышцах и миокарде и по своему строению и функциям схожий с гемоглобином. С химической точки зрения данный белок представляет собой гетеродимер, состоящий из пептидной цепи и гем группы. Важным компонентом гема является атом железа , который способен связываться с кислородом .( Рис. 1) Миоглобин кашалота был первым белком, для которого Дж. Кендрю со своей командой в 1957-1960 определили пространственную структуру молекулы методом рентгеноструктурного анализа.
Миоглобин является необходимым белком для многих жизненно важных процессов нашего организма он способен связывать до 14% общего количества кислорода, данное свойство играет важную роль в снабжении кислородом работающих мышц сердца и всего организма в целом . Если при сокращении мышцы кровеносные капилляры ее сжимаются и кровоток в некоторых участках мышцы прекращается , в течение некоторого времени сохраняется снабжение мышечных волокон кислородом.
Широко распространено представление о том , что миоглобин экспрессируется только в поперечнополосатых мышцах и сердце, однако теперь уже известно, что он есть и в других тканях , в том числе в гладких мышцах сосудов , где его функцией является нитрит — редуктазная активность, что также оказывает жизненно важное влияние на деятельность сердца.
Миоглобин находится в больших количествах в мышцах, ритмически сокращающихся (не более 1 раза в секунду) и способных производить значительную и длительную работу, причем в красных мышцах скелетной мускулатуры его больше, чем в белых. Было также показано, что в быстрых волокнах миоглобина меньше, чем в медленных. В сердце человека миоглобина меньше, чем в скелетных мышцах, при этом миокард содержит только около 1,5% всего миоглобина организма. Кроме того, у человека не обнаружено зависимости в содержании миоглобина от пола, но у лиц моложе 40 лет его больше, чем у людей старше 56 лет. У человека выявлена зависимость содержания миоглобина в плазме крови от времени суток. Так, наибольшее его содержание отмечено в период времени от 8 до 9 часов утра, а наименьшее – в ранние ночные часы . В миоцитах миоглобин располагается в основном диффузно, в миокарде его больше на уровне А-дисков, а зерна пигмента больше по размерам в сердечной мышце, чем в скелетной. При этом в приводящей системе сердца миоглобина меньше, чем в рабочей мускулатуре миокарда .
Физиологическая роль миоглобина в сердце до конца не изучена. Однако,можно с уверенностью утверждать , что миоглобин является хранилищем O2, который необходим во время систолы в бескислородных областях миокарда, расположенных в субэндокардиальных слоях. Миоглобин участвует в кардиопротекции. Оказывает значительное влияние на сердечную деятельность и действует не только обособленно на какие-то определенные части и органы нашего организма( сердце, скелетная мускулатура) но и влияет на функционирование всего организма.
1: Levantino M, Lemke HT, SchirГІ G, Glownia M, Cupane A, Cammarata M. Observing heme doming in myoglobin with femtosecond X-ray absorption spectroscopy. Struct Dyn. 2015 May 29;2(4):041713. doi: 10.1063/1.4921907. eCollection 2015 Jul. PubMed PMID: 26798812; PubMed Central PMCID: PMC4711634.
2: Liapis H, Boils C, Hennigar R, Silva F. Myoglobin Casts in Renal Biopsies: Immunohistochemistry and Morphologic Spectrum. Hum Pathol. 2016 Mar 30. pii: S0046-8177(16)30010-7. doi: 10.1016/j.humpath.2016.02.026. [Epub ahead of print PubMed PMID: 27038680.]
3. Hendgen-Cotta UB, Kelm M, Rassaf T. Myoglobin functions in the heart. Free Radic Biol Med. 2014 Aug;73:252-9. doi: 10.1016/j.freeradbiomed.2014.05.005. Epub 2014 May 22. Review. PubMed PMID: 24859377.
4: Xu M, Lin J, Lei C, Liu J, Yuan R, Tan G, Liu M. High Level of Serum Myoglobin in Human Intracerebral Hemorrhage: Implications for Large Hematoma Volume and Growth. J Stroke Cerebrovasc Dis. 2016 Apr 4. pii: S1052-3057(16)00091-4. doi: 10.1016/j.jstrokecerebrovasdis.2016.02.005. [Epub ahead of print PubMed PMID: 27056440.]
 |
 |
…
Состоит из одной полипептидной
цепи, содержащей 153 аминокислотных остатка (мол. м. 17800), к-рая уложена в
плотную глобулу размером 4,5 х 2,5 нм. В спец. полости миоглобина («кармане»)
помещается гем, к-рый связан с остальной частью молекулы (глобином), как в гемоглобине.
Ок. 75% полипептидной цепи находится в конформации a-спирали (все a-спирали
правозакрученные). Между областями спи-рализации находятся 5 неспирализованных
участков; такие же участки находятся на концах цепи. Внутр. область молекулы
состоит гл. обр. из неполярных остатков лейцина, валина, метионина, фенилаланина
и не содержит боковых полярных цепей глутаминовой и аспарагиновой к-т, глута-мина,
аспарагина, лизина и аргинина. На наружной стороне молекулы расположены как
полярные, так и неполярные аминокислотные остатки. Атом железа гема может
находиться в 4 состояниях: в физиологически активном пентакоординир. высокоспиновом
ферросостоянии (дезоксимиоглобин, Fe2 + , спиновое число
2), в гексакоординир. высокоспиновом феррисостоя-нии (метмиоглобин, Fe3
+ , 6-й лиганд Н2О, спиновое число 5/2)
и в низкоспиновых ферро- и феррисостояниях (соотв. Fe2+ и
Fe3+ , спиновое число О и 1/2). Низкоспиновые
формы образуются из высокоспиновых при взаимод. атома железа гема с нек-рыми
лигандами (у дезоксимиоглобина с О2, СО, NO и др.; у метмиоглобина
с CN—, N—3 и ими-дазолом). Для феррисостояния
возможна смесь высокоспиновой и низкоспиновой форм (лиганды ОН—,
NO—2, NCS—). Связывание лигандов сопровождается
конформац. изменениями белка, и, наоборот, конформац. изменения вблизи гема
изменяют его электронное состояние и реакц. способность (т.наз. электронно-конформац.
взаимод.). Ф-ция миоглобина запасать О2 в мышцах при его избытке и освобождать
при недостатке основана на способности иона Fe2+ обратимо связывать
молекулу О2 с образованием оксимио-глобина. Высвобождение из оксимиоглобина
молекулы О2, необходимого работающей мышце, происходит в момент сокращения
последней, когда в результате сжатия капилляров парциальное давление О2
резко падает. Белок выполняет роль водорастворимого носителя гема, предохраняет
Fe2+ от окисления при его взаимод. с О2 и регулирует величину
сродства к О2. При одном и том же геме и способе его связывания
с белком константа равновесия р-ции оксимио-глобиндезоксимиоглобин
+ О2 для миоглобина из разных организмов изменяется в пределах от
0,2.106 до 2,2.106 М-1 (давление
О2, соответствующее полунасыщению, от 2,7 до 0,5 мм рт. ст.). Метмиоглобин
обладает также слабыми пероксидазной и каталазной активностями. В больших кол-вах миоглобин содержится
в мышцах морских млекопитающих-дельфинов и тюленей (соотв. 3,5 и 7,7% от массы
тела). Миоглобин кашалота был первым
белком, для к-рого Дж. Кендрю с сотрудниками в 1957-60 определили пространств.
структуру молекулы методом рентгеноструктурного анализа. Страница «МИОГЛОБИН» подготовлена по материалам химической энциклопедии. Еще по теме: |

|
миоглобин — Викисловарь
 | В Википедии есть страница «миоглобин». |
Содержание
- 1 Русский
- 1.1 Морфологические и синтаксические свойства
- 1.2 Произношение
- 1.3 Семантические свойства
- 1.3.1 Значение
- 1.3.2 Синонимы
- 1.3.3 Антонимы
- 1.3.4 Гиперонимы
- 1.3.5 Гипонимы
- 1.4 Родственные слова
- 1.5 Этимология
- 1.6 Фразеологизмы и устойчивые сочетания
- 1.7 Перевод
- 1.8 Библиография
- 2 Болгарский
- 2.1 Морфологические и синтаксические свойства
- 2.2 Произношение
- 2.3 Семантические свойства
- 2.3.1 Значение
- 2.3.2 Синонимы
- 2.3.3 Антонимы
- 2.3.4 Гиперонимы
- 2.3.5 Гипонимы
- 2.4 Родственные слова
- 2.5 Этимология
- 2.6 Фразеологизмы и устойчивые сочетания
- 2.7 Библиография
- 3 Казахский
- 3.1 Морфологические и синтаксические свойства
- 3.2 Произношение
- 3.3 Семантические свойства
- 3.3.1 Значение
- 3.3.2 Синонимы
- 3.3.3 Антонимы
- 3.3.4 Гиперонимы
- 3.3.5 Гипонимы
- 3.4 Родственные слова
- 3.5 Этимология
- 3.6 Фразеологизмы и устойчивые сочетания
- 3.7 Библиография
- 4 Сербский
- 4.1 Морфологические и синтаксические свойства
- 4.2 Произношение
- 4.3 Семантические свойства
- 4.3.1 Значение
- 4.3.2 Синонимы
- 4.3.3 Антонимы
- 4.3.4 Гиперонимы
- 4.3.5 Гипонимы
- 4.4 Родственные слова
- 4.5 Этимология
- 4.6 Фразеологизмы и устойчивые сочетания
- 4.7 Библиография
| В Викиданных есть лексема миоглобин (L128346). |
Морфологические и синтаксические свойства[править]
| падеж | ед. ч. | мн. ч. |
|---|---|---|
| Им. | миоглоби́н | миоглоби́ны |
| Р. | миоглоби́на | миоглоби́нов |
| Д. | миоглоби́ну | миоглоби́нам |
| В. | миоглоби́н | миоглоби́ны |
| Тв. | миоглоби́ном | миоглоби́нами |
| Пр. | миоглоби́не | миоглоби́нах |
миоглоби́н
Существительное, неодушевлённое, мужской род, 2-е склонение (тип склонения 1a по классификации А. А. Зализняка).
Корень: -мио-; корень: -глобин- [Тихонов, 1996].
Произношение[править]
- МФА: [mʲɪəɡɫɐˈbʲin]
Семантические свойства[править]
Значение[править]
- биохим. кислородосвязывающий белок скелетных мышц и мышцы сердца ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы[править]
Антонимы[править]
- —
Гиперонимы[править]
- белок
Гипонимы[править]
Родственные слова[править]
| Ближайшее родство | |
Этимология[править]
Происходит от ??
Фразеологизмы и устойчивые сочетания[править]
Перевод[править]
| Список переводов | |
| |
Библиография[править]
 | Для улучшения этой статьи желательно:
|
Морфологические и синтаксические свойства[править]
миоглобин
Существительное.
Корень: —.
Произношение[править]
Семантические свойства[править]
Значение[править]
- биохим. миоглобин ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы[править]
Антонимы[править]
Гиперонимы[править]
Гипонимы[править]
Родственные слова[править]
| Ближайшее родство | |
Этимология[править]
От ??
Фразеологизмы и устойчивые сочетания[править]
Библиография[править]
 | Для улучшения этой статьи желательно:
|
Морфологические и синтаксические свойства[править]
миоглобин
Существительное.
Корень: —.
Произношение[править]
Семантические свойства[править]
Значение[править]
- биохим. миоглобин ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы[править]
Антонимы[править]
Гиперонимы[править]
Гипонимы[править]
Родственные слова[править]
| Ближайшее родство | |
Этимология[править]
От ??
Фразеологизмы и устойчивые сочетания[править]
Библиография[править]
 | Для улучшения этой статьи желательно:
|
Морфологические и синтаксические свойства[править]
миоглобин
Существительное.
Корень: —.
Произношение[править]
Семантические свойства[править]
Значение[править]
- биохим. миоглобин ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы[править]
Антонимы[править]
Гиперонимы[править]
Гипонимы[править]
Родственные слова[править]
| Ближайшее родство | |
Этимология[править]
От ??
Фразеологизмы и устойчивые сочетания[править]
Библиография[править]
 | Для улучшения этой статьи желательно:
|
Гемоглобин и миоглобин
Гемоглобин и миоглобин лишь незначительно связаны между собой по первичной последовательности. Хотя большинство аминокислот в этих двух последовательностях различаются, аминокислотные изменения между двумя белками обычно консервативны. Что еще более поразительно, вторичные структуры миоглобина и субъединиц гемоглобина практически идентичны, как показано на рисунке. Оба белка в значительной степени альфа-спиральные, и спирали сходятся друг с другом сходным образом. Одна молекула O 2 связана с каждой молекулой белка координационной ковалентной связью с атомом железа (Fe (II)) в гемовой группе .Гем представляет собой плоскую квадратную молекулу, содержащую четыре группы пиррола , атомы азота которых образуют координационные ковалентные связи с четырьмя из шести доступных положений железа. Одно положение используется для образования координированной ковалентной связи с боковой цепью отдельной гистидиновой аминокислоты белка, называемой проксимальным гистидином . Шестая и последняя орбиталь используется для кислорода. В нем нет неоксигенированных форм гемоглобина и миоглобина.
Когда молекулярный кислород встречается с изолированной молекулой гема, он быстро превращает Fe (II) в Fe (III).Окисленный гем очень плохо связывает кислород. Очевидно, что если бы это случилось с группами Fe (II) гемоглобина и миоглобина, белки были бы менее полезны в качестве переносчиков кислорода. Окислению гемового железа препятствует присутствие дистальной боковой цепи гистидина , которая препятствует образованию линейной связи Fe – O – O O 2 . Связь между Fe и O 2 изогнута, что означает, что эта связь не так сильна, как могла бы быть. Более слабое связывание кислорода означает более легкое выделение кислорода .Это важный принцип для понимания не только химии гема, но и регуляции сродства гемоглобина к кислороду.
Различия между гемоглобином и миоглобином наиболее важны на уровне четвертичной структуры. Гемоглобин представляет собой тетрамер, состоящий из двух каждого из двух типов тесно связанных субъединиц, альфа и бета. Миоглобин — это мономер (поэтому у него вообще нет четвертичной структуры). Миоглобин связывает кислород прочнее, чем гемоглобин. Эта разница в энергии связи отражает движение кислорода из кровотока к клеткам, от гемоглобина к миоглобину.
Каждая молекула миоглобина способна связывать один кислород, потому что миоглобин содержит один гем на молекулу. Несмотря на то, что реакция миоглобина и кислорода происходит в растворе, удобно измерять концентрацию кислорода с точки зрения его парциального давления , количества газа в атмосфере, которое находится в равновесии с кислородом в растворе.
Кривая титрования миоглобина кислородом представляет собой гиперболу, как показано на рисунке в виде:

, где Y — доля оксигенированного миоглобина, p O 2 — парциальное давление O 2 , выраженное в торр (мм рт. Ст .; 760 торр = 1 атмосфера) и P 0 — парциальное давление O 2 , необходимое для связывания 50% молекул миоглобина.Вывод этого уравнения из константы равновесия для связывания здесь не воспроизводится, но его можно найти во многих стандартных учебниках химии и биохимии. В приведенном выше уравнении, если Y установлено на 0,5, P 50 = p O 2 .
Рисунок 2
В стандартных физиологических условиях связывание P 50 для O 2 с миоглобином составляет приблизительно 1 торр.Поскольку атмосфера состоит примерно на 21% кислорода, при давлении в 1 атмосферу p O 2 = 0,21 × 760 = 159 торр миоглобин будет почти полностью насыщенным:

Поскольку p O 2 в крови ниже атмосферного p O 2 , Y варьируется от 0,91 (венозная кровь) до 0,97 (артериальная кровь).
Поскольку гемоглобин имеет четыре субъединицы, его связывание с кислородом может отражать множественные равновесия: 
Константы равновесия для этих четырех событий связывания O 2 зависят друг от друга и от условий раствора.Влияние связывания одного кислорода на связывание другого кислорода называется гомотропным эффектом . В целом, это кооперативное равновесное связывание делает кривую связывания сигмоидальной , а не гиперболической, как показано на рисунке. P 50 гемоглобина в красных кровяных тельцах составляет около 26 торр в нормальных физиологических условиях. В альвеолах легких pO 2 составляет около 100 торр, а в тканях — около 20 торр. Таким образом, вы можете ожидать, что гемоглобин будет загружен примерно на 80% в легких и на чуть более 40% загружен кислородом в тканевых капиллярах.Фактически, гемоглобин может быть более насыщенным в легких и менее насыщенным в капиллярах.
Рисунок 3
Сотрудничество — сложная тема; одна модель — взаимное преобразование гемоглобина между двумя состояниями — T (напряженная) и R (расслабленная) конформации — молекулы. Состояние R имеет более высокое сродство к кислороду. В условиях, когда pO 2 высокое (например, в легких), состояние R является предпочтительным; в условиях, когда pO 2 низкое (как при тренировке мышц), Т-состояние является предпочтительным.
Количественно кривая связывания сложного белка, такого как гемоглобин, описывается приближением:

, где n — количество взаимодействующих субъединиц. Уравнение можно преобразовать в логарифмическую форму:

График этого уравнения дает график Хилла (названный в честь британского физиолога, который первым его описал), как показано на рисунке. Графики холма log [ Y / (1 — Y )] по сравнению с log (pO 2 ) линейны, по крайней мере, в части диапазона, с наклоном n (иногда называемым коэффициентом Хилла), который — минимальное количество взаимодействующих субъединиц.Для миоглобина, который имеет только одну субъединицу, наклон должен быть 1; для гемоглобина коэффициент Хилла равен 2,8, что указывает на минимум трех взаимодействующих субъединиц, хотя в молекуле гемоглобина четыре субъединицы.
Даже если никакие другие факторы не действуют, поскольку P 50 гемоглобина больше, чем P 50 для миоглобина, гемоглобин в крови уступает O 2 миоглобину в тканях. Это следует из обсуждаемого выше принципа, что большее значение P 50 означает более низкое сродство, а более слабое связывание означает большее высвобождение.
.
Минутку …
Включите файлы cookie и перезагрузите страницу.
Этот процесс автоматический. Ваш браузер в ближайшее время перенаправит вас на запрошенный контент.
Подождите до 5 секунд…
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [ ] + !! [] + !! []) + (! + [] — (!! [])) + (! + [] + (!! []) + !! [] + !! []) + (+ !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! []) + (! + [] + ( !! []) + !! [] + !! []) + (+ !! [])) / + ((+ !! [] + []) + (! + [] + (!! [] ) + !! [] + !! []) + (! + [] + (!! []) — []) + (+ !! []) + (! + [] + (!! []) — []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + ( ! + [] + (!! []) + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []))
+ ( (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] +! ! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + ( ! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + (! + [] — (!! [])) + (! + [] + (!! [ ]) + !! [])) / + ((! + [] + (!! []) + !! [] + !! [] + []) + (! + [] + (!! [] ) — []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! [ ]) — []) + (! + [] + (!! []) + !! []) + (! + [] + (!! []) + !! [] + !! [] +! ! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + ( ! + [] + (!! []) + !! []) + (! + [] + (!! []) — [] ))
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] +! ! [] + []) + (! + [] + (!! []) — []) + (! + [] — (!! [])) + (! + [] + (!! [] ) + !! [] + !! []) + (+ !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] +! ! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) — []) + (! + [] + (!! []) + !! [])) » / + ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) — []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] +! ! []) + (! + [] — (!! [])) + (! + [] + (!! []) + !! [] + !! []) + (! + [] + ( !! []) + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) — []))
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (+ !! [] ) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + (! + [] — (!! [])) + (! + [] + (!! []) + !! [ ] + !! []) + (! + [] + (!! []) — []) + (! + [] + (!! []) + !! [] + !! []) + ( ! + [] + (!! []) + !! [])) / + ((! + [] + (!! []) + !! [] + !! [] + !! [] +! ! [] + !! [] + []) + (! + [] + (!! []) — []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [ ] + !! [] + !! []) + (! + [] — (!! [])) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! [ ]) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [ ] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) — []))
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [ ] + (!! []) + !! [] + !! []) + (+ !! []) + (! + [] — (!! [])) + (! + [] + (! ! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) +! ! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (+ !! [])) / + ((! + [] + (!! []) + !! [] + !! [] + []) + (+ !! []) + (! + [] + (!! []) — []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] — (!! [])) + (! + [] — (!! [])) + (+ !! []) + (+ !! []) + (! + [] + (!! []) + !! []))
+ ((! + [] + (!! []) + !! [] + !! [] + !! []
.Миоглобин | белок | Britannica
Миоглобин , белок, обнаруженный в мышечных клетках животных. Он функционирует как блок хранения кислорода, обеспечивая кислородом работающие мышцы. Ныряющие млекопитающие, такие как тюлени и киты, могут оставаться под водой в течение длительного времени, потому что в их мышцах содержится больше миоглобина, чем у других животных.
Британская викторина
Человеческое тело
Какая часть человеческого тела состоит из крови?
Между миоглобином и гемоглобином, кислородсвязывающим белком красных кровяных телец, существует близкое химическое сходство.Оба белка содержат молекулярный компонент, называемый гемом, который позволяет им обратимо соединяться с кислородом. Гемовая группа, содержащая железо, придает белкам красно-коричневый цвет. Связь между кислородом и гемоглобином более сложная, чем связь между кислородом и миоглобином, и объясняет двойную способность гемоглобина переносить кислород, а также хранить его.
При контакте с венозной кровью кислород легче соединяется с миоглобином, чем с гемоглобином, способствуя передаче кислорода от крови к мышечным клеткам.Таким образом обеспечивается кислород, который необходим работающей мышце для биохимических реакций, производящих энергию.
Миоглобин был получен в чистой кристаллической форме из многих источников. Его молекулярная масса составляет 16 700, что составляет около четверти веса гемоглобина. Хотя гемовая часть всех миоглобинов одинакова, белковые части значительно различаются между видами.
Britannica Premium: удовлетворение растущих потребностей искателей знаний. Получите 30% подписки сегодня. Подпишись сейчасМиоглобин сыграл большую роль в выяснении структуры белков.В 1962 году часть Нобелевской премии по химии была присуждена Джону К. Кендрю за работу, в которой использовалась техника дифракции рентгеновских лучей, позволившая построить трехмерную модель кристаллического миоглобина кашалота.
.5 Функция белка Миоглобин и гемоглобин — биомолекулы
Глава 5: Функция белка
-Миоглобин и гемоглобин-
Цели:
- Оцените взаимосвязь структура / функция миоглобина и гемоглобин.
- Оцените механизмы физиологической регуляции кислорода Доставка.
- Понимать механизмы и цели аллостерической регуляции гемоглобин.
- Понять патологический механизм серповидноклеточной анемии и как это происходит относится к малярии.
Текст чтения:
Страйер 2-е издание Вся глава 9
Глава 5: Функция белка
-Миоглобин и гемоглобин-
Большая картина Что нужно ценить из этой главы
Структурные белки, которые мы изучили до сих пор, были статичными в своих функции, в этой главе мы представим динамический аспект.
Белки обладают структурной гибкостью и способны изменяться в экстерьер, тонкий или драматический, связанный с их физиологическими особенностями. функции.
Функция белка неизменно зависит от взаимодействия с другими молекулами.
Мы исследуем, как белки взаимодействуют с другими молекулами и как эти взаимодействия связаны с динамической структурой белка.
Миоглобин и гемоглобин, как наиболее изученные и наиболее изученные белки, будут полезными моделями для понимания этих проблем.
Белковые лиганды
-Общие-
Функции многих белков включают обратимые взаимодействия с другими белками и / или молекулами.
Молекула, которая обратимо связывается белок называется лигандом.
- Лиганд может быть любой молекулой, включая еще один белок.
Ферменты — уникальный класс белков, в котором лиганд называется субстратом, а сайт связывания называется активным сайтом.
Белковые лиганды
-Специфичность-
Лиганд связывается на участке белка, называется сайтом привязки, который бесплатно (размер, форма, заряд, гидрофобность) к лиганду.
Высокоспецифичные взаимодействия между белки и их лиганды.
У данного белка может быть несколько сайты связывания для нескольких лигандов.
Кислород будет лигандом для миоглобин.
Лиганды гемоглобина будут включать кислород и 2,3-бисфосфоглицерат.
Системы доставки и хранения кислорода
-Обзор-
Миоглобин и гемоглобин имеют много общего структурные и функциональные сходства, но служат различные физиологические роли.
Мы интерпретируем эти различия в функциях что касается различий в структуре.
Миоглобин (Mb): мономерный белок, способствует хранению кислорода в периферических тканях.
Гемоглобин (Hb): тетрамерный белок, обнаруженный в эритроциты, которые переносят кислород из легких в периферия.
http://www.phartoonz.com
Кислород как ограниченный ресурс
- Кислород плохо растворяется в водных растворах. например кровь.
- Эволюция более крупных многоклеточных животных зависели от эволюции белков, которые могли транспортировать и хранить кислород.
- Количество доступного (или используемого) кислорода может ограничить размер организмов.
- Насекомые, выращенные в условиях повышенного содержания кислорода часто достигают больших размеров.
Проксимальный отдел Гиса
Дистальная часть
Реверсивное кислородное связывание
-Протезные группы Heme-
- Окись углерода (CO) имеет аналогичную молекулярную структуры как кислород (O 2).
- Окись углерода оказывает смертельное действие путем конкурируя с кислородом за связывание с гемом.
- CO связывается в 200 раз большей аффинностью, чем O2.
CO
O 2
Гемовые протезные группы
— Отравление угарным газом —
Миоглобин
— Кривая насыщения кислородом —
Кривая насыщения миоглобина кислородом гиперболическая, что указывает на единичный O 2 константа привязки.
Сумма.O 2, необходимый для полунасыщения белка, количественно определяется с помощью P50.
Р 50 миоглобина составляет 3 торр.
Если рассматривать это с физиологической точки зрения, pO 2 в легких обычно составляет 100 торр (где физиологические концентрации O 2 самые высокие) и 30 торр в периферия (где концентрации O 2 самые низкие).
- Доля миоглобина, насыщенного кислородом при заданном парциальном давлении кислород можно рассчитать по:
θ = [pO 2] / ([pO 2] + [P 50])
- В периферических тканях парциальное давление O 2 составляет около 30 торр.
θ = 30 / (30 + 3) = 91% насыщения Mb O 2 в периферических тканях.
- В легких парциальное давление O 2 составляет 100 торр.
θ = 100 / (100 + 3) = 97% насыщения Mb О 2 в легких.
- Миоглобин имеет очень высокое сродство к кислороду и почти полностью насыщен кислородом во всем теле при нормальных условиях обстоятельства.
Миоглобин
— Расчет насыщения фракции —
Аллостерические белки
— Общие —
Слово «аллостерический» образовано от двух греческих слов: allos, что означает «другой». и стереосистемы, что означает «сайт».Аллостерический = Другая форма
Аллостерические белки имеют активную (состояние R) и неактивную (состояние T) формы находятся в быстрое равновесие.
Аллостерические эффекторы (модуляторы) связываются с аллостерическими белками на отдельных участках от функционального сайта связывания.
Аллостерические эффекторы могут быть активаторами или ингибиторами.
Аллостерические активаторы стабилизируют состояние R; аллостерические ингибиторы стабилизируют T штат.
Когда нормальный лиганд и модулятор одинаковы, взаимодействие гомотропный; когда модулятор отличается от нормального лиганда, взаимодействие гетеротропно.
Белок, связывающий О 2 с высоким и постоянным сродство будет эффективно насыщать O 2 в легкие, но не попадают в ткани.
Белок с более низким сродством к O 2 будет способный высвобождать O 2 в ткани не имел бы достаточное сродство для насыщения в легких.
Гемоглобин решает проблему, проходя переход от состояния низкого сродства к высокому состояние сродства по мере связывания большего количества молекул O 2 (и наоборот).
Белок с одной субъединицей с одним лигандом — сайт связывания не может достичь этого эффекта, потому что каждая молекула лиганда связывается независимо и не может влиять на связывание лиганда другого молекула.
Аллостерические белки
-Гемоглобин-
О 2-индуцированные структурные и функциональные изменения гемоглобина
- С гемоглобином в Т-состоянии атом железа находится вне плоскости гема. кольцо.
- При переходе в состояние R (связанный O 2) железо перемещается в плоскость кольца.
- Это незначительное движение в третичной структуре одной субъединицы вызывает структурные изменения, которые вызывают серьезные изменения в четвертичном периоде структура белка.
Гемоглобин
-Кривая насыщения кислородом-
Очень важно посмотреть на изменения в насыщение гемоглобина над физиологическим диапазон O 2.
При парциальных давлениях кислорода в легкие, Hb полностью насыщается O 2.
При типичных парциальных давлениях O 2 в крайности тела Hb выпустит примерно половина его нагрузки O 2.
Hb имеет наибольшую чувствительность к выбросу O 2 при периферийные парциальные давления O 2, позволяющие Hb для быстрого распознавания и реагирования на изменения в Уровни O 2 в регионах с наибольшим риском для O 2 лишение.
P 50 гемоглобина близко соответствует частичному давления O 2 на периферии.
