Миелодиспластический синдром — Википедия
Миелодиспластический синдром (МДС) — группа гетерогенных клональных заболеваний, характеризующаяся наличием цитопении в периферической крови, дисплазии в костном мозге и риском трансформации в острый лейкоз.
МДС сегодня является одной из самых сложных проблем гематологии. Лишь недавно лечение МДС вышло за рамки поддерживающей терапии, проводившейся с целью облегчения симптомов.
МДС — это патология старшей возрастной группы. 80 % случаев МДС приходится на лица старше 60 лет. МДС в детском возрасте встречается крайне редко. В европейских странах среди лиц 50-69 лет регистрируется 40 новых случаев МДС на 1 млн населения, а среди лиц 70 лет и старше — 150 новых случаев на 1 млн населения. Заболеваемость МДС в РФ в среднем составляет 3-4 случая на 100 тыс. населения в год и увеличивается с возрастом.[2]
Первичный (идиопатический) тип — 80-90 % случаев, вторичный (вследствие предшествующей химиотерапии и др. факторов) — 10-20 %. Большинство (80 %) случаев МДС являются первичными — идиопатическими или de novo (лат. — вновь появившийся, новый).
Вторичный МДС является значительно более неблагоприятным и резистентным к лечению типом МДС, обладающим заведомо более худшим прогнозом в сравнении с первичным МДС. 10-20 % случаев МДС возникают вследствие предшествующей химиотерапии по поводу других новообразований. К препаратам, обладающим доказанной способностью повреждать геном с последующим развитием МДС, относятся алкилирующие агенты (циклофосфан), ингибиторы топоизомеразы — противоопухолевые агенты растительного происхождения (топотекан, иринотекан и др.), антрациклины (доксорубицин) и подофиллотоксины (этопозид). К МДС также могут приводить радиотерапия и контакт с токсическими материалами.
- Факторы риска, первичный МДС
- Факторы риска, вторичный МДС
Предшествующая химиотерапия онкологического заболевания или после ТКМ.
Прогноз: 5-летняя выживаемость при МДС не превышает 60 %. Трансформация в острый лейкоз ~30 % случаев. [3][4]
Причины МДС до конца не известны. В основе патогенеза МДС лежит воздействие повреждающих факторов на полипотентную стволовую клетку, приводящее к появлению в ней генетических аномалий, а также феномена гиперметилирования ДНК.
Указанные нарушения приводят к нарушению продукции клеток миелоидного ростка и появлению миелобластов в костном мозге и периферической крови, вследствие чего появляются диспластические изменения в зрелых клетках и их функциональная недостаточность, приводящие к описанным клиническим проявлениям.
Феномен гиперклеточности костного мозга на фоне периферической цитопении объясняется ускоренным апоптозом аномально пролиферирующих клеток костного мозга.[5]
МДС отличает отсутствие типичной клинической картины. Симптоматику МДС составляют последствия дисмиелопоэза, то есть цитопении: анемия, нейтропения и тромбоцитопения (анемия Hb меньше 110 г/л, нейтрофилы меньше 1,800 на 1 микролитр крови; гематокрит меньше 36 % эритроцитов в общем объёме крови в организме; тромбоциты меньше 100,000 на 1 микролитр крови).
Наиболее часто МДС манифестирует цитопениями, главным образом анемией. При этом необходимо дифференцировать МДС от железо- или B12- дефицитной анемии, постгеморрагической анемии, анемии при хронических заболеваниях и онкологии или связанной с хронической почечной недостаточностью, а также апластической анемией, пароксизмальной ночной гемоглобинурией. У 10 % пациентов имеются признаки инфекции, а у несколько меньшей доли пациентов болезнь проявляется кровотечениями.
В связи с этим диагностика МДС базируется исключительно на лабораторно-инструментальных методах, из которых ключевыми являются полный клинический анализ периферической крови, некоторые биохимические исследования и морфологический анализ аспиратов и биоптатов костного мозга.
Дифференциальная диагностика МДС также затруднена в силу множества состояний, имеющих общие с МДС клинико-лабораторные проявления.
Для анализа изменений в периферической крови проводится полный, с подсчетом ретикулоцитов (ускоренный эритропоэз с макроцитозом в ответ на гемолиз и острую кровопотерю приводит к увеличению ретикулоцитов), тромбоцитов и лейкоцитов клинический анализ крови. Типичными находками являются изменения формы клеток, патологические включения и уменьшение числа клеток одного или нескольких ростков кроветворения.
Другим ключевым с точки зрения диагностики МДС оценки прогноза и выработки тактики лечения больных исследованием является морфологическое, иммуногистохимическое и цитогенетическое исследования ткани костного мозга. Исследование костномозгового пунктата в этом отношении является несравненно более информативным, чем определение морфологического состава периферической крови.
Используются два способа получения материала: 1) аспирационная биопсия костного мозга и 2) трепанобиопсия из гребня подвздошной кости.
При цитологическом исследовании костного мозга (миелограмма) можно оценить наличие дисплазии миелоидного ростка.
Дизэритропоэз: многоядерность Костный мозг больного рефрактерной сидеробластной анемией: кольцевые сидеробласты- Дизэритропоэз
Ядро
- Межъядерные цитоплазматические мостики
- Кариорексис
- Многоядерность
- Баббл-формы
- Мегалобластоидность
Цитоплазма
- Кольцевидные сидеробласты
- Вакуолизация
- Положительная реакция с Шифф-йодной кислотой
- Дисгранулопоэз
- Маленькие или чрезмерно большие клетки
- Гиполобулярность ядер (псевдо-Пельгер-Хюит аномалия)
- Неравномерная гиперсегментация
- Гипо-/агрануляция
- Гранулы псевдо Чедиак-Хагаси
- Палочки Ауэра
- Дисмегакариопоэз
- Микромегакариоциты
- Гиполобулярные ядра
- Многоядерность
Гистологическое исследование костного мозга (трепанобиопсия) позволяет оценить архитектонику костного мозга, диффузный или очаговый характер изменений в нём, изучить соотношение кроветворной и жировой ткани, выявить атипичные клетки и т. п. Аспирация костного мозга при стернальной пункции так или иначе нарушает структуру костного мозга и не исключает примешивание к пунктату периферической крови. В связи с этим выполнение трепанобиопсии обязательно для подтверждения диагноза МДС.
Биохимические исследования обмена железа, содержания витамина В12 и фолиевой кислоты, иммунологические пробы призваны помочь провести дифференциальную диагностику с анемиями иного генеза, с учётом того, что у 80 % пациентов с МДС отмечается анемия.
МДС следует дифференцировать с другими онкогематологическими заболеваниями, включая острые и хронические лейкозы, а также лимфопролиферативные заболевания.
Часть изменений, свойственных МДС (в частности, моноцитоз, цитопенические нарушения), могут отмечаться при некоторых инфекционных процессах.
При отравлении тяжелыми металлами могут отмечаться изменения эритроцитарного ростка, сходные с таковыми при сидеробластных анемиях.
У пациентов с наследственными цитопениями рекомендуется проведение дополнительного генетического исследования, которое поможет выявить анемию Фанкони и врождённый дискератоз.
 Повторяющиеся хромосомные аномалии при MDS
Повторяющиеся хромосомные аномалии при MDSПри диагностике хромосомные аномалии обнаруживаются у 40-70 % пациентов с первичным MDS и у 95 % пациентов, MDS которых связан с терапией (вторичный).
К наиболее часто встречающимся при MDS цитогенетическим аномалиям относятся del(5q), −7 и +8.[6]
| Группа риска | Кариотип (22 группы) | Средняя выживаемость (мес) | Время, к которому 25 % пациентов развили ОМЛ |
|---|---|---|---|
| Благоприятная | 5q-, 12p-, 20q-, +21, -Y, 11q-, t(11(q23)), норма; любые 2 аномалии, включающие 5q- | 51 | 71,9 |
| Промежуточная-1 | +1q, аномалии 3q21/q26, +8, t(7q), +19, −21, любая др. одиночная поломка; любые двойные аномалии, не затрагивающие хр. 5q и 7 | 29 | 16 |
| Промежуточная-2 | -X, −7 или 7q-, любые двойные аномалии с −7 or 7q-, комплекс из 3х аномалий | 15,6 | 6 |
| Неблагоприятная | Более 3х аномалий | 5,9 | 2,8 |
Минимальные диагностические критерии[править | править код]
Минимальные диагностические критерии МДС включают обязательные диагностические условия (цитир. По NCCN, 2009)[7] — стабильная цитопения не менее 6 месяцев, (за исключением случаев, когда цитопения сопровождается специфическим кариотипом или дисплазией двух ростков кроветворения — в этих случаях длительность стабильной цитопении должна составлять не менее 2 месяцев).
- исключение других заболеваний, которые могут стать причиной развития дисплазии или/и цитопении.
В дополнение к этим двум диагностическим условиям для установления диагноза МДС необходимо соответствие хотя бы одному из трёх основных критериев:
- дисплазия (≥ 10 % клеток одного или более из трёх основных ростков кроветворения в костном мозге).
- содержание бластов в костном мозге 5-19 %.
- специфический кариотип, например делеция (5q), делеция (20q), +8 или −7/делеция (7q).
Кроме того, для диагностики МДС используются дополнительные критерии, в том числе результаты проточной цитометрии, гистологического и иммуногистохимического исследования костного мозга, выявления молекулярных маркеров.
Морфологическое исследование биоптатов, полученных путём билатеральной трепанобиопсии, является полезным, помимо верификации диагноза самого МДС, с точки зрения дифференциальной диагностики с лимфопролиферативными и другими миелопролиферативными заболеваниями. [7]
Дифференциальная диагностика проводится с:
- А. Мегалобластными анемиями (заболевания, характеризующиеся изменениями морфологии клеток к.м. вследствие нарушения синтеза ДНК. Более 90 % — В-12 и фолиево-дефицитные анемии).
После начала терапии витамином В-12 или фолиевой кислотой в анализе крови выявляется ретикулярный криз на 5-7 сутки и повышение показателей красной крови, что нехарактерно для больных рефрактерной анемией. Изменения кариотипа клеток костного мозга не встречаются при мегалобластных анемиях.
Апластическая анемия может быть врождённой, приобретённой и идиопатической. Врождённая апластическая анемия — анемия Фанкони сочетается с другими генетическими аномалиями (кожная пигментация, гипоплазия почек, микроцефалия), приобретённая связана с действием химических и физических агентов, инфекциями, нарушениями обмена веществ.
Для АА нехарактерны изменение кариотипа, гиперклеточный костный мозг.
- В. Анемии при ХПН.
- В. Анемии при хроническом активном гепатите характерно выявление маркеров вирусных инфекций, гепатоспленомегалия, клиническая картина хр. гепатита, изменения биохимических показателей крови (метаболизма билирубина, функции печени).
Разработка этой системы классификации франко-американо-британской группой была начата в 1976 году и позже, в 1982 году, она приняла свой окончательный вид.
В основе классификации лежит ключевой для МДС синдром — рефрактерная, то есть устойчивая к лечению препаратами витамина В12 и фолиевой кислоты, анемия (РА). Четыре типа РА являются последовательными стадиями, с нарастанием тяжести МДС, что имеет своё отражение в прогнозе выживаемости. В этой связи появление в КМ бластов резко меняет прогноз выживаемости в худшую сторону.
| Тип МДС | Бластов в периферической крови | Бластов в КМ | Другие патологические изменения | Выживаемость (лет) |
|---|---|---|---|---|
| Рефрактерная анемия (РА) | меньше 1 % | меньше 15 % кольцевых сидеробластов | меньше 5 % | 4,2 |
| РА с кольцевыми сидеробластами | меньше 1 % | больше 15 % кольцевых сидеробластов | меньше 5 % | 6,9 |
| РА с избытком бластов (РАИБ) | меньше 5 % | 5-20 % | — | 1,5 |
| РАИБ в стадии трансформации | больше 5 % | 21-29 % | Возможно наличие палочек Ауэра в КМ | 0,6 |
| ХММЛ | меньше 5 % | меньше 20 % | Моноциты больше 1х109/л | 2,4 |
Французско-американско-британская классификация позволяет отнести пациента к той или иной группе миелодиспластических синдромов в зависимости от морфологических показателей. Группа миелодиспластических синдромов включает пять заболеваний: рефрактерную анемию, рефрактерную анемию с кольцевыми сидеробластами, рефрактерную анемию с избыточным количеством бластов, рефрактерную анемию с избыточным количеством бластов на стадии трансформации и хронический миеломоноцитарный лейкоз. Согласно французско-американско-британской номенклатуре пациентам, у которых содержание бластов в костном мозге превышает 30 %, устанавливается диагноз острого миелоидного лейкоза.
В данной классификации хронический миеломоноцитарный лейкоз относится к группе миелодиспластических синдромов, несмотря на то, что это заболевание часто характеризуется признаками миелопролиферативного расстройства.[8]
В 2002 году Всемирная организация здравоохранения предложила новую классификацию миелодиспластических синдромов[9][10][11] в 2008 году были сделаны предложения по её пересмотру.[12][13]
Подгруппы, выделяемые в классификации ВОЗ включают: рефрактерную анемию и рефрактерную анемию с кольцевыми сидеробластами, рефрактерную цитопению с множественной дисплазией, рефрактерную анемию с избыточным количеством бластов-1 (содержание бластов в костном мозге составляет менее 10 %), рефрактерную анемию с избыточным количеством бластов-2 (содержание бластов в костном мозге превышает 10 %), синдром делеции 5q и миелодиспластический синдром неклассифицированный (с наличием или отсутствием кольцевых сидеробластов).
Пациенты, ранее классифицировавшиеся как страдающие хроническим миеломоноцитарным лейкозом, относятся к группе миелодиспластических синдромов/миелопролиферативных заболеваний.
Синдром делеции 5q, выделяемый в классификации Всемирной организации здравоохранения в отдельную подгруппу, характеризуется изолированной делецией 5q[14][15][16] и содержанием бластов в костном мозге меньше 5 %, часто в сочетании с тромбоцитозом.
| Тип МДС | Изменения в крови | Изменения в КМ |
|---|---|---|
| Рефрактерная анемия (РА) | Анемия, меньше 1 % бластов | Дисплазия эритроидного ростка, меньше 5 % бластов |
| Рефрактерная анемия с кольцевыми сидеробластами (РАКС) | То же, что и РА | то же, что и РА, ≥ 15 % кольцевых сидеробластов |
| Рефрактерная цитопения с многоростковой дисплазией (РЦМД) | Цитопения по 2-3 росткам, меньше 1 % бластов | Дисплазия в больше 10 % клеток 2 или 3 ростков, меньше 5 % бластов, меньше 15 % кольцевых сидеробластов |
| Рефрактерная цитопения с мультилинейной дисплазией и кольцевыми сидеробластами (РЦМД-КС) | То же, что и РЦМД | То же, что и РЦМД, ≥ 15 % кольцевых сидеробластов |
| Рефрактерная анемия с избытком бластов, тип I (РАИБ-1) | Цитопении, меньше 5 % бластов | 5-9 % бластов |
| Рефрактерная анемия с избытком бластов, тип II (РАИБ-2) | Цитопении, 5-19 % бластов | 10-19 % бластов |
| Синдром 5q- | Анемия, нормальное или повышенное содержание тромбоцитов | Нормальное или увеличенное количество мегакариоцитов с гипосегментированными ядрами; изолированная делеция 5q31 |
| МДС неклассифицированный (МДС-Н) | Цитопения | Унилинейная дисплазия в нейтрофильном или мегакариоцитарном ростках, Бласты менее 5 %, Палочки Ауэра отсутствуют |
Всемирная организация здравоохранения предложила исключить рефрактерную анемию с избыточным количеством бластов на стадии трансформации из группы миелодиспластических синдромов (диагноз острого миелоидного лейкоза устанавливается, если содержание бластов в костном мозге превышает 20 %, тогда как ранее для установления этого диагноза содержание бластов должно было превышать 30 %). Однако миелодиспластические синдромы отличаются от вновь диагностированного острого миелоидного лейкоза не только содержанием бластов, но и течением заболевания, обусловленным определёнными биологическими свойствами. Кроме того, эти группы заболеваний обычно отличаются и по частоте терапевтических ответов.
Шкала IPSS (International Scoring Prognostic System — Международная шкала оценки прогноза) была разработана в 1997 году с целью дать специалистам, помимо классификации, практический инструмент по оценке прогноза и выбора тактики лечения для пациентов с впервые установленным диагнозом МДС (то есть не подходит для прогноза уже леченных пациентов с МДС).
Вторичный МДС оценивается как изначально неблагоприятный, автоматически попадающий в категорию наиболее высокого риска согласно IPSS.
Тремя факторами, которые учитывает IPSS для оценки прогноза, являются количество бластов, категория цитогенетического риска и количество поражённых цитопенией линий.
Трактовка результатов суммирования баллов по этим трем параметрам представлена в таблице:[16]
| Количество балов | ||||||
|---|---|---|---|---|---|---|
| Прогностический фактор | 0 | 0,5 | 1,0 | 1,5 | 2,0 | |
| Бласты в костном мозге | меньше 5 % | 5-10 % | — | 11-20 % | 21-30 % | |
| Прогноз с учётом характеристик кариотипа | Хороший (норма, del(5q) del(20q) -Y) | Промежуточный (+8 хромосома, 2 аномалии и др.) | Плохой (аномалии 7 хромосомы, ≥ 3 аномалии) | — | — | |
| Цитопения (количество поражённых линий) | 0/1 | 2/3 | — | — | — | |
Сумма баллов, соответствующая высокому риску по IPSS (больше 2,5) складывается из мультилинейной дисплазии, плохого цитогенетического прогноза и высокого бластоза, на грани перехода в ОМЛ (срок трансформации в который в категории высокого риска составляет всего 2 месяца).
Категория промежуточного-2 риска также складывается из выраженного цитопенического синдрома и высокого, в пределах 10-20 % бластоза.
То, что в категории низкого риска медиана общей выживаемости ниже срока перехода в ОМЛ, объясняется меньшим сроком жизни больных с МДС, что отражает последствия осложнений цитопенического синдрома.[17]
| Сумма баллов | Риск по IPSS | Срок до перехода в ОМЛ у 25 % пациентов (лет) | Медиана общей выживаемости (лет) | % Пациентов |
|---|---|---|---|---|
| 0 | Низкий | 9,4 | 5,7 | 31 % |
| 0,5-1,0 | Промежуточный-1 | 3,3 | 3,5 | 39 % |
| 1,5-2,0 | Промежуточный-2 | 1,1 | 1,2 | 22 % |
| ≥ 2,5 | Высокий | 0,2 | 0,4 | 8 % |
| Баллы | 0 | 1 | 2 | 3 |
|---|---|---|---|---|
| Вид МДС по классификации ВОЗ | РА, РАКС, 5q- | РЦМД, РЦМД-КС | РАИБ1 | РАИБ2 |
| Кариотип | Хороший | Средний | Плохой | — |
| Потребность в гемотрансфузиях | Нет | Регулярная | — | — |
Кариотип:
- Хороший: нормальный, -Y, del 5q, del 20q
- Плохой: более 3х аномалий или аномалии 7 хромосомы
- Средний: все другие
Регулярные гемотрансфузии — переливание минимум 1 ЭМ каждые 8 недель в течение 4 месяцев.
| Группа риска | Баллы | Медиана выживаемости (мес) |
|---|---|---|
| Очень низкий | 0 | 136 |
| Низкий | 1 | 63 |
| Средний | 2 | 44 |
| Высокий | 3-4 | 19 |
| Очень высокий | 5-6 | 8 |
Не все пациенты с МДС нуждаются в терапии. Пациенты без анемического, геморрагического синдрома, инфекционных осложнений могут наблюдаться и не получать лечения (тактика «watch and wait»).
Выбор терапевтической тактики во многом определяется возрастом пациента, соматическим статусом, степенью риска по шкале IPSS, WPSS, наличием совместимого донора.
Можно выделить следующие направления терапии МДС:
- Сопроводительная терапия включает в себя переливание различных гемокомпонентов (эритроцитарной массы, тромбоконцентрата), терапию эритропоэтином, тромбопоэтином. У больных, часто получающих гемотрансфузии, развивается перегрузка организма железом. Железо обладает токсическим действием на различные ткани и органы, в первую очередь сердце, печень, поэтому такие пациенты должны получать препараты, связывающие железо, — хелаторы (десферал, эксиджад).
- Иммуносупрессивная терапия наиболее эффективна у пациентов с гипоклеточным костным мозгом, нормальным кариотипом и наличием HLA-DR15. Леналидомид, обладающий иммуномодулирующим и антиангиогенным действием, показал свою эффективность у трети пациентов с рефрактерной анемией (согласно критериям ВОЗ) и низким риском (по IPSS), а также у больных с 5q-синдромом. Эффективность лечения в данном случае весьма высока; 95 % больных достигают цитогенетической ремиссии.
- Аллогенная трансплантация гемопоэтических стволовых клеток от совместимых доноров является методом выбора у пациентов с миелодиспластическим синдромом.[19][20][21]
Пациентам с МДС моложе 65 лет, с хорошим соматическим статусом, при наличии HLA-совместимого донора показано проведение аллогенной трансплантации костного мозга, так как трансплантация является потенциально радикальным методом лечения МДС.
- Цитарабин, низкие дозы. Широко используются в России, да и во всей Европе, для лечения пациентов с МДС и ОМЛ, которым не подходит терапия методом ТКМ или применение интенсивной химиотерапии.
Мнения исследователей относительно целесообразности использования низкоинтенсивной терапии расходятся. Bowen D[22] считает, что нет оснований рекомендовать её рутинное использование при МДС: было выполнено 3 рандомизированных крупных исследования (141 пац.), которые показали, что применение низких доз цитарабина не увеличивает продолжительность жизни пациентов с МДС.[23] Вместе с тем, в более позднем исследовании у пациентов с ОМЛ и МДС высокого риска[24] было показано, что продолжительность жизни у больных, у которых применялся LDAC более, чем в 1 цикле, выше, чем при поддерживающей терапии.
Таким образом, необходимость в низкоинтенсивной терапии с доказанной эффективностью и лучшей переносимостью, чем LDAC, которая будет способствовать увеличению выживаемости пациентов с МДС высокого риска, остаётся актуальной.
- Высокодозная химиотерапия используется у больных с РАИБ с гипер- и нормоклеточным костным, при трансформации в ОМЛ. Пятилетняя выживаемость составляет около 18 %.
- Гипометилирующие препараты
Новые многообещающие терапевтические подходы, широко обсуждающиеся в последнее время, по поводу которых проводятся многочисленные клинические исследования, возникли в результате глубокого изучения биологии МДС. Среди них следует отметить ингибиторы метилирования ДНК (5-азацитидин, децитабин) и иммуномодулятор — леналидомид. 5-азацитидин обладает двойным механизмом действия. Он встраивается не только в молекулу ДНК, но и в молекулу РНК. В процессе метилирования ДНК гипометилирующие агенты ковалентно связываются с ДНК-метилтрансферазой, что приводит к реактивации генов, после чего восстанавливается дифференцировка гемопоэтических клеток-предшественников и нормальное кроветворение. Азацитидин, встраиваясь в РНК молекулу, тем самым понижает её количество в клетках, что приводит к цитостатическому эффекту вне зависимости от клеточной фазы. На основании результатов исследования 3 фазы AZA-001 — международное, мультицентровое, контролируемое, в параллельных группах, в котором пациенты МДС высокого риска/ОМЛ (ВОЗ критерии) сравнивались со стандартным лечением (сопроводительная терапия, интенсивная химиотерапия, низкие дозы цитарабина), азацитидин был зарегистрирован, в том числе и в РФ, для лечения этих больных. Было показано, что азацитидин в 2,5 раза увеличивает общую выживаемость.
- ↑ 1 2 Monarch Disease Ontology release 2018-06-29sonu — 2018-06-29 — 2018.
- ↑ Гематология / Под редак. О. А. Рукавицына. СПб.: 2007. С. 193—226
- ↑ Corey SJ, Minden MD, Barber DL et al. Myelodysplastic syndromes: the complexicity of stem-cell diseases. Cancer. Nature reviews. 2007. V.7; 118—129
- ↑ Pedersen-Bjergaard J, Pedersen M, Roulston D, Philip P. (1995) Different genetic pathways in leukemogenesis for patients presenting with therapy-related myelodysplasia and therapy-related acute myeloid leukemia. Blood. 86(9): 3542-3552.
- ↑ Greenberg P.L. Apoptosis and its role in the in the myelodysplastic syndromes; implications for disease natural history and treatment. Leuk res, 1998; 22: 1123—1136
- ↑ Onley HJ, Le Beau MM. Cytogenetic Diagnosis of Myelodysplastic syndromes. in book H.J.Deeg, D.T. Bowen, S.D.Gore, T.Haferlach, m.M.Le Beau and C.Niemeyr. Hematologic Malignancies: Myelodysplastic syndromes// Springler Berlin Heidelbery. 2006, P.55-79
- ↑ 1 2 NCCN Clinical Practice Guidelines in oncology. Myelodisplastic syndromes. V.1.2009 (англ.) : journal. Архивировано 31 октября 2010 года.
- ↑ Bennett JM, Catovsky D, Daniel MT, Flandrin G, Galton DA, et al. (1982) Proposals for the classification of the myelodysplastic syndromes. Br.J Haematol. 51(2): 189—199.
- ↑ Brunning R, Bennett J, Flandrin G et al. Myelodysplastic Syndromes. In: Jaffe E, Harris N, Stein H et al, eds. WHO Classification of Tumours. Pathology and Genetics of Haematopoietic and Lymphoid Tissues. Lyon: IARC Press 2001;61-73.
- ↑ Harris N, Jaffe E, Diebold J et al. WHO Classification of Neoplastic Diseases of the Hematopoietic and Lymphoid Tissues: Report of the Clinical Advisory Committee Meeting. J Clin Oncol 1999;17:3835-3849.
- ↑ Vardiman JW, Harris NL, Brunning RD. The World Health Organization (WHO) classification of the myeloid neoplasms. Blood 2002;100:2292-2302.
- ↑ Bruning RD, Orazi A., Germing U. Et al., 2008. WHO classification of tumors of hematopoietic and lymphoid tissues. Chapter 5, pp 88-107
- ↑ Hollstrem Lindberg E., Cazzola M. The role of JAK2 mutations in RARS and other MDS. 2008. Hematology, 52-59
- ↑ Greenberg PL, Baer M, Bennett J et al. NCCN Practice Guidelines for Myelodysplastic Syndromes, Version1, 2001, In «The Complete Library of NCCN Guidelines [CD-ROM], » Rockledge, PA.
- ↑ Cheson BD, Bennett JM, Kantarjian H et al. Report of an international working group to standardize response criteria for myelodysplastic syndromes. Blood 2000;96:3671-3674.
- ↑ 1 2 Greenberg P., Cox c., Le Beau MM et al., International scoring system for evaluating prognosis in myelodysplastic syndromes. Blood 1997; 89:2079-2088
- ↑ Malcovati L., Germing U., Kuendgen A. Et al. Time-dependant prognostic scoring system for predicting survival and leukemic evolution in myelodysplastic syndromes. J Clin Oncol 2007; 25: 3503-10
- ↑ A WHO Classification-Based Prognostic Scoring System (WPSS) for Predicting Survival in Myelodysplastic Syndromes. Luca Malcovati et al. ASH Annual Meeting Abstracts 2005 106: Abstract 788
- ↑ Scott BL, Sandmaier BM, Storer B et al. Myeloablative vs nonmyeloablative allogeneic transplantation for patients with myelodysplastic syndrome or acute myelogenous leukemia with multilineage dysplasia: a retrospective analysis. Leukemia 2006;20:128-135.
- ↑ Wallen H, Gooley TA, Deeg HJ et al. Ablative allogeneic hematopoietic cell transplantation in adults 60 years of age and older. J Clin Oncol 2005;23:3439-3446.
- ↑ Demuynck H, Verhoef GE, Zachee P et al. Treatment of patients with MDS with allogeneic bone marrow transplantation from genotypically similar HLA-identical sibling and alternative donors. Bone Marrow Transplant 1996;17:745-751.
- ↑ Bowen D. Is traditional low dose chemotherapy (cytarabine/melphalan) still on option? Leukemia Research, Volume 31, Supplement 1, May 2007, Page S19
- ↑ Miller K.B. et al. The evaluation of low-dose cytarabine in the treatment of myelodisplastic syndromes: a phase III intergroup study. Annals of hematology, 1992; 65: 162—168.
- ↑ Burnett A.K., Milligan D., Prentice A.G. et al. A comparison of low-dose cytarabine and hydroxyurea with or without all-trans retinoic for acute myeloid leukemia and high-risk myelodysplastic syndrome in patients not considered fit for intensive treatment. Cancer. 2007. 109: 1114—1124
Образовательный видеоролик в помощь пациентам с миелодиспластическим синдромом
Рефрактерная анемия с избытком бластов, лечение миелодиспластического синдрома
На сегодняшний день рефрактерная анемия является одним из самых грозных гемолитических заболеваний, поскольку в большинстве случаев, она заканчивается возникновением острого лейкоза. Патология возникает вследствие нарушения механизма образования эритроцитов в костном мозге, когда в кровоток выходят незрелые элементы, которые не могут в полной мере исполнить свои функции. В чем особенность данного вида анемии? Какие причины вызывают ее развитие?
Особенности патологии
Рефрактерную анемию относят к группе гетерогенных, приобретенных болезней косного мозга, при которой нарушение кроветворной функции происходит как по количественным, так и по качественным показателям. Заболевание устойчиво к различным видам терапии, при помощи которых устраняют большинство анемических состояний. По распространенности оно встречается с одинаковой частотой у женщин и мужчин.
Заболевания характеризуется нарушением процессов созревания стволовых клеток, в связи с чем в кровотоке появляются незрелые элементы
Рефрактерная анемия является заболеванием, возникающим на фоне нарушения механизма формирования форменных элементов, которые вырабатываются костным мозгом, что проявляется в уменьшении концентрации красных клеток. Данное расстройство кроветворной функции относят к миелодисплатическому синдрому, поскольку он объединяет группу патологий связаных с поражением костного мозга. Синдром проявляется резким снижением уровня гемоглобина в организме, а также уменьшением содержанием в крови эритроцитов, тромбоцитов и лейкоцитов. Таким образом, костный мозг подвергается необратимым диспластическим изменениям.
Патология не поддается медикаментозному лечению, которое заключается в приеме медикаментов, содержащих витаминные комплексы и железо. Главная ее опасность, это длительное отсутствие признаков заболевания, с дальнейшим возникновением острого лейкоза.
Причины возникновения
По причине развития патологию разделяют на два вида:
- Первичная (идиопатический). Данная форма диагностируется в пожилом возрасте. Происхождение аномалии не установлено.
- Вторичная. Развивается в независимости от возраста. Патологию вызывают химиотерапевтическое и радиотерапевтическое воздействие при лечении злокачественных образований.
Пусковым механизмом в развитии болезни могут быть аутоиммунные заболевания, и токсоплазмоз
Факторами риска, приводящими к формированию МДС (миелодиспластического синдрома), являются:
- высокий радиационный фон;
- продолжительное пребывание в экологической зоне;
- частый контакт с бензином, растворителями, пестицидами;
- генетические и врожденные болезни;
- некоторые виды лекарственных средств.
Вторичная форма болезни также может развиваться на фоне приема противоопухолевых антибиотиков, они действуют не только на опухолевые клетки, но и способны проникать в здоровые ткани, подавляя функционирования здоровых элементов.
Классификация патологии
В зависимости от морфологической и цитохимической характеристики, выделяют пять форм рефрактерной анемии:
- Рефрактерная анемия (происходит нарушение продукции предшественников красных клеток, наличие миелобластов в костном мозге не превышает 5%).
- Сидеробластная анемия (характеризуется наличием «колец» сидеробластов, препятствующим нормальному транспорту кислорода, миелобласты не превышают пределы 5%).
- Рефрактерная анемия с избытком бластов (происходит значительное повышение уровня миелобластов, которое составляет от 5 до 20%).
- Хроническая миеломоноцитарная лейкемия (для нее характерно наличие моноцитов и бластных клеток не больше 20%).
- В трансформации избыточное количество бластных клеток (миелобласты содержаться в количестве от 20 до 30%).
Наличие диспластических изменений в костном мозге характерно для всех форм рефрактерной анемии
Как правило, последняя форма патологии у взрослых трансформируется в острый миелобластный лейкоз, а у детей в острый лимфобластный лейкоз.
При всех формах заболевания наблюдается снижение количества лимфоцитов, нарушение образования тромбоцитов и эритроцитов, повышение уровня моноцитов в крови.
Первые признаки заболевания
Очень часто первые признаки заболевания могут отсутствовать на начальной стадии патологического процесса, особенно при мягких формах течения нарушений. Отсутствие выраженной симптоматики затягивает обращение к специалистам, что усугубляет течение патологии. Как правило, анемическое состояние выявляется при плановом обследовании пациентов, когда в общем анализе крови диагностируют патологические изменения в системе кроветворения.
Начальные признаки болезни по клинической картине схожи с патологическими процессами в печени и аутоиммунными расстройствами.

Одним из ранних признаков анемии является плохая переносимость любого рода физических нагрузок
К первым признакам, по которым можно заподозрить формирования патологического синдрома относят:
- бледность слизистых оболочек и кожных покровов;
- образования гематом при незначительной травме;
- точечные подкожные кровоизлияния;
- регулярная заболеваемость вирусными болезнями;
- нарастающая слабость;
- одышка;
- головокружение;
- обморочные состояния.
Симптоматика патологического состояния
В клинической картине данного типа анемии можно выделить две фазы течения патологического процесса:
- Хроническая гемодепрессия.
- Финальная или быстрая.
Фаза гемодепрессиии проявляется следующими симптомами:
- лихорадка неясной этиологии;
- слабость;
- хроническое недомогание;
- присоединение вторичной инфекции;
- снижение массы тела;
- увеличение селезенки;
- увеличение лимфатических узлов.
Продолжительность фазы составляет от нескольких недель до 20 лет, с периодами ремиссии в течение 3–5 лет, в большинстве случаев она колеблется в пределах 6–12 месяцев.
Симптомы финальной фазы развиваются по типу острого лейкоза. Течение клинических проявлений быстрое с внезапным появлением бластов. Характерными проявлениями, свидетельствующими о развитии данной фазы, являются резкое увеличение селезенки, печени, и лимфатических узлов.

Переносимость патологических симптомов у мужчин значительно хуже, чем у женщин
Симптоматика торомбоцитопении заключается в следующем:
- появление гематом после незначительной травмы;
- носовые кровотечения;
- кровоточивость десен;
- обильные менструальные кровотечения.
Низкий уровень лейкоцитов в кровотоке значительно снижает резистентные силы организма к воздействию инфекционных агентов, вирусов и бактерий. Поэтому у пациента наблюдаются частые сопутствующие симптомы:
- болезни кожных покровов;
- заболевания верхних дыхательных путей;
- болезни бронхолегочной системы;
- инфицирование мочевыделительной системы;
- афтозный стоматит.
- Сбор данных анамнеза. Включает установление наследственного фактора, уточнение продолжительности симптомов.
- Физикальное исследование. Позволяет определить тяжесть общего состояния, выраженность анемического и геморрагического симптомов.
- Лабораторная диагностика. Проводиться общий клинический анализ крови, исследование структурных компонентов костного мозга.
- уровень гемоглобина;
- лейкоцитарная формула;
- количество форменных элементов крови;
- уровень ретикулоцитов в периферической крови.
- Определение клеточности костного мозга.
- Установление точного соотношения кроветворных ростков.
- Выявление бластных клеток.
- Определение наличия атипичного скопления клеток-предшественников.
- Выявление наличия качественного и количественного изменения диспоэза.
- Заместительная терапия (внутривенное переливание необходимых компонентов крови).
- Гомопоэтические ростовые факторы (способствуют усиленной выработке ростков кроветворения и форменных элементов).
- Устранение вторичных заболеваний (прием антибактериальных и противогрибковых средств).
- Иммуносупрессорная терапия (применяют препараты глобулины и Циклоспорин А).
У пациентов в пожилом возрасте страдает сердечно-сосудистая система, возникают перебои в деятельности сердца, одышка, боли за грудиной, учащенное сердцебиение. При поражении сосудов нижних конечностей возникают острые боли, даже при непродолжительной ходьбе.
Методы диагностики
Как правило, первоначальное выявление рефракторной анемии основывается на жалобах, связанных с анемическими состояниями. Основными методами диагностики анемичного синдрома являются:

При подозрении на миелобластный синдром необходимо провести тщательный дифференциальный диагноз, для исключения схожих патологий
В общем анализе крови учитывают следующие параметры:
Диагностика рефрактерной анемии основывается на пункции костного мозга. Из спинномозговой жидкости, полученной в одной точке, делают десять мазков, несколько мазков из каждой точки окрашивают методом Романовского-Гимзе.
Во время оценки миелограммы нужно учитывать следующие критерии:
Цитогенетическое исследование также позволяет изучить хромосомные аномалии клеточных структур костного мозга.
Лечебные мероприятия
Терапевтические мероприятия направлены на уменьшение выраженности клинических проявлений, нормализацию показателей системы кровообращения, и предупреждения осложнения в виде острого лейкоза.
Лечение осуществляется с учетом типа заболевания, возрастной категории пациента, наличие сопутствующих недугов. Тактика лечения может быть как симптоматической, так и иммуносупрессивной.
Поддерживающая терапия заключается в проведении мероприятий:
В результате заместительной терапии существует риск присоединения инфекции, нарушения функций иммунной системы, а также перенасыщение организма железом.
Избыточное накопление железа в организме способно вызвать повреждение внутренних органов, поэтому необходим постоянный мониторинг количественного содержания ферритина в сыворотке крови, и очищение организма от железа при помощи специальных медикаментов.
Молодые пациенты с высоким риском перерождения анемии в острый лейкоз требуют курс интенсивной химиотерапии
Добиться полного излечения можно при помощи пересадки донорских кроветворных стволовых клеток. Результативность методики зависит от совместимости донора и реципиента, так как возможет риск развития осложнений в раннем и позднем послеоперационном периоде.
Больным, меньше 55-летнего возраста, у которых существует высокий риск негативных последствий и им противопоказано пересаживать стволовые клетки, назначают курс химиотерапии аналогичный, как при остром лейкозе. В стадии ремиссии нормализация элементов крови происходит в течение одного месяца.
Пациентам, имеющим противопоказания к процедуре трансплантации и химиотерапии, рекомендуется введение препарата, направленного на увеличение продолжительности жизни (Вайдаза) и медикамента улучшающего ее качество (Цитарабин).
Рефрактерная анемия является злокачественным гематологическим заболеванием, для которого характерно резкое понижение уровня форменных элементов крови, а также снижение их функциональной активности. Для предупреждения трансформации патологии в рак крови, необходимо обращаться к специалисту при первых признаках болезни. Так, исход анемического состояния зависит от своевременности проведения лечебных мероприятий, а значит и качества жизни пациента.
Миелодиспластический синдром — причины, симптомы, диагностика и лечение, прогноз
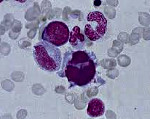
Миелодиспластический синдром – группа гематологических заболеваний, при которых наблюдаются цитопения, диспластические изменения костного мозга и высокий риск возникновения острого лейкоза. Характерные симптомы отсутствуют, выявляются признаки анемии, нейтропении и тромбоцитопении. Диагноз устанавливается с учетом данных лабораторных анализов: полного анализа периферической крови, гистологического и цитологического исследования биоптата и аспирата костного мозга и т. д. Дифференциальный диагноз может представлять значительные затруднения. Лечение – переливание компонентов крови, химиотерапия, иммуносупрессивная терапия, пересадка костного мозга.
Общие сведения
Миелодиспластический синдром – группа заболеваний и состояний с нарушениями миелоидного кроветворения и высоким риском развития острого лейкоза. Вероятность развития увеличивается с возрастом, в 80% случаев данный синдром диагностируется у людей старше 60 лет. Мужчины страдают несколько чаще женщин. У детей миелодиспластический синдром практически не встречается. В последние десятилетия гематологи отмечают увеличение заболеваемости среди лиц трудоспособного возраста. Предполагается, что причиной «омоложения» болезни могло стать существенное ухудшение экологической обстановки.
До недавнего времени лечение миелодиспластического синдрома было только симптоматическим. Сегодня специалисты разрабатывают новые методы терапии, однако эффективное лечение этой группы болезней все еще остается одной из самых сложных проблем современной гематологии. Пока прогноз при миелодиспластическом синдроме, в основном, зависит от особенностей течения болезни, наличия или отсутствия осложнений. Лечение осуществляют специалисты в сфере онкологии и гематологии.
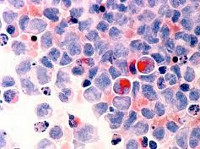
Миелодиспластический синдром
Причины и классификация миелодиспластического синдрома
С учетом причин развития различают два типа миелодиспластического синдрома: первичный (идиопатический) и вторичный. Идиопатический вариант выявляется в 80-90% случаев, диагностируется преимущественно у пациентов старше 60 лет. Причины возникновения установить не удается. В числе факторов риска первичного миелодиспластического синдрома – курение, повышенный уровень радиации при выполнении профессиональных обязанностей или проживании в неблагоприятной экологической зоне, частый контакт с бензином, пестицидами и органическими растворителям, некоторые наследственные и врожденные заболевания (нейрофиброматоз, анемия Фанкони, синдром Дауна).
Вторичный вариант миелодиспластического синдрома наблюдается в 10-20% случаев, может возникать в любом возрасте. Причиной развития становится химиотерапия или радиотерапия по поводу какого-то онкологического заболевания. В число лекарственных средств с доказанной способностью вызывать миелодиспластический синдром включают циклофосфан, подофиллотоксины, антрациклины (доксорубицин) и ингибиторы топоизомеразы (иринотекан, топотекан). Вторичный вариант отличается более высокой резистентностью к лечению, более высоким риском развития острого лейкоза и более неблагоприятным прогнозом.
В современной редакции классификации ВОЗ различают следующие типы миелодиспластического синдрома:
- Рефрактерная анемия. Сохраняется более полугода. В анализе крови бласты отсутствуют либо единичные. В костном мозге дисплазия эритроидного ростка.
- Рефрактерная анемия с кольцевыми сидеробластами. Сохраняется более полугода. В анализе крови бласты отсутствуют. В костном мозге дисплазия эритроидного ростка.
- Рефрактерная цитопения с многолинейной дисплазией. В анализе крови тельца Ауэра отсутствуют, бласты отсутствуют либо единичные, выявляются панцитопения и увеличение количества моноцитов. В костном мозге диспластические изменения менее 10% клеток в 1 миелоидной клеточной линии, бластов менее 5%, телец Ауэра нет.
- Рефрактерная анемия с избытком бластов-1. В анализе крови тельца Ауэра отсутствуют, бластов более 5%, цитопения и увеличение количества моноцитов. В костном мозге дисплазия одной либо нескольких клеточных линий, бластов 5-9%, телец Ауэра нет.
- Рефрактерная анемия с избытком бластов-2. В анализе крови увеличение количества моноцитов, цитопения, бластов 5-19%, могут выявляться тельца Ауэра. В костном мозге дисплазия одной либо нескольких клеточных линий, бластов 10-19%, обнаруживаются тельца Ауэра.
- Неклассифицируемый миелодиспластический синдром. В анализе крови цитопения, бласты отсутствуют либо единичные, тельца Ауэра отсутствуют. В костном мозге дисплазия одного мегакариоцитарного либо гранулоцитарного ростка, бластов более 5%, тельца Ауэра отсутствуют.
- Миелодиспластический синдром, ассоциированный с изолированной делецией 5q. В анализе крови анемия, бластов более 5%, возможен тромбоцитоз. В костном мозге более 5% бластов, тельца Ауэра отсутствуют, изолированная делеция 5q.
Симптомы миелодиспластического синдрома
Клиническая симптоматика определяется степенью нарушений миелопоэза. При мягко протекающих расстройствах возможно длительное бессимптомное или стертое течение. Из-за слабой выраженности клинических проявлений некоторые больные не обращаются к врачам, и миелодиспластический синдром обнаруживается во время проведения очередного медицинского осмотра. При преобладании анемии наблюдаются слабость, одышка, плохая переносимость физических нагрузок, бледность кожных покровов, головокружения и обморочные состояния.
При миелодиспластическом синдроме с тромбоцитопенией возникает повышенная кровоточивость, отмечаются десневые и носовые кровотечения, на коже появляются петехии. Возможны подкожные кровоизлияния и меноррагии. Миелодиспластический синдром с выраженными нейтропенией и агранулоцитозом проявляется частыми простудами, стоматитом, синуситом или стрептодермией. В тяжелых случаях возможно развитие пневмонии или сепсиса. Инфекционные заболевания нередко вызываются грибками, вирусами или условно-патогенными микробами. У каждого пятого пациента с миелодиспластическим синдромом выявляется увеличение лимфоузлов, селезенки и печени.
Диагностика миелодиспластического синдрома
Диагноз выставляется с учетом данных лабораторных исследований: анализа периферической крови, биопсии костного мозга с последующим цитологическим исследованием, цитохимических и цитогенетических тестов. В анализе периферической крови больных миелодиспластическим синдромом обычно обнаруживается панцитопения, реже выявляется дву- или одноростковая цитопения. У 90% пациентов наблюдается нормоцитарная либо макроцитарная анемия, у 60% — нейтропения и лейкопения. У большинства больных миелодиспластическим синдромом отмечается тромбоцитопения.
При исследовании костного мозга количество клеток обычно нормальное либо повышенное. Уже на ранних стадиях обнаруживаются признаки дизэритропоэза. Количество бластов зависит от формы миелодиспластического синдрома, может быть нормальным либо увеличенным. В последующем наблюдаются дисгранулоцитопоэз и дисмегакариоцитопоэз. У некоторых больных признаки дисплазии костного мозга выражены очень слабо. В процессе цитогенетического исследования у ¾ больных выявляются хромосомные нарушения. Дифференциальный диагноз миелодиспластического синдрома проводят с В12-дефицитной анемией, фолиево-дефицитной анемией, апластической анемией, острым миелолейкозом и другими острыми лейкозами.
Лечение и прогноз при миелодиспластическом синдроме
Тактика лечения определяется выраженностью клинической симптоматики и лабораторных изменений. При отсутствии явных признаков анемии, геморрагического синдрома и инфекционных осложнений осуществляется наблюдение. При миелодиспластическом синдроме с выраженной анемией, тромбоцитопенией и нейтропенией, а также при высоком риске возникновения острого лейкоза назначают сопроводительную терапию, химиотерапию и иммуносупрессивную терапию. При необходимости осуществляют пересадку костного мозга.
Сопроводительная терапия является самым распространенным методом лечения миелодиспластического синдрома. Предусматривает внутривенные инфузии компонентов крови. При длительном применении может провоцировать повышение уровня железа, влекущее за собой нарушения деятельности жизненно важных органов, поэтому переливания гемокомпонентов производят при одновременном приеме хелаторов (лекарственных средств, связывающих железо и способствующих его выведению).
Иммуносупрессоры эффективны при лечении миелодиспластического синдрома с отсутствием хромосомных аномалий, наличием гена HLA-DR15 и гипоклеточном костном мозге. Химиотерапию применяют при невозможности трансплантации костного мозга. Высокие дозы препаратов используют при трансформации миелодиспластического синдрома в острый лейкоз, а также при рефрактерных анемиях с избытком бластов при нормоклеточном и гиперклеточном костном мозге, низкие – при невозможности пересадки костного мозга. Наряду с перечисленными средствами пациентам назначают гипометилирующие средства (азацитидин). Наиболее надежным способом достижения полноценной длительной ремиссии является трансплантация костного мозга.
Прогноз зависит от типа миелодиспластического синдрома, количества хромосомных аномалий, необходимости в регулярных переливаниях компонентов крови, выраженности клинических проявлений и наличия осложнений. Различают 5 групп риска. Средняя выживаемость больных миелодиспластическим синдромом, входящих в группу с самым низким уровнем риска, составляет более 11 лет; с самым высоким – около 8 месяцев. Вероятность отторжения костного мозга после трансплантации – около 10%.
Городская клиническая больница №31 — Пациентам в помощь. Гематологические заболевания. Часть III. Миелодиспластические синдромы (страница 7)
Страница 7 из 7
Рефрактерная анемия с избытком бластов
Слово «анемия» на медицинском языке означает снижение гемоглобина, или малокровие, а «рефрактерная», или устойчивая, означает, что никакими витаминами, препаратами железа, диетой исправить ситуацию и поднять гемоглобин нельзя. Бласты являются самыми молодыми клеткам крови. Их очень мало, но если их количество превышает норму, значит, объявились первые предвестники опухоли крови.
Рефрактерная анемия с избытком бластов (РАИБ) – один из самых частых видов миелодиспластического синдрома, при котором из-за нарушений в созревании крови снижается гемоглобин и появляются признаки скорого острого лейкоза. Этой анемией болеют примерно 40% всех пациентов с миелодиспластическим синдромом. Чаще всего заболевают люди старше пятидесяти лет.
Откуда же берется РАИБ? Все, в том числе и болезни человека, развивается. Если, например, своевременно не вылечить кариес, то будет дупло, боль и флюс. РАИБ – это промежуточный этап между рефрактерной анемией и острым лейкозом, поэтому раньше эту болезнь называли даже «предлейкоз». Как правило, момент, когда появляется слишком много бластов, проходит для больного незаметно. Основным симптом остается слабость из-за снижения гемоглобина.
Диагноз
Диагноз «рефрактерная анемия с избытком бластов (РАИБ)» ставят, если у больного не находят других причин для изменения крови и одновременно видят типичные изменения в костном мозге. Пациента всесторонне обследуют: делают цитологическое, цитогенетическое и гистологическое исследование костного мозга, другие специальные анализы, чтобы понять, как быстро болезнь перейдет в острый лейкоз и каковы в настоящий момент возможности для лечения этого пациента.
Лечение
Главная цель в лечении РАИБ максимально затормозить переход болезни в острый лейкоз. Для этого проводят химиотерапию по разнообразным схемам. Переносимость лечения зависит от общего состояния больного. Если он до болезни крови был в целом здоров, то терапия РАИБ обычно переносится хорошо: пациент может продолжать работать, находится в семье, живет полноценной жизнью. Однако, несмотря на то, что возможности лечения есть, быстрый переход болезни в острый лейкоз ограничивает выживаемость больных. Статистический анализ показывает, что среднее время жизни пациентов (без пересадки стволовых клеток крови) от момента постановки диагноза составляет от 1-2 месяцев до полутора лет. Это зависит от различных факторов. Если пациент молод, то уже на стадии РАИБ, не дожидаясь острого лейкоза, можно выполнить пересадку стволовых (материнских) клеток крови и вылечить человека полностью.
Рефрактерная анемия: причины, симптомы, методы лечения
Заболевания крови составляют многочисленную и разнообразную группу синдромов, формирующихся при нарушениях качественного и количественного состава крови. Все они систематизируются, исходя из поражения какого-либо компонента крови. Гематологические заболевания делят на три основные группы:
- патологии, характеризующиеся снижением уровня гемоглобина;
- гемобластозы;
- гемостазиопатии.
Рефрактерная анемия – одна из разновидностей малокровия, отличающаяся нарушением созревания клеток красного ростка.
Миелодиспластический синдром – это что?
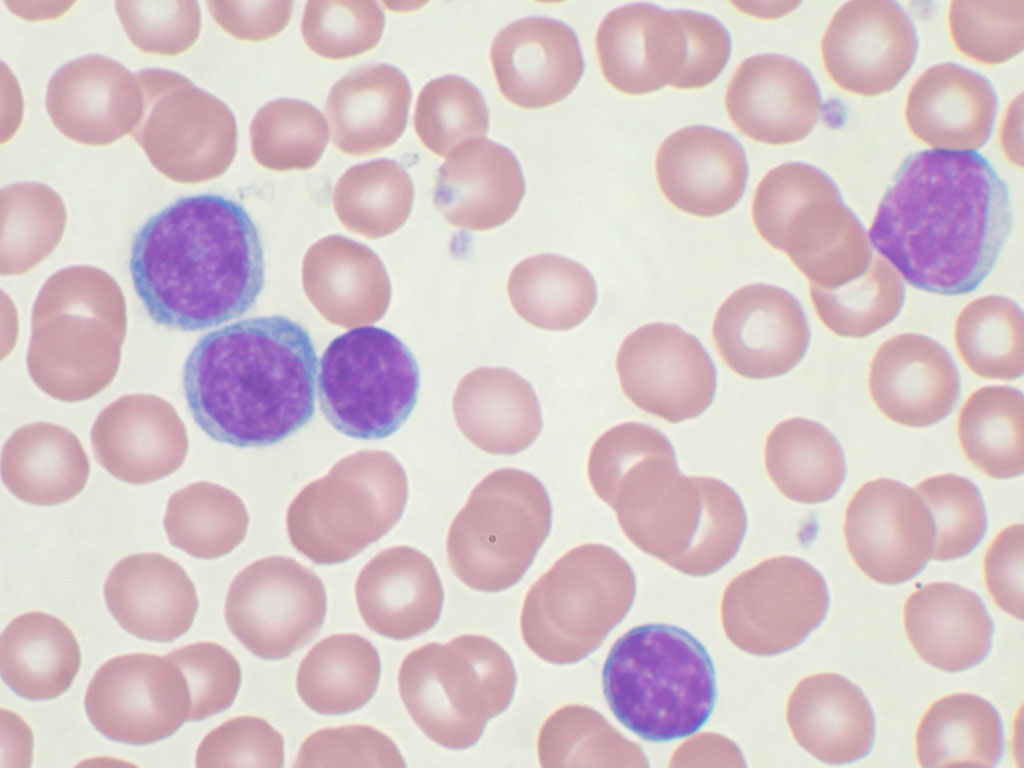
Группу заболеваний и состояний с нарушением процесса образования эритроцитов, моноцитов, тромбоцитов, гранулоцитов в миелоидной ткани (миелоидное кроветворение) с высокой вероятностью развития опухолевого поражения кроветворной системы в медицине именуют миелодиспластическим синдромом (МДС).
Клинические признаки в этом случае такие же как при анемии, состоянии, отличающимся снижением уровня нейтрофильных гранулоцитов в крови и тромбоцитопении. Заболевание чаще встречается у людей после 60 лет, причем мужчины подвержены ему больше, чем женщины. Однако в последнее время наблюдается «омоложение» болезни. Гематологи считают, что причина кроется в ухудшении экологической обстановки.
Одно из заболеваний группы миелодиспластического синдрома – рефракторная анемия. Данная патология, как и все остальные, объединенные МДС, относится к гематологическим заболеваниям, характеризующимися цитопенией (снижением уровня определенного вида клеток в крови) и патологическими изменениями костного мозга.
Классификация миелодиспластического синдрома
В международную классификацию болезней были внесены некоторые изменения, которые коснулись и гематологических заболеваний. Систематизация схожа с предложенной ранее ВОЗ, но отличается от FAB количеством вариантов определения заболеваний:
- D46.0 — рефрактерная анемия без сидеробластов.
- D46.1 — РА с кольцевыми сидеробластами. Незрелые кровяные клетки в крови не обнаруживаются.
- D46.2 — рефракторная анемия с избытком бластов 1. В анализе крови цитопения, превышение уровня моноцитов, тельца Ауэра отсутствуют.
- D46.3 — рефракторная анемия (РА) со множеством бластов с трансформацией.
- D46.4 — РА неуточненная.
- D46.5 — рефракторная цитопения со многолинейной дисплазией.
- D46.6 — миелодиспластический синдром, ассоциированный с делецией 5q.
- D46.7 — другие миелодиспластические синдромы.
- D46.9 — миелодиспластический синдром неуточненный.
Особенности рефрактерной анемии
Refractorius в переводе с латыни означает «невосприимчивый», «трудноизлечимый». Заболевание относится к гематологическим и характеризуется нарушением развития эритроцитного ростка в крови, продуцируемого костным мозгом. При синдроме рефрактерной анемии сначала снижается содержание эритроцитов в крови, а потом и остальных клеток, поражается орган кроветворной системы, отвечающий за гемопоэз.
Основная опасность патологии заключается в том, что она не поддается лечению, основанному на применении железосодержащих препаратов. Данный вид анемии часто протекает практически бессимптомно и выявляется при диагностике других патологий. Болезнь быстро прогрессирует и ведет к развитию острого лейкоза.
Рефракторная анемия с избытком бластов
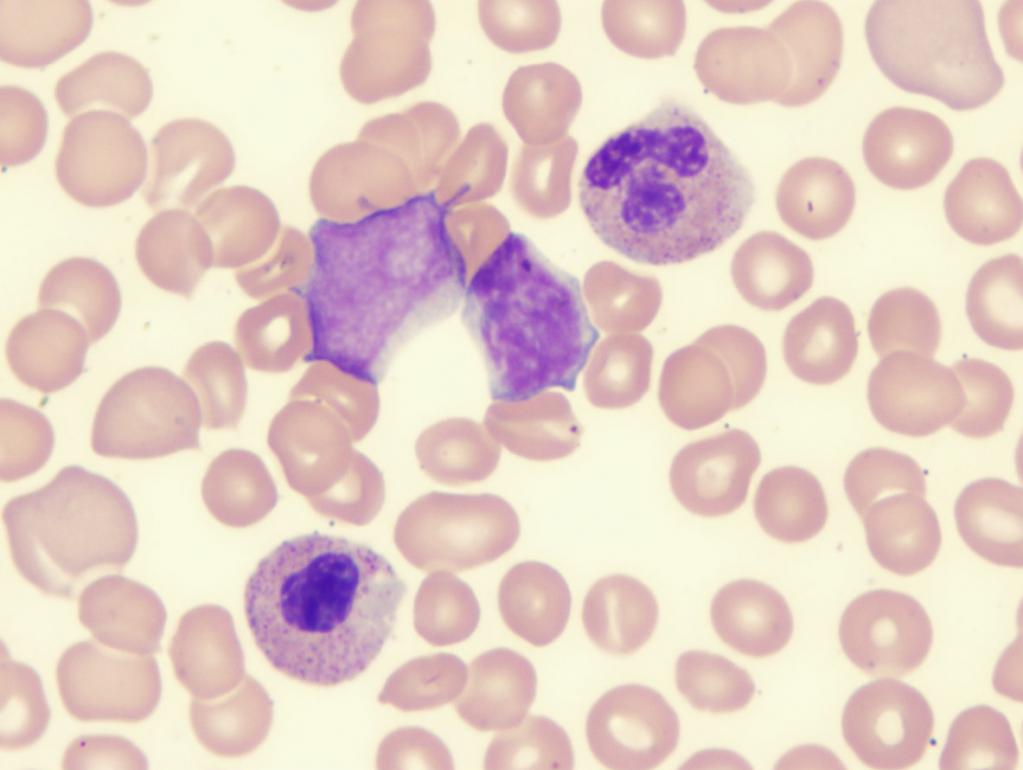
Исходя из статистических данных, людей с подобным диагнозом около 1 015 000. Заболевание чаще всего встречается у мужчин 75-80 лет, а у женщин в возрасте 73-79 лет. Патологию делят на два типа:
- РАИБ-1 – характеризуется цитопенией, увеличением числа моноцитов в крови. Палочковидные красные белковые включения в цитоплазме моноцитов (тельца Ауэра) не обнаруживаются. В костном мозге наблюдается дисплазия одной клеточной линии, бластов (незрелые кровяные клетки) около 5-19 %.
- РАИБ с трансформацией – анализ крови показывает повышенное содержание моноцитов, выявляются тельца Ауэра. Содержание бластов около 30 %. В костном мозге обнаруживаются дисплазии сразу нескольких клеточных линий. Подобная картина способствует развитию острого миелолейкоза.
Смертность от данной патологии составляет около 11 %.
Причины возникновения патологии
Точные причины развития заболевания до сих пор не выявлены. Разделяют два типа синдрома, и по каждому из них установлены факторы риска.
Первичный (идеопатический) выявляется в почти 90 % случаев. Факторы риска:
- Курение.
- Превышенный уровень радиации.
- Проживание в неблагоприятной экологической зоне.
- Регулярное вдыхание паров бензина, органических растворителей, пестицидов.
- Врожденный нейрофиброматоз Реклингхаузена (развитие опухолей из нервной ткани).
- Наследственная анемия Фанкони.
- Синдром Дауна.
Вторичный тип рефрактерной анемии (МДС) наблюдается в 20 % случаев, может развиваться в любом возрасте. Основные причины развития:
- Химиотерапия или радиотерапия.
- Долговременное применение некоторых групп лекарственных средств: циклофосфаты, антрациклины, ингибиторы топоизомеразы, подофиллотоксины.
Вторичный вариант отличается высокой резистентностью к терапии и большой вероятностью формирования острого лейкоза и, как следствие, неблагоприятным прогнозом.
По каким признакам определить заболевание?

Часто патология развивается без каких-либо симптомов, что мешает начать лечение на ранних этапах и в мягких формах. Как правило, диагностируется рефрактерная анемия в тяжелой степени при плановом обследовании пациента.
Но выявить заболевание на ранних этапах все же можно. Первые его признаки имеют много общего с проявлениями, возникающими при патологиях печени, аутоиммунных заболеваниях и любой другой анемии. К ним относятся:
- Бледность, прозрачность кожи, в особенности на лице.
- Чрезмерное утолщение рогового слоя эпидермиса на локтях и коленях.
- Образование гематом, которые долго проходят.
- Постоянные трещины на слизистой рта.
- Ломкость ногтей.
- Изменение обоняния и вкуса: пристрастие к резким запахам, желание есть землю, мел.
- Быстрая утомляемость.
- Частые ОРВИ с тяжелым течением.
При обнаружении подобных симптомов следует обратиться к врачу.
Клинические проявления тяжелой степени патологии

Клиническая картина анемии состоит из двух фаз: хроническая гемодепрессия и тяжелая (финальная) стадия.
При гемодепрессии наблюдаются следующие проявления:
- Значительное повышение температуры, лихорадка.
- Резкий упадок сил.
- Общее плохое самочувствие.
- Снижение веса.
- Увеличение внутренних органов: селезенки, печени.
- Увеличение и болезненность лимфатических узлов.
Подобные состояния затяжные, с периодами ремиссии.
Симптомы тяжелой степени рефрактерной анемии (миелодиспластический синдром) такие же, как при остром лейкозе. Болезнь развивается стремительно. Одной из ее особенностей является обнаружение бластов в анализе крови. Заболевание сопровождается следующими симптомами:
- Гематомы, даже при незначительных ушибах.
- Кровоточивость десен.
- Гингивит.
- Бинокулярное смещение глазного яблока.
- Упорные повторные воспалительные процессы в носоглотке.
- Нагноение царапин, небольших ран.
- Боли в области позвоночника.
У пациентов пожилого возраста возникают вторичные заболевания, чаще поражается сердечно-сосудистая система. Пациенты испытывают боли при ходьбе в нижних конечностях.
Диагностические мероприятия
При первых подозрительных симптомах необходимо обратиться к доктору. Диагноз «миелодиспластический синдром» или «рефрактерная анемия с избытком бластов» ставится только после прохождения ряда лабораторных исследований. Они включают:
- Клинический анализ периферической крови.
- Цитологические исследования аспирата костного мозга.
- Трепанобиопсия заключается во взятии биоматериала из костного мозга путем прокола большеберцовой кости.
- Цитогенетический тест. Анализ выявляет хромосомные нарушения, является обязательным.
В зависимости от клинической картины заболевания могут быть назначены дополнительные диагностические мероприятия:
- УЗИ брюшной полости.
- Эзофагогастродуоденоскопия желудочно-кишечного тракта.
- Анализ на специфические онкомаркеры.
Методы терапии
Выбор способа лечения рефрактерной анемии обусловлен выраженностью клинических проявлений и результатами лабораторных исследований. Схемы терапии довольно сложны и определяются врачом. Пациенты с небольшим количеством бластов находятся в группе низкого риска. Они получают заместительное и поддерживающее лечение и могут вести практически обычный образ жизни. Приблизительная схема лечения такова:
- В стационарных условиях осуществляется наблюдение. Основная задача: поддержка нормального уровня гемоглобина и недопущение развития анемического синдрома. Пациенту делают переливание эритроцитарной донорской массы.
- При тяжелой анемии назначают лекарственные препараты, способствующие восстановлению железосодержащего белка: «Эксиджад», «Десферол».
- Для предотвращения иммунной агрессии против костного мозга применяют «Леналидомид» с антимоноцитарным глобулином и «Циклоспорином».
- При выявлении инфекционных заболеваний назначают антибактериальные препараты в зависимости от возбудителя и его резистентности.
- При необходимости, проводят пересадку костного мозга.
Прогнозирование
Прогноз рефрактерной анемии (миелодиспластический синдром) зависит от клинической картины, ответной реакции организма на терапию, своевременности обращения за медицинской помощью. Исход заболевания обусловлен выраженностью дефицита определенных клеток, наличие и профиль хромосомных отклонений, количество бластов и их тенденцию к развитию в крови и костном мозге.
Профилактика

Ввиду того что сущность, обстоятельства и механизмы развития патологии до конца еще не исследованы, то и действенные профилактические методы назвать практически невозможно. Врачи советуют придерживаться следующих рекомендаций по сохранению здоровья:
- Правильно сбалансировано питаться.
- Включать в рацион продукты с высоким содержанием железа.
- Чаще совершать прогулки на свежем воздухе.
- Отказаться от вредных привычек, в частности курения.
- При работе с пестицидами или органическими растворителями применять средства защиты.
Рефракторная анемия – опасное гематологическое заболевание, переходящее в онкологию. Чтобы избежать тяжелых стадий заболевания и серьезных последствий, необходимо регулярно проводить плановый осмотр. При обнаружении патологии необходимо полностью пройти курс терапии, многим пациентам это помогло не только улучшить, но и продлить жизнь.
Миелодиспластические синдромы | Фонд «Подари жизнь»
Суть болезни
Миелодиспластические синдромы (МДС) – группа заболеваний, которые характеризуются нарушениями кроветворения миелоидной линии. В результате этих нарушений возможность выработки зрелых клеток крови частично сохраняется, но наблюдается дефицит тех или иных их видов, а сами клетки при этом изменены и плохо функционируют.
У значительной части больных МДС через некоторый промежуток времени, обычно от нескольких месяцев до нескольких лет, развивается острый миелоидный лейкоз.
МДС в обиходе иногда называют «предлейкемией», ранее применялись также термины «малопроцентный лейкоз», «тлеющий лейкоз» или «дремлющий лейкоз». Это связано с содержанием бластных клеток в костном мозге: если их более 20% (согласно классификации Всемирной организации здравоохранения) или более 30% (согласно франко-американо-британской классификации FAB), то речь уже идет о миелоидном лейкозе, если же их уровень ниже порогового значения, то может быть диагностирован МДС.
Под термином «миелодиспластический синдром» в настоящее время подразумевается целая группа заболеваний, различающихся по частоте встречаемости, клиническим проявлениям, а также по вероятности и ожидаемым срокам трансформации в лейкоз. Специалисты используют две классификации МДС: франко-американо-британскую (FAB) и классификацию Всемирной организации здравоохранения (ВОЗ). Рассмотрим классификацию FAB как более простую:
- Рефрактерная анемия (РА). Термин «рефрактерная» здесь означает, что анемия не поддается лечению препаратами железа и витаминами. В костном мозге менее 5% миелобластов, аномалии в основном касаются предшественников эритроцитов.
- Рефрактерная анемия с кольцевыми сидеробластами (РАКС): миелобластов в костном мозге менее 5%, но не менее 15% предшественников эритроцитов представлены особыми аномальными клетками – так называемыми кольцевыми сидеробластами. Это клетки с кольцеобразными «отложениями» железа, которые не могут обеспечивать эффективный транспорт кислорода.
- Рефрактерная анемия с избытком бластов (РАИБ): миелобластов в костном мозге 5–20%. В классификации ВОЗ дополнительно подразделяется на РАИБ-I (5–9% бластов) и РАИБ-II (10-19% бластов).
- Рефрактерная анемия с избытком бластов на стадии трансформации (РАИБ-T): миелобластов 21–30% (по классификации ВОЗ это уже острый миелоидный лейкоз).
- Хронический миеломоноцитарный лейкоз, ХММЛ (по классификации ВОЗ относится к миелодиспластическим-миелопролиферативным заболеваниям).
Частота встречаемости, факторы риска
Общая частота МДС составляет 3-5 случаев на 100 000 населения. Однако у детей и молодых взрослых это заболевание встречается во много раз реже: более 80% случаев МДС фиксируется после 60 лет, причем несколько чаще у мужчин, чем у женщин.
В большинстве случаев МДС возникает без какой-либо известной причины, но иногда его развитие может быть спровоцировано предшествующей химиотерапией или лучевой терапией по поводу какой-либо опухоли — например, лимфогранулематоза или неходжкинской лимфомы. В этих случаях говорят о вторичном МДС.
Частота МДС (как и острого миелоидного лейкоза) повышена у людей с определенными генетическими аномалиями, такими как синдром Дауна, анемия Фанкони, нейрофиброматоз и некоторые другие.
Изучается роль и других факторов в возникновении этого заболевания – например, воздействия некоторых вредных химических веществ. Но у детей и молодых взрослых эти факторы не играют существенной роли.
Признаки и симптомы
Симптомы и степень их выраженности могут различаться в зависимости от разновидности МДС и конкретного случая. Но большинство наблюдаемых проявлений возникает в результате цитопении, то есть дефицита нормальных клеток крови.
Анемия (недостаток эритроцитов, сниженный уровень гемоглобина) характерна для подавляющего большинства случаев МДС; она проявляется бледностью, утомляемостью, плохой переносимостью физических нагрузок; могут также возникнуть одышка, головокружения, боли в груди и т.п.
Примерно у половины больных встречается нейтропения (то есть пониженное содержание зрелых функциональных нейтрофилов) и поэтому снижена сопротивляемость инфекциям; может обнаруживаться стойкое повышение температуры. Нередко наблюдается и тромбоцитопения, то есть недостаточное содержание тромбоцитов, что ведет к возникновению кровотечений, синяков, петехий (мелкоточечных подкожных кровоизлияний). Возможны и другие симптомы.
Впрочем, в некоторых случаях пациенты с МДС долгое время не замечают существенного ухудшения самочувствия, и тогда проблемы обнаруживаются только в ходе обычного медосмотра по отклонениям от нормы в клиническом анализе крови.
Диагностика
Как правило, поводом к медицинскому осмотру служат жалобы на симптомы, связанные с анемией, причем эта анемия не поддается обычному лечению препаратами железа и витаминами. В клиническом анализе крови снижено количество эритроцитов, может быть также снижено количество лейкоцитов (нейтрофилов) и/или тромбоцитов. Характерно, что при уменьшении числа эритроцитов их размеры и цветовой показатель крови могут быть увеличены. Полезен также подсчет числа ретикулоцитов — незрелых эритроцитов, так как он дает информацию об интенсивности образования новых красных клеток крови.
Для точной диагностики и определения конкретной разновидности МДС необходимо детальное исследование образца костного мозга, взятого в ходе трепанобиопсии: анализируются характер расположения различных клеток («архитектоника» костного мозга), число бластных клеток, содержание кольцевых сидеробластов и других аномальных клеток, степень изменений во всех ростках кроветворения – то есть среди предшественников эритроцитов, гранулоцитов и тромбоцитов, изменения стромы – соединительной ткани костного мозга. Выявленные нарушения могут быть очень разнообразными.
Так как развитие МДС нередко связано с известными хромосомными аномалиями, определенную роль в диагностике и прогнозе играют цитогенетические исследования.
Лечение
Лечение МДС зависит от его конкретной формы. Так, если речь идет об относительно «доброкачественных» разновидностях МДС с небольшим числом бластных клеток, то больные из групп низкого риска могут длительное время сохранять нормальное качество жизни, просто время от времени получая заместительную терапию компонентами крови – эритроцитами и, возможно, тромбоцитами. При перегрузке железом после множественных переливаний необходима соответствующая терапия (десферал, эксиджад). Иногда для стимуляции кроветворения используют факторы роста. При инфекционных осложнениях требуется антибактериальная и противогрибковая терапия. В ряде случаев применяют и другие лекарственные средства.
Если же речь идет о формах болезни, связанных с более высоким риском, то вопрос о лечении таких пацентов достаточно сложен. Химиотерапия с использованием обычных цитостатиков (цитарабин и т.п.) малоэффективна и не приводит к долговременной ремиссии. Общепринятых стандартов химиотерапии при МДС практически не существует. Разрабатываются новые лекарства; в частности, обнадеживающие результаты показало применение дакогена (децитабина). Иногда может применяться иммуносупрессивная терапия и другие методы.
Единственным методом, позволяющим в случае успеха рассчитывать на полное излечение больных с МДС, является аллогенная трансплантация костного мозга – особенно у молодых пациентов, которые лучше переносят эту процедуру и связанные с ней осложнения. Однако аллогенная трансплантация по поводу МДС, как и по поводу других заболеваний, связана с проблемой поиска совместимого донора и с опасностью жизнеугрожающих осложнений.
При трансформации МДС в острый миелоидный лейкоз проводится химиотерапия этого лейкоза. Однако вторичный лейкоз, развившийся из МДС, обычно плохо поддается терапии. В этой ситуации, как правило, также показано проведение аллогенной трансплантации костного мозга, особенно у молодых больных.
Прогноз
Развитие МДС происходит с разной скоростью в зависимости от конкретной разновидности болезни. Если при некоторых формах МДС пациенты могут, особенно при наличии поддерживающей терапии (переливания эритроцитов и т.д.), прожить 5-10 лет, то при более «активных» и злокачественных разновидностях заболевания средняя продолжительность жизни составляет не более года. Особенно плохой прогноз при вторичном МДС. Пациенты могут погибнуть как от проявлений самого МДС, так и от развившегося на его основе острого миелоидного лейкоза.
При использовании аллогенной трансплантации костного мозга можно добиться нормализации кроветворения и стойкой ремиссии болезни более чем у половины молодых пациентов. Иными словами, в случае успеха трансплантация приводит к выздоровлению. Однако надо помнить о высокой вероятности жизнеугрожающих осложнений (таких как реакция «трансплантат против хозяина») и рецидивов после трансплантации.
Миелодиспластический синдром: рефрактерная анемия, признаки, лчение
Совокупность заболеваний, для которых отличительной чертой является уменьшение одного или нескольких видов клеток в периферической крови (цитопения) и нарушение процессов развития клеток-предшественниц в костном мозге, называется «Миелодиспластический синдром» (МДС). Рефрактерная анемия включена в группу этих заболеваний, и ее наличие может обернуться острым лейкозом.
Рефрактерная анемия
Миелодиспластический синдром встречается у людей в возрастной категории от шестидесяти лет, но может быть и у тридцатилетних.
Причины мдс
До сих пор не установлено, что же является основным фактором в возникновении миелодиспластического синдрома. Однако, принято считать, что мдс бывает первичным и вторичным. Первичный тип возникает спонтанно, и составляет 80-90% всех случаев патологии, а вторичные встречаются реже, и, как правило, являются осложнениями химиотерапии или следствием наследственной предрасположенности.
Способствующими факторами, оказывающими влияниями на развитие болезни бывают:
- хроническое отравление бензином, пестицидами, органическими растворителями;
- пожилой и старческий возраст;
- действие ионизирующей радиации;
- генетически обусловленные болезни крови.
Что происходит во время мдс
Физиологические процессы работы костного мозга сопровождаются выработкой стволовых клеток, из которых развиваются необходимые компоненты крови. Дисплазия костного мозга приводит к нарушению нормального образования кровяных клеток — эритроцитов, лейкоцитов и тромбоцитов. В результате этой патологии нарушается процесс созревания стволовых клеток, из-за чего в кровяное русло выходят незрелые клетки, которые не в состоянии справляться со своими функциями.
Интересные статьи
Типы миелодиспластического синдрома
Согласно классификации, принятой Всемирной организацией охраны здоровья, различают следующие подтипы мдс:
- рефрактерная анемия;
- рефрактерная анемия с кольцевыми сидеробластами;
- рефрактерная анемия с избытком бластов;
- рефрактерная анемия с избытком бластов в трансформации;
Признаки рефрактерной анемии
К общим симптомам всех подвидов мдс относятся слабость, повышенная утомляемость, бледность кожи и слизистых оболочек, повышение температуры тела, склонность к кровотечениям и кровоизлияниям, а также увеличение печени и селезенки.
Анемия Как лечить анемию?
Анемия-Симптомы и Лечение
9 ВОЗМОЖНЫХ ПРИЗНАКОВ АНЕМИИ, НЕЗАМЕТНЫХ НА ПЕРВЫЙ ВЗГЛЯД
Железодефицитная анемия 1
Анемия .Симптомы .Причины .Лечение
Причины анемии — Доктор Комаровский
Железодефицитная анемия | Что делать | Как лечить | Симптомы | беременности | Болезнь | Доктор Фил
О самом главном: Анемия, ком в горле, сосудистые звездочки на лице
Анемия или малокровие можно вылечить народными средствами
Вегетарианство/Анемия/Медленная смерть
Анемия. Симптомы и виды анемии
Чем страшна анемия
Анемия, лечение
О самом главном: Анемия, часто болит живот, сухость во рту
Все о крови. Анемия. Гемоглобин. Ольга Бутакова АКАДЕМИЯ ЗДОРОВЬЯ
Питание при анемии
АНЕМИЯ. КАК ЛЕЧИТЬ. СИМПТОМЫ. АНАЛИЗЫ. ФГС. КАПЕЛЬНИЦА.ТАБЛЕТКИ. ВЫПАДЕНИЕ ВОЛОС #анемия
В 12 -ДЕФИЦИТНАЯ АНЕМИЯ
Анемия. Как повысить гемоглобин натуральными средствами?
Торсунов О.Г. О причинах железодефицитной анемии
Для рефрактальной анемии характерно отсутствие лечебного эффекта при употреблении железосодержащих и витаминных препаратов. Анализ крови покажет небольшую дисплазию лишь одного класса кровяных клеток, а в пунктате костного мозга численность бластов будет менее 5 %.
При рефрактерной анемии с сидеробластами будут нарушения только в эритроцитарном ряду кроветворения, а также присутствие более 15% сидеробластов (аномальных эритроцитов с включением гранул железа). Этот вид анемии считается наиболее благоприятным.
Рефрактерная анемия с избытком бластов разделяется на две подгруппы, критерии которых определяются числом бластных клеток в костном мозге. У пациентов первой группы содержание бластов составляет 5-9%, во второй группе – 10-19%.
Рефрактерная анемия с избытком бластных клеток в трансформации характеризуется показателями 5% этих клеток в периферической крови и 20-30% в пунктате костного мозга. Кроме этого, определяются палочки Ауэра в клетках-предшественниках гранулоцитов.
Диагностика мдс
Уточнение диагноза проводят при наличии признаков анемии, а также с помощью лабораторного исследования крови, пункции костного мозга с целью его гистологического и цитологического анализа, а также определение хромосомных патологий в периферической крови путем цитогенетического исследования.
Лечение миелодиспластического синдрома
Единственный способ решить проблему миелодиспластического синдрома – это пересадка костного мозга. Остальные методы направлены на контроль признаков, предотвращение осложнений и улучшение качества жизни пациентов. Выбор схемы интенсивности лечения проводится с учетом возраста больного, а также при сопоставлении риска и пользы. Терапия пациентов с мдс осуществляется онкологом и гематологом. Раннее начало лечения повышает шанс на успешную ремиссии миелодиспластического синдрома.
Низкоинтенсивная терапия нацелена на уменьшение признаков анемии, и включает переливание эритроцитарной массы, тромбоцитов, введение эритропоэтинов. Также используются химиотерапевтические средства в минимальных дозах (Цитарабин, Децитарабин).
Лечение высокой интенсивности соответствует схемам химиотерапии при остром миелобластном лейкозе.
Миелодиспластический синдром: прогноз болезни
Прогностические данные при миелодиспластическом синдроме напрямую будут обуславливаться типом патологии, возрастом больного и его сопутствующими болезнями.
