Об использовании — Центр крови
Собранная донорская кровь не поступает в больницы непосредственно в виде цельной крови. Сначала ее компоненты отделяют друг от друга. Данный метод во-первых позволяет обеспечить пациента именно теми компонентами крови, в которых он в данный момент нуждается, а во-вторых помогает рационально использовать кровь, исключая ее введение при переливании в излишнем количестве.
Объем крови взрослого человека составляет от четырех до пяти литров; из них при донорском заборе крови берется 450 мл, что составляет в среднем 7-13% от общего объема крови (в зависимости от массы тела) и не представляет опасности для организма.
Кровь состоит из жидкой части, то есть плазмы (вода, питательные и остаточные вещества, белки, свертывающие вещества), и кровяных клеток, которые в свою очередь делятся на:
- красные кровяные тельца (эритроциты), осуществляющие транспортировку кислорода в организме;
- кровяные пластинки (тромбоциты), которые являются существенными для свертывания крови, и
- белые кровяные тельца (лейкоциты), выполняющие в организме функцию защиты от возбудителей болезней. Лейкоциты в отдельном виде от одного человека к другому в Эстонии не переливают.
После центрифугирования компоненты крови разделились на слои согласно своему весу: нижний темно-красный слой образуют красные кровяные тельца, в середине тонкий сероватый слой кровяных пластинок и лейкоцитов и на самом верху желтая плазма
Из цельной крови приготовляют обычно три основных компонента: эритроцитная суспензия, свежезамороженная плазма и концентрат тромбоцитов. Таким образом, донор имеет возможность одной сданной дозой крови помочь по меньшей мере трем пациентам.
После забора крови количество плазмы восстанавливается в среднем через 24 часа, а число кровяных клеток — в среднем в течение трех недель.
Компоненты сохраняются при разных условиях – это является еще одной причиной для их разделения: для сохранности эритроцитов требуется обыкновенная температура холодильника; для плазмы необходима морозильная камера, а для тромбоцитов нужна комнатная температура при постоянном покачивании.
Для сохранения компонентов применяются специальные питательные растворы, в течение определенного времени обеспечивающие биологическую полноценность клеток и пригодность материала для переливания. Поскольку донорская кровь сохраняется качественной лишь в течение короткого времени, Центр крови ежедневно нуждается в пополнении ее запасов.
Субпопуляционный состав лейкоцитов крови и ее продуктов
Периферическая кровь или цельная кровь содержит различные клетки крови, такие как эритроциты (красные кровяные клетки), лейкоциты (белые кровяные клетки) и тромбоциты, взвешенные в плазме крови. Плазма состоит в основном из воды, но также содержит белки, глюкозу, ионы, гормоны и факторы свертывания крови. Удаление факторов свертывания из плазмы приводит к образованию сыворотки крови.
Наиболее распространенными клетками в крови являются эритроциты, в состав которых входит гемоглобин, железосодержащий белок. Гемоглобин обратимо связывает кислород и тем самым облегчает его транспортировку по организму.
Тромбоциты играют важную роль в восстановлении ран, так как они останавливают кровотечение путем слипания и свертывания крови в сосудах. Тромбоциты млекопитающих не имеют ядра. Они состоят из участков цитоплазмы, которые получают из мегакариоцитов в костном мозге до поступления в кровообращение. Примерно 25-40% тромбоцитов находятся в селезенке и высвобождаются по мере необходимости, а остальные свободно циркулируют в крови около десяти дней.
Наконец, различные подтипы лейкоцитов играют существенную роль в иммунном ответе.
Все клеточные компоненты крови происходят из гемопоэтических стволовых клеток (ГСК). Эти плюрипотентные клетки располагаются в костном мозге и дают начало специализированным клеткам-предшественникам с более ограниченным потенциалом: лимфоидным клеткам-предшественникам и миелоидным клеткам-предшественникам. В свою очередь лимфоидные клетки-предшественники дают начало Т-и В-лимфоцитам, а также и естественным киллерам (NK-клеткам), тогда как миелоидные клетки-предшественники дают начало моноцитам, дендритным клеткам и гранулоцитам (включая нейтрофилы, базофилы и эозинофилы).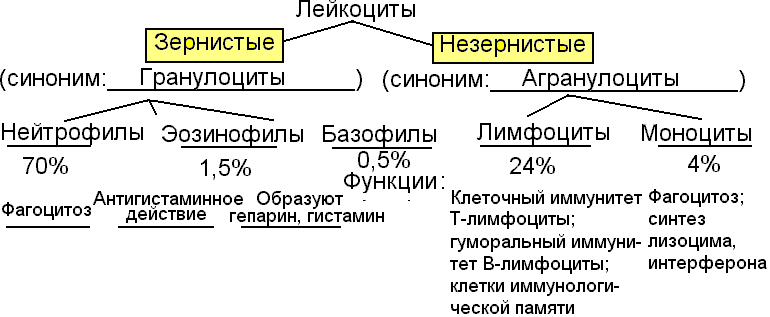 Наконец, эритроциты и тромбоцит-продуцирующие мегакариоциты, происходят от их общего предшественника.
Наконец, эритроциты и тромбоцит-продуцирующие мегакариоциты, происходят от их общего предшественника.
1 Лейкоциты
Лейкоциты играют ключевую роль в иммунном ответе и поэтому представляют особый интерес для понимания механизмов баланса здоровья и болезни. Для проведения исследований часто требуется проводить выделение лейкоцитов из крови или ее продуктов. Классификация лейкоцитов может быть основана на их происхождении (миелоидные или лимфоидные) или на морфологии их ядра (мононуклеарные или полинуклеарные) и наличии или отсутствии гранул в их цитоплазме, что разделяет лейкоциты на две группы: 1) мононуклеарные клетки периферической крови (PBMCs, также известные как агранулоциты) и 2) полиморфноядерные лейкоциты (PMNs, также известные как гранулоциты).
1.1 Мононуклеарные клетки периферической крови (PBMCs)
PBMCs включают лимфоциты (Т, В и NK-клетки), моноциты и дендритные клетки. Т-и В-лимфоциты отличаются местом своего созревания и антигенными рецепторами. Т-клетки созревают в тимусе и экспрессируют Т-клеточный рецептор TCR, тогда как В-клетки созревают в костном мозге и несут В-клеточный рецептор BCR.
Т-клетки являются CD3+ и далее классифицируются на хелперные Т-клетки (Th), экспрессирующие CD4, и цитотоксические Т-клетки (Tcyt), экспрессирующие CD8. В-клетки характеризуются экспрессией молекулы CD19 и реагируют на патогены, производя большое количество антигенспецифических антител для нейтрализации чужеродных объектов, таких как бактерии и вирусы, а также опсонизируют (маркируют) их для дальнейшего распознавания другими иммунными клетками. NK-клетки являются CD56+CD3-и происходят из тех же клеток-предшественников, что и Т-и В-клетки, но не имеют антигенных рецепторов. Наконец, моноциты являются самым крупным типом PBMCs и экспрессируют молекулу CD14 на своей поверхности. Они циркулируют в кровотоке в течение 1-3 дней, а затем обычно перемещаются в ткани по всему телу, где они могут дифференцироваться в макрофаги и миелоидные дендритные клетки.
Различные субпопуляции PBMCs
Тип клеток | % от PBMCs (вариабельность по здоровым донорам) | Маркеры | Функция |
| CD4+ T клетки | 25–60% | CD3+CD4+ | Координируют адаптивный иммунитет через активацию и регуляцию других иммунных клеток |
| CD8+ T клетки | 5–30% | CD3+CD8+ | Уничтожают раковые клетки, инфицированные или поврежденные клетки |
| B клетки | 5–10% | CD19+ | Секретируют антитела как часть гуморального иммунного ответа |
| NK клетки | 10–30% | CD56+ CD3— | Вызвают лизис или апоптоз инфицированных клеток |
| Моноциты | 5–10% | CD14+ | Захватывают чужеродные объекты посредством фагоцитоза, выполняют презентацию антигена и продуцируют цитокины |
| Дендритные клетки | 1–2% | Процессинг и презентация антигенного материала Т-клеткам |
1.2 Гранулоциты
Гранулоциты характеризуются наличием гранул в их цитоплазме и переменной формой ядра; отсюда и название — полиморфноядерные лейкоциты (PNMs). Нейтрофилы, эозинофилы и базофилы — это все гранулоциты, которые при активации высвобождают содержимое своих гранул. Нейтрофилы являются наиболее распространенными лейкоцитами крови и первыми реагируют на очаг воспаления, где они выполняют свою фагоцитарную функцию. Считается, что эозинофилы (также известные как ацидофилы) участвуют в нападении на многоклеточных паразитов, таких как черви. Базофилы связаны со многими специфическими воспалительными реакциями, особенно теми, которые вызывают аллергические симптомы. Базофилы содержат антикоагулянт гепарин, который препятствует слишком быстрому свертыванию крови, а также сосудорасширяющий гистамин, который способствует притоку крови к тканям.
2 Содержание лейкоцитов в крови и в продуктах крови
Наиболее часто используемый источник лейкоцитов-периферическая цельная кровь. Однако в качестве источников все чаще используются продукты крови, такие как лейкоцитарно-тромбоцитарный концентрат (Buffy Coat), лейкоциты из камеры системы удаления лейкоцитов (LRSC) и материал для лейкафереза, такой как Лейкопак (Leukopak®). Для некоторых направлений, например, исследования стволовых клеток, пуповинная кровь и костный мозг лучше подходят в качестве исходного материала. Количество и состав клеток различаются между кровью и различными продуктами крови. Поскольку к каждому прикладному или исследовательскому вопросу предъявляются особые требования в отношении количества и состава клеток, источник лейкоцитов должен быть выбран соответствующим образом.
Типы клеток, абсолютное количество, и встречаемость в цельной крови и ее продуктах
| Цельная кровь | Buffy coat | LRSC | Лейкопак® | ||
| Эритроциты | Абсолютное кол-во | 5×109 cells/mL | 4×1011 cells/buffy coat | 5×1010 cells/LRSC | 8×109 cells/половина Лейкопак® |
| По отношению к PBMCs | 2500 | 400 | 50 | 1.2 | |
| PBMCs | Абсолютное кол-во | 2×106 cells/mL | 1×109 cells/buffy coat | 1×109 cells/LRSC | 7×109 cells/половина Лейкопак® |
| По отношению к PBMCs | 1 | 1 | 1 | 1 | |
| Лейкоциты | Абсолютное кол-во | 5×106 cells/mL | 2×109 cells/buffy coat | 1×109 cells/LRSC | 7×109 cells/половина Лейкопак® |
| По отношению к PBMCs | 2.5 | 2 | 1 | 1 |
Средние частоты общего количества лейкоцитов в различных продуктах крови.
| Цельная кровь | Buffy coat | LRSC | Лейкопак® | |
| Общие T клетки | 22.5±3.8% | 53.8±6.1% | 53.8±6.1% | 54.5±12.4% |
| CD4+ T клетки | 14.6±3.5% | 24.4±6.6% | 32.4±6.6% | 31.9±6.4% |
| CD8+ T клетки | 6.8±1.3% | 10.8±4.6% | 15.0±4.5% | 17.1±8.1% |
| B клетки | 5.2±2.3% | 7.2±2.4% | 11.3±3.3% | 12.5±4.6% |
| Моноциты | 8.4±1.3% | 10.7±2.8% | 20.3±5.7% | 19.1±7.1% |
| NK клетки | 4.4±2.4% | 4.1±2.4% | 10.2±4.0% | 7.7±3.0% |
| CD3+CD56+ клетки | 0.8±0.7% | 1.4±2.1% | 1.8±1.3% | 4.3±7.1% |
| Эозинофилы | 3.2±1.6% | 1.3±0.8% | 1.9±2.3% | 1.1±0.9% |
| Нейтрофилы | 53.8±6.1% | 34.4±11.4% | 2.9±1.7% | 3.9±3.4% |
Частоты (% популяции) клеток определяли методом проточной цитометрии с использованием 7-цветного набора для Иммунофенотипирования клеток человека; количество лейкоцитов и эритроцитов определяли на Sysmex ® XP-300. Цифры указывают на проценты ± стандартное отклонение (n ≥ 10).
2.1 Цельная кровь
Все основные популяции иммунных клеток можно обнаружить в наиболее естественном состоянии в свежеприготовленной периферической крови. Однако типичный образец цельной крови редко превышает 10 мл и часто может быть меньше, особенно если донором является ребенок. Большие объемы могут быть получены от здоровых доноров, но обычно на одно донорство берется не более 500 мл. Это значительно ограничивает частоту встречаемости редких клеток, которые могут быть выделены из цельной крови. Преимуществом цельной крови, как источника, является свежесть материала, что очень важно для работы с чувствительными клеточными популяциями, такими как, например, нейтрофилы.
Антикоагулянты обычно добавляются к крови для предотвращения свертывания. Гепарин, этилендиаминтетрауксусная кислота (ЭДТА) и цитрат являются одними из наиболее часто используемых добавок. Гепарин связывается с ингибитором фермента антитромбином III (АТ), что приводит к конформационным изменениям внутри белка АТ и в конечном счете к его активации. Активированный АТ инактивирует тромбин, фактор Ха и другие протеазы, участвующие в свертывании крови. ЭДТА сильно и необратимо хелатирует двухвалентные катионы, такие как Са2+, тем самым предотвращая свертывание крови. Наконец, цитрат также используется для связывания Ca2+.
2.2 Лейкоцитарно-тромбоцитарный концентрат (Buffy coat)
Лейкоцитарно-тромбоцитарный концентрат или Buffy coat -это фракция образца крови, содержащая лейкоциты после удаления эритроцитов и плазмы. После донорства мешок с 450-мл крови центрифугируют, в результате чего получают три фракции: I) плазму (верхняя фракция), ii) Buffy coat (промежуточная фракция) и ii) эритроциты (нижняя фракция). Как правило, банки крови интересуются только плазмой и эритроцитами. Поэтому эти части извлекаются из кровяного мешка. Оставшийся материал – это и есть Buffy coat, состоящий из концентрированных лейкоцитов и тромбоцитов с уменьшенным количеством эритроцитов и гранулоцитов, объем которого колеблется в диапазоне от 30 до 80 мл. Легкодоступный лейкоцитарно-тромбоцитарный концентрат является популярным источником PBMCs для исследований.
2.3 Лейкоциты из камеры системы удаления лейкоцитов (LRSC)
LRSC, также известный как buffy cone, является побочной фракцией клеток в процессе тромбоцитарного фереза, при котором тромбоциты отделяются и собираются из взятой крови для последующего переливания пациентам с нарушениями, связанными с тромбоцитами. Отделенная фракция тромбоцитов все еще содержит лейкоциты, которые должны быть удалены до переливания тромбоцитов, чтобы предотвратить проблемы с отторжением. С этой целью лейкоциты отфильтровываются лейкоредукцией и собираются в специальной камере — LRSC.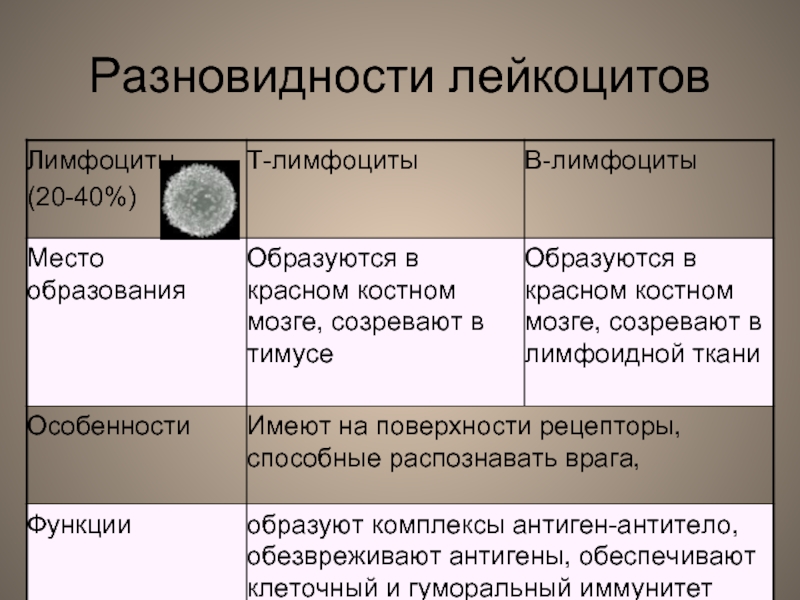 Таким образом, LRSC содержит высокую плотность лейкоцитов с низкой концентрацией нейтрофилов.
Таким образом, LRSC содержит высокую плотность лейкоцитов с низкой концентрацией нейтрофилов.
2.4 Leukopak®
Хорошим источником большого количества лейкоцитов являются коммерчески доступные Лейкопаки®. Это обогащенный продукт лейкафереза, собранный из периферической крови и состоящий из различных клеток крови, включая моноциты, лимфоциты и эритроциты. Соотношение лейкоцитов и эритроцитов низкое (в среднем 1:1), как и количество гранулоцитов. Коммерческие Лейкопаки® выпускаются в нескольких стандартных размерах, начиная от целого Лейкопака® до размеров ½ и ¼. Хотя количество PBMCs в Лейкопаке® является переменным, оно обычно остается в определенном диапазоне.
В некоторых случаях донорам вводят G-CSF (гранулоцитарный колониестимулирующий фактор), чтобы индуцировать выработку лейкоцитов и вызвать миграцию стволовых клеток из костного мозга в кровь. Таким образом, мобилизованные Лейкопаки® имеют более высокое количество лейкоцитов по сравнению с иммобилизованными Лейкопаками®, и частоты различных подтипов PBMC также различаются. Большинство Лейкопаков® получают от здоровых доноров, но также можно запросить Лейкопакс® для некоторых заболеваний, таких как аллергия и диабет.
3 Пуповинная кровь как источник лейкоцитов
Пуповинная кровь остается в плаценте и пуповине после рождения и собирается для сохранения стволовых клеток, которые могут быть использованы при лечении гемопоэтических и генетических нарушений. Пуповинная кровь содержит все компоненты цельной крови, включая лейкоциты, а также богата CD34+ гемопоэтическими стволовыми клетками. Несмотря на то, что количество CD34+ клеток сильно варьируется от донора к донору, обычно можно собрать от 1 до 4 миллионов CD34+ клеток с одной пуповины. Пуповинная кровь все чаще используется на экспериментальной основе в качестве альтернативного источника стволовых клеток, которые в противном случае получают из костного мозга.
4 Костный мозг как ресурс лейкоцитов
Костный мозг (КМ) – это полутвердая ткань, расположенная в губчатых частях костей и являющаяся основным местом кроветворения. Помимо костномозговой жировой ткани и поддерживающих стромальных клеток, КМ содержит мезенхимальные (МСК) и гемопоэтические стволовые клетки (ГСК). ГСК дают начало различным клеткам крови, включая лейкоциты. МСК дифференцируются в клетки скелетных тканей, включая клетки хрящей (хондроциты), костные клетки (остеобласты) и жировые клетки (адипоциты). Мононуклеарные клетки КМ, которые включают лейкоциты, а также стволовые и прогениторные клетки, можно отделить от эритроцитов и гранулоцитов путем центрифугирования в градиенте плотности.
Помимо костномозговой жировой ткани и поддерживающих стромальных клеток, КМ содержит мезенхимальные (МСК) и гемопоэтические стволовые клетки (ГСК). ГСК дают начало различным клеткам крови, включая лейкоциты. МСК дифференцируются в клетки скелетных тканей, включая клетки хрящей (хондроциты), костные клетки (остеобласты) и жировые клетки (адипоциты). Мононуклеарные клетки КМ, которые включают лейкоциты, а также стволовые и прогениторные клетки, можно отделить от эритроцитов и гранулоцитов путем центрифугирования в градиенте плотности.
Скачать PDF: Isolation of mononuclear cells from human bone marrow aspirates by density gradient centrifugation (special protocol)
5 Пробоподготовка крови
Для выделения клеток-мишеней можно использовать непосредственно цельную кровь. Однако в некоторых случаях использование именно фракции PBMC в качестве стартового материала для выделения определенного типа клеток может быть более эффективным. PBMCs могут быть получены из цельной крови путем центрифугирования в градиенте плотности или путем лизиса эритроцитов, хотя последний способ считается “быстрым и грязным” методом.
В наиболее распространенном методе центрифугирования, с использованием градиента плотности используется раствор высокомолекулярных полимеров сахарозы Ficoll Paque® (Фиколл). Образец крови центрифугируют в пробирке, содержащей фиколл, чтобы разделить его компоненты в соответствии с их плотностями. Эритроциты имеют более высокую плотность, чем плазма, и поэтому оседают в нижней части пробирки и могут составлять до 45% от общего объема (в крови от здоровых доноров). Этот процент объема известен как гематокрит. Лейкоциты и тромбоциты образуют узкий слой с кольцом непосредственно над эритроцитами. Как уже упоминалось ранее, этот слой называется Buffy coat или лейкоцитарно-тромбоцитарный слой. Наконец, плазма составляет чуть менее 55% от общего объема и представляет собой бледно-желтую жидкость. Лейкоцитарно-тромбоцитарный слой содержит лимфоциты, моноциты и тромбоциты. Этот слой аккуратно собирается центрифугируется дважды в буферном солевом растворе, чтобы промыть PBMCs от градиента плотности и удалить тромбоциты. Полученные PBMCs могут быть использованы для дальнейшего выделения клеточных субпопуляций или других экспериментов.
Этот слой аккуратно собирается центрифугируется дважды в буферном солевом растворе, чтобы промыть PBMCs от градиента плотности и удалить тромбоциты. Полученные PBMCs могут быть использованы для дальнейшего выделения клеточных субпопуляций или других экспериментов.
Скачать PDF: Isolation of mononuclear cells from human peripheral blood by density gradient centrifugation (special protocol)
Физиология человека и животных » Строение и функции лейкоцитов. Лейкоцитарная формула
Лейкоциты – это так называемые «белые» клетки крови диаметром 20 – 70 мкм. Они имеют ядро и цитоплазму. У взрослого человека натощак содержится 4 – 9 x 109/л лейкоцитов.
Увеличение содержания лейкоцитов в единице объема крови свыше 9 x 109/л называется
Именно лейкоциты формируют в организме кровяной и тканевой барьеры против микробной, вирусной и паразитарной (гельминтной) инфекции, поддерживают тканевой гомеостазис и регенерацию тканей. Все виды лейкоцитов способны к амебоидному движению.
Главные функции лейкоцитов:
1) фагоцитоз;
2) продукция антител;
3) разрушение и удаление токсинов белкового происхождения.
Лейкоциты делятся на две группы:
1) зернистые (гранулоциты): эозинофилы, базофилы, нейтрофилы, срок жизни до 30 ч, образуются в костном мозге.
2) незернистые (агранулоциты): моноциты и лимфоциты, срок жизни в крови – 40 ч., в тканях – до 3 недель, образуются в костном мозге, лимфоузлах, селезенке.
Они различаются по происхождению и функциям.
Гранулоциты:
Эозинофилы
– 1 – 4 % всех лейкоцитов: разрушают и обезвреживают токсины белкового происхождения и чужеродные белки. Под влиянием этих чужеродных белков количество эозинофилов увеличивается – эозинофилия (например, при аллергии, наличии глистов).
Базофилы (0 – 1 %) содержат в протоплазме гранулы с гепарином, поэтому препятствуют свертыванию крови в очаге воспаления, а это способствует процессам заживления. Количество базофилов возрастает при гемофилии. Срок жизни – 12 часов.
Нейтрофилы (70 %) находятся в крови 6 – 8 часов, т.к. мигрируют в слизистые оболочки. Продолжительность жизни около 13 суток. Их основная функция – фагоцитоз и внутриклеточное переваривание чужеродных клеток. Несмотря на свои достаточно большие размеры, нейтрофилы обладают способностью проникать через стенку эндотелия капилляров и активно продвигаться в тканях к месту проникновения микробов. Дойдя до микроба, нейтрофилы захватывают его и переваривают. Этот процесс называется
Нейтрофилы являются самыми мощными факторами неспецифической клеточной защитной системы крови. Их число резко возрастает при острых воспалительных процессах. Они первыми прибывают в очаг воспаления. В норме в крови обнаруживаются не только зрелые (сегментированные) формы нейтрофилов, но и немного их предшественников – незрелых клеток: палочкоядерные нейтрофилы (3-5 %) и юные (0 – 1 %).
Агранулоциты:
Моноциты (4 – 8 %) проникают к месту воспаления из крови и превращаются в макрофаги – гигантские клетки-фагоциты. При развитии воспаления и накоплении в очаге воспаления недоокисленных продуктов распада реакция среды становится более кислой, при этом нейтрофилы снижают свою активность. Макрофаги, наоборот, наиболее активны в кислой среде, поэтому при развитии воспаления они как бы приходят на смену нейтрофилам.
Лимфоциты (21 – 35 %) являются главным звеном и клеточной, и гуморальной специфических защитных систем организма. Продолжительность их жизни составляет несколько лет. Лимфоциты имеют на мембране рецепторы, позволяющие отличать «свое» и «чужое».
Продолжительность их жизни составляет несколько лет. Лимфоциты имеют на мембране рецепторы, позволяющие отличать «свое» и «чужое».
Лейкоцитарная формула (схема 1). Ее определяют на основании подсчета 200 лейкоцитов в окрашенном мазке крови и выражают в процентах содержание отдельных форм лейкоцитов:
Схема 1
Патологические изменения со стороны лейкоцитов могут проявляться в виде лейкоцитоза или лейкопении. Лейкоцитоз, как правило, свидетельствует о наличии воспалительного процесса в организме, а лейкопения – о нарушении образования лейкоцитов.
Показатели клинического анализа крови
Анализ крови – привычная медицинская процедура. Первый раз мы проходим ее еще в раннем детстве. При этом сама суть и значение этого вида диагностики для обывателя достаточно абстрактны. В этой статье мы расскажем о том, зачем берут анализ крови, какие показатели определяют, а также о чем говорят те или иные результаты.
Любые отклонения, происходящие в нашем организме, отражаются на биологических жидкостях – слюне, моче, крови. При этом ряд заболеваний на ранних стадиях протекает бессимптомно. Больной может не замечать начинающихся изменений. А вот кровь «чувствует», ее биохимические показатели реагируют на заболевание одними из первых. Таким образом, вовремя сдав общий анализ, можно заблаговременно выявить отклонения в организме и начать правильное лечение.
Общий анализ крови с исследованием лейкоцитарной формулы включает в себя следующие основные показатели: гемоглобин, эритроциты, тромбоциты, лейкоциты, лейкоцитарная формула (нейрофилы, эозинофилы, базофилы, лимфоциты и моноцициты), СОЭ.
Чуть подробнее расскажем о каждом из них.
СОЭ
Скорость оседания эритроцитов является одним из наиболее популярных лабораторных тестов. Повышенная скорость оседания свидетельствует о наличие хронического или острого воспалительного процесса. СОЭ может повышаться при беременности, инфекционном заболевании, воспалительном процессе, анемии, образовании опухоли и др.
СОЭ может повышаться при беременности, инфекционном заболевании, воспалительном процессе, анемии, образовании опухоли и др.
Лейкоциты
Лейкоциты — это белые кровяные тельца. Основная их функция заключается в защите организма от микробов и чужеродных веществ. Высокое количество лейкоцитов (лейкоцитоз) наблюдается при инфекционных заболеваниях и воспалениях различной локализации. При этом повышение лейкоциты не всегда свидетельствует о болезни — при беременности, после физической нагрузки или пережитого стресса их количество также возрастает.
Состояние организма, когда наблюдается пониженное содержание лейкоцитов в крови, называется лейкопенией. Причиной этого могут быть онкологические, аутоиммунные, некоторые инфекционные заболевания, патология костного мозга, прием медицинских препаратов и др.
Лейкоцитарная формула
При общем анализе крови оценивается не только уровень лейкоцитов вообще, но и процентное соотношение количества различных видов: нейтрофилов, лимфоцитов, эозинофилов, базофилов и моноцитов. Все типы лейкоцитов выполняют разные функции, в связи с этим, по изменениям пропорций их содержания в крови врач может определить характер патологического процесса в организме больного человека.
Эритроциты
Главная функция эритроцитов — транспортировка и отдача кислорода тканям и органам.
Повышение количества эритроцитов
наблюдается при патологии костного мозга, обезвоживании, почечных заболеваниях, нехватке кислорода в организме из-за легочных болезней, сердечно-сосудистых патологий или курения, снижение – при анемии вследствие потери крови, недостатке железа и витаминов.Гемоглобин
Гемоглобин – белок, содержащийся в эритроцитах. Его главная функция заключается в том, чтобы связываться с кислородом и переносить его к тканям, а также в выведении углекислого газа из организма. Обычно, пониженный уровень гемоглобина в крови, можно предположить по внешним признакам и симптомам – бледность, головокружение, сухая кожа, быстрая утомляемость. Такое состояние часто называют «малокровием» или анемией.
Такое состояние часто называют «малокровием» или анемией.
Повышение уровня гемоглобина встречается реже и может быть связано со «сгущением» крови (обезвоживание), эритроцитозами, при физиологических состояниях (у жителей высокогорных районов, летчиков, альпинистов, после повышенной физической нагрузки, длительного стресса).
Тромбоциты
Эти маленькие безъядерные клетки играют главную роль в свёртывании крови. Когда происходит кровотечение, они, соединяясь друг с другом, формируют сгусток, который закупоривает поврежденную стенку сосуда. Состояние, при котором снижены тромбоциты, сопровождается нарушением системы свертывания крови и ломкостью капилляров. Не меньшую опасность представляет увеличение их количества, приводящее к тромбообразованию в сосудах. Нарушение нормы содержания тромбоцитов может быть вызвано многими опасными заболеваниями, поэтому очень важно вовремя провести анализ крови.
Помните, даже при отсутствии ощутимых симптомов заболевания, врачи рекомендуют сдавать кровь на общий анализ не реже раза в год.
ФЕНОТИПИЧЕСКАЯ ГЕТЕРОГЕННОСТЬ НЕЙТРОФИЛОВ: НОВЫЕ АНТИМИКРОБНЫЕ Х АРАКТЕРИСТИКИ И ДИАГНОСТИЧЕСКИЕ ТЕХНОЛОГИИ | Андрюков
Нейтрофилы, или полиморфнонуклеарные нейтрофилы (ПМН) (polymorphonuclear neutrophils, PMN), являются наиболее многочисленным пулом лейкоцитов и основными клеточными компонентами врожденной иммунной системы человеческого организма и обладают как противоинфекционной, так и провоспалительной функцией [1—4]. Традиционно считалось, что нейтрофилы являются относительно гомогенной популяцией терминально дифференцированных лейкоцитов, что эти клетки, в отличие от лимфоцитов и моноцитов, обладают ограниченной универсальностью и пластичностью [1]. Однако полученные в последние годы данные показали, что ПМН представляют собой фенотипический гетерогенный пул и обладают высокой морфологической и функциональной вариабельностью [2, 3], что позволяет рассматривать нейтрофилы в качестве как важных модуляторов воспаления, так и активных эффекторов иммунных реакций [3, 4].
Еще в 1920 г. высказывались сомнения насчет гомогенности этого лейкоцитарного пула, основанные на сведениях, что циркулирующие нейтрофилы могут демонстрировать значительные различия в функциях, таких как фагоцитоз, синтез белка и окислительный обмен (цит. по [2]). Однако до недавнего времени лишь ограниченное количество исследований касалось фенотипических различий ПМН, и только благодаря обнаружению высокоспецифичных нейтрофильных маркеров стало возможным разделить эту субпопуляцию клеток на подмножества [2—4].
Целью настоящего обзора является обобщить основные концепции фенотипической и функциональной гетерогенности нейтрофилов с позиции их функций и роли в развитии физиологических и патологических реакций. Особое внимание будет уделено диагностической и иммуномодулирующей стратегиям.
Нейтрофилы: созревание и жизненный цикл
В нормальных условиях нейтрофилы образуются в костном мозге из морфологически неидентифицируемых гемопоэтических стволовых клеток, способных пролиферировать и дифференцироваться в белые и красные кровяные клетки и клетки — предшественники миелопоэза (гранулоцитарно-макрофагальная колониеобразующая единица (КОЕ-ГМ) гранулоци- тарная колониеобразующая единица (КОЕ-Г) [3, 5—7]. Деление и созревание этих клеток стимулируются факторами роста (интерлейкинами, гранулоцитарно- макрофагальным колониестимулирующим фактором (ГМ-КСФ) и гранулоцитарным КСФ — основными цитокинами, регулирующим гранулопоэз в норме через рецептор гранулоцитарного колониестимулирующего фактора, что приводит к формированию миелоидных пулов делящихся клеток (миелобластов, промиелоцитов и миелоцитов) и нейтрофилов, которые в процессе дифференцировки утратили способность к делению (метамиелоцитов, палочкоядерных и сегментоядерных гранулоцитов). Неделящийся пул составляет основную массу гранулоцитарного костномозгового резерва, превышающий по численности клетки, циркулирующие в периферической крови, в 30—70 раз [5, 8, 9]. Основные функции костномозгового резерва — поддерживать гомеостаз гранулоцитов («гомеостатический гранулопоэз»), циркулирующих в крови, и мобилизовать дополнительное количество клеток («экстренный гранулопоэз») при возникающей необходимости (воспаление, инфекции, рак и другие) [10, 11].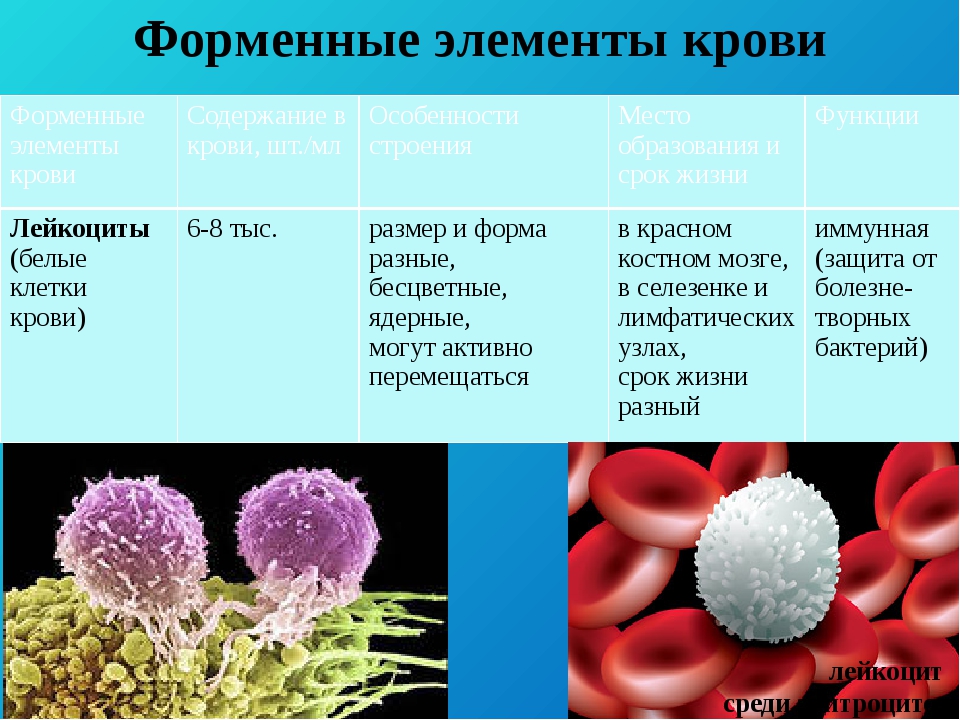 О значении гранулопоэза для организма говорит тот факт, что клетки миелоидных пулов занимают около 2/3 объема костного мозга [10].
О значении гранулопоэза для организма говорит тот факт, что клетки миелоидных пулов занимают около 2/3 объема костного мозга [10].
Для поддержания гомеостаза уровня нейтрофилов других клеток в периферической крови пролиферация и дифференцировка клеток-предшественников жестко регулируется и контролируется несколькими внутренними и внешними факторами. Например, в нишах костного мозга гемопоэтические стволовые клетки сохраняются посредством взаимодействия мембранных β-интегринов с остеобластами и внеклеточным матриксом [4, 12, 13].
После созревания ПМН попадают в периферический кровоток (5х1010—1011 клеток в сутки), мигрируют в ткани, где они выполняют свои антимикробные функции. Соответственно, эквивалентное количество стареющих нейтрофилов должно быть удалено из кровообращения для сохранения гомеостаза. Нейтрофильный гомеостаз в периферической крови строго регулируется благодаря многокомпонентному механизму поддержания баланса между ростом ПМН, их дифференцировкой и элиминацией [4, 12]. Этот баланс обеспечивает выполнение этими клетками многочисленных функций с помощью фенотипической пластичности [3, 13]. Нарушение гомеостаза периферических нейтрофилов влияет на врожденный и адаптивный иммунитет, может привести к возникновению опасных для жизни инфекций, аутоиммунным или онкологическим заболеваниям.
На протяжении всей их жизни нейтрофилы по мере созревания претерпевают фенотипические переходы, которые могут быть продиктованы местным микроокружением в кровообращении и периферических тканях. Во время развития и созревания нейтрофилы проходят ряд последовательных стадий до формирования генерации зрелых нейтрофилов [12, 13]. Гранулопоэтическая популяция нейтрофилов в костном мозге делится на 3 различных пула: стволовых клеток, митотический и постмитотический. Пул стволовых клеток состоит из недифференцированных полипотентных клеток-предшественников. Митотический пул представлен миелоидными клетками-предшественниками, такими как миелобласты, промиелоциты, метамиелоциты и миелоциты. Постмитотический пул состоит из метамиелоцитов и палочкоядерных нейтрофилов. Наконец, зрелые нейтрофилы являются полностью дифференцированной клеточной генерацией, которая выходит из костного мозга и циркулирует в периферической крови.
Постмитотический пул состоит из метамиелоцитов и палочкоядерных нейтрофилов. Наконец, зрелые нейтрофилы являются полностью дифференцированной клеточной генерацией, которая выходит из костного мозга и циркулирует в периферической крови.
По мере созревания и на разных стадиях диффе- ренцировки в цитоплазме нейтрофилов появляются гранулы (азурофильные, специфические и желати- назные) и секреторные пузырьки, которые содержат антимикробные пептиды и ферменты: эластазы, мие- лопероксидазы, кателицидины, дефензины и матрикс- ные металлопротеиназы, являющиеся эффективным инструментом для реализации антибактериальных стратегий ПМН [2, 10, 12].
Гранулярный аппарат нейтрофилов необходим для выполнения ими своей роли при врожденном иммунном ответе. Биологические молекулы, входящие в состав гранул, реагируют на окружающие сигналы, стимулирующие миграцию нейтрофилов к очагу инфекции и фагоцитоз вторгающихся микробов, инициируют генерацию активных форм кислорода из НАДФН-оксидазы, протеаз и антимикробных пептидов, которые, действуя совместно, создают агрессивную внутрифагосомальную среду и вызывают микробную эрадикацию [10, 13—16].
Важность образования активных форм кислорода проявляется при хронических гранулематозных заболеваниях с дефектной окислительной функцией ПМН. Для этих пациентов характерны частые рецидивирующие бактериальные и грибковые инфекции [4, 12, 14].
Являясь важными эффекторами иммунной системы, нейтрофилы ведут постоянный мониторинг организма, выявляя признаки микробных инфекций. После их обнаружения они мигрируют через эндотелий кровеносных сосудов в очаг инфекции или воспаления с помощью механизма, известного как каскад адгезии лейкоцитов (в котором принимают также участие селектины, лиганды и интегрины), и убивают вторгшиеся микроорганизмы [2, 5, 15, 16].
Миграция нейтрофилов в ткани имеет решающее значение для защиты от микробных инфекций. Важность этой функции проявляется у больных с дефектами адгезии этих клеток, что приводит к нарушению их миграции через эндотелий кровеносных сосудов. Такие больные страдают от множественных бактериальных инфекций из-за неспособности нейтрофилов к фагоцитозу [17, 18].
Такие больные страдают от множественных бактериальных инфекций из-за неспособности нейтрофилов к фагоцитозу [17, 18].
После выполнения своей функции в тканях нейтро- филы подвергаются апоптозу или элиминируются посредством фагоцитоза резидентными макрофагами и дендритными клетками. Запрограммированная гибель нейтрофилов — апоптоз — критичный процесс, модулирующий их количество и функции, запуская каскад противовоспалительных реакций и снижения продукции нейтрофилов [3, 17, 19—21].
В настоящее время признаны три основные проти- вомикробные стратегии нейтрофилов: фагоцитоз, дегрануляция, и формирование нейтрофильных внеклеточных ловушек (neutrophil extracellular traps, NETs) (рис. 1). NETs представляют собой защитный механизм, впервые описанный как средство улавливания и уничтожения бактерий и других патогенов [11, 22, 23]. Осуществляя такого рода внеклеточный киллинг микроорганизмов, нейтрофилы погибают через NETosis [11, 24].
Рисунок 1. Антибактериальные стратегии нейтрофилов: 1 — фагоцитоз; 2 — дегрануляция; 3 — нейтрофильные ловушки (рисунок авторов, световая микроскопия)
Figure 1. Anfibacferial strategies of neutrophils: I — phagocytosis; 2 — degranulation; 3 — neutrophilic traps (the authors’ picture, light microscopy)
Для выпуска сети активированные нейтрофилы претерпевают драматические морфологические изменения. Через минуты после активации они сплющиваются и крепко прикрепляются к субстрату. В течение следующего часа ядро теряет свои дольки, происходит деконденсация хроматина, а внутренние и внешние ядерные мембраны постепенно отделяются друг от друга. Одновременно гранулы распадаются. Через 1 ч ядерная оболочка дезагрегируется в везикулы, а нук- леоплазма и цитоплазма образуют гомогенную массу. Наконец, клетки округляются и, по-видимому, сжимаются до тех пор, пока клеточная мембрана не разрывается, а внутренняя часть клетки выбрасывается во внеклеточное пространство, образуя NETs [25].
Эти противомикробные стратегии до настоящего времени считались единственной функцией нейтро- филов. Однако недавние исследования биологии этих клеток показали, что они обладают разнообразным набором функциональных реакций, которые выходят за рамки простого уничтожения микроорганизмов [17, 18, 25].
Широкий спектр функциональных ответов нейтро- филов индуцируется активацией транскрипции и изменениями в экспрессии поверхностных молекул и их активности. Эти фенотипические изменения обычно обнаруживаются только в подгруппе нейтрофилов, что позволяет предположить наличие гетерогенных фенотипов этих клеток [3, 17, 19, 26].
Гетерогенность нейтрофилов
Теория гетерогенности нейтрофилов зародилась более 50 лет назад, когда была предложена концепция маргинального пула нейтрофилов [4, 19, 27], либо прикрепленных к сосудам, либо находящихся полностью вне циркуляционного русла. Они могут быть мобилизованы при стимуляции [5, 28]. Эксперименты проводились с использованием радиоактивной метки нейтрофилов и помогли определить в качестве резервуаров для них селезенку, печень и костный мозг, так как требуется меньше времени для прохождения через эти органы. Вопрос о легких в качестве резервуара для нейтрофилов остается открытым [12, 26, 29]. При оценке гетерогенности нейтрофилов могут быть исследованы такие параметры, как функции клеток, маркеры клеточной поверхности, зрелость, плотность и локализация. Концепция подмножества нейтрофилов справедлива при заболевании раком, инфекционном процессе, аутоиммунитете, воспалении и репарации [27, 28].
В нормальных условиях нейтрофилы остаются в кровообращении всего несколько часов, прежде чем начинают мигрировать в ткани [30]. В течение этого времени нейтрофилы, по-видимому, меняют свой фенотип. Наблюдения каждые 4 часа за циркулирующими у здоровых мышей нейтрофилами в течение дня, показали, что эти клетки меняют свою морфологию и фенотип [21, 30, 31].
Известно много описанных фенотипов нейтрофилов, но в литературе приводится отличная друг от друга информация, поскольку в каждом опыте исследовались разные функции, использовались различные методы изучения, виды ткани, биомаркеры [32, 33].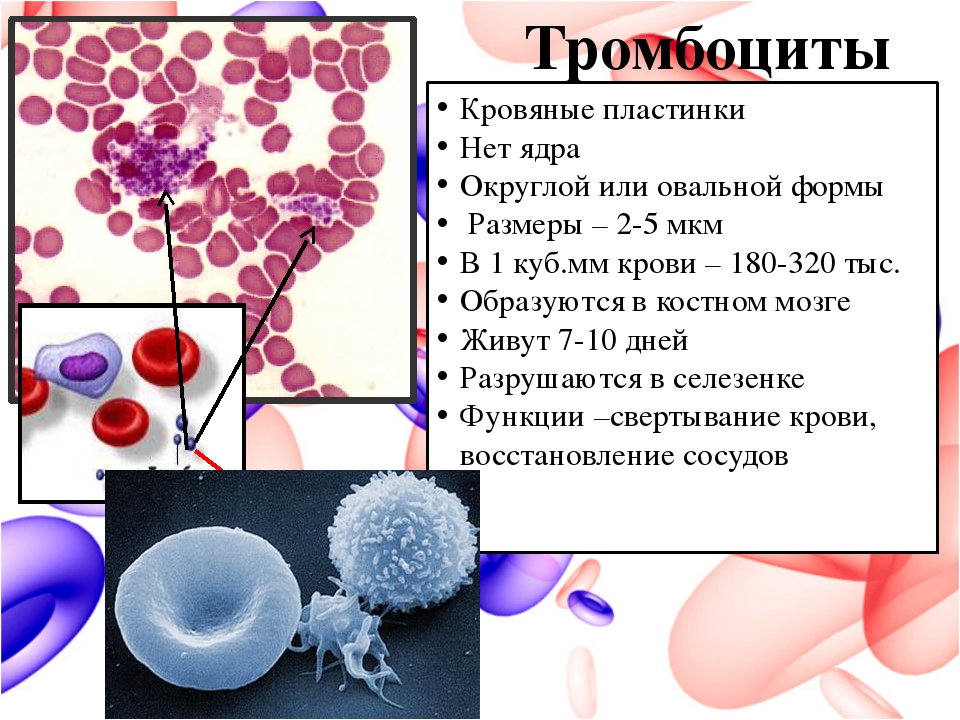
J.M. Adrover и соавт. [22] обратили внимание на циркадные ритмы изменения функционализации нейтрофилов. Недавно вышедшие из костного мозга нейтрофилы («свежие» клетки) претерпевали несколько метаболических изменений, которые накапливались до начала миграции из кровотока в ткани. Авторы назвали эти изменения в фенотипе гранулоцитов в отсутствие воспаления старением [22].
Нейтрофилы считаются дифференцированными клетками, которые прогрессируют от незрелых форм в костном мозге до циркуляции зрелых неактивных клеток. При последующей активации во время воспалительных состояний они перемещаются из сосудов в ткани и выполняют свои функции (например фагоцитоз, производство активных форм кислорода и уничтожение бактерий) [34]. Нейтрофилы могут быстро изменять свои характеристики и манеру поведения по мере активации, созревания или изменения внешней среды [35]. Кроме того, активность нейтро- филов в ответ на различные медиаторы при остром или хроническом воспалительном процессе может продлить жизнь клетки, дать возможность произвести альтернативные эффекторные и иммунорегуляторные молекулы [34, 35].
Наконец, нейтрофилы играют совершенно полярные роли в различных врожденных иммунных реакциях, возникающих в ответ на стерильную травму, инфекцию, рак, а также в реакциях аутоиммунитета. Поэтому неудивительно, что нейтрофилы с многочисленными разновекторными функциями были идентифицированы в последние годы в разных условиях [33, 36, 37].
Такая пластичность функций нейтрофилов, отмеченная и российскими учеными [32], побудила исследователей изучить область фенотипической и функциональной гетерогенности нейтрофилов, как это было сделано для лимфоцитов [38]. Появилась возможность вычленить регуляторные, супрессорные, провоспали- тельные, воспалительные, противоопухолевые, про- опухолевые и гибридные субпопуляции нейтрофилов [39]. Помимо классического антагонистического участия в антимикробных реакциях, нейтрофилы также играют значительную роль в модуляции различных типов раковых опухолей.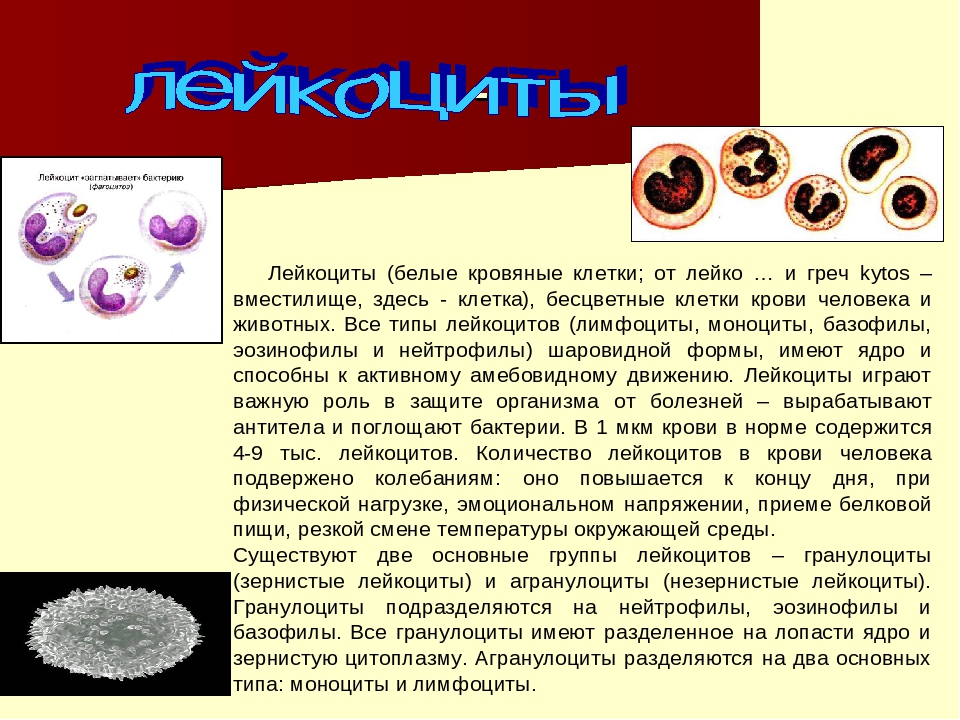
Фенотипическая гетерогенность нейтрофилов при раке
В вопросах влияния на опухолевый процесс нейтрофилы в течение длительного времени были обделены вниманием исследователей по сравнению с другими иммунокомпетентными клетками [39, 40]. Одной из причин этого, по-видимому, является небольшая продолжительность жизни гранулоцитов, которая, как считалось, слишком мала (в среднем 7 ч в циркулирующей крови и еще около 5 суток в тканях), чтобы влиять на прогрессию рака [41].
Однако в публикации М. Kurashige и соавт. [41] были подтверждены результаты экспериментальных исследований Y. Sawanobori и соавт. [42] с использованием молекулярных маркеров, которые позволили пересмотреть и эти фундаментальные положения [41, 42].
Экспериментальные исследования, выполненные на животных, показали, что продолжительность жизни тканевых нейтрофилов увеличивается на несколько дней в опухолях, микроокружение которых способствует их выживанию как локально, так и системно. Установлено, что средний период продолжительности жизни циркулирующих нейтрофилов у больных раком увеличен до 5,4 дня [44, 45], что более чем в 20 раз больше, чем было обнаружено ранее [44], и расценено исследователями как следствие передачи сигналов опухолевыми цитокинами на Г-КСФ [42].
Использование современных молекулярно-генетических инструментов позволило получить новые данные об участии ПМН на всех стадиях процесса канцерогенеза: от инициации опухолевого генотипа до инвазивного роста и метастазирования злокачественной опухоли [39, 40, 46]. По результатам этих исследований установили ведущую роль нейтрофилов в канцерогенезе, связанную с их способностью изменять поведение других иммунокомпетентных клеток в развитии опухолевого процесса [46].
Изменения функций нейтрофилов и их фенотипическая гетерогенность при раке являются в настоящее время наиболее изученными и наиболее интересными метаморфозами. Эти клетки крови играют важную и противоречивую роль в развитии раковых опухолей, что отражено в ряде современных обзоров [39, 40, 43, 46-49].
Этот функциональный дуализм нейтрофилов по отношению к опухолям в течение длительного времени был предметом споров, в которых оппоненты приводили убедительные доказательства в пользу как про-, так и противоопухолевой роли этих гранулоцитов. Это привело к возникновению гипотезы о неоднородности популяции ПМН и существовании нескольких субпопуляций, функции которых при раковых опухолях могут значительно отличаться. На всех этапах развития рака нейтрофилы формируют разные клеточные фенотипы, которые выполняют разновекторные функции. Установлено, что эти гранулоциты в организме опосредуют про- (клеточный фенотип N2) и противоопухолевые реакции (фенотип N1), которые вызывают прогрессию или ингибирование опухолевых клеток [47, 48].
С одной стороны, клетки N2 способствуют росту опухоли [39, 47], ангиогенезу — новообразованию в опухоли сети кровеносных сосудов [49] и активируют метастазирование опухолевых клеток [48], индуцируя иммунодепрессию [40] и инициируя подготовку тканей к раковой колонизации — создание предметастатической ниши [50]. С другой стороны, клетки N1 проявляют противоопухолевую активность, уничтожая раковые клетки непосредственно [51, 52] либо через антителозависимую цитотоксичность, ограничивающую распространение опухоли [33, 40, 46].
Индукция этих фенотипов ПМН регулируется сигналами, исходящими от раковых или стромаль- ных клеток из микроокружения опухоли, связана как с местными, так и системными реакциями и в настоящее время является предметом пристального внимания и изучения исследователей [33, 39, 46, 49].
Мы сосредоточимся на регуляции поведения ПМН сигналами, исходящими из микроокружения опухоли, а также на диагностическом и терапевтическом потенциале гетерогенных фенотипов миелоидных клеток. Чем же обусловлен этот функциональный дуализм нейтрофилов по отношению к раковым опухолям? В последние годы установлено, что вектор про- опухолевой активности этих клеток зависит от двух условных типов подмножеств ПМН в зависимости от их плотности: высокой (HDN, от англ. high density neutrophils), обеспечивающих противоопухолевую защиту организма (соответствует фенотипу N1), и низкой (LDN, low density neutrophils) — с проопухолевой и иммунодепрессирующей активностью (соответствует фенотипу N2), а также отношением этих клеточных фенотипов [53-56].
high density neutrophils), обеспечивающих противоопухолевую защиту организма (соответствует фенотипу N1), и низкой (LDN, low density neutrophils) — с проопухолевой и иммунодепрессирующей активностью (соответствует фенотипу N2), а также отношением этих клеточных фенотипов [53-56].
В практике выделения нейтрофильных кластеров HDN и LDN для последующего изучения их функциональных характеристик применяются несколько протоколов, включающих в себя сбор и очистку клеток крови человека или мыши [53, 55, 56] (рис. 2). В основе всех методов — выделение гранулоцитов путем градиентного центрифугирования разведенной периферической крови (1:5) с полисахаридами соответствующей плотности (Histopaque-1077, перколл или фи- колл — 3 мл). Кровь забирается с гепаринатом лития, эритроциты перед центрифугированием лизируются. Центрифугирование проводится при 1600 g в течение 20 мин (1000 g /30 мин) [53, 57].
Рисунок 2. Выделение нейтрофилов высокой (HDN) и низкой (LDN) плотности из периферической крови методом градиентного центрифугирования (рисунок авторов, пояснения в тексте)
Figure 2. Isolation of neutrophils of a high (HDN) and low (LDN) density from peripheral blood by gradient centrifugation (the authors’ picture, explanations in the text)
От вариаций протоколов зависит чистота выделенных клеточных фракций HDN и LDN, которые могут быть дополнительно обогащены при использовании специфических нейтрофильных антител, магнитных бус и разделительных колонок [53, 55, 56].
В последние годы интерес к субпопуляциям высокой и низкой плотности в контексте их проопухолевой активности значительно увеличился, появляется все больше данных о важной роли этих клеточных фенотипов в биологии опухолевого роста, а также механизмах регуляции раковыми клетками индукции N2-нейтрофилов [39, 53, 58, 59].
В связи с этим концепции о терминальной дифференцировке ПМН и их функциях, ограниченных антимикробной защитой и участием в воспалениях, постепенно пересматриваются [39, 47-49, 53, 59, 60]. Например, было установлено [53, 59], что у здоровых мышей более 95 % нейтрофилов в крови представлены клетками высокой плотности (N1), в то время как при возникновении злокачественной опухоли (рак молочной железы, легких, мезотелиома) у них возникала активная генерация нейтрофилов низкой плотности (N2), которые становились доминирующей циркулирующей субпопуляцией. При этом в костном мозге было достаточно много HDN, и увеличение соотношения субпопуляций в пользу LDN не было следствием простого медуллярного истощения клеток высокой плотности [53].
Например, было установлено [53, 59], что у здоровых мышей более 95 % нейтрофилов в крови представлены клетками высокой плотности (N1), в то время как при возникновении злокачественной опухоли (рак молочной железы, легких, мезотелиома) у них возникала активная генерация нейтрофилов низкой плотности (N2), которые становились доминирующей циркулирующей субпопуляцией. При этом в костном мозге было достаточно много HDN, и увеличение соотношения субпопуляций в пользу LDN не было следствием простого медуллярного истощения клеток высокой плотности [53].
Аналогичная картина наблюдалась и у больных опухолями различной локализации. При этом и у мышей, и у людей доминирующая субпопуляция LDN была неоднородной и состояла из зрелых и незрелых клеток, в то время как фенотип HDN был однородным и представлен только зрелыми клетками [49, 53].
Механизмы, с помощью которых опухоли индуцируют N2-нейтропоэз, до конца не изучены, хотя в ряде исследований была показана активация клеток-пред- шественников гранулопоэза (ГМ-КСФ и Г-КСФ) и прогностическое значение отношения численности LDN- кластера гранулоцитов к лимфоцитам при нескольких типах злокачественных новообразований [51, 52].
Недавние исследования R. Kanamaru и соавт. [9] показали, что внеклеточные ловушки (NETs), высвобожденные нейтрофилами LDN-кластера, выделенными из перитонеального лаважа у больных, прооперированных по поводу рака желудка, не только не уничтожали свободные раковые клетки, но и активировали их пролиферацию после прикрепления к NETs [9].
Один из механизмов индукции образования N2-нейтрофилов, выявленный указанными исследователями, связан со стимулирующим влиянием микроокружения опухоли, точнее, с трансформирующим фактором роста-β, который индуцирует созревание в костном мозге и миграцию в ткани проопухолевого фенотипа нейтрофилов N2, изменяя локальное соотношение гранулоцитов N2:N1 в пользу первых.
Функциональная дифференциация нейтрофилов приводит к появлению различных фенотипов под влиянием конкретных опухолевых факторов, среди которых наиболее изученными являются трансформирующий фактор роста-β, Г-КСФ и интерферон-β.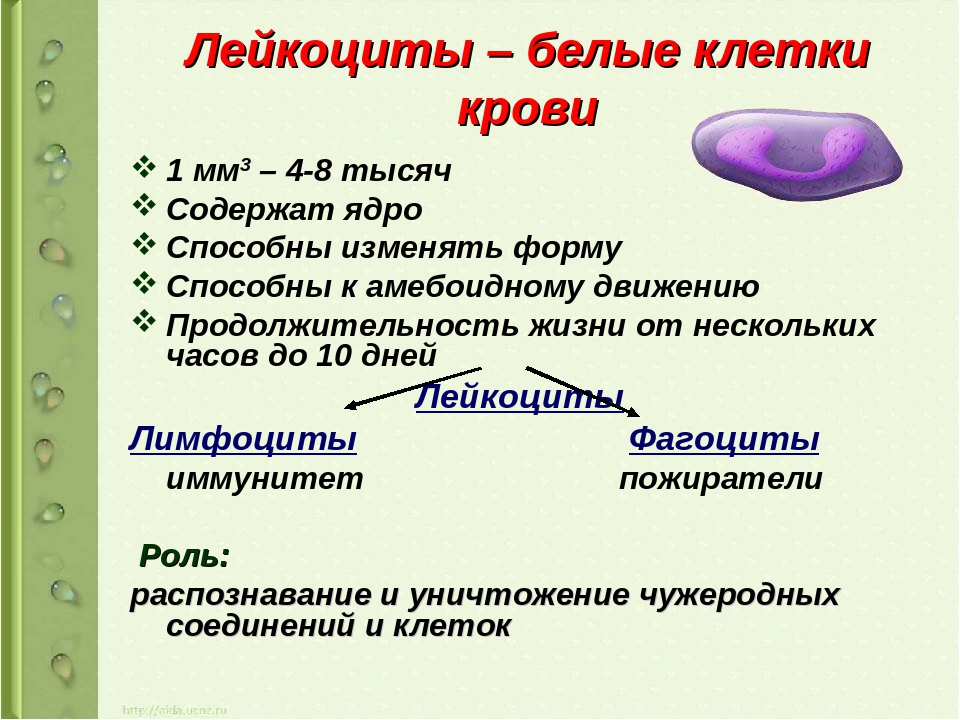
Таким образом, в дополнение к классическим антимикробным стратегиям, в последние годы был охарактеризован ряд других функций нейтрофилов, что вызвало большой интерес врачей и биологов в мире. Многочисленные свидетельства того, что разные фенотипы нейтрофилов обнаружены в различных тканях и при различных патологических состояниях, позволяют предположить, что действительно существуют подмножества нейтрофилов [39, 47—49, 53, 59]. Однако отсутствие прямых экспериментальных доказательств, основанных на многократных исследованиях, не дает основания утверждать о наличии гетерогенных подгрупп нейтрофилов. Поэтому большинство практикующих врачей и гематологов считают этот клеточный пул относительно гомогенной популяцией с минимальным фенотипическим и функциональным разнообразием [48, 49, 57, 58]. Среди причин этого заблуждения тот факт, что исследования нейтрофилов все еще в значительной степени определяются их морфологией [59, 60].
Недавно выявленные с помощью градиентного центрифугирования факты наличия нейтрофилов разной плотности и их разновекторного участия в физиологических и патологических состояниях организма, возможно, вызовут смену парадигмы о функциональной гомогенности нейтрофилов [50].
Пока же приведенные в обзоре результаты исследований вызывают ряд вопросов относительно фенотипической специализации нейтрофилов. Бывают ли эти клетки запрограммированными на определенный фенотип уже до выхода из костного мозга в периферическую кровь, или высокая пластичность позволяет им трансформироваться в определенные субпопуляции уже в тканях? Возможно ли перепрограммировать уже имеющиеся фенотипы? По-прежнему остается актуальной проблема поиска надежных молекулярных маркеров, позволяющих эффективно дифференцировать фенотипы нейтрофилов, установить степень их диагностической специфичности при различных патологиях. И, наконец, обозначить перспективы определения нейтрофилов как терапевтической стратегии в иммунопатологии. В любом случае, полученные результаты выявляют потенциальные направления, на которые могут быть направлены терапевтические и диагностические стратегии усиления противоопухолевой нейтрофильной активности для раннего выявления и ограничения опухолевого роста.
1. de Oliveira S., Rosowski E.E., Huttenlocher A. Neutrophil migration in infection and wound repair: going forward in reverse. Nature Reviews Immunology. 2016; 16(6): 378. DOI: 10.1038/nri.2016.49
2. Wang J., Hossain M., Thanabalasuriar A., et al. Visualizing the function and fate of neutrophils in sterile injury and repair. Science. 2017; 358(6359): 111–6. DOI: 10.1126/science.aam9690
3. Jones H. R., Robb C. T., Perretti M., et al. The role of neutrophils in inflammation resolution. Seminars in immunology. Academic Press. 2016; 289(2): 137–45. DOI: 10.1016/j.smim.2016.03.007
4. Kaur M., Singh D. Neutrophil chemotaxis caused by chronic obstructive pulmonary disease alveolar macrophages: the role of CXCL8 and the receptors CXCR1/CXCR2. Journal of Pharmacology and Experimental Therapeutics. 2013; 347(1): 173–80. DOI: 10.1124/jpet.112.201855
5. Андрюков Б.Г., Сомова Л.М., Дробот Е.И., Матосова Е.В. Антимикробные стратегии нейтрофилов при инфекционной патологии. Клин. лаб. диагностика. 2016; 12(61): 825–33. DOI: 10.18821/0869-2084-2016-61- 12-825-833
6. Wirths S., Stefanie Bugl S., Kopp H.-G. Steady-state neutrophil homeostasis is a demand-driven process. Cell Cycle. 2013; 12(5): 709–10. DOI: 10.4161/cc.23859
7. Cain D.W., Ueda Y., Holl T.M., et al. A comparison of “steady-state” and “emergency” granulopoiesis: evidence of a single pathway for neutrophil production. The Journal of Immunology, 2009; 182 (1): 87–95.
The Journal of Immunology, 2009; 182 (1): 87–95.
8. Cowland J.B., Borregaard N. Granulopoiesis and granules of human neutrophils. Immunological reviews. 2016; 273(1): 11–28. DOI: 10.1111/imr.12440/
9. Kanamaru R., Ohzawa H., Miyato H., et al. Neutrophil Extracellular Traps Generated by Low Density Neutrophils Obtained from Peritoneal Lavage Fluid Mediate Tumor Cell Growth and Attachment. J Vis Exp. 2018; 138. DOI: 10.3791/58201
10. Witko-Sarsat V., Pederzoli-Ribeil M., Hirsch E., et. al. Regulating neutrophil apoptosis: new players enter the game. Trends Immunol. 2011; 32: 117–24. DOI: 10.1016/j.it.2011.01.001
11. Luo D., McGettrick H.M., Stone P.C., et al. The roles of Integrins of Human Neutrophils after their migration through endothelium into intestinal matrix. PLOS One. 2015; 10(2): e0118593. DOI: 10.1371/journal.pone.0118593
12. Steinberg B.E., Grinstein S. Unconventional roles of the NADPH oxidase: signaling, ion homeostasis, and cell death. Science’s STKE. 2007; 2007(379): pe11. DOI: 10.1126/stke.3792007pe11
13. Marini O., Costa S., Bevilacqua D., et al. Mature CD10+ and immature CD10-neutrophils present in G-CSF-treated donors display opposite effects on T cells. Blood. 2016; 04: 713206. DOI: 10.1182/blood-2016-04-713206
14. Dopico X. C., Evangelou M., Ferreira R. C., et al. Widespread seasonal gene expression reveals annual differences in human immunity and physiology.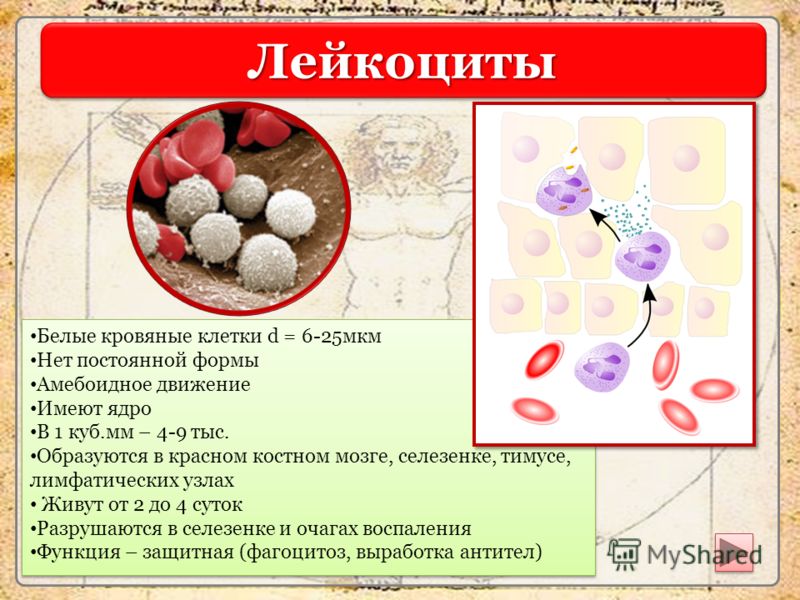 Nature communications. 2015; 6: 7000. DOI: 10.1038/ncomms8000
Nature communications. 2015; 6: 7000. DOI: 10.1038/ncomms8000
15. Kim M. H., Yang D., Kim M., et al. A late-lineage murine neutrophil precursor population exhibits dynamic changes during demand-adapted granulopoiesis. Scientific reports. 2017; 7: 39804. DOI: 10.1038/srep39804
16. Garlichs C.D., Eskafi S., Cicha I., et al. Delay of neutrophil apoptosis in acute coronary syndromes. Journal of leukocyte biology. 2004; 75(5): 828–35. DOI: 10.1189/jlb.0703358
17. Summers C., Singh N. R., White J. F., et al. Pulmonary retention of primed neutrophils: a novel protective host response, which is impaired in the acute respiratory distress syndrome. Thorax. 2014; thoraxjnl-2013-204742. DOI: 10.1136/ thoraxjnl-2013-204742
18. Матосова Е.В., Андрюков Б.Г. Морфофункциональная характеристика защитных механизмов нейтрофилов при бактериальных инфекциях и их вклад в патогенез провоспалительных реакций. Гематология и трансфузиология. 2017; 62(4): 223–9. DOI: 10.18821/0234-5730-2017-62-4-223-229
19. Jorgensen I., Rayamajhi M., Miao E.A. Programmed cell death as a defence against infection. Nature reviews immunology. 2017; 17(3): 151. DOI: 10.1038/ nri.2016.147
20. Jorgensen I., Lopez J.P., Laufer S.A., et al. IL-1β, IL-18, and eicosanoids promote neutrophil recruitment to pore-induced intracellular traps following pyroptosis. European journal of immunology. 2016; 46(12): 2761–6. DOI: 10.1002/ eji.201646647
21. Rodriguez F.M., Novak I.T.C. What about the neutrophil’s phenotypes? Hematol Med Oncol. 2017; 2: 1–6. DOI: 10.15761/HMO.1000130
Rodriguez F.M., Novak I.T.C. What about the neutrophil’s phenotypes? Hematol Med Oncol. 2017; 2: 1–6. DOI: 10.15761/HMO.1000130
22. Adrover J.M., Nicolás-Ávila J.A., Hidalgo A. Aging: a temporal dimension for neutrophils. Trends Immunol. 2016; 37: 334–45. DOI: 10.1016/j.it.2016.03.005
23. Brinkmann V., Zychlinsky A. Neutrophil extracellular traps: is immunity the second function of chromatin? J Cell Biol. 2012; 198(5): 773–83. DOI: 10.1083/ jcb.201203170
24. Silvestre-Roig C., Hidalgo A., Soehnlein O. Neutrophil heterogeneity: implications for homeostasis and pathogenesis. Blood. 2016 127:2173-2181 DOI: 10.1182/blood-2016-01-688887
25. Horckmans M., Ring L., Duchene J., et al. Neutrophils orchestrate postmyocardial infarction healing by polarizing macrophages towards a reparative phenotype. Eur Heart J. 2017; 38: 187–97. DOI: 10.1093/eurheartj/ehw002
26. Hellebrekers P., Vrisekoop N., Koenderman L. Neutrophil phenotypes in health and disease. Eur J Clin Invest. 2018; 48 Suppl 2: e12943. DOI: 10.1111/ eci.12943
27. Sagiv J.Y., Voels S., Granot Z. Isolation and Characterization of Low- vs HighDensity Neutrophils in Cancer. Methods Mol Biol. 2016; 1458: 179–93. DOI: 10.1007/978-1-4939-3801-8_13
28. Kuhns D.B., Priel D.A.L., Chu J., et al. Isolation and Functional Analysis of Human Neutrophils. Curr Protoc Immunol. 2015; 111: 7.23.1–16. DOI: 10.1002/0471142735.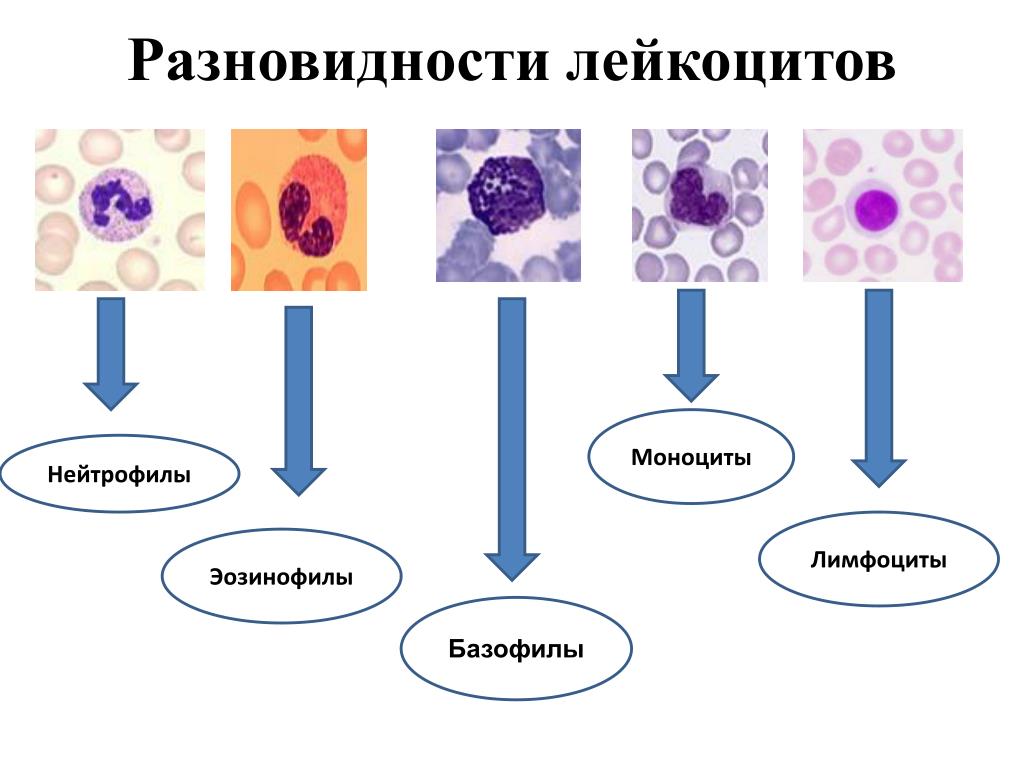 im0723s111
im0723s111
29. Deniset J.F., Kubes P. Neutrophil heterogeneity: Bona fide subsets or polarization states? J Leukoc Biol. 2018; 103(5): 829–38. DOI: 10.1002/JLB.3RI0917- 361R
30. Mortaz E., Alipoor S.D., Adcock I.M., et al. Update on Neutrophil Function in Severe Inflammation. Front Immunol. 2018; 9: 2171. DOI: 10.3389/ fimmu.2018.02171
31. Bekkering S., Torensma R. Another look at the life of a neutrophil. World J Hematol 2013; 2(2): 44–58. DOI: 10.5315/wjh.v2.i2.44
32. Нестерова И.В., Колесникова Н.В., Чудилова Г.А. и др. Новый взгляд на нейтрофильные гранулоциты: переосмысление старых догм. Часть 1. Инфекция и иммунитет. 2018; 7(3): 219–30. DOI: 10.15789/2220-7619- 2017-3-219-230
33. Galdiero M. R., Bonavita E., Barajon I., et al. Tumor associated macrophages and neutrophils in cancer. Immunobiology. 2013; 218(11): 1402–10. DOI: 10.1016/j.imbio.2013.06.003
34. Lai Guan Ng. Neutrophil: A mobile fertilizer J Exp Med. 2019; 216(1): 4–6. DOI: 10.1084/jem.20182059
35. Mishalian I., Granot Z., Fridlender Z.G. The diversity of circulating neutrophils in cancer. Immunobiology. 2017; 222(1): 82–8. DOI: 10.1016/j. imbio.2016.02.001
36. McCracken J.M., Allen L.A.H. Regulation of Human Neutrophil Apoptosis and Lifespan in Health and Disease. J Cell Death. 2014; 7: 15–23. DOI: 10.4137/ JCD.S11038
DOI: 10.4137/ JCD.S11038
37. Je Lin Sieow, Sin Yee Gun, Siew Cheng Wong The Sweet Surrender: How Myeloid Cell Metabolic Plasticity Shapes the Tumor Microenvironment. Front Cell Dev Biol. 2018; 6: 168. DOI: 10.3389/fcell.2018.00168
38. Sionov R.V., Fridlender Z.G., Granot Z. The multifaceted roles neutrophils play in the tumor microenvironment. Cancer Microenviron. 2014; 8(3):125–58.
39. Coffelt S.B., Wellenstein M.D., de Visser K.E. Neutrophils in cancer: neutral no more. Nature Reviews Cancer. 2016; 16(7): 431. DOI: 10.1038/nrc.2016.52/
40. Swierczak A., Mouchemore K.A., Hamilton J.A., Anderson R.L. Neutrophils: important contributors to tumor progression and metastasis. Cancer Metastasis Rev. 2015; 34(4): 735–51. DOI: 10.1007/s10555-015-9594-9
41. Kurashige M., Kohara M., Ohshima K., et al. Origin of cancer-associated fibrobla sts and tumor-associated macrophages in humans after sex-mismatched bone marrow transplantation. Commun Biol. 2018; 1: 131.
42. Sawanobori Y., Ueha S., Kurachi M., et al. Chemokine-mediated rapid tur nover of myeloid-derived suppressor cells in tumor-bearing mice. Blood. 2008; 111(12): 5457–66. DOI: 10.1182/blood-2008-01-136895
43. Granot Z., Henke E., Comen E.A., et al. Tumor entrained neutrophils inhibit seeding in the premetastatic lung. Cancer Cell. 2011; 20(3): 300–14.
44. Shaul M.E., Levy L., Sun J., et al. Tumor-associated neutrophils display a distinct N1 profile following TGFβ modulation: A transcriptomics analysis of pro- vs. antitumor TANs. Oncoimmunology. 2016; 5(11): e1232221. DOI: 10.1080/2162402X.2016.1232221
Shaul M.E., Levy L., Sun J., et al. Tumor-associated neutrophils display a distinct N1 profile following TGFβ modulation: A transcriptomics analysis of pro- vs. antitumor TANs. Oncoimmunology. 2016; 5(11): e1232221. DOI: 10.1080/2162402X.2016.1232221
45. Skendros P., Mitroulis I., Ritis K. Autophagy in Neutrophils: From Granulopoiesis to Neutrophil Extracellular Traps. Front Cell Dev Biol. 2018; 6: 109.
46. Rosales C. Neutrophil: A Cell with Many Roles in Inflammation or Several Cell Types? Front Physiol. 2018; 9: 113. DOI: 10.3389/fphys.2018.00113
47. Uribe-Querol E., Rosales C. Neutrophils in Cancer: Two Sides of the Same Coin. J Immunol Res. 2015; 2015: 983698. DOI: 10.1155/2015/983698
48. Sag iv J. Y., Michaeli J., Assi S., et al. Phenotypic diversity and plasticity in circulating neutrophil subpopulations in cancer. Cell reports. 2015; 10(4): 562–73. DOI: 10.1016/j.celrep.2014.12.039
49. Lee W., Ko S.Y., Mohamed M.S., et al. Neutrophils facilitate ovarian cancer premetastatic niche formation in the omentum. J Exp Med. 2019; 216(1): 176–94. DOI: 10.1084/jem.20181170
50. Granot Z, Jablonska J. Distinct Functions of Neutrophil in Cancer and Its Regulation. Mediators Inflamm. 2015; 701067. DOI: 10.1155/2015/701067
51. Lopez-Lago M.A., Posner S., Thodima V.J., et al. Neutrophil chemokines secreted by tumor cells mount a lung antimetastatic response during renal cell carcinoma progression. Oncogene, 2013; 32(14): 1752–60.
Oncogene, 2013; 32(14): 1752–60.
52. Hong C.W. Current Understanding in Neutrophil Differentiation and Heterogeneity. Immune Netw. 2017; 17(5): 298–306.
53. Liu Y., Yue Hu, Gu F., et al. Phenotypic and clinical characterization of low density neutrophils in patients with advanced lung adenocarcinoma. Oncotarget. 2017; 8(53): 90969–78. DOI: 10.18632/ oncotarget. 18771
54. Carmona-Rivera C., Kaplan M.J. Low-density granulocytes: a distinct class of neutrophils in systemic autoimmunity. Semin. Immunopathol. 2013; 35: 455–63. DOI: 10.1007/s00281-013-0375-7
55. Wright H. L., Makki F. A., Moots R. J., et al. Low-density granulocytes: functionally distinct, immature neutrophils in rheumatoid arthritis with altered properties and defective TNF signaling. Journal of leukocyte biology. 2017; 101(2): 599–611. DOI: 10.1189/jlb.5A0116-022R.
56. Hallett M. B. The Neutrophil: Cellular Biochemistry and Physiology. CRC Press; 2017.
57. Erpenbeck L., Schön M.P. Neutrophil extracellular traps: protagonists of cancer progression? Oncogene. 2017; 36(18): 2483. DOI: 10.1038/onc.2016.406
58. Porta C., Sica A., Riboldi E. Tumor-associated myeloid cells: new understandings on their metabolic regulation and their influence in cancer immunotherapy. FEBS J. 2018; 285(4): 717–33. DOI: 10.1111/febs.14288
59. Khadge S., Sharp J.G., McGuire T.R., et al. Immune regulation and anticancer activity by lipid inflammatory mediators. Int Immunopharmacol. 2018; 65: 580–92. DOI: 10.1016/ j. intimp.2018.10.026
Khadge S., Sharp J.G., McGuire T.R., et al. Immune regulation and anticancer activity by lipid inflammatory mediators. Int Immunopharmacol. 2018; 65: 580–92. DOI: 10.1016/ j. intimp.2018.10.026
Медицинский центр — Асклепий Клинический анализ крови. Сдать анализ во Владивостоке. Стоимость: 350руб.
Кровь — это жидкая ткань, выполняющая различные функции, в том числе, транспорта кислорода и питательных веществ к органам и тканям и выведения из них шлаковых продуктов. Состоит из плазмы и форменных элементов: эритроцитов, лейкоцитов и тромбоцитов. Клинический анализ крови (КАК)– одно из важнейших диагностических исследований которое отражает реакцию кроветворных органов на воздействие на организм различных физиологических и патологических факторов. Во многих случаях оно имеет большое значение в постановке диагноза, а при заболеваниях системы кроветворения ему отводится ведущая роль. В настоящее время большинство показателей определяют на автоматических гематологических анализаторах, которые позволяют одновременно исследовать от 5 до 36 параметров, основные из которых включают концентрацию Hb, Ht, количество эритроцитов, MCV, среднюю концентрацию Hb в эритроците (цветовой показатель), среднее содержание Hb в эритроците, полуширину распределения эритроцитов по размерам, количество тромбоцитов, средний объём тромбоцита, количество лейкоцитов, а также СОЭ и лейкоцитарная формула крови представленная % или же в абсолютных числах в расчете на 10 Г/л. Гемоглобин(Hb)является одним из основных параметров, используемых для оценки эритропоэза. Hb — основной компонент эритроцитов, представляет собой сложный белок, состоящий из гема и глобина. Главная функция Hb состоит в переносе кислорода от лёгких к тканям, а также в выведении углекислого газа из организма и регуляции КОС (кислотно основного состояния) крови.Снижение содержания гемоглобина является характерным признаком анемий различной этиологии. Повышение концентрации гемоглобина наблюдается при эритремии (полицитемии) и симптоматических реактивных эритроцитозах. А также, при сгущении крови (дегидратация при неукротимой рвоте, полиурии, диарее и т. п.) может возникнуть относительное увеличение концентрации гемоглобина. Гематокрит(Ht)– это показатель, дающий представление о соотношении объема форменных элементов крови к общему объему крови, выражается в процентах или в виде индекса. Показатель гематокрита широко используется для суждения о степени анемии, при которой, как правило, отмечается его снижение, иногда до значительных цифр (20-25%).Повышение гематокрита(55-65% и выше) характерно для эритремии, менее резкое увеличение (50-55%) наблюдается при симптоматических эритроцитозах, сопутствующих врожденным порокам сердца, легочной недостаточности, некоторым гемоглобинопатиям. Количество эритроцитов в крови(RBC)- один из наиболее важных показателей системы крови. Эритроцит — наиболее многочисленный форменный элемент крови, содержащий Hb. Зрелые эритроциты человека лишены ядра, имеют двояковогнутую форму, что увеличивает поверхность соприкосновения гемоглобина с плазмой и облегчает процесс переноса кислорода и углекислоты. Снижение количества эритроцитов(эритроцитопения) — один из важных признаков анемии. Эритроцитопения встречается также при увеличении объёма циркулирующей крови (беременности), гипергидратации, гиперпротеинемии). Повышение количества эритроцитов(эритроцитоз) — один из характерных лабораторных признаков эритремии. Эритроцитоз может быть абсолютным (увеличение массы циркулирующих эритроцитов, вследствие усиления эритропоэза) и относительным (вследствие уменьшения объёма циркулирующей крови. Эритроцитарные индексы В лабораторной практике используются различные индексы, позволяющие количественно характеризовать средний объем эритроцитов, степень их насыщения гемоглобином, анизоцитоз. (MCV, mean corpuscular volume, средний объем эритроцита) или средний корпускулярный объем эритроцита. MCV является важным показателем в дифференциальной диагностике анемий.
Повышение концентрации гемоглобина наблюдается при эритремии (полицитемии) и симптоматических реактивных эритроцитозах. А также, при сгущении крови (дегидратация при неукротимой рвоте, полиурии, диарее и т. п.) может возникнуть относительное увеличение концентрации гемоглобина. Гематокрит(Ht)– это показатель, дающий представление о соотношении объема форменных элементов крови к общему объему крови, выражается в процентах или в виде индекса. Показатель гематокрита широко используется для суждения о степени анемии, при которой, как правило, отмечается его снижение, иногда до значительных цифр (20-25%).Повышение гематокрита(55-65% и выше) характерно для эритремии, менее резкое увеличение (50-55%) наблюдается при симптоматических эритроцитозах, сопутствующих врожденным порокам сердца, легочной недостаточности, некоторым гемоглобинопатиям. Количество эритроцитов в крови(RBC)- один из наиболее важных показателей системы крови. Эритроцит — наиболее многочисленный форменный элемент крови, содержащий Hb. Зрелые эритроциты человека лишены ядра, имеют двояковогнутую форму, что увеличивает поверхность соприкосновения гемоглобина с плазмой и облегчает процесс переноса кислорода и углекислоты. Снижение количества эритроцитов(эритроцитопения) — один из важных признаков анемии. Эритроцитопения встречается также при увеличении объёма циркулирующей крови (беременности), гипергидратации, гиперпротеинемии). Повышение количества эритроцитов(эритроцитоз) — один из характерных лабораторных признаков эритремии. Эритроцитоз может быть абсолютным (увеличение массы циркулирующих эритроцитов, вследствие усиления эритропоэза) и относительным (вследствие уменьшения объёма циркулирующей крови. Эритроцитарные индексы В лабораторной практике используются различные индексы, позволяющие количественно характеризовать средний объем эритроцитов, степень их насыщения гемоглобином, анизоцитоз. (MCV, mean corpuscular volume, средний объем эритроцита) или средний корпускулярный объем эритроцита. MCV является важным показателем в дифференциальной диагностике анемий. Изменения MCV могут дать полезную информацию о нарушениях водно-электролитного баланса.ПовышениеMCV свидетельствует о гипотоническом характере нарушений водно-электролитного баланса, тогда какпонижение— о гипертоническом характере. (MCH, mean corpuscular hemoglobin)Среднее содержание гемоглобина в эритроците.Показатель МСН характеризует среднее содержание гемоглобина в отдельном эритроците в абсолютных единицах. Определение этого показателя основывается на определении общего гемоглобина и соотнесении этой величины к количеству эритроцитов. MCH самостоятельного значения не имеет и всегда соотносится с MCV,цветовым показателем и MCHC. Изменения МСН лежат в основе классификации анемий. (MCHС mean corpuscular hemoglobin concentration) Средняя концентрация гемоглобина в эритроците. Это показатель насыщенности эритроцитов Hb., т.е. соотношение содержания гемоглобина к объему клетки. Он отражает насыщение эритроцита гемоглобином. МСНС не зависит от клеточного объема (в отличие от MCH) и является чувстви-тельным показателем нарушения процессов гемоглобинообразования. (RDW red cell distribution width) Распределение эритроцитов по объему.RDW рассчитывается как коэффициент вариации среднего объема эритроцитов. Анизоцитоз — это увеличение показателя RDW> 14,5%. (PLT, platelets) количество тромбоцитов в крови. Тромбоциты форменные элементы крови, участвующие в гемостазе. Тромбоциты выполняют ангиотрофическую, адгезивно-агрегационную функции, участвуют в процессах свёртывания крови, поддерживать спазм сосудов и т.д Тромбоцитарные индексы: (MPV-mean platelet volume) Средний объем тромбоцитоввыражается в фемтолитрах (фл) или в кубических микронах (мкм3 (PDW- platelet distribution width) Распределение тромбоцитов по объему – измеряется в процентах и количественно отражает гетерогенность популяции этих клеток по размерам (степень анизоцитоза тромбоцитов). (PCT- platelet crit)Тромбокрит- является параметром, который отражает долю объема цельной крови, занимаемую тромбоцитами. Он аналогичен гематокриту и выражается в процентах.
Изменения MCV могут дать полезную информацию о нарушениях водно-электролитного баланса.ПовышениеMCV свидетельствует о гипотоническом характере нарушений водно-электролитного баланса, тогда какпонижение— о гипертоническом характере. (MCH, mean corpuscular hemoglobin)Среднее содержание гемоглобина в эритроците.Показатель МСН характеризует среднее содержание гемоглобина в отдельном эритроците в абсолютных единицах. Определение этого показателя основывается на определении общего гемоглобина и соотнесении этой величины к количеству эритроцитов. MCH самостоятельного значения не имеет и всегда соотносится с MCV,цветовым показателем и MCHC. Изменения МСН лежат в основе классификации анемий. (MCHС mean corpuscular hemoglobin concentration) Средняя концентрация гемоглобина в эритроците. Это показатель насыщенности эритроцитов Hb., т.е. соотношение содержания гемоглобина к объему клетки. Он отражает насыщение эритроцита гемоглобином. МСНС не зависит от клеточного объема (в отличие от MCH) и является чувстви-тельным показателем нарушения процессов гемоглобинообразования. (RDW red cell distribution width) Распределение эритроцитов по объему.RDW рассчитывается как коэффициент вариации среднего объема эритроцитов. Анизоцитоз — это увеличение показателя RDW> 14,5%. (PLT, platelets) количество тромбоцитов в крови. Тромбоциты форменные элементы крови, участвующие в гемостазе. Тромбоциты выполняют ангиотрофическую, адгезивно-агрегационную функции, участвуют в процессах свёртывания крови, поддерживать спазм сосудов и т.д Тромбоцитарные индексы: (MPV-mean platelet volume) Средний объем тромбоцитоввыражается в фемтолитрах (фл) или в кубических микронах (мкм3 (PDW- platelet distribution width) Распределение тромбоцитов по объему – измеряется в процентах и количественно отражает гетерогенность популяции этих клеток по размерам (степень анизоцитоза тромбоцитов). (PCT- platelet crit)Тромбокрит- является параметром, который отражает долю объема цельной крови, занимаемую тромбоцитами. Он аналогичен гематокриту и выражается в процентах.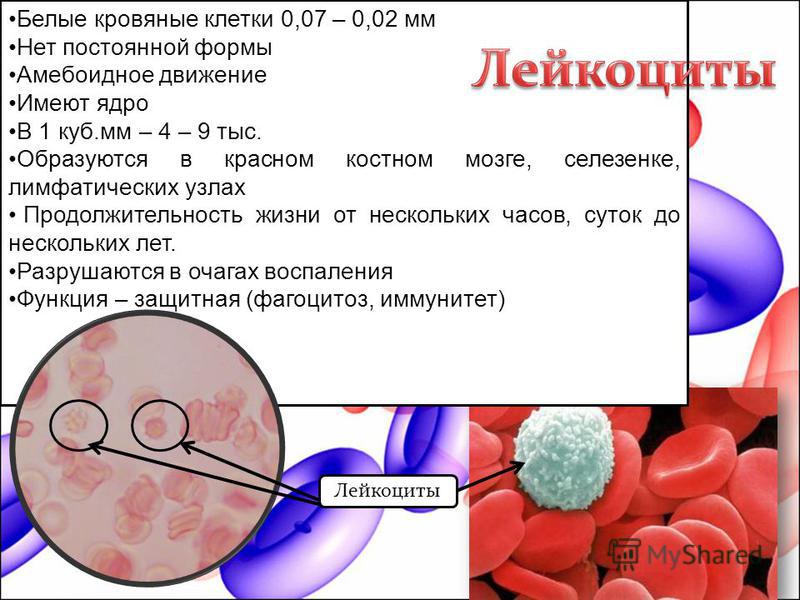 (WBC, white blood cell) Количество лейкоцитов в крови –важный диагностический показатель. Лейкоциты — это клетки крови, образующиеся в костном мозге и лимфатических узлах. Основная функция лейкоцитов заключается в защите организма от чужеродных агентов. Участие в клеточном и гуморальном иммунитете. Лейкоциты делятся на нейтрофилы , лимфоциты и моноциты. Увеличение общего количества лейкоцитов называется лейкоцитоз. Лейкоцитоз может быть нейтрофильный, эозинофильный, моноцитарный, редко вследствие увеличения другого вида клеток. Лейкоцитоз иногда может встречаться у здоровых людей, например: ?после приема пищи, особенно богатой белком; ?после значительной физической работы; ?на фоне выраженного психоэмоционального напряжения, ?после перегревания или охлаждения. Лейкоцитоз в большинстве случаев отражает удовлетворительную реактивность системы костномозгового кроветворения в ответ на действие внешних и внутренних стимуляторов внутренних органов. Наиболее выраженный лейкоцитоз встречается при хронических и острых лейкозах, гнойных заболеваниях сыпного тифа, а также для многих вирусных инфекций (грипп, корь, паротит, вирусный гепатит и д), при которых увеличение количества лейкоцитов в периферической крови свидетельствует о развитии бактериальных и других осложнений.. Лейкопения — уменьшение числа лейкоцитов. Лейкопения обусловлена угнетением лейкопоэза в кроветворных органах и наблюдается при многих патологических состояниях: -Вирусные инфекции (грипп, корь, краснуха, вирусный гепатит, СПИД и д). -Некоторые бактериальные (брюшной тиф, паратифы, бруцеллез и д), риккетсиальные (сыпной тиф, риккетсиоз и д) и протозойные инфекции (малярия и д). — Все виды генерализованной инфекции (септицемия, туберкулез и д). — Гипоплазия и аплазия костного мозга (например, при апластических и гипопластических анемиях, действии на организм ионизирующего облучения и т. д.). — Побочное действие цитостатических препаратов, антибиотиков, сульфаниламидов , нестероидных противовоспалительных препаратов, тиреостатиков и некоторых других медикаментов.
(WBC, white blood cell) Количество лейкоцитов в крови –важный диагностический показатель. Лейкоциты — это клетки крови, образующиеся в костном мозге и лимфатических узлах. Основная функция лейкоцитов заключается в защите организма от чужеродных агентов. Участие в клеточном и гуморальном иммунитете. Лейкоциты делятся на нейтрофилы , лимфоциты и моноциты. Увеличение общего количества лейкоцитов называется лейкоцитоз. Лейкоцитоз может быть нейтрофильный, эозинофильный, моноцитарный, редко вследствие увеличения другого вида клеток. Лейкоцитоз иногда может встречаться у здоровых людей, например: ?после приема пищи, особенно богатой белком; ?после значительной физической работы; ?на фоне выраженного психоэмоционального напряжения, ?после перегревания или охлаждения. Лейкоцитоз в большинстве случаев отражает удовлетворительную реактивность системы костномозгового кроветворения в ответ на действие внешних и внутренних стимуляторов внутренних органов. Наиболее выраженный лейкоцитоз встречается при хронических и острых лейкозах, гнойных заболеваниях сыпного тифа, а также для многих вирусных инфекций (грипп, корь, паротит, вирусный гепатит и д), при которых увеличение количества лейкоцитов в периферической крови свидетельствует о развитии бактериальных и других осложнений.. Лейкопения — уменьшение числа лейкоцитов. Лейкопения обусловлена угнетением лейкопоэза в кроветворных органах и наблюдается при многих патологических состояниях: -Вирусные инфекции (грипп, корь, краснуха, вирусный гепатит, СПИД и д). -Некоторые бактериальные (брюшной тиф, паратифы, бруцеллез и д), риккетсиальные (сыпной тиф, риккетсиоз и д) и протозойные инфекции (малярия и д). — Все виды генерализованной инфекции (септицемия, туберкулез и д). — Гипоплазия и аплазия костного мозга (например, при апластических и гипопластических анемиях, действии на организм ионизирующего облучения и т. д.). — Побочное действие цитостатических препаратов, антибиотиков, сульфаниламидов , нестероидных противовоспалительных препаратов, тиреостатиков и некоторых других медикаментов.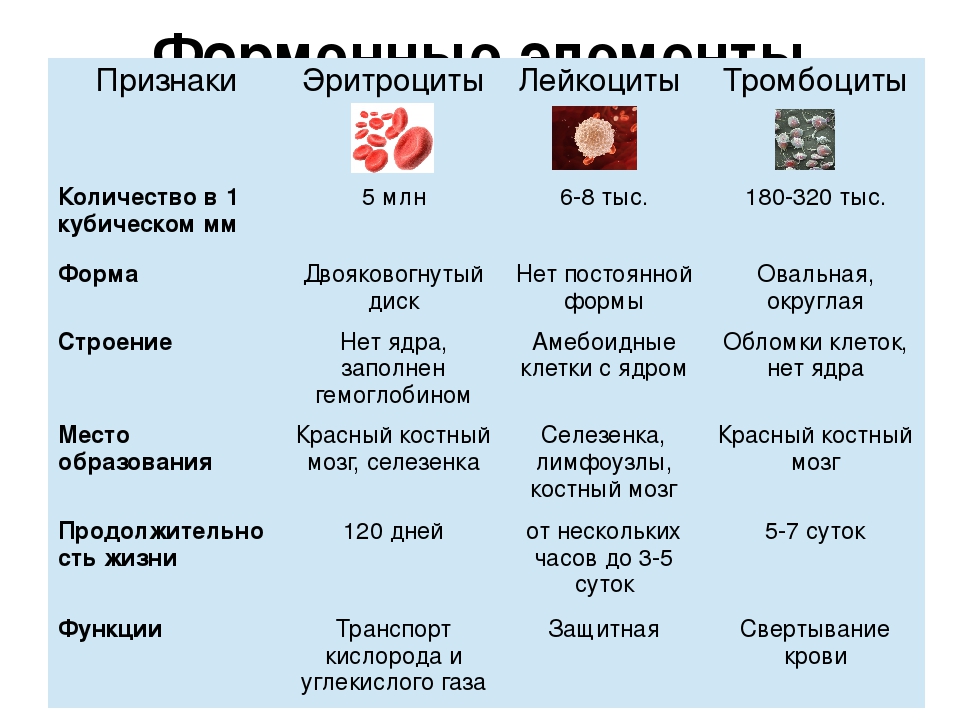 -Агранулоцитоз, сопровождающийся выраженным уменьшением или исчезновением из периферической крови гранулоцитов (нейтрофилов) и других состояниях. Лейкоцитарная формула. Лейкоцитарная формула — процентное соотношение разных видов лейкоцитов в мазке крови. Изменения лейкоцитарной формулы сопутствуют многим заболеваниям и нередко являются неспецифическими. Обращаем внимание,что при выполнении клинического анализа крови, если в пробах выявлены значимые отклонения и результат требует проведения ручной микроскопии, в нашей лаборатории дополнительно бесплатно проводят ручной подсчет лейкоцитарной формулы с подсчетом молодых форм нейтрофилов (в том числе точным подсчетом палочкоядерных нейтрофилов) и количественной оценкой всех патологических форм лейкоцитов (при их наличии).
-Агранулоцитоз, сопровождающийся выраженным уменьшением или исчезновением из периферической крови гранулоцитов (нейтрофилов) и других состояниях. Лейкоцитарная формула. Лейкоцитарная формула — процентное соотношение разных видов лейкоцитов в мазке крови. Изменения лейкоцитарной формулы сопутствуют многим заболеваниям и нередко являются неспецифическими. Обращаем внимание,что при выполнении клинического анализа крови, если в пробах выявлены значимые отклонения и результат требует проведения ручной микроскопии, в нашей лаборатории дополнительно бесплатно проводят ручной подсчет лейкоцитарной формулы с подсчетом молодых форм нейтрофилов (в том числе точным подсчетом палочкоядерных нейтрофилов) и количественной оценкой всех патологических форм лейкоцитов (при их наличии).
Типы и функции белых кровяных телец (лейкоцитов)
Лейкоциты (лейкоциты) являются частью иммунной системы, которая помогает бороться с инфекциями и защищать организм от других инородных материалов. Различные типы белых кровяных телец участвуют в распознавании злоумышленников, уничтожении вредных бактерий и создании антител для защиты вашего тела от будущего воздействия некоторых бактерий и вирусов.
Типы лейкоцитов
Есть несколько различных типов лейкоцитов.Они также известны как лейкоциты.
Эллен Линднер / ВеривеллНейтрофилы
Нейтрофилы составляют примерно половину популяции белых кровяных телец. Обычно они являются первыми клетками иммунной системы, которые реагируют на захватчика, такого как бактерии или вирус. Как первые респонденты, они также посылают сигналы, предупреждающие другие клетки иммунной системы, чтобы они отреагировали на сцену.
Возможно, вы знакомы с появлением нейтрофилов, поскольку они являются первичными клетками, присутствующими в гное.После выхода из костного мозга эти клетки живут всего около восьми часов, но около 100 миллиардов этих клеток вырабатываются вашим телом каждый день.
Эозинофилы
Эозинофилы также играют роль в борьбе с бактериями и очень важны в ответ на инфекции, вызванные паразитами (такими как глисты). Возможно, они наиболее известны своей ролью в возникновении симптомов аллергии, когда они переусердствуют в создании иммунного ответа против чего-то (например, пыльцы), которое ошибочно считается захватчиком.
Эти клетки составляют не более 5% лейкоцитов в вашем кровотоке, но в высоких концентрациях присутствуют в пищеварительном тракте.
Базофилы
Базофилы, составляющие лишь около 1% лейкоцитов, важны для создания неспецифического иммунного ответа на патогены. Эти клетки, пожалуй, наиболее известны своей ролью при астме.
При стимуляции эти клетки выделяют гистамин среди других химических веществ. Эти продукты могут вызвать воспаление и сужение бронхов в дыхательных путях.Взаимодействие с другими людьми
Лимфоциты (B и T)
Лимфоциты также очень важны для иммунной системы, при этом Т-клетки несут ответственность за прямое уничтожение многих чужеродных захватчиков. В-лимфоциты (В-клетки), в отличие от других типов лейкоцитов, отвечают за гуморальный иммунитет (в отличие от неспецифического иммунитета других лейкоцитов).
Они вырабатывают антитела, которые «запоминают» инфекцию и готовы к тому, что ваше тело подвергнется воздействию.В-лимфоциты играют основную роль в эффективности большинства современных вакцин, но в некоторых случаях (например, противотуберкулезных и коклюшных вакцин). Т-лимфоциты также очень важны.
Моноциты
Моноциты — это мусоровозы иммунной системы. Примерно от 5% до 12% лейкоцитов в вашем кровотоке являются моноцитами, но их самая важная функция — мигрировать в ткани и очищать мертвые клетки (среди других функций).
Формация
Лейкоциты образуются в костном мозге в процессе, называемом кроветворением.Все клетки крови, включая лейкоциты, эритроциты и тромбоциты, происходят от общих гемопоэтических стволовых клеток или «плюрипотентных» стволовых клеток. Эти стволовые клетки эволюционируют (дифференцируются) на разных стадиях.
Клетка HSC сначала разделяется на линию лимфоидных клеток через лимфоидную стволовую клетку или клетку-предшественницу и на линию миелоидных клеток через миелоидную стволовую клетку или клетку-предшественницу. Лимфоидная стволовая клетка или клетка-предшественница дает лимфоциты, в частности, В-лимфоциты или «В-клетки» и Т-лимфоциты (Т-клетки).Взаимодействие с другими людьми
Миелоидные стволовые клетки или клетки-предшественники дают начало миелобластам, которые далее дифференцируются в макрофаги, моноциты, нейтрофилы, базофилы и эозинофилы, а также в предшественников красных клеток и тромбоцитов.
Лабораторные значения
Нормальное количество лейкоцитов составляет от 4000 до 10000 клеток на микролитр (мкл).
Повышенное количество лейкоцитов
Хотя вы можете думать об инфекциях, есть много причин повышенного количества лейкоцитов.Они могут быть увеличены из-за перепроизводства или, скорее, из-за того, что организм рано высвобождает лейкоциты из костного мозга.
Стресс в любой форме также может привести к выбросу лейкоцитов. Некоторые причины увеличения количества лейкоцитов включают:
- Инфекции
- Раковые заболевания, такие как лейкозы, лимфомы и миеломы, при которых образуется большее количество лейкоцитов
- Воспаление, такое как воспалительное заболевание кишечника и аутоиммунные заболевания
- Травмы от переломов до эмоционального напряжения
- Беременность
- Астма и аллергия
- Упражнение
При тяжелых инфекциях молодые лейкоциты, называемые бластами, часто появляются в крови из-за попытки организма как можно быстрее доставить как можно больше лейкоцитов на место происшествия.
Низкое количество лейкоцитов
Состояния, которые могут привести к снижению количества лейкоцитов, включают:
- Тяжелые инфекции
- Повреждение или нарушения костного мозга, включая апластическую анемию, «захват» костного мозга раком крови или метастатическим раком, или лекарственное или химическое повреждение костного мозга
- Аутоиммунные заболевания, такие как волчанка
- «Секвестрация» селезенки, при которой лейкоциты накапливаются в селезенке.
Симптомы
Симптомы низкого количества лейкоцитов можно понять, зная функцию лейкоцитов. Лейкоциты — это защита организма от инфекций.
Некоторые из клеток являются частью нашей врожденной иммунной системы, что означает, что они с рождения знают, как атаковать иностранцев, а другие являются частью нашей гуморальной, или усвоенной иммунной системы, и производят антитела после того, как «увидели» один микроб, чтобы подготовиться к другому атаковать этим микробом раньше времени.
Симптомы инфекции могут включать:
- Лихорадка
- Кашель
- Боль или учащенное мочеиспускание
- Кровь в стуле
- Диарея
- Покраснение, припухлость или тепло в области инфекции
Химиотерапия
Один из наиболее распространенных и опасных побочных эффектов химиотерапии связан с ее воздействием на белые кровяные тельца, особенно на лейкоциты, известные как нейтрофилы.Нейтрофилы, по сути, являются «первыми ответчиками» нашей иммунной системы.
Снижение нейтрофилов во время химиотерапии, известное как нейтропения, вызванная химиотерапией, несет в себе риск серьезной инфекции. Организму труднее бороться с инфекциями не только по сравнению с кем-то без нейтропении, но и с бактериями, которые обычно не слишком опасны. может вызвать серьезные инфекции.
Слово от Verywell
От инфекции до рака белые кровяные тельца участвуют во многих функциях организма.Эти клетки могут сами заболеть.
Дефицит одного типа всех белых кровяных телец может возникать при нескольких синдромах иммунодефицита. Избыток определенного типа этих клеток (из-за злокачественности) присутствует при определенных заболеваниях, таких как лейкемии и лимфомы.
Функции, диапазоны, типы и многое другое
Белые кровяные тельца циркулируют в крови и помогают иммунной системе бороться с инфекциями.
Стволовые клетки костного мозга отвечают за производство лейкоцитов.В костном мозге хранится примерно 80–90% лейкоцитов.
Когда возникает инфекция или воспалительное состояние, организм выделяет лейкоциты, чтобы помочь бороться с инфекцией.
Из этой статьи вы узнаете больше о белых кровяных тельцах, включая типы и их функции.
Медицинские работники определили три основные категории лейкоцитов: гранулоциты, лимфоциты и моноциты. В разделах ниже они рассматриваются более подробно.
Гранулоциты
Гранулоциты — это белые кровяные тельца, которые имеют небольшие гранулы, содержащие белки. Существует три типа гранулоцитарных клеток:
- Базофилы : они составляют менее 1% лейкоцитов в организме и обычно присутствуют в увеличенном количестве после аллергической реакции.
- Эозинофилы : они отвечают за борьбу с инфекциями, вызываемыми паразитами. Они также играют роль в общем иммунном ответе, а также в воспалительной реакции организма.
- Нейтрофилы : они представляют собой большинство лейкоцитов в организме. Они действуют как падальщики, помогая окружать и уничтожать бактерии и грибки, которые могут присутствовать в организме.
Лимфоциты
Эти белые кровяные клетки включают следующее:
- B-клетки : Эти клетки, также известные как B-лимфоциты, вырабатывают антитела, которые помогают иммунной системе реагировать на инфекцию.
- Т-клетки : Эти лейкоциты, также известные как Т-лимфоциты, помогают распознавать и удалять клетки, вызывающие инфекцию.
- Естественные клетки-киллеры : Эти клетки отвечают за атаку и уничтожение вирусных клеток, а также раковых клеток.
Моноциты
Моноциты — это белые кровяные тельца, которые составляют около 2-8% от общего количества лейкоцитов в организме. Они присутствуют, когда организм борется с хроническими инфекциями.
Они нацелены и уничтожают клетки, вызывающие инфекции.
Согласно статье American Family Physician , нормальный диапазон (на кубический миллиметр) лейкоцитов в зависимости от возраста составляет:
| Возраст | Нормальный диапазон |
| Новорожденный | 13000–38000 |
| Двухнедельный младенец | 5 000–20 000 |
| Взрослый | 4,500–11 000 |
Нормальный диапазон для беременных в 3 триместре 200–5 800 на кубический миллиметр.
Высокое количество лейкоцитов
Если в организме человека вырабатывается больше лейкоцитов, чем должно быть, врачи называют это лейкоцитозом.
Высокое количество лейкоцитов может указывать на следующие заболевания:
- аллергические реакции, например, из-за приступа астмы
- те, которые могут вызвать гибель клеток, такие как ожоги, сердечный приступ и травмы
- воспалительные состояния, такие как ревматоидный артрит, воспалительное заболевание кишечника или васкулит
- Инфекции, такие как бактерии, вирусы, грибы или паразиты
- лейкемия
Хирургические процедуры, вызывающие гибель клеток, также могут вызывать высокое количество лейкоцитов .
Низкое количество лейкоцитов
Если в организме человека вырабатывается меньше лейкоцитов, чем должно быть, врачи называют это лейкопенией.
Состояния, которые могут вызвать лейкопению, включают:
Врачи могут постоянно контролировать лейкоциты, чтобы определить, вырабатывает ли организм иммунный ответ на инфекцию.
Во время медицинского осмотра врач может определить количество лейкоцитов (WBC) с помощью анализа крови. Они могут заказать анализ лейкоцитов, чтобы проверить или исключить другие состояния, которые могут повлиять на лейкоциты.
Хотя образец крови является наиболее распространенным методом тестирования лейкоцитов, врач может также проверить другие биологические жидкости, такие как спинномозговая жидкость, на наличие лейкоцитов.
Врач может заказать WBC:
- тест на аллергию
- тест на инфекцию
- тест на лейкемию
- контролировать прогрессирование определенных состояний
- контролировать эффективность некоторых методов лечения, таких как трансплантация костного мозга
Ниже перечислены условия, которые могут повлиять на количество лейкоцитов в организме человека.
Апластическая анемия
Это состояние, при котором организм человека разрушает стволовые клетки костного мозга.
Стволовые клетки отвечают за создание новых лейкоцитов, красных кровяных телец и тромбоцитов.
Синдром Эванса
Это аутоиммунное заболевание, при котором иммунная система организма разрушает здоровые клетки, включая красные и белые кровяные тельца.
ВИЧ
ВИЧ может уменьшать количество лейкоцитов, называемых Т-лимфоцитами CD4. Когда количество Т-лимфоцитов падает ниже 200, врач может диагностировать СПИД.
Лейкемия
Лейкемия — это тип рака, поражающий кровь и костный мозг. Лейкемия возникает, когда белые кровяные тельца быстро вырабатываются и не могут бороться с инфекциями.
Первичный миелофиброз
Это состояние заставляет организм человека чрезмерно производить некоторые типы клеток крови. Это вызывает образование рубцов в костном мозге человека.
Потребуется ли человеку изменить количество лейкоцитов, будет зависеть от диагноза.
Если у них есть заболевание, которое влияет на количество лейкоцитов в их организме, им следует поговорить с врачом о целях определения их количества лейкоцитов в зависимости от их текущего плана лечения.
Человек может снизить количество лейкоцитов, принимая лекарства, такие как гидроксимочевина, или перенося лейкаферез, который представляет собой процедуру, при которой используется машина для фильтрации крови.
Если количество лейкоцитов у человека низкое из-за лечения рака, например химиотерапии, врач может порекомендовать избегать продуктов, содержащих бактерии. Это может помочь предотвратить инфекции.
Человек также может принимать колониестимулирующие факторы. Это может помочь предотвратить инфекцию и увеличить количество лейкоцитов в организме.
Белые кровяные тельца — важная часть реакции иммунной системы организма. Существуют разные типы белых кровяных телец, и каждый из них выполняет определенную функцию в организме.
Определенные условия могут влиять на количество лейкоцитов в организме, делая их слишком высокими или слишком низкими.
При необходимости человек может принимать лекарства для изменения количества лейкоцитов.
Функции, диапазоны, типы и многое другое
Белые кровяные тельца циркулируют в крови и помогают иммунной системе бороться с инфекциями.
Стволовые клетки костного мозга отвечают за производство лейкоцитов. В костном мозге хранится примерно 80–90% лейкоцитов.
Когда возникает инфекция или воспалительное состояние, организм выделяет лейкоциты, чтобы помочь бороться с инфекцией.
Из этой статьи вы узнаете больше о белых кровяных тельцах, включая типы и их функции.
Медицинские работники определили три основные категории лейкоцитов: гранулоциты, лимфоциты и моноциты.В разделах ниже они рассматриваются более подробно.
Гранулоциты
Гранулоциты — это белые кровяные тельца, которые имеют небольшие гранулы, содержащие белки. Существует три типа гранулоцитарных клеток:
- Базофилы : они составляют менее 1% лейкоцитов в организме и обычно присутствуют в увеличенном количестве после аллергической реакции.
- Эозинофилы : они отвечают за борьбу с инфекциями, вызываемыми паразитами.Они также играют роль в общем иммунном ответе, а также в воспалительной реакции организма.
- Нейтрофилы : они представляют собой большинство лейкоцитов в организме. Они действуют как падальщики, помогая окружать и уничтожать бактерии и грибки, которые могут присутствовать в организме.
Лимфоциты
Эти белые кровяные клетки включают следующее:
- B-клетки : Эти клетки, также известные как B-лимфоциты, вырабатывают антитела, которые помогают иммунной системе реагировать на инфекцию.
- Т-клетки : Эти лейкоциты, также известные как Т-лимфоциты, помогают распознавать и удалять клетки, вызывающие инфекцию.
- Естественные клетки-киллеры : Эти клетки отвечают за атаку и уничтожение вирусных клеток, а также раковых клеток.
Моноциты
Моноциты — это белые кровяные тельца, которые составляют около 2-8% от общего количества лейкоцитов в организме. Они присутствуют, когда организм борется с хроническими инфекциями.
Они нацелены и уничтожают клетки, вызывающие инфекции.
Согласно статье American Family Physician , нормальный диапазон (на кубический миллиметр) лейкоцитов в зависимости от возраста составляет:
| Возраст | Нормальный диапазон |
| Новорожденный | 13000–38000 |
| Двухнедельный младенец | 5 000–20 000 |
| Взрослый | 4,500–11 000 |
Нормальный диапазон для беременных в 3 триместре 200–5 800 на кубический миллиметр.
Высокое количество лейкоцитов
Если в организме человека вырабатывается больше лейкоцитов, чем должно быть, врачи называют это лейкоцитозом.
Высокое количество лейкоцитов может указывать на следующие заболевания:
- аллергические реакции, например, из-за приступа астмы
- те, которые могут вызвать гибель клеток, такие как ожоги, сердечный приступ и травмы
- воспалительные состояния, такие как ревматоидный артрит, воспалительное заболевание кишечника или васкулит
- Инфекции, такие как бактерии, вирусы, грибы или паразиты
- лейкемия
Хирургические процедуры, вызывающие гибель клеток, также могут вызывать высокое количество лейкоцитов .
Низкое количество лейкоцитов
Если в организме человека вырабатывается меньше лейкоцитов, чем должно быть, врачи называют это лейкопенией.
Состояния, которые могут вызвать лейкопению, включают:
Врачи могут постоянно контролировать лейкоциты, чтобы определить, вырабатывает ли организм иммунный ответ на инфекцию.
Во время медицинского осмотра врач может определить количество лейкоцитов (WBC) с помощью анализа крови. Они могут заказать анализ лейкоцитов, чтобы проверить или исключить другие состояния, которые могут повлиять на лейкоциты.
Хотя образец крови является наиболее распространенным методом тестирования лейкоцитов, врач может также проверить другие биологические жидкости, такие как спинномозговая жидкость, на наличие лейкоцитов.
Врач может заказать WBC:
- тест на аллергию
- тест на инфекцию
- тест на лейкемию
- контролировать прогрессирование определенных состояний
- контролировать эффективность некоторых методов лечения, таких как трансплантация костного мозга
Ниже перечислены условия, которые могут повлиять на количество лейкоцитов в организме человека.
Апластическая анемия
Это состояние, при котором организм человека разрушает стволовые клетки костного мозга.
Стволовые клетки отвечают за создание новых лейкоцитов, красных кровяных телец и тромбоцитов.
Синдром Эванса
Это аутоиммунное заболевание, при котором иммунная система организма разрушает здоровые клетки, включая красные и белые кровяные тельца.
ВИЧ
ВИЧ может уменьшать количество лейкоцитов, называемых Т-лимфоцитами CD4. Когда количество Т-лимфоцитов падает ниже 200, врач может диагностировать СПИД.
Лейкемия
Лейкемия — это тип рака, поражающий кровь и костный мозг. Лейкемия возникает, когда белые кровяные тельца быстро вырабатываются и не могут бороться с инфекциями.
Первичный миелофиброз
Это состояние заставляет организм человека чрезмерно производить некоторые типы клеток крови. Это вызывает образование рубцов в костном мозге человека.
Потребуется ли человеку изменить количество лейкоцитов, будет зависеть от диагноза.
Если у них есть заболевание, которое влияет на количество лейкоцитов в их организме, им следует поговорить с врачом о целях определения их количества лейкоцитов в зависимости от их текущего плана лечения.
Человек может снизить количество лейкоцитов, принимая лекарства, такие как гидроксимочевина, или перенося лейкаферез, который представляет собой процедуру, при которой используется машина для фильтрации крови.
Если количество лейкоцитов у человека низкое из-за лечения рака, например химиотерапии, врач может порекомендовать избегать продуктов, содержащих бактерии. Это может помочь предотвратить инфекции.
Человек также может принимать колониестимулирующие факторы. Это может помочь предотвратить инфекцию и увеличить количество лейкоцитов в организме.
Белые кровяные тельца — важная часть реакции иммунной системы организма. Существуют разные типы белых кровяных телец, и каждый из них выполняет определенную функцию в организме.
Определенные условия могут влиять на количество лейкоцитов в организме, делая их слишком высокими или слишком низкими.
При необходимости человек может принимать лекарства для изменения количества лейкоцитов.
Функции, диапазоны, типы и многое другое
Белые кровяные тельца циркулируют в крови и помогают иммунной системе бороться с инфекциями.
Стволовые клетки костного мозга отвечают за производство лейкоцитов. В костном мозге хранится примерно 80–90% лейкоцитов.
Когда возникает инфекция или воспалительное состояние, организм выделяет лейкоциты, чтобы помочь бороться с инфекцией.
Из этой статьи вы узнаете больше о белых кровяных тельцах, включая типы и их функции.
Медицинские работники определили три основные категории лейкоцитов: гранулоциты, лимфоциты и моноциты.В разделах ниже они рассматриваются более подробно.
Гранулоциты
Гранулоциты — это белые кровяные тельца, которые имеют небольшие гранулы, содержащие белки. Существует три типа гранулоцитарных клеток:
- Базофилы : они составляют менее 1% лейкоцитов в организме и обычно присутствуют в увеличенном количестве после аллергической реакции.
- Эозинофилы : они отвечают за борьбу с инфекциями, вызываемыми паразитами.Они также играют роль в общем иммунном ответе, а также в воспалительной реакции организма.
- Нейтрофилы : они представляют собой большинство лейкоцитов в организме. Они действуют как падальщики, помогая окружать и уничтожать бактерии и грибки, которые могут присутствовать в организме.
Лимфоциты
Эти белые кровяные клетки включают следующее:
- B-клетки : Эти клетки, также известные как B-лимфоциты, вырабатывают антитела, которые помогают иммунной системе реагировать на инфекцию.
- Т-клетки : Эти лейкоциты, также известные как Т-лимфоциты, помогают распознавать и удалять клетки, вызывающие инфекцию.
- Естественные клетки-киллеры : Эти клетки отвечают за атаку и уничтожение вирусных клеток, а также раковых клеток.
Моноциты
Моноциты — это белые кровяные тельца, которые составляют около 2-8% от общего количества лейкоцитов в организме. Они присутствуют, когда организм борется с хроническими инфекциями.
Они нацелены и уничтожают клетки, вызывающие инфекции.
Согласно статье American Family Physician , нормальный диапазон (на кубический миллиметр) лейкоцитов в зависимости от возраста составляет:
| Возраст | Нормальный диапазон |
| Новорожденный | 13000–38000 |
| Двухнедельный младенец | 5 000–20 000 |
| Взрослый | 4,500–11 000 |
Нормальный диапазон для беременных в 3 триместре 200–5 800 на кубический миллиметр.
Высокое количество лейкоцитов
Если в организме человека вырабатывается больше лейкоцитов, чем должно быть, врачи называют это лейкоцитозом.
Высокое количество лейкоцитов может указывать на следующие заболевания:
- аллергические реакции, например, из-за приступа астмы
- те, которые могут вызвать гибель клеток, такие как ожоги, сердечный приступ и травмы
- воспалительные состояния, такие как ревматоидный артрит, воспалительное заболевание кишечника или васкулит
- Инфекции, такие как бактерии, вирусы, грибы или паразиты
- лейкемия
Хирургические процедуры, вызывающие гибель клеток, также могут вызывать высокое количество лейкоцитов .
Низкое количество лейкоцитов
Если в организме человека вырабатывается меньше лейкоцитов, чем должно быть, врачи называют это лейкопенией.
Состояния, которые могут вызвать лейкопению, включают:
Врачи могут постоянно контролировать лейкоциты, чтобы определить, вырабатывает ли организм иммунный ответ на инфекцию.
Во время медицинского осмотра врач может определить количество лейкоцитов (WBC) с помощью анализа крови. Они могут заказать анализ лейкоцитов, чтобы проверить или исключить другие состояния, которые могут повлиять на лейкоциты.
Хотя образец крови является наиболее распространенным методом тестирования лейкоцитов, врач может также проверить другие биологические жидкости, такие как спинномозговая жидкость, на наличие лейкоцитов.
Врач может заказать WBC:
- тест на аллергию
- тест на инфекцию
- тест на лейкемию
- контролировать прогрессирование определенных состояний
- контролировать эффективность некоторых методов лечения, таких как трансплантация костного мозга
Ниже перечислены условия, которые могут повлиять на количество лейкоцитов в организме человека.
Апластическая анемия
Это состояние, при котором организм человека разрушает стволовые клетки костного мозга.
Стволовые клетки отвечают за создание новых лейкоцитов, красных кровяных телец и тромбоцитов.
Синдром Эванса
Это аутоиммунное заболевание, при котором иммунная система организма разрушает здоровые клетки, включая красные и белые кровяные тельца.
ВИЧ
ВИЧ может уменьшать количество лейкоцитов, называемых Т-лимфоцитами CD4. Когда количество Т-лимфоцитов падает ниже 200, врач может диагностировать СПИД.
Лейкемия
Лейкемия — это тип рака, поражающий кровь и костный мозг. Лейкемия возникает, когда белые кровяные тельца быстро вырабатываются и не могут бороться с инфекциями.
Первичный миелофиброз
Это состояние заставляет организм человека чрезмерно производить некоторые типы клеток крови. Это вызывает образование рубцов в костном мозге человека.
Потребуется ли человеку изменить количество лейкоцитов, будет зависеть от диагноза.
Если у них есть заболевание, которое влияет на количество лейкоцитов в их организме, им следует поговорить с врачом о целях определения их количества лейкоцитов в зависимости от их текущего плана лечения.
Человек может снизить количество лейкоцитов, принимая лекарства, такие как гидроксимочевина, или перенося лейкаферез, который представляет собой процедуру, при которой используется машина для фильтрации крови.
Если количество лейкоцитов у человека низкое из-за лечения рака, например химиотерапии, врач может порекомендовать избегать продуктов, содержащих бактерии. Это может помочь предотвратить инфекции.
Человек также может принимать колониестимулирующие факторы. Это может помочь предотвратить инфекцию и увеличить количество лейкоцитов в организме.
Белые кровяные тельца — важная часть реакции иммунной системы организма. Существуют разные типы белых кровяных телец, и каждый из них выполняет определенную функцию в организме.
Определенные условия могут влиять на количество лейкоцитов в организме, делая их слишком высокими или слишком низкими.
При необходимости человек может принимать лекарства для изменения количества лейкоцитов.
16.3B: Функция лейкоцитов — Medicine LibreTexts
- Последнее обновление
- Сохранить как PDF
- Ключевые моменты
- Ключевые термины
- Функции врожденной иммунной системы
- Функции адаптивной иммунной системы
Каждый тип лейкоцитов (WBC) выполняет определенную функцию в защите организма от инфекций.
Задачи обучения
- Описать функции лейкоцитов (лейкоцитов)
Ключевые моменты
- Функции лейкоцитов часто возникают в кровотоке и могут представлять либо врожденную, либо адаптивную иммунную систему.
- Функции врожденной иммунной системы неспецифичны и включают фагоцитоз, воспаление и дегрануляцию.
- Функции адаптивной иммунной системы являются антигенспецифичными и включают презентацию антигена, а также клеточно-опосредованную и опосредованную гуморальной активностью.
- По сравнению с функциями врожденной иммунной системы, функции адаптивной иммунной системы запускаются дольше, но работают намного быстрее. У них есть компонент памяти, предотвращающий повторное заражение одним и тем же патогеном.
Ключевые термины
- макрофаг : лейкоцит, который фагоцитирует остатки некротических клеток и инородный материал, включая вирусы, бактерии и чернила для татуировок. Он представляет лимфоцитам чужеродные антигены на молекулах MHC II. Часть врожденной иммунной системы.
- Воспаление : Функция врожденной иммунной системы в ответ на патоген или травму. Химические медиаторы заставляют кровеносные сосуды расширяться и становиться более проницаемыми, что притягивает нейтрофилы в эту область.
- цитотоксический : Любой механизм, который может вызвать гибель клетки (обычно без фагоцитоза), такой как дегрануляция или опосредованный клетками апоптоз.
Лейкоциты (белые кровяные тельца) выполняют ряд функций, которые в первую очередь связаны с защитой организма от патогенов (чужеродных захватчиков).Большая активность лейкоцитов происходит в кровотоке, но не ограничивается этой областью. Многие лейкоциты способны выполнять свои функции в тканях или органах во время нормального транспорта и в ответ на травму. Функции лейкоцитов можно классифицировать как врожденные или адаптивные на основе нескольких характеристик.
Функции врожденной иммунной системы
Под врожденной иммунной системой понимается способность организма предотвращать проникновение патогенов и уничтожать патогены, которые попадают в организм.Его функции — быстрые реакции, которые подавляют патоген, как только он обнаруживается в организме. Функции врожденной иммунной системы, связанные с лейкоцитами, включают:
- Фагоцитоз возбудителей болезней. Этот процесс выполняется в основном нейтрофилами, макрофагами и дендритными клетками, но большинство других лейкоцитов также могут это делать. Он включает связывание рецептора Fc с хвостом патогена. Возбудитель поглощается лейкоцитами и разрушается ферментами и свободными радикалами.
- Воспаление.Этот процесс осуществляется в основном тучными клетками, эозинофилами, базофилами и NK-клетками. Когда патоген обнаружен или эндотелиальные клетки сосудов высвобождают стрессовые цитокины из-за повреждения, такого как порез, лейкоциты выделяют различные воспалительные цитокины, такие как гистамин или TNF-альфа. Они вызывают расширение сосудов, увеличивают проницаемость сосудов и способствуют перемещению нейтрофилов к месту воспаления.
- Дегрануляция. Этот процесс осуществляется гранулоцитами, такими как нейтрофилы. Когда патогены встречаются, у патогена может быть индуцирован гранулярно-зависимый апоптоз (механизм цитотоксичности) путем высвобождения перфоринов, гранзимов и протеаз из их гранул.
Нейтрофилы, фагоцитирующие бактерии : Здесь изображены нейтрофилы, фагоцитирующие и полностью поглощающие бактерии.
Функции адаптивной иммунной системы
Адаптивная иммунная система специфична для каждого патогена на основе антигенов, молекулярных компонентов патогенов, используемых лейкоцитами для распознавания этого специфического патогена. По сравнению с врожденной иммунной системой функции адаптивного иммунитета работают намного быстрее и имеют компонент памяти, который предотвращает повторное заражение тем же патогеном.Однако обычно проходит больше времени, прежде чем адпативная иммунная система начинает работать. К адаптивным иммунным функциям лейкоцитов относятся:
- Представление антигена. Этот процесс в основном осуществляется макрофагами и дендритными клетками. После фагоцитоза белковые компоненты (антигены) патогена экспрессируются на молекулах MHC лейкоцитов и представляются наивным Т-клеткам (и В-клеткам) в лимфатических узлах. Затем Т-клетки запускают адаптивный иммунный ответ, быстро пролиферируя и дифференцируясь.
- Клеточно-опосредованная активность. Этот процесс выполняется Т-клетками. Патогены, несущие антиген Т-клетки, уничтожаются за счет цитотоксического апоптоза и протеазной активности.
- Гуморальная деятельность. Этот процесс осуществляется В-клетками, которые секретируют антиген-специфические антитела. Антитела связываются с патогенами, чтобы опсонизировать (маркировать) их, чтобы фагоциты поглотили, нейтрализовали или запустили каскад комплемента, в котором белки образуют комплекс, атакующий мембрану, для лизирования патогена.
- Активность ячейки памяти. После презентации антигена создаются В- и Т-клетки памяти. Они быстро производят новые Т-клетки или антитела, если тот же патоген будет обнаружен в будущем. Это предотвращает повторное заражение организма этим патогеном.
Лейкоциты и тромбоциты — анатомия и физиология
OpenStaxCollege
Цели обучения
К концу этого раздела вы сможете:
- Опишите общую характеристику лейкоцитов
- Классифицируют лейкоциты в соответствии с их происхождением, их основными структурными особенностями и их основными функциями
- Обсудите наиболее распространенные злокачественные новообразования с участием лейкоцитов
- Определите происхождение, основную структуру и функцию тромбоцитов
Лейкоциты, широко известные как белые кровяные тельца (или WBC), являются основным компонентом защиты организма от болезней.Лейкоциты защищают организм от вторжения микроорганизмов и клеток тела с мутированной ДНК, а также убирают мусор. Тромбоциты необходимы для восстановления кровеносных сосудов, когда они были повреждены; они также обеспечивают факторы роста для исцеления и восстановления. См. [Ссылка] для обзора лейкоцитов и тромбоцитов.
Хотя лейкоциты и эритроциты происходят из гемопоэтических стволовых клеток костного мозга, они сильно отличаются друг от друга во многих существенных отношениях.Например, лейкоцитов намного меньше, чем эритроцитов: обычно их всего от 5000 до 10 000 на µ л. Они также больше, чем эритроциты, и являются единственными сформированными элементами, которые представляют собой полные клетки, обладающие ядром и органеллами. И хотя существует только один тип эритроцитов, существует множество типов лейкоцитов. У большинства из этих типов продолжительность жизни намного короче, чем у эритроцитов, у некоторых — всего несколько часов или даже несколько минут в случае острой инфекции.
Одной из наиболее отличительных характеристик лейкоцитов является их движение. В то время как эритроциты проводят свои дни, циркулируя в кровеносных сосудах, лейкоциты обычно покидают кровоток, чтобы выполнять свои защитные функции в тканях организма. Для лейкоцитов сосудистая сеть — это просто дорога, по которой они путешествуют, и вскоре с нее сворачивают, чтобы достичь своего истинного пункта назначения. По прибытии им часто дают разные названия, например, макрофаг или микроглия, в зависимости от их функции.Как показано в [ссылка], они покидают капилляры — мельчайшие кровеносные сосуды — или другие мелкие сосуды в результате процесса, известного как эмиграция (от латинского «удаление») или диапедез (dia- = «через»; -pedan = « прыгать »), в котором они протискиваются через соседние клетки в стенке кровеносного сосуда.
После выхода из капилляров некоторые лейкоциты занимают фиксированные позиции в лимфатической ткани, костном мозге, селезенке, тимусе или других органах. Другие будут перемещаться по тканевым пространствам очень похоже на амеб, непрерывно расширяя свои плазматические мембраны, иногда свободно блуждая, а иногда двигаясь в направлении, в котором их привлекают химические сигналы.Это привлечение лейкоцитов происходит из-за положительного хемотаксиса (буквально «движение в ответ на химические вещества»), явления, при котором поврежденные или инфицированные клетки и близлежащие лейкоциты испускают эквивалент химического звонка «911», привлекая больше лейкоцитов к месту. В клинической медицине дифференциальные подсчеты типов и процентного содержания лейкоцитов часто являются ключевыми показателями при постановке диагноза и выборе лечения.
Эмиграция
Лейкоциты выходят из кровеносного сосуда и затем перемещаются через соединительную ткань дермы к месту раны.Некоторые лейкоциты, такие как эозинофилы и нейтрофилы, характеризуются как гранулярные лейкоциты. Они выделяют из своих гранул химические вещества, уничтожающие болезнетворные микроорганизмы; они также способны к фагоцитозу. Моноцит, агранулярный лейкоцит, дифференцируется в макрофаг, который затем фагоцитирует патогены.
Когда ученые впервые начали наблюдать окрашенные препараты крови, быстро стало очевидно, что лейкоциты можно разделить на две группы в зависимости от того, содержит ли их цитоплазма хорошо видимые гранулы:
- Гранулированные лейкоциты содержат большое количество гранул в цитоплазме.Они включают нейтрофилы, эозинофилы и базофилы (вы можете увидеть их происхождение от миелоидных стволовых клеток в [ссылка]).
- Хотя гранулы не полностью отсутствуют в агранулярных лейкоцитах, их гораздо меньше и они менее очевидны. Агранулярные лейкоциты включают моноциты, которые созревают в макрофаги, которые являются фагоцитами, и лимфоциты, которые возникают из линии лимфоидных стволовых клеток.
Гранулированные лейкоциты
Мы рассмотрим гранулярные лейкоциты в порядке от наиболее частых до наименее распространенных.Все они производятся в красном костном мозге и имеют короткий срок жизни от нескольких часов до нескольких дней. Обычно они имеют дольчатое ядро и классифицируются в зависимости от того, какой тип красителя лучше всего выделяет их гранулы ([ссылка]).
Гранулированные лейкоциты
Нейтрофил имеет маленькие гранулы, окрашивающие в светло-сиреневый цвет, и ядро с двумя-пятью долями. Гранулы эозинофила немного больше и окрашены в красновато-оранжевый цвет, а его ядро состоит из двух-трех долей. Базофил имеет большие гранулы от темно-синего до пурпурного цвета и двухлопастное ядро.
Нейтрофилы, наиболее распространенные из всех лейкоцитов, обычно составляют 50–70 процентов от общего количества лейкоцитов. Их диаметр составляет 10–12 µ м, что значительно больше, чем у эритроцитов. Их называют нейтрофилами, потому что их гранулы наиболее отчетливо видны с химически нейтральными пятнами (ни кислотными, ни основными). Гранулы многочисленны, но довольно мелкие и обычно имеют светло-сиреневый оттенок. Ядро имеет отчетливо выраженную лопастную форму и может иметь от двух до пяти долей, число которых увеличивается с возрастом клетки.Старые нейтрофилы имеют увеличивающееся количество долей и часто называются полиморфноядерными (ядра с множеством форм) или просто «полисами». У молодых и незрелых нейтрофилов появляются доли, известные как «полосы».
Нейтрофилы быстро реагируют на очаг инфекции и являются эффективными фагоцитами, предпочитающими бактерии. Их гранулы включают лизоцим, фермент, способный лизировать или разрушать стенки бактериальных клеток; окислители, такие как перекись водорода; и дефенсины, белки, которые связываются с плазматическими мембранами бактерий и грибов и прокалывают их, так что содержимое клеток выходит наружу.Аномально высокое количество нейтрофилов указывает на инфекцию и / или воспаление, особенно вызванное бактериями, но также обнаруживается у ожоговых пациентов и других людей, испытывающих необычный стресс. Ожоговая травма увеличивает распространение нейтрофилов для борьбы с инфекцией, которая может возникнуть в результате разрушения кожного барьера. Низкое количество может быть вызвано токсичностью лекарства и другими нарушениями и может повысить восприимчивость человека к инфекции.
Эозинофилы обычно составляют 2–4 процента от общего количества лейкоцитов.Они также имеют диаметр 10–12 µ м. Гранулы эозинофилов лучше всего окрашиваются кислотным красителем, известным как эозин. Ядро эозинофила обычно имеет от двух до трех долей, и при правильном окрашивании гранулы будут иметь отчетливый красный или оранжевый цвет.
Гранулы эозинофилов включают молекулы антигистаминов, которые противодействуют активности гистаминов, воспалительных химических веществ, продуцируемых базофилами и тучными клетками. Некоторые гранулы эозинофилов содержат молекулы, токсичные для паразитических червей, которые могут проникать в организм через кожные покровы или когда человек ест сырую или недоваренную рыбу или мясо.Эозинофилы также способны к фагоцитозу и особенно эффективны, когда антитела связываются с мишенью и образуют комплекс антиген-антитело. Высокое содержание эозинофилов типично для пациентов, страдающих аллергией, заражением паразитарными червями и некоторыми аутоиммунными заболеваниями. Низкое количество может быть связано с токсичностью лекарств и стрессом.
Базофилы — наименее распространенные лейкоциты, обычно составляющие менее одного процента от общего количества лейкоцитов. Они немного меньше нейтрофилов и эозинофилов и имеют диаметр 8–10 µ м.Гранулы базофилов лучше всего окрашиваются основными (щелочными) красителями. Базофилы содержат большие гранулы, которые окрашиваются в темно-синий цвет, и настолько распространены, что могут затруднить просмотр двухлепесткового ядра.
В целом базофилы усиливают воспалительный ответ. Они разделяют эту черту с тучными клетками. В прошлом тучные клетки считались базофилами, покидающими кровообращение. Однако, похоже, это не так, поскольку два типа клеток развиваются из разных клонов.
Гранулы базофилов выделяют гистамины, способствующие воспалению, и гепарин, препятствующий свертыванию крови.Высокое количество базофилов связано с аллергией, паразитарными инфекциями и гипотиреозом. Низкие показатели связаны с беременностью, стрессом и гипертиреозом.
Агранулярные лейкоциты
Агранулярные лейкоциты содержат в своей цитоплазме менее заметные гранулы меньшего размера, чем гранулярные лейкоциты. Ядро простой формы, иногда с выемкой, но без отчетливых долей. Существует два основных типа агранулоцитов: лимфоциты и моноциты (см. [Ссылка]).
Лимфоциты — единственный элемент крови, образующийся из лимфоидных стволовых клеток. Хотя изначально они образуются в костном мозге, большая часть их последующего развития и размножения происходит в лимфатических тканях. Лимфоциты являются вторым по распространенности типом лейкоцитов, на их долю приходится около 20–30 процентов всех лейкоцитов, и они необходимы для иммунного ответа. Диапазон размеров лимфоцитов довольно обширен: одни авторитетные источники признают два класса размеров, а другие — три.Обычно размер крупных клеток составляет 10–14 мкм мкм, они имеют меньшее соотношение ядра и цитоплазмы и большее количество гранул. Меньшие клетки обычно имеют размер 6–9 µ мкм с большим объемом ядра до цитоплазмы, создавая эффект «ореола». Некоторые клетки могут выходить за пределы этих диапазонов, 14–17 µ м. Это открытие привело к классификации трех размеров.
Три основные группы лимфоцитов включают естественные клетки-киллеры, В-клетки и Т-клетки. Естественные киллеры (NK) способны распознавать клетки, которые не экспрессируют «собственные» белки на своей плазматической мембране или содержат чужеродные или аномальные маркеры.Эти «чужие» клетки включают раковые клетки, клетки, инфицированные вирусом, и другие клетки с атипичными поверхностными белками. Таким образом, они обеспечивают генерализованный неспецифический иммунитет. Более крупные лимфоциты обычно являются NK-клетками.
В-клетки и Т-клетки, также называемые В-лимфоцитами и Т-лимфоцитами, играют важную роль в защите организма от конкретных патогенов (болезнетворных микроорганизмов) и участвуют в формировании специфического иммунитета. Одна форма В-клеток (плазматические клетки) продуцирует антитела или иммуноглобулины, которые связываются со специфическими чужеродными или аномальными компонентами плазматических мембран.Это также называется гуморальным (жидкостным) иммунитетом. Т-клетки обеспечивают иммунитет на клеточном уровне, физически атакуя чужеродные или больные клетки. Клетка памяти — это множество как В-, так и Т-клеток, которые образуются после воздействия патогена и быстро реагируют на последующие воздействия. В отличие от других лейкоцитов, клетки памяти живут много лет. В-клетки подвергаются процессу созревания в одном костном мозге b , тогда как Т-клетки подвергаются созреванию в гимусе t . Этот участок процесса созревания дает название В- и Т-клеткам.Функции лимфоцитов сложны и будут подробно рассмотрены в главе, посвященной лимфатической системе и иммунитету. Более мелкие лимфоциты являются либо В-, либо Т-клетками, хотя их нельзя дифференцировать в нормальном мазке крови.
Аномально высокое количество лимфоцитов характерно для вирусных инфекций, а также для некоторых типов рака. Аномально низкое количество лимфоцитов характерно для длительных (хронических) заболеваний или иммуносупрессии, в том числе вызванных ВИЧ-инфекцией и лекарственными препаратами, которые часто включают стероиды.
Моноциты происходят из миелоидных стволовых клеток. Обычно они составляют 2–8 процентов от общего количества лейкоцитов. Их обычно легко узнать по крупному размеру 12–20 µ м и зазубренным или подковообразным ядрам. Макрофаги — это моноциты, которые покинули кровообращение и фагоцитируют мусор, чужеродные патогены, изношенные эритроциты и многие другие мертвые, изношенные или поврежденные клетки. Макрофаги также выделяют антимикробные дефенсины и хемотаксические химические вещества, которые привлекают другие лейкоциты к месту инфекции.Некоторые макрофаги занимают фиксированные места, тогда как другие блуждают в тканевой жидкости.
Аномально высокое количество моноцитов связано с вирусными или грибковыми инфекциями, туберкулезом, некоторыми формами лейкемии и другими хроническими заболеваниями. Аномально низкие показатели обычно вызваны подавлением костного мозга.
Большинство лейкоцитов имеют относительно короткую продолжительность жизни, обычно измеряемую часами или днями. Производство всех лейкоцитов начинается в костном мозге под влиянием спинномозговой жидкости и интерлейкинов.Вторичное производство и созревание лимфоцитов происходит в определенных областях лимфатической ткани, известных как зародышевые центры. Лимфоциты полностью способны к митозу и могут производить клоны клеток с идентичными свойствами. Эта способность позволяет человеку сохранять иммунитет на протяжении всей жизни ко многим угрозам, с которыми он сталкивался в прошлом.
Лейкопения — это состояние, при котором вырабатывается слишком мало лейкоцитов. Если это состояние выражено, человек может быть не в состоянии предотвратить болезнь.Чрезмерная пролиферация лейкоцитов называется лейкоцитозом. Хотя количество лейкоцитов велико, сами клетки часто нефункциональны, что подвергает человека повышенному риску заболевания.
Лейкоз — это рак, пораженный большим количеством лейкоцитов. Он может включать только один конкретный тип лейкоцитов либо из миелоидной линии (миелоцитарный лейкоз), либо из лимфоидной линии (лимфолейкоз). При хроническом лейкозе зрелые лейкоциты накапливаются и не умирают. При остром лейкозе наблюдается перепроизводство молодых незрелых лейкоцитов.В обоих случаях клетки не функционируют должным образом.
Лимфома — это форма рака, при которой массы злокачественных Т- и / или В-лимфоцитов накапливаются в лимфатических узлах, селезенке, печени и других тканях. Как и при лейкемии, злокачественные лейкоциты не функционируют должным образом, и пациент уязвим для инфекции. Некоторые формы лимфомы имеют тенденцию к медленному прогрессированию и хорошо поддаются лечению. Другие, как правило, быстро прогрессируют и требуют агрессивного лечения, без которого они быстро заканчиваются смертельным исходом.
Иногда вы можете увидеть тромбоциты, называемые тромбоцитами, но поскольку это название предполагает, что они являются типом клеток, это неточно. Тромбоцит — это не клетка, а скорее фрагмент цитоплазмы клетки, называемый мегакариоцитом, который окружен плазматической мембраной. Мегакариоциты происходят от миелоидных стволовых клеток (см. [Ссылка]) и имеют большие размеры, обычно 50–100 µ м в диаметре, и содержат увеличенное лопастное ядро. Как отмечалось ранее, тромбопоэтин, гликопротеин, секретируемый почками и печенью, стимулирует пролиферацию мегакариобластов, которые превращаются в мегакариоциты.Они остаются в ткани костного мозга ([ссылка]) и в конечном итоге образуют отростки-предшественники тромбоцитов, которые проходят через стенки капилляров костного мозга, высвобождая в кровообращение тысячи цитоплазматических фрагментов, каждый из которых окружен кусочком плазматической мембраны. Эти заключенные фрагменты представляют собой тромбоциты. Каждый мегакароцит выделяет 2000–3000 тромбоцитов в течение своей жизни. После высвобождения тромбоцитов остатки мегакариоцитов, которые представляют собой немного больше, чем ядро клетки, потребляются макрофагами.
Тромбоциты относительно малы, 2–4 µ м в диаметре, но многочисленны, обычно 150 000–160 000 на µ л крови.После попадания в кровоток примерно одна треть мигрирует в селезенку для хранения для последующего высвобождения в ответ на любой разрыв кровеносного сосуда. Затем они активируются для выполнения своей основной функции — ограничения кровопотери. Тромбоциты сохраняются всего около 10 дней, затем фагоцитируются макрофагами.
Тромбоциты имеют решающее значение для гемостаза, остановки кровотока после повреждения сосуда. Они также выделяют различные факторы роста, необходимые для роста и восстановления тканей, особенно соединительной ткани.Настои концентрированных тромбоцитов в настоящее время используются в некоторых методах лечения для стимуляции заживления.
Тромбоцитоз — это состояние, при котором слишком много тромбоцитов. Это может вызвать образование нежелательных тромбов (тромбоз), потенциально смертельное заболевание. При недостаточном количестве тромбоцитов, называемом тромбоцитопенией, кровь может не свернуться должным образом, что может привести к чрезмерному кровотечению.
Тромбоциты
Тромбоциты происходят из клеток, называемых мегакариоцитами.
Лейкоциты
(Микрофотографии предоставлены Медицинской школой Риджентс Мичиганского университета © 2012)
См. Веб-скопы Мичиганского университета по адресу
http://virtualslides.med.umich.edu/Histology/Cardiovascular%20System/081-2_HISTO_40X.svs/view.apml?cwidth=860&cheight=733&chost=virtualslides.med.viewich.edu&list 1 & title = & csis = 1 и изучите слайды крови более подробно. Функция Webscope позволяет перемещать слайды, как на механическом столике.Вы можете увеличивать и уменьшать увеличение. Есть возможность рассмотреть каждый из лейкоцитов индивидуально после того, как вы попытаетесь идентифицировать их по первым двум мазкам крови. Кроме того, есть несколько вопросов с несколькими вариантами ответов.
Умеете ли вы распознавать и идентифицировать различные формованные элементы? Делать это нужно будет систематически, сканируя по изображению. Стандартный метод — использовать сетку, но с этим ресурсом это невозможно. Попробуйте составить простую таблицу с каждым типом лейкоцитов, а затем сделать отметку для каждого идентифицированного вами типа клеток.Попытайтесь классифицировать не менее 50, а возможно, и 100 различных ячеек. Основываясь на процентном соотношении клеток, которое вы подсчитываете, представляют ли цифры нормальный мазок крови или что-то кажется ненормальным?
Лейкоциты участвуют в защите организма. Они выдавливаются из стенок кровеносных сосудов в результате эмиграции или диапедеза, затем могут перемещаться через тканевую жидкость или прикрепляться к различным органам, где они борются с патогенными организмами, больными клетками или другими угрозами для здоровья.Гранулярные лейкоциты, которые включают нейтрофилы, эозинофилы и базофилы, происходят из миелоидных стволовых клеток, как и агранулярные моноциты. Другие агранулярные лейкоциты, NK-клетки, B-клетки и T-клетки, происходят из линии лимфоидных стволовых клеток. Самыми многочисленными лейкоцитами являются нейтрофилы, которые первыми реагируют на инфекции, особенно бактерии. Около 20–30 процентов всех лейкоцитов составляют лимфоциты, которые имеют решающее значение для защиты организма от конкретных угроз. Лейкемия и лимфома — это злокачественные новообразования, в которых участвуют лейкоциты.Тромбоциты — это фрагменты клеток, известных как мегакариоциты, которые обитают в костном мозге. В то время как многие тромбоциты хранятся в селезенке, другие попадают в кровоток и необходимы для гемостаза; они также производят несколько факторов роста, важных для восстановления и заживления.
[ссылка] Умеете ли вы распознавать и идентифицировать различные формованные элементы? Делать это нужно будет систематически, сканируя по изображению. Стандартный метод — использовать сетку, но с этим ресурсом это невозможно.Попробуйте составить простую таблицу с каждым типом лейкоцитов, а затем сделать отметку для каждого идентифицированного вами типа клеток. Попытайтесь классифицировать не менее 50, а возможно, и 100 различных ячеек. Основываясь на процентном соотношении клеток, которое вы подсчитываете, представляют ли цифры нормальный мазок крови или что-то кажется ненормальным?
[ссылка] Это должен быть нормальный мазок крови.
Процесс, при котором лейкоциты проталкиваются через соседние клетки в стенке кровеносного сосуда, называется ________.
- лейкоцитоз
- положительный хемотаксис
- эмиграция
- Удлинение цитоплазмы
Что из перечисленного описывает нейтрофил?
- обильный, крупнозернистый, особенно эффективен против раковых клеток
- обильный, гранулированный, особенно эффективен против бактерий
- редкий, крупнозернистый, выделяет антимикробные дефенсины
- редкий, гранулированный, содержит несколько гранул, заполненных гистамином
Т- и В-лимфоцитов ________.
- являются полиморфно-ядерными
- связаны со специфической иммунной функцией
- чрезмерно размножаются при лейкопении
- наиболее активны против паразитических червей
Пациентка страдает тяжелыми стойкими симптомами аллергии, которые уменьшаются при приеме антигистаминных препаратов. До лечения у этого пациента, вероятно, была повышенная активность лейкоцитов?
- базофилов
- нейтрофилов
- моноцитов
- естественных клеток-киллеров
Тромбоциты точнее называть ________.
- Факторы свертывания
- мегакариобластов
- мегакариоцитов
- тромбоцитов
Одним из наиболее частых побочных эффектов химиотерапии рака является разрушение лейкоцитов. Перед очередным плановым курсом химиотерапии пациент сдает анализ крови, называемый абсолютным количеством нейтрофилов (АНК), который показывает, что его количество нейтрофилов составляет 1900 клеток на микролитр. Сможет ли его медицинская бригада продолжить курс химиотерапии? Почему?
Количество нейтрофилов ниже 1800 клеток на микролитр считается ненормальным.Таким образом, АНК этого пациента находится на нижней границе нормального диапазона, и нет причин откладывать химиотерапию. В клинической практике большинству пациентов назначают химиотерапию, если их ЧСС выше 1000.
Больной поступил в ожоговое отделение накануне вечером с тяжелым ожогом левой верхней конечности и плеча. Анализ крови показывает, что у него лейкоцитоз. Почему это ожидаемый результат?
Любой сильный стресс может увеличить количество лейкоцитов, что приведет к лейкоцитозу.Ожог особенно склонен к увеличению пролиферации лейкоцитов, чтобы предотвратить инфекцию, что представляет собой значительный риск, когда нарушается барьерная функция кожи.
Глоссарий
- агранулярные лейкоциты
- лейкоцитов с небольшим количеством гранул в цитоплазме; в частности, моноциты, лимфоциты и NK-клетки
- В-лимфоциты
- (также В-клетки) лимфоцитов, которые защищают организм от определенных патогенов и тем самым обеспечивают специфический иммунитет
- базофилы
- гранулоцитов, окрашиваемых щелочной (щелочной) окраской и хранящих гистамин и гепарин
- дефенсины
- антимикробных белков, выделяемых нейтрофилами и макрофагами, которые создают отверстия в плазматических мембранах для уничтожения клеток
- диапедез
- (также эмиграция) процесс, при котором лейкоциты проталкиваются через соседние клетки в стенке кровеносного сосуда и попадают в ткани
- эмиграция
- (также диапедез) процесс, при котором лейкоциты проталкиваются через соседние клетки в стенке кровеносного сосуда и попадают в ткани
- эозинофилов
- гранулоцитов, окрашивающихся эозином; они выделяют антигистаминные препараты и особенно активны против паразитических червей
- гранулярные лейкоциты
- лейкоцитов с обильными гранулами в цитоплазме; в частности, нейтрофилы, эозинофилы и базофилы
- лейкемия
- рак с участием лейкоцитов
- лейкоцитов
- (также лейкоцит) бесцветная ядросодержащая клетка крови, основная функция которой — защита организма от болезней
- лейкоцитоз
- чрезмерная пролиферация лейкоцитов
- лейкопения
- выработка лейкоцитов ниже нормы
- лимфоцитов
- агранулярных лейкоцитов линии лимфоидных стволовых клеток, многие из которых действуют в рамках специфического иммунитета
- лимфома
- форма рака, при которой массы злокачественных Т- и / или В-лимфоцитов накапливаются в лимфатических узлах, селезенке, печени и других тканях
- лизоцим
- пищеварительный фермент с бактерицидными свойствами
- мегакариоцит
- Клетка костного мозга, вырабатывающая тромбоциты
- ячейка памяти
- тип В- или Т-лимфоцитов, который образуется после воздействия патогена
- моноцитов
- агранулярных лейкоцитов линии миелоидных стволовых клеток, циркулирующих в кровотоке; тканевые моноциты — макрофаги
- естественных киллеров (NK) клеток
- цитотоксических лимфоцитов, способных распознавать клетки, которые не экспрессируют «собственные» белки на своей плазматической мембране или содержат чужеродные или аномальные маркеры; обеспечивают генерализованный неспецифический иммунитет
- нейтрофилов
- гранулоцитов, окрашиваемых нейтральным красителем и являющихся наиболее многочисленными лейкоцитами; особенно активен против бактерий
- полиморфноядерный
- с лопастным ядром, как видно в некоторых лейкоцитах
- положительный хемотаксис
- Процесс, при котором клетка движется в направлении химических стимулов
- Т-лимфоциты
- (также Т-клетки) лимфоцитов, которые обеспечивают иммунитет на клеточном уровне, физически атакуя чужеродные или больные клетки
- тромбоцитов
- тромбоцитов, один из форменных элементов крови, состоящий из фрагментов клеток, отколовшихся от мегакариоцитов
- тромбоцитопения
- Состояние, при котором тромбоцитов слишком мало, что приводит к аномальному кровотечению (гемофилия)
- тромбоцитоз
- Состояние, при котором слишком много тромбоцитов, приводящее к аномальному свертыванию (тромбозу)
лейкоцитов — Physiopedia
Введение
Лейкоциты (также называемые лейкоцитами) представляют собой клеточный компонент крови, в котором отсутствует гемоглобин, имеется ядро и способность к подвижности. Они защищают организм от инфекций и болезней путем: проглатывания посторонних материалов и клеточного мусора; уничтожая инфекционные агенты и раковые клетки; или путем производства антител [1] .
Лейкоциты вырабатываются костным мозгом, и уровень их производства регулируется такими органами, как селезенка, печень и почки.
- Гранулоциты и агранулоциты — это два типа белых кровяных телец или лейкоцитов.
- Гранулоциты содержат гранулы или мешочки в цитоплазме, а агранулоциты — нет. Каждый тип гранулоцитов и агранулоцитов играет немного разную роль в борьбе с инфекциями и болезнями.
- Три типа гранулоцитов: нейтрофилы, эозинофилы и базофилы.
- Два типа агранулоцитов — лимфоциты и моноциты [2] .
Количество лейкоцитов
Наш костный мозг постоянно вырабатывает белые кровяные тельца, потому что у них ограниченная продолжительность жизни всего от 1 до 3 дней. WBC хранятся в крови и лимфатических тканях. Количество лейкоцитов — показатель вашего здоровья. 4000–11000 на мл крови — нормальное количество, что составляет 1% от общего объема крови у взрослого [3] .
- Производство клеток крови часто регулируется такими структурами тела, как лимфатические узлы, селезенка, печень и почки.Продолжительность жизни зрелых лейкоцитов может составлять от нескольких часов до нескольких дней [2] .
- Лимфоциты составляют большинство клеток иммунной системы; они включают В-клетки, Т-клетки и естественные клетки-киллеры, все из которых атакуют чужеродные частицы или клетки, такие как вирусы, грибы, бактерии, трансплантированные клетки и раковые клетки. [4]
Большинство людей будет производить около 100 миллиардов лейкоцитов каждый день. Колебания количества лейкоцитов происходят в течение дня; более низкие значения получаются во время отдыха, а более высокие — во время упражнений.
- Аномальное увеличение количества лейкоцитов известно как лейкоцитоз. Количество лейкоцитов может увеличиваться в ответ на интенсивные физические нагрузки, судороги, острые эмоциональные реакции, боль, беременность, роды и определенные болезненные состояния, например инфекции и интоксикации.
- Аномальное уменьшение количества известно как лейкопения. Число может уменьшаться в ответ на определенные типы инфекций или лекарств или в связи с определенными состояниями, например хронической анемией, недоеданием или анафилаксией [1] .
Расположение
Хотя лейкоциты обнаруживаются в кровотоке, большинство из них происходит вне кровотока, в тканях, где они борются с инфекциями (некоторые из них в кровотоке переходят из одного места в другое). Лейкоциты пробиваются через кровеносные сосуды. Они размягчают свои громоздкие ядра и подталкивают их к переднему краю своих клеток, а затем исследуют каркасы в стенках кровеносных сосудов и проталкиваются через них. Этот процесс приводит к разрыву более мелких нитевидных волокон, которые образуют гибкие каркасы стенок кровеносных сосудов, и клетки легко восстанавливают этот разрыв позже в рамках повседневного обслуживания клеток. [5]
Изображение: нейтрофильные гранулоциты мигрируют из кровеносного сосуда в матрикс, секретируя протеолитические ферменты, чтобы растворить межклеточные связи (для улучшения их подвижности) и окружить бактерии посредством фагоцитоза.
Типы
Существует несколько различных типов белых кровяных телец, каждый из которых выполняет свои функции:
Лимфоциты: они жизненно важны для выработки антител, которые помогают организму защищаться от бактерий, вирусов и других угроз.
Нейтрофилы : это мощные лейкоциты, уничтожающие бактерии и грибки. Эти клетки имеют одно ядро с множеством долей. Нейтрофилы — это самые распространенные белые кровяные клетки в обращении. Они химически притягиваются к бактериям (цитокинами) и мигрируют через ткани к участкам инфекции. Нейтрофилы фагоцитируют (т.е. они поглощают и разрушают клетки-мишени). При высвобождении их гранулы действуют как лизосомы, переваривая клеточные макромолекулы, разрушая при этом нейтрофилы.
Базофилы : они предупреждают организм об инфекциях, выделяя химические вещества в кровоток, в основном для борьбы с аллергией. Это наименее многочисленный тип белых кровяных телец. У них есть многодольчатое ядро, а их гранулы содержат иммуностимулирующие соединения, такие как гистамин и гепарин. Гепарин разжижает кровь и препятствует образованию тромбов, в то время как гистамин расширяет кровеносные сосуды, чтобы увеличить кровоток и проницаемость капилляров, чтобы лейкоциты могли переноситься в инфицированные области.
Эозинофилы : они отвечают за уничтожение паразитов и раковых клеток, и они являются частью аллергической реакции. Ядро этих клеток двудольчатое и в мазках крови имеет U-образную форму. Эозинофилы обычно обнаруживаются в соединительных тканях желудка и кишечника. Это также фагоцитарные комплексы и в первую очередь целевые комплексы антиген-антитело, образующиеся, когда антитела связываются с антигенами, чтобы сигнализировать о том, что они должны быть разрушены. Эозинофилы наиболее активны при паразитарных инфекциях и аллергических реакциях.
Моноциты : Эти клетки являются самыми большими по размеру среди белых кровяных телец. У них есть большое одиночное ядро, которое бывает разной формы, но чаще всего имеет форму почки. Моноциты мигрируют из крови в ткань и развиваются либо в макрофаги, либо в дендритные клетки.
- Макрофаги — это крупные клетки, присутствующие почти во всех тканях. Они активно выполняют фагоцитарные функции. NB. Макрофаги необходимы для наступления беременности. Они помогают в развитии сети кровеносных сосудов в яичниках, жизненно важных для выработки гормона прогестерона.Прогестерон играет важную роль в имплантации эмбриона в матку. [6]
- Дендритные клетки чаще всего находятся в тканях областей, которые контактируют с внешними антигенами.
