Анализы на Лактатдегидрогеназа (ЛДГ), цены в лаборатории KDL
Лактатдегидрогеназа (ЛДГ) – внутриклеточный фермент, участвующий в метаболизме глюкозы. Содержит цинк, продуцируется всеми клетками организма. Наибольшая активность фермента наблюдается в мышцах, сердце, печени, почках и клетках крови — эритроцитах.
Существует 5 типов ЛДГ, от преобладания той или иной разновидности фермента зависит способ метаболизма глюкозы в тканях – аэробный (до углекислого газа и воды) или анаэробный (до молочной кислоты). Например, в миокарде преобладает ЛДГ-1, в почках и клетках крови – ЛДГ-2, в большинстве внутренних органов ЛДГ-3 и 4, в мышцах, плаценте, печени – ЛДГ-5. Все формы фермента присутствуют в крови, где они определяются в составе суммарного показателя – общей лактатдегидрогеназы.
Концентрация ЛДГ в крови повышается при заболеваниях, для которых характерно повреждение тканей организма. Анализ крови на ЛДГ не является специфичным, однако в совокупности с другими тестами он помогает диагностировать различные патологические состояния: инфаркт легкого, гемолитическую анемию и т.
В каких случаях обычно назначают исследование?
Анализ крови на лактатдегидрогеназу назначается при:
- дифференциальной диагностике загрудинных болей (инфаркт миокарда, стенокардия, инфаркт легкого) вместе с анализом на тропонин I;
- при подозрении на гемолиз;
- диагностике поражений мышц;
- комплексном профилактическом обследовании пациента.
Что именно определяется в процессе анализа?
В процессе анализа измеряется концентрация ЛДГ в сыворотке крови пациента при помощи колориметрического метода.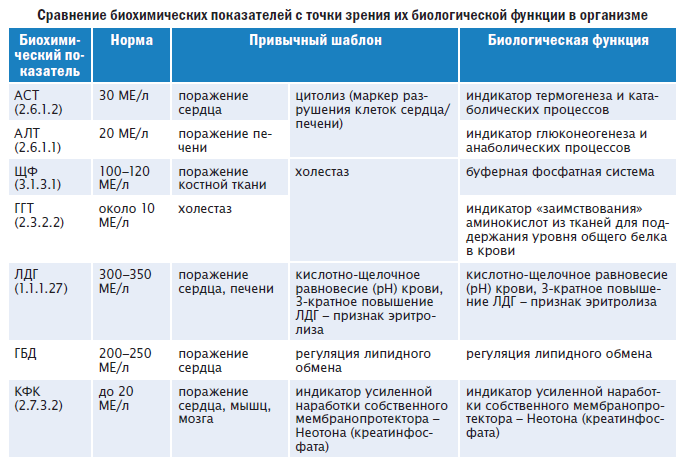
Что означают результаты теста?
У детей референсные значения меняются в зависимости от возраста. Верхняя граница нормы уровня ЛДГ у мужчин несколько выше, чем у женщин. Так же повышенная активность ЛДГ может выявляться у новорожденных, беременных и у пациентов после интенсивных физических нагрузок (в частности,у спортсменов). При выявлении любых отклонений требуются дополнительные исследования и консультация врача.
Сроки выполнения теста.
Результат исследования можно получить на следующий день после сдачи анализа.
Как подготовиться к анализу?
Следует придерживаться общих правил подготовки к взятию крови из вены. Кровь можно сдавать не ранее, чем через 3 часа после приема пищи в течение дня, или утром натощак. Чистую воду можно пить в обычном режиме. Накануне исключить избыточные физические, эмоциональные нагрузки и прием алкоголя.
Лактатдегидрогеназа (ЛДГ) – что это такое? Свойства и показания

ЛДГ — цинксодержащий фермент, катализирующий восстановление пировиноградной кислоты в молочную, и наоборот, пировиноградной в молочную. Является внутриклеточным энзимом, находящимся во всех тканях организма: почках, печени, сердце, скелетных мышцах, эритроцитах.
Синонимы:
ЛДГ, lactate dehydrogenase, LDH, КФ 1.1.1.27.
Метод исследования:
УФ кинетический тест. Метод основан на различии спектров поглощения окисленной и восстановленной форм NAD при 340 нм.Биоматериал для анализа:
Сыворотка крови.
Подготовка
Забор крови должен проводиться в утренние часы натощак. После последнего приема пищи должно пройти не менее 12 часов. За 30 мин до забора крови следует избегать физического и эмоционального напряжения. Исключить алкоголь.
Описание:
Лактатдегидрогеназа (ЛДГ) существует в тканях организма в форме тетрамера: два мономера, Н и М, могут соединяться в различных соотношениях, образуя пять известных изоферментов ЛДГ.
пируват + NADН + H+ ↔ L-лактат + NAD+
При некоторых патологических состояниях наблюдается повышение активности ЛДГ, например, при остром поражении печени, при поражениях скелетных мышц и почек, при мегалобластных и гемолитических анемиях. При лимфоме высокая активность ЛДГ в плазме является предвестником плохого прогноза. Существует зависимость между активностью фермента и объемом опухоли, поэтому последовательные измерения уровня активности ЛДГ позволяют оценивать эффективность терапии.
Как в сердечной мышце, так и в эритроцитах ЛДГ представлена главным образом изоферментами ЛДГ (Н4). Изофермент проявляет гораздо большую каталитическую активность в отношении α-гидроксибутирата, чем лактата (по сравнению с другими изоферментами), поэтому, при измерении активности ЛДГ, используют именно этот субстрат.
Определение уровня активности изоферментов ЛДГ имеет значение при подозрении на инфаркт миокарда и в диагностике гемолитического криза при серповидноклеточной анемии.
Для чего используется анализ?
Для определения активности ЛДГ в сыворотке крови.
Когда назначается?
При подозрении на:
- инфаркт миокарда,
- серповидноклеточную анемию,
- поражение печени,
- патологии поджелудочной железы.
Референсные значения (норма)
Нормальный уровень активности ЛДГ в сыворотке крови взрослого человека составляет 225–550 Ед/л.
Значения результатов
В физиологических условиях повышенная активность наблюдается у беременных, новорожденных и после интенсивных физических нагрузок. Повышение ЛДГ отмечается при инфаркте миокарда, лейкозах, тромбоцитопении, повреждениях печени вирусной, токсической и травматической природы, опухолях различной локализации, заболеваниях почек, гемолизе эритроцитов.
Превышение верхнего предела нормы более, чем в 10 раз:
- холестаз,
- алкогольное поражение печени.
Превышение верхнего предела нормы в 5 — 10 раз:
- гепатит (острый и хронический),
- цирроз (без холестаза),
- другие заболевания печени,
- панкреатит.
Превышение верхнего предела нормы менее, чем в 10 раз:
- злоупотребление алкоголем,
- лекарства, вызывающие индукцию фермента;
Понижение активности ЛДГ клинического значения не имеет.
ЛДГ (Лактатдегидрогеназа, L-лактат: НАД+Оксидоредуктаза, Lactate dehydrogenase, LDH)
Что такое ЛДГ (Лактатдегидрогеназа, L-лактат: НАД+Оксидоредуктаза, Lactate dehydrogenase, LDH)?
Лактатдегидрогеназа (ЛДГ) — это фермент, который участвует в выработке энергии и обнаруживается почти во всех клетках организма. Самое большое количество ЛДГ находится в клетках сердца, печени, мышц, почек, легких и в клетках крови.
Самое большое количество ЛДГ находится в клетках сердца, печени, мышц, почек, легких и в клетках крови.
В норме уровень ЛДГ в сыворотке крови низкий. При повреждении и/или разрушении клеток уровень ЛДГ повышается, что отражается в результатах данного теста. Однако повышение уровня ЛДГ не является специфичным, то есть установить точную локализацию поражения только по этому показателю нельзя.
Для чего определяют уровень АЛТ в крови?
ЛДГ может использоваться для отслеживания динамики тяжелых состояний, например, гемолитической анемии, мышечной дистрофии или тяжелых инфекций – уменьшение показателя в динамике сигнализирует об эффективности назначенной терапии.
Периодическое измерение ЛДГ необходимо для контроля некоторых видов лечения, например, химиотерапии злокачественных опухолей, когда снижающийся уровень этого показателя свидетельствует об эффективности терапии.
При каких заболеваниях повышается уровень АЛТ в крови?
ЛДГ повышается при инфаркте миокарда, инсульте, гемолизе (разрушении эритроцитов), инфекционных заболеваниях (инфекционном мононуклеозе, менингите, энцефалите и др. ), сепсисе (крайне тяжелое состояние, когда инфекционный процесс приводит к нарушению работы многих органов – полиорганной недостаточности), остром повреждении печени, почек, мышечной травме, переломах костей, различных видах онкологических заболеваний, панкреатите (воспалительном поражении поджелудочной железы) и т.д.
), сепсисе (крайне тяжелое состояние, когда инфекционный процесс приводит к нарушению работы многих органов – полиорганной недостаточности), остром повреждении печени, почек, мышечной травме, переломах костей, различных видах онкологических заболеваний, панкреатите (воспалительном поражении поджелудочной железы) и т.д.
Таким образом, для точной диагностики конкретного заболевания врач, обнаруживший повышение ЛДГ, вероятнее всего, назначит дополнительное обследование в соответствии с жалобами, историей заболевания и данными осмотра. Например, при подозрении на поражение печени и установленном повышении уровня ЛДГ дополнительными исследованиями станут показатели АЛТ, АСТ, в некоторых случаях – щелочной фосфатазы (ЩФ). При подозрении на инфаркт миокарда целесообразно исследовать уровней кардиоспецифичных ферментов, таких как тропонин, миоглобин, креатинкиназа (КФК).
Почему результат анализа может быть некорректным?
Если при подготовке к исследованию были соблюдены все рекомендации, то его результат будет корректным. Однако бывают ситуации, когда человек не может отказаться от приема тех или иных препаратов, а эти препараты способны исказить результат. Например, средства, содержащие ацетилсалициловую кислоту, и некоторые противовоспалительные лекарства могут завысить уровень лактатдегидрогеназы в сыворотке крови. Об их приеме нужно проконсультироваться с врачом и по возможности отменить за 2-3 дня до сдачи анализа.
Однако бывают ситуации, когда человек не может отказаться от приема тех или иных препаратов, а эти препараты способны исказить результат. Например, средства, содержащие ацетилсалициловую кислоту, и некоторые противовоспалительные лекарства могут завысить уровень лактатдегидрогеназы в сыворотке крови. Об их приеме нужно проконсультироваться с врачом и по возможности отменить за 2-3 дня до сдачи анализа.
Правила подготовки к анализу крови для определения уровня ЛДГ
Взятие крови предпочтительно проводить утром натощак, после 8-14 часов ночного периода голодания (воду пить можно), допустимо днем через 4 часа после легкого приема пищи. Накануне исследования необходимо исключить повышенные психоэмоциональные и физические нагрузки (спортивные тренировки), приём алкоголя.
Интерпретация результатов исследований содержит информацию для лечащего врача и не является диагнозом.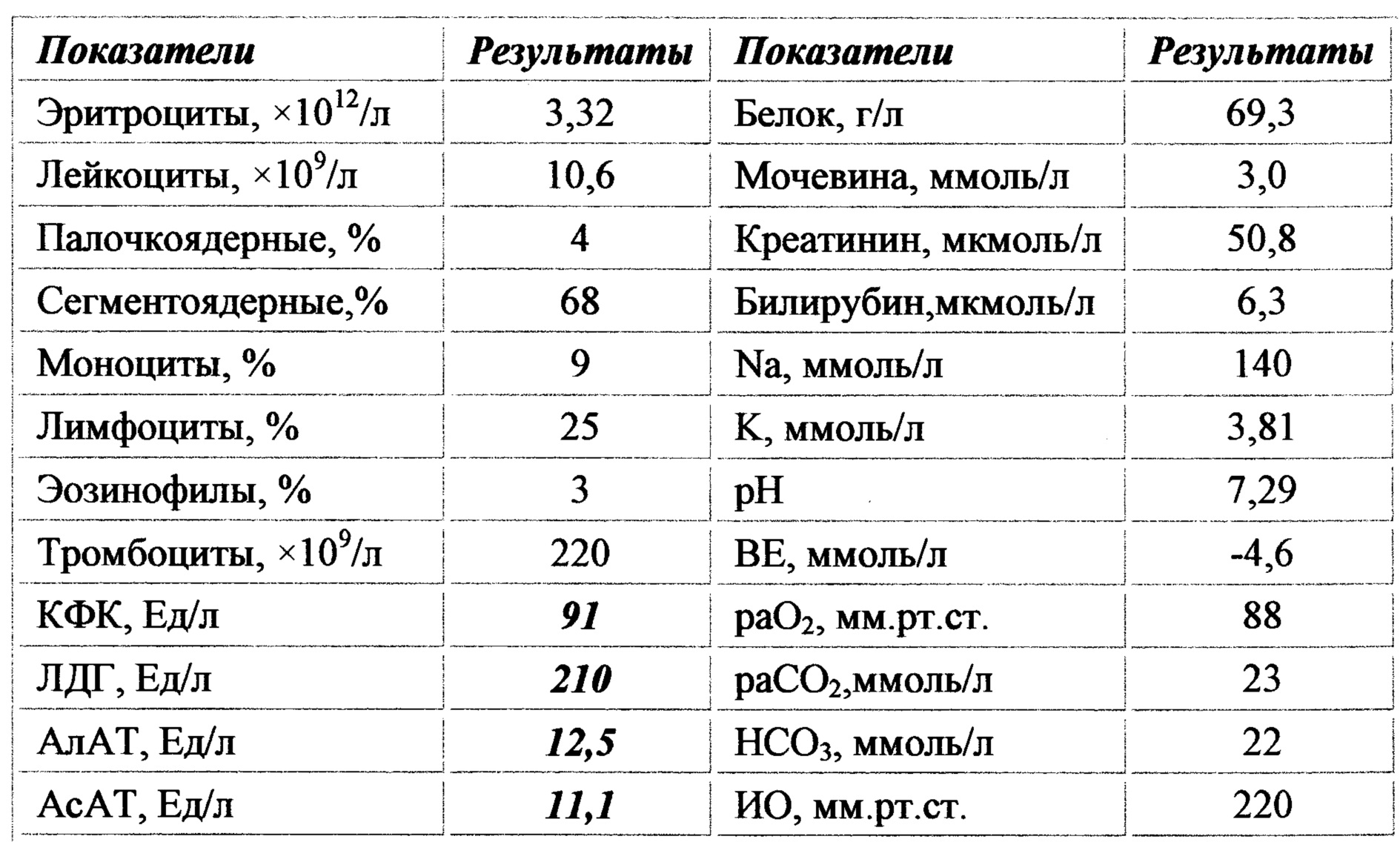
Трактовка результатов анализа крови на ЛДГ
Единицы измерения: Ед/л.
Референсные значения|
Возраст |
Уровень ЛДГ, Ед/л |
|
до 1 года |
< 451 |
|
от 1 года до 3 лет |
< 344 |
|
от 3 до 6 лет |
< 314 |
|
от 6 до 12 лет |
< 332 |
|
от 12 до 17 лет |
< 279 |
|
более 17 лет |
125-220 |
Повышение значений
- Патология печени (вирусные и токсические гепатиты, механическая желтуха, цирроз печени).

- Инфаркт миокарда и инфаркт лёгкого.
- Заболевания системы крови (гемолитическая, пернициозная, мегалобластная и серповидно-клеточная анемии, острый лейкоз).
- Злокачественные новообразования различных органов.
- Заболевания скелетных мышц (травма, атрофия).
- Патология почек (гломерулонефриты, пиелонефриты, инфаркт почки и т. п).
- Любые патологические процессы, которые сопровождаются разрушением клеток и потерей цитоплазмы (травматический шок, гемолиз, обширные ожоги, гипоксия, крайняя гипотермия и т. д.).
- Острый панкреатит.
- Приём алкоголя и некоторых лекарственных средств (например, кофеин, анестетики, цефалоспорины, нестероидные противовоспалительные средства, сульфаниламиды).
Лактатдегидрогеназа (ЛДГ) общая: исследования в лаборатории KDLmed
Лактатдегидрогеназа (ЛДГ) общая – внутриклеточный гликолитический фермент, который участвует в обратимом превращении лактата в пируват и содержится в большинстве тканей организма.
Синонимы русские
Дегидрогеназа молочной кислоты.
Синонимы английские
Lactate dehydrogenase, Total, Lactic dehydrogenase, LDH, LD.
Метод исследования
УФ кинетический тест.
Единицы измерения
Ед/л (единица на литр).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 12 часов до анализа.
- Исключить физическое и эмоциональное перенапряжение за 30 минут до исследования.
- Не курить в течение 30 минут до сдачи крови.
Общая информация об исследовании
Лактатдегидрогеназа (ЛДГ) – цинксодержащий внутриклеточный фермент, который катализирует окисление молочной кислоты в пируват и содержится практически во всех клетках организма. ЛДГ наиболее активна в скелетной мускулатуре, сердечной мышце, почках, печени и эритроцитах.
ЛДГ наиболее активна в скелетной мускулатуре, сердечной мышце, почках, печени и эритроцитах.
Существует пять разных форм (изоферментов) ЛДГ, которые отличаются молекулярной структурой и расположением в организме. От того, какая из пяти преобладает, зависит основной способ окисления глюкозы – аэробный (до CO2 и H2O) или анаэробный (до молочной кислоты). Подобное различие обусловлено разной степенью родства того или иного изофермента и пировиноградной кислоты. Для миокарда и мозговой ткани основной является ЛДГ-1, для эритроцитов, тромбоцитов, почечной ткани — ЛДГ-1 и ЛДГ-2. В лёгких, селезёнке, щитовидной и поджелудочной железах, надпочечниках, лимфоцитах преобладает ЛДГ-3. ЛДГ-4 находится во всех тканях с ЛДГ-3, а также в гранулоцитах, плаценте и мужских половых клетках, в которых содержится и ЛДГ-5. Изоферментная активность в скелетных мышцах (в порядке убывания): ЛДГ-5, ЛДГ-4, ЛДГ-3. Для печени наиболее характерен изофермент ЛДГ-5, меньшая активность у ЛДГ-4. В норме в сыворотке крови все фракции фермента определяются с небольшой активностью в составе суммарного показателя – общей ЛДГ. Их активность в крови распределяется следующим образом: ЛДГ-2 > ЛДГ-1 > ЛДГ-3 > ЛДГ-4 > ЛДГ-5.
В норме в сыворотке крови все фракции фермента определяются с небольшой активностью в составе суммарного показателя – общей ЛДГ. Их активность в крови распределяется следующим образом: ЛДГ-2 > ЛДГ-1 > ЛДГ-3 > ЛДГ-4 > ЛДГ-5.
При заболеваниях, сопровождающихся повреждением тканей и разрушением клеток, активность ЛДГ в крови повышается. В связи с этим она является важным маркером тканевой деструкции. Несмотря на то что увеличение активности фермента не указывает на какую-то определённую болезнь, его определение в комплексе с другими лабораторными анализами помогает в диагностике инфаркта лёгкого, мышечной дистрофии и гемолитической анемии. Повышенная активность ЛДГ может выявляться у новорождённых, беременных и после интенсивных физических нагрузок.
Ранее совместные анализы на ЛДГ, аспартатаминотрансферазу и креатинкиназу широко использовались в диагностике инфаркта миокарда. Сейчас для этой цели определяют уровень тропонина как более специфического маркера повреждения сердечной мышцы. Но исследование активности ЛДГ остается вспомогательным анализом при дифференциальной диагностике болевого синдрома в грудной клетке. У больных стенокардией активность фермента не изменяется, но при инфаркте миокарда начинает возрастать через 8-10 часов с максимумом в первые 24-48 часов после сердечного приступа и возвращается к норме через 10-12 дней. Повышение ЛДГ при нормальной активности АСТ через 1-2 дня после боли в грудной клетке указывает на инфаркт лёгкого.
Но исследование активности ЛДГ остается вспомогательным анализом при дифференциальной диагностике болевого синдрома в грудной клетке. У больных стенокардией активность фермента не изменяется, но при инфаркте миокарда начинает возрастать через 8-10 часов с максимумом в первые 24-48 часов после сердечного приступа и возвращается к норме через 10-12 дней. Повышение ЛДГ при нормальной активности АСТ через 1-2 дня после боли в грудной клетке указывает на инфаркт лёгкого.
При дифференциальной диагностике миопатий данный анализ помогает уточнить патофизиологические механизмы заболевания. Так, при нарушении мышечной функции, связанной с нейрогенными заболеваниями, ЛДГ не повышается, но при повреждении мышц из-за эндокринных и метаболических патологий активность ЛДГ увеличивается.
Активность ЛДГ в крови может возрастать вследствие многих злокачественных новообразований, при эффективном лечении она снижается, что иногда применяют для динамического наблюдения за онкологическими больными.
Для чего используется исследование?
- Для диагностики острого или хронического повреждения тканей при комплексном обследовании пациента.
- Для дифференциальной диагностики заболеваний при резкой боли в грудной клетке (инфаркт миокарда, стенокардия, инфаркт лёгкого).
- Чтобы выявлять заболевания, сопровождающиеся гемолизом эритроцитов.
- В целях наблюдения за течением онкологических заболеваний при терапии.
- Для исследования патологий печени и почек.
- Для диагностики поражений мышечной ткани.
Когда назначается исследование?
- При подозрении на острое или хроническое повреждение ткани и клеток в организме.
- При комплексном профилактическом обследовании пациента.
- При наблюдении за течением некоторых хронических заболеваний (мышечной дистрофии, гемолитических анемий, заболеваний печени, почек), онкологической патологии.
Что означают результаты?
Референсные значения
Возраст, пол | Референсные значения | |
1 — 3 года | ||
3 — 6 лет | ||
6 — 12 лет | ||
12 — 17 лет | ||
> 17 лет | женский | 135 — 214 Ед/л |
мужской | 135 — 225 Ед/л | |
Причины повышения активности лактатдегидрогеназы общей:
- инфаркт миокарда,
- лёгочная эмболия и инфаркт лёгкого,
- заболевания крови, сопровождающиеся гемолизом (гемолитическая, пернициозная, мегалобластическая, серповидно-клеточная анемии, эритремия),
- злокачественные новообразования различных локализаций (рак яичек, рак печени, лимфома, метастазы в костную ткань и печень и т.
 д.),
д.), - лейкозы,
- патология печени (вирусные и токсические гепатиты, цирроз печени, обтурационная желтуха, алкогольная болезнь печени),
- болезни почек (инфаркт почки, гломерулонефрит, пиелонефрит),
- патология мышц (мышечная дистрофия, травма, атрофия),
- переломы костей,
- застойная сердечная недостаточность, острая коронарная недостаточность (без инфаркта), миокардит (умеренное повышение фермента),
- инфекционный мононуклеоз,
- инфаркт кишечника,
- острый панкреатит,
- инсульт,
- судорожный припадок,
- белая горячка,
- эклампсия,
- травматический шок,
- тяжёлые состояния, сопровождающиеся гипоксией, гипер- и гипотермией,
- ожоговая болезнь,
- пневмоцистная пневмония,
- преждевременная отслойка плаценты,
- гипотиреоз.
Что может влиять на результат?
К повышению результата могут приводить:
- гемолиз эритроцитов в пробе крови (в связи с высокой активностью ЛДГ в клетках крови),
- интенсивные физические нагрузки незадолго до исследования,
- наличие у пациента протезированного клапана сердца (гемолиз эритроцитов вследствие повреждения клеток створками клапана),
- применение электроимпульсной терапии незадолго до исследования,
- гемодиализ (в связи с удалением ингибиторов фермента – мочевины во время процедуры),
- большое количество тромбоцитов (тромбоцитоз),
- некоторые заболевания кожи,
- лекарственные средства, повышающие активность ЛДГ (анестетики, аспирин, вазопрессин, вальпроевая кислота, наркотики, прокаинамид, этанол, амиодарон, анаболические стероиды, верапамил, изотретиноин, каптоприл, хлорамфеникол, кодеин, дапсон, дилтиазем, интерферон-альфа, интерлейкин-2, некоторые антибактериальные и противогрибковые препараты, неспецифические противовоспалительные препараты, пеницилламин, стрептокиназа, тиопентал, фуросемид, метотрексат, сульфасалазин, симвастатин, такролимус).

Возможные причины снижения результата:
- присутствие оксалатов и мочевины, ингибирующих фермент,
- лекарственные средства, снижающие активность ЛДГ (амикацин, аскорбиновая кислота, гидроксимочевина, дофибрат, эналаприл, метронидазол, налтрексон, противосудорожные препараты, цефотаксим).
Важные замечания
- Ввиду неспецифичности данного анализа его результат должен трактоваться с учётом показателей других лабораторных исследований и клинической картины заболевания.
- В диагностике острых процессов, сопровождающихся деструкцией ткани (инфаркта, некроза), необходимо учитывать изменения активности ЛДГ в плазме в течение некоторого времени после острого эпизода болезни.
- Определение изоферментов ЛДГ помогает уточнить локализацию патологического процесса.
- Основным лабораторным маркером инфаркта миокарда является тропонин I, а не ЛДГ.
Также рекомендуется
Кто назначает исследование?
Терапевт, кардиолог, онколог, врач общей практики.
Литература
- Назаренко Г.И., Кишкун А. Клиническая оценка результатов лабораторных исследований. – М.: Медицина, 2000. — 165-166.
- Fischbach F.T., Dunning M.B. A Manual of Laboratory and Diagnostic Tests, 8th Ed. Lippincott Williams & Wilkins, 2008: 1344 p.
- Wilson D. McGraw-Hill Manual of Laboratory and Diagnostic Tests 1st Ed Normal, Illinois, 2007: 347-348 pp.
№AN24LDH, ЛДГ (лактатдегидрогеназа) для собак и кошек: показатели, норма
Лактатдегидрогеназа содержится в цитоплазме большинства клеток и катализирует обратимое превращение L-лактата в пируват. ЛДГ является неспецифичным ферментом, поскольку к выходу фермента во внеклеточное пространство и кровь приводит повреждение многих тканей.
- Преаналитика
- Интерпретация результата
- Референсные значения
ЛДГ ‒ это тетрамер, состоящий из четырех субъединиц двух типов: H (сердечный) и M (мышечный), которые образуют пять молекулярных форм – ЛДГ1 (Н4), ЛДГ2 (h4M1), ЛДГ3 (h3M2), ЛДГ4 (h2M3) и ЛДГ5 (М4). Каждый изофермент присутствует в ограниченном числе тканей и, следовательно, определение изоферментов является более специфичным, чем определение общей сывороточной активности ЛДГ.
Каждый изофермент присутствует в ограниченном числе тканей и, следовательно, определение изоферментов является более специфичным, чем определение общей сывороточной активности ЛДГ.
Хотя существуют значительные межвидовые различия по содержанию изоформ фермента в тканях, как правило, изофермент ЛДГ-1 (Н4) преобладает в сердечной мышце и почках, а изофермент ЛДГ-5 (М4) является основным изоферментом в скелетных мышцах и эритроцитах. Остальные три изоформы фермента обнаруживаются в разных концентрациях в различных тканях. У многих видов животных в печени содержатся в первую очередь изоформы ЛДГ 4 и ЛДГ 5 (h2M3 и M4), но спектр изофермента печени для крупного рогатого скота и овец больше напоминает изоферментный спектр сердечной мышцы.
Существует заметная разница в периодах полураспада пяти изоферментов. Скорость полувыведения ЛДГ из плазмы крови варьирует для каждого изофермента: для ЛДГ 1 (Н4) она самая продолжительная, а для ЛДГ 5 (M4) самая короткая и у собак составляет в среднем 3,3 часа, у свиней 40 часов, у овец 50 часов. Некоторые изоформы ЛДГ могут образовывать комплексы с препаратами, например, стрептокиназой.
Некоторые изоформы ЛДГ могут образовывать комплексы с препаратами, например, стрептокиназой.
Мышцы, печень и разрушающиеся эритроциты, как правило, являются источниками высокой активности ЛДГ в сыворотке. После повреждения тканей сывороточная активность ЛДГ достигает пика через 24-48 часов и возвращается к норме в течение 7-10 дней. Для выявления повреждения мышечной ткани уровень ЛДГ в крови является менее информативным показателем, чем КФК и АСТ, поскольку ЛДГ не обладает тканевой специфичностью, и на ее сывороточную активность существенно влияет даже незначительный гемолиз. В совокупности исследование сывороточной активности ЛДГ может помочь в дифференциальной диагностике патологического процесса.
Преаналитика:
Для получения более точных результатов животные перед исследованием должны находиться на голодной диете не менее 12 часов. Образец стабилен 1 неделю при температуре хранения +2°С…+8°С; сохраняет стабильность 1 месяц при замораживании -17ºС…-23ºС.
При выраженном гемолизе уровень ЛДГ повышается.
Интерпретация:
Результаты исследования содержат информацию исключительно для врачей. Диагноз ставится на основании комплексной оценки различных показателей, дополнительных сведений и зависит от методов диагностики.
Единицы измерения в лаборатории VET UNION: Ед/л.
Референсные значения:
Собаки: 20-350 Ед/л.
Кошки: 40-350 Ед/л.
Лошади: 102-340 Ед/л.
Хорьки: 241-460 Ед/л.
Кролик:34-129 Ед/л.
Тукан:200-400 Ед/л.
Повышение уровня:
Состояния или заболевания, приводящие к гемолизу.
Повреждения скелетной мускулатуры.
Гепатоцелюллярные повреждения.
Инфаркт миокарда.
Неопластические процессы.
Острый панкреатит.
Нефрит.
Лептоспироз.
Инфекционный перитонит кошек.
Понижение уровня:
Не имеет клинической значимости.
Сдать анализ на ЛДГ, лактатдегидрогеназу
Метод определения
Лактат =>пируват (IFCC).
Исследуемый материал Сыворотка крови
Доступен выезд на дом
Онлайн-регистрацияСинонимы: Лактатдегидрогеназа; L-лактат; НАД+Оксидоредуктаза; Дегидрогеназа молочной кислоты.
Lactate dehydrogenase, Total; Lactic dehydrogenase; LDH; LD.
Краткая характеристика определяемого аналита ЛДГ (Лактатдегидрогеназа)
Гликолитический фермент, участвующий в конечных этапах превращения глюкозы (катализ взаимопревращения пирувата и лактата).
Цинксодержащий фермент, локализующийся в основном в цитоплазме и обнаруживающийся практически во всех органах и тканях человека.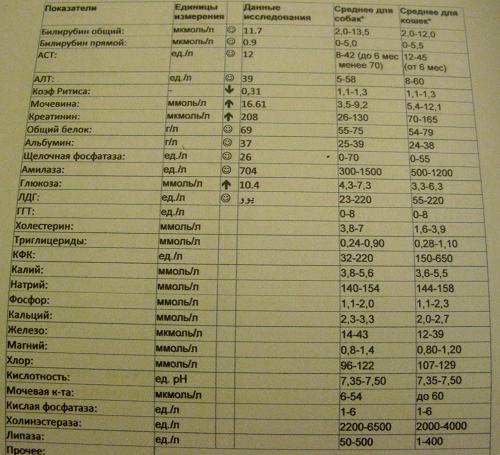 Наибольшая активность отмечается в почках, печени, сердце, скелетных мышцах, поджелудочной железе, клетках крови. В эритроцитах её уровень в 100 раз выше, чем в сыворотке. У детей активность фермента выше, чем у взрослых, с возрастом активность ЛДГ сыворотки плавно снижается.
Наибольшая активность отмечается в почках, печени, сердце, скелетных мышцах, поджелудочной железе, клетках крови. В эритроцитах её уровень в 100 раз выше, чем в сыворотке. У детей активность фермента выше, чем у взрослых, с возрастом активность ЛДГ сыворотки плавно снижается.
С какой целью определяют уровень ЛДГ в сыворотке крови
Оценка уровня ЛДГ в сыворотке крови помогает выявить состояния, сопровождающиеся повреждением клеток и тканей.
Что может повлиять на показатели активности фермента ЛДГ
Показатели активности ЛДГ зависят от метода исследования. Повышенная активность ЛДГ в физиологических условиях наблюдается у беременных, новорожденных, после интенсивных физических нагрузок. Активность фермента у женщин несколько ниже, чем у мужчин.
Мониторинг течения инфаркта миокарда. Рост активности ЛДГ наблюдается на 12-24 часу после инфаркта; максимальная активность отмечается через 24-48 часов. Повышенная активность фермента держится вплоть до 10 суток. Активность ЛДГ зависит от размеров очага поражения миокарда, а динамика ее снижения в процессе выздоровления – от интенсивности восстановительных процессов в сердечной мышце. Определение активности ЛДГ позволяет дифференцировать истинный инфаркт миокарда и клинически сходные с ним приступы стенокардии: при инфаркте суммарная активность ЛДГ возрастает и в результате ее значение в несколько раз превышает нормальный уровень, в то же время даже при тяжелых приступах стенокардии уровень активности ЛДГ соответствует норме. Снижение активности фермента в постинфарктном периоде происходит в 2 раза медленнее, чем нормализация таких маркеров поражения миокарда, как креатинкиназа и АСТ, что особенно ценно для поздней диагностики поражения.
Активность ЛДГ зависит от размеров очага поражения миокарда, а динамика ее снижения в процессе выздоровления – от интенсивности восстановительных процессов в сердечной мышце. Определение активности ЛДГ позволяет дифференцировать истинный инфаркт миокарда и клинически сходные с ним приступы стенокардии: при инфаркте суммарная активность ЛДГ возрастает и в результате ее значение в несколько раз превышает нормальный уровень, в то же время даже при тяжелых приступах стенокардии уровень активности ЛДГ соответствует норме. Снижение активности фермента в постинфарктном периоде происходит в 2 раза медленнее, чем нормализация таких маркеров поражения миокарда, как креатинкиназа и АСТ, что особенно ценно для поздней диагностики поражения.
ЛДГ (Лактатдегидрогеназа, LDH) — цена анализа в Днипро в ИНВИТРО
Исследуемый материал Сыворотка крови
Метод определения
Оптимизированный стандартизированный (DGKC) UV-тест (пируват ==> лактат).
Лдг лактатдегидрогеназа – это цинксодержащий внутриклеточный фермент, катализирующий окисление молочной кислоты в пируват. Содержится он в сыворотке крови и почти во всех клетках человека в виде пяти изоферментов. Подвижность каждого из них различается, они нумеруются как 1,2,3,4,5. Последний движется наиболее медленно, а первый наиболее быстро.
В норме основной источник изоферментов ЛДГ в сыворотке – это разрушающиеся клетки крови. Если ткани повреждаются, то ЛДГ из них поступает в кровь. Определение изоферментов очень важно для обнаружения проблемы и диагностики заболевания, так как повышенная концентрация отдельного изофермента является показателем повреждения конкретного органа.
В комплексе с другими лабораторными исследованиями анализ на лактатдегидрогеназ помогает в диагностике мышечной дистрофии, инфаркта легкого, гемолитической анемии и других заболеваний.
Концентрация ЛДГ в крови возрастает в результате большинства злокачественных новообразований, вследствие эффективного лечения они начинают снижаться, что дает возможность применять расшифровку результатов анализа для динамического осмотра и наблюдения за онкологическим больным пациентом.
Повышение уровня ЛДГ отмечают во время беременности, у новорожденных, после больших физических нагрузок. Для детей свойственна более высокая сывороточная активность фермента, чем у взрослых, но с возрастом она снижается. У мужчин активность фермента несколько выше, нежели у женщин.
Пониженный уровень ЛДГ, как правило, встречается редко и опасности не представляет.
Сдать анализ на лактатдегидрогеназ всегда можно в лаборатории ИНВИТРО, здесь вы получите наиболее достоверные результаты и останетесь довольны ценами, которые достаточно демократичны. Если потребуются повторные анализы, то предпочтительно делать их в той же лаборатории.
Лактатдегидрогеназа (ЛДГ) — понимание теста и ваших результатов
Источники, использованные в текущем обзоре
Лактатдегидрогеназа (LD), сыворотка. Медицинские лаборатории Мэйо. Доступно на сайте https://www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/8344. Доступ 13 июня 2018 г.
Доступ 13 июня 2018 г.
Лактатдегидрогеназа (ЛД), Жидкость организма. Медицинские лаборатории Мэйо. Доступно на сайте https://www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/8022.Доступ 13 июня 2018 г.
Дегидрогеназа молочной кислоты (кровь). Медицинский центр Университета Рочестера. Доступно в Интернете по адресу https://www.urmc.rochester.edu/encyclopedia/content.aspx?contenttypeid=167&contentid=lactic_acid_dehydrogenase_blood. Доступ 13.06.18.
Источники, использованные в предыдущих обзорах
Томас, Клейтон Л., редактор (1997). Циклопедический медицинский словарь Табера. Компания F.A. Davis, Филадельфия, Пенсильвания [18-е издание].
Пагана, Кэтлин Д.И Пагана, Тимоти Дж. (2001). Справочник по диагностическим и лабораторным испытаниям Мосби, 5-е издание: Mosby, Inc., Сент-Луис, Миссури.
Лактатдегидрогеназа. Руководство ARUP по клиническому лабораторному тестированию [он-лайн информация]. Доступно в Интернете по адресу http://www.aruplab.com/guides/clt/tests/clt_a32b.htm#1140532.
Доступно в Интернете по адресу http://www.aruplab.com/guides/clt/tests/clt_a32b.htm#1140532.
(25 октября 2002 г., обновлено). Изоферменты ЛДГ. Информация о здоровье MedlinePlus [онлайн-информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/003499.htm.
(20 ноября 2001 г., обновлено). LDH. Информация о здоровье MedlinePlus [онлайн-информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/003471.htm.
Шпенглер Р. (14 мая 2002 г., обновлено). Что такое лактатдегидрогеназа (ЛДГ)? Больница Св. Иосифа, Библиотека здоровья, Медицинские тесты [Он-лайн информация]. Доступно в Интернете по адресу http://www.sjo.org/library/healthguide/MedicalTests/topic.asp?hwid=tv6793abc.
Мартин, Г. (9 марта 1998 г.). Устаревание теста на лактатдегидрогеназу.Американская медицинская ассоциация, Архивы внутренней медицины, переписка редактора, Vol. 158 № 5 [Он-лайн информация]. Доступно в Интернете по адресу http://archinte.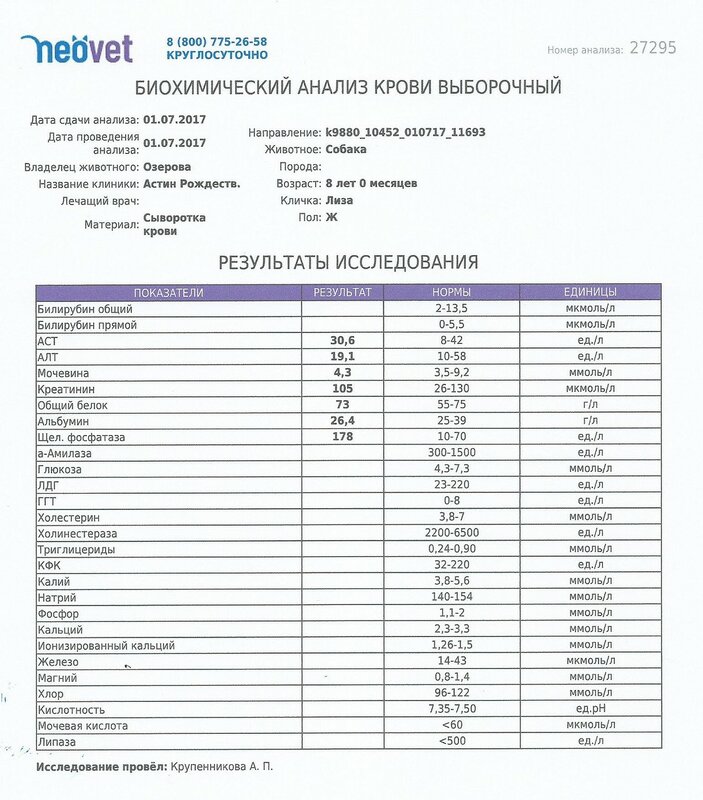 ama-assn.org/issues/v158n5/ffull/ilt0309-4.html.
ama-assn.org/issues/v158n5/ffull/ilt0309-4.html.
Шпенглер Р. (14 мая 2002 г., обновлено). Исследования сердечных ферментов. WebMD [Он-лайн информация]. Доступно в Интернете по адресу http://my.webmd.com/printing/article/1675.55521.
Тест на изоферменты лактатдегидрогеназы. Hendrick Health System, Библиотека медицинской информации AccessMed [онлайн-информация].Доступно в Интернете по адресу http://www.hendrickhealth.org/healthy/00054240.html.
Тест на лактатдегидрогеназу. Hendrick Health System, Библиотека медицинской информации AccessMed [онлайн-информация]. Доступно в Интернете по адресу http://www.hendrickhealth.org/healthy/00054250.html.
Пагана, Кэтлин Д. и Пагана, Тимоти Дж. (© 2007). Справочник по диагностическим и лабораторным испытаниям Мосби, 8-е издание: Mosby, Inc., Сент-Луис, Миссури. С. 581-582.
Кларк, В. и Дюфур, Д. Р., редакторы (2006).Современная практика клинической химии, AACC Press, Вашингтон, округ Колумбия. Глава 23 Лабораторная диагностика заболеваний печени, стр. 269 — 279.
269 — 279.
Ву, А. (2006). Клиническое руководство по лабораторным исследованиям Тиц, четвертое издание. Сондерс Эльзевир, Сент-Луис, Миссури. Стр. 652.
(13 марта 2007 г., обновлено). LDH. Медицинская энциклопедия MedlinePlus [Он-лайн информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/003471.htm. Доступно 7/9/07.
Форвик, Л.и Зиев, Д. (Обновлено 14 марта 2009 г.). Изоферменты ЛДГ. Медицинская энциклопедия MedlinePlus [Электронная информация] Доступна на сайте http://www.nlm.nih.gov/medlineplus/ency/article/003499.htm. По состоянию на октябрь 2010 г.
Форвик, Л. и Зиев, Д. (Обновлено 21 марта 2010 г.). Тест на лактатдегидрогеназу. Медицинская энциклопедия MedlinePlus [Электронная информация] Доступна на сайте http://www.nlm.nih.gov/medlineplus/ency/article/003471.htm. По состоянию на октябрь 2010 г.
Шаффер, Э. (отредактировано в июне 2009 г.).Тестирование на заболевания печени и желчевыводящих путей, лабораторные анализы. Пособие Merck для специалистов здравоохранения [Электронная информация] Доступно на сайте http://www.merck.com/mmpe/sec03/ch023/ch023b.html. По состоянию на октябрь 2010 г.
Пособие Merck для специалистов здравоохранения [Электронная информация] Доступно на сайте http://www.merck.com/mmpe/sec03/ch023/ch023b.html. По состоянию на октябрь 2010 г.
(© 1995-2010). Код единицы 8344: Лактатдегидрогеназа (ЛД), сыворотка. Клиника Мэйо, Медицинские лаборатории Мейо [Информация в режиме онлайн] Доступно в Интернете по адресу http://www.mayomedicallaboratories.com/test-catalog/Overview/8344. По состоянию на октябрь 2010 г.
Анализ крови: лактатдегидрогеназа (ЛДГ).KidsHealth от Nemours Foundation [Информация в Интернете] Доступно в Интернете по адресу http://kidshealth.org/parent/system/medical/test_ldh.html. По состоянию на октябрь 2010 г.
Пагана, К. Д. и Пагана, Т. Дж. (© 2007). Справочник по диагностическим и лабораторным испытаниям Мосби, 8-е издание: Mosby, Inc., Сент-Луис, Миссури. С. 581-583.
Ву, А. (© 2006). Клиническое руководство Tietz по лабораторным испытаниям, 4-е издание: Saunders Elsevier, Сент-Луис, Миссури. С. 648-651.
648-651.
Учебник Тиц по клинической химии и молекулярной диагностике.Burtis CA, Ashwood ER, Bruns DE, ред. Сент-Луис: Эльзевьер Сондерс; 2006, С. 601-602.
Национальный институт рака. Онкомаркеры. Доступно в Интернете по адресу http://www.cancer.gov/cancertopics/factsheet/Detection/tumor-markers. По состоянию на октябрь 2013 г.
Американское онкологическое общество. Специфические онкомаркеры. Доступно в Интернете по адресу http://www.cancer.org/treatment/understandingyourdiagnosis/examsandtestdescriptions/tumormarkers/tumor-markers-specific-markers. По состоянию на октябрь 2013 г.
KidsHealth.Анализ крови: лактатдегидрогеназа (ЛДГ). Доступно в Интернете по адресу http://kidshealth.org/parent/system/medical/test_ldh.html. По состоянию на октябрь 2013 г.
Национальный институт рака. Лечение рака яичек (PDQ®). Доступно в Интернете по адресу http://www.cancer.gov/cancertopics/pdq/treatment/testicular/HealthProfessional/page1#Section_562. По состоянию на октябрь 2013 г.
Герстен Т. (Обновлено 8 февраля 2012 г.). Тест на лактатдегидрогеназу. Медицинская энциклопедия MedlinePlus [Он-лайн информация]. Доступно в Интернете по адресу http: // www.nlm.nih.gov/medlineplus/ency/article/003471.htm. По состоянию на июль 2014 г.
(© 1995–2014) Лактатдегидрогеназа (LD), Сыворотка. Клиника Мэйо Медицинские лаборатории Мэйо [Он-лайн информация]. Доступно в Интернете по адресу http://www.mayomedicallaboratories.com/test-catalog/Overview/8344. По состоянию на июль 2014 г.
Дагдейл, Д. (Обновлено 26 января 2013 г.). Изоферменты ЛДГ. Медицинская энциклопедия MedlinePlus [Он-лайн информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/003499.htm. По состоянию на июль 2014 г.
Гарднер Т. и Берк Б. (Обновлено 3 сентября 2013 г.). Острый панкреатит. Справочник по Medscape [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/181364-overview. По состоянию на июль 2014 г.
(обновлено 3 июня 2013 г.). Острый перикардит. Справочник по Medscape [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/156951-overview. По состоянию на июль 2014 г.
Dowshen, S. (обзор, март 2011 г.). Анализ крови: лактатдегидрогеназа (ЛДГ).KidsHealth от Nemours [Он-лайн информация]. Доступно в Интернете по адресу http://kidshealth.org/parent/system/medical/test_ldh.html. По состоянию на июль 2014 г.
Пагана, К. Д. и Пагана, Т. Дж. (© 2011). Справочник по диагностическим и лабораторным испытаниям Мосби, 10-е издание: Mosby, Inc., Сент-Луис, Миссури. С. 603-605.
Кларк, У., редактор (© 2011). Современная практика клинической химии, 2-е издание: AACC Press, Вашингтон, округ Колумбия. Стр. 313.
Макферсон Р. и Пинкус М. (© 2011).Клиническая диагностика и лечение Генри с помощью лабораторных методов 22-е издание: Elsevier Saunders, Филадельфия, Пенсильвания. С. 292-294.
Strimel, W. (Обновлено 27 апреля 2014 г. ). Выпот в перикарде. Справочник по Medscape [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/157325-overview. По состоянию на июль 2014 г.
). Выпот в перикарде. Справочник по Medscape [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/157325-overview. По состоянию на июль 2014 г.
Рубинс Дж. (Обновлено 18 ноября 2013 г.). Плевральный выпот. Справочник по Medscape [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/299959-overview.По состоянию на июль 2014 г.
Тест на лактатдегидрогеназу (ЛДГ): цель, процедура, риски, результаты
Тест на лактатдегидрогеназу (ЛДГ) выявляет признаки повреждения тканей организма.
ЛДГ — это фермент, который содержится почти в каждой клетке вашего тела, включая кровь, мышцы, мозг, почки и поджелудочную железу.
Фермент превращает сахар в энергию. Тест на ЛДГ измеряет количество ЛДГ в крови или других жидкостях организма.
Когда клетки повреждаются или разрушаются, этот фермент попадает в жидкую часть крови.Врачи называют это «сывороткой» или «плазмой». ЛДГ также может выделяться в другие жидкости организма, включая спинномозговую жидкость, которая окружает головной и спинной мозг.
Зачем мне нужен тест LDH?
Ваш врач может назначить его по любому количеству причин, например:
- Чтобы определить, есть ли у вас повреждение тканей, и если да, то сколько
- Для мониторинга тяжелых инфекций или состояний, таких как гемолитическая или мегалобластная анемия, заболевание почек, и заболевание печени
- Для оценки некоторых видов рака или лечения рака
В зависимости от вашего состояния вы можете регулярно проходить тесты на ЛДГ.
Вы можете пройти тест на ЛДГ биологических жидкостей, чтобы:
- Определить причину скопления жидкости. Это может быть связано с множеством причин, например с травмой или воспалением. (Это также может быть вызвано дисбалансом давления в кровеносных сосудах и количеством белка в крови.)
- Помогите определить, есть ли у вас бактериальный или вирусный менингит.
Что происходит во время теста?
Кровь берется через иглу, введенную в вену на руке.
Для исследования спинномозговой жидкости на ЛДГ вам понадобится люмбальная пункция (также называемая спинномозговой пункцией). Вам в поясницу вставят тонкую иглу.
Перед каждым тестом вы должны сообщить своему врачу обо всех лекарствах, добавках, травах, витаминах и обо всем, что вы принимаете.
Каковы риски или побочные эффекты?
Для анализа крови на ЛДГ они включают:
- Кровотечение
- Ушиб
- Инфекция
- Болезненность в месте взятия крови
Если вам сделали люмбальную пункцию, у вас могут возникнуть следующие побочные эффекты:
Что означают результаты?
Более высокий уровень ЛДГ в крови может быть признаком повреждения тканей или заболевания.Уровень ЛДГ в крови также может сообщить врачу, если ваше заболевание ухудшается или помогает ли ваше лечение.
Продолжение
Нормальные уровни ЛДГ в крови могут варьироваться в зависимости от лаборатории, но обычно колеблются от 140 единиц на литр (Ед / л) до 280 Ед / л для взрослых и, как правило, выше у детей и подростков.
Продолжение
В спинномозговой жидкости нормальные уровни:
- 70 Ед / л или ниже для новорожденных
- 40 Ед / л или ниже для взрослых
Более высокие уровни ЛДГ в спинномозговой жидкости могут означать наличие инфекции или воспаление в центральной нервной системе.Это также может означать, что у вас заболевание головного или спинного мозга, например бактериальный менингит.
Если у вас уровень ЛДГ выше нормы, ваш врач может назначить дополнительные тесты, чтобы точно определить место повреждения. Один из них смотрит на уровни ваших изоферментов ЛДГ. Это типы ЛДГ. Существует пять различных форм, от LD-1 до LD-5.
Каждый из пяти имеет тенденцию концентрироваться в определенных тканях организма. Например, LD-1 обычно находится в сердце, эритроцитах, почках, семенниках и яичниках.
Если у вас повышен уровень ЛДГ, ваш врач может также назначить тесты на АЛТ, АСТ или ЩФ. Они могут помочь с диагностикой или определить, какие органы поражены.
Продолжение
Повышенный уровень ЛДГ в крови не всегда свидетельствует о проблеме. Это могло быть результатом физических упражнений. Уровень также может быть высоким, если с образцом крови грубо обращаются в лаборатории или хранятся при неправильной температуре. Иногда виноват прием слишком большого количества витамина С. Наконец, уровень ЛДГ в крови может быть высоким, если количество тромбоцитов выше нормы.
Уровни ЛДГ в пределах нормы или ниже нормы обычно не являются проблемой.
Тест на дегидрогеназу молочной кислоты (LDH)
Обзор тестаДегидрогеназа молочной кислоты (LDH) — это фермент, который помогает производить энергию. Он присутствует почти во всех тканях организма, и его уровни повышаются в ответ на повреждение клеток. Уровни ЛДГ измеряются в образце крови, взятой из вены.
Зачем это нужно
Уровни ЛДГ помогают найти причину заболеваний легких, лимфомы, анемии и заболеваний печени.Они также помогают узнать, насколько эффективно лечение лимфомы.
Как подготовиться
Как правило, вам ничего не нужно делать перед этим тестом, если только ваш врач не скажет вам об этом.
Как это делается
Медицинский работник использует иглу для взятия пробы крови, обычно из руки.
Сколько времени длится тест
Тест займет несколько минут.
Результаты
В каждой лаборатории свой диапазон нормальных значений. В вашем лабораторном отчете должен быть указан диапазон, который ваша лаборатория использует для каждого теста.Нормальный диапазон — это просто ориентир. Ваш врач также рассмотрит ваши результаты в зависимости от вашего возраста, состояния здоровья и других факторов. Значение, выходящее за пределы нормального диапазона, может быть для вас нормальным.
Нормальные уровни ЛДГ варьируются от 140 единиц на литр (Ед / л) до 280 Ед / л или от 2,34 мкат / л до 4,68 мкат / л.
Многие заболевания могут вызывать повышение уровня ЛДГ. Для подтверждения диагноза обычно необходимы другие тесты.
Для многих здоровых людей слегка повышенный уровень ЛДГ не является серьезным. Это может произойти из-за физических упражнений или из-за технических проблем с тестом.
Кредиты
Текущий по состоянию на: 23 сентября 2020 г.
Автор: Healthwise Staff
Медицинский обзор:
Энн К. Пуанье, врач-терапевт
Адам Хасни, врач-терапевт,
Э. Грегори Томпсон, врач-терапевт,
Мартин Дж. Габика, доктор медицины, семейная медицина
Дата: 23 сентября , 2020
Автор: Здоровый персонал
Медицинское обозрение: Энн К.Пуанье, врач-терапевт, Адам Хусни, врач, семейная медицина, и Э. Грегори Томпсон, врач-терапевт, и Мартин Дж. Габика, доктор медицины, семейная медицина
Модуль экспрессии генов, который идентифицирует гранулоциты низкой плотности в крови пациентов с системной волчанкой erythematosus ассоциируется с низким уровнем комплемента, повышенным титром анти-дцДНК и сигнатурами интерферона и TNF.

Abstract
SLE — это аутоиммунное заболевание, характеризующееся наличием аномальных гранулоцитов низкой плотности (LDG) с повышенной способностью к спонтанному НЕТозу.Чтобы охарактеризовать LDG при SLE, профили экспрессии генов, полученные из изолированных LDG, были охарактеризованы с помощью сетевого анализа взвешенной коэкспрессии генов, и был идентифицирован 92 генный модуль. Этот модуль содержит 30 генов с обозначением GO дегрануляции нейтрофилов и множество генов, связанных с синтезом и пролиферацией ДНК. Сравнение с экспрессией генов предшественниками нейтрофилов костного мозга показало, что модуль генов наиболее похож на модуль, экспрессируемый промиелоцитами / миелоцитами. Сигнатура гена LDG оценивалась в наборах данных экспрессии генов из цельной крови (WB), PBMC, почек, синовиальной оболочки и кожи.Модуль LDG постоянно обогащался в крови, но непоследовательно в тканях. Отсутствие транскриптов гранулярных белков в тканях свидетельствует о том, что LDG не обогащены в пораженных СКВ органах. Сигнатура гена LDG была также проанализирована в WB и PBMC у 1417 пациентов с СКВ с помощью анализа вариации набора генов (GSVA). 35% неактивных пациентов и 50% активных пациентов проявили сигнатуру LDG, которая показала значительную, но умеренную корреляцию с активностью заболевания, измеренной с помощью индекса активности заболевания СКВ (r = 0.16, p = 4,1E-9). Сигнатура LDG также была связана с присутствием анти-дцДНК (p <1E-6), пониженными уровнями C3 и C4 (p <1E-6), сигнатуры интерферона 1 типа (p <1E-11) и модуля генов, индуцированных TNF (p <1E-15, все по точному критерию Фишера). Эти данные свидетельствуют о том, что LDG представляют собой популяцию незрелых нейтрофилов, чрезмерно представленных в крови пациентов с СКВ в связи со стимуляцией цитокинов, присутствием аутоантител и потреблением комплемента.
Сигнатура гена LDG была также проанализирована в WB и PBMC у 1417 пациентов с СКВ с помощью анализа вариации набора генов (GSVA). 35% неактивных пациентов и 50% активных пациентов проявили сигнатуру LDG, которая показала значительную, но умеренную корреляцию с активностью заболевания, измеренной с помощью индекса активности заболевания СКВ (r = 0.16, p = 4,1E-9). Сигнатура LDG также была связана с присутствием анти-дцДНК (p <1E-6), пониженными уровнями C3 и C4 (p <1E-6), сигнатуры интерферона 1 типа (p <1E-11) и модуля генов, индуцированных TNF (p <1E-15, все по точному критерию Фишера). Эти данные свидетельствуют о том, что LDG представляют собой популяцию незрелых нейтрофилов, чрезмерно представленных в крови пациентов с СКВ в связи со стимуляцией цитокинов, присутствием аутоантител и потреблением комплемента.
- © Американская ассоциация иммунологов, Inc., 2018.
Активированные гранулоциты низкой плотности в периферической и межворсинчатой крови и нейтрофильное воспаление в плаценте от беременностей с СКВ
Ключевые сообщения
Что уже известно об этом предмете?
Что добавляет это исследование?
Женщины с СКВ имеют более высокую циркулирующую пропорцию и повышенную активацию гранулоцитов низкой плотности во время родов по сравнению со здоровыми женщинами.

У женщин с СКВ уровни привлекающих и активирующих нейтрофилы хемокинов CXCL8 и CXCL1 выше в межворсинчатой крови матери по сравнению с периферической кровью.
Децидуальные стромальные клетки материнского происхождения являются клеточным источником CXCL8 и CXCL1.
Повышенная активация нейтрофилов может способствовать воспалению плаценты у беременных женщин с СКВ.
Введение
СКВ — это хроническое воспалительное заболевание, которое поражает женщин в девять раз чаще, чем мужчин, и начало заболевания обычно в детородном возрасте.1 СКВ — гетерогенное заболевание, которое обычно поражает кожу и суставы, но может также включать жизненно важные такие органы, как почки и центральная нервная система.Хотя современный эпиднадзор и лечение улучшили исход беременности, 2 женщины с СКВ по-прежнему сталкиваются с более высоким риском осложнений беременности, включая преэклампсию, преждевременные роды и мертворождение. 3 4 В недавнем шведском исследовании 56% беременностей с СКВ были осложнены по крайней мере, один неблагоприятный исход беременности, включая кесарево сечение.5 Наше понимание иммунологических механизмов, предшествующих этим осложнениям беременности, и наша способность прогнозировать и лечить их ограничены.
3 4 В недавнем шведском исследовании 56% беременностей с СКВ были осложнены по крайней мере, один неблагоприятный исход беременности, включая кесарево сечение.5 Наше понимание иммунологических механизмов, предшествующих этим осложнениям беременности, и наша способность прогнозировать и лечить их ограничены.
Базальная пластинка плаценты — это место взаимодействия тканей матери и плода.Материнская децидуальная базальная мышца состоит из стромальной сети, в которой находятся иммунные клетки материнского происхождения и спиральные артерии, которые откладывают насыщенную кислородом кровь и питательные вещества в межворсинчатое пространство. При здоровой доношенной беременности межворсинчатая кровь демонстрирует различные профили иммунных клеток и хемокинов по сравнению с периферической кровью с более высокими пропорциями эффекторных Т-клеток памяти и MAIT-клеток, а также хемокинов CXCL10 и MIF в межворсинчатой крови.6 Тем не менее, межворсинчатая кровь от женщин с СКВ неизведан.
В последние годы нейтрофилы стали ключевыми эффекторными клетками в патогенезе СКВ. 7 При беременности СКВ профиль транскрипции нейтрофилов в периферической крови увеличивается по сравнению со здоровыми беременными женщинами. ловушки (NET) в межворсинчатом пространстве плаценты при СКВ по сравнению со здоровой беременностью.9 Впервые обнаруженная при СКВ, подмножество гранулоцитов низкой плотности (LDG) колокализуются с мононуклеарными клетками после градиентного центрифугирования.10 При СКВ LDG демонстрирует спонтанное образование NET и секрецию CXCL8, хемокина, который привлекает и активирует нейтрофилы. 11 12 Ни присутствие LDG, ни праймирование LDG не изучались в периферической или межворсистой крови беременных с СКВ.
7 При беременности СКВ профиль транскрипции нейтрофилов в периферической крови увеличивается по сравнению со здоровыми беременными женщинами. ловушки (NET) в межворсинчатом пространстве плаценты при СКВ по сравнению со здоровой беременностью.9 Впервые обнаруженная при СКВ, подмножество гранулоцитов низкой плотности (LDG) колокализуются с мононуклеарными клетками после градиентного центрифугирования.10 При СКВ LDG демонстрирует спонтанное образование NET и секрецию CXCL8, хемокина, который привлекает и активирует нейтрофилы. 11 12 Ни присутствие LDG, ни праймирование LDG не изучались в периферической или межворсистой крови беременных с СКВ.
Присутствие нейтрофилов, которые обычно отсутствуют в плодных оболочках плаценты, можно проверить с помощью гистологического исследования плаценты. Гистологический острый хориоамнионит характеризуется инфильтрацией нейтрофилов в хориоамниотические мембраны и может также возникать во время неинфекционного воспаления 13, 14, но причина этого явления неясна.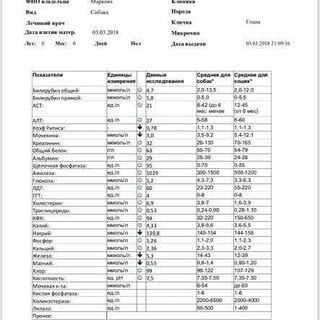 Несколько исследований сравнивали гистологический паттерн плаценты у женщин с СКВ с таковым у здоровых женщин.
Несколько исследований сравнивали гистологический паттерн плаценты у женщин с СКВ с таковым у здоровых женщин.
При СКВ около 50–75% взрослых пациентов демонстрируют сверхэкспрессию генов, индуцируемых интерфероном I типа (IFN), сигнатуры IFN.15 Было показано, что сигнатура IFN остается заметной у женщин с осложненной беременностью с СКВ, в то время как эта сигнатура снижена по сравнению с исходным уровнем у женщин со здоровой беременностью с СКВ.8 Более того, экспрессия IFNα-чувствительного гена MX1 повышена у женщин с СКВ, у которых развивается преэклампсия, по сравнению с женщинами с СКВ, у которых нет.16 Уровни белка IFNα было трудно количественно определить, но с помощью нового сверхчувствительного цифрового ИФА, основанного на технологии одиночных молекул (Simoa), у пациентов с СКВ были обнаружены повышенные уровни IFNα в сыворотке крови по сравнению с контрольной группой и связаны с активностью заболевания17 и риском рецидива.18 Уровни IFNα у беременных с СКВ еще предстоит изучить./151/151.jpg)
Целью настоящего исследования было изучить наличие и статус активации субпопуляций нейтрофилов в парных образцах периферической и межворсинчатой крови, а также возможность рекрутирования нейтрофилов в плаценту у женщин с СКВ и здоровой беременностью.
Методы
Пациенты и здоровые люди в контрольной группе
Беременные женщины с СКВ (n = 12) были набраны в ревматологических клиниках в Гетеборге (больница Салгренского университета), Стокгольме (больница Каролинского университета) и Лунде (больница Университета Сконе), а также в здоровом возрасте. беременных женщин (n = 10) набирали в одной женской консультации в Гётеборге (n = 10). Все женщины с СКВ соответствовали критериям классификации Американского колледжа ревматологии (ACR) 1997 года и / или Международной сотрудничающей клиники системной волчанки (SLICC) 2012 года.19 20 Активность заболевания оценивалась с помощью индекса активности системной волчанки 2000 (SLEDAI-2K) в какой-то момент во время беременности (7–34 недели) . 21 Критериями исключения были неспособность понять информацию о пациентах, а для женщин с СКВ — наличие другие серьезные заболевания и лечение анти-CD20 или анти-BAFF антителами в течение 12 месяцев до включения. Неблагоприятные исходы беременности определялись как один или несколько из следующих: (1) преэклампсия в любое время в соответствии с национальными рекомендациями 2019 года Шведского общества акушерства и гинекологии, (2) преждевременные роды <37-й недели беременности и (3) небольшие для гестационного возраста (SGA) с массой тела при рождении ниже среднего –2SD, расчет основан на массе тела при рождении, поле и сроке беременности.22 Все участники дали информированное согласие, и Комитет по этике Гетеборга одобрил протокол исследования (Dnr 404-18).
21 Критериями исключения были неспособность понять информацию о пациентах, а для женщин с СКВ — наличие другие серьезные заболевания и лечение анти-CD20 или анти-BAFF антителами в течение 12 месяцев до включения. Неблагоприятные исходы беременности определялись как один или несколько из следующих: (1) преэклампсия в любое время в соответствии с национальными рекомендациями 2019 года Шведского общества акушерства и гинекологии, (2) преждевременные роды <37-й недели беременности и (3) небольшие для гестационного возраста (SGA) с массой тела при рождении ниже среднего –2SD, расчет основан на массе тела при рождении, поле и сроке беременности.22 Все участники дали информированное согласие, и Комитет по этике Гетеборга одобрил протокол исследования (Dnr 404-18).
Выделение плазмы и иммунных клеток из периферической и межворсинчатой крови
Образцы периферической крови собирали в пробирки с гепарином после поступления в родильное отделение, а плаценту собирали после родов. В течение 24 часов после доставки в нашей лаборатории в Гетеборге была начата обработка образцов крови и плаценты. Во время транспортировки плаценту хранили в холоде, а образцы крови — при комнатной температуре.Плаценту приподняли, чтобы кровь из межворсинчатого пространства могла капать на стерильную чашку Петри, а затем быстро переместили в пробирки с гепарином. Периферическую и межворсинчатую кровь разбавляли 1: 1 фосфатно-солевым буфером (PBS), наносили на Ficoll-Paque plus (GE Healthcare, Упсала, Швеция) и центрифугировали (900 × g, 20 мин, без тормоза). После центрифугирования собирали мононуклеарные клетки, расположенные над слоем фиколла, включая LDG, если они присутствовали, а также гранулоциты нормальной плотности (NDG), которые попадали в осадок.Плазма сохранялась и замораживалась (-80 ° C) до использования. Из-за небольшого объема образцов крови у некоторых людей нельзя было применить все иммунологические анализы. Кроме того, когда роды происходили в выходные дни, использовался частичный протокол анализа образцов крови.
Во время транспортировки плаценту хранили в холоде, а образцы крови — при комнатной температуре.Плаценту приподняли, чтобы кровь из межворсинчатого пространства могла капать на стерильную чашку Петри, а затем быстро переместили в пробирки с гепарином. Периферическую и межворсинчатую кровь разбавляли 1: 1 фосфатно-солевым буфером (PBS), наносили на Ficoll-Paque plus (GE Healthcare, Упсала, Швеция) и центрифугировали (900 × g, 20 мин, без тормоза). После центрифугирования собирали мононуклеарные клетки, расположенные над слоем фиколла, включая LDG, если они присутствовали, а также гранулоциты нормальной плотности (NDG), которые попадали в осадок.Плазма сохранялась и замораживалась (-80 ° C) до использования. Из-за небольшого объема образцов крови у некоторых людей нельзя было применить все иммунологические анализы. Кроме того, когда роды происходили в выходные дни, использовался частичный протокол анализа образцов крови.
Выделение и размножение стромальных клеток из децидуальной оболочки материнского происхождения
Образцы тканей шести женщин с СКВ и шести здоровых контролей были выделены из материнской децидуальной оболочки базальной и тщательно промыты PBS. Кусочки ткани измельчали и ферментативно расщепляли либеразой (0,1 Ед / мл, Sigma-Aldrich, Сент-Луис, Миссури, США), смешанной со средой Игла, модифицированной Дульбекко (DMEM; HyClone, Юта, США) в 5% CO 2 ат. 37 ° C в течение 60 мин. Ткани и клетки промывали и культивировали в колбах с DMEM, содержащей 10% фетальную бычью сыворотку (FBS; HyClone) и гентамицин (Sigma-Aldrich) (полная DMEM). Когда 90% –95% конфлюэнтности, клетки собирали с помощью трипсина / ЭДТА (Thermo Fisher Scientific, Уолтем, Массачусетс, США), промывали полной средой DMEM и засевали в новые колбы.Клетки собирали после первого пассажа и замораживали в FBS с 7,5% диметилсульфоксидом (ДМСО).
Кусочки ткани измельчали и ферментативно расщепляли либеразой (0,1 Ед / мл, Sigma-Aldrich, Сент-Луис, Миссури, США), смешанной со средой Игла, модифицированной Дульбекко (DMEM; HyClone, Юта, США) в 5% CO 2 ат. 37 ° C в течение 60 мин. Ткани и клетки промывали и культивировали в колбах с DMEM, содержащей 10% фетальную бычью сыворотку (FBS; HyClone) и гентамицин (Sigma-Aldrich) (полная DMEM). Когда 90% –95% конфлюэнтности, клетки собирали с помощью трипсина / ЭДТА (Thermo Fisher Scientific, Уолтем, Массачусетс, США), промывали полной средой DMEM и засевали в новые колбы.Клетки собирали после первого пассажа и замораживали в FBS с 7,5% диметилсульфоксидом (ДМСО).
Проточная цитометрия
Для анализа общего количества гранулоцитов в периферической и межворсинчатой крови применяли анализ Trucount. Вкратце, моноклональные антитела к CD45, конъюгированные с PerCP, человека (клон 2D1, BD Biosciences, Нью-Джерси, США) и цельную кровь добавляли в пробирки BD Trucount (BD Biosciences) и инкубировали в течение 15 мин. Эритроциты лизировали с использованием раствора для лизиса BD FACS (BD Biosciences).Анализ доли LDG среди мононуклеарных клеток в периферической и межворсинчатой крови был основан на характеристиках экспрессии CD45 и бокового рассеяния. Активацию NDG и LDG исследовали по экспрессии CD62L и CD11b. Вкратце, эритроциты, присутствующие среди клеток NDG, лизировали короткой инкубацией с dH 2 O с последующим добавлением PBS (с 25 г NaCl / л), которое повторяли дважды. Затем NDG и мононуклеарные клетки, включая LDG, окрашивали следующими античеловеческими моноклональными антителами: PE-конъюгированный CD62L (клон SK11, BD Biosciences), APC-конъюгированный CD11b (клон D12, BD Biosciences) и FITC-конъюгированный CD45 (клон 2D1, Biolegend, Сан-Диего, Калифорния, США) на 20 мин.Для исключения мертвых клеток использовали 7-аминоактиномицин D (BD Biosciences). Для проверки фенотипа стромы децидуальные стромальные клетки окрашивали следующими античеловеческими моноклональными антителами: FITC-конъюгированный CD90 (клон 5E10, BD Biosciences), Bv421-конъюгированный CD105 (клон 266, BD Biosciences), PE-конъюгированный CD31 (клон WM59, BD Biosciences) и APC-конъюгированный CD45 (клон NZ-1.
Эритроциты лизировали с использованием раствора для лизиса BD FACS (BD Biosciences).Анализ доли LDG среди мононуклеарных клеток в периферической и межворсинчатой крови был основан на характеристиках экспрессии CD45 и бокового рассеяния. Активацию NDG и LDG исследовали по экспрессии CD62L и CD11b. Вкратце, эритроциты, присутствующие среди клеток NDG, лизировали короткой инкубацией с dH 2 O с последующим добавлением PBS (с 25 г NaCl / л), которое повторяли дважды. Затем NDG и мононуклеарные клетки, включая LDG, окрашивали следующими античеловеческими моноклональными антителами: PE-конъюгированный CD62L (клон SK11, BD Biosciences), APC-конъюгированный CD11b (клон D12, BD Biosciences) и FITC-конъюгированный CD45 (клон 2D1, Biolegend, Сан-Диего, Калифорния, США) на 20 мин.Для исключения мертвых клеток использовали 7-аминоактиномицин D (BD Biosciences). Для проверки фенотипа стромы децидуальные стромальные клетки окрашивали следующими античеловеческими моноклональными антителами: FITC-конъюгированный CD90 (клон 5E10, BD Biosciences), Bv421-конъюгированный CD105 (клон 266, BD Biosciences), PE-конъюгированный CD31 (клон WM59, BD Biosciences) и APC-конъюгированный CD45 (клон NZ-1. 3, BD Biosciences). Все образцы были собраны в FACSVerse, оборудованном программным обеспечением FACSuite (BD Biosciences), и проанализированы с помощью программного обеспечения FlowJo (TreeStar, Ashland, Oregon, USA).
3, BD Biosciences). Все образцы были собраны в FACSVerse, оборудованном программным обеспечением FACSuite (BD Biosciences), и проанализированы с помощью программного обеспечения FlowJo (TreeStar, Ashland, Oregon, USA).
Количественное определение CXCL8, CXCL5, CXCL1 и IFNα в плазме
Уровни CXCL8, CXCL5 и CXCL1 в периферической и межворсинчатой крови определяли количественно с помощью иммуноанализа на основе гранул проточной цитометрии (LEGENDplex, Biolegend) в соответствии с инструкциями производителя. Данные были получены в FACSVerse, оборудованном программным обеспечением FACSuite, и проанализированы с помощью программного обеспечения для массивов FCAP (SoftFlow, Печ, Венгрия). Уровень IFNα в плазме периферической и межворсинчатой крови определяли количественно с помощью Simoa на анализаторе HD-1 (Quanterix, Billerica, Massachusetts, USA).
Количественная ПЦР (qPCR)
Для исследования экспрессии гена CXCL8 , CXCL1 и MX1 в децидуальных стромальных клетках в пассаже 1 клетки размораживали и культивировали в полной среде DMEM во флаконах (7,5 × 10 4 клеток / мл) в течение 4 дней. После этого клетки промывали PBS и культивировали в течение ночи в DMEM с 0,1% FBS (среда голодания). Затем клетки промывали PBS и культивировали с IFNα или без него (1 нг / мл; PBL Biomedical Laboratories, Piscataway, New Jersey, USA) в течение 24 часов в среде для голодания.Клетки промывали PBS, после чего клетки лизировали добавлением 350 мкл буфера RLT (Qiagen, Hilden, Германия) с бета-меркаптоэтанолом (1: 100). РНК экстрагировали из лизатов с помощью набора RNeasy Kit (Qiagen) и использовали для создания комплементарной ДНК (кДНК) с помощью набора для синтеза кДНК iScript (Bio-Rad, Hercules, Калифорния, США). qPCR выполняли в системе для ПЦР в реальном времени ViiA7 (Applied Biosystems, Уолтем, Массачусетс, США) с SsoAdvanced Universal SYBR Green Supermix (Bio-Rad). Анализы праймеров для CXCL8 , CXCL1 , MX1 и GAPDH были получены от Sigma-Aldrich.Каждую реакцию нормализовали по уровням экспрессии гена домашнего хозяйства GAPDH . Результаты представлены в виде кратного изменения (относительная количественная оценка) по сравнению с уровнем экспрессии в здоровых контрольных образцах с использованием метода ΔΔ C t.
После этого клетки промывали PBS и культивировали в течение ночи в DMEM с 0,1% FBS (среда голодания). Затем клетки промывали PBS и культивировали с IFNα или без него (1 нг / мл; PBL Biomedical Laboratories, Piscataway, New Jersey, USA) в течение 24 часов в среде для голодания.Клетки промывали PBS, после чего клетки лизировали добавлением 350 мкл буфера RLT (Qiagen, Hilden, Германия) с бета-меркаптоэтанолом (1: 100). РНК экстрагировали из лизатов с помощью набора RNeasy Kit (Qiagen) и использовали для создания комплементарной ДНК (кДНК) с помощью набора для синтеза кДНК iScript (Bio-Rad, Hercules, Калифорния, США). qPCR выполняли в системе для ПЦР в реальном времени ViiA7 (Applied Biosystems, Уолтем, Массачусетс, США) с SsoAdvanced Universal SYBR Green Supermix (Bio-Rad). Анализы праймеров для CXCL8 , CXCL1 , MX1 и GAPDH были получены от Sigma-Aldrich.Каждую реакцию нормализовали по уровням экспрессии гена домашнего хозяйства GAPDH . Результаты представлены в виде кратного изменения (относительная количественная оценка) по сравнению с уровнем экспрессии в здоровых контрольных образцах с использованием метода ΔΔ C t.
Гистология плаценты
Образцы плаценты 12 женщин с СКВ и 10 здоровых людей из контрольной группы были оценены перинатальным патологом на предмет наличия гистологического острого хориоамнионита и фунизита. Морфологическая оценка и гистологический забор образцов были выполнены в соответствии с рекомендациями Шведского общества патологов и Королевского колледжа патологов.23 Вкратце, образцы ткани были получены из полных срезов центральной паренхимы плаценты, включая поверхности плода и матери, рулон наружных оболочек плода и пуповину. Гистологический острый хориоамнионит определялся как инфильтрация нейтрофилами хорионической пластинки и амниона, а фунизит — как нейтрофильная инфильтрация стенок сосудов плода и окружающей соединительной ткани.
Статистический анализ
U-критерий Манна-Уитни использовался для сравнения количества гранулоцитов, маркеров активации на субпопуляциях гранулоцитов и пропорций LDG в периферической и межворсинчатой крови женщин с СКВ и здоровых людей из контрольной группы. Для сравнения уровней CXCL8, CXCL5, CXCL1 и IFNα в периферической или межворсинчатой плазме крови женщин с СКВ и здоровых людей из контрольной группы использовали тест Краскела-Уоллиса с последующим тестом множественного сравнения Данна (программное обеспечение GraphPad Prism, Ла-Хойя, Калифорния, США). Значение p ≤0,05 считалось статистически значимым (* p≤0,05, ** p≤0,01, *** p≤0,001 и **** p≤0,0001).
Для сравнения уровней CXCL8, CXCL5, CXCL1 и IFNα в периферической или межворсинчатой плазме крови женщин с СКВ и здоровых людей из контрольной группы использовали тест Краскела-Уоллиса с последующим тестом множественного сравнения Данна (программное обеспечение GraphPad Prism, Ла-Хойя, Калифорния, США). Значение p ≤0,05 считалось статистически значимым (* p≤0,05, ** p≤0,01, *** p≤0,001 и **** p≤0,0001).
Результаты
Исходные характеристики и распространенность неблагоприятных исходов беременности
Периферическая кровь и плаценты были собраны у 12 нерожавших женщин с СКВ и у 10 нерожавших здоровых женщин во время родов.Среди женщин с СКВ одна женщина родила двойню (две плаценты). Исходные характеристики включенных пациентов с СКВ представлены в таблице 1. Все соответствовали критериям классификации ACR и / или SLICC, 19 20 и все имели ANA. Пять из женщин когда-либо были положительными на антифосфолипидные антитела, но ни одна из них не соответствовала критериям антифосфолипидного синдрома. Все, кроме одного, получали иммунодепрессанты (таблица 1). Любой неблагоприятный исход беременности (APO), включая преждевременные роды, преэклампсию или SGA, имел место у 17% (2 из 12) женщин с СКВ и у 20% (2 из 10) здоровых контрольных женщин (таблица 2). ).Ни у одной из женщин не было подтверждено COVID-19 при родах.
Все, кроме одного, получали иммунодепрессанты (таблица 1). Любой неблагоприятный исход беременности (APO), включая преждевременные роды, преэклампсию или SGA, имел место у 17% (2 из 12) женщин с СКВ и у 20% (2 из 10) здоровых контрольных женщин (таблица 2). ).Ни у одной из женщин не было подтверждено COVID-19 при родах.
Исходные характеристики включенных пациентов с СКВ
Доля ЛДГ и их статус активации выше в периферической крови женщин с СКВ по сравнению со здоровым контролем
При родах не было различий в общем количестве гранулоцитов в периферической крови. кровь между СКВ и здоровой беременностью (рис. 1А, В). Поскольку гранулоциты можно подразделить на NDG и LDG, мы исследовали эти подмножества в отношении маркеров активации CD62L, которые выделяются при активации, и CD11b, которые активируются при активации (стратегия гейтирования для NDG и маркеры активации на рисунке 1C).Наблюдалась тенденция к более низкой экспрессии CD62L и более высокой экспрессии CD11b на NDG у женщин с СКВ по сравнению со здоровыми женщинами, но различия не были статистически значимыми (рисунок 1D).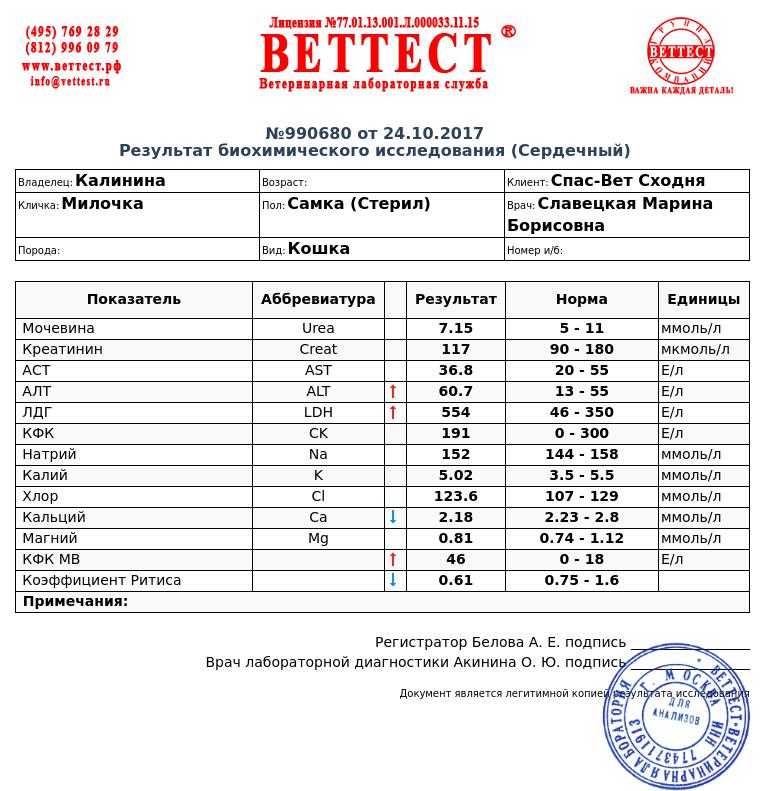 Стратегия стробирования для пропорций LDG среди мононуклеарных клеток CD45 + представлена на рисунке 1E. У женщин с СКВ наблюдались большие индивидуальные различия во фракции ЛДГ в периферической крови, а среднее значение было выше, чем у здоровых женщин (p = 0,02; рисунок 1F). Кроме того, SLE LDG демонстрирует повышенную активацию, о чем свидетельствует значительно более низкая экспрессия CD62L по сравнению с LDG из контроля (p = 0.002; рисунок 1G). Таким образом, у женщин с СКВ пропорции кровообращения и повышенное праймирование ЛДГ при родах выше, чем у здоровых женщин.
Стратегия стробирования для пропорций LDG среди мононуклеарных клеток CD45 + представлена на рисунке 1E. У женщин с СКВ наблюдались большие индивидуальные различия во фракции ЛДГ в периферической крови, а среднее значение было выше, чем у здоровых женщин (p = 0,02; рисунок 1F). Кроме того, SLE LDG демонстрирует повышенную активацию, о чем свидетельствует значительно более низкая экспрессия CD62L по сравнению с LDG из контроля (p = 0.002; рисунок 1G). Таким образом, у женщин с СКВ пропорции кровообращения и повышенное праймирование ЛДГ при родах выше, чем у здоровых женщин.
Повышенные пропорции и повышенное праймирование гранулоцитов низкой плотности (LDG) в периферической крови у женщин с СКВ по сравнению со здоровыми женщинами. (A) Стратегия гейтирования для гранулоцитов в цельной периферической крови. (B) Количество гранулоцитов в периферической крови у женщин с СКВ по сравнению со здоровым контролем (HCs). (C) Стратегия гейтирования для живых синглетных гранулоцитов нормальной плотности (NDG) в периферической крови и репрезентативные гистограммы экспрессии CD62L и CD11b в подгруппе NDG у одной женщины с СКВ и одной HC.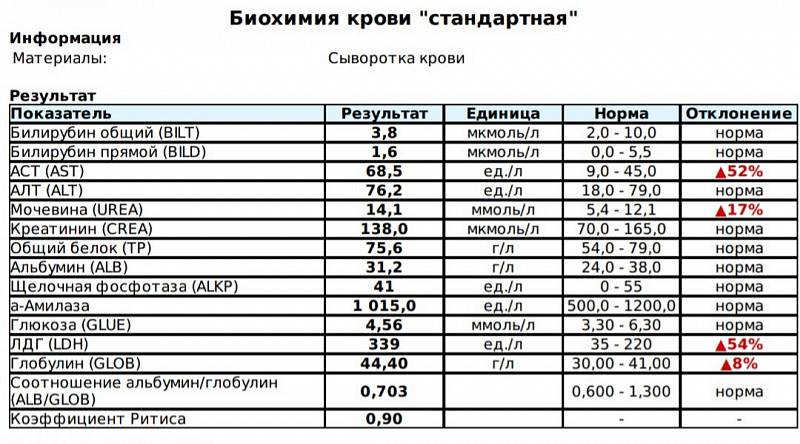 (D) Экспрессия CD62L и CD11b на NDG у женщин с СКВ по сравнению с HC. (E) Типичная стратегия гейтирования для живых синглетных LDG среди мононуклеарных клеток CD45 + от одной женщины с SLE и одной HC. (F) Процент LDG у женщин с СКВ по сравнению с HC. (G) Экспрессия CD62L и CD11b на LDG у женщин с СКВ по сравнению с HC. Горизонтальные полосы указывают медианы, а каждый символ представляет одного человека. * P≤0,05 и ** p≤0,01, U-критерий Манна-Уитни. MFI — средняя интенсивность флуоресценции; PBMC, мононуклеарные клетки периферической крови.
(D) Экспрессия CD62L и CD11b на NDG у женщин с СКВ по сравнению с HC. (E) Типичная стратегия гейтирования для живых синглетных LDG среди мононуклеарных клеток CD45 + от одной женщины с SLE и одной HC. (F) Процент LDG у женщин с СКВ по сравнению с HC. (G) Экспрессия CD62L и CD11b на LDG у женщин с СКВ по сравнению с HC. Горизонтальные полосы указывают медианы, а каждый символ представляет одного человека. * P≤0,05 и ** p≤0,01, U-критерий Манна-Уитни. MFI — средняя интенсивность флуоресценции; PBMC, мононуклеарные клетки периферической крови.
Повышенная активация LDG в межворсинчатой крови материнского происхождения у женщин с СКВ по сравнению со здоровым контролем
Децидуальная оболочка материнского происхождения содержит спиральные артерии, которые откладывают кровь в межворсинчатое пространство (схематически представлены на рисунке 2A). Затем мы исследовали количество гранулоцитов и активацию гранулоцитов в межворсинчатой крови как при СКВ, так и при здоровой беременности (репрезентативные графики проточной цитометрии для межворсинчатой крови представлены на дополнительном онлайн-рисунке 1). Как и в случае с периферической кровью, не было разницы в количестве гранулоцитов или статусе активации NDG в межворсинчатой крови между женщинами с СКВ и здоровыми женщинами (рисунок 2B, C). В отличие от периферической крови, не было различий в пропорциях ЛДГ в межворсинчатой крови между СКВ и здоровой беременностью (рисунок 2D). Однако ЛДГ от женщин с СКВ продемонстрировала повышенную активацию, о чем свидетельствует более высокая экспрессия CD11b по сравнению со здоровыми контрольными пациентами (p = 0,05; рисунок 2E).При СКВ на основании экспрессии CD11b ЛДГ в межворсинчатой крови были более активными, чем в периферической крови (p = 0,003, онлайн-дополнительный рисунок 2). Статистический анализ подгруппы пропорций LDG и статуса активации по отношению к APO не мог быть выполнен из-за небольшого количества людей (онлайн-дополнительные рисунки 3A – C и 4A – C, соответственно). Таким образом, LDG как в периферической, так и в межворсинчатой крови при беременности с СКВ демонстрирует повышенную активацию по сравнению с LDG при здоровой беременности.
Как и в случае с периферической кровью, не было разницы в количестве гранулоцитов или статусе активации NDG в межворсинчатой крови между женщинами с СКВ и здоровыми женщинами (рисунок 2B, C). В отличие от периферической крови, не было различий в пропорциях ЛДГ в межворсинчатой крови между СКВ и здоровой беременностью (рисунок 2D). Однако ЛДГ от женщин с СКВ продемонстрировала повышенную активацию, о чем свидетельствует более высокая экспрессия CD11b по сравнению со здоровыми контрольными пациентами (p = 0,05; рисунок 2E).При СКВ на основании экспрессии CD11b ЛДГ в межворсинчатой крови были более активными, чем в периферической крови (p = 0,003, онлайн-дополнительный рисунок 2). Статистический анализ подгруппы пропорций LDG и статуса активации по отношению к APO не мог быть выполнен из-за небольшого количества людей (онлайн-дополнительные рисунки 3A – C и 4A – C, соответственно). Таким образом, LDG как в периферической, так и в межворсинчатой крови при беременности с СКВ демонстрирует повышенную активацию по сравнению с LDG при здоровой беременности.
Повышенное праймирование гранулоцитов низкой плотности (LDG) в межворсинчатой крови материнского происхождения у женщин с СКВ по сравнению со здоровыми женщинами.(A) Схематические иллюстрации, сделанные AC Lundell, которые изображают базальную децидуальную оболочку со спиральными артериями и межворсинчатой кровью материнского происхождения по отношению к ворсинчатой ткани плода, которая изменена по сравнению с ссылкой 39. (B) Сравнение количества гранулоцитов в межворсинчатой цельной крови у женщин с СКВ со здоровым контролем (HCs). (C) Экспрессия CD62L и CD11b на гранулоцитах нормальной плотности у женщин с СКВ по сравнению с HC. (D) Процент LDG у женщин с СКВ по сравнению с HC. (E) Экспрессия CD62L и CD11b на LDG у женщин с СКВ по сравнению с HC.Горизонтальные полосы указывают медианы, а каждый символ представляет одного человека. * P≤0,05, U-критерий Манна-Уитни.
Более высокие уровни привлекающих нейтрофилы и активирующих хемокинов в межворсинчатой крови по сравнению с периферической кровью при беременности с СКВ
Хотя не было разницы в количестве гранулоцитов в межворсинчатой крови между СКВ и здоровой беременностью, гранулоциты могли быть привлечены к плаценте и мигрировали в нее. ткань. Поэтому мы исследовали наличие градиента уровней CXCL8, CXCL5 и CXCL1, всех хемокинов, привлекающих и активирующих нейтрофилы, в межворсинчатой плазме относительно плазмы периферической крови у женщин с СКВ и здоровых людей из контрольной группы.Наблюдались большие индивидуальные различия в уровнях CXCL8 и CXCL1 в межворсинчатой крови у женщин с СКВ, и концентрации обоих хемокинов были выше по сравнению с таковыми в периферической крови (p = 0,004 и p≤0,0001, соответственно; рисунок 3A, B ). У здоровых женщин не было значительных различий в уровнях CXCL8 или CXCL1 между межворсинчатой и периферической кровью (рисунок 3A, B). Концентрации CXCL8 или CXCL1 не различались между женщинами с СКВ и контрольной группой ни в периферической, ни в межворсинчатой крови (рис. 3A, B).В отличие от CXCL8 и CXCL1, не было разницы в уровнях CXCL5 между ворсинками и периферической кровью ни у женщин с СКВ, ни у здоровых людей из контрольной группы (онлайн-приложение 5). Учитывая, что стромальные клетки являются важными продуцентами хемокинов, мы исследовали экспрессию гена CXCL8 и CXCL1 в децидуальных стромальных клетках материнского происхождения.
ткань. Поэтому мы исследовали наличие градиента уровней CXCL8, CXCL5 и CXCL1, всех хемокинов, привлекающих и активирующих нейтрофилы, в межворсинчатой плазме относительно плазмы периферической крови у женщин с СКВ и здоровых людей из контрольной группы.Наблюдались большие индивидуальные различия в уровнях CXCL8 и CXCL1 в межворсинчатой крови у женщин с СКВ, и концентрации обоих хемокинов были выше по сравнению с таковыми в периферической крови (p = 0,004 и p≤0,0001, соответственно; рисунок 3A, B ). У здоровых женщин не было значительных различий в уровнях CXCL8 или CXCL1 между межворсинчатой и периферической кровью (рисунок 3A, B). Концентрации CXCL8 или CXCL1 не различались между женщинами с СКВ и контрольной группой ни в периферической, ни в межворсинчатой крови (рис. 3A, B).В отличие от CXCL8 и CXCL1, не было разницы в уровнях CXCL5 между ворсинками и периферической кровью ни у женщин с СКВ, ни у здоровых людей из контрольной группы (онлайн-приложение 5). Учитывая, что стромальные клетки являются важными продуцентами хемокинов, мы исследовали экспрессию гена CXCL8 и CXCL1 в децидуальных стромальных клетках материнского происхождения. CXCL8 и Экспрессия гена CXCL1 была повышена в децидуальных стромальных клетках у трех из шести женщин с СКВ по сравнению с контрольной группой (рисунок 3C, D, p = 0.23 и p = 0,39 соответственно), что соответствует индивидуальной вариации уровней CXCL8 и CXCL1 в межворсинчатой крови. В обеих группах децидуальные стромальные клетки экспрессировали гомогенный фенотип в отношении экспрессии CD90 и CD105, используемых для определения стромальных клеток человека24, и были отрицательными по маркеру эндотелиальных клеток CD31 и маркеру лейкоцитов CD45 (онлайн-дополнительный рисунок 6). Эти данные предполагают, что децидуальные стромальные клетки являются клеточным источником CXCL8 и CXCL1, что может способствовать увеличению притяжения и активации нейтрофилов у беременных с СКВ.
CXCL8 и Экспрессия гена CXCL1 была повышена в децидуальных стромальных клетках у трех из шести женщин с СКВ по сравнению с контрольной группой (рисунок 3C, D, p = 0.23 и p = 0,39 соответственно), что соответствует индивидуальной вариации уровней CXCL8 и CXCL1 в межворсинчатой крови. В обеих группах децидуальные стромальные клетки экспрессировали гомогенный фенотип в отношении экспрессии CD90 и CD105, используемых для определения стромальных клеток человека24, и были отрицательными по маркеру эндотелиальных клеток CD31 и маркеру лейкоцитов CD45 (онлайн-дополнительный рисунок 6). Эти данные предполагают, что децидуальные стромальные клетки являются клеточным источником CXCL8 и CXCL1, что может способствовать увеличению притяжения и активации нейтрофилов у беременных с СКВ.
Градиент привлекающих нейтрофилы хемокинов между IVB и PB у женщин с СКВ. Уровни CXCL8 (A) и CXCL1 (B) сравнивали в плазме, полученной из периферической или межворсинчатой крови при родах при СКВ и при здоровой беременности (здоровый контроль (HC)). Горизонтальные полосы указывают медианы, а каждый символ представляет одного человека. ** P≤0,01 и **** p≤0,0001, Краскал-Уоллис с последующим тестом множественных сравнений Данна. Количественный ПЦР-анализ экспрессии гена CXCL8 (C) и CXCL1 (D) в децидуальных стромальных клетках женщин с СКВ по сравнению с HCs.Полосы точечной диаграммы отображают медианное значение, и каждый символ представляет одного человека (критерий Манна-Уитни). IVB — межворсинчатая кровь; ПБ — периферическая кровь; RQ, относительное количественное определение.
Горизонтальные полосы указывают медианы, а каждый символ представляет одного человека. ** P≤0,01 и **** p≤0,0001, Краскал-Уоллис с последующим тестом множественных сравнений Данна. Количественный ПЦР-анализ экспрессии гена CXCL8 (C) и CXCL1 (D) в децидуальных стромальных клетках женщин с СКВ по сравнению с HCs.Полосы точечной диаграммы отображают медианное значение, и каждый символ представляет одного человека (критерий Манна-Уитни). IVB — межворсинчатая кровь; ПБ — периферическая кровь; RQ, относительное количественное определение.
IFNα присутствует в межворсинчатой крови при беременности с СКВ и усиливает экспрессию гена
CXCL8 в децидуальных стромальных клетках Около 50–75% взрослых пациентов с СКВ имеют выраженную сверхэкспрессию генов, индуцируемых IFN типа I. 15 In СКВ при беременности, белок IFNα был обнаружен в 2 из 10 образцов периферической крови и в 6 из 10 образцах межворсинчатой крови (рисунок 4A).При здоровой беременности IFNα обнаруживался в одном из семи образцов межворсинчатой крови и не определялся в образцах периферической крови. Статистический анализ подгруппы уровней IFNα в отношении APO не мог быть выполнен из-за небольшого количества людей (онлайн-дополнительные рисунки 7A, B). IFNα-чувствительный ген MX1 был активирован в децидуальных стромальных клетках у пяти из шести женщин с СКВ по сравнению со здоровым контролем (p = 0,06; фигура 4B). Даже при небольшом количестве субъектов наблюдалась линейная зависимость между уровнями IFNα в межворсинчатой крови и экспрессией MX1 в децидуальных стромальных клетках при беременности с СКВ (r = 0.75 и p = 0,1; рисунок 4C). Наконец, стимуляция IFNα in vitro значительно усилила экспрессию гена CXCL8 в децидуальных стромальных клетках как от СКВ, так и от здоровой беременности (рисунок 4D). В совокупности эти данные демонстрируют, что децидуальные стромальные клетки как от СКВ, так и от здоровой беременности реагируют на IFNα повышенной способностью секретировать CXCL8 in vitro, но детектируемая продукция белка IFNα и экспрессия гена CXCL8 in vivo были обнаружены только при беременности с СКВ.
Статистический анализ подгруппы уровней IFNα в отношении APO не мог быть выполнен из-за небольшого количества людей (онлайн-дополнительные рисунки 7A, B). IFNα-чувствительный ген MX1 был активирован в децидуальных стромальных клетках у пяти из шести женщин с СКВ по сравнению со здоровым контролем (p = 0,06; фигура 4B). Даже при небольшом количестве субъектов наблюдалась линейная зависимость между уровнями IFNα в межворсинчатой крови и экспрессией MX1 в децидуальных стромальных клетках при беременности с СКВ (r = 0.75 и p = 0,1; рисунок 4C). Наконец, стимуляция IFNα in vitro значительно усилила экспрессию гена CXCL8 в децидуальных стромальных клетках как от СКВ, так и от здоровой беременности (рисунок 4D). В совокупности эти данные демонстрируют, что децидуальные стромальные клетки как от СКВ, так и от здоровой беременности реагируют на IFNα повышенной способностью секретировать CXCL8 in vitro, но детектируемая продукция белка IFNα и экспрессия гена CXCL8 in vivo были обнаружены только при беременности с СКВ.
IFNα в периферической или межворсинчатой крови и экспрессия гена MX1 в децидуальных стромальных клетках женщин с СКВ и здоровых людей из контрольной группы.(A) Уровни белка IFNα в плазме, полученной из периферической или межворсинчатой крови при родах у женщин с СКВ и здоровых людей из контрольной группы (HCs). (B) Количественный ПЦР-анализ экспрессии гена MX1 в децидуальных стромальных клетках женщин с СКВ и HC. (C) Корреляция между уровнями белка IFNα в плазме из межворсинчатой крови и экспрессией гена MX1 в децидуальных стромальных клетках женщин с СКВ. (D) Количественный ПЦР-анализ экспрессии гена CXCL8 в децидуальных стромальных клетках женщин с СКВ и HC, стимулированных IFNα (1 нг / мл) или нет.Относительную количественную оценку (RQ) рассчитывали с использованием средней экспрессии CXCL8 в нестимулированных контролях HC в качестве эталона. Горизонтальные полосы в A и D указывают на медианы, полосы на диаграмме рассеяния в B отображают медианное значение, и каждый символ представляет одного человека. (B) U-критерий Манна-Уитни и (D) * p≤0,05 знаковый ранговый критерий Уилкоксона для согласованных пар.
(B) U-критерий Манна-Уитни и (D) * p≤0,05 знаковый ранговый критерий Уилкоксона для согласованных пар.
Гистологический хориоамнионит при беременности с СКВ
Как показано на рис. 5A, B, гистологический острый хориоамнионит, инфильтрация нейтрофилов в хорионической и амниотической оболочках плода и в субхорионическом фибриноидном слое был диагностирован у 6 из 12 женщин с СКВ и при беременности. 1 из 10 здоровых контролей (p = 0.07). Ни одна из переменных, связанных с нейтрофилами, включая пропорции и активацию LDG, а также рекрутирование и активацию нейтрофилов хемокинов, не была существенно связана с хориоамнионитом (данные не показаны). Более того, IFNα был измерен у пяти пациентов с СКВ, у которых был хориоамнионит, и у двоих из них был обнаружен IFNα в межворсинчатой крови (точный критерий Фишера p = 0,5). Фунисит, инфильтрация нейтрофильных гранулоцитов в пупочные сосуды и желе Уортона, был диагностирован у 4 из 12 женщин с СКВ и у 1 из 10 здоровых женщин в контрольной группе (рис. 5A, C).Гистологические изображения без хориоамнионита и фунизита показаны на рисунках 5D, E соответственно.
5A, C).Гистологические изображения без хориоамнионита и фунизита показаны на рисунках 5D, E соответственно.
Гистологическое нейтрофильное воспаление плаценты и пуповины. Наличие острого хориоамнионита или фунизита (А) в плацентарных оболочках плода и пуповине у женщин с СКВ и здоровых людей из контрольной группы (HCs). Репрезентативные гистологические изображения хориоамнионита (B), фунизита (C), отсутствия хориоамнионита (D) или отсутствия фунизита (E) у двух пациентов с СКВ. Масштабная линейка = 100 мкм.Нейтрофильные гранулоциты обозначены сплошными стрелками.
Обсуждение
Женщины с СКВ подвергаются повышенному риску неблагоприятных исходов беременности, но основные иммунологические механизмы в значительной степени неизвестны. Признанная связь активации нейтрофилов с патогенезом СКВ у небеременных пациенток побудила нас изучить наличие и активацию как NDG, так и LDG в периферической и межворсинчатой крови при СКВ по сравнению со здоровой беременностью. В настоящем исследовании мы сообщаем об увеличении доли ЛДГ в периферической крови и увеличении активации ЛДГ как в периферической, так и в межворсинчатой крови при СКВ по сравнению со здоровой беременностью.Кроме того, мы демонстрируем градиент привлекающих нейтрофилы хемокинов в межворсинчатой крови по сравнению с периферической кровью у женщин с СКВ, но не в контрольной группе здоровых людей. Другим новым открытием было увеличение присутствия гистологического хориоамнионита, инфильтрации нейтрофилов в плацентарных оболочках плода, при СКВ по сравнению со здоровой беременностью.
В настоящем исследовании мы сообщаем об увеличении доли ЛДГ в периферической крови и увеличении активации ЛДГ как в периферической, так и в межворсинчатой крови при СКВ по сравнению со здоровой беременностью.Кроме того, мы демонстрируем градиент привлекающих нейтрофилы хемокинов в межворсинчатой крови по сравнению с периферической кровью у женщин с СКВ, но не в контрольной группе здоровых людей. Другим новым открытием было увеличение присутствия гистологического хориоамнионита, инфильтрации нейтрофилов в плацентарных оболочках плода, при СКВ по сравнению со здоровой беременностью.
Нейтропения поражает около 20% взрослых пациентов с СКВ, 25 26 но также сообщалось, что пациенты с СКВ могут иметь повышенное количество циркулирующих нейтрофилов по сравнению с контрольной группой из-за лечения преднизоном.27 В настоящем исследовании мы не обнаружили различий в общем количестве гранулоцитов в периферической или межворсинчатой крови при СКВ по сравнению со здоровой беременностью во время родов.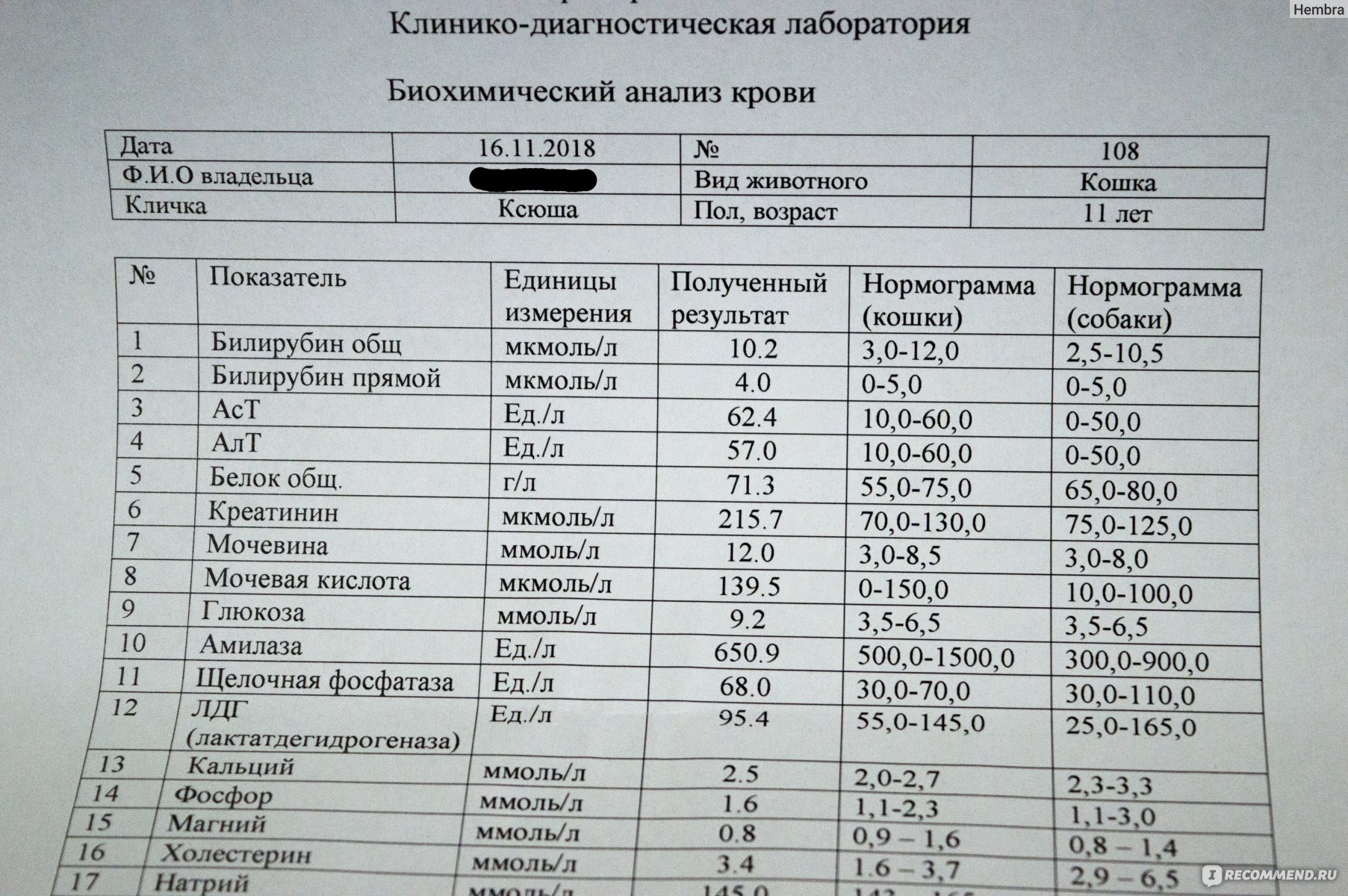 Общее количество гранулоцитов в обеих группах было выше по сравнению с количеством нейтрофилов, указанным в упомянутых исследованиях, что может зависеть от состояния активных родов при отборе образцов. Действительно, количество нейтрофилов в крови увеличивается по мере наступления беременности.28
Общее количество гранулоцитов в обеих группах было выше по сравнению с количеством нейтрофилов, указанным в упомянутых исследованиях, что может зависеть от состояния активных родов при отборе образцов. Действительно, количество нейтрофилов в крови увеличивается по мере наступления беременности.28
В последние годы внимание привлекла концепция различных субпопуляций нейтрофилов.29–31 Подгруппа ЛДГ была обнаружена у небеременных пациенток с СКВ10 и с тех пор была продемонстрирована при ряде воспалительных состояний и может, по крайней мере частично, состоять из активированных дегранулированных нейтрофилов с повышенной плавучестью.32 В соответствии с этим мы сообщаем об увеличении пропорции и повышенная активация ЛДГ в периферической крови у женщин с СКВ по сравнению со здоровыми женщинами во время родов. Также в межворсинчатой крови подгруппа ЛДГ от женщин с СКВ демонстрировала более активированный фенотип по сравнению со здоровой беременностью, но не было различий в доле ЛДГ между двумя группами. Фактически, ЛДГ составляла более 50% мононуклеарных клеток в межворсинчатой крови как от СКВ, так и от здоровых беременностей. О причинах этого можно только догадываться, но сам процесс активных родов может привести к повышенной активации и дегрануляции гранулоцитов в плаценте.33 34 Связаны ли активированные ЛДГ с патологией плаценты при беременности СКВ, еще предстоит изучить, но СКВ ЛДГ может сохраняются в сетях микрососудов35 и связаны с воспалением сосудов.36 37 Кроме того, СКВ ЛДГ спонтанно секретирует провоспалительные цитокины и привлекающий и активирующий нейтрофилы хемокин CXCL812 и спонтанно образуют сети, которые могут приводить к апоптозу эндотелия и дисфункции сосудов.11
Фактически, ЛДГ составляла более 50% мононуклеарных клеток в межворсинчатой крови как от СКВ, так и от здоровых беременностей. О причинах этого можно только догадываться, но сам процесс активных родов может привести к повышенной активации и дегрануляции гранулоцитов в плаценте.33 34 Связаны ли активированные ЛДГ с патологией плаценты при беременности СКВ, еще предстоит изучить, но СКВ ЛДГ может сохраняются в сетях микрососудов35 и связаны с воспалением сосудов.36 37 Кроме того, СКВ ЛДГ спонтанно секретирует провоспалительные цитокины и привлекающий и активирующий нейтрофилы хемокин CXCL812 и спонтанно образуют сети, которые могут приводить к апоптозу эндотелия и дисфункции сосудов.11
Предыдущее исследование сообщало об увеличении количества нейтрофилов и большем количестве сетей, визуализируемых с помощью иммунофлуоресценция в межворсинчатом пространстве плаценты у женщин с СКВ по сравнению с контрольной группой, 9 но как нейтрофилы рекрутируются в это место, неизвестно. Здесь мы показываем, что уровни CXCL8 и CXCL1 были выше в межворсинчатой крови по сравнению с периферической кровью при СКВ, но не при здоровой беременности, что позволяет предположить, что существует градиент привлекающих нейтрофилы хемокинов между межворсинчатой и периферической кровью у женщин с СКВ./79/79_2.jpg) Стромальные клетки играют центральную роль в привлечении и модуляции иммунных клеток за счет секреции хемокинов и цитокинов.38-40 Мы обнаружили, что экспрессия гена CXCL8 и CXCL1 была повышена в децидуальных стромальных клетках при некоторых беременностях с СКВ по сравнению с контрольной группой. , что соответствовало индивидуальным вариациям уровней белка этих двух хемокинов в межворсинчатой крови. Таким образом, наши данные показывают, что существует повышенная способность рекрутирования нейтрофилов в плаценту при беременности с СКВ и что децидуальные стромальные клетки могут быть клеточным источником привлекающих нейтрофилы хемокинов во время беременности.
Стромальные клетки играют центральную роль в привлечении и модуляции иммунных клеток за счет секреции хемокинов и цитокинов.38-40 Мы обнаружили, что экспрессия гена CXCL8 и CXCL1 была повышена в децидуальных стромальных клетках при некоторых беременностях с СКВ по сравнению с контрольной группой. , что соответствовало индивидуальным вариациям уровней белка этих двух хемокинов в межворсинчатой крови. Таким образом, наши данные показывают, что существует повышенная способность рекрутирования нейтрофилов в плаценту при беременности с СКВ и что децидуальные стромальные клетки могут быть клеточным источником привлекающих нейтрофилы хемокинов во время беременности.
Генетическая подпись IFN типа I присутствует примерно у 50–75% взрослых пациентов с СКВ.15 Здесь мы показываем, что белок IFNα обнаруживался в межворсинчатой крови от 60% беременностей с СКВ и что ген, отвечающий за IFN MX1 был активирован в децидуальных стромальных клетках пяти из шести женщин с СКВ. Мы также обнаружили, что децидуальные стромальные клетки как от СКВ, так и от здоровой беременности повышают экспрессию гена CXCL8 в ответ на стимуляцию IFNα in vitro.В совокупности наши данные предполагают, что повышенные уровни белка IFNα присутствуют в плаценте в подгруппе беременностей с СКВ, где он может действовать как эндогенный адъювант, который запускает децидуальные стромальные клетки для секреции CXCL8. Это могло привести к увеличению набора нейтрофилов в этот орган у этих женщин.
Мы также обнаружили, что децидуальные стромальные клетки как от СКВ, так и от здоровой беременности повышают экспрессию гена CXCL8 в ответ на стимуляцию IFNα in vitro.В совокупности наши данные предполагают, что повышенные уровни белка IFNα присутствуют в плаценте в подгруппе беременностей с СКВ, где он может действовать как эндогенный адъювант, который запускает децидуальные стромальные клетки для секреции CXCL8. Это могло привести к увеличению набора нейтрофилов в этот орган у этих женщин.
Гистологическое исследование плаценты беременных с СКВ обычно не проводится в рутинной клинической практике; поэтому информация о наличии острого воспаления в плаценте от СКВ по сравнению со здоровой беременностью скудна.Сообщалось, что женщины с СКВ или антифосфолипидным синдромом имеют больше поражений сосудов плаценты и тенденцию к увеличению хронических воспалений по сравнению со здоровыми людьми.41 В настоящем исследовании острый гистологический хориоамнионит, инфильтрация нейтрофильных гранулоцитов в хориоамниотические оболочки плода, был диагностирован в 60% беременностей с СКВ и в 10% здоровых беременностей. Нейтрофилы обычно не присутствуют в этих мембранах и мигрируют из децидуальной оболочки материнского происхождения.Соответственно, хориоамнионит является воспалительной реакцией матери, а инфильтрирующие нейтрофилы имеют материнское происхождение.13 42 43 В настоящем исследовании мы не можем исключить возможность того, что бактериальная инфекция является причиной гистологического острого хориоамнионита, но другие показали, что гистологические исследования хориоамнионит в доношенной плаценте часто вызывается неинфекционным воспалением.13 14 Воспалительная реакция плода, фунизит, с инфильтрацией нейтрофилов в сосудах пуповины и окружающих тканях также была чрезмерно представлена при СКВ по сравнению со здоровой беременностью.Несмотря на низкую распространенность неблагоприятных исходов беременности и низкую активность заболевания в данной когорте, у женщин с СКВ по-прежнему наблюдалось нейтрофильное воспаление в плаценте как со стороны матери, так и со стороны плода. Для изучения эффектов иммуносупрессивного лечения и клинической активности заболевания в отношении патологии плаценты и иммунологии требуется более широкая группа пациентов.
Нейтрофилы обычно не присутствуют в этих мембранах и мигрируют из децидуальной оболочки материнского происхождения.Соответственно, хориоамнионит является воспалительной реакцией матери, а инфильтрирующие нейтрофилы имеют материнское происхождение.13 42 43 В настоящем исследовании мы не можем исключить возможность того, что бактериальная инфекция является причиной гистологического острого хориоамнионита, но другие показали, что гистологические исследования хориоамнионит в доношенной плаценте часто вызывается неинфекционным воспалением.13 14 Воспалительная реакция плода, фунизит, с инфильтрацией нейтрофилов в сосудах пуповины и окружающих тканях также была чрезмерно представлена при СКВ по сравнению со здоровой беременностью.Несмотря на низкую распространенность неблагоприятных исходов беременности и низкую активность заболевания в данной когорте, у женщин с СКВ по-прежнему наблюдалось нейтрофильное воспаление в плаценте как со стороны матери, так и со стороны плода. Для изучения эффектов иммуносупрессивного лечения и клинической активности заболевания в отношении патологии плаценты и иммунологии требуется более широкая группа пациентов.
Использование четко определенной когорты нерожавших женщин с СКВ и здоровых контрольных женщин следует считать сильной стороной этого исследования.Во-вторых, мы впервые исследовали воспаление и активацию нейтрофилов в периферической и межворсинчатой крови при беременности с СКВ. В-третьих, в обеих группах проводилось гистологическое исследование плаценты, которое не проводится в рутинной клинической практике и поэтому редко изучается в предыдущих исследованиях. Ограничениями этого исследования являются небольшой размер исследования, в котором участвовало 12 пациентов с СКВ и 10 здоровых людей из контрольной группы, а также то, что не все иммунологические тесты применялись ко всем образцам. Тем не менее, мы по-прежнему демонстрируем четкие иммунологические различия с повышенной активацией нейтрофилов и воспалением в крови и плаценте у женщин с СКВ по сравнению со здоровыми женщинами.
Таким образом, роль плаценты как иммунологического органа при беременности с СКВ изучена не полностью. Здесь мы сообщаем об увеличении доли активированных ЛДГ в крови беременных с СКВ и о градиенте привлекающих нейтрофилы хемокинов между межворсинчатой и периферической кровью, что может усиливать плацентарное нейтрофильное воспаление, наблюдаемое при беременностях с СКВ. Возможный сценарий состоит в том, что повышенное количество нейтрофилов в плаценте во время прогрессирования беременности может способствовать снижению функции плаценты и повышению риска осложнений беременности у женщин с СКВ.
Благодарности
Мы хотели бы поблагодарить медсестер-исследователей Аниту Нильберг, Марию Андерссон, Марианну Петерссон, Соню Мёллер, Ханса Клинга, Еву Мальмквист, Элизабет Клинг и Лену Полссон из различных ревматологических клиник, а также акушерок Шарлотту Мёссон и Йоханссон. ассистент медсестры Анетт Свенск в дородовой клинике в Гетеборге и весь персонал родильного отделения. За помощь в сборе клинических данных мы хотели бы поблагодарить Кристину Карлссон, Мартину Уолберг и Илву Фолкессон.Мы также хотели бы поблагодарить доктора Мариэль Гатто за критическое прочтение рукописи. Наконец, мы хотим поблагодарить всех беременных женщин, принявших участие в исследовании.
На что указывает повышение ЛДГ при обследовании гемолитической анемии?
Шах А. Приобретенная гемолитическая анемия. Индийский журнал J Med Sci . 2004 декабрь 58 (12): 533-6. [Медлайн]. [Полный текст].
Хейли К. Врожденная гемолитическая анемия. Мед Клин Норт Ам . 2017 Март.101 (2): 361-374. [Медлайн].
Coetzer TI. Нарушения мембран эритроцитов. Каушанский К., Лихтман М.А., Прчал Дж.Т., Леви М.М., Пресс О.В., Бернс Л.Дж., Калиджури М.А., ред. Гематология Уильямса . 9 изд. Нью-Йорк, Нью-Йорк: образование Макгроу-Хилл; 2016. 661-88.
Lichtman MA. Гемолитическая анемия в результате заражения микроорганизмами. Каушанский К., Лихтман М.А., Прчал Дж.Т., Леви М.М., Пресс О.В., Бернс Л.Дж., Калиджури М.А., ред. Гематология Вильямса .9 изд. Нью-Йорк, Нью-Йорк: Образование Макгроу Хилл; 2016. 815-22.
Herrmann PC. Заболевания эритроцитов в результате действия химических и физических агентов. Каушанский К., Лихтман М.А., Прчал Дж.Т., Леви М.М., Пресс О.В., Бернс Л.Дж., Калиджури М.А., ред. Гематология Вильямса . 9 изд. Нью-Йорк, Нью-Йорк: образование Макгроу-Хилл; 2016. 809-14.
Сингх А., Мандал А., Патель А., Мишра С. Аутоиммунная гемолитическая анемия — спектр проявления у детей. Дж. Клин Диагностика .2017 11 (9) сентября: SR01-SR02. [Медлайн]. [Полный текст].
Kong JT, Schmiesing C. Скрытое злоупотребление нафталином до анестезии: нафталиновые шарики, ингалянты и их лечение. Acta Anaesthesiol Scand . 2005 Январь 49 (1): 113-6. [Медлайн].
Lane DR, Youse JS. Кумбс-положительная гемолитическая анемия, вторичная по отношению к укусу паука-отшельника: обзор литературы и обсуждение лечения. Cutis . 2004 декабрь 74 (6): 341-7.[Медлайн].
Packman CH, Leddy JP. Приобретенная гемолитическая анемия из-за аутоантител, реагирующих на тепло. Beutler E, Lichtman MA, Coller BS, Kipps TJ, eds. Гематология Вильямса . 5-е изд. Нью-Йорк, штат Нью-Йорк: Макгроу Хилл; 1995. 667-84.
Gallagher PG. Нарушения мембран эритроцитов. Hoffman R, Benz EJ Jr, Silberstein LE, Heslop H, Weitz J, Anastasi J, ред. Гематология: основные принципы и практика . 6-е изд. Нью-Йорк, Нью-Йорк: Черчилль Ливингстон; 2013.592-613.
Цена EA, Schrier SL. Внешние неиммунные гемолитические анемии. Hoffman R, Benz EJ Jr, Silberstein LE, Heslop H, Weitz J, Anastasi J, ред. Гематология: основные принципы и практика . 6-е изд. Нью-Йорк, Нью-Йорк: Черчилль Ливингстон; 2013. 628-38.
Ягер У., Лехнер К. Аутоиммунная гемолитическая анемия. Hoffman R, Benz EJ Jr, Silberstein LE, Heslop H, Weitz J, Anastasi J, ред. Гематология: основные принципы и практика .6-е изд. Нью-Йорк, Нью-Йорк: Черчилль Ливингстон; 2013. 614-17.
Berentsen S, Randen U, Tjønnfjord GE. Аутоиммунная гемолитическая анемия, опосредованная холодовыми агглютининами. Гематол Онкол Клин Норт Ам . 2015, 29 июня (3): 455-71. [Медлайн].
Rink BD, Gonik B, Chmait RH, O’Shaughnessy R. Гемолиз матери после внутривенного введения иммуноглобулинов при аллоиммунной тромбоцитопении у плода и новорожденного. Акушерский гинекол . 2013 фев.121 (2 Пет 2 Дополнение 1): 471-3. [Медлайн].
Майер Б., Лео А., Херцигер А., Хубен П., Шеммер П., Салама А. Внутрисосудистый иммунный гемолиз, вызванный контрастным веществом иомепролом. Переливание крови . 2013 24 января [Medline].
Ачарья Д., Макгиффин, округ Колумбия. Гемолиз после восстановления митрального клапана. J Card Surg . 2013 13 января. 1-4. [Медлайн].
Ренар Д., Росселе А. Лекарственная гемолитическая анемия: фармакологические аспекты. Трансфус Клин Биол . 2017 Сентябрь 24 (3): 110-114. [Медлайн].
Chiao EY, Engels EA, Kramer JR, Pietz K, Henderson L, Giordano TP и др. Риск иммунной тромбоцитопенической пурпуры и аутоиммунной гемолитической анемии среди 120 908 ветеранов США с вирусной инфекцией гепатита С. Arch Intern Med . 2009 23 февраля. 169 (4): 357-63. [Медлайн]. [Полный текст].
Замвар В., МакКлин П., Одека Е., Ричардс М., Дэвисон С. Инфекция вируса гепатита Е с неиммунной гемолитической анемией. J Педиатр Гастроэнтерол Нутр . 2005 Февраль 40 (2): 223-5. [Медлайн].
Найк Р. Теплая аутоиммунная гемолитическая анемия. Гематол Онкол Клин Норт Ам . 2015 июн.29 (3): 445-53. [Медлайн].
Майер Б., Юрек С., Кизеветтер Х., Салама А. Аутоиммунная гемолитическая анемия смешанного типа: дифференциальный диагноз и критический обзор зарегистрированных случаев. Переливание крови . 2008 окт. 48 (10): 2229-34. [Медлайн].
Hill A, Hill QA.Аутоиммунная гемолитическая анемия. Hematology Am Soc Hematol Educational Program . 2018 30 ноября 2018 (1): 382-389. [Медлайн].
Sanz J, Arriaga F, Montesinos P, Ortí G, Lorenzo I, Cantero S и др. Аутоиммунная гемолитическая анемия после трансплантации аллогенных гемопоэтических стволовых клеток у взрослых пациентов. Пересадка костного мозга . 2007 май. 39 (9): 555-61. [Медлайн].
Морейра М., Брас Р., Гонсалвес Д., Аленкоао И., Иноченсио Г., Родригес М. и др.Фетальная спленомегалия: обзор. Ультразвук Q . 2017 29 ноября. [Medline].
Джордж JN. Тромботическая тромбоцитопеническая пурпура и гемолитико-уремические синдромы: обзор патогенеза (Опыт Оклахомского реестра TTP-HUS, 1989-2007). Почки Int Suppl . 2009 Февраль S8-S10. [Медлайн].
Lechner K, Obermeier HL. Микроангиопатическая гемолитическая анемия, связанная с раком: клинические и лабораторные особенности в 168 зарегистрированных случаях. Медицина (Балтимор) . 2012 июл.91 (4): 195-205. [Медлайн].
Либман HA, Weitz IC. Аутоиммунная гемолитическая анемия. Мед Клин Норт Ам . 2017 Март 101 (2): 351-359. [Медлайн].
Audia S, Bach B, Samson M, Lakomy D, Bour JB, Burlet B и др. Венозные тромбоэмболические события при теплой аутоиммунной гемолитической анемии. PLoS One . 2018.13 (11): e0207218. [Медлайн]. [Полный текст].
Серегина Е.А., Полетаев А.В., Бондарь Е.В., Вуймо Т.А., Атауллаханов Ф.И., Сметанина Н.С.Система гемостаза у детей с наследственным сфероцитозом. Тромб Рез . 2019 5 февраля. 176: 11-17. [Медлайн].
Quintanilla-Bordás C, Castro-Izaguirre E, Carcelén-Gadea M, Marín M. Первый зарегистрированный случай лекарственной гемолитической анемии, вызванной диметилфумаратом, у пациента с рассеянным склерозом. Переливание крови . 2019 31 января. [Medline].
Фелан М.П., Рейнекс Э.З., Берриочоа Дж. П., Шольд Д. Д., Хусти Ф. М., Чемберлин Дж. И др.Влияние использования меньшего объема, меньших вакуумных пробирок для забора крови на гемолиз в образцах крови из отделения неотложной помощи. Ам Дж. Клин Патол . 2017 г. 1. 148 (4): 330-335. [Медлайн].
Дхингра К.К., Джайн Д., Мандал С., Хурана Н., Сингх Т., Гупта Н. Синдром Эванса: исследование шести случаев с обзором литературы. Гематология . 2008 г., 13 (6): 356-60. [Медлайн].
Гарратти Г. Иммунная гемолитическая анемия, связанная с отрицательными результатами рутинных серологических исследований. Семин Гематол . 2005 июл. 42 (3): 156-64. [Медлайн].
Kamesaki T, Oyamada T., Omine M, Ozawa K, Kajii E. Пороговое значение IgG, связанного с эритроцитами, для диагностики аутоиммунной гемолитической анемии, отрицательной по Кумбсу. Ам Дж. Гематол . 2009 Февраль 84 (2): 98-101. [Медлайн]. [Полный текст].
Kamesaki T, Toyotsuji T, Kajii E. Характеристика прямой отрицательной антиглобулиновой аутоиммунной гемолитической анемии: исследование 154 случаев. Ам Дж. Гематол . 2013 Февраль 88 (2): 93-6. [Медлайн].
Moraes ML, Lima LR, Vicentini-Oliveira JC, de Souza AVG, Oliveira ON, Deffune E, et al. Иммуносенсор для диагностики аутоиммунной гемолитической анемии (AIHA) на основе иммобилизации моноклональных антител на слое фиброина шелка. Дж. Наноси Нанотехнологии . 1 июля 2019 г. 19 (7): 3772-3776. [Медлайн].
Феррер Г., Наварро А., Ходжсон К. и др. Экспрессия микроРНК при хроническом лимфолейкозе с развитием аутоиммунной гемолитической анемии. Лимфома лейк . 2013 29 января. [Medline].
Jubinsky PT, Rashid N. Успешное лечение пациента с синдромом Эванса, опосредованным смешанными теплыми и холодными антителами, и непереносимостью глюкозы. Рак крови у детей . 2005 Сентябрь 45 (3): 347-50. [Медлайн].
Birgens H, Frederiksen H, Hasselbalch HC, Rasmussen IH, Nielsen OJ, Kjeldsen L, et al. Рандомизированное исследование фазы III, сравнивающее монотерапию глюкокортикоидами с глюкокортикоидами и ритуксимабом у пациентов с аутоиммунной гемолитической анемией. Br J Haematol . 2013 ноябрь 163 (3): 393-9. [Медлайн].
Go RS, Винтерс JL, Кей NE. Как я лечу аутоиммунную гемолитическую анемию. Кровь . 1 июня 2017 г. 129 (22): 2971-2979. [Медлайн].
Berentsen S, Tjønnfjord GE. Диагностика и лечение аутоиммунной гемолитической анемии, опосредованной холодовыми агглютининами. Кровь Ред. . 2012 май. 26 (3): 107-15. [Медлайн].
Dierickx D, Kentos A, Delannoy A.Роль ритуксимаба у взрослых с аутоиммунной гемолитической анемией теплых антител. Кровь . 2015 21 мая. 125 (21): 3223-9. [Медлайн]. [Полный текст].
Маклеод К., Флиман Н., Киркхэм Дж., Багуст А., Боланд А., Чу П. и др. Деферасирокс для лечения перегрузки железом, связанной с регулярными переливаниями крови (трансфузионный гемосидероз) у пациентов, страдающих хронической анемией: систематический обзор и экономическая оценка. Оценка медицинских технологий .2009 13 января (1): iii-iv, ix-xi, 1-121. [Медлайн]. [Полный текст].
Берк Младший. Низкие дозы подкожного рекомбинантного эритропоэтина у детей с хронической почечной недостаточностью. Ассоциация педиатрической нефрологии Австралии и Новой Зеландии. Педиатр Нефрол . 1995 Октябрь 9 (5): 558-61. [Медлайн].
Арбах О., Функ Р., Зейбт Ф., Салама А. Эритропоэтин может улучшить анемию у пациентов с аутоиммунной гемолитической анемией, связанной с ретикулоцитопенией. Transfus Med Hemother . 2012 июн. 39 (3): 221-223. [Медлайн]. [Полный текст].
Schettler V, Wieland E. Сообщение о случае лечения дарбэпоэтином у пациента с серповидно-клеточной анемией и хронической почечной недостаточностью, подвергающегося регулярным процедурам гемодиализа, которые вызывают дозозависимое увеличение интервалов переливания крови. Циферблат Тер Афера . 2009 Февраль 13 (1): 80-2. [Медлайн].
Болл AM, Уинстед ПС. Терапия рекомбинантным человеческим эритропоэтином у тяжелобольных Свидетелей Иеговы. Фармакотерапия . 2008 28 ноября (11): 1383-90. [Медлайн].
Tchernia G, Delhommeau F, Perrotta S, Cynober T., Bader-Meunier B, Nobili B и др. Терапия рекомбинантным эритропоэтином как альтернатива переливанию крови младенцам с наследственным сфероцитозом. Гематол Дж . 2000. 1 (3): 146-52. [Медлайн].
Хосоно С., Хосоно А., Мугишима Х., Накано И., Минато М., Окада Т. и др. Успешная терапия рекомбинантным эритропоэтином для новорожденных с анемией и наследственным сфероцитозом. Педиатр Инт . 2006 апр. 48 (2): 178-80. [Медлайн].
Моррисон Дж. Ф., Нойфельд Э. Дж., Грейс РФ. Использование средств, стимулирующих эритропоэтин, по сравнению с поддерживающей терапией у новорожденных с наследственным сфероцитозом: опыт единого центра. Eur J Haematol . 2014 августа 93 (2): 161-4. [Медлайн]. [Полный текст].
Balestracci A, Martin SM, Toledo I, Alvarado C, Wainsztein RE. Ранний эритропоэтин при постдиарейном гемолитико-уремическом синдроме: исследование случай-контроль. Педиатр Нефрол . 2014 21 августа [Medline].
Наирц М., Зоннвебер Т., Шролл А., Терл И., Вайс Г. Плейотропные эффекты эритропоэтина при инфекции и воспалении. Микробы заражают . 2012 марта, 14 (3): 238-46. [Медлайн]. [Полный текст].
Бьенвеню А.Л., Пико С. Церебральная малярия: защита эритропоэтином. Методы Мол Биол . 2013. 982: 315-24. [Медлайн].
Гамильтон Дж. У., Джонс Ф. Г., МакМуллин М Ф.Глюкозо-6-фосфатдегидрогеназа Гвадалахара — случай хронической несфероцитарной гемолитической анемии в ответ на спленэктомию и роль спленэктомии в этом заболевании. Гематология . 2004 г., 9 (4): 307-9. [Медлайн].
Reynaud Q, Durieu I., Dutertre M, Ledochowski S, Durupt S, Michallet AS, et al. Эффективность и безопасность ритуксимаба при аутоиммунной гемолитической анемии: метаанализ 21 исследования. Аутоиммунная Ред. . 2015 Апрель 14 (4): 304-13. [Медлайн].
субпопуляций нейтрофилов, экспрессирующих маркеры антигенпрезентирующих клеток, при висцеральном лейшманиозе человека | Журнал инфекционных болезней
Предпосылки
Висцеральный лейшманиоз (ВЛ) — это потенциально смертельное паразитарное заболевание, связанное с лихорадкой, кахексией и нарушением защитных Т-клеточных реакций против паразита.
Методы
Лейкоциты периферической крови 105 субъектов с ВН и здоровых контрольных субъектов из эндемичного региона Музаффарпур, Бихар, Индия, сравнивали с использованием проточной цитометрии и количественной полимеразной цепной реакции с обратной транскриптазой.Результаты коррелировали с клиническими данными.
Результаты
У субъектов с ВН наблюдалась расширенная популяция нейтрофилов низкой плотности, экспрессирующих HLA-DR, CD80 и CD86. Эта популяция нейтрофилов сократилась после успешного лечения болезни. Плазма пациентов с острой ВН была способна индуцировать подобную высокую экспрессию HLA-DR в нейтрофилах здоровых субъектов. Нейтрофилы HLA-DR + от субъектов с VL не стимулировали пролиферацию Т-клеток, но они действительно экспрессировали лиганд-1 запрограммированной гибели клеток (PDL1) в большей степени, чем другие нейтрофилы, а лимфоциты тех же субъектов выражали высокую запрограммированную гибель клеток 1 ( PD1).
Выводы
У пациентов с острой ВН увеличено количество циркулирующих нейтрофилов низкой плотности, экспрессирующих маркеры презентации антигена, которые уменьшаются после лечения. Развитие нейтрофилов HLA-DR + стимулируется, по крайней мере частично, компонентами плазмы пациентов с острым заболеванием. Хотя мы не нашли доказательств того, что они действуют как антигенпрезентирующие клетки, эти нейтрофилы экспрессировали маркеры, влияющие на истощение Т-клеток.
Лейшманиоз относится к группе синдромов, варьирующихся по степени тяжести от самозаживающих кожных язв до фатальной висцеральной инфекции.Все формы лейшманиоза в подавляющем большинстве случаев связаны с бедностью [1]. Возбудитель Leishmania spp. простейшие передаются человеку через укус самки гематофага песчаной мухи (род Phlebotomus в Старом Свете, Lutzomyia в Новом Свете). Висцеральный лейшманиоз (ВЛ) является наиболее тяжелой формой лейшманиоза, вызываемой либо Leishmania donovani в Индии и Судане, либо Leishmania infantum в Южной Америке и странах, граничащих со Средиземноморьем.В глобальном масштабе ВЛ уступает только малярии по причине смерти от паразитарных заболеваний [2].
Leishmania spp. являются облигатными внутриклеточными паразитами у своих млекопитающих-хозяев, которые наблюдались в нейтрофилах (полиморфно-ядерных лейкоцитах), моноцитах, макрофагах и дендритных клетках [3]. Хотя большинство паразитов находится в макрофагах на протяжении всей хронической инфекции, недавние исследования документально подтверждают тот факт, что нейтрофилы быстро привлекаются к месту инокуляции, где они интернализируют паразитов.Окончательное влияние нейтрофилов на исход лейшманиоза остается спорным, отчасти из-за различных методов, используемых для истощения нейтрофилов, и использования различных видов паразитов и линий мышей в исследованиях [4, 5]. Тем не менее, несколько исследований подтверждают наблюдение, что нейтрофилы помогают паразиту установить инфекцию [6]. Это, по-видимому, происходит, по крайней мере частично, из-за их воздействия на макрофаги или дендритные клетки, которые интернализируют нагруженные паразитами нейтрофилы [7]. Однако еще предстоит выяснить, играют ли нейтрофилы роль в хроническом лейшманиозе.
Нейтрофилы неоднородны. Подмножества нейтрофилов с отчетливыми фенотипическими или функциональными характеристиками включают поляризованные N1 (противоопухолевые) или N2 (протопухолевые) нейтрофилы, ассоциированные с опухолью, которые выделяют провоспалительные и ангиогенные факторы соответственно [8]. Нейтрофилы низкой плотности, очищаемые в градиенте плотности мононуклеарными клетками крови, наблюдались в контексте аутоиммунных заболеваний, особенно системной красной волчанки, в единичных сообщениях, начиная с 1986 г. [9].Супрессивные гранулоцитарные субпопуляции миелоидных супрессорных клеток (G-MDSCs) также мигрируют во фракциях лейкоцитов с низкой плотностью [10]. Недавно было обнаружено, что фракции мононуклеарных клеток периферической крови (PBMC) от эфиопских пациентов с активной VL содержат нейтрофилы CD15 + с высокими уровнями аргиназы, а истощение аргинина было связано с подавлением активности Т-клеток [11]. Параллельно с этими сообщениями сообщалось о субпопуляциях нейтрофилов, экспрессирующих HLA-DR и другие костимулирующие молекулы с некоторыми функциональными возможностями при аутоиммунных заболеваниях [12-15].Спектр клинических условий, в которых субпопуляции нейтрофилов многочисленны, а происхождение и функциональные возможности субпопуляций нейтрофилов не определены.
Вдохновленные потенциальным влиянием нейтрофилов на функцию Т-клеток, мы исследовали гипотезу о том, что могут существовать подмножества циркулирующих нейтрофилов, способных влиять на клеточные иммунные ответы у субъектов с острой ВН. Мы подтвердили увеличение популяции нейтрофилов низкой плотности у субъектов с ВН, как сообщили Abebe et al [11].Мы обнаружили, что эта популяция содержит еще одну субпопуляцию нейтрофилов, экспрессирующую HLA-DR и другие поверхностные маркеры антигенпрезентирующих клеток (APC), что указывает на перекрытие двух указанных «субпопуляций» нейтрофилов. Исследования этих нейтрофилов предполагают, что нейтрофилы HLA-DR + , возникающие во время VL, не стимулируют ответы T-лимфоцитов, но они могут играть альтернативную роль в патогенезе VL.
МЕТОДЫ
Человек-субъект
пациентов с ВЛ были набраны из Медицинского исследовательского центра Кала-Азар (KAMRC) в Музаффарпуре, штат Бихар, Индия.Диагноз был основан на наличии типичных симптомов и подтвержден обнаружением амастигот в аспиратах селезенки и / или антител к рекомбинантному антигену k39 с использованием коммерчески доступного тест-полоски (InBios Kala Azar Detect Rapid Test). Дополнительными критериями включения были возраст> 12 лет, небеременность, способность дать информированное согласие и ответ на терапию амфотерицином B. Все субъекты, включенные в исследование, были отрицательными по вирусу иммунодефицита человека.
Этические разрешения
Протоколы, использованные в этом исследовании, были одобрены институциональными наблюдательными советами Индусского университета Бенарас, Университета Айовы и Национальных институтов здравоохранения (NIH).Наблюдательный совет Института индуистского университета Банарас зарегистрирован в NIH. Все субъекты и / или опекуны предоставили письменное информированное согласие, а дети в возрасте 12–17 лет подписали форму согласия.
Препараты клеток периферической крови человека
Для получения клеток периферической крови использовали три метода:
1. Цельная кровь. Сначала 100 мкл гепаринизированной цельной крови инкубировали с панелью для окрашивания желаемых антител в течение 30 минут в темноте.Затем образцы инкубировали в 2 мл буфера для лизиса эритроцитов (Becton Dickinson) в течение 15 минут, после чего их промывали фосфатно-солевым буфером (PBS) центрифугированием и ресуспендировали в PBS с 0,1% бычьим сывороточным альбумином для проточной цитометрии.
2. Нейтрофилы низкой и нормальной плотности. Сначала 5 мл крови разделяли по плотности с использованием градиентов Ficoll Hypaque (Ambion; Thermo-Fischer Scientific), как описано для выделения PBMC [16]. После центрифугирования слой низкой плотности, мигрирующий над слоем фиколла, собирали и суспендировали в среде Roswell Park Memorial Institute с 10% инактивированной нагреванием фетальной телячьей сывороткой, пенициллином (100 Ед / мл) и стрептомицином (50 мкг / мл).Гранулоциты нормальной плотности (NDG) под слоем фиколла и над «осадком» эритроцитов (лейкоцитарная пленка) выделяли гипотоническим лизисом эритроцитов (15 минут; буфер для лизиса эритроцитов; BD Biosciences) и центрифугированием (300 г ; 10 минут ). Клеточные препараты использовали для окрашивания для проточной цитометрии.
3. Изолированные клетки CD66b + . Эритроциты в 15 мл свежесобранной периферической крови лизировали в 5–10 объемах лизирующего буфера (155 ммоль / л хлорида аммония, 10 ммоль / л бикарбоната калия и 0.1 ммоль / л этилендиаминтетрауксусной кислоты) в течение 10 минут при комнатной температуре. Клетки промывали центрифугированием и ресуспендировали в буфере для разделения клеток MACS (R) ™ (Miltenyi) (0,5% бычьего сывороточного альбумина и 2 ммоль / л этилендиаминтетрауксусной кислоты в × 1 PBS). Нейтрофилы были обогащены путем положительной селекции с использованием набора CD66abce MicroBead Kit с колонкой Magnetic LS в соответствии с протоколом, описанным производителем (Miltenyi Biotec).
Проточная цитометрия
Клетки периферической крови окрашивали антителами, конъюгированными с флуоресцентным маркером, в KAMRC, фиксировали и транспортировали в Banaras Hindu University для анализа.Антитела были следующими (с каталожными номерами BD Biosciences) CD66b (555724), CD62L (555544), CD11b / Mac1 (550019), CD86 (555660), CD80 (557227), CD15 (555401). HLA-DR (347364), CD66b (562254), CD3 (555333), CD14 (555397), CD63 (557305). Данные собирали на проточном цитометре FACSCalibur model 4CS (BD Biosciences).
Экстракция РНК и экспрессия генов
нейтрофилов, очищенных на наборе Militenyi CD66abce MicroBead, суспендировали в RNAlater (Qiagen), и общую РНК выделяли с использованием набора RNeasy Mini Kit и гомогенизаторов Qiashredder (Qiagen).Комплементарную ДНК (кДНК) синтезировали с помощью набора High-Capacity cDNA Archive (Applied Biosystems) с использованием случайных праймеров и обратной транскриптазы MultiScribe MuLV. Количественную полимеразную цепную реакцию проводили с помощью системы ABI Prism 7900HT, используя праймеры, перечисленные в таблице 1. Кратные изменения рассчитывали с использованием ΔΔCT с β 2 микроглобулина в качестве эндогенного контроля. Обилие транскриптов пациентов сравнивали со средним значением для эндемичных здоровых контрольных субъектов.
| Выписка . | Прямая грунтовка . | Обратный праймер . | ||
|---|---|---|---|---|
| аргиназы-1 | 5′-GTTTCTCAAGCAGACCAGCC-3 ‘ | |||
| β 2 | -микроглобулин 5′-CTCCGTGGCCTTAGCTGTG-3′ | 5′-TTTGGAGTACGCTGGATAGCCT-3 ‘ | ||
| HLA-DR | 5′-TCCGTCCCATTGAAGAAATG-3 ‘ | 5′-AGTGACACTGATGGTGCTGAG-3′ | ||
| IL-10 | 5′-GGTAGATGCC 90CC8CC8GATGACC8 | 5′-GGTAGATGCC | ||
| Интерферон-γ | 5′-CCAACGCAAAGCAATACATGA-3 ‘ | 5′-CGCTTCCCTGTTTTAGCTGC-3′ | ||
| TGF-3-β | 9087ACT||||
| TGF-3-3GTGACT | 5′-GCAGCAT | 5′-GCAGCAT | 5′-GCAGCAT 908CGCGCGCGCA | 5′-GAGCAT |
| Выписка . | Прямая грунтовка . | Обратный праймер . | ||
|---|---|---|---|---|
| аргиназы-1 | 5′-GTTTCTCAAGCAGACCAGCC-3 ‘ | |||
| β 2 | -микроглобулин 5′-CTCCGTGGCCTTAGCTGTG-3′ | 5′-TTTGGAGTACGCTGGATAGCCT-3 ‘ | ||
| HLA-DR | 5′-TCCGTCCCATTGAAGAAATG-3 ‘ | 5′-AGTGACACTGATGGTGCTGAG-3′ | ||
| IL-10 | 5′-GGTAGATGCC 90CC8CC8GATGACC8 | 5′-GGTAGATGCC | ||
| Интерферон-γ | 5′-CCAACGCAAAGCAATACATGA-3 ‘ | 5′-CGCTTCCCTGTTTTAGCTGC-3′ | ||
| TGF-3-β | 9087ACT||||
| TGF-3-3GTGACT | 5′-GCAGCAT | 5′-GCAGCAT | 5′-GCAGCAT 908CGCGCGCGCA | 5′-GAGCAT |
| Выписка . | Прямая грунтовка . | Обратный праймер . | ||
|---|---|---|---|---|
| аргиназы-1 | 5′-GTTTCTCAAGCAGACCAGCC-3 ‘ | |||
| β 2 | -микроглобулин 5′-CTCCGTGGCCTTAGCTGTG-3′ | 5′-TTTGGAGTACGCTGGATAGCCT-3 ‘ | ||
| HLA-DR | 5′-TCCGTCCCATTGAAGAAATG-3 ‘ | 5′-AGTGACACTGATGGTGCTGAG-3′ | ||
| IL-10 | 5′-GGTAGATGCC 90CC8CC8GATGACC8 | 5′-GGTAGATGCC | ||
| Интерферон-γ | 5′-CCAACGCAAAGCAATACATGA-3 ‘ | 5′-CGCTTCCCTGTTTTAGCTGC-3′ | ||
| TGF-3-β | 9087ACT||||
| TGF-3-3GTGACT | 5′-GCAGCAT | 5′-GCAGCAT | 5′-GCAGCAT 908CGCGCGCGCA | 5′-GAGCAT |
| Выписка . | Прямая грунтовка . | Обратный праймер . | ||
|---|---|---|---|---|
| аргиназы-1 | 5′-GTTTCTCAAGCAGACCAGCC-3 ‘ | |||
| β 2 | -микроглобулин 5′-CTCCGTGGCCTTAGCTGTG-3′ | 5′-TTTGGAGTACGCTGGATAGCCT-3 ‘ | ||
| HLA-DR | 5′-TCCGTCCCATTGAAGAAATG-3 ‘ | 5′-AGTGACACTGATGGTGCTGAG-3′ | ||
| IL-10 | 5′-GGTAGATGCC 90CC8CC8GATGACC8 | 5′-GGTAGATGCC | ||
| Интерферон-γ | 5′-CCAACGCAAAGCAATACATGA-3 ‘ | 5′-CGCTTCCCTGTTTTAGCTGC-3′ | ||
| TGF-3-β | 9087ACT||||
| TGF-3-3GTGACT | 5′-GCAGCAT | 5′-GCAGCAT | 5′-GCAGCAT 908CGCGCGCGCA | 5′-GAGCAT |
РЕЗУЛЬТАТЫ
Субъектов
ВЛ вызвано л.donovani был эндемиком в Бихаре и прилегающих штатах с конца 1800-х годов [17]. Аспирация селезенки с микроскопическим исследованием для амастигот Leishmania является стандартной диагностической процедурой для ВЛ в Индии. В дополнение к диагностике микроскопический анализ аспиратов селезенки позволяет приблизительно оценить тяжесть заболевания, от максимальной (5) до самой низкой (1) паразитарной нагрузки. Лица с подтвержденным диагнозом ВЛ были приглашены для участия в исследовании при поступлении в KAMRC.Всего за период с июля 2013 г. по август 2016 г. было включено 105 субъектов (36 женщин и 69 мужчин). Образцы крови были взяты в день 0 до лечения, но после подтверждения диагноза ВН. Все пациенты лечились в больнице амфотерицином B либо в его дезоксихолатной, либо в липосомальной форме в течение 30 дней [18] с исчезновением симптоматического заболевания. Второй образец крови был взят после завершения лечения, перед выпиской из больницы. Здоровые эндемичные контрольные субъекты были выбраны из членов семей пациентов, которые сопровождали пациентов с VL в KAMRC (n = 31).Кровь здоровых людей была собрана и обработана с образцами пациентов. У пациентов, включенных в это исследование, не было серьезных осложнений или летальных исходов.
Клинические характеристики
Пациенты проходят полный анализ крови при поступлении в KAMRC. Данные в дополнительной таблице 1A показывают совокупное количество клеток крови и результаты клинической химии 573 пациентов с активной ВН, поступивших в KAMRC. Данные, полученные исключительно от первых 83 субъектов текущего исследования, перечислены в дополнительной таблице 1B.Оба набора данных документируют лейкопению во время острого заболевания, которая исчезла после терапии. Как и ожидалось, уровни печеночных трансаминаз не были повышены. По окончании терапии у субъектов не наблюдалось значительного нарушения функции почек (измеряемого по креатинину сыворотки). У 573 пациентов, поступивших в медицинский центр с ВЛ, не было заметной корреляции между продолжительностью лихорадки (среднее [стандартное отклонение [SD], 43,8 [1,7] дня) и количеством нейтрофилов в день 0 до лечения ( R ). 2 = 0.00302; P = 0,19; Коэффициент корреляции Пирсона). Однако была обнаружена слабая обратная корреляция между тяжестью заболевания в соответствии с оценкой селезенки и количеством периферических нейтрофилов у 573 субъектов с ВН (среднее [SD], 1612 [889] или 1187 [620] нейтрофилов / мл, с оценкой селезенки 1 или 5 соответственно; P <0,05).
Лейкоциты в препаратах цельной крови
Проточной цитометрии цельной крови было достаточно, чтобы отличить нейтрофилы от моноцитов и лимфоцитов.Нейтрофилы вводили в образцы цельной крови в соответствии с их свойствами прямого и бокового рассеяния, как индикаторы размера и зернистости, а также в соответствии с их окрашиванием на маркер нейтрофилов CD66b. Идентичность этих закрытых клеток подтверждали окрашиванием на дополнительный маркер нейтрофилов (CD15), маркер моноцитов (CD14) и маркер лимфоцитов (CD3). Было четкое разделение между нейтрофилами CD66b + , CD15 + и моноцитами CD14 + или лимфоцитами CD3 + (дополнительный рисунок 1).Аналогичное разделение было показано между нейтрофилами и лимфоцитами CD4 + или CD8 + (не показано).
HLA-DR – экспрессирующие нейтрофилы в цельной крови субъектов с VL
Проточно-цитометрические исследования фенотипов нейтрофилов неожиданно показали, что большая часть нейтрофилов периферической крови у субъектов с VL окрашена на маркер HLA-DR. Это проиллюстрировано на графике потока образцов и на графиках, суммирующих результаты для группы пациентов с ВН до лечения или после полного курса терапии, или в эндемичной контрольной группе (рис. 1).Рисунок 1.
Обнаружение нейтрофилов, экспрессирующих HLA-DR, в цельной крови субъектов с висцеральным лейшманиозом (ВЛ). Периферическую венозную кровь собирали у субъектов с активной VL перед лечением (VL) или через 28 дней лечения и перед выпиской (Tx). Кровь собирали у здоровых эндемичных контрольных субъектов (Cont) в течение того же периода. Лейкоциты цельной крови окрашивали для проточной цитометрии и вводили нейтрофилы, как показано на дополнительной фигуре 1. A , репрезентативный график нейтрофилов CD66b + , окрашенных на HLA-DR. B , Доли нейтрофилов, экспрессирующих HLA-DR, у 84 субъектов с активной VL, у 20 из этих же субъектов после завершения терапии и у 33 контрольных лиц. * P <0,001, † P <0,0001. C . Нейтрофилы отделяли от лейкоцитов цельной крови субъектов с ВН до или после завершения терапии с использованием набора Miltenyi CD66abce MicroBead. Комплементарную ДНК использовали для анализа экспрессии генов с помощью SYBR green с праймерами, указанными в таблице 1.Данные показаны для экспрессии HLA-DR относительно β 2 -микроглобулина в качестве эндогенного эталона и нормализованы к средним пороговым значениям цикла для контролей. Статистический анализ проводился с парными тестами t (n = 7 пациентов с ВН).
Рисунок 1.
Обнаружение нейтрофилов, экспрессирующих HLA-DR, в цельной крови субъектов с висцеральным лейшманиозом (ВЛ). Периферическую венозную кровь собирали у субъектов с активной VL перед лечением (VL) или через 28 дней лечения и перед выпиской (Tx).Кровь собирали у здоровых эндемичных контрольных субъектов (Cont) в течение того же периода. Лейкоциты цельной крови окрашивали для проточной цитометрии и вводили нейтрофилы, как показано на дополнительной фигуре 1. A , репрезентативный график нейтрофилов CD66b + , окрашенных на HLA-DR. B , Доли нейтрофилов, экспрессирующих HLA-DR, у 84 субъектов с активной VL, у 20 из этих же субъектов после завершения терапии и у 33 контрольных лиц. * P <0,001, † P <.0001. C . Нейтрофилы отделяли от лейкоцитов цельной крови субъектов с VL до или после завершения терапии с использованием набора Miltenyi CD66abce MicroBead. Комплементарную ДНК использовали для анализа экспрессии гена SYBR green с праймерами в таблице 1. Данные показаны для экспрессии HLA-DR относительно β 2 -микроглобулина в качестве эндогенного эталона и нормированы на средние пороговые значения цикла для контролей. Статистический анализ проводился с парными тестами t (n = 7 пациентов с ВН).
Вдохновленные отчетом о нейтрофилах низкой плотности у пациентов с ВН [11], мы задались вопросом, будут ли нейтрофилы HLA-DR + , наблюдаемые у субъектов ВН, очищаться фракцией нейтрофилов низкой плотности. Сначала мы сравнили экспрессию HLA-DR в нейтрофилах CD66b + из фракций лейкоцитов с низкой плотностью у субъектов во время острой ВН, у тех же субъектов после лечения и у эндемичных контролей. Данные, представленные на фиг. 2, подтвердили наблюдение, что высокие пропорции нейтрофилов CD66b + присутствуют во фракциях с низкой плотностью (PBMC) субъектов с острой ВН, но уменьшаются после лечения.Эти клетки были подтверждены как нейтрофилы при микроскопическом исследовании нейтрофилов, выделенных из фракций низкой плотности (PBMC) с микрогранулами CD66abce. Окрашивание по Райту Гимза клеток CD66b + низкой плотности показало типичный вид многодольчатых нейтрофилов (гранулоциты низкой плотности [LDG]; фиг. 2 D ). LDG существенно не отличались по внешнему виду от нейтрофилов нормальной плотности, выделенных от того же пациента (NDG; фиг. 2 D ). Обе фракции включали ленточные формы, что свидетельствует о сдвиге в сторону раннего высвобождения незрелых форм во время острой ВН.Рисунок 2.
HLA-DR-экспрессирующие нейтрофилы обогащены фракциями нейтрофилов низкой плотности у субъектов с острым висцеральным лейшманиозом (ВЛ). Кровь собирали у субъектов с VL до (VL) или после лечения (Tx), а также у эндемичных здоровых контролей (ECs). Кровь отделяли осаждением плотности фиколла-гипака и фракции низкой плотности, мигрирующей над слоем фиколла, который также содержит мононуклеарные клетки периферической крови, и окрашивали для проточной цитометрии. A, B , типичная диаграмма рассеяния ( A ) и гистограмма ( B ) нейтрофилов CD66b + во фракции лейкоцитов низкой плотности (LD). C , Доли нейтрофилов, обнаруженные во фракциях с низкой плотностью, выделенных из крови 56 субъектов с VL, 16 с обработанными VL и 19 контрольных. * P <0,01; † P <0,001. D , Микроскопические изображения нейтрофилов, обогащенных фракцией низкой плотности или фракцией нормальной плотности пациентов с ВН до лечения, с использованием набора CD66abce MicroDead (Militenyi) и окрашенных с помощью набора для окрашивания Diff-Quik (эквивалент Райта Гимзы; Fisher Научный).Сокращения: ЛДГ — гранулоциты низкой плотности; НДГ, гранулоциты нормальной плотности.
Рисунок 2.
HLA-DR-экспрессирующие нейтрофилы обогащены фракциями нейтрофилов низкой плотности у субъектов с острым висцеральным лейшманиозом (ВЛ). Кровь собирали у субъектов с VL до (VL) или после лечения (Tx), а также у эндемичных здоровых контролей (ECs). Кровь отделяли осаждением плотности фиколла-гипака и фракции низкой плотности, мигрирующей над слоем фиколла, который также содержит мононуклеарные клетки периферической крови, и окрашивали для проточной цитометрии. A, B , типичная диаграмма рассеяния ( A ) и гистограмма ( B ) нейтрофилов CD66b + во фракции лейкоцитов низкой плотности (LD). C , Доли нейтрофилов, обнаруженные во фракциях с низкой плотностью, выделенных из крови 56 субъектов с VL, 16 с обработанными VL и 19 контрольных. * P <0,01; † P <0,001. D , Микроскопические изображения нейтрофилов, обогащенных фракцией низкой плотности или фракцией нормальной плотности пациентов с ВН до лечения, с использованием набора CD66abce MicroDead (Militenyi) и окрашенных с помощью набора для окрашивания Diff-Quik (эквивалент Райта Гимзы; Fisher Научный).Сокращения: ЛДГ — гранулоциты низкой плотности; НДГ, гранулоциты нормальной плотности.
Мы рассчитали абсолютное количество ЛДГ в крови пациентов с ВН на основании клинических лабораторных полных клеток крови и дифференциального подсчета вместе с данными проточной цитометрии. У двадцати двух пациентов была вся доступная информация до и после лечения. Среднее (SD) абсолютное число ЛДГ было в 1,79 (2,38) раза выше у пациентов с ВН до терапии, чем после завершения терапии. Хотя SD высокий из-за вариабельности между пациентами, у каждого субъекта после терапии было меньше LDG, чем до терапии.Разница была статистически значимой ( P <0,003; парный тест t ). Таким образом, как доля, так и количество ЛДГ были значительно выше у пациентов с ВН до лечения, чем после лечения ВН.
Эти наблюдения привели нас к скринингу субъектов с ВН и контрольной группой на содержание нейтрофилов CD66b + в цельной крови или во фракциях LDG или NDG, которые экспрессируют HLA-DR. Эти сравнения показаны на рисунке 3 для 39 субъектов с острой ВН, 13 таких же субъектов в день выписки и 13 эндемичных контрольных пациентов.Нейтрофилы HLA-DR + были сконцентрированы во фракциях LDG и истощены из фракций NDG у всех субъектов, несмотря на их резко различающиеся количества общих нейтрофилов HLA-DR + .Рисунок 3.
HLA-DR-экспрессирующие нейтрофилы обогащены фракциями нейтрофилов низкой плотности у субъектов с острым висцеральным лейшманиозом (ВЛ). Кровь собирали у пациентов с ВЛ до или после успешного лечения. Кровь также брали у здоровых эндемичных контрольных субъектов.Лейкоциты изучали в цельной крови или разделяли с помощью осаждения по плотности фиколла на фракции с низкой и высокой плотностью, содержащие популяции гранулоцитов низкой плотности (LDG) и гранулоцитов нормальной плотности (NDG), соответственно. Образцы окрашивали антителами к человеческому CD66b и HLA-DR и вводили нейтрофилы. A , Репрезентативные графики HLA-DR против CD66b во фракциях LDG 2 субъектов с указанными фенотипами. B , Доли нейтрофилов в каждой фракции (цельная кровь [WB], LDG и NDG), которые окрашиваются положительно на HLA-DR у указанных субъектов.Статистический анализ проводился с помощью программного обеспечения GraphPad Prism 7 с использованием одностороннего дисперсионного анализа и посттеста Тьюки (75 субъектов с ВН и 33 эндемичных контрольных субъекта). * P <.001.
Рисунок 3.
HLA-DR-экспрессирующие нейтрофилы обогащены фракциями нейтрофилов низкой плотности у субъектов с острым висцеральным лейшманиозом (ВЛ). Кровь собирали у пациентов с ВЛ до или после успешного лечения. Кровь также брали у здоровых эндемичных контрольных субъектов.Лейкоциты изучали в цельной крови или разделяли с помощью осаждения по плотности фиколла на фракции с низкой и высокой плотностью, содержащие популяции гранулоцитов низкой плотности (LDG) и гранулоцитов нормальной плотности (NDG), соответственно. Образцы окрашивали антителами к человеческому CD66b и HLA-DR и вводили нейтрофилы. A , Репрезентативные графики HLA-DR против CD66b во фракциях LDG 2 субъектов с указанными фенотипами. B , Доли нейтрофилов в каждой фракции (цельная кровь [WB], LDG и NDG), которые окрашиваются положительно на HLA-DR у указанных субъектов.Статистический анализ проводился с помощью программного обеспечения GraphPad Prism 7 с использованием одностороннего дисперсионного анализа и посттеста Тьюки (75 субъектов с ВН и 33 эндемичных контрольных субъекта). * P <.001.
Экспрессия костимулирующих молекул на HLA-DR + нейтрофилах
Мы выяснили, экспрессируют ли нейтрофилы HLA-DR + из цельной крови или фракций LDG костимулирующие молекулы, которые также необходимы для презентации антигена. Графики проточной цитометрии показали, что нейтрофилы, экспрессирующие HLA-DR, также экспрессируют как CD80, так и CD86, и разница между нейтрофилами HLA-DR + и HLA-DR — во всех фракциях и субъектах была значительной (рис. 4).Рисунок 4.
Костимулирующие молекулы в HLA-DR + по сравнению с HLA-DR — нейтрофилов. Периферическая кровь субъектов с висцеральным лейшманиозом (VL) до (VL; n = 11) или в конце лечения (VL Tx; n = 11) или кровь от эндемичных здоровых контролей (ECs; n = 15) изучалась как цельная кровь. или разделены на фракции с низкой и нормальной плотностью. Образцы окрашивали на CD66b, HLA-DR и либо на CD80, либо на CD86. Выбирали нейтрофилы на основании свойств рассеяния и окрашивания CD66b, как на дополнительном рисунке 1, и оценивали количество окрашенных CD80 или CD86 на нейтрофилах HLA-DR + или HLA-DR —.Данные показывают процент нейтрофилов HLA-DR + или HLA-DR — в цельной крови (WB) или фракциях гранулоцитов низкой плотности (LDG), которые окрашиваются положительно на CD80 или CD86. Результаты, выраженные в виде среднего геометрического индекса флуоресценции красителя CD80 или CD86, были аналогичными (не показаны). * P <0,001, † P <0,0001 (односторонний дисперсионный анализ).
Рисунок 4.
Костимулирующие молекулы в HLA-DR + по сравнению с HLA-DR — нейтрофилов.Периферическая кровь субъектов с висцеральным лейшманиозом (VL) до (VL; n = 11) или в конце лечения (VL Tx; n = 11) или кровь от эндемичных здоровых контролей (ECs; n = 15) изучалась как цельная кровь. или разделены на фракции с низкой и нормальной плотностью. Образцы окрашивали на CD66b, HLA-DR и либо на CD80, либо на CD86. Выбирали нейтрофилы на основании свойств рассеяния и окрашивания CD66b, как на дополнительном рисунке 1, и оценивали количество окрашенных CD80 или CD86 на нейтрофилах HLA-DR + или HLA-DR —.Данные показывают процент нейтрофилов HLA-DR + или HLA-DR — в цельной крови (WB) или фракциях гранулоцитов низкой плотности (LDG), которые окрашиваются положительно на CD80 или CD86. Результаты, выраженные в виде среднего геометрического индекса флуоресценции красителя CD80 или CD86, были аналогичными (не показаны). * P <0,001, † P <0,0001 (односторонний дисперсионный анализ).
Примирование и активация нейтрофилов в цельной крови субъектов с VL
Одной из потенциальных причин нейтрофилов низкой плотности может быть дегрануляция.Таким образом, мы определили, проявляют ли нейтрофилы HLA-DR + маркеры прайминга или активации. Нейтрофилы от людей с VL экспрессировали более высокие уровни CD11b и подавленного CD62L, обоих маркеров прайминга, по сравнению с эндемичными контролями (фиг. 5 A ). Если рассматривать как долю нейтрофилов, экспрессирующих высокий уровень CD11b или низкий уровень CD62L, нейтрофилы HLA-DR + показали значительно большее свидетельство активации, чем нейтрофилы HLA-DR — в крови пациентов с ВН (фиг. 5 B ).В соответствии с этими наблюдениями гранула тетраспанина CD63, которая экспонируется на поверхности нейтрофилов во время дегрануляции, была более высоко экспрессирована в нейтрофилах субъектов с ВН, чем у пациентов из контрольной группы, а в крови пациентов с ВН — CD63 + нейтрофилы были обнаружены во фракции LDG (фиг. 5 C ). Во фракции LDG окрашивание CD63 + было значительно более распространено в нейтрофилах HLA-DR + , чем нейтрофилы HLA-DR — ( P 19), не подвергалось повышенной регуляции на поверхности HLA-DR. + нейтрофилов (Фигура 5 D ).Вместе эти данные указывают на то, что подмножество нейтрофилов от субъектов с активной VL демонстрирует маркеры активации или прайминга и что активированные нейтрофилы содержатся во фракции LDG. Нейтрофилы HLA-DR + не обнаруживают поверхностных маркеров, что позволяет предположить, что они эквивалентны G-MDSC [10], хотя некоторые исследования задокументировали MDSC в фракциях крови с низкой плотностью [19].Рисунок 5.
Циркулирующие нейтрофилы от пациентов с висцеральным лейшманиозом (ВЛ) демонстрируют примированный фенотип. A, B , Образцы цельной крови от субъектов с острой VL (n = 38) или здоровых контролей (n = 17) окрашивали на маркеры прайминга / активации. Нейтрофилы CD66b + отбирали путем стробирования и анализировали с помощью проточной цитометрии на предмет их экспрессии поверхностных CD62L, CD11b и CD63. Данные представлены как средняя интенсивность флуоресценции (MFI) для CD62L и CD11b ( A ), а также для процента нейтрофилов HLA-DR + или HLA-DR — с высокой экспрессией CD11b или низкой экспрессией CD62L ( B ). ).* P <.05. C , Процент нейтрофилов, экспрессирующих CD63, сравнивается в цельной крови индивидуумов с острой ВН и эндемичных здоровых людей. Цельную кровь людей с VL разделяли на фракции гранулоцитов нормальной плотности (NDG) и гранулоцитов низкой плотности (LDG), и все фракции окрашивали на поверхностный CD63. † P <0,01; ‡ P <.0001. D , Нейтрофилы периферической крови 12 субъектов с острой VL окрашивали на CD62L и CD33 либо в виде цельной крови, либо после отделения LDG от NDG.Указывается процент нейтрофилов в каждой фракции, окрашиваемой положительно на CD33. Статистический анализ проводился с использованием дисперсионного анализа для 3 фракций или парного теста t при сравнении VL с контрольными группами или HLA-DR + против HLA-DR — нейтрофилов. * P <.05.
Рисунок 5.
Циркулирующие нейтрофилы от пациентов с висцеральным лейшманиозом (ВЛ) демонстрируют примированный фенотип. A, B , Образцы цельной крови от субъектов с острой VL (n = 38) или здоровых контролей (n = 17) окрашивали на маркеры прайминга / активации.Нейтрофилы CD66b + отбирали путем стробирования и анализировали с помощью проточной цитометрии на предмет их экспрессии поверхностных CD62L, CD11b и CD63. Данные представлены как средняя интенсивность флуоресценции (MFI) для CD62L и CD11b ( A ), а также для процента нейтрофилов HLA-DR + или HLA-DR — с высокой экспрессией CD11b или низкой экспрессией CD62L ( B ). ). * P <.05. C , Процент нейтрофилов, экспрессирующих CD63, сравнивается в цельной крови индивидуумов с острой ВН и эндемичных здоровых людей.Цельную кровь людей с VL разделяли на фракции гранулоцитов нормальной плотности (NDG) и гранулоцитов низкой плотности (LDG), и все фракции окрашивали на поверхностный CD63. † P <0,01; ‡ P <.0001. D , Нейтрофилы периферической крови 12 субъектов с острой VL окрашивали на CD62L и CD33 либо в виде цельной крови, либо после отделения LDG от NDG. Указывается процент нейтрофилов в каждой фракции, окрашиваемой положительно на CD33.Статистический анализ проводился с использованием дисперсионного анализа для 3 фракций или парного теста t при сравнении VL с контрольными группами или HLA-DR + против HLA-DR — нейтрофилов. * P <.05.
Влияние гетерологической плазмы пациентов с ВЛ на нейтрофилы
Плазма людей с ВН содержит провоспалительные и противовоспалительные цитокины, которые, как ожидается, будут влиять на функции циркулирующих иммунных клеток [20].Мы исследовали, может ли плазма пациентов с ВН активировать HLA-DR нейтрофилов периферической крови. Чтобы проверить это, мы инкубировали цельную кровь здоровых субъектов в плазме людей с или без ВЛ перед окрашиванием на поверхностные маркеры. Источники плазмы включали субъектов с активной ВН, пациентов с излеченной ВН, гетерологичных здоровых людей и аутологичную плазму. После инкубации при 37 ° C в 5% диоксиде углерода в течение 24 часов клетки окрашивали на CD66b и HLA-DR и обрабатывали для проточной цитометрии.Данные, обобщенные на Фигуре 6 A , показали, что плазма субъектов с активной VL, но не контрольных субъектов, вызвала увеличение HLA-DR на поверхности нейтрофилов здоровых субъектов.Рисунок 6.
Взаимодействие нейтрофилов с другими иммунными элементами in vitro. A , Взаимодействие нейтрофилов с плазмой. Образцы крови здоровых субъектов инкубировали в образцах плазмы пациентов с острым висцеральным лейшманиозом (VL; n = 21), субъектов с леченными VL (Tx; n = 12), гетерологичной (Hetero) плазмы здоровых субъектов (n = 8) или аутологичная плазма (Авто) (n = 17) при 37 ° C и 5% углекислого газа.Через 24 часа клетки окрашивали для проточной цитометрии. На графике показано процентное соотношение селективных нейтрофилов, окрашенных положительно на HLA-DR. B , Фракции лейкоцитов с низкой и высокой плотностью отделяли с помощью градиента фиколла-гипака от цельной крови субъектов с VL или эндемичных здоровых людей. CD15 + нейтрофилов низкой плотности (LDG) и CD3 + Т-клетки были выделены из фракций низкой плотности на шариках Miltenyi, а оставшиеся клетки низкой плотности были обогащены антигенпрезентирующими клетками (APC).Нейтрофилы нормальной плотности отделяли от лейкоцитов низкой плотности на шариках CD15 + (NDG). Т-клетки метили CFSE и инкубировали в течение 48 часов с каждой из очищенных фракций лейкоцитов при 37 ° C, 5% CO 2 в присутствии растворимого антигена Leishmania. Доля пролиферирующих (CFSE-low) Т-клеток в каждом состоянии, обнаруженная с помощью проточной цитометрии, показана на графике. C и D , Цельную кровь или очищенные нейтрофилы с низкой и нормальной плотностью (WB, LDG, NDG, соответственно) получали из крови субъектов с VL или от здоровых эндемичных контролей.Эти лейкоциты окрашивали антителами к CD66b, PD1 и PDL1 и анализировали проточной цитометрией. Гейты для нейтрофилов CD66b + и лимфоцитов CD66b — устанавливали из графиков прямого / бокового рассеяния и CD66b. Пропорции лимфоцитов от VL или контрольных субъектов, положительно окрашенных на PD1, показаны на панели C , а на панели D показаны фракции нейтрофилов, окрашенных положительно на PDL1 в крови субъектов VL. Сокращения: APC — антигенпрезентирующая клетка; CFSE, сукцинимидиловый эфир карбоксифлуоресцеина; ЛДГ, гранулоцит низкой плотности; NDG, гранулоциты нормальной-высокой плотности; PD1, белок-1 запрограммированной гибели клеток; PDL1, лиганд-1 программируемой клеточной смерти; PMN, полиморфноядерные лейкоциты; WB, цельная кровь. A, * P <0,05; † P <0,0001. B, * P <.01. C, P <0,003; † P <0,0001.
Рисунок 6.
Взаимодействие нейтрофилов с другими иммунными элементами in vitro. A , Взаимодействие нейтрофилов с плазмой. Образцы крови здоровых субъектов инкубировали в образцах плазмы пациентов с острым висцеральным лейшманиозом (VL; n = 21), субъектов с леченными VL (Tx; n = 12), гетерологичной (Hetero) плазмы здоровых субъектов (n = 8) или аутологичная плазма (Авто) (n = 17) при 37 ° C и 5% углекислого газа.Через 24 часа клетки окрашивали для проточной цитометрии. На графике показано процентное соотношение селективных нейтрофилов, окрашенных положительно на HLA-DR. B , Фракции лейкоцитов с низкой и высокой плотностью отделяли с помощью градиента фиколла-гипака от цельной крови субъектов с VL или эндемичных здоровых людей. CD15 + нейтрофилов низкой плотности (LDG) и CD3 + Т-клетки были выделены из фракций низкой плотности на шариках Miltenyi, а оставшиеся клетки низкой плотности были обогащены антигенпрезентирующими клетками (APC).Нейтрофилы нормальной плотности отделяли от лейкоцитов низкой плотности на шариках CD15 + (NDG). Т-клетки метили CFSE и инкубировали в течение 48 часов с каждой из очищенных фракций лейкоцитов при 37 ° C, 5% CO 2 в присутствии растворимого антигена Leishmania. Доля пролиферирующих (CFSE-low) Т-клеток в каждом состоянии, обнаруженная с помощью проточной цитометрии, показана на графике. C и D , Цельную кровь или очищенные нейтрофилы с низкой и нормальной плотностью (WB, LDG, NDG, соответственно) получали из крови субъектов с VL или от здоровых эндемичных контролей.Эти лейкоциты окрашивали антителами к CD66b, PD1 и PDL1 и анализировали проточной цитометрией. Гейты для нейтрофилов CD66b + и лимфоцитов CD66b — устанавливали из графиков прямого / бокового рассеяния и CD66b. Пропорции лимфоцитов от VL или контрольных субъектов, положительно окрашенных на PD1, показаны на панели C , а на панели D показаны фракции нейтрофилов, окрашенных положительно на PDL1 в крови субъектов VL. Сокращения: APC — антигенпрезентирующая клетка; CFSE, сукцинимидиловый эфир карбоксифлуоресцеина; ЛДГ, гранулоцит низкой плотности; NDG, гранулоциты нормальной-высокой плотности; PD1, белок-1 запрограммированной гибели клеток; PDL1, лиганд-1 программируемой клеточной смерти; PMN, полиморфноядерные лейкоциты; WB, цельная кровь. A, * P <0,05; † P <0,0001. B, * P <.01. C, P <0,003; † P <0,0001.
Взаимодействия ЛДГ-Т-клетки
Результаты предыдущих исследований позволяют предположить, что нейтрофилы, экспрессирующие HLA-DR, могут представлять антиген Т-клеткам [21]. Напротив, наши исследования, посвященные этой возможности, с использованием нейтрофилов HLA-DR + от субъектов с ВН, показали, что нейтрофилы, возникающие в этой ситуации, могут не стимулировать Т-клеточные ответы (рис. 6, B ).Для этого исследования мы использовали аффинную очистку с гранулами, чтобы фракционировать слой лейкоцитов низкой плотности на CD3 + Т-клетки, CD15 + LDG и оставшиеся клетки, содержащие классические APC. Нейтрофилы нормальной плотности (NDG) выделяли с помощью гранул анти-CD15 из нижней части фракции фиколла. Т-клетки, меченные карбоксифлуоресцеина сукцинимидиловым эфиром (CFSE), инкубировали в растворимом растворимом антигене Leishmania плюс буфер (отрицательный контроль), NDG, очищенных LDG или APC, и пролиферацию определяли разведением CFSE в дочерние клетки, измеренное с помощью потока цитометрия.Как показано на Фигуре 6 B , единственным условием, при котором Т-клетки пролиферировали значительно выше фоновых уровней, было присутствие антигена и классических APC. Очевидные различия между Т-клетками без или с NDG или LDG не были статистически значимыми.
В дополнение к вышеупомянутым доказательствам отсутствия стимуляции Т-клеток, поверхностные белки, опосредующие истощение Т-клеток, были активированы в LDG. Лимфоидные клетки в цельной крови или фракции PBMC низкой плотности у субъектов с VL экспрессируют высокие уровни лиганда-1 запрограммированной гибели клеток (PDL1) (фиг.6, C ), что согласуется с нашим предыдущим наблюдением высокой экспрессии PD1 на CD8. + Т-клеток от пациентов с [22].Кроме того, наблюдалось значительное увеличение экспрессии PDL1 на поверхности LDG у пациентов с VL (фиг. 6 D ).
ОБСУЖДЕНИЕ
VL приводит к нарушению регуляции периферического воспалительного состояния с дефектными кожными реакциями гиперчувствительности замедленного типа на антиген Leishmania и неспособностью клеточных ответов контролировать рост паразитов [23, 24]. Давнее убеждение, что неспособность очистить ВН происходит из-за дефекта высвобождения Т-клеточного интерферона (IFN) γ CD4 + , потребовало модификации с недавними доказательствами, что лимфоциты ведут себя совершенно по-разному в цельной крови по сравнению с препаратами мононуклеарных клеток [25– 28].Эти данные подчеркивают необходимость дальнейшего анализа клеточных ответов, лежащих в основе воспалительного состояния во время ВН человека.
Исследования на мышах подчеркивают роль нейтрофилов в лейшманиозе, несмотря на тот факт, что эти короткоживущие клетки ранее считались неспособными поддерживать инфекцию во время хронической протозойной инфекции [6, 29, 30]. Основываясь на гипотезе о том, что нейтрофилы человека также будут вносить вклад в патогенез, мы исследовали нейтрофилы у людей с активным ВН.Мы сделали неожиданное наблюдение, что подмножество циркулирующих нейтрофилов экспрессируют маркеры презентации антигена, включая главный комплекс гистосовместимости класса II и костимулирующие молекулы CD80 и CD86 у субъектов с ВН. Эти клетки мигрировали во фракцию лейкоцитов периферической крови с низкой плотностью, фракцию, которая содержит мононуклеарные лейкоциты и недавно описанную популяцию LDG, которая лучше всего изучена у пациентов со злокачественными новообразованиями или аутоиммунными заболеваниями [31]. Мы показали, что эти клетки являются нейтрофилами в соответствии с поверхностными маркерами, характерным микроскопическим видом и наличием транскрипта, специфичного для нейтрофилов.Несмотря на то, что у субъектов с ВН было низкое количество циркулирующих нейтрофилов, у них было больше ЛДГ до лечения, чем после лечения, и часть из них демонстрировала некоторую степень активации. Примированные / активированные нейтрофилы HLA-DR + мигрировали во фракцию лейкоцитов крови с низкой плотностью.
Нейтрофилы низкой плотности, очищающиеся в градиенте плотности мононуклеарными клетками крови, наблюдались еще в 1986 году у пациентов с системной красной волчанкой, ревматоидным артритом или острой ревматической лихорадкой.О субпопуляциях нейтрофилов, экспрессирующих HLA-DR и другие костимулирующие молекулы, также сообщалось в синовиальной жидкости или кровообращении субъектов с ревматоидным артритом или гранулематозом Вегенера, соответственно [12, 13], хотя до настоящего отчета не было показано, что они совпадают с LDG. Специфические для нейтрофилов транскрипты были обнаружены в микроматрицах PBMC пациентов с системной красной волчанкой, и их присутствие было подтверждено с помощью иммуногистохимии и микроскопии. Эти LDG активируются и секретируют IFN типа I, фактор некроза опухоли α и IFN-γ, но обладают пониженной способностью к фагоцитозу [9].Сообщается, что LDG у пациентов с септическим шоком экспрессируют аргиназу и дзета-цепь Т-клеточного рецептора (CD247), и количество этих нейтрофилов во фракциях PBMC коррелирует с тяжестью заболевания [31]. Наконец, фракции PBMC от эфиопских пациентов с активной VL, как было обнаружено, содержат нейтрофилы CD15 + с высоким уровнем аргиназы. У этих же субъектов предполагалось, что истощение аргинина связано с подавлением активности Т-клеток [11, 32].
Можно спорить, являются ли LDG такими же, как так называемые G-MDSC, супрессивные миелоидные клетки со свойствами незрелого гранулоцитарного клона, которые также мигрируют во фракции лейкоцитов низкой плотности [31, 33].Такие клетки могут быть индуцированы трансформирующим фактором роста бета, который широко присутствует в кровообращении людей с ВН [26, 33]. Тем не менее, у нас нет доказательств того, что нейтрофилы HLA-DR + , наблюдаемые при острой VL, имеют тип незрелых клеток и не активируют CD33, как описано для G-MDSC. Мы действительно демонстрируем доказательства потенциального подавляющего эффекта через экспрессию PDL1 в хозяине с высокими уровнями PD1 + лимфоцитов. Вместо того, чтобы находить их такими же, как G-MDSC, мы полагаем, что эти клетки добавляют еще один уровень сложности к возможным субпопуляциям нейтрофилов, наблюдаемым в болезненном состоянии.
Факторы, которые вызывают или усиливают развитие функционально различных субпопуляций нейтрофилов, четко не определены. Один отчет предполагает, что нетрадиционные Т-клетки индуцируют дифференцировку нейтрофилов человека в клетки, способные к перекрестной презентации антигена [21], а другие предполагают, что HLA-DR и костимулирующие молекулы индуцируются цитокинами, включая IFN-γ и / или колонию гранулоцитов-макрофагов. стимулирующий фактор [34, 35]. Наконец, наши собственные исследования субъектов с кожным лейшманиозом на северо-востоке Бразилии документально подтвердили наличие HLA-DR-экспрессирующих LDG в этом состоянии (R.E. D. et al, неопубликованные данные).
Функциональная роль субпопуляций нейтрофилов, в частности нейтрофилов HLA-DR + низкой плотности, неизвестна. Исследования других состояний, проведенные другими исследователями, предполагают, что эти клетки будут способны в некоторой степени представлять антиген Т-клеткам. Наши данные предполагают, что нейтрофилы, экспрессирующие HLA-DR, не действуют как APC. Мы проверили данные других о том, что лимфоциты субъектов с VL экспрессируют высокие уровни PD1, и совершенно новое открытие, что высокие уровни PDL1 экспрессируются на HLA-DR + низкой плотности, но не на нейтрофилах нормальной плотности.Это приводит нас к гипотезе о том, что нейтрофилы, экспрессирующие HLA-DR, которые становятся заметными во время VL, могут участвовать в обеспечении истощения Т-клеток, а не в представлении антигена.
Банкноты
Финансовая поддержка. Эта работа была частично поддержана грантом Исследовательского центра тропической медицины от NIH (P50 AI-074321), NIH (гранты R01 AI076233 и R01 AI045540 для MEW), Департамента по делам ветеранов (гранты 5I01BX001983 и 2I01BX000536), и Совет по научным и промышленным исследованиям.
Возможный конфликт интересов. Все авторы: о конфликтах не сообщалось. Все авторы подали форму ICMJE для раскрытия информации о потенциальных конфликтах интересов. Выявлены конфликты, которые редакция считает относящимися к содержанию рукописи.
Список литературы
1Альвар
Дж
,Yactayo
S
,Bern
C
.Лейшманиоз и бедность
.Trends Parasitol
2006
;22
:552
—7
,2Chappuis
Ф
,Sundar
S
,Hailu
A
et al. .Висцеральный лейшманиоз: каковы потребности в диагностике, лечении и контроле?
Nat Rev Microbiol
2007
;5
:873
—82
.3Кэй
-П
,Скотт
P
.Лейшманиоз: сложность взаимодействия «хозяин-патоген»
.Nat Rev Microbiol
2011
;9
:604
—15
,4Чармой
м
,Megnekou
R
,Allenbach
C
et al..Leishmania major индуцирует различные фенотипы нейтрофилов у мышей, которые устойчивы или чувствительны к инфекции
.J Leukoc Biol
2007
;82
:288
—99
,5Харрелл
Б.П.
,Regli
IB
,Tacchini-Cottier
F
.Разные Leishmania видов управляют различными функциями нейтрофилов
.Trends Parasitol
2016
,6Харрелл
Б.П.
,Schuster
S
,Grun
E
et al. .Быстрая секвестрация Leishmania mexicana нейтрофилами способствует развитию хронического поражения
.PLoS Pathog
2015
;11
:e1004929
.7Рибейро-Гомес
FL
,Peters
NC
,Debrabant
A
,Мешки
DL
.Эффективный захват инфицированных нейтрофилов дендритными клетками кожи подавляет ранний анти- Leishmania ответ
.PLoS Pathog
2012
;8
:e1002536
.8Piccard
H
,Muschel
RJ
,Opdenakker
G
.О двойной роли и поляризованных фенотипах нейтрофилов в развитии и прогрессировании опухоли
.Crit Rev Oncol Hematol
2012
;82
:296
—309
,9Денни
MF
,Yalavarthi
S
,Zhao
W
et al..Отдельная подгруппа провоспалительных нейтрофилов, выделенная от пациентов с системной красной волчанкой, вызывает повреждение сосудов и синтезирует интерфероны типа I
.J Immunol
2010
;184
:3284
—97
.10Юн
JI
,Collazo
M
,Shalova
IN
,Biswas
SK
,Gabrilovich
DI
.Характеристика природы клеток-супрессоров гранулоцитарного миелоидного происхождения у мышей с опухолями
.J Leukoc Biol
2012
;91
:167
—81
.11Abebe
т
,Takele
Y
,Weldegebreal
T
et al. .Активность аргиназы — маркер статуса заболевания у пациентов с висцеральным лейшманиозом в Эфиопии
.PLoS Negl Trop Dis
2013
;7
:e2134
.12Икинг-Конерт
С
,Vogt
S
,Radsak
M
,Wagner
C
,Hansch
GM
,Andrassy
K
.Полиморфноядерные нейтрофилы при гранулематозе Вегенера приобретают характеристики антигенпредставляющих клеток
.Kidney Int
2001
;60
:2247
—62
,13Крест
А
,Bucknall
RC
,Cassatella
MA
,Edwards
SW
,Moots
RJ
.Нейтрофилы синовиальной жидкости транскрибируют и экспрессируют молекулы главного комплекса гистосовместимости класса II при ревматоидном артрите
.Arthritis Rheum
2003
;48
:2796
—806
,14Икинг-Конерт
С
,Cseko
C
,Wagner
C
,Stegmaier
S
,Andrassy
K
,Hansch
GM
.Трансдифференцировка полиморфноядерных нейтрофилов: приобретение CD83 и других функциональных характеристик дендритных клеток
.J Mol Med (Berl)
2001
;79
:464
—74
,15Радсак
м
,Iking-Konert
C
,Stegmaier
S
,Andrassy
K
,Hansch
GM
.Полиморфноядерные нейтрофилы как дополнительные клетки для активации Т-клеток: главный комплекс гистосовместимости класса II ограничивает антиген-зависимую индукцию пролиферации Т-клеток
.Иммунология
2000
;101
:521
—30
,16Пирсон
RD
,Romito
R
,Symes
PH
,Harcus
JL
.Взаимодействие промастиготов Leishmania donovani с макрофагами, происходящими из моноцитов человека: проникновение паразитов, внутриклеточная выживаемость и размножение
.Infect Immun
1981
;32
:1249
—53
,17Бора
D
.Эпидемиология висцерального лейшманиоза в Индии
.Natl Med J India
1999
;12
:62
—8
,18Сундар
S
,Чакраварти
J
.Лейшманиоз: обновление текущей фармакотерапии
.Expert Opin Pharmacother
2013
;14
:53
—63
,19Poschke
Я
,Кисслинг
R
.О вооружении и внешнем виде супрессорных клеток миелоидного происхождения человека
.Клин Иммунол
2012
;144
:250
—68
.20Мухопадхяй
D
,Das
NK
,Roy
S
,Kundu
S
,Barbhuiya
JN
,Chatterjee
M
.Милтефозин эффективно модулирует цитокиновую среду при дермальном лейшманиозе Индии после кала-азара
.J Infect Dis
2011
;204
:1427
—36
.21Дэви
MS
,Morgan
MP
,Liuzzi
AR
et al. .Микроб-специфические нетрадиционные Т-клетки индуцируют дифференцировку нейтрофилов человека в антиген-кросс-презентирующие клетки
.J Immunol
2014
;193
:3704
—16
,22Гаутам
S
,Kumar
R
,Singh
N
et al..Истощение клеток CD8T при висцеральном лейшманиозе у человека
.J Инфекция Dis
2014
;209
:290
—9
,23Джеронимо
SM
,Duggal
P
,Braz
RF
et al. .Возникающая пригородная модель заражения Leishmania chagasi, простейшими, вызывающими висцеральный лейшманиоз на северо-востоке Бразилии
.Scand J Infect Dis
2004
;36
:443
—9
.24Хепнер Леви
л
,Mendes
E
.Нарушение клеточного иммунитета у пациентов с кала-азаром
.Allergol Immunopathol (Madr)
1981
;9
:109
—12
,25Карвалью
EM
,Badaro
R
,Reed
SG
,Jones
TC
,Johnson
WD
Jr.Отсутствие продукции гамма-интерферона и интерлейкина 2 при активном висцеральном лейшманиозе
.J Clin Invest.
1985
;76
:2066
—9
,26Уилсон
ME
,Jeronimo
SM
,Pearson
RD
.Иммунопатогенез инфекции висцерализующими Leishmania видов
.Microb Pathog.
2005
;38
:147
—60
,27Ho
м
,Koech
DK
,Iha
DW
,Bryceson
AD
.Иммуносупрессия при кенийском висцеральном лейшманиозе
.Clin Exp Immunol
1983
;51
:207
—14
.28Кумар
R
,Singh
N
,Gautam
S
et al. .CD4T-специфические клетки Leishmania выделяют IFN-гамма, который ограничивает репликацию паразитов у пациентов с висцеральным лейшманиозом
.PLoS Negl Trop Dis
2014
;8
:e3198
,29Петерс
NC
,Egen
JG
,Secundino
N
et al..Визуализация in vivo показывает важную роль нейтрофилов в лейшманиозе, передаваемом москитами
.Наука
2008
;321
:970
—4
.30Thalhofer
CJ
,Chen
Y
,Sudan
B
,Love-Homan
L
,Wilson
ME
.Лейкоциты инфильтрируют кожу и дренируют лимфатические узлы в ответ на простейшее Leishmania infantum chagasi
.Infect Immun
2011
;79
:108
—17
,31Дарси
CJ
,Minigo
G
,Piera
KA
et al. .Нейтрофилы с функцией супрессора миелоидного происхождения истощают аргинин и ограничивают функцию Т-лимфоцитов у пациентов с септическим шоком
.Crit Care
2014
;18
:R163
.32Такеле
Я
,Abebe
T
,Weldegebreal
T
et al. .Активность аргиназы в крови больных висцеральным лейшманиозом и ВИЧ-инфекцией
.PLoS Negl Trop Dis
2013
;7
:e1977
.33Пиллэй
Дж
,Tak
T
,Kamp
VM
,Koenderman
L
.Подавление иммунитета нейтрофилами и гранулоцитарными миелоидными супрессорными клетками: сходства и различия
.Cell Mol Life Sci
2013
;70
:3813
—27
,34Sandilands
GP
,McCrae
J
,Hill
K
,Perry
M
,Baxter
D
.Антиген главного комплекса гистосовместимости класса II (DR) и костимулирующие молекулы на полиморфно-ядерных нейтрофилах человека, активированных in vitro и in vivo
.Иммунология
2006
;119
:562
—71
,35Фангер
NA
,Liu
C
,Guyre
PM
et al. .Активация человеческих Т-клеток с помощью основного комплекса гистосовместимости класса II, экспрессирующего нейтрофилы: пролиферация в присутствии суперантигена, но не столбнячного анатоксина
.

 д.),
д.),
