Паренхиматозное кровотечение
Паренхиматозное кровотечение возникает при повреждении сосудов, снабжающих кровью внутренние органы. Его ещё называют внутренним. Протекает оно часто скрытно, диагностируется плохо или с затруднениями, а за то время пока специалистами распознаётся сама проблема, больной может потерять значительное количество крови.
Напомним, одномоментная потеря ½ крови, т.е. примерно до 2,5 литров у среднестатистического взрослого человека, является смертельной. Без вреда для себя и без каких-либо медицинских осложнений здоровые люди могут утратить лишь до 10—15% объёма этой жизненно важной жидкости (к слову, доноры обычно сдают 8—10% объёма).
Описываемый в статье тип кровотечения (обычно обильный, продолжительный, останавливающийся с большим трудом, опасный для жизни) возникает при повреждении таких жизненно важных органов, как печень, лёгкие, селезенка и почки, образуется при глубоких проникающих ранениях брюшной и/или грудной полости, а также при травмировании губчатого вещества костей и пещеристой ткани.
Любое, в том числе и паренхиматозное кровотечение опасно прежде всего тем, что из-за него значительно уменьшается количество циркулирующей в нашем организме крови и, как следствие, ухудшается работоспособность сердца, нарушается снабжение кислородом жизненно важных органов — печени, мозга, почек.
Всё это также вызывает резкое нарушение всех обменных процессов в организме человека. Особенно много осложнений появляется, когда пациент на момент травмы угнетён физически, психологически или ослаблен попутно протекающей ещё какой-либо болезнью.
Способы помощи пострадавшим при данном виде потери крови:
- применение фибринной пленки
- гемостатические швы
- электрокоагуляция и др.
Остановить такую проблему бывает очень трудно и требует от хирургов корректной диагностики и быстрого использования различных эффективных методов и процедур. На удачный исход также влияет (кроме скорости и правильности принятых мер помощи со стороны докторов пострадавшему) величина, быстрота потери крови, общее состояние организма и сердечно-сосудистой системы больного, а также возраст этого человека.
Метод стопроцентного гемостаза | Ураков
Аннотация
Введение. Острые кровотечения, возникающие из паренхиматозных органов при ушибах мягких тканей твердыми тупыми предметами, разрезах колющережущими предметами и разрывах пулями и осколками, часто угрожают жизни пострадавших изза гипоксии на фоне геморрагического шока. Гипоксия и геморрагический шок развиваются изза непрерывного истечения крови из множества зияющих кровеносных сосудов, лишенных способности сужаться. Безопасный и эффективный метод хирургического органосохраняющего лечения паренхиматозных кровотечений окончательно не разработан.
Материалы и методы. Проведен обзор научной и патентной литературы по способам гемостаза при кровотечениях из паренхиматозных органов путем локальных хирургических воздействий, дополненных локальными охлаждениями и нагреваниями. Исследование проведено с использованием баз данных Espacenet, Google Patent, eLibrary, Google Scholar, Web of Science, Scopus и PubMed.
Результаты и обсуждение. Показано, что в конце ХХ века в России был предложен оригинальный способ остановки паренхиматозного кровотечения. Метод основан на поперечном безопасном сдавливании органа в области сосудистого ствола, обеспечивающем безопасную ишемию травмированной части органа, и локальном нагревании раневой поверхности, обеспечивающем активацию свертывания крови. Сдавливание органа осуществляется с помощью хирургического инструмента, который обычно используется для мягкого сдавливания желудка и кишки. Механическое сдавливание органа осуществляется с силой, обеспечивающей полное пережатие его кровеносных сосудов и остановку вытекания крови из зияющих кровеносных сосудов раны. Локальная гипертермия раневой поверхности осуществляется с помощью прикладывания к ней твердого стерильного предмета с ровной гладкой и скользкой поверхностью при температуре +42…+45 °С. Ишемия и нагревание кровоточащей части паренхиматозного органа прекращаются через 5–15 минут.
Заключение. Показано, что для достижения максимально быстрого кровоостанавливающего эффекта во всех случаях паренхиматозных кровотечений нет альтернативы немедленному прекращению кровоснабжения раневой поверхности, дополненному ее нагреванием до +42…+45 °С вплоть до наступления окончательного гемостаза. Для профилактики развития послеоперационных спаек в брюшной полости предложено завершать хирургическую операцию орошением всей поверхности брюшины раствором 50 % глицерина при рН 7,4 и температуре +37…+42 °С.
Введение
На сегодня общепринятая медицинская технология неотложного лечения потенциально опасных для жизни паренхиматозных кровотечений, вызванных ушибами мягких тканей твердыми тупыми предметами, разрезами колюще-режущими предметами и разрывами пулями и осколками, включает борьбу за жизнь пострадавшего из-за угрозы гипоксии, развивающейся на фоне геморрагического шока, возникающего вследствие массивной кровопотери, и борьбу с неукротимым истечением крови из множества зияющих кровеносных сосудов, лишенных сосудосуживающей способности [1][2]. При этом современные методы борьбы с гипоксией основаны на искусственной вентиляции легких дыхательными газами; методы борьбы с геморрагическим шоком основаны на внутривенном введении инфузионных растворов и/или трансфузии донорской крови [3][4]; а методы борьбы с паренхиматозным кровотечением основаны на селективной артериальной эмболизации, которая в последние годы заменила собой спленэктомию [5]. Однако медицинская технология экстренной помощи пострадавшим при паренхиматозных кровотечениях не доведена до совершенства [6]. В частности, инфузионная терапия опасна угнетением свертывания крови из-за водного разведения ее плазмы, а гемотрансфузия опасна инфекционным заражением, острой гемолитической реакцией, анафилактическим шоком и другими осложнениями [7][8][9][10]. В свою очередь, селективная артериальная эмболизация опасна артериальным кровотечением, чрезмерно длительной ишемией и некрозом части кровоточащего органа [11][12].
Материалы и методы
Изучение научной и патентной информации, посвященной оригинальным способам гемостаза при острых паренхиматозных кровотечениях с помощью хирургических и температурных факторов локального взаимодействия, было проведено с использованием баз данных Espacenet, Google Patent, eLibrary, Google Scholar, Web of Science, Scopus и PubMed. Результаты были проанализированы, расставлены по приоритетам и обобщены. При этом были использованы следующие ключевые слова стратегии поиска: селезеночное кровотечение, мозговое кровотечение, почечное кровотечение, легочное кровотечение, паренхиматозное кровотечение, маточное кровотечение, остановка кровотечения, локальный гемостаз, хирургический гемостаз, способы локального гемостаза, угнетение свертывания крови, ускорение свертывания крови, холод, тепло, пузырь со льдом, грелка, локальная гипотермия, локальная гипертермия.
Ключевые слова были ограничены способами локального хирургического гемостаза и их использованием для остановки такого паренхиматозного кровотечения, как селезеночное кровотечение, а также их использованием в абдоминальной, торакальной и военно-полевой хирургии.
Результаты и обсуждение
Обзор научной и патентной литературы показал, что в конце ХХ века в России был изобретен оригинальный эффективный и безопасный способ немедленной остановки паренхиматозных кровотечений, получивший название «Способ остановки паренхиматозных кровотечений по А.Л. Уракову» (SU 1621890) [13]. Способ основан на локальных хирургических и температурных воздействиях, обеспечивающих немедленную остановку истечения крови из всех зияющих кровеносных сосудов и закупорку их тромбами через несколько минут. Остановка процесса истечения крови из раны достигается благодаря обратимой ишемии поврежденной части паренхиматозного органа, а экстренное свертывание крови в ране и закупорка тромбами зияющих кровеносных сосудов достигается локальной гипертермией кровоточащей раны. При этом обратимую атравматическую ишемию рекомендуется создавать путем временного пережатия проксимальной части поврежденного органа поперек предполагаемого сосудистого пучка вплоть до полного прекращения вытекания крови из раны. Для пережатия органа предложено применять мягкий медицинский жом (хирургический инструмент, используемый для мягкого пережатия желудка и/или кишки). Локальную гипертермию в области раны паренхиматозного органа предложено создавать путем прикладывания ко всей поверхности раны сухого твердого стерильного предмета с ровной гладкой и скользкой поверхностью при температуре +42…+45 °С. В частности, к ране может быть приложено дно химического стакана объемом 50-100 мл, наполненного водой с температурой +42…+45 °С.
Остановка процесса истечения крови из раны достигается благодаря обратимой ишемии поврежденной части паренхиматозного органа, а экстренное свертывание крови в ране и закупорка тромбами зияющих кровеносных сосудов достигается локальной гипертермией кровоточащей раны. При этом обратимую атравматическую ишемию рекомендуется создавать путем временного пережатия проксимальной части поврежденного органа поперек предполагаемого сосудистого пучка вплоть до полного прекращения вытекания крови из раны. Для пережатия органа предложено применять мягкий медицинский жом (хирургический инструмент, используемый для мягкого пережатия желудка и/или кишки). Локальную гипертермию в области раны паренхиматозного органа предложено создавать путем прикладывания ко всей поверхности раны сухого твердого стерильного предмета с ровной гладкой и скользкой поверхностью при температуре +42…+45 °С. В частности, к ране может быть приложено дно химического стакана объемом 50-100 мл, наполненного водой с температурой +42…+45 °С.
Было показано, что причиной «неукротимости» паренхиматозного кровотечения является отсутствие мышечного слоя в стенках кровеносных сосудов паренхиматозных органов. В связи с этой особенностью строения сосудистых стенок сосудов паренхиматозных органов кровеносные сосуды не сужаются, не пережимают свой просвет и не останавливают вытекание из самих себя крови при нарушении целостности стенки. К этому следует добавить, что в таких условиях кровь не может закупорить кровеносные сосуды, так как в норме при нормальной температуре тела (при +36,7 °С) она может превратиться в тромб только через 3-5 минут. За этот промежуток времени кровь стекает с поверхности раны и удаляется далеко за ее пределы. Поэтому кровь, истекшая из раны, превращается в тромб за пределами раны, то есть не там, где нужно. Именно поэтому при ранениях паренхиматозных органов кровь длительное время непрерывно течет через зияющие кровеносные сосуды, не закупоривая рану. Вполне очевидно, что кровь может свернуться в ране и закупорить рану только при прекращении своего движения на срок, достаточный для превращения жидкой крови в тромб.
Тем не менее этот метод не решал другую хирургическую проблему, связанную не только с паренхиматозным кровотечением, но и с любым хирургическим вмешательством в брюшной полости. Речь идет о высокой вероятности развития спаек в брюшной полости, несмотря на успешное завершение хирургической операции [14]. Однако в начале XXI века эта проблема была также успешно решена в России. В этот период фармакологи Ижевска обнаружили, что глицерин способен исключать развитие спаечной болезни после хирургических вмешательств на органах брюшной полости. Это открытие легло в основу двух изобретений: «Способ профилактики послеоперационных спаек» (RU заявка № 2006147057) и «Антиспаечное средство» (RU 2645074). Сущность этих изобретений заключается в том, что на завершающем этапе хирургической операции в брюшной полости париетальная и висцеральная поверхности брюшины орошаются раствором 50 % глицерина при рН 7,4 и температуре +37…+42 °С. Однократное применение глицерина по разработанному способу исключает спаечный процесс, индуцированный появлением порций крови в брюшной полости из-за паренхиматозного кровотечения. Показано, что нагретый водный щелочной раствор глицерина оказывает в брюшной полости антифрикционное действие на поверхность органов, локальное инактивирующее действие на медиаторы воспаления, соединительнотканные белки и ферменты, участвующие в образовании спаек. При этом глицерин не оказывает местное раздражающее действие на брюшину, спастическое действие на кишечник, кровоточащее действие на хирургическую рану. Важно, что у женщин детородного возраста глицерин не оказывает воспалительное действие на придатки матки, инактивирующее действие на половые клетки и тератогенное действие на эмбрионы.
Важно, что у женщин детородного возраста глицерин не оказывает воспалительное действие на придатки матки, инактивирующее действие на половые клетки и тератогенное действие на эмбрионы.
Заключение
Показано, что для достижения быстрого и надежного кровоостанавливающего эффекта при остром кровотечении из паренхиматозных органов нет альтернативы немедленному прекращению кровоснабжения раневой поверхности, дополненному ее нагреванием до +42…+45 °С вплоть до наступления окончательного гемостаза. Для профилактики развития послеоперационных спаек в брюшной полости предложено завершать хирургическую операцию орошением всей поверхности брюшины раствором 50 % глицерина при рН 7,4 и температуре +37…+42 °С.
1. Rossaint R., Bouillon B., Cerny V., Coats T.J., Duranteau J., FernándezMondéjar E., et al. The European guideline on management of major bleeding and coagulopathy following trauma: fourth edition. Crit Care. 2016;20:100. DOI: 10.1186/s13054-016-1265-x
2. Мустафин И.Г., Курманбаев Т.Е., Шмидт А.А., Тимошкова Ю.Л., Атаянц К.М. «Глобальные» методы исследования системы гемостаза в современной акушерской практике. Казанский медицинский журнал. 2019;100(6):958–64. DOI: 10.17816/KMJ2019-958
3. Urakov A., Urakova N., Kasatkin A. Thermal Imaging Improves the Accuracy Hemorrhagic Shock Diagnostics. The Concept and Practical Recommendations. LAP LAMBERT Academic Publishing; 2016.
4. Spahn D.R., Bouillon B., Cerny V., Duranteau J., Filipescu D., Hunt B.J., et al. The European guideline on management of major bleeding and coagulopathy following trauma: fifth edition. Crit Care. 2019;23(1):98. DOI: 10.1186/s13054-019-2347-3
2019;23(1):98. DOI: 10.1186/s13054-019-2347-3
5. Waseem M., Bjerke S. Splenic Injury. 2020 Aug 10. In: StatPearls. Treasure Island (FL): StatPearls Publishing; 2020 Jan. Available from: https://www.ncbi.nlm.nih.gov/books/NBK441993/
6. Курманбаев Т.Е., Яковлев Н.В., Хасанов А.А., Мустафин И.Г., Набиуллина Р.М. Современные методы оценки состояния системы гемостаза в акушерстве. Аспирантский вестник Поволжья. 2016;5–6:68–73.
7. Coats T.J., Brazil E., Heron M. The effects of commonly used resuscitation fluids on whole blood coagulation. Emerg Med J. 2006;23(7):546–9. DOI: 10.1136/emj.2005.032334. 2016;(5-6):68-73
8. Zubairova L.D., Nabiullina R.M., Nagaswami C., Zuev Y.F., Mustafin I.G., Litvinov R.I., et al. Circulating microparticles alter formation, structure, and properties of fibrin clots. Sci Rep. 2015;5:17611. DOI: 10.1038/srep17611
9. Омельяненко А.Г. Влияние лазерного облучения зон локализации красного костного мозга на состояние системы крови экспериментальных животных. Здравоохранение, образование и безопасность. 2019;(4):106–14.
10. Гомзикова М.О., Гайфуллина Р.Ф., Мустафин И.Г., Чернов В.М., Мифтахова З.Р., Галявич А.С., и др. Мембранные микровезикулы: биологические свойства и участие в патогенезе заболеваний. Клеточная трансплантология и тканевая инженерия. 2013;8(1):6–11.
11. Awwad A., Dhillon P.S., Ramjas G., Habib S.B., Al-Obaydi W. Transarterial embolisation (TAE) in haemorrhagic pelvic injury: review of management and mid-term outcome of a major trauma centre. CVIR Endovasc. 2018;1(1):32. DOI: 10.1186/s42155-018-0031-3
CVIR Endovasc. 2018;1(1):32. DOI: 10.1186/s42155-018-0031-3
12. Гольдберг Е.Д., Дыгай А.М., Жданов В.В., Зюзьков Г.Н., Гурьянцева Л.А., Першина О.В. и др. Теория регуляции кроветворения и создание на ее основе новых препаратов для терапии патологии системы крови. Бюллетень экспериментальной биологии и медицины. 2008;S2:6–13.
13. Ураков А.Л., Набоков В.А. Способ остановки паренхиматозного кровотечения. Вестник хирургии имени И.И. Грекова. 1988;140(5):113–4.
14. Ergul E., Korukluoglu B. Peritoneal adhesions: facing the enemy. Int J Surg. 2008;6(3):253–60. DOI: 10.1016/j.ijsu.2007.05.010
Журнал СТМ — Html View
Г.Г. Горохов, Л.В. Шкалова, А.В. Стриковский, С.В. Коробков, М.Е. Гущин, В.Е. Загайнов
Ключевые слова: гемостаз; паренхиматозные органы; коагуляция; СВЧ-аппликатор; СВЧ-коагулятор.
Цель исследования — оценка возможностей использования разработанного СВЧ-коагулятора с рабочей частотой 2,45 ГГц для достижения гемостаза на поверхности паренхиматозных органов.
Материалы и методы. Коагулятор представляет собой коаксиальную линию, нагруженную на антенну в форме однозаходной спирали Архимеда. Максимальный уровень подводимой мощности — 300 Вт. Параметры коагулятора определены по результатам численного моделирования и лабораторных испытаний при различных нагрузках. Работа коагулятора изучена на яичном белке и на паренхиме печени при различных экспозициях. Выполнено гистологическое исследование образцов биологической ткани из коагуляционных очагов.
Результаты. На паренхиме печени коагуляционный очаг с диаметром, равным диаметру аппликатора (20 мм), формируется за 10 с воздействия при максимальном уровне подводимой мощности. В зоне очага наблюдается коагуляция ткани, достаточно однородная по глубине.
На паренхиме печени коагуляционный очаг с диаметром, равным диаметру аппликатора (20 мм), формируется за 10 с воздействия при максимальном уровне подводимой мощности. В зоне очага наблюдается коагуляция ткани, достаточно однородная по глубине.
Заключение. Характер воздействия СВЧ-поля на ткани не зависит от степени влажности поверхности. Зона воздействия совпадает с диаметром рабочей части инструмента, что позволяет запланировать область необходимого воздействия. Можно утверждать о возможности применения созданного комплекса для гемостаза при паренхиматозном кровотечении.
Введение
Методы достижения гемостаза можно условно разделить на механические, химические и физические. Механические методы применяются только при повреждениях сосудов среднего и крупного калибра, при этом используются клипсы, лигатуры, шовный материал и т.п. Химические методы предполагают использование сосудосуживающих препаратов, повышающих свертываемость крови [1]. Например, Геласпон, представляющий собой губку из вспененного желатина: при контакте с желатином освобождаются тромбоциты, что ускоряет гемостаз. При капиллярных и паренхиматозных кровотечениях применяется также карбазохром, снижающий проницаемость сосудов и нормализующий микроциркуляцию крови. В целом остановка кровотечения путем местного использования химических средств производится редко из-за их недостаточной эффективности.
Достаточно широкое распространение получили физические методы гемостаза, иначе называемые термическими, основанные на применении технологий низкой или высокой температуры. Однако ни один из данных физических методов не лишен недостатков. Криогенные методы, реализуемые при температурах от –20 до –180°С, требуют использования значительного числа различных по размеру и конфигурации зондов, при этом отсутствует возможность контроля величины и формы зоны коагуляции ткани [2]. Использование технологий высокой температуры посредством применения монополярных или биполярных электрокоагуляторов приводит к образованию коагуляционного струпа, который характеризуется высоким риском отторжения с последующим рецидивом кровотечения. Также при прохождении электрического тока через тело пациента возможен электролиз крови и биологических тканей, что может неблагоприятно сказаться на динамике выздоровления. Поэтому в процессе остановки кровотечения приходится ограничивать полный ток разряда в ущерб объему и площади обрабатываемой поверхности. Кроме того, при работе коагуляторов достаточно часто возникают ожоговые поражения в области прилегания базового электрода, требующие дополнительного лечения [3].
Использование технологий высокой температуры посредством применения монополярных или биполярных электрокоагуляторов приводит к образованию коагуляционного струпа, который характеризуется высоким риском отторжения с последующим рецидивом кровотечения. Также при прохождении электрического тока через тело пациента возможен электролиз крови и биологических тканей, что может неблагоприятно сказаться на динамике выздоровления. Поэтому в процессе остановки кровотечения приходится ограничивать полный ток разряда в ущерб объему и площади обрабатываемой поверхности. Кроме того, при работе коагуляторов достаточно часто возникают ожоговые поражения в области прилегания базового электрода, требующие дополнительного лечения [3].
Одним из наиболее перспективных методов остановки кровотечения на сегодняшний день является плазменная коагуляция. К достоинствам такого воздействия относится обеспечение «чистого операционного поля», достигаемого за счет удаления свободных тканевых фрагментов и сгустков крови направленным потоком аргоновой плазмы.
К недостаткам плазменного коагулятора относят неконтролируемый некроз обрабатываемой ткани и риск возникновения ожога с перфорацией полого органа. Другим недостатком является образование коагуляционного струпа, что является препятствием для дальнейшего гемостаза [4].
Достаточно эффективным методом остановки кровотечения, в том числе и из паренхиматозных органов, служит лазерная фотокоагуляция, обладающая рядом преимуществ перед электрокоагуляцией: отсутствие механического контакта и, следовательно, «пригорания» коагулируемых тканей к электроду; строгая дозировка и равномерное распределение энергии в пределах светового пятна; постоянный визуальный контроль, поскольку кровоточащий участок никогда не перекрывается электродом; отсутствие электрического тока по тканям и локализация некробиотических изменений в области термического воздействия.
Серьезный недостаток данного метода — малая площадь воздействия лазерного луча на обрабатываемую ткань, составляющая всего 1–2 мм2, в результате чего остановка кровотечения на обширной поверхности сопряжена с серьезными трудностями [5, 6].
Фульгурация — еще один физический метод, называемый также спрей-коагуляцией. В рамках данного метода высокочастотным напряжением большой амплитуды формируются искровые разряды, не имеющие прямого контакта с биологической тканью. Разряды вызывают экстремальное повышение температуры на поверхности ткани и разрушают ее, при этом наблюдаются поверхностная коагуляция, образование струпа и карбонизация тканей. Спрей-коагуляция используется для гемостаза больших поверхностей, например при сильных капиллярных кровотечениях (так называемые сочащиеся поверхности). В этом случае возникающий ожоговый струп нередко ухудшает заживление, что приводит к рецидиву кровотечения [7].
Таким образом, на данный момент не существует ни одного надежного метода остановки кровотечения на поверхности биологической ткани и потому актуален поиск новых научно-технических решений.
Данная работа посвящена изучению объемных и поверхностных явлений при локальном воздействии на паренхиматозные ткани СВЧ-поля высокой интенсивности с целью остановки кровотечений с поверхности паренхиматозных органов, таких как печень, почки, селезенка, при хирургических вмешательствах. Особенностью коагуляции тканей таких органов является постоянное образование пленки крови на поверхности, и все известные физические методы остановки кровотечения из паренхиматозных органов требуют предварительного их осушения.
Цель исследования — оценка возможностей использования разработанного СВЧ-коагулятора с рабочей частотой 2,45 ГГц для достижения гемостаза на поверхности паренхиматозных органов.
Материалы и методы
На основе разработанного в 2011 г. прототипа медицинского СВЧ-комплекса для термического воздействия на биологические ткани [8–11] создан макет СВЧ-коагулятора для работы с паренхиматозными органами (рис. 1). Данное устройство обеспечивает максимальную выходную мощность 300 Вт на рабочей частоте 2,45 ГГц, имеет улучшенную эргономику с интуитивно понятным меню управления, в нем реализованы программируемые режимы воздействия на биологические ткани по форме огибающей СВЧ-поля и среднему уровню мощности.
| Рис. 1. Медицинский СВЧ-комплекс для термического воздействия на паренхиматозные ткани |
При воздействии электромагнитного поля на биологические ткани происходит распределенное по объему преобразование электромагнитной энергии в тепловую, обеспечивающее эффективный объемный нагрев. Структура температурного поля зависит прежде всего от структуры теплообразования, определяемой рабочей частотой, конструкцией антенны, биофизическими характеристиками самой ткани. Переход на более высокую частоту (в диапазон СВЧ) относительно ВЧ-диапазона традиционно используемых коагуляторов позволяет увеличить поглощаемую веществом мощность. При той же подводимой мощности нагрев биологической ткани в СВЧ-диапазоне происходит эффективней, а значит, повышается скорость нагрева обрабатываемой области. В результате открываются возможности быстрого, локального воздействия на сосуды, которое сопровождается коагуляцией белка и его «завариванием». В частности, при тепловом воздействии СВЧ-поля на кровоточащую поверхность образуется коагуляционный слой толщиной 2–3 мм и более в зависимости от органа и его структуры. Надежный гемостаз поврежденного органа, в том числе в ходе оперативного вмешательства, достигается независимо от наличия биологической жидкости на его поверхности.
На рис. 2 показан аппликатор для доставки СВЧ-мощности к биологической ткани. Выбору конфигурации и параметров антенны (рис. 3) предшествовали оптимизационные экспериментальные исследования и физический анализ электродинамической ближнепольной системы в режиме воздействия СВЧ-мощности на биологическую ткань. Конструктивно антенна, используемая для коагуляции, выполнена в виде плоской однозаходной спирали Архимеда, что обеспечивает широкоапертурное воздействие СВЧ-поля на биологическую ткань. СВЧ-мощность подводится к антенне коаксиальным радиочастотным кабелем. Наибольшая интенсивность СВЧ-поля достигается напротив провода спирали. Выравниванию температуры биологической ткани по пятну воздействия способствует электромагнитное поле меньшей интенсивности между витками. Для подавления отраженной СВЧ-волны, распространяющейся по оплетке кабеля в сторону генератора, а также для ослабления паразитных СВЧ-колебаний на границе раздела сред «воздух–биологическая ткань» используются два коаксиальных четвертьволновых резонатора. На рабочей части аппликатора установлена крышка из тефлона, защищающая антенну и резонаторы от проникновения жидкости и предупреждающая пригорание биологической ткани к аппликатору. Диаметр аппликатора — 20 мм.
| Рис. 2. Внешний вид аппликатора для СВЧ-термокоагуляции |
|
Рис. 3. Ближнепольная антенная система для СВЧ-термокоагуляции биологической ткани:
1 — СВЧ-генератор; 2 — радиочастотный кабель; 3 — центрирующая опора кабеля; 4 — однозаходная спираль Архимеда; 5 — корпус коагулятора; 6 — четвертьволновые резонаторы; 7 — диэлектрическая крышка |
Параметры аппликатора выбраны и обоснованы результатами численного моделирования электродинамической системы, включающей радиочастотный кабель, антенную систему и биологическую ткань с реалистичными параметрами проводимости и диэлектрической проницаемости. Согласно расчетам, представленным на рис. 4, максимальная амплитуда ближнего СВЧ-поля аппликатора достигается на расстоянии нескольких миллиметров от спирали, перед тефлоновой крышкой. На рис. 5 показан поперечный срез модуля напряженности электрического СВЧ-поля на расстоянии 2 мм от антенны. Распределение поля повторяет форму спирали, и, соответственно, основной энерговклад происходит в этой области, однако за счет теплопроводности биологической ткани температура достаточно быстро выравнивается по апертуре аппликатора.
Согласно расчетам, представленным на рис. 4, максимальная амплитуда ближнего СВЧ-поля аппликатора достигается на расстоянии нескольких миллиметров от спирали, перед тефлоновой крышкой. На рис. 5 показан поперечный срез модуля напряженности электрического СВЧ-поля на расстоянии 2 мм от антенны. Распределение поля повторяет форму спирали, и, соответственно, основной энерговклад происходит в этой области, однако за счет теплопроводности биологической ткани температура достаточно быстро выравнивается по апертуре аппликатора.
| Рис. 4. Расчетное распределение модуля напряженности электрического СВЧ-поля в продольном сечении коаксиальной линии, нагруженной на аппликатор |
| Рис. 5. Поперечная структура модуля электрического СВЧ-поля в рабочей зоне аппликатора (расчет) |
Измерения коэффициента отражения СВЧ-мощности от аппликатора в свободном пространстве (без нагрузки) и приложенного к биологической ткани (с нагрузкой) приводятся на рис. 6. На рабочей частоте (2,45 ГГц) разница в коэффициентах отражения от нагруженного и ненагруженного аппликатора составляет 16 дБ, что указывает на оптимальный режим согласования коагулятора с биологической тканью.
| Рис. 6. Коэффициент отражения СВЧ-мощности от ненагруженного (А) и нагруженного (Б) аппликатора (измерение) |
Исследования возможностей использования аппликатора для коагуляции паренхиматозных тканей проводили на яичном белке и на удаленной правой доле печени больного с колоректальными метастазами. Воздействие на ткани печени выполняли в двух режимах мощности СВЧ-генератора: 75% (225 Вт) и 100% (300 Вт) с экспозицией 2, 5, 10 и 15 с в каждом режиме. Удаленный из коагуляционных очагов печени материал был маркирован и направлен на гистологическое исследование.
Удаленный из коагуляционных очагов печени материал был маркирован и направлен на гистологическое исследование.
Результаты и обсуждение
Показан результат действия аппликатора на яичный белок (рис. 7). Коагулированный белок однороден по толщине и апертуре, имеющей форму окружности с диаметром аппликатора.
|
Рис. 7. Воздействие на яичный белок СВЧ-коагулятором |
Выполнена фотография печени с коагуляционными очагами, полученными при различных экспозициях (рис. 8). Взяты гистологические образцы (рис. 9). По данным гистологического исследования получены размерные параметры коагуляционных очагов на печени в зависимости от времени экспозиции и мощности (рис. 10).
|
Рис. 8. Правая доля печени, подвергнутая обработке СВЧ-коагулятором: 2, 5, 10, 15 с — экспозиция воздействия, 75% и 100% — мощность СВЧ-генератора |
| Рис. 9. Гистологические препараты печени (1–3), обработанной СВЧ-аппликатором в режиме 100% мощности генератора; время воздействия — 15 с |
|
Рис. 10. Результаты воздействия на печень СВЧ-коагулятором в зависимости от времени экспозиции: а — в режиме 75% мощности; б — в режиме 100% мощности; 1 — диаметр очага; 2 — глубина очага в центре; 3 — глубина очага на периферии |
На рис. 8 видно, что форма коагуляционных очагов близка к расчетным распределениям электромагнитного поля (см. рис. 4 и 5). Визуально наибольшие изменения наблюдаются в центре пятна воздействия. Сравнение гистологических образцов демонстрирует четкую зависимость размеров области изменений от времени и мощности воздействия (см. рис. 10). Подробных данных об изменении поперечной структуры очага в первые 2 с воздействия нет, но, начиная с 3-й секунды диаметр очага монотонно увеличивается с выходом через 10 с на значение, близкое к диаметру аппликатора. Далее до 15-й секунды воздействия диаметр очага не изменяется. Такая динамика обусловлена конфигурацией электромагнитного поля антенны и изменением поглощающих свойств биологической ткани в процессе воздействия. В первые секунды нагрева тканей формируется очаг видимых коагуляционных изменений с очерченными границами. Хотя СВЧ-поле неоднородно по апертуре аппликатора, за счет высокой теплопроводности тканей поле нагрева достаточно однородно в пределах пятна. Приблизительно с 10-й секунды видимый размер области воздействия прекращает увеличиваться, становится равным диаметру рабочей части инструмента и определяется распределением электрического поля. Что касается глубины коагуляции, то для каждого фиксированного момента времени ее значение в центре пятна воздействия и на периферии различается, но не более чем на 20%. Начиная со 2-й секунды воздействия граница макроскопических изменений углубляется в биологическую ткань практически с постоянной скоростью, составляющей от 0,35 мм/с в режиме 75% мощности до 0,45 мм/с в режиме 100% мощности. В то же время при максимальном времени экспозиции (15 с) глубина коагуляции для двух режимов мощности отличается не более чем на 10–15%.
рис. 4 и 5). Визуально наибольшие изменения наблюдаются в центре пятна воздействия. Сравнение гистологических образцов демонстрирует четкую зависимость размеров области изменений от времени и мощности воздействия (см. рис. 10). Подробных данных об изменении поперечной структуры очага в первые 2 с воздействия нет, но, начиная с 3-й секунды диаметр очага монотонно увеличивается с выходом через 10 с на значение, близкое к диаметру аппликатора. Далее до 15-й секунды воздействия диаметр очага не изменяется. Такая динамика обусловлена конфигурацией электромагнитного поля антенны и изменением поглощающих свойств биологической ткани в процессе воздействия. В первые секунды нагрева тканей формируется очаг видимых коагуляционных изменений с очерченными границами. Хотя СВЧ-поле неоднородно по апертуре аппликатора, за счет высокой теплопроводности тканей поле нагрева достаточно однородно в пределах пятна. Приблизительно с 10-й секунды видимый размер области воздействия прекращает увеличиваться, становится равным диаметру рабочей части инструмента и определяется распределением электрического поля. Что касается глубины коагуляции, то для каждого фиксированного момента времени ее значение в центре пятна воздействия и на периферии различается, но не более чем на 20%. Начиная со 2-й секунды воздействия граница макроскопических изменений углубляется в биологическую ткань практически с постоянной скоростью, составляющей от 0,35 мм/с в режиме 75% мощности до 0,45 мм/с в режиме 100% мощности. В то же время при максимальном времени экспозиции (15 с) глубина коагуляции для двух режимов мощности отличается не более чем на 10–15%.
Заключение
Данные, полученные в ходе экспериментов по коагуляции яичного белка и паренхимы печени с использованием СВЧ-энергии, свидетельствуют, что структура температурного поля зависит прежде всего от структуры теплообразования в тканях, которая определяется частотой поля, конструкцией излучателя, биофизическими характеристиками самой ткани. Характер воздействия не зависит от степени влажности поверхности, при этом зона воздействия совпадает с диаметром рабочей части инструмента. Наличие четкой границы зоны коагуляционных изменений позволяет планировать область воздействия. Полученные результаты эксперимента дают возможность применения описанной системы для гемостаза при паренхиматозном кровотечении.
Характер воздействия не зависит от степени влажности поверхности, при этом зона воздействия совпадает с диаметром рабочей части инструмента. Наличие четкой границы зоны коагуляционных изменений позволяет планировать область воздействия. Полученные результаты эксперимента дают возможность применения описанной системы для гемостаза при паренхиматозном кровотечении.
Финансирование исследования. Работа выполнена при поддержке Российского фонда фундаментальных исследований, грант №15-42-02348-р_поволжье_а.
Конфликт интересов. Авторы подтверждают отсутствие финансовых и других конфликтных интересов, способных оказать влияние на их работу.
- Сафронова Е.Ю., Нюшко К.М., Алексеев Б.Я., Калпинский А.С., Поляков В.А., Каприн А.Д. Способы осуществления гемостаза при выполнении резекции почки. Исследования и практика в медицине 2016; 3(1): 58–65, https://doi.org/10.17709/2409-2231-2016-3-1-8.
- Александров В.В., Маскин С.С., Иголкина Л.А., Ермолаева Н.К. Перспективы использования локального криогемостаза при травмах печени и селезенки. Кубанский научный медицинский вестник 2013; 7(142): 45–51.
- Пахлеванян В.Г., Колесников С.А. Электрокоагуляционный гемостаз, преимущества и недостатки. Научные ведомости Белгородского государственного университета. Серия: Медицина. Фармация 2016; 33(5): 5–9.
- Nomura Y., Takamatsu T., Kawano H., Miyahara H., Okino A., Yoshida M., Azuma T. Investigation of blood coagulation effect of nonthermal multigas plasma jet in vitro and in vivo. J Surg Res 2017; 219: 302–309, https://doi.org/10.1016/j.jss.2017.06.055.
- Kirschbaum A., Rexin P., Pehl A., Bartsch D., Quint K. Laser resection of lung tissue: heat accumulation from adjacent laser application and how to cool it down. Thorac Cardiovasc Surg 2014; 62(4): 363–368, https://doi.org/10.1055/s-0033-1358780.
- Шапкин Ю.Г.
 , Маслякова Г.Н., Капралов С.В., Урядов С.Е., Иванов Р.Ю., Гришаев В.А. Лазерная фотокоагуляция кровоточащей язвы желудка и двенадцатиперстной кишки. Хирургия. Журнал им. Н.И. Пирогова 2006; 5: 23–25.
, Маслякова Г.Н., Капралов С.В., Урядов С.Е., Иванов Р.Ю., Гришаев В.А. Лазерная фотокоагуляция кровоточащей язвы желудка и двенадцатиперстной кишки. Хирургия. Журнал им. Н.И. Пирогова 2006; 5: 23–25. - Hilal Z., Mavrommati G., Foerster C., Rezniczek G.A., Hefler L.A., Tempfer C.B. Spray versus forced coagulation in large loop excision of the transformation zone: a randomized trial. J Low Genit Tract Dis 2016; 20(2): 169–173, https://doi.org/10.1097/lgt.0000000000000177.
- Стриковский А.В., Костров А.В., Загайнов В.Е., Судаков М.А., Одзерихо Д.А. Устройство для термокоагуляции биологических тканей сверхвысокими частотами. Патент РФ 2481080. 2011.
- Загайнов В.Е., Костров А.В., Стриковский А.В., Горохов Г.Г., Васенин С.А., Шкалова Л.В., Рыхтик П.И., Шатохина И.В., Бугрова М.Л., Авдонин С.Н. Использование локального воздействия энергии СВЧ для термического разрушения опухолей печени (в клинике). Современные технологии в медицине 2011; 1: 29–34.
- Загайнов В.Е., Костров А.В., Стриковский А.В., Горохов Г.Г., Янин Д.В., Васенин С.А., Шкалова Л.В., Бугрова М.Л., Снопова Л.Б., Атдуев В.А. Экспериментальное обоснование нового метода термического разрушения опухолей паренхиматозных органов местным воздействием энергии сверхвысоких частот. Медицинский альманах 2011; 18(5): 60–66.
- Загайнов В.Е., Горохов Г.Г., Заречнова Н.В., Рыхтик П.И., Васенин С.А., Судаков М.А., Костров А.В., Стриковский А.В. Результаты хирургического лечения метастатического поражения печени с применением СВЧ-термоаблации при колоректальном раке. Хирургия. Журнал им. Н.И. Пирогова 2011; 8: 61–66.
Публикации в СМИ
Кровотечение — истечение крови из кровеносного сосуда при нарушении целостности или проницаемости его стенки.
Классификация • По этиологии •• Травматические — кровотечения в результате механического повреждения стенки кровеносного сосуда •• Нетравматические — кровотечение в результате патологического изменения сосудов (аррозия, расслоение стенки), например при атеросклерозе, сифилисе, злокачественных новообразованиях, гнойном воспалении, нарушениях свёртываемости крови •• Послеоперационные кровотечения возникают у больных с нарушениями свёртываемости крови (длительная желтуха, эхинококкоз печени, ДВС), при соскальзывании или прорезывании лигатуры, наложенной на сосуд • По месту истечения крови •• Наружные — истечение крови во внешнюю среду через повреждённую кожу и слизистые оболочки •• Внутренние — кровотечение в просвет полого органа или полости тела: ••• в ЖКТ — желудочно-кишечное кровотечение ••• в мочевой пузырь — гематурия ••• в матку — гематометра ••• в трахею и бронхи — лёгочное кровотечение ••• кровоизлияния и гематомы • По времени возникновения •• Первичные — кровотечения, возникающие в момент травмы •• Вторичные — кровотечения, возникающие через некоторое время после травмы и обусловленные нагноением раны, нарушениями свёртываемости крови и т. д. • По источнику кровотечения •• Артериальное кровотечение — кровь ярко-красного цвета, пульсирует, течёт струёй. Кровотечения из крупных артерий (аорты, сонной, бедренной, плечевой) могут быстро привести к остановке сердца •• Венозное кровотечение — кровь тёмно-красного цвета, вытекает медленной струёй. Кровотечения из крупных вен (бедренной, подключичной, яремной) опасны для жизни из-за значительной кровопотери и возможного развития воздушной эмболии •• Капиллярное кровотечение — кровоточит вся поверхность раны, как правило, останавливается самостоятельно. Опасность представляют капиллярные кровотечения у больных с нарушениями свёртываемости крови (например, гемофилия) •• Паренхиматозное кровотечение — возникает при повреждении ткани паренхиматозных органов (печень, почки, селезёнка и др.). Стенки кровеносных сосудов этих органов фиксированы и не спадаются, поэтому кровотечение самостоятельно останавливается редко и приводит к большой кровопотере.
д. • По источнику кровотечения •• Артериальное кровотечение — кровь ярко-красного цвета, пульсирует, течёт струёй. Кровотечения из крупных артерий (аорты, сонной, бедренной, плечевой) могут быстро привести к остановке сердца •• Венозное кровотечение — кровь тёмно-красного цвета, вытекает медленной струёй. Кровотечения из крупных вен (бедренной, подключичной, яремной) опасны для жизни из-за значительной кровопотери и возможного развития воздушной эмболии •• Капиллярное кровотечение — кровоточит вся поверхность раны, как правило, останавливается самостоятельно. Опасность представляют капиллярные кровотечения у больных с нарушениями свёртываемости крови (например, гемофилия) •• Паренхиматозное кровотечение — возникает при повреждении ткани паренхиматозных органов (печень, почки, селезёнка и др.). Стенки кровеносных сосудов этих органов фиксированы и не спадаются, поэтому кровотечение самостоятельно останавливается редко и приводит к большой кровопотере.
Клиническая картина • Общие симптомы — бледность кожи и слизистых оболочек, головокружение, слабость, зевота, жажда, тахикардия, снижение АД. В случае развития геморрагического шока — потеря сознания, холодный пот. При длительных кровотечениях — снижение Hb и Ht (разведение крови) • Наружное кровотечение диагностируют легко за счёт наличия раны. Нередко при травмах имеется одновременное повреждение и артерий и вен, в результате чего нельзя однозначно охарактеризовать кровотечение как артериальное или венозное. Повреждения магистральных сосудов представляют наибольшую опасность • Внутреннее кровотечение •• При кровотечениях в брюшную полость — притупление перкуторного звука в отлогих местах брюшной полости •• При кровотечениях в плевральную полость — притупление перкуторного звука, смещение средостения в противоположную сторону, ослабление дыхания на стороне поражения, при рентгенологическом исследовании — гидроторакс •• При кровотечениях в полость перикарда — расширение границ сердца, ослабление тонов •• Даже небольшая внутренняя кровопотеря в замкнутое пространство может быть опасной для жизни из-за сдавления кровью жизненно важных органов (головной мозг, сердце).
ЛЕЧЕНИЕ
• Временная остановка кровотечения направлена на предупреждение массивной кровопотери и позволяет выиграть время для окончательной остановки кровотечения •• Наложение давящей повязки показано для остановки небольших наружных кровотечений: венозных, капиллярных, из артерий мелкого калибра, кровотечений из ран, расположенных на туловище (например, на ягодичной области), предплечье, голени, волосистой части головы. На рану накладывают стерильную марлевую салфетку, сверху — неразмотанный бинт или подручный материал, а затем накладывают тугую циркулярную повязку •• Пальцевое прижатие артерий на протяжении к кости останавливает кровотечение практически моментально. Недостаток — небольшая длительность (10–15 мин) из-за утомления рук оказывающего первую помощь, однако за это время можно применить другие методы остановки кровотечения, например наложить жгут ••• Общую сонную артерию прижимают к поперечному отростку СVI ••• Подключичную артерию — в надключичной ямке к I ребру ••• Плечевую артерию — к плечевой кости у внутреннего края двуглавой мышцы на внутренней поверхности плеча ••• Бедренную артерию — к лобковой кости на середине расстояния между лобком и верхней передней остью подвздошной кости. Давление производят большими пальцами обеих рук или кулаком ••• Подколенную артерию прижимают к задней поверхности большеберцовой кости в области подколенной ямки •• Наложение жгута показано при кровотечениях из бедренной или плечевой артерий. Венозные кровотечения останавливают тугой повязкой и возвышенным положением конечности. Вместо стандартного кровоостанавливающего жгута могут быть использованы различные подручные средства и матерчатые закрутки ••• Жгут накладывают проксимальнее раны ••• Критерий адекватности наложения жгута — остановка кровотечения. Продолжающееся кровотечение может свидетельствовать о неполном пережатии артерии и кровотечении из одномоментно повреждённых вен ••• Жгут необходимо наложить через подкладку, нельзя накладывать на кожу ••• Максимальный срок — 2 ч, по истечении которых необходимо снять жгут, проводя пальцевое прижатие артерии тотчас выше раны. Через небольшое время жгут наложить вновь, причём проксимальнее предыдущего уровня. При наложении жгута следует зафиксировать время наложения (время записывают прямо на кожу или под жгутом оставляют бумажку с записью времени) •• Максимальное сгибание конечности в суставе с дополнительным сдавлением сосуда за счёт укладки над артерией валика (бинта), приводит к прекращению кровотечения ••• Предплечье максимально сгибают в локтевом суставе и фиксируют с помощью бинта к плечу ••• При кровотечениях из ран верхней части плеча и подключичной области верхнюю конечность заводят за спину со сгибанием в локтевом суставе и фиксируют бинтом или обе руки заводят назад со сгибанием в локтевых суставах и притягивают друг к другу бинтом ••• Нижнюю конечность сгибают в коленном и тазобедренном суставах и фиксируют •• Прижатие сосуда в ране пальцами и наложение зажима на кровоточащий сосуд применяют, в основном, во время хирургических вмешательств.
Через небольшое время жгут наложить вновь, причём проксимальнее предыдущего уровня. При наложении жгута следует зафиксировать время наложения (время записывают прямо на кожу или под жгутом оставляют бумажку с записью времени) •• Максимальное сгибание конечности в суставе с дополнительным сдавлением сосуда за счёт укладки над артерией валика (бинта), приводит к прекращению кровотечения ••• Предплечье максимально сгибают в локтевом суставе и фиксируют с помощью бинта к плечу ••• При кровотечениях из ран верхней части плеча и подключичной области верхнюю конечность заводят за спину со сгибанием в локтевом суставе и фиксируют бинтом или обе руки заводят назад со сгибанием в локтевых суставах и притягивают друг к другу бинтом ••• Нижнюю конечность сгибают в коленном и тазобедренном суставах и фиксируют •• Прижатие сосуда в ране пальцами и наложение зажима на кровоточащий сосуд применяют, в основном, во время хирургических вмешательств.
• Окончательная остановка кровотечения •• Перевязка сосуда в ране или на протяжении •• Прошивание мягких тканей и перевязка их вместе с находящимся в них сосудом •• Электрокоагуляция сосуда •• Наложение сосудистого шва или протезирование сосуда •• Тампонада раны •• Прижатие к ране паренхиматозного органа тампона, смоченного горячим (50–70 °С) стерильным 0,9% р-ром натрия хлорида на 3–5 мин •• Воздействие низкой температурой •• Для паренхиматозных кровотечений — обработка рассеянным лучом лазера, потоком плазмы •• Химический метод — применение сосудосуживающих средств (1–2 мл 0,1% р-ра эпинефрина) или средств, повышающих свёртываемость крови (например, 10 мл 10% р-ра кальция хлорида) •• Биологические методы ••• Тампонада раны мышцей или сальником ••• Применение тромбина, губки с фибрином, гемостатической губки ••• Переливание препаратов и компонентов крови.
• Возвышенное положение конечности и обеспечение покоя.
МКБ-10 • H92.2 Кровотечение из уха • I85.0 Варикозное расширение вен пищевода с кровотечением • K62. 5 Кровотечение из заднего прохода и прямой кишки • P10 Разрыв внутричерепных тканей и кровотечение, вследствие родовой травмы • P26 Лёгочное кровотечение, возникшее в перинатальном периоде • P38 Омфалит новорождённого с небольшим кровотечением или без него • P50.3 Кровотечение у плода другого однояйцевого близнеца • P50.4 Кровотечение у плода в кровеносное русло матери • P51 Кровотечение из пуповины у новорождённого • R04 Кровотечение из дыхательных путей • T79.2 Травматическое вторичное или рецидивирующее кровотечение.
5 Кровотечение из заднего прохода и прямой кишки • P10 Разрыв внутричерепных тканей и кровотечение, вследствие родовой травмы • P26 Лёгочное кровотечение, возникшее в перинатальном периоде • P38 Омфалит новорождённого с небольшим кровотечением или без него • P50.3 Кровотечение у плода другого однояйцевого близнеца • P50.4 Кровотечение у плода в кровеносное русло матери • P51 Кровотечение из пуповины у новорождённого • R04 Кровотечение из дыхательных путей • T79.2 Травматическое вторичное или рецидивирующее кровотечение.
Гемоблок, [email protected] 8(925)7712709
Регистрационный номер:ФСР 2012/13587 по ТУ 9391-002-68087337-2012
Описание:
Хирургическое инвазивное медицинское изделие кратковременного применения. Гемоблок® — жидкое гемостатическое средство в виде полимерного раствора по вязкости близкое к воде. Цвет раствора от бесцветного до желто-коричневого, возможно наличие взвеси, pH нейтральный. Стерильно.
Состав:
Гемоблок® — 1% водный раствор неполной серебряной соли полиакриловой кислоты, с интегрированными наночастицами серебра.
Назначение.
Гемостатическое средство с антисептическими свойствами для местного применения.
Применяется для остановки всех типов капиллярных и паренхиматозных кровотечений, возникающих при хирургических операциях и травмах (в том числе полостных операциях на паренхиматозных органах, кровотечениях из губчатого вещества кости), для обработки ран, ожогов, трофических язв, а так же для гемостаза и визуализации при эндоскопических манипуляциях, челюстно-лицевой и офтальмохирургии.
Используется в различных отраслях хирургии: ангиологии и кардиохирургии, абдоминальной хирургии, проктологии, гнойной хирургии, ортопедии и травматологии, урологии, гинекологии, пластической, эндокринной хирургии, онкологии, офтальмохирургии, нейрохирургии, челюстно-лицевой хирургии и стоматологии, детской хирургии и т.д.:
1. Кровотечения из мышечной, жировой, губчатой костной, соединительной ткани, возникающие в ходе выполнения хирургических операций.
2. Кровотечения из паренхиматозных органов при хирургических операциях (капиллярные кровотечения из паренхимы печени, селезенки, почек, надпочечников, головного мозга, лёгких, щитовидной железы и др.).
3. Кровотечения из эрозивных и язвенных дефектов и злокачественных неоплазий полых органов желудочно-кишечного тракта.
4. Кровотечения из эрозивных и язвенных дефектов и злокачественных неоплазий трахеи и бронхов.
5. Кровотечения после эндоскопических операций (полипэктомии, подслизистой диссекции, мукозэктомии, радиочастотной абляции, папиллосфинктеротомии и литоэкстракции, миотомии и др.)
6. Капиллярные кровотечения из распадающихся опухолей любой локализации.
7. Капиллярные кровотечения любой локализации и этиологии при врожденном или приобретенном дефиците факторов свертывания, в том числе при синдроме диссеминированного внутрисосудистого свертывания.
8. Остановка носовых кровотечений, а также интраоперационных кровотечений в оториноларингологии (после аденотомии, тонзиллотомии и тонзилэктомии).
9. В комбустиологии- обработка ран при термических, химических и лучевых ожогах кожных покровов и слизистых оболочек.
10. В офтальмологии: при операциях на веках, конъюктивальных сводах, склере, роговице.
11. В нейрохирургии для остановки паренхиматозных кровотечений любой этиологии, при гемостазе ложа, удаляемых новообразований головного и спинного мозга, операциях на позвоночнике.
12. Акушерство и гинекология как полостные, так и лапароскопические операции, Кесарево сечение, эпизиотомия, разрывы маточные, влагалища и промежности; внутриматочные кровотечения, послеродовые кровотечения.
В гинекологии: кровотечения из шейки матки, эндометриозе и прочие кровотечения паренхимы малого женского таза.
13. Оказание первой помощи при кровотечениях обусловленных травмами, сопровождающимися нарушением целостности кожных покровов и слизистых оболочек, и ожогами.
14. Для профилактики постоперационных осложнений (для снижения риска развития раневой инфекции и спаечного процесса), для ускорения (до полутора раз) заживления ран и ожогов кожных покровов и слизистых, послеоперационных швов, трофических язв.
Действие.
Действует местно, не проникает в системный кровоток. При взаимодействии с белками плазмы крови (главным образом с альбумином) Гемоблок® формирует полимерный комплекс (полиакриловая матричная структура, связанная с молекулами альбумина). Такая структура упаковывается в несколько микрослоев, создавая прочную полиметакрилатную пленку на поверхности раны. В дальнейшем поверхностная структура Гемоблок®- белок замещается фибрином. При образовании полимерного комплекса наступает гемостаз. Полиметакрилатная пленка не видима невооруженным глазом, биодеградирует естественным путем в течение суток.
Гемоблок® за счет наличия в составе наночастиц серебра, обладает бактерицидным, противовирусным и противогрибковым действием. Бактерицидный эффект проявляется в отношении большинства известных грамположительных и грамотрицательных бактерий, таких как Streptococcus spp., Staphylococcus spp., Moraxella spp., и других, а также грибковой флоры (Candida spp., и др.) и к устойчивым внутрибольничным штаммам бактерий. Препятствует развитию раневой инфекции. Раны заживают первичным натяжением шва без нагноений.
Гемоблок не содержит компонентов животного происхождения, не проявляет раздражающего, прижигающего, вяжущего, токсического, резорбтивного или аллергенного действия, не оказывает побочного действия на ткани. Средство не требует дополнительного оборудования при использовании. Не ухудшает визуализацию в области нанесения. Не всасывается. Не проникает в системный кровоток. Не влияет на функцию гемостаза в общем кровотоке, не приводит к тромбообразованию, повышению СОЭ.
Применение.
Гемоблок® применяют наружно, внутрисосудистое введение средства Гемоблок® запрещено. Препарат стерилен и его используют с соблюдением правил антисептики.
Средство готово к применению. Для однократного применения в зависимости от интенсивности кровотечения и площади кровоточащей поверхности может быть использовано от 5 до 100 и более миллилитров гемоблока. Гемостатический эффект является дозозависимым. Доза гемостатического средства не ограничена и определяется индивидуально в зависимости от площади кровоточащей поверхности и интенсивности кровотечения. Гемостатический эффект достигается в течение 1-2 минут. Визуально оценивать действие Гемоблока следует по уменьшению интенсивности кровотечения вплоть до его остановки.
Доза гемостатического средства не ограничена и определяется индивидуально в зависимости от площади кровоточащей поверхности и интенсивности кровотечения. Гемостатический эффект достигается в течение 1-2 минут. Визуально оценивать действие Гемоблока следует по уменьшению интенсивности кровотечения вплоть до его остановки.
С увеличением количества препарата эффект нарастает.
При обработке раны происходит остановка кровотечения с формированием гладкой эластичной поверхности – удобного поля для проведения дальнейших манипуляций.
При наружных кровотечениях, ранениях, ожогах, а также в качестве средства для оказания первой медицинской помощи: возможно прямое нанесение на пораженный участок кожи или слизистой, либо смачивание тампонов (марлевых носителей) с последующим наложением на кровоточащую поверхность. Поверхность рекомендуется предварительно осушить. При необходимости дополнительно орошают наложенные на кровоточащую поверхность марлевые салфетки раствором Гемоблока непосредственно из флакона, либо из одноразового медицинского шприца. После экспозиции (через 1-2 минуты) салфетки и тампоны осторожно удаляют с раневой поверхности. Оптимальное количество 1% раствора средства Гемоблок® — 30-50 мл для достижения надежного гемостаза, бактерицидного и бактериостатического эффекта. При обширных кровоточащих раневых поверхностях рекомендуется использовать 1% раствора средства Гемоблок® — 100 мл.
В полостной хирургии: после выполнения основного этапа оперативного вмешательства проводится осушение зоны оперативного вмешательства тампонами, перед ушиванием лапаро-, торакотомных ран тампоны удаляют, обильно орошают раневую поверхность раствором Гемоблок®. Обильно смоченные стерильные марлевые салфетки для получения гемостатического эффекта салфетку не отжимают и прикладывают к кровоточащей предварительно осушенной поверхности. Оптимальное количество 1% раствора средства Гемоблок® — 50 мл для достижения надежного гемостаза, бактерицидного и бактериостатического эффекта. С увеличением количества препарата эффект нарастает.
С увеличением количества препарата эффект нарастает.
В травматологии и нейрохирургии:
-после выполнения основного этапа оперативного вмешательства проводится осушение зоны оперативного вмешательства тампонами, перед ушиванием ран тампоны удаляют, обильно орошают раневую поверхность раствором Гемоблок® и затем проводят послойное ушивание операционных ран без удаления избытков препарата Гемоблок®. Также возможно введение препарата Гемоблок® непосредственно в установленные дренажи после ушивания операционных ран.
— обильно смоченные стерильные марлевые салфетки для получения гемостатического эффекта салфетку не отжимают и прикладывают к кровоточащей предварительно осушенной поверхности. Оптимальное количество 1% раствора средства Гемоблок® — 50-100 мл для достижения надежного гемостаза, бактерицидного и бактериостатического эффекта. С увеличением количества препарата эффект нарастает. Гемоблок не является нейротоксичным, не требует смывания.
При лапаро- и торакоскопических операциях, а также для остановки кровотечений из верхних и нижних отделов желудочно-кишечного тракта и бронхиального дерева проводят орошение средством Гемоблок® кровоточащей поверхности через ирригационный канал эндоскопа, до достижения необходимого эффекта. При необходимости возможно заведение обильно смоченной салфетки через порт. Для этого стерильную марлевую салфетку или тампон, обильно смоченные Гемоблоком, вводят через порт с помощью эндоскопических щипцов, накладывают на кровоточащую поверхность. После экспозиции через 1-2 минуты салфетки и тампоны осторожно удаляют. Так же при лапароскопических операциях препарат можно вводить путём прицельной ирригации через катетер.
При эндоскопических манипуляциях возможно использование Гемоблока при кровотечениях из верхнего отдела пищеварительного тракта, язвы двенадцатиперстной кишки, диффузных кровотечений, а также кровотечениях толстой и тонкой кишки. В этом случае возможно орошение препаратом Гемоблок раневой кровоточащей поверхности (в случае желудочных кровотечений до 200 мл) через катетер или спрей-катетер, введенный в инструментальный канал эндоскопа.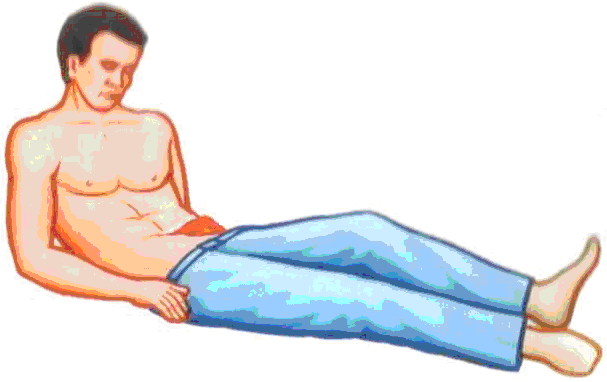 При необходимости можно наносить препарат непосредственно через инструментальный канал эндоскопа. Для инфильтрационного гемостаза (полипоэктомия, язвы ДПК и пр.) применяется подслизистое введение эндоскопической инъекционной иглой в подслизистый слой вокруг кровоточащего дефекта 1-5 мл Гемоблока.
При необходимости можно наносить препарат непосредственно через инструментальный канал эндоскопа. Для инфильтрационного гемостаза (полипоэктомия, язвы ДПК и пр.) применяется подслизистое введение эндоскопической инъекционной иглой в подслизистый слой вокруг кровоточащего дефекта 1-5 мл Гемоблока.
В акушерской практике и гинекологии возможна обработка раневых поверхностей, как на поверхности матки, так и внутриматочно. Используется как орошение, так и тампонирование источника кровотечения.
В оториноларингологии:
При носовых кровотечениях — передняя тампонада полости носа марлевыми тампонами пропитанными 1% раствором средства Гемоблок®.
При интраоперацинных кровотечениях — прижатие марлевыми тампонами, пропитанными 1% раствором средства Гемоблок®, раневых поверхностей, при необходимости дополнительно однократное закапывание 1% раствора средства Гемоблок® в носовые ходы по 5 капель.
Гемоблок® обеспечивает устойчивый местный гемостаз за 1-2 минуты, повторные кровотечения отсутствуют. Эффективен при нарушении свёртывающей системы крови (гемофилия, коагулопатия).
Гемоблок® может применяться без ограничений у пациентов с нарушениями функции почек и/или печени.
Гемоблок не инфицируется, не является нейротоксичным, не требует смывания.
Ограничения к применению:
Артериальные кровотечения, кровотечения из магистральных венозных сосудов.
Индивидуальная непереносимость.
Внутрисосудистое введение Гемоблок® запрещено.
Применение при беременности и в период грудного вскармливания
Клинические данные о применении средства Гемоблок® во время беременности и в период грудного вскармливания ограничены. Учитывая, что средство Гемоблок® не проникает в системный кровоток, не оказывает негативного влияния плод, его можно применять в период беременности и период грудного вскармливания.
Применение в педиатрии
Гемоблок® не имеет возрастных ограничений при применении у детей.
Передозировка
Случаев передозировки при применении средства Гемоблок® не установлено.
Форма выпуска
Средство гемостатическое «Гемоблок» в отдельных упаковках:
— раствор во флаконе 100 мл 1% раствора. Стерильно.
Средство гемостатическое «Гемоблок» в отдельных упаковках:
— раствор во флаконе 50 мл 1% раствора. Стерильно.
Средство гемостатическое «Гемоблок» в отдельных упаковках:
— раствор во флаконе 30 мл 1% раствора. Стерильно.
Средство гемостатическое «Гемоблок» в отдельных упаковках:
— раствор во флаконе 20 мл 1% раствора. Стерильно.
Средство гемостатическое «Гемоблок» в отдельных упаковках:
— раствор во флаконе 15 мл 1% раствора. Стерильно.
Срок годности
3 года от даты выпуска.
Не использовать по истечении срока годности, указанного на упаковке.
Условия хранения
Хранить в сухом прохладном месте при температуре от +5°С до +25°С, беречь от света.
Не подвергать заморозке.
Хранить в недоступном для детей месте.
Вскрытый флакон использовать сразу, не хранить.
Остановка паренхиматозного кровотечения из печени с помощью гемостатического средства на основе неорганических солей Текст научной статьи по специальности «Клиническая медицина»
doi: 10.18484/2305-0047.2016.4.361 И.С. ЖАВОРОНОК 1, Г.Г. КОНДРАТЕНКО 1, В.Н. ГАПАНОВИЧ 2, А.В. ЕСЕПКИН 3, А.Д. КАРМАН 1
ОСТАНОВКА ПАРЕНХИМАТОЗНОГО КРОВОТЕЧЕНИЯ ИЗ ПЕЧЕНИ С ПОМОЩЬЮ ГЕМОСТАТИЧЕСКОГО СРЕДСТВА НА ОСНОВЕ НЕОРГАНИЧЕСКИХ СОЛЕЙ
УО «Белорусский государственный медицинский университет» УП «ЛОТИОС» 2, УЗ «10-я городская клиническая больница г. Минска» 3, Республика Беларусь
Цель. Изучить возможность применения нового местного гемостатического средства «Гамастат» в комбинации с избирательной электрокоагуляцией отдельных кровоточащих сосудов ложа желчного пузыря во время холецистэктомии.
Материал и методы. Проведено сравнительное изучение результатов лечения 77 пациентов, которые были разделены на две группы. В основной группе (n=45) пациентов во время операции для остановки кровотечения из ложа желчного пузыря применен «Гамастат» и избирательная коагуляция только отдельных кровоточащих сосудов. В контрольной группе (n=32) во время холецистэктомии использовали общепринятую методику сплошной электрокоагуляции ложа желчного пузыря. Регистрировали факт остановки кровотечения после обработки раневой поверхности печени местными гемостатиками или электрокоагуляцией, исследовали динамику изменений цитологических и биохимических показателей крови, параметров плазменного гемостаза до операции и на 3 сутки после операции.
Проведено сравнительное изучение результатов лечения 77 пациентов, которые были разделены на две группы. В основной группе (n=45) пациентов во время операции для остановки кровотечения из ложа желчного пузыря применен «Гамастат» и избирательная коагуляция только отдельных кровоточащих сосудов. В контрольной группе (n=32) во время холецистэктомии использовали общепринятую методику сплошной электрокоагуляции ложа желчного пузыря. Регистрировали факт остановки кровотечения после обработки раневой поверхности печени местными гемостатиками или электрокоагуляцией, исследовали динамику изменений цитологических и биохимических показателей крови, параметров плазменного гемостаза до операции и на 3 сутки после операции.
Результаты. Окончательный гемостаз при использовании «Гамастата» и избирательной коагуляции отдельных кровоточащих сосудов достигается в большем числе случаев (88,9%), чем при применении сплошной электрокоагуляции ложа желчного пузыря (в 75,0% случаев). Пациентам, у которых гемостаз вышеуказанными методами не был достигнут, кровотечение из ложа желчного пузыря останавливали с помощью более обширной электрокоагуляции ложа желчного пузыря и пластины «Тахокомба». Применение «Гамастата» в сочетании с избирательной электрокоагуляцией кровоточащих сосудов в области ложа желчного пузыря обеспечивает меньшее коагуляционное повреждение печеночной паренхимы, чем при использовании сплошной электрокоагуляции, о чем свидетельствует меньшая степень проявлений цитолиза гепатоцитов.
Заключение. В основной группе установлена выраженная местная гемостатическая активность «Га-мастата» и достоверно меньшие проявления электрокоагуляционного повреждения печени, сопровождающиеся менее выраженным ростом показателей цитолиза гепатоцитов АлАт и АсАт по сравнению с таковыми у пациентов контрольной группы. Негативных эффектов применения «Гамастата» не наблюдалось.
Ключевые слова: местные гемостатические средства, гамастат, избирательная электрокоагуляция, остановка кровотечения, кровотечение из печени, холецистэктомия, гемостаз
Objectives. To study an application opportunity of a new local haemostatic agent «Gamastat» in the combination with a selective electrocoagulation of particular bleeding vessels of the gall bladder bed during cholecystectomy.
To study an application opportunity of a new local haemostatic agent «Gamastat» in the combination with a selective electrocoagulation of particular bleeding vessels of the gall bladder bed during cholecystectomy.
Methods. The comparative study of treatment results of patients (n=77), divided into two groups has been conducted. In the main group (n=45) of patients to stop bleeding from the gallbladder bed a haemostatic agent «Gamastat» and a selective coagulation only of particular bleeding vessels have been applied during surgery versus a standard technique of a continuous electrocoagulation of the gall bladder bed in cholecystectomy, used in the control group (n=32). A bleeding arrest after treating of the liver wound surface with local haemostatic agents or electrocoagulation was registered; dynamics of changes of the blood cytological and biochemical indicators and plasma haemostasis parameters were studied preoperatively and on the 3rd postoperative day.
Results. The complete haemostasis at «Gamastat» application and a selective coagulation of particular bleeding vessels have been achieved in a greater number of cases (88,9%), than at the application of a continuous electrocoagulation of the gall bladder bed (75% of cases).
If haemostasis by the abovementioned methods was not achieved, gall bladder bed bleeding was stopped by the use of more extensive electrocoagulation of the gall bladder bed and the plate «Tachoсomb». The combination of «Gamastat» application and a selective electrocoagulation of bleeding vessels in the area of the gall bladder bed provides less hepatic parenchyma coagulation injury as evidenced by a reduced manifestation of hepatocyte cytolysis versus a continuous electrocoagulation.
Conclusion. In the main group the expressed local haemostatic activity of «Gamastat» has been established as well as reliably insignificant manifestation of electrocoagulative injury of the liver accompanied by less marked growth of indicators of cytolisis AlAt and AsAt in comparison with those in patients of the control group. Negative
Negative
effects of «Gamastat» application were not observed.
Keywords: local haemostatic agent, Gamastat, selective electrocoagulation, bleeding arrest, hepatic bleeding, cholecystectomy, haemostasis
Novosti Khirurgii. 2016 Jul-Aug; Vol 24 (4): 361-367
The Arrest of Bleeding from the Liver Parenchyma by Using an Inorganic Hemostatic Agents I.S. Zhavoronok, G.G. Kondratenko, V.N. Gapanovich, A.V. Esepkin, A.D. Karman
Введение
Одной из важнейших задач современной хирургии является обеспечение эффективного гемостаза. Установлено, что до 85% времени в процессе оперативных вмешательств на печени затрачивается на борьбу с кровотечениями [1]. Распространенным физическим методом гемостаза является электрокоагуляция, которая хорошо зарекомендовала себя при небольших кровотечениях. Основные достоинства методики: простота применения и доступность большинству хирургов [2]. Однако исследования показали, что после электрокоагуляции образуется зона коагуляционного некроза, величину которого очень трудно контролировать, что в дальнейшем служит субстратом для развития инфекционных осложнений, вторичных кровотечений, желчных и мочевых свищей [2, 3, 4, 5, 6]. Кроме того, в случае использования монополярной коагуляции возможно повреждение электротоком тканей и органов, отдаленных от места оперативного вмешательства [6].
Значительные возможности для решения данной проблемы открываются при использовании гемостатических средств местного действия [7, 8, 9]. Белорусскими учеными разработано новое гемостатическое средство местного действия на основе неорганических солей — «Гамастат». Основными действующими веществами являются алюминия хлорид (в виде алюминия хлорида 6-водного — 1 г) и железа (III) хлорид (в виде железа (III) хлорида 6-во-дного — 0,5 г) в 10 мл, а также поливиниловый спирт в количестве 0,8 г, который повышает адгезивные свойства данного средства. Положительные экспериментальные данные и результаты клинических испытаний послужили основанием для дальнейшего изучения «Гама-стата» в клинических условиях [10].
Положительные экспериментальные данные и результаты клинических испытаний послужили основанием для дальнейшего изучения «Гама-стата» в клинических условиях [10].
Цель исследования — изучить возможность применения нового местного гемостатического средства «Гамастат» в комбинации с избирательной электрокоагуляцией отдельных кровоточащих сосудов ложа желчного пузыря во время холецистэктомии.
Материал и методы
У 45 пациентов (основная группа) для
остановки кровотечения из ложа желчного пузыря были использованы новое гемостатическое средство «Гамастат» и избирательная точечная электрокоагуляция. Основная группа состояла из 26 женщин (57,8%) и 19 мужчин (42,2%), средний возраст составил 68,0 [58,0; 77,0] лет. В 40 случаях (88,9%) была выполнена только открытая холецистэктомия, в 5 случаях (11,1%) — холецистэктомия и наложение холедоходуодено-анастомоза. Пациенты основной группу разделены на две подгруппы: подгруппа «эффективный гемостаз» составили 40 пациентов, у которых при применении «Гамастата» и избирательной электрокоагуляции (ИЭлК) сосудов был достигнут окончательный гемостаз, и подгруппу «неэффективный гемостаз» (п=5) составили пациенты, у которых остановка кровотечения была неполной, что потребовало дополнительных методов гемостаза, таких как использование более обширной электрокоагуляции ложа желчного пузыря и применения пластины «Тахокомба».
У 32 пациентов (контрольная группа) для остановки кровотечения применяли сплошную электрокоагуляцию (СЭлК) ложа желчного пузыря. В контрольной группе было 18 женщин (56,35%) и 14 мужчин (43,75%), средний возраст 66,5 [55,0; 75,0]) года. В данной группе 29 пациентам (90,6%) выполнялась холецистэктомия, а 3 пациентам (9,4%) — холецистэктомия, дополненная наложением холедоходуоденоана-стомоза. Эти пациенты также были разделены на две подгруппы: подгруппу «эффективный гемостаз» (п=24), с применением только сплошной электрокоагуляции, и подгруппу «неэффективный гемостаз» (п=8), в которой для достижения окончательного гемостаза после недостаточно эффективной электрокоагуляции применен «Тахокомб». Группы были сопоставимы по полу, возрасту и виду выполненных оперативных вмешательств (р>0,05).
Эти пациенты также были разделены на две подгруппы: подгруппу «эффективный гемостаз» (п=24), с применением только сплошной электрокоагуляции, и подгруппу «неэффективный гемостаз» (п=8), в которой для достижения окончательного гемостаза после недостаточно эффективной электрокоагуляции применен «Тахокомб». Группы были сопоставимы по полу, возрасту и виду выполненных оперативных вмешательств (р>0,05).
В основной группе методика гемостаза заключалась в следующем: во время холеци-стэктомии для остановки паренхиматозного кровотечения вначале к ложу желчного пузыря подводилась и прижималась печеночным зеркалом салфетка, смоченная раствором «Гамастата», после чего применяли избирательную электрокоагуляцию только отдельных кровоточащих сосудов. Регистрировали факт остановки кровотечения после применения
«Гамастата» через 1 минуту с последующим контролем полноты гемостаза в течение 10 минут. В обеих группах исследовали динамику изменений цитологических (количество эритроцитов, лейкоцитов и тромбоцитов, содержание гемоглобина, гематокрит, ширину распределения эритроцитов и средний объем эритроцита, среднее содержание гемоглобина в отдельном эритроците) и биохимических (концентрацию общего белка, билирубина, мочевины, креатинина и глюкозы, содержание АлАт, АсАт, активность амилазы) показателей крови, параметров плазменного гемостаза (АЧТВ, тромбиновое время, протромбиновое время, активность протромбинового комплекса по Квику, МНО, концентрацию фибриногена). Забор крови осуществляли до операции и на 3 сутки после операции. Статистическая обработка осуществлялась посредством статистических пакетов 81аЙ8Йеа 6.0 (серийный номер 31415926535897), применялись критерии Ман-на-Уитни, Вилкоксона, Пирсона. Значения показателей приводятся в виде медианы (нижний квартиль — верхний квартиль) (Ме (25%-75%)). За критический уровень статистической значимости принимали вероятность безошибочного прогноза 95% (р<0,05).
Результаты
В области ложа желчного пузыря после применения «Гамастата» образовывалась тонкая пленка темно-коричневого цвета, диффузное кровотечение из раневой поверхности прекращалось. Отдельные кровоточащие сосуды подвергались избирательной точечной электрокоагуляции, благодаря чему обеспечивался полный и стойкий гемостаз. Необходимость в дополнительных гемостатических мероприятиях в этой группе потребовалась в 5 случаях (11,1%). После применения сплошной электрокоагуляции ложа желчного пузыря дополнительный гемостаз потребовался в 8 случаях (25%). Таким образом, окончательный гемостаз при использовании «Гамастата» и избирательной коагуляции только отдельных кровоточащих сосудов достигнут в 88,9% случаев, а при применении сплошной электрокоагуляции ложа желчного пузыря — в 75,0% случаев (х2 Пирсона с учетом поправки Йетса, р>0,05).
Динамика изменения биохимических показателей плазмы крови у пациентов после холецистэктомии в зависимости от метода гемостаза приведена в таблице 1.
При изучении биохимических показателей плазмы крови на 3 сутки после операции по сравнению с исходными выявлено снижение
концентрации общего белка на 6,7% в основной группе с эффективным гемостазом (Wilcoxon matched pairs test, р<0,05) и на 16,2% (Wilcoxon matched pairs test, р<0,05) в основной группе с неэффективным гемостазом. В контрольной группе с эффективным гемостазом этот показатель снизился на 7,4% (Wilcoxon matched pairs test, р<0,05), а с неэффективным гемостазом — на 17,5% (Wilcoxon matched pairs test, р>0,05). Последнее указывает на некоторое снижение белковообразовательной функции печени и преобладание катаболических процессов после оперативного вмешательства. Снижение концентрации общего билирубина на 40,3% после эффективного гемостаза в результате использования «Гамастата» и точечной электрокоагуляции (Wilcoxon matched pairs test, р<0,005) было более выраженным, чем в контрольной группе с эффективным гемостазом после применения сплошной коагуляции (20,9%) (Wilcoxon matched pairs test, р<0,05), что свидетельствует о скорейшей нормализации пигментного обмена у пациентов основной группы. Содержание АсАт и АлАт в плазме крови всех пациентов в послеоперационном периоде имело тенденцию к повышению. Однако в подгруппах с применением сплошной электрокоагуляции оно было значительно более выраженным. Так, в основной группе на 3 сутки после эффективного гемостаза в результате применения «Гамастата» и точечной электрокоагуляции показатель АлАт возрос на 4,5% (Wilcoxon matched pairs test, р<0,05), АсАТ — на 15,5% (Wilcoxon matched pairs test, р<0,05), а у пациентов контрольной группы с эффективным гемостазом после сплошной коагуляции поверхности АлАт увеличился на 58,3% (Wilcoxon matched pairs test, р<0,05), АсАт — на 51,9% (Wilcoxon matched pairs test, р<0,05). Приведенные данные указывают на минимизацию травмирования печеночной паренхимы после применения «Гамастата» и точечной коагуляции для остановки кровотечения из ложа желчного пузыря по сравнению с использованием сплошной монополярной электрокоагуляции, о чем свидетельствует меньшая степень цитолиза гепатоцитов. Достоверно более высокая активность амилазы на 3 сутки после операции наблюдалась только в контрольной группе с неэффективным гемостазом (Mann-Whitney U test, р<0,05), что может быть связано с настойчивой попыткой достигнуть гемостаза электрокоагуляцией и, вследствие этого, большим отрицательным влиянием электротока на ткани, включая отдаленные от места коагуляции органы, в частности поджелудочную железу. Изменения остальных показателей были статистически не достоверны.
Содержание АсАт и АлАт в плазме крови всех пациентов в послеоперационном периоде имело тенденцию к повышению. Однако в подгруппах с применением сплошной электрокоагуляции оно было значительно более выраженным. Так, в основной группе на 3 сутки после эффективного гемостаза в результате применения «Гамастата» и точечной электрокоагуляции показатель АлАт возрос на 4,5% (Wilcoxon matched pairs test, р<0,05), АсАТ — на 15,5% (Wilcoxon matched pairs test, р<0,05), а у пациентов контрольной группы с эффективным гемостазом после сплошной коагуляции поверхности АлАт увеличился на 58,3% (Wilcoxon matched pairs test, р<0,05), АсАт — на 51,9% (Wilcoxon matched pairs test, р<0,05). Приведенные данные указывают на минимизацию травмирования печеночной паренхимы после применения «Гамастата» и точечной коагуляции для остановки кровотечения из ложа желчного пузыря по сравнению с использованием сплошной монополярной электрокоагуляции, о чем свидетельствует меньшая степень цитолиза гепатоцитов. Достоверно более высокая активность амилазы на 3 сутки после операции наблюдалась только в контрольной группе с неэффективным гемостазом (Mann-Whitney U test, р<0,05), что может быть связано с настойчивой попыткой достигнуть гемостаза электрокоагуляцией и, вследствие этого, большим отрицательным влиянием электротока на ткани, включая отдаленные от места коагуляции органы, в частности поджелудочную железу. Изменения остальных показателей были статистически не достоверны.
Динамика изменения биохимических показателей в плазме крови пациентов
Таблица 1
Динамика изменения биохимических показателей в плазме крови пациентов
Исследуемые показатели
Основная группа Эффективный гемостаз Неэффективный (Гамастат + ИЭлК) гемостаз (Гамастат + Ме [Р25;Р75] СЭлК + Тахокомб) _Ме [Р25;Р75]
Контрольная группа
Эффективный гемостаз (СЭлК) Ме [Р25;Р75]
Неэффективный гемостаз (СЭлК + Тахокомб) Ме [Р25;Р75]
Общий белок, г/л
Перед операцией (n=40) 67,5 [62,9; 74,8]
3 сутки (n=39)
63,0 [60,0; 70,0]
Перед операцией (n=5) 68,1 [67,9; 73,5]
3 сутки (n=5)
57,1 [55,3;65,1]
Перед операцией (n=24) 73,0 [70,3; 77,3]
3 сутки (n=24)
67,6 [60,8; 70,6]
Перед операцией (n=8) 71,4 [60,7; 80,6]
3 сутки (n=7)
58,9 [56,3; 71,4]
Билирубин общий, ммоль/л АСТ, U/l
АЛТ, U/l
Мочевина, ммоль/л
Креатинин, мкмоль/л
Глюкоза, ммоль/л
Амилаза, Ед/л
15,9 [9,1; 31,0]
34,3 [24,7; 59,4]
35,3 [22,4; 68,0]
6,0 [4,6; 7,7]
[78,2; 103,9]
6,2 [5,6; 10,0]
31,6 [20,9; 57,4]
9. 5 [6,7; 18,2]
5 [6,7; 18,2]
39,6 [27,0; 58,6]
36,9 [29,0; 62,1]
5,9 [4,8; 7,7]
81,4
[70,0;
107,5]
6.6 [5,5; 8,8]
38,3 [27,8; 60,9]
16,8 [15,3; 51,7]
41,4 [22,2; 45,0]
25,4 [24,10; 26,5]
10,0 [5,70; 11,5]
100,9
[98,90;
121,9]
7,5 [7,07; 8,2]
44,0 [16,00; 46,1]
11,1 [7,7; 16,7]
65,8 [31,5; 73,7]
84,1
[23,7;
107,2]
5,8 [5,6; 10,2]
77,5 [75,0; 97,2]
6,2 [5,8; 8,4]
32,0 [28,2;4 2,8]
13,9 [9,6; 17,95]
31,2 [25,0; 53,6]
32.6 [21,9; 53,3]
5,9 [3,9; 7,7]
94,2 [76,3; 100,0] 6,6 [5,5; 9,1]
39. 7 [23,8; 50,1]
7 [23,8; 50,1]
11,0 [6,9; 14,0] 47,4 [28,2; 69,9] 51,6 [24,0; 102,0] 5,4 [4,8; 8,2] 86,0 [66,1; 100,2]
6,9 [5,5; 8,4] 32,9 [19,0; 43,0]
14,2 [12,2; 29,8]
30,6 [26,0; 41,0]
19,6 [19,1; 28,8]
5.1 [3,9; 6,3]
87,9 [61,9; 102,0]
6.2 [5,3; 7,2]
49,2 [41,0; 67,1]
8,6 [6,3; 20,2] 43,0 [21,8; 63,6] 35,7 [14,2; 53,2] 6,5 [4,8; 9,2] 77,3 [66,9; 85,8] 6,8 [5,3; 7,9] 57,6 [37,0; 117,7]
Динамика изменения цитологических показателей крови пациентов по сравнению с исходными данными представлена в таблице 2.
При исследовании динамики цитологических показателей крови было установлено, что по сравнению с исходными на 3 сутки после операции наблюдалось достоверное снижение количества эритроцитов: в основной группе c эффективным гемостазом на 6,7% (Wilcoxon matched pairs test, р<0,005), в контрольной группе c эффективным гемостазом на 8,7% (Wilcoxon matched pairs test, р<0,005), в основной группе c неэффективным гемостазом на 22,3% (Wilcoxon matched pairs test, р<0,05), в контрольной группе c неэффективным гемостазом на 10,6% (Wilcoxon matched pairs test, р<0,05). Содержание гемоглобина в основной группе c эффективным гемостазом уменьшилось на 8,0% (Wilcoxon matched pairs test, р<0,005), в контрольной группе c эффективным гемостазом — на 8,9% (Wilcoxon matched pairs test, р<0,005), в основной группе c неэффективным гемостазом — на 18,5% (Wilcoxon matched pairs test, р<0,05) и в контрольной
группе c неэффективным гемостазом — на 12,3% (Wilcoxon matched pairs test, р<0,05).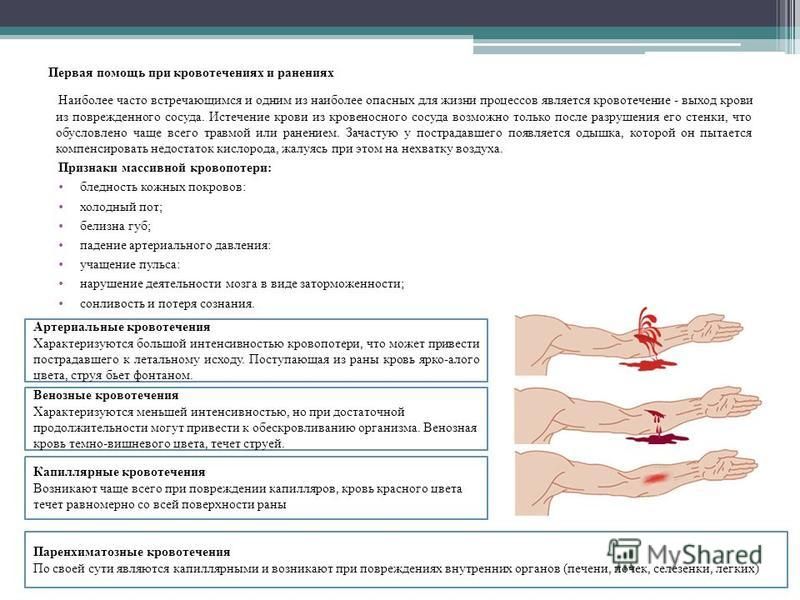 Гематокрит снизился на 5% (Wilcoxon matched pairs test, р<0,005) в основной группе c эффективным гемостазом и на 11,9% в контрольной группе c эффективным гемостазом (Wilcoxon matched pairs test, р<0,005). В основной группе c неэффективным гемостазом этот показатель уменьшился на 23,1% (Wilcoxon matched pairs test, р<0,05), а в контрольной группе c неэффективным гемостазом — на 7,1% (Wilcoxon matched pairs test, р<0,05). Ширина распределения эритроцитов (RDW) увеличилась в основной группе с эффективным гемостазом на 14,4% (Wilcoxon matched pairs test, р<0,05), в контрольной группе с эффективным гемостазом — на 20,1% (Wilcoxon matched pairs test, р<0,05). Зарегистрировано достоверное повышение количества тромбоцитов на 3 сутки послеоперационного периода по сравнению с исходным: в основной группе с эффективным гемостазом на 30,7% (Wilcoxon matched pairs test, р<0,005), а в контрольной группе с эффективным гемостазом на 26,8% (Wilcoxon matched
Гематокрит снизился на 5% (Wilcoxon matched pairs test, р<0,005) в основной группе c эффективным гемостазом и на 11,9% в контрольной группе c эффективным гемостазом (Wilcoxon matched pairs test, р<0,005). В основной группе c неэффективным гемостазом этот показатель уменьшился на 23,1% (Wilcoxon matched pairs test, р<0,05), а в контрольной группе c неэффективным гемостазом — на 7,1% (Wilcoxon matched pairs test, р<0,05). Ширина распределения эритроцитов (RDW) увеличилась в основной группе с эффективным гемостазом на 14,4% (Wilcoxon matched pairs test, р<0,05), в контрольной группе с эффективным гемостазом — на 20,1% (Wilcoxon matched pairs test, р<0,05). Зарегистрировано достоверное повышение количества тромбоцитов на 3 сутки послеоперационного периода по сравнению с исходным: в основной группе с эффективным гемостазом на 30,7% (Wilcoxon matched pairs test, р<0,005), а в контрольной группе с эффективным гемостазом на 26,8% (Wilcoxon matched
Динамика цитологических показателей крови пациентов
Таблица 2
Динамика цитологических показателей крови пациентов
Исследуемые показатели
Основная группа Эффективный Неэффективный
гемостаз (Гамастат + гемостаз (Гамастат + ИЭлК) СЭлК +Тахокомб)
Ме [Р25;Р75] Ме [Р25;Р75]
Контрольная группа Эффективный Неэффективный
гемостаз (СЭлК) гемостаз (СЭлК + Ме [Р25;Р75] Тахокомб)
Ме [Р25;Р75]
Перед 3 сутки Перед 3 сутки Перед 3 сутки Перед 3 сутки
операцией (n=40) операцией (n=5) операцией (n=24) операцией (n=8)
(n=40) (n=5) (n=24) (n=8)
Эритроциты, 4,5 4,2 3,9 3,03 4,6 4,2 4,7 4,2
1012/л [4,2; 4,9] [3,9; 4,6] [3,8; 4,6] [3,0; 3,8] [4,2; 5,0] [3,6; 4,5] [4,1; 5,1] [3,8; 4,4]
Гемоглобин, 137,0 126,0 135,0 110,0 140,0 127,5 142,0 124,5
г/л [127,0; [119,0; [131; 138] [105,0; [134,0; [116,5; [131,0; [118,0;
144,0] 132,5] 120,0] 149,0] 139,5] 150,0] 135,0]
Гематокрит, 0,4 0,38 0,39 0,3 0,42 0,37 0,42 0,39
% [0,37; 0,44] [0,35; [0,37; 0,41] [0,3; 0,3] [0,37; 0,45] [0,34; [0,41; 0,45] [0,34;
0,4] 0,42] 0,4]
MCV, фл 88,0 88,7 97,6 99,0 89,2 89,8 89,8 88,4
[84,8; 94,9] [86,0; [93,8; 100,3] [92,3; [83,4; 93,4] [84,4; [83,2; 95,4] [84,3;
93,9] 100,0] 93,4] 95,2]
МСН, пг 30,4 29,9 34;5 34,8 30,2 30,6 29,8 29,9
[28,9; 31,3] [29,1; [32,1; 35,4] [32,0; [29,2; 32,9] [29,7; [27,8; 31,7] [27,6;
31,5] 35,0] 32,0] 32,5]
Лейкоциты, 11,8 9,4 14,4 12,7 10,7 8,6 14,0 9,8
109/л [9,1; 16,9] [7,3; [13,3; 16,3] [12,5; [8,2; 13,0] [6,4; 10,4] [9,9; 19,6] [7,4;
11,8] 18,2] 10,6]
RDW, % 12,5 14,3 12,4 9,4 11,9 14,3 12,7 14,5
[11,4; 14,5] [12,6; [7,7; 14,3] [8,0; [11,0; 12,8] [12,7; [12,3; 14,8] [11,5;
15,2] 13,9] 15,4] 16,5]
Тромбоциты, 210,0 274,5 216,0 241,0 233,0 295,5 229,5 286,0
109/л [172,0; [220,5; [177,0; [224,0; [170,0; [252,5; [186,0; [236,5;
272,0] 383,5] 334,0] 286,0] 291,0] 363,5] 271,5] 304,5]
pairs test, р<0,005), а также достоверное снижение количества лейкоцитов (Wilcoxon matched pairs test, р<0,05). Вышеуказанные изменения являлись ответом организма пациентов на оперативное вмешательство, однако в основной группе они были менее выраженными. Сравнительный анализ полученных данных также свидетельствует об отсутствии отрицательного системного влияния разработанного гемостатического средства на цитологические показатели крови.
Вышеуказанные изменения являлись ответом организма пациентов на оперативное вмешательство, однако в основной группе они были менее выраженными. Сравнительный анализ полученных данных также свидетельствует об отсутствии отрицательного системного влияния разработанного гемостатического средства на цитологические показатели крови.
Результаты исследования показателей плазменного гемостаза отражены в таблице 3.
Как следует из таблицы 3, во всех группах на 3 сутки после операции по сравнению с исходным отмечалось повышение концентрации фибриногена: в основной группе с эффективным гемостазом на 54,8% (Wilcoxon matched pairs test, р<0,05), в контрольной группе с эффективным гемостазом на 50% (Wilcoxon matched pairs test, р<0,05), в основной группе с неэффективным гемостазом на 11,9% (Wilcoxon matched pairs test, р>0,05) и в контрольной группе с неэффективным гемостазом на 84,8% (Wilcoxon matched pairs test, р>0,05).
Активированное частичное тромбопластиновое время (АЧТВ) на 3 сутки послеоперационного периода в основной группе с эффективным гемостазом на 12,5% было меньше, чем в контрольной группе с эффективным гемостазом (Mann-Whitney U-test, p<0,05). Данные изменения в показателях плазменного гемостаза можно рассматривать как физиологическую реакцию организма на перенесенное оперативное вмешательство. Изменения остальных показателей плазменного гемостаза были статистически не достоверны.
Обсуждение
Проведенное исследование выявило значительно более выраженное повышение содержания АсАт и АлАт в плазме крови пациентов после использования сплошной электрокоагуляции ложа желчного пузыря по сравнению с таковыми у пациентов, у которых для остановки кровотечения были применены «Гамастат» и точечная электрокоагуляция. Полученные данные свидетельствуют о меньшей степени цитолиза гепатоцитов у пациентов основной группы, что
Полученные данные свидетельствуют о меньшей степени цитолиза гепатоцитов у пациентов основной группы, что
Таблица 3
Динамика показателей плазменного гемостаза пациентов после холецистэктомии
Динамика показателей плазменного гемостаза пациентов
Исследуемые показатели
Основная группа
Контрольная группа
Эффективный гемостаз (Гамастат + ИЭлК) Ме [Р25;Р75]
Неэффективный гемостаз (Гамастат + СЭлК +Тахокомб) Ме [Р25;Р75]
Эффективный гемостаз (СЭлК) Ме [Р25;Р75]
Неэффективный гемостаз (СЭлК + Тахокомб) Ме [Р25;Р75]
Перед 3 сутки Перед 3 сутки Перед 3 сутки Перед 3 сутки
операцией (п=39) операцией (п=5) операцией (п=24) операцией (п=7)
(п=40) (п=5) (п=24) (п=8)
АЧТВ, с 29,1 29,3 30,5 32,0 30,2 33,5 28,6 24,7
[26,7; 31,0] [26,0; [27,5; 31,0] [24,0; 46,5] [27,5; 37,0] [27,5; [24,6; 29,8] [22,4;
32,1] 44,4] 24,9]
ПВ, с 16,9 17,0 16,5 19,6 17,1 16,2 16,7 17,3
[15,5; 19,5] [15,1; [15,6; 21,0] [13,3; 21,6] [14,9; 19,3] [14,5; [15,1; 19,6] [14,0;
19,2] 17,9] 20,5]
МНО 1,1 1,2 1,1 1,3 1,2 1,2 1,1 1,2
[1,1; 1,3] [1,0; [1,0; 1,0] [0,9; 1,6] [1,0; 1,4] [1,0; 1,3] [1,0; 1,4] [1,0;
1,3] 1,4]
Активность 80,2 75,1 90,9 68,0 72,3 82,3 81,0 69,2
ПК по Квику [61,3; 91,0] [62,8; [51,7; 100,0] [53,2; [58,2; 97,7] [65,0; [63,6; 92,0] [45,6;
98,7] 118,1] 96,8] 99,3]
Фибриноген, 4,2 6,5 5,9 6,6 4,0 6,0 4,6 8,5
г/л [3,2; 8,2] [4,2; [5,1; 8,0] [6,3; 7,4] [3,1; 5,8] [3,5; 9,6] [3,0; 6,3] [5,6;
8,3] 10,0]
ТВ, с 13,4 14. 0 12,5 15,9 13,6 13,8 13,0 12,8
0 12,5 15,9 13,6 13,8 13,0 12,8
[12,5; 14,4] [12,5; [12,3; 13,0] [14,3; 16,0] [12,7; 15,3] [12,1; [12,0; 14,4] [12,2;
15,2] 15,6] 13,2]
обусловлено минимизацией травмирования печеночной паренхимы вследствие ограниченного использования электрокоагуляции. Эти сведения согласуются с данными других авторов о том, что монополярная коагуляция значительно повреждает печеночную паренхиму, вызывая интенсивное воспаление, которое существенно расширяет первичную зону повреждения [5]. Достоверные данные о более высокой активности амилазы в контрольной группе с неэффективным гемостазом на 3 сутки после операции также связаны с повреждением электротоком тканей органов, отдаленных от места оперативного вмешательства, в частности поджелудочной железы [6].
Использование для местной остановки кровотечений из паренхиматозных органов веществ на основе неорганических солей железа и алюминия лишено недостатков электрокоагуляции. Однако высокая концентрация ионов железа и алюминия во всех известных типах данных фармакологических средств оказывает прижигающее действие на ткани в зоне применения, что может приводить к неблагоприятным эффектам [8]. Снижение в «Гамастате» концентрации железа и алюминия позволило устранить негативные эффекты применения, присущие местным гемостатическим средствам с высоким содержанием солей неорганических металлов, о
чем свидетельствует динамика цитологических и биохимических показателей крови, показателей плазменного гемостаза. Вместе с тем применение гемостатического средства «Гамастат» в сочетании с избирательной электрокоагуляцией только отдельных кровоточащих сосудов обеспечивает стойкий и надежный гемостаз. Окончательный гемостаз при этом достигался в 88,9% случаев, рецидивов кровотечения не наблюдалось. Снижение концентрации общего белка у пациентов основной группы с эффективным гемостазом на 6,7% указывает на преобладание катаболических процессов, что характерно для обычного течения ближайшего послеоперационного периода. Снижение концентрации общего билирубина (на 40,3%) после эффективного гемостаза в результате использования «Гамастата» и точечной электрокоагуляции было более выраженным, чем в контрольной группе, что свидетельствует о скорейшей нормализации пигментного обмена у пациентов основной группы. Изменения показателей красной и белой крови, а также показателей плазменного гемостаза у пациентов основной группы также были менее выраженными.
Снижение концентрации общего белка у пациентов основной группы с эффективным гемостазом на 6,7% указывает на преобладание катаболических процессов, что характерно для обычного течения ближайшего послеоперационного периода. Снижение концентрации общего билирубина (на 40,3%) после эффективного гемостаза в результате использования «Гамастата» и точечной электрокоагуляции было более выраженным, чем в контрольной группе, что свидетельствует о скорейшей нормализации пигментного обмена у пациентов основной группы. Изменения показателей красной и белой крови, а также показателей плазменного гемостаза у пациентов основной группы также были менее выраженными.
Выводы
1. Разработанное кровоостанавливающее
средство «Гамастат» обладает выраженной гемостатической активностью при остановке диффузных кровотечений из ложа желчного пузыря во время холецистэктомии. Окончательный гемостаз при использовании «Гамастата» и избирательной коагуляции отдельных кровоточащих сосудов достигается в 88,9% случаев, а при применении сплошной электрокоагуляции ложа желчного пузыря — в 75,0% случаев.
2. Применение «Гамастата» в сочетании с избирательной электрокоагуляцией кровоточащих сосудов в области ложа желчного пузыря обеспечивает меньшее коагуляционное повреждение печеночной паренхимы, чем при использовании сплошной электрокоагуляции, о чем свидетельствует меньшая степень проявлений цитолиза гепатоцитов.
3. Комбинированный метод остановки кровотечения с использованием отечественного гемостатического средства «Гамастат» позволяет ограничить применение сплошной электрокоагуляции ложа желчного пузыря во время холецистэктомии и, как следствие, уменьшить зону коагуляционного некроза, снизить риск осложнений, присущих монополярной коагуляции.
4. Динамика цитологических и биохимических показателей крови, показателей плазменного гемостаза свидетельствует об отсутствии негативных эффектов применения «Гамастата» с целью остановки кровотечения.
Конфликт интересов отсутствует.
ЛИТЕРАТУРА
1. БунатянАГ, Завенян ЗС, БагметНН, Шатверян ГА, Скипенко ОГ. Проблемы гемостаза и герметизма при резекциях печени с использованием фибрин-коллагеновой субстанции. Хирургия Журн им НИ Пирогова. 2003;(9):18-23.
2. Ong AM, Bhayani SB, Hsu TH, Pinto PA, Rha KH, Thomas M, et al. Bipolar needle electrocautery for laparoscopic partial nephrectomy without renal vas-
Сведения
Жаворонок И.С., аспирант 1-й кафедры хирургических болезней УО «Белорусский государственный медицинский университет».
Кондратенко Г.Г., д.м.н., профессор, заведующий 1-й кафедрой хирургических болезней УО «Белорусский государственный медицинский университет». Гапанович В.Н., д.м.н., профессор, директор УП
cular occlusion in a porcine model. Urology. 2003 Dec;62(6):1144-48.
3. Седов ВМ, Юрлов ВВ, Петришин ВЛ, Бойкова НВ, Семенов ГМ, Кораблин НМ. Некоторые закономерности морфологических изменений ткани печени при электровоздействии. Вестн Хирургии им ИИ Грекова. 2001;160(4):27-31.
4. Черкова НВ. Сравнительная Оценка регенерации печени при воздействии электрокоагуляции и ультразвукового скальпеля. Вестн ХНУ им ВН Карази-на. Сер Медицина. 2004;(7):9-13.
5. Бойко ВВ, Ремнева НА, Черняев НС, Брицкая НН. Патоморфологические особенности резекционного края печени непосредственно после использования аппарата высокочастотной электрохирургической сварки и монополярного электрокоагулятора. Новости Хирургии. 2015;23(3):256-61.
Бойко ВВ, Ремнева НА, Черняев НС, Брицкая НН. Патоморфологические особенности резекционного края печени непосредственно после использования аппарата высокочастотной электрохирургической сварки и монополярного электрокоагулятора. Новости Хирургии. 2015;23(3):256-61.
6. Дамбаев ГЦ, Байков АН, Семичев ЕВ, Шписман МН, Алейник А Н, Денеко ОИ, и др. Интраопера-ционные способы гемостаза при операциях на печени. Бюл Сиб Медицины. 2011;10(4):89-92.
7. Таркова АР, Чернявский АМ, Морозов СВ, Григорьев ИА, Ткачева НИ, Родионов ВИ. Гемо-статический материал местного действия на основе окисленной целлюлозы. Сиб Науч Мед Журн. 2015;35(2):11-15.
8. Гаин ЮМ, Александрова ОС, Гапанович ВН. Современные методы местного гемостаза при повреждениях паренхиматозных органов живота. Новости Хирургии. 2009;17(4):160-71.
9. Nouri S, Sharif MR, Afzali H, Sharif A, Satkin M. The Advantages and disadvantages of methods used to control liver bleeding: a review. Trauma Mon. 2015 Nov;20(4):e28088. doi: 10.5812/traumamon.28088.
10. Мельнова НИ, Жаворонок ИС, Жук ИН, Бер-дина ЕЛ, Ермалюк НМ, Куцук ОК, и др. Применение нового гемостатического средства «Гамастат» при паренхиматозном кровотечении в эксперименте. Воен Медицина. 2013;(2):62-66.
Адрес для корреспонденции
220116, Республика Беларусь, г. Минск, пр. Дзержинского, д. 83, Белорусский государственный медицинский университет, 1-я кафедра хирургических болезней, тел. моб.: +375 29 624-98-37, e-mail: [email protected], Жаворонок Ирина Сергеевна
об авторах
«ЛОТИОС».
Есепкин А.В., заведующий хирургическим отделением №1 УЗ «10-я городская клиническая больница г. Минска».
Карман А.Д., к.м.н., доцент 1-й кафедры хирургических болезней УО «Белорусский государственный медицинский университет»
Поступила 26.04.2016 г.
ОСТРЫЕ ХИРРУРГИЧЕСКИЕ БОЛЕЗНИ ТРЕБУЮТ НЕМЕДЛЕННОГО ОБРАЩЕНИЯ ЗА МЕДИЦИНСКОЙ ПОМОЩЬЮ.
ОСТРЫЕ ХИРУРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ
Группа острых заболеваний, локализующиеся в брюшной полости, объединяющиеся в понятия «Острый живот».
Общие признаки «Острого живота»:
Боли в животе по характеру, локализации, иррадиации зависят от места воспалительного процесса, и сопровождают все острые хирургические заболевания органов брюшной полости. Могут отсутствовать только при желудочно-кишечном кровотечении. В норме болей в животе нет.
Появляются: тошнота, рвота, задержка стула, газы, сухой язык. Как правило, эти симптомы, сопровождает все острые хирургические заболевания органов брюшной полости. В норме язык влажный, чистый, рвота отсутствует, газы отходят, стул ежедневно, не реже 1 раза в 2-3 дня, оформленный и имеет коричневую окраску.
Особенностью всех острых хирургических заболеваний органов брюшной полости при прогрессировании процесса является наличие жизненных показаний к оперативному вмешательству, несвоевременность которого приводит к развитию тяжелых осложнений, в том числе перитониту с выраженной интоксикацией, создающих угрозу для жизни.
Запрещается:
•принимать слабительные
•пить обезболивающие и наркотические препараты
•принимать пищу
•оставаться дома
Необходимо:
•уложить больного
•положить холод на живот
•запретить прием пищи и жидкости
• вызвать скорую помощь.
КРОВОТЕЧЕНИЯ
Кровотечение –истечение крови из поврежденного сосуда.
Причины кровотечений:
•Механическое повреждение сосудов.
•Разрушение стенки сосуда патологическим процессом.
•Нарушение свертываемости крови.
•Повышение проницаемости мелких сосудов
Виды кровотечений:
По источнику
1.Артериальное.
2.Венозное.
3.Паренхиматозное (из внутренних органов).
4.Капиллярное.
По локализации
1.Наружное.
2.Внутреннее.
3.Явное.
4.Скрытое.
По времени
1.Острое.
2.Хроническое.
Кровотечение из паренхиматозных органов относится к внутренним кровотечениям и, как правило, сопровождается массивной кровопотерей.
Признаки кровотечений:
Субъективные признаки:
▪Головокружение
▪Нарастающая слабость
▪Потемнение в глазах
▪Сухость во рту
▪Жажда
Объективные признаки:
▪Бледность, снижение тургора кожи
▪Холодный пот
▪Сердцебиения, слабый пульс
▪Снижение АД (систолическое АД –т.е. САД <100мм рт. Ст
.▪ отсутствие мочеиспускания
▪Симптом «белого пятна»>3 секунд
Алгоритм неотложной помощи при кровотечении в зависимости от места
локализации
Локализация кровотечения | Объем помощи |
Носовое кровотечение | Создать положение сидя, с наклоном головы вперед, для предупреждение аспирации крови. Успокоить, рекомендовать дышать ртом. Прижать крылья носа двумя пальцами к носовой перегородке на 2-3 минуты. |
Закрытое повреждение мягких тканей (ушиб, гематома) | Холод местно. Вызвать скорую помощь. |
Открытая поверхностная травма с повреждением кожи, подкожной клетчатки | Наложить давящую повязку. Холод местно. Иммобилизовать конечность. Вызвать скорую помощь |
Открытая глубокая травма с повреждением сосудисто-нервного пучка | Пальцевое прижатие. Максимальное сгибание конечности в суставе. Временная остановка кровотечения. Наложение жгута, жгута-закрутки. Наложение асептической повязки. Защита раны от инфекции. Иммобилизация конечности. Создание покоя поврежденной конечности. Вызов скорой помощи. |
Кровохарканье, кровотечение из дыхательных путей при заболеваниях легких, трахеи и бронхов | Создание положения полусидя или лежа на боку, приподнятым головным концом. Освободить грудную клетку, живот от стесняющей одежды. Положить пузырь со льдом на грудную клетку. Успокоить, убедить дышать спокойно. Дать обильное питье. Вызов скорой помощи. |
Желудочно-кишечное кровотечение при заболеваниях желудочно-кишечного тракта (рвота алой, темной кровью, кофейной гущей, стул с примесью алой, темной крови, мелена | Придать положение лежа, с приподнятым ножным концом. Положить холод на живот. Успокоить, вселить уверенность в хорошем исходе. Запретить прием пищи и жидкости. Вызов скорой помощи. |
РАНЫ
Рана –механическое повреждение с нарушением целостности кожных покровов, слизистых и глубжележащих тканей.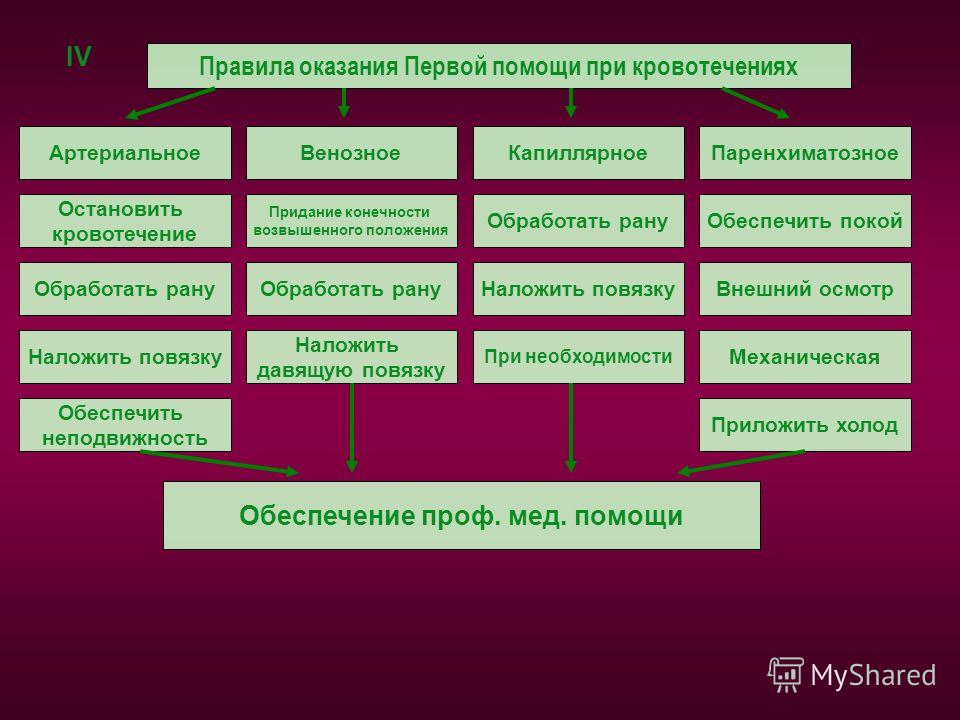
Виды ран
1.Колотые
2.Резаные
3.Рубленные
4.Ушибленные
5.Рваные
6.Размозжённые
7.Укушенные
8.Огнестрельные
9.Смешанные
Помните! Все раны, за исключением операционных, являются первично-инфицированными.
Неотложная помощь при ранениях:
1.Временная остановка наружного кровотечения
2.Обезболивание
3.Предупреждение дальнейшего инфицирования раны (наложение асептической повязки)
4.Создать покой поврежденной конечности
6.Вызвать скорую помощь.
Все манипуляции в ране противопоказаны!
Запрещается:
•Касаться раны руками
•Извлекать из раны инородные тела –осколки, ножи и т.п.
•Промывать рану, вытирать рану
•Засыпывать антибиотиками
•Накладывать мази и вату
•Вправлять выпавшие внутренние органы, костные отломки.
Внутримозговое кровоизлияние | Центр мозга и позвоночника Weill Cornell
Внутримозговое кровоизлияние (ICH) — это тип инсульта, который называется геморрагическим инсультом или «мозговой атакой». Его название относится к кровотечению (кровоизлиянию) в головной мозг (головной мозг), вызванному разрывом кровеносного сосуда и образованием лужи крови, называемой гематомой в головном мозге. По мере продолжения кровотечения гематома становится больше, увеличивая давление внутри мозга; сжатие мозга может вызвать повреждение мозга и привести к неврологическому дефициту, потере сознания или даже смерти.
Внутримозговое кровоизлияние — относительно редкая форма инсульта — оно вызывает от 10 до 15 процентов всех инсультов — но это все равно означает 100 000 новых случаев в Соединенных Штатах каждый год. Он более инвалидизирует и имеет более высокий уровень смертности, чем ишемический инсульт, и может возникнуть в любом возрасте. Это немного чаще встречается у мужчин, чем у женщин.
Ущерб, вызванный внутримозговым кровоизлиянием, зависит от места кровотечения — каждая часть мозга отвечает за свою функцию, поэтому геморрагический инсульт проявит свое влияние на часть тела, контролируемую пораженной областью мозга. .В зависимости от места и тяжести инсульта человек может страдать частичным параличом или онемением, потерей зрения, изменениями личности, потерей памяти или изменениями когнитивных способностей. Некоторые из этих эффектов могут быть хотя бы частично обратимы с помощью речевой терапии или физиотерапии. В более тяжелых случаях внутримозговое кровоизлияние вызывает необратимое повреждение мозга и потерю функции или смерть.
.В зависимости от места и тяжести инсульта человек может страдать частичным параличом или онемением, потерей зрения, изменениями личности, потерей памяти или изменениями когнитивных способностей. Некоторые из этих эффектов могут быть хотя бы частично обратимы с помощью речевой терапии или физиотерапии. В более тяжелых случаях внутримозговое кровоизлияние вызывает необратимое повреждение мозга и потерю функции или смерть.
Во всех случаях требуется немедленная медицинская помощь, чтобы остановить кровотечение и снизить давление, вызванное гематомой.(См. Хирургия внутримозгового кровоизлияния.)
Инсульт, вызванный внутримозговым кровоизлиянием, отличается от более распространенного типа инсульта, который называется ишемической атакой. Ишемическая атака вызывается блокировкой кровотока в головном мозге, вызванной окклюзией сонных артерий или другим состоянием, препятствующим попаданию крови в мозг. Люди, у которых наблюдается внутримозговое кровоизлияние, как правило, моложе тех, у кого есть ишемические атаки, которые чаще возникают у пожилых людей.Внутримозговое кровоизлияние может возникнуть в любом возрасте.
Что вызывает внутримозговое кровоизлияние?
Существует три типа внутримозговых кровоизлияний. Наиболее распространенным является субарахноидальное кровоизлияние , , которое возникает под паутинным слоем на мозговых оболочках (защитные слои вокруг головного мозга и позвоночника). Эти субарахноидальные кровоизлияния обычно возникают в результате несчастного случая, другой травмы головы или аневризмы. Внутрипаренхиматозное кровоизлияние происходит внутри самой ткани мозга и обычно является результатом высокого кровяного давления (гипертонии), опухоли, кавернозной мальформации или артериовенозной мальформации (АВМ).Внутрижелудочковое кровоизлияние происходит в желудочках (жидкостных камерах) головного мозга и обычно вызвано сосудистой мальформацией. Геморрагический инсульт также может возникнуть в результате разжижения крови, которое происходит при регулярном приеме аспирина или антикоагулянтных препаратов, таких как кумадин (варфарин). Люди, которые курят, пьют или принимают запрещенные наркотики, также подвержены повышенному риску геморрагического инсульта.
Люди, которые курят, пьют или принимают запрещенные наркотики, также подвержены повышенному риску геморрагического инсульта.
Назначить встречу | Направьте пациента
Рецензент: Филип Э.Стиг, доктор философии, доктор медицинских наук
Последнее рассмотрение / последнее обновление: апрель 2021 г.
Иллюстрация Тома Грейвса, CMI
Внутричерепное кровоизлияние: история вопроса, патофизиология, эпидемиология
Nishijima DK, Offerman SR, Ballard DW, Vinson DR, Chettipally UK, Rauchwerger AS, et al. Немедленное и отсроченное травматическое внутричерепное кровоизлияние у пациентов с травмой головы и предтравматическим применением варфарина или клопидогреля. Энн Эмерг Мед . 2012 июн. 59 (6): 460-8.e1-7. [Медлайн]. [Полный текст].
Hallevi H, Dar NS, Barreto AD, Morales MM, Martin-Schild S, Abraham AT, et al.Шкала ВЖК: новый инструмент для оценки объема внутрижелудочкового кровоизлияния: клиническое и исследовательское значение. Crit Care Med . 2009 марта, 37 (3): 969-74, e1. [Медлайн].
Kernan WN, Viscoli CM, Brass LM и др. Фенилпропаноламин и риск геморрагического инсульта. N Engl J Med . 2000 21 декабря. 343 (25): 1826-32. [Медлайн].
Vespa PM, О’Фелан К., Шах М., Мирабелли Дж., Старкман С., Кидвелл С. и др. Острые судороги после внутримозгового кровоизлияния: фактор прогрессирующего смещения средней линии и исход. Неврология . 2003 13 мая. 60 (9): 1441-6. [Медлайн].
Woo D, Haverbusch M, Sekar P. Влияние нелеченной гипертензии на геморрагический инсульт. Ход . 2004 июл.35 (7): 1703-8. [Медлайн].
Nishijima DK, Offerman SR, Ballard DW, Vinson DR, Chettipally UK, Rauchwerger AS и др. Риск травматического внутричерепного кровоизлияния у пациентов с черепно-мозговой травмой и применением варфарина или клопидогреля до травмы. Acad Emerg Med .2013 20 февраля (2): 140-5. [Медлайн]. [Полный текст].
Риск травматического внутричерепного кровоизлияния у пациентов с черепно-мозговой травмой и применением варфарина или клопидогреля до травмы. Acad Emerg Med .2013 20 февраля (2): 140-5. [Медлайн]. [Полный текст].
Wada R, Aviv RI, Fox AJ, Sahlas DJ, Gladstone DJ, Tomlinson G и др. «Точечный признак» КТ-ангиографии позволяет прогнозировать расширение гематомы при остром внутримозговом кровоизлиянии. Ход . 2007 апр. 38 (4): 1257-62. [Медлайн].
Bang OY, Buck BH, Saver JL, Alger JR, Yoon SR, Starkman S и др. Прогнозирование геморрагической трансформации после реканализирующей терапии с использованием магнитно-резонансной томографии Т2 * -проницаемости. Энн Нейрол . 2007 августа 62 (2): 170-6. [Медлайн].
Нишихара Т., Нагата К., Танака С. Новые эндоскопические инструменты для удаления внутримозговых гематом. Neurocrit Care . 2005. 2 (1): 67-74. [Медлайн].
Mayer SA, Brun NC, Begtrup K. Рекомбинантный активированный фактор VII для острого внутримозгового кровоизлияния. N Engl J Med . 2005 24 февраля. 352 (8): 777-85. [Медлайн].
Zaaroor M, Soustiel JF, Brenner B, Bar-Lavie Y, Martinowitz U, Levi L.Неуказанное назначение рекомбинантного фактора VIIa (rFVIIa) пациентам с тупым или проникающим повреждением головного мозга без коагулопатии. Acta Neurochir (Вена) . 2008 июль 150 (7): 663-8. [Медлайн].
Хоннер С.К., Сингх А., Чунг П.Т., Альтер Х.Дж., Дутарет К.Г., Патель А.К. и др. Отделение неотложной помощи — контроль артериального давления при внутримозговом кровоизлиянии. J Emerg Med . 2011 Октябрь 41 (4): 355-61. [Медлайн].
Taylor S, Heinrichs RJ, Janzen JM, Ehtisham A. Леветирацетам связан с улучшением когнитивных функций у пациентов с внутричерепным кровоизлиянием. Neurocrit Care . 2011 15 августа (1): 80-4. [Медлайн].
Куреши А.И., Палеш Ю.Ю., Мартин Р., Новицке Дж., Круз-Флорес С., Эхтишам А.Влияние снижения систолического артериального давления на расширение гематомы, отек перигематомы и трехмесячный исход среди пациентов с внутримозговым кровоизлиянием: результаты исследования антигипертензивного лечения острого кровоизлияния в мозг. Арка Нейрол . 2010 май. 67 (5): 570-6. [Медлайн].
Биффи А., Деван В.Дж., Андерсон С.Д. и др. Использование статинов и исходы после внутримозгового кровоизлияния: исследование случай-контроль и метаанализ. Неврология . 2011 3 мая. 76 (18): 1581-8.[Медлайн].
Finelli PF, Kessimian N, Bernstein PW. Церебральная амилоидная ангиопатия, проявляющаяся рецидивирующим внутримозговым кровоизлиянием. Арка Нейрол . 1984 марта 41 (3): 330-3. [Медлайн].
Риттер М.А., Дросте Д.В., Хегедус К. Роль церебральной амилоидной ангиопатии во внутримозговых кровоизлияниях у пациентов с гипертонией. Неврология . 2005 12 апреля. 64 (7): 1233-7. [Медлайн].
Castellanos M, Leira R, Tejada J.Предикторы хорошего исхода при средних и крупных спонтанных супратенториальных внутримозговых кровоизлияниях. J Neurol Neurosurg Psychiatry . 2005 г., май. 76 (5): 691-5. [Медлайн].
J Neurol Neurosurg Psychiatry . 2005 г., май. 76 (5): 691-5. [Медлайн].
Альбертс MJ, Latchaw RE, Selman WR. Рекомендации для комплексных центров инсульта: консенсусное заявление Коалиции по борьбе с мозговой атакой. Ход . 2005 июл. 36 (7): 1597-616. [Медлайн].
Ауэр Л. М., Дейнсбергер В., Нидеркорн К. и др. Эндоскопическая хирургия по сравнению с медикаментозным лечением спонтанной внутримозговой гематомы: рандомизированное исследование. Дж. Нейросург . 1989 апр. 70 (4): 530-5. [Медлайн].
Bang OY, Saver JL, Alger JR, Shah SH, Buck BH, Starkman S и др. Паттерны и предикторы нарушений проницаемости гематоэнцефалического барьера при остром ишемическом инсульте. Ход . 2008 26 ноября. [Medline].
Bang OY, Saver JL, Liebeskind DS, Starkman S, Villablanca P, Salamon N и др. Уровень холестерина и симптоматическая геморрагическая трансформация после тромболизиса ишемического инсульта. Неврология . 2007 6 марта. 68 (10): 737-42. [Медлайн].
Bradley WG Jr. МРТ появление кровоизлияния в мозг. Радиология . 1993 Октябрь 189 (1): 15-26. [Медлайн].
Бродерик Дж., Коннолли С., Фельдманн Э., Хэнли Д., Касе С., Кригер Д. и др. Рекомендации по лечению спонтанного внутримозгового кровоизлияния у взрослых: обновление 2007 г .: рекомендации Американской кардиологической ассоциации / Американской ассоциации инсультов по инсульту, Совета по исследованиям высокого кровяного давления и Междисциплинарной рабочей группы по качеству лечения и результатам. Ход . 2007 июн. 38 (6): 2001-23. [Медлайн].
Бродерик Дж. П., Бротт Т., Томсик Т. и др. Внутримозговые кровоизлияния более чем в два раза чаще, чем субарахноидальные кровоизлияния. Дж. Нейросург . 1993 г., февраль 78 (2): 188-91. [Медлайн].
П., Бротт Т., Томсик Т. и др. Внутримозговые кровоизлияния более чем в два раза чаще, чем субарахноидальные кровоизлияния. Дж. Нейросург . 1993 г., февраль 78 (2): 188-91. [Медлайн].
Бродерик Дж. П., Бротт Т. Г., Томсик Т. и др. Ультра-ранняя оценка внутримозгового кровоизлияния. Дж. Нейросург . 1990 Февраль 72 (2): 195-9. [Медлайн].
Чалела Дж. А., Кидвелл С. С., Нентвич Л. М., Луби М., Бутман Дж. А., Демчук А. М. и др.Магнитно-резонансная томография и компьютерная томография в неотложной оценке пациентов с подозрением на острый инсульт: проспективное сравнение. Ланцет . 2007, 27 января. 369 (9558): 293-8. [Медлайн].
Chiquete E, Ruiz-Sandoval MC, Alvarez-Palazuelos LE, Padilla-Martínez JJ, González-Cornejo S, Ruiz-Sandoval JL. Гипертоническое внутримозговое кровоизлияние у пожилых людей. Цереброваск Дис . 2007. 24 (2-3): 196-201. [Медлайн].
Коннор, доктор медицины, Моди Г, Варлоу, CP.Точность оценок инсульта в больнице Сирираджа и Гая у городских жителей Южной Африки. Ход . 2007 января 38 (1): 62-8. [Медлайн].
Демаршалк Б.М., Агилар, штат Мичиган. Лечение острого внутримозгового кровоизлияния. Варианты лечения Curr Neurol . 2008 10 ноября (6): 455-67. [Медлайн].
Derex L, Nighoghossian N. Внутримозговое кровоизлияние после тромболизиса при остром ишемическом инсульте: обновленная информация. J Neurol Neurosurg Psychiatry .2008 окт.79 (10): 1093-9. [Медлайн].
Fiehler J, Remmele C, Kucinski T. Реперфузия после тяжелого местного дефицита перфузии предшествует геморрагической трансформации: исследование МРТ у пациентов с острым инсультом. Цереброваск Дис . 2005. 19 (2): 117-24. [Медлайн].
Флемминг К.Д., Вейдикс Е.Ф., Сент-Луис Е.К., Ли Х. Прогнозирование ухудшения состояния у пациентов с крупозными кровотечениями. J Neurol Neurosurg Psychiatry . 1999 Май. 66 (5): 600-5.[Медлайн].
Гринберг С.М. Церебральная амилоидная ангиопатия: перспективы клинической диагностики и лечения. Неврология . 1998 Сентябрь 51 (3): 690-4. [Медлайн].
Hankey GJ, Hon C. Хирургия первичного внутримозгового кровоизлияния: это безопасно и эффективно? Систематический обзор серий случаев и рандомизированных исследований. Ход . 1997 28 ноября (11): 2126-32. [Медлайн].
Харт Р.Г., Буп Б.С., Андерсон округ Колумбия.Пероральные антикоагулянты и внутричерепное кровоизлияние. Факты и гипотезы. Ход . 1995 26 августа (8): 1471-7. [Медлайн].
Иваску Ф.А., Хауэллс Г.А., Джунн Ф.С. Быстрая отмена варфарина у пациентов с антикоагулянтной терапией с травматическим внутричерепным кровоизлиянием снижает прогрессирование кровотечения и смертность. Травма Дж. . 2005 ноября, 59 (5): 1131-7; обсуждение 1137-9. [Медлайн].
Juvela S, Heiskanen O, Poranen A, et al. Лечение спонтанного внутримозгового кровоизлияния.Проспективное рандомизированное исследование хирургического и консервативного лечения. Дж. Нейросург . 1989 Май. 70 (5): 755-8. [Медлайн].
Кан Х.С., Хан М.Х., Квон ОК, Квон Би Джей, Ким С.Х., О CW. Внутричерепное кровоизлияние после каротидной ангиопластики: объединенный анализ. Дж. Эндоваск Тер . 2007 14 февраля (1): 77-85. [Медлайн].
Касснер А., Робертс Т., Тейлор К. Прогнозирование кровотечения при остром ишемическом инсульте с использованием магнитно-резонансной томографии проницаемости. AJNR Am J Нейрорадиол . 2005 26 октября (9): 2213-7. [Медлайн].
Khatri P, Broderick JP, Khoury JC, Carrozzella JA, Tomsick TA. Инъекции микрокатетерного контраста во время внутриартериального тромболизиса могут увеличить риск внутричерепного кровоизлияния. Ход . 2008 декабрь 39 (12): 3283-7. [Медлайн].
Khatri P, Wechsler LR, Broderick JP. Внутричерепное кровоизлияние, связанное с реваскуляризационной терапией. Ход .2007 Февраль 38 (2): 431-40. [Медлайн].
Kidwell CS, Chalela JA, Saver JL. Сравнение МРТ и КТ для выявления острого внутримозгового кровоизлияния. ЯМА . 20 октября 2004 г. 292 (15): 1823-30. [Медлайн].
Клацкий А.Л., Фридман Г.Д., Сидни С. Риск геморрагического инсульта у американцев азиатского происхождения. Нейроэпидемиология . 2005. 25 (1): 26-31. [Медлайн].
Lees KR, Zivin JA, Ashwood T. NXY-059 для острого ишемического инсульта. N Engl J Med . 2006 9 февраля. 354 (6): 588-600. [Медлайн].
Лейра Р., Давалос А., Сильва Ю. Раннее неврологическое ухудшение внутримозгового кровоизлияния: предикторы и связанные факторы. Неврология . 2004, 10 августа. 63 (3): 461-7. [Медлайн].
Лю-ДеРайк X, Рони Д. Гемостатическая терапия для лечения внутричерепного кровоизлияния. Фармакотерапия . 2008 апр. 28 (4): 485-95. [Медлайн].
Ло В.Д., Ли Дж., Русин Дж., Перкинс Э., Роуч Э.С.Внутричерепное кровоизлияние у детей: развивающийся спектр. Арка Нейрол . 2008 декабрь 65 (12): 1629-33. [Медлайн].
Лу А., Тан И, Ран Р. Геномика мозга внутримозгового кровоизлияния. J Cereb Blood Flow Metab . 2006 26 февраля (2): 230-52. [Медлайн].
Mascitelli L, Pezzetta F, Goldstein MR. Геморрагический инсульт в исследовании SPARCL. Ход . 2008 г., 39 (11): e180; ответ автора e181. [Медлайн].
Майер С.А., Ринкон Ф.Лечение внутримозгового кровоизлияния. Ланцет Нейрол . 2005 г., 4 (10): 662-72. [Медлайн].
Mitchell P, Mitra D, Gregson BA, Mendelow AD. Профилактика внутримозгового кровоизлияния. Curr Drug Targets . 2007 июл.8 (7): 832-8. [Медлайн].
Нараян Р.К., Маас А.И., Маршалл Л.Ф., Сервадей Ф., Сколник Б.Е., Тиллинджер М.Н. Рекомбинантный фактор VIIA при травматическом внутримозговом кровоизлиянии: результаты клинического исследования с увеличением дозы. Нейрохирургия . 2008 апр. 62 (4): 776-86; обсуждение 786-8. [Медлайн].
Nghiemphu PL, Green RM, Pope WB, Lai A, Cloughesy TF. Безопасность применения антикоагулянтов и бевацизумаба у пациентов с глиомой. Нейро Онкол . 2008 июн.10 (3): 355-60. [Медлайн].
Nishijima DK, Dager WE, Schrot RJ, Holmes JF. Эффективность фактора VIIa у пациентов отделения неотложной помощи с варфарином и травматическим внутричерепным кровоизлиянием. Acad Emerg Med . 2010 марта 17 (3): 244-51. [Медлайн].
Найквист П. Лечение острого внутричерепного и внутрижелудочкового кровоизлияния. Crit Care Med . 2010 Март 38 (3): 946-53. [Медлайн].
Огасавара К., Сакаи Н., Куроива Т., Хосода К., Иихара К., Тойода К. и др. Внутричерепное кровоизлияние, связанное с синдромом церебральной гиперперфузии после каротидной эндартерэктомии и стентирования сонной артерии: ретроспективный обзор 4494 пациентов. Дж. Нейросург . 2007 декабрь 107 (6): 1130-6. [Медлайн].
Oppenheim C, Touze E, Hernalsteen D. Сравнение пяти последовательностей MR для обнаружения острого внутричерепного кровоизлияния. Цереброваск Дис . 2005. 20 (5): 388-94. [Медлайн].
Orakcioglu B, Becker K, Sakowitz OW, Unterberg A, Schellinger PD. Последовательный диффузионный и перфузионный МРТ-анализ перигеморрагической зоны на модели ICH крысы. Acta Neurochir Suppl .2008. 103: 15-8. [Медлайн].
Прасад К., Менделов А.Д., Грегсон Б. Хирургия первичного супратенториального внутримозгового кровоизлияния. Кокрановская база данных Syst Rev . 2008 г. 8 октября. CD000200. [Медлайн].
Куреши А.И., Мохаммад Ю.М., Яхья А.М. Проспективное многоцентровое исследование для оценки возможности и безопасности агрессивного антигипертензивного лечения у пациентов с острым внутримозговым кровоизлиянием. Дж. Мед. Интенсивной терапии .2005 янв-фев. 20 (1): 34-42. [Медлайн].
Куреши А.И., Сури М.Ф. Острое устранение связанного с клопидогрелом ингибирования тромбоцитов с использованием метилпреднизолона у пациента с внутричерепным кровоизлиянием. AJNR Am J Нейрорадиол . 2008 29 ноября (10): e97. [Медлайн].
Rincon F, Mayer SA. Современные варианты лечения внутримозгового кровоизлияния. Варианты лечения Curr Cardiovasc Med . 2008 июн.10 (3): 229-40. [Медлайн].
Rincon F, Mayer SA.Внутримозговое кровоизлияние: готовимся к эффективному лечению. Curr Opin Neurol . 2010 23 февраля (1): 59-64. [Медлайн].
Ранчи С., Макги С. Есть ли у этого пациента геморрагический инсульт ?: клинические данные, позволяющие отличить геморрагический инсульт от ишемического инсульта. ЯМА . 2010 июн 9. 303 (22): 2280-6. [Медлайн].
Сандеркок П. Да или нет обычным статинам после субарахноидального кровоизлияния для предотвращения отсроченной церебральной ишемии, вазоспазма и смерти? Поучительная история двух метаанализов. Ход . 2010 г., 41 (1): e1-2. [Медлайн].
Smith EE, Rosand J, Greenberg SM. Геморрагический инсульт. Клиника нейровизуализации N Am . 2005 г., май. 15 (2): 259-72, ix. [Медлайн].
Sorimachi T, Fujii Y, Morita K, Tanaka R. Предикторы увеличения гематомы у пациентов с внутримозговым кровоизлиянием, леченных быстрым введением антифибринолитических средств и строгим контролем артериального давления. Дж. Нейросург . 2007 фев.106 (2): 250-4. [Медлайн].
Steiner T, Rosand J, Diringer M. Внутримозговое кровоизлияние, связанное с пероральной антикоагулянтной терапией: текущая практика и нерешенные вопросы. Ход . 2006, январь, 37 (1): 256-62. [Медлайн].
Struffert T, Doelken M, Adamek E, Schwarz M, Engelhorn T, Kloska S и др. Компьютерная томография с плоским детектором и внутривенным введением контрастного вещества при экспериментальных аневризмах: сравнение с мультиспиральной КТ и традиционной ангиографией. Акта Радиол . 2010 май. 51 (4): 431-7. [Медлайн].
Tuhrim S, Dambrosia JM, Price TR, et al. Прогноз выживаемости при внутримозговых кровоизлияниях. Энн Нейрол . 24 августа 1988 г. (2): 258-63. [Медлайн].
Vernooij MW, van der Lugt A, Ikram MA, Wielopolski PA, Niessen WJ, Hofman A, et al. Распространенность и факторы риска церебральных микрокровоизлияний: исследование Роттердамского сканирования. Неврология . 2008 г. 1. 70 (14): 1208-14. [Медлайн].
Viswanathan A, Chabriat H. Церебральное микрокровоизлияние. Ход . 2006 Февраль 37 (2): 550-5. [Медлайн].
Чжу XL, Чан МС, Пун WS. Спонтанное внутричерепное кровоизлияние: каким пациентам нужна диагностическая церебральная ангиография? Проспективное исследование 206 случаев и обзор литературы. Ход . 1997 июл.28 (7): 1406-9. [Медлайн].
Внутримозговое кровоизлияние (ВЧК), геморрагический инсульт, инсульт
Обзор
Внутримозговое кровоизлияние (ICH) вызвано кровотечением внутри сама ткань мозга — опасная для жизни тип инсульта.Инсульт возникает, когда мозг лишены кислорода и кровоснабжения. ICH чаще всего вызывается при гипертонии, артериовенозных мальформациях, или травма головы. Лечение направлено на прекращение кровотечение, удаление тромба (гематомы), и снятие нагрузки на мозг.
Что такое внутримозговое кровоизлияние (ICH)?
Крошечные артерии приносят кровь к участкам глубоко внутри мозга (см. Анатомия мозга).Высокое кровяное давление (гипертония) может вызвать: эти тонкостенные артерии разрываются, высвобождая кровь в ткани мозга. Сгустки крови и жидкости, заключенные внутри твердого черепа, увеличивают давление, которое может раздавить мозг о кость или вызвать ее смещение и образование грыжи. (Рисунок 1). Как кровь попадает в мозг, в ту область, где находится артерия. поставляемый теперь лишен богатой кислородом крови — крикнул инсульт. Поскольку клетки крови внутри сгустка умирают, токсины выпущены, которые еще больше повреждают клетки мозга в область вокруг гематомы.
Фигура 1. Внутримозговое кровоизлияние (ICH) обычно вызвано разрывом крошечных артерий внутри ткань головного мозга (слева). По мере сбора крови образуется гематома или формы сгустка крови, вызывающие повышенное давление на мозг.ICH может возникнуть вблизи поверхность или в глубоких областях мозга. Иногда глубокие кровоизлияния могут распространяться на желудочки — заполненные жидкостью пространства в центре мозга.Блокировка нормального цереброспинального (CSF) кровообращения может привести к увеличению желудочков (гидроцефалия), вызывая спутанность сознания, летаргию и потерю сознания.
Что симптомы?
Если вы испытываете симптомы ICH, немедленно звоните 911! Симптомы обычно появляются внезапно и могут отличаться в зависимости от место кровотечения. Общие симптомы включают:
- головная боль, тошнота и рвота
- вялость или спутанность сознания
- внезапная слабость или онемение лица, рука или нога, обычно с одной стороны
- потеря сознания
- временная потеря зрения
- изъятия
Что такое причины?
- Гипертония : повышенное артериальное давление может вызвать появление крошечных артерий ворваться в мозг.Нормальное давление 120/80 мм рт.
- Разжижители крови : такие препараты, как кумадин, гепарин и варфарин используется для предотвращения образования тромбов в сердце и при инсульте, может вызвать ICH.
- AVM : а клубок аномальных артерий и вен с между ними нет капилляров.
- Аневризма : выпуклость или ослабление стенки артерии.
- Травма головы : перелом черепа и проникающие ранения (огнестрельные) могут повредить артерии и вызвать кровотечение.
- Нарушения свертывания крови : гемофилия, серповидноклеточная анемия, ДВС-синдром, тромбоцитопения.
- Опухоли : высокососудистые опухоли, например поскольку ангиомы и метастатические опухоли могут кровоточить в ткань мозга.
- Амилоидная ангиопатия : накопление белка в стенках артерий.
- Употребление наркотиков : алкоголь, кокаин и прочие незаконные лекарства могут вызвать ICH.
- Спонтанный : ICH по неизвестным причинам.
Кто пострадал?
Десять процентов инсультов вызваны пользователя ICH. ВЧГ в два раза чаще, чем субарахноидальный кровоизлияние (SAH) и риск смерти 40%. ВЧГ встречается немного чаще у мужчин. чем женщины, и чаще встречается среди молодежи и афроамериканцы и японцы среднего возраста. Пожилой возраст и гипертония — самые важные факторы риска ВЧГ.Примерно 70% пациентов испытывают длительный дефицит после ICH.
Как ставится диагноз?
Когда человека приводят в отделение неотложной помощи при подозрении на кровоизлияние в мозг, врачи узнает как можно больше о его или ее симптомах, текущих и предыдущие медицинские проблемы, лекарства, и семейный анамнез. Состояние человека оценивается быстро. Диагностические тесты помогут определить источник кровотечения.
Компьютерная томография (КТ) — это неинвазивный рентгеновский снимок для просмотра анатомические структуры головного мозга и для обнаружения кровотечений. КТ-ангиография включает: введение контраста в кровоток для просмотра артерий головного мозга.
Ангиограмма — инвазивная процедура, где катетер вставлен в артерию и прошел через кровеносные сосуды к мозг.Как только катетер установлен, контрастируйте краситель вводится в кровоток и делается рентген.
Магнитно-резонансная томография (МРТ) — это неинвазивный тест, в котором используются магнитное поле и радиоволны, чтобы дать подробный обзор мягких тканей твой мозг. МРА (магнитно-резонансная ангиограмма) включает введение контрастного вещества в кровоток для исследования кровеносные сосуды, а также структуры мозг.
Какие методы лечения доступны?
Лечение может включать в себя меры по спасению жизни, облегчение симптомов и предотвращение осложнений. Однажды причина и место кровотечение идентифицировано, медицинское или хирургическое лечение проводится для остановки кровотечения, удалите сгусток и снимите давление на мозг. Если оставить в покое, мозг в конце концов впитать сгусток за пару недель — однако повреждение головного мозга, вызванное ДЦП и токсины крови могут быть необратимыми.
Как правило, пациенты с малым кровоизлияния (<10 см3) и минимальные дефициты лечатся медикаментозно. Пациенты с мозжечком кровоизлияния (> 3 см3), которые ухудшаются или у кого сдавление ствола мозга и гидроцефалия проходят хирургическое лечение по удалению гематомы как можно скорее. Пациенты с большой долей кровоизлияния (50 см3), которые обычно ухудшаются пройти хирургическое удаление гематомы.
Лечение
Пациент останется в инсультном отделении или отделении интенсивной терапии (ОИТ) для тщательного наблюдения и ухода.
- Если пациент принимал антикоагулянты, будут назначены препараты для восстановления свертываемости крови.
- Артериальное давление снижено для снижения риска большего кровотечения, но обеспечить достаточный кровоток (перфузия) в мозг.
- Контроль внутричерепного давления является фактором больших кровотечений.Устройство, называемое монитором ICP, может быть размещено непосредственно в желудочки или в мозг для измерения давление. Нормальное ВЧД составляет 20 мм рт.
- Удаление спинномозговой жидкости (CSF) из желудочков помогает контролировать давление. Желудочковый катетер (шунт VP) может быть помещен для слива жидкости спинномозговой жидкости и дайте возможность гематоме расшириться без повреждение головного мозга.
- Гипервентиляция также помогает контроль ВЧД.В некоторых случаях может возникнуть кома. с препаратами для снижения ВЧД.
Хирургическое лечение
Цель операции — удалить как можно больше
тромб по возможности и остановить источник
кровотечения, если оно вызвано идентифицируемой причиной
например, АВМ или опухоль. В зависимости от местоположения
тромба либо краниотомией, либо стереотаксической
аспирация может быть выполнена.
Рисунок 2. Аспирация сгустка через катетер для уменьшения массового эффекта и давления в головном мозге. Рис. 3. Компьютерная томография большой ВЧГ до и после. удаление сгустка. Катетер остается в пространстве продолжать слив в течение нескольких дней.
- Краниотомия включает рассечение отверстия в черепе с помощью дрель, чтобы обнажить мозг и удалить сгусток.Из-за повышенного риска для мозга этот метод обычно используется только тогда, когда гематома находится близко к поверхности мозга или если это связано с АВМ или опухолью это также должно быть удалено.
- Стереотаксическая аспирация сгустка — это малоинвазивная операция при больших гематомах, расположенных глубоко внутри головного мозга. В этой процедуре используется стереотаксическая рамка для ввода иглы или эндоскопа непосредственно в сгусток.Стереотаксическое наведение похоже на систему GPS в вашем автомобиле. Это навигация, основанная на ваших дооперационных изображениях. КТ помогает определить наилучшую траекторию попадания в гематому. В операционной хирург просверливает небольшое отверстие размером с четверть черепа. С помощью стереотаксической рамки полая канюля вводится через отверстие через ткань мозга непосредственно в сгусток. Полая канюля присоединяется к большому шприцу для удаления жидкой части сгустка крови (рис.2). Затем вставляется катетер меньшего размера для продолжения дренирования в течение следующих дней или недель (рис. 3).
Восстановление и профилактика
Сразу после ICH пациент останется в отделении интенсивной терапии (ICU) в течение нескольких недель, где врачи и медсестры внимательно следите за ними на предмет признаков повторного кровотечения, гидроцефалия и другие осложнения.Один раз их состояние стабильное, больной переведен в обычную комнату.
пациентов с ВЧГ могут страдать кратковременно и / или долгосрочные дефициты в результате кровотечение или лечение. Некоторые из этих дефицитов может исчезнуть со временем при лечении и терапии. Процесс восстановления может занять недели, месяцы, или лет, чтобы понять уровень дефицита понесенные и восстановить функцию.
Клинический испытания
Клинические испытания — это научные исследования, в ходе которых новые методы лечения — лекарства, средства диагностики, процедуры и другие методы лечения — тестируются на людях, чтобы убедиться, что они безопасны и эффективны.Постоянно проводятся исследования по повышению уровня медицинского обслуживания. Информацию о текущих клинических испытаниях, включая право на участие, протокол и места проведения, можно найти в Интернете. Исследования могут спонсироваться Национальными институтами здравоохранения (см. Clinicaltrials.gov), а также частными промышленными и фармацевтическими компаниями (см. Centerwatch.com).
Источники и ссылки
Если есть еще вопросы, пожалуйста свяжитесь с Mayfield Brain & Spine по телефону 800-325-7787 или 513-221-1100.
Источники
- Рекомендации для лечения спонтанного внутримозгового Кровоизлияние. Инсульт 46: 2032-60, 2015.
- Fewel ME, Thompson BG, Hoff JT: Спонтанный Внутримозговое кровоизлияние: обзор. Нейрохирург Фокус 15: 2003.
Ссылки
Национальный Инсультная ассоциация
американец Инсультная ассоциация
Инсультный центр.org
трепанация черепа : хирургическое отверстие части черепа, чтобы получить доступ к внутричерепные структуры и замена костный лоскут.
гематома : тромб.
гидроцефалия : отек в головном мозге из-за блокировки спинномозговой жидкость.
внутричерепное давление (ВЧД) : давление внутри черепа.
Монитор ICP : используемое устройство
для измерения внутричерепного давления внутри
мозг.
стереотаксический : точный метод обнаружения глубоких структур мозга с помощью использование 3-х мерных координат.
желудочки : полые области в центре головного мозга, содержащем спинномозговой жидкость.
вентрикулоперитонеальный (ВП) шунт : катетер, помещенный в желудочек головного мозга для отвода избыточной спинномозговой жидкости.
обновлено> 4.2018
рассмотрено> Эндрю Рингер, доктор медицины, клиника Мэйфилд, Цинциннати, Огайо
Сертифицированная медицинская информация Mayfield материалов написаны и разработаны клиникой Mayfield Clinic. Мы соблюдаем стандарт HONcode в отношении достоверной информации о здоровье. Эта информация не предназначена для замены медицинских рекомендаций вашего поставщика медицинских услуг.
Внутричерепная гематома — Симптомы и причины
Обзор
Внутричерепная гематома — это скопление крови внутри черепа.Чаще всего это вызвано разрывом кровеносного сосуда в головном мозге или травмой, такой как автомобильная авария или падение. Сбор крови может происходить в ткани мозга или под черепом, давя на мозг.
Некоторые травмы головы, например, при кратковременной потере сознания, могут быть незначительными. Однако внутричерепная гематома потенциально опасна для жизни. Обычно требуется немедленное лечение, которое может включать операцию по удалению крови.
Продукты и услуги
Показать больше товаров от Mayo ClinicСимптомы
Признаки и симптомы внутричерепной гематомы могут появиться сразу после травмы головы, или они могут появиться через несколько недель или дольше.Вы можете выглядеть нормально после травмы головы — периода, называемого периодом осознанности.
Однако со временем нагрузка на ваш мозг увеличивается, вызывая некоторые или все следующие признаки и симптомы:
- Усиливающаяся головная боль
- Рвота
- Сонливость и прогрессирующая потеря сознания
- Головокружение
- Путаница
- Неравный размер зрачка
- Невнятная речь
- Потеря подвижности (паралич) на стороне тела, противоположной травме головы
Чем больше крови наполняет ваш мозг или узкое пространство между мозгом и черепом, другие признаки и симптомы могут стать очевидными, например:
- Летаргия
- Изъятия
- Бессознательное состояние
Когда обращаться к врачу
Внутричерепная гематома может быть опасной для жизни и требовать неотложной помощи.
Немедленно обратитесь за медицинской помощью после удара по голове, если вы:
- Терять сознание
- Постоянно болит голова
- Рвота, слабость, нечеткость зрения, шаткость
Если признаки и симптомы не проявляются сразу после удара по голове, обратите внимание на физические, психические и эмоциональные изменения. Например, если после удара по голове кто-то выглядит здоровым и может говорить, но позже теряет сознание, немедленно обратитесь за медицинской помощью.
Также, даже если вы чувствуете себя хорошо, попросите кого-нибудь присмотреть за вами. Потеря памяти после удара по голове может заставить забыть об ударе. Кто-то, кого вы скажете, может с большей вероятностью распознать предупреждающие знаки и обратиться за медицинской помощью.
Причины
Травма головы — наиболее частая причина кровотечения внутри черепа. Травмы головы могут возникнуть в результате дорожно-транспортных происшествий, падений, нападений и спортивных травм на автомобиле или велосипеде.
У пожилых людей даже легкая травма головы может вызвать гематому. Это особенно верно, если вы принимаете разжижающие кровь лекарства или антиагреганты, такие как аспирин.
Вы можете получить серьезную травму, даже если нет открытой раны, синяка или других явных повреждений.
Существует три категории гематом — субдуральная гематома, эпидуральная гематома и внутримозговая (интрапаренхиматозная) гематома.
Субдуральная гематома
Это происходит, когда кровеносные сосуды — обычно вены — разрываются между вашим мозгом и самым внешним из трех слоев мембраны, покрывающих ваш мозг (твердой мозговой оболочкой).Вытекающая кровь образует гематому, которая давит на ткани мозга. Увеличивающаяся гематома может вызвать постепенную потерю сознания и, возможно, смерть.
Три типа субдуральных гематом:
- Острый. Этот наиболее опасный тип обычно возникает в результате тяжелой травмы головы, и признаки и симптомы обычно появляются немедленно.
- Подострый. Признаки и симптомы проявляются через некоторое время, иногда через несколько дней или недель после травмы.
- Хрон. Гематома этого типа является результатом менее серьезных травм головы и может вызывать медленное кровотечение, а появление симптомов может занять недели и даже месяцы. Возможно, вы не помните, как повредили голову. Например, удар головой при посадке в машину может вызвать кровотечение, особенно если вы принимаете разжижающие кровь лекарства.
Все три типа требуют медицинской помощи при появлении признаков и симптомов, чтобы можно было предотвратить необратимое повреждение головного мозга.
Риск субдуральной гематомы увеличивается с возрастом.Риск также выше для людей, которые:
- Принимать аспирин или другое разжижающее кровь лекарство ежедневно
- Злоупотребление алкоголем
Эпидуральная гематома
Этот тип, также называемый экстрадуральной гематомой, возникает, когда кровеносный сосуд — обычно артерия — разрывается между внешней поверхностью твердой мозговой оболочки и черепом. Затем кровь просачивается между твердой мозговой оболочкой и черепом, образуя массу, которая давит на ткань мозга. Самая частая причина эпидуральной гематомы — травма.
Некоторые люди с этим типом травм остаются в сознании, но большинство из них становятся сонными или впадают в кому с момента травмы. Эпидуральная гематома, поражающая артерию головного мозга, может быть смертельной без своевременного лечения.
Внутримозговая (интрапаренхимальная) гематома
Этот тип гематомы, также известный как интрапаренхиматозная гематома, возникает, когда кровь скапливается в тканях головного мозга. Причин может быть множество, в том числе травма, разрыв выпуклого кровеносного сосуда (аневризма), плохое соединение артерий и вен с рождения, высокое кровяное давление и опухоли.Заболевания могут вызывать спонтанную утечку крови в мозг. Травма головы может привести к множественным тяжелым внутримозговым гематомам.
Профилактика
Для предотвращения или минимизации травм головы:
- Наденьте шлем и убедитесь, что ваши дети носят шлемы. Надевайте соответствующий и правильно подогнанный шлем при занятиях контактными видами спорта, езде на велосипеде, мотоцикле, лыжах, верховой езде, катании на коньках, скейтборде, сноуборде или при выполнении любых действий, которые могут привести к травме головы.
- Пристегните ремень безопасности и убедитесь, что ваши дети пристегнуты. Делайте это каждый раз, когда вы управляете автомобилем или едете в автомобиле.
- Берегите маленьких детей. Всегда используйте правильно подогнанные автомобильные сиденья, столешницы и края столов, блокируйте лестницы, привязывайте тяжелую мебель или приборы к стене, чтобы предотвратить их опрокидывание, и не позволяйте детям забираться на небезопасные или неустойчивые предметы.
Внутримозговое кровоизлияние (ICH) — EMCrit Project
Вы здесь: Домашняя страница / IBCC / Внутримозговое кровоизлияние (ICH), Джош Фаркас
СОДЕРЖАНИЕ
патофизиология
(к оглавлению)
- Расширение гематомы
- Примерно у трети пациентов наблюдается увеличение размера гематомы после начального кровотечения.
- Когда это происходит, это обычно происходит в течение первых 6 часов (но это может произойти в течение ~ 48 часов у пациентов с коагулопатией).
- Цитотоксический отек вокруг гематомы усиливается в течение нескольких дней, прежде чем улучшиться.
- Внутричерепное давление может повыситься из-за массового действия кровоизлияния, а также скопления крови в желудочках (если гематома распространяется на желудочки).
дифференциальная диагностика и причины
(вернуться к содержанию)
Гипертоническое внутрипаренхиматозное кровоизлияние
- Расположение: Чаще всего базальные ганглии, таламус, внутренняя капсула, мост и мозжечок.
- Эпидемиология:
- Наиболее частая причина внутричерепного кровоизлияния.
- Факторы риска включают возраст, гипертонию и диабет.
- Расположение: Обычно дольчатая, иногда с субарахноидальным расширением или пальцеобразными выступами кровоизлияния (изображение ниже).
- Эпидемиология:
- Это наиболее частая причина крупозного кровоизлияния у пожилых людей с нормальным давлением.
- Часто провоцируется антикоагулянтами или тромболизисом.
- Типы включают:
- Артериовенозная мальформация (АВМ).
- Кавернозная мальформация.
- Дуральный артериовенозный свищ.
- Разрыв ягодной аневризмы ( может вызвать комбинацию субарахноидального и внутрипаренхиматозного кровоизлияния).
- Микотическая аневризма (может быть результатом эндокардита или бактериемии).
- Значение лечения: сосудистые мальформации часто требуют хирургической резекции и / или эмболизации с помощью интервенционной радиологии, чтобы избежать повторного кровотечения.
- Метастазы (особенно: почечно-клеточная карцинома, меланома, рак легких и хориокарцинома).
- Первичная опухоль ЦНС.
- Эпидемиология: чаще встречается при более крупных инфарктах (что может происходить из-за фибрилляции предсердий).
- Три типа (в порядке возрастания серьезности):
- Петехиальные кровоизлияния — очень маленькие кровоизлияния.
- Паренхиматозная гематома 1 типа: <30% пораженной ишемической территории, с минимальным массовым эффектом.
- Паренхиматозная гематома 2 типа: поражено> 30% территории ишемии, с масс-эффектом.
- Эпидемиология: Факторы риска включают гиперкоагуляцию, обезвоживание, беременность, параметрингеальную инфекцию, волчанку, воспалительные заболевания кишечника и заболевания щитовидной железы. (30938800) На их долю приходится 5% паренхиматозных кровотечений у более молодых пациентов
- Значение лечения: Может потребоваться трансвенозная тромбэктомия и / или антикоагулянты.
- Травма
- Расположение: Обычно нижнее лобное расположение и передний конец височной доли.
- Васкулит
- Эпидемиология: Обычно вызывается узелковым полиартериитом или волчанкой, но также может возникать при ANCA-васкулите, ревматоидном артрите, саркоидозе, лекарственном васкулите или пурпуре Шенлейна-Геноха.
- Болезнь Моямоя
- Кровоизлияние обычно происходит в базальных ганглиях.
КТ без контрастирования
(вернуться к содержанию)
диагностика
- КТ без контрастирования — это стандартный диагностический тест для быстрой оценки внутричерепного кровоизлияния.
- Объем гематомы можно определить как произведение диаметров на два (ABC / 2, см. Ниже).
- Объем> 60 мл предполагает худший прогноз (подробнее ниже).
- 🧮 Калькулятор MDCalc здесь .
- Определяется как относительно ослабленная область внутри гематомы, не связанная с прилегающей тканью мозга.
- Прогнозирует рост гематомы с чувствительностью 32% и специфичностью 94%.
- Показано ниже (вверху, вторая панель слева) вместе с другими потенциальными маркерами роста гематомы. (28289239)
- Расширение гематомы часто происходит в течение 6 часов (или дольше у пациентов, принимающих антикоагулянты).
- У пациентов без доступного неврологического обследования (например, из-за седативного эффекта) рассмотрите возможность повторной компьютерной томографии через 4-6 часов. Если развивается гидроцефалия, это может быть показанием к установке внешнего желудочкового дренажа (подробнее об этом ниже).
оценка основной этиологии
(назад к содержанию)
при подозрении на наличие внутричерепной сосудистой патологии 🧐
- Выявление основной сосудистой патологии потенциально важно, поскольку многие из этих поражений требуют специфической терапии.
- Факторы, увеличивающие вероятность наличия патологии сосудов, включают:
- (1) Результаты визуализации при неконтрастной компьютерной томографии
- Гематома расположена на за пределами типичного места гипертонического кровоизлияния.
- Уровень жидкости в гематоме (нижняя правая панель на рисунке выше).
- Изолированное внутрижелудочковое кровоизлияние.
- Кальцинированные или расширенные сосуды.
- Аномальная паренхима, окружающая гематому (e.g., отек больше, чем можно было ожидать).
- (2) Эпидемиологические заключения
- Младший возраст
- Женский пол
- Нет гипертонии в анамнезе
- Нет коагулопатии
- (1) Результаты визуализации при неконтрастной компьютерной томографии
- Это предварительный тест для оценки первопричины ICH из-за скорости и безопасности (особенно для причин, требующих более немедленного лечения).
- КТ-ангиография может быть полезна для обнаружения аневризмы или сосудистой мальформации.
- КТ-венография может быть полезна для диагностики тромбоза венозного синуса.
- КТ-ангиография и венография могут выполняться одновременно (CTAV).
- Прогнозирование риска разрастания гематомы
- Это не причина для проведения КТ-ангиографии, но, тем не менее, она может быть полезной.
- Знак пятна показывает утечку контраста в гематому (прогнозирование расширения с чувствительностью 51% и специфичностью 85%).
- ⚠️ Обратите внимание, что контрастный краситель не является нефротоксичным.Соответствующую визуализацию нельзя откладывать из-за почечной дисфункции.
- Обычно это не выполняется немедленно из-за логистических ограничений.
- МРТ может быть лучше для выявления определенных основных патологий:
- Опухоль
- Ишемический инсульт с геморрагической трансформацией
- Амилоидная ангиопатия с множественными скрытыми церебральными микрокровотечениями
- Основная гипертоническая микроангиопатия (может указываться на поражение белого вещества и небольшие лакунарные штрихи)
- МР-ангиография может отображать сосуды, так что это тоже можно рассмотреть (особенно, если КТ-ангиография не проводилась).
- Это окончательное исследование для оценки аневризмы, артериовенозной мальформации или васкулита.
- Это показано при высоком подозрении на сосудистую патологию (например, разрыв аневризмы). (31092052)
- Ангиография может быть как диагностической, так и терапевтической (при обнаружении аневризмы или артериовенозной мальформации некоторые из них могут быть немедленно эмболизированы).
Управление проходимостью дыхательных путей
(вернуться к содержанию)
- Для защиты дыхательных путей может потребоваться интубация. Однако две трети пациентов не нуждаются в интубации. (31092052)
- Нет утвержденных или четко определенных критериев для интубации — это клиническое заключение, основанное на обследовании и траектории.
- Необходимо соблюдать осторожность, чтобы избежать стимуляции и гипертонии, которые могут усугубить повышение внутричерепного давления.
реверсирование антикоагуляции
(вернуться к содержанию)
реверсивный антикоагулянт
- Тщательно оцените коагуляцию (включая лабораторные анализы и обзор лекарств).
- Функция тромбоцитов
- Тромбоцитопению следует лечить, чтобы по возможности поддерживать количество тромбоцитов> 100000.
- Переливание тромбоцитов не приносит пользы пациентам, получавшим аспирин или антитромбоцитарные препараты (исследование PATCH).(27178479)
- Терапевтические антикоагулянты (например, варфарин, NOAC) должны быть полностью отменены.
- Для получения дополнительной информации см. Главу, посвященную отмене антикоагуляции.
Управление артериальным давлением
(вернуться к содержанию)
теоретическое обоснование и риски
- Обоснование : Снижение артериального давления теоретически может уменьшить расширение гематомы. Ожидается, что это будет наиболее эффективным в период, когда гематома расширяется (обычно первые шесть часов, но потенциально дольше у пациентов с коагулопатией).
- Риски
- Неврологический: Пониженное артериальное давление может нарушить перфузию полутени, окружающей гематому. Это может вызвать некроз, что приведет к ухудшению отека и внутричерепного давления (что приведет к каскаду вторичных поражений головного мозга).
- Почечная недостаточность может возникнуть в результате чрезмерного снижения артериального давления.
- 📊 INTERACT-2 Испытание в 2013 г. (23713578)
- РКИ, в которых сравнивали целевое значение САД <140 мм и САД <180 мм в течение семидневного периода среди> 2800 пациентов в течение <6 часов с момента появления симптомов.
- Первичная конечная точка смерти или инвалидности через 90 дней не показала улучшения. Точно так же не было разницы в частоте разрастания гематомы (таблица выше).
- Было небольшое улучшение вторичной конечной точки (качества жизни) в группе, получавшей более агрессивное лечение. Однако, учитывая отсутствие разницы в разрастании гематом, эта изолированная вторичная конечная точка имеет сомнительное значение.
- Наиболее часто используемым гипотензивным средством был урапидил (альфа-блокатор), который может ограничивать возможность обобщения.
- Это исследование традиционно использовалось для обоснования целевого систолического АД <140 мм.
- 📊 Испытание ATACH-2 в 2016 г. (27276234)
- Это было дальнейшее исследование INTERACT-2, в котором также сравнивались целевые значения САД 110–140 мм и 140–180 мм.
- В этом исследовании использовался никардипин внутривенно, что могло больше напоминать типичные схемы практики.
- Не было преимущества более интенсивного снижения артериального давления (либо с точки зрения функциональных конечных точек, либо с точки зрения увеличения гематомы).
- Более агрессивное снижение АД увеличивало риск почечных нежелательных явлений (с 4% до 9%, p = 0,002).
- Рекомендации?
- 🛣 Американская кардиологическая ассоциация / Американская ассоциация инсультов (AHA / ASA) предлагают снижение систолического артериального давления ниже 140 мм. Однако эти рекомендации были написаны в 2015 году, за до до испытания ATACH-2. (26022637)
- 🛣 Рекомендации Американской кардиологической ассоциации / Американского колледжа кардиологов от 2017 года рекомендуют против при резком снижении систолического артериального давления ниже 140 мм (рисунок ниже).(2
54)
- Нижняя строка?
- Несмотря на неоднократные и убедительные исследования, нет никаких доказательств того, что более интенсивный контроль артериального давления может улучшить размер гематомы. Если более низкое кровяное давление не уменьшает размер гематомы, это может только навредить пациентам из-за неправильной перфузии сжатой ткани полутени.
- Ориентация на систолическое артериальное давление <180 мм согласуется с имеющимися доказательствами и последними рекомендациями (см. Ниже).(2
54)
- Если вы стремитесь к достижению систолического АД <180 мм, вы часто получаете систолическое АД около 140–160 мм, что хорошо.
- Если вы стремитесь к систолическому АД <140 мм, вы часто получаете систолическое АД около ~ 100-120 мм, что, вероятно, слишком мало.
- Перед тем, как начать прием гипотензивных средств, всегда убедитесь, что боль и беспокойство были должным образом устранены. . Особенно у интубированных пациентов гипертония может быть проявлением боли.Правильная анальгезия и седация могут иметь большое значение для снижения артериального давления.
- Инфузия никардипина или клевидипина — наиболее распространенный и эффективный метод лечения сильно повышенного артериального давления.
- Небольшие болюсы лабеталола можно использовать PRN, если артериальное давление немного выше целевого (например, 10-20 мг внутривенно каждые 15 минут).
нейрохирургические вмешательства
(вернуться к содержанию)
Хирургическая эвакуация гематомы при супратенториальном кровоизлиянии
- 📊 Пробная STITCH-I (15680453)
- РКИ с участием 1033 пациентов, рандомизированных для лечения, vs.ранняя хирургическая эвакуация гематомы.
- Результаты были почти идентичны между двумя группами. Однако у пациентов с гематомой, распространяющейся в пределах 1 см от кортикальной поверхности, наблюдалась незначительная тенденция к пользе хирургического вмешательства. Точно так же наблюдались тенденции к пользе раннего хирургического вмешательства среди пациентов с долевым кровоизлиянием и оценкой по шкале комы Глазго от 9 до 12.
- Пациенты с ICH> 1 см от кортикальной поверхности или GCS <9 имели тенденцию к ухудшению на при хирургическом вмешательстве.
- 📊 STITCH-II Пробная (23726393)
- РКИ с участием 601 пациента, у которых на основании результатов исследования STITCH-1 было предсказано получение максимальной пользы от операции (пациенты были в сознании, имели поверхностное кровотечение <1 см от кортикальной поверхности, объем кровотечения составлял 10-100 мл, и не было внутрижелудочкового кровоизлияния).
- Пациенты были рандомизированы для раннего хирургического вмешательства по сравнению с ранним консервативным подходом.
- Результаты были почти идентичны между двумя группами.
- Итог:
- Имеющиеся данные свидетельствуют об отсутствии пользы для ранней эвакуации гематомы. Некоторые пациенты из медицинской группы этих исследований действительно перешли в хирургическую руку из-за прогрессирующего ухудшения, поэтому операция может быть полезной в отдельных случаях с прогрессирующим ухудшением с течением времени.
- Хирургическое вмешательство или интервенционная радиология могут быть показаны при кровоизлиянии вторичного при определенных поражениях (например,g., артериовенозная мальформация или опухоль).
- Новые данные свидетельствуют о том, что малоинвазивная хирургия может быть более перспективной (с несколькими продолжающимися испытаниями).
- Мозжечок в некоторой степени уникален своим закрытым расположением. Набухание мозжечка грозит вызвать катастрофическое повреждение соседнего ствола мозга, что подразумевает большую выгоду для эвакуации гематомы в этом месте.
- РКИ не существует, поскольку эти пациенты были исключены из испытаний STITCH.
- Данные наблюдений свидетельствуют о пользе в следующих ситуациях:
- Гематома> 3 см в диаметре
- Массовый эффект, вызывающий сжатие ствола мозга
- Гидроцефалия вследствие обструкции желудочков
- Желудочковый дренаж может быть рассмотрен при гидроцефалии (например, из-за желудочкового расширения кровотечения).
- Идеальным кандидатом может быть пациент, который сначала чувствовал себя хорошо, а затем у него развилась гидроцефалия с неврологическим ухудшением.
- К сожалению, общие данные свидетельствуют о том, что желудочковый дренаж увеличивает выживаемость , а не увеличивает вероятность хорошего неврологического исхода. Это означает, что пациенты, чьи жизни были спасены путем установки дренажа, обычно имеют плохой неврологический исход. (10751114, 22732889)
другие вспомогательные меры
(вернуться к содержанию)
Профилактика судорожных припадков / ведение
- Профилактика судорог обычно не рекомендуется
- Приступы являются обычным явлением, с частотой ~ 20% у всех пациентов.
- Предыдущие данные не выявили преимуществ профилактического применения фенитоина, что может быть связано с многочисленными побочными эффектами фенитоина.
- Может ли быть полезной профилактика судорог с помощью более современных агентов (например, леветирацетама), остается неизвестным.
- Низкий порог для оценки припадка с непрерывной ЭЭГ
- ЭЭГ следует рассматривать у пациентов с нарушением сознания, которое не соответствует тому, что можно было бы ожидать на основании компьютерной томографии.
- Обследование также показано на основании любого анамнеза или клинических признаков припадка.
- Противоэпилептическая терапия показана пациенту с очевидным припадком или электроэнцефалографическим припадком.
- Любую лихорадку следует лечить агрессивно (например, назначением ацетаминофена по расписанию).
- Если лихорадка не поддается лечению жаропонижающими средствами, для достижения нормотермии можно использовать внешнее охлаждающее устройство (аналогично лечению пациента после ареста).
- Избегайте гипонатриемии или быстрого снижения натрия.
- Обычное использование гипертонического раствора не подтверждено доказательствами.
- Болюсы гипертонического раствора или гипертонического бикарбоната могут использоваться для управления повышенным внутричерепным давлением, в идеале в качестве моста к более окончательной терапии (например, наружный желудочковый дренаж).
- Прерывистое пневматическое сжатие следует использовать изначально для профилактики ТГВ.
- Гепарин для профилактики ТГВ обычно безопасен> 48 часов после первоначального кровотечения, если при повторной компьютерной томографии не наблюдалось увеличения гематомы. (1865215)
прогноз
(вернуться к содержанию)
общий прогноз
- Смертность высока: только половина пациентов живы через год и только ~ 30% живы через пять лет.
- Только ~ 20% пациентов в целом остаются живыми и самостоятельно функционируют через год.
- Объем гематомы> 60 мл
- Шкала комы Гласкова <8
- Глубокое или инфратенториальное местоположение
- Внутрижелудочковое расширение
- С возрастом
- 🧮 Здесь можно рассчитать с помощью MDCalc.
- Одним из слабых мест шкалы ICH является то, что она предназначена для прогнозирования выживаемости , а не независимой выживаемости или качества жизни.
- 🧮 Здесь можно рассчитать с помощью MDCalc.
- Оценивает вероятность функциональной независимости через 90 дней, потенциально более значимая конечная точка.
- В таблицах ниже представлены более подробные сведения о том, как рассчитывается и интерпретируется оценка. (18556582)
внутрижелудочковое кровоизлияние
(вернуться к содержанию)
дифференциальный диагноз
- Первичное внутрижелудочковое кровоизлияние
- Аневризма или артериовенозная мальформация
- Травма
- Антикоагулянт
- Опухоль сосудистого сплетения или поражение эпендимы
- Вторичное внутрижелудочковое кровоизлияние
- Внутрипаренхиматозное кровоизлияние с распространением в желудочки
- Дренаж показан при острой обструктивной гидроцефалии.
сводка
(вернуться к содержанию)
подкаст
(назад к содержанию)
Следуйте за нами в iTunes
вопросы и обсуждения
(вернуться к содержанию)
Чтобы эта страница была маленькой и быстрой, вопросы и обсуждение этого сообщения можно найти на другой странице здесь .
- Для большинства пациентов лучшим лечением является высококачественная поддерживающая терапия.Агрессивные вмешательства (например, вызывающие резкое падение артериального давления и «профилактическое» введение гипертонического раствора) могут принести больше вреда, чем пользы.
- Гематомы мозжечка могут угрожать сдавлением ствола мозга, а также гидроцефалией, поэтому эти пациенты потенциально получают наибольшую пользу от срочной хирургической эвакуации и / или дренажа желудочков.
- Стероид не помогает ICH. Не используйте стероиды у этих пациентов, если нет других показаний.
- 10751114 Nieuwkamp DJ, de Gans K, Rinkel GJ, Algra A.Лечение и исход тяжелого внутрижелудочкового расширения у пациентов с субарахноидальным или внутримозговым кровоизлиянием: систематический обзор литературы. Дж. Нейрол . 2000; 247 (2): 117-121. DOI: 10.1007 / pl00007792 [PubMed]
- 15680453 Mendelow AD, Gregson BA, Fernandes HM, et al. Раннее хирургическое вмешательство по сравнению с начальным консервативным лечением у пациентов со спонтанными супратенториальными внутримозговыми гематомами в Международном хирургическом испытании внутримозговых кровоизлияний (STICH): рандомизированное исследование. Ланцет . 2005; 365 (9457): 387-397. DOI: 10.1016 / S0140-6736 (05) 17826-X [PubMed]
- 18556582 Рост Н.С., Смит Е.Е., Чанг И и др. Прогнозирование функционального исхода у пациентов с первичным внутримозговым кровоизлиянием: оценка FUNC. Инсульт . 2008; 39 (8): 2304-2309. DOI: 10.1161 / STROKEAHA.107.512202 [PubMed]
- 1865215 Boeer A, Voth E, Henze T, Prange HW. Ранняя терапия гепарином у пациентов со спонтанным внутримозговым кровоизлиянием. J Neurol Neurosurg Psychiatry . 1991; 54 (5): 466-467. DOI: 10.1136 / jnnp.54.5.466 [PubMed]
- 22732889 Габерел Т., Магеру С., Эмери Эмери. Лечение нетравматического внутрижелудочкового кровоизлияния. Neurosurg Ред. . 2012; 35 (4): 485-495. DOI: 10.1007 / s10143-012-0399-9 [PubMed]
- 23713578 Андерсон К.С., Хили Э., Хуанг И. и др. Быстрое снижение артериального давления у пациентов с острым внутримозговым кровоизлиянием. N Engl J Med . 2013; 368 (25): 2355-2365.DOI: 10.1056 / NEJMoa1214609 [PubMed]
- 23726393 Mendelow AD, Gregson BA, Rowan EN, et al. Раннее хирургическое вмешательство по сравнению с начальным консервативным лечением у пациентов со спонтанными супратенториальными долевыми внутримозговыми гематомами (STICH II): рандомизированное исследование [опубликованные поправки опубликованы в Lancet. 2013 августа 3; 382 (9890): 396]. Ланцет . 2013; 382 (9890): 397-408. DOI: 10.1016 / S0140-6736 (13) 60986-1 [PubMed]
- 26022637 Hemphill JC 3rd, Greenberg SM, Anderson CS, et al.Рекомендации по ведению спонтанного внутримозгового кровоизлияния: Руководство для медицинских работников Американской кардиологической ассоциации / Американской ассоциации инсульта. Инсульт . 2015; 46 (7): 2032-2060. DOI: 10.1161 / STR.0000000000000069 [PubMed]
- 27178479 Бахароглу М.И., Кордонье С., Аль-Шахи Салман Р. и др. Переливание тромбоцитов в сравнении со стандартным лечением после острого инсульта из-за спонтанного церебрального кровоизлияния, связанного с антиагрегантной терапией (PATCH): рандомизированное открытое исследование фазы 3. Ланцет . 2016; 387 (10038): 2605-2613. DOI: 10.1016 / S0140-6736 (16) 30392-0 [PubMed]
- 27276234 Куреши А.И., Палеш Ю.Ю., Барсан В.Г. и др. Интенсивное снижение артериального давления у больных с острым кровоизлиянием в мозг. N Engl J Med . 2016; 375 (11): 1033-1043. DOI: 10.1056 / NEJMoa1603460 [PubMed]
- 28289239 Boulouis G, Morotti A, Charidimou A, Dowlatshahi D, Goldstein JN. Неконтрастные компьютерные томографические маркеры расширения внутримозгового кровоизлияния. Инсульт . 2017; 48 (4): 1120-1125. DOI: 10.1161 / STROKEAHA.116.015062 [PubMed]
- 30516598 Ziai WC, Carhuapoma JR. Внутримозговое кровоизлияние. Континуум (Миннеап Минн) . 2018; 24 (6): 1603-1622. DOI: 10.1212 / CON.0000000000000672 [PubMed]
- 30938800 Гросс Б.А., Янковиц Б.Т., Фридлендер Р.М. Церебральное внутрипаренхиматозное кровоизлияние: обзор. ЯМА . 2019; 321 (13): 1295-1303. DOI: 10.1001 / jama.2019.2413 [PubMed]
- 31092052 Рейес Р., Вишванатан М., Айягари В.Обновленная информация о нейрокритической помощи при внутримозговом кровоизлиянии. Эксперт Рев Нейротер . 2019; 19 (6): 557-578. DOI: 10.1080 / 14737175.2019.1618709 [PubMed]
- 31188036 Хостеттлер IC, Seiffge DJ, Werring DJ. Внутримозговое кровоизлияние: обновленная информация о диагностике и лечении. Эксперт Рев Нейротер . 2019; 19 (7): 679-694. DOI: 10.1080 / 14737175.2019.1623671 [PubMed]
Интернет-книга интенсивной терапии — это онлайн-учебник, написанный Джошем Фаркасом (@PulmCrit), доцентом кафедры легочной медицины и реанимации Университета Вермонта.
Спонтанное паренхиматозное кровоизлияние в мозг: подход к визуализации для радиолога отделения неотложной помощи
Broderick JP, Brott TG, Duldner JE, Tomsick T, Huster G (1993) Объем внутримозгового кровоизлияния. Мощный и простой в использовании предсказатель 30-дневной смертности. Ход 24 (7): 987–993. DOI: 10.1161 / 01.STR.24.7.987
CAS PubMed Статья Google Scholar
Huttner HB (2006) Сравнение метода оценки ABC / 2 с компьютерным планиметрическим анализом при внутримозговых паренхиматозных кровоизлияниях, связанных с варфарином.Ход 37 (2): 404–408. DOI: 10.1161 / 01.STR.0000198806.67472.5c
PubMed Статья Google Scholar
Котари РУ, Бротт Т., Бродерик Дж. П., Барсан В. Г., Зауэрбек Л. Р., Зуккарелло М., Хури Дж. (1996) Азбука измерения объемов внутримозговых кровоизлияний. Ход 27 (8): 1304–1305. DOI: 10.1161 / 01.STR.27.8.1304
CAS PubMed Статья Google Scholar
Amar AP (2012) Споры в нейрохирургическом лечении кровоизлияния и инфаркта мозжечка. Нейрохирург Фокус 32 (4): E1. DOI: 10.3171 / 2012.2.FOCUS11369
PubMed Статья Google Scholar
Куреши А.И., Менделов А.Д., Хэнли Д.Ф. (2009) Внутримозговое кровоизлияние. Ланцет 373 (9675): 1632–1644. DOI: 10.1016 / S0140-6736 (09) 60371-8
PubMed Central PubMed Статья Google Scholar
Balami JS, Buchan AM (2011) Осложнения внутримозгового кровоизлияния. Lancet Neurol 11 (1): 101–118. DOI: 10.1016 / S1474-4422 (11) 70264-2
Артикул Google Scholar
Venkatasubramanian C, Mlynash M, Finley-Caulfield A, Eyngorn I, Kalimuthu R, Snider RW, Wijman CA (2011) Естественная история перигематомного отека после внутримозгового кровоизлияния, измеренного с помощью серийной магнитно-резонансной томографии. Инсульт 42 (1): 73–80
PubMed Central PubMed Статья Google Scholar
Fewel ME, Thompson BG, Hoff JT (2003) Спонтанное внутримозговое кровоизлияние: обзор. Нейрохирург Фокус 15 (4): E1
PubMed Google Scholar
Murthy JM (2005) Декомпрессивная краниоэктомия с эвакуацией сгустка при гипертензивном внутримозговом кровоизлиянии большого полушария. [Neurocrit Care] — PubMed — NCBI
Zhu XL, Chan MS, Poon WS (1997) Спонтанное внутричерепное кровоизлияние: каким пациентам нужна диагностическая церебральная ангиография? Проспективное исследование 206 случаев и обзор литературы.Ход 28 (7): 1406–1409
CAS PubMed Статья Google Scholar
Delgado Almandoz JE, Schaefer PW, Forero NP, Falla JR, Gonzalez RG, Romero JM (2009) Диагностическая точность и результативность мультидетекторной КТ-ангиографии при оценке спонтанного внутрипаренхиматозного церебрального кровоизлияния. AJNR Am J Neuroradiol 30 (6): 1213–1221. DOI: 10.3174 / ajnr.A1546
CAS PubMed Статья Google Scholar
Сазерленд Г.Р., Ауэр Р.Н. (2006) Первичное внутримозговое кровоизлияние. J Clin Neurosci 13 (5): 511–517. DOI: 10.1016 / j.jocn.2004.12.012
PubMed Статья Google Scholar
Руис-Сандовал JL, Cantu C, Barinagarrementeria F (1999) Внутримозговое кровоизлияние у молодых людей: анализ факторов риска, локализации, причин и прогноза. Ход 30 (3): 537–541. DOI: 10.1161 / 01.STR.30.3.537
CAS PubMed Статья Google Scholar
Atlas SW, Grossman RI, Gomori JM, Hackney DB, Goldberg HI, Zimmerman RA, Bilaniuk LT (1987) Геморрагические внутричерепные злокачественные новообразования: спин-эхо МРТ. Радиология 164 (1): 71–77. DOI: 10.1148 / радиология.164.1.3588929
CAS PubMed Статья Google Scholar
Ливони Дж. П., МакГахан Дж. П. (1983) Уровни внутричерепной жидкости и крови у пациента с антикоагулянтом. Нейрорадиология 25 (5): 335–337
CAS PubMed Статья Google Scholar
Fang MC, Go AS, Chang Y, Hylek EM, Henault LE, Jensvold NG, Singer DE (2007) Смерть и инвалидность в результате внутричерепных и экстракраниальных кровоизлияний, связанных с варфарином. Am J Med 120 (8): 700–705. DOI: 10.1016 / j.amjmed.2006.07.034
PubMed Central PubMed Статья Google Scholar
Моррис Б.С., Нагар А.М., Морани А.С., Чаудхари Р.К., Гарг П.А., Чудгар П.Д., Раут А.А. (2007) Уровни жидкости в крови в головном мозге.Br J Radiol 80 (954): 488–498. DOI: 10.1259 / bjr / 56532933
CAS PubMed Статья Google Scholar
Хосравани Х., Майер С.А., Демчук А., Джахроми Б.С., Гладстон Д.Д., Флаэрти М., Бродерик Дж., Авив Р.И. (2013) Экстренная неинвазивная ангиография при остром внутримозговом кровоизлиянии. AJNR Am J Neuroradiol 34 (8): 1481–1487. DOI: 10.3174 / ajnr.A3296
CAS PubMed Статья Google Scholar
Davis SM, Broderick J, Hennerici M, Brun NC, Diringer MN, Mayer SA, Begtrup K, Steiner T., Рекомбинантный активированный фактор VIIIHTI (2006) Рост гематомы является определяющим фактором смертности и неблагоприятного исхода после внутримозгового кровоизлияния. Неврология 66 (8): 1175–1181. DOI: 10.1212 / 01.wnl.0000208408.98482.99
CAS PubMed Статья Google Scholar
Ондра С.Л., Труп Х., Джордж Э.Д., Шваб К. (1990) Естественная история симптоматических артериовенозных мальформаций головного мозга: оценка через 24 года.J Neurosurg 73 (3): 387–391. DOI: 10.3171 / jns.1990.73.3.0387
CAS PubMed Статья Google Scholar
Виллинский Р.А., Тейлор С.М., ТерБругге К., Фарб Р.И., Томлинсон Г., Монтанера В. (2003) Неврологические осложнения церебральной ангиографии: проспективный анализ 2899 процедур и обзор литературы. Радиология 227 (2): 522–528. DOI: 10.1148 / radiol.2272012071
PubMed Статья Google Scholar
Halpin SF, Britton JA, Byrne JV, Clifton A, Hart G, Moore A (1994) Проспективная оценка церебральной ангиографии и компьютерной томографии при церебральной гематоме. J Neurol Neurosurg Psychiatry 57 (10): 1180–1186
CAS PubMed Central PubMed Статья Google Scholar
Йунг Р., Ахмад Т., Авив Р.И., де Тилли Л.Н., Фокс А.Дж., Саймонс С.П. (2009) Сравнение CTA и DSA в определении этиологии спонтанного ICH.Can J Neurol Sci 36 (2): 176–180
PubMed Статья Google Scholar
Wong GKC, Siu DYW, Abrigo JM, Ahuja AT, Poon WS (2012) Компьютерная томографическая ангиография для пациентов с острым спонтанным внутримозговым кровоизлиянием. J Clin Neurosci 19 (4): 498–500. DOI: 10.1016 / j.jocn.2011.08.017
PubMed Статья Google Scholar
Li Q, Lv F, Yao G, Li Y, Xie P (2013) 64-секционная мультидетекторная КТ-ангиография для оценки внутричерепных аневризм: сравнение с трехмерной ротационной ангиографией.Acta Radiol. DOI: 10.1177 / 0284185113506138
Google Scholar
Yoon DY, Chang SK, Choi CS, Kim WK, Lee JH (2009) Многодетекторная рядная КТ-ангиография при спонтанном долевом внутримозговом кровоизлиянии: перспективное сравнение с традиционной ангиографией. AJNR Am J Neuroradiol 30 (5): 962–967. DOI: 10.3174 / ajnr.A1471
CAS PubMed Статья Google Scholar
Provenzale JM, Kranz PG (2011) Тромбоз твердой мозговой оболочки: источники ошибок в интерпретации изображений. AJR Am J Roentgenol 196 (1): 23–31. DOI: 10.2214 / AJR.10.5323
PubMed Статья Google Scholar
Thompson AL, Kosior JC, Gladstone DJ, Hopyan JJ, Symons SP, Romero F, Dzialowski I., Roy J, Demchuk AM, Aviv RI, Group PSICS (2009) Определение «точечного признака» КТ-ангиографии в первичное внутримозговое кровоизлияние.Can J Neurol Sci: J Can Sci Neurol 36 (4): 456–461
Статья Google Scholar
Wada R, Aviv RI, Fox AJ, Sahlas DJ, Gladstone DJ, Tomlinson G, Symons SP (2007) КТ-ангиография «Spot Sign» позволяет прогнозировать расширение гематомы при остром внутримозговом кровоизлиянии. Ход 38 (4): 1257–1262. DOI: 10.1161 / 01.STR.0000259633.59404.f3
PubMed Статья Google Scholar
Goldstein JN, Fazen LE, Snider R, Schwab K, Greenberg SM, Smith EE, Lev MH, Rosand J (2007) Экстравазация контраста при КТ-ангиографии предсказывает расширение гематомы при внутримозговом кровоизлиянии. Неврология 68 (12): 889–894. DOI: 10.1212 / 01.wnl.0000257087.22852.21
CAS PubMed Статья Google Scholar
Becker KJ, Baxter AB, Bybee HM, Tirschwell DL, Abouelsaad T, Cohen WA (1999) Экстравазация рентгенологического контраста является независимым предиктором смерти при первичном внутримозговом кровоизлиянии.Stroke 30 (10): 2025–2032. DOI: 10.1161 / 01.STR.30.10.2025
CAS PubMed Статья Google Scholar
Kim J, Smith A, Hemphill JC, Smith WS, Lu Y, Dillon WP, Wintermark M (2008) Экстравазация контраста на КТ предсказывает смертность при первичном внутримозговом кровоизлиянии. Am J Neuroradiol 29 (3): 520–525. DOI: 10.3174 / ajnr.A0859
CAS PubMed Статья Google Scholar
Li N, Wang Y, Wang W, Ma L, Xue J, Weissenborn K, Dengler R, Worthmann H, Wang DZ, Gao P, Liu L, Wang Y, Zhao X (2011) Экстравазация контраста на компьютерной томографической ангиографии предсказывает клиническую исход при первичном внутримозговом кровоизлиянии: проспективное исследование 139 случаев. Ход 42 (12): 3441–3446. DOI: 10.1161 / STROKEAHA.111.623405
PubMed Статья Google Scholar
Демчук А.М., Довлатшахи Д., MD DR-L, MD PCAM, MD YSB, MD ID, MD AK, MD J-MB, MD CL, MD GG, MD PVP, MD JR, MD PCSK, PhD JK, MD RB, BSc ST, MD SS, MD DJG, MD PMDH, MBChB RIA, группа ftPSICs (2012) Прогнозирование роста гематомы и исхода у пациентов с внутримозговым кровотечением с использованием точечного знака КТ-ангиографии (PREDICT): проспективный наблюдательный изучение.Lancet Neurol 11 (4): 307-314. DOI: 10.1016 / S1474-4422 (12) 70038-8
Брауэрс HB, Falcone GJ, McNamara KA, Ayres AM, Oleinik A, Schwab K, Romero JM, Viswanathan A, Greenberg SM, Rosand J, Goldstein JN (2012) Точечный знак CTA предсказывает расширение гематомы у пациентов с отсроченное обращение после внутримозгового кровоизлияния. Neurocrit Care 17 (3): 421–428. DOI: 10.1007 / s12028-012-9765-2
PubMed Central PubMed Статья Google Scholar
Morgenstern LB, Hemphill JC, Anderson C, Becker K, Broderick JP, Connolly ES, Greenberg SM, Huang JN, Macdonald RL, Messe SR, Mitchell PH, Selim M, Tamargo RJ, Nursing obotAHASCaCoC (2010) Руководство по управлению спонтанное внутримозговое кровоизлияние: руководство для медицинских работников Американской кардиологической ассоциации / Американской ассоциации инсульта. Ход 41 (9): 2108–2129. DOI: 10.1161 / STR.0b013e3181ec611b
PubMed Статья Google Scholar
Bradley WG Jr (1993) МРТ появление кровоизлияния в мозг. Радиология 189 (1): 15–26. DOI: 10.1148 / радиология.189.1.8372185
PubMed Статья Google Scholar
Атлас С.В., Марк А.С., Гроссман Р.И., Гомори Дж.М. (1988) Внутричерепное кровоизлияние: МРТ с градиентным эхом при 1,5 Тл. Сравнение со спин-эхо-визуализацией и клиническими применениями. Радиология 168 (3): 803–807. DOI: 10.1148 / радиология.168.3.3406410
CAS PubMed Статья Google Scholar
Чавхан Г.Б., Бабин П.С., Томас Б., Шрофф М.М., Хааке Е.М. (2009) Принципы, методы и приложения МРТ на основе Т2 * и ее специальные приложения. Радиография 29 (5): 1433–1449. DOI: 10.1148 / rg.295095034
PubMed Central PubMed Статья Google Scholar
Wang QT, Tuhrim S (2012) Этиология внутримозговых гематом. Curr Atheroscler Rep 14 (4): 314–321. DOI: 10.1007 / s11883-012-0253-0
PubMed Статья Google Scholar
Блитштейн М.К., Тунг Г.А. (2007) МРТ церебральных микрокровоизлияний. Am J Roentgenol 189 (3): 720–725. DOI: 10.2214 / AJR.07.2249
Артикул Google Scholar
Соффер Д. (2006) Церебральная амилоидная ангиопатия — заболевание или возрастное состояние. Israel Med Assoc J: IMAJ 8 (11): 803–806
CAS PubMed Google Scholar
Гринберг С.М., Верноой М.В., Кордонье С., Вишванатан А., Аль-Шахи Салман Р., Варах С., Лаунер Л.Дж., Ван Бучем М.А., Бретелер М.М. (2009) Церебральные микрокровоизлияния: руководство по обнаружению и интерпретации.Lancet Neurol 8 (2): 165–174. DOI: 10.1016 / S1474-4422 (09) 70013-4
PubMed Central PubMed Статья Google Scholar
Vernooij MW, van der Lugt A, Ikram MA, Wielopolski PA, Niessen WJ, Hofman A, Krestin GP, Breteler MM (2008) Распространенность и факторы риска церебральных микрокровоизлияний: исследование Rotterdam Scan. Неврология 70 (14): 1208–1214. DOI: 10.1212 / 01.wnl.0000307750.41970.d9
CAS PubMed Статья Google Scholar
Woo D, Sauerbeck LR, Kissela BM, Khoury JC, Szaflarski JP, Gebel J, Shukla R, Pancioli AM, Jauch EC, Menon AG, Deka R, Carrozzella JA, Moomaw CJ, Fontaine RN, Broderick JP (2002) Genetic and Факторы экологического риска внутримозгового кровоизлияния: предварительные результаты популяционного исследования. Инсульт 33 (5): 1190–1195
PubMed Статья Google Scholar
Отличить геморрагический инфаркт от паренхиматозного внутримозгового кровоизлияния
Дифференцировать геморрагический инфаркт от паренхиматозного внутримозгового кровоизлияния может быть затруднительно.Немедленное и долгосрочное лечение этих двух состояний различаются, и поэтому важен точный диагноз. Используя серию случаев внутримозговых кровоизлияний, представленных нашему инсультному отделению, мы стремимся выделить ключи, которые могут быть полезны для различения этих двух сущностей. Основным признаком наличия геморрагического инфаркта на компьютерной томографии является топографическое распределение инсульта. Дополнительные методы визуализации, такие как компьютерная томография, ангиограмма, перфузия и магнитно-резонансная томография, могут предоставить дополнительную информацию для дифференциации геморрагического инфаркта от первичных кровотечений.
1. Введение
При остром инсульте дифференциальный диагноз кровотечения, обнаруженного при компьютерной томографии (КТ), варьируется от геморрагического инфаркта (HI), первичного внутримозгового кровоизлияния (ICH) до кровотечения из венозного инфаркта. Различить первые два состояния может быть сложно, и в настоящее время нет радиологических критериев, которые помогли бы в этом отношении. Поэтому неудивительно, что предыдущие исследователи не пришли к согласию в постановке диагноза HI или ICH [2].
HI, или геморрагическая трансформация инфаркта, встречается примерно в одной трети случаев ишемического инсульта [3]. Когда за инфарктом сразу следует возникновение петехиального кровотечения на той же артериальной территории, диагноз HI ставится легко. Однако, когда визуализация головного мозга откладывается после появления у пациента симптомов инсульта, может быть поставлен ошибочный диагноз ВЧГ, если кровоизлияние на КТ выглядит сливным. Этот вопрос о неправильной диагностике ГИ недавно был поднят другими исследователями и может частично быть причиной завышенной оценки распространенности ВКГ [4].Правильная постановка диагноза имеет решающее значение для ведения как неотложного, так и долгосрочного лечения, а также для оценки прогноза. Пациенты с ишемическим инсультом более склонны к развитию повторного ишемического инсульта, чем ICH. Антиагрегантная терапия является основной терапией для этой группы пациентов. Аналогичным образом, обнаружение HI и фибрилляции предсердий предполагает, что механизмом инсульта является кардиоэмболия, и необходимо учитывать антикоагулянтную терапию. Кроме того, также было высказано предположение, что некоторые случаи «ICH» у пациентов, принимающих антикоагулянты, на самом деле могут быть HI и, таким образом, представлять «неэффективность антикоагуляции», а не индуцированную антикоагулянтами ICH [5].
2. Клинические факторы и механизм HI
HI чаще встречается у пожилых пациентов и пациентов с более крупными инфарктами [6]. Среди пациентов, получающих тромболитическую терапию, это чаще встречается у пациентов с сахарным диабетом и гипертонией [7, 8]. Это также было связано с эндартерэктомией сонной артерии [9] и стентированием сонной артерии.
HI обычно возникает в течение 1-2 недель после начала инсульта, реже (~ 9%) в первые 24 часа [6]. Возникновение плотной гематомы, осложняющей ГИ, может быть даже ниже — примерно 3% [6].Было высказано предположение, что механизм HI связан с разрушением базальной пластинки микрососудов, связанным с активностью матриксной металлопротеиназы [10]. Это может быть следствием длительной ишемии и усугубляться реканализацией закупоренной артерии. Было высказано предположение, что тканевой активатор плазминогена (tPA) может усугубить этот процесс, но спонтанная внутриинфарктная гематома также может возникать в отсутствие тромболизиса [11].
3. Распознавание HI на КТ
Классификация HI, основанная на топографии и интенсивности кровотечения на КТ, ранее была предложена Moulin et al.в 1993 г. [1]: 1-й тип — мультифокальный или петехиальный геморрагический инфаркт и 2-й тип — внутриинфарктная гематома. Внешний вид последнего может имитировать ICH на компьютерной томографии. Тщательное наблюдение за глубокими структурами, вовлеченными в поражение при инсульте, и топографией окружающей гипоплотности может помочь в постановке правильного диагноза.
ICH, вовлекающий хвостатое ядро, встречается редко [12, 13] (рисунки 1 и 2), и вовлечение как хвостатого ядра, так и скорлупы может указывать на эмболию, поражающую лентикулостриатные артерии и геморрагический инфаркт стриатокапсулярной области (рисунки 3, 4 и 5).Петехиальное кровотечение после внутривенного тромболизиса легко распознать, поскольку перед тромболизисом всегда проводится базовая компьютерная томография. Первоначальная компьютерная томография может также показать сопутствующие признаки ишемии, такие как признак гиперплотной средней мозговой артерии (СМА) и потеря ленты островка (рис. 6).
Гиподенсная область отека, окружающая гематому при ICH, обычно излучается центростремительно и не соответствует топографии артериальной территории. Аналогичная картина отека наблюдается при кровотечениях в результате венозного инфаркта (Рисунки 7 и 8).У пациентов с ГИ гиподенсные области, окружающие гематому, могут достигать кортикальной поверхности и распространяться далеко от центра гематомы (рисунки 9, 10 и 11). Топография этой гиподенсированной области обычно повторяет пораженную сосудистую территорию. Карты зоны инфаркта MCA [14] и задней мозговой артерии (PCA) [15] были недавно опубликованы и могут быть использованы для определения территориальной принадлежности инсульта. Центр гематомы в случаях HI, по-видимому, соответствует областям с наибольшим риском инфаркта на карте инфаркта.Например, на территории СМА областью риска является стриатокапсулярная область, а на территории ЗПМ — медиальная височная и затылочная доли.
4. Особенности МРТ-визуализации HI
Характеристики магнитно-резонансной (МРТ) визуализации HI при диффузионно-взвешенной визуализации (DWI) имеют смешанный вид. Внутри геморрагической области вид между HI и ICH неотличим. Однако о наличии ишемического процесса могут свидетельствовать отдельные участки ограниченной диффузии, удаленные от геморрагической области (рис. 12–14).Эти поражения еще больше увеличивают вероятность того, что первичное поражение является HI.
Времяпролетная МР-ангиография может показать наличие окклюзионного внутричерепного заболевания и, следовательно, помочь в подтверждении диагноза HI (рисунки 13-14). МРТ-томография перфузии, хотя и не является широко доступной, может помочь в диагностике HI, если она показывает наличие дефицита перфузии, выходящего за пределы области гематомы. При ICH область дефицита перфузии не выходит за пределы ICH [16].
Наличие «микрокровоизлияний» на последовательности градиент-эхо (GRE) или визуализации, взвешенной по чувствительности (SWI), предполагает присутствие продукта крови, но не обязательно указывает на то, что рассматриваемое поражение является HI или ICH [17].Было установлено, что у пожилых пациентов у некоторых пациентов с ишемическим инсультом также могут быть признаки тихого микрокровотечения. Долевые ICH имеют тенденцию располагаться кзади, что соответствует распределению микрокровоизлияний и месту связывания амилоидного индикатора в исследованиях ПЭТ [18].
5. Роль КТ-ангиографии и перфузии
КТ-ангиография (КТА) часто используется в качестве скринингового инструмента для исключения возможности аневризматического кровотечения. Его также можно использовать для одновременной оценки возможности артериальной окклюзии и потенциальной внутриартериальной терапии.

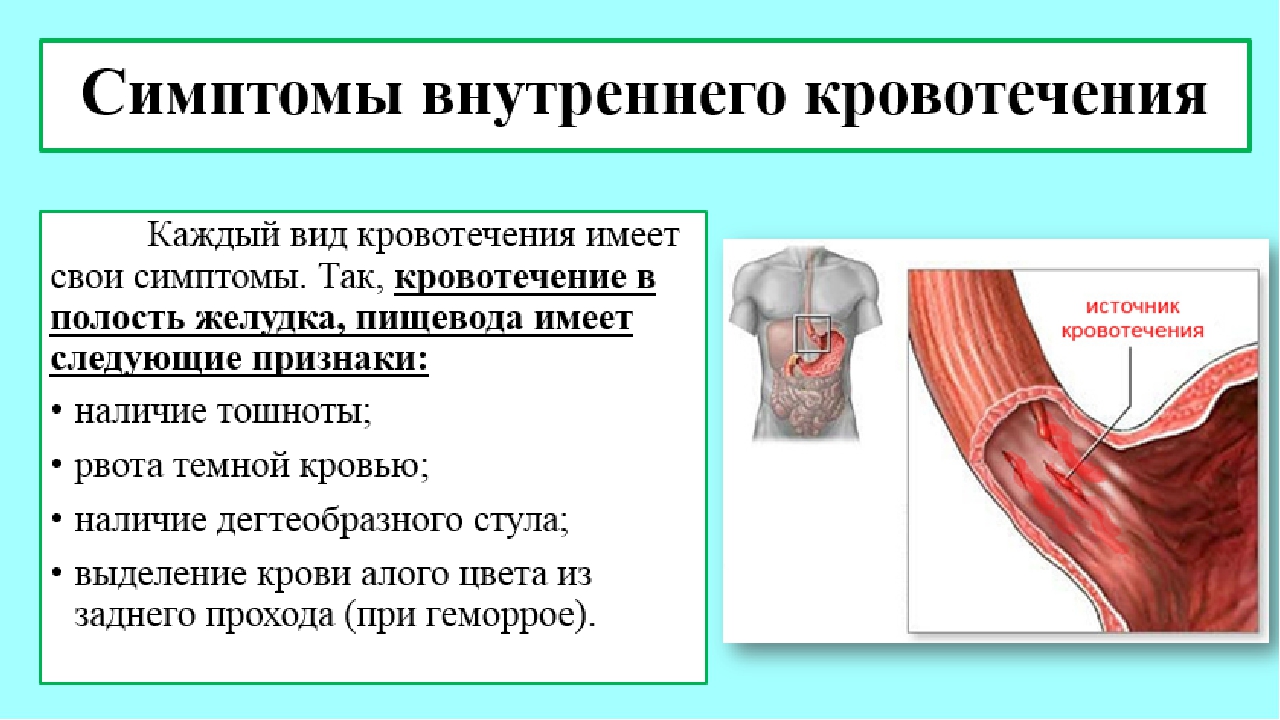 , Маслякова Г.Н., Капралов С.В., Урядов С.Е., Иванов Р.Ю., Гришаев В.А. Лазерная фотокоагуляция кровоточащей язвы желудка и двенадцатиперстной кишки. Хирургия. Журнал им. Н.И. Пирогова 2006; 5: 23–25.
, Маслякова Г.Н., Капралов С.В., Урядов С.Е., Иванов Р.Ю., Гришаев В.А. Лазерная фотокоагуляция кровоточащей язвы желудка и двенадцатиперстной кишки. Хирургия. Журнал им. Н.И. Пирогова 2006; 5: 23–25. По возможности ввести в носовые ходы ватные шарики, смоченные гемостатическими средствами местного действия. Вызвать скорую помощь.
По возможности ввести в носовые ходы ватные шарики, смоченные гемостатическими средствами местного действия. Вызвать скорую помощь.