Коагуляция — Medside.ru
Закрыть- Болезни
- Инфекционные и паразитарные болезни
- Новообразования
- Болезни крови и кроветворных органов
- Болезни эндокринной системы
- Психические расстройства
- Болезни нервной системы
- Болезни глаза
- Болезни уха
- Болезни системы кровообращения
- Болезни органов дыхания
- Болезни органов пищеварения
- Болезни кожи
- Болезни костно-мышечной системы
- Болезни мочеполовой системы
- Беременность и роды
- Болезни плода и новорожденного
- Врожденные аномалии (пороки развития)
- Травмы и отравления
- Симптомы
- Системы кровообращения и дыхания
- Система пищеварения и брюшная полость
- Кожа и подкожная клетчатка
- Нервная и костно-мышечная системы
- Мочевая система
- Восприятие и поведение
- Речь и голос
- Общие симптомы и признаки
- Отклонения от нормы
- Диеты
- Снижение веса
- Лечебные
- Быстрые
- Для красоты и здоровья
- Разгрузочные дни
- От профессионалов
- Монодиеты
- Звездные
- На кашах
- Овощные
- Детокс-диеты
- Фруктовые
- Модные
- Для мужчин
- Набор веса
- Вегетарианство
- Национальные
- Лекарства
- Антибиотики
- Антисептики
- Биологически активные добавки
- Витамины
- Гинекологические
- Гормональные
- Дерматологические
- Диабетические
- Для глаз
- Для крови
- Для нервной системы
- Для печени
- Для повышения потенции
- Для полости рта
- Для похудения
- Для суставов
- Для ушей
- Желудочно-кишечные
- Кардиологические
- Контрацептивы
- Мочегонные
- Обезболивающие
- От аллергии
- От кашля
- От насморка
- Повышение иммунитета
- Противовирусные
- Противогрибковые
- Противомикробные
- Противоопухолевые
- Противопаразитарные
- Противопростудные
- Сердечно-сосудистые
- Урологические
- Другие лекарства
- Врачи
- Клиники
- Справочник
- Аллергология
- Анализы и диагностика
- Беременность
- Витамины
- Вредные привычки
- Геронтология (Старение)
- Дерматология
- Дети
- Женское здоровье
- Инфекция
- Контрацепция
- Косметология
- Народная медицина
- Обзоры заболеваний
- Обзоры лекарств
- Ортопедия и травматология
- Питание
- Пластическая хирургия
- Процедуры и операции
- Психология
- Роды и послеродовый период
- Сексология
- Стоматология
- Травы и продукты
- Трихология
- Другие статьи
- Словарь терминов
- [А] Абазия .. Ацидоз
- [Б] Базофилы .. Булимия
- [В] Вазектомия .. Выкидыш
- [Г] Галлюциногены .. Грязи лечебные
- [Д] Дарсонвализация .. Дофамин
- [Е] Еюноскопия
- [Ж] Железы .. Жиры
- [З] Заместительная гормональная терапия
- [И] Игольный тест .. Искусственная кома
- [К] Каверна .. Кумарин
- [Л] Лапароскоп .. Лучевая терапия
- [М] Магнитотерапия .. Мутация
- [Н] Наркоз .. Нистагм
- [О] Общий анализ крови .. Отек
- [П] Паллиативная помощь .. Пульс
- [Р] Реабилитация .. Родинка (невус)
- [С] Секретин .. Сыворотка крови
- [Т] Таламус .. Тучные клетки
|
Фактор, номер или название |
Синоним |
Значение |
|
Плазменные факторы коагуляции |
|||
|
I |
Фибриноген |
Предшественник фибрина |
|
|
II |
Протромбин |
Предшественника тромбина в коагуляции, который конвертирует фибриноген в фибрин, активирует факторы V, VIII, XI и XIII, связывается с тромбомодулином для активации протеина С Витамин К-зависимый |
|
|
V |
Проакцелерин |
Активируется в фактор Va — кофактор фермента Ха в коаггуляции, который в комплексе Xa/Va/фосфолипидный комплекс конвертирует протромбин в тромбин Присутствует в α гранулах в тромбоцитах. В системе коагуляции фактор Va инактивируется активированным протеином С в комплексе с белком S. Витамин K-зависимый |
|
|
VII |
Проконвертин |
При коагуляции связывается с тканевым фактором и конвертируется в активную форму. Комплекс VIIa/тканевый фактор активирует IX и X факторы. Эндопептидаза с остатками GLA .Витамин K-зависимый |
|
|
VIII |
Антигемофильный глобулин |
В активной форме VIIIa в коагуляции выполняет роль кофактора фермента IXa. Комплекс IXa/VIIIa/фосфолипиды активирует фактор X. Фактор VIIIa инактивируется активированным протеином С в комплексе с белком S (как фактор Va). Это большой белок кофактор коагуляции (как и фактор V) Циркулирует в плазме связанным с мультимером фактором Виллебранда |
|
|
IX |
Кристмас фактор, антигемофильный фактор В, плазменный компонент тромбопластина (PTC) |
Активная форма фактора IXa, как фермент при коагуляции он включается в комплекс IXa/VIIIa/фосфолипид, активирующий фактор X. Витамин К-зависимый |
|
|
X |
фактор Стюарт-Прауэра |
Активная форма фактора Xa, который является ферментом , в составе комплекса Xa/Va/фосфолипид в системе свертывания расщепляет протромбин до тромбина. Витамин К-зависимый |
|
|
XI |
Плазменный предшественник тромбопластина |
Активная форма фактора XIa, который при коагуляции активирует фактор IX, в реакции требуются ионы Са2+ |
|
|
Прекалликреин |
фактор Флетчера |
При коагуляции активируется фактором XIIа в калликреин. Как фермент калликреин в при коагуляции катализирует дальнейшую активацию фактора XII в фактор XIIa. Циркулирует как биомолекулярный комплекс с ВМК |
|
|
Высокомолекулярный кининоген (ВМК) |
Фактор Фицджеральда-Фложе |
Циркулирует как биомолекулярный комплекс с прекалликреином Кофактор контактной активации коагуляции, Co-фактор активации калликреина и активации фактора XII, необходимый кофактор XIIa в активации XI, предшественник брадикинина (мощный сосудорасширяющий фактор и индуктор сокращения гладких мышц |
|
|
XII |
Фактор Хагемана |
При коагуляции активируется на контактной поверхности в фактор XIIa, активируют прекалликреин и фактор XI в калликреин и фактор XIа – in vitro триггеры, внутреннего пути свертывания крови |
|
|
XIII |
Фибрин стабилизирующий фактор (фибриназа) |
При активации тромбином, катализирует образование пептидных связей между соседними мономерами фибрина, что способствует укреплению и стабилизации фибринового сгустка при коагуляции |
|
|
Протеин C |
|
При коагуляции активируется тромбином, связанным с тромбомодулином, в присутствии белка S и фосфолипидов как кофакторов, расщепляет VIIIa и Va, препятствуя, таким образом, образованию тромбина. Витамин К-зависимый |
|
|
Протеин S |
|
Циркулирует в плазме в качестве свободного белка S и как белка S, связанного с C4b – белка системы комплемента. Функционирует в свободной форме и в качестве кофактора для активированного протеина C. Витамин К-зависимый |
|
|
Протеин Z |
|
Не обладает ферментативной активностью, структурно связан с карбоксиглутаматными остатками нескольких сериновых протеаз каскада свертывания: факторы VII, IX и X (которые требуют витамин К). По-видимому, основная роль белка Z – деградация фактора Ха. Белок Z связывает ингибитор протеазы Ха фактора. Данные о роли в гемостазе противоречивы. |
|
Фосфолипиды |
|||
|
Тканевый фактор |
Тканевый тромбопластин |
Липопротеин, который конститутивно присутствует на мембране клеток определенных тканей, в том числе периваскулярных фибробластов, клетках граничного эпителия (например, в эпителиальных клетках кожи, амниона, ЖКТ, МПТ, а также глиальных клетках нервной системы). При патологических состояниях может экспрессироваться на активированных моноцитах и макрофагах и активированном эндотелии сосудов Присутствует на некоторых опухолевых клетках Связывает фактор VIIa, который инициирует внешний путь коагуляции. |
|
|
Фосфолипиды в системе коагуляции |
|
Кислые фосфолипиды (в первую очередь фосфатидил серин), представленные на поверхности активированных тромбоцитов и других клеток тканей. При коагуляции являются составной частью комплексов IXa/VIIIa/фосфолипид – активатор фактора X и Xa/Va/фосфолипид – активатор протромбина. Функционируют как липидная часть тканевого тромбопластина. |
|
|
Тромбомодулин (ТМ) |
|
Является поверхностным белком эндотелиальных клеток, при коагуляции связывает тромбин; в комплексе с ТМ тромбин теряет активность, но связывается с протеином С и активирует его. |
|
Свёртывание крови — это… Что такое Свёртывание крови?
Свертывание крови – это важнейший этап работы системы гемостаза, отвечающей за остановку кровотечения при повреждении сосудистой системы организма. Свертыванию крови предшествует стадия первичного сосудисто-тромбоцитарного гемостаза. Этот первичный гемостаз почти целиком обусловлен сужением сосудов и механической закупоркой агрегатами тромбоцитов места повреждения сосудистой стенки. Характерное время для первичного гемостаза у здорового человека составляет 1-3 мин. Свёртывание крови (гемокоагуляция, коагуляция, плазменный гемостаз, вторичный гемостаз) — сложный биологический процесс образования в крови нитей белка фибрина, который полимеризуется и образует тромбы, в результате чего кровь теряет текучесть, приобретая творожистую консистенцию. Свертывание крови у здорового человека происходит локально, в месте образования первичной тромбоцитарной пробки. Характерное время образования фибринового сгустка – около 10 мин.
Физиология
Фибриновый сгусток, полученный путем добавления тромбина в цельную кровь. Сканирующая электронная микроскопия.Процесс гемостаза сводится к образованию тромбоцитарно-фибринового сгустка. Условно его разделяют на три стадии[1]:
- Временный (первичный) спазм сосудов;
- Образование тромбоцитарной пробки за счёт адгезии и агрегации тромбоцитов;
- Ретракция (сокращение и уплотнение) тромбоцитарной пробки.
Повреждение сосудов сопровождается немедленной активацией тромбоцитов. Адгезия (прилипание) тромбоцитов к волокнам соединительной ткани по краям раны обусловлена гликопротеином фактором Виллебранда[2]. Одновременно с адгезией наступает агрегация тромбоцитов: активированные тромбоциты присоединяются к поврежденным тканям и к друг другу, формируя агрегаты, преграждающие путь потере крови. Появляется тромбоцитарная пробка[1]
Из тромбоцитов, подвергшихся адгезии и агрегации, усиленно секретируются различные биологически активные вещества (АДФ, адреналин, норадреналин и др.), которые приводят к вторичной, необратимой агрегации. Одновременно с высвобождением тромбоцитарных факторов происходит образование тромбина[1], который воздействует на фибриноген с образованием сети фибрина, в которой застревают отдельные эритроциты и лейкоциты – образуется так называемый тромбоцитарно-фибриновый сгусток (тромбоцитарная пробка). Благодаря контрактильному белку тромбостенину тромбоциты подтягиваются друг к другу, тромбоцитарная пробка сокращается и уплотняется, наступает её ретракция[1].
Процесс свёртывания крови
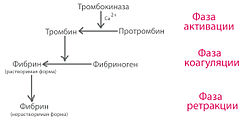 Классическая схема свёртывания крови по Моравицу (1905 год)
Классическая схема свёртывания крови по Моравицу (1905 год) 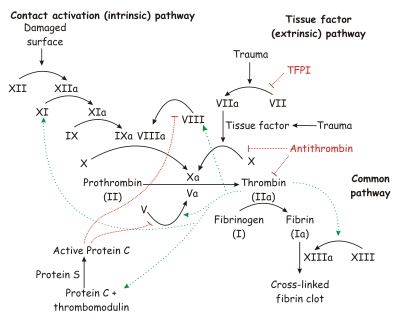
Процесс свёртывания крови представляет собой преимущественно проферментно-ферментный каскад, в котором проферменты, переходя в активное состояние, приобретают способность активировать другие факторы свёртывания крови[1]. В самом простом виде процесс свёртывания крови может быть разделён на три фазы:
- фаза активация включает комплекс последовательных реакций, приводящих к образованию протромбиназы и переходу протромбина в тромбин;
- фаза коагуляции — образование фибрина из фибриногена;
- фаза ретракции — образование плотного фибринового сгустка.
Данная схема была описана ещё в 1905 году[3] Моравицем и до сих пор не утратила своей актуальности [4].
В области детального понимания процесса свертывания крови с 1905 года произошел значительный прогресс. Открыты десятки новых белков и реакций, участвующих в процессе свертывания крови, который имеет каскадный характер. Сложность этой системы обусловлена необходимостью регуляции данного процесса. Современное представление каскада реакций, сопровождающих свертывание крови, представлено на рис. 2 и 3. Вследствие разрушения тканевых клеток и активации тромбоцитов высвобождаются белки фосфолипопротеины, которые вместе с факторами плазмы Xa и Va, а также ионами Ca2+ образуют ферментный комплекс, который активирует протромбин. Если процесс свёртывания начинается под действием фосфолипопротеинов, выделяемых из клеток повреждённых сосудов или соединительной ткани, речь идёт о внешней системе свёртывания крови (внешний путь активации свертывания, или путь тканевого фактора). Основными компонентами этого пути являются 2 белка: фактор VIIа и тканевый фактор, комплекс этих 2 белков называют также комплексом внешней теназы.
Если же инициация происходит под влиянием факторов свёртывания, присутствующих в плазме, используют термин внутренняя система свёртывания. Комплекс факторов IXа и VIIIa, формирующийся на поверхности активированных тромбоцитов, называют внутренней теназой. Таким образом, фактор X может активироваться как комплексом VIIa—TF (внешняя теназа), так и комплексом IXa—VIIIa (внутренняя теназа). Внешняя и внутренняя системы свертывания крови дополняют друг друга[3].
В процессе адгезии форма тромбоцитов меняется — они становятся округлыми клетками с шиповидными отростками. Под влиянием АДФ (частично выделяется из повреждённых клеток) и адреналина способность тромбоцитов к агрегации повышается. При этом из них выделяются серотонин, катехоламины и ряд других веществ. Под их влиянием происходит сужение просвета повреждённых сосудов, возникает функциональная ишемия. В конечном итоге сосуды перекрываются массой тромбоцитов, прилипших к краям коллагеновых волокон по краям раны[3].
На этой стадии гемостаза под действием тканевого тромбопластина образуется тромбин. Именно он инициирует необратимую агрегацию тромбоцитов. Реагируя со специфическими рецепторами в мембране тромбоцитов, тромбин вызывает фосфорилирование внутриклеточных белков и высвобождение ионов Ca2+.
При наличии в крови ионов кальция под действием тромбина происходит полимеризация растворимого фибриногена (см. фибрин) и образование бесструктурной сети волокон нерастворимого фибрина. Начиная с этого момента в этих нитях начинают фильтроваться форменные элементы крови, создавая дополнительную жёсткость всей системе, и через некоторое время образуя тромбоцитарно-фибриновый сгусток (физиологический тромб), который закупоривает место разрыва, с одной стороны, предотвращая потерю крови, а с другой — блокируя поступление в кровь внешних веществ и микроорганизмов. На свёртывание крови влияет множество условий. Например, катионы ускоряют процесс, а анионы — замедляют. Кроме того, существуют вещества как полностью блокирующие свёртывание крови (гепарин, гирудин и т. д.), так и активирующие его (яд гюрзы, феракрил).
Врождённые нарушения системы свёртывания крови называют гемофилией.
Методы диагностики свертывания крови
Все многообразие клинических тестов свертывающей системы крови можно разделить на 2 группы:[5] глобальные (интегральные, общие) тесты и «локальные» (специфические) тесты. Глобальные тесты характеризуют результат работы всего каскада свертывания. Они подходят для диагностики общего состояния свертывающей системы крови и выраженности патологий, с одновременным учетом всех привходящих факторов влияний. Глобальные методы играют ключевую роль на первой стадии диагностики: они дают интегральную картину происходящих изменений в свертывающей системе и позволяют предсказывать тенденцию к гипер- или гипокоагуляции в целом. «Локальные» тесты характеризуют результат работы отдельных звеньев каскада свертывающей системы крови, а также отдельных факторов свертывания. Они незаменимы для возможного уточнения локализации патологии с точностью до фактора свертывания. Для получения полной картины работы гемостаза у пациента врач должен иметь возможность выбирать, какой тест ему необходим.
Глобальные тесты:
«Локальные» тесты:
Все методы, измеряющие промежуток времени с момента добавления реагента (активатора, запускающего процесс свертывания) до формирования фибринового сгустка в исследуемой плазме, относятся к клоттинговым методам (от англ. «сlot» – сгусток).
См. также
Примечания
- ↑ 1 2 3 4 5 Кузник Б. И. 6.4 Система гемостаза // Физиология человека / Под редакцией В. М. Покровского, Г. Ф. Коротько. — М.:: Медицина, 2000. — Т. 1. — С. 313—325. — 448 с. — 3000 экз. — ISBN 5-225-00960-3
- ↑ Walsh P. N. Platelet-mediated coagulant protein interactions in hemostasis // Semin. Hematol. — 1985. — № 22 (3). — С. 178—186. — PMID 3898383.
- ↑ 1 2 3 Х. Вайс, В. Елькманн Глава 18. Функции крови. Раздел 6. Остановка кровотечения и свёртывание крови // Физиология человека / Под редакцией Р. Шмидта и Г. Тевса. — М.:: «Мир», 1996. — Т. 2. — С. 431—439. — ISBN 5-03-002544-8
- ↑ Коагуляционный гемостаз. Архивировано из первоисточника 20 ноября 2012.
- ↑ Пантелеев М. А., Васильев С. А., Синауридзе Е. И., Воробьев А. И., Атауллаханов Ф. И. Практическая коагулология / Под ред. А. И. Воробьева. — М.: Практическая медицина, 2011. — 192 с. — ISBN 978-5-98811-165-8
Ссылки
Гемостаз — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 8 июня 2018; проверки требует 1 правка. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 8 июня 2018; проверки требует 1 правка.Система гемостаза — это биологическая система в организме, функция которой заключается в сохранении жидкого состояния крови, остановке кровотечений при повреждениях стенок сосудов и растворении тромбов, выполнивших свою функцию. Различают три основных механизма остановки кровотечения при повреждении сосудов, которые в зависимости от условий могут функционировать одновременно, с преобладанием одного из механизмов:
- Сосудисто-тромбоцитарный гемостаз, обусловленный спазмом сосудов и их механической закупоркой агрегатами тромбоцитов. На обнажившихся в результате повреждения стенках сосуда коллагеновых молекулах происходит адгезия (прилипание), активация и агрегация (склеивание между собой) тромбоцитов. При этом образуется так называемый «белый тромб», то есть тромб с преобладанием тромбоцитов.
- Коагуляционный гемостаз (свертывание крови) запускается тканевым фактором из окружающих повреждённый сосуд тканей, и регулируемый многочисленными факторами свертывания крови. Он обеспечивает плотную закупорку повреждённого участка сосуда фибриновым сгустком — это так называемый «красный тромб», так как образовавшаяся фибриновая сетка включает в себя клетки крови эритроциты. Раньше сосудисто-тромбоцитарный гемостаз называли первичным, коагуляционный вторичным, так как считалось, что эти механизмы последовательно сменяются, в настоящее время доказано, что они могут протекать независимо друг от друга.
- Фибринолиз — растворение тромба после репарации (ремонта) повреждённой стенки сосуда.
Конечным итогом работы свертывающей системы крови является превращение фибриногена в волокна фибрина под действием тромбина. Установлено, что любой сгусток, который образуется в сосудах, в том числе в артериях, является тромбоцитарно-фибриновым. Тромбоциты играют важную роль в восстановлении стенок сосуда: из тромбоцитов, участвующих в образовании сгустка, выделяется большое количество активных веществ. В числе прочих выделяется фактор роста тромбоцитов (англ. Platelet-derived growth factor, PDGF) — сильный стимулятор восстановления тканей. Завершающий этап работы системы гемостаза — фибринолиз. Система фибринолиза разрушает фибриновый сгусток по мере того, как повреждённый сосуд восстанавливается, и необходимость в наличии сгустка пропадает.
- Исследование системы крови в клинической практике. / Под ред. Г. И. Козинца и В. А. Макарова. — М.: Триада-Х, 1997.
- Colman R.W. Hemostasis and thrombosis basic principles and clinical practice. / Под ред. Г. И. Козинца и В. А. Макарова. — Philadelphia: Lippincott, 1993.
- Пантелеев М. А., Васильев С. А., Синауридзе Е. И., Воробьев А. И., Атауллаханов Ф. И. Практическая коагулология / Под ред. А. И. Воробьева. — М.: Практическая медицина, 2011. — 192 с. — ISBN 978-5-98811-165-8.
Медицинские коагуляторы: современные технологические решения
Разрабатывая новые методики хирургического лечения различных заболеваний, врачи всего мира стремятся сократить травмирующее воздействие на ткани пациента до минимума. В этом им помогает высокотехнологичное оборудование, которое обеспечивает не просто щадящее, но и точное воздействие в оперируемой зоне. К таким приборам, в частности, относится аппарат для электрокоагуляции.
Коагуляция – один из тех простых на первый взгляд хирургических методов, которые с внедрением в медицину высоких технологий выходят на новый виток развития, обеспечивая максимальную уверенность врачам в успешности операции и безопасность пациентам.
Коагуляция в медицине
Остановка кровотечения или удаление новообразований при помощи прижигания электрическим током применяется в медицине с 20-х годов прошлого столетия. Этот метод был назван коагуляцией и нашел широкое применение в таких сферах, как хирургия, урология, гинекология, косметология, оториноларингология. Рынок медицинского оборудования в настоящее время предлагает большой выбор эффективных и безопасных коагуляторов и комплектующих к ним.
Коагуляторы хирургические: виды и назначение
С помощью хирургического коагулятора возможна срочная ликвидация кровотечения, что особенно важно при проведении операций. Современные коагуляторы бывают портативными и стационарными, могут работать в различных режимах и по разным принципам.
Электрохирургический коагулятор имеет ряд разновидностей. Прежде всего, необходимо различать монополярный и биполярный коагуляторы.
Монополярный коагулятор часто называют электрическим скальпелем. Воздействие на ткани производится одним электродом (в форме шарика, ланцета, петли, иглы и др.), вызывающим локальное рассечение и локальную коагуляцию тканей в месте соприкосновения. Такой электрод позволяет осуществлять манипуляции на бóльшей глубине, чем при использовании биполярного коагулятора. Особенностью работы последнего является то, что высокочастотный ток, подаваемый на инструмент, проходит между двумя точками соприкосновения и вызывает коагуляцию участка между ними.
Стоит сказать, что монополярные коагуляторы могут быть:
- контактными (разрез-коагуляторы), когда активный электрод имеет форму ланцета, петли или иглы, а результатом воздействия является образование чистой раны, пригодной для биопсии, или раны с тонким слоем поверхностной коагуляции;
- бесконтактными (спрей-коагуляторы), принцип действия которых основан на создании электрической дуги, вызывающей «испарение» клеточного вещества точно в месте соприкосновения. Это позволяет избежать нагревания и разрушения соседних тканей. Данный метод применяется для организации воздействия на достаточно большие биологические участки.
Бесконтактная методика менее травматична, контактная – более универсальна.
Термостеплер – метод облитерации сосудов до 7 мм в диаметре комбинированным тепловым и механическим воздействием. Успешно применяется в лапароскопии, простатэктомии, гистерэктомии, при удалении опухолей, геморроидальных узлов. В термостеплере используется метод биполярной коагуляции, когда электрический разряд возникает при соприкосновении двух электродов с тканями.
Аргоноплазменный коагулятор – аппарат, работающий на принципе бесконтактного воздействия электрическим током на ткани при помощи плазменной аргоновой струи. В отличие от биполярного и монополярного приложения тока данный метод исключает риск «прилипания» коагулята к электроду и последующего надрыва коагулированного сосуда. К преимуществам данного способа также можно отнести то, что он может быть применен для термической коагуляции. Эта возможность обусловлена тем, что аргон не вступает в химические реакции с биологическими тканями при повышенной температуре. Таким образом, инертность газа обеспечивает бездымность метода и гарантирует отсутствие обугливания тканей.
Принцип действия данного типа коагулятора заключается в том, что образующаяся между кончиком электрода зонда-аппликатора и прилежащими тка¬нями струя аргоновой плазмы автоматически на-правляется в участки с наименьшим электрическим сопротивлением. В результате происходит быстрая коагуляция большой поверхности с созданием тонкого слоя (до 3 мм) надежного струпа. Стоит отметить, что глубина проникновения в ткань при использовании данного метода примерно в 2 раза меньше, чем при традиционной коагуляции. Это позволяет использовать аргоноплазменную коагуляцию в операциях на двенадцатиперстной и толстой кишке, а также на пищеводе.
Аппараты для электрокоагуляции Emed
Польский производитель электрохирургического оборудования Emed в 2015 г. отпразднует свое двадцатилетие. За солидный срок своего существования компания снискала себе репутацию производителя высочайшего уровня, использующего передовые технологии, надежное оборудование и мощный научно-производственный потенциал. Компания «Emed» многие годы обеспечивает своих клиентов полным спектром высокотехнологичных электрохирургических систем. Вся выпускаемая продукция имеет европейский и международные сертификаты соответсвия и разрешена к применению в России.
Модельный ряд
Все коагуляторы Emed отличаются небольшими габаритами, позволяющими удобно размещать их в любой операционной или медицинском кабинете.
ES-Vision. Аргоноплазменный электрохирургический коагулятор с функцией термостеплера, снабженный электронной сенсорной панелью и удобным меню. Сто программ работы охватывает весь спектр методов коагуляции: аппарат объединяет в себе возможности термостеплера, электрохирургической и аргоноплазменной коагуляции. Выбор оптимальной комбинации возможен благодаря наличию четырех модификаций. Может применяться в общей, лапароскопической, эндоскопической хирургии, гинекологии, дерматологии, урологии, косметологии, оториноларингологии. Наиболее комфортный в работе аппарат в модельном ряду коагуляторов. Оптимальное соотношение цены и качества.
ES-350+ARGON+TERMOSTEPLER. Мультирежимный аппарат, объединяющий возможности монополярной и биполярной и аргоноплазменной коагуляции. Есть возможность выбрать режим разреза или спрей-коагуляции. Может работать как термостеплер, аргоноплазменный или электрохирургический коагулятор. Малотравматичен, может использоваться для иссечения опухолей, неглубокой гомогенной коагуляции, остановки паренхиматозного кровотечения, в том числе у пациентов с электрокардиостимулятором (в режиме биполярной коагуляции).
ES-350+ARGON. Упрощенный и менее дорогой аналог предыдущей модели, без термостеплера. В режиме биполярной коагуляции возможно использование среди пациентов с электрокардиостимуляторами.
ES-350. Моно- и биполярная коагуляция в режиме «разрез» или «спрей». Аппарат оснащен системой самотестирования, дающей возможность блокировки аппарата при ошибке специалиста в манипуляциях. Как и предыдущие модели, в режиме биполярной коагуляции возможно использование среди пациентов с электрокардиостимуляторами.
ES-120. Портативный коагулятор. Моно- и биполярная коагуляция в режиме разреза. Компактный и простой в эксплуатации аппарат, удобный для применения в кабинетах стоматологии, косметологии, дерматологии, гинекологии и оториноларингологии. Есть встроенная система контроля за качеством контакта с кожей пациента. Возможно использование среди пациентов с электрокардиостимуляторами (в режиме биполярной коагуляции).
Сопутствующее оборудование и инструменты
Для обеспечения комфортной работы с коагуляторами компания «Emed» выпускает сопутствующее оборудование и инструменты. Вы всегда можете подобрать:
- инструменты для лапароскопии и артроскопии;
- набор электродов нужной вам формы и размера;
- кабели;
- усилители аргоновой коагуляции;
- термостеплеры;
- эвакуаторы дыма;
- адаптеры;
- разъемы;
- мобильные подставки для коагуляторов;
- сумки для портативных коагуляторов;
- наборы для сервисного и ремонтного обслуживания коагуляторов;
- аксессуары для чистки аппаратов и инструмента.
Приобретая коагулятор, не стоит забывать, что от наличия нужных аксессуаров и их качества зависит не только удобство вашей работы, но и успех операции в целом. Кроме того, коагулятор хирургический, цена которого высока, может не окупиться при невозможности его полноценного использования. Политика разумной экономии здесь будет состоять в том, чтобы тщательно продумать нужную вам комплектацию и приобрести все необходимое сразу.

Гемофилия — Википедия
 Система для инъекций с раствором фактора VIII, способствующего свёртываемости крови; пригодна для самостоятельного введения препарата
Система для инъекций с раствором фактора VIII, способствующего свёртываемости крови; пригодна для самостоятельного введения препарата 
Гемофили́я (от др.-греч. αἷμα — «кровь» и др.-греч. φιλία, здесь — «склонность»[1]) — редкое наследственное заболевание, связанное с нарушением коагуляции (процессом свёртывания крови). При этом заболевании возникают кровоизлияния в суставы, мышцы и внутренние органы, как спонтанные, так и в результате травмы или хирургического вмешательства. При гемофилии резко возрастает опасность гибели пациента от кровоизлияния в мозг и другие жизненно важные органы, даже при незначительной травме. Больные с тяжёлой формой гемофилии подвергаются инвалидизации вследствие частых кровоизлияний в суставы (гемартрозы) и мышечные ткани (гематомы). Гемофилия относится к геморрагическим диатезам, обусловленным нарушением плазменного звена гемостаза (коагулопатия).
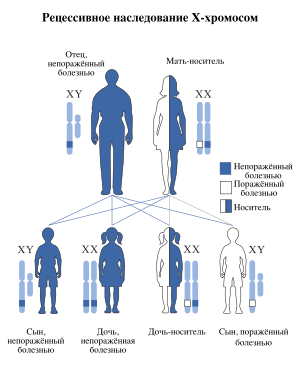
Гемофилия появляется из-за изменения одного гена в хромосоме X. Различают три типа гемофилии (A, B, C).
- Гемофилия A (рецессивная мутация в X-хромосоме) вызывает недостаточность в крови необходимого белка — так называемого фактора VIII (антигемофильного глобулина). Такая гемофилия считается классической, она встречается наиболее часто, у 80—90 %[1] больных гемофилией. Тяжёлые кровотечения при травмах и операциях наблюдаются при уровне VIII фактора — 5—20 %.
- Гемофилия B (рецессивная мутация в X-хромосоме) — недостаточность фактора плазмы IX (Кристмаса). Нарушено образование вторичной коагуляционной пробки.
- Гемофилия C (аутосомный рецессивный либо доминантный (с неполной пенетрантностью) тип наследования, то есть встречается как у мужчин, так и у женщин) — недостаточность фактора крови XI, известна в основном у евреев-ашкеназов. В настоящее время гемофилия С исключена из классификации, так как её клинические проявления значительно отличаются от А и В.
Ведущими симптомами гемофилии А и В являются повышенная кровоточивость с первых месяцев жизни; подкожные, межмышечные, субфасциальные, забрюшинные гематомы, обусловленные ушибами, порезами, различными хирургическими вмешательствами; гематурия; обильные посттравматические кровотечения; гемартрозы крупных суставов, с вторичными воспалительными изменениями, которые приводят к формированию контрактур и анкилозов.
Обычно болезнью страдают мужчины (наследование, сцепленное с полом), женщины же обычно выступают как носительницы гемофилии и могут родить больных сыновей или дочерей-носительниц. Всего в мире задокументировано порядка 60 случаев гемофилии (типа A или B) у девочек. В связи с тем, что современная медицина существенно продлевает среднюю продолжительность жизни больных гемофилией, то определённо можно сказать, что случаи гемофилии у девочек будут встречаться всё чаще. Кроме того, примерно в 15—25 % случаев обследование матерей мальчиков, страдающих гемофилией, не выявляет указанных мутаций генов[источник не указан 2506 дней], что означает появление мутации в момент формирования родительской половой клетки. Таким образом, гемофилия может появляться и при отсутствии среди родителей носителей её генов.
Наиболее распространённое заблуждение о гемофилии — это то, что больной гемофилией может истечь кровью от малейшей царапины, что неверно. Проблему составляют крупные ранения и хирургические операции, удаление зубов, а также спонтанные внутренние кровоизлияния в мышцы и суставы, обусловленные, по-видимому, уязвимостью стенок сосудов у больных гемофилией.
Самой известной носительницей гемофилии в истории была королева Виктория; по-видимому, эта мутация произошла в её генотипе de novo, поскольку в семьях её родителей страдающие гемофилией не зарегистрированы. Теоретически, это могло бы произойти и в том случае, если бы биологическим отцом Виктории являлся не Эдуард Август, а какой-либо другой мужчина (больной гемофилией), однако никаких исторических свидетельств в пользу этого не существует. Гемофилией страдал один из сыновей Виктории (Леопольд, герцог Олбани), а также ряд внуков и правнуков (родившихся от дочерей или внучек), включая российского царевича Алексея Николаевича. По этой причине данное заболевание получило такие названия: «викторианская болезнь» и «царская болезнь». Также иногда в царских фамилиях для сохранения титула допускались браки между близкими родственниками, отчего частота встречаемости гемофилии была выше.
Для диагностики гемофилии применяется: коагулограмма, определение времени свёртываемости, добавление образцов плазмы с отсутствием одного из факторов свёртывания.
Хотя болезнь на сегодняшний день неизлечима, её течение контролируется с помощью инъекций недостающего фактора свёртываемости крови, чаще всего выделенного из донорской крови. Некоторые гемофилики вырабатывают антитела против замещающего белка, что приводит к увеличению необходимой дозы фактора или применению заменителей, таких как свиной фактор VIII. В целом современные гемофилики при правильном лечении живут столько же, сколько и здоровые люди.
На настоящий момент для лечения используются концентраты факторов свертывания как полученные из донорской крови, так и рекомбинантные (выращенные искусственным путём у животных).
Носительницы гена гемофилии на сегодня практически не имеют возможности заранее спланировать рождение больного или здорового ребёнка, за исключением, возможно, процедуры экстракорпорального оплодотворения (ЭКО) при соблюдении определённого ряда условий. Также, при соблюдении определённых условий, возможно диагностировать наличие гемофилии у плода с 8 недели беременности. Такое исследование можно провести в ряде медицинских учреждений России, однако самый большой опыт пренатальной диагностики гемофилии накоплен в НИИ акушерства и гинекологии им. Отта в Санкт-Петербурге.
Группе генетиков удалось вылечить лабораторных мышей от гемофилии при применении генотерапии[2]. Учёные для лечения использовали аденоассоциированные вирусы (AAV).
Принцип лечения заключается в вырезании мутированной последовательности ДНК с помощью фермента, носителем которого является AAV, и последующей вставке в это место здорового гена уже вторым вирусом AAV. Фактор свёртывания IX кодируется геном F9. Если исправить последовательность F9, то фактор свёртывания начнёт вырабатываться в печени, как у здоровой особи.
После генотерапии у мышей уровень фактора в крови вырос до нормы. За 8 месяцев не было выявлено никаких побочных эффектов.
Лечение проводится во время кровотечения:
- гемофилия А — переливание свежей плазмы, антигемофилийная плазма, криопреципитат;
- гемофилия В — свежезамороженная донорская плазма, концентрат фактора свёртывания;
- гемофилия С — свежезамороженная сухая плазма.
Далее проводится симптоматическое лечение.
По мнению С. И. Куцева, опубликованному в мае 2019 года, некоторые фармацевтические компании мира «очень близки» к началу лечения гемофилии с помощью редактирования генома и классической генной терапии[3].
Методы лабораторной диагностики свертывающей системы крови[править | править код]
Регистрируют ее преимущественно у собак, свиней и лошадей. Диагноз устанавливают на основании повышенной кровоточивости, наличия случаев заболеваний по линии самцов, с учётом удлинения времени свёртывания крови. Пробы на ломкость сосудов при гемофилии отрицательные. Дифференциальную диагностику проводят с гиповитаминозами С, К, Р, тромбоцитопенией, апластической анемией и аллергией. Решающее значение в диагностике имеют данные биохимических, морфологических исследований крови и результаты постановки аллергических проб[4].
