Вопрос 2. Изоферменты. Понятие. Примеры изоформ лактатдегидрогеназы (лдг) и креатинкиназы (кк). Реакции, катализируемые лдг и кк. Значение определения активности изоферментов в сыворотке крови
Изоферменты, или изоэнзимы – ферменты, катализирующие один и тот же тип реакции с принципиально одинаковым механизмом, но отличающихся друг от друга кинетическими параметрами, условиями активации, особенностями связи апофермента и кофермента.
Природа появления изоферментов разнообразна, но чаще всего обусловлена различиями в структуре генов, кодирующих эти изоферменты. Следовательно, изоферменты различаются по первичной структуре белковой молекулы и, соответственно, по физико-химическим свойствам.
По своей структуре изоферменты в основном являются олигомерными белками. Причем та или иная ткань синтезирует преимущественно определенные виды протомеров. В результате определенной комбинации этих протомеров формируются ферменты с различной структурой – изомерные формы. Обнаружение определенных изоферментных форм ферментов позволяет использовать их для диагностики заболеваний.
Лактатдегидрогеназа (ЛДГ) – олигомерный белок с молекулярной массой 134000 Д. ЛДГ состоит из 4 пептидных цепей двух типов – M(от. англ. muscle) и H(от. англ.heart). Выделяют 5 изоформ ЛДГ, несколько отличающихся по химическим и физическим свойствам. В отличие от общей ЛДГ, изоформы фермента более или менее специфичны для разных тканей.
ЛДГ-1 (HHHH, H4) – преобладает в сердце, почках и эритроцитах;
ЛДГ-2 (HHHM, H3M) – в сердце, селезенке и лимфатических узлах; кребс изоформа кровь метаболический
ЛДГ-3 (HHMM, H2M2) – в легких;
ЛДГ-4 (HMMM, HM3) – в поджелудочной железе, плаценте;
ЛДГ-5 (MMMM, M4) – в печени и скелетных мышцах.
Появление в эволюции различных изоформ ЛДГ обусловлено особенностями окислительного метаболизма тканей. Изоферменты ЛДГ4 и ЛДГ5 (м-типы) работают эффективно в анаэробных условиях, ЛДГ1 и ЛДГ2 (Н-типы) – в аэробных, когда пируват быстро окисляется до СО2 и Н2О, а не восстанавливается до молочной кислоты.
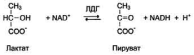
Фермент лактатдегидрогеназа (ЛДГ) катализирует обратимую реакцию окисления лактата (молочной кислоты) до пирувата (пировиноградной кислоты)
При
ряде заболеваний исследуют активность
ЛДГ в плазме крови. В норме активность
ЛДГ составляет 170 – 520 ЕД/л. Повышение
активности определенных изоформ ЛДГ
наблюдают при поражениях сердца, печени,
почек, а также при мегалобластных и
гемолитических анемиях. Для постановки
диагноза необходимо исследование
изоформ ЛДГ в плазме крови методом
электрофореза. Выявление
в плазме крови тканеспецифических
изоформ ЛДГ широко используется в
качестве диагностического теста. При
поражении печени в крови повышается
активность ЛДГ
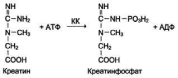
Креатинкиназа (КК) – это фермент, который катализирует реакцию переноса фосфорильного остатка с АТФ на креатинин с образованием креатинфосфата и АДФ. АТФ (аденозинтрифосфат) – молекула, являющаяся источником энергии в биохимических реакциях человеческого организма.
Реакция, катализируемая креатинкиназой, обеспечивает энергией мышечные сокращения. Различают креатинкиназу, содержащуюся в митохондриях и цитоплазме клеток.
Молекула креатинкиназы состоит из двух частей, которые могут быть представлены одной из двух субъединиц: М, от английского muscle – «мышца», и B, brain – «мозг». Таким образом, в организме человека креатинкиназа есть в виде трёх изомеров: ММ, МВ, ВВ. ММ-изомер содержится в скелетной мускулатуре и миокарде, МВ – в основном в миокарде, ВВ – в тканях головного мозга, в небольшом количестве в любых клетках организма.
Активность КК в норме не должна превышать 90 МЕ/л. Определение активности КК в плазме крови имеет диагностическое значение при инфаркте миокарда (происходит повышение уровня МВ-изоформы). Количество изоформы ММ может повышаться при травмах и повреждениях скелетных мышц. Изоформа ВВ не может проникнуть через гематоэнцефалический барьер, поэтому в крови практически не определяется даже при инсультах и диагностического значения не имеет.
Ферменты лактатдегидрогеназа и изоферменты ЛДГ
Лактатдегидрогеназа (ЛДГ). Катализирует обратимую реакцию образования лактата. Фермент является тетрамером и имеет 5 изоформ. Наиболее богаты этим ферментом клетки сердца, печени, почек, скелетной мускулатуры, эритроциты. Физиологическое повышение активности ЛДГ наблюдается при беременности. При инфаркте миокарда повышение активности ЛДГ может быть значительным. При коронарной недостаточности (но без инфаркта), застойных явлениях в печени ЛДГ почти не повышается. При инфаркте миокарда активность ЛДГ и АСТ значительно повышена, билирубин же остается в пределах нормы.
При инфаркте легкого повышение активности ЛДГ сравнимо с таковым при инфаркте миокарда, но сочетается с нормальной активностью АСТ и повышенным билирубином. При гепатитах легкой и средней тяжести активность ЛДГ повышена только в первые дни и быстро снижается до нормы. При тяжелых гепатитах активность ЛДГ повышена значительно и длительно. При поражениях печени ЛДГ повышается вследствие длительной механической желтухи. ЛДГ повышается также при гемолитических анемиях.
Изоферменты лактатдегидрогеназы (ЛДГ). Молекула ЛДГ обладает четвертичной структурой и состоит из четырех субединиц. При этом вариантов субъединиц только два – Н и М. Такая структура делает возможным существование пяти изоферментов. На электрофореграмме подвижность изоферментов различна.
Изоферменты обозначаются цифрами: ЛДГ-1 (самый подвижный), ЛДГ-2, ЛДГ-3, ЛДГ-4 и ЛДГ-5 (наименее подвижный). Изофермент ЛДГ-1, являющийся гомомером НННН, содержится в больших количествах в миокарде, в цитоплазме эритроцитов, а также в корковом веществе почек. ЛДГ-3 (гетеромер ННММ) более характерен для эпителия лёгочных альвеол. ЛДГ-5 (гомомер ММММ) присутствует в клетках поперечно-полосатой скелетной мускулатуры и в гепатоцитах. Благодаря большой активности ЛДГ в эритроцитах даже следы гемолиза в сыворотке крови приводят к ложно завышенным результатам теста на ЛДГ. ЛДГ служит маркером гликолиза.
Повышение активности изофермента ЛДГ-1 в течение первых трёх суток после приступа загрудинных болей, особенно когда болевой синдром не купируется нитроглицерином, позволяет говорить об инфаркте миокарда. Наиболее высока диагностическая ценность теста на ЛДГ-1 в первые 16-20 часов после приступа, когда активность ЛДГ-1 в сыворотке крови уже повышена, а тотальная активность ЛДГ еще в норме. При инфаркте миокарда изофермент ЛДГ-1 первым среди изоферментов ЛДГ повышается и последним возвращается к норме – его активность может оставаться высокой и после того, как общая активность ЛДГ уже вернулась в рамки референтных значений. При незначительных зонах некроза в миокарде активность ЛДГ-1 увеличивается, а тотальная ЛДГ все время остается в норме.
Изоферменты и их роль
Варбург установил, что альдолазы дрожжей из различных животных тканей различаются по ряду св-в. Пепсин, трипсин, химотрипсин также различались по растворимости, рН, температурному оптимуму.
В конце пятидесятых годов биохимики Виланд и Пфлейдерер, а также другие исследователи выделяли из тканей животных чистые кристаллические препараты фермента лактатдегидрогеназы и подвергали их электрофорезу. В результате электрофореза фермент разделялся, как правило, на 5 фракций, имеющнх различную электрофоретическую подвижность. Все эти фракции обладали лактатдегидрогеназной активностью. Таким образом было установлено, что фермент лактатдегидрогеназа присутствует в тканях в виде нескольких форм. Эти формы в соответствии с их электрофоретпческой подвижностью получили обозначение ЛДГ1, ЛДГ2, ЛДГ3. ЛДГ4, ЛДГ5. (ЛДГ — сокращенное обозначекие лактатдегидрогеназы), причем номером 1 обозначают компонент с наибольшей элсктрофоретической подвижностью.
Исследования иэоферментов лактатдегидрогеназы, выделенных из разных органов животных, показали, что они различаются как по электрофоретическим и хроматографическим свойствам, так и по химическому составу, термостабильности, чувствительности к действию ингибитооров, Кm и по другим свойствам. При анализах лактатдегидрогеназы разных видов животных выявлены очень большие межвидовые различия, однако в пределах данного вида распределение изоферментов характеризуется большим постоянством.
Лактатдегидрогеназа была первым ферментом, отдельные компоненты которого были подвергнуты детальзому изучению. Несколько позднее были получены данные о множественных формах и молекулярной неоднородности ряда других фермеатов, а в 1959 г. было предложено называть такие формы изоферментами или изоэнзимами. Комиссия по ферментам Международного биохимического союза официально рекомендовала этот термин для обозначевия мвожествеинь форм ферментов, того же биологического вида.
Итак, изоферменты — это группа ферментов из одного и того же источника, обладающих одним типом субстратной специфичности, катализирующих одну и ту же химическую реакцию, но различающихся по ряду физико-химических свойств.
Наличие множественных форм ферментов, или изоферментов, установлено более чем для 100 ферментов, выделеаных из различных видов животных, растений и микроорганизмов. Изоферменты не всегда состоят из двух или нескольких субъединиц. У ряда ферментов отдельные изофермсаты представляют собой разные по химическому строению белки, обладающие одной и той же каталитической активностью, но состоящие только из одной субъединицы.
Основным критерием для номенклатуры изоферментов в настоящее время принята их электрофоретическая подвижвость. Это объясняется, тем, что по сравнению с другими способами характеристики изферментов электрофорез дает наиболее высокую разрешающую способность.
К настоящему времени в результате изучения растительных изоферментов установлено, что многие ферменты присутствуют в растениях в виде множественных форм. Познакомимся с некоторыми из этих ферментов.
М а л а т д е г и д р о г е н а з а ( 1.1.1.37 ) имеет довольно сложвый изофермецтный состав. В семенах хлопчатника и листьях шпината обнаружено по 4 изофермента малатдегидрогеназы, различающихся по электрофоретической подвижности, причем молекулярная масса каждого из четырех изофермевтов шпината равнялась примерно 60 тыс. Разные растения содержат неодинаковое число изоферментов малатдегидрогеназы. Например, в семенах различных сорта к пшеницы обнаружено 7-10 изоферментов, в корнях кукурузы — 4-5, а в различных органах горе (корень, семядоли, подсемядольное и надсемядольное колено) обнаруживали 9-12 изофермевтов малатдегидрогеназы, причем число изоферментов изменялось в зависимости от фазы развития растений.
Отмечалась, что молекулярные массы изоферментоэ малатдегидрогеназы иногда существенно различались. Например, в листьях хлопчатника содержится 7 изоферментов малатдегидрогеназы, из которых 4 изофермеета являются изоформами, имеющими различный электрический заряд, но одинаковую молекулярную массу, равную примерно 60 тыс. Пятый изофермент имел молекулярную массу около 500 тыс. и был олигомером по крайней мере одной из изо форм малатдегидрогеназы с молекулярной массой 60 тыс. Так как в этих исследованиях молекулярные массы определяли приближенно, то можао полагать, что этот изофермент состоит из 8 субъединиц изофермента с молекулярной массой 60 тыс.
Устойчивость и восприимчивость растений к болезням часто связана с регуляцией синтеза изоферментов. В качестве ответной реакции на внедрение инфекции у растениий усилива интенсивность обмена вв., прежде всего окислительно-восставовительньных. Поэтому активность ОВ ферментов и число их изоферментов при поражении растений увеличиваются.
Повышевие активности и увеличение числа изоферментов пероксидазы и о-дифенолоксидазы наблюдаются при различных заболеваниях кукурузы фасоли, табака, клевера, картофелям льна, овса и других растении. На рисунке 22 схематически показано изменение числа изоферментов пероксидазы и их активности при поражении томатов фитофторой. Если в листьях здоровых растений содержалось четыре изофермента пероксидазы, то в пораженных листьях их число возрастало до девяти, причем активность всех изо ферментов значительно повышалась.
При изучении изменений в изоферментном составе пероксидазы п полифенолоксидазы митохондрий при вирусном патогенезе устойчивого и неустойчивого к вирусу табачной мозаики видов табака установлено, что вирусная инфекция вызывает качественно различные изменения изо ферментного состава разных по устойчивости видов табака. У устойчивого вида активность ряда изоферментов повышается в большей степени, чем у восприимчивого. Таким образом, в зависимости от потенциальной способности растения к биосинтезу зоферментов изменяется восприимчивость растения к инфекционным заболевакиям.
Глутаматдегидрогеназы
Эстеразы
Амилазы
Сахараза
Биологическая роль изоферментов в растениях.
ИФ свидетельствуют о большой лабильности ферментативного аппарата растений, дает возможность осуществлять необходимые процессы обмена вв. в клетке при изменении условий внешней среды, обеспечивает специфику обмена вв. для данного органа или ткани растений. Способствует приспособляемости растений к изменяющимся условиям вн. среды.
Одновременное присутствие в клетках множественных форм одного и того же фермента, наряду с другими механизмами регуляции, способствует согласованности процессов обмена вв. в клетке и быстрой адаптации растений к изменяющимся условиям среды.
В самом деле мы отмечали, что отдельные изоерменты различаются по температурным оптимумам, оптимумам рН, отношению к ингибиторам и другим свойствам. Отсюда следует, что если, например, резко изменяются температурные условия, которые становятся неблагоприятными для проявления каталитической активности некоторых изоферментов, то их активность подавляется. Однако данный фермеатативный процесс в растениях не прекращается полностью, так как начинают проявлять каталитическую активность другие изоферменты того же фермента, для которых данная температура является благоприятной. Если в силу каких-либо причин изменяется рН реакционной среды, то также ослабляется активность некоторых изоферментов, но вместо них начинают проявлять каталитическую активность изоферменты, имеющие иной оптимум рН. Высокие концентр ации солей подавляют активность многих ферментов, что является одной из причин ухудшения роста растений на засоленных почвах. Однако даже при высоких концентрациях солей в клетках ферментативные процессы не прекращаются полностью, так как отдельные изоферменты неодинаково относятся к повышению концентрации солей: активность одних изоферментов снижается, других повышается..
Устойчивость и восприимчивость к болезням часто основана на регуляции синтеза ИФ.
Биосинтез изоферментов определяется генетическими факторами и каждый вид растений характеризуется специфическим для данного вида набором изоферментов, т.е. проявляется видовая специфичность по изоферментному составу.
Разные органы одного растения различаются по ИФ.Изучение свойств изоферментов лактатдегидрогеназы, выделенных из различных тканей животных показало, что все изофермевты имеют приблизительно одинаковую молекулярную массу (около 140 тыс ) вых условиях, например под действием обработки 42М мочевиной каждый из изоферментов диссоциирует на 4 субъедивицы с молекулярной массой около 35 тыс. Таким образом, каждый из пяти изоферментов лактатдегттдрогеназы представляет собой тетрамер. Установлено что все изоферменты лактатдегирогеназы представляют собой возможные комбинации всего лишь субъединиц двух типов, условно обозначаемых буквами А и В. Разные сочетания этих типов субъединиц образуют все пять изофермеатов лактатдегидрогеназы (рис. 18). Это показывает, что изоферменты лактатдегидрогеназы имеют строго упорядоченную структуру, причем отдельные субъединицы в молекуле этого белка-фермента соединевы водородными связями, которые могут быть разорваны под действием концентрированного раствора мочевивы.
Возникает вопрос, чем отличаются друг от друга отдельные субъединицы лактатдегидрогеаазы и с чем связава различная электрофоретическая подвижность отдельных из изоферментов ? На этот вопрос сейчас получены довольно определенные ответы. Оказалось, что субъединицы А и В т- ц аминокислот. Субъединица В содержит большее количество кислых мелочных аминокислот по сравнению с субъединицей А. В связи с этим все изоферменты лактатдегидрогеназы (ЛДГ1 — ЛДГ2) различаются по количеству этих аминокислот, молекулы их имеют разную величину электрического заряда и разную электрофоретическую подвижность. Изоферменты лактатдегидрогеаазы различаются и по ряду других свойств, в частности константам Михаэлиса Км, отношению к ряду ингибиторов, термостабильности.
Изоферменты
Это разновидности одного и того же фермента, катализирующие одну и ту же химическую реакцию, но отличающиеся по первичной структуре белка. Различные изоферменты определяют скорость и направление реакции благодаря разному сродству к субстрату.
Например, димерный фермент креатинкиназа (КК) представлен тремя изоферментными формами, составленными из двух типов субъединиц: M (англ. muscle – мышца) и B (англ. brain – мозг). Креатинкиназа-1 состоит из субъединиц типа B и локализуется в головном мозге, креатинкиназа-2 – по одной М и В субъединице, активна в миокарде, креатинкиназа-3 содержит две М-субъединицы, специфична для скелетной мышцы. Креатинкиназа (цитозольный и митохондриальный фермент) обратимо катализирует в клетках многих тканей реакцию переноса фосфатного остатка между АТФ и креатином:
Креатин + АТФ ——— Креатинфосфат + АДФ.
Изоферменты креатинкиназы |
Изоферменты лактатдегидрогеназы |
Также существует пять изоферментов лактатдегидрогеназы – фермента, участвующего в обмене глюкозы. Отличия между ними заключаются в разном соотношении субъединиц Н (англ. heart – сердце) и М (англ. muscle – мышца). Лактатдегидрогеназы типов 1 (Н4) и 2 (H3M1) присутствуют в тканях с аэробным обменом (миокард, мозг, корковый слой почек), обладают высоким сродством к молочной кислоте (лактату) и превращают его в пируват. ЛДГ-4 (H1M3) и ЛДГ-5 (М4) находятся в тканях, склонных к анаэробному обмену (печень, скелетные мышцы, кожа, мозговой слой почек), обладают низким сродством к лактату и катализируют превращение пирувата в лактат. В тканях с промежуточным типом обмена (селезенка, поджелудочная железа, надпочечники, лимфатические узлы) преобладает ЛДГ-3 (H2M2).
Пируват + НАДН ———————Лактат + НАД+ + Н+
Мультиферментные комплексы
В мультиферментном комплексе несколько разных ферментов прочно связаны между собой в единый комплекс и осуществляют ряд последовательных разных реакций, но обеспечивающих единый процесс. В этом случае, продукт первой реакции непосредственно передается на следующий фермент и является исходным веществом, т.е. субстратом для второй реакции и так далее до завершения процесса окончательно. Благодаря таким комплексам значительно ускоряется скорость превращения молекул.
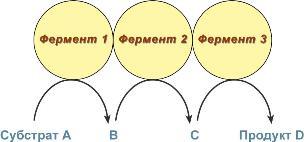
Строение мультиферментного комплекса
пируватдегидрогеназный комплекс (пируватдегидрогеназа), превращающий пируват в ацетил-SКоА,
α-кетоглутаратдегидрогеназный комплекс (в цикле трикарбоновых кислот) превращающий α-кетоглутарат в сукцинил-SКоА,
комплекс под названием «синтаза жирных кислот» (или пальмитатсинтаза), синтезирующий пальмитиновую кислоту.
Конец формы
2 Теории, объясняющие суть действия ферментов.
Адсорбционная: считалось, что фермент, как магнит притягивает (адсорбирует) на себя молекулы субстрата, их концентрация у активного центра повышается и реакция идет быстрее. Это устаревшая теория, и имеет только исторический интерес.
Теория промежуточных фермент-субстратных комплексов объясняет механизм действия ферментов тем, что фермент: связывается с субстратом и образует комплекс фермент-субстрат, этот комплекс превращается в другой, третий, где происходит напряжение, деформация субстрата, формируются и отделяются от фермента уже конечные продукты реакции. Вместо одной реакции с высоким энергетическим барьером, идут несколько новых с низким.
А + В (субстраты) Е (фермент)————— С (продукт)
А + Е ——— АЕ1 (комплекс 1)—— АЕ2(комплекс 2)
АЕ2 + В —— С (продукт) + Е (исходный неизмененный фермент)
2.E + S ——— ES ——— EZ ——- EP ——- E + P
S – субстрат, P — продукт, Z — переходное состояние
Т.е. при фермент-субстратном взаимодействии происходят:
1. сближение и необходимая ориентация субстратов,
2.удаление гидратной оболочки субстрата (внутри активного центра создаются другие условия, чем в растворе),
3.ослабляется разрываемая связь между атомами субстрата (при связывании происходит индуцированное субстратом конформационное изменение фермента и его активного центра, образуется фермент-субстратный комплекс; индуцированное соответствие обеспечивает эффективный ферментативный процесс, но не вносит решающий вклад в увеличение скорости реакции; каталитическая активность ферментов связана с их непосредственным участием в самих процессах разрыва и образования новых связей),
4.стабилизация переходного состояния, образующегося в результате взаимодействия между субстратом и аминокислотными остатками активного центра фермента или кофактором, достижение которого требует значительно меньшей энергии активации.
В общем виде все сводится к комплементарному взаимодействию фермента и субстрата. При этом функциональные группы субстрата взаимодействуют с соответствующими им функциональными группами фермента. Наличие субстратной специфичности объясняют две теории: Фишера и Кошланда.
1. Теория Фишера (модель «жесткой матрицы», «ключ-замок») – активный центр фермента строго соответствует конфигурации субстрата и не изменяется при его присоединении. Эта модель хорошо объясняет абсолютную специфичность, но не групповую.

2. Теория Кошланда (модель «индуцированного соответствия», «рука-перчатка») – подразумевает гибкость активного центра (т.е. сначала активный центр не соответствует – не комплементарен субстрату). Присоединение субстрата к якорному участку фермента вызывает изменение конфигурации каталитического центра таким образом, чтобы его форма соответствовала форме субстрата (индуцированное, наведенное соответствие).

В тот момент, когда субстрат(S) полностью заполняет собой активный центр, максимально возрастает степень разрыхления его химических связей, и он преобразуется в промежуточное вещество, которое в последствие получает дополнительные порции (кванты) тепловой энергии и образует продукт реакции (Р). Продукт реакции связан с активным центром менее прочно и покидает активный центр.
Активный центр фермента лучше согласован со структурой субстрата в переходном состоянии, чем со структурой субстрата в свободной форме, и следующая запись ферментативного процесса показывает, что субстрат в активном центре приобретает возбужденное состояние последовательно, в несколько этапов:
E + S —— ES —— ES* —— ES** —— ES*** —— EP —- E + P
Специфичность
Специфичность — высокая избирательность действия ферментов:
— реакционная/каталитическая специфичность (по отношению к катализируемой реакции) — фермент катализирует определенный тип каталитических превращений одного или нескольких субстратов по одному из возможных путей,
— субстратная специфичность (по отношению к соответствующим субстратам) — способность каждого фермента взаимодействовать только с одним или несколькими определенными субстратами; выделяют абсолютную,
групповую (относительную),
стереоспецифичность,
редко двойственную специфичность.
Стереоспецифичность – катализ только одного из стереоизомеров, например:
специфичность к L- или D-аминокислотам – например, почти все ферменты человека взаимодействуют с L-аминокислотами,
ферменты метаболизма углеводов имеют специфичность к D-, а не к L-моносахаридам,
специфичность к цис- и транс-изомерам. Например, аспартаза реагирует только с транс-изомером – фумаровой кислотой, но не с малеатом (цис-изомер).

Презентация на тему: 2. Изоферменты
Ферменты, катализирующие одну и ту же химическую реакцию, но отличающиеся по первичной структуре белка, называют изоферментами, или изоэнзимами. Они катализируют один и тот же тип реакции с принципиально одинаковым механизмом, но отличаются друг от друга кинетическими параметрами, условиями активации, особенностями связи апофермента и кофермента.
Природа появления изоферментов разнообразна, но чаще всего обусловлена различиями в структуре генов, кодирующих эти изоферменты. Следовательно, изоферменты различаются по первичной структуре белковой молекулы и, соответственно, по физико- химическим свойствам. На различиях в физико-химических свойствах основаны методы определения изоферментов.
По своей структуре изоферменты в основном являются олигомерными белками.
Причём та или иная ткань преимущественно синтезирует определённые виды протомеров.
В результате определённой комбинации этих протомеров формируются ферменты с различной структурой — изомерные формы.
Обнаружение определённых изоферментных форм ферментов позволяет использовать их для диагностики заболеваний.

Изоформы лактатдегидрогеназы.
Фермент лактатдегидрогеназа (ЛДГ) катализирует обратимую реакцию окисления лактата (молочной кислоты) до пирувата (пировиноградной кислоты)
Лактатдегидрогеназа — олигомерный белок с молекулярной массой 134 кД, состоящий из 4 субъединиц 2 типов: М (от англ, muscle — мышца) и Н (от англ, heart — сердце).
Комбинация этих субъединиц лежит в основе формирования 5 изоформ лактатдегидрогеназы.
ЛДГ1 и ЛДГ2 наиболее активны в сердечной мышце и почках, ЛДГ4 и ЛДГ5 — в скелетных мышцах и печени. В остальных тканях имеются различные формы этого фермента.
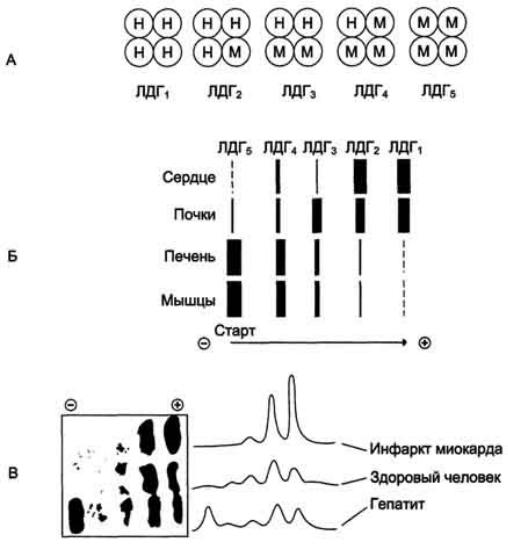
Изоформы
лактатдегидрогеназы. А — строение различных изоформ ЛДГ; Б — распределение на
электрофореграмме и относительные количества изоформ ЛДГ в различных органах; В — содержание изоформ ЛДГ в плазме крови в норме и при патологии
Появление в эволюции различных изоформ ЛДГ обусловлено особенностями окислительного метаболизма тканей.
Изоферменты ЛДГ4 и ЛДГ5 (М-типы ЛДГ) работают эффективно в анаэробных условиях, ЛДГ1 и ЛДГ2 (Н-типы) — в аэробных, когда пируват быстро
окисляется до СО2 и Н2О, а не восстанавливается до молочной кислоты.
При ряде заболеваний исследуют активность ЛДГ в плазме крови.
В норме активность ЛДГ составляет 170-520 ЕД/л. Повышение активности наблюдают при острых поражениях сердца, печени, почек, а также при мегалобластных и гемолитических анемиях.
Однако это указывает на повреждение лишь одной из перечисленных тканей.

Изоформы креатинкиназы.
Креатинкиназа (КК) катализирует реакцию образования креатинфосфата:
Молекула КК — димер, состоящий из субъединиц двух типов: М (от англ, muscle — мышца) и В (от англ, brain — мозг).
Из этих субъединиц образуются 3 изофермента — ВВ, MB, MM.
Изофермент ВВ находится преимущественно в головном мозге, ММ — в скелетных мышцах и MB — в сердечной мышце. Изоформы КК имеют разную электрофоретическую подвижность.
Активность КК в норме не должна превышать 90 МЕ/л. Определение активности КК в плазме крови имеет диагностическое значение при инфаркте миокарда (происходит повышение уровня МВ-изоформы – КК2).
Количество изоформы ММ (КК3)может повышаться при травмах и повреждениях скелетных мышц.
Изоформа ВВ (КК1) не может проникнуть через гематоэнцефалический барьер, поэтому в крови практически не определяется даже при инсультах и диагностического значения не имеет.
Аспартатаминотрансфераза (ACT) катализирует реакцию переаминирования (трансаминирования) между аспартатом и α- кетоглутаратом:
α -Кетоглутарат + L-аспартат ↔ L-глутамат + оксалоацетат.
У млекопитающих наиболее высокая активность и концентрация ACT отмечена в печени, нервной ткани, скелетной мускулатуре и миокарде.
Незначительная активность ACT определена и в крови здоровых людей.
В большинстве тканей существует как минимум два изофермента ACT: митохондриальный изофермент (мАСТ) и растворимый в цитозоле изофермент ACT (цАСТ).
цАСТ состоит из двух идентичных субъединиц; димер 93 кДа. мАСТ — димер с молекулярной массой 91 кДа.
Изоферменты ACT имеют некоторое различие кинетических характеристик: оптимум действия мАСТ более низкий, чем цАСТ.
3. Энзимодиагностика при инфаркте миокарда Примерно 30% больных инфарктом миокарда имеют атипичную клиническую картину этого заболевания = >.
дополнительные методы исследования для подтверждения повреждения сердечной мышцы.
При инфаркте миокарда наблюдают достоверные изменения в крови активности ферментов КК, ЛДГ и аспартатаминотрансферазы — ACT, которые зависят от времени, прошедшего от начала развития инфаркта и от зоны тканевого повреждения.
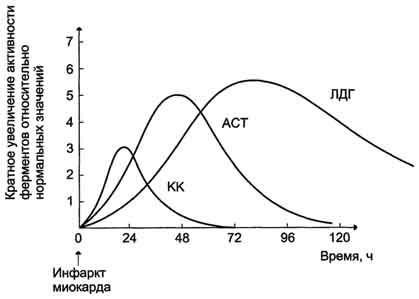
После закупорки (окклюзии) коронарного сосуда в крови вначале отмечают повышение активности КК изоформы MB, однако фермент быстро удаляется из кровотока. Обнаружение повышенной активности КК в плазме крови — основной энзимодиагностический критерий инфаркта миокарда.
Если у пациента с загрудинными болями не обнаружено изменения в активности КК, диагноз инфаркта миокарда маловероятен.
Активность ACT в норме составляет 5-40 МЕ/л. При инфаркте миокарда активность ACT повышается через 4- 6 ч, максимум — 2-3 дн.
Уровень ЛДГ также увеличивается в плазме крови через несколько часов после закупорки кровеносного сосуда; максимум активности наблюдают на 3-4-й день, затей наступает постепенная нормализация активности. Уровень повышения активности ЛДГ
Лактатдегидрогеназа-1 (1-й изофермент ЛДГ, ЛДГ-1, альфа-гидроксибутират дегидрогеназа, изофермент лактатдегидрогеназы-1, Alpha-HBDH)
Метод определения Кинетический UV-тест c a-кетобутиратом (оптимизированный, рекомендованный DGKC).
Исследуемый материал Сыворотка крови
Доступен выезд на дом
Фракция ЛДГ, характерная для сердечной мышцы.
В сыворотке крови и тканях человека лактатдегидрогеназа присутствует в виде 5 изоферментов. Каждый из изоферментов ЛДГ является тетрамером, образованным субъединицами двух типов — Н и М. При электрофоретическом разделении подвижность изоферментов различается, и они нумеруются как 1 (движется наиболее быстро), 2, 3, 4 и 5 (движется наиболее медленно). Изофермент ЛДГ 1 присутствует в большой концентрации в мышце сердца (тетрамер НННН), а также в эритроцитах и корковом веществе почек; изофермент 5 (тетрамер ММММ) — в скелетной мускулатуре и в печени. ЛДГ 3 характерен для лёгочной ткани. В норме основным источником изоферментов ЛДГ в сыворотке являются разрушающиеся клетки крови. При повреждении тканей ЛДГ поступает из них в кровь.
Определение изоферментов имеет важное диагностическое значение, т. к. повышение концентрации отдельных изоферментов характеризует повреждение конкретных органов. Повышение активности ЛДГ-1 в течение первых трёх суток после появления болей позволяет с большой вероятностью диагностировать инфаркт миокарда или исключить этот диагноз. Наиболее высокую диагностическую значимость повышение ЛДГ-1 имеет в первые 16 — 20 часов инфаркта миокарда, когда общая активность ЛДГ не превышает нормы. ЛДГ-1 может оставаться увеличенной после того как общая ЛДГ уже возвращается к норме. При небольших инфарктах активность ЛДГ-1 может быть увеличенной, в то время как общая ЛДГ остается в пределах нормы.

ТОП 10: |
Ферменты, катализирующие одну и ту же химическую реакцию, но отличающиеся по первичной структуре белка, называют изофермен-тами, или изоэнзимами. Они катализируют один и тот же тип реакции с принципиально одинаковым механизмом, но отличаются друг от друга кинетическими параметрами, условиями активации, особенностями связи апофермента и кофермента. Природа появления изоферментов разнообразна, но чаще всего обусловлена различиями в структуре генов, кодирующих эти изоферменты. Следовательно, изоферменты различаются по первичной структуре белковой молекулы и, соответственно, по физико-химическим свойствам. На различиях в физико-химических свойствах основаны методы определения изоферментов. По своей структуре изоферменты в основном являются олигомерными белками. Причём та или иная ткань преимущественно синтезирует определённые виды протомеров. В результате определённой комбинации этих протомеров формируются ферменты с различной структурой — изомерные формы. Обнаружение определённых изоферментных форм ферментов позволяет использовать их для диагностики заболеваний. Фермент лактатдегидрогеназа (ЛДГ) катализирует обратимую реакцию окисления лактата (молочной кислоты) до пирувата (пировиноградной кислоты). Повышение активности наблюдают при острых поражениях сердца, печени, почек, а также при мегалобластных и гемолитических анемиях. Однако это указывает на повреждение лишь одной из перечисленных тканей. Креатинкиназа (КК) катализирует реакцию образования креатинфосфата. Определение активности КК в плазме крови имеет диагностическое значение при инфаркте миокарда (происходит повышение уровня МВ-изоформы). Количество изоформы ММ может повышаться при травмах и повреждениях скелетных мышц. Изоформа ВВ не может проникнуть через гематоэнцефалический барьер, поэтому в крови практически не определяется даже при инсультах и диагностического значения не имеет. 10. Органная специфичность изоферментов ЛДГ. Физиологические значения общей активности лактатдегидрогеназы и ее изоферментов в плазме крови. Диагностическая значимость определения активности ЛДГ и ее изоферментов. Лактатдегидрогеназа является гликолитическим ферментом и катализирует следующую реакцию: Лактат + НАД Лактатдегидрогеназа Пируват + НАДН Молекула ЛДГ представляет собой тетрамер, состоящий из одного или двух типов субъединиц, обозначаемых как M (мышцы) и H (сердце). В сыворотке крови фермент существует в пяти молекулярных формах, различающихся по первичной структуре, кинетическим свойствам, электрофоретической подвижности (ЛДГ‑1 быстрее движется к аноду по сравнению с ЛДГ‑5, то есть более электрофоретичеки подвижна). Каждая форма имеет характерный полипептидный состав: ЛДГ‑1 состоит из 4 H‑субъединиц, ЛДГ‑2 — из 3 H‑субъединиц и 1 M‑субъединицы, ЛДГ‑3 представляет собой тетрамер из 2 H‑субъединиц и 2 M‑субъединиц, ЛДГ‑4 содержит 1 H‑субъединицу и 3 M‑субъединицы, ЛДГ‑5 состоит только из M‑субъединиц. По степени убывания общей каталитической активности энзима все органы и ткани располагаются в следующем порядке: почки, сердце, скелетные мышцы, поджелудочная железа, селезенка, печень, легкие, сыворотка крови. От того, какой изофермент наиболее представлен, зависит преимущественный способ окисления глюкозы в ткани: аэробный (до CO2 и h3O) или анаэробный (до молочной кислоты). Подобное различие обусловлено разной степенью сродства изоферментов к пировиноградной кислоте. Изоферменты, содержащие в основном H‑субъединицы (ЛДГ‑1 и ЛДГ‑2), обладают низким сродством к пирувату и поэтому неспособны эффективно конкурировать за субстрат с пируватдегидрогеназным комплексом. В результате пируват подвергается окислительному декарбоксилированию и в виде ацетил‑КоA вступает в цикл Кребса. Напротив, изоферменты, обладающие главным образом M‑субъединицами (ЛДГ‑4 и ЛДГ‑5), имеют более высокое сродство к пирувату и, как следствие, превращают его в молочную кислоту. Для каждой ткани установлены наиболее типичные изоферменты. Для миокарда и мозговой ткани основным изоэнзимом является ЛДГ‑1, для эритроцитов, тромбоцитов, почечной ткани — ЛДГ‑1 и ЛДГ‑2. В легких, селезенке, щитовидной и поджелудочной железах, надпочечниках, лимфоцитах преобладает ЛДГ‑3. ЛДГ‑4 находится во всех тканях с ЛДГ‑3, а также в гранулоцитах и мужских половых клетках, в последних дополнительно обнаруживается ЛДГ‑5. В скелетных мышцах изоферментная активность располагается в порядке убывания в ряду: ЛДГ‑5, ЛДГ‑4, ЛДГ‑3. Для печени наиболее характерен изофермент ЛДГ‑5, выявляется также ЛДГ‑4. В норме основным источником активности ЛДГ в плазме крови являются разрушающиеся клетки крови. В сыворотке активность изоферментов распределяется следующим образом: ЛДГ‑2 > ЛДГ‑1 > ЛДГ‑3 > ЛДГ‑4 > ЛДГ‑5. При электрофорезе между фракциями ЛДГ‑3 и ЛДГ‑4 иногда обнаруживается дополнительная полоса изофермента ЛДГ‑X, данный изофермент локализован в тех же органах, что и ЛДГ‑5. Все заболевания, протекающие с разрушением клеток, сопровождаются резким повышением активности ЛДГ в сыворотке крови. Нарастание общей активности фермента обнаруживается при таких заболеваниях как инфаркт миокарда, некротическое поражение почек, гепатит, панкреатит, воспаление и инфаркт легкого, опухоли различной локализации, повреждения, дистрофия и атрофия мышц, гемолитические анемии и физиологическая желтуха новорожденных, лимфогранулематоз, лейкозы. При инфаркте миокарда начало роста активности фермента в сыворотке крови отмечается на 8‑10 час от момента приступа, максимальное увеличение наступает к 24‑48 часу, нередко в 15‑20 раз превышая норму. Повышенная активность ЛДГ сохраняется до 10‑12 суток от начала заболевания. Степень нарастания активности фермента не всегда коррелирует с размерами поражения сердечной мышцы и для прогноза исхода заболевания может являться лишь ориентировочным фактором. У больных стенокардией активность фермента не изменяется, что позволяет применять тест для дифференциальной диагностики в пределах 2‑3 суток после сердечного приступа. Наличие органной специфичности ферментов позволяет применять исследование их активности с целью топической диагностики. 11. Физиологические значения общей активности креатининкиназы (КК) и ее изоферментов в плазме крови. Диагностическая значимость определения активности КК и ее изоферментов. Креатинкиназа (КК) – это фермент, природный катализатор химических реакций, значительно увеличивающий скорость преобразования креатина и АТФ (аденозинтрифосфат) в высокоэнергетическое соединение креатинфосфат, который расходуется при интенсивных мышечных сокращениях. Данный фермент содержится в цитоплазме клеток различных мышц (сердечной, скелетных), а также в клетках мозга, легких, щитовидной железы. Молекулу креатинкиназы можно поделить на две части, каждая из которых реализуется в виде отдельной субъединицы: М (мышца), и B (мозг). Данные субъединицы в организме человека могут объединяться вместе тремя способами, образуя, соответственно, три изоформы креатинкиназы: ММ, МВ и ВВ. Эти изоферменты отличаются своей локализацией в организме человека: креатинкиназа ММ расположена в миокарде и скелетных мышцах; креатинкиназа МВ локализована в большей степени в миокарде; креатинкиназа ВВ содержится в клетках плаценты, головного мозга, мочевыводящих путей, некоторых опухолях и других местах. Нормальная концентрация фермента напрямую зависит от возраста и пола человека. В связи с активным развитием мускулатуры и нервной системы, у детей активность природного катализатора повышена по отношению к активности у взрослых. У женщин креатинкиназа ниже, чем у мужчин. Уровень изофермента ММ оказывается повышен в большей степени в результате повреждений мышц, и редко при повреждениях сердца. Содержание КК МВ связано с повреждением миокарда. Значительное увеличение активности данной формы наблюдается при инфаркте миокарда. Ее уровень резко возрастает уже через два — четыре часа после первых симптомов. Поэтому концентрация данного фермента в крови активно используется для определения инфаркта миокарда. Однако, стоит отметить, что содержание КК МВ возвращается к нормальному уровню по прошествии трех-шести дней, что обуславливает низкую эффективность диагностики на поздних сроках. Концентрация КК ВВ увеличивается при онкологических заболеваниях. Снижение уровня изоферментов не несет никакой диагностической ценности, так как минимальный порог содержания КК у здорового человека равен нулю. 12. Липазы плазмы крови. Диагностическая значимость определения активности липазы.Липаза — синтезируемый человеческим организмом водорастворимый фермент, катализирующий гидролиз нерастворимых эстеров (липидных субстратов) и способствующий перевариванию, растворению и фракционированию нейтральных жиров. Вместе с желчью липаза стимулирует переваривание жиров, жирных кислот, жирорастворимых витаминов А, Е, D, К, трансформируя их в энергию и тепло. Назначением липопротеинлипазы является расщепление триглицеридов (липидов) в липопротеинах крови, благодаря чему обеспечивается доставка жирных кислот к тканям. Липазу вырабатывают: поджелудочная железа; печень; легкие; кишечник особые железы, расположенные в ротовой полости детей грудного возраста. В последнем случае синтезируется так называемая лингвальная липаза. Каждый из перечисленных ферментов способствует расщеплению определенной группы жиров. С точки зрения значимости при постановке диагноза важную роль играет липаза, вырабатываемая поджелудочной железой. Повышение уровня фермента отмечается при: панкреатите, протекающем в острой форме, или при обострении хронического процесса; желчных коликах; травме поджелудочной железы; наличии в поджелудочной железе новообразований; хронических патологиях желчного пузыря; образовании кисты или псевдокисты в поджелудочной железе; закупорке панкреатического протока рубцом или камнем; внутрипеченочном холестазе; острой кишечной непроходимости; инфаркте кишечника; перитоните; прободении язвы желудка; перфорации внутреннего (полого) органа; острой или хронической почечной патологии; эпидемическом паротите, при котором происходит поражение поджелудочной железы; нарушениях обменных процессов, имеющих место при сахарном диабете, ожирении или подагре; циррозе печени; длительном приеме медицинских препаратов – в частности, барбитуратов, анальгетиков наркотического ряда, гепарина, индометацина; операции по трансплантации органов. В редких случаях процесс активизации липазы оказывается связанным с некоторыми травмами – например, переломами трубчатых костей. Но в этом случае колебания уровня фермента в крови не могут считаться специфическим показателем наличия физического повреждения. По этой причине анализы на липазу не учитываются при диагностике травм различного происхождения. Определение уровня липазы в сыворотке обретает особую важность при любом поражении поджелудочной железы. В этом случае анализ крови на содержание данного энзима вместе с анализом на амилазу (фермент, способствующий расщеплению крахмала до олигосахаридов) с высокой степенью достоверности указывает на наличие патологического процесса в тканях поджелудочной железы: оба показателя оказываются выше нормы). В процессе нормализации состояния больного названные ферменты возвращаются к адекватным показателям не одновременно: как правило, уровень липазы остается на высоком уровне дольше, чем уровень амилазы. Высокий уровень липазы сохраняется от 3 до 7 суток с начала развития воспаления. Тенденция к снижению фиксируется только спустя 7-14 дней. Низкий уровень липазы фиксируется: при наличии злокачественного новообразования в любой части организма, кроме самой поджелудочной железы; вследствие снижения функции поджелудочной железы; при кистозном фиброзе (муковисцидозе) – генетическом заболевании с тяжелым течением, возникающем в результате патологического поражения желез внешней секреции (ЖКТ, легких). после оперативного вмешательства по удалению поджелудочной железы; при избыточном содержании триглицеридов в крови, возникающем по причине неправильного питания с обилием жирных продуктов в рационе или вследствие наследственной гиперлипидемии. В некоторых случаях снижение уровня липазы является маркером перехода панкреатита в хроническую форму. |


