Матричная РНК — Википедия
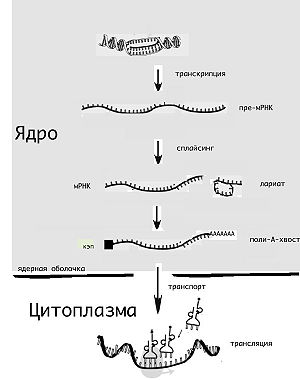
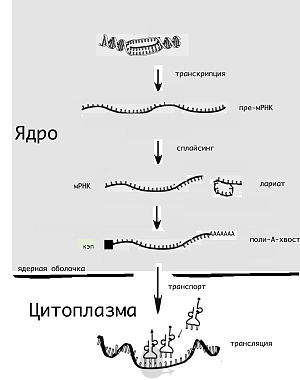 Основные этапы жизненного цикла мРНК эукариот
Основные этапы жизненного цикла мРНК эукариот 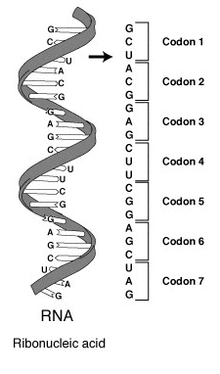
Ма́тричная рибонуклеи́новая кислота́ (мРНК, синоним — информацио́нная РНК, иРНК) — РНК, содержащая информацию о первичной структуре (аминокислотной последовательности) белков[1]. мРНК синтезируется на основе ДНК в ходе транскрипции, после чего, в свою очередь, используется в ходе трансляции как матрица для синтеза белков. Тем самым мРНК играет важную роль в «проявлении» (экспрессии) генов.
Длина типичной зрелой мРНК составляет от нескольких сотен до нескольких тысяч нуклеотидов. Самые длинные мРНК отмечены у (+)оц РНК-содержащих вирусов, например пикорнавирусов, однако следует помнить, что у этих вирусов мРНК образует весь их геном.
ДНК нередко сравнивают с чертежами для изготовления белков. Развивая эту инженерно-производственную аналогию, можно сказать, что, если ДНК — полный набор чертежей для изготовления белков, находящийся на хранении в сейфе директора завода, то мРНК — временная рабочая копия чертежа отдельной детали, выдаваемая в сборочный цех. Следует отметить, что ДНК не содержит чертежи
К середине XX века были накоплены научные данные, которые позволили заключить, что структура белков кодируется участками ДНК — генами[2]. Однако непосредственный механизм кодирования не был установлен.
Работы Ж. Браше (1944) и Т. Касперссона (1947) показали, что клетки, активно синтезирующие белок, содержат большое количество РНК в цитоплазме. Впоследствии выяснилось, что это относится главным образом к рибосомальной РНК, а не к мРНК, количество которой в клетке относительно невелико. Тем не менее, это наблюдение связывало между собой ДНК, РНК и белок и, вероятно, сыграло роль в предположении о возможной роли РНК как посредника, способного переносить информацию от ДНК в ядре к аппарату биосинтеза белка в цитоплазме [3].
В это же время были открыты рибосомы — рибонуклеопротеидные частицы, синтезирующие белок. Было сделано предположение о том, что гены транскрибируются в РНК рибосом, которые и служат матрицами для синтеза белка[4]. Однако в 1956—1958 годах А. Белозерский и А. Спирин, проведя сравнительный анализ нуклеотидного состава ДНК и РНК ряда микроорганизмов, показали, что, при больших вариациях в составе ДНК, РНК разных видов были довольно похожи[5]. Это указывало на то, что основная масса клеточной РНК (рРНК) не отражает нуклеотидный состав ДНК данного организма и не может служить матрицей для синтеза белков. В то же время авторам удалось наблюдать слабую положительную корреляцию между составом ДНК и РНК при больших различиях между видами. Это позволило им предположить, что в клетке, помимо рРНК, существует ещё одна небольшая фракция РНК, которая может быть посредником при экспрессии генов.
Независимо Э. Волкин и Л. Астрачан пришли к сходным выводам: они обнаружили, что при заражении бактериальных клеток бактериофагом Т2 они полностью переключаются на синтез белков вируса. В то время как большая часть РНК клетки-хозяина остаётся неизменной, после заражения синтезируется небольшое количество короткоживущей РНК, сходной по нуклеотидному составу с ДНК фага[6][7].
В 1961 году несколькими группами исследователей было прямо доказано существование короткоживущего РНК-посредника, близкого по структуре к генам в ДНК, который служит матрицей для синтеза белка, связываясь с рибосомами[8][9].
Жизненный цикл молекулы мРНК начинается её «считыванием» с матрицы ДНК (транскрипция) и завершается её деградацией до отдельных нуклеотидов. Молекула мРНК в течение своей жизни может подвергаться различным модификациям перед синтезом белка (трансляцией). Эукариотические молекулы мРНК часто требуют сложной обработки и транспортировки из ядра — места синтеза мРНК, на рибосомы, где происходит трансляция, в то время как прокариотические молекулы мРНК этого не требуют и синтез РНК у них сопряжён с синтезом белка [10].
Транскрипция[править | править код]
Транскрипцией называют процесс копирования генетической информации с ДНК на РНК, в частности на мРНК. Транскрипция осуществляется ферментом РНК-полимеразой, строящей, согласно принципу комплементарности, копию участка ДНК на основании одной из цепей двойной спирали. Этот процесс как у эукариот, так и у прокариот организован одинаково. Основное различие между про- и эукариотами состоит в том, что у эукариот РНК-полимераза во время транскрипции ассоциируется с мРНК-обрабатывающими ферментами, поэтому у них обработка мРНК и транскрипция могут проходить одновременно. Короткоживущие необработанные или частично обработанные продукты транскрипции называются пре-мРНК
Созревание эукариотической мРНК[править | править код]
В то время как мРНК прокариот (бактерий и архей), за редкими исключениями, сразу готовы к трансляции и не требуют специальной обработки, эукариотические пре-мРНК подвергаются интенсивным модификациям. Так, одновременно с транскрипцией происходит добавление на 5′-конец молекулы РНК специального модифицированного нуклеотида (кэпа), удаление определённых участков РНК (сплайсинг), а также добавление на 3′-конец адениновых нуклеотидов (так называемый полиадениновый, или поли(А)-, хвост). Обычно эти посттранскрипционные изменения мРНК эукариот обозначают термином «процессинг мРНК».
Кэпирование является первым этапом процессинга мРНК. Оно осуществляется, когда синтезируемый транскрипт достигает длины 25—30 нуклеотидов[12]. Сразу после присоединения кэпа к 5′-концу транскрипта с ним связывается кэп-связывающий комплекс CBC (англ. cap binding complex), который остаётся связанным с мРНК до завершения процессинга и важен для всех последующих его этапов [13]. В процессе сплайсинга из пре-мРНК удаляются не кодирующие белок последовательности — интроны. Полиаденилирование необходимо для транспорта большинства мРНК в цитоплазму и защищает молекулы мРНК от быстрой деградации (увеличивает время их полужизни). Лишённые поли(А)-участка молекулы мРНК (например, вирусные) быстро разрушаются в цитоплазме клеток эукариот рибонуклеазами.
После завершения всех стадий процессинга мРНК проходит проверку на отсутствие преждевременных стоп-кодонов, после чего она становится полноценной матрицей для трансляции[14]. В цитоплазме кэп узнаётся факторами инициации, белками, отвечающими за присоединение к мРНК рибосомы, полиадениновый хвост связывается со специальным поли(А)-связывающим белком PABP1.
Сплайсинг[править | править код]
 Схема сплайсинга, в процессе которого пре-мРНК созревает в зрелую РНК. Зелёный — нетранслируемые участки (UnTranslated Regions, UTR), синий — интроны, красный — транслируемые (кодирующие белок) участки
Схема сплайсинга, в процессе которого пре-мРНК созревает в зрелую РНК. Зелёный — нетранслируемые участки (UnTranslated Regions, UTR), синий — интроны, красный — транслируемые (кодирующие белок) участкиТранспорт[править | править код]
Другое различие между эукариотами и прокариотами — транспорт мРНК. Из-за того, что эукариотические транскрипция и трансляция пространственно разделены, эукариотические мРНК должны быть выведены из ядра в цитоплазму[16]. Зрелые мРНК распознаются по наличию модификаций и покидают ядро через ядерные поры, в цитоплазме мРНК образует нуклеопротеидные комплексы — информосомы, в составе которых транспортируется к рибосомам. Многие мРНК содержат сигналы, которые определяют их локализацию [17]. В нейронах мРНК должна транспортироваться из тела нейронов в дендриты, где трансляция происходит в ответ на внешние раздражители[18].
Экспорт мРНК осуществляется при участии комплекса транспортных факторов Mex67—Mtr2 (у дрожжей) или TAP—p15 (у многоклеточных)[19]. Однако этот комплекс связывает мРНК не напрямую, а через адаптерный белок Yra1 (у дрожжей) или ALY/REF (у многоклеточных), который является одной из субъединиц белкового комплекса TREX. В свою очередь, TREX привлекается в комплекс с мРНК за счёт прямого взаимодействия ALY/REF с CBC80 субъединицей кэп-связывающего комплекса[20]. Такой механизм обеспечивает присоединение транспортного комплекса близко к 5′-концу мРНК и соответствующую направленность её транспорта, 5′-концом в сторону цитоплазмы.
Метилирование[править | править код]
мРНК эукариот подвергаются посттранскрипционному метилированию. Наиболее распространённой модификацией является метилирование остатков аденозина по положению N6 с образованием N6-метиладенозина (m6A). Этот процесс катализируют ферменты N6-аденозинметилтрансферазы, которые распознают остатки аденозина в консенсусных последовательностях GAC (70 % случаев) и AAC (30 % случаев). Соответствующие деметилазы катализируют обратный процесс деметилирования. Учитывая обратимость и динамичность процесса метилирования мРНК, а также повышенную концентрацию m6A в длинных экзонах и вокруг стоп-кодонов, предполагают, что метилирование мРНК выполняет регуляторную функцию[21].
Трансляция[править | править код]
Поскольку прокариотическая мРНК не нуждается в обработке и транспортировке, трансляция рибосомой может начаться немедленно после транскрипции. Следовательно, можно сказать, что трансляция у прокариот совмещена с транскрипцией и происходит ко-транскрипционно.
Эукариотическая мРНК должна быть обработана и доставлена из ядра в цитоплазму, и только тогда может быть транслирована рибосомой. Трансляция может происходить как на рибосомах, находящихся в цитоплазме в свободном виде, так и на рибосомах, ассоциированных со стенками эндоплазматического ретикулума. Таким образом, у эукариот трансляция не совмещена напрямую с транскрипцией.
Регуляция трансляции[править | править код]
Так как у прокариот транскрипция совмещена с трансляцией, прокариотическая клетка может быстро реагировать на изменения в окружающей среде путём синтеза новых белков, то есть регуляция происходит, в основном, на уровне транскрипции. У эукариот из-за необходимости процессинга и транспорта мРНК ответ на внешние стимулы занимает больше времени. Поэтому их синтез белка интенсивно регулируется на посттранскрипционном уровне. Не всякая зрелая мРНК транслируется, поскольку в клетке существуют механизмы регуляции экспрессии белков на посттранскрипционном уровне, например, РНК-интерференция.
Некоторые мРНК в действительности содержат два тандемных терминаторных кодона (стоп-кодона) — часто это кодоны различного типа на конце кодирующей последовательности[22].
 Схема строения зрелой эукариотической мРНК
Схема строения зрелой эукариотической мРНКЗрелая мРНК состоит из нескольких участков, различающихся по функциям: «5′-кэп», 5′-нетранслируемая область, кодирующая (транслируемая) область, 3′-нетранслируемая область и 3′-полиадениновый «хвост».
5′-Кэп[править | править код]
Основная статья: Кэп5′-кэп (от англ. cap — шапочка) — модифицированный гуанозиновый нуклеотид, который добавляется на 5′- (передний) конец незрелой мРНК. Эта модификация очень важна для узнавания мРНК при инициации трансляции, а также для защиты от 5′-нуклеаз — ферментов, разрушающих цепи нуклеиновых кислот с незащищённым 5′-концом.
Кодирующие области[править | править код]
Кодирующие области состоят из кодонов — следующих непосредственно друг за другом последовательностей из трёх нуклеотидов, каждая из которых соответствует в генетическом коде определённой аминокислоте или началу и концу синтеза белка. Кодирующие области начинаются со старт-кодона и заканчиваются одним из трёх стоп-кодонов. Считывание последовательности кодонов и сборка на её основе последовательности аминокислот синтезируемой молекулы белка осуществляется рибосомами при участии транспортных РНК в процессе трансляции. В дополнение к кодированию белков, части кодирующих областей могут служить управляющими последовательностями. Например, вторичная структура РНК в некоторых случаях определяет результат трансляции.
Моноцистронная и полицистронная мРНК[править | править код]
мРНК называют моноцистронной, если она содержит информацию, необходимую для трансляции только одного белка (один цистрон). Полицистронная мРНК кодирует несколько белков. Гены (цистроны) в такой мРНК разделены интергенными, некодирующими последовательностями. Полицистронные мРНК характерны для прокариот и вирусов, у эукариот большая часть мРНК является моноцистронной[23][24][25]. Полицистронные мРНК встречаются у эукариот и в митохондриях.
Нетранслируемые области[править | править код]
Нетранслируемые области — участки РНК, расположенные до старт-кодона и после стоп-кодона, которые не кодируют белок. Они называются 5′-нетранслируемая область и 3′-нетранслируемая область, соответственно. Эти области транскрибируются в составе того же самого транскрипта, что и кодирующий участок. Нетранслируемые области имеют несколько функций в жизненном цикле мРНК, включая регуляцию стабильности мРНК, локализации мРНК и эффективности трансляции. Стабильность мРНК может контролироваться 5′- и/или 3′-областью из-за различной чувствительности к ферментам, которые отвечают за деградацию РНК — РНКазам и регуляторным белкам, которые убыстряют или замедляют деградацию[26].
3′-полиадениновый хвост[править | править код]
Длинная (часто несколько сотен нуклеотидов) последовательность адениновых оснований, которая присутствует на 3′-«хвосте» мРНК эукариот, синтезируется ферментом полиаденилатполимеразой. У высших эукариот поли(А)-хвост добавляется к транскрибированной РНК, которая содержит специфическую последовательность, AAUAAA. Важность этой последовательности можно увидеть на примере мутации в гене человеческого 2-глобина, которая изменяет AAUAAA на AAUAAG, что приводит к недостаточному количеству глобина в организме[27].
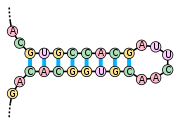
 «Стебель-петля» — элемент вторичной структуры мРНК, схематично
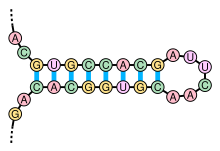
«Стебель-петля» — элемент вторичной структуры мРНК, схематично 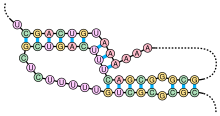 «Псевдоузел» — элемент вторичной структуры мРНК, схематично
«Псевдоузел» — элемент вторичной структуры мРНК, схематичноКроме первичной структуры (последовательности нуклеотидов), мРНК обладает вторичной структурой. В отличие от ДНК, вторичная структура которой основана на межмолекулярных взаимодействиях (двойная спираль ДНК образована двумя линейными молекулами, соединенными друг с другом по всей длине водородными связями), вторичная структура мРНК основана на внутримолекулярных взаимодействиях (линейная молекула «складывается», и водородные связи возникают между разными участками одной и той же молекулы).
Примерами вторичной структуры могут служить стебель-петля и псевдоузел[28]
Вторичные структуры в мРНК служат для регуляции трансляции. Например, вставка в белки необычных аминокислот, селенометионина и пирролизина, зависит от стебля-петли, расположенной в 3′-нетранслируемой области. Псевдоузлы служат для программированного изменения рамки считывания генов. Также вторичная структура служит для замедления деградации определённых мРНК[29][30]
В вирусных мРНК сложные вторичные структуры (IRES) направляют трансляцию, не зависящую от узнавания кэпа и факторов инициации трансляции (см. «Инициация трансляции»).
Различные мРНК имеют различную продолжительность жизни (стабильность). В клетках бактерий молекула мРНК может существовать от нескольких секунд до более часа, а в клетках млекопитающих от нескольких минут до нескольких дней. Чем больше стабильность мРНК, тем больше белка может быть синтезировано с данной молекулы. Ограниченное время жизни мРНК клетки позволяет быстро изменять синтез белка в ответ на изменяющиеся потребности клетки. По прошествии некоторого времени, определяемого её нуклеотидной последовательностью, в частности, длиной полиаденинового участка на 3′-конце молекулы, мРНК разрушается на составляющие её нуклеотиды с участием РНКаз. К настоящему времени известно много механизмов деградации мРНК, некоторые из которых описаны ниже.
Деградация мРНК у прокариот[править | править код]
У прокариот стабильность мРНК намного меньше, чем у эукариот. Деградация мРНК в клетках прокариот происходит под действием комбинации рибонуклеаз, в том числе эндонуклеаз, 3′-экзонуклеаз и 5′-экзонуклеаз. В некоторых случаях малые молекулы РНК длиной от десятков до сотен нуклеотидов могут стимулировать деградацию мРНК, комплементарно спариваясь с соответствующими последовательностями в мРНК и содействуя рибонуклеазам[31][32] . В 2008 году было показано, что бактерии имеют нечто вроде кэпа — трифосфат на 5′-конце[33]. Удаление двух фосфатов оставляет монофосфат на 5′-конце, в результате чего мРНК расщепляется эндонуклеазой РНКаза E.
У эукариот[править | править код]
Как правило, разрушение начинается с удаления кэпа на 5′-конце, полиаденинового хвоста на 3′-конце, и затем нуклеазы одновременно разрушают мРНК в направлениях 5′ ->3′ и 3′ ->5′. мРНК, в которой сигнал завершения синтеза белка, стоп-кодон, в результате ошибки транскрипции находится в середине кодирующей последовательности, подвержена особой быстрой форме деградации, НМД.
В последнее время разработаны очень чувствительные методы, позволяющие проанализировать «транскриптом» из образцов размером в 50—100 клеток[34][35][36].
- ↑ Bruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, Peter Walter. Molecular Biology of the Cell. — 5. — Garland Science, 2008. — 1392 с. — ISBN 0815341059.
- ↑ Ичас М. Биологический код. — Москва: Мир, 1971.
- ↑ Crick F. H. The genetic code — yesterday, today, and tomorrow // Cold Spring Harb. Symp. Quant. Biol.. — 1966. — Т. 31. — С. 1—9. — PMID 5237190.
- ↑ Спирин А. С. Глава II. Информационная РНК и генетический код // Молекулярная биология. Структура рибосомы и биосинтез белка. — Москва: Высшая школа, 1986. — С. 9—11.
- ↑ Belozersky A. N., Spirin A. S. A correlation between the compositions of deoxyribonucleic and ribonucleic acids (англ.) // Nature. — 1958. — Vol. 182, iss. 4628. — P. 111—112. — PMID 13566202.
- ↑ Volkin E., Astrachan L. Intracellular distribution of labeled ribonucleic acid after phage infection of Escherichia coli // Virology. — 1956. — Т. 2, вып. 4. — С. 433—437. — PMID 13352773.
- ↑ Volkin E., Astrachan L. Phosphorus incorporation in Escherichia coli ribo-nucleic acid after infection with bacteriophage T2 // Virology. — 1956. — Т. 2, вып. 2. — С. 149—161. — PMID 13312220.
- ↑ Brenner S., Jacob F., Meselson M. An unstable intermediate carrying information from genes to ribosomes for protein synthesis (англ.) // Nature. — 1961. — Vol. 190. — P. 576—581. — PMID 20446365.
- ↑ Gros F., Hiatt H., Gilbert W., Kurland C. G., Risebrough R. W., Watson J. D. Unstable ribonucleic acid revealed by pulse labelling of Escherichia coli (англ.) // Nature. — 1961. — Vol. 190. — P. 581—585. — PMID 13708983.
- ↑ Alberts, Bruce; Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, and Peter Walters. Molecular Biology of the Cell; Fourth Edition (англ.). — New York and London: Garland Science (англ.)русск., 2002.
- ↑ Rasmussen E. B., Lis JT. In vivo transcriptional pausing and cap formation on three Drosophila heat shock genes (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1993. — Vol. 90. — P. 7923—7927. — PMID 8367444.
- ↑ Topisirovic I., Svitkin Y. V., Sonenberg N., Shatkin A. J. Cap and cap-binding proteins in the control of gene expression (англ.) // Wiley Interdiscip Rev RNA : journal. — 2011. — Vol. 2, no. 2. — P. 277—298. — DOI:10.1002/wrna.52. — PMID 21957010.
- ↑ Maquat L. E. Nonsense-mediated mRNA decay: splicing, translation and mRNP dynamics (англ.) // Nat. Rev. Mol. Cell Biol. : journal. — 2004. — Vol. 5, no. 2. — P. 89—99. — DOI:10.1038/nrm1310. — PMID 15040442.
- ↑ Johnston W., Unrau P., Lawrence M., Glasner M., Bartel D. RNA-catalyzed RNA polymerization: accurate and general RNA-templated primer extension (англ.) // Science : journal. — 2001. — Vol. 292, no. 5520. — P. 1319—1325. — PMID 11358999. Архивировано 27 февраля 2012 года.
- ↑ Paquin N., Chartrand P. Local regulation of mRNA translation: new insights from the bud (англ.) // Trends Cell Biol (англ.)русск. : journal. — 2008. — Vol. 18. — P. 105—111.
- ↑ Ainger, Kevin; Avossa, Daniela; Diana, Amy S. & Barry, Christopher (1997), «Transport and Localization Elements in Myelin Basic Protein mRNA», The Journal of Cell Biology Т. 138 (5): 1077–1087, PMID 9281585, doi:10.1083/jcb.138.5.1077, <http://www.jcb.org/cgi/content/full/138/5/1077>
- ↑ Job, C. & Eberwine, J. (1912), «Localization and translation of mRNA in dendrites and axons», Nat Rev Neurosci Т. 2001 (12): 889–98, PMID 11733796, doi:10.1038/35104069, <https://www.ncbi.nlm.nih.gov/pubmed/11733796>
- ↑ Köhler A., Hurt E. Exporting RNA from the nucleus to the cytoplasm (англ.) // Nat. Rev. Mol. Cell Biol. : journal. — 2007. — Vol. 8, no. 10. — P. 761—773. — DOI:10.1038/nrm2255. — PMID 17786152.
- ↑ Cheng H., Dufu K., Lee C. S., Hsu J. L., Dias A., Reed R. Human mRNA export machinery recruited to the 5′ end of mRNA (англ.) // Cell : journal. — Cell Press (англ.)русск., 2006. — Vol. 127, no. 7. — P. 1389—1400. — DOI:10.1016/j.cell.2006.10.044. — PMID 17190602.
- ↑ Wang X., Lu Z., Gomez A., Hon G. C., Yue Y., Han D., Fu Y., Parisien M., Dai Q., Jia G., Ren B., Pan T., He C. {{{заглавие}}} (англ.) // Nature. — 2014. — Vol. 505, iss. 7481. — P. 117—120. — DOI:10.1038/nature12730. — PMID 24284625.
- ↑ Айала Ф. Д. Современная генетика. 1987.
- ↑ Poyry, T.,Kaminski, A., Jackson R. What determines whertehr mammalian ribosomes resume scanning after translation of a short upstream open reading frame (англ.) // Genes and Development : journal. — 2004. — Vol. 18. — P. 62—75.
- ↑ Kozak, M. (1983), «Comparison of initiation of protein synthesis in procaryotes, eucaryotes, and organelles», Microbiological Reviews Т. 47 (1): 1–45, PMID 6343825, <http://www.pubmedcentral.nih.gov/picrender.fcgi?artid=281560&blobtype=pdf>. Проверено 12 августа 2006.
- ↑ Niehrs C, Pollet N (1999), «Synexpression groups in eukaryotes», Nature Т. 402 (6761): 483–7, PMID 10591207, DOI 10.1038/990025
- ↑ Kozak, M. Comparison of initiation of protein synthesis in procaryotes, eucaryotes, and organelles (англ.) // Microbiology and Molecular Biology Reviews (англ.)русск. : journal. — American Society for Microbiology (англ.)русск., 1983. — Vol. 47, no. 1. — P. 1—45. — PMID 15680349.
- ↑ Shaw, G. and Kamen, R. A conserved AU sequence from the 3′ untranslated region of GM-CSF mRNA mediates selective mRNA degradation (англ.) // Cell : journal. — Cell Press (англ.)русск., 1986. — Vol. 46, no. 5. — P. 659—667. — PMID 15680349.
- ↑ Козлов, Н. Н., Кугушев, Е. И., Сабитов, Д. И., Энеев, Т. М. «Компьютерный анализ процессов структурообразования нуклеиновых кислот».
- ↑ Shabalina SA, Ogurtsov AY, Spiridonov NA (2006), «A periodic pattern of mRNA secondary structure created by the genetic code», Nucleic Acids Res. Т. 34 (8): 2428–37, PMID 16682450, DOI 10.1093/nar/gkl287
- ↑ Katz L, Burge CB (2003), «Widespread selection for local RNA secondary structure in coding regions of bacterial genes», Genome Res. Т. 13 (9): 2042–51, PMID 12952875, DOI 10.1101/gr.1257503
- ↑ Vogel J., Wagner E. G. Target identification of small noncoding RNAs in bacteria (англ.) // Curr. Opin. Microbiol. : journal. — 2007. — June (vol. 10, no. 3). — P. 262—270. — DOI:10.1016/j.mib.2007.06.001. — PMID 17574901.
- ↑ Viegas S. C., Arraiano C. M. Regulating the regulators: How ribonucleases dictate the rules in the control of small non-coding RNAs (англ.) // RNA Biol (англ.)русск. : journal. — 2008. — Vol. 5, no. 4. — P. 230—243. — PMID 18981732.
- ↑ Deana, Atilio; Celesnik, Helena & Belasco, Joel G. (2008), «The bacterial enzyme RppH triggers messenger RNA degradation by 5′ pyrophosphate removal», Nature Т. 451 (7176): 355–8, PMID 18202662, doi:10.1038/nature06475, <http://www.nature.com/nature/journal/v451/n7176/abs/nature06475.html>
- ↑ Bhargava, V., Ko, P., Willems, E., Mercola, M., & Subramaniam, S. (2013)Quantitative Transcriptomics using Designed Primer-based Amplification. Scientific reports, 3, Article number: 1740 doi:10.1038/srep01740
- ↑ Tilgner, H., Raha, D., Habegger, L., Mohiuddin, M., Gerstein, M., & Snyder, M. (2013). Accurate Identification and Analysis of Human mRNA Isoforms Using Deep Long Read Sequencing. G3: Genes| Genomes| Genetics, 3(3), 387—397.doi: 10.1534/g3.112.004812
- ↑ Drewe, P., Stegle, O., Hartmann, L., et al. & Rätsch, G. (2013). Accurate detection of differential RNA processing. Nucleic acids research, 41(10), 5189-5198 doi: 10.1093/nar/gkt211
ИРНК — это… Что такое ИРНК?
Основные этапы жизненного цикла мРНК эукариот
Ма́тричная рибонуклеи́новая кислота́ (мРНК, синоним — информацио́нная РНК, иРНК) — РНК, отвечающая за перенос информации о первичной структуре белков от ДНК к местам синтеза белков. мРНК синтезируется на основе ДНК в ходе транскрипции, после чего, в свою очередь, используется в ходе трансляции как матрица для синтеза белков. Тем самым мРНК играет важную роль в «проявлении» (экспрессии) генов.
Длина типичной зрелой мРНК составляет от нескольких сотен до нескольких тысяч нуклеотидов. Самые длинные мРНК отмечены у (+)оц РНК-содержащих вирусов, например пикорнавирусов, однако следует помнить, что у этих вирусов мРНК образует весь их геном.
ДНК нередко сравнивают с чертежами для изготовления белков. Развивая эту инженерно-производственную аналогию, можно сказать, что, если ДНК — это полный набор чертежей для изготовления белков, находящийся на хранении в сейфе директора завода, то мРНК — временная рабочая копия чертежа, выдаваемая в сборочный цех.
Гипотеза о значении РНК в синтезе белков была высказана Торбьёрном Касперссоном (Torbjörn Caspersson) на основе исследований 1937—1939 гг., в результате которых было показано, что клетки, активно синтезирующие белок, содержат большое количество РНК. Подтверждение гипотезы было получено Юбером Шантренне (Hubert Chantrenne).
«Жизненный цикл» мРНК
Жизненный цикл молекулы мРНК начинается её «считыванием» с матрицы ДНК (транскрипция) и завершается её деградацией до отдельных нуклеотидов. Молекула мРНК в течение своей жизни может быть также «отредактирована» перед синтезом белка (трансляцией). Эукариотические молекулы мРНК часто требуют сложной обработки и транспортировки из ядра — места синтеза мРНК, в цитоплазму, где происходит трансляция, в то время как прокариотические молекулы мРНК этого не требуют и синтез РНК у них сопряжён с синтезом белка.[1].
Транскрипция
Транскрипцией называют процесс копирования генетической информации с ДНК на РНК, в частности на мРНК. Транскрипция осуществляется ферментом РНК-полимеразой, строящей, согласно принципу комплементарности, копию участка ДНК на основании одной из цепей двойной спирали. Этот процесс как у эукариот, так и у прокариот организован одинаково. Основное различие между про- и эукариотами состоит в том, что у эукариот РНК-полимераза во время транскрипции ассоциируется с мРНК-обрабатывающими ферментами, поэтому у них обработка мРНК и транскрипция могут проходить одновременно. Короткоживущие необработанные или частично обработанные продукты транскрипции называются пред-мРНК; после полной обработки — зрелая мРНК.
Обработка эукариотической пред-мРНК
Основная статья: Посттранскрипционные изменения РНК
В то время как мРНК прокариот (бактерий и архей), за редкими исключениями, сразу готовы к трансляции и не требуют специальной обработки, эукариотические пре-мРНК требуют более интенсивной обработки. В процессе сплайсинга из пре-мРНК удаляются не кодирующие белок последовательности (интроны), на 5′ конец молекулы добавляется специальный модифицированный нуклеотид (кэп), на 3′ конец добавляются несколько аденинов, так называемый полиадениновый хвост. Кэп узнаётся факторами инициации, белками, отвечающими за присоединение к мРНК рибосомы, полиадениновый хвост связывается с со специальным белком. Обычно эти посттранскрипционные изменения мРНК эукариот обозначают термином «процессинг мРНК». Полиаденилирование необходимо для транспорта большинства мРНК в цитоплазму и защищает молекулы мРНК от быстрой деградации (увеличивает время их полужизни). Лишенные поли-А участка молекулы мРНК (например, вирусные) быстро разрушаются в цитоплазме клеток эукариот рибонуклеазами.
Сплайсинг

Схема сплайсинга, в процессе которого пре-мРНК созревает в зрелую РНК. Зелёный — нетранслируемые участки (UnTranslated Regions, UTR), синий — интроны, красный — транслируемые (кодирующие белок) участки.
Сплайсинг — это процесс, в котором из пре-мРНК удаляются участки некодирующей белок последовательности, называемые интронами; последовательности, которые остаются, включают в себя кодирующие белки нуклеотиды, и называются экзонами. Иногда продукты сплайсинга пре-мРНК могут быть соединены разными способами, позволяя одному гену кодировать несколько белков. Этот процесс называется альтернативным сплайсингом. Сплайсинг обычно производится РНК-белковым комплексом, который называется сплайсосома, но некоторые молекулы мРНК также могут катализировать сплайсинг без участия белков(см. рибозимы)[2].
Транспорт
Другое различие между эукариотами и прокариотами — транспорт мРНК. Из-за того, что эукариотические транскрипция и трансляция пространственно разделены, эукариотические мРНК должны быть выведены из ядра в цитоплазму[3]. Зрелые мРНК распознаются по наличию модификаций и покидают ядро через ядерные поры, в цитоплазме мРНК образует нуклеопротеидные комплексы — информосомы, в составе которых транспортируется к рибосомам.
Трансляция
Поскольку прокариотическая мРНК не нуждается в обработке и транспортировке, трансляция рибосомой может начаться немедленно после транскрипции. Следовательно, можно сказать, что трансляция у прокариот совмещена с транскрипцией и происходит ко-транскрипционнно.
Эукариотическая мРНК должна быть обработана и доставлена из ядра в цитоплазму, и только тогда может быть транслирована рибосомой. Трансляция может происходить как на рибосомах, находящихся в цитоплазме в свободном виде, так и на рибосомах, ассоциированных со стенками эндоплазматического ретикулума. Таким образом, у эукариот трансляция не совмещена напрямую с транскрипцией.
Регуляция трансляции
Так как у прокариот транскрипция совмещена с трансляцией, прокариотическая клетка может быстро реагировать на изменения в окружающей среде путём синтеза новых белков, то есть регуляция происходит, в основном, на уровне транскрипции. У эукариот из-за необходимости в редактировании и транспорте мРНК ответ на внешние стимулы занимает больше времени. Поэтому их синтез белка интенсивно регулируется на посттранскрипционном уровне. Не всякая зрелая мРНК транслируется, поскольку в клетке существуют механизмы регуляции экспрессии белков на пост-транскрипционном уровне, например, РНК-интерференция.
Разрушение
По прошествии некоторого времени, определяемого её нуклеотидной последовательностью, в частности, длиной полиаденинового участка на 3′ конце молекулы, мРНК разрушается на составляющие её нуклеотиды с участием РНКаз. Как правило, разрушение начинается с удаления кэпа на 5′ конце, полиаденинового хвоста на 3′ конце и затем нуклеазы одновременно разрушают мРНК в 5′ ->3′ и 3′ ->5′ направлении. мРНК, в которой сигнал завершения синтеза белка, стоп-кодон, в результате ошибки транскрипции находится в середине кодирующей последовательности, подвержена особой быстрой форме деградации, НМД, (nonsense-mediated decay).
Строение зрелой мРНК

Схема строения зрелой эукариотической мРНК
Зрелая мРНК состоит из нескольких участков, различающихся по функциям: «5′ кэп», 5′ нетранслируемая область, кодирующая (транслируемая) область, 3′ нетранслируемая область и 3′ полиадениновый «хвост».
5′ Кэп
5′ кэп (или кап) (от англ. cap — шапочка) — это модифицированный гуанидиновый нуклеотид, который добавляется на 5′ (передний) конец незрелой мРНК. Эта модификация очень важна для узнавания мРНК при инициации трансляции, а также для защиты от 5’нуклеаз — ферментов, разрушающих цепи нуклеиновых кислот с незащищённым 5′-концом.
Кодирующие области
Кодирующие области состоят из кодонов — следующих непосредственно друг за другом последовательностей из трёх нуклеотидов, каждая из которых соответствует в генетическом коде определённой аминокислоте или началу и концу синтеза белка. Кодирующие области начинаются со старт-кодона и заканчиваются одним из трёх стоп-кодонов. Считывание последовательности кодонов и сборка на её основе последовательности аминокислот синтезируемой молекулы белка осуществляется рибосомами при участии транспортных РНК в процессе трансляции. В дополнение к кодированию белков, части кодирующих областей могут служить управляющими последовательностями. Например, вторичная структура РНК в некоторых случаях определяет результат трансляции.
Моноцистронная и полицистронная мРНК
мРНК называют моноцистронной, если она содержит информацию, необходимую для трансляции только одного белка (один цистрон). Полицистронная мРНК кодирует несколько белков. Гены (цистроны) в такой мРНК разделены интергенными, некодирующими последовательностями. Полицистронные мРНК характерны для прокариот и вирусов, у эукариот большая часть мРНК является моноцистронной [4]. Полицистронные мРНК встречаются у эукариот в митохондриях.
Нетранслируемые области
Нетранслируемые области — участки РНК, расположенные до старт-кодона и после стоп-кодона, которые не кодируют белок. Они называются 5′-нетранслируемая область и 3′-нетранслируемая область, соответственно. Эти области транскрибируются в составе того же самого транскрипта, что и кодирующий участок. Нетранслируемые области имеют несколько функций в жизненном цикле мРНК, включая регуляцию стабильности мРНК, локализации мРНК и эффективности трансляции. Стабильность мРНК может контролироваться 5′- и/или 3′-областью из-за различной чувствительности к ферментам, которые отвечают за деградацию РНК — РНКазам и регуляторным белкам, которые убыстряют или замедляют деградацию[5].
3′ полиадениновый хвост
Длинная (часто несколько сотен нуклеотидов) последовательность адениновых оснований, которая присутствует на 3′ «хвосте» мРНК эукариот, синтезируется ферментом полиаденилат-полимеразой. У высших эукариот поли-А-хвост добавляется к транскрибированной РНК, которая содержит специфическую последовательность, AAUAAA. Важность этой последовательности можно увидеть на примере мутации в гене человеческого 2-глобина, которая изменяет AAUAAA на AAUAAG, что приводит к недостаточному количеству глобина в организме[6].
Вторичная структура
«Стебель-петля» — элемент вторичной структуры мРНК, схематично

«Псевдоузел» — элемент вторичной структуры мРНК, схематично
Кроме первичной структуры (последовательности нуклеотидов), мРНК обладает вторичной структурой. В отличие от ДНК, вторичная структура которой основана на межмолекулярных взаимодействиях (двойная спираль ДНК образована двумя линейными молекулами, соединенными друг с другом по всей длине водородными связями), вторичная структура мРНК основана на внутримолекулярных взаимодействиях (линейная молекула «складывается», и водородные связи возникают между разными участками одной и той же молекулы).
Примерами вторичной структуры могут служить стебель-петля и псевдоузел [7]
Вторичные структуры в мРНК служат для регуляции трансляции. Например, вставка в белки необычных аминокислот, селенометионина и пирролизина, зависит от стебля-петли, расположенной в 3′ нетранслируемой области. Псевдоузлы служат для программированного изменения рамки считывания генов.
В вирусных мРНК сложные вторичные структуры (Инициация трансляции»).
См. также
Ссылки
- Жизненный цикл мРНК Флэш анимация
- База данных модификаций РНК [1] (англ.)
- База данных старт- и стоп-кодонов, нетранслируемых последовательностей [2] (англ.)
- Сайт, содержащий список программ по предсказанию свойств молекул РНК [3] (англ.)
Литература
- ↑ Bruce Alberts Molecular Biology of the Cell; Fourth Edition. — New York and London: Garland Science. — ISBN ISBN 0-8153-3218-1
- ↑ Johnston W, Unrau P, Lawrence M, Glasner M, Bartel D (2001). «RNA-catalyzed RNA polymerization: accurate and general RNA-templated primer extension». Science 292 (5520): 1319-25. PMID 11358999.
- ↑ Paquin N, Chartrand P. (2008). «Local regulation of mRNA translation: new insights from the bud.». Trends Cell Biol 18: 105-11.
- ↑ Poyry, T.,Kaminski, A., Jackson R (2004). «What determines whertehr mammalian ribosomes resume scanning after translation of a short upstream open reading frame». Genes and Development 18: 62 -75.
- ↑ Kozak, M. (1983). «Comparison of initiation of protein synthesis in procaryotes, eucaryotes, and organelles.». Microbiological Reviews 47 (1): 1-45. PMID 15680349.
- ↑ Shaw, G. and Kamen, R. (1986). «A conserved AU sequence from the 3′ untranslated region of GM-CSF mRNA mediates selective mRNA degradation». Cell. 46 (5): 659-67. PMID 15680349.
- ↑ Козлов, Н. Н., Кугушев, Е. И., Сабитов, Д. И., Энеев, Т. М. «Компьютерный анализ процессов структурообразования нуклеиновых кислот».
| Типы нуклеиновых кислот | |
|---|---|
| Азотистые основания | Пурины (Аденин, Гуанин) | Пиримидины (Урацил, Тимин, Цитозин) |
| Нуклеозиды | Аденозин | Гуанозин | Уридин | Тимидин | Цитидин |
| Нуклеотиды | монофосфаты (АМФ, ГМФ, UMP, ЦМФ) | дифосфаты (АДФ, ГДФ, УДФ, ЦДФ) | трифосфаты (АТФ, ГТФ, УТФ, ЦТФ) | циклические (цАМФ, цГМФ, cADPR) |
| Рибонуклеиновые кислоты | РНК | мРНК | тРНК | рРНК | антисмысловые РНК | микроРНК | некодирующие РНК | piwi-interacting RNA | малые интерферирующие РНК | малые ядерные РНК | малые ядрышковые РНК | тмРНК |
| Дезоксирибонуклеиновые кислоты | ДНК | кДНК | Геном | msDNA | Митохондриальная ДНК |
| Аналоги нуклеиновых кислот | GNA | LNA | ПНК | TNA | Морфолино |
| Типы векторов | en:phagemid | Плазмиды | Фаг лямбда | en:cosmid | en:P1 phage | en:fosmid | BAC | YAC | HAC |
Wikimedia Foundation. 2010.
МРНК — это… Что такое МРНК?
Основные этапы жизненного цикла мРНК эукариотМа́тричная рибонуклеи́новая кислота́ (мРНК, синоним — информацио́нная РНК, иРНК) — РНК, содержащая информацию о первичной структуре (аминокислотной последовательности) белков[1]. мРНК синтезируется на основе ДНК в ходе транскрипции, после чего, в свою очередь, используется в ходе трансляции как матрица для синтеза белков. Тем самым мРНК играет важную роль в «проявлении» (экспрессии) генов.
Длина типичной зрелой мРНК составляет от нескольких сотен до нескольких тысяч нуклеотидов. Самые длинные мРНК отмечены у (+)оц РНК-содержащих вирусов, например пикорнавирусов, однако следует помнить, что у этих вирусов мРНК образует весь их геном.
ДНК нередко сравнивают с чертежами для изготовления белков. Развивая эту инженерно-производственную аналогию, можно сказать, что, если ДНК — это полный набор чертежей для изготовления белков, находящийся на хранении в сейфе директора завода, то мРНК — временная рабочая копия чертежа, выдаваемая в сборочный цех. Следует отметить, что ДНК не содержит чертежи взрослого организма, а больше похожа на «рецепт» по его изготовлению.
Гипотеза о значении РНК в синтезе белков была высказана Торбьёрном Касперссоном (Torbjörn Caspersson) на основе исследований 1937—1939 гг., в результате которых было показано, что клетки, активно синтезирующие белок, содержат большое количество РНК. Подтверждение гипотезы было получено Юбером Шантренне (Hubert Chantrenne).
«Жизненный цикл»
Жизненный цикл молекулы мРНК начинается её «считыванием» с матрицы ДНК (транскрипция) и завершается её деградацией до отдельных нуклеотидов. Молекула мРНК в течение своей жизни может быть также «отредактирована» перед синтезом белка (трансляцией). Эукариотические молекулы мРНК часто требуют сложной обработки и транспортировки из ядра — места синтеза мРНК, на рибосомы, где происходит трансляция, в то время как прокариотические молекулы мРНК этого не требуют и синтез РНК у них сопряжён с синтезом белка.[2].
Транскрипция
Транскрипцией называют процесс копирования генетической информации с ДНК на РНК, в частности на мРНК. Транскрипция осуществляется ферментом РНК-полимеразой, строящей, согласно принципу комплементарности, копию участка ДНК на основании одной из цепей двойной спирали. Этот процесс как у эукариот, так и у прокариот организован одинаково. Основное различие между про- и эукариотами состоит в том, что у эукариот РНК-полимераза во время транскрипции ассоциируется с мРНК-обрабатывающими ферментами, поэтому у них обработка мРНК и транскрипция могут проходить одновременно. Короткоживущие необработанные или частично обработанные продукты транскрипции называются пре-мРНК; после полной обработки — зрелая мРНК.
Обработка эукариотической пре-мРНК
Основная статья: Посттранскрипционные изменения РНК
В то время как мРНК прокариот (бактерий и архей), за редкими исключениями, сразу готовы к трансляции и не требуют специальной обработки, эукариотические пре-мРНК требуют более интенсивной обработки. В процессе сплайсинга из пре-мРНК удаляются не кодирующие белок последовательности (интроны), на 5′ конец молекулы добавляется специальный модифицированный нуклеотид (кэп), на 3′ конец добавляются несколько аденинов, так называемый полиадениновый хвост. Кэп узнаётся факторами инициации, белками, отвечающими за присоединение к мРНК рибосомы, полиадениновый хвост связывается с со специальным белком. Обычно эти посттранскрипционные изменения мРНК эукариот обозначают термином «процессинг мРНК». Полиаденилирование необходимо для транспорта большинства мРНК в цитоплазму и защищает молекулы мРНК от быстрой деградации (увеличивает время их полужизни). Лишенные поли-А участка молекулы мРНК (например, вирусные) быстро разрушаются в цитоплазме клеток эукариот рибонуклеазами.
Сплайсинг
Сплайсинг — это процесс, в котором из пре-мРНК удаляются участки некодирующей белок последовательности, называемые интронами; последовательности, которые остаются, включают в себя кодирующие белки нуклеотиды, и называются экзонами. Иногда продукты сплайсинга пре-мРНК могут быть соединены разными способами, позволяя одному гену кодировать несколько белков. Этот процесс называется альтернативным сплайсингом. Сплайсинг обычно производится РНК-белковым комплексом, который называется сплайсосома, но некоторые молекулы мРНК также могут катализировать сплайсинг без участия белков(см. рибозимы)[3].
Транспорт
Другое различие между эукариотами и прокариотами — транспорт мРНК. Из-за того, что эукариотические транскрипция и трансляция пространственно разделены, эукариотические мРНК должны быть выведены из ядра в цитоплазму[4]. Зрелые мРНК распознаются по наличию модификаций и покидают ядро через ядерные поры, в цитоплазме мРНК образует нуклеопротеидные комплексы — информосомы, в составе которых транспортируется к рибосомам.
Трансляция
Поскольку прокариотическая мРНК не нуждается в обработке и транспортировке, трансляция рибосомой может начаться немедленно после транскрипции. Следовательно, можно сказать, что трансляция у прокариот совмещена с транскрипцией и происходит ко-транскрипционно.
Эукариотическая мРНК должна быть обработана и доставлена из ядра в цитоплазму, и только тогда может быть транслирована рибосомой. Трансляция может происходить как на рибосомах, находящихся в цитоплазме в свободном виде, так и на рибосомах, ассоциированных со стенками эндоплазматического ретикулума. Таким образом, у эукариот трансляция не совмещена напрямую с транскрипцией.
Регуляция трансляции
Так как у прокариот транскрипция совмещена с трансляцией, прокариотическая клетка может быстро реагировать на изменения в окружающей среде путём синтеза новых белков, то есть регуляция происходит, в основном, на уровне транскрипции. У эукариот из-за необходимости в редактировании и транспорте мРНК ответ на внешние стимулы занимает больше времени. Поэтому их синтез белка интенсивно регулируется на посттранскрипционном уровне. Не всякая зрелая мРНК транслируется, поскольку в клетке существуют механизмы регуляции экспрессии белков на пост-транскрипционном уровне, например, РНК-интерференция.
Некоторые мРНК в действительности содержат два тандемных терминаторных кодона (стоп-кодона) — часто это кодоны различного типа на конце кодирующей последовательности[5].
Разрушение
По прошествии некоторого времени, определяемого её нуклеотидной последовательностью, в частности, длиной полиаденинового участка на 3′ конце молекулы, мРНК разрушается на составляющие её нуклеотиды с участием РНКаз. Как правило, разрушение начинается с удаления кэпа на 5′ конце, полиаденинового хвоста на 3′ конце и затем нуклеазы одновременно разрушают мРНК в 5′ ->3′ и 3′ ->5′ направлении. мРНК, в которой сигнал завершения синтеза белка, стоп-кодон, в результате ошибки транскрипции находится в середине кодирующей последовательности, подвержена особой быстрой форме деградации, НМД (nonsense-mediated decay).
Строение зрелой мРНК
Схема строения зрелой эукариотической мРНКЗрелая мРНК состоит из нескольких участков, различающихся по функциям: «5′ кэп», 5′ нетранслируемая область, кодирующая (транслируемая) область, 3′ нетранслируемая область и 3′ полиадениновый «хвост».
5′ Кэп
5′ кэп (от англ. cap — шапочка) — это модифицированный гуанидиновый нуклеотид, который добавляется на 5′ (передний) конец незрелой мРНК. Эта модификация очень важна для узнавания мРНК при инициации трансляции, а также для защиты от 5’нуклеаз — ферментов, разрушающих цепи нуклеиновых кислот с незащищённым 5′-концом.
Кодирующие области
Кодирующие области состоят из кодонов — следующих непосредственно друг за другом последовательностей из трёх нуклеотидов, каждая из которых соответствует в генетическом коде определённой аминокислоте или началу и концу синтеза белка. Кодирующие области начинаются со старт-кодона и заканчиваются одним из трёх стоп-кодонов. Считывание последовательности кодонов и сборка на её основе последовательности аминокислот синтезируемой молекулы белка осуществляется рибосомами при участии транспортных РНК в процессе трансляции. В дополнение к кодированию белков, части кодирующих областей могут служить управляющими последовательностями. Например, вторичная структура РНК в некоторых случаях определяет результат трансляции.
Моноцистронная и полицистронная мРНК
мРНК называют моноцистронной, если она содержит информацию, необходимую для трансляции только одного белка (один цистрон). Полицистронная мРНК кодирует несколько белков. Гены (цистроны) в такой мРНК разделены интергенными, некодирующими последовательностями. Полицистронные мРНК характерны для прокариот и вирусов, у эукариот большая часть мРНК является моноцистронной [6]. Полицистронные мРНК встречаются у эукариот в митохондриях.
Нетранслируемые области
Нетранслируемые области — участки РНК, расположенные до старт-кодона и после стоп-кодона, которые не кодируют белок. Они называются 5′-нетранслируемая область и 3′-нетранслируемая область, соответственно. Эти области транскрибируются в составе того же самого транскрипта, что и кодирующий участок. Нетранслируемые области имеют несколько функций в жизненном цикле мРНК, включая регуляцию стабильности мРНК, локализации мРНК и эффективности трансляции. Стабильность мРНК может контролироваться 5′- и/или 3′-областью из-за различной чувствительности к ферментам, которые отвечают за деградацию РНК — РНКазам и регуляторным белкам, которые убыстряют или замедляют деградацию[7].
3′ полиадениновый хвост
Длинная (часто несколько сотен нуклеотидов) последовательность адениновых оснований, которая присутствует на 3′ «хвосте» мРНК эукариот, синтезируется ферментом полиаденилат-полимеразой. У высших эукариот поли-А-хвост добавляется к транскрибированной РНК, которая содержит специфическую последовательность, AAUAAA. Важность этой последовательности можно увидеть на примере мутации в гене человеческого 2-глобина, которая изменяет AAUAAA на AAUAAG, что приводит к недостаточному количеству глобина в организме[8].
Вторичная структура
«Стебель-петля» — элемент вторичной структуры мРНК, схематично «Псевдоузел» — элемент вторичной структуры мРНК, схематично
Кроме первичной структуры (последовательности нуклеотидов), мРНК обладает вторичной структурой. В отличие от ДНК, вторичная структура которой основана на межмолекулярных взаимодействиях (двойная спираль ДНК образована двумя линейными молекулами, соединенными друг с другом по всей длине водородными связями), вторичная структура мРНК основана на внутримолекулярных взаимодействиях (линейная молекула «складывается», и водородные связи возникают между разными участками одной и той же молекулы).
Примерами вторичной структуры могут служить стебель-петля и псевдоузел [9]
Вторичные структуры в мРНК служат для регуляции трансляции. Например, вставка в белки необычных аминокислот, селенометионина и пирролизина, зависит от стебля-петли, расположенной в 3′ нетранслируемой области. Псевдоузлы служат для программированного изменения рамки считывания генов.
В вирусных мРНК сложные вторичные структуры (IRES) направляют трансляцию, не зависящую от узнавания кэпа и факторов инициации трансляции (см. «Инициация трансляции»).
См. также
Ссылки
- Жизненный цикл мРНК Флэш анимация
- База данных модификаций РНК [1] (англ.)
- База данных старт- и стоп-кодонов, нетранслируемых последовательностей [2] (англ.)
- Сайт, содержащий список программ по предсказанию свойств молекул РНК [3] (англ.)
Литература
- ↑ Bruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, Peter Walter Molecular Biology of the Cell. — 5. — Garland Science, 2008. — 1392 с. — ISBN 0815341059
- ↑ Bruce Alberts Molecular Biology of the Cell; Fourth Edition. — New York and London: Garland Science. — ISBN ISBN 0-8153-3218-1
- ↑ Johnston W, Unrau P, Lawrence M, Glasner M, Bartel D (2001). «RNA-catalyzed RNA polymerization: accurate and general RNA-templated primer extension». Science 292 (5520): 1319-25. PMID 11358999.
- ↑ Paquin N, Chartrand P. (2008). «Local regulation of mRNA translation: new insights from the bud.». Trends Cell Biol 18: 105-11.
- ↑ Айала Ф. Д. Современная генетика. 1987.
- ↑ Poyry, T.,Kaminski, A., Jackson R (2004). «What determines whertehr mammalian ribosomes resume scanning after translation of a short upstream open reading frame». Genes and Development 18: 62 -75.
- ↑ Kozak, M. (1983). «Comparison of initiation of protein synthesis in procaryotes, eucaryotes, and organelles.». Microbiological Reviews 47 (1): 1-45. PMID 15680349.
- ↑ Shaw, G. and Kamen, R. (1986). «A conserved AU sequence from the 3′ untranslated region of GM-CSF mRNA mediates selective mRNA degradation». Cell. 46 (5): 659-67. PMID 15680349.
- ↑ Козлов, Н. Н., Кугушев, Е. И., Сабитов, Д. И., Энеев, Т. М. «Компьютерный анализ процессов структурообразования нуклеиновых кислот».
| Типы нуклеиновых кислот | |
|---|---|
| Азотистые основания | Пурины (Аденин, Гуанин) | Пиримидины (Урацил, Тимин, Цитозин) |
| Нуклеозиды | Аденозин | Гуанозин | Уридин | Тимидин | Цитидин |
| Нуклеотиды | монофосфаты (АМФ, ГМФ, UMP, ЦМФ) | дифосфаты (АДФ, ГДФ, УДФ, ЦДФ) | трифосфаты (АТФ, ГТФ, УТФ, ЦТФ) | циклические (цАМФ, цГМФ, cADPR) |
| Рибонуклеиновые кислоты | РНК | мРНК | тРНК | рРНК | антисмысловые РНК | gRNA | микроРНК | некодирующие РНК | piwi-interacting RNA | shRNA | малые интерферирующие РНК | малые ядерные РНК | малые ядрышковые РНК | тмРНК |
| Дезоксирибонуклеиновые кислоты | ДНК | кДНК | Геном | msDNA | Митохондриальная ДНК |
| Аналоги нуклеиновых кислот | GNA | LNA | ПНК | TNA | Морфолино |
| Типы векторов | en:phagemid | Плазмиды | Фаг лямбда | en:cosmid | en:P1 phage | en:fosmid | BAC | YAC | HAC |
Информационная РНК — это… Что такое Информационная РНК?

Основные этапы жизненного цикла мРНК эукариот
Ма́тричная рибонуклеи́новая кислота́ (мРНК, синоним — информацио́нная РНК, иРНК) — РНК, отвечающая за перенос информации о первичной структуре белков от ДНК к местам синтеза белков. мРНК синтезируется на основе ДНК в ходе транскрипции, после чего, в свою очередь, используется в ходе трансляции как матрица для синтеза белков. Тем самым мРНК играет важную роль в «проявлении» (экспрессии) генов.
Длина типичной зрелой мРНК составляет от нескольких сотен до нескольких тысяч нуклеотидов. Самые длинные мРНК отмечены у (+)оц РНК-содержащих вирусов, например пикорнавирусов, однако следует помнить, что у этих вирусов мРНК образует весь их геном.
ДНК нередко сравнивают с чертежами для изготовления белков. Развивая эту инженерно-производственную аналогию, можно сказать, что, если ДНК — это полный набор чертежей для изготовления белков, находящийся на хранении в сейфе директора завода, то мРНК — временная рабочая копия чертежа, выдаваемая в сборочный цех.
Гипотеза о значении РНК в синтезе белков была высказана Торбьёрном Касперссоном (Torbjörn Caspersson) на основе исследований 1937—1939 гг., в результате которых было показано, что клетки, активно синтезирующие белок, содержат большое количество РНК. Подтверждение гипотезы было получено Юбером Шантренне (Hubert Chantrenne).
«Жизненный цикл» мРНК
Жизненный цикл молекулы мРНК начинается её «считыванием» с матрицы ДНК (транскрипция) и завершается её деградацией до отдельных нуклеотидов. Молекула мРНК в течение своей жизни может быть также «отредактирована» перед синтезом белка (трансляцией). Эукариотические молекулы мРНК часто требуют сложной обработки и транспортировки из ядра — места синтеза мРНК, в цитоплазму, где происходит трансляция, в то время как прокариотические молекулы мРНК этого не требуют и синтез РНК у них сопряжён с синтезом белка.[1].
Транскрипция
Транскрипцией называют процесс копирования генетической информации с ДНК на РНК, в частности на мРНК. Транскрипция осуществляется ферментом РНК-полимеразой, строящей, согласно принципу комплементарности, копию участка ДНК на основании одной из цепей двойной спирали. Этот процесс как у эукариот, так и у прокариот организован одинаково. Основное различие между про- и эукариотами состоит в том, что у эукариот РНК-полимераза во время транскрипции ассоциируется с мРНК-обрабатывающими ферментами, поэтому у них обработка мРНК и транскрипция могут проходить одновременно. Короткоживущие необработанные или частично обработанные продукты транскрипции называются пред-мРНК; после полной обработки — зрелая мРНК.
Обработка эукариотической пред-мРНК
Основная статья: Посттранскрипционные изменения РНК
В то время как мРНК прокариот (бактерий и архей), за редкими исключениями, сразу готовы к трансляции и не требуют специальной обработки, эукариотические пре-мРНК требуют более интенсивной обработки. В процессе сплайсинга из пре-мРНК удаляются не кодирующие белок последовательности (интроны), на 5′ конец молекулы добавляется специальный модифицированный нуклеотид (кэп), на 3′ конец добавляются несколько аденинов, так называемый полиадениновый хвост. Кэп узнаётся факторами инициации, белками, отвечающими за присоединение к мРНК рибосомы, полиадениновый хвост связывается с со специальным белком. Обычно эти посттранскрипционные изменения мРНК эукариот обозначают термином «процессинг мРНК». Полиаденилирование необходимо для транспорта большинства мРНК в цитоплазму и защищает молекулы мРНК от быстрой деградации (увеличивает время их полужизни). Лишенные поли-А участка молекулы мРНК (например, вирусные) быстро разрушаются в цитоплазме клеток эукариот рибонуклеазами.
Сплайсинг

Схема сплайсинга, в процессе которого пре-мРНК созревает в зрелую РНК. Зелёный — нетранслируемые участки (UnTranslated Regions, UTR), синий — интроны, красный — транслируемые (кодирующие белок) участки.
Сплайсинг — это процесс, в котором из пре-мРНК удаляются участки некодирующей белок последовательности, называемые интронами; последовательности, которые остаются, включают в себя кодирующие белки нуклеотиды, и называются экзонами. Иногда продукты сплайсинга пре-мРНК могут быть соединены разными способами, позволяя одному гену кодировать несколько белков. Этот процесс называется альтернативным сплайсингом. Сплайсинг обычно производится РНК-белковым комплексом, который называется сплайсосома, но некоторые молекулы мРНК также могут катализировать сплайсинг без участия белков(см. рибозимы)[2].
Транспорт
Другое различие между эукариотами и прокариотами — транспорт мРНК. Из-за того, что эукариотические транскрипция и трансляция пространственно разделены, эукариотические мРНК должны быть выведены из ядра в цитоплазму[3]. Зрелые мРНК распознаются по наличию модификаций и покидают ядро через ядерные поры, в цитоплазме мРНК образует нуклеопротеидные комплексы — информосомы, в составе которых транспортируется к рибосомам.
Трансляция
Поскольку прокариотическая мРНК не нуждается в обработке и транспортировке, трансляция рибосомой может начаться немедленно после транскрипции. Следовательно, можно сказать, что трансляция у прокариот совмещена с транскрипцией и происходит ко-транскрипционнно.
Эукариотическая мРНК должна быть обработана и доставлена из ядра в цитоплазму, и только тогда может быть транслирована рибосомой. Трансляция может происходить как на рибосомах, находящихся в цитоплазме в свободном виде, так и на рибосомах, ассоциированных со стенками эндоплазматического ретикулума. Таким образом, у эукариот трансляция не совмещена напрямую с транскрипцией.
Регуляция трансляции
Так как у прокариот транскрипция совмещена с трансляцией, прокариотическая клетка может быстро реагировать на изменения в окружающей среде путём синтеза новых белков, то есть регуляция происходит, в основном, на уровне транскрипции. У эукариот из-за необходимости в редактировании и транспорте мРНК ответ на внешние стимулы занимает больше времени. Поэтому их синтез белка интенсивно регулируется на посттранскрипционном уровне. Не всякая зрелая мРНК транслируется, поскольку в клетке существуют механизмы регуляции экспрессии белков на пост-транскрипционном уровне, например, РНК-интерференция.
Разрушение
По прошествии некоторого времени, определяемого её нуклеотидной последовательностью, в частности, длиной полиаденинового участка на 3′ конце молекулы, мРНК разрушается на составляющие её нуклеотиды с участием РНКаз. Как правило, разрушение начинается с удаления кэпа на 5′ конце, полиаденинового хвоста на 3′ конце и затем нуклеазы одновременно разрушают мРНК в 5′ ->3′ и 3′ ->5′ направлении. мРНК, в которой сигнал завершения синтеза белка, стоп-кодон, в результате ошибки транскрипции находится в середине кодирующей последовательности, подвержена особой быстрой форме деградации, НМД, (nonsense-mediated decay).
Строение зрелой мРНК

Схема строения зрелой эукариотической мРНК
Зрелая мРНК состоит из нескольких участков, различающихся по функциям: «5′ кэп», 5′ нетранслируемая область, кодирующая (транслируемая) область, 3′ нетранслируемая область и 3′ полиадениновый «хвост».
5′ Кэп
5′ кэп (или кап) (от англ. cap — шапочка) — это модифицированный гуанидиновый нуклеотид, который добавляется на 5′ (передний) конец незрелой мРНК. Эта модификация очень важна для узнавания мРНК при инициации трансляции, а также для защиты от 5’нуклеаз — ферментов, разрушающих цепи нуклеиновых кислот с незащищённым 5′-концом.
Кодирующие области
Кодирующие области состоят из кодонов — следующих непосредственно друг за другом последовательностей из трёх нуклеотидов, каждая из которых соответствует в генетическом коде определённой аминокислоте или началу и концу синтеза белка. Кодирующие области начинаются со старт-кодона и заканчиваются одним из трёх стоп-кодонов. Считывание последовательности кодонов и сборка на её основе последовательности аминокислот синтезируемой молекулы белка осуществляется рибосомами при участии транспортных РНК в процессе трансляции. В дополнение к кодированию белков, части кодирующих областей могут служить управляющими последовательностями. Например, вторичная структура РНК в некоторых случаях определяет результат трансляции.
Моноцистронная и полицистронная мРНК
мРНК называют моноцистронной, если она содержит информацию, необходимую для трансляции только одного белка (один цистрон). Полицистронная мРНК кодирует несколько белков. Гены (цистроны) в такой мРНК разделены интергенными, некодирующими последовательностями. Полицистронные мРНК характерны для прокариот и вирусов, у эукариот большая часть мРНК является моноцистронной [4]. Полицистронные мРНК встречаются у эукариот в митохондриях.
Нетранслируемые области
Нетранслируемые области — участки РНК, расположенные до старт-кодона и после стоп-кодона, которые не кодируют белок. Они называются 5′-нетранслируемая область и 3′-нетранслируемая область, соответственно. Эти области транскрибируются в составе того же самого транскрипта, что и кодирующий участок. Нетранслируемые области имеют несколько функций в жизненном цикле мРНК, включая регуляцию стабильности мРНК, локализации мРНК и эффективности трансляции. Стабильность мРНК может контролироваться 5′- и/или 3′-областью из-за различной чувствительности к ферментам, которые отвечают за деградацию РНК — РНКазам и регуляторным белкам, которые убыстряют или замедляют деградацию[5].
3′ полиадениновый хвост
Длинная (часто несколько сотен нуклеотидов) последовательность адениновых оснований, которая присутствует на 3′ «хвосте» мРНК эукариот, синтезируется ферментом полиаденилат-полимеразой. У высших эукариот поли-А-хвост добавляется к транскрибированной РНК, которая содержит специфическую последовательность, AAUAAA. Важность этой последовательности можно увидеть на примере мутации в гене человеческого 2-глобина, которая изменяет AAUAAA на AAUAAG, что приводит к недостаточному количеству глобина в организме[6].
Вторичная структура

«Стебель-петля» — элемент вторичной структуры мРНК, схематично

«Псевдоузел» — элемент вторичной структуры мРНК, схематично
Кроме первичной структуры (последовательности нуклеотидов), мРНК обладает вторичной структурой. В отличие от ДНК, вторичная структура которой основана на межмолекулярных взаимодействиях (двойная спираль ДНК образована двумя линейными молекулами, соединенными друг с другом по всей длине водородными связями), вторичная структура мРНК основана на внутримолекулярных взаимодействиях (линейная молекула «складывается», и водородные связи возникают между разными участками одной и той же молекулы).
Примерами вторичной структуры могут служить стебель-петля и псевдоузел [7]
Вторичные структуры в мРНК служат для регуляции трансляции. Например, вставка в белки необычных аминокислот, селенометионина и пирролизина, зависит от стебля-петли, расположенной в 3′ нетранслируемой области. Псевдоузлы служат для программированного изменения рамки считывания генов.
В вирусных мРНК сложные вторичные структуры (Инициация трансляции»).
См. также
Ссылки
- Жизненный цикл мРНК Флэш анимация
- База данных модификаций РНК [1] (англ.)
- База данных старт- и стоп-кодонов, нетранслируемых последовательностей [2] (англ.)
- Сайт, содержащий список программ по предсказанию свойств молекул РНК [3] (англ.)
Литература
- ↑ Bruce Alberts Molecular Biology of the Cell; Fourth Edition. — New York and London: Garland Science. — ISBN ISBN 0-8153-3218-1
- ↑ Johnston W, Unrau P, Lawrence M, Glasner M, Bartel D (2001). «RNA-catalyzed RNA polymerization: accurate and general RNA-templated primer extension». Science 292 (5520): 1319-25. PMID 11358999.
- ↑ Paquin N, Chartrand P. (2008). «Local regulation of mRNA translation: new insights from the bud.». Trends Cell Biol 18: 105-11.
- ↑ Poyry, T.,Kaminski, A., Jackson R (2004). «What determines whertehr mammalian ribosomes resume scanning after translation of a short upstream open reading frame». Genes and Development 18: 62 -75.
- ↑ Kozak, M. (1983). «Comparison of initiation of protein synthesis in procaryotes, eucaryotes, and organelles.». Microbiological Reviews 47 (1): 1-45. PMID 15680349.
- ↑ Shaw, G. and Kamen, R. (1986). «A conserved AU sequence from the 3′ untranslated region of GM-CSF mRNA mediates selective mRNA degradation». Cell. 46 (5): 659-67. PMID 15680349.
- ↑ Козлов, Н. Н., Кугушев, Е. И., Сабитов, Д. И., Энеев, Т. М. «Компьютерный анализ процессов структурообразования нуклеиновых кислот».
| Типы нуклеиновых кислот | |
|---|---|
| Азотистые основания | Пурины (Аденин, Гуанин) | Пиримидины (Урацил, Тимин, Цитозин) |
| Нуклеозиды | Аденозин | Гуанозин | Уридин | Тимидин | Цитидин |
| Нуклеотиды | монофосфаты (АМФ, ГМФ, UMP, ЦМФ) | дифосфаты (АДФ, ГДФ, УДФ, ЦДФ) | трифосфаты (АТФ, ГТФ, УТФ, ЦТФ) | циклические (цАМФ, цГМФ, cADPR) |
| Рибонуклеиновые кислоты | РНК | мРНК | тРНК | рРНК | антисмысловые РНК | микроРНК | некодирующие РНК | piwi-interacting RNA | малые интерферирующие РНК | малые ядерные РНК | малые ядрышковые РНК | тмРНК |
| Дезоксирибонуклеиновые кислоты | ДНК | кДНК | Геном | msDNA | Митохондриальная ДНК |
| Аналоги нуклеиновых кислот | GNA | LNA | ПНК | TNA | Морфолино |
| Типы векторов | en:phagemid | Плазмиды | Фаг лямбда | en:cosmid | en:P1 phage | en:fosmid | BAC | YAC | HAC |
Wikimedia Foundation. 2010.
иРНК — это… Что такое иРНК?
иРНК — информационная рибонуклеиновая кислота генетика то же, что мРНК … Словарь сокращений и аббревиатур
ИРНК — Основные этапы жизненного цикла мРНК эукариот Матричная рибонуклеиновая кислота (мРНК, синоним информационная РНК, иРНК) РНК, отвечающая за перенос информации о первичной структуре белков от ДНК к местам синтеза белков. мРНК синтезируется на… … Википедия
иРНК — mRNA, messenger RNA матричная (информационная) РНК, мРНК, иРНК. Mолекула РНК, содержащая информацию о последовательности аминокислот в белке, которая реализуется; мРНК является транскриптом гена, кодирующего соответствующий белок; полицистронные… … Молекулярная биология и генетика. Толковый словарь.
иРНК — см. Рибонуклеиновая кислота информационная … Медицинская энциклопедия
иРНК — информационная рибонуклеиновая кислота … Словарь сокращений русского языка
Моноцистронная иРНК — * монацыстронная іРНК * monocistronic mRNA иРНК, кодирующая только одну полипептидную цепь. Среди иРНК бактерий М. иРНК составляет меньшинство (ср. Полицистронная информация) … Генетика. Энциклопедический словарь
РНК информационные редкие иРНК р; иРНК сложные — РНК информационные редкие, иРНК р.; иРНК сложные * РНК інфармацыйныя рэдкія, іРНК р., іРНК складаныя * scarce mRNA or complex mRNA фракция внутриклеточных иРНК, для которых характерны относительно низкие значения копийности до 10 копий … Генетика. Энциклопедический словарь
Процессинг про-иРНК — * працэсінг праіРНК * processing pro mRNA образование зрелой иРНК () из предшественника РНК гетерогенной ядерной РНК () … Генетика. Энциклопедический словарь
РНК информационные многокопийные иРНК м — РНК информационные многокопийные, иРНК м. * РНК інфармацыйныя многакапійныя, іРНК м. * abundant mRNA фракция эукариотических информационных РНК, кодируемых примерно 100 тканеспецифическими генами. Для них характерна многокопийность от 1000 до… … Генетика. Энциклопедический словарь
альтернативный сплайсинг иРНК — — [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN alternative mRNA splicing … Справочник технического переводчика
Матричная РНК — это… Что такое Матричная РНК?

Основные этапы жизненного цикла мРНК эукариот
Ма́тричная рибонуклеи́новая кислота́ (мРНК, синоним — информацио́нная РНК, иРНК) — РНК, отвечающая за перенос информации о первичной структуре белков от ДНК к местам синтеза белков. мРНК синтезируется на основе ДНК в ходе транскрипции, после чего, в свою очередь, используется в ходе трансляции как матрица для синтеза белков. Тем самым мРНК играет важную роль в «проявлении» (экспрессии) генов.
Длина типичной зрелой мРНК составляет от нескольких сотен до нескольких тысяч нуклеотидов. Самые длинные мРНК отмечены у (+)оц РНК-содержащих вирусов, например пикорнавирусов, однако следует помнить, что у этих вирусов мРНК образует весь их геном.
ДНК нередко сравнивают с чертежами для изготовления белков. Развивая эту инженерно-производственную аналогию, можно сказать, что, если ДНК — это полный набор чертежей для изготовления белков, находящийся на хранении в сейфе директора завода, то мРНК — временная рабочая копия чертежа, выдаваемая в сборочный цех.
Гипотеза о значении РНК в синтезе белков была высказана Торбьёрном Касперссоном (Torbjörn Caspersson) на основе исследований 1937—1939 гг., в результате которых было показано, что клетки, активно синтезирующие белок, содержат большое количество РНК. Подтверждение гипотезы было получено Юбером Шантренне (Hubert Chantrenne).
«Жизненный цикл» мРНК
Жизненный цикл молекулы мРНК начинается её «считыванием» с матрицы ДНК (транскрипция) и завершается её деградацией до отдельных нуклеотидов. Молекула мРНК в течение своей жизни может быть также «отредактирована» перед синтезом белка (трансляцией). Эукариотические молекулы мРНК часто требуют сложной обработки и транспортировки из ядра — места синтеза мРНК, в цитоплазму, где происходит трансляция, в то время как прокариотические молекулы мРНК этого не требуют и синтез РНК у них сопряжён с синтезом белка.[1].
Транскрипция
Транскрипцией называют процесс копирования генетической информации с ДНК на РНК, в частности на мРНК. Транскрипция осуществляется ферментом РНК-полимеразой, строящей, согласно принципу комплементарности, копию участка ДНК на основании одной из цепей двойной спирали. Этот процесс как у эукариот, так и у прокариот организован одинаково. Основное различие между про- и эукариотами состоит в том, что у эукариот РНК-полимераза во время транскрипции ассоциируется с мРНК-обрабатывающими ферментами, поэтому у них обработка мРНК и транскрипция могут проходить одновременно. Короткоживущие необработанные или частично обработанные продукты транскрипции называются пред-мРНК; после полной обработки — зрелая мРНК.
Обработка эукариотической пред-мРНК
Основная статья: Посттранскрипционные изменения РНК
В то время как мРНК прокариот (бактерий и архей), за редкими исключениями, сразу готовы к трансляции и не требуют специальной обработки, эукариотические пре-мРНК требуют более интенсивной обработки. В процессе сплайсинга из пре-мРНК удаляются не кодирующие белок последовательности (интроны), на 5′ конец молекулы добавляется специальный модифицированный нуклеотид (кэп), на 3′ конец добавляются несколько аденинов, так называемый полиадениновый хвост. Кэп узнаётся факторами инициации, белками, отвечающими за присоединение к мРНК рибосомы, полиадениновый хвост связывается с со специальным белком. Обычно эти посттранскрипционные изменения мРНК эукариот обозначают термином «процессинг мРНК». Полиаденилирование необходимо для транспорта большинства мРНК в цитоплазму и защищает молекулы мРНК от быстрой деградации (увеличивает время их полужизни). Лишенные поли-А участка молекулы мРНК (например, вирусные) быстро разрушаются в цитоплазме клеток эукариот рибонуклеазами.
Сплайсинг

Схема сплайсинга, в процессе которого пре-мРНК созревает в зрелую РНК. Зелёный — нетранслируемые участки (UnTranslated Regions, UTR), синий — интроны, красный — транслируемые (кодирующие белок) участки.
Сплайсинг — это процесс, в котором из пре-мРНК удаляются участки некодирующей белок последовательности, называемые интронами; последовательности, которые остаются, включают в себя кодирующие белки нуклеотиды, и называются экзонами. Иногда продукты сплайсинга пре-мРНК могут быть соединены разными способами, позволяя одному гену кодировать несколько белков. Этот процесс называется альтернативным сплайсингом. Сплайсинг обычно производится РНК-белковым комплексом, который называется сплайсосома, но некоторые молекулы мРНК также могут катализировать сплайсинг без участия белков(см. рибозимы)[2].
Транспорт
Другое различие между эукариотами и прокариотами — транспорт мРНК. Из-за того, что эукариотические транскрипция и трансляция пространственно разделены, эукариотические мРНК должны быть выведены из ядра в цитоплазму[3]. Зрелые мРНК распознаются по наличию модификаций и покидают ядро через ядерные поры, в цитоплазме мРНК образует нуклеопротеидные комплексы — информосомы, в составе которых транспортируется к рибосомам.
Трансляция
Поскольку прокариотическая мРНК не нуждается в обработке и транспортировке, трансляция рибосомой может начаться немедленно после транскрипции. Следовательно, можно сказать, что трансляция у прокариот совмещена с транскрипцией и происходит ко-транскрипционнно.
Эукариотическая мРНК должна быть обработана и доставлена из ядра в цитоплазму, и только тогда может быть транслирована рибосомой. Трансляция может происходить как на рибосомах, находящихся в цитоплазме в свободном виде, так и на рибосомах, ассоциированных со стенками эндоплазматического ретикулума. Таким образом, у эукариот трансляция не совмещена напрямую с транскрипцией.
Регуляция трансляции
Так как у прокариот транскрипция совмещена с трансляцией, прокариотическая клетка может быстро реагировать на изменения в окружающей среде путём синтеза новых белков, то есть регуляция происходит, в основном, на уровне транскрипции. У эукариот из-за необходимости в редактировании и транспорте мРНК ответ на внешние стимулы занимает больше времени. Поэтому их синтез белка интенсивно регулируется на посттранскрипционном уровне. Не всякая зрелая мРНК транслируется, поскольку в клетке существуют механизмы регуляции экспрессии белков на пост-транскрипционном уровне, например, РНК-интерференция.
Разрушение
По прошествии некоторого времени, определяемого её нуклеотидной последовательностью, в частности, длиной полиаденинового участка на 3′ конце молекулы, мРНК разрушается на составляющие её нуклеотиды с участием РНКаз. Как правило, разрушение начинается с удаления кэпа на 5′ конце, полиаденинового хвоста на 3′ конце и затем нуклеазы одновременно разрушают мРНК в 5′ ->3′ и 3′ ->5′ направлении. мРНК, в которой сигнал завершения синтеза белка, стоп-кодон, в результате ошибки транскрипции находится в середине кодирующей последовательности, подвержена особой быстрой форме деградации, НМД, (nonsense-mediated decay).
Строение зрелой мРНК

Схема строения зрелой эукариотической мРНК
Зрелая мРНК состоит из нескольких участков, различающихся по функциям: «5′ кэп», 5′ нетранслируемая область, кодирующая (транслируемая) область, 3′ нетранслируемая область и 3′ полиадениновый «хвост».
5′ Кэп
5′ кэп (или кап) (от англ. cap — шапочка) — это модифицированный гуанидиновый нуклеотид, который добавляется на 5′ (передний) конец незрелой мРНК. Эта модификация очень важна для узнавания мРНК при инициации трансляции, а также для защиты от 5’нуклеаз — ферментов, разрушающих цепи нуклеиновых кислот с незащищённым 5′-концом.
Кодирующие области
Кодирующие области состоят из кодонов — следующих непосредственно друг за другом последовательностей из трёх нуклеотидов, каждая из которых соответствует в генетическом коде определённой аминокислоте или началу и концу синтеза белка. Кодирующие области начинаются со старт-кодона и заканчиваются одним из трёх стоп-кодонов. Считывание последовательности кодонов и сборка на её основе последовательности аминокислот синтезируемой молекулы белка осуществляется рибосомами при участии транспортных РНК в процессе трансляции. В дополнение к кодированию белков, части кодирующих областей могут служить управляющими последовательностями. Например, вторичная структура РНК в некоторых случаях определяет результат трансляции.
Моноцистронная и полицистронная мРНК
мРНК называют моноцистронной, если она содержит информацию, необходимую для трансляции только одного белка (один цистрон). Полицистронная мРНК кодирует несколько белков. Гены (цистроны) в такой мРНК разделены интергенными, некодирующими последовательностями. Полицистронные мРНК характерны для прокариот и вирусов, у эукариот большая часть мРНК является моноцистронной [4]. Полицистронные мРНК встречаются у эукариот в митохондриях.
Нетранслируемые области
Нетранслируемые области — участки РНК, расположенные до старт-кодона и после стоп-кодона, которые не кодируют белок. Они называются 5′-нетранслируемая область и 3′-нетранслируемая область, соответственно. Эти области транскрибируются в составе того же самого транскрипта, что и кодирующий участок. Нетранслируемые области имеют несколько функций в жизненном цикле мРНК, включая регуляцию стабильности мРНК, локализации мРНК и эффективности трансляции. Стабильность мРНК может контролироваться 5′- и/или 3′-областью из-за различной чувствительности к ферментам, которые отвечают за деградацию РНК — РНКазам и регуляторным белкам, которые убыстряют или замедляют деградацию[5].
3′ полиадениновый хвост
Длинная (часто несколько сотен нуклеотидов) последовательность адениновых оснований, которая присутствует на 3′ «хвосте» мРНК эукариот, синтезируется ферментом полиаденилат-полимеразой. У высших эукариот поли-А-хвост добавляется к транскрибированной РНК, которая содержит специфическую последовательность, AAUAAA. Важность этой последовательности можно увидеть на примере мутации в гене человеческого 2-глобина, которая изменяет AAUAAA на AAUAAG, что приводит к недостаточному количеству глобина в организме[6].
Вторичная структура

«Стебель-петля» — элемент вторичной структуры мРНК, схематично

«Псевдоузел» — элемент вторичной структуры мРНК, схематично
Кроме первичной структуры (последовательности нуклеотидов), мРНК обладает вторичной структурой. В отличие от ДНК, вторичная структура которой основана на межмолекулярных взаимодействиях (двойная спираль ДНК образована двумя линейными молекулами, соединенными друг с другом по всей длине водородными связями), вторичная структура мРНК основана на внутримолекулярных взаимодействиях (линейная молекула «складывается», и водородные связи возникают между разными участками одной и той же молекулы).
Примерами вторичной структуры могут служить стебель-петля и псевдоузел [7]
Вторичные структуры в мРНК служат для регуляции трансляции. Например, вставка в белки необычных аминокислот, селенометионина и пирролизина, зависит от стебля-петли, расположенной в 3′ нетранслируемой области. Псевдоузлы служат для программированного изменения рамки считывания генов.
В вирусных мРНК сложные вторичные структуры (Инициация трансляции»).
См. также
Ссылки
- Жизненный цикл мРНК Флэш анимация
- База данных модификаций РНК [1] (англ.)
- База данных старт- и стоп-кодонов, нетранслируемых последовательностей [2] (англ.)
- Сайт, содержащий список программ по предсказанию свойств молекул РНК [3] (англ.)
Литература
- ↑ Bruce Alberts Molecular Biology of the Cell; Fourth Edition. — New York and London: Garland Science. — ISBN ISBN 0-8153-3218-1
- ↑ Johnston W, Unrau P, Lawrence M, Glasner M, Bartel D (2001). «RNA-catalyzed RNA polymerization: accurate and general RNA-templated primer extension». Science 292 (5520): 1319-25. PMID 11358999.
- ↑ Paquin N, Chartrand P. (2008). «Local regulation of mRNA translation: new insights from the bud.». Trends Cell Biol 18: 105-11.
- ↑ Poyry, T.,Kaminski, A., Jackson R (2004). «What determines whertehr mammalian ribosomes resume scanning after translation of a short upstream open reading frame». Genes and Development 18: 62 -75.
- ↑ Kozak, M. (1983). «Comparison of initiation of protein synthesis in procaryotes, eucaryotes, and organelles.». Microbiological Reviews 47 (1): 1-45. PMID 15680349.
- ↑ Shaw, G. and Kamen, R. (1986). «A conserved AU sequence from the 3′ untranslated region of GM-CSF mRNA mediates selective mRNA degradation». Cell. 46 (5): 659-67. PMID 15680349.
- ↑ Козлов, Н. Н., Кугушев, Е. И., Сабитов, Д. И., Энеев, Т. М. «Компьютерный анализ процессов структурообразования нуклеиновых кислот».
| Типы нуклеиновых кислот | |
|---|---|
| Азотистые основания | Пурины (Аденин, Гуанин) | Пиримидины (Урацил, Тимин, Цитозин) |
| Нуклеозиды | Аденозин | Гуанозин | Уридин | Тимидин | Цитидин |
| Нуклеотиды | монофосфаты (АМФ, ГМФ, UMP, ЦМФ) | дифосфаты (АДФ, ГДФ, УДФ, ЦДФ) | трифосфаты (АТФ, ГТФ, УТФ, ЦТФ) | циклические (цАМФ, цГМФ, cADPR) |
| Рибонуклеиновые кислоты | РНК | мРНК | тРНК | рРНК | антисмысловые РНК | микроРНК | некодирующие РНК | piwi-interacting RNA | малые интерферирующие РНК | малые ядерные РНК | малые ядрышковые РНК | тмРНК |
| Дезоксирибонуклеиновые кислоты | ДНК | кДНК | Геном | msDNA | Митохондриальная ДНК |
| Аналоги нуклеиновых кислот | GNA | LNA | ПНК | TNA | Морфолино |
| Типы векторов | en:phagemid | Плазмиды | Фаг лямбда | en:cosmid | en:P1 phage | en:fosmid | BAC | YAC | HAC |
Wikimedia Foundation. 2010.
18) Особенности строений и функций : мРнк, тРнк, рРнк
м-РНК Открыта в 1961 году Жакобом и Мано. Она составляет всего 2-3% от общего количества РНК клетки. Эта РНК не имеет жесткой специфической структуры и ее полинуклеотидная цепь образует изогнутые петли. В нерабочем состоянии м-РНК собрана в складки, свернута в клубок, связана с белком; а во время функционирования цепь расправляется. Матричные РНК синтезируются на ДНК в ядре. Процесс называется транскрипция (списывание). Роль м-РНК – она несет информацию об аминокислотной последовательности (т.е. о первичной структуре) синтезируемого белка. Место каждой аминокислоты в молекуле белка закодировано определенной последовательностью нуклеотидов в цепи м-РНК, т.е. в м-РНК имеются «кодовые слова» для каждой аминокислоты – триплеты, или кодоны, или генетические коды. м-РНК принимает непосредственное участие в биосинтезе белка.
р-РНК На долю этого вида РНК приходится более 80% от всей массы РНК клетки. Она входит в состав рибосом. Рибосомы – это РНП, состоящие на 65% из р-РНК и на 35% из белка. Полинуклеотидная цепь р-РНК легко изгибается и укладывается вместе с белком в компактные тельца. Рибосома состоит из 2-х субъединиц – большой и малой (соотношение их 2,5:1). В рибосоме различают 2 участка – А (аминокислотный, или участок узнавания) и Р – пептидный, здесь присоединяется п/п цепь. Эти центры расположены на контактирующих поверхностях обеих субъединиц. Рибосомы могут свободно перемещаться в клетке, что дает возможность синтезировать белки в клетке там, где это необходимо. Рибосомы мало специфичны и могут считывать информацию с чужеродных м-РНК, вместе с м-РНК рибосомы образуют матрицу. Роль р-РНК – обуславливает количество синтезируемого белка. т-РНК этот вид т-РНК изучен лучше всего, составляет 10% всей клеточной РНК. Содержится в цитоплазме, мол.масса небольшая (20тыс.Da) состоит из 70-80 нуклеотидов. Основная роль – транспорт и установка аминокислот на комплиментарном кодоне м-РНК.
Генетический код. Понятие и свойства
В ДНК содержится определенная генетическая информация о структуре всех белков, РНК (и, т, р) о порядке реализации этой информации.
Во всех соматических клетках организма человека имеется один и тот же набор из 46 хромосом ДНК.
Генетическая информация в составе ДНК-> иРНК (транскрипция)-> тРНК (трансляция)-> полипептид (первичная структура) –> белок(фолдинг)
Ген— участок молекулы ДНК, в котором заключена информация, о структуре 1 белка.
Цистрон-участок ДНК, кодирующий 1 полипептидную цепь
Соотношение между геном и цистроном, кроме генов всех белков в хромосоме имеются гены РНК
Геном— общая совокупность генов организма, составляющая наследственную информацию данного организма в хромосомах человека, число генов 30000-50000 генов.
Гены эукариот — содержат, кодирующие участки, информационные – экзоны, содержат некодирующие участки — интроны. Количество интронов и экзонов разное
Отделы ДНК
Участки между генами называются спэйсерами, они некодирующие, выполняют структурную роль. Участвуют в укладке и в упаковке хроматина. Прикрепления хроматина к центриоли.
— участок, молекулы ДНК, к которому прикреплен элемент фермент ДНК-полимераза для начала синтеза м-РНК
Способы записи генетической информации — хранится на ДНК. Две цепи ДНК в области гена различаются по своей функциональной роли:
А) кодирующая (смысловая)
Б) матричная
В процессе считывания гена в процессе транскрипции и синтезе пре-м-РНК.
В качестве матрицы выступают матричная цепь ДНК. Продукт процесса: образование пре-м-РНК
При транскрипции с помощью матричной цепи РНК, генетической информации воспроизводится в структуре РНК. Информация, на кодирующей и смысловой цепи ДНК записана в направлении от 5” от 3” , в результате промоутер находится на 5” кодирующего гена. В одной хромосоме на 1 молекуле ДНК находится несколько тысяч генов.
Генетический код — способ записи генетической информации. Единица информации в кодирующей цепи ДНК является триплет т.е. 3 последовательных нуклеотида, которые соответствуют 1 аминокислоте. В ДНК используется четыре азотистых основания — аденин (А), гуанин (G), цитозин (С), тимин (T), которые в русскоязычной литературе обозначаются буквами А, Г, Ц и Т. Эти буквы составляют алфавит генетического кода. В РНК используются те же нуклеотиды, за исключением тимина, который заменён похожим нуклеотидом — урацилом.
Смысловая цепь ДНК — Матричная цепь ДНК — транскрипция (и-РНК, м-РНК) — трансляция (т-РНК) – р-РНК
м-РНК- из 4 видов нуклеотидов ДНК (А, Т, Г, Ц) могут образоваться 64 видов триплетов.
61 триплет является смысловым, кодируют 20 аминокислот
3 триплета являются бессмысленными или не соответствует ни одна аминокислота
Свойства генетического кода
На 20 аминокислот-61 смысл. кодон триплетов, на 1 аминокислоту- 1-6 триплетов.
Вырожденность — генетического кода, когда одну и ту же аминокислоту можно зашифровать несколькими триплетами. Суть аминокислоты в первых двух нуклеотидах, а 3-я зависит от внешних факторов
Специфичность — каждому триплету соответствует 1 аминокислота.
Последовательность или линейность — триплеты следуют линейно, один за другим, 1 не может наслаиваться и т.п. Первичная структура белка определяется в будущем пространственной конфигурацией молекулы, ее физико-химические и биологические свойства.
Колинеарность ген. кода – линейное соответствие между последствием триплетов в гене и аминокислоты в пептидной связи.
Способ записи генетической информации
Реализация генетической информации в живых клетках (то есть синтез белка, кодируемого геном) осуществляется при помощи двух матричных процессов: транскрипции (то есть синтеза мРНК на матрице ДНК) и трансляции генетического кода в аминокислотную последовательность (синтез полипептидной цепи на мРНК). Для кодирования 20 аминокислот, а также сигнала «стоп», означающего конец белковой последовательности, достаточно трёх последовательных нуклеотидов. Набор из трёх нуклеотидов называется триплетом.
Единица ген. кода-триплет-1 аминокислота
Триплеты ДНК копируются на матричную РНК при замене Т на У (транспорт)
I смысловая ДНК
II матричная ДНК
III матричная РНК- кодон
IV транспортная- антикодон
V рибосомальная-аминокислота
Биосинтез белка. Транскрипция
Биосинтез белка- сложный многостадийный процесс синтеза полипептидной цепи, из аминокислот, происходящих на рибосомах с участием молекул мРНК и тРНК.
Транскрипция у любого организма является первым этапом реализации генетической информации – экспрессии генов. Однако первичные транскрипты, как правило, представляют собой лишь предшественники зрелых мРНК – пре-мРНК, которые перед выполнением своих функций должны претерпеть многочисленные изменения, называемые посттранскрипционными модификациями. Кроме того, у эукариот зрелые мРНК должны быть доставлены от места их биосинтеза (ядра) к месту трансляции (цитоплазматическим рибосомам), т.е. экспортироваться из ядра в цитоплазму.
Активация аминокислот. Каждая из 20 аминокислот белка соединяется ковалентными связями к определённой т-РНК, используя энергию АТФ. Реакция катализуется специализированными ферментами, требующими присутствия ионов магния.
Инициация белковой цепи. и-РНК, содержащая информацию о данном белке, связывается с малой частицей рибосомы и с инициирующей аминокислотой, прикреплённой к соответствующей т-РНК. т-РНК комплементарна с находящимся в составе и-РНК триплетом, сигнализирующим о начале белковой цепи.
Элонгация. Полипептидная цепь удлиняется за счёт последовательного присоединения аминокислот, каждая из которых доставляется к рибосоме и встраивается в определённое положение при помощи соответствующей т-РНК. В настоящее время генетический код полностью расшифрован, то есть всем аминокислотам поставлены в соответствие триплеты нуклеотидов. Элонгация осуществляется при помощи белков цитозоля (так называемые факторы элонгации).
Терминация — разрезание на экзоны и интроны. После завершения синтеза цепи, о чём сигнализирует ещё один специальный кодон и-РНК, полипептид высвобождается из рибосомы.
Сворачивание и процессинг. Чтобы принять обычную форму, белок должен свернуться, образуя при этом определённую пространственную конфигурацию. До или после сворачивания полипептид может претерпевать процессинг, осуществляющийся ферментами и заключающийся в удалении лишних аминокислот, присоединении фосфатных, метильных и других групп и т. п.
Ингибиторы транскрипции: Аманитин — токсин ядовитых грибов, прочно связывает РНК-полимеразу, блокирует мРНК (на стадии элонгации)
Актиномицин D –антибиотик, связывается с ГЦ-богатыми участками ДНК. Блокирует продвижение РНК-полимеразы-из-за невозможности локального расплетения цепей.
(из лекции) Во время транскрипции различают 3 этапа: Инициация, Элонгация, Терминация. Результат транскрипции также образуются пре-м-РНК (в несколько раз длиннее чем зрелые мРНК) , в которой имеется информационные и неинформационные зоны, а в процессе процессинга-удаление одних, присоединение других и модификация, сплайсинг- сшивание информационных и неинформационных зон, в котором образуется короткая, зрелая м-РНК
Процесс транскрипции происходит в ядре. Для связывания промоутэра и молекулы фермента РНК-полимеразы нужны определенные условия. Фермент находит начало гена. Условия: У бактерии фермент РНК-полимераза узнает определенную последовательность нуклеотидных пар в сотсаве промоутэра. Это называется бокс-Прибного. У эукариот намного сложнее.
Полипептид и белок понятия разные!!!
Определенная последовательность аминокислот образуют полипептидную цепь, она в свою очередь образует белок, белок выполняет конкретные функции
Постранскрипционная модификация РНК
Одной из наиболее удивительных постранскрипционных модификаций пре-мРНК является редактирование их первичной структуры. В результате постранскрипционной модификации изменяется смысл генетической информации, заключенной в соответствующем гене. Постранскрипционные модификации РНК особенно характерны для эукариотических организмов, у которых в силу мозаичной интрон-экзонной структуры их генов первичные транскрипты представлены гигантскими предшественниками, включающими в себя последовательности как экзонов, так и интронов. 5’-Конец предшественника мРНК чаще всего подвергается котранскрипционным модификациям, в результате которых к его 5’-концевому нуклеотиду особым образом присоединяется остаток гуанозина с образованием «шапочки» – кэпа. Эта котранскрипционная модификация создает условия для прохождения следующего этапа процессинга мРНК – сплайсинга, сопровождающегося вырезанием последовательностей интронов и объединением экзонов с образованием непрерывной кодирующей последовательности мРНК. Одновременно от 3’-конца путем эндонуклеазного расщепления отделяется избыточный фрагмент РНК, и к оставшейся части присоединяется поли(А)-последовательность. Эта совокупность реакций получила название полиаденилирования мРНК. После таких котранскрипционных и посттранскрипционных модификаций пре-мРНК образовавшаяся зрелая, стабилизированная мРНК переносится из ядра в цитоплазму, часто к специфическому месту своей внутриклеточной локализации, где может быть депонирована или эффективно транслироваться рибосомами. Каждый из этапов посттранскрипционных модификаций может использоваться для регуляции уровня экспрессии соответствующих генов.
Синтез и — РНК (транскрипция) происходит следующим образом. Фермент (РНК — полимераза) расщепляет двойную цепочку ДНК, и на одной из ее цепей (кодирующей) по принципу комплементарности выстраиваются нуклеотиды РНК. Синтезированная таким образом (матричный синтез) молекула и — РНК выходит в цитоплазму, и на один ее конец нанизываются малые субъединицы рибосом.
Биосинтез белков. Трансляция
Процесс сборки молекулы белка идет в рибосомах и называется трансляцией. На одной молекуле и-РНК последовательно располагаются несколько рибосом. В функциональном центре каждой рибосомы способны поместиться два триплета и-РНК. Кодовый триплет нуклеотидов – молекулы т-РНК, подошедшей к месту синтеза белка, соответствует триплету нуклеотидов и-РНК, находящемуся в данный момент в функциональном центре рибосомы. Тогда рибосома по цепочке и-РНК делает шаг, равный трем нуклеотидам. Аминокислота отделяется от т-РНК и становится в цепочку мономеров белка. Освободившаяся т-РНК уходит в сторону и через некоторое время может снова соединиться с определенной кислотой, которую будет транспортировать к месту синтеза белка. Таким образом, последовательность нуклеотидов в триплете ДНК соответствует последовательности нуклеотидов в триплете и-РНК.
Трансляция (translation): синтез белкасматрицымРНК (матричной РНК). (В настоящее время чаще используется термин информационная РНК (иРНК). Процесс, посредством которого генетическая информация с матричной РНК переводится в белок.
иРНК, несущая сведения о первичной структуре белков, синтезируется в ядре клетки. Пройдя через поры ядерной оболочки, иРНК на правляется крибосомам, где осуществляется расшифровка генетической информации — перевод ее с «языка» нуклеотидов на «язык» аминокислот. Синтез полипептидных цепей белков по матрице иРНК, выполняемыйрибосомами, называется трансляцией (лат. translatio — перевод).
Этапы трансляции мРНК
Инициация. 1. Узнавание стартового кодона , сопровождается присоединением тРНК аминоацилированной метионином и сборкой рибосомы из большой и малой субъединиц. Элонгация. 2. Узнавание текущего кодона соответствующей ему аминоацил-тРНК (комплементарное взаимодействие кодона мРНК и антикодона тРНК увеличено). 3. Присоединение аминокислоты, принесённой тРНК, к концу растущей полипептидной цепи. 4. Продвижение рибосомы вдоль матрицы, сопровождающееся высвобождением молекулы тРНК. 5. Аминоацилирование высвободившейся молекулы тРНК соответствующей ей аминоацил-тРНК-синтетазой. 6. Присоединение следующей молекулы аминоацил-тРНК, аналогично стадии . 7. Движение рибосомы по молекуле мРНК до стоп-кодона. Терминация. Узнавание рибосомой стоп-кодона сопровождается отсоединением новосинтезированного белка и в некоторых случаях диссоциацией рибосомы.
Строение и функции рибосом в процессе синтеза белка
Рибосомы состоят из примерно равных (по массе) количеств РНК и белка. Входящая в их состав РНК, называемая рибосомной РНК (рРНК), синтезируется в ядрышке. Вместе те и другие молекулы образуют сложную трехмерную структуру. Во время синтеза белка на рибосомах аминокислоты последовательно соединяются друг с другом, формируя полипептидную цепь. Рибосома служит местом связывания для молекул, участвующих в синтезе, т. е. таким местом, где эти молекулы могут занять по отношению друг к другу совершенно определенное положение. В синтезе участвуют: матричная РНК (мРНК), несущая генетические инструкции от клеточного ядра, транспортная РНК (тРНК), доставляющая к рибосоме требуемые аминокислоты, и растущая полипептидная цепь. Кроме того, в этом процессе участвуют факторы инициации, элонгации и терминации цепи. Весь процесс в целом настолько сложен, что без рибосомы он не мог бы идти эффективно (или не шел бы вообще). Примером белка, синтезируемого свободными рибосомами, может служить гемоглобин, образующийся в молодых эритроцитах. В процессе синтеза белка рибосома перемещается вдоль нитевидной молекулы мРНК. Процесс идет более эффективно, когда вдоль мРНК перемещается не одна рибосома, а одновременно много рибосом, напоминающих в этом случае бусины на нитке. Такие цепи рибосом называются полирибосомами или полисомами — комплекс рибосом На ЭР полисомы обнаруживаются в виде характерных завитков.
Понятие о фолдинге. Роль шаперонов в процессе биосинтеза белка
Белки синтезируются в рибосомах в виде длинной полипептидной нити, но затем быстро сворачиваются в свою естественную («нативную») пространственную структуру. Этот процесс называется фолдинг белка. Правильное сворачивание ( фолдинг ) полипептидных цепей белков в клетках эукариот обеспечивается специфическими белками, называемыми шаперонами (chaperone). Шапероны необходимы для эффективного формирования третичной структуры полипептидных цепей других белков, но они не входят в состав конечной белковой структуры.
Шапероны — обеспечивают правильный фолдинг новообразованных белков, контроль за рефолдингом, участие во внутриклеточном транспорте белков.
