Вопрос от: Анна — Клиника Здоровье 365 г. Екатеринбург
Вопрос Гастроэнтерологу
Вопрос от Анна
Вопрос: Инф: девушка, 22 года. Вес — 53кг, хронических заболеваний — нет.
Здравствуйте!
Подскажите пожалуйста, так бывает? Ситуация в следующем. Я сдавала анализ кала на дисбактериоз. Вот результаты, выходящие за рамки референсных значений:
Бифидобактерии = 5 *lg KOE/1г (норм. 9 — 10)
Лактобактерии = 6 * lg KOE/1г (норм. 7 — 8)
E.coli типичные = 6.5 * lg KOE/1г (норм. 7 — 8)
E.coli гемолитические = 6 * lg KOE/1г (норм. 0)
Все остальные показатели в норме.
Врач поставил диагноз — синдром раздраженного кишечника, и отправил на повторный анализ с добавлением выявления чувствительности E.coli гемолитических к бактериофагам. Сдала новый анализ кала на дисбактериоз. вот результаты по тем же параметрам:
Бифидобактерии = 7 *lg KOE/1г (норм. 9 — 10)
Лактобактерии = 7 * lg KOE/1г (норм.
E.coli типичные = 9 * lg KOE/1г (норм. 7 — 8)
E.coli гемолитические = 0 * lg KOE/1г (норм. 0)
Лечения никакого не проводилось! По времени второй анализ сдала через 3 недели после первого. Симптомы все сохранились (периодическое расстройство стула, метеоризм, дискомфорт).
Возможно ли, чтобы бактерии E.coli с гемолитической активностью сами исчезли без лечения? И с чем связано повышение содержания кишечной палочки с типичными свойствами (в таком высоком титре)?
Или все-таки результат повторного анализа ошибочный и его нужно оспаривать?
Ответ:
Здравствуйте, Анна.
Такая вариабельность в анализе кала на дисбиоз возможна в норме. Состояние микрофлоры завистит от общего состояния организма, от приема каких — либо других препаратов, от пищи. Оспаривать анализ в связи с этим бессмысленно. Судя по клинически проявления лечить дисбиоз Вам нужно.
С уважением,
Рудник В.Б., заведующая поликлиническим отделением
Назад
Посев на кишечную палочку и определение чувствительности к антимикробным препаратам (E.
 Coli O157:H7, эшерихиоз). (E.Coli O157:H7 Culture. Bacteria Identification and Antibiotic Susceptibility testing)
Coli O157:H7, эшерихиоз). (E.Coli O157:H7 Culture. Bacteria Identification and Antibiotic Susceptibility testing)Исследуемый материал Кал
Диагностика этиологии геморрагического колита и гемолитического уремического синдрома.
Escherichia coli (или просто E.coli) — грамотрицательные палочковидные бактерии. Названы в честь открывшего их в 1885 г. T. Escherich. Обычный обитатель кишечника. В организме человека E.coli выполняет полезную роль, подавляя рост вредных бактерий и синтезируя некоторые витамины. Но эти бактерии могут вызывать у человека острые кишечные заболевания эшерихиозы с фекально-оральным механизмом заражения.
E. Coli O157:H7 вырабатывает шига-токсин. Инкубационный период длится от 3 до 6 дней. В наибольшей степени восприимчивы к заболеванию дети раннего возраста, пожилые и ослабленные люди.
У детей эшерихиоз протекает в виде различной тяжести энтеритов, энтероколитов в сочетании с синдромом общей интоксикации и острой почечной недостаточностью.
У взрослых заболевание, вызванное эшерихией, напоминает по течению и клиническим симптомам острую дизентерию. Нередко развивается тромбоцитопеническая пурпура.
Выделяемые возбудители: E. Coli O157:H7.
Обращаем внимание на необходимость приобретения стерильной пробирки с питательной средой для взятия биоматериала под залог. Возврат залоговых средств осуществляется при сдаче анализа и при условии наличия чека за внесение залога.
Литература
- Богомолов Г.И. Дифференциальная диагностика инфекционных болезней М. 2000. 231 стр.
- Jacobs D. et al. Laboratory test handbook/ Lexi-Comp./2002 — 1534 p.
- Wallach J. Interpretation of diagnostic tests/Lippincott Williams & Wilkins/2000/ 1026 ps.
Гемолитические кишечные палочки и их опасность для человека
Когда в конце 19-го века немецкий бактериолог Теодор Эшерих открыл кишечную палочку, получившую впоследствии его имя — e coli гемолитические в кале у ребенка, вряд ли он догадывался, какой ящик Пандоры принесет она на землю. Грамотрицательная палочковидная бактерия — неприметная и даже полезная обитательница кишечной среды при условии, что ее количество в норме. Она играет не последнюю роль в здоровом функционировании ЖКТ, вырабатывая витамин В, жирные кислоты, участвуя в обмене веществ. Но если количество E. Coli (общепринятое сокращение) выходит за рамки обычного, человек обязательно почувствует недомогание. Диагноз – эшерихиоз, дискбактериоз или гемолитическая кишечная палочка. E. Coli вызывает не только недуги пищеварительного тракта, но и проблемы в половой и мочевыделительной системах. Самая опасная разновидность палочки Эшериха — гемолитическая кишечная палочка.Содержание:
Грамотрицательная палочковидная бактерия — неприметная и даже полезная обитательница кишечной среды при условии, что ее количество в норме. Она играет не последнюю роль в здоровом функционировании ЖКТ, вырабатывая витамин В, жирные кислоты, участвуя в обмене веществ. Но если количество E. Coli (общепринятое сокращение) выходит за рамки обычного, человек обязательно почувствует недомогание. Диагноз – эшерихиоз, дискбактериоз или гемолитическая кишечная палочка. E. Coli вызывает не только недуги пищеварительного тракта, но и проблемы в половой и мочевыделительной системах. Самая опасная разновидность палочки Эшериха — гемолитическая кишечная палочка.Содержание:
Виды кишечной палочки
Норма E. Coli в организме
Виновники заболевания
Заболевания мочеполовой сферы, вызванные Escherichia coli
Гемолитико-уремический синдром
Симптомы
Лечение диареи
Лечение и его особенности в зависимости от локализации
Народные методы борьбы с кишечной инфекцией
Профилактика недугов
Виды кишечной палочкиРазновидностей эшерихии больше сотни, типы патогенных бактерий объединяют в 4 класса или вида:
Энтеротоксигенные. Прилипая к слизистой тонкой кишки, Escherichia coli вызывает на свет ядовитые вещества. Этот вид — причина поноса у грудничков.
Прилипая к слизистой тонкой кишки, Escherichia coli вызывает на свет ядовитые вещества. Этот вид — причина поноса у грудничков.
Энтероинвазивные. Вызывают жидкую диарею с кровянистыми выделениями и боль в животе.
Энтеропатогенные. Этот вид характеризуется сильным поносом и жидким стулом, интенсивными болями в животе, подчас рвотой. Связанная с переменой климата «диарея путешественника» из этой серии.
Вышеперечисленные виды обладают большой выносливостью, хорошо приспосабливаются к внешней среде. Пища, особенно молочные продукты – благоприятный климат для размножения бактерий.Довольно долго они могут обитать в земле, воде, фекальных массах. Но при кипячении и употреблении средств дезинфекции довольно быстро гибнут.
 Обеззараживание проводят при помощи формалина, хлорки, едкого натра и других средств. За несколько минут гибнут при попадании прямых солнечных лучей.Смотрим видео о том, что собой представляют кишечные палочки, почему возникают вспышки кишечных заболеваний:Норма E. Coli в организмеС рождения и до конца жизни в организме здорового человека Escherichia coli не должны превышать следующие нормы:
Обеззараживание проводят при помощи формалина, хлорки, едкого натра и других средств. За несколько минут гибнут при попадании прямых солнечных лучей.Смотрим видео о том, что собой представляют кишечные палочки, почему возникают вспышки кишечных заболеваний:Норма E. Coli в организмеС рождения и до конца жизни в организме здорового человека Escherichia coli не должны превышать следующие нормы:106—108 КОЕ/г в толстой кишке;
107—108 КОЕ/г в кале (из них 105 КОЕ/г лактозонегативные палочки и отсутствие гемолитических кишечных палочек).
Снижение до 105-106 КОЕ/г и повышение до 109-110 КОЕ/г – симптомы дисбактериоза.
Виновники заболеванияВспоминая детство, каждый помнит вечную установку мамы: «Мой руки перед едой», «Помой яблоко», «Не поднимай с пола». Эти советы дети обычно игнорируют, потому и попадают в группу риска в первую очередь.Не новы причины кишечных инфекций:
поедание плодов прямо с дерева или огорода;
игнорирование правил гигиены;
употребление некипяченого молока;
недостаточная термическая обработка мясных продуктов;
рукопожатие больного человека.
У взрослых эшерихия, в том числе гемолитическая, может появиться в результате иммунодефицита, на фоне ОРЗ, приема антибиотиков и др.Заболевания мочеполовой сферы, вызванные Escherichia coliЭшерихию нередко обнаруживают во время сдачи анализов у беременных. Присутствие кишечной палочки во влагалище – путь ко многим неприятным последствиям, это первый звонок о наличии воспаления в мочеполовой сфере. Инфицирование нередко происходит вследствие специфической половой жизни и несоблюдения гигиены.Кишечная палочка – виновница развития множества заболеваний половой и мочевыделительной систем:
воспаление яичников у женщин;
хронический простатит у 8 из 10 мужчин;
цистит у лиц обеих полов;
пиелонефрит и многие другие.
Попадание эшерихии во влагалище лечить следует немедленно, последствия бывают слишком сложными, вплоть до бесплодия. Поэтому с профилактической целью мазок на Escherichia coli надо сдавать как минимум раз в год.
 Никаких симптомов нередко не имеет, тем не менее количество микробных тел в миллилитре мочи составляет 105 единиц. Если в моче параллельно обнаруживают лейкоциты, к тому же больной чувствует озноб, подташнивание, рвоту, боли в пояснице, это симптомы острого цистита или пиелонефрита.
Никаких симптомов нередко не имеет, тем не менее количество микробных тел в миллилитре мочи составляет 105 единиц. Если в моче параллельно обнаруживают лейкоциты, к тому же больной чувствует озноб, подташнивание, рвоту, боли в пояснице, это симптомы острого цистита или пиелонефрита.Гемолитико-уремический синдромВ состоянии низкой сопротивляемости организма, наблюдающемся в большей степени у грудничков, женщин после родов, пожилых людей, гемолизирующая кишечная палочка может вызвать сбои микроциркуляции крови и стать причиной гемолитико-уремического синдрома. Признаки интоксикации при этой инфекции ярко выражены, начало заболевания – острое. Присутствие крови в испражнениях свидетельствует о развитии геморрагического колита. Токсины оказывают пагубное действие на тромбоциты, которые сначала активизируются, а потом склеиваются. При бледной коже становятся заметными кровоизлияния. В почечных канальцах и клубочках начинается ишемия, откладывается фибрин и возникают тромбы. Количество мочи становится все меньше, а потом и вовсе прекращается.
 Это признаки некрозов и развития почечной недостаточности.Вследствие повреждения эритроцитов токсинами гемолизирующей кишечной палочки развивается особый вид желтухи, кожа становится лимонного цвета.Восстановить функцию почек возможно при рациональных методах лечения, это удается в 75% случаев. В противном случае наступает летальный исход или хроническая почечная недостаточность. 3-7% заболевших гемолитико-уремическим синдромом не выживают.СимптомыНачальные признаки кишечной палочки большинству знакомы:
Это признаки некрозов и развития почечной недостаточности.Вследствие повреждения эритроцитов токсинами гемолизирующей кишечной палочки развивается особый вид желтухи, кожа становится лимонного цвета.Восстановить функцию почек возможно при рациональных методах лечения, это удается в 75% случаев. В противном случае наступает летальный исход или хроническая почечная недостаточность. 3-7% заболевших гемолитико-уремическим синдромом не выживают.СимптомыНачальные признаки кишечной палочки большинству знакомы:боль в животе (преимущественно острая)
диарея (понос)
возможно повышение температуры
Сколько продлится дискомфорт, вызванный гемолитической кишечной палочкой, зависит от ее штамма (классификация палочки подробно описана выше). Обычно заболевание проходит за 2-3 дня, не требуя особого лечения или обращения к врачу. В некоторых случаях лучше проконсультироваться со специалистом. Если через день-два диарея усилилась, появилась рвота, поднялась температура, больной чувствует слабость, обезвоживание, отсутствие аппетита, головокружение, рези в области живота, надо обязательно сдать анализ кала.
 Для детей такие симптомы могут быть смертельно опасны, поэтому вызывать врача следует не медля.Лечение диареиУдаление симптомов интоксикации — начало лечения гемолитической кишечной палочки. Экстренная терапия не требуется, поскольку за пару-тройку дней кишечник очистится природным путем. По симптомам лечащий врач должен определить – в процессе лечения надо уничтожить инфекцию или восстановить микрофлору и заселить ЖКТ нормальной палочкой. Но в обоих случаях необходимо остановить диарею. В эти дни врачи советуют придерживаться специального режима питания, ограничивая больного в еде, пить регидранты и сорбенты, отвар ромашки и коры дуба, чтобы не обезводить организм. Строго-настрого запрещено употреблять жирное, соленое, копченое, молоко и сырые овощи. Лучше включить в свой рацион кисель, чай, отварное мясо, рисовую кашу на воде, вместо хлеба сухари.Кисломолочные продукты (кефир, сметана, биойогурт) восстанавливают микрофлору. Об этом надо помнить при дисбактериозе. Активность защитной флоры ЖКТ помогут повысить отруби.
Для детей такие симптомы могут быть смертельно опасны, поэтому вызывать врача следует не медля.Лечение диареиУдаление симптомов интоксикации — начало лечения гемолитической кишечной палочки. Экстренная терапия не требуется, поскольку за пару-тройку дней кишечник очистится природным путем. По симптомам лечащий врач должен определить – в процессе лечения надо уничтожить инфекцию или восстановить микрофлору и заселить ЖКТ нормальной палочкой. Но в обоих случаях необходимо остановить диарею. В эти дни врачи советуют придерживаться специального режима питания, ограничивая больного в еде, пить регидранты и сорбенты, отвар ромашки и коры дуба, чтобы не обезводить организм. Строго-настрого запрещено употреблять жирное, соленое, копченое, молоко и сырые овощи. Лучше включить в свой рацион кисель, чай, отварное мясо, рисовую кашу на воде, вместо хлеба сухари.Кисломолочные продукты (кефир, сметана, биойогурт) восстанавливают микрофлору. Об этом надо помнить при дисбактериозе. Активность защитной флоры ЖКТ помогут повысить отруби. Полезную простоквашу и биоквас, рецепты которых в достаточном количестве есть в Интернете, можно приготовить самому.Не помешает сдать анализы, чтобы знать, какой именно штамм кишечной палочки вызвал заболевание. В зависимости от результата анализа, назначают антибиотики, но это делают в крайних случаях. После курса лечения анализы необходимо сдать повторно.Лечение в зависимости от локализацииКишечную палочку, обнаруженную в моче, называют бактериурией. При таком диагнозе назначают уросептики, антибиотики и БАДы. Препараты должны не только остановить развитие инфекции, но и укрепить иммунитет.Причина воспаления органов половой сферы (кольпит, вагинит) — кишечная палочка, обнаруженная во влагалище. В гинекологии эшерихию лечат небольшим курсом антибиотиков, отказавшись на это время от секса. Наружные половые органы омывают отваром ромашки, проводят спринцевания, ставят вагинальные свечи.Бывают случаи, когда кишечную палочку обнаруживают в зобе. Это длительная терапия комбинированием противогрибковых препаратов и антибиотиков.
Полезную простоквашу и биоквас, рецепты которых в достаточном количестве есть в Интернете, можно приготовить самому.Не помешает сдать анализы, чтобы знать, какой именно штамм кишечной палочки вызвал заболевание. В зависимости от результата анализа, назначают антибиотики, но это делают в крайних случаях. После курса лечения анализы необходимо сдать повторно.Лечение в зависимости от локализацииКишечную палочку, обнаруженную в моче, называют бактериурией. При таком диагнозе назначают уросептики, антибиотики и БАДы. Препараты должны не только остановить развитие инфекции, но и укрепить иммунитет.Причина воспаления органов половой сферы (кольпит, вагинит) — кишечная палочка, обнаруженная во влагалище. В гинекологии эшерихию лечат небольшим курсом антибиотиков, отказавшись на это время от секса. Наружные половые органы омывают отваром ромашки, проводят спринцевания, ставят вагинальные свечи.Бывают случаи, когда кишечную палочку обнаруживают в зобе. Это длительная терапия комбинированием противогрибковых препаратов и антибиотиков. Дезинфицирующий эффект окажут ополаскиватели рта.Гемолитическую кишечную палочку у грудных младенцев лечат пробиотиками и пребиотиками. Цель лечения – стабилизация микрофлоры кишечника малыша. Кормящая мать при этом соблюдает строжайшую диету. Само по себе грудное вскармливание способствует наполнению кишечника крохи «хорошими» бактериями. Если ребенок на штучном вскармливании, выбирают смесь, насыщенную пребиотиками.Народные методы борьбы с кишечной инфекциейТрадиционную медицину в этом случае дополняют народные средства. Существует множество рецептов борьбы с кишечным недугом, сохранившихся от бабушек:
Дезинфицирующий эффект окажут ополаскиватели рта.Гемолитическую кишечную палочку у грудных младенцев лечат пробиотиками и пребиотиками. Цель лечения – стабилизация микрофлоры кишечника малыша. Кормящая мать при этом соблюдает строжайшую диету. Само по себе грудное вскармливание способствует наполнению кишечника крохи «хорошими» бактериями. Если ребенок на штучном вскармливании, выбирают смесь, насыщенную пребиотиками.Народные методы борьбы с кишечной инфекциейТрадиционную медицину в этом случае дополняют народные средства. Существует множество рецептов борьбы с кишечным недугом, сохранившихся от бабушек:300 г земляной груши (топинамбура), нарезанных кубиками, опускают в разбавленное водой кипящее молоко в пропорции 50/50. Размягченный топинамбур вынуть, а в молоко добавить 20 г муки и 40 г масла и варить, пока не загустеет. Массой залить вынутый ранее топинамбур и добавить зелень. Своеобразный соус может служить дополнением к рису.
20 грамм лапчатки гусиной заварить в 250 миллилитрах кипятка. Подержать на пару 15 минут и оставить на ночь. Употреблять по 80 мл трижды в день.
Подержать на пару 15 минут и оставить на ночь. Употреблять по 80 мл трижды в день.
Столовую ложку череды залить стаканом холодной кипяченой воды и держать на водяной бане четверть часа. Трижды в день отвар принимают по 20 мл.
Мать-и-мачеху, лекарственный донник и золототысячник в равных частях перемешать, чтобы в общей сложности получилось 20 грамм. Залить стаканом кипятка и настоять 15 минут. Пить раз в день от 20 до 50 мл.
Травы с противомикробным действием рекомендует и традиционная медицина. Кроме уже упомянутых мать-и-мачехи, череды и ромашки, рекомендуют настои корня аира, календулы и зверобоя. Отвары и кисели готовят из ягод шиповника, клюквы и черники. Закреплящий эффект при диарее оказывают кора дуба, семена конского щавеля. Полезны корочки граната, отваренные с изюмом. Убивает «плохие» палочки и восстанавливает микрофлору обыкновенный мед, многие даже не подозревают, каким целебным действием обладает этот продукт при лечении поноса и дисбактериоза.
Профилактика недуговИсходя из причин заболевания, выводы напрашиваются сами. Избежать заражения каким бы то ни было видом кишечной палочки помогут простые правила гигиены:
Избежать заражения каким бы то ни было видом кишечной палочки помогут простые правила гигиены:
овощи и фрукты мыть перед употреблением и приготовлением
проводить достаточную тепловую обработку мясных продуктов
кипятить домашнее молоко
не употреблять воду из сомнительных источников
как можно чаще мыть руки с мылом.
Комментирование и размещение ссылок запрещено.
Анализ на дисбактериоз у детей. Как сдавать кал для анализа. Расшифровка результатов анализа на дисбактериоз
Автор
Евтушенко-Сигаева Мария ВячеславовнаВедущий врач
Гастроэнтеролог
Что такое дисбактериоз
В норме состояние микрофлоры кишечника таково, что деятельность вредоносных бактерий успешно подавляется, а количество полезных бактерий соответствует потребностям организма. Но если необходимый баланс нарушается, кишечник перестаёт функционировать правильным образом. Подобное состояние и есть дисбактериоз.
Но если необходимый баланс нарушается, кишечник перестаёт функционировать правильным образом. Подобное состояние и есть дисбактериоз.
Зачем нужен анализ на дисбактериоз
Чтобы подтвердить, что проблемы со здоровьем вызваны дисбактериозом, необходимо сделать анализ на дисбактериоз.
Анализ на дисбактериоз позволяет установить концентрацию и определить соотношение:
- полезных микроорганизмов, таких как лактобактерии, бифидобактерии, кишечная палочка Escherichia coli с нормальными ферментативными свойствами;
- условно-патогенных, т.е. населяющих кишечник, но не всегда приводящих к заболеванию. (энтеробактерии, стафилококки, клостридии, грибы рода Candida). Болезненные проявления, наблюдаются, как правило, лишь в том случае, если количество подобных микроорганизмов резко возрастает и начинает превышать норму;
- патогенных, в норме в кишечнике отсутствующих (шигеллы, сальмонеллы).
Когда назначается анализ на дисбактериоз
Анализ на дисбактериоз назначается:
Анализ на дисбактериоз может назначить врач общей практики (терапевт, семейный врач, педиатр) или гастроэнтеролог.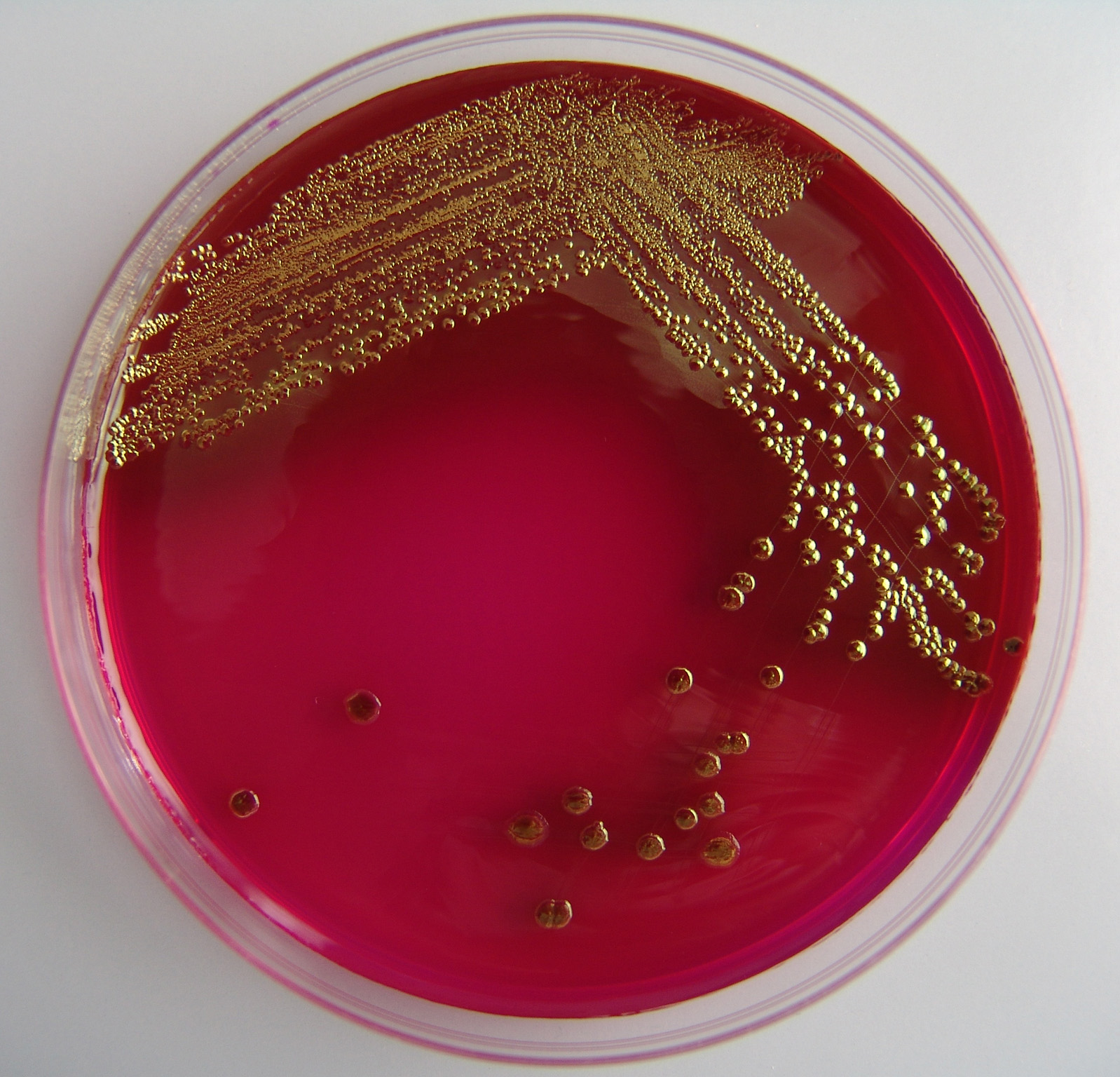
Как сдавать анализ на дисбактериоз
Материалом для анализа является кал. Кал собирается в стерильный контейнер. Для анализа достаточно около 10 мл (меньше столовой ложки). Важно, чтобы в кал не попала моча. Собранный материал нужно доставить в лабораторию в течение 3-х часов.
Подготовка к анализу кала на дисбактериоз
За 3-4 дня до анализа необходимо прекратить прием слабительных препаратов. Также не следует пользоваться ректальными свечами.
Если Вы проходили рентгенографическое исследование желудка или кишечника с введением рентгеноконтрастного вещества, необходимо будет подождать, пока оно полностью выведется из организма, и только потом собрать материал для анализа. Также для анализа не подходит материал, полученный с помощью клизмы.
Расшифровка результатов анализа на дисбактериоз
Патогенные энтеробактерии – в норме отсутствуют. Их присутствие указывает на острую кишечную инфекцию. Энтеробактерии – сальмонеллы и шигеллы – являются возбудителями серьезного заболевания – дизентерии.
Энтеробактерии – сальмонеллы и шигеллы – являются возбудителями серьезного заболевания – дизентерии.
Бифидобактерии – обеспечивают расщепление и переваривание пищи, усвоение железа, нейтрализацию токсинов. Норма – 109-1010 КОЕ/г, у детей первого года жизни 1010-1011. Существенное снижение количества бифидобактерий – явный признак дисбактериоза.
Лактобактерии – расщепляют лактозу, поддерживают необходимый уровень кислотности толстой кишки, повышают активность фагоцитов – клеток иммунной защиты. Норма: 107-108 КОЕ/г, у детей первого года жизни 106-107.
Кишечная палочка (E.coli) с нормальной ферментативной активностью – препятствует развитию условно-патогенной микрофлоры, вырабатывает витамины группы B, способствует усвоению железа и кальция. Нормальное значение: 107-108 КОЕ/г. Результат ниже нормы может указывать на наличие кишечных паразитов – глистов.
Кишечная палочка (E.coli) со сниженной ферментативной активностью – не причиняет вреда, но и не приносит никакой пользы. В норме кишечная палочка с подобными свойствами должна составлять не более 105 КОЕ/г. Увеличение ее количества является признаком начинающегося дисбактериоза.
В норме кишечная палочка с подобными свойствами должна составлять не более 105 КОЕ/г. Увеличение ее количества является признаком начинающегося дисбактериоза.
Гемолитические кишечные палочки (E.coli) – способны вырабатывать токсины. В норме должны отсутствовать.
Нормы по условно-патогенным микроорганизмам:
- микробы рода протея – менее 102;
- условно-патогенные энтеробактерии – менее 104;
- энтерококки – 105-108, у детей до года 105-107;
- стафилококк золотистый (S.aureus.) и др. гемолитические стафилококки – отсутствуют;
- стафилококки (сапрофитные, эпидермальный) – менее 104;
- грибы рода Candida – менее 103;
- бактероиды – менее 107;
- клостридии – не более 105.
Не занимайтесь самолечением. Обратитесь к нашим специалистам, которые правильно поставят диагноз и назначат лечение.
Оцените, насколько был полезен материал
Спасибо за оценку
что нужно знать об этой угрозе человечеству и как быть с антибиотиками
В прессе все чаще говорят о скором кошмарном будущем, где можно будет погибнуть от безобидного пореза: все лекарства окажутся бессильны против даже самой простой инфекции. Апокалиптические сценарии еще далеки от реальности, но проблема антибиотикорезистентности – устойчивости бактерий к лекарствам – с каждым годом становится все острее.
Апокалиптические сценарии еще далеки от реальности, но проблема антибиотикорезистентности – устойчивости бактерий к лекарствам – с каждым годом становится все острее.
На прошедшей неделе в Давосе британский министр здравоохранения Мэтт Хэнкок призвал «предотвратить ужасное будущее», в котором люди окажутся беззащитны перед бактериями с множественной лекарственной устойчивостью (их иногда называют «супербактериями» или «супермикробами»).
Представляя свой план борьбы, Хэнкок сравнил масштаб проблемы антибиотикорезистентности с войнами и изменением климата. Похожими формулировками оперирует Всемирная организация здравоохранения (ВОЗ) и специалисты по всему миру.
Настоящее Время разобралось для вас в антибиотиках и супербактериях.
Насколько все плохо?Ситуация пока не критическая, но очень серьезная. Бактерии научились противостоять даже самым сильным и редко применяемым лекарствам («антибиотикам резерва», таким, как колистин), при этом с 1980-х годов принципиально новых антибиотиков практически не появлялось. Исследования идут, но они слишком долгие и дорогие – а бактерии вырабатывают неуязвимость против антибиотиков куда быстрее. Дело осложняется и простотой путешествий: супербактерии получают возможность легко распространяться по всему миру.
Исследования идут, но они слишком долгие и дорогие – а бактерии вырабатывают неуязвимость против антибиотиков куда быстрее. Дело осложняется и простотой путешествий: супербактерии получают возможность легко распространяться по всему миру.
Авторы британского исследования антибиотикорезистентности (2016 год) оценивали, что количество смертей от таких супербактерий в мире может вырасти примерно с 700 тысяч в год до 10 млн ежегодно к 2050 году – это больше, чем число жертв онкозаболеваний (на момент публикации). Потери ВВП при таком сценарии достигнут 100 триллионов долларов.
Пока не существует систем, позволяющих полноценно отслеживать мировую ситуацию с антибиотикорезистентностью в мировом масштабе. Проект ВОЗ под названием GLASS стартовал в 2015 году и по состоянию на конец 2018 года включал в себя лишь 71 страну. В последний отчет (опубликован в январе 2019 года) вошли данные об антибиотикорезистентности всего из 49 стран, при этом их качество пока не позволяет сравнивать между собой ситуацию в различных государствах и регионах.
В региональных отчетах также не много поводов для оптимизма. Страны Евросоюза за восемь лет (2007-2015) зафиксировали более чем двукратный рост числа погибших от инфекций, вызванных неуязвимыми для антибиотиков микробами, говорится в недавнем исследовании. По количеству потерянных лет здоровой жизни в пересчете на 100 тысяч населения (170) подобные инфекции практически сравнялись с суммарным эффектом ВИЧ, гриппа и туберкулеза (183). Более всего таким инфекциям в ЕС подвержены дети до года и люди старше 65 лет.
Хотя в еще одной свежей публикации крупный госпиталь Марселя показал, что за 15 лет (2001-2016) у них ситуация с резистентностью к антибиотикам не ухудшилась. К тому же, судя по мировой прессе, пока неуязвимые к абсолютно всем антибиотикам инфекции все же не носят массовый характер: громче всего обсуждали отчет двухлетней давности о 70-летней американке, погибшей от неуязвимой для всех антибиотиков бактерии (ее она скорее всего подхватила в Индии, где попала в больницу с переломом).
Супербактерии (супермикробы) – это микроорганизмы, обладающие устойчивостью сразу к нескольким антибиотикам. Иногда – ко всем существующим.
В 2017 году ВОЗ опубликовала список из 12 бактерий, для борьбы с которыми срочно нужны новые антибиотики. Критически важны лекарства, способные справиться с устойчивыми к карбапенему энтеробактериями (например, кишечной палочкой E.Coli), синегнойной палочкой (Pseudomonas aeruginosa) и ацинетобактером (Acinetobacter baumannii). Чаще всего именно эти возбудители вызывают так называемые «внутрибольничные инфекции», с которыми врачам особенно сложно бороться из-за множественной устойчивости бактерий и ухудшенного состояния больных.
Также в список ВОЗ попали ванкомицин-резистентные энтерококки (Enterococcus faecium), невосприимчивый к метициллину и ванкомицину золотистый стафилококк (methicillin-resistant staphylococcus aureus, MRSA), цефалоспорин- и фторхинолон-резистентный гонококк, кларитромицин-резистентный хеликобактер и другие бактерии. Они вызывают серьезные болезни: заражение крови, менингит, пневмонию, инфекции мочевыводящих путей и гонорею.
Они вызывают серьезные болезни: заражение крови, менингит, пневмонию, инфекции мочевыводящих путей и гонорею.
Часто в материалах об антибиотиках фигурируют понятия “грамположительные бактерии” и “грамотрицательные бактерии”. Последние (например, кишечная палочка) обладают двумя клеточными мембранами: с ними сложнее бороться, и эффективных против них антибиотиков в мире меньше.
Как действуют антибиотики и появляется резистентность?Антибиотики или «противомикробные препараты» – особые вещества, останавливающие рост клеток бактерий или уничтожающие их. Для этого существуют несколько механизмов: как правило антибиотики атакуют клеточную стенку, мешают синтезу белка или ДНК бактерий.
Резистентность к антибиотикам обнаружили вскоре после их появления. Первый в мире антибиотик – перевернувший медицину ХХ века пенициллин – Александр Флеминг открыл в 1928 году, но массово применять его начали лишь в 1942-м. Еще до этого, в 1940-м стало известно об устойчивой к пенициллину кишечной палочке.
Бактерии постоянно меняются, чтобы стать невосприимчивыми к действию антибиотиков: «выгодные» мутации передаются бактериями друг другу. Микробы приспосабливаются к антибиотикам даже в огромной концентрации крайне быстро. Посмотрите на видео, как всего за 11 дней кишечная палочка адаптируется к тысячекратной дозе (в центре) антибиотика:
Главными «инкубаторами» супербактерий оказываются больницы: там, где постоянно применяются мощные антибиотики, растут популяции невосприимчивых к ним микробов. Способствует развитию устойчивости бактерий и сельское хозяйство: там антибиотики широко применяют для профилактики болезней и ускорения роста животных.
Смертельна ли встреча с супербактерией?Для здорового человека с нормальным иммунитетом – нет. Но чаще всего такие микробы встречаются в больницах, куда попадают люди, уже ослабленные той или иной болезнью. Для пациентов (например, находящихся на искусственной вентиляции легких) встреча с супербактериями может запросто стать фатальной.
Сейчас без антибиотиков невозможны сложные хирургические операции, трансплантации и борьба с раком посредством химиотерапии. Последняя обычно значительно подавляет иммунитет: для таких больных даже самая обычная инфекция может стать смертельной, не говоря уже о вызванной супермикробами.
При этом с инфекциями от мультирезистентных бактерий, пока на них действуют хоть какие-то антибиотики, можно жить, пусть даже это и будет сопряжено со страданиями.
Эмили Моррис рассказала, что супербактерию в ее мочевом пузыре обнаружили в подростковом возрасте и с тех пор ей пришлось перепробовать множество антибиотиков, в том числе «препараты резерва», вроде карбапенема.
Во время беременности она была вынуждена принимать антибиотик, не проверявшийся на беременных, ее новорожденному ребенку пришлось сразу пройти курс терапии антибиотиками. «Это было очень страшно», – рассказывала 24-летняя Моррис журналу New Scientist в 2017 году.
32-летняя Кэтрин Уильямс уже более 10 лет постоянно принимает антибиотики из-за болезни мочевыводящих путей, вызванной супербактериями.
«Каждый раз, когда заканчивается курс приема антибиотиков, болезнь возвращается, – говорила она в интервью BBC. – Боль просто приковывает тебя к постели до следующего курса приема антибиотиков. То, что мне придется принимать антибиотики всю жизнь, меня очень пугает».
Что в России и других постсоветских странах?В России и других постсоветских странах – например, Украине, Казахстане, Беларуси – антибиотики долго продавались без рецепта. Это вело к злоупотреблениям и самолечению, а в итоге – способствовало развитию резистентности у бактерий.
В октябре 2017 года в России приняли «Стратегию предупреждения распространения антимикробной резистентности». Документ, подписанный главой правительства Дмитрием Медведевым, предусматривает два главных этапа:
- До 2020 года население будут информировать о правильном использовании антибиотиков, работать над лучшим выявлением резистентности и определении базовых показателей, как оценивать ее распространенность.

- На втором этапе (до 2030 года) планируется снизить число случаев болезней, связанных с супербактериями.
За последние десятилетия арсенал медиков практически не пополнялся антибиотиками принципиально новых классов. Причин тому несколько.
Разработка таких лекарств – это сложное и затратное занятие, обходящееся в сотни миллионов или миллиарды долларов. Для фармакологических компаний оно не всегда интересно с коммерческой точки зрения: курсы антибиотиков обычно краткосрочны, в отличие от лекарств для хронических заболеваний (антиретровирусная терапия, например, людям с ВИЧ необходима всю жизнь). К тому же из-за быстрого возникновения резистентности растет риск обесценивания инвестиций в разработку новых препаратов.
Тем не менее, в последнее время вошли в обиход мощные антибиотики, полученные на базе старых открытий – в первую очередь, Линезолид (Зивокс). Да и представители существующих классов все время совершенствуются и нередко могут усиливать эффект при совместном использовании.
ВОЗ рекомендует использовать антибиотики только по назначению врача (а врачам – их разумно назначать) и всегда полностью проходить курс лечения, а не останавливать прием антибиотиков сразу после улучшения самочувствия.
Также рекомендуется не хранить, не использовать заново и не передавать другим оставшиеся дозы лекарства.
Важно не пытаться лечить вирусные заболевания антибиотиками, вакцинироваться, укреплять собственный иммунитет и тщательно соблюдать правила гигиены, рекомендует ВОЗ.
Также есть смысл по возможности избегать больниц в регионах, где санитарная ситуация далека от идеальной. В первую очередь – в Азии и Африке. По данным британского отчета, там к 2050 году будет больше всего погибших от инфекций супербактериями.
Если у вас или у близких есть подозрение на такую инфекцию, добейтесь консультации специалиста по инфекционным болезням. Недавнее исследование показало, что это может на 50% снизить смертность от инфекций, вызванных бактериями с множественной лекарственной устойчивостью.
Проблемой невосприимчивости к антибиотикам годами занимаются ученые и специалисты в области охраны общественного здоровья, и поводы для оптимизма есть.
ВОЗ в 2015 году одобрила глобальный план по борьбе с устойчивостью к противомикробным препаратам. Различные страны – в том числе США, Россия и совсем недавно Великобритания – принимают собственные комплексы мер по борьбе с устойчивостью бактерий к антибиотикам. Обычно они включают информирование пациентов и врачей о разумном использовании препаратов, ограничения на применение антибиотиков в сельском хозяйстве и содействие разработкам новых классов антибиотиков.
Несмотря на все сложности, такие разработки уже идут и появляются отдельные многообещающие результаты. Например, теиксобактин – принципиально новый антибиотик, открытый в 2015 году группой ученых из США, Германии и Великобритании.
В конце 2017 года его научились эффективно синтезировать, а в 2018-м действие синтетического теиксобактина успешно проверили на мышах. Но до появления лекарства для людей еще далеко: по оценкам ученых, 6-10 лет.
Но до появления лекарства для людей еще далеко: по оценкам ученых, 6-10 лет.
Оно может и вовсе не появиться: например, многообещающий платенсимицин, представленный в 2006 году, так и не добрался до полноценных клинических тестов из-за его неэффективности при введении стандартными методами. Однако исследования принципов работы платенсимицина позволяют надеяться на появление новых, более эффективных разработок.
В начале 2018 года ученые Рокфеллеровского университета в США представили еще один принципиально новый класс антибиотиков – малацидины, но до появления лекарств на их основе понадобится еще больше времени.
Рассматриваются и другие варианты терапии против супербактерий: целенаправленное усиление иммунитета, антимикробные пептиды, синтетические вещества, позаимствованные у вирусов, добавление особых элементов к уже существующим антибиотикам для повышения эффективности и другие способы. Однако все они пока находятся на разных стадиях готовности и для массового клинического использования не одобрены.
Эшерихия коли e coli гемолитическая лечение
Довольно много проблем возникает у человека после попадания в организм кишечной палочки. E coli гемолитические – палочковая бактерия различного типа, некоторые естественны для организма человека. Как ранее было отмечено, существует огромное количество разновидностей подобных бактерий, патогенных около одной сотни. Следует отметить, что все патогенные варианты е коли объединены в 4 большие группы.
Особенности E coli
Проблема с патогенными кишечными палочками возникают по причине того, они могут длительное время сохраняться в воде, почве, фекалиях и другой внешней среде. При этом палочка может развиваться и размножаться в пищевых продуктах различного типа, особенно в кисломолочных продуктах. Погибают они только в случае использования дезинфицирующих средств: едкого натрия, фенола, сулемы. Следует учитывать тот момент, что кишечная палочка имеет более высокую устойчивость к воздействию окружающей среды нежели энтеробактерии. Однако прямой солнечный свет может убить бактерию в течение нескольких минут, температура выше 60 градусов Цельсия также губительна. Применение 1% раствора карболовой кислоты поражает возбудитель за 15 минут.
Однако прямой солнечный свет может убить бактерию в течение нескольких минут, температура выше 60 градусов Цельсия также губительна. Применение 1% раствора карболовой кислоты поражает возбудитель за 15 минут.
Следует выделить тот момент, что кишечная палочка может выглядеть по-разному. Часть имеет жгутик, который используется бактерией для передвижения, другие не имеют жгутиков и способность к движению отсутствует.
Заболевания мочеполовых органов
Эшерихия коли – возбудитель заболеваний, которые поражают мочеполовые органы. При недостаточном соблюдении правил гигиены заражение мочеиспускательных органов проходит непосредственно через желудочно-кишечный тракт. Также не стоит забывать о том, что незащищенные половые акты во многих случаях становятся причиной возникновения проблемы.
Рассматриваемый тип кишечной палочки становится причиной возникновение нижеприведенных проблем:
- Практически в 80% случаев происходит заражение мочевыводящих путей.
 При этом проходит воспалительный процесс, который вызывает проявление довольно большого количества симптомов.
При этом проходит воспалительный процесс, который вызывает проявление довольно большого количества симптомов. - Практически в 80% рассматриваемый возбудитель становится причиной развития хронического простатита.
- В 64% возбудитель становится причиной острого простатита.
- Если пациенту более 35 лет, то большая часть воспалительных процессов в придатке яичка возникают по причине попадания возбудителя.
- Проведенные исследования указывают на то, что в 70-95% инфицирование происходит путем восходящего движения возбудителя. Он может достигнуть мочевого пузыря, мочевых путей и почек.
Также есть вероятность развития других проблем с мочеполовыми органами.
Современные методы исследования основаны на выявлении бактерий в моче, что говорит о воспалении путей, мочевого пузыря и почек. Небольшая концентрация возбудителей не приводит к проявлению симптоматики, только при 105 микробных тел на 1 мл мочи приводит к появлению серьезных симптомов. Однако в некоторых случаях есть вероятность того, что бактерии даже при высокой концентрации могут не вызывать проблемы. Бессимптомная бактериурия может протекать незаметно для больного, что не требует лечения.
Бессимптомная бактериурия может протекать незаметно для больного, что не требует лечения.
Однако при наличии яркой симптоматики диагностический порог существенно снижается. При этом поводом для лечения становится концентрация бактерий в размере 104 на 1 мл мочи. Симптомы могут быть следующими:
- Боли в поясничном отделе. Следует учитывать, что боли могут быть тупыми и острыми, проявляться приступами. Да что говорить- рекомендуется к игре на деньги и бонусы. Это значит, что они проверенны пользователями, имеют отличные бонусы, скидки и постоянные выплаты удачливым игрокам. На просторах интернета сейчас много онлайн-казино, но казино Пин Ап является лицензионным, проверенным мгровым клубом. Многие новые игроки ошибочно судят казино исходя из предлагаемого им приветственного бонуса. Для этого игрокам нужно пройти по специальной ссылке или использовать бонусные коды.
 тоит быть внимательнее, так как такой бонус имеет свой срок отыгрыша. Отыграть бонусы нужно в 35 раз. Зачастую проблемы подобного рода связывают с иными заболеваниями.
тоит быть внимательнее, так как такой бонус имеет свой срок отыгрыша. Отыграть бонусы нужно в 35 раз. Зачастую проблемы подобного рода связывают с иными заболеваниями. - Лихорадка – реакция организма на появление бактерии. При этом существенно повышается температура, увеличивается количество лейкоцитов в крови.
- Тошнота и рвота также характерны для бактериального заражения.
- Озноб и дизурия.
Как правило, вышеприведенная симптоматика приводит к тому, что нужно проводить лечение. Однако их зачастую связывают с другими проблемами, к примеру, вирусными заболеваниями: ОРВИ, грипп, воспалительными процессами. Убивать возбудитель можно различными способами, зачастую нужно колоть специальные препараты. Лечение направлено на снижение проявления симптоматики, а также на борьбу с самой причиной возникновения проблемы.
Эшерихиозы
Эшерихиоза зачастую является причиной, по которой развивается гемолитическая инфекция. Для данного типа инфицирования свойственно появление лихорадки. Зачастую возбудитель появляется в органах пищеварительной системы, реже в мочеполовой системе. Также довольно редки бактерии становятся причиной сепсиса. Эшерихиозы чаще всего возникают у детей раннего возраста. Возбудитель распространяется фекально-оральным путем.
Зачастую возбудитель появляется в органах пищеварительной системы, реже в мочеполовой системе. Также довольно редки бактерии становятся причиной сепсиса. Эшерихиозы чаще всего возникают у детей раннего возраста. Возбудитель распространяется фекально-оральным путем.
Особенности проводимого лечения
Лечение основано на приеме антибиотиков. В последнее время было создано довольно много препаратов, которые могут эффективно бороться с возбудителем в организме человека. Самостоятельный прием без назначения врача не рекомендуется. Это связано с тем, что есть определенные побочные эффекты. Многие могут привести к осложнениям.
Профилактика
Как и во многих других случаях с бактериальным или вирусным заражением, проще избежать проникновение вируса в организм, нежели провести эффективное лечение. Это связано с тем, что бактерии, как и вирус, быстро размножаются и поселяются в различных системах организма. К рекомендациям, касающихся профилактики, можно отнести:
- Следует внимательно относится к выбору продуктов питания.
 Это связано с тем, что при нарушении срока годности бактерии начинают размножаться. Нарушение рекомендаций по хранению продуктов питания создают наиболее благоприятную среду для размножения бактерии.
Это связано с тем, что при нарушении срока годности бактерии начинают размножаться. Нарушение рекомендаций по хранению продуктов питания создают наиболее благоприятную среду для размножения бактерии. - Даже в случае, когда сроки годности и хранения не были нарушены, бактерии могут передаваться вместе с продуктами питания, фруктами, овощами. Поэтому перед употреблением многих продуктов питания следует тщательно их промывать под чистой или теплой водой.
- Следующим шагом защиты организма от проникновения бактерии можно назвать мытье рук после посещения туалета или общественных мест. Бактерии, в отличии от вируса, в большинстве случае передаются бытовым методом, то есть через соприкосновение.
- Применение антисептиков позволяет также удалить с поверхности возбудителей. Их эффективность очень велика, применять следует при мыть рук. В последнее время проводится производство различного типа антисептиков. Их стоимость может существенно отличаться, как и эффективность.
- Антибиотики способны бороться с бактериальными возбудителями.
 В качестве профилактики некоторые препараты из этой группы рекомендуют употреблять в случае эпидемии. При выборе следует обратить внимание на дорогие препараты, которые производят по современным технологиям для исключения вероятности возникновения побочных эффектов.
В качестве профилактики некоторые препараты из этой группы рекомендуют употреблять в случае эпидемии. При выборе следует обратить внимание на дорогие препараты, которые производят по современным технологиям для исключения вероятности возникновения побочных эффектов.
Вышеприведенные моменты следует учитывать для того, чтобы исключить вероятность бактериального заражения. Однако уже после заражения они не позволяют снизить проявление симптоматики.
В заключение отметим, что бактерии, как и вирусы, передаются от человека к человеку и могут вызывать серьезные осложнения со здоровьем. Именно поэтому следует сразу после проявления симптомов посетить врача. Проводимые исследования позволяют выявить бактерию в организме, определить степень поражения, а также назначить наиболее эффективное лечение.
Испытан фаговый коктейль против кишечной палочки
Коктейль, содержащий три бактериофага, успешно справился практически со всеми протестированными штаммами Escherichia coli, не повлияв на полезную кишечную микрофлору
Ученые из Университета Копенгагена (Дания) уверяют, что скоро можно будет уничтожить кишечную инфекцию, не причинив вреда симбионтной кишечной микрофлоре (микробиоте) человека. Они протестировали препарат на основе бактериофагов – вирусов, специфически поражающих бактерии.
Они протестировали препарат на основе бактериофагов – вирусов, специфически поражающих бактерии.
Для создания условий, максимально приближенных к физиологическим, авторы разработали модель, в которой воспроизведены условия тонкого кишечника. Если обычно подобные модели имитируют только биохимию процесса (pH, воздействие желчных кислот, ферментов), то в данной модели присутствует такой важный фактор как кишечная микробиота. Как известно, микроорганизмы, обитающие в кишечнике, играют большую роль не только в пищеварении, но и в других аспектах жизнедеятельности человека. Дисбаланс кишечной микрофлоры, в частности вследствие приема антибиотиков, может вызывать обменные, иммунные и другие нарушения.
В эксперименте в модель тонкого кишечника, населенную кишечной микрофлорой, внесли патогенные штаммы кишечной палочки, а затем – фагопрепарат, специфический против них (разработка компании Intralytix).
Бактериофаги в условиях, имитирующих физиологические, уничтожали множество штаммов кишечной палочки, не воздействуя при этом на полезную кишечную микрофлору.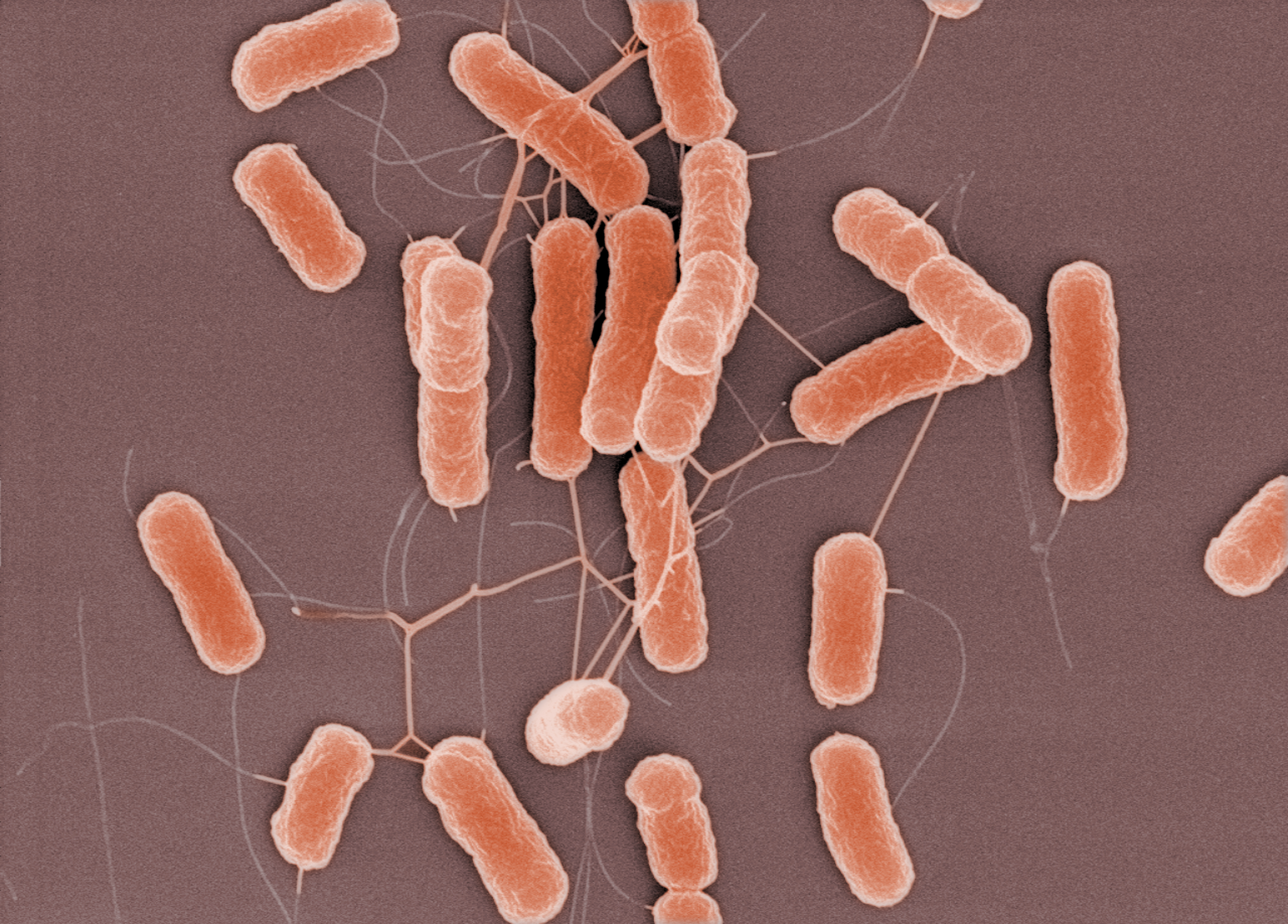 На следующих этапах планируется испытание фагопрепарата на животных, а затем – проведение клинических испытаний.
На следующих этапах планируется испытание фагопрепарата на животных, а затем – проведение клинических испытаний.
Три бактериофага (розовые точки) протестированы против большой коллекции штаммов Escherichia coli различных серотипов. Комбинация фагов уничтожала практически все штаммы (инфографика Intralytix, Inc.)
* Cieplak T, Soffer N, Sulakvelidze A, and Nielsen DS. A bacteriophage cocktail targeting Escherichia coli reduces E. coli in simulated gut conditions, while preserving a non-targeted representative commensal normal microbiota // Gut Microbes, 2018. DOI: 10.1080/19490976.2018.1447291
Гемолитико-уремический синдром (ГУС) — Симптомы и причины
Обзор
Гемолитико-уремический синдром (ГУС) — это состояние, которое может возникать при повреждении и воспалении мелких кровеносных сосудов в почках. Это повреждение может вызвать образование тромбов в сосудах. Сгустки закупоривают фильтрующую систему в почках и приводят к почечной недостаточности, что может быть опасно для жизни.
Сгустки закупоривают фильтрующую систему в почках и приводят к почечной недостаточности, что может быть опасно для жизни.
Любой может развить HUS , но чаще всего он встречается у маленьких детей.Во многих случаях HUS вызывается инфекцией определенными штаммами бактерий Escherichia coli (E. coli). Первым симптомом этой формы HUS является диарея в течение нескольких дней, часто, но не всегда с кровью.
HUS также может быть вызван другими инфекциями, некоторыми лекарствами или состояниями, такими как беременность, рак или аутоиммунное заболевание. В некоторых случаях HUS является результатом определенных генетических мутаций. Эти формы HUS обычно не вызывают диарею..
HUS — состояние тяжелое. Но своевременное и соответствующее лечение обычно приводит к полному выздоровлению большинства людей, особенно маленьких детей.
Но своевременное и соответствующее лечение обычно приводит к полному выздоровлению большинства людей, особенно маленьких детей.
Продукты и услуги
Показать больше товаров от Mayo ClinicСимптомы
Признаки и симптомы HUS могут различаться в зависимости от причины. Большинство случаев HUS вызвано инфицированием определенными штаммами E.coli, которые сначала поражают пищеварительный тракт. Первоначальные признаки и симптомы этой формы HUS могут включать:
- Диарея, часто с кровью
- Боль в животе, спазмы или вздутие живота
- Рвота
- Лихорадка
Все формы HUS — независимо от причины — повреждают кровеносные сосуды. Это повреждение вызывает разрушение эритроцитов (анемия), образование тромбов в кровеносных сосудах и повреждение почек. Признаки и симптомы этих изменений включают:
Признаки и симптомы этих изменений включают:
- Бледное окрашивание, включая потерю розового цвета на щеках и внутренней части нижних век
- Экстремальная усталость
- Одышка
- Легкие синяки или синяки необъяснимого характера
- Необычное кровотечение, такое как кровотечение из носа и рта
- Уменьшение мочеиспускания или кровь в моче
- Отек (отек) ног, ступней или щиколоток, реже лица, рук, ступней или всего тела
- спутанность сознания, судороги или инсульт
- Высокое кровяное давление
Когда обращаться к врачу
Немедленно обратитесь к врачу, если вы или ваш ребенок испытываете кровавую диарею или диарею в течение нескольких дней, за которой следует:
- Снижение диуреза
- Набухание
- Синяки необъяснимого происхождения
- Необычное кровотечение
- Экстремальная усталость
Обратитесь за неотложной помощью, если вы или ваш ребенок не мочитесь в течение 12 часов или более.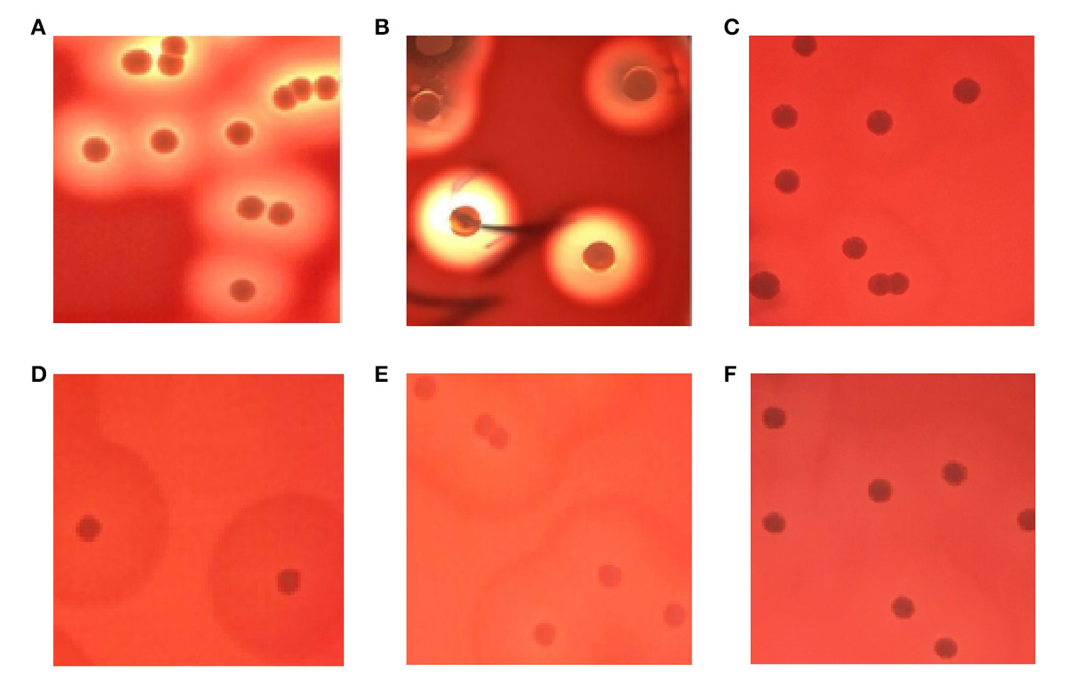
Причины
Наиболее частой причиной HUS — особенно у детей в возрасте до 5 лет — является инфицирование определенными штаммами бактерий E. coli. E. coli относится к группе бактерий, обычно обнаруживаемых в кишечнике здоровых людей и животных. Большинство из сотен типов кишечной палочки нормальны и безвредны. Но некоторые штаммы кишечной палочки вызывают диарею.
Некоторые штаммы кишечной палочки, вызывающие диарею, также производят токсин, называемый токсином шига.Эти штаммы называются E.coli, продуцирующей токсин Shiga, или STEC. Когда вы инфицированы штаммом STEC , токсин шига может попасть в ваш кровоток и вызвать повреждение кровеносных сосудов, что может привести к HUS . Но у большинства людей, инфицированных кишечной палочкой, даже более опасными штаммами, не развивается HUS .
Другие причины HUS могут включать:
- Другие инфекции, такие как инфекция пневмококковыми бактериями, вирусом иммунодефицита человека (ВИЧ) или гриппом
- Использование определенных лекарств, особенно некоторых лекарств, используемых для лечения рака, и некоторых лекарств, используемых для подавления иммунной системы реципиентов трансплантата органов
- Редко HUS может возникать как осложнение беременности или состояния здоровья, такого как аутоиммунное заболевание или рак
Необычный тип HUS , известный как атипичный HUS , может передаваться детям генетически.Люди, унаследовавшие мутировавший ген, вызывающий эту форму HUS , не обязательно заболеют этим заболеванием. Но мутировавший ген может быть активирован после воздействия триггера, такого как инфекция, использование определенных лекарств или хроническое заболевание.
Факторы риска
Большинство случаев HUS вызвано инфицированием определенными штаммами бактерий E. coli. Контакт с кишечной палочкой может произойти, если вы:
- Есть зараженное мясо или производить
- Плавать в бассейнах или озерах, загрязненных фекалиями
- Тесно контактируйте с инфицированным человеком, например, в семье или в детском саду.
Риск развития HUS самый высокий для:
- Дети до 5 лет
- Взрослые 65 лет и старше
- Люди с ослабленной иммунной системой
- Люди с определенными генетическими изменениями, которые делают их более восприимчивыми к HUS
Осложнения
HUS может вызвать опасные для жизни осложнения, в том числе:
- Почечная недостаточность, которая может быть внезапной (острой) или развиваться с течением времени (хронической)
- Высокое кровяное давление
- Инсульт или судороги
- Кома
- Проблемы со свертыванием, которые могут привести к кровотечению
- Проблемы с сердцем
- Проблемы с пищеварительным трактом, например проблемы с кишечником, желчным пузырем или поджелудочной железой
Профилактика
Мясо или продукты, зараженные E. coli не обязательно будет плохо выглядеть, чувствовать или пахнуть. Для защиты от инфекции E. coli и других болезней пищевого происхождения:
coli не обязательно будет плохо выглядеть, чувствовать или пахнуть. Для защиты от инфекции E. coli и других болезней пищевого происхождения:
- Избегайте непастеризованного молока, сока и сидра.
- Тщательно мойте руки перед едой, после посещения туалета и смены подгузников.
- Часто очищайте посуду и пищевые поверхности.
- Готовьте мясо до внутренней температуры не менее 160 градусов по Фаренгейту.
- Размораживание мяса в микроволновой печи или холодильнике.
- Храните сырые продукты отдельно от готовых к употреблению продуктов.Не кладите приготовленное мясо на тарелки, ранее загрязненные сырым мясом.
- Храните мясо под продуктами в холодильнике, чтобы снизить риск попадания жидкостей, например крови, на продукты.
- Избегайте нечистых мест для купания. Не плавайте, если у вас понос.
Каковы признаки и симптомы гемолитико-уремического синдрома (ГУС), вызванного Escherichia coli (E coli)?
Франк С., Вербер Д., Крамер Дж. П., Аскар М., Фабер М., ан дер Хайден М. и др. Эпидемический профиль вспышки Escherichia coli O104: h5, продуцирующей шига-токсин, в Германии. N Engl J Med . 2011, 10 ноября. 365 (19): 1771-80. [Медлайн].
Buchholz U, Bernard H, Werber D, Böhmer MM, Remschmidt C, Wilking H, et al.Вспышка Escherichia coli O104: h5 в Германии, связанная с проростками. N Engl J Med . 2011, 10 ноября. 365 (19): 1763-70. [Медлайн].
Camins BC, Marschall J, De Vader SR, Maker DE, Hoffman MW, Fraser VJ. Клиническое влияние устойчивости к фторхинолонам у пациентов с бактериемией E. coli. Дж Хосп Мед . 2011 июл.6 (6): 344-9. [Медлайн]. [Полный текст].
coli. Дж Хосп Мед . 2011 июл.6 (6): 344-9. [Медлайн]. [Полный текст].
Уолмсли Р.С., Дэвид ДБ, Аллан Р.Н., Киркби Г.Р. Двусторонний эндогенный эндофтальмит, вызванный Escherichia coli: серьезное осложнение у инсулинозависимого диабетика. Постградская медицина J . 1996 июн.72 (848): 361-3. [Медлайн].
McGannon CM, Fuller CA, Weiss AA. Различные классы антибиотиков по-разному влияют на выработку токсина шига. Противомикробные агенты Chemother . 2010 сентябрь 54 (9): 3790-8. [Медлайн].
Pitout JD, Laupland KB. Enterobacteriaceae, продуцирующие бета-лактамазы расширенного спектра действия: новая проблема общественного здравоохранения. Ланцет Infect Dis . 2008 марта 8 (3): 159-66.[Медлайн].
Melzer M, Petersen I. Смертность в результате бактериемической инфекции, вызванной E.coli, продуцирующей бета-лактамазы расширенного спектра (ESBL), по сравнению с E. coli, не продуцирующей ESBL. J Заражение . 2007 Сентябрь 55 (3): 254-9. [Медлайн].
Смертность в результате бактериемической инфекции, вызванной E.coli, продуцирующей бета-лактамазы расширенного спектра (ESBL), по сравнению с E. coli, не продуцирующей ESBL. J Заражение . 2007 Сентябрь 55 (3): 254-9. [Медлайн].
Doi Y, Park YS, Rivera JI, Adams-Haduch JM, Hingwe A, Sordillo EM, et al. Связанная с населением инфекция Escherichia coli, продуцирующая ß-лактамазу расширенного спектра действия, в США. Clin Infect Dis .2013 Март 56 (5): 641-8. [Медлайн]. [Полный текст].
Batard E, Ollivier F, Boutoille D, Hardouin JB, Montassier E, Caillon J, et al. Связь между использованием антибиотиков в больницах и устойчивостью к хинолонам у Escherichia coli. Int J Infect Dis . 2012 г. 22 ноября. [Medline].
Karlowsky JA, Denisuik AJ, Lagacé-Wiens PR, Adam HJ, Baxter MR, Hoban DJ, et al. Активность фосфомицина in vitro против Escherichia coli, выделенная от пациентов с инфекциями мочевыводящих путей в Канаде; Исследование наблюдения CANWARD. Противомикробные агенты Chemother . 2013 декабрь 9 [Medline].
Активность фосфомицина in vitro против Escherichia coli, выделенная от пациентов с инфекциями мочевыводящих путей в Канаде; Исследование наблюдения CANWARD. Противомикробные агенты Chemother . 2013 декабрь 9 [Medline].
Agustin ET, Gill V, Domenico P. Окрашивание ЦСЖ по граммам при менингите. Медицинский работник . 1994. 15: 14-24.
Барнетт Б.Дж., Стивенс Д.С. Инфекция мочевыводящих путей: обзор. Am J Med Sci . 1997 Октябрь 314 (4): 245-9. [Медлайн].
Boam WD, Miser WF. Острый очаговый бактериальный пиелонефрит. Ам Фам Врач . 1995 1 сен.52 (3): 919-24. [Медлайн].
Bohnen JM. Антибактериальная терапия при абдоминальной инфекции. Мир J Surg . 1998 22 февраля (2): 152-7. [Медлайн].
Carpenter HA. Бактериальный и паразитарный холангит. Mayo Clin Proc . 1998 Май. 73 (5): 473-8. [Медлайн].
Чайлдс SJ.Современные концепции лечения инфекций мочевыводящих путей и простатита. Am J Med . 1991 г. 30 декабря. 91 (6А): 120С-123С. [Медлайн].
Cunha BA. Боль в животе у больных сахарным диабетом. Инфекция Dis Prac . 1997. 21: 14-5.
Cunha BA. Острый бескаменный холецистит. Инфекция Dis Prac . 1997. 21: 70-1.
Cunha BA. Острый и хронический бактериальный простатит. Инфекция Dis Prac .1994. 18: 78-9.
18: 78-9.
Cunha BA. Чувствительность изолятов мочевыводящих путей, зависящая от концентрации антибиотиков. Антиб Клиницист . 1999. 3: 57-8.
Cunha BA. Хинолоны: клинические аспекты. Антиб Клиницист . 1998. 2: 129-35.
Cunha BA. Фторхинолоны при инфекциях мочевыводящих путей: обзор. Adv Ther . 1994 ноябрь-декабрь. 11 (6): 277-96. [Медлайн].
Cunha BA.Терапевтический подход к лечению ИМП. Антиб Клиницист . 1998. 2 (S2): 35-40.
Cunha BA. Окраска мочи по Граму при уросепсисе. Медицинский работник . 1997. 18: 75-8.
Cunha BA. Уросепсис. Дж. Крит. Бол. . 1997. 12: 616-25.
Donnenberg MS, Kaper JB. Энтеропатогенная кишечная палочка. Заражение иммунной . 1992 Октябрь 60 (10): 3953-61. [Медлайн].
DuPont HL.Диарея путешественников: современные подходы к лечению и профилактике. Наркотики . 2006. 66 (3): 303-14. [Медлайн].
Эйзенштейн Б.И., Джонс Г.В. Спектр инфекций и механизмы патогенеза Escherichia coli. Adv Intern Med . 1988. 33: 231-52. [Медлайн].
Glandt M, Adachi JA, Mathewson JJ, Jiang ZD, DiCesare D, Ashley D. Энтероагрегантная кишечная палочка как причина диареи путешественника: клинический ответ на ципрофлоксацин. Clin Infect Dis . 1999 29 августа (2): 335-8. [Медлайн].
Голд Р. Бактериальный менингит — 1982. Am J Med . 1983, 28 июля. 75 (1B): 98-101. [Медлайн].
Am J Med . 1983, 28 июля. 75 (1B): 98-101. [Медлайн].
Hansing CE, Allen VD, Cherry JD. Эндокардит, вызванный Escherichia coli. Обзор литературы и тематическое исследование. Arch Intern Med . 1967 Октябрь 120 (4): 472-7. [Медлайн].
Харрингтон С.М., Дадли Е.Г., Натаро Дж. П. Патогенез энтероагрегативной инфекции Escherichia coli. FEMS Microbiol Lett . 2006 Январь 254 (1): 12-8. [Медлайн].
Харви Д., Холт Д. Е., Бедфорд Х. Бактериальный менингит у новорожденных: проспективное исследование смертности и заболеваемости. Семин Перинатол . 1999 июн., 23 (3): 218-25. [Медлайн].
Джонсон-младший. Факторы вирулентности при инфекции мочевыводящих путей, вызванной Escherichia coli. Clin Microbiol Ред. . 1991, 4 января (1): 80-128. [Медлайн].
[Медлайн].
Jonas M, Cunha BA.Бактериальная пневмония, вызванная Escherichia coli. Arch Intern Med . 1982 ноябрь 142 (12): 2157-9. [Медлайн].
Klein NC, Cunha BA. Цефалоспорины третьего поколения. Мед Клин Норт Ам . 1995 июл.79 (4): 705-19. [Медлайн].
Koutkia P, Mylonakis E, Flanigan T. Энтерогеморрагическая кишечная палочка O157: H7 — новый патоген. Ам Фам Врач . 1997 г., 1. 56 (3): 853-6, 859-61. [Медлайн].
Lepelletier D, Caroff N, Reynaud A, Richet H.Escherichia coli: эпидемиология и анализ факторов риска инфекций, вызванных устойчивыми штаммами. Clin Infect Dis . 1999 Сентябрь 29 (3): 548-52. [Медлайн].
Лернер AM. Грамотрицательные бациллярные пневмонии. Dis Mon . 1980, 27 ноября (2): 1-56. [Медлайн].
Dis Mon . 1980, 27 ноября (2): 1-56. [Медлайн].
Макдональд Мичиган. Пиогенный абсцесс печени: диагностика, бактериология и лечение. Eur J Clin Microbiol . 1984 декабрь 3 (6): 506-9. [Медлайн].
Мид ПС, Гриффин ПМ.Escherichia coli O157: H7. Ланцет . 1998 10 октября. 352 (9135): 1207-12. [Медлайн].
Moon HW. Патогенез кишечных заболеваний, вызываемых Escherichia coli. Adv Vet Sci Comp Med . 1974. 18 (0): 179-211. [Медлайн].
Neu HC. Инфекции, вызванные грамотрицательными бактериями: обзор. Ред. Заразить Dis . 1985 ноябрь-декабрь. 7 Приложение 4: S778-82. [Медлайн].
Нордманн П. Тенденции устойчивости к бета-лактамам среди Enterobacteriaceae. Clin Infect Dis . 1998, 27 августа, приложение 1: S100-6. [Медлайн].
Clin Infect Dis . 1998, 27 августа, приложение 1: S100-6. [Медлайн].
Ортега AM, Cunha BA. Острый простатит. Контемп Урол . 1997. 18: 73-80.
Палмер DL. Микробиология пневмонии у пациента группы риска. Am J Med . 1984 15 мая. 76 (5A): 53-60. [Медлайн].
Филипс А.Д., Франкель Г. Механизмы поражения кишечника кишечной палочкой. Baillieres Clin Гастроэнтерол .1997 сентября, 11 (3): 465-83. [Медлайн].
Робертс JA. Пиелонефрит, корковый абсцесс и околопочечный абсцесс. Урол Клин Норт Ам . 1986, ноябрь 13 (4): 637-45. [Медлайн].
Savatta D, Cunha BA. Острый пиелонефрит и его аналоги: Xanthogranulomaotus pyelonephritis и malacoplakia. Инфекция Dis Prac . 1996. 20: 86-8.
1996. 20: 86-8.
Schimpff SC. Грамотрицательная бактериемия. Поддержка лечения рака .1993 1 (1): 5-18. [Медлайн].
Schindzielorz A, Edberg SC, Bia FJ. Strongyloides stercoralis гиперинфекция и поражение центральной нервной системы у пациента с рецидивирующим полихондритом. South Med J . 1991 августа 84 (8): 1055-7. [Медлайн].
Shea KW, Cunha BA. Остеомиелит грудины, вызванный Escherichia coli, после операции на открытом сердце. Сердце легкое . 1995 март-апрель. 24 (2): 177-8. [Медлайн].
Tabacof J, Feher O, Katz A, et al.Гиперинфекция Strongyloides у двух пациентов с лимфомой, гнойным менингитом и сепсисом. Рак . 1991 15 октября. 68 (8): 1821-3. [Медлайн].
Tenner SM, Yadven MW, Kimmel PL. Острый пиелонефрит. Предотвращение осложнений за счет своевременной диагностики и правильной терапии. Постградская медицина .1992 г. 1. 91 (2): 261-8. [Медлайн].
Tice AD. Краткосрочная терапия острого цистита: краткий обзор терапевтических стратегий. J Антимикробный Chemother . 1999, 43 марта, приложение A: 85-93. [Медлайн].
Wanke CA. Кишечная палочка. J Diarrheal Dis Res . 1988 марта 6 (1): 1-5. [Медлайн].
Weinberger M, Cytron S, Servadio C и др. Абсцесс предстательной железы в эпоху антибиотиков. Ред. Заразить Dis . 1988 март-апрель. 10 (2): 239-49. [Медлайн].
1988 март-апрель. 10 (2): 239-49. [Медлайн].
Westphal JF, Brogard JM. Инфекции желчевыводящих путей: руководство по медикаментозному лечению. Наркотики . 1999, январь, 57 (1): 81-91. [Медлайн].
Whipp SC, Rasmussen MA, Cray WC Jr. Животные как источник патогенной для человека Escherichia coli. J Am Vet Med Assoc . 1994 15 апреля. 204 (8): 1168-75. [Медлайн].
Гемолитико-уремический синдром STEC — NORD (Национальная организация по редким заболеваниям)
СТАТЬИ В ЖУРНАЛЕ
Каплан Б.С., Рубнер Р.Л., С. Спинале Дж. М., Копелович Л.Современное лечение атипичного гемолитико-уремического синдрома. Непреодолимый редкий диск Res. 2014. 3 (2): 34–45.
Спинале, Дж. М., Рубнер Р. Л., Копелович Л., Каплан Б. С.: Долгосрочные исходы гемолитико-уремического синдрома шига-токсина [STEC HUS]. Педиатр Нефрол. 2013; 28 (11): 2097-105. DOI: 10.1007 / s00467-012-2383-6. Epub 2013 4 января.
2013; 28 (11): 2097-105. DOI: 10.1007 / s00467-012-2383-6. Epub 2013 4 января.
Калетти М.Г., Миссони М., Веццани К., Гриньоли М. и др. Влияние диеты, эналаприла или лозартана на нефропатию постдиарейного гемолитико-уремического синдрома. Педиатр Нефрол 2011; 26: 1247-1254.
Франк С., Вербер Д., Крамер Дж. П. и др. Эпидемический профиль вспышки EscherichiacoliO104: h5, продуцирующей шига-токсин, в Германии. N Engl J Med. 2011; 365 (19): 1771-80.
Hickey CA, Битти Т.Дж., Коуисон Дж. И др. Раннее увеличение объема при диарее и относительная нефропротекция при последующем гемолитико-уремическом синдроме. Arch Pediatr Adolesc Med. 2011; 165 (10): 884-9.
Копелович Л, Каплан Б.С. Гемолитико-уремический синдром, ассоциированный со Streptococcus pneumoniae: классификация и появление серотипа 19А.Педиатрия. 2010; 125 (1): e174.
Натансон С., Квон Т., Эльмалех М., Чарбит М. и др. (2010) Острое неврологическое поражение при диарее-ассоциированном гемолитико-уремическом синдроме. Clin J Am Soc Nephrol 2010; 5: 1218-1228.
Clin J Am Soc Nephrol 2010; 5: 1218-1228.
Scheiring J, Andreoli SP, Zimmerhackl LB. Лечение и исходы гемлотического уремического синдрома (ГУС), ассоциированного с шига-токсином. Педиатр Нефрол. 2008; 23: 1749-1760.
Зиглер Р., Оукс Р. Гемолитико-уремический синдром: патогенез, лечение и исход. Curr Opin Pediatr.2005; 17: 200-204.
Tarr PI, Gordon CA, Chandler WL. Escherichia coli, продуцирующая шига-токсин, и гемолитико-уремический синдром. Ланцет. 2005; 19-25; 365 (9464): 1073-86.
Ван Дайк М., Проэсманс В. Ренопротекция ингибиторами АПФ после тяжелого гемолитико-уремического синдрома. Педиатр Нефрол. 2004; 19: 688-690.
Джанвити А., Тоцци А.Е., Де Петрис Л., Каприоли А. и др. (2003) Факторы риска плохого почечного прогноза у детей с гемолитико-уремическим синдромом. Педиатр Нефрол 2003; 18: 1229-1235.
Каплан Б.С., Мейерс К.В., Шульман С.Л .: Патогенез и лечение гемолитико-уремического синдрома. Журнал Американского общества нефрологов. 1998; 9: 1126-1133.
1998; 9: 1126-1133.
ИНТЕРНЕТ
Национальный институт неврологических заболеваний и Сток. Гемолитико-уремический синдром у детей. Обновлено в июне 2015 г. Доступно по адресу: http://kidney.niddk.nih.gov/kudiseases/pubs/childkidneydiseases/hemolytic_uremic_syndrome/ По состоянию на 21 марта 2016 г.
Mayo Clinic для медицинского образования и исследований.Гемолитико-уремический синдром (ГУС). Обновлено 3 июля 2013 г. Доступно по адресу: http://www.mayoclinic.com/health/hemolytic-uremic-syndrome/DS00876 Проверено 21 марта 2016 г.
Parmar MS. Гемолитико-уремический синдром. Medscape. Обновлено 5 февраля 2015 г. Доступно по адресу: http://emedicine.medscape.com/article/201181-overview Проверено 21 марта 2016 г.
Gillespie, RS. Детский гемолитико-уремический синдром. Medscape. 28 сентября 2015 г. Доступно по адресу: http://emedicine.medscape.com/article/982025-overview Проверено 21 марта 2016 г.
Гемолитико-уремический синдром — NYC Health
Гемолитико-уремический синдром — серьезное заболевание, поражающее почки и способность к свертыванию крови. В тяжелых случаях красные кровяные тельца разрушаются, что приводит к анемии и почечной недостаточности. Это редкое заболевание, которое чаще поражает детей, чем взрослых.
В тяжелых случаях красные кровяные тельца разрушаются, что приводит к анемии и почечной недостаточности. Это редкое заболевание, которое чаще поражает детей, чем взрослых.
В большинстве случаев гемолитико-уремический синдром вызывается инфекцией бактериями E. coli O157: H7, которые являются типом продуцирующего токсин шига E.coli . Однако у большинства людей, инфицированных E. coli , O157: H7, гемолитико-уремический синдром не развивается. Инфекции возникают после употребления в пищу зараженной пищи, такой как недоваренное мясо или молочные продукты, или при контакте с человеком, у которого есть инфекционная диарея.
Симптомы
Через 5-10 дней после контакта с E. coli O157: H7 у вас могут возникнуть симптомы. Это включает диарею, лихорадку, тошноту или рвоту. В некоторых случаях могут возникать раздражительность, утомляемость, сильная бледность и снижение выработки мочи. E. coli O157: H7 продуцируют токсин, который может вызвать повреждение почек и системы свертывания крови. Неврологические симптомы могут присутствовать при начале заболевания или развиваться во время болезни.
Неврологические симптомы могут присутствовать при начале заболевания или развиваться во время болезни.
Профилактика
Следуйте этим мерам, чтобы предотвратить гемолитико-уремический синдром.
- Свежее мясо заверните в полиэтиленовые пакеты, чтобы кровь не капала на другие продукты.
- Быстро охлаждайте продукты.
- Мойте разделочные доски и столешницы сразу после использования, чтобы предотвратить перекрестное заражение другими продуктами.
- Следите за тем, чтобы продукты достигли правильной внутренней температуры приготовления.
- Не ешьте сырое или недоваренное мясо.
- Избегайте сырых молочных продуктов, например сырого сыра
- Избегайте сырых соков, продаваемых в магазинах
- Вымойте руки теплой водой с мылом.
- Оставайтесь дома, когда заболеете.
Лечение
Диарея, вызванная E. coli O157: H7-инфекция обычно проходит в течение нескольких дней без специального лечения. Антибиотики не рекомендуются.Антибиотики могут увеличить выброс вредных токсинов и риск развития гемолитико-уремического синдрома. Важно предотвратить и лечить обезвоживание. Гемолитико-уремический синдром требует госпитализации для проведения диализа почек.
Антибиотики не рекомендуются.Антибиотики могут увеличить выброс вредных токсинов и риск развития гемолитико-уремического синдрома. Важно предотвратить и лечить обезвоживание. Гемолитико-уремический синдром требует госпитализации для проведения диализа почек.
Гемолитико-уремический синдром | Американское общество нефрологов
Эпидемиология и клинические особенности
Не-Stx-HUS встречается реже, чем Stx-HUS, и на его долю приходится всего от 5 до 10% всех случаев заболевания (1,88). Это может проявляться в любом возрасте, но чаще встречается у взрослых.Согласно недавнему исследованию в США, заболеваемость не-Stx-HUS у детей составляет примерно одну десятую от Stx-HUS (10), что соответствует примерно 2 случаям в год на 1000000 всего населения. В отличие от Stx-HUS, нет четкого возбудителя или сезонной закономерности. Возникновению могут предшествовать признаки нефротического синдрома. Продромальный период диареи наблюдается редко (D — HUS) (1,3,10,89). Не-Stx-HUS может возникать спорадически или в семьях.
Не-Stx-HUS может возникать спорадически или в семьях.
Спорадически Non – Stx-HUS.
Было выявлено множество триггеров для спорадических не-Stx-HUS, включая различные не кишечные инфекции, вирусы, лекарства, злокачественные новообразования, трансплантацию, беременность и другие основные заболевания (склеродермия, антифосфолипидный синдром, волчанка; таблица 2). Инфекция, вызванная Streptococcus pneumoniae , составляет 40% не-Stx-HUS и 4,7% всех причин HUS у детей в США (10). Нейроаминидаза, продуцируемая S. pneumoniae , путем удаления сиаловых кислот с клеточных мембран, подвергает антиген Томсена-Фриденрейха предварительно сформированным циркулирующим антителам IgM, которые связываются с этим неоантигеном на тромбоцитах и эндотелиальных клетках и вызывают агрегацию тромбоцитов и повреждение эндотелия (90,91 ).Клиническая картина обычно тяжелая, с респираторным дистрессом, неврологическими нарушениями и комой, а уровень смертности составляет 50% (91).
Категории препаратов, которые, как сообщалось, чаще всего вызывают не-Stx-HUS, включают противораковые молекулы (митомицин, цисплатин, блеомицин и гемцитабин), иммунотерапевтические (циклоспорин, такролимус, OKT3, IFN и хинидин) и антитромбоцитарные (тиклопидин и клопидогрель) (92). Риск развития ГУС после митомицина составляет от 2 до 10%.Начало заболевания отсрочено и наступает почти через 1 год после начала лечения. Прогноз плохой, до 75% летальности через 4 месяца (92).
Посттрансплантационный ГУС регистрируется все чаще (1,93). Это может произойти впервые у пациентов, которые никогда не испытывали заболевания ( de novo, посттрансплантационный HUS), или могут затронуть пациентов, у которых основной причиной ESRD был HUS (рецидивирующий посттрансплантационный HUS, обсуждается далее в этом обзоре). De novo посттрансплантационный ГУС может возникать у пациентов, которым проводят трансплантацию почек и других органов, как следствие использования ингибиторов кальциневрина или гуморального (C4b-положительного) отторжения. Это происходит у 5–15% пациентов с трансплантацией почки, получающих циклоспорин, и примерно у 1% пациентов, получающих такролимус (94).
Это происходит у 5–15% пациентов с трансплантацией почки, получающих циклоспорин, и примерно у 1% пациентов, получающих такролимус (94).
ГУС, связанный с беременностью, может иногда развиваться как осложнение преэклампсии. У некоторых пациентов развивается опасный для жизни вариант преэклампсии с тяжелой тромбоцитопенией, микроангиопатической гемолитической анемией, почечной недостаточностью и поражением печени (синдром HELLP). Эти формы всегда указывают на быстрое родоразрешение, за которым обычно следует полная ремиссия (95).Послеродовой ГУС в большинстве случаев проявляется в течение 3 месяцев после родов. Результат обычно плохой, летальность составляет от 50 до 60%; остаточная почечная дисфункция и артериальная гипертензия — правило у выживших пациентов (96). Следует отметить, что примерно в 50% случаев спорадического HUS, не связанного с Stx-HUS, не было обнаружено четких условий запуска (идиопатический HUS) (1).
Семейный Non-Stx-HUS.

На семейные формы приходится менее 3% всех случаев ГУС. Отмечаются как аутосомно-доминантные, так и аутосомно-рецессивные формы наследования (97).Аутосомно-рецессивный ГУС начинается обычно в раннем детстве. Прогноз плохой, летальность от 60 до 70%. Рецидивы очень часты. Аутосомно-доминантный ГУС в большинстве случаев возникает у взрослых; прогноз плохой, с кумулятивной частотой смерти или ТПН от 50 (98) до 90% (97).
Недавние исследования документально подтвердили, что семейный ГУС может быть вызван генетическими аномалиями белков, участвующих в регуляции системы комплемента. Сходные генетические аномалии были обнаружены при спорадических ГУС, не связанных с Stx-HUS, в основном при идиопатических формах (99 100), но также в редких случаях ассоциированного с беременностью (99) и послеродового ГУС (три пациента) (101 102), индуцированного тиклопидином ГУС (один пациент) (99) и постинфекционный ГУС ( Neisseria meningitidis, ; один пациент) (103).
Генетические исследования
Снижение сывороточных уровней третьего компонента (C3) комплемента было зарегистрировано с 1974 г. как при семейных, так и при спорадических формах не-Stx-HUS (98,104,105). Низкие уровни C3, скорее всего, отражают потребление C3 в микроциркуляторном русле, а не дефектный синтез, о чем свидетельствуют гранулярные отложения C3 в клубочках и артериолах пациентов с ГУС (106,107) и увеличение количества продуктов распада C3 в сыворотке. Напротив, уровни четвертой фракции комплемента, C4, обычно в норме (98).Стойкие и заметно сниженные уровни С3, обнаруженные у пациентов с семейным ГУС, даже у здоровых родственников (98), указывают на наследственный дефект, вызывающий гиперактивацию каскада комплемента.
Система комплемента состоит из нескольких белков, связанных с плазмой и мембранами, которые организованы по трем путям активации: классическому, лектиновому и альтернативному (108,109) (рис. 2). После активации молекулами на поверхности микроорганизмов эти пути приводят к образованию протеазных комплексов, C3-конвертаз, которые расщепляют C3, образуя C3b. Классические / лектиновые конвертазы образованы фрагментами C2 и C4, тогда как генерация конвертазы альтернативного пути требует расщепления C3, но не C4. Таким образом, низкие уровни C3 у пациентов с HUS при наличии нормального C4 указывают на избирательную активацию альтернативного пути (98).
Классические / лектиновые конвертазы образованы фрагментами C2 и C4, тогда как генерация конвертазы альтернативного пути требует расщепления C3, но не C4. Таким образом, низкие уровни C3 у пациентов с HUS при наличии нормального C4 указывают на избирательную активацию альтернативного пути (98).
Пути активации системы комплемента и их регуляторов (красным).
При образовании C3b откладывается на поверхности бактерий, что приводит к опсонизации для фагоцитоза PMN и макрофагами.C3b также участвует в образовании конвертаз C5, которые расщепляют C5 и инициируют сборку комплекса мембранной атаки, который вызывает лизис клеток. Система комплемента человека строго регулируется, чтобы предотвратить неспецифическое повреждение клеток-хозяев и ограничить отложение C3b на поверхности патогенов. Эта тонкая регуляция основана на ряде закрепленных за мембраной (CR1, DAF, MCP и CD59) и жидкофазных (фактор H) регуляторов, которые защищают ткани хозяина. Чужеродные поверхности, которые либо лишены мембраносвязанных регуляторов, либо не могут связывать растворимые регуляторы, подвергаются атаке комплемента.
В 1998 году Warwicker et al. (110) изучил три семьи с HUS и установил связь у пораженных людей с регулятором кластера генов активации комплемента на хромосоме 1q32 человека, который кодирует несколько регуляторных белков комплемента. Первым исследованным геном-кандидатом в этой области был фактор H (HF1), поскольку ранее сообщалось о связи между семейным HUS и аномалиями HF1 (103,111,112). HF1 представляет собой многофункциональный одноцепочечный гликопротеин плазмы массой 150 кДа, который играет важную роль в регуляции альтернативного пути комплемента (113).Он служит кофактором фактора I расщепляющего C3b фермента в деградации вновь образованных молекул C3b и контролирует распад, образование и стабильность C3b-конвертазы C3bBb. HF1 состоит из 20 гомологичных единиц, называемых короткими консенсусными повторами (SCR). Регуляторные домены комплемента, которые необходимы для предотвращения амплификации альтернативного пути в жидкой фазе, локализованы в N-терминальном SCR1-4 (114).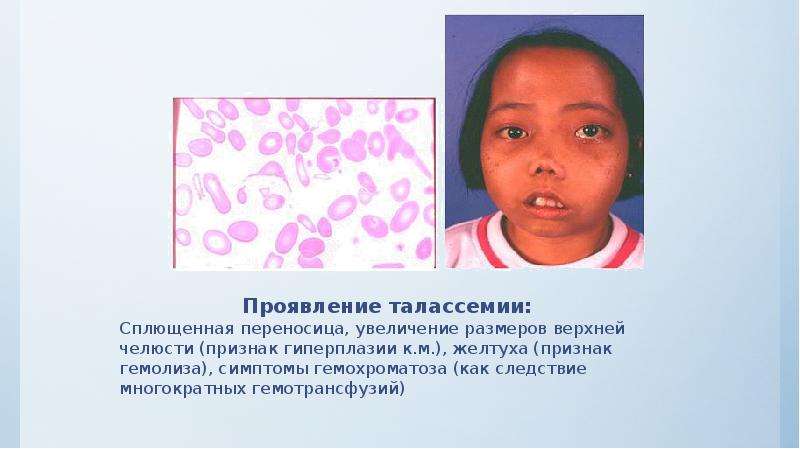 Инактивация связанного с поверхностью C3b зависит от связывания C-концевого домена HF1 с полианионными молекулами, что увеличивает сродство HF1 к C3b и обнажает его регуляторный N-концевой домен комплемента.С-концевые домены содержат два сайта связывания C3b, расположенные в SCR12-14 и SCR19-20, и три сайта связывания полианионов, расположенные в SCR 7, SCR 13 и SCR19-20 (Рисунок 3) (115-117). Однако C3b и сайты связывания полианионов, расположенные в SCR19-20, являются единственными необходимыми сайтами для HF1, чтобы инактивировать поверхностно связанный C3b, потому что удаление этой части молекулы вызывает потерю способности HF1 предотвращать активацию комплемента на эритроцитах барана ( 115,116). Эндотелиальные клетки клубочков человека и базальная мембрана клубочков почек богаты полианионными молекулами, поэтому HF1, отложенный на их поверхности, будет обеспечивать эффективный щит против атаки комплемента (рис. 4A) (117,118).
Инактивация связанного с поверхностью C3b зависит от связывания C-концевого домена HF1 с полианионными молекулами, что увеличивает сродство HF1 к C3b и обнажает его регуляторный N-концевой домен комплемента.С-концевые домены содержат два сайта связывания C3b, расположенные в SCR12-14 и SCR19-20, и три сайта связывания полианионов, расположенные в SCR 7, SCR 13 и SCR19-20 (Рисунок 3) (115-117). Однако C3b и сайты связывания полианионов, расположенные в SCR19-20, являются единственными необходимыми сайтами для HF1, чтобы инактивировать поверхностно связанный C3b, потому что удаление этой части молекулы вызывает потерю способности HF1 предотвращать активацию комплемента на эритроцитах барана ( 115,116). Эндотелиальные клетки клубочков человека и базальная мембрана клубочков почек богаты полианионными молекулами, поэтому HF1, отложенный на их поверхности, будет обеспечивать эффективный щит против атаки комплемента (рис. 4A) (117,118).
Мутации фактора H, связанные с гемолитико-уремическим синдромом (ГУС). На рисунке показана структура человеческого фактора H с 20 короткими консенсусными повторами. Указаны положения N-концевого регуляторного домена, ответственного за активность кофакторов, и сайты связывания для C3b и полианионов (гепарин). Большинство мутаций, обнаруженных у пациентов с HUS-кластерами на С-конце фактора H, важны для связывания с полианионами и поверхностно-связанным C3b, а также для контроля отложения C3b на клеточных мембранах и внеклеточном матриксе.
На рисунке показана структура человеческого фактора H с 20 короткими консенсусными повторами. Указаны положения N-концевого регуляторного домена, ответственного за активность кофакторов, и сайты связывания для C3b и полианионов (гепарин). Большинство мутаций, обнаруженных у пациентов с HUS-кластерами на С-конце фактора H, важны для связывания с полианионами и поверхностно-связанным C3b, а также для контроля отложения C3b на клеточных мембранах и внеклеточном матриксе.
Предлагаемая модель патологических последствий мутаций фактора H и хемоаттрактантного белка моноцитов (MCP). (A) После вирусной или бактериальной инфекции или инсульта эндотелия активируется комплемент и образуется C3b. В присутствии нормального фактора H (HF1) C3b быстро инактивируется до неактивного C3b (iC3b). Фактор H в кровообращении связывает C3b в жидкой фазе и способствует его разложению фактором I (FI; активность кофактора, желтый домен). Кроме того, он связывается (зеленый домен) с полианионными протеогликанами, которые присутствуют на поверхности эндотелиальных клеток и в субэндотелиальном матриксе, где из-за своего высокого сродства к C3b он захватывает C3b в жидкой фазе, тем самым предотвращая его отложение на поверхности хозяина и его связывание с фактором B (FB) с образованием комплекса конвертазы C3 (C3bBb).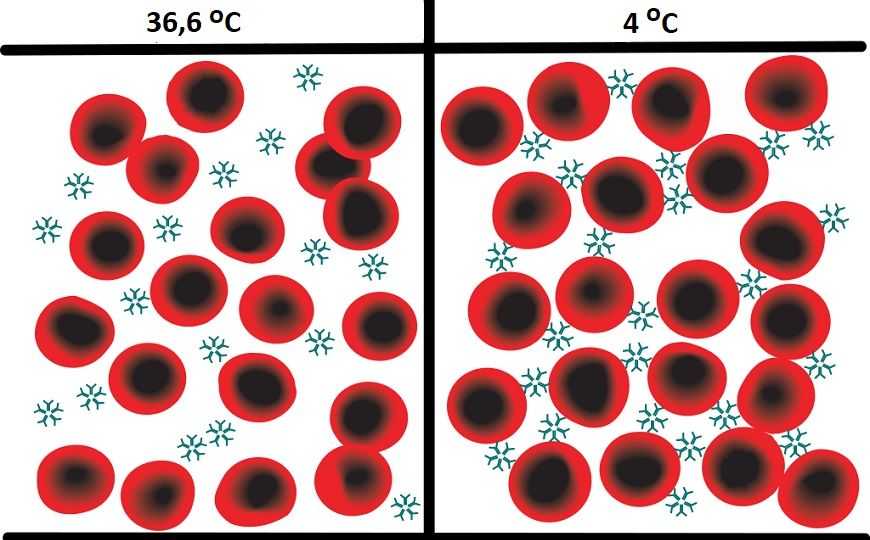 Субэндотелиальный матрикс лишен эндогенных регуляторов комплемента и полностью зависит от фактора H, контролирующего активацию комплемента. МСР также инактивирует C3b, депонированный на эндотелиальных клетках, способствуя его расщеплению до iC3b посредством FI. (B) Предполагаемые последствия мутаций фактора H, обнаруженных у пациентов с HUS. Мутантный фактор H имеет нормальную активность кофактора в жидкой фазе. Однако мутации влияют на сайт взаимодействия полианионов на С-конце фактора Н, так что он демонстрирует пониженное связывание с протеогликанами на поверхности эндотелиальных клеток и в субэндотелиальном матриксе.Это приводит к тому, что большее количество C3b достигает поверхности клеток эндотелия, так что MCP недостаточно для адекватного контроля активации комплемента на клеточной мембране. Кроме того, C3b, отложенный на обнаженном внеклеточном матриксе, не разрушается и образует конвертазу C3 альтернативного пути комплемента, который дополнительно расщепляет C3 до C3b. (C) Дефицит MCP также предрасполагает к HUS.
Субэндотелиальный матрикс лишен эндогенных регуляторов комплемента и полностью зависит от фактора H, контролирующего активацию комплемента. МСР также инактивирует C3b, депонированный на эндотелиальных клетках, способствуя его расщеплению до iC3b посредством FI. (B) Предполагаемые последствия мутаций фактора H, обнаруженных у пациентов с HUS. Мутантный фактор H имеет нормальную активность кофактора в жидкой фазе. Однако мутации влияют на сайт взаимодействия полианионов на С-конце фактора Н, так что он демонстрирует пониженное связывание с протеогликанами на поверхности эндотелиальных клеток и в субэндотелиальном матриксе.Это приводит к тому, что большее количество C3b достигает поверхности клеток эндотелия, так что MCP недостаточно для адекватного контроля активации комплемента на клеточной мембране. Кроме того, C3b, отложенный на обнаженном внеклеточном матриксе, не разрушается и образует конвертазу C3 альтернативного пути комплемента, который дополнительно расщепляет C3 до C3b. (C) Дефицит MCP также предрасполагает к HUS. Мутации MCP, обнаруженные у пациентов с HUS, приводят к снижению поверхностной экспрессии белка или к снижению способности MCP связывать C3b.В обоих случаях связанный с мембраной C3b не инактивируется эффективно, что приводит к нежелательной амплификации образования C3b и отложению на поврежденных эндотелиальных клетках за счет образования C3-конвертазы. (D) Последовательность событий, ведущих к тромбозу микрососудов. Протеолиз C3 и C5 конвертазами вызывает высвобождение хемотаксических анафилатоксинов C3a и C5a, которые связываются с рецепторами воспалительных клеток и привлекают их к эндотелиальному слою. Отложение C3b на эндотелиальных клетках сопровождается образованием комплекса мембранной атаки (C5b9), который приводит к повреждению и отслоению клеток и к сублитическому возмущению мембраны, что приводит к активации эндотелия и экспрессии молекул адгезии ( e.грамм. , Р-селектин). Последние способствуют прикреплению и активации лейкоцитов с высвобождением кислородных радикалов и протеиназ, которые дополнительно повреждают эндотелий.
Мутации MCP, обнаруженные у пациентов с HUS, приводят к снижению поверхностной экспрессии белка или к снижению способности MCP связывать C3b.В обоих случаях связанный с мембраной C3b не инактивируется эффективно, что приводит к нежелательной амплификации образования C3b и отложению на поврежденных эндотелиальных клетках за счет образования C3-конвертазы. (D) Последовательность событий, ведущих к тромбозу микрососудов. Протеолиз C3 и C5 конвертазами вызывает высвобождение хемотаксических анафилатоксинов C3a и C5a, которые связываются с рецепторами воспалительных клеток и привлекают их к эндотелиальному слою. Отложение C3b на эндотелиальных клетках сопровождается образованием комплекса мембранной атаки (C5b9), который приводит к повреждению и отслоению клеток и к сублитическому возмущению мембраны, что приводит к активации эндотелия и экспрессии молекул адгезии ( e.грамм. , Р-селектин). Последние способствуют прикреплению и активации лейкоцитов с высвобождением кислородных радикалов и протеиназ, которые дополнительно повреждают эндотелий. После повреждения эндотелия происходит отслоение клеток, обнажающее базальные мембраны. В этих условиях тромбоциты из микроциркуляции прилипают и агрегируют на обнаженном матриксе.
После повреждения эндотелия происходит отслоение клеток, обнажающее базальные мембраны. В этих условиях тромбоциты из микроциркуляции прилипают и агрегируют на обнаженном матриксе.
Со времени первого отчета Warwicker, ряд исследований был проведен четырьмя независимыми группами, которые на данный момент выявили до 50 различных мутаций HF1 (Рисунок 3) у 80 пациентов, у которых были семейные (36 пациентов) и спорадические (44 пациенты) формы не-Stx-HUS (99–102,114,119–121).В спорадических формах мутация была либо унаследована от здорового родителя, либо, что реже — сообщалось только о четырех случаях — возникла у пробанда de novo (100, 102). Частота мутаций составляет до 40% в семейных формах, тогда как только от 13 до 17% спорадических форм имеют мутации HF1 (100, 119). Изменения в других генах, кодирующих регуляторные белки комплемента, теоретически могут быть вовлечены в определение предрасположенности к спорадическим не-Stx-HUS. С другой стороны, эти формы могут быть вызваны приобретенным аутоиммунным дефектом HF1, подобным тому, что наблюдается у некоторых пациентов с тромботической тромбоцитопенической пурпурой, у которых острый эпизод запускается антителами против металлопротеиназы ADAMTS-13, расщепляющей фактор фон Виллебранда (122). Эта возможность подтверждается недавно опубликованной статьей (123), в которой задокументировано присутствие антител к фактору H в плазме трех детей с рецидивирующим ГУС.
Эта возможность подтверждается недавно опубликованной статьей (123), в которой задокументировано присутствие антител к фактору H в плазме трех детей с рецидивирующим ГУС.
Подавляющее большинство (48 из 50) мутаций HF1 у пациентов с HUS являются гетерозиготными и вызывают либо изменения одной аминокислоты, либо преждевременное прерывание трансляции, в основном кластеризацию в C-концевых доменах и обычно связаны с нормальным уровнем HF1 в плазме. Это не согласуется с пациентами с мембранопролиферативным гломерулонефритом типа II, которые несут гомозиготные мутации HF1, которые вызывают серьезное снижение уровней HF1 (101).Экспрессионные и функциональные исследования показали, что белки HF1, несущие HUS-ассоциированные мутации, имеют сильно сниженную способность взаимодействовать с полианионами и с поверхностно связанным C3b (117,118,124), что приводит к более низкой плотности мутантных молекул HF1, связанных с поверхностью эндотелиальных клеток, и снижение регуляторной активности комплемента на клеточной мембране (117,118). Напротив, эти мутанты обладают нормальной способностью контролировать активацию комплемента в плазме, на что указывают данные о том, что они сохраняют нормальную активность кофактора в протеолизе жидкофазного C3b (124).Последнее открытие объясняет случай пациентов с мутациями HUS и HF1 и нормальным уровнем комплемента в сыворотке (100, 101). Sánchez-Corral et al. (125) предположил, что связанные с HF1 регуляторные дефекты комплемента могут быть обнаружены в сыворотке пациентов с помощью гемолитического анализа ex vivo , в котором сыворотка пациентов с мутациями HF1 вызвала более тяжелый лизис эритроцитов барана, чем сыворотка пациентов без мутаций. . Если это подтвердится, это может стать полезным инструментом для отбора пациентов с ГУС, заслуживающих изучения HF1 и других регуляторных белков комплемента.
Напротив, эти мутанты обладают нормальной способностью контролировать активацию комплемента в плазме, на что указывают данные о том, что они сохраняют нормальную активность кофактора в протеолизе жидкофазного C3b (124).Последнее открытие объясняет случай пациентов с мутациями HUS и HF1 и нормальным уровнем комплемента в сыворотке (100, 101). Sánchez-Corral et al. (125) предположил, что связанные с HF1 регуляторные дефекты комплемента могут быть обнаружены в сыворотке пациентов с помощью гемолитического анализа ex vivo , в котором сыворотка пациентов с мутациями HF1 вызвала более тяжелый лизис эритроцитов барана, чем сыворотка пациентов без мутаций. . Если это подтвердится, это может стать полезным инструментом для отбора пациентов с ГУС, заслуживающих изучения HF1 и других регуляторных белков комплемента.
Пациенты, несущие мутации HF1, имеют частичный дефицит HF1 в результате одного интактного и одного дефектного аллеля, который, скорее, предрасполагает, а не напрямую вызывает заболевание. Наблюдение за тем, что у этих пациентов иногда бывают длительные ремиссии от ГУС или не наступают до позднего возраста, подтверждает эту гипотезу (125). Кроме того, состояния, которые вызывают активацию комплемента либо напрямую (бактериальные и вирусные инфекции), либо косвенно, вызывая эндотелиальный инсульт (лекарственные препараты, системные заболевания или беременность), ускоряют острое событие примерно у 60% пациентов с мутациями HF1 (99,119) .Все вышеперечисленные наблюдения могут быть согласованы, если предположить, что у этих пациентов субоптимальной активности HF1 достаточно для защиты хозяина от активации комплемента в физиологических условиях. Однако при воздействии агента, активирующего комплемент, C3b образуется в количествах, превышающих норму, и его отложение на эндотелиальных клетках сосудов невозможно полностью предотвратить в результате потери способности мутированного HF1 связывать полианионы (рис. 4B). Это приводит к формированию комплекса мембранной атаки и привлечению воспалительных клеток, всем событиям, которые вызывают повреждение и ретракцию эндотелиальных клеток, адгезии и агрегации тромбоцитов, увеличению местного тканевого фактора со связыванием и активацией фактора VII, а также образованию тромбина и полимеров фибрина (рис.
Наблюдение за тем, что у этих пациентов иногда бывают длительные ремиссии от ГУС или не наступают до позднего возраста, подтверждает эту гипотезу (125). Кроме того, состояния, которые вызывают активацию комплемента либо напрямую (бактериальные и вирусные инфекции), либо косвенно, вызывая эндотелиальный инсульт (лекарственные препараты, системные заболевания или беременность), ускоряют острое событие примерно у 60% пациентов с мутациями HF1 (99,119) .Все вышеперечисленные наблюдения могут быть согласованы, если предположить, что у этих пациентов субоптимальной активности HF1 достаточно для защиты хозяина от активации комплемента в физиологических условиях. Однако при воздействии агента, активирующего комплемент, C3b образуется в количествах, превышающих норму, и его отложение на эндотелиальных клетках сосудов невозможно полностью предотвратить в результате потери способности мутированного HF1 связывать полианионы (рис. 4B). Это приводит к формированию комплекса мембранной атаки и привлечению воспалительных клеток, всем событиям, которые вызывают повреждение и ретракцию эндотелиальных клеток, адгезии и агрегации тромбоцитов, увеличению местного тканевого фактора со связыванием и активацией фактора VII, а также образованию тромбина и полимеров фибрина (рис. 4D).Такой сценарий особенно применим к ложе клубочковых капилляров, которое представляет собой фенестрированный эндотелий, а обнаженная базальная мембрана обеспечивает поверхность, богатую полианионами для связывания HF1, что может объяснять почечную локализацию микрососудистого повреждения HUS.
4D).Такой сценарий особенно применим к ложе клубочковых капилляров, которое представляет собой фенестрированный эндотелий, а обнаженная базальная мембрана обеспечивает поверхность, богатую полианионами для связывания HF1, что может объяснять почечную локализацию микрососудистого повреждения HUS.
Две трети пациентов с не-Stx-HUS не имеют мутаций HF1, несмотря на то, что до 50% из них демонстрируют признаки повышенной активности альтернативного пути комплемента (99). Недавно появилась возможность того, что необычные полиморфные варианты гена HF1 могут вызывать предрасположенность к HUS у пациентов без мутаций HF1.Действительно, аллель T C-257T, аллель G A2089G и аллель T полиморфизма G2881T были более частыми у пациентов с HUS без мутаций HF1, чем у здоровых людей (99), и анализ Общая популяция исследования показала, что у лиц, несущих два или три из вышеперечисленных вариантов, риск развития ГУС увеличивался в четыре раза (99). Аллели -257T, 2089G и 2881T также могут играть роль в определении пенетрантности (которая составляет примерно 50%) (99) заболевания у носителей мутации HF1. В пяти из девяти семей люди, у которых развился HUS, унаследовали аллель, несущий мутацию HF1 от одного родителя, вместе с аллелем, несущим по крайней мере один ассоциированный с заболеванием полиморфизм HF1 от другого родителя. Вместо этого все здоровые носители мутации HF1 унаследовали только мутацию, но не полиморфизм (99).
В пяти из девяти семей люди, у которых развился HUS, унаследовали аллель, несущий мутацию HF1 от одного родителя, вместе с аллелем, несущим по крайней мере один ассоциированный с заболеванием полиморфизм HF1 от другого родителя. Вместо этого все здоровые носители мутации HF1 унаследовали только мутацию, но не полиморфизм (99).
Аномалии двух дополнительных генов, кодирующих белки, модулирующие комплемент, также недавно были вовлечены в предрасположенность к не-Stx-HUS.Два отчета независимых групп, опубликованные с разницей в несколько дней, описывают мутации в гене MCP, кодирующем мембранный кофакторный белок, клеточно-связанный регулятор комплемента, у пораженных людей из четырех семей (127, 128). МСР представляет собой широко экспрессируемый трансмембранный гликопротеин, который служит кофактором фактора I для расщепления C3b и C4b, отложенных на поверхности клетки-хозяина (129–131). MCP имеет четыре внеклеточных модуля контрольных белков комплемента (CCP), которые важны для его ингибирующей активности, за которыми следуют домен, богатый серин-треонином-пролином, трансмембранный домен и цитоплазматический хвост (132). Richards et al. (128) сообщил о гетерозиготной делеции аминокислот D237 / S238 в одном семействе и замене S206P в двух семействах. Оценки экспрессии и функции белка на PBMC показали, что мутанты обладают пониженной способностью связывания C3b и пониженной способностью предотвращать активацию комплемента. Другая гетерозиготная мутация, вызывающая две замены аминокислот и преждевременное прерывание белка MCP в CCP4, была идентифицирована (127) у двух братьев и сестер, что вызвало снижение уровней экспрессии MCP на PBMC гетерозиготных индивидуумов на 50%.Дополнительные исследования нашей группы на 112 пациентах с не-Stx-HUS выявили пять дополнительных мутаций MCP в семейном (семь случаев) и спорадическом (пять случаев) HUS с частотой мутаций 11% (25% в семейном и 6% в семейном). спорадические формы) (133).
Richards et al. (128) сообщил о гетерозиготной делеции аминокислот D237 / S238 в одном семействе и замене S206P в двух семействах. Оценки экспрессии и функции белка на PBMC показали, что мутанты обладают пониженной способностью связывания C3b и пониженной способностью предотвращать активацию комплемента. Другая гетерозиготная мутация, вызывающая две замены аминокислот и преждевременное прерывание белка MCP в CCP4, была идентифицирована (127) у двух братьев и сестер, что вызвало снижение уровней экспрессии MCP на PBMC гетерозиготных индивидуумов на 50%.Дополнительные исследования нашей группы на 112 пациентах с не-Stx-HUS выявили пять дополнительных мутаций MCP в семейном (семь случаев) и спорадическом (пять случаев) HUS с частотой мутаций 11% (25% в семейном и 6% в семейном). спорадические формы) (133).
MCP высоко экспрессируется в почках и может быть обнаружен на эндотелиальных клетках клубочков с помощью иммуногистохимического анализа (134–136). Вероятно, он играет основную роль в защите эндотелиальных клеток клубочков от активации C3, на что указывают данные о том, что активность кофакторов в экстрактах этих клеток полностью блокируется антителами против MCP (136).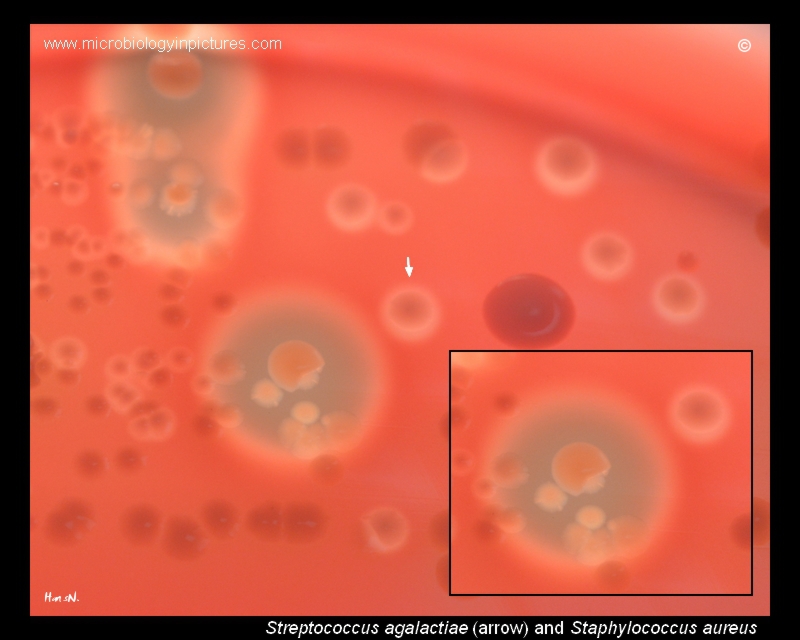 Фактор H и MCP, вероятно, интегрируют друг друга, контролируя активацию комплемента в клетках-хозяевах. Присоединенный к полианиону HF1 отходит от клеточной мембраны примерно на 120 нм и может представлять собой внешний барьер клеток против атаки комплемента. Однако, поскольку МСР представляет собой интегрированный в мембрану регулятор комплемента небольшого размера, который простирается примерно на 20 нм, можно предположить, что белок МСР участвует в контроле комплемента в непосредственной близости от клеточной мембраны (117). Как и предполагалось для HF1, мутации в MCP скорее предрасполагают, чем напрямую вызывают ГУС.При воздействии условий, вызывающих активацию каскада комплемента, снижение уровней или нарушение способности связывания C3b и кофакторная активность мутировавших МСР на эндотелиальных клетках клубочков может привести к недостаточной защите этих клеток от активации комплемента (рис. 4С). Мутации фактора H или MCP приводят к активации комплемента, а HUS указывает на то, что эти регуляторы комплемента не имеют перекрывающихся функций и что они оба необходимы для адекватного контроля над комплементом.
Фактор H и MCP, вероятно, интегрируют друг друга, контролируя активацию комплемента в клетках-хозяевах. Присоединенный к полианиону HF1 отходит от клеточной мембраны примерно на 120 нм и может представлять собой внешний барьер клеток против атаки комплемента. Однако, поскольку МСР представляет собой интегрированный в мембрану регулятор комплемента небольшого размера, который простирается примерно на 20 нм, можно предположить, что белок МСР участвует в контроле комплемента в непосредственной близости от клеточной мембраны (117). Как и предполагалось для HF1, мутации в MCP скорее предрасполагают, чем напрямую вызывают ГУС.При воздействии условий, вызывающих активацию каскада комплемента, снижение уровней или нарушение способности связывания C3b и кофакторная активность мутировавших МСР на эндотелиальных клетках клубочков может привести к недостаточной защите этих клеток от активации комплемента (рис. 4С). Мутации фактора H или MCP приводят к активации комплемента, а HUS указывает на то, что эти регуляторы комплемента не имеют перекрывающихся функций и что они оба необходимы для адекватного контроля над комплементом.
Наконец, три мутации в гене, кодирующем фактор I, были зарегистрированы у трех пациентов со спорадическим не-Stx-HUS (137), что дополнительно подтверждает концепцию, что HUS является заболеванием дисрегуляции комплемента. Другие гены-кандидаты находятся в стадии исследования, включая DAF, CR1, CD59, C3 и фактор B.
Пациенты с не-Stx-HUS должны быть сначала проверены на концентрацию C3 в сыворотке; однако нормальный уровень C3 не обязательно исключает дисфункцию комплемента.Более чувствительными анализами могут быть более высокое, чем обычно, соотношение C3d / C3 в плазме (неопубликованные данные) или наличие отложений C3 при биопсии почек (106,107). Измерение HF1 в сыворотке было бы полезно для выявления тех немногих пациентов, у которых есть мутации HF1, вызывающие снижение уровня HF1. Снижение значений CH50 и концентрации фактора B может быть обнаружено у некоторых, но не у всех пациентов с мутациями HF1 или MCP. Вторым шагом должен быть поиск мутаций в генах-кандидатах HF1 и MCP. Поиск мутаций фактора I следует проводить у пациентов с более низким, чем обычно, уровнем фактора I.
Поиск мутаций фактора I следует проводить у пациентов с более низким, чем обычно, уровнем фактора I.
Какое лечение не-Stx-HUS?
Несмотря на то, что не-Stx-HUS имеет плохой прогноз, после введения манипуляций с плазмой уровень смертности снизился с 50 до 25% (138–140). Однако до сих пор ведутся споры о том, эффективна ли плазма для лечения острых эпизодов (141–144). Опубликованные наблюдения (139, 145–147) и наш собственный опыт показывают, что постоянное количество пациентов с не-Stx-HUS отвечает на лечение плазмой. Было высказано предположение, что плазмаферез может быть относительно более эффективным, чем инфузия плазмы, поскольку он может удалить потенциально токсичные вещества из кровотока пациента.То, что это может быть не так, документально подтверждается данными о том, что у пациента с рецидивирующей тромботической микроангиопатией (148) нормализация количества тромбоцитов неизменно достигалась с помощью плазмафереза или инфузии, тогда как удаление плазмы и замена альбумином и физиологическим раствором никогда не повышали количество тромбоцитов считать. Однако в таких ситуациях, как почечная недостаточность или сердечная недостаточность, которые ограничивают количество плазмы, которое может быть получено только при инфузии, плазмаферез следует рассматривать как терапию первого выбора (1).Плазменную терапию следует начинать в течение 24 часов с момента обращения, поскольку задержка в начале лечения может привести к неэффективности лечения. Обычно за сеанс заменяют один объем плазмы (40 мл / кг) (1149). Лечение можно усилить, увеличив объем замещаемой плазмы. Обмен одного объема плазмы два раза в день, вероятно, является методом выбора для рефрактерных пациентов, чтобы свести к минимуму рециркуляцию инфузированной плазмы (1). Что касается инфузии плазмы, рекомендуемая доза составляет от 30 до 40 мл / кг в день 1, затем от 10 до 20 мл / кг в день.Ежедневная плазменная терапия должна продолжаться как минимум 2 дня после достижения полной ремиссии (1,149).
Однако в таких ситуациях, как почечная недостаточность или сердечная недостаточность, которые ограничивают количество плазмы, которое может быть получено только при инфузии, плазмаферез следует рассматривать как терапию первого выбора (1).Плазменную терапию следует начинать в течение 24 часов с момента обращения, поскольку задержка в начале лечения может привести к неэффективности лечения. Обычно за сеанс заменяют один объем плазмы (40 мл / кг) (1149). Лечение можно усилить, увеличив объем замещаемой плазмы. Обмен одного объема плазмы два раза в день, вероятно, является методом выбора для рефрактерных пациентов, чтобы свести к минимуму рециркуляцию инфузированной плазмы (1). Что касается инфузии плазмы, рекомендуемая доза составляет от 30 до 40 мл / кг в день 1, затем от 10 до 20 мл / кг в день.Ежедневная плазменная терапия должна продолжаться как минимум 2 дня после достижения полной ремиссии (1,149).
Инфузия или замена плазмы использовалась у пациентов с мутациями HUS и HF1 с целью обеспечения пациентов с нормальным HF1 для коррекции генетического дефицита. Некоторые пациенты вообще не ответили на лечение и умерли или у них развилась ТПН (107). Другие оставались хронически больными (121 150) или нуждались в инфузии плазмы с недельными интервалами, чтобы поднять уровень HF1 в плазме до уровня, достаточного для поддержания ремиссии (151).Stratton et al. (152) смогли вызвать стойкую ремиссию у пациента с мутацией HF1, у которого развился острый эпизод ГУС и потребовался гемодиализ. Через 3 месяца еженедельного плазмафереза в сочетании с внутривенными иммуноглобулинами у пациента восстановилась функция почек, диализ был отменен, и плазмотерапия была прекращена. Через 1 год после прекращения плазмотерапии у пациента не наблюдалось заболевания и он не зависел от диализа. Плазменная терапия противопоказана пациентам с ГУС, вызванным S.pneumoniae , потому что плазма взрослых содержит антитела против антигена Томсена-Фриденрейха, которые могут обострить заболевание.
Некоторые пациенты вообще не ответили на лечение и умерли или у них развилась ТПН (107). Другие оставались хронически больными (121 150) или нуждались в инфузии плазмы с недельными интервалами, чтобы поднять уровень HF1 в плазме до уровня, достаточного для поддержания ремиссии (151).Stratton et al. (152) смогли вызвать стойкую ремиссию у пациента с мутацией HF1, у которого развился острый эпизод ГУС и потребовался гемодиализ. Через 3 месяца еженедельного плазмафереза в сочетании с внутривенными иммуноглобулинами у пациента восстановилась функция почек, диализ был отменен, и плазмотерапия была прекращена. Через 1 год после прекращения плазмотерапии у пациента не наблюдалось заболевания и он не зависел от диализа. Плазменная терапия противопоказана пациентам с ГУС, вызванным S.pneumoniae , потому что плазма взрослых содержит антитела против антигена Томсена-Фриденрейха, которые могут обострить заболевание.
У тех немногих пациентов с обширным микрососудистым тромбозом при биопсии почек, рефрактерной гипертензией и признаками гипертонической энцефалопатии, когда обычных методов лечения, включая манипуляции с плазмой, недостаточно для контроля заболевания (, т. е. , стойкая тяжелая тромбоцитопения и гемолитическая анемия), двусторонняя нефрэктомия был выполнен с отличным последующим наблюдением у некоторых пациентов (153).Другие методы лечения, включая антитромбоцитарные препараты, простациклин, гепарин или фибринолитические средства, стероиды и внутривенные иммуноглобулины, не дали устойчивой пользы (1).
е. , стойкая тяжелая тромбоцитопения и гемолитическая анемия), двусторонняя нефрэктомия был выполнен с отличным последующим наблюдением у некоторых пациентов (153).Другие методы лечения, включая антитромбоцитарные препараты, простациклин, гепарин или фибринолитические средства, стероиды и внутривенные иммуноглобулины, не дали устойчивой пользы (1).
Пациенты, у которых развивается ГУС после провокации циклоспорином или такролимусом, должны прекратить прием лекарства. Сиролимус использовался в качестве альтернативы у отдельных пациентов с обнадеживающими результатами (154).
Среди пациентов без Stx-HUS от 50% (при спорадических формах) до 60% (при семейных формах) прогрессируют до ТПН (1,99).Трансплантация почки не обязательно является вариантом лечения без Stx-HUS, в отличие от Stx-HUS. Фактически, примерно у 50% пациентов, которым была проведена трансплантация почки, был рецидив заболевания в трансплантированном органе (86,155). Рецидивы возникают в среднем через 30 дней после трансплантации (диапазон от 0 дней до 16 лет). Эффективного лечения рецидивов нет. Несостоятельность трансплантата встречается у> 90% пациентов, у которых наблюдается рецидив, несмотря на инфузию плазмы или плазмаферез, высокие дозы преднизона и отмену циклоспорина (1,86).Пациенты, потерявшие первый трансплантат почки из-за рецидива, не должны получать повторную трансплантацию. Также следует избегать трансплантации почки, связанной с живым заболеванием, поскольку она несет дополнительный риск ускорения начала заболевания у здорового родственника-донора, о чем недавно сообщалось в двух семьях (156). Новые знания, полученные в результате генетических исследований, позволят более точно предсказать риск рецидива. У пациентов с мутациями HF1 частота рецидивов колеблется от 30 до 100%, согласно различным исследованиям (99–101), и значительно выше, чем у пациентов без мутаций HF1 (99).Ввиду того факта, что HF1 является белком плазмы в основном печеночного происхождения, трансплантат почки не корректирует генетический дефект HF1 (110, 119).
Эффективного лечения рецидивов нет. Несостоятельность трансплантата встречается у> 90% пациентов, у которых наблюдается рецидив, несмотря на инфузию плазмы или плазмаферез, высокие дозы преднизона и отмену циклоспорина (1,86).Пациенты, потерявшие первый трансплантат почки из-за рецидива, не должны получать повторную трансплантацию. Также следует избегать трансплантации почки, связанной с живым заболеванием, поскольку она несет дополнительный риск ускорения начала заболевания у здорового родственника-донора, о чем недавно сообщалось в двух семьях (156). Новые знания, полученные в результате генетических исследований, позволят более точно предсказать риск рецидива. У пациентов с мутациями HF1 частота рецидивов колеблется от 30 до 100%, согласно различным исследованиям (99–101), и значительно выше, чем у пациентов без мутаций HF1 (99).Ввиду того факта, что HF1 является белком плазмы в основном печеночного происхождения, трансплантат почки не корректирует генетический дефект HF1 (110, 119).
Одновременная трансплантация почек и печени была выполнена двум маленьким детям с мутациями, не относящимися к Stx-HUS и HF1, с целью исправления генетического дефекта и предотвращения рецидивов заболевания (157, 158). Однако по причинам, которые в настоящее время изучаются и которые, возможно, связаны с повышенной восприимчивостью печени к иммунным или ишемическим повреждениям, связанным с неконтролируемой активацией комплемента, оба случая, которые лечились с помощью этой процедуры, были осложнены преждевременной необратимой печеночной недостаточностью.В первом опубликованном случае (157) гуморальное отторжение трансплантата печени проявилось к 26-му дню после трансплантации; у пациента действительно был высокий титр антител к донорскому HLA I класса. Через несколько дней у ребенка развилась печеночная энцефалопатия и кома, которые вылечились после второй трансплантации печени без осложнений (157). Второй случай осложнился смертельным исходом из-за первичного нарушения функции трансплантата печени. Гипоперфузия трансплантата в результате внезапного падения артериального АД, происходящего вскоре после реперфузии, вызвала серьезное повреждение ишемии / реперфузии и отложение комплемента в печени, вероятно, в результате недостаточного регуляторного потенциала комплемента HF1.Последним событием, приведшим к смерти пациента, была полиорганная недостаточность (158). Таким образом, несмотря на его способность исправлять генетический дефект, комбинированная трансплантация почек и печени для не-Stx-HUS, связанного с мутациями HF1, не должна выполняться, если у пациента нет неминуемого риска угрожающих жизни осложнений.
Исход почечного трансплантата благоприятен у пациентов с мутациями MCP, что было обнаружено у четырех пациентов, которые успешно перенесли трансплантацию и не испытали рецидива заболевания (128; неопубликованные данные).Принимая во внимание тот факт, что MCP представляет собой мембранно-связанный белок, который высоко экспрессируется в почках, трансплантат почки мог бы разумно исправить местную дисфункцию MCP. Трансплантат, несущий МСР дикого типа, экспрессируемый на поверхности почечных эндотелиальных клеток, вероятно, должен быть защищен от рецидива заболевания.
Взаимосвязь между продуцированием гемолиза и устойчивостью к фторхинолонам среди клинических изолятов Escherichia coli | Журнал антимикробной химиотерапии
Аннотация
Активность ампициллина, амоксициллин-клавулановой кислоты, гентамицина, тетрациклина, налидиксовой кислоты, ципрофлоксацин, пефлоксацин и тровафлоксацин против 207 последовательных клинических изолятов Escherichia coli .Пятьдесят шесть (27,3%) изолятов были гемолитическими. В процент устойчивости к хинолонам и тетрациклину, но не к другим агентам, среди гемолитические изоляты были значительно ниже ( P <0,05), чем среди негемолитических изолятов. изолирует. Устойчивые к ципрофлоксацину мутанты, полученные из чувствительных к ципрофлоксацину гемолитиков. изоляты по-прежнему вызывают гемолиз. Сделан вывод, что большинство клинических изолятов, устойчивых к хинолонам, из E. coli негемолитические, хотя гемолиз вызывается хинолон-резистентными мутанты, полученные из штаммов, чувствительных к гемолитическим хинолонам.
Введение
Устойчивость к фторхинолонам в Escherichia coli — растущая проблема в Испании и другие страны. 1 Известно несколько механизмов, определяющих это устойчивость в E. coli, , включая мутации в генах топоизомеразы (II и IV), и снижение накопления из-за изменений внешней мембраны и / или проявления оттока насосы. 2
E.coli может продуцировать несколько типов гемолизина, включая внеклеточный белок (α-гемолизин), связанный с клеткой белок (β-гемолизин) и гемолизин, экспрессируемый мутанты, устойчивые к налидиксовой кислоте (γ-гемолизин). 3 , 4 γ-гемолизин не может гемолизировать эритроциты человека или кролика, в отличие от α- и β-гемолизинов. 4 α-Гемолизин, как известно, является продуктом оперона hlyCABD . 5 Белок внешней мембраны TolC также необходим для экспорт гемолизина во внеклеточную среду. 6 α-Гемолизин является фактором вирулентности у штаммов, вызывающих различные внекишечные инфекции. Белок может вызывать осмотический лизис эритроцитов, потому что его порообразующей активности, и он цитотоксичен для некоторых типов клеток человека. 3
При определении чувствительности к противомикробным препаратам в нашей клинической лаборатории мы часто наблюдали что штаммы E. coli , устойчивые к хинолонам, не являются гемолитическими. Это исследование было предпринята для оценки этого наблюдения и определения того, являются ли устойчивые к хинолонам мутанты чувствительный к гемолитическим хинолонам E.coli все еще может продуцировать гемолизин.
Материалы и методы
Штаммы бактерий
Двести семь последовательных клинических изолятов E. coli , полученных из разных пациенты, направленные в клиническую лабораторию Университетской клиники Вирхен Макарена, Севилья, Испания в сентябре и октябре 1996 г. подвергалась оценке. Организмы культивировали из мочи. (86%), перитонеальная жидкость (5%), посев крови (4%), экссудат раны (4%) и другие участки (1%).Идентификация проводилась с помощью системы WalkAway (MicroScan, Dade, Sacramento, CA, США), с панельными типами Urine-Combo 6I (изоляты мочи) и Neg-Combo 6I (микроорганизмы из другие образцы) согласно инструкции производителя. Организмы поддерживались в триптическом соевом бульоне, содержащем 10% глицерина, при -30 ° C до использования для дальнейших исследований.
Тест на чувствительность
Предварительные испытания на чувствительность проводились с теми же панелями, что и для бактериальных идентификация.Окончательное испытание на чувствительность проводилось путем микроразведения в соответствии с Рекомендации NCCLS. 7 Были изучены следующие противомикробные препараты: ампициллин (Sigma, Мадрид, Испания), амоксициллин (Sigma) плюс клавулановая кислота (SmithKline Бичем, Мадрид, Испания) в фиксированной концентрации 2 мг / л, гентамицин (Sigma), тетрациклин. (Sigma), налидиксовая кислота (Sigma), ципрофлоксацин (Sigma), пефлоксацин (Rhône-Poulenc, Antony, Франция) и тровафлоксацин (Pfizer, Groton, CT, США).Тест-полоски (AB Biodisk, Solna, Швеция) также использовались для определения МИК тетрациклина для 22 изолятов (в том числе девяти изолятов). гемолитические изоляты) из-за несоответствий между WalkAway и эталонным методы микроразбавления. Значения, определенные эталонным микроразбавлением, считались окончательный, поскольку они согласились с определенными с помощью полосок Etest.
Организмы считались устойчивыми к противомикробным препаратам, оцененным при оценке соответствующие МПК (мг / л) были ≥16 (ампициллин), ≥16 / 2 (амоксициллин-клавулановый кислота), ≥ 8 (гентамицин, тетрациклин, пефлоксацин), ≥32 (налидиксовая кислота) и ≥2 (ципрофлоксацин и тровафлоксацин).Эти контрольные точки позволили сравнить восприимчивые и невосприимчивые (промежуточные или устойчивые) изоляты в соответствии с рекомендациями NCCLS. 7 Тровафлоксацин не включен в документ NCCLS, поэтому использованная точка останова была такой же, как определенная для ципрофлоксацина. Для амоксициллин-клавулановой кислоты, точка останова, определенная NCCLS, составляет ≥16 / 8, но мы использовали клавуланат в фиксированной концентрация 2 мг / л.
Селекция in vitro мутантов, устойчивых к хинолонам
устойчивые к ципрофлоксацину мутанты были отобраны из двух гемолитических клинических изолятов, для которых МИК ципрофлоксацина составляла 0.015 мг / л. Культура в лог-фазе в бульоне Мюллера-Хинтона была инокулируют на чашки с агаром Мюллера-Хинтона, содержащие 5% агара с овечьей кровью и 1, 2 или 4 × МИК ципрофлоксацина. Планшеты инкубировали при 37 ° C в течение 48 часов. Мутанты с повышенным Устойчивость к ципрофлоксацину была получена после повторного пересева в тех же условиях. Мутанты пересевали на среду без антибиотиков и хранили для МИК и гемолиза. решимость.
Определение гемолитической активности
Организм считался гемолитическим, когда вокруг изолированного колонии после инкубации в течение ночи.Организмы считались продуцентами гамма-гемолизина. когда гемолиз наблюдался на колумбийской агаровой основе, содержащей овечью кровь (5%, BioMérieux, Marcy l ‘Etoile, Франция), но не в том случае, если он содержит человеческую кровь. (5%).
Статистические методы
Статистическая значимость различий в устойчивости к противомикробным препаратам между Гемолитические и негемолитические изоляты тестировали с использованием теста χ 2 и (в случай гентамицина) Точный тест Фишера.Различия считались значимыми, если значение P было <0,05.
Результаты и обсуждение
В целом, процент устойчивости среди 207 оцененных изолятов составил: 61,9% для ампициллин, 16,4% для амоксициллин-клавулановой кислоты, 3,6% для гентамицина, 36,8% для тетрациклина, 36,2% для налидиксовой кислоты, 21,5% для ципрофлоксацина, 23,7% для пефлоксацина и 10,8% для тровафлоксацин. Следует отметить, что показатель устойчивости к амоксициллин-клавулановой кислоте включает (как минимум) организмы, соответствующие как промежуточным, так и устойчивым категориям NCCLS, и всего за 5.У 8% организмов МПК> 32/2 мг / л. Ставки Устойчивость к хинолонам, описанная здесь, аналогична той, которая представлена в других исследованиях, проведенных в Испании, и выше, чем в предыдущем исследовании в нашем учреждении, 1 , подтверждающем тенденцию к повышенной устойчивости к хинолонам в последние годы.
Пятьдесят семь (27,5%) изолятов были гемолитическими как на овечьем, так и на человеческом кровяном агаре, что позволяет предположить что эти организмы производят α-гемолизин.Процент устойчивости к хинолонам (налидиксовая кислота, ципрофлоксацин, пефлоксацин и тровафлоксацин) и тетрациклину, но не другим агентов, были значительно выше ( P <0,05) среди негемолитических изолятов, чем среди гемолитических изолятов (таблица). Hariharan et al. 8 показали, что устойчивость к ко-тримоксазолу, неомицину и тетрациклин в штаммах E. coli , выделенных от поросят с диареей, встречались реже среди штаммов, продуцирующих термолабильный энтеротоксин (LT) и гемолизин, чем среди штаммов без оба фактора, в то время как устойчивость к гентамицину чаще встречалась у продуцентов LT-гемолизина. чем среди непродуцентов LT-гемолизина.Взаимосвязь между производством гемолизина и Устойчивость к энрофлоксацину не могла быть оценена, так как все штаммы были чувствительны к энрофлоксацину. Наши данные для тетрациклина аналогичны данным, полученным этими авторами, но мы не обнаружили значительная разница в устойчивости к гентамицину среди гемолитических и негемолитических изолятов. Фактически, несколько устойчивых к гентамицину штаммов в нашем исследовании были негемолитическими.
Механизмы, ответственные за преобладание негемолитических E.coli штаммы среди лиц, проявляющих устойчивость к хинолонам, неизвестны. Мутанты, устойчивые к ципрофлоксацину (МИК ципрофлоксацина в диапазоне от 0,03 до> 32 мг / л) получено in vitro из Изоляты, чувствительные к гемолизу, по-прежнему вызывают гемолиз. Эти мутанты не относятся к ранее описанные продуценты γ-гемолизина (выбранные в присутствии налидиксовой кислоты) как они все еще гемолизировали человеческие эритроциты. Неизвестно, есть ли устойчивость к хинолонам и потеря гемолиз вызван общими или связанными механизмами или если эти фенотипы являются производными из независимые мутации.Большинство клинических изолятов E. coli , устойчивых к хинолонам, являются мутантами gyrA , 2 , и возможно, что измененная суперспирализация ДНК в этих мутанты могут влиять на экспрессию генов, участвующих в производстве гемолиза. Другой возможность существования плейотропных мутаций в устойчивых к хинолонам штаммах E. coli которые могут влиять на экспрессию или активность гемолизина, как недавно сообщалось для мутации, затрагивающие гены, участвующие в синтезе липополисахаридов. 9
Устойчивость к фторхинолонам у клинических изолятов и лабораторных мутантов E. coli часто связана со сниженной экспрессией фимбрий типа 1, другого фактора вирулентности из E. coli. 10 Наше исследование показывает, что гемолизин также реже продуцируется устойчивыми к хинолонам клиническими изолятами E. coli. Возможно, сопротивление к хинолонам имеет косвенные издержки с точки зрения снижения вирулентности бактерий.Дальнейшие исследования необходимо проверить эту гипотезу.
Таблица.Устойчивость к восьми противомикробным препаратам из 57 гемолитических и 150 негемолитических клинические изоляты E. coli
| . | Процент стойкости . | |
|---|---|---|
| Агент . | гемолитический . | негемолитический . |
| Ампициллин | 50,9 | 65,3 |
| Амоксициллин-клавулановая кислота | 19,3 | 15,3 | 5,3
| Налидиксовая кислота | 1,8 | 28,7 |
| Ципрофлоксацин | 5,3 | 51,3 |
| Пефлоксацин | 3.6 | 34,7 |
| Тровафлоксацин | 1,8 | 18,0 |
| . | Процент стойкости . | |
|---|---|---|
| Агент . | гемолитический . | негемолитический . |
| Ампициллин | 50,9 | 65,3 |
| Амоксициллин-клавулановая кислота | 19.3 | 15,3 |
| Гентамицин | 0 | 5,3 |
| Тетрациклин | 17,5 | 44,0 |
| Налидиксовая кислота | 9018||
| Пефлоксацин | 3,6 | 34,7 |
| Тровафлоксацин | 1,8 | 18,0 |
Устойчивость к восьми противомикробным препаратам из 57 гемолитических и 150 негемолитических клинические изоляты E. coli
| . | Процент стойкости . | |
|---|---|---|
| Агент . | гемолитический . | негемолитический . |
| Ампициллин | 50,9 | 65,3 |
| Амоксициллин-клавулановая кислота | 19.3 | 15,3 |
| Гентамицин | 0 | 5,3 |
| Тетрациклин | 17,5 | 44,0 |
| Налидиксовая кислота | 9018||
| Пефлоксацин | 3,6 | 34,7 |
| Тровафлоксацин | 1,8 | 18,0 |
| . | Процент стойкости . | |
|---|---|---|
| Агент . | гемолитический . | негемолитический . |
| Ампициллин | 50,9 | 65,3 |
| Амоксициллин-клавулановая кислота | 19,3 | 15,3 | 5,3
| 901817909 | ||
| 44,0 | ||
| Налидиксовая кислота | 1,8 | 28,7 |
| Ципрофлоксацин | 5,3 | 51,3 |
| Пефлоксацин 9017 9017 9017 9017 9017 909 18 909 | ||
Список литературы
1.Мартинес-Мартинес, Л., Суарес, А. И., Карранса, Р. и Переа, Э. Дж. (
1993
).Resistencia a ciprofloxacino en bacilos gram negativos. Аспектос Epidemiológicos.Enfermedades Infecciosas y Microbiología Clínica
11
,434
–8. 2.Эверетт, М. Дж., Фанг Джин, Ю., Риччи, В. и Пиддок, Л. Дж. В. (
1996
). Вклад индивидуальные механизмы устойчивости к фторхинолонам у 36 штаммов Escherichia coli изолированы от человека и животных.Противомикробные препараты и химиотерапия
40
,2380
–6. 3.Кавальери, С. Дж., Бохач, Г. А. и Снайдер, И. С. (
1984
). кишечная палочка α -гемолизин: характеристики и вероятная роль в патогенности.микробиологический Отзывы
48
,326
–43. 4.Уолтон, Дж. Р. и Смит, Д. Х. (
1969
). Новый гемолизин (γ), продуцируемый Escherichia coli .Бактериологический журнал
98
,304
–5. 5.Велч Р. А. и Пеллет С. (
1988
). Транскрипционная организация генов гемолизина Escherichia coli .Бактериологический журнал
170
,1622
–30. 6.Wandersman, C. & Delepelaire, P. (
1990
) .TolC, Escherichia coli белок внешней мембраны, необходимый для секреции гемолизина.Труды Национального Академия наук США
87
,4776
–80. 7.Национальный комитет клинических лабораторных стандартов. (1997). Методы разбавления Тесты на чувствительность к бактериям, которые растут в аэробных условиях: утвержденный стандарт M7-A3. NCCLS, Уэйн, Пенсильвания.
8.Hariharan, H., Heaney, S., Bryenton, J. & Daley, J. (
1992
). Замечания по выработка гемолизина, термолабильного энтеротоксина и устойчивости к противомикробным препаратам среди энтеротоксигенный Escherichia coli от свиней.Сравнительная иммунология, Микробиология и инфекционные болезни
15
,229
–34. 9.Бауэр М. Э. и Велч Р. А. (
1997
). Плейотропные эффекты мутации rfaC на гемолизине Escherichia coli .Инфекция и иммунитет
65
,2218
–24. 10.Bagel, S., Heisig, P. & Wiedemann, B. (1997). Устойчивость к фторхинолонам Escherichia coli часто ассоциируется со сниженной экспрессией фимбрий 1-го типа.В программе и тезисов Тридцать седьмой Международной конференции по противомикробным агентам и Химиотерапия. Торонто. Реферат C-37, p. 52. Американское общество микробиологии, Вашингтон.
Британское общество антимикробной химиотерапии
Гемолитико-уремический синдром
Обзор
Что такое гемолитико-уремический синдром?
Гемолитико-уремический синдром или ГУС — это заболевание, при котором поражаются мельчайшие кровеносные сосуды в различных органах, вызывая их закупорку.Это приводит к разрушению красных кровяных телец (гемолитическая анемия) и уменьшению количества тромбоцитов, называемых тромбоцитами (тромбоцитопения). Чаще всего поражаются органы, в том числе почки (почечная недостаточность) и мозг (спутанность сознания, судороги).
HUS ранее был отнесен к другому диагнозу, называемому тромбоцитопеническая тромботическая пурпура (TTP), и назывался «HUS / TTP», потому что имел сходные симптомы. Однако теперь известно, что это отдельные заболевания, и их не следует путать.Термин «HUS» не зарезервирован для процесса, описанного ниже, когда он вызван инфекцией желудочно-кишечного тракта E coli . Другие причины этого проявления называются «атипичным» ГУС и составляют менее 10% случаев.
Гемолитико-уремический синдром — частая причина острого повреждения почек у детей.
Кто наиболее подвержен риску гемолитико-уремического синдрома?
Гемолитико-уремический синдром с большей вероятностью разовьется:
- Дети до пяти лет
- Лица, употребляющие недоваренное мясо или непастеризованное молоко
- Лица, непосредственно контактировавшие с больным диареей, вызванной одной из перечисленных выше инфекций
Симптомы и причины
Что вызывает гемолитико-уремический синдром?
Гемолитико-уремический синдром поражает как детей, так и взрослых, у которых развилась инфекция пищеварительной системы, вызванная специфическим штаммом Escherichia coli (E.coli, O157: H7) , который производит химическое вещество, называемое токсином шига или, реже, штамм шигелл, называемый Shigella dysenteriae type 1. E. coli . Не все E. coli токсичны; на самом деле есть типы _E. coli в кишечнике, которые полезны и действительно помогают пищеварению . E. Coli O157: H7 _продуцирует в кишечнике токсины, которые вызывают диарею, попадают в кровоток, разрушают эритроциты и повреждают почки.
Этот токсичный штамм E.coli попадает в организм, когда ребенок или взрослый ест испорченные, недоваренные или плохо обработанные продукты, например:
- Недоваренное мясо (обычно говяжий фарш)
- Непастеризованные молоко или фруктовые соки — нагревание для уничтожения микробов
- Немытые, зараженные сырые фрукты и овощи
Плохое мытье рук после контакта с сельскохозяйственными животными и контакта с нечистой водой в плавательных бассейнах или озерах также может быть источником E.coli O157: H7 бактерий.
Диарея, вызванная этими бактериями, очень тяжелая и часто с кровью.
Каковы симптомы гемолитико-уремического синдрома?
Симптомы гастроэнтерита , вызванного E. coli :
- Диарея (обычно с кровью)
- Лихорадка
- Боль в животе
- Рвота
Диарея не означает, что у вас ГУС. Кровавый понос может быть вызван множеством причин. Но любая причина тяжелой диареи (когда вы не можете поддерживать водный баланс или она длится дольше трех дней) или любой случай кровавой диареи требует медицинской помощи.
Люди, у которых развивается ГУС, имеют также другие симптомы. Поскольку токсины, выделяемые в кишечнике, начинают разрушать эритроциты, некоторые люди могут казаться бледными и иметь меньше энергии по мере прогрессирования болезни. Уменьшение количества красных кровяных телец не позволяет организму получать достаточно кислорода. Поскольку тромбоциты израсходованы, у некоторых людей могут появиться синяки. Во время этого процесса у пациентов также может развиться лихорадка.
Если болезнь продолжает прогрессировать и поврежденные эритроциты закупоривают ткань почек, отходы не могут быть отфильтрованы и выведены из организма.В конечном итоге это может привести к острому повреждению почек, которое имеет следующие признаки и симптомы:
- Снижение диуреза
- Кровь в моче
- Чувство тошноты из-за повышения уровня токсинов в крови, если это продолжается слишком долго
При поражении кровеносных сосудов головного мозга пациенты могут терять сознание, становиться сонливыми или даже могут развиться судороги.
Диагностика и тесты
Как диагностируется гемолитико-уремический синдром?
Врач задаст вопросы о медицинском и семейном анамнезе пациента и проведет медицинский осмотр.Можно заказать следующие тесты:
- Анализ мочи на наличие крови или белка : Первоначально это выполняется с помощью тест-полоски на образце мочи.
- Анализы крови : Проведение анализов крови пациента предоставит врачу подробную информацию об уровнях эритроцитов и тромбоцитов, функции печени и почек.
- Тест стула : Этот тест проверяет небольшой образец стула пациента на наличие бактерий E. coli O157: H7 .
- Биопсия почки : Хотя этот тест не требуется для диагностики гемолитико-уремического синдрома, при необходимости его может назначить врач. Пациенту проводят анестезию, чтобы врач мог сделать небольшой разрез на теле, взять небольшой кусочек ткани почек и внимательно изучить его под микроскопом. Во многих случаях, когда в анамнезе имеется диарея и почечная недостаточность, гемолитическая анемия и низкий уровень тромбоцитов, особенно при обнаружении инфекции кишечной палочки, биопсия почки не требуется.
Ведение и лечение
Как лечится гемолитико-уремический синдром?
Лечение гемолитико-уремического синдрома требует пребывания в больнице. Для поддержания гидратации пациента можно вводить внутривенные (IV) жидкости. Повышенное кровяное давление, которое может возникать как часть почечной недостаточности, может потребовать приема лекарств для его снижения.Если почечная недостаточность достаточно серьезна, может потребоваться диализ (обычно временный), чтобы кровь оставалась чистой на время заживления почек. При правильном уходе пациенты с этим заболеванием могут выздороветь без необратимого ущерба для своего здоровья. Антибиотики не нужны для лечения диареи. Инфекция пройдет сама по себе. В некоторых исследованиях использование антибиотиков было связано с повышенным риском развития ГУС.
Дети выздоравливают легче, чем взрослые. Более 85 процентов пациентов с наиболее распространенной формой ГУС полностью восстанавливают функцию почек.Однако даже при полном выздоровлении высокое кровяное давление или другие проблемы с почками могут повлиять на пациента в будущем.
Каковы осложнения гемолитико-уремического синдрома?
Пациенты с гемолитико-уремическим синдромом могут иметь серьезные, а иногда и опасные для жизни осложнения, в том числе:
- Необратимое повреждение почек
- Высокое кровяное давление
- Изъятия
Профилактика
Как предотвратить гемолитико-уремический синдром?
Выполнение этого списка простых задач может помочь предотвратить гемолитико-уремический синдром, вызванный E.coli O157: H7 :
- Избегайте нечистых мест для купания.
- Избегайте непастеризованного молока, сока и сидра.
- Часто чистите кухонную утварь и пищевые поверхности.
- Готовьте мясо при внутренней температуре не менее 70 ° C / 160 ° F.
- Размораживание мяса в микроволновой печи или холодильнике.
- Не позволяйте детям посещать бассейны, если у них был понос.
- Отделяйте сырые продукты от приготовленных.
- Вымыть руки перед едой.
- Вымойте руки после посещения туалета и после смены подгузников.
- Мыть руки после того, как погладить сельскохозяйственных животных.


 При этом проходит воспалительный процесс, который вызывает проявление довольно большого количества симптомов.
При этом проходит воспалительный процесс, который вызывает проявление довольно большого количества симптомов. тоит быть внимательнее, так как такой бонус имеет свой срок отыгрыша. Отыграть бонусы нужно в 35 раз. Зачастую проблемы подобного рода связывают с иными заболеваниями.
тоит быть внимательнее, так как такой бонус имеет свой срок отыгрыша. Отыграть бонусы нужно в 35 раз. Зачастую проблемы подобного рода связывают с иными заболеваниями. Это связано с тем, что при нарушении срока годности бактерии начинают размножаться. Нарушение рекомендаций по хранению продуктов питания создают наиболее благоприятную среду для размножения бактерии.
Это связано с тем, что при нарушении срока годности бактерии начинают размножаться. Нарушение рекомендаций по хранению продуктов питания создают наиболее благоприятную среду для размножения бактерии. В качестве профилактики некоторые препараты из этой группы рекомендуют употреблять в случае эпидемии. При выборе следует обратить внимание на дорогие препараты, которые производят по современным технологиям для исключения вероятности возникновения побочных эффектов.
В качестве профилактики некоторые препараты из этой группы рекомендуют употреблять в случае эпидемии. При выборе следует обратить внимание на дорогие препараты, которые производят по современным технологиям для исключения вероятности возникновения побочных эффектов.