что такое, как берут анализ и где можно сдать?
В нашем организме живут миллионы бактерий — их общий вес составляет около двух килограммов. Кишечная палочка занимает среди них далеко не последнее место. Эта бактерия может долгое время помогать человеку в формировании микрофлоры и пищеварении, а может в один момент превратиться в серьезную медицинскую проблему. В нашей статье мы расскажем о способах выявления кишечной палочки.
Кишечная палочка: две стороны одной медали
Кишечная палочка, или Escherichia coli (Эшерихия коли) — это палочковидная бактерия, которая обитает в кишечнике человека и некоторых животных. Существует более сотни разновидностей этой палочки. Большинство из них совершенно безвредны, но некоторые могут вызвать серьезные заболевания.
Кстати
Один из редких видов кишечной палочки — штамм О141:Н4 — стал знаменит из-за эпидемии в Европе в 2011 году. Тогда в странах Европы и северной Америки за период с мая по июнь заболело примерно 4 000 человек, из них 43 человека погибло.
У здорового человека Escherichia coli живет в толстом кишечнике. Ее количество обычно составляет 104–1010 КОЕ в 1 мл содержимого. В кишечнике эта бактерия участвует в переваривании пищи, синтезирует нужные нам витамины, а также производит органические кислоты. Эти кислоты создают благоприятную среду для развития лакто- и бифидобактерий.
У организма человека есть различные механизмы, которые помогают контролировать количество бактерий и ограничивать места их «обитания». Но если механизм дает сбой, могут возникнуть как легкие проходящие расстройства, так и действительно серьезные заболевания, иногда с летальным исходом. Из-за кишечной палочки могут развиваться различные заболевания: от диареи до тяжелого менингита и коли-сепсиса. Обнаружение бактерии в любых органах, кроме толстого кишечника, уже говорит о развитии нарушений.
Чаще всего кишечная палочка попадает в другие органы при нарушении гигиены или при снижении иммунитета. Попадая в женскую половую систему, она вызывает кольпит, аднексит, другие воспалительные заболевания.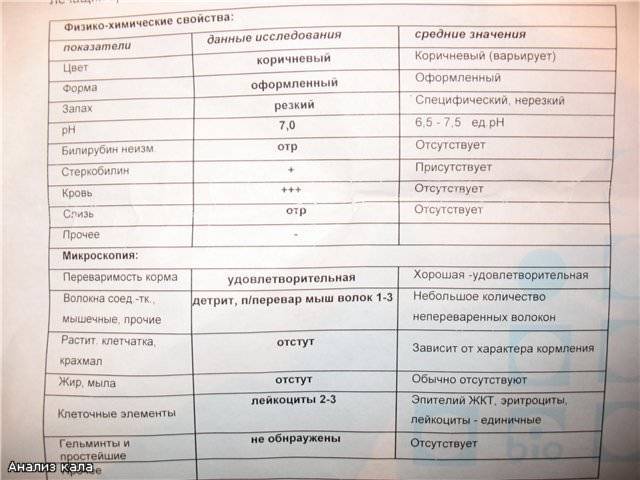 Особенно опасно заражение при беременности и после родов. Это может вызвать внутриутробную инфекцию у ребенка и стать причиной послеродового эндометрита у матери. Мужчин эта опасность тоже не обходит стороной. Кишечная палочка, попавшая в уретру, может вызвать уретрит, простатит, воспаление придатков и яичек.
Особенно опасно заражение при беременности и после родов. Это может вызвать внутриутробную инфекцию у ребенка и стать причиной послеродового эндометрита у матери. Мужчин эта опасность тоже не обходит стороной. Кишечная палочка, попавшая в уретру, может вызвать уретрит, простатит, воспаление придатков и яичек.
Кроме этого, нормальная кишечная палочка может мутировать и становиться действительно опасной. Некоторые виды этой бактерии, например O157:H7, O104:h5, O121 и O104:h31, выделяют сильные токсины. Они могут вызвать гемолитико-уремический синдром, перитонит, пневмонию, пищевые отравления.
Чаще всего мутировавшая кишечная палочка попадает в организм вместе с продуктами питания, такими как немытые овощи, плохо обработанное мясо, молоко. Но в некоторых случаях такие штаммы могут образоваться внутри организма в результате мутаций и обмена генами.
Когда может быть назначен анализ
Патогенная кишечная палочка нередко вызывает диарею. Обычно эшерихиозом страдают дети младшего возраста и люди, путешествующие в страны с низким уровнем гигиены (так называемая диарея путешественников). Вовремя проведенный анализ позволит выявить кишечную палочку и начать лечение.
Вовремя проведенный анализ позволит выявить кишечную палочку и начать лечение.
Некоторые опасные штаммы кишечной палочки могут вызвать гемолитико-уремический синдром (ГУС). Это тяжелое состояние, при котором в мелких сосудах образуется большое количество тромбов, собственные эритроциты разрушаются и возникает полиорганная недостаточность — тяжелая стресс-реакция организма. При любом подозрении на ГУС обязательно проводят анализ на энтеропатогенные (опасные) эшерихии.
Обычный бактериологический анализ, который проводят при воспалительных заболеваниях органов половой системы, послеродовых эндометритах и других, — также может показать наличие кишечной палочки.
Еще одним показанием к проведению исследования является дисбактериоз. Изменение состава микрофлоры кишечника может привести к проблемам с пищеварением, к урчанию и болям в животе. Нарушение образования витаминов и повышенное всасывание токсинов приводит к слабости, утомляемости и другим неспецифическим симптомам.
Какие типы анализов назначают при подозрении на патологический процесс
Кишечную палочку можно обнаружить в кале, в моче, в мазках с поверхности половых органов или из ран, при посеве промывных вод. Также во время исследований она может быть обнаружена в ране, в легких.
Также во время исследований она может быть обнаружена в ране, в легких.
Основным методом анализа для обнаружения кишечной палочки является бактериологический посев. Для этого небольшое количество материала помещают в питательную среду, на которой бактерии очень хорошо размножаются. Результат подсчитывают через несколько дней по количеству образовавшихся колоний. Единица измерения — КОЕ/мл, то есть количество бактерий, из которых при исследовании выросли колонии, в миллилитре материала.
На выращенных колониях проводят тест с чувствительностью к антибиотикам или бактериофагам. Для этого в чашку Петри помещают микробы и выкладывают на ее поверхность диски, содержащие определенный антибиотик. Если антибиотик действует, рядом с диском образуется «пустое» кольцо, в котором роста микроорганизмов нет. Так же поступают и с бактериофагами.
Кроме ручного способа существует и полуавтоматический метод исследования чувствительности. Для этого микроб «засевают» не на чашки Петри, а на специальные кассеты, уже содержащие определенный набор антибиотиков. После эти кассеты помещают в анализатор.
После эти кассеты помещают в анализатор.
Также существует метод ПЦР-диагностики. Он позволяет сказать, присутствует ли в материале патогенная кишечная палочка. Но ни количество бактерий, ни их чувствительность к лекарственным препаратам этот метод не покажет.
Другие методы, которые не подразумевают выделение чистой культуры кишечной палочки, могут сказать о заражении только косвенно. Например, в общем анализе мочи могут обнаружить бактерии в виде палочек. Но для того чтобы определить их вид придется сдавать дополнительно бактериологический посев. Похожая ситуация и с копрограммой. Анализ может дать представление о состоянии желудка и кишечника, но не позволяет выявить конкретные бактерии.
Общий анализ крови позволяет выявить характерные для воспалительных заболеваний сдвиги. Но они могут быть вызваны не только эшерихиозом, но и дизентерией, пневмонией или любым другим воспалительным заболеванием.
Как сдавать биоматериал для анализа на кишечную палочку
Любое бактериологическое исследование нужно проводить до начала лечения антибиотиками. В противном случае можно получить ложноотрицательный результат.
В противном случае можно получить ложноотрицательный результат.
Анализ кала на кишечную палочку собирается в стерильную пробирку с транспортной средой. Для этого нужно заранее подготовить судно или другую емкость, тщательно вымыть ее и ополоснуть кипятком. В эту емкость собирается кал после естественной дефекации. Из специальной пробирки с транспортной средой нужно достать аппликатор, погрузить его в несколько участков собранного биоматериала и снова убрать в пробирку, плотно закрыв крышку. Если в собранном материале присутствуют кишечные палочки, бактериологический анализ это покажет.
Знаете ли вы, что…
кишечная палочка попадает в организм ребенка в первые же дни его жизни. Уже через 40 часов после рождения кишечник малыша заселен нормальной микрофлорой, в том числе и кишечной палочкой. Такое «сожительство» будет продолжаться всю его жизнь.
Анализ мочи на бактериологическое исследование тоже собирают в специальную стерильную емкость.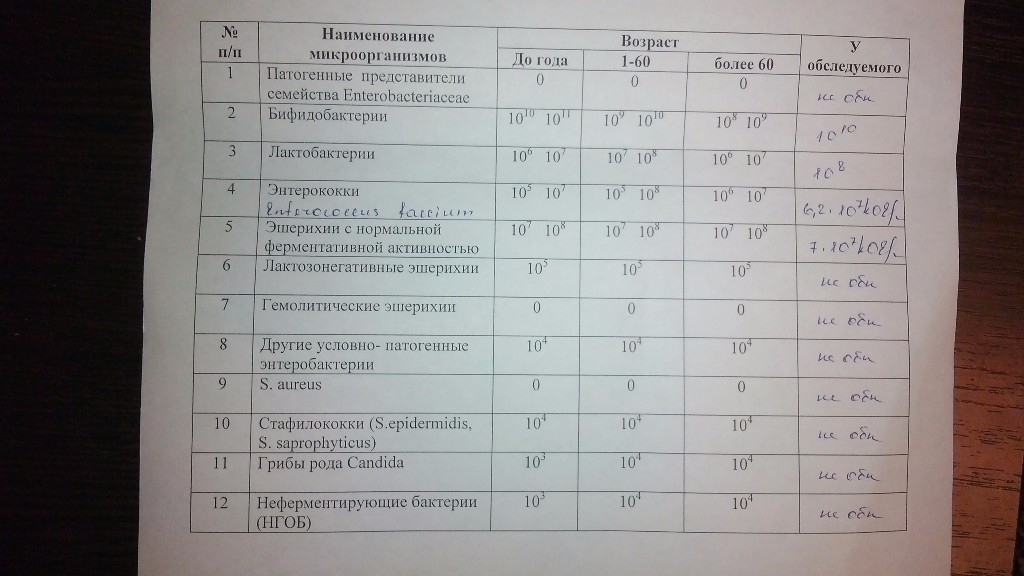 Собрать материал можно в любое время суток. Перед этим обязательно нужно принять душ, чтобы в емкость не попали бактерии с поверхности кожи. Чем скорее получится доставить материал в лабораторию, тем лучше.
Собрать материал можно в любое время суток. Перед этим обязательно нужно принять душ, чтобы в емкость не попали бактерии с поверхности кожи. Чем скорее получится доставить материал в лабораторию, тем лучше.
Мазки и соскобы урогенитального тракта при подозрении на уретрит, вагинит и любые другие мочеполовые заболевания, вызванные кишечной палочкой, забирают сразу в лаборатории или на приеме врача. Специальной щеточкой делается соскоб из уретры, со стенок влагалища или с шейки матки. Это не очень приятная процедура, но без нее не обойтись.
В каком виде и когда выдаются результаты
Быстрый анализ, который позволяет выявить в материале ДНК кишечной палочки, проводится за 1–2 рабочих дня. Результат бактериологического анализа на кишечную палочку придется ждать дольше — от 5 до 7 дней. За это время выращивается культура клеток, определяется их вид, проводится анализ на чувствительность к антибиотикам и бактериофагам.
В норме кишечной палочки не должно быть нигде, кроме толстого кишечника.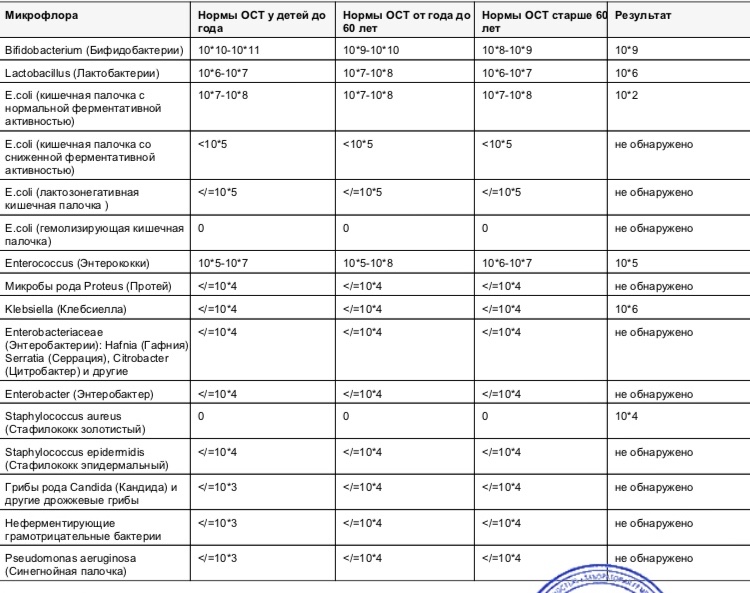 То есть если вы сдаете мочу или мазок, то лучший результат — это отрицательное заключение. Если речь идет о содержимом кишечника, то здесь не должно обнаруживаться энтеропатогенных кишечных палочек, таких как O157:H7. В некоторых лабораториях проводят быстрый ПЦР-тест на целую группу таких бактерий.
То есть если вы сдаете мочу или мазок, то лучший результат — это отрицательное заключение. Если речь идет о содержимом кишечника, то здесь не должно обнаруживаться энтеропатогенных кишечных палочек, таких как O157:H7. В некоторых лабораториях проводят быстрый ПЦР-тест на целую группу таких бактерий.
При определении чувствительности к антибиотикам или бактериофагам выдается бланк, на котором напротив каждого наименования написана степень влияния препарата на рост бактерии. По такому бланку врач за несколько минут подберет наиболее эффективный для конкретного случая антибиотик.
Где можно сдать анализ на кишечную палочку
Анализ на эшерихиоз можно сдать как в обычной поликлинике, так и в частной лаборатории. Желательно заранее уточнить, какой метод исследования при этом используется.
Бактериологические исследования лучше проводить в клиниках и лабораториях, оснащенных автоматическими и полуавтоматическими анализаторами. Это исключает человеческий фактор, позволяет проводить исследование с широким перечнем антибиотиков и бактериофагов. Такие оснащенные лаборатории имеют как современные государственные больницы, занимающиеся лечением инфекционных болезней, так и частные медицинские центры.
Такие оснащенные лаборатории имеют как современные государственные больницы, занимающиеся лечением инфекционных болезней, так и частные медицинские центры.
Также стоит обратить внимание на время проведения исследования. Для бактериологического исследования это не менее пяти дней. Раньше бактерия просто не успеет вырасти в достаточном для анализа количестве. Время больше 7–10 дней говорит о том, что исследование будет проводиться в сторонней лаборатории. Это существенный недостаток, поскольку речь идет о транспортировке биоматериала, что нежелательно: чем раньше был доставлен материал, тем более достоверным будет результат.
Так как с результатами исследования еще придется идти к врачу для назначения лечения, не стоит выбирать неизвестные лаборатории по принципу «ближе к телу». Врач может просто не поверить полученным результатам и отправить сдавать анализ заново в свою больницу или в лабораторный центр, которому он доверяет. А это повлечет дополнительные временные и денежные траты.
Кишечная палочка — неотъемлемая часть микрофлоры кишечника. Пока она находится под контролем организма, ее клетки помогают синтезировать витамины, переваривать пищу, создавать благоприятную среду для жизни других полезных микробов. Но любое нарушение этого равновесия грозит патологиями вплоть до серьезных воспалительных заболеваний. К счастью, медицина помогает нам вовремя выявить отклонения от нормы и приять соответствующие меры.
E Coli гемолитические в кале у ребенка, грудничка.
Пути и сроки попадания Escherichia coli в организм человекаОткрыв в 19 веке кишечную палочку, которая позже получила название Escherichia coli, немецкий ученый Теодор Эшерих, даже предположить не мог, сколько проблем она создаст жителям планеты Земля. Эта грамотрицательная палочковидная бактерия постоянный обитатель в организме человека и даже принимает участие во многих процессах: обмен веществ, образование жирных кислот, выработка витамина В и общее функционирование желудочно-кишечного тракта.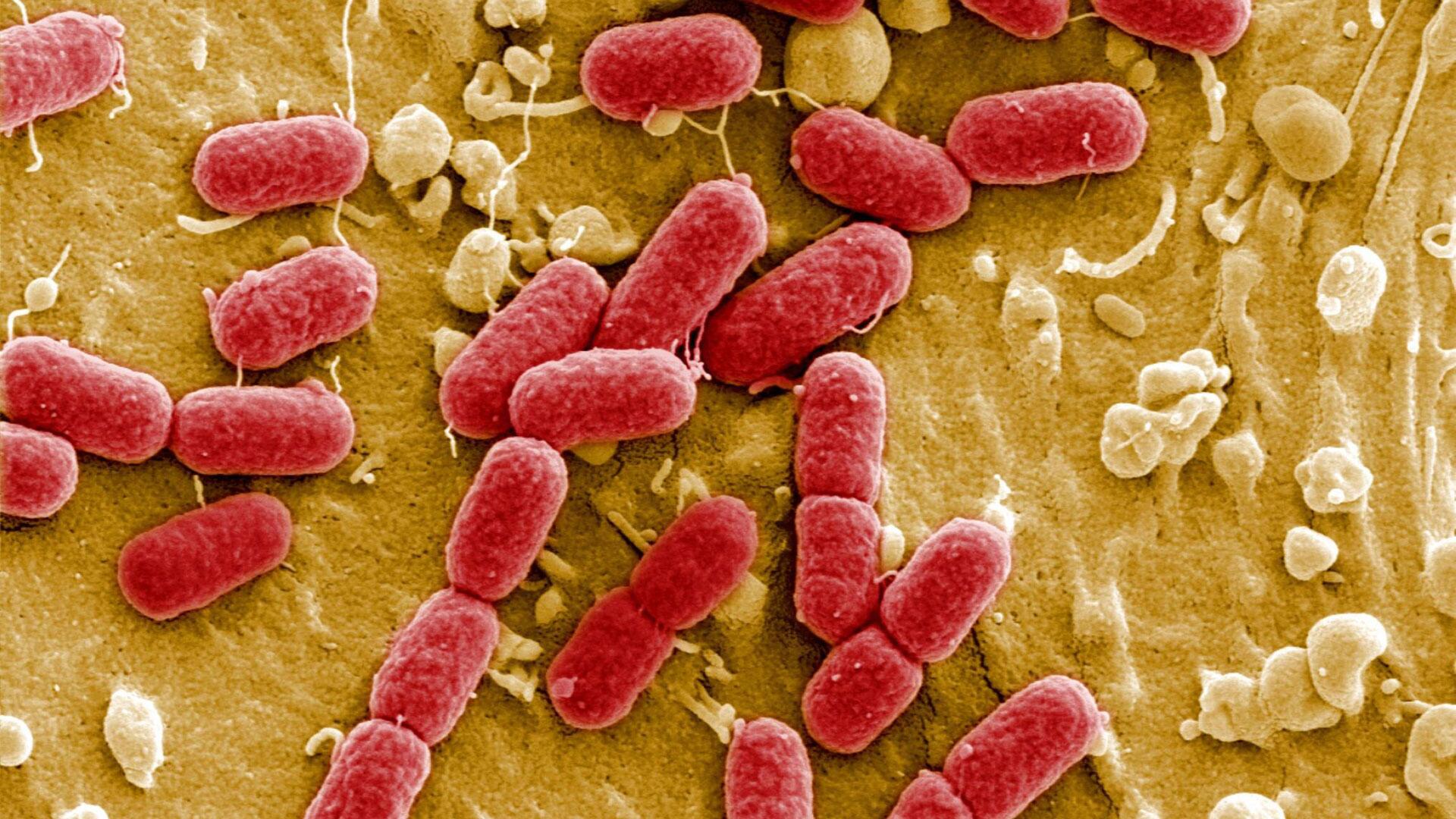 Но помощь организму E Coli приносит только тогда, когда количество бактерий не превышает установленную норму. В противном случае дисбактериоз, эшерихиоз и другие заболевания обеспечены.
Но помощь организму E Coli приносит только тогда, когда количество бактерий не превышает установленную норму. В противном случае дисбактериоз, эшерихиоз и другие заболевания обеспечены.
Особое внимание следует уделять концентрации бактерии у детей грудного возраста.
Содержание статьи
Разновидности кишечной палочки
По своему виду воздействия на организм бактерии гемолитические E-Coli в кале у ребенка можно разделить на несколько видов:
- Энтеротоксигенные. Палочка этого типа способствует аккумуляции ядовитых веществ в кишечнике и является основной причиной поноса у ребенка.
- Энтероинвазивные. Основными симптомами считаются: жидкий стул, боли в животе и кровянистые выделения.
- Энтеропатогенные. Для этого вида характерен понос с сильными болями живота и рвотой.
- Энтерогеморрагические. Считаются самыми опасными. Характерны схватки в области живота, высокая температура, диарея с кровяными выделениями.
Заболевание длительное и может вызывать различного рода осложнения.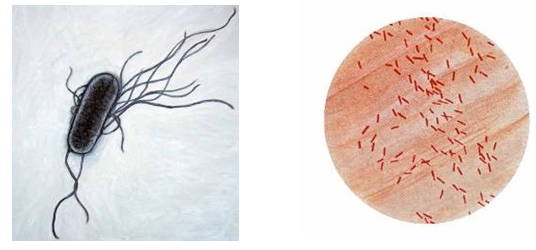 К данному виду относится кишечная палочка с гемолитическими свойствами.
К данному виду относится кишечная палочка с гемолитическими свойствами.
Симптоматика инфекции у детей грудного возраста
При развитии Escherichia coli резко ухудшается состояние ребенка
Развитие Escherichia coli в больших количествах становится основной причиной нарушения баланса микрофлоры желудочно-кишечного тракта у новорожденных. Ребенок становится беспокойным, нарушается сон, появляются боли в животе, обычно после кормления. Симптоматика разнообразна:
- Вздутие живота, урчание и повышенное газообразование,
- Появление рвоты,
- После кормления, срыгивание происходит чаще обычного,
- Своеобразный понос. Пенистый кал сопровождается неприятным кислым запахом,
- При серьезном заболевании, возможна потеря веса ребенка.
Следует следить и за общим физиологическим состоянием грудничка. Повышенная сонливость, слабость, повышение температуры тела или редкое мочеиспускание являются первыми признаками проблем с желудочно-кишечным трактом.
Диагностика заболевания
При возникновении симптомов описанных выше, важно правильно поставить диагноз. Для этого необходимо сделать анализ кала заболевшего малыша. Специалисты определяют вид и количество бактерий. Обнаружив E Coli гемолитические в кале у ребенка, врач назначает лечение. Здесь главное не заниматься самолечением, ведь разобраться в результатах анализа, бактериях и другой патогенной микрофлоре сможет только специалист.
Увеличение количества Escherichia coli не всегда говорит о заболевании. Делать выводы не зная общей клинической картины невозможно. Для более полной постановки диагноза, лечащий врач должен знать, после чего возникли кишечные расстройства, как долго и с какой периодичностью они протекают, чем сопровождаются и другие признаки.
Важно, не скрывать от врача ни одной детали. Все это поможет сделать верный диагноз и назначить правильное лечение.
Лечение заболеваний вызванных кишечными палочками
Лечение любых заболеваний, вызванных микроорганизмами, сводится к приему противомикробных препаратов – антибиотиков, фагов и др.
Следует помнить, что при рождении, кишечник ребенка стерилен, но через несколько суток в нем появляются бактерии E Coli и сохраняются на протяжении всей жизнедеятельности организма. Нормальная концентрация бактерий составляет 106 – 108 КОЕ/г содержимого толстой кишки.
Однако, если присутствие E Coli в кишечнике неизбежно, то кишечная палочка с гемолитическими свойствами у ребенка присутствовать не должна. Ее наличие – это явное отклонение от нормы.
Следует помнить, что гемолитические заболевания кишечника могут возникнуть на фоне ОРЗ или в результате приема антибиотиков. Поэтому к выбору лекарственных препаратов нужно отнестись с особым вниманием.

Профилактика кишечных заболеваний
Следуя простым советам, можно защитить ребенка от кишечной палочкиОсновная причина увеличения количества бактерий E Coli в кале у ребенка – низкая иммунная защита. Большинство педиатров рекомендуют не прекращать кормление грудью малыша минимум год, ведь, как известно с молоком матери младенец получает лактозу и все необходимые компоненты для борьбы с воздействием негативной микрофлоры. При невозможности грудного вскармливания, следует использовать молочные смеси содержащие пребиотики.
Естественно, элементарное соблюдение гигиены кормящей матери, сведет к минимуму возникновение заболеваний связанных с желудочно-кишечным трактом у ребенка и гемолитические E-Coli в кале у грудничка не появятся. При этом основные причины возникновения кишечных инфекций стары как мир:
• Плохая термическая обработка яиц, рыбы и мясных продуктов;
• Не соблюдение правил гигиены.
Кроме того, употребление сырого молока не желательно для взрослых, а для детей – продукт обязательно должен пройти процедуру кипячения.

Выводы и заключительные аспекты
• Если у ребенка стали проявляться симптомы нарушения работы желудочно-кишечного тракта – понос, рвота, повышение температуры тела, следует незамедлительно обратиться к врачу и сдать соответствующие анализы.
• При обнаружении E Coli гемолитические в кале у грудничка, не заниматься самолечением, а точно следовать указаниям лечащего врача.
• Строго соблюдать личную гигиену.
• Употреблять в пищу продукты богатые витаминами и аминокислотами.
Придерживаясь простых правил, ребенок будет активным и здоровым, а при возможном наступлении болезни – быстро пойдет на поправку.
Кишечная инфекция у детей
Кишечная инфекция у детей – группа инфекционных заболеваний различной этиологии, протекающих с преимущественным поражением пищеварительного тракта, токсической реакцией и обезвоживанием организма.
У детей кишечная инфекция проявляется повышением температуры тела, вялостью, отсутствием аппетита, болями в животе, рвотой, диареей. Диагностика кишечной инфекции у детей основана на клинико-лабораторных данных (анамнезе, симптоматике, выделении возбудителя в испражнениях, обнаружении специфических антител в крови). При кишечной инфекции у детей назначаются антимикробные препараты, бактериофаги, энтеросорбенты; в период лечения важно соблюдение диеты и проведение регидратации.
Диагностика кишечной инфекции у детей основана на клинико-лабораторных данных (анамнезе, симптоматике, выделении возбудителя в испражнениях, обнаружении специфических антител в крови). При кишечной инфекции у детей назначаются антимикробные препараты, бактериофаги, энтеросорбенты; в период лечения важно соблюдение диеты и проведение регидратации.
Кишечная инфекция у детей – острые бактериальные и вирусные инфекционные заболевания, сопровождающиеся кишечным синдромом, интоксикацией и дегидратацией. В структуре инфекционной заболеваемости в педиатриикишечные инфекции у детей занимают второе место после ОРВИ. Восприимчивость к кишечной инфекции у детей в 2,5-3 раза выше, чем у взрослых. Около половины случаев кишечной инфекции у детей приходится на ранний возраст (до 3 лет). Кишечная инфекция у ребенка раннего возраста протекает тяжелее, может сопровождаться гипотрофией, развитием дисбактериоза и ферментативной недостаточности, снижением иммунитета. Частое повторение эпизодов инфекции вызывает нарушение физического и нервно-психического развития детей.
Причины кишечной инфекции у детей
Спектр возбудителей кишечных инфекций у детей крайне широк. Наиболее часто патогенами выступают грамотрицательные энтеробактерии (шигеллы, сальмонеллы, кампилобактеры, эшерихии, иерсинии) и условно-патогенная флора (клебсиеллы, клостридии, протей, стафилококки и др.). Кроме этого, встречаются кишечные инфекции, вызываемые вирусными возбудителями (ротавирусами, энтеровирусами, аденовирусами), простейшими (лямблиями, амебами, кокцидиями), грибами. Общими свойствами всех возбудителей, обусловливающих развитие клинических проявлений, являются энтеропатогенность, способность к синтезу эндо- и экзотоксинов.
Заражение детей кишечными инфекциями происходит посредством фекально-орального механизма алиментарным (через пищу), водным, контактно-бытовым путями (через посуду, грязные руки, игрушки, предметы обихода и т. д.). У ослабленных детей с низкой иммунологической реактивностью возможно эндогенное инфицирование условно-патогенными бактериями. Источником ОКИ может выступать носитель, больной со стертой или манифестной формой заболевания, домашние животные. В развитии кишечной инфекции у детей большую роль играет нарушение правил приготовления и хранения пищи, допуск на детские кухни лиц-носителей инфекции, больных тонзиллитом, фурункулезом, стрептодермией и пр.
Источником ОКИ может выступать носитель, больной со стертой или манифестной формой заболевания, домашние животные. В развитии кишечной инфекции у детей большую роль играет нарушение правил приготовления и хранения пищи, допуск на детские кухни лиц-носителей инфекции, больных тонзиллитом, фурункулезом, стрептодермией и пр.
Наиболее часто регистрируются спорадические случаи кишечной инфекции у детей, хотя при пищевом или водном пути инфицирования возможны групповые и даже эпидемические вспышки. Подъем заболеваемости некоторыми кишечными инфекциями у детей имеет сезонную зависимость: так, дизентерия чаще возникает летом и осенью, ротавирусная инфекция — зимой.
Распространенность кишечных инфекций среди детей обусловлена эпидемиологическими особенностями (высокой распространенностью и контагиозностью возбудителей, их высокой устойчивостью к факторам внешней среды), анатомо-физиологическими особенностями пищеварительной системы ребенка (низкой кислотностью желудочного сока), несовершенством защитных механизмов (низкой концентрацией IgA).
Классификация кишечной инфекции у детей
По клинико-этиологическому принципу среди кишечных инфекций, наиболее часто регистрируемых в детской популяции, выделяют шигеллез (дизентерию), сальмонеллез, коли-инфекцию (эшерихиозы), иерсиниоз, кампилобактериоз, криптоспоридиоз, ротавирусную инфекцию, стафилококковую кишечную инфекцию и др.
По тяжести и особенностям симптоматики течение кишечной инфекции у детей может быть типичным (легким, средней тяжести, тяжелым) и атипичным (стертым, гипертоксическим). Выраженность клиники оценивается по степени поражения ЖКТ, обезвоживания и интоксикации.
Характер местных проявлений при кишечной инфекции у детей зависит от поражения того или иного отдела ЖКТ, в связи с чем выделяют гастриты, энтериты, колиты, гастроэнтериты, гастроэнтероколиты, энтероколиты. Кроме локализованных форм, у грудных и ослабленных детей могут развиваться генерализованные формы инфекции с распространением возбудителя за пределы пищеварительного тракта.
Кроме локализованных форм, у грудных и ослабленных детей могут развиваться генерализованные формы инфекции с распространением возбудителя за пределы пищеварительного тракта.
В течении кишечной инфекции у детей выделяют острую (до 1,5 месяцев), затяжную (свыше 1,5 месяцев) и хроническую (свыше 5-6 месяцев) фазы.
Дизентерия у детейПосле непродолжительного инкубационного периода (1-7 суток) остро повышается температура (до 39-40° C), нарастает слабость и разбитость, снижается аппетит, возможна рвота. На фоне лихорадки отмечается головная боль, ознобы, иногда – бред, судороги, потеря сознания. Кишечная инфекция у детей сопровождается схваткообразными болями в животе с локализацией в левой подвздошной области, явлениями дистального колита (болезненностью и спазмом сигмовидной кишки, тенезмами с выпадением прямой кишки), симптомами сфинктерита. Частота дефекации может варьировать от 4-6 до 15-20 раз за сутки. При дизентерии стул жидкий, содержащий примеси мутной слизи и крови. При тяжелых формах дизентерии возможно развитие геморрагического синдрома, вплоть до кишечного кровотечения.
При тяжелых формах дизентерии возможно развитие геморрагического синдрома, вплоть до кишечного кровотечения.
У детей раннего возраста при кишечной инфекции общая интоксикация преобладает над колитическим синдромом, чаще возникают нарушения гемодинамики, электролитного и белкового обмена. Наиболее легко у детей протекает кишечная инфекция, вызванная шигеллами Зоне; тяжелее — шигеллами Флекснера и Григорьеза-Шига.
Сальмонеллез у детейНаиболее часто (в 90% случаев) развивается желудочно-кишечная форма сальмонеллеза, протекающая по типу гастрита, гастроэнтерита, гастроэнтероколита. Характерно подострое начало, фебрильный подъем температуры, адинамия, рвота, гепатоспленомегалия. Стул при сальмонеллезе жидкий, обильный, каловый, цвета «болотной тины», с примесями слизи и крови. Обычно данная форма кишечной инфекции заканчивается выздоровлением, однако у грудных детей возможен летальный исход вследствие тяжелого кишечного токсикоза.
Гриппоподобная (респираторная) форма кишечной инфекции встречается у 4-5% детей. При данной форме сальмонеллы обнаруживаются в посеве материала из зева. Ее течение характеризуется фебрильной температурой, головной болью, артралгией и миалгией, явлениями ринита, фарингита, конъюнктивита. Со стороны сердечно-сосудистой системы отмечаются тахикардия и артериальная гипотония.
На тифоподобную форму сальмонеллеза у детей приходится 2% клинических случаев. Она протекает с длительным периодом лихорадки (до 3-4-х недель), выраженной интоксикацией, нарушением функции сердечно-сосудистой системы (тахикардией, брадикардией).
Септическая форма кишечной инфекции обычно развивается у детей первых месяцев жизни, имеющих неблагоприятный преморбидный фон. На ее долю приходится около 2-3% случаев сальмонеллеза у детей. Заболевание протекает крайне тяжело, сопровождается септицемией или септикопиемией, нарушением всех видов обмена, развитием тяжелых осложнений (пневмонии, паренхиматозного гепатита, отоантрита, менингита, остеомиелита).
Эшерихиозы у детейДанная группа кишечных инфекций у детей крайне обширна и включает коли-инфекци, вызываемые энтеропатогенными, энтеротоксигенными, энтероинвазивными, энтерогеморрагическими эшерихиями.
Кишечная инфекция у детей, вызванная эшерихиями, протекает с субфебрильной или фебрильной температурой, слабостью, вялостью, снижением аппетита, упорной рвотой или срыгиваниями, метеоризмом. Характерна водянистая диарея (обильный, брызжущий стул желтого цвета с примесью слизи), быстро приводящая к дегидратации и развитию эксикоза. При эшерихиозе, вызываемом энтерогеморрагическими эшерихиями, диарея носит кровавый характер.
Вследствие обезвоживания у ребенка возникает сухость кожи и слизистых оболочек, снижается тургор и эластичность тканей, западает большой родничок и глазные яблоки, снижается диурез по типу олигурии или анурии.
Ротавирусная инфекция у детейОбычно протекает по типу острого гастроэнтерита или энтерита. Инкубационный период в среднем длится 1-3 дня. Все симптомы кишечной инфекции у детей разворачиваются в течение одних суток, при этом поражение ЖКТ сочетается с катаральными явлениями.
Респираторный синдром характеризуется гиперемией зева, ринитом, першением в горле, покашливанием. Одновременно с поражением носоглотки развиваются признаки гастроэнтерита: жидкий (водянистый, пенистый) стул с частотой дефекаций от 4-5 до 15 раз в сутки, рвотой, температурной реакцией, общей интоксикацией. Длительность течения кишечной инфекции у детей – 4-7 дней.
Стафилококковая кишечная инфекция у детейРазличают первичную стафилококковую кишечную инфекцию у детей, связанную с употреблением пищи, обсемененной стафилококком, и вторичную, обусловленную распространением возбудителя из других очагов.
Течение кишечной инфекции у детей характеризуется тяжелым эксикозом и токсикозом, рвотой, учащением стула до 10-15 раз в день. Стул жидкий, водянистый, зеленоватого цвета, с небольшой примесью слизи. При вторичной стафилококковой инфекции у детей кишечные симптомы развиваются на фоне ведущего заболевания: гнойного отита, пневмонии, стафилодермии, ангины и пр. В этом случае заболевание может принимать длительное волнообразное течение.
Диагностика кишечной инфекции у детей
На основании осмотра, эпидемиологических и клинических данных педиатр (детский инфекционист) может лишь предположить вероятность кишечной инфекции у детей, однако этиологическая расшифровка возможна только на основании лабораторных данных.
Главную роль в подтверждении диагноза кишечной инфекции у детей играет бактериологическое исследование испражнений, которое следует проводить как можно ранее, до начала этиотропной терапии. При генерализованной форме кишечной инфекции у детей проводится посев крови на стерильность, бактериологическое исследование мочи, ликвора.
Определенную диагностическую ценность представляют серологические методы (РПГА, ИФА, РСК), позволяющие выявлять наличие Ат к возбудителю в крови больного с 5-х суток от начала болезни. Исследование копрограммы позволяет уточнить локализацию процесса в ЖКТ.
При кишечной инфекции у детей требуется исключить острый аппендицит, панкреатит, лактазную недостаточность, дискинезию желчевыводящих путей и др. патологию. С этой целью проводятся консультации детского хирурга и детского гастроэнтеролога.
Лечение кишечной инфекции у детей
Комплексное лечение кишечных инфекций у детей предполагает организацию лечебного питания; проведение оральной регидратации, этиотропной, патогенетической и симптоматической терапии.
Диета детей с кишечной инфекцией требует уменьшения объема питания, увеличения кратности кормлений, использования смесей, обогащенных защитными факторами, употребление протертой легкоусвояемой пищи. Важной составляющей терапии кишечных инфекций у детей является оральная регидратация глюкозо-солевыми растворами, обильное питье. Она проводится до прекращения потерь жидкости. При невозможности перорального питания и употребления жидкости назначается инфузионая терапия: внутривенно вводятся растворы глюкозы, Рингера, альбумина и др.
Этиотропная терапия кишечных инфекций у детей проводится антибиотиками и кишечными антисептиками (канамицин, гентамицин, полимиксин, фуразолидон, налидиксовая кислота), энтеросорбентами. Показан прием специфических бактериофагов и лактоглобулинов (сальмонеллезного, дизентерийного, колипротейного, клебсиеллезного и др.), а также иммуноглобулинов (антиротавирусного и др.). Патогенетическая терапия предполагает назначение ферментов, антигистаминных препаратов; симптоматическое лечение включает прием жаропонижающих, спазмолитиков. В период реконвалесценции необходима коррекция дисбактериоза, прием витаминов и адаптогенов.
Прогноз и профилактика кишечной инфекции у детей
Раннее выявление и адекватная терапия обеспечивают полное выздоровление детей после кишечной инфекции. Иммунитет после ОКИ нестойкий. При тяжелых формах кишечной инфекции у детей возможно развитие гиповолемического шока, ДВС-синдрома, отека легких, острой почечной недостаточности, острой сердечной недостаточности, инфекционно-токсического шока.
В основе профилактики кишечных инфекций у детей – соблюдение санитарно-гигиенических норм: правильное хранение и термическая обработка продуктов, защита воды от загрязнения, изоляция больных, проведение дезинфекции игрушек и посуды в детских учреждениях, привитие детям навыков личной гигиены. При уходе за грудным ребенком мама не должна пренебрегать обработкой молочных желез перед кормлением, обработкой сосок и бутылочек, мытьем рук после пеленания и подмывания ребенка.
Дети, контактировавшие с больным кишечной инфекцией, подлежат бактериологическому обследованию и наблюдению в течение 7 дней.
Роль кишечной палочки в норме и патологии у ребенка Текст научной статьи по специальности «Фундаментальная медицина»
ОБЗОРЫ
УДК 576.851.48:616—053.2
РОЛЬ КИШЕЧНОЙ ПАЛОЧКИ В НОРМЕ И ПАТОЛОГИИ У РЕБЕНКА
Ю.А. Тюрин, В.А. Анохин
Кафедра детских инфекций (зав.— проф. В.А. Анохин) Казанского государственного медицинского университета
Колифлора — составная часть аэробного спектра нормальной микрофлоры кишечника [21], и она всегда представлена типовым видом аэробных грамотрицательных микроорганизмов, относящихся к семейству Enterobacteriaceae рода Escherichia [15, 32], в составе которого рассматривают только один вид — Е. coli [8, 9]. Кишечная палочка (КП), как и другие представители нормальной флоры толстой кишки, постоянно ферментирует лактозу [16], не имеет уреазы и, в отличие от протея и псевдомонад, не обладает оксидазной активностью [13]. На основе данных антигенной структуры в 1947 г. была создана дифференциально-диагностическая схема Kauffmann— Knipschildt—Uahlne [8], позволившая дополнительно выделить КП, ответственные за групповую заболеваемость диареей детей — так называемые энтеропатогенные (в последующем энте-роинвазивные, энтеротоксигенные, энтерогемор-рагические, энтероадгезивные) Е. coli.
КП выделяются из дистальных отделов желудочно-кишечного тракта (ЖКТ). По данным Simon и др. [20], энтеробактерии практически не выделяются из содержимого проксимальных отделов ЖКТ человека. Количественное содержание бактерий этого семейства по отделам следующее: в 1 мл содержимого желудка — 0—102 КОЕ, тощей кишки — 0—103, подвздошной кишки —
О—102—106 , толстой кишки — 104—1010 [20]. По данным микробиологического исследования материала тонкого кишечника, Е. coli является, как правило, составной частью полостной микрофлоры, значительно реже — пристеночной [21].
В отличие от тотального расселения лактобактерий по ЖКТ, эшерихиям в здоровом организме свойственны определенные экологические ниши: прежде всего это толстая кишка, в меньшей степени дистальные отделы тонкой кишки [20, 21]. Обнаружение КП или представителей других родов энтеробактерии в желчи, дуоденальном содержимом, содержимом желудка и в ротовой полости свидетельствует о дисбиозе этих отделов пищеварительного тракта [13], связанном, как правило, с контаминацией этих отделов ЖКТ из толстого кишечника [3]. Это положение в определенной мере подтверждает повышенная продукция секреторных антиэшерихиозных 1gA в полость тонкого кишечника [13, 46], поскольку защита против энтеробактериальной агрессии обеспечивается целым рядом гуморальных факторов, первостепенная роль среди которых принадлежит иммуноглобулинам этого класса [17, 30].
Антагонистическая активность эшерихий [49] в отношении к другим микробам [4], их роль в метаболических процессах и в регуляции моторной функции кишечника [21] макроорганизма традиционно известны. Реальным подтверждени-
ем значимости колифлоры в поддержании микробиоценоза толстой кишки стали результаты клинического использования широко известных в отечественной практике колибактерина и би-фикола [19]. Формирование защитной популяции КП в кишечнике ребенка тесно связано с грудным вскармливанием [13].
По данным современных исследований, наличие в кишечнике бактерий таких родов нормальной флоры, как Escherichia, Enterococcus, Lactobacillus [58], Bifidobacterium, их количество и видовой спектр целиком и полностью определяются генотипом макроорганизма [5].
Другие представители семейства энтеробактерий (Proteus, Enterobacter, Citrobacter, Klebsiella) в составе нормального микробиоценоза обнаруживаются в сравнительно небольшом количестве (до 104—105 микробных тел в грамме кала). Они не вызывают развития каких-либо патологических явлений со стороны стенки кишки и, более того, локализуются преимущественно в просвете толстого кишечника (входят в состав полостной флоры) [19]. Присутствие родов таких бактерий, как Clostridium и Citrobacter, обусловлено практически равнозначным влиянием гено- и паратипических составляющих [5]. Встречаемость всех остальных изученных родов бактерий находится под контролем среды [5]. Вместе с тем Escherichia coli — один из видов семейства энтеробактерий, ответственный за самый широкий спектр патологических процессов у человека: от классических диарейных заболеваний [24] (острых кишечных заболеваний) до генерализованных, диссеминированных процессов типа коли-сепсиса [43] или колибациллярного менингита [8, 32]. Более трети всех бактериальных госпитальных инфекций вызваны мультирезистен-тной КП [32]. Выявлены пенициллиназная активность у КП, а также штаммы, резистентные к антибиотикам группы резерва, например к ри-фампицину [11, 18]. В целом же необходимо отметить, что какие-либо морфологические, ферментативные и культуральные признаки, определяющие патогенность E. Coli, отсутствуют [8]. Однако на современном этапе развития методов генодиагностики [6] экспериментально предложены тесты определения с помощью ПЦР-ре-акции факторов патогенности, например термостабильного и термолабильного энтеротоксина у энтеропатогенных штаммов E. coli, продуцирующих эти токсины в низких концентрациях in vitro и не определяемых биологическими методами [25].
Вирулентность и патогенность определяются в каждой серогруппе эшерихий возможностями образования токсинов (шигатоксин, веротоксин, энтеротоксин) [28, 42, 44], гемолизинов [34],
4. ’’Казанский мед. ж.”, № 1.
49
факторов адгезии [23] и инвазии [38], цитотокси-ческих некротических факторов (CNF1, CNF2) [40], а также наличием факторов колонизации, связанных у эшерихий со множеством фимбрий [8, 36]. Показано повреждающее воздействие шига- и веротоксинов на эндотелий почечных сосудов [45]. В Италии опубликованы данные о выделении из кишечника крупного рогатого скота веротоксинпродуцирующих E. coli 0157, ответственных за развитие диарейных заболеваний и такого грозного осложнения болезни, как ге-молитико-уремический синдром у человека [28].
Установлено, что при эшерихиозе наибольшее патогенное значение в развитии заболевания имеет система защиты эшерихий, связанная с К-антигеном, колицинами, и наличие у эшерихий собственных агрессивных веществ (токсинов, гемолизинов), обусловленных плазмидами Ent, Н1у, а также фимбриями, которые детерминируются у эшерихий факторами CFA/1, CFA/
II. Именно эти факторы ответственны за способность эшерихий колонизировать кишечник человека [8, 26]. Немаловажное значение фим-
брии имеют в процессе колонизации и размножения в кишечнике энтеротоксигенных КП в ранней фазе патогенеза эшерихиоза, но при этом установлено, что гены FasH, FasA, будучи активаторами транскрипции фимбриального протеина (Р987) энтеротоксигенной КП, регулируются внешними стимулами кишечной среды: pH, градиентами азота и углерода, температурой [33]. Однако даже неагрессивная, нормальная КП становится потенциально опасной при ее попадании, росте и размножении в нетипичных экологических нишах [3, 37]. Данный результат
может быть частично объяснен переходом ави-рулентных E. coli, получивших участок генома, содержащего гены, ответственные за адгезию от энтеропатогенных Escherichia coli, в типы, образующие белковые факторы вирулентности [41].
Одной из важнейших функций ЖКТ является его участие в формировании общей иммунобиологической реактивности организма [13, 31]. Это определяется тесным взаимодействием им-мунокомпетентных образований, ассоциированных с кишечником (так называемая GALT-система), с населяющими его бактериями, вирусами, одноклеточными и многоклеточными паразитами, а также присутствующими в химусе чужеродными макромолекулами с антигенными свойствами [13, 39].
Микроэкологическая система пищеварительного тракта — открытый биоценоз [15]. С общебиологической точки зрения совокупность популяций разных видов микроорганизмов, обитающих в биотопе ЖКТ, — самая большая среди микробиоценозов внутренних сред организма [21]. Их состав зависит от условий обитания, миграционного потока с соседних биотопов, изменчивости микробов, типа и выраженности внутривидовых взаимоотношений и т.д. [15]. Непрерывный поток антигенных раздражителей, исходящий как из микробной биопленки, выстилающей слизистую кишечника [31], так и из химуса, содержащего чужеродные макромолекулы с антигенными свойствами [13], оказывает
стимулирующее влияние на иммунный ответ к большому спектру антигенов [29]. Исследования по сравнительному содержанию \gA, IgG, IgM к антигенам энтеробактерий (Proteus mirabilis, Escherichia coli, C ampylobacter jejuni, Salm. typhimurium и Salm. enteritidis, Yersinia enterocolitica и Klebsiella pneumoniae капсульные серотипы 31 и 43) в сыворотке крови больных с ревматоидным артритом и у здоровых показали сходный уровень антител класса IgG как у больных, так и у здоровых, в то время как различия в уровнях антител классов IgM и 1 gA были существенными [27].
Еще одной иллюстрацией механизмов стимулирующего влияния является взаимодействие кишечных эпителиальных клеток (Т84) с энте-ропатогенными E. coli, что приводит к активации ядерного фактора транскрипции (NF-kB) интерлейкина-8 [47], одного из группы медиаторов, влияющих на пролиферацию, дифферен-цировку и функцию иммунокомпетентных кле-
т[]
Компоненты клеточных стенок грамотрица-тельных бактерий семейства Enterobacteriaceae -липополисахарид (ЛПС) [11] и пептидоглика-ны, высвобождающиеся при гибели и размножении микроорганизмов, обладают широким спектром биологических эффектов [1, 17, 21, 35]. ЛПС грамотрицательных бактерий явля-
ется одним из самых мощных биологических агентов, способных стимулировать целый комплекс систем организма (система комплимента, клетки миелоидного ряда, несущие специфические рецепторы к ЛПС), формирующих антимикробную [17] и антиэндотоксиновую защиту, направленную на локализацию инфекционного процесса, предупреждение диссеминации возбудителя и его элиминацию [14].
Пептидогликаны грамотрицательных бактерий способны оказывать адъювантный и мито-генный эффекты [17], индуцировать реакции клеточного иммунитета, формируя в определенной мере резистентность к патогенным и условно-патогенным бактериям [2]. Эти антигенные структуры (при их использовании в больших дозах in vitro) способны вызывать неспецифическую поликлональную активацию иммунных клеток [2]. Пептидогликаны КП оказывают воздействие также на гранулоциты крови опосредованно через комплекс опсонинов [2]. 1п vitro показано, что пептидогликан E. coli стимулирует образование лимфоцитами человека факторов, активирующих кислородзависимый метаболизм нейтрофилов (НСТ-л) [2].
При экспериментальном дисбактериозе кишечника у мышей отмечалось, в частности, снижение Fc-зависимого связывания эндотоксина полиморфно-ядерными лейкоцитами крови [22]. В исследованиях отечественных авторов показано, что при дисбактериозах кишечника наблюдается отчетливо выраженное снижение показателей гуморального антиэндотоксинового иммунитета, причем утрачиваются резервы связывания эндотоксина лейкоцитами [12].
Гуморальные факторы иммунной защиты организма — антитела и комплимент, а также
комплементне зависимые и антителонезависимые компоненты и механизмы играют значительную роль в защите организма от инкапсулированных бактерий (Е. coli, K1ebsie11a) [2, 17]. Опсоничес-кая активность антител и компонентов комплемента проявляется неодинаково. У взрослых доноров главную роль играют антитела, значение комплемента выражено слабо, у новорожденных же ведущая роль принадлежит компонентам системы комплемента, ответственным за развитие реакций альтернативного пути активации при низком содержании или полном отсутствии антител [2]. В отдельных публикациях по результатам исследований указывается на возможную связь состояния гуморального иммунитета к эндотоксину грамотрицательных бактерий с развитием кишечного дисбактериоза [7]. Клеточная стенка энтеробактерий представляет собой биогетерополимер. Основой клеточной стенки является уже упомянутый выше пептидогликан. Доказана возможность выделения этого антигена энтеробактериями во внешнюю среду в виде так называемых неполимеризованных блоков, а также после разрушения бактериальными и тканевыми ферментами клеточной стенки [17, 21]. Иммунная система эволюционирует в интимной и постоянной связи с микроорганизмами, которые всегда присутствуют в пищеварительной системе, респираторном тракте, на коже, возможно, и в других органах [17]. Можно ожидать, что таким образом индуцируется естественный иммунный ответ Т-клеток, подвергающихся действию этой нормальной бактериальной флоры, и персистируют естественно сенсибилизированные Т-лимфоциты, способные ответить гиперпродукцией макрофаг активирующих факторов в случае нарушения равновесия с определенной инфекционной флорой [17].
Особенно многообразны проявления действия ЛПС на иммунную систему [21]. Прежде всего сам ЛПС является высоко иммуногенным агентом, относящимся к так называемым тимусне-зависимым антигенам. Он способен вызывать неспецифическую пролиферацию (митогенный эффект) и дифференцировку (поликлональный эффект) В-клеток in vivo и in vitro. ЛПС повышает естественную резистентность к инфекциям [17]. Низкие дозы ЛПС стимулируют почти все функции нейтрофила и макрофага: хемотаксис, респираторный взрыв, фагоцитоз, бактерицидность [17]. ЛПС Е. coli в дозе 40—60 нг/мл увеличивает фагоцитоз в 2—4 раза через неопсоническое связывание и метаболизм фагоцитов [2, 17]. Выделение нейтрофилстимулирующих лимфокинов не зависит от моноцитов, в основном связано с Т-клетками и является результатом специфической сенсибилизации лимфоцитов [2].
Таким образом, КП служит одним из ключевых факторов, определяющих поддержание нормального микробиоценоза у ребенка. Уникальность этого микроорганизма состоит в том, что он отвечает, с одной стороны, за многие физиологические процессы, а с другой — за формирование классической инфекционной патологии.
При сравнительно небольшом содержании (относительно биомассы анаэробов кишечника)
роль КП исключительна: с участием нормальных эшерихий формируется и поддерживается в достаточно активном состоянии антибактериальный гуморальный и клеточный иммунитет, благодаря ей обеспечивается ряд жизненно важных функций толстого кишечника. В то же время проявление возможных патогенных свойств у эше-рихий может привести к развитию грозных, мало управляемых бактериальных воспалительных процессов у ребенка. Мультирезистентная к действию антибактериальных средств КП была, есть и, видимо, в ближайшее время останется одной из основных причин госпитальных инфекций.
ЛИТЕРАТУРА
1. Анохин В. А. Патогенетическое значение эн-дотоксинемии и изменений активности систем антитоксической защиты при острых респираторных вирусных инфекциях у детей: Автореф. дисс. … докт. мед. наук. — М., 1994.
2. Азов Н. А. Иммунологическая характеристика пептидогликана кишечной палочки в системе фагоцитоза: Автореф. дисс. … канд. мед. наук.
— Казань, 1986.
3. Валышев А. В., Гильмутдинова Ф. Г. и др. // Журн. микробиол.—1997.— № 4.— С. 87—88.
4. Воробьев А. А., Быков А. С. и др. Микробиология: Учеб. —М., 1984.
5. Воробьев А. А., Несвижский Ю. В. и др.// Журн. микробиол. — 1995. — № 4. — С. 30 — 35.
6. Гинцбург А. Л. // Журн. микробиол. — 1998.— № 3.— С. 86—95.
7. Гладько И. А. и др. // Иммунология. — 1993.
— № 2. — С. 56 — 59.
8. Голубева И. В., Килессо В. А. и др. Энтеробактерии: Руководство для врачей.—М., 1985.
9. Гусев М. В., Минеева Л. А. Микробиология: Учеб. для биол. спец. ун-тов. — 3-е изд. — М., 1992.
10. Захарова И. Я. Эндотоксины — О-антиге-ны кишечной палочки. — Киев, 1980.
11. Кабаков В. Е., Клячко Н. Л., Левашов А. В. / / Биохимия. — 1995. — № 5. — С. 791—797.
12. Качурко Л. И.., Лиходед В. Г. и др. // Журн. микробиол.— 1998. — № 5. — С. 25.
13. Куваева И. Б., Ладодо К. С. Микроэколо-гические и иммунные нарушения у детей: Диетическая коррекция. АМН СССР. — М., 1991.
14. Молов В. А., Пак С. Г. // Вестн. росс. акад. мед. наук. — 1997. — № 8. — С. 33 — 38.
15. Мусина Л. Т. Основные понятия экологии микроорганизмов. — Казань, 1997.
16. Павлович С. А. Медицинская микробиология в графах: Учебное пособие. —1986.
17. Покровский В. И., Гордиенко С. П., Литвинов В. И. Иммунология инфекционного процесса: Руководство для врачей.— М., 1993.
18. Смирнов И. В., Евдокимова О. В. и др. // Антибиот. и химиотер. —1995. — 40. — № 2. — С. 27 —31.
19. Субботина М. Д., Тимченко В. Н. и др. Дисбактериоз кишечника у детей и микроэкологи-ческие подходы к его коррекции. — Учебно-методическое пособие. — Спб, 1997.
20. Уголев А. М. Теория адекватного питания и трофология. — Л., 1991.
21. Шендеров Б. А. Медицинская микробная
5 1
экология и функциональное питание. Toм 1: Микрофлора человека и животных и ее функции. —
М., 1998.
22. Яковлев М. Ю., Aнuxовская И. A, и др. Ak-туальные проблемы общей и частной патологии.
— М., 1993.
23. Якушенко О. C., Aбукова В. В. и др. // Ak-туальные вопросы инфекционной патологии: C6. науч. тр. — Нальчик., 1993. — C. 27 —31.
24. Aihaгa M.// Rinsho-Byon. — 1997. — Vol. 45.
— P. 421—426.
25. Alexa P., Rychlik I., Nejezchleh A., Hamгik J./ / Vet. Med. Pmha. — 1997. — Vol. 42. — P. 97—100.
26. Cassels F.J., Jaгhoe D.L. et al.// J. Ind.
Micmbiol-iotechnol. — 1997. — Vol. 19. — P. 66—70.
27. Chou C.T., Uksila J., Toivanen P.// Clin. Exp. Rheumatol. — 1998. — Vol. 16. — P. 161 — 164.
28. Conedeгa G., Marangon S. et al.// Zentralbl. Vetennarned. B. — 1997. — Vol. 44. — P. 301—306.
29. Crahhe F.A., Basin H. et al.// Int. Arch. Afcgy.
— 1968. — Vol . 34. — P. 362—375.
30. Diehel L.N., Liheгati D.M. et al.// J. Suig. Res.
— 1997. — Vol. 69. — P. 178—182.
31.Duchmann R., Neurath M., Maгkeг-Heгmann E., Meyer-Zum-Buschenfelde K.H. // Z. Gastroenterol.
— 1997. — Vol. 35. — P. 337—346.
32. Eherlin Therry// Les infections microbiennes. -1997. — T. 1: Agent infectieus./ Ouvrage publie sous la diïection de E. Perilleux. Pans: Nathan, 1997. — P. 9—16.
33. Edwards R.A., Schifferli D.M.// Mol. Microbiol.
УДК 616.936.1—092
— 1997. — Vol. 25. — P. 797—809.
34. Elliott S.J., Srinivas S. et al.ff Infect. Immun.
— 1998. — Vol. 66. — P. 2040—2051.
35. Hellstrom P., al-Saffar A. et al.f f Dig. Dis. Sci.
— 1997. — Vol. 42. — P. 1640—1651.
36. Hicks S., Frankel G. et al.ff Infect. Immun. -1998. — Vol. 66. — P. 1570—1578.
37. Johnson J.R., Brown J.J. et al.ff J. Inf. Dis. -1998. — Vol. 177. — P. 1120—1124.
38. Kaper J.B., McDaniel T.K. et al.ff Adv. Exp. Med. Biol. — 1997. — Vol. 412. — P. 279—287.
39. Khoo U.Y., Proctor I.E., Macpherson A.J.ff J. Immunol. — 1997. — Vol. 158. — P. 3626—3634.
40. Mainil J.G., Jacquemin E. et al.ff Can. J. Vet. Res. — 1997. — Vol. 61. — P. 193— 199.
41. McDaniel T.K., Kaper J.B.f f Mol. Microbiol. -1997. — Vol. 23. — P. 399—407.
42. Nandi A., Bhandari R., Visweswariah S.S.ff J. Cell. Biochem. — 1997. — Vol. 66. — P. 500—511.
43. O’Boyle C.J., MacFie J. et al.ff Gut. — 1998. -Vol. 42. — P. 29—35.
44. Paton A.W., Voss E., Manning P.A., Paton J.C.f f Microb. Pathog. — 1998. — Vol. 24. — P. 57—63.
45. Sandvig K., Garred O., van-Deurs B.f f Adv. Exp. Med. Biol. — 1997. — Vol. 412. — P. 225—232.
46. Sarrazin E., Bertschinger H.U.f f Vet. Microbiol.
— 1997. — Vol. 52. — P. 133—144.
47. Savkovic S.D., Koutsouris A., Hecht G.ff Am. J. Physiol. — 1997. — Vol. 273. — P. 1160—1167.
48. Schiffrin E.J., Brassart D. et al.ff J. Clin. Nutr.
— 1997. — Vol. 66. — P. 515—520.
49. Stoicheva M., Argirova P.f f Folia. Med. Plovdiv.
— 1997. — Vol. 39. — P. 87—92.
Поступила 04.05.00.
О ПАТОГЕНЕЗЕ ТРОПИЧЕСКОЙ МАЛЯРИИ
А.Ф. Попов, В.С. Мороков , В.П. Чирков
Поликлиника со стационаром при ПОСОЛЬСТВЕ РФ в Гвинейской республике (главврач — А.Ф.Попов), кафедра инфекционных болезней (зав. — проф. В.Х. Фазылов) Казанского государственного медицинского университета
В патогенезе тропической малярии наибольший интерес представляют следующие тесно взаимосвязанные аспекты:
1. Молекулярные механизмы проникновения плазмодиев в клетки хозяина, реализуемые посредством мембранных рецепторов.
2. Патологические феномены, связанные с нарушением состояния эритроцитов (розетинг, цитоадгезия, секвестрация в микроваскулярном русле), также зависящие от активации поверхностных лигандов — адгезивных рецепторов.
3. Действие эндотоксинов (перекисей, лей-котриенов, протеаз), вызывающее нарушения гомеостаза и определяющее поливисцеральную симптоматику тропической малярии.
4. Иммунный ответ хозяина и возникновение аутоиммунных поражений органов.
Сразу после внедрения в кровеносную систему человека при комарином укусе спорозоиты попадают в синусоидальные пространства печени и инфицируют гепатоциты. Внутрипече-
ночная фаза характеризуется размножением па-
разитов с высвобождением тканевых мерозоитов. Она длится около одной недели и соответствует инкубационному периоду. Мерозоиты накапли-
ваются в кровеносном русле и инфицируют эритроциты. При достижении пирогенного порога паразитемии начинается период явных клинических проявлений малярии [4]. Клеточная инвазия связана с наличием на поверхности плазмодиев циркумспорозоитного белка (ЕВА-175), содержащего последовательность аминокислот, получившую название “район II”. Рецепторами этого белка на мембране эритроцитов являются гликофорины А и В [5], а на мембране гепатоци-тов — тромбо-спондин и гепарансульфат-проте-огликаны [11]. Инвазию гепатоцитов можно блокировать конкурентным ингибированием клеточных рецепторов липопротеинами и кишечными хиломикронами, проникающими в гепато-цит через эти же рецепторы [28]. Блокирующий эффект можно также получить с помощью моноклональных антител против района II белка ЕВА-175, что открывает перспективу создания эффективной противомалярийной вакцины, действующей на ранней стадии инвазии [15].
Значительная роль в патогенезе тропической малярии отводится адгезии эритроцитов друг с другом и на эндотелии микрососудов. Цитоадгезия вызвана наличием на поверхности эритро-
Дисбактериоз кишечника — Клиника Здоровье 365 г. Екатеринбург
Микробиоцеоз – это сообщество микроорганизмов, обитающих на территориально ограниченном участке с однородными условиями жизни. Бактерии нормальной кишечной флоры живут, прикрепляясь к кишечной стенке и образуя пленку, покрывающую кишечник изнутри. Через эту пленку происходит все всасывание в кишечнике. Бактерии нормальной кишечной микрофлоры обеспечивают по совокупности 50 – 80% всего пищеварения, а также выполняют защитные функции, нейтрализуют действие чужеродных и гнилостных бактерий. Бифидобактерии. Это основные представители нормальной кишечной микрофлоры, количество которых в кишечнике должно быть 95 – 99%. Бифидобактерии выполняют важную работу по расщеплению, перевариванию и всасыванию различных компонентов пищи, например, углеводов; они сами синтезируют витамины, а также способствуют усвоению их из пищи. При участии бифидобактерий происходит всасывание в кишечнике железа, кальция и других важных микроэлементов; нейтрализуют различные токсические вещества. В бланке анализа указывается титр бифидобактерий, который должен быть не меньше 107 – 108. Существенное снижение количества бифидобактерий – признак выраженного дисбактериоза.
Лактобактерии (лактобациллы, молочнокислые микробы, молочнокислые стрептококки).
Второй по представительству (5% в совокупности микроорганизмов кишечника) и по значимости представитель нормальной флоры. Лактобактерии или молочнокислые микробы вырабатывают молочную кислоту – важнейший компонент для нормальной работы кишечника. В результатах исследования их количество должно быть не меньше 106 – 107. Дефицит лактобактерий может привести к развитию аллергических заболеваний, запоров, лактазной недостаточности.
Кишечная палочка с нормальной ферментативной активностью (эшерихии).
Третий представитель нормальной флоры. Количество кишечной палочки среди других бактерий не превышает 1%, но роль ее очень важна. Во-первых, кишечная палочка является главным конкурентом условно-патогенной флоры, препятствуя заселению чужеродными микробами кишечной стенки; во-вторых, кишечная палочка забирает из просвета кишечника кислород, который является ядом для бифидобактерий и лактобактерий. Снижение общего количества кишечной палочки может быть признаком присутствия в кишечнике небактериальных паразитов (глистов, простейших, которые также нуждаются в кислороде, обделяя им кишечную палочку). Кишечная палочка со сниженной ферментативной активностью. Это неполноценная кишечная палочка, которая не представляет никакого вреда, но при этом не выполняет своих полезных функций. Присутствие данного показателя в анализе является признаком начинающегося дисбактериоза, а также как и снижение общего количества может быть косвенным признаком присутствия в кишечнике глистов или простейших.
В некоторых анализах описываются бактероиды, роль которых неясна, но известно, что это – не вредные бактерии, обычно их количество не имеет практического значения. Все остальные показатели микрофлоры являются условно-патогенной флорой. Они становятся патогенными (нарушающими нормальные функции кишечника) при определенных условиях: повышение их абсолютного количества или снижении функции иммунной системы.
Условно-патогенная флора – это лактозонегативные энтеробактерии (клебсиелла, протей, цитробактеры, энтеробактеры, гафнии, серрации), гемолизирующая кишечная палочка и различные кокки (энтерококки, эпидермальные или сапрофитные стафилококки, золотистый стафилококк). Кроме того, к условно-патогенным относятся клостридии, которые высеваются не во всех лабораториях. Условно-патогенная флора внедряется, конкурируя с полезными бактериями, в микробную пленку кишечника, заселяет кишечную стенку и вызывает нарушения работы всего желудочно-кишечного тракта. Дисбактериоз кишечника с повышенным содержанием условно-патогенной флоры может сопровождаться аллергическими кожными реакциями, нарушениями стула (запоры, поносы, зелень и слизь в кале), болями в животе, вздутиями живота, срыгиваниями, рвотами.
Кокковые формы в общей сумме микробов.
Самыми безобидными представителями условно-патогенной флоры являются энтерококки. Они наиболее часто встречаются в кишечнике у здоровых людей, их количество до 106 — 107 не представляет угрозы здоровью. Если количество превышает 25% (более 107), это чаще всего связано со снижением нормальной флоры. Эпидермальный (или сапрофитный) стафилококк (S. epidermidis, S. saprophyticus). Эти виды стафилококков могут вызывать нарушения, но их количество до 104 является допустимым. Золотистый стафилококк (S. aureus). Один из самых неприятных (наряду с гемолизирующей кишечной палочкой, протеем и клебсиеллой) представителей условно-патогенной флоры. Даже небольшие его количества могут вызвать выраженные клинические проявления, особенно у детей первых месяцев жизни. Поэтому обычно в нормах, приведенных в бланке анализа, указывается, что его быть не должно (на самом деле допустимы количества, не превышающие 103). Патогенность золотистого стафилококка напрямую зависит от состояния нормальной флоры: чем больше бифидобактерий, лактобактерий и нормальной кишечной палочки, тем меньше вреда от стафилококка. Гемолизирующая кишечная палочка. Является представителем лактозонегативных энтеробактерий, но выделяется отдельно в связи с распространенностью и значимостью. В норме должна отсутствовать. К данному микробу применимо практически все, сказанное про золотистый стафилококк. То есть, она может вызывать аллергические и кишечные проблемы, очень распространена в окружающей среде (правда, практически никогда не встречается в грудном молоке), вызывает проблемы у ослабленных детей, требует иммунокоррекции. Следует отметить, что термин “гемолизирующая” не означает, что имеется какое-то влияние на кровь. Лактозонегативные энтеробактерии. Большая группа условно-патогенных бактерий большей или меньшей степени патогенности. Их количество не должно превышать (в титрах: 103 – 106 ). Наиболее неприятными бактериями из этой группы являются протей (чаще всего с ними связаны запоры) и клебсиеллы (являются прямыми антагонистами (конкурентами) лактобактерий, что приводит к развитию аллергии и запоров, а также к проявлениям лактазной недостаточности). Часто в бланке анализа указывается общее количество лактозонегативных энтеробактерий (наиболее информативно процентное соотношение), а затем идет расшифровка: клебсиеллы, протей, хафнии, серрации, энтеробактерии и цитробактерии. Обычно какие-то количества этих бактерий постоянно живут в кишечнике, не вызывая проблем. В нормах могут быть указаны цифры от 104 до 105, являющиеся допустимыми.
Грибы рода Candida.
Допустимо присутствие до 103. Повышение этого параметра может быть после применения антибиотиков. Если количество грибов повышено, а количество нормальной кишечной флоры резко снижено, при этом отмечается кандидоз (молочница) видимых слизистых оболочек (ротовая полость, половые органы) – это проявления системного кандидоза, то есть имеется инфицирование грибами кишечника. Если же количество грибов в анализе на дисбактериоз увеличено, но нет снижения нормальной кишечной флоры, это свидетельствует о том, что грибы живут на коже вокруг заднего прохода, а не в кишечнике, в этом случае достаточно наружной терапии с использованием противогрибковых мазей или кремов.
Клостридии. Допустимое количество до 105. Проявляют патогенность обычно в комплексе с другой условно-патогенной флорой, редко изолированно вызывают проблемы (чаще всего – разжижение стула, понос). Их количество зависит от функции местного иммунитета кишечника.
Прочие микроорганизмы.
В данном параметре описываются редко встречающиеся виды бактерий, самым опасным из которых является синегнойная палочка (Pseudomonas aerugenosa). Чаще всего, микроорганизмы, описанные в этой позиции, не имеют практического значения. Термин “abs” обозначает отсутствие данного микроорганизма, также употребляется “не обнаружено”.
Возможности коррекции нарушений микробной колонизации кишечника у детей первого года жизни | Самсыгина Г.А., Буслаева Г.Н., Овечкина Н.В., Кац Т.Г., Никандрова Л.Я.
Для цитирования: Самсыгина Г.А., Буслаева Г.Н., Овечкина Н.В. и др. Возможности коррекции нарушений микробной колонизации кишечника
у детей первого года жизни. РМЖ. 2005;18:1215.
Под кишечным дисбактериозом подразумевают изменение кишечной микрофлоры, характеризующееся снижением общего количества типичной кишечной палочки, бифидобактерий и лактобактерий и появлением лактозонегативных эшерихий, гемолизирующих кишечных палочек, увеличением количества гнилостных, спороносных, гноеродных и других бактерий.
Нарушение микробной колонизации – частое состояние у новорожденных и детей первого года жизни. В детском возрасте склонность к более быстрому и легкому развитию кишечного дисбактериоза связана, прежде всего, с ферментативной, иммунной и двигательной незрелостью кишечника. Во–вторых, – с более частыми острыми инфекционными заболеваниями, особенно свойственными раннему детскому возрасту. При них желудочно–кишечный тракт, так или иначе, вовлекается в общий инфекционный процесс, а в лечении часто используются антибиотики. В третьих, в детском возрасте микроэкологическая система кишечника переживает период становления и адаптации к расширяющейся пищевой нагрузке. Это делает саму микроэкологическую систему нестабильной и особо уязвимой по отношению к воздействию неблагоприятных факторов.
В то же время роль нормального биоценоза кишечника чрезвычайно велика и многообразна. Во–первых, в силу своих антагонистических по отношению к патогенным кишечным микроорганизмам свойствам, нормальная кишечная микрофлора является одним из основных факторов противоинфекционной защиты организма. Во–вторых, нормальная микрофлора способствует образованию короткоцепочечных жирных кислот, которые, являясь основными энергоносителями, обеспечивают нормальную трофику слизистой кишечника, снижают его проницаемость по отношению к различным антигенам. Ферменты нормальной микрофлоры участвуют в деконьюгации желчных кислот, преобразовании первичных желчных кислот во вторичные, большая часть из которых реабсорбируется, а меньшая определяет уровень гидратации кала и, соответственно, нормальный транзит каловых масс по кишечной трубке, и адекватный акт дефекации. Избыточное микробное обсеменение тонкой кишки, свойственное дисбактериозу, способствует преждевременной и избыточной деконъюгации желчных кислот и вызывает разжижение стула (секреторная диарея). С другой стороны, нарушение обмена желчных кислот при дефиците секреторного иммуноглобулина А, отмечаемого при нарушениях микрофлоры кишечника, и индигенной флоры может привести к нарушению функции печени.
Период становления кишечного биоценоза не ограничивается только неонатальным периодом жизни ребенка. У 85–90% детей он продолжается на протяжении всего первого года жизни, а у 10–15%, по–видимому, охватывает еще больший по продолжительности период жизни.
В связи с этим встает вопрос о целесообразности и необходимости коррекции микробиологических изменений, нередко обнаруживаемых при обследовании грудных детей. В настоящее время, когда медицинская практика располагает большим арсеналом препаратов и пищевых добавок с пробиотическим и пребиотическим действием, это далеко не праздный вопрос. Не секрет, что диагноз «дисбактериоз» является «расхожим» диагнозом, оправдывающим длительное, нередко малооправданное и малоэффективное назначение пробиотиков.
Нами изучена сравнительная клинико–лабораторная эффективность препаратов Линекс (пробиотик, содержащий лиофилизированные бактерии – Lactobacillus acidophilus, Bifidobacterium infantis v. liberorum, Streptococcus faecium), бифидумбактерин (пробиотик, содержащий только Bifidobacterium bifidum, а также лактозу), и хилак форте (пребиотик, содержащий продукты обмена Escherichia coli, Streptococcus faecalis, Lactobacillus acidophilus и Lactobacillushelvenicus, а также молочную кислоту).
В исследование были включены дети в возрасте до 1 года.
Критерии включения:
1. Учащение стула:
на естественном вскармливании:
для детей 1–х 6 месяцев жизни – более 6–8 раз в сутки,
для детей 6–12 месяцев жизни – более 4–6 раз в сутки,
на искусственном вскармливании:
для детей 1–х 6 месяцев жизни – более 4–6 раз в сутки,
для детей 6–12 месяцев жизни – более 2–4 раз в сутки;
2. Склонность к запорам:
на естественном вскармливании:
для детей 1–х 6 месяцев жизни – менее 1–2 раз в сутки,
для детей 6–12 месяцев жизни – менее 0–1 раз в сутки,
на искусственном вскармливании:
для детей 1–х 6 месяцев жизни – менее 0–1 раз в сутки,
для детей 6–12 месяцев жизни – 1 раз в 2–3 дня;
3. Диспептический характер стула: консистенция – жидкая, наличие непереваренных комочков, примесь слизи и зелени и др.
4. Сочетание нарушений стула со срыгиваниями и рвотой.
Во время проведения исследования не назначались антибиотики, бактериофаги, антимикотики и смеси, содержащие пробиотики.
Курс терапии составил 21 день. Препараты назначались 3 раза в день в дозировке: Линекс – по 1 капсуле, бифидумбактерин – по 5 доз, хилак форте – по 20 капель.
Всем детям проведено 3–х кратное микробиологическое исследование кала, копрологический анализ кала (до начала приема препарата, через 2 недели после начала приема препарата и через две недели после окончания приема препарата), а также анализ кала на углеводы (для исключения первичной лактазной недостаточности).
Критерии дисбактериоза соответствовали методическим рекомендациям по бактериологической диагностике дисбактериоза кишечника у детей:
I степень – количество бифидобактерий и лактобактерий в границах возрастной нормы, но количество аэробных микроорганизмов увеличено;
II степень – количество бифидобактерий и лактобактерий на нижней границе нормы, а количество аэробных микроорганизмов возрастает;
III степень – бифидо– и лактобактерии не выявляются в исследуемых разведениях, количество аэробных микроорганизмов в пределах нормы или увеличено;
IV степень – выраженные нарушения в соотношении анаэробных и аэробных микроорганизмов; бифидо– и лактобактерии не выявляются в исследуемых разведениях, количество аэробных микроорганизмов нарастает.
Полученные результаты
Все дети (30), которым был назначен Линекс, соответствовали критериям включения в исследование. Их возраст колебался от 19 дней до 10 месяцев. Из них около 1/4 находились на естественном вскармливании, 1/5 – на смешанном, а остальные – на искусственном вскармливании. Чуть меньше половины детей имели склонность к запорам. У остальных – учащенный стул или нормальный по частоте, но разжиженный, с примесью зелени и не переваренных комочков. Срыгивания с частотой более 4–5 раз отмечены лишь у 2–х пациентов, причем необильные, створоженным молоком. У остальных срыгивания также необильные, 1–3 раза в день. Аппетит снижен у 1/3 пациентов, у остальных – сохранен.
При бактериологическом исследовании нарушения микробиоценоза кишечника выявлены у всех. Из них у 27% – III степени, 27% – II степени и у 46% – I степени. Эти нарушения были обусловлены снижением менее 107 или полным отсутствием бифидобактерий у 28% обследованных, снижением лактобактерий ниже 106 вплоть до полного отсутствия – у 41%, снижением общего количества кишечной палочки ниже106 вплоть до полного отсутствия – у 27%, повышением содержания лактозонегативной кишечной палочки более 10% – у 18% и гемолизирующей кишечной палочки более 2% – у 59%, отсутствием энтерококков – у 45% и повышением их содержания более 107 – у 23%, повышением золотистого стафилококка более 103 – у 23%, других видов стафилококков более 106 – у 5%, повышением дрожжеподобных грибов более 104 – у 14%, пролиферацией протея более 103 – у 9%, Klebsiella pneumoniae более 10% – у 18%, Klebsiella oxytocae более 10% – у 5%, Citrobacter более 10% – у 5%.
При исследовании кала в этой группе пациентов было выявлено, что практически у всех определялись мыла, у большинства в небольшом количестве, а у 1/5 – в значительном. У 82% выявлено повышенное содержание слизи. У 1/3 определялись лейкоциты, преимущественно в тяжах слизи, в количестве от 3–5 до 15–20.
Содержание углеводов в кале было в пределах нормы лишь у 30%, у остальных отмечалось повышение от 0,3% до 0,95%. Части пациентов в связи с этим проводилась терапия лактазой.
Через 2 недели после начала терапии зарегистрировано улучшение в клинической картине. У половины пациентов с нарушением частоты стула отмечена тенденция к нормализации: при первоначальном учащении – урежение, а при урежении – учащение, хотя консистенция кала сохранялась измененной. Примерно у 1/3 уменьшилось содержание патологических примесей (не переваренные комочки, слизь) в кале.
При исследовании биоценоза выявлено следующее: увеличилось в 11/2 раза количество пациентов с дисбактериозом I степени. При этом возросло число детей с нормальной концентраций бифидобактерий, лактобактерий, энтерококков. Одновременно несколько снизилась общее количество кишечной палочки при значительном уменьшении лактозонегативной E. coli. Снизилось содержание Klebsiella pneumoniae и Citrobacter, при пролиферации золотистого стафилококка.
Через 2 недели после окончания лечения клиническое улучшение отмечено практически у всех детей. Аппетит полностью нормализовался, срыгивания сохранялись лишь у 3–х детей, необильные, 2–3 раза в день, прибавка в весе достаточная. При первоначально учащенном стуле нормализация частоты произошла у всех, кроме 1–го пациента, у которого в возрасте 7 месяцев стул был 5 раз на смешанном вскармливании. При первоначальной склонности к запорам более чем у половины отмечено учащение или стул стал регулярным. У большинства больных с первоначально разжиженным стулом или склонностью к запорам консистенция нормализовалась, цвет стал желтым, исчезли патологические примеси в виде зелени и непереваренных комочков.
При копрологическом исследовании мыла определялись в меньшем количестве, содержание слизи также уменьшилось, содержание лейкоцитов уменьшилось у всех до 1–10, кроме одного ребенка, у которого отмечено нарастание с 3–5 до 5–10 при отсутствии ухудшения стула и снижении содержания бифидобактерий с 109 до 107.
Исследование биоценоза показало, что полная нормализация биоценоза отмечена у 30% детей. При оценке содержания отдельных микроорганизмов выявлены нормальные концентрации: бифидобактерий – у 65% пациентов, лактобактерий – у 70%, общее количество E.coli – у 75%. Допустимое содержание Klebsiella pneumonia обнаружено у 85%, Klebsiella oxytocae и Citrobacter отсутствовали.
Все дети (30), которым был назначен бифидумбактерин, соответствовали критериям включения в исследование. Их возраст колебался от 3 недель до 10 месяцев. Из них около 3/4 находились на естественном вскармливании, 1/5 – на искусственном вскармливании. Учащенный стул или нормальный по частоте, но разжиженный, с примесью зелени и не переваренных комочков отмечался у 70% пациентов, у остальных – склонность к запорам. Срыгивания с частотой более 4–5 раз отмечены у 30% пациентов, причем необильные, створоженным молоком. У остальных срыгивания также были необильные, 1–3 раза в день. Аппетит снижен примерно у 1/4 пациентов, у остальных – сохранен.
При бактериологическом исследовании нарушения микробиоценоза кишечника выявлены у всех. Из них у 54% – III степени, 15% – II степени и у 31% – I степени. Эти нарушения были обусловлены снижением менее 107 или полным отсутствием бифидобактерий у 54% обследованных, снижением лактобактерий ниже 106 вплоть до полного отсутствия – у 31%, повышением гемолизирующей кишечной палочки до 100% – у 46% (при нормальном общем количестве E. coli), отсутствием энтерококков – у 16% или их избыточной пролиферацией до 109 – у 15, повышением золотистого стафилококка более 103 – у 15%, повышением дрожжеподобных грибов более 104 – у 23%, пролиферацией протея более 103 – у 15%, Klebsiella pneumoniae более 10% – у 23%.
При исследовании кала в этой группе пациентов было выявлено, что практически у всех определялись мыла, но в небольшом количестве. У 69% выявлено повышенное содержание слизи. Более чем у 1/3 детей определялись лейкоциты, преимущественно в тяжах слизи, в количестве от 3–5 до 10–12, у одного – сплошь.
Содержание углеводов в кале было в пределах нормы у 46%, у остальных отмечалось повышение от 0,4% до 0,8%. Части пациентов в связи с этим проводилась заместительная терапия лактазой. У 4 больных с лактазной недостаточностью в связи с ухудшением стула на фоне терапии бифидумбактерином препарат был заменен на Линекс.
Через 2 недели после начала терапии в клинической картине отмечено, что частота стула при изначально учащенном практически не изменилась, а при изначальной склонности к запорам выявлялось учащение на 1 раз в сутки, хотя консистенция кала и содержание патологических примесей (не переваренные комочки, слизь) сохранялись.
При исследовании биоценоза выявлено следующее: уменьшилось до 11% количество пациентов с дисбактериозом III степени и у одного ребенка с биоценоз полностью нормализовался. При этом возросло число детей с нормальной концентраций бифидобактерий, лактобактерий. У 11% пациентов отмечено увеличение общего количества Е.coli до 109. Отмечена тенденция к снижению содержания лактозонегативной и гемолитической кишечной палочки, дрожжеподобных грибов, при пролиферации золотистого стафилококка и протея.
Через 2 недели после окончания лечения клиническое улучшение отмечено практически у всех детей. Аппетит полностью нормализовался, но срыгивания сохранялись у 1/3 детей, необильные, 2–3 раза в день, прибавка в весе достаточная. При первоначально учащенном стуле нормализация частоты произошла у всех, кроме одного пациента. При первоначальной склонности к запорам примерно у половины отмечено учащение стула. У большинства больных с первоначально разжиженным стулом или склонностью к запорам консистенция нормализовалась, цвет стал желтым, но у 4–х пациентов оставалась примесь зелени и не переваренных комочков.
При копрологическом исследовании мыла и слизь определялись в меньшем количестве, количество лейкоцитов уменьшилось, но полностью не нормализовалось. У 2–х детей отмечалось нарастание количества лейкоцитов до 15–20 при отсутствии клинической картины и высоком содержании бифидобактерий – 109.
Исследование биоценоза показало, что биоценоз нормализовался у 33% обследованных детей. Выявлены нормальные концентрации бифидобактерий – у 92% пациентов, лактобактерий – у 84%, общего количества E.coli – у 92% при пролиферации лактозонегативной и гемолизирующей кишечной палочки, золотистого стафилококка, протея, Klebsiella pneumoniae и Citrobacter.
Все дети, которым был назначен хилак форте (30), соответствовали критериям включения в исследование. Их возраст колебался от 5 до 11 месяцев. Из них около половины находилось на смешанном, а половина – на искусственном вскармливании. Нормальный по частоте, но разжиженный, с примесью зелени и не переваренных комочков стул отмечался у 1/2 пациентов, у остальных – склонность к запорам. Срыгивания с частотой до 1–2 раз отмечены у 30% пациентов, необильные, створоженным молоком. Аппетит был снижен примерно у 40% пациентов, у остальных – сохранен.
При бактериологическом исследовании нарушения микробиоценоза кишечника выявлены у всех. Из них у 45% – II степени и у 55% – I степени, III степень не выявлена ни у одного ребенка. Бифидобактерии у всех определялись в нормальной концентрации. Эти нарушения были обусловлены снижением лактобактерий ниже 106 вплоть до полного отсутствия – у 50%, снижением общего количества кишечной палочки – у 33% при повышении гемолизирующей кишечной палочки у 17%, снижением и отсутствием энтерококков – у 34% и их пролиферацией до 108–9 – у 33%, повышением золотистого стафилококка более 103 – у 50%, повышением дрожжеподобных грибов более 104 – у 50%, пролиферацией протея более 103 – у 33%, Klebsiella pneumoniae более 10% – у 17% и Klebsiella oxytocae – у 17%.
При исследовании кала этой группы было выявлено, что у 60% пациентов определялись мыла, но в небольшом количестве. У 40% выявлено небольшое повышенное содержание слизи. Лейкоциты определялись у 1/6 детей, преимущественно в тяжах слизи, в количестве не более 6–8.
Содержание углеводов в кале было в пределах нормы практически у всех, за исключением нескольких детей, у которых отмечалось незначительное повышение до 0,3%.
Через 2 недели после начала терапии в клинической картине отмечено, что частота и консистенция стула практически не изменилась, хотя патологические примеси (не переваренные комочки, слизь) ни у кого не определялись.
При исследовании биоценоза выявлено следующее: у 27% биоценоз нормализовался полностью, у остальных отмечалась I степень дисбактериоза.
Содержание лактобактерий и золотистого стафилококка нормализовалось у всех. Оставалась пониженной концентрация кишечной палочки и энтерококков (17%). У 1/5 пациентов сохранялась пролиферация гемолизирующей E.coli, дрожжеподобных грибов, протея.
Через 2 недели после окончания лечения аппетит нормализовался у 80% детей. При первоначальной склонности к запорам учащение стула отмечено не у всех. У большинства больных консистенция и цвет кала нормализовалась, стал желтым, примеси не определялись.
При копрологическом исследовании мыла и слизь определялись в меньшем количестве, лейкоцитов не найдены.
Исследование биоценоза показало, биоценоз нормализовался у 40% обследованных детей. Выявлены нормальные концентрации бифидобактерий – у 100% пациентов, лактобактерий – у 100%, общего количества E.coli – у 60% при пролиферации гемолизирующей E.coli, энтерококков, золотистых стафилококков, дрожжеподобных грибов и Enterobacter aerogenes.
При сравнении эффективности препаратов Линекс и хилак форте в одинаковых возрастных группировках получены сходные результаты. При терапии Линексом нормализация биоценоза зарегистрирована у 37% детей.
Обсуждение полученных результатов
Назначение препарата Линекс сопровождалось клиническим улучшением ко 2 неделе приема препарата. Клиническое улучшение сопровождалось уменьшением выраженности изменений в копрологическом исследовании кала и отклонений в биоценозе фекалий. Характерна отчетливая тенденция к возрастанию количества бифидо– и лактобактерий, снижению количества кишечной палочки за счет штаммов с измененной ферментативной активностью (лактозонегативных, гемолизирующих штаммов) и увеличению степени колонизации энтерококками. Имелась тенденция к исчезновению или уменьшению степени колонизации грамнегативными бактериями семейства кишечных, такими как некоторые штаммы клебсиеллы, цитробактер. Наряду с этим нельзя не отметить, что сохранялась и даже несколько усиливалась колонизация фекалий золотистым стафилококком и грибами рода Кандида.
Полученный клинический эффект сохранялся в течение 2 недель после отмены терапии. Однако количественная характеристика микробиоценоза фекалий к 4–5 недели наблюдения демонстрировала тенденцию к восстановлению, но в меньшей степени, выявленных до начала терапии изменений микробиоценоза. При этом достоверно сохранялось нормальное количество лактобактерий, нормальной кишечной палочки и несколько возрастало количество энтерококков. Таким образом, полученные данные свидетельствовали о том, что после отмены препарата его протективный эффект сохранялся еще в течение 2 недель.
Использование препарата бифидумбактерин в терапии нарушений микробиоценоза у детей первого года жизни дает не однозначный результат. Поскольку препарат в своем составе содержит лактозу, а нарушения микробиоценоза у детей этого возраста часто сопровождаются вторичной лактазной недостаточностью, то в ряде случаев его назначение даже усугубляет клинические проявления ферментативной недостаточности и требует его отмены. Возможно этим же обусловлены более частые находки в копрологии по окончании курса терапии. В то же время нельзя не отметить, что назначение бифидумбактерина сопровождается отчетливым увеличением степени колонизации фекалий бифидобактериями, лактобактериями и тенденцией к снижению количества кишечной палочки с измененными свойствами. В то же время мы не отметили существенного возрастания количества энтерококков, не было выявлено подавляющего влияния препарата на рост стафилококков и условно–патогенных энтеробактерий. Более того, после окончания терапии у ряда пациентов появлялись новые для них виды условно–патогенной микрофлоры. Приведенные данные свидетельствуют о довольно ограниченном влиянии препарата на нормализации микробиоценоза у детей первого года жизни и клинический результат.
Результаты проведенного исследования свидетельствуют о положительном влиянии препарата хилак форте. К сожалению, полученные данные мало сопоставимы, т.к. 1) дети, получавшие препарат, в основном относятся к возрасту второго полугодия жизни, 2) в этой группе пациентов не было выявлено дисбактериоза III степени и 3) у всех обследованных отсутствовало снижение колонизационной резистентности, обусловленной снижением уровня бифидобактерий, представители транзиторной условно патогенной микрофлоры кишечника присутствовали в значительно меньшем количестве.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Дисбактериоз
Общее понятие о дисбактериозе
Дисбактериоз — это нарушение состава и свойств микрофлоры. Возникнуть он может где угодно: и в носоглотке, и в кишечнике, и во влагалище. Но дисбактериоз кишечника диагностируется намного чаще, чем все другие варианты дисбактериоза вместе взятые. Неудивительно, что часто употребляя слово «дисбактериоз», и врачи, и больные почти всегда подразумевают именно дисбактериоз кишечника.
В кишечнике обитают различные полезные бактерии, обеспечивающие нормальную работу нашего организма: молочнокислые бактерии, кишечная палочка, различные виды кокков и многие другие. Постоянство состава этой микрофлоры очень важно для поддержания хорошего здоровья. С ее помощью осуществляется защитная функция в случае попадания микробов, которые содержатся в недоброкачественной пище, грязных овощах и фруктах; иммунная, которая стимулирует выработку антител, повышая иммунитет человека; синтез незаменимых для человека витаминов (например, витамина К, который играет важную роль в системе свертывания крови).
Однако, когда вследствие различных причин, о которых далее пойдет речь, происходят нарушения микрофлоры кишечника, развивается «дисбактериоз».
Причины возникновения дисбактериоза
Наиболее частой причиной дисбактериоза является лечение антибактериальными препаратами (антибиотики, сульфаниламиды и т.д.). Ведь совершенно очевиден тот факт, что практически невозможно убить «плохие» микробы, оставив при этом в неприкосновенности «хорошие». Однако не только антибиотики бывают «виновниками» дисбактериоза. По большому счету, любые препараты и любые способы терапии, подавляющие иммунитет, способствуют развитию дисбактериоза (кортикостероидные гормоны, лучевая терапия, использование средств, подавляющих рост опухолей и т.п.).
Еще одна причина дисбактериоза — нарушения питания. Это и однообразная пища, и различные злоупотребления (жирным, сладким), и тяга населения к экспериментам над собой (голодание, уринотерапия, кефирная диета, яблочные дни, банановые недели).
Обусловливают возникновение дисбактериоза и такие заболевания, как гастриты, дуодениты, язвы, панкреатиты, колиты. Вполне естественно также, что к дисбактериозу может привести любое оперативное вмешательство на органах системы пищеварения.
Инфекционные болезни и наличие паразитов тоже относятся к числу причинных факторов появления дисбактериоза кишечника.
У детей первого года жизни дисбактериоз может быть следствием необоснованно раннего введения прикорма.
Проявления дисбактериоза
К основным проявлениям дисбактериоза относятся следующие:
синдром желудочно-кишечной диспепсии: нарушения со стулом, как правило, диарея, но могут быть и запоры. Больные также жалуются на урчание в животе, вздутие, неприятный вкус во рту, отрыжку, тошноту, изжогу.
Болевой синдром: боли в животе различного характера.
Аллергический синдром. Проявляется практически у всех больных дисбактериозом. Выражается, как правило, в том, что человек не может переносить какие-то продукты. Вскоре после употребления в пищу таких продуктов у больных появляется тошнота, жидкий стул, вздутие, аллергические реакции: крапивница, кожный зуд, отек.
Синдром нарушенного кишечного всасывания. Характеризуется, во-первых, упорной диареей, а во-вторых, признаками, очевидными для конкретных нарушений. И если процессы нарушения всасывания длятся долго, то четко обозначаются общие признаки нездоровья человека: падает иммунитет, на фоне чего начинается частые заболевания носоглотки, бронхов, легких, кожи, суставов.
От синдрома нарушенного кишечного всасывания в прямой зависимости находится другой — синдромокомплекс витаминной недостаточности.
Аноректальный синдром. Чаще всего развивается у людей при длительном лечении антибиотиками. Ему предшествует общее плохое самочувствие: слабость, головная боль, отсутствие аппетита. Затем может подняться температура, начинается понос и тупая боль в аноректальной области.
Какую опасность таит «простой» дисбактериоз?
При дисбактериозе «расцветает» патогенная микрофлора, плохо (или полностью) не усваиваются необходимые организму питательные вещества и микроэлементы. В кишечнике накапливается огромное количество токсических веществ, которые, всасываясь в кровь, поражают все органы и ткани. Снижается эффективный синтез витамина Д в организме, противовирусная и противоопухолевая защита, нарушается местный иммунитет.
Вследствие этого «простейший» дисбактериоз кишечника может явиться первопричиной поражения органов и тканей и вызывать многие заболевания, например, панкреатит, сахар 1000 ный диабет, жировой гепатоз, цирроз, желчекаменную болезнь.
Дисбактериоз кишечника может также привести к экземе, псориазу, атопическому дерматиту, бронхиальной астме, пищевой и поливалентной аллергии, иммунодефициту, изменению состава крови, заболеваниям щитовидной железы, центральной нервной системы и даже психическим заболеваниям!
Диагностика и лечение
Наиболее распространенный метод диагностики — бактериологический посев кала на дисбактериоз. С его помощью удается оценить довольно широкий спектр условно-патогенных микроорганизмов, выявить дефицит бифидо- и лактобактерий. Проводят также копрологическое исследование (копрограмму) – биологическое исследование кишечного содержимого.
Как расшифровать бланк анализа на дисбактериоз?
Бифидобактерии.
Основные представители нормальной кишечной микрофлоры, количество которых в кишечнике должно быть 95 – 99%. Существенное снижение количества бифидобактерий – всегда признак выраженного дисбактериоза.
Кишечная палочка с нормальной ферментативной активностью (эшерихии).
Количество кишечной палочки среди других бактерий не превышает 1%, но роль ее очень важна, поскольку этот микроб: во-первых, является главным конкурентом условно-патогенной флоры, препятствуя заселению чужеродными микробами кишечной стенки; во-вторых, кишечная палочка забирает из просвета кишечника кислород, который является ядом для бифидобактерий и лактобактерий, таким образом, создаются комфортные условия для основных бактерий кишечной флоры.
Снижение общего количества кишечной палочки может быть признаком присутствия в кишечнике небактериальных паразитов (глистов, простейших, которые также нуждаются в кислороде, обделяя им кишечную палочку).
Гемолизирующая кишечная палочка.
В норме должна отсутствовать. Она может вызывать аллергические и кишечные проблемы, очень распространена в окружающей среде (правда, практически никогда не встречается в грудном молоке), вызывает проблемы у ослабленных детей, требует иммунокоррекции. Следует отметить, что термин «гемолизирующая» не означает, что имеется какое-то влияние на кровь. Условно-патогенная флора при дисбактериозе не должна преодолевать кишечную стенку и попадать в кровь. Это возможно только при крайне выраженных формах дисбактериоза у детей с выраженными иммунодефицитами, как правило, представляющих угрозу для жизни. К счастью, такие состояния встречаются нечасто.
Кокковые формы в общей сумме микробов.
Самыми безобидными представителями условно-патогенной флоры являются энтерококки. Они наиболее часто встречаются в кишечнике у здоровых людей, их количество до 25% не представляет угрозы здоровью. Если количество превышает 25%, это чаще всего связано со снижением нормальной флоры. В редких случаях повышение количества энтерококков является главной причиной дисфункции, связанной с дисбактериозом.
Золотистый стафилококк (S. aureus).
Один из самых неприятных (наряду с гемолизирующей кишечной палочкой, протеем и клебсиеллой) представителей условно-патогенной флоры. Даже небольшие его количества могут вызвать выраженные клинические проявления, особенно у детей первых месяцев жизни. Поэтому обычно в нормах, приведенных в бланке анализа, указывается, что его быть не должно.
Патогенность золотистого стафилококка напрямую зависит от состояния нормальной флоры: чем больше бифидобактерий, лактобактерий и нормальной кишечной палочки, тем меньше вреда от стафилококка. Присутствие его в кишечнике может приводить к аллергическим реакциям, гнойничковым кожным высыпаниям, дисфункции кишечника. Стафилококки являются распространенными микробами окружающей среды, в частности, они в больших количествах живут на коже и слизистых оболочках верхних дыхательных путей. Ребенку они могут попадать через грудное молоко. Наиболее подвержены заражению стафилококками ослабленные дети (проблемная беременность, недоношенность, кесарево сечение, искусственное вскармливание, применение антибиотиков – факторы риска ослабления функций иммунной системы).
Лактозонегативные энтеробактерии.
Большая группа условно-патогенных бактерий большей или меньшей степени патогенности. Их количество не должно превышать 5%. Наиболее неприятными бактериями из этой группы являются протеи (чаще всего с ними связаны запоры) и клебсиеллы (являются прямыми антагонистами (конкурентами) лактобактерий, что приводит к развитию аллергии и запоров, а также к проявлениям лактазной недостаточности). Часто в бланке анализа указывается общее количество лактозонегативных энтеробактерий.
Грибы рода Candida.
Допустимо присутствие до 104. Повышение этого параметра может быть после применения антибиотиков. Если количество грибов повышено, а количество нормальной кишечной флоры резко снижено, при этом отмечается кандидоз (молочница) видимых слизистых оболочек (ротовая полость, половые органы) – это проявления системного кандидоза, то есть имеется инфицирование грибами кишечника.
Лечение дисбактериоза – дело непростое, требует от врача достаточной квалификации, а от пациента – терпения. В качестве компонентов терапии используется определенная диета и фармакологические средства.
Выбор диеты и лекарств обусловлен конкретным вариантом болезни, который уточняется причиной, жалобами и симптомами, анализами. Основной, но далеко не единственный способ лечения — выяснить, каких бактерий не хватает и восполнить недостачу с помощью так называемых эубиотиков — лекарственных средств, представляющих собой высушенные и специальным образом обработанные кишечные микробы. Попадая в кишечник, эти микробы оживают и начинают выполнять свою работу.
Применяют также ферменты (фестал, мезим, энзистал, панзинорм и т.д.), витамины. Особенностью некоторых вариантов дисбактериоза является не снижение общего количества микроорганизмов, а значительное преобладание какого-нибудь одного микроба, например, стафилококка. В такой ситуации приходится использовать антибиотики, подавляющие именно стафилококк.
Лечение дисбактериоза не представляет особых проблем только тогда, когда, во-первых, устраняется первопричина болезни и, во-вторых, давность заболевания не очень велика (не более полугода). Но, в любом случае, излечить дисбактериоз быстро невозможно.
Escherichia coli в кишечной микрофлоре младенцев: скорость колонизации, оборот штаммов и носительство вирулентности
Hewitt JH, Rigby J 1976 Влияние различных молочных кормов на количество Escherichia coli и Bifidobacterium новых в -норожденные младенцы. J Hyg (Лондон) 77 : 129–139
CAS Статья Google Scholar
Фини А.Р., Кук Е.М., Шинебаум Р. 1980 Сравнительное исследование грамотрицательных аэробных бацилл в кале младенцев, рожденных в больнице и дома. J Hyg (Лондон) 84 : 91–95
CAS Статья Google Scholar
Нельсон Д.П., Мата Л.Дж. 1970 Бактериальная флора, связанная со слизистой оболочкой желудочно-кишечного тракта человека. Гастроэнтерология 58 : 56–61
CAS PubMed Google Scholar
Moore WEC, Cato EP, Holdeman LV 1978 Некоторые современные концепции кишечной бактериологии. Am J Clin Nutr 31 : S33 – S42
CAS Статья Google Scholar
Bettelheim KA, Breadon A, Faiers MC, O’Farell SM, Shooter RA 1974 Происхождение О-серотипов Escherichia coli у младенцев после нормальных родов. J Hyg (Лондон) 72 : 67–70
CAS Статья Google Scholar
Fryklund B, Tullus K, Berglund B, Burman LG 1992 Важность окружающей среды и фекальной флоры младенцев, медперсонала и родителей как источников грамотрицательных бактерий, колонизирующих новорожденных в трех неонатальных отделениях. Инфекция 20 : 253–257
CAS Статья Google Scholar
Lindberg E, Nowrouzian F, Adlerberth I, Wold A E 2000 Длительное сохранение суперантиген-продуцирующих штаммов Staphylococcus aureus в микрофлоре кишечника здоровых младенцев. Pediatr Res 48 : 741–747
CAS Статья Google Scholar
Sears HJ, Brownlee I 1951 Дальнейшие наблюдения персистенции отдельных штаммов Escherichia coli в кишечном тракте человека. Дж Бактериол 63 : 47–57
Google Scholar
Nowrouzian F, Wold AE, Adlerberth I 2001 P fimbriae и аэробактин как факторы кишечной колонизации кишечной палочки у пакистанских младенцев. Epidemiol Infect 126 : 19–23
CAS PubMed PubMed Central Google Scholar
Nowrouzian F, Adlerberth I, Wold AE 2001 P Фимбрии, капсула и аэробактин характеризуют резидента толстой кишки Escherichia coli . Epidemiol Infect 126 : 11–18
CAS PubMed PubMed Central Google Scholar
Wold AE, Caugant DA, Lidin-Janson G, Man PD, Svanborg C 1992 Резидентные штаммы Escherichia coli толстой кишки часто проявляют уропатогенные характеристики. J Infect Dis 165 : 46–52
CAS Статья Google Scholar
Adlerberth I, Hanson LA, Svanborg C, Svennerholm AM, Nordgren S, Wold AE 1995 Адгезины Escherichia coli , связанные с внекишечным патогенным действием, связываются с эпителиальными клетками толстой кишки. Microb Pathog 18 : 373–385
CAS Статья Google Scholar
Strömberg N, Marklund BI, Lund B, Ilver D, Hamers A, Gaastra W, Karlsson KA, Normark S 1990 Хозяин-специфичность уропатогенной Escherichia coli зависит от различий в специфичности связывания с Galα1-4Gal-содержащими изорецепторы. EMBO J 9 : 2001–2010
Артикул Google Scholar
Johnson JR 1998 Аллели PapG среди штаммов Escherichia coli , вызывающих уросепсис: ассоциации с другими бактериальными характеристиками и компромисс с хозяином. Infect Immun 66 : 4568–4571
CAS PubMed PubMed Central Google Scholar
Йохансон М., Плос К., Марклунд Б.И., Сванборг С. 1993 Последовательности ДНК Pap, papG и prsG в Escherichia coli из фекальной флоры и мочевыводящих путей. Microb Pathog 15 : 121–129
CAS Статья Google Scholar
Johnson JR, O’Bryan TT, Low DA, Ling G, Delavari P, Fasching C, Russo TA, Carlino U, Stell AL 2000 Доказательства общности между собачьими и человеческими внекишечными патогенными штаммами Escherichia coli, которые экспрессируют аллель papG III. Infect Immun 68 : 3327–3336
CAS Статья Google Scholar
Feria C, Machado J, Durate Correia J, Goncalves J, Gaastra W. 2001 Распределение аллелей papG среди уропатогенных Escherichia coli , выделенных от разных видов. FEMS Microbiol Lett 21 : 205–208
Артикул Google Scholar
Gästrin B, Kallings LO, Marcetic A 1968 Время выживания различных бактерий в различных транспортных средах. Acta Path Microbiol Scand 74 : 371–380
Артикул Google Scholar
Kauffman F 1969 Бактериология Enterobacteriaceae . Munksgaard, Copenhagen
Ahrné S, Molin G, Ståhl S 1989 Плазмиды в штаммах Lactobacillus , выделенных из мяса и мясных продуктов. Syst Appl Microbiol 11 : 320–325
Артикул Google Scholar
Nowrouzian F, Wold AE, Adlerberth I 2001 Компьютерный анализ отпечатков пальцев RAPD (случайная амплифицированная полиморфная ДНК) для типирования кишечной Escherichia coli . Mol Biol Сегодня 2 : 5–10
CAS Google Scholar
Le Bouguenec C, Archambaud M, Labigne A 1992 Быстрое и специфическое обнаружение адгезин-кодирующих оперонов pap, afa, и sfa в уропатогенных штаммах Escherichia coli с помощью полимеразной цепной реакции. J Clin Microbiol 30 : 1189–1193
CAS PubMed PubMed Central Google Scholar
Ямамото С., Тераи А., Юрий К., Куразоно Х., Такеда Ю., Йошида О. 1995 Обнаружение факторов уровня вирулентности в Escherichia coli с помощью мультиплексной полимеразной цепной реакции. FEMS Immunol Med Microbiol 12 : 85–90
CAS Статья Google Scholar
Johnson JR, Brown JJ 1996 Новый анализ полимеразной цепной реакции с многократным праймированием для идентификации генов варианта papG , кодирующих Gal (α1-4) Gal-связывающие адгезины papG Escherichia coli . J Infect Dis 173 : 920–926
CAS Статья Google Scholar
Johnson JR, Stapleton AE, Russo TA, Scheutz F, Brown JJ, Maslow JN 1997 Характеристики и распространенность в серогруппе O4 J96-подобной клональной группы уропатогенных Escherichia coli O4: H5, содержащих класс I и аллели класса II papG . Infect Immun 65 : 2153–2159
CAS PubMed PubMed Central Google Scholar
Sussman M 1997 Escherichia coli и болезни человека. В: Sussman M (ed) Escherichia coli Механизм вирулентности . Cambridge University Press, Кембридж, Великобритания, стр. 331–340
Google Scholar
Gareau FE, Mackel DC, Boring III, Payne FJ, Hammett FL 1959 Получение фекальной флоры младенцами от их матерей во время родов. J Педиатр 54 : 313–318
CAS Статья Google Scholar
Gothefors L, Carlsson B, Ahlstedt S, Hanson LA, Winberg J 1976 Влияние кишечной флоры матери и антител сыворотки молозива и пуповины на присутствие Escherichia coli в фекалиях новорожденного. Acta Paediatr Scand 65 : 225–232
CAS Статья Google Scholar
Bettelheim KA, Teoh-Chan C, Chandler ME, O’Farrell SM, Rahamim L, Shaw EJ, Shooter RA 1974 Распространение Escherichia coli , колонизирующих новорожденных и их матерей. J Hyg (Лондон) 73 : 383–387
CAS Статья Google Scholar
Mata LJ, Urrutia JJ 1971 Кишечная колонизация детей, находящихся на грудном вскармливании, в сельской местности с низким социально-экономическим уровнем. Ann NY Acad Sci 176 : 93–109
Статья Google Scholar
Adlerberth I, Carlsson B, de Man P, Jalil F, Khan SR, Larsson P, Mellander L, Svanborg C, Wold AE, Hanson LA 1991 Колонизация кишечника Enterobacteriaceae в больницах Пакистана и Швеции, доставленных младенцам. Acta Paediatr Scand 80 : 602–610
CAS Статья Google Scholar
Ротими В.О., Олоу С.А., Ахмед И. 1985 Развитие бактериальной флоры недоношенных новорожденных. J Hyg (Лондон) 94 : 309–318
CAS Статья Google Scholar
Беттельхейм К.А., Педди Б.А., Черешский А. 1983 Экология Escherichia coli в родильном отделении в Черстчерч, Новая Зеландия. Zentralbl Bakteriol Mikrobiol Hyg Ser B Umwelthyg Krankenhaushyg Arbeitshyg Praev Med 178 : 389–393
CAS Google Scholar
Lundequist B, Nord CE, Winberg J 1985 Состав фекальной микрофлоры у детей, вскармливаемых грудью и из бутылочки, от рождения до восьми недель. Acta Paediatr Scand 74 : 45–51
CAS Статья Google Scholar
Adlerberth I, Jalil F, Carlsson B, Mellander L, Hanson LÅ, Larsson P, Khalil K, Wold AE 1998 Высокая скорость обновления штаммов Escherichia coli в кишечной флоре младенцев в Пакистане. Эпидемиол. Инфекция 121 : 587–598
CAS Статья Google Scholar
Kühn I, Tullus K, Möllby R 1986 Колонизация и сохранение фенотипов Escherichia coli в кишечнике детей в возрасте от 0 до 18 месяцев. Инфекция 14 : 7–12
Артикул Google Scholar
Mevissen-Verhage EA, Marcelis JH, Guinée PA, Verhoef J 1985 Влияние железа на серотипы и структуру гемагглютинации Escherichia coli у младенцев, находящихся на искусственном вскармливании. Eur J Clin Microbiol 4 : 570–574
CAS Статья Google Scholar
van der Waaij D 1999 Микробная экология кишечной микрофлоры: влияние взаимодействий с организмом хозяина. В: Hanson LÅ, Yolken RH (eds) Пробиотики, другие факторы питания и кишечная микрофлора . Липпинкотт-Рэйвен, Филадельфия, стр. 1–16
Google Scholar
Shroff KE, Meslin K, Cebra JJ 1995 Комменсальные кишечные бактерии порождают самоограничивающийся гуморальный иммунный ответ слизистой оболочки, постоянно колонизируя кишечник. Infect Immun 63 : 3904–3913
CAS PubMed PubMed Central Google Scholar
Mellander L, Carlsson B, Jalil F, Söderström T., Hanson LÅ 1985 Ответ секреторных антител IgA против антигенов Escherichia coli у младенцев в зависимости от воздействия. J Педиатр 107 : 430–433
CAS Статья Google Scholar
Freter R 1992 Факторы, влияющие на микроэкологию кишечника.В: Fuller R (ed) Пробиотики — научная основа . Chapman 38 Hall, Лондон, стр 111–144
Google Scholar
Adlerberth I, Hanson LÅ, Wold AE 1999 Онтогенез кишечной флоры. В: Sanderson IR, Walker WA (eds) Развитие желудочно-кишечного тракта . BC Decker Inc, Гамильтон, Онтарио, стр. 279–292
Google Scholar
Старк П.Л., Ли А. 1982 Микробная экология толстой кишки грудных детей и детей, вскармливаемых смесями, в течение первого года жизни. J Med Microbiol 15 : 189–203
CAS Статья Google Scholar
Duriez P, Clermont O, Bonacorsi S, Bingen E, Chaventré A, Elion J, Picard B, Denamur E 2001 Commensal Изоляты Escherichia coli филогенетически распределены среди географически различных популяций человека. Микробиология 147 : 1671–1676
CAS Статья Google Scholar
Орсков Ф., Соренсен К.Б. 1975 Серогруппы Escherichia coli у детей, находящихся на грудном и искусственном вскармливании. Acta Pathol Microbiol Scand Sect B Microbiol 83 : 25–30
Google Scholar
Tullus K, Kallenius G, Möllby R Колонизация фекалий P-фимбриированными E. coli в возрасте от 0 до 18 месяцев. Epidemiol Infect 100 : 185–191
Hesselmar B, Åberg N, Åberg B, Eriksson B, Björkstén B 1999 Защищает ли раннее воздействие кошки или собаки от последующего развития аллергии ?. Clin Exp Allergy 29 : 611–617
CAS Статья Google Scholar
Bråbäck L, Kjellman N-I M, Sandin A, Björkstén B 2000 Атопы среди школьников в северной и южной Швеции в связи с владением домашними животными и событиями раннего возраста. Pediatr Allergy Immunol 12 : 4–10
Артикул Google Scholar
Wold AE, Thorssén M, Hull S, Svanborg Edén C 1988 Присоединение Escherichia coli через маннозу или Galα1-4Galβ-содержащие рецепторы к эпителиальным клеткам толстой кишки человека. Infect Immun 56 : 2531–2537
CAS PubMed PubMed Central Google Scholar
Wold AE, Mestecky J, Tomana M, Kobata A, Ohbayashi H, Endo T, Svanborg Edén C 1990 Секреторный иммуноглобулин A несет рецепторы олигосахаридов для фимбриального лектина Escherichia coli типа 1. Infect Immun 58 : 3073–3077
CAS PubMed PubMed Central Google Scholar
Friman V, Adlerberth I, Conell H, Svanborg C, Hanson LÅ, Wold AE 1996 Снижение экспрессии маннозо-специфических адгезинов Escherichia coli в микрофлоре толстой кишки людей с дефицитом IgA. Infect Immun 64 : 2794–2798
CAS PubMed PubMed Central Google Scholar
Johnson JR 1991 Факторы вирулентности Escherichia coli Инфекция мочевыводящих путей. Clin Microbiol Ред. 4 : 80–128
CAS Статья Google Scholar
Smith HW, Linggood MA 1971 Наблюдение за патогенными свойствами плазмид K88, Hly и Ent Escherichia coli с особым упором на диарею свиней. J Med Microbiol 4 : 467–485
CAS Статья Google Scholar
Krivan HC, Franklin DP, Wang W, Laux DC, Cohen PC 1992 Фосфатидилсерин, обнаруженный в слизи кишечника, служит единственным источником углерода и азота для Salmonellae и Escherichia coli . Infect Immun 60 : 3943–3946
CAS PubMed PubMed Central Google Scholar
Hacker J, Blum-Oehler G, Mühldorfer I., Tschäpe H 1997 Острова патогенности вирулентных бактерий: структура, функции и влияние на эволюцию микробов. Mol Microbiol 23 : 1089–1097
CAS Статья Google Scholar
Dobrindt U, Blum-Oehler G, Hartsch T, Gottschallk G, Ron EZ, Fünfstück R, Hacker J 2001 Детерминант, кодирующий S-фимбрию, sfa 1 расположен на острове патогенности III536 9 coli000 9 uropathogenic. штамм 536. Infect Immun 69 : 4248–4256
CAS Статья Google Scholar
Bingen-Bidois M, Clermont O, Bonacorsi S, Terki M, Brahimi N, Loukil C, Barraud D, Bingen E 2002 Филогенетический анализ и преобладание штаммов уросепсиса Escherichia coli , несущих островоподобные домены патогенности. Infect Immun 70 : 3216–3226
CAS Статья Google Scholar
Пикард Б., Севали Гарсиа Дж., Гуриу С., Дуриес П., Брахими Н., Бинген Е., Элион Дж., Денамур Е. 1999 Связь между филогенезом и вирулентностью в внекишечной инфекции Escherichia coli . Infect Immun 67 : 546–553
CAS PubMed PubMed Central Google Scholar
Karch H, Schubert S, Zhang D, Zhang W, Schmidt H, Ölschläger T, Hacker J 1999 Геномный остров, называемый островом высокой патогенности, присутствует в некоторых не-O157, продуцирующих токсин Shiga Escherichia coli. клональных линий. Infect Immun 67 : 5994–6001
CAS PubMed PubMed Central Google Scholar
Инфекция E. Coli через пищу или воду | Детская больница CS Mott
Обзор темы
Что такое инфекция
E. coli ?E. coli ( Escherichia coli ) — это название микроба или бактерии, обитающей в пищеварительном тракте людей и животных.
Существует много типов E. coli , и большинство из них безвредны. Но некоторые могут вызвать кровавый понос. Некоторые штаммы бактерий E. coli могут также вызывать тяжелую анемию или почечную недостаточность, что может привести к смерти.
Другие штаммы E. coli могут вызывать инфекции мочевыводящих путей или другие инфекции.
Что вызывает кишечную инфекцию
E. coli ?Вы заразитесь E. coli при контакте с фекалиями или калом людей или животных.Это может произойти, если вы пьете воду или едите пищу, загрязненную фекалиями.
E. coli в продуктах питания
E. coli может попасть в мясо во время обработки. Если зараженное мясо не было приготовлено до 160 ° F (71 ° C), бактерии могут выжить и заразить вас, когда вы его съедите. Это наиболее распространенный способ заражения людей в США E. coli . Любая пища, контактировавшая с сырым мясом, также может заразиться.
Другие продукты, которые могут быть инфицированы E. coli , включают:
- Сырое молоко или молочные продукты. Бактерии могут передаваться из вымени коровы в молоко. Проверьте этикетки на молочных продуктах, чтобы убедиться, что они содержат слово «пастеризованные». Это означает, что пища была нагрета для уничтожения бактерий.
- Сырые фрукты и овощи, такие как салат, проростки люцерны, непастеризованный яблочный сидр или другие непастеризованные соки, контактировавшие с инфицированными фекалиями животных.
E. coli в воде
Фекалии человека или животных, инфицированные E. coli , иногда попадают в озера, бассейны и водоемы. Люди могут заразиться, если загрязненный город или городское водоснабжение не было должным образом обработано хлором или когда люди случайно проглотили зараженную воду во время купания в озере, бассейне или оросительном канале.
E. coli при личном контакте
Бактерии также могут передаваться от одного человека к другому, обычно, когда инфицированный человек плохо моет руки после дефекации. E. coli может передаваться от рук инфицированного человека к другим людям или объектам.
Каковы симптомы?
Основными симптомами кишечной инфекции E. coli являются:
- Кровавая диарея.
- Спазмы желудка.
- Тошнота и рвота.
Некоторые люди не замечают никаких симптомов. У детей симптомы появляются чаще, чем у взрослых. Симптомы обычно появляются через 3-4 дня после контакта с E.coli .
Большинство людей поправляются примерно через неделю. Они часто не обращаются к врачу и не знают, что у них проблемы с кишечной палочкой .
Когда E. coli вызывает серьезные проблемы с кровью или почками, симптомы включают:
- Бледная кожа.
- Лихорадка.
- Слабость.
- Ушиб.
- Выделение лишь небольшого количества мочи.
Как работает
E.coli диагностирована кишечная инфекция?Ваш врач может заподозрить, что у вас инфекция E. coli , после того, как он или она задаст вам вопросы и сделает экзамен. Ваш стул, вероятно, будет проверен на E. coli .
Как лечится?
Инфекция E. coli обычно проходит сама по себе. Ваше основное лечение — устроиться поудобнее и пить воду глотками. При диарее организм теряет больше воды, чем обычно. Это может привести к обезвоживанию, что особенно опасно для младенцев и пожилых людей.Регулярные небольшие глотки воды помогут предотвратить обезвоживание.
Если у вас кровавый понос, который может быть вызван инфекцией E. coli , не принимайте лекарства от диареи или антибиотики. Эти лекарства могут замедлить процесс пищеварения, давая вашему организму больше времени для поглощения ядов, вырабатываемых E. coli . Вместо этого позвоните своему врачу.
У некоторых людей инфекция E. coli вызывает серьезные проблемы с кровью и почками. Этим людям может потребоваться переливание крови или диализ.Диализ — это лечение, которое помогает отфильтровывать отходы из крови, когда почки не работают должным образом.
Как предотвратить кишечную инфекцию
E. coli ?Пища и вода, зараженные бактериями E. coli , выглядят и пахнут нормально. Но есть кое-что, что можно сделать, чтобы предотвратить заражение:
- Приготовьте говяжий фарш как минимум до 160 ° F (71 ° C).
- На кухне часто мойте руки горячей мыльной водой, особенно после прикосновения к сырому мясу.
- Вымойте все инструменты или кухонные поверхности, которые соприкасались с сырым мясом.
- Используйте только пастеризованное молоко, молочные и соковые продукты.
- Используйте только очищенную или хлорированную питьевую воду.
- Когда вы путешествуете в страны, где может быть небезопасная питьевая вода, не используйте лед и не пейте воду из-под крана. Избегайте сырых фруктов и овощей, за исключением тех, с кожицы которых вы чистите сами.
- Часто мойте руки и всегда мойте их после посещения туалета или смены подгузников.
Симптомы
У детей чаще, чем у взрослых, развиваются симптомы инфекции E. coli . У большинства инфицированных людей будут:
- Сильные спазмы и болезненность желудка.
- Понос, сначала водянистый, но часто становящийся очень кровянистым.
- Тошнота и рвота.
Некоторые люди, инфицированные бактериями, не замечают никаких симптомов. Они могут передавать бактерии другим, даже не подозревая об этом.
Существует множество состояний с симптомами, аналогичными симптомам кишечной инфекции E. coli . Диагностика инфекции E. coli может быть осложнена тем фактом, что большинство бактериальных инфекций, вызывающих диарею, сопровождаются высокой температурой. Если у вас нет лихорадки или у вас только умеренная температура, ваш врач может подозревать, что ваши симптомы вызывает что-то другое, а не бактерии.
Кровавая диарея часто встречается в подтвержденных случаях кишечной инфекции E. coli , но бактерии также следует рассматривать как возможную причину некровавой диареи.
Для получения дополнительной информации о том, когда обращаться к врачу по поводу диареи без крови, см.:
Симптомы инфекции E. coli обычно проходят примерно через неделю без дальнейших проблем. Но серьезные проблемы с кровью и почками могут возникнуть в течение 2 недель после начала диареи. Эти проблемы могут вызывать почечную недостаточность, а иногда и длительную инвалидность или смерть у некоторых детей и пожилых людей.
Обследования и анализы
Медицинское обследование диареи, которая может быть вызвана болезнью E.coli обычно начинается с медицинского осмотра и сбора анамнеза.
Во время истории болезни ваш врач задаст вопросы о ваших симптомах, например:
- Когда началась диарея, как долго она длилась и как часто бывают дефекации?
- Есть ли кровь при диарее? Если да, то сколько?
- У вас был озноб или жар?
- Были ли у вас спазмы в животе, тошнота или рвота?
- Чувствуете усталость или раздражительность?
- Вы упали в обморок или почувствовали головокружение?
Заражение E.coli легко спутать с другими заболеваниями с аналогичными симптомами, например с другими инфекционными заболеваниями.
Врач может заподозрить у вас инфекцию E. coli , если вы подверглись воздействию этих бактерий. Во время истории болезни ваш врач может спросить, были ли вы:
- Были в детском саду, школе, доме престарелых или другом учреждении по уходу за взрослыми.
- Недавно ел в ресторане.
- Потребляли недоваренное мясо или непастеризованное молоко, молочные продукты или соки.
- Имел контакт с кем-либо, у кого недавно или в настоящее время наблюдается диарея.
- Ездил недавно.
- Недавно использовала антибиотики.
Во время медицинского осмотра врач обычно:
- Измеряет вашу температуру.
- Измерьте артериальное давление и определите частоту пульса.
- Посмотрите на свой цвет кожи, чтобы увидеть, не слишком ли вы бледны.
- Проверьте живот на нежность.
- Проведите ректальное исследование, чтобы узнать, есть ли у вас кровь в стуле.
Врачи, подозревающие инфекцию E. coli , заказывают культуру стула, которая обнаруживает штаммы E. coli . Поскольку бактерии могут покинуть организм всего за несколько дней, образец следует получить как можно скорее после появления симптомов.
Иногда используются другие тесты, когда диагноз неясен, но они еще не широко доступны.
Если у ребенка или пожилого человека диагностирована инфекция E. coli , за ним можно наблюдать на предмет развития серьезных проблем с кровью или почками.Для мониторинга необходимы анализы крови и мочи для измерения основных элементов крови и биологических жидкостей.
Обзор лечения
Лечение инфекции, вызванной болезнетворными бактериями E. coli , включает лечение осложнений, в основном обезвоживания, вызванного диареей.
Если у вас развиваются симптомы серьезных проблем с кровью или почками, такие как анемия или почечная недостаточность, ваше лечение может включать:
- Тщательное регулирование количества жидкости и основных минералов.
- Диализ, чтобы отфильтровать отходы из крови. Некоторым людям с почечной недостаточностью, вызванной инфекцией E. coli , требуется диализ.
- Переливание крови для лечения анемии путем введения дополнительных богатых кислородом красных кровяных телец.
Лекарства, которых следует избегать
Большинство людей выздоравливают от инфекций E. coli за 5–10 дней без лекарств. Антибиотики не рекомендуются. Сообщите своему врачу, если вы думаете, что у вас может быть E.coli и принимают антибиотики.
Лекарства от диареи, отпускаемые без рецепта или по рецепту, обычно не используются для лечения инфекции E. coli . Многие противодиарейные продукты замедляют скорость прохождения пищи и продуктов жизнедеятельности через кишечник. Это может дать организму больше времени для поглощения ядов, производимых бактериями, увеличивая риск таких осложнений, как серьезные проблемы с кровью и почками.
Избегайте этих продуктов без рецепта, если у вас есть или вы подозреваете, что у вас есть E.coli :
- Продукты лоперамида. К ним относятся Имодиум, Маалокс и другие противодиарейные средства. Примечание: Следует избегать только тех продуктов, в состав которых входит лоперамид.
- Продукты, содержащие салицилаты. К ним относятся пепто-бисмол и аналогичные противодиарейные продукты на основе висмута, аспирин и ибупрофен (например, Адвил). Салицилаты могут усилить кровотечение из кишечника. Кроме того, салицилаты связаны с синдромом Рея, редким, но серьезным заболеванием у детей.
Лекарства от диареи, отпускаемые по рецепту, могут быть опасными при назначении человеку с инфекцией E. coli . Врач может прописать одно из этих лекарств, если он или она не знает, что E. coli вызвала диарею. Обязательно обсудите свои симптомы со своим врачом. Обмен информацией важен для постановки правильного диагноза вашего состояния.
Избегайте приема этих лекарств, отпускаемых по рецепту, если у вас есть или вы думаете, что у вас инфекция E. coli :
- Дифеноксин с атропином (Мотофен)
- Дифеноксилат с атропином (Ломотил)
- Лоперамид (имодиум, отпускаемый по рецепту)
Домашнее лечение
Домашнее лечение инфекционных заболеваний E.coli состоит в том, чтобы чувствовать себя комфортно и предотвращать распространение бактерий. Если вы не инфицированы, примите меры для предотвращения заражения.
Если вы считаете, что вы или кто-либо из ваших опекунов инфицированы E. coli , немедленно обратитесь к врачу. Не лечите симптомы диареи какими-либо лекарствами, отпускаемыми без рецепта или по рецепту.
Домашнее лечение диареи или кровавой диареи, вызванной инфекцией
E. coli- Не используйте противодиарейные препараты, отпускаемые без рецепта, если у вас диарея с кровью или без крови, которая, как вы подозреваете, может быть вызвана E.coli инфекция. Эти продукты включают Imodium и Maalox Anti-Diarrheal. Не принимайте другие лекарства, оставшиеся после перенесенной болезни.
- Часто делайте небольшие глотки воды или напитка для регидратации, чтобы восполнить потерю жидкости и предотвратить обезвоживание. Поскольку обезвоживание может быть более опасным для младенцев, позвоните своему врачу, если вы считаете, что у вашего ребенка может быть обезвоживание. Ваш желудок не может обрабатывать слишком много жидкости за один раз. Обратитесь за медицинской помощью, если у вас появятся признаки умеренного обезвоживания, к которым относятся:
- Сухость во рту.
- Глаза, которые не слезятся.
- Низкий диурез.
- Головокружение.
Особенно у детей и взрослых в возрасте 65 лет и старше обратите внимание на симптомы серьезных проблем с кровью и почками, такие как лихорадка, слабость, бледность кожи или выделение небольшого количества мочи. При развитии любого из этих симптомов немедленно обратитесь к врачу. .
Советы по защите от заражения
E. coli из зараженной пищи и воды- Приготовьте говяжий фарш при температуре не менее 160 ° F (71 ° C).Говяжий фарш следует готовить до тех пор, пока не исчезнет весь розовый цвет, но не полагайтесь только на цвет. Проверяйте температуру термометром для мяса. Разрежьте ресторан и домашние гамбургеры, чтобы они были полностью приготовлены. Соки должны быть прозрачными или желтоватыми, без следов розового. Никогда не ешьте сырой или недоваренный говяжий фарш.
- При приготовлении пищи:
- Часто мойте руки горячей мыльной водой, особенно после работы с сырым мясом.
- Всегда мойте инструменты для приготовления пищи, разделочные доски, посуду, столешницы и посуду горячей мыльной водой сразу после того, как они соприкоснулись с сырым мясом.Не кладите приготовленное мясо обратно на тарелку, на которой находилось сырое мясо, если тарелка не была тщательно вымыта водой с мылом и высушена.
- Используйте отдельные разделочные доски для сырого мяса и других продуктов.
- Храните сырое мясо, птицу и морепродукты отдельно от овощей, фруктов, хлеба и других продуктов, которые уже были приготовлены для употребления в пищу.
- Используйте только пастеризованное молоко, молочные и соковые продукты. Проверьте этикетку продукта на наличие слова «пастеризованный».«Сок из концентрата такой же, как и пастеризованный.
- Используйте только очищенную (хлорированную) питьевую воду.
- Путешественникам в страны, где водоснабжение может быть небезопасным, следует быть особенно осторожными, чтобы не класть лед в напитки и не пить воду из-под крана. Вся употребляемая вода должна быть кипяченой или разлитой по бутылкам. Ешьте горячие блюда. Избегайте сырых фруктов и овощей, за исключением тех, с кожицы которых вы чистите сами.
Советы по предотвращению передачи
E.coli бактерии- Часто мойте руки и всегда мойте их после дефекации или смены подгузников. Если в вашем доме несколько ванных комнат, ограничьте использование инфицированного человека только одной ванной.
- Осторожно выбрасывайте загрязненные подгузники и стул. Если есть подозрение на инфекцию у маленького ребенка, используйте одноразовые подгузники вместо тканевых, пока болезнь не пройдет.
- Взрослые должны следить за тем, чтобы дети, страдающие диареей, тщательно мыли руки после посещения туалета.Дети, инфицированные E. coli , должны избегать контакта с другими детьми, особенно во время плавания.
- Вымойте ручки унитазов и раковин антибактериальным очистителем.
- Люди, у которых была диагностирована инфекция E. coli , не должны работать с едой или работать в детском саду или другом учреждении до тех пор, пока у них не будет отрицательного результата теста на бактерии в двух образцах стула. Если вы принимали какой-либо антибиотик, образец стула следует взять как минимум через 48 часов после приема последней дозы.
- Хлорированная вода в плавательных бассейнах и гидромассажных ваннах.
Список литературы
Консультации по другим работам
- Американская педиатрическая академия (2015). Диарея, вызванная Escherichia coli (включая гемолитико-уремический синдром). В DW Kimberlin et al., Eds., Red Book: 2015 Report of the Committee on Infectious Diseases, 30th ed., Pp. 343–347. Деревня Элк-Гроув, Иллинойс: Американская академия педиатрии.
- Procop GW, Cockerill F III (2001). Энтерит, вызываемый видами Escherichia coli и Shigella и Salmonella. В WR Wilson et al., Под ред., Current Diagnosis and Treatment in Infectious Diseases, pp. 548–556. Нью-Йорк: Макгроу-Хилл.
Кредиты
Текущий по состоянию на: 23 сентября 2020 г.
Автор: Healthwise Staff
Медицинский обзор:
E.Грегори Томпсон, врач-терапевт
Кэтлин Ромито, доктор медицины, семейная медицина
Адам Хусни, доктор медицины, семейная медицина
Элизабет Т. Руссо, врач-терапевт,
В. Дэвид Колби, IV Магистр, доктор медицины, FRCPC — инфекционное заболевание
По состоянию на: 23 сентября 2020 г.
Автор: Здоровый персонал
Медицинское обозрение: E.Грегори Томпсон, врач-терапевт и Кэтлин Ромито, доктор медицины, семейная медицина и Адам Хусни, доктор медицины, семейная медицина, и Элизабет Т. Руссо, врач-терапевт, и У. Дэвид Колби IV, магистр медицины, доктор медицинских наук, FRCPC — инфекционные заболевания
Escherichia coli и синдром внезапной детской смерти
До 1940-х годов патогенные E. coli не были идентифицированы; их нельзя было отличить методами, доступными для непатогенных комменсалов E. coli .Новаторская работа Кауфманна по разработке схемы серотипирования позволила связать штаммы, принадлежащие к определенным серотипам O: H, с определенными из патотипов. В течение многих лет EPEC распознавался только серотипами, пока не были идентифицированы специфические факторы вирулентности.
Механизмы, с помощью которых патогенная бактерия E. coli получает доступ к восприимчивому хозяину и остается в нем, были неизвестны, но считались, вероятно, аналогичными таковому у комменсала E. coli в течение длительных периодов совместной эволюции.Исследования комменсала E. coli в 1970-х годах послужили основой для понимания колонизации человеческого тела E. coli .
Комменсальные штаммы
В первом из этих исследований (4) были исследованы полные фекалии 9 здоровых взрослых с 10 участками на каждом образце и по крайней мере 10 E. coli -подобных колоний, собранных с каждого участка. Они выявили большое разнообразие типов, хотя во всех стулах, кроме одного, один преобладающий тип присутствовал на всех 10 участках.Это указывает на то, что обычно, когда изолят E. coli выбирается из образца фекалий, он, вероятно, будет преобладающим типом, но второстепенные типы могут быть пропущены.
Обширное исследование приобретения новорожденными E. coli (5) показало, что « E. coli присутствует во влагалище женщин и что приобретение этих E. coli младенцами связано с длиной времени, которое занимает рождение. Также было отмечено, что существует взаимосвязь между E.coli , обнаруженная в фекалиях матерей, слизи, проглоченной младенцами при рождении, а затем в фекалиях младенцев ». Хотя, возможно, именно так младенцы приобретают свою E. coli и другую микрофлору, было отмечено, что «младенцы после кесарева сечения обычно не колонизируются фекалиями своей матери E. coli ». Однако они были колонизированы так же быстро, как и младенцы, рожденные естественным путем. Эти исследования показали, что кишечник младенцев был колонизирован рано, и эти колонизированные младенцы стали очагами распространения E.coli другим младенцам. Экологические исследования показали, что «зараженные руки и униформа медперсонала могут быть основным вектором передачи E. coli ». Также было отмечено, что эти E. coli приобрели или утратили определенные черты во время своего распространения, включая устойчивость к антибиотикам, серологические вариации и даже биохимические характеристики (6). Распространение E. coli произошло максимум у четырех других младенцев; Младенцы после кесарева сечения особенно подвержены колонизации этими типами E.coli .
Патотипы
Исследования комменсала E. coli , приведенные выше, частично были вдохновлены двумя более ранними исследованиями. Первый был инициирован в результате обследования инфекции мочевыводящих путей (ИМП) E. coli среди пациентов, которые находились в женском общем медицинском отделении в течение 2 лет (7). Использование обширного набора антисывороток для типирования E. coli позволило провести более полную идентификацию и анализ. Было отмечено, что O-типы, ответственные за большинство инфекций, относятся к относительно небольшому числу распространенных типов.
Пациенты с диабетом, злокачественными заболеваниями, ревматоидным артритом и гипертонией имели гораздо более высокую заболеваемость инфекцией мочевых путей E. coli , чем остальная часть населения отделения. Кроме того, в отделении были небольшие эпидемии ИМП из-за специфических типов E. coli O. Эти исследования показали, что ничего из этого не было получено путем катетеризации или с помощью инструментов. Доказательства соответствуют оральной передаче типоспецифической E. coli из кишечных резервуаров человека-носителя.
Среди 20 пациентов (8), которые ранее не болели ИМП и у которых развилась инфекция, у 13 эти инфекции развились в течение 12 дней после гинекологических операций, сопровождавшихся введением самоудерживающегося катетера. Инфекции были вызваны типом, который присутствовал до операции в прямой кишке, влагалище или в обоих случаях.
Эти исследования показывают, что комменсал E. coli может передаваться среди младенцев, а восприимчивые люди могут заразиться такими E.coli , наблюдения, которые могут иметь отношение к восприимчивости как новорожденных (особенно недоношенных), так и женщин, у которых развились ИМП.
В ходе расследований, проведенных при спонсорской поддержке военных властей, изучалась причина диареи путешественников, которая поражает лиц, недавно прибывших в другую страну, обычно в течение 14 дней с момента прибытия (9). Группа из 540 британских солдат совершила воздушное путешествие из Англии в Аден; из них у 38 был эпизод диареи в течение первых 14 дней после прибытия.Были исследованы пробы фекалий 35, и в 2 были получены штаммы Salmonella spp., Из оставшихся 33 возбудителей не было выделено. Новый серотип E. coli (O148.h38) был выделен в острой фазе из 19 штаммов. эти случаи. В остальных 14 (40%) случаях было выделено несколько различных серотипов E. coli . К ним относятся серотипы, связанные с детской диареей и не связанные с диареей путешественников. Пик выделений E.coli O148: h38 соответствует пику заболеваемости диареей путешественников. Этот серотип никогда не выделяли у здорового человека. Год спустя в лаборатории в Англии у техника, работающего с этим серотипом, развился тяжелый эпизод диареи, и E. coli O148: h38 был выделен в чистой культуре из его стула. Этот же серотип, а также O6: h26 были впоследствии выделены у американских солдат во Вьетнаме (10).
С момента этих ранних открытий было описано по крайней мере 78 детектируемых антигенов O и 34 антигена H, связанных с ETEC.Среди наиболее распространенных серотипов, которые продуцируют так называемый термостабильный энтеротоксин (ST), термолабильный энтеротоксин (LT) или оба, являются O6: h26 (LT / ST), O8: H9 (только ST), O25: NM. (Только LT), O78: h22 (только ST), O148: h38 (только ST) и O153: h55 (только ST). Их распространенность и фенотипы [в зависимости от токсинов, которые они переносят, или факторов колонизации (CF), которые они выражают], могут варьироваться в зависимости от местоположения. Многие из этих серотипов также обычно выделялись из источников окружающей среды, случаев заболевания людей и вспышек заболеваний по всему миру (11).Эти исследования подтвердили, что E. coli может быть не только комменсалом, но и истинными патогенами, и они могут быть приобретены и распространены людьми.
В 1983 г. небольшая вспышка диареи произошла в неонатальном отделении (12), в котором проводились более ранние исследования распространения комменсала E. coli (5, 6). Несмотря на введение строгих мер контроля, эпидемический штамм (O125: K70: h31) распространился на 16 младенцев, в то время как комменсальные штаммы распространились максимально на 4 младенцев, аналогично распространению, наблюдаемому в предыдущем исследовании, в отношении которого не было предпринято никаких специальных мер по сдерживанию.Комменсал E. coli беспрепятственно распространился среди других младенцев, и штамм вспышки распространился гораздо шире, чем комменсалы.
Первоначально EPEC был идентифицирован на основании того, что определенные серотипы были регулярно связаны с инфантильным гастроэнтеритом, но фактические факторы вирулентности не были известны. После открытия факторов вирулентности было показано, что они присутствуют не только в выделенных в настоящее время штаммах EPEC, но и в исходных архивных штаммах EPEC, выделенных задолго до описания этих факторов вирулентности (13), что свидетельствует о том, что EPEC представляет собой специфическую линию патогенных E.coli .
Shigatoxigenic E. coli или VTEC — еще один патотип, впервые описанный в 1977 г. (14) при исследовании воздействия супернатантов культур из различных E. coli на различные клеточные линии, включая клетки Vero (14). В то время как ряд различных серотипов был идентифицирован как связанный с этими патотипами (15), один серотип (O157: H7), впервые описанный в 1983 году (16), доминировал в литературе STEC / VTEC. Вскоре выяснилось, что веротоксины похожи на токсин шига, связанный со штаммом Shigella dysenteriae , который был описан еще в 1903 году (17, 18).STEC / VTEC, не относящиеся к O157, как правило, игнорировались в первые годы исследований STEC / VTEC, но их важность в качестве причин спорадических и вспышек заболеваний в настоящее время хорошо установлена (15).
На протяжении многих лет было показано, что различные «мобильные генетические элементы», такие как транспозоны, инсерционные последовательности, бактериофаги и плазмиды, могут существовать либо интегрированными в хромосому, либо посредством саморепликации в новом хозяине, обеспечивая новые признаки и преимущества фитнеса. Наиболее поддающиеся определению факторы вирулентности, обнаруженные у патогенного E.coli происходят из генетических мобильных элементов. Например, большинство генов токсинов и CF, необходимых для патогенеза ETEC, обнаруживаются почти исключительно на плазмидах (11). Эти плазмиды могут перемещаться между штаммами, предоставляя различные палитры факторов вирулентности. Недавний пример такого взаимодействия был показан со смешением факторов вирулентности, что привело к одной из самых серьезных вспышек, вызванной E. coli . Это была вспышка в 2011 г. (19) из-за энтероагреганта E.coli O104: h5, которые также были способны продуцировать токсины шига и от которых пострадали около 4000 человек в Германии и многие другие в 16 других странах. Недавно было показано, что энтероагрегативный штамм приобрел бактериофаг, кодирующий токсин шига 2а, у крупного рогатого скота (20). Большинство инфекций E. coli являются кишечными. Внекишечные инфекции, такие как ИМП и неонатальный менингит, вероятно, также имеют кишечное происхождение (7, 8, 21). Это может иметь последствия в отношении СВДС ( см. Ниже) .
Escherichia coli и синдром внезапной детской смерти
До 1940-х годов патогенные E. coli не были идентифицированы; их нельзя было отличить методами, доступными для непатогенных комменсалов E. coli . Новаторская работа Кауфманна по разработке схемы серотипирования позволила связать штаммы, принадлежащие к определенным серотипам O: H, с определенными из патотипов. В течение многих лет EPEC распознавался только серотипами, пока не были идентифицированы специфические факторы вирулентности.
Механизмы, с помощью которых патогенная бактерия E. coli получает доступ к восприимчивому хозяину и остается в нем, были неизвестны, но считались, вероятно, аналогичными таковому у комменсала E. coli в течение длительных периодов совместной эволюции. Исследования комменсала E. coli в 1970-х годах послужили основой для понимания колонизации человеческого тела E. coli .
Комменсальные штаммы
В первом из этих исследований (4) были исследованы полные фекалии от 9 здоровых взрослых людей с 10 участками на каждом оцениваемом образце и не менее 10 E.coli -подобные колонии, собранные с каждого сайта. Они выявили большое разнообразие типов, хотя во всех стулах, кроме одного, один преобладающий тип присутствовал на всех 10 участках. Это указывает на то, что обычно, когда изолят E. coli выбирается из образца фекалий, он, вероятно, будет преобладающим типом, но второстепенные типы могут быть пропущены.
Обширное исследование приобретения новорожденными E. coli (5) показало, что « E. coli присутствует во влагалище женщин и что приобретение этих E.coli младенцами зависит от продолжительности родов. Также было отмечено, что существует связь между E. coli , обнаруженным в фекалиях матерей, слизью, проглоченной младенцами при рождении, и впоследствии в фекалиях младенцев. Хотя, возможно, именно так младенцы приобретают свою E. coli и другую микрофлору, было отмечено, что «младенцы после кесарева сечения обычно не колонизируются фекалиями их матери E. coli ».Однако они были колонизированы так же быстро, как и младенцы, рожденные естественным путем. Эти исследования показали, что кишечник младенцев был колонизирован рано, и эти колонизированные младенцы стали очагами распространения E. coli среди других младенцев. Экологические исследования показали, что «зараженные руки и униформа медперсонала могут быть основным вектором передачи E. coli ». Также было отмечено, что эти E. coli приобрели или утратили определенные черты во время своего распространения, включая устойчивость к антибиотикам, серологические вариации и даже биохимические характеристики (6).Распространение E. coli произошло максимум у четырех других младенцев; Младенцы после кесарева сечения были особенно склонны к колонизации этими типами E. coli .
Патотипы
Исследования комменсала E. coli , приведенные выше, частично были вдохновлены двумя более ранними исследованиями. Первый был инициирован в результате обследования инфекции мочевыводящих путей (ИМП) E. coli среди пациентов, которые находились в женском общем медицинском отделении в течение 2 лет (7).Использование обширного набора антисывороток для типирования E. coli позволило провести более полную идентификацию и анализ. Было отмечено, что O-типы, ответственные за большинство инфекций, относятся к относительно небольшому числу распространенных типов.
Пациенты с диабетом, злокачественными заболеваниями, ревматоидным артритом и гипертонией имели гораздо более высокую заболеваемость инфекцией мочевых путей E. coli , чем остальная часть населения отделения. Кроме того, в отделении были небольшие эпидемии ИМП из-за специфических типов E. coli O.Эти исследования показали, что ничего из этого не было получено путем катетеризации или с помощью инструментов. Доказательства соответствуют оральной передаче типоспецифической E. coli из кишечных резервуаров человека-носителя.
Среди 20 пациентов (8), которые ранее не болели ИМП и у которых развилась инфекция, у 13 эти инфекции развились в течение 12 дней после гинекологических операций, сопровождавшихся введением самоудерживающегося катетера. Инфекции были вызваны типом, который присутствовал до операции в прямой кишке, влагалище или в обоих случаях.
Эти исследования показывают, что комменсал E. coli может передаваться среди младенцев, а восприимчивые люди могут заразиться такими E. coli , наблюдения, которые могут иметь отношение к восприимчивости как новорожденных (особенно недоношенных), так и женщин, у которых развились ИМП. .
В ходе расследований, проведенных при спонсорской поддержке военных властей, изучалась причина диареи путешественников, которая поражает лиц, недавно прибывших в другую страну, обычно в течение 14 дней с момента прибытия (9).Группа из 540 британских солдат совершила воздушное путешествие из Англии в Аден; из них у 38 был эпизод диареи в течение первых 14 дней после прибытия. Были исследованы пробы фекалий 35, и в 2 были получены штаммы Salmonella spp., Из оставшихся 33 возбудителей не было выделено. Новый серотип E. coli (O148.h38) был выделен в острой фазе из 19 штаммов. эти случаи. В остальных 14 (40%) случаях было выделено несколько различных серотипов E. coli .К ним относятся серотипы, связанные с детской диареей и не связанные с диареей путешественников. Пик выделений E. coli O148: h38 соответствовал пику заболеваемости диареей путешественников. Этот серотип никогда не выделяли у здорового человека. Год спустя в лаборатории в Англии у техника, работающего с этим серотипом, развился тяжелый эпизод диареи, и E. coli O148: h38 был выделен в чистой культуре из его стула. Этот же серотип, а также O6: h26 были впоследствии выделены у американских солдат во Вьетнаме (10).
С момента этих ранних открытий было описано по крайней мере 78 детектируемых антигенов O и 34 антигена H, связанных с ETEC. Среди наиболее распространенных серотипов, которые продуцируют так называемый термостабильный энтеротоксин (ST), термолабильный энтеротоксин (LT) или оба, являются O6: h26 (LT / ST), O8: H9 (только ST), O25: NM. (Только LT), O78: h22 (только ST), O148: h38 (только ST) и O153: h55 (только ST). Их распространенность и фенотипы [в зависимости от токсинов, которые они переносят, или факторов колонизации (CF), которые они выражают], могут варьироваться в зависимости от местоположения.Многие из этих серотипов также обычно выделялись из источников окружающей среды, случаев заболевания людей и вспышек заболеваний по всему миру (11). Эти исследования подтвердили, что E. coli может быть не только комменсалом, но и истинными патогенами, и они могут быть приобретены и распространены людьми.
В 1983 г. небольшая вспышка диареи произошла в неонатальном отделении (12), в котором проводились более ранние исследования распространения комменсала E. coli (5, 6). Несмотря на введение строгих мер контроля, эпидемический штамм (O125: K70: h31) распространился на 16 младенцев, в то время как комменсальные штаммы распространились максимально на 4 младенцев, аналогично распространению, наблюдаемому в предыдущем исследовании, в отношении которого не было предпринято никаких специальных мер по сдерживанию.Комменсал E. coli беспрепятственно распространился среди других младенцев, и штамм вспышки распространился гораздо шире, чем комменсалы.
Первоначально EPEC был идентифицирован на основании того, что определенные серотипы были регулярно связаны с инфантильным гастроэнтеритом, но фактические факторы вирулентности не были известны. После открытия факторов вирулентности было показано, что они присутствуют не только в выделенных в настоящее время штаммах EPEC, но и в исходных архивных штаммах EPEC, выделенных задолго до описания этих факторов вирулентности (13), что свидетельствует о том, что EPEC представляет собой специфическую линию патогенных E.coli .
Shigatoxigenic E. coli или VTEC — еще один патотип, впервые описанный в 1977 г. (14) при исследовании воздействия супернатантов культур из различных E. coli на различные клеточные линии, включая клетки Vero (14). В то время как ряд различных серотипов был идентифицирован как связанный с этими патотипами (15), один серотип (O157: H7), впервые описанный в 1983 году (16), доминировал в литературе STEC / VTEC. Вскоре выяснилось, что веротоксины похожи на токсин шига, связанный со штаммом Shigella dysenteriae , который был описан еще в 1903 году (17, 18).STEC / VTEC, не относящиеся к O157, как правило, игнорировались в первые годы исследований STEC / VTEC, но их важность в качестве причин спорадических и вспышек заболеваний в настоящее время хорошо установлена (15).
На протяжении многих лет было показано, что различные «мобильные генетические элементы», такие как транспозоны, инсерционные последовательности, бактериофаги и плазмиды, могут существовать либо интегрированными в хромосому, либо посредством саморепликации в новом хозяине, обеспечивая новые признаки и преимущества фитнеса. Наиболее поддающиеся определению факторы вирулентности, обнаруженные у патогенного E.coli происходят из генетических мобильных элементов. Например, большинство генов токсинов и CF, необходимых для патогенеза ETEC, обнаруживаются почти исключительно на плазмидах (11). Эти плазмиды могут перемещаться между штаммами, предоставляя различные палитры факторов вирулентности. Недавний пример такого взаимодействия был показан со смешением факторов вирулентности, что привело к одной из самых серьезных вспышек, вызванной E. coli . Это была вспышка в 2011 г. (19) из-за энтероагреганта E.coli O104: h5, которые также были способны продуцировать токсины шига и от которых пострадали около 4000 человек в Германии и многие другие в 16 других странах. Недавно было показано, что энтероагрегативный штамм приобрел бактериофаг, кодирующий токсин шига 2а, у крупного рогатого скота (20). Большинство инфекций E. coli являются кишечными. Внекишечные инфекции, такие как ИМП и неонатальный менингит, вероятно, также имеют кишечное происхождение (7, 8, 21). Это может иметь последствия в отношении СВДС ( см. Ниже) .
Escherichia coli и синдром внезапной детской смерти
До 1940-х годов патогенные E. coli не были идентифицированы; их нельзя было отличить методами, доступными для непатогенных комменсалов E. coli . Новаторская работа Кауфманна по разработке схемы серотипирования позволила связать штаммы, принадлежащие к определенным серотипам O: H, с определенными из патотипов. В течение многих лет EPEC распознавался только серотипами, пока не были идентифицированы специфические факторы вирулентности.
Механизмы, с помощью которых патогенная бактерия E. coli получает доступ к восприимчивому хозяину и остается в нем, были неизвестны, но считались, вероятно, аналогичными таковому у комменсала E. coli в течение длительных периодов совместной эволюции. Исследования комменсала E. coli в 1970-х годах послужили основой для понимания колонизации человеческого тела E. coli .
Комменсальные штаммы
В первом из этих исследований (4) были исследованы полные фекалии от 9 здоровых взрослых людей с 10 участками на каждом оцениваемом образце и не менее 10 E.coli -подобные колонии, собранные с каждого сайта. Они выявили большое разнообразие типов, хотя во всех стулах, кроме одного, один преобладающий тип присутствовал на всех 10 участках. Это указывает на то, что обычно, когда изолят E. coli выбирается из образца фекалий, он, вероятно, будет преобладающим типом, но второстепенные типы могут быть пропущены.
Обширное исследование приобретения новорожденными E. coli (5) показало, что « E. coli присутствует во влагалище женщин и что приобретение этих E.coli младенцами зависит от продолжительности родов. Также было отмечено, что существует связь между E. coli , обнаруженным в фекалиях матерей, слизью, проглоченной младенцами при рождении, и впоследствии в фекалиях младенцев. Хотя, возможно, именно так младенцы приобретают свою E. coli и другую микрофлору, было отмечено, что «младенцы после кесарева сечения обычно не колонизируются фекалиями их матери E. coli ».Однако они были колонизированы так же быстро, как и младенцы, рожденные естественным путем. Эти исследования показали, что кишечник младенцев был колонизирован рано, и эти колонизированные младенцы стали очагами распространения E. coli среди других младенцев. Экологические исследования показали, что «зараженные руки и униформа медперсонала могут быть основным вектором передачи E. coli ». Также было отмечено, что эти E. coli приобрели или утратили определенные черты во время своего распространения, включая устойчивость к антибиотикам, серологические вариации и даже биохимические характеристики (6).Распространение E. coli произошло максимум у четырех других младенцев; Младенцы после кесарева сечения были особенно склонны к колонизации этими типами E. coli .
Патотипы
Исследования комменсала E. coli , приведенные выше, частично были вдохновлены двумя более ранними исследованиями. Первый был инициирован в результате обследования инфекции мочевыводящих путей (ИМП) E. coli среди пациентов, которые находились в женском общем медицинском отделении в течение 2 лет (7).Использование обширного набора антисывороток для типирования E. coli позволило провести более полную идентификацию и анализ. Было отмечено, что O-типы, ответственные за большинство инфекций, относятся к относительно небольшому числу распространенных типов.
Пациенты с диабетом, злокачественными заболеваниями, ревматоидным артритом и гипертонией имели гораздо более высокую заболеваемость инфекцией мочевых путей E. coli , чем остальная часть населения отделения. Кроме того, в отделении были небольшие эпидемии ИМП из-за специфических типов E. coli O.Эти исследования показали, что ничего из этого не было получено путем катетеризации или с помощью инструментов. Доказательства соответствуют оральной передаче типоспецифической E. coli из кишечных резервуаров человека-носителя.
Среди 20 пациентов (8), которые ранее не болели ИМП и у которых развилась инфекция, у 13 эти инфекции развились в течение 12 дней после гинекологических операций, сопровождавшихся введением самоудерживающегося катетера. Инфекции были вызваны типом, который присутствовал до операции в прямой кишке, влагалище или в обоих случаях.
Эти исследования показывают, что комменсал E. coli может передаваться среди младенцев, а восприимчивые люди могут заразиться такими E. coli , наблюдения, которые могут иметь отношение к восприимчивости как новорожденных (особенно недоношенных), так и женщин, у которых развились ИМП. .
В ходе расследований, проведенных при спонсорской поддержке военных властей, изучалась причина диареи путешественников, которая поражает лиц, недавно прибывших в другую страну, обычно в течение 14 дней с момента прибытия (9).Группа из 540 британских солдат совершила воздушное путешествие из Англии в Аден; из них у 38 был эпизод диареи в течение первых 14 дней после прибытия. Были исследованы пробы фекалий 35, и в 2 были получены штаммы Salmonella spp., Из оставшихся 33 возбудителей не было выделено. Новый серотип E. coli (O148.h38) был выделен в острой фазе из 19 штаммов. эти случаи. В остальных 14 (40%) случаях было выделено несколько различных серотипов E. coli .К ним относятся серотипы, связанные с детской диареей и не связанные с диареей путешественников. Пик выделений E. coli O148: h38 соответствовал пику заболеваемости диареей путешественников. Этот серотип никогда не выделяли у здорового человека. Год спустя в лаборатории в Англии у техника, работающего с этим серотипом, развился тяжелый эпизод диареи, и E. coli O148: h38 был выделен в чистой культуре из его стула. Этот же серотип, а также O6: h26 были впоследствии выделены у американских солдат во Вьетнаме (10).
С момента этих ранних открытий было описано по крайней мере 78 детектируемых антигенов O и 34 антигена H, связанных с ETEC. Среди наиболее распространенных серотипов, которые продуцируют так называемый термостабильный энтеротоксин (ST), термолабильный энтеротоксин (LT) или оба, являются O6: h26 (LT / ST), O8: H9 (только ST), O25: NM. (Только LT), O78: h22 (только ST), O148: h38 (только ST) и O153: h55 (только ST). Их распространенность и фенотипы [в зависимости от токсинов, которые они переносят, или факторов колонизации (CF), которые они выражают], могут варьироваться в зависимости от местоположения.Многие из этих серотипов также обычно выделялись из источников окружающей среды, случаев заболевания людей и вспышек заболеваний по всему миру (11). Эти исследования подтвердили, что E. coli может быть не только комменсалом, но и истинными патогенами, и они могут быть приобретены и распространены людьми.
В 1983 г. небольшая вспышка диареи произошла в неонатальном отделении (12), в котором проводились более ранние исследования распространения комменсала E. coli (5, 6). Несмотря на введение строгих мер контроля, эпидемический штамм (O125: K70: h31) распространился на 16 младенцев, в то время как комменсальные штаммы распространились максимально на 4 младенцев, аналогично распространению, наблюдаемому в предыдущем исследовании, в отношении которого не было предпринято никаких специальных мер по сдерживанию.Комменсал E. coli беспрепятственно распространился среди других младенцев, и штамм вспышки распространился гораздо шире, чем комменсалы.
Первоначально EPEC был идентифицирован на основании того, что определенные серотипы были регулярно связаны с инфантильным гастроэнтеритом, но фактические факторы вирулентности не были известны. После открытия факторов вирулентности было показано, что они присутствуют не только в выделенных в настоящее время штаммах EPEC, но и в исходных архивных штаммах EPEC, выделенных задолго до описания этих факторов вирулентности (13), что свидетельствует о том, что EPEC представляет собой специфическую линию патогенных E.coli .
Shigatoxigenic E. coli или VTEC — еще один патотип, впервые описанный в 1977 г. (14) при исследовании воздействия супернатантов культур из различных E. coli на различные клеточные линии, включая клетки Vero (14). В то время как ряд различных серотипов был идентифицирован как связанный с этими патотипами (15), один серотип (O157: H7), впервые описанный в 1983 году (16), доминировал в литературе STEC / VTEC. Вскоре выяснилось, что веротоксины похожи на токсин шига, связанный со штаммом Shigella dysenteriae , который был описан еще в 1903 году (17, 18).STEC / VTEC, не относящиеся к O157, как правило, игнорировались в первые годы исследований STEC / VTEC, но их важность в качестве причин спорадических и вспышек заболеваний в настоящее время хорошо установлена (15).
На протяжении многих лет было показано, что различные «мобильные генетические элементы», такие как транспозоны, инсерционные последовательности, бактериофаги и плазмиды, могут существовать либо интегрированными в хромосому, либо посредством саморепликации в новом хозяине, обеспечивая новые признаки и преимущества фитнеса. Наиболее поддающиеся определению факторы вирулентности, обнаруженные у патогенного E.coli происходят из генетических мобильных элементов. Например, большинство генов токсинов и CF, необходимых для патогенеза ETEC, обнаруживаются почти исключительно на плазмидах (11). Эти плазмиды могут перемещаться между штаммами, предоставляя различные палитры факторов вирулентности. Недавний пример такого взаимодействия был показан со смешением факторов вирулентности, что привело к одной из самых серьезных вспышек, вызванной E. coli . Это была вспышка в 2011 г. (19) из-за энтероагреганта E.coli O104: h5, которые также были способны продуцировать токсины шига и от которых пострадали около 4000 человек в Германии и многие другие в 16 других странах. Недавно было показано, что энтероагрегативный штамм приобрел бактериофаг, кодирующий токсин шига 2а, у крупного рогатого скота (20). Большинство инфекций E. coli являются кишечными. Внекишечные инфекции, такие как ИМП и неонатальный менингит, вероятно, также имеют кишечное происхождение (7, 8, 21). Это может иметь последствия в отношении СВДС ( см. Ниже) .
Инфекция E-Coli: не только из продуктов питания
E coli и другие грамотрицательные бациллы, такие как штаммы Klebsiella, Enterobacter, Proteus, и Pseudomonas, также могут вызывать заболевания, не связанные с пищевыми продуктами , включая инфекции крови (сепсис), воспаление оболочки головного и спинного мозга (менингит) у новорожденных детей и инфекции мочевыводящих путей у детей и взрослых всех возрастов.
При большинстве инфекций новорожденных E coli или другие грамотрицательные бактерии обычно передаются из половых путей матери новорожденному во время родов.Иногда они также могут передаваться при личном контакте с опекунами или другими детьми.
Признаки и симптомы
Ребенок, у которого развивается сепсис, часто демонстрирует такие признаки и симптомы, как
- Лихорадка, включая повышающую и понижающуюся температуру
- Дыхание с кряхтением
- Вялость
- Раздражительность
- Отсутствие аппетита
- Рвота
- Желтуха (пожелтение кожи и глаз)
- Вздутие живота
- Диарея
Менингит у новорожденных с E coli или другой грамотрицательной инфекцией может не вызывать всех признаков, обычно связанных с инфекцией центральной нервной системы.Признаки менингита могут включать лихорадку или аномально низкую температуру, вялость или кому, рвоту, вздутие мягкого пятна (технический термин для мягкого места на голове — родничок) и судороги.
Признаки инфекции мочевыводящих путей (ИМП) включают боль при мочеиспускании, учащенное мочеиспускание и мокнутие в постели или одежде у ранее сухого ребенка.
Когда звонить педиатру
Немедленно обратитесь к педиатру, если у вашего ребенка появятся симптомы, подобные описанным здесь.
Как ставится диагноз?
Для диагностики этих инфекций ваш педиатр назначит анализы крови, спинномозговой жидкости и мочи вашего ребенка.
Лечение
Если у вашего новорожденного сепсис или менингит, врач сначала пропишет вам ампициллин и аминогликозиды. (Иногда вместо аминогликозидов используются препараты цефалоспорина.) Лабораторные тесты могут определить точный организм, вызывающий инфекцию. Лечение длится от 10 до 14 дней в большинстве случаев сепсиса и не менее 21 дня при менингите.
Инфекции мочевыводящих путей обычно можно лечить пероральными антибиотиками. Если у вашего ребенка ИМП, ваш педиатр назначит несколько тестов для оценки состояния мочевого пузыря и почек. Некоторые анализы проводятся во время заражения, другие — после выздоровления ребенка.
Информация, содержащаяся на этом веб-сайте, не должна использоваться вместо медицинской помощи и рекомендаций вашего педиатра. Ваш педиатр может порекомендовать лечение по-разному, исходя из индивидуальных фактов и обстоятельств.
Клиническая картина детской инфекции, вызванной Escherichia Coli: история, физика, причины
Nataro JP. Кишечная палочка. Лонг С., Пикеринг Л.К., Пробер К.Г. (редакторы). Принципы и практика детских инфекционных болезней . 3-е издание. Орландо, Флорида: Черчилль Ливингстон; 2008.
Диарея, вызванная Escherichia coli. Пикеринг LK, Бейкер CJ, Overturf GD, Prober CG (редакторы). Отчет Комитета по инфекционным заболеваниям Американской академии педиатров.Красная книга . 2008. 291-6.
Центры по контролю и профилактике заболеваний. Предварительные данные FoodNet о заболеваемости патогенами, обычно передаваемыми через пищу — 10 штатов, 2007 г. MMWR Morb Mortal Wkly Rep . 2008 г. 11 апреля. 57 (14): 366-70. [Медлайн].
ВОЗ. Энтеротоксигенная кишечная палочка. Всемирная организация здоровья. Доступно по адресу http://www.who.int/vaccine_research/diseases/e_e_coli/en/. Дата обращения: 01.10.2008.
Гупта С.К., Кек Дж., Рам П.К., Крамп Дж. А., Миллер М.А., Минц Э.Д. Часть III. Анализ пробелов в данных, касающихся энтеротоксигенных инфекций, вызванных Escherichia coli, в странах с низким и средним индексом человеческого развития, 1984-2005 гг. Эпидемиол. Инфекция . 2008 июнь 136 (6): 721-38. [Медлайн].
Qadri F, Svennerholm AM, Faruque AS, et al. Энтеротоксигенная кишечная палочка в развивающихся странах: эпидемиология, микробиология, клинические особенности, лечение и профилактика. Clin Microbiol Ред. . 2005 июля 18 (3): 465-83. [Медлайн].
Bolin I, Wiklund G, Qadri F, et al. Энтеротоксигенная кишечная палочка с генотипами STh и STp связана с диареей как у детей в эндемичных районах, так и у путешественников. Дж. Клин Микробиол . 2006 ноябрь 44 (11): 3872-7. [Медлайн].
Rockabrand DM, Shaheen HI, Khalil SB и др. Энтеротоксигенные типы факторов колонизации кишечной палочки, собранные с 1997 по 2001 год у военнослужащих США во время операции «Яркая звезда» в северном Египте. Диагностика Microbiol Infect Dis . 2006 май. 55 (1): 9-12. [Медлайн].
Yolbas I, Tekin R, Kelekci S, Tekin A, Okur MH, Ece A и др. Внебольничные инфекции мочевыводящих путей у детей: возбудители, чувствительность к антибиотикам и сезонные изменения. Eur Rev Med Pharmacol Sci . 2013 Апрель 17 (7): 971-6. [Медлайн].
Canizalez-Roman A, Gonzalez-Nuñez E, Vidal JE, Flores-Villaseñor H, León-Sicairos N. Профили распространенности и антибиотикорезистентности диарейных штаммов Escherichia coli, выделенных из пищевых продуктов на северо-западе Мексики. Int J Food Microbiol . 2013 27 марта. 164 (1): 36-45. [Медлайн].
Buchholz U, Bernard H, Werber D, et al. Немецкая вспышка Escherichia coli O104: h5, связанная с проростками. N Engl J Med . 2011 26 октября. [Medline].
Франк С., Вербер Д., Крамер Дж. П. и др. Эпидемический профиль вспышки Escherichia coli O104: h5, продуцирующей шига-токсин, в Германии. N Engl J Med . 22 июня 2011 г. [Medline].
Центры по контролю и профилактике заболеваний.Escherichia coli O157: инфекция H7, связанная с употреблением сырого молока — Вашингтон и Орегон, ноябрь-декабрь 2005 г. MMWR Morb Mortal Wkly Rep . 2007 марта 2. 56 (8): 165-7. [Медлайн].
Rossit AR, de Almeida MT, Nogueira CA, et al. Бактериальные, дрожжевые, паразитарные и вирусные энтеропатогены у ВИЧ-инфицированных детей из штата Сан-Паулу, юго-восток Бразилии. Диагностика Microbiol Infect Dis . 2007 Январь 57 (1): 59-66. [Медлайн].
Gassama A, Sow PS, Fall F, et al.Обычные и условно-патогенные энтеропатогены, ассоциированные с диареей у взрослых сенегальцев в связи с серостатусом вируса иммунодефицита человека. Int J Infect Dis . 2001. 5 (4): 192-8. [Медлайн].
Hien BT, Scheutz F, Cam PD и др. Диарейные штаммы Escherichia coli и Shigella, выделенные у детей в ходе исследования методом случай-контроль в больнице в Ханое, Вьетнам. Дж. Клин Микробиол . 2008 г., 46 (3): 996-1004. [Медлайн].
Аль-Галлас Н., Бахри О., Буратбин А. и др.Этиология острой диареи у детей и взрослых в Тунисе, Тунис, с акцентом на диареи, вызывающую кишечную палочку Escherichia coli: распространенность, фенотипирование и молекулярная эпидемиология. Am J Trop Med Hyg . 2007 Сентябрь 77 (3): 571-82. [Медлайн].
Ким MJ, Ким С.А., Кан Ю.С., Хван И.Г., Ри МС. Микробное разнообразие и распространенность патогенов пищевого происхождения в дешевой и нездоровой пище, потребляемой детьми младшего школьного возраста. Lett Appl Microbiol . 2013 г., 1 апреля [Medline].
Центры по контролю и профилактике заболеваний.Escherichia coli 0157: инфекции H7 у детей, связанные с сырым молоком и сырым молозивом коров — Калифорния, 2006. MMWR Morb Mortal Wkly Rep . 13 июня 2008 г. 57 (23): 625-8. [Медлайн].
Центры по контролю и профилактике заболеваний. Продолжающаяся вспышка инфекции Escherichia coli серотипа O157: H7, связанная с потреблением свежего шпината — США, сентябрь 2006 г. MMWR Morb Mortal Wkly Rep . 2006 29 сентября. 55 (38): 1045-6.[Медлайн].
Диарейная кишечная палочка. Центры по контролю и профилактике заболеваний. Доступно по адресу http://www.cdc.gov/ncidod/dbmd/diseaseinfo/diarrecoli_t.htm. Доступ: 1 октября 2008 г.
Серна А 4-й, Бодекер ЕС. Патогенез и лечение инфекций Escherichia coli, продуцирующих токсин Shiga. Curr Opin Gastroenterol . 2008 24 января (1): 38-47. [Медлайн].
Zhang W, Bielaszewska M, Pulz M, et al.Новый иммуно-ПЦР-анализ для обнаружения низких концентраций токсина шига 2 и его вариантов. Дж. Клин Микробиол . 2008 апр. 46 (4): 1292-7. [Медлайн].
Beutin L, Steinruck H, Krause G, et al. Сравнительная оценка иммуноферментного анализа Ridascreen Verotoxin для обнаружения шигатоксин-продуцирующих штаммов Escherichia coli (STEC) из пищевых и других источников. J Appl Microbiol . 2007 марта 102 (3): 630-9. [Медлайн].
Лотигиус А., Янзон А., Бегум И. и др.Энтеротоксигенная кишечная палочка обнаруживается в пробах воды из эндемичных районов с помощью ПЦР в реальном времени. J Appl Microbiol . 2008 апр. 104 (4): 1128-36. [Медлайн].
Морган Дж., Белл М., Сэдлер М.А. КТ острого колита, связанного с кишечной палочкой. Emerg Radiol . 2007 июля. 14 (3): 187-9. [Медлайн].
Kliegman RM, Behrman RE, Jenson HB, et al. Патофизиология жидкостей организма и инфузионная терапия. Учебник педиатрии Нельсона, 18-е изд. Elsevier Health Sciences, . 2007. гл. 55.1.
Фор С. Роль противодиарейных препаратов в качестве дополнительных методов лечения острой диареи у детей. Int J Pediatr . 2013. 2013: 612403. [Медлайн]. [Полный текст].
Wong CS, Jelacic S, Habeeb RL, et al. Риск гемолитико-уремического синдрома после лечения антибиотиками инфекций, вызванных Escherichia coli O157: H7. N Engl J Med . 2000, 29 июня. 342 (26): 1930-6. [Медлайн].
Scheiring J, Andreoli SP, Zimmerhackl LB. Лечение и исходы гемолитико-уремического синдрома, ассоциированного с шига-токсином. Педиатр Нефрол . 2008 23 октября (10): 1749-60. [Медлайн].
Safdar N, Said A, Gangnon RE, Maki DG. Риск гемолитико-уремического синдрома после лечения антибиотиками энтерита, вызванного Escherichia coli O157: H7: метаанализ. JAMA . 2002, 28 августа. 288 (8): 996-1001. [Медлайн].
Ake JA, Jelacic S, Ciol MA, et al.Относительная нефропротекция при инфекциях Escherichia coli O157: H7: связь с увеличением объема внутривенного введения. Педиатрия . 2005 июн 115 (6): e673-80. [Медлайн].
Anjay MA, Anoop P, Britland A. Лейкоцитоз как предиктор прогрессирования гемолитико-уремического синдрома при инфекции Escherichia coli O157: H7. Арка Дис Детский . 2007 сентябрь 92 (9): 820-3. [Медлайн].
Джойши М., Джаухари П., Мэтью А.А. и др. Можем ли мы предсказать развитие гемолитико-уремического синдрома на ранней стадии инфекции Escherichia coli O157 ?. Арка Дис Детский . 2008 Февраль 93 (2): 180-1. [Медлайн].
Grisaru S, Xie J, Samuel S, Hartling L, Tarr PI, Schnadower D и др. Связи между статусом гидратации, внутривенным введением жидкости и результатами пациентов, инфицированных Escherichia coli, продуцирующей токсин шига: систематический обзор и метаанализ. Педиатр JAMA . 2017 г. 1. 171 (1): 68-76. [Медлайн].
Сапс М., Пенсабене Л., Ди Мартино Л. и др.Постинфекционные функциональные расстройства ЖКТ у детей. J Педиатр . 2008 июн. 152 (6): 812-6, 816.e1. [Медлайн].
Frech SA, Dupont HL, Bourgeois AL, et al. Использование пластыря, содержащего термолабильный токсин из Escherichia coli, против диареи путешественников: рандомизированное двойное слепое плацебо-контролируемое полевое испытание фазы II. Ланцет . 2008, 14 июня. 371 (9629): 2019-25. [Медлайн].
Glenn GM, Villar CP, Flyer DC, et al.Безопасность и иммуногенность энтеротоксигенного пластыря вакцины против Escherichia coli, содержащего термолабильный токсин: использование предварительной обработки кожи для разрушения рогового слоя. Инфекция иммунной . 2007 май. 75 (5): 2163-70. [Медлайн].
Ахмед А., Ли Дж., Шилоач И. и др. Безопасность и иммуногенность конъюгированной вакцины с О-специфическим полисахаридом против Escherichia coli O157 у детей 2-5 лет. J Заразить Dis . 2006 15 февраля. 193 (4): 515-21. [Медлайн].
Амиева МР.Важные бактериальные патогены желудочно-кишечного тракта у детей: перспективы патогенеза. Pediatr Clin North Am . 2005 июн. 52 (3): 749-77, vi. [Медлайн].
Блэколл Д.П., Маркес МБ. Еще раз о гемолитико-уремическом синдроме: токсин шига, фактор H и образование фибрина. Ам Дж. Клин Патол . 2004 июн 121 Дополнение: S81-8. [Медлайн].
Дэвид Р.Д., DeBlieux PM, Press R. Рациональное лечение антибиотиками амбулаторных мочеполовых инфекций в изменяющейся среде. Am J Med . 2005 июл.118 Дополнение 7А: 7С-13С. [Медлайн].
Расследование множественной вспышки инфекции E. coli O157: H7: Обновлено 18 июля 2008 г. Центры по контролю и профилактике заболеваний. Доступно по адресу http://www.cdc.gov/ecoli/june2008outbreak/. Доступ: 30 сентября 2008 г.
Li F, Zhao C, Zhang W и др. Использование анализа амплификации ветвления для обнаружения Escherichia coli O157: H7 и других штаммов, продуцирующих токсин E. coli Shiga. Дж. Клин Микробиол . 2005 декабрь 43 (12): 6086-90. [Медлайн]. [Полный текст].
Mehnert-Kay SA. Диагностика и лечение неосложненных инфекций мочевыводящих путей. Am Fam Врач . 2005 августа 1. 72 (3): 451-6. [Медлайн].
Столл Б.Дж., Хансен Н. Инфекции у младенцев с очень низкой массой тела: исследования Сети неонатальных исследований NICHD. Семин Перинатол . 2003 27 августа (4): 293-301. [Медлайн].
Tarr PI, Gordon CA, Chandler WL.Escherichia coli, продуцирующая шига-токсин, и гемолитико-уремический синдром. Ланцет . 2005 19-25 марта. 365 (9464): 1073-86. [Медлайн].
Видал М., Крюгер Э., Дюран С. и др. Одноместный мультиплексный ПЦР-анализ для одновременного выявления шести категорий диареи, вызывающих кишечную палочку, связанных с кишечными инфекциями. Дж. Клин Микробиол . 2005 Октябрь 43 (10): 5362-5. [Медлайн]. [Полный текст].
Йейтс Дж. Диарея путешественника. Am Fam Врач .2005 г. 1. 71 (11): 2095-100. [Медлайн].
Yada N, Fujioka M, Bennett CL, Inoki K, Miki T, Watanabe A и др. STEC: O111-HUS, осложненный острой энцефалопатией у молодой девушки, успешно лечился с помощью набора гемодиафильтрации, стероидного пульса и растворимого тромбомодулина в условиях плазмафереза. Clin Case Rep . 2015 апр. 3 (4): 208-12. [Медлайн]. [Полный текст].
Таканаши Дж., Танейчи Х., Мисаки Т., Яхата Й., Окумура А., Исида Й. и др.Клинические и радиологические особенности энцефалопатии во время вспышки E coli O111 в 2011 г. в Японии. Неврология . 2014 18 февраля. 82 (7): 564-72. [Медлайн].
Pape L, Hartmann H, Bange FC, Suerbaum S, Bueltmann E, Ahlenstiel-Grunow T. Экулизумаб при типичном гемолитико-уремическом синдроме (HUS) с неврологическим вовлечением. Медицина (Балтимор) . 2015 июн.94 (24): e1000. [Медлайн].
Dinh A, Anathasayanan A, Rubin LM. Безопасное и эффективное использование экулизумаба в лечении тяжелого гемолитико-уремического синдрома, связанного с токсином шига, вызванным Escherichia coli. Am J Health Syst Pharm . 2015 15 января. 72 (2): 117-20. [Медлайн].
Delmas Y, Vendrely B, Clouzeau B, Bachir H, Bui HN, Lacraz A, et al. Вспышка гемолитико-уремического синдрома Escherichia coli O104: h5 во Франции: исход лечения экулизумабом. Циферблат нефрола для трансплантации . 2014 29 марта (3): 565-72.

