что значат, аваскулярные, гипоэхогенные и гиперэхогенные образования, анэхогенное содержимое, расшифров
На чем основана методика УЗИ?
Ультразвуковые волны имеют свойство по-разному отражаться от поверхностей или тканей с различной плотностью. Излучаемые УЗИ-прибором, эти волны равномерно распространяются в организме, при этом часть из них поглощается, а часть – рассеивается. Доходя до участков, где граничат ткани с разной акустической плотностью, они отражаются, возвращаясь в обратном направлении. При этом прибор регистрирует эти волны, после чего, исходя из характера отраженного сигнала, формирует двухмерное изображение исследуемого органа.
Свойство той или иной ткани организма отражать ультразвуковую волну на границе перехода с тканью, имеющую другую акустическую плотность, называют эхогенностью.
Одним из ключевых свойств структуры органов и тканей при ультразвуковом исследовании является эхогенная однородность. При выявлении участков неоднородности отраженного сигнала можно предположить прорастание соединительной ткани.
Соответственно, если эхогенность печени повышена, врач-диагност имеет основания предположить, что в определенном участке происходит рубцевание (прорастание соединительной ткани) или жировой дистрофии.
Что это такое?
Эхогенность — технический термин, используемый в эхографии для обозначения способности органов отражать звуковые волны.
Аппарат УЗИ преобразует звуковые волны, отражающиеся от тканей с разной акустической плотностью, в картинку, которую видно на экране во время исследования. Зная точные данные об эхогенности каждого органа, врач констатирует повышение или понижение. Отклонение от общепринятых параметров означает, что негативные факторы спровоцировали диффузные изменения в структурах и функционировании внутренних органов: почек, поджелудочной железы, кишечника, селезенки, желудка и печени. УЗИ дает возможность визуалировать органы, выявить болезнь и проследить в динамике.
Зная точные данные об эхогенности каждого органа, врач констатирует повышение или понижение. Отклонение от общепринятых параметров означает, что негативные факторы спровоцировали диффузные изменения в структурах и функционировании внутренних органов: почек, поджелудочной железы, кишечника, селезенки, желудка и печени. УЗИ дает возможность визуалировать органы, выявить болезнь и проследить в динамике.
Когда у органа эхогенность паренхимы повышена, значит, на данный момент ее ткани отличаются от здоровых. При увеличении или уменьшении эхогенности, изменении однородности структуры или контуров органа, проводится прицельный досмотр сомнительной зоны. Расшифровка УЗИ дает ясное представление о состоянии и диффузных изменениях паренхимы печени и всей пищеварительной системы. Манипуляция позволяет выяснить врачу и следующие вопросы:
какова плотность и размеры органа;однородная или неоднородная структура;присутствуют ли рубцы или узлы;какова концентрация продуктов метаболизма;заражение глистами;есть ли опухолевые образования;состояние (расширение или сужение) кровеносных сосудов и желчевыводящих протоков;образование камней и обструкцию вен;сопровождается ли повышенная эхогенность увеличением лимфатических узлов.
Что такое жировая дистрофия?
Жировая дистрофия – это хроническое заболевание, также известное как стеатоз печени. Данная патология характеризуется нарушением питания печеночных клеток и накоплению в них жира. Причины возникновения и развития данного заболевания могут быть разными. Перечислим наиболее распространенные факторы, способствующие развитию жировой дистрофии:
- воздействие токсических веществ. Чаще всего таким веществом становится сорокапроцентный этиловый спирт. У пьющих людей степень развития жировой дистрофии печени будет прямо пропорциональна количеству употребляемого спирта. Кроме спирта существует ряд гепатотоксичных веществ, таких как дихлодифенил- трихлорэтан (ДДТ) фосфор, четыреххлористый углерод ;
- сахарный диабет;
- избыточное поступление жиров в организм с пищей. Чаще всего встречается у людей, страдающих ожирением;
- недостаточное количество белка в рационе. Казалось бы, причем здесь жировая дистрофия? Дело в том, что белки обеспечивают транспортировку жиров к органам и тканям из печени.
 Таким образом, человек, отказывающийся от мяса, рискует получить неприятное осложнение в виде накопления жиров в печени;
Таким образом, человек, отказывающийся от мяса, рискует получить неприятное осложнение в виде накопления жиров в печени; - прием фармакологических препаратов;
- нарушение деятельности щитовидной железы, сопровождающееся нарушениями белкового и липидного обмена;
- избыточная выработка гормонов надпочечников, негативно воздействующих на ткани печени.
В большинстве случаев жировая дистрофия печени протекает и развивается незаметно, по мере регулярного поступления в организм токсических веществ. Иногда эта патология обнаруживается совершенно случайно в ходе ультразвукового исследования. В тяжелых случаях развития стеатоза печени у пациента появляется тошнота, тянущие боли в правом подреберье, расстройства пищеварения, пожелтение склер и кожи – словом, типичные для большинства заболеваний печени симптомы.
Достоверность результатов ультразвукового исследования не является стопроцентной.
Повышенная эхогенность печени говорит об изменении однородности ткани, но не более того. Иногда такая картина наблюдается у пациентов, которые перед прохождением УЗИ перенесли простудное заболевание – то есть результат может быть и ложноположительным.
Иногда такая картина наблюдается у пациентов, которые перед прохождением УЗИ перенесли простудное заболевание – то есть результат может быть и ложноположительным.
Повышение эхогенности печени также часто встречается при гепатитах и циррозах. Эти заболевания также могут до определенного момента протекать бессимптомно, однако в большинстве случаев внешний вид и самочувствие пациента очень быстро дадут знать о наличии патологии. Особенно яркую картину дает цирроз, когда процесс гибели печеночных клеток уже необратим. Пациент стремительно теряет вес, при этом его живот увеличивается за счет скопления жидкости. При этом за счет нарушения гормонального фона у мужчин может наблюдаться феминизация внешнего вида – смягчение черт лица и уменьшение количества волосяного покрова на груди, лобке и подмышками.
Причины повышенной эхогенности
Увеличение эхогенности происходит при развитии таких заболеваний и состояний:
отравление алкоголем;цирроз печени;хронический гепатит;хроническое заболевание в состоянии рецидива;эндокринные болезни, в том числе сахарный диабет;избыток массы тела;жировое перерождение печени;длительный прием лекарств.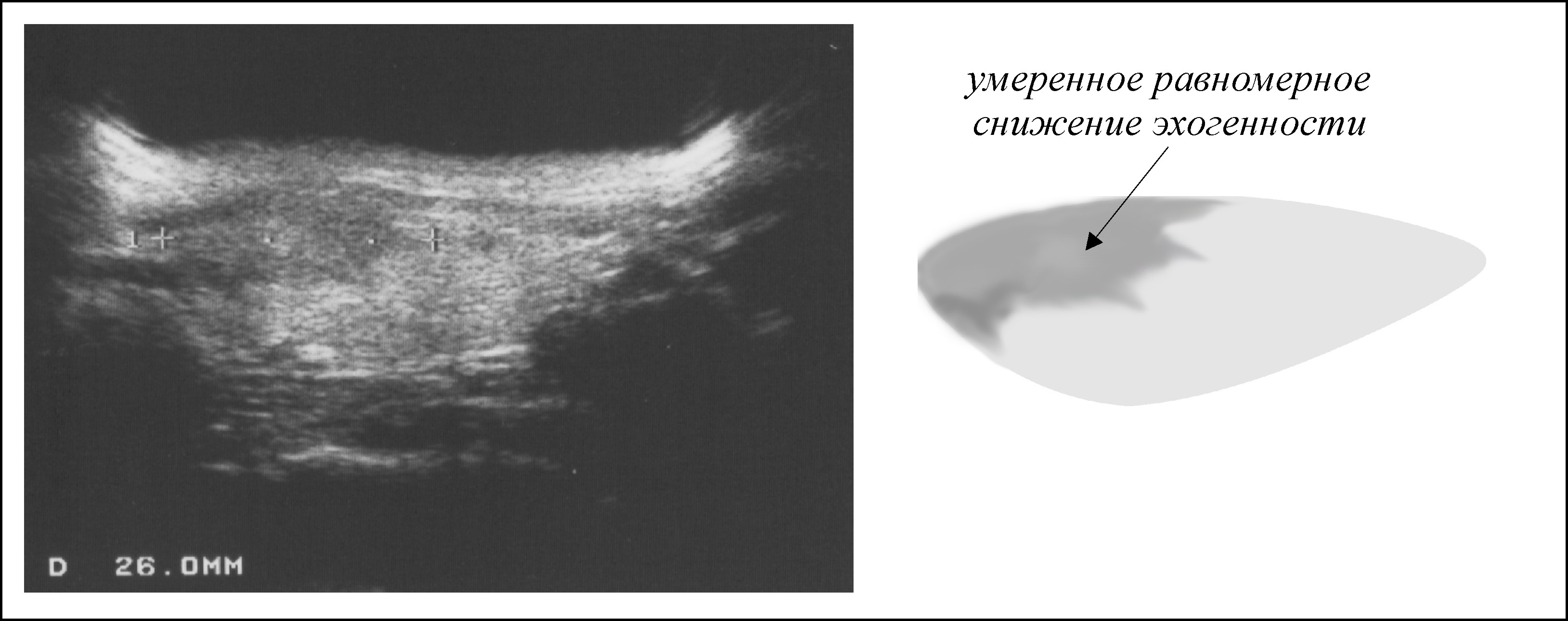
Увеличение эхогенности может сопровождаться изменением размера органа, неровностью его края, нарушением формы углов. Выявленный на УЗИ такой показатель, подкрепленный симптомами болезни, изменениями в лабораторных данных, требует проведения соответствующего лечения.
Уточнение диагноза при повышенной эхогенности
При обнаружении неоднородных эхогенных участков в печени при УЗИ врачу для уточнения диагноза потребуется назначить сразу несколько исследований. В первую очередь будет назначен общий анализ крови, в котором ключевыми показателями будут лейкоциты (их повышенное количество свидетельствует о наличии воспалительных процессов) и тромбоциты (отклонения от нормы дают основания заподозрить снижение функциональной активности печени). Далее обязательно придется пройти биохимический анализ крови. При его расшифровке особое внимание врач обращает на такие параметры как содержание аланинаминотрансферазы, аспартатаминотрансферазы, билирубина, щелочной фосфатазы, а также альбумина и холинестеразы.
При подозрении на нарушение оттока желчи назначается дуоденальное зондирование – в течение нескольких часов пациент сидит с проглоченным зондом, через который поступают пробы желчи.
Основанием для гистологического исследования ткани печени (пункция) может стать подозрение на опухоль или тяжелую форму гепатита, грозящую перейти в цирроз.
Довольно дорогим, однако очень информативным методом визуализации внутренних органов и тканей является МРТ (магнитно-резонансная томография), которую также назначают при подозрении на наличие кист, опухолей или абсцессов. Данный метод является альтернативой УЗИ в случае если пациент тучный, и его обширная жировая прослойка мешает прохождению ультразвуковых волн.
Причины патологических образований
Нормой считается эхогенность средняя, или изоэхогенность. Повышенной эхогенностью обладают кости и хрящи. Пониженная эхогенность характерна для фолликулов в яичнике. Остальные случаи являются патологией.
Гиперэхогенные
Эхопозитивное образование, то есть с повышенной эхогенностью, имеет плотность, близкую к костям.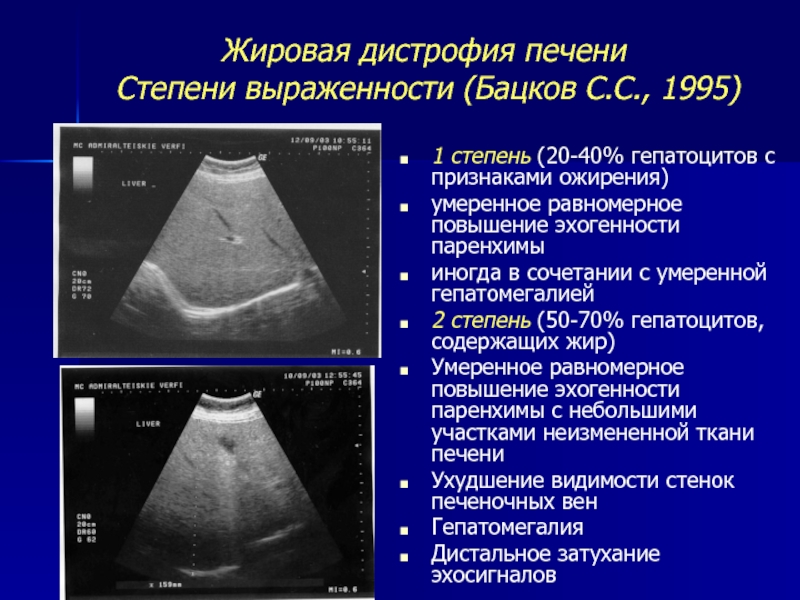 Таким критериям отвечают опухоли и разрастания рубцовой ткани.
Таким критериям отвечают опухоли и разрастания рубцовой ткани.
- Повышенная эхогенность возникает в печени при циррозе. В норме она обладает изоэхогенной структурой, но цирроз — это замещение здоровой ткани рубцовой, которая отражает ультразвук сильнее.
- Высокая эхогенность характерна для некоторых злокачественных опухолей. Они поражают печень и почки, реже поджелудочную железу.
- Гиперэхогенные образования округлой формы в желчном пузыре или почках — камни. Они образуются из-за скопления желчи или солей.
- Если эхогенность повышена умеренно в стенке матки, это признак миомы. Доброкачественная опухоль, образованная мышцами, растет медленно.
Гиперэхогенные новообразования отличаются четкими контурами, форма их обычно овальная. Цвет на снимке зависит от плотности. Чем плотнее новообразование, тем светлее оно выглядит.
На видео новообразования печени с повышенными эхогенными признаками:
Гипоэхогенные
Эхонегативное образование имеет плотность ниже, чем здоровый орган. Такой признак наблюдается при воспалениях, появлениях полостей.
- Эхогенность снижена при воспалении любого органа. При этом он увеличивается в размере. Такой признак наблюдается при гепатите, панкреатите, простатите.
- Низкой эхогенностью обладают полости, содержащие воздух или жидкость. Они называются кистами, у них есть стенка, которая на снимке выглядит светлой. Внутри же обнаруживается темное пятно, потому что воздух или жидкость плохо отражают ультразвук.

- Сниженная эхогенность типична для большинства злокачественных и доброкачественных опухолей. На снимке они имеют цвет более темный, чем окружающие ткани.
- Низкой эхогенностью характеризуются фиброзные мастопатии. Доброкачественные опухоли молочной железы развиваются на фоне гормональных нарушений.
- Равномерно низкая эхогенность внутри полости матки — признак эндометрита. Так называют воспаление слизистой матки.
Новообразования с низкой эхогенностью имеют различные формы, их контуры чаще расплывчатые. Гипоэхогенная эхоструктура бывает диффузной, когда поражается весь орган. При опухолях и кистах гипоэхогенность имеет локальный характер.
На видео УЗИ кисты матки продемонстрирована гипоэхогенность:
Смешанные
Некоторые патологические образования имеют смешанную эхогенность. Так выглядит начальная стадия цирроза печени, когда еще не вся здоровая ткань превратилась в рубцовую.
Гиперэхогенные включения в гипоэхогенной опухоли — это кальцинаты. Признак характерен для рака щитовидной железы или туберкулеза. Подобные изменения наблюдаются в поджелудочной железе при сахарном диабете.
Признак характерен для рака щитовидной железы или туберкулеза. Подобные изменения наблюдаются в поджелудочной железе при сахарном диабете.
Смешанная эхогенность наблюдается при гломерулонефрите — заболевании почек. Воспалительный процесс развивается только в части органа, а часть его остается здоровой.
На видео УЗИ печени со смешанной эхогенностью:
Диагностика эхогенности. Как проверить правильность диагноза
Изменение эхогенности определяется с помощью УЗИ. Но сам по себе это признак не информативен. Для подтверждения заболевания прибегают к дополнительным методам.
Жалобы больного.Осмотр кожных покровов, слизистой рта, склер глаз, пальпация печени, живота.Лабораторные анализы крови на сахар, билирубин, печеночные ферменты, вирусы гепатита, ВИЧ.Компьютерная томография и магнитно-резонансное исследование помогут уточнить локализацию объектов с повышенной эхогенностью.При подозрении на онкологическое заболевание, для уточнения цирротических изменений, проводят биопсию печени.
Расшифровка УЗИ щитовидной железы: норма – МЕДСИ
Оглавление
Что такое УЗИ?
УЗИ (ультразвуковое исследование, сонография) – процедура для обследования организма посредством ультразвуковых волн. Их частота порядка 20000 Гц, она выше той, которую может воспринять человеческое ухо. Этот анализ безопасен для организма и при необходимости может проводиться часто.
Щитовидная железа вырабатывает йодсодержащие гормоны и хранит йод. Она состоит из двух долей и перешейка и расположена в передней части шеи. Ее правильная работа чрезвычайно важна для нормального функционирования всего организма, а нарушения ведут к ряду заболеваний: рак, базедова болезнь, кретинизм, аденома, микседема и пр.
УЗИ этой железы позволяет узнать, в каком состоянии она находится, есть ли какие-либо патологии или новообразования. Оно показывает изменение ее структуры, из-за которых могут возникнуть различные проблемы со здоровьем.
Как проводится УЗИ?
Перед исследованием не требуется длительной подготовки, но существует несколько правил:
- Рекомендуется не есть за несколько часов до него
- Если предполагается делать допплерографию, необходимо за 3-4 часа принять йодсодержащий препарат
- Перед тем, как лечь на кушетку, нужно снять с шеи все украшения и освободиться от воротника, шарфа и любого другого элемента одежды или декора
Допплер-УЗИ – это вид анализа, который позволяет совместить черно-белое изображение щитовидной железы с цветным отображением кровяного тока. Оно позволяет определить:
Оно позволяет определить:
- Проходимость кровеносных сосудов
- Нарушения их стенок (утончение/утолщение)
- Направление и скорость
- Индекс сопротивления
Сама процедура проходит так:
- Пациент ложится на кушетку
- На его шею наносится специальный крем
- Сонолог водит прибором по области щитовидной железы, и в это время данные передаются на экран и записываются на жесткий диск компьютера
Общее время исследования – порядка 15 минут.
Показания к анализу для взрослого пациента
Ультразвуковое исследование щитовидной железы назначают в таких случаях:
- Пациент бледен и плохо себя чувствует
- Он испытывает боль в горле/шее и при этом не болеет простудными заболеваниями
- Анализы на гормоны показывают нарушения
- Аритмия
- Сонливость, апатия и вялость
- Внезапное ожирение или истощение
- Слишком частые перепады настроения
При планировании беременности также следует провести такое исследование.
Когда УЗИ щитовидной железы необходимо ребенку?
У детей также могут возникнуть проблемы с работой этого органа. Поэтому врач может назначить такое исследование при следующих признаках:
- Во время осмотра у ребенка обнаружено уплотнение на шее
- У него затруднено дыхание, возникает одышка
- Внезапное увеличение/снижение веса
- Аритмия
- Если пациент перенес тяжелое заболевание, при котором возможны осложнения
Существует несколько предпосылок, при наличии которых рекомендуется делать ребенку профилактический осмотр щитовидной железы:
- Проживание на территории с низким содержанием йода в продуктах
- В больших промышленных городах
- Если у ребенка имеется генетическая предрасположенность к проблемам с этим органом
Нормы щитовидной железы
В результате исследования этого органа важным является состояние его долей.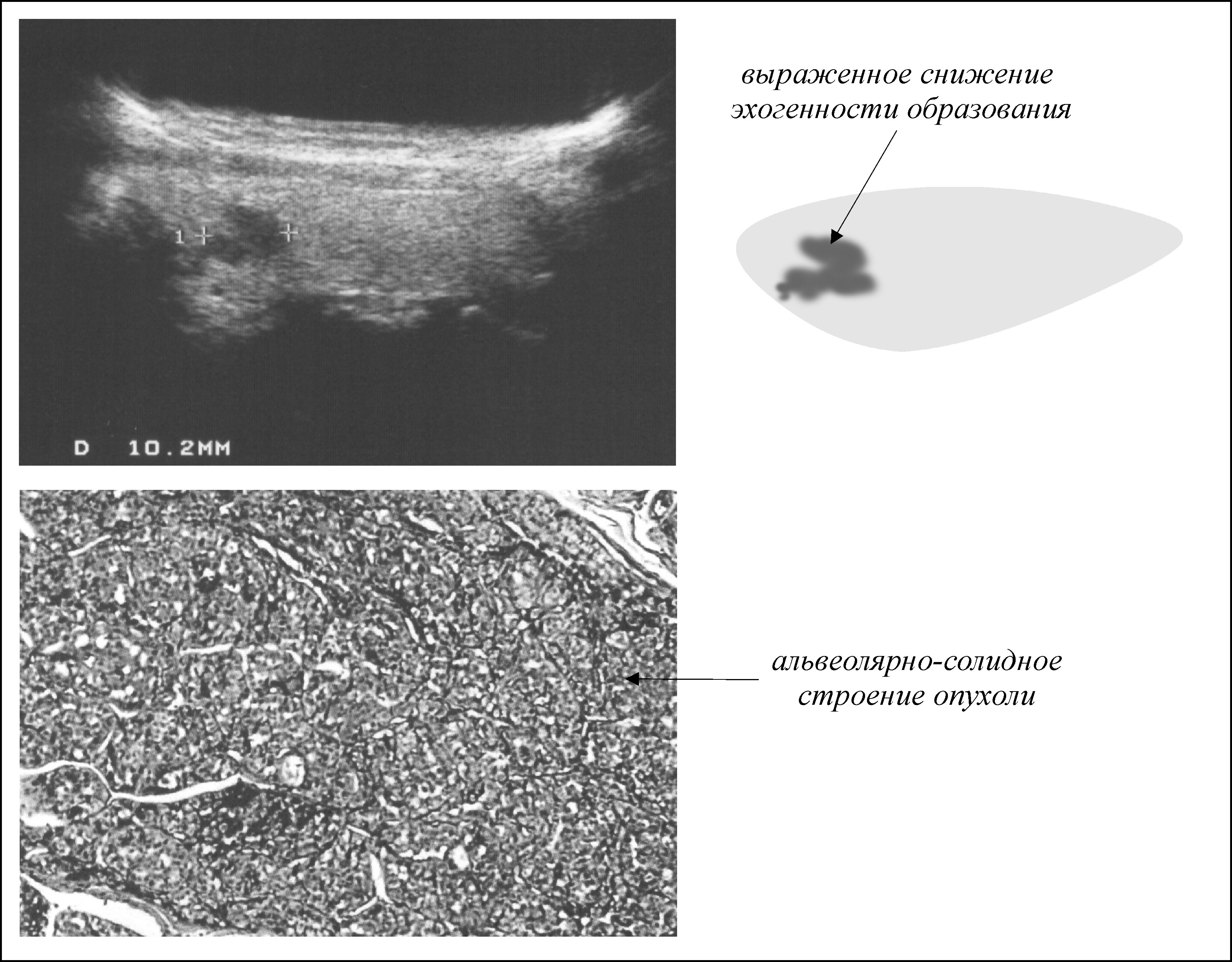
- Размеры
- Структура тканей
- Эхогенность
- Наличие или отсутствие новообразований
Размеры в норме
На результатах УЗИ щитовидной железы размеры и объемы имеют важное значение. Максимальный объем должен рассчитывается в соответствии с весом пациента и может составлять от 12,3 см3 при массе до 40 кг до 35 см3 при 110 кг. Часто у женщин он меньше, чем у мужчин, из-за различий некоторых процессов в работе эндокринной системы. Если железа работает правильно, но при этом ее объем на 1 и более см3 больше, то это также считается нормой.
Отдельно рассматриваются параметры долей. На УЗИ щитовидной железы их нормальные размеры должны соответствовать таким категориям:
- Ширина 1,5-2 см
- Толщина 1-1,5 см
Перешеек может быть от 4 до 8 мм. Размер паращитовидных желез – 2-8 мм. В норме правая доля может быть немного больше левой (изредка – левая больше правой).
Размер паращитовидных желез – 2-8 мм. В норме правая доля может быть немного больше левой (изредка – левая больше правой).
В период беременности размер этого органа может увеличиться, сохраняя нормальное функционирование. Через 3-4 месяца после родов он возвращается в привычное состояние.
У детей до 16-18 щитовидная железа растет постепенно с момента рождения. Может быть увеличена в период полового созревания.
Параметры тканей железы
Структура должна быть зернистой, однородной, железистой и состоять из маленьких фолликул, в которых образуются гормоны. Всего их порядка 30 миллионов.
Ее неоднородность может быть признаком воспалительных заболеваний (диффузный токсический зоб и иные), хотя встречается и у здоровых пожилых людей. Это происходит из-за высокой выработки антител к некоторым ферментам.
Эхогенность
Это параметр, который показывает, как сильно ткани отражают или не отражают ультразвук. Он характеризуется плотностью вещества.
Существует 4 типа эхогенности:
- Анаэхогенный – на мониторе ткани черные, поглощает ультразвук (кровеносные сосуды, доброкачественные образования)
- Изоэхогенный – отражает частично, светло-серый на экране (здоровые ткани)
- Гипоэхогенный – мало отражает, темная область (кисты)
- Гиперэхогенный – полностью отражает, очень светлые части (соединительная ткань)
Если на УЗИ щитовидной железы эхогенность повышена, это может быть признаком иммунных заболеваний.
Новообразования
Анализ помогает выявить различные виды новообразований. Это могут быть:
- Доброкачественные коллоидные узлы, аденомы
- Кисты (содержат жидкость)
- Раковая опухоль
Когда на УЗИ щитовидной железы эхогенность понижена, вероятность наличия кисты или злокачественного образования увеличивается. О нем свидетельствуют размытые границы пятна на сонограмме.
В случае обнаружения таких уплотнений проводят и другие анализы, чтобы уточнить диагноз.
Какие заболевания помогает выявить УЗИ?
В процессе ультразвуковой диагностики врач может обнаружить ряд нарушений. Они определяются в зависимости от размера, объема, структуры тканей и эхогенности. Изменение этих параметров может быть признаком таких заболеваний, как:
- Гипотериоз – уменьшение органа
- Узловой зоб – появление одного или нескольких очагов плотных тканей
- Дифффузно-токсический зоб – чрезмерное увеличение железы
- Воспаление – появление отека и, в некоторых случаях, гноя
- Аденома – доброкачественное опухолевое образование
- Киста – полость, наполненная жидкостью
- Раковая опухоль
Аденому от рака можно отличить по четкости обозначения границ опухоли:
- у доброкачественной они ясно определены и хорошо видны на сонограмме
- у злокачественной – расплывчатые, проросшие в здоровую область
Для установки точного диагноза в таких случаях используют дополнительные методы: анализ крови, КТ, МРТ и другие.
Клиники МЕДСИ предлагают:
- 30 видов ультразвуковых исследований
- современные УЗИ-аппараты экспертного класса – Pro Focus 2202, Philips iU22
- оборудование, которое подходит для обследования детей
- врачи ультразвуковой диагностики и эндокринологи высшей квалификационной категории, кандидаты и доктора медицинских наук
- срочная диагностика
УЗИ печени – что это и что оно показывает?
Ультразвуковое исследование – основной метод диагностики, применяемый в качестве скрининга (первичного обследования) пациентов с неалкогольной жировой болезнью печени (НАЖБП). Среди основных преимуществ УЗИ – безопасность, относительно невысокая стоимость, безболезненность и неинвазивность1,2.
Что такое УЗИ печени?
Ультразвуковое исследование печени (эхография или сонография) – это инструментальный метод, в основе которого лежит применение звуковой волны с частотой более 20 000 Гц. В основе данного метода лежит свойство тканей организма отражать или преломлять ультразвуковые волны. Это свойство тканей называется эхогенность. Эхогенность исследуемых органов сравнивается с эхогеностью коркового вещества почек, на основании чего делается вывод о том, повышена или понижена эхогенность данного органа.
Для УЗИ желчного пузыря и желчевыводящих путей печени обычно используют аппараты с частотой от 3,5 до 5 МГц. Датчики, работающие с различной частотой, позволяют получить изображение на различной глубине (например, максимальная глубина для датчика с частотой 3,5 МГц – 28 см, 5 МГц – 15 см). 2 У пациентов с ожирением и толщиной брюшной стенки более 28 см данная методика может быть не информативна. Применение дополнительных методик исследования может помочь в оценке других характеристик тканей организма, например, применение специальных методик для оценки скорости кровотока в тканях и органах.2
Как с помощью УЗИ выявляют жировой гепатоз?
Часто НАЖБП (стеатоз, жировой гепатоз) выявляется случайно при проведении ультразвукового исследования брюшной полости по другому поводу. Случайное выявление жировой дистрофии печени также обусловлено тем, что НАЖБП может длительное время протекать практически бессимптомно.4
Что может оценивать специалист при проведении УЗИ печени?
- положение органа, его размеры, контуры, оценку размеров долей
- структуру и эхогенность ткани
- сосудистый рисунок печени в целом, особенности структуры конкретных сосудов и желчевыводящих путей;
Исследование проводится врачом функциональной диагностики. Интерпретация результатов исследования проводится лечащим врачом пациента.
Когда важно исключение жирового гепатоза?
Поводом к проведению УЗИ могут стать жалобы пациента на тяжесть или дискомфорт в правом подреберье, тошноту, общую слабость. Обследование пациента с данными жалобами также может включать в себя также определение уровня трансаминаз в биохимическом анализе крови4. Стеатоз по данным УЗИ даже при неповышенных значениях печеночных трансаминаз является достаточным критерием для постановки диагноза
НАЖБП, поскольку результаты биохимического анализа крови не всегда информативны в отношении наличия или отсутствия стеатоза.4
Проведение ультразвукового исследования печени в целях скрининга жирового гепатоза представляется целесообразным также у пациентов с метаболическими нарушениями, такими как ишемическая болезнь сердца, сахарный диабет 2-го типа, артериальная гипертензия, гипотиреоз, холелитиаз и т.д. 4
Как подготовиться к УЗИ печени?
УЗИ органов пищеварительной системы назначают натощак, то есть пациенту необходимо воздержаться от приема пищи за 6-12 часов до исследования.
Предварительная подготовка кишечника проводится с целью уменьшения газообразования. Не рекомендуется в течение нескольких дней употреблять черный хлеб, молоко, газированные напитки, овощи и фрукты, соки, кондитерские изделия, алкоголь. При необходимости назначается очистительная клизма или сорбенты7. Со всеми рекомендациями по подготовке к УЗИ может помочь ознакомиться врач или сотрудники диагностического центра, где проводится исследование. Необходимо учитывать, что результаты проведенного исследования могут быть неинформативными в случае, если не соблюдаются рекомендации по подготовке к исследованию.
Как делают УЗИ печени?
УЗИ проводится через брюшную стенку со стороны правого подреберья с использованием специального геля, который облегчает скольжение датчика и облегчает проведение сигнала через разнородные среды. Специалист исследует все доли печени – правую, левую, квадратную и хвостатую. Проводиться ультразвуковое исследование печени через разные плоскости, накладывая датчик на разные точки, а также в различные фазы дыхания. Иногда может понадобиться дополнительный доступ через межреберье. 2
Какие показатели считаются нормальными?
В норме печень имеет однородную структуру средней эхогенности (сопоставима с эхогенностью почек), четкие контуры и неувеличенные размеры.2 Объемные образования в норме не выявляются.
Основные ультразвуковые показатели печени2:
При выявлении признаков жировой инфильтрации печени, начальной стадии неалкогольной жировой болезни печени (НАЖБП), или других заболеваний, назначается соответствующее лечение. Оно может быть немедикаментозным и медикаментозным.
Среди лекарственных препаратов можно обратить внимание на группу гепатопротекторов, например, на основе эссенциальных фосфолипидов, способствующих восстановлению поврежденных печеночных клеток. Эссенциале® форте Н — препарат на основе эссенциальных фосфолипидов, которые были изучены более чем в 200 исследованиях.5
Дата публикации материала: 17 ноября 2020 года
MAT-RU-2003445-1.00-11/2020
Другие статьи
Биохимический анализ крови – один из эффективных способов оценки состояния здоровья пациента. Узнайте, какие показатели могут помочь в диагностике болезни печени
Печень, как настоящий атлет, который постоянно в действии, должна быть в отличной форме. Но что будет, если атлет начнет набирать лишний вес и накапливать жир? Узнайте в нашей статье
Терапия жирового гепатоза — комплексный процесс, который включает в себя, прежде всего, изменение образа жизни. Почему так важна ранняя диагностика заболевания, а также как его лечить – читайте в нашем материале.
Фиброз печени характеризуется накоплением волокон соединительной ткани. Прогрессирование этого состояния может приводить к циррозу и нарушению функции печени.
Читать все статьиПройдите тест
Жировой гепатоз важно диагностировать как можно раньше, чтобы он не повлиял на работу других органов. Наш тест позволит Вам больше узнать о факторах риска этого заболевания.
Эхогенность атеросклеротических бляшек в сонных артериях у больных с острым коронарным синдромом и ее влияние на прогноз сердечно-сосудистых событий | Гучаева
1. Gaigalaite1. Гайгалайте В., Ожерайтене В., Калибатене Д., и др. Взаимосвязь между структурными изменениями атеросклеротических бляшек каротидных артерий и инфарктом миокарда. Кардиология. 2013;9:21-5.
2. Kajermo U, Ulvenstam A, Modica A, et al. Incidence, trends, and predictors of ischemic stroke 30 days after an acute myocardial infarction. Stroke. 2014;45:1324-30. doi:101161/STROKEAHA.113.001963.
3. Libby P, Pasterkamp G. Requiem for the ‘vulnerable plaque. European Heart Journal. 2015;36:2984-7. doi:10.1093/eurheartj/ehv349.
4. Picano E, Paterni M. Ultrasound tissue characterization of vulnerable atherosclerotic plaque. Int J Mol Sci. 2015;16 (5):10121-33. doi:10.3390/ijms160510121.
5. Spanos K, Tzorbatzoglou I, Lazari P, et al. Carotid artery plaque echomorphology and its association with histopathologic characteristics. J Vasc Surg. 2018;68 (6):1772-80. doi:10.1016/j.jvs.2018.01.068.
6. Honda O, Sugiyama S, Kugiyama K, et al. Echolucent carotid plaques predict future coronary events in patients with coronary artery disease. J Am Coll Cardiol. 2004;43:1177-84. doi:10.1016/j.jacc.2003.09.063.
7. Ishizu T, Seo Y, Machino T, et al. Prognostic impact of plaque echolucency in combination with inflammatory biomarkers on cardiovascular outcomes of coronary artery disease patients receiving optimal medical therapy. Atherosclerosis. 2011 ;216 (1): 120-4. doi:10.1016/j.atherosclerosis.2011.01.048.
8. Hirano M, Nakamura T, Kitta Y, et al. Assessment of carotid plaque echolucency in addition to plaque size increases the predictive value of carotid ultrasound for coronary events in patients with coronary artery disease and mild carotid atherosclerosis. Atherosclerosis. 2010;211 (2):451-5. doi:10.1016/j.atherosclerosis.2010.03.003.
9. Della-Morte D, Moussa I, Elkind MS, et al. The short-term effect of atorvastatin on carotid plaque morphology assessed by computer-assisted gray-scale densitometry: a pilot study. Neurol Res. 2011;33 (9):991-4. doi:10.1179/1743132811Y.0000000039.
10. Marchione P, Vento C, Morreale M, et al. Atorvastatin treatment and carotid plaque morphology in first-ever atherosclerotic transient ischemic attack/stroke: a case-control study. J Stroke Cerebrovasc Dis. 2015;24 (1):138-43. doi:10.1016/j.jstrokecerebrovasd is.2014.08.006.
11. Thygesen K, Alpert J, Jaffe A, et al. The Writing group on behalf of the joint ESC/ACCF/ AHA/WHF. Third Universal Definition of Myocardial Infarction. Circulation. 2012;126:2020-35. doi:10.1161/CIR.0b013e31826e1058.
12. Трипотень М. И., Погорелова О. А., Хамчиева Л. Ш., и др. Количественная оценка эхогенности атеросклеротических бляшек сонных артерий и ее значение в клинической практике. Ультразвуковая и функциональная диагностика. 2017;1:54-64.
13. Salem MK, Bown MJ, Sayers RD, et al. Identification of patients with a histologically unstable carotid plaque using ultrasonic plaque image analysis. Eur J Vasc Endovasc Surg. 2014;48 (2):118-25. doi:10.1016/j.ejvs.2014.05.015.
14. Ibrahimi P, Jashari F, Bajraktari G, et al. Ultrasound assessment of carotid plaque echogenicity response to statin therapy: a systematic review and meta-analysis. Int. J. Mol. Sci. 2015;16:10734-47. doi:10.3390/ijms160510734.
15. Noyes AM, Thompson PD. A systematic review of the time course of atherosclerotic plaque regression. Atherosclerosis. 2014;234:75-84. doi:10.1016/j.atherosclerosis.2014.02.007.
УЗИ поджелудочной железы — показания, как делают, нормы и результаты
Сейчас практически невозможно представить, как еще до недавнего времени врачи обходились без такой диагностики, как ультразвуковые исследования. В конце 18 века Ладзаро Спалланцани, итальянский физик и натуралист, проводил опыты, доказывающие возможность навигации (эхолокации) летучих мышей в темноте с помощью неслышимого человеком звука. Также ориентируются в море многие животные: киты, белухи, дельфины. Эти звуковые колебания, имеющие частоту выше 20 000 Гц, получили название ультразвук.
Первые опыты со звуковыми волнами начались в 19 веке, когда ученые определили скорость звука в воде. Это дало толчок к развитию гидроакустике – обнаружению подводных и надводных объектов в водоеме.
В 30-ых годах 20 столетия были созданы приборы, выявляющие дефекты в металлах – дефектоскопы. В этот же период ученые пытаются использовать ультразвук для медицинских целей. В конце 40-х годов американский ученый Хаури Д. построил первый прибор для медицинской диагностики. Это был бассейн с жидкостью, где размещался пациент. Он должен был сидеть в нем довольно долго, пока его сканировал датчик, что было крайне неудобно.
Принцип действия УЗИ прибора основан на наличии у тканей организма, так называемого, акустического сопротивления, значение которого определяется плотностью и скоростью излучения звуковых колебаний. Распространяются такие волны по принципу геометрической оптики, т.е. колебания не огибают препятствие, а отражаются, поглощаются и преломляются (меняют первоначальное направление). Преломление происходит на границе раздела двух сред с неодинаковой плотностью. Что бы уменьшить потери на отражение ультразвука при переходе с кожи на тело, необходимо использовать специальный водорастворимый гель.
Ученые заметили, что отраженная звуковая волна меняет свою частоту в зависимости от скорости движения облучаемого объекта. Частота может увеличиваться, или уменьшаться при изменении направления движения. Это эффект получил название «эффект Доплера» по имени ученого, его обнаружившего. В современной медицине это явление широко применяется для определения параметров кровотока, а такая процедура называется допплерография.
Процедура УЗИ является достаточно дешевой, широко используемой процедурой, позволяющей довольно точно диагностировать очень большое количество заболеваний в режиме реального времени.
Поджелудочная железа. Общие понятия
Поджелудочная железа является одним из основных органов пищеварительного тракта, который выполняет комбинированную функцию: внешней и внутренней секреции. Функция внешней секреции или экзокринная заключается в выделении панкреатического сока, в своем составе содержащего ферменты, которые нужны для нормальной переработки пищи. Задача внутренней или эндокринной секреции состоит в выработке необходимых гормонов и нормализации процессов обмена в организме – белкового, жирового и углеводного.
Нормально работающая поджелудочная железа выделяет каждые сутки от 0,5 до 1 л сока, в состав которого входят вода, кислые соли, которые ответственные за обеспечение щелочной реакции и соответствующие ферменты.
Выделяемые ферменты
- Амилаза, воздействует на углеводы, расщепляя их. Несоответствие количества его в крови указывает на определенные заболевания. Среди которых панкреатит в острой или хронической форме, гепатит, сахарный диабет.
- Трипсин, работает над расщеплением белков и пептидов. При исследовании поджелудочной железы ему отдается особое внимание. Так как он вырабатывается только в ней. Его активность – главный показатель при диагностировании панкреатита в остром состоянии, а также определение его патогенеза.
- Липаза. Функция данного фермента заключается в расщеплении жиров, после воздействия на них желчи, пришедшей из желчного пузыря.
Внутренняя секреторная функция железы обеспечивает кровь гормонами инсулина и глюкагона. Они производятся клетками, находящимися между дольками и не имеющих выводных протоков, их называют островками Лангерганса. Они находятся в хвосте железы состоят главным образом, из альфа-клеток и бета-клеток.
Их количество у здоровых людей составляет около 1-2 миллионов. В малых долях также присутствуют дельта-клетки (1%), которые секретируют гормон грелин, стимулирующий к потреблению пищи и вызывающий аппетит. Также присутствуют ПП-клетки, их 5%, они отвечают за выработку панкреатического полипептида, образованный 36 аминокислотами, выполняет задачу подавления секреции поджелудочной железы.
- Инсулин вырабатывается бета-клетками и контролирует углеводный и липидный жирового обмен. Благодаря ему, глюкоза из крови попадает в ткани и клетки организма, в результате понижая уровень сахара в крови. На островках Лангерганса бета-клеток около 60-80%.
- Глюкагон производится альфа-клетками и его можно назвать антагонистом инсулина, так как с его помощью уровень глюкозы в крови повышается. Также альфа-клетки выполняют такую значимую функцию, как выработка липокаина, который предохраняет печень от жирового перерождения. Их островках Лангерганса содержится около 20%.
Распадение бета-клеток может привести к уменьшению выработки инсулина, что является основной причиной возникновения сахарного диабета. Основные симптомы — постоянное чувство жажды, кожный зуд, повышенное мочеиспускание.
Поджелудочная железа расположена в брюшной полости, вплотную соприкасаясь с желудком и двенадцатиперстной кишкой, примерно на уровне первого или второго поясничных позвонков. Строение имеет альвеолярно-трубчатое, состоящее из трех частей — головки, тела и хвоста.
Головка с шириной до 5 см, толщина от 1,5 до 3 см. Тело железы – самая длинная часть, его ширина в среднем 1,75-2,5 см. Длина хвоста не превышает 3,5 см, а ширина около 1,5 см. Небольшие отклонения от нормальных размеров головки, тела и хвоста допустимы только при показателях биохимического анализа крови, которые находятся в пределах нормы.
Длина поджелудочной железы взрослого человека составляет от 15 до 22 см, масса около 70-80 граммов.
Факторы, при которых возникает необходимость проведения УЗИ-исследования
Из-за того, что поджелудочная железа углублена довольно глубоко, проведение диагностики заболеваний и отклонений от нормы очень трудно. Именно поэтому очень распространено УЗИ-исследование, позволяющее определить форму и параметры железы, проанализировав затем данные, сделать соответствующие заключения об её состоянии. Одновременно с проведением УЗИ поджелудочной допускается проведение УЗИ печени.
Все параметры, размеры, формы, изменения органа подробно фиксируются в протоколе УЗИ. В нем же так же указываются возможные причины, вызвавшие отклонения.
Симптомы, при которых необходимо провести УЗИ диагностику:
- острая и тупая боль левом подреберье;
- учащенное сердцебиение, аритмия;
- боль при пальпации;
- повышенное потоотделение;
- резкая потеря массы тела;
- желтоватый оттенок кожи и глазных белков;
- слабость;
- увеличение температуры тела;
- понос, тошнота, рвотные позывы.
При исследовании с помощью УЗИ выявляются отклонения структуры и характера контуров поджелудочной, состояние общего выводного протока, выявления желчных камней, острый или хронический панкреатит, аденокарцинома поджелудочной, некроз, сахарный диабет.
Процесс проведения УЗИ – исследования
- Подготовительный этап. Трое суток до проведения УЗИ пациенту необходимо придерживаться щадящей диеты. Не употреблять такие продукты: сырые фрукты и овощи, газированные напитки, молоко, пиво, продукты, которые могут спровоцировать вздутие и газообразование. Пить лучше всего чистую воду. За 12 часов до процедуры нельзя кушать ничего. За час до процедуры не рекомендуется даже пить. В день проведения категорически запрещается курить, принимать алкоголь и лекарства. Если есть склонность к метеоризму, можно принять несколько таблеток активированного угля.
- Исследование. Само по себе обследование абсолютно безболезненное, длится около 10 минут. Перед началом врач смазывает живот специальным гелем. Затем с помощью датчика УЗ-аппарата начинает исследование. Во время сонографического исследования пациент сначала лежит на спине, а затем на правом и левом боку.
- Заключительный этап. В конце процедуры врач-диагност делает расшифровку результатов исследования, в которой указывает, что поджелудочная железа в норме или прописывает патологии. Также к документу прилагается фотография поджелудочной.
Расшифровка результатов и нормы
Что же можно увидеть, проведя УЗИ поджелудочной железы? В протокол исследования заносятся данные:
- присутствие отклонений в расположении;
- проверка признаков диффузных изменений железы, а также проверяются рамерные параметры на уменьшение органа или увеличение;
- форма контурных границ, их ровность и отчетливость;
- эхогенность железы и структура;
- диаметры Вирсунгова и желчевыводящих протоков;
- состояние сосудистой сетки органа;
- проверка на появление положительных и отрицательных опухолей.
Проведя анализ данных, проверив соответствие размеров по норме, врач-диагност выявляет патологические отклонения и заболевания.
Характеристики поджелудочной железы в норме
Нормальные размеры:
|
|
Взрослые (мужчины и женщины) |
Дети |
|
Головка, мм |
18-28 |
10-21 |
|
Тело, мм |
8-18 |
6-13 |
|
Хвост |
22-29 |
10-24 |
Нормальная форма поджелудочной – S-образная.
Контуры железы ровные, четкие. Железа должна выделяться на фоне рядом находящихся органов и тканей. Расплывчатость контуров говорит о возможном начале воспаления. Хотя бывает, что эта неровность может возникнуть в результате некоторых болезней органов, находящихся по соседству.
Эхогенность в норме считается средней, для пациентов среднего и пожилого возраста возможна немного повышенная.
Структура нормальной поджелудочной железы – средней плотности, зернистая, однородная. Уменьшение или увеличение плотности поджелудочной, указывает на панкреатит, отложенных камнях, отечности, новообразованиях.
Сосуды должны быть не деформированы, нормального диаметра, размер которого соответствует 1,5-2,5 мм.
Новообразования, которые диагностированы диагностом, могут быть:
- опухоли – границы четко не просматриваются, бугристые узлы;
- наличие кист и камней, при четких границах.
Возможно обнаружение нарушений и патологий. Часто у пациентов обнаруживаются отклонения:
- Маленький размер поджелудочной железы. Если не сопровождается симптом болью или дискомфортом говорит о старении органа у возрастных пациентов. Является нормой;
- Симптом дольчатой железы. Возникает, когда происходит замена нормальных тканей на жировые. Их отличает более светлый цвет. При этом симптоме эхогенность повышена;
- Воспалительный процесс отражают диффузные изменения. Признаки, определяющие воспаление: увеличение параметров поджелудочной железы, преобразование структуры, уплотнения, области окрашены неоднородным цветом. Это может свидетельствовать о таких болезнях – липоматоз, панкреатит, изменения в эндокринной системе, сбоев в работе кровеносной системы;
- Если головка сильно увеличена и панкреатический проток расширен – это симптомы воспалительного процесса в головке, онкологического заболевания или псевдокисты;
- На развивающийся панкреатит укажет неравномерно увеличенная железа;
- Если началось возникновении опухоли на головке железы покажет утолщение в теле.
Симптомами патологии не являются небольшие отклонения от нормы.
Анализ и расшифровка полученных данных УЗИ-обследования проводится врачом после обследования. Эта работа занимает до 15 минут.
О присутствии заболевания обычно говорят не отдельные отклонения от нормальных характеристик, а совокупность нескольких факторов. Обычно, при обнаружении отклонений в физических показателях железы , врач направляет на дополнительные исследования. Это могут быть УЗИ или МРТ органов пищеварения, проведение биопсии тканей, общий и развернутый анализы крови и мочи. Очень важно для выздоровления или снятия болезненных ощущений вовремя провести диагностику и начать непосредственно лечение.
УЗИ молочной железы
Рак занимает ведущее место в структуре онкологической заболеваемости среди женщин. В диагностике рака молочной железы ультразвуковое исследование имеет существенное значение.
Исследование молочной железы выполняют с применением линейного датчика с частотой излучения 7,5–10 МГц. Какой-либо специальной подготовки пациентки к исследованию не требуется. Однако следует оговориться, что эхография предпочтительна для пациенток до 35 лет. Женщинам после 35 лет, особенно при больших размерах молочных желез и наличии жировой инволюции, обследование необходимо начинать с рентгеновской маммографии, которая у этой группы пациенток является более эффективней. Врачу, выполняющему исследование молочных желез данной возрастной группе больных, необходимо познакомиться с результатами маммографии, чтобы участки жировой инволюции в железе не были ошибочно приняты за патологические очаги.
Исследование выполняют в положении пациентки на спине. Также используют положение на боку вполоборота. Одноименную руку пациентка поднимает и в расслабленном положении кладет за голову. Молочную железу осматривают в радиальном направлении сканирования от периферии к центру, также используют продольное и поперечное сканирование. После этого отдельно осматривают субареолярную область.
Эхография молочной железы позволяет визуализировать кожу, премаммарную клетчатку, железистую ткань, связки Купера, ретромаммарную клетчатку, грудные мышцы, передние контуры костных отделов ребер, хрящевые отделы ребер, межреберные мышцы. Эхографическая структура молочных желез даже у практически здоровых женщин неодинакова. Так, у молодых женщин центральная часть молочной железы представляет собой зону однородной средней эхогенности, жировая ткань визуализируется в виде тонкого слоя низкой эхогенности. С возрастом увеличивается количество жировой ткани, эхогенность железистой ткани повышается. У женщин старше 40 лет в связи с атрофией железистой ткани и замещением ее жировой большая часть железы представлена зоной низкой эхогенности, которая прерывается более эхогенными тяжами, состоящими из соединительной ткани и остатков железистой. Участки жировой инволюции в такой молочной железе могут быть ошибочно приняты за патологические структуры.
Анализируя эхограммы при различных заболеваниях молочных желез, необходимо оценивать форму новообразования (правильная, неправильная), контуры (четкие, нечеткие, ровные, неровные), эхогенность (гиперэхогенная, средняя, гипоэхогенная, анэхогенная), внутреннюю структуру (гомогенная, гетерогенная), а также звукопроводимость образования (повышена, понижена, не изменена). Для рака молочной железы характерны округлая или неправильная форма. Контуры узла неровные, нередко нечеткие, структура обычно гипоэхогенная. Для рака молочной железы наиболее типична пониженная звукопроводимость, за опухолью часто видно затухание эхосигнала или акустическая тень. Нередко, особенно при опухолях небольшого размера, звукопроводимость узла не отличается от окружающей ткани железы. Изменений эхосигнала за опухолью у таких больных не отмечается. Иногда в структуре опухоли видны микрокальцинаты или (чаще в опухолях значительных размеров) анэхогенные участки некроза.
В отличие от рака, для фиброаденомы характерна овальная форма, ровные или волнистые контуры, отсутствие изменений дистального эхосигнала или его усиление, иногда в фиброаденомах встречаются крупные кальцинаты или массивное обызвествление. При раке молочной железы возможны инфильтрация кожи опухолью: при УЗИ вначале видно гиперэхогенное утолщение кожи возле опухоли, затем кожа замещается гипоэхогенной опухолевой тканью. Возможно также изъязвление кожи в зоне инфильтрации. Также возможно диагностировать инфильтрацию грудных мышц: при УЗИ видно нарушение структурности мышцы в месте прилежания опухоли, замещение мышечной ткани опухолью. Кроме основного узла опухоли в молочной железе могут выявляться дополнительные узлы, что характерно для мультицентричного роста и для внутриорганных метастазов. Выявление дополнительных узлов важно для планирования объема операции, а именно для решения вопроса о возможности органосохраняющего лечения.
Минимальные размеры опухоли молочной железы, видимые при УЗИ при благоприятных условиях, – 4-5мм, однако следует помнить, что опухолевый узел даже больших размеров виден не всегда, особенно если выражена железистая ткань, а структура узла изоэхогенная. Также часто не удается визуализировать узел при отечной форме рака молочной железы – видно только повышение эхогенности всех структур железы, смазанность, нечеткость их контуров, утолщение кожи, иногда значительное.
Обследовав молочную железу, приступают к исследованию областей регионарного лимфооттока – подмышечных, надключичных, подключичных и парастернальных. Независимо от стороны локализации патологического процесса выполняют осмотр областей регионарного лимфооттока с обеих сторон. Осмотр областей регионарного лимфооттока при раке молочной железы производится при положении пациентки на спине, исследование левой подмышечной области выполняется при повороте пациентки вполоборота лицом к исследователю. При осмотре над- и подключичных, парастернальных областей руки пациентки вытянуты вдоль тела, при осмотре подмышечных областей – закинуты за голову. Исследование над- и подключичных, подмышечных областей выполняется по стандартной методике исследования этой области. Исследование парастернальных областей менее распространено в практике, однако не представляет технических трудностей. Датчик для исследования мягких тканей устанавливается перпендикулярно коже у края грудины и проводится от уровня ключицы до нижнего края грудины. Сканирование проводится в двух проекциях – при расположении датчика параллельно и перпендикулярно грудине. Анатомическими ориентирами для выявления патологии являются хрящевые отделы ребер, край грудины, межреберные мышцы, внутренние грудные артерия и вена. Патологически измененные узлы визуализируются на уровне межреберий сзади от межреберных мышц возле внутренних грудных артерии и вены.
Метастатически пораженные лимфатические узлы при раке молочной железы обычно имеют пониженную эхогенность, могут быть увеличенными или иметь размеры в пределах нормы. Для подмышечных узлов достаточно характерно сохранение кортико-медуллярной дифференцировки узлов, при этом кортикальный слой утолщен, имеет пониженную эхогенность. Утолщение кортикального слоя может быть асимметричным, иногда – локальным. Если метастаз прорастает капсулу узла, контур последнего становится нечетким.
Обязательным этапом ультразвукового исследования при раке молочной железы является исследование печени для исключения ее метастатического поражения. При необходимости выполняется осмотр плевральных полостей и полости перикарда (исключение наличия плеврита, перикардита) и органов малого таза для исключения метастатического поражения яичников.
В настоящее время ультразвуковое исследование молочных желез широко используют не только для диагностики патологических образований, но и для получения материала для морфологического исследования – прицельной диагностической пункции под контролем эхографии.
Если при ультразвуковом исследовании найден гиперэхогенный кишечник
 Что такое гиперэхогенный кишечник?
Гиперэхогенный кишечник – это термин, говорящий о повышенной эхогенности (яркости) кишечника на ультразвуковом изображении. Выявление гиперэхогенного кишечника НЕ является пороком развития кишечника, а просто отражает характер его ультразвукового изображения. Необходимо помнить, что эхогенность нормального кишечника выше, чем эхогенность соседних с ним органов (печени, почек, легких), но такой кишечник не считается гиперэхогенным. Гиперэхогенным называется только такой кишечник, эхогенность которого сравнима с эхогенностью костей плода.
Почему кишечник у плода гиперэхогенный?
Возможные причины гиперэхогенности кишечника:
- Иногда гиперэхогенный кишечник выявляется у абсолютно нормальных плодов, и при УЗИ в динамике этот признак может исчезать.
- Повышенная эхогенность кишечника может быть проявлением хромосомных болезней плода, в частности, синдрома Дауна. В связи с этим при обнаружении гиперэхогенного кишечника проводится тщательная оценка анатомии плода. Однако при выявлении гиперэхогенного кишечника можно говорить лишь о повышенном риске синдрома Дауна, так как подобные изменения могут встречаться и у совершенно здоровых плодов.
- Иногда гиперэхогенный кишечник может быть признаком внутриутробной инфекции плода.
- Гиперэхогенный кишечник часто обнаруживается у плодов с задержкой внутриутробного развития. Однако при этом будут обязательно выявляться отставание размеров плода от срока беременности, маловодие и нарушение кровотока в сосудах плода и матки. Если ничего из вышеперечисленного не выявлено, то диагноз задержки развития плода исключен.
Что делать при выявлении гиперэхогенного кишечника у плода?
В случае, если у плода обнаружился гиперэхогенный кишечник необходимо обратить на это внимание:
- Вам следует обратиться специалисту генетику, который еще раз оценит результаты двойного и (или) тройного биохимического теста. Генетик даст необходимые рекомендации по дальнейшему ведению беременности.
- рекомендуется пройти обследование на определение антител к краснухе, цитомегаловирусу, вирусу простого герпеса, парвовирусу В19, токсоплазме.
- контрольное УЗИ через 4 недели для оценки темпов роста плода и его функционального состояния.
Эхогенность — обзор | Темы ScienceDirect
Эхогенность эндометрия: биомаркер действия прогестерона
Эхогенность отражает различные взаимодействия тканей с ультразвуком. Эхогенность тканей варьируется от почти сонотранспрозрачной, которая встречается в некоторых составляющих тела, особенно в воде, до самой высокой эхогенности, производимой воздухом (присутствующим в кишечнике). На изображениях с серой шкалой низкая эхогенность, как у воды, обычно отображается черным цветом, а высокая эхогенность — белым.Как правило, твердые ткани с промежуточными эхогенными характеристиками изображаются степенями серого с окончательной оценкой в зависимости от содержания воды и / или воздуха и количества таких межфазных границ. В матке эхогенность миометрия остается постоянной на протяжении всего менструального цикла и после различных гормональных процедур. Напротив, эхогенность эндометрия варьируется между фолликулярной и лютеиновой фазами менструального цикла и в ответ на экзогенные гормоны.
В проспективном исследовании с участием 80 бесплодных пациентов Форрест и его коллеги 105 показали, что эхогенность эндометрия увеличивается после овуляции под влиянием прогестерона.Эти авторы были первыми, кто распознал гипоэхогенные характеристики эндометрия фолликулярной фазы (рис. 35.4). Эндометрий характеризуется гипоэхогенным функциональным слоем, граничащим с гиперэхогенными базальными слоями с центральной гиперэхогенной линией, образованной межфазной границей виртуальной полости эндометрия. Вместе гипоэхогенный функциональный слой эндометрия и его внешние границы образуют типичный трехстрочный узор .
Изменения эхогенности эндометрия наблюдаются вскоре после овуляции.Эндометрий постепенно приобретает гиперэхогенные черты, характерные для лютеиновой фазы, начиная с базального слоя эндометрия и расширяясь вверх. Forrest и соавторы 105 наблюдали гиперэхогенный эндометрий у 78% женщин, сканированных во время лютеиновой фазы. Точно так же группа Темплтона определила аналогичную последовательность изменений от гипоэхогенного эндометрия в фолликулярной фазе до преимущественно гиперэхогенного характера в лютеиновой фазе стимулированных циклов. 68 Сонографические изменения фолликулярной фазы на те, что характерны для лютеиновой фазы, начинают быть видимыми в течение 48 часов после овуляции.Для завершения гиперэхогенной трансформации функционального слоя эндометрия требуется от 4 до 7 дней.
Grunfeld и его коллеги изучали изменения эхогенности эндометрия у 18 женщин, последовательно получавших E 2 (от 0,2 до 04 мг / день, трансдермально) и прогестерон (50 мг / день внутримышечно) при подготовке к ЭКО донорской яйцеклетки. 106 Ультразвук влагалища проводился до начала введения прогестерона и каждые 3 дня после этого до 8-го дня прогестерона, когда выполнялась биопсия эндометрия.Эхогенность эндометрия оценивалась как образец I, показывающий образец из трех линий перед началом лечения прогестероном, к образцу III, показывающий полную гиперэхогенную трансформацию fucntionalis слоя от базальной пластинки до просвета эндометрия (рис. 35.5). Эти авторы пришли к выводу, что толщина эндометрия является плохим критерием различия между продвинутыми и задержанными стромальными изменениями при биопсии эндометрия. И наоборот, степень гиперэхогенных изменений на УЗИ (полных или частичных) коррелировала со степенью развития лютеиновых изменений (конденсация, прецидуализация) в строме эндометрия.У всех женщин, у которых биопсия эндометрия выявила отсроченные секреторные изменения в железах и строме эндометрия, было проведено ультразвуковое исследование, показывающее частичные гипоэхогенные изображения (образец II) (рис. 35.6).
Анализируя эхогенность эндометрия на следующий день после введения ХГЧ при АРТ, Гонен и Каспер наблюдали типичный гипоэхогенный трехстрочный паттерн у 49% (60/123) субъектов. 107 В этой подгруппе участниц АРТ частота наступления беременности составила 30% (18/60), что значительно выше, чем показатель, полученный во всей когорте (19.5%). Напротив, полный или частично гиперэхогенный эндометрий был обнаружен у 33% (41/123) и 18% (22/123) женщин, у которых частота наступления беременности на 9% и 9,1% соответственно была заметно ниже, чем у их гипоэхогенных аналогов. . Исходные данные Casper и Gonen о неблагоприятном прогнозе гиперэхогенного эндометрия в поздней фолликулярной фазе АРТ были в значительной степени подтверждены в других публикациях, 108-113 , в то время как другие не смогли найти эту взаимосвязь. 114-115
В попытке проанализировать, как данные УЗИ, а именно эхогенность, могут отражать восприимчивость эндометрия, мы изучили внешний вид эндометрия на УЗИ в день введения ХГЧ в 228 последовательных циклах КГ. 116 Мы включали только женщин моложе 38 лет, матки которых были морфологически нормальными и находились в положении, обеспечивающем оптимальную визуализацию на УЗИ. Ультразвуковые изображения были оцифрованы и проанализированы с помощью компьютерной системы, предназначенной для измерения степени эхогенности эндометрия (рис. 35.7). В частности, мы изучили степень гиперэхогенных изменений, которые развиваются от базального эндометрия вверх во время фолликулярно-лютеинового перехода, как описано в E 2 и циклах прогестерона, 106 , но иногда сообщалось при АРТ до воздействия прогестерона, при время введения ХГЧ. 107 Наши результаты показали, что в отобранной популяции кандидатов на ЭКО 34/228 (14%) имели полностью гипоэхогенный трехстрочный эндометрий (менее 30% гиперэхогенный у основания эндометрия), в то время как 28/228 (12 %) имели полностью гиперэхогенный эндометрий (более 70% гиперэхогенной инвазии функционального слоя). 116 У остальных 166 женщин были 4 степени прогрессирующих гиперэхогенных изменений, которые распространялись с 31% до 40% до 61% до 70% от полного функционального слоя.Демографические, гормональные и биологические характеристики каждой из этих групп были сходными, включая толщину эндометрия и уровни прогестерона в плазме, которые оставались менее 1 нг / мл в каждой группе. Это последнее наблюдение указывает на то, что преждевременное повышение эхогенности на , наблюдаемое у некоторых пациентов с ЭКО, не является результатом преждевременной лютеинизации с увеличением выработки прогестерона. Наконец, количество перенесенных эмбрионов также было одинаковым во всех шести группах; в каждом случае было перенесено от двух до четырех эмбрионов (как это обычно делалось в 1990-х годах).Тем не менее, частота беременностей и имплантации эмбрионов сильно различалась в разных группах, основанных на эхогенности. С самого высокого значения 59% и 16% соответственно для гипоэхогенной группы он снизился до 23% и 3% соответственно для гиперэхогенной группы с прогрессивно уменьшающимися результатами повышения эхогенности в промежуточных группах (рис. 35.8). .
В другом исследовании мы оценивали эхогенность эндометрия в день введения ХГЧ, извлечения ооцитов и переноса эмбриона (день 2) у пациентов, у которых уровень прогестерона в плазме был ниже или выше порогового значения 0.9 нг / мл. 117 В день ХГЧ среднее гиперэхогенное преобразование функционального слоя эндометрия было одинаковым в двух группах и составляло 40% и 41% соответственно. Однако в течение 4 дней после введения ХГЧ гиперэхогенная трансформация была намного быстрее в группе с высоким содержанием прогестерона, со значениями 70% против 63% при извлечении ооцитов и 90% против 79% во время переноса эмбриона (ET ), соответственно.
Гистологическая основа преждевременной гиперэхогенной трансформации, наблюдаемой у некоторых женщин с ЭКО, остается неясной.Было высказано предположение, что во время фолликулярно-лютеинового перехода развитие спиральных артерий и скручивание желез, происходящее под влиянием прогестерона, вызывает повышение эхогенности. Тот факт, что прогестерон был низким (менее 1 нг / мл) у женщин с преждевременной эхогенностью, исключал это простое объяснение. Работа команды Девроя, выполнявшей биопсию эндометрия в день извлечения ооцитов в цикле переноса эмбриона, подтвердила, что преждевременная лютенизация не объясняет раннюю гиперэхогенную трансформацию. 118,119 Это не оставляет нам объяснения увеличения эхогенности, обнаруживаемого у некоторых женщин в день введения ХГЧ при АРТ, наблюдения, имеющего угрожающую прогностическую ценность для исхода АРТ.
Существуют значительные различия между исследованиями в прогностической ценности различных эхогенных паттернов в день ХГЧ, извлечения ооцитов и переноса эмбрионов, для которых нет доступных объяснений. 120 Мы полагаем, что некоторая вариабельность представленных ультразвуковых изображений проистекает из методологических проблем.Например, эндометрий женщин, матка которых находится в промежуточном положении, вероятно, будет ошибочно выглядеть гиперэхогенным из-за того, что ультразвуковой луч имеет тенденцию попадать на железы эндометрия под углом, а не параллельно железам, когда матка находится в заметном положении. перевернутое или перевернутое положение. В неопубликованном исследовании мы выполнили ручную ротацию только что удаленной матки перед ультразвуковым зондированием. Это подтвердило, что гипоэхогенный рисунок, полученный, когда матка удерживается в антивертированном или ретровертированном положении до того, как зонд становится гиперэхогенным при имитации промежуточного положения. 73 Недавно Диттерих и его коллеги указали, что трансабдоминальный скрининг, вероятно, ограничивает возможность ложного вмешательства. 101
Повышенная эхогенность печени при ультразвуковом исследовании отражает степень стеатоза, но не фиброза у бессимптомных пациентов с легкими / умеренными отклонениями печеночных трансаминаз
Цели: Изучить, можно ли надежно интерпретировать гиперэхогенность печени как стеатоз печени и можно ли выявить какой-либо сопутствующий или изолированный фиброз.
Пациенты и методы: Серия из 165 пациентов без признаков или симптомов заболевания печени, направленных из-за незначительного или умеренно повышенного уровня аминотрансфераз (аланинаминотрансфераза и / или аспартатаминотрансфераза 0,7-5,0 микрокат / л) в течение более 6 месяцев, была проспективно исследована с использованием всестороннего лабораторного профиля. Ультразвуковое исследование печени и чрескожная биопсия печени. Фиброз оценивали количественно и по метавиру.Стеатоз был классифицирован как легкий, средний или тяжелый.
Полученные результаты: Из 98 (59,4%) пациентов с повышенной эхогенностью 85 (86,7%) имели стеатоз печени как минимум средней степени, 9 пациентов с такой же степенью стеатоза имели нормальную эхогенность и 13 пациентов с отсутствием стеатоза или только с легким стеатозом имели гиперэхогенную печень (чувствительность 0,90, специфичность 0,82, прогностическая ценность положительного результата 0.87, отрицательная прогностическая ценность 0,87). Выявлены примерно одинаковые зависимости вне зависимости от индекса массы тела и степени фиброза. При увеличении эхогенности в сочетании с высоким затуханием (n = 591 и уменьшением различий в стенке воротного сосуда (n = 79) прогностическая ценность положительного результата увеличилась до 0,93 и 0,94 соответственно. Количественно оцененный фиброз (среднее +/- SD) составил 3,2 +/- 4,6 % площади биопсии с нормальной и 2,3 +/- 1,8% с повышенной эхогенностью (нс) .Эхогенность была нормальной у 5 из 9 пациентов с фиброзом перегородки и у 4 из 6 пациентов с циррозом печени.Любые структурные неоднородные признаки на УЗИ не были связаны с архитектурными фиброзными изменениями, и ни у одного из них не было узловых контуров поверхности печени.
Выводы: Оценка эхогенности печени имеет значение для выявления или исключения умеренной или выраженной жировой инфильтрации (правильная классификация 86,6%), но на нее нельзя полагаться при диагностике фиброза, даже цирроза у бессимптомных пациентов с легким или умеренно повышенным уровнем трансаминаз печени.
Эхогенные очаги в узлах щитовидной железы: диагностическая эффективность с комбинацией TIRADS и эхогенных очагов | BMC Medical Imaging
Брандер А., Виикинкоски П., Никелс Дж., Кивисаари Л. Щитовидная железа: американский скрининг случайной взрослой популяции. Радиология. 1991; 181: 683–7.
CAS Статья Google Scholar
Frates MC, Benson CB, Charboneau JW, Cibas ES, Clark OH, Coleman BG и др.Лечение узелков щитовидной железы, обнаруженных в США: Общество радиологов в заявлении консенсусной конференции по ультразвуку. Радиология. 2005; 237: 794–800.
Артикул Google Scholar
Tan GH, Gharib H. Случайные опухоли щитовидной железы: подходы к лечению непальпируемых узелков, случайно обнаруженных при визуализации щитовидной железы. Ann Intern Med. 1997. 126: 226–31.
CAS Статья Google Scholar
Cheng SP, Lee JJ, Lin JL, Chuang SM, Chien MN, Liu CL. Характеристика узлов щитовидной железы с использованием предлагаемой системы отчетов и данных визуализации щитовидной железы (TI-RADS). Голова Шея. 2013; 35: 541–7.
Артикул Google Scholar
Haugen BR, Alexander EK, Bible KC, Doherty GM, Mandel SJ, Nikiforov YE, et al. Рекомендации Американской ассоциации по щитовидной железе 2015 года по ведению взрослых пациентов с узлами щитовидной железы и дифференцированным раком щитовидной железы: рабочая группа рекомендаций Американской ассоциации по щитовидной железе по узелкам щитовидной железы и дифференцированному раку щитовидной железыЩитовидная железа. 2016; 26: 1–133.
Артикул Google Scholar
Хорват Э., Маджлис С., Росси Р., Франко К., Нидманн Дж. П., Кастро А. и др. Система отчетов об УЗИ для узлов щитовидной железы с разбивкой по риску рака для клинического ведения. J Clin Endocrinol Metab. 2009; 94: 1748–51.
CAS Статья Google Scholar
Shin JH, Baek JH, Chung J, Ha EJ, Kim JH, Lee YH и др.Ультрасонографическая диагностика и лечение узлов щитовидной железы на основе изображений: пересмотренное заявление и рекомендации Корейского общества радиологии щитовидной железы. Корейский J Radiol. 2016; 17: 370–95.
Артикул Google Scholar
Ха Э.Дж., Мун В.Дж., На Д.Г., Ли Ю.Х., Чой Н., Ким С.Дж. и др. Многоцентровое проспективное валидационное исследование корейской системы отчетов и данных визуализации щитовидной железы у пациентов с узлами щитовидной железы. Корейский J Radiol.2016; 17: 811–21.
Артикул Google Scholar
Choi YJ, Baek JH, Baek SH, Shim WH, Lee KD, Lee HS, et al. Интернет-оценка риска злокачественных новообразований для узлов щитовидной железы с использованием характеристик ультразвукового исследования: разработка и проверка прогностической модели. Щитовидная железа. 2015; 25: 1306–12.
Артикул Google Scholar
Русс Дж., Ройер Б., Бигорн С., Руссель А., Бьенвеню-Перрард М., Линхардт Л.Проспективная оценка системы отчетов и данных визуализации щитовидной железы для 4550 узлов с эластографией и без нее. Eur J Endocrinol. 2013; 168: 649–55.
CAS Статья Google Scholar
Зайберлинг К.А., Дутра Дж. С., Грант Т., Байрамович С. Роль интратироидальных кальцификатов, обнаруживаемых на УЗИ, как маркера злокачественности. Ларингоскоп. 2004; 114: 1753–7.
Артикул Google Scholar
Такашима С., Фукуда Х, Номура Н., Кишимото Х, Ким Т., Кобаяши Т. Узлы щитовидной железы: повторная оценка с помощью УЗИ. J Clin Ультразвук. 1995; 23: 179–84.
CAS Статья Google Scholar
Таки С., Терахата С., Ямасита Р., Кинуя К., Нобата К., Какуда К. и др. Кальцификации щитовидной железы. сонографические модели и заболеваемость раком Clin Imaging. 2004. 28: 368–71.
PubMed Google Scholar
Wang N, Xu Y, Ge C, Guo R, Guo K. Ассоциация сонографически обнаруженной кальцификации с карциномой щитовидной железы. Голова Шея. 2006; 28: 1077–83.
Артикул Google Scholar
Kakkos SK, Scopa CD, Chalmoukis AK, Karachalios DA, Spiliotis JD, Harkoftakis JG, et al. Относительный риск рака у узлов щитовидной железы с кальцификациями, обнаруженных сонографически. J Clin Ультразвук. 2000; 28: 347–52.
CAS Статья Google Scholar
Khoo ML, Asa SL, Witterick IJ, Freeman JL. Кальцификация щитовидной железы и ее связь с карциномой щитовидной железы. Голова Шея. 2002; 24: 651–5.
Артикул Google Scholar
Фукацу Х., Макино Н., Кодама Й., Икеда М., Исигаки Т., Сакума С. Оценка кальцификации щитовидной железы с использованием компьютерной рентгенографии с пластиной изображения. Eur J Radiol. 1989; 9: 22–8.
CAS PubMed Google Scholar
Брюнетон Дж. Н., Балу-Маэстро С., Марси П. Я., Мелия П., Моуру М. Ультрасонографическое исследование нормальной шеи с очень высокой частотой (13 МГц): обнаружение нормальных лимфатических узлов и узлов щитовидной железы. J Ultrasound Med. 1994; 13: 87–90.
CAS Статья Google Scholar
Peccin S, de Castsro JA, Furlanetto TW, Furtado AP, Brasil BA, Czepielewski MA. Ультрасонография: полезно ли оно при диагностике рака узлов щитовидной железы? J Endocrinol Investig.2002; 25: 39–43.
CAS Статья Google Scholar
Тесслер Ф.Н., Миддлтон В.Д., Грант Э.Г., Хоанг Дж. К., Берланд Л.Л., Тифей С.А. и др. Система визуализации, отчетности и данных по щитовидной железе ACR (TI-RADS): официальный документ комитета ACR TI-RADS. J Am Coll Radiol. 2017; 14: 587–95.
Артикул Google Scholar
Уоттерс Д.А., Ахуджа А.Т., Эванс Р.М., Чик В., Кинг В.В., Метревели С. и др.Роль ультразвука в лечении узлов щитовидной железы. Am J Surg. 1992; 164: 654–7.
CAS Статья Google Scholar
Malhi H, Beland MD, Cen SY, Allgood E, Daley K, Martin SE и др. Эхогенные очаги в узлах щитовидной железы: значение задних акустических артефактов. AJR Am J Roentgenol. 2014; 203: 1310–6.
Артикул Google Scholar
Na DG, Kim DS, Kim SJ, Ryoo JW, Jung SL.Узлы щитовидной железы с изолированной макрокальцификацией: риск злокачественного новообразования и диагностическая эффективность тонкоигольной аспирации и стержневой биопсии. Ультразвуковая эхография. 2016; 35: 212–9.
Артикул Google Scholar
Cibas ES, Ali SZ, NCITFSotS C. Система Bethesda для отчетности по цитопатологии щитовидной железы. Am J Clin Pathol. 2009. 132: 658–65.
Артикул Google Scholar
Jung CK, Min HS, Park HJ, Song DE, Kim JH, Park SY и др. Отчет о патологии биопсии сердечной иглой щитовидной железы: предложение корейской группы исследования эндокринной патологии тироидной биопсии иглой сердечника. J Pathol Transl Med. 2015; 49: 288–99.
Артикул Google Scholar
Русс Г. Стратификация риска узлов щитовидной железы при УЗИ с французским TI-RADS: описание и размышления. Ультразвуковая эхография. 2016; 35: 25–38.
Артикул Google Scholar
Квак Дж.Й., Хан К.Х., Юн Дж.Х., Мун Х.Дж., Сон Э.Дж., Пак Ш.и др. Система отчетов и данных визуализации щитовидной железы для УЗИ узловых образований: шаг в установлении лучшей стратификации риска рака. Радиология. 2011; 260: 892–9.
Артикул Google Scholar
Ulisse S, Bosco D, Nardi F, Nesca A, D’Armiento E, Guglielmino V, et al. Отчетность по визуализации щитовидной железы и оценка системы данных в сочетании с новой итальянской классификацией цитологии щитовидной железы улучшают клиническое ведение неопределенных узлов.Int J Endocrinol. 2017; 2017: 9692304.
Артикул Google Scholar
He YP, Xu HX, Zhao CK, Sun LP, Li XL, Yue WW и др. Цитологически неопределенные узелки щитовидной железы: повышенная диагностическая эффективность благодаря комбинации US TI-RADS и новой системы оценок. Научный доклад 2017; 7: 6906.
Артикул Google Scholar
Frates MC, Benson CB, Doubilet PM, Kunreuther E, Contreras M, Cibas ES, et al.Распространенность и распределение карциномы у пациентов с одиночными и множественными узлами щитовидной железы при сонографии. J Clin Endocrinol Metab. 2006; 91: 3411–7.
CAS Статья Google Scholar
Ким MJ, Ким EK, Kwak JY, Park CS, Chung WY, Nam KH, et al. Дифференциация узлов щитовидной железы с макрокальцификациями: роль подозрительных результатов сонографии. J Ultrasound Med. 2008. 27: 1179–84.
Артикул Google Scholar
Коике Э., Ногучи С., Ямасита Х., Мураками Т., Охима А., Кавамото Х. и др. Ультрасонографические характеристики узлов щитовидной железы: прогноз злокачественности. Arch Surg. 2001; 136: 334–7.
CAS Статья Google Scholar
Beland MD, Kwon L, Delellis RA, Cronan JJ, Grant EG. Незатененные эхогенные очаги в узлах щитовидной железы: достаточно ли определенных проявлений, чтобы избежать биопсии щитовидной железы? J Ultrasound Med. 2011; 30: 753–60.
Артикул Google Scholar
Ахуджа А., Чик В., Кинг В., Метревели К. Клиническое значение артефакта «хвост кометы» при ультразвуковом исследовании щитовидной железы. J Clin Ультразвук. 1996. 24: 129–33.
CAS Статья Google Scholar
Bonavita JA, Mayo J, Babb J, Bennett G, Oweity T, Macari M, et al. Распознавание доброкачественных узелков на УЗИ щитовидной железы: какие узелки можно оставить в покое? AJR Am J Roentgenol. 2009; 193: 207–13.
Артикул Google Scholar
Амрикачи М., Рамзи И., Рубенфельд С., Уиллер TM. Точность тонкоигольной аспирации щитовидной железы. Arch Pathol Lab Med. 2001; 125: 484–8.
CAS PubMed Google Scholar
Park M, Shin JH, Han BK, Ko EY, Hwang HS, Kang SS, et al. Сонография узлов щитовидной железы с периферическими кальцификациями. J Clin Ультразвук. 2009; 37: 324–8.
Артикул Google Scholar
Consorti F, Anello A, Benvenuti C, Boncompagni A, Giovannone G, Moles N и др. Клиническое значение кальцификатов при карциноме щитовидной железы и многоузловом зобе. Anticancer Res. 2003; 23: 3089–92.
PubMed Google Scholar
Печень и сердечно-сосудистые заболевания: что кардиологам необходимо знать о результатах ультразвукового исследования
Учитывая анатомическую близость печени и желчного пузыря к сердцу, кардиологи должны быть в состоянии идентифицировать определенные общие состояния, поражающие эти органы, которые могут иметь значительные клинические последствия для ведение пациентов.Здесь мы представляем типичные результаты в отношении эхогенности, размера и краев печени, а также исследования очаговых поражений.
Нормальная печень является минимально гиперэхогенной или изоэхогенной по сравнению с нормальной почечной корой1 (рис. 1А и В). Наиболее частой причиной гиперэхогенности печени (повышенная эхогенность печени по сравнению с почечной корой) в повседневной практике является стеатоз, также известный как «жировая дистрофия печени». Он может быть диффузным или очаговым.
Области интактной паренхимы обычно встречаются при диффузном стеатозе.Эти области являются гипоэхогенными, поскольку соответствуют «островкам» нормальной паренхимы печени, контрастирующим с патологической печенью (с повышенной эхогенностью из-за жировой инфильтрации).
Также могут быть обнаружены очаги жировой инфильтрации, т. Е. Участки повышенной эхогенности на фоне нормальной паренхимы печени.1,2
Как интактные участки паренхимы при диффузном стеатозе, так и участки очагового стеатоза при нормальной печени имеют географическое расположение. границы, не связаны с масс-эффектом, меняются со временем (иногда быстро) и обычно располагаются в субкапсулярных или перивезикальных областях, прилегающих к портальной бифуркации и серповидной связке.Однако их можно найти в любом месте. Иногда эти области могут напоминать узелки / твердые образования2 (рис. 1C-F).
Нормальная эхогенность печени однородна, с мелкими эхогенными сигналами.1 Одной из основных причин неоднородной эхогенности печени является хроническое заболевание / цирроз печени (Рисунок 1 дополнительного материала). Другими распространенными состояниями, приводящими к гетерогенной эхогенности, являются пятнистый стеатоз и диффузная инфильтрация опухолью.2
При застое в печени, вызванном правосторонней сердечной недостаточностью, такой как трехстворчатая регургитация, может наблюдаться диффузное снижение эхогенности печени.
Другие типичные признаки хронического заболевания / цирроза печени включают перераспределение объема с увеличением хвостатой доли, левой доли или обоих по отношению к правой доле, а также неровность поверхности печени. Фонтановое кровообращение. Неравномерность / узловатость контура печени более очевидна при асците, который часто присутствует при декомпенсированном заболевании печени.
Гепатомегалия и расширение нижней полой вены и надпеченочных вен являются типичными симптомами застойных явлений в печени, таких как трикуспидальная регургитация и аномалия Эбштейна.
Ультразвук полезен для различения кистозных и солидных образований, лечение которых обычно существенно различается.
На УЗИ поражение определяется как простая киста, если она анэхогенная, с тонкими гладкими стенками и усиленным звуком в задней части. Кистозное поражение является сложным, если оно не соответствует всем этим характеристикам, например, если оно имеет толстую или неправильную стенку, с узлами на стенах, перегородками, эхогенным содержимым или кальцификациями. Эхинококковые кисты и абсцессы являются типичными примерами сложных кистозных поражений (рис. 2E-H).
Твердый узелок может быть гиперэхогенным, изоэхогенным или гипоэхогенным по отношению к прилегающей паренхиме, он может быть гомогенным или гетерогенным, и кровоток может быть обнаружен при допплеровском исследовании, хотя отрицательный результат не исключает твердого поражения. Если обнаружен твердый узелок, его следует сравнить с любыми предыдущими исследованиями, которые могут быть доступны для оценки того, является ли он новым узлом, стабильным или выросшим, и его следует соотнести с историей болезни пациента (например, историей болезни). опухоли, вирусная инфекция гепатита B или C, алкогольный цирроз печени) для принятия решения о выполнении любых дополнительных тестов визуализации.
Доброкачественные узелки, наиболее часто наблюдаемые на практике, включают гемангиому, которая имеет типичный вид гиперэхогенного узелка с четко очерченными границами.
Двумя наиболее распространенными типами злокачественных поражений печени являются метастазы и гепатоцеллюлярная карцинома.
Как правило, существуют различные метастазы, и их ультразвуковой вид сильно варьируется (гиперэхогенный, изоэхогенный или гипоэхогенный по сравнению с прилегающей паренхимой, и они могут быть гомогенными или гетерогенными, с ореолом или без него, и даже могут быть кистозными или иметь кальцификаты 4) (Рисунок 2A-D).
В большинстве случаев гепатоцеллюлярная карцинома обнаруживается в печени с хроническим заболеванием / циррозом печени. Он может представлять собой твердый узелок (или другой вид в случае многоцентровой гепатоцеллюлярной карциномы) и может быть гиперэхогенным, изоэхогенным или гипоэхогенным, иногда с ореолом.3 Таким образом, это будет первая диагностическая возможность при обнаружении твердого узелка в печени. с признаками хронического заболевания печени / цирроза.
Что касается желчного пузыря, то в норме его содержимое анэхогенно.Любое эхогенное содержимое является патологическим и может соответствовать камнеобразованию (гиперэхогенные изображения, обычно с задней акустической затенением), желчному осадку, крови, гною или мусору. Эхогенное содержимое характеризуется его движением с изменением положения пациента (если оно не очень плотно прилегает к стене), что отличает его от очагового утолщения, зависящего от стенки (полипы или образования) (рис. 2 дополнительного материала).
Нормальная стенка желчного пузыря гладкая, толщиной ≤ 3 мм.1 На стенке можно увидеть очаговое утолщение (обычно полипы, единичные или множественные) и диффузное утолщение.
Диффузное утолщение стенок может быть вызвано заболеванием желчного пузыря (в основном, острым холециститом) или экстрахолекистозными причинами. Обычно он определяется как гипоэхогенная область между 2 эхогенными линиями или может иметь бороздчатый или слоистый вид.
Типичные признаки острого холецистита включают вздутие мочевого пузыря, диффузное утолщение стенок, желчекаменную болезнь или желчный осадок, а также положительный признак Мерфи на УЗИ.Бекалькулезный холецистит встречается гораздо реже и возникает у пациентов с длительным критическим состоянием (например, у пациентов, поступивших в отделение интенсивной терапии). Диффузное утолщение стенки желчного пузыря, помимо вызванного воспалением в контексте острого холецистита, может быть вызвано экстрахолекистозными причинами, такими как дисфункция печени (связанная с алкоголизмом, гипоальбуминемией, асцитом и / или гепатитом), застойная сердечная недостаточность, заболевание почек. , панкреатит, симптомы мононуклеоза, СПИД и сепсис5 (рис. 3 дополнительных материалов).
Используя основные концепции, представленные в отношении наиболее распространенных состояний печени и желчного пузыря, кардиологи могут направлять надлежащее ведение пациентов, которым проводится эхокардиограмма.
Эхогенные почки | Павильон для женщин
Обзор
Эхогенные почки плода — это почки, которые выглядят яркими на ультразвуковом изображении, что указывает на возможное заболевание почек.
Требуются дальнейшие исследования и испытания. Однако, поскольку эхогенные почки связаны с широким спектром почечных заболеваний и исходов, часто до рождения невозможно диагностировать конкретную причину или определить прогноз ребенка.
Эхогенные почки могут быть двусторонними (обе почки яркие на изображениях) или односторонними (только одна почка выглядит яркой).
Ультразвуковая визуализация и эхогенность
Пренатальное ультразвуковое исследование в градациях серого позволяет получать изображения с использованием оттенков серого (обычно называемые черно-белыми изображениями). Насколько ярким или темным кажется что-то, — это его «эхогенность». Чем ярче (белее) он кажется, тем он более эхогенный.
Во время ультразвукового сканирования, когда звуковые волны отражаются от структур или тканей тела плода, возвращающиеся эхо-сигналы отображаются на изображении в виде точек.Чем сильнее отраженное эхо, тем ярче точка.
Обычно яркость или эхогенность почек плода равна яркости печени. Если почки выглядят ярче, чем печень, они считаются эхогенными или гиперэхогенными.
Как эхогенные почки влияют на моего ребенка?
Эхогенная болезнь почек считается «неспецифической находкой», потому что она не указывает на конкретное состояние или диагноз, а скорее указывает на возможность аномалии почек.
К наиболее частым причинам эхогенных почек плода относятся:
- Поликистоз почек (аутосомно-доминантный и аутосомно-рецессивный) ,00
- Мультикистозная диспластическая почка
- Хромосомные аномалии ,00
- Синдромы чрезмерного роста
- Цитомегаловирусная (ЦМВ) инфекция ,00
- Обструкция мочевыводящих путей
В некоторых случаях эхогенные почки могут быть нормальным «вариантом» для этого ребенка (а не результатом основного заболевания), или это может быть так называемое «преходящее» или временное обнаружение.
Диагностика
Эхогенность почек может быть диагностирована при обычном пренатальном УЗИ.
Если обнаружены эхогенные почки, будет проведено более тщательное обследование для поиска других аномалий, включая увеличение почек плода, структурные аномалии почек плода или мочевыводящих путей, недостаток околоплодных вод (жидкость, которая окружает плод в плодном пузыре). матка) и другие врожденные пороки развития, которые могут указывать на хромосомное состояние.Может быть рекомендовано генетическое тестирование.
Если эхогенная эхогенность почек плода является изолированной находкой, то есть других аномалий не обнаружено, основная причина и прогноз ребенка часто неопределенны.
В тяжелых случаях, когда почки плода также увеличены, а уровень околоплодных вод низкий (известный как олигогидрамнион), вероятна почечная (почечная) недостаточность и прогноз неблагоприятный. Без функции почек плод не может вырабатывать мочу, основной компонент околоплодных вод.Амниотическая жидкость жизненно важна для здоровья и развития ребенка. Недостаток жидкости может привести к недоразвитию легких (гипоплазия легких) и затрудненному дыханию при рождении, деформациям конечностей и лица (известные как последовательность Поттера), вызванным сжатием в утробе матери, мертворождением и неонатальной смертью.
Специализированная оценка и дородовое наблюдение
Если во время беременности диагностирована эхогенность почек, вас могут направить в центр для плода для дальнейшего обследования и дополнительных исследований.
В Детском фетальном центре Техаса мы организуем для вас как можно более быстрый визит для всесторонней оценки командой специалистов, имеющих опыт в оценке эхогенных почек, а также в диагностике и лечении врожденных заболеваний почек. В состав группы входят врачи по материнско-фетальной медицине (акушеры-гинекологи, специализирующиеся на беременностях с высоким риском), эксперты по визуализации плода, детские нефрологи и урологи, генетики и генетические консультанты, а также неонатологи.
Дополнительное тестирование может включать:
После этой тщательной оценки наши специалисты встретятся с вами, чтобы обсудить результаты и ответить на любые вопросы вашей семьи, чтобы помочь вам принять наиболее обоснованные решения относительно ухода и лечения вашего ребенка.
Диагностика эхогенного поражения почек во время беременности позволяет вашей семье и вашей медицинской бригаде заранее спланировать специализированное лечение и опыт, которые могут потребоваться вашему ребенку при рождении, оптимизируя результаты.
Беременность и роды
Мать и ребенок будут находиться под тщательным наблюдением на протяжении всей беременности с более частыми ультразвуковыми исследованиями для оценки роста плода и выявления признаков осложнений.
Мы рекомендуем роды в больнице, располагающей опытом и ресурсами для лечения врожденных состояний почек и любых связанных с ними дефектов, включая отделение интенсивной терапии новорожденных (NICU) самого высокого уровня.Роды и послеродовой уход должны быть тщательно спланированы и координированы группой специалистов по материнско-фетальной медицине, неонатологам и педиатрам.
Наша команда Центра плода тесно сотрудничает с экспертами Детской почечной службы Техаса, одной из крупнейших программ в мире по лечению детей с врожденными заболеваниями почек, обеспечивая беспрепятственный доступ к службам интенсивной терапии и специалистам, которые могут понадобиться вашему ребенку при рождении. Здесь педиатры-специалисты, лечащие вашего новорожденного, были неотъемлемой частью их команды ухода еще до рождения.
Лечение после родов
После рождения ваш ребенок подвергнется тщательному физическому обследованию и обследованию, чтобы оценить состояние почек, оценить функцию почек и найти любые связанные с ними дефекты или другие аномалии.
Потребности в лечении будут зависеть от уникального состояния и симптомов каждого ребенка.
Дети, рожденные с заболеванием почек, нуждаются в постоянном наблюдении детского нефролога, имеющего опыт лечения этих врожденных дефектов, с регулярными ультразвуковыми исследованиями, проверками артериального давления, а также анализом мочи и крови для оценки функции почек.
Бригада послеродового ухода
В зависимости от состояния вашего ребенка бригада послеродового ухода может включать:
Почему Техасский детский фетальный центр?
- Единое место для оказания квалифицированной медицинской помощи матери, плоду и педиатру. В детской больнице Техаса мать и ребенок получают специализированную помощь, необходимую для лечения эхогенных почек плода и врожденных заболеваний почек, в одном месте, включая отделение интенсивной терапии самого высокого уровня, если это необходимо.
- Квалифицированная, опытная команда с проверенными результатами. У нас есть специальная группа специалистов в области медицины плода и матери (MFM), экспертов по визуализации плода, генетических консультантов, неонатологов, детских нефрологов и урологов, которые работают сообща, чтобы заботиться о вас и вашем ребенке на каждом этапе пути, используя проверенные протоколы мы развивались годами. Благодаря объединенному опыту и единому подходу эта команда предлагает наилучший уход при беременности с эхогенными почками.
- Мы заботимся о потребностях вашего ребенка на всех этапах жизни. Наш комплексный подход начинается с вашего первого дородового визита и продолжается во время родов, послеродового ухода и детства, благодаря одной из ведущих в стране бригад специалистов по плодам и педиатрам.
Видео
Дополнительные ресурсы
Количественная эхогенность почек как инструмент для диагностики запущенной хронической болезни почек у пациентов с гломерулопатиями и без заболевания печени — FullText — Исследование почек и артериального давления 2017, Vol.42, № 4
Абстрактные
Предпосылки / цели: Пациенты с гломерулопатией склонны к развитию преходящего снижения скорости клубочковой фильтрации (СКФ), которое трудно отличить от необратимой хронической болезни почек (ХБП). Ультразвук почек может быть полезным, но, в отличие от длины почек, количественная эхогенность почек ранее не оценивалась с точки зрения его способности выявлять необратимую прогрессирующую ХБП. Методы: Было проведено проспективное исследование, в котором количественная эхогенность почек определялась во время биопсии почек у пациентов с подозрением на гломерулярную болезнь (n = 197). Количественная эхогенность измерялась как обратное соотношение между средней плотностью пикселей коры почек и прилегающей печени с использованием программного обеспечения ScionImage. Пациенты наблюдались в течение шести месяцев для выявления необратимой прогрессирующей ХБП. Количественная почечная эхогенность и дискриминирующая способность гистопатологических параметров сравнивались в отношении их способности выявлять запущенную и необратимую ХБП — расчетная СКФ менее 30 мл / мин / л.73m 2 подтверждено после шестимесячного наблюдения. Результаты: При биопсии почек средняя рСКФ составила 53,9 ± 33,6 мл / мин / 1,73 м 2 и 63 (32,0%) пациента имели рСКФ менее 30 мл / мин / 1,73 м 2 . Среднее соотношение эхогенности почек / печени составляло 1,06 ± 0,19 и обратно коррелировало с рСКФ при последующем наблюдении (r = -0,684, p <0,001). Для создания гистопатологического индекса, который правильно определяет необратимую распространенную ХБП, был проведен многомерный анализ. Дискриминационная способность почечной эхогенности выявлять необратимую прогрессирующую ХБП была равна 0.793 (0,719 -0,867), что аналогично индексу гистопатологии. Повышенная эхогенность почек с наилучшей дискриминационной способностью была при соотношении почка / печень более 1,15. Это пороговое значение имело прогностическое положительное значение 92% у пациентов с рСКФ менее 30 мл / мин / 1,73 м 2 . Заключение: Количественная эхогенность почек может быть полезным инструментом у пациентов с гломерулярной болезнью и нормальным размером почек (> 8 см) для выявления пациентов с необратимой распространенной ХБП.
© 2017 Автор (ы).Опубликовано S. Karger AG, Базель
Введение
При гломерулярном заболевании у взрослых биопсия почки является обязательной для диагностики и оценки «хроничности поражения», то есть того, является ли поражение обратимым или излечимым. По мере того как клубочки покрываются рубцами, возникает атрофия остальной части нефрона с интерстициальным фиброзом, и степень хронического необратимого повреждения обычно оценивается на основании степени атрофии канальцев / интерстициального фиброза.Хотя рекомендуется гистологическая оценка, существует концепция «точки невозврата», когда обширное и необратимое рубцевание почек указывает на иммуносупрессивную терапевтическую неэффективность [1]. «Точка невозврата» в настоящее время определяется как расчетная скорость клубочковой фильтрации (рСКФ) менее 30 мл / мин / 1,73 м 2 и необратимые поражения в почечной гистологии [1].
Хотя почти все согласны с тем, что не следует выполнять биопсию почки у пациентов с СКФ <30 мл / мин и уменьшенным размером почки, многие пациенты с запущенной хронической болезнью почек из-за гломерулярной болезни могут иметь нормальную длину почки [2].У этих пациентов клиническая проблема заключается в том, чтобы дифференцировать пациентов с преимущественно необратимыми хроническими поражениями от пациентов с обратимым снижением скорости клубочковой фильтрации (СКФ), например, из-за гемодинамических изменений.
При почечной недостаточности ультразвуковое исследование широко используется в клинической практике [3]. Помимо исключения обструктивных и кистозных нефропатий, сонографическая оценка может предоставить информацию о размере почек и толщине паренхимы, что указывает на необратимое хроническое заболевание почек.Другой сонографический признак, который, как считается, связан с необратимым поражением почек, — это эхогенность. Однако имеется мало информации только о пациентах с нарушением эхогенности почек [4].
Несколько исследований оценивали корреляцию между почечной эхогенностью и необратимой почечной недостаточностью [5-8]. Также Hricak et al [9] обнаружили корреляцию между почечной эхогенностью с атрофией канальцев, гломерулярным склерозом, гиалиновыми цилиндрами и инфильтрацией лейкоцитов. Однако в этих исследованиях эхогенность почек оценивалась качественно человеческим глазом, что очень ненадежно.В 2001 году Manley и O’Neill описали количественный метод оценки эхогенности коркового вещества почек по отношению к эхогенности печени [10]. Впоследствии та же группа коррелировала эхогенность коры почек с гистопатологическими данными [2]. Повышенная эхогенность почек в основном определялась атрофией канальцев и интерстициальным воспалением. В этом же исследовании авторы пришли к выводу, что уменьшение длины почек в сочетании с эхогенностью коры почек, большей, чем у печени, связано с тяжелым хроническим заболеванием почек.Однако дизайн исследования ограничивает его клиническую применимость при использовании почечной эхогенности для определения обратимости поражения из-за: (1) расширенного определения ХБП на основе гистологических параметров; (2) его поперечный дизайн и (3) отсутствие данных о СКФ.
В настоящем исследовании мы стремились оценить эффективность количественной эхогенности почек в прогнозировании необратимой прогрессирующей ХБП у пациентов с гломерулопатией, у которых любая терапия будет ненужной и потенциально вредной. Чтобы ответить на этот вопрос, мы выполнили ультразвуковое исследование почек одновременно с биопсией почек и наблюдали за этими пациентами в течение 6 месяцев, чтобы подтвердить или нет наличие прогрессирующей и необратимой ХБП.
Материалы и методы
Субъекты
Это проспективное исследование, проведенное с октября 2010 года по июль 2013 года. В исследование были включены все взрослые пациенты (возраст> 18 лет), которым была проведена биопсия почек из-за гломерулярных заболеваний. Показания к биопсии почек при гломерулярной патологии: необъяснимая суточная экскреция белка с мочой более 1 г и необъяснимое повреждение почек, связанное с гематурией или протеинурией любой степени. Поскольку только несколько пациентов были подвергнуты биопсии почек из-за необъяснимой ОПП без изменений, предполагающих гломерулярную болезнь (n = 8), они были исключены.Кроме того, пациенты с прогрессирующим заболеванием почек (скорость клубочковой фильтрации менее 30 мл / мин), ассоциированным с комбинированной длиной почек менее 16 см, обычно не рассматривались для биопсии почек. У пациентов, которым выполняли более одной биопсии почек, учитывалась только первая биопсия. Были исключены пациенты с известным заболеванием печени. Все биопсии почек были показаны после независимой консультации нефролога. Институциональный этический комитет одобрил это исследование, и было применено информированное согласие.
Клинические и лабораторные данные
Лабораторные данные о функции почек, скорости выведения белка с мочой за 24 часа и сывороточного альбумина были собраны у пациентов за три дня до и между тремя и шестью месяцами после проведения биопсии почек.Пациенты считались страдающими необратимой распространенной ХБП, если у них было: рСКФ менее 30 мл / мин / 1,73 м 2 при биопсии почек, которая сохранялась после шести месяцев наблюдения. Пациенты с рСКФ менее 30 мл / мин / 1,73 м 2 при биопсии почек, но не через 6 месяцев наблюдения, считались страдающими ОПП или острой формой ХБП. Пациенты с рСКФ выше 40 мл / мин / 1,73 м 2 при биопсии почек и менее 30 мл / мин / 1,73 м 2 через 3–6 месяцев считались быстро прогрессирующими, а не необратимо запущенной ХБП.Пациенты, у которых невозможно было выполнить эту оценку из-за недоступности данных о функции почек, были исключены. Расчетная скорость клубочковой фильтрации (рСКФ) рассчитывалась с использованием уравнения CKD-EPI [11].
Гистопатологическая оценка
Образцы тканей для исследования под световым микроскопом были погружены в формалин, обезвожены в спиртах различной степени очистки, очищены ксилолом и пропитаны парафином с использованием автоматизированных процедур. Залитые парафином ткани разрезали на 3-микронные срезы и окрашивали гематоксилином и эозином (H&E), реактивом Шиффа периодической кислоты (PAS), трихромом Массона и окрашиванием серебра метенамином Джонса.Каждая биопсия содержала не менее 12 клубочков. Биопсии оценивали по 4 параметрам: (1) гломерулярный склероз, (2) атрофия канальцев, (3) интерстициальный фиброз и (4) воспалительный инфильтрат. Каждый параметр измерялся в каждой биопсии с использованием полуколичественной шкалы оценок от 0 до 4, где оценка 0 означала, что поражено 5% или менее образца биопсии; оценка 1 от 6% до 25%; оценка 2 от 26% до 50%; оценка 3 от 51% до 75%; и оценка 4, более 75%.
Сонографическая оценка
Пациентам была выполнена биопсия почек под контролем УЗИ. Перед процедурой пациенты были лишены пищи и воды в течение 8 часов. Все сонограммы были выполнены с использованием системы PICO Mycolor 202 (Medison CO LTD, Сеул, Корея) с использованием широкополосного диапазона 5,0 МГц и зонда с фазированной решеткой. Вывод был на бумагу для термопринтера. Все исследования проводились непосредственно перед биопсией почек, выполняемой одним нефрологом, ответственным за эти процедуры.Длина почки определялась как максимальный продольный размер, а толщина паренхимы определялась как кратчайшее расстояние от жира почечного синуса до почечной капсулы. Эти параметры были измерены во время сонограммы. Исследователь, проводивший эти измерения, не знал патологических данных. Эти измерения проводились на почке, из которой была сделана биопсия. Эхогенность оценивали, как описано ранее [10]. Вкратце, эхогенность измерялась как обратное соотношение между средней плотностью пикселей коры почек и прилегающей печени с использованием программного обеспечения ScionImage (Scion Corp., Frederick, MD, USA) после того, как изображения были сохранены в формате тегов. Поскольку необходимо сравнение с печенью, эхогенность была проанализирована только в правой почке. Для каждого пациента были выбраны три разные области почек и печени. Каждый сонографический параметр измерялся одним исследователем, чтобы избежать различий между наблюдателями.
Статистический анализ
Анализ проводился с использованием SPSS 19.0 для Windows. Все переменные были проверены на нормальное распределение с помощью критерия Колмогорова-Смирнова.Нормально или почти нормально распределенные переменные представлены как средние значения со стандартными отклонениями (SD). Категориальные данные были представлены в виде пропорций и сравнивались с использованием точного критерия Фишера. Если указано, одномерный анализ отображается как коэффициент Пирсона или Спирмена. Дискриминацию оценивали по площади под кривой характеристики оператора приемника (AuROC), а сравнение дискриминирующей способности проводили с использованием непараметрического метода. Для каждого параметра-предиктора точки отсечения были выбраны в соответствии с наивысшим индексом Юдена, который был рассчитан как [1- (1 — чувствительность) + (1 — специфичность)].Чувствительность, специфичность, положительные и отрицательные прогностические значения выражаются в процентах. Для выявления независимых гистопатологических параметров, связанных с распространенной ХБП, была проведена обратная ступенчатая многомерная регрессия. Данные представлены в виде отношения шансов (OR) с 95% доверительным интервалом (CI). Значение p <0,05 считалось статистически значимым для всех сравнений.
Результаты
Характеристики субъектов
Всего было выполнено 255 биопсий почек в естественных почках.После исключения (рисунок 1) в окончательный анализ были включены 197 пациентов. Преобладали женщины (56,9%), средний возраст составлял 39,0 ± 16,1 года. Диагноз почечной биопсии раскрыт в таблице 1. Что касается функции почек при почечной биопсии, средняя рСКФ составила 53,9 ± 33,6 мл / мин / 1,73 м. 2 , и 63 (32,0%) пациента имели рСКФ менее 30 мл / мин. / 1,73 м 2 .
Таблица 1.
Рис. 1.
После периода наблюдения 54 (27,4%) пациента были признаны страдающими необратимой распространенной ХБП (рСКФ менее 30 мл / мин / л.73m 2 ), и среди этих пациентов у семи была рСКФ между 30-40 мл / мин при биопсии почек. У 17 пациентов функция почек восстановилась, по крайней мере частично.
Гистопатология и сонографическая оценка
Пациенты имели среднюю длину почек 10,3 ± 1,12 см и среднюю толщину паренхимы 16,4 ± 0,5 мм. Среднее соотношение эхогенности почек / печени составило 1,06 ± 0,29. Что касается гистопатологических параметров, используемых для оценки хронического заболевания, некоторая степень интерстициального фиброза была обнаружена у 66 (33.5%) пациентов, атрофия канальцев у 70 (35,5%) и воспалительный инфильтрат у 53 (26,9%). 83 пациента (42,1%) имели более 30% глобально склерозированных клубочков.
Как и ожидалось, между всеми оцененными гистопатологическими параметрами была положительная корреляция. Самая сильная корреляция была обнаружена между интерстициальным фиброзом и атрофией канальцев (r = 0,697, p <0,001), а самая слабая - между склерозированными клубочками и воспалительным инфильтратом (r = 0,273, p <0,001). Эхогенность почек обратно коррелировала с длиной почек (r = -0.266, p <0,001), но не с толщиной паренхимы (r = -0,062, p = 0,429). Эхогенность почек коррелировала со всеми гистопатологическими параметрами (таблица 2). Более того, почечная эхогенность напрямую коррелировала с 24-часовой протеинурией (r = 0,216, p = 0,008) и обратно с рСКФ при последующем наблюдении (r = -0,684, p <0,001) и уровнем сывороточного альбумина (r = -0,201, p = 0,011). ).
Таблица 2.
Коэффициенты корреляции Спирмена для взаимосвязей между корковой эхогенностью и патологическими параметрами
Гистопатологические параметры и прогрессирующая необратимая хроническая болезнь почек
Первоначально каждый гистопатологический параметр оценивался отдельно в зависимости от его дискриминирующей способности таблица 3).Как правило, они обладали дискриминационной способностью от умеренной до хорошей и аналогичной способностью по сравнению друг с другом. Единственная тенденция в статистической разнице была между различительной способностью интерстициального фиброза и атрофии канальцев (p = 0,050). Оценка с лучшей дискриминационной способностью была 3 или выше по всем гистопатологическим параметрам и более 30% склерозированных клубочков. Эти баллы использовались для расчета чувствительности, специфичности, положительных и отрицательных прогностических значений для каждого параметра, как показано в таблице 3.
Таблица 3.
Дискриминационная способность, чувствительность, специфичность, прогностические положительные и отрицательные значения каждого простого или комбинированного гистопатологического параметра и почечной эхогенности. Индекс IF / II: сводный индекс, добавляющий интерстициальный фиброз и воспалительный инфильтрат
В попытке проанализировать всю гистопатологическую способность почек для выявления распространенной ХБП и поскольку гистологические параметры были тесно связаны, был проведен многомерный анализ для определения их относительного вклада в определение распространенных ХБП — Таблица 4.Только интерстициальный фиброз и воспалительный инфильтрат оставались значимыми независимыми предикторами. У них были аналогичные стандартизированные значения коэффициента бета, поэтому мы рассчитали комбинированный индекс с равным вкладом интерстициального фиброза и воспалительного инфильтрата (индекс IF / II). Даже после расчета этого составного индекса он не показал лучших результатов, чем только интерстициальный фиброз — таблица 3.
Таблица 4.
Многофакторный анализ с запущенным хроническим заболеванием почек через 6 месяцев наблюдения в качестве зависимой переменной
Кортикальная эхогенность и расширенная необратимая хроническая болезнь почек
Дискриминационная способность почечной эхогенности для выявления запущенной и необратимой ХБП показана на рисунке 2.Повышенная эхогенность почек с наилучшей дискриминационной способностью была при соотношении почка / печень более 1,15. Используя это пороговое значение, 65 (33,0%) пациентов имели повышенную эхогенность почек. Почечная эхогенность характеризовалась умеренной чувствительностью и хорошей специфичностью для выявления распространенной ХБП. По сравнению с гистопатологическими параметрами, он имел лучшую чувствительность, чем атрофия канальцев и воспалительный инфильтрат, но хуже, чем процент склерозированных клубочков и интерстициальный фиброз. Как и ожидалось, в отношении специфичности было подтверждено обратное — таблица 3.
Рис. 2.
Дискриминационная способность количественной эхогенности почек при выявлении прогрессирующей хронической болезни почек.
Мы также сравнили показатели корковой эхогенности с индексом IF / II (общая оценка, разработанная для включения значимых гистопатологических параметров). У них была очень похожая дискриминационная способность — таблица 3. За исключением лучшей, но не статистически значимой чувствительности индекса IF / II, эхогенность почек была сопоставима с этим индексом гистопатологии.
Одним из наиболее важных параметров, влияющих на клиническое решение в этой ситуации, является способность удостовериться в том, что пациенты с более высокой корковой эхогенностью наверняка имеют прогрессирующую и необратимую ХБП; в противном случае эти пациенты были бы неправильно исключены из почечной биопсии. Эта способность означает более высокое прогнозируемое положительное значение (PPV). Эхогенность коры почек характеризовалась обычным PPV, только 63,8% [50,1-76,0], но выше, чем у гистопатологических параметров, за исключением воспалительного инфильтрата, с PPV 71.4% [47,8–88,6] — таблица 3.
При анализе только пациентов с рСКФ менее 30 мл / мин / 1,73 м 2 при биопсии почек PPV увеличилось до 92,1% [75,6–98,7]. Фактически, в этой подгруппе только у трех пациентов с повышенной эхогенностью почек не была подтверждена прогрессирующая ХБП после 6 месяцев наблюдения: у двух пациентов рСКФ составляла 30-40 мл / мин / 1,73 м2, а у другого рСКФ была близка. до 50 мл / мин / 1,73 м 2 .
Почечная эхогенность, серповидные поражения и запущенная необратимая хроническая болезнь почек
В исследуемой популяции 33 (16.7%) пациентов имели более 20% клубочков с серповидными поражениями. В этой подгруппе у 11 (33,3%) пациентов была развитая ХБП. Опять же, почечная эхогенность имела хорошую дискриминирующую способность для выявления прогрессирующей ХБП — AuROC: 0,872 [0,736–1,000] и PPV 72,7%, в то время как индекс IF / II имел AuROC 0,806 [0,660–0,952] и PPV 50%.
Обсуждение
В настоящем исследовании мы впервые оценили дискриминационную способность почечной эхогенности для выявления необратимой прогрессирующей ХБП у пациентов с гломерулярной болезнью, используя проспективный дизайн и eGRF в качестве суррогатной конечной точки.Таким образом, количественная эхогенность имела хорошую обратную корреляцию с рСКФ при последующем наблюдении и хорошие результаты при идентификации пациентов с необратимой распространенной ХБП. Более того, у пациентов с рСКФ <30 мл / мин / 1,73 м2 эхогенность коры почек выше, чем у печени, и имелся хороший PPV для выявления необратимой прогрессирующей ХБП.
Во многих ситуациях, особенно при гломерулярной болезни, прогрессирующая ХБП может иметь место при нормальной длине почки, поэтому биопсия почек необходима для оценки почечного прогноза.В нашей серии исследований ни у одного пациента не было длины почки менее 8 см, что делало диагностику необратимой ХБП сложной клинической проблемой. В этом сценарии нормальной длины почек и подозрении на необратимое рубцевание полезность почечной эхогенности была ранее оценена. В нескольких исследованиях изучали, может ли повышенная эхогенность коры почек дифференцировать острое повреждение почек от хронического [8, 9]. Этот потенциал основан на предположении, что коллаген, присутствующий при интерстициальном фиброзе и гломерулосклерозе, ответственен за повышенную эхогенность.
В предыдущем исследовании, использующем тот же количественный подход, Moghazi et al [2]. коррелировали почечную эхогенность с данными гистопатологии. Повышенная эхогенность была независимо связана с атрофией канальцев и интерстициальным воспалением, что аналогично нашим результатам. Интересно, что хотя почечная эхогенность тесно связана с атрофией канальцев, интерстициальный фиброз был более мощным предиктором снижения рСКФ. Могхази и др. [2]. показали, что, хотя гистопатологические параметры коррелировали с эхогенностью почек, они составляли только 20% вариаций эхогенности коркового вещества почек.Наши данные дополняют эти знания, поскольку мы обнаружили корреляцию между тяжестью нефротического синдрома и почечной эхогенностью.
В этом же исследовании авторы предположили, что комбинированная длина почек менее 20 см и эхогенность почек выше, чем у печени, имеют большую дискриминационную способность для диагностики тяжелого хронического заболевания почек при биопсии. Наши результаты имеют преимущество по сравнению с этим исследованием в отношении важного момента: мы использовали проспективную оценку рСКФ в течение 6-месячного периода наблюдения для определения прогрессирующей и необратимой ХБП с аналогичным определением, принятым недавним консенсусом KDIGO [1].Хотя параметры биопсии почек являются общепринятыми для оценки почечного прогноза, даже выраженный интерстициальный фиброз не обязательно связан со значительным снижением рСКФ. Фактически, он чаще используется в качестве предиктора снижения функции почек. Например, в исследовании, посвященном оценке пациентов с нефропатией IgA, у пациентов с тяжелым интерстициальным фиброзом / тубулярной атрофией средняя рСКФ составляла 48 мл / мин [12]. Таким образом, важно оценить количественную эхогенность в отношении СКФ, и в нашем исследовании мы обнаружили хорошую обратную корреляцию между этими параметрами, которая может иметь важные клинические последствия.
Мы оценили потенциал количественной эхогенности почек при выявлении распространенной ХБП с использованием рСКФ в качестве конечной точки и, кроме того, сравнили неинвазивные данные, полученные по эхогенности почек, с гистопатологическими параметрами. Поскольку биопсия почек дает не только один, но и несколько параметров, которые могут быть связаны с хроническим течением и прогрессированием заболевания почек, мы выполнили анализ множественной логистической регрессии, чтобы получить уникальный индекс гистопатологии для выявления распространенной ХБП.Даже по сравнению с этим ассоциированным индексом эхогенность имела аналогичную дискриминационную способность для оценки хронической почечной недостаточности.
Однако только хорошей дискриминирующей способности, определяемой кривой ROC, может быть недостаточно, чтобы помочь клиницисту решить, проводить ли биопсию почки или нет. Мы считаем, что в клинических условиях гломерулярной болезни лучшим параметром является параметр с наибольшей точностью, а также хороший PPV. Учитывая всех пациентов, наш PPV составлял только 57,4%, то есть более 40% пациентов с повышенной эхогенностью почек не имели бы прогрессирующей ХБП.Такое низкое PPV можно объяснить тем, что многие пациенты с запущенной ХБП и уменьшенным размером почек не были включены в исследование, что снизило его реальную распространенность и отрицательно повлияло на PPV. В попытке преодолеть эту ловушку мы проанализировали только пациентов с рСКФ менее 30 мл / мин / 1,73 м 2 при биопсии почек: субпопуляция, у которой эхогенность коры почек может повлиять на клиническое решение о том, выполнять или нет биопсия почек. В этом анализе подгруппы это значение увеличилось почти до 90%.Такой подход логичен в данной клинической ситуации, поскольку ни один врач не откажется от проведения биопсии почек у пациента с нормальной или близкой к нормальной рСКФ, поэтому ожидается, что почечная эхогенность будет полезна только для пациентов со сниженной рСКФ.
Чтобы выяснить, почему эхогенность почек увеличивается у пациентов с более высоким уровнем рСКФ, мы исследовали связь с клиническими параметрами и обнаружили связь между эхогенностью почек и тяжестью нефротического синдрома (24-часовая протеинурия и сывороточный альбумин).Мы предполагаем, что у этих пациентов почечная эхогенность может быть увеличена из-за внутриканальцевого белкового дебриса и / или интерстициального отека.
Взяв на себя смелость повторно проанализировать вышеупомянутые данные, предоставленные Moghazi et al. [2], мы заметили, что почечная эхогенность выше, чем у печени, имеет AuROC 0,671 при выявлении распространенной ХБП, определяемой гистопатологическими параметрами. Согласно нашим данным, используя рСКФ в качестве суррогатной конечной точки, AuROC составлял 0,793. Мы предполагаем, что эту разницу можно объяснить тем, что образец биопсии не является репрезентативным для всей почки, а только для рСКФ.Кроме того, ограниченный образец, взятый при биопсии почек, может объяснить, почему параметр, который может пострадать от влияния нескольких других состояний, таких как эхогенность почек, имел эффективность, аналогичную показателям гистопатологического анализа почек.
Другой важный клинический сценарий, при котором необходимо дифференцировать острое и хроническое заболевание почек, — это быстро прогрессирующий гломерулонефрит. Хотя мы обследовали небольшое количество пациентов (n = 33) с серповидными поражениями, наши данные позволяют предположить, что почечная эхогенность оставалась полезным инструментом для оценки обратимости почечной функции при гломерулопатиях с серповидными поражениями.Количественная почечная эхогенность — потенциальный инструмент, который будет включен в будущие исследования, направленные на оценку прогноза гломерулярной болезни.
Наше исследование имеет несколько ограничений: во-первых, все УЗИ почек выполнял один опытный нефролог. Однако в предыдущем исследовании, которое имело аналогичные результаты о корреляции между эхогенностью почек и гистопатологическими параметрами, стажеры выполняли все УЗИ почек [2]. Это пример хорошей валидации техники. Во-вторых, наше исследование ограничивалось пациентами, которым проводилась биопсия почек из-за подозрения на гломерулярное поражение, и оно должно быть валидировано в других популяциях почечных заболеваний, таких как чисто канальцевое интерстициальное заболевание и обструктивная нефропатия.Наконец, хотя мы исключили пациентов с диагностированным заболеванием печени, возможно, что у некоторых пациентов наблюдается жировая болезнь печени, влияющая на эхогенность печени и, следовательно, на соотношение эхогенности почек / печени.
Заключение
Мы продемонстрировали, что количественная эхогенность почек может быть полезным инструментом у пациентов с гломерулярной болезнью, нормальным размером почек (> 8 см) и отсутствием заболевания печени для выявления пациентов с необратимой рСКФ менее 30 мл / мин / 1,73 м 2 .Мы ожидаем, что эти результаты могут помочь врачам в процессе принятия решений при назначении биопсии почек и иммуносупрессивного лечения, избегая неэффективных процедур.
Заявление о раскрытии информации
Нет.
Благодарности
ABL является получателем гранта от Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq). Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Список литературы
- Eckardt K-U, Kasiske BL: KDIGO Clinical Practice Guideline for Glomerulonephritis General Principles in the Management of Glomerular Disease. Руководство KDIGO по клинической практике по гломерулонефриту: Общие принципы ведения гломерулярных заболеваний, 2012 г.
- Moghazi S, Jones E, Schroepple J, Arya K, McClellan W, Hennigar RA, O’Neill WC: Корреляция почечной гистопатологии с данными сонографии. Kidney Int 2005; 67: 1515-1520.
- Lai S, Ciccariello M, Dimko M, Galani A, Lucci S, Cianci R, Mariotti A: Кардио-почечный синдром, тип 4: корреляция между кардиоренальными ультразвуковыми параметрами.Kidney Blood Press Res 2016; 41: 654-662.
- Готтлиб Р.Х., Вайнберг Е.П., Рубенс Д.Д., Монк Р.Д., Гроссман Э.Б.: Ультразвуковое исследование почек: можно ли его использовать более избирательно при повышенном уровне креатинина в сыворотке? Am J Kidney Dis 1997; 29: 362-367.
- Päivänsalo M, Huttunen K, Suramo I. Результаты ультразвукового исследования паренхиматозных заболеваний почек.Scand J Urol Nephrol 1985; 19: 119-123.
- Пейдж Дж. Э., Морган Ш., Иствуд Дж. Б., Смит С. А., Уэбб Д. Д., Дилли С. А., Чоу Дж., Поттье А., Джозеф А. Э .: Результаты ультразвукового исследования паренхиматозной болезни почек: сравнение с гистологическими проявлениями. Clin Radiol 1994; 49: 867-870.
- Nomura G, Kinoshita E, Yamagata Y, Koga N: Полезность ультразвукового исследования почек для оценки тяжести и течения острого канальцевого некроза.J Clin Ultrasound 1984; 12: 135-139.
- Ozmen CA, Akin D, Bilek SU, Bayrak AH, Senturk S, Nazaroglu H: Ультразвук как диагностический инструмент для дифференциации острой почечной недостаточности от хронической. Clin Nephrol 2010; 74: 46-52.
- Hricak H, Cruz C, Romanski R, Uniewski MH, Levin NW, Madrazo BL, Sandler MA, Eyler WR: Почечная паренхиматозная болезнь: сонографическая-гистологическая корреляция.Радиология 1982; 144: 141-147.
- Manley JA, O’Neill WC: Насколько эхогенный является эхогенным? Количественная акустика коры почек. Am J Kidney Dis 200137: 706-711.
- Леви А.С., Стивенс Л.А., Шмид С.Х., Чжан Ю.Л., Кастро А.Ф., Фельдман Х.И., Кусек Дж. В., Эггерс П., Ван Ленте Ф., Грин Т., Кореш Дж .: Новое уравнение для оценки скорости клубочковой фильтрации.Ann Intern Med 2009; 150: 604-612.
- Zeng C-H, Le W, Ni Z, Zhang M, Miao L, Luo P, Wang R, Lv Z, Chen J, et al .: Многоцентровое приложение и оценка оксфордской классификации IgA-нефропатии у взрослых китайских пациентов. Am J Kidney Dis 2012; 60: 812-820.
Автор Контакты
Alexandre Braga Libório
Avenida Abolição no.4043 Ап. 1203 Edifício Jangada,
Mucuripe, CEP 60.165-082, Fortaleza, Ceará
Электронная почта [email protected]
Подробности статьи / публикации
Предварительный просмотр первой страницы
Получено: 5 августа 2017 г.
Принято: 18 сентября 2017 г.
Опубликовано в Интернете: 18 октября 2017 г.
Дата выпуска: декабрь 2017 г.
Количество страниц для печати: 9
Количество рисунков: 2
Количество столов: 4
ISSN: 1420-4096 (печатный)
eISSN: 1423-0143 (онлайн)
Для дополнительной информации: https: // www.karger.com/KBR
Лицензия открытого доступа / Дозировка лекарства / Заявление об ограничении ответственности
Эта статья находится под международной лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 (CC BY-NC-ND). Использование и распространение в коммерческих целях, а также любое распространение измененных материалов требует письменного разрешения. Дозировка лекарства: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор и дозировка лекарства, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Однако с учетом продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новое и / или редко применяемое лекарство. Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, причиненный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
Сериядля детей: Эхогенность почек у детей: требуется клиническая корреляция
Ультрасонография почек — один из наиболее распространенных методов визуализации, выполняемых у детей в клинике нефрологии.Регулярное использование пренатального УЗИ при уходе за беременными дополнительно предоставило нефрологам возможность изучить состояние почек и мочевыводящих путей по мере развития в утробе матери , что позволяет семьям и медицинским бригадам подготовиться к осложнениям, связанным с почками, которые могут возникнуть после родов. Повышенная эхогенность почек, хотя и неспецифическая, является одним из наиболее частых результатов визуализации при УЗИ почек; это может быть временное открытие или предвестник серьезного заболевания почек, требующего обследования детским нефрологом.
Эхогенность почки или любого органа в этом отношении относится к тому, насколько яркой она отображается на полутоновом изображении с помощью ультразвука. Эти изображения создаются, когда ультразвуковой аппарат работает в двухмерном режиме яркости (B-режим), в котором отраженные эхо-сигналы отображаются в виде ярких точек. Ткань, которая наиболее сильно отражает звуковые волны, является гиперэхогенной и выглядит белой (например, волокнистая и жировая ткань), тогда как жидкость, например, из простых кист или мочи в собирательной системе, отражает наиболее слабую (безэхогенную) и имеет черный цвет.Традиционно яркость почек на УЗИ описывается по отношению к яркости печени, которая имеет промежуточную эхогенность, и используется в качестве внутреннего сравнения (при отсутствии патологии печени, такой как жировая болезнь печени). .
Рис. 1. Почка нормального вида. На УЗИ почка (белая стрелка) является гипоэхогенной по сравнению с печенью (белая стрелка). Хотя это немного сложно оценить с этой точки зрения, существует хорошая кортикомедуллярная дифференциация с визуализацией мозговых пирамид (звездочки).Центральная гиперэхогенная область почки — почечный синус. Источник изображения: Викимедиа.
Нормальные почки у детей выглядят гипоэхогенными для печени на ультразвуковом изображении, при этом кора почек имеет относительное увеличение яркости по сравнению с мозговыми пирамидами. Почки новорожденных обычно выглядят изоэхогенными, но обычно к 6-месячному возрасту почки становятся похожими на почки старших детей и взрослых. Недоношенные новорожденные являются исключением, так как у них могут быть гиперэхогенные при ультразвуковом исследовании почки, что может быть нормальным вариантом.Неонатальные почки также могут иметь временную повышенную эхогенность, особенно костномозговых пирамид, которая проходит к 2 неделям жизни. Этиология остается неясной, но может быть связана с повышенной концентрацией белка Тамма-Хорсфалла в почечных канальцах.
Рисунок 2. Почка новорожденного. На УЗИ кора почки (белая стрелка) изоэхогенна по сравнению с печенью (белая стрелка). Увеличивается кортикомедуллярная дифференциация с четкой визуализацией мозговых пирамид (звездочки), что часто встречается в нормальных почках новорожденных.Источник изображения: Аноним.
Хотя есть некоторые нормальные перинатальные вариации эхотекстуры почек, пренатальные и неонатальные почки с повышенной эхогенностью всегда следует оценивать на предмет патологии, которая может указывать на заболевание почек, включая врожденные аномалии почек и мочевыводящих путей (CAKUT).
- Определите, является ли эхогенность пятнистой (например, дисплазия) или диффузной (например, ARPKD)
- Ее расположение в почке
- Является ли она преимущественно корковой (например.грамм. острый тубулярный некроз)
- медуллярный (например, нефрокальциноз)?
- Нормальные мозговые пирамиды всегда должны быть гипоэхогенными по сравнению с корой, независимо от того, насколько яркой кора головного мозга выглядит на снимках.
Далее обратите особое внимание на размер почек. Увеличенные эхогенные почки in utero — обычная пренатальная находка при поликистозе почек, даже до того, как макрокисты становятся видимыми на УЗИ. Важно отметить объем околоплодных вод, поскольку сопутствующее маловодие или ангидрамнион предвещают ухудшение функции почек в долгосрочной перспективе, повышенный риск гипоплазии легких и снижение постнатальной выживаемости.Следует оценить степень расширения мочевыводящих путей, если таковая имеется, поскольку это может указывать на обструктивную уропатию с сопутствующими кистозно-диспластическими изменениями почек. Наличие других врожденных аномалий на изображениях плода может сильно указывать на лежащий в основе генетический синдром. Эхогенные почки, проявляющиеся в более позднем детстве или подростковом возрасте, особенно если размер почек нормальный или увеличен для возраста, более вероятно от приобретенного заболевания почек , такие как гломерулярные расстройства (например,грамм. ФСГС), ОПН от нескольких причин, пиелонефрит (текущая инфекция или старые рубцы почек) и инфильтративные заболевания. Маленькие, эхогенные почки также обычно имеют плохую кортикомедуллярную дифференцировку и могут быть замечены при длительном недиагностированном заболевании почек по многим причинам, которое привело к поздней стадии ХБП. Случайное обнаружение эхогенных почек в этой ситуации должно сопровождаться соответствующей оценкой функции почек, включая измерение артериального давления, электролитов сыворотки, мочевины, креатинина, кальция, фосфора, анализа мочи и скрининга на другие последствия ХБП, такие как анемия и вторичный гиперпаратиреоз. .
Таблица 1. Примеры состояний, связанных с повышенной эхогенностью почек у детей. Обратите внимание, что при определенных условиях размер почек может варьироваться. Источники: Krensky et al 1983, Kraus et al 1990, Chaumoitre et al 2006, Bullo et al 2012 и Faubel et al 2014.
Еще больше усложняет ситуацию то, что повышенная эхогенность почек также может быть временным признаком при отсутствии других признаков заболевания почек. Некоторые исследования показали, что повышенное состояние гидратации у взрослых и детей без основного заболевания почек может влиять на эхогенность коркового вещества почек.В исследовании, проведенном Wiersma et al., 189 последовательных детей с острой абдоминальной болью были обследованы с помощью УЗИ, у 10% были гиперэхогенные почки, а у 8% — изоэхогенные почки по сравнению с печенью. Среди клинических диагнозов острый аппендицит, в частности, был наиболее тесно связан с аномальным ультразвуковым исследованием почек, при этом 31% пациентов с острым аппендицитом имели повышенную корковую эхогенность почек. Хотя только 50% детей с повышенной эхогенностью, по сообщениям, измеряли креатинин в сыворотке, а 67% — анализ мочи (данные не сообщаются), обнаружение повышенной кортикальной эхогенности почек разрешилось у всех повторно обследованных детей через 2 недели после первоначального ультразвукового исследования.Случайно обнаруженные эхогенные почки во время острого заболевания, когда функция почек в норме, требует повторной визуализации, чтобы оценить, исчезла ли эта аномалия.
В следующий раз, когда вы будете читать отчет УЗИ почек, в котором говорится о «повышенной эхогенности почек, связанной с соматическим заболеванием почек», вы сможете самостоятельно интерпретировать изображения и оценить возможные причины этого неспецифического обнаружения. Опишите паттерн повышенной эхогенности (кортикальный, медуллярный или оба), размер почек (маленькие, нормальные или увеличенные, если учитывать возраст пациента) и клинический контекст, чтобы определить, почему почки в первую очередь эхогенные.
Сообщение
Брайан Стоттер, Мэриленд

 Таким образом, человек, отказывающийся от мяса, рискует получить неприятное осложнение в виде накопления жиров в печени;
Таким образом, человек, отказывающийся от мяса, рискует получить неприятное осложнение в виде накопления жиров в печени;