Гемоглобин
дыхательный пигмент, содержащийся в эритроцитах крови человека, позвоночных животных и некоторых беспозвоночных, осуществляющий перенос кислорода из легких в ткани и участвующий в переносе углекислого газа из тканей в легкие; представляет собой сложный белок, состоящий из гема и белка глобина, связанных между собой через радикал гистидинового остатка белка и атом железа гема.
Гемоглоби́н A — Г., составляющий основную часть нормального гемоглобина взрослого человека; белковая часть гемоглобина А содержит две пары различающихся по строению полипептидных цепей, которые обозначаются как α-цепи и β-цепи.
Гемоглоби́н A2 — Г., входящий в небольшом количестве (до 2,5%) в состав нормального гемоглобина взрослого человека и в более значительном при β-талассемии; отличается от гемоглобина А строением одной пары полипептидных цепей (δ-цепи вместо β-цепей).
Гемоглоби́н C — аномальный Г., отличающийся от гемоглобина А заменой в (β-цепи глутаминовой кислоты в 6-м положении на лизин; при высоком содержании гемоглобина С (в гомозиготном организме) развивается легкая форма гемолитической анемии.
Гемоглоби́н D — аномальный Г., отличающийся от гемоглобина А заменой в β-цепи глутаминовой кислоты в 121-м положении на глутамин; при высоком содержании гемоглобина D (в гомозиготном организме) развивается легкая форма гемолитической анемии.
Гемоглоби́н E — аномальный Г., отличающийся от гемоглобина A заменой в β-цепи глутаминовой кислоты в 26-м положении на лизин; при высоком содержании гемоглобина E (в гомозиготном организме) развивается легкая форма гемолитической анемии.
Гемоглоби́н F (син.: Г. фетальный, Г. эмбриональный) — нормальный Г. плода человека, отличающийся от гемоглобина А строением одной пары полипептидных цепей (γ-цепи вместо β-цепей), большим сродством к кислороду и большей стабильностью; увеличение содержания гемоглобина F наблюдается при некоторых формах β-талассемии, остром лейкозе, апластической анемии и других болезнях.
Гемоглоби́н M — общее название аномальных Г., отличающихся легкой окисляемостью в присутствии кислорода с превращением в метгемоглобин, что обусловлено заменой гистидина на тирозин в одной из полипептидных цепей в области контактов гема и глобина.
Гемоглоби́н P — нормальный Г. плода человека, преобладающий в период желточного кроветворения, (до 18 недель).
Гемоглоби́н S — аномальный Г., отличающийся от гемоглобина A заменой в β-цепи глутаминовой кислоты в 6-м положении на валин; при высоком содержании гемоглобина S (в гомозиготном организме) развивается серповидно-клеточная анемия.
Гемоглоби́н анома́льный — Г., образующийся вследствие наследственных нарушений первичной структуры полипептидных цепей глобина; наличие Г. а. иногда приводит к развитию гемолитической анемии.
Гемоглоби́н восстано́вленный — см. Дезоксигемоглобин.
Гемоглоби́н оксигени́рованный — см. Оксигемоглобин.
Гемоглоби́н фета́льный — см. Гемоглобин F.
Гемоглоби́н эмбриона́льный — см. Гемоглобин F.
Гемоглобин — это… Что такое Гемоглобин?
 Молекула гемоглобина: 4 субъединицы глобина окрашены в разные цвета
Молекула гемоглобина: 4 субъединицы глобина окрашены в разные цвета 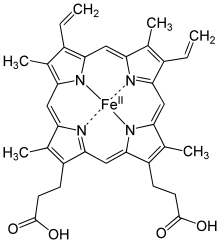
Гемоглоби́н (от др.-греч. αἷμα — кровь и лат. globus — шар) — сложный железосодержащий белок кровосодержащих животных, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У позвоночных животных содержится в эритроцитах, у большинства беспозвоночных растворён в плазме крови (эритрокруорин) и может присутствовать в других тканях [1].
Нормальным содержанием гемоглобина в крови человека считается: у мужчин 130—170 г/л (нижний предел — 120, верхний предел — 180 г/л), у женщин 120—150 г/л; у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям. Так, у детей через 1—3 дня после рождения нормальный уровень гемоглобина максимальный и составляет 145—225 г/л, а к 3—6 месяцам снижается до минимального уровня 95—135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в крови.[2]
Главная функция гемоглобина состоит в переносе кислорода. У человека в капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином. Током крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются к органам и тканям, где кислорода мало; здесь необходимый для протекания окислительных процессов кислород освобождается из связи с гемоглобином. Кроме того, гемоглобин способен связывать в тканях небольшое количество диоксида углерода (CO
Метгемоглобин — производное гемоглобина, в котором железо окислено (трехвалентно). Метгемоглобин не способен переносить кислород. Образуется в организме при некоторых видах отравлений.[3]
Строение
Гемоглобин является сложным белком класса хромопротеинов, то есть в качестве простетической группы здесь выступает особая пигментная группа, содержащая химический элемент железо — гем. Гемоглобин человека является тетрамером, то есть состоит из четырёх субъединиц. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологического тетраэдра. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков, обозначаемых буквами A-H (От N-конца к C-концу).Гем представляет собой комплекс протопорфирина IX, относящегося к классу порфириновых соединений, с атомом железа(II). Эта простетическая группа нековалентно связана с гидрофобной впадиной молекул гемоглобина и миоглобина.
Железо(II) характеризуется октаэдрической координацией, то есть связывается с шестью лигандами. Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две других координационных позиции лежат на оси, перпендикулярной плоскости порфирина. Одна из них занята азотом остатка гистидина в 93 положении полипептидной цепи (участок F). Связываемая гемоглобином молекула кислорода координируется к железу с обратной стороны и оказывается заключённой между атомом железа и азотом ещё одного остатка гистидина, располагающегося в 64 положении цепи (участок E).
Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы. Гемоглобин в легких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу гема на 6-ю координационную связь. На эту же связь присоединяется и моноксид углерода, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образуя карбоксигемоглобин.
Связь моноксида углерода с гемоглобином более прочная, чем с кислородом. Поэтому часть гемоглобина, образующая комплекс с моноксидом углерода, не участвует в транспорте кислорода. В норме у человека образуется 1,2 % карбоксигемоглобина. Повышение его уровня характерно для гемолитических процессов, в связи с этим уровень карбоксигемоглобина является показателем гемолиза.
Физиология
Для связывания кислорода с гемоглобином характерна кооперативность: после присоединения первой молекулы кислорода связывание последующих облегчается.
Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии — возбудители малярии, и в эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина, затрудняющие малярийным плазмодиям питание этим белком и проникновение в эритроцит. В частности, к таким имеющим эволюционно-приспособительное значение мутациям относится аномалия гемоглобина, приводящая к серповидно-клеточной анемии. Однако, к несчастью, эти аномалии (как и аномалии строения гемоглобина, не имеющие явно приспособительного значения) сопровождаются нарушением кислород-транспортирующей функции гемоглобина, снижением устойчивости эритроцитов к разрушению, анемией и другими негативными последствиями. Аномалии строения гемоглобина называются гемоглобинопатиями.
Гемоглобин высоко токсичен при попадании значительного его количества из эритроцитов в плазму крови (что происходит при массивном внутрисосудистом гемолизе, геморрагическом шоке, гемолитических анемиях, переливании несовместимой крови и других патологических состояниях). Токсичность гемоглобина, находящегося вне эритроцитов, в свободном состоянии в плазме крови, проявляется тканевой гипоксией — ухудшением кислородного снабжения тканей, перегрузкой организма продуктами разрушения гемоглобина — железом, билирубином, порфиринами с развитием желтухи или острой порфирии, закупоркой почечных канальцев крупными молекулами гемоглобина с развитием некроза почечных канальцев и острой почечной недостаточности.
Ввиду высокой токсичности свободного гемоглобина в организме существуют специальные системы для его связывания и обезвреживания. В частности, одним из компонентов системы обезвреживания гемоглобина является особый плазменный белок гаптоглобин, специфически связывающий свободный глобин и глобин в составе гемоглобина. Комплекс гаптоглобина и глобина (или гемоглобина) затем захватывается селезёнкой и макрофагами тканевой ретикуло-эндотелиальной системы и обезвреживается.
Другой частью гемоглобинообезвреживающей системы является белок гемопексин, специфически связывающий свободный гем и гем в составе гемоглобина. Комплекс гема (или гемоглобина) и гемопексина затем захватывается печенью, гем отщепляется и используется для синтеза билирубина и других желчных пигментов, или выпускается в рециркуляцию в комплексе с трансферрином для повторного использования костным мозгом в процессе эритропоэза.
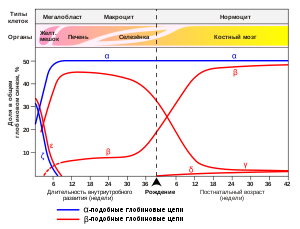 Экспрессия генов гемоглобина до и после рождения.
Экспрессия генов гемоглобина до и после рождения.Также указаны типы клеток и органы в которых происходит экспрессия гена (данные по Wood W. G., (1976). Br. Med. Bull. 32, 282.).[4]
Гемоглобин при заболеваниях крови
Дефицит гемоглобина может быть вызван, во-первых, уменьшением количества молекул самого гемоглобина (см. анемия), во-вторых, из-за уменьшенной способности каждой молекулы связать кислород при том же самом парциальном давлении кислорода.
Гипоксемия — это уменьшение парциального давления кислорода в крови, её следует отличать от дефицита гемоглобина. Хотя и гипоксемия, и дефицит гемоглобина являются причинами гипоксии.
Прочие причины низкого гемоглобина разнообразны: кровопотеря, пищевой дефицит, болезни костного мозга, химиотерапия, отказ почек, атипичный гемоглобин.
Повышенное содержание гемоглобина в крови связано с увеличением количества или размеров эритроцитов, что наблюдается также при поликизэмии (англ.)русск.. Это повышение может быть вызвано: врожденной болезнью сердца, лёгочным фиброзом, слишком большим количеством эритропоэтина.
См. также
Примечания
Литература
- Mathews, CK; KE van Holde & KG Ahern (2000), Biochemistry (3rd ed.), Addison Wesley Longman, ISBN 0-8053-3066-6.
- Levitt, M & C Chothia (1976), «Structural patterns in globular proteins», Nature. doi 10.1038/261552a0.
| B05A |
| ||||
|---|---|---|---|---|---|
| B05B |
| ||||
| B05C |
| ||||
| B05D |
| ||||
| B05X |
| ||||
| B05Z |
Гемоглобин — это… Что такое Гемоглобин?
дыхательный пигмент, содержащийся в эритроцитах крови человека, позвоночных животных и некоторых беспозвоночных, осуществляющий перенос кислорода из легких в ткани и участвующий в переносе углекислого газа из тканей в легкие; представляет собой сложный белок, состоящий из гема и белка глобина, связанных между собой через радикал гистидинового остатка белка и атом железа гема.Гемоглоби́н A — Г., составляющий основную часть нормального гемоглобина взрослого человека; белковая часть гемоглобина А содержит две пары различающихся по строению полипептидных цепей, которые обозначаются как α-цепи и β-цепи.
Гемоглоби́н A2 — Г., входящий в небольшом количестве (до 2,5%) в состав нормального гемоглобина взрослого человека и в более значительном при β-талассемии; отличается от гемоглобина А строением одной пары полипептидных цепей (δ-цепи вместо β-цепей). Гемоглоби́н C — аномальный Г., отличающийся от гемоглобина А заменой в (β-цепи глутаминовой кислоты в 6-м положении на лизин; при высоком содержании гемоглобина С (в гомозиготном организме) развивается легкая форма гемолитической анемии. Гемоглоби́н D — аномальный Г., отличающийся от гемоглобина А заменой в β-цепи глутаминовой кислоты в 121-м положении на глутамин; при высоком содержании гемоглобина D (в гомозиготном организме) развивается легкая форма гемолитической анемии.Гемоглоби́н E — аномальный Г., отличающийся от гемоглобина A заменой в β-цепи глутаминовой кислоты в 26-м положении на лизин; при высоком содержании гемоглобина E (в гомозиготном организме) развивается легкая форма гемолитической анемии.
Гемоглоби́н F (син.: Г. фетальный, Г. эмбриональный) — нормальный Г. плода человека, отличающийся от гемоглобина А строением одной пары полипептидных цепей (γ-цепи вместо β-цепей), большим сродством к кислороду и большей стабильностью; увеличение содержания гемоглобина F наблюдается при некоторых формах β-талассемии, остром лейкозе, апластической анемии и других болезнях. Гемоглоби́н M — общее название аномальных Г., отличающихся легкой окисляемостью в присутствии кислорода с превращением в метгемоглобин, что обусловлено заменой гистидина на тирозин в одной из полипептидных цепей в области контактов гема и глобина.Гемоглоби́н P — нормальный Г. плода человека, преобладающий в период желточного кроветворения, (до 18 недель).
Гемоглоби́н S — аномальный Г., отличающийся от гемоглобина A заменой в β-цепи глутаминовой кислоты в 6-м положении на валин; при высоком содержании гемоглобина S (в гомозиготном организме) развивается серповидно-клеточная анемия.Гемоглоби́н анома́льный — Г., образующийся вследствие наследственных нарушений первичной структуры полипептидных цепей глобина; наличие Г. а. иногда приводит к развитию гемолитической анемии.
Гемоглоби́н нестаби́льный — общее название аномальных Г., характеризующихся пониженной, в сравнении с гемоглобином А, устойчивостью к действию высоких температур, окислителей и других факторов.
Гемоглоби́н фета́льный — см. Гемоглобин F.
Гемоглоби́н эмбриона́льный — см. Гемоглобин F.
Чем отличается гемоглобин от миоглобина?
Миоглоби́н — кислород-связывающий белок скелетных мышц и мышцы сердца. Миоглобин скелетных мышц и миоглобин миокарда (сердечной мышцы) слегка различны по аминокислотной последовательности. В практической медицине этот факт используется для определения диагноза инфаркта миокарда по появлению специфического «сердечного» изотипа миоглобина (равно как и «сердечных» изотипов некоторых мышечных ферментов) в крови. В нормальных условиях, в отсутствие повреждения или воспаления мышечной ткани, миоглобин в кровь не попадает. Подобно гемоглобину, миоглобин высокотоксичен при его нахождении в свободном состоянии в плазме крови: крупные молекулы миоглобина могут закупоривать канальцы почек и приводить к их некрозу; конкурируя с гемоглобином эритроцитов за связывание с кислородом в лёгких и не выполняя функцию отдавания кислорода тканям, свободный миоглобин ухудшает кислородное снабжение тканей и приводит к развитию тканевой гипоксии. Самоотравление организма свободным миоглобином и как следствие острая почечная недостаточность и тканевая гипоксия — одна из главных причин смерти при синдроме длительного сдавливания (крэш-синдром) , встречающемся при тяжелых травмах со сдавлением или размозжением значительных количеств мышечной ткани. Гемоглоби́н (от греч. haima — кровь и лат. globus — шар) — сложный железосодержащий белок эритроцитов животных и человека, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. Главная функция гемоглобина состоит в транспорте дыхательных газов. В капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином. Током крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются к органам и тканям, где кислорода мало, здесь необходимый для протекания окислительных процессов кислород освобождается из связи с гемоглобином. Кроме того, гемоглобин способен связывать в тканях небольшое количество диоксида углерода (CO2) и освобождать его в лёгких. Монооксид углерода (CO) связывается с гемоглобином крови прочнее, чем кислород, образуя метгемоглобин (metHb, от мета… и гемоглобин, иначе гемиглобин или ферригемоглобин) . Таким образом, блокируется процессы транспортировки кислорода. В метгемоглобине железо гема находится в комплексе или в трёхвалентном состоянии (см. Метгемоглобинемия) . Нормальным содержанием гемоглобина в крови человека считается: у мужчин 130—170 г/л, у женщин 120—150 г/л; у детей — 120—140 г/л.
ГЕМОГЛОБИН — это… Что такое ГЕМОГЛОБИН?
гемоглобин — гемоглобин … Орфографический словарь-справочник
ГЕМОГЛОБИН — ГЕМОГЛОБИН. Содержание: Содержание в крови и количественное определение Г……………… 523 Химическая природа Г………… 523 Редуцированный Г…………… 524 Оксигемоглобин…………… 524 Метгемоглобин……………. 527 .… … Большая медицинская энциклопедия
ГЕМОГЛОБИН — (гр.). Красящее вещество кровяных шариков, снабжающее ткани тела кислородом. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ГЕМОГЛОБИН красящее вещество красных кровяных шариков; обладает свойством поглощать… … Словарь иностранных слов русского языка
гемоглобин — а, м. hémoglobine f. гр. haima кровь + лат. globus шар. Красный железосодержащий пигмент крови, осуществляющий перенос кислорода из легких в ткани организма. БАС 2. . Французские исследователи создали искусственную кровь, гемоглобин которой… … Исторический словарь галлицизмов русского языка
ГЕМОГЛОБИН — (от гемо… и лат. globus шар) красный дыхательный пигмент крови человека, позвоночных и некоторых беспозвоночных животных. Состоит из белка (глобина) и железопорфирина гема. Переносит кислород от органов дыхания к тканям и углекислый газ от… … Большой Энциклопедический словарь
гемоглобин S — В 6 м положении β цепи валин замещен глутаминовой кислотой, при низких концентрациях кислорода Г.S полимеризуется с образованием кристаллов; Г.S первый описанный аномальный гемоглобин, открытый Л. Полингом с соавт. в 1949 (отличие лишь по… … Справочник технического переводчика
ГЕМОГЛОБИН — (от гемо… и латинское globus шар), красный дыхательный пигмент крови человека, позвоночных и некоторых беспозвоночных животных. Состоит из белка (глобина) и железопорфирина гема. Переносит кислород от органов дыхания к тканям и диоксид углерода … Современная энциклопедия
ГЕМОГЛОБИН — ГЕМОГЛОБИН, гемоглобина, муж. (от греч. haima кровь и лат. globus шар) (физиол.). Красящее вещество крови, составная часть красных кровяных шариков. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
ГЕМОГЛОБИН — ГЕМОГЛОБИН, а, муж. Красный пигмент крови, переносящий кислород от органов дыхания к тканям. | прил. гемоглобинный, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
гемоглобин — сущ., кол во синонимов: 6 • карбогемоглобин (1) • карбоксигемоглобин (1) • … Словарь синонимов
что входит в состав гемоглобина
Гемоглобин – это белок, содержащийся в крови человека, и отвечающий за нысещение тканей человеческого организма кислородом из легких, а также за вывод углекислого газа из тканей обратно в легкие. Гемоглобин входит в состав эритроцитов (98% эритроцита состоит из гемоглобина) . Соответственно, при снижении уровня гемоглобина в крови появляется гипоксия тканей, т. е. недостаток кислорода. Состав гемоглобина Гемоглобин состоит из белка под названием глобин и комплексного соединения железа под названием гем. Норма гемоглобина в крови детей: в 1 месяц жизни ребенка – 107-117 грам/литр в 1 год – 117-140 грам/литр в 1-5 лет – 115-145 грам/литр (уровень гемоглабина в крови может упасть) в 10-12 лет – 120-150 грам/литр
Железо, молочная кислота.
Гемоглобин состоит из белка под названием глобин и комплексного соединения железа под названием гем.
вашко у вікіпедії подивитись
Гемоглобин — это белок с четвертичной структурой. Его небелковая часть, — катион железа Fe(2+).
железо+белок «глобин»
Гемоглобин — это… Что такое Гемоглобин?
 Молекула гемоглобина: 4 субъединицы глобина окрашены в разные цвета
Молекула гемоглобина: 4 субъединицы глобина окрашены в разные цвета 
Гемоглоби́н (от др.-греч. αἷμα — кровь и лат. globus — шар) — сложный железосодержащий белок кровосодержащих животных, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У позвоночных животных содержится в эритроцитах, у большинства беспозвоночных растворён в плазме крови (эритрокруорин) и может присутствовать в других тканях[1].
Нормальным содержанием гемоглобина в крови человека считается: у мужчин 130—170 г/л (нижний предел — 120, верхний предел — 180 г/л), у женщин 120—150 г/л; у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям. Так, у детей через 1—3 дня после рождения нормальный уровень гемоглобина максимальный и составляет 145—225 г/л, а к 3—6 месяцам снижается до минимального уровня 95—135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в крови.[2]
Главная функция гемоглобина состоит в переносе кислорода. У человека в капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином. Током крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются к органам и тканям, где кислорода мало; здесь необходимый для протекания окислительных процессов кислород освобождается из связи с гемоглобином. Кроме того, гемоглобин способен связывать в тканях небольшое количество диоксида углерода (CO2) и освобождать его в лёгких. Монооксид углерода (CO) связывается с гемоглобином крови намного сильнее (почти в 500 раз), чем кислород, образуя карбоксигемоглобин (HbCO). Некоторые процессы приводят к окислению иона железа в гемоглобине до степени окисления +3. В результате образуется форма гемоглобина, известная как метгемоглобин (HbOH) (metHb, от мета… и гемоглобин, иначе гемиглобин или ферригемоглобин, см. Метгемоглобинемия). В обоих случаях блокируются процессы транспортировки кислорода. Впрочем, монооксид углерода может быть частично вытеснен из гема при повышении парциального давления кислорода в легких.
Метгемоглобин — производное гемоглобина, в котором железо окислено (трехвалентно). Метгемоглобин не способен переносить кислород. Образуется в организме при некоторых видах отравлений.[3]
Строение
Гемоглобин является сложным белком класса хромопротеинов, то есть в качестве простетической группы здесь выступает особая пигментная группа, содержащая химический элемент железо — гем. Гемоглобин человека является тетрамером, то есть состоит из четырёх субъединиц. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологического тетраэдра. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков, обозначаемых буквами A-H (От N-конца к C-концу).
Гем представляет собой комплекс протопорфирина IX, относящегося к классу порфириновых соединений, с атомом железа(II). Эта простетическая группа нековалентно связана с гидрофобной впадиной молекул гемоглобина и миоглобина.
Железо(II) характеризуется октаэдрической координацией, то есть связывается с шестью лигандами. Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две других координационных позиции лежат на оси, перпендикулярной плоскости порфирина. Одна из них занята азотом остатка гистидина в 93 положении полипептидной цепи (участок F). Связываемая гемоглобином молекула кислорода координируется к железу с обратной стороны и оказывается заключённой между атомом железа и азотом ещё одного остатка гистидина, располагающегося в 64 положении цепи (участок E).
Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы. Гемоглобин в легких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу гема на 6-ю координационную связь. На эту же связь присоединяется и моноксид углерода, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образуя карбоксигемоглобин.
Связь моноксида углерода с гемоглобином более прочная, чем с кислородом. Поэтому часть гемоглобина, образующая комплекс с моноксидом углерода, не участвует в транспорте кислорода. В норме у человека образуется 1,2 % карбоксигемоглобина. Повышение его уровня характерно для гемолитических процессов, в связи с этим уровень карбоксигемоглобина является показателем гемолиза.
Физиология
Для связывания кислорода с гемоглобином характерна кооперативность: после присоединения первой молекулы кислорода связывание последующих облегчается.
Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии — возбудители малярии, и в эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина, затрудняющие малярийным плазмодиям питание этим белком и проникновение в эритроцит. В частности, к таким имеющим эволюционно-приспособительное значение мутациям относится аномалия гемоглобина, приводящая к серповидно-клеточной анемии. Однако, к несчастью, эти аномалии (как и аномалии строения гемоглобина, не имеющие явно приспособительного значения) сопровождаются нарушением кислород-транспортирующей функции гемоглобина, снижением устойчивости эритроцитов к разрушению, анемией и другими негативными последствиями. Аномалии строения гемоглобина называются гемоглобинопатиями.
Гемоглобин высоко токсичен при попадании значительного его количества из эритроцитов в плазму крови (что происходит при массивном внутрисосудистом гемолизе, геморрагическом шоке, гемолитических анемиях, переливании несовместимой крови и других патологических состояниях). Токсичность гемоглобина, находящегося вне эритроцитов, в свободном состоянии в плазме крови, проявляется тканевой гипоксией — ухудшением кислородного снабжения тканей, перегрузкой организма продуктами разрушения гемоглобина — железом, билирубином, порфиринами с развитием желтухи или острой порфирии, закупоркой почечных канальцев крупными молекулами гемоглобина с развитием некроза почечных канальцев и острой почечной недостаточности.
Ввиду высокой токсичности свободного гемоглобина в организме существуют специальные системы для его связывания и обезвреживания. В частности, одним из компонентов системы обезвреживания гемоглобина является особый плазменный белок гаптоглобин, специфически связывающий свободный глобин и глобин в составе гемоглобина. Комплекс гаптоглобина и глобина (или гемоглобина) затем захватывается селезёнкой и макрофагами тканевой ретикуло-эндотелиальной системы и обезвреживается.
Другой частью гемоглобинообезвреживающей системы является белок гемопексин, специфически связывающий свободный гем и гем в составе гемоглобина. Комплекс гема (или гемоглобина) и гемопексина затем захватывается печенью, гем отщепляется и используется для синтеза билирубина и других желчных пигментов, или выпускается в рециркуляцию в комплексе с трансферрином для повторного использования костным мозгом в процессе эритропоэза.
 Экспрессия генов гемоглобина до и после рождения.
Экспрессия генов гемоглобина до и после рождения.Также указаны типы клеток и органы в которых происходит экспрессия гена (данные по Wood W. G., (1976). Br. Med. Bull. 32, 282.).[4]
Гемоглобин при заболеваниях крови
Дефицит гемоглобина может быть вызван, во-первых, уменьшением количества молекул самого гемоглобина (см. анемия), во-вторых, из-за уменьшенной способности каждой молекулы связать кислород при том же самом парциальном давлении кислорода.
Гипоксемия — это уменьшение парциального давления кислорода в крови, её следует отличать от дефицита гемоглобина. Хотя и гипоксемия, и дефицит гемоглобина являются причинами гипоксии.
Прочие причины низкого гемоглобина разнообразны: кровопотеря, пищевой дефицит, болезни костного мозга, химиотерапия, отказ почек, атипичный гемоглобин.
Повышенное содержание гемоглобина в крови связано с увеличением количества или размеров эритроцитов, что наблюдается также при поликизэмии (англ.)русск.. Это повышение может быть вызвано: врожденной болезнью сердца, лёгочным фиброзом, слишком большим количеством эритропоэтина.
См. также
Примечания
Литература
- Mathews, CK; KE van Holde & KG Ahern (2000), Biochemistry (3rd ed.), Addison Wesley Longman, ISBN 0-8053-3066-6.
- Levitt, M & C Chothia (1976), «Structural patterns in globular proteins», Nature. doi 10.1038/261552a0.
| B05A |
| ||||
|---|---|---|---|---|---|
| B05B |
| ||||
| B05C |
| ||||
| B05D |
| ||||
| B05X |
| ||||
| B05Z |
