Альфа-амилаза общая биохимический анализ крови на фосфор сдать платно в Воронеже
Описание
Альфа-амилаза – это фермент, основную часть которого вырабатывает поджелудочная железа и слюнные железы. Амилаза играет важную роль в углеводном обмене веществ, регулирует работу пищеварительной системы, а также отвечает за расщепление и усвоение крахмала и сложных углеводов. Повышенная концентрация этого фермента типична для широкого круга заболеваний, имеющих схожую с панкреатитом клиническую картину. Амилаза в самых больших концентрациях находится в поджелудочной железе и слюнных железах. Амилаза удаляется из плазмы почками и экскретируется с мочой. Рост активности амилазы имеет самое большое значение при диагностике болезней поджелудочной железы.
Диагностические возможности тестов на альфа-амилазу
Анализ крови на альфа-амилазу включает в себя определение суммарной активности панкреатической и слюнной амилаз. Из-за ограниченного количества специфических клинических проявлений, сопровождающих болезни поджелудочной железы, именно общий анализ амилазы имеет важнейшее значение в их диагностике и мониторинге, особенно это касается острых панкреатитов.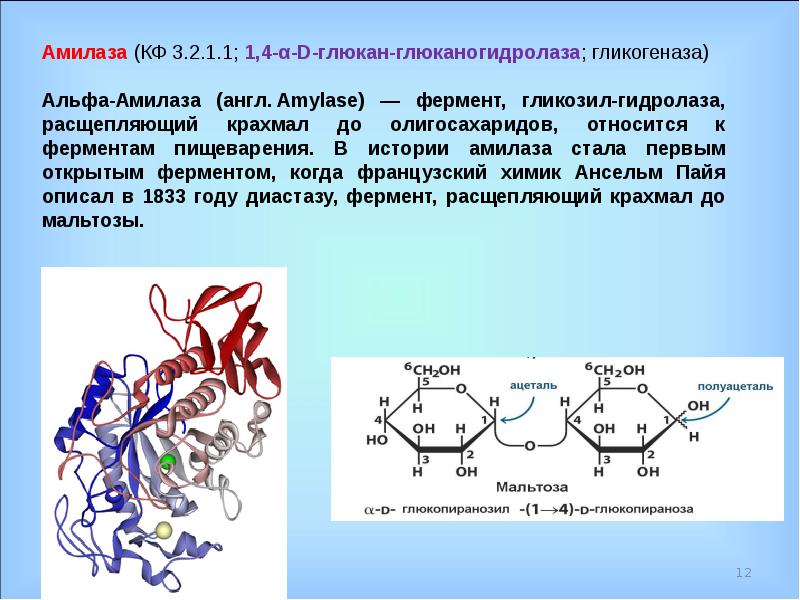
Помимо панкреатитов гиперамилаземия наблюдается при ряде других заболеваний:
- сахарный диабет любого типа;
- травматические поражения брюшной полости;
- перфоративная язва желудка;
- рак поджелудочной железы;
- кишечная непроходимость;
- острый аппендицит;
- тромбоз брыжеечных сосудов;
- почечная недостаточность;
- перитонит;
- паротит;
- злоупотребление алкоголем;
- камни в желчном пузыре и протоках.
Низкий уровень альфа-амилазы в крови характерен для следующих состояний:
- послеоперационный период после удаления поджелудочной железы;
- повышенный уровень холестерина;
- токсикоз во время беременности;
- острые и хронические гепатиты, а также другие патологии печени;
- гепатоз;
- кистозный фиброз;
- нарушения в работе поджелудочной железы;
- осложнения при остром панкреатите;
- тиреотоксикоз.

Перечисленные заболевания – это только часть наиболее типичных случаев, сопровождающихся повышением или снижением уровня альфа-амилазы. Отклонения от нормы по концентрации в крови этого фермента должны трактоваться только лечащим врачом с учетом анамнеза, результатов других анализов и обследований, поскольку активность альфа-амилазы имеет свою специфику.
Наивысшая концентрация амилаза проявляется в течение нескольких часов после повреждения клеток и сохраняется на таком уровне до пяти дней, что наиболее характерно для острого панкреатита. Но нередко даже при таком состоянии концентрация фермента может быть в норме или лишь незначительно ее превышать, кроме того эти данные не дают возможности определить степень поражения железы. Поэтому при расшифровке результатов большое значение имеет общая клиническая картина.
Несмотря на информативность для диагностики широко спектра заболеваний, основными показаниями к назначению исследования на эти ферменты являются: заболевания поджелудочной и слюнных желез, муковисцидоз и синдром острого живота.
О приеме любых медикаментозных средств, перед тем как сдать кровь нужно предупредить врача, а при возможности их прием лучше отменить, поскольку на уровень этих ферментов влияет широкий спектр препаратов: анаболические стероиды, эстрогены, фуросемид, ибупрофен, пероральные контрацептивы, тетрациклин и др.
«Детский доктор» – сеть современных клиник в Воронеже с собственной лабораторией, где мы среди прочего проводим тестирование на уровень альфа-амилазы. Мы работаем как с детьми, так и со взрослыми и гарантируем высокое качество тестирования, диагностики и лечения.
Амилаза
Амилаза – один из ферментов пищеварительного сока, который выделяется слюнными железами и поджелудочной железой.
Метод исследования
Кинетический колориметрический метод.
Единицы измерения
Ед/л (единица на литр).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 12 часов до исследования.

- Исключить физическое и эмоциональное перенапряжение и не курить 30 минут до сдачи крови.
Общая информация об исследовании
Амилаза – один из нескольких ферментов, которые вырабатываются в поджелудочной железе и входят в состав панкреатического сока. Амилаза расщепляет углеводы. Из поджелудочной железы панкреатический сок, содержащий амилазу, через панкреатический проток попадает в двенадцатиперстную кишку, где помогает переварить пищу.
В норме только небольшое количество амилазы циркулирует в кровяном русле и попадает в мочу. Если происходит повреждение поджелудочной железы, как при панкреатите, или если панкреатический проток блокируется камнем либо опухолью, амилаза начинает в больших количествах попадать в кровоток, а затем в мочу.
Небольшие количества амилазы образуются в яичниках, кишечнике, бронхах и скелетной мускулатуре.
Для чего используется исследование?
- Чтобы диагностировать острый или хронический панкреатит и другие заболевания, вовлекающие в патологический процесс поджелудочную железу (вместе с тестом на липазу).

- Для контроля за лечением рака, затрагивающего поджелудочную железу.
- Чтобы убедиться, что панкреатический проток не скомпрометирован после удаления камней из желчного пузыря.
Что означают результаты?
Референсные значения: 28 — 100 Ед/л.
Причины повышения активности общей амилазы в сыворотке
- Острый панкреатит. При этом заболевании активность амилазы может превосходить допустимую в 6-10 раз.
- Хронический панкреатит.
- Травма поджелудочной железы.
- Рак поджелудочной железы.
- Закупорка (камнем, рубцом) панкреатического протока.
- Острый аппендицит, перитонит.
- Перфорация (прободение) язвы желудка.
- Декомпенсация сахарного диабета – диабетический кетоацидоз.
- Нарушение оттока в слюнных железах или слюнных протоках, например при паротите (свинке).
- Операции на органах брюшной полости.
- Острый холецистит – воспаление желчного пузыря.

- Кишечная непроходимость.
- Прерванная трубная беременность.
- Разрыв аневризмы аорты.
Причины понижения активности общей амилазы в сыворотке
- Снижение функции поджелудочной железы.
- Тяжелый гепатит.
- Муковисцидоз.
- Удаление поджелудочной железы.
Что может влиять на результат?
- Активность амилазы в сыворотке повышается:
- у беременных,
- при приеме каптоприла, кортикостероидов, оральных контрацептивов, фуросемида, ибупрофена, наркотических анальгетиков.
- Повышенный холестерин может занижать активность амилазы.
Важные замечания
- При остром панкреатите повышение амилазы обычно сопровождается увеличением активности липазы.
- Активность амилазы у детей в первые два месяца жизни низкая, она повышается до взрослого уровня к концу первого года.
Вопрос: Евгений | 08 Июня, 2021
Как максимально ыстро делается тест пцр
Здравствуйте. При сдаче анализа до 15-00 часов срочное выполнение анализа возможно в течение 6 часов.
При сдаче анализа до 15-00 часов срочное выполнение анализа возможно в течение 6 часов.
Вопрос: Анна | 07 Июня, 2021
Здравствуйте. Принимаете анализ на сахар из пальчика? (Капиллярная кровь)
Здравствуйте. При заборе крови из пальца проводим экспресс-метод определения уровня сахара. Более точные результаты дает венозный забор биоматериала.
Поджелудочная железа и влияние на неё вредных привычек
02/12/19
Поджелудочная железа — продолговатый орган, расположенный позади желудка, приблизительно на пять–десять сантиметров выше пупка. Длина поджелудочной железы — 15–22 сантиметра, а вес — всего 50–70 граммов. Орган состоит из трех отделов-головки, тела и хвоста.
Поджелудочная выделяет панкреатический сок, необходимый для переваривания питательных веществ- это экзокринная(внешнесекреторная) функция. Кроме того что она выполняет еще и эндокринную функцию. В ПЖ есть клетки, которые вырабатывают инсулин, глюкагон и другие гормоны. Они поступают в кровь и регулируют обмен глюкозы. Нехватка инсулина или нечувствительность инсулиновых рецепторов вызывает сахарный диабет. В панкреатическом соке содержатся ферменты — вещества, которые расщепляют белки, жиры и углеводы на мельчайшие фрагменты, которые затем всасываются в кишечнике. Наиболее важными из панкреатических ферментов являются: липаза — помогает переваривать жиры; амилаза — отвечает за углеводы; химотрипсин и трипсин — расщепляют белки. Для работы этим ферментам нужна слабощелочная среда. Так как из желудка поступает кислое содержимое, то в панкреатическом соке содержится большое количество бикарбонатов для нейтрализации соляной кислоты. Жиры и кислоты раздражают стенку двенадцатиперстной кишки и заставляют поджелудочную железу активно работать. Ферменты производятся в ПЖ в нерабочей форме и только после попадания в кишечник активируются для расщепления пищи. Если клетки поджелудочной железы повреждаются, то ферменты могут активироваться досрочно, и в результате происходит воспаление железы — панкреатит, которое проявляется болевым синдромом.
Они поступают в кровь и регулируют обмен глюкозы. Нехватка инсулина или нечувствительность инсулиновых рецепторов вызывает сахарный диабет. В панкреатическом соке содержатся ферменты — вещества, которые расщепляют белки, жиры и углеводы на мельчайшие фрагменты, которые затем всасываются в кишечнике. Наиболее важными из панкреатических ферментов являются: липаза — помогает переваривать жиры; амилаза — отвечает за углеводы; химотрипсин и трипсин — расщепляют белки. Для работы этим ферментам нужна слабощелочная среда. Так как из желудка поступает кислое содержимое, то в панкреатическом соке содержится большое количество бикарбонатов для нейтрализации соляной кислоты. Жиры и кислоты раздражают стенку двенадцатиперстной кишки и заставляют поджелудочную железу активно работать. Ферменты производятся в ПЖ в нерабочей форме и только после попадания в кишечник активируются для расщепления пищи. Если клетки поджелудочной железы повреждаются, то ферменты могут активироваться досрочно, и в результате происходит воспаление железы — панкреатит, которое проявляется болевым синдромом.
Чаще всего боли возникают при погрешностях в диете. Если мы переедаем или употребляем слишком много алкоголя и тяжелых жирных продуктов, железа работает на пределе возможностей, чтобы помочь организму их усвоить. Алкоголь является самой частой причиной поражения поджелудочной железы, он вызывает до 70% случаев хронического панкреатита. Курение — дополнительный фактор, провоцирующий развитие панкреатита. Чем чаще и больше курит человек, тем выше риск.
Клиническими признаками острого панкреатита будут интенсивная постоянная боль в верхних отделах отделах живота с иррадиацией в спину, тошнота, рвота, часто с примесью желчи. При увеличении головки поджелудочной железы возможно развитие механической желтухи из-за нарушения оттока желчи. Острый панкреатит обычно требует госпитализации пациента. Иногда первый же приступ панкреатита заканчивается панкреонекрозом и смертью пациента.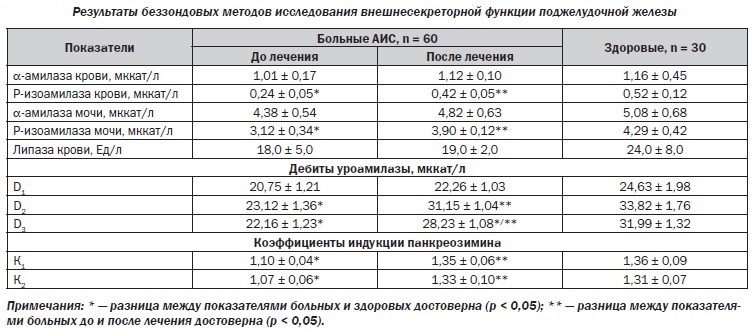 При длительном застолье, поджелудочная железа, чтобы переработать всю пищу и алкоголь, вырабатывает ударную дозу сока, богатого ферментами.
При длительном застолье, поджелудочная железа, чтобы переработать всю пищу и алкоголь, вырабатывает ударную дозу сока, богатого ферментами.
Давление в протоках повышается, происходит разрыв клеток поджелудочной, и ферменты, которые должны перерабатывать пищу, попадают в окружающие ткани и начинают переваривать всё подряд.
Для диагностики панкреатита кроме клинических данных используют УЗИ органов брюшной полости, биохимические анализы крови, мочи и кала.
Лечения заболевания включает комплекс мер, в первую очередь назначается щадящая диета(при остром панкреатите-голод)- стол № 5 с ограничением острой, жирной, жареной пищи, отказ от алкоголя. Рекомендуется пища, приготовленная на пару или отварная. Прием пищи дробный, небольшими порциями. А медикаментозное лечение конечно же назначает врач.
Впереди длинные новогодние каникулы и нужно помнить, что новогоднее застолье – это не только повод поесть, а это повод встретиться с друзьями, повеселиться, о чем-то поговорить, о чем-то помечтать, потанцевать, подвигаться, погулять. За праздничным столом всегда присутствуют более жирные и менее жирные продукты. Нужно сделать так, чтобы более жирных было меньше, а менее жирных больше. Проще говоря, нужно стараться наедаться менее жирными продуктами, а лакомиться более жирными. Менее жирные продукты – это хлеб, овощи, иногда еще нежирные мясные нарезки. А поверх этого – небольшая ложечка традиционного новогоднего салата. Не существует безвредных, безопасных доз алкоголя, алкоголь всегда токсичен, просто меньшие дозы менее токсичны, большие дозы более токсичны. Никогда не надо начинать трапезу с алкоголя. Сначала надо закусить, а уже потом можно и выпить.
За праздничным столом всегда присутствуют более жирные и менее жирные продукты. Нужно сделать так, чтобы более жирных было меньше, а менее жирных больше. Проще говоря, нужно стараться наедаться менее жирными продуктами, а лакомиться более жирными. Менее жирные продукты – это хлеб, овощи, иногда еще нежирные мясные нарезки. А поверх этого – небольшая ложечка традиционного новогоднего салата. Не существует безвредных, безопасных доз алкоголя, алкоголь всегда токсичен, просто меньшие дозы менее токсичны, большие дозы более токсичны. Никогда не надо начинать трапезу с алкоголя. Сначала надо закусить, а уже потом можно и выпить.
Всегда нужно знать меру.
Альфа — амилаза — Диагностическая лаборатория «HUMAN»
Анализ крови на альфа-амилазу — исследование для определения функции поджелудочной железы и диагностики ее заболеваний. Амилаза — фермент пищеварительного сока, выделяется слюнными железами и поджелудочной, входит в состав панкреатического сока. «Отвечает» за расщепление углеводов. Сок с альфа-амилазой через проток попадает в двенадцатиперстную кишку, где идет процесс пищеварения.
«Отвечает» за расщепление углеводов. Сок с альфа-амилазой через проток попадает в двенадцатиперстную кишку, где идет процесс пищеварения.
В норме в крови анализ на альфа-амилазу выявляет малое количество фермента. Так происходит из-за клеточного обновления поджелудочной железы и слюнных желез. Амилаза также выделяется в мочу. Если железа повреждена, заблокирован поджелудочный проток, то альфа-амилаза в большом объеме поступает в кровоток и мочу. Низкие концентрации фермента присутствуют в яичниках, кишечнике, бронхах, скелетной мускулатуре.
Анализ крови используется для диагностики острого, хронического панкреатита и других заболеваний поджелудочной железы. Исследование проводят при контроле лечения онкологии данного органа, а также для проверки панкреатического протока. Анализ на альфа-амилазу назначают при симптомах: опоясывающей боли, повышении температуры, потери аппетита, рвоте.
Активность альфа-амилазы не всегда связана с патологией. Повышение значения характерна при беременности, приеме некоторых оральных контрацептивов, кортикостероидов, обезболивающих, жаропонижающих. Малое значение — при высоком холестерине. У нас Вы можете сдать анализ крови на холестерин и прочие показатели. Исследования проводятся по современным технологиям, что гарантирует точные результаты.
Малое значение — при высоком холестерине. У нас Вы можете сдать анализ крови на холестерин и прочие показатели. Исследования проводятся по современным технологиям, что гарантирует точные результаты.
Сдавать кровь утром, в период с 7:30 до 12:00 часов, строго натощак.
Рекомендуется не менее 8 часов и не более 14 часов голода, питье – вода, в обычном режиме; накануне избегать пищевых перегрузок; исключить курение и употребление алкоголя.
Сотрудники лаборатории и лечащий врач должны знать, принимает ли пациент препараты, которые могут повлиять на результат анализа (в некоторых случаях от их применения необходимо воздержаться).
Биохимический анализ крови. Расшифровка основных показателей
2. Холестерин общий. Этот показатель в норме не должен превышать 5,2. Высокий холестерин в крови, не считавшийся проблемой еще несколько десятков лет назад, сейчас волнует многих. Инфаркты и инсульты уносят жизни, а причиной половины из них является атеросклероз сосудов, который, в свою очередь, является следствием повышенного холестерина в крови у мужчин и женщин. Цифра именно «общего» холестерина сама по себе не показательна, поэтому если он повышен, то врач назначит дополнительные анализы, которые покажут фракции холестерина, то есть соотношение «плохого» (липопротеид низкой плотности) и «хорошего» (липопротеид высокой плотности ) холестерина в крови.
Цифра именно «общего» холестерина сама по себе не показательна, поэтому если он повышен, то врач назначит дополнительные анализы, которые покажут фракции холестерина, то есть соотношение «плохого» (липопротеид низкой плотности) и «хорошего» (липопротеид высокой плотности ) холестерина в крови.
Повышенное содержание в крови холестерина способствует развитию атеросклеротического поражения стенок кровеносных сосудов и является одним из факторов риска развития тяжелых сердечно-сосудистых заболеваний, таких как стенокардия (ишемическая болезнь сердца) и инфаркт миокарда, мозговой инсульт и перемежающаяся хромота.
Помогает снизить холестерин физическая активность, отсутствие в рационе продуктов, содержащих транс-жиры, употребление клетчатки, в продуктах, разрешенных для низко-углеводной диеты, включение в рацион морской рыбы хотя бы 2 раза в неделю, отказ от курения и алкоголя.
Следует отметить важное значение регулярных медицинских осмотров, ведь большинство заболеваний гораздо проще вылечить на начальной стадии, когда человека еще практически ничто не беспокоит. Помните: осложнения, которые вызываются повышенным холестерином, необратимы, а лечение не избавляет от существующих проблем, а лишь предотвращает развитие новых.
Помните: осложнения, которые вызываются повышенным холестерином, необратимы, а лечение не избавляет от существующих проблем, а лишь предотвращает развитие новых.
3. Билирубин общий. Биохимический анализ крови на билирубин проводится при: болезнях печени, разрушении эритроцитов, нарушении оттока желчи и заболеваниях желчевыводящих путей, появлении желтушности глаз и кожи. Этот показатель дает врачу понимание о том, как у человека работает печень.
Билирубином называют желчный пигмент, вещество, которое образуется при распаде некоторых веществ, в том числе отработанного гемоглобина. Железо из гемоглобина организм использует повторно, а вот белковая часть молекулы после сложных биохимических процессов превращается в билирубин.
Показатель в норме – от 5 до 21. Если билирубин повышен, то нужно обратиться к врачу, чтобы он исключил желчекаменную болезнь, гепатиты, инфекционное поражение печени. Часто повышенный билирубин может говорить о гепатите А (болезнь Боткина, желтуха). Подъем этой болезни обычно бывает осенью.
Подъем этой болезни обычно бывает осенью.
4. АЛТ, АлАТ, аланинаминотрансфераза и АСТ, АсАТ, аспартатаминотрансфераза. Все это вместе можно назвать одним термином – «трансминазы». Аланинаминотрансфераза (алт, или АлАТ) — маркерные ферменты для печени. Аспартатаминотрансфераза (аст, или АсАТ) — маркерные ферменты для миокарда. Количество содержания фермента аланинаминотрансферазы в крови измеряется в единицах на литр. Врач смотрит на соотношение АЛТ и АСТ и делает выводы.
В диагностических целях важен не только факт изменения показателей крови АсАТ и АлАТ, но и степень их повышения или понижения, а также соотношение количества ферментов между собой. К примеру:
Об инфаркте миокарда свидетельствует повышение обоих показателей (АСТ и АЛТ) в анализе в 1,5–5 раз. Если соотношение АСТ/АЛТ находится в пределах 0,55–0,65, можно предположить вирусный гепатит.
Анализы крови у кошек: как подготовить животное
Назначить эффективное лечение можно только после тщательной диагностики. Касается это не только людей, но и животных. Кошкам тоже делают анализы крови и мочи, проводят УЗИ. Разбираемся, что показывает анализ крови у кошки и как подготовить её к процедуре.
Касается это не только людей, но и животных. Кошкам тоже делают анализы крови и мочи, проводят УЗИ. Разбираемся, что показывает анализ крови у кошки и как подготовить её к процедуре.
Когда нужно сдавать анализы кошке
Симптомы, при которых нужно показать животное ветеринарному врачу:
- отказ от еды,
- рвота,
- нарушения стула,
- апатия,
- дезориентация,
- судороги,
- проблемы с мочеиспусканием,
- сонливость,
- резкая потеря веса,
- выпадение шерсти,
- слезящиеся глаза,
- зуд.
Причины, вызывающие недомогание, очень разнообразны. Чтобы диагностировать заболевание, специалист проведёт полное обследование: осмотр, сбор анамнеза, забор крови, УЗИ и возможно, могут понадобиться и другие методы диагностики. В первую очередь кошке назначат общий и биохимический анализы крови. Они позволяют получить достаточно полную картину состояния животного.
Также анализ крови у кошек берут, чтобы контролировать ход лечения и избежать развития осложнений. А в целях профилактики рекомендуется один раз в год делать анализы животным даже без признаков заболеваний. Некоторые болезни долго протекают бессимптомно, разрушая организм.
Что покажет общий клинический анализ крови
Первичная диагностика начинается с общего анализа крови. Он позволяет обнаружить воспалительный процесс, анемию, обезвоживание, выявляет аутоиммунные и аллергические реакции и паразитов.
Показатели общего анализа крови:
- Эритроциты. Содержат гемоглобин и белок, участвуют в газообмене, транспортируют питательные вещества, выводят токсины.
- Гемоглобин. Принимает непосредственное участие в газообменном процессе — переносит кислород и выполняет буферную функцию
- Гематокрит. Показывает количество эритроцитов в крови.
- Цветовой показатель. Выражает относительное содержание гемоглобина в одном эритроците.
 Помогает диагностировать тип анемии.
Помогает диагностировать тип анемии. - Среднее содержание гемоглобина в эритроцитах. Измеряется в абсолютных величинах. Говорит о характере анемии и её причинах.
- Скорость оседания эритроцитов. Неспецифический показатель воспаления. Позволяет оценить тяжесть заболевания, может указывать на развитие злокачественных процессов.
- Лейкоциты. Характеризуют работу иммунитета кошки. Для диагностики важно соотношение клеток: лимфоцитов, нейтрофилов, моноцитов, базофилов и эозинофилов.
- Тромбоциты. Кровяные клетки, которые отвечают за свёртываемость крови.
Повышение уровня эритроцитов может указывать на заболевания лёгких и сердца, снижение лейкоцитов, на болезни печени. Лимфоциты растут при инфекциях, стрессе и анемии. Расшифровкой анализа обязательно должен заниматься ветеринарный специалист, он учтёт все симптомы и результаты других обследований.
Что покажет биохимический анализ крови
Биохимический анализ крови кошки проводят, чтобы оценить работу всех систем организма, проанализировать обмен веществ, водно-солевой баланс, выявить патологии.
Показатели биохимического анализа крови:
- Общий белок. Функции: поддерживает рН крови, участвует в транспорте (например, гормонов), участвует в свертываемости крови, иммунных реакциях и многих других.
- Щелочная фосфатаза. Фермент, который синтезируется в таких органах, как печень, поджелудочная железа, почки; его повышение характерно для многих патологий
- Глюкоза. Снабжает организм энергией.
- Мочевина. Позволяет оценить работу мочевыделительной системы.
- Креатинин. Продукт белкового обмена в мышцах, выводится почками.
- Холестерин. Характеризует липидный обмен, участвует в синтезе гормонов, желчных кислот.
- Креатинкиназа. Заполняет скелетные мышечные ткани и расходуется при нагрузках. У домашних животных уровень креатинкиназы оценивают в качестве маркера повреждения мышечной ткани в результате травмы, хирургического вмешательства, внутримышечных инъекций или врождённой миопатии.

- АЛТ и АСТ. Ферменты, которые содержатся в сердечных и печёночных клетках, а также в скелетных мышцах. Участвуют в обмене аминокислот. Активно высвобождаются в кровь при наличии патологий.
- Триглицериды. Помогают оценить работу сердца и сосудов, а также энергетический обмен.
- Альфа-амилаза. Отвечает за выработку слюны, участвует в процессе переработки углеводов. Производится поджелудочной и слюнной железами.
- ГГТ (гамма-глутамилтрансфераза). Фермент, участвующий в метаболизме аминокислот
- Электролиты (калий, натрий и хлориды). Участвуют в нервной проводимости, отвечают за давление и водный баланс.
Повышенный уровень глюкозы может указывать на сахарный диабет, недостаток мочевины — на болезни печени, рост холестерина — на заболевания почек, гипотиреоз, высокий АСТ — на болезни сердца или печени. Расшифровкой анализа обязательно должен заниматься ветеринарный специалист, он учтёт все симптомы и результаты других обследований.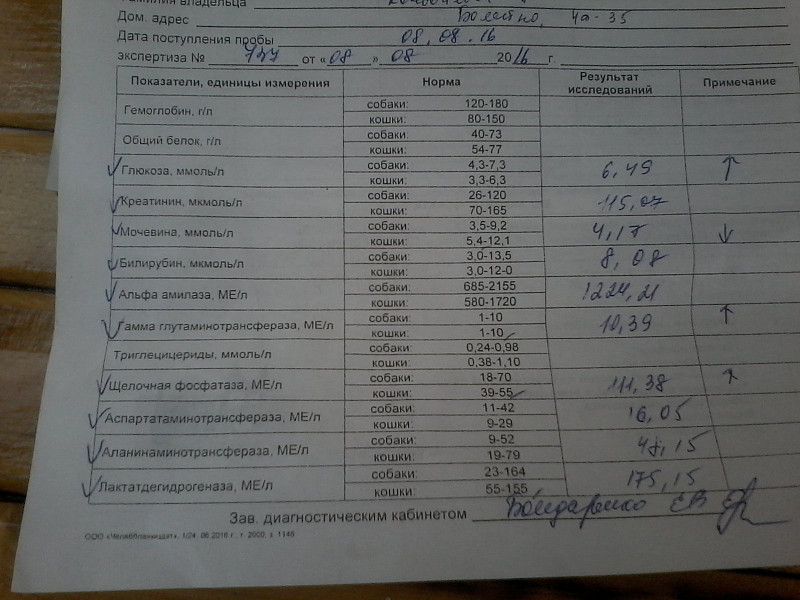
Когда нужно сдавать анализы кошке
Чтобы меньше беспокоиться за пушистого любимца, важно понимать, как берут анализ крови у кошек. На самом деле вся процедура занимает не больше 10 минут. Врач фиксирует кошку на столе, чтобы она не могла случайно себя травмировать. Затем он находит вену и вводит стерильную иглу. Потом кровь помещают в специальную пробирку.
Перед проведением процедуры забора крови рекомендуют держать животное на голодной диете, оградить его от стрессов и отменить медикаменты. Решение об отмене лекарственных препаратов должно быть принято совместно с ветеринарным врачом.
Не отказывайтесь от диагностики из-за страха причинить животному дискомфорт: серьёзные заболевания требуют тщательного и своевременного лечения. А профилактические посещения ветеринарного специалиста позволят поддерживать здоровье кошки на высоком уровне.
Анализ альфа-амилаза панкреатическая (моча) – сдать по цене 290 руб. в Москве
Стоимость забора биоматериалаНастоящим уведомляем Вас о том, что с 01 марта 2016 года Лаборатория «Литех» изменяет порядок и стоимость забора биоматериала. Прейскурант
*Цены у Партнеров могут отличаться.
|
Альфа-амилаза панкреатическая (моча)
Описание
Альфа-амилаза панкреатическая является ферментом, который вырабатывается слюнной и поджелудочной железами.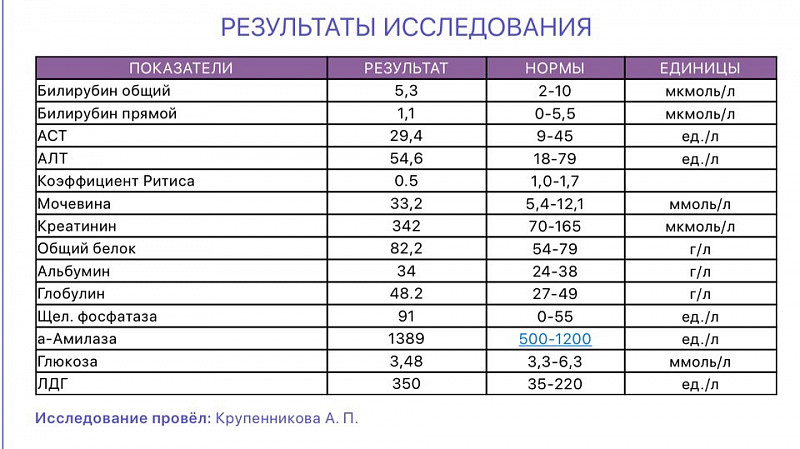 Она отвечает за расщепление углеводов. Панкреатическая альфа-амилаза в норме курсирует в крови, и в случае превышения ее нормы может попадать в мочу после фильтрации почками. Это является признаком воспалительных процессов и иных патологий в слюнной и поджелудочной железе.
Она отвечает за расщепление углеводов. Панкреатическая альфа-амилаза в норме курсирует в крови, и в случае превышения ее нормы может попадать в мочу после фильтрации почками. Это является признаком воспалительных процессов и иных патологий в слюнной и поджелудочной железе.
Подготовка
После консультации с лечащим врачом необходимо временно прекратить прием лекарственных препаратов, которые могут повлиять на результат исследования. Не употреблять алкоголь в течение 24 часов до исследования и мочегонные препараты – в течение 2 суток. Исключить из рациона острую, соленую пищу, продукты питания, изменяющие цвет мочи (например, свеклу, морковь).
Сбор материала
Провести туалет наружных половых органов. Собрать среднюю порцию мочи. Женщины: небольшую первую порцию утренней мочи спустить в унитаз, наполнить мочой контейнер.
Мужчины: отвести крайнюю плоть и выпустить небольшое количество мочи в унитаз. Не прекращая мочеиспускание, удерживая крайнюю плоть в отведенном состоянии, наполнить мочой контейнер.
Причины изменения показателей
Причины повышения уровня:
- обострение хронического панкреатита
- киста
- закупорка вирсунгова протока
- эпидемический паротит
- Причины понижения уровня:
- недостаточность железы
- муковисцидоз
- заболевания печени
Примечания
Для правильной интерпретации результата необходимо учесть все клинические, анамнестические и лабораторные данные.
Амилаза — обзор | ScienceDirect Topics
8.1.1 Амилазы: единство в разнообразии
Амилаза была одним из первых ферментов, которые были обнаружены и изолированы, и в последнее тысячелетие ее различные роли широко исследовались и обсуждались [18–20]. Некоторые из этих ферментов существуют в мультимерных формах. Β-амилаза сладкого картофеля является тетрамером [21,22]. Α-амилаза поджелудочной железы свиньи, по-видимому, синтезируется в виде единой цепи в 56 000 дальтон, но она подвергается некоторому протеолизу с образованием более мелких ассоциированных фрагментов с сохранением активности [23]. Амилазы из разных тканей одного вида животных очень похожи, по-видимому, вследствие дупликации и мутации генов, а также тканеспецифической регуляции и экспрессии [24]. Кластер генов амилазы человека представляет собой очень повторяющуюся область с переменным числом копий, которая претерпела увеличение количества генов, особенно в человеческой линии [25].
Амилазы из разных тканей одного вида животных очень похожи, по-видимому, вследствие дупликации и мутации генов, а также тканеспецифической регуляции и экспрессии [24]. Кластер генов амилазы человека представляет собой очень повторяющуюся область с переменным числом копий, которая претерпела увеличение количества генов, особенно в человеческой линии [25].
Напротив, α-амилазы из различных бактерий, особенно экстремофилов, например, Bacillus subtilis (ссылки [12,26]), удивительно похожи по своей специфичности продукта на α-амилазы прорастающих злаков [27].Кроме того, животные α-амилазы дают набор разветвленных олигосахаридов, по существу идентичных олигосахаридам, полученным под действием α-амилаз грибов, например, амилазы Така [28].
Carpenter et al. [29] подробно обсудили разнообразие, выраженное в терминах вариации числа копий (CNV), которая измеряет истинный диапазон вариации, в частности, кластером генов AMY1, продуцирующим амилазу человека, а также кластерами генов панкреатической амилазы AMY2A и AMY2B. Их результаты показывают, что аллель с делецией AMY2A имеет частоту около 7% у европейцев, так что примерно у 1 из 200 человек полностью отсутствует этот генный продукт, что открывает возможности для дальнейших исследований, направленных на выявление новых закономерностей в вариациях амилазы человека и предполагающих потенциальная роль AMY2 CNV в функциональных ассоциациях, а также его фенотипические последствия.Ранее Perry et al. [25] сообщили, что более высокое количество копий AMY1 и уровень белка, вероятно, улучшают переваривание крахмалистой пищи и могут служить буфером против эффектов снижения физической формы кишечных заболеваний. Интересно, что они также отметили, что у Homo sapiens sapiens можно найти больше копий AMY1, чем у нашего ближайшего живого родственника, шимпанзе (рис. 8.2). До того, как началось расширение сельского хозяйства и приручение животных, части диких растений и диких животных представляли собой основные компоненты предсельскохозяйственной диеты гоминидов [30].
Их результаты показывают, что аллель с делецией AMY2A имеет частоту около 7% у европейцев, так что примерно у 1 из 200 человек полностью отсутствует этот генный продукт, что открывает возможности для дальнейших исследований, направленных на выявление новых закономерностей в вариациях амилазы человека и предполагающих потенциальная роль AMY2 CNV в функциональных ассоциациях, а также его фенотипические последствия.Ранее Perry et al. [25] сообщили, что более высокое количество копий AMY1 и уровень белка, вероятно, улучшают переваривание крахмалистой пищи и могут служить буфером против эффектов снижения физической формы кишечных заболеваний. Интересно, что они также отметили, что у Homo sapiens sapiens можно найти больше копий AMY1, чем у нашего ближайшего живого родственника, шимпанзе (рис. 8.2). До того, как началось расширение сельского хозяйства и приручение животных, части диких растений и диких животных представляли собой основные компоненты предсельскохозяйственной диеты гоминидов [30]. Следовательно, популяция охотников и собирателей не сильно пострадала от кариеса в основном из-за отсутствия пищевых компонентов, таких как молочные продукты, злаки и рафинированный сахар [31,32].
Следовательно, популяция охотников и собирателей не сильно пострадала от кариеса в основном из-за отсутствия пищевых компонентов, таких как молочные продукты, злаки и рафинированный сахар [31,32].
Рисунок 8.2. Сравнение активности α-амилазы у людей и близкородственных приматов.
Пищеварительные ферменты: амилаза, протеаза и липаза
Концепция пищеварительных ферментов довольно проста для понимания, но, углубляясь в детали, полезно сделать шаг назад и понять, в чем на самом деле работают мириады доступных ферментов. тело.Хотя для взаимодействия с пищей, которую мы едим, необходимо много отдельных ферментов, есть три амилазы, протеаза и липаза, которые связаны с основными макроэлементами в нашем рационе; углеводы, белки и жиры соответственно.
Поджелудочная железа является основным органом, ответственным за производство и высвобождение амилазы, протеазы и липазы. Когда пищевой комок проходит через пищеварительный тракт, он стимулирует высвобождение этих важных ферментов для эффективного расщепления углеводов, белков и жиров на более мелкие частицы, которые впоследствии могут абсорбироваться в процессе пищеварения и в конечном итоге использоваться по всему телу. Помимо поджелудочной железы, амилаза также выделяется в слюне во рту и известна как амилаза слюны.
Помимо поджелудочной железы, амилаза также выделяется в слюне во рту и известна как амилаза слюны.
Хотя пищеварительный процесс зависит от гораздо большего, чем просто амилаза, протеаза и липаза для полного и эффективного переваривания съеденной пищи, они являются основным компонентом и отличным местом для начала изучения того, как пищеварительные ферменты способствуют здоровью желудочно-кишечного тракта. *
Amalyse
Амилаза отвечает за разрыв связей в крахмале, полисахаридах и сложных углеводах до более простых для усвоения простых сахаров. 1 Амилаза слюны — это первый шаг в химическом переваривании пищи. Это одна из основных причин, по которой людям так важно уделять время еде и тщательно пережевывать пищу. 2 Этот начальный этап процесса пищеварения необходим для правильного расщепления съеденной пищи и высвобождения питательных веществ изнутри для последующего усвоения в процессе пищеварения. По мере того как крахмалы, полисахариды и сложные углеводы попадают в пищеварительный тракт, они дополнительно расщепляются за счет дополнительной амилазы, высвобождаемой из поджелудочной железы в проксимальный отдел тонкой кишки.
Протеаза
Другой важный фермент для эффективного переваривания съеденной пищи — протеаза. Он отвечает за первичный распад белков и полипептидов животных и растений, а также за дипептиды пролина из глютена и казеина. Протеазы высвобождаются поджелудочной железой в проксимальный отдел тонкой кишки, где они смешиваются с белками, уже денатурированными желудочным секретом, и расщепляют их на аминокислоты, строительные блоки белка, которые в конечном итоге будут абсорбированы и использованы по всему телу.
Липаза
В то время как амилаза и протеаза отлично справляются с расщеплением углеводов и белков, организму нужен еще один фермент для расщепления жиров, масел и триглицеридов. Здесь действует липаза. Липаза необходима для полного переваривания жиров до более мелких компонентов жирных кислот.
Почему важны пищеварительные ферменты?
Иногда пища не может полностью перевариваться при прохождении через пищеварительный тракт. В основе этого обстоятельства может лежать ряд причин.Это может привести к неэффективному высвобождению питательных веществ из пищи. Хотя это может быть трудно ощущать повседневно, есть несколько вещей, которые могут указывать на необходимость более целенаправленной поддержки пищеварительных ферментов. Когда кто-то иногда испытывает газы, вздутие живота и / или несварение, дополнительный пищеварительный фермент может быть эффективным решением. * 3 , 4 Когда пища не переваривается полностью до того, как она продвигается по желудочно-кишечному тракту, она вступает в контакт. с бактериями в дистальном отделе тонкой кишки и толстой кишки.Бактерии, присутствующие в этой области, будут сбраживать плохо переваренные макроэлементы, в результате чего побочные продукты выделяются в пищеварительный тракт. Это чрезмерное скопление газа — это то, что многие люди замечают и сначала сообщают своему лечащему врачу.
В основе этого обстоятельства может лежать ряд причин.Это может привести к неэффективному высвобождению питательных веществ из пищи. Хотя это может быть трудно ощущать повседневно, есть несколько вещей, которые могут указывать на необходимость более целенаправленной поддержки пищеварительных ферментов. Когда кто-то иногда испытывает газы, вздутие живота и / или несварение, дополнительный пищеварительный фермент может быть эффективным решением. * 3 , 4 Когда пища не переваривается полностью до того, как она продвигается по желудочно-кишечному тракту, она вступает в контакт. с бактериями в дистальном отделе тонкой кишки и толстой кишки.Бактерии, присутствующие в этой области, будут сбраживать плохо переваренные макроэлементы, в результате чего побочные продукты выделяются в пищеварительный тракт. Это чрезмерное скопление газа — это то, что многие люди замечают и сначала сообщают своему лечащему врачу.
Пищеварительные ферменты, включая амилазу, протеазу и липазу, представляют собой основополагающий аспект здоровья желудочно-кишечного тракта *. Либо их эффективное производство, либо добавление при необходимости — важные соображения для современного практикующего интегратора.
Либо их эффективное производство, либо добавление при необходимости — важные соображения для современного практикующего интегратора.
ССЫЛКИ
- Сундаррам А, Мурти ТПК. Производство и применение α-амилазы: обзор. Журнал прикладной и экологической микробиологии. 2014; 2 (4): 166-75.
- Маки Д.А., Пэнгборн РМ. Жевание и его влияние на слюноотделение человека и секрецию альфа-амилазы. Physiol Behav .. 1990. 47 (3), 593-5.
- Суарес Ф, Левитт, доктор медицины, Адсхед Дж, Баркин Дж. Добавки поджелудочной железы уменьшают симптоматическую реакцию здоровых людей на пищу с высоким содержанием жиров.Dig Dis Sci .. 1999. 44 (7), 1317-21.
- Roxas M. Роль добавок ферментов при расстройствах пищеварения. Альтернативная медицина Rev. 2008. 13 (4), 307-14.
Амилаза слюны: пищеварительный и метаболический синдром
Curr Diab Rep. Автор рукописи; доступно в PMC 2019 3 ноября.
Опубликован в окончательной отредактированной форме как:
PMCID: PMC6825871
NIHMSID: NIHMS1055272
Катрин Пейро де Гахонс
1 Monell Chemical Sensesia Center, США
Пол А.
 С. Бреслин
С. Бреслин1 Monell Chemical Senses Center, Филадельфия, Пенсильвания, США
2 Департамент диетологии, Школа экологических и биологических наук, Университет Рутгерса, Нью-Брансуик, Нью-Джерси, США
1 Monell Центр химических чувств, Филадельфия, штат Пенсильвания, США
2 Департамент диетологии, Школа экологических и биологических наук, Университет Рутгерса, Нью-Брансуик, Нью-Джерси, США
Окончательная отредактированная версия этой статьи доступна на Curr Diab RepSee. другие статьи в PMC, цитирующие опубликованную статью.Abstract
Амилаза слюны — это фермент расщепления полимера глюкозы, который вырабатывается слюнными железами. Он составляет небольшую часть выделяемой амилазы, которая в основном вырабатывается поджелудочной железой. Амилазы расщепляют крахмал на более мелкие молекулы, в конечном итоге давая мальтозу, которая, в свою очередь, расщепляется мальтазой на две молекулы глюкозы. Крахмал составляет значительную часть типичного человеческого рациона большинства национальностей. Учитывая, что амилаза слюны составляет такую небольшую часть от общей амилазы, неясно, почему она существует и дает ли она эволюционное преимущество при приеме внутрь крахмала.В этом обзоре будет рассмотрено влияние амилазы слюны на оральное восприятие, передачу сигналов о питательных веществах, упреждающие метаболические рефлексы, уровень сахара в крови и ее клиническое значение для предотвращения метаболического синдрома и ожирения.
Крахмал составляет значительную часть типичного человеческого рациона большинства национальностей. Учитывая, что амилаза слюны составляет такую небольшую часть от общей амилазы, неясно, почему она существует и дает ли она эволюционное преимущество при приеме внутрь крахмала.В этом обзоре будет рассмотрено влияние амилазы слюны на оральное восприятие, передачу сигналов о питательных веществах, упреждающие метаболические рефлексы, уровень сахара в крови и ее клиническое значение для предотвращения метаболического синдрома и ожирения.
Ключевые слова: Амилаза слюны, переваривание крахмала, изменение числа копий AMY1, гомеостаз глюкозы, инсулин, метаболический синдром
Введение
Слюна играет важную роль в укреплении здоровья, включая защиту полости рта и облегчение приема пищи.Внутри рта слюна гидратирует слизистые оболочки, удаляет клетки и остатки пищи, буферизует pH полости рта, смазывает ротовую полость, способствуя жеванию и предотвращая износ зубов, образует пищевые комки для облегчения глотания, защищает от деминерализации зубов, обладает антимикробной активностью и предотвращает инфекции, а также закрывает раны, стимулируя заживление [1, 2]. Слюна также играет важную роль в восприятии пищи и пищеварении. Точные механизмы пищеварения остаются неясными. Что касается вкуса, то физические и композиционные характеристики слюны облегчают восприятие.Например, тот факт, что слюна представляет собой водную жидкость, делает ее идеальным средством переноса вкусовых стимулов и питательных веществ к вкусовым рецепторам [3], которые широко распространены на языке, мягком небе и глотке. Нестимулированная слюна также представляет низкие уровни вкусовых стимулов, таких как соли и глюкоза, по сравнению с плазмой, что обеспечивает низкий порог обнаружения [1, 4]. Восприятие вкуса определяет выбор диеты, а также влияет на физиологические процессы до и после всасывания [5, 6].Упреждающая фаза пищеварения называется «ответной фазой головного мозга» и служит для подготовки организма к эффективному метаболизму потребляемых питательных веществ, что делает ее важным шагом в переваривании пищи и предотвращении дисгликемии и дислипидемии.
Слюна также играет важную роль в восприятии пищи и пищеварении. Точные механизмы пищеварения остаются неясными. Что касается вкуса, то физические и композиционные характеристики слюны облегчают восприятие.Например, тот факт, что слюна представляет собой водную жидкость, делает ее идеальным средством переноса вкусовых стимулов и питательных веществ к вкусовым рецепторам [3], которые широко распространены на языке, мягком небе и глотке. Нестимулированная слюна также представляет низкие уровни вкусовых стимулов, таких как соли и глюкоза, по сравнению с плазмой, что обеспечивает низкий порог обнаружения [1, 4]. Восприятие вкуса определяет выбор диеты, а также влияет на физиологические процессы до и после всасывания [5, 6].Упреждающая фаза пищеварения называется «ответной фазой головного мозга» и служит для подготовки организма к эффективному метаболизму потребляемых питательных веществ, что делает ее важным шагом в переваривании пищи и предотвращении дисгликемии и дислипидемии.
Кроме того, слюна содержит большое количество белков, участвующих в липазной, пептидазной и гидролазной активности. При сравнении протеомов слюны и плазмы становится ясно, что распределение белков слюны связано с метаболическими и катаболическими процессами.Это указывает на то, что слюна играет важную физиологическую роль в переваривании пищи [7]. Самый распространенный белок в слюне человека — пищеварительный фермент α-амилаза [8]. Этот фермент расщепляет большие молекулы крахмала на декстрин, а затем на более мелкие мальтоолигосахариды (MOS), содержащие α-D- (1,4) связи, изомальтоолигосахариды (IMOS), содержащие α-D- (1,6) связи, трисахарид мальтотриозу и дисахарид мальтозы [9]. Затем глюкоза будет производиться из мальтозы под действием дисахаридных ферментов, таких как мальтаза.В организме человека амилаза вырабатывается преимущественно слюнными железами и поджелудочной железой. Хотя амилазы слюны и поджелудочной железы схожи, они кодируются разными генами ( AMY1 и AMY2 соответственно) и проявляют разные уровни активности против крахмалов различного происхождения [10].
При сравнении протеомов слюны и плазмы становится ясно, что распределение белков слюны связано с метаболическими и катаболическими процессами.Это указывает на то, что слюна играет важную физиологическую роль в переваривании пищи [7]. Самый распространенный белок в слюне человека — пищеварительный фермент α-амилаза [8]. Этот фермент расщепляет большие молекулы крахмала на декстрин, а затем на более мелкие мальтоолигосахариды (MOS), содержащие α-D- (1,4) связи, изомальтоолигосахариды (IMOS), содержащие α-D- (1,6) связи, трисахарид мальтотриозу и дисахарид мальтозы [9]. Затем глюкоза будет производиться из мальтозы под действием дисахаридных ферментов, таких как мальтаза.В организме человека амилаза вырабатывается преимущественно слюнными железами и поджелудочной железой. Хотя амилазы слюны и поджелудочной железы схожи, они кодируются разными генами ( AMY1 и AMY2 соответственно) и проявляют разные уровни активности против крахмалов различного происхождения [10].
Физиологическое значение амилазы слюны все еще не выяснено, и ее аспекты являются спорными, например, ее нормативная секреторная функция в плазме остается загадкой. Амилаза слюны имеет относительно короткое время активного контакта с крахмалом. Когда пищевой комок проглочен и пропитан желудочным соком, его катаболическая активность в основном останавливается из-за низкого кислого pH. Некоторая активность сохраняется внутри частиц из-за барьерной защиты, обеспечиваемой частично переваренным крахмалом на внешней стороне частицы [11], но большая часть крахмала переваривается обильной панкреатической амилазой, которая выделяется в двенадцатиперстную часть тонкой кишки. . Тем не менее, исследования показали, что значительный гидролиз крахмала происходит в полости рта за секунды, превращая студенистую консистенцию крахмала в полужидкую [12, 13].Это изменение текстуры само по себе может влиять на переваривание крахмала, сенсорные предпочтения и потребление крахмала. Кроме того, недавние исследования также продемонстрировали, что небольшие MOS-амилолитические продукты могут быть обнаружены в полости рта через вкусовую систему [14]. Эти данные убедительно подтверждают физиологическую роль амилазы слюны в переваривании крахмала.
Амилаза слюны имеет относительно короткое время активного контакта с крахмалом. Когда пищевой комок проглочен и пропитан желудочным соком, его катаболическая активность в основном останавливается из-за низкого кислого pH. Некоторая активность сохраняется внутри частиц из-за барьерной защиты, обеспечиваемой частично переваренным крахмалом на внешней стороне частицы [11], но большая часть крахмала переваривается обильной панкреатической амилазой, которая выделяется в двенадцатиперстную часть тонкой кишки. . Тем не менее, исследования показали, что значительный гидролиз крахмала происходит в полости рта за секунды, превращая студенистую консистенцию крахмала в полужидкую [12, 13].Это изменение текстуры само по себе может влиять на переваривание крахмала, сенсорные предпочтения и потребление крахмала. Кроме того, недавние исследования также продемонстрировали, что небольшие MOS-амилолитические продукты могут быть обнаружены в полости рта через вкусовую систему [14]. Эти данные убедительно подтверждают физиологическую роль амилазы слюны в переваривании крахмала.
В этом обзоре мы обсудим эволюционные силы, которые определяют существование амилазы слюны, преимущества создания более высоких уровней амилазы слюны, возможные физиологические последствия раннего разложения крахмала в ротовой полости и его роль в защите профиля глюкозы в крови и инсулина в крови. , а также болезненные состояния метаболического синдрома, диабета и ожирения.
Эволюционная перспектива роли амилазы слюны в переваривании крахмала
Амилаза слюны была обнаружена в слюне многих всеядных животных и некоторых травоядных. Напротив, облигатные плотоядные животные, такие как кошки, никогда не имеют амилазы слюны [15]. Животные, питающиеся незрелыми фруктами, семенами, корнями и луковицами, богатыми крахмалом, проявляют более высокую активность амилазы слюны. Это подтверждает мнение о том, что ключевой ролью амилазы слюны является переваривание крахмала. Активность амилазы слюны человека намного выше среди приматов.Это связано с тем, что Homo sapiens sapiens обладают множественными копиями гена AMY1 , тогда как другие приматы, включая нашего ближайшего живого родственника шимпанзе, имеют нормативные две копии на клетку (по одной от каждого родителя) [ 16]. AMY1 Вариация числа копий (CNV) не является единственной движущей силой продукции амилазы у животных, поскольку факторы окружающей среды, такие как уровень стресса [17], циркадные ритмы [18] и диета [15, 19], значительно влияют на количественные различия между виды и особи.Тем не менее существует хорошая корреляция между числом копий AMY1 и количеством и активностью амилазы в слюне [13, 20–22]. Каждый дублированный сегмент гена AMY1 содержит регуляторные последовательности, необходимые для экспрессии, специфичной для слюны [23], и, таким образом, действительно может напрямую влиять на информационную РНК (мРНК) и уровни экспрессии белка. Это не относится ко всем ген-содержащим CNV [24, 25]. Человек может нести от 2 до 17 копий гена AMY1 [21, 26, 27].Высокое количество копий AMY1 наблюдалось в популяциях, предки которых употребляли пищу, богатую крахмалом [21]; это предполагает направленный отбор в сторону более высокой амилазы слюны для переваривания крахмала.
AMY1 Вариация числа копий (CNV) не является единственной движущей силой продукции амилазы у животных, поскольку факторы окружающей среды, такие как уровень стресса [17], циркадные ритмы [18] и диета [15, 19], значительно влияют на количественные различия между виды и особи.Тем не менее существует хорошая корреляция между числом копий AMY1 и количеством и активностью амилазы в слюне [13, 20–22]. Каждый дублированный сегмент гена AMY1 содержит регуляторные последовательности, необходимые для экспрессии, специфичной для слюны [23], и, таким образом, действительно может напрямую влиять на информационную РНК (мРНК) и уровни экспрессии белка. Это не относится ко всем ген-содержащим CNV [24, 25]. Человек может нести от 2 до 17 копий гена AMY1 [21, 26, 27].Высокое количество копий AMY1 наблюдалось в популяциях, предки которых употребляли пищу, богатую крахмалом [21]; это предполагает направленный отбор в сторону более высокой амилазы слюны для переваривания крахмала. Развитие кулинарии и, в последнее время, более широкий доступ к крахмалистым продуктам с появлением сельского хозяйства будет благоприятствовать AMY1 CNV, поскольку повышенная доступность перевариваемого крахмала может привести к тому, что уровни амилазы слюны и, возможно, панкреатической амилазы станут ограничивающим фактором для крахмала. пищеварение [28].Важно отметить, что даже если гены панкреатической амилазы у людей не подверглись такой обширной дупликации, индивидуальный AMY2 CNV существует и варьируется от 0 до 4 для AMY2A и от 2 до 6 для AMY2B [26, 27 ].
Развитие кулинарии и, в последнее время, более широкий доступ к крахмалистым продуктам с появлением сельского хозяйства будет благоприятствовать AMY1 CNV, поскольку повышенная доступность перевариваемого крахмала может привести к тому, что уровни амилазы слюны и, возможно, панкреатической амилазы станут ограничивающим фактором для крахмала. пищеварение [28].Важно отметить, что даже если гены панкреатической амилазы у людей не подверглись такой обширной дупликации, индивидуальный AMY2 CNV существует и варьируется от 0 до 4 для AMY2A и от 2 до 6 для AMY2B [26, 27 ].
Как и многие животные, домашние собаки, не являющиеся обязательными хищниками, экспрессируют амилазу только в поджелудочной железе, но не в слюне [29]. Интересно, что волки, являющиеся облигатными плотоядными животными, несут только 2 копии AMY2B , тогда как количество диплоидных копий у собак колеблется от 4 до 30; более высокий CNV связан с повышенной активностью амилазы поджелудочной железы [30, 31]. Это увеличение активности амилазы за счет дупликации AMY2B , как полагают, объясняет, почему домашние собаки могут жить на диете, богатой крахмалом, в то время как их ближайшие дикие родственники — нет. Таким образом, один и тот же молекулярный механизм (дупликация) действует на сходные гены у разных видов, подвергающихся одинаковому давлению питания (приручение собак) [30].
Это увеличение активности амилазы за счет дупликации AMY2B , как полагают, объясняет, почему домашние собаки могут жить на диете, богатой крахмалом, в то время как их ближайшие дикие родственники — нет. Таким образом, один и тот же молекулярный механизм (дупликация) действует на сходные гены у разных видов, подвергающихся одинаковому давлению питания (приручение собак) [30].
Можно провести параллельное эволюционное событие между грызунами и людьми. Грызуны, как и люди, обладают амилазой слюны. Исследования показали, что оба вида приобрели активность амилазы в слюне независимо через встраивание чужеродного ретровируса в примитивный кластер амилазы, превращая ген поджелудочной железы в ген слюны [32].Поскольку эта ретровирусная вставка произошла после разделения отрядов приматов и грызунов, это означает, что некоторые из элементов, необходимых для экспрессии гена амилазы слюны, эволюционировали независимо в геномах мыши и человека. Это поддерживает идею об очень сильном эволюционном отборе амилазы, выделяемой со слюной [33]. Это яркие примеры параллельной эволюции, которые убедительно подтверждают важность амилазы слюны в переваривании крахмала для человека. Но остаются вопросы: «Что это за эволюционное давление, заставляющее экспрессировать амилазу в слюне?» Или: «Что именно амилаза слюны дает нам такое преимущество?» Поскольку ферментативная активность амилаз поджелудочной железы и слюны весьма схожа, и все млекопитающие продуцируют амилазу поджелудочной железы, нет очевидного преимущества дублирования этого механизма переваривания крахмала.В следующих разделах мы попытаемся показать, что, возможно, можно привести аргумент в пользу преимущества.
Это яркие примеры параллельной эволюции, которые убедительно подтверждают важность амилазы слюны в переваривании крахмала для человека. Но остаются вопросы: «Что это за эволюционное давление, заставляющее экспрессировать амилазу в слюне?» Или: «Что именно амилаза слюны дает нам такое преимущество?» Поскольку ферментативная активность амилаз поджелудочной железы и слюны весьма схожа, и все млекопитающие продуцируют амилазу поджелудочной железы, нет очевидного преимущества дублирования этого механизма переваривания крахмала.В следующих разделах мы попытаемся показать, что, возможно, можно привести аргумент в пользу преимущества.
Роль амилазы слюны в преабсорбции в переваривании крахмала
Амилаза слюны сильно влияет на текстурные характеристики крахмала. Ферментативное расщепление крахмала приводит к быстрому уменьшению длины и вязкости цепи глюкоза-полимер после того, как было расщеплено относительно небольшое количество гликозидных связей [34]. Эти изменения вязкости могут сыграть важную роль в определении вкуса и предпочтения пищи. Следовательно, степень уменьшения вязкости крахмала в полости рта может иметь важное значение для питания. Наша группа показала, что люди с высоким числом копий AMY1 имели более высокую активность амилазы в слюне и сообщали о более быстром и значительном снижении воспринимаемой вязкости крахмала, чем люди с низким числом копий AMY1 [13]. Улучшение вкусовых качеств крахмалистой пищи могло быть одним из способов, которым CNV амилазы слюны помогал увеличить потребление крахмала в процессе эволюции гоминидов.К этому моменту люди, чьи предки придерживались более богатой крахмалом диеты, несут большее количество AMY1 CNV [21].
Следовательно, степень уменьшения вязкости крахмала в полости рта может иметь важное значение для питания. Наша группа показала, что люди с высоким числом копий AMY1 имели более высокую активность амилазы в слюне и сообщали о более быстром и значительном снижении воспринимаемой вязкости крахмала, чем люди с низким числом копий AMY1 [13]. Улучшение вкусовых качеств крахмалистой пищи могло быть одним из способов, которым CNV амилазы слюны помогал увеличить потребление крахмала в процессе эволюции гоминидов.К этому моменту люди, чьи предки придерживались более богатой крахмалом диеты, несут большее количество AMY1 CNV [21].
В то время как крахмал не имеет ясного вкуса для людей, пероральное обнаружение крахмала или продуктов его разложения с помощью специализированных вкусовых рецепторов было бы очень полезным из-за его важности в питании человека. Существуют значительные доказательства того, что грызуны могут перорально воспринимать продукты разложения крахмала (олиго и полисахариды) [35–37] и что их обнаружение не зависит от рецептора сладкого вкуса T1R2 / T1R3 [38, 39]. Есть некоторые свидетельства того, что люди могут также воспринимать полимеры глюкозы как имеющие отличный вкус от сладких сахаров. Люди могут отличить вкус высокой концентрации мальтозы от вкуса глюкозы или фруктозы, если подбирать их по интенсивности [40]. Совсем недавно было показано, что люди реагируют на короткие MOS во рту как не сладкие на вкус, а как ощутимые [14]. Таким образом, люди могут ощущать слабый вкус полимера глюкозы, который является уникальным качеством вкуса, отличным от сладкого.
Есть некоторые свидетельства того, что люди могут также воспринимать полимеры глюкозы как имеющие отличный вкус от сладких сахаров. Люди могут отличить вкус высокой концентрации мальтозы от вкуса глюкозы или фруктозы, если подбирать их по интенсивности [40]. Совсем недавно было показано, что люди реагируют на короткие MOS во рту как не сладкие на вкус, а как ощутимые [14]. Таким образом, люди могут ощущать слабый вкус полимера глюкозы, который является уникальным качеством вкуса, отличным от сладкого.
Кроме того, T1R-независимый метаболический путь моносахаридов был недавно идентифицирован во вкусовых рецепторных клетках мышей. Он состоит из транспортеров глюкозы (GLUT) и метаболического сенсорного пути (котранспортер глюкозы натрия 1 (SGLT1) и АТФ-управляемый канал K + (K ATP )), которые служат в качестве метаболических сенсоров сахара в других тканях, особенно в тканях. кишечника и поджелудочной железы, и может быть ключевым шагом в физиологическом различении калорийных и некалорийных подсластителей [41]. Таким образом, калорийные подсластители у грызунов будут действовать по двум сигнальным путям, T1R и метаболическому сенсору, тогда как некалорийные сенсоры будут действовать только на T1R. Метаболический путь сам по себе не может объяснить вкусовые реакции на крахмалистые продукты, поскольку продукты разложения крахмала не являются субстратами для переносчиков GLUT или SGLT1, транспортируется только глюкоза, а амилаза слюны не генерирует глюкозу. Но этот необходимый шаг для метаболического обнаружения крахмала через T1R-независимый путь в полости рта был идентифицирован как мембраносвязанные ферменты дисахаридазы [42].Авторы предположили, что, поскольку вкусовые и кишечные эпителии имеют много общих хеморецепторов и путей передачи сигналов (например, вкусовые рецепторы в кишечнике [43], метаболические сенсоры в клетках вкусовых рецепторов [41]), а энтероциты кишечного эпителия экспрессируют GLUT и SGLT1, а также ферменты, гидролизующие дисахариды, и содержащие амилазу поджелудочной железы [44], вкусовые клетки, вероятно, также могут экспрессировать эти ферменты.
Таким образом, калорийные подсластители у грызунов будут действовать по двум сигнальным путям, T1R и метаболическому сенсору, тогда как некалорийные сенсоры будут действовать только на T1R. Метаболический путь сам по себе не может объяснить вкусовые реакции на крахмалистые продукты, поскольку продукты разложения крахмала не являются субстратами для переносчиков GLUT или SGLT1, транспортируется только глюкоза, а амилаза слюны не генерирует глюкозу. Но этот необходимый шаг для метаболического обнаружения крахмала через T1R-независимый путь в полости рта был идентифицирован как мембраносвязанные ферменты дисахаридазы [42].Авторы предположили, что, поскольку вкусовые и кишечные эпителии имеют много общих хеморецепторов и путей передачи сигналов (например, вкусовые рецепторы в кишечнике [43], метаболические сенсоры в клетках вкусовых рецепторов [41]), а энтероциты кишечного эпителия экспрессируют GLUT и SGLT1, а также ферменты, гидролизующие дисахариды, и содержащие амилазу поджелудочной железы [44], вкусовые клетки, вероятно, также могут экспрессировать эти ферменты. Они показали, что вкусовые клетки экспрессируют ферменты мальтаза-глюкоамилаза (MGAM), сахароза-изомальтаза (SIS), лактаза (LCT) и треалаза (TREH), которые гидролизуют дисахариды мальтозу, сахарозу, лактозу и трегалозу, соответственно, с образованием моносахариды, которые могут быть легко обнаружены GLUT и SGLT1.Они также показали, что AMY1 экспрессируется на низких уровнях во вкусовой ткани и на высоких уровнях в слюнных околоушных железах и язычных железах фон Эбнерса (VEG), подтверждая предыдущие данные [45]. Таким образом, во вкусовых тканях присутствует весь необходимый механизм для получения вкусовых сигналов от крахмала. Поскольку VEG секретируют свое содержимое непосредственно в траншеи циркумваллатных и листовых сосочков, продуцируемый VEG AMY1 может иметь важное значение для образования локально повышенного количества олигосахаридов и дисахаридов в непосредственной близости от поры вкуса, где локализуются MGAM, SIS и GLUT. вызывая метаболический сигнал даже при очень низких количествах моносахаридов [42].
Они показали, что вкусовые клетки экспрессируют ферменты мальтаза-глюкоамилаза (MGAM), сахароза-изомальтаза (SIS), лактаза (LCT) и треалаза (TREH), которые гидролизуют дисахариды мальтозу, сахарозу, лактозу и трегалозу, соответственно, с образованием моносахариды, которые могут быть легко обнаружены GLUT и SGLT1.Они также показали, что AMY1 экспрессируется на низких уровнях во вкусовой ткани и на высоких уровнях в слюнных околоушных железах и язычных железах фон Эбнерса (VEG), подтверждая предыдущие данные [45]. Таким образом, во вкусовых тканях присутствует весь необходимый механизм для получения вкусовых сигналов от крахмала. Поскольку VEG секретируют свое содержимое непосредственно в траншеи циркумваллатных и листовых сосочков, продуцируемый VEG AMY1 может иметь важное значение для образования локально повышенного количества олигосахаридов и дисахаридов в непосредственной близости от поры вкуса, где локализуются MGAM, SIS и GLUT. вызывая метаболический сигнал даже при очень низких количествах моносахаридов [42]. Здесь интересно отметить, что Axelsson et al., Сравнивая геномы волков и домашних собак, сообщили о доказательствах увеличения функциональных изменений в гене AMY2B , а также в генах MGAM и SGLT1 у собак [30]. Таким образом, ферменты расщепления углеводов, способные генерировать транспортируемые моносахариды, могут увеличиваться вместе в процессе эволюции.
Здесь интересно отметить, что Axelsson et al., Сравнивая геномы волков и домашних собак, сообщили о доказательствах увеличения функциональных изменений в гене AMY2B , а также в генах MGAM и SGLT1 у собак [30]. Таким образом, ферменты расщепления углеводов, способные генерировать транспортируемые моносахариды, могут увеличиваться вместе в процессе эволюции.
В дополнение к осознанному восприятию вкуса активация вкуса стимулирует физиологические реакции (реакции головной фазы), такие как повышенная секреция слюны [46], желудочного сока [46, 47] и секреции поджелудочной железы [46, 48].Такие реакции подготавливают пищеварительную систему к метаболизму и поглощению питательных веществ [5] и позволяют лучше поддерживать гомеостаз питательных веществ в плазме [5, 6]. Высвобождение инсулина в головной фазе (CPIR) является одной из таких преабсорбтивных реакций на еду [49]. Хотя это относительно незначительный компонент общей секреции инсулина, было показано, что CPIR является чрезвычайно важным фактором, определяющим общую толерантность к глюкозе [50]. В одном исследовании наша группа показала, что люди с низкой активностью амилазы в слюне из-за низкого числа копий AMY1 не проявляли CPIR в ответ на крахмал и, следовательно, имели более высокий гликемический ответ.Однако после приема раствора глюкозы у этих людей наблюдалось CPIR, что указывает на то, что они могли это делать [51]. Эти результаты предполагают, что амилаза слюны может иметь важное значение для повышения толерантности к глюкозе и что люди с более высоким числом копий AMY1 лучше приспособлены к потреблению крахмала. Недавно Glendinning et al. [52] не только подтвердили, что грызуны обладают двумя путями передачи вкуса сахаров, но также продемонстрировали, что если путь T1R2 / T1R3 необходим для привлечения сахара, путь, независимый от T1R2 / T1R3, опосредует индуцированный сахаром CPIR, предположительно независимый от T1R метаболический путь с участием GLUT, SGLT1 и KATP и ферментов, переваривающих углеводы, в случае обнаружения ди- или олигосахаридов.
В одном исследовании наша группа показала, что люди с низкой активностью амилазы в слюне из-за низкого числа копий AMY1 не проявляли CPIR в ответ на крахмал и, следовательно, имели более высокий гликемический ответ.Однако после приема раствора глюкозы у этих людей наблюдалось CPIR, что указывает на то, что они могли это делать [51]. Эти результаты предполагают, что амилаза слюны может иметь важное значение для повышения толерантности к глюкозе и что люди с более высоким числом копий AMY1 лучше приспособлены к потреблению крахмала. Недавно Glendinning et al. [52] не только подтвердили, что грызуны обладают двумя путями передачи вкуса сахаров, но также продемонстрировали, что если путь T1R2 / T1R3 необходим для привлечения сахара, путь, независимый от T1R2 / T1R3, опосредует индуцированный сахаром CPIR, предположительно независимый от T1R метаболический путь с участием GLUT, SGLT1 и KATP и ферментов, переваривающих углеводы, в случае обнаружения ди- или олигосахаридов.
Следовательно, продукты расщепления крахмала, выделяемые амилазой слюны, могут быть обнаружены в полости рта и вызывают раннее высвобождение инсулина, возможно, после того, как дисахаридазы генерируют транспортируемые моносахариды. Через один или оба пути метаболического вкуса и пути вкуса MOS активность амилазы слюны в полости рта может улучшать метаболизм крахмала до абсорбции. Эти пути должны быть подтверждены у людей, и связь между высокой активностью амилазы слюны и индуцированным крахмалом CPIR должна быть подтверждена в более крупных популяциях.
Постабсорбтивная роль амилазы слюны в переваривании крахмала
Большие количества панкреатической амилазы высвобождаются в двенадцатиперстную кишку через проток поджелудочной железы, чтобы продолжить переваривание поступающего крахмала. Пищеварительные ферменты производятся и транспортируются ацинарными клетками, которые являются экзокринными клетками поджелудочной железы. Второй функциональный компонент поджелудочной железы — эндокринная поджелудочная железа. Эндокринная поджелудочная железа состоит из небольших островков клеток, называемых островками Лангерганса.Эндокринные клетки не выделяют свои секреты в протоки поджелудочной железы. Скорее они выделяют в кровь гормоны, такие как инсулин, чтобы контролировать уровень глюкозы в крови. Скоординированным образом инсулин напрямую регулирует ацинарную поджелудочную железу через портальную систему, которая транспортирует островковую кровь к ацинарным клеткам [53]. У ацинусов есть рецепторы инсулина, и было продемонстрировано, что инсулин необходим для нормальной функции ацинарных клеток. Таким образом, инсулин регулирует секрецию панкреатической амилазы в двенадцатиперстную кишку и за счет расширения переваривания крахмала в кишечнике.
Любопытно, что амилаза может не только выполнять экзокринные функции, но также выполнять эндокринные функции. Присутствие амилазы в крови исторически связывали с патологической утечкой из поджелудочной железы и слюнных желез из-за воспаления и болезни. Следовательно, содержание амилазы в сыворотке просто отражает содержание амилазы в пищеварительных железах: низкое в случае дефицита инсулина и повышенное после кормления [54] или после искусственной активации экзокринной секреции желудочно-кишечных желез [55, 56].Однако стало ясно, что уровень амилазы в крови на самом деле жестко регулируется [56]. Поэтому следует задаться вопросом, какова его физиологическая секреторная функция? Присутствие амилазы в крови является результатом очень активного процесса кровообращения, баланса между скоростью проникновения и скоростью выведения [57]. Когда околоушные железы, основной источник амилазы плазмы у крыс, удаляются, уровень амилазы слюнного типа в покое не изменяется, и при кормлении обнаруживается повышение [58].Другие источники фермента компенсируют их потерю. Одним из источников может быть печень, которая также производит небольшое количество «слюнной» амилазы [59, 60] и может секретировать амилазу в плазму [61]. Более того, Cloutier et al. [44] продемонстрировали на крысах, что уровни циркулирующей амилазы (и липазы) связаны с их присутствием в просвете кишечника. Интернализация энтероцитами и прогрессирование абсорбированных ферментов по трансцитотическому пути позволяет им достигать кровообращения.В этом исследовании амилаза присутствовала в более высоких концентрациях в слизистой оболочке кишечника и в крови после кормления, как наблюдали другие. Этот тип интернализации и передачи эпителия полости рта не изучался; Было бы интересно узнать, происходит ли это на слизистой оболочке полости рта. Амилаза может служить пищеварительным или непищеваренным целям в крови. Концентрация амилазы в сыворотке очень низкая по сравнению (нг / мл) с ее концентрацией в секреторных железах (миллимолярная). Тем не менее, этого достаточно для обнаружения ферментативной активности, и из-за большого объема крови (5 л) эта концентрация все еще составляет значительную величину в диапазоне 1–10% от тканевого уровня [56].Также возможно, что циркуляция амилазы через кровоток обеспечивает средство транспортировки этих белков от одного органа к другому. Когда меченые экзокринные белки поджелудочной железы вводили в кровоток крыс, находящихся в сознании, большая часть (приблизительно 97%) поглощалась различными тканями организма, в частности, почками, печенью, селезенкой и легкими [62].
Связь между амилазой слюны и ожирением / метаболическим синдромом
Недавние исследования связывают AMY1 CNV с ожирением в европейских и азиатских популяциях [63 ••, 64–66].Они обнаружили, что повышенное количество копий AMY1 в слюне положительно связано с более низким индексом массы тела (ИМТ) и риском ожирения, тем самым обеспечивая генетическую связь между эффективностью переваривания крахмала и низким ИМТ благодаря гену AMY1 . Но другие исследовательские группы поставили под сомнение эти результаты, утверждая, что авторы использовали молекулярные методы, такие как qPCR, которые не могут обеспечить точное абсолютное количество CNV, что приводит к неточным числам копий в локусе AMY [26].При использовании методов с более высоким разрешением генотипирования паттерн CNV в локусе амилазы очень точен и отличается от паттерна, полученного в исследованиях с использованием qPCR [67]. Что еще более важно, они не наблюдали сообщенной отрицательной связи между AMY1 и ожирением или ИМТ в больших когортах при использовании методов подсчета с высоким разрешением [26, 27, 68]. Таким образом, похоже, что влияние AMY1 CNV на риск ожирения не так сильно, как предполагалось изначально. Тем не менее, ассоциация, скорее всего, присутствует.Подсчет числа копий гена и измерения массы тела находятся на противоположных концах спектра объяснительных уровней с множеством регулирующих факторов и факторов окружающей среды, которые вмешиваются и размывают любую причинную связь. Следовательно, вероятно, будет трудно найти сильную связь между CNV амилазы слюны и ожирением. Кроме того, числа копий AMY1 и AMY2A коррелированы, так что фенотипические ассоциации, вызванные вариациями числа копий панкреатической амилазы, могут быть обнаружены косвенно как связь с числом копий AMY1 [26].
На уровне белка низкий уровень амилазы в сыворотке крови наблюдается в течение многих лет в клинических условиях у пациентов с ожирением, диабетом 1 и 2 типа и метаболическим синдромом [69]. Сывороточная амилаза состоит из почти равных пропорций изоформ амилазы поджелудочной железы и слюны [63, 70]. Традиционно врачи измеряли уровень амилазы в сыворотке для определения наличия острого панкреатита или степени прогрессирующего хронического панкреатита. И наоборот, истощение ацинарных клеток и ограниченный поток ферментов из паренхимы поджелудочной железы в кровоток [71, 72] или разрушение β-клеток из-за повторного панкреатита может привести к снижению уровня амилазы в сыворотке крови в результате низкого уровня амилазы поджелудочной железы [71, 72]. 69 ••].Низкий уровень амилазы в сыворотке также был связан с повышенным риском кардиометаболических нарушений в больших популяциях бессимптомных взрослых [73–77]. Ожирение и диабет имеют общую патологию недостаточной функции инсулина из-за инсулинорезистентности и / или снижения выработки инсулина, и известно, что инсулин имеет решающее значение для производства амилазы поджелудочной железы [53, 78]. Следовательно, низкий уровень амилазы в сыворотке может отражать проявление недостаточной секреции инсулина поджелудочной железы у бессимптомных людей [69].Schneeman [79] предположил, что инсулинорезистентность может препятствовать усилению эффекта инсулина на синтез амилазы, что приводит к снижению уровня амилазы. К сожалению, почти во всех этих исследованиях и клинических наблюдениях измерялась только общая сывороточная амилаза; поэтому мы не знаем, какие изоформы присутствовали в сыворотке. Было бы очень полезно систематически дифференцировать амилазу поджелудочной железы от амилазы слюны в крови. Неизвестно, играет ли инсулин также роль в мониторинге амилазы, продуцируемой слюнными железами или другими тканями, продуцирующими амилазу слюнного типа, такими как печень, которая вырабатывает небольшое количество слюнной амилазы, но некоторые исследования указывают на причинное действие инсулина на продукция амилазы в слюнных железах [80, 81].Таким образом, может существовать прямая функциональная связь между функцией инсулина и производством амилазы, тем самым создавая причинную связь между перевариванием крахмала, гомеостазом глюкозы и метаболическим синдромом.
Выводы
Амилаза слюны влияет на пероральное восприятие крахмала, преабсорбтивную метаболическую сигнализацию и реакцию глюкозы в плазме на проглоченный крахмал. Этот ранний контроль пищеварения приводит к различиям в эффективности метаболизма крахмала. Эти метаболические регуляторы, по-видимому, имеют достаточное значение для того, чтобы ген панкреатической амилазы копировался и экспрессировался в слюнных железах у приматов и грызунов независимо.У людей, которые с появлением сельского хозяйства значительно увеличили потребление крахмала, ген амилазы слюны значительно расширился как вариант числа копий. Тем не менее, в современном обществе люди, как правило, едят в среднем одинаковое количество крахмала, независимо от того, производят ли они высокий или низкий уровень амилазы слюны. Похоже, что это подвергает тех, кто производит низкий уровень амилазы слюны и потребляет большое количество крахмала, риску развития метаболического синдрома.
Благодарности
Мы благодарны Луизе Слэйд за полезные ранние обсуждения.
Сноски
Конфликт интересов Катрин Пейро де Гашон и Поль А.С. Бреслин заявляет, что у них нет конфликта интересов.
Права человека и животных и осознанное согласие Эта статья не содержит исследований с участием людей или животных, выполненных кем-либо из авторов.
Список литературы
Недавно опубликованные статьи, представляющие особый интерес, были отмечены как:
•• Важные
1.Дауэс С., Педерсен А.М., Вилла А и др. Функции слюны человека: обзор, спонсируемый Всемирным семинаром по оральной медицине VI. Arch Oral Biol 2015; 60 (6): 863–74. [PubMed] [Google Scholar] 2. Рул С. Научное исследование слюны в постпротеомную эпоху: от базы данных до основных функций. Эксперт Рев Протеомика 2012. 9 (1): 85–96. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Мацуо Р. Роль слюны в поддержании вкусовой чувствительности. Крит Рев Орал Биол Мед 2000. 11 (2): 216–29. [PubMed] [Google Scholar] 4.Хенкин Р.И., Гилл-младший-младший, Барттер ФК. Исследования вкусовых порогов у нормального человека и у пациентов с корковой недостаточностью надпочечников: роль кортикальных стероидов надпочечников и концентрации натрия в сыворотке. J Clin Invest 1963; 42 (5): 727. [Бесплатная статья PMC] [PubMed] [Google Scholar] 5. Power ML, Schulkin J. Опережающая физиологическая регуляция в биологии питания: ответы головной фазы. Аппетит. 2008. 50 (2): 194–206. [Бесплатная статья PMC] [PubMed] [Google Scholar] 6. Woods SC. Парадокс питания: как мы переносим пищу.Psychol Rev 1991; 98 (4): 488. [PubMed] [Google Scholar] 8. Scannapieco FA, Torres G, Levine MJ. Α-амилаза слюны: роль в формировании зубного налета и кариеса. Крит Рев Орал Биол Мед 1993. 4 (3): 301–7. [PubMed] [Google Scholar] 9. Якобсен Н., Мелваер К.Л., Хенстен-Петтерсен А. Некоторые свойства амилазы слюны: обзор литературы и некоторые наблюдения. J Dent Res 1972 г., 51 (2): 381–8. [PubMed] [Google Scholar] 10. Hall FF, Ratliff CR, Hayakawa T. и др. Субстратная дифференциация альфа-амилаз поджелудочной железы и слюны человека.Am J Dig Dis 1970. 15 (11): 1031–8. [PubMed] [Google Scholar] 11. Розенблюм JL, Ирвин CL, Alpers DH. Олигосахариды крахмала и глюкозы защищают активность амилазы слюнного типа при кислом pH. Am J Physiol Gastrointest Liver Physiol 1988; 254 (5): G775–80. [PubMed] [Google Scholar] 12. Hoebler C, Karinthi A, Devaux MF и др. Физические и химические превращения зерновой пищи при пероральном переваривании у людей. Br J Nutr 1998. 80 (05): 429–36. [PubMed] [Google Scholar] 13. Мандель А.Л., Пейро де Гашон С., Планк К.Л. и др.Индивидуальные различия в количестве копий гена AMY1, уровнях α-амилазы в слюне и восприятии перорального крахмала. PLoS One. 2010; 5 (10): e13352. [Бесплатная статья PMC] [PubMed] [Google Scholar] 14. Ляпис Т.Дж., Пеннер М.Х., Лим Дж. Доказательства того, что люди могут ощущать вкус полимеров глюкозы. Chem Senses 2014. 39 (9): 737–47. [PubMed] [Google Scholar] 15. Boehlke C, Zierau O, Hannig C. Амилаза слюны — фермент неспециализированных эврифагов. Arch Oral Biol 2015; 60 (8): 1162–76. [PubMed] [Google Scholar] 16. Самуэльсон Л.С., Филлипс Р.С., Суонберг Л.Дж.Структуры генов амилазы у приматов: вставки ретропозонов и эволюция промоторов. Мол Биол Эвол 1996. 13 (6): 767–79. [PubMed] [Google Scholar] 17. Chatterton RT, Vogelsong KM, Lu Y, Ellman AB, Hudgens GA. Альфа-амилаза слюны как мера эндогенной адренергической активности. Clin Physiol 1996. 16: 433–48. [PubMed] [Google Scholar] 18. Ehlert U, Kirschbaum C. Детерминанты суточного течения альфа-амилазы слюны. Психонейроэндокринология. 2007. 32 (4): 392–401. [PubMed] [Google Scholar] 20. Банк RA, Hettema EH, Muijs MA и др.Вариация числа копий гена и полиморфизма изоферментной системы амилазы слюны человека у кавказцев. Hum Genet 1992. 89 (2): 213–22. [PubMed] [Google Scholar] 21. Perry GH, Dominy NJ, Claw KG и др. Диета и эволюция изменения числа копий гена амилазы человека. Нат Жене 2007. 39 (10): 1256–60. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Ян З.М., Лин Дж., Чен Л.Х. и др. Роль копий AMY1 и экспрессии белка в активности α-амилазы слюны человека. Physiol Behav (физиологическое поведение) 2015; 138: 173–8. [PubMed] [Google Scholar] 23.Groot PC, Mager WH, Henriquez NV и др. Эволюция мультигенного семейства человеческой α-амилазы посредством неравных, гомологичных, меж- и внутрихромосомных кроссоверов. Геномика. 1990. 8 (1): 97–105. [PubMed] [Google Scholar] 24. Купер GM, Никерсон Д.А., Эйхлер Э. Мутационные и селективные эффекты на варианты числа копий в геноме человека. Нат Жене 2007; 39: S22–9. [PubMed] [Google Scholar] 25. Perry GH. Эволюционное значение вариации числа копий в геноме человека. Cytogenet Genome Res 2008. 123 (1–4): 283–7.[Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Карпентер Д., Дхар С., Митчелл Л. М. и др. Ожирение, переваривание крахмала и амилаза: связь между вариантами числа копий в генах амилазы слюны человека (AMY1) и поджелудочной железы (AMY2). Хум Мол Генет 2015; 24 (12): 3472–80. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Usher CL, Handsaker RE, Esko T, et al. Структурные формы локуса амилазы человека и их связь с SNP, гаплотипами и ожирением. Нат Жене 2015; 47 (8): 921–5. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28.Харди К., Брэнд-Миллер Дж., Браун К.Д. и др. Важность пищевых углеводов в эволюции человека. Q Rev Biol 2015; 90 (3): 251–68. [PubMed] [Google Scholar] 29. Симпсон Дж. В., Докси Д. Л., Браун Р. Значения изоамилазы в сыворотке у нормальных собак и собак с внешнесекреторной недостаточностью поджелудочной железы. Vet Res Commun 1984. 8 (1): 303–8. [PubMed] [Google Scholar] 30. ••. Axelsson E, Ratnakumar A, Arendt ML, et al. Геномный признак одомашнивания собак свидетельствует об их адаптации к диете, богатой крахмалом. Природа. 2013. 495 (7441): 360–4.[PubMed] [Google Scholar]Покажите доказательства увеличения функции гена AMY2B, а также генов MGAM и SGLT1 у собак. Арендт М., Фолл Т., Линдблад-То К. и др. Активность амилазы связана с количеством копий AMY2B у собак: последствия для приручения собак, диеты и диабета. Anim Genet 2014; 45 (5): 716–22. [Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Тинг К.Н., Розенберг М.П., Сноу К.М., Самуэльсон Л.К., Мейслер М.Х. Эндогенные ретровирусные последовательности необходимы для тканеспецифической экспрессии гена амилазы слюны человека.Genes Dev 1992; 6: 1457–65. [PubMed] [Google Scholar] 33. Meisler MH, Ting CN. Замечательная эволюционная история генов амилазы человека. Крит Рев Орал Биол Мед 1993. 4 (3): 503–509. [PubMed] [Google Scholar] 34. Эванс И.Д., Хайсман Д.Р., Элсон Э.Л. и др. Влияние амилазы слюны на вязкость суспензий желатинизированного крахмала и механические свойства гранул желатинизированного крахмала. J Sci Food Agric 1986. 37 (6): 573–90. [Google Scholar] 35. Склафани А., Ниссенбаум Дж. В., Вигорито М. Предпочтение крахмала у крыс.Neurosci Biobehav Rev 1987. 11 (2): 253–62. [PubMed] [Google Scholar] 36. Вигорито М., Склафани А. Онтогенез аппетита поликозы и сахарозы у новорожденных крыс. Дев Психобиол 1988. 21 (5): 457–65. [PubMed] [Google Scholar] 37. Рамирес И.С. Хеморецепция нерастворимого нелетучего вещества: вкус крахмала? Am J Physiol Regul Integr Comp Physiol 1991; 260 (1): R192–9. [PubMed] [Google Scholar] 38. Treesukosol Y, Smith KR, Spector AC. Поведенческие данные о вкусовом рецепторе полимера глюкозы, который не зависит от гетеродимера T1R2 + 3 на мышиной модели.J Neurosci Nurs 2011. 31 (38): 13527–34. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39. Zukerman S, Glendinning JI, Margolskee RF, et al. Вкусовой рецептор T1R3 имеет решающее значение для вкуса сахарозы, но не вкуса поликозы. Am J Physiol Regul Integr Comp Physiol 2009; 296 (4): R866–76. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Бреслин PAS, Beauchamp GK, Pugh EN. Моногевзия для фруктозы, глюкозы, сахарозы и мальтозы. Восприятие психофизики. 1996. 58 (3): 327–41. [PubMed] [Google Scholar] 41. Йи К.К., Сукумаран С.К., Кота Р. и др.Переносчики глюкозы и АТФ-зависимые K + (KATP) метаболические сенсоры присутствуют во вкусовых клетках, экспрессирующих вкусовые рецепторы 3 (T1r3) типа 1. Proc Natl Acad Sci 2011. 108 (13): 5431–6. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. ••. Сукумаран С.К., Йи К.К., Ивата С. и др. Ферменты α-глюкозидазы, экспрессируемые вкусовыми клетками, участвуют во вкусовых ответах на дисахариды. PNAS. 2016; 113 (21): 6035–40. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Доказательства экспрессии амилазы и мальтазы слюны во вкусовых клетках и окружающих язычных слюнных железах.43. Маргольски Р.Ф., Дайер Дж., Кокрашвили З. и др. T1R3 и густдуцин в кишечных сахарах для регуляции экспрессии котранспортера Na + -глюкозы 1. Proc Natl Acad Sci 2007. 104 (38): 15075–80. [Бесплатная статья PMC] [PubMed] [Google Scholar] 44. Клотье М., Жинграс Д., Бендаян М. Интернализация и трансцитоз ферментов поджелудочной железы слизистой оболочкой кишечника. J Histochem Cytochem 2006. 54 (7): 781–94. [PubMed] [Google Scholar] 45. Мериго Ф., Бенати Д., Чеккини М.П. и др. Экспрессия амилазы в клетках вкусовых рецепторов кольцевых сосочков крыс.Клеточная ткань Res 2009. 336 (3): 411–21. [PubMed] [Google Scholar] 46. Павлов И.П. Работа пищеварительных желез. Лондон: Charles Griffin Co Ltd; 1902. [Google Scholar] 47. Фаррелл JI. Вклад в физиологию желудочной секреции. Am J Physiol 1928; 85: 672–87. [Google Scholar] 48. Прешоу Р. М., Кук А. Р., Гроссман М. И.. Количественные аспекты реакции поджелудочной железы собак на закисление двенадцатиперстной кишки. Гастроэнтерология. 1966; 210: 629–34. [PubMed] [Google Scholar] 49. Powley TL. Вентромедиальный гипоталамический синдром, сытость и гипотеза головной фазы.Psychol Rev 1977; 84: 89–126. [PubMed] [Google Scholar] 50. Арен Б., Холст Дж. Дж. Головной инсулиновый ответ на прием пищи у людей зависит как от холинергических, так и нехолинергических механизмов и важен для постпрандиальной гликемии. Сахарный диабет. 2001; 50: 1030–8. [PubMed] [Google Scholar] 51. Мандель АЛ, Бреслин ПА. Высокая эндогенная активность амилазы слюны связана с улучшением гликемического гомеостаза после приема крахмала у взрослых. J Nutr 2012. 142 (5): 853–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 52.Глендиннинг Дж. И., Стано С., Холтер М. и др. Индуцированное сахаром высвобождение инсулина в головной фазе опосредуется T1r2 + T1r3-независимым путем передачи вкуса у мышей. Am J Physiol Regul Integr Comp Physiol 2015; 309 (5): R552–60. [Бесплатная статья PMC] [PubMed] [Google Scholar] 53. Уильямс Дж. А., Goldfine ID. Ось инсулин-панкреатический ацинар. Сахарный диабет. 1985. 34 (10): 980–6. [PubMed] [Google Scholar] 54. Schneyer CA, Schneyer LH. Амилаза в сыворотке крови, подчелюстной железе и печени крыс после введения пилокарпина или нормального кормления.Am J Physiol 1960; 198: 771–3. [PubMed] [Google Scholar] 55. Schrifin A, Tuchman L, Antopol W. Ответ амилазы крови на хлорид ацетил-b-метилхолина у кроликов. Proc Soc Exp Biol Med 1936; 34: 539–40. [Google Scholar] 56. Изенман Л., Либов С., Ротман С. Эндокринная секреция пищеварительных ферментов млекопитающих экзокринными железами. Am J Physiol Endocrinol Metab 1999; 276 (2): E223–32. [PubMed] [Google Scholar] 57. Пипер-Бигелоу С., Строкки А., Левитт, доктор медицины. Откуда берется сывороточная амилаза и куда она девается? Гастроэнтерол Клин Норт Ам 1990. 19 (4): 793–810.[PubMed] [Google Scholar] 58. Проктор Г.Б., Спрашивающий Б., Гаррет-младший. Сывороточная амилаза непаротидного и непанкреатического происхождения увеличивается при кормлении у крыс и может происходить из печени. Comp Biochem Physiol B Biochem Mol Biol 1991. 98 (4): 631–5. [PubMed] [Google Scholar] 59. Мессер М.И., декан Р.Т. Иммунохимическая взаимосвязь между α-амилазами печени, сыворотки, поджелудочной железы и околоушной железы крыс. Biochem J 1975. 151 (1): 17–22. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60. Хокари С., Миура К., Кояма И. и др. Экспрессия изоферментов α-амилазы в тканях крыс.Comp Biochem Physiol B Biochem Mol Biol 2003. 135 (1): 63–9. [PubMed] [Google Scholar] 61. МакГичин Р.Л., Абшиер В.М., О’Лири К. Влияние пуромицина и актиномицина D на уровни амилазы в сыворотке и печени у мышей, кроликов и крыс. Carbohydr Res 1978; 61 (1): 425–9. [PubMed] [Google Scholar] 62. Рор Г., Шееле Г. Судьба радиоактивных экзокринных белков поджелудочной железы, введенных в кровообращение крысы. Поглощение тканями и трансэпителиальная экскреция. Гастроэнтерол. 1983; 85 (5): 991–1002. [PubMed] [Google Scholar] 63.••. Фалчи М., Мустафа Дж. С., Такусис П. и др. Низкое количество копий гена амилазы слюны предрасполагает к ожирению. Нат Жене. 2014. 46 (5): 492–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Первая статья, показывающая положительную связь между AMY CN и ожирением.64. Вильякайнен Х., Андерссон-Ассарссон Й.С., Арменио М. и др. Низкое количество копий локуса AMY1 связано с ранним началом женского ожирения в Финляндии. PLoS One. 2015; 10 (7): e0131883. [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Мехиа-Бенитес М.А., Боннефонд А., Йенго Л. и др.Благоприятное влияние большого количества копий гена амилазы AMY1 слюны на риск ожирения у мексиканских детей. Диабетология. 2015; 58 (2): 290–4. [PubMed] [Google Scholar] 66. Марковеккио М.Л., Флорио Р., Вергинелли Ф. и др. Низкое количество копий гена AMY1 связано с повышенным индексом массы тела у мальчиков препубертатного возраста. PLoS One. 2016; 11 (5): e0154961. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67. Usher CL, McCarroll SA. Сложные и мультиаллельные вариации числа копий при заболеваниях человека. Краткая функциональная геномика.2015; elv02814: 329–38. [Бесплатная статья PMC] [PubMed] [Google Scholar] 68. Йонг Р.Ю., Мустаффа С.А., Васан П.С. и др. Сложное изменение числа копий AMY1 не связано с ожирением в двух восточноазиатских когортах. Хум Мутат 2016; 37: 669–78. [PubMed] [Google Scholar] 69. ••. Накадзима К. Низкая сывороточная амилаза и ожирение, диабет и метаболический синдром: новая интерпретация. Всемирный диабет J 2016; 7 (6): 112. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Интересный обзор о низком уровне амилазы в сыворотке и метаболическом синдроме.70. Skrha J, Stĕpán J. Клиническое значение определения изофермента амилазы. Acta Univ Carol Med Monogr. 1986; 120: 1–81. [PubMed] [Google Scholar] 71. Дандона П., Фридман Д. Б., Фу Й, Перкинс Дж., Катрак А., Михайлидис Д. П. и др. Внешнесекреторная функция поджелудочной железы при сахарном диабете. Дж. Клин Патол 1984. 37: 302–6. [Бесплатная статья PMC] [PubMed] [Google Scholar] 72. Swislocki A, Noth R, Hallstone A, Kyger E, Triadafilopoulos G. Стимулируемое секретином высвобождение амилазы в кровь нарушается при сахарном диабете 1 типа.Horm Metab Res 2005; 37: 326–30. [PubMed] [Google Scholar] 73. Ли Дж. Г., Пак С. В., Чо Б. М. и др. Сывороточная амилаза и риск метаболического синдрома у взрослых корейцев. Clin Chim Acta 2011; 412 (19): 1848–53. [PubMed] [Google Scholar] 74. Накадзима К., Немото Т., Мунеюки Т. и др. Низкий уровень амилазы в сыворотке крови в связи с метаболическим синдромом и диабетом: исследование на уровне сообщества. Кардиоваск Диабетол. 2011; 10 (1): 34. [Бесплатная статья PMC] [PubMed] [Google Scholar] 75. Накадзима К., Мунэюки Т., Мунаката Х. и др. Возвращаясь к кардиометаболическому значению сывороточной амилазы.BMC Res Примечания 2011; 4 (1): 419. [Бесплатная статья PMC] [PubMed] [Google Scholar] 76. Мунэюки Т., Накадзима К., Аоки А. и др. Скрытые ассоциации низкого уровня амилазы в сыворотке со сниженным уровнем инсулина в плазме и инсулинорезистентностью у бессимптомных взрослых людей среднего возраста. Кардиоваск Диабетол. 2012. 11 (80): 10–186. [Бесплатная статья PMC] [PubMed] [Google Scholar] 77. Чжао Ю., Чжан Дж., Чжан Дж. И др. Метаболический синдром и диабет связаны с низким уровнем сывороточной амилазы у бессимптомной популяции китайцев. Сканд Дж Клин Лаб Инвест 2014; 74 (3): 235–9.[PubMed] [Google Scholar] 78. Mossner J, Logsdon CD, Goldfine ID и др. Регулирование инсулиновых рецепторов ацинарных клеток поджелудочной железы инсулином. Am J Physiol Gastrointest Liver Physiol. 1984; 247 (2): G155–60. [PubMed] [Google Scholar] 79. Schneeman BO, Inman MD, Stern JS. Активность ферментов поджелудочной железы у тучных и худых крыс Zucker: исследование развития. J Nutr 1983; 113 (4): 921–5. [PubMed] [Google Scholar] 80. Картер Д.А., Вобкен Д.Д., Диксит П.К. и др. Иммунореактивный инсулин в слюнных железах крыс и его зависимость от возраста и уровня инсулина в сыворотке крови.Эксп Биол Мед 1995. 209 (3): 245–50. [PubMed] [Google Scholar] 81. Роча Е.М., Карвалью С.Р., Саад М.Дж. и др. Влияние старения на сигнальную систему инсулина в слезных и слюнных железах крыс. Acta Ophthalmol Scand. 2003. 81 (6): 639–45. [PubMed] [Google Scholar]
Амилаза слюны: пищеварение и метаболический синдром
Curr Diab Rep. Автор рукопись; доступно в PMC 2019 3 ноября.
Опубликован в окончательной отредактированной форме как:
PMCID: PMC6825871
NIHMSID: NIHMS1055272
Катрин Пейро де Гахонс
1 Monell Chemical Sensesia Center, США
Пол А.С. Бреслин
1 Monell Chemical Senses Center, Филадельфия, Пенсильвания, США
2 Департамент диетологии, Школа экологических и биологических наук, Университет Рутгерса, Нью-Брансуик, Нью-Джерси, США
1 Monell Центр химических чувств, Филадельфия, штат Пенсильвания, США
2 Департамент диетологии, Школа экологических и биологических наук, Университет Рутгерса, Нью-Брансуик, Нью-Джерси, США
Окончательная отредактированная версия этой статьи доступна на Curr Diab RepSee. другие статьи в PMC, цитирующие опубликованную статью.Abstract
Амилаза слюны — это фермент расщепления полимера глюкозы, который вырабатывается слюнными железами. Он составляет небольшую часть выделяемой амилазы, которая в основном вырабатывается поджелудочной железой. Амилазы расщепляют крахмал на более мелкие молекулы, в конечном итоге давая мальтозу, которая, в свою очередь, расщепляется мальтазой на две молекулы глюкозы. Крахмал составляет значительную часть типичного человеческого рациона большинства национальностей. Учитывая, что амилаза слюны составляет такую небольшую часть от общей амилазы, неясно, почему она существует и дает ли она эволюционное преимущество при приеме внутрь крахмала.В этом обзоре будет рассмотрено влияние амилазы слюны на оральное восприятие, передачу сигналов о питательных веществах, упреждающие метаболические рефлексы, уровень сахара в крови и ее клиническое значение для предотвращения метаболического синдрома и ожирения.
Ключевые слова: Амилаза слюны, переваривание крахмала, изменение числа копий AMY1, гомеостаз глюкозы, инсулин, метаболический синдром
Введение
Слюна играет важную роль в укреплении здоровья, включая защиту полости рта и облегчение приема пищи.Внутри рта слюна гидратирует слизистые оболочки, удаляет клетки и остатки пищи, буферизует pH полости рта, смазывает ротовую полость, способствуя жеванию и предотвращая износ зубов, образует пищевые комки для облегчения глотания, защищает от деминерализации зубов, обладает антимикробной активностью и предотвращает инфекции, а также закрывает раны, стимулируя заживление [1, 2]. Слюна также играет важную роль в восприятии пищи и пищеварении. Точные механизмы пищеварения остаются неясными. Что касается вкуса, то физические и композиционные характеристики слюны облегчают восприятие.Например, тот факт, что слюна представляет собой водную жидкость, делает ее идеальным средством переноса вкусовых стимулов и питательных веществ к вкусовым рецепторам [3], которые широко распространены на языке, мягком небе и глотке. Нестимулированная слюна также представляет низкие уровни вкусовых стимулов, таких как соли и глюкоза, по сравнению с плазмой, что обеспечивает низкий порог обнаружения [1, 4]. Восприятие вкуса определяет выбор диеты, а также влияет на физиологические процессы до и после всасывания [5, 6].Упреждающая фаза пищеварения называется «ответной фазой головного мозга» и служит для подготовки организма к эффективному метаболизму потребляемых питательных веществ, что делает ее важным шагом в переваривании пищи и предотвращении дисгликемии и дислипидемии.
Кроме того, слюна содержит большое количество белков, участвующих в липазной, пептидазной и гидролазной активности. При сравнении протеомов слюны и плазмы становится ясно, что распределение белков слюны связано с метаболическими и катаболическими процессами.Это указывает на то, что слюна играет важную физиологическую роль в переваривании пищи [7]. Самый распространенный белок в слюне человека — пищеварительный фермент α-амилаза [8]. Этот фермент расщепляет большие молекулы крахмала на декстрин, а затем на более мелкие мальтоолигосахариды (MOS), содержащие α-D- (1,4) связи, изомальтоолигосахариды (IMOS), содержащие α-D- (1,6) связи, трисахарид мальтотриозу и дисахарид мальтозы [9]. Затем глюкоза будет производиться из мальтозы под действием дисахаридных ферментов, таких как мальтаза.В организме человека амилаза вырабатывается преимущественно слюнными железами и поджелудочной железой. Хотя амилазы слюны и поджелудочной железы схожи, они кодируются разными генами ( AMY1 и AMY2 соответственно) и проявляют разные уровни активности против крахмалов различного происхождения [10].
Физиологическое значение амилазы слюны все еще не выяснено, и ее аспекты являются спорными, например, ее нормативная секреторная функция в плазме остается загадкой.Амилаза слюны имеет относительно короткое время активного контакта с крахмалом. Когда пищевой комок проглочен и пропитан желудочным соком, его катаболическая активность в основном останавливается из-за низкого кислого pH. Некоторая активность сохраняется внутри частиц из-за барьерной защиты, обеспечиваемой частично переваренным крахмалом на внешней стороне частицы [11], но большая часть крахмала переваривается обильной панкреатической амилазой, которая выделяется в двенадцатиперстную часть тонкой кишки. . Тем не менее, исследования показали, что значительный гидролиз крахмала происходит в полости рта за секунды, превращая студенистую консистенцию крахмала в полужидкую [12, 13].Это изменение текстуры само по себе может влиять на переваривание крахмала, сенсорные предпочтения и потребление крахмала. Кроме того, недавние исследования также продемонстрировали, что небольшие MOS-амилолитические продукты могут быть обнаружены в полости рта через вкусовую систему [14]. Эти данные убедительно подтверждают физиологическую роль амилазы слюны в переваривании крахмала.
В этом обзоре мы обсудим эволюционные силы, которые определяют существование амилазы слюны, преимущества создания более высоких уровней амилазы слюны, возможные физиологические последствия раннего разложения крахмала в ротовой полости и его роль в защите профиля глюкозы в крови и инсулина в крови. , а также болезненные состояния метаболического синдрома, диабета и ожирения.
Эволюционная перспектива роли амилазы слюны в переваривании крахмала
Амилаза слюны была обнаружена в слюне многих всеядных животных и некоторых травоядных. Напротив, облигатные плотоядные животные, такие как кошки, никогда не имеют амилазы слюны [15]. Животные, питающиеся незрелыми фруктами, семенами, корнями и луковицами, богатыми крахмалом, проявляют более высокую активность амилазы слюны. Это подтверждает мнение о том, что ключевой ролью амилазы слюны является переваривание крахмала. Активность амилазы слюны человека намного выше среди приматов.Это связано с тем, что Homo sapiens sapiens обладают множественными копиями гена AMY1 , тогда как другие приматы, включая нашего ближайшего живого родственника шимпанзе, имеют нормативные две копии на клетку (по одной от каждого родителя) [ 16]. AMY1 Вариация числа копий (CNV) не является единственной движущей силой продукции амилазы у животных, поскольку факторы окружающей среды, такие как уровень стресса [17], циркадные ритмы [18] и диета [15, 19], значительно влияют на количественные различия между виды и особи.Тем не менее существует хорошая корреляция между числом копий AMY1 и количеством и активностью амилазы в слюне [13, 20–22]. Каждый дублированный сегмент гена AMY1 содержит регуляторные последовательности, необходимые для экспрессии, специфичной для слюны [23], и, таким образом, действительно может напрямую влиять на информационную РНК (мРНК) и уровни экспрессии белка. Это не относится ко всем ген-содержащим CNV [24, 25]. Человек может нести от 2 до 17 копий гена AMY1 [21, 26, 27].Высокое количество копий AMY1 наблюдалось в популяциях, предки которых употребляли пищу, богатую крахмалом [21]; это предполагает направленный отбор в сторону более высокой амилазы слюны для переваривания крахмала. Развитие кулинарии и, в последнее время, более широкий доступ к крахмалистым продуктам с появлением сельского хозяйства будет благоприятствовать AMY1 CNV, поскольку повышенная доступность перевариваемого крахмала может привести к тому, что уровни амилазы слюны и, возможно, панкреатической амилазы станут ограничивающим фактором для крахмала. пищеварение [28].Важно отметить, что даже если гены панкреатической амилазы у людей не подверглись такой обширной дупликации, индивидуальный AMY2 CNV существует и варьируется от 0 до 4 для AMY2A и от 2 до 6 для AMY2B [26, 27 ].
Как и многие животные, домашние собаки, не являющиеся обязательными хищниками, экспрессируют амилазу только в поджелудочной железе, но не в слюне [29]. Интересно, что волки, являющиеся облигатными плотоядными животными, несут только 2 копии AMY2B , тогда как количество диплоидных копий у собак колеблется от 4 до 30; более высокий CNV связан с повышенной активностью амилазы поджелудочной железы [30, 31].Это увеличение активности амилазы за счет дупликации AMY2B , как полагают, объясняет, почему домашние собаки могут жить на диете, богатой крахмалом, в то время как их ближайшие дикие родственники — нет. Таким образом, один и тот же молекулярный механизм (дупликация) действует на сходные гены у разных видов, подвергающихся одинаковому давлению питания (приручение собак) [30].
Можно провести параллельное эволюционное событие между грызунами и людьми. Грызуны, как и люди, обладают амилазой слюны. Исследования показали, что оба вида приобрели активность амилазы в слюне независимо через встраивание чужеродного ретровируса в примитивный кластер амилазы, превращая ген поджелудочной железы в ген слюны [32].Поскольку эта ретровирусная вставка произошла после разделения отрядов приматов и грызунов, это означает, что некоторые из элементов, необходимых для экспрессии гена амилазы слюны, эволюционировали независимо в геномах мыши и человека. Это поддерживает идею об очень сильном эволюционном отборе амилазы, выделяемой со слюной [33]. Это яркие примеры параллельной эволюции, которые убедительно подтверждают важность амилазы слюны в переваривании крахмала для человека. Но остаются вопросы: «Что это за эволюционное давление, заставляющее экспрессировать амилазу в слюне?» Или: «Что именно амилаза слюны дает нам такое преимущество?» Поскольку ферментативная активность амилаз поджелудочной железы и слюны весьма схожа, и все млекопитающие продуцируют амилазу поджелудочной железы, нет очевидного преимущества дублирования этого механизма переваривания крахмала.В следующих разделах мы попытаемся показать, что, возможно, можно привести аргумент в пользу преимущества.
Роль амилазы слюны в преабсорбции в переваривании крахмала
Амилаза слюны сильно влияет на текстурные характеристики крахмала. Ферментативное расщепление крахмала приводит к быстрому уменьшению длины и вязкости цепи глюкоза-полимер после того, как было расщеплено относительно небольшое количество гликозидных связей [34]. Эти изменения вязкости могут сыграть важную роль в определении вкуса и предпочтения пищи.Следовательно, степень уменьшения вязкости крахмала в полости рта может иметь важное значение для питания. Наша группа показала, что люди с высоким числом копий AMY1 имели более высокую активность амилазы в слюне и сообщали о более быстром и значительном снижении воспринимаемой вязкости крахмала, чем люди с низким числом копий AMY1 [13]. Улучшение вкусовых качеств крахмалистой пищи могло быть одним из способов, которым CNV амилазы слюны помогал увеличить потребление крахмала в процессе эволюции гоминидов.К этому моменту люди, чьи предки придерживались более богатой крахмалом диеты, несут большее количество AMY1 CNV [21].
В то время как крахмал не имеет ясного вкуса для людей, пероральное обнаружение крахмала или продуктов его разложения с помощью специализированных вкусовых рецепторов было бы очень полезным из-за его важности в питании человека. Существуют значительные доказательства того, что грызуны могут перорально воспринимать продукты разложения крахмала (олиго и полисахариды) [35–37] и что их обнаружение не зависит от рецептора сладкого вкуса T1R2 / T1R3 [38, 39].Есть некоторые свидетельства того, что люди могут также воспринимать полимеры глюкозы как имеющие отличный вкус от сладких сахаров. Люди могут отличить вкус высокой концентрации мальтозы от вкуса глюкозы или фруктозы, если подбирать их по интенсивности [40]. Совсем недавно было показано, что люди реагируют на короткие MOS во рту как не сладкие на вкус, а как ощутимые [14]. Таким образом, люди могут ощущать слабый вкус полимера глюкозы, который является уникальным качеством вкуса, отличным от сладкого.
Кроме того, T1R-независимый метаболический путь моносахаридов был недавно идентифицирован во вкусовых рецепторных клетках мышей. Он состоит из транспортеров глюкозы (GLUT) и метаболического сенсорного пути (котранспортер глюкозы натрия 1 (SGLT1) и АТФ-управляемый канал K + (K ATP )), которые служат в качестве метаболических сенсоров сахара в других тканях, особенно в тканях. кишечника и поджелудочной железы, и может быть ключевым шагом в физиологическом различении калорийных и некалорийных подсластителей [41].Таким образом, калорийные подсластители у грызунов будут действовать по двум сигнальным путям, T1R и метаболическому сенсору, тогда как некалорийные сенсоры будут действовать только на T1R. Метаболический путь сам по себе не может объяснить вкусовые реакции на крахмалистые продукты, поскольку продукты разложения крахмала не являются субстратами для переносчиков GLUT или SGLT1, транспортируется только глюкоза, а амилаза слюны не генерирует глюкозу. Но этот необходимый шаг для метаболического обнаружения крахмала через T1R-независимый путь в полости рта был идентифицирован как мембраносвязанные ферменты дисахаридазы [42].Авторы предположили, что, поскольку вкусовые и кишечные эпителии имеют много общих хеморецепторов и путей передачи сигналов (например, вкусовые рецепторы в кишечнике [43], метаболические сенсоры в клетках вкусовых рецепторов [41]), а энтероциты кишечного эпителия экспрессируют GLUT и SGLT1, а также ферменты, гидролизующие дисахариды, и содержащие амилазу поджелудочной железы [44], вкусовые клетки, вероятно, также могут экспрессировать эти ферменты. Они показали, что вкусовые клетки экспрессируют ферменты мальтаза-глюкоамилаза (MGAM), сахароза-изомальтаза (SIS), лактаза (LCT) и треалаза (TREH), которые гидролизуют дисахариды мальтозу, сахарозу, лактозу и трегалозу, соответственно, с образованием моносахариды, которые могут быть легко обнаружены GLUT и SGLT1.Они также показали, что AMY1 экспрессируется на низких уровнях во вкусовой ткани и на высоких уровнях в слюнных околоушных железах и язычных железах фон Эбнерса (VEG), подтверждая предыдущие данные [45]. Таким образом, во вкусовых тканях присутствует весь необходимый механизм для получения вкусовых сигналов от крахмала. Поскольку VEG секретируют свое содержимое непосредственно в траншеи циркумваллатных и листовых сосочков, продуцируемый VEG AMY1 может иметь важное значение для образования локально повышенного количества олигосахаридов и дисахаридов в непосредственной близости от поры вкуса, где локализуются MGAM, SIS и GLUT. вызывая метаболический сигнал даже при очень низких количествах моносахаридов [42].Здесь интересно отметить, что Axelsson et al., Сравнивая геномы волков и домашних собак, сообщили о доказательствах увеличения функциональных изменений в гене AMY2B , а также в генах MGAM и SGLT1 у собак [30]. Таким образом, ферменты расщепления углеводов, способные генерировать транспортируемые моносахариды, могут увеличиваться вместе в процессе эволюции.
В дополнение к осознанному восприятию вкуса активация вкуса стимулирует физиологические реакции (реакции головной фазы), такие как повышенная секреция слюны [46], желудочного сока [46, 47] и секреции поджелудочной железы [46, 48].Такие реакции подготавливают пищеварительную систему к метаболизму и поглощению питательных веществ [5] и позволяют лучше поддерживать гомеостаз питательных веществ в плазме [5, 6]. Высвобождение инсулина в головной фазе (CPIR) является одной из таких преабсорбтивных реакций на еду [49]. Хотя это относительно незначительный компонент общей секреции инсулина, было показано, что CPIR является чрезвычайно важным фактором, определяющим общую толерантность к глюкозе [50]. В одном исследовании наша группа показала, что люди с низкой активностью амилазы в слюне из-за низкого числа копий AMY1 не проявляли CPIR в ответ на крахмал и, следовательно, имели более высокий гликемический ответ.Однако после приема раствора глюкозы у этих людей наблюдалось CPIR, что указывает на то, что они могли это делать [51]. Эти результаты предполагают, что амилаза слюны может иметь важное значение для повышения толерантности к глюкозе и что люди с более высоким числом копий AMY1 лучше приспособлены к потреблению крахмала. Недавно Glendinning et al. [52] не только подтвердили, что грызуны обладают двумя путями передачи вкуса сахаров, но также продемонстрировали, что если путь T1R2 / T1R3 необходим для привлечения сахара, путь, независимый от T1R2 / T1R3, опосредует индуцированный сахаром CPIR, предположительно независимый от T1R метаболический путь с участием GLUT, SGLT1 и KATP и ферментов, переваривающих углеводы, в случае обнаружения ди- или олигосахаридов.
Следовательно, продукты расщепления крахмала, выделяемые амилазой слюны, могут быть обнаружены в полости рта и вызывают раннее высвобождение инсулина, возможно, после того, как дисахаридазы генерируют транспортируемые моносахариды. Через один или оба пути метаболического вкуса и пути вкуса MOS активность амилазы слюны в полости рта может улучшать метаболизм крахмала до абсорбции. Эти пути должны быть подтверждены у людей, и связь между высокой активностью амилазы слюны и индуцированным крахмалом CPIR должна быть подтверждена в более крупных популяциях.
Постабсорбтивная роль амилазы слюны в переваривании крахмала
Большие количества панкреатической амилазы высвобождаются в двенадцатиперстную кишку через проток поджелудочной железы, чтобы продолжить переваривание поступающего крахмала. Пищеварительные ферменты производятся и транспортируются ацинарными клетками, которые являются экзокринными клетками поджелудочной железы. Второй функциональный компонент поджелудочной железы — эндокринная поджелудочная железа. Эндокринная поджелудочная железа состоит из небольших островков клеток, называемых островками Лангерганса.Эндокринные клетки не выделяют свои секреты в протоки поджелудочной железы. Скорее они выделяют в кровь гормоны, такие как инсулин, чтобы контролировать уровень глюкозы в крови. Скоординированным образом инсулин напрямую регулирует ацинарную поджелудочную железу через портальную систему, которая транспортирует островковую кровь к ацинарным клеткам [53]. У ацинусов есть рецепторы инсулина, и было продемонстрировано, что инсулин необходим для нормальной функции ацинарных клеток. Таким образом, инсулин регулирует секрецию панкреатической амилазы в двенадцатиперстную кишку и за счет расширения переваривания крахмала в кишечнике.
Любопытно, что амилаза может не только выполнять экзокринные функции, но также выполнять эндокринные функции. Присутствие амилазы в крови исторически связывали с патологической утечкой из поджелудочной железы и слюнных желез из-за воспаления и болезни. Следовательно, содержание амилазы в сыворотке просто отражает содержание амилазы в пищеварительных железах: низкое в случае дефицита инсулина и повышенное после кормления [54] или после искусственной активации экзокринной секреции желудочно-кишечных желез [55, 56].Однако стало ясно, что уровень амилазы в крови на самом деле жестко регулируется [56]. Поэтому следует задаться вопросом, какова его физиологическая секреторная функция? Присутствие амилазы в крови является результатом очень активного процесса кровообращения, баланса между скоростью проникновения и скоростью выведения [57]. Когда околоушные железы, основной источник амилазы плазмы у крыс, удаляются, уровень амилазы слюнного типа в покое не изменяется, и при кормлении обнаруживается повышение [58].Другие источники фермента компенсируют их потерю. Одним из источников может быть печень, которая также производит небольшое количество «слюнной» амилазы [59, 60] и может секретировать амилазу в плазму [61]. Более того, Cloutier et al. [44] продемонстрировали на крысах, что уровни циркулирующей амилазы (и липазы) связаны с их присутствием в просвете кишечника. Интернализация энтероцитами и прогрессирование абсорбированных ферментов по трансцитотическому пути позволяет им достигать кровообращения.В этом исследовании амилаза присутствовала в более высоких концентрациях в слизистой оболочке кишечника и в крови после кормления, как наблюдали другие. Этот тип интернализации и передачи эпителия полости рта не изучался; Было бы интересно узнать, происходит ли это на слизистой оболочке полости рта. Амилаза может служить пищеварительным или непищеваренным целям в крови. Концентрация амилазы в сыворотке очень низкая по сравнению (нг / мл) с ее концентрацией в секреторных железах (миллимолярная). Тем не менее, этого достаточно для обнаружения ферментативной активности, и из-за большого объема крови (5 л) эта концентрация все еще составляет значительную величину в диапазоне 1–10% от тканевого уровня [56].Также возможно, что циркуляция амилазы через кровоток обеспечивает средство транспортировки этих белков от одного органа к другому. Когда меченые экзокринные белки поджелудочной железы вводили в кровоток крыс, находящихся в сознании, большая часть (приблизительно 97%) поглощалась различными тканями организма, в частности, почками, печенью, селезенкой и легкими [62].
Связь между амилазой слюны и ожирением / метаболическим синдромом
Недавние исследования связывают AMY1 CNV с ожирением в европейских и азиатских популяциях [63 ••, 64–66].Они обнаружили, что повышенное количество копий AMY1 в слюне положительно связано с более низким индексом массы тела (ИМТ) и риском ожирения, тем самым обеспечивая генетическую связь между эффективностью переваривания крахмала и низким ИМТ благодаря гену AMY1 . Но другие исследовательские группы поставили под сомнение эти результаты, утверждая, что авторы использовали молекулярные методы, такие как qPCR, которые не могут обеспечить точное абсолютное количество CNV, что приводит к неточным числам копий в локусе AMY [26].При использовании методов с более высоким разрешением генотипирования паттерн CNV в локусе амилазы очень точен и отличается от паттерна, полученного в исследованиях с использованием qPCR [67]. Что еще более важно, они не наблюдали сообщенной отрицательной связи между AMY1 и ожирением или ИМТ в больших когортах при использовании методов подсчета с высоким разрешением [26, 27, 68]. Таким образом, похоже, что влияние AMY1 CNV на риск ожирения не так сильно, как предполагалось изначально. Тем не менее, ассоциация, скорее всего, присутствует.Подсчет числа копий гена и измерения массы тела находятся на противоположных концах спектра объяснительных уровней с множеством регулирующих факторов и факторов окружающей среды, которые вмешиваются и размывают любую причинную связь. Следовательно, вероятно, будет трудно найти сильную связь между CNV амилазы слюны и ожирением. Кроме того, числа копий AMY1 и AMY2A коррелированы, так что фенотипические ассоциации, вызванные вариациями числа копий панкреатической амилазы, могут быть обнаружены косвенно как связь с числом копий AMY1 [26].
На уровне белка низкий уровень амилазы в сыворотке крови наблюдается в течение многих лет в клинических условиях у пациентов с ожирением, диабетом 1 и 2 типа и метаболическим синдромом [69]. Сывороточная амилаза состоит из почти равных пропорций изоформ амилазы поджелудочной железы и слюны [63, 70]. Традиционно врачи измеряли уровень амилазы в сыворотке для определения наличия острого панкреатита или степени прогрессирующего хронического панкреатита. И наоборот, истощение ацинарных клеток и ограниченный поток ферментов из паренхимы поджелудочной железы в кровоток [71, 72] или разрушение β-клеток из-за повторного панкреатита может привести к снижению уровня амилазы в сыворотке крови в результате низкого уровня амилазы поджелудочной железы [71, 72]. 69 ••].Низкий уровень амилазы в сыворотке также был связан с повышенным риском кардиометаболических нарушений в больших популяциях бессимптомных взрослых [73–77]. Ожирение и диабет имеют общую патологию недостаточной функции инсулина из-за инсулинорезистентности и / или снижения выработки инсулина, и известно, что инсулин имеет решающее значение для производства амилазы поджелудочной железы [53, 78]. Следовательно, низкий уровень амилазы в сыворотке может отражать проявление недостаточной секреции инсулина поджелудочной железы у бессимптомных людей [69].Schneeman [79] предположил, что инсулинорезистентность может препятствовать усилению эффекта инсулина на синтез амилазы, что приводит к снижению уровня амилазы. К сожалению, почти во всех этих исследованиях и клинических наблюдениях измерялась только общая сывороточная амилаза; поэтому мы не знаем, какие изоформы присутствовали в сыворотке. Было бы очень полезно систематически дифференцировать амилазу поджелудочной железы от амилазы слюны в крови. Неизвестно, играет ли инсулин также роль в мониторинге амилазы, продуцируемой слюнными железами или другими тканями, продуцирующими амилазу слюнного типа, такими как печень, которая вырабатывает небольшое количество слюнной амилазы, но некоторые исследования указывают на причинное действие инсулина на продукция амилазы в слюнных железах [80, 81].Таким образом, может существовать прямая функциональная связь между функцией инсулина и производством амилазы, тем самым создавая причинную связь между перевариванием крахмала, гомеостазом глюкозы и метаболическим синдромом.
Выводы
Амилаза слюны влияет на пероральное восприятие крахмала, преабсорбтивную метаболическую сигнализацию и реакцию глюкозы в плазме на проглоченный крахмал. Этот ранний контроль пищеварения приводит к различиям в эффективности метаболизма крахмала. Эти метаболические регуляторы, по-видимому, имеют достаточное значение для того, чтобы ген панкреатической амилазы копировался и экспрессировался в слюнных железах у приматов и грызунов независимо.У людей, которые с появлением сельского хозяйства значительно увеличили потребление крахмала, ген амилазы слюны значительно расширился как вариант числа копий. Тем не менее, в современном обществе люди, как правило, едят в среднем одинаковое количество крахмала, независимо от того, производят ли они высокий или низкий уровень амилазы слюны. Похоже, что это подвергает тех, кто производит низкий уровень амилазы слюны и потребляет большое количество крахмала, риску развития метаболического синдрома.
Благодарности
Мы благодарны Луизе Слэйд за полезные ранние обсуждения.
Сноски
Конфликт интересов Катрин Пейро де Гашон и Поль А.С. Бреслин заявляет, что у них нет конфликта интересов.
Права человека и животных и осознанное согласие Эта статья не содержит исследований с участием людей или животных, выполненных кем-либо из авторов.
Список литературы
Недавно опубликованные статьи, представляющие особый интерес, были отмечены как:
•• Важные
1.Дауэс С., Педерсен А.М., Вилла А и др. Функции слюны человека: обзор, спонсируемый Всемирным семинаром по оральной медицине VI. Arch Oral Biol 2015; 60 (6): 863–74. [PubMed] [Google Scholar] 2. Рул С. Научное исследование слюны в постпротеомную эпоху: от базы данных до основных функций. Эксперт Рев Протеомика 2012. 9 (1): 85–96. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Мацуо Р. Роль слюны в поддержании вкусовой чувствительности. Крит Рев Орал Биол Мед 2000. 11 (2): 216–29. [PubMed] [Google Scholar] 4.Хенкин Р.И., Гилл-младший-младший, Барттер ФК. Исследования вкусовых порогов у нормального человека и у пациентов с корковой недостаточностью надпочечников: роль кортикальных стероидов надпочечников и концентрации натрия в сыворотке. J Clin Invest 1963; 42 (5): 727. [Бесплатная статья PMC] [PubMed] [Google Scholar] 5. Power ML, Schulkin J. Опережающая физиологическая регуляция в биологии питания: ответы головной фазы. Аппетит. 2008. 50 (2): 194–206. [Бесплатная статья PMC] [PubMed] [Google Scholar] 6. Woods SC. Парадокс питания: как мы переносим пищу.Psychol Rev 1991; 98 (4): 488. [PubMed] [Google Scholar] 8. Scannapieco FA, Torres G, Levine MJ. Α-амилаза слюны: роль в формировании зубного налета и кариеса. Крит Рев Орал Биол Мед 1993. 4 (3): 301–7. [PubMed] [Google Scholar] 9. Якобсен Н., Мелваер К.Л., Хенстен-Петтерсен А. Некоторые свойства амилазы слюны: обзор литературы и некоторые наблюдения. J Dent Res 1972 г., 51 (2): 381–8. [PubMed] [Google Scholar] 10. Hall FF, Ratliff CR, Hayakawa T. и др. Субстратная дифференциация альфа-амилаз поджелудочной железы и слюны человека.Am J Dig Dis 1970. 15 (11): 1031–8. [PubMed] [Google Scholar] 11. Розенблюм JL, Ирвин CL, Alpers DH. Олигосахариды крахмала и глюкозы защищают активность амилазы слюнного типа при кислом pH. Am J Physiol Gastrointest Liver Physiol 1988; 254 (5): G775–80. [PubMed] [Google Scholar] 12. Hoebler C, Karinthi A, Devaux MF и др. Физические и химические превращения зерновой пищи при пероральном переваривании у людей. Br J Nutr 1998. 80 (05): 429–36. [PubMed] [Google Scholar] 13. Мандель А.Л., Пейро де Гашон С., Планк К.Л. и др.Индивидуальные различия в количестве копий гена AMY1, уровнях α-амилазы в слюне и восприятии перорального крахмала. PLoS One. 2010; 5 (10): e13352. [Бесплатная статья PMC] [PubMed] [Google Scholar] 14. Ляпис Т.Дж., Пеннер М.Х., Лим Дж. Доказательства того, что люди могут ощущать вкус полимеров глюкозы. Chem Senses 2014. 39 (9): 737–47. [PubMed] [Google Scholar] 15. Boehlke C, Zierau O, Hannig C. Амилаза слюны — фермент неспециализированных эврифагов. Arch Oral Biol 2015; 60 (8): 1162–76. [PubMed] [Google Scholar] 16. Самуэльсон Л.С., Филлипс Р.С., Суонберг Л.Дж.Структуры генов амилазы у приматов: вставки ретропозонов и эволюция промоторов. Мол Биол Эвол 1996. 13 (6): 767–79. [PubMed] [Google Scholar] 17. Chatterton RT, Vogelsong KM, Lu Y, Ellman AB, Hudgens GA. Альфа-амилаза слюны как мера эндогенной адренергической активности. Clin Physiol 1996. 16: 433–48. [PubMed] [Google Scholar] 18. Ehlert U, Kirschbaum C. Детерминанты суточного течения альфа-амилазы слюны. Психонейроэндокринология. 2007. 32 (4): 392–401. [PubMed] [Google Scholar] 20. Банк RA, Hettema EH, Muijs MA и др.Вариация числа копий гена и полиморфизма изоферментной системы амилазы слюны человека у кавказцев. Hum Genet 1992. 89 (2): 213–22. [PubMed] [Google Scholar] 21. Perry GH, Dominy NJ, Claw KG и др. Диета и эволюция изменения числа копий гена амилазы человека. Нат Жене 2007. 39 (10): 1256–60. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Ян З.М., Лин Дж., Чен Л.Х. и др. Роль копий AMY1 и экспрессии белка в активности α-амилазы слюны человека. Physiol Behav (физиологическое поведение) 2015; 138: 173–8. [PubMed] [Google Scholar] 23.Groot PC, Mager WH, Henriquez NV и др. Эволюция мультигенного семейства человеческой α-амилазы посредством неравных, гомологичных, меж- и внутрихромосомных кроссоверов. Геномика. 1990. 8 (1): 97–105. [PubMed] [Google Scholar] 24. Купер GM, Никерсон Д.А., Эйхлер Э. Мутационные и селективные эффекты на варианты числа копий в геноме человека. Нат Жене 2007; 39: S22–9. [PubMed] [Google Scholar] 25. Perry GH. Эволюционное значение вариации числа копий в геноме человека. Cytogenet Genome Res 2008. 123 (1–4): 283–7.[Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Карпентер Д., Дхар С., Митчелл Л. М. и др. Ожирение, переваривание крахмала и амилаза: связь между вариантами числа копий в генах амилазы слюны человека (AMY1) и поджелудочной железы (AMY2). Хум Мол Генет 2015; 24 (12): 3472–80. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Usher CL, Handsaker RE, Esko T, et al. Структурные формы локуса амилазы человека и их связь с SNP, гаплотипами и ожирением. Нат Жене 2015; 47 (8): 921–5. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28.Харди К., Брэнд-Миллер Дж., Браун К.Д. и др. Важность пищевых углеводов в эволюции человека. Q Rev Biol 2015; 90 (3): 251–68. [PubMed] [Google Scholar] 29. Симпсон Дж. В., Докси Д. Л., Браун Р. Значения изоамилазы в сыворотке у нормальных собак и собак с внешнесекреторной недостаточностью поджелудочной железы. Vet Res Commun 1984. 8 (1): 303–8. [PubMed] [Google Scholar] 30. ••. Axelsson E, Ratnakumar A, Arendt ML, et al. Геномный признак одомашнивания собак свидетельствует об их адаптации к диете, богатой крахмалом. Природа. 2013. 495 (7441): 360–4.[PubMed] [Google Scholar]Покажите доказательства увеличения функции гена AMY2B, а также генов MGAM и SGLT1 у собак. Арендт М., Фолл Т., Линдблад-То К. и др. Активность амилазы связана с количеством копий AMY2B у собак: последствия для приручения собак, диеты и диабета. Anim Genet 2014; 45 (5): 716–22. [Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Тинг К.Н., Розенберг М.П., Сноу К.М., Самуэльсон Л.К., Мейслер М.Х. Эндогенные ретровирусные последовательности необходимы для тканеспецифической экспрессии гена амилазы слюны человека.Genes Dev 1992; 6: 1457–65. [PubMed] [Google Scholar] 33. Meisler MH, Ting CN. Замечательная эволюционная история генов амилазы человека. Крит Рев Орал Биол Мед 1993. 4 (3): 503–509. [PubMed] [Google Scholar] 34. Эванс И.Д., Хайсман Д.Р., Элсон Э.Л. и др. Влияние амилазы слюны на вязкость суспензий желатинизированного крахмала и механические свойства гранул желатинизированного крахмала. J Sci Food Agric 1986. 37 (6): 573–90. [Google Scholar] 35. Склафани А., Ниссенбаум Дж. В., Вигорито М. Предпочтение крахмала у крыс.Neurosci Biobehav Rev 1987. 11 (2): 253–62. [PubMed] [Google Scholar] 36. Вигорито М., Склафани А. Онтогенез аппетита поликозы и сахарозы у новорожденных крыс. Дев Психобиол 1988. 21 (5): 457–65. [PubMed] [Google Scholar] 37. Рамирес И.С. Хеморецепция нерастворимого нелетучего вещества: вкус крахмала? Am J Physiol Regul Integr Comp Physiol 1991; 260 (1): R192–9. [PubMed] [Google Scholar] 38. Treesukosol Y, Smith KR, Spector AC. Поведенческие данные о вкусовом рецепторе полимера глюкозы, который не зависит от гетеродимера T1R2 + 3 на мышиной модели.J Neurosci Nurs 2011. 31 (38): 13527–34. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39. Zukerman S, Glendinning JI, Margolskee RF, et al. Вкусовой рецептор T1R3 имеет решающее значение для вкуса сахарозы, но не вкуса поликозы. Am J Physiol Regul Integr Comp Physiol 2009; 296 (4): R866–76. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Бреслин PAS, Beauchamp GK, Pugh EN. Моногевзия для фруктозы, глюкозы, сахарозы и мальтозы. Восприятие психофизики. 1996. 58 (3): 327–41. [PubMed] [Google Scholar] 41. Йи К.К., Сукумаран С.К., Кота Р. и др.Переносчики глюкозы и АТФ-зависимые K + (KATP) метаболические сенсоры присутствуют во вкусовых клетках, экспрессирующих вкусовые рецепторы 3 (T1r3) типа 1. Proc Natl Acad Sci 2011. 108 (13): 5431–6. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. ••. Сукумаран С.К., Йи К.К., Ивата С. и др. Ферменты α-глюкозидазы, экспрессируемые вкусовыми клетками, участвуют во вкусовых ответах на дисахариды. PNAS. 2016; 113 (21): 6035–40. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Доказательства экспрессии амилазы и мальтазы слюны во вкусовых клетках и окружающих язычных слюнных железах.43. Маргольски Р.Ф., Дайер Дж., Кокрашвили З. и др. T1R3 и густдуцин в кишечных сахарах для регуляции экспрессии котранспортера Na + -глюкозы 1. Proc Natl Acad Sci 2007. 104 (38): 15075–80. [Бесплатная статья PMC] [PubMed] [Google Scholar] 44. Клотье М., Жинграс Д., Бендаян М. Интернализация и трансцитоз ферментов поджелудочной железы слизистой оболочкой кишечника. J Histochem Cytochem 2006. 54 (7): 781–94. [PubMed] [Google Scholar] 45. Мериго Ф., Бенати Д., Чеккини М.П. и др. Экспрессия амилазы в клетках вкусовых рецепторов кольцевых сосочков крыс.Клеточная ткань Res 2009. 336 (3): 411–21. [PubMed] [Google Scholar] 46. Павлов И.П. Работа пищеварительных желез. Лондон: Charles Griffin Co Ltd; 1902. [Google Scholar] 47. Фаррелл JI. Вклад в физиологию желудочной секреции. Am J Physiol 1928; 85: 672–87. [Google Scholar] 48. Прешоу Р. М., Кук А. Р., Гроссман М. И.. Количественные аспекты реакции поджелудочной железы собак на закисление двенадцатиперстной кишки. Гастроэнтерология. 1966; 210: 629–34. [PubMed] [Google Scholar] 49. Powley TL. Вентромедиальный гипоталамический синдром, сытость и гипотеза головной фазы.Psychol Rev 1977; 84: 89–126. [PubMed] [Google Scholar] 50. Арен Б., Холст Дж. Дж. Головной инсулиновый ответ на прием пищи у людей зависит как от холинергических, так и нехолинергических механизмов и важен для постпрандиальной гликемии. Сахарный диабет. 2001; 50: 1030–8. [PubMed] [Google Scholar] 51. Мандель АЛ, Бреслин ПА. Высокая эндогенная активность амилазы слюны связана с улучшением гликемического гомеостаза после приема крахмала у взрослых. J Nutr 2012. 142 (5): 853–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 52.Глендиннинг Дж. И., Стано С., Холтер М. и др. Индуцированное сахаром высвобождение инсулина в головной фазе опосредуется T1r2 + T1r3-независимым путем передачи вкуса у мышей. Am J Physiol Regul Integr Comp Physiol 2015; 309 (5): R552–60. [Бесплатная статья PMC] [PubMed] [Google Scholar] 53. Уильямс Дж. А., Goldfine ID. Ось инсулин-панкреатический ацинар. Сахарный диабет. 1985. 34 (10): 980–6. [PubMed] [Google Scholar] 54. Schneyer CA, Schneyer LH. Амилаза в сыворотке крови, подчелюстной железе и печени крыс после введения пилокарпина или нормального кормления.Am J Physiol 1960; 198: 771–3. [PubMed] [Google Scholar] 55. Schrifin A, Tuchman L, Antopol W. Ответ амилазы крови на хлорид ацетил-b-метилхолина у кроликов. Proc Soc Exp Biol Med 1936; 34: 539–40. [Google Scholar] 56. Изенман Л., Либов С., Ротман С. Эндокринная секреция пищеварительных ферментов млекопитающих экзокринными железами. Am J Physiol Endocrinol Metab 1999; 276 (2): E223–32. [PubMed] [Google Scholar] 57. Пипер-Бигелоу С., Строкки А., Левитт, доктор медицины. Откуда берется сывороточная амилаза и куда она девается? Гастроэнтерол Клин Норт Ам 1990. 19 (4): 793–810.[PubMed] [Google Scholar] 58. Проктор Г.Б., Спрашивающий Б., Гаррет-младший. Сывороточная амилаза непаротидного и непанкреатического происхождения увеличивается при кормлении у крыс и может происходить из печени. Comp Biochem Physiol B Biochem Mol Biol 1991. 98 (4): 631–5. [PubMed] [Google Scholar] 59. Мессер М.И., декан Р.Т. Иммунохимическая взаимосвязь между α-амилазами печени, сыворотки, поджелудочной железы и околоушной железы крыс. Biochem J 1975. 151 (1): 17–22. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60. Хокари С., Миура К., Кояма И. и др. Экспрессия изоферментов α-амилазы в тканях крыс.Comp Biochem Physiol B Biochem Mol Biol 2003. 135 (1): 63–9. [PubMed] [Google Scholar] 61. МакГичин Р.Л., Абшиер В.М., О’Лири К. Влияние пуромицина и актиномицина D на уровни амилазы в сыворотке и печени у мышей, кроликов и крыс. Carbohydr Res 1978; 61 (1): 425–9. [PubMed] [Google Scholar] 62. Рор Г., Шееле Г. Судьба радиоактивных экзокринных белков поджелудочной железы, введенных в кровообращение крысы. Поглощение тканями и трансэпителиальная экскреция. Гастроэнтерол. 1983; 85 (5): 991–1002. [PubMed] [Google Scholar] 63.••. Фалчи М., Мустафа Дж. С., Такусис П. и др. Низкое количество копий гена амилазы слюны предрасполагает к ожирению. Нат Жене. 2014. 46 (5): 492–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Первая статья, показывающая положительную связь между AMY CN и ожирением.64. Вильякайнен Х., Андерссон-Ассарссон Й.С., Арменио М. и др. Низкое количество копий локуса AMY1 связано с ранним началом женского ожирения в Финляндии. PLoS One. 2015; 10 (7): e0131883. [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Мехиа-Бенитес М.А., Боннефонд А., Йенго Л. и др.Благоприятное влияние большого количества копий гена амилазы AMY1 слюны на риск ожирения у мексиканских детей. Диабетология. 2015; 58 (2): 290–4. [PubMed] [Google Scholar] 66. Марковеккио М.Л., Флорио Р., Вергинелли Ф. и др. Низкое количество копий гена AMY1 связано с повышенным индексом массы тела у мальчиков препубертатного возраста. PLoS One. 2016; 11 (5): e0154961. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67. Usher CL, McCarroll SA. Сложные и мультиаллельные вариации числа копий при заболеваниях человека. Краткая функциональная геномика.2015; elv02814: 329–38. [Бесплатная статья PMC] [PubMed] [Google Scholar] 68. Йонг Р.Ю., Мустаффа С.А., Васан П.С. и др. Сложное изменение числа копий AMY1 не связано с ожирением в двух восточноазиатских когортах. Хум Мутат 2016; 37: 669–78. [PubMed] [Google Scholar] 69. ••. Накадзима К. Низкая сывороточная амилаза и ожирение, диабет и метаболический синдром: новая интерпретация. Всемирный диабет J 2016; 7 (6): 112. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Интересный обзор о низком уровне амилазы в сыворотке и метаболическом синдроме.70. Skrha J, Stĕpán J. Клиническое значение определения изофермента амилазы. Acta Univ Carol Med Monogr. 1986; 120: 1–81. [PubMed] [Google Scholar] 71. Дандона П., Фридман Д. Б., Фу Й, Перкинс Дж., Катрак А., Михайлидис Д. П. и др. Внешнесекреторная функция поджелудочной железы при сахарном диабете. Дж. Клин Патол 1984. 37: 302–6. [Бесплатная статья PMC] [PubMed] [Google Scholar] 72. Swislocki A, Noth R, Hallstone A, Kyger E, Triadafilopoulos G. Стимулируемое секретином высвобождение амилазы в кровь нарушается при сахарном диабете 1 типа.Horm Metab Res 2005; 37: 326–30. [PubMed] [Google Scholar] 73. Ли Дж. Г., Пак С. В., Чо Б. М. и др. Сывороточная амилаза и риск метаболического синдрома у взрослых корейцев. Clin Chim Acta 2011; 412 (19): 1848–53. [PubMed] [Google Scholar] 74. Накадзима К., Немото Т., Мунеюки Т. и др. Низкий уровень амилазы в сыворотке крови в связи с метаболическим синдромом и диабетом: исследование на уровне сообщества. Кардиоваск Диабетол. 2011; 10 (1): 34. [Бесплатная статья PMC] [PubMed] [Google Scholar] 75. Накадзима К., Мунэюки Т., Мунаката Х. и др. Возвращаясь к кардиометаболическому значению сывороточной амилазы.BMC Res Примечания 2011; 4 (1): 419. [Бесплатная статья PMC] [PubMed] [Google Scholar] 76. Мунэюки Т., Накадзима К., Аоки А. и др. Скрытые ассоциации низкого уровня амилазы в сыворотке со сниженным уровнем инсулина в плазме и инсулинорезистентностью у бессимптомных взрослых людей среднего возраста. Кардиоваск Диабетол. 2012. 11 (80): 10–186. [Бесплатная статья PMC] [PubMed] [Google Scholar] 77. Чжао Ю., Чжан Дж., Чжан Дж. И др. Метаболический синдром и диабет связаны с низким уровнем сывороточной амилазы у бессимптомной популяции китайцев. Сканд Дж Клин Лаб Инвест 2014; 74 (3): 235–9.[PubMed] [Google Scholar] 78. Mossner J, Logsdon CD, Goldfine ID и др. Регулирование инсулиновых рецепторов ацинарных клеток поджелудочной железы инсулином. Am J Physiol Gastrointest Liver Physiol. 1984; 247 (2): G155–60. [PubMed] [Google Scholar] 79. Schneeman BO, Inman MD, Stern JS. Активность ферментов поджелудочной железы у тучных и худых крыс Zucker: исследование развития. J Nutr 1983; 113 (4): 921–5. [PubMed] [Google Scholar] 80. Картер Д.А., Вобкен Д.Д., Диксит П.К. и др. Иммунореактивный инсулин в слюнных железах крыс и его зависимость от возраста и уровня инсулина в сыворотке крови.Эксп Биол Мед 1995. 209 (3): 245–50. [PubMed] [Google Scholar] 81. Роча Е.М., Карвалью С.Р., Саад М.Дж. и др. Влияние старения на сигнальную систему инсулина в слезных и слюнных железах крыс. Acta Ophthalmol Scand. 2003. 81 (6): 639–45. [PubMed] [Google Scholar]
Амилаза слюны: пищеварение и метаболический синдром
Curr Diab Rep. Автор рукопись; доступно в PMC 2019 3 ноября.
Опубликован в окончательной отредактированной форме как:
PMCID: PMC6825871
NIHMSID: NIHMS1055272
Катрин Пейро де Гахонс
1 Monell Chemical Sensesia Center, США
Пол А.С. Бреслин
1 Monell Chemical Senses Center, Филадельфия, Пенсильвания, США
2 Департамент диетологии, Школа экологических и биологических наук, Университет Рутгерса, Нью-Брансуик, Нью-Джерси, США
1 Monell Центр химических чувств, Филадельфия, штат Пенсильвания, США
2 Департамент диетологии, Школа экологических и биологических наук, Университет Рутгерса, Нью-Брансуик, Нью-Джерси, США
Окончательная отредактированная версия этой статьи доступна на Curr Diab RepSee. другие статьи в PMC, цитирующие опубликованную статью.Abstract
Амилаза слюны — это фермент расщепления полимера глюкозы, который вырабатывается слюнными железами. Он составляет небольшую часть выделяемой амилазы, которая в основном вырабатывается поджелудочной железой. Амилазы расщепляют крахмал на более мелкие молекулы, в конечном итоге давая мальтозу, которая, в свою очередь, расщепляется мальтазой на две молекулы глюкозы. Крахмал составляет значительную часть типичного человеческого рациона большинства национальностей. Учитывая, что амилаза слюны составляет такую небольшую часть от общей амилазы, неясно, почему она существует и дает ли она эволюционное преимущество при приеме внутрь крахмала.В этом обзоре будет рассмотрено влияние амилазы слюны на оральное восприятие, передачу сигналов о питательных веществах, упреждающие метаболические рефлексы, уровень сахара в крови и ее клиническое значение для предотвращения метаболического синдрома и ожирения.
Ключевые слова: Амилаза слюны, переваривание крахмала, изменение числа копий AMY1, гомеостаз глюкозы, инсулин, метаболический синдром
Введение
Слюна играет важную роль в укреплении здоровья, включая защиту полости рта и облегчение приема пищи.Внутри рта слюна гидратирует слизистые оболочки, удаляет клетки и остатки пищи, буферизует pH полости рта, смазывает ротовую полость, способствуя жеванию и предотвращая износ зубов, образует пищевые комки для облегчения глотания, защищает от деминерализации зубов, обладает антимикробной активностью и предотвращает инфекции, а также закрывает раны, стимулируя заживление [1, 2]. Слюна также играет важную роль в восприятии пищи и пищеварении. Точные механизмы пищеварения остаются неясными. Что касается вкуса, то физические и композиционные характеристики слюны облегчают восприятие.Например, тот факт, что слюна представляет собой водную жидкость, делает ее идеальным средством переноса вкусовых стимулов и питательных веществ к вкусовым рецепторам [3], которые широко распространены на языке, мягком небе и глотке. Нестимулированная слюна также представляет низкие уровни вкусовых стимулов, таких как соли и глюкоза, по сравнению с плазмой, что обеспечивает низкий порог обнаружения [1, 4]. Восприятие вкуса определяет выбор диеты, а также влияет на физиологические процессы до и после всасывания [5, 6].Упреждающая фаза пищеварения называется «ответной фазой головного мозга» и служит для подготовки организма к эффективному метаболизму потребляемых питательных веществ, что делает ее важным шагом в переваривании пищи и предотвращении дисгликемии и дислипидемии.
Кроме того, слюна содержит большое количество белков, участвующих в липазной, пептидазной и гидролазной активности. При сравнении протеомов слюны и плазмы становится ясно, что распределение белков слюны связано с метаболическими и катаболическими процессами.Это указывает на то, что слюна играет важную физиологическую роль в переваривании пищи [7]. Самый распространенный белок в слюне человека — пищеварительный фермент α-амилаза [8]. Этот фермент расщепляет большие молекулы крахмала на декстрин, а затем на более мелкие мальтоолигосахариды (MOS), содержащие α-D- (1,4) связи, изомальтоолигосахариды (IMOS), содержащие α-D- (1,6) связи, трисахарид мальтотриозу и дисахарид мальтозы [9]. Затем глюкоза будет производиться из мальтозы под действием дисахаридных ферментов, таких как мальтаза.В организме человека амилаза вырабатывается преимущественно слюнными железами и поджелудочной железой. Хотя амилазы слюны и поджелудочной железы схожи, они кодируются разными генами ( AMY1 и AMY2 соответственно) и проявляют разные уровни активности против крахмалов различного происхождения [10].
Физиологическое значение амилазы слюны все еще не выяснено, и ее аспекты являются спорными, например, ее нормативная секреторная функция в плазме остается загадкой.Амилаза слюны имеет относительно короткое время активного контакта с крахмалом. Когда пищевой комок проглочен и пропитан желудочным соком, его катаболическая активность в основном останавливается из-за низкого кислого pH. Некоторая активность сохраняется внутри частиц из-за барьерной защиты, обеспечиваемой частично переваренным крахмалом на внешней стороне частицы [11], но большая часть крахмала переваривается обильной панкреатической амилазой, которая выделяется в двенадцатиперстную часть тонкой кишки. . Тем не менее, исследования показали, что значительный гидролиз крахмала происходит в полости рта за секунды, превращая студенистую консистенцию крахмала в полужидкую [12, 13].Это изменение текстуры само по себе может влиять на переваривание крахмала, сенсорные предпочтения и потребление крахмала. Кроме того, недавние исследования также продемонстрировали, что небольшие MOS-амилолитические продукты могут быть обнаружены в полости рта через вкусовую систему [14]. Эти данные убедительно подтверждают физиологическую роль амилазы слюны в переваривании крахмала.
В этом обзоре мы обсудим эволюционные силы, которые определяют существование амилазы слюны, преимущества создания более высоких уровней амилазы слюны, возможные физиологические последствия раннего разложения крахмала в ротовой полости и его роль в защите профиля глюкозы в крови и инсулина в крови. , а также болезненные состояния метаболического синдрома, диабета и ожирения.
Эволюционная перспектива роли амилазы слюны в переваривании крахмала
Амилаза слюны была обнаружена в слюне многих всеядных животных и некоторых травоядных. Напротив, облигатные плотоядные животные, такие как кошки, никогда не имеют амилазы слюны [15]. Животные, питающиеся незрелыми фруктами, семенами, корнями и луковицами, богатыми крахмалом, проявляют более высокую активность амилазы слюны. Это подтверждает мнение о том, что ключевой ролью амилазы слюны является переваривание крахмала. Активность амилазы слюны человека намного выше среди приматов.Это связано с тем, что Homo sapiens sapiens обладают множественными копиями гена AMY1 , тогда как другие приматы, включая нашего ближайшего живого родственника шимпанзе, имеют нормативные две копии на клетку (по одной от каждого родителя) [ 16]. AMY1 Вариация числа копий (CNV) не является единственной движущей силой продукции амилазы у животных, поскольку факторы окружающей среды, такие как уровень стресса [17], циркадные ритмы [18] и диета [15, 19], значительно влияют на количественные различия между виды и особи.Тем не менее существует хорошая корреляция между числом копий AMY1 и количеством и активностью амилазы в слюне [13, 20–22]. Каждый дублированный сегмент гена AMY1 содержит регуляторные последовательности, необходимые для экспрессии, специфичной для слюны [23], и, таким образом, действительно может напрямую влиять на информационную РНК (мРНК) и уровни экспрессии белка. Это не относится ко всем ген-содержащим CNV [24, 25]. Человек может нести от 2 до 17 копий гена AMY1 [21, 26, 27].Высокое количество копий AMY1 наблюдалось в популяциях, предки которых употребляли пищу, богатую крахмалом [21]; это предполагает направленный отбор в сторону более высокой амилазы слюны для переваривания крахмала. Развитие кулинарии и, в последнее время, более широкий доступ к крахмалистым продуктам с появлением сельского хозяйства будет благоприятствовать AMY1 CNV, поскольку повышенная доступность перевариваемого крахмала может привести к тому, что уровни амилазы слюны и, возможно, панкреатической амилазы станут ограничивающим фактором для крахмала. пищеварение [28].Важно отметить, что даже если гены панкреатической амилазы у людей не подверглись такой обширной дупликации, индивидуальный AMY2 CNV существует и варьируется от 0 до 4 для AMY2A и от 2 до 6 для AMY2B [26, 27 ].
Как и многие животные, домашние собаки, не являющиеся обязательными хищниками, экспрессируют амилазу только в поджелудочной железе, но не в слюне [29]. Интересно, что волки, являющиеся облигатными плотоядными животными, несут только 2 копии AMY2B , тогда как количество диплоидных копий у собак колеблется от 4 до 30; более высокий CNV связан с повышенной активностью амилазы поджелудочной железы [30, 31].Это увеличение активности амилазы за счет дупликации AMY2B , как полагают, объясняет, почему домашние собаки могут жить на диете, богатой крахмалом, в то время как их ближайшие дикие родственники — нет. Таким образом, один и тот же молекулярный механизм (дупликация) действует на сходные гены у разных видов, подвергающихся одинаковому давлению питания (приручение собак) [30].
Можно провести параллельное эволюционное событие между грызунами и людьми. Грызуны, как и люди, обладают амилазой слюны. Исследования показали, что оба вида приобрели активность амилазы в слюне независимо через встраивание чужеродного ретровируса в примитивный кластер амилазы, превращая ген поджелудочной железы в ген слюны [32].Поскольку эта ретровирусная вставка произошла после разделения отрядов приматов и грызунов, это означает, что некоторые из элементов, необходимых для экспрессии гена амилазы слюны, эволюционировали независимо в геномах мыши и человека. Это поддерживает идею об очень сильном эволюционном отборе амилазы, выделяемой со слюной [33]. Это яркие примеры параллельной эволюции, которые убедительно подтверждают важность амилазы слюны в переваривании крахмала для человека. Но остаются вопросы: «Что это за эволюционное давление, заставляющее экспрессировать амилазу в слюне?» Или: «Что именно амилаза слюны дает нам такое преимущество?» Поскольку ферментативная активность амилаз поджелудочной железы и слюны весьма схожа, и все млекопитающие продуцируют амилазу поджелудочной железы, нет очевидного преимущества дублирования этого механизма переваривания крахмала.В следующих разделах мы попытаемся показать, что, возможно, можно привести аргумент в пользу преимущества.
Роль амилазы слюны в преабсорбции в переваривании крахмала
Амилаза слюны сильно влияет на текстурные характеристики крахмала. Ферментативное расщепление крахмала приводит к быстрому уменьшению длины и вязкости цепи глюкоза-полимер после того, как было расщеплено относительно небольшое количество гликозидных связей [34]. Эти изменения вязкости могут сыграть важную роль в определении вкуса и предпочтения пищи.Следовательно, степень уменьшения вязкости крахмала в полости рта может иметь важное значение для питания. Наша группа показала, что люди с высоким числом копий AMY1 имели более высокую активность амилазы в слюне и сообщали о более быстром и значительном снижении воспринимаемой вязкости крахмала, чем люди с низким числом копий AMY1 [13]. Улучшение вкусовых качеств крахмалистой пищи могло быть одним из способов, которым CNV амилазы слюны помогал увеличить потребление крахмала в процессе эволюции гоминидов.К этому моменту люди, чьи предки придерживались более богатой крахмалом диеты, несут большее количество AMY1 CNV [21].
В то время как крахмал не имеет ясного вкуса для людей, пероральное обнаружение крахмала или продуктов его разложения с помощью специализированных вкусовых рецепторов было бы очень полезным из-за его важности в питании человека. Существуют значительные доказательства того, что грызуны могут перорально воспринимать продукты разложения крахмала (олиго и полисахариды) [35–37] и что их обнаружение не зависит от рецептора сладкого вкуса T1R2 / T1R3 [38, 39].Есть некоторые свидетельства того, что люди могут также воспринимать полимеры глюкозы как имеющие отличный вкус от сладких сахаров. Люди могут отличить вкус высокой концентрации мальтозы от вкуса глюкозы или фруктозы, если подбирать их по интенсивности [40]. Совсем недавно было показано, что люди реагируют на короткие MOS во рту как не сладкие на вкус, а как ощутимые [14]. Таким образом, люди могут ощущать слабый вкус полимера глюкозы, который является уникальным качеством вкуса, отличным от сладкого.
Кроме того, T1R-независимый метаболический путь моносахаридов был недавно идентифицирован во вкусовых рецепторных клетках мышей. Он состоит из транспортеров глюкозы (GLUT) и метаболического сенсорного пути (котранспортер глюкозы натрия 1 (SGLT1) и АТФ-управляемый канал K + (K ATP )), которые служат в качестве метаболических сенсоров сахара в других тканях, особенно в тканях. кишечника и поджелудочной железы, и может быть ключевым шагом в физиологическом различении калорийных и некалорийных подсластителей [41].Таким образом, калорийные подсластители у грызунов будут действовать по двум сигнальным путям, T1R и метаболическому сенсору, тогда как некалорийные сенсоры будут действовать только на T1R. Метаболический путь сам по себе не может объяснить вкусовые реакции на крахмалистые продукты, поскольку продукты разложения крахмала не являются субстратами для переносчиков GLUT или SGLT1, транспортируется только глюкоза, а амилаза слюны не генерирует глюкозу. Но этот необходимый шаг для метаболического обнаружения крахмала через T1R-независимый путь в полости рта был идентифицирован как мембраносвязанные ферменты дисахаридазы [42].Авторы предположили, что, поскольку вкусовые и кишечные эпителии имеют много общих хеморецепторов и путей передачи сигналов (например, вкусовые рецепторы в кишечнике [43], метаболические сенсоры в клетках вкусовых рецепторов [41]), а энтероциты кишечного эпителия экспрессируют GLUT и SGLT1, а также ферменты, гидролизующие дисахариды, и содержащие амилазу поджелудочной железы [44], вкусовые клетки, вероятно, также могут экспрессировать эти ферменты. Они показали, что вкусовые клетки экспрессируют ферменты мальтаза-глюкоамилаза (MGAM), сахароза-изомальтаза (SIS), лактаза (LCT) и треалаза (TREH), которые гидролизуют дисахариды мальтозу, сахарозу, лактозу и трегалозу, соответственно, с образованием моносахариды, которые могут быть легко обнаружены GLUT и SGLT1.Они также показали, что AMY1 экспрессируется на низких уровнях во вкусовой ткани и на высоких уровнях в слюнных околоушных железах и язычных железах фон Эбнерса (VEG), подтверждая предыдущие данные [45]. Таким образом, во вкусовых тканях присутствует весь необходимый механизм для получения вкусовых сигналов от крахмала. Поскольку VEG секретируют свое содержимое непосредственно в траншеи циркумваллатных и листовых сосочков, продуцируемый VEG AMY1 может иметь важное значение для образования локально повышенного количества олигосахаридов и дисахаридов в непосредственной близости от поры вкуса, где локализуются MGAM, SIS и GLUT. вызывая метаболический сигнал даже при очень низких количествах моносахаридов [42].Здесь интересно отметить, что Axelsson et al., Сравнивая геномы волков и домашних собак, сообщили о доказательствах увеличения функциональных изменений в гене AMY2B , а также в генах MGAM и SGLT1 у собак [30]. Таким образом, ферменты расщепления углеводов, способные генерировать транспортируемые моносахариды, могут увеличиваться вместе в процессе эволюции.
В дополнение к осознанному восприятию вкуса активация вкуса стимулирует физиологические реакции (реакции головной фазы), такие как повышенная секреция слюны [46], желудочного сока [46, 47] и секреции поджелудочной железы [46, 48].Такие реакции подготавливают пищеварительную систему к метаболизму и поглощению питательных веществ [5] и позволяют лучше поддерживать гомеостаз питательных веществ в плазме [5, 6]. Высвобождение инсулина в головной фазе (CPIR) является одной из таких преабсорбтивных реакций на еду [49]. Хотя это относительно незначительный компонент общей секреции инсулина, было показано, что CPIR является чрезвычайно важным фактором, определяющим общую толерантность к глюкозе [50]. В одном исследовании наша группа показала, что люди с низкой активностью амилазы в слюне из-за низкого числа копий AMY1 не проявляли CPIR в ответ на крахмал и, следовательно, имели более высокий гликемический ответ.Однако после приема раствора глюкозы у этих людей наблюдалось CPIR, что указывает на то, что они могли это делать [51]. Эти результаты предполагают, что амилаза слюны может иметь важное значение для повышения толерантности к глюкозе и что люди с более высоким числом копий AMY1 лучше приспособлены к потреблению крахмала. Недавно Glendinning et al. [52] не только подтвердили, что грызуны обладают двумя путями передачи вкуса сахаров, но также продемонстрировали, что если путь T1R2 / T1R3 необходим для привлечения сахара, путь, независимый от T1R2 / T1R3, опосредует индуцированный сахаром CPIR, предположительно независимый от T1R метаболический путь с участием GLUT, SGLT1 и KATP и ферментов, переваривающих углеводы, в случае обнаружения ди- или олигосахаридов.
Следовательно, продукты расщепления крахмала, выделяемые амилазой слюны, могут быть обнаружены в полости рта и вызывают раннее высвобождение инсулина, возможно, после того, как дисахаридазы генерируют транспортируемые моносахариды. Через один или оба пути метаболического вкуса и пути вкуса MOS активность амилазы слюны в полости рта может улучшать метаболизм крахмала до абсорбции. Эти пути должны быть подтверждены у людей, и связь между высокой активностью амилазы слюны и индуцированным крахмалом CPIR должна быть подтверждена в более крупных популяциях.
Постабсорбтивная роль амилазы слюны в переваривании крахмала
Большие количества панкреатической амилазы высвобождаются в двенадцатиперстную кишку через проток поджелудочной железы, чтобы продолжить переваривание поступающего крахмала. Пищеварительные ферменты производятся и транспортируются ацинарными клетками, которые являются экзокринными клетками поджелудочной железы. Второй функциональный компонент поджелудочной железы — эндокринная поджелудочная железа. Эндокринная поджелудочная железа состоит из небольших островков клеток, называемых островками Лангерганса.Эндокринные клетки не выделяют свои секреты в протоки поджелудочной железы. Скорее они выделяют в кровь гормоны, такие как инсулин, чтобы контролировать уровень глюкозы в крови. Скоординированным образом инсулин напрямую регулирует ацинарную поджелудочную железу через портальную систему, которая транспортирует островковую кровь к ацинарным клеткам [53]. У ацинусов есть рецепторы инсулина, и было продемонстрировано, что инсулин необходим для нормальной функции ацинарных клеток. Таким образом, инсулин регулирует секрецию панкреатической амилазы в двенадцатиперстную кишку и за счет расширения переваривания крахмала в кишечнике.
Любопытно, что амилаза может не только выполнять экзокринные функции, но также выполнять эндокринные функции. Присутствие амилазы в крови исторически связывали с патологической утечкой из поджелудочной железы и слюнных желез из-за воспаления и болезни. Следовательно, содержание амилазы в сыворотке просто отражает содержание амилазы в пищеварительных железах: низкое в случае дефицита инсулина и повышенное после кормления [54] или после искусственной активации экзокринной секреции желудочно-кишечных желез [55, 56].Однако стало ясно, что уровень амилазы в крови на самом деле жестко регулируется [56]. Поэтому следует задаться вопросом, какова его физиологическая секреторная функция? Присутствие амилазы в крови является результатом очень активного процесса кровообращения, баланса между скоростью проникновения и скоростью выведения [57]. Когда околоушные железы, основной источник амилазы плазмы у крыс, удаляются, уровень амилазы слюнного типа в покое не изменяется, и при кормлении обнаруживается повышение [58].Другие источники фермента компенсируют их потерю. Одним из источников может быть печень, которая также производит небольшое количество «слюнной» амилазы [59, 60] и может секретировать амилазу в плазму [61]. Более того, Cloutier et al. [44] продемонстрировали на крысах, что уровни циркулирующей амилазы (и липазы) связаны с их присутствием в просвете кишечника. Интернализация энтероцитами и прогрессирование абсорбированных ферментов по трансцитотическому пути позволяет им достигать кровообращения.В этом исследовании амилаза присутствовала в более высоких концентрациях в слизистой оболочке кишечника и в крови после кормления, как наблюдали другие. Этот тип интернализации и передачи эпителия полости рта не изучался; Было бы интересно узнать, происходит ли это на слизистой оболочке полости рта. Амилаза может служить пищеварительным или непищеваренным целям в крови. Концентрация амилазы в сыворотке очень низкая по сравнению (нг / мл) с ее концентрацией в секреторных железах (миллимолярная). Тем не менее, этого достаточно для обнаружения ферментативной активности, и из-за большого объема крови (5 л) эта концентрация все еще составляет значительную величину в диапазоне 1–10% от тканевого уровня [56].Также возможно, что циркуляция амилазы через кровоток обеспечивает средство транспортировки этих белков от одного органа к другому. Когда меченые экзокринные белки поджелудочной железы вводили в кровоток крыс, находящихся в сознании, большая часть (приблизительно 97%) поглощалась различными тканями организма, в частности, почками, печенью, селезенкой и легкими [62].
Связь между амилазой слюны и ожирением / метаболическим синдромом
Недавние исследования связывают AMY1 CNV с ожирением в европейских и азиатских популяциях [63 ••, 64–66].Они обнаружили, что повышенное количество копий AMY1 в слюне положительно связано с более низким индексом массы тела (ИМТ) и риском ожирения, тем самым обеспечивая генетическую связь между эффективностью переваривания крахмала и низким ИМТ благодаря гену AMY1 . Но другие исследовательские группы поставили под сомнение эти результаты, утверждая, что авторы использовали молекулярные методы, такие как qPCR, которые не могут обеспечить точное абсолютное количество CNV, что приводит к неточным числам копий в локусе AMY [26].При использовании методов с более высоким разрешением генотипирования паттерн CNV в локусе амилазы очень точен и отличается от паттерна, полученного в исследованиях с использованием qPCR [67]. Что еще более важно, они не наблюдали сообщенной отрицательной связи между AMY1 и ожирением или ИМТ в больших когортах при использовании методов подсчета с высоким разрешением [26, 27, 68]. Таким образом, похоже, что влияние AMY1 CNV на риск ожирения не так сильно, как предполагалось изначально. Тем не менее, ассоциация, скорее всего, присутствует.Подсчет числа копий гена и измерения массы тела находятся на противоположных концах спектра объяснительных уровней с множеством регулирующих факторов и факторов окружающей среды, которые вмешиваются и размывают любую причинную связь. Следовательно, вероятно, будет трудно найти сильную связь между CNV амилазы слюны и ожирением. Кроме того, числа копий AMY1 и AMY2A коррелированы, так что фенотипические ассоциации, вызванные вариациями числа копий панкреатической амилазы, могут быть обнаружены косвенно как связь с числом копий AMY1 [26].
На уровне белка низкий уровень амилазы в сыворотке крови наблюдается в течение многих лет в клинических условиях у пациентов с ожирением, диабетом 1 и 2 типа и метаболическим синдромом [69]. Сывороточная амилаза состоит из почти равных пропорций изоформ амилазы поджелудочной железы и слюны [63, 70]. Традиционно врачи измеряли уровень амилазы в сыворотке для определения наличия острого панкреатита или степени прогрессирующего хронического панкреатита. И наоборот, истощение ацинарных клеток и ограниченный поток ферментов из паренхимы поджелудочной железы в кровоток [71, 72] или разрушение β-клеток из-за повторного панкреатита может привести к снижению уровня амилазы в сыворотке крови в результате низкого уровня амилазы поджелудочной железы [71, 72]. 69 ••].Низкий уровень амилазы в сыворотке также был связан с повышенным риском кардиометаболических нарушений в больших популяциях бессимптомных взрослых [73–77]. Ожирение и диабет имеют общую патологию недостаточной функции инсулина из-за инсулинорезистентности и / или снижения выработки инсулина, и известно, что инсулин имеет решающее значение для производства амилазы поджелудочной железы [53, 78]. Следовательно, низкий уровень амилазы в сыворотке может отражать проявление недостаточной секреции инсулина поджелудочной железы у бессимптомных людей [69].Schneeman [79] предположил, что инсулинорезистентность может препятствовать усилению эффекта инсулина на синтез амилазы, что приводит к снижению уровня амилазы. К сожалению, почти во всех этих исследованиях и клинических наблюдениях измерялась только общая сывороточная амилаза; поэтому мы не знаем, какие изоформы присутствовали в сыворотке. Было бы очень полезно систематически дифференцировать амилазу поджелудочной железы от амилазы слюны в крови. Неизвестно, играет ли инсулин также роль в мониторинге амилазы, продуцируемой слюнными железами или другими тканями, продуцирующими амилазу слюнного типа, такими как печень, которая вырабатывает небольшое количество слюнной амилазы, но некоторые исследования указывают на причинное действие инсулина на продукция амилазы в слюнных железах [80, 81].Таким образом, может существовать прямая функциональная связь между функцией инсулина и производством амилазы, тем самым создавая причинную связь между перевариванием крахмала, гомеостазом глюкозы и метаболическим синдромом.
Выводы
Амилаза слюны влияет на пероральное восприятие крахмала, преабсорбтивную метаболическую сигнализацию и реакцию глюкозы в плазме на проглоченный крахмал. Этот ранний контроль пищеварения приводит к различиям в эффективности метаболизма крахмала. Эти метаболические регуляторы, по-видимому, имеют достаточное значение для того, чтобы ген панкреатической амилазы копировался и экспрессировался в слюнных железах у приматов и грызунов независимо.У людей, которые с появлением сельского хозяйства значительно увеличили потребление крахмала, ген амилазы слюны значительно расширился как вариант числа копий. Тем не менее, в современном обществе люди, как правило, едят в среднем одинаковое количество крахмала, независимо от того, производят ли они высокий или низкий уровень амилазы слюны. Похоже, что это подвергает тех, кто производит низкий уровень амилазы слюны и потребляет большое количество крахмала, риску развития метаболического синдрома.
Благодарности
Мы благодарны Луизе Слэйд за полезные ранние обсуждения.
Сноски
Конфликт интересов Катрин Пейро де Гашон и Поль А.С. Бреслин заявляет, что у них нет конфликта интересов.
Права человека и животных и осознанное согласие Эта статья не содержит исследований с участием людей или животных, выполненных кем-либо из авторов.
Список литературы
Недавно опубликованные статьи, представляющие особый интерес, были отмечены как:
•• Важные
1.Дауэс С., Педерсен А.М., Вилла А и др. Функции слюны человека: обзор, спонсируемый Всемирным семинаром по оральной медицине VI. Arch Oral Biol 2015; 60 (6): 863–74. [PubMed] [Google Scholar] 2. Рул С. Научное исследование слюны в постпротеомную эпоху: от базы данных до основных функций. Эксперт Рев Протеомика 2012. 9 (1): 85–96. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Мацуо Р. Роль слюны в поддержании вкусовой чувствительности. Крит Рев Орал Биол Мед 2000. 11 (2): 216–29. [PubMed] [Google Scholar] 4.Хенкин Р.И., Гилл-младший-младший, Барттер ФК. Исследования вкусовых порогов у нормального человека и у пациентов с корковой недостаточностью надпочечников: роль кортикальных стероидов надпочечников и концентрации натрия в сыворотке. J Clin Invest 1963; 42 (5): 727. [Бесплатная статья PMC] [PubMed] [Google Scholar] 5. Power ML, Schulkin J. Опережающая физиологическая регуляция в биологии питания: ответы головной фазы. Аппетит. 2008. 50 (2): 194–206. [Бесплатная статья PMC] [PubMed] [Google Scholar] 6. Woods SC. Парадокс питания: как мы переносим пищу.Psychol Rev 1991; 98 (4): 488. [PubMed] [Google Scholar] 8. Scannapieco FA, Torres G, Levine MJ. Α-амилаза слюны: роль в формировании зубного налета и кариеса. Крит Рев Орал Биол Мед 1993. 4 (3): 301–7. [PubMed] [Google Scholar] 9. Якобсен Н., Мелваер К.Л., Хенстен-Петтерсен А. Некоторые свойства амилазы слюны: обзор литературы и некоторые наблюдения. J Dent Res 1972 г., 51 (2): 381–8. [PubMed] [Google Scholar] 10. Hall FF, Ratliff CR, Hayakawa T. и др. Субстратная дифференциация альфа-амилаз поджелудочной железы и слюны человека.Am J Dig Dis 1970. 15 (11): 1031–8. [PubMed] [Google Scholar] 11. Розенблюм JL, Ирвин CL, Alpers DH. Олигосахариды крахмала и глюкозы защищают активность амилазы слюнного типа при кислом pH. Am J Physiol Gastrointest Liver Physiol 1988; 254 (5): G775–80. [PubMed] [Google Scholar] 12. Hoebler C, Karinthi A, Devaux MF и др. Физические и химические превращения зерновой пищи при пероральном переваривании у людей. Br J Nutr 1998. 80 (05): 429–36. [PubMed] [Google Scholar] 13. Мандель А.Л., Пейро де Гашон С., Планк К.Л. и др.Индивидуальные различия в количестве копий гена AMY1, уровнях α-амилазы в слюне и восприятии перорального крахмала. PLoS One. 2010; 5 (10): e13352. [Бесплатная статья PMC] [PubMed] [Google Scholar] 14. Ляпис Т.Дж., Пеннер М.Х., Лим Дж. Доказательства того, что люди могут ощущать вкус полимеров глюкозы. Chem Senses 2014. 39 (9): 737–47. [PubMed] [Google Scholar] 15. Boehlke C, Zierau O, Hannig C. Амилаза слюны — фермент неспециализированных эврифагов. Arch Oral Biol 2015; 60 (8): 1162–76. [PubMed] [Google Scholar] 16. Самуэльсон Л.С., Филлипс Р.С., Суонберг Л.Дж.Структуры генов амилазы у приматов: вставки ретропозонов и эволюция промоторов. Мол Биол Эвол 1996. 13 (6): 767–79. [PubMed] [Google Scholar] 17. Chatterton RT, Vogelsong KM, Lu Y, Ellman AB, Hudgens GA. Альфа-амилаза слюны как мера эндогенной адренергической активности. Clin Physiol 1996. 16: 433–48. [PubMed] [Google Scholar] 18. Ehlert U, Kirschbaum C. Детерминанты суточного течения альфа-амилазы слюны. Психонейроэндокринология. 2007. 32 (4): 392–401. [PubMed] [Google Scholar] 20. Банк RA, Hettema EH, Muijs MA и др.Вариация числа копий гена и полиморфизма изоферментной системы амилазы слюны человека у кавказцев. Hum Genet 1992. 89 (2): 213–22. [PubMed] [Google Scholar] 21. Perry GH, Dominy NJ, Claw KG и др. Диета и эволюция изменения числа копий гена амилазы человека. Нат Жене 2007. 39 (10): 1256–60. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Ян З.М., Лин Дж., Чен Л.Х. и др. Роль копий AMY1 и экспрессии белка в активности α-амилазы слюны человека. Physiol Behav (физиологическое поведение) 2015; 138: 173–8. [PubMed] [Google Scholar] 23.Groot PC, Mager WH, Henriquez NV и др. Эволюция мультигенного семейства человеческой α-амилазы посредством неравных, гомологичных, меж- и внутрихромосомных кроссоверов. Геномика. 1990. 8 (1): 97–105. [PubMed] [Google Scholar] 24. Купер GM, Никерсон Д.А., Эйхлер Э. Мутационные и селективные эффекты на варианты числа копий в геноме человека. Нат Жене 2007; 39: S22–9. [PubMed] [Google Scholar] 25. Perry GH. Эволюционное значение вариации числа копий в геноме человека. Cytogenet Genome Res 2008. 123 (1–4): 283–7.[Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Карпентер Д., Дхар С., Митчелл Л. М. и др. Ожирение, переваривание крахмала и амилаза: связь между вариантами числа копий в генах амилазы слюны человека (AMY1) и поджелудочной железы (AMY2). Хум Мол Генет 2015; 24 (12): 3472–80. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Usher CL, Handsaker RE, Esko T, et al. Структурные формы локуса амилазы человека и их связь с SNP, гаплотипами и ожирением. Нат Жене 2015; 47 (8): 921–5. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28.Харди К., Брэнд-Миллер Дж., Браун К.Д. и др. Важность пищевых углеводов в эволюции человека. Q Rev Biol 2015; 90 (3): 251–68. [PubMed] [Google Scholar] 29. Симпсон Дж. В., Докси Д. Л., Браун Р. Значения изоамилазы в сыворотке у нормальных собак и собак с внешнесекреторной недостаточностью поджелудочной железы. Vet Res Commun 1984. 8 (1): 303–8. [PubMed] [Google Scholar] 30. ••. Axelsson E, Ratnakumar A, Arendt ML, et al. Геномный признак одомашнивания собак свидетельствует об их адаптации к диете, богатой крахмалом. Природа. 2013. 495 (7441): 360–4.[PubMed] [Google Scholar]Покажите доказательства увеличения функции гена AMY2B, а также генов MGAM и SGLT1 у собак. Арендт М., Фолл Т., Линдблад-То К. и др. Активность амилазы связана с количеством копий AMY2B у собак: последствия для приручения собак, диеты и диабета. Anim Genet 2014; 45 (5): 716–22. [Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Тинг К.Н., Розенберг М.П., Сноу К.М., Самуэльсон Л.К., Мейслер М.Х. Эндогенные ретровирусные последовательности необходимы для тканеспецифической экспрессии гена амилазы слюны человека.Genes Dev 1992; 6: 1457–65. [PubMed] [Google Scholar] 33. Meisler MH, Ting CN. Замечательная эволюционная история генов амилазы человека. Крит Рев Орал Биол Мед 1993. 4 (3): 503–509. [PubMed] [Google Scholar] 34. Эванс И.Д., Хайсман Д.Р., Элсон Э.Л. и др. Влияние амилазы слюны на вязкость суспензий желатинизированного крахмала и механические свойства гранул желатинизированного крахмала. J Sci Food Agric 1986. 37 (6): 573–90. [Google Scholar] 35. Склафани А., Ниссенбаум Дж. В., Вигорито М. Предпочтение крахмала у крыс.Neurosci Biobehav Rev 1987. 11 (2): 253–62. [PubMed] [Google Scholar] 36. Вигорито М., Склафани А. Онтогенез аппетита поликозы и сахарозы у новорожденных крыс. Дев Психобиол 1988. 21 (5): 457–65. [PubMed] [Google Scholar] 37. Рамирес И.С. Хеморецепция нерастворимого нелетучего вещества: вкус крахмала? Am J Physiol Regul Integr Comp Physiol 1991; 260 (1): R192–9. [PubMed] [Google Scholar] 38. Treesukosol Y, Smith KR, Spector AC. Поведенческие данные о вкусовом рецепторе полимера глюкозы, который не зависит от гетеродимера T1R2 + 3 на мышиной модели.J Neurosci Nurs 2011. 31 (38): 13527–34. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39. Zukerman S, Glendinning JI, Margolskee RF, et al. Вкусовой рецептор T1R3 имеет решающее значение для вкуса сахарозы, но не вкуса поликозы. Am J Physiol Regul Integr Comp Physiol 2009; 296 (4): R866–76. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Бреслин PAS, Beauchamp GK, Pugh EN. Моногевзия для фруктозы, глюкозы, сахарозы и мальтозы. Восприятие психофизики. 1996. 58 (3): 327–41. [PubMed] [Google Scholar] 41. Йи К.К., Сукумаран С.К., Кота Р. и др.Переносчики глюкозы и АТФ-зависимые K + (KATP) метаболические сенсоры присутствуют во вкусовых клетках, экспрессирующих вкусовые рецепторы 3 (T1r3) типа 1. Proc Natl Acad Sci 2011. 108 (13): 5431–6. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. ••. Сукумаран С.К., Йи К.К., Ивата С. и др. Ферменты α-глюкозидазы, экспрессируемые вкусовыми клетками, участвуют во вкусовых ответах на дисахариды. PNAS. 2016; 113 (21): 6035–40. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Доказательства экспрессии амилазы и мальтазы слюны во вкусовых клетках и окружающих язычных слюнных железах.43. Маргольски Р.Ф., Дайер Дж., Кокрашвили З. и др. T1R3 и густдуцин в кишечных сахарах для регуляции экспрессии котранспортера Na + -глюкозы 1. Proc Natl Acad Sci 2007. 104 (38): 15075–80. [Бесплатная статья PMC] [PubMed] [Google Scholar] 44. Клотье М., Жинграс Д., Бендаян М. Интернализация и трансцитоз ферментов поджелудочной железы слизистой оболочкой кишечника. J Histochem Cytochem 2006. 54 (7): 781–94. [PubMed] [Google Scholar] 45. Мериго Ф., Бенати Д., Чеккини М.П. и др. Экспрессия амилазы в клетках вкусовых рецепторов кольцевых сосочков крыс.Клеточная ткань Res 2009. 336 (3): 411–21. [PubMed] [Google Scholar] 46. Павлов И.П. Работа пищеварительных желез. Лондон: Charles Griffin Co Ltd; 1902. [Google Scholar] 47. Фаррелл JI. Вклад в физиологию желудочной секреции. Am J Physiol 1928; 85: 672–87. [Google Scholar] 48. Прешоу Р. М., Кук А. Р., Гроссман М. И.. Количественные аспекты реакции поджелудочной железы собак на закисление двенадцатиперстной кишки. Гастроэнтерология. 1966; 210: 629–34. [PubMed] [Google Scholar] 49. Powley TL. Вентромедиальный гипоталамический синдром, сытость и гипотеза головной фазы.Psychol Rev 1977; 84: 89–126. [PubMed] [Google Scholar] 50. Арен Б., Холст Дж. Дж. Головной инсулиновый ответ на прием пищи у людей зависит как от холинергических, так и нехолинергических механизмов и важен для постпрандиальной гликемии. Сахарный диабет. 2001; 50: 1030–8. [PubMed] [Google Scholar] 51. Мандель АЛ, Бреслин ПА. Высокая эндогенная активность амилазы слюны связана с улучшением гликемического гомеостаза после приема крахмала у взрослых. J Nutr 2012. 142 (5): 853–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 52.Глендиннинг Дж. И., Стано С., Холтер М. и др. Индуцированное сахаром высвобождение инсулина в головной фазе опосредуется T1r2 + T1r3-независимым путем передачи вкуса у мышей. Am J Physiol Regul Integr Comp Physiol 2015; 309 (5): R552–60. [Бесплатная статья PMC] [PubMed] [Google Scholar] 53. Уильямс Дж. А., Goldfine ID. Ось инсулин-панкреатический ацинар. Сахарный диабет. 1985. 34 (10): 980–6. [PubMed] [Google Scholar] 54. Schneyer CA, Schneyer LH. Амилаза в сыворотке крови, подчелюстной железе и печени крыс после введения пилокарпина или нормального кормления.Am J Physiol 1960; 198: 771–3. [PubMed] [Google Scholar] 55. Schrifin A, Tuchman L, Antopol W. Ответ амилазы крови на хлорид ацетил-b-метилхолина у кроликов. Proc Soc Exp Biol Med 1936; 34: 539–40. [Google Scholar] 56. Изенман Л., Либов С., Ротман С. Эндокринная секреция пищеварительных ферментов млекопитающих экзокринными железами. Am J Physiol Endocrinol Metab 1999; 276 (2): E223–32. [PubMed] [Google Scholar] 57. Пипер-Бигелоу С., Строкки А., Левитт, доктор медицины. Откуда берется сывороточная амилаза и куда она девается? Гастроэнтерол Клин Норт Ам 1990. 19 (4): 793–810.[PubMed] [Google Scholar] 58. Проктор Г.Б., Спрашивающий Б., Гаррет-младший. Сывороточная амилаза непаротидного и непанкреатического происхождения увеличивается при кормлении у крыс и может происходить из печени. Comp Biochem Physiol B Biochem Mol Biol 1991. 98 (4): 631–5. [PubMed] [Google Scholar] 59. Мессер М.И., декан Р.Т. Иммунохимическая взаимосвязь между α-амилазами печени, сыворотки, поджелудочной железы и околоушной железы крыс. Biochem J 1975. 151 (1): 17–22. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60. Хокари С., Миура К., Кояма И. и др. Экспрессия изоферментов α-амилазы в тканях крыс.Comp Biochem Physiol B Biochem Mol Biol 2003. 135 (1): 63–9. [PubMed] [Google Scholar] 61. МакГичин Р.Л., Абшиер В.М., О’Лири К. Влияние пуромицина и актиномицина D на уровни амилазы в сыворотке и печени у мышей, кроликов и крыс. Carbohydr Res 1978; 61 (1): 425–9. [PubMed] [Google Scholar] 62. Рор Г., Шееле Г. Судьба радиоактивных экзокринных белков поджелудочной железы, введенных в кровообращение крысы. Поглощение тканями и трансэпителиальная экскреция. Гастроэнтерол. 1983; 85 (5): 991–1002. [PubMed] [Google Scholar] 63.••. Фалчи М., Мустафа Дж. С., Такусис П. и др. Низкое количество копий гена амилазы слюны предрасполагает к ожирению. Нат Жене. 2014. 46 (5): 492–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Первая статья, показывающая положительную связь между AMY CN и ожирением.64. Вильякайнен Х., Андерссон-Ассарссон Й.С., Арменио М. и др. Низкое количество копий локуса AMY1 связано с ранним началом женского ожирения в Финляндии. PLoS One. 2015; 10 (7): e0131883. [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Мехиа-Бенитес М.А., Боннефонд А., Йенго Л. и др.Благоприятное влияние большого количества копий гена амилазы AMY1 слюны на риск ожирения у мексиканских детей. Диабетология. 2015; 58 (2): 290–4. [PubMed] [Google Scholar] 66. Марковеккио М.Л., Флорио Р., Вергинелли Ф. и др. Низкое количество копий гена AMY1 связано с повышенным индексом массы тела у мальчиков препубертатного возраста. PLoS One. 2016; 11 (5): e0154961. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67. Usher CL, McCarroll SA. Сложные и мультиаллельные вариации числа копий при заболеваниях человека. Краткая функциональная геномика.2015; elv02814: 329–38. [Бесплатная статья PMC] [PubMed] [Google Scholar] 68. Йонг Р.Ю., Мустаффа С.А., Васан П.С. и др. Сложное изменение числа копий AMY1 не связано с ожирением в двух восточноазиатских когортах. Хум Мутат 2016; 37: 669–78. [PubMed] [Google Scholar] 69. ••. Накадзима К. Низкая сывороточная амилаза и ожирение, диабет и метаболический синдром: новая интерпретация. Всемирный диабет J 2016; 7 (6): 112. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Интересный обзор о низком уровне амилазы в сыворотке и метаболическом синдроме.70. Skrha J, Stĕpán J. Клиническое значение определения изофермента амилазы. Acta Univ Carol Med Monogr. 1986; 120: 1–81. [PubMed] [Google Scholar] 71. Дандона П., Фридман Д. Б., Фу Й, Перкинс Дж., Катрак А., Михайлидис Д. П. и др. Внешнесекреторная функция поджелудочной железы при сахарном диабете. Дж. Клин Патол 1984. 37: 302–6. [Бесплатная статья PMC] [PubMed] [Google Scholar] 72. Swislocki A, Noth R, Hallstone A, Kyger E, Triadafilopoulos G. Стимулируемое секретином высвобождение амилазы в кровь нарушается при сахарном диабете 1 типа.Horm Metab Res 2005; 37: 326–30. [PubMed] [Google Scholar] 73. Ли Дж. Г., Пак С. В., Чо Б. М. и др. Сывороточная амилаза и риск метаболического синдрома у взрослых корейцев. Clin Chim Acta 2011; 412 (19): 1848–53. [PubMed] [Google Scholar] 74. Накадзима К., Немото Т., Мунеюки Т. и др. Низкий уровень амилазы в сыворотке крови в связи с метаболическим синдромом и диабетом: исследование на уровне сообщества. Кардиоваск Диабетол. 2011; 10 (1): 34. [Бесплатная статья PMC] [PubMed] [Google Scholar] 75. Накадзима К., Мунэюки Т., Мунаката Х. и др. Возвращаясь к кардиометаболическому значению сывороточной амилазы.BMC Res Примечания 2011; 4 (1): 419. [Бесплатная статья PMC] [PubMed] [Google Scholar] 76. Мунэюки Т., Накадзима К., Аоки А. и др. Скрытые ассоциации низкого уровня амилазы в сыворотке со сниженным уровнем инсулина в плазме и инсулинорезистентностью у бессимптомных взрослых людей среднего возраста. Кардиоваск Диабетол. 2012. 11 (80): 10–186. [Бесплатная статья PMC] [PubMed] [Google Scholar] 77. Чжао Ю., Чжан Дж., Чжан Дж. И др. Метаболический синдром и диабет связаны с низким уровнем сывороточной амилазы у бессимптомной популяции китайцев. Сканд Дж Клин Лаб Инвест 2014; 74 (3): 235–9.[PubMed] [Google Scholar] 78. Mossner J, Logsdon CD, Goldfine ID и др. Регулирование инсулиновых рецепторов ацинарных клеток поджелудочной железы инсулином. Am J Physiol Gastrointest Liver Physiol. 1984; 247 (2): G155–60. [PubMed] [Google Scholar] 79. Schneeman BO, Inman MD, Stern JS. Активность ферментов поджелудочной железы у тучных и худых крыс Zucker: исследование развития. J Nutr 1983; 113 (4): 921–5. [PubMed] [Google Scholar] 80. Картер Д.А., Вобкен Д.Д., Диксит П.К. и др. Иммунореактивный инсулин в слюнных железах крыс и его зависимость от возраста и уровня инсулина в сыворотке крови.Эксп Биол Мед 1995. 209 (3): 245–50. [PubMed] [Google Scholar] 81. Роча Е.М., Карвалью С.Р., Саад М.Дж. и др. Влияние старения на сигнальную систему инсулина в слезных и слюнных железах крыс. Acta Ophthalmol Scand. 2003. 81 (6): 639–45. [PubMed] [Google Scholar]
Амилаза — StatPearls — NCBI Bookshelf
Введение
Амилаза — это пищеварительный фермент, который преимущественно секретируется поджелудочной железой и слюнными железами и обнаруживается в других тканях в очень малых количествах [1]. Амилаза была впервые описана в начале 1800-х годов и считается одним из первых ферментов в истории, подвергшихся научным исследованиям.Первоначально он назывался диастаста , но позже был переименован в амилазу в начале 20 века [2].
Основная функция амилаз — гидролиз гликозидных связей в молекулах крахмала, превращая сложные углеводы в простые сахара. Существует три основных класса ферментов амилазы; Альфа-, бета- и гамма-амилазы, каждая из которых действует на разные части молекулы углеводов. Альфа-амилазу можно найти у людей, животных, растений и микробов. Бета-амилаза содержится в микробах и растениях.Гамма-амилаза содержится у животных и растений. Эта статья будет посвящена альфа-амилазе и ее применению [3].
В 1908 году исследование Вольгемута выявило присутствие амилазы в моче, что впоследствии привело к использованию амилазы в качестве диагностического лабораторного теста. Амилаза — это обычно назначаемый тест наряду с липазой, особенно при подозрении на острый панкреатит [2].
Этиология и эпидемиология
Хотя повышенный уровень амилазы или гиперамилаземия в основном наблюдается при заболеваниях слюнной железы и поджелудочной железы, они также могут наблюдаться при различных заболеваниях, включая желудочно-кишечные заболевания, злокачественные новообразования и гинекологические заболевания (см. Таблицу ниже).Снижение уровня амилазы наблюдается при преэклампсии, муковисцидозе и заболеваниях печени [4] [5] [6] [1] [7] [8] [9] [10] [11] ».
Повышенный уровень амилазы может наблюдаться при различных состояниях, включая заболевание поджелудочной железы, заболевание слюнной железы, снижение метаболического клиренса, кишечное заболевание и макроамилаземию (обсуждается ниже). Хроническое повышение уровня амилазы также может наблюдаться при редком состоянии, называемом доброкачественной гиперферментемией поджелудочной железы или синдромом Галло. Пациенты обычно здоровы и не имеют заболеваний поджелудочной железы.Этиология заболевания неизвестна [3] [12]. У 26 (12,5%) из 208 пациентов с острой абдоминальной болью, не связанной с поджелудочной железой, при поступлении был повышен уровень амилазы в сыворотке крови [13]. Аномально повышенный уровень амилазы наблюдается у 35% пациентов с заболеванием печени [14]. В 16-25% случаев диабетического кетоацидоза наблюдается повышенный уровень амилазы [15] [11]. В группе из 74 пациентов с хирургически резектабельным раком легкого у 13 выявлена гиперамилаземия [16].
Патофизиология
Основная функция амилазы — катализировать гидролиз крахмала до сахаров.Было обнаружено несколько изоформ амилазы, но наиболее распространенными из них являются панкреатическая амилаза (P-амилаза) и амилаза слюны (S-амилаза). P-амилаза специфически обнаруживается в поджелудочной железе и синтезируется ацинарными клетками, затем секретируется в желудочно-кишечный тракт. тракт. S-амилаза в основном вырабатывается в слюнных железах, но также может вырабатываться в яичниках, маточных трубах, желудочно-кишечном тракте, легких, поперечно-полосатых мышцах и злокачественных новообразованиях [17] [18]. Амилаза сыворотки строго регулируется в организме.Существует баланс между скоростью производства и скоростью очистки. Повышение уровня амилазы может быть связано с увеличением панкреатической или внепанкреатической продукции или снижением скорости клиренса [19].
Амилаза имеет молекулярную массу от 50 до 55 кДа, оптимальный физиологический pH от 6,7 до 7,0 и требует ионов кальция и хлорида для оптимальной активности фермента. Небольшой размер позволяет легко фильтровать его через клубочки [3]. Амилаза выводится через почки и ретикулоэндотелиальную систему [1].
Диагностические тесты
В течение многих лет амилаза в основном использовалась для диагностики острого панкреатита. Амилазу можно измерить с помощью анализа крови или мочи. Анализ мочи может быть выполнен путем сбора чистой уловки или 24-часового сбора мочи. Нормальный диапазон сывороточной амилазы различается от лаборатории к лаборатории [3]. Клинически важно дифференцировать амилазу поджелудочной железы от других изоформ амилазы. Повышенный уровень амилазы при нормальной липазе может указывать на проблему вне поджелудочной железы [20].
Мешающие факторы
Лекарства, включая аспирин, морфин, антиретровирусные и эстрогеносодержащие препараты, могут влиять на уровень амилазы в сыворотке крови. Макроамилаземия, как упоминалось выше, является еще одной хорошо известной причиной повышенного уровня амилазы в сыворотке. В этом состоянии фермент образует комплекс с белками, такими как иммуноглобулины и полисахариды [21]. Из-за большого размера макромолекулярного комплекса почечный клиренс снижается, вызывая стойкое повышение уровня амилазы [22] [7].Макроамилаземия может возникать у здоровых людей или при заболеваниях, включая аутоиммунные заболевания, диабет и рак, например, рак щитовидной железы [23] [24].
Мочевая амилаза обычно является нормальной макроамилаземией и может помочь исключить заболевание. Это состояние встречается у 1 процента здоровых людей и 2,5 процентов людей с гиперамилаземией. Макроамилаземию следует рассматривать у бессимптомных пациентов с повышенным уровнем сывороточной амилазы. Требуемого лечения этого состояния не существует [21].Предыдущие исследования показали, что макроамилаземия в основном наблюдалась у пациентов с нарушенным гуморальным иммунитетом, таких как целиакия, ВИЧ-инфекция, язвенный колит, ревматоидный артрит и множественная миелома [25].
Результаты, отчетность, важные выводы
В настоящее время не существует международно установленного референсного диапазона для уровней амилазы. Референсный диапазон может достигать 20-300 Ед / л. Однако повышенные уровни амилазы, превышающие верхний предел нормы более чем в три раза, убедительно подтверждают диагноз острого панкреатита.Менее этого часто связано с другими состояниями [26]. Аномально низкие уровни амилазы встречаются нечасто, но могут наблюдаться при муковисцидозе, хроническом панкреатите, сахарном диабете, ожирении и курении [8] [27]. Клиницисты должны знать о таких причинах, чтобы помочь интерпретировать низкую активность амилазы у пациентов [8].
Клиническая значимость
Амилаза в основном используется для диагностики заболеваний поджелудочной железы. Амилаза — это обычно измеряемый фермент из-за доступности недорогих, легко автоматизированных методов [18].Хотя амилаза является чувствительным индикатором острого панкреатита, она не специфична, поскольку может повышаться при некоторых состояниях, не связанных с поджелудочной железой. Панкреатит можно определить по двум из трех следующих критериев: боль в животе, уровни сывороточной амилазы и / или липазы более чем в три раза превышающие верхний предел нормы, а также визуализация брюшной полости, подтверждающая характерные признаки панкреатита [28]. Таким образом, его клиническое значение было поставлено под сомнение. В случаях повышенного уровня амилазы при незначительной поддержке панкреатита следует рассмотреть альтернативные причины гиперамилаземии [20].Амилаза бесполезна для прогнозирования тяжести острого панкреатического эпизода или мониторинга состояния [29].
Ингибиторы амилазы, такие как акарбоза, использовались при лечении диабета 2 типа, и было показано, что они снижают уровень гемоглобина A1C и пик глюкозы после приема пищи [30]. Также было показано, что акарбоза улучшает ремиссию демпинг-синдрома у пациентов с ожирением [31]. Также было показано, что препарат повышает риск сердечно-сосудистых заболеваний, замедляя утолщение сонных артерий [32].Повышенную амилазу можно увидеть в самых разных условиях. Для клиницистов важно иметь четкий, поэтапный подход при обнаружении гиперамилаземии. Это поможет избежать ненужной госпитализации и отсроченного или несоответствующего лечения [22] [7].
Улучшение результатов команды здравоохранения
Медицинские работники должны эффективно общаться, когда результаты лабораторных исследований указывают на непанкреатическую причину. Также важно знать различные условия, которые могут повлиять на уровень амилазы [18].Липаза обычно предпочтительнее амилазы из-за более высокой специфичности. Липаза обычно остается повышенной до двух недель, в то время как концентрация амилазы остается повышенной до пяти дней. Следовательно, амилаза не так клинически полезна, как липаза, если есть задержка между появлением симптомов и временем обращения пациента за медицинской помощью [26] [29]. Американский колледж гастроэнтерологии в 2013 году отмечает, что совместный заказ липазы и амилазы не является рентабельным и нецелесообразным. Он также утверждает, что заказ только амилазы ненадежен и не увеличивает диагностическую эффективность по сравнению с липазой [33].Если есть доступ к тесту на липазу, добавление амилазы увеличивает стоимость для пациента и не имеет большого значения для подтверждения диагноза панкреатита [34] [26].
Повышение квалификации / Контрольные вопросы
Рисунок
Состояния, связанные с высоким уровнем амилазы в сыворотке крови. Предоставлено Ololade Akinfemiwa
Ссылки
- 1.
- Pieper-Bigelow C, Strocchi A, Levitt MD. Откуда берется сывороточная амилаза и куда она девается? Гастроэнтерол Clin North Am.1990 декабрь; 19 (4): 793-810. [PubMed: 1702756]
- 2.
- Zakowski JJ, Bruns DE. Биохимия изоферментов альфа-амилазы человека. Критик Rev Clin Lab Sci. 1985; 21 (4): 283-322. [PubMed: 2578342]
- 3.
- Аззопарди Э., Ллойд С., Тейшейра С.Р., Конлан Р.С., Уитакер И.С. Клиническое применение амилазы: новые перспективы. Операция. 2016 июл; 160 (1): 26-37. [PubMed: 27117578]
- 4.
- Corlette MB, Dratch M, Sorger K. Повышение уровня амилазы, связанное с новообразованием яичников.Гастроэнтерология. 1978 май; 74 (5, п.1): 907-9. [PubMed: 640346]
- 5.
- Хаякава Т., Камея А., Мизуно Р., Нода А., Кондо Т., Хирабаяси Н. Гиперамилаземия с папиллярной серозной цистаденокарциномой яичника. Рак. 1984, 15 октября; 54 (8): 1662-5. [PubMed: 6206939]
- 6.
- Катаяма С., Икеучи М., Канадзава Ю., Аканума И., Косака К., Такеучи Т., Накаяма Т. Рак легких, продуцирующий амилазу: отчет о клиническом случае и обзор литературы. Рак. 1981 декабрь 01; 48 (11): 2499-502. [PubMed: 6170423]
- 7.
- Шривастава Р., Фрейзер С., Джентльмен Д., Джеймисон Л.А., Мерфи М.Дж. Гиперамиласемия: не обычные подозреваемые. BMJ. 2005 октября 15; 331 (7521): 890-1. [Бесплатная статья PMC: PMC1255801] [PubMed: 16223823]
- 8.
- Теруи К., Хишики Т., Сайто Т., Мицунага Т., Наката М., Йошида Х. Соотношение амилаза / креатинин мочи (uAm / uCr) — a менее инвазивный параметр для лечения гиперамилаземии. BMC Pediatr. 2013 13 декабря; 13: 205. [Бесплатная статья PMC: PMC3878803] [PubMed: 24330759]
- 9.
- Nitsche CJ, Jamieson N, Lerch MM, Mayerle JV. Панкреатит, индуцированный лекарствами. Лучшие Практики Рес Клин Гастроэнтерол. 2010 Апрель; 24 (2): 143-55. [PubMed: 20227028]
- 10.
- Андерсен В., Сонне Дж., Андерсен М. Спонтанные сообщения о лекарственном панкреатите в Дании с 1968 по 1999 год. Eur J Clin Pharmacol. 2001 сентябрь; 57 (6-7): 517-21. [PubMed: 11699619]
- 11.
- Muniraj T., Dang S, Pitchumoni CS. ПАНКРЕАТИТ ИЛИ НЕТ? — Повышенный уровень липазы и амилазы у пациентов в ОИТ.J Crit Care. 2015 декабрь; 30 (6): 1370-5. [PubMed: 26411523]
- 12.
- Rosell-Camps A, Martínez-Cepas P, Riera-Llodrá JM, Ventura-Espejo L, Riutord-Arrom N. Доброкачественная панкреатическая гиперензимемия, также известная как синдром Галло. Lab Med. 2020 Июл 08; 51 (4): 423-425. [PubMed: 31860089]
- 13.
- Чейз С.В., Баркер Д.Е., Рассел В.Л., Бернс Р.П. Амилаза и липаза сыворотки при оценке острой боли в животе. Am Surg. 1996 декабрь; 62 (12): 1028-33. [PubMed: 8955242]
- 14.
- Pezzilli R, Andreone P, Morselli-Labate AM, Sama C, Billi P, Cursaro C, Barakat B, Gramenzi A, Fiocchi M, Miglio F, Bernardi M. Концентрации ферментов поджелудочной железы в сыворотке при хронических вирусных заболеваниях печени. Dig Dis Sci. 1999 Февраль; 44 (2): 350-5. [PubMed: 10063922]
- 15.
- Rizvi AA. Амилаза и липаза сыворотки при диабетическом кетоацидозе. Уход за диабетом. 2003 ноя; 26 (11): 3193-4. [PubMed: 14578269]
- 16.
- Lenler-Petersen P, Grove A, Brock A, Jelnes R. Альфа-амилаза при операбельном раке легкого.Eur Respir J. 1994 May; 7 (5): 941-5. [PubMed: 8050552]
- 17.
- Линдберг Т., Скуде Г. Амилаза в материнском молоке. Педиатрия. 1982 Август; 70 (2): 235-8. [PubMed: 6179037]
- 18.
- Логи Дж. Дж., Кокс М., Шарки Дж., Уильямс А. Междисциплинарный подход к необычной причине гиперамиласемии. BMJ Case Rep. 2015 6 июля; 2015 [Бесплатная статья PMC: PMC4493173] [PubMed: 26150631]
- 19.
- Peyrot des Gachons C, Breslin PA. Амилаза слюны: пищеварение и метаболический синдром.Curr Diab Rep.2016 Октябрь; 16 (10): 102. [Бесплатная статья PMC: PMC6825871] [PubMed: 27640169]
- 20.
- Оцуки М. [Полезность определения изофермента амилазы для диагностики заболеваний поджелудочной железы]. Нихон Риншо. 1995 Май; 53 (5): 1184-91. [PubMed: 7541479]
- 21.
- Klonoff DC. Макроамилаземия и другие ферментные нарушения, связанные с иммуноглобулином. West J Med. 1980 ноя; 133 (5): 392-407. [Бесплатная статья PMC: PMC1272350] [PubMed: 6162278]
- 22.
- Wiederkehr JC, Wiederkehr BA, Wiederkehr HA, Carvalho CA.Неспецифическая гиперамилаземия: история болезни. JOP. 2013 10 января; 14 (1): 74-6. [PubMed: 23306339]
- 23.
- Кутоло М., Солли А., Бароне А., Пиччотто А., Мангравити С., Сериоло Б., Аккардо С. Макроамилаземия: возможная причина необъяснимой гиперамилаземии при ревматоидном артрите. Br J Rheumatol. 1995 Март; 34 (3): 290-2. [PubMed: 7537158]
- 24.
- Ishizuka T, Yasuda K, Kajita K, Sakata S, Kimura M, Ito Y, Miura K. Макроамилаземия, связанная с раком щитовидной железы, повышенный уровень тироксин-связывающего глобулина (TBG) в сыворотке, хронический панкреатит и полипоз желудочно-кишечного тракта.Gastroenterol Jpn. 1986 августа; 21 (4): 385-90. [PubMed: 2429888]
- 25.
- Чо С.И., Ли А., Ли Х.Дж., Су Дж. Т.. Перекрывающееся присутствие макроамилаземии и гиперамилаземии при остром панкреатите. Корейский J Lab Med. 2011 Апрель; 31 (2): 98-100. [Бесплатная статья PMC: PMC3116008] [PubMed: 21474984]
- 26.
- Rompianesi G, Hann A, Komolafe O, Pereira SP, Davidson BR, Gurusamy KS. Амилаза и липаза сыворотки, трипсиноген и амилаза в моче для диагностики острого панкреатита. Кокрановская база данных Syst Rev.2017 21 апреля; 4: CD012010. [Бесплатная статья PMC: PMC6478262] [PubMed: 28431198]
- 27.
- Oh HC, Kwon CI, El Hajj II, Easler JJ, Watkins J, Fogel EL, McHenry L., Sherman S, Zimmerman MK, Lehman GA. Низкие значения амилазы и липазы поджелудочной железы в сыворотке крови — простые и полезные предикторы для диагностики хронического панкреатита. Кишечная печень. 2017 15 ноября; 11 (6): 878-883. [Бесплатная статья PMC: PMC5669605] [PubMed: 2
12]
- 28.
- Мунирадж Т., Гаджендран М., Тирувенгадам С., Рагурам К., Рао С., Деварадж П.Острый панкреатит. Dis Mon. 2012 Март; 58 (3): 98-144. [PubMed: 22370054]
- 29.
- Basnayake C, Ratnam D. Анализы крови на острый панкреатит. Aust Prescr. 2015 август; 38 (4): 128-30. [Бесплатная статья PMC: PMC4653980] [PubMed: 26648641]
- 30.
- Макиннес Н., Смит А., Отто Р., Вандермей Дж., Пунтхаки З., Шерифали Д., Баласубраманиан К., Холл С., Герштейн ХК. Пилотирование стратегии ремиссии при диабете 2 типа: результаты рандомизированного контролируемого исследования. J Clin Endocrinol Metab. 2017 г. 01 мая; 102 (5): 1596-1605.[PubMed: 28324049]
- 31.
- Каделиани Ф.А., Сильва О.С. Акарбоза способствует ремиссии как раннего, так и позднего демпинг-синдромов у постбариатрических пациентов. Синдр диабета, метаболизма, ожирения. 2016; 9: 443-446. [Бесплатная статья PMC: PMC5153290] [PubMed: 27994477]
- 32.
- Ямагиши С., Мацуи Т., Уэда С., Фуками К., Окуда С. Клиническая полезность акарбозы, ингибитора альфа-глюкозидазы при кардиометаболических расстройствах. Curr Drug Metab. 2009 Февраль; 10 (2): 159-63. [PubMed: 19275550]
- 33.
- Barbieri JS, Riggio JM, Jaffe R. Тестирование амилазы при боли в животе и подозрении на острый панкреатит. J Hosp Med. 2016 Май; 11 (5): 366-8. [PubMed: 27160507]
- 34.
- Beauregard JM, Lyon JA, Slovis C. Использование литературы для оценки диагностических тестов: амилаза или липаза для диагностики острого панкреатита? J Med Libr Assoc. 2007 Апрель; 95 (2): 121-6. [Бесплатная статья PMC: PMC1852619] [PubMed: 17443244]
4.2: Переваривание и усвоение углеводов
Цели обучения
- Узнайте о переваривании и всасывании углеводов
Ото рта к желудку
Механическое и химическое переваривание углеводов начинается во рту.Жевание, также известное как пережевывание, измельчает углеводную пищу на все более мелкие кусочки. Слюнные железы в полости рта выделяют слюну, которая покрывает частицы пищи. Слюна содержит фермент амилазу слюны. Этот фермент разрывает связи между мономерными сахарными звеньями дисахаридов, олигосахаридов и крахмалов. Амилаза слюны расщепляет амилозу и амилопектин на более мелкие цепи глюкозы, называемые декстринами и мальтозой. Повышенная концентрация мальтозы во рту в результате механического и химического разложения крахмала в цельнозерновых продуктах усиливает их сладость.Только около пяти процентов крахмала расщепляется во рту. (Это хорошо, так как большее количество глюкозы во рту приведет к еще большему разложению зубов.) Когда углеводы достигают желудка, химического разложения не происходит, потому что фермент амилаза не действует в кислых условиях желудка. Но механическое разрушение продолжается — сильные перистальтические сокращения желудка смешивают углеводы в более однородную смесь химуса.
Рисунок \ (\ PageIndex {1} \): слюнные железы во рту.Слюнные железы выделяют слюнную амилазу, которая начинает химический распад углеводов, разрывая связи между мономерными сахарными звеньями.От желудка до тонкого кишечника
Химус постепенно выходит в верхнюю часть тонкой кишки. При попадании химуса в тонкий кишечник поджелудочная железа выделяет панкреатический сок через проток. Этот панкреатический сок содержит фермент панкреатическую амилазу, которая снова запускает расщепление декстринов на более короткие и более короткие углеводные цепи.Кроме того, ферменты секретируются клетками кишечника, выстилающими ворсинки. Эти ферменты, известные под общим названием дисахаридаза, представляют собой сахаразу, мальтазу и лактазу. Сахараза расщепляет сахарозу на молекулы глюкозы и фруктозы. Мальтаза разрывает связь между двумя глюкозными единицами мальтозы, а лактаза разрывает связь между галактозой и глюкозой. После того, как углеводы химически расщепляются на отдельные сахарные единицы, они переносятся внутрь кишечных клеток.
Когда людям не хватает фермента лактазы, лактоза не расщепляется в достаточной степени, что приводит к состоянию, называемому непереносимостью лактозы.Непереваренная лактоза перемещается в толстую кишку, где бактерии могут ее переваривать. Бактериальное переваривание лактозы приводит к образованию газов, вызывающих симптомы диареи, вздутия живота и спазмов в животе. Непереносимость лактозы обычно возникает у взрослых и связана с расой. Национальный информационный центр по заболеваниям пищеварительной системы утверждает, что афроамериканцы, латиноамериканцы, американские индейцы и американцы азиатского происхождения имеют гораздо более высокие показатели непереносимости лактозы, в то время как у выходцев из Северной Европы — меньше всего.[1] Большинство людей с непереносимостью лактозы могут переносить некоторое количество молочных продуктов в своем рационе. Выраженность симптомов зависит от количества потребляемой лактозы и степени лактазной недостаточности.
Поглощение: переход к кровотоку
Клетки тонкого кишечника имеют мембраны, которые содержат много транспортных белков, чтобы доставить моносахариды и другие питательные вещества в кровь, где они могут быть распределены по остальному телу. Первым органом, получающим глюкозу, фруктозу и галактозу, является печень.Печень забирает их и превращает галактозу в глюкозу, расщепляет фруктозу на еще более мелкие углеродсодержащие единицы и либо хранит глюкозу в виде гликогена, либо экспортирует ее обратно в кровь. Сколько глюкозы печень экспортирует в кровь, находится под гормональным контролем, и вскоре вы обнаружите, что даже сама глюкоза регулирует ее концентрацию в крови.
Рисунок \ (\ PageIndex {2} \): Переваривание углеводов. Переваривание углеводов начинается во рту и наиболее обширно в тонком кишечнике.Полученные моносахариды всасываются в кровоток и транспортируются в печень.Поддержание уровня глюкозы в крови: поджелудочная железа и печень
Уровень глюкозы в крови строго контролируется, поскольку слишком много или слишком мало глюкозы в крови может иметь последствия для здоровья. Глюкоза регулирует свой уровень в крови посредством процесса, называемого отрицательной обратной связью. Повседневный пример отрицательной обратной связи — ваша духовка, потому что в ней есть термостат. Когда вы устанавливаете температуру для приготовления вкусной домашней запеканки с лапшой на 375 ° F, термостат определяет температуру и отправляет электрический сигнал, чтобы включить элементы и разогреть духовку.Когда температура достигает 375 ° F, термостат определяет температуру и отправляет сигнал на выключение элемента. Точно так же ваше тело определяет уровень глюкозы в крови и поддерживает «температуру» глюкозы в целевом диапазоне. Термостат глюкозы расположен внутри клеток поджелудочной железы. После приема пищи, содержащей углеводы, уровень глюкозы в крови повышается.
Инсулин-секретирующие клетки поджелудочной железы ощущают повышение уровня глюкозы в крови и выделяют в кровь гормон инсулин.Инсулин посылает сигнал клеткам организма удалить глюкозу из крови, транспортируя ее в клетки различных органов по всему телу и используя ее для производства энергии. В случае мышечной ткани и печени инсулин посылает биологическое сообщение о хранении глюкозы в виде гликогена. Присутствие инсулина в крови означает для организма, что глюкоза доступна в качестве топлива. Поскольку глюкоза транспортируется в клетки по всему телу, уровень глюкозы в крови снижается. Инсулин имеет противоположный гормон, называемый глюкагоном.Клетки поджелудочной железы, секретирующие глюкагон, чувствуют падение уровня глюкозы и, в ответ, высвобождают глюкагон в кровь. Глюкагон связывается с клетками организма, чтобы перестать использовать всю глюкозу. В частности, он сигнализирует печени о расщеплении гликогена и высвобождении накопленной глюкозы в кровь, чтобы уровень глюкозы оставался в пределах целевого диапазона, а все клетки получали необходимое топливо для правильного функционирования.
Рисунок \ (\ PageIndex {3} \): Регулирование уровня глюкозы.Остаточные углеводы: толстый кишечник
Почти все углеводы, за исключением пищевых волокон и резистентных крахмалов, эффективно перевариваются и усваиваются организмом.Некоторые из оставшихся неперевариваемых углеводов расщепляются ферментами, выделяемыми бактериями в толстом кишечнике. Продуктами бактериального переваривания этих медленно высвобождающихся углеводов являются короткоцепочечные жирные кислоты и некоторые газы. Короткоцепочечные жирные кислоты используются бактериями для выработки энергии и роста, выводятся с калом или абсорбируются клетками толстой кишки, при этом небольшое количество транспортируется в печень. Клетки толстой кишки используют короткоцепочечные жирные кислоты для поддержки некоторых из своих функций.Печень также может метаболизировать короткоцепочечные жирные кислоты в клеточную энергию. Выход энергии из пищевых волокон составляет около 2 килокалорий на грамм для человека, но сильно зависит от типа волокна, при этом растворимые волокна и устойчивые крахмалы дают больше энергии, чем нерастворимые волокна. Поскольку пищевые волокна перевариваются в желудочно-кишечном тракте намного меньше, чем другие типы углеводов (простые сахара, много крахмалов), повышение уровня глюкозы в крови после их употребления в пищу происходит меньше и медленнее. Эти физиологические характеристики продуктов с высоким содержанием клетчатки (т.е. цельнозерновые) связаны с уменьшением набора веса и снижением риска хронических заболеваний, таких как диабет 2 типа и сердечно-сосудистые заболевания.
Рисунок \ (\ PageIndex {4} \): Обзор переваривания углеводов.Углеводный пир
Вы пришли к бабушке на семейный ужин и только что съели поросенка калуа, белый рис, сладкий картофель, мак-салат, длинный рис с курицей и горячую сладкую булочку с маслом. Менее чем через час вы завершаете это кусочком пирога с хаупиа, а затем ложитесь на диван и смотрите телевизор.«Гормон изобилия», инсулин, отвечает на зов питательных веществ. Инсулин посылает физиологическое сообщение о том, что глюкозы в крови много, поэтому клетки могут поглощать ее и либо использовать, либо хранить. Результатом этого гормонального сообщения является максимальное увеличение запасов гликогена, а весь избыток глюкозы, белка и липидов откладывается в виде жира.
Рисунок \ (\ PageIndex {5} \): Углеводный пир.Типичная американская трапеза на День благодарения содержит много продуктов с высоким содержанием углеводов, большинство из которых — простые сахара и крахмалы.Эти виды углеводной пищи быстро перевариваются и усваиваются. Уровень глюкозы в крови быстро повышается, вызывая скачок уровня инсулина. Напротив, продукты, содержащие большое количество клетчатки, похожи на капсулы с замедленным высвобождением сахара. Измерение влияния углеводсодержащей пищи на уровень глюкозы в крови называется гликемическим ответом.
Гликемический индекс
Были измерены гликемические реакции различных пищевых продуктов, а затем они были ранжированы по сравнению с эталонным продуктом, обычно ломтиком белого хлеба или просто чистой глюкозой, для получения числового значения, называемого гликемическим индексом (ГИ).Продукты с низким ГИ не повышают уровень глюкозы в крови ни так быстро, как продукты с более высоким ГИ. В эпидемиологических и клинических исследованиях было показано, что диета, состоящая из продуктов с низким ГИ, увеличивает потерю веса и снижает риск ожирения, диабета 2 типа и сердечно-сосудистых заболеваний [2].
Таблица \ (\ PageIndex {1} \): Гликемический индекс: продукты питания по сравнению с глюкозой.
| Продукты питания | Значение GI |
|---|---|
| Продукты с низким ГИ (<55) | |
| Яблоко, сырое | 36 |
| Апельсин, сырой | 43 |
| Банан, сырой | 51 |
| Манго, сырое | 51 |
| Морковь вареная | 39 |
| Таро вареное | 53 |
| Кукурузная лепешка | 46 |
| Спагетти (цельнозерновой) | 37 |
| Печеные бобы | 48 |
| Соевое молоко | 34 |
| Обезжиренное молоко | 37 |
| Цельное молоко | 39 |
| Йогурт фруктовый | 41 |
| Йогурт простой | 14 |
| Мороженое | 51 |
| Продукты со средним гликемическим индексом (56–69) | |
| Ананас сырой | 59 |
| дыня | 65 |
| Картофельное пюре | 70 |
| Цельнозерновой хлеб | 69 |
| Коричневый рис | 55 |
| Сырная пицца | 60 |
| Сладкий картофель, вареный | 63 |
| Макароны с сыром | 64 |
| Попкорн | 65 |
| Продукты с высоким ГИ (70 и выше) | |
| Банан (перезрелый) | 82 |
| Кукурузные чипсы | 72 |
| Крендели | 83 |
| Белый хлеб | 70 |
| Рис белый | 72 |
| Бублик | 72 |
| Рисовое молоко | 86 |
| Cheerios | 74 |
| Изюмовые отруби | 73 |
| Фруктовый рулет | 99 |
| Gatorade | 78 |
Чтобы узнать о гликемическом индексе различных пищевых продуктов, посетите сайт http: // www.mendosa.com/gilists.htm.
Тип углеводов в пище влияет на ГИ, а также на содержание жира и клетчатки. Повышенное содержание жира и клетчатки в пищевых продуктах увеличивает время, необходимое для пищеварения, и замедляет скорость опорожнения желудка в тонкий кишечник, что в конечном итоге снижает ГИ. Обработка и приготовление пищи также влияет на ГИ продуктов, повышая их усвояемость. Достижения в технологиях обработки пищевых продуктов и высокий потребительский спрос на удобные полуфабрикаты в Соединенных Штатах создали продукты, которые перевариваются и усваиваются быстрее, независимо от содержания клетчатки.Современные хлопья для завтрака, хлеб, макаронные изделия и многие полуфабрикаты имеют высокий ГИ. Напротив, у большинства сырых продуктов ГИ ниже. (Однако, чем более созрел фрукт или овощ, тем выше его ГИ.)
ГИ может использоваться в качестве руководства для выбора более здоровых углеводов, но имеет некоторые ограничения. Во-первых, GI учитывает не количество углеводов в порции пищи, а только тип углеводов. Другой заключается в том, что сочетание продуктов с низким и высоким ГИ меняет ГИ для еды.Кроме того, у некоторых продуктов, богатых питательными веществами, ГИ выше, чем у менее питательных продуктов. (Например, у овсяных хлопьев ГИ выше, чем у шоколада, потому что содержание жира в шоколаде выше.) Наконец, мясо и жиры не имеют ГИ, поскольку они не содержат углеводов.
больше ресурсов
Посетите эту онлайн-базу данных, чтобы узнать гликемические индексы пищевых продуктов. Продукты перечислены по категориям, а также по низкому, среднему или высокому гликемическому индексу.
http://www.gilisting.com/
Сноски
- Непереносимость лактозы.Национальный информационный центр по заболеваниям пищеварительной системы. digestive.niddk.nih.gov/ddise…seintolerance/. Обновлено 23 апреля 2012 г. Проверено 22 сентября 2017 г.
- Brand-Miller J, et al. Диетический гликемический индекс: последствия для здоровья. J Am Coll Nutr. 2009; 28 (4), 446S – 49S.





 Помогает диагностировать тип анемии.
Помогает диагностировать тип анемии.
