Трудности лечения рецидивирующей инфекции мочевых путей. Возможности фитопрепаратов. | Перепанова Т.С.
Инфекции мочевых путей (ИМП) представляют серьезную проблему для здоровья миллионов людей: ежегодно в Западной Европе наблюдают свыше 10 млн случаев ИМП [9]. При ИМП отмечается высокий уровень рецидивов инфекции, которая принимает характер хронической с частыми обострениями. При неосложненной инфекции нижних мочевых путей в воспалительный процесс вовлекается слизистая оболочка уретры и мочевого пузыря, однако в дальнейшем может вовлекаться и лоханка почки при восходящем пути инфицирования. Поражение почечной паренхимы инфекционно–воспалительным процессом может привести к развитию пиелонефрита, хронической почечной недостаточности и бактериемии.
Различают неосложненные и осложненные инфекции верхних или нижних мочевых путей. К неосложненным инфекциям мочевых путей относят острые циститы, пиелонефриты и уретриты у больных, чаще женщин, при отсутствии каких–либо нарушений к оттоку мочи из почек или из мочевого пузыря и структурных изменений в почках или мочевыводящих путях, а также у пациентов без серьезных сопутствующих заболеваний.
Осложненные ИМП (ОИМП) возникают на фоне анатомических нарушений и обструкции мочевыводящих путей (камни, стриктуры, опухоли, кисты, фистулы, доброкачественная гиперплазия предстательной железы), а также на фоне функциональных нарушений, таких как нейрогенный мочевой пузырь и везикоуретеральный рефлюкс.
 На инородных телах в мочевых путях (катетерах, стентах, дренажах, камнях) микроорганизмы формируют биопленки (biofilms), т.е скопления микроорганизмов из различных семейств с особыми механизмами самозащиты, что приводит к развитию «катетер–ассоциированной ИМП», «биофильм–инфекции». Таким образом, инородное тело становится очагом инфекции для организма, и бактериурия в таких случаях становится неизбежной [2].
На инородных телах в мочевых путях (катетерах, стентах, дренажах, камнях) микроорганизмы формируют биопленки (biofilms), т.е скопления микроорганизмов из различных семейств с особыми механизмами самозащиты, что приводит к развитию «катетер–ассоциированной ИМП», «биофильм–инфекции». Таким образом, инородное тело становится очагом инфекции для организма, и бактериурия в таких случаях становится неизбежной [2].Колонизация мочи микроорганизмами при отсутствии клинических симптомов называется асимптоматической бактериурией (АСБ). АСБ встречается у 6% здоровых людей и у 20% пожилых граждан. При АСБ понимают выделение микроорганизмов в 10 в 5 степени КОЕ/мл в 2 анализах средней порции утренней мочи, взятых через 24 ч [26]. Большинство пациентов с АСБ не требует лечения, т.к. у них нет клинических проявлений инфекции.
 сoli (UPEC) вызывать симптоматическую инфекцию связывают с экспрессией различных факторов вирулентности, таких как адгезины (например, тип 1 и Р фимбрий) и токсины (например, гемолизин) [5,8].
сoli (UPEC) вызывать симптоматическую инфекцию связывают с экспрессией различных факторов вирулентности, таких как адгезины (например, тип 1 и Р фимбрий) и токсины (например, гемолизин) [5,8]. Бактериальная адгезия является основным моментом в колонизации тканевых поверхностей организма–хозяина. Мочевые пути человека подчиняются силам гидродинамики, и адгезия микроорганизмов к уротелию дает им возможность противостоять удалению потоком мочи. Бактериальная адгезия не только способствует колонизации, но также благоприятствует инвазии микроорганизмов, формированию биопленок и повреждению клеток хозяина.
Оба типа фимбрий (1 и Р) запускают воспалительный ответ организма–хозяина, который включает продукцию цитокинов, воспалительную реакцию и отшелушивание инфицированных клеток уротелия [7,10,18].
Возбудителями ОИМП являются многочисленные резистентные микроорганизмы семейства Enterobacteriaceae: E. coli, Klebsiella pneumonia, Citrobacter spp., Enterobacter spp., Staphylococcus spp.
 , Enterococcus faecalis, Proteus mirabilis, а также синегнойная палочка.
, Enterococcus faecalis, Proteus mirabilis, а также синегнойная палочка.В ситуациях частой возвратной инфекции нижних мочевых путей, рецидива заболевания, когда вновь выделяется первоначальный патогенный возбудитель, необходимо урологическое обследование на предмет выявления аномалий развития или выявления сопутствующих заболеваний с соответствующей их коррекцией и обязательным подбором адекватного антибиотика.
Целью лечения ОИМП является профилактика уросепсиса, рецидива заболевания, предупреждение развития осложнений и повреждения паренхимы почек.
Из антибактериальных препаратов для лечения ОИМП рекомендуются фторхинолоны, защищенные b–лактамы, цефалоспорины, аминогликозиды, комбинации антибиотиков.
 Однако длительная непрерывная антибактериальная терапия приводит к дисбиозу кишечника, влагалища, аллергизации организма и селекции резистентных штаммов микроорганизмов.
Однако длительная непрерывная антибактериальная терапия приводит к дисбиозу кишечника, влагалища, аллергизации организма и селекции резистентных штаммов микроорганизмов. Персистенция бактерий в мочевых путях представляет одну их наиболее трудных задач успешного лечения ИМП. При «катетер–ассоциированной ИМП», «биофильм–инфекции», «инфекции инородного тела» быстрая (в течение 24–72 ч) колонизация поверхностей инородных тел микроорганизмами приводит к формированию биопленок. Чаще всего после удаления инородных тел из мочевых путей бактериурия исчезает.
Однако наибольшие трудности представляет персистенция микроорганизмов в слизистой оболочке мочевых путей без наличия или после удаления катетеров, инородных тел. Так называемый рецидивирующий, или персистирующий, бактериальный цистит (свыше 3 обострений в год) наблюдается у 25–40% женщин после однократного эпизода острого цистита.
Многие виды бактерий способны паразитировать внутриклеточно, проявляя тропность к различным клеткам хозяина – факультативный паразитизм.
 Кишечная палочка, например, может паразитировать в клетках эпителия и макрофагов, создавая внутриклеточные бактериальные сообщества (ВБС). Наличие фимбрий и ферментативная активность микроорганизмов обеспечивает им проникновение в клетку или межклеточное пространство. Необходимым условием персистенции являются определенные биологические свойства микроорганизма и дефектность защиты хозяина, что обусловливает бактерионосительство (персистенция возбудителей) и хронизацию воспалительного процесса (частые рецидивы заболевания).
Кишечная палочка, например, может паразитировать в клетках эпителия и макрофагов, создавая внутриклеточные бактериальные сообщества (ВБС). Наличие фимбрий и ферментативная активность микроорганизмов обеспечивает им проникновение в клетку или межклеточное пространство. Необходимым условием персистенции являются определенные биологические свойства микроорганизма и дефектность защиты хозяина, что обусловливает бактерионосительство (персистенция возбудителей) и хронизацию воспалительного процесса (частые рецидивы заболевания). 
Лечение персистирующей или хронической ИМП и эффективная санация от бактерионосительства представляют большую проблему. Во внутриклеточных бактериальных сообществах резистентность к антибиотикам обусловлена:
• ограниченным проникновением антимикробных веществ в биопленки;
• различием в метаболической активности и скорости роста отдельных клеток бактерий, т.к. многие антибиотики не действуют на клетки, находящиеся в покое;
• уменьшением диффузии АБ внутрь;
• инактивацией АБ внутри матрикса.
Однако выяснено, что малые концентрации антибиотиков вызывают существенные изменения в морфологии и биохимии бактерий. Суб–бактериостатические концентрации (1/4 МПК) пенициллина, гентамицина, ванкомицина и др. вызывают резкое подавление адгезии стрептококков разных видов к слизистой оболочке [24]. В то же время длительное антибактериальное лечение в суб–бактериостатических дозах чревато селекцией резистентных штаммов микроорганизмов.
/Ukr/25/1.jpg) Выяснено, что ингибирующее действие различается в отношении разных возбудителей инфекции: E. coli, Klebsiella spp., Proteus mirabilis – в зависимости от механизма персистенции микроорганизмов: антилизоцимной или анти–интерфероновой их активности.
Выяснено, что ингибирующее действие различается в отношении разных возбудителей инфекции: E. coli, Klebsiella spp., Proteus mirabilis – в зависимости от механизма персистенции микроорганизмов: антилизоцимной или анти–интерфероновой их активности. Одна из задач растительных диуретиков заключается в стимуляции диуреза и улучшении механизма самоочищения мочевых путей. Сам акт мочеиспускания является естественным механизмом защиты от внедрения возбудителей мочевой инфекции, поэтому увеличение диуреза на фоне увеличенного количества выпиваемой жидкости (соответственно, при хорошей переносимости) являются обязательными мерами при лечении мочевой инфекции. Растительные диуретики больше влияют на водный диурез (акварез), чем на диурез как таковой, за счет увеличения почечного кровотока или участия в осмотических процессах [14]. Действующими веществами, ответственными за акваретический эффект растительных препаратов, обычно выступают эфирные масла, флавоноиды, сапонины, производные ксантины и гликозиды [4,11,12,13].
 Прием растительных препаратов, обеспечивающих как диуретический, так и комбинацию антисептического, противовоспалительного и спазмолитического эффектов, наилучшим образом подходит для лечения и профилактики ИМП.
Прием растительных препаратов, обеспечивающих как диуретический, так и комбинацию антисептического, противовоспалительного и спазмолитического эффектов, наилучшим образом подходит для лечения и профилактики ИМП.Канефрон Н (Бионорика АГ, Германия) — комбинированный препарат растительного происхождения. В состав его входят: золототысячник (Herba Centaurii), обладающий диуретическим и антибактериальным действиями, любисток (Radix Levistici) с его диуретическим (акваретическим), спазмолитическим, а также антибактериальными эффектами, и розмарин (Folia Rosmarini), который, помимо прочего, обладает также и противовоспалительным эффектом. Компоненты препарата оказывают выраженное антисептическое, спазмолитическое, противовоспалительное действие на мочеполовой тракт, улучшают кровоток и уменьшают проницаемость капилляров почек, обладают диуретическим (акваретическим) эффектом, улучшают функцию почек, потенцируют эффект антибактериальной терапии. В траве золототысячника присутствуют алкалоиды, флавоноидные соединения, горькие гликозиды, феноловые кислоты.

Водный диурез (акварез) – важный эффект препарата. Значительное мочеотделение, вызванное эфирным маслом (терпеном) любистока, происходит за счет расширения почечных сосудов, благодаря чему улучшается кровоток. Было также показано, что и секоиридоидные горечи (золототысячника малого) обладают сосудорасширяющими свойствами, наряду с положительным инотропным эффектом. Рассматривается также действие эфирных масел на реабсорбционную способность эпителиальных клеток канальцев. Диуретический эффект фенолкарбоновых кислот связывают с тем, что нерасщепляющиеся кислоты попадают в кровь, снижая щелочной резерв и смещая реакцию крови в кислую сторону. Смещение кислотно–щелочного баланса в крови и тканях приводит к тканевому эксикозу, и освобождающаяся из тканей жидкость выводится с мочой [4]. Спазмолитический (антихолинергический) эффект помимо фенолкарбоновых кислот оказывают и фталиды любистока: бутилиденфталид и лигустилид [17].
 Розмариновая кислота ответственна за противовоспалительный эффект: она ингибирует неспецифическую активацию комплемента и липоксигеназу и в результате тормозит синтез лейкотриенов.
Розмариновая кислота ответственна за противовоспалительный эффект: она ингибирует неспецифическую активацию комплемента и липоксигеназу и в результате тормозит синтез лейкотриенов. Все компоненты препарата Канефрон Н содержат активные вещества с антимикробным действием (фенолкарбоновые кислоты, секоиридоиды и др). Экскреция нерасщепляемых органических (фенол–) карбоновых кислот и их метилированных, глюкуронидированных и сульфатированных продуктов элиминации может провоцировать ацидификацию мочи, препятствуя росту бактерий.
Клинические исследования Канефрона Н охватывают период с 1973 г. до наших дней. За последние годы проведено несколько отечественных исследований по оценке эффективности Канефрона Н у больных с ИМП или профилактике ИМП.
Исследования эффективности Канефрона Н в течение 2 месяцев при лечении хронической инфекции мочевых путей и пиелонефрита на фоне мочекаменной болезни у 371 пациента показали его антимикробное действие, спазмолитический эффект, уменьшение процессов кристаллизации в моче, усиление отхождения кристаллов с мочой, увеличение диуреза [21].
 Эти данные согласуются с исследованиями Аляева Ю.Г. и соавт. [19]. В их исследовании наблюдались 55 женщин с хроническим циститом и 79 пациентов с мочекаменной болезнью. Больным с циститом назначали фосфомицин (2 дозы) вместе с Канефроном Н (30 дней), в контрольной группе пациентки получали только фосфомицин (2 дозы). Авторы отмечают отсутствие рецидивов цистита в течение месяца приема Канефрона Н, в то время как в контрольной группе у 30% пациентов отмечены рецидивы. В течение следующего месяца наблюдения рецидив заболеваний отмечался у 21% больных контрольной группы, в то время как в основной группе – только у 7,2% пациентов. Камнеизгоняющее действие Канефрона Н подтверждено в этом исследовании у 73% пациентов в течение первых 5 сут. после дистанционной ударно–волновой литотрипсии, в то время как в контрольной группе, получавшей стандартную спазмолитическую терапию, – лишь у 33% пациентов. Ни у одного пациента не отмечено осложнений и нежелательных побочных реакций после приема Канефрона Н.
Эти данные согласуются с исследованиями Аляева Ю.Г. и соавт. [19]. В их исследовании наблюдались 55 женщин с хроническим циститом и 79 пациентов с мочекаменной болезнью. Больным с циститом назначали фосфомицин (2 дозы) вместе с Канефроном Н (30 дней), в контрольной группе пациентки получали только фосфомицин (2 дозы). Авторы отмечают отсутствие рецидивов цистита в течение месяца приема Канефрона Н, в то время как в контрольной группе у 30% пациентов отмечены рецидивы. В течение следующего месяца наблюдения рецидив заболеваний отмечался у 21% больных контрольной группы, в то время как в основной группе – только у 7,2% пациентов. Камнеизгоняющее действие Канефрона Н подтверждено в этом исследовании у 73% пациентов в течение первых 5 сут. после дистанционной ударно–волновой литотрипсии, в то время как в контрольной группе, получавшей стандартную спазмолитическую терапию, – лишь у 33% пациентов. Ни у одного пациента не отмечено осложнений и нежелательных побочных реакций после приема Канефрона Н.
Осложненные госпитальные ИМП у больных с цистостомическими дренажами («катетер–ассоциированная бактериурия») обычно бывают вызванными несколькими возбудителями, характеризующимися множественной устойчивостью к противомикробным препаратам. Частота бактериурии у таких больных приближается к 100%, что требует длительного проведения антимикробной терапии. В исследовании в урологической клинике РГМУ [Мазо Е.Б., Попов С.В., 2006] было показано, что препарат Канефрон®Н повышает эффективность лечения таких больных, способствуя уменьшению выраженности кристаллурии, а также лейкоцитурии и бактериурии [23]. На основании полученных результатов авторы рекомендуют применение этого препарата в интервалах между повторными курсами антибактериальной терапии или вслед за назначением антибиотиков при долгосрочном лечении больных с постоянным цистостомическим дренажом.
Известно, что сахарный диабет (СД) существенно усугубляет патологические процессы в мочевыводящих путях и способствует их прогрессированию: частота пиелонефрита у больных СД достигает 35%, что в 7–8 раз выше, чем в популяции.
 Причиной этому является не только глюкозурия, создающая благоприятные условия для размножения микрофлоры в мочевом тракте, но и нарушение уродинамики вследствие диабетической нейропатии, ухудшение кровоснабжения почек (интерстициальной ткани и чашечно–лоханочной системы) и даже иммунологические нарушения. С целью оценить эффективность препарата Канефрон®Н в терапии ИМП у больных с метаболическим синдромом или СД 2 типа Иванов Д.Д. и соавт. (2005 г.) спланировали и провели многоцентровое открытое контролируемое рандомизированное исследование с участием 302 пациентов в возрасте от 15 до 58 лет [20]. Отдельно анализировались группы пациентов с инфекцией нижних и верхних мочевых путей в сравнении с соответствующими контрольными группами. Из исследования были исключены больные с заболеваниями, передающимися половым путем.
Причиной этому является не только глюкозурия, создающая благоприятные условия для размножения микрофлоры в мочевом тракте, но и нарушение уродинамики вследствие диабетической нейропатии, ухудшение кровоснабжения почек (интерстициальной ткани и чашечно–лоханочной системы) и даже иммунологические нарушения. С целью оценить эффективность препарата Канефрон®Н в терапии ИМП у больных с метаболическим синдромом или СД 2 типа Иванов Д.Д. и соавт. (2005 г.) спланировали и провели многоцентровое открытое контролируемое рандомизированное исследование с участием 302 пациентов в возрасте от 15 до 58 лет [20]. Отдельно анализировались группы пациентов с инфекцией нижних и верхних мочевых путей в сравнении с соответствующими контрольными группами. Из исследования были исключены больные с заболеваниями, передающимися половым путем.Критериями оценки эффективности применения Канефрона®Н были отсутствие бактериурии, лейкоцитурии, а также клинических проявлений ИМП после проведенного курса лечения антибиотиками через 3 мес.
 при инфекции нижних мочевых путей и 6 мес. при инфекции верхних мочевых путей. Оценка результатов лечения осуществлялась по первичной конечной точке – частоте реинфекции органов мочевой системы.
при инфекции нижних мочевых путей и 6 мес. при инфекции верхних мочевых путей. Оценка результатов лечения осуществлялась по первичной конечной точке – частоте реинфекции органов мочевой системы.Полученные результаты свидетельствуют о достоверном (р
Для оптимизации результатов лечения и уменьшения риска рецидивирования пиелонефрита в этом же исследовании пациенты на этапе реабилитации с профилактической целью получали Канефрон®Н или 1/3–1/4 терапевтической дозы уроантисептика. При этом в процессе 6–месячного наблюдения количество больных с наличием реинфекции пиелонефрита не увеличилось при назначении профилактического лечения уроантисептиком или Канефроном®Н. Это свидетельствует о сходной эффективности фитопрепарата и химиопрепаратов, назначаемых для профилактического лечения после перенесенного пиелонефрита у пациентов с МС/СД 2 типа. При этом частота рецидивов пиелонефрита у пациентов, не получавших профилактического лечения уроантисептиком, в 5 раз превышала таковую у пациентов, принимавших Канефрон®Н.
 В ходе исследования не было выявлено ни одного случая нежелательной побочной реакции при использовании Канефрона®Н [20].
В ходе исследования не было выявлено ни одного случая нежелательной побочной реакции при использовании Канефрона®Н [20].В клинике кафедры урологии РМАПО было проведено исследование по изучению эффективности растительных препаратов в качестве метода профилактики рецидивов инфекции мочевых путей и на этапе амбулаторного долечивания при поражении верхних мочевых путей [27]. Препарат Канефрон®Н применяли для лечения 2 групп больных: у пациентов с острым необструктивным пиелонефритом (n=30) на этапе амбулаторного долечивания и у пациентов с хроническим рецидивирующим циститом на фоне ИППП (n=60). Отмечено, что бактериурия у пациентов обеих групп выявлена только в 55,8% (n=62), а E. coli выявлена в 58% (n=36). Отсутствие бактериурии (в основном в группе больных хроническим циститом) исследователи объяснили бесконтрольным применением антибактериальных препаратов и постоянным приемом уроантисептиков такими больными. В качестве эмпирической терапии больным острым необструктивным пиелонефритом назначались фторхинолоны, а больным с выявленными атипичными возбудителями проводился курс специфической терапии.
 Далее на амбулаторном этапе все пациенты получали Канефрон Н в течение 1 мес. При контрольном обследовании через 1 мес. после окончания терапии лейкоцитурии, бактериурии не было выявлено ни у одной пациентки.
Далее на амбулаторном этапе все пациенты получали Канефрон Н в течение 1 мес. При контрольном обследовании через 1 мес. после окончания терапии лейкоцитурии, бактериурии не было выявлено ни у одной пациентки. Больным хроническим циститом и наличием ИППП (длительность заболевания от 1 до 8 лет) после проведения курса специфической терапии выполнялась цистоскопия. Тем пациентам, у которых была выявлена плоскоклеточная метаплазия (лейкоплакия) слизистой шейки мочевого пузыря и мочепузырного треугольника (83,3%; n=50), проводилась терапия, направленная на восстановление слоя гликозаминогликанов: три курса внутрипузырных инстилляций гепарина – на все время внутрипузырной терапии и до следующего курса больным назначался Канефрон®Н (1 мес.). За время лечения ни у одной пациентки не было обострения цистита, больные хорошо перенесли курс внутрипузырной терапии, при контрольном обследовании через 30 дней у 90% больных посев мочи был стерильным. Таким образом, Канефрон®Н обеспечил надежную «антибактериальную защиту» при выполнении таких инвазивных манипуляций, как внутрипузырные инстилляции.
 Длительный прием Канефрона®Н оказал устойчивое противорецидивное действие. Авторы особо отметили, что ни в одном случае не было отмечено побочных реакций или непереносимости препарата [27].
Длительный прием Канефрона®Н оказал устойчивое противорецидивное действие. Авторы особо отметили, что ни в одном случае не было отмечено побочных реакций или непереносимости препарата [27].В клинической практике ФГУ НИИ урологии М3 РФ мы также в своей повседневной практике постоянно применяем Канефрон®Н как у пациентов с рецидивирующими циститами и уретритами, а также при хронической инфекции мочевых путей, почек и мочеполовых органов. Предварительно проведенные исследования в нашей клинике в 2004 г. показали эффективность и безопасность использования Канефрона®Н у пациентов с хронической персистирующей инфекцией нижних мочевых путей и с бактериальным простатитом [25].
Контрольную группу составили пациентки с хроническим циститом, не получавшие лечение Канефроном®Н. Им проводилась стандартная антибактериальная терапия при обострениях (фторхинолоны по 3–5 дней или фосфомицин трометамол 3 г однократно), клюквенный морс.
Клинические, клинико–лабораторные, биохимические исследования включали: осмотр урологом с обязательным влагалищным или ректальным исследованием; общеклинический анализ крови и мочи, микроскопическое исследование мазков из уретры, влагалища и шейки матки, бактериологическое исследование мочи и кала (по показаниям), ПЦР на заболевания передающиеся половым путем (микоплазмы, вирус простого герпеса, хламидии).
 Проводилось уродинамическое исследование; больные вели дневник мочеиспусканий в течение 3–х месяцев.
Проводилось уродинамическое исследование; больные вели дневник мочеиспусканий в течение 3–х месяцев.Пациенты (n=27) получали Канефрон®Н в течение 3 мес.: 16 пациентов получали лечение Канефроном®Н в виде монотерапии, а 11 пациентов в сочетании с антибиотиками – фосфомицин трометамол по 3 г 1 раз/сут. Ни один из пациентов не был исключен из исследования.
Средний объем диуреза в группе наблюдения составил 1,6 л до лечения Канефроном®Н и 1,9 л после лечения; в контрольной группе 1,6 и 1,6 л соответственно различия статистически достоверны, p
Бактериурия была выявлена у 46% пациентов из группы наблюдения до лечения и лишь у 14% после лечения. У пациентов из контрольной группы (n=70), бактериурия имелась у 41% пациентов до лечения и у 38% через 3 мес. после лечения – различия были статистически достоверны (p
Безрецидивный период в группе, получавшей лечение Канефроном®Н, до лечения составлял 1,5 мес., а после лечения 3,2 мес. В контрольной группе исходный интервал составил 1,7 мес.
 , а через 3 мес. наблюдения – 2,3 мес. Различия статистически достоверны, p
, а через 3 мес. наблюдения – 2,3 мес. Различия статистически достоверны, pВсего проведено 27 стандартных курсов лечения Канефроном®Н: 5 пациенток (18,5%) отмечали отличный клинический эффект, 17 (63,0%) – хороший эффект, а в 5 случаях (18,5%), эффект был удовлетворительным. Все пациенты отметили снижение симптоматики, уменьшение болей в области мочевого пузыря, исчезновение резей, связанных с мочеиспусканием, а также увеличение интервалов между обострениями заболеваний, при этом сами обострения протекали в более легкой форме, чем до лечения Канефроном®Н.
Препарат показал хорошую безопасность и переносимость всеми пациентами, побочных эффектов, аллергических реакций за время наблюдения отмечено не было.
Таким образом, при лечении как острой ИМП, так и персистирующей бактериальной инфекции нижних мочевых путей, являющейся одной из проблемных тем в урологической практики, растительный препарат Канефрон®Н выступает эффективным и безопасным средством. Он значительно увеличивает диурез, что является одним из ключевых моментов при лечении больных с мочевой инфекцией (антиадгезивное действие, «самопромывание организма»).
 Снижение бактериурии способствует снижению персистенции микроорганизмов в мочевых путях, что приводит к увеличению безрецидивного периода. Следует отметить противовоспалительный эффект препарата, особо ценный в лечении острой симптоматики. Удобство применения (пероральная форма) обеспечивает комплаентность пациентов с урологической инфекцией, также способствуя повышению эффективности лечения.
Снижение бактериурии способствует снижению персистенции микроорганизмов в мочевых путях, что приводит к увеличению безрецидивного периода. Следует отметить противовоспалительный эффект препарата, особо ценный в лечении острой симптоматики. Удобство применения (пероральная форма) обеспечивает комплаентность пациентов с урологической инфекцией, также способствуя повышению эффективности лечения.Литература
1. Bhardi S., Nackman N.,Nicaud J.M.,Holland I.B.Escherihia coli hemolysin may damage target cell membranes by generating transmembrane pores// Infect. Immun. 1986,V.52, p.63–69.
2. Foxman, B. 2002. Epidemiology of urinary tract infections: incidence, morbidity,and economic costs. Am. J. Med. 113(Suppl. 1A):5S–13S.
3. Hedlund, M., R. D. Duan, A. Nilsson, M. Svensson, D. Karpman, and C. Svanborg. 2001. Fimbriae, transmembrane signaling, and cell activation.//J. Infect. Dis. 183 (Suppl. 1):S47–S50.
4. Kartnig T. 1983. Pflanzliche Drogen mit Wirkung auf Nieren und Hamwege. Osterreich Apotheker–Zeitung 37:353–358.
Osterreich Apotheker–Zeitung 37:353–358.
5. Klemm, P., and M. A. Schembri. 2000. Bacterial adhesins: function and structure. Int. J. Med. Microbiol. 290:27–35.
6. Kunin Calvin M. Urinary Tract Infections. Detection, Prevention and Management. Fifth Edition. Williams and Wilkins, 1997, 419 s.
7. Mulvey, M. A., Y. S. Lopez–Boado, C. L. Wilson, R. Roth, W. C. Parks, J. Heuser, and S. J. Hultgren. 1998. Induction and evasion of host defenses by type 1–piliated uropathogenic Escherichia coli. Science 282:1494–1497.
8. Oelschlaeger,T. A., U. Dobrindt, and J. Hacker. 2002. Virulence factors of uropathogens. Curr. Opin. Urol. 12:33–38.
9. Roos Viktoria, Ulett Glen C., Schembri Mark A., and Klemm Per. The Asymptomatic Bacteriuria Escherichia coli Strain 83972 Outcompetes Uropathogenic E. coli Strains in Human Urine// INFECTION AND IMMUNITY, Jan. 2006, Vol. 74, No. 1 p. 615–624.
10. Samuelsson, P., L. Hang, B. Wullt, H. Irjala, and C. Svanborg. 2004. Tolllike receptor 4 expression and cytokine responses in the human urinary tract mucosa. Infect. Immun. 72:3179–3186; 48.
2004. Tolllike receptor 4 expression and cytokine responses in the human urinary tract mucosa. Infect. Immun. 72:3179–3186; 48.
11. Schilcher H.1984 Pflanzliche Urologika. Dtsch Apoth Ztg 124:2429–2436.
12. Schilcher H.1987 Pflanzliche Diuretika. Urologe [B] 27:215–222.
13. Schilcher H.1992 Phytotherapie in der Urologie. Aquaretika Durchspulungstherapeutika, Hamwegsdesinfizienzien. Hippokrates Verlag.13–35,41–45.
14. Schilcher H, May P, Sokeland Z, 1988. Phytotherapie in der Urologie Urologe [B]28:265–271
15. Steinegger E, Hansel R, 1992. Pharmakognosie 5 Aufl. Kap 6.2.1 Freie Phenolcarbonsauren Springer Verlag Berlin, Heidelberg 372–374.
16. Svanborg, C., and Godaly G. Bacterial virulence in urinary tract infection.// Infect. Dis. Clin. North Am.– 11:513–529,1997.
17. Vollmann C. 1988. Levisticum officinale – Der Liebstockel. ZS Phvthother 9: 128–132.
18. Wullt, B., G. Bergsten, H. Fischer, G. Godaly, D. Karpman, I. Leijonhufvud, A. C. Lundstedt, P. Samuelsson, M. Samuelsson, M. L. Svensson, and C. Svanborg. 2003. The host response to urinary tract infection. Infect. Dis. Clin. North Am. 17:279–301.
Leijonhufvud, A. C. Lundstedt, P. Samuelsson, M. Samuelsson, M. L. Svensson, and C. Svanborg. 2003. The host response to urinary tract infection. Infect. Dis. Clin. North Am. 17:279–301.
19. Аляев Ю.Г., Амосов А.В., Григорян В.А. и соавт. Применение растительного препарата Канефрона®Н у больных с хроническим циститом и мочекаменной болезнью//Урология 2005;4:29–33.
20. Иванов Д.Д., Назаренко В.И., Кушниренко С.В. и соавт. Фитотерапия метаболического синдрома и сахарного диабета 2 типа: возможности фитониринга// Здоров’я Украiни 2005;17:46–47.
21. Калинина С.Н., Тиктинский О.Л., Семенов В.А. и соавт. Роль Канефрона®Н при лечении хронического пиелонефрита и профилактике его осложнений//Урология 2006;1:22–25.
22. Кремлинг Х., Лутвайер В., Хайнтц Р. Гинекологическая урология и нефрология.– М., 1985.– 506 с.
23. Мазо Е.Б., Попов С.В. Канефрон®Н в комплексной противовоспалительной терапии больных с цистостомическим дренажом//Врачебное сословие 2006;7:40–42.
24. Навашин С.М. Некоторые аспекты химиотерапии бактериальных инфекций// Журн.микробиологии, 1984, №7,с. 37–45.
25. Перепанова Т.С., Хазан П.Л. Растительный препарат Канефрон®Н в лечении и профилактике инфекций мочевых путей//Врачебное сословие 2005;5:44–46.
26. Рекомендации по ведению больных с инфекциями почек, мочевых путей и мужских половых органов. К.Набер, М.Бишоп, Т.Бйерклунд–Йохансен и др. Европейская Урологическая Ассоциация, 2008// Перевод на русский язык – Смоленск, 2008, 224 с.
27. Синякова Л.А., Косова И.В. Профилактика рецидивов инфекций мочевых путей. Урология, 2009, №2, С. 22–25.
28. Чахава О.В., Горская Е.М. Носительство патогенных микроорганизмов как фаза резервации возбудителя в межэпидемическом периоде // Журн.микробиол.1984, №9, с. 9–16.
29. Челпаченко О.Е. Экспериментальное обоснование рациональной терапии пиелонефрита у детей под контролем маркеров персистенции возбудителя.// Автореферат дис….канд. мед. наук. Челябинск,1993. 23 с.
Челябинск,1993. 23 с.
.
Как избавиться от кишечной палочки в моче и почему она появляется? 2020
Кишечная палочка в моче появляется, когда показатель концентрации ее в организме отклоняется от нормы в большую сторону, то микроорганизм заселяет ближайшие органы. Одним из мест, наиболее частого поражения выступает мочеиспускательный канал, т.к. расположен он ближе всего к очагу образования патогенной микрофлоры. В норме среда их обитания – кишечник, а показатель у взрослого человека и новорожденного в диапазоне 106-108 КОЕ/г.
Содержание статьи
Что собой представляет кишечная палочка
Сама по себе кишечная палочка не вредна – она может быть патогенной лишь в том случае, если ее значение в рамках анализов существенно превышает норму. Дело в том, что энтеробактерии изначально приносят организму и ЖКТ пользу. Подпитка клеток происходит за счет температуры тела человек, необходимой им влажности, кислорода и других условий жизнедеятельности. Они же, в свою очередь, обеспечивают организм жирными кислотами, витаминами К и В. Участвуют в расщеплении белка, метаболизируют билирубин, холестерин и желчные кислоты. Кроме того, они уничтожают патогенные бактерии и не дают возможности распространиться им в собственной среде обитания.
Они же, в свою очередь, обеспечивают организм жирными кислотами, витаминами К и В. Участвуют в расщеплении белка, метаболизируют билирубин, холестерин и желчные кислоты. Кроме того, они уничтожают патогенные бактерии и не дают возможности распространиться им в собственной среде обитания.
Если показатель уровня кишечной палочки снижается, то это дает сигнал патогенным и болезнетворным организмам о возможности заселения в слизистой оболочке органа, т.к. защитные функции человека снижаются. При повышении кишечная палочка стремится «покорить» новые органы, поражая смежные слизистые, например, мочеполовую систему.
Основные факторы, влияющие на отклонения от нормы:
- Вирусные заболевания в течение продолжительного времени или частые рецидивы.
- Повышенные нагрузки физической и эмоциональной (стрессы).
- Нарушение функционирования внутренних органов (особенно актуально для пожилых людей).

- Курение, алкоголь и наркотические вещества также способны провоцировать размножение условно-патогенных бактерий и расширение среды обитания.
Причины появления в урине
Моча здорового человека не должна содержать бактерий, поэтому кишечная палочка в норме там присутствовать не должна. Исключением являются случаи, когда органы системы мочеиспускания поражены какими-либо патологическими процессами. Обнаружить данный факт можно совершенно случайно, при сдаче в рамках планового профосмотра общего анализа мочи, или в момент диспансеризации по поводу другой болезни, но все же бессимптомная форма встречается намного реже. Куда как чаще процесс сопровождается жалобами со стороны пациента, поэтому он отправляется лечащим врачом в лабораторию для проведения исследований с определенными подозрениями.
Пробы берутся для проведения:
- Общего анализа. Лаборант осуществляет исследование через микроскоп, определяя тип и количество микроорганизмов и бактерий.
 Количество отображается в результате в виде одного, двух или трех «+». Дополнительно определяет вид микрофлоры, род возбудителя.
Количество отображается в результате в виде одного, двух или трех «+». Дополнительно определяет вид микрофлоры, род возбудителя. - Бакпасева. Образец в чашке Петри попадает в комфортные условия для микроорганизмов, где благополучно размножаются и находятся несколько дней в благоприятной среде. Ко вторым суткам в пробе формируются колонии, соответствующие виду бактерий (кишечная палочка – серо-голубая при мясопептонном агаре, на среде Эдно – плоская и красная). Анализ также показывает чувствительность к различным антибактериальным препаратам, на чем и основывается дальнейшая терапия.
Какие заболевания вызывает
Причинами попадания кишечной палочки в мочу могут быть заболевания половой и мочевой системы и размножение патогенных и условно-патогенных микроорганизмов. Способствующими факторами можно назвать тесное белье, несоблюдение правил личной гигиены и анальные половые акты. Следствие – воспаление мочевого пузыря, почек, уретры. Среди заболеваний наиболее распространены пиелонефриты и циститы.
Пиелонефрит относится к воспалительным заболеваниям, в результате которых происходит перемещение инфекции (кишечной палочки) от уретры к почкам, заполняя лоханки и заражая почки. Восхождение воспалительного процесса наблюдается у женщин. У мужчин в силу особенностей анатомического строения мочеполовой системы такого рода осложнения не выявлены.
Особый риск бактерия представляет для беременных женщин, и вне зависимости от сложности заболевания, чтобы предотвратить воспалительный процесс, таким пациенткам назначают курс антибиотиков.
Расшифровка анализов
Как уже говорилось, есть 2 варианта проведения исследования – это общий анализ и бакпосев. В первом случае отображается наличие бактерий – выявлено / не выявлено. И только второй, после лабораторных исследований и выстраивания колонии в благоприятных условиях, может отображать их вид и чувствительность к антибиотикам.
Величина измерения роста микроорганизмов в пробе обозначается КОЭ, т. е. колониеобразующие единицы. «+» означает увеличение количества бактерий, а «-» – отсутствие.
е. колониеобразующие единицы. «+» означает увеличение количества бактерий, а «-» – отсутствие.
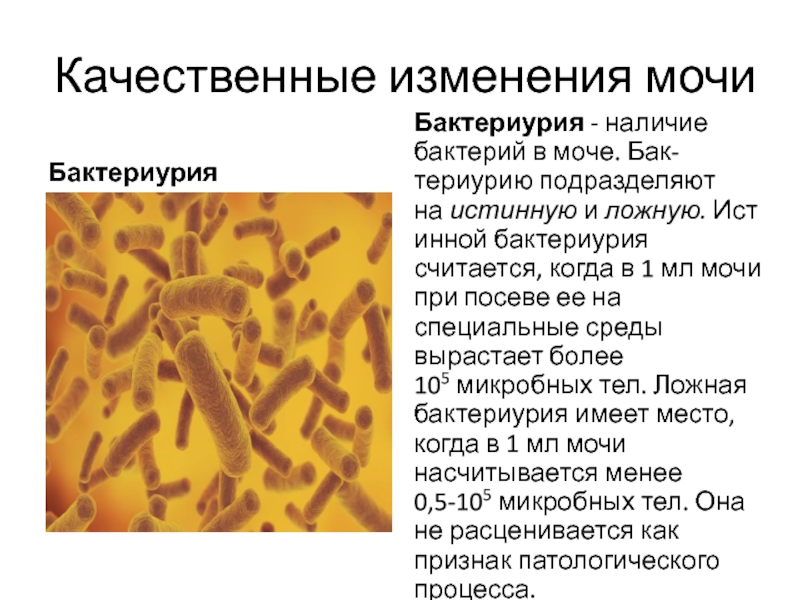
Причины бактериурии
Если рассматривать вопрос о причинах возникновения бактерий любого типа в урине и мочевыводящем канале человека, то следует выделить два пути их образования.
- Истинная бактериурия. Размножение происходит непосредственно в урине, провоцируя воспалительные процессы и перемещение болезнетворных клеток к другим органам.
- Ложная бактериурия. Появление микроорганизмов связано с заболеванием смежных мочеполовой системе органов, т.е. в данном случае кишечника.
Бактериурия – это симптом, а не само заболевание, и помимо сдачи анализов, потребуется пройти обследование других органов. Реже диагностируют патологии, связанные с аденомой, сахарным диабетом и простатитом, уретритом и бактериальным сепсисом.
Чаще других выявляют уретрит, цистит и пиелонефрит. Симптомами следует считать:
- Нарушение мочеиспускания, сопровождающиеся болью или жжением – дизурия.

- Болезненное состояние поясницы и живота внизу.
- Недержание.
- Неприятный запах урины, и виднеющиеся в ней примеси гноя;
- Гиперемия уретры.
О чём свидетельствует бессимптомная бактериурия
Бессимптомная бактериурия свидетельствуют о заболевании при отсутствии его характерных признаков. Анализы у пациентов говорят о наличии колоний микроорганизмов в уретре, в сочетании с повышенной концентрацией лейкоцитов, но человек при этом не испытывает дискомфорт. Такие обстоятельства лишь осложняют картину, т.к. несвоевременная диагностика может повлечь за собой инфицирование и заболевание других органов, включая брюшную полость и половую систему.
Причинами отсутствия симптомов может быть как индивидуальная особенность отдельно взятого пациента, так и устойчивость, связанная с большим количеством рецидивов заболевания.
Когда результаты могут быть неточными
- В случае несоблюдения правил забора анализов или личной гигиены.
 Попадание в мочу выделений из половых органов.
Попадание в мочу выделений из половых органов. - Забор мочи в нестерильную тару.
- Влияние могут оказывать лекарственные препараты и проводимые диагностические исследования накануне.
Обследование при появлении кишечной палочки в моче
Единственным способом обследования, выявляющий тип бактерии, является бактериологическое исследование. Сложностью является определение в пробе эшерехий, присущих естественной микрофлоре, патогенных клеток. Определить колонии можно по скорости их образования, но наиболее точные результаты будут лишь при биохимическом и морфологическом исследовании.
Дополнительно делают забор пробы слизистых, а также рвотных и каловых масс, крови, гноя, мазков, в зависимости от предварительного диагноза и на усмотрение лечащего доктора. Очевидно, что результаты могут быть скрытые, ложные или демонстрировать объективную картину. Важным является своевременное обращение к специалисту при первых признаках заболевания, во избежание развития патологий и заражения бактерией ближайших органов.
Лечение
При появлении кишечной палочки рекомендуется лечение у врача. Терапия при обнаружении возбудителя инфекции мочевыводящей и мочеобразующей системы проводится в комплексе физиотерапевтическими процедурами. Назначаются препараты следующих групп:
- антибиотики;
- нестероидные противовоспалительные средства;
- травяные сборы.
При образовании абсцесса почечной лоханки проводится оперативное лечение.
Профилактика инфекции мочевыделительной системы
Чтобы избежать появления кишечной палочки в моче, рекомендуется избегать переохлаждений, соблюдать меры гигиены, при нарушении процесса мочеиспускания – обращаться к врачу.
Источник:
http://konstantinsmirnov.ru/analiz/sostav/kishechnaya-palochka-v-moche.html
Кишечная палочка в моче
9 минут Автор: Любовь Добрецова 1042
- Показатели нормы
- Причины появления
- Симптоматика
- Диагностика
- Особенности у ребенка
- Методы лечения
- Профилактические меры
- Заключение
- Видео по теме
Если человек здоров, в моче не должно содержаться никаких бактерий. Если в ходе анализа была обнаружена кишечная палочка в моче, это свидетельствует о развитии патологического процесса. При выявлении в урине эшерихии коли требуется незамедлительно приступить к лечению, в противном случае существует вероятность развития воспалительного процесса в органах мочеполовой системы.
Также микроорганизмы этого типа могут спровоцировать развитие пиелонефрита, цистита и других опасных болезней. Прежде чем назначать схему лечения, необходимо провести полноценную диагностику и выявить, что именно стало причиной такого отклонения.
Показатели нормы
Обнаружив в бланке с результатами присутствие в моче бактерий типа escherichia coli, многие мужчины и женщины начинают паниковать. Но специалисты предупреждают, что присутствие в урине этого микроорганизма не всегда является поводом для беспокойства.
Если биохимический анализ показал, что кишечная палочка в урине не превышает 10 в 3-й степени или 10 в 4-й степени, это не является отклонением от нормы. При таком результате ставится отрицательная реакция. Стоит учитывать, что нормативы одинаковы для представителей обеих полов и всех возрастных групп.
Если анализ покажет, что количество бактерий превышает 10 единиц в 5-1 степени, это признак нарушения микрофлоры урины. Также подобная реакция может указывать на наличие урологического заболевания. Расшифровка анализа всегда проводится урологом, который выписал направление на обследование.
Причины появления
Бактерии типа эшерихия коли в моче у женщин и мужчин могут присутствовать по самым разным причинам. Но в не зависимости от того, что именно служит первоисточником патологии, вывести микроорганизмы очень сложно. Примерно в 25% случаев их присутствие является безопасным для здоровья, но чаще обнаружение палочки говорит об опасных патологических процессах.
Основными причинами возникновения в органах мочеполовой системы болезнетворных бактерий этого типа являются:
- воспаление стенок мочевого пузыря (почек, выделительных каналов), сопровождающееся множественными осложнениями. Присутствие кишечной палочки в этом случае обусловлено тем, что воспалительный процесс ослабевает местный иммунитет и организм не может справиться с активностью кишечной палочки;
- несоблюдение правил личной гигиены. Чаще всего отсутствие должного ухода обнаруживается у мужчин, которые отказываются от ежедневного приема душа;
- беспорядочные сексуальные связи;
- неправильный сбор биоматериала для анализа и использование нестерильной емкости. Чтобы результаты анализа были достоверными, сбор мочи рекомендуется осуществлять в специальный пластиковый контейнер, продающийся в аптеке;
- у детей этот инфекционный возбудитель часто обнаруживается из-за дисбактериоза кишечника. При этом заболевании в организме начинают преобладать патогенные микроорганизмы;
- анальный секс без презервативов.
Также вероятность появления в урине кишечной палочки повышается у беременных женщин (мазок показывает нарушение микрофлоры более чем в 30% случаев). Такая реакция связана с ослаблением иммунитета и повышенными нагрузками на организм. Подробнее о появлении кишечной палочки в моче у беременных можно прочитать в этой статье.
Симптоматика
Если органы мочевыделительной системы поражены кишечной палочкой, признаки патологии не заставят себя долго ждать. Симптомы недуга всегда проявляются остро и при отсутствии своевременного лечения могут спровоцировать развитие хронических заболеваний. Именно поэтому при появлении сомнительных признаков требуется незамедлительно обратиться к врачу.
Чаще присутствие кишечной палочки в моче у ребенка и взрослого сопровождается такой симптоматикой:
- появление резкой и жгучей боли во время опорожнения мочевого пузыря;
- слизистая выделительного канала приобретает отечный вид. Также может наблюдаться незначительное покраснение эпителиальной поверхности;
- частые позывы к мочеиспусканию. Подобная симптоматика свидетельствует о том, что микроорганизм проник в мочевой пузырь;
- выводимая урина приобретает более темный оттенок и становится концентрированной. В некоторых случаях может измениться и запах мочи. Этот признак является опасным и указывает на развитие урологических заболеваний инфекционной природы;
- присутствие в моче гнойных примесей и небольших сгустков крови;
- общая ослабленность организма;
- дискомфорт и незначительная болезненность в области почек;
- озноб и повышение температуры тела.
В редчайших случаях патология может повлечь за собой возникновение сыпи на коже половых органов. Такая реакция организма говорит о сильном ослаблении иммунитета и требует профессиональной помощи.
Диагностика
Прежде чем назначать схему лечения и прописать пациенту медикаменты, врач должен убедиться, действительно ли в моче присутствует кишечная палочка коли. Как показывает медицинская практика, примерно в 20% случаев результат анализа оказывается ложноположительным.
Такая реакция может быть следствием следующих нарушений: несоблюдение правил гигиены перед сбором мочи (если не провести гигиену половых органов, патогенные микроорганизмы могут попасть в мочу из биологических выделений), сбор биоматериала в нестерильную емкость, прием некоторых медикаментов накануне.
Сложность бактериологического исследования заключается в том, что медику необходимо отличить бактерии, присущие естественной микрофлоре, от патогенных клеток. Сделать это можно, только определив скорость образования колоний. Наиболее достоверный результат будет известен при проведении биохимического анализ или морфологического исследования.
Если в посеве мочи нашли следы кишечной палочки, назначается повторное исследование. В качестве дополнительных мер лечащий врач может выдать пациенту направление на общий анализ крови и каловых масс. Анализы помогут оценить общую клиническую картину и выявить, почему в урине появился патогенный микроорганизм.
Особенности у ребенка
Довольно часто присутствие бактерий типа эшерихия коли обнаруживается в анализе мочи у детей и грудничков. Часто причина положительной реакции кроется в неправильном сборе биоматериала. Чтобы избежать ложных показаний, врачи советуют родителям собирать урину у детей маленького возраста и грудничков в специальные мочеприемники, которые продаются в аптеках.
Если анализ показал положительный результат, через несколько дней назначается повторное исследование. Если оно покажет аналогичную реакцию, врач назначает дополнительную диагностику, что поможет выявить причину возникновения недуга. Приступать к лечению недуга можно будет только после постановки правильного диагноза.
Методы лечения
Заранее сказать, какой способ лечения кишечной палочки в моче будет назначен, невозможно, поскольку терапия носит индивидуальный характер и зависит от первоисточника заболевания. Чаще всего пациентам назначают прием сразу нескольких медикаментов разных фармкатегорий, действие которых направлено на очищение тканей мочеполовой системы от патогенных микроорганизмов.
При этом необходимо учитывать, что эшерихия отличается большим количеством штаммов, поэтому пациенту обязательно придется принимать антибактериальные средства. Антибиотики также подбираются индивидуально для каждого пациента с учетом типа бактерий и их восприимчивости к активным компонентам препарата.
Чаще всего урологические патологии, вызванные кишечной палочкой, лечатся при помощи следующих препаратов:
- антибиотики. Избавиться от микроорганизмов типа Эшерихия коли помогают практически все антибиотики, относящиеся к группе аминогликозидов (Нетилмицин, Неомицин, Тобрамицин). Дозировка препарата и длительность приема подбираются исключительно лечащим врачом. Пациенту может быть назначен прием антибиотиков в таблетированной форме либо внутримышечное введение препарата;
- средства от дисбактериоза. Помогают восстановить баланс полезных и вредоносных микроорганизмов и активизируют работу иммунной системы. Чтобы восстановить организм после антибактериальной терапии, чаще назначают Линекс, Дюфалак, Нормазе;
- противовоспалительные спазмолитические средства;
- также пациентам назначается ежедневное потребление кисломолочных продуктов. Молоко, сметана, кефир и творог способствуют укреплению иммунитета и помогают восстановить организм после антибактериальной терапии.
Вне зависимости от того, что вызвало присутствие кишечной палочки в моче, основу лечебного курса составляют антибактериальные препараты. В большинстве случаев продолжительность терапии варьируется от 10 до 15 суток. Длительность лечения зависит от восприимчивости бактериями активных компонентов препарата, а также от динамики выздоровления.
Если препарат будет подобран правильно, улучшения будут заметны уже через 3-4 дня – симптоматика заболевания станет менее выраженной. При этом пациентам необходимо помнить, что при первых симптомах выздоровления бросать лечение нельзя. При прерывании терапии часть патогенных микроорганизмов останется на слизистых оболочках органов мочеполовой системы, в результате чего через пару недель может произойти рецидив.
Народные методы лечения
Лечить кишечную палочку в моче можно и при помощи нетрадиционной терапии. Но необходимо понимать: народные средства можно использовать только в качестве вспомогательных. Если весь упор будет сделан на них, смысла от терапии не будет.
Несмотря на то, что представители официальной медицины не приветствуют такой способ лечения, применение народных рецептов против разных недугов широко используется разными слоями населения. Самыми эффективными и действенными считаются следующие способы борьбы с недугом.
Мумие
Это минеральное вещество является мощным активатор иммунной системы. Мумие принимают на голодный желудок перед завтраком (по 0,5 гр.). Курс лечения – 30 суток. По истечении месяца нужно сделать 5-дневный перерыв и в случае необходимости пройти повторный курс лечения (в большинстве случаев он не требуется). Представительницам прекрасного пола также можно делать спринцевания при помощи раствора на основе этого компонента. Для его приготовления нужно развести 1 гр. мумие в стакане теплой воды.
Творожная сыворотка
В продукте содержится множество полезных лактобактерий, подавляющих распространение кишечной палочки и восстанавливающих микрофлору кишечника. Сыворотку рекомендуется принимать утром, днем и вечером (по стакану) за 15 минут до еды. Продолжительность курса лечения составляет 15 суток.
Отвар земляничной груши
Для приготовления целебного напитка требуется выкопать 300 гр. земляной груши и как следует вымыть корнеплоды. Далее их заливают литром воды и ставят на плиту. Корнеплоды необходимо кипятить на протяжении 20-30 минут. После готовности полученный отвар остужают. Его принимают по 100 гр. 3 раза в день (перед приемом пищи). Корнеплоды также можно не выкидывать, а употребить в пищу.
Гусиная лапчатка
Это целебное растение можно использовать для приготовления чая, обладающего противовоспалительным и антибактериальным действием. Для его приготовления нужно залить столовую ложку сухого растения стаканом кипятка, накрыть крышкой и дать настояться 30 минут. Напиток рекомендуется выпивать за раз, оптимальная суточная доза – 1 стакан. Такой чай пьется без добавления сахара и только на голодный желудок. Принимать его рекомендуется на протяжении 10-12 дней.
Профилактические меры
Чтобы свести к минимуму риск появления в моче кишечной палочки, необходимо знать, откуда берется этот микроорганизм, и знать пути его передачи. Врачи советуют придерживаться таких рекомендаций:
- необходимо соблюдать правила личной гигиены и следить за чистотой тела;
- категорически запрещено потреблять в пищу плохо вымытые продукты;
- запрещено вести беспорядочную половую жизнь и экспериментировать с нетрадиционной интимной жизнью.
Чтобы оградить себя от такого недуга, нужно вести здоровый образ жизни, правильно питаться и заниматься укреплением иммунной системы.
Заключение
Несмотря на то, что кишечная палочка в моче хорошо поддается лечению, ее присутствие может вызвать определенные проблемы со здоровьем, вплоть до развития хронических заболеваний. Именно поэтому при возникновении первых сомнительных признаков требуется незамедлительно обратиться к врачу и пройти полноценное обследование.
Источник:
http://apkhleb.ru/mocha/kishechnaya-palochka-moche
Как избавиться от E. coli в анализе мочи: лечение антибиотиками и народными средствами
Кишечная палочка – это бактерия, которая живет в пищеварительной системе у всех здоровых людей. В урине и других выделениях ее быть не должно больше определенного количества. Кишечная палочка в моче сигнализирует о патологии мочеполовой системы, например, о воспалении. Необходимы срочные меры, так как дальнейшее развитие подобных болезней всегда чревато осложнениями. Особенно опасна Escherichia coli для будущих матерей и для детей.
- Что за микроб – кишечная палочка
- Какой анализ показывает бактерию Escherichia coli в моче
- Общие правила подготовки к анализу мочи
- Норма содержания палочки в пробе
- Что означает повышенное содержание бактерии E. coli
- Физиологические причины
- Воспаления мочеполовых органов
- Хронические болезни
- Незащищенный секс
- Другие причины
- Дополнительные симптомы инфицирования эшерихией коли
- Чем опасен микроорганизм Escherichia coli
- Как избавиться от кишечной палочки в моче
Что за микроб – кишечная палочка
Бактерия Е. coli, которую нашли в моче, — тревожный звонок. Микроорганизм относят к условно-патогенным. В кишечной микрофлоре здорового человека мирно сосуществует множество бактерий, выполняющих полезную работу. Эта палочка — ее безвредные штаммы — участвует в синтезе витаминов B и K, активно помогает поддерживать обмен веществ, блокирует размножение недружелюбных «собратьев».
При неблагоприятных условиях для организма (например, снижение иммунитета) эта условно-патогенная бактерия превращается во врага. Одни ее штаммы становятся виновниками уретритов, другие — менингита или коли-сепсиса.
Извне проникают опасные разновидности этой кишечной бактерии и вызывают эшерихиозы – инфекции, провоцирующие диарею. Наличие палочки в моче — аномалия, симптом, который нужно устранить как можно быстрее.
Какой анализ показывает бактерию Escherichia coli в моче
Наличие патологии показывают общие анализы. Кишечную палочку обнаруживают, исследуя кровь, мочу, кал. Также берут мазки с половых органов. Однако чаще используют другой тест — идентификацию Escherichia coli в посеве мочи. Биоматериал помещают в оптимальные условия, в которых микроорганизмы размножаются очень быстро. Попутно определяют их чувствительность к антибиотикам.
Общие правила подготовки к анализу мочи
Нередки случаи ложноположительного результата бакпосева. Причина ошибки — некорректный забор биоматериала. Чтобы избежать лишних волнений, нужно следовать рекомендациям врачей.
- Обязательно собирать утреннюю мочу сразу после пробуждения, первую и последнюю порцию пропускать. Необходимый объем — минимум 70 мл.
- Мочу лучше собирать в стерильный аптечный контейнер.
- Накануне нельзя есть продукты, окрашивающие мочу, принимать диуретики.
- Перед процессом забора материала нужно вымыть половые органы, используя нейтральные средства.
- Для женщин обязателен ввод тампона во влагалище.
- 2 часа — максимальный срок хранения биоматериала. В холодильнике мочу можно держать 4 часа.
Чтобы избежать некорректного результата, врачи советуют иную процедуру — забор мочи катетером. Она не очень приятная, но болезненных ощущений не вызывает.
Норма содержания палочки в пробе
В моче здорового человека огромного количества E. coli быть не должно. Если обнаружено небольшое присутствие кишечной палочки (не более 10 3 КОЕ/мл), то результат трактуется как отрицательный. Нередко виноват в нем некорректный сбор материала. Когда данный показатель превышает 10 5 КОЕ/мл, можно с уверенностью говорить о наличии в моче бактерии (бактериурии), о воспалении.
Что означает повышенное содержание бактерии E. coli
Любой микроорганизм, обнаруженный в моче, — симптом какого-то заболевания. Иногда не совсем понятно, как и откуда кишечная палочка проникает в мочу, причины явления весьма разнообразны.
Физиологические причины
В большей степени физиология женщин виновата в проникновении коварной палочки в мочевыделительную систему. Широкий, но короткий, мочеиспускательный канал, его близость к анальному отверстию — причина проникновения палочки в уретру из кала. Этому способствуют постоянные нарушения правил гигиены — редкое мытье, нерегулярная смена постельного и нижнего белья.
Воспаления мочеполовых органов
Наиболее распространенные причины появления кишечной палочки — заболевания мочеполовой системы:
- везикулит, поражающий семенные пузырьки;
- пиелонефрит — воспаление почек;
- простатит — патология в предстательной железе;
- уретрит — воспаление мочеиспускательного канала;
- цистит — заболевание мочевого пузыря.
Кишечная бактерия сигнализирует и о других неполадках в урогенитальной сфере. Это аднексит, кольпит, орхит или эндометрит.
Хронические болезни
E. coli в моче у мужчин, женщин, детей может активизироваться на фоне вялотекущих хронических заболеваний мочеполовой системы, из-за которых значительно ослабевает иммунитет. Тогда палочка беспрепятственно распространяется по всему организму, лишенному защиты от инфекций.
Незащищенный секс
Половые контакты без контрацептивов, анальный секс увеличивают риск возникновения палочки в анализе мочи. При этом можно заразиться множеством других, не менее неприятных бактерий — стрептококком, стафилококком.
Другие причины
Палочка в моче у женщин — нередкий случай во время беременности, когда практически любой инфекции открыт доступ в организм. Патогенный штамм попадает в новую среду обитания из-за:
- близких контактов с его носителем;
- недостаточно термически обработанных продуктов;
- зараженной некипяченой воды;
- гормональных сбоев, сахарного диабета.
Нередко в анализе обнаруживается палочка из-за того, что емкость для мочи была нестерильной.
Дополнительные симптомы инфицирования эшерихией коли
В ряде случаев коварная палочка, быстро размножаясь, ведет себя мирно: она ничем не беспокоит человека. Однако косвенными признаками ее присутствия в моче бывают:
- неприятный запах мочи, обнаружение в ней белых хлопьев, гноя либо крови;
- боли при мочеиспускании, сопровождающиеся жжением, зудом;
- озноб, повышение температуры, слабость;
- болезненные менструации;
- тошнота — при воспалении почек;
- поясничные боли или тревожащие ощущения в боку;
- недержание, участившееся мочеиспускание;
- диарея, запор.
О запущенной инфекции сигнализируют гнойные выделения из уретры, сыпь красного цвета около половых органов.
Чем опасен микроорганизм Escherichia coli
Кишечная палочка, обнаруженная в моче, — сигнал воспалительного процесса в мочеполовой системе. Патология, устраненная вовремя, не окажет разрушительного влияния на организм. А вот запущенные болезни неминуемо спровоцируют серьезные осложнения. Одним из самых опасных является почечная недостаточность.
Немного по-другому обстоят дела у беременных женщин. Сопротивляемость инфекциям у них чрезвычайно мала, а бактерия еще больше усугубляет положение. Потенциальные последствия для матери и ребенка угрожающи:
- токсичная бактерия проникает из влагалища в плаценту, попадает в кровоток эмбриона, из-за этого возрастает риск врожденных патологий;
- заражение при родах приводит к отставанию в развитии, иногда — к гибели;
- кишечная бактерия может спровоцировать менингит.
Escherichia coli, распространившаяся по всему организму матери, — причина пневмонии, сепсиса. В таком состоянии риск гибели плода возрастает.
Как избавиться от кишечной палочки в моче
Урологические болезни, вызванные кишечной палочкой, требуют быстрых мер. Однако подбор лекарственных препаратов — прерогатива врача. Только он вправе решать, как лечить кишечную палочку и те болезни, что она вызвала. Всегда назначаются такие препараты:
- антибиотики из группы аминогликозидов и аминопенициллинов в таблетированных формах либо внутримышечных инъекциях — Амикацин, Канамицин, Тобрамицин, Ампициллин, Мономицин;
- бактериофаги, уничтожающие многие виды опасных микроорганизмов: Интести, Секстафаг, Пиобактериофаг;
- препараты, поддерживающие иммунитет, и пробиотики, избавляющие от дисбактериоза: Дюфалак, Линекс, Нормазе;
- противодиарейные — Лоперамид, Стопдиар;
- сорбенты для вывода токсинов: Полисорб, Смекта.
Помимо препаратов больные должны каждый день пить кисломолочные продукты — йогурт, кефир, простоквашу. Симптомы слабеют через несколько дней, выздоровление занимает 1-2 недели, если антибактериальное средство подобрано корректно.
Устранение кишечных бактерий народными методами врачи не приветствуют. Но если доктор разрешил, можно готовить дома такие рецепты:
- Лапчатка гусиная. 1 ст. л. заливают 250 мл кипящей воды, проваривают 15 минут. Емкость закутывают на ночь. Утром фильтруют, весь объем делят на 3 части, выпивают за день.
- Топинамбур. Овощ измельчают, отмеряют стакан. В кастрюлю выливают такое же количество молока, доводят до кипения, высыпают земляную грушу, варят 5 минут, кладут масло (2 ст. л.), муку (1 ст. л.). Перемешав, снимают с плиты. Средство используют в качестве соуса.
- Мумие. Препарат принимают по 50 мг перед каждой трапезой. Терапию продолжают месяц, делают перерыв 5 дней, и курс возобновляют.
Все препараты, включая растительные, лучше согласовать с врачом. Иначе терапия может не только не дать результатов, но и возыметь обратный эффект — кишечная инфекция будет распространяться дальше.
Источник:
http://tden.ru/health/kishechnaya-palochka-v-moche
О чем свидетельствует появление кишечной палочки в моче
Когда возникает боль во время посещения туалета, причиной неприятности могут быть разные возбудители, в том числе кишечная палочка в моче. Это условно патогенный микроб, и понятия «норма» в урине для него не существует.
Откуда берется возбудитель
Кишечная палочка относится к специфическим микроорганизмам, заселяющим кишечник. Она выделяет витамин К, который участвует в кроветворении. Микроб помогает синтезировать витамины группы В, занимается “переработкой” жирных кислот, билирубина и холестерина.
В мочу кишечная палочка может попасть при нескольких условиях. Причины бывают случайными, то есть связанными с неправильной подготовкой к сдаче анализа, использованием нестерильного контейнера для сбора. Занятие анальным сексом накануне исследования тоже провоцирует попадание микробов в урину. В первом случае при подмывании бактерии с анального отверстия смываются в исследуемую порцию мочи. Такая ситуация чаще встречается у женщин. Во втором случае бактерии попадают на наружные половые органы во время секса.
Кишечная палочка в моче у ребенка – частое явление, поскольку не все родители придерживаются правил ухода за половыми органами малыша.
Есть и другие причины возникновения неспецифической флоры:
- беременность;
- постоянное несоблюдение правил личной гигиены;
- воспалительные заболевания почек;
- цистит и воспаление мочеточника;
- анатомически близкое расположение уретры и анального отверстия.
Появление микроба обусловлено снижением иммунитета. Именно поэтому мазок беременных женщин нередко показывает нарушение микрофлоры. Опасность появления кишечной палочки связана с тем, что повышается риск заражения плода и преждевременных родов.
Другими факторами снижения иммунитета являются частые инфекционные заболевания, злоупотребление алкоголем и сигаретами, переутомление, вызванное нервными и физическими перегрузками.
Есть патологии почек, связанные с появлением кишечной палочки. Это пиело- и гломерулонефрит. Попадание кишечной палочки в мочу может быть признаком специфического воспаления любого органа выделительной системы.
Возбудитель определяется при общем исследовании мочи. Если анализ выявляет бактерию, то посев позволяет идентифицировать ее тип.
Способы передачи
Передача возбудителя происходит разными путями. Источник заражения – больной человек или носитель кишечной палочки. Существует несколько типов возбудителя, поэтому и “заразность” бактерий разная. Инкубационный период при попадании кишечной палочки внутрь организма составляет около 24 часов.
Основной способ передачи возбудителя – фекально-оральный. Кишечная палочка попадает в воду, ее употребляет человек и заболевает. Бактерия может сохраняться на предметах обихода и продуктах питания. При недостаточной гигиене рук палочка попадает в организм, задерживается в выделительной системе и ЖКТ, вызывая воспаление.
Второй способ передачи – гематогенный. Возбудитель с током крови разносится по различным органам, из-за чего развивается нисходящий тип заражения, начинающийся с поражения почек.
У ребенка симптомы инфекции являются результатом плохой гигиены рук. Чаще всего палочка распространяется в детских дошкольных учреждениях и педиатрических отделениях больниц.
Симптомы
Иногда возбудителя выявляют при обследовании. Но чаще всего размножение кишечной палочки проявляется такими симптомами:
- жжение в области уретры;
- боль при мочеиспускании;
- нарушение оттока мочи;
- изменение цвета, неприятный запах биоматериала;
- примеси гноя или крови;
- повышение температуры;
- слабость, недомогание;
- боль внизу живота или в пояснице.
Симптомы поражения мочевыводящих путей неспецифичны. Патологический процесс в мочевом пузыре нарушает отток урины и вызывает сопутствующие признаки цистита.
У грудничка выяснить причину недомогания бывает сложно. Ребенок беспокойный, кричит без видимых причин. При обращении в поликлинику ситуацию помогает прояснить анализ.
Лечение
Если появления кишечной палочки в моче избежать не удалось, необходимо быстро справиться с патологией, пока она не распространилась дальше. Чтобы избавиться от возбудителя, не обязательно назначать антибиотики. Есть состояния, при которых следует лечить патологию другими методами.
Если причина появления палочки в выделительной системе связана с нарушениями микрофлоры, назначают средства для ее нормализации. Кишечная палочка в моче – это не норма. Но если симптомы патологии отсутствуют, лечение медикаментами не понадобится. Ведущая роль в терапии – работа собственного иммунитета. Если ему удастся самостоятельно справиться с незначительным количеством возбудителя, то не произойдет распространения инфекции.
Но чаще врачи назначают антибиотики. Их выбор зависит от возраста пациента, состояния здоровья, стадии патологического процесса. Это могут быть средства ампициллинового ряда, нитрофураны, цефалоспорины. Предпочтение отдается препаратам широкого спектра действия, но некоторые из них нельзя назначать детям и беременным. Курс терапии длится не менее недели. Насколько успешно назначенное лечение, проверяют контрольным анализом мочи.
Чтобы освободить мочевыводящую систему от кишечной палочки, необходимо не только подавить рост бактерии. Нужно нормализовать собственную флору, помочь восстановить поврежденную стенку пострадавшего органа.
Поскольку терапия проводится фармакологическими средствами, важно защитить печень от их агрессивного воздействия. В период лечения обязательны гепатопротекторы.
Когда воспалительный процесс поражает несколько органов, необходима госпитализация.
Лечить воспаление легче, соблюдая специальную диету. Она предполагает прием большого объема жидкости. Требуется полный отказ от соли, специй и маринадов. Активировать борьбу иммунитета с бактерией можно, если включить в рацион больше кисломолочных продуктов: натуральных йогуртов, простокваши, кефира, ряженки.
Можно воспользоваться и народными средствами. Например, прием мумие на протяжении месяца позволяет избавиться от кишечной палочки. А отвар гусиной лапчатки помогает вылечить воспаление намного быстрее.
Источник:
http://nefrologinfo.ru/mocha/kishechnaya-palochka-v-moche.html
Кишечная палочка в моче у женщин лечение
Инфекции моче выводящих путей
Инфекции кишечной палочки мочевых путей очень распространены, особенно у женщин. Примерно 50% взрослых женщин сообщили о наличии некоторых эпизодов инфекции мочевых путей (IVU) в течение их жизни.
ИМП включают инфекции мочевого пузыря (CYSTITIS) и более серьезные инфекции почек (PIELONEFRITI), но наиболее распространенными инфекциями являются цистит, который обычно заживает с курсом антибиотиков. Кроме того, у молодых женщин также наблюдается присутствие бактерий кишечной палочки (обозначенных позитивной мочи) в образце мочи у пациента без симптомов, называемое «бессимптомная бактериурия». Этот вывод не обязательно подразумевает назначение антибиотика, если не в особых условиях, например у беременных женщин.
Мы сосредоточимся главным образом на остром цистите, проявляющемся у здоровых женщин.
Что имеется в виду при инфекциях мочевых путей ?
Бактерии обычно не живут в мочевом тракте, который включает в себя почки (которые отфильтровывают мочу), мочевой пузырь (который собирает мочу) и уретру (путь прохождения для выделения мочи). Когда бактерии попадают в мочевой путь и начинают размножаться, они могут вызывать IVU. Подавляющее большинство ИМП – инфекции мочевого пузыря.
Как возникает кишечная палочка в моче?
Кишечная палочка в моче в основном затрагивают женщин. Это, как полагают, связано главным образом с близостью отверстия уретры к анусу и к меньшей длине уретры. Большая часть ИМП происходит из-за бактерий Escherichia Coli (E. COLI), который является одним из наиболее распространенных микробов в фекалиях. Загрязнение фекалия может привести к прохождению микроорганизма, такого как E. COLI в уретре. Эти бактерии затем переходят в мочевой пузырь (и иногда возвращаются к почке), что приводит к инфекции. Конечно, у E. COLI есть функции, которые облегчают IVU, такие как способность прилипать к поверхностным клеткам уретры и мочевого пузыря.
Кишечная палочка в моче у женщин
Каковы факторы риска для развития кишечной палочки в моче?
Вхождение бактерий в мочеиспускательный канал может быть обусловлено многочисленными факторами, в частности факторами, связанными с сексуальной активностью. Использование спермицидов, особенно в связи с диафрагмой, по-видимому, увеличивает риск развития ИВС у женщин.
Некоторые женщины подвержены рецидивирующим ИМП. Факторы, которые могут предрасполагать молодых женщин к повторным эпизодам IVU, следующие:
• сексуальная активность
• использование спермицидов
• генетические факторы
• новый сексуальный партнер
Здоровые мужчины развиваются реже, чем женщины IVU.
Мужчины, женщины и дети с другими проблемами со здоровьем могут подвергаться IVU. Некоторые клинические состояния могут иногда приводить к ИМП, которые являются более серьезными, чем просто цистит. К таким факторам относятся: катетер с постоянным мочевым пузырем, недавний урологический маневр на мочевом тракте, анатомические аномалии мочевого тракта, нейрогенный мочевой пузырь (паралич мочевого пузыря из-за неврологических изменений), беременность, диабет, возраст старше 65 лет лет и наличие обструкции мочевых путей.
Каковы симптомы кишечной палочки у женщин?
Типичными симптомами острого цистита являются:
• частое мочеиспускание
• боль или жжение во время мочеиспускания
• кровь в моче
• дискомфорт в средней части нижней части живота (надлобковая боль)
Сжигание во время мочеиспускания является частым расстройством даже у пациентов с вагинитом (воспаление влагалища) или уретритом (воспаление уретры). Присутствие крови в моче распространено при цистите, но не в двух других условиях. Вагинальные выделения, неприятный запах, зуд или боль во время полового акта являются типичными особенностями вагинита. Вы должны думать об уретрите, если у пациента появился новый сексуальный партнер, партнер с уретритом или постепенное развитие симптомов мочеиспускания в течение 6-7 дней (как правило, в случае острого цистита симптомы становятся важными в 1 -2 дня).
Если у пациента имеется пиелонефрит (инфекция почек), лихорадка почти всегда присутствует. Пиелонефрит также может вызывать боль на стороне пораженной стороны, тошноту, рвоту. Частое мочеиспускание, боль или жжение во время мочеиспускания и боли выше лобка часто возникают в случаях пиелонефрита. Важно помнить, что присутствие бактерий в моче при отсутствии симптомов (бессимптомная бактериурия) не считается IVU и не всегда нуждается в лечении.
Как диагностируется ИВУ?
Простой цистит часто может быть диагностирован неуловимым, полагаясь исключительно на симптомы. Это особенно верно, если у женщины есть частый ИВС и он может легко распознать симптомы. Однако большинство пациентов, особенно с первым эпизодом, обращаются к своему врачу. Врач осмотрит пациента и спросит, есть ли у него лихорадка или боль в боку, что свидетельствует о пиелонефрите. Если симптомы указывают на вагинит или уретрит, необходимы гинекологическое или урологическое обследование и соответствующие культуры. Один из способов отличить IVU и вагинит – это исследовать мочу с помощью микроскопа для поиска белых кровяных клеток. Моча обычно имеет эти клетки в случае IVU, но не вагинита,
Поиск бактерий в моче осуществляется с помощью уринокультуры. Для проведения анализа мочи пациент должен собрать небольшое количество мочи, собранной в специальном стерильном контейнере во время средней части мочеиспускания (промежуточная жидкость), когда поток мочи имеет хорошую форму, без прерывания мочеиспускания. Собранный таким образом образец (10-20 см3) должен быть немедленно доставлен в лабораторию и, по возможности, охлажден в термоконтейнере. Фактически, если мочу оставляют надолго при комнатной температуре, количество присутствующих микробов умножается, и результат обследования более не является надежным.
Каково лечение ИВС?
У здоровых молодых женщин с простым циститом обычное лечение состоит из трех дней антибиотика. Наиболее распространенными препаратами являются триметоприм-сульфаметоксазол (бактрим), ципрофлоксацин (ципроксин) или левофлоксацин (левоксацин). Ведущие эксперты согласны с тем, что триметоприм-сульфаметоксазол является препаратом выбора для цистита, если только сопротивление E. COLI у местного населения не очень высока, или если у пациента аллергия, если он страдает фавизмом или пациент беременен. Ципрофлоксацин (Ципроксин) и левофлоксацин (Левоксацин) являются препаратами, которые нельзя назначать беременным или кормящим грудью женщинам. Некоторые антибиотики, такие как нитроформатоин (Furandantin), следует назначать в течение 5-7 дней. Симптомы обычно разрешаются в течение одного-трех дней после
Некоторые врачи рекомендуют увеличить потребление жидкости, чтобы помочь избавиться от бактерий из мочевого пузыря. Другие, однако, полагают, что увеличение жидкости в организме разбавляет концентрацию антибиотика в мочевом пузыре, делает препарат менее эффективным. Для подтверждения этой гипотезы исследований не проводилось.
Лечение при беременности.
Беременным женщинам с IVU с симптомами или без них требуется агрессивное лечение. На самом деле, во время беременности риск развития пиелонефрита (вовлечение почки) IVU или бессимптомной бактериурии больше. Кроме того, ИВУ может вызывать осложнения в течение беременности. У беременных женщин проводят культуру мочи, чтобы идентифицировать бактерии, и пациент лечится от инфекции даже при отсутствии симптомов.
Инспекционные визиты.
Они необходимы только молодым здоровым женщинам, у которых симптомы цистита не устранены. У беременных женщин мочеиспускание необходимо через две недели после окончания лечения, чтобы повторить терапию в случае рецидива инфекции.
Можно ли предотвратить вторжение?
Часто возникает проблема профилактики ИМП у молодых женщин с рецидивирующими инфекциями. Необходимо соблюдать следующие рекомендации:
1. Измените контрацептивы.
Женщины, которые используют спермициды, особенно в сочетании с диафрагмой или презервативом, должны использовать альтернативные меры контрацепции.
2. Увеличить потребление жидкости и мочеиспускание после полового акта.
Несмотря на то, что нет исследований, которые четко демонстрируют обоснованность этих мер, многие врачи считают, что эти рекомендации полезны.
3. Антибиотики.
Для пациентов, которые не нуждаются в изменении своего поведения или типа контрацепции, или для тех, у кого эти меры не были доказаны, антибиотики должны использоваться для профилактики рецидивирующих ИМП. Эти циклы антибиотиков могут быть даны по-разному, включая:
– Непрерывное использование антибиотиков. Антибиотики с низкой дозой можно назначать ежедневно в течение шести месяцев или нескольких лет у некоторых пациентов (амбибиотическая профилактика). Обычно рекомендуется принимать препарат до ночного отдыха, чтобы обеспечить большую эффективность.
– Антибиотики после полового акта. У женщин, у которых рецидив явно связан с половым актом, использование одной дозы антибиотика (например, таблетки Bactrim или Ciproxin) после полового акта может быть эффективным лечением.
– Самолечение. Некоторые женщины могут работать со своими врачами, чтобы разработать план самолечения с помощью антибиотиков при первом признаке инфекции мочевых путей, даже не дожидаясь результатов лабораторных исследований.
Где я могу найти дополнительную информацию?
Ваш врач – лучший человек, который предоставит вам важную информацию о вашем конкретном случае. Не все пациенты с IVU описаны, и важно, чтобы ваша ситуация оценивалась кем-то, кто знает вашу конкретную ситуацию
клиника.
Этот материал дает вам общую информацию и не заменяет рекомендации врача. Вам следует обратиться к своему врачу, чтобы задать ему любые вопросы, касающиеся вашего здоровья, терапии или лечения.
Источник:
http://dogerli.ru/kishechnaja-palochka-v-moche-u-zhenshhin-lechen/
Все о кишечной палочке | Domestos
Причины передачи кишечной палочки, причины и каналы ее распространения, а также методы профилактики.
Кишечная палочка – это бактерия, которая может причинить вред вашему здоровью. Если вы узнаете о способах уничтожения и профилактики кишечной палочки, вы сможете снизить риск заражения и не допустить ее распространения.
Мы поможем вам разобраться с такими вопросами, как «кишечная палочка: причины», «как передается кишечная палочка?» и расскажем, каким образом Domestos может помочь убить вредоносные бактерии, живущие в вашем туалете, и предотвратить распространение заболевания. Давайте рассмотрим подробнее, что представляет собой эта бактерия.
Кишечная палочка: симптомы
Кишечная палочка — это палочковидная бактерия, которая обитает в кишечнике человека и имеет множество разновидностей. Большинство из них — это безвредные микроорганизмы, но есть и такие, которые влекут за собой серьезные проблемы со здоровьем. Кишечная палочка возникает из-за несоблюдения гигиены и чистоты, поэтому использование хлоросодержащих моющих средств, таких как Domestos, необходимо.
Перед тем, как ответить на вопросы «откуда берется кишечная палочка?» и «как передается кишечная палочка?», нужно упомянуть симптомы, появляющиеся при заражении, такие как рвота, спазмы желудка и температура.
Кишечная палочка: причины
Одним из первых шагов по профилактике кишечной палочки в вашем доме должен стать ответ на вопрос «как передается кишечная палочка?» Для этого существует несколько основных причин:
Зараженная еда:
Зараженные бактерии можно обнаружить в мясе крупного рогатого скота, включая говядину и баранину, так как бактерии кишечной палочки могут находиться в кишечнике животных. Кроме того, может быть заражена и фермерская продукция: зелень, фрукты и овощи.
Зараженная вода:
Подхватить кишечную палочку очень просто, выпив воды из зараженного источника.
Все описанные выше причины и являются ответом на вопрос «откуда возникает кишечная палочка?» А теперь перейдем к самому важному – профилактике кишечной палочки в вашем доме.
Кишечная палочка передается?
Присутствие безвредных разновидностей кишечной палочки является нормой для микрофлоры кишечника человека. Такие бактерии полезны для здоровья, так как препятствуют появлению других болезнетворных бактерий в кишечнике. Однако при нарушении работы пищеварительного тракта безвредная норма кишечной палочки может увеличиться и тогда необходима консультация доктора.
К сожалению, кишечная палочка заразна и тем самым еще более опасна. Кишечная палочка передается от человека к человеку воздушно-капельным и половым путем. Помимо прямого контакта с зараженным человеком, инфекция может передаваться путем употребления некачественной еды или загрязненной воды.
Кишечная палочка: профилактика с помощью личной гигиены
Чтобы остановить распространение кишечной палочки, нужно обязательно мыть руки:
После обращения с животными
После любого контакта с зараженным человеком
Перед и после приготовления еды
После замены подгузников, грязной одежды или постельного белья
После использования туалета
После уборки
Кишечная палочка: профилактика дома
Теперь перейдем к домашней уборке – важной части профилактики кишечной палочки. Следуйте этим простым советам, чтобы защитить свой дом:
Тщательно убирайте ванную комнату и туалет – пользуйтесь хлорсодержащими чистящими средствами при уборке раковин, сантехники и всех твердых поверхностей. Особое внимание стоит уделить туалету, так как он – один из основных источников распространения кишечной палочки. Использование Domestos поможет убить все вредоносные бактерии в вашем туалете и ванной. Такое чистящее средство сэкономит ваше время, а также позаботится о вашем здоровье. Однако, перед использованием любого нового средства, не забудьте его протестировать и внимательно читайте инструкцию.
Вытирайте все ручки в доме, чтобы не допустить распространения бактерий.
Протирайте стиральную машину после стирки грязной одежды и постельного белья.
Когда дело касается дезинфекции вашего дома, хлорсодержащие чистящие средства становятся основным способом поддержания гигиены. Многочисленные исследования не раз показывали эффективность геля Domestos, содержащего хлор, в уничтожении вредных бактерий и в борьбе по предотвращению кишечных инфекций.
Не стоит забывать и про использование туалетных блоков, которые помогут поддержать гигиеническую чистоту и предотвратить распространение бактерий. Туалетные блоки Domestos идеально встраиваются под ободок унитаза, плотно прилегая в самом критичном, с точки зрения грязи и микробов, месте.
Максимальный эффект защиты вашего туалета может быть достигнут благодаря совместному использованию чистящего геля и туалетных блоков Domestos. Результат — чистый и опрятный туалет 24/7*!
*Защита от загрязнений (благоприятной среды для микробов) 24 часа в сутки, 7 дней в неделю при использовании согласно инструкции. По результатам инструментальных тестов Unilever, Италия, 2016
Когда кишечная палочка больше не несет пользу, или как бороться с симптомами эшерихиоза
Кишечная палочка — это отдельный вид грамотрицательных микроорганизмов бактериальной природы, который обитает в нижних отделах кишечника и входит в состав нормальной кишечной микробиоты. Все штаммы данного микроорганизма являются безвредными кроме одного серотипа (O157:H7). При попадании в просвет толстого кишечника этот микроорганизм способен вызывать тяжелые пищевые интоксикации, приводя к резкому ухудшению общего состояния и развитию серьезных осложнений. Характер клинических симптомов инфицирования кишечной палочкой напрямую зависит от того, какой из штаммов инфекции попал в пищеварительный тракт.
Симптомы и признаки инфицирования
В зависимости от типа бактерии, которая привела к развитию эшерихиоза, распознать инфицирование можно по таким характерным признакам:
- Энтероинвазивная палочка. Данный возбудитель способен вызывать острую интоксикацию как у взрослых, так и у детей. Клинические симптомы инфицирования энтероинвазивной палочкой похожи на симптоматику дизентерии. Об инфицировании говорят частые позывы к опорожнению кишечника (до 25 раз в сутки), общая слабость, тошнота, испражнения приобретают водянистую консистенцию и могут содержать примеси слизи.
- Гемолитическая (энтерогеморрагическая, гемолизирующая) палочка. Этот патогенный микроорганизм вызывает у взрослых гемолитико-уремический синдром, а у детей провоцирует геморрагический колит. Оба заболевания нуждаются в своевременном лечении.
- Энтеротоксигенная. К симптомам инфицирования данным микроорганизмом, относят тошноту и частые эпизоды рвоты, выраженную диарею, спастическую боль в околопупочной области. Этот вариант кишечной инфекции одинаково часто встречается среди взрослых и детей.
- Энтеропатогенный эшерихиоз. Если кишечная палочка выявлена у ребёнка грудного возраста, то в 80% случаев речь идет об энтеропатогенном эшерихиозе. Распознать инфицирование можно по таким симптомам, как диарея и рвота. Новорожденный ребёнок отказывается от приема пищи, наблюдается частое срыгивание, беспокойство, непрерывный плач и бессонница.
Стандартное лечение кишечной палочки включает в себя прием медикаментов, оказывающих губительное воздействие на микроорганизм, а также препараты для устранения симптомов интоксикации.
Особенности инфицирования у женщин
По статистике, эшерихиозы чаще диагностируются у женщин различного возраста, при этом патогенные серотипы бактерий обнаруживаются в просвете толстого кишечника, во влагалище и мочевыводящих путях. Если говорить о причинах возникновения кишечной палочки в моче, то спровоцировать данное явление могут такие факторы:
- Анатомически близкое расположение наружного отверстия мочеиспускательного канала и анального отверстия.
- Снижение иммунитета.
- Беременность.
- Несоблюдение правил личной гигиены и гигиены половой жизни.
- Воспалительное поражение почек и мочевыводящих путей.
Важно помнить, что лечение симптомов кишечной палочки в моче у женщин народными средствами может обернуться развитием тяжёлого инфекционно- воспалительного процесса в области почек и мочевыводящих путей.
Нередко, патогенные штаммы бактерии обнаруживаются в мазке из влагалища у женщин. Если в мазке у женщины обнаружена кишечная палочка, лечение включает не только использование лекарственных средств, но и полный отказ от ношения нижнего белья из синтетических материалов, а также временный отказ от незащищенной интимной близости.
Появление данного микроорганизма в моче у женщин в период вынашивания ребенка, не является редкостью. На этапе беременности, под воздействием гормональных факторов наблюдается снижение общего иммунитета, что создает благоприятные условия для проникновения и размножения болезнетворных микроорганизмов. Если у беременной женщины появились симптомы кишечной палочки в моче, лечение рекомендовано не откладывать, так как эшерихиоз может обернуться тяжелыми последствиями как для её организма, так и для организма развивающегося плода.
Лечение
Для лечения симптомов кишечной палочки у взрослых и детей используются такие группы препаратов:
- Антибактериальные средства. Традиционное лечение кишечной палочки в моче, во влагалище у женщин и в просвете толстого кишечника, включает прием антибиотиков из группы цефалоспоринов. Курс лечения составляет от 5 до 10 дней.
- Спазмолитики и обезболивающие препараты. Обезболивающие таблетки для лечения симптомов кишечной палочки у взрослых и детей назначаются при выраженном болевом синдроме. С лечебной целью назначаются такие препараты, как Нурофен, Спазмалин, Но-шпа.
- Пробиотики. Эта группа лекарственных средств помогает восстановить баланс нормальной микрофлоры в просвете толстого кишечника и во влагалище у женщин.
Для того чтобы пробиотики, содержащие бифидум и лактобактерии, могли эффективно восстановить микрофлору, их приём необходимо сочетать с пребиотиками, которые создают благоприятную среду для размножения полезных бактерий. Высокую результативность при эшерихиозе доказал комбинированный препарат Стимбифид Плюс, который относится к метапребиотикам, и содержит уникальную комбинацию фруктополисахаридов и фруктоолигосахаридов.
Метапребиотик Стимбифид Плюс обеспечивает микрофлору толстого кишечника и влагалища уникальным питанием, чем стимулируют её размножение. На основании полученных результатов клинических исследований, была составлена сравнительная характеристика эффективности Стимбифид Плюс и других препаратов, влияющих на состав кишечной микрофлоры. Метапребиотик доказал свое абсолютное лидерство. Биодобавка Стимбифид Плюс одинаково эффективна для профилактики как эшерихиозов, так и для их других заболеваний.
Как избежать инфицирования
Для того чтобы избежать развития эшерихиозов, рекомендовано соблюдать такие правила:
- Соблюдать правила личной гигиены и гигиены половой жизни.
- Перед употреблением, мясные и рыбные ингредиенты необходимо подвергать термической обработке.
- Перед едой тщательно мыть руки с использованием мыла.
- Употреблять только фильтрованную или кипячёную воду.
- Не употреблять продукты после истечения их срока годности.
- Овощи, фрукты и зелень перед употреблением необходимо мыть под проточной водой.
Беременным женщинам, а также лицам, падающим в группу риска по инфицированию кишечной палочкой, с профилактической целью рекомендовано принимать метапребиотик Стимбифид Плюс в соответствии с прилагаемой инструкцией.
/ Доктор Стимбифид
Поделиться в соцсетях:
Уропатогенные E. coli, устойчивые к антибиотикам 2 поколения, могут сохраняться в кишечниках здоровых женщин и вызывать бактериурию
29.07.2019 00:19Штаммы уропатогенной кишечной палочки могут длительно сохраняться в кишечниках здоровых женщин и вызывать бактериуриюНа рисунке: Раскрашенное изображение (полученное с помощью растрового электронного микроскопа) уропатогенных Е. coli, эпителия и нейтрофилов на поверхности слизистой оболочки мочевого пузыря.
Пандемическая уропатогенная устойчивая к фторхинолонам кишечная палочка Escherichia coli обладает повышенной способностью сохраняться в кишечнике и вызывать бактериурию у здоровых женщин
Прим. ред.: Бактериурия – это наличие бактерий в моче. Бактериурия, сопровождаемая симптомами, является инфекцией мочевыводящих путей, в тоже время есть и бессимптомная бактериурия. Диагноз ставится путем анализа мочи или посева мочи. Кишечная палочка Escherichia coli является наиболее распространенной бактерией при бактериурии.
В конце страницы, в рамках рассматриваемой темы, см. также результаты более раннего исследования об антиадгезионной терапии (альтернаьтиве антибиотикотерапии), которая может уменьшить колонизацию уропатогенной Escherichia coli.
ИССЛЕДОВАНИЕ
Исследование более 1000 здоровых женщин без симптомов инфекции мочевыводящих путей показало, что почти 9% носили в кишечнике штаммы Escherichia coli с множественной лекарственной устойчивостью. Дополнительные результаты указывают на вероятные причины пандемии резистентных штаммов E.coli. Они показывают ценность проверки статуса пациента-носителя для прогнозирования резистентных инфекций, а также необходимость переосмысления клинического значения бактерий в моче без симптомов, поскольку пандемические штаммы могут быть высокопатогенными для мочевыделительной системы и устойчивыми к лечению.
Это вызывает клиническую озабоченность, поскольку болезнетворные бактерии E. coli могут переноситься из пищеварительного тракта в женский мочевой тракт через мочеиспускательный канал, который короче и расположен по-разному у женщин, чем у мужчин. Затем бактерии могут попасть в мочевой пузырь и другие части мочевыводящих путей.
Более трети образцов мочи, предоставленных теми, кто имел устойчивую к фторхинолонам (Ципро) кишечную кишечную палочку, дали положительный результат на рост E. coli. Из них около 77% были Ципро-устойчивы, и клональный тип бактерий соответствовал образцу кала.
Большая часть обнаруженной патогенной кишечной палочки принадлежала к пандемическим клональным группам ST131-h40R или ST1193 с множественной лекарственной устойчивостью, которые в настоящее время вызывают большинство лекарственно-устойчивых инфекций мочевыводящих путей и кровотока. Они были обнаружены в два раза чаще в моче людей, у которых эти специфические штаммы были в кишечнике, по сравнению с другими штаммами кишечной палочки E. coli в целом.
Кроме того, присутствие группы ST ST131-h40R в кишечнике в этом исследовании было связано с более старшим возрастом.
Исследователи также проверили, какие участники могли иметь назначение антибиотиков во время исследования для любого типа инфекции, включая респираторную.
Через три месяца после этого более раннего сбора мочи инфекции мочевыводящих путей были диагностированы почти в 7% из 45 ранее бессимптомных носителей, которые дали согласие на последующее электронное медицинское обследование. Участники исследования были из района Пьюджет-Саунд (Puget Sound).
«Два пандемических фторхинолон-резистентных патогенных штамма E. coli, обнаруженных в клинических образцах, являются превосходными колонизаторами кишечника и, как правило, сохраняются там», — отметили исследователи. «Они также могут обнаруживаться с необычно высокой частотой в моче здоровых женщин, у которых не было документированного диагноза инфекции мочевыводящих путей во время тестирования образцов. Оба явления, по-видимому, взаимосвязаны».
Исследователи отметили, что уже давно известно, что микробная флора кишечника пациента часто содержит штаммы, вызывающие инфекцию мочевыводящих путей. Не было точно установлено, имеют ли пандемические, лекарственно-устойчивые штаммы отчетливые паттерны (очаги) в кишечнике или нижних мочевых путях здоровых людей.
Исследование было опубликовано в журнале Oxford University Press Journal, Clinical Infectious Diseases («Клинические Инфекционные Заболевания»).
По словам Евгения Сокуренко, профессора микробиологии в Медицинской школе Вашингтонского университета (UW), полученные результаты могут иметь несколько клинических последствий для лечения и инфекционного контроля. Он был старшим научным сотрудником по исследованию. Несколько других преподавателей микробиологии UW и исследователей Постоянного НИИ Кайзера в Сиэтле (Kaiser Permanent Research Institute investigators in Seattle) сотрудничали в этой работе. Ведущим научным сотрудником была Вероника Леонидовна Чеснокова, заведующая кафедрой микробиологии Медицинской школы UW.
Результаты показывают, что определенные штаммы кишечной палочки с множественной лекарственной устойчивостью, обнаруженные в этом исследовании, занимают гораздо более длительное пребывание в кишечнике, чем некоторые другие устойчивые штаммы, а также могут присутствовать в моче здоровых женщин, не вызывая жжения, крови в моче или других предупреждающих признаков бактериальной инфекции.
Сокуренко объяснил, что знание того, присутствуют ли в кишечнике женщины множественные лекарственно-устойчивые штаммы, может помочь предсказать профиль резистентности последующей клинической инфекции. Усилия по избавлению от пандемических штаммов кишечной палочки в кишечнике носителей могут снизить частоту возникновения множественных лекарственно-устойчивых инфекций и, возможно, защитить их домашние или другие контакты.
Сокуренко также сказал, что медицине, возможно, потребуется пересмотреть клиническую значимость обнаружения бактерий в моче, даже без симптомов, во время этой пандемии множественных устойчивых к антибиотикам штаммов E. coli, поскольку эти штаммы могут подвергнуть носителей риску возникновения трудно поддающегося лечению бактериального заболевания.
Фторхинолоны являются наиболее часто назначаемыми препаратами при инфекциях мочевыводящих путей. Несмотря на усилия по ограничению их использования, согласно исследователям, штаммы, устойчивые к этой категории антибиотиков, процветают и распространяются по всему миру.
Исследователи предположили, что превосходная способность двух пандемических штаммов, ST131-h40R и ST119, длительно занимать место в кишечнике людей, возможно, способствовала их быстрому глобальному распространению. Они могут сохраняться и передаваться среди здоровых людей даже в отсутствие применения антибиотиков, что может нарушить микробную структуру кишечной флоры.
Ученые пришли к выводу, что это исследование выдвигает на первый план вероятные физиологические причины пандемии этих устойчивых штаммов кишечной палочки. Оно также указывает на ценность определения статуса носителя у пациенток для прогнозирования будущих резистентных инфекций, а также на необходимость переосмысления клинического значения бактерий, присутствующих в моче без симптомов, особенно с учетом того, что эти пандемические штаммы могут быть супербактериями: высокопатогенными для мочевой системы и устойчивыми к лечению.
Источник: Материалы предоставлены Вашингтонским университетом медицинских наук — University of Washington Health Sciences / UW Medicine
Статья в журнале: Veronika L Tchesnokova, Evgeni V Sokurenko, et al. Pandemic uropathogenic fluoroquinolone-resistant Escherichia coli have enhanced ability to persist in the gut and cause bacteriuria in healthy women. Clinical Infectious Diseases, 2019
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
У уропатогенной кишечной палочки понизили способность «прилипать» к эпителию кишечникаНа рисунке: Ингибиторы адгезии (красные точки) связываются пилями бактерий, препятствуя их соединению с рецепторами клеток организма-хозяина
Выборочное истощение уропатогенных штаммов E. coli из кишечника с помощью ингибирующего высокоаффинного маннозида
Инфекции мочевыводящих путей (ИМП), вызванные уропатогенной кишечной палочкой (UPEC), поражают 150 миллионов человек ежегодно. Несмотря на эффективную терапию антибиотиками, у 30–50% пациентов наблюдаются рецидивирующие ИМП. Кроме того, растущая распространенность UPEC, которые устойчивы к антибиотикам последней линии, а в последнее время к карбапенемам и колистину, делает ИМП ярким примером кризиса устойчивости к антибиотикам и подчеркивает необходимость новых подходов к лечению и профилактике бактериальных инфекций. Штаммы UPEC устанавливают резервуары в кишечнике, из которых они выделяются с фекалиями, и могут колонизировать периуретральную область или влагалище и впоследствии подниматься через мочеиспускательный канал к мочевыводящим путям, где они вызывают ИМП.
Известно, что бактериальные пили (ворсинки) играют жизненно важную роль в взаимодействиях организма-хозяина и E. coli, опосредуя прикрепление (адгезию) к эпителиальным клеткам мочевого пузыря и почек. Однако в настоящее время недостаточно информации о механизмах колонизации и устойчивости UPEC в кишечнике.
Молекулы адгезии выносятся на поверхность бактерии и собираются с помощью системы секреции chaperon-usher (‘Chaperon-usher pathway’, сокращенно — CUP). Она состоит из двух белков. Один из них получил английское название «chaperone», которое переводится как «компаньон», «сопровождающее лицо», а в транскрипции — «шаперон», а второй компонент получил английское название «usher», которое переводится как «швейцар», «привратник», в транскрипции – «ашер».
Изоляты UPEC кодируют до 16 различных пилей пути CUP, и каждый тип пилей может обеспечивать колонизацию среды обитания в хозяине или окружающей среде.
В исследовании 2017 года, результаты которого опубликованы в журнале Nature, американские ученые продемонстрировали, что механизм шаперон-ашер (CUP) играет роль в колонизации кишечника штаммами UPEC. В частности, авторы создали девять бактерий с одиночными делециями (отсутствующими участками ДНК), у каждого из которых отсутствовал один из генов, кодирующих белки CUP. Эффект этих мутаций тестировали в модели колонизации кишечника мыши. Обнаружилось, что одиночная делеция двух генов, fim и ucl, которые кодируют пили типа 1 и пили типа F17, соответственно, вызвали заметное снижение способности бактерии колонизировать кишечник. Более того, удаление обоих генов в одном штамме приводило к большему дефекту, чем одиночная делеция, что доказывает, что их роли не являются вырожденными.
Операторы fim и ucl кодируют адгезины, которые расположены на дистальном конце каждой ворсинки. Эти адгезины, FimH и UclD, соответственно, опосредуют связывание с клетками организма-хозяина. Путем тестирования очищенных фрагментов этих двух адгезинов в анализах in vitro авторы продемонстрировали четкую специфичность связывания с гликанами, присутствующими на поверхности эпителиальных клеток хозяина, располагающимися в криптах кишечной стенки; FimH связан преимущественно с N-связанными гликанами, которые содержат маннозу (т.е. адгезин пилей типа 1 FimH в дальнейшем связывает маннозу на поверхности мочевого пузыря и опосредует колонизацию мочевого пузыря), тогда как UclD связаны с O-связанными гликанами.
В предыдущих исследованиях было показано, что потеря пилей типа 1 отразилась в потере способности UPEC колонизировать мочевой пузырь. Чтобы попытаться предотвратить связывание пилей типа 1 с эпителиальными клетками кишечника, авторы протестировали маннозид M4284, который представляет собой небольшую синтетическую молекулу, которая связана с маннозой и связывается с адгезином FimH пилей 1 типа с высокой аффинностью.
Прим. ред.: Справедливости ради стоит отметить, что уже ранее (судя по публикациям), для целей терапии рецидивирующих инфекций мочеполовых путей, вызываемых уропатогенными штаммами E.coli, рассматривалось применение маннозидов, т.е. D-маннозы, которая чаще встречается именно в виде «маннозидов» — гликозидов, содержащих маннозу. В свободном же состоянии D-манноза, которая представляет 1 из 2-х стереоизомеров маннозы (т.е. и есть сама манноза) лишь иногда встречается в некоторых растениях (в Amorphophallus Konjac, в кожуре апельсинов), при этом, D-манноза является основным стереоизомером маннозы, встречающимся в природе. Однако в описываемом исследовании речь идет о тестировании более эффективного варианта маннозида, что указывает на возможность более успешной антиадгезионной терапии.
У мышей, которые перорально получали это соединение, произошло снижение колонизации кишечника штаммами UPEC по сравнению с контрольной группой. То есть этот маннозид может эффективно конкурировать за связывание с маннозой на клетках хозяина и, таким образом, непосредственно вмешиваться во взаимодействие «хозяин-патоген». Авторы также показывают, что введение маннозида может снизить вероятность развития ИМП путем одновременного удаления UPEC из кишечника и лечения активной инфекции мочевого пузыря.
Исследование показало, ингибирующий высокоаффинный маннозид, уменьшает кишечную колонизацию генетически разнообразных изолятов UPEC, одновременно обрабатывая ИМП, без заметного нарушения структурной конфигурации микробиоты кишечника. Избирательно истощая резервуары UPEC в кишечнике, маннозиды могут заметно снизить частоту ИМП и рецидивирующих ИМП.
Иными словами, лечение не вызывало существенных изменений в составе микробиоты кишечника, в отличие от применяемых в настоящее время антибиотиков. Таким образом, антиадгезионная терапия может уменьшить колонизацию конкретными бактериями и представляет собой альтернативу антибиотикотерапии.
Источник: Caitlin N. Spaulding. et al. Selective depletion of uropathogenic E. coli from the gut by a FimH antagonist. Nature 546, 529–532 (2017)
Об адгезии микроорганизмов (в т.ч. про «пили», «фимбрии», адгезины и т.д.) см. дополнительно в подразделе Адгезия микроорганизмов: общие сведения
Пожалуйста, авторизуйтесь, чтобы оставить комментарий.
Цистит из за кишечной палочки в моче лечение
Ключевые теги: цистит и беременность лечение, лекарства при лечении цистита с кровью, ветеринарные препараты лечения цистита.
Цистит лечение мочекаменной болезни, цистит лечение укроп, ветеринарные препараты лечения цистита, цистит лечение одноразово, цистит лечение у женщин препараты нолицин.
Принцип действия
Каждая таблетка Cyto forte: препятствует прикреплению бактерий к клеткам уротелия; деформирует клетки болезнетворных микроорганизмов; повреждает клеточные мембраны бактерий и блокирует их синтез; предотвращает образование бактериальных биопленок; способствует естественному выведению вредных бактерий вместе с мочой.
Важно выпивать за день достаточное количество жидкости. Это будет способствовать вымыванию кишечной палочки из мочевого пузыря и уменьшению раздражения слизистой оболочки органа мочой. 9/27/2017«При обнаружении кишечной палочки в моче уместно использовать отвары целебных трав как вспомогательную терапию. Лечение Эшерихии коли в моче можно дополнить рецептами из … Кишечная палочка в моче в норме не появляется. Ее присутствие говорит об ошибках сбора материала либо о воспалительном процессе в мочевыводящих путях.
Официальный сайт Cytoforte — средство от цистита
Состав
Чаще всего цистит развивается из-за кишечной палочки, которая проникает в мочевой пузырь. Воспаление слизистой оболочки пузыря проявляется следующими признаками: Лечение кишечной палочки в моче Если кишечная палочка в моче не вызвала никаких патологических изменений и человек не чувствует каких-либо тревожных симптомов, вероятней всего ему не … Лечение кишечной палочки в моче Кишечная палочка – наиболее частый возбудитель цистита. Она провоцирует эту болезнь примерно в 80% случаев.
Результаты клинических испытаний
Лечение кишечной палочки в моче включает в себя различные мероприятия: Кишечная палочка в мочевом пузыре Кишечник человека заселен огромным числом различных бактерий, которые принимают участие в формировании иммунной защиты. Важно выпивать за день достаточное количество жидкости. Это будет способствовать вымыванию кишечной палочки из мочевого пузыря и уменьшению раздражения слизистой … Чтобы обезопасить себя, и чтобы правильно подобрать лечение, нужно знать, какую роль кишечная палочка играет в организме, как она попадает в мочевой пузырь, как распознать признаки цистита …
Мнение специалиста
Олег Дмитриевич Высоцкий Доктор уролог, кандидат медицинских наук Мои рекомендации пациентам с циститом — отказ от некомфортного телу обтягивающего и тесного синтетического белья. Второе — постельный режим, если это возможно. Третье, но самое важное — прием биодобавки CytoForte. На данный момент этот препарат единственный быстродействующий препарат абсолютно без побочных эффектов в отличии от антибиотиков. Потребуется всего 17 минут после приема CytoForte, чтобы средство начало действовать.
Если кишечная палочка вызвала диарею, необходимо восстановление водно-электролитного баланса с помощью регидратации. В целом, лечение зависит в первую очередь от штамма кишечной палочки. При обнаружении кишечной палочки в моче уместно использовать отвары целебных трав как вспомогательную терапию. Лечение Эшерихии коли в моче можно дополнить рецептами из народа. Лечение кишечной палочки в моче Кишечная палочка в мочевом пузыре Кишечник человека заселен огромным числом различных бактерий, которые принимают участие в формировании иммунной защиты.
Способ применения
Лечебный курс: по 1 таблетке 2 раза в день Совместно с антибиотиками: по 1,5 таблетки 2 раза в день В период обострений: по 2 таблетки 2 раза в день В целях профилактики: по 1 таблетке 1 раз в день
Причины появления в моче кишечной палочки. Escherichia coli в моче может появиться из-за различных причин. Некоторые из них неопасны и не требуют лечения. Откуда берется возбудительСпособы передачиСимптомыЛечениеКишечная палочка относится к специфическим микроорганизмам, заселяющим кишечник. Она выделяет витамин К, который участвует в кроветворении. Микроб помогает синтезировать витамины группы В, занимается “переработкой” жирных кислот, билирубина и холестерина.В мочу кишечная палочка может попасть при нескольких условиях. Причины бывают случайными, то есть связанными с неправильной подготовкой к сдаче анализа, использованием нестерильного конте…See more on nefrologinfo.ruАвтор: Admin1Лечение кишечной палочки в мочеhttps://nmed.org/kishechnaya-palochka-v-moche.htmlОднако иногда соответствующие анализы выявляют наличие кишечной палочки в моче человека. Это говорит о том, что микроорганизм обитает в мочевых путях, что является тревожным звоночком. Требуется устранение кишечной палочки в мочевом пузыре и лечение, выведение из урины. Лечение – медикаментозное и народными методами.
Как заказать?
Заполните форму для консультации и заказа Cytoforte — средство от цистита. Оператор уточнит у вас все детали и мы отправим ваш заказ. Через 1-10 дней вы получите посылку и оплатите её при получении
Однако иногда соответствующие анализы выявляют наличие кишечной палочки в моче человека. Это говорит о том, что микроорганизм обитает в мочевых путях, что является тревожным звоночком. О своем здоровье человек начинает думать только тогда, когда оно начинает напоминать о себе различными заболеваниями. Цистит — одно из инфекционных заболеваний, известное и мужчинам, и женщинам.
Как облегчить цистит, лечение цистита и воспаления яичников, цистит лечение у женщин препараты нолицин, возможно ли лечение цистита без антибиотиков, средство от цистита для кормящих, Купить Cytoforte — средство от цистита в Днепропетровске, какое эффективное средство от цистита у женщин.Официальный сайт Cytoforte — средство от цистита
Купить Cytoforte — средство от цистита можно в таких странах как:
Россия, Беларусь, Казахстан, Киргизия, Молдова, Узбекистан, Украина, Эстония, Латвия, Литва, Болгария, Венгрия, Германия, Греция, Испания, Италия, Кипр, Португалия, Румыния, Франция, Хорватия, Чехия, Швейцария, Азербайджан , Армения ,Турция, Австрия, Сербия, Словакия, Словения, Польша
У меня супруга раньше постоянно страдала циститом, хотя никогда не ходила раздетая. Год назад, может больше доктор посоветовал ей CytoForte и после курса она ни разу не жаловалась на симптомы. Так что от ее лица советую.
CytoForte отлично работает! Был хронический пиелонефрит, как чуть простужусь или переработаю, давал о себе знать. Лечилась от него почти 4 года. Перепила много всего, особых улучшений не было. По совету врача в прошлом году прошла курс CytoForte, и все прошло. С тех пор про болячку эту забыла.
Извиняюсь, не заметила на сайте сначала информацию про наложенный платеж. Тогда все в порядке точно, если оплата при получении. Пойду, оформлю себе тоже заказ.
что нужно знать об этой угрозе человечеству и как быть с антибиотиками
В прессе все чаще говорят о скором кошмарном будущем, где можно будет погибнуть от безобидного пореза: все лекарства окажутся бессильны против даже самой простой инфекции. Апокалиптические сценарии еще далеки от реальности, но проблема антибиотикорезистентности – устойчивости бактерий к лекарствам – с каждым годом становится все острее.
На прошедшей неделе в Давосе британский министр здравоохранения Мэтт Хэнкок призвал «предотвратить ужасное будущее», в котором люди окажутся беззащитны перед бактериями с множественной лекарственной устойчивостью (их иногда называют «супербактериями» или «супермикробами»).
Представляя свой план борьбы, Хэнкок сравнил масштаб проблемы антибиотикорезистентности с войнами и изменением климата. Похожими формулировками оперирует Всемирная организация здравоохранения (ВОЗ) и специалисты по всему миру.
Настоящее Время разобралось для вас в антибиотиках и супербактериях.
Насколько все плохо?Ситуация пока не критическая, но очень серьезная. Бактерии научились противостоять даже самым сильным и редко применяемым лекарствам («антибиотикам резерва», таким, как колистин), при этом с 1980-х годов принципиально новых антибиотиков практически не появлялось. Исследования идут, но они слишком долгие и дорогие – а бактерии вырабатывают неуязвимость против антибиотиков куда быстрее. Дело осложняется и простотой путешествий: супербактерии получают возможность легко распространяться по всему миру.
Авторы британского исследования антибиотикорезистентности (2016 год) оценивали, что количество смертей от таких супербактерий в мире может вырасти примерно с 700 тысяч в год до 10 млн ежегодно к 2050 году – это больше, чем число жертв онкозаболеваний (на момент публикации). Потери ВВП при таком сценарии достигнут 100 триллионов долларов.
Пока не существует систем, позволяющих полноценно отслеживать мировую ситуацию с антибиотикорезистентностью в мировом масштабе. Проект ВОЗ под названием GLASS стартовал в 2015 году и по состоянию на конец 2018 года включал в себя лишь 71 страну. В последний отчет (опубликован в январе 2019 года) вошли данные об антибиотикорезистентности всего из 49 стран, при этом их качество пока не позволяет сравнивать между собой ситуацию в различных государствах и регионах.
В региональных отчетах также не много поводов для оптимизма. Страны Евросоюза за восемь лет (2007-2015) зафиксировали более чем двукратный рост числа погибших от инфекций, вызванных неуязвимыми для антибиотиков микробами, говорится в недавнем исследовании. По количеству потерянных лет здоровой жизни в пересчете на 100 тысяч населения (170) подобные инфекции практически сравнялись с суммарным эффектом ВИЧ, гриппа и туберкулеза (183). Более всего таким инфекциям в ЕС подвержены дети до года и люди старше 65 лет.
Хотя в еще одной свежей публикации крупный госпиталь Марселя показал, что за 15 лет (2001-2016) у них ситуация с резистентностью к антибиотикам не ухудшилась. К тому же, судя по мировой прессе, пока неуязвимые к абсолютно всем антибиотикам инфекции все же не носят массовый характер: громче всего обсуждали отчет двухлетней давности о 70-летней американке, погибшей от неуязвимой для всех антибиотиков бактерии (ее она скорее всего подхватила в Индии, где попала в больницу с переломом).
Какие именно организмы называют супербактериями?Супербактерии (супермикробы) – это микроорганизмы, обладающие устойчивостью сразу к нескольким антибиотикам. Иногда – ко всем существующим.
В 2017 году ВОЗ опубликовала список из 12 бактерий, для борьбы с которыми срочно нужны новые антибиотики. Критически важны лекарства, способные справиться с устойчивыми к карбапенему энтеробактериями (например, кишечной палочкой E.Coli), синегнойной палочкой (Pseudomonas aeruginosa) и ацинетобактером (Acinetobacter baumannii). Чаще всего именно эти возбудители вызывают так называемые «внутрибольничные инфекции», с которыми врачам особенно сложно бороться из-за множественной устойчивости бактерий и ухудшенного состояния больных.
Также в список ВОЗ попали ванкомицин-резистентные энтерококки (Enterococcus faecium), невосприимчивый к метициллину и ванкомицину золотистый стафилококк (methicillin-resistant staphylococcus aureus, MRSA), цефалоспорин- и фторхинолон-резистентный гонококк, кларитромицин-резистентный хеликобактер и другие бактерии. Они вызывают серьезные болезни: заражение крови, менингит, пневмонию, инфекции мочевыводящих путей и гонорею.
Часто в материалах об антибиотиках фигурируют понятия “грамположительные бактерии” и “грамотрицательные бактерии”. Последние (например, кишечная палочка) обладают двумя клеточными мембранами: с ними сложнее бороться, и эффективных против них антибиотиков в мире меньше.
Как действуют антибиотики и появляется резистентность?Антибиотики или «противомикробные препараты» – особые вещества, останавливающие рост клеток бактерий или уничтожающие их. Для этого существуют несколько механизмов: как правило антибиотики атакуют клеточную стенку, мешают синтезу белка или ДНК бактерий.
Резистентность к антибиотикам обнаружили вскоре после их появления. Первый в мире антибиотик – перевернувший медицину ХХ века пенициллин – Александр Флеминг открыл в 1928 году, но массово применять его начали лишь в 1942-м. Еще до этого, в 1940-м стало известно об устойчивой к пенициллину кишечной палочке.
Бактерии постоянно меняются, чтобы стать невосприимчивыми к действию антибиотиков: «выгодные» мутации передаются бактериями друг другу. Микробы приспосабливаются к антибиотикам даже в огромной концентрации крайне быстро. Посмотрите на видео, как всего за 11 дней кишечная палочка адаптируется к тысячекратной дозе (в центре) антибиотика:
Главными «инкубаторами» супербактерий оказываются больницы: там, где постоянно применяются мощные антибиотики, растут популяции невосприимчивых к ним микробов. Способствует развитию устойчивости бактерий и сельское хозяйство: там антибиотики широко применяют для профилактики болезней и ускорения роста животных.
Смертельна ли встреча с супербактерией?Для здорового человека с нормальным иммунитетом – нет. Но чаще всего такие микробы встречаются в больницах, куда попадают люди, уже ослабленные той или иной болезнью. Для пациентов (например, находящихся на искусственной вентиляции легких) встреча с супербактериями может запросто стать фатальной.
Сейчас без антибиотиков невозможны сложные хирургические операции, трансплантации и борьба с раком посредством химиотерапии. Последняя обычно значительно подавляет иммунитет: для таких больных даже самая обычная инфекция может стать смертельной, не говоря уже о вызванной супермикробами.
При этом с инфекциями от мультирезистентных бактерий, пока на них действуют хоть какие-то антибиотики, можно жить, пусть даже это и будет сопряжено со страданиями.
Эмили Моррис рассказала, что супербактерию в ее мочевом пузыре обнаружили в подростковом возрасте и с тех пор ей пришлось перепробовать множество антибиотиков, в том числе «препараты резерва», вроде карбапенема.
Во время беременности она была вынуждена принимать антибиотик, не проверявшийся на беременных, ее новорожденному ребенку пришлось сразу пройти курс терапии антибиотиками. «Это было очень страшно», – рассказывала 24-летняя Моррис журналу New Scientist в 2017 году.
32-летняя Кэтрин Уильямс уже более 10 лет постоянно принимает антибиотики из-за болезни мочевыводящих путей, вызванной супербактериями.
«Каждый раз, когда заканчивается курс приема антибиотиков, болезнь возвращается, – говорила она в интервью BBC. – Боль просто приковывает тебя к постели до следующего курса приема антибиотиков. То, что мне придется принимать антибиотики всю жизнь, меня очень пугает».
Что в России и других постсоветских странах?В России и других постсоветских странах – например, Украине, Казахстане, Беларуси – антибиотики долго продавались без рецепта. Это вело к злоупотреблениям и самолечению, а в итоге – способствовало развитию резистентности у бактерий.
В октябре 2017 года в России приняли «Стратегию предупреждения распространения антимикробной резистентности». Документ, подписанный главой правительства Дмитрием Медведевым, предусматривает два главных этапа:
- До 2020 года население будут информировать о правильном использовании антибиотиков, работать над лучшим выявлением резистентности и определении базовых показателей, как оценивать ее распространенность.
- На втором этапе (до 2030 года) планируется снизить число случаев болезней, связанных с супербактериями.
За последние десятилетия арсенал медиков практически не пополнялся антибиотиками принципиально новых классов. Причин тому несколько.
Разработка таких лекарств – это сложное и затратное занятие, обходящееся в сотни миллионов или миллиарды долларов. Для фармакологических компаний оно не всегда интересно с коммерческой точки зрения: курсы антибиотиков обычно краткосрочны, в отличие от лекарств для хронических заболеваний (антиретровирусная терапия, например, людям с ВИЧ необходима всю жизнь). К тому же из-за быстрого возникновения резистентности растет риск обесценивания инвестиций в разработку новых препаратов.
Тем не менее, в последнее время вошли в обиход мощные антибиотики, полученные на базе старых открытий – в первую очередь, Линезолид (Зивокс). Да и представители существующих классов все время совершенствуются и нередко могут усиливать эффект при совместном использовании.
Что делать?ВОЗ рекомендует использовать антибиотики только по назначению врача (а врачам – их разумно назначать) и всегда полностью проходить курс лечения, а не останавливать прием антибиотиков сразу после улучшения самочувствия.
Также рекомендуется не хранить, не использовать заново и не передавать другим оставшиеся дозы лекарства.
Важно не пытаться лечить вирусные заболевания антибиотиками, вакцинироваться, укреплять собственный иммунитет и тщательно соблюдать правила гигиены, рекомендует ВОЗ.
Также есть смысл по возможности избегать больниц в регионах, где санитарная ситуация далека от идеальной. В первую очередь – в Азии и Африке. По данным британского отчета, там к 2050 году будет больше всего погибших от инфекций супербактериями.
Если у вас или у близких есть подозрение на такую инфекцию, добейтесь консультации специалиста по инфекционным болезням. Недавнее исследование показало, что это может на 50% снизить смертность от инфекций, вызванных бактериями с множественной лекарственной устойчивостью.
Чего ждать в будущем?Проблемой невосприимчивости к антибиотикам годами занимаются ученые и специалисты в области охраны общественного здоровья, и поводы для оптимизма есть.
ВОЗ в 2015 году одобрила глобальный план по борьбе с устойчивостью к противомикробным препаратам. Различные страны – в том числе США, Россия и совсем недавно Великобритания – принимают собственные комплексы мер по борьбе с устойчивостью бактерий к антибиотикам. Обычно они включают информирование пациентов и врачей о разумном использовании препаратов, ограничения на применение антибиотиков в сельском хозяйстве и содействие разработкам новых классов антибиотиков.
Несмотря на все сложности, такие разработки уже идут и появляются отдельные многообещающие результаты. Например, теиксобактин – принципиально новый антибиотик, открытый в 2015 году группой ученых из США, Германии и Великобритании.
В конце 2017 года его научились эффективно синтезировать, а в 2018-м действие синтетического теиксобактина успешно проверили на мышах. Но до появления лекарства для людей еще далеко: по оценкам ученых, 6-10 лет.
Оно может и вовсе не появиться: например, многообещающий платенсимицин, представленный в 2006 году, так и не добрался до полноценных клинических тестов из-за его неэффективности при введении стандартными методами. Однако исследования принципов работы платенсимицина позволяют надеяться на появление новых, более эффективных разработок.
В начале 2018 года ученые Рокфеллеровского университета в США представили еще один принципиально новый класс антибиотиков – малацидины, но до появления лекарств на их основе понадобится еще больше времени.
Рассматриваются и другие варианты терапии против супербактерий: целенаправленное усиление иммунитета, антимикробные пептиды, синтетические вещества, позаимствованные у вирусов, добавление особых элементов к уже существующим антибиотикам для повышения эффективности и другие способы. Однако все они пока находятся на разных стадиях готовности и для массового клинического использования не одобрены.
Симптомы, лечение, причины и профилактика
E. coli ( Escherichia coli ) — это тип бактерий, которые обычно обитают в вашем кишечнике. Он также содержится в кишечнике некоторых животных.
Большинство типов кишечной палочки безвредны и даже помогают поддерживать здоровье пищеварительного тракта. Но некоторые штаммы могут вызвать диарею, если вы едите зараженную пищу или пьете загрязненную воду.
Хотя многие из нас связывают кишечную палочку с пищевым отравлением, вы также можете заразиться пневмонией и инфекциями мочевыводящих путей от различных типов бактерий.Фактически, от 75% до 95% инфекций мочевыводящих путей вызываются кишечной палочкой. Кишечная палочка — это нормальный обитатель кишечника, по которому она попадает в мочевыводящие пути.
Некоторые разновидности кишечной палочки вызывают тошноту, вырабатывая токсин под названием Шига. Этот токсин повреждает слизистую оболочку кишечника. Штаммы E. coli, вырабатывающие токсин, иногда называют STEC, что является сокращением от «E. coli, продуцирующей токсин Shiga».
Один особенно плохой штамм, O157: H7, может вызвать сильное заболевание. Это вызывает спазмы в животе, рвоту и кровавый понос.Это основная причина острой почечной недостаточности у детей. Он также может вызывать опасные для жизни симптомы, такие как:
Вам следует обратиться за неотложной помощью, если у вас есть какие-либо из этих симптомов.
Как вы заразились?
Вы можете заразиться, если проглотите даже небольшое количество бактерий E. coli. Это может произойти, например, по следующим причинам:
- Мясной фарш: Вы едите фарш, содержащий кишечную палочку, и мясо было недостаточно приготовлено, чтобы убить бактерии.При переработке мяса иногда в мясо попадают бактерии из кишечника животных. Это чаще случается с мясным фаршем, потому что его получают от нескольких животных.
- Необработанное молоко: Вы пьете непастеризованное молоко, которое не подвергалось нагреванию для уничтожения бактерий. E. coli может попасть в молоко из вымени коровы или из доильного оборудования.
- Овощи и фрукты: Можно есть свежие овощи или фрукты, загрязненные водой, содержащей бактерии.Чаще всего это происходит, когда навоз соседних животных смешивается с водой.
- Другие продукты и напитки: Вы также можете заразиться кишечной палочкой из непастеризованных фруктовых соков, йогурта и сыра из сырого молока.
- Вода: Вы глотаете воду, содержащую кишечную палочку, например, купаясь в бассейне, озере или пруду.
- Другие люди: Вы можете заразиться кишечной палочкой от другого человека, например, ребенка. Бактерии могут передаваться вам, если вы убираете за инфицированным человеком, а затем не очень хорошо вымываете руки, прежде чем дотронуться до рта.
- Животные: Его можно найти в контактных зоопарках или на выставках животных на ярмарках.
Вы также можете заразить пищу на своей кухне, если позволите ножу или разделочной доске, касающимся сырого мяса (например, курицы), соприкоснуться с пищей, которая будет употребляться в сыром виде (например, салат).
Симптомы
Вы, вероятно, почувствуете недомогание через 2–5 дней после приема бактерий E. coli. Наиболее частые симптомы:
- Спазмы в животе
- Диарея, которая может быть кровавой
- Тошнота
- Постоянная усталость
У вас может не быть лихорадки.Если вы это сделаете, это может быть незначительно.
Здоровые люди, инфицированные кишечной палочкой, обычно чувствуют себя лучше в течение недели. Но у некоторых людей возникает серьезное осложнение, называемое гемолитико-уремическим синдромом, которое поражает почки. Это чаще случается с пожилыми людьми и детьми.
Лечение
Единственный способ, которым ваш врач может точно узнать, есть ли у вас инфекция E. coli, — это отправить образец вашего стула в лабораторию для анализа.
К счастью, инфекция обычно проходит сама по себе.
Для некоторых типов кишечной палочки, связанных с диареей, таких как диарея водянистых путешественников, антибиотики могут сократить продолжительность появления симптомов и могут использоваться в умеренно тяжелых случаях.
Но если у вас жар или кровавая диарея, или если ваш врач подозревает, что вырабатывающая токсин шига E. coli, антибиотики принимать не следует. Они действительно могут увеличить выработку токсина шига и ухудшить ваши симптомы.
Продолжение
Важно отдыхать и пить много жидкости, чтобы восполнить то, что ваше тело теряет из-за рвоты или диареи.
Не принимайте отпускаемые без рецепта лекарства от диареи. Вы не хотите замедлять работу пищеварительной системы, потому что это задержит распространение инфекции из вашего организма.
Когда вы почувствуете себя лучше, сначала придерживайтесь продуктов с низким содержанием клетчатки, например:
Молочные продукты и продукты с высоким содержанием жира или клетчатки могут ухудшить ваши симптомы.
Профилактика
Одна из самых важных вещей, которые вы можете сделать, чтобы защитить себя и свою семью от E.coli — мойте руки, особенно в этих ситуациях:
- Перед приготовлением еды
- Перед приготовлением бутылочек или еды для младенцев или детей ясельного возраста
- Перед тем, как прикасаться к чему-либо, например, к соске, попадающей в рот маленького ребенка.
- После посещения туалета или смены подгузника
- После контакта с животными, даже с собственными домашними животными
- После контакта с сырым мясом
Продолжение
Вы также можете предотвратить заражение E.coli, обращая внимание на продукты, которые несут наибольшую вероятность заражения:
- Готовьте гамбургеры, пока они не нагреются до 160 F.
- Пейте только пастеризованное молоко, сок и сидр.
- Вымойте все продукты перед их употреблением. Будьте особенно осторожны, чтобы удалить грязь с листовой зелени, такой как салат и шпинат.
На кухне вам помогут несколько простых правил:
Мойка: Очищайте ножи, столешницы и разделочные доски горячей мыльной водой после того, как их коснется сырое мясо.
Храните сырые и приготовленные отдельно: Используйте разные разделочные доски для продуктов, которые вы едите в сыром виде, например овощей и фруктов. Не кладите приготовленное мясо обратно на ту же тарелку, которую вы использовали для сырого мяса, не вымыв предварительно тарелку.
Когда вы плаваете, старайтесь не глотать воду, будь то бассейн, озеро или океан. Он может быть заражен кишечной палочкой из фекалий.
Инфекция E. coli: симптомы, причины и лечение
Escherichia coli (E. coli) — бактерия, обычно обнаруживаемая в кишечнике теплокровных организмов.
Большинство штаммов E. coli не вредны, но являются частью здоровой бактериальной флоры в кишечнике человека. Однако некоторые типы могут вызывать у людей заболевания, включая диарею, боль в животе, лихорадку и иногда рвоту.
E. coli O157: H7 является одним из штаммов и продуцирует токсин, известный как шига. Это один из самых сильных токсинов, который может вызвать кишечную инфекцию.
Около 265000 инфекций E. coli, продуцирующих токсин шига (STEC), ежегодно происходят в Соединенных Штатах (U.С.). Примерно 36 процентов из них, вероятно, вызваны E. coli O157: H7. Вспышка пищевого происхождения обычно связана с продуцирующей токсин шига E. coli .
Большинство людей выздоравливают в течение 6-8 дней, но это может быть опасно для жизни младенцев и людей с ослабленной иммунной системой.
Некоторые другие типы инфекции E. coli могут приводить к инфекциям мочевыводящих путей, респираторным заболеваниям, пневмонии и другим заболеваниям, таким как менингит.
Поделиться в PinterestE.coli поражает кишечник и вызывает симптомы от отсутствия до тяжелых.Симптомы заражения E. coli 0157 обычно проявляются через 3-4 дня после контакта с бактериями. Однако симптомы могут появиться уже через 24 часа или уже через 1 неделю.
К ним могут относиться:
- боль в животе или сильные спазмы в животе, часто начинающиеся внезапно
- водянистая диарея, начинающаяся через несколько часов после начала боли
- ярко-красный кровянистый стул примерно через день в результате повреждения токсином кишечник
- тошнота и в некоторых случаях рвота
- в некоторых случаях лихорадка, обычно ниже 101 градуса по Фаренгейту
- усталость в результате обезвоживания и потери жидкости и электролитов
У некоторых людей нет заметных симптомов, но они может передать инфекцию другим.
Нет лекарства от E. coli O157: H7. Это должно разрешиться само. Антибиотики не рекомендуются. Они могут увеличить риск ГУС.
Пациенты должны много отдыхать и пить много воды, чтобы предотвратить обезвоживание.
Безрецептурные лекарства от диареи не рекомендуются, так как они могут замедлить работу пищеварительной системы, подрывая способность организма эффективно выводить токсины.
Бактерии E. coli являются частой причиной инфекций мочевыводящих путей, например цистита.Выход из мочевыводящих путей находится рядом с анальным отверстием, поэтому бактерии могут распространяться из желудочно-кишечного тракта в мочевыводящие пути.
Протирание спереди назад может снизить риск.
Большинство штаммов E. coli безвредны, но некоторые производят токсин, от которого люди болеют.
Группа E. coli , которая включает 0157: H7 производит сильный токсин под названием Шига. Этот токсин может повредить слизистую оболочку тонкой кишки.
Люди могут заразиться:
Проглатывание зараженной воды : Водопроводная вода в США очищается и содержит хлор, но около E.вспышки coli были вызваны загрязнением муниципального водоснабжения.
Источником инфекции могут быть частные колодцы, некоторые озера и бассейны.
Путешественникам в места, где вода может быть неочищенной, следует соблюдать осторожность при питье воды, использовании льда или употреблении овощей, промытых водой неопределенного происхождения.
Проглатывание зараженных пищевых продуктов : Возможные источники включают недоваренный говяжий фарш, непастеризованное молоко, сок, сидр или сыр, ростки люцерны или сырые овощи.
Зараженные люди, которые работают в ресторанах и не моют руки после посещения туалета, могут передать инфекцию клиентам и другим сотрудникам.
Контакт между людьми : Хорошая гигиена рук важна для предотвращения распространения инфекции.
Контакт с животными : Бактерии могут распространяться на фермах, в контактных зоопарках и на ярмарках.
Факторы риска
Некоторые люди, которые с большей вероятностью пострадают от E.coli — заболевание, связанное с этим.
Люди с ослабленной иммунной системой более подвержены осложнениям. Сюда входят пациенты со СПИДом, принимающие иммунодепрессанты и люди, получающие химиотерапию.
Пациенты с пониженной кислотностью желудка , вызванной хирургическим вмешательством на желудке или лекарствами, снижающими кислотность желудка, имеют более высокий риск заражения.
Маленькие дети и люди старшего возраста имеют более высокий риск развития серьезных заболеваний и осложнений.
Большинство людей полностью выздоравливают в течение недели.
Однако около 10 процентов людей подвержены риску развития гемолитико-уремического синдрома (ГУС). В основном это маленькие дети и люди старшего возраста.
HUS характеризуется гемолизом или разрушением эритроцитов. Это может вызвать анемию, низкое количество тромбоцитов и почечную недостаточность.
Тромбоциты, клетки крови, отвечающие за свертывание крови, слипаются в мелких кровеносных сосудах почек, что приводит к снижению кровотока или ишемии.
Со временем это может привести к почечной недостаточности. Снижение тромбоцитов увеличивает риск кровотечений.
У пациентов с этими сгустками могут также развиться проблемы с центральной нервной системой (ЦНС), которые влияют на головной и спинной мозг.
Это может привести к судорогам, параличу, отеку мозга и коме. В 3-5 процентах случаев это приводит к летальному исходу.
Острая почечная недостаточность у младенцев и детей младшего возраста обычно вызывается ГУС.
ГУС обычно начинается примерно через 5-8 дней после начала диареи.Это неотложная медицинская помощь, и требуется лечение в больнице.
Поделиться на PinterestПить много воды, чтобы избежать обезвоживания, очень важно во время инфекции E. coli.Врач определит признаки, спросит о симптомах и отправит образец стула в лабораторию для анализа.
Образец необходимо взять в течение 48 часов после начала кровавой диареи.
Некоторые советы могут помочь предотвратить заражение E. Coli и другими патогенами.
К ним относятся:
- хорошее приготовление мяса, особенно фарша
- питье пастеризованного молока, яблочного сока и сидра вместо непастеризованного
- мытье овощей, особенно зеленолистных
- обеспечение тщательной мойки столовых приборов и посуды теплая мыльная вода
- Хранение мясных и немясных продуктов отдельно и использование отдельных разделочных досок
- с соблюдением правил гигиены рук
Хорошая гигиена рук включает в себя тщательное мытье рук теплой водой с мылом регулярно, особенно после использования кухонной посуды. ванная комната, после смены подгузников, до и после приготовления пищи, а также после прикосновения к животным
Лечение ESBL-продуцирующей E coli инфекции нижних мочевых путей
Случай с участием 43-летней женщины с сахарным диабетом 2 типа в анамнезе. госпитализирован по поводу гипергликемии, а также жалоб на дизурию и учащенное мочеиспускание.
Случай
KS, 43-летняя женщина с сахарным диабетом 2-го типа в анамнезе, поступила с гипергликемией, а также с жалобами на дизурию и учащенное мочеиспускание. Ей эмпирически назначено сульфаметоксазол-триметоприм (SMX-TMP) для лечения цистита. Escherichia coli , продуцирующая b-лактамазу расширенного спектра (ESBL) , растет из культуры мочи, устойчивая как к SMX-TMP, так и к ципрофлоксацину. Пациент готов к выписке, и клинический фармацевт консультируется относительно вариантов лечения.
Ответ
Увеличение количества продуцирующих ESBL E coli (ESBL-EC) среди инфекций мочевыводящих путей (ИМП), возникающих в сообществе, представляет собой серьезную проблему для общественного здравоохранения, поскольку эти микроорганизмы устойчивы ко многим противомикробным препаратам. 1-3 Ферменты БЛРС способны гидролизовать большинство бета-лактамных антибиотиков, включая цефалоспорины третьего поколения. 1 Кроме того, ESBL-EC может обладать сопутствующей резистентностью к SMX / TMP, фторхинолонам и аминогликозидам. 1,4
Карбапенемы обычно считаются препаратом выбора для лечения инфекций ESBL-EC. 1,5 С периодом полураспада 4 часа эртапенем может быть хорошим вариантом из-за того, что его вводят только один раз в день, в отличие от других карбапенемов. 4,6 Эртапенем также можно вводить внутримышечно вместо внутривенного, что позволяет применять его пациентам без внутрисосудистого доступа. Однако карбапенемы — дорогие агенты с очень широким спектром действия.Для лечения цистита ESBL-EC следует также рассмотреть более узкие противомикробные препараты.
Некоторые изоляты ESBL-EC обладают чувствительностью in vitro к пиперациллину / тазобактаму; однако использование этого антибиотика остается спорным. Исследования противоречат друг другу относительно клинической эффективности лечения инфекций ESBL-EC, особенно при более серьезных инфекциях, таких как бактериемия. 1,5 Если пиперациллин / тазобактам используется для лечения инфекции ESBL-EC, большинство экспертов рекомендуют более высокие дозы, равные 4.5 граммов каждые 6 часов для пациентов с нормальной функцией почек. 7
Существуют ограниченные возможности перорального лечения цистита ESBL-EC. Фосфомицин — пероральный антибиотик, обладающий широкой активностью против патогенов с множественной лекарственной устойчивостью, включая ESBL-EC. Фосфомицин достигает очень высоких концентраций в моче и поэтому является отличным средством от цистита, но не должен использоваться при пиелонефрите или пациентах с бактериемией из-за недостаточной концентрации в кровотоке.Хотя фосфомицин в настоящее время одобрен FDA для лечения неосложненного цистита у женщин в виде разовой дозы 3 грамма, несколько исследований показали клиническую эффективность при лечении цистита ESBL-EC, когда дозировка увеличивалась до 3 граммов каждые 48 часов. до 72 часов за 3 приема. 8-10 Одна из основных проблем, связанных с использованием фосфомицина, заключается в том, что во многих учреждениях невозможно провести тестирование на чувствительность.
Еще одно пероральное противомикробное средство, которое можно рассматривать для лечения цистита ESBL-EC, — это нитрофурантоин.Одно исследование показало уровень клинического излечения 69% у пациентов с циститом ESBL-EC, при котором все изоляты также были устойчивы к SMX / TMP и ципрофлоксацину. 11 Нитрофурантоин следует использовать только при более низких уровнях ИМП, и его следует избегать у пациентов с клиренсом креатинина менее 60 мл / мин, поскольку снижение функции почек приводит к уменьшению количества активного препарата в моче. 12 В случае СК, при которой планирование выписки уже началось, наиболее практичным лечением будет выбор перорального противомикробного средства, которым в данном случае будет нитрофурантоин или фосфомицин.Следует наблюдать за пациентом, чтобы убедиться, что клинические признаки цистита исчезли.
Келли Э. Мартин, фармацевт, BCPS, клинический специалист по инфекционным заболеваниям и антимикробным препаратам в Медицинском центре Каролины в Шарлотте, Северная Каролина.
Каталожные номера:
- Pitout JDD, Laupland KB. Enterobacteriaceae, продуцирующая β-лактамазы расширенного спектра действия: новая проблема общественного здравоохранения. Lancet Infect Dis. 2008; 8: 159-166.
- RodrÄ ± guez-Bano J, Alcala JC, Cisneros JM, et al.Общинные инфекции, вызванные b-лактамазой расширенного спектра действия, продуцирующей Escherichia coli. Arch Intern Med. 2008; 168: 1897-1902.
- Pallett A, Hand K. Осложненные инфекции мочевыводящих путей: практические решения для лечения мультирезистентных грамотрицательных бактерий. J Antimicrob Chemother. 2010; 65 (приложение 3): iii25-iii33.
- Пракаш В., Льюис Дж. С., Эррера М. Л., Викес Б. Л., Йоргенсен Дж. Х. Пероральные и парентеральные терапевтические возможности для амбулаторных инфекций мочевыводящих путей, вызванных энтеробактериями, продуцирующими β-лактамазы расширенного спектра CTX-M.Противомикробные агенты Chemother. 2009; 53 (3): 1278-1280.
- Rodriguez-Bano J, Navarro MD, Retamar P, et al. Комбинации β-лактам / β-лактамных ингибиторов для лечения бактериемии, вызванной продуцирующей β-лактамазой расширенного спектра Escherichia coli: апостериорный анализ предполагаемых когорт. Clin Infect Dis. 2012; 54 (2): 167-174.
- Эртапенем. В: Lexi-Drugs Online. Хадсон, Огайо: Lexi-Comp, Inc. По состоянию на 1 июля 2013 г.
- Perez F, Bonomo RA. Можем ли мы действительно использовать комбинации β-лактамных / β-лактамных ингибиторов для лечения инфекций, вызванных бактериями, продуцирующими β-лактамазу расширенного спектра? Clin Infect Dis.2012: 54 (2): 175-177.
- Pullukchu H, Tasbakan M, Sipahi OR, Yamazhan T., Aydemir S, Ulusoy S. Фосфомицин в лечении инфекций нижних мочевых путей, связанных с Escherichia coli, связанных с производством бета-лактамаз расширенного спектра. Int J Antimicrob Agents. 2007; 29 (1): 62-65.
- Senol S, Tasbakan M, Pullukcu H, et al. Карбапенем по сравнению с фосфомицином трометанолом в лечении осложненной инфекции нижних мочевых путей, связанной с Escherichia coli, продуцирующей бета-лактамазы расширенного спектра действия.J Chemother. 2010; 22 (5): 355-357.
- Neuner EA, Sekeres J, Hall GS, van Duin D. Опыт применения фосфомицина для лечения инфекций мочевыводящих путей, вызванных микроорганизмами с множественной лекарственной устойчивостью. Противомикробные агенты Chemother. 2012; 56 (11): 5744-5748.
- Тасбакан М.И., Пуллукчу Х., Сипахи О.Р., Ямажан Т., Улусой С. Нитрофурантоин в лечении вызванной Escherichia coli инфекции нижних мочевых путей, вызывающей β-лактамазы расширенного спектра действия. Int J Antimicrob Agents. 2012; 40: 554-556.
- Нитрофурантоин.В: Lexi-Drugs Online. Хадсон, Огайо: Lexi-Comp, Inc. По состоянию на 1 июля 2013 г.
Лечение и профилактика E. coli
Лечение диареи путешественников, связанной с кишечной палочкой
В то время как диарея, связанная с STEC, не следует лечить ни антибиотиками, ни противодиарейными средствами , это не всегда относится к диарее путешественников. Обычно диарея путешественника возникает, когда человек отправляется в развивающуюся страну и затем подвергается воздействию бактерий (чаще всего штамм E. coli , названный энтеротоксигенным E.coli, или ETEC) через пищу или воду, с которыми их организм практически не знаком. (10)
Вот несколько вариантов лечения для тех, у кого во время заграничной поездки развиваются такие симптомы, как тошнота, спазмы и диарея:
- Избегайте обезвоживания. Потребляйте много жидкости.
- Примите противодиарейные препараты. Используйте такие лекарства, как имодиум (лоперамид), хотя люди с лихорадкой или кровавым стулом не должны их принимать, а также детям младше 2 лет.
- Спросите, нужны ли вам антибиотики. Они могут быть прописаны медицинским работником, если у человека наблюдается жидкий стул три или более в течение восьмичасового периода или серьезные симптомы, включая лихорадку, кровь или слизь в стуле (10,11)
Предотвращение кишечной палочки –Related Traveler’s Diarrhea
Многие районы Центральной и Южной Америки, Мексики, Африки, Ближнего Востока и большей части Азии считаются направлениями с высоким риском диареи путешественников.(Есть некоторый риск при поездке в Восточную Европу и на несколько Карибских островов.) Это, конечно, не означает, что следует избегать поездок в эти районы. Вместо этого примите определенные меры предосторожности при выезде за границу. К ним относятся: избегать:
- Еда от уличных торговцев
- Влажные продукты комнатной температуры, например соусы
- Непастеризованные молочные продукты
- Сырое или недоваренное мясо, рыба и моллюски
- Салаты и неочищенные фрукты, такие как виноград и ягоды
- Напитки, содержащие кубики льда (12)
Хотя приведенные выше советы полезны для всех, знайте, что определенные группы людей более склонны к развитию диареи путешественников.Сюда входят люди с диабетом, воспалительным заболеванием кишечника, циррозом печени или ослабленной иммунной системой. Лица, принимающие блокаторы кислоты или антациды, также подвергаются повышенному риску, потому что снижение уровня кислоты в желудке может облегчить выживание таких бактерий, как E. coli . (12)
Лечение инфекций мочевыводящих путей
Некоторые штаммы E. coli являются нормальной частью микробных сообществ в кишечнике, но могут вызывать инфекцию мочевыводящих путей (ИМП), если попадают в мочевыделительную систему.
Врачи обычно лечат ИМП с помощью широкого спектра антибиотиков. Какой именно антибиотик назначают, зависит от типа бактерий, обнаруженных в моче. Некоторые антибиотики, используемые для лечения ИМП, ассоциированных с E. coli– , включают:
Заметные исключения из списка включают ампициллин, амоксициллин и сульфаниламиды. Эти антибиотики больше не используются для борьбы с ИМП из-за появления устойчивости к антибиотикам. (14)
Для большинства людей трех- или пятидневный курс антибиотиков может успешно вылечить большинство ИМП, при этом боль и постоянные позывы к мочеиспусканию стихают после нескольких доз.(15)
Некоторые штаммы E. coli , называемые бета-лактамазой расширенного спектра (ESBL) E. coli , устойчивы ко многим антибиотикам. К группе наибольшего риска относятся люди с мочевыми катетерами, рецидивирующие ИМП в анамнезе или недавно принимавшие антибиотики. (16) Этим людям часто рекомендуют следующее:
Профилактика инфекций мочевыводящих путей
Существует множество способов предотвратить возникновение ИМП.Некоторые домашние меры включают:
- Часто мочитесь. Опорожнение мочевого пузыря примерно каждые два-три часа поможет вымыть бактерии E. coli из мочевыводящих путей до того, как может начаться инфекция. (Чем дольше моча удерживается в мочевом пузыре, тем больше вероятность размножения бактерий.)
- Протрите спереди назад. Это помогает предотвратить распространение бактерий из анальной области в уретру.
- Мочеиспускание после полового акта. При половом акте и контакте бактерии из заднего прохода могут попасть в мочевой пузырь через уретру. Но мочеиспускание после секса помогает вывести бактерии из организма.
- Пейте много жидкости. Питьевая вода (особенно после полового акта) помогает разжижать мочу и стимулировать более частое мочеиспускание, которое выводит E. coli из мочевыводящих путей.
- Избегайте диафрагм или спермицидов. Они могут способствовать росту бактерий и убивать полезные бактерии, защищающие от ИМП.(18)
Лечение инфекций, вызванных кишечной палочкой, вызывающих неонатальный менингит
Хотя это правда, что E. coli вызывает около 20 процентов всех случаев неонатального менингита, бактериальный менингит по-прежнему считается очень редким явлением в развитых странах благодаря успеху. вакцин.
При подозрении на неонатальный менингит медицинский работник возьмет кровь и выполнит спинномозговую пункцию (также называемую люмбальной пункцией), чтобы проверить спинномозговую жидкость на E.coli бактерии. Если подтвержден бактериальный менингит, лечение будет состоять из внутривенных антибиотиков и жидкостей.
При ранней диагностике и правильном лечении ребенок с бактериальным менингитом имеет разумные шансы на хорошее выздоровление. (19)
Дополнительный отчет Джозефа Беннингтона-Кастро.
Лечение ИМП снижает количество кишечной палочки, может быть альтернативой антибиотикам — Медицинская школа Вашингтонского университета в Сент-Луисе
Посетите новостной центрЛечение молекулярной ловушкой может уменьшить рецидивирующие инфекции, исследование на мышах показывает
Скотт Халтгрен и Джон ХойзерAn E.coli (вверху, в золоте) прикрепляется к клеткам, выстилающим внутреннюю поверхность мочевого пузыря, и проникает в них. ИМП — одни из самых распространенных инфекций, которые имеют тенденцию повторяться. Исследователи из Медицинской школы Вашингтонского университета в Сент-Луисе обнаружили молекулярную ловушку, которая снижает количество кишечных бактерий, вызывающих ИМП. Это соединение потенциально может снизить вероятность повторных ИМП.
Инфекции мочевыводящих путей (ИМП) являются одними из самых распространенных инфекций и имеют тенденцию возвращаться снова и снова, даже после лечения.Большинство ИМП вызываются E. coli , которые живут в кишечнике и распространяются в мочевыводящие пути.
Новое исследование, проведенное Медицинской школой Вашингтонского университета в Сент-Луисе, показало, что молекулярная ловушка может нацеливаться на эти бактерии, вызывающие ИМП, в кишечнике и уменьшать их количество. По словам исследователей, при меньшем количестве болезнетворных бактерий в кишечнике риск ИМП снижается.
«Конечная цель нашего исследования — помочь пациентам справиться и предотвратить общую проблему рецидивирующих инфекций мочевыводящих путей, в то же время помогая преодолеть всемирный кризис устойчивости к противомикробным препаратам», — сказал Скотт Дж.Халтгрен, доктор философии, профессор молекулярной микробиологии Хелен Л. Стоувер и старший автор исследования. «Это соединение может обеспечить способ лечения ИМП без использования антибиотиков».
Исследование опубликовано 14 июня в журнале Nature.
Связано: Исследователи определяют белок, критически важный в возникновении хронических ИМП.Результаты предлагают новый способ предотвращения распространенной инфекции
Около 100 миллионов человек во всем мире заражаются ИМП каждый год, и, несмотря на лечение антибиотиками, около четверти заболевают другой такой инфекцией в течение шести месяцев.ИМП вызывают болезненное жжение при мочеиспускании и частые позывы к мочеиспусканию. В серьезных случаях инфекция может распространиться на почки, а затем в кровоток, где она может стать опасной для жизни.
Большинство ИМП вызываются E. coli , которые безвредно живут в кишечнике. Однако, когда они выделяются с фекалиями, бактерии могут распространяться к отверстию мочевыводящих путей и до мочевого пузыря, где они могут вызвать проблемы. Принято считать, что ИМП часто повторяются, потому что популяции бактерий из кишечника постоянно заселяют мочевыводящие пути болезнетворными бактериями.
Халтгрен, аспирантка Кейтлин Сполдинг и его коллеги пришли к выводу, что, если они смогут уменьшить количество опасных E. coli в кишечнике, они смогут снизить вероятность развития ИМП и, возможно, предотвратить некоторые рецидивирующие инфекции.
Во-первых, исследователи определили гены, которые необходимы E. coli для выживания в кишечнике. Один набор генов закодирован для своего рода пилуса, волосовидного отростка на поверхности E. coli , который позволяет бактериям прилипать к тканям, как молекулярная липучка.Без этого пилуса бактерии не могут развиваться в кишечнике.
Более ранние исследования показали, что идентифицированные ворсинки прикрепляются к сахару, называемому маннозой, который находится на поверхности мочевого пузыря. Захват рецепторов маннозы на мочевом пузыре с помощью пилуса позволяет бактериям избежать уноса во время мочеиспускания. Бактерии, которым не хватает этой пилуса, не могут вызывать ИМП у мышей.
Ранее Халтгрен и соавтор, Джеймс У. Джанетка, доктор философии, доцент кафедры биохимии и молекулярной биофизики Вашингтонского университета, химически модифицировали маннозу для создания группы молекул, называемых маннозидами, которые похожи на маннозу, но изменены в так, чтобы бактерии крепче цеплялись за них своими пилями.Однако, в отличие от рецепторов маннозы, эти маннозиды не прикрепляются к стенке мочевого пузыря, поэтому бактерии, которые захватывают маннозиды, а не рецепторы маннозы, вымываются с мочой.
Поскольку исследователи обнаружили, что тот же самый пилус также позволяет бактериям связываться в кишечнике, они пришли к выводу, что лечение маннозидом может снизить количество E. coli в кишечнике и, возможно, предотвратить распространение бактерий в мочевой пузырь.
Чтобы проверить эту идею, они представили болезнетворный штамм E.coli в мочевой пузырь и кишечник мышей, чтобы отразить картину, наблюдаемую у людей. У женщин с ИМП те же бактерии, которые вызывают проблемы с мочевым пузырем, обычно также обитают в кишечнике.
Исследователи дали мышам три пероральные дозы маннозида, а затем измерили количество бактерий в мочевом пузыре и кишечнике мышей после последней дозы маннозида. Они обнаружили, что болезнетворные бактерии были почти полностью удалены из мочевого пузыря и в стократном уменьшении в кишечнике, со 100 миллионов на образец до 1 миллиона.
«Хотя мы не полностью исключили этот штамм бактерий из кишечника, результаты все еще многообещающие», — сказал Сполдинг, первый автор статьи. «Уменьшение количества болезнетворных бактерий в кишечнике означает, что меньше бактерий может попасть в мочевыводящие пути и вызвать ИМП».
Тип ворса, изученный исследователями, обнаружен у большинства штаммов E. coli , а также у некоторых родственных видов бактерий. Теоретически лечение маннозидом может привести к уничтожению других бактерий, живущих в кишечнике с таким же ворсом, подобно тому, как лечение антибиотиками убивает случайные бактерии вместе с намеченной целью.Устранение безобидных бактерий потенциально открывает в кишечнике пространство для роста более опасных микробов. Это может привести к кишечным расстройствам — одному из известных рисков широкого применения антибиотиков.
В сотрудничестве с соавтором Джеффри И. Гордоном, доктором медицины, доктором Робертом Дж. Глейзером, заслуженным профессором медицинского факультета университета, исследователи измерили состав микробиома кишечника после лечения маннозидом. Они обнаружили, что лечение маннозидом оказало минимальное влияние на кишечные бактерии, кроме тех, которые вызывают большинство ИМП.Это резко контрастирует с огромными изменениями численности многих видов микробов, наблюдаемыми после лечения антибиотиками.
«Это открытие интересно, потому что мы разработали терапевтическое средство, которое действует как молекулярный скальпель», — сказал Сполдинг. «Он входит и специально уничтожает бактерии, от которых вы хотите избавиться, оставляя при этом остальную часть микробного сообщества нетронутой».
Кроме того, поскольку маннозид не является антибиотиком, он потенциально может использоваться для лечения ИМП, вызванных устойчивыми к антибиотикам штаммами бактерий, что является растущей проблемой.На ИМП приходится 9 процентов всех антибиотиков, назначаемых каждый год в Соединенных Штатах, поэтому лечение ИМП без применения антибиотиков может помочь сдержать развитие и распространение устойчивых к антибиотикам организмов.
Различия в анатомии и поведении мышей и женщин делают мышей сложной моделью для проверки того, действительно ли снижение бактериальной нагрузки в кишечнике снижает количество повторных ИМП. Чтобы ответить на этот вопрос, необходимы исследования на людях.
Халтгрен вместе с Джанеткой и Томасом Мак Хутоном, доктором медицины, из Медицинской школы Университета Майами, основал компанию Fimbrion Therapeutics для разработки маннозидов и других препаратов в качестве потенциальных средств лечения ИМП.Fimbrion работает над определением перспективного лекарственного препарата для клинических испытаний на людях.
Сполдинг С.Н., Кляйн Р.Д., Руер С., Кау А.Л., Шрайбер Х.Л., Кусумано З.Т., Додсон К.В., Пинкнер Дж.С., Фремонт Д.Х., Джанетка Дж. В., Ремоут Х, Гордон Дж. Селективное истощение уропатогенной E. coli из кишечника антагонистом FimH. Природа. 14 июня 2017.
Эта работа была поддержана Национальными институтами здравоохранения (NIH), номера грантов K08AI113184, R01AI048689, RO1DK051406, P50DK064540, RC1DK086378, DK30292, RO1DK051406 и 1F31DK107057; Исследовательский фонд — Фландрия, номер гранта G030411N; Фонд Геркулеса, номер гранта UABR / 09/005; и Институт биотехнологии Фландрии, номер гранта PRJ9.
Халтгрен и Джанетка являются авторами заявки на патент US8937167, которая охватывает применение антагонистов лиганда FimH на основе маннозида для лечения заболеваний. Эти двое владеют долей участия в Fimbrion Therapeutics и могут выиграть, если компания добьется успеха в маркетинге маннозидов.
Медицинский факультет Вашингтонского университета насчитывает 2100 штатных и добровольных врачей-преподавателей, которые также входят в медицинский персонал детских больниц Барнс-Еврей и Сент-Луис. Медицинский факультет является одним из ведущих медицинских научно-исследовательских, учебных и лечебных учреждений в стране, в настоящее время он занимает седьмое место в стране по мнению У.S. News & World Report. Медицинская школа связана с BJC HealthCare через свои связи с больницами Barnes-Jewish и St. Louis Children’s.
Диагностика и лечение неосложненных инфекций мочевыводящих путей
1. Национальные институты здравоохранения. Национальный информационный центр по почечным и урологическим заболеваниям (NKUDIC). Доступ онлайн 4 мая 2005 г. по адресу: http: //kidney.niddk.nih.gov …
2. Nicolle LE. Инфекция мочевыводящих путей: традиционные фармакологические методы лечения. Dis Mon . 2003. 49: 111–28.
3. Faro S, Fenner DE. Инфекции мочевыводящих путей. Clin Obstet Gynecol . 1998. 41: 744–54.
4. Perfetto EM, Гондек К. Устойчивость к Escherichia coli при неосложненной инфекции мочевыводящих путей: модель для определения того, когда следует изменить эмпирический выбор антибиотиков первой линии. Интерфейс Manag Care . 2002; 15: 35–42.
5. Hooton TM, Штамм МЫ. Диагностика и лечение неосложненной инфекции мочевыводящих путей. Инфекция Dis Clin North Am . 1997; 11: 551–81.
6. Вости КЛ. Инфекции мочевыводящих путей у женщин: проспективное продольное исследование с участием 235 женщин, наблюдаемых в течение 1–19 лет. Медицина (Балтимор) . 2002. 81: 369–87.
7. Стюарт М.Э., Macuiba J, Гейдрих Ф, Фаррелл Р.Г., Брэддик М, Этчисон С. Успешное внедрение научно обоснованных рекомендаций по клинической практике: острая дизурия / неотложные позывы у взрослых женщин. HMO Pract . 1997; 11: 150–7.
8. Оренштейн Р., Вонг ES. Инфекции мочевыводящих путей у взрослых. Врач Фам . 1999; 59: 1225–341237.
9. Saint S, , Скоулз Д., Файн С.Д., Фаррелл Р.Г., Штамм МЫ. Эффективность руководства по клинической практике для лечения предполагаемой неосложненной инфекции мочевыводящих путей у женщин. Am J Med . 1999; 106: 636–41.
10.Барри ХК, Хикнер Дж. Эбелл MH, Эттенхофер Т. Рандомизированное контролируемое испытание телефонного ведения пациентов с подозрением на инфекцию мочевыводящих путей у женщин. Дж. Фам Практ . 2001; 50: 589–94.
11. Маккарти Дж. М., Ричард Джи, Гек В, Такер Р.М., Тозиелло Р.Л., Шан М, и другие., для группы инфекций мочевыводящих путей ципрофлоксацином. Рандомизированное исследование коротких курсов ципрофлоксацина, офлоксацина или триметоприма / сульфаметоксазола для лечения острой инфекции мочевыводящих путей у женщин. Am J Med . 1999; 106: 292–9.
12. Иревани А, Климберг I, Брифер С, Мунера С, Ковальский С.Ф., Echols RM. Испытание, сравнивающее низкие дозы короткого курса ципрофлоксацина и стандартную 7-дневную терапию котримоксазолом или нитрофурантоином при лечении неосложненной инфекции мочевыводящих путей. J Антимикробный препарат Chemother . 1999; 43 (приложение A): S67–75.
13. Генри, округ Колумбия мл., Беттис РБ, Риффер E, Хаверсток, округ Колумбия, Ковальский С.Ф., Мэннинг К., и другие.Сравнение ципрофлоксацина с пролонгированным высвобождением один раз в сутки и обычного ципрофлоксацина два раза в день для лечения неосложненной инфекции мочевыводящих путей у женщин. Clin Ther . 2002; 24: 2088–104.
14. Карловский Ю.А., Торнсберри С, Джонс МЕНЯ, Sahm DF. Чувствительность устойчивых к противомикробным препаратам изолятов мочевой Escherichia coli к фторхинолонам и нитрофурантоину. Клиническая инфекция . 2003. 36: 183–7.
15.Sahm DF, Торнсберри С, Мэйфилд, округ Колумбия, Джонс МЕНЯ, Карловский Я. Изоляты Escherichia coli из мочевыводящих путей с множественной лекарственной устойчивостью: распространенность и демографические данные пациентов в США в 2000 г. Противомикробные агенты Chemother . 2001; 45: 1402–6.
16. Зейферт Р., Вайнштейн Д.М., Ли-МакЛеод Дж. Национальная распространенность устойчивости Escherichia coli к триметоприм-сульфаметоксазолу: последствия управляемой помощи при лечении инфекций мочевыводящих путей.Дж. Манаг Кэр Фарм 2001; 7: 132. Доступ онлайн 4 мая 2005 г. по адресу: http://www.amcp.org/data/jmcp/jmcp_2001_7_2.pdf.
17. Набер КГ. Варианты лечения острого неосложненного цистита у взрослых. J Антимикробный препарат Chemother . 2000; 46 (приложение 1): S23–7.
18. Иревани А, Тайс А.Д., Маккарти Дж, Сайкс DH, Нолен Т, Галлис HA, и другие., для исследовательской группы по инфекциям мочевыводящих путей. Краткосрочное лечение ципрофлоксацином острой неосложненной инфекции мочевыводящих путей у женщин.Минимальная эффективная доза [опубликованные поправки приведены в Arch Intern Med 1995; 155: 871]. Arch Intern Med . 1995; 155: 485–94.
19. Ричард Г.А., Мэтью CP, Кирштейн Дж. М., Фруктовый сад D, Ян JY. Терапия однократной дозой фторхинолона при острой неосложненной инфекции мочевыводящих путей у женщин: результаты рандомизированного двойного слепого многоцентрового исследования, сравнивающего схемы однократной и трехдневной терапии фторхинолоном. Урология . 2002; 59: 334–9.
20. Stein GE. Сравнение однократной дозы фосфомицина и 7-дневного курса нитрофурантоина у женщин с неосложненной инфекцией мочевыводящих путей. Clin Ther . 1999; 21: 1864–72.
21. Фосфомицин при инфекциях мочевыводящих путей. Med Lett Drugs Ther . 1997; 39: 66–8.
22. Джепсон Р.Г., Михальевич Л, Крейг Дж. Клюква для лечения инфекций мочевыводящих путей. Кокрановская база данных Syst Rev .2000; (2): CD001322.
23. Гомолин И.Х., Сиами ПФ, Реюнинг-Шерер Дж., Хаверсток, округ Колумбия, Гейд А, для группы по изучению пероральной подвески .. Эффективность и безопасность пероральной суспензии ципрофлоксацина по сравнению с пероральной суспензией триметоприм-сульфаметоксазола для лечения пожилых женщин с острой инфекцией мочевыводящих путей. Дж. Ам Гериатр Соц . 2001; 49: 1606–13.
24. Уоррен Дж. У., Абрутын Э, Hebel JR, Джонсон-младший, Шеффер А.Дж., Штамм МЫ.Американское общество инфекционных болезней (IDSA). Рекомендации по противомикробной терапии неосложненного острого бактериального цистита и острого пиелонефрита у женщин. Клиническая инфекция . 1999. 29: 745–58.
25. Роторы М, Фогт Н. Продолжительность приема антибиотиков для лечения неосложненных симптоматических инфекций нижних мочевых путей у пожилых женщин. Кокрановская база данных Syst Rev . 2002; (3): CD001535.
Кишечный колибактериоз свиней: диагностика, терапия, устойчивость к противомикробным препаратам | Управление здоровьем свиней
Escherichia coli представляет собой грамотрицательные перитрихно-жгутиковые бактерии, принадлежащие к семейству Enterobatteriaceae, и является возбудителем широкого спектра заболеваний у свиней, включая неонатальную диарею и диарею после отъема (PWD), которые являются важными причинами смерти во всем мире. у поросят-сосунов и свиней-отъемышей соответственно [1].
В кишечную колибактериозу вовлечены два основных патотипа: энтеротоксигенная кишечная палочка (ETEC) и энтеропатогенная кишечная палочка (EPEC). ETEC является наиболее важным патотипом у свиней и включает различные виротипы (этот термин используется для описания штаммов, характеризующихся различными комбинациями токсинов и фимбрий). Вспышки неонатальной диареи и диареи после отъема из-за инфекции ETEC, обычно поражающей значительную часть свиней, часто повторяются в одних и тех же стадах и требуют дорогостоящих мер борьбы.Кишечный колибактериоз может привести к значительным экономическим потерям из-за смертности, снижения привеса, стоимости лечения, вакцинации и кормовых добавок [1]. В зависимости от тяжести заболевания стоимость PWD оценивалась в диапазоне от 40 до 314 евро на свиноматку [2]. ETEC обладают фимбриями, которые прикрепляются к энтероцитам и вырабатывают один или несколько энтеротоксинов (рис. 1), которые вызывают секреторную диарею, вызывая некоторые из наиболее серьезных заболеваний в свиноводстве во всем мире, такие как колибактериоз новорожденных и ЛЗЗ.
Рис. 1Патотипы, адгезины и токсины патогенных свиней E.coli , ответственные за неонатальный колибактериоз и колибактериоз после отъема (AIDA: адгезин, участвующий в диффузном прилипании; EAST-1: энтероагрегантный термостабильный энтеротоксин) 9000
Стратегии, обычно используемые для профилактики колибактериоза новорожденных и борьбы с ним, должны быть нацелены на снижение количества патогенных E.coli в окружающей среде, соблюдение гигиенических мер, а также внутреннюю и внешнюю биобезопасность.Поддержание подходящих условий окружающей среды и высокий уровень иммунитета поросят, гарантированный лактогенным иммунитетом и вакцинацией свиноматок против ETEC F4 (k88), F5 (k99), F6 (987P) и F41, снижают риск развития болезни.
Для предотвращения ETEC PWD использовались различные подходы, включая пассивное введение специфических антител, диетические добавки, такие как пребиотики и пробиотики, и диетические профилактические меры, генетическое разведение для ETEC-устойчивых стад и живых пероральных нетоксигенных E.coli [3].
Даже если некоторые из описанных выше профилактических подходов как для неонатального колибактериоза, так и для колибактериоза после отъема показали некоторую перспективность и эффективность, антибиотики по-прежнему часто используются для лечения кишечного колибактериоза парентеральным и пероральным путем. При пероральном введении свиньям часто наблюдается недостаточная дозировка, и это состояние может способствовать отбору устойчивых бактерий [4]. Противомикробные препараты, обычно используемые для лечения кишечного колибактериоза, следует выбирать из-за их способности достигать терапевтических концентраций в кишечном содержимом.Наиболее часто используются энрофлоксацин, апрамицин, цефтиофур, неомицин, гентамицин, амоксициллин / клавулановая кислота, триметоприм / сульфонамид и колистин [1]. Устойчивость к противомикробным препаратам к апрамицину, неомицину, триметоприм-сульфонимиду и колистину наблюдается все чаще, особенно у штаммов ETEC, вызывающих PWD [3].
Лечение кишечного колибактериоза свиней требует понимания патотипов и виротипов кишечной палочки , а также условий, при которых они могут вызывать заболевание, с тем чтобы применять соответствующие методы диагностики и стратегии профилактики и борьбы.Ключевым элементом подхода к вспышке колибактериоза для постановки надежного и точного диагноза является знание диагностического процесса и критериев интерпретации диагностических методов.
Этот документ направлен на решение некоторых основных вопросов, которые часто задают при столкновении с кишечным колибактериозом новорожденных и колибактериозом после отъема, которые являются основными предметами данного обзора, относительно диагностического подхода и интерпретации специальные исследования, меры контроля, основанные на терапии антибиотиками, и влияние устойчивости к противомикробным препаратам в борьбе с этими заболеваниями.
Патогенез кишечного колибактериоза свиней
Кишечный колибактериоз новорожденных
ЕТЭК, вызывающий кишечный колибактериоз новорожденных, проникает в животное при приеме внутрь и при наличии предрасполагающих условий окружающей среды и факторов хозяина, размножается в кишечнике и вызывает заболевание посредством специфических факторов вирулентности. Степень колонизации и разрастания определяет, является ли заболевание результатом инфекции. ETEC, ответственные за неонатальную диарею, содержат адгезины, поверхностные белки, называемые фимбриями, которые идентифицированы как F4 (k88), F5 (k99), F6 (987P) и F41 (рис.1). Фимбрии позволяют микроорганизмам прикрепляться к специфическим рецепторам на щеточных краях энтероцитов тонкой кишки. ETEC с фимбриями F4 колонизируют длину тощей кишки и подвздошной кишки, тогда как ETEC с фимбриями F5, F6, F41 в основном колонизируют заднюю часть тощей кишки и подвздошную кишку [1]. Восприимчивость к ETEC F5, F6 и F41 снижается с возрастом и связана с уменьшением количества активных рецепторов, присутствующих в эпителиальных клетках кишечника с возрастом. Большинство штаммов ETEC колибактериоза новорожденных продуцируют термостабильный энтеротоксин STa, который связывает гликопротеиновый рецептор гуанилилциклазы C на щеточной кайме эпителиальных клеток кишечника ворсинок и крипт, стимулируя выработку циклического гуанозинмонофосфата (цГМФ), что приводит к секреции электролитной конечной жидкости [1] .Чрезмерная секреция приводит к обезвоживанию и в конечном итоге к смерти [1]. Метаболический ацидоз, определяемый как состояние пониженного системного pH, является тяжелым осложнением колибактериоза новорожденных и возникает из-за продукции лактата. Большинство клинических признаков, которые раньше связывали с ацидозом, на самом деле были связаны с повышенным уровнем D-лактата в крови. Источником D-лактатемии является бактериальная ферментация непереваренного субстрата, который достигает толстого кишечника из-за повреждения эпителия слизистой оболочки тонкого кишечника.Респираторная компенсация ацидоза происходит за счет гипервентиляции, но этот механизм не работает из-за неадекватного бикарбонатного буфера [5].
Исходя из концентрации и сродства рецепторов STa, задняя часть тощей кишки, по-видимому, является основным местом гиперсекреции в ответ на STa. В развитии кишечного колибактериоза новорожденных очень важную роль играет пассивный иммунитет. В частности, большинство неонатальных инфекций можно предотвратить с помощью пассивного молозива и лактогенного иммунитета [6].Поскольку инфекции ETEC являются неинвазивными желудочно-кишечными инфекциями, для борьбы с заболеванием важен иммунитет слизистой оболочки, то есть лактогенный, а не молозивный, то есть системный иммунитет [6]. По этой причине присутствие высоких уровней IgA в молоке свиноматок, вакцинированных или подвергшихся воздействию патогенной E.coli , присутствующей в окружающей среде поросят, может предотвратить колонизацию тонкой кишки ETEC. Поскольку материнские вакцины применяются парентерально, успех вакцинации, в частности свинок, во многом зависит от предыдущего воздействия ETEC на слизистые оболочки этих животных.Поросята более подвержены заболеваниям, если в молоке свиноматки отсутствуют специфические антитела или у них нет доступа к достаточному количеству молока.
Кишечный колибактериоз после отъема
Как описано для неонатального колибактериоза, E.coli , вызывающая PWD, проникает в животное при приеме внутрь и в присутствии соответствующих предрасполагающих условий окружающей среды и факторов хозяина, размножается в кишечнике и вызывает заболевание посредством специфические факторы вирулентности [1].
Штаммы ETEC после отъема в основном обладают фимбриями F4 и F18, за некоторыми редкими исключениями.Оба фимбриальных типа (F4 и F18) имеют несколько вариантных подтипов, основанных на антигенных различиях. Были описаны варианты F4 ab, ac и ad, даже если почти все штаммы, выделенные из случаев PWD, принадлежат к подтипу F4 ac. F18 имеет два известных варианта: ab и ac. F18 ab обычно ассоциируется со штаммами отековой болезни (OD), а F18 ac — со штаммами PWD [7].
Нефимбриальный адгезин, идентифицированный как адгезин, участвующий в диффузной адгезии (AIDA), был связан со штаммами ETEC, полученными от свиней-отъемышей с PWD, и есть доказательства того, что он причинно участвует в диарее, экспериментально вызванной у новорожденных поросят, лишенных молозива с кодировкой STb E.coli [8]. Однако роль EAST1 и AIDA в развитии колибактериоза у свиней еще предстоит выяснить [9]. Штаммы ETEC после отъема продуцируют один или несколько из следующих известных энтеротоксинов: термостабильные энтеротоксины STa, STb, термолабильный энтеротоксин LT и энтероагрегант E.coli термостабильный энтеротоксин (EAST1) [1]. Механизм действия STa был описан при колибактериозе новорожденных. STb не изменяет цГМФ, как описано для STa, показывая другой механизм действия.Связывание STb с его рецептором приводит к захвату Ca 2+ клетками, вызывая секрецию воды и электролитов двенадцатиперстной кишкой и тощей кишкой. In vivo значительное накопление Na + и Cl — происходит внутрилуминально после интоксикации STb. Кроме того, STb стимулирует секрецию бикарбоната (HCO3-) [10].
LT является частью важной группы токсинов — семейства токсинов AB5. Были описаны два подтипа LT, LTI и LTII. Различия между LTI и LTII в значительной степени связаны с различиями в их субъединице B.LTI можно разделить на LTIh и LTIp, продуцируемые соответственно ETEC человека и свиньи. Было также показано, что штаммы, экспрессирующие LT, обладают преимуществом в колонизации, способствуя прилипанию ETEC in vitro и in vivo [10, 11]. LT постоянно активирует аденилциклазу на базолатеральной границе клетки и приводит к гиперсекреции электролитов и воды [10], вызывая обезвоживание. Метаболический ацидоз является осложнением колибактериоза после отъема, но его действие ограничивается до тех пор, пока не произойдет коллапс кровообращения.
EAST1 был обнаружен в ETEC, изолированном от свиней с диареей, однако его роль в развитии диареи не выяснена [9].
Кишечная микробиота и etec
Экологические и материнские бактерии быстро колонизируют кишечник потомства после рождения и формируют начало здоровой кишечной иммунной системы и ее будущее развитие [12]. Кишечная микробиота характеризуется высокой плотностью населения, большим разнообразием и сложностью взаимодействий в желудочно-кишечном тракте [13].Исследования характеристик кишечной микробиоты показывают, что основными группами бактерий, выделенными из кишечника свиней, являются Streptococcus , Lactobacillus , Prevotella , Selenomona , Mitsuokella , Megasphera67 E , Bacteroides , Fusobacteria , Acidodaminococci и Enterobacteria [13]. Интересно, что сообщалось, что есть четкие доказательства того, что микробиота кишечника играет важную роль в управлении метаболизмом хозяина и что разнообразие фекального бактериального сообщества и их изменения с течением времени были разными у свиней в зависимости от их последующей восприимчивости к диарее после отъема [ 12].Желудок и проксимальный отдел тонкой кишки (двенадцатиперстная кишка) содержат относительно небольшое количество бактерий (10 3 –10 5 бактерий / г или мл содержимого) из-за низкого pH и / или быстрого потока пищеварительного тракта. Напротив, в дистальном отделе тонкой кишки обитает более разнообразная и численно большая (10 8 бактерий / г или мл содержимого) популяция бактерий [13].
Среднее количество биохимических фенотипов E.coli у поросят увеличивалось с возрастом животных [14], а популяции E. coli в фекальной микробиоте свиней и в окружающей среде фермы динамичны и демонстрируют высокий уровень разнообразия [15] .
Клинические проявления кишечного колибактериоза, очевидно, требуют наличия патогенной кишечной палочки , а также изменений окружающей среды и признанных факторов риска [16]. Моредо и др. [17] продемонстрировали, что процент положительных по ЕТЕС свиней без поноса составлял 16,6% в период лактации, 66% в фазе доращивания и 17,3% в популяции откорма. Эти данные продемонстрировали, что эти патогены также могут выделяться с фекалиями здоровых животных, как уже сообщал Осек в 1999 году [18].
Барьерные функции желудочно-кишечного тракта у новорожденных поросят не так развиты, как у взрослых животных, из-за более высокого pH в желудке, более низкой протеолитической способности и зависимости от пассивной иммунной защиты из-за иммунологической незрелости [19]. Сообщается, что время регенерации эпителия тонкой кишки у суточных поросят составляет 7-10 дней по сравнению с 2-4 днями у 3-недельных свиней. Это различие, вероятно, способствует восприимчивости к инфекционному энтериту у новорожденных поросят, поскольку быстрое обновление энтероцитов считается защитным механизмом путем вытеснения инфицированных клеток [20].Взятые вместе, все эти условия в сочетании с предрасполагающими факторами способствуют уязвимости новорожденных поросят к кишечным инфекциям, вызванным ETEC.
После отъема изменение кишечной среды поросят, в основном из-за изменений в рационе питания, приводит к изменению состава местной флоры. Разнообразие штаммов E.coli кишечной флоры обычно велико у здоровых свиней [15], тогда как при кишечном колибактериозе мы наблюдаем нарушение баланса между бактериями, присутствующими в нормальной кишечной флоре [14].Это состояние приводит к распространению доминирующего патогенного штамма, который колонизирует тонкий кишечник [21], быстро достигая массовых количеств, порядка 10 9 / г содержимого. Это причина того, почему часто, если не всегда, образцы, собранные у диарейных свиней, пораженных колибактериозом, позволяют выделить чистую культуру патогенной кишечной палочки .
Эту информацию необходимо учитывать для правильной интерпретации результатов диагностики. В частности, оценка диагностических результатов должна производиться только с учетом как клинических признаков, так и патологических поражений, а также с учетом количества изолированных патогенных E.coli , принадлежащих к идентифицированному патотипу и виротипу.
Диагностический подход
Диагностика кишечного колибактериоза новорожденных и после отъема включает комбинацию различных диагностических процедур, начиная с наблюдения за клиническими признаками и грубыми поражениями, с последующими соответствующими бактериологическими исследованиями и типированием выделенных бактериальных штаммов.
Клинические признаки, макроскопические поражения и отбор проб
Диарея новорожденных, вызванная энтеротоксигенным действием E.coli чаще всего наблюдается у поросят в возрасте от 0 до 4 дней жизни, и, как правило, в эндемичных условиях пометы от свиноматок первого помета могут быть более вовлечены из-за отсутствия защиты пассивным иммунитетом.
PWD из-за E.coli обычно наблюдается через 2–3 недели после отлучения, и, хотя и не в исключительных случаях, его можно зарегистрировать через 6–8 недель после отлучения.
Когда ETEC поддерживает неонатальную диарею, наблюдаются большие количества водянистой или кремообразной консистенции, с характерным запахом и часто от белого до желтого цвета.
Случаи колибактериоза после отъема, вызванного ETEC, обычно характеризуются желтоватым, серым или слегка розовым водянистым поносом с характерным запахом, который обычно длится одну неделю (рис. 2).
Рис. 2Диарейные фекалии свиней, страдающих ETEC F4 PWD
Больные свиньи обычно подавлены с пониженным аппетитом и грубой липкой влажной шерстью. Может произойти внезапная смерть, особенно в начале вспышки, а мертвые свиньи обычно обезвоживаются с запавшими глазами.Тонкая кишка обычно расширена, слегка отечна и гиперемирована (рис. 3). Желудок, обычно расширенный и наполненный свернувшимся молоком или сухим кормом, при колибактериозе новорожденных или после отъема, соответственно, демонстрирует гиперемию глазного дна (рис. 4). Брыжеечные лимфатические узлы увеличены и обычно гиперемированы. Эти поражения, даже если они не патогномоничны, наводят на мысль о кишечном колибактериозе. По этой причине вскрытие трупа, как в случае колибактериоза новорожденных, так и после отъема, помогает патологоанатому в выборе последующего лабораторного обследования.
Рис. 3Кишечник свиньи, страдающей ETEC F4 PWD, выглядит расширенным, отечным и гиперемированным
Рис. 4Желудок свиньи, страдающей ETEC F4 PWD. На дне желудка сильная гиперемия
Наиболее эффективный подход — отобрать несколько необработанных свиней (3-5), страдающих диареей в течение менее 12-24 часов, и гуманно усыпить их и выполнить точное вскрытие трупа для оценки грубых поражений (оценка тонкой кишки). , толстой кишки, илеоцекального клапана, брыжеечных лимфатических узлов) и соберите образцы.Неоткрытые сегменты тонкой кишки (в частности, подвздошной и тощей кишки) и толстой кишки с перевязанными концами должны быть взяты и отправлены в лабораторию (свежие образцы для бактериологических исследований и зафиксированы в 10% забуференном формалине для гистологии) с запросом бактериологического исследования. для выделения патогенного штамма E. coli , вовлеченного в вспышку, его количественной оценки (чистая культура или нет), его типирования и оценки чувствительности к антибиотикам (рис. 5).Свежие образцы должны храниться при +4 ° C и должны быть доставлены в лабораторию менее чем за 24 часа.
Рис. 5Блок-схема отбора проб кишечного колибактериоза (неонатального и после отъемного) у свиней
Недавно спонтанно умершие животные также могут быть использованы для микробиологического анализа. Поскольку автолиз кишечника после смерти происходит быстро, ткани, полученные от животных через 4–6 ч после смерти, обычно не подходят для гистопатологического анализа. Если нет свиней с характерными клиническими признаками кишечного колибактериоза для усыпления или недавно умерших свиней, рекомендуется собрать фекалии (непосредственно от животных, а не из почвы) или ректальные мазки от 3 до 5 свиней (рис.5).
Для окончательного диагноза требуется сочетание нескольких исследований, включая количественную бактериологию, идентификацию факторов вирулентности, обычно с помощью ПЦР, и гистопатологию в качестве дополнительного анализа, чтобы получить комплексную интерпретацию микроскопических поражений, наблюдаемых при обнаруженном патогене. Диагностическое дерево и диагностические критерии, которым необходимо следовать при диагностике кишечного колибактериоза, представлены на рис. 6.
Рис. 6Диагностика кишечного колибактериоза: предлагаемое диагностическое дерево и диагностические критерии
Бактериология и характеристика бактериальных изолятов
Диагноз кишечного колибактериоза основывается на бактериологическом исследовании образцов содержимого просвета (первый выбор) или ректальных мазков.Образцы следует засеять на кровяной агар и агар МакКонкея или другую среду, которая является селективной в отношении Enterobatteriaceae, например агар Гектоена. Эти селективные среды позволяют дифференцировать ферментирующие лактозу (например, E.coli ) от неферментирующих лактозу грамотрицательных кишечных бацилл. Колонии на твердой среде достигают своего полного размера в течение 1 дня инкубации и варьируются от гладких до грубых или слизистых. Характеристики колоний, выращенных на кровяном агаре, и ферментация лактозы на селективных средах дают первое диагностическое указание.В частности, наличие гемолитических колоний как при неонатальной диарее, так и при PWD часто используется в качестве быстрого инструмента для диагностики диареи ETEC (рис. 7). В общих чертах, ETEC, изолированные от случаев неонатального колибактериоза, могут проявляться в виде гемолитических (ETEC F4 положительных) или негемолитических (ETEC F5, F6, F41) колоний на чашках с кровяным агаром [1, 22]. ETEC, изолированные от пациентов с PWD, в основном являются гемолитическими (ETEC F4 или F18), даже если могут наблюдаться негемолитические штаммы. В недавнем исследовании авторы сообщили, что E.coli , выделенные из пациентов с PWD и охарактеризованные как ETEC, были гемолитическими в 97,6% случаев. Оставшиеся 2,4% негемолитических изолятов ETEC, гемолитическая активность которых постоянно проверялась, были выделены во Франции, Италии и Германии и имели один и тот же виротип: F4, STa, STb [23].
Рис. 7ETEC F4, выделенный из кишечного содержимого свиньи, страдающей PWD. На снимке представлена чистая культура гемолитической E.coli на кровяном агаре
.Обнаружение патогенных штаммов не во всех случаях оправдывает заболевание, и важно учитывать, что E.coli , как сообщалось выше, можно, конечно, также изолировать из кишечной среды обитания здоровых хозяев.
Таким образом, оценка диагностических результатов может производиться только с учетом как клинических, так и патологических наблюдений, в сочетании с количественной оценкой изолированного патогенного E.coli . По этой причине высокая концентрация патогенной кишечной палочки в чистой или почти чистой культуре, выделенной из тонкой кишки (подвздошной и тощей кишки), свидетельствует о кишечном колибактериозе.Поскольку почти все ETEC F4 или F18 являются гемолитическими, наличие чистой культуры гемолитических колоний можно использовать в качестве предполагаемого диагноза колибактериоза новорожденных (ETEC F4) или колибактериоза после отъема (ETEC F4 или F18) [1].
Интерпретация бактериологических отрицательных результатов у животных, получавших антибиотики, ненадежна и требует повторного исследования с нелеченными свиньями.
Идентификация генов вирулентности, кодирующих фимбрии и токсины изолированного штамма, имеет решающее значение для выяснения его роли в наблюдаемой клинической проблеме.В настоящее время в рутинной диагностике генотипический анализ, такой как полимеразная цепная реакция (ПЦР) для обнаружения генов, кодирующих факторы вирулентности, выполняется во многих лабораториях для характеристики выделенных штаммов. Праймеры, распознающие гены, кодирующие токсины (STa, STb, LT и EAST1) и фимбрии (F4, F5, F6, F18, F41) ETEC, для белка внешней мембраны Eae или intimin в энтеропатогенной кишечной палочке E.coli (EPEC) и для токсина Stx2e в штаммах STEC ( штаммов E.coli, , вызывающих отек) доступны и могут использоваться для выполнения ПЦР-анализов для повседневной рутинной диагностики [24].Интересно, что некоторые штаммы F18 продуцируют как энтеротоксины, так и токсин Stx2e. Эти штаммы классифицируются как ETEC, а не STEC, поскольку они вызывают клинические симптомы PWD в большей степени, чем отек [1].
Использование конечной точки ПЦР для прямой идентификации факторов вирулентности в образцах от больных свиней без проведения полуколичественной бактериологии и типирования отдельных изолятов может сделать интерпретацию трудной и ненадежной. Этот диагностический подход не позволяет количественно оценить патоген и может дать сочетание всех определяемых факторов вирулентности, принадлежащих разным E.coli , присутствующие в образце, и, как следствие, ложные комбинации этих факторов. Кроме того, не исключено, что подобные гены факторов вирулентности могут быть обнаружены и у других кишечных энтеробактерий. Например, исследование, проведенное на бактериях, выделенных из случаев диареи у детей в Мексике, показало, что ген токсина ST одного штамма, идентифицированного как M. morganii , на 100% идентичен гену токсина ST E. coli [25 ]. О наличии генов, кодирующих токсин LT, ранее сообщалось у M.morganii , полученный из образцов стула путешественников с диареей [26].
Разработка количественных ПЦР-тестов (кПЦР) стала возможным вариантом диагностики [27] отдельно или в сочетании с бактериологией. Стол и его коллеги сообщили, что чувствительность кПЦР была выше по сравнению с культивированием E. coli F4 и E. coli F18 из образцов фекалий свиней с диареей. В 34% образцов, положительных по F4-qPCR и / или F18-qPCR, патогенные E.coli не были обнаружены при культивировании. Когда было обнаружено более 10 7 КОЕ / г E. coli F4 и / или E. coli F18, это коррелировало с культивированием большого количества потенциально патогенных E. coli [27] . Даже если количественная оценка патогенной кишечной палочки с помощью кПЦР представляет собой многообещающий метод диагностики кишечного колибактериоза, полуколичественная бактериология имеет фундаментальное значение для проведения изоляции и тестирования чувствительности к антимикробным препаратам E.coli , вызвавший вспышку.
Обычно вспышки F4-положительных E.coli , как правило, затрагивают только один штамм в любой момент времени, даже если наблюдались смешанные инфекции с выделением разных виротипов в одной и той же вспышке. В этих случаях, вероятно, преобладает один виротип в любой данной вспышке [1]. По этим причинам было бы целесообразно типизировать больше изолятов, полученных от разных свиней, вовлеченных в вспышку, после количественного бактериологического исследования и в соответствии с затратами на исследования, чтобы определить, участвует ли более одного виротипа во вспышке кишечный колибактериоз.Например, было бы целесообразно протестировать образцы от 5 репрезентативных свиней с диареей и типировать 3 изолята, ранее выбранных по их культуральным и биохимическим характеристикам. Хотя такой подход не дает абсолютных результатов, он, безусловно, повышает надежность полученных результатов.
Исследование, проведенное на 160 европейских стадах во время вспышек ЛЗИН, в соответствии с протоколом отбора проб, описанным выше, показало, что смешанные инфекции (ETEC F4 и F18) наблюдались в 13% случаев (данные не опубликованы) (рис.8).
Рис. 8Различные виротипы, выделенные из 160 случаев PWD в разных странах Европы, выборка 5 свиней с диареей и типирование 3 изолята, ранее выбранных по их культуральным и биохимическим характеристикам для каждой вспышки (данные не опубликованы)
Патогенная E.coli также может быть идентифицирована с помощью серотипирования антигенов O (LPS клеточной стенки), поскольку с заболеванием связано небольшое количество специфических групп O (таблица 1).
Таблица 1 Серогруппы O, наиболее часто участвующие в качестве энтеротоксигенных E.coli , вызывающих неонатальную диарею у свинейПолное серотипирование H (антигена жгутикового белка) и O-антигенов с дополнительной идентификацией антигенов K (капсульный полисахарид) является стандартным методом определения всех серотипов, но в целом его проводят в нескольких справочных лабораториях.
Различные клоны внутри серогруппы, возможно, эволюционировали, приобретая разные гены вирулентности, что привело к клональной вариации, связанной с конкретным регионом или страной.Например, ETEC серогруппы O139, связанный во всем мире с фимбриями F18ab, обычно вызывает PWD в Австралии и OD в Европе, в то время как преобладающая серогруппа, связанная с PWD у свиней во всем мире, — O149 [1] (Таблица 2).
Таблица 2 Общие серовиротипы патогенной E.coli от свиней с PWD (модифицировано из Fairbrother and Gyles [1])Гистопатология
Гистопатология фиксированных формалином и залитых парафином тканей (следует включить подвздошную кишку, тощую кишку и толстую кишку) может использоваться в качестве дополнительного исследования для окончательного диагноза колибактериоза.У поросят, страдающих кишечным колибактериозом новорожденных, F4-положительные ЕТЭК прилипают к большей части щеточной мембраны энтероцитов тонкой кишки и подвздошной кишки слизистой оболочки кишечника, тогда как другие ЕТЭК в основном колонизируют дистальную часть тощей кишки или подвздошную кишку [1]. Другие изменения включают заложенность сосудов, кровотечения и увеличение количества воспалительных клеток (нейтрофилов и макрофагов в собственной пластинке , ) [1]. Микроскопические поражения при ETEC PWD характеризуются бактериальными слоями, наблюдаемыми в виде пятен на апикальной поверхности эпителиальных клеток ворсинок в подвздошной кишке и в меньшей степени в тощей кишке.Легкая атрофия ворсинок и повышенное количество нейтрофилов могут наблюдаться в поверхностной пластинке lamina propria [1]. Иммуногистохимия и флуоресцентная гибридизация in situ могут использоваться в качестве инструментов для подтверждения этиологии наблюдаемых микроскопических поражений.
Критерии и методы, использованные для идентификации штаммов E.coli , выделенных из случаев колибактериоза у новорожденных и после отъема, представлены в таблице 3.
Таблица 3 Интерпретативные критерии, использованные для диагностики E.coli неонатальная диарея и диарея после отъема (по данным Fairbrother and Gyles, 2012) [1]Дифференциальный диагноз
Вспышки кишечных заболеваний у свиней часто бывают многофакторными. Сосредоточение внимания на диагностике и последующих стратегиях контроля без учета всех возможных дифференциальных диагнозов или нескольких задействованных агентов может ввести практикующих в заблуждение. Диагностическая оценка неонатального колибактериоза и колибактериоза после отъема требует аналогичных стандартных диагностических процедур.Путь диагностики остается простым, если поражения, наблюдаемые во время вскрытия трупа, вызывают серьезные подозрения. Так обстоит дело с кишечным колибактериозом, когда бактериология обычно может легко подтвердить подозрение на основании зарегистрированных патологических поражений. Диарею у поросенка до отъема, вероятно, проще выявить, лечить и предотвратить, чем понос после отъема. В частности, неонатальную диарею, вызванную ETEC, необходимо дифференцировать от других причин диареи, таких как Clostridium difficile , Clostridium perfrigens типов A и C, кишечного коронавируса (TGEV, PEDV) и ротавирусов групп A, B и C.У поросят старше 7 дней также следует учитывать кокцидиоз, вызванный Isospora suis [28] (Таблица 4).
Таблица 4 Дифференциальная диагностика основных возбудителей диареи новорожденных (по данным Martelli et al. 2013) [28]ETEC PWD следует дифференцировать от других причин диареи, уже описанных у поросят, таких как EPEC, кишечный коронавирус (TGEV, PEDV), ротавирус групп A, B и C, сальмонеллез, пролиферативная энтеропатия, вызванная Lawsonia intracellularis и Brachyspira spp. .[28] (Таблица 5).
Таблица 5 Дифференциальная диагностика основных возбудителей диареи после отъема (по данным Martelli et al. 2013) [28]Лечение кишечного колибактериоза
Симптоматическое лечение
Эффект диареи у свиней, пораженных кишечным колибактериозом, заключается в потере жидкости, которая приводит к обезвоживанию животных. Во многих случаях необходимы физиологический раствор и регидратация [1]. Свиньи представляют особую проблему при регидратации, поскольку внутривенный путь введения нецелесообразен, как и подкожное введение.Можно использовать внутрибрюшинную инъекцию, но объем, который можно ввести, ограничен, а поглощение является неопределенным [29]. Инфузионная терапия, состоящая из растворов для замещения электролитов, содержащих глюкозу, вводимых перорально, используется для лечения обезвоживания и метаболического ацидоза у свиней, пораженных колибактериозом [1]. Исследования на крысах и клинические исследования на детях показали, что растворы для пероральной регидратации с низкой осмоляльностью способствуют всасыванию кишечной жидкости, оказывая благотворное влияние на течение диареи [30].
Оксид цинка
Корм, содержащий от 2400 до 3000 частей на миллион цинка, снижает диарею, смертность и улучшает рост. Долгое время считалось, что оксид цинка должен иметь антибактериальный эффект, особенно против кишечной палочки . На основании исследований, проведенных in vitro, были предложены несколько антимикробных механизмов оксида цинка: 1) перекись водорода, которая образуется с поверхности оксида цинка, может проникать через клеточную мембрану, вызывать некоторые виды повреждений и подавлять рост клетки; 2) сродство между оксидом цинка и бактериальными клетками является важным фактором антибактериальной активности.Другие исследователи показали, что оксид цинка снижает адгезию бактерий к ETEC F4 и блокирует бактериальную инвазию, предотвращая повышенную проницаемость плотных контактов и модулируя экспрессию генов цитокинов [31].
Цинк плохо усваивается, поэтому он становится высококонцентрированным в навозе с последствиями с точки зрения загрязнения окружающей среды. Терапевтическое использование цинка в настоящее время обсуждается. В целом бактерии у животных могут развить устойчивость к Zn, а также к другим тяжелым металлам, таким как Cu.Гены устойчивости к Zn часто расположены на плазмидах, которые могут передаваться другим бактериям внутри и между видами. Воздействие микроэлементов металлов также может способствовать устойчивости к антибиотикам, даже в отсутствие самих антибиотиков. Добавление цинка в корм для животных может увеличить долю мультирезистентной E. coli в кишечной микробиоте [32]. Несколько исследований сосредоточили внимание на тяжелых металлах, используемых в животноводстве, и возможных механизмах, которые могут способствовать распространению устойчивости к антибиотикам посредством совместного отбора.В одном сообщении цинк ассоциировался с метициллин-резистентным Staphylococcus aureus (MRSA) CC398 в Дании [33], и сделан вывод о том, что соединения цинка могут быть частично причастны к появлению клонов MRSA. Механизмы совместного отбора включают совместную резистентность и перекрестную резистентность. Совместная резистентность определяется как непосредственная близость двух или более генетических элементов, кодирующих резистентность. Например, устойчивость к сульфонамидам будет следовать по пути совместной устойчивости. Перекрестная резистентность развивается, когда антибактериальный агент атакует одну и ту же цель, например системы оттока, которые одновременно транспортируют два или более типов антибактериальных агентов.Пример перекрестной устойчивости может быть получен с тетрациклином, так как устойчивые к цинку штаммы также вытесняют тетрациклин с использованием той же системы оттока [34].
Недавно Комитет по лекарственным препаратам для ветеринарии (CVMP) Европейского агентства по лекарственным средствам (EMA) завершил процедуру направления ветеринарных лекарственных препаратов, содержащих оксид цинка, для перорального введения животным, производящим пищевые продукты. Комитет принял консенсусное мнение о том, что преимущества оксида цинка для предотвращения диареи у свиней не перевешивают риски для окружающей среды.CVMP подчеркнул, что существует риск совместного отбора на устойчивость, связанный с использованием оксида цинка, но в настоящее время этот риск не поддается количественной оценке. Поэтому Комитет рекомендовал отказать в выдаче разрешений на продажу и отозвать существующие разрешения на продажу ветеринарных лекарственных препаратов, содержащих оксид цинка [35].
Противомикробные препараты
Лечение кишечного колибактериоза: общие принципы антимикробной терапии
Противомикробная терапия требуется во многих случаях кишечного колибактериоза, помимо использования подходов для предотвращения инфекционных агентов и клинических заболеваний.Необходимо выбрать противомикробную терапию, которая достигает терапевтических концентраций в просвете кишечника, как это наблюдается для различных классов антибиотиков: β-лактамные антибиотики (амоксициллин и комбинация, содержащая амоксициллин / клавулановую кислоту), цефалоспорины (цефтиофур, цефхином), аминоглюкозиды (апрамицин, , гентамицин), аминоциклитолы (спектиномицин), сульфонамид в сочетании с триметопримом (например, триметоприм / сульфаметоксазол), фторхинолоны (энрофлоксацин, марбофлоксацин и данофлоксацин), хинолоны (флумекин] 1 (флумекин) и полимиксульфат).
Терапевтический подход и, следовательно, выбор антибиотика для лечения должны учитывать несколько аспектов:
- 1.
Инфекция локализуется в основном в тонком кишечнике. Антибиотик, выбранный для терапии, должен достигать достаточной концентрации в тонком кишечнике.
- 2.
Эмпирические обработки выполняются на основе знаний об отдельном стаде и местных данных о структуре устойчивости.
- 3.
Во многих случаях оценка чувствительности изолированного штамма к противомикробным препаратам является фундаментальной для правильной терапии.
Вспышка колибактериоза часто требует быстрых действий, и поэтому использование антибиотиков почти всегда предшествует появлению результатов по структуре устойчивости.В результате в большинстве случаев ответственность за правильный выбор антибиотиков остается за врачом, и лаборатория дает ретроспективный результат. Самая основная информация, которую может предоставить лаборатория, — это качественные результаты чувствительности (бактериальный штамм является чувствительным, промежуточным или устойчивым к определенному антибиотику). Количественные результаты, полученные с помощью минимальной ингибирующей концентрации (МИК), могут быть более полезными, чем традиционные качественные результаты, поскольку данные МИК более точно определяют степень восприимчивости патогена.
На рис. 9 в качестве примера показаны этапы начала, ведения и переоценки антибактериальной терапии во время вспышки кишечного колибактериоза.
Рис. 9Этапы начала, ведения и переоценки антибактериальной терапии во время вспышки кишечного колибактериоза (изменено по Пейджу и Готье [40])
Некоторые европейские страны, такие как Нидерланды, ввели классификацию всех антибиотиков на первый, второй и третий выбор (последнее средство).Такой подход был описан Burch et al. [37]. Эти классификации постоянно пересматриваются. В общих чертах, антибиотики первого выбора могут использоваться после клинического диагноза (эмпирическое лечение), тогда как антибиотики второго выбора следует зарезервировать для случаев, когда тестирование чувствительности или клинические результаты доказали, что антибиотики первого выбора не эффективны, а антибиотики третьего выбора (например, цефалоспорины третьего и четвертого поколения, фторхинолоны и макролиды) зарезервированы в качестве противомикробных препаратов последнего средства, если не доступны другие варианты.
Антибиотик следует вводить всем животным с клиническими признаками колибактериоза, а больных свиней следует лечить парентерально, так как они мало едят и пьют. На практике, когда происходит смертность, применяется метафилактический подход, при котором обрабатываются все животные в загонах, где наблюдалась смертность. В руководстве по разумному использованию противомикробных препаратов в ветеринарии (2015 / C 299/04), опубликованном в официальном журнале Европейского Союза, рассматривается использование метафилаксии и говорится, что противомикробные метафилаксии следует назначать только тогда, когда есть реальная необходимость в лечении и ветеринарный врач должен обосновывать и задокументировать лечение на основании клинических данных о развитии заболевания в стаде или отаре [38].
Фармакокинетические / фармакодинамические показатели: общая информация о противомикробных препаратах, используемых для лечения кишечного колибактериоза
Эффективность противомикробной терапии зависит от способности патогена реагировать на противомикробную терапию, характеристик воздействия лекарственного средства, необходимых для вызова целевого микробиологического ответа, и способности достигать необходимых активных концентраций лекарственного средства в очаге инфекции [39].Взаимосвязь между системным воздействием лекарственного средства и его соответствующими клиническими и микробиологическими эффектами называется фармакокинетикой / фармакодинамикой (PK / PD) (Таблица 6). Это соотношение PK / PD, в свою очередь, определяет дозу, частоту дозирования и продолжительность введения лекарства, необходимые для достижения желаемого клинического и микробиологического результата. Компонент PK описывает обращение с лекарством хозяином (абсорбция, распределение, метаболизм и выведение) (таблица 7). Компонент PD описывает действие препарата с течением времени на бактерии в очаге инфекции.Таким образом, взаимодействие между PK и PD отражает взаимосвязь между флуктуирующими концентрациями биологически активного лекарственного средства в очаге инфекции, что отражается в его концентрациях в сыворотке или плазме, по сравнению с его воздействием на целевой микробный патоген [39].
Таблица 6 Классификация антибактериальных препаратов, часто используемых при лечении кишечного колибактериоза, по фармакокинетическим и фармакодинамическим показателям (модифицировано из Ahmad et al. [41]) Таблица 7 Основные противомикробные препараты, используемые у свиней для лечения кишечного колибактериоза: пути введения, дозировки и основные фармакокинетические свойства (изменено из Burch [37])Три индекса PK / PD были предложены для прогнозирования антимикробной эффективности: отношение максимальной несвязанной (свободной) концентрации и MIC (Cmax / MIC), отношение свободной площади под кривой зависимости концентрации от времени и MIC. (AUC / MIC) и процент времени, в течение которого концентрация свободного лекарственного средства превышает MIC (T> MIC) [40].
Правильное использование показателей PK / PD может оптимизировать дозировку, что, в свою очередь, увеличивает вероятность терапевтического успеха, снижает токсичность и появление резистентности. Для достижения высокой вероятности микробиологического и клинического излечения требуется адекватное воздействие на бактерии антимикробного агента. Воздействие зависит от применяемой дозы и зависит от различных фармакокинетических параметров, таких как биодоступность и клиренс лекарственного средства, а также от чувствительности патогена (например,грамм. MIC). Интересно, что клинические контрольные точки, используемые для оценки МИК, рассчитываются с учетом различных критериев и в основном зависят от параметров PK / PD [41].
Для различных противомикробных препаратов подход, основанный на фармакокинетических параметрах и распределении МПК, используется для оценки потенциала дозы для лечения системной инфекции, вызванной патогеном. Распределение значений MIC для патогена используется для оценки диапазона доз, необходимых для получения вероятности терапевтического успеха, согласно данным фармакокинетики населения.Надлежащая дозировка антибиотика является ключом к контролю или уничтожению бактерий в очаге инфекции, а также к ограничению устойчивости к противомикробным препаратам. Индексы PK / PD в основном используются в качестве целевых показателей эффективности в процессе выбора дозы, но также необходимо работать над оптимизацией режима дозирования (частота, продолжительность лечения) для достижения наилучшего клинического результата и наименьшей резистентности бактерий. выбор [41].
Основные характеристики противомикробных препаратов, используемых для лечения кишечного колибактериоза
ß-лактамные антибиотики (такие как пенициллины, амоксициллин, цефалоспорины, монобактамы и карбапенем) предотвращают формирование бактериальной клеточной стенки, препятствуя заключительной стадии синтеза пептидогликана.Бета-лактамные антибиотики действуют путем связывания с ферментами синтеза клеточной стенки, известными как пенициллин-связывающие белки (PBP), тем самым подавляя синтез пептидогликана. Препараты обладают бактерицидным действием, но вызывают лизис только растущих клеток, то есть клеток, которые подвергаются активному синтезу клеточной стенки [42].
Амоксициллин достигает высоких концентраций в тканях, поскольку хорошо всасывается в кишечнике. Амоксициллин, как и большинство ß-лактамов, почти полностью выводится почками, что приводит к очень высоким уровням в моче.Устойчивость к ß-лактамам опосредуется механизмами оттока и модификацией поринов у грамотрицательных бактерий, которые препятствуют проникновению антибиотика [42].
Клавулановая кислота сочетается с амоксициллином в соотношении 2: 1, и эти комбинации обычно обладают бактерицидным действием. Комбинация имеет потенциальное применение при лечении различных инфекций у свиней, вызванных плазмид-опосредованными бактериями, продуцирующими ß-лактамазу, включая неонатальную диарею E. coli .Клавулановая кислота хорошо всасывается после перорального приема и имеет фармакокинетические свойства, аналогичные амоксициллину [43].
Цефалоспорины обладают такими преимуществами, как стабильность β-лактамаз, хорошая активность против целевых белков (PBP) и хорошая способность проникать через стенки бактериальных клеток. Цефалоспорины четвертого поколения эффективны против Enterobacteriaecae и других грамотрицательных бактерий, устойчивых к цефалоспоринам более ранних поколений из-за приобретенной устойчивости на основе ß-лактамаз.Цефалоспорины — одни из самых безопасных противомикробных препаратов. Широкий спектр антибактериальной активности препаратов второго-четвертого поколений может вызвать чрезмерный рост резистентных бактерий, включая Clostridium difficile , которым больше не приходится конкурировать с чувствительными представителями микробной флоры [44]. Цефтиофур натрия доступен для использования на свиньях при лечении колибактериоза новорожденных. Цефалоспорины четвертого и третьего поколения не являются противомикробными препаратами первого выбора и должны быть зарезервированы для использования в тех случаях, когда тестирование на чувствительность показывает, что альтернативы недоступны.Часто эффективны препараты более узкого спектра действия, и им следует отдавать предпочтение [44].
В целом, 3 механизма устойчивости к ß-лактамам: снижение доступа к PBP, снижение аффинности связывания PBP и разрушение антибиотика за счет экспрессии ß-лактамазы (ферменты, которые связывают и гидролизуют ß-лактамы) [45] .
Антибактериальные диаминопиримидины сочетаются с различными сульфонамидами (сульфадиазином, сульфаметоксазолом и сульфадоксином) в фиксированном (1: 5) соотношении.Комбинация диаминопиримидина с сульфонамидом ингибирует последовательные стадии синтеза фолиевой кислоты и, следовательно, пуринов, необходимых для бактериального синтеза ДНК. Вмешательство диаминопиримидина в рециркуляцию тетрагидрофолиевой или дигидрофолиевой кислоты, вероятно, отвечает за синергетическое взаимодействие комбинации. Комбинация имеет большой запас прочности, а побочные эффекты в основном связаны с сульфаниламидом. Компонент диаминопиримидина концентрируется в тканях, тогда как компонент сульфонамида перемещается из плазмы в ткани очень медленно.Комбинации триметоприма и сульфонамида успешно применялись для борьбы с широким спектром заболеваний у свиней, включая колибактериоз у новорожденных и после отъема [46].
Аминогликозидные антибиотики канамицин, гентамицин, амикацин и неомицин представляют собой большие молекулы с многочисленными аминокислотными группами, что делает их основными поликатионами, которые сильно ионизируются при физиологических значениях pH. Антибактериальное действие аминогликозидов направлено в первую очередь против аэробных грамотрицательных бактерий.Бактерицидное действие аминогликозидов на аэробные грамотрицательные бактерии заметно зависит от pH, поскольку они наиболее активны в щелочной среде. Повышенная местная кислотность, вызванная повреждением тканей или разрушением бактерий, может объяснить неспособность аминогликозидов убивать обычно чувствительные патогены. Аминогликозиды плохо всасываются из нормального желудочно-кишечного тракта, но хорошо всасываются после внутримышечной или подкожной инъекции. Выведение полностью происходит за счет почечной экскреции (клубочковой фильтрации), и неизмененный препарат быстро выводится с мочой.Нефротоксичность (острый некроз канальцев) является наиболее частым побочным эффектом терапии аминогликозидами. Наиболее клинически важная устойчивость к аминогликозидам вызывается плазмидными ферментами, широко классифицируемыми как фосфотрансферазы, ацетилтрансферазы и аденилтрансферазы [47]. Гентамицин используется для лечения неонатального колибактериоза у поросят в возрасте от 1 до 3 дней с помощью однократной внутримышечной инъекции или пероральной дозы 5 мг. [47].
Спектиномицин — это аминоциклитоловый антибиотик, который лишен большинства токсических эффектов аминогликозидных антибиотиков, но его применение ограничено из-за быстрого развития резистентности.Спектиномицин обычно является бактериостатическим препаратом относительно широкого спектра действия, который может быть бактерицидным при концентрациях, в 4 раза превышающих МИК. Одноступенчатая хромосомная мутация высокого уровня устойчивости легко развивается in vivo и in vitro. Хромосомно-устойчивые штаммы не проявляют перекрестной устойчивости с аминогликозидами. Фармакокинетические свойства аналогичны свойствам аминогликозидов. Для свиней спектиномицин доступен в виде перорального раствора для лечения колибактериоза [47].
После приема фторхинолоны быстро и широко распределяются в тканях из-за их гидрофильной природы и низкого (<50%) связывания с белками.Высокие концентрации обнаруживаются в желчи и органах выделения (печень, кишечник и мочевыводящие пути). Фторхинолоны выводятся преимущественно в неизмененном виде с мочой за счет клубочковой фильтрации и активной канальцевой секреции. Фторхинолоны - относительно безопасные противомикробные препараты. При введении в терапевтических дозах токсические эффекты легкие и обычно ограничиваются желудочно-кишечными расстройствами, такими как тошнота, рвота и диарея. Устойчивость к фторхинолонам возникает в результате модификации мишени, снижения проницаемости, оттока и / или защиты мишени.Каждый из этих механизмов устойчивости к фторхинолонам может происходить одновременно в одной и той же клетке, что приводит к очень высоким уровням устойчивости [48]. Цефалоспорины четвертого и третьего поколения и фторхинолоны не являются противомикробными препаратами первого выбора и должны быть зарезервированы для использования в тех случаях, когда тестирование на чувствительность показывает, что альтернативы отсутствуют.
Колистин (полимиксин E) — катионный, многокомпонентный липопептидный антибактериальный агент, открытый вскоре после окончания Второй мировой войны (1949).Колистин — это бактерицидный препарат, который связывается с липополисахаридом (ЛПС) и фосфолипидами на внешней мембране грамотрицательных бактерий. Этот процесс приводит к увеличению проницаемости клеточной оболочки, утечке содержимого клетки и последующей гибели клеток. Сульфат колистина — единственный разрешенный продукт в некоторых странах для перорального применения в свиноводстве для борьбы с кишечными инфекциями, вызываемыми Enterobacteriaceae [49]. Полимиксины хорошо переносятся после перорального или местного применения, но системное применение вызывает нефротоксические, нейротоксические и нервно-мышечные эффекты.
Использование колистина в Европе сильно различается в зависимости от страны. Страны с интенсивным животноводством могут иметь уровень использования ниже 1 мг / PCU (например, Дания и Великобритания) или намного выше, до 20-25 мг / PCU (Италия и Испания) [50]. В связи с его важностью для медицины человека, воздействие на здоровье людей текущего или будущего использования продуктов колистина у животных обсуждалось в течение долгого времени [49]. Обычно рекомендуемая доза для терапии составляет 100000 МЕ / кг МТ (100000 МЕ / кг массы тела в день или 50000 МЕ / кг, вводимых с 12-часовыми интервалами), но в некоторых неевропейских странах разрешено использование колистина в более низких дозах. в качестве кормовой добавки для стимуляции роста [51].
E.coli и устойчивость к противомикробным препаратамУстойчивость к противомикробным препаратам к нескольким антибиотикам, таким как апрамицин, неомицин, триметоприм-сульфаметоксазол и колистин, все чаще наблюдается у штаммов ETEC, вызывающих PWD [3]. Развитие устойчивости к широкому спектру противомикробных препаратов, а также продемонстрированная тенденция устойчивости штаммов ETEC к антибиотикам, используемым для лечения колибактериоза у свиней, в настоящее время вызывают беспокойство [52].Была описана множественная лекарственная устойчивость среди изолятов ЕТЕС, и в последнее время наблюдается возрастающая тенденция у свиного ЕТЕС к выражению фенотипа с множественной лекарственной устойчивостью [33].
Трудно, если не невозможно, предоставить общие данные об устойчивости, потому что ситуация варьируется в разных странах и популяциях свиней и в основном зависит от предпочтительно используемых противомикробных препаратов. В таблице 8 приведены данные об устойчивости штаммов E.coli к различным антибиотикам, обычно используемым для лечения колибактериоза.
Таблица 8 Примеры уровней устойчивости к различным антибиотикам у штаммов E.coli , выделенных от здоровых и больных свиней в разных странах (модифицировано из Aarestrup et al. 2008) [33]В исследовании, проведенном в Италии с целью оценки тенденции резистентности ETEC, выделенных за 10-летний период (2002–2011 гг.), Было обнаружено 442 штамма F4-положительных E.coli , выделенных в случаях колибактериоза после отъема от груди. протестирован против нескольких антибиотиков с использованием метода дисковой диффузии [52].В ходе исследования промежуточные штаммы были сгруппированы с устойчивым. Изоляты показали статистически значимую тенденцию к увеличению устойчивости на протяжении всего периода исследования к: энрофлоксацину (с 14,5% до 89,3%), флумехину (с 49,1% до 92,9%) и цефхиному (с 3,8% до 44%). Повышение устойчивости (статистически недостоверно) также наблюдалось к гентамицину (с 63,6% до 85,7%), апрамицину (с 61,8% до 82,1%) и триметоприм-сульфаметоксазолу (с 75% до 89,3%).
Устойчивость к энрофлоксацину описана у E.coli , выделенных в Бразилии, где почти 30% изолятов, выделенных при неонатальной колибактериозе, были устойчивы к этому антибиотику [53]. Устойчивость к фторхинолонам сильно коррелировала с количеством препарата, используемого для лечения свиней, и плазмидная передача устойчивости к фторхинолонам была продемонстрирована на штаммах E. coli свиней [54].
Высокие уровни устойчивости к гентамицину были зарегистрированы у E. coli , изолированной от больных свиней в Бельгии (46%), Польше (45%) и Испании (20%) [33].Устойчивость к гентамицину и другим аминогликозидам обычно является трансмиссивной, и описана перекрестная резистентность между гентамицином и апрамицином [55].
Изоляты E. coli из случаев PWD в Австралии оказались устойчивыми к стрептомицину, спектиномицину, ампициллину и триметоприм-сульфаметоксазолу. В том же исследовании меньшее количество изолятов было устойчивым к неомицину и апрамицину, и часть из них показала устойчивость к гентамицину. Ни один из изолятов не был устойчив к энрофлоксацину или цефтиофуру [56].
Исследование, проведенное в Корее, показало, что штаммов E. coli , выделенных от диарейных свиней, были мультирезистентными (устойчивыми к более чем 4 антибиотикам) с высоким уровнем устойчивости к нескольким антибиотикам: гентамицину (77%), триметоприм-сульфаметоксазолу (75,7 %), амоксициллин (75,7%), ампициллин (73%) и энрофлоксацин (64,9%) [57].
За последние несколько лет штаммов E. coli, устойчивых к колистину, стали более распространенными.Штаммы E. coli с приобретенной устойчивостью встречаются среди патогенных изолятов, обычно у свиней, страдающих диареей [51] (Таблица 9).
Таблица 9 Примеры устойчивости к колистину у штаммов E.coli , выделенных от здоровых и больных свиней в разных странах (модифицировано из Kempf et al. [51])Устойчивость к колистину основана на мутациях, ответственных за изменение заряда ЛПС. До сих пор устойчивость к полимиксину включала хромосомные мутации, делающие механизм устойчивости нестабильным и неспособным распространяться на другие бактерии, но никогда не сообщалось о горизонтальном переносе генов.Проведенное в Китае исследование устойчивости к противомикробным препаратам у комменсала E. coli от пищевых животных показало повышение устойчивости к колистину и описало появление первой трансмиссивной, опосредованной плазмидой устойчивости к полимиксину в форме mcr -1 [ 58]. Ген может легко передаваться между разными типами бактерий, что потенциально может привести к быстрому развитию устойчивости. Хотя этот ген был впервые обнаружен у E.coli в Китае, впоследствии он был обнаружен и в ЕС.Что касается устойчивости к антибиотикам, плазмиды играют центральную роль в качестве средств захвата гена устойчивости и последующего распространения.
Европейская комиссия, после недавнего открытия этого нового механизма устойчивости бактерий к колистину (вызванного геном mcr -1), запросила у Специальной экспертной группы по противомикробным советам (AMEG) обновленную информацию о своих рекомендациях от 2013 года. об «использовании продуктов колистина для животных в Европейском Союзе». В своем совете, опубликованном в июле 2016 года, Группа экспертов описывает несколько мер, которые следует рассмотреть для решения проблемы.Их кратко можно описать следующим образом:
В течение следующих 3-4 лет все государства-члены должны сократить использование колистина у животных по крайней мере до целевого уровня 5 мг колистина / PCU.
Государствам-членам также рекомендуется установить более строгие национальные целевые показатели, в идеале желаемый уровень ниже 1 мг колистина / PCU.


 Количество отображается в результате в виде одного, двух или трех «+». Дополнительно определяет вид микрофлоры, род возбудителя.
Количество отображается в результате в виде одного, двух или трех «+». Дополнительно определяет вид микрофлоры, род возбудителя.
 Попадание в мочу выделений из половых органов.
Попадание в мочу выделений из половых органов.