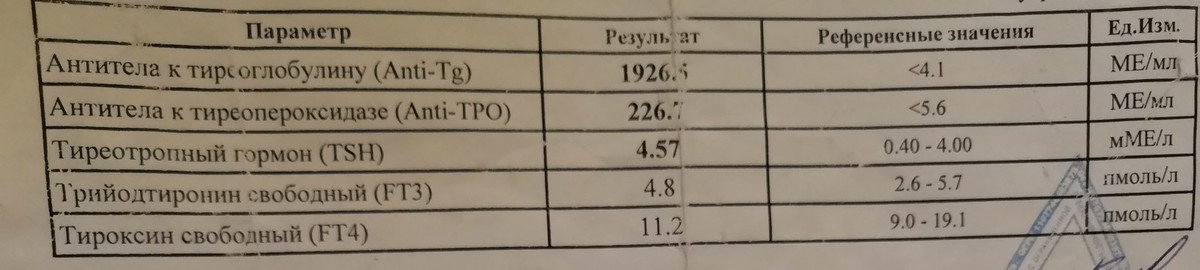Про антитела к щитовидной железе
В современном мире пациент часто оказывается один на один с результатами анализов, которые были выполнены без надобности или соответствующих показаний. Возникает это по ряду причин, в том числе из-за существования «стандартных пакетов» обследования и недостаточной квалификации врача.
Популярным параметром в этой категории анализов являются антитела к щитовидной железе.
Что же такое антитела (АТ)?
Антитела — это сложные молекулы, синтезируемые клетками иммунной системы. Основная функция антител — идентификация и нейтрализация чужеродных объектов — например, бактерий и вирусов. Однако случается, что антитела начинают вырабатываться к тканям собственного организма, что может сопровождаться различными аутоиммунными заболеваниями.
Какие антитела могут вырабатываться к щитовидной железе (ЩЖ)?
В щитовидной железе наиболее частыми объектами выработки антител являются фермент тиреоидная пероксидаза (ТПО) и матрица для синтеза гормонов — тиреоглобулин (ТГ).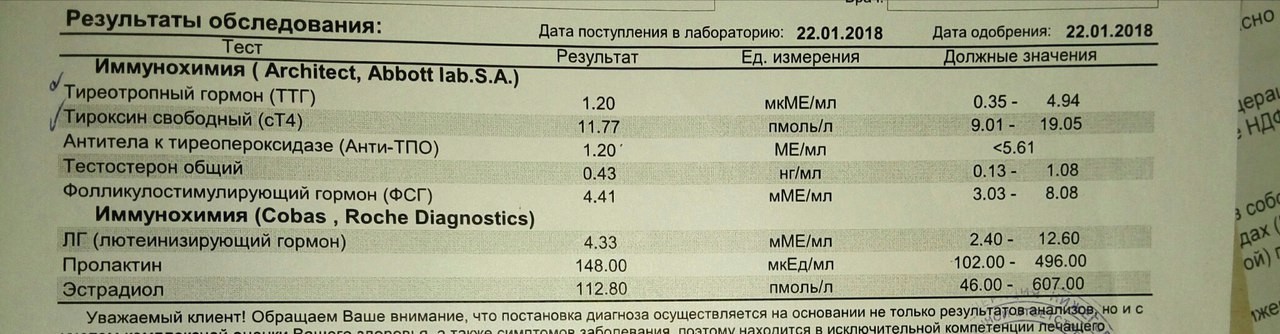
В клинической практике также используется определение антител к рецептору тиреотропного гормона (АТ-рТТГ), однако этот анализ назначается реже, и в большинстве случаев — по показаниям.
О чем говорит повышение уровней АТ-ТПО и/или АТ-ТГ?
Далеко не всегда продукция АТ к щитовидной железе приводит к развитию аутоиммунных заболеваний. Обнаружение в крови только лишь повышенных АТ-ТПО и/или АТ-ТГ не позволяет установить какой-либо диагноз. По статистике около 15–20% здоровой популяции являются простыми «носителями» этих антител.
Когда исследование АТ-ТПО и АТ-ТГ оправдано?
За редким исключением исследование уровней АТ-ТПО и АТ-ТГ должно быть рекомендовано только при нарушении функции ЩЖ. Именно в этих случаях уровень АТ к ЩЖ может помочь в диагностике заболевания, а точнее — помочь установить его природу.
Нужно ли снижать и контролировать уровни АТ-ТПО и АТ-ТГ?
Важно подчеркнуть, что ключевым звеном в патогенезе аутоиммунных заболеваний ЩЖ антитела к ТПО и ТГ, по всей видимости, не являются и начинают вырабатываться уже в ответ на повреждение ЩЖ.
Оценка уровней АТ-ТПО в динамике также не рекомендуется.
В каких редких ситуациях исследование АТ-ТПО и АТ-ТГ может быть показано при нормальной функции ЩЖ?
- Когда на фоне беременности уровень ТТГ (тиреотропного гормона) превышает триместр-специфические нормы,
- Когда планируется процедура экстракорпорального оплодотворения,
- Перед назначением амиодарона, препаратов интерферона и лития (поскольку носители антител имеют повышенный риск развития патологии ЩЖ, индуцированной этими препаратами)
- Для оценки эффективности лечения дифференцированного рака ЩЖ может быть необходим мониторинг уровня АТ-ТГ.
Исследование уровней АТ-ТПО и АТ-ТГ в других ситуациях можно считать избыточным, а интерпретацию результатов бессмысленной.
Антитела к рецепторам ТТГ в медицинском центре «Мать и Дитя»
Антитела к рецепторам ТТГ вырабатываются в результате аутоиммунных нарушений в щитовидной железе и организме в целом. Тиреотропный гормон синтезируется в гипофизе и регулирует функции щитовидной железы (ЩЖ). В клетках ЩЖ локализованы рецепторы, с которыми ТТГ образует комплексы. Сигналы от них стимулируют синтез гормонов ЩЖ – тироксина и трийодтиронина. Нарушение образования комплексов «рецептор-гормон» приводит к сбою многих процессов в организме.
Тиреотропный гормон синтезируется в гипофизе и регулирует функции щитовидной железы (ЩЖ). В клетках ЩЖ локализованы рецепторы, с которыми ТТГ образует комплексы. Сигналы от них стимулируют синтез гормонов ЩЖ – тироксина и трийодтиронина. Нарушение образования комплексов «рецептор-гормон» приводит к сбою многих процессов в организме.
Рецепторы ТТГ – это белковые молекулы, на которые организм может реагировать, как на чужеродный белок – вырабатывая аутоантитела. По способу воздействия антитела к рецепторам ТТГ подразделяют на:
- стимулирующие – повышающие чувствительность рецепторов ТТГ и стимулирующие выработку гормонов ЩЖ. В результате отмечаются признаки гипертиреоза или диффузного зоба;
- блокирующие антитела к ТТГ подавляют синтез Т3 и Т4, разрушают клеточную структуру железы, приводят к развитию гипотиреоза или атрофии ЩЖ.
Анализ не дифференцирует антитела к рецепторам ТТГ, а показывает общее их количество, но так как повышенные антитела обоих типов неблагоприятно воздействуют на структуру и функцию железы, то детализация не обязательна.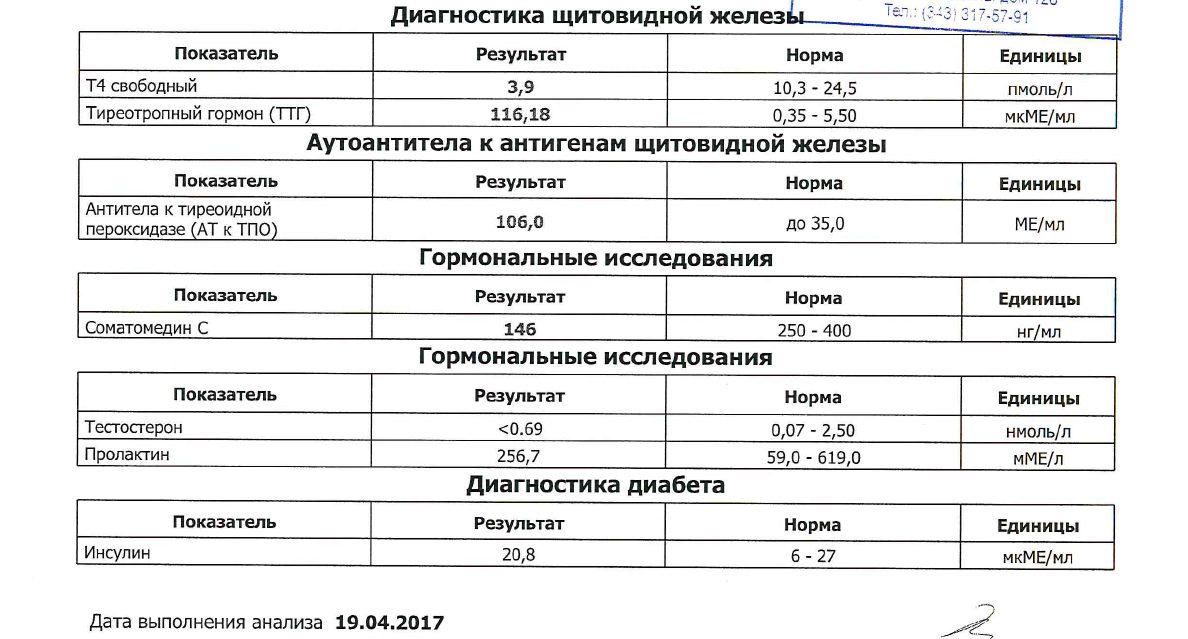
Показанием к направлению на проведение анализа служит:
- Тиреотоксикоз. Пациента направляют на исследование для уточнения природы патологии. При обнаружении антител к рецепторам ТТГ причиной заболевания, с большой долей вероятности, является аутоиммунная патология, что требует особой тактики лечения.
- Базедова болезнь. В процессе терапии болезни Грейвса или Базедовой требуется контроль за эффективностью применяемой терапии. Если антитела ТТГ постепенно исчезают, то это служит сигналом к тому, что было разработано адекватное лечение, не требующее пересмотра и коррекции. Когда будет зафиксирована норма содержания антител лечение прекратится.
- Беременность у женщины, страдавшей тиреотоксикозом. Антитела ТТГ обладают способностью преодолевать плацентарную защиту и мигрировать в кровоток плода, вызывая нарушения функций ЩЖ.
Анализ на АТ к рецепторам ТТГ является единственным методом обнаружения патологии ЩЖ у беременных, так как другие инструментальные методы представляют опасность для плода.
В результате исследований венозной крови с помощью иммуноферментных или иммунохимических методов пациент получает бланк с полученным значением и референсным показателем. Результат оформляют в виде следующего заключения:
| Интервал полученных значений (МЕ/л) | Результат анализа |
| ˃ 1,5 | отрицательный |
| 1,5-1,75 | промежуточный |
| ˂ 1,75 | положительный |
Норма содержания антител составляет 0-0,99 МЕ/мл. Референсные значения указываются, так как в каждой лаборатории они могут быть свои, что обусловлено реактивами от разных производителей. Если показатели повышены, то требуется провести дополнительные исследования и назначить лечение. Отрицательный и промежуточный результат также должен быть подтвержден другими исследованиями.
Подготовка к исследованиюПри проведении исследований крови необходимо придерживаться общих правил подготовки к забору материала:
- перед анализом не есть в течение 8-12 ч, пить только воду без газа;
- за 3-4 ч прекратить курить;
- накануне (за 1-2 сут.

- исключить прием стероидных гормонов, оральных контрацептивов, антибиотиков и других препаратов, которые могут исказить результаты тестирования.
Цена за исследование зависит от выбранной клиники.
Клиника Ито
Обследование
Для диагностики Базедовой болезни проводят изучение симптоматики, анализ крови, а в некоторых случаях – радиоизотопное обследование. Кроме того, проводится ультразвуковое исследование для исключения сопутствующих заболеваний. Высокий уровень тиреоидных гормонов повышает нагрузку на сердце, поэтому может проводиться рентген грудной клетки и ЭКГ.
- (1) Анализ крови
- Наблюдается повышение уровня тиреоидных гормонов (FT3、FT4, низкий уровень тиреотропного гормона (ТТГ), высокий уровень антител к рецепторам ТТГ.
- (2) Радиозотопное обследование
- Если в анализе крови показатель TRAb в норме или незначительно повышен, необходимо установить диагноз с помощью этого обследования.
 Поскольку радиоактивный йод и технеций обладает свойством захватываться щитовидной железой, уровень их накопления повышается при чрезмерной выработке гормонов, которая происходит при Базедовой болезни.
Поскольку радиоактивный йод и технеций обладает свойством захватываться щитовидной железой, уровень их накопления повышается при чрезмерной выработке гормонов, которая происходит при Базедовой болезни.
- (3) Ультразвуковое исследование
- Проверяется размер щитовидной железы и наличие уплотнений.
- (4) ЭКГ, рентген грудной клетки
- Проверяется наличие аритмий и сердечной недостаточности, которые могут возникать в состоянии гипертиреоза.
Пояснительные комментарии к радиоизотопному обследованию
- При обследованиях с применением радиоактивного йода необходимо воздерживаться от употребления богатой йодом пищи в течение 7 дней до назначенной даты обследования.
- Поскольку используются радиоактивные вещества, данное обследование не назначается при беременности. Для кормящих матерей в обследовании используются ядра изотопов с коротким периодом полураспада * (123I), но необходимо прекратить кормление грудью на 3 дня, включая день обследования.

Более подробные объяснения предоставляются при обследовании.
※Период полураспада: время, к которому количество радиоактивных веществ в организме сократится в 2 раза
Заболевания щитовидной железы / Заболевания / Клиника ЭКСПЕРТ
Общие представления о щитовидной железе и ее функции
Щитовидная железа (ЩЖ) – это эндокринный орган, располагающийся на передней поверхности шеи. Железа отделена от кожи только тонкими фасциями («пластинами» из соединительной ткани), поэтому находится практически под кожей. За счет своего расположения она хорошо доступна пальпации (ощупыванию в ходе осмотра), а при значительном увеличении хорошо заметна «на глаз», деформируя контур шеи. ЩЖ в норме состоит из двух долей, соединенных перешейком. Такое строение напоминает бабочку.
Основная задача щитовидной железы – продукция специфических веществ — тиреоидных гормонов. Происходит этот процесс при обязательном участии йода. ЩЖ единственная железа, захватывающая йод из кровотока и только при адекватном его поступлении способна синтезировать гормоны.
ЩЖ единственная железа, захватывающая йод из кровотока и только при адекватном его поступлении способна синтезировать гормоны.
Гормоны ЩЖ оказывают влияние на весь организм. Если описать одной фразой действие «щитовидных» гормонов – они регулируют обмен веществ. При нормальном содержании тиреоидных гормонов в крови все процессы в организме протекают в физиологическом ритме. Механизм выработки гормонов у взрослых не зависит от пола и возраста.
Причины
Определенно, существует наследственная предрасположенность к болезням щитовидной железы. Давно замечено, что такими заболеваниями чаще страдают в одной семье. Обычно пациенты уже на первом приеме сообщают, что ближайшие кровные родственники имели проблемы со «щитовидкой». Женщины более подвержены заболеваниям ЩЖ, (в 10 раз чаще мужчин).
Отмечается связь между началом заболевания щитовидной железы и:
- перенесенным стрессом
- инфекцией
- интенсивным пребыванием на солнце
- неблагоприятными экологическими условиями
На фоне генетической предрасположенности, провоцирующие внешние факторы запускают патологический механизм, результатом которого становится заболевание щитовидной железы.
Заболевания щитовидной железы
Все заболевания щитовидной железы протекают или с нарушением выработки гормонов ЩЖ, или без таковых.
В свою очередь, нарушение работы ЩЖ происходит в сторону
- уменьшения — гипофункция, гипотиреоз
- увеличения — гиперфункция, гипертиреоз.
Гипотиреоз
Причинами первичного гипотиреоза могут быть:
- аутоиммунный тиреоидит
- удаление ЩЖ при операции (послеоперационный гипотиреоз)
- разрушение ЩЖ под влиянием радиоактивных веществ (пострадиационный гипотиреоз)
Аутоиммунный тиреоидит (АИТ)
Заболевание, относящееся к разряду аутоиммунных, когда собственная иммунная система вырабатывает антитела, влияющие на работу ЩЖ.
Типичными для АИТа являются антитела к тиреопероксидазе (ат к ТПО) — более специфичные по заболеванию и антитела к тиреоглобулину (ат к ТГ). При иммунной агрессии этими антителами развивается постепенное снижение работы ЩЖ, т.е. возникает гипотиреоз — одно из закономерных проявлений АИТа.
Происходящий в щитовидной железе патологический процесс способен изменить не только функцию, но и ее структуру. При УЗИ щитовидной железы определяются специфические для АИТа изменения. Поскольку АИТ приводит к гипотиреозу, то лечение заболевания сводится к назначению гормона ЩЖ (тироксина) для восполнения дефицита гормонов в организме.
Лечение назначается только при снижении работы ЩЖ. Если у пациента только определяется в крови повышенный уровень антител, но функция ЩЖ нормальна, лечения не назначают. Функцию ЩЖ оставляют на ежегодный контроль и более частый контроль у женщин во время беременности. Считается также, что наличие аутоиммунного заболевания одного органа способно сочетаться с другими аутоиммунными заболеваниями (других органов). Поэтому обнаружение АИТа нередко влечет за собой обследование других эндокринных желез.
Для установления диагноза «Аутоиммунный тиреоидит» необходимо выявление не менее двух из трех показателей (сниженная работа ЩЖ (гипотиреоз), наличие антител к ЩЖ, специфическая картина структуры ЩЖ при УЗИ).
Если присутствует только один параметр, то диагноз выставляется «под вопросом» и берется на контроль.
Послеоперационный и пострадиационный гипотиреоз(АИТ)
В результате частичного или полного удаления/разрушения щитовидной железы (операция или лечение радиоактивным йодом) организм оказывается в условиях дефицита тиреоидных гормонов. Заболевание выявляется сразу после лечения (при полном удалении ЩЖ) или спустя непродолжительное время (при неполном удалении органа или после радиойодтерапии). Единственное лечение – восполнение гормонов ЩЖ приемом тироксина.
Причины вторичного гипотиреоза
Редкой причиной снижения работы щитовидной железы является патология регулирующих ее функцию органов (гипофиза и гипоталамуса). Это значит, что поражена не сама щитовидная железа, а «начальники» над ней. Причиной патологии гипофиза и гипоталамуса могут явиться опухоли, травмы, кисты этой области. Очень редко гипофиз может производить «недействующий» гормон ТТГ, который не способен стимулировать ЩЖ к выработке гормонов.
Гипертиреоз
Заболевания, протекающие с повышением работы щитовидной железы
Диффузный токсический зоб (ДТЗ, болезнь Грейвса, Базедова болезнь)
Это аутоиммунное заболевание ЩЖ, когда иммунной системой вырабатываются специфические антитела, стимулирующие работу ЩЖ (тиреостимулирующие антитела, антитела к рецептору ТТГ). Продукция гормонов в ЩЖ становится патологически повышенной, клинически проявляется тиреотоксикозом (реакцией различных тканей организма на большое количество тиреоидных гормонов ЩЖ), а лабораторно — повышенной концентрацией Т3 и Т4 в крови и сниженным показателем ТТГ. Нередко ДТЗ сочетается с аутоиммунной эндокринной офтальмопатией (специфическим поражением глаз). Эти два заболевания имеют общие аутоиммунные корни, поэтому нередким бывает их сочетание. Существует три варианта лечения этого заболевания:
- консервативная терапия (таблетками) в течение 1-1,5 лет
- операция по удалению щитовидной железы
- лечение радиоактивным йодом (радиойодтерапия).

Успех от таблетированной терапии наименее стоек (заболевание может давать в 30—70% случаев рецидив).
Чаще болезнь Грейвса встречается у молодых пациентов, чаще у женщин.
Узловой (и многоузловой) токсический зоб (УТЗ, МУТЗ)
Заболевание такое же, как узловой нетоксический зоб: по неустановленной причине в структуре щитовидной железы образуются узловые образования, но они (узлы) патологически активны и способны вырабатывать высокое количество тиреоидных гормонов с развитием клинической картины тиреотоксикоза. Часто заболевание сопровождается нарушением сердечного ритма. Помимо рутинного определения уровня тиреоидных гормонов (они будут как при болезни Грейвса), заболевание подтверждается еще сцинтиграфией ЩЖ для определения автономности узла. Лечение — операция или радиойодтерапия после медикаментозной подготовки пациента.
Заболевания, протекающие без нарушения функции щитовидной железы:
Узловой (и многоузловой) нетоксический зоб (УНЗ, МНЗ)
Заболевание неуточненной этиологии (причины), когда в ткани ЩЖ формируются узловые образования. В большинстве случаев узлы имеют небольшой размер (от 1 см до 2,5-3 см), являются доброкачественными по клеточному составу, не нарушают функцию ЩЖ и не требуют никакого лечения. Осуществляется наблюдение, выполняется ежегодное динамическое обследование.
В большинстве случаев узлы имеют небольшой размер (от 1 см до 2,5-3 см), являются доброкачественными по клеточному составу, не нарушают функцию ЩЖ и не требуют никакого лечения. Осуществляется наблюдение, выполняется ежегодное динамическое обследование.
Диффузный нетоксический зоб (ДНЗ)
Этим термином описывают диффузное увеличение щитовидной железы в размерах при неизмененной функции органа, отсутствии лабораторных и ультразвуковых данных за аутоиммунный процесс. Чаще всего увеличение ЩЖ связано с дефицитом йода. При устранении данного факта размеры ЩЖ возвращаются к норме.
Злокачественные заболевания
Это отдельная группа онкологических заболеваний ЩЖ. Различают папиллярный рак, фолликулярный рак, медуллярный рак, анапластический рак ЩЖ. Они отличаются по клеточному составу, каждый имеет особенности диагностики, лечения и наблюдения. Наиболее частые варианты рака ЩЖ (папиллярный и фолликулярный) успешно подвергаются лечению, соответственно у пациентов есть хороший шанс на излечение и прогноз для жизни. Более агрессивный рак – медуллярный и анапластический — имеет свои диагностические и лечебные особенности, дает худший прогноз на лечение и выживаемость. Пациенты с онкологическим заболеванием ЩЖ наблюдаются онкологом и эндокринологом, которые составляют индивидуальный план лечения и наблюдения.
Симптомы заболеваний щитовидной железы
Наиболее типичные проявления заболеваний щитовидной железы:
- общая и мышечная слабость
- неконтролируемое снижение веса при повышенном аппетите или, наоборот, мало поддающийся контролю набор массы тела
- нарушение памяти, внимания, апатия, депрессия
- нервозность, гневливость, повышенная эмоциональность, плаксивость, снижение работоспособности
- малая продуктивность работы, отсутствие «сил на работу»
- распространенные отеки (лицо, руки, ноги, передняя брюшная стенка, язык)
- нарушение стула (запоры или поносы)
- нарушение сердечного ритма (особенно у пожилых пациентов)
- анемия, трудно поддающаяся лечению
- постоянное чувство внутренней дрожи, беспокойства, дрожание рук (вплоть до изменения почерка и невозможности выполнять мелкие движения)
- изменения со стороны глаз (пучеглазие, изменение взгляда, отечность век, слезотечение, особенно от яркого света)
- наконец, больной может пожаловаться на увеличение передней поверхности шеи в размерах, деформацию контура шеи.
Симптомы заболеваний щитовидной железы не всегда специфичны. Совершенно не обязательно, что все эти симптомы наблюдаются одновременно. Если у Вас есть хотя бы один из перечисленных симптомов, необходимо проверить функцию ЩЖ. На эти жалобы обязательно обратит внимание и врач эндокринолог при беседе и осмотре пациента.
Диагностика
Поскольку влияние гормонов ЩЖ на организм очень значимо и разнообразно, ее заболевания, несомненно, будут отражаться на функции всех органов, поэтому важна своевременная диагностика.
Обследование простое и весьма доступное.
Первый шаг – это прием врача эндокринолога, который включает беседу и осмотр. Как правило, при расспросе пациента можно выявить некоторые беспокоящие симптомы, которые заставляют думать о нарушении работы ЩЖ. Эти симптомы в большинстве своем неспецифичны и могут наблюдаться у многих больных, а иногда и здоровых в условиях стресса, усталости.
Вторым шагом, при обоснованном подозрении на нарушение функции или структуры ЩЖ является направление пациента на анализ крови для определения содержания тиреоидных гормонов.
- в крови определяют уровень Т4, Т3 (гормоны ЩЖ) и ТТГ (гормон гипофиза)
- нередко исследование дополняется определением в крови уровня различных антител к ЩЖ
При снижении работы самой ЩЖ — гормоны Т4 (в большей степени) и Т3 оказываются сниженными, а «гормон-начальник» (ТТГ) — повышен. Наоборот, при увеличенной продукции гормонов щитовидной железой, уровень Т4 и Т3 повышен, но ТТГ снижен.
Третьим шагом в диагностике необходимо визуализировать ЩЖ.
Самый простой, доступный и информативный метод — ультразвуковое исследование (УЗИ) ЩЖ, при котором определяется размер и структура ткани органа.
При этом, одно исследование не заменяет другое исследование. Осмотр, лабораторные и инструментальные обследования – три ключевых момента в диагностике заболеваний ЩЖ.
Врачи Клиники ЭКСПЕРТ составили перечень всех необходимых исследований, необходимых для базового обследования щитовидной железы.
Существуют и более специализированные, нужные только в некоторых случаях, исследования:
Сцинтиграфия ЩЖ — использующийся метод при подозрении на активно функционирующие узловые образования в ЩЖ. Также может использоваться для дифференциальной диагностики в условиях тиреотоксикоза для подтверждения/исключения деструктивного тиреоидита.
Другие инструментальные методы обследования (МРТ, СКТ, ПЭТ) в рутинной клинической практике используются гораздо реже. Для дополнительного проведения этих методов обследования нужны веские основания.
Особенную важность представляет оценка функционального состояния щитовидной железы у беременной женщины в связи с тем, что развитие ребенка – в особенности, его нервной системы – зависит от уровня тироксина (основной формы тиреоидных гормонов) у будущей матери.
Лечение заболеваний щитовидной железы
Лечение зависит от конкретной патологии и нарушения функции ЩЖ.
Лечение всех форм гипотиреоза одинаково – назначение препарата тироксина. Лечение хорошо переносится и полностью восполняет дефицит гормонов в организме.
Лечение гипертиреоза – более сложное. Требуется целый ряд препаратов: одни снижают избыточную работу ЩЖ, другие нормализуют работу сердца, кишечника. Зачастую требуется участие в лечении не только врача эндокринолога, но и других специалистов (кардиолога, гастроэнтеролога).
При отсутствии нарушений функций ЩЖ чаще всего ограничиваются наблюдением за патологией.
Прогноз
Любые заболевания ЩЖ поддаются лечению. Чаще всего удается добиться хорошего ответа на медикаментозную (таблетированную) терапию с достойным шансом на полное излечение. Лечение некоторых заболеваний ЩЖ позволяет перевести их в длительную ремиссию (заболевание не проявляется активно, не прогрессирует и не нарушает качества жизни пациента, а соответственно, не требует постоянного лечения). Болезни ЩЖ, протекающие со стойким гипотиреозом, также можно успешно компенсировать медикаментозно, когда приходится постоянно (всю жизнь) принимать таблетированные препараты для восполнения утраченной функции ЩЖ. В данном случае лечение абсолютно безопасно, т. к. при назначении с целью лечения препаратов тиреоидных гормонов побочных эффектов от лечения не возникает.
Если заболевание не удается компенсировать (или излечить) таблетированными средствами (это, в основном, касается патологий, протекающих с тиреотоксикозом; при больших размерах ЩЖ и узлов в ней; онкологических заболеваний ЩЖ), то операция на ЩЖ позволяет в подавляющем большинстве случаев решить проблему болезни.
Грамотное и своевременное лечение заболеваний щитовидной железы позволит не допустить осложнений болезни со стороны других систем в организме: сердечно-сосудистой, пищеварительной, костной и т.д.
Отсутствие лечения в течение длительного времени со временем вызовет изменения в жизненно важных органах. Они могут оказаться необратимыми — даже при начале терапии!
Профилактика и рекомендации
Как таковой профилактики заболеваний ЩЖ не существует. Поэтому высокую степень важности приобретает периодическое профилактическое обследование (осмотр врача эндокринолога, УЗИ щитовидной железы, анализы крови), особенно для групп риска (к ним относят при наличии факторов наследственности, неблагоприятной экологии места проживания, профессиональной вредности, частых стрессов).
Ведение здорового образа жизни, охранительное отношение к своей нервной системе, физиологическое потребление продуктов, содержащих йод и т. д. выступят лучшей профилактикой патологии этого эндокринного органа.
Часто задаваемые вопросы
У близких родственников выявлено заболевание щитовидной железы, есть ли риск заболеть?
Заболевания ЩЖ не являются «заразными», но существует генетическая предрасположенность к патологии ЩЖ. Зачастую (но совсем не в 100%), в одной семье у нескольких человек наблюдается заболевание ЩЖ. Не обязательно патология ЩЖ должна быть одинаковой у всех, это могут быть совершенно различные варианты заболеваний ЩЖ.
Единственное тяжелое заболевание ЩЖ — медуллярный рак — обязательно уточняется у всех ближайших кровных родственников больного этой патологией, т.к. встречаются генетические варианты болезни, поражающие родных со 100% вероятностью.
Ничего не беспокоит, но при лабораторном обследовании в крови выявлены очень высокие показатели антител к ЩЖ, что дальше?
Примерно у 15-20% здоровых людей в крови выявляются антитела (АТ) к различным структурам ЩЖ (как правило, это антитела к ТПО и ТГ, реже к рецептору ТТГ). Если функция ЩЖ не нарушена, то клинического значения факт наличия антител иметь не будет, назовем это «индивидуальной особенностью». Разумеется, только лишь факт наличия антител не будет подвергаться лечению, какой бы их уровень не регистрировался в крови. При нарушении функции ЩЖ или при увеличении в размерах ЩЖ определение наличия антител (в большей степени АТ к ТПО) будет сообщать о причине нарушений в железе. Сочетание нарушенной функции ЩЖ и высокий титр АТ к ЩЖ позволяет установить диагноз аутоиммунного поражения ЩЖ. Еще наличие антител к ЩЖ будет диктовать необходимость более частой оценки функции щитовидной железы в условиях приема препаратов с большим (нефизиологическим) количеством йода и препаратов лития, а также при беременности, поскольку могут отмечаться особенности в функционировании ЩЖ на этом фоне. Отметим, что само по себе присутствие антител в крови на самочувствие влияния не оказывает. В большинстве случаев, пациента больше пугает «цифра» антител в лабораторном бланке, иногда превышающая в сотни раз верхнюю границу нормы. Лечить «уровень антител в крови» не нужно.
Что можно сделать, чтобы снизить риск заболевания?
Оказать влияние на генетическую предрасположенность к болезни мы не в состоянии. Она дана нам от рождения. Пусковым моментом в реализации патологической наследственной предрасположенности могут явиться стрессы, тяжелые инфекционные заболевания, прием некоторых медикаментов и т.д. Поэтому выполнение общих рекомендаций по здоровому образу жизни в какой-то степени предостережет от манифестации болезни.
Чтобы исключить нарушение функции ЩЖ, какой анализ нужно сдать?
Первым (а иногда единственным) анализом, который нужно выполнить при подозрении на нарушение функции ЩЖ – это тиреотропный гормон (ТТГ). Если этот показатель в норме, то ни одно нарушение в самочувствии пациента не может быть связано с ЩЖ. Справедливости ради нужно сказать, что есть очень редкие заболевания эндокринной системы, при которых ТТГ остается нормальным, но есть нарушение выработки гормонов. Определение показаний к расширению обследования — прерогатива врача эндокринолога, осуществляющего осмотр пациента. Иногда сами пациенты просят врача выдать направление на исследование «всех гормонов ЩЖ», объясняя такое желание «нелюбовью» к забору крови на анализ, но это не всегда оправдано. Подробная беседа, объяснение, когда может потребоваться углубленное обследование функции ЩЖ, поможет пациенту не тратить «лишнего», но и не пропустить «нужного».
Анализ крови на тиреоидные гормоны выполняется в первую половину дня, натощак. У женщин — вне зависимости от дня менструального цикла.
Впервые выявлены изменения в уровне ТТГ, нужно ли сразу лечить?
Чаще всего, выявляется очень умеренное (до 10 Мед/л) увеличение уровня ТТГ при нормальных показателях Т4. Такая ситуация сначала требует повторного контроля через 2-3 месяца. Если это повышение стойкое, т.е. не произошло самостоятельной нормализации уровня гормонов, то далее индивидуально с пациентом, при тщательной оценке сопутствующей патологии, врачом эндокринологом решается вопрос о необходимости назначения лечения. Возможно, что ситуация просто будет «взята на карандаш». Единственная категория наших пациенток, для которых повышение уровня ТТГ не требует дополнительной перепроверки – это беременные. В этом случае терапия тироксином назначается сразу, т.к. «нет времени» перепроверять через несколько месяцев.
Поставлен диагноз «аутоиммунный тиреоидит», что делать?
При установлении такого диагноза и назначении заместительной терапии препаратами тироксина, подбор дозы препарата происходит под контролем уровня ТТГ. В начале болезни, снижение функции собственной ЩЖ может быть не тотальным, т.е. для восполнения нехватки тироксина требуется небольшая доза гормона. С течением времени болезни, все новые клетки ЩЖ захватываются патологическим процессом и для восполнения утраченного требуется соответствующее повышение дозы тироксина, доходящее со временем до индивидуальной суточной потребности. Пациенты, зачастую, делают из этого факта «свои» выводы: «Прием препарата прекратил работу моей щитовидной железы, теперь я буду «зависеть от гормонов». Это обывательское представление абсолютно не верно. Не прием препарата, а сама ЩЖ постепенно снизила и наконец, прекратила свою работу. Это вполне закономерное течение аутоиммунного тиреоидита, когда с течением времени болезни повышается потребность в тироксине.
Как часто нужно контролировать функцию ЩЖ?
Существуют более распространенные и менее распространенные заболевания ЩЖ.
При аутоиммунном тиреоидите и подобранной дозе тироксина достаточно контролировать уровень ТТГ 1 раз в год. Исключение – беременность, когда контроль осуществляется 1 раз в месяц. Необходимость к коррекции терапии обсуждается с врачом после получения результатов.
При болезни Грейвса контроль тиреоидных гормонов осуществляется гораздо чаще. Сначала ежемесячно, а при хорошем ответе на лечение, в дальнейшем 1 раз в 2 месяца. Обязателен осмотр врача, т.к. возможна коррекция терапии.
При узловом зобе с подтвержденной доброкачественной структурой узла в ЩЖ контроль гормонов ЩЖ осуществляется 1 раз в год.
Другие, более редкие заболевания, требуют составления врачом эндокринологом индивидуального планадинамического обследования и наблюдения.
Какие параметры, кроме тиреоидных гормонов, нужно контролировать?
При некоторых болезнях ЩЖ периодического контроля требует УЗИ ЩЖ. В большей степени это касается узлового нетоксического зоба, когда оцениваются в динамике размеры узловых образований в ЩЖ. Также, динамическое УЗИ ЩЖ выполняется при диффузном увеличении ЩЖ, когда необходимо оценить динамику размеров ЩЖ на фоне лечения или без терапии. УЗИ ложа удаленной ЩЖ и лимфатических узлов необходимо после радикального лечения рака ЩЖ.
Необходимости динамического выполнения УЗИ ЩЖ при наблюдении пациента с аутоиммунным тиреоидитом, как правило, нет.
Другие специальные методы динамического обследования (сцинтиграфия, компьютерная томография, МРТ шеи) назначаются редко, только при наличии специальных к тому показаний.
Материал подготовлен с использованием данных из «Клинических рекомендаций Российской Ассоциации Эндокринологов по диагностике и лечению аутоиммунного тиреоидита у взрослых»; «Клинических рекомендаций Российской Ассоциации Эндокринологов по диагностике и лечению узлового зоба»
Истории лечения
Узловой зоб
Пациентка В., 45 лет. Обратилась в Клинику ЭКСПЕРТ с данными УЗИ щитовидной железы. Жалоб на самочувствие не было. Пошла обследоваться «за компанию» с подругой. В семье пациентки родственников, страдающих патологией щитовидной железы, нет. При первом УЗИ были выявлены множественные очень мелкие изменения в ткани железы 3-6 мм в диаметре, описанные УЗ-специалистом как «множественные узлы». Пациентка выполнила исследование крови на гормоны щитовидной железы, отклонений в данных лабораторного обследования не обнаружилось. Пациентке было предложено динамическое наблюдение (контроль УЗИ) каждые полгода, что пациентка и делала. На прием пришла с пятью УЗ-заключениями, в которых изменений в размерах очагов в щитовидной железе не выявлено. Тем не менее, динамическое обследование рекомендовалось УЗ-специалистом.
Важно! Выявленные у данной пациентки «узлы» в щитовидной железе, не имеющие отрицательной динамики, вообще не требуют какого-либо лечения и наблюдения в динамике. Это случайные находки, которые клинического значения не имеют.
Пациентка И., 32 года. На самочувствие не жаловалась. Направлена к эндокринологу после диспансерного осмотра, в ходе которого терапевтом заподозрен узел в щитовидной железе. При обследовании узловой зоб был подтвержден – узел 12 мм в диаметре с нечеткими контурами и повышенным кровотоком внутри. Гормональная функция железы не нарушалась. Была выполнена биопсия узла, по итогам которой выявлено подозрение на рак щитовидной железы. Пациентка была прооперирована (удалена железа и частично лимфоузлы на шее). При последующем гистологическом исследовании диагноз рака подтвержден, дополнительно выявлены метастазы в лимфоузлы. Пациентке потребовалось дальнейшее лечение – радиойодтерапия. В настоящее время пациентка получает лечение и находится под динамическим контролем эндокринолога и онколога. Данных о прогрессировании и возврата болезни спустя 2 года нет.
Впоследствии (через 3 года), убедившись в том, что болезнь не вернулась, пациентка планирует беременность.
Важно! Своевременная диагностика и лечение позволяют адекватно лечить больного, предоставляя ему хорошие шансы на выздоровление.
Гипотиреоз
Пациентка М., 20 лет. В течение 3 лет постепенно неуклонно набирает вес. Отмечает отеки на лице, на кистях рук, на ногах, на животе. В течение всего этого времени беспокоят непрекращающиеся запоры. Кожа стала бледной, с желтоватым оттенком. Пациентка учится в институте на III курсе. Стала хуже учиться, т.к. ухудшились внимания и способность запоминать, стало трудно усваивать большой объем информации, хотя раньше учеба давалась легко. Пыталась больше заниматься. Все описанные жалобы – в особенности изменение веса, отеки и запоры – связывала с тем, что ведет преимущественно сидячий образ жизни. Старалась применять «различные диеты» для снижения веса. Значительного эффекта они не приносили. Для нормализации стула использовала слабительные, клизмы. Обратилась в студенческую поликлинику. При обследовании был выявлен сниженный уровень гемоглобина. Назначены препараты железа, витаминные препараты, но значительного эффекта от лечения не было.
Обратилась в Клинику ЭКСПЕРТ. При обследовании был выявлен гипотиреоз на фоне аутоиммунного тиреоидита. Пациентке назначено лечение, все симптомы болезни прошли в течение 3 месяцев.
Важно! Гипотиреоз у взрослых, чаще всего возникающий на фоне аутоиммунного поражения щитовидной железы – нередкое заболевание. Его несложно диагностировать и просто лечить. Главное вовремя поставить диагноз и правильно подобрать лечение. От этого будет зависеть качество жизни пациента.
Диффузный токсический зоб
Пациентка Н., 32 года. Обратилась в Клинику ЭКСПЕРТ с жалобами на плаксивость, неустойчивость настроения, повышенную раздражительность. Стала конфликтной в отношении домочадцев и коллег по работе. Беспокоила повышенная потливость, дрожание рук – как при нервной нагрузке, так и в состоянии покоя. Стала отмечать частый жидкий стул; снижение массы тела. Все эти изменения возникли за 3-4 месяца. Сама больная указала, что самочувствие нарушилось вскоре после психотравмирующей ситуации в семье.
С вышеописанными жалобами пациентка обратилась к терапевту поликлиники, где был установлен диагноз «расстройство вегетативной нервной системы» и «синдром раздраженной кишки».
Обратилась к гастроэнтерологу, затем к врачу неврологу Клиники ЭКСПЕРТ. При осмотре сразу была заподозрена возможная патология щитовидной железы. При обследовании был выявлен впервые и подтвержден гипертиреоз (болезнь Грейвса).
На фоне своевременного лечения самочувствие пациентки полностью нормализовалось. Гастроэнтерологическое и неврологическое лечение даже не потребовалось. В настоящее время пациентка продолжает лечение, чувствует себя хорошо. Находится под наблюдением врача эндокринолога (куратора), проводящего коррекцию лечения. Пациентка довольна кураторством, возможностью посоветоваться и получить консультацию при любых настораживающих изменениях в самочувствии, имеет полную информацию о лечении и прогнозе своего заболевания.
Важно! Своевременная диагностика заболевания ЩЖ позволяет в кратчайшие сроки назначить лечение, не дожидаясь выраженного влияния на другие системы организма.
Стимулирующие антитела к рецептору тиреотропного гормона (анти-рТТГ)
Описание
Синонимы (rus): Аутоантитела к рецепторам тиреотропного гормона, тиреоидстимулирующий иммуноглобулин
Синонимы (eng): Thyroid-stimulating immunoglobulins, TSIs, Thyroid-stimulating hormone receptor antibodies, TSH receptor antibodies, TSHRAbs, TSH binding inhibitor immunoglobulin, TBII, TRAb
Биоматериал: Венозная кровь
Показатель(и): Антитела к рецептору тиреотропного гормона
Метод(и): Иммуноферментный анализ (ИФА)
Тип контейнера и особенности преаналитики: Биохимическая пробирка с активатором свертывания,6 мл (красная или коричневая крышечка)
Рецептор тиреотропного гормона – это гликопротеин из двух субъединиц (альфа и бета), экспрессируемый на поверхности фолликулярных клеток щитовидной железы, ответственный за регуляцию ее функции. Взаимодействие ТТГ с рецептором приводит к продукции тиреоидных гормонов и росту тиреоидных фолликулярных клеток. В случае повышенной активации рецептора происходит избыточный синтез гормона и рост клеток, что приводит к тиреотоксикозу и формированию зоба. Главной причиной гиперактивации рецептора является образование стимулирующих антител, связывающихся с рецепторной экстрацеллюлярной субъединицей альфа. В целом, антитела к рецептору ТТГ можно разделить на 3 категории: стимулирующие, блокирующие и нейтральные. Следует отметить, что все три типа антител могут присутствовать у одного пациента. Причиной развития болезни Грейвса является аутоиммунный процесс с образованием стимулирующих антител к рецептору ТТГ. Патогенетическая роль данных антител впервые была доказана в 1956 году, когда D.D. Adams воспроизвел клиническую картину болезни Грейвса путем инъекции плазмы от больного. Так как рецептор ТТГ располагается, помимо клеток щитовидной железы, также на фибробластах, адипоцитах и лимфоцитах, одним из симптомов заболевания является офтальмопатия, проявляющаяся протрузией глазного яблока и воспалением оболочек глаза, что связано со связыванием антител с перечисленными клетками в ретробульбарной клетчатке. Блокирующие антитела, взаимодействуя с поверхностной субъединицей бета, препятствуют взаимодействию рецептора с ТТГ. Это приводит к снижению тиреоидной функции, формированию гипотиреоза и атрофии щитовидной железы. Данные антитела выявляются у пациентов с атрофическим тиреоидитом Хашимото. Наличие блокирующих антител при болезни Грейвса может обуславливать колебания тиреоидной функции у таких больных. Нейтральные антитела направлены к эпитопам, расположенным вне точки связывания ТТГ, поэтому они не оказывают блокирующего действия. Их патогенетическая роль неизвестна. Проведение анализа на антитела к рецептору ТТГ необходимо при подозрении на болезнь Грейвса у беременных. Важно отметить, что данные антитела могут проходить через плацентарный барьер и оказывать воздействие на щитовидную железу плода. Таким образом, стимулирующие антитела вызывают развитие транзиторного гипотиреоза новорожденного, блокирующие – транзиторного гипотиреоза. Важную роль играет определение антител для оценки риска рецидива у пациентов, прошедших лечение тиреостатиками. Наличие высокой концентрации антител в крови рассматривается как маркер высокого риска рецидива. Используемые в лабораторной практике методы не позволяют различить наличие в крови стимулирующих или блокирующих антител. Применяемый для этих целей LATS-тест является сложным и трудоемким, что затрудняет его использование в рутинных исследованиях. Специфичность теста достигает 100%, так как антитела к рецептору ТТГ почти не встречаются у здоровых людей. Однако чувствительность теста составляет около 80%, что связано с малой концентрацией антител в сыворотке крови. Таким образом, отрицательный результат теста не позволяет исключить заболевание.
Когда назначается
Дифференциальная диагностика гипотиреоза и гипертиреоза. Диагностика болезни Грейвса (диффузный токсический зоб). Дифференциальная диагностика офтальмопатии и перитибиальной микседемы.
Подготовка к анализу
Специальной подготовки не требуется. Исследование проводится натощак (не принимать пищу 3 часа до исследования, можно пить воду).
Интерпретация
В норме уровень антител в крови составляет ≤ 1,75 МЕ/л. Получение отрицательного результата может свидетельствовать об отсутствии заболевания, о низком риске рецидива и о контроле болезни на фоне проводимой терапии. В то же время, следует помнить, что отрицательный результат в данном случае не позволяет исключить заболевание. Положительный результат (> 1,75 МЕ/л) практически всегда свидетельствует о развитии болезни Грейвса, поскольку данные антитела редко встречаются у здоровых лиц. У новорожденных такой результат может говорить о транзиторном тиреотоксикозе/гипотиреозе, а у лиц, проходивших лечение болезни Грейвса – о высоком риске рецидива при совокупной оценке с другими показателями. В ряде случаев отмечается наличие антител к рецептору тиреотропного гормона у пациентов с тиреоидитом Хашимото.
Список литературы
- Лапин С.В. Тотолян А.А. Иммунологическая лабораторная диагностика аутоиммунных заболеваний. Издательство «Человек», СПб- 2010
- Tietz Clinical guide to laboratory tests. 4-th ed. Ed. Wu A.N.B.- USA,W.B Sounders Company, 2006,1798 p.
- Conrad K, Schlosler W., Hiepe F., Fitzler M.J. Autoantibodies in Organ Specific Autoimmune Diseases: A Diagnostic Reference/ PABST, Dresden – 2011.
- Conrad K, Schlosler W., Hiepe F., Fitzler M.J. Autoantibodies in Systemic Autoimmune Diseases: A Diagnostic Reference/ PABST, Dresden – 2007.
- Gershvin ME, Meroni PL, Shoenfeld Y. Autoantibodies 2nd ed./ Elsevier Science – 2006.
- Shoenfeld Y., Cervera R, Gershvin ME Diagnostic Criteria in Autoimmune Diseases / Humana Press – 2008.
- Tozzoli, R., Bagnasco, M., & Villalta, D. Thyrotropin Receptor Antibodies / Autoantibodies, 375–383 — 2014
- Weetman, A. P. (2014). Thyroid Disease. / The Autoimmune Diseases, 557–574 — 2014.
- Инструкция производителя тест-системы
Анализ на ТТГ (тиреотропный гормон): норма, расшифровка, как сдавать
Щитовидная железа является важнейшим органом внутренней секреции, контролирующим практически все процессы. Она вырабатывает несколько жизненно важных гормонов, обеспечивающих нормальное функционирование всего организма. Согласно официальной статистике Всемирной Организации Здравоохранения, от заболеваний щитовидной железы страдает около 3% населения. Это связано с различными причинами: сопутствующие патологии, генетическая предрасположенность, проживание в йододефицитной местности и прочее. Поэтому красней важно периодически проверять тиреотропный гормон, так как это поможет своевременно выявить отклонения в гормональном балансе и начать эффективное лекарственное лечение.
Зачем необходим анализ ТТГ
Уровень ТТГ — это важный диагностический показатель, позволяющий судить о функционировании щитовидной железы. Этот гормон выделяется гипофизом, воздействует на выработку Т3 и Т4 (играют важную роль в росте, интеллектуальном и физическом развитии, энергетическом запасе, жировом и белковом обменах). ТТГ отвечает за регулировку процессов доставки йода в щитовидку и усиление липолиза. Т3 и Т4 оказывают существенное влияние на работу внутренних систем организма. Кроме метаболических процессов они контролируют сердечно-сосудистую деятельность, пищеварение, репродуктивную функцию и даже на психическое здоровье. ТТГ, Т3 и Т4 крепко связаны между собой, поэтому в медицинской практике они исследуются одновременно. Концентрация последних гормонов обратно пропорционально содержанию ТТГ: как только в организме появляется достаточное количество Т3 и Т4 — прекращается выделение ТТГ и наоборот.
Анализ на гормон ТТГ, чаще, назначается при:
- Гипотиреоз и зоб.
- Бесплодие и прочие нарушения половой системы.
- Прохождение гормонозаместительной терапии.
- Нарушение сердечно-сосудистой деятельности.
- Миопатия.
- Расстройство менструального цикла.
- Психологические расстройства.
- Задержка полового и интеллектуального развития в детском возрасте.
Нарушение синтеза ТТГ может возникать в результате нескольких причин, среди которых:
- Черепно-мозговые травмы, большая потеря крови, поражение гипоталамо-гипофизарной системы (новообразования, кровоизлияния).
- Опухоли гипофиза (как доброкачественные, так и злокачественные), способствующие увеличению синтеза гормонов. В результате этого возникает активная и бесконтрольная гормональная выработка, приводящая к появлению гипотериоза, сахарного диабета, бесплодия и т.п.
- Поражение других эндокринных желез, в том числе новообразования или надпочечниковая несостоятельность.
- Недостаточность гипоталамо-гипофизарной системы. Может возникнут на фоне инфекции (менингит), отравления токсическими веществами, аутоиммунных патологий или хирургических вмешательств на головном мозге.
- Геморрагический инсульт (в этом случае эндокринные нарушения уходят на второй план, так как преобладает мозговая симптоматика).
- Концентрация ТТГ у женщин может измениться вследствие возникновения осложнений при родах или абортах, в период беременности (более подробно описано ниже). Поэтому ТТГ при беременности всегда проводится в 1-ом триместре.
Подготовка к процедуре
Крайне важно знать как сдавать анализ ТТГ, так как выполнение подготовительных мероприятий позволит получить максимально достоверные данные. Подготовка включает в себя:
- За 3 дня до забора крови нужно отказаться от алкогольных напитков, курения, занятия спортом, воздержаться от стрессов и температурных перепадов.
- Прекратить медикаментозную терапию (при возможности и одобрении врача).
- Перед процедурой не завтракать, максимум — стакан воды без газа. Отказаться от употребления любой пищи рекомендуется за 12 часов до исследования.
Как проводится исследование
Сдача анализа на ТТГ является повсеместной процедурой, не требующий специального медицинского инструментария или оснащения. Она проводится во всех клинических лабораториях (как платных, так и государственных). Сдавать кровь рекомендуется в утреннее время (с 8 до 11 часов). Установка концентрации ТТГ осуществляется при помощи хемилюминесцентного иммуноанализа на микрочастицах, отличающегося высоким уровнем точности. Для этого используется сыворотка крови, полученная из вены пациента. Сама процедура не вызывает сильной болезненности, но может сопровождаться незначительным дискомфортом. Как правило, получить результат можно в течение 1-2 рабочих дней. Важно понимать, что пациент получает на руки исключительно диагностические данные, без расшифровки и постановке диагноза. Этим занимается исключительно лечащий врач. Если анализ ТТГ норма, то ВОЗ рекомендует проводить следующее обследования не раньше, чем через год. При наличии проблем с щитовидной железой, кратность процедуры должна быть увеличена до 2 раз в год. Сдать анализ ТТГ можно в клинике medart.
Что может повлиять на результаты анализа ТТГ
Норма гормона ТТГ может варьироваться вследствие воздействия на организм различными внешними или внутренними факторами. Особенно это касается времени суток. Максимальная концентрация наблюдается ночью (с 2 до 4 часов ночи и с 6 до 8 часов утра), а минимальная — с 5 до 7 часов вечера. При отсутствии полноценного сна в ночное время происходит нарушение гормонального синтеза. Помимо этого, снижение ТТГ может стать симптомом беременности и грудного вскармливания, что расценивается как вариант нормы. Некоторые лекарственные средства также могут способствовать изменению концентрации ТТГ. Щитовидная железа тесно связана с другими внутренними органами, поэтому расстройство их функционирования существенно влияет на гормональную выработку. У женщин средневозрастной категории и мужчин в престарелом возрасте максимальное значение тиреотропного гормона обнаруживается в декабре. При климаксе допускается рост ТТГ при отсутствии признаков увеличения щитовидки в размере.
Тиреотропный гормон: норма
Нормальный ТТГ напрямую зависит от возраста человека. Для каждого возрастного периода это значение имеет различные показатели, что заметно прослеживается в первые месяцы после рождения. Референсными значениями являются:
| Возраст | Уровень ТТГ, мЕд/литр |
| 4 дня — пол года | 0,73–4,77 |
| пол года – 14 лет | 0,7–4,17 |
| 14–19 лет | 0,47–3,41 |
| Старше 19 лет | 0,4–4,0 |
Как видно из таблицы, изменение нормальных показателей ТТГ меняется на протяжении всей жизни. Поэтому исключительно медицинский работник должен делать заключение по полученным результатам анализа, сопоставляя их с нормой. При расшифровке эндокринолог также может учитывать особенности каждого организма, гендерную принадлежность (согласно статистике, у женщин проблемы с щитовидкой развиваются в 2 раза чаще, чем у мужчин), имеющиеся заболевания в анамнезе, прием лекарств и многое другое.
Расшифровка
Увеличение концентрации ТТГ в крови может свидетельствовать о:
- Первичный гипотериоз, даже при отсутствии клинических симптомов. Но, как показывает медицинская практика, при детальном расспроси человека, нередко выявляется невозможность длительно заниматься физической нагрузкой, быстрая утомляемость, упадок сил, нестабильное психо-эмоциональное состояние, склонность к депрессиям, ухудшение памяти, сухость кожных покровов, ломкость волос.
- Подострый тиреоидит — это воспаление щитовидки. При таком заболевании ткань органа повреждается из-за инфицирования верхних дыхательных путей. У больного наблюдается боль в области щитовидной железы и увеличение её размеров, миалгии и невозможность длительно заниматься физическими нагрузками.
- Наличие опухоли, способствующей бесконтрольной выработке гормона. Часто возникает при онкологическом процессе, локализующемся в щитовидной железе, легких и молочной железе, а также при аденоме гипофиза.
- Резистентность к щитовидным гормонам.
- Терапия некоторыми группами медикаментов, которые в качестве побочного эффекта могут усилить выработку ТТГ.
Снижение нормальных значений ТТГ может возникать вследствие:
- Поражение щитовидки.
- Синдром Иценко-Кушинга (развивается при поражении надпочечников, в результате чего увеличивается синтез кортизола и падает значение ТТГ).
- Сильные черепно-мозговые травмы.
- Геморрагический инсульт в области гипофиза или гипоталамуса.
ТТГ при беременности
Хорионический гонадотропин обладает похожим молекулярным строением с тиреотропным гормоном, что определяет активацию работы щитовидной железы. В 1-ом триместре концентрация тиреоидных гормонов увеличивается, а ТТГ — снижается. В дальнейшем тиреотропин возвращается в норму. Поэтому ТТГ норма сильно зависит от триместра и должна определяться исключительно лечащим врачом.
| Срок | Уровень ТТГ, мЕд/литр |
| Первый триместр | 0,15 — 2,45 |
| Второй триместр | 0,18 — 3,2 |
| Третий триместр | 0,29 — 3,5 |
Небольшое отступление от нормальных показателей (не больше 5 мЕд/литр) может развиться следствие перенесенного психо-эмоционального перенапряжения у беременной женщины. Постоянно повышенная концентрация ТТГ при беременности может быть признаком следующих состояний:
- Воспаление в щитовидной железе.
- Тяжелый гестоз.
- Новообразования в органах эндокринной системы.
- Гипофизарная аденома.
- Гипотериоз.
- Надпочечников недостаточность.
- Тяжелые заболевания внутренних органов и прочее.
Если низкий уровень ТТГ во время беременности выявляется в 1-ом триместре, то женщине можно не переживать. Такое изменение может быть вызвано появлением признаков токсикоза, часто проявляющегося в качестве тошноты и рвоты. Нормальные гормональные показатели появляются только во втором триместре, когда происходит спад токсикозом симптоматики.
Опасностью является снижение тиреотропного гормона на фоне поражения эндокринной системы. Поэтому крайне важно регулярно контролировать гормональный фон и при выявлении даже небольших отклонений обращаться за врачебной помощью. Отсутствие своевременного медицинского вмешательства может привести к выкидышу, преждевременным родам, гестозу, гипоксии плода, задержке роста и развития ребенка.
ТТГ у мужчин
Нормальные показатели ТТГ у мужчин полностью соответствуют нормам для не беременных женщин (как в детском, так и во взрослом возрасте). Причины, симптомы и последствия этих нарушений также аналогичны описанным выше. Единственным симптоматическим отличием для мужчин является импотенция, которая может возникнуть на фоне гормонального дисбаланса. Различия в подготовке к процедуре взятия сыворотки крови и самой манипуляции также отсутствуют.
Антитела Ig G к рецепторам тиреотропного гормона | Салютем
Антитела Ig G к рецепторам тиреотропного гормона (АТрТТГ)
TSH receptor autoantibodies
Антитела к рецепторам тиреотропного гормона – это ауто антитела, которые вырабатываются самим организмом к рецепторам тиреотропного гормона, которые локализованы на мембране тиреоцитов. Эти рецепторы специфически связывают тиреотропный гормон гипофиза и обеспечивают реализацию его биологического действия.
По воздействиям, которые оказывают антитела на щитовидную железу, они делятся на блокирующие и стимулирующие. Стимулирующие антитела многократно усиливают функцию щитовидной железы, что приводит к диффузному зобу и гипертиреозу. Блокирующие антитела препятствуют действию тиреотропного гормона и приводят к атрофии щитовидной железы и гипотиреозу. В крови пациента могут быть как один вид антител, так и оба вместе.
Антитела относятся к иммуноглобулинам класса G и проникают через плацентарный барьер, что является одной из причин врожденного гипертиреоза у новорожденных, если мать страдает болезнью Грейвса.
Антитела являются клинико-диагностическим маркером болезни Грейвса и используются при дифференциальной диагностике синдрома гипертиреоза. Наличие этих антител не характерно для других причин гипертиреоза, таких как токсический узловой зоб, гранулематозный тиреоидит или введение экзогенного тироксина. Стимулирующие антитела к рецепторам тиреоглобулина обнаруживаются у 85-100% пациентов с болезнью Грейвса и могут быть диагностическим критерием. Концентрация их отражает активность болезни и связана с тяжестью офтальмопатии. Концентрация антител к рецепторам тиреотропного гормона уменьшается при назначении антитиреоидных препаратов и хирургическом лечении, при этом высокая скорость снижения титра антител свидетельствует об эффективности лечения. Динамика титра антител может служить причиной коррекции лечения. Отмену лечения проводят только после нормализации уровня антител. У 75-96% пациентов оказываются блокирующие антитела.
Ауто антитела к рецепторам ТТГ могут проявляться также у больных с зобом Хашимото и подостром тиреоидите.
Болезнь Грейвса и аутоиммунный тиреоидит могут сочетаться с другими аутоиммунными состояниями, такими как системная красная волчанка, пернициозная анемия и ревматоидный артрит. Поэтому при положительном результате анализа на антитела к рецепторам ТТГ и диагностике аутоиммунного заболевания щитовидной железы рекомендуется провести дополнительные лабораторные тесты для исключения сопутствующей патологии.
Подготовка пациента:
— Забор крови проводится натощак утром (до 12:00).
— За 12 часов до исследования нужно исключить прием алкоголя, курение, прием пищи, ограничить физическую активность.
— Сок, чай, кофе (тем более с сахаром), не допускается.
— Можно пить воду утром.
— Исключить прием лекарственных средств, если отменить прием невозможно, необходимо проинформировать об этом лабораторию.
— Забор крови желательно проводить до других медицинских манипуляций.
Ограничения: концентрация антител уменьшается на фоне приема тиреотоксических препаратов.
Материал: сыворотка или плазма крови.
Транспортная среда: вакутейнер с активатором свертывания с/без гелевой фазы и с антикоагулянтом литий-гепарином, объемом 5,5 или 8,5 мл.
Стабильность пробы:
— 24 часа при температуре +20 — 250 С
— 72 часа при температуре + 2 — 80С
— 30 дней при температуре -200С
— замораживать только 1 раз.
Метод: электрохемилюминисцентный.
Анализатор: Access2.
Тест-система: TSHrAb, Beckman Coulter (USA).
Референсные значения (норма):
Антитела Ig G к рецепторам ТТГ, мЕд/л, международные единицы на литр, (IU/l):
- <1.5 мЕд/л — отрицательный результат.
- 1.5-1.75 мЕд/л — сомнительный результат.
- >1.75 мЕд/л — положительный результат.
Основные показания для назначения анализа:
1. Дифференциальный диагноз послеродового тиреоидита и болезни Грейвса при послеродовом тиреотоксикозе.
2. Прогнозирование риска фетального или неонатального тиреотоксикоза у женщин с радиоабляцией щитовидной железы по поводу болезни Грейвса или на фоне лечения тионамиды.
3. Диагностика эутиреоидной офтальмопатии Грейвса.
4. Расчет длительности лечения и риска рецидива у пациентов, получающих терапию по поводу болезни Грейвса, особенно у детей.
5. Прогнозирование развития преходящих нарушений функции щитовидной железы у новорожденных.
6. Плотный отек голеней (перитибиальная микседема)
7. Офтальмопатия.
8. При симптомах гипо- и гипертиреоза.
9. Беременные с признаками гипотиреоза.
10. Эутиреоидная форма болезни Грейвса.
Интерпретация результатов:
Отрицательный результат:
1. Отсутствие заболеваний щитовидной железы.
2. Контроль болезни на фоне лечения.
Положительный результат:
1. 85-95% диффузный токсический зоб (болезнь Грейвса)
2. Аутоиммунный тиреоидит.
3. Подострый тиреоидит.
4. Зоб Хашимото.
Что происходит с пациентами с положительными результатами тканевых трансглутаминаз и антител к эндомизию в общей практике?
J Clin Pathol. 2004 Sep; 57 (9): 943–945.
D Sinclair
1 Отделение клинической биохимии, Госпиталь Королевы Александры, Портсмут PO6 3LY, Великобритания
H Дункан
2 Отделение гастроэнтерологии, Госпиталь Королевы Александры
1 Отделение клинической биохимии Больница Александра, Портсмут, PO6 3LY, Великобритания
2 Отделение гастроэнтерологии, госпиталь Королевы Александры
Для корреспонденции:Доктору Д. Синклеру
Отделение клинической биохимии, Госпиталь Королевы Александры, Портсмут, PO6 3LY, Великобритания; ку[email protected] Авторские права © Copyright 2004 Journal of Clinical Pathology Эта статья цитируется в других статьях в PMC.
Abstract
Предпосылки: Предыдущее исследование показало, что многим пациентам с положительными антителами кишечника (антитела против тканевой трансглутаминазы (TTG) и / или антитела против эндомизия (EMA)), указывающими на глютеновую болезнь, не предлагалось дуоденальное лечение. биопсия, несмотря на рекомендации Британского общества гастроэнтерологии.
Цели / методы: Исследовать, улучшит ли добавление комментария о целесообразности направления к гастроэнтерологу и биопсии к каждому положительному результату на антитела, связанные с кишечником, частоту направления к специалистам для исследования возможной целиакии.
Результаты: Частота направлений улучшилась с 30,1% пациентов, которые были направлены и 18% впоследствии прошли биопсию до добавления комментария, до 79,8%, которые были направлены после введения специального лабораторного комментария, прикрепленного к положительным антителам к ТТГ. и / или EMA. Всем пациентам с этими положительными антителами, которые были направлены на консультацию, была сделана биопсия.
Выводы: Чтобы обеспечить соблюдение рекомендаций Британского общества гастроэнтерологии, лаборатории должны включать более подробные сведения о рекомендуемых курсах действий для врачей общей практики при получении ими положительных кишечных антител к TTG / EMA.
Ключевые слова: общая практика, антитела, биопсия, целиакия
Целиакия (БК) — пожизненное воспалительное заболевание желудочно-кишечного тракта, и биопсия тонкого кишечника является обязательной для подтверждения диагноза. Согласно рекомендациям Британского общества гастроэнтерологии (BSG), 1 пациентов с CD должны быть обследованы гастроэнтерологом. Этот тип направления важен не только с точки зрения просвещения пациентов, но и из-за потенциальных долгосрочных осложнений БК, в том числе остеопороза и лимфомы.
«Целиакия — это пожизненное воспалительное заболевание желудочно-кишечного тракта, и биопсия тонкого кишечника обязательна для подтверждения диагноза»
Недавние данные свидетельствуют о том, что распространенность CD в Великобритании составляет 1/300, 2 и что примерно 150 пациентов одновременно проходят лечение в средней районной больнице общего профиля. 1 Тем не менее, вероятно, состояние недооценивается, и пациенты, обращающиеся к врачам общей практики с летаргией, анемией или симптомами синдрома раздраженного кишечника, должны быть обследованы для исключения БК.БК проявляется в любом возрасте с очень разными симптомами. Пациенты могут иметь клинические или гематологические особенности или могут быть идентифицированы серологическим скринингом бессимптомных родственников.
Мы недавно опубликовали исследование, которое пришло к выводу, что многим пациентам с положительными антителами кишечника не предлагалась биопсия двенадцатиперстной кишки, несмотря на рекомендации руководящих принципов BSG. 3 В течение исследуемого периода мы обнаружили 67 из 1450 пациентов с положительными IgA-антителами к эндомизию, но у 55 из них не было записей последующей биопсии, то есть 82% пациентов с кишечными антителами не имели результатов биопсии двенадцатиперстной кишки и 47 пациентов ( 69.9%) не были направлены. Это было явно слишком высоким, и, чтобы попытаться улучшить это, мы добавили следующий комментарий к каждому положительному результату на антитела, связанные с кишечником: «Предлагается направление на дальнейшие гастроэнтерологические исследования, включая биопсию двенадцатиперстной кишки, в соответствии с текущими рекомендациями BSG по ведению подозреваемой целиакии». . До этого наши комментарии, сопровождающие положительные антитела к тканевой трансглутаминазе (TTG) и / или эндомизию (EMA), были просто информативными (например, «соответствуют глютеновой болезни»), а не указывали на конкретный курс действий.В этом исследовании описывается эффект, который добавление этого нового комментария оказало на направление на консультацию гастроэнтеролога и биопсию.
МАТЕРИАЛЫ И МЕТОДЫ
Всего с помощью компьютерного поиска было идентифицировано 5632 пациента, прошедших скрининг на наличие антител, связанных с кишечником, в период с 1 апреля 2001 г. по 16 мая 2003 г. Пациенты проходят скрининг на общие сывороточные антитела IgA и IgA к TTG, 4 и положительные результаты TTG дополнительно исследуются путем поиска антител IgA EMA.Любой пациент, у которого был обнаружен дефицит IgA, был исследован путем поиска антител IgG EMA.
Были исключены все пациенты в возрасте до 16 лет, находящиеся под наблюдением педиатров, а также пациенты, которые уже были направлены к консультанту-гастроэнтерологу или которым уже был поставлен диагноз БК или герпетиформный дерматит.
Анализы EMA проводили с помощью непрямой иммунофлуоресценции с использованием пищевода обезьяны и IgA против человека (или IgG, если у пациента был дефицит IgA) (сайт связывания, Бирмингем, Великобритания).Сыворотку разводили 1/10 в фосфатно-солевом буфере (pH 7,4), и срезы интерпретировали с использованием флуоресценции синим светом на микроскопе Olympus BX40.
АнализыIgA TTG проводили с использованием иммуноферментного анализа Pharmacia Celikey (Pharmacia, Uppsala, Sweden) в соответствии с инструкциями производителя.
РЕЗУЛЬТАТЫ
В период с 1 апреля 2001 г. по 16 мая 2003 г. из почти одного миллиона взрослого населения мы протестировали 5632 сыворотки на антитела к TTG / EMA (таблица 1).Сыворотки поступили из 78 терапевтических кабинетов и 400 терапевтов. Из этих 5632 сывороток 180 имели положительные антитела к TTG / EMA.
Таблица 1
Данные биопсии пациентов с положительными антителами к TTG / EMA
| Известный CD / DH? | Сделан реферальный комментарий? | Биопсия сделана? | Номер | |
| Взрослый | Неизвестно | Да | Да | 71 |
| Взрослый | Неизвестно | Да | Нет | 18 |
| Взрослый | DHИзвестный CD или | Нет | Не актуально | 29 |
| Взрослый | Неизвестно | Уже направлен в гастроэнтерологию | Не актуально | 19 |
| Взрослый | Неизвестно | Нет | Нет | 2 * |
| Ребенок | Неизвестно | Нет | Неизвестно | 41 |
Мы не включили 41 ребенка в наше исследование, потому что они были направлены к педиатрам, а не к гастроэнтерологам, и мы также не включили 48 взрослых уже диагностирован БК / герпетиформный дерматит или направлен на исследование п.Было два пациента, у которых мы обнаружили несоответствие между результатами TTG и EMA. Они были слабо положительными для TTG и отрицательными для EMA и рассматривались отдельно.
Было 89 взрослых пациентов, которые ранее не направлялись на гастроэнтерологическое заключение или с диагнозом БК / герпетиформный дерматит, о которых мы сделали комментарий с предложением направления в соответствии с рекомендациями BSG. Из них 71 был направлен, и всем была выполнена биопсия двенадцатиперстной кишки; однако у остальных 18 пациентов биопсия не проводилась.Что касается этих 18 пациентов, один из нас (DS) связался с запрашивающим клиницистом с запросом информации о том, направляли ли они пациента для получения заключения гастроэнтеролога и их текущего лечения. Таблица 2 показывает, что эти пациенты делятся на шесть категорий. Один не явился на консультацию гастроэнтеролога, но был переведен на безглютеновую диету (GFD) врачом общей практики, а один попал в эту категорию после направления к врачу.
Таблица 2
Результаты опроса 18 пациентов, у которых мы прокомментировали рекомендацию направления, но для которых нет записи о биопсии
| Причина | N | |
| 1 | Не на GFD, не направлен к гастроэнтерологу и не прошел биопсию | 9 |
| 2 | На GFD, но не передан для консультации консультанта | 2 |
| 3 | На GFD; направлен к врачу, но не прошел биопсию | 1 |
| 4 | Пациент больше не зарегистрирован; невозможно отследить; в HIS нет данных о направлениях или биопсии | 1 |
| 5 | Нет ответа на письмо; нет данных о направлении к специалисту или биопсии | 4 |
| 6 | На GFD, направлен к гастроэнтерологу, но не посещал | 1 |
| Всего | 18 |
Два пациента были начаты на GFD но мнение консультанта не запрашивалось.Один пациент больше не был зарегистрирован у терапевта и был потерян для последующего наблюдения. Четыре письма остались без ответа через два месяца после получения, и никаких повторных анализов крови, данных биопсии или эпизодов гастроэнтерологического заключения не было зарегистрировано в компьютерных системах нашей больницы для этих пациентов.
Девять пациентов не были помещены на GFD, и, согласно полученным данным, не запрашивались мнения гастроэнтеролога и не проводилась биопсия. Из этих девяти пациентов один переехал, и теперь терапевт связался с новым терапевтом пациента с просьбой о дальнейших действиях.Ни у кого нет записей о запросе или получении результатов. Один пациент не посещал врача общей практики, и через год у него нет симптомов. Один терапевт отрицает, что получил результат, и сейчас осматривает пациента. Один пациент отказался от дальнейшего исследования и от GFD. Один терапевт осматривает пациента, у которого нет симптомов, после получения нашего письма. Один набор результатов, по-видимому, побудил к обращению к аудиологу-консультанту, но мнение гастроэнтеролога не запрашивалось.Один набор результатов на антитела был отклонен терапевтом как нерелевантный. Один пациент отменил последующие визиты, потому что все симптомы исчезли.
ОБСУЖДЕНИЕ
Наше исследование показало, что добавление комментария, рекомендующего клиницистам направлять пациентов с положительными кишечными антителами к консультанту-гастроэнтерологу, значительно увеличило долю пациентов, направленных и прошедших надлежащую биопсию.
18 из 89 (20,2%) пациентов, которых мы предложили направить на биопсию, но еще не сделали биопсию, по-прежнему являются значительным числом, хотя нас воодушевляет улучшение показателей у 81%, у которых не было результатов биопсии до нашего добавления. комментария с предложением перехода. 3 Что касается только направлений, 69,9% пациентов, которых мы обнаружили ранее, не направлялись или не посещали специализированного гатроэнтеролога, 3 упало до 19,1% (17 из 89) после добавления комментария. Хотя некоторые клиницисты решили вести своих пациентов с положительными антителами к TTG / EMA, не обращаясь к мнению консультантов, мы считаем, что улучшение показателей направления к специалистам и биопсии в результате наших комментариев сделало это стоящим упражнением, и мы рекомендуем его использовать более широко.
В литературе очень мало информации по этой теме, и если наши результаты окажутся репрезентативными для других областей, тогда необходимо приложить значительные усилия в образовании, чтобы гарантировать, что пациенты с положительными антителами к TTG / EMA будут осмотрены соответствующими специалистами. медицинский персонал.
«Мы считаем, что улучшение показателей направления к специалистам и биопсии в результате наших комментариев сделало это упражнение стоящим, и мы бы рекомендовали его использовать более широко»
Вызывают беспокойство 15 пациентов, которые, по-видимому, не прошли обследован гастроэнтерологом, и только двое из них, как известно, были помещены на GFD их терапевтами.Четыре врача общей практики не ответили на письмо, а у оставшихся девяти было девять разных причин отсутствия биопсии или осмотра консультантом-гастроэнтерологом. Такой обзор рекомендован рекомендациями BSG, 1 , чтобы все последствия этого диагноза можно было обсудить с пациентом. Примечательно, что некоторые врачи общей практики отреагировали на наше аудиторское письмо, проверив своих пациентов. Будет интересно посмотреть, сколько из четырех врачей общей практики, которые не ответили, повторяют анализы крови или направляют своих пациентов после получения нашего письма; до сих пор, через два месяца после получения нашего письма, мы еще не получили новых образцов крови от этих пациентов.
В соответствии с рекомендациями BSG, у всех пациентов, направленных на гастроэнтерологическое заключение, были взяты образцы биопсии. Из первоначальных 18 пациентов, для которых у нас не было записей биопсии, все, возможно, находятся в группе повышенного риска, поскольку они не были осмотрены гастроэнтерологом.
Забрать домой сообщения
Мы исследовали, улучшило ли добавление комментария о целесообразности направления к гастроэнтерологу (и последующей биопсии) к каждому положительному результату на антитела, связанные с кишечником, частоту направлений для исследования возможной целиакии
Скорость улучшено с 30.1% пациентов, которые были направлены и 18% впоследствии прошли биопсию до добавления комментария к 79,8%, которые были направлены и подвергнуты биопсии после добавления комментария
Чтобы обеспечить соблюдение рекомендаций Британского общества гастроэнтерологии, лаборатории должны включать больше подробное описание рекомендованного курса действий для врачей общей практики по получению ими положительных кишечных антител к эндомизию и тканевой трансглутаминазе
Наибольшую озабоченность вызывают девять пациентов, которым не назначили GFD и которые не осматривались. специалист, несмотря на положительные результаты лабораторных тестов, чувствительность и специфичность которых в отношении CD высока, 4 , хотя очевидно, что некоторые из этих пациентов могли отказаться от дальнейших исследований или не явиться на прием.Четыре врача общей практики, которые не ответили, не направляли своих пациентов на гастроэнтерологическое заключение, но у нас нет данных о том, помещали ли они своих пациентов на GFD.
Аббревиатуры
BSG, Британское общество гастроэнтерологии
CD, целиакия
EMA, антитела против эндомизия
GFD, безглютеновая диета, трансглютеновая диета
- антитела
ССЫЛКИ
2. Kennedy NP , Feighery C. Клинические особенности глютеновой болезни сегодня. Biomed Pharmacother 2000; 54: 373–80. [PubMed] [Google Scholar] 3. Pearce AB , Sinclair D, Duncan HD, et al. Использование теста на антиэндомизиальные антитела для диагностики целиакии в клинической практике. Clin Lab 2002; 48: 319–25. [PubMed] [Google Scholar] 4. Sinclair D , Pearce CB, Saas MS, et al. Сравнительное исследование иммунофлуоресценции тканевых трансглутаминазных антител и эндомизиевых антител в рутинной клинической лабораторной практике.Энн Клин Биохим 2003; 40: 411–16. [PubMed] [Google Scholar]Целиакия — Американский семейный врач
1. Fasano A, Берти I, Герардуцци Т, и другие. Распространенность целиакии в группах риска и без риска в Соединенных Штатах: большое многоцентровое исследование. Arch Intern Med . 2003; 163 (3): 286–292 ….
2. Ростом А, Мюррей Дж. А., Kagnoff MF. Технический обзор Института Американской гастроэнтерологической ассоциации (AGA) по диагностике и лечению целиакии. Гастроэнтерология . 2006. 131 (6): 1981–2002.
3. Greco L, Ромино Р, Кото I, и другие. Первое крупное популяционное исследование целиакии на близнецах. Кишка . 2002. 50 (5): 624–628.
4. Коллин П., Каукинен К, Välimäki M, Салми Дж. Эндокринологические расстройства и целиакия. Endocr Ред. . 2002. 23 (4): 464–483.
5. Катальдо Ф, Марьино В, Вентура А, Боттаро Г, Corazza GR.Распространенность и клинические особенности дефицита селективного иммуноглобулина А при целиакии: итальянское многоцентровое исследование. Итальянское общество детской гастроэнтерологии и гепатологии (SIGEP) и рабочие группы Club del Tenue по целиакии. Кишка . 1998. 42 (3): 362–365.
6. Институт AGA. Заявление о медицинской позиции института AGA по диагностике и лечению целиакии. Гастроэнтерология . 2006. 131 (6): 1977–1980.
7.Сандерс Д.С., Hurlstone DP, Стокса Р.О., и другие. Меняющееся лицо целиакии у взрослых: опыт единственной университетской больницы в Южном Йоркшире. Постградская медицина J . 2002. 78 (915): 31–33.
8. Коллин П. Следует ли обследовать взрослых на целиакию? В чем польза и вред скрининга? Гастроэнтерология . 2005; 128 (4 доп. 1): S104 – S108.
9. Зеленый PH. Многоликость целиакии: клинические проявления целиакии у взрослого населения. Гастроэнтерология . 2005; 128 (4 доп. 1): S74 – S78.
10. Дьюар Д.Х., Ciclitira PJ. Клиника и диагностика целиакии. Гастроэнтеролология . 2005; 128 (4 доп. 1): S19 – S24.
11. Боде С, Гудманд-Хойер Э. Симптомы и гематологические особенности у взрослых пациентов с целиакией. Сканд Дж Гастроэнтерол . 1996. 31 (1): 54–60.
12. Реверс М, Лю Э, Симмонс Дж. Редондо MJ, Hoffenberg EJ.Целиакия, связанная с сахарным диабетом 1 типа. Endocrinol Metab Clin North Am . 2004; 33 (1): 197–214, xi.
13. Реверс М. Эпидемиология целиакии: каковы распространенность, частота и прогрессирование целиакии? Гастроэнтерология . 2005; 128 (4 доп. 1): S47 – S51.
14. Алаедин А, Зеленый PH. Описательный обзор: целиакия: понимание сложного аутоиммунного заболевания. Энн Интерн Мед. .2005. 142 (4): 289–298.
15. Заявление конференции по развитию консенсуса национальных институтов здравоохранения по целиакии, 28–30 июня 2004 г. Гастроэнтерология . 2005; 128 (4 доп. 1): S1 – S9.
16. Холм ID. Какова чувствительность и специфичность серологических тестов на целиакию? Различаются ли чувствительность и специфичность в разных популяциях? Гастроэнтерология . 2005; 128 (4 доп. 1): S25 – S32.
17. Treem WR. Новые концепции в глютеновой болезни. Curr Opin Pediatr . 2004. 16 (5): 552–559.
18. Аккомандо S, Катальдо Ф. Глобальная деревня целиакии. Dig Liver Dis . 2004. 36 (7): 492–498.
19. Томмазини А, Не Т, Кирен В, и другие. Массовый скрининг на целиакию с использованием анализа антител к трансглутаминазе человека. Арка Дис Детский . 2004. 89 (6): 512–515.
20. Льюис Н.Р., Скотт ББ. Систематический обзор: использование серологии для исключения или диагностики целиакии (сравнение тестов на антитела к эндомизиальной и тканевой трансглутаминазе). Алимент Фармакол Тер . 2006. 24 (1): 47–54.
21. Каллифорд А, Дэйли Дж, Бриллиант B, Рубин М, Зеленый PH. Значение беспроводной капсульной эндоскопии у пациентов с осложненной глютеновой болезнью. Гастроинтест Эндоск . 2005. 62 (1): 55–61.
22. Щит Дж., Муллин М.С. Материалы для обучения пациентов. Приложение к Руководству по клинической диатетике. 3-е изд. Чикаго, Иллинойс: Американская диетическая ассоциация; 2001.
23.Куппер К. Диетические рекомендации и выполнение при глютеновой болезни. Гастроэнтерология . 2005; 128 (4 доп. 1): S121 – S127.
24. Freeman HJ. Лимфопролиферативные и кишечные злокачественные новообразования у 214 пациентов с целиакией, определенной биопсией. Дж Клин Гастроэнтерол . 2004. 38 (5): 429–434.
25. Логан РФ, г. Рифкинд EA, Идентификатор Тернера, Фергюсон А. Смертность при глютеновой болезни. Гастроэнтерология .1989. 97 (2): 265–271.
26. Catassi C, Беарзи I, Холмс Г.К. Ассоциация глютеновых и кишечных лимфом и других танцоров. Гастроэнтерология . 2005; 128 (4 доп. 1): S79 – S86.
27. Зеленый РН, Fleischauer AT, Бхагат Г, Гоял Р., Джабри Б, Neugut AI. Риск злокачественного новообразования у пациентов с глютеновой болезнью. Am J Med . 2003. 115 (3): 191–195.
28. Коллин П., Пуккала Э, Реунала Т.Злокачественность и выживаемость при герпетиформном дерматите: сравнение с глютеновой болезнью. Кишка . 1996. 38 (4): 528–530.
29. Холмс Г.К., Приор П, Переулок MR, Папа D, Аллан Р.Н. Злокачественные новообразования при целиакии — эффект безглютеновой диеты. Кишка . 1989. 30 (3): 333–338.
Скрининг целиакии | Фонд по глютеновой болезни
IgA Эндомизиальные антитела (EMA): Специфичность теста EMA составляет почти 100%, что делает его наиболее специфичным тестом на целиакию, хотя он не так чувствителен, как тест tTG-IgA. 2 Около 5-10% людей с глютеновой болезнью не имеют положительного результата теста EMA. Это также очень дорого по сравнению с tTG-IgA и требует использования пищевода приматов или пуповины человека. Обычно это делается для пациентов, которым трудно поставить диагноз.
Общий сывороточный IgA: Этот тест используется для проверки дефицита IgA, состояния, связанного с глютеновой болезнью, которое может вызывать ложноотрицательный результат tTG-IgA или EMA. Если у вас дефицит IgA, ваш врач может назначить тест на DGP или tTG-IgG.
Пептид деамидированного глиадина (DGP IgA и IgG): Этот тест можно использовать для дальнейшего скрининга целиакии у лиц с дефицитом IgA, которым страдают 2-3% пациентов с глютеновой болезнью или людей с отрицательным тестом на tTg или Антитела ЕМА. Дефицит IgA у пациента может указывать на другие заболевания, которые могут вызывать атрофию ворсинок, такие как лямблиоз, избыточный бактериальный рост в тонкой кишке (SIBO) или общий вариабельный иммунодефицит (CVID). 2
Хотя это очень редко, у людей с глютеновой болезнью могут быть отрицательные результаты тестов на антитела.Если ваши анализы были отрицательными, но симптомы продолжаются, проконсультируйтесь с врачом и пройдите дополнительное медицинское обследование.
Видеокапсульная эндоскопия (VCE): VCE имеет чувствительность 89% и специфичность 95% для диагностики целиакии. Этот метод тестирования более чувствителен при обнаружении макроскопических атрофий по сравнению с обычной верхней эндоскопией (92% против 55%). VCE также полезен для выявления осложнений, связанных с глютеновой болезнью. 2
Белок, связывающий жирные кислоты кишечника (I-FABP): При повреждении клеток этот цитозольный белок попадает в системный кровоток и может указывать на непреднамеренное потребление глютена. 2
Радиология: Некоторые рентгенологические данные могут указывать на наличие целиакии, например, расширение тонкой кишки, утолщение стенок, сосудистые изменения и другие. 2
Антитела IgA к тканевой трансглутаминазе — Просмотр полного текста
В рамках этого определения пациенты могут быть дополнительно определены как пациенты с бессимптомной, потенциальной или латентной глютеновой болезнью. Термин «тихая глютеновая болезнь» относится к пациентам, которые соответствуют приведенному выше определению, но не проявляют никаких симптомов.Обычно такой диагноз ставится путем скрининга бессимптомных людей, которые подвержены повышенному риску глютеновой болезни. Термин «потенциальная глютеновая болезнь» описывает пациентов, у которых есть специфические сывороточные аутоантитела и которые могут иметь или не иметь симптомы, соответствующие глютеновой болезни, но не иметь доказательств аутоиммунного повреждения слизистой оболочки кишечника. Последняя категория пациентов с глютеновой болезнью представлена так называемой латентной глютеновой болезнью: люди с нормальной морфологией слизистой оболочки (как потенциальная), но, как известно, в какой-то момент жизни страдали глютен-зависимой энтеропатией.
Мальабсорбция возникает в результате повреждения тонкого кишечника с потерей площади абсорбирующей поверхности, снижением пищеварительных ферментов и, как следствие, нарушением всасывания микроэлементов, таких как жирорастворимые витамины, железо и, возможно, B12 и фолиевая кислота. Кроме того, воспаление усугубляет симптомы мальабсорбции, вызывая чистую секрецию жидкости, что может привести к диарее. Нарушение всасывания достаточного количества калорий приводит к потере веса, а нарушение всасывания вызывает боли в животе и вздутие живота.
Положительный семейный анамнез является фактором риска целиакии. Частота целиакии выше среди родственников первой и второй степени родства людей с целиакией, хотя оценки распространенности колеблются от 5 до 20 процентов. Частота целиакии также выше среди лиц с другими аутоиммунными заболеваниями, такими как сахарный диабет 1 типа, воспалительные заболевания желудочно-кишечного тракта, синдром Дауна, синдром Тернера, дефицит IgA и нефропатия IgA.
Желудочно-кишечные и внекишечные проявления целиакии включают диарею, боль в животе, вздутие живота, анорексию, рвоту, запор, задержку развития, хроническую усталость, анемию, остеопороз, афтозный стоматит, повышение ферментов печени, боли в суставах / мышцах, эпилепсию, и периферическая невропатия.
Руководства по клинической практике рекомендуют начинать с анализа сывороточных антител к тканевой трансглутаминазе IgA (anti-tTG IgA) в качестве диагностического теста на целиакию. Тест на tTG IgA — это стандартный метод тестирования на целиакию. Клиническая практика в руководящих принципах США и Европы рекомендуют биопсию кишечника для подтверждения диагноза целиакии (например, на основании наличия атрофии ворсинок, гиперплазии крипт и увеличения интраэпителиальных лимфоцитов) и для дифференциации целиакии от других заболеваний, поражающих тонкий кишечник. .Биопсия кишечника также может быть выполнена, если клиническое подозрение на целиакию велико, но серологические тесты отрицательны. Было высказано предположение, что комбинация серологических тестов может использоваться для установления диагноза целиакии в качестве альтернативы биопсии, но неясно, как часто целиакия диагностируется при отсутствии биопсии в клинической практике.
Целиакия: полный текущий обзор | BMC Medicine
Fasano A, Catassi C. Целиакия.N Engl J Med. 2012; 367: 2419–26.
CAS PubMed Статья PubMed Central Google Scholar
Volta U, Caio G, Stanghellini V, De Giorgio R. Меняющийся клинический профиль целиакии: 15-летний опыт работы (1998-2012) в итальянском специализированном центре. BMC Gastroenterol. 2014; 14: 194.
PubMed PubMed Central Статья Google Scholar
Volta U, Caio G, Tovoli F, De Giorgio R. Чувствительность к глютену без целиакии: вопросы, на которые еще предстоит ответить, несмотря на растущую осведомленность. Cell Mol Immunol. 2013; 10: 383–92.
CAS PubMed PubMed Central Статья Google Scholar
де Лоргерил М., Сален П. Непереносимость глютена и пшеницы сегодня: задействованы ли современные сорта пшеницы? Int J Food Sci Nutr. 2014; 65: 577–81.
PubMed Статья CAS PubMed Central Google Scholar
van den Broeck HC, de Jong HC, Salentijn EM, et al. Наличие эпитопов целиакии в современных и старых сортах гексаплоидной пшеницы: селекция пшеницы могла способствовать увеличению распространенности целиакии. Theor Appl Genet. 2010; 121: 1527–39.
PubMed PubMed Central Статья CAS Google Scholar
Bach JF. Гипотеза гигиены при аутоиммунных заболеваниях: роль патогенов и комменсалов. Nat Rev Immunol.2018; 18: 105–20.
CAS PubMed Статья PubMed Central Google Scholar
Корацца Г.Р., Андреани М.Л., Бьяджи Ф. и др. Меньший размер «глютенового айсберга» у взрослых. Сканд Дж Гастроэнтерол. 1997; 32: 917–9.
CAS PubMed Статья PubMed Central Google Scholar
Иварссон А., Перссон Л.А., Джуто П. и др. Высокая распространенность недиагностированной целиакии у взрослых: шведское популяционное исследование.J Intern Med. 1999; 245: 63–8.
CAS PubMed Статья PubMed Central Google Scholar
Риестра С., Фернандес Э., Родриго Л. и др. Распространенность целиакии среди населения северной Испании. Сканд Дж Гастроэнтерол. 2000; 35: 398–402.
CAS PubMed Статья PubMed Central Google Scholar
Volta U, Bellentani S, Bianchi FB, et al.Высокая распространенность целиакии среди населения Италии в целом. Dig Dis Sci. 2001; 46: 1500–5.
CAS PubMed Статья PubMed Central Google Scholar
Мусталахти К., Катасси С., Реунанен А. и др. Распространенность целиакии в Европе: результаты централизованного международного проекта массового скрининга. Ann Med. 2010; 42: 587–95.
PubMed Статья PubMed Central Google Scholar
Rubio-Tapia A, Ludvigsson JF, Brantner TL, et al. Распространенность целиакии в США. Am J Gastroenterol. 2012; 107: 1538–44.
PubMed Статья PubMed Central Google Scholar
Сингх П., Арора С., Сингх А. и др. Распространенность целиакии в Азии: систематический обзор и метаанализ. J Gastroenterol Hepatol. 2016; 3: 1095–101.
Артикул Google Scholar
Катасси С., Крышак Д., Бхатти Б. и др. Естественный анамнез аутоиммунной болезни целиакии в когорте США отслеживался с 1974 г. Ann Med. 2010; 42: 530–8.
PubMed Статья PubMed Central Google Scholar
Hall EJ, Batt RM. Диетическое регулирование чувствительности к глютену при естественной энтеропатии ирландских сеттеров. Кишечник. 1992; 33: 198–205.
CAS PubMed PubMed Central Статья Google Scholar
Окада Х., Кун С., Фейле Х., Бах Дж. «Гигиеническая гипотеза» аутоиммунных и аллергических заболеваний: обновленная информация. Clin Exp Immunol. 2010; 160: 1-9.
Verdu EF, Galipeau HJ, Jabri B. Новые участники патогенеза целиакии: роль микробиоты кишечника. Нат Рев Гастроэнтерол Гепатол. 2015; 185: 2969–82.
Google Scholar
Лундин К.Э., Вейменга С. Целиакия и аутоиммунные заболевания — генетическое совпадение и скрининг.Нат Рев Гастроэнтерол Гепатол. 2015; 12: 507–15.
CAS PubMed Статья PubMed Central Google Scholar
Lionetti E, Castellaneta S, Francavilla R, et al. Введение глютена, статуса HLA и риска глютеновой болезни у детей. N Engl J Med. 2014; 371: 1295–303.
PubMed Статья CAS PubMed Central Google Scholar
Лю Э., Ли Х.С., Аронссон Калифорния и др. Риск детской целиакии в соответствии с гаплотипом HLA и страной. N Engl J Med. 2014; 371: 42–9.
PubMed PubMed Central Статья CAS Google Scholar
Vriezinga SL, Auricchio R, Bravi E, et al. Рандомизированное кормление детей с высоким риском глютеновой болезни. N Engl J Med. 2014; 371: 1304–15.
CAS PubMed Статья PubMed Central Google Scholar
Mazzilli MC, Ферранте П., Мариани П. и др. Исследование итальянских педиатрических пациентов с целиакией подтверждает, что первичная ассоциация HLA связана с гетеродимером DQ (α1 ∗ 0501, β1 ∗ 0201). Human Immunol. 1992; 33: 133–9.
CAS Статья Google Scholar
Dieli-Crimi R, Cénit MC, Núñez C. Генетика целиакии: всесторонний обзор клинических последствий. J Autoimmun. 2015; 64: 26–41.
CAS PubMed Статья PubMed Central Google Scholar
Силано М., Винсентини О., Де Винченци М. Токсичные, иммуностимулирующие и антагонистические пептиды глютена при целиакии. Curr Med Chem. 2009; 16: 1489–98.
CAS PubMed Статья PubMed Central Google Scholar
Шан Л., Мольберг О., Попугай И. и др. Структурные основы непереносимости глютена в чревном спру. Наука. 2002; 297: 2275–9.
CAS PubMed Статья PubMed Central Google Scholar
Jelinkova L, Tuckova L, Cinova J, et al. Глиадин стимулирует человеческие моноциты к выработке IL-8 и TNF-альфа через механизм, включающий NF-kappaB. FEBS Lett. 2004; 571: 81–5.
CAS PubMed Статья PubMed Central Google Scholar
Ламмерс К.М., Ханделвал С., Чаудхри Ф. и др. Идентификация нового иммуномодулирующего пептида глиадина, который вызывает высвобождение интерлейкина-8 зависимым от хемокинового рецептора CXCR3 образом только у пациентов с целиакией.Иммунология. 2011; 132: 432–40.
CAS PubMed PubMed Central Статья Google Scholar
Пикарелли А., Ди Тола М., Саббателла Л. и др. 31–43 аминокислотная последовательность альфа-глиадина индуцирует продукцию антиэндомизиальных антител во время заражения in vitro. Сканд Дж Гастроэнтерол. 1999; 34: 1099–102.
CAS PubMed Статья PubMed Central Google Scholar
Клементе М.Г., Де Вирджилис С., Канг Дж. С. и др. Ранние эффекты глиадина на внутриклеточную передачу сигналов энтероцитов, участвующих в барьерной функции кишечника. Кишечник. 2003. 52: 218–23.
CAS PubMed PubMed Central Статья Google Scholar
Sander GR, Cummins AG, Henshall T, Powell BC. Быстрое нарушение функции кишечного барьера глиадином включает изменение экспрессии белков апикального соединения. FEBS Lett.2005; 579: 4851–5.
CAS PubMed Статья PubMed Central Google Scholar
Wang W, Uzzau S, Goldblum SE, Fasano A. Человеческий зонулин, потенциальный модулятор плотных контактов кишечника. J Cell Sci. 2000; 113: 4435–40.
CAS PubMed PubMed Central Google Scholar
Fasano A, Not T, Wang W, et al. Зонулин, недавно открытый модулятор кишечной проницаемости, и его проявление при глютеновой болезни.Ланцет. 2000; 355: 1518–9.
CAS PubMed Статья PubMed Central Google Scholar
Трипати А., Ламмерс К.М., Голдблюм С. и др. Идентификация человеческого зонулина, физиологического модулятора плотных контактов, как преаптоглобина-2. Proc Natl Acad Sci U S. A. 2009; 106: 16799–804.
CAS PubMed PubMed Central Статья Google Scholar
Эль-Асмар Р., Паниграхи П., Бамфорд П. и др. Зависимая от хозяина секреция зонулина вызывает нарушение барьерной функции тонкого кишечника после воздействия бактерий. Гастроэнтерология. 2002; 123: 1607–15.
PubMed Статья CAS PubMed Central Google Scholar
Smecuol E, Sugai E, Niveloni S, et al. Проницаемость, продукция зонулина и энтеропатия при герпетиформном дерматите. Clin Gastroenterol Hepatol.2005; 3: 335–41.
PubMed Статья PubMed Central Google Scholar
Sapone A, de Magistris L, Pietzak M, et al. Повышенная регуляция зонулина связана с повышенной проницаемостью кишечника у пациентов с диабетом 1 типа и их родственников. Сахарный диабет. 2006; 55: 1443–9.
CAS PubMed Статья PubMed Central Google Scholar
Симпсон М., Моджибиан М., Баррига К. и др.Исследование уровней антител Glo-3A у детей с повышенным риском сахарного диабета 1 типа. Педиатр Диабет. 2009; 10: 563–72.
CAS PubMed PubMed Central Статья Google Scholar
Duerksen DR, Wilhelm-Boyles C, Veitch R, et al. Сравнение тестов на антитела, проницаемости и уровней зонулина с биопсией тонкой кишки у пациентов с глютеновой болезнью, соблюдающих безглютеновую диету. Dig Dis Sci. 2010; 55: 1026–31.
CAS PubMed Статья PubMed Central Google Scholar
Драго С., Эль-Асмар Р., Ди Пьерро М. и др. Глиадин, зонулин и проницаемость кишечника: воздействие на слизистую оболочку кишечника и линии кишечных клеток при целиакии и без целиакии. Сканд Дж Гастроэнтерол. 2006; 41: 408–19.
CAS PubMed Статья PubMed Central Google Scholar
Холлон Дж., Пуппа Э.Л., Гринвальд Б. и др.Влияние глиадина на проницаемость эксплантатов кишечной биопсии от пациентов с глютеновой болезнью и пациентов с нечувствительностью к глютену. Питательные вещества. 2015; 7: 1565–76.
CAS PubMed PubMed Central Статья Google Scholar
Патерсон Б.М., Ламмерс К.М., Арриета М.С. и др. Безопасность, переносимость, фармакокинетические и фармакодинамические эффекты однократных доз AT-1001 у субъектов с глютеновой болезнью: доказательство концепции исследования.Алимент Pharmacol Ther. 2007. 26: 757–66.
CAS PubMed Статья PubMed Central Google Scholar
Thomas KE, Sapone A, Fasano A, Vogel SN. Стимуляция глиадином экспрессии воспалительных генов макрофагов мышей и кишечная проницаемость зависят от MyD88: роль врожденного иммунного ответа при целиакии. J Immunol. 2006; 176: 2512–21.
CAS PubMed Статья PubMed Central Google Scholar
Ламмерс К.М., Лу Р., Браунли Дж. И др. Глиадин вызывает увеличение кишечной проницаемости и высвобождение зонулина за счет связывания с хемокиновым рецептором CXCR3. Гастроэнтерология. 2008. 135: 194–204.
CAS PubMed PubMed Central Статья Google Scholar
Монсуур А.Дж., де Баккер П.И., Ализаде Б.З. и др. Вариант миозина IXB увеличивает риск целиакии и указывает на первичный дефект кишечного барьера.Нат Жене. 2005; 37: 1341–4.
CAS PubMed Статья PubMed Central Google Scholar
Loeff T, Araya M, Pérez-Bravo F. Частота полиморфизмов MYO9B у пациентов с глютеновой болезнью и контрольной группы. Rev Esp Enferm Dig. 2012; 104: 566–71.
CAS PubMed Статья PubMed Central Google Scholar
Wapenaar MC, Monsuur AJ, van Bodegraven AA, et al.Связь с генами плотного соединения PARD3 и MAGI2 у голландских пациентов указывает на общий дефект барьера для целиакии и язвенного колита. Кишечник. 2008; 57: 463–7.
CAS PubMed Статья PubMed Central Google Scholar
Schumann M, Richter JF, Wedell I, et al. Механизмы эпителиальной транслокации альфа (2) -глиадина-33-мера в чревном спру. Кишечник. 2008; 57: 747–54.
CAS PubMed Статья PubMed Central Google Scholar
Морено М.Л., Себолла А., Муньос-Суано А. и др. Обнаружение иммуногенных пептидов глютена в моче пациентов с глютеновой болезнью выявляет нарушения безглютеновой диеты и неполное заживление слизистой оболочки. Кишечник. 2017; 66: 250–7.
CAS PubMed Статья PubMed Central Google Scholar
Matysiak-Budnik T, Moura IC, Arcos-Fajardo M, et al. Секреторный IgA опосредует ретротрансцитоз интактных пептидов глиадина через рецептор трансферрина при целиакии.J Exp Med. 2008. 205: 143–54.
CAS PubMed PubMed Central Статья Google Scholar
Ким С.М., Маясси Т., Джабри Б. Врожденный иммунитет: задействование механизмов патогенеза целиакии. Лучшие Практики Рес Клин Гастроэнтерол. 2015; 29: 425–35.
CAS PubMed PubMed Central Статья Google Scholar
Junker Y, Zeissig S, Kim SJ, et al.Ингибиторы трипсина амилазы пшеницы вызывают воспаление кишечника за счет активации толл-подобного рецептора 4. J Exp Med. 2012; 209: 2395–408.
CAS PubMed PubMed Central Статья Google Scholar
Бароне М.В., Тронкон Р., Ауриккио С. Пептиды глиадина как триггеры пролиферативного и стрессового / врожденного иммунного ответа слизистой оболочки тонкой кишки при целиакии. Int J Mol Sci. 2014; 15: 20518–37.
CAS PubMed PubMed Central Статья Google Scholar
Cinova J, Palova-Jelinkova L, Smythies LE, et al. Пептиды глиадина активируют моноциты крови пациентов с глютеновой болезнью. J Clin Immunol. 2007; 27: 201–9.
CAS PubMed Статья PubMed Central Google Scholar
Ламмерс К.М., Чиппа М., Лю Л. и др. Глиадин индуцирует миграцию нейтрофилов за счет вовлечения рецептора формилпептида, FPR1. PLoS One. 2015; 10: e0138338.
PubMed PubMed Central Статья CAS Google Scholar
Stamnaes J, Sollid LM. Целиакия: аутоиммунитет в ответ на пищевой антиген. Semin Immunol. 2015; 27: 343–52.
CAS PubMed Статья PubMed Central Google Scholar
Tang F, Chen Z, Ciszewski C, et al. Цитозольный PLA2 необходим для CTL-опосредованной иммунопатологии целиакии через NKG2D и IL-15. J Exp Med. 2009; 206: 707–19.
CAS PubMed PubMed Central Статья Google Scholar
Тьон Дж. М., Ван Берген Дж., Конинг Ф. Целиакия: насколько усложняется она? Иммуногенетика. 2010; 62: 641–51.
CAS PubMed PubMed Central Статья Google Scholar
Пальяри Д., Ургези Р., Фросали С. и др. Взаимодействие между микробиотой, иммунитетом, генетическими и диетическими факторами является причиной развития condicio sine qua non глютеновой болезни. J Immunol Res. 2015; 2015: 123653.
CAS PubMed PubMed Central Google Scholar
Hüe S, Mention JJ, Monteiro RC и др. Непосредственная роль взаимодействия NKG2D / MICA в атрофии ворсинок при целиакии. Иммунитет. 2004; 21: 367–77.
PubMed Статья PubMed Central Google Scholar
Senger S, Sapone A, Fiorentino MR, et al. Гистопатология глютеновой болезни резюмирует подавление активности ежа, соответствующее активации процессов заживления ран. PLoS One. 2015; 10: e0144634.
PubMed PubMed Central Статья CAS Google Scholar
Ju JM, Marietta EV, Murray JA. Создание моделей трансгенных мышей для изучения целиакии. Методы Мол биол. 2015; 1326: 23–33.
CAS PubMed Статья PubMed Central Google Scholar
Шуман М., Зигмунд Б., Шульцке Дж. Д., Фромм М. Целиакия: роль эпителиального барьера. Клеточный Мол Гастроэнтерол Гепатол. 2017; 3: 150–62.
PubMed PubMed Central Статья Google Scholar
Olivares M, Benítez-Páez A, de Palma G, et al. Повышенная распространенность патогенных бактерий в кишечной микробиоте младенцев с риском развития глютеновой болезни: исследование PROFICEL. Кишечные микробы. 2018; 9: 551–8.
PubMed PubMed Central Google Scholar
Чандер А.М., Ядав Х., Джайн С. и др. Взаимосвязь между глютеном, кишечной микробиотой и слизистой оболочкой кишечника при целиакии: последние достижения и основы аутоиммунитета.Front Microbiol. 2018; 9: 2597.
PubMed PubMed Central Статья Google Scholar
Селлитто М., Бай Дж., Серена Дж. И др. Доказательство концепции анализа микробиома-метаболома и отсроченного воздействия глютена на аутоиммунитет целиакии у младенцев с генетической группой риска. PLoS One. 2012; 7: e33387.
CAS PubMed PubMed Central Статья Google Scholar
Olivares M, Neef A, Castillejo G и др. Генотип HLA-DQ2 выбирает ранний состав кишечной микробиоты у младенцев с высоким риском развития глютеновой болезни. Кишечник. 2015; 64: 406–17.
CAS PubMed Статья PubMed Central Google Scholar
Choung RS, Ditah IC, Nadeau AM, et al. Тенденции и расовые / этнические различия в проблемах, связанных с глютеном, в Соединенных Штатах: результаты национальных обследований здоровья и питания с 1988 по 2012 год.Am J Gastroenterol. 2015; 110: 455–61.
PubMed Статья PubMed Central Google Scholar
Фазано А. Целиакия: как лечить клинический хамалеон. N Engl J Med. 2003; 348: 2568–70.
PubMed Статья PubMed Central Google Scholar
Людвигссон Дж. Ф., Леффлер Д. А., Бай Дж. К. и др. Определения глютеновой болезни и связанных с ней терминов в Осло.Кишечник. 2013; 6: 43–52.
Артикул Google Scholar
Леонард М.М., Сапоне А., Катасси С., Фазано А. Целиакия и нецеловая чувствительность к глютену: обзор. ДЖАМА. 2017; 318: 647–56.
PubMed Статья PubMed Central Google Scholar
Вивас С., Руис де Моралес Дж. М., Фернандес М. и др. Возрастные клинические, серологические и гистопатологические особенности целиакии.Am J Gastroenterol. 2008. 103: 2360–5.
PubMed Статья PubMed Central Google Scholar
Рейли Н.Р., Агилар К., Хассид Б.Г. и др. Целиакия у детей с нормальным и избыточным весом: клинические особенности и результаты роста после безглютеновой диеты. J Педиатр Гастроэнтерол Нутр. 2011; 53: 528–31.
PubMed PubMed Central Google Scholar
Байдун А., Маакарон Дж. Э., Халави Х. и др. Гематологические проявления целиакии. Сканд Дж Гастроэнтерол. 2012; 47: 1401–11.
PubMed Статья PubMed Central Google Scholar
Камычева Е., Гото Т., Камарго Калифорния мл. Целиакия связана со снижением минеральной плотности костей и повышением показателей FRAX в Национальном обследовании здоровья и питания США. Osteoporos Int. 2017; 28: 781–90.
CAS PubMed Статья PubMed Central Google Scholar
Krzywicka B, Herman K, Kowalczyk-Zając M, Pytrus T. Целиакия и ее влияние на состояние здоровья полости рта — обзор литературы. Adv Clin Exp Med. 2014; 23: 675–81.
PubMed Статья PubMed Central Google Scholar
Volta U, De Franceschi L, Lari F, et al. Глютеновая болезнь, скрытая криптогенной гипертрансаминаземией. Ланцет. 1998. 352: 26–9.
CAS PubMed Статья PubMed Central Google Scholar
Volta U, Caio G, Tovoli F, De Giorgio R. Ось кишечника-печени: иммунная связь между глютеновой болезнью и первичным билиарным циррозом. Эксперт Рев Гастроэнтерол Гепатол. 2013; 7: 253–61.
CAS PubMed Статья PubMed Central Google Scholar
Volta U, Tovoli F, Caio G. Клинические и иммунологические особенности целиакии у пациентов с сахарным диабетом 1 типа. Эксперт Рев Гастроэнтерол Гепатол. 2011; 5: 479–87.
CAS PubMed Статья PubMed Central Google Scholar
Caio G, De Giorgio R, Venturi A, et al. Клиническая и иммунологическая значимость антинейрональных антител при целиакии с неврологическими проявлениями. Gastroenterol Hepatol Bed Bench. 2015; 8: 146–52.
PubMed PubMed Central Google Scholar
Saccone G, Berghella V, Sarno L, et al.Целиакия и акушерские осложнения: систематический обзор и метанализ. Am J Obstet Gynecol. 2016; 214: 225–34.
PubMed Статья PubMed Central Google Scholar
Фартинг MJG, Edwards CRW, Rees LH, Dawson AM. Функция мужских гонад при целиакии: сексуальная дисфункция, бесплодие и качество спермы. Кишечник. 1982; 23: 608–14.
CAS PubMed PubMed Central Статья Google Scholar
Леффлер Д.А., Грин PH, Фазано А. Внекишечные проявления целиакии. Нат Рев Гастроэнтерол Гепатол. 2015; 12: 561–71.
CAS PubMed Статья PubMed Central Google Scholar
Гейл Л., Вималаратна Х, Бротодихарджо А, Дугган Дж. М.. Синдром Дауна тесно связан с глютеновой болезнью. Кишечник. 1997. 40: 492–6.
CAS PubMed PubMed Central Статья Google Scholar
Бонамико М., Паскуино А.М., Мариани П. и др. Распространенность и клиническая картина целиакии при синдроме Тернера. J Clin Endocrinol Metab. 2002; 87: 5495–8.
CAS PubMed Статья PubMed Central Google Scholar
Джаннотти А., Тиберио Дж., Кастро М. и др. Целиакия при синдроме Вильямса. J Med Genet. 2001; 38: 767–8.
CAS PubMed PubMed Central Статья Google Scholar
Caio G, De Giorgio R, Ursini F и др. Распространенность серологических маркеров целиакии в когорте итальянских ревматологов. Gastroenterol Hepatol Bed Bench. 2018; 11: 244–9.
PubMed PubMed Central Google Scholar
Volta U, De Franceschi L, Molinaro N, et al. Частота и значение антиглиадиновых и антиэндомизиальных антител при аутоиммунном гепатите. Dig Dis Sci. 1998. 43: 2190–5.
CAS PubMed Статья PubMed Central Google Scholar
Volta U, Rodrigo L, Granito A и др. Целиакия при аутоиммунных холестатических заболеваниях печени. Am J Gastroenterol. 2002; 97: 2609–13.
PubMed Статья PubMed Central Google Scholar
Volta U, Bardazzi F, Zauli D, et al. Серологический скрининг на целиакию при витилиго и очаговой алопеции. Br J Dermatol. 1997; 136: 801–2.
CAS PubMed Статья PubMed Central Google Scholar
Oleary C, Walsh CH, Wieneke P, et al. Целиакия и аутоиммунная болезнь Аддисона: клиническая ловушка. QJM. 2002; 95: 79–82.
CAS Статья Google Scholar
Катальдо Ф., Марино В., Вентура А. и др. Распространенность и клинические особенности дефицита селективного иммуноглобулина А при целиакии: итальянское многоцентровое исследование. Кишечник. 1998. 42: 362–5.
CAS PubMed PubMed Central Статья Google Scholar
Курион М., Барбато М., Де Биасе Л. и др. Распространенность целиакии при идиопатической дилатационной кардиомиопатии. Ланцет. 1999; 354: 222–3.
CAS PubMed Статья PubMed Central Google Scholar
Caio G, De Giorgio R, Volta U. Целиакия и герпетиформный дерматит. Ланцет. 2018; 392: 916–7.
PubMed Статья PubMed Central Google Scholar
Volta U, Caio G, Boschetti E, et al. Серонегативная глютеновая болезнь: проливает свет на малоизвестную клиническую сущность. Dig Liver Dis. 2016; 48: 1018–22.
PubMed Статья PubMed Central Google Scholar
Муни П.Д., Эванс К.Э., Сингх С., Сандерс Д.С. Неэффективность лечения целиакии: практическое руководство по исследованию и лечению невосприимчивой и рефрактерной целиакии. J Gastrointest Liver Dis. 2012; 21: 197–203.
Google Scholar
Volta U, Granito A, Fiorini E, et al. Польза антител к дезамидированным пептидам глиадина в диагностике целиакии и последующем наблюдении. Dig Dis Sci. 2008; 853: 1582–8.
Артикул CAS Google Scholar
Volta U, Tovoli F, Piscaglia M, et al. Старый и новый серологический тест для скрининга целиакии. Exp Rev Gatroenterol Hepatol.2010; 4: 31–5.
CAS Статья Google Scholar
Caio G, Volta U. Целиакия: изменение диагностических критериев? Gastroenterol Hepatol Bed Bench. 2012; 5: 119–22.
PubMed PubMed Central Google Scholar
Husby S, Koletzko S, Korponay-Szabó IR, et al. Руководство Европейского общества детской гастроэнтерологии, гепатологии и питания по диагностике целиакии.J Педиатр Гастроэнтерол Нутр. 2012; 54: 136–60.
CAS PubMed Статья PubMed Central Google Scholar
Werkstetter KJ, Korponay-Szabó IR, Popp A, et al. Точность диагностики целиакии без биопсии в клинической практике. Гастроэнтерология. 2017; 153: 924–35.
PubMed Статья PubMed Central Google Scholar
Эгнер В., Шримптон А., Саргур Р. и др.Руководство ESPGHAN по глютеновой болезни 2012: множественные ULN для принятия решений не гармонизируют эффективность анализа в разных центрах. J Педиатр Гастроэнтерол Нутр. 2012; 55: 733–5.
PubMed Статья PubMed Central Google Scholar
Fuchs V, Kurppa K, Huhtala H, et al. Критерии, основанные на серологических исследованиях целиакии у взрослых, имеют превосходную точность во всем диапазоне вероятностей до тестирования. Алимент Pharmacol Ther. 2019; 49: 277–84.
CAS PubMed Статья PubMed Central Google Scholar
Катасси К., Фазано А. Диагностика целиакии: простые правила лучше сложных алгоритмов. Am J Med. 2010; 123: 691–3.
PubMed Статья PubMed Central Google Scholar
Kostopoulou O, Devereaux-Walsh C, Delaney BC. Отсутствие целиакии в семейной медицине: важность генерации гипотез.Med Decis Mak. 2009; 29: 282–90.
Артикул Google Scholar
Zanchetta MB, Longobardi V, Bai JC. Костная и глютеновая болезнь. Curr Osteoporos Rep. 2016; 14: 43–8.
PubMed Статья PubMed Central Google Scholar
Corazza GR, Zoli G, Di Sabatino A, et al. Переоценка гипофункции селезенки при целиакии. Am J Gastroenterol.1999; 94: 391–7.
CAS PubMed Статья PubMed Central Google Scholar
Карачени П., Бенацци Б., Кайо Г. и др. Гипоспленизм как причина пневмококкового менингоэнцефалита у взрослого пациента с глютеновой болезнью. Ital J Med. 2011; 5: 124–7.
Артикул Google Scholar
Ди Сабатино А., Росадо М.М., Каццола П. и др. Гипофункция селезенки и спектр аутоиммунных и злокачественных осложнений при целиакии.Clin Gastroenterol Hepatol. 2006; 4: 179–86.
PubMed Статья PubMed Central Google Scholar
Caio G, Riegler G, Patturelli M, et al. Патофизиология нечувствительности к глютену без целиакии: где мы сейчас находимся? Минерва Гастроэнтерол Диетол. 2017; 63: 16–21.
PubMed PubMed Central Google Scholar
Villalta D, Tonutti E, Prause C, et al.Антитела IgG к дезамидированным пептидам глиадина для диагностики целиакии у пациентов с дефицитом IgA. Clin Chem. 2010; 56: 464–8.
CAS PubMed Статья PubMed Central Google Scholar
Volta U, Molinaro N, De Franceschi L, et al. Антиэндомизиальные антитела IgA к ткани пуповины человека для скрининга глютеновой болезни: сэкономьте и деньги, и обезьяны. Dig Dis Sci. 1995; 40: 1902–1905.
CAS PubMed Статья PubMed Central Google Scholar
Стерн М. Сравнительная оценка серологических тестов на целиакию: европейская инициатива по стандартизации. J Педиатр Гастроэнтерол Нутр. 2000; 31: 513–9.
CAS PubMed Статья PubMed Central Google Scholar
Salardi S, Volta U, Zucchini S, et al. Распространенность целиакии у детей с сахарным диабетом 1 типа увеличилась в середине 1990-х годов: 18-летнее продольное исследование, основанное на антиэндомизиальных антителах.J Педиатр Гастроэнтерол Нутр. 2008; 46: 612–4.
PubMed Статья PubMed Central Google Scholar
Zucchini L, Giusti D, Gatouillat G, et al. Интерпретация серологических тестов в диагностике целиакии: новый взгляд на антитела к дезамидированному пептиду глиадина. Аутоиммунитет. 2016; 49: 414–20.
CAS PubMed Статья PubMed Central Google Scholar
Амарри С., Алвиси П., Де Джорджио Р. и др. Антитела к дезамидированным пептидам глиадина: точный предиктор глютеновой болезни в младенчестве. J Clin Immunol. 2013; 33: 1027–30.
CAS PubMed Статья PubMed Central Google Scholar
Диппер С.Р., Майтра С., Томас Р. и др. Антитела к тканевой трансглутаминазе при последующем наблюдении за целиакией у взрослых. Алимент Пармакол Тер. 2009. 30: 236–44.
CAS Статья Google Scholar
Choung RS, Khaleghi Rostamkolaei S, Ju JM, et al. Синтетические неоэпитопы комплекса трансглутаминаза-дезамидированный глиадин как биомаркеры для диагностики и мониторинга целиакии. Гастроэнтерология. 2019; 156: 582–91.
CAS PubMed Статья PubMed Central Google Scholar
Леонард М.М., Weir DC, DeGroote M, et al. Значение IgA tTG в прогнозировании восстановления слизистой оболочки у детей с глютеновой болезнью на безглютеновой диете.J Педиатр Гастроэнтерол Нутр. 2017; 64: 286–91.
CAS PubMed PubMed Central Статья Google Scholar
Леонард М.М., Фазано А. Ноль, одна или две эндоскопии для диагностики и мониторинга детской целиакии? Жюри пока еще нет. J Педиатр Гастроэнтерол Нутр. 2017; 65: 270–1.
PubMed Статья PubMed Central Google Scholar
Оберхюбер Г., Грандич Г., Фогельсанг Х. Гистопатология целиакии: время для стандартизированной схемы отчетов для патологов. Eur J Gastroenterol Hepatol. 1999; 11: 1185–94.
PubMed Статья PubMed Central Google Scholar
Корацца Г.Р., Вильяначчи В. Целиакия: некоторые соображения по гистологическому диагнозу. J Clin Pathol. 2005; 58: 573–4.
CAS PubMed PubMed Central Статья Google Scholar
Оксентенко А.С., Мюррей Дж. Целиакия: десять вещей, которые должен знать каждый гастроэнтеролог. Clin Gastroenterol Hepatol. 2015; 13: 1396–404.
PubMed Статья PubMed Central Google Scholar
Villanacci V, Ceppa P, Tavani E, et al. Целиакия: гистологический отчет. Dig Liver Dis. 2011; 43: 385–95.
Артикул Google Scholar
Rostami-Nejad M, Villanacci V, Hogg-Kollars S, et al. Эндоскопические и гистологические ошибки в диагностике целиакии: многоцентровое исследование, оценивающее текущую практику. Rev Esp Enferm Dig. 2013; 105: 326–33.
PubMed Статья PubMed Central Google Scholar
Браун И., Мино-Кенудсон М., Дешпанде В., Лауэрс Дж. Интраэпителиальный лимфоцитоз в проксимальной части слизистой оболочки тонкой кишки с архитектурной сохранностью.Arch Pathol Lab Med. 2006; 130: 1020–5.
PubMed PubMed Central Google Scholar
Бьяджи Ф., Бьянки П.И., Кампанелла Дж. И др. Распространенность и причины минимальных поражений кишечника у пациентов, жалующихся на симптомы, указывающие на энтеропатию. Последующее исследование. J Clin Pathol. 2008; 61: 1116–8.
CAS PubMed Статья PubMed Central Google Scholar
Какар С., Нехра В., Мюррей Дж. А. и др. Значение интраэпителиального лимфоцитоза в образцах биопсии тонкой кишки с нормальной архитектурой слизистой оболочки. Am J Gastroenterol. 2003. 98: 2027–2033.
PubMed Статья PubMed Central Google Scholar
Аптон М.П. «Дай нам на сей день хлеб наш насущный». Развивающиеся концепции глютенового литника. Arch Pathol Lab Med. 2008; 132: 1594–159.
PubMed PubMed Central Google Scholar
Фернандес-Баньярес Ф., Карраско А., Гарсия-Пуиг Р. и др. Цитометрическая картина кишечных интраэпителиальных лимфоцитов более точна, чем субэпителиальные отложения антител к тканевой трансглутаминазе IgA, для диагностики целиакии при лимфоцитарном энтерите. PLoS One. 2014; 9: e101249.
PubMed PubMed Central Статья CAS Google Scholar
Ростами К., Марш М.Н., Джонсон М.В. и др. ROC-king и далее: количество интраэпителиальных лимфоцитов, их распределение и роль в интерпретации слизистой оболочки при целиакии.Кишечник. 2017; 66: 2080–6.
CAS PubMed PubMed Central Статья Google Scholar
Марш М.Н., Ростами К. Что такое нормальная слизистая оболочка кишечника? Гастроэнтерология. 2016; 151: 784–8.
PubMed Статья PubMed Central Google Scholar
Марш М.Н., Джонсон В.М., Ростами К. Гистопатология слизистой оболочки при целиакии: опровержение подраздела Марша III Оберхубера.Gastroenterol Hepatol Bed Bench. 2015; 8: 99–109.
Google Scholar
Rubio-Tapia A, Hill ID, Kelly CP, et al. Клинические рекомендации ACG: диагностика и лечение целиакии. Am J Gastroenterol. 2013; 108: 656–76.
CAS PubMed PubMed Central Статья Google Scholar
Volta U, Villanacci V. Целиакия: диагностические критерии в стадии разработки.Cell Mol Immunol. 2011; 8: 96–102.
CAS PubMed PubMed Central Статья Google Scholar
Volta U, Caio G, Giancola F, et al. Особенности и прогрессирование потенциальной целиакии у взрослых. Clin Gastroenterol Hepatol. 2016; 14: 686–93.
CAS PubMed Статья PubMed Central Google Scholar
Курппа К., Коллин П., Вильямаа М. и др.Диагностика легкой энтеропатии целиакии: рандомизированное контролируемое клиническое исследование. Гастроэнтерология. 2009; 136: 816–23.
PubMed Статья PubMed Central Google Scholar
Тоско А., Сальвати В.М., Ауриккио Р. и др. Естественная история потенциальной целиакии у детей. Clin Gastroenterol Hepatol. 2011; 9: 320–5.
PubMed Статья PubMed Central Google Scholar
Lionetti E, Castellaneta S, Pulvirenti A, et al. Распространенность и естественный анамнез потенциальной целиакии у младенцев из семейного риска проспективно исследуются с рождения. J Pediatr. 2012; 161: 908–14.
PubMed Статья PubMed Central Google Scholar
Занини Б., Казелани Ф., Магни А. и др. Целиакия с легкой энтеропатией не является легкой болезнью. Clin Gastroenterol Hepatol. 2013; 11: 253–8.
PubMed Статья PubMed Central Google Scholar
Biagi F, Trotta L, Alfano C и др. Распространенность и естественное течение потенциальной целиакии у взрослых пациентов. Сканд Дж Гастроэнтерол. 2013; 48: 537–42.
PubMed Статья PubMed Central Google Scholar
Ауриккио Р., Тоско А., Пикколо Е. и др. Дети с потенциальной целиакией: наблюдение в течение 9 лет на диете, содержащей глютен. Am J Gastroenterol. 2014; 109: 913–21.
CAS PubMed Статья PubMed Central Google Scholar
Курппа К., Коллин П., Линдфорс К. и др. Спонтанная отрицательная сероконверсия эндомизиальных антител не исключает последующей целиакии. J Педиатр Гастроэнтерол Нутр. 2011; 53: 576–9.
PubMed Статья PubMed Central Google Scholar
Ростами К., Керкхарт Дж., Тимессен Р. и др. Чувствительность антиэндомизиевых и антиглиадиновых антител при нелеченой целиакии: разочарование в клинической практике.Am J Gastroenterol. 1999; 94: 888–94.
CAS PubMed Статья PubMed Central Google Scholar
Shah VH, Rotterdam H, Kotler DP, et al. Все эти гребешки не являются глютеновой болезнью. Gastrointest Endosc. 2000; 51: 717–20.
CAS PubMed Статья PubMed Central Google Scholar
Гринсон Дж. К. Патология биопсии энтеропатии, не связанной с глютеном.Гистопатология. 2015; 66: 29–36.
PubMed Статья PubMed Central Google Scholar
Де Гаэтани М., Теннисон, Калифорния, Лебволь Б. и др. Атрофия ворсинок и отрицательная серология целиакии: диагностическая и терапевтическая дилемма. Am J Gastroenterol. 2013; 108: 647–53.
Артикул CAS Google Scholar
Азиз И., Пиралли М.Ф., Барнс Дж. Х. и др. Клинико-фенотипическая оценка серонегативной атрофии ворсинок; предполагаемый опыт британского центра по оценке 200 взрослых случаев за 15-летний период (2000-2015).Кишечник. 2017; 66: 1563–72.
CAS PubMed Статья PubMed Central Google Scholar
Дьюар Д.Х., Доннелли С.К., Маклафлин С.Д. и др. Целиакия: лечение стойких симптомов у пациентов, соблюдающих безглютеновую диету. Мир Дж. Гастроэнтерол. 2012; 18: 1348–56.
PubMed PubMed Central Статья Google Scholar
Rubio-Tapia A, Ludvigsson JF, Choung RS, et al.Повышенная смертность среди мужчин в возрасте 50 лет и старше с повышенным уровнем антител IgA к трансглутаминазе: NHANES III. BMC Gastroenterol. 2016; 16: 136.
PubMed PubMed Central Статья CAS Google Scholar
Biagi F, Gobbi P, Marchese A, et al. Низкая частота, но плохой прогноз осложненной целиакии: ретроспективное многоцентровое исследование. Dig Liver Dis. 2014; 46: 227–30.
PubMed Статья PubMed Central Google Scholar
Аль-Тома А., Геррес М.С., Мейер Дж. В. и др. Гомозиготность лейкоцитарного антигена DQ2 человека и развитие рефрактерной целиакии и Т-клеточной лимфомы, ассоциированной с энтеропатией. Clin Gastroenterol Hepatol. 2006; 4: 315–9.
CAS PubMed Статья PubMed Central Google Scholar
Ди Сабатино А., Брунетти Л., Карневале Маффе Дж. И др. Стоит ли исследовать функцию селезенки у пациентов с глютеновой болезнью? Мир Дж. Гастроэнтерол.2013; 19: 2313–8.
PubMed PubMed Central Статья Google Scholar
Рошан Б., Леффлер Д.А., Джамма С. и др. Заболеваемость и клинический спектр рефрактерной целиакии в североамериканском специализированном центре. Am J Gastroenterol. 2011; 106: 923–8.
PubMed Статья PubMed Central Google Scholar
Маламут Г., Афчейн П., Веркарре В. и др.Представление и отдаленное наблюдение при рефрактерной целиакии: сравнение типа I с типом II. Гастроэнтерология. 2009; 136: 81–90.
PubMed Статья PubMed Central Google Scholar
Nasr I, Nasr I, Campling H, Ciclitira PJ. Подход к пациентам с рефрактерной глютеновой болезнью. F1000Res. 2016; 5. https://doi.org/10.12688/f1000research.9051.1.
Артикул CAS Google Scholar
Наср I, Наср I, Бейерс С. и др. Распознавание и лечение рефрактерной целиакии: опыт третичного центра. Питательные вещества. 2015; 7: 9896–907.
CAS PubMed PubMed Central Статья Google Scholar
Уильямс М.Дж., Сазерленд Д.Х., Кларк К.Г. Лимфосаркома тонкого кишечника с синдромом мальабсорбции и кишечным пневматозом. Отчет о случае пероральной биопсии тощей кишки. Гастроэнтерология.1963; 45: 550e7.
Артикул Google Scholar
Silano M, Volta U, Mecchia AM, et al. Поздняя диагностика целиакии увеличивает риск рака. BMC Gastroenterol. 2007; 7: 8.
PubMed PubMed Central Статья Google Scholar
Маламут Г., Селье С. Осложнения целиакии. Лучшие Практики Рес Клин Гастроэнтерол. 2015; 29: 451–8.
CAS PubMed Статья PubMed Central Google Scholar
Cheminant M, Bruneau J, Malamut G, et al. NKp46 является диагностическим биомаркером и может быть терапевтической мишенью при лимфопролиферативных заболеваниях Т-лимфоцитов желудочно-кишечного тракта: исследование CELAC. Кишечник. 2018. https://doi.org/10.1136/gutjnl-2018-317371.
PubMed Статья PubMed Central Google Scholar
Ilus T, Kaukinen K, Virta LJ, et al. Заболеваемость злокачественными новообразованиями у пациентов с диагнозом целиакия: популяционная оценка. Am J Gastroenterol. 2014; 109: 1471–7.
PubMed Статья PubMed Central Google Scholar
Caio G, Volta U, Ursini F, et al. Аденокарцинома тонкой кишки как осложнение целиакии: клинико-диагностические особенности. BMC Gastroenterol. 2019; 19:45.
PubMed PubMed Central Статья Google Scholar
Catassi C, Copparoni R, Corazza GR и др. Протокол по диагностике последующего наблюдения за малаттией целиакией. Официальная газета делла Итальянская Республика, Общая серия № 191 от 19 августа 2015 г., стр. 148–58.
Tortora R, Capone P, De Stefano G, et al. Метаболический синдром у пациентов с глютеновой болезнью, соблюдающих безглютеновую диету. Алимент Pharmacol Ther. 2015; 41: 352–9.
CAS PubMed Статья PubMed Central Google Scholar
Рейли Н.Р., Лебволь Б., Хульткранц Р. и др. Повышенный риск неалкогольной жировой болезни печени после диагностики целиакии. J Hepatol. 2015; 62: 1405–11.
PubMed PubMed Central Статья Google Scholar
Лаурикка П., Салми Т., Коллин П. и др. Желудочно-кишечные симптомы у пациентов с глютеновой болезнью, длительно соблюдающих безглютеновую диету. Питательные вещества. 2016; 14: 8.
Google Scholar
Thompson T. Содержание фолиевой кислоты, железа и пищевых волокон в безглютеновой диете. J Am Diet Assoc. 2000; 100: 1389–96.
CAS PubMed Статья PubMed Central Google Scholar
Карроччо А., Амброзиано Дж., Ди Прима Л. и др. Клинические симптомы у пациентов с глютеновой болезнью, соблюдающих безглютеновую диету. Сканд Дж Гастроэнтерол. 2008; 43: 1315–21.
PubMed Статья PubMed Central Google Scholar
Valitutti F, Trovato CM, Montuori M, Cucchiara S. Детская глютеновая болезнь: наблюдение в центре внимания. Adv Nutr. 2017; 8: 356–61.
PubMed PubMed Central Статья Google Scholar
Mubarak A, Oudshoorn JH, Kneepkens CM, et al. Ребенок с рефрактерной глютеновой болезнью. J Педиатр Гастроэнтерол Нутр. 2011; 53: 216–8.
CAS PubMed Статья PubMed Central Google Scholar
West J, Logan RF, Card TR и др. Риск сосудистых заболеваний у взрослых с диагностированной целиакией: популяционное исследование. Алимент Pharmacol Ther. 2004; 20: 73–9.
CAS PubMed Статья PubMed Central Google Scholar
Hallert C, Grant C, Grehn S, et al. Доказательства низкого витаминного статуса у пациентов с глютеновой болезнью, соблюдающих безглютеновую диету в течение 10 лет. Алимент Pharmacol Ther. 2002; 16: 1333–9.
CAS PubMed Статья PubMed Central Google Scholar
Midhagen G, Hallert C. Высокая частота желудочно-кишечных симптомов у пациентов с глютеновой болезнью, живущих на безглютеновой диете: контролируемое исследование. Am J Gastroenterol. 2003. 98: 2023–206.
CAS PubMed Статья PubMed Central Google Scholar
Роос С., Кернер А., Халлерт С. Психологическое благополучие взрослых пациентов с глютеновой болезнью, леченных в течение 10 лет. Dig Liver Dis. 2006; 38: 177–80.
CAS PubMed Статья PubMed Central Google Scholar
Азиз I, Эванс К.Е., Папагеоргиу В., Сандерс Д.С. Ищут ли пациенты с глютеновой болезнью альтернативные методы лечения безглютеновой диете? J Gastrointestin Liver Dis. 2011; 20: 27–31.
PubMed PubMed Central Google Scholar
McCarville JL, Caminero A, Verdu EF. Фармакологические подходы к целиакии. Curr Opin Pharmacol. 2015; 25: 7–12.
CAS PubMed Статья PubMed Central Google Scholar
Леффлер Д.А., Келли С.П., Грин PH и др. Ларазотида ацетат при стойких симптомах целиакии, несмотря на безглютеновую диету: рандомизированное контролируемое исследование. Гастроэнтерология. 2015; 148: 1311–9.
CAS PubMed PubMed Central Статья Google Scholar
Lähdeaho ML, Kaukinen K, Laurila K, et al. Глютеназа ALV003 ослабляет повреждение слизистой оболочки, вызванное глютеном, у пациентов с глютеновой болезнью. Гастроэнтерология.2014; 146: 1649–58.
PubMed Статья CAS PubMed Central Google Scholar
Gottlieb K, Dawson J, Hussain F, Murray JA. Разработка лекарств от целиакии: обзор конечных точек для исследований фазы 2 и 3. Gastroenterol Rep. 2015; 3: 91–102.
Артикул Google Scholar
Мюррей Дж. А., Келли С. П., Грин PHR и др. Нет разницы между латиглутеназой и плацебо в снижении атрофии ворсинок или улучшении симптомов у пациентов с симптоматической глютеновой болезнью.Гастроэнтерология. 2017; 152: 787–98.
CAS PubMed Статья PubMed Central Google Scholar
Андерсон Р.П., Джабри Б. Вакцина против аутоиммунного заболевания: антиген-специфическая иммунотерапия. Curr Opin Immunol. 2013; 25: 410–7.
CAS PubMed PubMed Central Статья Google Scholar
Лионетти Э., Кастелланета С., Франкавилла Р. и др.Способ родов и риск глютеновой болезни: риск глютеновой болезни и возраст когортного исследования введения глютена. J Pediatr. 2017; 184: 81–6.
PubMed Статья PubMed Central Google Scholar
Колецко С., Ли Х.С., Бейерлейн А. и др. Кесарево сечение о риске глютеновой болезни у детей: плюшевое исследование. J Педиатр Гастроэнтерол Нутр. 2018; 66: 417–24.
PubMed PubMed Central Статья Google Scholar
Диденсборг Сандер С., Хансен А.В., Стёрдал К. и др. Способ доставки не связан с глютеновой болезнью. Clin Epidemiol. 2018; 10: 323–32.
PubMed PubMed Central Статья Google Scholar
Сильвестр Дж. А., Леффлер Д. А.. Аутоиммунитет заразен? Влияние вирусных инфекций желудочно-кишечного тракта и вакцинации на риск аутоиммунитета к целиакии. Clin Gastroenterol Hepatol. 2017; 15: 703–5.
PubMed Статья PubMed Central Google Scholar
Леонард М.М., Камхи С., Хуэдо-Медина Т.Д., Фазано А. Дизайн исследования геномной, окружающей среды, микробиома и метаболизма целиакии (CDGEMM): подход к будущему персонализированной профилактики целиакии. Питательные вещества. 2015; 7: 9325–36.
CAS PubMed PubMed Central Статья Google Scholar
Hujoel IA, Van Dyke CT, Brantner T, et al. Естественный анамнез и клиническое выявление недиагностированной целиакии в североамериканском сообществе.Алимент Pharmacol Ther. 2018; 47: 1358–66.
CAS PubMed PubMed Central Статья Google Scholar
Скрининг целиакии | Центр глютеновой болезни Чикагского университета
Люди с глютеновой болезнью, которые едят глютен, имеют более высокие, чем обычно, уровни определенных антител в их кровь. Антитела вырабатываются иммунной системой в ответ на вещества, которые организм воспринимает. быть угрозой.Думайте об антителах как о солдатах, которым приказано сражаться с конкретным врагом, только в случае аутоиммунное заболевание, такое как глютеновая болезнь, враг на самом деле то, что безвредно для людей без болезнь — в данном случае белки пшеницы, ржи и ячменя, известные как «глютен».
Тестирование антител: только первый шаг
Чтобы диагностировать целиакию, врачи сначала проводят анализ крови для определения уровня определенных антител. Эти антитела:
- Анти-тканевая трансглутаминаза (tTG)
- Антиэндомизий (EMA)
- Анти-дезамидированные пептиды глиадина (DGP)
Положительный тест на антитела предполагает, что у человека может быть глютеновая болезнь, но это не окончательный результат; Для подтверждения диагноза потребуется биопсия.
Ваш врач может назначить один или несколько тестов на антитела, указанных выше («панель»), для помощи в диагностике.
Какие тесты мне нужны?
Если мой положительный тест на антитела предполагает, что у меня глютеновая болезнь, как мне узнать наверняка?
Если тесты на антитела и / или симптомы указывают на глютеновую болезнь, врач должен подтвердить диагноз, взяв крошечные кусочки ткани из тонкой кишки, чтобы проверить наличие повреждений ворсинок. Это делается во время процедуры эндоскопической биопсии.Под седацией врач вводит длинную тонкую трубку, называемую эндоскопом, через рот и желудок в тонкий кишечник, а затем берет образцы ткани с помощью небольших инструментов, пропущенных через эндоскоп.
Несмотря на то, что анализы крови достаточно точны, они могут иногда давать ложноположительные результаты (когда человек, не страдающий глютеновой болезнью, получает положительный результат теста) или, реже, ложноотрицательные результаты (когда человек с глютеновой болезнью получает нормальный результат). результат испытаний).Таким образом, биопсия тонкой кишки — единственный способ диагностировать целиакию.
Что мне делать, если у меня отрицательный анализ крови (или анализ крови), но симптомы не исчезают?
Хотя это случается редко, пациенты могут иметь отрицательные результаты теста на антитела, но при этом страдают глютеновой болезнью. Дефицит IgA — один из примеров, когда это могло произойти. Дальнейшее медицинское обследование важно для любого, кто все еще испытывает симптомы, чтобы установить диагноз или исключить целиакию в рамках постановки другого диагноза.
Узнай наверняка
Тесты на антитела точны только в том случае, если пациент соблюдает глютеносодержащую диету. Тем, кто обеспокоен глютеновой болезнью, настоятельно не рекомендуется переходить на безглютеновую диету без точного диагноза. Любое изменение диеты, даже на один-два месяца, может усложнить диагностический процесс.
Отборочный тест
Анти-тканевая трансглутаминаза (tTG-IgA)
Скрининговый тест обычно используется, когда человек находится в группе риска по глютеновой болезни, независимо от того, есть ли у него симптомы или нет.Тест tTGIgA обычно предлагается при обследовании на целиакию, так как это наиболее чувствительный тест из имеющихся. Фактически, обычно считается, что около 98% людей с глютеновой болезнью имеют положительный тест на тТГ. Хотя тест tTG очень специфичен, он также может иногда давать ложноположительные результаты. Действительно, некоторые люди с диабетом 1 типа, тиреоидитом Хашимото и аутоиммунными заболеваниями печени особенно склонны иметь повышенный уровень ТТГ без целиакии.
Прочие испытания
- Общий сывороточный IgA — тест на дефицит IgA (это состояние здоровья иногда может влиять на точность других тестов на антитела
- Тест на антиэндомизиальные антитела (EMA-IgA) — тест, специфичный для целиакии.Считается, что человек с повышенным уровнем EMA имеет почти 100% шанс заболеть глютеновой болезнью. Однако этот тест не так чувствителен, как тест tTG-IgA — от 5% до 10% людей с глютеновой болезнью фактически не имеют положительного теста EMA
- HLA-DQ2 и HLA-DQ8 — генные тесты на целиакию
Генные тесты не являются антителами и, следовательно, не зависят от диеты (без глютена или без глютена), которой придерживается человек. В случае отрицательного результата эти генные тесты очень полезны, поскольку в этом случае целиакию можно уверенно исключить на всю жизнь.
Еще кое-что…
Людям с дефицитом IgA требуется другая версия тестов на антитела, перечисленных слева. Тесты tTG и EMA имеют версии IgG, и эти тесты будут точными для человека с дефицитом IgA. Дефицит IgA диагностируется, когда результаты теста на общий сывороточный IgA человека очень близки к нулю (менее 10 мг / дл). Это не тест на целиакию, а средство для более точной диагностики дефицита IgA
Когда человеку ставят диагноз целиакия, вся семья узнает, что они должны пройти обследование на это заболевание, поскольку теперь они находятся в группе риска.Родственники первой степени родства (родитель, ребенок, брат или сестра) имеют шанс 1 из 22 заболеть глютеновой болезнью в течение своей жизни; у родственников второй степени родства (тетя, дядя, бабушка и дедушка) риск составляет 1 к 39. Простой генетический тест может определить, нужен ли дальнейший скрининг, или он может полностью исключить возможность развития болезни. Если генетический тест положителен на целиакию, человеку следует регулярно проходить скрининг на антитела, чтобы определить, активна ли болезнь и когда, помня, что они вполне могут оставаться свободными от целиакии на всю жизнь.
Что такое генетическое тестирование и кому оно может быть полезно?
ДНК-тестирование доступно (с помощью анализа крови или мазка из щеки), чтобы определить, несет ли человек из группы риска гены, ответственные за развитие целиакии. Эти гены расположены в комплексе HLA-класса II и называются DQ2 и DQB, которые в современных терминах называются DQA1 * 05XX и DQB1 * 02XX для HLA-DQ2 и DQA1 * 03XX и DQB1 * 0302 для HLA-DQ8. Было обнаружено, что каждый случай целиакии демонстрирует эти так называемые гаплотипы; следовательно, отрицательный генный тест указывает на то, что глютеновая болезнь не может развиться у этого человека.
Есть две основные причины использования генетического теста при обследовании человека на целиакию. В первом случае необходимо «исключить» целиакию — медицинский термин, указывающий на то, что человек не обладает необходимым фактором риска развития целиакии или не имеет генетической предрасположенности. Без этого фактора у человека с отрицательным результатом генного теста невозможно заболеть целиакией в будущем. Людям с отрицательным результатом теста на ген не требуется регулярный скрининг на антитела до конца своей жизни.Детям взрослых с глютеновой болезнью следует пройти генетический тест, чтобы родители знали, за какими детьми нужно тщательное наблюдение.
Для людей с симптомами, которым не проводилась биопсия для диагностики целиакии, но которые длительное время соблюдали безглютеновую диету, генетический тест часто является единственным способом определить, могут ли симптомы быть связаны с глютеновой болезнью. болезнь. Для человека, который сталкивается с этой ситуацией, отрицательный генный тест указывает на то, что симптомы не являются результатом целиакии.Однако положительный генный тест не диагностирует заболевание, но увеличивает вероятность его наличия.
Если у меня есть ген глютеновой болезни, означает ли это, что у меня глютеновая болезнь?
Генный тест не диагностирует целиакию. Он помещает человека в группу риска по глютеновой болезни, что указывает на то, что в будущем за человеком следует внимательно следить с тестированием на антитела. Когда генетическая предрасположенность к целиакии была впервые обнаружена (на хромосоме 6), исследователи отметили, что наличие генов необходимо для развития болезни, но это не единственный фактор.Фактически, до одной трети населения США имеет гены целиакии. Это означает, что у людей с DQ2 или DQ8 может развиться глютеновая болезнь в любое время.
Чем генетическое тестирование отличается от тестирования на антитела при целиакии?
Анализы крови, с которыми знакомо большинство людей с глютеновой болезнью, — это тесты на антитела. Эти тесты, такие как тест тканевой трансглутаминазы (tTG) или тест на антиэндомизиальные (EMA) антитела, измеряют аутоиммунный ответ, вызванный глютеном, который возникает в определенный момент времени.(Думайте об этом как о фотографии.) Это важные тесты, потому что они характеризуют степень, в которой иммунная система реагирует на глютен.
В отличие от тестирования на антитела, тестирование гена HLA на целиакию измеряет наличие или отсутствие генетически запрограммированных молекул, которые находятся на поверхности некоторых клеток. Тест гена HLA на целиакию можно выполнить в любое время после рождения (и даже на пуповинной крови при рождении) — человек рождается с этими факторами или без них, и это не меняется со временем.
Как наследуется генетическая предрасположенность к целиакии?
Наследование генов целиакии происходит иначе, чем то, как передаются многие генетические признаки. Мы привыкли мыслить категориями доминантных или рецессивных генов, которые унаследованы от обоих родителей и образуют наборы для определения цвета волос, роста и других характеристик здоровья человека. Фактически, даже если гены DQ2 и DQ8 передаются одинаково, их наличия недостаточно для определения возникновения заболевания, даже если гены унаследованы от обоих родителей.
Поскольку 35% населения Америки имеют ген DQ2 (чаще) или DQ8, двое пострадавших могут жениться друг на друге. Гены могут передаваться как самцами, так и самками. Следовательно, генетический тест одного человека не обязательно означает, что другая сторона семьи также не затронута.
Кто может заказать генетический тест? Должен ли он поступать в специальную лабораторию? Сколько это стоит?
Генетическое тестирование доступно у большинства врачей.Большинство основных диагностических лабораторий в Соединенных Штатах имеют возможность проводить HLA-тестирование на целиакию. Kimball Genetics, подразделение LabCorp, также предлагает тест с использованием мазка из щеки, а не образца крови. Все больше и больше страховых компаний покрывают стоимость теста, особенно если тестируемый человек имеет фактор риска заболевания.
Должен ли я есть глютен, чтобы генетический тест был достоверным?
Нет, на присутствие или отсутствие генетических факторов диета не влияет на генетический тест, который отличается от тестов на антитела, которые зависят от определения глютена в рационе.
Антитела к тканевой трансглутаминазе, не связанные с потреблением глютена
ВведениеАнтитела против тканевой трансглутаминазы (tTG) очень специфичны для диагностики целиакии (CD) .1,2 Фактически, благодаря усовершенствованию серологических методов обнаружения этих маркеров и в соответствии с новыми диагностическими критериями Европейское общество детской гастроэнтерологии, гепатологии и питания (ESPGHAN) 2012 г., при определенных обстоятельствах может быть даже возможно отказаться от выполнения биопсии кишечника для диагностики БК.3
Однако, несмотря на высокую специфичность антител против tTG к CD, были сообщения о наличии этих антител у пациентов без CD. Патогенные механизмы, с помощью которых вырабатываются эти антитела, полностью не известны, но они, по-видимому, различаются между людьми с CD и людьми без них. Одним из возможных предложенных механизмов является «модель-носитель гаптена», с помощью которой глиадин будет образовывать комплекс с трансглутаминазой в слизистой оболочке кишечника, образуя агрегаты макромолекул, которые после процессинга B-клетками приводят к синтезу антител против tTG.Эти В-клетки с антителами, специфичными к тТГ, вероятно, будут присутствовать у всех людей, но зависят от помощи Т-клеток, чтобы начать секретировать иммуноглобулин.4 Другая гипотеза заключается в том, что продукция трансглутаминазы активируется в областях воспаления и может генерировать новые антигенные эпитопы. путем сшивания или дезамидирования нативных белков или белков из экзогенных источников, таких как вирусы, бактерии или продукты питания5
Сообщалось о временном повышении уровня антител против tTG при некоторых аутоиммунных заболеваниях и у пациентов с воспалительными заболеваниями кишечника.6 Ди Тола и др. (7) в своем исследовании обнаружили повышение уровня антител против tTG более чем у 50% пациентов с воспалительным заболеванием кишечника, у всех из которых были отрицательные результаты в тесте на антиэндомизиальные антитела (EMA) и низкие титры антитела против tTG по сравнению с пациентами с CD; кроме того, они обнаружили связь между титрами антител и активностью заболевания.
С другой стороны, некоторые инфекционные агенты могут играть роль в выработке антител против tTG. В проспективном исследовании Ferrara et al.8 нашли доказательства временной продукции анти-tTG в контексте инфекционного заболевания (вирус Эпштейна – Барра и инфекция, вызванная вирусом Коксаки) у пациентов с CD и без нее. Продукция антител против tTG будет отражать иммунологический процесс, запускаемый сверхэкспрессией аутоантигенов или вирусной инфекцией. Ни у одного из пациентов с положительным результатом теста на антитела к tTG не было положительных результатов на EMA, что подтверждает гипотезу о том, что иммунологические механизмы, лежащие в основе продукции антител против tTG, отличаются у лиц с CD по сравнению с пациентами без него.
Наконец, в литературе есть доказательства того, что некоторые пищевые белки, такие как белок коровьего молока (БКМ), могут вызывать желудочно-кишечные симптомы у некоторых пациентов с БК. Белки крупного рогатого скота могут вызывать воспалительную реакцию слизистой оболочки пациентов с глютеновой болезнью. Эта чувствительность к казеину у пациентов с БК, по-видимому, опосредована врожденным иммунным ответом.9 Эти симптомы нельзя объяснить присутствием глютена в коровьем молоке, поскольку глютен не обнаружен в молоке коров, которых кормили пшеницей.10 Вместо этого кажется, что этот ответ связан с присутствием эпитопов, общих для глиадинов и бычьих казеинов, которые распознаются антителами иммуноглобулина A (IgA) к глиадину (AGA) .11,12 Казеин также был идентифицирован как потенциальный пусковой механизм. при других аутоиммунных заболеваниях.13
Целью нашего исследования было оценить наличие положительного уровня анти-tTG-антител, не связанного с потреблением глютена, в группе пациентов, находящихся под наблюдением при подозрении на БК.
Пациенты и методыМы провели ретроспективное обсервационное исследование, изучив случаи всех пациентов, лечившихся в амбулаторных клиниках нашей больницы в период с 2002 по 2010 год, у которых изначально подозревался БК, но серологические паттерны которых были нетипичными во время наблюдения, т. изменения уровней антител к тТГ не были связаны с потреблением глютена.
Критерии включения: повышение уровня антител против tTG или IgA к глиадину в начале наблюдения и прохождение биопсии кишечника. Мы исключили пациентов с подтвержденной инфекционной этиологией повышения уровня антител и пациентов, которые не проходили генетическое тестирование. В группу А вошли пациенты с характерными гистологическими особенностями биопсии кишечника, у которых диагноз БК был поставлен на основании критериев EPSGHAN 1990. В этой группе серологический образец считался атипичным в случае повышения уровня антител к tTG, несмотря на безглютеновую диету.В группу B вошли пациенты с нормальной биопсией кишечника, которые были помещены на диету без CMP для диагностических целей из-за подозрения на не-IgE-опосредованную аллергию на CMP. Диагноз аллергии на CMP был клиническим и основывался на улучшении симптомов после исключения CMP и последующего рецидива при контрольном тесте; Тест на радиоаллергоабсорбент (RAST) на аллергию на коровье молоко был отрицательным у всех пациентов, у которых он был запрошен. В этой группе серологическая картина считалась атипичной, если уровни анти-tTG-антител снижались при исключении CMP из рациона, несмотря на то, что не исключали глютен.
Антитела IgA к tTG измеряли с помощью автоматического метода иммуноферментного анализа флуоресценции (EliA CeliKey, Phadia-Thermo Fisher; интерпретация: отрицательный
U, положительный> 10 U). Мы определили сильный положительный результат (++) как титр, превышающий верхний предел нормы более чем в 10 раз (> 100U), и слабоположительный результат (+) как положительный результат с титром менее чем в 10 раз превышающим верхний предел нормы. нормальный (> 7U и> 100U). Антитела IgA к глиадину измеряли с помощью собственного метода ELISA.Референсный диапазон, выраженный в условных единицах (AU), составлял менее 0,3 AU у детей и менее 0,6 AU у взрослых14.Антитела к дезамидированному пептиду глиадина измеряли с помощью автоматического иммуноферментного метода флуоресценции (EliA AGP Phadia-Thermo Фишера; интерпретация: отрицательная
U, положительная> 10 U). Наличие антител IgA к ЕМА оценивали с помощью непрямой иммунофлуоресценции с использованием срезов пищевода обезьяны в качестве субстрата (Biosystems). Каждый тест включал положительный и отрицательный контроль.Сыворотку разводили 1: 5 и инкубировали в течение 30 минут в темной влажной камере с последующей инкубацией с FITC-конъюгированным антителом против человеческого IgA, разведенным до 1:20, в течение 30 минут. Срезы помещали на предметные стекла для проведения слепой флуоресцентной микроскопии (Motic Trinocular BA400, оснащенный фильтрующим кубом Motic FITC FLUO 3).Типирование лейкоцитарного антигена человека (HLA) проводили с помощью полимеразной реакции для обнаружения аллелей DRB1, DQA1 или DQB1.
Гистологические находки были классифицированы в соответствии с классификацией Марша, модифицированной Оберхубером.15 Для обнаружения субэпителиальных отложений IgA против tTG из образцов кишечной биопсии получали срезы размером 5 мкм, замораживали свежими, помещали на предметные стекла SuperFrost и инкубировали (15 мин, влажная камера, комнатная температура) последовательно с: мышиным моноклональным антителом к трансглутаминазе 2 ( Разведение 1: 200), TRITC-конъюгированные кроличьи антитела против иммуноглобулина мыши (разведение 1: 120) и FITC-конъюгированные поликлональные кроличьи антитела против человеческого IgA (разведение 1:40). После этого была проведена слепая флуоресцентная микроскопия с использованием программного обеспечения для наложения изображений (Motic Images Plus 2.0).
Мы провели ретроспективный обзор медицинских карт этих пациентов, извлекая данные о возрасте на момент постановки диагноза, симптомах, уровнях антител к tTG, типе HLA, гистологических характеристиках на основе классификации Марша-Оберхубера и изменениях симптомов и уровней антитела IgA к tTG, AGA и EMA в зависимости от наличия глютена или CMP в рационе. Мы также извлекли данные, записанные во время наблюдения, чтобы проанализировать изменения этих параметров и попытаться поставить точный диагноз.
Протокол исследования был одобрен этическим комитетом больницы Universitari i Politècnic La Fe (Валенсия).
Мы выразили качественные переменные как абсолютные частоты (n) и проценты, и суммировали качественные переменные как медиана и межквартильный размах (IQR, 25–75 процентиль). Мы использовали программное обеспечение SPSS® 21.0 для анализа данных.
РезультатыИз 629 пациентов с подозрением на БК в период 2002–2010 гг. У 11 (1,7%) наблюдалась атипичная серологическая картина. Мы исключили 2 из этих пациентов в связи с подтверждением инфекционной этиологии (Giardia lamblia и Campylobacter jejuni).Кишечная инфекция была исключена у 9 оставшихся пациентов (1,4%). Средняя продолжительность наблюдения составила 10 лет (IQR, 8–12,5).
Мы разделили пациентов на 2 группы. В группу А вошли 5 пациентов с поражениями типа 3 по Маршу при первичной биопсии, которым был поставлен диагноз БК; Этим пациентам во время постановки диагноза была прописана безглютеновая диета. В группу B вошли оставшиеся 4 пациента, у которых были нормальные результаты первичной биопсии и незначительные гистологические особенности, этих пациентов не просили исключить глютен из своего рациона.
Диета без ХМП была назначена пациентам обеих групп по разным причинам. В группе A причиной диеты было то, что пациенты проявляли проблемы с питанием во время диагностической оценки синдрома кишечной мальабсорбции, а в группе B причиной было подозрение, что причиной желудочно-кишечных симптомов была не-IgE-опосредованная аллергия ( Таблица 1).
В группе А после того, как стали доступны результаты биопсии кишечника и был поставлен диагноз БК, глютен был исключен из рациона.У пациентов наблюдалось снижение уровня антител к tTG. Впоследствии, как только состояние питания этих пациентов улучшилось, CMP был снова включен в рацион, и произошло связанное с этим повышение уровней антител против tTG, которые ранее становились отрицательными, в то время как уровни антител EMA были отрицательными (рис. 1А). Из этих пациентов у одного была диарея, у остальных не было симптомов. Результаты были подтверждены у всех этих пациентов при повторном тестировании различных образцов после исключения несоблюдения безглютеновой диеты (диетическое интервью и отрицательные уровни антител к AGA).После повторного исключения БКМ из рациона серологические маркеры нормализовались. После второго заражения коровьим молоком у пациента 3 по-прежнему были отрицательные результаты анти-tTG, тогда как у пациентов 1, 2 и 4 снова были положительные результаты. Пациент 5 все еще проходит обследование. У 3 из 5 пациентов в этой группе БК была подтверждена при введении глютена (пациенты 1, 2 и 3). Из 2 оставшихся пациентов 1 отказался от провокации с глютеном (пациент 4), а пациент 5 на момент написания этой статьи проходил провокацию с глютеном.У пациентов 1 и 2 сенсибилизация к бычьим белкам сохранялась через 12 и 8 лет наблюдения соответственно (таблица 2). Пациентка 4 потребляет CMP, и ее уровни антител против tTG продолжают оставаться отрицательными, поэтому ее чувствительность к CMP исчезла в течение 5 лет.
В группе B удаление CMP из рациона сопровождалось исчезновением симптомов, при этом значения антител к tTG и EMA стали отрицательными (рис. 1B). У 2 из этих пациентов (6 и 7) серологические маркеры оставались отрицательными, и симптомы не повторялись при повторном введении CMP в диету.С другой стороны, у двух других пациентов (8 и 9) возникли рецидивы симптомов и повышение уровня антител против tTG при повторном введении CMP. Пациент 8 прошел вторую контрольную пробу через год, оставаясь бессимптомным и с отрицательными уровнями антител к tTG. Пациенту 9 была проведена вторая контрольная проба CMP по той же процедуре, после которой тестирование показало дефицит железа и положительные значения анти-tTG и EMA. Это привело к выполнению биопсии кишечника, которая выявила поражения Marsh 3 B и субэпителиальные отложения IgA против tTG в слизистой оболочке кишечника.Несмотря на эти результаты, CMP снова был исключен из рациона с нормализацией значений анти-tTG и EMA. В настоящее время пациенту назначена биопсия кишечника для исключения латентной БК (таблица 3).
ОбсуждениеВ исследуемой выборке мы обнаружили, что повышение уровня антител против tTG происходило как часть иммунного ответа на пищевые белки, отличные от глютена, как у пациентов с глютеновой болезнью (группа A), так и у пациентов без CD (группа B).
У пациентов с CD это повышение уровня антител против tTG совпало с повторным введением CMP в рацион.После исключения потребления глютена как причины этого повышения путем опроса пациентов об их приверженности безглютеновой диете во время последовательных посещений, повышение сохранялось в связи с отрицательными уровнями антител к AGA. В настоящее время недавно внедренные методы обнаружения пептидов глютена в стуле позволят нам подтвердить соблюдение диеты.16
Когда пациенты вернулись к диете без коровьего молока, уровни антител к tTG снова стали отрицательными. Это открытие подтверждает нашу гипотезу о том, что CMP может запускать этот иммунный ответ, как было ранее описано в литературе.Кабрера-Чавес и др. представили гипотезу о том, как определенные эпитопы в CMP могут вызывать симптомы у пациентов с CD. Высокая гомология некоторых пептидов в α- и β-цепях казеинов крупного рогатого скота с пептидами глютена может объяснить эту иммунореактивность IgA.11,12
Этот ответ был временным у 2 из 5 пациентов с CD, пациентов 3 и 4. Однако он сохраняется на сегодняшний день еще у 2, пациентов 1 и 2, в настоящее время в возрасте 12 и 8 лет соответственно, которые с момента постановки диагноза соблюдают безглютеновую диету.У нелеченных пациентов с CD этот ответ можно объяснить повышенным прохождением макромолекул через кишечный барьер. Однако у пациентов с БК на безглютеновой диете со здоровой слизистой кишечника неясно, может ли это быть связано с сохранением повышенной кишечной проницаемости или с другими провоспалительными факторами.7
Все пациенты с БК, у которых это ответ наблюдался при соблюдении диеты без CMP, что могло быть причиной последующей реактивности.Кроме того, все они были в возрасте 2 лет или меньше, возрастная группа, в которой наблюдается повышенная реактивность к диетическим антигенам.17,18 Таким образом, мы должны рассмотреть вопрос о том, следует ли избегать диеты без CMP у пациентов, у которых сильно подозревается CD.
Атипичная серологическая картина у пациентов в группе B могла быть связана с различными механизмами, поскольку не было доказательств того, что у них была CD, хотя все они имели типы HLA, связанные с более высоким риском CD. Как описано в литературе, некоторые инфекционные агенты также могут запускать этот иммунный ответ, что приводит к повышению уровня антител против tTG у пациентов без CD.8 Тем не менее, мы не нашли в литературе никаких упоминаний о пищевых белках крупного рогатого скота как о потенциальном триггере повышения уровня антител к tTG у пациентов без целиакии, как это было в случае пациентов из группы B нашего исследования. Все эти пациенты были носителями HLA-DQ2 или DQ8. Может ли казеин играть роль, аналогичную глиадину, у пациентов с БК, только не повреждая слизистую оболочку кишечника? Как мы отмечали выше, иммунный ответ на казеин может быть вовлечен в патогенез некоторых аутоиммунных заболеваний, таких как болезнь Бехчета, посредством модуляции Т-клеток и макрофагов.13
В 80% нашей выборки этот ответ был временным. Однако у пациента 9 реакция сохранялась с возможным повреждением слизистой оболочки кишечника, включая признаки отложений IgA, так что нельзя исключать латентную CD.
В дополнение к повышению уровней антител против tTG, у пациента 8 были положительные значения AGA и EMA, которые впоследствии разрешились без гистологических доказательств CD и постоянной серологической нормализации с диетой, из которой не исключался глютен. У пациента 7 также были временные положительные значения AGA.Это можно объяснить повышенной проницаемостью кишечника у детей с воспалением, вторичным по отношению к инфекции или пищевой аллергии. У этих пациентов процесс, вызвавший развитие не-IgE-опосредованной аллергии на БКМ, вероятно, был инфекционным гастроэнтеритом, поскольку оба пациента ранее без проблем принимали БКМ, и непереносимость появилась в 32 и 18 месяцев. Сама инфекция также могла быть причиной повышения этих маркеров, как было описано ранее.19
Приверженность строгой диете без CMP является сложной задачей в современном обществе, возможно, более сложной, чем соблюдение безглютеновой диеты. Маркировка пищевых продуктов сбивает с толку. Белок коровьего молока может присутствовать во всех типах пищевых продуктов в виде различных добавок, названия которых неясны. Таким образом, было бы полезно знать маркер, который мог бы помочь определить, может ли этот иммунный ответ быть вызван БКМ у пациентов с глютеновой болезнью, у которых было исключено несоблюдение безглютеновой диеты, прежде чем добавлять дополнительные ограничения на диету. .С другой стороны, поскольку это, по-видимому, IgA-опосредованная реакция, можно ожидать, что у этих пациентов будут более высокие уровни казеин-специфического IgA. Опубликованные данные по этому вопросу показывают, что антитела IgG и IgA к бычьим белкам больше повышены у пациентов с нелеченым CD по сравнению с пациентами с CD после безглютеновой диеты и с зажившей слизистой оболочкой, у которых наблюдается более низкий уровень антител, 17 хотя дальнейшие исследования необходимо для подтверждения этой ассоциации.
Выборка в нашем исследовании была небольшой, так как мы включали только пациентов, перенесших биопсию кишечника в одной больнице.Однако длительное наблюдение позволило нам выявить эту нетипичную картину.
По нашему опыту, у некоторых пациентов с CD повторное введение CMP в рацион после периода исключения вызывало повышение уровней антител IgA к tTG, которое в большинстве случаев протекало бессимптомно. Мы считаем, что после исключения несоблюдения безглютеновой диеты БКМ следует рассматривать как потенциальный триггер этого иммунного ответа.


 Поскольку радиоактивный йод и технеций обладает свойством захватываться щитовидной железой, уровень их накопления повышается при чрезмерной выработке гормонов, которая происходит при Базедовой болезни.
Поскольку радиоактивный йод и технеций обладает свойством захватываться щитовидной железой, уровень их накопления повышается при чрезмерной выработке гормонов, которая происходит при Базедовой болезни.