Водородный показатель значении — Справочник химика 21
Нанример, если [Н+] = 10- , то pH = — 10 = 5. В нейтральной среде, где [Н+] = 10″ pH = 7 в кис 10й среде [Н+] > 10 и р.Н щелочной среде Н+] 7. Чем выше концентрация водородных ионов, тем меньше pH. Водородный показатель может быть больше 14, а также может принимать отрицательные значення (в очень кислой среде). [c.256]Для 0,005 и 0,05 М водных растворов серной кислоты при 298 К определены значения pH 2,10 и 1,2 соответственно. Вычислите водородный показатель этого раствора, используя данные о средних ионных и ионных коэффициентах активности. [c.298]
Зная концентрацию (активность) водородных ионов Н+ в растворе, можно определить водородный показатель (pH) и, наоборот, можно определить концентрацию Н+-ионов по известному значению pH. [c.204]
Не менее важное значение имеет водородный показатель в химической технологии. В частности, под влиянием pH могут изменяться растворимость, фильтрация. вязкость, поверхностное натяжение, осмотическое давление, набухание и другие свойства. Вот почему определение концентрации водородных ионов (точнее,, измерение pH) нашло применение во всех областях не только биологии, но и химии, агрохимии, биохимии, почвоведения, физиологии растений и животных, микробиологии, медицины и в других областях науки и практики.
Если, например, [Н+1 = 10″ , то pH = —lg 10 = 5. В нейтральной среде, где [Н ] = 10 , pH = 7 в кислой среде, где [Н+] > 10 , pH щелочной среде, где [Н+1 7. Чем выше концентрация водородных ионов, тем меньше pH. В качестве примера рассчитаем pH раствора, в котором [Н» ] = 2-10 . В соответствии с (IV.36) получаем pH = —lg 2 + 7 = 6,7. Водородный показатель может быть больше 14, а также может принимать отрицательные значения (в очень кислой среде). [c.194]
Водородный показатель. Значение pH в биологии, медицине и сельском хозяйстве [c.153]
Рассчитайте значение ПР гидроксида металла M(OH)j, если известен водородный показатель его насыщенного раствора при 25° С а) 9,54 б) 9,17 [c.144]
Чем выше концентрация водородных ионов, тем меньше pH. Водородный показатель может быть немного больше 14 (в сильнощелочной среде), а также может принимать отрицательные значения (в очень кислой среде). [c.274]
Что представляет собой шкала водородного показателя pH и как она используется Имеет ли сильная кислота большое значение pH или. наоборот, маленькое Имеет она высокое или низкое значение рОН Допустим, что pH раствора равен 3 каковы его рОН и концентрации водородных и гидроксидных ионов [c.258]
Водородный показатель — pH имеет большое значение в химических и биологических процессах, так как в зависимости от реакции среды эти процессы могут протекать с различными скоростями и направлением.
Для определения pH растворов перечисленных солей в стакан емкостью 50 мл налейте приблизительно 40 мл раствора исследуемой соли. Прежде чем измерять pH, электроды прибора 2—3 раза сполосните дистиллированной водой. После этого переключатель рН-метра установите в положение pH 1—14. По этой шкале найдите ориентировочное значение pH раствора. Затем перейдите на более чувствительный диапазон измерений. Определите и запишите точное значение pH. Зная исходную концентрацию растворов исследуемых солей, константы диссоциации гидроксидов, образующих эти соли, легко рассчитать теоретическое значение водородного показателя для каждой соли. [c.64]
Выполнение. Поставить ряд стаканов (белый фон ). Налить в каждый одинаковое количество воды и универсального индикатора. Затем внести небольшое количество кристалликов различных солей (каждую соль отдельно ). Размешивая палочками, соли растворить. Изменение окраски растворов указывает на смещение химического равновесия, а сравнение с окраской стандартных растворов позволяет оценить значение водородного показателя. [c.87]
Вместо самих значений концентраций ионов водорода пользуются их логарифмами с обратным знаком. Эту величину называют водородным показателем (pH), он определяется соотношением pH —lg [Н+] или, если [Н+] обозначена через сн, pH [c.52]
В любых водных растворах имеются гидроксид-ионы и ионы водорода, но в таких концентрациях, что их произведение равняется 10 . При повышении температуры значение/Св увеличивается, но при температурах, близких к комнатной, этим увеличением можно пренебречь. В чистой воде [Н+] равна 10″ . В этом случае среда является нейтральной при [Н+] меньше 10″ —щелочной, а при 1Н+] больше 10″- — кислой. Вместо концентрации ионов водорода часто пользуются водородным показателем (pH) [c.127]
Для количественной характеристики кислотных, основных и нейтральных свойств служит шкала водородных показателей pH. Значения этой шкалы
Для раствора, содержащего 0,9 моль КС1 и 0,01 моль НС на, 1000 г воды, вычислите водородный показатель pH. Опытное значение pH 2,078. [c.307]
Эмульсии имеют значение водородного показателя на уровне 2-7. В качестве эмульгаторов используются сульфированные моно-, ди- и трикарбоксижирные кислоты, твердые кислоты, лигнин и полиамины «. Запатентованы и некоторые другие эмульгаторы, например, в патенте DE 2737986 предложен эмульгатор для быстро-распадающихся эмульсий, получаемый конденсацией диэти.лент-риамина и триэтиленамина с жирной кислотой 12- 18 (йодное число около 25) при 160-180°С и последующей циклизацией продукта конденсации при 190-240°С. На основе этого эмульгатора создана эмульсия с содержанием битума 180/220 60% масс., эмульгатора 0.2-2.0% масс., остальное — вода, подкисленная соляной кислотой до рН=2-2.5. [c.85]
Поскольку значения [Н ] (или [ОН ]) в химии растворов используются очень часто, то для удобства введено представление о водородном показателе (символ — pH). [c.74]
Величина ионного произведения позволяет характеризовать все растворы (кислые, нейтральные и щелочные) значением концентрации водородных ионов. В большинстве случаев главный интерес представляет порядок величины, т. е. показатель степени концентрации водородных ионов. Поэтому для различных практических целей удобно пользоваться так называемым водородным показателем [c.292]
Для оценки кислотности, нейтральности и щелочности водных растворов удобно пользоваться не концентрацией водородных ионов, а водородным показателем pH. Он равен десятичному логарифму значения молярной концентрации водородных ионов, взятому с обратным знаком [c.273]
Задачи работы рассчитать значения водородного показателя (pH) буферных н небуферных растворов на основе измеренных в работе 21 значений ЭДС гальванических элементов найти активную кислотность ан . &ensp
31.Эксперементальное определение водородного показателя
Многие органические вещества могут изменять свой цвет в зависимости от кислотности. Самый известный подобный «индикатор» это чай. Когда вы бросаете в стакан с крепким коричневым чаем ломтик лимона, чай в стакане становится значительно светлее. При снижении pH, то есть при увеличении кислотности благодаря лимонной кислоте чай меняет свою окраску на более светлую.
Другим не менее известным «индикатором» является сок столовой свеклы. Хозяйки давно знают его способность принимать более насыщенный красный цвет в кислой среде. После того как борщ практически готов и имеет оранжевый цвет добавьте в него немного уксуса и прямо на глазах ваше блюдо окрасится в ярко красный цвет.
Сейчас наиболее известными индикаторами в химии являются лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и ряд других.
Эти индикаторы могут иметь два цвета в зависимости от кислотности среды. Цвет для каждого из индикаторов может изменяться в диапазоне 1 – 2 единицы рН.
Следовательно, этот метод определения водородного показателя имеет ряд недостатков.
Во-первых, определять кислотность можно лишь в определенном небольшом диапазоне значений рН. Этот недостаток иногда обходят, приготовляя универсальный индикатор – смесь нескольких из выше перечисленных индикаторов. Но этот индикатор все же не охватывает всю шкалу активности водорода.
Во-вторых использование изменения окраски индикатора для определения активности водородных ионов сильно затруднено, а иногда и невозможно в мутных и цветных средах.
32.Расчет рН в растворе сильного электролита.
Для сильных кислот и щелочей, полностью диссоциированных на ионы,
Н+ = zCк и ОН = zCщ, (2.4)
где Ск и Сщ моляльные концентрации кислоты и, соответственно, щелочи, z основность кислоты или кислотность основания.
Пример.
Вычислить рН раствора серной кислоты концентрацией 0,005 моль/кг в воде и в растворе хлорида алюминия концентрацией 0,005 моль/кг.
Решение. 1. Составить уравнение диссоциации серной кислоты:
 .
.
2. Согласно уравнению
диссоциации концентрация катионов
водорода 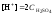 ,
концентрация сульфат-ионов
,
концентрация сульфат-ионов .
.
3. Оценить рН раствора по концентрации катионов водорода:
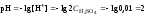 .
.
4. Вычислить ионную силу раствора:
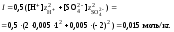
5. Вычислить значение коэффициента активности катионов водорода:
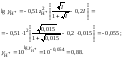
6. Вычислить значение активности катионов водорода в растворе серной кислоты:
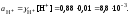
7. Вычислить значение рН:
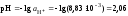 .
.
8. Вычислить ионную силу раствора, содержащего серную кислоту и хлорид алюминия
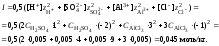
9. Вычислить коэффициент активности катионов водорода
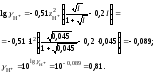
10. Вычислить рН раствора серной кислоты в присутствии хлорида алюминия
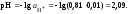
Вывод: увеличение ионной силы раствора приводит к снижению активности катионов водорода и снижению рН.
33.Расчет рН в растворе слабого электролита.
Слабые кислоты и основания в водных растворах диссоциированы не полностью и основная масса вещества существует в растворе в молекулярной форме. Процесс диссоциации слабого электролита протекает ступенчато. Например, для слабой двухосновной кислоты H2An:
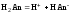 –первая ступень
диссоциации;
–первая ступень
диссоциации;
 –вторая ступень
диссоциации.
–вторая ступень
диссоциации.
Основной количественной характеристикой силы слабого электролита является константа равновесия процесса диссоциации или константа диссоциации. Каждая ступень диссоциации характеризуется своей константой равновесия. Для слабой двухосновной кислоты H2An существует две константы диссоциации:


Значения констант диссоциации для 25°С приводятся в справочной литературе или могут быть вычислены через энергию Гиббса реакции диссоциации.
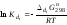 ,
(2.13)
,
(2.13)
где 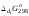 вычисляется, в соответствии с законом
Гесса, для конкретной ступени диссоциации
через энергии Гиббса образования ионов
в водном растворе и энергии Гиббса
образования молекул слабого электролита
в водном растворе. Например, для слабой
одноосновной кислоты:
вычисляется, в соответствии с законом
Гесса, для конкретной ступени диссоциации
через энергии Гиббса образования ионов
в водном растворе и энергии Гиббса
образования молекул слабого электролита
в водном растворе. Например, для слабой
одноосновной кислоты:
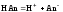 ;
;
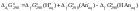 .
.
Обычно константа диссоциации по второй ступени приближенно в 104-105 раз ниже, чем по первой. По третьей ступени константа диссоциации еще во столько же раз ниже. Поэтому при расчетах рН в растворах многоосновных слабых кислот обычно учитывают только первую ступень диссоциации, пренебрегая второй и третьей ступенями.
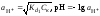 и
(2.15)
и
(2.15)
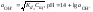 ,
(2.16)
,
(2.16)
где 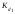 – первая константа диссоциации слабого
электролита,Ск и Сщ
молярные концентрации кислоты и,
соответственно, щелочи.
– первая константа диссоциации слабого
электролита,Ск и Сщ
молярные концентрации кислоты и,
соответственно, щелочи.
Пример.
Вычислить рН
раствора гидроксида аммония концентрацией
0,5 моль/л; 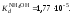
Решение. 1. Записать уравнение диссоциации гидроксида аммония

2. Вычислить концентрацию гидроксид-ионов в растворе аммиака в воде
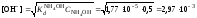
и величину рН
(полагая 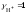 )
)

Роль ионов водорода в биологических процессах
Биологические жидкости содержат сильные и слабые кислоты: HCl, H2CO3, пировиноградную, молочную кислоты и другие.
Различают три вида кислотности в биологических жидкостях:
Общая кислотность – это общая концентрация сильных и слабых кислот. Общую кислотность обычно определяют методом кислотно-основного титрования.
Активная кислотность равна активности (концентрации) свободных ионов водорода в растворе. Мерой активной кислотности служит значение рН раствора.
Потенциальная кислотность равна концентрации непродиссоциированных молекул слабых кислот и рассчитывается по разности значений общей и активной кислотностей.
Любая биологическая жидкость в норме имеет определенное значение активной кислотности, т.е. рН.
Таблица 1.
Интервал значений рН важнейших биологических жидкостей.
Желудочный сок | 0,9 – 2,0 |
Моча | 5,0 – 8,0 |
Слюна | 5,6 – 7,9 |
Плазма крови | 7,36 – 7,44 |
Слезная жидкость | 7,6 – 7,8 |
Сок поджелудочной железы | 8,6 – 9,0 |
Целый ряд патологических процессов, протекающих в организме, может приводить к изменению рН некоторых биологических жидкостей. Поэтому определение рН биологических жидкостей (желудочный сок, моча и др) используются при диагностике и контроле за эффективностью терапии.
Определение реакции среды и знание концентрации ионов Н+ в биожидкостях часто является необходимым в биохимических исследованиях (исследование активности ферментов).
Определение водородного показателя
Колориметрическое определение рН основано на изменении цвета кислотно-основных индикаторов, окраска которых зависит от рН среды. Индикаторы могут быть одноцветными, имеющими окраску только в щелочной среде, а в кислой среде – бесцветные (фенолфталеин, нитрофенолы), и двухцветными, имеющими различную окраску в кислой и щелочной средах (метилоранж, феноловый красный и др.).
Каждый индикатор характеризуется показателем титрования и интервалом (зоной) перехода окраски.
Показатель титрования рТ – это значение рН в пределах интервала перехода окраски, при котором наблюдается наиболее резкое изменение цвета индикатора.
Интервалом перехода окраски индикатора называется интервал значений рН (рН), в пределах которого происходит различимое глазом изменение окраски индикатора. Граница интервала перехода приблизительно равна рТиндикатора 1. При определении рН раствора можно использовать только тот индикатор, в интервал перехода окраски которого входит рН исследуемого раствора.
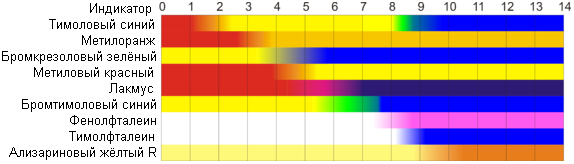
Таблица 2
Кислотно-основные индикаторы
Индикатор | рТинд. | Интервал перехода окраски | ||
окраска I | рН | окраска II | ||
Метиловый оранжевый | 3,7 | красная | 3,1–4,4 | желтая |
Метиловый красный | 5,7 | красная | 4,2–6,3 | желтая |
Лакмус | 7,0 | красная | 5,0–8,0 | синяя |
Фенолфталеин | 9,2 | бесцветная | 8,2–10,0 | малиновая |
Обычно вначале определяют приблизительное значение рН с помощью универсального индикатора. Универсальный индикатор – это смесь нескольких индикаторов с различными, но примыкающими друг к другу интервалами перехода окраски, охватывающими шкалу рН от 1 до 14, причем эта смесь индикаторов имеет определенную окраску при тех или иных значениях рН. Универсальная индикаторная бумага – это фильтровальная бумага, пропитанная универсальным индикатором. К ней прилагается цветная шкала со значениями рН для каждой окраски. Точность определения не превышает 0,5 ед. рН. По приблизительному значению рН подбирают индикатор для более точного определения.
Потенциометрическое (ионометрическое) определение рН основано на измерении электродвижущей силы (ЭДС) гальванической цепи, составленной из индикаторного полуэлемента (электрода определения), потенциал которого зависит от рН среды (стеклянный, водородный, хингидронный) и электрода сравнения (хлорсеребряного, каломельного), имеющего постоянный потенциал. Измерительная шкала иономера (рН-метра) градуирована как в милливольтах, так и в ед. рН. Точность определения до 0,01 ед. рН. Можно использовать для определения рН мутных и окрашенных жидкостей.
водородный показатель — это… Что такое водородный показатель?
- водородный показатель
- (pH) количественная мера активной кислотности или щелочности среды, численно равная отрицательному десятичному логарифму концентрации водородных ионов; определение pH биологических жидкостей широко применяется при диагностических и экспериментальных исследованиях.
Большой медицинский словарь. 2000.
- водород
- водоросли
Смотреть что такое «водородный показатель» в других словарях:
Водородный показатель — (рН) величина, характеризующая активность или концентрацию ионов водорода в растворах; численно равна отрицательному десятичному логарифму концентрации, выраженной в грамм ионах на литр. рН = 1g(H+], где [Н+] концентрация ионов водорода. Понятие… … Геологическая энциклопедия
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ — См. Активная реакция среды. Экологический энциклопедический словарь. Кишинев: Главная редакция Молдавской советской энциклопедии. И.И. Дедю. 1989. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ (pH) величина, характеризующая концентрацию (активность) ионов водорода в… … Экологический словарь
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ — (рН) характеризует концентрацию (активность) ионов водорода в растворах; численно равен отрицательному десятичному логарифму концентрации (активности) водородных ионов ВОДОРОДНЫЙ цикл (протон протонная цепочка) цепочка термоядерных реакций… … Большой Энциклопедический словарь
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ — (обозначается рН), показатель кислотности или щелочности раствора. Шкала водородных показателей выражает ряд значений рН, основанных на логарифмическом измерении концентрации, или активности, ионов водорода. Шкала включает значения от 0 до 14, а… … Научно-технический энциклопедический словарь
водородный показатель — Параметр, характеризующий концентрацию водородных ионов в растворе, т. е. степень его щелочности или кислотности. Показатель рН может изменяться от 0 до 14. Раствор, в котором рН равно семи, является нейтральным, ниже семи кислым, выше щелочным.… … Справочник технического переводчика
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ — (pH), характеризует кислотность разбавленных растворов. Определяется как отрицательный десятичный логарифм концентрации ионов H+. В нейтральных водных растворах pH=7, в кислых <7, в щелочных >7 … Современная энциклопедия
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ (pH) — Величина, характеризующая концентрацию (активность) ионов водорода в растворах; численно равен отрицательному десятичному логарифму концентрации (активности) ионов водорода [H+], выраженной в молях на литр: pH= lg[H+]. Водные растворы могут иметь … Словарь бизнес-терминов
Водородный показатель (Ph) — величина, характеризующая концентрацию ионов водорода; равна отрицательному десятичному логарифму концентрации ионов водорода. В нейтральной среде Ph = 7, в кислых средах < 7, в щелочных >7. В. п. бумаги характеризует ее стойкость к… … Издательский словарь-справочник
водородный показатель — Величина, характеризующая концентрацию иона водорода в растворах, а отсюда степень кислотности, широко используется для определения кислотности или щелочности почв. Syn.: индекс pH … Словарь по географии
водородный показатель pH — – отрицательный десятичный логарифм концентрации водородных ионов: pH = lg[H+]. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
Водородный показатель — (pH), характеризует кислотность разбавленных растворов. Определяется как отрицательный десятичный логарифм концентрации ионов H+ . В нейтральных водных растворах pH=7, в кислых 7. … Иллюстрированный энциклопедический словарь
1)Какое значение имеет водородный показатель в кислой, нейтральной и щелочной средах?
в кислой рНменьше 7; рН=7-нейтральная среда; рН больше 7-щелочная среда
в кислой рН меньше 7; в нейтральной рН=7; в щелочной рН больше 7. рН = 14 — рОН = 14 — 6 = 8 [Н+] = 10^-8 моль/л
Водоро́дный показа́тель, pH — мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, количественно выражающая его кислотность. Равен по модулю и противоположен по знаку десятичному логарифму активности водородных ионов, выраженной в молях на один литр: Величина рН используется как мера кислотности, основности или нейтральности водных растворов. рН< 7 – реакция среды кислая; рН >7 – реакция среды щелочная; рН = 7 – реакция среды нейтральная.
