Желчный пузырь и желчевыводящие пути
РАК ЖЕЛЧНОГО ПУЗЫРЯ (Carcinoma vesicae fellae) и РАК ЖЕЛЧЕВЫВОДЯЩИХ ПУТЕЙ (Carcinoma ductus choledochus)
Желчь — это образуемый в печени секрет, который очень важен для процесса переваривания пищи. Желчь движется из печени в кишечник через внепеченочные и внутрипеченочные желчевыводящие пути. Желчевыводящие пути — это система объединяющихся друг с другом и поэтому всё более расширяющихся протоков (трубчатых образований), которые выходят из печени общим желчным протоком и входят в двенадцатиперстную кишку в начале тонкой кишки. Общий желчный проток и желчный пузырь объединяет пузырный желчный проток. Образующаяся в печени желчь собирается в протоках и оттуда движется дальше в желчный пузырь.
Желчный пузырь является грушеподобным полым органом, который находится в правой верхней части живота и присоединен к нижней поверхности печени. В желчном пузыре происходит концентрация желчи. Во время приема пищи мышечная стенка желчного пузыря продавливает желчь через общий желчный проток в двенадцатиперстную кишку, где желчь помогает переваривать жиры.
Рак желчного пузыря и рак желчевыводящих путей является болезнью, при которой в стенках желчного пузыря или желчевыводящих путей возникают и начинают размножаться раковые клетки.
Причины возникновения и факторы риска:
- возраст — рак желчного пузыря, как правило, является заболеванием пожилых людей
- пол — у женщин возникает почти в два раза чаще
- желчнокаменная болезнь — вызывает хроническое воспаление, которое может развиться в рак
- доброкачественные опухоли (аденомы, папилломы) и кисты — редко, однако до 5% случаев могут стать злокачественными опухолями
- нарушения функции желчевыводящих путей после операции (созданные соединения между желчевыводящими путями и кишечником)
- язвенный колит, или воспаление кишечника.

Симптомы:
- на ранней стадии развития часто не вызывает значительных жалоб, поэтому трудно диагностируется
- пожелтение кожи и глаз, обусловленное закупоркой желчевыводящих путей
- тошнота, отсутствие аппетита и потеря веса
- продолжительная небольшая высокая температура, вялость и усталость
- бледность кожи, вызванная кровотечением и анемией
- боли в верхней части живота
- сероватый кал, темная моча кофейного цвета
- опухоль может прощупываться рукой в верхней правой части живота
Выполняемые для диагностики исследования:
- физический осмотр, т. е. пальпация;
- анализ крови — определяются функциональные показатели печени, исключается воспаление;
- ультразвуковое исследование брюшной полости, или зонография — показывает наличие желчных камней, состояние стенки желчного пузыря и наличие нарушения оттока желчи из печени
- рентгеновское исследование легких и ультразвуковое исследование брюшной полости, таза и ретроперитонеального пространства (забрюшинного) — показывает распространение опухоли в соседние органы
- компьютерная томография — уточняет расположение опухоли и захвата соседних органов
- биопсия — из участка с подозрением на опухоль тонкой иглой берется образец клетки, который исследуется гистологическим путем для выяснения диагноза рака
- Гастродуоденоскопия — осмотр внутренней поверхности желудка и двенадцатиперстной кишки
- рентген желчевыводящих путей и протока поджелудочной железы — эндоскопическая холангиопанкреатография (контрастная рентгенография), в ходе которой из общего желчного протока можно взять желчь и исследовать ее гистологически на наличие раковых клеток.
Возможности лечения:
Возможности хирургического лечения и прогноз зависят от распространения болезни, т. е. стадии, и состояния пациента:
- оздоровительное лечение — полное удаление рака желчного пузыря возможно только тогда, когда опухоль не распространилась за пределы желчного пузыря.
 Удаляется весь желчный пузырь, часть граничащей с ним печени и связанные с желчным пузырем лимфатические узлы:
Удаляется весь желчный пузырь, часть граничащей с ним печени и связанные с желчным пузырем лимфатические узлы:
o при раке с удалением внутрипеченочных желчевыводящих путей проводится резекция печени, т. е. частичное удаление печени
o при раке с удалением внепеченочных желчевыводящих путей в воротах печени (выходе из печени) удаляется общий желчный проток, желчный пузырь и часть расположенной в воротах печени печеночной ткани, делается соединение между тонкой кишкой и внутрипеченочными желчевыводящими путями
o при раке с удалением внепеченочных желчевыводящих путей на месте впадения в двенадцатиперстную кишку проводится т. н. операция Уиппла — удаляется конечная часть общего желчного протока, головка поджелудочной железы и двенадцатиперстная кишка вместе с жировой тканью, содержащей окружающие лимфатические узлы
Если из-за рака отток желчи в кишечник заблокирован, и больной становится желтым, можно:
- стентировать — для восстановления разлития желчи в закупоренный участок эндоскопическим путем вставляется специальный дренаж, или стент
- с помощью операции создать обходящее осложнение соединение, т. е. анастомоз между желчевыводящими путями и кишечником;
- установить в желчевыводящие пути выводящую желчь тонкую трубку, т. е. создать наружный желчный свищ
- лучевая терапия и химиотерапия используются отдельно или в комбинации — уничтожают раковые клетки в опухолевом очаге и метастазах, таким образом уменьшая размер опухоли, тормозят развитие опухоли и облегчают жалобы больного.

Если опухоль расположена рядом с воротами печени и большими жизненно важными кровеносными сосудами, несмотря на небольшой размер, удалить ее сложно — поэтому возможности радикальной операции ограничены. В качестве лечения применяются также химио- и лучевая терапия.
Выздоровление
Больные раком желчевыводящих путей в первые годы проверяются каждые 3–6 месяцев, начиная с третьего года — один раз в год или согласно распоряжению лечащего врача.
Прогноз больных раком желчного пузыря и желчевыводящих путей считается плохим, поскольку ввиду немногих симптомов опухоль обнаруживается в поздней стадии. Болезнь часто возникает у пожилых больных, поэтому выбор методов лечения ввиду сопутствующих заболеваний ограничен.
Лечение заболеваний желчного пузыря — лечение в Медлайн в Кемерово
Несмотря на небольшие размеры, желчный пузырь — важный орган пищеварительной системы. Он выполняет функцию сбора желчи из печени и регуляции ее выделения в двенадцатиперстную кишку, в зависимости от приема пищи.
Функции желчи заключаются в активации пищеварительных ферментов в кишечнике и эмульгировании жиров (процесс измельчения крупных капель жира до более мелких) для облегчения процесса переваривания. Кроме того, в этом органе происходит резорбция (обратное всасывание) в кровь белка, важных солей, аминокислот, а также выделение слизь и особого гормона — холецистокинина.
Холецистокинин (СКК)
— это нейропептидный гормон, вырабатываемый слизистой оболочкой кишечника. Он отвечает за: уменьшение выделения соляной кислоты; стимуляцию поджелудочной железы, пищеварительных ферментов, выделения желчи, сокращения желчного пузыря, напрямую связан с расслаблением сфинктеров желчных протоков и стимуляцией блуждающего нерва. Нехватка данного вещества в организме чревата:- нарушениями в работе желчного пузыря
- нарушением потока желчи в двенадцатиперстную кишку
- нарушением работы ЖКТ в целом
Помимо этого, данный гормон участвует в поддержании спокойствия, регуляции сна, подавлении страха и боли, а также психического напряжения.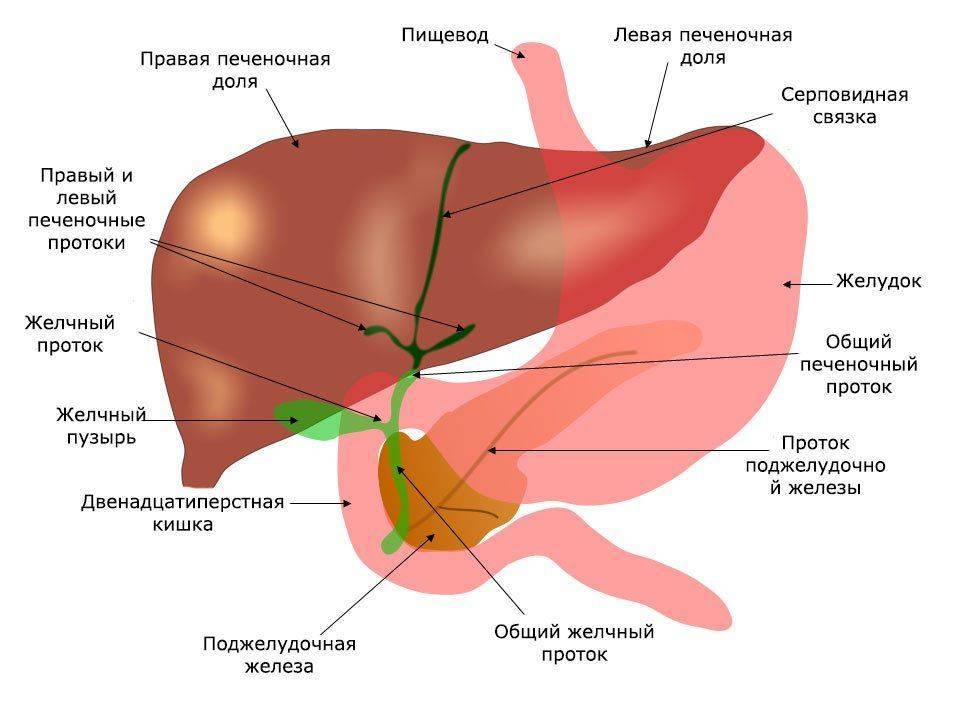
Желчный пузырь: интересные факты
- Желчный пузырь вмещает около 50 мл желчи, образующейся в клетках печени, затем по специальным желчным протокам, которые образуют сложную сеть, поступает в желчный пузырь, где храниться вплоть до приема пищи человеком
- Как только пища попадает в 12-перстную кишку, происходит сокращение желчного пузыря, и желчь вместе с поджелудочным соком движется в кишечник
- В сутки у здорового человека может образовываться от 500 до 1000 мл желчи
- В ее составе — вода, желчные кислоты, неорганические вещества, витамины А, В, С, Д, аминокислоты, фосфолипиды, холестерин, билирубин, протеины, слизь и остатки лекарственных препаратов
- Функции желчи: нейтрализация желудочного сока; активизация кишечных и поджелудочных ферментов; препятствование росту вредных бактерий в кишечнике; улучшение перистальтики кишечника; выведение токсических веществ и лекарственных препаратов
Основные патологии желчного пузыря
Желчекаменная (желчнокаменная) болезнь — заболевание желчевыводящей системы, связанное с нарушением билирубинового обмена и холестерина, характеризующееся образованием камней внутри печени, в общем желчном протоке и в желчном пузыре.
По механизму образования выделяют 3 типа камней:
- холестериновые
- пигментные билирубиновые коричневые
- черные
Желчекаменная болезнь может протекать бессимптомно длительное время, иногда проявляясь в виде приступов печеночной колики.
Хронический безкаменный холецистит — это длительный воспалительный процесс, поражающий внутреннюю оболочку пузыря и не сопровождающийся образованием камней.
Основные причины заболевания:
- бактериальная инфекция — кишечная микрофлора (кишечная палочка, энтерококк), стафилококки и стрептококки, протей, палочки брюшного тифа и паратифа, анаэробная микрофлора
- паразитарная инвазия — кошачий сосальщик, лямблии, аскариды
- обратный заброс желчи из кишечника — опасен находящимися в нем поджелудочными ферментами, которые при поступлении в пузырь, начинают переваривать его стенку (данную патологию еще называют химический холецистит)
- аллергии — пищевые и аэрогенные аллергены
- воспалительные заболевания органов пищеварения — особенно отрицательно влияют гепатиты и панкреатиты
- застой желчи
Дискинезия желчевыводящих путей — функциональное заболевание желчевыводящих путей, связанное с изменением тонуса желчного пузыря или протоков.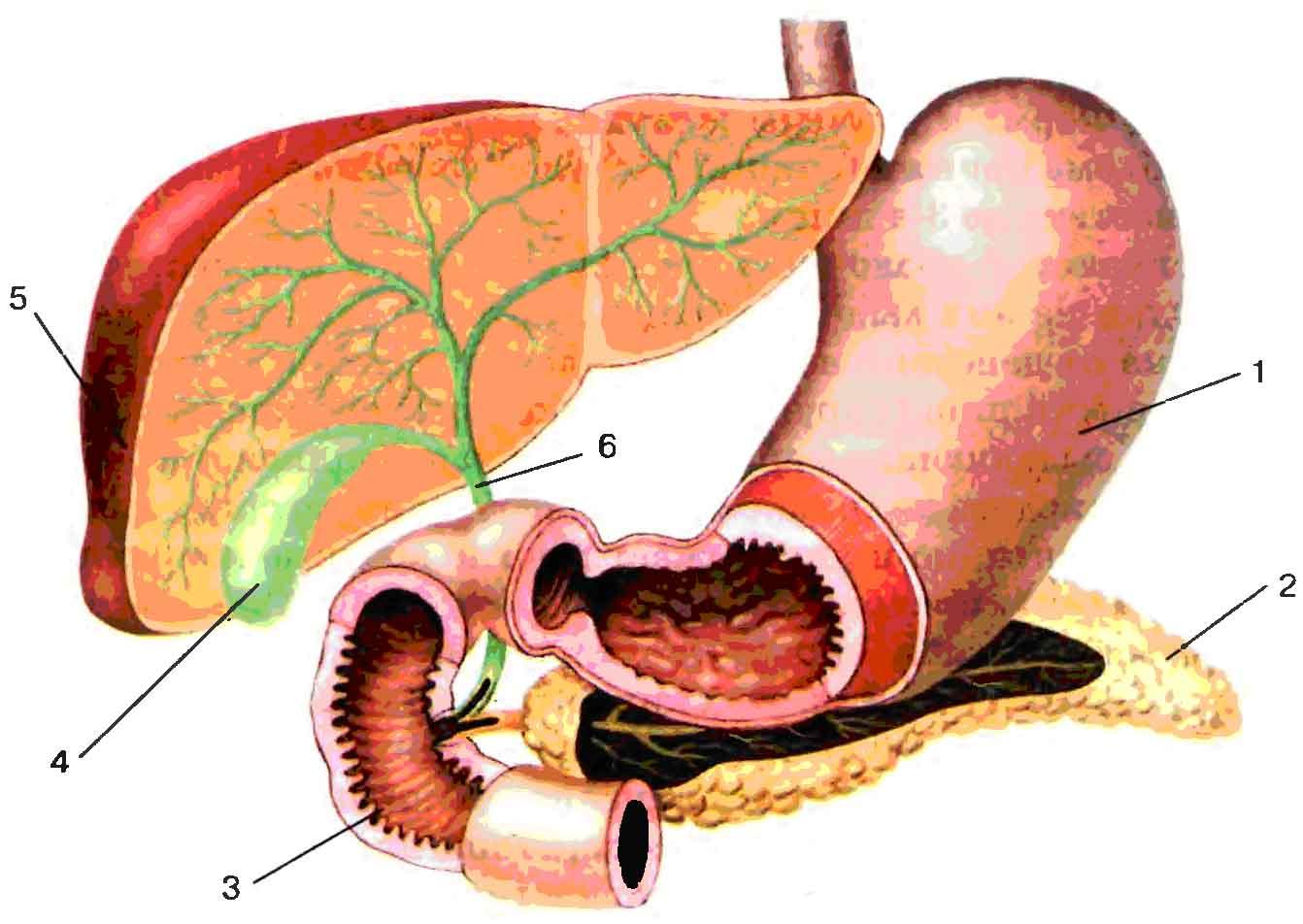 Как правило, сопровождается периодической болью в правом подреберье и диспепсическими расстройствами. Дискинезия возникает обычно при постоянных стрессах, психоэмоциональных нагрузках, неврозах. В зависимости от изменения тонуса пузыря различают болевой (гиперкинетический) и диспепсический (гипокинетический) типы заболевания.
Как правило, сопровождается периодической болью в правом подреберье и диспепсическими расстройствами. Дискинезия возникает обычно при постоянных стрессах, психоэмоциональных нагрузках, неврозах. В зависимости от изменения тонуса пузыря различают болевой (гиперкинетический) и диспепсический (гипокинетический) типы заболевания.
Острый холангит — воспалительный процесс в стадии острого обострения, который поражает желчевыводящие протоки. Возникает обычно как осложнение хронического холецистита, ЖКБ или после удаления желчного пузыря. Развитию инфекции способствует застой желчи, сдавливание протоков опухолями, камнями. Выделяют обструктивный, рецидивирующий, бактериальный, вторичный склерозирующий холангиты.
Холецистит — воспаление желчного пузыря. Признаки болезни — боли в правом подреберье тянущего характера, могут усиливаться после еды. Лечение медикаментозное — антибиотики, желчегонные и противовоспалительные препараты.
Холестероз — процесс откладывания в стенках желчного пузыря холестерина, длительное время ничем себя не проявляет. Лечение — диета и режим питания.
Полипы — доброкачественная опухоль, протекает бессимптомно, кроме случаев перекрытия выхода из желчного пузыря. Лечение — хирургическое удаление полипов.
Рак желчного пузыря — достаточно редкая патология, в большинстве случаев является исходом хронического воспалительного процесса в органе. Лечение — удаление желчного пузыря и химиотерапия. Выделяют аденокарциному, слизистый, солидный и плоскоклеточный рак. Для рака желчного пузыря характерна высокая злокачественность, раннее метастазирование и прорастание в соседние органы.
Обратите внимание
- Болезни желчного пузыря по частоте занимают 2-е место среди заболеваний печени и желчевыводящих путей и 3-е место всех болезней желудочно-кишечного тракта.
- Что касается возраста, то ими чаще страдают люди старше 50-ти лет, причем женщины подвержены больше мужчин.

Симптомы болезней желчного пузыря
- Боль — локализуется в области подреберья, различной интенсивности (меньше при перегибе желчного пузыря, более выражена при холецистите и камнях, может отсутствовать при полипах). Боль усиливается в течение суток после приема пищи, в особенности жирной, жареной или копченой. В случае выхода камня из желчного пузыря и закупорки им общего желчного протока возникает резкая приступообразная боль — печеночная колика
- Тошнота, периодическая рвота, метеоризм (вздутие) и расстройства стула (послабление или склонность к запорам) — эти симптомы нарушения пищеварения связаны с поступлением желчи в кишечник в неполном объеме или изменением ее состава процесс переваривания пищи нарушается
- Горький привкус во рту — сопровождает практически все заболевания печени и желчного пузыря
- Малиновый язык — покраснение языка, специфический симптом различных проблем с печенью или желчевыводящими путями
- Интенсивный цвет мочи — моча становится насыщенно желтой, вплоть до коричневого цвета. Это связано с тем, что при заболеваниях желчного пузыря желчные кислоты частично всасываются в кровь и выводятся с мочой, что придает ей характерное окрашивание
- Светлый кал — в норме коричневый цвет стула обеспечивается наличием в нем желчных кислот, соответственно при уменьшении поступления желчи в кишечник кал становится светлым
- Желтушность кожи и склер (от еле различимой до выраженного желтого окрашивания кожи и склер) — возникает при попадании желчных кислот в кровь из желчного пузыря и оседания их в тканях организма (желтуха)
Диагностика проблем
При появлении вышеперечисленных симптомов кроме осмотра врача необходима лабораторная и инструментальная диагностика.
В медицинском центре «Медлайн» к услугам пациентов:
- Клинический анализ крови — для выявления воспалительного процесса в организме, при котором происходит повышение СОЭ (скорость оседания эритроцитов) и количества лейкоцитов
- Дуоденальное зондирование — это информативный диагностический тест, при котором в двенадцатиперстную кишку вводится тонкая трубка (зонд) и через нее собирается желчь для исследования в лаборатории.
 Так определяется химический состав желчи, воспалительные элементы (появляются лейкоциты и слизь), атипические клетки при опухолевых процессах. Также проводится бактериальный посев желчи на питательные среды с целью выявления возбудителя инфекции
Так определяется химический состав желчи, воспалительные элементы (появляются лейкоциты и слизь), атипические клетки при опухолевых процессах. Также проводится бактериальный посев желчи на питательные среды с целью выявления возбудителя инфекции - Ультразвуковое исследование (УЗИ) органов брюшной полости — этот метод обследования визуализирует желчный пузырь, его перегиб, толщину стенок желчного пузыря, расширение общего желчного протока, наличие камней, полипов и т.д.
- Тонкоигольная биопсия — под ультразвуковым контролем в желчный пузырь вводят тонкую иглу, которой берется кусочек ткани для анализа. Исследование под микроскопом позволяет выявить атипические (опухолевые) клетки
- Рентгенологическое исследование с контрастным веществом — внутривенно вводится контрастное вещество. Далее оно вместе с клетками печени выводится и скапливается в желчном пузыре. Это позволяет оценить размер пузыря и изменение формы (деформацию)
- Компьютерная и магнитно-резонансная томография (КТ и МРТ) — лучевое послойное исследование тканей и органов, показывает даже мелкие небольшие опухоли, полипы и камни (включения) и изменения в них
Лечение заболеваний желчного пузыря
Лекарственная терапия, назначаемая в отделении гастроэнтерологии клиники «Медлайн» является комплексной — с учетом причины заболевания и патологических изменений. Существуют основополагающие принципы, которых здесь придерживаются в лечении всех заболеваний желчного пузыря.
Этиотропная терапия — направлена на полное устранение причины заболевания. Для этого используются антибиотики при холецистите, хирургическое лечение при желчнокаменной болезни, полипах и опухолях желчного пузыря.
Патогенетическая терапия — используется для восстановления функции желчного пузыря (спазмолитики при гиперкинетическом типе дискинезии), снижение интоксикации организма при холецистите и опухолях. Для улучшения пищеварения используются ферментативные препараты с желчными кислотами (мезим).
Симптоматическая терапия — лечение, направленное на уменьшение неприятных ощущений и дискомфорта, обезболивающие (кетанов, анальгин) и противовоспалительные (парацетамол) препараты, спазмолитики (но-шпа, дротаверин) или их комбинации (ношпалгин, спазмалгон).
Диета. Диета при заболевании желчного пузыря заключается в минимизации вредного влияния пищи на работу желчного пузыря. Для этого используется стол №5 по Певзнеру, при котором исключаются жирные сорта мяса и птицы (свинина, утка), наваристые бульоны (усиливают сокращение стенок желчного пузыря).
Желательно употреблять в пищу нежирные сорта мяса (говядина, кролик), птицы (курица), рыбу (предпочтительно речную рыбу), кисломолочные продукты, овощи и фрукты. Важным также является процесс приготовления пищи, нельзя ее жарить, коптить. Все блюда готовятся на пару или тушением.
Питание. Очень важным фактором при проблемах с желчным пузырем является не только то, какую пищу можно есть, а какую нельзя, но и то, как и когда принимать пищу. Наиболее оптимальным является 5-тиразовое питание небольшими порциями, последний ужин не менее, чем через 2 часа до сна. Перекусы на ходу и питание всухомятку недопустимы.
Сравнительная Анатомия печени и желчевыводящих путей человека и крысы Текст научной статьи по специальности «Фундаментальная медицина»
VESTNIK VGMU/ VESTNIK OF VSMU, 2016, VOL. 15, N3
© ЗИМАТКИН С.М., МАРКОВЕЦ Н.И., 2016
СРАВНИТЕЛЬНАЯ АНАТОМИЯ ПЕЧЕНИ И ЖЕЛЧЕВЫВОДЯЩИХ ПУТЕЙ ЧЕЛОВЕКА И КРЫСЫ
ЗИМАТКИН С.М., МАРКОВЕЦ Н.И.
УО «Гродненский государственный медицинский университет», г. Гродно, Республика Беларусь
Вестник ВГМУ. — 2016.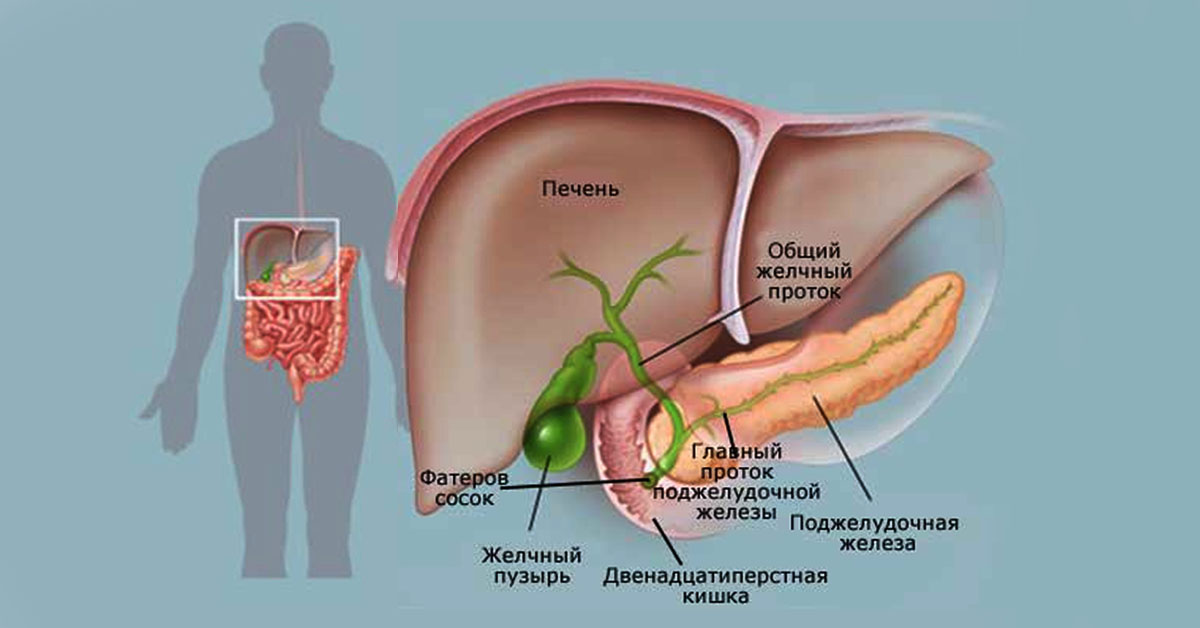 — Том 15, №3. — С. 18-23.
— Том 15, №3. — С. 18-23.
COMPARATIVE ANATOMY OF THE LIVER AND BILE DUCTS OF HUMANS AND RATS ZIMATKIN S.M., MARKAVETS N.I.
Educational Establishment «Grodno State Medical University», Grodno, Republic of Belarus Vestnik VGMU. 2016;15(3):18-23.
Резюме.
Обзор посвящен сравнительному анализу анатомии печени и желчевыводящих путей человека и крысы, а также установлению особенностей их органо- и гистогенеза. В морфогенезе печени и желчевыводящих путей крысы в течение пренатального развития имеют место сходные с человеком закономерные стадии образования органа, непрерывно переходящие одна в другую. Несмотря на относительно большую массу печени, большее количество долей печени и отсутствие желчного пузыря у крыс, показано, что микроскопическая организация печени и цитофизиологические особенности гепатоцитов крысы и человека принципиально не отличаются. В обзоре приведены данные, доказывающие гомологичность печени и желчевыводящих путей человека и крысы, что является основанием для экстраполяции на человека результатов экспериментальных исследований на лабораторных крысах. Ключевые слова: печень, желчевыводящие пути, желчный пузырь, крыса.
Abstract.
This review is devoted to the comparative analysis of anatomy of the liver and biliary tract of human beings and rats, as well as the determination of the specificity of their organohistogenesis. In the morphogenesis of the liver and biliary tract in rats during their prenatal development the formation periods similar to those in the human body take place which are continuously passing one into another. Despite the relatively large mass of the liver, the greater number of hepatic lobules and the absence of the gallbladder in rats show that microscopic organization of the liver and cytophysiological hepatocytes peculiarities of rats and human beings do not differ fundamentally. The review presents data demonstrating the homology of the liver and biliary tract of human beings and rats, which is the basis for extrapolation of the results of the experimental studies on laboratory rats onto humans. Key words: liver, bile ducts, gallbladder, rat.
The review presents data demonstrating the homology of the liver and biliary tract of human beings and rats, which is the basis for extrapolation of the results of the experimental studies on laboratory rats onto humans. Key words: liver, bile ducts, gallbladder, rat.
Болезни печени и желчевыводящих путей широко распространены в современном обществе и являются важной проблемой практической медицины [1, 2]. Существенный вклад в эту патологию вносит желчнокаменная болезнь: от 10 до 15% людей в промышлен-но развитых странах, 20% европейцев и около 50% американских индейцев страдают этим заболеванием [3, 4].
Печень — жизненно важный орган, выполняющий множество важных функций, в
частности совместно с желчевыводящими путями обеспечивает выведение в кишечник физиологически важного секрета гепатоцитов
— желчи [5].
При моделировании на животных патологии печени и желчевыводящих путей человека часто используют лабораторных крыс [6
— 10]. Для экстраполяции полученных экспериментальных данных на человека необходимо глубокое понимание морфофункциональных особенностей печени и желчевыводящих пу-
тей у крысы, особенностей их гисто- и органогенеза, начиная от эмбрионального периода развития и заканчивая взрослым животным и человеком.
Этапы развития печени
Зачаток печени и желчевыводящих путей человека возникает в конце 3-й недели эмбриогенеза в виде утолщения энтодермы первичной кишки, называемого «печеночным полем». Далее образуется печеночный дивертикул, который подразделяется на 2 неравные части: большая — краниальный отдел, меньшая — кау-дальный отдел, из которых в дальнейшем, соответственно, развиваются печень с печеночным протоком и желчный пузырь с его протоком [10 — 13]. У зародышей крысы в конце 10-х суток в энтодерме кишечной трубки образуется утолщение, клетки которого митотически делятся и на 14-е сутки эмбриогенеза погружаются в вентральную брыжейку по направлению к сердцу, формируя печеночный дивертикул [9, 14]. По степени дифференцировки среди эпителиальных элементов зачатка у человека и крысы можно выделить клетки гепато- и холанги-областического дифферонов. Холангиобласты и хонлангиоциты контактируют с мезенхим-ными и фибробластоподобными клетками развивающихся прослоек соединительной ткани и крупных кровеносных сосудов [10-13].
У зародышей крысы в конце 10-х суток в энтодерме кишечной трубки образуется утолщение, клетки которого митотически делятся и на 14-е сутки эмбриогенеза погружаются в вентральную брыжейку по направлению к сердцу, формируя печеночный дивертикул [9, 14]. По степени дифференцировки среди эпителиальных элементов зачатка у человека и крысы можно выделить клетки гепато- и холанги-областического дифферонов. Холангиобласты и хонлангиоциты контактируют с мезенхим-ными и фибробластоподобными клетками развивающихся прослоек соединительной ткани и крупных кровеносных сосудов [10-13].
В раннем постнатальном развитии у крыс (первые 14 суток) наибольший вклад по сравнению с другими периодами вносят пролиферация и гипертрофия клеток, которая обусловлена увеличением числа и размеров ор-ганелл вследствие интенсификации функции печени. Заметный вклад в увеличение массы печени с 15-е по 60-е сутки после рождения вносит полиплоидизация и пролиферация ге-патоцитов. Гемопоэтическая функция печени характерна для раннего периода ее развития, а к моменту рождения осуществляется переход в основном на медуллярный путь кроветворения [15]. Характерной особенностью эмбриональной печени в первой половине эмбриогенеза является наличие многочисленных очагов кроветворения. В последнюю неделю эмбриогенеза происходит постепенное замещение сетчатой структуры печени на дольчатую, при этом происходят существенные изменения как в строении, так и в цитохимии паренхиматоз-
ных клеток [11]. Дифференцировка гепатоци-тов и холангиоцитов у крыс заканчивается в постнатальном периоде на 50-60 сутки [10]. У человека формирование окончательной структуры печеночных долек заканчивается к 8-10 годам [16].
Анатомия печени и желчевыводящих путей
Печень у человека расположена непосредственно под диафрагмой, в верхней части брюшной полости справа, так что лишь сравнительно небольшая часть органа у взрослого заходит влево от срединной линии; у новорожденного она занимает большую часть брюшной полости.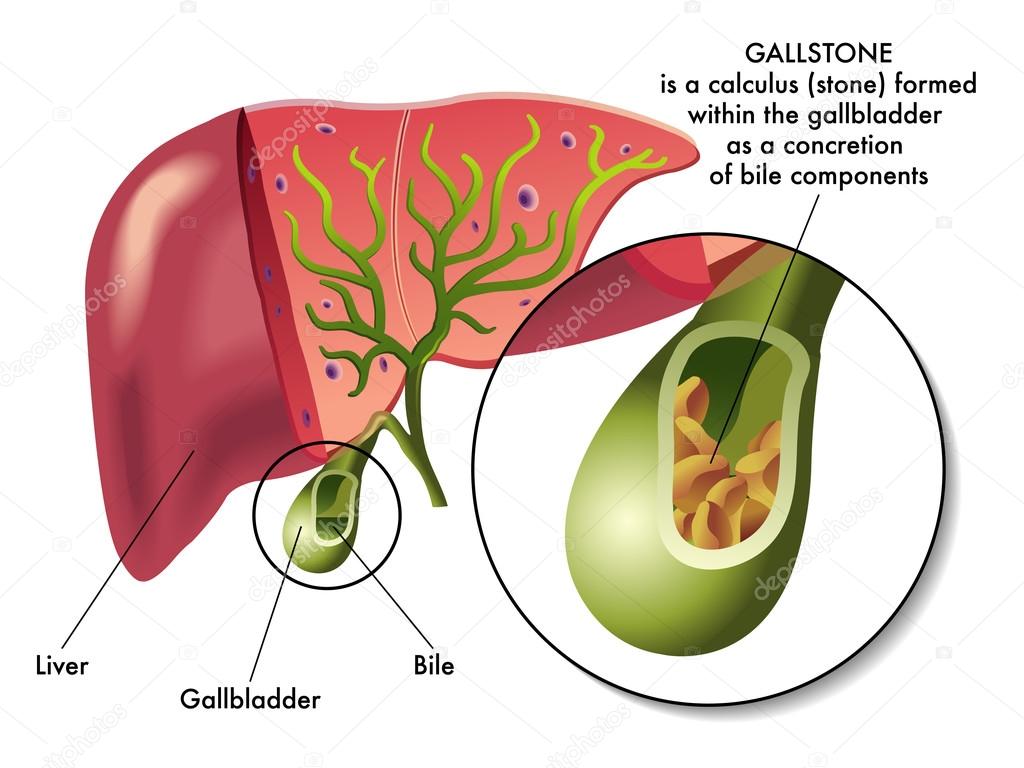 Масса печени взрослого 1,5-2 кг, что составляет 2-3% массы человека. В печени человека различают две доли: правую и меньшую, левую, которые на диафрагмальной поверхности отделены друг от друга серповидной связкой печени. Каждая доля печени поделена на секторы, которые, в свою очередь, разделяются на сегменты [17]. Таким образом, орган разделен на две доли, 5 секторов и 8 сегментов. На печени различают 2 поверхности и 2 края. Верхняя, или, точнее, передневерхняя, поверхность выпукла соответственно вогнутости диафрагмы, к которой она прилежит; нижняя поверхность обращена вниз и назад и несет на себе ряд вдавлений от других органов брюшной полости, к которым она прилежит. Верхняя и нижняя поверхности отделяются друг от друга острым нижним краем. Другой край печени, верхнезадний, напротив, настолько тупой, что его можно рассматривать как заднюю поверхность печени [17, 18] (рис. 1).
Масса печени взрослого 1,5-2 кг, что составляет 2-3% массы человека. В печени человека различают две доли: правую и меньшую, левую, которые на диафрагмальной поверхности отделены друг от друга серповидной связкой печени. Каждая доля печени поделена на секторы, которые, в свою очередь, разделяются на сегменты [17]. Таким образом, орган разделен на две доли, 5 секторов и 8 сегментов. На печени различают 2 поверхности и 2 края. Верхняя, или, точнее, передневерхняя, поверхность выпукла соответственно вогнутости диафрагмы, к которой она прилежит; нижняя поверхность обращена вниз и назад и несет на себе ряд вдавлений от других органов брюшной полости, к которым она прилежит. Верхняя и нижняя поверхности отделяются друг от друга острым нижним краем. Другой край печени, верхнезадний, напротив, настолько тупой, что его можно рассматривать как заднюю поверхность печени [17, 18] (рис. 1).
Внутрипеченочные протоки долей печени, сливаясь, образуют левый и правый печеночный протоки. Они соединяются и образуют общий печеночный проток, соединяющий систему желчных протоков с желчным пузырем. После соединения общего печеночного и пузырного протоков образуется общий желчный проток [17, 18]. Общий желчный проток впадает в двенадцатиперстную кишку (наиболее часто в средней трети нисходящей ее части), притом не просто в стенку кишки, а в центр особого сосочкообразного выбухания (фате-ров сосок). Перед этим в большинстве случаев (около 75%) конечная часть общего желчного протока соединяется с главным протоком под-
УЕБТМК Увми/ УЕБТШК 0¥ УБЫи, 2016, УОЬ. 15, N3
Рисунок 1 — Печень человека: 1 — правая доля, 2 — левая доля, 3 — желчный пузырь,
4 — общий желчный проток,
5 — поджелудочная железа,
6 — двенадцатиперстная кишка.
желудочной железы. В месте их слияния образуется печеночно-поджелудочная ампула, в которой происходит смешивание желчи и панкреатического сока, что имеет определенное физиологическое значение. Иногда общий желчный и панкреатический протоки не сливаются и не образуют ампулу, а открываются на большом дуоденальном сосочке раздельными отверстиями; возможны и другие варианты (например, слияние общего желчного протока с добавочным протоком поджелудочной железы) [18-20]. Печень человека выделяет в сутки 250-1000 мл желчи [21, 22].
Желчный пузырь — часть желчевыдели-тельной системы человека, небольшой полый орган, служащий для накопления желчи в межпищеварительный период, ее концентрирования и выделения во время приема пищи и пищеварения. Он представляет собой тонкостенный грушевидный мешок (его размеры весьма вариабельны — длина 5-14 см, наибольший диаметр 3,5-4 см), вмещающий около 30-70 мл желчи.
Следует отметить, что все отделы жел-чевыделительной системы человека анатомически весьма вариабельны (число печеночных протоков, длина отдельных участков, места соединения, расположение и т.д.) [17, 18].
Масса печени крысы составляет от 6,5 г (у крыс массой 150 г) до 10-12 г (у крыс массой 250 г), что составляет 4-6% массы животного.
Рисунок 2 — Печень белой крысы (вид сзади): 1 — правая боковая, 2 — правая центральная, 3 — левая боковая, 4 — левая центральная, 5 — хвостатая, 6 — добавочная (срединная) доля печени, 7 — общий желчный проток.
Это округлый с неправильными очертаниями орган красно-коричневого цвета, самый крупный в брюшной полости. Большая часть органа находится в правом подреберье. Различают краниальную (диафрагмальную) поверхность печени и каудальную (висцеральную) поверхность, соприкасающуюся с желудком. В центре висцеральной поверхности расположены ворота печени — участок вхождения сосудов, нервов и выхода печеночных протоков. Печень посредством междолевых вырезок подразделяется на шесть долей: правую (боковую и центральную), левую (боковую и центральную), хвостовую и добавочную [7, 23] (рис. 2).
В центре висцеральной поверхности расположены ворота печени — участок вхождения сосудов, нервов и выхода печеночных протоков. Печень посредством междолевых вырезок подразделяется на шесть долей: правую (боковую и центральную), левую (боковую и центральную), хвостовую и добавочную [7, 23] (рис. 2).
Добавочная (срединная) доля печени крысы расположена наиболее краниально. Правая доля печени больше, краниально прилежит к срединной доле, каудально — к двенадцатиперстной кишке. Левая доля печени самая крупная, каудальным краем прилежит к желудку, вентральнее ее располагается хвостатая доля. Хвостатая доля самая маленькая, расположена вокруг пищевода, прилежит к срединной и левой долям [7, 9, 23].
От каждой доли отходит печеночный проток, они сливаются и образуют общий желчный проток. Последний проток полупрозрачный, шириной около 1 мм, идет от ворот печени, где он принимает печеночные протоки от долей печени, проходит через ткань подже-
лудочной железы в нескольких миллиметрах ниже двенадцатиперстной кишки и впадает в ее каудальный конец. В общий желчный проток впадают многочисленные выводные протоки поджелудочной железы [7, 9, 14].
Печень крысы вырабатывает и выделяет за сутки в среднем 11,6 мл желчи. Печеночная желчь имеет рН 8,3 [7, 9, 14, 23]. Характерным отличием желчевыделительной системы крысы является отсутствие желчного пузыря, поэтому образующаяся в печени желчь не депонируется, а сразу поступает в кишечник. Кроме того, у крыс имеются особенности в образовании желчи, обмене билирубина, процессах регенерации печени [8]. Крысы способны регидроксилировать литохолевую кислоту в ди- и тригидроксижелчные кислоты, чего не наблюдается у людей [7, 24].
Микроструктура печени
Микроскопическая организация печени человека и крысы очень похожа [25].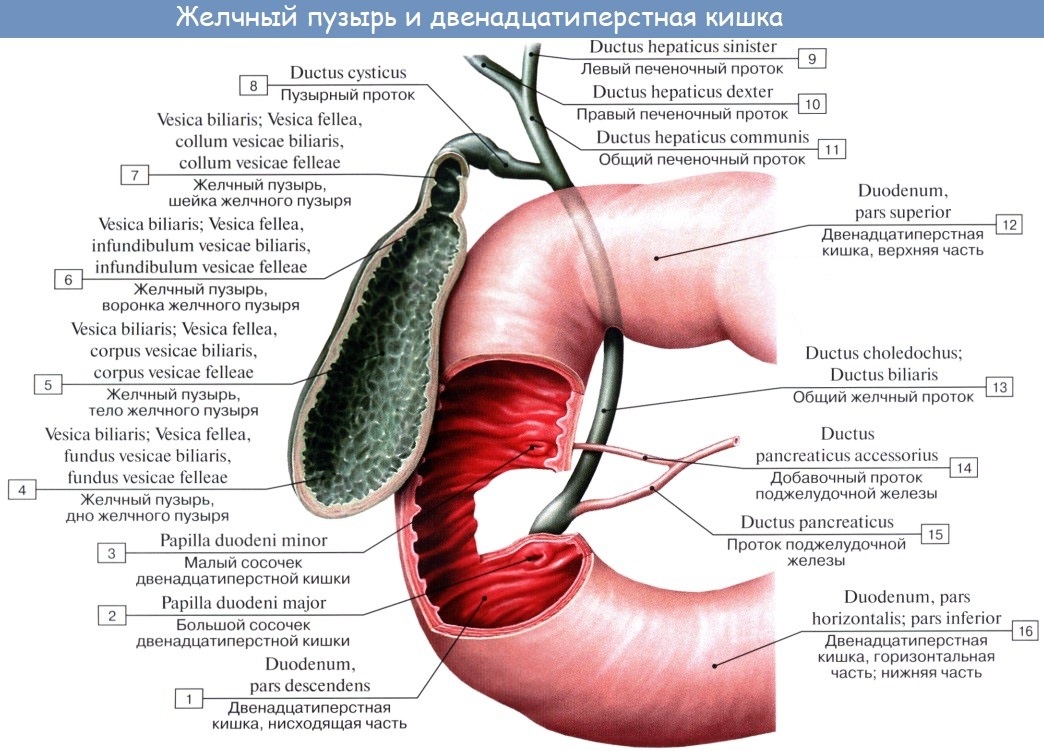 Строма образована соединительнотканной капсулой, покрывающей орган снаружи и плотно сращенной с висцеральным листком брюшины. Отходящие от капсулы прослойки соединительной ткани разделяют паренхиму органа на дольки, являющиеся его структурными и функциональными единицами. Классические печеночные дольки в печени имеют форму шестигранных призм размером до 1,5 мм; количество долек в органе достигает 500 тысяч. У крыс и человека на гистологических препаратах классические дольки не имеют четких границ, но об их наличии и очертаниях можно судить по расположению центральной вены и портальных зон [26, 27].
Строма образована соединительнотканной капсулой, покрывающей орган снаружи и плотно сращенной с висцеральным листком брюшины. Отходящие от капсулы прослойки соединительной ткани разделяют паренхиму органа на дольки, являющиеся его структурными и функциональными единицами. Классические печеночные дольки в печени имеют форму шестигранных призм размером до 1,5 мм; количество долек в органе достигает 500 тысяч. У крыс и человека на гистологических препаратах классические дольки не имеют четких границ, но об их наличии и очертаниях можно судить по расположению центральной вены и портальных зон [26, 27].
Гепатоциты человека и крысы имеют неправильную многоугольную форму и составляют 60% всех клеточных элементов печени. Диаметр их достигает 20-25 мкм. Многие из них (до 20% в печени человека) содержат два ядра и больше. Гепатоциты крыс и человека имеют полигональную форму, границы их хорошо различимы даже на окрашенных гематоксилином и эозином препаратах. Интересно, что гепатоциты крысы значительно крупнее, чем у человека [28].
Сравнительный цитологический анализ печеночной паренхимы позвоночных, проведенный в последние годы, показал, что электронно-микроскопическая организация и ци-
тофизиологические особенности гепатоцитов крысы и человека принципиально не отличаются [8, 10, 14, 25].
Известно, что различные отделы печеночной дольки выполняют неодинаковые функции. При этом выделяют два функциональных поля — центральное (перивенозное) и периферическое (перипортальное). На основании гистохимических и электронно-микроскопических исследований введено понятие о гетерогенности, разнородности гепатоцитов в дольке. Из-за особенностей кровоснабжения в печеночной дольке гепатоциты находятся в неравных условиях: клетки периферии долек получают кровь, более оксигенированную и содержащую больше питательных веществ. Соответственно, у этих клеток лучше развиты органеллы и выше активность различных ферментов. Поэтому выше и способность противостоять действию неблагоприятных факторов. Под влиянием последних обычно в первую очередь поражаются клетки центральных отделов долек [12, 29, 30]. По этим параметрам печень крысы и человека также сходны.
Соответственно, у этих клеток лучше развиты органеллы и выше активность различных ферментов. Поэтому выше и способность противостоять действию неблагоприятных факторов. Под влиянием последних обычно в первую очередь поражаются клетки центральных отделов долек [12, 29, 30]. По этим параметрам печень крысы и человека также сходны.
Заключение
Таким образом, несмотря на очевидные различия размеров и формы органа, приведенные выше данные подтверждают гомо-логичность строения печени и желчевыводя-щих путей человека и крысы (за исключением желчного пузыря), а также схожую динамику морфологических преобразований органа на протяжении эмбриогенеза, что позволяет использовать данное экспериментальное животное для изучения закономерностей развития печени и моделирования разных заболеваний и патологических состояний человека.
Литература
1. Бабак, О. Я. Синдром холестаза: что нужно знать каждому врачу / О. Я. Бабак // Укр. терапевт. журн. — 2005.
— № 3. — С. 4-22.
2. Вовк, Е. И. Желчнокаменная болезнь в XXI веке: что нового? / Е. И. Вовк // Лечащий врач. — 2011. — N° 2. — С. 58-65.
3. Konikoff, F. Gallstones — approach to medical management / F. Konikoff // Med. Gen. Med. — 2003 Oct.
— Vol. 5, N 4. — P. 8.
4. Intrahepatic cholestasis of pregnancy: molecular pathogenesis, diagnosis and management / F. Lammert [et al.] // J. Hepatol. — 2000 Dec. — Vol. 33, N 6. — P. 1012-1021.
VESTNIK VGMU/ VESTNIK OF VSMU, 2016, VOL. 15, N3
5. Lichtenstein, D. Hepatobiliary complications of inflammatory bowel disease / D. Lichtenstein // Curr. Gastroenterol. Rep. — 2011 Oct. — Vol. 13, N 5. — P. 495505.
Lichtenstein, D. Hepatobiliary complications of inflammatory bowel disease / D. Lichtenstein // Curr. Gastroenterol. Rep. — 2011 Oct. — Vol. 13, N 5. — P. 495505.
6. Максимова, Л. А. Пригодность некоторых видов лабораторных животных для моделирования холестати-ческих поражений печени / Л. А. Максимова [и др.] // Лабораторные животные в медицинских исследованиях : тез. докл. конф., 3-4 окт. 1974 г. — М., 1974. — С. 142-144.
7. Лабораторные животные. Разведение, содержание, использование в эксперименте / И. П. Западнюк [и др.]. — Киев : Вища школа. Головное изд-во, 1983. — 383 с.
8. Регенерация печени белых крыс при холестазе / Д. В. Дзидзигури [и др.] // Цитология. — 2004. — Т. 46, № 5. -С. 411-415.
9. Руководство по лабораторным животным и альтернативным моделям в биомедицинских технологиях / под ред. Н. Н. Каркищенко, С. В. Грачева. — М. : Профиль-2С, 2010. — 358 с.
10. Руководство по гистологии : в 2 т. Т. 2 / под ред. К. Данилова. — СПб. : СпецЛит, 2011. — 512 с.
11. Верин, В. К. Дифференцировка гепатоцитов и холан-гиоцитов в эмбриональном и постнатальном периоде онтогенеза крыс / В. К. Верин // Архив анатомии, гистологии и эмбриологии. — 1982. — Т. 82, № 2. — С. 106-114.
12. Никитюк, Б. А. Морфология человека : учеб. пособие / Б. А. Никитюк, В. П. Чтецова. — 2-е изд. — М. : Изд-во МГУ, 1990. — 344 с.
13. Гистология, цитология и эмбриология : учеб. для студентов мед. вузов / под ред. Ю. И. Афанасьева, Н. А. Юриной. — М. : Медицина, 2002. — 744 с.
14. Ноздрачев, А. Д. Анатомия крысы (Лабораторные животные) / А. Д. Ноздрачев, Е. Л. Поляков. — СПб. : Лань, 2001. — 464 с.
Д. Ноздрачев, Е. Л. Поляков. — СПб. : Лань, 2001. — 464 с.
15. Experimental obstructive cholestasis: the wound-like inflammatory liver response / M.-A. Aller [et al.] // Fibrogenesis Tissue Repair. — 2008 Nov. — Vol. 1, N 1. — P. 6.
16. Леонтюк, А. С. Основы возрастной гистологии : учеб. пособие / А. С. Леонтюк, Б. А. Слука. — Мн. : Выш. шк., 2000. — 416 с.
17. Зуфаров, К. А. Структурные особенности печени при нарушении ее экскреторной функции / К. А. Зуфаров,
References
1. Babak OYa. Sindrom kholestaza: chto nuzhno znat’ kazhdomu vrachu [Cholestasia syndrome: what each doctor needs to know]. Ukr Terapevt Zhurn. 2005;(3):4-22.
2. Vovk EI. Zhelchnokamennaia bolezn’ v KhKhI veke: chto novogo? [Cloelithiasis in the XXI century: any news?] Lechashchii Vrach. 2011 ;(2):58-65.
3. Konikoff F. Gallstones — approach to medical management. Med Gen Med. 2003 Oct;5(4):8.
4. Lammert F, Marschall HU, Glantz A, Matern S. Intrahepatic cholestasis of pregnancy: molecular pathogenesis, diagnosis and management. J Hepatol. 2000 Dec;33(6):1012-21.
А. Ф. Садриддинов // Морфология. — 1993. — Т. 105, № 10. — С. 81.
18. Привес, М. Г. Анатомия человека / М. Г. Привес, Н. К. Лысенков, В. И. Бушкович. — СПб. : Издательский дом СПбМАПО, 2006. — 720 с.
19. Esteller, A. Physiology of bile secretion / A. Esteller // J. World. Gastroenterol. — 2008 Oct. — Vol. 14, N 37. — P. 5641-5649.
20. Wang, D. Q.-H. The billiary system / D. Q.-H. Wang, B. A. Neuschwander-Tetri, P. Portincasa. — Florida, US : Morgan & Claypool Life Sciences, 2012. — 156 р.
21. Иванченкова, Р. А. Генетические аспекты желчеобразования / Р. А. Иванченкова, В. П. Гаценко, Е. Р. Ать-кова // Эксперим. и клин. гастроэнтерология. — 2009.
— № 3. — С. 56-63.
22. Florkemeier, V. Cholestatic Liver Disease / V. Florkemeier.
— Freinburg : Dr. Falk Pharma GmbH, 2006. — 112 p.
23. Гамбарян, П. П. Крыса : учеб. пособие для ун-тов / П. П. Гамбарян, Н. М. Дукельская. — М. : Совет. наука, 1955. — 255 с.
24. Морфология печени при CCM-индуцированном циррозе под влиянием фотодинамической терапии / А. В. Могилевец [и др.] // Проблемы здоровья и экологии. -2015. — № 1. — С. 71-75.
25. Лебедева, Е. И. Сравнительная морфофункциональ-ная характеристика печени белых крыс и человека при алкогольном циррозе / Е. И. Лебедева, О. Д. Мяделец // Новости мед.-биол. наук. — 2015. — Т. 12, № 3. — С. 97-106.
26. Усынин, И. Ф. Адаптивная роль функциональной гетерогенности гепатоцитов / И. Ф. Усынин // Бюл. СО РАМН. — 2007. — № 5. — С. 17-23.
27. New insights into functional aspects of liver morphology / D. E. Malarkey [et al.] // Toxicol. Pathol. — 2005. — Vol. 33, N 1. — P. 27-34.
28. Лебедева, Е. И. Морфофункциональная характеристика печени белых крыс в норме / Е. И. Лебедева, О. Д. Мяделец, В. С. Прудников // Учен. зап. Витеб. ордена «Знак Почета» гос. акад. ветеринар. медицины. — 2015.
— Т. 51, вып. 1, ч. 1. — С. 80-83.
29. Серов, В. В. Ультраструктурная патология / В. В. Серов, В. С. Пауков. — М. : Медицина, 1975. — 432 с.
30. Хэм, А. Гистология : в 5 т. / А. Хэм, Д. Кормак. — М. : Мир, 1983. — Т. 4. — 245 с.
Поступила 27.05.2016г. Принята в печать 16.06.2016г.
5. Lichtenstein D. Hepatobiliary complications of inflammatory bowel disease. Curr Gastroenterol Rep. 2011 0ct;13(5):495-505.
6. Maksimova LA, Zaltsmane VK, Kartashova OYa, Mayore AYa, Saldava LA, Sondore VYa, Raytsic AB. Prigodnost’ nekotorykh vidov laboratornykh zhivotnykh dlia modelirovaniia kholestaticheskikh porazhenii pecheni [Suitability of some species of laboratory animals for modeling of cholestatic lesions of a liver]. V: Laboratornye zhivotnye v meditsinskikh issledovaniiakh: tez dokl konf 3-4 okt 1974 g. Moscow, RF; 1974. Р. 142-4.
7. Zapadnyuk IP, Zapadnyuk VI, Zakhariya EA, Zapadnyuk BV. Laboratornye zhivotnye. Razvedenie, soderzhanie, ispol’zovanie v eksperimente [Laboratory animals.
Delution, maintenance, use in experiment]. Kiev, Ukraine: Vishcha shkola. Golovnoe izd-vo; 1983. 383 p.
8. Dzidziguri DV, Bakuradze ED, Kakhidze IG, Megrelishvili GZ, Kordzaia DD. Regeneratsiia pecheni belykh krys pri kholestaze [Neogenesis of a liver of white rats at a cholestasia]. Tsitologiia. 2004;46(5):411-5.
9. Karkishchenko NN, Grachev SV, red. Rukovodstvo po laboratornym zhivotnym i al’ternativnym modeliam v biomeditsinskikh tekhnologiiakh [The guide to laboratory animals and alternative models in biomedical technologies]. Moscow, RF: Profil’-2S; 2010. 358 p.
10. Danilov K, red. Rukovodstvo po gistologii [Guide to a histology]: v 2 t. T. 2. Saint-Petersburg, RF: SpetsLit; 2011. 512 p.
11. Verin VK. Differentsirovka gepatotsitov i kholangiotsitov v embrional’nom i postnatal’nom periode ontogeneza krys [Differentiation of hepatocytes and holangiotsit in the fetal and post-natal period of an ontogenesis of rats]. Arkhiv Anatomii Gistologii Embriologii. 1982;82(2):106-14.
12. Nikityuk BA, Chtetsova VP. Morfologiia cheloveka [Morphology of the person]: ucheb posobie. 2-e izd. Moscow, RF: Izd-vo MGU; 1990. 344 p.
13. Afanasyev Yul, Yurina NA, red. Gistologiia, tsitologiia i embriologiia [Histology, cytology and fetology]: ucheb dlia studentov med vuzov. Moscow, RF: Meditsina; 2002. 744 p.
14. Nozdrachev AD, Polyakov EL. Anatomiia krysy (Laboratornye zhivotnye) [Anatomy of a rat (Laboratory animals)]. Saint-Petersburg, RF: Lan’; 2001. 464 p.
15. Aller MA, Arias JL, García-Domínguez J, Arias JI, Durán M, Arias J. Experimental obstructive cholestasis: the wound-like inflammatory liver response. Fibrogenesis Tissue Repair. 2008 Nov;1(1):6.
16. Leontyuk AS, Sluka BA. Osnovy vozrastnoi gistologii [Fundamentals of age histology]: ucheb posobie. Minsk, RB: Vysh shk; 2000. 416 p.
17. Zufarov KA, Sadriddinov AF. Strukturnye osobennosti pecheni pri narushenii ee ekskretornoi funktsii [Structural features of a liver at disturbance of its excretory function]. Morfologiia. 1993;105(10):81.
18. Prives MG, Lysenkov NK, Bushkovich VI. Anatomiia cheloveka [Human anatomy]. Saint-Petersburg, RF: Izdatel’skii dom SPbMAPO; 2006. 720 p.
19. Esteller A. Physiology of bile secretion. World J Gastroenterol. 2008 Oct;14(37):5641-9.
20. Wang D Q-H, Neuschwander-Tetri BA, Portincasa P. The billiary system. Florida, US: Morgan & Claypool Life Sciences; 2012. 156 p.
21. Ivanchenkova RA, Gatsenko VP, Atkova ER. Geneticheskie aspekty zhelcheobrazovaniia [Genetic aspects of biliation]. Eksperim Klin Gastroenterologiia. 2009;(3):56-63.
22. Flörkemeier V. Cholestatic Liver Disease. Freinburg: Dr Falk Pharma GmbH; 2006. 112 p.
23. Gambaryan PP, Dukelskaya NM. Krysa [Rat]: ucheb posobie dlia un-tov. Moscow, RF: Sovet nauka; 1955. 255 p.
24. Mogilevets EV, Garelik PV, Zimatkin SM, Anufrik SS, Prokopchik NI. Morfologiia pecheni pri CCl4-indutsirovannom tsirroze pod vliianiem fotodinamicheskoi terapii [Liver morphology at the CCl4-induced cirrhosis under the influence of photodynamic therapy]. Problemy Zdorov’ia Ekologii. 2015;(1 ):71 -5.
25. Lebedeva EI, Myadelets OD. Sravnitel’naia morfofunktsional’naia kharakteristika pecheni belykh krys i cheloveka pri alkogol’nom tsirroze [The comparative morfofunktsionalny characteristic of a liver of white rats and the person at an alcoholic cirrhosis]. Novosti Med-Biol Nauk. 2015;12(3):97-106.
26. Usynin IF. Adaptivnaia rol’ funktsional’noi geterogennosti gepatotsitov [Adaptive role of functional heterogeneity of hepatocytes]. Biul SO RAMN. 2007;(5):17-23.
27. Malarkey DE, Johnson K, Ryan L, Boorman G, Maronpot RR. New insights into functional aspects of liver morphology. Toxicol Pathol. 2005;33(1):27-34.
28. Lebedeva EI, Myadelets OD, Prudnikov VS. Morfofunktsional’naia kharakteristika pecheni belykh krys v norme [The Morfofunktsionalny characteristic of a liver of white rats is normal]. Uchen Zap Viteb Ordena Znak Pocheta Gos Akad Veterinar Meditsiny. 2015;51(vyp 1, ch 1):80-3.
29. Serov VV, Paukov VS. Ul’trastrukturnaia patologiia [Ultrastructural pathology]. Moscow, RF: Meditsina; 1975. 432 p.
30. Khem A, Kormak D. Gistologiia [Histology]: v 5 t. Moscow, RF: Mir; 1983. T 4. 245 p.
Submitted 27.05.2016 Accepted 16.06.2016
Сведения об авторах:
Зиматкин С.М. — д.б.н., профессор, заведующий кафедрой гистологии, цитологии и эмбриологии УО «Гродненский государственный медицинский университет»;
Марковец Н.И. — ассистент кафедры гистологии, цитологии и эмбриологии УО «Гродненский государственный медицинский университет». Information about authors:
Zimatkin S.M. — Doctor of Biological Sciences, professor, head of the Chair of Histology, Cytology & Embryology, Educational Establishment «Grodno State Medical University»;
Markovets N.I. — teacher of the Chair of Histology, Cytology & Embryology, Educational Establishment «Grodno State Medical University».
Адрес для корреспонденции: Республика Беларусь, 230009, г. Гродно, ул. Горького, 80, УО «Гродненский государственный медицинский университет», кафедра гистологии, цитологии и эмбриологии. E-mail: [email protected] — Зиматкин Сергей Михайлович.
Correspondence address: Republic of Belarus, 230009, Grodno, 80 Gorky str., Educational Establishment «Grodno State Medical University», Chair of Histology, Cytology & Embryology. E-mail: [email protected] — Zimatkin S.M.
Холангит (воспаление желчных протоков) симптомы и лечение
Холангит: с воспалением желчных протоков шутить опасно
Если вас «температурит», увы, это не всегда от «горячих чувств». Иногда лихорадка — один из грозных признаков серьезного недуга — холангита. Что представляет собой это заболевание и как ему воспрепятствовать, читайте далее.
Факт. Холерез — процесс образования желчи — происходит непрерывно. А холекинез — процесс поступления желчи в 12-перстную кишку — во время приема пищи.
Различают:
- Острый холангит — его возбудителями выступают разнообразные бактерии, которые проникают из просвета кишечника и желчного пузыря в желчные пути. Иногда попадают в протоки через кровеносное русло и лимфу. Практически при любой клинической картине болезнь формируется на основе застоя желчи.
- Хронический холангит часто развивается после оперативных вмешательств на протоках, на фоне регулярно повторяющихся приступов панкреатита, гастродуоденита (воспаление слизистой оболочки 12-перстной кишки и примыкающей к ней зоны желудка) и холецистита.
- Склерозирующий холангит — вследствие воспалительного процесса или после операций желчные протоки постепенно перекрываются и зачастую возникает болезнь печени — цирроз.
Факт. Нет определенной тенденции, кто именно чаще страдает холангитом. В этой ситуации возрастных и гендерных разграничений нет.
Симптомы холангита
Острый холангит «прихватывает» неожиданно. Для него характерны:
- озноб, лихорадка
- приступообразные колики в правом подреберье, ощутимые даже в области шеи и плеча, а также лопатки
- состояние слабости и снижение аппетита, связанное с интоксикацией
- головная боль
Эта разновидность болезни зачастую принимает осложненную форму желтухи, сопровождаемой изменением окраски кожной оболочки и склер, зудом.
Факт. Древнеримский медик Гален считал желчь маркером поведения человека. Преобладание светлой желчи относил к прямой связи с такими чертами человека, как вспыльчивость и неуравновешенность. А избыток темной желчи связывал с доминантой пессимистичного настроения в темпераменте. «Сhole» в переводе с греческого означает «желчь».
Признаки хронического холангита
- периодически возникающая лихорадка
- приглушенные боли слабой интенсивности в правом подреберье
- ощущение «вздутия» верхних отделов живота
- на тяжелой стадии ему может сопутствовать механическая желтуха
- субфебрильная температура тела (в пределах 37-38 градусов)
- частая утомляемость
Симптоматика склерозирующего холангита аналогична острому и хроническому подвидам. Но иногда может усугубляться развитием множественных абсцессов (гнойных воспалений ткани) печени, сепсисом («заражением крови»), токсическим шоком.
Кто придет на выручку?
В Медицинском доме Odrex вам окажут ургентную помощь и помогут своевременно снять воспалительный процесс. Здесь работают хирурги высшей категории, которые в доскональности владеют самыми сложными оперативными приемами. Здесь сражаются за жизнь каждого и сохраняют самое ценное — здоровье.
Диагностика холангита
- ультразвуковое обследование органов брюшной полости
- МРТ органов брюшной полости с виртуальной холангиографией
- общие анализы
- ЭРХПГ — рентген-эндоскопическое исследование желчных протоков и главного протока поджелудочной железы с введением контрастных веществ.
Факт. В течение дня у человека скапливается примерно 15 мл желчи на кг массы тела.
Лечение холангита
Врач назначает пациенту либо консервативное, либо хирургическое лечение. Если желчевыводящие протоки полностью заблокированы, то явно понадобится оперативное вмешательство, если же нет — то еще допустимо применение в отношении больного медикаментозного курса. Он предусматривает прием:
- антибиотиков для ликвидации инфекционного очага
- спазмолитиков и анальгетиков для устранения болевого синдрома
- антигельминтных препаратов при проникновении в протоки паразитарной инфекции
- гепатопротекторов — для нормализации обменных процессов желчных кислот
- инфузии (внутривенные вливания) глюкозо-солевых растворов при проявленной интоксикации
Хирургическое вмешательство представляет собой:
- наружное чреспеченочное дренирование желчных протоков (установление дренажа в просвете желчных протоков для выведения патологических жидкостных скоплений)
- эндоскопическое бужирование опухолевой стриктуры внепеченочных желчных протоков — расширение суженных желчных протоков с помощью специальных бужей (инструментов для расширения каналов), введенных через дуоденоскоп (снабженный видеокамерой оптический прибор). Это помогает восстановить нарушение оттока желчи в 12-перстную кишку.
Послеоперационный период длится в среднем от двух суток до недели. А процесс восстановления организма занимает около полугода и предусматривает самостоятельную регуляцию уровня физической нагрузки на организм, максимальное ее снижение, и соблюдение режима диеты.
Вопрос — ответ
Какую роль играет сбалансированное питание в лечении холангита?
Прооперированным пациентам рекомендуют диету №5 по Певзнеру, направленную на снижение потребления калорий за счет сокращения жиров (до 100 грамм в сутки) и белков в ежедневном рационе. Есть следует отварную, теплую, желательно несоленую пищу — 5-6 раз в день мелкими порциями.
Разрешены:
- полувязкие каши
- овощи, зелень, квашеная некислая капуста
- отварные яйца
- сливочное или растительное масло — не более 50 г в день
- куриное мясо, нежирная рыба в запеченном виде, отварная или на пару
- овощные супы
- если хлеб — то ржаной, несдобное тесто в минимальным количествах
- обезжиренный творог
- если соки — то некислые, компот, некрепкий чай
- мед, варенье
Запрещены:
- супы на бульонах
- кислые фрукты и ягоды
- жирное мясо и рыба
- жареная пища
- крепкий кофе, алкоголь, мороженое, кондитерские изделия с шоколадом и кремовым наполнителем
- свежий хлеб
- копчености
- консервация
- маринованные овощи
- алкоголь
Бывает ли хронический холангит у ребенка?
Да, бывает. Иногда он может выступать следствием острого холангита, но в основном развивается «на базе» хронического холецистита и панкреатита. У ребенка возможен кожный зуд; появляется субфебрильная температура, слабость; он худеет, часто испытывает изжоги, запоры или поносы, ощущает неприятный привкус во рту. Объемы печени увеличиваются, ее ткани уплотняются, что приводит даже к циррозу. Но своевременное лечение способно остановить разрушительные процессы в пищеварительной системе.
Я слышал, что желчь бывает «светлая» и «темная». А чем они отличаются?
В печени желчь — прозрачно-золотистого цвета. В желчном пузыре вещество становится более насыщенной концентрации, приобретает темный оттенок, так как к нему присоединяется муцин желчных путей и пузыря. Смену цвета ученые объясняют также всасыванием желчью гидрокарбонатов и образованием с ее помощью солей желчных кислот. Желчь нивелирует разрушительное действие фермента желудочного сока пепсина.
Ученые вырастили функциональный прототип печени из клеток кожи человека — Сибирь |
Новосибирск. 8 июня. ИНТЕРФАКС-СИБИРЬ — Исследователи из Медицинской школы Университета Питтсбурга, используя клетки кожи от людей-добровольцев, создали функциональные мини-печени, которые затем пересадили крысам, сообщает издание Сибирского отделения РАН «Наука из первых рук».
Отмечается, что исследования, направленные на разработку методов выращивания новых органов из собственных клеток пациента ведутся достаточно активно. С помощью методов генетического перепрограммирования из обычных соматических клеток человека сначала получают неспециализированные индуцированные плюрипотентные стволовые клетки (ИПСК), из которых затем получают специализированные клетки нужных типов тканей и органов.
Ранее попытки вырастить функциональный прототип человеческой печени заканчивались не слишком удачно: хотя большинство клеток и трансформировалось в гепатоциты — основные клетки печеночной ткани, однако они так и оставались незрелыми и неспособными нормально работать.
«Кроме того, пока никому не удалось создать, хотя бы в миниатюре, полноценный орган со всеми необходимыми и хорошо работающими структурами, такими как сеть кровеносных сосудов и система желчных протоков», — отмечает издание.
Американские ученые получили из человеческих ИПСК не только гепатоциты, но и клетки других типов, присутствующих в нормальной печени: эндотелия (внутренней выстилки) кровеносных сосудов, холангиоциты — клетки выстилки желчных протоков, участвующие в регуляции секреции желчи и др.
На следующем этапе полученные клетки пересадили в печень крыс, освобожденную от ее собственных клеточных элементов, — от органа оставался лишь соединительнотканный каркас с кровеносными сосудами и желчевыводящими путями.
При этом сосуды и желчные протоки также были заселены соответствующими клеточными элементами. Ученые смогли увидеть, как холангиоциты, «устроившись» на новом месте, производят специфические для них вещества-маркеры, хотя доказательств полного восстановления их функций получить не удалось.
Созданные прототипы печени были затем пересажены пяти взрослым животным. Изучив имплантированные органы через несколько дней, ученые обнаружили в них разнообразные нарушения, связанные с плохой работой печеночной кровеносной сети: недостаточность кровотока, тромбозы — как в самом трансплантате, так и в близлежащих тканях.
«Это серьезная проблема, решение которой должно быть одним из приоритетных — для создания органа, который можно использовать для пересадки человеку, необходимо научиться формировать в нем полноценно работающую печеночную ткань и сосудистую систему. Но все же в целом трансплантаты работали: в крови крыс были обнаружены циркулирующие человеческие белки, которые производили клетки «новой» печени», — говорится в сообщении.
Отмечается, что хотя ученым пока не удалось создать полноценный орган для трансплантации, результаты сами по себе имеют практическую ценность в случае, когда полная трансплантация не нужна, а требуется лишь временно поддержать больной орган (например, при острой печеночной недостаточности).
МРТ брюшной полости
МРТ брюшной полости (БП) – результативный метод обследования и контроля изменений внутренних органов в процессе терапии и после операционных вмешательств. Главные преимущества магнитно-резонансной томографии — обзор состояния организма, невозможный другими способами, а кроме того, получение трехмерного изображения внутренних органов послойно, с разной глубиной и в многочисленных проекциях.
МРТ-исследование брюшной полости и забрюшинного пространства без применения контрастного вещества безопасно для пациентов с патологиями (даже при острой стадии). МРТ не базируется на радиационном излучении, что выгодно отличает его от рентгена. Магнитное поле, продуцируемое томографом, не провоцирует побочных эффектов и нежелательных осложнений.
Что увидит врач на МРТ брюшной полости?
На изображении, полученном с помощью МРТ, доктор увидит недостатки развития и патологические изменения органов брюшины, воспаления, обструктивные процессы, кисты, панкреатит, увеличение печени, проблемы с кровообращением в тканях забрюшинного пространства, камни в желчном пузыре и протоках. Уникальность исследования в том, что оно может установить тип и стадию онкологии. Показано это обследование для определения, доброкачественное новообразование или злокачественное, с его помощью диагностируют метастазы, определяют границу опухоли и прогнозируют шансы на исцеление.
Рекомендацию провести МРТ брюшной полости дает врач, если в процессе предшествующего обследования пациента другими способами (при визуальном осмотре, по результатам анализов или ультразвуковой диагностики) возникли подозрения на дефекты развития, аномалии или патологии внутренних органов. Также МРТ-тестирование показано для выявления сосудистых патологий. Перед проведением хирургических операций доктора также назначают МРТ. Для установления характера образований, определения типов камней в почках и желчном пузыре хирурги Медгарда также советуют этот вид обследования.
Противопоказания к МРТ
Наличие в теле металлических элементов — имплантатов (кроме зубных), кардиостимуляторов, инсулиновых помп, протезов (штифтов, пластин, искусственных суставов) — абсолютное противопоказание к этому обследованию. Томограф производит сильное магнитное поле, на него реагируют металлические элементы, нагреваясь и вызывая ожоги и риск поломки имплантированных аппаратов. МРТ с парамагнетиком (контрастным веществом) может вызвать аллергическую реакцию.
Виды МРТ-исследования брюшной полости и забрюшинного пространства.
Обзорное МРТ брюшной полости предусматривает визуализацию гепатобилиарной системы (печень, селезенка, желчевыводящие пути, панкреатические протоки, поджелудочная железа) и забрюшинного пространства (желудок, кишечник, ткани поясной области, сосуды и лимфоузлы, почки, надпочечники и мочеполовая система). На МРТ рентгенолог увидит воздействие изменений в одном органе на другие органы и системы организма. При желании пациента сделать МРТ брюшной полости по собственному желанию, без направления лечащего врача, рекомендуем выбрать именно обзорный вариант исследования.
МРТ отдельных органов брюшной полости;
Подготовка к МРТ органов и сосудов брюшной полости
Подготовка к диагностике предполагает безуглеводную диету в течение 48 часов до обследования. За сутки до тестирования не стоит употреблять напитки с газом, фрукты и овощи, черный хлеб, кофе и чай, чтобы газы и спазмы в кишечнике не нарушили точность изображения.
Подготовиться к МРТ пациентам с клаустрофобией или иными психологическими проблемами чуть сложнее. Перед тестированием можно выпить успокоительные лекарства, назначенные врачом или использовать беруши.
Как проводится томография
Пациент помещается в аппарат МРТ, имеющий вид открытой с двух сторон трубы (существуют и томографы открытого типа). Создаваемое томографом мощное поле возбуждает атомы водорода в организме пациента, ядра клеток излучают радиоволны и формируют изображение, передавая его на монитор. Сформировав картинку, клетки возвращаются в привычное состояние без изменений. Обработка полученных данных происходит в специализированной программе, компьютер создает 3-Д изображение высокого качества.
Время тестирования на томографе зависит от количества исследуемых органов и числа слоев (срезов). Диагностика одного органа полости занимает около получаса. Магнитное поле томографов измеряется в Теслах. Минимальная мощность аппаратов МРТ — 0,5 тесла, максимальное для человека — 3 Тесла, выше запрещено. Золотой стандарт диагностики в этой области — 1,5 Тесла. Именно такой высокопольный аппарат установлен в лечебно-диагностическом комплексе Медгард. Наш томограф Siemens Magnetom Aera 1,5 Тл позволяет проводить диагностику всех органов и систем человека. Помимо высокой точности получаемых изображений, аппарат имеет повышенную грузоподъемность — на нем можно исследовать людей массой тела до 200 кг, а также расширенное «окно», куда помещается пациент — 70 см вместо «стандартных» 60.
Низкопольные томографы часто бывают открытого типа. Качество изображений на них менее контрастное.
Описание результатов МРТ выполняет врач-рентгенолог. Результаты выдаются пациенту в форме заключения, распечатанного на бумаге, а сама запись исследования на CD-диске. Также пациенты увидят описание в личном кабинете на сайте лечебно-диагностического центра Медгард.
Медицинский центр ЛорЗдрав — Какие анализы рекомендуется делать?
- Общий клинический анализ крови. Этот анализ покажет, нет ли анемии, заболеваний крови, воспалительных процессов, по нему можно судить о состоянии иммунитета, наличии аллергических реакций.
- Общий анализ мочи для оценки функции мочеполовой системы. Анализ мочи определяет состояние мочевыделительной системы человека. Есть ли какое-то воспаление в организме — цистит, уретрит, пиелонефрит, либо заболевание почек – гломерулонефрит, а также ранние признаки диабета. По плотности мочи можно определить, как работают почки. Если в моче обнаруживают сахар или ацетон, это значит, что у вас запущенный сахарный диабет. Заболевания почек могут привести к почечной недостаточности.
- Биохимический анализ крови. Определение холестерина и его фракций (ЛПНП, ЛПВП, ЛПОНП, триглицериды) — выявление атеросклероза, креатинина, отражающего фильтрационное действие почек, печеночных трансаминаз и других показателей. Этот анализ выявит, нормально ли работают сердечно-сосудистая система, печень, почки, желчевыводящие протоки и другие органы.
- Сдать анализ на гормоны.
Женщинам особое внимание необходимо уделить анализу на гормоны. Если у Вас есть нарушение менструального цикла, он покажет, здоровы ли яичники, щитовидная железа. Скажет о состоянии всей женской гормональной сферы. - Сдать анализы на выявление инфекций, передающихся половым путем
Как и женщинам, мужчинам необходимо сдавать эти анализы для того, чтобы не допустить развитие неприятных болезней. Всем пациентам проводится диагностика ВИЧ-инфекции, сифилиса, а также гепатитов В и С. Желательно сдавать их каждые полгода, даже если у вас постоянный партнер. - Для мужчин после 45 лет. Показано определение в крови уровня простат-специфического антигена (ПСА). Этот онкомаркер указывает на злокачественные образования предстательной железы или возможность их развития.
- Анализ крови на сахар. По нему можно судить об опасности развития сахарного диабета. Если вы сладкоежка и не хотите допустить развитие сахарного диабета, а тем более, если в роду есть диабетики, то обязательно сдайте кровь на сахар. Анализ сдается натощак. Помните, что на начальных стадиях заболевания ещё можно изменить свой образ жизни и питания, и все будет хорошо, а в запущенных стадиях болезнь может дать такие страшные осложнения как слепоту или гангрену ноги, а также инфаркт и инсульт.
- Проверить липидный профиль. Данный анализ поможет узнать, нет ли у вас заболевания атеросклероз, провоцирующего образование тромбов, провоцирующих инфаркты и инсульты.
В зависимости от индивидуальных особенностей каждого человека, его анамнеза, наследственности и жалоб врачом могут быть назначены и другие обследования и анализы.
Желчный пузырь и желчные пути — Заболевания печени и желчного пузыря
Желчный пузырь — это небольшой грушевидный мускулистый накопительный мешок, в котором содержится желчь и который соединен с печенью протоками, известными как желчные пути. (См. Также Обзор печени и желчного пузыря.)
Желчь — зеленовато-желтая густая липкая жидкость. Он состоит из солей желчных кислот, электролитов (растворенных заряженных частиц, таких как натрий и бикарбонат), желчных пигментов, холестерина и других жиров (липидов).Желчь выполняет две основные функции:
Удаление из организма определенных продуктов жизнедеятельности (в основном гемоглобина и избыточного холестерина)
Желчные соли способствуют пищеварению, облегчая всасывание холестерина, жиров и жирорастворимых витаминов из кишечника.
Билирубин — основной пигмент желчи. Билирубин — это продукт жизнедеятельности, который образуется из гемоглобина (белка, переносящего кислород в кровь) и выводится с желчью.Гемоглобин высвобождается при разрушении старых или поврежденных эритроцитов.
Желчь выходит из печени через левый и правый печеночные протоки, которые вместе образуют общий печеночный проток. Затем этот проток соединяется с протоком, соединенным с желчным пузырем, называемым пузырным протоком, образуя общий желчный проток. Общий желчный проток входит в тонкий кишечник через сфинктер Одди (кольцеобразная мышца), расположенный на несколько дюймов ниже желудка.
Около половины желчи, выделяемой между приемами пищи, проходит через общий желчный проток в тонкий кишечник.Остальная желчь отводится через пузырный проток в желчный пузырь для хранения. В желчном пузыре до 90% воды, содержащейся в желчи, всасывается в кровоток, что делает оставшуюся желчь очень концентрированной. Когда пища попадает в тонкий кишечник, серия гормональных и нервных сигналов заставляет желчный пузырь сокращаться, а сфинктер Одди расслабляться и открываться. Затем желчь течет из желчного пузыря в тонкий кишечник, где смешивается с содержимым пищи и выполняет свои пищеварительные функции.
После того, как желчь входит и проходит по тонкой кишке, около 90% желчных солей реабсорбируются в кровоток через стенку нижней части тонкой кишки. Печень извлекает эти желчные соли из крови и повторно выделяет их обратно в желчь. Соли желчных кислот проходят этот цикл от 10 до 12 раз в день. Каждый раз небольшое количество солей желчных кислот не всасывается и попадает в толстую кишку, где они расщепляются бактериями. Некоторые соли желчных кислот реабсорбируются в толстом кишечнике.Остальные выводятся с калом.
Желчный пузырь хоть и полезен, но не обязателен. Если желчный пузырь удален (например, у человека с холециститом), желчь может перейти непосредственно из печени в тонкий кишечник.
Желчные камни — твердые образования, состоящие в основном из холестерина. Камни в желчном пузыре могут образовываться в желчном пузыре или желчных протоках. Камни в желчном пузыре обычно не вызывают симптомов. Однако желчные камни могут блокировать отток желчи из желчного пузыря, вызывая боль (желчные колики) или воспаление.Они также могут мигрировать из желчного пузыря в желчный проток, где они могут блокировать нормальный поток желчи в кишечник, вызывая желтуху (желтоватое изменение цвета кожи и белков глаз) в дополнение к боли и воспалению. Отток желчи также может быть заблокирован опухолями. Другие причины блокировки потока встречаются реже.
Желчные пути — обзор
Необструктивное заболевание желчевыводящих путей
Необструктивные заболевания желчевыводящих путей включают осложнения, возникающие в результате бактериальной инфекции желчевыводящих путей, мукоцеле желчных путей, холецистита (некротизирующего, эмфизематозного, бактериального, паразитарного), панкреатита, холелитиаза и / или холелитиаза. новообразования.
Холецистит или воспаление желчного пузыря может иметь стерильный или нестерильный характер. Обычно он затрагивает как внутрипеченочные, так и внепеченочные желчные протоки. 3,8 Состояние пациента часто можно стабилизировать медикаментозно с помощью антибиотиков, холеретиков и времени. Однако, если эпизоды повторяются или симптомы не исчезают при консервативном лечении, может потребоваться холецистэктомия. 3
Бактерии, скорее всего, попадают в желчевыводящую систему, восходя из желудочно-кишечного тракта (ЖКТ) ретроградным образом.Бактериальные инфекции в желчных путях иногда лечат соответствующей медикаментозной терапией, включая антибиотики (в идеале на основе результатов аэробных и анаэробных культур и результатов чувствительности). Сообщалось о бактериальной колонизации желчевыводящих путей у животных с холангитом, холангиогепатитом, холециститом, холедохитом, панкреатитом и очаговыми гнойными или множественными образованиями абсцесса печени. 3,8 У животных с холециститом воспаление ограничивается желчным пузырем.Если воспаление или инфекция прогрессируют, это может привести к холангиту или холангиогепатиту. Холангиогепатит чаще встречается у кошек, чем у собак (см. Главу 126, Гепатит и холангиогепатит). Когда желчный пузырь инфицирован газообразующими бактериями (например, Escherichia coli или Clostridium perfringens ), возникает эмфизематозный холецистит. Газообразование может привести к просветлению на рентгенограммах в области желчного пузыря или акустической тени в желчном пузыре при УЗИ брюшной полости.
Некротический холецистит может вызвать сильное ослабление стенки желчевыводящих путей и последующий разрыв желчевыводящих путей. Патогенез холецистита плохо изучен, а связь между холангитом и холангиогепатитом у собак и кошек сомнительна. Рецидивирующие бактериальные инфекции или признаки разрыва желчевыводящих путей являются показаниями к хирургическому обследованию и холецистэктомии. Бактерии можно выделить из чрескожной аспирации или полученных хирургическим путем культур желчи и печени.Были идентифицированы различные бактериальные изоляты; однако чаще всего сообщалось о E. coli, Clostridium spp и Streptococcus spp. 3,8 Билиарные паразиты встречаются редко. Platynosomum fastosum может инфицировать кошек из теплого тропического климата; Amphimerus pseudofelineus был связан с холангитом, холангиогепатитом и расширением общего желчного протока у кошек; и Metorchis conunctus и Eurytrema procyonis могут быть обнаружены в желчных путях кошек. 3 Ультразвуковое исследование или осаждение фекалий могут помочь в диагностике, а празиквантел является препаратом выбора при большинстве заражений двуустками.
Инфаркт желчного пузыря был обнаружен при гистопатологическом исследовании у 12 собак и может привести к разрыву желчного пузыря. 17 У некоторых из этих собак также были признаки инфаркта в других органах, что вызывало предположения, что системная гиперкоагуляция могла привести к инфаркту желчных структур. Это состояние не было связано с холециститом.
Новообразование желчевыводящих путей не обязательно приводит к обструктивным заболеваниям. Сообщалось о карциномах желчных протоков, и на момент постановки клинического диагноза метастазы являются обычным явлением. 3 Врожденные состояния, такие как синдром Кароли (врожденная аномалия желчных протоков) или поликистоз, могут вызывать врожденное расширение как внутрипеченочных, так и внепеченочных желчных протоков по всей печени. Эти животные обычно молоды, и диагноз ставится на основании гистопатологического исследования. 18
Желчный пузырь и сфинктер Одди — обзор
Желчные пути собирают, хранят, концентрируют и доставляют желчь, выделяемую печенью. Его подвижность контролируется нейрогормональными механизмами, при этом ключевую роль играет блуждающий и чревный нервы, а также гормон холецистокинин. Эти нейрогормональные механизмы объединяют моторику желчного пузыря и сфинктера Одди (SO) с желудочно-кишечным трактом в фазах голодания и пищеварения. Во время голодания большая часть печеночной желчи направляется в желчный пузырь благодаря сопротивлению SO.Желчный пузырь позволяет постепенному поступлению желчи, расслабляясь за счет пассивных и активных механизмов. Во время фазы пищеварения желчный пузырь сжимается, и SO расслабляется, позволяя желчи попасть в двенадцатиперстную кишку для переваривания и всасывания жиров. Патологические процессы, проявляющиеся повторяющимися эпизодами болей в верхней части живота, затрагивают как желчный пузырь, так и СО. Подвижность желчного пузыря и цитопротекторные функции нарушаются литогенной печеночной желчью с избытком холестерина, что позволяет гидрофобным солям желчных кислот вызывать хронический холецистит.Лапароскопическая холецистэктомия — стандартное лечение. Три типа дискинезии SO также вызывают боль в желчных путях. Их патофизиология полностью не известна. Боль I и II типа обычно поддается сфинктеротомии, но боль III типа — нет.
1. Введение
В этой статье рассматриваются анатомия и физиология внепеченочных желчных путей, а также патофизиология и клинические симптомы воспалительных и функциональных нарушений двух его ключевых структур: желчного пузыря и сфинктера Одди.Также имеется краткое описание общепринятых методов лечения этих состояний.
Внепеченочные желчные пути — это закрытая система, предназначенная для сбора, хранения и концентрации желчи, выделяемой печенью и периодически доставляемой в двенадцатиперстную кишку через желчные протоки. Желчь содержит соли желчных кислот, ключевой компонент, участвующий в переваривании и всасывании жиров и липосолюбильных витаминов, а также другие компоненты, участвующие в энтерогепатическом кровообращении, включая холестерин (Ch), наиболее важный с патологической точки зрения.
Эти моторные функции желчных путей тесно интегрированы с остальной пищеварительной системой нейрогормональными механизмами, которые включают блуждающие и чревные нервы и различные гормоны, в том числе холецистокинин (CCK). Они контролируют двигательную активность желчевыводящих путей во время голодания и пищеварения.
2. Анатомия и физиология
2.1. Желчный пузырь
Желчный пузырь — это тонкостенный мешок, обычно помещаемый между обеими долями печени, состоящий из трех анатомических частей: дна, тела и воронки [1].Анатомически желчный пузырь человека довольно похож на большинство видов млекопитающих, которые были подвергнуты экспериментальным исследованиям на собаках, кошках, опоссумах, морских свинках, луговых собачках и мышах. У некоторых видов, например у крыс, желчный пузырь отсутствует. Желчный пузырь заканчивается пузырным протоком, который представляет собой пассивный канал, который у человека имеет диаметр около 7 мм со слизистой оболочкой, содержащей спиральные клапаны (клапаны Heister). Этот проток впадает в общий желчный проток без сфинктерной структуры. Общий желчный проток проходит через головку поджелудочной железы, заканчиваясь сфинктером Одди, поскольку он проникает в стенку двенадцатиперстной кишки, где образует ампулу Фатера.В общем желчном протоке мало неорганизованных мышечных волокон. Ни пузырный проток, ни общий желчный проток не имеют перистальтической моторики.
Гистология желчного пузыря состоит из слизистой оболочки с одним слоем эпителиальных клеток, собственной пластинки, однослойной мышцы, напоминающей мышечную слизистую оболочку желудочно-кишечного тракта, и серозного слоя [2]. Эпителиальный слой поглощает воду и электролиты, которые концентрируют желчь желчного пузыря, содержащую гидрофобные соли желчных кислот. Слизистая оболочка также переносит небольшие количества солей желчных кислот и Ch, вероятно, путем пассивной диффузии [3, 4].Эти эпителиальные клетки способны переносить гидрофобные соли желчных кислот, хотя они очень агрессивны в других органах (желудке и пищеводе) из-за их цитопротекторных функций, в которых простагландин E2 (PGE2) играет важную роль. Этот простагландин защищает эпителиальные клетки, секретируя муцин, который покрывает слизистую оболочку и инактивирует свободные радикалы, вызванные солями желчных кислот. Единственный мышечный слой иннервируется блуждающими и чревными нервами, которые синапсируют с интрамуральными нейронами.
Желчные пути функционально интегрированы с пищеварительным трактом посредством нейрогормональных механизмов в фазах голодания и пищеварения [1]. Печень непрерывно выделяет желчь во внутрипеченочные протоки, впадающие во внепеченочные протоки. Желчный пузырь наполняется с помощью сфинктера Одди (SO), где желчь накапливается и концентрируется в состоянии натощак и опорожняется в течение всех трех фаз пищеварительного периода. В межпищеварительный период около 10% печеночной желчи может стекать в двенадцатиперстную кишку, что происходит в промежутках между фазовыми сокращениями сфинктера Одди (диастолические периоды), когда секретируемая желчь поднимает протоковое давление выше сфинктера базального давления Одди [5] .Оставшиеся 90% желчи перенаправляются в пузырный проток , чтобы накапливаться в желчном пузыре. Поступление желчи расширяет желчный пузырь за счет пассивных и активных механизмов. Адренергические и нехолинергические неадренергические нервы опосредуют активное расслабление или аккомодацию желчного пузыря , которое постепенно индуцируется поступающей желчью.
Основными нейрогормональными механизмами, регулирующими моторику желчного пузыря, являются блуждающие и чревные нервы, а также гормон CCK [6–8].Блуждающий нерв содержит афферентные и эфферентные волокна [9]. Эфферентные волокна представляют собой преганглионарные нейроны, которые синапсируют с интрамуральными постганглионарными холинергическими нейронами, присутствующими в стенке желчного пузыря. Стимуляция эфферентных волокон блуждающего нерва сокращает желчный пузырь, которому противодействуют ганглионарный блокатор гексаметоний и антагонист мускариновых рецепторов атропин. Стимуляция внутренних нервов расслабляет желчный пузырь, который блокируется пропранололом [10].Эта ингибирующая иннервация была продемонстрирована на полосах мышц желчного пузыря кошек, обработанных атропином [11]. Полоски расслаблялись в ответ на стимуляцию электрического поля, которая блокировалась пропранололом, но не подвергалась действию частичных антагонистов вазоактивного кишечного пептида (VIP), что позволяет предположить, что стимул действовал на симпатические постганглионарные нейроны, высвобождающие адреналин как нейротрансмиттер, который действует в первую очередь на бета-адренорецепторы. рецепторы. Однако разные результаты были получены, когда желчный пузырь кошки, обработанный атропином, был расслаблен путем стимуляции блуждающего нерва.В этих экспериментальных условиях релаксация была резистентной к пропранололу, но отменялась предварительной обработкой антисывороткой против VIP, что позволяет предположить, что этот пептид является нейротрансмиттером, ответственным за него [12]. Возможно, что антисыворотка против VIP является более эффективным антагонистом против VIP, чем частичные антагонисты VIP, которые использовались в мышечных полосках. Эти расхождения между исследованиями in vitro и in vivo в настоящее время невозможно полностью объяснить, хотя вполне возможно, что оба нейромедиатора участвуют в релаксации желчного пузыря.Необходимы дальнейшие исследования, чтобы согласовать эти разные наблюдения, которые были продемонстрированы с использованием различных экспериментальных условий.
Во время голодания желчный пузырь поддерживает умеренное тоническое сокращение, которое накладывается на непропульсивные и пропульсивные сокращения [13, 14]. Эти тонические и ритмические сокращения были продемонстрированы у собак in vivo. Непропульсивные сокращения, вероятно, предназначены для удержания нерастворимых в желчи компонентов в растворе, предотвращая их осаждение, особенно осаждение Ch, которое может привести к образованию желчных камней.Эти сокращения наблюдаются даже в мышечных полосках нормального желчного пузыря человека [14]. Пропульсивные сокращения освобождают фракции желчного пузыря, способствуя тому, чтобы небольшой процент желчи поступал в двенадцатиперстную кишку в этот межпищеводный период. Эти сокращения также происходят в период голодания во время мигрирующего двигательного комплекса, который, как известно, стимулирует моторику желчного пузыря. Повышенное количество сокращений желчного пузыря совпадает с фазой 3 антрального мигрирующего двигательного комплекса и с фазой 2 двенадцатиперстной кишки [15].Эти сокращения ответственны за дополнительное, хотя и небольшое, выделение желчи из желчного пузыря в двенадцатиперстную кишку, которое происходит в этот период.
В период пищеварения сильные сокращения желчного пузыря и расслабление сфинктера Одди приводят к быстрому оттоку желчи в общий желчный проток и двенадцатиперстную кишку. В этот период на двигательную активность желчного пузыря, как и на остальную часть желудочно-кишечного тракта, влияют три фазы пищеварительного процесса: головная, антральная и двенадцатиперстная [16].Головная фаза инициируется стимулами, которые активируют центральную нервную систему, поскольку люди подвергаются обонятельному, визуальному и вкусовому воздействию пищи. Эта фаза опосредуется преганглионарными волокнами блуждающего нерва, которые синапсируют с постганглионарными холинергическими нейронами. Подсчитано, что во время этой фазы может опорожняться до 30-40% желчного пузыря. Когда пища достигает желудка, она запускает антрально-желчный рефлекс, также опосредованный волокнами блуждающего нерва. Желчный пузырь опорожняет большую часть своего оставшегося содержимого во время кишечной фазы, вызванной высвобождением CCK из двенадцатиперстной и проксимальной части тощей кишки [17].Дуоденальный CCK сокращает желчный пузырь, в основном воздействуя непосредственно на холинергические нейроны [6] и, как и на поджелудочную железу, а также может активировать длинные рефлексы через блуждающий нерв. Прием пищи, содержащей белки и жиры, воздействует на дуоденальные CCK, содержащие эндокринные клетки, которые стимулируют сенсорные волокна блуждающего нерва с последующей активацией пре- и постганглионарных холинергических нейронов [18]. Любой из этих механизмов стимулирует конечный путь постганглионарных холинергических нейронов, поскольку предварительная обработка атропином блокирует сокращение желчного пузыря, вызванное физиологическими концентрациями CCK-8 [19] или белково-жировой пищей.Рецепторы CCK-1 также присутствуют в мышцах желчного пузыря, но их можно стимулировать только фармакологическими концентрациями CCK, поскольку они не блокируются ни атропином, ни тетродотоксином.
2.2. Сфинктер Одди: анатомия и физиология
Человеческий сфинктер Одди составляет приблизительно 10 мм в длину и имеет хорошо выраженную и сильную мускулатуру. Он похож на сфинктер Одди, обнаруженный у преимущественно плотоядных видов, таких как собаки и кошки [20, 21]. Он имеет как очный, так и заочный сегменты.Этот сфинктер Одди анатомически и функционально не зависит от двенадцатиперстной кишки. Его миоэлектрический и сократительный паттерны по характеру и времени отличаются от таковых для двенадцатиперстной кишки. Сокращения человеческого сфинктера Одди одновременны, хотя они могут иметь небольшие различия в конфигурации, которые иногда могут казаться перистальтическими. Наличие одновременных сокращений согласуется с его основной функцией — действовать как сопротивление потоку желчи.
Кроме того, важно подчеркнуть, что подвижность сфинктера человека Одди сильно отличается от подвижности сфинктера опоссума, морской свинки и кролика [22].Анатомически эти травоядные животные, которые едят в течение всего периода бодрствования, имеют длинные и в основном экстрадуоденальные сфинктеры. Большое количество исследований было проведено на сфинктере опоссума Одди. В отличие от невысокого человека, сфинктер опоссума Одди составляет приблизительно 3 см в длину с четкими перистальтическими сокращениями. Это облегчает отток желчи через этот сегмент, предполагая, что он ведет себя скорее как короткий проток, чем как сфинктер. Кроме того, в отличие от человеческого сфинктера Одди, влияние CCK на сфинктер этих животных дополнительно иллюстрирует эти физиологические различия.CCK расслабляет человека, в то время как сжимает сфинктер опоссума Одди, воздействуя только на рецепторы гладких мышц, поскольку они не блокируются тетродотоксином [23].
Человеческий сфинктер Одди имеет довольно стабильное базальное давление с наложенными на него сильными сокращениями. В нормальном сфинктере Одди базальное давление колеблется от 10 до 15 мм рт. Ст. С сильными фазовыми сокращениями с амплитудами до 150 мм рт. Ст. [24]. Его сфинктерная функция демонстрируется, когда постоянная канюля помещается поперек этого сфинктера.Открытый сфинктер Одди препятствует наполнению желчного пузыря [25]. Человеческий сфинктер Одди также предотвращает дуоденальный рефлюкс в общий желчный проток, потому что его базальное давление выше, чем дуоденальное базальное давление, а его фазовые сокращения почти совпадают с фазовыми сокращениями двенадцатиперстной кишки. Функциональная роль человеческого сфинктера Одди была элегантно продемонстрирована путем изучения его подвижности и поступления желчи в двенадцатиперстную кишку. Подвижность и поток из желчного пузыря через сфинктер Одди в двенадцатиперстную кишку определяли с помощью комбинации холецистохолагиографии и измерения давления сфинктера Одди.Эти исследования были выполнены с использованием комбинации гидравлической капиллярной инфузионной системы и измерений давления, которые коррелировали изменения потока и моторики с концентрацией желудочно-кишечных гормонов в плазме [26]. Эти исследования показали, что отток желчи ограничивается, когда сокращения сфинктера Одди происходят со скоростью от 2 до 4 в минуту. Однако при скорости от 8 до 10 сокращений в минуту выделение желчи не наблюдалось.
Экзогенный или эндогенный CCK вызывает скоординированное действие, сокращая желчный пузырь и расслабляя сфинктер Одди и прилегающий сегмент двенадцатиперстной кишки, что приводит к эффективному выбросу желчи в двенадцатиперстную кишку.Это наблюдение противоречит мнению о том, что активный сфинктер сократительной активности Одди необходим для оттока желчи. Причем заброс воздуха и дуоденального содержимого в общий желчный проток наблюдается только после разрыва сфинктера Одди. Поэтому важно принимать во внимание эти анатомические и функциональные различия, когда результаты экспериментов, проведенных на травоядных животных, таких как опоссум и морская свинка, экстраполируются для объяснения физиологии и патофизиологии сфинктера человека Одди.
Подвижность сфинктера Одди регулируется нейрогормональными механизмами во время голодания и пищеварения [27]. Базальные и фазовые сокращения в основном генерируются миогенными факторами, регулируемыми противоположным действием холинергических и нехолинергических возбуждающих и неадренергических нехолинергических ингибирующих нейронов [28]. Устранение этих нервных воздействий после лечения тетродотоксином приводит к увеличению частоты и силы его сокращений из-за преобладающей тормозящей иннервации.
В большинстве исследований возбуждающей и тормозной иннервации использовались фармакологические методы, выявляющие наличие нескольких типов рецепторов. Эти рецепторы предполагают потенциальную физиологическую роль нейромедиаторов, регулирующих подвижность сфинктера Одди. Большинство этих исследований было выполнено на сфинктере Одди кошек и собак [29]. Исследования, проведенные на травоядных животных, показывают существенные отличия от нейронных механизмов, контролирующих кошачий и собачий сфинктер Одди, и, вероятно, от человеческого [30].Есть только одно исследование на людях, которое показало наличие возбуждающего нервного пути, который включал холинергические нейроны, использующие ацетилхолин в качестве нейромедиатора. В этом исследовании пирензепин, селективный антимускариновый агент M1, уменьшал амплитуду тонических и фазических сокращений, тогда как атропин, неселективный мускариновый антагонист, только уменьшал частоту фазических сокращений [31].
Большинство фармакологических исследований, проведенных на кошках, выявили холинергические, опиатные и серотонинергические рецепторы, которые могут регулировать моторную активность сфинктера Одди.Рецепторы опиатов — это преимущественно возбуждающие рецепторы мю. Морфин, агонист мю-рецепторов, вызывает сильные сокращения сфинктера Одди. Более важным является эффект налоксона, антагониста мю-рецепторов. Низкие дозы налоксона (40 мкг / кг) блокировали действие максимальных доз морфина и устраняли как базальные, так и фазовые сокращения сфинктера Одди. Напротив, мет-энкефалин, агонист дельта-опиатов, расслабляет сфинктер Одди с максимальной релаксацией, вызываемой 8 мкг / кг [32].Индуцированная энкефалином релаксация блокируется высокими дозами налоксона (до 640 мкг / кг) или после денервации сфинктера Одди тетродотоксином, что позволяет предположить, что эти дельта-опиатные рецепторы присутствуют в неадренергических нехолинергических ингибирующих нейронах.
5-гидрокситриптамин (5-HT) стимулирует как возбуждающие, так и тормозные рецепторы, присутствующие на холинергических и неадренергических нехолинергических нейронах, а также на рецепторах гладких мышц [33]. В этих исследованиях использовались только два антагониста 5-HT, известные на момент проведения этих исследований.Эти антагонисты блокировали гладкие мышцы и неспецифические нервные рецепторы. Необходимы дополнительные исследования с более специфическими антагонистами, поскольку недавние исследования показали, что 5-HT имеет до семи подтипов рецепторов. Однако роль этих рецепторов и нейротрансмиттеров в сфинктере человека неизвестна.
Потенциальная физиологическая роль вышеупомянутых нервных путей была продемонстрирована путем стимуляции сфинктера Одди мотилином, гормоном, который, как известно, вносит вклад в фазу III мигрирующего двигательного комплекса.Эти исследования проводились на кошках in vivo, измеряя давление сфинктера, а в отдельных экспериментах — миоэлектрическую активность и поток жидкости через сфинктер. Увеличение дозы внутриартериального мотилина с 32 до 256 нг / кг вызывало более высокое базальное давление, силу и частоту фазовых сокращений. Они также продемонстрировали, что этот сфинктер действует как резистор, потому что более низкий трансфинктерный поток коррелирует с сопутствующим увеличением миоэлектрической активности с более высокой частотой всплесков спайков [34].На действие мотилина не влияла внешняя денервация, которая включала шейную ваготомию или спланхникэктомию, блокатор ганглиев , гексаметоний и антагонист бета-адренорецепторов пропранолол. Однако атропин или метисергид обладали небольшим ингибирующим действием, а комбинация атропина и метисергида, налоксона по отдельности или тетродотоксина полностью блокировала действие этого гормона. Таким образом, действие мотилина дополнительно подтвердило наличие вышеупомянутых интрамуральных возбуждающих путей, которые включают холинергические, опиатные и серотонинергические нейроны.Сфинктер также регулируется посредством ингибирующей иннервации неадренергическими нехолинергическими нейронами, которые используют оксид азота и VIP в качестве нейротрансмиттеров [35–37]. Инъекция доноров оксида азота в сфинктер собаки Одди генерировала оксид азота и сопутствующее расслабление.
На моторику сфинктера Одди, как и остального желудочно-кишечного тракта, влияют периоды голодания и пищеварения. Во время голодания на давление сфинктера влияют все четыре фазы мигрирующего двигательного комплекса [38].Фаза 3 мигрирующего двигательного комплекса генерирует большую амплитуду и более частые сокращения, которые происходят одновременно с двенадцатиперстным компонентом. Одновременное возникновение фазы 3 в обеих структурах предотвращает заброс дуоденального содержимого (ферментов и бактерий) в общий желчный проток.
Во время кишечной фазы пищеварительного периода жиры и белки высвобождают CCK из слизистой оболочки двенадцатиперстной кишки, вызывая одновременное сокращение желчного пузыря и расслабление сфинктера Одди и двенадцатиперстной кишки [26].Скоординированное сокращение желчного пузыря, сфинктер Одди и дуоденальное расслабление позволяют желчи, хранящейся в желчном пузыре, проходить через общий желчный проток и в двенадцатиперстную кишку с минимальным сопротивлением сфинктера Одди и двенадцатиперстной кишки. Эти эффекты CCK усиливаются одновременным действием блуждающего нерва, который сокращает желчный пузырь и расслабляет сфинктер Одди. Они оба расслабляют сфинктер Одди, стимулируя постганглионарные неадренергические нехолинергические ингибирующие нейроны, которые выделяют VIP и оксид азота в качестве своих основных нейротрансмиттеров [12, 39].CCK стимулирует рецепторы CCK-1, присутствующие в неадренергических нехолинергических нейронах, поскольку его ингибирующее действие блокируется только тетродотоксином и антагонистами рецепторов CCK-1 [28]. Однако в отсутствие этих нейронов или после лечения тетродотоксином CCK сокращает сфинктер Одди, стимулируя возбуждающие рецепторы CCK-1, присутствующие в его гладких мышцах.
Таким образом, моторные функции желчевыводящих путей интегрированы с остальной частью желудочно-кишечного тракта в периоды голодания и пищеварения посредством сложных нейрогормональных механизмов, которые включают блуждающий и внутренностный нервы и гормон CCK в качестве основных действующих лиц.Во время голодания стабильная секреция желчи печенью в основном направляется в пузырный проток и желчный пузырь, где сохраняется и концентрируется из-за сопротивления сфинктера Одди. В этот период небольшая часть желчи просачивается в двенадцатиперстную кишку во время диастолической фазы фазовых сокращений сфинктера Одди и во время фазы II мигрирующего моторного комплекса, когда наблюдается небольшое сокращение желчного пузыря. Во время пищеварительного периода желчный пузырь сокращается, опорожняя большую часть его содержимого, а желчь транспортируется в двенадцатиперстную кишку через кистозные и общие желчные протоки, проходящие через расслабленный сфинктер Одди и двенадцатиперстную кишку.В двенадцатиперстной кишке и тощей кишке желчные соли участвуют в переваривании и всасывании жиров (триглицеридов, Ch и фосфолипидов, а также липосолюбильных витаминов). Затем соли желчных кислот транспортируются к концу подвздошной кишки , где в основном рециркулируются как часть энтерогепатической циркуляции с помощью активного транспортного механизма, присутствующего в эпителиальных клетках конца подвздошной кишки .
3. Хронический и острый холецистит
3.1. Патогенез
Наиболее часто цитируемая гипотеза в патогенезе хронического и острого холецистита — это гипотеза, вызванная обструкцией пузырного протока желчными камнями малого и среднего размера, которые мигрируют из желчного пузыря, или, в случае больших желчных камней, которые периодически блокируют шейку желчного пузыря. желчный пузырь.Однако эта гипотеза не подтверждается клиническими и гистологическими исследованиями на людях или экспериментальной обструкцией пузырного протока у нормальных животных. Хотя иногда в пузырном протоке обнаруживаются камни в желчном пузыре, неясно, действительно ли эти камни препятствуют оттоку желчи. Тщательно проведенное исследование у пациентов с острым холециститом, у которых желчный пузырь подвергался минимальным манипуляциям, желчные камни были обнаружены в пузырном протоке только у 12,3% пациентов, обследованных во время хирургической процедуры [40].
Холецистографические исследования у пациентов с острым холециститом с использованием меченных технецием 99m HIDA, PIPIDA или DISIDA были использованы для подтверждения этой гипотезы. Невозможность визуализировать желчный пузырь у пациентов с острым холециститом была интерпретирована как из-за обструкции пузырного протока. Этот результат присутствует у пациентов с острым холециститом, клинически и патологически подтвержденным у 97% пациентов [41]. Однако другие объяснения этой неудачи более вероятны, что (а) обструкция пузырного протока может быть связана с распространением острого воспаления и отека из желчного пузыря, или (б) атонический желчный пузырь препятствует проникновению большей части желчного пузыря. меченный изотопом агент, потому что он заполнен воспалительным секретом.Более того, остро воспаленный желчный пузырь может быть не в состоянии пассивно расширяться из-за отека или активно из-за нарушения релаксации, которое, как было показано, присутствует в желчном пузыре с литогенной желчью с высокими концентрациями Ch [42].
Гипотеза обструкции пузырного протока дополнительно оспаривается наличием холецистита, связанного только с литогенной желчью (бескаменный желчный пузырь) или с одним большим камнем, в несколько раз превышающим типичный диаметр просвета пузырного протока.Маловероятно, что такие большие камни могут вызвать повторяющиеся эпизоды обструкции из-за блокировки шейки желчного пузыря. Более того, возникновение острого воспаления, наложенного на хронически воспаленный или атрофический фиброз желчного пузыря, трудно объяснить, потому что это может означать повторяющиеся эпизоды обструкции пузырного протока. Более вероятно, что развитие острого воспаления, связанного с прогрессированием хронического процесса, имело место задолго до этого. В таких желчных пузырях часто наблюдается утолщение слизистой оболочки, гипертрофированные мышечные слои и макрофагальная инфильтрация собственной пластинки.Хронический холецистит также часто наблюдается гистопатологически при отсутствии желчных камней. Они возникают у пациентов с патологическим ожирением, у которых есть литогенная желчь без желчных камней. Эти желчные пузыри имеют аномалии слизистой оболочки, соответствующие хроническому холециститу, по сравнению с нормальной слизистой оболочкой у субъектов, не страдающих ожирением [43, 44].
Более того, гипотеза обструкции пузырного протока не смогла предложить потенциальных факторов, которые могли бы вызвать воспалительный процесс. Было высказано предположение, что расширение желчного пузыря из-за увеличения количества жидкости в просвете может привести к ишемии.Однако эти жидкости возникают из-за секреции уже воспаленного желчного пузыря. Некоторые из предложенных провоспалительных агентов, которые были предложены, являются клеточными медиаторами воспаления, такими как лизолецитин и факторы активации тромбоцитов, секретируемые эпителиальными клетками, уже подвергшимися окислительному стрессу [45]. Отсутствуют гистологические и функциональные аномалии желчного пузыря с черными пигментными камнями [46]. На слизистой оболочке желчного пузыря, содержащей пигментные камни, отсутствуют признаки хронического холецистита, аденоматозной гиперплазии или синусов Рокитанского-Ашоффа.Эти гистологические особенности обычно обнаруживаются в желчном пузыре, содержащем Ch-камни. В отличие от нарушения сокращения желчного пузыря из-за Ch-камнями сокращение мышечных клеток из желчного пузыря с пигментными камнями не отличается от такового, наблюдаемого в мышечных препаратах из нормального желчного пузыря [47]. Хотя сообщалось о небольшом снижении постпрандиального опорожнения у некоторых пациентов с желчным пузырем с черными пигментными камнями, это функциональное нарушение, вероятно, было связано с одновременным замедленным опорожнением желудка, которое происходит у пациентов с талассемией.Большинство пациентов, включенных в это исследование, страдали этим гематологическим заболеванием [48].
Эксперименты на животных не подтверждают обструкцию пузырного протока как начальное событие в развитии острого холецистита. Перевязка пузырного протока у луговых собачек не вызывает холецистита, если концентрированная желчь не вводится в закупоренный желчный пузырь [49]. Чтобы у этих животных развился острый холецистит, в перевязанный желчный пузырь собак необходимо вводить ежедневные инфузии стерильной свежей желчи [3].Напротив, животные, которых кормили литогенной желчью, воспроизводят эпителиальные и мышечные аномалии, которые присутствуют у пациентов с хроническим холециститом (рис. 1). Эти высокие концентрации желчи Ch вызывают повреждение эпителиальных и мышечных клеток желчного пузыря [50]. Кролики, получавшие 1% дигидрохолестерин, демонстрируют признаки пролиферации эпителиальных клеток на начальных стадиях этого процесса еще до образования желчных камней [51, 52]. Повышение пролиферативной активности, предшествующее образованию камней в желчном пузыре, является еще одним признаком того, что эти нарушения не связаны между собой.
Таким образом, эти данные позволяют предположить, что и камни в желчном пузыре, и аномалии слизистой оболочки и мышц желчного пузыря вызываются литогенной желчью с чрезмерными концентрациями Ch. Они развиваются независимо друг от друга, даже если они могут быть обнаружены одновременно у пациентов с симптомами. Ch диффундирует через стенку желчного пузыря и поглощается эпителиальными клетками, макрофагами собственной пластинки (холестеролоз) и включается в плазматическую мембрану мышечных клеток [53].Скорость диффузии Ch через слизистую, по-видимому, зависит от его концентрации в желчном пузыре [50]. Эпителиальные клетки, подвергшиеся воздействию литогенной желчи с избытком Ch, увеличивают уровни PGE2, которые стимулируют секрецию воды и слизи до образования желчных камней [54, 55]. PGE2 стимулирует секрецию муцина, активируя лагерь, создавая толстый слой слизи, который часто покрывает слизистую оболочку желчного пузыря при хроническом холецистите [56]. Повышенные уровни этого простагландина также, вероятно, ответственны за гиперплазию слизистых оболочек, синусов Рокитанского-Ашоффа и метаплазию желудка и кишечника [52, 57].Эти аномалии часто присутствуют в желчном пузыре с хроническим воспалением [50]. Более того, в этих желчных пузырях также обнаруживаются макрофаги в пропиационной пластинке, даже при отсутствии желчных камней. Эксперименты на животных показывают влияние кормления литогенной желчью с избытком Ch на мышечные клетки желчного пузыря. Сокращение мышц, вызванное CCK-8, нарушается у луговых собачек, получавших литогенную диету, по сравнению с мышечными клетками животных, получавших обычную пищу [58, 59]. Это нарушение сокращения происходит из-за более высокого поглощения Ch мышечными клетками.Подобные аномалии присутствуют в плазматических мембранах мышечных клеток желчного пузыря человека с Ch-камнями. У них также более высокий уровень Ch, чем в мышечных клетках желчного пузыря с пигментными камнями.
Большая часть Ch в плазматической мембране находится в кавеолах [60]. В нормальных и патологических условиях клеточный приток и отток Ch происходит через эти кавеолы [61]. Эти домены богаты Ch, связанным с белками кавеолинов. Помимо транспорта Ch через мембраны, кавеолиновые белки связываются и помогают интернализовать комплексы белков рецептор-G в цитозоль.Активация рецепторов агонистом приводит к их связыванию со специфическими G-белками и затем переносится в кавеоловые домены, где они связываются с кавеолиновыми белками. Эти белковые комплексы рецептор-G затем фосфорилируют кавеолиновые белки с использованием специфических тирозинкиназ [62]. Фосфорилирование белков кавеолина делает возможным перенос комплексов белок кавеолин-рецептор-G-белок в эндосомы, органеллы, предназначенные для рециркуляции рецепторов обратно на плазматическую мембрану, чтобы они могли стать доступными для дальнейшей активации агонистов.Однако высокие уровни Ch в кавеолах ингибируют фосфорилирование тирозинкиназ кавеолиновых белков, тем самым блокируя интернализацию этих рецепторов и их рециркуляцию в плазматическую мембрану [62]. Это ингибирование приводит к секвестрации рецепторов и кавеолиновых белков в кавеолах, в результате чего меньшее количество рецепторов возвращается к плазматической мембране. Меньшее количество рецепторов CCK-1 объясняет снижение связывания 121- I-CCK-8 с плазматическими мембранами мышечных клеток желчного пузыря с Ch-камнями по сравнению с таковыми из желчного пузыря с «черными» пигментными камнями, которые имеют нормальные или даже субнормальные концентрации Ch [63].Более низкое связывание рецептора и более слабый мышечный ответ не являются уникальными для рецепторов CCK-1, поскольку другие рецепторы в равной степени подвержены влиянию, включая холинергические рецепторы, которые интернализуются через эти домены. Напротив, рецепторы, интернализованные через покрытые клатрином ямки, такие как рецепторы дельта-опиатов и эритромицина, выражают нормальные мышечные реакции. Обнаружение низкого уровня Ch в клатриновом пути объясняет, почему эритромицин вызывает нормальное сокращение и опорожнение желчного пузыря с Ch-камнями [62].
Эти патологические эффекты высоких уровней Ch в плазматической мембране были экспериментально продемонстрированы на изолированных мышечных клетках желчного пузыря людей и морских свинок, получавших липосомы, богатые или не содержащие Ch. Липосомы представляют собой агрегаты фосфолипидов, которые могут нести Ch, который легко обменивается с клеточными фосфолипидными мембранами. Обмен является пассивным, и его направление зависит от градиента Ch между липосомами и плазматическими мембранами. Липосомы, не содержащие Ch, удаляют Ch из мембран мышечных клеток желчного пузыря с камнями с высоким содержанием Ch [42].Напротив, Ch диффундирует из липосом, богатых Ch, в мышечные клетки из желчного пузыря с пигментными камнями, которые имеют нормальный уровень Ch. Этот обмен Ch коррелирует с величиной сокращения мышц, индуцированного CCK-8. После инкубации с липосомами, не содержащими Ch, которые удаляли избыток Ch из плазматических мембран, наблюдается значительное увеличение степени сокращения мышечных клеток желчного пузыря с Ch-камнями. Обратное происходит, когда нормально сокращающиеся мышечные клетки желчного пузыря человека или морской свинки инкубируются с липосомами, богатыми хромом.Эти клетки приобретают аномальные концентрации Ch и развивают более слабое сокращение в ответ на CCK-8. Высокие уровни Ch влияют только на мембранные рецепторы, поскольку пути, которые опосредуют сокращение дистальных от них мышечных клеток желчного пузыря, нормальны. Эти клетки обычно сокращаются при стимуляции GTP γ S, активатором G-белка или инозитолтрифосфатом, который обходит рецепторы и G-белки, чтобы активировать кальмодулин [64].
Более того, высокий уровень мембранного Ch в равной степени влияет на расслабление мышц.Расслабление мышечных полос желчного пузыря с Х-камнями, индуцированное рецептор-зависимыми агонистами, такими как изопротеренол или VIP, было ниже, чем расслабление мышечных полос желчного пузыря с черными пигментными камнями. Однако не было никакой разницы в величине релаксации между этими двумя типами мышечных полос, индуцированных оксидом азота или 8-бром-цАМФ, который обходит мембранные рецепторы [65]. Таким образом, эффекты высоких уровней мембранного Ch, которые ухудшают сокращение и расслабление мышц, ограничиваются рецепторами плазматической мембраны.
Эффекты высоких концентраций Ch в плазматической мембране мышечных клеток желчного пузыря также влияют на кальций, не затрагивая калиевые каналы. Высокие уровни Ch также подавляют активируемый напряжением ток Ca2 + в этих клетках [66]. Активность этих Са2 + каналов отвечает за спонтанные ритмические потенциалы действия в гладкомышечных клетках желчного пузыря [67], и это поступление Са2 + необходимо для поддержания внутриклеточных запасов Са2 + [68]. Интересно, что K + каналы в гладких мышцах желчного пузыря не подвержены влиянию повышенных концентраций мембранного Ch, что позволяет предположить, что в отличие от Ca 2+ каналов в гладких мышцах желчного пузыря K + каналы могут не располагаться в кавеолярных мембранах и, следовательно, не подвержены влиянию Ch.
Высокий уровень Ch также влияет на мышечные клетки тонкого кишечника, которые, в свою очередь, способствуют развитию холецистита. Литогенная диета, которую скармливают мышам C57L, нарушает сократительную способность мышечных клеток тонкой кишки, что приводит к замедлению кишечного транзита. Медленный транзит генерирует в дистальном отделе тонкой кишки вторичную дезоксихолевую кислоту желчных кислот [69] и большую абсорбцию Ch. Они оба увеличивают количество воспалительных клеток в собственной пластинке и мышечной гипертрофии желчного пузыря.Эти аномалии возникают через четыре недели после литогенной диеты и до образования желчных камней [70]. Эти отклонения не возникают, когда этих мышей предварительно обрабатывают максимальными доз эзетимиба, который блокирует кишечную абсорбцию Ch.
Нормальный желчный пузырь допускает физиологические концентрации гидрофобных солей желчных кислот. Однако в присутствии литогенной желчи с высокими концентрациями Ch или после обструкции общего желчного протока эти соли желчных кислот могут повреждать эпителиальные и мышечные клетки за счет повышения уровней окислительного стресса (H 2 O 2 ) и липидного перекисное окисление [51, 71] (рис. 2).У морских свинок развивается острая воспалительная реакция после перевязки общего желчного протока в течение 3 дней [72]. Предварительная обработка этих животных в течение 2 недель гидрофильной желчной кислотой URSO перед перевязкой общего желчного протока предотвращает развитие острого холецистита. Напротив, острый холецистит был гораздо более тяжелым, когда они были предварительно обработаны гидрофобной желчной кислотой хенодезоксихолевой кислотой в течение двух недель перед перевязкой общей желчи, по сравнению с морскими свинками, которые не получали лечения в течение этого периода времени.
Механизм, посредством которого URSO оказывает терапевтический эффект, был исследован на эпителиальных и мышечных клетках. Перекисное окисление липидов в эпителиальных клетках и секреция слизистой оболочки муцина и секреция воды , вызванные обработкой только гидрофобными солями желчных кислот , предотвращались предварительной обработкой URSO [73]. Предварительная обработка URSO также предотвратила нарушение мышечного сокращения, индуцированное в изолированных мышечных клетках, обработанных гидрофобными солями желчных кислот [74].Гидрофобные соли желчных кислот подавляют сокращение гладких мышц, воздействуя на рецепторы BAR1, связанные с G-белком, активируя каналы KATP [74] и обладая высокими моющими свойствами. Они увеличивают окислительный стресс в мышечных клетках in vitro и in vivo. URSO снижает уровни свободных радикалов и цитопротекторный ответ в мышечных клетках желчного пузыря по сравнению с мышечными клетками, инкубированными только с хенодезоксихолатом [75]. Другие ткани слизистой оболочки могут также пострадать от длительного воздействия гидрофобных солей желчных кислот, что приводит к эзофагиту и гастриту.
Терапевтический эффект лечения УРСО был продемонстрирован у пациентов с симптоматическим желчным пузырем и желчнокаменной болезнью. Лечение УРСО за месяц до операции увеличивало сократимость мышц желчного пузыря, снижало уровень мембранного Ch и показатели окислительного стресса [76]. URSO также улучшил воспаление желчного пузыря, уменьшив моноциты / макрофаги, дегрануляцию тучных клеток, инфильтрат гранулоцитов и экспрессию COX-2 по сравнению с пациентами, получавшими плацебо. Это краткосрочное исследование подтверждается более крупным исследованием, проведенным у пациентов с симптоматическими камнями желчного пузыря.18-летнее исследование продемонстрировало, что лечение URSO снижает частоту возникновения боли в желчных протоках и холецистэктомии по сравнению с нелеченными пациентами [77]. Положительный эффект от УРСО наблюдался, несмотря на сохранение камней желчного пузыря. Механизм защиты URSO от воздействия гидрофобных солей in vivo полностью не известен. Гидрофобные соли желчных кислот увеличивают уровень окислительного стресса в мышечных клетках желчного пузыря in vitro, вызывая нарушение сокращения. URSO предотвращает эти пагубные воздействия на эпителиальные и мышечные клетки желчного пузыря, блокируя действие гидрофобных солей желчных кислот на клеточном уровне [75] и ингибируя всасывание Ch в кишечнике [78].
Высокие уровни Ch плазматической мембраны также влияют на рецепторы PGE2, участвующие в цитопротекторных функциях. PGE2 представляет собой автакоид, выделяемый клетками, но действующий на их рецепторы плазматической мембраны, которые стимулируют активацию каталазы. Этот фермент инактивирует свободные радикалы (например, H 2 O 2 ), поддерживая уровни окислительного стресса в пределах нормы, предотвращая перекисное окисление липидов и повреждение рецепторов [79]. Нет различий между уровнями PGE2, вызванными окислительным стрессом (H 2 O 2 ) в мышечных клетках желчного пузыря с Ch и с «черными» пигментными желчными камнями.Однако влияние экзогенного PGE2 или окислительного стресса (H 2 O 2 ) на активность каталазы и степень инактивации свободных радикалов снижается в мышечных клетках желчного пузыря с желчными камнями Ch по сравнению с мышечными клетками желчного пузыря с пигментными камнями [ 80]. Эти данные свидетельствуют о том, что высокие уровни Ch плазматической мембраны нарушают цитопротекторные ответы на экзогенный и эндогенный PGE2, потому что, как и в случае с рецепторами CCK, меньше рецепторов PGE2 доступно для стимуляции.
Здоровые клетки желчного пузыря, таким образом, защищают себя от агрессивного действия гидрофобных солей желчных кислот, используя цитопротективные механизмы, которые включают действие PGE2 и механизмы подвижности, которые регулярно опорожняют желчный пузырь [79]. На оба защитных механизма влияют перенасыщенные уровни Ch, что делает слизистую оболочку и мышечные слои уязвимыми для гидрофобных солей желчных кислот. На начальных стадиях воспалительного процесса эти соли желчных кислот повреждают незащищенные рецепторы, так что они стимулируются экзогенными агонистами.Рецепторы CCK-1 гладкой мускулатуры изначально повреждаются, что нарушает сокращение мускулов. Некоторые рецепторы остаются незатронутыми, потому что они защищены высвобождением аутакоидов, как, например, рецепторы PGE2, защищенные клеточным высвобождением PGE2. Однако высокие уровни мембранного Ch влияют даже на эти рецепторы. Эти эффекты были четко продемонстрированы на изолированных мышечных клетках желчного пузыря, обработанных липосомами, богатыми или не содержащими Ch [80]. Существует нормальный ответ на действие PGE2 на мышечные клетки желчного пузыря с пигментными камнями или мышечные клетки желчного пузыря с Ch-камнями, обработанные липосомами, не содержащими Ch.Напротив, эффекты PGE2 нарушены в нормальных мышечных клетках, инкубированных с липосомами, богатыми Ch. Эти данные свидетельствуют о том, что литогенная желчь с высокими концентрациями Ch влияет на мембранные рецепторы, отличные от рецепторов CCK-1, нарушая способность желчного пузыря защищаться от гидрофобных солей желчных кислот за счет снижения сократимости желчного пузыря и опорожнения и нарушения PGE2-зависимых цитопротекторных механизмов, которые инактивируют свободные радикалы.
Распространенность литогенной желчи и желчного пузыря у женщин выше, чем у мужчин, что позволяет предположить, что половые гормоны могут быть вовлечены в патогенез холецистита.Большинство исследований было сосредоточено на действии прогестерона, поскольку этот гормон нарушает сократимость желчного пузыря за счет своего геномно-опосредованного действия, которое подавляет G-белки (Gq / 11 и Gi3), которые опосредуют сокращение, вызванное агонистами [81]. Прогестерон нарушает сокращение, вызванное CCK-8 в нормальных мышечных клетках желчного пузыря, но не влияет на мышечные клетки желчного пузыря, которые содержат камни Ch или нормальные мышечные клетки, обработанные липосомами, богатыми Ch. Подобно Ch, прогестерон транспортируется через плазматическую мембрану с помощью кавеолиновых белков.Экспериментально обработка липосомами, богатыми Ch, блокирует проникновение 3 H-прогестерона в плазматическую мембрану нормальных мышечных клеток по сравнению с клетками, обработанными липосомами, не содержащими Ch [82]. Ch ингибирует проникновение этого гормона в плазматическую мембрану, возможно, из-за более сильных гидрофобных взаимодействий Ch с сайтами гидрофобного связывания кавеоловых белков. Эстрогены, вероятно, будут играть более важную роль в патогенезе заболеваний желчного пузыря, поскольку они увеличивают секрецию Ch.Рецептор эстрогена альфа, но не бета, играет главную роль в индуцированных 17-бета-эстрадиолом желчных камнях мышей [83]. Повышение уровня эстрогена и прогестерона во время беременности объясняет пониженную подвижность желчного пузыря, застой и перенасыщение желчью Ch.
Другие гормоны также могут увеличивать частоту заболеваний желчного пузыря. Октреотрид — это один из гормонов, вызывающих пониженную моторику желчного пузыря. Пациенты, получавшие октреотрид в течение длительного времени, имеют повышенную заболеваемость желчнокаменной болезнью.Вероятно, что этот гормон вызывает заболевание желчного пузыря, увеличивая насыщение желчи Ch. Он вызывает гиперабсорбцию Ch как из пищевых, так и из желчных источников, вызывая пониженную моторику тонкой кишки [84]. Этот медленный кишечный транзит также приводит к образованию более вторичных и, следовательно, более гидрофобных солей желчных кислот, таких как конъюгат дезоксихолата. Снижение подвижности желчного пузыря и застой желчи, как правило, способствуют образованию макроскопических желчных камней из кристаллов Ch в желчи, поскольку желчь задерживается в течение более длительных периодов времени в межпищеводном и постпрандиальном состояниях.Однако, если желчь не перенасыщена Ch, нет никаких доказательств того, что нарушение моторики само по себе приводит к воспалению желчного пузыря [85].
Факторы, способствующие прогрессированию хронического холецистита в острый, неизвестны. Большинство случаев острого холецистита развивается у пациентов, у которых в желчном пузыре уже есть признаки хронического холецистита, что определяется наличием желчных камней Ch и гистологией, соответствующей хроническому воспалению. Эти хронические изменения характеризуются гипертрофией слизистых оболочек и мышц, а также утолщением серозного слоя.Широко распространенное предположение о том, что причиной острого холецистита является обструкция пузырного протока желчными камнями, не подтверждается исследованиями на людях и животных (см. Раздел о патогенезе хронического холецистита, связанного с литогенной желчью с избытком Ch). Однако известны факторы риска, увеличивающие частоту этого прогрессирования. С возрастом увеличивается заболеваемость острым холециститом (20% мужчин и 35% женщин к 75 годам) и диабетом, связанным с ослаблением иммунитета.Заболеваемость острым холециститом у пациентов с сахарным диабетом и хроническим холециститом, определяемая по наличию камней в желчном пузыре, достигает 13–16% [86, 87]. Также известно, что трансплантация органов и химиотерапия ускоряют это прогрессирование. Заболеваемость острым холециститом с камнями в желчном пузыре или без них выше при состояниях, которые, как известно, влияют на иммунный ответ, таких как лейкемия, химиотерапия, а также после серьезной операции и других изнурительных состояний. Хотя в этой области необходимы исследования, можно предположить, что снижение местного или системного иммунитета может способствовать этому прогрессированию.
В заключение, данные, полученные в результате вышеупомянутых исследований на людях и животных, убедительно свидетельствуют о том, что холецистит развивается в присутствии литогенной желчи с высокими концентрациями Ch, которая создает благоприятную среду, позволяющую гидрофобным солям желчных кислот повышать уровень окислительного стресса и инициировать воспалительный процесс. Этот воспалительный процесс требует постоянного поступления гидрофобных солей желчных кислот в больной желчный пузырь.
3.2. Хронический холецистит: клинические симптомы
Пациенты с хроническим холециститом могут протекать бессимптомно или жаловаться на повторяющиеся эпизоды боли в эпигастрии и правом подреберье, которая часто распространяется вокруг талии и к лопатке.Боль от умеренной до сильной, не постпрандиальная, а часто ночная. Это не происходит ежедневно и, как правило, происходит каждые две-три недели. Обычно диагноз ставится на основании ультразвукового исследования. Этот тест может обнаружить наличие камней в желчном пузыре и утолщение стенки желчного пузыря. Лабораторные исследования в норме [88].
Хотя камни в желчном пузыре часто протекают бессимптомно, их обвиняют в возникновении ряда симптомов со стороны верхних отделов желудочно-кишечного тракта, поскольку они легко обнаруживаются в желчном пузыре при визуализации.Считается, что камни в желчном пузыре ответственны за неспецифические желудочно-кишечные симптомы из-за хронической диспепсии, пареза желудка и даже синдрома раздраженного кишечника. Пациенты с этими функциональными состояниями обычно жалуются на ежедневные симптомы со стороны верхних отделов желудочно-кишечного тракта, которые часто возникают после приема пищи и вызваны жирной пищей или обильным приемом пищи. Эти пациенты жалуются на страдания в эпигастрии, тошноту и вздутие живота. Холецистэктомия не устраняет эти жалобы, хотя патологические исследования могут выявить камни в желчном пузыре и гистологические признаки хронического холецистита.Несколько исследований, включая исследования вскрытия, показали, что камни в желчном пузыре могут оставаться бессимптомными в течение длительных периодов времени. В проспективном итальянском исследовании у большинства пациентов с бессимптомными камнями в желчном пузыре симптомы отсутствовали в течение всего 8-летнего периода наблюдения [89].
3.3. Факторы риска
Заболеваемость желчными камнями и воспалительными заболеваниями желчного пузыря высока в Западном полушарии, особенно среди коренного индейского населения Северной и Южной Америки. Эпидемиология и естественное течение этого заболевания у индейцев пима позволяют предположить, что генетические факторы играют важную роль.Заболеваемость желчным пузырем среди индийского женского населения Нью-Мексико достигает 40% к 85 годам [90, 91]. Кроме того, литогенные гены Ch широко распространены среди чилийских индейцев и латиноамериканцев. Эти гены могут определять раннее образование камней в желчном пузыре и объяснять высокую распространенность заболеваний желчного пузыря среди некоторых популяций Южной Америки [92]. Заболеваемость желчным пузырем у женщин особенно высока у пациентов с ожирением и диабетом по сравнению с контрольной группой.Напротив, нет различий в частоте заболеваний желчного пузыря у мужчин между диабетиками и недиабетиками. Более высокая частота заболеваний желчного пузыря у женщин предполагает, что половые гормоны участвуют в патогенезе этого заболевания, причем эстрогены играют наиболее важную роль (см. «Патогенез»).
3.4. Диагноз
УЗИ правого верхнего квадранта — диагностический тест выбора у пациентов с хроническим холециститом. Этот тест проводится у пациентов с болью в желчных путях, обычно описываемой как боль в эпигастрии и правом подреберье.Ультрасонография обнаруживает камни в желчном пузыре или желчный осадок [93]. Желчные камни обычно, но не всегда, являются визуализирующим признаком литогенной желчи с избытком Ch в желчном пузыре. Хронический холецистит может присутствовать при отсутствии камней в желчном пузыре. Нет ничего необычного в том, чтобы найти гистологические доказательства хронического холецистита в бескаменном желчном пузыре у пациентов с ожирением. Косвенные доказательства в поддержку этого диагноза можно получить, выполнив сканирование HIDA с провокационным тестом с CCK-8. У пациентов с хроническим холециститом, вызванным литогенной желчью с высокими концентрациями Ch, наблюдается нарушение моторики и опорожнения по сравнению с нормальными субъектами или пациентами с черными пигментными камнями [14].Этот тест не позволяет отличить бескаменный хронический холецистит от функционального заболевания желчного пузыря. Окончательный диагноз может быть поставлен только после тщательного гистологического исследования желчного пузыря с использованием специфических антител к ЦОГ-2, которые могут обнаружить присутствие активированных макрофагов, содержащих повышающую регуляцию ЦОГ-2. Эти клетки должны отсутствовать у пациентов с функциональным заболеванием желчного пузыря.
3.5. Лечение
Лапароскопическая холецистэктомия — это метод выбора для пациентов с хроническим холециститом и повторяющимися эпизодами умеренной или сильной боли в желчных путях.Тем не менее, пациенты с эпизодической слабой или умеренной болью в желчных путях с камнями желчного пузыря могут не нуждаться в немедленном лечении, поскольку боль может не повторяться. Аналогичные наблюдения были сделаны в 8-летнем проспективном исследовании, в котором участвовали пациенты без симптомов легкой и средней степени тяжести с камнями желчного пузыря [89].
Значительные технические улучшения в лапароскопической хирургии и больший хирургический опыт заметно снизили частоту осложнений. Этот тип процедуры следует выполнять, когда хирурги могут идентифицировать структуры сосудов и желчных протоков.Однако при наличии спаек общие желчные и пузырные протоки не всегда легко распознать. Если хирурги не могут полностью идентифицировать эти структуры, процедуру следует преобразовать в открытую холецистэктомию.
Эти хирургические процедуры у пациентов без значительных системных рисков имеют очень низкую частоту хирургических осложнений, возникающих в основном из-за нераспознанных аномалий желчевыводящих путей. Подсчитано, что около 10% пациентов могут иметь одну или несколько аномалий желчных протоков, но не все из них трудно распознать во время операции.Распространенным вариантом ветвления главного желчного протока печени является так называемое тройное слияние, которое представляет собой аномалию, характеризующуюся одновременным опорожнением правого заднего протока, правого переднего протока и левого печеночного протока в общий печеночный проток [94]. У пациентов с этим вариантом правый печеночный проток практически отсутствует. Другие распространенные анатомические варианты ветвления желчного дерева включают правый задний проток и его слияние с правым передним или левым печеночным протоком. Как упоминалось ранее, правый задний проток обычно проходит кзади от правого переднего протока и присоединяется к нему слева, образуя правый печеночный проток, который затем образует соединение с левым печеночным протоком, образуя общий печеночный проток.Дренирование правого заднего протока в левый печеночный проток до его слияния с правым передним протоком является наиболее частым анатомическим вариантом желчевыводящей системы. Более того, описано несколько менее распространенных и обычно более сложных анатомических вариантов желчных протоков, которые состоят как из аберрантных, так и из дополнительных желчных протоков. В клиническом контексте знакомство с этими объектами важно, потому что аберрантный желчный проток является единственным желчным протоком, отводящим определенный сегмент печени, тогда как дополнительный желчный проток является дополнительным желчным протоком, отводящим ту же область печени.Неспособность распознать некоторые из этих аномалий желчных протоков может привести к утечке желчи, вызывая воспаление оболочек брюшины (желчный перитонит). Эти утечки лечат путем установки стентов с помощью эндоскопической ретроградной холагиопанкреатографии (ERCP). Они могут остановить эти утечки, возникающие из общих желчных или пузырных протоков.
Хотя хирургическое вмешательство является методом выбора для пациентов с хроническим холециститом, лечение УРСОДИОЛом является потенциальной альтернативой для пожилых пациентов с высоким хирургическим риском и повторяющейся болью в желчных путях из-за хронического холецистита. Первоначальным стимулом для использования URSO у пациентов с хроническим холециститом было растворение камней в желчном пузыре, критерии, которые ограничивали право на это лечение примерно 20-25% пациентов [95]. Однако с учетом наших изменяющихся представлений о патогенезе холецистита терапевтической целью должно быть лечение желчного пузыря литогенной желчью с высокими концентрациями Ch с помощью URSO, чтобы улучшить способность желчного пузыря переносить агрессивное действие гидрофобных солей желчных кислот (пожалуйста, см. патогенез хронического холецистита) и блокируя их действия на клеточном уровне.Однако есть лишь несколько кандидатов, которые могут пройти это лечение. Следовательно, размер камней в желчном пузыре не должен быть критерием исключения. Эффективность этого лечения была исследована путем сравнения результатов лечения пациентов в возрасте от 50 до 70 лет с типичной болью в желчевыводящих путях с помощью УРСО или плановой холецистэктомии. Пациенты включались в это исследование, если у них были некальцинированные желчные камни диаметром менее 20 мм и функционирующий желчный пузырь. Это клиническое испытание показало, что УРСО было клинически выгодным и менее дорогостоящим, чем хирургическое лечение у пожилых пациентов с хирургическим риском.Ожидаемые пожизненные затраты на урсодиол колеблются от 300–400 долларов больше, чем операция для 50-летних, до 700–1000 долларов меньше, чем операция для 70-летних [96]. Это исследование подтверждается 18-летним исследованием, в котором сравнивали лечение УРСО с отсутствием лечения у большого числа пациентов с симптоматическими камнями желчного пузыря. УРСО был значительно более эффективным, чем отсутствие лечения, в борьбе с болью в желчевыводящих путях и предотвращении необходимости холецистэктомии [77]. Однако медикаментозное лечение может быть неэффективным у пациентов с хроническим холециститом на более поздних стадиях.
4. Острый холецистит
4.1. Клинические симптомы
Хронический холецистит является наиболее частым фактором риска острого холецистита. Эти пациенты обычно жалуются на внезапное начало сильной боли, которая часто сопровождается тошнотой в 90% и рвотой в 50% случаев. При физикальном обследовании выявляется болезненность в эпигастрии, правом подреберье и положительный признак Мерфи, а в тяжелых случаях у пациентов может наблюдаться болезненность отскока. Однако, прежде чем поставить этот диагноз, клиницистам необходимо исключить другие острые абдоминальные состояния, которые включают острый аппендицит, особенно с ретроцекальным отростком, острый панкреатит, локализованную перфоративную язвенную болезнь, перфорацию кишечника или ишемию.Эти клинические объекты имеют схожие демографические характеристики и факторы риска. Эти пациенты жалуются на острую боль в животе, тошноту и рвоту, а физикальное обследование выявляет болезненность в животе, которая может быть локализованной или диффузной, а также выраженное снижение шумов кишечника.
4.2. Диагноз
Лабораторные исследования больных острым холециститом выявили лейкоцитоз от 10 000 до 15 000 на куб. Визуализирующие исследования необходимы для подтверждения предполагаемого клинического диагноза острого холецистита.Большинство клиницистов рекомендуют ультразвук как первичный визуализирующий тест, который в настоящее время является наиболее распространенным диагностическим тестом, проводимым у этих пациентов. Этот тест может выявить наличие камней в желчном пузыре в 98% случаев, и у значительной части этих пациентов могут быть обнаружены другие аномалии, характерные для острого холецистита, такие как утолщение стенки желчного пузыря, аномальный внешний вид стенки с просвечивающими зонами, вызванные суберозным отеком или кровоизлиянием. , и перихоле-кистозная жидкость. Стенки желчного пузыря толщиной более 2–4 мм считаются аномально утолщенными.Перихолекистозная жидкость представляет собой воспалительный экссудат, но иногда это может быть связано с локализованными перфорациями. Однако некоторые из этих результатов могут не указывать на острый холецистит, если есть доказательства тяжелой гипоальбуминемии или асцита, которые также могут вызывать диффузный отек тонкой и толстой кишки.
Тем не менее, этот тест имеет чувствительность и специфичность от 90 до 95%. Радиологи пытаются повысить точность диагностики острого холецистита, выполняя ультразвуковой признак Мерфи.Этот тест является положительным, если датчик может продемонстрировать, что самая нежная точка брюшной стенки при глубоком вдохе находится непосредственно над положением желчного пузыря. Этот прием очень полезен, хотя и не специфичен, поскольку воспалительные состояния соседних органов могут имитировать эту болезненную точку.
Хотя ультразвуковое исследование менее специфично, чем холесцинтиграфия, оно может предоставить важную информацию о состоянии других органов брюшной полости, таких как печень, общий желчный проток и поджелудочная железа.Он также может распознавать некоторые из наиболее серьезных осложнений острого холецистита, такие как эмпиема, перихолекистозный абсцесс и перфорация. Кроме того, в отличие от холесцинтиграфии, он может исследовать желчный пузырь у пациентов с гипербилирубинемией и не подвергает пациентов воздействию ионизирующего излучения. Это причина того, что это диагностический тест выбора для беременных женщин и детей.
Если после ультразвукового исследования этот диагноз все еще остается неубедительным, врачи рекомендуют провести холесцинтиграфию с радиоактивными метками HIDA, PIPIDA или DISIDA [41].Визуализация желчного пузыря обычно происходит в течение 30 минут после инъекции этих радиоактивно меченных аналогов технеция. Невозможность визуализировать желчный пузырь в течение 60 минут соответствует диагнозу острого холецистита. Сообщается, что этот тест на 95% чувствителен и специфичен при диагностике острого холецистита. Невозможность визуализации желчного пузыря была интерпретирована как из-за обструкции пузырного протока желчными камнями. Однако более вероятны другие интерпретации такого распространения воспалительного процесса на пузырный проток или желчный пузырь, заполненный воспалительными секретами (см. Обсуждение этого вопроса в патогенезе хронического и острого холецистита).Этот тест имеет ложноотрицательный показатель 0,5%, если желчный пузырь виден в течение 30 минут после введения изотопа. Заполнение желчного пузыря в течение 30-60 минут менее надежно для исключения острого холецистита с 20% ложноотрицательными показателями. Ложноположительный тест встречается чаще и возникает, когда он не может показать желчный пузырь при отсутствии острого холецистита. Подсчитано, что желчный пузырь не заполняется в течение 1 часа у 5–10% пациентов при отсутствии острого холецистита.
Если этот диагноз подозревается в контексте симптомов и признаков острого живота, врачи отделения неотложной помощи проводят компьютерную томографию брюшной полости. Этот тест также следует выполнять, когда ультразвуковое исследование желчного пузыря не дает результатов [97]. Другое преимущество этого теста заключается в том, что на качество компьютерной томографии не влияет воздух или ожирение. Однако он может пропустить некоторые желчные камни, если они имеют такую же радиологическую плотность желчи желчного пузыря. Подсчитано, что компьютерная томография может обнаружить только 79% желчных камней.В целом положительная прогностическая ценность компьютерной томографии для острого холецистита не сильно отличается от таковой для ультразвукового исследования. Преимущество компьютерной томографии заключается в том, что она может обнаруживать другие патологические процессы, затрагивающие другие органы, например, желчный пузырь. Компьютерная томография также пропускает меньше случаев, чем УЗИ, поскольку на чувствительность УЗИ могут влиять характеристики пациента и опыт читателя при интерпретации изображений.
4.3. Лечение
После постановки диагноза «острый холецистит» пациентам нельзя ничего вводить перорально и лечить с помощью внутривенных жидкостей.Боль следует контролировать с помощью меперидина или демерола, поскольку этот опиат не увеличивает давление сфинктера Одди. Большинство хирургов рекомендуют использовать антибиотики, особенно при умеренных и тяжелых случаях острого холецистита и при наличии таких осложнений, как перфорация и перихолекистозный абсцесс. Использование профилактических антибиотиков необходимо, если планируется хирургическое вмешательство или если рассматривается холедохолитиаз.
Лапароскопическую холецистэктомию следует выполнять как можно скорее, обычно в течение первых 48–72 часов с момента появления симптомов, если нет серьезных противопоказаний к хирургической процедуре, таких как тяжелая эмфизема или застойная сердечная недостаточность.Однако несколько исследований показали, что нет различий в заболеваемости и смертности между ранним определением хирургической процедуры в течение семи дней с момента появления симптомов и отложенной холецистэктомией, выполненной между 8 и 16 неделями [98]. В большинстве этих исследований были исключены пожилые люди, и поэтому неизвестно, применим ли этот подход к этим пациентам. Также неясно, следует ли лечить пациентов с диабетом вскоре после появления симптомов. Переход к открытой холецистэктомии является абсолютным показанием, когда сосудистые структуры и желчные протоки не могут быть окончательно идентифицированы во время лапароскопической процедуры из-за обширной воспалительной реакции, фиброза, окружающего желчный пузырь, или подозрений на необычные аномалии желчных протоков.
Частота острого холецистита у беременных колеблется от 0,08 до 0,8 на 1000 случаев. Эта частота может быть немного выше, чем у небеременных женщин. Нет единого мнения о предпочтительности хирургического вмешательства или консервативного лечения. Консервативное лечение рекомендуется из-за высокого риска потери плода, связанного с общей анестезией, особенно в первом триместре. Опыт клиники Майо отличается от этой рекомендации, поскольку в их серии был только один аборт среди 20 беременных пациенток, которым в первом триместре была проведена холецистэктомия.Обычно в первом и третьем триместре рекомендуется консервативное лечение. Во втором триместре увеличенная матка ограничивает лапароскопический доступ к желчному пузырю [99].
5. Функциональные расстройства желчного пузыря
Функциональные расстройства желчного пузыря — это плохо определяемые нарушения моторики, которые могут быть первоначально вызваны метаболическими нарушениями или первичным нарушением моторики. Дисфункция желчного пузыря вызывает паттерн боли, подобный таковому при хроническом холецистите [100].На конференции в Риме III был достигнут консенсус, согласно которому диагноз нарушения моторики желчного пузыря должен основываться на симптомах, характеризующихся эпизодами устойчивой боли от умеренной до сильной в эпигастрии и правом верхнем квадранте живота, которые длятся не менее 30 минут. Эти симптомы обычно не возникают после приема пищи и не возникают ежедневно. Эту клиническую картину следует рассматривать после исключения камней в желчном пузыре и других структурных аномалий. Ультразвук желчного пузыря может быть полезен, поскольку он может исключить присутствие литогенной желчи с микрокристаллами.Затем этот диагноз должен быть подтвержден сниженной фракцией выброса желчного пузыря, определяемой провокационной холецистокинином с внутривенным введением холецистокинина и после разрешения рецидивирующей боли в желчных путях после холецистэктомии. Исследования, подтверждающие эти выводы, были получены без учета влияния литогенной желчи с избытком Ch на моторику желчного пузыря и хроническое воспаление. В большинстве этих исследований сообщалось о диагнозе функционального заболевания желчного пузыря без изучения того, содержат ли они литогенную желчь и присутствуют ли активированные воспалительные клетки в стенке желчного пузыря.Как и при функциональном расстройстве моторики, желчный пузырь с литогенной желчью демонстрирует более низкую фракцию выброса после CCK или стимуляции пищей. Однако гистологическое исследование показывает наличие активированных макрофагов, характерных для хронического холецистита. Эти гистологические отклонения должны быть исключены до установления функционального диагноза. Поэтому диагноз нарушения моторики желчного пузыря должен быть установлен у пациентов с болью, подобной билиарной, сниженной фракцией выброса при холесцинтиграфии после стимуляции CCK, нормальной желчью желчного пузыря с отсутствием литогенной желчи с избытком Ch и отсутствием воспалительных клеток.
Резюме и перспективы на будущее. За последние 30 лет мы многое узнали о патогенезе хронического холецистита, известного предшественника развития острого холецистита. Появляется все больше доказательств того, что желчные камни, хотя и играют важную роль в патогенезе осложнений со стороны желчных протоков, не играют значительной роли в развитии холецистита. Следовательно, существует необходимость в клинических испытаниях URSO на пациентах, которые не являются кандидатами на хирургическое лечение.Растворение желчных камней в желчном пузыре, хотя и является важной целью, не должно быть единственным критерием эффективности УРСО. Эту желчную соль следует рассматривать у пациентов с литогенной желчью с высокими концентрациями Ch, чтобы снизить литогенность и блокировать действие гидрофобных желчных солей.
6. Сфинктер Дискинезии Одди
Пациенты с дискинезией сфинктера Одди (СО), которые жалуются на симптомы, напоминающие желчные протоки, обычно выявляемые в период после холецистэктомии.Эти пациенты с дисфункцией сфинктера желчных протоков имеют симптомы и признаки, указывающие на преходящую обструкцию желчных протоков, а симптомы дисфункции панкреатического сфинктера Одди связаны с повышением уровня ферментов поджелудочной железы и даже с полным панкреатитом.
Пациенты с дисфункцией сфинктера Одди обследуются либо с помощью количественной холедохосцинтиграфии, либо с помощью манометрических тестов сфинктера Одди, предназначенных для объективного подтверждения этого диагноза. Хотя первоначальное исследование определило эту функциональную сущность с помощью сфинктера манометрии Одди, более поздние исследования показали, что количественная холедохосцинтиграфия так же полезна, как и сфинктер манометрии Одди при установлении этого диагноза.Аномальное время прохождения от ворот к сфинктеру Одди / двенадцатиперстной кишки при количественной холедохосцинтиграфии так же или даже более полезно, чем сфинктер манометрии Одди в диагностике дискинезии сфинктера Одди, поскольку у большого процента пациентов с аномальным временем прохождения улучшается после сфинктер Одди сфинктеротомия [101]. Пациенты со сфинктером дискинезии Одди I и II имеют отличный симптоматический ответ на сфинктеротомию, независимо от того, были ли они выбраны на основе аномального времени прохождения посредством количественной холедохосцинтиграфии или сфинктера манометрии Одди.Преимущество первого из них состоит в том, что он не инвазивен и не вызывает серьезных осложнений. Однако, если сфинктер манометрии Одди требуется для дальнейшего подтверждения этого диагноза и определения типа сфинктера дискинезии Одди, консенсус Рима III предполагает, что этих пациентов следует направлять в экспертное отделение из-за высокой частоты осложнений, которые возникают после этот тест. Консенсус Рима III также пришел к выводу, что этот инвазивный тест следует проводить только при наличии убедительных клинических доказательств и после того, как неинвазивное тестирование дало отрицательные результаты.Римский комитет III рекомендовал рассматривать разделение билиарного или панкреатического сфинктеров только тогда, когда пациенты имеют тяжелые симптомы и соответствуют требуемым критериям: дискинезии сфинктера Одди, и другие диагнозы исключены. Более того, на основе этих и других исследований, по-видимому, существует тесная корреляция между результатами количественной холедохосцинтиграфии и сфинктера манометрии Одди.
Эти пациенты были разделены на три типа в зависимости от их лаборатории и сфинктера результатов исследования Одди.Пациенты с билиарным сфинктером I типа с дискинезией Одди жалуются на боль, подобную желчевыводящей, у них два или более случаев подтверждены повышенные показатели функции печени, расширенный общий желчный проток с исправленным диаметром, равным или более 12 мм, и задержка оттока контрастного вещества из общий желчный проток при эндоскопической ретроградной холангиопанкреатографии и базальном давлении выше 40 мм рт. Пациенты типа II жалуются на боль, подобную билиарной, и имеют только один или два из ранее упомянутых критериев.Пациенты III типа характеризуются рецидивирующей болью желчного типа, но без лабораторных или манометрических отклонений [102].
Частота осложнений у пациентов с жалобами на сильную боль или развивающимся панкреатитом после моторики сфинктера Одди выше у пациентов с дискинезией сфинктера Одди, чем у пациентов с органическими аномалиями общего желчного протока. Эти осложнения даже выше у пациентов с дискинезией сфинктера Одди III типа, чем у пациентов с I и II типами.Заболеваемость панкреатитом после перипетии у этих пациентов может достигать 19,7%. Причины высокой частоты осложнений до конца не известны, хотя есть данные, свидетельствующие о том, что более высокая скорость перфузии во время процедуры частично ответственна за эти осложнения [103]. Методы неперфузионной моторики были разработаны для изучения сфинктера дискинезии Одди. Этот метод, вероятно, должен снизить частоту постманометрического панкреатита.
Большинство симптомов у пациента с дискинезией I типа поддаются сфинктеротомии по сравнению с симптоматической реакцией на фиктивное лечение.У некоторых из этих пациентов, по-видимому, имеется органический стеноз, поскольку их высокий базальный сфинктер давления Одди не расслабляется в ответ на CCK. У большинства пациентов со сфинктером II типа дискинезии Одди также улучшается состояние после сфинктеротомии, но этот процент ниже, чем терапевтический ответ, наблюдаемый у пациентов с дискинезией I типа. Есть небольшая группа пациентов со сфинктером Одди с дискинезией I или II типа, у которых сфинктер Одди сокращается, а не расслабляется в ответ на CCK [104].Этот парадоксальный ответ предполагает денервацию сфинктера Одди из-за отсутствия неадренергических нехолинергических ингибирующих нейронов. Пациенты с дискинезией сфинктера Одди III типа испытывают боль, похожую на желчевыводящие пути, но имеют нормальные лабораторные тесты и давление сфинктера Одди. Большинство симптомов этих пациентов не реагируют на сфинктеротомию, что ставит вопрос о том, вызвана ли боль функциональными расстройствами желудочно-кишечного тракта, не связанными со сфинктером Одди. Однако есть одно небольшое открытое исследование, которое показало, что у некоторых пациентов со сфинктером III типа дискинезии Одди симптомы улучшались после инъекции ботулотоксина в сосочек Фатера.Он показал, что у 50% пациентов наблюдалось временное улучшение симптомов на срок до шести месяцев после лечения [105]. Известно, что ботулинический токсин блокирует нервную стимуляцию, в частности, через холинергические нейроны и сенсорные пути [106, 107]. Этот терапевтический ответ предполагает, что боль может быть вызвана аномалией сенсорных путей, возникающих в этой области. Однако результаты вышеупомянутого исследования должны быть подтверждены более крупным двойным слепым клиническим исследованием плацебо.
В большинстве этих отчетов не описываются аномалии желчного пузыря у пациентов до прохождения холецистэктомии, независимо от того, были ли эти пациенты хроническим или острым холециститом, были ли они камнями или некалькулезными.Эти данные могут быть важны, потому что мы не знаем, исходили ли первоначальные симптомы из желчного пузыря, сфинктера Одди или обоих. Эти знания также важны для объяснения патогенеза и природы дискинезии типа I и, возможно, типа II, при которой аномалия может иметь органическую природу или иметь стеноз сфинктера Одди. Вполне возможно, что этот тип дискинезии сфинктера Одди (или стеноз?) Может быть вызван прохождением желчных камней через этот сегмент, что приводит к травме и последующему фиброзу сфинктера.Кроме того, наличие желчных камней в анамнезе у пациентов с дискинезией сфинктера Одди также может объяснить однобокую заболеваемость этим заболеванием у женщин по сравнению с мужчинами.
Таким образом, много новых знаний было получено в результате серии тщательных исследований, проведенных у пациентов с постхолецистэктомической болью с использованием сфинктера манометрии Одди и / или холедохосцинтиграфии, а также клинических испытаний, которые оценивали симптоматический ответ на сфинктеротомию Одди.Однако необходимы дальнейшие исследования, чтобы определить природу дисфункции, может ли дисфункция у некоторых пациентов быть вызвана органическим стенозом, а у других — нервными аномалиями, включающими моторную или сенсорную иннервацию сфинктера Одди.
Желчный пузырь: функция, анатомия и гистология
Автор:
Лоренцо Крамби, бакалавр наук
• Рецензент:
Урудж Зехра MBBS, MPhil, PhD
Последний раз отзыв: 13 ноября 2020 г.
Время чтения: 24 минуты
Пищеварительный тракт — одна из крупнейших систем человеческого тела.Помимо основных сегментов, простирающихся от рта до ануса, есть множество дополнительных органов пищеварения, которые способствуют выработке и усвоению питательных микроэлементов из проглоченных макромолекул. Одним из таких органов является желчный пузырь .
В этой статье рассматривается анатомия желчного пузыря, а также связанного с ним билиарного аппарата. Особое внимание также будет уделено соответствующей эмбриологии, гистологии и смежным анатомическим структурам.
Функция желчного пузыря
Этот мешок грушевидной формы в основном функционирует как резервуар для желчи , которая была синтезирована на уровне гепатоцитов.При приеме пищи присутствие жиров и белков в кишечнике стимулирует высвобождение холецистокинина ; который действует на уровне тела и шейки желчного пузыря, а также кистозных и внепеченочных протоков. Этот пептидный гормон вызывает одновременное сокращение тела желчного пузыря и расслабление шейки желчного пузыря.
Желчный пузырь (вид снизу)Когда давление внутри желчного дерева достигает 10 мм вод. Ст. Желчи, происходит расслабление сфинктера из Oddi .Таким образом, желчь может выделяться как из желчного пузыря, так и непосредственно из печени через желчное дерево дерево . Однако во время голодания отсутствие холецистокинина приводит к сокращению сфинктера Одди. Повышенное давление в желчном дереве приводит к отведению желчи в желчный пузырь, где она хранится и концентрируется. Эндотелиальная мембрана желчного пузыря оснащена многочисленными ионными каналами, которые активно поглощают натрия , хлорид и бикарбонат ионов .Затем молекулы воды следуют осмотическому градиенту, создаваемому сдвигом ионов, что приводит к концентрации желчи. Наконец, желчный пузырь также производит около 15-20 мл слизи в течение дня.
Чтобы изучить анатомию печени, ознакомьтесь со следующими ресурсами:
Эмбриология желчного пузыря и желчного дерева
На четвертой неделе развития дифференцировка эмбриональной энтодермы приводит к выпячиванию дистальной области передней кишки.Эта структура, известная как печеночный дивертикул , дает начало желчному пузырю и связанным с ним желчным протокам; а также печень. Напомним, что примерно в это время существует обширное кардиологическое оригами, и поэтому необходимо разделить клетки развивающегося сердца и пищеварительной системы. Следовательно, организованный слой чревной мезодермы, известный как перегородка , , , поперечная, , растет между сердцем и средней кишкой.
По мере роста дивертикул печени делится неравномерно.Более крупный зачаток черепа стремится стать зачатком печени и внепеченочным желчным деревом . Внепеченочная желчная система (обсуждается ниже) определяется к 5-й неделе беременности. Внепеченочные желчные протоки переходят в мезенхиму поперечной перегородки и вызывают характерный фиброзный вид печени.
Желчный пузырь (осевой вид)Внутри печени клетки эндометрия, которые перекрывают друг друга, образуя гепатоциты, также дают внутрипеченочную билиарную систему .Сообщение с внепеченочными желчными протоками знаменует завершение внутрипеченочной желчевыводящей системы, которое происходит примерно на 10-й неделе беременности.
Меньшая хвостовая зачатка дивертикула печени подразделяется на верхнюю и нижнюю зачатки. Верхний зачаток и связанный с ним стебель станут желчным пузырем и кистозным протоком (соответственно), а нижний зачаток станет вентральным компонентом поджелудочной железы.И печень, и желчный пузырь прорастут в брюшную часть мезогастрия (образованную из поперечной перегородки).
Желчный пузырь, пузырный проток и внепеченочные желчные протоки изначально закупорены клетками. Поскольку желчный проток продолжает расти, центрально расположенные клетки подвергаются апоптозу ; таким образом превращая твердую трубку в люминесцентную структуру. Первоначально этот процесс начинается в общем желчном протоке и продолжается дистально в конце 5-й недели беременности. Реканализация — медленный процесс, который перекрывается анатомическим изменением положения общего желчного протока и брюшной части поджелудочной железы; таким образом, что общий желчный проток расположен на дорсомедиальной поверхности двенадцатиперстной кишки. Желчный проток становится проходимым только между концом второй и началом 8-й недели гестации, когда он переходит в двенадцатиперстную кишку. Примерно на 7-й неделе беременности реканализация переходит в пузырный проток и распространяется на желчный пузырь к 12-й неделе беременности.Новорожденные имеют небольшую поверхность брюшины, поэтому глазное дно находится в пределах границы печени. После второго года жизни желчный пузырь принимает относительные размеры.
Желчный пузырь (аксиальный вид)Общий печеночный проток и протоки поджелудочной железы объединяются, образуя гепатопанкреатический проток. Он заходит в стенку двенадцатиперстной кишки на уровне подслизистой оболочки в виде ампулы Фатера (большого дуоденального сосочка). Концентрические мезенхимальные кольца окружают ампулу и дают начало сфинктеру Одди.Сфинктер Одди далее дифференцируется примерно на 10-й неделе беременности на сфинктер , , , холедох, , верхний и нижний; оба из них окружают желчный проток. Хотя окончательное развитие ампулы продолжается до 28-й недели гестации, внепеченочные органы готовы транспортировать желчь из печени в двенадцатиперстную кишку к 12-й неделе гестации (то есть через 6 недель после начала кроветворения).
Анатомия желчного пузыря
Расположение
Желчный пузырь представляет собой тупик грушевидной формы, который сообщается с общими печеночными протоками через кистозный проток проток .In vivo мешок на самом деле имеет серо-синий цвет (а не зеленый, как показано в текстах). Орган длиной 7,5–12 см находится в нижней части анатомической правой доли печени, рядом с печеночными ножницами scissura , глубоко в печеночной части брюшины.
Есть случаи, когда желчный пузырь может быть полностью погружен в паренхиму печени; здесь говорят, что он имеет интрапаренхимный образец .В других случаях желчный пузырь может иметь собственную брыжейку, отходящую от висцеральной и париетальной брюшины; в этом случае он описывается как имеющий мезентериальный образец . Это две крайности спектра, на которых может появиться желчный пузырь. В нормальных условиях мешок может вместить 25-30 мл желчи; но может увеличиваться до 50 мл.
Детали
Желчный пузырь состоит из трех анатомических частей. От латерального до медиального — это глазное дно, тело и шея (воронка).Дно — самая боковая часть желчного пузыря. Обычно он выступает за нижнюю границу печени и может касаться передней брюшной стенки. Клинический ориентир для дна желчного пузыря находится на уровне 9-го ребра , на пересечении латеральной границы правой прямой мышцы живота и реберного края. На этом этапе клинически можно оценить увеличенный желчный пузырь.
Медиальнее дна находится тело желчного пузыря.Это часть мешка, которая либо встроена, либо контактирует с желчным пузырем ямкой печени. Нисходящая часть (вторая часть) двенадцатиперстной кишки , а также печеночный изгиб и проксимальная поперечная ободочная кишка кзади связаны с желчным пузырем.
Тело желчного пузыря сужается к середине шейкой или инфундибулумом. Он расположен проксимальнее ворот печени и обычно связан с короткой брыжейкой, которая также содержит кистозную артерию.По мере того, как шейка сужается в проток пузырного протока , он содержит наклонные бороздки, которые переходят в спиральный клапан пузырного протока. Существует относительно непостоянная, хотя и часто встречающаяся патологическая вариация шейки желчного пузыря, известная как мешочек Хартмана . Это выпячивание стенки шеи в результате камней в желчном пузыре или расширения мешка. Размер мешочка может варьироваться у разных пациентов, что может быть связано с многочисленными осложнениями.
Желчный пузырь внутри трупа: желчный пузырь расположен внутри ямки желчного пузыря в нижней части печени. У трупов он выглядит обезвоженным и сморщенным, потому что в этом полостном органе нет желчного содержимого, которое позволяло бы ему расширяться, как у живых людей. Кроме того, кистозная артерия, снабжающая желчный пузырь, выглядит зеленой из-за присутствия желчи. Кроме того, он очень хрупкий, что затрудняет рассечение. На этом изображении также изображена подковообразная почка.Внутрипеченочная желчная система
Внутрипеченочные желчные пути — это уникальная система, предназначенная для транспортировки желчи от гепатоцитов к внепеченочному билиарному дереву.Он начинается на уровне желчи canaliculi (s. Canaliculus), который представляет собой расширенное пространство между соседними гепатоцитами. Напомним, что многогранные гепатоциты расположены так, что их апикальные концы выступают в печеночных синусоидов (которые в конечном итоге сливаются в печеночные вены). Основания этих клеток обращены к желчным каналам и выделяют желчь в эти каналы. Стенки канальцев считаются модифицированными участками стенок гепатоцитов.По мере формирования этих каналов они проходят аналогичный путь к печеночным синусоидам. Однако их содержимое течет в обратном направлении.
Каналы желчи (гистологический слайд)Канальцы в каждом сегменте печени сливаются, образуя сегментные протоков . Следовательно, существует восемь сегментарных протоков, соответствующих каждому функциональному сегменту печени: сегментарные протоки, отходящие от сегментов II и III печени, дают начало правому печеночному протоку .Обычно к ним также присоединяется сегмент , сегмент IV, канал ; однако это может варьироваться в зависимости от пациента. Сегменты V – VIII в конечном итоге будут способствовать левому печеночному протоку . Однако сегменты V и VIII дают начало правому переднему (медиальному) секторальному протоку, тогда как сегменты VI и VII дают начало правому заднему (латеральному) секторальному протоку.
Правый задний секторный проток длиннее своего аналога, и его можно увидеть, проходя медиально, позади правого переднего секторального протока (образующего изгиб Хьортсё) перед тем, как проколоть правый передний секторальный проток на медиальной поверхности, чтобы сформировать левый канал печеночный проток .Следует отметить, что I печеночный сегмент (т.е. хвостатая доля) отводится как в левый печеночный проток, так и в правый задний секторный проток.
Другой набор внутрипеченочных протоков встречается с относительной частотой. Эти структуры развиваются в результате вегетативного роста дистальных желчных протоков, которые возникают из pars hepatica поперечной перегородки. В областях, где ожидается регресс паренхимы печени, эти протоки могут не дегенерировать; следовательно, они дают начало субпузырным протокам протокам (также известным как протоков Люшки ).Эти небольшие каналы часто возникают в виде дольчатых скоплений протоков разного размера. Они часто исходят из правой доли и могут попадать либо во внутрипеченочные, внепеченочные протоки, либо в желчный пузырь. Описано несколько подтипов субпузырных протоков. К ним относятся:
- Дополнительные субпузырные протоки — наиболее распространенные варианты субпузырных протоков. Они возникают из любой из правых секторных артерий и впадают в основные желчные протоки после пересечения ямки желчного пузыря.Эти протоки обычно превышают типичное желчное дерево.
- Секторальный / сегментарный субпузырный проток встречается относительно часто. Он представляет собой протоки, которые имеют нехарактерный для себя ход, поверхностный в ямке желчного пузыря. Он берет начало из правого заднего сегментарного или секторального протока и дренирует отдельно в главный правый печеночный проток.
- Гепатохолекистозные субпузырные протоки впадают непосредственно в желчный пузырь из печени и обычно выходят из правой доли.
- Аберрантные субпузырные протоки находятся в капсуле ямки желчного пузыря. Они имеют околопеченочное сообщение с внутрипеченочными протоками, но оканчиваются дистально в виде тупиков.
Внепеченочная желчная система
Как описано выше, сегментарный и секторный протоки дают начало левому и правому печеночным протокам. Левый печеночный проток немного длиннее правого печеночного протока и проходит по более горизонтальному пути, чем правый проток, поскольку он проходит вдоль основания сегмента IV печени.Правый печеночный проток обычно имеет вертикальное направление и более подвержен анатомическим изменениям, чем левый печеночный проток. Хотя у большинства пациентов анатомия этих структур будет нормальной, существуют другие варианты, описанные Блюмгартом, которые должны быть знакомы хирургам, занимающимся гепатобилиарной областью.
Классификация вариаций правого печеночного протока БлюмгартаОба протока сливаются на боковой стороне порта гепатиса, образуя общий печеночный проток .Эта часть желчного дерева имеет длину от 2,5 до 3 см и часто находится латеральнее печеночной артерии, с воротной веной позади нее. Все три структуры можно найти в свободной границе малого сальника (так как он образует желудочно-сальниковое отверстие Уинслоу).
Шейка желчного пузыря выходит медиально в кистозный проток канал . Эта трубчатая структура обычно имеет длину 3–4 см и ширину около 1–3 мм. Слизистая оболочка пузырного протока сложена по спирали и образует клапанов из Heister ; которые, по мнению некоторых анатомов, помогают сохранить проходимость протока.Он также имеет связанный сфинктер — сфинктер из Lütkens — который помогает регулировать отток желчи из желчного пузыря. Затем пузырный проток берет задний ход вместе с общим печеночным протоком (и прилегает к нему) до их соединения. У большинства пациентов кистозный и общий печеночные протоки объединяются над двенадцатиперстной кишкой рядом с воротами печени.
Пузырный проток (вид с вентральной стороны)В результате соединения кистозного и общего печеночного протоков образуется общий желчный проток длиной 6-8 см .В среднем общий желчный проток взрослого человека имеет ширину около 6 мм; однако были сообщения о его увеличении с возрастом. Эту структуру анатомически можно разделить на четыре части:
- Наддуоденальная часть составляет 2,5 см от общей длины конструкции. Он проходит вниз по правой части свободного края малого сальника, кпереди от желудочно-сальникового отверстия Уинслоу. Следует отметить, что печеночная артерия медиально связана с этой частью общего желчного протока, а воротная вена также расположена заднемедиально от нее.
- Ретродуоденальная часть проходит позади верхней части (первой части) двенадцатиперстной кишки вместе с гастродуоденальной артерией, также медиально связанной с протоком на этом уровне.
- Инфрадуоденальная часть проходит в канавке на суполатеральной стороне задней поверхности головки поджелудочной железы. Нижняя полая вена здесь находится кзади от протока. Проток обычно находится в пределах 2 см от нижней части двенадцатиперстной кишки.
- Интрадуоденальная часть прокалывает медиальную стенку нисходящей части (вторая часть) двенадцатиперстной кишки вместе с протоком поджелудочной железы.
Общий желчный проток и проток поджелудочной железы часто сливаются после прокалывания двенадцатиперстной кишки, образуя гепатопанкреатический проток проток . Проток выходит на просветную поверхность второй части двенадцатиперстной кишки в виде гепатопанкреатической ампулы по Vater .Напомним, что вокруг гепатопанкреатической ампулы есть две круговые мышечные структуры — верхний и нижний холедох сфинктера. Верхний холедох сфинктера расположен вокруг дистальной части общего желчного протока. Также есть похожий сфинктер вокруг дистальной части главного панкреатического протока. Следовательно, выброс содержимого из желчных путей и протока поджелудочной железы можно регулировать независимо. нижний холедох сфинктера становится гепатопанкреатическим сфинктером Одди.
Гистология желчного пузыря и билиарного аппарата
Слизистая и подслизистая
Как и большинство внутренних органов брюшной полости, желчный пузырь имеет три отдельных слоя внутри своей стенки. Большинство этих слоев также непрерывны по всей внепеченочной желчной системе. Мешок и протоки снабжены слизистой оболочкой, мышечным слоем и окружающей серозной оболочкой. Желто-коричневая слизистая оболочка образована из простого столбчатого эпителия , который расположен на пластинке propria .Эти клетки содержат микроворсинок на апикальной поверхности, и эти клетки богаты митохондриями. У них также есть многочисленные натрий- аденозинтрифосфат (Na + -ATP), насосы на базолатеральной поверхности клеток, что позволяет клеткам активно переносить ионы натрия из просвета желчного пузыря. Впоследствии вода будет диффундировать по осмотическому градиенту, создаваемому ионным сдвигом. В результате желчь может концентрироваться, поскольку она хранится в желчном пузыре.
Желчный пузырь (гистологический препарат)Просветная поверхность желчного пузыря, как и поверхность тонкого кишечника, сильно сложена в морщин и имеет вид сот.Однако, в отличие от тонкого кишечника, морщинки — это временные структуры, которые исчезают, когда желчный пузырь расширяется. Внутри слизистой оболочки также есть дивертикулы, которые доходят до мышечного слоя, известные как крипты из Luschka . Относительно рыхлая подслизистая основа под слоем слизистой оболочки богата эластичными волокнами, кровеносными сосудами и лимфатическими сосудами.
Собственная мышца
Собственная мышца — это относительно тонкий слой гладких мышечных волокон, расположенных беспорядочно.Эти мышечные волокна обладают рецепторами CCK, и отвечает на холецистокинин, высвобождается из энтероэндокринных клеток двенадцатиперстной кишки в ответ на присутствие жиров и белков в кишечнике. В результате концентрированная желчь из желчного пузыря перекачивается в пузырный проток и транспортируется в двенадцатиперстную кишку через общий желчный проток.
Сероса
Мешок заключен в тонкий слой серозной оболочки ( внешний адвентиция ).Серозная оболочка обычно ограничена дном , желчного пузыря и простирается по окружности вокруг нижних сторон тела и шейки мешка. Однако в мезентериальном желчном пузыре серозная оболочка продолжается выше, через весь желчный пузырь, сливаясь с серозной оболочкой брыжейки. Внутрипаренхиматозный желчный пузырь не имеет связанной серозной оболочки. Обычно имеется скопление адипоцитов и рыхлой соединительной ткани брюшины, образующее суберозу .
Пузырный проток и внепеченочное билиарное дерево также имеют сходные гистологические слои. Поверхность просвета выстлана холангиоцитами . Это простые кубовидные (или низко столбчатые) эпителиальные клетки, расположенные на собственной пластинке. Подслизистая основа тонкая и содержит тубулоальвеолярные слизистые железы на некоторых участках вдоль пузырного протока. Тонкий мышечный слой с круглыми, косыми и продольными гладкими мышечными волокнами окружает всю билиарную систему внутри волокнистой соединительнотканной оболочки.Однако он постепенно становится толще по мере того, как канал приближается к своей конечной точке в ампуле Фатера. Гепатопанкреатический проток также имеет ворсинчатые складки с гладкими миоцитами в его ядре; они функционируют как односторонние клапаны, предотвращая отток содержимого двенадцатиперстной кишки в гепатопанкреатический проток.
Гепатопанкреатическая ампула (вид снизу)Треугольник Кало
Пузырьковый проток , нижняя граница сегмента V и общий печеночный проток соединяются, образуя почти треугольное пространство, известное как треугольник Калота.Пространство можно представить в виде пирамиды с вершинами в следующих областях:
- Между пузырным протоком и дном желчного пузыря
- В воротах гепатита
- Два на стыке желчного пузыря и его ямки
Нижняя граница V сегмента печени образует основание треугольника. Пространство окружено брыжейкой пузырного протока и содержит жировую ткань, лимфатические узлы и сосуды, а также другие сосудисто-нервные структуры.
Нейроваскулярное кровоснабжение и лимфодренаж желчного пузыря
Артериальное кровоснабжение
Основная артерия, снабжающая желчный пузырь, — это кистозная артерия . Трифуркация чревного ствола дает общую печеночную артерию как одну из его ветвей. Обычная печень раздваивается после относительно короткого бокового путешествия над верхней границей головки поджелудочной железы и перед воротными венами печени. Собственно печеночная артерия разветвляется около порта гепатиса на левую и правую печеночные артерии.Это правая печеночная артерия , , которая разветвляется, образуя кистозную артерию, снабжающую желчный пузырь.
Кистозная артерия (каудальный вид)Кистозная артерия — одна из основных структур, проходящих через треугольник Калота. Однако его анатомия может отличаться от человека к человеку. Последующее ветвление и анастомозирование производных кистозной артерии расширяет территорию сосуда до уровня долевого и общего печеночных протоков, а также до проксимальных отделов общих желчных протоков.Внепеченочное билиарное дерево снабжается ветвями от задней верхней панкреатодуоденальной артерии , а также других артерий в непосредственной близости.
Задняя верхняя панкреатодуоденальная артерия (вид снизу)Венозный дренаж
Множественные мелкие безымянные вены часто дренируют желчный пузырь. Они могут происходить из ареолярной ткани, отделяющей печень от желчного пузыря. Эти сосуды пронизывают паренхиму печени и образуют притоки к сегментарной воротам вен .
Иннервация
Вегетативные ветви печеночного сплетения иннервируют желчный пузырь. Небольшие ветви блуждающего нерва (CN X) иннервируют ретродуоденальный общий желчный проток, а также гепатопанкреатическую ампулу Фатера.
Печеночное сплетение (вид снизу)Лимфатические сосуды
Кистозный лимфатический узел (вид снизу)Лимфатические каналы желчного пузыря пересекают подсерозный и подслизистый слои мешка, образуя соответствующие сплетения.Некоторые стекают во внутрипеченочные лимфатические сосуды, в то время как другие опорожняются в кистозный узел , расположенный в треугольнике Кало. В конечном итоге они стекают в узлы свободного края малого сальника, а также в узлы ворот гепатита. Хвостовая часть желчного дерева отводится к верхним панкреатико-селезеночным и нижним печеночным узлам .
Клинические аспекты
Присутствие камней в желчном пузыре, которое клинически известно как холелитиаз , лучше всего описать как твердые сферические отложения избыточных побочных продуктов, которые необходимы для образования желчи, образующейся внутри желчного пузыря.Два основных типа камней — это те, которые состоят из холестерина , и те, которые называются пигментом , камни . Последняя форма возникает из-за хронического гемолиза, инфекции желчных путей или желудочно-кишечного заболевания, такого как болезнь Крона.
Холестериновые камни имеют гораздо более длинный список причинных факторов, таких как:
- старость
- Избыточные женские половые гормоны
- ожирение
- инсулинорезистентность
- Застой желчного пузыря
- Синдромы дислипидемии
Хирургия обычно рекомендуется, чтобы избежать инфекции желчного пузыря, которая может потенциально распространиться среди других рисков.
Реконструкция внепеченочного билиарного дерева мыши с использованием первичных органоидов внепеченочных холангиоцитов человека
Murray, K.F. & Carithers, R.L. Jr. Практические рекомендации AASLD: оценка пациента для трансплантации печени. Гепатология 41 , 1407–1432 (2005).
Артикул Google Scholar
Perkins, J.D. Мы сообщаем об одном и том же? Liver Transpl. 13 , 465–466 (2007).
PubMed Google Scholar
Скаро, А.И. и другие. Влияние ишемической холангиопатии на трансплантацию печени с использованием доноров после сердечной смерти: нерассказанная история. Хирургия 146 , 543–552, обсуждение 552–553 (2009).
Артикул Google Scholar
Enestvedt, C.K. и другие. Осложнения со стороны желчевыводящих путей отрицательно сказываются на выживаемости пациента и трансплантата после ретрансплантации печени. Liver Transpl. 19 , 965–972 (2013).
Артикул Google Scholar
Gallo, A. & Esquivel, C.O. Современные варианты лечения атрезии желчных путей. Pediatr. Пересадка. 17 , 95–98 (2013).
Артикул Google Scholar
Felder, S.I. et al. Гепатикоеюностомия с использованием реконструкции Roux-en-Y на короткой конечности. JAMA Surg. 148 , 253–257, обсуждение 257–258 (2013).
Артикул Google Scholar
Sampaziotis, F., Segeritz, C.-P. И Валлиер, Л. Потенциал индуцированных человеком плюрипотентных стволовых клеток в исследованиях заболеваний печени. Гепатология 62 , 303–311 (2015).
Артикул Google Scholar
Канно, Н., Лесаж, Г., Глейзер, С., Альваро, Д. и Альпини, Г. Функциональная неоднородность внутрипеченочного желчного эпителия. Гепатология 31 , 555–561 (2000).
CAS Статья Google Scholar
Sampaziotis, F. et al. Холангиоциты, полученные из индуцированных человеком плюрипотентных стволовых клеток, для моделирования заболеваний и валидации лекарств. Nat. Biotechnol. 33 , 845–852 (2015).
CAS Статья Google Scholar
Сампазиотис, Ф.и другие. Направленная дифференцировка индуцированных человеком плюрипотентных стволовых клеток в функциональные холангиоцитоподобные клетки. Nat. Protoc. 12 , 814–827 (2017).
CAS Статья Google Scholar
LeSage, G., Glaser, S. & Alpini, G. Регулирование пролиферации холангиоцитов. Печень 21 , 73–80 (2001).
CAS Статья Google Scholar
Хуч, М.и другие. Долгосрочная культура геном-стабильных бипотентных стволовых клеток печени взрослого человека. Cell 160 , 299–312 (2015).
CAS Статья Google Scholar
Масюк А.И., Масюк Т.В., ЛаРуссо Н.Ф. Первичные реснички холангиоцитов в здоровье и болезнях печени. Dev. Дин. 237 , 2007–2012 (2008).
CAS Статья Google Scholar
Табибиан, Дж.Х., Масюк, А.И., Масюк, Т.В., О’Хара, С.П., ЛаРуссо, Н.Ф. Физиология холангиоцитов. Компр. Physiol. 3 , 541–565 (2013).
PubMed Google Scholar
Cízková, D., Morký, J., Micuda, S., Osterreicher, J. & Martínková, J. Экспрессия транспортеров MRP2 и MDR1 и других печеночных маркеров в печени крысы и человека, а также в клеточной линии WRL 68 . Physiol. Res. 54 , 419–428 (2005).
PubMed Google Scholar
Gigliozzi, A. et al. Молекулярная идентификация и функциональная характеристика Mdr1a в холангиоцитах крысы. Гастроэнтерология 119 , 1113–1122 (2000).
CAS Статья Google Scholar
Xia, X., Francis, H., Glaser, S., Alpini, G. & LeSage, G. Взаимодействие желчных кислот с холангиоцитами. World J. Gastroenterol. 12 , 3553–3563 (2006).
CAS Статья Google Scholar
Каперна, Т.Дж., Бломберг, А., Гарретт, В.М. & Talbot, N.C. Культура гепатоцитов свиней или эпителиальных клеток желчных протоков с помощью индуктивной бессывороточной среды. Клетка in vitro. Dev. Биол. Anim. 47 , 218–233 (2011).
Артикул Google Scholar
Маринелли Р.A. et al. Секретин вызывает апикальное введение водных каналов аквапорина-1 в холангиоциты крысы. Am. J. Physiol. 276 , G280 – G286 (1999).
CAS PubMed Google Scholar
Гонг, А.-Й. и другие. Соматостатин стимулирует всасывание желчи протоков и подавляет секрецию желчи протоков у мышей посредством SSTR2 на холангиоцитах. Am. J. Physiol. Cell Physiol. 284 , C1205 – C1214 (2003).
CAS Статья Google Scholar
Ito, M. et al. NOD / SCID / γ c null Мышь : отличная модель мышей-реципиентов для приживления клеток человека. Кровь 100 , 3175–3182 (2002).
CAS Статья Google Scholar
Чан, Б.П. И Леонг, К. Строительные леса в тканевой инженерии: общие подходы и особенности тканей. Eur. Spine J. 17 (Приложение 4), 467–479 (2008).
CAS Статья Google Scholar
Cheung, H.-Y., Lau, K.-T., Lu, T.-P. & Хуэй, Д. Критический обзор биотехнологических материалов на основе полимеров для разработки каркасов. Compos., Part B Eng. 38 , 291–300 (2007).
Артикул Google Scholar
Яблонска, Б.Протоковый анастомоз конец в конец при реконструкции желчных протоков: показания и ограничения. Банка. J. Surg. 57 , 271–277 (2014).
Артикул Google Scholar
Gjorevski, N. et al. Дизайнерские матрицы для кишечных стволовых клеток и органоидов. Природа 539 , 560–564 (2016).
CAS Статья Google Scholar
Коо, Б.K. & Clevers, H. Стволовые клетки, маркированные рецептором R-спондина LGR5. Гастроэнтерология 147 , 289–302 (2014).
CAS Статья Google Scholar
Фарин, Х.Ф., Ван Эс, Дж. Х. & Clevers, H. Избыточные источники Wnt регулируют стволовые клетки кишечника и способствуют образованию клеток Панета. Гастроэнтерология 143 , 1518–1529. e7 (2012).
CAS Статья Google Scholar
Ду, П., Киббе В.А. и Лин С.М. lumi: конвейер для обработки микрочипов Illumina. Биоинформатика 24 , 1547–1548 (2008).
CAS Статья Google Scholar
Lin, S.M., Du, P., Huber, W. & Kibbe, W.A. Преобразование для стабилизации дисперсии на основе модели для данных микрочипов Illumina. Nucleic Acids Res. 36 , e11 (2008).
Артикул Google Scholar
Смит, Г.K. Линейные модели и эмпирические байесовские методы для оценки дифференциальной экспрессии в экспериментах с микрочипами. Stat. Прил. Genet. Мол. Биол. 3 , Статья 3 (2004).
Артикул Google Scholar
Тянова С.В. и др. Вычислительная платформа Perseus для всестороннего анализа (проте )омических данных. Nat. Методы 13 , 731–740 (2016).
CAS Статья Google Scholar
Хуанг, В., Шерман, Б. И Лемпицки, Р.А. Систематический и комплексный анализ больших списков генов с использованием ресурсов биоинформатики DAVID. Nat. Protoc. 4 , 44–57 (2009).
CAS Google Scholar
Хуанг В., Шерман Б.Т. И Лемпицки, Р.А. Инструменты обогащения биоинформатики: пути к всестороннему функциональному анализу больших списков генов. Nucleic Acids Res. 37 , 1–13 (2009).
Артикул Google Scholar
Bertero, A. et al. Передача сигналов Activin / nodal и NANOG управляют решениями о судьбе эмбриональных стволовых клеток человека, контролируя метку хроматина h4K4me3. Genes Dev. 29 , 702–717 (2015).
CAS Статья Google Scholar
Campos, P.B., Sartore, R.C., Abdalla, S.N. И Рехен, С. Препарат хромосомного распространения стволовых клеток человеческого эмбриона для кариотипирования. J. Vis. Exp. http://dx.doi.org/10.3791/1512 (2009 г.).
Hannan, N.R.F. и другие. Получение мультипотентных стволовых клеток передней кишки из плюрипотентных стволовых клеток человека. Stem Cell Reports 1 , 293–306 (2013).
CAS Статья Google Scholar
Ку, Б.-К., Сасселли, В. и Клеверс, Х. Контроль экспрессии гена ретровирусов в первичных культурах органоидов. Curr.Protoc. Stem Cell Biol. 27 , Блок 5A.6 (2013).
Артикул Google Scholar
Shultz, L.D. и другие. Развитие лимфоидных и миелоидных клеток человека у мышей NOD / LtSz-scid IL2Rγ null , которым прививали мобилизованные гемопоэтические стволовые клетки человека. J. Immunol. 174 , 6477–6489 (2005).
CAS Статья Google Scholar
Влияние желчевыводящей системы на билиарные бактерии, выявленное бактериальными сообществами желчевыводящих путей и верхних отделов пищеварительного тракта человека
Abstract
Билиарные бактерии участвуют в патогенезе желчных камней, хотя четкое понимание их состава и источника отсутствует.Более того, влияние желчной среды, которая, как известно, в целом враждебна большинству бактерий, на желчные бактерии неясно. Здесь мы исследовали бактериальные сообщества желчных путей, двенадцатиперстной кишки, желудка и полости рта от шести пациентов с желчнокаменной болезнью, используя секвенирование ампликона 16S рРНК. Мы обнаружили, что все наблюдаемые желчные бактерии обнаруживаются в верхних отделах пищеварительного тракта. Желчная микробиота имела сравнительно большее сходство с микробиотой двенадцатиперстной кишки по сравнению с микробиотой других регионов, но с меньшим разнообразием.Хотя большинство идентифицированных бактерий было значительно уменьшено в образцах желчи, три рода Enterobacteriaceae ( Escherichia , Klebsiella и неклассифицированный род) и Pyramidobacter были в изобилии в желчи. Прогнозный функциональный анализ показал улучшенные возможности обработки информации об окружающей среде и подвижности клеток желчных бактерий. Наше исследование предоставляет доказательства потенциального источника желчных бактерий и иллюстрирует влияние желчевыводящей системы на сообщества желчных бактерий.
Образец цитирования: Ye F, Shen H, Li Z, Meng F, Li L, Yang J, et al. (2016) Влияние желчевыводящей системы на желчные бактерии, выявленное бактериальными сообществами желчных и верхних пищеварительных трактов человека. PLoS ONE 11 (3): e0150519. https://doi.org/10.1371/journal.pone.0150519
Редактор: Юэ Ван, Национальный институт по контролю и профилактике вирусных заболеваний, CDC, Китай, КИТАЙ
Поступила: 18 ноября 2015 г .; Одобрена: 15 февраля 2016 г .; Опубликован: 1 марта 2016 г.
Авторские права: © 2016 Ye et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все данные о последовательностях были депонированы в Национальном центре биотехнологической информации (NCBI) в рамках BioProject PRJNA2. Все образцы были зарегистрированы в NCBI под номерами BioSample SAMN03938337 – SAMN03938359.
Финансирование: Работа поддержана планом крупных исследований Национального фонда естественных наук Китая (грант №U1435222) и Программа международного научно-технического сотрудничества (№ 2014DFB30020). Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Желчная микробиота считается жизненно важным фактором в патогенезе желчных камней [1–5]. Многие бактерии, такие как Escherichia coli , Klebsiella pneumoniae и Enterococcus faecium , были идентифицированы путем культивирования [6–8] или полимеразной цепной реакции в образцах желчи или желчных камней [9, 10].Недавно применение секвенирования следующего поколения на образцах желчных путей дало более полное представление о сообществе билиарных бактерий и расширило микробиоту, обнаруженную в желчных путях человека [11]. В нашей предыдущей работе, используя как цельнометагеномное секвенирование с дробовиком (WMS), так и секвенирование бактериального ампликона 16S рРНК (называемое «секвенирование 16S») для изучения образцов желчи от пациентов с желчнокаменной болезнью, мы наблюдали большую гетерогенность бактериального сообщества среди пациентов и определили 13 новых видов желчных бактерий, таких как Prevotella pallens , Streptococcus infantis и Porphyromonas endodontalis [12].
Однако остается неясным еще один важный вопрос о происхождении желчных бактерий. Обычно ретроградная инфекция кишечными бактериями из двенадцатиперстной кишки считается вероятным первичным источником инфекции желчных путей [13, 14]. Кроме того, бактериальная инвазия через систему воротной вены также способствует развитию билиарной инфекции с относительно низкой заболеваемостью [15, 16]. Анатомически двенадцатиперстная кишка соединяется с желчевыводящими путями через сфинктер Одди, и сфинктер Одди, по-видимому, является единственным путем, который необходимо пройти для возможной восходящей инфекции кишечных бактерий.Однако, насколько нам известно, сравнительного исследования микробиоты желчных путей и двенадцатиперстной кишки еще не проводилось. Предыдущее исследование показало, что микробиота трех участков верхних отделов пищеварительного тракта (представленных в виде образцов слюны, биопсии желудка и биопсии двенадцатиперстной кишки) имеет общие выявленные бактериальные таксоны [17]. Было обнаружено, что образцы верхних отделов пищеварительного тракта человека, включая слюну, желудочный сок и слизь двенадцатиперстной кишки, сильно отличаются по бактериальному составу от образцов кала [18, 19].Таким образом, учитывая меньшее анатомическое расстояние до желчных путей, верхний пищеварительный тракт, а не дистальный отдел кишечника, более вероятно, будет основным источником желчных бактерий.
С защитой сфинктера Одди от кишечной бактериальной инвазии, антимикробной активностью солей желчных кислот и системой иммунологической защиты [8], билиарное микроокружение считается в целом враждебным по отношению к большинству бактерий. Таким образом, представляет большой интерес использование микробиоты пищеварительного тракта человека в качестве эталона для исследования вероятного воздействия желчной микросреды на желчные бактерии и степени изменения бактериального состава в желчных путях, негостеприимных для микробов.Более того, из-за большой микробной неоднородности среди людей такое сравнительное исследование следует проводить на одних и тех же людях. До сих пор таких расследований не проводилось.
В этом исследовании мы сравнили бактериальные сообщества желчных и верхних отделов пищеварительного тракта шести пациентов с желчнокаменной болезнью. Мы стремимся получить доказательства источника желчных бактерий и наблюдать, как на микробиоту желчных путей может влиять окружающая среда.
Материалы и методы
Сбор образцов
У всех пациентов был диагностирован холедохолитиаз (средний возраст: 69 лет.3 ± 14,6 года; 4 мужчины, 2 женщины) с помощью УЗИ в B-режиме и компьютерной томографии. У каждого человека были обнаружены желчные камни в общем желчном протоке. Камней желчного пузыря не было. Эти пациенты не получали антибиотики в течение как минимум трех месяцев до процедуры эндоскопической ретроградной холангиопанкреатографии (ЭРХПГ). При включении все пациенты дали письменное информированное согласие. Исследование соответствовало этическим принципам Хельсинкской декларации 1975 года и было одобрено институциональным наблюдательным советом Первой народной больницы Ханчжоу.Все образцы были собраны в Первой народной больнице Ханчжоу. Образцы слюны были собраны после того, как пациенты полоскали горло 20 мл стерильной физиологической воды. Пациенты сливали жидкость для полоскания рта в стерильные чашки для мокроты. Образцы желудочного сока, двенадцатиперстной кишки и желчи были собраны с использованием строго стерильных эндоскопов бокового обзора (TJF240 / JF-260V; Olympus Optical, Токио, Япония). Были приняты меры, чтобы избежать артефактов отбора проб или перекрестного загрязнения между образцами у одного и того же пациента. Во время продвижения эндоскопа изо рта в желудок и в двенадцатиперстную кишку рабочий канал эндоскопа оставался чистым и незагрязненным за счет исключения любого перекачивания.Образцы желудочного сока, двенадцатиперстной кишки и желчи (2–5 мл каждого типа образцов) аспирировали в стерильные чашки для мокроты через стерильные катетеры, которые проходили через рабочий канал. Каждый катетер использовался только один раз и был заменен новым катетером перед взятием следующего образца. Если желудочный сок был невидим в желудке, через катетер вводили стерильную физиологическую воду и собирали промывочную жидкость. Когда эндоскоп достиг двенадцатиперстной кишки, использовался новый стерильный катетер для введения стерильной физиологической воды и аспирации промывочной жидкости двенадцатиперстной кишки.Стерильные катетеры сфинктеротома (V-SYSTEM; KD-V411M-0725; Olympus Optical) использовались для отсасывания образцов желчи (2–5 мл) из общего желчного протока. Все образцы хранили при -80 ° C до дальнейшей обработки.
Извлечение ДНК
Тотальную ДНК экстрагировали из каждого нецентрифугированного образца с помощью мини-набора геномной ДНК Invitrogen Purelink (Life Technologies, Карлсбад, Калифорния, США) в соответствии с инструкциями производителя. Флуорометр Qubit 2.0 (Life Technologies) использовался для количественного определения всей ДНК, а система электрофореза E-Gel (Life Technologies) использовалась для проверки качества ДНК.
Секвенирование ампликона 16S рРНК
Область V3 – V4 бактериального гена 16S рРНК амплифицировали с использованием универсальных пар праймеров 356F (5’CCTACGGGNGGCWGCAG3 ’) и 803R (5’GACTACHVGGGTATCTAATCC3’). Подробные протоколы двухэтапной амплификации гена 16S рРНК и процедуры построения библиотеки описаны в других источниках [12, 20]. В первом раунде ПЦР для амплификации области V3-V4 16S рРНК использовали праймеры 16S и выступающие адаптеры, совместимые с набором Illumina Nextera XT (Illumina, Сан-Диего, Калифорния, США).Во втором раунде ПЦР адаптеры Illumina и штрих-коды образцов были добавлены к очищенным продуктам ПЦР с первого этапа. Три пробирки со стерильной водой использовали в качестве отрицательного контроля в течение всего процесса амплификации и подготовки библиотеки. Образцы отрицательного контроля не содержали детектируемых продуктов ДНК при оценке с помощью системы электрофореза в E-геле (Life Technologies). Библиотеки ДНК секвенировали на платформе Illumina MiSeq для создания считываний парных концов размером 2 × 250 пар оснований.
Таксономические профили и профили путей данных секвенирования 16S
FLASH v1.2.11 [21] слитные считывания на конце пары в последовательности длиной ~ 460 п.н. QIIME v1.8.0 [22] использовался для анализа объединенных операций чтения. Контроль качества производился с помощью скрипта «split_libraries_fastq.py» в QIIME со следующими параметрами «-n 0 -p 0,75 -q 19 -r 3». Химеры были удалены путем сопоставления считываний с последовательностями в базе данных Greengenes (версия от августа 2013 г.) с USEARCH v6.1 [23]. Оставшиеся чтения были сгруппированы в операционные таксономические единицы (OTU) на уровне сходства 97% с помощью UCLUST v1.2.22 [23].Каждой репрезентативной OTU был присвоен таксономический ранг с помощью классификатора Ribosomal Database Project v2.2 [24] с уровнем достоверности 0,85. Филогенетическое исследование сообществ путем реконструкции ненаблюдаемых состояний (PICRUSt) [25] был проведен анализ для создания профилей путей Киотской энциклопедии генов и геномов (KEGG), как описано ранее [26]. Вкратце, OTU, используемые для анализа PICRUSt, были выбраны с помощью сценария QIIME «pick_closed_reference_otus.py» на уровне сходства 97%.Принимая сгенерированную таблицу OTU в качестве входных данных, PICRUSt выводит аннотированную таблицу прогнозируемых метаболических функций на уровне пути KEGG, используя сценарии «normalize_by_copy_number.py» и «pred_metagenomes.py». Профили путей использовали для дальнейшего сравнения.
Статистический анализ
Чтобы избежать систематической ошибки, вносимой разной глубиной секвенирования этих выборок, индексы разнообразия (наблюдаемое несходство OTU и Брея-Крутиса) были рассчитаны путем случайной повторной выборки считываний каждой выборки до единообразного числа 1000 раз.Для последующего анализа использовались средние индексы разнообразия. Анализ сходства (ANOSIM) с использованием несходства Брея-Крутиса выполняли с использованием программного обеспечения Past (http://folk.uio.no/ohammer/past/). Коэффициенты корреляции Пирсона между микробиотой желчных путей и микробиотой каждого участка верхнего пищеварительного тракта были рассчитаны с использованием R (v3.1.2). Чтобы обнаружить дифференциально многочисленные роды и пути KEGG в желчных путях по сравнению с другими участками выборки, тест суммы рангов Вилкоксона (проект R, v3.1.2) использовался для сравнения образцов желчи и образцов верхних отделов пищеварительного тракта. Статистически значимыми считались различия с P <0,05.
Размещение данных последовательности
Все данные о последовательностях были депонированы в Национальном центре биотехнологической информации (NCBI) в рамках BioProject PRJNA2. Все образцы были зарегистрированы в NCBI под номерами BioSample SAMN03938337 – SAMN03938359.
Результаты
Все желчные бактерии обнаружены в верхних отделах пищеварительного тракта
Используя 16S-секвенирование, мы получили в среднем 12 299 считываний высокого качества на образец (диапазон: 3088–83 985, образец желудочного сока из P6 был исключен для дальнейшего анализа из-за его сверхнизкой глубины секвенирования) и выявили всего из 1398 операционных таксономических единиц (OTU) (таблица S1).Среди образцов желчи Proteobacteria , Firmicutes , Bacteroidetes , Actinobacteria , Fusobacteria , Synergistetes и TM7 были идентифицированы на уровне филума, первые пять из которых являются обычными обитателями человеческого организма. пищеварительный тракт [17, 27]. Шесть из этих семи бактериальных типов были обнаружены в образцах желчных протоков в предыдущих исследованиях, за исключением Synergistetes [7, 11, 28–31].
Мы обнаружили, что все желчные бактерии обнаруживаются в верхних отделах пищеварительного тракта.Все эти семь вышеупомянутых билиарных типов были идентифицированы в одном или нескольких участках пищеварительного тракта у одних и тех же пациентов (таблица S2). На уровне родов 53 рода бактерий были обнаружены в образцах желчи с численностью ≥0,1%, все из которых были включены в 102 рода (численность ≥0,1%), идентифицированных по крайней мере в одном участке верхних отделов пищеварительного тракта (таблица S3). Среди них наиболее распространенными у этих пациентов были Streptococcus , Veillonella , Prevotella и Rothia со средней относительной численностью ≥2% на каждом участке тела (рис. 1, таблица S3).
Рис. 1. Распределение родов, которые были широко распространены по четырем участкам тела.
Представлены только роды с численностью ≥0.01% как минимум в 12 образцах. OTU, которые не могли быть отнесены на уровне родов, были помечены как «неклассифицированные» (неклассифицированные). Роды, которые были плохо определены в базе данных Greengenes, были помечены как «прочие». [Prevotella] и [Mogibacteriaceae] — это предварительные таксономические присвоения операционных таксономических единиц Greengenes.Стрелки вверх и вниз указывают роды, численность которых в образцах желчи увеличивалась и уменьшалась по сравнению с другими регионами, соответственно.
https://doi.org/10.1371/journal.pone.0150519.g001
Затем мы исследовали корреляцию между микробиотой каждого участка верхнего пищеварительного тракта и желчной микробиотой. Как правило, желчная микробиота была больше похожа на микробиоту двенадцатиперстной кишки, чем на образцы желудочной жидкости или слюны (рис. 2А).У пяти пациентов (P1 – P4 и P6) бактериальный состав образцов желчи все более хорошо коррелировал с бактериальным составом слюны, желудочного сока и двенадцатиперстной кишки того же пациента. У одного исключительного пациента, P5, все участки верхних отделов пищеварительного тракта имели высокое сходство бактериального состава с образцом желчи (коэффициент корреляции Пирсона> 0,73, P <2,6 × 10 −7 ). Доминантные роды желчных путей в P5 (например, Prevotella , Rothia и Haemophilus ) отличались от таковых у других пациентов и относительно больше соответствовали микробиоте слюны пациента (таблица S3).Наблюдение в P5 выявило вариабельность бактериального состава у этих пациентов.
Рис. 2. Коэффициенты корреляции между микробиотой каждого участка верхнего пищеварительного тракта и желчной микробиотой.
Для каждого пациента коэффициенты корреляции между микробиотой желчных путей и других участков отбора проб были рассчитаны, когда в образцы желчи были включены Pyramidobacter и три Enterobacteriaceae родов ( Escherichia , Klebsiella и неклассифицированный род). (а) и исключен (б).Слюна, желудочный сок, двенадцатиперстная кишка и желчь обозначены как «S», «G», «D» и «B» соответственно на оси абсцисс. Статистически значимые корреляции обозначены красными кружками.
https://doi.org/10.1371/journal.pone.0150519.g002
Pyramidobacter и три рода Enterobacteriaceae ( Escherichia , Klebsiella и неклассифицированный род) были широко распространены в большинстве желчных образцы.Для дальнейшего отслеживания потенциального источника редких желчных микробов мы пересчитали коэффициенты корреляции между желчью и другими участками после исключения этих четырех родов (рис. 2B). Интересно, что напоминая наши наблюдения с P5, желчь P1 также имела бактериальное распределение, которое было очень похоже на то, которое наблюдалось в его слюне, желудочном соке и двенадцатиперстной жидкости (коэффициенты корреляции Пирсона> 0,72, P <3,4 × 10 −6 ). Этот результат предполагает, что микробиота слюны также может вносить вклад в микробиоту желчных путей, хотя в большинстве случаев это совпадение может быть затенено относительным преобладанием родов двенадцатиперстной кишки.После вышеупомянутого исключения значимая корреляция между двенадцатиперстной и желчной микробиотой сохранялась в P6, но не в P2 или P4.
Различные изменения микробиоты желчных путей по сравнению с микробиотой верхних отделов пищеварительного тракта
Наблюдались различия в разнообразии желчной микробиоты по сравнению с микробиотой верхних отделов пищеварительного тракта. Индексы альфа-разнообразия показали, что образцы желчи имели меньшее бактериальное разнообразие, чем образцы верхних отделов пищеварительного тракта.Чтобы избежать потенциальной погрешности при различной глубине секвенирования, мы произвольно повторно взяли прочтения этих образцов до однородного числа 3088, которое было наименьшим числом считываний среди этих образцов, и рассчитали индексы микробного разнообразия. Альфа-разнообразие образцов желчи, измеренное с помощью наблюдаемых OTU, было значительно меньше в образцах желчи, чем в образцах из трех других участков верхнего пищеварительного тракта (критерий суммы рангов Вилкоксона, желчь против . слюна, P = 0,015; желчь и .желудочный сок, P = 0,03; желчь против . двенадцатиперстная жидкость, P = 0,041). Анализ сходства (ANOSIM) с использованием несходства Брея-Крутиса продемонстрировал значительные различия между образцами желчи и слюны ( P = 0,003), но не между образцами желчи и желудочной или двенадцатиперстной жидкости (желчь против . желудочная жидкость, P = 0,125; желчь против . двенадцатиперстная жидкость, P ( = 0,3772).
Хотя роды, встречающиеся в желчи, также были обнаружены в верхних отделах пищеварительного тракта, относительная численность и распространенность этих бактерий сильно различались.Из 36 преобладающих родов, идентифицированных как минимум в 12/23 образцах, 30 (83,3%) имели более низкое среднее содержание в желчи, чем в одном или нескольких других участках, а 6 (16,7%) имели более высокое среднее содержание в желчи (рис. ). Что касается бактериальной распространенности среди этих пациентов, то 17 родов желчных протоков присутствовали только в образцах желчи 1-2 пациентов, хотя те же самые 17 родов наблюдались в двенадцатиперстной жидкости у 3-5 пациентов (таблица S3).
Более того, примечательно, что относительное количество некоторых таксонов демонстрирует тенденцию к увеличению или уменьшению от слюны через желудочный сок и двенадцатиперстной кишки к желчи.Роды бактерий, относительные количества которых значительно различались между желчью и одним или несколькими участками верхних отделов пищеварительного тракта, показаны на рис. 3A и 3B. Для Veillonella и Prevotella мы наблюдали постепенно снижающуюся тенденцию от слюны к желчи (рис. 3A). Prevotella не обнаруживалась в желчи у большинства пациентов. Между тем, общая численность Porphyromonas , Rothia и неклассифицированного рода Carnobacteriaceae поддерживалась на несколько сравнимых уровнях в верхних отделах пищеварительного тракта с внезапным и резким уменьшением желчи.Эти пять родов, количество которых в желчи снижено, часто обнаруживаются в ротовой полости, желудке и двенадцатиперстной кишке человека [17, 27], подразумевая, что желчная среда может оказывать большее влияние на выживаемость и селективное давление на эти бактерии.
Рис. 3. Распределение дифференциально численных родов по всем участкам отбора проб.
Роды были отфильтрованы по критериям: с численностью ≥10% по крайней мере в одном участке отбора проб и с обилием ≥0,01% по крайней мере в 12 пробах.Затем были проиллюстрированы отфильтрованные роды, относительное содержание которых было уменьшено (а) и увеличено (б) в образцах желчи по сравнению, по крайней мере, с одним из других участков тела. Ось Y представляет относительную численность. Участки тела, показавшие статистически значимые различия по сравнению с образцами желчи, помечены знаком «*». Прямоугольники представляют 25-75-перцентильный межквартильный диапазон. Красные линии внутри прямоугольников обозначают медианные значения, а усы — самые крайние значения в пределах 1.В 5 раз больше межквартильного размаха. Красные линии для рода Pyramidobacter были особенно утолщены для лучшей визуализации, так как средние значения были близки к нулю. Значения выбросов представлены в виде кружков. ** P <0,01, * P <0,05.
https://doi.org/10.1371/journal.pone.0150519.g003
У четырех родов значительно увеличилось содержание желчи (рис. 3B). Среди них три рода, а именно Escherichia , Klebsiella и неклассифицированный род, принадлежат к семейству Enterobacteriaceae и ранее были выделены из желчных культур [6–8, 11].Их повышенное содержание в желчи может быть связано с устойчивостью к желчи [3]. Четвертый род, Pyramidobacter , который принадлежит к типу Synergistetes , был высокообогащен P2 и P4. Pyramidobacter был выделен в основном из ротовой полости человека [32, 33], а также, хотя и реже, из тонкой кишки человека [34]. Он также был идентифицирован в образцах желчи человека в нашем предыдущем исследовании [12]. Архетип этого рода — P . piscolens , кодирует белок-переносчик множества лекарственных средств AcrB, связанный с устойчивостью бактерий к желчи [3]; если этот ген является общим с другими видами Pyramidobacter , это может объяснить, по крайней мере частично, обогащение желчи Pyramidobacter .
У билиарных бактерий предполагалось множество путей обмена веществ
Мы построили прогностические функциональные профили бактериальных сообществ в четырех местах отбора проб с помощью филогенетического исследования сообществ путем реконструкции ненаблюдаемых состояний (PICRUSt) [25] и определили, что желчные бактерии имеют дифференциальное изобилие, согласно Киотской энциклопедии генов и геномов (KEGG). ) по сравнению с микробиотой верхних отделов пищеварительного тракта (рис. 4A и 4B).Мы идентифицировали 24 значительно обогащенных пути и 41 истощенный путь (все P <0,05) в образцах желчи (таблица S4).
Рис. 4. Бактериальные метаболические пути в образцах слюны, желудочного сока, двенадцатиперстной кишки и желчи.
Были проиллюстрированы пути KEGG с более высоким (a) и более низким (b) содержанием в образцах желчи по сравнению с другими участками. Участки тела со значительными различиями относительно образцов желчи помечены знаком «*» ( P <0,05) или «#» ( P <0.01) над решетками.
https://doi.org/10.1371/journal.pone.0150519.g004
Обогащенные пути в образцах желчи были связаны с обработкой информации об окружающей среде, подвижностью клеток, метаболизмом углеводов, метаболизмом липидов и метаболизмом аминокислот (рис. 4A). В этих образцах преобладали пути обработки экологической информации, такие как переносчики ABC, двухкомпонентная система и система секреции. Мы наблюдали тенденцию к увеличению их относительного содержания от слюны к желчи.Учитывая высокий уровень антимикробных солей желчных кислот и иммуноглобулинов в желчных путях, этот результат предполагает, что бактерии, которые могут выжить в желчи, могут иметь большую способность реагировать на информацию окружающей среды, чем бактерии в других местах отбора проб. Бактериальный хемотаксис и пути сборки жгутиков также были обогащены. Эти функции, связанные с подвижностью клеток, позволяют бактериям двигаться к благоприятным условиям жизни [35] и, таким образом, могут играть важную роль в их выживании и колонизации в желчных путях.Что касается источника энергии и использования питательных веществ, метаболических путей углеводов (например, метаболизма бутаноата, пропаноата, глиоксилата и дикарбоксилата), метаболических путей липидов (например, метаболизма жирных кислот и биосинтеза ненасыщенных жирных кислот) и метаболических путей аминокислот (например, метаболизма триптофана). и деградация валина, лейцина, изолейцина и лизина) также были хорошо представлены в желчных бактериях.
Пути с относительно низкой представленностью в желчной микробиоте были вовлечены в обработку генетической информации, метаболизм нуклеотидов, метаболизм аминокислот и метаболизм кофакторов и витаминов (рис. 4B).Пути обработки генетической информации включали репликацию ДНК, механизм транскрипции, репарацию несовпадений, деградацию РНК, РНК-полимеразу, гомологичную рекомбинацию и экспорт белка. Метаболизм пуринов и метаболизм пиримидина были связаны с метаболизмом нуклеотидов. Метаболизм кофакторов и витаминов включает биосинтез фолиевой кислоты, биосинтез пантотената / КоА и метаболизм тиамина. Связанные с метаболизмом аминокислот пути метаболизма цистеина / метионина и биосинтеза лизина снизились в образцах желчи.Более того, желчная микробиота характеризовалась относительно большим количеством процессов деградации (например, деградация лизина) в сочетании с относительно низкой представленностью процессов биосинтеза (например, биосинтеза лизина). Взятые вместе, различия между путями, участвующими в метаболизме углеводов, липидов, аминокислот, нуклеотидов и кофакторов / витаминов, предполагают, что желчные бактерии могут иметь разные источники энергии и питательных веществ из микробиоты верхних отделов пищеварительного тракта.
Обсуждение
Наши результаты подтверждают гипотезу о том, что билиарные бактерии происходят от ретроградной инфекции кишечных бактерий.Все наблюдаемые желчные бактерии могут быть идентифицированы в верхних отделах пищеварительного тракта с помощью секвенирования 16S, при этом желчная микробиота относительно более похожа на микробиоту двенадцатиперстной кишки. Кроме того, мы наблюдали влияние желчной среды на бактериальный состав желчных путей, о чем свидетельствуют различные изменения желчной микробиоты по сравнению с микробиотой верхних отделов пищеварительного тракта. Изменения могут быть связаны с анатомической структурой и особенностями жидкости желчного дерева. Сфинктер Одди, через который желчь из желчных путей однонаправленно поступает в двенадцатиперстную кишку, действует как анатомический барьер и защищает желчную систему от кишечной бактериальной инвазии [8].Более того, антимикробная активность солей желчных кислот и иммуноглобулинов в желчных путях также оказывает избирательное давление на желчные бактерии [16].
Разница в относительном количестве бактерий в образцах желчи может означать различие в их способности сопротивляться желчи. Escherichia и Klebsiella имели повышенное содержание в пробах желчи по сравнению с другими участками отбора проб. Виды обоих родов были выращены из образцов желчи человека, например E . coli , К . пневмония и К . oxytoca [6–8, 11]. Другие бактериальные таксоны, такие как Veillonella и Prevotella , имели меньшую численность в желчных путях по сравнению с верхними отделами пищеварительного тракта, и их реже культивировали из образцов желчных путей. Было обнаружено, что несколько генов потенциально связаны с устойчивостью к желчи, включая bsh , acrA , acrB , emrA , emrB и tolC .Путем поиска в базе данных KEGG GENOME мы обнаружили, что геномы видов, принадлежащих к вышеупомянутым многочисленным родам Escherichia и Klebsiella , содержат больше устойчивых к желчи генов, чем геномы Veillonella , Prevotella , Rothia и . Порфиромонас . Один представляющий интерес род бактерий — это Pyramidobacter , который принадлежит к типу Synergistetes . Его было очень много в некоторых образцах желчи по сравнению с соответствующими образцами из верхних отделов пищеварительного тракта.Виды из Pyramidobacter были выделены из ротовой полости человека [32, 33] и тонкой кишки [34], и мы впервые обнаружили эти роды в образцах желчи человека в нашем предыдущем исследовании [12]. AcrB, белок эффлюксной помпы с множеством лекарственных препаратов, связанный с устойчивостью к желчи, кодируется архетипом этого рода, P . piscolens , что может до некоторой степени объяснить высокую численность Pyramidobacter в желчном дереве. Усовершенствование методов, основанных на культивировании, поможет идентифицировать Pyramidobacter в образцах желчных протоков, и механизм устойчивости к желчи, используемый этим новым, но плохо определенным родом бактерий, также требует дальнейшего изучения.
Прогнозные функциональные профили всех участков отбора проб, оцененные PICRUSt, определили, что желчные бактерии могут иметь повышенные способности к обработке информации об окружающей среде и подвижности клеток, которые являются ключевыми функциями для жизни бактерий. Дифференциальное представление путей, связанных с источниками энергии и питательных веществ, также предполагает, что может быть влияние желчевыводящей системы на функцию резидентных бактерий. Метаболизм пропаноата и переносчики ABC также были обогащены в образцах желчи при использовании цельного метагеномного секвенирования в нашем предыдущем исследовании [12].Следует отметить, что большинство различных путей было обнаружено между образцами слюны и желчи (рис. 4A и 4B), что согласуется со сравнениями, основанными на микробном распределении (рис. 2 и 3). Сообщества бактериальных микробов, которые имеют похожие микробные структуры, как правило, имеют сходные функции (включая пути). Поскольку желчная микробиота по порядку все больше походила на микробиоту слюны, желудочного сока и образцов двенадцатиперстной кишки, образцы желчи могут иметь меньше статистически дифференциальных путей по сравнению с образцами двенадцатиперстной жидкости и желудочного сока, чем образцы слюны.В дополнение к секвенированию 16S, более продвинутые технологии, такие как полное метагеномное секвенирование, метатранскриптомные, метаметаболомные и метапротеомные технологии, будут способствовать более полной картине билиарной бактериальной функции и взаимодействия микроба-хозяина.
В совокупности наши результаты свидетельствуют о том, что двенадцатиперстная кишка человека является основным источником желчных бактерий, и характеризует влияние желчевыводящей системы на желчную микробиоту. Целью нашего исследования является изучение того, как изменяется бактериальная микробиота желчевыводящих путей и верхних отделов пищеварительного тракта человека.С 23 образцами от 6 пациентов мы провели сравнение микробных сообществ из каждого участка отбора проб и наблюдали очевидные тенденции изменения сходства между желчной микробиотой и микробиотой других верхних отделов пищеварительного тракта. Однако вполне вероятно, что существуют другие паттерны микробной изменчивости, которые мы не обнаружили из-за ограниченного размера выборки. Что касается микробного сообщества, желчные пути представляют собой малоизученную микросреду по сравнению с другими участками человеческого тела.Для понимания микробной экологии желчных путей в будущем необходимы дополнительные исследования, особенно те, которые посвящены роли микробов в патогенезе желчных камней.
Благодарности
Мы благодарим Лу Се за помощь в сборе образцов и помощь Пейсун Сю и Инцзе Сюй в проведении экспериментов.
Вклад авторов
Задумал и спроектировал эксперименты: MN XZ XB. Проведены эксперименты: ZL LL FM. Проанализированы данные: MN.Предоставленные реагенты / материалы / инструменты анализа: HS JY YC. Написал статью: FY MN HS.
Список литературы
- 1. Свидсински А, Ли СП. Роль бактерий в патогенезе желчных камней. Front Biosci. 2001. 6 (1): 93–103.
- 2. Стюарт Л., Грифисс Дж. М., Джарвис Г. А., Уэй Л. В.. Бактериальные факторы желчных путей определяют путь образования камней в желчном пузыре. Американский журнал хирургии. 2006. 192 (5): 598–603. pmid: 17071191
- 3. Бегли М., Гаан CGM, Хилл С.Взаимодействие бактерий и желчи. Fems Microbiol Rev.2005; 29 (4): 625–51. pmid: ISI: 000231625700001.
- 4. Маки Т. Патогенез желчного камня билирубината кальция: роль E. coli, бета-глюкуронидазы и коагуляции неорганическими ионами, полиэлектролитами и возбуждением. Летопись хирургии. 1966. 164 (1): 90–100. pmid: 5329901
- 5. Стюарт Л., Эстерле А. Л., Эрдан И., Гриффисс Дж. М., Уэй Л. В.. Патогенез пигментных желчных камней в западных обществах: центральная роль бактерий.Журнал желудочно-кишечной хирургии. 2002; 6 (6): 891–904. pmid: 12504229
- 6. Герцог Т., Беляев О., Аккузу Р., Хёллинг Дж., Уль В., Хромик А.М. Влияние культур желчных протоков на инфекции области хирургического вмешательства в хирургии поджелудочной железы. Хирургические инфекции. 2015; 16 (4): 443–449. pmid: 26110464
- 7. Guaglianone E, Cardines R, Vuotto C, Di Rosa R, Babini V, Mastrantonio P и др. Микробные биопленки, связанные с закупоркой билиарного стента. FEMS Иммунология и медицинская микробиология.2010. 59 (3): 410–20.
- 8. Schneider J, De Waha P, Hapfelmeier A, Feihl S, Römmler F, Schlag C и др. Факторы риска повышенной устойчивости к противомикробным препаратам: ретроспективный анализ 309 эпизодов острого холангита. Журнал антимикробной химиотерапии. 2014; 69 (2): 519–25. pmid: 24084640
- 9. Пратт Л.А., Колтер Р. Генетический анализ образования биопленок Escherichia coli: роль жгутиков, подвижность, хемотаксис и пили типа I. Mol Microbiol. 1998. 30 (2): 285–93.Epub 1998/10/29. pmid: 97.
- 10. Свидсински А., Хилкин М., Палиг Х., Свидсински С., Прием Ф. Изменения в зависимости от времени концентрации и типа бактериальных последовательностей, обнаруженных в холестериновых желчных камнях. Гепатология. 1998. 27 (3): 662–5. pmid: 9500691
- 11. Ву Т, Чжан З., Лю Б., Хоу Д., Лян И, Чжан Дж. И др. Дисбактериоз кишечной микробиоты и сборка бактериального сообщества, связанная с холестериновыми камнями в желчном пузыре, в крупномасштабном исследовании. BMC Genomics. 2013; 14 (1): 669.
- 12. Шен Х, Е Ф, Се Л., Ян Дж, Ли З, Сюй П и др. Метагеномное секвенирование желчи пациентов с камнями в желчном пузыре для выявления различных паттернов микробного сообщества и новых желчных бактерий. Научный доклад 2015; 5: 17450. pmid: 26625708
- 13. душ Сантуш Дж. С., Джуниор В. С., Модена Дж., Брунальди Дж. Э., Сеневива Р. Влияние предоперационной эндоскопической декомпрессии на злокачественную обструкцию желчных путей и послеоперационную инфекцию. Гепатогастроэнтерология. 2005. 52 (61): 45–7. pmid: 15782991
- 14.Ипек С., Альпер Э., Чекич С., Черрах С., Арабул М., Аслан Ф. и др. Оценка эффективности эндоскопической ретроградной холангиопанкреатографии у пациентов с перихилярной холангиокарциномой и ее влияние на развитие холангита. Гастроэнтерологические исследования и практика. 2014; 2014: 508286. pmid: 24982670
- 15. Сунг Дж.Й., Шаффер Э.А., Олсон М.Э., Люн Дж. В., Лам К., Костертон Дж. В.. Бактериальная инвазия желчевыводящей системы через портально-венозную систему. Гепатология.1991. 14 (2): 313–7. pmid: 1860688
- 16. Сунг Дж., Костертон Дж., Шаффер Э. Система защиты желчных путей от бактериальной инфекции. Заболевания органов пищеварения и науки. 1992. 37 (5): 689–96. pmid: 1563308
- 17. Stearns JC, Lynch MD, Senadheera DB, Tenenbaum HC, Goldberg MB, Cvitkovitch DG, et al. Бактериальная биогеография пищеварительного тракта человека. Научные отчеты. 2011; 1: 170. pmid: 22355685
- 18. Ли Г, Ян М., Чжоу К., Чжан Л., Тиан Л., Львов С. и др.Разнообразие микробиоты двенадцатиперстной и прямой кишки в биопсийных тканях и содержимом просвета у здоровых добровольцев. Журнал микробиологии и биотехнологии. 2015; 25 (7): 1136–45. pmid: 25737115
- 19. Цуда А., Суда В., Морита Н., Таканаши К., Такаги А., Кога Ю. и др. Влияние ингибиторов протонной помпы на микробиоту просвета желудочно-кишечного тракта. Клиническая и трансляционная гастроэнтерология. 2015; 6 (6): e89.
- 20. Оттесен А.Р., Горхэм С., Петтенгилл Дж. Б., Райдаут С., Эванс П., Браун Э.Влияние системных и медных пестицидов на филлосферную микрофлору томатов. Журнал продовольственной науки и сельского хозяйства. 2014; 95 (5): 1116–25. pmid: 25410588
- 21. Магоч Т, Зальцберг С.Л. FLASH: быстрая корректировка длины коротких чтений для улучшения сборки генома. Биоинформатика. 2011. 27 (21): 2957–63. pmid: 219
- 22. Caporaso JG, Kuczynski J, Stombaugh J, Bittinger K, Bushman FD, Costello EK, et al. QIIME позволяет анализировать данные секвенирования сообщества с высокой пропускной способностью.Природные методы. 2010. 7 (5): 335–6. pmid: 20383131
- 23. Эдгар RC. Поиск и кластеризация на порядки быстрее, чем BLAST. Биоинформатика. 2010. 26 (19): 2460–1. pmid: 20709691
- 24. Коул Дж. Р., Ван К., Карденас Э., Фиш Дж., Чай Б., Фаррис Р. Дж. И др. Проект базы данных рибосом: улучшенное выравнивание и новые инструменты для анализа рРНК. Nucleic Acids Res. 2009; 37 (приложение 1): D141 – D5.
- 25. Лангиль М.Г., Заневельд Дж., Капорасо Дж. Дж., Макдональд Д., Найтс Д., Рейес Дж. А. и др.Прогнозирующее функциональное профилирование микробных сообществ с использованием последовательностей маркерного гена 16S рРНК. Биотехнология природы. 2013. 31 (9): 814–21. pmid: 23975157
- 26. Морган XC, Tickle TL, Sokol H, Gevers D, Devaney KL, Ward DV и др. Дисфункция кишечного микробиома при воспалительном заболевании кишечника и лечении. Genome Biol. 2012; 13 (9): R79. pmid: 23013615
- 27. Сегата Н., Хааке С.К., Маннон П., Лимон К.П., Уолдрон Л., Геверс Д. и др. Состав бактериального микробиома пищеварительного тракта взрослого человека на основе семи образцов поверхности рта, миндалин, горла и стула.Genome Biol. 2012; 13 (6): R42. pmid: 22698087
- 28. Брук И. Аэробная и анаэробная микробиология заболеваний желчевыводящих путей. J Clin Microbiol. 1989. 27 (10): 2373–5. Epub 1989/10/01. pmid: 2584384; PubMed Central PMCID: PMC267027.
- 29. Леунг Дж.В., Лю И-л, Лау Г.К., Чан Р.С., Лай А.С., Линг Т.К. и др. Бактериологический анализ желчных и коричневых пигментных камней у больных острым холангитом. Эндоскопия желудочно-кишечного тракта. 2001. 54 (3): 340–5. pmid: 11522975
- 30.Sakaguchi Y, Murata K, Kimura M. Clostridium perfringens и другие анаэробы, выделенные из желчи. J Clin Pathol. 1983; 36 (3): 345–349. pmid: 6298284
- 31. Лу И, Сян Т., Ши Дж.С, Чжан Би. Обнаружение желчных анаэробных бактерий и чувствительность к антибиотикам у пациентов с желчнокаменной болезнью. Гепатобилиарный панкреат Dis Int. 2003. 2 (3): 431–4. pmid: 14599954
- 32. Доунс Дж., Вартукиан С.Р., Дьюхёрст Ф.Э., Изард Дж., Чен Т., Ю В-Х и др. Pyramidobacter piscolens gen.nov., sp. nov., член филума Synergistetes, выделенный из ротовой полости человека. Международный журнал систематической и эволюционной микробиологии. 2009. 59 (5): 972–80.
- 33. Rôças IN, Siqueira JF. Идентификация бактерий, переносящих процедуры эндодонтического лечения, с помощью комбинированного подхода обратной транскриптазы – полимеразной цепной реакции и обратного захвата шахматной доски. Журнал эндодонтии. 2010. 36 (1): 45–52. pmid: 20003934
- 34. Marchandin H, Damay A, Roudière L, Teyssier C, Zorgniotti I, Dechaud H и др.Филогения, разнообразие и специализация хозяев в типе Synergistetes с упором на штаммы и клоны человеческого происхождения. Исследования в области микробиологии. 2010. 161 (2): 91–100. pmid: 20079831
- 35. Люкс Р., Ши В. Движения бактерий, управляемые хемотаксисом. Критические обзоры в оральной биологии и медицине. 2004. 15 (4): 207–20.
пищеварительная система человека | Описание, части и функции
Пищеварительный тракт начинается у губ и заканчивается у заднего прохода.Он состоит из рта или ротовой полости с зубами для измельчения пищи и языка, который служит для замешивания пищи и смешивания ее со слюной; горло или глотка; пищевод; желудок; тонкий кишечник, состоящий из двенадцатиперстной кишки, тощей кишки и подвздошной кишки; и толстая кишка, состоящая из слепой кишки, мешочка с закрытым концом, соединяющегося с подвздошной кишкой, восходящей ободочной кишкой, поперечной ободочной кишкой, нисходящей ободочной кишкой и сигмовидной кишкой, которая заканчивается прямой кишкой. Железы, обеспечивающие пищеварительный сок, включают слюнные железы, желудочные железы в слизистой оболочке желудка, поджелудочную железу, печень и ее вспомогательные вещества — желчный пузырь и желчные протоки.Все эти органы и железы способствуют физическому и химическому расщеплению съеденной пищи и, в конечном итоге, устранению неперевариваемых отходов. Их структура и функции описаны в этом разделе шаг за шагом.
Рот и полости рта
На самом деле во рту происходит небольшое переваривание пищи. Однако в процессе пережевывания или жевания пища готовится во рту для транспортировки через верхний пищеварительный тракт в желудок и тонкий кишечник, где происходят основные пищеварительные процессы.Жевание — это первый механический процесс, которому подвергается пища. Движения нижней челюсти при жевании вызываются жевательными мышцами (жевательными, височными, медиальным и латеральным крыловидными мышцами, а также букцинатором). Чувствительность периодонтальной мембраны, которая окружает и поддерживает зубы, а не сила жевательных мышц, определяет силу укуса.
человеческий ротРотовая полость, вид спереди.
Британская энциклопедия, Inc.Пережевывание не является необходимым для полноценного пищеварения. Однако жевание действительно способствует пищеварению за счет измельчения пищи до мелких частиц и смешивания ее со слюной, выделяемой слюнными железами. Слюна смазывает и увлажняет сухой корм, при жевании слюна распределяется по всей пищевой массе. Движение языка к твердому нёбу и щекам помогает сформировать округлую массу или комок пищи.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.Подпишитесь сейчасГубы и щеки
Губы, две мясистые складки, окружающие рот, снаружи состоят из кожи, а изнутри — из слизистой оболочки или слизистой оболочки. Слизистая оболочка богата слизистыми железами, которые вместе со слюной обеспечивают достаточную смазку для речи и жевания.
Щеки, стороны рта, переходят в губы и имеют аналогичное строение. Отчетливая жировая прослойка находится в подкожной клетчатке (ткани под кожей) щеки; эта подушечка особенно велика у младенцев и известна как присоска.На внутренней поверхности каждой щеки, напротив второго верхнего коренного зуба, есть небольшое возвышение, которое отмечает отверстие околоушного протока, ведущего от околоушной слюнной железы, расположенной перед ухом. Сразу за этой железой находятся четыре-пять слизистых желез, протоки которых открываются напротив последнего коренного зуба.
Нёбо
Нёбо вогнутое и образовано твердым и мягким небом. Твердое небо образовано горизонтальными частями двух небных костей и небными частями верхних челюстей или верхней челюсти.Твердое небо покрыто толстой, несколько бледной слизистой оболочкой, которая является продолжением десен и связана с верхней челюстью и костями неба твердой фиброзной тканью. Мягкое нёбо переходит в переднее твердое. Сзади он непрерывен слизистой оболочкой, покрывающей дно носовой полости. Мягкое небо состоит из прочного тонкого фиброзного листа, небного апоневроза, а также глоссопалатиновых и фарингопалатиновых мышц.


 Удаляется весь желчный пузырь, часть граничащей с ним печени и связанные с желчным пузырем лимфатические узлы:
Удаляется весь желчный пузырь, часть граничащей с ним печени и связанные с желчным пузырем лимфатические узлы: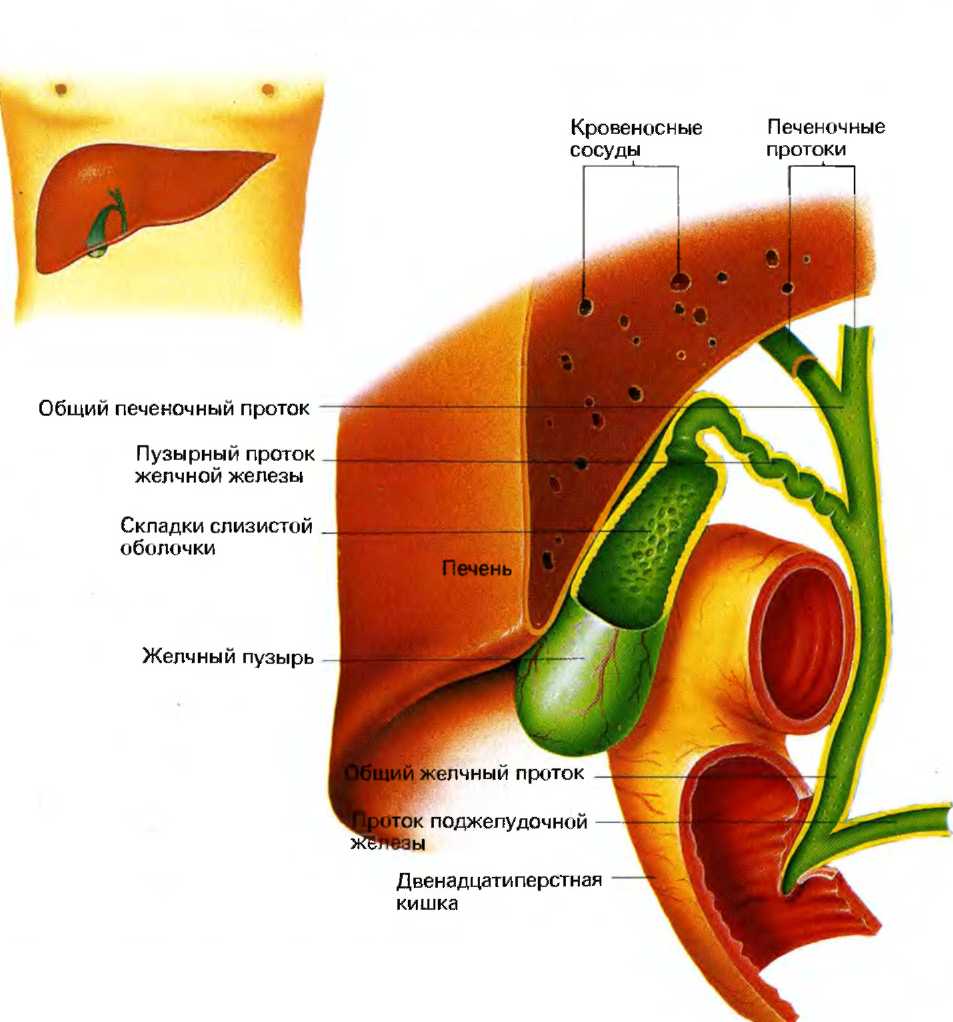

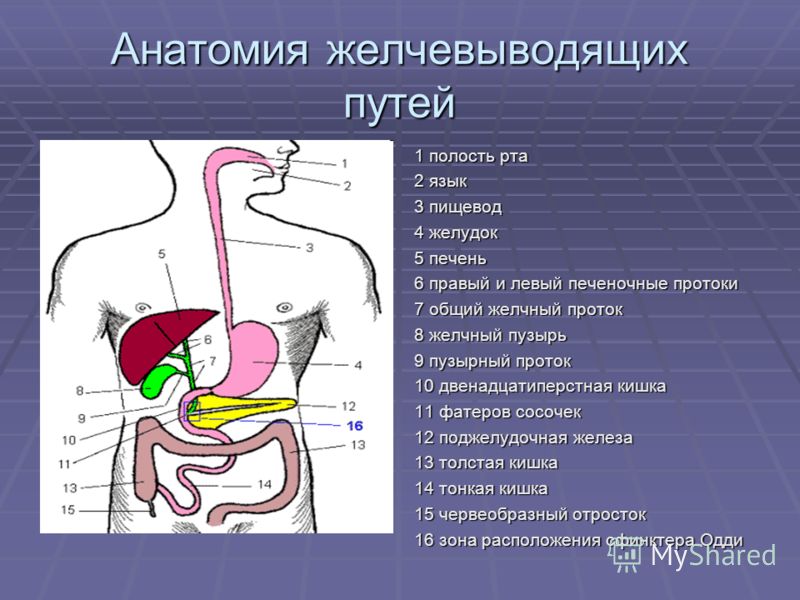 Так определяется химический состав желчи, воспалительные элементы (появляются лейкоциты и слизь), атипические клетки при опухолевых процессах. Также проводится бактериальный посев желчи на питательные среды с целью выявления возбудителя инфекции
Так определяется химический состав желчи, воспалительные элементы (появляются лейкоциты и слизь), атипические клетки при опухолевых процессах. Также проводится бактериальный посев желчи на питательные среды с целью выявления возбудителя инфекции