Биосинтез холестерина — Википедия
Материал из Википедии — свободной энциклопедии
Биосинтез холестерина — образование в живом организме органического спирта холестерина стероидной природы. Синтез холестерина происходит в клетках печени (50 %), кишечнике и коже. В клетке он идёт в гладком эндоплазматическом ретикулуме и цитозоле. Биосинтез холестерина служит основой синтеза других стероидных соединений. Начальные этапы синтеза являются общими с этапами синтеза других изопреноидов.
 Нумерация атомов в молекуле холестерина
Нумерация атомов в молекуле холестеринаВ 1940-е годы Блох с сотр. установил, что все атомы углерода холестерина происходят из ацетата, причём оба атома включаются в одинаковых количествах. В настоящее время установлена следующая цепь биосинтеза холестерина, включающая в себя несколько ступеней. (Образование промежуточных соединений этого пути может происходить и другими способами).
- Превращение трёх молекул активного ацетата в пятиуглеродный мевалонат.
- Превращение мевалоната в активный изопреноид — изопентенилпирофосфат.
- Образование тридцатиуглеродного изопреноида сквалена из шести молекул изопентенилдифосфата.
- Циклизация сквалена в ланостерин.
- Последующее превращение ланостерина в холестерин.
Синтез мевалоната протекает в три этапа.
- Образование ацетоацетил-КоА из двух молекул ацетил-КоА с помощью тиолазного фермента ацетоацетилтрансферазы. Реакция обратима. Происходит в цитозоле.
- Образование β-гидрокси-β-метилглутарил-КоА из ацетоацетил-коА с третьей молекулой ацетил-КоА с помощью гидроксиметилглутарил-КоА-синтазы (ГМГ-КоА-синтазы). Реакция также обратима. Происходит в цитозоле.
- Образование мевалоната восстановлением ГМГ и отщеплением HS-KoA с помощью НАДФ-зависимой гидроксиметилглутарил-КоА-редуктазы (ГМГ-КоА-редуктаза). Происходит в гЭПР. Это первая практически необратимая реакция в цепи биосинтеза холестерина, а также она лимитирует скорость биосинтеза холестерина. Отмечены суточные колебания синтеза этого фермента. Активность его увеличивается при введении инсулина и тиреоидных гормонов, снижается при голодании, введении глюкагона, глюкокортикоидов.
Схема этапа: 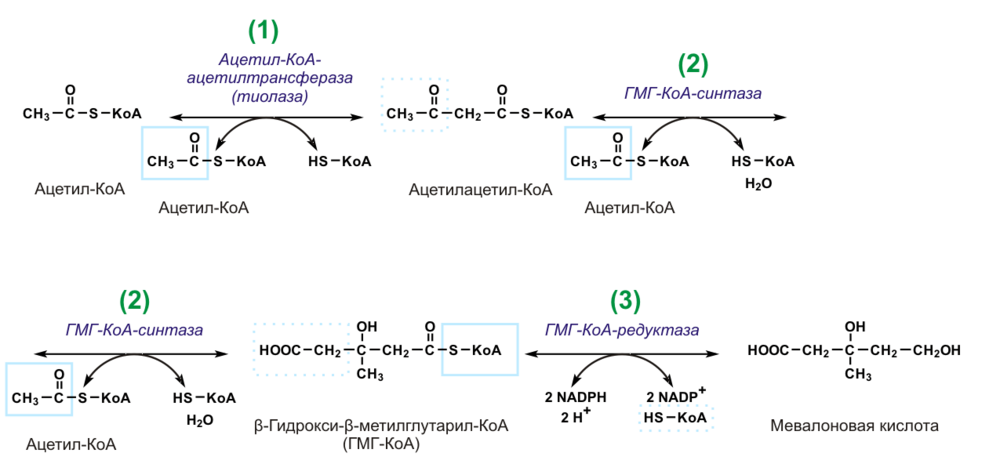
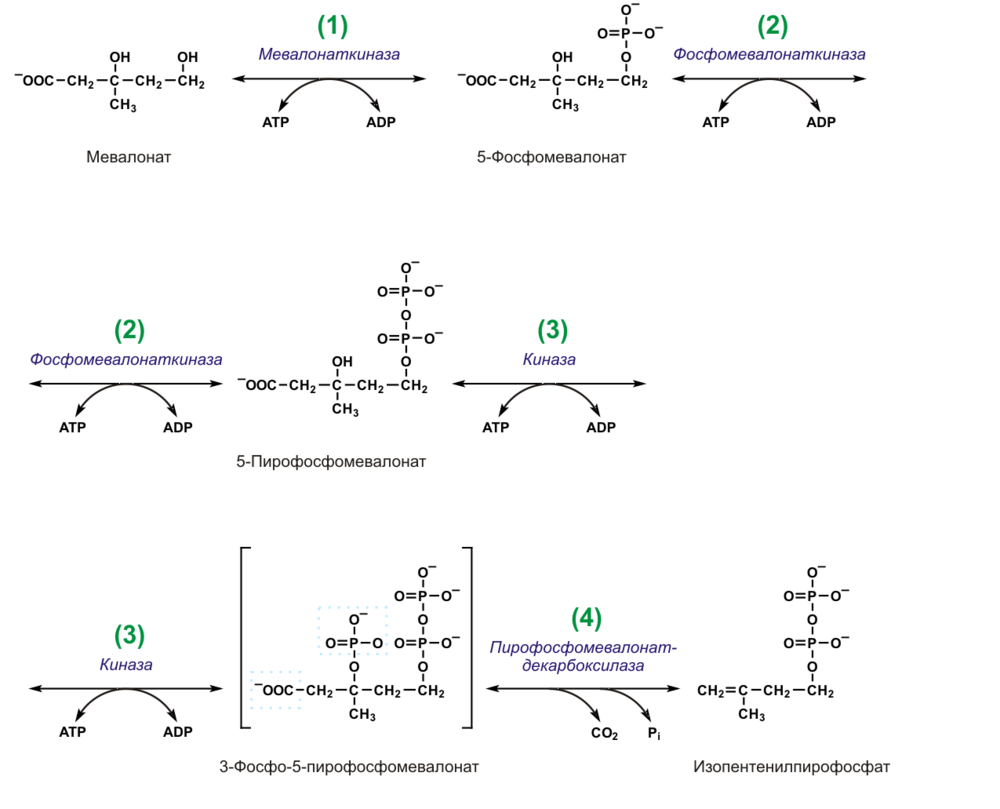
Существуют и другие пути синтеза мевалоната.
- 1, 2. Вначале мевалоновая кислота дважды фосфорилируется с помощью АТФ: до 5-фосфомевалоната, а затем до 5-пирофосфомевалоната.
- 3. 5-пирофосфомевалонат фосфорилируется по 3 атому углерода, образуя нестабильный промежуточный продукт — 3-фосфо-5-пирофосфомевалонат.
- 4. Последний декарбоксилируется и дефосфорилируется, образуется изопентенилпирофосфат.
- Изопентенилпирофосфат изомеризуется в диметилаллилпирофосфат.
- Конденсация изопентенилпирофосфата (С5) с диметилаллилпирофосфатом (С5) и образование геранилпирофосфата (С10). При этом высвобождается молекула пирофосфата.
- Конденсация изопентенилпирофосфата (С5) с геранилпирофосфатом (С10). Образуется фарнезилпирофосфат (С15) и высвобождается ещё одна молекула пирофосфата.
- Конденсация двух молекул фарнезилпирофосфата (С15) «голова-к-голове» и образование сквалена (С30). Реакция проходит с затратой НАДФН, и высвобождаются две молекулы пирофосфата. Молекулы фарнезилпирофосфата конденсируются концами, несущими пирофосфатные группы. Сначала отщепляется одна пирофосфатная группа и образуется промежуточный прескваленпирофосфат. Он, в свою очередь, восстанавливается с помощью НАДФН. Второй пирофосфат уходит. Образуется сквален.
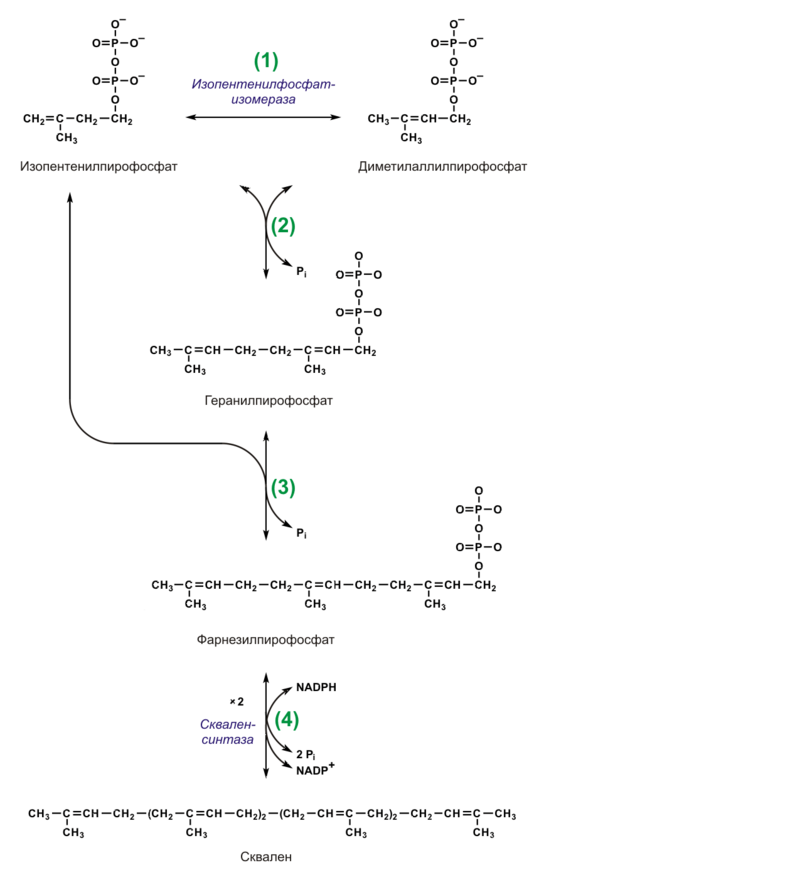
Начиная со сквалена, продукты пути биосинтеза холестерина нерастворимы в водной среде и участвуют в дальнейших реакциях, будучи связанными со стеринпереносящими белками (СПБ).
- 1. Под действием скваленэпоксидазы образуется эпоксид сквалена.
- 2. Затем эпоксид сквалена циклизуется в ланостерин. При этом метильная группа у С14 переносится на С13, а метильная группа у С8 — на С14.
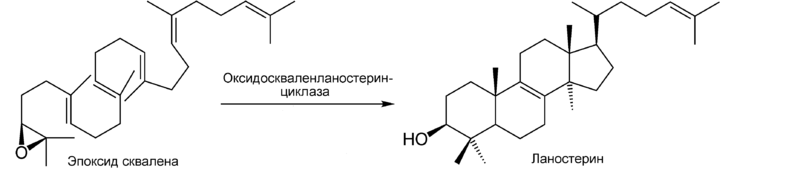
Ланостерин превращается в мембранах гладкого эндоплазматического ретикулума в холестерин.
- Метильная группа при С14 окисляется, и образуется 14-десметилланостерин.
- 2. Затем удаляются ещё два метила при С4, и образуется зимостерол.
- 3. Далее двойная связь C8=С9 перемещается в положение С8=С7 и образуется Δ7,24-холестадиенол.
- 4. Двойная связь далее перемещается в положение С5=С6,образуется десмостерол.
- 5. После чего в боковой цепи восстанавливается двойная связь, и образуется холестерин.
(Восстановление двойной связи в боковой цепи может, однако, происходить и на предшествующих стадиях биосинтеза холестерола.) 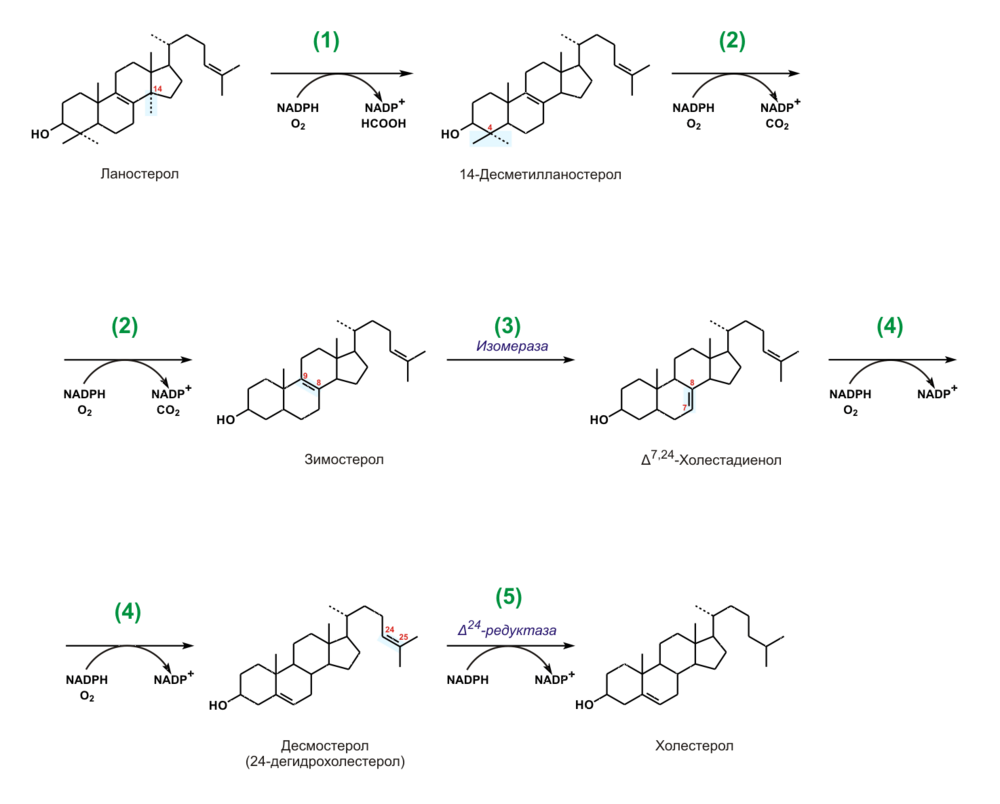
У некоторых организмов при синтезе стероидов могут встречаться другие варианты реакций (например, немевалонатный путь образования пятиуглеродных молекул).
- Химическая энциклопедия сайта www.humuk.ru. Скан учебника «Биологическая химия», Берёзов Т. Т., Коровкин Б. Ф.
- Кольман Я., Рём К.-Г., «Наглядная биохимия», пер. с нем., М., «Мир», 2009.
- Марри Р., Греннер Д., Мейес П., Родуэлл В., «Биохимия человека». М., «Мир», 1993.
— холестерол — Биохимия
Холестерол относится к группе соединений, имеющих в своей основе циклопентан-пергидрофенантреновое кольцо, и является ненасыщенным спиртом.
Примерно 1/4 часть всего холестерола в организме этерифицирована олеиновой кислотой и полиненасыщенными жирными кислотами. В плазме крови соотношение эфиров холестерола к свободному холестеролу составляет 2:1.
Источники
Синтез холестерола в организме составляет примерно 0,5-0,8 г/сут, при этом половина образуется в печени, около 15% в кишечнике, оставшаяся часть в любых клетках, не утративших ядро. Таким образом, все клетки организма способны синтезировать холестерол.
Из пищевых продуктов наиболее богаты холестеролом (в пересчете на 100 г продукта) сметана (0,002 г), сливочное масло (0,03 г), яйца (0,18 г), говяжья печень (0,44 г). В целом за сутки с обычным рационом поступает около 0,4 г.
Выведение из организма
Выведение холестерола из организма происходит в основном через кишечник:
- с фекалиями в виде холестерола, поступающего с желчью, и образованных микрофлорой нейтральных стеролов (до 0,5 г/сут),
- в виде желчных кислот (до 0,5 г/сут),
- около 0,1 г удаляется в составе слущивающегося эпителия кожи и кожного сала,
- примерно 0,1 г превращается в стероидные гормоны (женские и мужские половые гормоны, глюкокортикоиды, минералокортикоиды) и после их деградации выводится с мочой.
Уплотняющая роль холестерина в клеточных мембранах |
Функции холестерола
1. Структурная – входит в состав мембран, повышая их вязкость и жесткость.
2. Связывание полиненасыщенных жирных кислот и их транспорт между органами и тканями в составе липопротеинов низкой и высокой плотности.
3. Является предшественником желчных кислот, стероидных гормонов (кортизола, альдостерона, половых гормонов) и витамина D.
Разработка расширений JoomlaСТЕРОИДЫ. «БИОЛОГИЧЕСКАЯ ХИМИЯ», Березов Т.Т., Коровкин Б.Ф.
Все рассмотренные липиды принято называть омыляемыми, поскольку при их щелочном гидролизе образуются мыла. Однако имеются липиды, которые не гидролизуются с освобождением жирных кислот. К таким липидам относятся стероиды. Стероиды – широко распространенные в природе соединения. Они часто обнаруживаются в ассоциации с жирами. Их можно отделить от жира путем омыления (они попадают в неомыляемую фракцию). Все стероиды в своей структуре имеют ядро, образованное гидрированным фенантреном (кольца А, В и С) и циклопентаном (кольцо D):
Рис. 6.2. Обобщенное стероидное ядро.
К стероидам относятся, например, гормоны коркового вещества надпочечников, желчные кислоты, витамины группы D, сердечные гликозиды и другие соединения. В организме человека важное место среди стероидов занимают стерины (стеролы), т.е. стероидные спирты. Главным представителем стеринов является холестерин (холестерол).
Ввиду сложного строения и асимметрии молекулы стероиды имеют много потенциальных стереоизомеров. Каждое из шестиуглеродных колец (кольца А, В и С) стероидного ядра может принимать две различные пространственные конформации – конформацию «кресла» либо «лодки».
В природных стероидах, в том числе и в холестерине, все кольца в форме «кресла» (рис. 6.2), что является более устойчивой конформацией. В свою очередь по отношению друг к другу кольца могут находиться в цис- или транс-положениях.
Холестерин. Как отмечалось, среди стероидов выделяется группа соединений, получивших название стеринов (стеролов). Для стеринов характерно наличие гидроксильной группы в положении 3, а также боковой цепи в положении 17. У важнейшего представителя стеринов – холестерина – все кольца находятся в транс-положении; кроме того, он имеет двойную связь между 5-м и 6-м углеродными атомами. Следовательно, холестерин является ненасыщенным спиртом:
Кольцевая структура холестерина отличается значительной жесткостью, тогда как боковая цепь – относительной подвижностью. Итак, холестерин содержит спиртовую гидроксильную группу при С-3 и разветвленную алифатическую цепь из 8 атомов углерода при С-17. Химическое название холестерина 3-гидрокси-5,6-холестен. Гидроксильная группа при С-3 может быть этерифицирована высшей жирной кислотой, при этом образуются эфиры холестерина (холестериды).
Каждая клетка в организме млекопитающих содержит холестерин. Находясь в составе мембран клеток, неэтерифицированный холестерин вместе с фосфолипидами и белками обеспечивает избирательную проницаемость клеточной мембраны и оказывает регулирующее влияние на состояние мембраны и на активность связанных с ней ферментов. В цитоплазме холестерин находится преимущественно в виде эфиров с жирными кислотами, образующих мелкие капли – так называемые вакуоли. В плазме крови как неэтерифицированный, так и этерифицированный холестерин транспортируется в составе липопротеинов.
Холестерин – источник образования в организме млекопитающих желчных кислот, а также стероидных гормонов (половых и кортикоидных). Холестерин, а точнее продукт его окисления – 7-дегидрохолестерин, под действием УФ-лучей в коже превращается в витамин D3. Таким образом, физиологическая функция холестерина многообразна.
Холестерин находится в животных, но не в растительных жирах. В растениях и дрожжах содержатся близкие по структуре к холестерину соединения, в том числе эргостерин.
Эргостерин – предшественник витамина D. После воздействия на эрго-стерин УФ-лучами он приобретает свойство оказывать противорахитное действие (при раскрытии кольца В).
Восстановление двойной связи в молекуле холестерина приводит к образованию копростерина (копростанола). Копростерин находится в составе фекалий и образуется в результате восстановления бактериями кишечной микрофлоры двойной связи в холестерине между атомами С5 и С6.
Указанные стерины в отличие от холестерина очень плохо всасываются в кишечнике и потому обнаруживаются в тканях человека в следовых количествах.
Предыдущая страница | Следующая страница
СОДЕРЖАНИЕ
Еще по теме:Холестерин, строение, биологическая роль, биосинтез и распад холестерина в организме человека
Холестерин является одноатомным циклическим спиртом, который в тканях легко образует ХОЛЕСТЕРИДЫ. В организм человека поступает в составе пищи и синтезируется г.о. в печени, тонком отделе кишечника и коже.
Биологическая роль холестерина:
1.Структурная. Свободный холестерин является, обязательным структурным компонентом мембран клеток.
2.Метаболическая. Холестерин является предшественником биологически активных веществ: витамина D3,СТЕРОИДНЫХ гормонов (АНДРОГЕНОВ, ЭСТРОГЕНОВ, КОРТИКОИДОВ) При окислении холестерина в печени при участии ЦИТОХРОМА Р-450 образуются желчные кислоты. В свободном виде холестерин транспортируется по организму с помощью транспортных ЛИПОПРОТЕИНОВ крови. Источники холестерина:
1. Пища. За сутки в организм взрослого человека поступает 0,3гр. холестерина.
2. У человека в среднем с массой 65-70кг за сутки синтезируется 3.5 -4,2гр. холестерина. Печень занимает главное место в синтезе холестерина (85%), холестерин синтезируется в кишечнике (10%) и коже (5%). Процесс биосинтеза многоступенчат:

Образовавшийся в результате распада мембранных ЛИПИДОВ, а также излишки холестерина с помощью ЛПВП доставляется для окисления в печень, и в составе желчных кислот удаляется из организма с каловыми массами. При поражении печени и кишечника нарушается образование и транспорт ЛП крови. При поражении печени и желчевыводяицих путей нарушается образование и экскреция желчных кислот, участвующих в переваривании жиров пищи. В случае нарушения оттока желчи происходит насыщение её холестерином, что ведёт в этих условиях к застою и образованию холестериновых камней. Развивается ЖЕЛЧЕКАМЕННАЯ БОЛЕЗНЬ. В крови отмечается ГИПЕРХОЛЕСТЕРИНЕМИЯ.
Витамины, их характеристика, отличительные признаки витаминов. Номенклатура и классификация витаминов. Роль витаминов в обмене веществ. Причины недостаточной обеспеченности организма витаминами. Понятие о гипо-, гипер- и авитаминозах. Причины гиповитаминозов.
Русский врач ЛУНИН в эксперименте на животных установил, что животные, которых кормили казеином, жирами, лактозой, водой и минеральными солями болели и погибали, в отличие от животных, получавших свежее молоко. В 1911г. учёный ФУНД выделил и кристаллизовал азотсодержащее вещество, которое вылечивало экспериментальную бери-бери. Это вещество он назвал ВИТАМИНОМ (амином жизни).
Витамины — это НМС различного строения, синтез которых в организме отсутствует или ограничен. Особенности витаминов:
-не синтезируются в организме или синтезируются в недостаточном количестве;
-не выполняют пластической функции, т.е. не являются структурным компонентом клеток;
-не выполняют энергетической функции;
-выполняют специфические функции, которые не могут быть восполнены другими соединениями;
-при дефиците витаминов в организме развивается патологическое состояние с характерными клиническими признаками;
-витамины — это метаболиты, суточная потребность в которых выражается в миллиграммах, микрограммах или ME.
КЛАССИФИКАЦИЯ ВИТАМИНОВ. жирорастворимые (A, D, E, К) и водорастворимые (РР, С, В1, В2, ВЗ, В6, В10, В12, Н).. НОМЕНКЛАТУРА: Каждый витамин имеет:
o буквенное название: аскорбиновая кислота — вит.С; ретинол — вит.А.
o химическое название: вит.В1 -тиамин.
· 3. Клиническое название, которое формируется из клинической картины патологического состояния, которое развивается при дефиците витамина в организме с приставкой «анти»: Вит.D — антирахитический; Вит.С — антискорбутный.
ФУНКЦИИ ВИТАМИНОВ В ОРГАНИЗМЕ.
o Выделяют группу энзимовитаминов — это предшественники коэнзимов или простетических групп ферментов:
· Функциональное производное вит. РР: НАД и НАДФ. Функциональное производное вит.В2: ФМН и ФАД.
o Гормоновитамины: последовательная активация вит.DЗ приводит к образованию кальцитриола.
o Редоксвитамины или витамины- антиоксиданты — это вещества, которые препятствуют развитию процессов свободно-радикального окисления. Это природные оксиданты: Е, С, А.
o Участвуют в синтезе медиаторов (вит.С — серотонин), стероидных гормонов.
Витаминные коферменты
Тиаминсодержащие (вит. B1) — тиаминмонофосфат (ТМФ), тиаминдифосфат (ТДФ) или тиаминпирофосфат (ТПФ)
Флавиновые (вит В2 — рибофлавин) — флавинмононуклетид (ФМН), флавинадениндинуклеотид (ФАД)
Никотинамидные (содержат вит. РР или Никотинамид) — никотинамидадениндинуклеотид (НАД),
никотинамидадениндинуклеотидфосфат (НАДФ)
 В результате многочисленных исследований витаминной обеспеченности было установлено, что глубокий дефицит витаминов наблюдается менее чем у 20% населения, а содержание витаминов ниже нормы наблюдается у 50 — 90% населения. Содержание витаминов определяется в крови. Недостаточная витаминная обеспеченность проявляется: (1) повышенная утомляемость; (2) повышенная сонливость; (3) повышенная восприимчивость к заболеваниям; (4) повышена частота сердечно-сосудистых заболеваний; (5) повышение тяжести переноса заболеваний. При этом отсутствует специфическая клиническая симптоматика, как при гиповитаминозах. Причины недостаточной витаминной обеспеченности:
В результате многочисленных исследований витаминной обеспеченности было установлено, что глубокий дефицит витаминов наблюдается менее чем у 20% населения, а содержание витаминов ниже нормы наблюдается у 50 — 90% населения. Содержание витаминов определяется в крови. Недостаточная витаминная обеспеченность проявляется: (1) повышенная утомляемость; (2) повышенная сонливость; (3) повышенная восприимчивость к заболеваниям; (4) повышена частота сердечно-сосудистых заболеваний; (5) повышение тяжести переноса заболеваний. При этом отсутствует специфическая клиническая симптоматика, как при гиповитаминозах. Причины недостаточной витаминной обеспеченности:
1. Снижение затрат энергии в современных условиях, следовательно, необходимость снижение
потребления пищи.
2. Повышение потребления рафинированных продуктов, калорийных, но бедных витаминами.
3. Использование консервированных продуктов длительного хранения. Выход:
1. Витаминизация пищи.
2. Поливитамины с не менее 8-9 компонентами.
Рацион современного человека, достаточный по калорийности, не может удовлетворить потребность организма в витаминах и микроэлементах.
АВИТАМИНОЗ — это патологическое состояние, которое развивается в результате отсутствия витаминов организме, характеризуется чёткой клинической симптоматикой.
ГИПЕРВИТАМИНОЗ — это состояние, связанное с избытком витамина в организме человека. Растворимые в воде витамины, не накапливаются в организме, их избыток выводится из организма с мочой. Жирорастворимые витамины депонируются
ГИПОВИТАМИНОЗ — патологическое состояние, связанное с недостатком витаминов в организме. В зависимости от причины гиповитаминоз может быть:
1. Первичный (ЭКЗОГЕННЫЙ), связанный с дефицитом витаминов в употребляемой пище.
2. Вторичный, связанный с причинами эндогенного характера:
-нарушение всасывания витаминов в ЖКТ;
-недостаточный синтез витаминов микрофлорой кишечника (вит.В и вит.К), например,
-при дисбактериозе;
-поступление в пищу пищевых или лекарственных антивитаминов, которые препятствуют активации и всасыванию витаминов;
— нарушение активации при усвоении витаминов в организме при патологии печени и почек;
-относительная недостаточность из-за, беременности, кормлении грудью, требующие повышенного количества витаминов.
Холестерин
Холестерин
Холестерин или холестерол – это стероид, характерный только для животных организмов. Относится к классу стеринов (стерилов). Для стеринов характерно наличие гидроксильной группы в положении 3, а также боковой цепи в положении 17. У холестерина – все кольца находятся в транс-положении; кроме того, он имеет двойную связь между 5-м и 6-м углеродными атомами. Следовательно, холестерин является ненасыщенным спиртом:
Ядро,
образованное гидрированным фенантреном
(кольца А, В и С) и циклопентаном (кольцо
D). Циклопентанпергидрофенантрен (общая
структурная основа стероидов)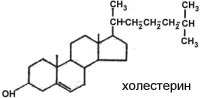
Кольцевая структура холестерина отличается значительной жесткостью, тогда как боковая цепь – относительной подвижностью. Итак, холестерин содержит спиртовую гидроксильную группу при С-3 и разветвленную алифатическую цепь из 8 атомов углерода при С-17. Химическое название холестерина 3-гидрокси-5,6-холестен. Гидроксильная группа при С-3 может быть этерифицирована высшей жирной кислотой, при этом образуются эфиры холестерина (холестериды)
В печени синтезируется более 50% холестерола, в тонком кишечнике — 15- 20%, остальной холестерол синтезируется в коже, коре надпочечников, половых железах. В цитоплазме холестерин находится преимущественно в виде эфиров с жирными кислотами, образующих вакуоли. В плазме крови как неэтерифицированный, так и этерифицированный холестерин транспортируется в составе липопротеинов. В сутки в организме синтезируется около 1 г холестерола; с пищей поступает 300-500 мг. Он является компонентом клеточных мембран, предшественником при синтезе желчных кислот, стероидных гормонов, витамина D.
История открытия. В 1769 году Пулетье де ла Саль получил из желчных камней плотное белое вещество («жировоск»), обладавшее свойствами жиров. В чистом виде холестерин был выделен химиком, членом национального Конвента и министром просвещения Антуаном Фуркруа в 1789 году. В 1815 годуМишель Шеврёль, тоже выделивший это соединение, назвал его холестерином («холе» — желчь, «стерин» — жирный). В 1859 году Марселен Бертло доказал, что холестерин принадлежит к классу спиртов, после чего французы переименовали холестерин в «холестерол». В ряде языков (русском, немецком, венгерском и др.) сохранилось старое название — холестерин.
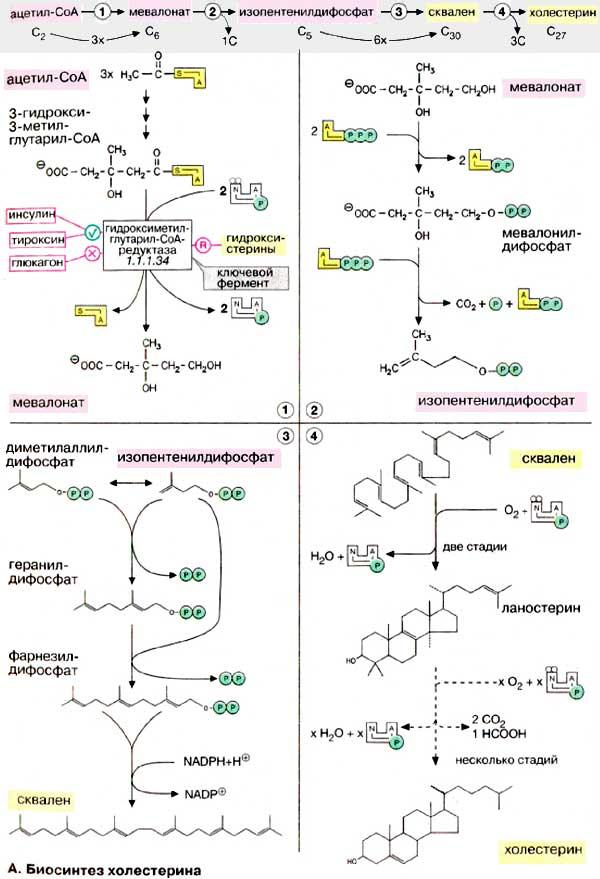
Синтез холестерина начинается с ацетил-КоА. Биосинтез холестерина можно разделить на четыре этапа. На первом этапе (1) из трех молекул ацетил-КоА образуется мевалонат (С6). На втором этапе (2) мевалонат превращается в «активный изопрен», изопентенилдифосфат. На третьем этапе (3) шесть молекул изопрена полимеризуются с образованием сквалена (С30). Наконец, сквален циклизуется с отщеплением трех атомов углерода и превращается в холестерин (4). На схеме представлены только наиболее важные промежуточные продукты биосинтеза.
1. Образование мевалоната. Превращение ацетил-КоА в ацетоацетил-КоА и затем в З-гидрокси-З-метилглутарил-КоА (3-ГМГ-КоА) соответствует пути биосинтеза кетоновых тел (подробно см. рис. 305), однако этот процесс происходит не в митохондриях, а в эндоплазматическом ретикулуме (ЭР). 3-ГМГ-КоА восстанавливается с отщеплением кофермента А с участием 3-ГМГ-КоА-редуктазы, ключевого фермента биосинтеза холестерину (см. ниже). На этом важном этапе путем репрессии биосинтеза фермента (эффекторы: гидроксистерины), а также за счет взаимопревращения молекулы фермента (эффекторы: гормоны) осуществляется регуляция биосинтеза холестерина. Например, фосфорилированная редуктаза представляет собой неактивную форму фермента; инсулин и тироксин стимулируют фермент, глюкагон тормозит; холестерин, поступающий с пищей, также подавляет 3-ГМГ-КоА-редуктазу.
2. Образование изопентенилдифосфата. Мевалонат за счет декарбоксилирования с потреблением АТФ превращается в изопентенилдифосфат, который и является тем структурным элементом, из которого строятся все изопреноиды.
3. Образование сквалена. Изопентенилдифосфат подвергается изомеризации с образованием диметилаллилдифосфата. Обе С5-молекулы конденсируются в геранилдифосфат и в результате присоединения следующей молекулы изопентенилдифосфата образуют фарнезилдифосфат. При димеризации последнего по типу «голова к голове» образуется сквален. Фарнезилдифосфат является также исходным соединением для синтеза других полиизопреноидов, таких, как долихол и убихинон.
4. Образование холестерина. Сквален,
линейный изопреноид, циклизуется с
потреблением кислорода в ланостерин,
С30-стерин, от которого на последующих
стадиях, катализируемых цитохромом
Р450, отщепляются три метильные группы,
вследствие чего образуется конечный
продукт — холестерин. Описанный путь
биосинтеза локализован в гладком ЭР.
Синтез идет за счет энергии, освобождающейся
при расщеплении производных кофермента
А и энергетически богатых фосфатов.
Восстановителем при образовании
мевалоната и сквалена, а также на
последних стадиях биосинтеза холестерина
является НАДФН + Η+. Для этого пути
характерно то, что промежуточные
метаболиты можно подразделить на три
группы: производные кофермента А,
дифосфаты и высоко липофильные соединения
(от сквалена до холестерина), связанные
с переносчиками стеринов. 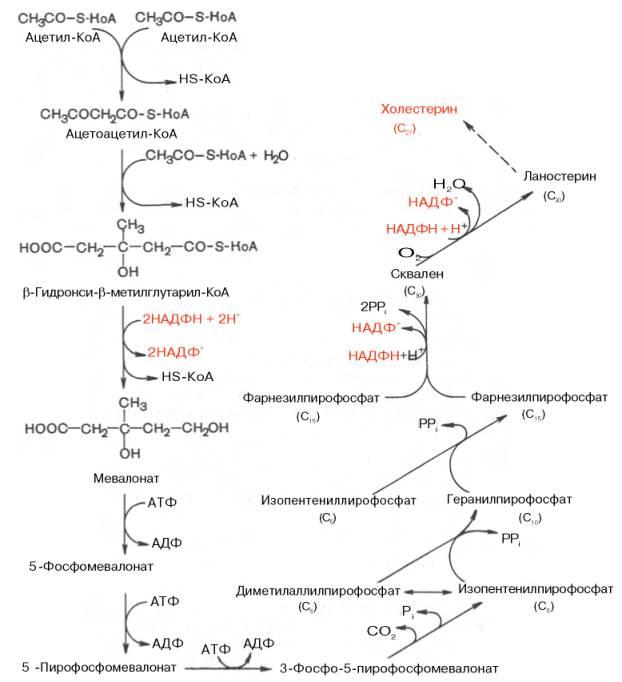
. 
Этерификация холестерола. В некоторых тканях гидроксильная группа холестерола этерифицируется с образованием более гидрофобных молекул — эфиров холестерола. Реакция катализируется внутриклеточным ферментом АХАТ (ацилКоА: холестеролаиилтрансферазой). Реакция этерификации происходит также в крови в ЛПВП, где находится фермент ЛХАТ (лецитин: холестеролацилтрансфераза). Эфиры холестерола — форма, в которой они депонируются в клетках или транспортируются кровью. В крови около 75% холестерола находится в виде эфиров.
Используемая литература
Березов. Коровкин.
Северин
http://www.xumuk.ru/biochem/174.html
http://biokhimija.ru/lipidny-obmen/cholesterin.html
http://ru.wikipedia.org/wiki/%D0%A5%D0%BE%D0%BB%D0%B5%D1%81%D1%82%D0%B5%D1%80%D0%B8%D0%BD
холестериды, всасывание холестерина
Переваривание холестеридов и всасывание холестерина. Понятие об экзогенном и эндогенном холестерине.
Холестерин в организме человека бывает 2 видов:
1) холестерин, поступающий с пищей через ЖКТ и называемый экзогенный
2) холестерин, синтезируемый из Ац – КоА — эндогенный.
С пищей ежедневно поступает ≈ 0,2 – 0,5 г, синтезируется ≈ 1 г (почти все клетки за исключением эритроцитов синтезируют холестерин, 80% холестерина синтезируется в печени.)
Взаимоотношения экзо и эндогенного холестерина в определенной степени конкурентные – холестерин пищи ингибирует его синтез в печени.
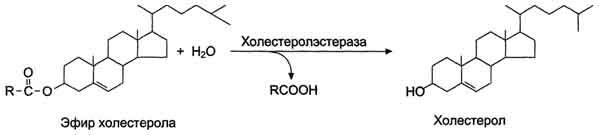
В составе пищи холестерин находится в основном в виде эфиров. Гидролиз эфиров холестерола происходит под действием холестеролэстеразы. Продукты гидролиза всасываются в составе смешанных мицелл.
Всасывание холестерина происходит в основном в тощей кишке (пищевой холестерин всасывается почти полностью – если в пище его не очень много)
Всасывание холестерина осуществляется только после эмульгирования эфиров холестерина. Эмульгаторами являются желчные кислоты, моно- и диглицериды и лизолецитины. Холестериды гидролизуются холестеринэстеразой поджелудочной железы.
Пищевой и эндогенный холестерин находится в просвете кишечника в неэстерифицированной форме в составе сложных мицелл (желчные, жирные кислоты, лизолецитин), причем поступают в состав слизистой кишечника не вся мицелла целиком, а ее отдельные фракции.
Поглощение холестерина из мицелл – пассивный процесс, идущий по градиенту концентрации. Поступивший в клетки слизистой холестерин этерифицируется холестеринэстеразой или АХАТ (у человека это в основном олеиновая кислота). Из клеток слизистой кишечника холестерин поступает в лимфу в составе ХМ, из них он переходит в ЛНП и ЛВП. В лимфе и крови 60-80% всего холестерина находится в этерифицированном виде.
Процесс всасывания холестерина из кишечника зависит от состава пищи: жиры и углеводы способствуют его всасыванию, растительные стероиды (структурные аналоги) блокируют этот процесс. Большое значение принадлежит желчным кислотам (все функции активируют – улучшают эмульгирование, всасывание). Отсюда значение лекарственных веществ, блокирующих всасывание желчных кислот.
Основные этапы синтеза холестерина. Химизм реакции образования мевалоновой кислоты. Ключевой фермент синтеза холестерина. Представьте схематически скваленовый путь синтеза холестерина
Ключевой фермент биосинтеза холестерина — ГМГ-редуктаза
Локализация:печень,кишечник,кожа
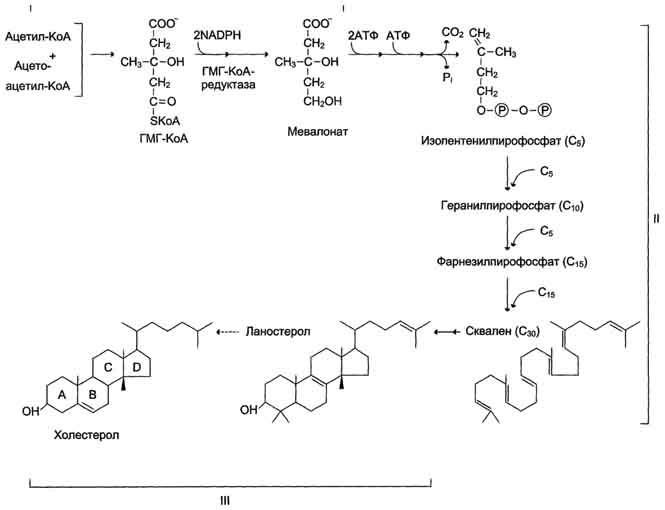
Реакции синтеза холестерола происходят в цитозоле клеток. Это один из самых длинных метаболических путей в организме человека.
Источник-ацетил-КоА
1 этап-Образование мевалоната
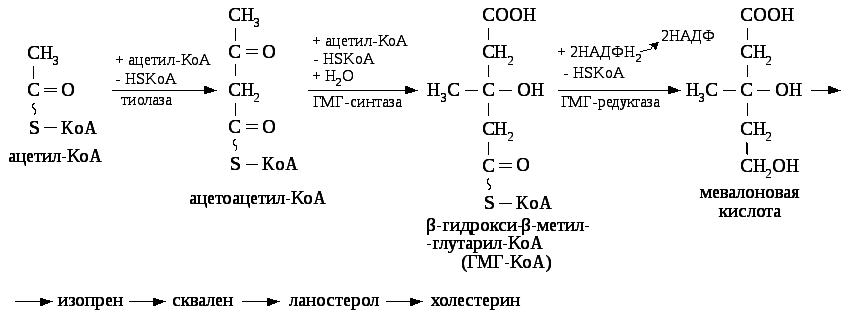
Две молекулы ацетил-КоА конденсируются ферментом тиолазой с образованием ацетоацетил-КоА.
Фермент гидроксиметилглутарил-КоА-синтаза присоединяет третий ацетильный остаток с образованием ГМГ-КоА (3-гидрокси-3-метилглутарил-КоА).
Следующая реакция, катализируемая ГМГ-КоА-редуктазой, является регуляторной в метаболическом пути синтеза холестерола. В этой реакции происходит восстановление ГМГ-КоА до мевалоната с использованием 2 молекул NADPH. Фермент ГМГ-КоА-редуктаза — гликопротеин, пронизывающий мембрану ЭР, активный центр которого выступает в цитозоль.
2 этап — Образование сквалена
На втором этапе синтеза мевалонат превращается в пятиуглеродную изопреноидную структуру, содержащую пирофосфат — изопентенилпирофосфат. Продукт конденсации 2 изопреновых единиц — геранилпирофосфат. Присоединение ещё 1 изопреновой единицы приводит к образованию фарнезилпирофосфата — соединения, состоящего из 15 углеродных атомов. Две молекулы фарнезилпирофосфата конденсируются с образованием сквалена — углеводорода линейной структуры, состоящего из 30 углеродных атомов.
3 этап — Образование холестерола
На третьем этапе синтеза холестерола сквален через стадию образования эпоксида ферментом циклазой превращается в молекулу ланостерола, содержащую 4 конденсированных цикла и 30 атомов углерода. Далее происходит 20 последовательных реакций, превращающих ланостерол в холестерол. На последних этапах синтеза от ланостерола отделяется 3 атома углерода, поэтому холестерол содержит 27 углеродных атомов.
Биологическая роль холестерина. Пути использования холестерина в различных тканях. Биосинтез желчных кислот.
Часть холестеринового фонда в организме постоянно окисляется, преобразуясь в различного рода стероидные соединения. Основной путь окисления холестерина — образование желчных кислот. На эти цели уходит от 60 до 80% ежедневно образующегося в организме холестерина. Второй путь — образование стероидных гормонов (половые гормоны, гормоны коры надпочечников и др.). На эти цели уходит всего 2-4% холестерина, образующегося в организме. Третий путь — образование в коже витамина ДЗ под действием ультрафиолетовых лучей.
Еще одним производным холестерина является холестанол. Его роль в организме пока еще не выяснена. Известно лишь, что он активно накапливается в надпочечниках и составляет 16% от всех находящихся там стероидов. С мочой у человека выделяется около 1 мг холестерина в сутки, а со слущивающимся эпителием кожи теряется до 100 мг/сут.
Желчные кислоты являются основным компонентом билиарной секреции, они образуются только в печени. Синтезируются в печени из холестерина.
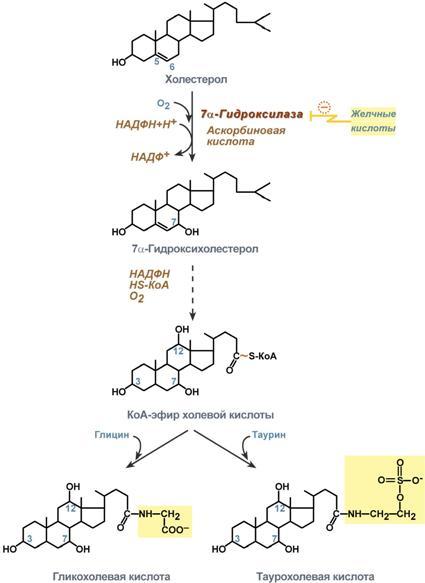
В организме синтезируется за сутки 200-600 мг желчных кислот. Первая реакция синтеза-образование 7-альфа-гидроксихолестерола-является регуляторной.Фермент-7-альфа-гидроксилаза,ингибируется конечным продуктом-желчными кислотами.7-альфа-гидроксилаза представляет собой одну из форм цитохрома п450 и использует атом кислорода как один из субстратов. Один атом кислорода из О2 включается в гидроксильную группу в 7 положении, а другой восстанавливается до воды. Последующие реакции синтеза приводят к формированию 2 видов желчных кислот:холевой и хондезоксихолевой(первичные желчные кислоты)
Особенности обмена холестерина в организме человека. Роль липопротеинлипазы, печеночной липазы, липопротеинов, ЛХАТ, апопротеинов в транспорте холестерина в крови: альфа- и бета-холестерин, коэффициент атерогенности, АХАТ, накопление холестерина в тканях. Пути распада и выведения холестерина
В организме человека содержится 140-190 г холестерина и около 2 г образуется ежедневно из жиров,углеводов, белков. Чрезмерное поступление холестерина с пищей приводит к отложению его в сосудах и может способствовать развитию атеросклероза, а также нарушению функции печени и развитию желчно-каменной болезни. Ненасыщенные жирные кислоты ( линолевая, линоленовая) затрудняют всасывание холестерина в кишечнике, тем самым способствуя уменьшению его содержания в организме. Насыщенные жирные кислоты (пальмитиновая, стеариновая) являются источником образования холестерина.
Липопротеинлипаза (ЛПЛ) — фермент, относящийся к классу липаз. ЛПЛ расщепляет триглицериды самых крупных по размеру и богатых липидами липопротеинов плазмы крови — хиломикронов и липопротеинов очень низкой плотности (ЛПОНП или ЛОНП)). ЛПЛ регулирует уровень липидов в крови, что определяет её важное значение в атеросклерозе.
Печёночная липаза — один из ферментов липидного метаболизма. Эта липаза по ферментативному действию похожа на панкреатическую липазу. Однако в отличие от панкреатической липазы ПЛ синтезируется в печени и секретируется в кровь. Печёночная липаза после секреции связывается со стенкой сосуда (почти исключительно в печени) и расщепляет липиды липопротеинов.
Печёночная липаза работает в кровотоке в тандеме с липопротеинлипазой. Липопротеинлипаза расщепляет липопротеины, богатые триглицеридами (липопротеины очень низкой плотности и хиломикроны), до их остатков. Остатки липопротеинов являются в свою очередь субстратом для печёночной липазы. Таким образом, в результате действия печёночной липазы образуются атерогенные липопротеины низкой плотности, которые поглощаются печенью.
(ЛВП) — Транспорт холестерина от периферийных тканей к печени
(ЛНП) — Транспорт холестерина, триацилглицеридов и фосфолипидов от печени к периферийным тканям
ЛПП (ЛСП) — Транспорт холестерина, триацилглицеридов и фосфолипидов от печени к периферийным тканям
(ЛОНП)-Транспорт холестерина, триацилглицеридов и фосфолипидов от печени к периферийным тканям
Хиломикроны -Транспорт холестерина и жирных кислот, поступающих с пищей, из кишечника в периферические ткани и печень
Лецитинхолестеринацилтрансфераза (ЛХАТ)- является ферментом метаболизма липопротеинов. ЛХАТ связан с поверхностью липопротеинов высокой плотности, которые содержат аполипопротеин A1 — активатор этого фермента. Холестерин, превращённый в эфиры холестерина, благодаря высокой гидрофобности перемещается с поверхности липопротеина в ядро, освобождая место на поверхности частицы для захвата нового свободного холестерина. Таким образом, эта реакция является исключительно важной для процесса очищения периферических тканей от холестерина (обратный транспорт холестерина). Частица ЛПВП в результате увеличивается в диаметре или в случае насцентных ЛПВП превращается из дисковидной в сферическую.
Апопротеины формируют структуру липоппротеинов,взаимодействуют с рецепторами на поверхности клеток и таким образом определяют какими тканями будет захватываться данный тип липопротеидов, служат ферментами или активаторами ферментов, действующих на липопротеины.
АХАТ катализирует эстерификацию холестерола . Свободный холестерол выходит в цитоплазму , где ингибирует ГМГ-CoA-редуктазу и de novo синтез холестерола и активирует АХАТ . У человека, однако, из-за низкой активности АХАТ в печени холестерол поступает в плазму в составе ЛПОНП преимущественно в свободном виде.
Нарушение обмена холестерола и холестеридов проявляется прежде всего накоплением их в тканях (кумулятивные холестерозы), особенно в стенке артерий и в коже. Основной причиной накопления холестерола в тканях является недостаточность механизма его обратного транспорта. Ключевым фактором системы обратного транспорта холестерола (с периферии в печень, откуда его излишки удаляются из организма с желчью) являются липопротеины высокой плотности, точнее входящий в их состав белок апопротеин А. Частицы липопротеинов высокой плотности собирают холестерол не только в интерстициальном секторе, но и внутри клеток. У человека (а также высших обезьян и свиней) существует видовая (характерная для всех представителей вида) недостаточность апопротеина А и, соответственно, липопротеинов высокой плотности. Животные с высоким содержанием этих липопротеинов не страдают холестериновым диатезом, даже при постоянном употреблении богатой холестеролом пищи. Некоторые люди также отличаются довольно высокой концентрацией апопротеина А («синдром долголетия»).
Из организма человека ежедневно выводится около 1 г холестерола. Приблизительно половина этого количества экскретируется с фекалиями после превращения в желчные кислоты . Оставшаяся часть выводится в виде нейтральных стероидов. Большая часть холестерола, поступившего в желчь, реабсорбируется; считается, что по крайней мере часть холестерола, являющегося предшественником фекальных стеролов , поступает из слизистой оболочки кишечника . Основным фекальным стеролом является копростанол , который образуется из холестерола в нижнем отделе кишечник а под действием присутствующей в нем микрофлоры . Значительная доля солей желчных кислот , поступающих с желчью, всасывается в кишечнике и через воротную вену возвращается в печень , где снова поступает в желчь. Этот путь транспорта солей желчных кислот получил название кишечно-печеночной циркуляции . Оставшаяся часть солей желчных кислот, а также их производные выводятся с фекалиями. Под действием кишечных бактерий первичные желчные кислоты превращаются во вторичные.
7.14. Обмен холестерина
Ежесуточно в организме взрослого человека обменивается до 1,5 г холестерина. Примерно половина этого количества синтезируется в организме (эндогенный холестерин), а половина поступает с пищей (экзогенный холестерин). Холестерин пищевых продуктов всасывается в тонком кишечнике при участии жёлчных кислот.
7.14.1. Биосинтез холестерина
Синтез холестерина происходит в печени из ацетил-КоА. Синтез холестерина представляет собой сложный многоэтапный процесс, протекающий в 20 стадий. Начальная стадия – образование мевалоновой кислоты является ключевой
ГМГ — редуктаза – ключевой фермент синтеза холестерина, она угнетается высокими концентрациями холестерина. Синтезированный в печени холестерин включается в состав липопротеидов ЛПОНП. Под действием липопротеидной липазы ЛПОНП переходят в ЛПНП, которые транспортируют холестерин от печени к органам и тканям. В тканях имеются рецепторы к липопротеидам, при участии которых происходит захват холестерина и проникновение его в клетки.
В клетках часть холестерина превращается в эфиры при участии фермента АХАТ (ацилхолестеролацилтрансфераза). Эфиры холестерина депонируются в тканях.
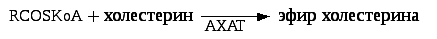
7.14.2. Использование холестерина в тканях
Холестерин необходим для всех клеток и тканей.
1. В печени примерно половина синтезирующегося холестерина превращается в жёлчные кислоты при участии ключевого фермента 7-α-гидроксилазы. Применение веществ, адсорбирующих жёлчные кислоты в кишечнике, повышает переход холестерина в жёлчные кислоты и снижает его уровень в крови.
2. Холестерин используется для построения клеточных мембран, где он составляет примерно треть всех липидов мембран и определяет физико-химические свойства липидной фазы мембран.
3. В надпочечниках, половых железах холестерин используется на синтез стероидных гормонов
4. В коже из производного холестерина происходит образование витамина Д3(холекальциферола).
7.14.3. Выведение холестерина из организма
Избыток холестерина удаляется из тканей при участии ЛПВП, которые адсорбируют холестерин из клеток и переносят его в печень. Основная часть холестерина выводится из организма через кишечник в виде жёлчных кислот, продуктов их обмена и образующихся из холестерина под действием микрофлоры холестанола и копростанола. Выведение холестерина из организма в небольших количествах происходит со слущивающимся эпителием, с мочой в виде соединений стероидных гормонов с глюкуроновой кислотой.
7.14.4. Нарушение обмена холестерина
В норме концентрация холестерина в крови взрослых людей составляет 3,5 – 5,2 ммоль/л. У детейконцентрация холестерина в крови ниже, чем у взрослых. У новорожденных уровень холестерина равен 2,67 ммоль/л, у детей в возрасте одного года — 4,03 ммоль/л.
Симптом повышения уровня холестерина в крови называется гиперхолестеринемией. Врождённые гиперхолестеринемии встречаются редко, чаще развиваются приобретённые (вторичные) гиперхолестеринемии. На фоне гиперхолестеринемии возможно развитие таких заболеваний как атеросклероз и жёлчекаменная болезнь.
При атеросклерозеизбыток холестерина откладывается в эндотелии сосудов, что ведёт к развитию асептического воспаления, отложению кальция, вследствие чего нарушается кровоснабжение тканей. Для диагностики атеросклероза рекомендуется определение коэффициента атерогенности, который показывают соотношение между ЛПНП и ЛПВП.
К атерогенности = (Хобщ. — ХЛПВП)/ХЛПВП≤ 3.
Для лечения атеросклероза применяют ингибиторы ГМГ-редуктазы, которые блокируют синтез холестерина.
Жёлчекаменная болезнь связана с нарушением соотношения между водонерастворимым холестерином и гидрофильными фосфолипидами и жёлчными кислотами в составе жёлчи. Холестерин является основой формирования камней в жёлчных путях.
При циррозах печени, гепатитах возможно развитие гипохолестеринемии.
