Амилаза — Википедия
Материал из Википедии — свободной энциклопедии
Структура амилазы слюнных желез. Катион кальция показан жёлтым цветом, анион хлора — зелёным.Амила́за (др.-греч. ἄμυλον — крахмал) — фермент, гликозил-гидролаза, расщепляющий крахмал до олигосахаридов, относится к ферментам пищеварения. В истории амилаза стала первым открытым ферментом, когда французский химик Ансельм Пайен описал в 1833 году диастазу[en]* — фермент (на самом деле, смесь ферментов), расщепляющий крахмал до мальтозы. Согласно другим данным, амилазу в 1814 году открыл академик петербургской Академии наук К. С. Кирхгоф. Именно амилаза приводит к появлению сладковатого вкуса при длительном пережёвывании крахмалосодержащих продуктов (например, из риса или картофеля), но без добавления сахара. Амилаза присутствует в слюне (птиалин), где начинает процесс пищеварения. Расщепляет α-1,4-гликозидную связь.
Классификация
По субстратной специфичности амилазы классифицируют на альфа-, бета- и гамма-амилазу.
α-Амилаза
α-Амилаза (1,4-α-d-глюкан-глюкагоногидролаза, гликогеназа; шифр КФ — 3.2.1.1) является кальций-зависимым ферментом. К этому типу относятся амилаза слюнных желез и амилаза поджелудочной железы[1]. Она способна гидролизовать полисахаридную цепь крахмала и других длинноцепочечных углеводов в любом месте. Таким образом, процесс гидролиза ускоряется и приводит к образованию олигосахаридов различной длины. У животных α-амилаза является основным пищеварительным ферментом. Активность α-амилазы оптимальна в нейтральной среде (pH = 6,7—7,0). Фермент обнаружен также у растений (например, в овсе), в грибах (в аскомицетах и базидиомицетах) и бактериях (Bacillus).
β-Амилаза
β-Амилаза (1,4-α-d-глюкан-мальтогидролаза; шифр КФ — 3.2.1.2) присутствует у бактерий, грибов и растений, но отсутствует у животных. Она отщепляет вторую с конца α-1,4-гликозидную связь, образуя, таким образом, дисахарид мальтозу. При созревании фруктов β-амилаза расщепляет плодовый крахмал на сахара́, что приводит к сладкому вкусу зрелых плодов. В семенах β-амилаза активна на стадии, предшествующей прорастанию, тогда как α-амилаза важна при непосредственно прорастании семени.
β-Амилаза пшеницы является ключевым компонентом при образовании солода. Бактериальная β-амилаза участвует в разложении внеклеточного крахмала.
γ-Амилаза
γ-Амилаза (1,4-α-d-гликан-глюкогидролаза, глюкан-1,4-α-глюкозидаза, амилоглюкозидаза, экзо-1,4-α-глюкозадаза, глюкоамилаза, лизосомальная α-глюкозидаза; шифр КФ — 3.2.1.3) отщепляет последнюю α-1,4-гликозидную связь, приводя к образованию глюкозы. Кроме этого, γ-амилаза способна гидролизовать α-1,6-гликозидную связь. В отличие от других амилаз, γ-амилаза наиболее активна в кислых условиях (при pH = 3).
Применение
Некоторые виды дрожжей способны разлагать крахмал с помощью амилазы до ди- и трисахаридов, которые потом используются в жизнедеятельности, образуя в результате этанол, углекислый газ (CO
Бактериальная амилаза используется в стиральных порошках для разложения крахмала, присутствующего в белье.
В пищевой промышленности амилаза зарегистрирована в качестве пищевой добавки E1100 как улучшитель муки и хлеба.
Примечания
Ссылки
Амилаза — Википедия
Материал из Википедии — свободной энциклопедии
 Структура амилазы слюнных желез. Катион кальция показан жёлтым цветом, анион хлора — зелёным.
Структура амилазы слюнных желез. Катион кальция показан жёлтым цветом, анион хлора — зелёным.Амила́за (др.-греч. ἄμυλον — крахмал) — фермент, гликозил-гидролаза, расщепляющий крахмал до олигосахаридов, относится к ферментам пищеварения. В истории амилаза стала первым открытым ферментом, когда французский химик Ансельм Пайен описал в 1833 году диастазу[en]* — фермент (на самом деле, смесь ферментов), расщепляющий крахмал до мальтозы. Согласно другим данным, амилазу в 1814 году открыл академик петербургской Академии наук К. С. Кирхгоф. Именно амилаза приводит к появлению сладковатого вкуса при длительном пережёвывании крахмалосодержащих продуктов (например, из риса или картофеля), но без добавления сахара. Амилаза присутствует в слюне (птиалин), где начинает процесс пищеварения. Расщепляет α-1,4-гликозидную связь.
Классификация
По субстратной специфичности амилазы классифицируют на альфа-, бета- и гамма-амилазу.
α-Амилаза
α-Амилаза (1,4-α-d-глюкан-глюканогидролаза, гликогеназа; шифр КФ — 3.2.1.1) является кальций-зависимым ферментом. К этому типу относятся амилаза слюнных желез и амилаза поджелудочной железы[1]. Она способна гидролизовать полисахаридную цепь крахмала и других длинноцепочечных углеводов в любом месте. Таким образом, процесс гидролиза ускоряется и приводит к образованию олигосахаридов различной длины. У животных α-амилаза является основным пищеварительным ферментом. Активность α-амилазы оптимальна в нейтральной среде (pH = 6,7—7,0). Фермент обнаружен также у растений (например, в овсе), в грибах (в аскомицетах и базидиомицетах) и бактериях (Bacillus).
β-Амилаза
β-Амилаза (1,4-α-d-глюкан-мальтогидролаза; шифр КФ — 3.2.1.2) присутствует у бактерий, грибов и растений, но отсутствует у животных. Она отщепляет вторую с конца α-1,4-гликозидную связь, образуя, таким образом, дисахарид мальтозу. При созревании фруктов β-амилаза расщепляет плодовый крахмал на сахара́, что приводит к сладкому вкусу зрелых плодов. В семенах β-амилаза активна на стадии, предшествующей прорастанию, тогда как α-амилаза важна при непосредственно прорастании семени.
β-Амилаза пшеницы является ключевым компонентом при образовании солода. Бактериальная β-амилаза участвует в разложении внеклеточного крахмала.
γ-Амилаза
γ-Амилаза (1,4-α-d-гликан-глюкогидролаза, глюкан-1,4-α-глюкозидаза, амилоглюкозидаза, экзо-1,4-α-глюкозадаза, глюкоамилаза, лизосомальная α-глюкозидаза; шифр КФ — 3.2.1.3) отщепляет последнюю α-1,4-гликозидную связь, приводя к образованию глюкозы. Кроме этого, γ-амилаза способна гидролизовать α-1,6-гликозидную связь. В отличие от других амилаз, γ-амилаза наиболее активна в кислых условиях (при pH = 3).
Видео по теме
Применение
Некоторые виды дрожжей способны разлагать крахмал с помощью амилазы до ди- и трисахаридов, которые потом используются в жизнедеятельности, образуя в результате этанол, углекислый газ (CO
Бактериальная амилаза используется в стиральных порошках для разложения крахмала, присутствующего в белье.
В пищевой промышленности амилаза зарегистрирована в качестве пищевой добавки E1100 как улучшитель муки и хлеба.
Примечания
Ссылки
Амилаза — Википедия
Материал из Википедии — свободной энциклопедии
Структура амилазы слюнных желез. Катион кальция показан жёлтым цветом, анион хлора — зелёным.Амила́за (др.-греч. ἄμυλον — крахмал) — фермент, гликозил-гидролаза, расщепляющий крахмал до олигосахаридов, относится к ферментам пищеварения. В истории амилаза стала первым открытым ферментом, когда французский химик Ансельм Пайен описал в 1833 году диастазу[en]* — фермент (на самом деле, смесь ферментов), расщепляющий крахмал до мальтозы. Согласно другим данным, амилазу в 1814 году открыл академик петербургской Академии наук К. С. Кирхгоф. Именно амилаза приводит к появлению сладковатого вкуса при длительном пережёвывании крахмалосодержащих продуктов (например, из риса или картофеля), но без добавления сахара. Амилаза присутствует в слюне (птиалин), где начинает процесс пищеварения. Расщепляет α-1,4-гликозидную связь.
Классификация
По субстратной специфичности амилазы классифицируют на альфа-, бета- и гамма-амилазу.
α-Амилаза
α-Амилаза (1,4-α-d-глюкан-глюканогидролаза, гликогеназа; шифр КФ — 3.2.1.1) является кальций-зависимым ферментом. К этому типу относятся амилаза слюнных желез и амилаза поджелудочной железы[1]. Она способна гидролизовать полисахаридную цепь крахмала и других длинноцепочечных углеводов в любом месте. Таким образом, процесс гидролиза ускоряется и приводит к образованию олигосахаридов различной длины. У животных α-амилаза является основным пищеварительным ферментом. Активность α-амилазы оптимальна в нейтральной среде (pH = 6,7—7,0). Фермент обнаружен также у растений (например, в овсе), в грибах (в аскомицетах и базидиомицетах) и бактериях (Bacillus).
β-Амилаза
β-Амилаза (1,4-α-d-глюкан-мальтогидролаза; шифр КФ — 3.2.1.2) присутствует у бактерий, грибов и растений, но отсутствует у животных. Она отщепляет вторую с конца α-1,4-гликозидную связь, образуя, таким образом, дисахарид мальтозу. При созревании фруктов β-амилаза расщепляет плодовый крахмал на сахара́, что приводит к сладкому вкусу зрелых плодов. В семенах β-амилаза активна на стадии, предшествующей прорастанию, тогда как α-амилаза важна при непосредственно прорастании семени.
β-Амилаза пшеницы является ключевым компонентом при образовании солода. Бактериальная β-амилаза участвует в разложении внеклеточного крахмала.
γ-Амилаза
γ-Амилаза (1,4-α-d-гликан-глюкогидролаза, глюкан-1,4-α-глюкозидаза, амилоглюкозидаза, экзо-1,4-α-глюкозадаза, глюкоамилаза, лизосомальная α-глюкозидаза; шифр КФ — 3.2.1.3) отщепляет последнюю α-1,4-гликозидную связь, приводя к образованию глюкозы. Кроме этого, γ-амилаза способна гидролизовать α-1,6-гликозидную связь. В отличие от других амилаз, γ-амилаза наиболее активна в кислых условиях (при pH = 3).
Применение
Некоторые виды дрожжей способны разлагать крахмал с помощью амилазы до ди- и трисахаридов, которые потом используются в жизнедеятельности, образуя в результате этанол, углекислый газ (CO
Бактериальная амилаза используется в стиральных порошках для разложения крахмала, присутствующего в белье.
В пищевой промышленности амилаза зарегистрирована в качестве пищевой добавки E1100 как улучшитель муки и хлеба.
Примечания
Ссылки
Альфа-амилаза — Википедия
Материал из Википедии — свободной энциклопедии
Альфа-амилаза Другой вид альфа-амилазыАльфа-амилаза (α-Амилаза, 1,4-α-d-глюкан-глюканогидролаза, гликогеназа; шифр КФ — 3.2.1.1) является кальций-зависимым ферментом. К этому типу относятся амилаза слюнных желез и амилаза поджелудочной железы[1]. Она способна гидролизовать полисахаридную цепь крахмала и других длинноцепочечных углеводов в любом месте. Таким образом, процесс гидролиза ускоряется и приводит к образованию олигосахаридов различной длины. У животных α-амилаза является основным пищеварительным ферментом. Активность α-амилазы оптимальна в нейтральной среде (pH = 6,7—7,0), а также при содержании: хлорида и бромида — наибольшее влияние, йодида — меньшее влияние, сульфата и фосфата — наименьшее влияние. Фермент обнаружен также у растений (например, в овсе), в грибах (в аскомицетах и базидиомицетах) и бактериях (Bacillus). Это основная форма амилазы, обнаруженная у людей и других млекопитающих. Активность альфа-амилазы в зерне измеряется методами Хагберга-Пертена и Фадебаса.
В физиологии человека
Хотя альфа-амилаза обнаружена во многих тканях, она наиболее заметна в соке поджелудочной железы и слюне, каждая из которых имеет свою собственную изоформу α-амилазы человека. Они ведут себя по-разному при изоэлектрическом фокусировании и могут также быть разделены при тестировании с использованием специфических моноклональных антител. У людей все изоформы амилазы связаны с хромосомой 1р 21. Один из видов альфа-амилазы — птиалин. Птиалин гидролизует большие молекулы нерастворимого крахмала и образует растворимый крахмал (амилодекстрин, эритродекстрин или акродекстрин), производя последовательно все меньшие и меньшие молекулы крахмала до образования мальтозы. В желудочном соке при водородном показателе (далее — pH) 3,3 птиалин полностью инактивируется через 20 минут при 37ºC. Напротив, за 150 минут в желудочном соке при рН 4,3 50 % активности амилазы все ещё сохраняются. Когда при рН 3,0 добавляют птиалин, он полностью инактивируется через 120 минут; однако добавление 0,1 % крахмала приводит к тому, что через 120 минут раствор все ещё сохраняет активность амилазы 10 %; и добавление 1,0 крахмала позволяет поддерживать 40 % активности амилазы в течение тех же 120 минут.
В промышленности
α-Амилаза используется в производстве этанола для расщепления крахмала в зернах на сахара. Также первым этапом производства кукурузного сиропа с высоким содержанием фруктозы является обработка кукурузного крахмала α-амилазой. А-амилаза, называемая «термамил», полученная из бактерий Bacillus licheniformis, также используется в некоторых моющих средствах, особенно в моющих средствах для мытья посуды и удаления крахмала.
Примечания
Амилаза — Википедия. Что такое Амилаза
 Структура амилазы слюнных желез. Катион кальция показан жёлтым цветом, анион хлора — зелёным.
Структура амилазы слюнных желез. Катион кальция показан жёлтым цветом, анион хлора — зелёным.Амила́за (др.-греч. ἄμυλον — крахмал) — фермент, гликозил-гидролаза, расщепляющий крахмал до олигосахаридов, относится к ферментам пищеварения. В истории амилаза стала первым открытым ферментом, когда французский химик Ансельм Пайен описал в 1833 году диастазу[en]* — фермент (на самом деле, смесь ферментов), расщепляющий крахмал до мальтозы. Согласно другим данным, амилазу в 1814 году открыл академик петербургской Академии наук К. С. Кирхгоф. Именно амилаза приводит к появлению сладковатого вкуса при длительном пережёвывании крахмалосодержащих продуктов (например, из риса или картофеля), но без добавления сахара. Амилаза присутствует в слюне (птиалин), где начинает процесс пищеварения. Расщепляет α-1,4-гликозидную связь.
Классификация
По субстратной специфичности амилазы классифицируют на альфа-, бета- и гамма-амилазу.
α-Амилаза
α-Амилаза (1,4-α-d-глюкан-глюканогидролаза, гликогеназа; шифр КФ — 3.2.1.1) является кальций-зависимым ферментом. К этому типу относятся амилаза слюнных желез и амилаза поджелудочной железы[1]. Она способна гидролизовать полисахаридную цепь крахмала и других длинноцепочечных углеводов в любом месте. Таким образом, процесс гидролиза ускоряется и приводит к образованию олигосахаридов различной длины. У животных α-амилаза является основным пищеварительным ферментом. Активность α-амилазы оптимальна в нейтральной среде (pH = 6,7—7,0). Фермент обнаружен также у растений (например, в овсе), в грибах (в аскомицетах и базидиомицетах) и бактериях (Bacillus).
β-Амилаза
β-Амилаза (1,4-α-d-глюкан-мальтогидролаза; шифр КФ — 3.2.1.2) присутствует у бактерий, грибов и растений, но отсутствует у животных. Она отщепляет вторую с конца α-1,4-гликозидную связь, образуя, таким образом, дисахарид мальтозу. При созревании фруктов β-амилаза расщепляет плодовый крахмал на сахара́, что приводит к сладкому вкусу зрелых плодов. В семенах β-амилаза активна на стадии, предшествующей прорастанию, тогда как α-амилаза важна при непосредственно прорастании семени.
β-Амилаза пшеницы является ключевым компонентом при образовании солода. Бактериальная β-амилаза участвует в разложении внеклеточного крахмала.
γ-Амилаза
γ-Амилаза (1,4-α-d-гликан-глюкогидролаза, глюкан-1,4-α-глюкозидаза, амилоглюкозидаза, экзо-1,4-α-глюкозадаза, глюкоамилаза, лизосомальная α-глюкозидаза; шифр КФ — 3.2.1.3) отщепляет последнюю α-1,4-гликозидную связь, приводя к образованию глюкозы. Кроме этого, γ-амилаза способна гидролизовать α-1,6-гликозидную связь. В отличие от других амилаз, γ-амилаза наиболее активна в кислых условиях (при pH = 3).
Применение
Некоторые виды дрожжей способны разлагать крахмал с помощью амилазы до ди- и трисахаридов, которые потом используются в жизнедеятельности, образуя в результате этанол, углекислый газ (CO2) и другие метаболиты, которые придают хлебу специфический вкус и «поднимают» тесто. Но пекарские дрожжи (Saccharomyces cerevisiae) этого не могут, поэтому в современных хлебопекарных технологиях амилаза используется как одно из важных составляющих специальной добавки. Добавление амилазы в тесто позволяет использовать для жизнедеятельности дрожжей часть крахмала муки, ускоряя тем самым процесс брожения, и одновременно позволяет изготовителю хлеба сэкономить, уменьшив количество используемого сахара.[источник не указан 319 дней]
Бактериальная амилаза используется в стиральных порошках для разложения крахмала, присутствующего в белье.
В пищевой промышленности амилаза зарегистрирована в качестве пищевой добавки E1100 как улучшитель муки и хлеба.
Примечания
Ссылки
Амилаза — это… Что такое Амилаза?
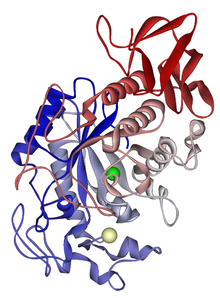 Структура амилазы слюнных желез. Катион кальция показан жёлтым цветом, анион хлора — зелёным.
Структура амилазы слюнных желез. Катион кальция показан жёлтым цветом, анион хлора — зелёным.Амила́за (англ. Amylase) — фермент, гликозил-гидролаза, расщепляющий крахмал до олигосахаридов, относится к ферментам пищеварения. В истории амилаза стала первым открытым ферментом, когда французский химик Ансельм Пайя описал в 1833 году диастазу, фермент, расщепляющий крахмал до мальтозы. Согласно другим данным, амилазу в 1814 году открыл академик петербургской Академии наук К. Г. С. Кирхгоф. Именно амилаза приводит к появлению сладковатого вкуса при длительном пережёвывании крахмалосодержащих продуктов (например, из риса или картофеля), но без добавления сахара. Амилаза присутствует в слюне (птиалин), где начинает процесс пищеварения. Существует три типа амилаз, обозначаемых альфа, бета и гамма. Расщепляет α-1,4-гликозидную связь.
Классификация
По субстратной специфичности амилазы классифицируют на альфа-, бета- и гамма-амилазу.
α-Амилаза
α-Амилаза (КФ 3.2.1.1; 1,4-α-D-глюкан-глюканогидролаза; гликогеназа) является кальций-зависимым ферментом. К этому типу относятся амилаза слюнных желез и амилаза поджелудочной железы. Она способна гидролизовать полисахаридную цепь крахмала и других длинноцепочечных углеводов в любом месте. Таким образом, процесс гидролиза ускоряется и приводит к образованию олигосахаридов различной длины. У животных α-амилаза является основным пищеварительным ферментом. Активность α-амилазы оптимальна при нейтральной pH 6,7-7,0. Фермент обнаружен также у растений (например, в овсе), в грибах (в аскомицетах и базидиомицетах) и бактериях (Bacillus).
β-Амилаза
β-Амилаза (КФ 3.2.1.2; 1,4-α-D-глюкан-мальтогидролаза) присутствует у бактерий, грибов и растений, но отсутствует у животных. Она отщепляет вторую с конца α-1,4-гликозидную связь, образуя, таким образом, дисахарид мальтозу. При созревании фруктов β-амилаза расщепляет плодовый крахмал на сахара́, что приводит к сладкому вкусу зрелых плодов. В семенах β-амилаза активна на стадии, предшествующей прорастанию, тогда как α-амилаза важна при непосредственно прорастании семени.
β-Амилаза пшеницы является ключевым компонентом при образовании солода. Бактериальная β-амилаза участвует в разложении внеклеточного крахмала.
γ-Амилаза
γ-Амилаза (КФ 3.2.1.3; глюкан-1,4-α-глюкозидаза; амилоглюкозидаза; экзо-1,4-α-глюкозадаза; глюкоамилаза; лизосомальная α-глюкозидаза; 1,4-α-D-гликан-глюкогидролаза) отщепляет последнюю α-1,4-гликозидную связь, приводя к образованию глюкозы. Кроме этого, γ-амилаза способна гидролизовать α-1,6-гликозидную связь. В отличие от других амилаз γ-амилаза наиболее активна в кислых условиях при pH 3.
Применение
При приготовлении дрожжевого теста дрожжи разлагают крахмал с помощью амилазы до ди- и трисахаридов, которые потом используются в жизнедеятельности, образуя в результате спирт, углекислый газ (CO2) и другие метаболиты, которые придают хлебу специфический вкус и «поднимают» тесто. Однако это длительный процесс, поэтому в современных технологиях амилаза используется как одно из важных составляющих специальной добавки, ускоряющий процесс брожения. Бактериальная амилаза используется в стиральных порошках для разложения крахмала, присутствующего в белье.
В пищевой промышленности зарегистрирована в качестве пищевой добавки E1100 как улучшитель муки и хлеба.
Ссылки
амилаза — Викисловарь
 | См. также амилоза. |
 | В Википедии есть страница «амилаза». |
Содержание
- 1 Русский
- 1.1 Морфологические и синтаксические свойства
- 1.2 Произношение
- 1.3 Семантические свойства
- 1.3.1 Значение
- 1.3.2 Синонимы
- 1.3.3 Антонимы
- 1.3.4 Гиперонимы
- 1.3.5 Гипонимы
- 1.4 Родственные слова
- 1.5 Этимология
- 1.6 Фразеологизмы и устойчивые сочетания
- 1.7 Перевод
- 1.8 Библиография
| В Викиданных есть лексема амилаза (L86016). |
Морфологические и синтаксические свойства[править]
| падеж | ед. ч. | мн. ч. |
|---|---|---|
| Им. | амила́за | амила́зы |
| Р. | амила́зы | амила́з |
| Д. | амила́зе | амила́зам |
| В. | амила́зу | амила́зы |
| Тв. | амила́зой амила́зою | амила́зами |
| Пр. | амила́зе | амила́зах |
а·ми-ла́-за
Существительное, неодушевлённое, женский род, 1-е склонение (тип склонения 1a по классификации А. А. Зализняка).
Корень: -амил-; суффикс: -аз; окончание: -а.
Произношение[править]
- МФА: [ɐmʲɪˈɫazə]
Семантические свойства[править]
 Структура амилазы слюнных желёз
Структура амилазы слюнных желёзЗначение[править]
- биохим. фермент, благодаря действию которого в организме человека и животных полисахариды (крахмал, инулин) превращаются в простые сахара ◆ Уже в ротовой полости ферменты амилазы приступают к гидролизу крахмала с образованием промежуточных продуктов — декстрина и дисахарида мальтозы. Анна Петрухина, «Йогурт: добавка добавке рознь», 2009 г. // «Наука и жизнь» (цитата из Национального корпуса русского языка, см. Список литературы)
Синонимы[править]
- —
Антонимы[править]
- —
Гиперонимы[править]
- фермент, гидролаза
Гипонимы[править]
- глюкоамилаза
Родственные слова[править]
| Ближайшее родство | |
Этимология[править]
Происходит от ??
Фразеологизмы и устойчивые сочетания[править]
Перевод[править]
| Список переводов | |
| |
Библиография[править]
 | Для улучшения этой статьи желательно:
|
