Лекция №12 Тема: Формы иммунного ответа. Антитела.
Формы иммунного ответа:
— антителообразование,
— иммунологическую память,
— иммунологическую толерантность,
— гиперчувствительность немедленного типа,
— гиперчувствительность замедленного типа,
— иммунный фагоцитоз и киллерная функция иммунных макрофагов и лимфоцитов.
Различают клеточный и гуморальный иммунный ответ.
Клеточный иммунный ответ происходит с участием Т-лимфоцитов. Эффекторные Т-лимфоциты – Т-киллеры способны уничтожить клетки путем прямой цитотоксичности и путем синтеза лимфокинов, которые участвуют в процессах взаимодействия иммунокомпетентных клеток. В регуляции иммунного ответа участвуют два подтипа Т клеток – Т-хелперы усиливают иммунный ответ, Т-супрессоры, наобарот, угнетают.
Общая схема гуморального иммунного ответа выглядит таким образом:
Антиген (инфекционный агент) фагоцитируется макрофагом. Макрофаг перерабатывает антиген таким образом, что он приобретает способность распознаваться Т-хелперами. При контакте с чужеродным веществом, антигеном макрофаг (фагоцит) активируется и начинает вырабатывать иммуноцитокины, в т. ч. ИЛ-1. Т-хелперы при помощи особого рецептора распознает антиген и выделяет в окружающую среду ИЛ-2. С антигеном связывается соответствующей его рецептору В-клетки.
Для активации В лимфоцитов необходим тройной сигнал: от антигенспецифичного рецептора, фагоцита (ИЛ-1) и Т- хелпера (ИЛ-2). В результате чего образуются клетки, которые синтезируют антитела. Образовавшиеся антитела вступают во взаимодействие с антигеном с образованием комплекса антиген-антитело, которые запускают в действие неспецифические механизмы защитной реакции. Эти комплексы активизируют систему комплемента.
Антитела. Свойства антител.
Антителами называются сывороточные белки (обладающие защитными свойствами) образующиеся в ответ на действие антигена. Они относятся к сывороточным глобулинам и поэтому называются иммуноглобулинами (Ig). Через них реализуется гуморальный тип иммунного ответа.
Важным свойством антител является их специфичность, т.е. способность вступать во взаимодействие с антигеном, аналогичным тому, который индуцировал (вызвал) их образование.
В зависимости от видимых проявлений взаимодействия антитела и антигена различают:
— агглютинины – антитела, вызывающие склеивание микроорганизмов;
— преципитины – антитела, вызывающие осаждение антигена;
— антитоксины – антитела, нейтрализирующие экзотоксины;
— лизины – вызывающие лизис бактерий, спирохет и т.д.;
— опсонины – антитела, усиливающие фагоцитоз и др.
По происхождению антитела делятся на:
• нормальные (анамнестические) антитела, которые обнаруживаются в любом организме как результат бытовой иммунизации, это антитела, появление которых не связанно с инфекцией или искусственной иммунизацией;
• инфекционные антитела, которые накапливаются в организме в период инфекционного заболевания;
• постинфекционные антитела, которые обнаруживаются в организме после перенесенного инфекционного заболевания;
• поствакцинальные антитела, которые возникают после искусственной иммунизации.
Антитела (иммуноглобулины) всегда специфичны антигену, индуцировавшему их образование. Тем не менее противомикробные иммуноглобулины по специфичности делятся на те же группы, что и соответствующие микробные антигены.
• группоспецифические;
• видоспецифические;
• вариантспецифические;
• перекрестнореагирующие.
В настоящее время довольно часто методами биотехнологии и/или генной инженерии получают иммуноглобулины, продуцируемые одним клоном клеток. Они называются моноклональными антителами. Их продуценты — клетки-гибридомы, являющиеся потомками, полученными при скрещивании В-лимфоцита (плазматической клетки) с опухолевой клеткой. От плазматической клетки гибридома наследует способность к синтезу антител, а от опухолевой клетки — способность длительно культивироваться вне организма.
Помимо специфичности одним из основных свойств иммуноглобулинов является их гетерогенность, т. е. неоднородность популяции иммуноглобулинов по генетической детерминированности их образования и по физико-химическому строению.
Полные и неполные антитела.
Среди многообразия Ig выделяют:
полные
неполные антитела.
Деление основано на способности образовывать в реакции агглютинации или преципитации (in vitro) хорошо различимую глазом макромолекулярную структуру гигантского иммунного комплекса. Таким свойством обладают полные антитела. К ним относятся полимерные молекулы Ig (изотип М), а также некоторые IgA и IgG.
Неполные
антитела лишены
такой способности,
несмотря на то что они специфически
связываются
с антигеном. В связи с этим их
еще называют непреципитирующими или
блокирующими
антителами. Причиной этого явления
может быть экранирование одного из
антигенсвязывающих
центров мономерной 
Другие виды антител. Помимо вышеприведенных различают тепловые и холодовые антитела. Первые взаимодействуют с антигеном при температуре +37 °С. Для вторых наибольшая эффективность связывания проявляется в диапазоне +4… -10 °С. Понижение температуры реакционной смеси позволяет в ряде случаев (например, при отсутствии специфического антигена) ограничить низкоаффинные взаимодействия и повысить специфичность реакции.
По способности активировать комплемент (классический путь) антитела подразделяются на комплементсвязывающие (IgM, IgGl и IgG3) и комплементнесвязывающие.
В последние годы открыт вид антител, которые выполняют функции катализаторов биохимических процессов — обладают протеазной или нуклеазной активностью. Это реликтовые свойства антител. Такие антитела получили название абзимы.
Большим достижением молекулярной биологии в области иммунологии, помимо гибридом, явилось получение белков со свойствами антител — это одноцепочечные антитела, бифункциональные антитела и иммунотокси-ны. Они синтезируются живыми биологическими системами. Одноцепочечные антитела представляют собой фрагмент вариабельного домена Ig, который обладает определенной специфичностью и аффинностью и способен к блокирующему действию. Размер такой молекулы очень мал и практически не обладает иммуногенностью. Бифункциональные антитела имеют антигенсвязывающие центры разной специфичности, т. е. направлены к различным антигенным детерминантам. Иммунотоксины представляют собой гибрид молекулы иммуноглобулина и токсина. Они способны направленно доставить молекулу токсина к клетке-мишени, убить ее или нарушить в ней метаболические процессы.
Иммунотоксины и бифункциональные антитела имеют большое будущее. В перспективе их будут использовать для иммунодиагностики, а также профилактики и лечения инфекционных, онкологических, аллергических и других заболеваний.
Механизм взаимодействия антитела с антигеном
В процессе взаимодействия с антигеном принимает участие не вся молекула Ig, а лишь ее ограниченный участок — антигенсвязывающий центр, или паратоп, который локализован в Fab-фрагменте молекулы Ig. Co своей стороны, антитело взаимодействует не со всей молекулой антигена сразу, а лишь
Антитела отличает специфичность взаимодействия, т. е. способность связываться со строго определенной антигенной детерминантой. Наиболее доступные для взаимодействия эпитопы располагаются на поверхности молекулы антигена.
Связь антигена с антителом осуществляется за счет слабых взаимодействий (ван-дерваальсовы силы, водородные связи, электростатические взаимодействия) в пределах антигенсвязывающего центра. Такая связь отличается неустойчивостью — образовавшийся иммунный комплекс (ИК) может легко диссоциировать на составляющие его компоненты. Поэтому взаимодействие антигена и антитела может быть представлено в виде уравнения:
[АГ] + [AT] « [ИК].
Продолжительность существования иммунного комплекса определяется целым рядом факторов. При этом важное значение имеют особенности антитела, антигена и условия, в которых происходит их взаимодействие.
К особенностям антитела следует отнести его аффинность и авидность.
Аффинность — сила специфического взаимодействия антитела с антигеном (или энергия их связи). Эта характеристика зависит от степени стерического, или пространственного, соответствия (комплементарности) структуры антигенсвязывающего центра и антигенной детерминанты. Чем выше их комплементарность, т. е. чем больше они подходят друг другу, тем больше образуется межмолекулярных связей и тем выше будет устойчивость и продолжительность жизни образовавшегося иммунного комплекса. Структурные несоответствия антигенсвязывающего центра и антигенной детерминанты существенно снижают число образующихся связей и прочность взаимодействия антитела с антигеном. Иммунный комплекс, образованный низкоаффинными антителами, чрезвычайно неустойчив, имеет малую продолжительность существования и быстро распадается на исходные компоненты.
• Установлено, что в условиях макроорганизма с одной и той же антигенной детерминантой способны одновременно прореагировать и образовать иммунный комплекс около 100 различных клонов антител. Все они будут отличаться структурой антигенсвязывающего центра и аффинностью.
Аффинность антител существенно меняется в процессе иммунного ответа в связи с селекцией наиболее специфичных клонов В-лимфоцитов. Наименее аффинными считаются нормальные антитела. По расчетам, общее число различных антигенспецифических клонов В-лимфоцитов достигает 106—107.
Под термином «авидность» понимают прочность связывания антитела и антигена. Эта характеристика определяется аффинностью Ig и числом антигенсвязывающих центров. При равной степени аффинности наибольшей авид-ностью обладают антитела класса М, так как они имеют 10 антигенсвязывающих центров.
Особенности антигена также влияют на эффективность его взаимодействия с антителом. Так, важное значение имеют стерическая (пространственная) доступность антигенной детерминанты для антигенсвязывающего центра молекулы Ig и число эпитопов в составе молекулы антигена.
Эффективность взаимодействия антитела с антигеном существенно зависит от условий, в которых происходит реакция, и прежде всего от рН среды, осмотической плотности, солевого состава и температуры среды. Оптимальными для реакции антиген—антитело являются физиологические условия внутренней среды макроорганизма: близкая к нейтральной реакция среды, присутствие фосфат-, карбонат-, хлорид- и ацетат-ионов, осмолярность физиологического раствора (концентрация раствора 0,15 М), а также температура (36—37 °С).
Структура антител и их функции
Одной из основных функций иммунной системы является продукция растворимых белков, свободно циркулирующих и обладающих особыми свойствами, необходимыми для работы иммунной системы и защиты от чужеродных субстанций. Эти растворимые белки — антитела — относятся к классу белков, называемых глобулинами в связи с их глобулярной структурой.Первоначально из-за способности к перемещению при электрофорезе их назвали γ-глобулинами (в отличие от более быстро перемещающихся альбумина, α-глобулинов и β-глобулинов). Теперь они известны под общим названием иммуноглобулины (Ig).
Иммуноглобулины экспрессируются в виде секретируемых и мембранных форм. Секретируемые антитела вырабатываются В-клетками на терминальной стадии дифференцировки — плазматическими клетками, которые служат фабриками по производству антител и располагаются в основном в костном мозге. Мембранные антитела присутствуют на поверхности В-клеток, где они служат антигенспецифичными рецепторами. Мембранная форма антитела, ассоциированная с гетеродимером, называемым Iga/Igp, образует В-клеточный рецептор (BCR). Гетеродимер Iga/Igp проводит внутрь клетки сигналы, связанные с активацией В-лимфоцита.
Структура иммуноглобулинов определяет некоторые свойства, необходимые для их участия в иммунном ответе. Двумя наиболее важными из этих свойств являются специфичность и биологическая активность. Как будет показано далее, специфичность обусловлена определенной областью молекулы антитела, которая содержит гипервариабельный участок, или участок, определяющий комплементарность (CDR). Этот участок ограничивает связь антитела только с теми субстанциями, которые содержат одну определенную антигенную структуру.
Существование огромного разнообразия потенциальных антигенных детерминант, или эпитопов, обусловило эволюцию системы в направлении продукции такого спектра молекул антител, чтобы каждая из них была способна комбинироваться со строго определенной (частной) антигенной структурой. Все вместе — репертуар антител — характеризуется большим разнообразием в отношении типов молекулярных структур, с которыми они способны реагировать, однако по отдельности эти антитела проявляют высокий уровень специфичности, поскольку одно антитело способно реагировать только с одной определенной антигенной структурой.
Хотя количество антител разных специфичностей, способных реагировать со многими структурными единицами, очень велико, биологические эффекты таких реакций довольно немногочисленны. К ним относятся: нейтрализация токсинов, иммобилизация микроорганизмов, нейтрализация вирусной активности, агглютинация (скопление) микроорганизмов или антигенных частиц, связывание растворимого антигена, ведущее к образованию преципитатов (которые активно элиминируются фагоцитирующими клетками) и активация сывороточного комплемента для усиления лизиса микроорганизмов или фагоцитоза и деструкции, осуществляемых либо фагоцитирующими клетками, либо лимфоцитами-киллерами.
Еще одним важным биологическим свойством антител является их способность проникать через плаценту от матери к плоду. Не все молекулы антител способны одинаково выполнять все эти биологические функции.
Различия в биологических функциях антител определяются их изотипической структурой (классом). В то время как одна часть молекулы антитела должна легко подвергаться адаптации, чтобы обеспечить возможность приспосабливаться к ‘большому числу эпитопов, другая часть должна легко адаптироваться для выполнения биологических функций, общих для многих антител.
Определение структуры антител, установление взаимосвязи между их структурой и функцией и выявление генетической организации молекул иммуноглобулинов в значительной степени способствовали нашему пониманию эволюционирования иммунной системы. Весь антительный репертуар представляет собой сложную, высокоспециализированную систему, в которой различные структуры (иммуноглобулины) распознают одно и то же — антиген, но комплекс иммуноглобулина с антигеном определяет развитие множества различных биологических эффектов. В этой главе описываются структурные и биологические свойства иммуноглобулинов.
Обнаружение антител и определение их характеристик
Антитела содержатся в сыворотке крови, которую получают после ее свертывания и удаления образовавшегося сгустка с находящимися в нем клетками и факторами свертывания. При электрофорезе сыворотки (разделении в электрическом поле) в условиях слабощелочной среды (рН 8,2), в ней, как правило, можно различить пять основных компонентов (рис. 4.1). Было показано, что антитела содержатся в области γ-глобулинов, где располагаются самые медленные с точки зрения миграции относительно анода элементы. После выявления этой закономерности провели простое сравнение элекрофоретических профилей антисыворотки, взятой у гипериммунизированного кролика (получившего многоразовую иммунизацию тест-антигеном) до и после удаления тестируемых антигенспецифичных антител, для чего провели преципитацию с антигеном.Эта процедура привела к уменьшению размера только фракции γ-глобулинов. Анализ показал, что когда эта фракция собиралась отдельно, в ней содержались все определяемые антитела. Позднее было показано, что активность антител присутствует не только в γ-глобулиновой фракции, но и в области, несколько более близкой к аноду. В результате все глобулярные белки, обладающие свойствами антител, были в основном отнесены к иммуноглобулинам, что подтверждает γ-пик (см. рис. 4.1).
Ширина электрофоретических пиков свидетельствует, что они представляют гетерогенную смесь иммуноглобулиновых молекул с немного различающимися зарядами. Эта гетерогенность была одним из первых препятствий на пути определения структуры антител, поскольку аналитическая химия в качестве первичного материала требует гомогенных материалов, способных кристаллизоваться.
Эта проблема была частично решена после открытия миеломных белков, которые являются гомогенными иммуноглобулинами, производимыми потомством одной плазматической клетки, подвергшейся опухолевой трансформации при злокачественном заболевании, называемом множественной миеломой. Это наглядно демонстрирует форма ү-глобулинового зубца элекрофореграммы сывороточных белков больного множественной миеломой (см. рис. 4.1). Когда выяснили, что некоторые миеломные белки связывают антиген, стало очевидно, что с ними можно обращаться, как с типичными молекулами иммуноглобулина.

Рис. 4.1. Электрофоретическая мобильность белков сывороток, полученных от нормального индивидуума (голубая) и больного с lgG-миеломой (красная) (с любезного разрешения д-ра С Miller, School of Medicine, University of California at Davis)
Другим подспорьем в исследованиях структуры антител стало открытие белков Бенс-Джонса в моче. Эти гомогенные белки, определяемые в больших количествах у некоторых больных множественной миеломой, являются димерами κ- или λ-легких цепей иммуноглобулинов. Они оказались очень полезными при определении структуры этой части иммуноглобулиновой молекулы. Сегодня разработана эффективная методика гибридизации двух клеток (гибридомная технология), которая позволяет получать большое количество гомогенных препаратов моноклональных антител практически любой специфичности.
Структура легких и тяжелых цепей
Структурные характеристики антител начали анализировать в 1959 г. после двух открытий, показавших, что эти молекулы могут быть разделены на части, пригодные для дальнейшего исследования. В Англии Р. Р. Портер (R.R., Porter) обнаружил, что после протеолитического расщепления молекулы иммуноглобулина (молекулярная масса 150000 Да) ферментом папаином получаются три фрагмента примерно одинаковой величины (рис. 4.2). Два фрагмента сохраняют способность к специфическому связыванию антигена, хотя в отличие от интактной молекулы утрачивают способность к преципитации антигена в растворе.
Рис 4.2. Протеолитическое расщепление иммуноглобулина с использованием папаина и пепсина
Эти два фрагмента назвали Fab-фрагментами (fragment antigen binding — фрагмент, связывающий антиген), их считают моновалентными (имеющими по одному связывающему центру) и идентичными по всем параметрам. Третий фрагмент может быть выкристаллизован из раствора, что указывает на его явную гомогенность. Он называется Fc-фрагментом (crystallizable fragment — кристаллизуемый фрагмент). Он не может связываться с антигеном, но, как было показано в дальнейшем, отвечает за биологические функции молекулы антитела после того, как антиген связывается с Fab-фрагментом интактной молекулы.
Примерно в то же время в США Д. Г. Эдельман (D. H.Edelman) обнаружил, что при воздействии меркаптоэтанола (реактива, разрушающего S — S-мостики) молекула γ-глобулина значительно уменьшается; она разделяется на четыре цепи: две одинаковые легкие цепи молекулярной массой около 53000 Да каждая и две другие примерно по 22000 Да каждая. Более крупные молекулы были названы тяжелыми (heavy — Н) цепями, а более мелкие — легкими (light — L). На основании этих результатов была определена структура молекул иммуноглобулина, как она представлена на рис. 4.2.
В последующем была доказана принципиальная правильность модели, а Р. Р. Портер и Д. Г. Эдельман поделили Нобелевскую премию за открытие структуры антител. Таким образом, все молекулы иммуноглобулина имеют базовую структуру, состоящую из четырех полипептидных цепей — двух одинаковых тяжелых и двух одинаковых легких, связанных несколькими дисульфидными мостиками. Следует отметить, что папаин расщепляет иммуноглобулиновую молекулу в N-терминальном конце шарнирной области до дисульфидного мостика, в результате чего получаются два моновалентных Fab- и Fc-фрагмента.
В отличие от папаина пепсин расщепляет шарнирную область в С-терминальном конце ниже дисульфидного мостика, что приводит к получению двухвалентного фрагмента, названного F(ab’)2, в котором содержатся два Fab-фрагмента, соединенных дисульфидным мостиком, а также несколько Fc-субфрагментов (см. рис. 4.2). Детально базовая структура молекулы иммуноглобулина, состоящая из двух гликозилированных тяжелых и двух легких цепей, представлена на рис. 4.3.
Заметьте, что кроме дисульфидных мостиков между цепями, которые удерживают их вместе, внутри каждой тяжелой и легкой цепи содержатся дисульфидные мостики создающие иммуноглобулиновые (петлевые) домены, которые формируют антипараллельную β-складку — структуру, характерную для молекул антител. Другие молекулы, принадлежащие к так называемому суперсемейству иммуноглобулинов, также обладают этим структурным признаком.

Рис. 4.3. Молекула иммуноглобулина с наличием иммуноглобулиновых петлевых доменов, сформированных дисульфидными мостиками внутри цепей
Как в случае с другими белками, иммуноглобулины одного вида иммуногенны для другого вида. Использование иммуноглобулинов определенного вида в качестве иммуногенов у другого вида позволяет вырабатывать различные антисыворотки, которые способны распознавать структуру разных цепей иммуноглобулинов. При совместном использовании биохимических и серологических (с использованием сывороточных антител) методов было показано, что почти у всех исследованных видов животных имеются два основных класса легких цепей: κ и λ.
У животных каждого вида продуцируются легкие цепи обоих типов, но соотношение κ- и λ-цепей различны для каждого вида (у мыши 95 % κ-цепей, у человека 60%). Однако в любой молекуле иммуноглобулина обе легкие цепи всегда или κ-, или λ-типа; никогда не бывает по одной цепи каждого типа. Хотя существует всего два типа легких цепей, было показано, что иммуноглобулины практически у всех видов состоят из пяти разных классов (изотипов), различающихся по структуре тяжелых цепей.
Эти тяжелые цепи различаются по антигенным свойствам (серологически), содержанию углеводородов и размеру. Более важно то, что они определяют различные биологические свойства, присущие каждому изотипу. Тяжелые цепи, чьи константные области являются производными генов тяжелых цепей иммуноглобулинов, обозначаются греческими буквами, как показано в табл. 4.1.
Гены, кодирующие константные области тяжелых цепей, обозначаются сходным образом. Поэтому гены, кодирующие константные (С) области, отвечающие за μ, δ, γ, α и ε тяжелые цепи, называются Сμ, Сδ, Сγ, Сα, Сε соответственно.
Таблица 4.1. Распределение иммуноглобулинов по изотипам в соответствии с наличием тяжелых цепей
| Изотип | Тяжелая цепь | Изотип | Тяжелая цепь |
| IgM | μ | IgA | α |
| IgD | δ | IgE | ε |
| IgG | γ |
У представителей любого вида есть тяжелые цепи в пропорциях, характерных для данного вида, но в любой молекуле антитела обе тяжелые цепи идентичны (например 2γ, 2ε). Таким образом, молекула антитела класса IgG может иметь структуру κ2γ2 с двумя идентичными легкими κ-цепями и двумя тяжелыми γ-цепями. В отличие от этого антитело класса IgE может иметь структуру κ2ε2 или λ2ε2. В каждом случае именно природа тяжелых цепей придает молекуле ее уникальные биологические свойства, такие как период полураспада в кровотоке, способность связываться с определенными рецепторами и активировать ферменты в комбинации с антигенами.
Дальнейшее определение характеристик этих изотипов с помощью специфических антисывороток привело к выявлению ряда подклассов, имеющих более тонкие отличия. Так, основной класс IgG человека может быть разделен на подклассы IgG1 IgG2, IgG3 и IgG4. Иммуноглобулин А также был разделен на два подкласса: IgA1 и lgA2. Подклассы отличаются друг от друга по числу и организации дисульфидных мостиков между цепями, а также по изменениям в других структурных свойствах. Эти изменения в свою очередь вызывают изменения функциональных свойств, как описано далее.
Домены
На ранних этапах исследования структуры иммуноглобулинов стало ясно, что кроме дисульфидных мостиков, которые удерживают вместе легкие и тяжелые цепи, а также две тяжелые цепи, внутри каждой цепи существуют дисульфидные мостики, формирующие петли в структуре каждой цепи. Глобулярная структура иммуноглобулинов и способность ферментов расщеплять эти молекулы на крупные составляющие в строго определенных местах, а не разрушать их до олигопептидов и аминокислот, указывает на чрезвычайную компактность структуры.Более того, наличие дисульфидных мостиков внутри цепи через регулярные и примерно равные промежутки по 100—110 аминокислот означает, что каждая петля в пептидных цепях должна формировать компактно сложенный глобулярный домен. В действительности каждая легкая цепь имеет по два домена, а тяжелые цепи — по четыре или пять доменов, разделенных несложно организованными отрезками (см. рис. 4.3). Наличие таких конфигураций было подтверждено прямыми наблюдениями и с помощью генетического анализа.
Молекулы иммуноглобулинов собраны из отдельных доменов, каждый из которых располагается вокруг дисульфидного мостика и настолько гомологичен остальным, что можно предположить, что они развились из одного общего гена-предшественника, который дуплицировал себя несколько раз, а затем изменил свою аминокислотную последовательность, чтобы получившиеся разные домены выполняли различные функции. Каждый домен обозначают буквой, означающей его принадлежность к легкой или тяжелой цепи, и числом, указывающим его положение.
Как мы детально рассмотрим далее, первый домен на легкой и тяжелой цепях всех антител крайне вариабелен по последовательности аминокислот; он обозначается как VL и VH соответственно (см. рис. 4.3). Второй и последующие домены на обеих тяжелых цепях гораздо более постоянны по последовательности аминокислот и обозначаются CL или Сн1, Сн2 и Сн3 (см. рис. 4.3). В дополнение к дисульфидным мостикам между цепями глобулярные домены связываются друг с другом в гомологичные пары в основном за счет гидрофобных взаимодействий в следующем порядке: VHVL, Ch2Cl, Сн2Сн2, Сн3Сн3.
Шарнирная область
У иммуноглобулинов (возможно, за исключением IgM и IgE) шарнирная область состоит из короткого сегмента аминокислот и обнаруживается между участками Сн1 и Сн2 тяжелых цепей (см. рис. 4.3). Этот сегмент состоит преимущественно из остатков цистеина и пролина. Цистеины вовлечены в формирование дисульфидных мостиков между цепями, а пролиновые остатки предотвращают складывание в глобулярную структуру. Этот участок тяжелой цепи отвечает за важную структурную характеристику иммуноглобулинов.Он обеспечивает подвижность между двумя Fab-фрагментами Ү-образной молекулы антитела. Это позволяет Fab-фрагментам открываться и закрываться, чтобы обеспечивать связывание с двумя эпитопами, разделенными фиксированным промежутком, что может наблюдаться на поверхности бактерии. Кроме того, поскольку этот отрезок аминокислот открыт и доступен, как любой другой несвернутый пептид, он может быть расщеплен протеазами для получения Fab- и Fc-фрагментов, описанных ранее (см. рис. 4.2).
Вариабельная область
Биологические функции молекулы антитела проистекают из свойств константной области, которая идентична для антител любой специфичности внутри определенного класса. При этом часть молекулы, которая связывается с эпитопом, составляет вариабельную область. Основной проблемой для иммунологов было определение, каким образом вариабельная область может обеспечить такое большое разнообразие индивидуальных специфичностей, которое необходимо для соответствия огромному количеству антигенов.Когда была определена последовательность аминокислот у белков с высокой однородностью (например, миеломные белки и белки Бенс-Джонса), обнаружили, что наибольшая вариабельность последовательностей существует для 110 N-терминальных аминокислот как легкой, так и тяжелой цепей. Е.А.Кабат (E.A.Kabat) и Т.Т.Ву (T.T.Wu) сравнили последовательность аминокислот многих Vl- и Vн-областей. Они схематически представили вариабельность аминокислот в каждой позиции цепи и показали, что наибольшая степень вариабельности (определяемая соотношением числа различных аминокислот в данной позиции к частоте наиболее характерных аминокислот в данной позиции) наблюдается в трех областях легкой и трех областях тяжелой цепи.
Эти участки называются гипервариабельными. Менее вариабельные участки, которые находятся между гипервариабельными участками, называются каркасными. Теперь известно, что гипервариабельные участки принимают участие в связывании антигена и формируют регион, комплементарный по структуре эпитопу антигена. Исходя из этого, гипервариабельные участки называются участками, определяющими комплементарность легких и тяжелых цепей: CDR1, CDR2 и CDR3 (рис. 4.4).

Рис. 4.4. Вариабельность аминокислот, составляющих N-концевые остатки VHf в молекуле иммуноглобулина
Гипервариабельные участки, хотя и разделены в линейной двухмерной модели пептидных цепей, в действительности приближены друг к другу в свернутой форме интактной молекулы антитела. Вместе они составляют антигенсвязывающий центр, комплементарный эпитопу (рис. 4.5).

Рис. 4.5. Комплементарность между эпитопом и анти генсвязывающим центром, состоящим из гипервариабельных участков L- и Н-цепей. Пронумерованные буквы обозначают CDR тяжелой и легкой цепей, номера в кружках — номера аминокислотных остатков в CDR
Вариабельность этих CDR обеспечивает различия в конфигурации антигенсвязывающего центра, которые необходимы для функционирования антител различной специфичности. Все известные силы, вовлеченные во взаимодействие антиген — антитело, являются слабыми нековалентными взаимодействиями (например, ионные, водородные, ван-дер-ваальсовы силы и гидрофобные взаимодействия). Поэтому необходимо, чтобы между антигеном и антителом был тесный контакт в достаточно большой области, чтобы обеспечить общую связывающую силу, адекватную для устойчивого взаимодействия. В соединении между эпитопом и антителом участвуют и тяжелая, и легкая цепи.
Теперь должно быть ясно, что две молекулы антитела с разной антигенной специфичностью должны иметь и различную последовательность аминокислот в своих гипервариабельных участках, а те, которые обладают одинаковой последовательностью, обычно имеют и одинаковую специфичность. Однако существует возможность, что два антитела с разной последовательностью аминокислот обладают специфичностью к одному и тому же эпитопу. В этом случае аффинность связывания антител с эпитопом будет, вероятно, различной, поскольку будут существовать различия в числе и типах связывающих сил, доступных для связывания идентичных антигенов с разными связывающими участками двух антител.
Дополнительный источник вариабельности может заключаться в размере антигенсвязывающего участка на антителе, который обычно (но не всегда) имеет форму углубления или щели. В некоторых случаях, особенно если вовлечены небольшие гидрофобные гаптены, эпитопы занимают не весь антигенсвязывающий участок. Однако при этом достигается достаточная аффинность связывания. Было показано, что антитела, специфичные для таких небольших гаптенов, могут в действительности реагировать с другими антигенами, не обладающими явным сходством с гаптеном (например, динитрофенол и эритроциты барана). Эти большие отличающиеся антигены связываются или с большим участком, или же с другим участком антигенсвязывающего центра на антителе (рис. 4.6).

Рис. 4.6. Варианты того, как антитело (АТ1) определенной специфичности может проявлять способность к связыванию с двумя различными эпитопами (АГ1 и АГ2)
Таким образом, способность определенного антигенсвязывающего центра связываться с двумя (или более) действительно различными эпитопами называют избыточностью. Способность одной молекулы антитела перекрестно реагировать с неопределенным числом эпитопов может уменьшить количество антител, необходимых для защиты индивида от широкого спектра агрессивных антигенов.
Р.Койко, Д.Саншайн, Э.Бенджамини
Опубликовал Константин Моканов
Антитела
Антитела – это белки сыворотки крови (преимущественно глобулиновой фракции), относящиеся к различным классам иммуноглобулинов, способные специфически связываться с антигеном и участвующие во многих иммунологических реакциях.
Антитела обладают способностью специфически взаимодействовать с детерминантами антигенов. Например, на рисунке видно, что антитело 1 способно реагировать только с антигенной детерминантой 1, антитело 2-е детерминантой 2, антитело 3-е детерминантой 3, антитело 4 — с детерминантой 4.
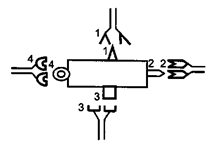
Специфичность иммунитета в большой мере определяется антителами. Человек, переболевший дифтерией, не заболевает этим заболеванием повторно из-за присутствия в его крови антител, способных соединяться и обезвреживать дифтерийный токсин. Однако эти антитела не защищают человека от других заболеваний, например от кори, гриппа или кишечных инфекций. Специфические антитела против дифтерийного токсина, введенные ребенку, создают у него невосприимчивость к заболеванию только дифтерией. В этом проявляется специфичность антител.
Функции AT:
1) взаимодействие с соответствующим АГ;
2) фиксация комплемента;
3) лизис клеток;
4) нейтрализация вирусов и токсинов;
5) опсонизация;
6) проникновение через физиологические барьеры.
Строение молекулы иммуноглобулина было изучено Портером и Эделманом (Нобелевская премия, 1972), которые показали, что она состоит из двух тяжелых полипептидных цепей (Н-цепей из 440-450 аминокислотных остатков, соединенных дисульфидными связями) и двух легких цепей (L-цепей из 220 аминокислотных остатков), которые соединяются с тяжелыми, также дисульфидными связями. Одна тяжелая и одна легкая цепь формируют элементарное звено молекулы им-муноглобулина. Молекулу иммуноглобулина формирует четное число спаренных звеньев.
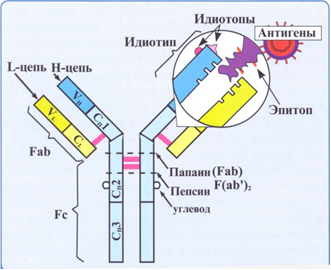
Состав аминокислот в концевых участках L- и Н-цепей вариабельный и определяет специфичность молекулы Ig. Участок L- и Н-цепей связывается с АГ, поэтому называется фрагментом связывания АГ, или Fab. Концевые домены Fab-фрагментов формируют активный центр (паратоп), который состоит из гипервариабельных участков L- и Н-цепей соответственно, строго специфичных определенным эпи топам АГ. Активный центр AT состоит из 15-20 аминокислот и определяет специфичность взаимодействия AT с АГ (другое название активного центра — идиотип, что означает индивидуальность построения его структуры, отличие ее от других активных центров аналогичных AT).
Фрагменты полипептидных цепей с постоянным составом аминокислот АГ не связывают. Этот участок называется Fc-фрагментом.
Функции Fc-фрагмента:
связывает комплемент;
активирует фагоцитоз;
обеспечивает проникновение через плаценту некоторых иммуноглобулинов;
соединяется с рецепторами клеток у цитофильных иммуноглобулинов;
участвует в дегрануляции тучных клеток и базофилов.
Показателями, характеризующими способность антител реагировать с антигеном, являются аффинность и авидность.
Афинность – степень пространственного соответствия структуры антигенсвязывающего центра АТ (паратопа) и антигенной детерминанты АГ (эпитопа).
Авидность – сила прочности и интенсивности связывания Аг и АТ. Наибольшим аффинитетом обладают моноклональные антитела, наименьшим — нормальные или естественные антитела.
Валентность — это количество активных центров AT, которые способны соединяться с антигенными детерминантами.
Характеристика иммуноглобулинов
По физико-химическим и биологическим свойствам выделяют классы иммуноглобулинов: G, М, А, Е, D.
Антитела виды антител — Справочник химика 21
Преимуществом колоночной хроматографии является возможность количественного фракционирования больших количеств веществ без превращения их в какие-либо производные. Однако хорошее разделение часто возможно лишь при малых скоростях элюирования, поэтому были разработаны новые виды колоночной хроматографии. Методы аффинной и адсорбционной хроматографии основаны на избирательной адсорбции молекул на нерастворимом адсорбенте, который содержит группы (молекулы), специфически взаимодействующие с молекулами подлежащих очистке соединений, например ингибиторы (для очистки ферментов) или антитела (для очистки антигенов) в настоящее время эти методы нашли широкое применение и для разделения углеводов. Невзаимодействующие с адсорбентом примеси удаляются, а связанный с адсорбентом сахар затем десорбируют способом, не приводящим к его разрушению. Десорбцию можно осуществить, изменяя pH, ионную силу среды или применяя соответствующий ингибитор взаимодействия, удерживающего вещество на адсорбенте. Для разделения ряда полисахаридов были использованы иммобилизованные формы (см. разд. 26.3.7.6) конканавалина А [40], являющегося фитогемагглютинином (лектином), который специфически взаимодействует с разветвленными полисахаридами определенного строения в настоящее время применяют и другие иммобилизованные фитогемагглютинины. Колоночная хроматография на носителях, покрытых полиароматическими соединениями [41], также находит применение для разделения полисахаридов. Благодаря достижениям в производстве носителей для жидкостной хроматографии под высоким давлением можно осуществить хроматографическое разделение быстро и избирательно описаны методы фракционирования небольших олигосахаридов, продолжающегося менее 1 ч [42]. [c.224]Механизм биосинтеза антител, который в настоящее время активно изучается, становится все более и более понятным. Согласно сегодняшним представлениям иммунный ответ — это сложный процесс межклеточного взаимодействия различных типов лимфоидных клеток с участием специальных гормонов, в результате чего одна группа участников этого процесса — В-клетки — начинает активно синтезировать и выделять в кровь специфические антитела против данного антигена. На поверхности В-клеток предсуществуют рецепторы, аналогичные антителам, взаимодействие которых с антигеном в сложном межклеточном комплексе служит стимулом для начала биосинтеза антитела. Следует отметить, что иммунный ответ на одно вещество сопровождается синтезом различных видов антител, имеющих у разных особей различный состав, что отражает генетические особенности каждого организма. [c.103]
В принципе возможен систематический анализ любой системы иммуноглобулин — лиганд. Исследование моделей связывания может проводиться систематическим образом, поскольку у млекопитающих, например кроликов или коз, синтез антител может индуцироваться по отношению к любой специально подобранной молекуле (с низкой или высокой молекулярной массой). Используя аффинную хроматографию, получаемые антитела затем очищаются. Как правило, эта процедура приводит к вырожденному иммунному ответу, т. е. к синтезу нескольких видов антител несколькими клонами так называемых клеток плазмы (542]. Эти антитела отличаются константами сродства к лиганду, что проявляется также в химических, спектральных и иммунологических свойствах центров связывания. Последующие анализы аминокислотной последовательности показали, что различия вызваны аминокислотными заменами в гипер-вариабельных областях доменов /ь и Ун [622]. На первый взгляд кажется, что вырожденный ответ должен усложнить пространственную организацию центров связывания. В действительности, однако, в этом случае возможно объединить и взаимно контролировать данные по нескольким центрам связывания, что заметно увеличивает вероятность нахождения правильных моделей. [c.245]
Синтез природных антител — это настоящее чудо. Антитело — очень сложная тетрамерная конструкция, состоящая из двух пар разных цепей. Одна из них называется тяжелой (Н), а другая — легкой X или к). Эти термины отражают различия в молекулярных массах субъединиц антитела. Генетические особенности каждой тяжелой цепи определяются комбинацией вариабельного (Vjj), дивергентного (Dp ), шарнирного (Тд) и константного (С ) участков (доменов) соматической ДНК в В-клетке. Известны два типа легких цепей, X и к, которые образуются в результате перестройки их собственных вариабельных (УХ, Vk), шарнирных (JX, Jk) и константных (С , Ск) доменов. Данная В-клетка синтезирует один вид антител, с уникальной комбинацией участков, составляющих Н-цепь, и либо перестроенной X-, либо к-цепью. [c.429]
Антитела — это белки, синтезируемые зрелыми формами В-лимфоцитов (В-клетками), которые возникают при дифференцировке стволовых клеток в костном мозге. Взрослый человек обычно способен производить до 10 —10 различных В-клеток. Каждая В-клетка может синтезировать единичный вид антител против какого-нибудь чужеродного соединения, называемого антигеном. [c.315]
Говорит ли наличие нескольких полос преципитации за или против высокой специфичности серологических реакций (мы ведь хотим проникнуть в тайны иммунохимии именно при помощи специфичности) На этот вопрос мы пока не можем ответить однозначно нам нужно знать, содержался ли в исследуемой антисыворотке один или несколько видов антител если только один, значит, он один должен был реагировать с различными [c.328]
Но если антиген несет различные детерминантные группы, то тогда вообще не может образоваться один вид антител к данному антигену, а вместо этого возникает по меньшей мере столько же различных антител, сколько имеется различных детерминантных групп. Таким образом, обычно возникает целое семейство антител — каждый член этого семейства [c.331]
Известно свыше 12 различных сахаров, способных участвовать в качестве отдельных кирпичиков в построении полисахаридной части капсулы. Обычно, правда, капсулу образуют не более 3—5 из них они объединяются в группы, которые затем регулярно повторяются. Каждой такой комбинации из 3—5 субъединиц соответствует свой специфический вид антител. А поскольку замещение даже одной-единственной молекулы сахара другой, несколько иначе построенной, означает изменение детерминантной группы и, следовательно, вызывает образование других антител, то должны существовать сотни различных антител, т. е., как говорят, сотни серотипов . Исследование их родства, позволяющее распознать генетические и эволюционные взаимоотношения между организмами, само по себе могло бы послужить темой целой книги — здесь мы вынуждены оставить все это в стороне. [c.334]
Методом ультрацентрифугирования установлено, что у человека, кролика, а также у животных многих других видов антитела имеют молекулярный вес, характерный для -глобулинов, а именно около 160 000. [c.14]
При проведении аналогичных опытов с использованием растительных агглютининов вместо антисывороток животных получаются,
