Антитела [Иммуноглобулины] — определение, норма, свойства, какие, выявление, виды, вики — Wiki-Med
Основная статья: Гуморальный иммунитетСодержание (план)
Строение иммуноглобулинов
Антитела разных классов имеют общие черты строения (рис. 17. 18, 19).
Мономерная молекула иммуноглобулина имеет Y-образную форму и состоит из двух тяжелых и двух легких цепей, которые имеют разную длину и объединены дисульфидными связями. Цепи состоят из аминокислот определенной последовательности. Молекула иммуноглобулина G имеет два одинаковых Fab- фрагмента, каждый из которых состоит из целой легкой и части тяжелой цепи. Именно здесь содержится антигенсвязывающий сайт (участок). Хвостовая часть молекулы представлена одним Fc-фрагментом (константный участок), образованным продолжением тяжелых цепей. С помощью константного участка иммуноглобулин связывается с рецептором к Fc-фрагменту мембран разных клеток (макрофагов, дендритных клеток). Конечные участки тяжелой и легкой цени Fab-фрагмента достаточно разнообразны (вариабельны) и являются специфическими к определенному антигену. Отдельные зоны этих цепей отличаются гипервариабельностью (особенным разнообразием), Шарнирная зона, расположенная между двумя вариабельными и константным участком, позволяет свободно смещаться Fab-фрагментам относительно друг друга и относительно Fc-фрагмента, что имеет важное значение для эффективного взаимодействия антител с антигенными детерминантами возбудителей (позволяет пространственно «приспосабливаться» к антигену).
Синтез антител
см. Синтез антител, Гуморальный иммунный ответ
IgM и IgG синтезируются преимущественно в селезенке и регионарных лимфоузлах внутренних органов, IgA в диффузных скоплениях лимфоидной ткани и солитарных фолликулах слизистых оболочек, a IgE — преимущественно в регионарных лимфоузлах, слизистых оболочках и коже.
Т-зависимый синтез антител
Для полноценной активации В-лимфоциты должны получить два сигнала — первый от специфического антигена при распознавании его иммуноглобулиновым рецептором, а второй от Т-хелпера путем антигенной презентации и взаимодействия молекул CD40 и CD40L Первый сигнал свидетельствует о наличии во внутренней среде клетки антигенной детерминанты, которую способен распознать данный В-лимфоцит. Второй является своеобразным «разрешением» со стороны Т-хелпера на синтез специфических антител к ней. Описанные реакции являются основой Т-зависимого синтеза антител.
Антигенная стимуляция
Активация В-клеток происходит после взаимодействия их рецепторов антигенного распознавания со специфическим антигеном, поступившим в организм. Дело в том, что рецепторы антигенного распознавания этих клеток — не что иное, как те же антигенспецифические антитела, которые способен синтезировать данный В-лимфоцит. Такие антитела не секретируются клетками в тканевую жидкость, а остаются фиксированными на внешней поверхности мембраны В лимфоцита и при связывании специфического антигена активируют В-клетку. Но этого стимула недостаточно для полноценной активации, поскольку формируется слабый по силе стимуляционный сигнал.
Антигенная презентация
Необходимо дополнительное взаимодействие с активированным антигенспецифическим Т-лимфоцитом, именуемым хелпером, которое состоит в непосредственном контакте с Т-лимфоцитом и во влиянии синтезированных им иммунных медиаторов — цитокинов. Суть непосредственного контакта между двумя лимфоцитами состоит во взаимодействии комплекса иммуногенный пептид — молекула HLA II В-лимфоцита с антигенраспознающим рецептором Т-хелпера (т.е. в осуществлении антигенной презентации). Это ведущий механизм отбора наиболее специфических к антигену В-клеток. Также при контакте лимфоцитов происходит взаимодействие молекулы CD40, которая активно экспрессируется на поверхности В-клетки после связывания специфического антигена, и CD40-лиганда (CD40L), появляющимся на мембране активированного Т-хелпера. Подобное взаимодействие создает костимулирующий сигнал, необходимый для полноценной активации иммунокомпетентных клеток. Важно отметить, что комплексирование CD40-CD40L также необходимо для переключения плазматических клеток на синтез иммуноглобулинов другого класса.
Т-независимый синтез антител
В отдельных случаях, когда в организм поступает патоген, являющийся полимером и состоящий из многократно повторяющихся мономеров с антигенными свойствами, возможна активация В-лимфоцита при непосредственном взаимодействии с антигенами без участия Т-клеток (Т-независимый синтез антител). В подобном случае взаимодействие многочисленных антигенов-мономеров патогена с иммуноглобулиновыми рецепторами В-лимфоцита на ограниченном мембранном участке создает достаточно сильный локальный стимуляционный сигнал для активации лимфоцита. Так как активационный сигнал достаточно сильный, необходимость в дополнительном взаимодействии с Т-хелпером отпадает. Следует отметить, что отсутствие Т-хелперной поддержки накладывает существенный отпечаток на качество иммунного ответа. Так, при Т-независимых иммунных реакциях синтезируются лишь иммуноглобулины класса М и не формируется иммунная память.
Функции антител
см. Функции антител
Уровень иммуноглобулинов в плазме крови характеризует функциональное состояние В-звена иммунитета (табл. 3).
Содержание в сыворотке (г/л) | Функции | Т созревания | Т 1/2 |
IgM — 10% (0,5-2 г/л) | Бактериолизины, цитолизины, ревматоидный фактор, изогемагглютинины, антитела против грамотрицательных бактерий, шигелл, палочек брюшного тифа. Активирует систему комплемента. Принимает участие в первичном иммунном ответе | До 1 года жизни | 5 суток |
IgG- 75% (7-20 г/л) Выделяют 4 изотипа | Антитела против вирусов, нейротоксинов, грамположительных бактерий, возбудителей столбняка, малярии Активирует систему комплемента. Принимает участие во вторичном иммунном ответе и в образовании иммунных комплексов | До 2 лет жизни | 23 суток |
IgA — 15% (0,7-5 г/л) Выделяют 2 изотипа | Изогемагглютинины, антитела против вирусов, бактерий. Местный иммунитет — сывороточный и секреторный иммуноглобулины. Не активирует систему комплемента | До 12 лет жизни | 6 суток |
IgE (0,02-0,04 г/л) | Нормальные антитела очага альтерации. Активируют макрофаги и эозинофилы, усиливают фагоцитоз и активность нейтрофилов | До 15 лет | 2 суток |
IgD (0,000001- 0003 г/л) | Функция практически не измена, обладают антивирусной активностью. Пребывают ь ткани миндалин, аденоидов. Не активируют систему комплемента | 3 суток |
Классы антител
Существует 5 классов антител (иммуноглобулинов): IgG, IgM, IgA, lgE, IgD, которые отличаются по строению константных участков тяжелых цепей и функциональным свойствам.
Иммуноглобулины делятся на классы и подклассы (изотипы) в зависимости от строения константных участков тяжелых цепей. Отличия между указанными участками определяют особенности функциональных свойств каждого класса иммуноглобулинов.
IgG
IgG — мономер, состоящий из двух тяжелых и двух легких цепей. Такие антитела являются бивалентными, поскольку содержат лишь два Fab-фрагмента. Класс IgG имеет 4 изотипа: (IgG1, IgG2 , IgG3, IgG4) (см. рис. 20), которые отличаются эффекторными функциями и специфичностью. Антитела к липополисахаридам относятся к субклассу IgG2, антирезусные антитела — к IgG4. Антитела субклассов IgG1 и IgG4 принимают участие в опсонизации. Для этого они специфически связываются посредством Fab- фрагментов с возбудителем, а посредством Fc-фрагмента — с соответствующими рецепторами фагоцитов, что способствует захвату патогена.
IgG составляет 70-75 % общего пула иммуноглобулинов плазмы крови, проходит через плацентарный барьер, эффективно активирует систему комплемента.
К иммуноглобулинам класса G относятся антитела против большинства антигенов различной природы. В первую очередь с этими иммуноглобулинами связывают защиту от грамположительных бактерий, токсинов, вирусов (например, от вируса полиомиелита, где IgG принадлежит ведущая роль). Он считается иммуноглобулином вторичного иммунного ответа.
IgA
IgA может встречаться в форме мономеров, димеров и тримеров. Он имеет сывороточную (IgA1 и А2) и секреторную формы, существенно отличающиеся между собой.
Секреторный иммуноглобулин A
Секреторный иммуноглобулин A (sIgA) состоит из двух молекул сывороточного, объединенных в единую молекулу джоинг-цепью (от англ. to join — соединять) и содержащими секреторный (транспортный) компонент, который обеспечивает защиту от протеолитических ферментов (рис. 20). Секреторный компонент синтезируется эпителием слизистой оболочки, поэтому содержится только в антителах, которые находятся на слизистых. Таким образом, slgA пребывает в биологических жидкостях (молозиво, молоко, слюна, бронхиальный и желудочно-кишечный секрет, желчь, моча) и играет важную роль в формировании местных механизмов резистентности. Он противодействует массированному поступлению антигенов через слизистые оболочки, препятствует прикреплению бактерий к слизистым, нейтрализует энтеротоксины, способствует фагоцитозу. В реакциях гиперчувствительности немедленного типа он действует в качестве блокирующего антитела. Этот иммуноглобулин не проникает через плаценту и не способен активировать систему комплемента. Материал с сайта http://wiki-med.com
IgM
IgM — пентамер, состоящий из пяти молекул IgG, объединенных джоинг-цепью, поэтому он способен связать 10 молекул антигена (рис. 21). На долю IgM приходится около 10% общего количества иммуноглобулинов. К классу IgM относится основная масса антител против полисахаридных антигенов и антигенов грамотрицательных бактерий, а также ревматоидный фактор, гематтлютинины крови. Иммуноглобулины этого класса синтезируются в ответ на большинство антигенов на ранних стадиях иммунного ответа, то есть это антитела первичного иммунного ответа. В дальнейшем происходит переключение на синтез IgG (или антител другого класса), которые являются более специфическими и лучше проникают в ткани (имеют меньший размер). IgM вместе с IgA принимает участие в местном иммунитете слизистых оболочек. IgM лучше других антител активирует систему комплемента. Он не проходит через плаценту, но синтезируется плодом.
IgE
IgE — мономер, содержащийся в незначительном количестве в сыворотке крови. Этот иммуноглобулин принимает участие в защите от гельминтов и в аллергических реакциях немедленного типа. Защита от гельминтов осуществляется путем связывания IgE через Fab-фрагмент с возбудителем (гельминтом), а через Fc-фрагмент — с рецептором на эозинофиле. Таким образом, происходит реакция антителозависимой клеточно-опосредованной цитотоксичности (АЗКОЦ), приводящая к гибели гельминта. IgE также принимает участие в атопических реакциях.
В последнее время изучается физиологическая роль IgE в защите слизистых. Если инфекционный агент преодолевает преграду образуемую IgA, то в роли следующей линии защиты выступают антитела, относящиеся к классу IgE. Они, связываясь с антигеном Fab-фрагментом, фиксируются Fc-фрагментом на мембранах тучных клеток и базофилов. что приводит к высвобождению биологически активных веществ и развитию экссудативной реакции. IgE не проникает через плаценту и не активирует комплемент.
IgD
IgD — антитела с не установленной точно функцией. Известно лишь, что зрелость В-лимфоцитов определяется именно наличием мембранной формы этого иммуноглобулина. IgD не проникает через плаценту и не активирует комплемент.
На этой странице материал по темам:антитела функции
антитела связаны с клеткой или нет
функция синтеза антител
иммуноглобулин википедия
укажите основные функции антител
2.Антитела, их виды, материальная основа, функции.
Антителами называют белки, образования которых индуцируются антигенами и основным свойством которых является способность к специфическому взаимодействию с антигеном. Антитела – это молекулы гликопротеидов, которые по своей электрофоретической подвижности относятся к µ-глобулинам и по международной классификации именуется иммуноглобулинами. Являются продуктами одного клона клеток-антителпродуцентов. Продукты одного клона – моноклональные антитела. Образованные антитела – поликлональные. Иммунные антитела – продуцируются в организме после иммунизации или в результате инфекционного процесса. Нормальные антитела способствуют индукции первичного иммунного ответа и усиливают фагоцитоз, направляя действие фагоцитов на микробные и другие клетки.
Антитела являются важным специфическим фактором защиты организма против возбудителей болезней и генетически чужеродных веществ. Они образуются в организме в результате естественного инфицирования, вакцинации живыми или убитыми вакцинами, контакта лимфоидной системы с чужеродными клетками или тканями (трансплантанты) либо с собственными аутоантигенами.
Структурная организация Ig. Иммуноглобулины — белки с четвертичной структурой, то есть молекулы построены из нескольких полипептидных цепей. Молекула каждого класса состоит из четырех полипептидных цепей — двух тяжелых и двух легких, связанных между собой дисульфидными мостиками. Легкие цепи (L) являются общими для всех классов и подклассов. Тяжелые цепи (Н) имеют характерные особенности строения у каждого класса (подкласса). Легкие цепи подразделены на два типа: κ (каппа) и λ (лямбда). Тяжелые цепи обозначаются греческими буквами: γ (гамма), μ (мю), α (альфа), β (дельта) и ς (эпсилон)—соответственно латинскому обозначению того или иного класса иммуноглобулинов: IgG, IgM, IgA и др.
Следует отметить, что при анализе аминокислотной последовательности полипептидных цепей иммуноглобулинов оказалось, что в каждой цепи существуют участки длиной около ПО аминокислотных остатков, обладающих высокой степенью подобия первичной и пространственной структур, стабилизированных дисульфидной связью; такие участки цепей иммуноглобулинов были названы доменами.
Механизм образование антител. Установлено, что антитела вырабатываются плазматическими клетками, находящимися в селезенке, лимфатических узлах, костном мозге, пейеровых бляшках. Плазматические клетки (антитело-продуценты) происходят из предшественников В-клеток, подвергшихся контакту с антигеном. В-клетки и их потомки функционируют по клепальному принципу: по мере развития иммунного ответа они дифференцируются, пролиферируют и созревают. Механизм синтеза антител не отличается от синтеза любых белков. Синтез молекул антител происходит на полирибосомах. Легкие и тяжелые цепи, из которых состоит молекула антител, синтезируются раздельно, затем соединяются на полирибосомах, и окончательная сборка происходит в пластинчатом комплексе. Одна плазматическая клетка может переключаться с синтеза IgM на синтез IgG.
При первичном иммунном ответе в антителообразовании различают две фазы: индуктивную (латентную) и продуктивную. Индуктивная фаза—от момента парентерального введения антигена до появления лимфоидных антиген-реактивных клеток. Продолжительность этой фазы не более суток. В этот период происходит пролиферация и дифференцировка лимфоидных клеток в направлении синтеза иммуноглобулина класса IgM. Вслед за индуктивной фазой наступает продуктивная фаза антителообразования. В этот период, примерно до 10—15-го дня, кривая антител резко возрастает, уменьшается число клеток, синтезирующих IgM, начинает нарастать продукция IgG.
В случае повторной иммунизации спустя 2—4 нед и даже несколько месяцев и лет организм может ответить усиленной выработкой иммуноглобулинов на гомологичный и даже гетерологичный антигены. Эта реакция получила название вторичного иммунного ответа; она базируется на иммунологической памяти.
Антигены и антитела
Антигены – это вещества несущие признаки генетически чужеродности и при введении в организм вызывают развитие специфических иммунологических реакций (синтез антител, реакции клеточного иммунитета, повышенную чувствительность, иммунологическую толерантность, а также иммунологическую память).
Антигены – это органические вещества микробного, растительного и животного происхождения, химические элементы, простые и сложные, неорганические соединения антигенностью не обладают.
Ряд субстанций самостоятельно не вызывают иммунный ответ, но приобретают эту способность будучи конъюгированными с высокомолекулярными белковыми носителями – неполные антигены (гаптены). Антигенами являются бактерии, грибы, вирусы, микробные токсины и т. д. Бактериальные и вирусные корпускулы, клетки животных организмов представляют сложные в химическом отношении образования. Например, в составе стрептококка гр. А выявлено 7 антигенов.
Иммунный ответ индуцируют только полные антигены. Полные антигены могут иметь в сваоем составе 2 и более однозначно детерминированные группировки и являются 2-х валентными или поливалентными. Гаптены имеют лишь одну детерминантную группировку, т. е. являются одновалентными.
Классификация антигенов. Антигенность вещества и видовые особенности реципиента.
Антигенность веществ, помимо их физико-химических свойств обусловлена и другими факторами. В частности, она зависит от видовых и индивидуальных особенностей реципиента.
Сила антигена пропорциональна доле иммунокомпетентных клеток в лимфоидной ткани реципиента, способных реагировать на данный антиген. Чем меньше клеток, реактивных к данному антигену, тем он слабее.
Антигеность веществ зависит от видовой принадлежности животных: чем дальше в филогенетическом отношении отстоят животные, тем более чужеродными друг для друга являются их ткани, и тем более они антигеннее.
Белки, выполняющие одинаковые функции в организме разных животных, обладают относительно низкой степенью антигенности (так, гемоглобин млекопитающих обычно не вызывает образования антител у человека).
Химическая природа антигенов.
Антигенами являются органические вещества различного происхождения. По химической природе антигены – белки, полисахариды, липиды и их соединения. Вещества с более сложной химической структурой обладают более высокой антигенностью. Наиболее выраженными антигенными свойствами обладают белки. Одно и то же химическое вещество может быть высокоантигенным для одних видов животных и не антигенным для других. Например, стрептококк I типа вызывает синтез антител у мышей, кошек, собак, человека, но не вызывает образование антител у крыс, морских свинок, кроликов.
Свойства антигенов. Генетическая чужеродность.
Каждому организму присуща генетическая специфичность и стабильность физико-химического строения.
Первым условием антигенности вещества является его чужеродность в генетическом отношении. Вещество обладает антигенными свойствами для данного животного в том случае, если оно генетически чужеродно для его лимфоидной системы. Степнь чужеродности является важным фактором иммунногенности антигена. Вещества, близкие химическом отношении собственным антителам, слабо антигенны или же не антигеннны вовсе. Например, гемоглобин и инсулин разных видов животных слабо антигенны в виду сходства их химической структуры.
Рассказать о чужеродности экбарьерных антигенов.
Забарьерные антигены.
Классификация антигенов (по признаку генетической чужеродности).
Тип антигенов | Примеры | Роль в развитии цитологического процесса |
| Органо-специфические антигены (щитовидная железа, хрусталик). | Аутоиммунные болезни (тиреоидит). |
| Иммуноглобулин-специфические антигены антител, синтезированные данным клоном. | Регуляция синтеза антител. |
(изоантигены) | Антигены гистосовместимости, группы крови. | Реакции трансплантационного иммунитета, гемолитическая болезнь новорожденных. |
| Почечные и сердечные антигены, перекрестно реагирующие с антигенами В-гемолитические стрептококки. | Роль в патогенезе аутоиммунных заболеваний (гломерулонефрит, коллагеназы). |
происхождения | Микробы, пища, пыльца, пыль, лекарства и др. | Инфекционные и аллергические заболевания. |
Макромолекулярность.
Антигены – высокомолекулярные соединения. Белковые вещества проявляют антигенные свойства при мм выше 10 000, и по мере увеличения мм антигенность их повышается.
В прямой зависимости от мм находится его валентность. Валентность антигена – это количество детерминант на молекуле антигена или, точнее, число молекул антител, которые могут с ней соединится. Антигенность веществ зависит от сложности их молекул и количества детерминант.
Например, растворимые белки сыворотки крови в мономерной форме слабо антигенны или вовсе не антигенны.
Растворимые антигены вызывают менее интенсивный иммунный ответ, чем аггрессивные. В порядке исключения известны антигены с небольшой мм и обладающие антигенностью (при мм – 2000 – 4000). Низкомолекулярные антигены: вазопрессин – 1000 мм
ангиотензин –1000 мм
глюкагон – 3500 мм
АКТГ – 3900 мм
инсулин – 6000 мм
гаптоглобин – 9000 мм
Специфичность антигенов.
Определяется химическим составом и структурными особенностями их молекул.
Специфичность антигенов – это способность индуцировать синтез антител, комплементаных данному антигену, более активно взаимодействующих с данным антигеном по сравнению с родственными.
Виды специфичности антигенов:
Видовая (у животных данного вида).
Групповая специфичность (среди животных одного и того же вида имеются группы, отличающиеся специфическими антигенами. Например, изоантигены эритроцитов, HLA-системы, групповые антигены микробов. Так сальмонеллы по общим соматическим 0-антигенам объединяются в серологические группы).
Органная специфичность (ткани каждого органа имеют специфическую химическую структуру, поэтому при иммунизации ими, они индуцируют синтез специфических антител (они выявлены в легких, почках, щитовидной железе, нервной ткани)).
Тканевая специфичность ткани, хрусталик (антигены образуются только в данном виде тканей).
Органоидная специфичность (органоиды клеток имеют специфические антигены)
Дифференцированные антигены – новые антигены. Которые появляются на ЦПМ клетке в процессе их морфологической дифференцировки. По таким антигенам дифференцируют субпопуляции лимфоцитов.
IgM обеспечивает:
нейтрализацию,
опсонизацию маркирование антигена,
осуществляет запуск комплемент-опосредованного цитолиза
антителозависимой клеточно-опосредованной цитотоксичности.
Иммуноглобулин класса А. Существует в сывороточной и секреторной формах. Около 60 % I всех IgA содержится в секретах слизистых. Сывороточный IgA: На его долю приходится около 10—15 % всех сывороточных Ig. В сыворотке крови здорового взрослого человека содержится около 2,5 г/л IgA, максимум достигается к 10-летнему возрасту. Период полураспада IgA — 6 дней.
IgA — мономер, имеет 2 антигенсвязывающих центра (т. е. 2-валентный), молекулярную массу около 170 кДа и константу седиментации 7S. Различают подтипы А1 и А2.
Синтезируется зрелыми В-лимфоцитами (Ва) и плазматическими клетками. Хорошо определяется в сыворотке крови на пике первичного и при вторичном иммунном ответе.
Обладает высокой аффинностью. Может быть неполным антителом. Не связывает комплемент.
Не проходит через плацентарный барьер.
IgA обеспечивает:
нейтрализацию,
опсонизацию
маркирование антигена,
осуществляет запуск антителозависимой клеточно-опос-редованной цитотоксичности.
Секреторный IgA: В отличие от сывороточного, секреторный IgA (slgA) существует в полимерной форме в виде ди- или тримера (4- или 6-валентный) и содержит J- и S-nenтиды. Молекулярная масса 350 кДа и выше, константа седиментации 13S и выше.
Синтезируется Ва-лимфоцитами и их потомками — плазматическими клетками соответствующей специализации только в пределах слизистых и выделяется в их секреты. Объем продукции может достигать 5 г в сутки. Пул slgA считается самым многочисленным в организме — его количество превышает суммарное содержание IgM и IgG. В сыворотке крови slgA не обнаруживается.
Формирование молекулы slgA происходит при прохождении через эпителиальную клетку, где он присоединяется к секреторному компоненту. На базальной и латеральной поверхности эпителиальная клетка несет рецептор к J-цепи полимерной молекулы Ig (JR). Образующийся после взаимодействия этого рецептора с полимерной молекулой IgA комплекс эндоцитиру-ется клеткой в виде везикулы. Затем везикула переносится к апикальной поверхности эпите-лиоцита, где JR подвергается ферментативному расщеплению. В итоге IgA высвобождается в слизистый секрет просвета органа уже в секреторной форме — оставшийся прикрепленным к молекуле Ig фрагмент JR является S-цепью.
Секреторная форма IgA — основной фактор специфического гуморального местного иммунитета слизистых оболочек желудочно-кишечного тракта, мочеполовой системы и респираторного тракта. Благодаря S-цепи он устойчив к действию протеаз. slgA не активирует комплемент, но эффективно связывается с антигенами и нейтрализует их. Он препятствует адгезии микробов на эпителиальных клетках и генерализации инфекции в пределах слизистых.
Иммуноглобулин класса Е. Называют также реагином. Содержание в сыворотке крови крайне невысоко — примерно 0,00025 г/л. Обнаружение требует применения специальных высокочувствительных методов диагностики. Молекулярная масса — около 190 кДа, константа седиментации — примерно 8S, мономер. На его долю приходится около 0,002 % всех циркулирующих Ig. Этот уровень достигается к 10—15 годам жизни.
Синтезируется зрелыми В-лимфоцитами (Ве) и плазматическими клетками преимущественно в лимфоидной ткани бронхолегочного дерева и ЖКТ.
Не связывает комплемент.
Не проходит через плацентарный барьер.
Обладает выраженной цитофильностыо — тропностыо к тучным клеткам и базофилам. Участвует в развитии гиперчувствительности немедленного типа — реакция I типа.
Иммуноглобулин класса D. Сведений об Ig данного изотипа не так много. Практически полностью содержится в сыворотке крови в концентрации около 0,03 г/л (около 0,2 % от общего числа циркулирующих Ig). IgD имеет молекулярную массу 160 кДа и константу седиментации 7S, мономер.
Не связывает комплемент. Не проходит через плацентарный барьер. Является рецептором предшественников В-лимфоцитов.
Рецепторные иммуноглобулины. Рецепторные, или мембраные Ig, локализуются на цитоплазматической мембране В-лимфоцитов. Выполняют функции антигенспецифических рецепторов. Рецепторные Ig имеют те же изотип и специфичность, что и синтезируемые в межклеточную среду антитела. Структурное отличие от секретируемых антител заключается в особом, дополнительном М-пептиде, благодаря которому молекула рецепторного Ig фиксируется в цитоплазматической мембране иммунокомпетентной клетки.
Нормальные антитела. В сыворотке крови человека всегда определяется базальный уровень иммуноглобулинов, которые получили название нормальных, или естественных, антител. К нормальным антителам относят изогемагглютинины — антитела различной аффинности и специфичности направленные против эритроцитарных антигенов групп крови (система АВО), а также против бактерий кишечной группы, кокков и некоторых вирусов. Эти антитела постоянно образуются в организме без явной антигенной стимуляции. С одной стороны, они отражают готовность макроорганизма к иммунному реагированию, а с другой — могут свидетельствовать об отдаленном контакте с антигеном.
Моноклональные антитела. Каждый В-лимфоцит и его потомки, образовавшиеся в результате пролиферации (т. е. клон), способны синтезировать антитела с паратопом строго определенной специфичности. Такие антитела получили название моноклональных. В природных условиях макроорганизма получить моноклональные антитела практически невозможно. Дело в том, что на одну и ту же антигенную детерминанту одновременно реагируют до 100 различных клонов В-лимфоцитов, незначительно различающихся антигенной специфичностью рецепторов и, естественно, аффинностью. Поэтому в результате иммунизации даже
монодетерминантным антигеном мы всегда получаем поликлональные антитела.
Принципиально получение моноклональных антител выполнимо, если провести предварительную селекцию антителопродуцирую-щих клеток и их клонирование (т. е. выделение отдельных клонов в чистые культуры). Однако задача осложняется тем, что В-лимфоциты, как и другие эукариотические клетки, имеют ограниченную продолжительность жизни и число возможных митотических делений.
Проблема получения моноклональных антител была успешно решена Д. Келлером и Ц. Мильштейном (1975). Авторы получили гибридные клетки путем слияния иммунных В-лимфоцитов с миеломной (опухолевой) клеткой. Полученные гибриды обладали специфическими свойствами антителопро-дуцента и «бессмертием» раковотрансфор-мированной клетки. Такой вид клеток получил название гибридом. Гибридома хорошо размножается в искусственных питательных средах и в организме животных и в неограниченном количестве вырабатывает антитела. В результате дальнейшей селекции были отобраны отдельные клоны гибридных клеток, обладавшие наивысшей продуктивностью и наибольшей аффинностью специфических антител.
Гибридомные моноклональные антитела нашли широкое применение при создании диагностических и лечебных иммунобиологических препаратов.
Полные и неполные антитела.
Среди многообразия Ig выделяют:
полные
неполные антитела.
Деление основано на способности образовывать в реакции агглютинации или преципитации (in vitro) хорошо различимую глазом макромолекулярную структуру гигантского иммунного комплекса. Таким свойством обладают полные антитела. К ним относятся полимерные молекулы Ig (изотип М), а также некоторые IgA и IgG.
Неполные
антитела лишены
такой способности,
несмотря на то что они специфически
связываются
с антигеном. В связи с этим их
еще называют непреципитирующими или
блокирующими
антителами. Причиной этого явления
может быть экранирование одного из
антигенсвязывающих
центров мономерной  молекулы
Ig,
а также недостаточное число или
малая доступность антигенных детерминант
на молекуле антигена. Выявить неполные
антитела можно при помощи реакции Кумбса — путем
использования «вторых», ан-тииммуноглобулиновых
антител.
молекулы
Ig,
а также недостаточное число или
малая доступность антигенных детерминант
на молекуле антигена. Выявить неполные
антитела можно при помощи реакции Кумбса — путем
использования «вторых», ан-тииммуноглобулиновых
антител.
Другие виды антител. Помимо вышеприведенных различают тепловые и холодовые антитела. Первые взаимодействуют с антигеном при температуре +37 °С. Для вторых наибольшая эффективность связывания проявляется в диапазоне +4… -10 °С. Понижение температуры реакционной смеси позволяет в ряде случаев (например, при отсутствии специфического антигена) ограничить низкоаффинные взаимодействия и повысить специфичность реакции.
По способности активировать комплемент (классический путь) антитела подразделяются на комплементсвязывающие (IgM, IgGl и IgG3) и комплементнесвязывающие.
В последние годы открыт вид антител, которые выполняют функции катализаторов биохимических процессов — обладают протеазной или нуклеазной активностью. Это реликтовые свойства антител. Такие антитела получили название абзимы.
Большим достижением молекулярной биологии в области иммунологии, помимо гибридом, явилось получение белков со свойствами антител — это одноцепочечные антитела, бифункциональные антитела и иммунотокси-ны. Они синтезируются живыми биологическими системами. Одноцепочечные антитела представляют собой фрагмент вариабельного домена Ig, который обладает определенной специфичностью и аффинностью и способен к блокирующему действию. Размер такой молекулы очень мал и практически не обладает иммуногенностью. Бифункциональные антитела имеют антигенсвязывающие центры разной специфичности, т. е. направлены к различным антигенным детерминантам. Иммунотоксины представляют собой гибрид молекулы иммуноглобулина и токсина. Они способны направленно доставить молекулу токсина к клетке-мишени, убить ее или нарушить в ней метаболические процессы.
Иммунотоксины и бифункциональные антитела имеют большое будущее. В перспективе их будут использовать для иммунодиагностики, а также профилактики и лечения инфекционных, онкологических, аллергических и других заболеваний.
Характеристика анти-а, анти-в антител
Естественные антитела анти-А, анти-В принадлежат к иммуноглобулинам класса М. Выработанные в процессе иммунизации А или В антигеном анти-А, анти-В антитела являются иммунными и принадлежат к иммуноглобулинам класса G. Они вырабатываются в результате полигенного воздействия группоспецифических субстанций А и В на организм человека: инфекционные заболевания, медицинские профилактические прививки, потребление продуктов животного и растительного происхождения, гетероспецифическая беременность, гемотрансфузии иногруппной крови. Анти-А, анти-В антитела в сыворотках большинства людей представляют собой смесь естественных и иммунных антител (смесь иммуноглобулинов классов М и G).
Вследствие структурных особенностей иммуноглобулинов класса М (пентамерное образование с десятью активными центрами), естественные анти-А, анти-В антитела способны связывать большое количество эритроцитов и вызывать прямую агглютинацию в солевой среде. Это свойство естественных антител используется при приготовлении типирующих стандартов для выявления антигенов эритроцитов системы АВ0.
Кроме того, высокая активность анти-А, анти-В антител определяет клиническую значимость указанных антител в развитии посттрансфузионных реакций при трансфузиях несовместимой по антигенам АВО крови.
Доноры группы крови 0, имеющие Ig G анти-А, анти-В антитела, являются «опасными универсальными донорами», т.к. трансфузия их эритроцитов, содержащих даже небольшое количество плазмы, реципиентам А, В, АВ может приводить к посттрансфузионным осложнениям.
Гипопластический тип крови
Тип крови, при котором могут отсутствовать агглютинины α и/или β относится к гипопластическому типу крови. Этот феномен встречается:
В результате генетического выпадения при наследовании группы крови.
При различных заболеваниях, связанных с выраженной гипопротеинемией (сепсис, вирусные и бактериальные инфекции, ожоговая болезнь, туберкулезная интоксикация, онкологические и гематологические заболевания)
У детей до 1 года жизни и у пожилых людей как вариант нормы.
Гипопластический тип крови выявляется при перекрестном способе определения групповой принадлежности крови. Он выражается в отсутствии агглютинации со стандартными эритроцитами А(II) и/или B(III) группы.
Рекомендации при переливании компонентов крови:
Переливать эритромассу одногруппную, плазму АВ(IV).
Экстраагглютинины
Landsteiner с сотрудниками (1926 г.) обнаружили, что сыворотки некоторых людей групп А2(II) и A2B(IV) содержат особый экстраагглютинин–α1,который может быть использован для выделения антигена А1. У некоторых лиц, принадлежащих к группе А1(II) или A1B(IV), в сыворотке может содержаться экстраагглютинин α2.
Обнаруживаемые в сыворотке человека такого рода агглютинины назвали «иррегулярными», т.е. непостоянными.
Экстраагглютинины чаще всего встречаются при системных заболеваниях, беременности, сепсисе.
Частота встречаемости экстраагглютининов α1 и α2 среди лиц А(II) и AB(IV) групп:
— α1в А(II) — 1 — 2 % случаев
— α1 в AB(IV) — 26 % случаев
— α2в А(II) и AB(IV) — 0,1 % случаев
Экстраагглютинины α1 и α2 выявляются при перекрестном способе определения групповой принадлежности крови.
Экстраагглютинин α1определяется в виде агглютинации со стандартными эритроцитами А(II) группы.
Экстраагтлютинин α2 (анти — Н) определяется в виде агглютинации состандартными эритроцитами 0(I) группы.
Экстраагглютинины могут быть:
— холодовыми — активны при комнатной температуре и неактивны при температуре человеческого тела; при добавлении теплого физ.раствора агглютинация исчезает;
-тепловыми — активны при температуре человеческого тела; при добавлении теплого физиологического раствора агглютинация не исчезает или даже усиливается.
Экстраагглютинины могут послужить причиной осложнений после переливания совместимой в групповом отношении крови.
Рекомендации при переливании компонентов крови:
— A2(II) с экстраагглютином α1 — переливать эритромассу 0(I) группы, плазму А(II) группы.
— A2B(1V)
с экстраагглютинином 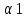 — переливать эритромассу В(III)
группы, плазму AB(IV)
группы.
— переливать эритромассу В(III)
группы, плазму AB(IV)
группы.
— А(II) с экстраагглютинином α2— переливать эритромассу с индивидуальным подбором, плазму А(II) группы.
— AB(IV) с экстраагтлютинином α2— переливать эритромассу В(III) группы, плазму AB(IV) группы.
65. Антитела, иммуноглобулины, их основные свойства. Специфичность антител
Антитела (иммуноглобулины) — белки плазмы крови, которые образуются в организме под влиянием антигенов. Основным свойством антител является специфичность, то есть способность соединяться с тем
антигеном, который вызвал их образование. Специфичность антител обусловлена активными центрами, то есть участками молекулы иммуноглобулина, которые соединяются с детерминантными группами (эпитопами) антигена. Число активных центров называют валентностью антител.
Антитела содержатся в жидкой части крови и в других жидкостях организма. Сыворотку, содержащую антитела, называют иммунной, в отличие от нормальной, не содержащей специфических антител.
Химическая природа антител. Это гликопротеиды. Состоят из двух тяжелых полипептидных цепей — Н-цепей (англ, heavy — тяжелый) и двух легких цепей — L-цепей (англ, light — легкий). Цепи связаны дисульфидными мостиками. Как в легких, так и в тяжелых цепях имеется вариабельная V-обдасть с непостоянной последовательностью аминокислот, и константная С-область. Аминокислоты в полипептидных цепях направлены таким образом, что их NН2-концевые группы расположены в вариабельной части, а СООН-концевые группы — в константной.
При обработке протеолитическим ферментом папаином молекула иммуноглобулина распадается на Fab-фрагменты (англ, fragment antigen binding — фрагмент, связывающий антиген) и Fc-фрагмент (англ. fragment cristalline — кристаллизующийся фрагмент). В состав Fab-фрагмента входит целиком легкая цепь и часть тяжелой цепи, концевые их части составляют активный центр. В состав Fc-фрагмента входят остатки двух тяжелых цепей.
Активный центр молекулы иммуноглобулина по конфигурации соответствует конфигурации детерминантной группе антигена. Он очень мал, занимает лишь 2% поверхности антитела. Описанная мономерная молекула иммуноглобулина имеет два активных центра, то есть может связать две молекулы антигена.
Будучи белками, антитела (иммуноглобулины) обладают антигенной, видовой специфичностью. Детерминантная группа, определяющая специфичность, расположена в области Fc-фрагмента. Наличие антигенной специфичности иммуноглобулинов имеет практическое значение, так как позволяет обнаружить их с помощью антиглобулиновых сывороток.
Различают пять классов иммуноглобулинов, которые обозначаются IgG, IgM, IgA, IgD, IgE и отличаются между собой по физико-химическим свойствам и биологическим функциям (рис. 17).
Иммуноглобулины класса G (Ig G) являются мономерами, то есть состоят из двух легких и двух тяжелых цепей, молекулярная масса 160 кД, константа седиментации (скорость осаждения в центрифуге) 7S. Составляют основную массу сывороточных иммуноглобулинов (70-80%). Единственные из всех классов проникают через плаценту и играют важную роль в защите новорожденного от инфекции.
Иммуноглобулины класса М (Ig М) первыми появляются после введения антигена. Молекула IgM состоит из 5 субъединиц, то есть является пентамером. Молекулярная масса 300 кД, константа седиментации 19S. Содержание в сыворотке крови 5-10%.
Иммуноглобулины класса A (Ig А) синтезируются в селезенке, лимфоузлах и подслизистом слое дыхательных путей и кишечного тракта. По физико-химическим свойствам неодинаковы и могут иметь константы седиментации 7,9,11 и 18S. Часть IgA попадает в кровь — это сывороточные IgA. Большая же часть IgA — это секреторные SIgA, у которых два или три мономера соединены между собой секреторным фрагментом, защищающим иммуноглобулин от разрушения ферментами. Секреторные SIgA проникают на поверхность слизистых оболочек, содержатся в секретах и играют важную роль в защите организма от проникновения возбудителей, например, вирусов гриппа, полиомиелита.
Иммуноглобулины класса D (Ig D) — молекулярная масса 180 кД, константа седиментации 7S. Содержание в сыворотке крови около 0,2%. Роль IgD пока неизвестна
Иммуноглобулины класса Е (Ig E) — молекулярная масса 200 кД, константа седиментации 8S, содержатся в нормальной сыворотке крови в небольших количествах (0,002%). Их называют также реагинами, поскольку они способны присоединяться к клеткам (цитофильны) и принимают участие в реакции анафилаксии
Форма и размеры иммуноглобулинов G и М были изучены в электронном микроскопе. IgG имеют форму вытянутых эллипсов с тупыми концами, a IgM — форму паучка с пятью ножками.
