Макрофаги в моче: что это значит, чем это опасно и что делать
Иммунная система человека — это дар природы, который трудно переоценить. Благодаря защитной функции организма ежедневное столкновение с различными болезнетворными микроорганизмами – бактериями и вирусами, не приносит значительного урона деятельности органов и систем.
Определить количество клеток, ответственных за иммунитет позволяют клинические лабораторные анализы крови и мочи. На основании данных лабораторных анализов в комплексе с жалобами, клиническими симптомами, признаками, результатами прочих исследований, в том числе инструментальных.
Макрофаги в моче
Одними из наиболее активных защитников от инфекции являются специфические клетки – макрофаги, лейкоциты и лимфоциты.
Специалист на основании полученных анализов делает выводы о том, соответствует ли определенное количество тех или иных клеток норме здорового человека или отклонения являются подтверждением присутствия воспалительного процесса или других патологических состояний.

Итак, насколько опасно появление в моче макрофагов и чем это может быть чревато для исследуемого человека в ближайшем будущем и на перспективу?
Макрофаг – клетка человеческого организма, значительно превышающая по размерам другие элементы. Название состоит из двух частей, где «макрос» на греческом языке обозначает большой, гигантский, а «фагос» – истребитель, пожиратель.
Действительно, его основные задачи состоят в следующем:
- Распознавание инородных агентов, которые при попадании в организм вызывают патологический процесс.
- Улавливание, локализация и уничтожение источников инфекции.
- Утилизация погибших естественным путем клеточных образований, глубокая очистка от продуктов жизнедеятельности клеток.
- Формирование и подержание функций противоопухолевого иммунного механизма. Когда макрофаги фиксируют возникновение и развитие атипичных тканей, они выполняют очень важную роль – локализовать колонию раковых клеток, напасть и незамедлительно поедать.
Важная особенность деятельности макрофагов. Они не просто призваны уничтожить клетки, которые приносят вред и представляют собой значительную опасность. Благодаря макрофагам распознаются и презентуются антигены чужеродных объектов, несущих вред и разрушение иммунитета.
В нормальном состоянии макрофаги в моче не выявляются или могут встречаться в количестве 1 – 2 в поле зрения, что соответствует нормальному состоянию здоровья или индивидуальным особенностям организма. Другие клетки – защитники лейкоциты могут находиться в моче здорового человека не более чем 10 в поле зрения.
Что это значит
Появление макрофагов и увеличение лейкоцитов в моче называется лейкоцитурией. Основными анализами, которые позволяют определить отклонения, является общий анализ мочи и анализ по методике Нечипоренко.

Исследование с применением современного метода тестов недостаточно точное, под влиянием внешних факторов отклонения могут колебаться в пределах от 17 до 90%.
Изменения лейкоцитарной формулы, в том числе и появление макрофагов в моче может быть следствием различных причин:
- Появление и активное развитие в организме воспалительных процессов, инфекций различной тяжести.
- Системные патологии суставов, наличие глистных инвазий, различного рода аллергические реакции.
- Становление функций органов и систем в раннем детском возрасте. К достижению пяти – семи лет анализ мочи ребенка по лейкоцитарной формуле достигает показатели взрослого.
- Последствия стрессов, неврозов, депрессивного состояния, напряжения и физико-психологической усталости.
- Беременность. При вынашивании ребенка у женщин ослабевает иммунный барьер, в начале третьего триместра количество клеток в моче физиологически резко взрастает.
- Активная фаза гломерулонефрита, IgA-нефропатии и развитие полиомавирусной инфекции, вызванной ВК – возбудителями туберкулеза.
- Развитие атипичных клеток раковых новообразований.
Важно рассматривать появление макрофагов в анализах мочи как результат наследственных изменений органов, врожденные нарушения строения мочевыделительной системы и гинекологической сферы у женщин.
Чем это опасно
Определение той или иной причины массового появления макрофагов в моче в значительной мере определяет дальнейшую стратегию лечения. Насколько эффективно можно избавиться от причин, вылечить основное заболевание, настолько же быстро и качественно удастся восстановить здоровье.
Появление иммунных клеток в анализах мочи представляет значительную опасность для организма. Это может сигнализировать о следующих опасных для жизни состояниях, которые до определенного времени не показывают четкой клинической картины.
- Абсцессы и карбункулы тканей почек.
- Образование очагов воспаления в просветах почечных протоков.
- Развитие очагового поражения иммунной системы.
- Обширная глистная инвазия, поражение гельминтами всего организма.
- Быстротекущие онкологические процессы.
Наличие макрофагов в моче клиницисты считают одним из самых достоверных сигналов организма о серьезных патологических изменениях.
Что делать
Чтобы исключить вероятность ошибки в полученных анализах, специалист назначает повторное прохождение диагностических процедур. После получения результатов, доктор назначает прохождение консилиума различных специалистов – нефролога, гинеколога, аллерголога.
В конечном итоге пациенту назначается комплексное лечение, противогистаминные, иммуностимулирующие и общеукрепляющие препараты. Нужно как можно скорее попасть на прием к доктору.
 Загрузка…
Загрузка…Макрофаги в моче: что это значит, чем это опасно и что делать
Иммунная система человека — это дар природы, который трудно переоценить. Благодаря защитной функции организма ежедневное столкновение с различными болезнетворными микроорганизмами – бактериями и вирусами, не приносит значительного урона деятельности органов и систем.
Определить количество клеток, ответственных за иммунитет позволяют клинические лабораторные анализы крови и мочи. На основании данных лабораторных анализов в комплексе с жалобами, клиническими симптомами, признаками, результатами прочих исследований, в том числе инструментальных.
Макрофаги в моче
Одними из наиболее активных защитников от инфекции являются специфические клетки – макрофаги, лейкоциты и лимфоциты. Специалист на основании полученных анализов делает выводы о том, соответствует ли определенное количество тех или иных клеток норме здорового человека или отклонения являются подтверждением присутствия воспалительного процесса или других патологических состояний.

Итак, насколько опасно появление в моче макрофагов и чем это может быть чревато для исследуемого человека в ближайшем будущем и на перспективу?
Макрофаг – клетка человеческого организма, значительно превышающая по размерам другие элементы. Название состоит из двух частей, где «макрос» на греческом языке обозначает большой, гигантский, а «фагос» – истребитель, пожиратель. Действительно, его основные задачи состоят в следующем:
Важная особенность деятельности макрофагов. Они не просто призваны уничтожить клетки, которые приносят вред и представляют собой значительную опасность. Благодаря макрофагам распознаются и презентуются антигены чужеродных объектов, несущих вред и разрушение иммунитета.
В нормальном состоянии макрофаги в моче не выявляются или могут встречаться в количестве 1 – 2 в поле зрения, что соответствует нормальному состоянию здоровья или индивидуальным особенностям организма. Другие клетки – защитники лейкоциты могут находиться в моче здорового человека не более чем 10 в поле зрения.
Что это значит
Появление макрофагов и увеличение лейкоцитов в моче называется лейкоцитурией. Основными анализами, которые позволяют определить отклонения, является общий анализ мочи и анализ по методике Нечипоренко.

Исследование с применением современного метода тестов недостаточно точное, под влиянием внешних факторов отклонения могут колебаться в пределах от 17 до 90%. Изменения лейкоцитарной формулы, в том числе и появление макрофагов в моче может быть следствием различных причин:
- Появление и активное развитие в организме воспалительных процессов, инфекций различной тяжести.
- Системные патологии суставов, наличие глистных инвазий, различного рода аллергические реакции.
- Становление функций органов и систем в раннем детском возрасте. К достижению пяти – семи лет анализ мочи ребенка по лейкоцитарной формуле достигает показатели взрослого.
- Последствия стрессов, неврозов, депрессивного состояния, напряжения и физико-психологической усталости.
- Беременность. При вынашивании ребенка у женщин ослабевает иммунный барьер, в начале третьего триместра количество клеток в моче физиологически резко взрастает.
- Активная фаза гломерулонефрита, IgA-нефропатии и развитие полиомавирусной инфекции, вызванной ВК – возбудителями туберкулеза.
- Развитие атипичных клеток раковых новообразований.
Важно рассматривать появление макрофагов в анализах мочи как результат наследственных изменений органов, врожденные нарушения строения мочевыделительной системы и гинекологической сферы у женщин.
Чем это опасно
Определение той или иной причины массового появления макрофагов в моче в значительной мере определяет дальнейшую стратегию лечения. Насколько эффективно можно избавиться от причин, вылечить основное заболевание, настолько же быстро и качественно удастся восстановить здоровье.
Появление иммунных клеток в анализах мочи представляет значительную опасность для организма. Это может сигнализировать о следующих опасных для жизни состояниях, которые до определенного времени не показывают четкой клинической картины.
Наличие макрофагов в моче клиницисты считают одним из самых достоверных сигналов организма о серьезных патологических изменениях.
Что делать
Чтобы исключить вероятность ошибки в полученных анализах, специалист назначает повторное прохождение диагностических процедур. После получения результатов, доктор назначает прохождение консилиума различных специалистов – нефролога, гинеколога, аллерголога.
В конечном итоге пациенту назначается комплексное лечение, противогистаминные, иммуностимулирующие и общеукрепляющие препараты. Нужно как можно скорее попасть на прием к доктору.
 Загрузка…
Загрузка…Макрофаги в моче: что это значит, чем это опасно и что делать
Иммунная система человека — это дар природы, который трудно переоценить. Благодаря защитной функции организма ежедневное столкновение с различными болезнетворными микроорганизмами – бактериями и вирусами, не приносит значительного урона деятельности органов и систем.
Определить количество клеток, ответственных за иммунитет позволяют клинические лабораторные анализы крови и мочи. На основании данных лабораторных анализов в комплексе с жалобами, клиническими симптомами, признаками, результатами прочих исследований, в том числе инструментальных.
Макрофаги в моче
Одними из наиболее активных защитников от инфекции являются специфические клетки – макрофаги, лейкоциты и лимфоциты. Специалист на основании полученных анализов делает выводы о том, соответствует ли определенное количество тех или иных клеток норме здорового человека или отклонения являются подтверждением присутствия воспалительного процесса или других патологических состояний.
Итак, насколько опасно появление в моче макрофагов и чем это может быть чревато для исследуемого человека в ближайшем будущем и на перспективу?
Макрофаг – клетка человеческого организма, значительно превышающая по размерам другие элементы. Название состоит из двух частей, где «макрос» на греческом языке обозначает большой, гигантский, а «фагос» – истребитель, пожиратель. Действительно, его основные задачи состоят в следующем:
- Распознавание инородных агентов, которые при попадании в организм вызывают патологический процесс.
- Улавливание, локализация и уничтожение источников инфекции.
- Утилизация погибших естественным путем клеточных образований, глубокая очистка от продуктов жизнедеятельности клеток.
- Формирование и подержание функций противоопухолевого иммунного механизма. Когда макрофаги фиксируют возникновение и развитие атипичных тканей, они выполняют очень важную роль – локализовать колонию раковых клеток, напасть и незамедлительно поедать.
Важная особенность деятельности макрофагов. Они не просто призваны уничтожить клетки, которые приносят вред и представляют собой значительную опасность. Благодаря макрофагам распознаются и презентуются антигены чужеродных объектов, несущих вред и разрушение иммунитета.
В нормальном состоянии макрофаги в моче не выявляются или могут встречаться в количестве 1 – 2 в поле зрения, что соответствует нормальному состоянию здоровья или индивидуальным особенностям организма. Другие клетки – защитники лейкоциты могут находиться в моче здорового человека не более чем 10 в поле зрения.
Что это значит
Появление макрофагов и увеличение лейкоцитов в моче называется лейкоцитурией. Основными анализами, которые позволяют определить отклонения, является общий анализ мочи и анализ по методике Нечипоренко.
Исследование с применением современного метода тестов недостаточно точное, под влиянием внешних факторов отклонения могут колебаться в пределах от 17 до 90%. Изменения лейкоцитарной формулы, в том числе и появление макрофагов в моче может быть следствием различных причин:
- Появление и активное развитие в организме воспалительных процессов, инфекций различной тяжести.
- Системные патологии суставов, наличие глистных инвазий, различного рода аллергические реакции.
- Становление функций органов и систем в раннем детском возрасте. К достижению пяти – семи лет анализ мочи ребенка по лейкоцитарной формуле достигает показатели взрослого.
- Последствия стрессов, неврозов, депрессивного состояния, напряжения и физико-психологической усталости.
- Беременность. При вынашивании ребенка у женщин ослабевает иммунный барьер, в начале третьего триместра количество клеток в моче физиологически резко взрастает.
- Активная фаза гломерулонефрита, IgA-нефропатии и развитие полиомавирусной инфекции, вызванной ВК – возбудителями туберкулеза.
- Развитие атипичных клеток раковых новообразований.
Важно рассматривать появление макрофагов в анализах мочи как результат наследственных изменений органов, врожденные нарушения строения мочевыделительной системы и гинекологической сферы у женщин.
Чем это опасно
Определение той или иной причины массового появления макрофагов в моче в значительной мере определяет дальнейшую стратегию лечения. Насколько эффективно можно избавиться от причин, вылечить основное заболевание, настолько же быстро и качественно удастся восстановить здоровье.
Появление иммунных клеток в анализах мочи представляет значительную опасность для организма. Это может сигнализировать о следующих опасных для жизни состояниях, которые до определенного времени не показывают четкой клинической картины.
- Абсцессы и карбункулы тканей почек.
- Образование очагов воспаления в просветах почечных протоков.
- Развитие очагового поражения иммунной системы.
- Обширная глистная инвазия, поражение гельминтами всего организма.
- Быстротекущие онкологические процессы.
Наличие макрофагов в моче клиницисты считают одним из самых достоверных сигналов организма о серьезных патологических изменениях.
Что делать
Чтобы исключить вероятность ошибки в полученных анализах, специалист назначает повторное прохождение диагностических процедур. После получения результатов, доктор назначает прохождение консилиума различных специалистов – нефролога, гинеколога, аллерголога.
В конечном итоге пациенту назначается комплексное лечение, противогистаминные, иммуностимулирующие и общеукрепляющие препараты. Нужно как можно скорее попасть на прием к доктору.
Похожие статьи:
Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет
Статья на конкурс «био/мол/текст»: Иммунная система — это мощная многослойная защита нашего организма, которая потрясающе эффективна против вирусов, бактерий, грибов и других патогенов извне. Кроме того, иммунитет способен эффективно распознавать и уничтожать трансформированные собственные клетки, которые могут перерождаться в злокачественные опухоли. Однако сбои в работе иммунной системы (по генетическим либо другим причинам) приводят к тому, что однажды злокачественные клетки берут верх. Разросшаяся опухоль становится нечувствительной к атакам организма и не только успешно избегает уничтожения, но и активно «перепрограммирует» защитные клетки для обеспечения собственных нужд. Поняв механизмы, которые опухоль использует для подавления иммунного ответа, мы сможем разработать контрмеры и попытаться сдвинуть баланс в сторону активации собственных защитных сил организма для борьбы с болезнью.
Опухоль и иммунитет — драматический диалог в трех частях с прологом
Долгое время считалось, что причина низкой эффективности иммунного ответа при раке — то, что опухолевые клетки слишком похожи на нормальные, здоровые, чтобы иммунная система, настроенная на поиск «чужаков», могла их как следует распознавать. Этим как раз и объясняется тот факт, что иммунная система успешнее всего противостоит опухолям вирусной природы (их частота резко возрастает у людей, страдающих иммунодефицитом). Однако позже стало ясно, что это не единственная причина.
Оказалось, что взаимодействие раковых клеток с иммунной системой носит гораздо более разносторонний характер. Опухоль не просто «прячется» от атак, она умеет активно подавлять местный иммунный ответ и перепрограммировать иммунные клетки, заставляя их обслуживать собственные злокачественные нужды.
«Диалог» между переродившейся, вышедшей из-под контроля клеткой с ее потомством (то есть будущей опухолью) и организмом развивается в несколько стадий, и если вначале инициатива почти всецело находится на стороне защитных сил организма, то в конце (в случае развития болезни) — переходит на сторону опухоли. Несколько лет назад учеными-онкоиммунологами была сформулирована концепция «иммуноредактирования» (immunoediting), описывающая основные этапы этого процесса (рис. 1) [2].
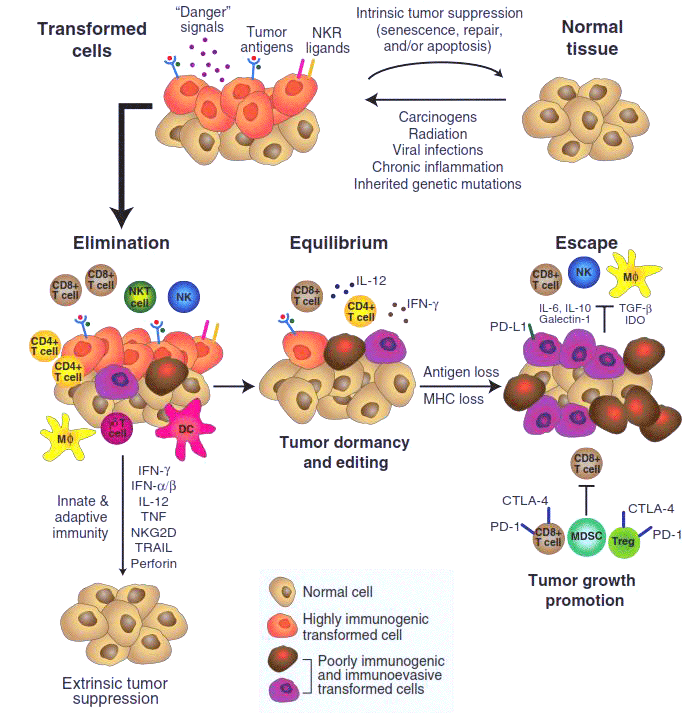
Рисунок 1. Иммуноредактирование (immunoediting) в процессе развития злокачественной опухоли.
Первая стадия иммуноредактирования — процесс устранения (elimination). Под действием внешних канцерогенных факторов или в результате мутаций нормальная клетка «трансформируется» — приобретает способность неограниченно делиться и не отвечать на регуляторные сигналы организма. Но при этом она, как правило, начинает синтезировать на своей поверхности особые «опухолевые антигены» и «сигналы опасности». Эти сигналы привлекают клетки иммунной системы, прежде всего макрофаги, натуральные киллеры и Т-клетки. В большинстве случаев они успешно уничтожают «испортившиеся» клетки, прерывая развитие опухоли. Однако иногда среди таких «предраковых» клеток оказывается несколько таких, у которых иммунореактивность — способность вызывать иммунный ответ — по каким-то причинам оказывается ослабленной, они синтезируют меньше опухолевых антигенов, хуже распознаются иммунной системой и, пережив первую волну иммунного ответа, продолжают делиться.
В этом случае взаимодействие опухоли с организмом выходит на вторую стадию, стадию равновесия (equilibrium). Здесь иммунная система уже не может полностью уничтожить опухоль, но еще в состоянии эффективно ограничивать ее рост. В таком «равновесном» (и не обнаруживаемом обычными методами диагностики) состоянии микроопухоли могут существовать в организме годами. Однако такие затаившиеся опухоли не статичны — свойства составляющих их клеток постепенно меняются под действием мутаций и последующего отбора: преимущество среди делящихся опухолевых клеток получают такие, которые способны лучше противостоять иммунной системе, и в конце концов в опухоли появляются клетки-иммуносупрессоры. Они в состоянии не только пассивно избегать уничтожения, но и активно подавлять иммунный ответ. По сути, это эволюционный процесс, в котором организм невольно «выводит» именно тот вид рака, который его убьет.
Этот драматический момент знаменует собой переход опухоли к третьей стадии развития — избегания (escape), — на которой опухоль уже малочувствительна к активности клеток иммунной системы, более того — обращает их активность себе на пользу. Она принимается расти и метастазировать. Именно такая опухоль обычно диагностируется медиками и изучается учеными — две предыдущие стадии протекают скрыто, и наши представления о них основаны главным образом на интерпретации целого ряда косвенных данных.
Дуализм иммунного ответа и его значение в канцерогенезе
Существует множество научных статей, описывающих, как иммунная система борется с опухолевыми клетками, но не меньшее количество публикаций демонстрирует, что присутствие клеток иммунной системы в ближайшем опухолевом окружении является негативным фактором, коррелирующим с ускоренным ростом и метастазированием рака [2], [3]. В рамках концепции иммуноредактирования, описывающей, как изменяется характер иммунного ответа по мере развития опухоли, подобное двойственное поведение наших защитников получило, наконец, свое объяснение.
Переориентирование иммунной системы от борьбы с опухолью на ее защиту возможно благодаря пластичности клеток этой системы. Говоря об иммунном ответе, мы, как правило, используем «воинственные» метафоры — «борьба», «уничтожение», «подавление». Но мало уничтожить врага, будь то вирус, бактерия или другой паразит. Организм должен еще и исправить причиненные им повреждения. Регенерация поврежденных тканей и заживление ран тоже находятся под контролем клеток иммунной системы: она не только «воин», но еще и «целитель». Коварство рака заключается в том, что, будучи по сути «чужеродным агентом» в организме, он выделяет специальные вещества, которые подавляют активный иммунный ответ и побуждают лейкоциты воспринимать опухоль не как врага, требующего уничтожения, а как рану, требующую помощи, защиты и исцеления.
Мы рассмотрим некоторые механизмы того, как это происходит, на примере макрофагов. Похожие приемы опухоль использует и для того, чтобы обманывать другие клетки врожденного и приобретенного иммунитета.
Макрофаги — «клетки-воины» и «клетки-целители»
Макрофаги, пожалуй, самые знаменитые клетки врожденного иммунитета — именно с изучения их способностей к фагоцитозу Мечниковым и началась классическая клеточная иммунология. В организме млекопитающих макрофаги — боевой авангард: первыми обнаруживая врага, они не только пытаются уничтожить его собственными силами, но также привлекают к месту сражения другие клетки иммунной системы, активируя их. А после уничтожения чужеродных агентов принимаются активно участвовать в ликвидации причиненных повреждений, вырабатывая факторы, способствующие заживлению ран. Эту двойственную природу макрофагов опухоли используют себе на пользу.
В зависимости от преобладающей активности различают две группы макрофагов: М1 и М2. М1-макрофаги (их еще называют классически активированными макрофагами) — «воины» — отвечают за уничтожение чужеродных агентов (в том числе и опухолевых клеток), как напрямую, так и за счет привлечения и активации других клеток иммунной системы (например, Т-киллеров). М2 макрофаги — «целители» — ускоряют регенерацию тканей и обеспечивают заживление ран [4], [8].
Присутствие в опухоли большого количества М1-макрофагов тормозит ее рост [5], а в некоторых случаях может вызвать даже практически полную ремиссию (уничтожение). И наоборот: М2-макрофаги выделяют молекулы — факторы роста, которые дополнительно стимулируют деление опухолевых клеток, то есть благоприятствуют развитию злокачественного образования. Экспериментально было показано, что в опухолевом окружении обычно преобладают именно М2-клетки («целители»). Хуже того: под действием веществ, выделяемых опухолевыми клетками, активные М1-макрофаги «перепрограммируются» в М2-тип [6], перестают синтезировать антиопухолевые цитокины, такие как интерлейкин-12 (IL12) или фактор некроза опухолей (TNF) и начинают выделять в окружающую среду молекулы, ускоряющие рост опухоли и прорастание кровеносных сосудов, которые будут обеспечивать ее питание, например фактор роста опухолей (TGFb) и фактор роста сосудов (VGF). Они перестают привлекать и инициировать другие клетки иммунной системы и начинают блокировать местный (противоопухолевый) иммунный ответ (рис. 2).
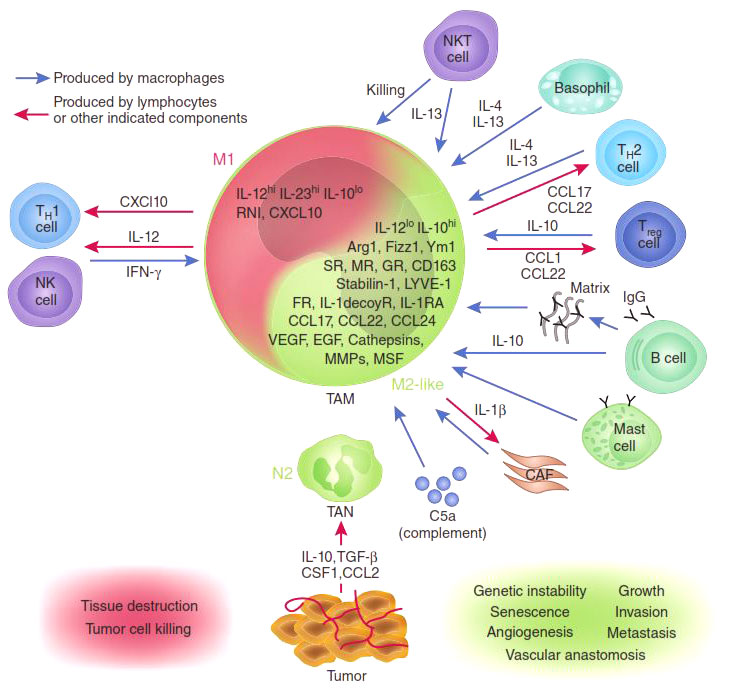
Рисунок 2. М1- и М2-макрофаги: их взаимодействие с опухолью и другими клетками иммунной системы.
Ключевую роль в этом перепрограммировании играют белки семейства NF-kB [7]. Эти белки являются транскрипционными факторами, контролирующими активность множества генов, необходимых для М1 активации макрофагов. Наиболее важные представители этого семейства — р65 и р50, вместе образующие гетеродимер р65/р50, который в макрофагах активирует множество генов, связанных с острым воспалительным ответом, таких как TNF, многие интерлейкины, хемокины и цитокины. Экспрессия этих генов привлекает все новые и новые иммунные клетки, «подсвечивая» для них район воспаления. В то же время другой гомодимер семейства NF-kB — р50/р50 — обладает противоположной активностью: связываясь с теми же самыми промоторами, он блокирует их экспрессию, снижая градус воспаления.
И та, и другая активность NF-kB транскрипционных факторов очень важна, но еще важнее равновесие между ними. Было показано, что опухоли целенаправленно выделяют вещества, которые нарушают синтез p65 белка в макрофагах и стимулируют накопление ингибиторного комплекса р50/р50 [7]. Таким способом (помимо еще ряда других) опухоль превращает агрессивных М1-макрофагов в невольных пособников своего собственного развития: М2-тип макрофагов, воспринимая опухоль как поврежденный участок ткани, включают программу восстановления, однако секретируемые ими факторы роста только добавляют ресурсы для роста опухоли. На этом цикл замыкается — растущая опухоль привлекает новые макрофаги, которые перепрограммируются и стимулируют ее рост вместо уничтожения.
Реактивация иммунного ответа — актуальное направление антираковой терапии
Таким образом, в ближайшем окружении опухолей присутствует сложная смесь молекул: как активирующих, так и ингибирующих иммунный ответ. Перспективы развития опухоли (а значит, перспективы выживания организма) зависят от баланса ингредиентов этого «коктейля». Если будут преобладать иммуноактиваторы — значит, опухоль не справилась с задачей и будет уничтожена или ее рост сильно затормозится. Если же преобладают иммуносупрессорные молекулы — это значит, что опухоль смогла подобрать ключ и начнет быстро прогрессировать. Понимая механизмы, которые позволяют опухолям подавлять наш иммунитет, мы сможем разработать контрмеры и сдвинуть баланс в сторону уничтожения опухолей [8].
Как показывают эксперименты, «перепрограммирование» макрофагов (и других клеток иммунной системы) обратимо. Поэтому одним из перспективных направлений онко-иммунологии на сегодняшний день является идея «реактивации» собственных клеток иммунной системы пациента с целью усиления эффективности других методов лечения. Для некоторых разновидностей опухолей (например, меланом) это позволяет добиться впечатляющих результатов. Другой пример, обнаруженный группой Меджитова [9], — обычный лактат, молекула, которая производится при недостатке кислорода в быстрорастущих опухолях за счет эффекта Варбурга [10]. Эта простая молекула стимулирует перепрограммирование макрофагов, заставляя их поддерживать рост опухоли. Лактат транспортируется внутрь макрофагов через мембранные каналы, и потенциальная терапия заключается в блокировке этих каналов.
Развитие методов антираковой терапии в настоящее время идет по нескольким направлениям сразу , и все они важны. Ведь научившись управлять иммунным ответом так же эффективно, как это делают злокачественные опухоли, мы сумеем окончательно «переиграть» эту болезнь, которая остается одной из главных причин смертности в России и в мире.
- Страшней клешней на свете нет…;
- Schreiber R.D., Old L.J., Smyth M.J. (2011). Cancer immunoediting: integrating immunity’s roles in cancer suppression and promotion. Science. 331, 1565–1570;
- Hanahan D. and Weinberg R.A. (2011). Hallmarks of cancer: the next generation. Cell. 144, 646–674;
- Martinez F.O. and Gordon S. (2014). The M1 and M2 paradigm of macrophage activation: time for reassessment. F1000Prime Rep. 6, 13;
- Ma J., Liu L., Che G., Yu N., Dai F., You Z. (2010). The M1 form of tumor-associated macrophages in non-small cell lung cancer is positively associated with survival time. BMC Cancer. 10, 112;
- Hagemann T., Wilson J., Burke F., Kulbe H., Li N.F., Plüddemann A. et al. (2006). Ovarian cancer cells polarize macrophages toward a tumor-associated phenotype. J. Immunol. 176, 5023–5032;
- Mantovani A. and Sica A. (2010). Macrophages, innate immunity and cancer: balance, tolerance, and diversity. Curr. Opin. Immunol. 22, 231–237;
- Biswas S.K. and Mantovani A. (2010). Macrophage plasticity and interaction with lymphocyte subsets: cancer as a paradigm. Nat. Immunol. 11, 889–896;
- Толл-подобные рецепторы: от революционной идеи Чарльза Джейнуэя до Нобелевской премии 2011 года;
- Colegio O.R., Chu N.Q., Szabo A.L., Chu T., Rhebergen A.M., Jairam V. et al. (2014). Functional polarization of tumour-associated macrophages by tumour-derived lactic acid. Nature. 513, 559–563;
- Как распознать рак при помощи биомаркеров?;
- Биоинформатика: большие БД против «большого Р».
Макрофаги — Википедия
Материал из Википедии — свободной энциклопедии
Макрофáги (от др.-греч. μακρός — большой, и φάγος — пожиратель) — клетки в организме животных и в т.ч. человека, способные к активному захвату и перевариванию бактерий, остатков погибших клеток и других чужеродных или токсичных для организма частиц. Термин «макрофаги» введён Мечниковым [1][2]. Устаревшие, вышедшие из употребления синонимы: гистиоцит-макрофаг, гистофагоцит, макрофагоцит, мегалофаг-пожиратель.
Макрофаги присутствуют практически в каждом органе и ткани, где они выступают в качестве первой линии иммунной защиты от патогенов и играют важную роль в поддержании тканевого гомеостаза[3][4].
В 1970-х годах была сформулирована гипотеза о системе мононуклеарных фагоцитов, в соответствии с которой макрофаги представляют собой конечную стадию дифференцировки моноцитов крови, которые, в свою очередь, происходят из мультипотентных стволовых клеток крови в костном мозге[5]. Однако исследования, проведённые в 2008—2013 годах, показали, что макрофаги тканей взрослых мышей представлены двумя популяциями, которые различаются по своему происхождению, механизму поддержания численности и функциям[6][7][8]. Первая популяция это тканевые, или резидентные макрофаги. Они происходят из эритромиелоидных предшественников (не имеющих отношения к стволовым клеткам крови) желточного мешка и эмбриональной печени и заселяют ткани на различных этапах эмбриогенеза. Резидентные макрофаги приобретают тканеспецифичные характеристики и поддерживают свою численность за счёт пролиферации in situ без какого-либо участия моноцитов. К долгоживущим тканевым макрофагам относят купферовские клетки печени, микроглию центральной нервной системы, альвеолярные макрофаги лёгких, перитонеальные макрофаги брюшной полости, клетки Лангерганса кожи, макрофаги красной пульпы селезёнки[3][7].
Вторая популяция представлена относительно короткоживущими макрофагами моноцитарного (костномозгового) происхождения. Относительное содержание таких клеток в ткани зависит от её типа и возраста организма. Так макрофаги костномозгового происхождения составляют менее 5% всех макрофагов головного мозга, печени и эпидермиса, небольшую долю макрофагов лёгких, сердца и селезёнки (однако эта доля увеличивается с возрастом организма) и большую часть макрофагов собственной пластинки слизистой оболочки кишечника[8][3][6][7]. Количество макрофагов моноцитарного происхождения резко увеличивается при воспалении и нормализуется по его окончании.
In vitro, под воздействием экзогенных стимулов, макрофаги могут активироваться. Активация сопровождается существенным изменением профиля экспрессии генов и формированием клеточного фенотипа специфичного для каждого типа стимулов. Исторически первыми были открыты два во многом противоположных типа активированных макрофагов, которые по аналогии с Th2/Th3 назвали M1 и M2. Макрофаги типа М1 дифференцируются ex vivo при стимуляции предшественников интерфероном-γ при участии фактора транскрипции STAT1[9]. Макрофаги типа М2 дифференцируются ex vivo при стимуляции интерлейкином 4 (через STAT6).
Долгое время М1 и М2 были единственными известными типами активированных макрофагов, что позволило сформулировать гипотезу об их поляризации. Однако к 2014 году накопились сведения, указывающие на существование целого спектра активированных состояний макрофагов, которые не соответствуют ни типу М1, ни типу М2[10][11]. В настоящее время, нет убедительных доказательств того, что активированные состояния макрофагов, наблюдаемые in vitro, соответствуют тому, что происходит в живом организме, и являются ли эти состояния постоянными или временными[12].
Макрофаги, ассоциированные с опухолью[править | править код]
Злокачественные опухоли оказывают влияние на своё тканевое микроокружение, в том числе и на макрофаги. Моноциты крови инфильтрируют опухоль и под влиянием сигнальных молекул, секретируемых опухолью (M-CSF[en], GM-CSF, IL4, IL10, TGF-β), дифференцируются в макрофаги с «антивоспалительным» фенотипом и, подавляя антиопухолевый иммунитет и стимулируя формирование новых кровеносных сосудов, способствуют росту и метастазированию опухоли[13].
- ↑ Jean-Marc Cavaillon. The historical milestones in the understanding of leukocyte biology initiated by Elie Metchnikoff // Journal of Leukocyte Biology. — 2011-09-01. — Т. 90, вып. 3. — С. 413–424. — ISSN 1938-3673. — doi:10.1189/jlb.0211094.
- ↑ Arthur M. Silverstein. Ilya Metchnikoff, the phagocytic theory, and how things often work in science // Journal of Leukocyte Biology. — 2011-09-01. — Т. 90, вып. 3. — С. 409–410. — ISSN 1938-3673. — doi:10.1189/jlb.0511234.
- ↑ 1 2 3 Chen Varol, Alexander Mildner, Steffen Jung. Macrophages: development and tissue specialization // Annual Review of Immunology. — 2015-01-01. — Т. 33. — С. 643–675. — ISSN 1545-3278. — doi:10.1146/annurev-immunol-032414-112220.
- ↑ Yasutaka Okabe, Ruslan Medzhitov. Tissue biology perspective on macrophages // Nature Immunology. — 2015-12-17. — Т. 17, вып. 1. — С. 9–17. — ISSN 1529-2916. — doi:10.1038/ni.3320.
- ↑ van Furth R., Cohn Z. A., Hirsch J. G., Humphrey J. H., Spector W. G., Langevoort H. L. The mononuclear phagocyte system: a new classification of macrophages, monocytes, and their precursor cells. (англ.) // Bulletin of the World Health Organization. — 1972. — Vol. 46, no. 6. — P. 845—852. — PMID 4538544. [исправить]
- ↑ 1 2 Ugel S., De Sanctis F., Mandruzzato S., Bronte V. Tumor-induced myeloid deviation: when myeloid-derived suppressor cells meet tumor-associated macrophages. (англ.) // The Journal of clinical investigation. — 2015. — Vol. 125, no. 9. — P. 3365—3376. — doi:10.1172/JCI80006. — PMID 26325033. [исправить]
- ↑ 1 2 3 Florent Ginhoux, Martin Guilliams. Tissue-Resident Macrophage Ontogeny and Homeostasis // Immunity. — 2016-03-15. — Т. 44, вып. 3. — С. 439–449. — ISSN 1097-4180. — doi:10.1016/j.immuni.2016.02.024.
- ↑ 1 2 Perdiguero E. G., Geissmann F. The development and maintenance of resident macrophages. (англ.) // Nature immunology. — 2016. — Vol. 17, no. 1. — P. 2—8. — doi:10.1038/ni.3341. — PMID 26681456. [исправить]
- ↑ Peter J. Murray, Judith E. Allen, Subhra K. Biswas, Edward A. Fisher, Derek W. Gilroy. Macrophage activation and polarization: nomenclature and experimental guidelines // Immunity. — 2014-07-17. — Т. 41, вып. 1. — С. 14–20. — ISSN 1097-4180. — doi:10.1016/j.immuni.2014.06.008.
- ↑ Fernando O. Martinez, Siamon Gordon. The M1 and M2 paradigm of macrophage activation: time for reassessment // F1000prime Reports. — 2014-01-01. — Т. 6. — С. 13. — ISSN 2051-7599. — doi:10.12703/P6-13.
- ↑ Jia Xue, Susanne V. Schmidt, Jil Sander, Astrid Draffehn, Wolfgang Krebs. Transcriptome-based network analysis reveals a spectrum model of human macrophage activation // Immunity. — 2014-02-20. — Т. 40, вып. 2. — С. 274–288. — ISSN 1097-4180. — doi:10.1016/j.immuni.2014.01.006.
- ↑ Matthias Nahrendorf, Filip K. Swirski. Abandoning M1/M2 for a Network Model of Macrophage Function // Circulation Research. — 2016-07-22. — Т. 119, вып. 3. — С. 414–417. — ISSN 1524-4571. — doi:10.1161/CIRCRESAHA.116.309194.
- ↑ Alberto Mantovani, Paola Allavena. The interaction of anticancer therapies with tumor-associated macrophages // The Journal of Experimental Medicine. — 2015-04-06. — Т. 212, вып. 4. — С. 435–445. — ISSN 1540-9538. — doi:10.1084/jem.20150295.
Макрофаги в моче — Про потенцию и простатит
Многие годы пытаетесь вылечить ПРОСТАТИТ?
Глава Института: «Вы будете поражены, насколько просто можно вылечить простатит принимая каждый день…Читать далее »
Анализ мочи – лабораторный метод диагностики, который позволяет выявить воспалительные процессы в органах мочевыделительной системы, а также другие патологические процессы в организме обследуемого.
В норме урина человека прозрачная, она имеет светло-желтый или соломенный оттенок, поэтому любое изменение ее цвета должно натолкнуть врача на мысль о начале того или иного заболевания. Мочевой осадок содержит такие элементы, как лейкоциты, эритроциты, эпителиальные клетки и другие компоненты в небольшом количестве. Когда концентрация лейкоцитов в урине превышает предельно допустимые показатели, это значит, что у пациента будет определяться гной в моче.
НАШИ ЧИТАТЕЛИ РЕКОМЕНДУЮТ!
Для улучшения потенции наши читатели успешно используют M-16. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию.
Подробнее здесь…
В медицине существует термин пиурия, который означает появление гноя в моче. Также широко используется понятие лейкоцитурии, что является синонимами одного и того же процесса.
Откуда в мочевом осадке появляется гной?
Для того чтобы понимать, основные причины появления «гнойной» мочи, необходимо разобраться в вопросах о том, что же собой представляет гной, и как он образуется.
Когда в органы мочевыделительной системы проникает инфекционный агент, организм больного запускает механизмы, направленные на борьбу с патогенным микроорганизмом и полное его устранение. В место внедрения возбудителя направляются лейкоциты (нейтрофилы), макрофаги и другие иммунноактивные клетки (цитокины, фактор некроза опухоли и т.д.). Они выделяют вещества, способные его уничтожить и инактивировать. Появление гноя – это, не что иное, как погибшие клетки «защитники» организма и инфекционные агенты.
Основные причины пиурии
Лейкоцитурия наблюдается у мужчин и женщин самого разного возраста, что связано с большим перечнем факторов, которые могут к этому привести.
Среди основных причин патологического симптома стоит выделить следующие:
- Воспалительные процессы в почках (острый и хронический пиелонефрит или гломерулонефрит, туберкулез, абсцесс и другие). Поражаться может одна или обе почки, проникновение патогенного микроорганизма чаще всего происходит из нижних отделов мочевого тракта (мочевого пузыря или уретры), а также из других инфекционных очагов отдаленной локализации. В период беременности возможно появление такого заболевания, как гестационный пиелонефрит.
- Воспалительные процессы в тканях мочевого пузыря (острый или хронический цистит). Чаще всего заболевание регистрируется у представительниц женского пола, при этом пиурия является характерным и патогномоничным симптомом заболевания.
- Воспалительный процесс в тканях мочеиспускательного канала (острый или хронический уретрит). Болезнь имеет крайне неприятные проявления и, как правило, она имеет связь с инфекционными процессами венерического происхождения (ИППП).
- Воспалительный процесс в тканях предстательной железы (острый или хронический простатит). Заболевание является уделом представителей сильного пола, при этом заболевание встречается примерно у каждого второго мужчины старше 40 лет.
- Воспаление в тканях полового члена и крайней плоти (острый и хронический баланопостит). Чаще всего такой диагноз выставляется ребенку, у которого имеется врожденное сужение крайней плоти, что приводит к постоянному скоплению там патогенных микроорганизмов.
- Мочекаменная болезнь. Если на фоне МКБ наблюдается пиурия, то это является прямым свидетельством того, что у пациента есть осложнения в виде воспалительных процессов в нижних отделах мочевыводящего тракта (в мочеточниках, мочевом пузыре или уретре).
- Появление гнойных выделений у женщин может быть обусловле
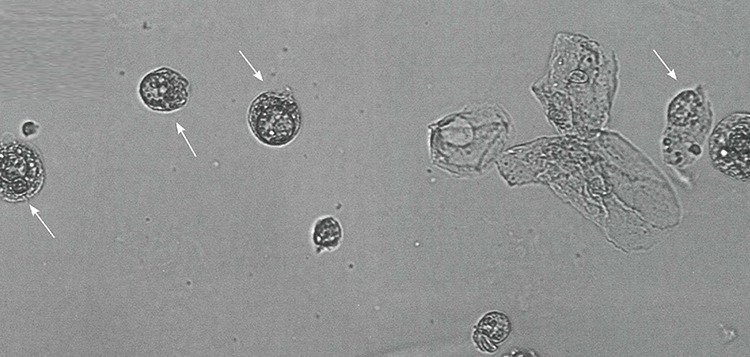
Форменные элементы осадка мочи
Форменные элементы осадка мочи |
|
Здравствуйте!
В предыдущем письме мы рассмотрели эритроциты, лейкоциты и макрофаги в осадке мочи. Сегодня о других типах клеток.
Клетки почечного эпителия
Клетки почечного эпителия образуются из эпителия, выстилающего различные участки почечных канальцев.
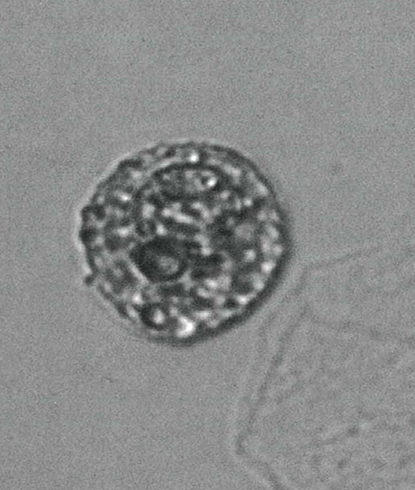
Чаще всего клетки почечного эпителия, обнаруженные в моче, образуются из эпителия проксимальных извитых канальцев. Эти клетки могут быть круглыми, овальными или прямоугольными. Они содержат крупное ядро, расположенное центрально или слегка эксцентрично, в котором одно или два ядрышка. Гранулярная цитоплазма отличается непостоянным количеством органоидов (1, 2, 3). Средний диаметр этих клеток составляет 14 мкм. Таким образом, их размер варьируется между размером лейкоцитов и размером клеток поверхностного слоя переходного эпителия.
Клетки почечного эпителия, образованные из участков канальцев, расположенных более дистально, имеют полигональную форму и несколько меньшие размеры, чем клетки проксимальных извитых канальцев почки (4).
Клетки почечного эпителия обнаруживаются в моче, как в виде одиночных клеток, так и в виде небольших скоплений (5), иногда эти скопления могут формировать сердцевину цилиндров.
Обнаружение клеток почечного эпителия в моче указывает на острый канальцевый некроз. Таким образом, они являются признаками таких заболеваний как острый тубулярный некроз и острый интерстициальный нефрит. Опыт показал, что эти клетки также можно выявить у пациентов при заболеваниях клубочкового аппарата почек, сопровождающихся пролиферацией.
Несмотря на все свое важное диагностическое значение, клетки почечного эпителия остаются наименее известными элементами мочевого осадка. Поэтому, во всех образовательных программах, направленных на изучение мочевого осадка, этим элементам следует уделять особое внимание.
Клетки переходного эпителия
Данные клетки образуются из эпителия, который выстилает мочевыделительную систему от почечных лоханок до мочевого пузыря у женщин и до проксимальной части мочеиспускательного канала у мужчин.
Переходный эпителий содержит в себе несколько слоев клеток, которые образуют непрерывный покров от глубоких слоев, выстилающих базальную мембрану, до поверхностных слоев, находящихся в прямом контакте с мочой.
В моче можно найти клетки всех слоев переходного эпителия, но легче всего идентифицировать клетки глубоких и поверхностных слоев.
Клетки глубоких слоев переходного эпителия могут быть различной формы, но большинство из них чаще всего имеют овальную или булавовидную форму с одним ярко выраженным ядром (6, 7, 8). В овальных клетках ядро находится в центре, тогда как в булавовидных — на периферии. Диаметр таких клеток может сильно варьироваться от 10 мкм (для овальных клеток) до 30 мкм (для булавовидных клеток).
Клетки глубоких слоев обнаруживаются в моче при урологических заболеваниях, повреждающих эпителий мочевыводящих путей, например, при мочекаменной болезни, раке мочевого пузыря или гидронефрозе. Опыт показал, что такие клетки могут обнаруживаться в моче пациентов с установленным в течение продолжительного времени мочеточниковым стентом или мочевым катетером, которые впоследствии механически повреждают («царапают») слизистую оболочку мочевыводящих путей. Клетки поверхностных слоев переходного эпителия намного больше клеток глубоких слоев, их размер колеблется от 17 до 43 мкм. Форма клеток варьирует от круглой до овальной с круглым или овальным ядром, расположенным центрально, реже слегка эксцентрично (9, 10, 11). Иногда в них можно различить четкую зону перинуклеарного просветления (перинуклеарный ореол) (12). В моче они часто формируют скопления из нескольких клеток (13, 14).
Клетки поверхностных слоев переходного эпителия встречаются намного чаще, чем клетки глубоких слоев. Даже легкие повреждения переходного эпителия могут привести к их отделению от слизистой оболочки. Опыт показал, что наиболее часто присутствие большого количества этих клеток в моче указывает на воспаление мочевого пузыря.
Клетки плоского эпителия
Клетки плоского эпителия являются самыми большими клетками в моче, их средний диаметр составляет около 50 мкм и колеблется от 17 до 120 мкм. Форма клеток разнообразна от четырехугольной до многоугольной. Они имеют маленькое ядро, расположенное в центре и обильную цитоплазму, содержащую органоиды. Часто они имеют неровные края и обнаруживаются в виде скоплений различного размера (15, 16, 17).
Обнаружение в моче у женщин небольшого количества (нескольких клеток) плоского эпителия является нормой. Однако, их большое количество указывает на некорректный сбор мочи с возможной примесью клеток наружных половых органов (например, при сборе мочи без разведения половых губ и/или без сбора средней порции мочи), или связано с загрязнением мочи обильными выделениями из половых органов. В последнем случае клетки плоского эпителия часто ассоциируются с присутствием в моче бактерий, грибков и/или Trichomonas vaginalis.
Тема следующей недели — липиды. Не пропустите.
До скорого!
Ваша Вест Медика.
