Атеросклероз почечных артерий — признаки, симптомы, причины, диагностика и способы лечения заболевания
Атеросклероз почечных артерий подразумевает под собой уплотнение стенок и сужение просвета почечных артерий в результате холестериновых отложений внутри сосуда. Протекает в большинстве случаев в виде хронического заболевания, ухудшающего кровоснабжение почек. Основная опасность заключается в риске возникновения вазоренальной симптоматической гипертензии, влекущей за собой угрозу для жизни больного. В другом случае хроническая недостаточность кровоснабжения может привести к развитию почечной недостаточности.
К факторам риска можно отнести:
- пожилой возраст;
- наследственная предрасположенность;
- курение и алкоголь;
- малоподвижный образ жизни;
- сахарный диабет;
- чрезмерное употребление жирной и жареной пищи;
- избыточный вес.
В ходе своего развития атеросклероз почечных артерий проходит несколько стадий:
Латентная стадия – в этом периоде симптоматика заболевания отсутствует, а наличие патологии можно увидеть только с помощью лабораторных и инструментальных методов исследования. Эта стадия может продолжаться в течение нескольких лет.
Эта стадия может продолжаться в течение нескольких лет.
1 стадия заболевания – в тканях почек происходит нарастание ишемических расстройств, и единственным симптомом является повышение артериального давления. Помимо этого в анализе мочи можно увидеть повышение белка.
2 стадия заболевания – в почечных сосудах запускается процесс образования тромбов. Это сопровождается симптомами общей интоксикации в виде рвоты и повышения температуры. Помимо этого присоединяется боль в пояснице с иррадиацией в низ живота и паховую область.
3 стадия заболевания – нефроны почек начинают гибнуть, что влечет за собой формирование почечной недостаточности и более выраженной артериальной гипертензии.
ДиагностикаПомимо общеклинических анализов крови и мочи проводятся инструментальные обследования пациента:
- почечная ангиография;
- МРТ, Эхо-КГ, УЗИ;
- сцинтиграфия почек;
- дуплексное сканирование.

Лечение начинается с устранения провоцирующих факторов, а именно корректировка диеты, увеличение физической активности, устранение вредных привычек и так далее.
Врачом-нефрологом подбирается индивидуальная схема лечения для каждого пациента в зависимости от стадии заболевания и степени изменений в почечной ткани. Медикаментозное лечение осуществляется с помощью антиагрегантов, ангиопротекторов, спазмолитиков, гиполипидемических средств и гипертензивной терапии.
В случае запущенного течения заболевания и наличия высокого риска образования тромбов применяется хирургическое лечение. Существует три основных метода оперативных вмешательств:
- стентирование;
- шунтирование;
- протезирование.
При своевременном лечении данного состояния есть все возможности избежать дальнейших осложнений и сделать благоприятный прогноз для жизни пациента.
Приём флеболога в наших клиниках
Неотложная лучевая диагностика тромбоза главной почечной артерии у пациента с повреждением почки при политравме Текст научной статьи по специальности «Клиническая медицина»
Статья поступила в редакцию 17. 01.2012 г.
01.2012 г.
НЕОТЛОЖНАЯ ЛУЧЕВАЯ ДИАГНОСТИКА ТРОМБОЗА ГЛАВНОЙ ПОЧЕЧНОЙ АРТЕРИИ У ПАЦИЕНТА С ПОВРЕЖДЕНИЕМ ПОЧКИ ПРИ ПОЛИТРАВМЕ
EMERGENCY RADIODIAGNOSIS OF THROMBOSIS OF MAIN RENAL ARTERY
Агафонова Н.В. Agafonova N.V.
Конев С.В. Konev S.V.Агаларян А.Х. Agalaryan A.K.
Левченко Т.В. Levchenko T.V.
Федеральное государственное бюджетное Federal State Medical Prophylactic
лечебно-профилактическое учреждение Institution «Scientific Clinical Center
Научно-клинический центр охраны здоровья шахтеров», of the Miners’ Health Protection»,
г. Ленинск-Кузнецкий, Россия Leninsk-Kuznetsky, Russia
Ленинск-Кузнецкий, Россия Leninsk-Kuznetsky, Russia
Введение. Повреждения почек при политравме занимают третье место среди повреждений органов брюшной полости и забрюшинного пространства, часто сопровождаются повреждением почечной ножки с разрывом, либо окклюзией сосудистых образований, что приводит к развитию некроза почечной паренхимы.
Цель — лучевая диагностика тромбоза почечных артерий в раннем посттравматическом периоде у пациента с политравмой. Материалы и методы. Пациент Л., 1982 г.р., поступил в приёмное отделение через 2,5 часа после случая производственной травмы с повреждением грудной клетки, костей таза, поясничной области слева. Проведены рентгенологические исследования: рентгенография, мультиспиральная компьютерная томография с использованием контрастных препаратов. Выполнена нефрэктомия слева. Проведено гистологическое исследование удалённой левой почки.
Результаты.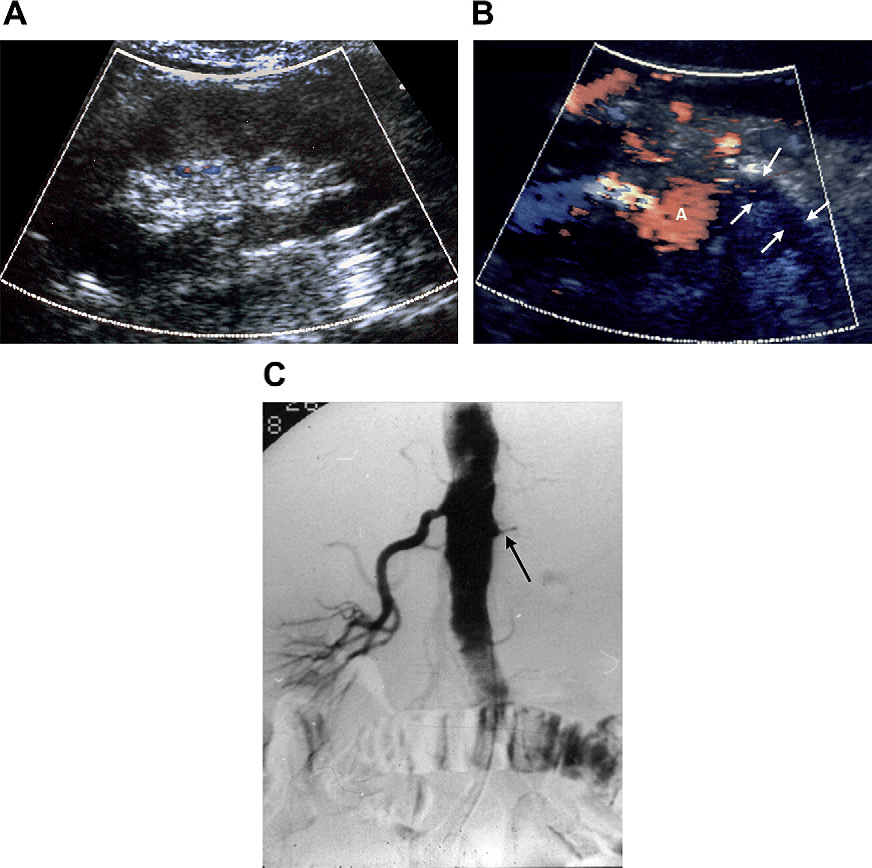 МСКТ ангиография позволила диагностировать травматический тромбоз левой почечной артерии и развитие некроза почечной паренхимы, что послужило поводом для проведения нефрэктомии. Клинико-рент-генологические данные подтверждены результатами патологогистологиче-ского исследования.
МСКТ ангиография позволила диагностировать травматический тромбоз левой почечной артерии и развитие некроза почечной паренхимы, что послужило поводом для проведения нефрэктомии. Клинико-рент-генологические данные подтверждены результатами патологогистологиче-ского исследования.
Выводы. МСКТ ангиография позволила повысить качество диагностики повреждения почек и их сосудов и определить рациональную тактику хирургического лечения.
Ключевые слова: мультиспиральная компьютерная томография; ангиография; тромбоз почечной артерии; рентгеноконтрастные средства; не-фрэктомия.
Introduction. Renal injuries in polytrauma take the third place among the injuries of abdomen and retroperitoneal space. They are often accompanied by injury of renal pedicle with rupture or vascular occlusion that results in renal parenchyma necrosis.2009/76/2.jpg)
The aim of the study — to investigate X-ray diagnostics of renal arteries after polytrauma.
Patients and methods. Patient L. (1982), was admitted to the department in 2,5 hours after industrial trauma of chest, pelvic bones and lumbar region to the left. The X-ray examination was performed which included roentgenography and multispiral computer tomography with contrast media. The nephrectomy of left kidney was carried out. The histological study of the removed kidney was performed.
Results. MSCT angiography allowed to diagnose traumatic thrombosis of the left renal artery and development of renal parenchyma necrosis that resulted in performing of nephrectomy. The clinical radiological data was supported with the results of histopathologic examination.
Conclusion. MSCT angiography improved the quality of diagnostics of renal and vascular injuries, and defined the rational surgical approach.
Key words: multispiral computer tomography; angiography; renal arterial thrombosis; contrast media; nephrectomy.
Повреждения почек при политравме занимают третье место среди повреждений органов брюшной полости и забрюшинного пространства [1-5]. В 38 % летальных исходов при различных травмах фигурируют повреждения почек [2, 3]. Сочетанный характер травмы, шок, нередко алкогольное опьянение, нарушение сознания значительно затрудняют диагностику повреждений органов мочевыводя-щей системы, что приводит к задержке неотложного оперативного
№ 1 [март]
 Левая почка более уязвима и подвержена повреждениям по сравнению с правой почкой,
Левая почка более уязвима и подвержена повреждениям по сравнению с правой почкой,которая топографически лучше защищена [3, 6]. Тяжелые повреждения почек связаны с повреждением почечной ножки с разрывом, либо окклюзией сегментарных или главных сосудистых образований, множественные разрывы почки с повреждением полостной системы почки с явлениями экстравазации мочи, размозжение почки. В литературе мало отражены и недостаточно изучены рентгенологические признаки тромбоза почечной артерии, которые приводят к развитию
острой ишемии почки и затем к некрозу, не указаны сроки ее развития, степень выраженности тромбоза, что влияет на тактику экстренного оперативного вмешательства [7, 8]. Технические особенности мультиспиральной компьютерной томографии (МСКТ), такие как высокая скорость сканирования, а также доступность пациента для реанимационной поддержки в ходе исследования, являются предпосылками к использованию этого метода при неотложных состояниях [4, 5, 7-9]..jpg)
Шкала тяжести травмы почки принятая Американской ассоциацией хирургии травмы (AAST) [10]:
1. Контузия или обширная субкап-сулярная гематома, без разрыва тканей.
2. Необширная околопочечная гематома, кортикальный разрыв < 1 см глубиной, без экстраваза-ции.
3.Кортикальный разрыв > 1 см, без экстравазации мочи.
4. Разрыв: через кортико-медулляр-ное соединение в собирательную систему или сосудистую: повреждение сегментарной почечной артерии или вены, вызывающее гематому.
5.Разрыв: размозженная почка или сосуды: повреждение или отрыв почечной ножки.
Легкая травма почек (I-III степень) является показанием к консервативной терапии, при тяжелой травме почек (IV-V степень) чаще всего выполняют нефрэктомию [11].
Цель — лучевая диагностика тромбоза почечных артерий в раннем посттравматическом периоде у пациента с политравмой.
МАТЕРИАЛ И МЕТОДЫ Проведены рентгенографические исследования органов грудной клетки, костей таза, экскреторная урография на стационарном рентге-нодиагностическом аппарате «Pres-tilix 600», СКТ почек с внутривенным введением контрастного препарата Ультравист 370 на аппарате «Dual Speed», МСКТ ангиография почек и динамическое МСКТ анги-ографическое исследование почек на аппарате «Light Speed».
Выполнена нефрэктомия слева, с гистологическим исследованием макропрепарата удаленной почки.
РЕЗУЛЬТАТЫ
Пациент Л., 1982 г.р., поступил в дежурное приемное отделение в 23.30 14.05.11 г., через 2,5 часа после случая производственной травмы (падение с опрокидывающегося автомобиля БЕЛАЗ, высота около 3 метров), с последующим ударом частью этого автомобиля, с диагнозом: «Политравма.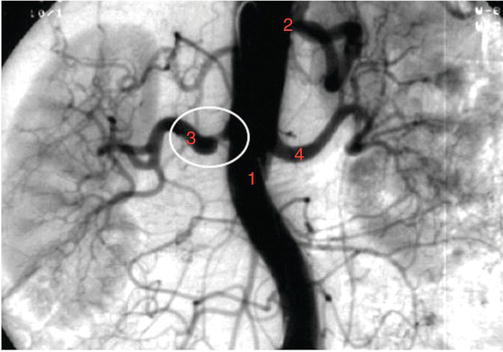 Закрытый, неосложненный перелом VI-VIII ребер слева. Ушиб грудной клетки слева. Закрытый перелом заднего края подвздошной кости слева. Закрытые краевые переломы переднего и заднего отделов боковой массы крестца слева на уровне S2, S3. Разрыв левого крестцово-подвздошного сочленения. Разрыв лонного сочленения. Закрытый перелом основания суставного отростка левой лопатки со смещением отломков. Ушиб поясничной области слева».
Закрытый, неосложненный перелом VI-VIII ребер слева. Ушиб грудной клетки слева. Закрытый перелом заднего края подвздошной кости слева. Закрытые краевые переломы переднего и заднего отделов боковой массы крестца слева на уровне S2, S3. Разрыв левого крестцово-подвздошного сочленения. Разрыв лонного сочленения. Закрытый перелом основания суставного отростка левой лопатки со смещением отломков. Ушиб поясничной области слева».
Состояние пациента средней степени тяжести, в сознании. Выраженная болезненность при пальпации в области VI-VШ ребер слева. Подкожной эмфиземы нет. Дыхание выслушивается с обеих сторон, одинаковое над всеми легочными полями. ЧД 21 в минуту. Пульс 84 удара в минуту, ритмичный, удовлетворительного качества. АД 110/70 мм рт. ст. Тоны сердца ясные, ритмичные. Живот участвует в акте дыхания, при пальпации умеренно напряжен, безболезненный во всех отделах. Перитонеальные симптомы отрицательные. Симптом поколачивания отрицательный с обеих сторон. При пальпации болезненность в области крестцово-подвздошного сочленения слева, в области левой лопатки.
При пальпации болезненность в области крестцово-подвздошного сочленения слева, в области левой лопатки.
При поступлении проведено рентгенологическое и компьютерно-томографическое исследования органов грудной клетки, левой лопатки, таза, контрастное исследование почек. Учитывая отсутствие выделительной функции левой почки по результатам экскреторной урографии, проведено компьютерно-томографическое исследование брюшной полости с внутривенным струйным контрастированием.
Диагностировано отсутствие концентрационной и выделительной функции левой почки. Гемипельви-оперитонеум. Ушиб поясничной и подвздошной мышц слева.
Пациент по экстренным показаниям взят в операционную, где был произведен остеосинтез таза аппаратом внешней фиксации, репозиция перелома левой лопатки.
16.05.11 г. пациенту проведено МСКТ ангиографическое исследование брюшной полости. Заключение: Множественные ушибы и кровоизлияния в паренхиме левой почки. Подкапсульная гематома верхнего полюса левой почки. Тромбоз проксимальной трети левой почечной артерии. Субтотальная ишемия левой почки. Экстраваза-ция контрастного вещества в зонах паренхиматозных кровоизлияний левой почки. Ушиб хвоста поджелудочной железы. Свободная жидкость в левом забрюшинном пространстве, полости таза. Гематома в полости малого таза слева. Ушиб поясничной и подвздошной мышц слева (рис. 1).
Заключение: Множественные ушибы и кровоизлияния в паренхиме левой почки. Подкапсульная гематома верхнего полюса левой почки. Тромбоз проксимальной трети левой почечной артерии. Субтотальная ишемия левой почки. Экстраваза-ция контрастного вещества в зонах паренхиматозных кровоизлияний левой почки. Ушиб хвоста поджелудочной железы. Свободная жидкость в левом забрюшинном пространстве, полости таза. Гематома в полости малого таза слева. Ушиб поясничной и подвздошной мышц слева (рис. 1).
Клинически у больного болевой синдром в левой поясничной области был незначительный, отсутствовала температурная реакция, гемодинамика была стабильной. Учитывая наличие перелома костей левой половины тазового кольца и повреждение крестцово-подвздош-ного сочленения слева, оперативное лечение было связано с высоким риском рецидива кровотечения, а использование донорских компонентов крови могло негативно сказаться на функции правой почки. В связи с этим была выбрана активно-выжидательная тактика ведения больного, скорректирована консервативная терапия. реконструкции
реконструкции
контрастного вещества в участках паренхиматозных кровоизлияний в левой почке, сохраняется нечеткость капсулы левой почки, с формированием паранефральных спаек. Отсутствовало контрастирование ЧЛС левой почки. Ушиб хвоста поджелудочной железы без отрицательной динамики (рис. 2).
На шестые сутки после операции у больного усилился болевой синдром в левой поясничной области, повысилась температура тела до субфебрильных цифр (до 37,4°С). Артериальное давление с тенденцией к гипертензии, нарастал интоксикационный синдром, что явилось показанием к оперативному лечению. С целью уменьшения негативного воздействия на область переломов тазового кольца и развитие вторичного кровотечения был вы-
бран трансабдоминальный доступ к левой почке.
20.05.2011 г. Операция: лапаро-томия, ревизия, нефрэктомия слева, дренирование забрюшинного пространства слева.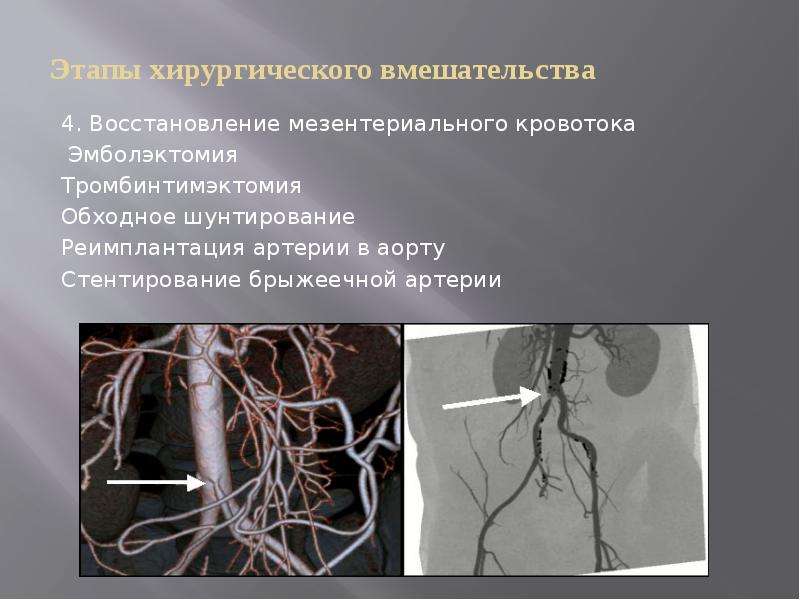 ЭТН. Обработка операционного поля спиртовым раствором хлоргексидина дважды. Верхнесрединная лапаротомия с обходом пупка слева. Послойно вскрыта брюшная полость. В брюшной полости незначительный серозный выпот. Петли тонкого и толстого кишечника не расширены. Видимых повреждений со стороны органов брюшной полости не выявлено. Предбрюшинная, паравези-кальная и забрюшинная клетчатка слева имбибированы кровью. Рассечена брюшина по левому боковому каналу. После мобилизации нисходящей ободочной кишки вскрыто забрюшинное пространство слева.
ЭТН. Обработка операционного поля спиртовым раствором хлоргексидина дважды. Верхнесрединная лапаротомия с обходом пупка слева. Послойно вскрыта брюшная полость. В брюшной полости незначительный серозный выпот. Петли тонкого и толстого кишечника не расширены. Видимых повреждений со стороны органов брюшной полости не выявлено. Предбрюшинная, паравези-кальная и забрюшинная клетчатка слева имбибированы кровью. Рассечена брюшина по левому боковому каналу. После мобилизации нисходящей ободочной кишки вскрыто забрюшинное пространство слева.
При ревизии забрюшинная клетчатка и паранефральная клетчатка имбибирована кровью, отечная, больше в проекции верхнего полюса. Взят посев из забрюшинного пространства слева. Пульсация на левой почечной артерии не определяется, почечная вена слева спавшаяся. Левый мочеточник после лиги-рования с прошиванием пересечен на уровне средней трети. После ли-гирования с прошиванием пересечена сосудистая ножка левой почки между лигатурами. Левая почка удалена единым блоком вместе с паранефральной и забрюшинной клетчаткой, отправлена на гистологическое исследование (рис. 3). При дальнейшей ревизии выявлены участки ушиба и кровоизлияний в области хвоста поджелудочной железы. Забрюшинное пространство слева промыто водным раствором
Левая почка удалена единым блоком вместе с паранефральной и забрюшинной клетчаткой, отправлена на гистологическое исследование (рис. 3). При дальнейшей ревизии выявлены участки ушиба и кровоизлияний в области хвоста поджелудочной железы. Забрюшинное пространство слева промыто водным раствором
Рисунок 3
Макропрепарат удаленной левой почки с паранефральной клетчаткой: а, б — вид левой почки по передней и задней поверхности с участками линейных повреждений и очагами некроза паренхимы; в — разрез левой почки через почечный синус (визуализируются тромбированные артерии, множественные очаги кровоизлияний в паренхиме)
г ;
Л «
№ 1[март]2012
81
хлоргексидина, осушено.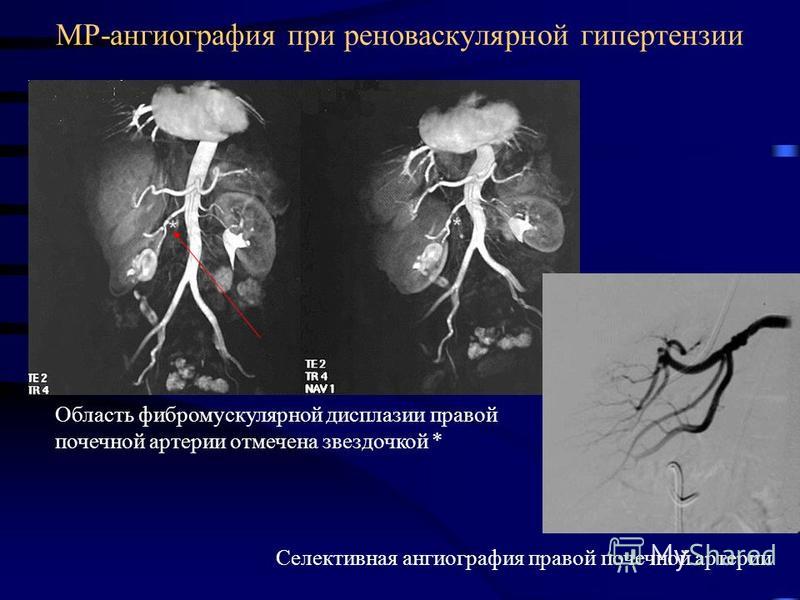 Через отдельный разрез в левом подреберье забрюшинное пространство слева дренировано дренажом по Редону. Дренаж фиксирован кожной лигатурой. Контроль гемостаза сухо. Счет салфеток и инструментария со слов операционной сестры совпал. Забрюшинное пространство слева перитонизировано. Лапаро-томная рана послойно ушита. Наложена асептическая повязка.
Через отдельный разрез в левом подреберье забрюшинное пространство слева дренировано дренажом по Редону. Дренаж фиксирован кожной лигатурой. Контроль гемостаза сухо. Счет салфеток и инструментария со слов операционной сестры совпал. Забрюшинное пространство слева перитонизировано. Лапаро-томная рана послойно ушита. Наложена асептическая повязка.
Операционное заключение: Закрытое повреждение левой почки. Посттравматический тромбоз левой почечной артерии. Нефункци-онирующая левая почка. Гематома (урогематома) забрюшинного пространства слева. Ушиб хвоста поджелудочной железы. Посттравматический панкреатит. Послеоперационный период без особенностей.
Гистологическое исследование левой почки: Макро: почка с околопочечной жировой клетчаткой, надпочечник. Клетчатка желтая с очагами бурого цвета от 0,5 до 1,5 см. Почка размерами 12,5 х 6,5 см, серовато-синюшная с полями бледно-розового цвета. В области верхнего полюса дефект капсулы линейной формы дли-
В области верхнего полюса дефект капсулы линейной формы дли-
Литература:
ной 1 см. На разрезе в области 1-4 сегментов участок клиновидной формы 8 х 4 х 1,5 см бело-желтого цвета с бурым ободком по периферии. В остальных отделах корковый слой розовато-красного цвета, пирамиды красновато-синюшные. Чашечки, лоханки не расширены, слизистая их бледно-серая. Мочеточник тонкий, серый. В просветах ветвей почечной артерии рыхлые серовато-красные тромбы, обтури-рующие их просвет. Материал для морфологического исследования фиксировали 24 часа в 10 % растворе формалина, обезвоживали в спиртах возрастающих концентраций и заливали в гистомикс. Срезы толщиной 4 мкм окрашивали гематоксилин-эозином и по Ван-Гизо-ну. Микро: поля некроза паренхимы (канальцы, клубочки без ядер, контуры их сохранены, набухание, распад волокнистой субстанции стромы). В зоне демаркационного воспаления — кровоизлияния, гиперемия, лимфо-лейкоцитарная инфильтрация. Сохранившиеся клубочки полнокровные, эпителий извитых канальцев с дистрофическими изменениями. В артериях — смешаннные тромбы, участки по-
Сохранившиеся клубочки полнокровные, эпителий извитых канальцев с дистрофическими изменениями. В артериях — смешаннные тромбы, участки по-
вреждения целостности интимы. В жировой клетчатке — крупноочаговые кровоизлияния. В надпочечнике — дисциркуляторные изменения.
Патологогистологический диагноз: Тупая травма почки. Травматический тромбоз передней ветви почечной артерии. Субтотальный инфаркт почки (I, II, III, IV сегментов). Разрыв капсулы почки без повреждения паренхимы, очаговые кровоизлияния в околопочечной жировой клетчатке. Дис-циркуляторные изменения в надпочечнике.
ВЫВОДЫ:
Включение в диагностический алгоритм закрытых повреждений почек при политравме неотложной компьютерной томографии и МСКТ ангиографии значительно повысило качество диагностики повреждения почек и их сосудов, дало объективную, детальную информацию о характере изменения функции и кровоснабжения почек. Проведение МСКТ ангиографии почек в динамике позволило определить рациональную хирургическую тактику и предотвратить развитие осложнений у пациента.
Проведение МСКТ ангиографии почек в динамике позволило определить рациональную хирургическую тактику и предотвратить развитие осложнений у пациента.
1.
2.
3.
4.
5.
6.
7.
8.
Диагностика и лечение закрытых сочетанных повреждений органов брюшной полости и почки /В.Г. Стенько, Н.А. Нечипорен-ко, С.Ф. Ровбуть, А.С. Фоменков //Скорая медицинская помощь. — 2004. — № 3. — С. 194-195.
Лечение закрытых повреждений почек при сочетанной травме /С. Ф. Багненко, И.В. Сорока, Г.Ш. Шанова, Е.А. Мелихов //Материалы X Российского съезда урологов, 1-3 октября 2002 г., г. Москва. — М., 2002. — С. 522-523.
Ф. Багненко, И.В. Сорока, Г.Ш. Шанова, Е.А. Мелихов //Материалы X Российского съезда урологов, 1-3 октября 2002 г., г. Москва. — М., 2002. — С. 522-523.
Довлатян, А.А. Травмы органов мочеполовой системы /А.А. Дов-латян, Ю.В. Черкасов //Урология. — 2003. — № 4. — С. 52-57.
CT findings in blunt renal trauma /A.C. Harris, C.V. Zwirewich, I.D. Lyburn et al. //Radiographics. — 2001. — Vol. 21, Spec. N. — P. 201-214.
Imaging of renal trauma: a comprehensive review /A. Kawashima, C.M. Sandler, F.M. Corl et al. //Radiographics. — 2001. — Vol. 21, N 3. — P. 557-574.
Савченко, С.В. Экспертная оценка повреждения почек при тупой травме /С.В. Савченко, В.П. Новоселов, О.А. Саковчук //Сибирский медицинский журнал. — 2008. — № 1. — C. 71-73. Лучевая диагностика. Болезни мочеполовой системы: пер. с англ. /Б. Хамм, П. Асбах, Д. Бейерсдорф и др.; под ред. Л.М. Гумина. — М.: «Медпресс-информ», 2010. — С. 21-30. CT features of renal infarction /O. Suzer, A. Shirkhoda, S.Z. Jafri et al. //Eur. J. Radiol. — 2002. — Vol. 44, N 1. — P. 59-64.
с англ. /Б. Хамм, П. Асбах, Д. Бейерсдорф и др.; под ред. Л.М. Гумина. — М.: «Медпресс-информ», 2010. — С. 21-30. CT features of renal infarction /O. Suzer, A. Shirkhoda, S.Z. Jafri et al. //Eur. J. Radiol. — 2002. — Vol. 44, N 1. — P. 59-64.
ПОЛИТРАВМА
9. Ангиографическая диагностика травматических повреждений почек /Страхов С.Н., Косырева Н.Б., Беляева О.А. и др. //Материалы X Российского съезда урологов, 1-3 октября 2002 г., г. Москва. — М., 2002. — С. 615.
10. Рекомендации по урологической травме /Н. Дьякович, Т. Линч, Л. Мартинез-Пинейро и др. //Евр. урол. — 2005. — Vol. 47, N 1. — P. 1-15.
11. Lent V. //European journal of trauma. — 2003. — N 4. — P. 193-198.
Сведения об авторах:
Агафонова Н. В., к.м.н., заведующая рентгенологическим отделением, Федеральное государственное бюджетное лечебно-профилактическое учреждение «Научно-клинический центр охраны здоровья шахтеров», г. Ленинск-Кузнецкий, Россия.
В., к.м.н., заведующая рентгенологическим отделением, Федеральное государственное бюджетное лечебно-профилактическое учреждение «Научно-клинический центр охраны здоровья шахтеров», г. Ленинск-Кузнецкий, Россия.
Агаларян А.Х., к.м.н., заведующий хирургическим отделением № 2, Федеральное государственное бюджетное лечебно-профилактическое учреждение «Научно-клинический центр охраны здоровья шахтеров», г. Ленинск-Кузнецкий, Россия.
Конев С.В., врач-рентгенолог, рентгенологическое отделение, Федеральное государственное бюджетное лечебно-профилактическое учреждение «Научно-клинический центр охраны здоровья шахтеров», г. Ленинск-Кузнецкий, Россия.
Левченко Т.В., заведующая патологоанатомическим отделением, Федеральное государственное бюджетное лечебно-профилактическое учреждение «Научно-клинический центр охраны здоровья шахтеров», г. Ленинск-Кузнецкий, Россия.
Ленинск-Кузнецкий, Россия.
Адрес для переписки:
Конев С.В.,
7-й микрорайон, № 9, г. Ленинск-Кузнецкий, 652509, Россия.
ФГБЛПУ «НКЦОЗШ».
Тел: 8 (38456) 9-53-24
Information about authors:
Agafonova N.V., candidate of medical sciences, head of X-ray department, Federal State Medical Prophylactic Institution «Scientific Clinical Center of the Miners’ Health Protection», Leninsk-Kuznetsky, Russia.
Agalaryan A.K., candidate of medical sciences, head of surgery department N 2, Federal State Medical Prophylactic Institution «Scientific Clinical Center of the Miners’ Health Protection», Leninsk-Kuznetsky, Russia.
Konev S.V., radiologist, X-ray department, Federal State Medical Prophylactic Institution «Scientific Clinical Center of the Miners’ Health Protection», Leninsk-Kuznetsky, Russia.
Levchenko T.V., head of anatomic pathology department, Federal State Medical Prophylactic Institution «Scientific Clinical Center of the Miners’ Health Protection», Leninsk-Kuznetsky, Russia.
Address for correspondence:
Konev S.V.,
7th district, 9, Leninsk-Kuznetsky, 652509, Russia.
Federal State Medical Prophylactic Institution «Scientific Clinical Center of the Miners’ Health Protection».
Tel: 8 (38456) 9-53-24
m
№ 1[март]2012
83
11.
 7. Острые окклюзии почечных сосудов
7. Острые окклюзии почечных сосудовВ мировой литературе намного чаще обсуждаются вопросы стенозирующих и окклюзионных поражений почечных сосудов, чем случаи острой патологии (тромбозы и эмболии), хотя последние являются такой же важной проблемой ангиологии. Эффективность лечения этой группы больных во многом определяется своевременностью и точностью диагностики, а специфика острых заболеваний нередко диктует необходимость в
короткое время выбрать оптимальную тактику оказания помощи больному.
11.7.1. Тромбоз почечной артерии
Gilbert и соавт. (1997) отмечают, что наиболее высокий риск развития тромбоза возникает у больных с тяжелыми атеросклеротическими поражениями брюшной аорты в сочетании со стенозами устьев почечных
645
артерий или при
наличии фибромы-шечной дисплазии. Клиническое течение заболевания
может протекать по-разному у больных
с развитой системой коллатерального
кровоснабжения в системах
надпочечни-ковых, капсулярных, поясничных
артерий и больных с единственной
функционирующей почкой. В одном случае
явлений острого тромбоза может
и не быть, в то время как у пациентов
с острым тромбозом и плохим
коллатеральным кровообращением
почки проявляются синдром вазоренальной
гипертензии и явлениями почечной
недостаточности. В современной литературе
описываются
случаи острого тромбоза почечных
артерий как результата транслю-минарной
баллонной ангиопластики при
атеросклеротическом стенозе [Komeyama,
1993].
Клиническое течение заболевания
может протекать по-разному у больных
с развитой системой коллатерального
кровоснабжения в системах
надпочечни-ковых, капсулярных, поясничных
артерий и больных с единственной
функционирующей почкой. В одном случае
явлений острого тромбоза может
и не быть, в то время как у пациентов
с острым тромбозом и плохим
коллатеральным кровообращением
почки проявляются синдром вазоренальной
гипертензии и явлениями почечной
недостаточности. В современной литературе
описываются
случаи острого тромбоза почечных
артерий как результата транслю-минарной
баллонной ангиопластики при
атеросклеротическом стенозе [Komeyama,
1993].
Среди
инструментальных методов исследования,
которые могут подтвердить у больного
тромбоз почечной артерии, основное
значение имеют цветное дуплексное
сканирование, ангиография, компьютерная
томография в сочетании с изотопной
ренографией и сцинтиграфией. При
ангиографии у больных с развитой
коллатеральной системой дисталь-ное
русло обычно сохранено, может быть
проходимым и поэтому конт-растируется.
Стойкое устранение ишемии органа или гипертензии с восстановлением магистрального кровотока без реконструктивной операции невозможно. Хирургическое лечение включает в себя аортопочечное, подвздошно-почечное шунтирование, а в случаях тяжелого атеросклеротического поражения этих сегментов целесообразно выполнение спленоренально-го шунтирования. В качестве пластического материала используются большая подкожная аутовена, внутренняя подвздошная аутоартерия или синтетические протезы. Сообщения об успехе тромболитической терапии с последующим стентированием
единичны, а отдаленные результаты неизвестны.
Следует
воздерживаться от проведения
ангиографического исследования
интраоперационно и в ближайшем
послеоперационном периоде ввиду
нефротоксического действия контрастных
веществ непосредственно после
периода ишемии. Контрольное цветное
дуплексное сканирование позволяет
получить полноценную информацию о
техническом успехе операции.
11.7.2. Эмболия почечных артерий
Значительное
число эмболии происходит спонтанно
из левых отделов сердца. Этому способствует
наличие нарушений ритма, поражения
клапанного
аппарата сердца или наличия эндокардита
или постинфарктной аневризмы,
состояний после протезирования
митрального и/или аортального
клапанов. Реже эмболии имеют артериальное
происхождение: атеро-матозные
и старые тромботические массы из зоны
аневризмы супраре-нального отдела
аорты или изъязвленной атеросклеротической
бляшки.
Введение в клиническую практику
рентгенэндохирургических
вмешательств привело к появлению
ятро-генных эмболии атероматозными
частицами во время катетерных
манипуляций. В 70 % случаев эмболия
происходит
в почечную артерию с одной
стороны, а в 30 % билатерально. Как
правило, эмболии предшествует
нарушение ритма сердца. Клиническая
симптоматика эмболии остается
скудной или может отсутствовать
полностью пока не наступит инфаркт
почки. Симптоматика инфаркта почки
является неспецифичной и проявляется
субфебрильной температурой, болями
во всех отделах живота,
тошнотой, рвотой, гематурией.
Больные отмечают головную боль,
головокружения,
сердцебиение, ноющие
боли в области сердца. При одновременной
эмболии в другие артериальные
бассейны могут присоеди-
Симптоматика инфаркта почки
является неспецифичной и проявляется
субфебрильной температурой, болями
во всех отделах живота,
тошнотой, рвотой, гематурией.
Больные отмечают головную боль,
головокружения,
сердцебиение, ноющие
боли в области сердца. При одновременной
эмболии в другие артериальные
бассейны могут присоеди-
646
ниться
клиника нарушении мозгового и
висцерального кровообращения, симптомы
ишемии конечностей. По данным
лабораторных методов исследования
отмечается лейкоцитарный сдвиг
в сторону юных форм, повышение
уровня ACT
и
ЛДГ, а в анализах мочи макро- и
микрогематурия, про-теинурия,
лейкоцитурия. О нарушении функции
почек могут свидетельствовать
результаты изотопной ренографии и
сцинтиграфии. Однако эти методы не
позволяют судить о локализации поражения
и дифференцировать тромбоз и эмболию.
Ангиографическое исследование помогают
установить диагноз и дифференцировать
тромбоз и эмболию. Исследование может
быть дополнено цветным дуплексным
сканированием.
Сохранение функции
почки при наличии симптомов острой
ишемии более 12 ч маловероятно. Для
решения вопроса об оперативном
вмешательстве имеют значение не
только продолжительность и степень
ишемии, но и состояние другой почки,
выраженность явлений почечной
недостаточности, наличие сопутствующей
сердечно-сосудистой патологии. Выполнение
оперативного вмешательства
в группе больных с высоким риском
осложнений не оправдано даже при
использовании метода селективной
тромболитической терапии и оперативной
эмболэктомии, адекватного до-, интра-
и послеоперационного лечения. У
больных, находящихся в тяжелом
состоянии, предпочтительнее обычное
тромбо-литическое лечение, оно
неэффективно
в случаях эмболизации клапанными
вегетациями, атероматозными массами
и при организовавшемся тромбе. При
осложнении эмболии почечной артерии
инфарктом почки вероятность сохранения
органа остается низкой. Хирургическое
лечение показано у больных с низким
оперативным риском и локальной
окклюзией почечной артерии. Предоперационная подготовка включает
стан-
Предоперационная подготовка включает
стан-
дартную коррекцию водно-электролитного баланса и метаболических нарушений. Техника операции при эмболии почечных артерий аналогична плановым хирургическим вмешательствам у больных вазореналь-ной гипертензией.
Оценка эффективности тромбэк-томии осуществляется интраопера-ционным дуплексным сканированием, что позволяет избежать нефро-токсического действия контрастного вещества при ангиографии. После включения магистрального кровотока в почку возможен отек паренхимы органа, поэтому рекомендуется дека-псуляция почки.
МАТЕРИАЛЫ КОНГРЕССОВ И КОНФЕРЕНЦИЙ: VI РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
VI РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
ОПЕРАЦИИ НА НИЖНЕЙ ПОЛОЙ ВЕНЕ У БОЛЬНЫХ РАКОМ ПОЧКИ
М.И. Давыдов, В.Б. Матвеев, Б.П. Матвеев, К.М. Фигурин, Ю.М. Буйденок, П.И. Феоктистов
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Н.Н. Блохина» Минздрава России, Москва
В России рак почки стоит на одном из первых мест по темпам роста заболеваемости среди злокачественных новообразований. Несмотря на возросшие возможности современных диагностических методов, количество пациентов с распространенными формами заболевания не снижается. В недалеком прошлом результаты лечения больных местно-распространенным и метастатическим раком почки были неутешительными в связи с высокой частотой осложнений и летальности после расширенных оперативных вмешательств, а также отсутствием методов эффективного воздействия на метастазы. Однако совершенствование техники хирургических вмешательств и развитие новых стратегий лечения метастатической болезни требуют пересмотра прежних представлений.
В 4-10% случаев рак почки осложняется развитием опухолевого тромба, распространяющегося по просвету почечной и нижней полой вены (НПВ) вплоть до правых отделов сердца. Хирургическое удаление опухолевого тромба является единственным методом лечения, дающим шанс на выздоровление и продление жизни большинству больных.
С 1971 по 2000 гг. в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России проходили лечение 2507 больных раком почки. Сосудистая инвазия (стадии Т3b-c) была выявлена у 227 (9%) пациентов. В 98 (43,2%) случаях было выполнено радикальное хирургическое вмешательство — нефрэктомия с тромбэктомией.
Основным отличием тромбэктомии от просто радикальной нефрэктомии является необходимость мобилизации, контроля и резекции НПВ, что превращает обычную полостную операцию в сосудистую и может представлять определенные технические сложности.
Прежде чем остановиться на технических приемах, применяемых нами при выполнении операций по удалению опухолевых тромбов, мы хотим выделить основные методологические аспекты тромбэктомий.
1. Вопрос о хирургическом доступе при выполнении нефрэктомии с тромбэктомией является предметом частых дискуссий. Каждый из существующих трех основных доступов — правосторонний торакоабдоминальный, срединный лапаротомный и двухсторонний подреберный — имеет свои преимущества и недостатки. На основании нашего опыта мы считаем, что срединная лапаротомия является наиболее удобным доступом в большинстве случаев рака почки с опухолевым тромбозом НПВ. Его преимуществами являются легкость и быстрота выполнения, малая травматичность, возможность работы на всех органах брюшной полости и выполнения расширенной лимфаденэктомии.
На основании нашего опыта мы считаем, что срединная лапаротомия является наиболее удобным доступом в большинстве случаев рака почки с опухолевым тромбозом НПВ. Его преимуществами являются легкость и быстрота выполнения, малая травматичность, возможность работы на всех органах брюшной полости и выполнения расширенной лимфаденэктомии.
2. Вне зависимости от стороны поражения почки операция должна начинаться «справа», т.е. с мобилизации правой ободочной кишки, выхода на НПВ, почечные вены и аорту.
3. Ранняя перевязка почечной артерии обеспечивает наиболее благоприятные условия для дальнейшего хода операции, т.к. при этом уменьшается объем пораженной почки, уменьшается кровотечение из многочисленных венозных коллатералей и облегчается мобилизация НПВ.
4. Хорошая мобилизация почечных вен и НПВ позволяет осуществлять надежный контроль над гемостазом.
5. Точное определение границ тромба уменьшает риск его фрагментации и отрыва, соответственно снижая возможность развития тромбоэмболических осложнений.
6. Во время операции необходима точная согласованная работа хирурга, анестезиолога и трансфузиолога с применением современных методов уменьшения кровопотери, возврата потерянной крови, коррекции объема циркулирующей крови (ОЦК) и т.д.
Мы считаем, что соблюдение вышеуказанных общих принципов выполнения тромбэктомии является залогом успеха операции.
Методика выполнения тромбэктомии зависит от уровня опухолевого тромба. В зависимости от протяженности и отношения к печеночным венам выделяют 4 вида тромбов НПВ: периренальные, субпеченочные, внутрипеченочные (ретропеченочные) и надпеченочные. Первые три вида относят к группе поддиафрагмальных тромбов. Надпеченочные, они же наддиафрагмальные тромбы, подразделяют на внутриперикардиальные и внутрипредсердные. Уровень распространения тромба является важным фактором при выборе метода хирургического лечения. Для планирования техники операции и прогнозирования результатов лечения большое значение имеет не только протяженность опухолевого тромба, но и степень его фиксации и врастания в сосудистую стенку.
1. Операции при периренальных тромбах.
В случае опухолевого тромба, ограниченного почечной веной, или периренального тромба операция заключается в наложении зажима Сатинского на предварительно мобилизованную НПВ «вокруг» него. Далее выполняется пристеночная резекция НПВ с циркулярным иссечением устья почечной вены, после чего тромб удаляется одним блоком с почкой. Дефект НПВ ушивается непрерывным швом.
2. Операции при субпеченочных тромбах.
В случае подпеченочного тромбоза контроль за сосудами осуществляется наложением турникетов или зажимов на НПВ ниже почечных сосудов, противоположную почечную вену и супраренальный отдел НПВ выше верхнего конца тромба. НПВ вскрывается над устьем почечной вены, разрез продлевается на несколько сантиметров по направлению к верхнему концу опухолевого тромба для его безопасного извлечения. После циркулярного иссечения устья почечной вены почка удаляется единым блоком с опухолевым тромбом. После удаления ромба выполняется ревизия внутренней поверхности НПВ. При наличии мелких фиксированных к интиме фрагментов опухоли производится мобилизация последних острым путем с их максимально полным удалением. Разрез НПВ ушивается непрерывным швом. Турникеты и зажимы удаляются в следующей последовательности: дистальный, затем проксимальный зажим с НПВ, турникет с левой почечной вены.
После удаления ромба выполняется ревизия внутренней поверхности НПВ. При наличии мелких фиксированных к интиме фрагментов опухоли производится мобилизация последних острым путем с их максимально полным удалением. Разрез НПВ ушивается непрерывным швом. Турникеты и зажимы удаляются в следующей последовательности: дистальный, затем проксимальный зажим с НПВ, турникет с левой почечной вены.
3. Операции при ретропеченочных тромбах.
В случае ретропеченочных опухолевых тромбов используются две методики.
I. При распространении опухолевого тромба только на проксимальный ретропеченочный отдел НПВ операция выполняется без мобилизации печени. Дополнительная экспозиция НПВ на 2-3 см вверх достигается с помощью лигирования коротких печеночных вен, идущих из хвостатой доли печени. Данный прием позволяет достигнуть верхней границы опухолевого тромба для наложения зажима Сатинского и его безопасного удаления. Далее операция продолжается как при подпеченочном тромбозе.
II. Удаление внутрипеченочных тромбов, достигающих устьев главных печеночных вен, требует рассечения связочного аппарата печени. После рассечения серповидной, правой треугольной и коронарной связок, печень ротируется медиально, открывая доступ к печеночному и субдиафрагмальному отделу НПВ. При обнажении этих отделов НПВ, как правило, лигируются и пересекаются от 2 до 5 коротких печеночных вен. Турникеты накладываются на субренальный отдел НПВ и на противоположную почечную вену. Для уменьшения циркуляции во внутрипеченочном отделе полой вены и снижения кровопотери на турникет берется также гепатодоуденальная связка (прием Прингла). НПВ выше тромба контролируется пальцевым прижатием или турникетом на уровне внутриперикардиального отдела. НПВ вскрывается на уровне ее ретропеченочного отдела на 1-2 см ниже верхней границы тромба. Разрез продлевается по направлению к устью пораженной почечной вены. Верхний конец тромба выводится в рану с помощью заведенного выше его верхней границы катетера Фолея, после чего освобожденный от тромба печеночный отдел НПВ после визуальной инспекции ушивается. Как только ушивание дефекта стенки ретропеченочной НПВ заканчивается, на субпеченочный отдел НПВ накладывается зажим Сатинского. Далее операция продолжается как при субпеченочном тромбозе.
Как только ушивание дефекта стенки ретропеченочной НПВ заканчивается, на субпеченочный отдел НПВ накладывается зажим Сатинского. Далее операция продолжается как при субпеченочном тромбозе.
4. Операции при надпеченочных тромбах.
Для удаления внутриперикардиальных и внутрипредсердных опухолевых тромбов мы использовали два различных подхода: с использованием искусственного кровообращения и без него.
А) Нами выполнено 3 операции с использованием сердечно-легочного шунтирования без гипотермии у больных с массивным внутрипредсердным тромбом, когда требовалось чреспредсердное удаление опухоли. В качестве хирургического доступа использовалась срединная лапаротомия со стернотомией. После перевязки почечной артерии и мобилизации подпеченочной НПВ почка полностью мобилизовалась экстрафасциально, оставаясь фиксированной только тромбированной веной. НПВ ниже почечных сосудов, контралатеральная почечная вена и гепатодоуденальная свзязка брались на турникеты. После тщательного гемостаза проводилась гепаринизация и канюлирование восходящей части дуги аорты и правого предсердия. Больной переводился на искусственное кровообращение. Полая вена вскрывалась над устьем правой почечной вены, которое циркулярно иссекалось. Одновременно вскрывалось правое предсердие, через которое удалялась наддиафрагмальная часть опухоли. Почка удалялась одним блоком с поддиафрагмальной частью фрагментированного тромба. После тщательной ревизии НПВ и удаления всех фрагментов опухоли НПВ ушивалась непрерывным швом. Правое предсердие ушивалось двухрядным швом, и больной переводился на самостоятельное кровообращение. Канюли удалялись, и больному вводился протамин сульфат для нейтрализации действия гепарина.
После тщательного гемостаза проводилась гепаринизация и канюлирование восходящей части дуги аорты и правого предсердия. Больной переводился на искусственное кровообращение. Полая вена вскрывалась над устьем правой почечной вены, которое циркулярно иссекалось. Одновременно вскрывалось правое предсердие, через которое удалялась наддиафрагмальная часть опухоли. Почка удалялась одним блоком с поддиафрагмальной частью фрагментированного тромба. После тщательной ревизии НПВ и удаления всех фрагментов опухоли НПВ ушивалась непрерывным швом. Правое предсердие ушивалось двухрядным швом, и больной переводился на самостоятельное кровообращение. Канюли удалялись, и больному вводился протамин сульфат для нейтрализации действия гепарина.
Б) Для контроля за НПВ при внутри- и надпеченочных опухолевых тромбах нами использовался предложенный проф. Давыдовым М.И. простой и легко выполнимый доступ к внутриперикардиальному отделу НПВ, позволяющий избежать нежелательных последствий кардиопульмонального шунтирования. Доступ заключается в вертикальном рассечении диафрагмы и прилежащего к ней перикарда непосредственно над НПВ или чуть правее ее прохождения через диафрагму. При этом хирург получает возможность контролировать крайне важный отдел НПВ, что позволяет уменьшить кровопотерю, дополнительную мобилизацию и снижает риск тромбоэмболических осложнений. При внутрипеченочных тромбах, достигающих уровня диафрагмы, на внутриперикардиальный отдел НПВ может быть наложен турникет для уменьшения циркуляции во внутрипеченочном отделе НПВ. При тромбах, достигающих предсердия, данный доступ позволяет осуществлять визуальный и пальпаторный контроль за внутриперикардиальным отделом НПВ на этапе выведения флотирующей верхушки тромба из просвета сосуда с помощью заведенного выше его верхней границы катетера Фолея. Преимущество трансдиафрагмального доступа заключается в меньшей травматичности и инвазивности, по сравнению со стернотомией и торакотомией.
Доступ заключается в вертикальном рассечении диафрагмы и прилежащего к ней перикарда непосредственно над НПВ или чуть правее ее прохождения через диафрагму. При этом хирург получает возможность контролировать крайне важный отдел НПВ, что позволяет уменьшить кровопотерю, дополнительную мобилизацию и снижает риск тромбоэмболических осложнений. При внутрипеченочных тромбах, достигающих уровня диафрагмы, на внутриперикардиальный отдел НПВ может быть наложен турникет для уменьшения циркуляции во внутрипеченочном отделе НПВ. При тромбах, достигающих предсердия, данный доступ позволяет осуществлять визуальный и пальпаторный контроль за внутриперикардиальным отделом НПВ на этапе выведения флотирующей верхушки тромба из просвета сосуда с помощью заведенного выше его верхней границы катетера Фолея. Преимущество трансдиафрагмального доступа заключается в меньшей травматичности и инвазивности, по сравнению со стернотомией и торакотомией.
Таким образом, большинство опухолевых тромбов может быть удалено без применения кардиопульмонального шунтирования. Снижая риск эмболических осложнений, кардиопульмональное шунтирование значительно увеличивает объем, травматичность операции и риск коагулопатических кровотечений вследствие системной гепаринизации. Мы считаем, что применение искусственного кровообращения ограничено случаями, когда тромб невозможно удалить через разрез НПВ, не фрагментируя его, из-за большого внутрипредсердного компонента, а также при фиксированных к интиме НПВ и правого предсердия тромбах, что имело место у 3 наших больных. Для получения дополнительной информации о степени фиксации тромба всем больным с внутрипеченочными и наддиафрагмальными тромбами целесообразно выполнение интраоперационного ультразвукового исследования.
Снижая риск эмболических осложнений, кардиопульмональное шунтирование значительно увеличивает объем, травматичность операции и риск коагулопатических кровотечений вследствие системной гепаринизации. Мы считаем, что применение искусственного кровообращения ограничено случаями, когда тромб невозможно удалить через разрез НПВ, не фрагментируя его, из-за большого внутрипредсердного компонента, а также при фиксированных к интиме НПВ и правого предсердия тромбах, что имело место у 3 наших больных. Для получения дополнительной информации о степени фиксации тромба всем больным с внутрипеченочными и наддиафрагмальными тромбами целесообразно выполнение интраоперационного ультразвукового исследования.
Анатомические взаимоотношения левой почки и магистральных сосудов, а также особенности венозного коллатерального кровотока создают определенные трудности при выполнении нефрэктомии с тромбэктомией. При поражении левой почки операция начинается точно так же как при опухоли правой почки, т. е. с мобилизации правой ободочной кишки, выхода на почечные вены, НПВ и аорту. Ранняя перевязка почечной артерии пораженной почки является одним из наиболее важных этапов операции. Далее производятся мобилизация и взятие на турникет тромбированной левой почечной вены. Дальнейшая мобилизация НПВ не отличается от таковой при поражении правой почки и зависит от протяженности опухолевого тромба. Контроль за сосудами осуществляется путем наложения турникетов на НПВ ниже почечных сосудов, правую почечную вену и НПВ выше верхней границы тромба. Следующим этапом выполняется полная мобилизация левой почки, которая остается фиксированной только тромбированной левой почечной веной. В зависимости от размеров опухоли возможно использование трех различных приемов. При небольших размерах пораженной почки последняя проводится в окно в мезоколон для моноблочного удаления с тромбом. При невозможности выполнения данного приема (опухоль больших размеров) выполняется перевязка и пересечение тромбированной левой почечной вены с последующей раздельной тромбэктомией и нефрэктомией.
е. с мобилизации правой ободочной кишки, выхода на почечные вены, НПВ и аорту. Ранняя перевязка почечной артерии пораженной почки является одним из наиболее важных этапов операции. Далее производятся мобилизация и взятие на турникет тромбированной левой почечной вены. Дальнейшая мобилизация НПВ не отличается от таковой при поражении правой почки и зависит от протяженности опухолевого тромба. Контроль за сосудами осуществляется путем наложения турникетов на НПВ ниже почечных сосудов, правую почечную вену и НПВ выше верхней границы тромба. Следующим этапом выполняется полная мобилизация левой почки, которая остается фиксированной только тромбированной левой почечной веной. В зависимости от размеров опухоли возможно использование трех различных приемов. При небольших размерах пораженной почки последняя проводится в окно в мезоколон для моноблочного удаления с тромбом. При невозможности выполнения данного приема (опухоль больших размеров) выполняется перевязка и пересечение тромбированной левой почечной вены с последующей раздельной тромбэктомией и нефрэктомией. Третий вариант заключается в извлечении тромба из просвета НПВ с последующей циркулярной резекцией стенки левой почечной вены без фрагментации тромба. После ушивания дефекта стенки НПВ завернутый в салфетку опухолевый тромб проводится под мезоколон для моноблочного удаления с почкой.
Третий вариант заключается в извлечении тромба из просвета НПВ с последующей циркулярной резекцией стенки левой почечной вены без фрагментации тромба. После ушивания дефекта стенки НПВ завернутый в салфетку опухолевый тромб проводится под мезоколон для моноблочного удаления с почкой.
Возможность распространения опухоли не только по почечной, но и по надпочечниковой и гонадной венам при поражении левой почки требует мобилизации указанных вен для визуальной и пальпаторной инспекции. При пальпируемом тромбе с целью обеспечения радикальности операции перевязка вены осуществляется максимально отступя от предполагаемой границы опухоли. После ее пересечения производится визуальная инспекция внутреннего просвета.
По нашим данным, общая 5- и 10-летняя выживаемость пациентов, подвергнутых нефрэктомии с тромбэктомией, составляет 48,9% и 26%, скорректированная — 55% и 39,6%. При однофакторном анализе выживаемость достоверно коррелировала с протяженностью тромба, степенью дифференцировки опухоли (G), наличием метастазов в лимфатических узлах и полнотой удаления всей видимой опухоли (p<0,05, Logrank Test). Объединив больных с наличием факторов плохого прогноза в одну группу, мы сравнили отдаленные результаты лечения данных пациентов с больными, не имеющими прогностически неблагоприятных факторов. Медианы выживаемости двух когорт составили 51 мес. и 131 мес. соответственно. Разница была статистически значима (p=0,01, Logrank Test). 5- и 10-летняя выживаемость в указанных группах составила 33% и 62,3%, 16,2% и 52% соответственно. При многофакторном регрессионном анализе Cox единственным признаком, влияющим на выживаемость, оказалась радикальность выполненной операции, что говорит о высокой значимости влияния «хирургического» фактора на отдаленные результаты лечения.
Объединив больных с наличием факторов плохого прогноза в одну группу, мы сравнили отдаленные результаты лечения данных пациентов с больными, не имеющими прогностически неблагоприятных факторов. Медианы выживаемости двух когорт составили 51 мес. и 131 мес. соответственно. Разница была статистически значима (p=0,01, Logrank Test). 5- и 10-летняя выживаемость в указанных группах составила 33% и 62,3%, 16,2% и 52% соответственно. При многофакторном регрессионном анализе Cox единственным признаком, влияющим на выживаемость, оказалась радикальность выполненной операции, что говорит о высокой значимости влияния «хирургического» фактора на отдаленные результаты лечения.
Таким образом, активный хирургический подход к больным с опухолевым тромбозом НПВ является эффективным методом лечения, а радикальное удаление тромба любой протяженности даёт шанс на выздоровление большинству больных.
Клинический случай одномоментного малоинвазивного хирургического лечения пациента с новообразованием почки и опухолевым тромбом в нижней полой вене | Мосоян
В настоящее время в хирургии прослеживается тенденция к переходу к малоинвазивным вмешательствам, позволяющим снизить риски интра- и постоперационных осложнений и добиться более быстрого реабилитационного периода. В статье представлен клинический случай успешного одномоментного малоинвазивного хирургического лечения пациента со злокачественным новообразованием правой почки. По данным ультразвукового исследования в правой почке пациента обнаружено объемное образование. По результатам компьютерной томографии брюшной полости подтверждено новообразование и обнаружен опухолевый тромб в просвете нижней полой вены. Первым этапом в условиях гибридной операционной пациенту под местной анестезией выполнена эмболизация правой почечной артерии. Вторым этапом проведена робот-ассистированная лапароскопическая правосторонняя нефрэктомия с тромбэктомией из нижней полой вены и адреналэктомией. В представленном клиническом случае эмболизация и нефрэктомия осуществлялись в качестве одномоментного двухэтапного хирургического лечения. Пациент выписан на 10-е сут. в удовлетворительном состоянии. Уникальная работа двух команд хирургов, занимающихся малоинвазивными технологиями, позволила добиться радикального удаления опухоли и тромба из нижней полой вены за меньшее число процедур и тем самым снижения риска кровотечения, уменьшения длительности койко-дня и реабилитационного периода. Данная методика открывает возможность для помощи большему числу пациентов, имеющих опухоль почки.
В статье представлен клинический случай успешного одномоментного малоинвазивного хирургического лечения пациента со злокачественным новообразованием правой почки. По данным ультразвукового исследования в правой почке пациента обнаружено объемное образование. По результатам компьютерной томографии брюшной полости подтверждено новообразование и обнаружен опухолевый тромб в просвете нижней полой вены. Первым этапом в условиях гибридной операционной пациенту под местной анестезией выполнена эмболизация правой почечной артерии. Вторым этапом проведена робот-ассистированная лапароскопическая правосторонняя нефрэктомия с тромбэктомией из нижней полой вены и адреналэктомией. В представленном клиническом случае эмболизация и нефрэктомия осуществлялись в качестве одномоментного двухэтапного хирургического лечения. Пациент выписан на 10-е сут. в удовлетворительном состоянии. Уникальная работа двух команд хирургов, занимающихся малоинвазивными технологиями, позволила добиться радикального удаления опухоли и тромба из нижней полой вены за меньшее число процедур и тем самым снижения риска кровотечения, уменьшения длительности койко-дня и реабилитационного периода. Данная методика открывает возможность для помощи большему числу пациентов, имеющих опухоль почки.
Введение
Распространенность рака почки в России составляет 4–5% всех видов опухолей. В большинстве случаев этот вид онкологического заболевания на начальных стадиях протекает бессимптомно, поэтому он обнаруживается случайно или на поздних симптомных стадиях. Кроме того, в последние несколько лет распространенность рака почки увеличилась [1, 2]. Способность опухоли к быстрому росту и метастазированию, благодаря выраженной васкуляризации, а также образованию тромбов в нижней полой вене (НПВ), венах малого таза и печеночных венах определяет сложность лечения данного вида рака и необходимость междисциплинарного этапного подхода [1, 3].
Эмболизация почечной артерии перед нефрэктомией — метод, позволяющий избежать массивного кровотечения при удалении пораженной злокачественным образованием почки, снизить травматичность радикальной операции и уменьшить частоту осложнений, прежде всего геморрагических [1, 3, 4]. Новым направлением в хирургии, в частности урологии, являются робот-ассистированные операции. Роботизированный комплекс позволяет добиться более точного, направленного выполнения нефрэктомии или резекции почки, более полной визуализации операционного поля при минимальной травматичности. Данные преимущества особенно актуальны при онкологических заболеваниях, когда опухоль изменяет нормальную анатомию, архитектонику и взаимоотношение органов [4, 5].
Показанием к эмболизации почечной артерии служит обильно васкуляризированная опухоль перед нефрэктомией или паллиативное лечение у пациентов с неоперабельной опухолью [6, 7].
Эмболизация почечной артерии как первый этап перед нефрэктомией в комплексном лечении пациентов с опухолью почки достаточно широко освещена в литературе [1, 2, 7–9]. Количество публикаций, в которых описано успешное применение данной методики, увеличилось за последнее десятилетие, что связано с совершенствованием технических средств и распространением малоинвазивной хирургии [1, 3, 6–8, 10]. В литературе также освещены вопросы робот-ассистированного удаления опухолевого тромба из нижней полой вены при нефрэктомии [4, 5, 11–14], кроме того, Z.J. Estebanez с соавт. сообщают об эндоваскулярной эмболизации перед робот-ассистированной нефрэктомией с тромбэктомией из нижней полой вены [13].
В статье представлен случай успешного применения двумя командами хирургов малоинвазивных методик для лечения пациента с гиперваскуляризированными опухолями почек.
Клинический случай
Пациент Я. 50 лет госпитализирован в отделение урологии ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России для обследования и хирургического лечения. Новообразование правой почки впервые обнаружено в октябре 2017 г., когда пациент обратился в больницу по месту жительства с гематурией. При ультразвуковом исследовании (УЗИ) брюшной полости выявлено объемное образование нижнего полюса правой почки. Консультирован онкоурологом, определены показания для хирургического лечения. В декабре 2017 г. проведена мультиспиральная компьютерная томография органов брюшной полости с контрастированием, по результатам которой подтверждено новообразование правой почки, распространяющееся в нижнюю полую вену и занимающее около 70% площади сечения НПВ на уровне правой почечной артерии. Учитывая сложный клинический случай, пациента направили в ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России.
Случай обсудили на консилиуме с участием урологов и сосудистых хирургов, определены показания к выполнению одномоментного хирургического лечения.
Первым этапом в условиях гибридной операционной проведена эндоваскулярная эмболизация правой почечной артерии.
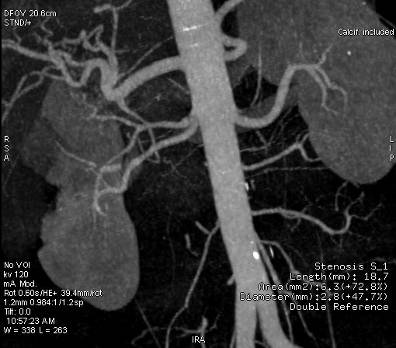
Под местной анестезией пунктирована в ретроградном направлении правая общая бедренная артерия, установлен интродьюсер 6F, к устью правой почечной артерии по гидрофильному проводнику подведен диагностический катетер SIM1 6F. При селективной ангиографии — равномерное контрастирование правой почечной артерии, сосудистой сети новообразования в нижнем полюсе почки (рис. 1).
Эмболизация почечной артерии частицами Contour 500–710 мкм (рис. 2). Согласно результатам контрольной ангиографии, междольковые, дуговые и междолевые артерии не контрастируются (достигнута их окклюзия, рис. 3).
Пункционное отверстие закрыто с помощью ушивающего устройства AngioSeal 6F.
Затем выполнен второй этап хирургического лечения — робот-ассистированная лапароскопическая правосторонняя нефрэктомия с тромбэктомией из НПВ, правосторонняя адреналэктомия. Под эндотрахеальным наркозом в положении больного на левом боку выполнен лапароцентез в нижней параумбиликальной точке, наложен карбоксиперитонеум. Троакары da Vinci введены в типичных местах.
При ревизии в брюшной полости визуализируется образование правой почки больших размеров. Выделены сосудистая ножка правой почки (артерия, вена), нижняя полая вена, левая почечная вена. Правая почечная артерия клипирована и пересечена. Выделена нижняя полая вена выше места впадения в нее правой надпочечниковой вены. В ее просвете у места впадения правой почечной вены определяется опухолевый тромб. Выполнено интраоперационное УЗИ лапароскопическим датчиком, определены границы тромба — верхняя граница примерно на 2 см ниже уровня впадения печеночной вены. Последовательно наложены лигатуры и зажимы типа «бульдог» на нижнюю полую вену проксимальнее (ниже уровня впадения печеночной вены) и дистальнее тромба (ниже впадения правой почечной вены примерно на 3 см), на левую почечную вену (проксимальнее впадения левых надпочечниковой и яичниковой вен). Просвет нижней полой вены вскрыт в месте впадения правой почечной вены, опухолевый тромб размерами 2 х 2,1 см извлечен методом прямой тромбэктомии, правая почечная вена отсечена. Дефект в стенке НПВ ушит двухрядным сосудистым швом. Последовательно сняты зажимы типа «бульдог’» с левой почечной вены, затем ниже ушитого дефекта НПВ, далее — выше ушитого дефекта НПВ. Выделена правая надпочечниковая вена, клипирована, пересечена. Правая почка выделена единым блоком с правым надпочечником, опухолевым тромбом, удалена через дополнительный разрез по Мак-Бурнею в правой подвздошной области. Проведен гемостаз, рана послойно ушита. Выполнено экспресс-гистологическое исследование — подтверждено злокачественное новообразование, опухолевый тромб и метастаз в надпочечнике. Общий объем кровопотери за время операции составил 800 мл. Реинфузия крови осуществлялась с помощью аппарата Сell Saver (объем реинфузии 400 мл), рис. 4.
На 7-е сут. после хирургического лечения проведено контрольное УЗИ брюшной полости: плановые послеоперационные изменения в ложе удаленной правой почки. Со стороны эндоваскулярного доступа осложнений не было. На 10-е сут. пациент в удовлетворительном состоянии выписан на амбулаторное лечение.
Обсуждение
Использование малоинвазивных методик в качестве одного из этапов хирургического лечения рака почки позволяет снизить травматичность и частоту геморрагических осложнений при мобилизации почки, выделении и иссечении почечной ножки, лигировании почечной вены. Эндоваскулярные методы лечения обеспечивают минимальный риск осложнений, что позволяет провести «открытое» вмешательство в кратчайшие сроки после него [2, 7].
Изначально эмболизация почечной артерии применялась при нерезектабельной опухоли у пациента. В 1970-х гг. хирурги начали использовать эмболизацию как самостоятельный хирургический метод перед резекцией почки или нефрэктомией, добиваясь тем самым снижения осложнений, связанных с кровотечением [10]. В настоящее время эмболизация почечной артерии находит все большее применение как самостоятельный метод, так и в качестве одного из этапов хирургического вмешательства [3, 6, 8].
Новой тенденцией в развитии малоинвазивной хирургии, в частности урологии, являются робот-ассистированные операции. В настоящее время наибольшую известность получил роботизированный комплекс da Vinci. Первая робот-ассистированная нефрэктомия проведена в 2000 г. За последнее десятилетие данный вид вмешательств приобретает широкое распространение благодаря более полной визуализации, точности и радикальности в сочетании с минимальным риском операционных осложнений и малой травматичностью [4, 5, 12].
Особенностью гиперваскуляризированных опухолей почки является то, что выраженная артериальная сеть сопровождается наличием большого количества расширенных вен, таким образом эмболизация почечной артерии ведет не только к прекращению артериального кровотока, но и к спадению венозных коллатералей [8].
Для выполнения эмболизации существует множество эмболизирующих агентов, но все они должны полностью окклюзировать кровоток не только по основному артериальному руслу, но и сосудистым коллатералям, идущим к опухоли. Эмболизацию осуществляют эндоваскулярно, после катетеризации почечной артерии выполняют селективную ангиографию и целенаправленную эмболизацию до полной окклюзии выбранной артерии и ее ветвей [2, 10, материалы Четвертого российского съезда интервенционных кардиоангиологов. Москва, 21–23 марта 2011 г.].
Традиционно эмболизацию почечной артерии проводит эндоваскулярный хирург с использованием малоинвазивного доступа, селективной катетеризации и введением эмболизирующих агентов, приводящих к ишемии опухоли. Спустя 2–3 дня хирург-уролог выполняет следующий этап — нефрэктомию. При таком подходе у пациентов развивается так называемый постэмболизационный синдром, связанный с прекращением притока к органу, пораженному опухолью. Данный синдром проявляется болями в животе, тошнотой, рвотой, лихорадкой и лейкоцитозом [3, 6].
В представленном нами клиническом случае эмболизация и нефрэктомия осуществлялись в качестве одномоментного двухэтапного хирургического лечения. Такую технику часто применяют, что позволяет не только снизить риск кровотечения, избежать постэмболизационный синдром и добиться радикального излечения за меньшее число процедур, но и уменьшить количество дней, проведенных пациентом в стационаре [10].
Выводы
Описанный клинический случай демонстрирует успешность, эффективность и перспективность применения двух малоинвазивных хирургических методик в лечении пациентов с гиперваскуляризированными опухолями почки. Данная комбинация является альтернативой «открытому» хирургическому лечению и может использоваться у пациентов высокого риска. Также этот уникальный случай показывает возможность снижения травматичности, уменьшения сроков госпитализации и реабилитации пациентов трудоспособного возраста.
Информированное согласие
Получено информированное согласие пациента на использование медицинских данных в научных целях.
Финансирование
Исследование не имело спонсорской поддержки.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Триплексное сканирование основных сосудов почек с оценкой внутрипочечного кровотока
В Клиническом госпитале на Яузе проводится триплексное сканирование основных сосудов почек и внутрипочечного кровотока — неинвазивное исследование, помогающее поставить точный диагноз при заболеваниях почек, провести предоперационное обследование, оценить состояние органа после трансплантации.
Исследование выполняют врачи отделения ультразвуковой диагностики, имеющие высшую врачебную категорию, ученые степени. В работе отделения используется современное диагностическое оборудование, в том числе ультразвуковые сканеры Aсcuvix A30 производства фирмы Samsung Medison, Южная Корея и HIVision Prerius — Hitachi, Япония.
Триплексное сканирование сосудов почек с оценкой внутрипочечного кровотока — это комплексное ультразвуковое обследование артерий и вен, включающее 3 вида исследований.
- ультразвуковую диагностику в режиме серошкального сканирования (В-режим),
- цветовое допплеровское картирование (ЦДК),
- спектральный анализ кровотока на основе ультразвуковой допплерографии.
Возможности метода
Триплексное сканирование почечных сосудов позволяет в режиме реального времени, позволяет получить следующие данные:
- Выявить патологические изменения сосудов почек.
- Определить анатомическую форму и расположение почечных артерий и вен.
- Выявить сужения (стенозы), извитости, перекруты, перегибы и иные аномалии форм и хода сосудов, в том числе — добавочные сосуды.
- Исследовать проходимость сосудов, например, атеросклеротические наслоения на их стенках и иные случаи окклюзий (закрытия просвета), выявить тромбы в почечных венах и/или артериях.
- Провести анализ состояния внутрипочечного кровотока, необходимый для дифференциальной диагностики заболеваний почек.
Показания к триплексному сканированию сосудов почек
- Хронические диффузные заболевания почек (гломерулонефрит, интерстициальный нефрит различного происхождения), воспалительные заболевания почек (пиелонефрит) при сохраненной функции почек (ХПН 0) для их дифференциальной диагностики.
- Подозрение на аномалию развития сосудов почек.
- Артериальная гипертония.
- Хроническая почечная недостаточность
- Ангиопатии (заболевания сосудов) разного происхождения.
- Осмотр по желанию пациента.
Подготовка к исследованию
Исследование выполняется строго натощак. В день исследования запрещается курить, жевать жвачку, исключить физические нагрузки.
Мочевой пузырь должен быть опорожнен.
Накануне исследования нельзя употреблять продукты, вызывающие метеоризм: ржаной и хлеб, молоко, каши и пр.
Пациентам с избыточным весом и со склонностью к вздутию живота за 2-3 суток рекомендуется прием препаратов, уменьшающих газообразование: сорбенты (активированный уголь), ферменты (Фестал) и/или препараты, такие как Эспумизан.
Исследование почечного кровотока и основных сосудов почек методом триплексного сканирования в Клиническом госпитале на Яузе поможет быстрее установить правильный диагноз и выбрать оптимальное лечение.
Цены на услуги Вы можете посмотреть в прайсе или уточнить по телефону, указанному на сайте.
СЛУЧАЙ ЛЕВОСТОРОННЕЙ ОККЛЮЗИИ ПОЧЕЧНОЙ АРТЕРИИ У РЕБЕНКА С ГЕНЕТИЧЕСКОЙ ФОРМОЙ ТРОМБОФИЛИИ | Ни
В последние годы проблема тромботических заболеваний становится актуальной для врачей различных специально стей как взро слой, так и детской практики. В связи с открытием ряда генетически обусловленных дефектов гемостаза, предрасполагающих к тромбозу (мутация фактора V Leiden, мутация протромбина G20210A, мутация метиленте- трагидрофолатредуктазы С677Т, полиморфизм гена активатора плазминогена-1, полиморфизм тромбоцитарных рецепторов), стало возможным объяснение тромботических состояний, возникающих у детей [1]. Особенностью генетически обусловленной тромбофилии является то, что она может долгое время никак себя не проявлять клинически. В течение последних лет тромбозы у детей диагностируют все чаще. Обычно они возникают при воздействии двух протромботических факторов и более, как генетически обусловленных, так и остро развившихся тромботических осложнений. При этом тромботические и геморрагические осложнения приводят к ранней инвалидизации и смертности пациентов [2, 3]. Большинство случаев тромбоза у детей (95%) — вторичные, связанные с такими патологическими состояниями, как злокачественные новообразования, травмы, операции, врожденные заболевания сердца и системная красная волчанка (СКВ) [4]. Как правило, тромбоз развивается при дополнительных условиях (длительной катетеризации вен, асфиксии, септицемии, врожденных пороках сердца и сосудов, ревматических, инфекционных и онкологических заболеваниях, хирургических вмешательствах, травмах и др.). Выяснение этих факторов риска помогает эффективно проводить профилактическое лечение у носителей вариантных генов.
В литературе есть лишь единичные описания артериальных почечных тромбозов у взрослых [5]. В связи с этим представляет интерес собственное клиническое наблюдение развития артериального тромба у ребенка.
Девочка, Анастасия Г., 12 лет (08.07.2002 г.)
Анамнез жизни: ребенок от 3-й беременности, 1-х родов путем кесарева сечения в 37 нед. Вес при рождении — 3200 г, длина тела — 51 см.
Перенесенные заболевания: острый ринофа- рингит, острый фарингит, ветряная оспа, ОРВИ 3 раза в год.
На «Д» учете состоит у кардиолога с 2009 г. Диагноз: врожденный порок сердца (ВПС), подклапанный стеноз аорты I ст., недостаточность аортального клапана I ст. НК 1 ст.
Наследственность отягощена: пиелонефрит у матери и бабушки по линии отца; ВПС, подклапанный стеноз аорты — у сестры (прооперирована).
Анамнез заболевания: в декабре 2014 г. после изменения положения тела (встала с дивана) правая нога перестала функционировать, отмечалась потеря речи, в ванной потеряла сознание, появились судороги. Мама вызвала бригаду скорой медицинской помощи. При осмотре обращала на себя внимание высокая артериальная гипертензия: АД до 230/190 мм рт. ст. Ребенок был госпитализирован в реанимационное отделение Краевой детской клинической больницы (КДКБ) № 1. В течение недели сохранялась злокачественная артериальная гипертензия. Для исключения патологии сердечно-сосудистой системы (ССС), как причины гипертензии, ребенок переведен в отделение кардиологии Краевого клинического центра специализированных видов медицинской помощи (ККЦ СВМП), где с 19.12 по 31.12.2014 г. результаты обследования были следующими. Клинический анализ крови: Нв 116 г/л, эритроциты 4,96*1012/л, лейкоциты 19,5*109/л, гематокрит 34,7%, тромбоциты 468*109, эозинофилы 2%, палочкоядерные нейтрофилы 3%, сегментоядерные нейтрофилы 65%, лимфоциты 21%, моноциты 9%, СОЭ 40 мм/ч, время свертывания крови 3 мин 45 с, длительность кровотечения 1 мин 20 с.
Биохимический анализ крови: АСТ 14 ЕД/л, АЛТ 13 ЕД/л, билирубин общий 5,6 мкмоль/л, прямой билирубин 1,6 мкмоль/л, глюкоза 3,57 ммоль/л, общий белок 62 г/л, калий 5,0 ммоль/л, натрий 134,6 ммоль/л, холестерин 5,77 ммоль/л, креати- нин 103 мкмоль/л, мочевина 3,4 ммоль/л, мочевая кислота 262 мкмоль/л, КФК 75 ЕД/л, КФК-МММВ 22,9 ЕД/л, ЛДГ 149 ЕД/л, СРБ 12 мг/мл, ASLO < 200 МЕ/мл, РФ — 4 МЕ/мл, серомукоид 0,183 ед.
Исследование крови на гормоны: Т3 1,8 нмоль/л, ТТГ 2,2 пмоль/л, Т4 св. 21,7 нмоль/л.
Коагулограмма: АЧТВ 36 с, МНО — 0,94, фибриноген 5,6 г/л, тромбиновое время 15 с, РФМК — 15,0 мг/дл.
Группа крови — 11А, Rh — положительная
Общий анализ мочи: удельный вес — 1015, реакция кислая, прозрачная, белок 1,0 г/л, глюкоза отр., плоские эпителиальные клетки ед. в п/зр, лейкоциты 3-4 в п/зр, эритроциты — 0-1 в п/зр. Суточная протеинурия 0,756 г/сут.
Анализ мочи по Нечипоренко: лейкоциты 500, эритроциты 0 в 1 мл.
Проба по Зимницкому: удельный вес 10051011, дневной диурез 820 мл, ночной диурез — 860 мл, суточный диурез 1680 мл.
Проба Реберга: креатинин мочи 32 мкмоль/л, креатинин крови 103 мкмоль/л, суточная экскреция креатинина 0,61 г/сут, скорость клубочковой фильтрации 53,7 мл/мин, канальцевая реабсорбция 97,8 %.
ПЦР мочи на туберкулез, ВПГ1,2, ЦМВ, ВЭБ — отр. ПЦР со слизистых оболочек носа на ЦМВ, ВПГ, ВЭБ — отр., ПЦР из зева на ЦМВ, ВЭБ — отр., ВПГ1,2 — полож.
ИФА крови на антитела: Chlamydia trachomatis, Ureaplasma urealiticum, Mycoplasma hominis — отр. Антитела к лямблиям — IgM КП 2,5, IgM+IgG КП= 2,9; ВПГ тип I — IgG — 1:800, ВПГ тип II — отр., ЦМВ — IgG 1:800, токсоплазмам, токсокарам, аскаридам — отр.
Антинуклеарные антитела (profile 3), антитела к миелопероксидазе, протеиназе — отр., ScLo-70 — 2/4 МЕ/мл.
Антитела к фосфолипидам IgM — 4,2 ЕД/л, антитела к фосфолипидам IgG 0,7 ЕД/л (норма).
Кровь на программу генетической предрасположенности к тромбообразованию: по молекулярногенетическому тестированию выявлены полиморфные варианты генов, ассоциированных с патологическими эффектами:
- гомозиготное носительство аллеля ингибитора плазминогена I типа.
- гетерозиготное компаунд-носительство аллеля метилентетрагидрофолатредуктазы.
- гетерозиготное носительство аллеля метионин-синтазы-редуктазы.
ЭКГ от 19.12.2014 г.: синусовая тахикардия, ЧСС — 114 в 1 мин. Признаки гипертрофии левого желудочка (ЛЖ) с нарушениями процессов реполяризации. QT/QT с — 332/399 мс.
ЭКГ от 25.12.2014 г.: ритм синусовый, ЧСС — 88 в мин. Преобладание электрической активности ЛЖ с нарушениями процессов реполяризации. QT/QT с — 401|487, PQ — 0.12.
Холтеровское мониторирование ЭКГ: синусовый ритм, ЧСС 82-151 в 1 мин. Достигнуто 72% от максимальной ЧСС. Пауз, превышающих возрастную норму, нет. По данным суточного мо- ниторирования АД мягкая стабильная систолодиастолическая артериальная гипертензия. АД среднее 147 /110 мм рт. ст., дневное — 147/111 мм рт. ст., ночное — 150/113 мм рт. ст.
ЭХО-КГ. Левый желудочек: КДД 37 мм, КДС 24 мм, МЖП 9,8 мм, КДО 60 мл, КСО 23 мл, ЗСЛЖ 8 мм, ФВ 60%. ДМЖП нет. Левое предсердие: 36*38 мм. ДМПП нет. Правое предсердие: 36*39 мм. Правый желудочек: толщина миокарда 3,5 мм. КДД — 18 мм. Расчётное давление в ПЖ — нет. Аортальный клапан: 3-створчатый, створки не изменены. Подклапанная мембрана: обструкция утолщенным базальным сегментом МЖП; ФК 17 мм. Аортальная регургитация 1 ст. Митральный клапан: ФК 22 мм. Митральная регургитация 0 ст. Трикуспидальный клапан: ФК 22 мм. Пульмональный клапан: ФК 20 мм. Регургитация ЛК 1 ст. Аорта: синус 23 мм, синотубулярный отдел 24 мм, дуга 18 мм. Легочная артерия: ствол 23 мм, правая ЛА 11 мм, левая ЛА 11 мм. Заключение: ВПС. Подклапанный стеноз аорты с пиковым градиентом 40 мм рт. ст. Гипертрофия ЛЖ, гипертрофия МЖП с умеренной обструкцией ВОЛЖ. Расширение восходящей аорты. Полости сердца не расширены. Движение миокарда не нарушено. Сократительная функция левого желудочка хорошая. Клапаны не изменены. ЛГ нет.
УЗИ печени, желчного пузыря с желчегонным завтраком, поджелудочной железы: эхо-структура печени, желчного пузыря, поджелудочной железы, селезенки — без патологии.
УЗИ почек: правая почка 10,0*3,6 см, толщина паренхимы — 1,6 см, паренхима однородная, ЧЛС не изменена. Левая почка 6,4*2,7 см, толщина паренхимы 1,0 см, паренхима однородная, ЧЛС не изменена. Заключение: эхо-признаки уменьшения размеров левой почки.
УЗИ щитовидной железы, надпочечников: эхокартина без видимой патологии.
Дуплексное исследование почечных сосудов: правая почка 9,9*4,2 см, контуры ровные, чёткие, толщина паренхимы 1,4 см. ЧЛС не расширена, конкременты не выявлены. Левая почка 6,4*2,9 см, контуры ровные, чёткие, толщина пар- нехимы 0, 9 см. ЧЛС не расширена. Конкременты не выявлены. В режиме цветного картирования кровоток правой почки в норме, скоростные показатели в норме. Резистивный индекс — 0,6.
Стволы почечных артерий Vps справа 115 см/с, резистивный индекс справа 0,62, сегментарные артерии: Vрs справа 50 см/с. Междолевые артерии: Vps справа 30-40 см/с, резистивный индекс справа 0,62.
Кровоток в левой почечной артерии в режиме ЦДК резко обеднён, определяются единичные «всплески» на уровне сегментарных артерий. Определяется реверсивный кровоток в среднем сегменте паренхимы левой почки артериального типа (коллатеральный кровоток субкапсулярной артерии среднего сегмента).
Заключение: гипоплазия левой почки. Окклюзия левой почечной артерии. Признаки коллатерального кровотока в левой почке.
Транскраниальное дуплексное исследование сосудов головного мозга: признаки вазоспазма средних мозговых артерий 1 ст. Признаков внутричерепной гипертензии не отмечено.
Электроэнцефалография: умеренные диффузные изменения биоэлектрической активности головного мозга с признаками нарушения регуляторных подкорково-корковых влияний и дисфункции срединных структур ствола. Корковая ирритация в височно-затылочных областях. Эпифеноменов не зарегистрировано.
Компьютерная томография (КТ): грудная аорта имеет обычное положение, ход. Диаметр устья аорты на уровне кольца аортального клапана 16 мм, клапан трехстворчатый, диаметр аорты на уровне синусов до 26 мм, синотубулярное соединение 23 мм, расширение тубулярной части восходящей аорты до 28 мм, проксимальная часть дуги аорты 18 мм, дистальная часть дуги 16 мм, на уровне перешейка 15 мм, диаметр нисходящей части грудной аорты 13-14 мм. На уровне артериальной связки по её ходу имеется небольшое локальное выпячивание стенки до 1-2 мм (вариант строения). Брюшная аорта имеет просвет в инфраренальном сегменте 12 мм. Определяется окклюзия левой почечной артерии, артерия не контрастируется от устья и на протяжении около 15 мм, далее просвет очень узкий 0,5-0,8 мм. Перфузия паренхимы левой почки резко снижена. Сама почка уменьшена до 7,5*4 см. Толщина паренхимы до 13 мм. Исследование функции почек выполнено через 1 ч после введения контраста при инвазивной ангиографии — отсутствие выделительной функции левой почки
Селективная ангиография почечных артерий: аорта с ровными контурами. Правая почечная артерия без признаков стенозирования . Левая почечная артерия — окклюзия от устья, частично по коллатералям контрастируется средний сегмент (диаметр 1,3 мм), сегментарная окклюзия артерии нижнего полюса.
Заключение: протяжённая окклюзия левой почечной артерии с резким снижением перфузии паренхимы левой почки, с атрофией последней (формирование сморщенной почки). Данных за коарктацию аорты нет, диффузное расширение тубулярной части восходящей аорты.
Осмотрена специалистами.
Невролог: вторичная артериальная гипертензия. Острое нарушение мозгового кровообращения (очаги ишемии в затылочной, лобной долях слева). Судорожный синдром. Окулист: патологии нет. Эндокринолог: дефицит массы тела. Нефролог: окклюзия левой почечной артерии. Ишемическая нефропатия. Симптоматическая артериальная гипертензия. Рекомендовано дообследование в отделении нефрологии. ЛОР: ЛОР-органы без патологии. Сердечно-сосудистый хирург: в оперативном лечении ВПС не нуждается. Восстановительная операция на почечных артериях не показана. Врач-генетик: предварительное заключение (без результатов молекулярно-генетического исследования) — не исключено тромбофилическое состояние, нарушение кровообращения на фоне аномалии строения сосудов головного мозга и почек. Нейрохирург: оперативное лечение не показано. контроль МРТ. Ревматолог: данных за ревматические заболевания нет.
Выставлен диагноз: вторичная артериальная гипертензия II ст. на фоне ишемической нефропатии с нарушением функции почек. Окклюзия левой почечной артерии. ВПС. Подклапанный стеноз аорты 1 ст. Острое нарушение мозгового кровообращения от 12.12.2014 г. Судорожный синдром от 12.12.2014 г.
Получила лечение: актовегин, цефтриаксон, сульперазон, депакин хроносфера, конкор, кор- дипин, капотен, амлодипин, гипотиазид, фенибут, трентал, гепарин.
На фоне лечения состояние с положительной динамикой по уровню АД.
Ребёнок стал более активным. Температура тела нормальная. ЧСС 95 в 1 мин. АД на правой руке 140/110 мм рт. ст., на левой руке 135/100 мм рт. ст.
Для дальнейшего обследования и лечения переведена в отделение нефрологии КДКБ №1.
Продолжено обследование.
Клинический анализ крови: Нв 111г/л, эритроциты 4,45*1012/л, лейкоциты 7,9*109/л, цв. показатель 0,81, тромбоциты 367*109, эозинофилы 2%, палочкоядерные нейтрофилы 1%, сегментоядерные нейтрофилы 49%, лимфоциты 43%, моноциты 5%, СОЭ 10 мм/ч.
Биохимический анализ крови: АСТ 15 ЕД/л, АЛТ 1 ЕД/л, билирубин общий 10,2 мкмоль/л, глюкоза 4,66 ммоль/л, общий белок 74,5 г/л, калий 4,61 ммоль/л, натрий 136,7 ммоль/л, хлориды 100,2 ммоль/л, Ca 2,6 ммоль/л, P 1,87 ммоль/л, холестерин 5,36 ммоль/л, β-липопротеиды 70 ед., триглицериды 1,58 ммоль/л, креатинин 86 мкмоль/л, мочевина 4,63 ммоль/л, ЩФ 320,1 ЕД/л, железо 4,4 ммоль/л, α-амилаза 44,5 ЕД/л.
Протеинограмма: общий белок 66 г/л, альбумины 57,62%, а1-глобулины 1,81%, а2-глобулины 10,64%, β-глобулины 12,88%, γ-гобулины 17,04%, А/Г 1,36.
Липидограмма: холестерин 5,04 ммоль/л,
триглицериды 1,91 ммоль/л, холестерин ЛПВП 1,31 ммоль/л, холестерин ЛПНП 2,86 ммоль/л, холестерин ЛПОНП 0,87 ммоль/л, коэффициент атерогенности 2,8 у.е.
Коагулограмма: АЧТВ 44,6 с, ПТИ 99%, фибриноген 3,77 г/л, гепариновое время 49 с, время рекальцификации 139 с, ТПГ 13 мин, тромботест 4 ст.
ИФА крови: антитела к лямблиям IgM 1:200, КП 3,5, IgG отр.; IgG Helicobacter pillory, HBSАg, IgM IgG к HCV отр.
Общий анализ мочи: удельный вес 1008, реакция нейтр., прозрачная, белок 0,33 г/л, глюкоза отр., плоские эпителиальные клетки ед. в п/зр, лейкоциты 1-2 в п/зр, эритроциты 3-4 в п/зр, ок- салаты +, аморфные фосфаты +.
Диастаза мочи 64 ед.
Суточная протеинурия 1,36 г/сут.
Анализ мочи по Нечипоренко: лейкоциты 300, эритроциты 0 в 1 мл.
Проба по Зимницкому: удельный вес 10001010, дневной диурез 1120 мл, ночной диурез 1158 мл, суточный диурез 2278 мл.
Проба Реберга: суточный диурез 3350 мл, креатинин мочи 15,75 мкмоль/л, креатинин крови 1,05 мг/дл, минутный диурез 2,33 мл/мин, суточная экскреция креатинина 0,61 г/сут, скорость клубочковой фильтрации 50,0 мл/мин, канальцевая реабсорбция 95,0%.
Анализ мочи на кристаллурию: суточный диурез 3150 мл, полярные липиды (+ +), перекиси (+ + +), мочевая кислота 565 ммоль/л, оксалаты 79,8 мг/сут.
Копрограмма: стул неоформленный, коричневый, кислый, растительная непереваримая клетчатка +, переваримая +, жирные кислоты +, нейтральный жир +, лейкоциты 0-1, бактерии ++, мыла +, я/г и ц/л не обнаружены.
УЗИ почек: положение типичное, контуры ровные. Правая почка 10,5 х 4,1 см, толщина паренхимы 1,6 см, паренхима однородная, умеренно повышенной эхогенности, ЧЛС не расширена, КМД сохранена. Левая почка 7,0*2,7 см, толщина паренхимы 1,1 см, паренхима однородная, эхо- генность в пределах нормы, ЧЛС не расширена, КМД сохранена. В режиме ЦДК кровоток правой почки в норме, в левой почке обеднён. В среднем сегменте паренхимы левой почки определяется реверсионный кровоток. Индекс резистивности в стволе почечной артерии справа 0,58, слева 1,60.
Мочевой пузырь: объем 138 мл, стенка 2,8 мм, содержимое однородное, контур четкий, ровный. Из правого мочеточникового устья четко регистрируются выбросы, число выбросов 5-6 в 1 мин. Слева регистрируется слабый сигнал мочеточникового выброса, число выбросов 1-2 в 1 мин Траектория направления выбросов к противоположной стенке.
Заключение: эхо-признаки уменьшения размеров левой почки, коллатерального кровотока в левой почке, диффузных изменений правой почки, снижения числа выбросов мочи из левого мочеточника.
УЗИ органов брюшной полости: эхо-признаки диффузных изменений поджелудочной железы.
ЭКГ: умеренная тахикардия, ускоренный верхнепередний правопредсердный ритм, 100 в 1 мин. Слабовыраженный синдром ранней реполяризации желудочков. Нарушение реполяризации миокарда левого желудочка в верхушечно-боковой области.
Осмотрена специалистами.
Гастроэнтеролог: дисфункция гепатобилиар- ной системы. Диспанкреатизм.
Заочно (по телефону) консультирована в РДКБ (Москва): в настоящее время тромболизис не показан. Целесообразно провести радиоизотопное исследование почек, после которого решить вопрос о нефрэктомии (возможно отсроченной).
Заочно (по телефону) консультирована в Институте патологии кровообращения им. акад. Е.Н. Мешалкина (г. Новосибирск). Заключение: окклюзия левой почечной артерии, гипоплазия левой почки. Симптоматическая гипертензия. Неспецифический аортоартериит? Рекомендовано проведение дополнительного обследования у ревматолога для подтверждения/исключения аортоартериита, МСКТ. Результаты МСКТ выслать для повторной заочной консультации.
Лечение: сульперазон, амписид, гепарин, фраксипарин, конкор, дилтиазем, амлодипин, капотен, лоратадин, курантил, депакин-хроно, микразим, урсосан, липоевая кислота.
Проведено радиоизотопное исследование с 99тТс-технемагом: на серии динамических сцинтиграмм получено изображение правой почки в типичном месте с четкими контурами. Радиоконтрастного изображения левой почки не получено. Амплитуда сосудистого сегмента справа сохранена. Накопление РФП: справа — снижено, замедленно; секреторный пик сглажен. Слева — афункциональная кривая. Экскреция РФП: справа — растянута по времени, равномерная. По ренограмме: афункциональная левая почка. Почечный кровоток справа сохранен. Признаки снижения канальцевой функции правой почки, паренхиматозного воспалительного процесса справа.
Проведена нефрэктомия левой почки.
На фоне гипотензивной терапии АД 120/80 мм рт. ст. с тенденцией к повышению в течение дня
Полученные данные позволяют предположить, что у девочки с наследственной тромбофилией, поражение почек с развитием нефросклероза, явилось результатом хронической ишемии, обусловленной тромбообразованием в почечной артерии. Это не противоречит сведениям о возможной связи тромботической микроангиопатии (ТМА) с генетическими формами тромбофилии [6].
Адаптационные механизмы, включающиеся при хроническом нарушении перфузии почек, направлены на обеспечение снижения потребности почечной ткани в снабжении кислородом, сохранение его минимальной доставки и предотвращение реакций, вызывающих повреждение клеток в условиях дефицита кислорода. Наиболее очевидным механизмом адаптации является развитие коллатерального кровообращения, при критическом снижении перфузии необходимого для поддержания жизнеспособности почечной паренхимы. Коллатерали, участвующие в кровоснабжении почек, как правило, отходят от надпочечниковых, поясничных, половых и околомочеточниковых артерий. Реже коллатеральную сеть могут формировать другие сосуды [5]. Длительное отсутствие симптомов поражения почек, по-видимому, связано с развитием коллатерального кровообращения почек. У нашего ребенка при дуплексном сканировании и почечной ангиографии выявлены коллатерали, но они были недостаточны для сохранения функции и размеров почек. Особенностями данного случая являются быстрое развитие тяжёлой АГ и почечной недостаточности у ребенка с компенсированным врожденным пороком сердца.
Таким образом, представленное клиническое наблюдение демонстрирует развитие нефросклероза у ребенка с генетической формой тромбофилии и врожденным пороком сердца вследствие односторонней окклюзии почечной артерии, обусловленной тромбозом, которая привела к тяжёлой реноваскулярной артериальной гипертензии и почечной недостаточности. Отсутствие клинических и лабораторных симптомов поражения почек не позволило своевременно диагностировать данное состояние, что привело к нефрэктомии почки. Учитывая наследственную предрасположенность, сохраняется высокий риск развития рецидивов тромбообразования, о чем необходимо помнить при диспансерном наблюдении ребенка.
Случай тромбоза почечной артерии с инфарктом почки
J Emerg Trauma Shock. Июль-сентябрь 2010 г .; 3 (3): 302.
Валери М. Лопес
Институт неотложной помощи, Клиника Кливленда, Кливленд, Огайо, США
Джонатан Глаузер
Институт неотложной помощи, Клиника Кливленда, Кливленд, Огайо, США
Институт неотложной помощи, Cleveland Clinic, Кливленд, Огайо, США
Адрес для корреспонденции: Д-р Валери М. Лопес, электронная почта: gro.fcc @ vzepolПолучено 24 августа 2009 г .; Принято 4 июня 2010 г.
Copyright © Journal of Emergencies, Trauma, and ShockЭто статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии оригинальная работа правильно цитируется.
Эта статья цитируется в других статьях в PMC.Abstract
Тромбоз почечной артерии — редкое, но серьезное заболевание, которое часто неправильно диагностируется.Врачам скорой помощи и другим врачам необходимо учитывать этот диагноз при необъяснимой боли в боку, особенно у пациентов с факторами риска этого заболевания. В этом отчете авторы рассматривают случай инфаркта почки, вызванного тромбозом почечной артерии, у пациента с факторами риска тромбоза, но без предшествующей истории тромбоэмболии. Был проведен обзор научных статей, и случай обсуждается в контексте современных знаний об этом состоянии. Здесь будут обсуждаться общие симптомы, особенности анамнеза и факторы риска.Будет обсуждаться диагностическая оценка боли в боку при подозрении на инфаркт почки, включая методы компьютерной томографии высокого разрешения, почечной ангиографии, сцинтографии и УЗИ. Также будут обсуждаться неотложная помощь и прогноз.
Ключевые слова: Боль в боку, инфаркт почки, тромбоз
ВВЕДЕНИЕ
Тромбоз почечной артерии — редкое, но серьезное и часто неправильно диагностируемое состояние. В серии из более чем 14 000 вскрытий было выявлено около 200 случаев инфаркта почки — распространенность 14/1000.[1] Самая большая серия случаев у пациентов отделения неотложной помощи дает распространенность 0,02 / 1000, [2,3] с <50 пациентами в каждой серии.
Этот диагноз следует рассматривать при недиагностированной боли в боку, особенно у пациентов с факторами риска этого заболевания. Мы представим случай боли в боку для оказания неотложной помощи в отделении неотложной помощи, а затем обсудим варианты оценки и лечения.
СЛУЧАЙ ИЗЛУЧЕНИЯ
Мужчина 65 лет обратился с жалобой на резкую, жгучую, постоянную боль в правой нижней части живота после того, как ранее почувствовал себя хорошо.В анамнезе не было травм, лихорадки, рвоты, диареи, боли в груди, одышки, обморока, дизурии, гематурии или мелены. Его прошлый медицинский анамнез включал гипертонию, трепетание предсердий и кардиомиопатию, и ему был имплантирован кардиовертер / дефибриллятор (ICD). В анамнезе не было аневризмы брюшной аорты ни у пациента, ни в его семье. Его прошлый хирургический анамнез включал пластику паховой грыжи. Его лекарства включали аспирин, валсартан, метопролол и аторвастатин. Он не курил, не употреблял алкоголь и запрещенные наркотики.
Физический осмотр показал следующие жизненно важные признаки: температура тела 36,3 ° C, артериальное давление 140/82 мм рт. Ст., Частота сердечных сокращений 52 удара в минуту, частота дыхания 18 вдохов в минуту и пульсоксиметрия 98% на воздухе помещения. Он был настороже, но страдал от боли. Его абдоминальное обследование показало болезненность при пальпации в правом нижнем квадранте, без отскока, защиты, вздутия или органегалии. Остаток экзамена прошел нормально.
Первоначальная оценка отделения неотложной помощи включала электрокардиограмму, которая показала трепетание предсердий с блокадой 4: 1.Лабораторная оценка выявила следы гематурии, отсутствие лейкоцитоза, креатинин 1,3 мг / дл (нормальный диапазон 0,7–1,4 мг / дл), умеренно повышенный уровень липазы до 85 Ед / л (нормальный диапазон 12-70 Ед / л), легкую гипергликемию и слегка повышенный уровень аспартатаминотрансферазы до 46 Ед / л (нормальный диапазон 7-40 Ед / л). Профили лактата и коагуляции были в пределах нормы. Лактатдегидрогеназу не назначали при обращении, но она была получена через 2 дня после поступления и была повышена до 1479 Ед / л (нормальный диапазон 100–220 Ед / л). Лактатдегидрогеназа присутствует в почечной ткани и повышается в сыворотке после повреждения почек, и неизвестно, коррелирует ли этот уровень с тяжестью инфаркта.
Учитывая характер боли и гематурию, наблюдаемую при анализе мочи, а также наличие в анамнезе кардиомиопатии с трепетанием предсердий, как нефролитиаз, так и брыжеечная ишемия были решительно рассмотрены как причины этой острой боли. Таким образом, были получены изображения спиральной компьютерной томографии (КТ) как без использования контраста, так и с контрастным усилением [Рисунки и], которые показали обширный инфаркт с вовлечением верхнего полюса правой почки с множественными очаговыми инфарктами в нижнем полюсе, патологией правой почки. артерии, но не визуализируются межпаренхиматозные артериальные ветви в пределах среднего и верхнего полюсов правой почки, что свидетельствует об артериальной тромбоэмболии.Было плохое помутнение правой почечной вены, поэтому нельзя было исключить тромб почечной вены. Также был обнаружен камень левой почки размером 2 мм.
Аксиальная компьютерная томография, усиленная внутривенным контрастированием, демонстрирующая минимальное усиление правой почки с некоторыми щадящими участками периферии, что соответствует признаку кортикального обода (щадящее периферическое кровообращение через капсульные коллатеральные артериолы)
Корональная реконструированная компьютерная томография с внутривенным контрастированием демонстрирует нерегулярную гиподенсную область верхнего полюса правой почки, соответствующую гипоперфузии.
Были проконсультированы со службами урологии и сосудистой хирургии, и оба рекомендовали консервативное лечение антикоагулянтами.В дополнение к физиологическому раствору и дилаудиду для снятия боли был введен болюс гепарина в дозе 80 мг / кг и начата инфузия в дозе 18 мг / кг / ч, при этом пациент был помещен в службу общей медицины.
Был сделан вывод, что тромбоз почечной артерии, скорее всего, был эмболическим, и была назначена двумерная эхокардиограмма, которая не показала интрамурального тромба. Через 5 дней он был выписан на прием кумадина. Его креатинин, который составлял 1,3 мг / дл при поступлении, повысился до 1,8 мг / дл и упал до 1,7 мг / дл при выписке.Через месяц уровень креатинина снизился до 1,6 мг / дл.
ОБСУЖДЕНИЕ
Патогенез / факторы риска
Инфаркт почек обычно считается недостаточно диагностируемой причиной острой боли в животе / боку. [1–3] Обычно он вызывается сгустками крови или холестерина, закупоривающими почечную артерию или ветвь. сосуды. Источником сгустков крови, как правило, является фибрилляция предсердий, вызывающая тромбообразование в левом предсердии и ушка левого предсердия. Эмболы на основе холестерина вызывают частичные окклюзии с более хроническим проявлением.В исследовании, проведенном с участием более 600 пациентов с тромбоэмболией периферических артерий, наиболее частым местом тромбоэмболии периферических артерий были конечности (61%), за ними следуют брыжеечные артерии (29%), тазовые артерии (9%), аорта (7%). %) и, наконец, почечные артерии (2%). [4] В серии случаев из 27 пациентов у 41% были очевидные сердечные заболевания, почти все с фибрилляцией предсердий; однако 59% не имели заметных структурных или аритмических заболеваний сердца. [5] Идиопатические пациенты обычно моложе [5] и имеют мало тромбогенных факторов риска.[6]
Полный инфаркт (вовлечение всей почки из-за окклюзии или прерывания почечной артерии) является наиболее редким, обычно наблюдается после травмы или вмешательств на аорте. [7] Большинство инфарктов почек возникает в результате эмболов, вызванных фибрилляцией предсердий или эндокардитом [8], вызывая лишь частичную окклюзию почечной артерии или ветви. Сообщалось о редких причинах, включая спонтанное расслоение почечной артерии [9], дилатационную кардиомиопатию, [10] парадоксальную эмболию [11,12] и поражение нескольких органов.Сообщалось также о двустороннем инфаркте [3], включая двусторонний (глобальный) инфаркт почек после расслаивания аневризмы аорты [13] с септическими эмболами от эндокардита, волчаночного васкулита или серповидно-клеточной анемии [14] или фибромышечной дисплазии почек артерии. [15,16] Сообщения о других причинах, связанных с инфарктом почек, включают травмы, васкулит, инструментарий, трансплантат, сепсис, [14] серповидноклеточную анемию [14,17] и синдром антифосфолипидных антител, [18,19] употребление кокаина, [20] и после расслоения сонной артерии.[21]
Клиническая картина инфаркта почек
Наиболее частыми жалобами при обращении являются боль в боку [3,5] или боль в животе [22], обычно постоянная по своей природе [5]. Другие общие признаки включают лихорадку, [3,5,22] тошноту и рвоту. [3,5,22] Болезненность поясницы и бока [5] наблюдается и еще более вероятна в идиопатической / более молодой группе. Олигурия встречается редко. [22] Впервые возникшая гипертензия встречается редко, но особенно заметна при поражении почечной артерии. [8]
Типичный пациент имеет тенденцию быть старше, средний возраст 67 лет в одной серии [3], хотя значительная часть пациентов моложе.При рассмотрении 89 случаев из литературы [2, 3, 22, 23] средний возраст на момент обращения составил 65,7 года, без значительного гендерного преобладания или преобладания правой или левой почки. Около 10% случаев представляют собой двустороннее поражение почек. Предыдущие тромбоэмболические события наблюдались у 20/89 (22%).
Дифференциальный диагноз
Дифференциальный диагноз этого расстройства, как и всех болей в животе, обширен. Неотложные состояния, которые необходимо будет исключить, включают причины острого хирургического заболевания брюшной полости, особенно аппендицита, дивертикулита, разрыва аневризмы брюшной аорты, перекрута яичка / яичника, ущемленной грыжи, кишечной непроходимости и / или перфорации.Также следует учитывать другие нехирургические причины, такие как ишемия брыжейки, нефролитиаз и пиелонефрит. Из-за нечеткой клинической картины диагноз не часто ставится при поступлении (только 40% пациентов в одной серии случаев) [22] и часто откладывается на срок до 2 дней и более [7]. Однако вполне вероятно, что эта точность будет увеличиваться с увеличением доступности компьютерных томографических (КТ) сканирований, которые являются лучшим способом распознать инфаркт.
Оценка
Лаборатории
Рекомендуется анализ мочи, при этом гематурия является очень частой находкой, наблюдаемой во всех случаях в одном исследовании.[3] Однако гематурия не универсальна: около половины пациентов в другом исследовании не показали гематурии [22], а два случая из другого центра также не имели гематурии [24]. Напротив, повышение уровня лактатдегидрогеназы (ЛДГ) является почти универсальным: почти все пациенты участвовали в одном исследовании [5] и во всех случаях — в других отчетах. [3,24] Протеинурия наблюдалась у 45% пациентов в одном ретроспективном случае. обзор. [22] Количество лейкоцитов часто было повышено. [3,5] Креатинин сыворотки не был заметно повышен при обращении, но небольшое увеличение было замечено [5] на пике в одном исследовании, а более заметное повышение было замечено в другом, немного более крупном обзоре случая. .[22] С-реактивный белок также часто повышен. [5]
Диагностическая визуализация
Ангиография положительна в 100% случаев (10/10). [22] Изотопное исследование почек отклоняется от нормы в 97% случаев [22]. Компьютерная томография является диагностической в 80% случаев. [22] Только в 3% случаев УЗИ дает положительный результат [22]. Контрастная КТ — это диагностический метод выбора в настоящее время, при этом основные данные заключаются в клиновидной, периферической, неусиливающейся области. Наиболее частая находка — это гипоаттенуированная область с ассоциированным массовым эффектом [22], иногда сопровождающаяся признаком кортикального обода.Знак кортикального обода представляет собой помутнение каймы функционирующих нефронов, снабжаемых через капсульные коллатерали, окружающие нефункционирующую почку. [25] Признак кортикального обода может быть особенно полезен при дифференциации ишемии (где она иногда наблюдается, особенно при глобальных инфарктах) от пиелонефрита (где она не видна) [14]. Клиновидные очаговые инфаркты, глобальные инфаркты и мультифокальные инфаркты также могут наблюдаться при инфаркте [26]. В серии из 12 пациентов 47% имели признак кортикального обода, 21% имели скопление субкапсулярной жидкости, 11% имели массовый эффект и 6% имели аномально утолщенную почечную фасцию.[14]
Из-за расплывчатого изображения и отсутствия легко доступных окончательных изображений для постановки диагноза необходимо поддерживать высокую клиническую подозрительность. Улучшение техники КТ и увеличение ее использования, вероятно, улучшат историческую диагностическую точность. Однако все больше полагают, что использование сканирования без контрастного усиления позволяет диагностировать не только почечные камни, но также аппендицит, дивертикулит, заболевание желчных путей, некоторые состояния аорты и гинекологические заболевания, но, в частности, не позволяет выявить тромбоэмболические и другие почечные заболевания. сосудистые заболевания.[25]
Поскольку КТ без контраста часто является предпочтительным исследованием, когда целесообразно исследование с усилением контраста? Некоторые предлагаемые общие рекомендации включают наличие одностороннего околопочечного перегиба без гидроутеронефроза (подозрительно на инфаркт почек, тромбоз почечных вен и пиелонефрит), наличие значительных гипо / гиперплотных периренальных скоплений (уринома, гематома), наличие массивной или сложной кисты и отрицательный результат КТ без усиления у пациента с необъяснимой гематурией.[27]
Кроме того, даже если заказано исследование с контрастным усилением, чувствительность составляет всего 80%. Следовательно, если у пациента есть риск развития эмболических событий и повышен уровень ЛДГ в сыворотке крови, рекомендуется выполнить дополнительное исследование с помощью изотопного исследования почек (сцинтография) или почечной ангиографии [22], если результаты КТ с контрастированием отрицательны.
Лечение
Из-за нечастой природы этого заболевания не было крупных проспективных исследований, в которых оценивались оптимальные методы лечения, касающиеся дозирования гепарина, использования низкомолекулярного гепарина или тромболитиков или использования медикаментозного лечения по сравнению схирургическое лечение. В настоящее время в литературе есть только рекомендации, основанные на единодушном мнении.
Антикоагуляция: Начните с болюса гепарина с инфузией с последующим началом терапии кумадином на неопределенный срок, что было рекомендовано. [3,22] Дозирование исходного гепарина, а также целевое международное нормализованное отношение (МНО) и Продолжительность терапии кумадином не определена. Рекомендуются целевые показатели антикоагуляции с обычным 2,0–3,0 МНО, за исключением случаев тромбирования у пациента во время лечения, в этом случае цель 2.5–3,5 может быть более желательным. Многие пациенты будут продолжать принимать кумадин на неопределенный срок, поскольку у них есть основное проэмболическое состояние, такое как фибрилляция предсердий.
Антигипертензивное средство: Пациенты с предшествующей гипертензией или с впервые возникшей гипертензией в результате инфаркта должны лечиться антигипертензивными средствами. [8] Из-за поражения почек часто развивается гипертензия, и поскольку это опосредуется повышением уровня ренина, считается, что использование ингибиторов ангиотензинпревращающего фермента или блокатора рецепторов ангиотензина может быть наиболее подходящим.
Тромболизис / тромбэктомия: Эти вмешательства в настоящее время подтверждаются только историями болезни, в которых сообщается об успешной реперфузии, но не об однородном улучшении почечного исхода. Открытая операция не рекомендуется, за исключением случаев травмы, когда другие проблемы могут указывать на необходимость операции. В одном случае эмболэктомия была выполнена через 30 часов после полной двусторонней окклюзии с полным разрешением почечной недостаточности [28]. Можно рассмотреть возможность местного тромболизиса или тромбэктомии с минимально инвазивной чрескожной эндоваскулярной терапией при острой окклюзии основной почечной артерии или значительной ветви, но, опять же, нет значительных клинических данных, подтверждающих это вмешательство.
Прогноз
Наиболее частым последствием инфаркта почек является потеря функции почек и стойкая гипертензия. [8] Однако у многих пациентов сохраняется нормальная функция почек [3,8,22] без постоянной гипертензии. Небольшому проценту пациентов потребуется диализ, 8% — в одной серии случаев [22].
Наблюдались повторяющиеся эмболические события, некоторые с событиями до почечного инфаркта, а некоторые с последующими событиями. [22] Из-за отсутствия данных проспективных исследований неизвестно, каковы преимущества продолжения антикоагуляции.Однако, учитывая данные относительно других катастрофических тромботических событий, вероятно, рекомендуется продолжать лечение фибрилляции предсердий на неопределенный срок.
РЕЗЮМЕ
В целом острый инфаркт почки встречается редко [8], и, возможно, из-за этого, а также из-за его неспецифического проявления, его часто упускают из виду. При обследовании пациента с известной фибрилляцией предсердий врачи неотложной помощи обычно рассматривают ишемический инсульт как обычные артериальные тромботические / эмболические последствия этого синдрома.Но есть и другие эмболические синдромы, которые, хотя и встречаются редко, также следует учитывать у пациентов с этой конкретной коморбидностью. Инфаркт почек следует серьезно рассматривать, когда он представлен следующей триадой: стойкая боль в животе и / или в боку, повышенный уровень ЛДГ в сыворотке и / или гематурия и риск тромбоэмболического события [5] с оговоркой, что недавние доказательства [5], вероятно, поддерживаются повышенная диагностическая точность КТ, по-видимому, выявляет у значительной части пациентов с этим заболеванием отсутствие тромботической части этой триады.Рассмотрите возможность проведения усиленной КТ, особенно у пациентов с повышенным уровнем ЛДГ, и если результат отрицательный, рассмотрите возможность последующего наблюдения с помощью радиоизотопного сканирования почек и оценки тромба предсердий.
Благодарности
Авторы хотели бы поблагодарить доктора Стивена Хатема и доктора Брайана Аллена, Институт визуализации клиники Кливленда, за их помощь.
Сноски
Источник поддержки: Нет
Конфликт интересов: Не объявлен.
СПРАВОЧНАЯ ИНФОРМАЦИЯ
1.Хокси Х., Коггин С. Инфаркт почки. Arch Intern Med. 1940; 65: 587–94. [Google Scholar] 2. Домановиц Х., Паулис М, Никфарджам М, Мерон Г, Куркцян И., Банкир А.А. Острый инфаркт почки. Клиническая характеристика 17 пациентов. Медицина (Балтимор) 1999; 78: 386–94. [PubMed] [Google Scholar] 3. Корзец З., Плоткин Э., Бернхейм Дж., Зиссин Р. Клинический спектр острого инфаркта почки. Isr Med Assoc J. 2002; 10: 781–4. [PubMed] [Google Scholar] 4. Фрост Л., Энгхольм Дж., Йонсен С., Моллер Х., Хеннеберг Е. В., Хустед С.Произошедшая тромбоэмболия аорты и почечных, брыжеечных, тазовых и конечных артерий после выписки из больницы с диагнозом фибрилляция предсердий. Arch Intern Med. 2001. 161: 272–6. [PubMed] [Google Scholar] 5. Болдерман Р., Ойен Р., Веррийкен А., Ноккарт Д., Вандершуерен С. Идиопатический инфаркт почки. Am J Med. 2006; 119: 356. e9-12. [PubMed] [Google Scholar] 6. Браун Д.Р., Савчук И.С., Axelrod SA. Идиопатический инфаркт почки. Урология. 1995; 45: 142–145. [PubMed] [Google Scholar] 7.Tsai SH, Chu SJ, Chen SJ, Fan YM, Chang WC, Wu CP, et al. Острый инфаркт почки: опыт 10 лет. Int J Clin Pract. 2007; 61: 62. [PubMed] [Google Scholar] 8. Пэрис Б, Бобри Г, Россиньоль П, Ле Коз С, Шедид А, Плуэн ПФ. Артериальное давление и почечные исходы у пациентов с инфарктом почки и артериальной гипертензией. Гипертоническая болезнь. 2006; 24: 1649–54. [PubMed] [Google Scholar] 9. Аламир А., Мидденфорф Д.Ф., Бейкер П., Нахман Хс, младший, Фонтейн А.Б., Хеберт Л.А. Расслоение почечной артерии, вызывающее инфаркт почки у здоровых мужчин.Am J Kidney Dis. 1997. 30: 851–5. [PubMed] [Google Scholar] 10. Насер Н.Дж., Абади С., Аззам З.С. Острый инфаркт почки из-за сердечного тромба. Нат Клин Практ Нефрол. 2007; 11: 631–5. [PubMed] [Google Scholar] 11. Туреди С., Гундуз А., Эроглу О, Хос Г., Дурмус И., Гёкче М. и др. Парадоксальная эмболия с вовлечением 4 систем органов (легочная, почечная, селезеночная и печеночная артерия) Am J Emerg Med. 2007; 6: 737. e1-3. [PubMed] [Google Scholar] 12. Кэри HB, Botax R, Дики KW, Финкельштейн FO. Двусторонний инфаркт почки, вторичный по отношению к парадоксальной эмболии.Am J Kidney Dis. 1999; 34: 752. [PubMed] [Google Scholar] 13. Франк Р.Г., Пейзер Д., Херасме В. Глобальный инфаркт почек, вторичный по отношению к расслаивающей аневризме грудной клетки. Урология. 1996; 48: 930–1. [PubMed] [Google Scholar] 14. Вонг В.С., Мосс А.А., Федерле М.П., Кокран-СТ, Лондон СС. Инфаркт почек: КТ-диагностика и корреляция между результатами КТ и этиологией. Радиология. 1984; 150: 201–5. [PubMed] [Google Scholar] 15. Салифу, Миссури, Гордон Д.Х., Фридман Э.А., Делано Б.Г. Двусторонний инфаркт почки у черного мужчины с медиальной фиброзно-мышечной дисплазией.Am J Kidney Dis. 2000; 36: 184–9. [PubMed] [Google Scholar] 16. Стинчкомб SJ, Manhire AR, Bishop MC, Gregson RH. Фиброзно-мышечная дисплазия почечной артерии: острый инфаркт почки у трех пациентов с ангиографическими признаками медиальной фиброплазии. Br J Radiol. 1992; 65: 81–4. [PubMed] [Google Scholar] 17. Гранфортуна Дж., Замкофф К., Уррутия Э. Острый инфаркт почек при серповидно-клеточной анемии. Am J Hematol. 1986; 23: 59–64. [PubMed] [Google Scholar] 18. Сонпал Г.М., Шарма А., Миллер А. Синдром первичных антифосфолипидных антител, инфаркт почек и гипертония.J Rheumatol. 1993; 20: 1221–3. [PubMed] [Google Scholar] 19. Poux JM, Boudet R, Lacroix P, Jauberteau MO, Plouin PF, Aldigier JC и др. Инфаркт почек и тромбоз инфраренальной аорты у 35-летнего мужчины с первичным антифосфолипидным синдромом. Am J Kidney Dis. 1996; 27: 721–5. [PubMed] [Google Scholar] 20. Беманян С, Моталлеби М, Носрати СМ. Инфаркт почки, вызванный кокаином: отчет о случае и обзор литературы. BMC Nephrol. 2005; 6: 10. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21.Amarenco P, Seux-Levieil ML, Cohen A, Levy C, Touboul PJ, Bousser MG. Расслоение сонной артерии при инфаркте почек. Два случая. Инсульт. 1994; 25: 2488–91. [PubMed] [Google Scholar] 22. Хазанов Х., Сомин М., Аттали М., Бейлинсон Х., Талер М., Мулаллем М. и др. Острая почечная эмболия. Сорок четыре случая инфаркта почек у пациентов с фибрилляцией предсердий. Медицина (Балтимор) 2004; 83: 292–9. [PubMed] [Google Scholar] 23. Лессман Р.К., Джонсон С.Ф., Коберн Дж. В., Кауфман Дж. Дж. Эмболия почечной артерии: клинические особенности и отдаленные результаты 17 случаев.Ann Intern Med. 1978; 89: 477–82. [PubMed] [Google Scholar] 24. Йошида Т., Икехара Н., Миябе Х., Саката С., Ядзима К., Мукаи С. и др. Два случая инфаркта почки, диагностированного на ранней стадии с помощью КТ с контрастированием. Hypertens Res. 2004. 27: 523–6. [PubMed] [Google Scholar] 25. Amilineni V, Lackner DR, Morse WS, Srinivas H. КТ с контрастированием для острой боли в боку, вызванной острой окклюзией почечной артерии. AJR Am J Roentgenol. 2000. 174: 105–6. [PubMed] [Google Scholar] 26. Suzer O, Shirkhoda A, Jafri SZ, Madrazo BL, Bis KG, Mastromatteo JF.КТ особенности инфаркта почки. Eur J Radiol. 2002; 44: 59–64. [PubMed] [Google Scholar] 27. Акпинар Э., Туркбей Дж., Элдем Дж., Карджаалтинкаба М., Ахан О. Когда нам нужна КТ с контрастным усилением у пациентов с неопределенными результатами КТ мочевыводящих путей? Emerg Radiol. 2009. 15: 97–103. [PubMed] [Google Scholar] 28. Моррис Д., Кисли А., Стойка К. Г., Провенцано Р. Спонтанная двусторонняя окклюзия почечной артерии, связанная с хронической фибрилляцией предсердий. Clin Nephrol. 1993; 39: 257–9. [PubMed] [Google Scholar]Острая окклюзия почечной артерии: презентация, лечение и исход
Цель
Острая окклюзия почечной артерии — необычное заболевание, требующее быстрой диагностики для предотвращения потери почек или необратимого повреждения почек.Целью этого исследования было выявление пациентов с острым инфарктом почки; охарактеризовать их представление, визуализацию и лечение; и сравнить подгруппу пациентов, перенесших катетер-направленный тромболизис (CDT), с теми, кто лечился без вмешательства.
Методы
Больничные записи за период с 2005 по 2015 год были запрошены по ключевым словам, указывающим на инфаркт почки. Пациенты были разделены на две группы: группа CDT и группа без вмешательства. Собранные данные включали демографические данные, сопутствующие заболевания, методы диагностики и время от обращения до постановки диагноза.Для пациентов, получавших CDT, были собраны дополнительные данные, включающие сведения о тромболитической терапии и последующих исследованиях. Две группы сравнивались относительно их клинических характеристик и результатов.
Результаты
У 42 пациентов был диагностирован острый инфаркт почки; 13 (31%) получали CDT и 29 (69%) лечились консервативно. Среднее время от появления до постановки диагноза составило 42 часа в группе CDT и 32 часа в группе без лечения. В группе CDT полное или частичное рассасывание тромба наблюдалось у всех пациентов.Двум из них потребовался постоянный диализ, оба — пациенты с пересадкой почки. Медиана наблюдения составила 30 месяцев (межквартильный размах, 2,7–46,2) в группе CDT и 13 месяцев (межквартильный размах, 0,11–16) в группе без вмешательства. Средний клиренс креатинина при постановке диагноза и при последнем наблюдении составил 74,3 и 54,6 мл / мин, соответственно, в группе CDT (снижение на 27%; P = 0,032) и 66,1 и 60 мл / мин в группе консервативного лечения. группа (снижение на 9%; P = 0,04). Последующие визуализации были доступны у девяти пациентов, получавших CDT.Средний интервал от лечения до последующего наблюдения составлял 13 месяцев (диапазон от 1 до 35 месяцев) и неизменно демонстрировал функциональную, но меньшую по размеру почку, подвергшуюся лечению. (Средняя межполюсная длина почки на исходном и позднем этапе наблюдения: 10,4 см и 8,5 см соответственно).
Выводы
Большинство пациентов с острым инфарктом почки лечатся консервативно. Подгруппе пациентов с полной окклюзией почечной артерии выполняется CDT с хорошими ангиографическими результатами. Ожидается, что обработанная почка со временем уменьшится в размерах, а общая функция почек снизится по сравнению с исходным уровнем.Ухудшение функции почек стабилизируется и не продолжается с течением времени. CDT при острой окклюзии почечной артерии является безопасным методом лечения, и его следует предпринимать с целью спасения почек, даже в условиях длительной ишемии.
Рекомендуемые статьиЦитирующие статьи (0)
Просмотреть аннотациюCopyright © 2016 Общество сосудистой хирургии. Опубликовано Elsevier Inc.
Рекомендуемые статьи
Ссылки на статьи
Тромбоз почечной артерии, вызванный COVID-19 | Клинический журнал почек
Мужчина 52 лет поступил в реанимацию с болями в животе.Его история болезни включала правую нефрэктомию по поводу неоплазии почек и стентирование аорты и левой почечной артерии после расслоения аорты. В последние недели у него была астения. При клиническом обследовании выявлено нормальное артериальное давление, апирексия, вздутие живота, олиго-анурия. Его первоначальные лабораторные тесты были следующими: сывороточный креатинин 486 мкмоль / л, гемоглобин 15,9 г / дл, тромбоциты 400 г / л, лактатдегидрогеназа 1795 Ед / л (норма <246), протеин C реактивный 82, D-димер 16354 нг. / мл и фибриноген 7.2 г / л. Компьютерная томография торакоабдоминальной области и таза показала внутристентный тромбоз левой почечной артерии с обширным ишемическим поражением почечной паренхимы, а также изображения, свидетельствующие о тяжелой пневмонии, вызванной коронавирусом 2 (SARS-CoV-2) с острым респираторным синдромом (двусторонняя , субплевральные помутнения по типу матового стекла) (Рисунок 1). Восстановить реваскуляризацию левой почечной артерии после ангиопластики не удалось. Катетер для диализа был установлен для начала хронического гемодиализа.РНК SARS-CoV-2 была обнаружена в мазках из носоглотки. Поставлен диагноз: тромбоз почечной артерии, вызванный коронавирусной болезнью 2019 (COVID-19). Результат был благоприятным без специального лечения и постоянного гемодиализа.
РИСУНОК 1:
Компьютерная томография. ( A ) Интрастентный тромбоз левой почечной артерии с обширным ишемическим поражением почечной паренхимы. ( B ) Двусторонние субплевральные помутнения в виде матового стекла, указывающие на пневмонию SARS-CoV-2.
РИСУНОК 1:
Компьютерная томография. ( A ) Интрастентный тромбоз левой почечной артерии с обширным ишемическим поражением почечной паренхимы. ( B ) Двусторонние субплевральные помутнения в виде матового стекла, указывающие на пневмонию SARS-CoV-2.
В настоящее время известно, что COVID-19 может предрасполагать пациентов к тромботическим заболеваниям как венозного, так и артериального кровообращения из-за чрезмерного воспаления, активации тромбоцитов, эндотелиальной дисфункции и застоя. Первоначальная коагулопатия COVID-19 проявляется заметным повышением содержания фибрина / фибриногена и продуктов распада, в то время как отклонения в протромбиновом времени, частичном тромбопластиновом времени и количестве тромбоцитов при начальных проявлениях относительно редки.
ЗАЯВЛЕНИЕ О КОНФЛИКТЕ ИНТЕРЕСОВ
Не объявлено.
© Автор (ы) 2020. Опубликовано Oxford University Press от имени ERA-EDTA.
Это статья в открытом доступе, распространяемая в соответствии с условиями некоммерческой лицензии Creative Commons Attribution (http://creativecommons.org/licenses/by-nc/4.0/), которая разрешает некоммерческое повторное использование, распространение, и воспроизведение на любом носителе при условии правильного цитирования оригинала.По вопросам коммерческого повторного использования обращайтесь по адресу [email protected].Тромбоз левой почечной артерии у пациента 78 лет с фибрилляцией предсердий
Тромбоз почечной артерии — редкое клиническое состояние. Часто диагноз ставится с опозданием из-за неспецифических клинических жалоб. Мы представили женщину с фибрилляцией предсердий пожилого возраста, у которой развился тромбоз левой почечной артерии. Несмотря на лечение антикоагулянтами, пациенту не было положительных результатов, и почка была полностью повреждена.
Почечная артерия, тромбоз, антикоагулянтная терапия, фибрилляция предсердий, острая боль в животе
Женщина 78 лет с вторичной регургитацией митрального и трехстворчатого клапанов и мерцательной аритмией была направлена в отделение неотложной помощи с жалобой на внезапную и постоянную боль в левой брюшной полости, начавшуюся 2 дня назад. При физикальном обследовании выявлены болезненность и боль в боку слева в брюшной полости. Пациент проходил лечение по поводу хронической обструктивной болезни легких.У него была лихорадка, артериальное давление 140/90 мм рт. Пульс 120 / мин, аритмия. Сатурация крови кислородом составила 88%, значение PO2 — 55 мм рт. Лабораторные анализы показали: количество лейкоцитов — 14.200, уровень азота мочевины в крови — 44 мг / дл, уровень креатинина сыворотки — 1,4 мг / дл. Значения ЛДГ и СРБ были выше нормы. В анализе мочи выявлены гематурия и протеинурия. Была выполнена чреспищеводная эхокардиограмма и выявлен тромб в левом предсердии (рис. 1).Ишемическое событие эмболического происхождения рассматривалось как причина боли в животе, и была сделана томография брюшной полости. Компьютерная томография (КТ) брюшной полости показала, что левая почечная артерия закупорена тромбом (рис. 2). Поскольку это эмболический тромб, антикоагулянтное лечение было начато подкожным путем (Innohep, Abdi Ibrahim, Турция; SC 100 МЕ / кг / день), немедленно. Тошнота, рвота и боль уменьшились через 2 дня лечения. Уровень креатинина сыворотки упал до 1,2 мг / дл. Через 2 дня была проведена повторная компьютерная томография, и было обнаружено, что тромбоз левой почечной артерии и инфаркт продолжаются, а левая почка нефункционирует (рис. 3).Несмотря на лечение антикоагулянтами, улучшения почечной перфузии не наблюдалось. Пациент рассматривался как отсроченный случай, и никакого другого интервенционного лечения не требовалось.
Рисунок 1. Эхокардиографическое изображение, показывающее тромб в левом предсердии.
Рис. 2. Сагиттальный вид артериальной фазы компьютерной томографии, показывающий тромбы в левой почечной артерии (черная звездочка).
Рисунок 3. Компьютерная томография, показывающая тромбоз левой почечной артерии (белая звездочка) и нефункциональная левая почка.
Большая часть тромбозов почечной артерии может быть вызвана фибрилляцией предсердий, вмешательством на аорте, травмой живота, хирургическим вмешательством почек и нарушениями свертывания крови [1]. Поскольку продолжительность ишемии почек составляет 1-6 часов, диагноз тромбоза почечной артерии должен быть поставлен как можно скорее, чтобы сохранить функцию почек. Таким образом, у пациентов с болью в боку, которую нельзя объяснить другими причинами, следует помнить о диагностике тромбоза почечной артерии и как можно скорее проводить контрастную КТ.В дополнение к компьютерной томографии для подтверждения диагноза также можно использовать магнитно-резонансную томографию [1,2].
Рекомендуется начинать лечение в течение 90-180 минут для успешного лечения и защиты тканей почек. Другими вариантами лечения, помимо антикоагулянтной терапии, являются чрескожная транскатетерная аспирация, эмболэктомия и нефрэктомия. Из-за их высокой заболеваемости и ограниченной сохранности почечной ткани использование хирургического лечения в настоящее время очень ограничено. Поэтому риски и преимущества тщательно оцениваются, и для односторонних бессимптомных пациентов следует рассмотреть консервативное лечение вместо хирургического лечения [2,3].
В заключение, тромбоз почечной артерии — редкое клиническое заболевание, и клинические данные часто неспецифичны. Таким образом, диагноз часто откладывается, что является важным клиническим состоянием, которое приводит к потере паренхимы почек. Цель этого описания случая — напомнить врачам, что тромбоз почечной артерии следует учитывать при дифференциальной диагностике жалоб на боль в животе у пациентов, поступающих в больницы и отделения неотложной помощи. В случаях с такими жалобами и подозрением на тромбоз почечной артерии компьютерная томография брюшной полости важна для ранней диагностики и спасения почек.
Авторы заявляют, что у них нет конкурирующих интересов, и что финансирование этой статьи не поступало.
Письменное информированное согласие было получено от семьи пациента на публикацию этого описания случая и любых сопутствующих изображений.
- Bourgault M, Grimbert P, Verret C, Pourrat J, Herody M и др. (2013) Острый инфаркт почки: серия случаев. Clin J Am Soc Nephrol 8: 392-398.
- Frost L, Engholm G, Johnsen S, Moller H, Henneberg EW, et al.(2001) Инцидентная тромбоэмболия аорты и почечных, брыжеечных, тазовых и конечных артерий после выписки из больницы с диагнозом фибрилляция предсердий. Arch Intern Med 161: 272-276
- Domanovits H, Paulis M, Nikfardjam M, Meron G, Kürkciyan I, et al. (1999) Острый инфаркт почки. Клиническая характеристика 17 пациентов. Медицина (Балтимор) 78: 386-394.
Тромбоз почечных вен: история болезни, патофизиология, этиология
Автор
Игорь А. Ласковский, доктор медицины Доцент кафедры хирургии, отделение сосудистой хирургии, Нью-Йоркский медицинский колледж, Вестчестерский медицинский центр
Игорь А. Ласковский, доктор медицинских наук, является членом следующих медицинских обществ: Американского колледжа хирургов, Общества сосудистых заболеваний. Хирургия, Американская гепато-панкреатобилиарная ассоциация, Общество сосудистой и эндоваскулярной хирургии, Общество трансплантологии
Раскрытие информации: раскрывать нечего.
Специальная редакционная коллегия
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Получил зарплату от Medscape за работу. для: Medscape.
Главный редактор
Винсент Лопес Роу, доктор медицины Профессор хирургии, программный директор, резидентура и стипендия интегрированной сосудистой хирургии, отделение хирургии, отделение сосудистой хирургии и эндоваскулярной терапии, Медицинская школа Кека Университета Южной Калифорнии
Винсент Лопес Роу, Доктор медицины является членом следующих медицинских обществ: Американского колледжа хирургов, Американской хирургической ассоциации, Хирургической ассоциации тихоокеанского побережья, Общества клинической сосудистой хирургии, Общества сосудистой хирургии, Западного сосудистого общества
Раскрытие информации: не раскрывать.
Дополнительные участники
Ричард А. Сантуччи, доктор медицины, FACS , главный специалист отделения урологии Детройтского медицинского центра; Заведующий урологом Детройтской приемной больницы; Директор Центра урологической реконструкции; Клинический профессор урологии Медицинского колледжа Мичиганского государственного университета
Ричард Сантуччи, доктор медицинских наук, FACS является членом следующих медицинских обществ: Американского колледжа хирургов, Международного общества урологов, Американской урологической ассоциации
Раскрытие информации: не раскрывать.
Благодарности
Сатиш К. Бабу, доктор медицины Профессор клинической хирургии, Медицинский колледж Нью-Йорка; Заведующий отделением сосудистой и эндоваскулярной хирургии, Вестчестерский медицинский центр
Раскрытие: Ничего не раскрывать.
Луи Швинг, MD Консультант, Отделение внутренней медицины, Carle Clinic Associates
Луи Швинг, доктор медицины, является членом следующих медицинских обществ: Американская медицинская ассоциация
Раскрытие: Ничего не раскрывать.
Неонатальный тромбоз почечных вен и артерий | Итальянский педиатрический журнал
Шмидт Б., Эндрю М.: Неонатальный тромбоз: отчет о предполагаемом канадском и международном регистрах. Педиатрия. 1995, 96: 939-943.
CAS PubMed Google Scholar
Новак-Готтль У, фон Крис Р., Гобель У: Симптоматическая тромбоэмболия новорожденных в Германии: двухлетнее исследование. Arch Dis Child Fetal Neonatal Ed.1997, 76: F 163-167. 10.1136 / fn.76.3.F163.
CAS Статья Google Scholar
Бёкенкамп А., фон Крис Р., Новак-Гёттль Ю., Гёбель Ю., Хойер П. Ф.: Тромбоз почечных вен у новорожденных в Германии в период с 1992 по 1994 год: эпидемиология, лечение и исход. Eur J Pediatr. 2000, 159: 44-48. 10.1007 / s004310050008.
Артикул PubMed Google Scholar
Kuhle S, Massicotte P, Chan A, Mitchell L: серия случаев из 72 новорожденных с тромбозом почечной вены.Данные из реестра 1-800-NO-CLOTS. ThrombHaemost. 2004, 92: 729-733.
CAS Google Scholar
Messinger Y (1), Sheaffer JW, Mrozek J, Smith CM, Sinaiko AR: Почечный исход тромбоза почечных вен у новорожденных: обзор 28 пациентов и эффективность фибринолитиков и гепарина у 10 пациентов. Педиатрия. 2006, 118: e 1478-1484. 10.1542 / peds.2005-1461.
Артикул Google Scholar
Kosch A, Kuwertz-Bröking E, Heller C, Kurnik K, Schobess R, Nowak-Göttl U: Тромбоз почечных вен у новорожденных: факторы протромботического риска и долгосрочное наблюдение. Кровь. 2004, 104: 1356-1360. 10.1182 / кровь-2004-01-0229.
CAS Статья PubMed Google Scholar
Крафт Дж. К., Брандао Л. Р., Наварро О. М.: Сонография тромбоза почечных вен у новорожденных и младенцев: можем ли мы предсказать результат ?. PediatrRadiol. 2011, 41: 299-307.
Google Scholar
Мокан Х., Битти Т.Дж., Мерфи А.В.: Тромбоз почечных вен в младенчестве: долгосрочное наблюдение. ПедиатрНефрол. 1991, 5: 45-49.
CAS Google Scholar
Monagle P, Chan AK, Goldenberg NA, Ichord RN, Journeycake JM, Nowak-Göttl U, Vesely SK: Антитромботическая терапия новорожденных и детей. Антитромботическая терапия и профилактика тромбозов, 9-е изд. Американского колледжа врачей-терапевтов по клинической практике, основанные на фактических данных.Грудь. 2012, 141 (2 доп.): E737S-801S.
PubMed Central CAS Статья PubMed Google Scholar
Payne RM, Martin TC, Bower RJ, Canter CE: Управление и последующее наблюдение за артериальным тромбозом в неонатальном периоде. J Pediatr. 1989, 114: 853-858. 10.1016 / S0022-3476 (89) 80152-0.
CAS Статья PubMed Google Scholar
Proesmans W, van de Wijdeven P, Van Geet C: Тромбофилия при неонатальном почечном венозном и артериальном тромбозе.ПедиатрНефрол. 2005, 20: 241-242.
Google Scholar
% PDF-1.4 % 1 0 obj >>> эндобдж 2 0 obj > поток uuid: 725afa6e-19fe-4f36-b85f-c395bcbe7746xmp.did: 4977A1595A8FE511882FC421E23B5B75adobe: docid: indd: bcf2ca23-9776-11de-88e9-fb1643342012ecproof: BCF2CA23-9776-11de-88e9-fb16433481ecproof: pdf123121ecproof: pdf123121ecproof: pdf128c03 6.0 /

