Где разрушаются тромбоциты
Тромбоцитопения причины и лечение альтернативной и традиционной медициной
Сегодня поговорим о таком заболевании крови, как тромбоцитопения причины и лечение, что такое тромбоциты, их роль в организме. Выясним симптомы болезни, как она проявляется и лечится у детей и беременных женщин, а так же какие есть народные способы помощи при этом недуге. А самое главное — вы узнаете, каким образом можно вылечить болезнь, и что советует для этого альтернативная медицина.
Также рассмотрим альтернативный способ лечения тромбоцитопении. Несмотря на то, что традиционные врачи считают тромбоцитопению неизлечимой, врачи альтернативной медицины находят пути для того, чтобы вылечить это заболевание.
Что такое тромбоцитопения
В дословном переводе с греческого это слово обозначает нехватку тромбоцитов — красных кровяных пластинок (не путать с красными кровяными тельцами — клетками крови эритроцитами), что вызывает «жидкую кровь», кровоточивость и невозможность быстро остановить кровотечение — тромб долго не образовывается.
При подобном заболевании всегда есть угроза внешних и внутренних кровотечений. Внешние кровотечения — это носовые и слизистая рта, внутренние кровотечения — это внутрикожные, легочные, желудочные, кишечные, маточные кровоизлияния, наличие крови в моче и кале.
Как выглядит тромбоцитопения на коже ног — смотрите фото петехий (красных точек) ниже: Фото, как выглядит пурпура: Ещё одно фото проявления на коже точечных кровоизлияний:
Основные функции тромбоцитов в организме или что нарушается при тромбоцитопении
Тромбоциты — маленькие элементы крови, которые слипаются, образуя тромбы на местах ран, останавливая кровотечение. Когда кровеносный сосуд поврежден, они устремляются к месту повреждения, чтобы остановить кровотечение. Тромбоциты способны к прилипанию на повреждённую поверхность сосуда и слипанию между собой для образования сгустка на месте повреждения сосуда.
При нехватке тромбоцитов, закупорка места повреждения сосуда более длительная и соответственно — потеря крови может быть значительной, а иногда и опасной для жизни.
Тромбоцит (кровяная пластинка) – форменный элемент крови, образуется от клеток-великанов костного мозга мегекариоцитов. Время созревания клеток 8 суток, длительность пребывания в кровяном русле 9-11 дней, колебания числа пластинок составляет до 15% в сутки.
В норме образование кровяных пластинок равно их разрушению (деструкции), то есть между этими двумя процессами существует баланс. Уменьшение уровня тромбоцитов в кровеносном русле менее чем 180 г/литр возникает при нарушении баланса между образования тромбоцитов и их разрушением.
Возможно, вам будут полезные статьи по смежной тематике — аутоиммунный тиреоидит лечение или вы хотите узнать, какая функция щитовидной железы в организме. Возможно, вас интересует что делает в нашем организме хеликобактер пилори, и как с ним правильно бороться. Проблемы с кровью часто приводят к различным патологиям, поэтому рекомендую ознакомится с таким явлением, как симптомы повышенного давления и как поднять давление в домашних условиях. Интересные рекомендации вас ждут в статье синдром беспокойных ног причины и лечение.
Основная роль тромбоцитов в организме:
- участие в процессе формирования сгустка и первичного тромба
- соединение (слипание) пластинок друг с другом и фиксация в месте разрыва сосудистой стенки
- участие в иммунных процессах в роли фагоцитов
- отделение сгустка крови от сыворотки (ретракция сгустка)
В результате патологической нехватки тромбоцитов, в организме происходит следующее:
- появляются множественные микротрещины сосудов и капилляров
- слипание пластинок тромбоцитов и фиксация их на месте разрыва стенки сосудов слишком медленная, что приводит к кровотечению
- снижается защитная функция организма, так как уменьшается количество фагоцитов
- замедляется отделение сгустка крови от сыворотки
Тромбоцитопения причины и лечение: классификация
Чтобы лучше представлять, что за болезнь тромбоцитопения причины и лечение, рассмотрим классификацию заболевания. Причины возникновения болезни могут быть следующие:
- сниженная продукция (образование) тромбоцитов
- повышенное разрушение тромбоцитов
- завышенное потребление тромбоцитов
Показатель уровня тромбоцитов, при котором следует начинать лечение – ниже 10 – 20 г/литр.
Заболевание может иметь острую и хроническую форму, с периодами обострения и ремиссии.
Различают наследственные (редкие) и приобретенные (более часто). При наследственной болезни нарушены функции кровяных пластинок, приобретенная тромбоцитопения возникает, когда угнетается процесс образования тромбоцитов в костном мозге.
Снижение числа кровяных пластинок до критического уровня и ниже (меньше 50 г/литр) ведет к развитию геморрагического синдрома или, говоря простым языком склонность к подкожным кровоизлияниям и кровоточивости слизистых оболочек.
Физиологические и патологические условия развития тромбоцитопении
В физиологических (нормальных) условиях встречается уменьшение числа тромбоцитов во время менструального цикла у женщин, после введения гистамина и других средств, минуя пищеварительный тракт (такие действия имеют перераспределительный характер).
В патологических условиях тромбоцитопения у взрослых наблюдается в следующих случаях:
- при замедленном вызревании и снижении распада тромбоцитов
- при токсических (инфекционных и аллергических) состояниях — в результате распада пластинок в кровеносном русле, замедленном созревании и выпадении их из костного мозга под воздействием токсических и аллергических влияний
- во время паразитарных и инфекционных заболеваний, отравлениях, анемии
- при нарушении работы кровеносной системы
- при тиреотоксикозе (нарушении работы щитовидной железы)
- во время острого лейкоза и миеломной болезни (в результате опухоли в костном мозге
Есть разные причины уменьшения показателей тромбоцитов в крови. Сокращение числа тромбоцитов в кровотоке могут вызвать следующие факторы:
- перераспределение их по кровяному руслу
- обильное тромбообразование
- ускоренный распад клеток (тромбоцитолиз)
- снижение образования их в костном мозге
Рассмотрим кратко каждый из них.
Перераспределение тромбоцитов по кровяному руслу
Тромбоциты имеют своё депо, где хранится определённое количество тромбоцитов — до 1/3 от всего объёма. Это в нормально функционирующем организме. Но бывает ряд болезней, которые вызывают 90% депонирования всех тромбоцитов. Они образовываются — и отправляются в депо. В селезенке их переизбыток — в крови — большая нехватка. Подобный процесс происходит при следующих заболеваниях:
- гипотермия (длительное охлаждение организма)
- туберкулез
- эндокардит
- малярия
- лейкозы
- лимфомы
- цирроз печени
Вот такое перераспределение тромбоцитов почти всех в депо приводит к тромбоцитопении.
Обильное тромбообразование
Обильное тромбообразование требует большого количества материала, из которого образуются тромбы, то есть, кровяных пластинок — тромбоцитов. Происходит это в трёх случаях:
- при искусственной почке
- при искусственном кровообращении
- при массовых кровотечениях
Если в перечисленных случаях не будет достаточного количества тромбоцитов, это приведёт к тромбоцитопении.
Ускоренный распад — тромбоцитолиз
Ускоренный распад тромбоцитов — главная причина тромбоцитопении. Когда тромбоциты ускорено разрушаются, то костный мозг переходит в ускоренный ритм работы и резко увеличивается количество клеток-гигантов, от которых образуются тромбоциты.
Если в организме запущенный механизм разрушения кровяных пластинок протекает быстрее, чем их синтез из мегакариоцитов — развивается тромбоцитопения. Она бывает двух типов:
- иммунологическая тромбоцитопения
- изоиммунная, возникает при беременности или переливании крови, продуцируются антитела к антигенам тромбоцитов другого организма
- аутоиммунная, продуцируются антитела к антигенам своих собственных тромбоцитов
- иммунная или медикаментозная, так как возникает после принятия некоторых препаратов
- неиммунологическая тромбоцитопения
- врожденная
- приобретённая (целый список заболеваний)
Все описанные состояния приводят к ускоренному распаду тромбоцитов и, как результат — к тромбоцитопении.
Сниже
Этот загадочный тромбоцит
Алена Якименко, Анастасия Свешникова, Елена Артеменко, Михаил Пантелеев
«Природа» №2, 2014
Об авторах

Алена Олеговна Якименко (вторая слева) — кандидат биологических наук, старший научный сотрудник Центра теоретических проблем физико-химической фармакологии (ЦТПФХФ) РАН. Область научных интересов — свертывание крови, механизмы тромбообразования, субпопуляции активированных тромбоцитов крови человека. |
Анастасия Никитична Свешникова (крайняя справа) — кандидат физико-математических наук, старший научный сотрудник физического факультета МГУ им. М. В. Ломоносова. Научные интересы связаны с компьютерным моделированием биологических процессов, изучением внутриклеточной сигнализации, биохимии свертывания крови. |
Елена Олеговна Артеменко — научный сотрудник ЦТПФХФ РАН. Занимается исследованием реорганизации цитоскелета тромбоцитов при активации и механизмов, приводящих к формированию прокоагулянтных активированных тромбоцитов. |
Михаил Александрович Пантелеев — доктор физико-математических наук, профессор, заведующий лабораторией молекулярных механизмов гемостаза ЦТПФХФ РАН. Лауреат премии им. Р. В. Хохлова (2002) и премии Европейской академии (2007). Область научных интересов — механизмы регуляции гемостаза и тромбоза, биохимия и биофизика свертывания крови, математическое моделирование биологических систем. |
Важнейшую роль тромбоцитов в живом организме открыл итальянский врач и патолог Джулио Биццоцеро, который в 1882 г. провел ряд блестящих экспериментов, имея в своем распоряжении лишь световой микроскоп. Сегодня у нас куда больше измерительных приборов и вычислительных машин, выполняющих сложнейшие математические расчеты, однако множество вопросов остаются открытыми. Известно, что тромбоциты играют ключевую роль в остановке кровотечения из раны (гемостазе) и опасном перекрывании здорового сосуда (тромбозе). Однако до сих пор неясно, как именно функционирует система гемостаза. Какие причины приводят к ее переключению с защиты организма на развитие угрожающих жизни патологий? Какова роль тромбоцитов в регуляции процессов гемостаза и тромбоза? Не знаем мы, и зачем тромбоциты устроены так сложно, и не представляем всю последовательность событий, обеспечивающих формирование тромба в месте повреждения, а экспериментальные данные приносят с собой новые загадки.
Строение

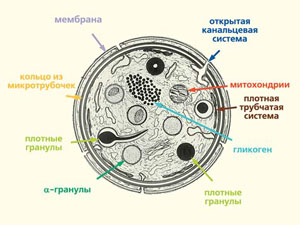
Тромбоциты (от греч. θρομβοζ — ‘сгусток’ и κυτοζ — ‘клетка’) — специализированные безъядерные клетки крови, имеющие форму диска диаметром около 3 мкм и толщиной около 0,5 мкм (рис. 1). Образуются они при фрагментации больших клеток костного мозга — мегакариоцитов и циркулируют в кровотоке в концентрации 200–400 тыс. клеток в 1 мкл крови. Живут тромбоциты в кровотоке в среднем 5–9 дней, а затем разрушаются в селезенке и печени.
Устроен тромбоцит довольно сложно. Снаружи он ограничен билипидным слоем мембраны, многочисленные впячивания которой (открытая канальцевая система) дают запас поверхности для изменения формы (рис. 2). Поддерживает ее и одновременно позволяет сильно менять цитоскелет (каркас) клетки. Внутри находятся эндоплазматический ретикулум (хранилище ионов кальция, необходимых для сигнализации и выполнения тромбоцитом своих функций) и митохондрии (органеллы, обеспечивающие дыхание). В цитозоле присутствуют гранулы, содержащие вещества, выплескивающиеся при активации клетки (переходе в новое состояние) во внеклеточное пространство. В плотных гранулах содержатся нуклеотиды (АТФ, АДФ, ГТФ, ГДФ), серотонин, ионы кальция в высокой концентрации, в α-гранулах — различные белки (в том числе факторы свертывания крови), а в лизосомах — некоторые ферменты (коллагеназа, эластаза и др.).

После активации тромбоцита на внешней поверхности его мембраны появляется отрицательно заряженный липид — фосфатидилсерин. С ним с помощью ионов кальция связываются некоторые факторы свертывания, формируя специальные комплексы. Они во много раз ускоряют реакции, приводящие к желированию плазмы крови у места повреждения (этот процесс называется плазменным гемостазом). Иными словами, фосфатидилсерин обеспечивает прокоагулянтную, способствующую плазменному гемостазу, функцию тромбоцитов.
Почему же век этих клеток крови столь недолог (эритроциты, например, живут три-четыре месяца), ведь в норме, в отсутствие серьезных повреждений сосудов, они практически не работают? Почему они имеют вид дисков? Зачем тромбоциту митохондрии, если его энергетические расходы крайне скромны? Зачем природе понадобилось ускорять реакции плазменного свертывания на клеточных мембранах? Для чего α-гранулы содержат белки свертывания, которые есть и в плазме крови? Это только некоторые из вопросов, не имеющих пока четких ответов.
Активация
Для выполнения своей основной функции — заделывания повреждения в стенке сосуда — тромбоциты должны перейти в активное состояние. Как и у большинства клеток нашего организма, этот процесс протекает по следующей схеме: сигнал — рецептор — внутриклеточный сигнал — усилитель — регулятор — ответ (рис. 3). Сигналом к активации служит появление в кровотоке агониста — специальной сигнальной молекулы, которая должна появляться только при необходимости и связываться со специфической молекулой, пронизывающей мембрану тромбоцита (рецептором). Агонист взаимодействует с одним «хвостом» рецептора, выступающим снаружи, и это приводит к изменению другого, со стороны цитозоля, где появляется следующая сигнальная молекула — вторичный мессенджер. Он запускает синтез еще нескольких мессенджеров, те, в свою очередь, — еще нескольких, и так сигнал распространяется в цитозоле и усиливается с помощью каскада внутриклеточных реакций, что в конечном итоге приводит к комплексному ответу тромбоцита. Важно, что в тромбоците существуют специальные регуляторные системы, модулирующие концентрации внутриклеточных мессенджеров на разных этапах активации, чтобы, например, не было реакции на следовые количества агониста.

Как же эта схема реализуется в нашем организме? В сосудах тромбоциты выталкиваются эритроцитами из основного потока и движутся вдоль стенок, проводя своего рода мониторинг их состояния. Одним из первых сигналов к активации тромбоцитов становится коллаген — основной белок соединительной ткани, обнажающийся при повреждении сосуда. Обнаружив коллаген, они связываются с ним через специальные рецепторы, одновременно активируясь и прочно прикрепляясь к месту повреждения. Взаимодействие тромбоцита с коллагеном и ведет к запуску упомянутого внутриклеточного сигнального каскада и появлению в цитозоле вторичного мессенджера — инозитолтрифосфата (ИФ3). Эта маленькая водорастворимая молекула способна быстро передвигаться в цитозоле и служит сигналом к выходу ионов кальция из внутриклеточных хранилищ. А повышение его внутриклеточной концентрации может приводить к разнообразным ответам тромбоцита: выплескиванию содержимого гранул (секреции), изменению формы, прикреплению к стенке сосуда (адгезии), скреплению с другими тромбоцитами (агрегации), появлению прокоагулянтной активности (рис. 4). После того, как кровеносная система уже распознала повреждение сосуда, в крови появляются еще три природных активатора тромбоцита — тромбин, АДФ и тромбоксан A2. Белок тромбин образуется из предшественника, протромбина, в плазме крови, но массово — уже на мембранах активированных тромбоцитов. При секреции их плотных гранул выбрасывается большое количество АДФ (маленькая молекула, выполняющая в клетках в основном энергетические функции), и гораздо меньше АДФ высвобождается из поврежденных клеток эндотелия, выстилающего внутреннюю поверхность сосудов. Из арахидоновой кислоты, находящейся в мембранах активированных тромбоцитов, синтезируется тромбоксан А2. Связывание этих трех активаторов со своими рецепторами на мембране тромбоцита приводит, как и в случае с коллагеном, к появлению ИФ3 в цитозоле и повышению в нем концентрации кальция (рис. 4). Таким образом, все три растворимых активатора и коллаген действуют по одному пути, однако вызывают разные тромбоцитарные ответы. Например, тромбоксан А2 провоцирует выброс плотных гранул, а АДФ — нет. Активация отдельно коллагеном или тромбином вызывает все перечисленные ответы одновременно, а совместно — приводит к появлению группы прокоагулянтных тромбоцитов и синтезу тромбина на их мембранах. Видимо, существуют еще недостаточно изученные различия в сигнализации, запускаемой разными агонистами. Чтобы случайная активация не превращала тромбоцит в настоящую «бомбу», несущуюся в кровотоке и запускающую всю систему свертывания, в организме неповрежденные клетки эндотелия постоянно выделяют простациклин и оксид азота, которые блокируют активацию клеток, препятствуя повышению в них концентрации кальция.
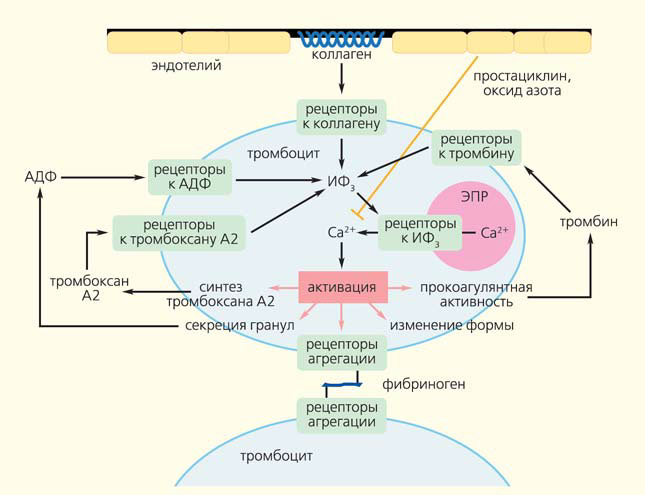
Сигнализация — один из самых сложных и плохо изученных разделов в исследовании тромбоцитов. По устройству каждого рецептора и сигнального пути существует множество вопросов, и самый простой из них: зачем вообще столько активаторов?
Цитоскелет и изменение формы
Цитозоль тромбоцита пронизан трехмерной сетью из водонерастворимых белковых нитей (филаментов), которая формирует цитоскелет. Филаменты состоят из полимеризованного белка актина и обеспечивают изменение формы тромбоцита при активации. Кроме того, непосредственно под плазматической мембраной находится мембранный скелет, связанный с цитоплазматическими «хвостами» некоторых рецепторов. Состоит он из коротких актиновых филаментов, соединенных друг с другом с помощью специальных белков. Мембранный скелет не только поддерживает плазматическую мембрану, регулируя контуры клетки, и стабилизирует ее, предотвращая фрагментацию, но и регулирует распределение в плоскости мембраны рецепторов, прикрепленных к нему. Также предполагают, что он играет важную роль в регуляции различных внутриклеточных событий, которые запускаются при активации.
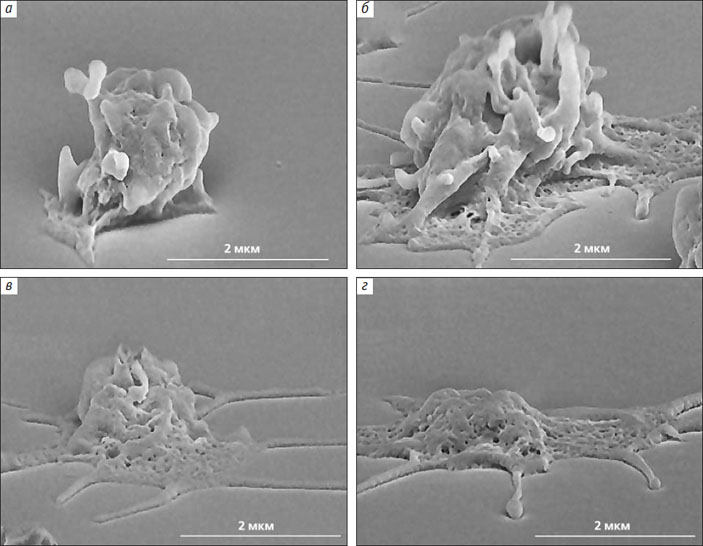
Интересно, что цитоскелет — структура динамичная, благодаря которой тромбоцит может не только менять форму, но и отращивать «щупальца» (филоподии). С их помощью он распластывается по поверхности поврежденного сосуда (рис. 5) и легче прилепляется к другим тромбоцитам (рис. 6). Относительно недавно было обнаружено, что при сильной активации (одним тромбином или вместе с коллагеном) тромбоциты разделяются на две группы (субпопуляции), сильно отличающиеся по свойствам и даже форме, что предполагает принципиально разную организацию в них цитоскелета. Одни из них («обычные» активированные) имеют вид амеб — комков с филоподиями, другие (прокоагулянтные, так как на внешней поверхности их мембраны много фосфатидилсерина) — шариков без «щупалец». Полученные в нашей лаборатории данные свидетельствуют о том, что некоторые мембранные рецепторы, отвечающие за связывание клеток с поверхностью и друг с другом, у тромбоцитов из двух субпопуляций неодинаково прикреплены к цитоскелету. А это значит, что они могут по-разному взаимодействовать с поврежденной сосудистой стенкой и друг с другом в формирующемся тромбе.
Последовательность процессов при перестройке цитоскелета тромбоцита вообще изучена пока достаточно мало, а тут уже новый вопрос: зачем одним клеткам при активации становиться «амебами», а другим — «шариками»?
Адгезия и агрегация
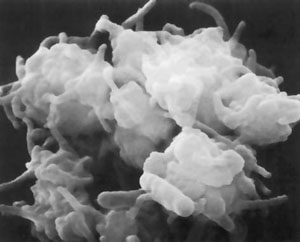
Чтобы залатать неисправный сосуд и предотвратить кровопотерю, тромбоцитам нужно прикрепиться к месту «аварии» (адгезия) и друг к другу (агрегация). Первые обнаружившие повреждение клетки прикрепляются к нему и формируют нижний слой тромба. К ним прилепляются новые тромбоциты из потока, и постепенно образуется тромбоцитарный агрегат (рис. 6). Но между клетками в нем остаются промежутки, через которые может просачиваться плазма крови, поэтому она желируется вблизи места повреждения в результате реакций между факторами свертывания. Образующийся гель заполняет промежутки между тромбоцитами и полностью останавливает вытекание крови из раны. Адгезия и агрегация в норме ведут к перекрыванию места «аварии» и предотвращению кровопотери, а при патологических условиях, плохо пока изученных, вызывают формирование тромбов, мешающих нормальному кровотоку в здоровых сосудах. Их тромбирование является причиной многих сердечно-сосудистых заболеваний, в том числе инфарктов и инсультов.
Адгезия происходит за счет связывания специальных рецепторов, гликопротеинов (ГП) VI и Ib и интегрина αIIbβ3 (или ГП IIbIIIa), на мембране тромбоцита с определенными белками на поверхности поврежденного сосуда. Агрегация же происходит за счет ГП Ib и IIbIIIa и представляет собой образование связи между двумя рецепторами посредством растворенного в плазме крови лиганда (от лат. ligare — ‘связывать’; вещество, специфически соединяющееся с рецептором). Гликопротеинам Ib и VI для связывания лигандов не требуется дополнительных условий, в отличие от ГП IIbIIIa, который приобретает такую способность только благодаря своим конформационным изменениям, происходящим после активации тромбоцита. Фибриноген и фактор Виллебранда, основные лиганды интегрина αIIbβ3, обладают симметричной структурой и поэтому взаимодействуют одновременно с двумя рецепторами на соседних активированных тромбоцитах, формируя между ними скрепляющие «мостики» (рис. 4).
Рассмотрим приближенную последовательность событий, происходящих с тромбоцитами при нарушении целостности сосуда. Повреждение эндотелия приводит к выставлению в кровоток коллагена, на который из плазмы крови тут же садятся молекулы фактора Виллебранда. Тромбоциты, приносимые к месту травмы, связываются с ними, а затем с коллагеном через рецепторы ГП Ib и ГП VI соответственно. Это запускает сигнальные процессы, приводящие к активации интегринов αIIbβ3 и к началу формирования тромба. По мере того как клетки склеиваются друг с другом за счет интегринов αIIbβ3, они секретируют тромбоксан А2 и АДФ, которые активируют интегрины αIIbβ3 на проносящихся в потоке тромбоцитах, вовлекая их в растущий тромб.
В нашем организме размеры сосудов и скорости кровотока меняются от аорты с диаметром 2,5 см и средней скоростью потока 48 см/с до мельчайших капилляров диаметром 0,0008 см и скоростью течения крови 0,1 см/с. Тромбоциты обладают уникальной способностью формировать стабильные контакты друг с другом в этом широком диапазоне условий. А удается им это благодаря тому, что при разных условиях вклад различных рецепторов, осуществляющих прикрепление тромбоцитов к стенке сосуда или друг к другу, сильно меняется. И когда работа одного рецептора оказывается неэффективной, инициативу подхватывает другой, лучше приспособленный к данным условиям.
Напомним, что традиционной схемой скрепления двух тромбоцитов является образование связей «рецептор на одной клетке — лиганд в плазме — рецептор на другой». Однако недавно нам удалось показать, что существует еще одна схема — «рецептор на одной клетке — лиганд на другой» [5]. На внешней поверхности мембраны прокоагулянтных тромбоцитов непонятным пока образом удерживается большое количество белков α-гранулярного происхождения, в частности фибриноген и фактор Виллебранда. Из-за этой белковой «шубы» такие тромбоциты некоторое время назывались в литературе «укутанными», при этом интегрины αIIbβ3, основные рецепторы агрегации, на них парадоксальным образом неактивны и не могут связывать свои лиганды. В связи с этим долгое время считалось, что прокоагулянтные тромбоциты вообще не могут агрегировать, однако, как мы выяснили, способны слепляться с «обычными» активированными тромбоцитами (но не друг с другом). И происходит это за счет связывания активных интегринов αIIbβ3 на поверхности «обычных» активированных тромбоцитов и лигандов этого рецептора, удерживаемых на поверхности прокоагулянтных тромбоцитов в составе их белковой «шубы».
Сегодня уже достаточно хорошо известно, как запускается и происходит рост тромба, но неясно, как этот процесс останавливается. Почему в норме рост тромба со временем прекращается, не приводя к закупорке сосуда? Вероятно, ответ на этот вопрос кроется в сложном одновременном действии множества факторов, оказывающих влияние на рост тромба, включая локальные условия кровотока и концентрации растворимых агонистов — таких как АДФ, тромбоксан А2 и тромбин.
Итак, прокоагулянтные тромбоциты по сравнению с «обычными» активированными обладают лучшей способностью ускорять плазменный гемостаз и особым механизмом агрегации — могут скрепляться с «обычными» активированными тромбоцитами, но не с себе подобными. Формирование субпопуляций, обладающих уникальными комбинациями свойств, — один из самых интересных и сложных феноменов в науке о тромбоцитах. Экспериментальных данных, накопленных в результате более 15 лет продолжающихся исследований, достаточно, чтобы предполагать, что субпопуляции этих клеток играют разные роли в регуляции роста тромба. Сейчас в нашей и нескольких зарубежных лабораториях ведется активная работа по выявлению (пато)физиологической роли тромбоцитарных субпопуляций и исследование их пространственного распределения в растущих тромбах. Эти знания позволят разработать новые лекарства, избирательно влияющие на клетки разных субпопуляций. Так мы сможем вмешиваться в регуляцию роста тромба и предотвращать развитие патологических процессов (тромбоза), а там, где это требуется, наоборот, стимулировать нормальный гемостаз.
***
Тромбоциты обеспечивают остановку кровотечения и одновременно играют главную роль в тромбозе. Постепенно все больше вопросов, связанных с этими клетками, находят ответы, но тромбоциты таят в себе еще очень много секретов. Достаточно добавить, что в последние 20 лет было обнаружено их участие в иммунном ответе, воспалении, регенерации тканей, ангиогенезе (образовании новых кровеносных сосудов) и даже развитии опухолей. Дальнейшее изучение тромбоцитов поможет лучше понять протекание многих жизненно важных процессов нашего организма, но в первую очередь станет решающим шагом в победе над тромбозом — основной причиной смертности в развитых странах.
Работа выполнена при поддержке Программы фундаментальных исследований Президиума РАН «Молекулярная и клеточная биология» и Российского фонда фундаментальных исследований (проекты № 12-04-31401, 12-04-31788, 12-04-31873, 12-04-32246, 12-04-33055, 13-04-00401, 14-04-00670).
Литература
1. Ohlmann P., Eckly A., Freund M. et al. ADP induces partial platelet aggregation without shape change and potentiates collagen-induced aggregation in the absence of Galphaq // Blood. 2000. V. 96. № 6. P. 2134–2139.
2. White J. G. Electron microscopy methods for studying platelet structure and function // Platelets and megakaryocytes / Eds J. M. Gibbins, M. P. Mahaut-Smith. Totowa; N. J., 2004. P. 47–63.
3. Fatisson J., Mansouri S., Yacoubet D. et al. Determination of surface-induced platelet activation by applying time-dependency dissipation factor versus frequency using quartz crystal microbalance with dissipation // J. R. Soc. Interface. 2011. V. 8. № 60. P. 988–997.
4. Gerrard J. M., White J. G., Rao G. H. et al. Effects of the lonophore A23187 on the blood platelets II. Influence on ultrastructure // Am. J. Pathol. 1974. V. 77. № 2. P. 151–166.
5. Yakimenko A. O., Verholomova F. Y., Kotova Y. N. et al. Identification of different proaggregatory abilities of activated platelet subpopulations // Biophys. J. 2012. V. 102. № 10. P. 2261–2269.
Подробнее см.: Баландина А. Н., Пантелеев М. А., Атауллаханов Ф. И. Система свертывания крови и ее регуляция // Природа. 2011. № 3. С. 32–38 (PDF, 4 Мб).
Где отмирают Лейкоциты в крови? Тромбоциты? Плазма?
Продолжительность жизни тромбоцитов составляет от 5 до 11 дней. Разрушаются кровяные пластинки в клетках системы макрофагов. лейкоциты—-в селезенке но не все —большинство выполняя свою работу в различых тканях—там и гибнут плазма —отмирает—странный вопрос—фильтруется очищается почками—образуется моча
Значение крови. Кровь — одна из жидких внутренних сред организма. Кровь движется по замкнутой системе кровеносных сосудов и выполняет транспортную функцию. Она приносит к клеткам всех органов питательные вещества и кислород и переносит к органам выделения продукты жизнедеятельности. С участием крови осуществляется гуморальная регуляция функций организма биологически активными веществами. Кровь обеспечивает защитные реакции организма от инфекций. Состав крови. В организме взрослого человека находится около 5 л крови. Кровь — это один из видов соединительной ткани организма. Основную ее часть составляет жидкое межклеточное вещество — плазма. В плазме находятся клетки крови — эритроциты и лейкоциты и кровяные пластинки — тромбоциты (рис. 1), <img src=»//otvet.imgsmail.ru/download/2eb241b9fd25fc432cb0cd8829f4e279_i-450.jpg» >Рис 1. Форменные элементы крови человека в мазке. 1 – эритроцит, 2-10 — лейкоциты, 11 – тромбоциты (кровяные пластинки) . которые образуются из клеток красного костного мозга. Их созревание, накапливание и разрушение происходит в других органах (рис. 2). <img src=»//otvet.imgsmail.ru/download/2eb241b9fd25fc432cb0cd8829f4e279_i-451.jpg» >Рис 2. Органы кроветворения. Плазма крови – жидкая часть крови. В плазме находятся форменные элементы крови (эритроциты, лейкоциты, тромбоциты) . Изменения в составе плазмы имеют диагностическое значение при различных заболеваниях. Из плазмы готовят лекарственные препараты. Эритроциты – красные клетки крови животных и человека, содержащие гемоглобин. Переносят кислород от органов дыхания к тканям и диоксид углерода от тканей к органам дыхания. Образуются в костном мозге. У млекопитающих эритроциты не содержат ядра. Лейкоциты – бесцветные клетки крови человека и животных. Образуются в органах кроветворения. Все типы лейкоцитов имеют ядро и способны к движению. В организме поглощают бактерии и отмершие клетки, вырабатывают антитела. Тромбоциты – клетки крови, содержащие ядро у всех позвоночных, кроме млекопитающих. Участвуют в свёртываемости крови. Безъядерные тромбоциты млекопитающих и человека называют кровяными пластинками. Существует мнение, что клетки лейкоцитов и эритроцитов в физиологических условиях погибают в легких, печени и селезенке, тромбоциты у здорового человека также разрушаются главным образом в печени и селезенке. Вероятно, селезенка принимает и другое участие в обмене тромбоцитов, так как после удаления селезенки по поводу повреждения этого органа наступает тромбоцитоз. . Селезенка не только разрушает, но и накапливает форменные элементы крови — эритроциты, лейкоциты, тромбоциты. В частности, в ней содержится от 30 до 50% и более циркулирующих тромбоцитов, которые при необходимости могут быть выброшены в периферическое русло. При патологических состояниях скопление их иногда столь велико, что может привести к тромбоцитопении.
что это такое, где образуются и сколько живут, их функции
В основе поддержания крови в жидком состоянии лежит противодействие двух систем: свертывания и противосвертывания. Эти мощные физиологические механизмы обеспечивают то, что медики называют коагуляционным гомеостазом. В рамках данной статьи речь пойдет о системе свертывания, а точнее об одном из самых мощных ее звеньев, которым являются тромбоциты. Ведь их значение для организма невозможно преувеличить.
Что это за клетки и каков их жизненный цикл
Кровь человека представлена жидкой частью, которую называют плазмой, и форменными элементами – клетками, которые выполняют все функции этой жидкой внутренней среды организма. Представителями компонентов второй составляющей являются тромбоциты. Они представляют собой мелкие клетки (по диаметру в более, чем 10 раз меньше волоса) сферической формы. Свой жизненный цикл тромбоциты в крови начинают из костного мозга, где происходит их выработка. Общей тканью предшественником является миелоидная, дающая начало не только данным кровяным тельцам, но и лейкоцитам с эритроцитами. Поэтому очень часто состояние уровень тромбоцитов коррелирует с функционированием этих клеток крови.
Непосредственным предшественником тромбоцита можно назвать мегакариоцит. По мере созревания в течении чуть более недели происходит его превращение в зрелый тромбоцит. Из костного мозга в системный кровоток постоянно выбрасываются, как зрелые, функционально способные тромбоциты, так и несозревшие. От интенсивности выхода вторых зависит то, насколько тромбоцитарные факторы будут способны к поддержанию постоянства свертываемости крови. Поэтому бывает такое состояние, при котором в анализах крови регистрируется нормальное или даже увеличенное количество тромбоцитов, но большинство из них не обладают физиологическими способностями, позволяющими выполнять предназначенных природой задач.
Функциональная полноценность тромбоцитов после их выхода в кровеносное русло сохраняется в течение не более 11 дней. По мере старения теряется их способность к подвижности и выработке специфических веществ, позволяющих им мобильно передвигаться по сосудам микроциркуляторного русла, где они живут все это время. Самыми мощными их скоплениями становится ретикулярная ткань – селезенка и печень. Большинство старых тромбоцитов задерживается именно в селезенке, которая относится к основному концентратору всех клеточных элементов крови. Среди них много макрофагов, осуществляющих процесс непосредственного разрушения тромбоцитов. Все те белки и вещества, которые образуются в результате этого процесса, расходуются организмом в качестве строительного материала для новых тромбоцитов или других клеток.
Важно помнить! Норма количества тромбоцитов всех видов в составе крови, циркулирующей в тканях, составляет от 150 до 400 тысяч клеток в одном миллилитре (150-400 гиг/л). Эта цифра представляет собой усредненный показатель. В зависимости от пола, возраста и состояния организма существуют более специфические показатели нормы. Это обязательно должно учитываться при оценке уровня тромбоцитов, особенно у особей женского пола!Физиологическая роль для организма
Кровь человека, помимо поддержания жидкого состояния, должна обладать достаточной вязкостью. Это нужно для того, чтобы создавать своеобразный буфер, который способен удержать все свои клеточные компоненты в просвете сосудистого русла. И делают это тромбоциты. Эти клетки находятся в состоянии повышенной готовности и способны мгновенно выполнять свои функции в случае наличия малейшей угрозы кровопотери.
За счет своих мелких размеров и большого количества тромбоцитарных клеток крови по сравнению с другими клеточными элементами, больше всего их скапливается возле стенки сосудов. Изнутри она выстлана специфической оболочкой, именуемой интимой, образованной клетками эндотелия. Пока в организме не происходит никаких патологических изменений тромбоциты, имеющие отрицательный заряд клеточной мембраны, отталкиваются от эндотелия. Это позволяет крови беспрепятственно циркулировать по ветвящимся сосудам.
Тромбоциты первыми реагируют на повреждение сосудистой стенки
Активация тромбоцитов происходит при:
- Минимальных изменениях со стороны эндотелия сосудов, что сможет стать следствием атеросклероза или воспалительного процесса;
- Появлении в крови коллагена, который выделяется при травме или пересечении сосудистой стенки;
- Избыточной выработке печенью факторов свертывания крови;
- Любых тяжелых заболеваниях и критических состояниях, сопровождающихся обезвоживанием организма и выраженной интоксикацией.
При этом запускается цепочка физиологических реакций и механизмов, в ходе которых эти клетки пытаются не только возобновить целостность сосудов, но и поддержать кровь в таком состоянии, чтобы она смогла циркулировать в условиях повышенной вязкости. Это и есть основная функция тромбоцитов. Цепочка трансформации и активизации представлена так:
- Изменение заряда мембраны тромбоцитов. Это приводит к тому, что они начинают адгезироваться (прилипать) к месту повреждения сосудистой стенки и друг у другу;
- Изменение формы тромбоцитов. Мгновенно происходит появление множественных специфических отростков на поверхности тромбоцитов, за счет которых они приобретают хаотичное строение и звездчатую форму. Такая особенность увеличивает площадь клетки;
- Скопление клеток в патологических участках сосудистого русла. При этом образуются конгломераты, позволяющие создать сетчатый каркас, на который сможет оседать фибриноген. Этот фактор свертывания является окончательным звеном свертывающей системы, взаимодействуя с тромбоцитарной пробкой, образует полноценный тромб или сгусток;
- Активация взаимопревращений факторов свертывания. Направлена на ускорение образования фибриногена и его превращений из малоактивной формы в активную;
- Стимуляция синтеза тромбоцитов костным мозгом и различных веществ сосудистой стенкой, что ускорит процесс свертывания крови и остановит имеющуюся кровопотерю.
Важно помнить! Тромбоциты отвечают за первый этап в запуске свертывания крови. Если их количество превышает норму, даже в условиях отсутствия провоцирующих свертывание факторов, существует угроза спонтанного запуска образования тромбов в просвете сосудов. В случае низкого содержания тромбоцитов резко повышается риск просачивания клеточных элементов крови через сосудистую стенку, особенно в условиях снижения ее прочности. Это проявляется повышенной склонностью к кровотечениям и спонтанному образованию гематом!
Согласно данным последних исследований ведущих гематологических клиник, зафиксирована весомая роль тромбоцитов в стимуляции заживления ран. Подобный физиологический феномен связан с выработкой ими специфических факторов роста, оказывающих потенцирующее влияние на размножение клеток в очаге поражения.
Анализ крови из пальца – достоверный метод определения состояния тромбоцитов
Как можно определить количество тромбоцитов
Для исследования состояния тромбоцитарного звена и определения, сколько клеточных элементов содержится в крови, достаточно обычных рутинных методов, которым является общий анализ крови. Провести его можно при помощи стандартного изучения под микроскопом или новейшими автоматическими анализаторами. В любом случае, для исследования нужна кровь из пальца (капиллярная).
Обычно при оценке результатов анализа, проведенного микроскопическим исследованием, вопросов не возникает, так как в нем в понятном стиле изложены все показатели, в том числе тромбоциты. Сложность может быть лишь с оценкой результатов автоматизированного анализа. Тромбоциты в нем обозначаются аббревиатурой из латинских букв PLT. Рядом с ней указаны цифры, которые и соответствуют полученному результату. При наличии отклонений от нормы в обязательном порядке назначается повторный анализ крови.
Тромбоциты относятся к очень важным элементам крови, исследование состояния которых не представляет больших трудностей. Но оценку результатов анализов и, тем более, правильную их интерпретацию в случае наличия отклонений от нормы должен проводить исключительно знающий специалист.
Тромбоцит крови и его враги. Часть 2 — ПолонСил.ру — социальная сеть здоровья
Часть 2. Симптомы тромбоцитопении и её причины
Как будет проявляться тромбоцитопения (или функциональная неполноценность тромбоцитов при их нормальном количестве)?
Симптомы.
Возникают кровоизлияния на коже и слизистых оболочках. На коже они могут быть мелкоточечными и более крупными, бывают разной величины, разного срока давности (судя по цвету) и не симметричные.
Появляются при самых незначительных воздействиях и даже во сне. Чаще они наблюдаются на передних поверхностях конечностей и туловища, бывают на лице, губах, слизистой оболочке рта.А вот на фотографии типичная мелкоточечная сыпь.
Появляется кровоточивость из дёсен.
Часты носовые и маточные кровотечения. Возникают синяки — кровоизлияния в месте инъекций.
Вторично развивается анемия (малокровие). И поэтому появляются бледность, слабость, головокружения до обмороков, сердцебиения.
(На фотографии мальчик очень бледненький с синевой под глазами. – Это явные признаки того, что кровотечение не первое, и уже развилась анемия.)
Почему всё это происходит?
Причины тромбоцитопении (или нарушения функции тромбоцитов при достаточном их количестве).
Тромбоцитопении и нарушения функции тромбоцитов по происхождению бывают первичными и вторичными.
Первичные — отдельные заболевания, связанные с патологией изначально именно тромбоцитов. Они могут быть связаны с наследственными дефектами тромбоцитов, это могут быть заболевания системы крови или иммунные поражения тромбоцитов при каких-то неблагоприятных внешних воздействиях.
Вторичные — тромбоцитопенические синдромы (синдром – устойчивый комплекс симптомов, который может присутствовать при разных заболеваниях), всегда связанны с каким-то серьёзным заболеванием не системы крови.
По механизмам тромбоцитопении (и первичные, и вторичные) бывают следующие.
1. Тромбоцитов недостаточно производится в костном мозге.
2. Их распределение в организме не рационально – слишком много депонируется в селезёнке.
3. Ускорена убыль – слишком много потребляется для остановки кровотечений или разрушается в селезёнке.
Всё это приходится учитывать, потому что при разных механизмах необходимо разное лечение.
Количество тромбоцитов может падать при следующих заболеваниях (вторичные тромбоцитопении, когда для подъёма числа тромбоцитов, надо лечить и основное заболевание).
Сердечно-сосудистая патология. Если нарушается внутренняя выстилка сердца и сосудов (ревматизм, атеросклероз).
Нарушение функций печени или почек при их хронических заболеваниях.
Системная красная волчанка. Ревматоидный артрит.
Нарушения функции щитовидной железы: гипотиреоз и гипертиреоз.
Хронические инфекции.
ДВС-синдром.
А теперь о первичных тромбоцитопениях.
Иммунная тромбоцитопения, острая, с соответствующей симптоматикой кровоточивости бывает у детей через 2 недели после ОРВИ. Возникает картина тромбоцитопенической пурпуры – мелкие точечные кровоизлияния, кровоточивость дёсен, бывают почечные кровотечения. Чаще такое состояние проходит само за 2 -6 месяцев. Бывает это и после коревой краснухи, и после других острых инфекционных детских заболеваний.
Объясняется состояние тем, что на тромбоцитах фиксируются антитела – иммуноглобулины класса G. И такие тромбоциты разрушаются макрофагами. Т.е. это аутоиммунный процесс – агрессия иммунной системы против собственных клеток.
А вот у взрослых причины подобной хронической или рецидивирующей тромбоцитопении зачастую не ясны. Здесь причину бывает установить сложнее. Иногда и не удаётся. Здесь много неясностей, существует несколько гипотез, что говорит о том, что пока наука от четкого ответа на все вопросы далека.
Перечислю лекарства, приём которых может вызвать тромбоцитопению (иммунную по механизму).
Кстати, длинный список таких препаратов ниже ещё раз показывает, что употреблять фармацевтические препараты надо только в ситуациях действительной необходимости. А не глотать горстями на всякий случай.
Если у Вас появилась повышенная кровоточивость или снизились тромбоциты крови, а вы принимаете эти препараты, надо решать вопрос об их отмене.
Чаще это сульфаниламиды, пенициллин, ампициллин, окситетрациклин, рифампицин, цефалоспорины, снотворные из группы барбитуратов, аспирин, индометацин, ПАСК, изониазид, гипотиазид, фуросемид, циметидин, гепарин, альфа-метилдопа, хлорпропамид.
Несколько реже вызывает тромбоцитопению ряд других препаратов. Это нитроглицерин, антипирин, гентомицин, линкомицин, левамизол, лидокаин, стрептомицин, метициллин, ибупрофен.
При приёме любого из этих препаратов тромбоциты могут снижаться. Но при их отмене, если, конечно, причиной был этот препарат, тромбоциты быстро повышаются.
Зачем я так подробно перечислила эти лекарства? – Потому что этот список ваш участковый врач может и не помнить или не знать. Желательно самому помнить, почему у вас вдруг, например, могли начаться кровотечения из носа.
И ещё. При понижении числа тромбоцитов в крови запрещается употребление спиртного, уксуса, консервированных продуктов вообще, но особенно с уксусом и ацетилсалициловой кислотой (аспирином), специй типа перца.
О лечении писать не буду сознательно. Лечиться самостоятельно нельзя.
Что полезно при тромбоцитопении? — Всё, что ускоряет размножение и созревание мегакариоцитов, образование и выход в кровь тромбоцитов, и то, что уменьшает опасность кровотечений, а, значит, расход тромбоцитов.
Для увеличения поступления тромбоцитов в кровь — это молоки, рыбья икра (но всё в жаренном, а не соленом виде), орехи, например, миндаль, витамин А.
Для предупреждения кровотечений – по возможности избегать травм, петрушка, черноплодная рябина, черная смородина, крапива, всё содержащее в большом количестве кальций (творог, сыр) витамины К и С.
Рекомендация для женщин. При менструациях, если кровотечения сильные, – препараты пастушьей сумки и экстракт водяного перца.
