ТЕМПЕРАТУРНАЯ РЕАКЦИЯ ПРИ ОСТРЫХ НАРУШЕНИЯХ МОЗГОВОГО КРОВООБРАЩЕНИЯ | Садчиков
1. Гусев Е.И., Скворцова В.И., Стаховская Л.В. Проблема инсульта в Российской Федерации: время активных действий. Журн. неврологии и психиатрии им. С.С.Корсакова. 2007; 107 (8): 1–11. PMID: 18693348
2. Суслина З.А., Варакин Ю.Я., Верещагин Н.В. Сосудистые заболевания головного мозга: Эпидемиология. Основы профилактики. М.: МЕДпресс-Информ; 2009.
3. Saini M., Saqqur M., Kamruzzaman A., Lees K.R., Shuaib A.; VISTA Investigators. Effect of hyperthermia on prognosis after acute ischemic stroke. Stroke. 2009; 40 (9): 3051—3059. http://dx.doi.org/10.1161/STROKEAHA.109.556134. PMID: 19644066
4.
5. Hajat C., Hajat S., Sharma P. Effect of poststroke pyrexia on stroke outcome: a meta-analysis of studies in patients. Stroke. 2000; 31 (2): 410—414. http://dx.doi.org/10.1161/01.STR.31.2.410. PMID: 10657414
6. Wartenberg K.E., Schmidt J.M., Claassen J., Temes R.E., Frontera J.A., Ostapkovich N., Parra A., Connolly E.S., Mayer S.A. Impact of medial complication on outcome after subarachnoid hemorrhage. Crit. Care Med. 2006; 34 (3): 617—623. PMID: 16521258
7. Seo W.K., Yu S.W., Kim J.H., Park K.W., Koh S.B.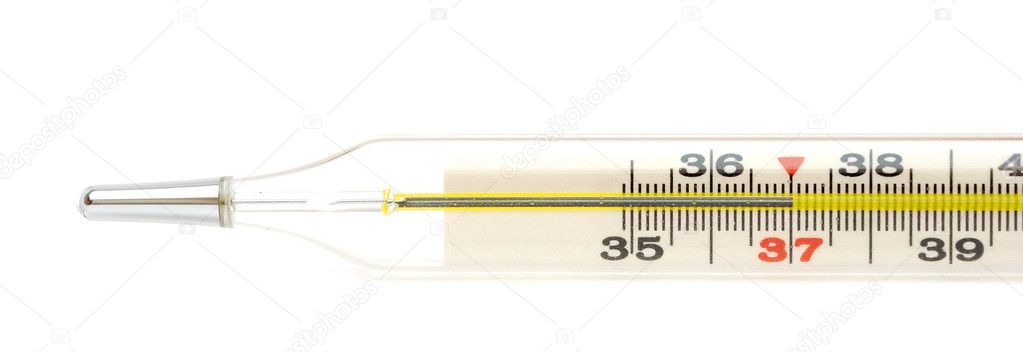
8. Phipps M.S., Desai R.A., Wira C., Bravata D.M. Epidemiology and outcomes of fever burden among patients with acute ischemic stroke. Stroke. 2011; 42 (12): 3357—3362. http://dx.doi.org/10.1161/STROKEAHA.111.621425. PMID: 21980196
9. Greer D.M., Funk S.E., Reaven N.L., Ouzounelli M., Uman G.C. Impact of fever on outcome in patients with stroke and neurologic injury. A comprehensive meta-analysis. Stroke. 2008; 39 (11): 3029—3035. http://dx.doi.org/10. 1161/STROKEAHA.108.521583. PMID: 18723420
10. Stocchetti N., Protti A., Lattuada M., Magnoni S., Longhi L. , Ghisoni L., Egidi M., Zanier E.R. Impact of pyrexia on neurochemistry and cerebral oxygenation after acute brain injury. J. Neurol. Neursurg. Psychiatry. 2005; 76 (8): 1135—1139. http://dx.doi.org/10.1136/jnnp.2004. 041269. PMID: 16024893
, Ghisoni L., Egidi M., Zanier E.R. Impact of pyrexia on neurochemistry and cerebral oxygenation after acute brain injury. J. Neurol. Neursurg. Psychiatry. 2005; 76 (8): 1135—1139. http://dx.doi.org/10.1136/jnnp.2004. 041269. PMID: 16024893
11. Мухин Н.А., Моисеев В.С. Пропедевтика внутренних болезней. М.: ГЭОТАР Медиа; 2004.
Инсульт мозговой › Болезни › ДокторПитер.ру
Инсульт мозговой – острое нарушение мозгового кровообращения.
Признаки
Острые поражения сосудов мозга подразделяют на пять групп:
- преходящие нарушения мозгового кровообращения;
- инфаркт мозга;
- эмболия сосудов мозга;
- кровоизлияние в мозг;
- субарахноидальное кровоизлияние.
Выделяют также так называемый малый инсульт, или инсульт с обратимым неврологическим дефицитом, при котором все очаговые симптомы исчезают через 3 недели.
Преходящие нарушения мозгового кровообращения – остро возникающие расстройства кровообращения, при которых очаговые и общемозговые симптомы держатся не более 24 часов. Непосредственной причиной их является микроэмболия скоплениями кристаллов холестерина, фрагментами атероматозных бляшек или конгломератами тромбоцитов. Микроэмболы, заносимые током крови в мелкие сосуды мозга, вызывают регионарный спазм. Реже преходящие нарушения обусловлены микрогеморрагиями. Дисциркуляция в бассейне сонных артерий проявляется онемением половины лица, гемипарестезиями или гемипарезом. Недостаточность кровотока в вертебробазилярной системе, встречающаяся много чаще, проявляется головокружением, рвотой и неустойчивостью при ходьбе, изредка очаговыми знаками. Частым вариантом преходящих цереброваскулярных расстройств является гипертонический церебральный криз, при котором преобладают общемозговые и вегетативные симптомы: головная боль, тошнота, рвота, звон и шум в ушах, головокружение, потливость, гиперемия лица.
Инфаркт мозга (тромбоз по старым классификациям) характеризуется наличием в анамнезе транзисторных ишемических атак, постепенным (в течение нескольких часов) формированием очаговых знаков, сохранностью сознания, отсутствием или малой выраженностью общемозговых симптомов, отсутствием крови в цереброспинальной жидкости.
Однако при обширных инфарктах общемозговые симптомы могут не уступать таковым при кровоизлиянии в мозг. «Мерцание» очаговых симптомов перед окончательным развитием очагового выпадения или «ступенеобразное» формирование дефекта, наличие шума при аускультации сонной артерии или уменьшение ее пульсации с большой долей вероятности указывают на экстрацеребральный генез ишемии, вызываемой атеросклеротической окклюзией магистральных сосудов шеи (не менее половины всех случаев мозговых инфарктов). Вопреки бытующим представлениям относительно нередко инфаркт мозга развивается на фоне резкого повышения АД.
Эмболия сосудов мозга характеризуется апоплектиформным развитием инсульта, нередко потерей сознания и наличием у большинства больных ревматической митральной болезни, реже недавно перенесенного инфаркта миокарда или пролапса митрального клапана (эхокардиография). «Парадоксальная эмболия» – инсульт при врожденном незаращении межпредсердной перегородки, обусловливающем попадание в мозговые сосуды эмболов из тромбированных вен нижних конечностей. Инфаркт, возникающий вследствие эмболии мозгового сосуда, может носить как ишемический, так и геморрагический характер и широко варьирует в размерах. У некоторых больных с эмболическим инсультом наблюдается стадия предвестников («инсульт в ходу»): за несколько часов (реже дней) появляются локальные или диффузные головные боли, а иногда и преходящие очаговые симптомы. У 5 — 10 % больных отмечаются повторные эмболии, в том числе других органов. В связи с этим обстоятельством встает вопрос о хирургической коррекции порока и удалении тромботических масс из полостей сердца в каждом случае инсульта при ревматическом пороке сердца.
«Парадоксальная эмболия» – инсульт при врожденном незаращении межпредсердной перегородки, обусловливающем попадание в мозговые сосуды эмболов из тромбированных вен нижних конечностей. Инфаркт, возникающий вследствие эмболии мозгового сосуда, может носить как ишемический, так и геморрагический характер и широко варьирует в размерах. У некоторых больных с эмболическим инсультом наблюдается стадия предвестников («инсульт в ходу»): за несколько часов (реже дней) появляются локальные или диффузные головные боли, а иногда и преходящие очаговые симптомы. У 5 — 10 % больных отмечаются повторные эмболии, в том числе других органов. В связи с этим обстоятельством встает вопрос о хирургической коррекции порока и удалении тромботических масс из полостей сердца в каждом случае инсульта при ревматическом пороке сердца.
Кровоизлияние в мозг в типичных случаях характеризуется апоплектиформным появлением очаговых симптомов, развитием коматозного состояния и примесью крови к цереброспинальной жидкости.

Субарахноидальное кровоизлияние обычно (80 % случаев) обусловлено разрывом интракраниальных аневризм, как правило, локализующихся в области артериального круга большого мозга (вилизиева круга), реже их причиной служат гипертоническая болезнь, геморрагические синдромы. В клинической картине таких инсультов преобладает пароксизмально возникающий симптомокомплекс раздражения мозговых оболочек: головная боль, рвота, ригидность мышц затылка, симптом Кернига, нередко психомоторное возбуждение. Иногда возникает судорожный припадок. На 2-3-й день болезни повышается температура. Базальное расположение аневризм — основного источника кровотечения — объясняет частое поражение краниальных нервов, чаще глазодвигательных. Часто нарушено сознание. Приблизительно у 1/3 больных возникает (обычно на 2-3-й день болезни) спазм отдельных интракраниальных сосудов. Стойкий спазм сосудов приводит к ишемическим очагам размягчения, в частности в стволе мозга. Уже в первые часы кровоизлияния на глазном дне можно обнаружить кровоизлияния в сетчатку или застойные диски.

Описание
В большинстве случаев инсульты являются осложнением гипертонической болезни и атеросклероза, реже они обусловлены болезнями клапанного аппарата сердца, инфарктом миокарда, врожденными аномалиями сосудов мозга, геморрагическими синдромами и артериитами. Приблизительно у 90 % больных с инсультом обнаруживают те или иные формы поражения сердца с симптомами сердечно-сосудистой недостаточности. Исключение составляют лишь некоторые варианты геморрагических инсультов, например, при разрыве аневризмы у людей молодого возраста.
Диагностика
Исследования крови и мочи в острейшей стадии инсульта обязательны. Однако только обнаружение значительного лейкоцитоза в первый день инсульта может служить косвенным признаком геморрагии. Рентгеноскопия грудной клетки весьма важна для обнаружения гипертрофии левого желудочка сердца как индикатора длительно существующей артериальной гипертензии. Весьма желательно и краниографическое исследование, так как при падении в момент инсульта больной может получить серьезную черепно-мозговую травму. Надо считать правилом исследование цереброспинальной жидкости у всех больных с острым нарушением мозгового кровообращения, поступивших в стационар. Противопоказания к пункции в острейшей стадии инсульта возникают относительно нечасто. От люмбальной пункции следует отказаться при агональном состоянии, некупируемой левожелудочковой недостаточности с отеком легкого и признаками мозговой грыжи. Быстрое снижение давления цереброспинальной жидкости по мере ее извлечения может служить указанием на тампонирование большого затылочного отверстия смещающимися миндалинами мозжечка. В подобной ситуации извлечение жидкости следует немедленно прекратить. Ни один из современных способов оценки гемокоагуляции (в том числе протромбиновый индекс и развернутая коагулограмма) не дает никакой информации о характере инсульта.
Надо считать правилом исследование цереброспинальной жидкости у всех больных с острым нарушением мозгового кровообращения, поступивших в стационар. Противопоказания к пункции в острейшей стадии инсульта возникают относительно нечасто. От люмбальной пункции следует отказаться при агональном состоянии, некупируемой левожелудочковой недостаточности с отеком легкого и признаками мозговой грыжи. Быстрое снижение давления цереброспинальной жидкости по мере ее извлечения может служить указанием на тампонирование большого затылочного отверстия смещающимися миндалинами мозжечка. В подобной ситуации извлечение жидкости следует немедленно прекратить. Ни один из современных способов оценки гемокоагуляции (в том числе протромбиновый индекс и развернутая коагулограмма) не дает никакой информации о характере инсульта.
Дифференциальный диагноз мозгового инсульта нередко требует исключения воспалительного или опухолевого поражения мозга. При остром развитии оболочечного синдрома обнаружение крови в цереброспинальной жидкости позволяет уверенно отличить оболочечное кровоизлияние от менингита. Следует лишь иметь в виду возможность получения кровянистой жидкости и при менингококковом менингите, но цитограмма резко отличается и в этих случаях (тысячи нейтрофилов при менингите). Инсультообразно протекает кровоизлияние в опухоль, однако обычно при опухоли мозга удается выяснить, что острому периоду предшествовали нарастающая головная боль и очаговые симптомы. Особенно сложными являются случаи подострого (иногда в течение нескольких суток) развития инсульта. Существенную помощь в диагностике оказывает степень смещения срединных структур на эхоэнцефалограмме: крайние степени смещения, как правило, типичны для объемных процессов. Решающее значение во всех сомнительных случаях имеет компьютерная томография.
Следует лишь иметь в виду возможность получения кровянистой жидкости и при менингококковом менингите, но цитограмма резко отличается и в этих случаях (тысячи нейтрофилов при менингите). Инсультообразно протекает кровоизлияние в опухоль, однако обычно при опухоли мозга удается выяснить, что острому периоду предшествовали нарастающая головная боль и очаговые симптомы. Особенно сложными являются случаи подострого (иногда в течение нескольких суток) развития инсульта. Существенную помощь в диагностике оказывает степень смещения срединных структур на эхоэнцефалограмме: крайние степени смещения, как правило, типичны для объемных процессов. Решающее значение во всех сомнительных случаях имеет компьютерная томография.
Лечение
Больничные условия резко расширяют диапазон терапевтических возможностей и обеспечивают постоянный контроль за состоянием больного, поэтому следует помещать в стационар большинство больных с мозговым инсультом. Противопоказаниями к перевозке в стационар являются грубые нарушения дыхания и сердечно-сосудистой деятельности, а также предагональное состояние.
Установить характер инсульта в первые часы болезни часто невозможно, поэтому лечебные мероприятия должны быть направлены на нормализацию дыхания, сердечно-сосудистой деятельности, гомеостаза и профилактику пневмоний, тромбоэмболии, пролежней. Лекарственная стимуляция дыхательного центра при мозговом инсульте нецелесообразна. Повышенное АД следует снижать до привычных для больного цифр, а не до стандартных показателей нормы. При острой гипотонической реакции (коллапс) применяют гипертензизные средства и внутривенное струйное или капельное введение жидкости. Важное место в лечении инсульта занимает борьба с отеком мозга. Выраженным противоотечным действием обладают все диуретические средства. Мощным эффектом обладает назначаемый внутрь глицерин, разовую дозу которого определяют из расчета 1 г/кг. С первых дней при тяжелом инсульте необходимо назначение антибиотиков для профилактики пневмонии. При гипертермии применяют пузырь с холодной водой или льдом и т. п. В случаях выраженного психомоторного возбуждения наиболее целесообразно парентеральное применение седативных препаратов.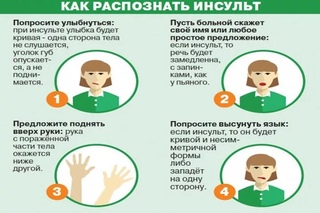 При развитии сердечно-сосудистой недостаточности и связанных с нею расстройств циркуляции большинство препаратов необходимо вводить внутривенно, а не подкожно или внутримышечно. Важную роль в остром и особенно восстановительном периоде инсульта играет борьба с гиподинамиай; больного уже с первых суток каждые 2 ч нужно поворачивать в постели с целью профилактики пневмонии и пролежней. Существенное значение имеют туалет полости рта (удаление съемных протезов!), уход за кожей и высококалорийная и легкоусвояемая пища. При задержке стула назначают слабительные средства, при задержке мочи — катетеризацию.
При развитии сердечно-сосудистой недостаточности и связанных с нею расстройств циркуляции большинство препаратов необходимо вводить внутривенно, а не подкожно или внутримышечно. Важную роль в остром и особенно восстановительном периоде инсульта играет борьба с гиподинамиай; больного уже с первых суток каждые 2 ч нужно поворачивать в постели с целью профилактики пневмонии и пролежней. Существенное значение имеют туалет полости рта (удаление съемных протезов!), уход за кожей и высококалорийная и легкоусвояемая пища. При задержке стула назначают слабительные средства, при задержке мочи — катетеризацию.
Вопрос о сроках активизации решается индивидуально. При геморрагических и эмболических инсультах длительность строгого постельного режима не должна быть менее 3 недель. Напротив, при благоприятном течении неэмболических инфарктов и преходящих нарушений мозгового кровообращения больных можно осторожно сажать уже через несколько дней после инсульта. Особенно плохо переносят гиподинамию пожилые люди; в случае длительного постельного режима их последующая реабилитация крайне осложняется из-за декомпенсации вестибулярного аппарата. Восстановительную гимнастику и особенно массаж при удовлетворительном состоянии больного можно начинать уже в первые дни болезни. Следует соотносить объем нагрузок с тяжестью инсульта и состоянием сердечно-сосудистой системы.
Восстановительную гимнастику и особенно массаж при удовлетворительном состоянии больного можно начинать уже в первые дни болезни. Следует соотносить объем нагрузок с тяжестью инсульта и состоянием сердечно-сосудистой системы.
© Большая медицинская энциклопедия
Возможности и перспективы гипотермии в лечении ишемического инсульта | Фартаков
В Российской Федерации показатель заболеваемости и смертности от инсульта один из самых высоких в мире. Для лечения ишемического инсульта используют два метода: тромболизис и тромбэкстракцию. Однако, несмотря на эффективность, эти методы имеют ограниченное применение вследствие строгих показаний и противопоказаний. В связи с этим поиск новых методов лечения ишемического инсульта, которые могут быть эффективны как при самостоятельном применении, так и в качестве дополнения к уже существующим, актуальная задача. Целью работы является обзор мировых исследований, посвященных применению гипотермии при ишемическом инсульте. Гипотермия обладает доказанным нейропротективным действием при ишемии мозга. В данном контексте интерес представляет интракаротидная селективная церебральная гипотермия, которая, согласно ряду доклинических исследований, значительно уменьшает объем инфаркта мозга после ишемического инсульта. Преимуществами этого метода являются быстрое достижение целевой температуры, направленное влияние на головной мозг и минимальное влияние на системную температуру. Таким образом, интракаротидная селективная церебральная гипотермия является перспективным методом лечения ишемического инсульта и заслуживает дальнейшего изучения. В связи с этим авторы решили провести доклиническое исследование, посвященное этой тематике.
Гипотермия обладает доказанным нейропротективным действием при ишемии мозга. В данном контексте интерес представляет интракаротидная селективная церебральная гипотермия, которая, согласно ряду доклинических исследований, значительно уменьшает объем инфаркта мозга после ишемического инсульта. Преимуществами этого метода являются быстрое достижение целевой температуры, направленное влияние на головной мозг и минимальное влияние на системную температуру. Таким образом, интракаротидная селективная церебральная гипотермия является перспективным методом лечения ишемического инсульта и заслуживает дальнейшего изучения. В связи с этим авторы решили провести доклиническое исследование, посвященное этой тематике.
Введение
В России ежегодно инсульт диагностируется у 433 на 100 000 человек, при этом летальность составляет 179 смертей на 100 000 человек, что является одними из худших показателей в мире [1]. Для сравнения во Франции заболеваемость составляет 166, а летальность 27 на 100 000 человек [1]. Кроме летальности большой проблемой является инвалидизация после перенесенного инсульта. Так, в крупном метаанализе 2014 г. показано, что без применения тромболизиса и тромбэкстракции частота положительного неврологического исхода составляет 28,5% [2]. В свою очередь, остальные 71,5% пациентов умирают или становятся инвалидами. Для лечения острого ишемического инсульта используют два метода: тромболизис и тромбоэкстракцию. Однако тромболизис имеет большое количество противопоказаний, в связи с чем его целесообразно применять лишь у 24% пациентов с ишемическим инсультом [3]. Кроме того, тромболизис имеет ограниченную эффективность. Так, по данным того же метаанализа, применение тромболизиса увеличивало частоту положительного неврологического исхода на 5,2% (33,7% в группе тромболизиса, 28,5% в контрольной группе) [2]. Тромболизис наиболее эффективен в первые 4,5 ч после начала инсульта, по истечении этого времени он незначительно улучшает частоту положительного неврологического исхода, но увеличивает смертность.
Кроме летальности большой проблемой является инвалидизация после перенесенного инсульта. Так, в крупном метаанализе 2014 г. показано, что без применения тромболизиса и тромбэкстракции частота положительного неврологического исхода составляет 28,5% [2]. В свою очередь, остальные 71,5% пациентов умирают или становятся инвалидами. Для лечения острого ишемического инсульта используют два метода: тромболизис и тромбоэкстракцию. Однако тромболизис имеет большое количество противопоказаний, в связи с чем его целесообразно применять лишь у 24% пациентов с ишемическим инсультом [3]. Кроме того, тромболизис имеет ограниченную эффективность. Так, по данным того же метаанализа, применение тромболизиса увеличивало частоту положительного неврологического исхода на 5,2% (33,7% в группе тромболизиса, 28,5% в контрольной группе) [2]. Тромболизис наиболее эффективен в первые 4,5 ч после начала инсульта, по истечении этого времени он незначительно улучшает частоту положительного неврологического исхода, но увеличивает смертность. Таким образом, согласно рекомендациям Американской ассоциации сердца / Американской ассоциации инсульта (англ. American Heart Association / American Stroke Association, AHA / ASA) 2018 г., тромболизис можно применять только в первые 4,5 ч после начала инсульта, что серьезным образом ограничивает его использование [4].
Таким образом, согласно рекомендациям Американской ассоциации сердца / Американской ассоциации инсульта (англ. American Heart Association / American Stroke Association, AHA / ASA) 2018 г., тромболизис можно применять только в первые 4,5 ч после начала инсульта, что серьезным образом ограничивает его использование [4].
Тромбэкстракция является относительно новым методом лечения ишемического инсульта, который показал высокую эффективность по сравнению с тромболизисом. Так, по данным исследования, в котором сравнивали тромбэкстракцию после тромболизиса против только тромболизиса (контрольная группа), показано, что тромбэкстракция связана со значительно большей частотой положительного неврологического исхода (60% в группе тромбэкстракции, 36% в контрольной группе) [5]. Однако тромбэкстракция также имеет противопоказания и рекомендована к использованию в первые 6 ч после начала инсульта, в связи с чем ее применение целесообразно только в 10–15% случаев [6]. С другой стороны, согласно последним исследованиям, тромбэкстракция целесообразна у пациентов с большой зоной пенумбры в течение 16–24 ч после начала инсульта, что увеличивает количество пациентов, подходящих для этой процедуры [7, 8].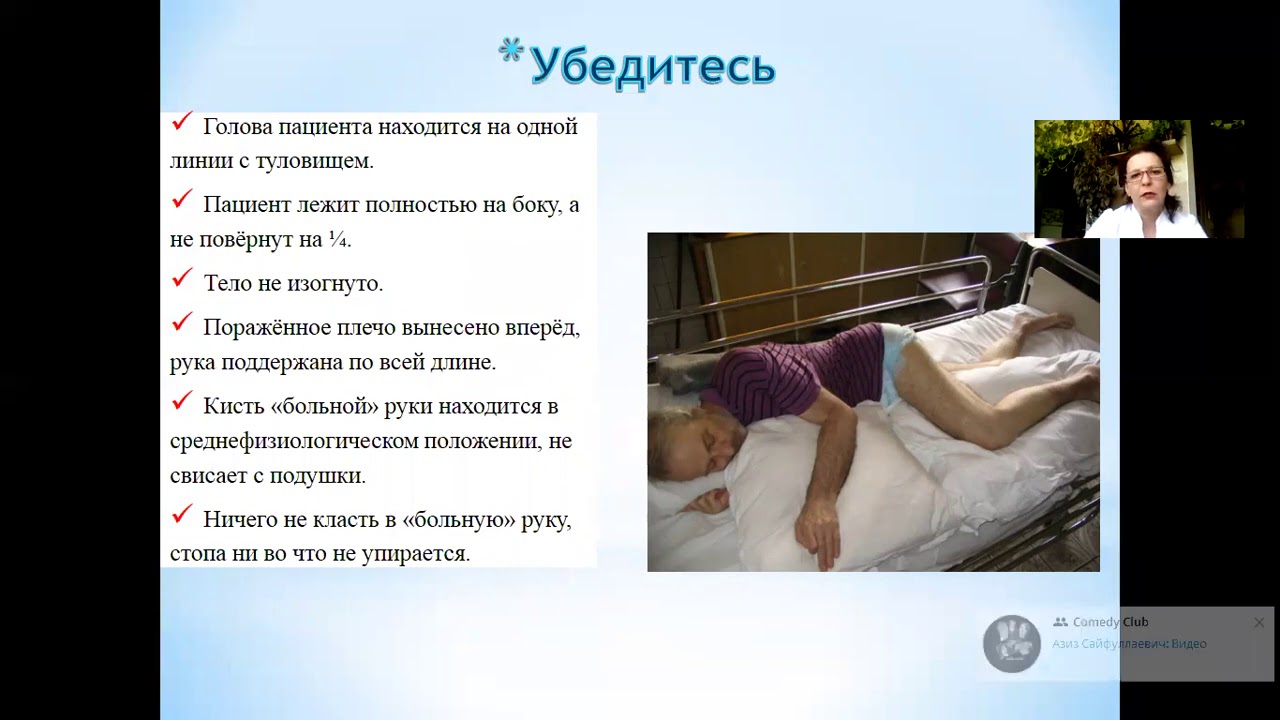 Согласно последним рекомендациям AHA / ASA 2018 г., тромбэкстракция является методом выбора в лечении пациентов с ишемическим инсультом [4]. Главными факторами, которые ограничивают распространение этого метода, являются высокая стоимость лечения и необходимость ангиографической установки. Поиск эффективных и в то же время простых методов лечения острого инсульта, которые будут доступны повсеместно и позволят увеличить эффективность уже существующих методов лечения инсульта, является актуальной и перспективной задачей в медицине.
Согласно последним рекомендациям AHA / ASA 2018 г., тромбэкстракция является методом выбора в лечении пациентов с ишемическим инсультом [4]. Главными факторами, которые ограничивают распространение этого метода, являются высокая стоимость лечения и необходимость ангиографической установки. Поиск эффективных и в то же время простых методов лечения острого инсульта, которые будут доступны повсеместно и позволят увеличить эффективность уже существующих методов лечения инсульта, является актуальной и перспективной задачей в медицине.
Патофизиологические основы инсульта и механизм действия гипотермии
Причиной ишемического инсульта служит остро возникающий дефицит церебрального кровотока, что приводит к появлению неврологических расстройств. В подавляющем большинстве случаев острый дефицит церебрального кровотока происходит в результате острой эмболии церебральных артерий тромботическими массами. Чаще всего тромботические массы возникают в камерах сердца (кардиоэмболический тип инсульта) или на месте атеросклеротических бляшек в сонных артериях или аорте (атероэмболический тип), в которых происходит их дистальная эмболизация. Главными факторами, которые определяют исход для ишемизированной ткани мозга при инсульте, являются интенсивность мозгового кровотока в зоне ишемии и продолжительность ишемии [9]. Согласно исследованиям G. Boysen и W.B. Jennett с соавт., локальное снижение интенсивности мозгового кровотока ниже 50% от нормальных значений приводит к возникновению неврологических нарушений [10, 11]. Кроме того, между интенсивностью мозгового кровотока и продолжительностью ишемии, необходимой для гибели клеток мозга, имеется прямо пропорциональная связь: чем ниже интенсивность мозгового кровотока, тем меньше времени нужно для гибели клеток. Эта зависимость была ярко продемонстрирована в исследовании на приматах, проведенном T.H. Jones с соавт. После двухчасовой окклюзии средней мозговой артерии инфаркт ткани мозга развивался в области, где интенсивность мозгового кровотока равнялась 5 мл/100 г/мин и ниже, в то время как после трехчасовой окклюзии инфаркт развивался в области с интенсивностью кровотока 12 мл/100 г/мин и ниже. При постоянной окклюзии средней мозговой артерии инфаркт развивался в области с интенсивностью кровотока 18 мл/100 г/мин и ниже [12]. В том же 1981 г. J. Astrup с коллегами предложили в ишемизированной ткани выделять зону ишемического ядра с необратимыми повреждениями и зону пенумбры с обратимыми повреждениями [13]. Зона пенумбры — ткань с пограничным значением интенсивности мозгового кровотока и функциональными, но не структурными нарушениями — может либо переходить в зону ишемического ядра, либо после наступления реперфузии возвращаться к нормальному функционированию. Таким образом, спасение зоны пенумбры является главной целью в лечении пациентов c ишемическим инсультом.
Главными факторами, которые определяют исход для ишемизированной ткани мозга при инсульте, являются интенсивность мозгового кровотока в зоне ишемии и продолжительность ишемии [9]. Согласно исследованиям G. Boysen и W.B. Jennett с соавт., локальное снижение интенсивности мозгового кровотока ниже 50% от нормальных значений приводит к возникновению неврологических нарушений [10, 11]. Кроме того, между интенсивностью мозгового кровотока и продолжительностью ишемии, необходимой для гибели клеток мозга, имеется прямо пропорциональная связь: чем ниже интенсивность мозгового кровотока, тем меньше времени нужно для гибели клеток. Эта зависимость была ярко продемонстрирована в исследовании на приматах, проведенном T.H. Jones с соавт. После двухчасовой окклюзии средней мозговой артерии инфаркт ткани мозга развивался в области, где интенсивность мозгового кровотока равнялась 5 мл/100 г/мин и ниже, в то время как после трехчасовой окклюзии инфаркт развивался в области с интенсивностью кровотока 12 мл/100 г/мин и ниже. При постоянной окклюзии средней мозговой артерии инфаркт развивался в области с интенсивностью кровотока 18 мл/100 г/мин и ниже [12]. В том же 1981 г. J. Astrup с коллегами предложили в ишемизированной ткани выделять зону ишемического ядра с необратимыми повреждениями и зону пенумбры с обратимыми повреждениями [13]. Зона пенумбры — ткань с пограничным значением интенсивности мозгового кровотока и функциональными, но не структурными нарушениями — может либо переходить в зону ишемического ядра, либо после наступления реперфузии возвращаться к нормальному функционированию. Таким образом, спасение зоны пенумбры является главной целью в лечении пациентов c ишемическим инсультом.
На клеточном уровне в ишемизированной ткани основную роль играют два процесса: некроз и апоптоз. Некроз является нерегулируемым процессом и развивается вследствие нарушения клеточного гомеостаза, вызванного выраженным снижением энергетического обмена. Этот тип клеточной гибели характерен для ишемического ядра. В ходе некроза нарушается проницаемость клеточной мембраны с развитием внутриклеточного отека, что может приводить к нарушению перфузии окружающих тканей и гибели клеток зоны пенумбры. Апоптоз является программированной клеточной смертью и характерен для клеток зоны пенумбры, которым хватает энергии для выработки ферментов, необходимых для развития апоптоза. Центральная роль в развитии апоптоза принадлежит специфическим генам, которые ингибируют или инициируют клеточную смерть, и семейству ферментов, называемых каспазами. Эти ферменты расщепляют внутриклеточные белки, в результате чего происходит смерть клетки. Кроме того, возникновение ишемии и некроз клеток ишемического ядра вызывают миграцию клеток воспаления в поврежденную зону. Клетки воспаления, в свою очередь, высвобождают активные формы кислорода и такие цитокины, как фактор некроза опухоли-α, интерлейкин-6 и интерлейкин-1. Все это усугубляет ишемическое повреждение и способствует развитию апоптоза в зоне пенумбры [9].
Кроме того, важное значение в исходе ишемического инсульта играет целостность гематоэнцефалического барьера. Главная роль в дисфункции гематоэнцефалического барьера принадлежит семейству ферментов матриксных металлопротеиназ. Повышенное количество этих ферментов связано с повреждением гематоэнцефалического барьера и повышенным риском геморрагической трансформации при тромболизисе [14].
Гипотермия оказывает влияние на множество факторов, которые играют роль в патогенезе ишемического инсульта. Так, при снижении температуры на один градус по Цельсию потребление кислорода и утилизация глюкозы клетками мозга сокращаются на 5% [15]. За счет снижения интенсивности метаболизма уменьшаются выработка клетками молочной кислоты и выраженность ацидоза [16]. За счет ингибирования аквапорина-4 гипотермия улучшает микроциркуляцию после реперфузии [17]. Применение гипотермии препятствует накоплению и высвобождению глутамата, который в больших количествах является токсичным для нервных клеток [15, 18]. За счет ингибирования специфических белков и ферментов гипотермия препятствует развитию апоптоза нервных клеток [16]. Кроме того, гипотермия снижает количество нейтрофилов и активированных клеток микроглии в зоне ишемии, а также выработку множества медиаторов воспаления, что предупреждает их губительное действие на нервную ткань [19–22]. Наконец, гипотермия препятствует активации матриксных металлопротеиназ, что предупреждает повреждение гематоэнцефалического барьера [23, 24]. Учитывая все вышесказанное, можно сделать вывод, что гипотермия оказывает положительное влияние на множество факторов, участвующих в течении ишемического инсульта. Таким образом, становится очевидно, что гипотермия является оправданным и перспективным методом при лечении ишемического инсульта.
Общая гипотермия
Общая гипотермия достигается при помощи обкладывания пациента льдом, использования специальных охлаждающих одеял и матрасов, внутривенного введения охлаждающих растворов и так далее. Отличительной особенностью общей гипотермии является охлаждение всего тела человека. Первое упоминание об использовании общей гипотермии относится к 1942 г., когда Темпл Фэй сообщил об успешном использовании гипотермии в лечении пациентов с тяжелой травмой головы. В 1950-х гг. во многих центрах гипотермия использовалась при кардио- и нейрохирургических операциях. Однако наибольшее распространение гипотермия получила после внедрения метода искусственного кровообращения, что привело к практически рутинному использованию гипотермии при многих операциях [25]. В ФГБУ «НМИЦ им. ак. Е.Н. Мешалкина» Минздрава России применение общей гипотермии получило широкое распространение и дальнейшее развитие. Так, в клинической практике применялся метод умеренной (29–31 °С) гипотермии, который оказывал антигипоксическое воздействие на головной мозг в течение 30 мин. В дальнейшем с целью увеличения эффективности антигипоксической защиты головного мозга разработан и внедрен в клиническую практику метод углубленной (24–26 °С) гипотермии, который позволял осуществлять безопасную для мозга остановку кровообращения в течение 60 мин. Принимая во внимание опыт использования бесперфузионной гипотермии, разработали методику, которая сочетала глубокую гипотермию, ретроградную перфузию головного мозга, краниоцеребральное охлаждение и фармакологическую защиту центральной нервной системы, и установили, что увеличение длительности гипотермической остановки кровообращения до 80 мин при использовании данного вида защиты мозга не приводит к росту частоты неврологических осложнений и росту летальности. На основании полученных данных появилась возможность увеличения времени гипотермической остановки кровообращения до 80 мин. Низкая частота неврологических осложнений позволила широко использовать данную методику. При исследовании метаболизма головного мозга выявлены периоды его наибольшей уязвимости во время операции — глубокая гипотермическая остановка кровообращения и этап реперфузии. Кроме того, эффективным методом защиты мозга при оперативных вмешательствах является гипотермическая остановка кровообращения с применением постоянной антеградной цереброплегии. Этот метод позволяет снизить степень гипотермии перед остановкой кровообращения с 17–18 до 24–25 °С, что предупреждает отрицательное действие низких температур и позволяет ускорить этап согревания. Данный метод позволяет осуществлять безопасную для мозга и других органов и систем остановку кровообращения на срок до 60–80 мин. Результаты исследований были внедрены в клиническую практику ФГБУ «НМИЦ им. ак. Е.Н. Мешалкина» Минздрава России [26, 27].
Согласно международным клиническим исследованиям, применение общей гипотермии улучшает неврологический исход и снижает смертность при гипоксически ишемической энцефалопатии у новорожденных [28, 29] и после остановки сердца у взрослых [30, 31]. Все это говорит о том, что гипотермия оказывает выраженное нейропротективное влияние при ишемии. Однако по результатам ряда клинических исследований применение общей гипотермии при ишемическом инсульте не показало эффективности [32–34]. Возможной причиной такой неудачи является долгое время достижения целевой температуры (около часа) и отсутствие целенаправленного охлаждения головного мозга, в то время как при инсульте необходимо быстрое снижение температуры головного мозга: чем больше времени проходит после начала инсульта, тем больше клеток мозга погибает и тем хуже исход. Также минусом общей гипотермии при ишемическом инсульте является охлаждение всего организма, что приводит к возникновению ряда осложнений, таких как пневмония и мышечная дрожь, хотя при ишемическом инсульте можно ограничиться охлаждением только головного мозга.
Местная гипотермия
Местная гипотермия отличается тем, что при ее применении происходит охлаждение определенного участка тела человека, при этом влияние на системную температуру должно быть минимальным. Местная гипотермия достигается при помощи обкладывания льдом определенного участка тела человека, использования охлаждающих воротников и шлемов, интраназального охлаждения, внутривенного, внутриартериального и эпидурального введения охлаждающих растворов.
При интраназальном охлаждении смесь из охлажденной жидкости и кислорода подается в носоглотку, при этом происходит быстрое испарение жидкости и охлаждение носовой полости и мозга [35]. В многоцентровом рандомизированном исследовании PRINCE было изучено влияние интраназальной гипотермии на клинический исход у пациентов после остановки сердца. По результатам исследования достоверной разницы между группой интраназальной гипотермии и группой контроля не получено [36]. В другом исследовании изучали влияние интраназальной гипотермии на паренхиматозную и субдуральную температуру мозга. По результатам исследования изменения температуры мозга не зарегистрировано [35, 36]. Таким образом, эффективность этого метода гипотермии вызывает сомнения.
Эффективность селективного охлаждения головного мозга при помощи охлаждающих шлемов и воротников изучалась среди пациентов с черепно-мозговой травмой. Так, B. Harris и соавт. изучили эффективность охлаждающего шлема у пациентов с черепно-мозговой травмой. Гипотермия продолжалась на протяжении 24 ч. По результатам исследования не показано значимого снижения смертности у пациентов группы гипотермии по сравнению с контрольной группой [35]. W. Qiu и соавт. провели более крупное исследование, которое включало 90 пациентов с черепно-мозговой травмой. Пациенты были разделены на 2 группы: гипотермия и контроль. Гипотермия достигалась при помощи охлаждающего шлема и воротника и продолжалась в течение трех дней. По результатам исследования показано значимое снижение интракраниального давления в группе гипотермии. Однако к 6 мес. разницы в клиническом исходе не обнаружено [35, 37].
Исследований, посвященных гипотермии при помощи эпидурального введения охлаждающего раствора, не так много, поэтому говорить об эффективности этого метода не представляется возможным.
Интракаротидная гипотермия
В течение последних нескольких лет в мире проведен ряд исследований, в которых продемонстрирована эффективность интракаротидной селективной церебральной гипотермии при ишемическом инсульте [38–43]. Отличительной особенностью этого метода является быстрое снижение температуры головного мозга при минимальном влиянии на системную температуру. С учетом вышеизложенного метод является наиболее перспективным и заслуживает дальнейшего изучения.
Интракаротидная селективная церебральная гипотермия, согласно доклиническим исследованиям, быстро снижает температуру головного мозга и значительно уменьшает объем поражения головного мозга [38]. Также доказано, что применение интракаротидной селективной церебральной гипотермии улучшает неврологический исход и препятствует повышению проницаемости гематоэнцефалического барьера при инсульте [39]. Кроме того, преимуществом селективной гипотермии является незначительное влияние на системную температуру, что позволяет избежать таких осложнений, как пневмония и мышечная дрожь, свойственных общей гипотермии [44].
На данный момент имеется ряд доклинических исследований, посвященных применению селективной церебральной гипотермии при остром инсульте. Так, A.E. Schwartz с соавт. изучали влияние селективной церебральной гипотермии при остром инсульте у лабораторных животных (бабуины) [40]. Гипотермия достигалась при помощи экстракорпорального охлаждения крови с последующей инфузией с использованием аппарата искусственного кровообращения. Это давало возможность вводить охлажденную кровь с высокой скоростью, не увеличивая при этом объем циркулирующей крови. В этом заключается недостаток исследования, так как данный метод не может использоваться повсеместно из-за высокого риска процедуры. Результаты исследования показали значительное уменьшение объема инфаркта мозга у исследуемой группы (0,5±1% полушария мозга) по сравнению с контрольной группой (35,4±4,4%, р<0,01). T.K. Mattingly с соавт. провели похожее исследование на свиньях, по результатам которого показано десятикратное уменьшение объема инфаркта мозга у животных, которым проводилась селективная гипотермия мозга, по сравнению с контрольной группой без гипотермии [38]. Кроме того, имеется ряд исследований, проведенных на мелких грызунах, которые в случае применения селективной гипотермии головного мозга показали не только значительное уменьшение зоны инфаркта мозга, но и уменьшение степени отека мозга и значительное улучшение неврологического исхода [39, 41, 42].
При анализе мировой литературы по данному вопросу следует обратить внимание на работу K. Kurisu с соавт. [43]. В отличие от других исследований на мелких лабораторных животных, где для развития инсульта пережимали общую сонную артерию с одной стороны, происходило пережатие обеих общих сонных артерий, таким образом сводился к минимуму коллатеральный кровоток в области ишемии. Кроме того, группа селективной гипотермии включала две подгруппы: в первой раствор вводился во время окклюзии дистальнее места пережатия сонных артерий, во второй — после реперфузии. Оценка объема инфаркта мозга, объема жидкости в мозге и определение тяжести неврологического дефицита происходила через 48 ч после реперфузии. Объем инфаркта мозга в контрольной группе составил 35%, в группе, которой проводилась селективная гипотермия во время окклюзии сонных артерий, — 8%; в группе, которой проводилась селективная гипотермия после реперфузии, — 15%. Объем отека мозга в группах, подвергавшихся селективной гипотермии, оказался в 2,5 раза ниже, чем в контрольной группе. Неврологический исход также оказался значительно лучше в группах селективной гипотермии, при этом время начала гипотермии не повлияло на исход. Кроме того, необходимо упомянуть исследование, проведенное J. Chen с соавт., посвященное изучению безопасности применения эндоваскулярной селективной церебральной гипотермии при остром инсульте у человека [44]. Инфузия охлаждающего раствора проводилась через гайд-катетер, установленный в общую сонную артерию для тромбэкстракции. Перед реканализацией выполнялась инфузия охлажденного до 4 °С физиологического раствора со скоростью 10 мл/мин в течение 5 мин, после реканализации раствор вводился со скоростью 30 мл/мин в течение 10 мин. По результатам исследования установлено, что эндоваскулярная селективная церебральная гипотермия является безопасным методом и влияние на системную температуру было незначительным (в ходе гипотермии ректальная температура снижалась на 0,1 °С).
Таким образом, во всех приведенных исследованиях доказано не только значительное уменьшение объема инфаркта мозга при интракаротидной селективной церебральной гипотермии при остром инсульте, но и уменьшение степени отека мозга и значительное улучшение неврологического исхода. Эти результаты подчеркивают большие перспективы данного метода в лечении острого инсульта.
Однако доклинические исследования по интракаротидной селективной церебральной гипотермии при остром инсульте не позволяют определить оптимальный режим введения охлаждающего раствора у человека ввиду того, что они проводились либо на мелких лабораторных животных, либо на крупных животных, но с использованием аппарата искусственного кровообращения, который не может применяться повсеместно. Учитывая этот факт, научный коллектив ФГБУ «НМИЦ им. ак. Е.Н. Мешалкина» Минздрава России планирует проведение доклинического исследования по оценке эффективности интракаротидной селективной церебральной гипотермии при остром ишемическом инсульте на крупных лабораторных животных (свиньях). В исследовании для гипотермии будет использована интракаротидная инфузия охлажденного физиологического раствора, что позволит максимально приблизить условия к клинической практике. В ходе работы будет отработана методика моделирования ишемического инсульта у свиней, определена оптимальная продолжительность и эффективность гипотермии до и после реперфузии.
Исследование будет проводиться в два этапа. На первом этапе животные будут разделены на две группы:
1. В контрольной группе животным на 3 ч будет окклюзирована средняя мозговая артерия.
2. В группе гипотермии методика моделирования ишемического инсульта будет такой же, как и у контрольной группы. Животным этой группы будет пунктироваться бедренная артерия с последующей установкой интродьюсера. Далее через интродьюсер в восходящую глоточную артерию будет установлен проводниковый катетер. Через 1,5 ч после окклюзии через проводниковый катетер будет вводиться 0,9% раствор NaCl, охлажденный до 4 °С. Общее время введения раствора составит 3 ч и захватит периоды как до, так и после реперфузии.
На втором этапе исследования животные также будут разделены на две группы:
1. В первой группе будет проводиться интракаротидное введение охлаждающего раствора в течение 1,5 ч до наступления реперфузии.
2. Во второй группе будет проводиться интракаротидное введение охлаждающего раствора в течение 1,5 ч после наступления реперфузии.
Для оценки эффективности охлаждения в головной мозг будет установлен температурный датчик, а также датчик для трасназальной термометрии. Показатели этих двух датчиков будут сопоставляться, что позволит установить достоверность трансназальной термометрии в определении температуры головного мозга. Для определения динамики системной температуры в ходе гипотермии будет установлен датчик для ректальной термометрии.
Всем животным через 48 ч после начала эксперимента будет проводиться магнитно-резонансная томография головного мозга с целью определения размера очага ишемического инсульта. На основании этих данных будет проведена оценка влияния интракаротидной гипотермии на размер очага ишемического инсульта. Кроме того, посредством сравнения трех групп гипотермии будет определена эффективность гипотермии в зависимости от времени введения охлаждающего раствора.
Таким образом, в ходе данной работы будет проведена оценка эффективности и безопасности применения интракаротидной церебральной гипотермии при ишемическом инсульте. Полученные данные помогут определить перспективы применения данного метода в клинической практике.
Заключение
Ишемический инсульт является распространенным заболеванием с высокой частотой смертности и инвалидизации, требующим новых эффективных и доступных методов лечения. Гипотермия имеет большой потенциал в лечении ишемического инсульта, так как обладает выраженным нейропротективным действием. Однако применение общей гипотермии при данной патологии не показало эффективности, в то время как в ряде доклинических исследованиях подтверждена эффективность интракаротидной селективной церебральной гипотермии. Учитывая перспективность данного метода, авторы решили провести доклиническое исследование по оценке эффективности интракаротидной церебральной гипотермии при остром инсульте у свиней.
Финансирование
Работа выполнена при поддержке гранта РФФИ (проект № 18-415-540025).
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
первые признаки, основные симптомы, первая помощь
О центре — Учимся быть здоровыми
25.05.2016
Автор: ManagerПервые признаки инсульта очень разнообразны и зависят от многих причин, прежде всего от локализации очага поражения и его размера. Немаловажным фактором является возраст, сопутствующие заболевания и скорость доставки больного в специализированное учреждение.
При ишемическом инсульте, или инфаркте головного мозга, у больного может наблюдаться потеря сознания, памяти, нарушение речи, походки, вплоть до полной немоты и обездвиженности.
Храпящее дыхание и отсутствие сознания очень грозный признак инсульта, который свидетельствует о поражении центров дыхания и сердечной деятельности в головном мозге.
Головокружение, тошнота и рвота, судороги также часто наблюдаются при возникновении инсульта.
По обширности поражения можно выделить микроинсульт, или лакунарный инсульт, когда очаг настолько мал, что неврологические проявления минимальны и могут характеризоваться изолированным головокружением, незначительной слабостью в руке или ноге или изменением формы лица.Микроинсульт при своевременном и адекватном лечении обычно завершается полным выздоровлением.
Обширный инсульт головного мозга — это тяжелый процесс, когда повреждается более 1/4 ткани головного мозга.Первые признаки инсульта при обширном инфаркте головного мозга характеризуются полным параличом одной половины тела, отсутствием речи, нарушениями сознания и дыхания вплоть до комы.
Обширный инсульт головного мозга ишемического характера протекает более доброкачественно, чем геморрагический. Однако последствия обширного ишемического инсульта часто серьезные и ведут к полной или частичной инвалидизации больного.
Обширный инсульт головного мозга геморрагического характера очень часто несовместим с жизнью и заканчивается летальным исходом. И дело даже не в том, что ничем нельзя помочь, а в том, что медики просто не успевают оказать помощь в таких случаях. Уж очень внезапным и стремительным течением отличается обширный геморрагический инсульт.
По локализации можно выделить инсульт в полушариях головного мозга и стволовой инсульт. Если при полушарном инсульте изменения чаще всего проявляются в виде парезов и параличей конечностей, то первые признаки стволового инсульта могут складываться из парезов лица, изменений речи, головокружения.
Большой по размерам стволовой инсульт, в первую очередь, вызывает нарушения дыхания и отличается очень тяжелым прогнозом.
К сожалению, при инсульте первая помощь на дому очень ограничена. Главное: вызвать скорую медицинскую помощь, обеспечить заболевшему покой и предотвратить аспирацию рвотными массами. Если больной в сознании, уложите его в положение с приподнятой на 30% верхней половиной тела, так как такое положение является профилактикой отека головного мозга.Пациента без сознания лучше всего уложить на ровную поверхность на боку, чтобы при рвоте желудочные массы не попали в трахею и бронхи. Очистите рот больного от пищи и рвотных масс, если это уже произошло. Не пытайтесь поить больного без сознания. Не давайте аспирин и какие-либо другие препараты.
На голову пациенту с инсультом можно положить лед или любой продукт из холодильника, предварительно обернув его в чистую материю. Температура тела у больных с инсультом должна быть не выше нормы, так как головной мозг не любит тепло.
Бездыханному пациенту надо срочно начать искусственную вентиляцию легких изо рта в рот и массаж сердца. Этими приемами должен владеть любой человек.
В качестве обезболивающего предпочтительнее парацетамол, так как он не оказывает влияние на вязкость крови.
Если больной в сознании и у него давление выше 180/110, дайте ему таблетку капотена или другого гипотензивного средства. Не ждите мгновенного результата и не повторяйте прием таблеток в течение последующих 2 часов. Передозировка гипотензивных препаратов опаснее высокого давления.
Гипертермия у выживших больных при инсульте
Проведен ретроспективный анализ историй болезни 89 пациентов с инсультом в возрасте 50-86 лет (табл. 1). Деление пациентов на группы и подгруппы отражено на таб. 3.
В исследование включались больные только в остром периоде инсульта. Пациенты поступившие с острым нарушением мозгового кровообращения из других стационаров, тем более, с имеющимися гнойно-воспалительными осложнениями, не включались в исследование, так как у данных больных отсутствовали данные о температурной реакции на начальном периоде заболевания.
Верификация инсульта проводилась на основе Приказа Минздравсоцразвития РФ от 01.08.2007 N 513 «Об утверждении стандарта медицинской помощи больным с инсультом (при оказании специализированной помощи)». Компьютерная томография и/или магнитно-резонансная томография выполнялись в 1-3 сутки при поступлении в стационар однократно и, по показаниям, повторно.
Для обозначения повышения температуры тела использовали термин гипертермия. В МБК-10 термины гипертермия, лихорадка и пирексия сведены вместе и представлены в одной рубрике – R50.9. С целью удобства сравнения групп больных с инфарктом мозга и внутримозговым кровоизлиянием за гипертермию принимали значение аксиллярной температуры за 37,2°С [3, 7]. Для оценки гипертермии использовали общеизвестную для врачей классификацию повышения температуры тела из пропедевтики внутренних болезней [10].
Измерение аксиллярной температуры проводилось 4-8 раз в сутки. Из полученных показателей температуры выбирали максимальное значение, которое и использовали для составления температурных кривых за все время пребывания пациентов в стационаре. Регистрация температуры проводилась с помощью прикроватного мониторы МПР 6-03 «Тритон» с использованием температурных датчиков.
Дифференциальную диагностику инфекционной гипертермии от центральной проводили по следующим критериям: абсолютной величины гипертермии, цикличности температурной реакции, эффективности антипиретической терапии, взаимосвязи температурной реакции с гнойно-воспалительными осложнениями, динамикой температурной реакции в зависимости от появления или стихания ГВО.
Коррекцию гипертермии проводили согласно общепринятым рекомендациям ведущих учреждений НИИ нейрохирургии им. Н.Н. Бурденко, НИИ скорой помощи им. Н.В. Склифосовского, Военно-медицинской Академии и НИИ им. А.Л.Поленова [11]. Использовали физические и фармакологические методы купирования гипертермии. Однако, несмотря на проводимую терапию, в ряде случаев у пациентов сохранялась стойкая гипертермия. В иных случаях эффект от проводимой терапии регистрировался отсрочено. В связи с этим оценивали такие показатели как продолжительность гипертермии (час), продолжительность некупируемой гипертермии (час). Дополнительно фиксировали начало гипертермии (час), продолжительность гипертермии (сутки).
Для оценки влияния инфекционного компонента в гипертермическом синдроме вели учет структуры и количества ГВО. Гнойно-воспалительные осложнения делили на интракраниальные и экстракраниальные. Обязательным условием включения данных пациентов в подгруппы больных с гнойно-воспалительными осложнениями была регистрация SIRS (Bone R.C., 1992).
Статистический анализ и построение графиков проводили с помощью программы Microsoft Office Excel 2007.
Температура при инсульте — высокая температура при и после инсульта
В зависимости от показателей при инсульте температура тела может указывать на процессы, происходящие в организме, а также на степень поражения мозга. Кроме того, на основании данного показателя можно составить прогноз относительно дальнейшего развития болезни, степени восстановления, а в некоторых случаях и выживания после перенесенного удара.
Какая температура у больного после инсульта считается нормальной
Специалисты говорят о том, что если человек перенес ишемический или геморрагический приступ, то в этом случае общая температура тела повышается практически у всех. В этом случае речь идет о том, что организм просто подтверждает тот факт, что совсем недавно он вынужден был перенести сложное потрясение. Однако это также может быть сигналом о том, что на фоне приступа у пациента развились осложнения.
Врачи рекомендуют обратить внимание именно на показатели температуры. Если он не превышает допустимых 37,5 градусов, то в этом случае речь идет о нормальном процессе восстановления. Человек идет на поправку и в скором времени утраченные силы вернутся к нему.
Если же температура после инсульта 38 и более градусов, то ее уровень свидетельствует о том, насколько обширное или интенсивное кровоизлияние произошло во время инсульта. Это означает, что организму человека намного сложнее справиться с последствиями данного происшествия, поэтому есть риск возможных осложнений. Поэтому при резком скачке данного показателя нужно незамедлительно обращаться за помощью.
Если температура после геморрагического инсульта или ишемического сильно подскочила, в первую очередь пациенту вводится жаропонижающее средство. Это необходимо для того, чтобы снизить обширность кровоизлияния и предотвратить возможные повреждения мозговой структуры. После этого больному может потребоваться госпитализация и в обязательном порядке обследование.
Норма и нарушения
Температура при инсульте
Для врача все показатели важны. Гипертермия при инсульте подскажет специалисту, насколько сильно поражены клетки головного мозга. Параметры меняются не сразу. Сначала появляются характерные симптомы патологии, после чего поднимается температура тела. В некоторых ситуациях гипертермия присутствует сразу в начале приступа. По нормальным данным или отклонениям доктор определяет состояние человека. Иногда ситуации бывают слишком критические.
Возможные отклонения:
- Допустимое повышение температуры тела, когда показатели не выше, чем 37,5оС. Это нормально для пациента, но для специалиста идеальное состояние больного, когда температура 37,2оС. Показатели для человеческого организма на фоне приступа могут колебаться в пределах 1 градуса, не больше.
- При ишемическом инсульте температура тела понижается. Если отметка останавливается на 36оС, у пациента есть все шансы на положительный исход.
- Повышенная температура тела. Отметка достигает 37,5оС и выше. Такое состояние специалисты считают критичным. Чем выше показатели, тем хуже. Гипертермия указывает на серьезные нарушения, которые происходят в организме человека.
Температура при инсульте имеет огромное значение, по ней врач не только определяет состояние пациента, но и дает прогнозы относительно его здоровья. Если параметры достаточно высокие у пациента мало шансов, чтобы выжить и восстановиться после удара. Гипертермия осложняет кровообращение. При повышенной температуре гематома давит на ткани головного мозга. Решающую роль может сыграть даже 1 градус.
Важен момент, когда поднялась температура у больного. Чем позже это произошло, тем меньше шансы на положительный прогноз у пациента. Риск летального исхода достаточно высокий.
Температурные показатели у таких пациентов измеряется сразу после приступа. Если человеку дать жаропонижающие лекарства у него есть все шансы избежать осложнений и последствий до приезда врача. Бывает, что гипертермия возникает в самом начале инсульта. Врач дает пациенту жаропонижающие средства. Подобное решение помогает не только спасти жизнь пациенту, но и защитить ткани головного мозга от обширного повреждения.
Повышенная температура
Если говорить, о чем свидетельствует жар, то, как правило, он является реакцией организма на патологические процессы, которые могут быть как приемлемыми, так и патологическими. В последнем случае речь идет о нарушениях в работе мозга. При сильном повышении температуры после инсульта происходит усиление процессов метаболизма в организме. Поэтому человеческому телу нужно тратить намного больше энергии для того, чтобы сохранить жизнедеятельность клеточного материала. Как правило, это приводит к тому, что клетки постепенно начинают терять свою функциональность, нейроны быстрей погибают.
Восстановление нормального протекания обменных процессов необходимо для того, чтобы клетки получали необходимое количество кислорода. Дело в том, что в момент инсульта происходит резкое замедление кровообращения. Если одновременно с этим резко увеличивается температура, то клетки головного мозга начинают погибать в 2 раза быстрее. Появление жара после приступа чревато схожими последствиями.
В чем опасность гипертермии
Температура при инсульте – явление нормальное, если она не превышает отметки в 37,3-37,5о, в такой ситуации это воспринимается как ответная реакция на мозговую катастрофу. При таком развитии событий больному обычно ставят благоприятный прогноз, особенно если температура не только не повышается, но и снижается до 36о. По утверждениям докторов, если при геморрагическом инсульте произошло обширное кровоизлияние, это будет сопровождаться стойкой гипертермией, так же как во время ишемического повреждения, сопровождающегося большим очагом некроза. В таких ситуациях прогноз не будет благоприятным.
В острой стадии кровоизлияния работники бригады скорой помощи обязательно дают больному таблетки жаропонижающего, это служит профилактикой дальнейших осложнений, а в некоторых ситуациях позволяет существенно снизить уровень повреждений мозга. Делается это по следующей причине – с прогрессирующим повышением температуры метаболические процессы в тканях организма значительно ускоряются, а энергия клеток расходуется на борьбу с патологией. Такая трата сил провоцирует гибель большого количества нейронов головного мозга, которые итак пострадали во время катастрофы.
Любой обменный процесс, проходящий в тканях головного мозга, требует необходимого количества кислорода. Если развивается гипертермия, может развиться кислородное голодание при инсульте, усугубляющее ситуацию. При значительном повышении температуры, которое больше характерно для геморрагического инсульта, пациенту угрожает состояние комы или даже летального исхода.
Дополнительная информация
Бывают случаи, когда у некоторых пациентов, наоборот, понижается (например, до 36 градусов) температура после инсульта. Причины такого проявления заключаются в том, что не происходит серьезного неврологического дефицита. В этом случае речь идет о положительной динамике. Процесс выздоровления происходит довольно быстро и у больного есть все шансы на восстановление.
Соответственно, повышение температуры может говорить о том, что клетки мозга не способны восстанавливаться должным образом, вместо этого они продолжают умирать.
Что происходит при ишемическом инсульте?
Инсульт ишемического типа появляется из-за атеросклероза мозговых артерий, стеноза позвоночных и сонных артерий, снижения давления, увеличения свертываемости крови, по причине закупорки сосуда мозга тромбом или эмболом.
Ишемический инсультный тип
Зачастую перед ишемическим инсультом наблюдается нарушение кровоснабжения мозговых отделов – повторятся патологии мозговой работы, которые длятся не больше суток. Среди симптомов инсульта на фоне ишемии можно назвать:
- Головокружение.
- Температура 38 и выше.
- Иногда бывает гипотермия – пониженные температурные показатели.
- Боли в голове.
- Становится страшно, человек впадает в панику.
- Ослабление и потеря чувствительности в ногах и руках.
- Обморочное состояние.
- Иногда сердечные боли.
Парализации конечностей при таком инсульте протекает поэтапно. Зачастую инсульт наступает ночью во время беспокойного сна или после пробуждения утром. Часто наблюдается потеря сознания, длящаяся недолго. Лицо бледнеет, замедленный пульс, давление снижается, сердце бьется слабо, дыхание натянутое.
Инсульт при ишемии наблюдается в случае разрыва сердца, эндокардита на фоне сепсиса. «Букет» признаков проявляется выражено, на фоне короткой потери сознания могут наблюдаться припадки судорог, особенно у пациентов старшего и пожилого возраста. Если инсульт из-за эмболии головных артерий, то лицо наливается кровью, выделяется пот, лихорадка, наблюдается субфебрильная температура – гипертермия, озноб, аритмичное биение сердца.
Помочь пациенту нужно следующим образом: уложить так, чтобы голова находиласяь практически на одном уровне с телом, обеспечить приток свежего воздуха, дать успокоительные средства, вызвать врача.
Внимание! Если удар протекает благоприятно, то сознание пациента восстановится в ближайшие часы. Если этого не происходит, то прогноз неутешителен. Лечение инсульта проводится только в стационаре.
Температура после инсульта: почему повышается?
Есть самые разные версии в зависимости от того, сколько времени прошло после приступа. Однако чаще всего повышение температуры происходит из-за:
- Обширных кровоизлияний.
- Ишемии.
- Тромбоза артерий.
- Некроза мозговых тканей.
- Тромбоза вен или отеком мозга.
Если после инсульта происходят изменения показателей центра терморегуляции человеческого тела. Это приводит к нейрогенной гипертермии. В некоторых ситуациях причины температуры после инсульта заключаются в том, что у пациента началась аллергическая реакция на тот или иной препарат, который был прописан ему на восстановительный период, чтобы ускорить процесс выздоровления. В этом случае необходимо незамедлительно отказаться от его приема или выбрать средства из другой группы.
Когда возможны температурные скачки, их причины
При инсульте температура поднимается по следующим причинам:
- отек мозга;
- тромбы в сосудах;
- воспаление легких;
- вирусные инфекции;
- смещение центра терморегуляции, возникающего по причине кровоизлияния в мозг.
Кроме этого, при инсульте наблюдается обострение и иных серьёзных нарушений, которые предшествовали удару. К ним относят.
- сердечно-сосудистые заболевания;
- пневмонию;
- мочеполовые инфекции.
Поэтому крайне важно, чтобы врач знал обо всех болезнях, ранее перенесенных пациентом.
Дополнительные причины
Если говорить о статистике, то, согласно мнению врачей, больше всего больных страдает от повышения температуры, точнее, гипертермии в течение месяца после перенесенного инсульта. Часто такое развивается на фоне:
- Пневмонии.
- Появлении пролежней.
- Ненадлежащего ухода за пациентом, который не может обслуживать себя самостоятельно.
- Застойных явлений, если речь идет о слишком долгом лежачем положении.
- Обострении хронических заболеваний, появившихся на фоне инфекции.
- Мочеполовых инфекций.
- Некроза тканей.
Дополнительно может появиться не только высокая температура после инсульта, но также и усиленное потоотделение. При этом у пациентов не наблюдается других изменений самочувствия. Поэтому если в процессе восстановления происходит исключительно повышение температуры, но отсутствуют любые другие признаки вирусного или сезонного заболевания, то это говорит о реакции организма на случившуюся катастрофу.
Список литературы
- Dr Amir Ahmad, Dr Jouher Kallingal , Professor Pippa Tyrrell. Acute Stroke Management of Fever, 2018
- David M. Greer, Susan E. Funk, Nancy L. Reaven, Myrsini Ouzounelli and Gwen C. Uman. Impact of Fever on Outcome in Patients With Stroke and Neurologic Injury, 2008
- Д. В. Садчиков, С. Н. Котов. Гипертермия и антипиретическая терапия при инфаркте мозга, 2013
- Sylwia E. Wrotek, PhD, Wieslaw E. Kozak, PhD, David C. Hess, MD, Susan C. Fagan, PharmD.Treatment of Fever After Stroke: Conflicting Evidence, 2011
Ирина Костылева
Высшее медицинское образование. Кировская государственная медицинская академия (КГМА). Участковый терапевт.
Последнее обновление: Август 22, 2019
- МКБ-10 (Международная классификация болезней)
- Юсуповская больница
- Клиническая неврология с основами медико-социальной экспертизы. СПб.: ООО «Медлайн-Медиа», 2006.
- Широков, Е. А. Инсульт, инфаркт, внезапная смерть. Теория сосудистых катастроф / Е.А. Широков. — М.: Кворум, 2010. — 244 c.
- Виленский, Б. С. Инсульт: профилактика, диагностика и лечение / Б.С. Виленский. — Москва: Высшая школа, 1999. — 336 c.
Какими могут быть последствия
Если у человека поднимается температура после ишемического инсульта или приступов другой категории, то в первую очередь это является признаком кровоизлияний, происходящих в мозгу.
Есть ряд довольно серьезных последствий такого изменения состояния. Если у человека наблюдается жар, то это может привести к ускорению метаболических процессов и последующему кислородному голоданию клеток. На фоне этого происходит повреждение некоторых центров головного мозга.
Если организм человека не смог полностью восстановиться, то это может спровоцировать развитие инвалидности. Бывают случаи, когда после инсульта люди впадают в кому и погибают.
Постинсультная гипертермия
Повышение термального показателя возможно даже спустя время, когда инсультный удар уже случился. Ничего хорошего это не предвещает. Если это случилось в первые 30 дней, то риск смертности будет выше, нежели у пациентов без данного явления. Это выявлено у тех, чей диагноз конкретизируется по инсульту ишемического и геморрагического типов. Поводов для запоздалого сценария может быть несколько, начиная инфекционными процессами и пневмонией, до пролежней, отсутствия должных мер ухода, застоев в процессе долговременного сохранения позиции лежа.
Определить развитие процессов можно по некоторым признакам:
- Повышению потоотделения;
- Без жалоб на болезненное состояние;
- С нормальным самочувствием.
Диагностику процессов можно выполнить как в стационаре, так и на дому. Однако меры по лечению должны предприниматься лишь при наблюдении специалиста. Ведь неверно выбранное средство либо дозировка могут привести к нежелательным последствиям.
Что делать в домашних условиях
В первую очередь стоит сказать, что если после инсульта держится температура, родственники пациента ни в коем случае не должны самостоятельно пытаться справиться с проблемой или назначать больному сильнодействующие лекарственные средства. В этом случае есть большой риск только еще больше навредить здоровью человека. Однако далеко не всегда удается получить своевременную квалифицированную помощь. В этом случае разрешается дать пациенту с высокой температурой после инсульта противовоспалительные препараты нестероидной группы. К ним относятся «Аспирин», «Анальгин», «Парацетамол», а также «Ибупрофен». Однако давать более двух таблеток запрещается.
Ни в коем случае нельзя пытаться лечить больного при помощи антибиотиков и препаратов, входящих в группу стероидных средств, включая сильнодействующие анальгетики.
Если родные пациента ожидают приезд медиков, то нужно провести проверку рефлексов больного. Ни в коем случае нельзя давать больному жаропонижающие таблетки, если он тяжело дышит или не может самостоятельно проглотить средство. Есть вероятность, что случился рецидив и началось развитие инсультного состояния.
Клиническая картина в целом
В клиническую картину инсульта помимо гипертермии медики включают общемозговые и очаговые симптомы.
Общемозговая симптоматика
Включает в себя следующие признаки:
- головокружение и головная боль;
- шум в ушах;
- позывы на рвоту;
- нарушения в сознании – от незначительной дезориентации в пространстве и времени до частичной или полнейшей потери сознания и погружения в кому;
- судороги.
Очаговые признаки
Повреждения в правом полушарии сопровождаются следующими симптомами:
При нарушении в области левого полушария наблюдаются такие признаки:
- парез правой половины тела;
- проблемы с пространственным восприятием;
- вспыльчивость и агрессия;
- нарушения поведения.
Особенности выбора медикаментов
Когда человек перенес серьезный приступ, очень важно контролировать температурный режим его тела. Если температура после инсульта не поднимается выше 37,5 градусов, то не стоит предпринимать серьезных мер. Однако важно отслеживать любые изменения этих показателей. Если температура поднялась выше 38,6 градусов, то больному можно дать «Парацетамол». Рассчитать дозировку самостоятельно сложно. Важно не навредить больному еще больше. Специалисты рекомендуют давать пациенту примерно 325-1000 мг препарата каждые 5-6 часов. Однако доза лекарства не должна превышать 4 г в день. Нужно оценивать не только состояние больного, но также его вес и возраст. Если речь идет о пожилом человеке, то не стоит экспериментировать. Лучше вызвать врача.
Специалисты проводят необходимые мероприятия по понижению температуры. Сегодня существует два метода подобной терапии.
Лечение инсульта в Юсуповской больнце
Неврологическое отделение Юсуповской больницы оснащено современным диагностическим оборудованием, которое позволяет пройти диагностику инсульта, быстро определить степень поражения головного мозга. Команда больницы – это профессора и врачи высшей категории, квалифицированный медицинский персонал. В больнице можно пройти исследования с помощью ЭНМГ, ВЭЭГ, ЭМГ, дуплексного сканирования, нейровизуализации и других современных методик. Неврологическое отделение принимает больных с инсультами всех степеней тяжести, врач разрабатывает программу лечения, исходя из состояния больного.
Пациент получает медикаментозное лечение, круглосуточный уход, терапевтические процедуры, помощь психолога. После стабилизации состояния с пациентом работают специалисты по реабилитации. Команда специалистов постоянно проводит мониторинг состояния больного, делает новые назначения. Большого внимания требуют пожилые люди – после длительной гиподинамии наступает декомпенсация вестибулярного аппарата. Специалист по реабилитации разрабатывает программу с точным соотношением нагрузки, тяжести инсульта и состояния сосудов и сердца. Записаться на прием к врачу-неврологу Юсуповской больницы можно по телефону.
Автор
Екатерина Дмитриевна Абрамова
Врач-невролог, руководитель клиники хронической боли
Инвазивный способ
При применении данного метода медики вводят пациенту внутривенно специализированный физиологический раствор, который обладает охлаждающим эффектом. Это способ считает наиболее эффективным, так как он позволяет быстро снизить и скорректировать температуру больного.
Однако у инвазивного способа есть и недостаток. Он заключается в том, что подобные манипуляции могут спровоцировать определенные осложнения. Например, в качестве побочного явления может развить тромбоз или кровоизлияние в сосудах.
Неинвазивный способ
В этом случае понизить температурный режим тела пациента удается при воздействии на его кожные покровы. Обычно для этого используется обычный лед, который упаковывается в специальные мешки. После этого холодные примочки накладываются на голову пациента. Такой способ позволяет минимизировать влияние на состояние сосудов, однако есть риск обморожения. Поэтому очень важно следить за состоянием больного. Если допустить переохлаждение, то это может спровоцировать серьезные проблемы.
Оба этих метода не подходят для тех людей, которые не являются медиками. Без должной подготовки очень легко нанести вред пациенту. Хоть врачи и допускают использование неинвазивного метода в домашних условиях, нужно быть предельно осторожным. Нужно ежеминутно контролировать уровень температуры больного и не прикладывать лед слишком долго.
Как часто контролируют температуру тела?
При поступлении в больницу всем больным обязательно измеряют температуру тела. Первые трое суток повторные замеры проводятся каждые 4 часа. Если за это время состояние нормализуется, переходят к 2-3-разовым измерениям. После выписки из больницы контроль необходимо продолжать, чтобы вовремя заметить отдаленные последствия инсульта: инфекцию мочевыводящих путей, воспаление легких. Измерения проводят утром, вечером, записывают показатели в дневник больного. При внезапном повышении значений – необходимо немедленно оповестить лечащего врача.
Профилактика
Важно не допустить того, чтобы у пациента после инсульта поднималась температура. Для этого необходимо выполнять несколько профилактических мероприятий. Больного нужно периодически переворачивать. Это необходимо для того, чтобы не допустить появления пролежней. Особенно это важно для парализованных пациентов, так как в их организме происходят застойные явления.
В домашних условиях рекомендуется использовать специализированные противопролежневые матрацы. Кроме этого, переворачиваться в постели нужно и для того, чтобы противостоять вероятному развитию пневмонии. Не лишним будет использовать массаж. Подобные мероприятия также полезны в том случае, если у больного диагностировано воспаление легких. Массажные процедуры способствуют лучшему выведению мокроты.
Очень важно следить за гигиеной пациента. Если он не проходит ежедневных процедур, то это может привести к инфекционным заболеваниям. Нужно понимать, что организма после полученного удара сильно ослабевает. Его защитные и прочие функции не работают в должном режиме. Поэтому стоит также исключить возможные контакты с людьми, страдающими от вирусных патологий.
Помещение, где находится пациент, должно периодически проветриваться. Однако нельзя допускать, чтобы больной находился на сквозняке. Кроме этого в палате или комнате нужно ежедневно производить влажную уборку. Если больной страдает от аллергии, то важно исключить любые контакты с раздражителями.
Повышение температуры тела при инсульте. Возникновение высокой температуры при инсульте
Острое нарушение мозгового кровообращения является крайне опасным состоянием, требующим немедленного лечения – в особенности если присоединяется температура при инсульте. После инсульта люди частого остаются инвалидами, особенно если помощь была оказано несвоевременно или не квалифицированно. В настоящее время не прекращаются разработки новых способов лечения и восстановления после инсульта.
Типы инсульта
Это говорит о высокой социальной значимости этой проблемы для нашей страны. Не меньшее внимание уделяется специалистами и изучению причин нарушения мозгового кровообращения. Сам инсульт может протекать по-разному, соответственно, и последствия для человека могут быть очень разнообразные. Стоит отметить, что инсульт не всегда сразу укладывает человека в постель, а отсутствие своевременной терапии делает его дальнейшее течение более сложным.
Ни для лечения, ни при последующем восстановлении после инсульта не рекомендуется использовать самостоятельные или народные методики – они могут дополнять терапию, но лишь в качестве вспомогательного средства, и если назначаются врачом.
Оперативная помощь при инсульте – гарантия жизни пациента
К основным симптомам острого нарушения мозгового кровообращения можно отнести следующие:
- головная боль, чаще сильная;
- головокружение;
- неврологические симптомы, появляющиеся сразу после возникновения инсульта
- повышение температуры тела различной интенсивности.
Ранние признаки инсульта
Если опытный врач занимается диагностированием инсульта, то обязательно осуществляется контроль за температурой тела, практически всегда повышающейся после острого нарушения. В дальнейшем этот показатель часто становится средством контроля за состоянием пациента. Конечно, термометрия является далеко не единственным способом диагностики, но если температура поднимается до критических значений, чаще всего это свидетельствует об обширном кровоизлиянии в ткани головного мозга.
Если же речь идет об ишемическом инсульте, развивающемся без кровоизлияния, постоянно повышенная температура может свидетельствовать о таких патологиях, как:
- отек мозга;
- воспалительный процесс в организме, вызванный бактериями или вирусами;
- тромбоз артерий или вен;
- пневмония или обострение хронических заболеваний.
Температура при инсульте является важным диагностическим критерием, игнорирование которого недопустимо.
Для ишемического инсульта чаще характерна субфебрильная температура
Поскольку нарушения мозгового кровообращения являются серьезной проблемой для человека, о том, что температура должна оставаться в общеизвестных границах нормы (36,6) речи идти не может. Связано это с выбросом в кровь простагландинов, образующихся при любом воспалении в огромных количествах. Поэтому при любом остром нарушении мозгового кровообращения может наблюдаться подъем температуры до 37,2-37,5 градусов Цельсия. Это характерно для первых дней кризиса.
Но если термометр неумолимо показывает более высокие значения, это практически всегда свидетельствует о существенном ухудшении состояния, либо о присоединении осложнений. Прогноз для пациента в этом случае ухудшается. Если не принять экстренных и адекватных мер к таким пациентам, может возникнуть угроза для жизни пациента.
Чем опасна гипертермия при инсульте?
Гипертермический синдром опасен для любого человека, не говоря уже о пациентах с инсультами. Любое повышение температуры приводит к резкому ускорению протекания всех метаболических процессов в организме. При остром нарушении мозгового кровообращения гипертермия способствует увеличению проницаемости гематоэнцефалического барьера, снижается активность ферментов, гибель клеток мозга происходит быстрее.
Проведение термометрии
Если погибших клеток станет слишком много, происходит увеличение очага инсульта с необратимыми изменениями в ЦНС, после чего, человек может стать инвалидом. Стоит отметить что активная гибель клеток головного мозга при нарушении кровообращения уже началась, поэтому при лечении очень важен контроль за температурой тела. Особенно опасна гипертермия при геморрагических поражениях мозговой ткани.
Термометрия пациентам с инсультами должна проводиться не менее 2-х раз в день, даже при видимом улучшении состояния. Это связано с неспособностью такого пациента адекватно оценить свое состояние – высокую температуру они могут просто не заметить.
Диагностика гипертермии
Повышение температуры тела пациента после инсульта может происходить и по ряду других причин. На первом месте стоят гнойно-воспалительные заболевания (ГВЗ), которые могли присутствовать у человека и до инсульта. Для исключения ошибок в диагностике причины гипертермии, она оценивается по множеству критериев, например:
- максимальные значения температуры;
- цикличность;
- эффективность жаропонижающей терапии.
Кроме этого, во внимание принимается и динамика повышения температуры в зависимости от наличия или отсутствия очагов ГВЗ или осложнений. При дифференциальной диагностике термометрия проводится до 8 раз в сутки.
Как помочь человеку с гипертермией?
Стоит отметить, что лечение инсульта в домашних условиях не представляется возможным – госпитализация проводится в обязательном порядке. Тем не менее, не лишним окажется узнать, что вне зависимости от причины самого инсульта, пациент часто остается в палате один. При признаках повышения температуры по совету врача можно принимать лишь нестероидные противовоспалительные средства (анальгин, ибупрофен).
При геморрагическом инсульте в условиях стационара могут использоваться другие способы борьбы с гипертермией, после чего состояние пациентов улучшается. Используют наркотические, нестероидные противовоспалительные и седативные препараты.
Немедикаментозные методы
Неинвазивный
Охлаждение происходит исключительно через кожу. Могут применяться пузыри со льдом, влажные повязки или специальные шлемы, надеваемые на голову пациента – внутри шлема постоянно циркулирует охлаждающая жидкость.
Инвазивный
- Для этого используют внутривенное вливание охлажденного физиологического раствора. Метод удобен, поскольку позволяет не только быстро охладить человека, но и согреть, если возникает такая необходимость.
- Внутривенное катетерное управление температурой. Суть метода заключается в установке особого катетера, имеющего собственную систему охлаждения. В мочевой катетер пациента, располагающийся устанавливается температурный датчик, на основании показаний которого меняется температура внутривенного катетера. Это достаточно сложная, но высокоэффективная система, позволяющая постоянно контролировать и корректировать температуру пациента.
Нередко возникает ситуация, когда во время приступа или через какое-то время после него больной ощущает жар, ломоту во всем теле. Температура при инсульте может указывать на то, насколько сильно был поврежден мозг в процессе возникновения кровоизлияния, и какие именно процессы в настоящий момент протекают в организме. Эти показатели могут помочь специалистам грамотно выстроить тактику лечения, чтобы больной как можно скорее пошел на поправку.
Итак, почему и до каких значений может повыситься температура после кровоизлияния в мозг, и как можно помочь больному в таком случае?
При возникновении подозрения на инсульт врачи всегда обращают пристальное внимание на то, насколько высокой становится температура больного. Данные показатели помогают узнать, какие именно процессы протекают в организме в настоящий момент. В зависимости от того, насколько высоко поднимается температура при инсульте, можно предположить развитие следующих состояний в организме.
При показателях не выше 37,5 градусов ситуация является нормальной, здоровью больного ничего не угрожает. В таком случае в организме не начинают протекать патологические процессы, способные значительно ухудшить состояние больного и стать причиной летального исхода. Оптимальной температурой, при которой нет никаких поводов для беспокойства, является 37,2.
Температура в 36 градусов характерна для ишемического инсульта . Если такой показатель держится длительное время, то это является хорошим показателем. В организме не происходит никаких деструктивных процессов и больной может рассчитывать на благоприятный исход.
Когда температура при инсульте стремительно поднимается выше отметки 37,5 градусов , это означает, что в организме начались деструктивные процессы, которые могут негативным образом повлиять на исход болезни и привести не только к возникновению многочисленных осложнений, но и летального исхода.
Существует прямая зависимость между повышением температуры и стремительным ухудшением состояния больного, так как в этот момент происходит стремительное увеличение гематомы в размерах, и она начинает давить на головной мозг, нарушая обменные процессы и вызывая его деформацию. В таком случае речь не идет о нормальном восстановлении организма, больному становится практически невозможно избежать летального исхода. Критическим может оказаться повышение температуры тела при инсульте даже на 1 градус.
Еще один крайне негативный момент – когда во время приступа состояние больного не вызывает опасений, а деструктивные процессы начинают нарастать позже. В таком случае высокая температура после инсульта становится сигналом того, что шансы больного на выживание стремительно уменьшаются.
Поэтому жизненно важное значение будет иметь своевременный прием жаропонижающих препаратов больным. Это будет способствовать нормализации температуры тела, а у врачей появится небольшое количество времени для стабилизации состояния пострадавшего человека. Поэтому, при подозрении на кровоизлияние в мозг либо микроинсульт, больному немедленно дают жаропонижающие и кроворазжижающие препараты.
Гипертермия при инсульте может возникнуть по следующим причинам. Когда кровоизлияние произошло в стволе головного мозга. Данный участок ответственен за терморегуляцию, при его повреждении возможно резкое увеличение температуры тела. В некоторых случаях возникновению данного состояния способствует рассасывание поврежденных клеток.
Активизация патогенных организмов в организме под влиянием инсульта. Отек мозга и тромбозы, которые замедляют кровоток, что способствует нарастанию интоксикации в клетках . Обострение таких заболеваний, как воспаление легких, инфекции мочеполовой системы и патологии сердечно-сосудистой системы.
Аллергия на медпрепараты. При повышении температуры после инсульта данная причина является наиболее благоприятной, так как у больного шансы на выживание остаются достаточно высокими. Важно лишь вовремя заменить неподошедшие лекарства.
Зная о данных негативных факторах, медики стараются тщательно отслеживать состояние больных и своевременно предпринимать необходимые меры по предотвращению гипертермии. Последствия такого состояния могут быть плачевными.
При резком увеличении температуры тела в организме начинают нарастать следующие процессы:
- Значительно усиливается межклеточный метаболизм, что негативным образом влияет на клетки головного мозга, которые испытывают сильное кислородное голодание. Также начинают нарастать симптомы интоксикации.
- Постепенно нарастает некроз тканей, площадь поражения увеличивается.
- Серое вещество получает повреждения, под воздействием которых начинается его изменение и постепенная гибель. Все это приводит к гибели клеток головного мозга, вследствие которой повышается риск возникновения летального исхода.
Если больному удалось выжить, велик риск, что он на всю жизнь окажется и не сможет обслуживать себя самостоятельно. В тяжелых случаях больные нередко впадают в кому.
Нередко возникают ситуации, когда температура после инсульта начинает повышаться примерно через месяц после кровоизлияния в мозг. У такого явления могут быть следующие причины. Наличие инфекции в организме. После инсульта организм ослаблен, и патогенные организмы начинают быстро распространяться, провоцируя возникновение заболеваний различной этиологии.
Плохой уход за лежачим больным, когда у него начинает появляться большое количество пролежней. Когда пациенту была установлена трахеоскома и за ней не осуществляется должного ухода. Некачественная обработка катетеров и мест их установки. Последствия такого небрежного отношения могут быть плачевными, вплоть до возникновения сепсиса .
Нарастание застойных явлений в организме, когда больной просто лежит в постели без движения. В таких случаях он становится очень уязвимым перед любыми вирусами и бактериями. Стандартные заболевания протекают в таких случаях гораздо тяжелее. Возникновение пневмонии.
При этом пациенты могут страдать от повышенного потоотделения, но самочувствие будет находиться в пределах нормы, у больных не наблюдается выраженных болевых синдромов, лишь сильная и продолжительная слабость.
Как помочь больному
Чтобы снизить риск повышения температуры, следует не только выполнять все предписания лечащих врачей, но и выполнять следующие действия. Тщательно , особенно если он лежачий. Регулярно проводить гигиеническую обработку, менять постельное и нательное белье.
Если человек лежит, не вставая, регулярно менять положение тела, чтобы избежать возникновения незаживающих пролежней. Также для этой цели можно использовать специально сконструированные матрасы, которые подходят как доя стационара, таки для дома.
При наличии катетеров, дренажных трубок уход за ними должен быть особенно тщательным. Следует регулярно обрабатывать кожу вокруг них, периодически снимать сами приспособления и заменять их на новые. Исключить контакт пациента с потенциальными разносчиками инфекции, чтобы не спровоцировать возникновение болезней.
Когда у больного поднимается температура, следует давать ему обычное жаропонижающее. Антибиотики находятся под запретом. Регулярно проводить влажную уборку в помещении, где находится пациент, и устраивать проветривания минимум 1 раз в день. должен содержать достаточное количество витаминов и микроэлементов, чтобы помочь ослабленному организму поскорее прийти в форму.
Категорически запрещены любые виды самолечения, так как бесконтрольный прием лекарственных препаратов может оказать негативное влияние на состояние больного. Прежде чем давать жаропонижающее лекарство, важно убедиться, что человек сможет его самостоятельно проглотить. В противном случае имеет смысл дать ему сироп либо суспензию.
Если состояние больного начинает стремительно ухудшаться, следует как можно скорее доставить его в медучреждение . Врачи проведут все необходимые лечебные мероприятия для стабилизации состояния пациента.
Температура во время и после инсульта – грозный сигнал, свидетельствующий о наличии патологических процессов в организме. Чтобы предотвратить их стремительное развитие и избежать ухудшения состояния больного, нужно, чтобы он как можно раньше принял жаропонижающее средство. В таком случае удастся замедлить либо полностью избавиться от бактериальной или вирусной инфекции, избежать развития патологических процессов в головном мозге. Все это будет не только способствовать нормализации состояния больного, но и поможет избежать развития множества осложнений.
Мозговая катастрофа иногда сопровождается реакцией, которую некоторые считают нетипичной. Температура при часто не превышает обычных значений, а ее значительное увеличение служит дополнительным диагностическим симптомом.
Механизмы повышения температуры при инсульте
В регуляции температуры тела участвует гипоталамус и его особая зона. Нейроны работают в определенном режиме и задают «установочную точку», которая регулирует процессы теплоотдачи и теплопродукции. Изменение их работы происходит под действием пирогенов: экзо- или эндогенных веществ, способных повышать температуру.
Они могут воздействовать непосредственно на нервные клетки или опосредованно через другие вещества. В роли пирогенов, поступающих извне служат вирусы, выступают бактерии. Эндогенные представлены различными веществами после распада клеток.
Этапы повышения температуры:
- Под действием пирогенов вырабатывается интерлейкин-1 в лейкоцитах.
- Воздействие ИЛ-1 на гипоталамический центр терморегуляции.
- Перестройка работы центра и повышение температуры.
При этом возникает спазм сосудов кожи и гладких мышц, снижается теплоотдача. В мозг идет сигнал о похолодании, повышается тонус скелетных мышц, развивается дрожь, повышается выработка тепла.
Повышение температуры при инсульте может быть вызвано непосредственным повреждением клеток гипоталамуса. Нарушение кровотока в нем при кровоизлиянии или спазме сосудов приводит к температурной реакции. Этот механизм называется центральным.
Допустимые значения
Если случился инсульт, температура может быть немного снижена до отметки 36,0 градусов. Это объясняется снижением кровотока и является благоприятным диагностическим критерием. Допустимой считается гипертермия до 37,5 градусов. Температура при инсульте 38 и выше говорит об обширном кровоизлиянии, развитии некротических процессов. Чем выше этот показатель, тем хуже прогноз для больного.
При развитии лихорадки ускоряются окислительные реакции, увеличивается потребность тканей в кислороде. Рефлекторно на каждый добавочный градус сердцебиение учащается на 10 ударов. Также учащается дыхание.
Причины повышения температуры
Этиология гипертермии в разные периоды инсульта отличается. Частые причины температуры при инсульте:
- обширное кровоизлияние;
- ишемия большого участка мозга;
- тромбоз артерий или вен;
- некроз мозговой ткани;
Вовлечение в зону инсульта центра терморегуляции приводит к нейрогенной гипертермии. Иногда аллергия на некоторые применяемые медикаменты может вызвать высокую температуру при инсульте, что является показанием для отмены используемого лекарства и применения средства другой группы.
По данным различных исследований, значительное количество больных в течение месяца после перенесенной мозговой катастрофы сталкивалось с гипертермией. У температуры после инсульта причины следующие:
- пневмония;
- образование пролежней у парализованных;
- ненадлежащий уход за лежачими пациентами;
- использование трахеостомы;
- застойные явления при длительном лежачем положении;
- обострение хронических инфекционных заболеваний, часто это мочеполовые инфекции;
- после – некроз тканей.
Высокая температура после инсульта сопровождается усиленным потоотделением, отсутствием плохого самочувствия и жалоб на болезненность.
Последствия повышения температуры
Гипертермия не проходит бесследно. Она способствует увеличению очага поражения, гибели клеток. В остальных тканях усиливаются окислительные реакции, и повышается потребность в кислороде. Неадекватное кровоснабжение приводит к гипоксическому повреждению. Отдаленные последствия – различные постинсультные патологии, ухудшение прогноза реабилитации, кома, летальный исход.
Способы устранения гипертермии
Высокая температура при инсульте не всегда снижается после приема жаропонижающих противовоспалительных средств. Это объясняется механизмом действия лекарства, он основан на подавлении синтеза веществ, которые способствуют выработке ИЛ-1. При кровоизлиянии в мозг или ишемии повышение температуры имеет центральный механизм. Лейкоциты могут активироваться и вырабатывать интерлейкин в случае некротических процессов.
В условиях стационара для устранения лихорадки применяют литические смеси – растворы для внутривенного введения. Даже физраствор, введенный капельно, снижает жар за счет своей более низкой температуры по отношению к крови.
В домашних условиях, пока едет скорая, с больного нужно снять теплую одежду, не накрывать. Можно протирать места прилегания к коже крупных сосудов прохладной водой. Это область шеи, локтевые сгибы, подколенные ямки.
Температура после инсульта чаще провоцируется инфекцией. Поэтому для лечения врач может назначить нестероидные противовоспалительные средства (Парацетамол, Индаметацин). Лечение антибиотиками должен назначить врач после обследования.
Профилактика повышения температуры
Предотвратить образование пролежней после кровоизлияния можно частым переворачиванием парализованного больного. Оптимально использование специального противопролежневого матраса. Поворачивание в постели является профилактикой застойных явлений и пневмонии. Можно применять массаж. Если уже развилось воспаление легких, то это будет способствовать отделению мокроты.
Установленную трахеостому ежедневно проверяют на предмет проходимости, прочищают. Для промывания используют стерильные катетеры. Кожу вокруг нее протирают фурациллином, смазывают цинковой пастой. Важно соблюдение гигиены тела, обмывание. Палата или комната, где находится после инсульта больной, должна ежедневно проветриваться, проводиться влажная уборка.
Об основных симптомах инсульта можно узнать из видео:
На чтение 4 мин. Просмотров 1.4k.
Температура при инсульте играет важную роль для определения степени выраженности патологического процесса. Данный показатель помогает выявить кровоизлияние и вовремя предупредить отек мозговых тканей. Гипертермия и повышение артериального давления появляются как компенсаторные реакции организма на развитие ишемии. Скорость движения крови в сосудах увеличивается с целью доставить нейронам кислород и питательные вещества, но при остром нарушении церебрального кровообращения такая защитная реакция может только ухудшить общее состояние.
Нормальные показатели
Показатели температуры тела отражают состояние организма во время приступа инсульта. В ходе клинических исследований была выявлена следующая закономерность: чем больше температурные показатели, тем выше риск развития кровоизлияния. Температура после инсульта ишемической формы слегка понижена, но соответствует пределам нормы. Показатели могут снижаться до +36°С, что обусловлено изменением кровообращения в организме. При такой отметке увеличиваются шансы на быстрое выздоровление без развития осложнений. Критической границей нормы считается значение +37,5°С.
Многие люди интересуются, какой бывает температура при геморрагическом инсульте, характеризующимся разрывом мозговой артерии с последующим кровоизлиянием в головной мозг. Гипертермия, при которой отметка градусника поднимается выше допустимой границы в +37,5°С, свидетельствует о тяжелом поражении центральной нервной системы. В такой ситуации с повышением показателей увеличивается вероятность развития осложнений, комы и летального исхода.
Повышение температурных показателей может привести к возникновению некроза, воспалительного процесса, нового тромбообразования и повторного нарушения мозгового кровообращения.
Как часто Вы сдаете анализ крови?
Poll Options are limited because JavaScript is disabled in your browser.
Только по назначению лечащего врача 30%, 949 голосов
Один раз в год и считаю этого достаточно 18%, 550 голосов
Как минимум два раза в год 15%, 459 голосов
Чаще чем два раза в год но меньше шести раз 11%, 343 голоса
Я слежу за своим здоровьем и сдаю раз в месяц 6%, 197 голосов
Боюсь эту процедуру и стараюсь не сдавать 4%, 135 голосов
21.10.2019
Почему поднимается температура
Если повышается температура после инсульта, причина развития симптома свидетельствует о развитии осложнений. При гипертермии возможны: обширное кровоизлияние в головной мозг, атипичная анафилактическая или аллергическая реакция на лекарственную терапию, поражение инфекционным или вирусным заболеванием. Наиболее опасной этиологией повышения температурных показателей считается тромбоз мозговых артерий, отек головного мозга и разрыв церебрального сосуда с последующим кровоизлиянием.
В зависимости от причины появления гипертермии пациенту назначают лечение медикаментами:
- при подозрении на отек тканей мозга выписывают мочегонные средства;
- развитие инфекционно-воспалительных процессов тормозят антибактериальные препараты.
В постинсультный период высокая температура ускоряет внутриклеточный метаболизм в ответ на прогрессирующую ишемию головного мозга. Организм пытается восстановить питание нейронов, увеличивая частоту сердечных сокращений. В результате повышается скорость течения крови, начинает подниматься температура. Но в условиях острого нарушения церебрального кровообращения ткани не насыщаются питательными веществами и кислородом, развивается гипоксия.
При отсутствии лечения на фоне подъема температуры развивается некроз тканей, распространяется воспаление, область ишемии продолжает расширяться. Гипертермия ухудшает состояние, провоцируя возникновение осложнений и кому.
В ходе клинических исследований врачи зафиксировали, что при тяжелом течении инсульта температура поднималась через 4-6 часов после удара. При патологии средней тяжести временной промежуток увеличивался до 10-12 часов и достигал отметки +38…+40°С. На фоне микроинсультов или ишемического инсульта, не сопровождающегося разрывом сосуда, температура не повышается.
Осложнения, которые ставят под угрозу жизнь человека, могут развиться вскоре после начала инсульта.
Опасные для жизни осложнения включают, в том числе, и высокую температуру больного.
Температура после инсульта может быть признаком инфекции, в частности пневмонии или инфекция мочевых путей.
Профилактика этих осложнений является одним из основных направлений первоначального лечения инсульта.
Появление воспалительных процессов и повышенной температуры тела в острой фазе ишемического инсульта является хорошо известным явлением.
Повышенная температура тела может возникать в случаях инфекции экзогенными микроорганизмами или эндогенного воспалительного ответа на восстановление тканей головного мозга.
Механизм реакции организма человека на вторжение воспалительных микроорганизмов, таких как бактерии, запускает процесс, активирующий лейкоциты и простагландины, изменяющие терморегуляторную установку в переднем гипоталамусе головного мозга.
Проявляющийся вследствие этого отклик симпатической нервной системы (части автономной нервной системы) повышает температуру ядра головного мозга до лихорадочного уровня. В результате растет общая температура тела больного для борьбы с чужеродным агентом.
Лихорадка чаще всего встречается в течение первых двух дней после инсульта. Однако ее истинную причину не всегда легко установить. Некоторые исследования показывают, что время лихорадки может указывать на причины ее происхождения.
Обычная лихорадка, вызванная патологическими процессами, связанными с инсультом, начинается в течение 24 часов после симптомов инсульта, в то время как лихорадка из-за инфекции возникает в более позднее время.
Это говорит о том, что если ранняя инфекция исключена, ранняя лихорадка у пациентов с инсультом может указывать на ее неврологическое происхождение.
Высказывается предположение, что у пациентов с объемами инфаркта малого инсульта в качестве индикатора инфекции следует принимать заметный рост температуры тела, уровня С-реактивного белка или лейкоцитов.
Пациенты с большими инфарктами также часто имеют умеренное увеличение температуры при отсутствии инфекции.
При количественном определении воспалительных маркеров С-реактивного белка, фибриногена и лейкоцитов, установлено, что ишемический инсульт не вызывает типичную острую фазовую реакцию, связанную с высокой температурой у большинства больных.
Однако при тяжелом инсульте массивный некроз тканей может повышать температуру тела. Другой причиной неинфекционной лихорадки может быть наличие крови в головном мозге.
В результате исследованиями установлено, что в большинстве случаев выявленной причиной лихорадки после инсульта является инфекция.
Температурные показатели после мозгового удара
Исследование больных, госпитализированных после ишемического инсульта, показывает, что у 25% пациентов наблюдается температура тела более 38C в течение 24 часов после начала инсульта.
У 32% отмечена температура выше 37,5C в течение 48 часов после начала инсульта.
Высказывается предположение, что вероятные причины повышенной температуры в течение 48 часов после ишемического инсульта включают наличие в организме больных пневмококков, стрептококков, кишечной палочки, энтерококков, вируса парагриппа или вируса гриппа типа А.
Исследователи приходят к выводу, что большинство случаев повышенной температуры (около 83%) можно объяснить инфекционной или химической аспирационной пневмонией. Пневмонит (локализированное поражение тканей в легких) часто сопровождается ранней бактериальной инфекцией даже в течение первых 48 часов после инсульта.
После инсульта больной должен соблюдать режим питания. Питание после ишемического инсульта исключает употребление жирных, соленых и некоторых других продуктов. Подробнее о правильном питании читайте .
Как побороть?
Контроль температуры тела рассматривается в качестве важного компонента ухода после инсульта.
- Для снижения температуры рекомендуется Ацетаминофен (Парацетамол) с выбором дозировок в конкретных случаях. Примерные дозировки Ацетаминофена составляют 325-1000 мг каждые 4-6 часов до 6 раз в сутки (но не более 4 г/сутки) при температуре выше 38,6C.
- Если температура тела высокая, рекомендуются атипиретики (жаропонижающие средства), как при ишемических, так и при геморрагических инсультах. Температурный порог и стратегия лечения в этом случае выбираются индивидуально.
Лечение повышенной температуры тела при инсульте рекомендуется только в остром его периоде.
Подчеркивается, что на текущий момент нет данных, свидетельствующих о том, что снижение температуры тела у лихорадочных или афебрильных пациентов улучшает неврологический исход.
Заключение
Лечение жаропонижающими средствами при возникновении инсульта следует рассматривать очень тщательно, так как снижение лихорадки может продлить течение инфекции у больного.Профилактическое введение жаропонижающих средств также может маскировать инфекции и приводить к задержанному лечению антибиотиками в тех случаях, когда они показаны пациенту.
Заметное снижение температуры может спровоцировать физическое охлаждение, дрожь и сужение просвета кровеносных сосудов.
Клинические преимущества снижения температуры тела при лечении инсультных больных еще не установлены.
Видео на тему
Предикторы постинсультной лихорадки и инфекций: систематический обзор и метаанализ | BMC Neurology
Westendorp WF, Nederkoorn PJ, Vermeij JD, Dijkgraaf MG, van de Beek D. Постинсультная инфекция: систематический обзор и метаанализ. BMC Neurol. 2011; 11: 110.
Артикул PubMed PubMed Central Google Scholar
Bustamante A, Garcia-Berrocoso T, Rodriguez N, Llombart V, Ribo M, Molina C, Montaner J.Исход ишемического инсульта: обзор влияния постинсультных осложнений в различных сценариях лечения инсульта. Eur J Intern Med. 2016; 29: 9–21.
Артикул PubMed Google Scholar
Георгилис К., Пломаритоглу А., Дафни Ю., Бассиакос Ю., Веммос К. Этиология лихорадки у пациентов с острым инсультом. J Intern Med. 1999. 246 (2): 203–209.
CAS Статья PubMed Google Scholar
Рейт Дж., Йоргенсен Х.С., Педерсен П.М., Накаяма Х., Раашу ХО, Джеппесен Л.Л., Олсен Т.С. Температура тела при остром инсульте: связь с тяжестью инсульта, размером инфаркта, смертностью и исходом. Ланцет. 1996. 347 (8999): 422–5.
CAS Статья PubMed Google Scholar
Аззимонди G, Bassein L, Nonino F, Fiorani L, Vignatelli L, Re G, D’Alessandro R. Лихорадка при остром инсульте ухудшает прогноз. Перспективное исследование. Инсульт.1995. 26 (11): 2040–203.
CAS Статья PubMed Google Scholar
Liberati A, Altman DG, Tetzlaff J, Mulrow C, Gotzsche PC, Ioannidis JPA, Clarke M, Devereaux PJ, Kleijnen J, Moher D. Заявление PRISMA о систематических обзорах и мета-анализах исследований, которые оценка медицинских вмешательств: объяснение и уточнение. PLoS Med. 2009; 6: e1000100.
Артикул PubMed PubMed Central Google Scholar
Stroup DF, Berlin JA, Morton SC, Olkin I, Williamson GD, Rennie D, Moher D, Becker BJ, Sipe TA, Thacker SB. Метаанализ наблюдательных исследований в эпидемиологии: предложение для отчетности. Метаанализ обсервационных исследований в группе эпидемиологии (MOOSE). ДЖАМА. 2000; 283: 2008–12.
CAS Статья PubMed Google Scholar
Шведское агентство по оценке технологий здравоохранения и социальных услуг, Vår metod . Стокгольм: SBU; [обновлено в 2014 г. / цитировано в 2016–11–11]. Доступно по адресу: http://www.sbu.se/sv/var-metod.
Palmer TM, STERNE JAC. Мета-анализ в Stata: обновленная коллекция из журнала Stata. Техас: публикация Stata Press; 2016.
Google Scholar
Селларс С., Боуи Л., Бэгг Дж., Суини М.П., Миллер Х., Тилстон Дж., Лангхорн П., Стотт Дж. Факторы риска инфекции грудной клетки при остром инсульте: проспективное когортное исследование.Инсульт. 2007. 38 (8): 2284–91.
Артикул PubMed Google Scholar
Флури Ф., Моргенталер Н.Г., Мюллер Б., Крист-Крейн М., Катан М. Копептин, прокальцитонин и обычные воспалительные маркеры-предикторы инфекции после инсульта. PLoS One. 2012; 7 (10): e48309.
CAS Статья PubMed PubMed Central Google Scholar
Finlayson O, Kapral M, Hall R, Asllani E, Selchen D, Saposnik G, Canadian Stroke N, Stroke Outcome Research Canada Working G.Факторы риска, стационарное лечение и исходы пневмонии после ишемического инсульта. Неврология. 2011. 77 (14): 1338–45.
CAS Статья PubMed Google Scholar
Brogan E, Langdon C, Brookes K, Budgeon C, Blacker D. Респираторные инфекции при остром инсульте: назогастральный зонд и неподвижность являются более сильными предикторами, чем дисфагия. Дисфагия. 2014; 29 (3): 340–5.
Артикул PubMed Google Scholar
Zhang X, Yu S, Wei L, Ye R, Lin M, Li X, Li G, Cai Y, Zhao M. Оценка A2DS2 как предиктор пневмонии и госпитальной смерти после острого ишемического инсульта у населения Китая. PLoS One. 2016; 11 (3): e0150298.
Артикул PubMed PubMed Central Google Scholar
Лю К.Л., Шау, Вайоминг, Ву, С.С., Лай, МС. Ингибитор ангиотензинпревращающего фермента / блокаторы рецепторов ангиотензина II и риск пневмонии у пациентов с инсультом.J Hypertens. 2012; 30 (11): 2223–9.
CAS Статья PubMed Google Scholar
Исигами К., Окуро М., Коидзуми Ю., Сато К., Иритани О., Яно Х., Хигашикава Т., Иваи К., Моримото С. Связь тяжелой гипертензии с пневмонией у пожилых пациентов с острым ишемическим инсультом. Hypertens Res. 2012. 35 (6): 648–53.
Артикул PubMed PubMed Central Google Scholar
Bray BD, Smith CJ, Cloud GC, Enderby P, James M, Paley L, Tyrrell PJ, Wolfe CD, Rudd AG, Collaboration S. Связь между задержками в скрининге и оценке дисфагии после острого инсульта и риском инсульта -ассоциированная пневмония. J Neurol Neurosurg Psychiatry. 2017; 88 (1): 25–30.
Артикул PubMed Google Scholar
Дзевас Р., Риттер М., Шиллинг М., Конрад С., Оленберг С., Набави Д. Г., Стогбауэр Ф., Рингельштейн Э. Б., Людеманн П.Пневмония у пациентов с острым инсультом, получающих питание через назогастральный зонд. J Neurol Neurosurg Psychiatry. 2004. 75 (6): 852–6.
CAS Статья PubMed PubMed Central Google Scholar
Hug A, Murle B, Dalpke A, Zorn M, Liesz A, Veltkamp R. Полезность сывороточных уровней прокальцитонина для ранней диагностики инфекций дыхательных путей, связанных с инсультом. Neurocrit Care. 2011. 14 (3): 416–22.
CAS Статья PubMed Google Scholar
Джонс Е.М., Олбрайт К.С., Фоссати-Беллани М., Зиглер Дж. Э., Мартин-Шильд С. Смена смены отделения неотложной помощи связана с пневмонией у пациентов с острым ишемическим инсультом. Инсульт. 2011. 42 (11): 3226–30.
Артикул PubMed Google Scholar
Хармс Х., Гриттнер У., Дроге Х., Мейзель А. Прогнозирование постинсультной пневмонии: оценка PANTHERIS. Acta Neurol Scand. 2013. 128 (3): 178–84.
CAS Статья PubMed Google Scholar
Титсворт В.Л., Абрам Дж., Фуллертон А., Хестер Дж., Гуин П., Уотерс М.Ф., Мокко Дж. Перспективная инициатива в области качества по максимальному скринингу на дисфагию снижает распространенность внутрибольничной пневмонии у пациентов с инсультом. Инсульт. 2013. 44 (11): 3154–60.
Артикул PubMed Google Scholar
Masiero S, Pierobon R, Previato C, Gomiero E. Пневмония у пациентов с инсультом и ротоглоточной дисфагией: последующее исследование через шесть месяцев. Neurol Sci.2008. 29 (3): 139–45.
Артикул PubMed Google Scholar
Херциг С.Дж., Даути С., Лахоти С., Маркина С., Санан Н., Фенг В., Кумар С. Использование кислотосупрессорных препаратов при остром инсульте и внутрибольничной пневмонии. Энн Нейрол. 2014; 76 (5): 712–8.
CAS Статья PubMed PubMed Central Google Scholar
Ли С.И., Чжоу К.С., Хсу С.П., Ши С.К., Йе С.К., Хунг С.Дж., Чен Т.Л., Ляо С.К.Результаты после инсульта у пациентов с предыдущей пролежней: согласованное ретроспективное когортное исследование в масштабах всей страны. J Stroke Cerebrovasc Dis. 2016; 25 (1): 220–7.
Артикул PubMed Google Scholar
Кван Дж., Хэнд П., Деннис М., Сандеркок П. Эффекты внедрения системы интегрированной помощи в отделении острого инсульта. Возраст Старение. 2004. 33 (4): 362–7.
Артикул PubMed Google Scholar
Лэнгдон П.К., Ли А.Х., Биннс CW. Высокая частота респираторных инфекций у пациентов с острым ишемическим инсультом, получающих питание через зонд без приема внутрь. Нейроэпидемиология. 2009. 32 (2): 107–13.
CAS Статья PubMed Google Scholar
Chen CM, Hsu HC, Tsai WS, Chang CH, Chen KH, Hong CZ. Инфекции у пожилых пациентов с острым инсультом, проходящих реабилитацию. Am J Phys Med Rehabil. 2012. 91 (3): 211–9.
Артикул PubMed Google Scholar
Stott DJ, Falconer A, Miller H, Tilston JC, Langhorne P. Инфекция мочевыводящих путей после инсульта. QJM. 2009. 102 (4): 243–9.
CAS Статья PubMed Google Scholar
Dromerick AW, Edwards DF. Связь резидуального мочеиспускания с инфекцией мочевыводящих путей во время реабилитации после инсульта. Arch Phys Med Rehabil. 2003. 84 (9): 1369–72.
Артикул PubMed Google Scholar
Фоксман Б. Синдромы инфекций мочевыводящих путей: возникновение, рецидивы, бактериология, факторы риска и бремя болезней. Заражение Dis Clin N Am. 2014; 28 (1): 1–13.
Артикул Google Scholar
Brogan E, Langdon C, Brookes K, Budgeon C, Blacker D. Невозможно глотать, не передается, не может ходить в туалет: факторы, прогнозирующие инфекции в первую неделю после инсульта. J Clin Neurosci. 2015; 22 (1): 92–7.
Артикул PubMed Google Scholar
Флорес-Мирелес А.Л., Уокер Дж. Н., Капарон М., Халтгрен С.Дж. Инфекции мочевыводящих путей: эпидемиология, механизмы заражения и варианты лечения. Nat Rev Microbiol. 2015; 13 (5): 269–84.
CAS Статья PubMed PubMed Central Google Scholar
Brogaard SL, Nielsen MB, Nielsen LU, Albretsen TM, Bundgaard M, Anker N, Appel M, Gustavsen K, Lindkvist RM, Skjoldan A, et al. Затраты на здравоохранение и социальную помощь при пневмонии в Дании: исследование на основе регистров всех граждан и пациентов с ХОБЛ в трех муниципалитетах.Int J Chron Obstruct Pulmon Dis. 2015; 10: 2303–9.
PubMed PubMed Central Google Scholar
Миллетт Э.Р., Куинт Дж. К., Смит Л., Даниэль Р. М., Томас С. Л.. Заболеваемость внебольничными инфекциями нижних дыхательных путей и пневмонией среди пожилых людей в Соединенном Королевстве: популяционное исследование. PLoS One. 2013; 8 (9): e75131.
CAS Статья PubMed PubMed Central Google Scholar
Нг М., Фриман М.К., Флеминг Т.Д., Робинсон М., Дуайер-Линдгрен Л., Томсон Б., Воллум А., Санман Е., Вульф С., Лопес А.Д. и др. Распространенность курения и потребление сигарет в 187 странах, 1980-2012 гг. ДЖАМА. 2014; 311 (2): 183–92.
CAS Статья PubMed Google Scholar
Ингеман А., Андерсен Дж., Хундборг Х. Х., Свендсен М.Л., Йонсен С.П. Процессы лечения и медицинские осложнения у больных с инсультом. Инсульт. 2011; 42 (1): 167–72.
Артикул PubMed Google Scholar
Muscari A, Puddu GM, Conte C, Falcone R, Kolce B, Lega MV, Zoli M. Клинические предикторы лихорадки у пациентов с инсультом: актуальность назогастрального зонда. Acta Neurol Scand. 2015; 132 (3): 196–202.
CAS Статья PubMed Google Scholar
Юань М.З., Ли Ф., Тиан Х, Ван В., Цзя М., Ван ХФ, Лю Г.В. Факторы риска легочной инфекции у пациентов с инсультом: метаанализ обсервационных исследований.Expert Rev Anti-Infect Ther. 2015; 13 (10): 1289–98.
CAS Статья PubMed Google Scholar
Almeida SR, Bahia MM, Lima FO, Paschoal IA, Cardoso TA, Li LM. Предикторы пневмонии при остром инсульте у больных в отделении неотложной помощи. Arq Neuropsiquiatr. 2015; 73 (5): 415–9.
Артикул PubMed Google Scholar
Альсумрайн М., Мелилло Н., Дебари В.А., Кирмани Дж., Муссави М., Дорайсвами В., Катапалли Р., Корья Д., Адельман М., Миллер Р.Предикторы и исходы пневмонии у пациентов со спонтанным внутримозговым кровоизлиянием. J Intensive Care Med. 2013. 28 (2): 118–23.
Артикул PubMed Google Scholar
Brogan E, Langdon C, Brookes K, Budgeon C, Blacker D. Дисфагия и факторы, связанные с респираторными инфекциями в первую неделю после инсульта. Нейроэпидемиология. 2014; 43 (2): 140–4.
Артикул PubMed Google Scholar
Брюнинг Т., Аль-Халед М. Пневмония, связанная с инсультом, у пациентов с тромболизацией: частота и исход. J Stroke Cerebrovasc Dis. 2015; 24 (8): 1724–9.
Артикул PubMed Google Scholar
Чамблер Н.Р., Уильямс Л.С., Уэллс К.К., Ло А.С., Надо С., Пейшото А.Дж., Горман М., Бойс Д.Л., Конкато Дж., Бравата Д.М. Вывод и проверка клинической системы прогнозирования пневмонии при остром инсульте. Нейроэпидемиология. 2010. 34 (4): 193–9.
Артикул PubMed PubMed Central Google Scholar
Кольбер Дж. Ф., Трайстман Р. Дж., Пуассон С. Н., Херсон П. С., Гинде А. А.. Связанные с полом различия в риске госпитального сепсиса и пневмонии после острого ишемического инсульта. J Stroke Cerebrovasc Dis. 2016; 25 (10): 2399–404.
Артикул PubMed PubMed Central Google Scholar
Дзедзич Т., Пера Дж., Климкович А., Турай В., Словик А., Рог Т.М., Щудлик А.Уровень сывороточного альбумина и нозокомиальная пневмония у пациентов с инсультом. Eur J Neurol. 2006. 13 (3): 299–301.
CAS Статья PubMed Google Scholar
Гаргано Дж. У., Венер С., Ривз М. Половые различия в лечении острого инсульта в общегосударственном регистре инсультов. Инсульт. 2008. 39 (1): 24–9.
Артикул PubMed Google Scholar
Hoffmann S, Malzahn U, Harms H, Koennecke HC, Berger K, Kalic M, Walter G, Meisel A, Heuschmann PU, Berlin Stroke R, et al.Разработка клинической шкалы (A2DS2) для прогнозирования пневмонии при остром ишемическом инсульте. Инсульт. 2012. 43 (10): 2617–23.
Артикул PubMed Google Scholar
Hoffmeister L, Lavados PM, Comas M, Vidal C, Cabello R, Castells X. Показатели эффективности стационарной помощи при остром ишемическом инсульте в государственных больницах Чили. BMC Neurol. 2013; 13:23.
Артикул PubMed PubMed Central Google Scholar
Hug A, Dalpke A, Wieczorek N, Giese T, Lorenz A, Auffarth G, Liesz A, Veltkamp R. Объем инфаркта является основным фактором, определяющим постинсультную функцию иммунных клеток и восприимчивость к инфекции. Инсульт. 2009. 40 (10): 3226–32.
Артикул PubMed Google Scholar
Ji R, Shen H, Pan Y, Wang P, Liu G, Wang Y, Li H, Wang Y, Китайский национальный регистр инсультов I. Новая оценка риска для прогнозирования пневмонии после острого ишемического инсульта.Инсульт. 2013; 44 (5): 1303–1309.
CAS Статья PubMed Google Scholar
Джи Р, Шен Х, Пан И, Ду В, Ван П, Лю Дж, Ван И, Ли Х, Чжао Х, Ван Й и др. Оценка риска для прогнозирования внутрибольничной пневмонии после спонтанного внутримозгового кровоизлияния. Инсульт. 2014. 45 (9): 2620–8.
Артикул PubMed Google Scholar
Квон Х.М., Чон С.В., Ли С.Х., Юн Б.В.Оценка пневмонии: простая шкала для прогнозирования пневмонии после острого инсульта. Am J Infect Control. 2006. 34 (2): 64–8.
Артикул PubMed Google Scholar
Лакшминараян К., Цай А.В., Тонг Х, Васкес Дж., Пикок Дж. М., Джордж М.Г., Люпкер Р.В., Андерсон, округ Колумбия. Полезность скрининга на дисфагию позволяет прогнозировать постинсультную пневмонию. Инсульт. 2010. 41 (12): 2849–54.
Артикул PubMed PubMed Central Google Scholar
Li Y, Song B, Fang H, Gao Y, Zhao L, Xu Y. Внешнее подтверждение оценки A2DS2 для прогнозирования связанной с инсультом пневмонии в китайской популяции: проспективное когортное исследование. PLoS One. 2014; 9 (10): e109665.
Артикул PubMed PubMed Central Google Scholar
Ляо CC, Ши CC, Yeh CC, Chang YC, Hu CJ, Lin JG, Chen TL. Влияние диабета на риск и исходы инсульта: два общенациональных ретроспективных когортных исследования.Медицина (Балтимор). 2015; 94 (52): e2282.
Артикул PubMed Central Google Scholar
Маэшима С., Осава А., Хаяси Т., Танахаши Н. Пожилой возраст, двусторонние поражения и тяжелый неврологический дефицит коррелируют с пневмонией, связанной с инсультом. J Stroke Cerebrovasc Dis. 2014; 23 (3): 484–9.
Артикул PubMed Google Scholar
Марчиньяк К., Коруц А.В., Лин Э, Рот Э, Велти Л., Ловелл Л.Изучение выбранных клинических факторов и использования лекарств в качестве факторов риска пневмонии во время реабилитации после инсульта: исследование случай-контроль. Am J Phys Med Rehabil. 2009. 88 (1): 30–8.
Артикул PubMed Google Scholar
Masrur S, Smith EE, Saver JL, Reeves MJ, Bhatt DL, Zhao X, Olson D, Pan W., Hernandez AF, Fonarow GC, et al. Скрининг на дисфагию и внутрибольничную пневмонию у пациентов с острым ишемическим инсультом: выводы из руководства — инсульт.J Stroke Cerebrovasc Dis. 2013; 22 (8): e301–9.
Артикул PubMed Google Scholar
Ribeiro PW, Cola PC, Gatto AR, da Silva RG, Luvizutto GJ, Braga GP, Schelp AO, de Arruda Henry MA, Bazan R. Взаимосвязь между дисфагией, шкалой инсульта Национального института здравоохранения и предикторами пневмонии после ишемического инсульта. J Stroke Cerebrovasc Dis. 2015; 24 (9): 2088–94.
Артикул PubMed Google Scholar
Scheitz JF, Endres M, Heuschmann PU, Audebert HJ, Nolte CH. Снижение риска постинсультной пневмонии у пациентов с тромболизированным инсультом при продолжении лечения статинами. Int J Stroke. 2015; 10 (1): 61–6.
Артикул PubMed Google Scholar
Smith CJ, Bray BD, Hoffman A, Meisel A, Heuschmann PU, Wolfe CD, Tyrrell PJ, Rudd AG, Межвузовская рабочая группа G по инсульту. Может ли новая оценка клинического риска улучшить прогнозирование пневмонии при лечении острого инсульта? Многоцентровое когортное исследование в Великобритании.J Am Heart Assoc. 2015; 4 (1): e001307.
Артикул PubMed PubMed Central Google Scholar
Суи Р., Чжан Л. Факторы риска инсульта-ассоциированной пневмонии у китайских пациентов. Neurol Res. 2011; 33 (5): 508–13.
Артикул PubMed Google Scholar
Warnecke T, Ritter MA, Kroger B, Oelenberg S, Teismann I, Heuschmann PU, Ringelstein EB, Nabavi DG, Dziewas R.Волоконно-оптическая шкала тяжести эндоскопической дисфагии позволяет прогнозировать исход острого инсульта. Cerebrovasc Dis. 2009. 28 (3): 283–9.
Артикул PubMed Google Scholar
Ямамото К., Ко Х., Шимада Х, Такеучи Дж., Ямакава Ю., Кавамура М., Мики Т. Инфаркт мозга в левом полушарии по сравнению с правым полушарием увеличивает риск аспирационной пневмонии. Osaka City Med J. 2014; 60 (2): 81–6.
PubMed Google Scholar
Zhang X, Wang F, Zhang Y, Ge Z. Факторы риска развития пневмонии у пациентов с сахарным диабетом после острого ишемического инсульта. J Int Med Res. 2012; 40 (5): 1860–5.
CAS Статья PubMed Google Scholar
Миннеруп Дж., Вершинг Х., Брокинкель Б., Дзевас Р., Хойшманн ПУ, Набави Д.Г., Рингельштейн Э.Б., Шабиц В.Р., Риттер М.А. Влияние местоположения и размера поражения на частоту постинсультных инфекций.J Neurol Neurosurg Psychiatry. 2010. 81 (2): 198–202.
Артикул PubMed Google Scholar
Эрсоз М., Улусой Х., Октар М.А., Акьюз М. Инфекция мочевыводящих путей и бактериурия у пациентов с инсультом: частота, патогенные микроорганизмы и факторы риска. Am J Phys Med Rehabil. 2007. 86 (9): 734–41.
Артикул PubMed Google Scholar
Физиология и патофизиология после травмы головного мозга
Регулирование температуры мозга в значительной степени зависит от метаболической активности ткани головного мозга и остается сложной.В клинической практике интенсивной терапии в настоящее время настоятельно рекомендуется постоянный мониторинг внутренней температуры у пациентов с черепно-мозговой травмой. После серьезной черепно-мозговой травмы температура мозга часто выше и может изменяться независимо от системной температуры. Было показано, что в случае черепно-мозговой травмы мозг чрезвычайно чувствителен и уязвим к небольшим колебаниям температуры. Профилактика лихорадки была предложена в качестве терапевтического инструмента для ограничения повреждения нейронов. Однако контроль температуры после черепно-мозговой травмы, субарахноидального кровоизлияния или инсульта может оказаться сложной задачей.Кроме того, жар может иметь положительные эффекты, особенно в случаях, связанных с инфекциями. Хотя терапевтическая гипотермия показала положительный эффект на животных моделях, ее использование все еще обсуждается в клинической практике. Цель данной статьи — описать физиологию и патофизиологию изменений температуры мозга после травмы головного мозга и изучить влияние контроля температуры мозга после такой травмы.
1. Введение
Многие популярные речевые обороты связывают активность мозга с температурой.В настоящее время хорошо известно, что, хотя температура мозга в значительной степени зависит от метаболической активности ткани мозга, регулирование этих двух параметров является сложным. Взаимосвязь между температурой и обменом веществ всегда интерактивна. Хотя метаболизм клеток головного мозга является основным определяющим фактором температуры мозга, незначительные изменения температуры мозга могут привести к значительным изменениям метаболизма нервных клеток и, следовательно, функции мозга. Жесткий контроль температуры мозга имеет решающее значение для оптимального функционирования мозга в различных физиологических условиях, таких как интенсивная физическая активность или полный отдых.
В клинической практике интенсивной терапии настоятельно рекомендуется постоянный мониторинг внутренней температуры у пациентов с черепно-мозговой травмой [1]. Было показано, что в случае травм мозг чрезвычайно чувствителен и уязвим к небольшим колебаниям температуры. Действительно, лихорадка считается вторичным повреждением головного мозга у нейрохирургических пациентов с тяжелой черепно-мозговой травмой [2], субарахноидальным кровоизлиянием [3] или инсультом [4], у которых гипертермия является частым явлением. В этих случаях направленная нормотермия может использоваться для ограничения вторичного повреждения головного мозга.Эта статья направлена на описание физиологии и патофизиологии, связанных с изменениями температуры мозга, с особым вниманием к остро больным пациентам, страдающим тяжелой черепно-мозговой травмой, инсультом или субарахноидальным кровоизлиянием.
2. Физиология температуры мозга
Производство энергии в организме человека происходит за счет метаболизма глюкозы, белков и жиров. Конечными продуктами аэробного метаболизма являются углекислый газ (CO 2 ) и вода. Производство аденозинтрифосфата (АТФ), основной молекулы внутриклеточного хранения энергии, сопровождается нагревом (рис. 1).Энергия, теряемая при переносе электронов и окислительном фосфорилировании, в значительной степени преобразуется в тепло и способствует поддержанию температуры тела на уровне 37 ° C. При сжигании глюкозы и белка получается 4,1 ккал / кг, а при сжигании жира — 9,3 ккал / кг. Таким образом, производство тепла зависит от энергетического обмена [5].
Хотя мозг составляет всего от 2 до 3% массы тела человека, он использует 20% и 25% от общего потребления организмом кислорода и глюкозы, соответственно.Даже в состоянии покоя метаболическая активность тканей головного мозга высока. Энергетический обмен в головном мозге в основном аэробный; 95% глюкозы, используемой мозгом, подвергается окислительному метаболизму. Примерно 40% энергии, обеспечиваемой глюкозой, используется для производства АТФ; остаток (примерно 60%) превращается в тепло [5]. В нормальных условиях производство тепла в головном мозге уравновешивается его рассеиванием. В отличие от других органов, таких как мышцы, тепло, производимое в головном мозге, нелегко рассеивается из-за защиты мозга черепом.Температура мозга зависит в первую очередь от трех факторов: местного производства тепла, температуры кровеносных сосудов и церебрального кровотока. Рассеяние выделяемого тепла улучшается за счет анатомической специализации сосудов, которая обеспечивает теплообмен.
2.1. Теплообменники
Теплообменники различаются в зависимости от вида. У кошачьих артериальная кровь для головного мозга протекает через сосудистую сеть у основания черепа. У этих видов сонная артерия находится очень близко к кавернозному или крыловидному синусу, который принимает холодную кровь со слизистой оболочки носа.Этот теплообмен вызывает избирательное охлаждение мозга (SBC), которое зависит от симпатической активности [6]. У собак каротидная сетка находится в зачаточном состоянии [7]. Однако большая поверхность кавернозного синуса, которая находится в тесном контакте с основанием мозга, позволяет напрямую охлаждать ростральный ствол мозга. Подобные региональные SBC были обнаружены у других млекопитающих. У людей лицо и слизистые оболочки носа, которые являются источниками холодной венозной крови, имеют небольшие размеры по сравнению с массой мозга.Более того, у человека не существует специализированного теплообменника, подобного сетчатой сонной артерии, и значительная часть кровоснабжения головного мозга обеспечивается позвоночными артериями, которые не имеют прямого контакта с холодной венозной кровью [6]. Холодная кровь с кожи головы может течь в череп и охлаждать мозг через эмиссарные вены височных и теменных костей [8]. Более того, корковые артерии головного мозга могут преодолевать расстояния от 15 до 20 см в трещинах и бороздах на поверхности мозга, прежде чем достигнут своего конечного пункта назначения в коре и прилегающем белом веществе [9].Перфорирующие вены, соединяющие кожу головы с венозными синусами твердой мозговой оболочки, позволяют венозным синусам получать прохладную кровь. Таким образом, температура крови в носовых пазухах зависит от относительного вклада экстракраниальных и внутричерепных притоков. Путь скальп-синус может быть источником регионарного SBC. Еще один источник регионарного SBC — верхние дыхательные пути. Носовые полости помогают охлаждать артериальную кровь за счет теплообмена между вдыхаемым воздухом и кровью слизистой оболочки носа.Толщина кости между носом и дном передней черепной ямки обеспечивает теплообмен и охлаждение лобных долей [10]. Когда эти теплообменники закорочены, например, при механической вентиляции с интубацией трахеи, венозная кровь из носовых полостей больше не охлаждается при вентиляции. Высокая частота дыхания, наблюдаемая в связи с повышением температуры тела, скорее всего, способствует увеличению теплопередачи в носовых полостях, что приводит к защите мозга за счет снижения температуры крови, питающей мозг.
2.2. Тепловые отсеки
У человека описаны два тепловых отсека: центральный и периферийный [11]. Центральный отсек включает ткани, которые обладают высокой перфузией при любых условиях. В этом отсеке происходит быстрый теплообмен, и теоретически его температура относительно однородна. Туловище, голова, а также мозг составляют центральный отсек. Периферический отсек включает ткани, температура в которых переменная и неоднородная (нижние конечности, руки и кожа).Температура в периферическом отделении обычно на 2–4 ° C ниже, чем в центральном отделении, и сильно зависит от тонуса сосудов.
Интегративный центр, регулирующий внутреннюю температуру, расположен в гипоталамусе [12]. Хотя механизмы ответа этого центра еще полностью не известны, они, вероятно, включают нейротрансмиттеры, такие как норадреналин, дофамин, ацетилхолин, нейропептиды и простагландины, такие как PGE2. Внутренняя температура подвергается циркадным колебаниям, которые контролируются высвобождением мелатонина из супрахиазматического ядра.Гипоталамический центр также регулирует температуру центрального компартмента в ответ на информацию от терморецепторов (моносинаптический путь), питание, двигательную активность или секрецию кортикостероидов (плюрисинаптический путь).
Регулирование температуры, или гомеотермия, остается очень активной областью исследований. Были описаны две нейронные модели регуляции температуры у млекопитающих: модель заданного значения и модель нулевой зоны. Модель уставки включает регулируемую уставку и сигналы от периферических и / или центральных нейронов, чувствительных к температуре, которые интегрируются и сравниваются с уставкой на уровне гипоталамуса.Термогенные или термолитические реакции могут скорректировать внутреннюю температуру до заданного уровня [13, 14]. Здесь считается, что лихорадка или переохлаждение являются результатом изменения уставки [15]. Альтернативная точка зрения состоит в том, что внутренняя температура тела защищается на уровне «установленного уровня» или «нулевой зоны», а не на уровне уставки [16]. Существование этой «нулевой зоны» было продемонстрировано у нескольких видов, включая человека [16]. Модель нулевой зоны основана на взаимодействии двух переменных, а не на сравнении переменной с постоянной уставкой.Взаимное перекрестное ингибирование между датчиком холода и эффекторным путем производства тепла и теплым датчиком и эффекторным путем потери тепла с целью защиты нулевой зоны внутренней температуры является основой этой модели [17].
2.3. Психологические колебания температуры мозга
2.3.1. Активность мозга
Энергетический метаболизм нейронов в основном используется для восстановления мембранного потенциала после деполяризации клеток [18]. Это предполагает связь между клеточным метаболизмом и электрической активностью.Учитывая, что большая часть энергии, используемой для метаболизма нейронов, в конечном итоге преобразуется в тепло, производство тепла мозгом является важной характеристикой метаболической активности мозга. У животных наблюдались значительные изменения температуры мозга на 2–3 ° C после поведенческих стимулов [19, 20]. Увеличение внутримозгового производства тепла, по-видимому, является основной причиной гипертермии мозга, наблюдаемой у животных во время поведенческих стимулов. Действительно, сначала повышается температура мозга, а затем температура крови [21, 22].У бодрствующих субъектов (или животных) в этих условиях кровь, поступающая в мозг, поэтому холоднее, чем сам мозг, и температурный градиент между мозгом и артериальной кровью увеличивается с интенсивностью поведенческих стимулов.
Поэтому повышенная активность мозга и метаболизм сопровождается повышением температуры. Одновременно как у животных, так и у людей увеличивается церебральный кровоток (CBF). Повышение локальной церебральной температуры в результате усиления местного метаболизма можно рассматривать как одну из причин увеличения местного кровотока, которое способствует взаимодействию между CBF и метаболизмом.
2.3.2. Общая анестезия
Как описано ранее, в состоянии бодрствования мозг теплее, чем артериальная кровь. Снижение церебрального метаболизма, вызванное общей анестезией, может повлиять на температуру мозга. У крыс, которым вводили пентобарбитал, уретан или альфа-хлоралозу, температура головного мозга снижалась быстрее, чем ректальная температура [23]. Таким образом, под общей анестезией здоровый мозг может быть холоднее, чем кровь, как показали эти исследования на животных.
2.4. Где нам измерять температуру?
Центральную температуру можно оценить путем измерения температуры нижней части пищевода, легочной артерии, носоглотки или барабанной полости [24]. Температура головного мозга обычно считается «центральной» температурой, и при отсутствии внутричерепной патологии ее можно оценить путем измерения температуры барабанной перепонки или пищевода. Эти температуры легко измерить, и их часто используют для отслеживания изменений температуры мозга. Однако в случаях тяжелого повреждения головного мозга оценки, полученные с помощью таких измерений, могут быть неточными [25, 26].
У человека центр мозга на 0,5–1 ° C теплее эпидурального пространства [27]. Температура поверхности мозга всегда ниже, чем температура его ядра, но она также более изменчива. По этим причинам рекомендуется вводить датчики температуры на глубину не менее 1,5–2 см в паренхиму головного мозга [28]. В настоящее время доступно несколько датчиков температуры, все из которых используют технологию термопар. Некоторые из них предназначены для интрапаренхиматозного, а другие — для внутрижелудочкового применения.Анализ литературы не позволяет рекомендовать один зонд по сравнению с другим. Чаще всего используются интрапаренхимальные зонды [29].
Совсем недавно были разработаны методы неинвазивного измерения температуры мозга с помощью магнитно-резонансной спектроскопии (MRS) [30, 31]. Экспериментальные исследования на фантомах [31] и экспериментальных моделях [32] показали тесную корреляцию между температурами, измеренными с помощью MRS, и температурами, измеренными с помощью имплантированных зондов. MRS использовался для измерения температуры у здоровых взрослых людей-добровольцев, во время охлаждения головы, у детей, у пациентов с опухолями головного мозга и у пациентов с ишемическим инсультом [33].
3. Физиологические изменения в мозге, вызванные вариациями температуры головного мозга
Изменения температуры головного мозга существенно влияют на сосудистые, метаболические и нейрональные параметры. Поскольку они оказывают большое влияние на физиологию головного мозга, понимание этих изменений имеет важное значение.
3.1. Церебральный метаболизм
Взаимосвязь между температурой и мозговой активностью широко изучалась с помощью электрофизиологии. Исследования на животных показали тесную взаимосвязь между температурой мозга и скоростью метаболизма кислорода в мозге (CMRO 2 ) [34].Предыдущие исследования на крысах и собаках показали, что изменения температуры более чем на 1 ° C значительно влияют как на функциональный неврологический исход, так и на гистопатологию [35]. Церебральный метаболизм изменяется линейно с температурой мозга, с изменениями метаболизма от 6 до 8% на градус Цельсия температуры [36, 37]. У собак, находящихся под наркозом при 28 ° C, церебральный метаболизм составляет только 50% от метаболизма при 37 ° C [38]. Следовательно, при таких температурах потребление кислорода мозгом резко снижается. Также было показано, что все пути производства энергии в головном мозге, включая скорость церебрального метаболизма глюкозы (CMR glu ) и лактата, снижаются в 2–4 раза с каждым понижением температуры на 10 ° C [39 ].
In vitro температура влияет на пассивные свойства нейрональной мембраны и синаптические ответы (постпотенциал). Синаптическая передача зависит от температуры. Влияние температуры на высвобождение нейротрансмиттеров (возбуждающий постсинаптический потенциал) кажется более выраженным, чем влияние температуры на сам синаптический ответ [40, 41]. Эти температурно-зависимые изменения электрофизиологических свойств могут быть связаны с воздействием на ионные каналы нейронов.Действительно, некоторые кальциевые или потенциалзависимые натриевые каналы регулируются температурой [42, 43]. Более того, диффузия глутамата и токсичность повышаются с повышением температуры [44]. Изменения температуры изменяют высвобождение, обратный захват и диффузию нейромедиаторов в головном мозге. На животных моделях ишемии или очагового повреждения головного мозга температура мозга выше 39 ° C связана с повышенным уровнем внеклеточных возбуждающих аминокислот, открытием гематоэнцефалического барьера и увеличением протеолиза цитоскелета нейронов [45].Эксайтотоксичность зависит от температуры мозга.
3.2. Церебральный кровоток
Церебральный кровоток (CBF) также изменяется с температурой, и эти изменения пропорциональны изменениям в мозговом метаболизме, вызванным колебаниями температуры [46]. Из-за физиологической связи между CBF и метаболизмом снижение температуры мозга вызывает сопутствующее снижение метаболизма и кровотока [47], что приводит к снижению внутримозгового сосудистого объема и внутричерепного давления [48].Однако некоторые исследования предполагают, что связь между CMRO 2 и CBF является нелинейной [49]. Во время легкой гипотермии после остановки сердца у человека CBF низкий [47]. Нагревание в течение 24 часов увеличивает CBF до нормальных значений. Недавнее исследование 10 пациентов в коме, которые были успешно реанимированы после остановки сердца вне больницы, сообщило о влиянии легкой терапевтической гипотермии на CBF и извлечение кислорода из мозга. Средняя внутренняя температура в начале исследования составляла 34,3 ° C, и эта температура поддерживалась между 32 и 34 ° C в течение 72 часов.Средняя скорость кровотока в средней мозговой артерии (MFV MCA ) была низкой при поступлении и значительно увеличилась через 72 часа [50]. Средняя оксигенация луковицы яремной впадины (SjbO 2 ) была нормальной у большинства пациентов на протяжении всего исследования. Наблюдение нормального SjbO 2 вместе с низким MFV MCA убедительно свидетельствует о снижении церебрального метаболизма в течение первых 24–48 часов легкой терапевтической гипотермии. Однако тот факт, что SjbO 2 достиг плато через 24–30 часов после поступления, указывает на относительно низкую экстракцию кислорода головным мозгом.Эти данные предполагают, что церебральная метаболическая связь может быть потеряна во время переохлаждения.
3.3. Углекислый газ, pH и кислород
Уровень газообразного углекислого газа (CO 2 ) или парциальное давление CO 2 (PaCO 2 ) в артериальной крови зависит от коэффициента растворимости этого газа, который равен сам зависит от температуры. При понижении температуры количество газообразного CO 2 уменьшается. Другими словами, когда бутылка холодная, в бутылке шампанского становится меньше пузырей.Более того, энергетический метаболизм клеток, конечными продуктами которого являются вода и CO 2 , снижается с температурой. Следовательно, производство CO 2 снижается при гипотермии. Таким образом, как по физическим, так и по метаболическим причинам, PaCO 2 уменьшается с температурой [51]. Точно так же pH изменяется под воздействием температуры из-за изменений PaCO 2 : гипертермия сопровождается ацидозом, а гипотермия — алкалозом [52]. Газ CO 2 проникает через гематоэнцефалический барьер и передает индуцированные модификации (например,ж., алкалоз при переохлаждении) во внеклеточную среду, регулирующую состояние сосудистого тонуса артериол. Это объясняет, почему гипокапния, вызванная гипотермией, может вызывать сужение артериол и снижение внутричерепного давления [53].
Уменьшение PaCO 2 частично является результатом снижения потребления кислорода (O 2 ) [53]. Это снижение может быть полезным в регионах с высоким риском ишемии. Однако этому эффекту противодействует увеличение сродства гемоглобина к кислороду, которое происходит при понижении температуры (рис. 2).Повышенное сродство гемоглобина к кислороду препятствует диффузии кислорода к тканям.
3.4. Воспаление головного мозга и гематоэнцефалический барьер
У животных после очаговой травмы (перкуссия жидкости) воспалительная реакция ушибленных и неконтактных участков мозга зависит от температуры. Накопление лейкоцитов увеличивается с повышением температуры [54]. Эти изменения воспалительных процессов могут играть важную роль в посттравматическом каскаде. Более того, проницаемость гематоэнцефалического барьера, по-видимому, также зависит от температуры мозга.Повышение температуры головного мозга может повредить эндотелиальные клетки головного и спинного мозга, что приведет к диффузии сывороточных белков через гематоэнцефалический барьер и способствует возникновению отека мозга [55]. Даже если гипертермия возникает через четыре дня после травмы (животная модель перкуссии жидкости), гипертермия головного мозга увеличивает смертность и увеличивает повреждения гематоэнцефалического барьера и аксонов [56].
4. Изменения температуры мозга при нейроинтенсивной терапии
После серьезной черепно-мозговой травмы температура мозга часто выше системной температуры и может изменяться независимо, что затрудняет экстраполяцию температуры мозга от «центральной» температуры.Росси и др. [25] обнаружили, что количество измерений температуры> 38 ° C в головном мозге было на 15% выше, чем внутренняя температура тела, измеренная одновременно в легочной артерии. Было обнаружено, что разница между температурой мозга и внутренней температуры достигает 2 ° C в зависимости от характеристик пациента, размещения зонда и взаимодействия с другими физиологическими переменными [25, 57]. По мере того, как пациенты становятся гипертермическими, разница между температурой мозга и внутренней температурой увеличивается, что может указывать на то, что истинная частота приступов лихорадки в головном мозге даже выше, чем сообщалось в крупных наблюдательных исследованиях, в которых измерялась только внутренняя температура тела.
4.1. Тяжелая черепно-мозговая травма
Травматическая черепно-мозговая травма (ЧМТ) вызывает очаговые или множественные повреждения головного мозга, нарушение гематоэнцефалического барьера, ишемию и реперфузию, диффузное повреждение аксонов и развитие церебрального микрокровотечения, внутричерепных гематом или контузионных участков [58]. Первичное повреждение может сопровождаться вторичным повреждением, которое приводит к повышенной гибели клеток и плохому неврологическому исходу [58, 59].
В двух исследованиях, проведенных у пациентов с седативным действием, страдающих тяжелой ЧМТ, средняя температура мозга была примерно на 1 ° C выше, чем средняя ректальная температура в первые посттравматические дни [25, 60].Это различие усиливается, когда у пациентов появляется лихорадка. При отсутствии инфекционной причины одним из объяснений этого явления может быть «перезагрузка» гипоталамического центра терморегуляции. Вскрытие действительно обнаружило высокую частоту (42%) поражений гипоталамуса у пациентов, умерших после тяжелой ЧМТ [61]. Однако другие причины могут вызвать повышение «внутримозговой» температуры после ЧМТ. Наблюдаемое повышение температуры мозга может быть связано с посттравматическими изменениями метаболизма мозга (гипергликолиз) [62], CBF (гиперемия) [63] или местной воспалительной реакцией (напр.g., повышенный уровень интрацеребрального интерлейкина-1 β ) [64]. Разделение энергетического обмена в случае травмы головного мозга также может способствовать выработке тепла; в таких случаях действительно может произойти короткое замыкание синтеза АТФ. Снижение протонного градиента и потенциала митохондриальной мембраны ускоряет клеточное дыхание, и дыхание больше не связано с фосфорилированием аденозиндифосфата (АДФ), становясь чисто термогенным процессом (рис. 1).
Инверсия градиента температуры мозга / тела, при которой температура мозга опускается ниже «общей» температуры тела, связана с плохим неврологическим прогнозом при тяжелой ЧМТ [65].Это явление также наблюдается при прогрессировании до смерти мозга [66]. Снижение CBF, связанное с повышенным внутричерепным давлением, скорее всего, вызывает снижение температуры мозга до температуры ниже центральной. Следовательно, вариации этого градиента могут отражать возникновение церебральной ишемии.
С другой стороны, ранняя лихорадка часто возникает после ЧМТ и связана с более серьезной тяжестью при обращении и с наличием диффузного аксонального повреждения, отека мозга на начальном сканировании компьютерной томографии головы, систолической гипотензии, гипергликемии и лейкоцитоза [2] .Повышение температуры в течение первых 24 часов после ЧМТ связывают с реакцией острой фазы [67]. В других исследованиях сообщалось, что наличие крови в спинномозговой жидкости, особенно во внутрижелудочковых пространствах, может стимулировать центры терморегуляции гипоталамуса и приводить к повышению температуры тела [68]. Как и все другие травмы головного мозга, лихорадка после ЧМТ может быть связана с развитием инфекции, возникновением воспалительных реакций и дисфункцией гипоталамуса после травмы.Наблюдательные исследования показали, что возникновение лихорадки в первую неделю после травмы связано с повышением внутричерепного давления, неврологическими нарушениями и длительным пребыванием в отделении интенсивной терапии [69, 70]. Jiang et al. сообщили о тесной взаимосвязи между лихорадкой и исходом в исследовании 846 пациентов с ЧМТ [71]. Чайлдс и др. предположили, что пациенты, у которых была самая высокая и самая низкая средняя температура мозга в течение первых 48 часов после травмы, с большей вероятностью имели худший исход и умерли [72].Соукуп и др. также сообщили о плохом исходе через 3 месяца у пациентов с ЧМТ, у которых наблюдалась экстремальная температура мозга [65]. Недавно Sacho et al. провели исследование, в котором измеряли внутрипаренхиматозную температуру мозга у пациентов с тяжелой ЧМТ в течение первых 5 дней в отделении интенсивной терапии. Температура мозга в диапазоне от 36,5 ° C до 38 ° C в течение первых 24 часов была связана с более низкой вероятностью смерти (10–20%). Температура мозга за пределами этого диапазона была связана с более высокой вероятностью смерти и плохими неврологическими исходами через 3 месяца [73].Доказательства неблагоприятного воздействия небольшого повышения температуры мозга на вторичное повреждение нейронов [74] и смертность [4, 56] в настоящее время обширны. Гипертермия вызывает высвобождение возбуждающих аминокислот и свободных радикалов, усугубляет разрушение гематоэнцефалического барьера, усиливает протеолиз цитоскелета и увеличивает скорость церебрального метаболизма [75–77]. Недавно Stocchetti et al. описали влияние гипертермии на нейрохимию и оксигенацию мозга после острой черепно-мозговой травмы у человека [78]. Во время начала лихорадки церебральная оксигенация сохранялась, и никаких признаков анаэробного метаболизма (стабильные концентрации глюкозы, лактата, пирувата и глутамата и соотношение лактата к пирувату) не регистрировалось, возможно, из-за сопутствующего увеличения CBF.
В качестве нейрозащитного лечения ЧМТ было предложено терапевтическое охлаждение или целевое регулирование температуры. С исторической точки зрения, Фэй впервые ввел неврологическую терапевтическую гипотермию в 1943 году в случае тяжелой ЧМТ [79]. Основное нейрозащитное действие терапевтической гипотермии было связано с уменьшением CMRO 2 , которое тесно связано с потреблением кислорода и глюкозы и выработкой лактата в нейронах [80, 81]. Однако описаны многие нейрозащитные эффекты гипотермии, в том числе снижение метаболизма (позволяющее снизить накопление лактата в интерстициальной ткани и поддержание физиологического баланса pH тканей) [82], снижение внутричерепного давления (ВЧД) [83], стабилизация гематоэнцефалического барьера. , снижение выработки свободных радикалов, снижение накопления молочной кислоты и других нейротоксинов, повышение утилизации глюкозы, облегчение противовоспалительных реакций и антиапоптотических путей, а также снижение высвобождения эксайтотоксических нейромедиаторов, таких как глутамат [82, 84–87].Снижение внутричерепного давления, вызванное гипотермией, происходит за счет нескольких механизмов: уменьшение CMRO 2 и, следовательно, CBF и объема церебральной крови, уменьшение ишемического отека и снижение PaCO 2 .
Ряд исследований на животных моделях показал, что переохлаждение может улучшить исход после экспериментальной ЧМТ [84, 88, 89]. Эти результаты привели к клиническим испытаниям. Исследования с участием пациентов с рефрактерным повышенным ВЧД показали снижение ВЧД во время охлаждения [84, 90–93].Одно проспективное многоцентровое рандомизированное исследование не обнаружило положительного влияния на исход [48]. Однако в подгруппе пациентов, у которых при поступлении наблюдалась гипотермия, 52% пациентов, отнесенных к группе гипотермии, имели плохие результаты, в то время как 76% пациентов, отнесенных к группе нормотермии, имели плохие результаты. Недавний метаанализ предполагает, что лечение гипотермией может снизить смертность и улучшить неврологический исход, если лечение продолжается более 48 часов [94]. Рекомендации по ведению тяжелой ЧМТ ограничены рекомендациями по профилактической гипотермии до уровня III из-за потенциальных смешивающих факторов [95].
Терапевтическая гипотермия кажется привлекательным инструментом, но для ее обработки требуются опытные бригады. В нашем отделении нейроинтенсивной терапии мы рекомендуем использовать его у пациентов с тяжелой ЧМТ с переохлаждением по прибытии в больницу и в качестве варианта третьей линии для лечения повышенного внутричерепного давления (целевая температура 33 ° C в течение не менее 48 часов).
Лихорадку также можно рассматривать как адаптивную реакцию, повышающую способность контролировать инфекцию. Индукция нормотермии может нарушить этот адаптивный ответ.Фактически, сообщалось о том, что использование жаропонижающих средств продлевает развитие определенных типов бактериальных и вирусных инфекций [96, 97]. Исследования показали корреляцию между фебрильной реакцией и повышенной выживаемостью у пациентов с внебольничной пневмонией, Escherichia coli, Streptococcus pneumonia, и Pseudomonas aeruginosa, сепсисом [98–101]. Лихорадка также оказывает прямое влияние на подавление репликации некоторых микроорганизмов и усиливает антибактериальный эффект различных антибиотиков [102, 103].Schulman et al. сообщили о более высоких показателях смертности у тяжелобольных пациентов при агрессивном лечении (лечение при температуре> 38,5 ° C) по сравнению с разрешающей группой (лечение при температуре> 40 ° C) [104]. Однако недавно Schortgen et al. описали эффект внешнего охлаждения для контроля температуры во время септического шока в многоцентровом рандомизированном контролируемом исследовании. Температура тела была ниже в охлаждающей группе через 2 часа (36,8 ° C, против , 38,4 ° C), что привело к значительному снижению дозировки вазопрессоров и лучшему преодолению шока.Более того, уровень смертности на 14-й день был лучше в охлаждающей группе (19% против 34%) [105]. Таким образом, в этом исследовании было продемонстрировано, что контроль температуры во время септического шока безопасен. Однако следует выделить несколько важных моментов этого исследования. Во-первых, основным источником инфекции были легкие, а не брюшная полость; в случаях, связанных с последним, вредные эффекты контроля лихорадки были показаны на экспериментальных моделях [106, 107]. Во-вторых, большинство пациентов в исследовании Шортгена получали соответствующую противомикробную терапию, тем самым смягчая потенциальный негативный эффект контроля лихорадки на защитные силы организма [102].Кроме того, важно подчеркнуть, что целью этого исследования был контроль лихорадки, а не индукция гипотермии. Следует отметить, что в нескольких предыдущих исследованиях был продемонстрирован повышенный риск заражения после легкой терапевтической гипотермии [108, 109].
4.2. Тяжелое субарахноидальное кровоизлияние
Нетравматическое субарахноидальное кровоизлияние (САК) в основном возникает из-за разрыва внутричерепной аневризмы [110]. Внезапное внутреннее кровотечение вызывает высокое ВЧД. Кровотечение из субарахноидальных пространств, иногда с внутрижелудочковым кровоизлиянием или внутрипаренхиматозной гематомой, следует за разрывом аневризмы.Гипоксия ткани головного мозга может возникать в связи со значительным снижением CBF и образованием отека [111]. После тяжелой САК температура мозга обычно выше, чем температура тела [112]. Привлекательная гипотеза предполагает потенциальную роль продуктов распада гема. Молекула гема расщепляется гемоксигеназой до биливердина, железа и окиси углерода (СО) [113]. У крыс внутрижелудочковая инъекция CO повышает температуру тела более чем на 1 ° C [114].
Проспективное исследование пациентов, поступивших с тяжелой формой САК, обнаружило взаимосвязь между температурой мозга и выживаемостью [112].При ЧМТ, когда измеренная температура мозга ниже температуры тела (мочевого пузыря), прогноз очень плохой. Это снижение температуры также может быть связано со значительным снижением CBF.
В острой фазе САК часто наблюдаются изменения в регуляции температуры тела. Лихорадка, определяемая как температура тела> 38,3 ° C, встречается почти у 72% пациентов с аневризмой САК [115, 116]. Неинфекционная лихорадка, обычно начинающаяся в первые 3 дня, часто встречается у пациентов с САК [117]. У пациентов с внутрижелудочковым кровоизлиянием температура тела постоянно повышается (плато) вместо скачков [68].Рефрактерная лихорадка в течение первых 10 дней после САК связана с повышенной смертностью, тяжелой функциональной инвалидностью и когнитивными нарушениями у выживших [3]. Кумулятивное бремя лихорадки, определяемое как сумма времени при температуре тела> 38,3 ° C в течение первых 13 дней, связано с худшим исходом и с более поздним и часто неполным выздоровлением у пациентов с хорошей оценкой и потенциальным поздним выздоровлением у пациентов с плохой степенью [ 118]. Кроме того, лихорадка вызывает нарушение мозгового обмена, и повышенное соотношение лактат / пируват было зарегистрировано с помощью микродиализа во время приступов лихорадки.В совместном исследовании Oddo et al. обнаружили связь между лихорадкой и церебральным метаболическим расстройством и показали, что церебральный метаболический дисбаланс можно уменьшить с помощью контроля лихорадки независимо от управления внутричерепным давлением [119]. Индуцированная нормотермия была связана со значительным снижением соотношения лактат / пируват и меньшим количеством эпизодов церебрального метаболического кризиса, что подтверждает мнение о том, что контроль лихорадки может быть «нейрозащитным». Эти данные свидетельствуют о том, что лихорадка может быть вредной и что ее контроль может уменьшить метаболический дисбаланс.
В недавнем обзоре описывается частота лихорадки, влияние и лечение пациентов с САК [120]. При САК лихорадка связана с худшим исходом и увеличением продолжительности пребывания в стационаре [121] и имеет пагубные последствия независимо от спазма сосудов. Лихорадка также связана с симптоматическим вазоспазмом независимо от тяжести кровотечения или наличия инфекции [113, 122]. Эта ассоциация может быть связана с воспалительной активацией после САК [123], которая может быть причастна к развитию обоих явлений.Помимо тяжести заболевания и количества крови в субарахноидальном пространстве, наличие внутрижелудочкового кровоизлияния является сильным фактором риска развития лихорадки [3, 68]. Лихорадка усугубляет ишемическое повреждение [75], усиливает отек мозга, повышает внутричерепное давление [25] и может привести к снижению уровня сознания.
Гипотермия не изучалась у пациентов с тяжелым САК, находящихся на лечении в отделениях интенсивной терапии. Была предложена глубокая интраоперационная гипотермия для защиты ткани мозга от ишемического повреждения, связанного с операцией.В недавнем обзоре Кокрановского сотрудничества оценивалось влияние интраоперационной легкой гипотермии на послеоперационную смерть и неврологический дефицит у пациентов с внутричерепными аневризмами [124]. Авторы пришли к выводу, что данных недостаточно, чтобы сделать какие-либо выводы, и поэтому не следует рекомендовать терапевтическую гипотермию во время операции у пациентов с аневризматическим САК низкой степени. Недавно в руководстве по лечению аневризматической САК были предложены рекомендации по анестезиологическому лечению во время хирургического и эндоваскулярного лечения.Вызванная гипотермия во время операции по поводу аневризмы обычно не рекомендуется, но может быть разумным вариантом в отдельных случаях (класс III, уровень доказательности B) [125]. В исследовании IHAST сравнивали 499 пациентов, случайно отнесенных к группе интраоперационной гипотермии во время операции по поводу внутричерепной аневризмы (целевая температура 33 ° C), и 501 пациент в группе нормотермии (36,5 ° C) [126]. Целью исследования было определить, приводит ли интраоперационное охлаждение во время открытой краниотомии к улучшению результатов у пациентов с острым аневризматическим САК.Результаты не показали каких-либо существенных различий между двумя группами. Другие исследования не показали положительного влияния гипотермии на когнитивные функции или нейропсихологический исход после САК [127, 128].
Терапевтическая гипотермия обычно не используется и не рекомендуется при тяжелой САК. На практике мы не используем интраоперационное охлаждение из-за отсутствия доказательств его использования.
4.3. Инсульт
Ишемический инсульт — одна из основных причин инвалидности взрослых в промышленно развитых странах [129].Инсульт вызывает необратимое повреждение головного мозга и долгосрочные нарушения. В центральных областях поражения нейрональные клетки гибнут в течение нескольких минут. Вокруг этого ядра уровни CBF могут падать ниже функциональных порогов, но выше порога гибели клеток; эта область получила название полутени [130]. Зона полутени позволяет клеткам выживать только в течение определенного периода времени, но по крайней мере часть ткани в этой зоне потенциально может быть спасена.
После ишемического инсульта температура в областях мозга, пораженных ишемией, выше, чем температура в непораженных частях мозга и остальном теле [33].Клинические испытания терапевтической гипотермии у пациентов с ишемическим инсультом были проведены на основании наблюдений, что на моделях животных гипотермия уменьшает размер церебральных инфарктов более чем наполовину [131]. Кроме того, у пациентов с инсультом более высокая температура тела связана с более неблагоприятным исходом [4].
Процессы, определяющие температуру мозга после ишемического инсульта у человека, до конца не изучены. В ишемическом мозге может быть диссоциация между метаболической активностью и выделением тепла.Системный ответ на повышение системных воспалительных цитокинов после инсульта также может повышать температуру мозга. Интерлейкин-6 (ИЛ-6) запускает высвобождение других провоспалительных цитокинов, и его присутствие важно для возникновения лихорадки [132]. Более высокие уровни IL-6 и белков острой фазы связаны с худшим функциональным исходом после инсульта [133, 134], и одним из возможных механизмов ассоциации с плохим исходом является повышение температуры мозга. Whiteley et al.недавно изучили 44 пациента с острым ишемическим инсультом и обнаружили связь между уровнями ИЛ-6, а также нижестоящими белками острой фазы, такими как С-реактивный белок и фибриноген, и изменениями температуры мозга или тела в течение первых 5 дней после инсульта. [135]. В этом исследовании температура головного мозга регистрировалась при поступлении в больницу и через 5 дней после инсульта с использованием мультивоксельной магнитно-резонансной спектроскопической визуализации нормального внешнего вида мозга и острого ишемического поражения, которое определялось с помощью диффузно-взвешенной визуализации [35].Средняя температура в головном мозге с DWI-ишемией вскоре после поступления составляла 38,4 ° C (95% доверительный интервал (ДИ) 38,2–38,6), в то время как в нормальном мозге при DWI средняя температура составляла 37,7 ° C (95% ДИ 37,6–37,7). Средняя температура тела составляла 36,6 ° C (95% ДИ 36,3–37,0). Более высокие уровни интерлейкина-6, С-реактивного белка и фибриногена были связаны с более высокой температурой в DWI-нормальном мозге при поступлении и через 5 дней.
Лечебная гипотермия была предложена в качестве нейрозащитной стратегии после ишемического инсульта.У пациентов, страдающих церебральной ишемией, терапевтическая гипотермия может минимизировать степень повреждения, модулируя различные этапы ишемического каскада [136]. Регулирование целевой температуры снижает нейрональную эксайтотоксичность за счет блокирования высвобождения глутамата и дофамина, что приводит к уменьшению притока кальция и перекисного окисления липидов и, таким образом, к снижению выработки свободных радикалов [85]. Снижение образования свободных радикалов, связанное с температурой, было связано со снижением повреждения нейронов как во время ишемической, так и реперфузионной фазы [137].Другая гипотеза состоит в том, что терапевтическая гипотермия может способствовать активации генов стрессовой реакции, которые продуцируют антиапоптотические белки. Эти генные продукты перемещаются в ядра, где они регулируют экспрессию генов, способствуя выживанию клеток [138, 139].
В экспериментальных исследованиях инсульта легкая гипотермия (32–34 ° C) оказалась лучше, чем при других испытанных температурах; например, это привело к большему уменьшению объема инфаркта, чем 27 ° C [140], и лучшей переносимости, чем 30 ° C [141].Ряд исследований показывает, что гипотермия оказывает нейрозащитное действие, если применяется сразу после инсульта, и что она остается полезной, если продолжительность охлаждения увеличивается [142–144]. Следует отметить, что во многих исследованиях на животных терапевтическая гипотермия начинается до или в начале ишемического инсульта, тогда как в клинических ситуациях пациенты обычно попадают в больницу через несколько часов после начала травмы. Кроме того, большинство пациентов получают гипотермию в течение нескольких дней, тогда как модели на животных используют гипотермию только в течение коротких периодов охлаждения.Фаза согревания после терапевтической гипотермии также имеет решающее значение, поскольку быстрое согревание может усилить пагубные ишемические эффекты. Бергер и др. показали, что медленное согревание значительно уменьшает объем инфаркта по сравнению с быстрым согреванием [145].
В недавнем обзоре было обнаружено 17 релевантных клинических исследований использования гипотермии после ишемического инсульта (4 обсервационных исследования, 5 самоконтролируемых клинических испытаний и 8 параллельно контролируемых клинических испытаний) [129]. Наблюдательные исследования показывают, что температура при поступлении является прогностическим фактором плохого неврологического исхода и смертности при ишемическом инсульте [146–148].Самоконтролируемые исследования страдают отсутствием надлежащей контрольной группы, а их результаты недостаточно надежны, чтобы оправдать вывод о том, что гипотермия влияет на исход инсульта [149–153]. Из проведенных на сегодняшний день клинических испытаний с параллельным контролем только одно показало улучшение по шкале NIHSS (шкала инсульта Национального института здравоохранения) и значительные различия в уровне смертности при комбинации гипотермии и трепанации черепа по сравнению с одной только краниэктомией [154]. Завершены два рандомизированных двойных слепых исследования.Не сообщалось о каких-либо различиях между гипотермией и нормотермией в отношении смертности или NIHSS через 24 или 72 часа у пациентов, перенесших трепанацию черепа [155]. Смертность была сходной между группами гипотермии и контрольной группой во всех рандомизированных слепых клинических испытаниях [155, 156].
В литературе не хватает доказательств, подтверждающих использование легкой терапевтической гипотермии у пациентов с ишемическим инсультом.
5. Заключение
После тяжелой черепно-мозговой травмы температуру мозга обычно не измеряют, хотя несколько исследований показали, что она может значительно отличаться от внутренней температуры.Измерение температуры тела часто занижает температуру мозга, особенно в ситуациях, когда центральная нервная система уязвима. Диссоциация между температурой мозга и тела может быть признаком плохого прогноза. После серьезной черепно-мозговой травмы необходимо постоянно контролировать температуру мозга, как и внутричерепное давление, с помощью измерения in situ ; такое измерение, скорее всего, должно быть частью мультимодального мониторинга пациентов для предотвращения вторичного повреждения головного мозга.
При лечении лихорадки следует учитывать защиту мозга от вторичных повреждений, а также способность бороться с инфекциями. Лихорадку, скорее всего, следует лечить агрессивно в первые дни ЧМТ, САК или инсульта, но для оценки соотношения риска и пользы необходимы рандомизированные контролируемые испытания. Терапевтическая гипотермия дала многообещающие результаты на животных моделях ЧМТ, САК или инсульта, но ее полезность в клинической практике все еще обсуждается. При тяжелой ЧМТ терапевтическая гипотермия позволяет контролировать повышение внутричерепного давления, но ее влияние на исход и смертность окончательно не продемонстрировано.Пациентам с аневризматическим САК плохой степени терапевтическая гипотермия не рекомендуется во время аневризматической хирургии. Польза гипотермии в уменьшении размера инфаркта у людей после ишемического инсульта не ясна.
Управление температурой при инсульте: текущие и будущие варианты (Р. Армонда)
Автор
полковник Рокко А. Армонда, MD
Директор Цереброваскулярной хирургии и интервенций Нейрорадиология,
Neurocritical Care National Capital Neurosurgery Консорциум
Бетесда, Мэриленд, США
[адрес электронной почты защищен]
[адрес электронной почты защищен]
Введение
сочетание усиленного ухода, предоставляемого инсультными аппаратами, в сочетании с передовыми температурная технология позволяет более точно контролировать состояние пациента. температура с в конечном итоге улучшенными клиническими результатами.Температура управление было сложным, трудоемким процессом с традиционными жаропонижающие средства и нерегулируемые охлаждающие кожные покровы. Совсем недавно использование замкнутых, саморегулирующихся кожных гидрогелевых подушечек и эндоваскулярных охлаждающие катетеры значительно повысили точность контроля температуры и сократили время и трудозатраты. Дополнительные нейроэндоваскулярные и нейрохирургические методы лечения улучшили способность реваскуляризировать ишемическую пациенты, а также декомпрессируют опасные для жизни инфаркты.Однако есть место для улучшение существует с опасными для жизни реперфузионными кровотечениями, функциональными ограничения после декомпрессивной операции и вторичного распространения инфаркта.
Цели лечения инсульта
цели в лечении инсульта включают, когда это возможно, устранение клинического дефицита, ограничение зоны травмы и снижение повышенного внутричерепного давления в лицо большого инфаркта. Гипотермия в сочетании с современными нейроинтервенционные методы и, при показаниях, декомпрессивные гемикраниэктомия может достичь этих целей.Хотя нет рандомизированного контрольного исследования комбинированная гипотермия для лечения инсульта, 9 технико-экономических обоснований с 215 пациентами показали многообещающие результаты. Это были одно- центрированные исследования с изменением времени охлаждения от 4 до 75 часов как недавно рассмотренный Полдерманом в журнале Lancet и другими авторами, объединяющими индуцированные гипотермия с гемикраниэктомией (Polderman 2008; Bardutzky and Schwab 2008; Oehm et al. 2006 г.). Это включает ограничение вторичных опасных для жизни отеков. от тяжелых инфарктов средней мозговой артерии.Однако во время согревания восстановление фазы внутричерепного давления привело к смерти у трети пациентов (Георгиадия и др., 2002). Это подчеркивает необходимость точного, медленного и контролируемое согревание.
Это предполагает, что существует роль комбинированной терапии, недавно предложенной доктором Хуаном. Сахукильо из отделения нейрохирургии Vall D’Hebron в Барселоне, Испания. В его пилотном исследовании Cool-Stroke гипотермия вызывалась с помощью эндоваскулярное охлаждение в течение первых 24 часов с внутричерепным мониторингом при 32-34 ° по Цельсию с последующей гемикраниэктомией у тех пациентов, которые продемонстрировал сдвиг средней линии на> / = 5 мм в последующие дни (Delgado et al. al.2006 г.). Предлагаемая комбинация методов лечения включает несколько клинических и экспериментальные опоры. Метаанализ экспериментальных данных в инсультных суппортах роль 33 ° C в уменьшении размера инфаркта. Дозозависимая зависимость существует с ответом
Дополнительный о клинической поддержке этого комбинированного лечения сообщили исследователи. в испытании безопасности с участием 25 пациентов с улучшением функциональных результатов по сравнению с одной гемикраниэктомией. В исследовании Эльса гемикраниэктомия с гипотермия ниже 35 ° C применялась через 3 часа декомпрессивного гемикраниэктомия выполнялась в среднем через 15 часов после обращения.в отличие В других исследованиях ни у одного пациента не было смерти от трудноизлечимого ВЧД во время согревания. Нет отмечалось усиление осложнений в группе гипотермии и в целом смертность была ниже, чем в предыдущих отчетах об использовании гемикраниэктомии или гипотермии. один. В дополнение к раннему применению гемикраниэктомии (14,9 +/- 5,6 часов) стихи 24 часа в Георгиадиасе, 21 час в Швабе и 60 часов в Walz, была применена умеренная гипотермия ( и сердечные эффекты, включая брадикардию и аритмию). были под контролем .Нет Были отмечены немедленные различия в результатах. Однако через 6 месяцев наметилась тенденция к улучшению приводит к гипотермии пролеченных пациентов по сравнению с одной гемикраниэктомией с NIHSSS (10 +/- 1 и 11 +/- 3) и индекс Бартала (81 +/- 14 по сравнению с 70 +/- 17) (Els et al., 2006).
Контроль температуры
ICU — идеальное место для применения контроля температуры при лечении инсульта. Вверх у 47% пациентов с инсультом будет постоянная температура> 38.5 ° С. Предотвращение лихорадки в качестве первого шага — важное достижение в ограничении вторичная травма. Высокая корреляция существует для плохого результата, большой продолжительности пребывания, и снижение функционального восстановления, напрямую связанное с лихорадочное бремя. В недавнем всеобъемлющем метаанализе лихорадка была связана с повышенная смертность, пребывание в отделении интенсивной терапии, продолжительность пребывания в больнице и более низкое функциональное восстановление (Greer et al. 2008; Ginsberg and Busto 1998). Этот связь неблагоприятного исхода также наблюдается при САК с лихорадкой и независимо связаны с плохим исходом и летальностью, а также лихорадкой в ВЧГ с длительностью лихорадки> 37.5 ° C, связанный с плохим исходом, особенно в первые 72 часа.
Текущие достижения в лечении
Текущий достижения в области интенсивной терапии, технологии контроля температуры и нейроэндоваскулярное лечение инсульта создало решающую возможность улучшить лечение инсульта и его исход. В США быстро стареющее население увеличение факторов риска инсульта и более малоподвижный образ жизни привели к продолжающийся рост числа инсультов. Технологии продвинулись и включают улучшения в контролируемых системах с замкнутым контуром, как инвазивных, так и неинвазивных, которые позволяют точное понижение температуры, контроль и подогрев.Эти радикальные технологические модификации позволяют включать пациентов с травматическими черепно-мозговая травма и инсульт в процедурах для контроля температуры как правило, исключены в прошлом. Первая линия температурного вмешательства у неврологически ослабленных пациентов снижается лихорадка. В Отчет Дирингера о 296 пациентах из 13 нейрокритических центров (The Группа исследования снижения лихорадки в отделении нейрокритической помощи) была проспективной, рандомизированной, не слепой. исследование сравнения эндоваскулярного охлаждения с использованием центральной линии CoolGuard / Cool Line катетером (n = 142) традиционными поверхностными методами (n = 154).Это включало пациенты с субарахноидальным кровоизлиянием (41%), внутримозговым кровоизлиянием (23%), ишемическим инфаркт (13%) или черепно-мозговая травма (24%). Температура была> 38 градусов Цельсия дважды или в течение> 4 часов непрерывно, и требуется центральный венозный доступ. Он продемонстрировал значительное снижение лихорадки на 64%. нагрузки (2,87 против 7,92 ° C · ч) и не более высокий уровень осложнений по сравнению с стандартное использование катетера центральной линии. Нет повышенных доз антибиотиков, были отмечены инфекции, седативные средства или наркотики.(Дирингер и др., 2004).
В у отдельных пациентов реваскуляризация может быть проведена либо химическим, либо однако механический тромболизис приводит к разрушительному реперфузионному кровотечению ограничивает применение реваскуляризации. Преимущество переохлаждения при сохранение гематоэнцефалического барьера и ограничение риска реперфузионного кровотечения представляет собой уникальное комбинированное преимущество.
роль комбинированного лечения включает использование гипотермии с обоими эндоваскулярные и открытые хирургические методы.В частности, эндоваскулярный реваскуляризация с применением как химического, так и механического тромболизиса позволяет использовать реваскуляризации с нейропротекцией при гипотермии. Дополнительный интраоперационное использование гипотермии во время реваскуляризации с выбранными Пациент с экстракраниально-внутричерепным шунтированием обеспечивает церебральную защиту во время анастамоз. Преимущества переохлаждения включают снижение скорости метаболизма, уменьшение воспалительного каскада, уменьшение свободных радикалов, эксайтотоксичность нейротрансмиттеры и ограниченная запрограммированная гибель клеток.Мониторинг микродиализа во время индуцированная гипотермия была сопоставима с положительным эффектом декомпрессивного гемикраниэктомия в недавнем клиническом исследовании (Berger et al. 2008).
использование гипотермии следует рассматривать как спектр температурного контроля, которые включали умеренную, легкую и нормотермию. Различные уровни ишемия / инфаркт могут потребовать переохлаждения разной глубины. Использование контроль температуры, включая нормотермию, также важен для сильных связь неблагоприятного исхода при инсульте и лихорадке.
А для острой ишемии доступен ряд стратегий контроля температуры инсульт и включает умеренное переохлаждение (32-34 ° C), легкое переохлаждение (35 ° C), и поддержание нормотермии (
Использование современных методов лечения
Недавние крупные рандомизированные исследования продемонстрировали улучшение неврологического исхода после остановка сердца. Значительное принятие и применение произошло более чем в 77% скандинавских стран с менее чем 25% применения в большинстве центров США (Polderman 2008 г.).Это проблема не только с образованием, но и с изменением здравоохранения. выполнение. Врачи склонны сопротивляться переменам. Новые методики, процедуры и стандарты медленно продвигаются в медицинских кругах из-за этого сопротивления. Преодоление сопротивления институтов требует скоординированного руководства на многих уровнях. включая участие администрации, медсестер и врачей. Через далеко вперед мыслящие люди эти идеи ограничения вторичных нейронных Повреждение уязвимого ишемизированного мозга практично и достижимо.
Подробнее передовые терапевтические нейроэндоваскулярные процедуры также были объединены с управление температурой при инсульте. Разработаны дополнительные протоколы сочетание гипотермии с нейропротекторными средствами для ускорения восстановления, защиты гематоэнцефалический барьер, ограничивающий реперфузионное кровотечение и отек мозга. К ним относятся сочетание механического и химического тромболизиса с эндоваскулярное охлаждение: ICTUS-L, ICTUS-C и Cool-Aid II. Во время Cool-Aid II цель была достигнута у 13 из 18 пациентов, 5 ограничены из-за побочных эффектов дрожи.Текущие протоколы с использованием избирательного подогрева ладони и подошвы в сочетании с Демерол, магний, дексметомидин и протоколы седации ограничивают возникновение дрожи (Mayer, Neurocritical Care).
Недавние сообщалось, что использование эндоваскулярных устройств сокращает время и трудозатраты. для достижения целевой температуры при злокачественном инсульте СМА. В серии из 35 пациенты старше 5 лет, использующие французский катетер диаметром 8,5 см, 35 см (ICY, Alsius Corporation) замкнутую регулируемую индуцированную гипотермию при 33 ° C (32.1-33,6) был выполнен. Пациентов держали при целевой температуре> 72 часов с медленное повторное нагревание, не превышающее 0,1 ° C / час (продолжительность охлаждения 85 +/- 10 часов). Пациенты охлаждались через 17 +/- 9 часов после начала инсульта. достигается за 2,7 +/- 0,6 часа. Смертность снизилась с выживаемостью 57% и средний индекс Бартеля 65 (40-85), оценка Рэнкина 2,9 (Бардуцки и Шваб 2008; Els et al. 2006; Geor -giadia et al. 2002). Однако неконтролируемый отскок ВЧД произошел у 11/35 пациентов, что привело к смерти (Bar dutzky и Schwab 2008).
Будущие варианты
А новую передовую терапию также предложили исследователи из Колумбийского университета. Университет Нью-Йорка и больница Сюань Ву, Столичный медицинский университет в Пекин, Китай. Доктора Джон Пайл-Спеллман и Фэн Лин исследуют применение одновременного внутриартериального селективного быстрого цереброваскулярного охлаждение с помощью инъекции холодного физиологического раствора во время реваскуляризации и церебральной ангиография (Chen et al. 2008). Это надежное исследование включает в себя МРТ-визуализацию, который оценивает местную температуру мозга и обмен веществ, транскраниальные допплеры, церебральная ангиография с внутриартериальным охлаждением и нейропсихологическим оценки.Этот протокол предполагает использование выборочного краткосрочного раннего исследования мозга. охлаждение (33-35 ° C) во избежание реперфузионной геморрагической трансформации и системного побочных эффектов, а также с использованием передовых методов нейровизуализации для измерения температура мозга и метаболические эффекты. В методах нейровизуализации используется МРТ. спектроскопия (3T) в качестве MR-термометрии и измерения CBF с использованием холодного физиологического раствора в качестве контрастное вещество. Они также планируют оценить нейропсихологические эффекты избирательное охлаждение мозга на внимании.В их предложении будет использоваться выборочная церебральная гипотермия как промежуточная процедура перед системной гипотермией и в качестве дополнения к другим методам нейроэндоваскулярной реканализации. Кроме того, они добавили бы средство анатомической локализации для измерения различная температура, скорость метаболизма и CBF в мозге, благодаря чему комбинирование физиологические и анатомические данные при лечении инсульта с использованием выборочных переохлаждение.
Заключение
будущее гипотермии в лечении инсульта в конечном итоге приведет к менее инвазивным и более избирательные средства охлаждения мозга.Такие методы могут включать фармакологические агенты, такие как вариации h3S, вызывающие гипотермию у лабораторные животные, имитирующие спячку. В сочетании с другими методы реваскуляризации увеличивают терапевтическое окно для других нервно-сосудистая и хирургическая терапия для выполнения неврологической помощи. Будущее улучшено мультимодальный мониторинг пациентов с инсультом, перенесших индуцированный переохлаждение поможет лучше понять метаболический кризис и роль комбинированных терапии для этого постоянно растущего и уязвимого населения.
Какова роль целевого управления температурой (ТТМ) у пациентов с острым инсультом?
Walker AC, Джонсон, штат Нью-Джерси. Целенаправленное регулирование температуры и уход после остановки сердца. Emerg Med Clin North Am . 2019 37 августа (3): 381-93. [Медлайн].
[Рекомендации] Callaway CW, Donnino MW, Fink EL, et al. Часть 8: Уход после остановки сердца: Обновление рекомендаций Американской кардиологической ассоциации 2015 г. по сердечно-легочной реанимации и неотложной сердечно-сосудистой помощи. Тираж . 2015 3 ноября. 132 (18 приложение 2): S465-82. [Медлайн]. [Полный текст].
Килганнон Дж. Х., Робертс Б. В., Рейл Л. Р. и др. Ранняя артериальная гипотензия часто встречается при пост-сердечном синдроме и связана с повышенной внутрибольничной летальностью. Реанимация . 2008 декабрь 79 (3): 410-6. [Медлайн]. [Полный текст].
Брей Дж. Э., Бернард С., Кэнтуэлл К., Стивенсон М., Смит К. для Руководящего комитета VACAR. Связь между систолическим артериальным давлением по прибытии в больницу и исходом у взрослых, выживших после внебольничной остановки сердца предполагаемой сердечной этиологии. Реанимация . 2014 Апрель 85 (4): 509-15. [Медлайн].
Rajek A, Greif R, Sessler DI, Baumgardner J, Laciny S, Bastanmehr H. Охлаждение сердцевины посредством центральной венозной инфузии ледяной (4 и 20 градусов C) жидкости: изоляция сердцевины и периферических тепловых отсеков. Анестезиология . 2000 Сентябрь 93 (3): 629-37. [Медлайн].
Becker LB, Smith DW, Rhodes KV. Частота остановки сердца: фактор, которым пренебрегают при оценке выживаемости. Энн Эмерг Мед . 1993, 22 января (1): 86-91. [Медлайн].
Cobb LA. Вариабельность частоты реанимации при внебольничной остановке сердца. Arch Intern Med . 1993 24 мая. 153 (10): 1165-6. [Медлайн].
Гиппократ (460-375 гг. До н.э.). Джонс WHS, Withington ET, пер. Ветер Медицина . Кембридж: Классическая библиотека Леба; Классическая библиотека Леба:
Hegnauer AH, D’Amato HE.Потребление кислорода и сердечный выброс у гипотермической собаки. Am J Physiol . 1954 Июль 178 (1): 138-42. [Медлайн].
Бенсон Д.В., Уильямс Г.Р. младший, Спенсер ФК, Йейтс А.Дж. Применение переохлаждения после остановки сердца. Анест Анальг . 1959 ноябрь-декабрь. 38: 423-8. [Медлайн].
[Рекомендации] Нолан Дж. П., Дикин С.Д., Соар Дж., Боттигер Б.В., Смит Дж. И Европейский совет по реанимации. Рекомендации Европейского совета по реанимации по реанимации, 2005 г.Раздел 4. Продвинутое жизнеобеспечение взрослых. Реанимация . 2005 декабрь 67, приложение 1: S39-86. [Медлайн].
Arrich J, Группа изучения гипотермии после остановки сердца Европейского совета по реанимации. Клиническое применение легкой терапевтической гипотермии после остановки сердца. Crit Care Med . 2007 апр. 35 (4): 1041-7. [Медлайн].
Polderman KH, Rijnsburger ER, Peerdeman SM, Girbes AR. Индукция гипотермии у пациентов с различными видами неврологической травмы с использованием больших объемов ледяной внутривенной жидкости. Crit Care Med . 2005 декабрь 33 (12): 2744-51. [Медлайн].
Seupaul RA, Wilbur LG. Доказательная медицина неотложной помощи. Помогает ли терапевтическая гипотермия выжившим после остановки сердца? Энн Эмерг Мед . 2011 Сентябрь 58 (3): 282-3. [Медлайн].
Williams SE, Sabir I, Nimmo C и др. Количественная оценка эффектов терапевтической гипотермии на раннюю реполяризацию у выживших после идиопатической фибрилляции желудочков: 7-летнее когортное исследование. Электрофизиол циркулярной аритмии . 2014 7 февраля (1): 120-6. [Медлайн].
Группа исследования гипотермии после остановки сердца. Легкая терапевтическая гипотермия для улучшения неврологического исхода после остановки сердца. N Engl J Med . 2002 21 февраля. 346 (8): 549-56. [Медлайн].
Райт В.Л., Геокадин Р.Г. Постреанимационная интенсивная терапия: нейропротективные стратегии после остановки сердца. Семин Нейрол . 2006 Сентябрь 26 (4): 396-402.[Медлайн].
Бернард С.А., Грей Т.В., Буист М.Д. и др. Лечение выживших в коме после внебольничной остановки сердца с индуцированной гипотермией. N Engl J Med . 2002, 21 февраля. 346 (8): 557-63. [Медлайн].
Kragholm K, Skovmoeller M, Christensen AL, et al. Статус занятости через 1 год после остановки сердца вне больницы у пациентов в коматозном состоянии, получавших терапевтическую гипотермию. Acta Anaesthesiol Scand . 2013 Август.57 (7): 936-43. [Медлайн].
Kim WY, Giberson TA, Uber A, Berg K, Cocchi MN, Donnino MW. Неврологический исход у коматозных пациентов, которые были реанимированы после остановки сердца вне больницы с длительным перерывом в работе и лечились терапевтической гипотермией. Реанимация . 2014 августа 85 (8): 1042-6. [Медлайн].
Нильсен Н., Веттерслев Дж., Кронберг Т. и др. Для исследователей испытаний TTM. Целевое управление температурой 33 ° C по сравнению с 36 ° C после остановки сердца. N Engl J Med . 2013 декабрь 5. 369 (23): 2197-206. [Медлайн].
Стангер Д., Михайлович В., Певица Дж., Десаи С., Эль-Сайег Р., Вонг Г.К. Выбор редакции. Влияние целевого управления температурой на смертность и неврологические исходы: систематический обзор и метаанализ. Eur Heart J Acute Cardiovasc Care . 2018 7 августа (5): 467-77. [Медлайн].
Constant AL, Mongardon N, Morelot Q, et al. Целевое управление температурой после интраоперационной остановки сердца: многоцентровое ретроспективное исследование. Intensive Care Med . 2017 20 февраля. [Medline].
Абелла Б.С., Ри Дж. В., Хуанг К. Н., Ванден Хук Т. Л., Беккер Л. Б. Вызванная гипотермия недостаточно используется после реанимации после остановки сердца: текущее исследование практики. Реанимация . 2005 Февраль 64 (2): 181-6. [Медлайн].
Merchant RM, Soar J, Skrifvars MB, et al. Использование терапевтической гипотермии у врачей после реанимации после остановки сердца. Crit Care Med .2006 июл. 34 (7): 1935-40. [Медлайн].
Cooper WA, Duarte IG, Thourani VH, et al. Гипотермическая остановка кровообращения вызывает мультисистемную сосудистую эндотелиальную дисфункцию и апоптоз. Энн Торак Хирург . 2000 Mar.69 (3): 696-702; обсуждение 703. [Medline].
Jiang J, Yu M, Zhu C. Эффект длительной терапии умеренной гипотермией у пациентов с тяжелой черепно-мозговой травмой: обзор 87 случаев за год после наблюдения. Дж. Нейросург .2000 Октябрь 93 (4): 546-9. [Медлайн].
Сиодзаки Т., Накадзима Ю., Танеда М. и др. Эффективность умеренной гипотермии у пациентов с тяжелой травмой головы и внутричерепной гипертензией, рефрактерной к легкой гипотермии. Дж. Нейросург . 2003 Июль 99 (1): 47-51. [Медлайн].
Polderman KH, Rijnsburger ER, Peerdeman SM, Girbes AR. Индукция гипотермии у пациентов с различными видами неврологической травмы с использованием больших объемов ледяной внутривенной жидкости. Crit Care Med . 2005 декабрь 33 (12): 2744-51. [Медлайн].
Hammer MD, Кригер DW. Гипотермия при остром ишемическом инсульте: не просто еще один нейропротектор. Невролог . 2003 ноябрь 9 (6): 280-9. [Медлайн].
Den Hertog HM, van der Worp HB, Tseng MC, Dippel DW. Охлаждающая терапия при остром инсульте. Кокрановская база данных Syst Rev . 2009 21 января. CD001247. [Медлайн].
[Рекомендации] Комитет по неотложной помощи при сердечно-сосудистых заболеваниях, подкомитеты и рабочие группы Американской кардиологической ассоциации.Рекомендации Американской кардиологической ассоциации по сердечно-легочной реанимации и неотложной сердечно-сосудистой помощи, 2005 г. Тираж . 13 декабря 2005 г. 112 (24 доп.): IV1-203. [Медлайн].
Hovdenes J, Laake JH, Aaberge L, Haugaa H, Bugge JF. Терапевтическая гипотермия после остановки сердца вне больницы: опыт пациентов, получавших чрескожное коронарное вмешательство и кардиогенный шок. Acta Anaesthesiol Scand . 2007 Февраль 51 (2): 137-42. [Медлайн].
Торговец Р.М., Абелла Б.С., Пеберди М.А. и др. Терапевтическая гипотермия после остановки сердца: при использовании пакетов со льдом и обычных охлаждающих одеял часто случается непреднамеренное переохлаждение. Crit Care Med . 2006 декабрь 34 (12 доп.): S490-4. [Медлайн].
Holzer M, Mullner M, Sterz F и др. Эффективность и безопасность эндоваскулярного охлаждения после остановки сердца: когортное исследование и байесовский подход. Инсульт . 2006 июл. 37 (7): 1792-7.[Медлайн].
Ким Ф., Олсуфка М., Лонгстрет В. Т. младший и др. Пилотное рандомизированное клиническое испытание догоспитальной индукции легкой гипотермии у внебольничных пациентов с остановкой сердца с помощью быстрой инфузии физиологического раствора 4 ° C. Тираж . 19 июня 2007 г. 115 (24): 3064-70. [Медлайн].
Неговский В.А. Постреанимационная болезнь. Crit Care Med . 1988 16 октября (10): 942-6. [Медлайн].
Alam HB, Bowyer MW, Koustova E, et al.Обучение и память сохраняются после остановки кровяного гиперкалиемического переохлаждения в модели травматического обескровливания свиней. Хирургия . 2002, август 132 (2): 278-88. [Медлайн].
Граймс С., Андерсон Р., Хориучи Т., Конча М., Флиглер Б., Гурвиц К. Реанимационная гипотермия после остановки сердца: работа в общественной больнице. Сундук . 2005. 128 (4_meetingabstracts): 167S-a-167S. [Полный текст].
Scott BD, Hogue T, Fixley MS, Adamson PB.Вызванная гипотермия после остановки сердца вне больницы; начальный опыт работы в общественной больнице. Клин Кардиол . 2006 29 декабря (12): 525-9. [Медлайн].
Дюма Ф., Гримальди Д., Зубер Б. и др. Эффективна ли гипотермия после остановки сердца как для пациентов, подвергающихся электрошоку, так и для пациентов, не подвергающихся электрошоку ?: данные большого реестра. Тираж . 2011 г. 1. 123 (8): 877-86. [Медлайн].
Testori C, Sterz F, Behringer W. и др.Легкая терапевтическая гипотермия ассоциируется с благоприятным исходом у пациентов после остановки сердца с ритмами без электрошока. Реанимация . 2011 Сентябрь 82 (9): 1162-7. [Медлайн].
Мохтарани М., Махгуб А.Н., Мориока Н. и др. Буспирон и меперидин синергетически снижают порог дрожи. Анест Анальг . 2001 ноябрь 93 (5): 1233-9. [Медлайн].
Guluma KZ, Hemmen TM, Olsen SE, Rapp KS, Lyden PD. Испытание терапевтической гипотермии с помощью эндоваскулярного подхода у бодрствующих пациентов с острым ишемическим инсультом: методология. Acad Emerg Med . 2006 августа 13 (8): 820-7. [Медлайн].
Ли Б.К., Чо И.С., О Дж. С. и др. Непрерывная инфузия нервно-мышечной блокады для внебольничных пациентов с остановкой сердца, получавших целенаправленное управление температурой: многоцентровое рандомизированное контролируемое исследование. PLoS One . 2018.13 (12): e0209327. [Медлайн]. [Полный текст].
Хак И.Ю., Латур М.Ц., Зарицкий А.Л. Опрос сообщества педиатрических отделений интенсивной терапии, посвященный знаниям и отношению к терапевтической гипотермии у детей в коматозном состоянии после остановки сердца. Педиатр Crit Care Med . 2006 7 января (1): 7-14. [Медлайн].
Hoedemaekers CW, Ezzahti M, Gerritsen A, van der Hoeven JG. Сравнение методов охлаждения для индукции и поддержания нормо- и гипотермии у пациентов в отделениях интенсивной терапии: проспективное интервенционное исследование. Crit Care . 2007. 11 (4): R91. [Медлайн].
Hachimi-Idrissi S, Corne L, Ebinger G, Michotte Y, Huyghens L. Легкое переохлаждение, вызванное устройством шлема: клиническое технико-экономическое исследование. Реанимация . 2001 декабрь 51 (3): 275-81. [Медлайн].
Ning XH, Chen SH, Xu CS и др. Гипотермическая защита ишемического сердца за счет изменений в путях апоптоза, оцененных с помощью анализа массива генов. J Appl Physiol (1985) . 2002 май. 92 (5): 2200-7. [Медлайн].
den Hertog H, van der Worp B, van Gemert M, Dippel D. Лечебная гипотермия при остром ишемическом инсульте. Эксперт Rev Neurother .2007 7 февраля (2): 155-64. [Медлайн].
Бернард С., Буист М., Монтейро О., Смит К. Вызванная гипотермия с использованием большого объема ледяной внутривенной жидкости у выживших в коме после остановки сердца вне больницы: предварительный отчет. Реанимация . 2003 Январь 56 (1): 9-13. [Медлайн].
Ким Ф., Олсуфка М., Карлбом Д. и др. Экспериментальное исследование быстрой инфузии 2 л физиологического раствора 4 ° C для индукции легкой гипотермии у госпитализированных, выживших в коме после остановки сердца вне больницы. Тираж . 2005, 2 августа. 112 (5): 715-9. [Медлайн].
Ким Ф., Олсуфка М., Лонгстрет В. Т. младший и др. Пилотное рандомизированное клиническое испытание догоспитальной индукции легкой гипотермии у внебольничных пациентов с остановкой сердца с помощью быстрой инфузии физиологического раствора 4 ° C. Тираж . 19 июня 2007 г. 115 (24): 3064-70. [Медлайн].
Booth CM, Boone RH, Tomlinson G, Detsky AS. Этот пациент мертв, вегетативен или имеет серьезные неврологические нарушения? Оценка результатов для выживших в коме после остановки сердца. JAMA . 2004 18 февраля. 291 (7): 870-9. [Медлайн].
Jiang JY, Xu W, Li WP и др. Влияние длительного умеренного переохлаждения или кратковременного умеренного переохлаждения на исход пациентов с тяжелой черепно-мозговой травмой. J Cereb Blood Flow Metab . 2006 июня 26 (6): 771-6. [Медлайн].
Сиодзаки Т., Сугимото Х., Танеда М. и др. Влияние легкой гипотермии на неконтролируемую внутричерепную гипертензию после тяжелой черепно-мозговой травмы. Дж. Нейросург . 1993 сентябрь 79 (3): 363-8. [Медлайн].
Сиодзаки Т., Като А., Танеда М. и др. Небольшая польза от терапии легкой гипотермией для пациентов с тяжелой травмой головы и низким внутричерепным давлением. Дж. Нейросург . 1999, август 91 (2): 185-91. [Медлайн].
Клифтон Г.Л., Валадка А., Зыгун Д. и др. Очень ранняя индукция гипотермии у пациентов с тяжелой травмой головного мозга (Национальное исследование острых повреждений мозга: гипотермия II): рандомизированное исследование. Ланцет Нейрол . 2011 10 февраля (2): 131-9. [Медлайн].
Саксена М., Эндрюс П.Дж., Ченг А. Скромные охлаждающие терапии (от 35 до 37,5 ° С) при черепно-мозговой травме. Кокрановская база данных Syst Rev . 16 июля 2008 г. (3): CD006811. [Медлайн].
Саксена М., Эндрюс П.Дж., Ченг А., Деол К., Хаммонд Н. Скромные охлаждающие терапии (от 35 ° C до 37,5 ° C) при черепно-мозговой травме. Кокрановская база данных Syst Rev . 2014 авг 19.CD006811. [Медлайн].
Баттин MR, Dezoete JA, Gunn TR, Gluckman PD, Gunn AJ. Результаты неврологического развития младенцев, получавших охлаждение головы и умеренную гипотермию после перинатальной асфиксии. Педиатрия . 2001 марта 107 (3): 480-4. [Медлайн].
Баттин MR, Penrice J, Gunn TR, Gunn AJ. Лечение доношенных детей с охлаждением головы и легкой системной гипотермией (35,0 ° C и 34,5 ° C) после перинатальной асфиксии. Педиатрия .2003 Февраль 111 (2): 244-51. [Медлайн].
Акису М., Гусейнов А., Ялаз М., Цетин Х, Культурсай Н. Селективное охлаждение головы с гипотермией подавляет образование фактора активации тромбоцитов в спинномозговой жидкости новорожденных с перинатальной асфиксией. Prostaglandins Leukot Essent Fatty Acids . 2003 июл.69 (1): 45-50. [Медлайн].
Inoue A, Hifumi T, Kuroda Y, et al, для группы изучения гипотермии мозга (B-HYPO) в Японии.Умеренное снижение частоты сердечных сокращений на ранней стадии целевого управления температурой после тахикардии при поступлении связано с неблагоприятными неврологическими исходами после тяжелой черепно-мозговой травмы: апостериорный анализ многоцентрового рандомизированного контролируемого исследования. Crit Care . 2018 19 декабря. 22 (1): 352. [Медлайн]. [Полный текст].
Yenari MA, Han HS. Влияние лечебной гипотермии на регенерацию после церебральной ишемии. Фронт Neurol Neurosci .2013. 32: 122-8. [Медлайн].
Тахир РА, Пабаней АХ. Лечебная гипотермия и ишемический инсульт: обзор литературы. Хирургия Neurol Int . 2016 г., 3 июня (приложение 14): S381-6. [Медлайн].
Kammersgaard LP, Rasmussen BH, Jorgensen HS, Reith J, Weber U, Olsen TS. Выполнимость и безопасность индукции умеренной гипотермии у бодрствующих пациентов с острым инсультом посредством поверхностного охлаждения: исследование случай-контроль: Копенгагенское исследование инсульта. Инсульт . 2000 Сентябрь 31 (9): 2251-6. [Медлайн].
Jacobs SE. ICE (Infant Cooling Evaluation) Испытание: прагматичное многоцентровое рандомизированное контролируемое испытание охлаждения всего тела у доношенных новорожденных с гипоксически-ишемической энцефалопатией. Представлено на: Семинар NICHD по гипотермии и перинатальной асфиксии; Бетесда, Мэриленд; 18-19 мая 2005 г.
Horn CM, Sun CH, Nogueira RG, et al. Эндоваскулярная реперфузия и охлаждение при острой ишемии головного мозга (ReCCLAIM I). J Neurointerv Surg . 2014 марта 6 (2): 91-5. [Медлайн].
Чен Дж., Лю Л., Чжан Х. и др. Эндоваскулярная гипотермия при остром ишемическом инсульте: пилотное исследование селективной внутриартериальной инфузии холодного физиологического раствора. Инсульт . 2016 июль 47 (7): 1933-5. [Медлайн].
Такур Н.Х., Спенсер А.Дж., Килбрайд Х.В., Лоу Л.Х. Результаты и закономерности МРТ и МР-спектроскопии у новорожденных после терапевтической гипотермии для лечения гипоксической ишемической энцефалопатии. South Med J . 2013 июн.106 (6): 350-5. [Медлайн].
Guluma KZ, Oh H, Yu SW, Meyer BC, Rapp K, Lyden PD. Влияние эндоваскулярной гипотермии на острый ишемический отек: морфометрический анализ исследования ICTuS. Neurocrit Care . 2008. 8 (1): 42-7. [Медлайн].
Камарайнен А., Вирккунен И., Тенхунен Дж., Или-Ханкала А., Сильфваст Т. Догоспитальная терапевтическая гипотермия для переживших остановку сердца в коме: рандомизированное контролируемое исследование. Acta Anaesthesiol Scand . 2009 Август 53 (7): 900-7. [Медлайн].
Бернард С.А., Смит К., Кэмерон П. и др., Для исследователей быстрой инфузии холодного хартмана (RICH). Индукция терапевтической гипотермии парамедиками после реанимации из-за внебольничной фибрилляции желудочков остановка сердца: рандомизированное контролируемое исследование. Тираж . 17 августа 2010 г. 122 (7): 737-42. [Медлайн]. [Полный текст].
Бернард С.А., Смит К., Кэмерон П. и др., За быстрое вливание холода исследователей Хартмана.Индукция догоспитальной лечебной гипотермии после реанимации из-за невентрикулярной фибрилляции остановки сердца *. Crit Care Med . 2012 Март 40 (3): 747-53. [Медлайн].
Rincon F, Mayer SA. Лечебное переохлаждение при черепно-мозговой травме после остановки сердца. Семин Нейрол . 2006 Сентябрь 26 (4): 387-95. [Медлайн].
Акча О. Осложнения переохлаждения. В: Mayer SA, Sessler DI, eds. Лечебная гипотермия .Нью-Йорк, Нью-Йорк: Марсель Деккер; 2005. 179–210.
Сиодзаки Т., Хаяката Т., Танеда М. и др. Многоцентровое проспективное рандомизированное контролируемое исследование эффективности легкой гипотермии у пациентов с тяжелой травмой головы и низким внутричерепным давлением. Группа по изучению умеренной гипотермии в Японии. Дж. Нейросург . 2001 Январь 94 (1): 50-4. [Медлайн].
Джейкобс С., Хант Р., Тарнов-Морди В., Индер Т., Дэвис П. Охлаждение новорожденных с гипоксической ишемической энцефалопатией. Кокрановская база данных Syst Rev . 2003. (4): CD003311. [Медлайн].
Клифтон ГЛ. Гипотермия при нейротравме [аннотация]. Представлено на: 3-м Международном симпозиуме по нейротравме; Торонто, Канада ;. 22-27 июля 1995 г.
[Рекомендации] Комитет по неотложной помощи при сердечно-сосудистых заболеваниях, подкомитеты и рабочие группы Американской кардиологической ассоциации. Рекомендации Американской кардиологической ассоциации по сердечно-легочной реанимации и неотложной сердечно-сосудистой помощи, 2005 г. Часть 7.5: Постреанимационная поддержка. Тираж . 2005. 112 (24 доп.): IV84-8. [Медлайн]. [Полный текст].
[Рекомендации] Adams HP Jr, del Zoppo G, Alberts MJ, AHA, ASA Stroke Council, CLCD, et al. Рекомендации по раннему ведению взрослых с ишемическим инсультом: рекомендации Американской кардиологической ассоциации / Американского совета по инсульту, Совета по клинической кардиологии, Совета по сердечно-сосудистой радиологии и вмешательствам, а также Совета по атеросклеротическим заболеваниям периферических сосудов и качеству лечения в междисциплинарных исследованиях Группы: Американская академия неврологии подтверждает ценность этого руководства как учебного пособия для неврологов. Инсульт . 2007 май. 38 (5): 1655-711. [Медлайн].
Busch M, Soreide E, Lossius HM, Lexow K, Dickstein K. Быстрое применение терапевтической гипотермии у пациентов, перенесших остановку сердца вне больницы в коме. Acta Anaesthesiol Scand . 2006 ноябрь 50 (10): 1277-83. [Медлайн].
Клифтон Г.Л., Миллер Э.Р., Чой С.К. и др. Отсутствие эффекта индукции переохлаждения после острой черепно-мозговой травмы. N Engl J Med .2001 22 февраля. 344 (8): 556-63. [Медлайн].
Коррейя М., Сильва М., Велозо М. Охлаждающая терапия при остром инсульте. Кокрановская база данных Syst Rev . 2000. (2): CD001247. [Медлайн].
Dae MW, Gao DW, Sessler DI, Chair K, Stillson CA. Влияние эндоваскулярного охлаждения на температуру миокарда, размер инфаркта и сердечный выброс у свиней человеческого роста. Am J Physiol Heart Circ Physiol . 2002 май. 282 (5): h2584-91. [Медлайн].
Eisenburger P, Sterz F, Holzer M и др.Лечебное переохлаждение после остановки сердца. Curr Opin Crit Care . 2001 июн. 7 (3): 184-8. [Медлайн].
Fehlings MG, Батист, округ Колумбия. Текущее состояние клинических исследований острого повреждения спинного мозга. Травма . 2005 июл. 36, приложение 2: B113-22. [Медлайн].
Fu ES, Tummala RP. Нейропротекция при травмах головного и спинного мозга. Curr Opin Anaesthesiol . 2005 апреля 18 (2): 181-7. [Медлайн].
Gunn AJ, Глюкман PD, Gunn TR.Избирательное охлаждение головы у новорожденных после перинатальной асфиксии: исследование безопасности. Педиатрия . 1998 Октябрь 102 (4, п.1): 885-92. [Медлайн].
Хейл С.Л., Дэйв Р.Х., Клонер Р.А. Региональная гипотермия снижает некроз миокарда, даже если она проводится после начала ишемии. Кардиол Базовый Рес . 1997 Октябрь 92 (5): 351-7. [Медлайн].
Hashiguchi N, Shiozaki T, Ogura H, et al. Легкая гипотермия снижает экспрессию белка теплового шока 60 в лейкоцитах пациентов с тяжелой травмой головы. J Травма . 2003 Декабрь 55 (6): 1054-60. [Медлайн].
Хиггинс Р.Д., Раджу Т.Н., Перлман Дж. И др. Гипотермия и перинатальная асфиксия: резюме семинара Национального института детского здоровья и развития человека. Дж. Педиатр . 2006 Февраль 148 (2): 170-5. [Медлайн].
Holzer M, Bernard SA, Hachimi-Idrissi S, Roine RO, Sterz F, Mullner M и др. Гипотермия для нейропротекции после остановки сердца: систематический обзор и метаанализ индивидуальных данных пациентов. Crit Care Med . 2005 Февраль 33 (2): 414-8. [Медлайн].
Ким Ф., Никол Дж., Мейнард С. и др. Влияние догоспитальной индукции легкой гипотермии на выживаемость и неврологический статус среди взрослых с остановкой сердца: рандомизированное клиническое исследование. JAMA . 2014 г., 1. 311 (1): 45-52. [Медлайн].
Kliegel A, Losert H, Sterz F и др. Простые холодные внутривенные инфузии, предшествующие специальному эндоваскулярному охлаждению, для более быстрого индукции легкой гипотермии после остановки сердца — технико-экономическое обоснование. Реанимация . 2005 Mar.64 (3): 347-51. [Медлайн].
Laver SR, Padkin A, Atalla A, Nolan JP. Терапевтическая гипотермия после остановки сердца: обзор практики отделений интенсивной терапии в Великобритании. Анестезия . 2006 сентябрь 61 (9): 873-7. [Медлайн].
Нолан Дж. П., Морли П. Т., Ванден Хук Т. Л. и др., Для Международного комитета по связям по реанимации. Терапевтическая гипотермия после остановки сердца: консультативное заявление специальной группы поддержки жизнеобеспечения Международного комитета связи по реанимации. Тираж . 8 июля 2003 г. 108 (1): 118-21. [Медлайн].
Oddo M, Schaller MD, Feihl F, Ribordy V, Liaudet L. От доказательств к клинической практике: эффективное применение терапевтической гипотермии для улучшения результатов лечения пациентов после остановки сердца. Crit Care Med . 2006 июл. 34 (7): 1865-73. [Медлайн].
Пестель Г.Дж., Курц А. Гипотермия — это больше, чем игрушка. Curr Opin Anaesthesiol . 2005 апреля 18 (2): 151-6.[Медлайн].
Reith J, Jørgensen HS, Pedersen PM, et al. Температура тела при остром инсульте: связь с тяжестью инсульта, размером инфаркта, смертностью и исходом. Ланцет . 1996 17 февраля. 347 (8999): 422-5. [Медлайн].
Rittenberger JC, Callaway CW. Контроль температуры и современная помощь после остановки сердца. N Engl J Med . 2013 декабрь 5. 369 (23): 2262-3. [Медлайн].
Скотт И., Чан Дж., Арони К., Кэрролл Г.Местный тромболизис или быстрый перенос для первичной ангиопластики у пациентов с инфарктом миокарда с подъемом сегмента ST в больницы без средств ангиопластики. Intern Med J . 2004 июн. 34 (6): 373-7. [Медлайн].
Шанкаран С., Лапток А., Райт Л.Л. и др. Гипотермия всего тела при неонатальной энцефалопатии: наблюдения за животными как основа для рандомизированного контролируемого пилотного исследования доношенных новорожденных. Педиатрия . 2002 августа 110 (2, часть 1): 377-85.[Медлайн].
Стайлз С. Пост арестованные испытания гипотермии разочаровывают и дразнят. Medscape Medical News . 17 ноября 2013 г. 25 ноября 2013 г. [Полный текст].
Sunde K, Søreide E, Jacobsen D, Steen PA. [Лечебная гипотермия после остановки сердца спасает больше жизней!] [Норвежский]. Тидсскр Нор Лаэгефорен . 2004 г. 1. 124 (7): 925-6. [Медлайн].
Sunde K, Dunlop O, Rostrup M, Sandberg M, Sjoholm H, Jacobsen D.Определение прогноза после остановки сердца может быть затруднено после введения лечебной гипотермии. Реанимация . 2006 апр. 69 (1): 29-32. [Медлайн].
Thoresen M, Whitelaw A. Сердечно-сосудистые изменения во время легкой терапевтической гипотермии и согревания у младенцев с гипоксически-ишемической энцефалопатией. Педиатрия . 2000 июл.106 (1 п.1): 92-9. [Медлайн].
Тодд М.М., Хиндман Б.Дж., Кларк В.Р., Торнер Дж.С. и исследователи исследования интраоперационной гипотермии для хирургии аневризмы (IHAST).Легкое интраоперационное переохлаждение во время операции по поводу внутричерепной аневризмы. N Engl J Med . 2005 13 января 352 (2): 135-45. [Медлайн].
Wolfrum S, Radke PW, Pischon T., Willich SN, Schunkert H, Kurowski V. Легкая терапевтическая гипотермия после остановки сердца — общенациональное исследование по внедрению рекомендаций ILCOR в немецких отделениях интенсивной терапии. Реанимация . 2007 Февраль 72 (2): 207-13. [Медлайн].
Zeiner A, Holzer M, Sterz F, et al.Гипертермия после остановки сердца связана с неблагоприятным неврологическим исходом. Arch Intern Med . 2001, 10 сентября. 161 (16): 2007-12. [Медлайн].
Crombez T, Hachimi-Idrissi S. Влияние целевого управления температурой на фармакокинетику лекарств, вводимых во время и после остановки сердца: систематический обзор. Acta Clin Belg . 2017 21 февраля. 1-7. [Медлайн].
Aibiki M, Chiang MC, Muengtaweepongsa S, Pothiawala S, Huang CH.Отчет Азиатской целевой группы задач по управлению температурой. Управление температурой гипотермии . 2017 Март 7 (1): 16-23. [Медлайн].
Сторм С., Лейтнер С., Краннич А., Суарес Д.И., Стивенс Р.Д. Влияние структурированных путей на лечение после остановки сердца: систематический обзор и метаанализ. Crit Care Med . 47 августа 2019 (8): e710-6. [Медлайн].
Маркота А., Скок К., Бурджа С., Мори Дж. Температура поверхности тела и терморегуляция после остановки сердца. Управление температурой гипотермии . 19 декабря 2018 г. [Medline].
Целевое управление температурой у пациентов с внутримозговым кровоизлиянием, субарахноидальным кровоизлиянием или острым ишемическим инсультом: согласованные рекомендации
Резюме
Предпосылки
Был использован модифицированный подход Delphi для достижения консенсуса по практическим рекомендациям по использованию нефармакологической целевой температуры ведение пациентов с внутримозговым кровоизлиянием, субарахноидальным кровоизлиянием или острым ишемическим инсультом с неинфекционной лихорадкой (предполагаемая нейрогенная лихорадка).
Методы
Девять экспертов по лечению нейрогенной лихорадки участвовали в процессе, который включал заполнение онлайн-анкет, личные обсуждения и сводные обзоры, чтобы консолидировать консенсус по целевому управлению температурой.
Результаты
Рекомендации комиссии основаны на балансе существующих доказательств и практических соображений. Имея это в виду, они подчеркивают важность управления нейрогенной лихорадкой с использованием единого протокола для целевого управления температурой.Целенаправленное регулирование температуры следует начинать, если температура пациента повышается выше 37,5 ° C, после того, как было проведено соответствующее обследование на наличие инфекции. Это помогает предотвратить использование целевого профилактического управления температурой и обеспечивает надлежащее лечение инфекции. При обнаружении нейрогенной лихорадки следует незамедлительно начать целевое регулирование температуры, если жаропонижающие средства не справляются с температурой в течение 1 часа, и затем поддерживать ее до тех пор, пока существует вероятность вторичного повреждения головного мозга.Рекомендуемая целевая температура для целевого управления температурой составляет 36,5–37,5 ° C. Рекомендуется использовать передовые методы целевого управления температурой, которые обеспечивают непрерывное или почти непрерывное измерение температуры и точный контроль температуры.
Выводы
Учитывая ограниченные разнородные данные, доступные в настоящее время об использовании таргетного контроля температуры у пациентов с нейрогенной лихорадкой и внутримозговым кровоизлиянием, субарахноидальным кровоизлиянием или острым ишемическим инсультом, подход Дельфи был подходящим для получения экспертного консенсуса.Чтобы помочь в разработке будущих исследований, группа предоставляет рекомендации по сбору данных.
Ключевые слова
инсульт
субарахноидальное кровоизлияние
внутримозговое кровоизлияние
Техника Дельфи
Рекомендуемые статьиЦитирующие статьи (0)
Просмотреть аннотацию© 2018 British Journal of Anesthesia. Опубликовано Elsevier Ltd.
Рекомендуемые статьи
Цитирующие статьи
Лихорадка — канал улучшения здоровья
Лихорадка — это повышение температуры тела выше нормальной, обычно вызванное инфекцией.Нормальная температура тела составляет около 37 ° C (плюс-минус градус, в зависимости от индивидуальных особенностей). Также могут быть небольшие колебания в течение дня и ночи. Вопреки распространенному мнению, тяжесть лихорадки не обязательно связана с серьезностью заболевания — например, опасный для жизни менингит может вызвать лишь небольшое повышение температуры.
Лихорадка, вызванная вирусной или бактериальной инфекцией, вызывается химическими веществами, вырабатываемыми иммунной системой, которые сбрасывают термостат тела на более высокий уровень.В большинстве случаев легкая лихорадка проходит сама собой в течение нескольких дней. Небольшая температура (до 39 ° C) действительно может помочь иммунной системе избавиться от инфекции. У детей в возрасте от шести месяцев до шести лет лихорадка может вызвать судороги. Температура 42,4 ° C или выше, особенно у пожилых людей, может необратимо повредить мозг.
Симптомы лихорадки
Симптомы лихорадки могут включать:
- Плохое самочувствие
- Чувство жара и пота
- Дрожь
- Стук зубов
- Покраснение лица.
Инфекция обычно является причиной лихорадки
Причиной лихорадки обычно является какая-либо инфекция. Это может включать:
- Вирусы — например, простудные заболевания или инфекции верхних дыхательных путей.
- Бактерии — например, тонзиллит, пневмония или инфекции мочевыводящих путей.
- Некоторые хронические заболевания — например, ревматоидный артрит и язвенный колит, которые могут вызывать лихорадку, которая сохраняется более двух недель.
- Некоторые тропические болезни — например, малярия, которая может вызывать приступы повторяющейся лихорадки или брюшного тифа.
- Тепловой удар — одним из симптомов которого является повышение температуры тела (без потоотделения).
- Лекарства — некоторые люди могут быть подвержены лихорадке как побочному эффекту определенных лекарств.
- Злокачественные опухоли .
Рекомендации по самолечению при лихорадке
Рекомендации по лечению лихорадки включают:
- Принимайте парацетамол или ибупрофен в соответствующих дозах, чтобы снизить температуру.
- Пейте много жидкости, особенно воды.
- Избегайте алкоголя, чая и кофе, так как эти напитки могут вызвать легкое обезвоживание.
- Смочите открытые участки кожи теплой водой. Чтобы усилить охлаждающий эффект испарения, вы можете попробовать встать перед вентилятором.
- Избегайте принятия холодной ванны или душа. Кожа реагирует на холод, сужая кровеносные сосуды, которые задерживают тепло тела. Холод также может вызвать дрожь, что может привести к выделению большего количества тепла.
- Убедитесь, что вы много отдыхаете, включая постельный режим.
Когда обращаться к врачу по поводу симптомов лихорадки
Вы всегда должны консультироваться со своим врачом в следующих случаях:
- У вас по-прежнему лихорадка через три дня, несмотря на лечение в домашних условиях.
- Ваша температура превышает 40 ° C.
- Вы непроизвольно дрожите и трясетесь или стучите зубами.
- Вам жарко, но вы не потеете.
- Кажется, со временем тебе становится все хуже.
- У вас необычные симптомы, такие как галлюцинации, рвота, ригидность шеи, кожная сыпь, учащенное сердцебиение, озноб или мышечные спазмы.
- Вы чувствуете смущение и сонливость.
- У вас сильная головная боль, не поддающаяся лечению обезболивающими.
- Вы недавно были за границей.
Вам следует немедленно обратиться за медицинской помощью, если у вас или у кого-то есть следующие симптомы:
- Лихорадка с головной болью и ригидностью шеи
- Сыпь, которая не бледнеет при надавливании на кожу (указывает на кровотечение в кожу) Это может указывать на Опасное для жизни заболевание
Методы диагностики
Поскольку лихорадка является симптомом, а не заболеванием, необходимо определить первопричину, прежде чем начинать конкретное лечение.Некоторые анализы могут потребоваться, если причина лихорадки не выяснена после того, как ваш врач изучил историю болезни и провел осмотр. Эти тесты могут включать:
- Анализы крови
- Исследование мочи и посев
- Анализ мазков из горла или слизи и посев
- Исследование кала и посев
- Рентгеновские снимки.
Варианты лечения
Лечение зависит от причины — например, при хроническом тонзиллите может потребоваться операция по удалению миндалин (тонзиллэктомия).Лихорадку, вызванную вирусными заболеваниями, нельзя лечить антибиотиками, поскольку эти препараты не действуют против вирусов. В случае легкой бактериальной инфекции, как правило, лучше позволить вашей иммунной системе справиться с проблемой, а не принимать антибиотики.
Лихорадка у детей
В среднем у ребенка до 10 инфекций в год. Температура тела не является надежным индикатором болезни для младенцев и детей раннего возраста: у ребенка может быть умеренная температура, согласно термометру (чуть выше 37 ° C), но он может казаться счастливым и здоровым.Доверяйте своим инстинктам, но обратитесь за медицинской помощью, если вашему ребенку:
- В возрасте шести месяцев или меньше
- Имеет сыпь
- Имеет лихорадку 40 ° C или более
- По-прежнему лихорадит через день или около того, несмотря на то, что четырехчасовые дозы детского парацетамола
- Рвота или постоянная диарея
- Отказывается от еды или питья
- Безутешно плачет
- Кажется вялым, вялым или просто выглядит больным
- Судороги или подергивания
- Проблемы с дыханием
- Боль при дыхании
- Если вы чувствуете беспокойство или беспокойство на каком-либо этапе, проконсультируйтесь с врачом.
Где получить помощь
- Ваш врач
- Линия охраны здоровья матери и ребенка работает круглосуточно Тел. 13 22 29.
- Дежурная медсестра Тел. 1300 60 60 24 — для получения экспертной медицинской информации и совета (24 часа, 7 дней)
Что следует помнить
- Лихорадка — это повышение температуры тела, обычно вызванное инфекцией.
- Лихорадку, вызванную вирусными заболеваниями, нельзя лечить антибиотиками, поскольку эти препараты не действуют против вирусов.
- Высокая температура (около 41,5 ° C и выше) чрезвычайно опасна и может вызвать судороги.
Отсроченная лихорадка после инсульта ухудшает исходы
НЬЮ-ЙОРК (Reuters Health) — Начало гипертермии через несколько дней после острого ишемического инсульта тесно связано с более высокой заболеваемостью и смертностью через 3 месяца, сообщают исследователи.Различные исследования показали, что температура тела после инсульта связана с исходами, объясняют доктор Ашфак Шуайб и его коллеги в сентябрьском выпуске журнала Stroke, но они были ограничены небольшими размерами выборки, а температура регистрировалась в разное время после начала инсульта. .
Доктор Шуайб из Университета Альберты, Канада, и его команда получили доступ к данным о 5305 пациентах в испытаниях острого инсульта из базы данных Virtual International Stroke Trials Archive, чтобы определить эффект гипертермии, «в зависимости от времени, об исходе после ишемического инсульта ». Гипертермия определялась как температура выше 37,2 ° C, а плохой исход — как оценка выше 2 по 90-дневной модифицированной шкале Рэнкина.
Средний возраст пациентов составлял 68 лет, из них 45% составляли женщины.Через 3 месяца умерло 996 пациентов (18,8%).
Доля пациентов с зарегистрированными температурами составляла 96% на исходном уровне, 32% через 8 часов, 57% через 24 часа, 32% через 48 часов, 34% через 72 часа и 31% на 7 день. -up имели более низкие базовые температуры », — комментируют авторы.
Гипертермия была задокументирована у 16% на исходном уровне, 11% через 8 часов, 17% через 24 часа, 19% через 48 часов, 18% через 72 часа и 9,3% через 7 дней.
Отношения рисков показали, что вероятность неблагоприятного исхода была наибольшей через 7 дней (HR 1.2 на исходном уровне, 1,7 через 8 часов, 1,5 через 24 часа, 2,0 через 48 часов, 2,2 через 72 часа и 2,7 через 7 дней).
«По сравнению с нормотермическими пациентами уровень смертности был значительно выше (p
Однако они указывают, что« любое повышение температуры по отношению к исходному уровню было значимым предиктором или плохим исходом ».
