Свертывающая и антисвертывающая системы крови.
Сущность и значение свертывания крови.
Если выпущенную из кровеносного сосуда кровь оставить на некоторое время, то из жидкости она вначале превращается в желе, а затем в крови организуется более или менее плотный сгусток, который, сокращаясь, выжимает из себя жидкость, называемую кровяной сывороткой. Это — плазма, лишенная фибрина. Описанный процесс называется свертыванием крови (гемокоагуляцией). Его сущность заключается в том, что растворенный в плазме белок фибриноген в определенных условиях переходит в нерастворимое состояние и выпадает в осадок в виде длинных нитей фибрина. В ячейках этих нитей, как в сетке, застревают клетки и коллоидное состояние крови в целом меняется. Значение этого процесса заключается в том, что свернувшаяся кровь не вытекает из раненного сосуда, предотвращая смерть организма от кровопотери.
Свертывающая система крови.
Первая теория, объясняющая процесс свертывания крови работой специальных ферментов, была разработана в 1902 г. русским ученым Шмидтом. Он считал, что свертывание протекает в две фазы. В первую один из белков плазмы протромбин под влиянием освобождающихся из разрушенных при травме клеток крови, особенно тромбоцитов, ферментов (тромбокиназы) и ионов Са переходит в фермент тромбин. На второй стадии под влиянием фермента тромбина растворенный в крови фибриноген превращается в нерастворимый фибрин, который и заставляет кровь свертываться. В последние годы жизни Шмидт стал выделять в процессе гемокоагуляции уже 3 фазы: 1- образование тромбокиназы, 2- образование тромбина. 3- образование фибрина.
Дальнейшее изучение механизмов свертывания показало, что это представление весьма схематично и не полностью отражает весь процесс. Основное заключается в том, что в организме отсутствует активная тромбокиназа, т.е. фермент, способный превратить протромбин в тромбин (по новой номенклатуре ферментов этот следует называть протромбиназой). Оказалось, что процесс образования протромбиназы очень сложен, в нем участвует целый ряд т.н. тромбогенных белков-ферментов, или тромбогенных факторов, которые, взаимодействуя в каскадном процессе, все необходимы для того, чтобы свертывание крови осуществилось нормально. Кроме того, было обнаружено, что процесс свертывания не кончается образованием фибрина, ибо одновременно начинается его разрушение. Таким образом, современная схема свертывания крови значительно сложнее Шмидтовой.
Современная схема свертывания крови включает в себя 5 фаз, последовательно сменяющих друг друга. Фазы эти следующие:
1. Образование протромбиназы.
2. Образование тромбина.
3. Образование фибрина.
4. Полимеризация фибрина и организация сгустка.
5. Фибринолиз.
За последние 50 лет было открыто множество веществ, принимающих участие в свертывании крови, белков, отсутствие которых в организме приводит к гемофилии (не свертываемости крови). Рассмотрев все эти вещества, международная конференция гемокоагулологов постановила обозначить все плазменные факторы свертывания римскими цифрами, клеточные — арабскими. Это было сделано для того, чтобы исключить путаницу в названиях. И теперь в любой стране после общепринятого в ней названия фактора (они могут быть разными) обязательно указывается номер этого фактора по международной номенклатуре. Для того, чтобы мы могли дальше рассматривать схему свертывания, давайте сначала дадим краткую характеристику этих факторов.
А. Плазменные факторы свертывания.
I. Фибрин и фибриноген. Фибрин — конечный продукт реакции свертывания крови. Свертывание фибриногена, являющееся его биологической особенностью, происходит не только под влиянием специфического фермента — тромбина, но может быть вызвано ядами некоторых змей, папаином и другими химическими веществами. В плазме содержится 2-4 г/л. Место образования — ретикулоэндотелиальная система, печень, костный мозг.
II. Тромбин и протромбин. В циркулирующей крови в норме обнаруживаются лишь следы тромбина. Молекулярный вес его составляет половину молекулярного веса протромбина и равен 30 тыс. Неактивный предшественник тромбина — протромбин — всегда присутствует в циркулирующей крови. Это гликопротеид, в составе которого насчитывают 18 аминокислот. Некоторые исследователи полагают, что протромбин — это комплексное соединение тромбина и гепарина. В цельной крови содержится 15-20 мг% протромбина. Этого содержания в избытке хватает для того, чтобы перевести весь фибриноген крови в фибрин.
Уровень протромбина в крови представляет собой относительно постоянную величину. Из моментов, вызывающих колебания этого уровня, следует указать на менструации (повышают), ацидоз (снижает). Прием 40% алкоголя увеличивает содержание протромбина на 65-175% cпустя 0,5-1 час, что объясняет наклонность к тромбозам у лиц, систематически употребляющих алкоголь.
В организме протромбин постоянно используется и одновременно синтезируется. Важную роль в его образовании в печени играет антигеморрагический витамин К. Он стимулирует деятельность печеночных клеток, синтезирующих протромбин.
III. Тромбопластин. В крови этого фактора в активном виде нет. Он образуется при повреждении клеток крови и тканей и может быть соответственно кровяной, тканевой, эритроцитарный, тромбоцитарный. По своей структуре это фосфолипид, аналогичный фосфолипидам клеточных мембран. По тромбопластической активности ткани различных органов по убывающей располагаются в таком порядке: легкие, мышцы, сердце, почки, селезенка, мозг, печень. Источниками тромбопластина являются также женское молоко и околоплодная жидкость. Тромбопластин участвует как обязательный компонент в первой фазе свертывания крови.
IV. Кальций ионизированный, Са++. Роль кальция в процессе свертывания крови была известна еще Шмидту. Именно тогда в качестве консерванта крови им был предложен цитрат натрия — раствор, который связывал ионы Са++ в крови и предотвращал ее свертывание. Кальций необходим не только для превращения протромбина в тромбин, но для других промежуточных этапов гемостаза, во всех фазах свертывания. Содержание ионов кальция в крови 9-12 мг%.
V и VI. Проакцелерин и акцелерин (АС-глобулин). Образуется в печени. Участвует в первой и второй фазах свертывания, при этом количество проакцелерина падает, а акцелерина — увеличивается. По существу V является предшественником VI фактора. Активизируется тромбином и Са++. Является ускорителем (акцелератором) многих ферментативных реакций свертывания.
VII. Проконвертин и конвертин. Этот фактор является белком, входящим в бета глобулиновую фракцию нормальной плазмы или сыворотки. Активирует тканевую протромбиназу. Для синтеза проконвертина в печени необходим витамин К. Сам фермент становится активным при контакте в поврежденными тканями.
VIII. Антигемофилический глобулин А (АГГ-А). Участвует в образовании кровяной протромбиназы. Способен обеспечивать свертывание крови, не имевшей контакта с тканями. Отсутствие этого белка в крови является причиной развития генетически обусловленной гемофилии. Получен сейчас в сухом виде и применяется в клинике для ее лечения.
IX. Антигемофилический глобулин В (АГГ-В, Кристмас-фактор, плазменный компонент тромбопластина). Участвует в процессе свертывания как катализатор, а также входит в состав тромбопластического комплекса крови. Способствует активации Х фактора.
X. Фактор Коллера, Стьюард-Прауэр-фактор. Биологическая роль сводится к участию в процессах образования протромбиназы, так как он является ее основным компонентом. При свертывании утилизируется. Назван (как и все другие факторы) по именам больных, у которых была впервые обнаружена форма гемофилии, связанная с отсутствием указанного фактора в их крови.
XI. Фактор Розенталя, плазменный предшественник тромбопластина (ППТ). Участвует в качестве ускорителя в процессе образования активной протромбиназы. Относится к бета глобулинам крови. Вступает в реакцию на первых этапах 1 фазы. Образуется в печени с участием витамина К.
XII. Фактор контакта, Хагеман-фактор. Играет роль пускового механизма в свертывании крови. Контакт этого глобулина с чужеродной поверхностью (шероховатость стенки сосуда, поврежденные клетки т.п.) приводит к активации фактора и инициирует всю цепь процессов свертывания. Сам фактор адсорбируется на поврежденной поверхности и в кровоток не поступает, тем самым предупреждается генерализация процесса свертывания. Под влиянием адреналина (при стрессе) частично способен активизироваться прямо в кровотоке.
XIII. Фибринстабилизатор Лаки-Лоранда. Необходим для образования окончательно нерастворимого фибрина. Это — транспептидаза, которая сшивает отдельные нити фибрина пептидными связями, способствуя его полимеризации. Активируется тромбином и Са++. Кроме плазмы есть в форменных элементах и тканях.
Описанные 13 факторов являются общепризнанными основными компонентами, необходимыми для нормального процесса свертывания крови. Вызываемые их отсутствием различные формы кровоточивости относятся к разным видам гемофилий.
В. Клеточные факторы свертывания.
Наряду с плазменными факторами первостепенную роль в свертывании крови играют и клеточные, выделяющиеся из клеток крови. Больше всего их содержится в тромбоцитах, но есть они и в других клетках. Просто при гемокоагуляции тромбоциты разрушаются в большем количестве, чем, скажем, эритроциты или лейкоциты, поэтому наибольшее значение в свертывании имеют именно тромбоцитарные факторы. К ним относятся:
1ф. АС-глобулин тромбоцитов. Подобен V-VI факторам крови, выполняет те же функции, ускоряя образование протромбиназы.
2ф. Тромбин-акцелератор. Ускоряет действие тромбина.
3ф. Тромбопластический или фосполипидный фактор. Находится в гранулах в неактивном состоянии, и может использоваться только после разрушения тромбоцитов. Активируется при контакте с кровью, необходим для образования протромбиназы.
4ф.Антигепариновый фактор. Связывает гепарин и задерживает его антикоагулирующий эффект.
6ф. Ретрактозим. Обеспечивает уплотнение тромба. В его составе определяют несколько субстанций, например тромбостенин +АТФ +глюкоза.
7ф. Антифибинозилин. Тормозит фибринолиз.
8ф. Серотонин. Вазоконстриктор. Экзогенный фактор, 90% синтезируется в слизистой ЖКТ, остальные 10% — в тромбоцитах и ЦНС. Выделяется из клеток при их разрушении, способствует спазму мелких сосудов, те самым способствуя предотвращению кровотечения.
Всего в тромбоцитах находят до 14 факторов, таких еще, как антитромбопластин, фибриназа, активатор плазминогена, стабилизатор АС-глобулина, фактор агрегации тромбоцитов и др.
В других клетках крови в основном находятся эти же факторы, но заметной роли в гемокоагуляции в норме они не играют.
С. Тканевые факторы свертывания
Участвуют во всех фазах. Сюда относятся активные тромбопластические факторы, подобные III, VII,IX,XII,XIII факторам плазмы. В тканях есть активаторы V и VI факторов. Много гепарина, особенно в легких, предстательной железе, почках. Есть и антигепариновые вещества. При воспалительных и раковых заболеваниях активность их повышается. В тканях много активаторов (кинины) и ингибиторов фибринолиза. Особенно важны вещества, содержащиеся в сосудистой стенке. Все эти соединения постоянно поступают из стенок сосудов в кровь и осуществляют регуляцию свертывания. Ткани обеспечивают также и выведение продуктов свертывания из сосудов.
Современная схема гемостаза.
Попытаемся теперь объединить в одну общую систему все факторы свертывания и разберем современную схему гемостаза .
Цепная реакция свертывания крови начинается с момента соприкосновения крови с шероховатой поверхностью раненного сосуда или тканью. Это вызывает активацию тромбопластических факторов плазмы и затем происходит поэтапное образование двух отчетливо различающихся по своим свойствам протромбиназ — кровяной и тканевой..
Однако прежде, чем закончится цепная реакция образования протромбиназы, в месте повреждения сосуда происходят процессы, связанные с участием тромбоцитов (т.н. сосудисто-тромбоцитарный гемостаз). Тромбоциты за счет своей способности к адгезии налипают на поврежденный участок сосуда, налипают друг на друга, склеиваясь тромбоцитарным фибриногеном. Все это приводит к образованию т.н. пластинчатого тромба («тромбоцитарный гемостатический гвоздь Гайема»). Адгезия тромбоцитов происходит за счет АДФ, выделяющейся из эндотелия и эритроцитов. Этот процесс активируется коллагеном стенки, серотонином, XIII фактором и продуктами контактной активации. Сначала (в течение 1-2 минут) кровь еще проходит через эту рыхлую пробку, но затем происходит т.н. вискозное перерождение тромба, он уплотняется и кровотечение останавливается. Понятно что такой конец событий возможен только при ранении мелких сосудов, там, где артериальное давление не в состоянии выдавить этот «гвоздь».
1 фаза свертывания. В ходе первой фазы свертывания, фазе образования протромбиназы, различают два процесса, которые протекают с разной скоростью и имеют различное значение. Это — процесс образования кровяной протромбиназы, и процесс образования тканевой протромбиназы. Длительность 1 фазы составляет 3-4 минуты. однако, на образование тканевой протромбиназы тратится всего 3-6 секунд. Количество образующейся тканевой протромбиназы очень мало, ее недостаточно для перевода протромбина в тромбин, однако тканевая протромбиназа выполняет роль активатора целого ряда факторов, необходимых для быстрого образования кровяной протромбиназы. В частности, тканевая протромбиназа приводит к образованию малого количества тромбина, который переводит в активное состояние V и VIII факторы внутреннего звена коагуляции. Каскад реакций, заканчивающихся образованием тканевой протромбиназы (внешний механизм гемокоагуляции), выглядит следующим образом:
1. Контакт разрушенных тканей с кровью и активация III фактора — тромбопластина.
2. III фактор переводит VII в VIIa (проконвертин в конвертин).
3.Образуется комплекс (Ca++ + III + VIIIa)
4. Этот комплекс активирует небольшое количество Х фактора — Х переходит в Ха.
5. (Хa + III + Va + Ca) образуют комплекс, который и обладает всеми свойствами тканевой протромбиназы. Наличие Va (VI) связано с тем, что в крови всегда есть следы тромбина, который активирует V фактор.
6. Образовавшееся небольшое количество тканевой протромбиназы переводит небольшое количество протромбина в тромбин.
7. Тромбин активирует достаточное количество V и VIII факторов, необходимых для образования кровяной протромбиназы.
В случае выключения этого каскада (например, если со всею предосторожностью с использованием парафинированных игл, взять кровь из вены, предотвратив ее контакт с тканями и с шероховатой поверхностью, и поместить ее в парафинированную пробирку), кровь свертывается очень медленно, в течение 20-25 минут и дольше.
Ну, а в норме одновременно с уже описанным процессом запускается и другой каскад реакций, связанных с действием плазменных факторов, и заканчивающийся образованием кровяной протромбиназы в количестве, достаточном для перевода большого количества протромбина с тромбин. Реакции эти следующие ( внутренний механизм гемокоагуляции):
1. Контакт с шероховатой или чужеродной поверхностью приводит к активации XII фактора : XII — XIIa. Одновременно начинает образовываться гемостатический гвоздь Гайема (сосудисто-тромбоцитарный гемостаз).
2.Активный ХII фактор превращает XI в активное состояние и образуется новый комплекс XIIa +Ca++ +XIa + III(ф3)
3. Под влиянием указанного комплекса IX фактор активизируется и образуется комплекс IXa + Va + Cа++ +III(ф3).
4. Под влиянием этого комплекса происходит активация значительного количества Х фактора, после чего в большом количестве образуется последний комплекс факторов: Xa + Va + Ca++ + III(ф3), который и носит название кровяная протромбиназа.
На весь этот процесс затрачивается в норме около 4-5 минут, после чего свертывание переходит в следующую фазу.
2 фаза свертывания — фаза образования тромбина заключается в том, что под влиянием фермента протромбиназы II фактор (протромбин) переходит в активное состояние (IIa). Это протеолитический процесс, молекула протромбина расщепляется на две половинки. Образовавшийся тромбин идет на реализацию следующей фазы, а также используется в крови для активации все большего количества акцелерина (V и VI факторов). Это пример системы с положительной обратной связью. Фаза образования тромбина продолжается несколько секунд.
3 фаза свертывания — фаза образования фибрина — тоже ферментативный процесс, в результате которого от фибриногена благодаря воздействию протеолитического фермента тромбина отщепляется кусок в несколько аминокислот, а остаток носит название фибрин-мономер, который по своим свойствам резко отличается от фибриногена. В частности, он способен к полимеризации. Это соединение обозначается как Im.
4 фаза свертывания — полимеризация фибрина и организация сгустка. Она тоже имеет несколько стадий. Вначале за несколько секунд под влиянием рН крови, температуры, ионного состава плазмы происходит образование длинных нитей фибрин-полимера Is который, однако, еще не очень стабилен, так как способен растворяться в растворах мочевины. Поэтому на следующей стадии под действием фибрин-стабилизатора Лаки-Лоранда (XIII фактора) происходит окончательная стабилизация фибрина и превращение его в фибрин Ij. Он выпадает из раствора в виде длинных нитей, которые образуют сетку в крови, в ячейках которой застревают клетки. Кровь из жидкого состояния переходит в желеобразное (свертывается). Следующей стадией этой фазы является длящаяся достаточно долго (несколько минут) ретракия (уплотнение) сгустка, которая происходит за счет сокращения нитей фибрина под действием ретрактозима (тромбостенина). В результате сгусток становится плотным, из него выжимается сыворотка, а сам сгусток превращается в плотную пробку, перекрывающую сосуд — тромб.
5 фаза свертывания — фибринолиз. Хотя она фактически не связана с образованием тромба, ее считают последней фазой гемокоагуляции, так как в ходе этой фазы происходит ограничение тромба только той зоной, где он действительно необходим. Если тромб полностью закрыл просвет сосуда, то в ходе этой фазы этот просвет восстанавливается (происходит реканализация тромба). Практически фибринолиз всегда идет параллельно с образованием фибрина, предотвращая генерализацию свертывания и ограничивая процесс. Растворение фибрина обеспечивается протеолитическим ферментом плазмином (фибринолизином) который содержится в плазме в неактивном состоянии в виде плазминогена (профибринолизина). Переход плазминогена в активное состояние осуществляется специальным активатором, который в свою очередь образуется из неактивных предшественников (проактиваторов), высвобождающихся из тканей, стенок сосудов, клеток крови, особенно тромбоцитов. В процессах перевода проактиваторов и активаторов плазминогена в активное состояние большую роль играют кислые и щелочные фосфатазы крови, трипсин клеток, тканевые лизокиназы, кинины, реакция среды, XII фактор. Плазмин расщепляет фибрин на отдельные полипептиды, которые затем утилизируются организмом.
В норме кровь человека начинает свертываться уже через 3-4 минуты после вытекания из организма. Через 5-6 минут она полностью превращается в желеобразный сгусток. Способы определения времени кровотечения, скорости свертывания крови и протромбинового времени вы узнаете на практических занятиях. Все они имеют важное клиническое значение.
Ингибиторы свертывания (антикоагулянты). Постоянство крови как жидкой среды в физиологических условиях поддерживается совокупностью ингибиторов, или физиологических антикоагулянтов, блокирующих или нейтрализующих действие коагулянтов (факторов свертывания). Антикоагулянты являются нормальными компонентами системы функциональной системы гемокоагуляции.
В настоящее время доказано, что существует ряд ингибиторов по отношению к каждому фактору свертывания крови, и, однако, наиболее изученным и имеющим практическое значение является гепарин. Гепарин — это мощный тормоз превращения протромбина в тромбин. Кроме того, он влияет на образование тромбопластина и фибрина.
Гепарина много в печени, мышцах и легких, чем и объясняется не свертываемость крови в малом круге кровотечения и связанная с этим опасность легочных кровотечений. Кроме гепарина обнаружено еще несколько естественных антикоагулянтов с антитромбиновым действием, их принято обозначать порядковыми римскими цифрами:
I. Фибрин (поскольку он в процессе свертывания поглощает тромбин).
II. Гепарин.
III. Естественные антитромбины (фосфолипопротеиды).
IV. Антипротромбин (препятствующий превращению протромбина в тромбин).
V. Антитромбин крови больных ревматизмом.
VI. Антитромбин, возникающий при фибринолизе.
Кроме этих физиологических антикоагулянтов многие химические вещества различного происхождения обладают антикоагулянтной активностью — дикумарин, гирудин (из слюны пиявок) и др. Эти препараты применятся в клинике при лечении тромбозов.
Препятствует свертыванию крови и фибринолитическая система крови. По современным представлениям она состоит из профибринолизина (плазминогена), проактиватора и системы плазменных и тканевых активаторов плазминогена. Под влиянием активаторов плазминоген переходит в плазмин, который растворяет сгусток фибрина.
В естественных условиях фибринолитическая активность крови находится в зависимости от депо плазминогена, плазменного активатора, от условий, обеспечивающих процессы активации, и от поступления этих веществ в кровь. Спонтанная активность плазминогена в здоровом организме наблюдается при состоянии возбуждения, после инъекции адреналина, при физических напряжениях и при состояниях, связанных с шоком. Среди искусственных блокаторов фибринолитической активности крови особое место занимает гамма аминокапроновая кислота (ГАМК). В норме в плазме содержится количество ингибиторов плазмина, превышающее в 10 раз уровень запасов плазминогена в крови.
Состояние процессов гемокоагуляции и относительное постоянство или динамическое равновесие факторов свертывания и антисвертывания связано с функциональным состоянием органов системы гемокоагуляции (костного мозга, печени, селезенки, легких, сосудистой стенки). Деятельность последних, а следовательно, и состояние процесса гемокоагуляции, регулируется нервно-гуморальными механизмами. В кровеносных сосудах имеются специальные рецепторы, воспринимающих концентрацию тромбина и плазмина. Эти два вещества и программируют деятельность указанных систем.
Регуляция процессов гемокоагуляции и антигоагуляции.
Рефлекторные влияния. Важное место среди многих раздражителей, падающих на организм, занимает болевое раздражение. Боль приводит к изменению деятельности почти всех органов и систем, в том числе и системы свертывания. Кратковременное или длительное болевое раздражение ведет к ускорению свертывания крови, сопровождаемое тромбоцитозом. Присоединение к боли чувства страха приводит к еще более резкому ускорению свертывания. Болевое раздражение, нанесенное анестезированному участку кожи, не вызывает ускорения свертывания. Такой эффект наблюдается с первого дня рождения.
Большое значение имеет продолжительность болевого раздражения. При кратковременной боли сдвиги менее выражены и возврат к норме совершается в 2-3 раза быстрей, чем при длительном раздражении. Это дает основание полагать, что в первом случае принимает участие лишь рефлекторный механизм, а при длительном болевом раздражении включается и гуморальное звено, обусловливая продолжительность наступающих изменений. Большинство ученых полагает, что таким гуморальным звеном при болевом раздражении является адреналин.
Значительное ускорение свертывания крови происходит рефлекторно также при действии на организм тепла и холода. После прекращения теплового раздражения период восстановления до исходного уровня в 6-8 раз короче, чем после холодового.
Свертывание крови является компонентом ориентировочной реакции. Изменение внешней среды, неожиданное появление нового раздражителя вызывают ориентировочную реакцию и одновременно ускорение свертывания крови, что является биологически целесообразной защитной реакцией.
Влияние вегетативной нервной системы. При раздражении симпатических нервов или после инъекции адреналина свертывание ускоряется. Раздражение парасимпатического отдела НС приводит к замедлению свертывания. Показано, что вегетативная нервная система оказывает влияние на биосинтез прокоагулянтов и антикоагулянтов в печени. Имеются все основания полагать, что влияние симпатико-адреналовой системы распространяется преимущественно на факторы свертывания крови, а парасимпатической — преимущественно на факторы, препятствующие свертыванию крови. В период остановки кровотечения оба отдела ВНС выступают синергично. Их взаимодействие в первую очередь направлено на остановку кровотечения, что жизненно важно. В дальнейшем, после надежной остановки кровотечения, усиливается тонус парасимпатической НС, что приводит к повышению антикоагулятной активности, столь важной для профилактики внутрисосудистых тромбозов.
Эндокринная система и свертывание. Эндокринные железы являются важным активным звеном механизма регуляции свертывания крови. Под влиянием гормонов процессы свертывания крови претерпевают ряд изменений, а гемокоагуляция либо ускоряется, либо замедляется. Если сгруппировать гормоны по их действию на свертывание крови, то к ускоряющим свертывание будут относиться АКТГ, СТГ, адреналин, кортизон, тестостерон, прогестерон, экстракты задней доли гипофиза, эпифиза и зобной железы; замедляют свертывание тиреотропный гормон, тироксин и эстрогены.
Во всех приспособительных реакциях, в особенности протекающих с мобилизацией защитных сил организма, в поддержании относительного постоянства внутренней среды вообще и системы свертывания крови, в частности, гипофизарно-анреналовая система является важнейшим звеном нейрогуморального механизма регуляции.
Имеется значительное количество данных, свидетельствующих о наличии влияния коры головного мозга на свертывание крови. Так, свертывание крови изменяется при повреждении полушарий головного мозга, при шоке, наркозе, эпилептическом припадке. Особый интерес представляют изменения скорости свертывания крови в гипнозе, когда человеку внушают, что он ранен, и в это время свертываемость возрастает так: как будто это происходит в действительности.
Противосвертывающая система крови.
Еще в 1904 году известный немецкий ученый — коагулолог Моравиц впервые высказал предположение о наличие в организме противосвертывающей системы, которая сохраняет кровь в жидком состоянии, а также о том что свертывающая и антисвертывающая системы, находятся в состоянии динамического равновесия.
Позже эти предположения подтвердились в лаборатории, возглавляемой профессором Кудряшовым. В 30-е годы был получен тромбин, который вводился крысам с целью вызвать свертывание крови в сосудах. Оказалось, что кровь в этом случае вообще перестала свертываться. Значит, тромбин активизировал какую-то систему, которая препятствует свертыванию крови в сосудах. На основании этого наблюдения , Кудряшов пришел также к выводу о наличии противосвертывающей системы.
Под противосвертывающей системой следует понимать совокупность органов и тканей, которые синтезируют и утилизируют группу факторов, обеспечивающих жидкое состояние крови, то есть препятствующих свертыванию крови в сосудах. К таким органам и тканям относятся сосудистая система, печень, некоторые клетки крови и др. Эти органы и ткани вырабатывают вещества, которые получили на звание ингибиторов свертывания крови или естественных антикоагулянтов. Они вырабатываются в организме постоянно, в отличие от искусственных, которые вводятся при лечении претромбических состояний.
Ингибиторы свертывания крови действуют по фазам. Предполагается, что механизм их действия заключается либо в разрушении, либо в связывании факторов свертывания крови.
В 1 фазе в качестве антикоагулянтов срабатывают: гепарин (универсальный ингибитор) и антипротромбиназы.
Во 2 фазе срабатывают ингибиторы тромбина: фибриноген, фибрин с продуктами своего распада — полипептиды, продукты гидролиза тромбина, претромбин 1 и II, гепарин и естественный антитромбин 3, который относится к группе глюкозоаминогликанов.
При некоторых патологических состояниях, например, заболевания сердечно — сосудистой системы, в организме появляются дополнительные ингибиторы.
Наконец, имеет место ферментативный фибринолиз, ( фибринолитическая система) протекающий в 3 фазы. Так, если в организме много образуется фибрина или тромбина, то моментально включается фибринолитическая система и происходит гидролиз фибрина. Большое значение в сохранении жидкого состояния крови имеет неферментативный фибринолиз, о котором говорилось раньше.
По Кудряшову различают две противосвертывающие системы:
I-ая имеет гуморальную природу. Она срабатывает постоянно, осуществляя выброс всех уже перечисленных антикоагулянтов, исключая гепарин. II-ая — аварийная противосвертывающая система, которая обусловлена нервными механизмами, связанными с функциями определенных нервных центров. Когда в крови накапливается угрожающее количество фибрина или тромбина, происходит раздражение соответствующих рецепторов, что через нервные центры активизирует противосвертывающую систему.
Как свертывающая, так и противосвертывающая система регулируются. Давно было замечено, что под влиянием нервной системы, а также некоторых веществ, происходит либо гипер-, либо гипокоагуляция. Например, при сильном болевом синдроме, имеющем место при родах, может развиваться тромбоз в сосудах. Под влиянием стрессовых напряжений также могут образовываться в сосудах тромбы.
Свертывающая и антисвертывающая системы взаимосвязаны, находятся под контролем как нервных, так и гуморальных механизмов.
Можно предположить, что существует функциональная система, обеспечивающая свертывание крови, которая состоит из воспринимающего звена, представленного специальными хеморецепторами, заложенными в сосудистых рефлексогенных зонах (дуга аорты и синокаротидная зона), которые улавливают факторы, обеспечивающие свертывание крови. Второе звено функциональной системы — это механизмы регуляции. К ним относятся нервный центр, получающий информацию с рефлексогенных зон. Большинство ученых предполагает, что этот нервный центр, обеспечивающий регуляцию свертывающей системы, находится в области гипоталамуса. Эксперименты над животными показывают, что при раздражении задней части гипоталамуса имеет место чаще гиперкоагуляция, а при раздражении передней части — гипокоагуляция. Эти наблюдения доказывают влияние гипоталамуса на процесс свертывания крови, и наличие в нем соответствующих центров. Через этот нервный центр осуществляется контроль за синтезом факторов, обеспечивающих свертывание крови .
К гуморальным механизмам относятся вещества, меняющие скорость свертывания крови. Это прежде всего гормоны: АКТГ, СТГ, глюкокортикоиды, ускоряющие свертывание крови; инсулин действует двуфазно — в течение первых 30 минут ускоряет свертывание крови, а затем в течение нескольких часов — замедляет.
Минералокортикоиды (альдостерон) снижают скорость свертывания крови. Половые гормоны действуют по-разному: мужские ускоряют свертывание крови, женские действуют двояко: одни из них увеличивают скорость свертывание крови — гормоны желтого тела. другие же, замедляют (эстрогены)
Третье звено — органы — исполнители, к которым, прежде всего, относится печень, вырабатывающая факторы свертывания, а также клетки ретикулярной системы.
Как работает функциональная система? Если концентрация каких — либо факторов обеспечивающих процесс свертывания крови, возрастает или падает, то это воспринимается хеморецепторами. Информация от них идет в центр регуляции свертывания крови, а затем на органы — исполнители, и по принципу обратной связи их выработка или тормозится или увеличивается.
Регулируется также и антисвертывающая система, обеспечивающая крови жидкое состояние. Воспринимающее звено этой функциональной системы находится в сосудистых рефлексогенных зонах и представлено специфическими хеморецепторами, улавливающими концентрацию антикоагулянтов. Второе звено представлено нервным центром противосвертывающей системы. По данным Кудряшова, он находится в продолговатом мозге, что доказывается рядом экспериментов. Если, например, выключить его такими вещества ми, как аминозин, метилтиурацил и другими, то кровь начинает свертываться в сосудах. К исполнительным звеньям относятся органы, синтезирующие антикоагулянты. Это сосудистая стенка, печень, клетки крови. Срабатывает функциональная система, препятствующая свертыванию крови следующим образом: много антикоагулянтов — их синтез тормозится, мало — возрастает (принцип обратной связи).
Система свёртывания крови
Система свёртывания крови по функциональному признаку делится на две системы: свёртывающую (гемокоагуляционную) и противосвёртывающую (антитромботичес-кую). Противосвёртывающее действие обеспечивается антикоагулянтной и фибринолитической системами. Поддержание жидкого состояния циркулирующей крови обеспечивается взаимодействием свёртывающей и противосвёртывающей систем крови, которые в физиологических условиях находятся в динамическом равновесии.
Свёртывающая (гемокоагуляционная) система крови
Назначение свёртывающей системы крови — образование нерастворимого фибрина. В свёртывающую систему крови входят ферментные и неферментные белки плазмы, тканей и форменных элементов крови (прежде всего тромбоцитов), надмолекулярные образования (фрагменты клеточных мембран) и ионизированный кальций. Международный комитет по выработке номенклатуры факторов свёртывания присвоил арабскую нумерацию тромбоцитарным (P1–11) и римскую (ф.I–XIII) — плазменным и тканевым факторам.
Большинство плазменных факторов гемокоагуляции являются ферментами (сериновые протеиназы), синтезируются в печени и секретируются в кровь в неактивном состоянии, то есть в виде прокоагулянтов. Активирование большинства прокоагулянтов осуществляется путём частичного протеолиза. На определённых этапах процесс свёртывания резко ускоряется неферментными белками (ф.VIII и ф.V), выполняющими роль коферментов.
Свёртывание крови (гемокоагуляция) — цепной каскадный ферментативный процесс, в ходе которого происходит взаимодействие и последовательная активация ряда сериновых протеиназ на фосфолипидных матрицах (тромбопластинах), заканчивающийся превращением растворимого фибриногена в нерастворимый фибрин.
Время свёртывания крови составляет 5–7 минут.
Выделяют три фазы гемокоагуляции и посткоагуляционную фазу.
Первая фаза — образование протромбиназы или активного тромбопластина крови (4 мин 50 с – 6 мин 50 с).
Вторая фаза — образование тромбина (2–5 с).
Третья фаза — образование фибрина (2–5 с).
Четвертая (посткоагуляционная) фаза — ретракция тромба, то есть образование гемостатически полноценного тромба (55–85 мин).
В зависимости от механизма первой фазы различают внешнюю и внутреннюю системы свёртывания крови.
Внутренний путь образования протромбиназы. Во внутреннем пути все необходимые факторы присутствуют в движущейся крови и реакции свёртывания начинаются при контакте крови с измененной или чужеродной поверхностью, по смачиваемости отличающейся от эндотелия (повреждённая сосудистая стенка или измененная вследствие васкулитов, атеросклероза, интоксикации; поврежденный эндокард). Кроме контакта с чужеродной поверхностью активирование фактора ХII может осуществляться ферментом калликреином, а также иммунными комплексами, адреналином, жирными кислотами, холестеролом, триацилглицеролами, эндотоксинами, бактериальными липопротеинами и другими веществами. Во внутренней активирующей системе источник тромбопластинов — плазматические мембраны активированных тромбоцитов (Р3 — тромбоцитарный тромбопластин).
Внешний путь образования протромбиназы. Появление в кровотоке обломков клеточных мембран (ф.IIIа — активный тканевой тромбопластин) при травме и других патологических состояниях или продукция тканевого тромбопластина эндотелиоцитами (при стазе крови, гипоксии, ацидозе, действии протеиназ и токсинов на эндотелий) быстро запускает внешний механизм свертывания крови.
Продукт второй фазы — тромбин. Тромбин — ключевой фермент гемокоагуляции, количество которого строго контролируется.
Роль витамина «К» в гемокоагуляции. Витамин К (К1, К2, К3, викасол и другие) является антигеморрагическим фактором. Он принимает участие в посттрансляционном созревании факторов II, VII, IX и Х свёртывающей системы крови (а также в созревании витамин К-зависимых антикоагулянтов — протеинов С и S). Гамма-карбоксилирование остатков глутаминовой кислоты в молекуле этих белков протекает после трансляции, в эндоплазматическом ретикулуме гепатоцитов с участием -глутамилкарбоксилазы. Роль кофактора в составе этого феромента выполняет восстановленная форма витамина К:
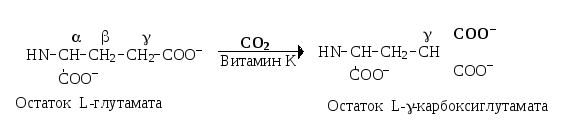
Наличие дополнительной -карбоксильной группы в остатках глутаминовой кислоты придает этим белкам способность при посредстве иона кальция связываться на фосфолипидной поверхности и участвовать в реакциях гемокоагуляции. При авитаминозе К содержание витамин К-зависимых факторов системы свёртывания в плазме крови не изменяется, но нарушается их способность связываться на поверхности тромбопластинов.
Свёртывающая система крови:

Длительная и выраженная гиперкоагуляция создает благоприятные условия для тромбообразования. Аномалии или дефицит факторов гемокоагуляции (коагулопатии) ведут к нарушению коагуляционного гемостаза, что сопровождается кровотечениями.
Физиология свертывания крови.
Свертывание крови – совокупность биофизических, биохимических процессов, обеспечивающих переход крови из жидкого состояние в твердое (агрегатное состояние) и защищает организм от кровопотери, обеспечивает постоянство объема циркулирующей крови.
Система свертывания крови – совокупность механизмов клеточного и ферментативного характера.
Функционирует в норме вместе с механизмами, которые препятствуют свертыванию крови — это противосвертывающая система. Свертывающая и противосвертывающая системы образуют единую систему – система регуляции агрегатного состояния крови.
Механизмы свертывания крови.
Первые данные получены А. А. Шмидтом:
При свертывании крови образуются нити нерастворимого белка – фибрина. Они служат основой будущего кровяного плотного сгустка.
Образование фибрина является аутокаталитическим ферментативным процессом и свертывание крови представляет собой ферментативную, биохимическую реакцию.
Показано, что в норме в циркулирующей крови фибрина почти нет, имеется его химический предшественник – фибриноген, который присутствует постоянно в плазме в растворенном состоянии в избирательных концентрациях; в случае повреждения сосудистой стенки происходит ферментативная реакция.
тромбин
Фибриноген—————————фибрин
Тромбин является ферментативным катализатором.
Шмидт А. А. показал, что в нормальной крови тромбина почти нет, но при активации свертывания он образуется из своего предшественника протромбина.
Протромбин———————————тромбин.
Реакция ферментативная.
Один из учеников А. А. Шмидта — Моравитц установил, что принимают участие ионы кальция, растворенные в плазме; красные кровяные пластинки-тромбоциты. Переход протромбина в тромбин многоступенчатый аутокаталитический процесс, который осуществляется под влиянием протромбиназ (тромбопластин).
Тромбопластины – это совокупность факторов, обеспечивающих переход протромбина в тромбин, множество ферментативных реакций приводит к образованию тромбопластина.
Современные представления о процессе свертывания.
Свертывание крови – это многоступенчатый, ферментативный процесс, протекающий по типу каскада; активация осуществляется с помощью факторов, которые выбрасываются в кровь или околоклеточную жидкость при повреждении клеток и тканей.
Гемостаз – остановка кровотечения, направленная на поддержание массы циркулирующей крови; представляет собой совокупность физиологических и биохимических процессов; состоит из трех компонентов.
Сосудистый компонент.
Активная реакция сужения сосудов в участке повреждения, которое возникает вследствие сосудосуживающих биологически активных веществ. Обусловливает резкое ограничение кровотока: профилактика кровопотери.
2. Клеточный компонент.
Переход тромбоцитов в функционально активное состояние – подвижность, способность склеиваться друг с другом и прилипать в виде агрегатов к стенкам поврежденных сосудов.
Структурная основа первичного пластинчатого тромба – хлопьевидное скопление тромбоцитов. Происходит заклеивание образующейся бреши, однако тромб мягкий и структурно непрочный, может удержать движение крови в микрососудах, в крупных сосудах не справится.
Клеточный компонент является одним из древнейших, у моллюсков, насекомых движение гемолимфы осуществляется под небольшим давлением.
Активация тромбоцитов и агрегация: тромбоциты выбрасывают в плазму крови ряд веществ, которые активируют третий компонент.
4. Фазы свертывания крови. Нормальная физиология: конспект лекций
4. Фазы свертывания крови
Свертывание крови – это сложный ферментативный, цепной (каскадный), матричный процесс, сущность которого состоит в переходе растворимого белка фибриногена в нерастворимый белок фибрин. Процесс называется каскадным, так как в ходе свертывания идет последовательная цепная активация факторов свертывания крови. Процесс является матричным, так как активация факторов гемокоагуляци происходит на матрице. Матрицей служат фосфолипиды мембран разрушенных тромбоцитов и обломки клеток тканей.
Процесс свертывания крови происходит в три фазы.
Сущность первой фазы состоит в активации X-фактора свертывания крови и образовании протромбиназы. Протромбиназа – это сложный комплекс, состоящий из активного X-фактора плазмы крови, активного V-фактора плазмы крови и третьего тромбоцитарного фактора. Активация X-фактора происходит двумя способами. Деление основано на источнике матриц, на которых происходит каскад ферментативных процессов. При внешнем механизме активации источником матриц является тканевый тромбопластин (фосфолипидные осколки клеточных мембран поврежденных тканей), при внутреннем – обнаженные коллагеновые волокна, фосфолипидные осколки клеточных мембран форменных элементов крови.
Сущность второй фазы – образование активного протеолитического фермента тромбина из неактивного предшественника протромбина под влиянием протромбиназы. Для осуществления этой фазы необходимы ионы Ca.
Сущность третьей фазы – переход растворимого белка плазмы крови фибриногена в нерастворимый фибрин. Эта фаза осуществляется три 3 стадии.
1. Протеолитическая. Тромбин обладает эстеразной активность и расщепляет фибриноген с образованием фибринмономеров. Катализатором этой стадии являются ионы Ca, II и IX протромбиновые факторы.
2. Физико-химическая, или полимеризационная, стадия. В ее основе лежит спонтанный самосборочный процесс, приводящий к агрегации фибрин-мономеров, который идет по принципу «бок в бок» или «конец в конец». Самосборка осуществляется путем формирования продольных и поперечных связей между фибринмономерами с образованием фибрин-полимера (фибрина-S) Волокна фибрина-S легко лизируются не только под влиянием плазмина, но и комплексных соединений, которые не обладают фибринолитической активностью.
3. Ферментативная. Происходит стабилизация фибрина в присутствии активного XIII фактора плазмы крови. Фибрин-S переходит в фибрин-I (нерастворимый фибрин). Фибрин-I прикрепляется к сосудистой стенке, образует сеть, где запутываются форменные элементы крови (эритроциты) и образуется красный кровяной тромб, который закрывает просвет поврежденного сосуда. В дальнейшем наблюдается ретракция кровяного тромба – нити фибрина сокращаются, тромб уплотняется, уменьшается в размерах, из него выдавливается сыворотка, богатая ферментом тромбином. Под влиянием тромбина фибриноген вновь переходит в фибрин, за счет этого тромб увеличивается в размерах, что способствует лучшей остановке кровотечения. Процессу ретракции тромба способствует тромбостенин – контрактивный белок кровяных пластинок и фибриноген плазмы крови. С течением времени тромб подвергается фибринолизу (или растворению). Ускорение процессов свертывания крови называется гиперкоагуляцией, а замедление – гипокоагуляцией.
Данный текст является ознакомительным фрагментом.Читать книгу целиком
Поделитесь на страничкеСледующая глава >
Свертывание крови [Свертывающая система] — развитие, нарушение, особенности, формирование, функции, виды, условия, механизм, регуляция, стадии, этапы, фазы, вики — Wiki-Med
Основная статья: КровьСодержание (план)
Свертывание крови — это очень сложный процесс, который происходит при участии многих факторов.
При вытекании из сосуда кровь довольно быстро свертывается, превращаясь в желеобразную массу. Благодаря такому свойству крови кровотечение останавливается, так как сгусток заклеивает рану. Внутри сосудов кровь не свертывается, но если произошло нарушение целости сосудистой стенки, то на этом месте тотчас же начинает образовываться сгусток.
У некоторых моллюсков жидкость тела не свертывается, но зато мощная кожная мускулатура своим сокращением предотвращает ее вытекание, у насекомых же каждая трещинка в покровах тотчас заклеивается лимфой.
Основной механизм свертывания крови был установлен более 60 лет тому назад русским ученым Шмидтом. Такое представление о свертывании крови лежит в основе и современного учения, но значительно расширено в последнее время многими дополнительными факторами, участвующими в этом процессе.
Фазы свертывания крови
Процесс свертывания крови можно разделить на несколько фаз (рис. 45).
Образование тромбопластина
Прежде всего, для начала свертывания необходимо появление в плазме крови тромбопластина (синоним — тромбокиназа), содержащегося в кровяных пластинках и отчасти в тканях. Кровяные пластинки очень неустойчивые клетки и при соприкосновении с патологически измененными стенками сосудов (еще внутри сосудов) или с тканями (вне сосудов при их разрыве) они разрушаются (дезинтеграция) и содержащийся в них тромбопластин выходит в плазму крови. При этом из пластинок в плазму поступают еще некоторые вещества, в дальнейшем принимающие участие в свертывании крови.
В 1-й фазе свертывания тромбопластин, соединившись с находящимся в плазме белком — гемофилическим глобулином (фактор VIII) и при воздействии других факторов (IX, X) и ионов Са2+ превращается в активный тромбопластин (тромбокиназу).
Образование тромбина
Во 2-й фазе активный тромбопластин взаимодействует с находящимся в плазме крови ферментом протромбином, который под влиянием тромбопластина, ионов Са2+, превращается в активный фермент — тромбин. На скорость образования тромбина и его количество и активность оказывают влияние ряд других факторов: имеющийся в плазме глобулин (акцелератор — фактор V), тромботропин (конвертин —фактор VII и VIIa), фактор VI и пластиночный фактор 1. Большую роль в процессе свертывания крови и особенно в образовании протромбина играет витамин К1; который может синтезироваться микрофлорой кишечника и, всасываясь, поступает в кровь.
Образование фибрина
В 3-й фазе свертывания происходит коагуляция фибриногена под воздействием тромбина. Фибриноген переходит из состояния коллоидного раствора — золя в состояние геля, т. е. коагулирует.
Фибриноген в состоянии геля называется фибрином. Фибрин образует нити белка, приклеивающиеся к стенкам раны, и в петлях этой сетки задерживаются клетки крови и остатки плазмы. В дальнейшем нити фибрина укорачиваются, сгусток уплотняется (ретракция) и при этом из него выжимается остаток плазмы — сыворотка (серум), которая содержит все остальные белки (сывороточные) и другие составные части плазмы.
При сбивании свежеполученной, еще не свернувшейся крови палочкой, нити фибрина наматываются на нее и при отмывании оказываются белой волокнистой массой. После такого удаления из крови фибрина она называется дефибринированной и в дальнейшем не свертывается.
Ретракция сгустка
В 1-й фазе, более растянутой во времени в сравнении с быстро протекающими тремя первыми фазами, происходит ретракция сгустка, а в дальнейшем — его постепенный распад. Как ретракция, так и распад фибрина протекают под действием ферментов (энзим ретракции, происходящий из тромбоцитов, и фибринолизин — образующийся в плазме).
Противосвертывающая система крови
Наряду с факторами, без которых свертывание крови или невозможно или протекает замедленно и неполно, есть вещества, которые, наоборот, тормозят свертывание крови. К ним относятся прежде всего гепарин, найденный впервые в печени. В плазме и в тканях он обычно неактивен, но соединяясь с ко фактором — альбумином X (XII) — превращается в активный тормозящий фактор. Гепарин тормозит образование активного тромбопластина (1-яфаза), активацию протромбина (2-я фаза) и действие тромбина (3-я фаза). Материал с сайта http://wiki-med.com
Нарушение свертывания крови
При некоторых условиях в крови может появиться антитромбин, который, соединяясь с тромбином, превращает его в метатромбин, уже неспособный вызвать коагуляцию фибриногена.
Затормозить и даже сделать невозможным свертывание можно также осаждением в плазме ионов Са2+ (лимонно- или щавелевокислыми солями и др. средними солями) и введением кумаринов (производных кумариновой кислоты), связывающих ряд вышеуказанных факторов.
Скорость свертывания крови
Свертывание крови у разных животных происходит с различной скоростью. Так, у птиц она свертывается очень быстро, у лошади — медленно. Скорость свертывания зависит от состояния организма, от температуры окружающей среды. При понижении температуры свертывание крови замедляется. Для клинических целей скорость свертывания определяют приборами разной сложности или просто на предметном стекле, или в пробирке.
На этой странице материал по темам:скорость свертываемости крови у животных
скорость свертывание крови
курсовая работа на тему свертывание крови
система свертывания крови сообщение
противосвёртывающая система крови кратко
4. Свертывающая система крови. О чем говорят анализы. Секреты медицинских показателей – для пациентов
Свертывающая система крови – это одна из наиболее важных защитных систем организма, которая обеспечивает сохранность крови в сосудистой системе, а также предотвращает гибель организма от кровопотери при нарушении целостности сосудов при травме.

Рис. 15. Так выглядит артерия изнутри
Науке на современном этапе ее развития известно, что в остановке кровотечения принимают участие два механизма:
• Клеточный, или сосудисто-тромбоцитарный.
• Плазменный, коагуляционный.
Следует иметь в виду, что деление реакций гемостаза на клеточный и плазменный является условным, т. к. два этих механизма свертывающей системы неразрывно связаны и отдельно друг от друга функционировать не могут.
Процесс свертывания крови осуществляется при многостадийном взаимодействии плазменных белков на фосфолипидных мембранах, именуемых факторами свертывания крови. Эти факторы обозначаются римскими цифрами. В случае же их перехода в активированную форму к номеру фактора добавляют маленькую букву «а».
Чтобы как следует разобраться, необходимо знать, что же входит в состав этих факторов.
Их всего 12:
I – фибриноген. Его синтез происходит в печени, а также в костном мозге, селезенке, лимфатических узлах и других клетках ретикулоэндотелиальной системы. Разрушение фибриногена происходит в легких под действием специального фермента – фибриногеназы. В норме в плазме содержится 2–4 г/л. Минимальное же количество, необходимое для гемостаза, составляет всего 0,8 г/л.
II – протромбин. Протромбин образуется в печени с помощью витамина К. При эндогенном или экзогенном дефиците витамина К происходит снижение количества протромбина или же нарушается его функциональность. Это ведет к образованию неполноценного протромбина. В плазме его содержится всего 0,1 г/л, но скорость свертывания крови нарушается только при снижении протромбина до 40 % от нормы и ниже.
III – тканевой тромбопластин. Это не что иное как термостабильный липопротеид, который содержится во многих органах (в легких, мозге, сердце, почках, печени и скелетных мышцах). Особенностью тканевого тромбопластина является то, что он находится в тканях не в активном состоянии, а лишь в роли предшественника – протромбопластина.
Тканевой тромбопластин, взаимодействуя с факторами IV и VII, может активировать плазменный фактор X, а также принимает участие во внешнем пути формирования комплекса факторов, которые протромбин преобразовывает в тромбин, т. е. протромбиназы.
IV – ионы кальция. В норме содержание этого фактора в плазме равно 0,09-0,1 г/л. Из достоинств фактора IV следует отметить то, в принципе невозможен его расход, и процессы свертывания не нарушаются даже при снижении концентрации кальция. Ионы кальция также участвуют во всех трех фазах свертывания крови.
V – проакцелерин, плазменный AC-глобулин, или лабильный фактор. Этот фактор образуется в печени, но от других печеночных факторов (II,VII, X) его отличает то, что он не зависит от витамина K. В плазме его содержится всего 0,01 г/л.
VI – акцелерин, или сывороточный AC-глобулин. Является активной формой фактора V.
VII – проконвертин. Образуется в печени при участии витамина К. Содержится в плазме всего 0,005 г/л.
VIII – антигемофильный глобулин А. Синтез его происходит в печени, селезенке, клетках эндотелия, почках, лейкоцитах. Его содержание в плазме колеблется в пределах 0,01-0,02 г/л. Принимает участие во внутреннем пути формирования протромбиназы.
IX – фактор Кристмаса, антигемофильный глобулин В. Синтезируется в печени также при участии витамина K и его количество в плазме составляет 0,003 г/л. Активно принимает участие во внутреннем пути формирования протромбиназы.
X – фактор Стюарта-Прауэра. Образуется в неактивном состоянии в печени, а затем активируется трипсином и ферментом из яда гадюки. Также зависим от витамина K. Участвует в образовании протромбиназы. Содержание в плазме составляет всего 0,01 г/л.
XI – фактор Розенталя. Этот фактор синтезируется в печени, а также является антигемофильным фактором и плазменным предшественником тромбопластина. Содержание фактора Розенталя в плазме составляет примерно 0,005 г/л.
XII – фактор контакта, фактор Хагемана. Образуется также в печени в неактивном состоянии. Содержание в плазме всего 0,03 г/л.
XIII Фибринстабилизирующий фактор, фибриназа, плазменная трансглутаминаза. Принимает участие в формировании плотного сгустка.
Также не стоит забывать и о вспомогательных факторах:
• Фактор Виллебранда, который является антигеморрагическим сосудистым фактором. Он выполняет роль белка-носителя для антигемофильного глобулина А.
• Фактор Флетчера – плазменный прекалликреин. Принимает участие в активации плазминогена, факторов IX и XII, а также переводит кининоген в кинин.
• Фактор Фитцджеральда – плазменный кининоген (фактор Фложека, фактор Вильямса). Активно принимает участие в активации плазминогена и фактора XII.
Для нормального состояния крови бесперебойно должны работать три системы:
1. Свертывающая.
2. Противосвертывающая.
3. Фибринолитическая.
И эти три системы находятся в состоянии динамического равновесия. Нарушение этого равновесия может привести, как к неостанавливаемым кровотечениям, так и к тромбофилиям.
Так, наследственный или приобретенный дефицит компонентов фибринолитической системы и первичных антикоагулянтов может стать причиной развития тромбофилических состояний, которые характеризуются склонностью к многочисленно повторяющимся тромбозам. Наиболее часто приобретенные формы тромбофилии вызваны:
Во-первых, повышенным потреблением антикоагулянтов или компонентов фибринолитической системы, которое сопровождается массивным внутрисосудистым свертыванием крови;
Во-вторых, проведением интенсивной противосвертывающей и фибринолитической терапии, которая ускоряет метаболизм тех же антикоагулянтов или компонентов фибринолитической системы. В данной ситуации, чтобы восполнить недостаток факторов крови, проводят внутривенное введение их концентратов или переливание свежезамороженной плазмы.
Нарушение свертываемости крови, которое характеризуется склонностью к часто повторяющимся тромбозам сосудов и инфарктам органов, также очень часто связывают с наследственным или симптоматическим недостатком антитромбина III, компонентов фибринолитической и калликреин-кининовой системы, а также с нехваткой фактора XII и аномалиями фибриногена.
К причинам тромбофилий относят гипперагрегацию тромбоцитов, а также недостаток простациклина и прочих блокираторов агрегации тромбоцитов.
С другой стороны, существует определенное состояние, при котором наоборот происходит снижение свертываемости крови. Данное состояние получило название – гипокоагуляция. Ее появление связывают:
• С недостатком одного или нескольких факторов свертывания крови.
• С появлением в кровотоке антител к факторам свертывания крови. Наиболее часто происходит угнетение факторов V, VIII, IX, а также фактора Виллебранда.
• С действием противосвертывающих и тромболитических препаратов.
• С ДВС-синдромом (синдромом диссеминированного внутрисосудистого свертывания крови.
Что касается наследственных заболеваний, при которых происходит нарушение свертываемости крови, то в большинстве случаев они представлены гемофилией A и B, а также болезнью Виллебранда. Для этих болезней свойственна кровоточивость, возникающая еще в детском возрасте, причем у мужчин кровоточивость преимущественно гематомного типа, т. е. кровоизлияния наблюдаются в суставах и происходит поражение всего опорно-двигательного аппарата. Смешанный же тип кровоточивости – петехиально-пятнистый с редкими гематомами встречается у обоих полов, но уже при болезни Виллебранда.
Данный текст является ознакомительным фрагментом.Читать книгу целиком
Поделитесь на страничкеСледующая глава >
Система свертывания крови. Заболевания крови
Система свертывания крови
Механизм гемокоагуляции
Основы ферментной теории свертывания крови были заложены еще в XIX в. профессором Юрьевского университета А. А. Шмидтом (1861 г.; 1895 г.) и уточнены П. Моравитцем в 1905 г. Согласно данной теории образование волокон фибрина, составляющих каркас любого свертка крови, связано с ферментным отщеплением от молекул фибриногена небольших фрагментов (фибринопептидов), после чего остающиеся основные части этих молекул (фибрин-мономеры) соединяются друг с другом в длинные цепи «фибринполимера».
Фермент крови, обеспечивающий отщепление фибрино-пептидов и превращение фибриногена в фибрин, получил название тромбина. Готового тромбина в плазме нет, но в ней имеется его неактивный предшественник – протромбин (фактор II), который в присутствии ионов кальция и под влиянием «тромбокиназы» превращается в тромбин.
Имеется 2 различных механизма активации свертывания крови. Один из них обозначается как «внешний механизм», поскольку запускается поступлением из тканей или из лейкоцитов в плазму тканевого тромбопластического фактора (фактора III), относящегося к липопротеидам. Этот фактор вступает во взаимодействие с фактором VII и при участии ионов кальция быстро образует активатор фактора X, который и является главной составной частью протромбиназы, поскольку трансформирует протромбин (фактор II) в тромбин (IIа). В лабораторных условиях этот путь имитируется протромбиновым тестом Квика: к исследуемой рекальцифицированной плазме добавляется стандартная доза тканевого (мозгового) тромбо-пластина, получается, что процесс искусственно запускается по внешнему механизму.
Второй путь активации свертывания назван внутренним, поскольку осуществляется без добавления извне тканевого тромбопластина, за счет внутренних ресурсов плазмы. В искусственных условиях свертывание по внутреннему механизму наблюдается тогда, когда кровь, извлеченная из сосудистого русла, самопроизвольно свертывается в пробирке. Запуск этого внутреннего механизма начинается с активации фактора XII (фактора Хагемана). Эта активация возникает в разных условиях: вследствие контакта крови с поврежденной сосудистой стенкой (коллагеном и другими структурами), с измененными клеточными мембранами, под влиянием некоторых протеаз и адреналина, а вне организма – вследствие контакта крови или плазмы с чужеродной поверхностью – стеклом, иглами, кюветами и др. Этой контактной активации не препятствует удаление из крови ионов кальция, в связи с чем она происходит и в цитратной (или оксалатной) плазме. Однако в этом случае процесс обрывается на активации фактора IX, для которой уже необходим ионизированный кальций. Вслед за фактором XII последовательно активируются факторы XI, IX и VIII. Последние два фактора образуют продукт, который активирует фактор X, что приводит к формированию протромбиназной активности. Вместе с тем сам по себе активированный фактор X обладает слабой протромбиназной активностью, но она усиливается в 1000 раз акселерирующим фактором – фактором V.
Точно так же действие фактора IX на фактор X усиливается в несколько тысяч раз фактором VIII – антигемофильным глобулином. Этим обосновывается деление плазменных факторов свертывания на 2 группы: ферментную – факторы XII, XI, IX, VII, X и II и неферментную – факторы I, V и VIII. Фактор X последовательно отщепляет от протромбина два фрагмента, в результате чего образуется тромбин-эстераза, отщепляющая от ?– и ?-цепей фибриногена вначале 2 пептида А, затем – 2 пептида В (всего 4 фибринопептида). Незавершенный фибрин-мономер, от которого отделились лишь пептиды А, обозначается как «дес-А-фибрин», а лишенный пептидов А и В – как «дес-АВ-фибрин». Фибрин-мономеры имеют трехмодулярную структуру, их сборка в полимер проходит этапы формирования димеров, из которых путем дальнейшего продольного и поперечного связывания образуются протофибрилы фибрина. Соединяясь друг с другом, протофибрилы формируют волокна фибрина. Фибринстабилизирующий фактор XIII (плазменная трансглутаминаза) «прошивает» фибрин-полимеры дополнительными перекрестными связями между ?-цепями и тем самым укрепляет фибрин, делает его нерастворимым в мочевине, монохлоруксусной кислоте и других растворителях. Основным активатором фактора XIII является тромбин.
В условиях патологии процесс полимеризации фибрина легко нарушается либо вследствие плохой трансформации дес-А-фибрина в дес-АВ-фибрин, либо из-за нарушения сборки димеров и протофибрил. В этих случаях фибрин-мономеры (дес-А-фибрин и дес-АВ-фибрин) соединяются с фибриногеном, образуя средне– и крупномолекулярные (от 450 000 до 2 000 000 и более) растворимые фибрин-мономерные комплексы. Фибриноген в этих комплексах блокируется и утрачивает способность свертывания под влиянием тромбина. Этот феномен, имеющий большое диагностическое значение, в литературе обозначается по-разному – «растворимые фибрин-мономерные комплексы» (РФМК), «фибринемия», «несвертывающийся фибрин», «заблокированный, или тромбинрезистентный, фибриноген», «феномен паракоагуляции». Последнее название связано с тем, что не свертывающиеся тромбином РФМК коагулируют или преципитируют под влиянием ряда неферментных воздействий – при добавлении к плазме спирта (этаноловый тест), сульфата протамина (протамин-сульфатный тест) или при охлаждении (криофибриноген).
Биологический смысл и санационное значение образования РФМК заключаются в том, что они способствуют поддержанию жидкого состояния крови при тромбинемии, препятствуют отложению больших масс фибрина в сосудах и уменьшают блокаду зоны микроциркуляции.
Вместе с тем доказано, что РФМК значительно легче и быстрее растворяются плазмином, чем коагулировавший фибрин.
Таким образом, свертывание крови – многоэтапный каскадный ферментный процесс, в котором последовательно активируются проферменты и действуют силы аутокатализа, функционирующие как сверху вниз, так и по механизму обратной связи. Так, первые малые дозы тромбина, чаще всего образующиеся благодаря включению внешнего механизма свертывания под влиянием тканевого тромбопластина, активируют акселераторы – факторы VIII и V, в результате чего интенсифицируется основный внутренний механизм формирования протромбиназной активности и тромбина.
Эти механизмы аутокатализа действуют интенсивно, но кратковременно. Вскоре их сменяют инактивация факторов свертывания и самоторможение системы. Этому способствуют как физиологические антикоагулянты, так и конечные и побочные продукты свертывания, многие с высокой противосвертывающей активностью. Ингибирующим влиянием на свертывание крови и тромбоцитарный гемостаз обладают и продукты фибринолиза.
По всем этим причинам свертывание крови затормаживается и не переходит в обычных условиях из локального процесса во всеобщую коагуляцию циркулирующего фибриногена.
Также в активации начальных этапов свертывания участвуют компоненты калликреин-кининовой системы. Стимуляторами являются фактор ХIIа и его фрагменты, образующиеся в результате расщепления фактора XII калликреином. Комплекс фактор ХIIа – калликреин – высокомолекулярный кининоген (ВМК) ускоряет активацию не только фактора XI, но и фактора VII, реализуя взаимосвязь между внутренним и внешним механизмами свертывания. Еще более важно активирующее влияние тромбопластина и фактора VII на фактор IX, в результате чего даже малые дозы тканевого тромбопластина запускают процесс свертывания крови не только по внешнему, но и по внутреннему пути, через фактор IX. Установлено также, что фактор ХIIа и его фрагменты через калликреин-кининовую систему, а отчасти и непосредственно активируют ряд других плазменных ферментных систем, в том числе фибринолитическую и систему комплемента.
Фактор VIII – многокомпонентная система, состоящая из нескольких субъединиц, участвующих в формировании его коагуляционной активности (VIII : С) и в тромбоцитарно-сосудистом взаимодействии (фактор Виллебранда VIII : FW). Эти субъединицы отличаются разной стабильностью, гетерогенны по генетическому контролю и антигенным свойствам.
Противосвертывающие механизмы
Противосвертывающие механизмы играют ведущую роль в поддержании жидкого состояния крови и в ограничении процесса тромбообразования. Однако они изучены значительно меньше, чем процесс свертывания крови, в связи с чем вопросы функции и физиологической регуляции антикоагулянтного звена системы гемостаза во многом остаются дискуссионными.
Все образующиеся в организме антикоагулянты можно разделить на 2 группы:
1) существующие или синтезируемые самостоятельно, возникающие независимо от свертывания крови, фибринолиза или активации других ферментных систем;
2) образующиеся в процессе протеолиза – свертывания крови, фибринолиза. Химически антикоагулянты относятся к разным группам веществ – белкам, пептидам, липидам, мукополисахаридам.
Физиологические антикоагулянты, образующиеся независимо от протеолиза. К ним относятся белковые и фосфолипидные ингибиторы начальной фазы свертывания крови, из которых наиболее активен и физиологически важен относящийся к ?2-глобулинам ингибитор фактора XIа. Слабее действует на начальные фазы свертывания липидный антикоагулянт.
Из всех предшествующих антикоагулянтов наиболее активен, универсален по действию и важен для поддержания жидкого состояния крови антитромбин III (AT III). Этот белок, содержащийся в плазме в количестве около 0,3–0,42 г/л, или 3,0–4,7 ммоль/л, инактивирует не только тромбин, но и все другие активированные ферментные факторы свертывания: ХIIа, XIa, IXa, Ха. Он же является плазменным кофактором гепарина – без AT III гепарин почти совершенно не оказывает антикоагулянтного действия. Дефицит AT III, наследственный или вторичный (симптоматический), закономерно приводит к развитию тяжелейшего, часто несовместимого с жизнью тромбоэмболического синдрома. Дефицит всех других предшествующих физиологических антикоагулянтов по раздельности либо в совокупности не создает подобных критических ситуаций. Все вышеперечисленные данные закрепили за AT III репутацию главного ингибитора и модулятора системы свертывания крови. Местом синтеза AT III долгое время считали печень, однако исследования последних лет, в том числе выполненные на клеточных культурах иммунологическими методами, показали, что этот антикоагулянт продуцируется сосудистым эндотелием. Все факторы свертывания AT III инактивирует, образуя с ними эквимолярные комплексные соединения. Гепарин, соединяясь с AT III, резко ускоряет это взаимодействие и фиксирует антикоагулянт на поверхности эндотелиальных клеток, чем повышается тромбоустойчивость внутренней стенки сосудов.
Альфа2-макроглобулин является слабым ингибитором тромбина, действие которого становится ощутимым лишь при депрессии AT III. На долю этого антикоагулянта приходится, по разным авторам, от 4 до 21% антитромбиновой активности дефибринированной плазмы. Несколько больше роль ?2-макроглобулина в связывании плазмина, но и в этом случае его действие становится ощутимым после удаления быстродействующего антиплазмина. В отличие от AT III он из всех активированных факторов свертывания взаимодействует только с тромбином. Наследственный дефицит ?2-макроглобулина не сопровождается ни сколько-нибудь заметной тромбогенностью, ни существенными сдвигами в свертывающей системе крови, что говорит о его весьма ограниченном значении в регуляции гемостатического потенциала крови.
Более выражено ингибирующее действие на тромбин и другие активированные факторы свертывания (IXa, XIa и ХПа) ?1-антитрипсина и ингибитора 1 компонента комплемента. Однако и при их дефиците не наблюдается значительных нарушений гемостаза, что, очевидно, связано с одинаково выраженным ослаблением инактивации как свертывания крови, так и фибринолиза, вследствие чего сохраняется динамическое равновесие между этими системами.
Антикоагулянты, образующиеся в процессе свертывания крови и фибринолиза. Многие прокоагулянты и их метаболиты в процессе свертывания крови и фибринолиза приобретают антикоагулянтные свойства. Так, фибрин адсорбирует и инактивирует образующийся при свертывании тромбин, вследствие чего фибрин обозначается как антитромбин I. Эта инактивация настолько велика, что в сыворотке, как известно, остаются ничтожно малые количества тромбина. Имеются указания, что фибринопептиды, отщепляемые от фибриногена тромбином, также обладают антикоагулянтным действием.
Самоторможение наблюдается и на других этапах свертывания. Так, тромбин действует ферментативно на протромбин, отщепляя от него ингибитор фактора Ха; фактор Va после участия в свертывании начинает тормозить превращение протромбина в тромбин, а фактор ХIа после взаимодействия с фактором XII начинает тормозить его дальнейшую активацию. Мощные антикоагулянты, обладающие антитромбиновым и антиполимеразным действием, образуются в процессе фибринолиза.
Все вышеперечисленные данные в очередной раз свидетельствуют о том, что в свертывающей системе крови на всех этапах каскада действуют силы самоограничения процесса, одни и те же факторы могут выступать вначале как коагулянты, а затем – как антикоагулянты.
Схема 2 Система свертывания крови
 Данный текст является ознакомительным фрагментом.
Данный текст является ознакомительным фрагментом. Читать книгу целиком
Поделитесь на страничкеСледующая глава >
