1 | Производитель: «ДиаМед ГмбХ», Швейцария. Предназначен для приготовления суспензии эритроцитов для определения групп крови АВО/RH, RH/Келл фенотипирования, для определения и идентификации антиэритроцитарных антител, постановки реакции на совместимость по антигенам эритроцитов при использовании линии реагентов ID-System. Представляет собой модифицированный раствор бромелина для суспензии эритроцитов для ферментативных тестов. Регистрация изделия медицинского назначения в соответствии с требованиями в РФ. Инструкции по применению реагентов на русском языке. В 1 упаковке 2 флакона по 100 мл. ID-Дилюент 1 (ID Diluent 1) | 24.42.23.119 | УПАК | 8 921.67 | 2.0 | 17 843.34 | 2 | Производитель: «ДиаМед ГмбХ», Швейцария. | 24.42.23.119 | НАБОР | 2 768.33 | 6.0 | 16 609.98 | 3 | Производитель: «ДиаМед ГмбХ», Швейцария. | 24.42.23.119 | НАБОР | 4 755.33 | 6.0 | 28 531.98 | 4 | Производитель: Федеральное государственное учреждение «Российское научно-исследовательский институт гематологии и трансфузиологии Федерального агентства по высокотехнологичной медицинской помощи», Россия. | 24.42.23.111 | УПАК | 1 923.33 | 3.0 | 5 769.99 | 5 | Производитель: «ДиаМед ГмбХ», Швейцария.
Предназначены для скрининга и идентификации антиэритроцитарных антител, постановки пробы на совместимость по антигенам эритроцитов в непрямом антиглобулиновом тесте (проба Кумбса), прямого антиглобулинового теста (прямой реакции Кумбса).
Диагностические карты с 6 микропробирками, размером 70х52 мм, содержащими полиспецифический АГР (кроличий анти-IgG, моноклональный анти-С3d, клон no C139-9), суспендированный в геле. | 24.42.23.111 | НАБОР | 78 459.00 | 2.0 | 156 918.00 | 6 | Производитель: «ДиаМед ГмбХ», Швейцария.
Предназначены для определения групп крови по системе АВО и резус антигена D эритроцитов в прямой и обратной реакции методом гель-фильтрации.
Диагностические карты с 6 микропробирками, заполненными, размером 70х52 мм.
Карта содержит смесь поликлональных и моноклональных антител анти-A (клеточная линия: A5), поликлональные анти-B и анти-D антитела человеческого происхождения в гелевом матриксе. Микропробирка ctl является отрицательным контролем. Две микропробирки с ˝нейтральным˝ гелем для определения группы крови обратным методом с A1 и B стандартными эритроцитами. | 24.42.23.119 | НАБОР | 65 548.00 | 3.0 | 196 644.00 |
Аллоиммунные антитела (включая антитела к Rh-антигену)
Исследуемый материал Венозная кровь (сыворотка)
Метод определения Метод агглютинации + гель-фильтрации (карточки).
Инкубация стандартных типированных эритроцитов с исследуемой сывороткой и фильтрация путём центрифугирования смеси через гель, импрегированный полиспецифическим антиглобулиновым реагентом. Агглютинированные эритроциты выявляются на поверхности геля или в его толще.
В методе используются стандартные эритроциты ID-DIA Cell I-II-III типированные по антигенам эритроцитов:Два резус положительных эритроцита (ССCW Dee R1WR1 ) , ccDEE R2WR2 ) и один резус отрицательный эритроцит ссddee rr.
ID карты Liss (Coombs)-основная функция реагента с полиспецифическим антиглобулиновым –детектировать IgG. Активность анти C3d важна при прямом антиглобулиновом тесте при исследовании аутоиммунной гемолитической анемии (AIHA).
Антитела к клинически наиболее важным эритроцитарным антигенам, в первую очередь резус-фактору, свидетельствующие о сенсибилизации организма к этим антигенам. Резус-антитела относятся к так называемым аллоиммунным антителам.
Аллоиммунные антиэритроцитарные антитела (к резус-фактору или другим эритроцитарным антигенам) появляются в крови при особых условиях — после переливания иммунологически несовместимой донорской крови или при беременности, когда эритроциты плода, несущие иммунологически чужеродные для матери отцовские антигены, проникают через плаценту в кровь женщины. У неиммунных резус-отрицательных людей антител к резус-фактору нет.
В системе резус различают 5 основных антигенов, основным (наиболее иммуногенным) является антиген D (Rh), который обычно подразумевают под названием резус-фактор. Помимо антигенов системы резус есть ещё ряд клинически важных эритроцитарных антигенов, к которым может возникать сенсибилизация, вызывающая осложнения при переливании крови.
Помимо антигенов системы резус есть ещё ряд клинически важных эритроцитарных антигенов, к которым может возникать сенсибилизация, вызывающая осложнения при переливании крови.
Метод скринингового исследования крови на присутствие аллоиммунных антиэритроцитарных антител, использующийся в Независимой лаборатории ИНВИТРО, позволяет, помимо антител к резус-фактору Rh2(D), выявить в исследуемой сыворотке аллоиммунные антитела и к другим эритроцитарным антигенам. Ген, кодирующий резус-фактор D (Rh), является доминантным, аллельный ему ген d — рецессивным (резус-положительные люди могут иметь генотип DD или Dd, резус-отрицательные — только генотип dd).
Во время беременности резус-отрицательной женщины резус-положительным плодом возможно развитие иммунологического конфликта матери и плода по резус-фактору. Резус-конфликт может привести к выкидышу или развитию гемолитической болезни плода и новорожденных. Поэтому определение группы крови, резус-фактора, а также наличия аллоиммунных антиэритроцитарных антител должно проводиться при планировании или во время беременности для выявления вероятности иммунологического конфликта матери и ребёнка. Возникновение резус-конфликта и развитие гемолитической болезни новорожденных возможно в том случае, если беременная резус-отрицательна, а плод — резус-положителен. В случае, если у матери резус-антиген положительный, а у плода отрицательный, конфликт по резус-фактору не развивается. Частота развития резус-несовместимости составляет 1 случай на 200 — 250 родов.
Гемолитическая болезнь плода и новорождённых — гемолитическая желтуха новорожденных, обусловленная иммунологическим конфликтом между матерью и плодом из-за несовместимости по эритроцитарным антигенам. Болезнь обусловлена несовместимостью плода и матери по D-резус- или АВО- (групповым) антигенам, реже имеет место несовместимость по другим резус- (С, Е, с, d, e) или М-, М-, Kell-, Duffy-, Kidd-антигенам. Любой из указанных антигенов (чаще D-резус-антиген), проникая в кровь резус-отрицательной матери, вызывает образование в её организме специфических антител. Проникновению антигенов в материнский кровоток способствуют инфекционные факторы, повышающие проницаемость плаценты, мелкие травмы, кровоизлияния и другие повреждения плаценты. Последние через плаценту поступают в кровь плода, где разрушают соответствующие антигенсодержащие эритроциты.
Проникновению антигенов в материнский кровоток способствуют инфекционные факторы, повышающие проницаемость плаценты, мелкие травмы, кровоизлияния и другие повреждения плаценты. Последние через плаценту поступают в кровь плода, где разрушают соответствующие антигенсодержащие эритроциты.
Предрасполагают к развитию гемолитической болезни новорожденных нарушение проницаемости плаценты, повторные беременности и переливания крови женщине без учёта резус-фактора и др. При раннем проявлении заболевания иммунологический конфликт может быть причиной преждевременных родов или выкидышей. Во время первой беременности резус-положительным плодом у беременной с Rh «-» риск развития резус-конфликта составляет 10 — 15%. Происходит первая встреча организма матери с чужеродным антигеном, накопление антител происходит постепенно, начиная, приблизительно с 7 — 8 недели беременности. Риск несовместимости возрастает с каждой последующей беременностью резус-положительным плодом, независимо от того, чем она закончилась (искусственным абортом, выкидышем или родами, операцией при внематочной беременности), при кровотечениях во время первой беременности, при ручном отделении плаценты, а также если роды проводятся путём кесарева сечения или сопровождаются значительной кровопотерей при переливании резус-положительной крови (в том случае, если они проводились даже в детском возрасте).
Если последующая беременность развивается с резус-отрицательным плодом, несовместимость не развивается. Всех беременных женщин с Rh «-» ставят на специальный учёт в женской консультации и проводят динамический контроль над уровнем резус-антител. В первый раз анализ на антитела надо сдать с 8-й до 20-й недели беременности, затем периодически проверять титр антител: 1 раз в месяц до 30-й недели беременности, дважды в месяц до 36-й недели и 1 раз в неделю до 36-й недели. Прерывание беременности на сроке менее 6 — 7 недель может не привести к формированию у матери Rh-антител. В этом случае при последующей беременности, если у плода будет положительный резус-фактор, вероятность развития иммунологической несовместимости вновь будет равна 10 — 15 %. Проведение тестирования на аллоиммунные антиэритроцитарные антитела важно также при общей предоперационной подготовке, особенно для людей, которым ранее уже проводилось переливание крови.
В этом случае при последующей беременности, если у плода будет положительный резус-фактор, вероятность развития иммунологической несовместимости вновь будет равна 10 — 15 %. Проведение тестирования на аллоиммунные антиэритроцитарные антитела важно также при общей предоперационной подготовке, особенно для людей, которым ранее уже проводилось переливание крови.
Фенотип антигенов эритроцитов и индекс сенсибилизации у доноров компонентов крови и пациентов г. Астаны
Ж.К. Буркитбаев, Р.Б. Меирбекова, Е.Н. Курганская, Л.Л. Карп, Р.З. Магзумова
Научно-производственный центр трансфузиологии, г. Астана, Казахстан
Трансфузиология №2, 2013
Резюме
В результате проведенного исследования установлено большое разнообразие фенотипов в системе Резус, а также достаточно высокая степень сенсибилизации у реципиентов и высокий индекс сенсибилизации населения города Астаны.
Ключевые слова: антигенный состав эритроцитов.
Введение
Исследование распространенности у доноров основных клинически значимых антигенов эритроцитов, определение индекса аллоиммунизации является непременным условием адекватной профилактики посттрансфузионных реакций и осложнений гемолитического типа. Определение группы крови, резус-принадлежности и типирование антигенов эритроцитов имеет большое значение при проведении гемотрансфузий для подбора совместимых пар донор-реципиент и профилактики наиболее опасных для жизни реципиентов посттрансфузионных осложнений гемолитического типа [1–16]. Методика агглютинации в геле была разработана с целью стандартизации реакций гемагглютинации и получения достоверных результатов. Тестирование на индивидуальную совместимость крови донора и реципиента по антигенам эритроцитов не заменяет обязательное иммуногематологическое исследование, а лишь дополняет его. Использование гелевой системы позволяет также снизить риск заражения персонала даже при работе с потенциально инфицированными образцами [2]. Благодаря высокой чувствительности, стандартности и хорошей воспроизводимости результатов, методы агглютинации в геле получили широкое распространение [3].
Использование гелевой системы позволяет также снизить риск заражения персонала даже при работе с потенциально инфицированными образцами [2]. Благодаря высокой чувствительности, стандартности и хорошей воспроизводимости результатов, методы агглютинации в геле получили широкое распространение [3].
Цель и задачи исследования
Целью работы явилось изучение частоты встречаемости антигенов эритроцитов и определение уровня сенсибилизации населения г. Астаны.
Материал и методы исследования
Материалом исследования служили 119882 образцов крови доноров и 6313 реципиентов за период 2010–2012 гг. Возраст доноров колебался от 18 до 60 лет. Средний возраст доноров составил 43,4±5,1 года. Возраст больных колебался от 0 до 77 лет. Средний возраст больных составил 37,9±9,5 года. Среди доноров было 64736 мужчин (54,0%) и 55146 – женщин (46,0%). Среди реципиентов мужчины составили 66,9%, женщины – 33,1%. Контингент обследованных пациентов: реципиенты, в анамнезе которых многократные трансфузии; беременные, входившие в группу риска по аллоиммунизации; дети с гемолитической болезнью новорожденных. Все образцы крови доноров исследовались на групповую принадлежность по системе АВО перекрестным методом с использованием моноклональных антител, стандартных эритроцитов, а также методом микроколоночной агглютинации с использованием кассет ORTHO BioVue. Образцы крови реципиентов исследовались на групповую принадлежность по системе АВО с применением гелевой методики Scangel. А нтиген D с истемы Р езус выявляли с помощью Цоликлона АнтиD Супер (ООО «Гематолог», Москва) и с применением метода микроколоночной агглютинации с использованием кассет ORTHO BioVue, дополнительно все RH(D)-отрицательные доноры (3464 из 119 тысяч) исследовались на наличие вариантных и слабых форм антигена D с помощью моноклональных антител анти-Rh2(D)/ RhW1 в реакции Кумбса с применением гелевой методики Scangel (Карты Scangel Кумбс анти-IgG, C3d), «BioRad Laboratories», США). Все образцы крови доноров тестировались на наличие антигена К системы Кell с использованием моноклональных антител анти-К Супер (ООО «Гематолог», Москва) и с помощью метода микроколоночной агглютинации с использованием ORTHO BioVue анти-К. Все RH(D)-отрицательные доноры, а также «кадровые» RH(D)-положительные доноры были фенотипированы по антигенам С, с, Е, е системы Резус с использованием метода микроколоночной агглютинации с использованием кассет RH/K ORTHO BioVue, все реципиенты были фенотипированы по антигенам С, с, Е, е системы Резус с помощью гелевого метода с использованием карт Scangel Моноклональные RH/Kell производст- ва «Bio-Rad Laboratories», США. Во всех образцах крови доноров и реципиентов был проведен скрининг антиэритроцитарных аллоантител с помощью реакции Кумбса, выполненной с применением гелевой методики Scangel (Карты Scangel Кумбс анти-IgG, C3d), с эритроцитами Scangel I-II-III производства фирмы «Bio-Rad Laboratories», США-Франция). При положительных результатах скрининга проводилась идентификация анти- тел с эритроцитами ScanPanel из 10 линий клеток, «Bio-Rad laboratories», США.
Все образцы крови доноров тестировались на наличие антигена К системы Кell с использованием моноклональных антител анти-К Супер (ООО «Гематолог», Москва) и с помощью метода микроколоночной агглютинации с использованием ORTHO BioVue анти-К. Все RH(D)-отрицательные доноры, а также «кадровые» RH(D)-положительные доноры были фенотипированы по антигенам С, с, Е, е системы Резус с использованием метода микроколоночной агглютинации с использованием кассет RH/K ORTHO BioVue, все реципиенты были фенотипированы по антигенам С, с, Е, е системы Резус с помощью гелевого метода с использованием карт Scangel Моноклональные RH/Kell производст- ва «Bio-Rad Laboratories», США. Во всех образцах крови доноров и реципиентов был проведен скрининг антиэритроцитарных аллоантител с помощью реакции Кумбса, выполненной с применением гелевой методики Scangel (Карты Scangel Кумбс анти-IgG, C3d), с эритроцитами Scangel I-II-III производства фирмы «Bio-Rad Laboratories», США-Франция). При положительных результатах скрининга проводилась идентификация анти- тел с эритроцитами ScanPanel из 10 линий клеток, «Bio-Rad laboratories», США.
Результаты и обсуждения
Нами было проанализировано распределение групп крови системы АВО у доноров и реципиентов (таблица 1).
Полученные данные свидетельствуют о том, что распределение групп крови по системе АВО у доноров и пациентов сходны. Преобладающими являются O и А группы крови. Выявленная нами частота встречаемости антигена А2 в группе крови А и АВ составляет для доноров 0,32%, а для пациентов 3,2%. Выявленное нами соотношение Rh(D)-положительных и Rh(D)-отрицательных лиц среди пациентов составило 94,39 и 5,6% соответственно. Для доноров это соотношение составило 92,43% Rh(D)-положительных и 7,57% Rh(D)-отрицательных (табл. 2).
Полученные нами данные выявили значительно больший процент антигена D вариантного у пациентов. Возможно, это является результатом ослабления антигена D при заболеваниях. Изучение антигенного состава эритроцитов кадровых доноров и пациентов показало, что наиболее распространенным фенотипом среди Rh(D)-положительных лиц является фенотип CCDee-, далее следуют фенотипы CcDee-, CcDEe- и ccDEe- (табл. 3).
3).
Наибольшую опасность представляют в трансфузионном отношении гомозиготные сочетания антигенов системы Резус (СС, сc, ЕЕ и ее), которые встречаются у 86% резус-положительных (D+). Всем донорам и реципиентам независимо от групповой и резус- принадлежности предварительно проводился скрининг на наличие антиэритроцитарных антител. При оценке антиэритроцитарных антител у 13,3% пациентов обнаружены иммунные антитела различной специфичности. В связи с тем, что среди контингента обследованных в лаборатории лиц превалировали беременные, входившие в группу риска по аллоиммунизации, а также больные получившие многократные трансфузии, – индекс сенсибилизации у пациентов оказался высоким. Антитела к антигенам эритроцито системы Резус появляются в организме в результате трансфузий эритроцитов доноров, содержащих антигены, отсутствующие у реципиента, а также при иммунизации матери эритроцитами плода. Частота встречаемости аллоантител к антигенам эритроцитов системы Резус различна и определяется иммуногенностью антигена и частотой встречаемости в популяции. В 31% случаев антитела не идентифицировали, что связано с сочетанной специфичностью антител или наличием антител к широко распространенным в популяции антигенам. При изучении частоты аллосенсибилизации среди RH(D)-положительных и RH(D)-отрицательных лиц, было обнаружено, что RH(D)-отрицательные люди иммунизируются в 2–2,5 раза чаще, чем RH(D)-положительные. Антитела к минорным антигенам эритроцитов чаще встречаются у резус-положительных лиц, чем у резус-отрицательных. У доноров встречаемость аллоантител составила 0,46% (табл. 4).
Проблема гемолитической болезни новорожденных (ГБН) для города Астана актуальна. Наиболее часто ГБН развивается вследствие конфликта по антигенам системы Резус и АВ0 (табл. 5).
| Наименование объекта закупки | Срок размещения извещения об осуществлении закупки |
| Поставка мягкого инвентаря (не более 6 позиций) | апрель, ноябрь |
| Поставка канцелярских товаров (не более 10 позиций) | март, сентябрь |
| Поставка бумаги | февраль, сентябрь |
| Поставка топлива моторного | февраль, май, август, ноябрь |
| Поставка мебели | март |
| Поставка угля | июнь |
| Оказание услуг по приобретению (продлению) неисключительных прав (лицензий) на программное обеспечение | март, июль |
| Предоставление средств защиты информации автоматизированных рабочих мест, функционирующих на OC Windows, на OC Linux (соответственно Secret Net Studio, Secret Net LSP) | февраль |
| Приобретение средств защиты информации, в том числе криптографической защиты информации VipNet Client | февраль |
| Поставка офисной техники и комплектующих | апрель, август |
| Поставка расходных материалов для оргтехники (картриджи) | март, сентябрь |
Поставка продуктов питания (для учреждений г. Омска и Омской области): Омска и Омской области): | |
| -поставка молочной продукции (молочная и кисломолочная продукция) | май, октябрь |
| — поставка говядины | май, октябрь |
| — поставка мяса кур | май, октябрь |
| — поставка рыбы | май, октябрь |
| — поставка яиц | май, октябрь |
| — поставка хлеба | май, октябрь |
| — поставка овощей | май, октябрь |
| — поставка круп | май, октябрь |
| — поставка макаронных изделий | май, октябрь |
| — поставка муки | май, октябрь |
| — поставка фруктов | май, октябрь |
| Поставка хозяйственных товаров | март, ноябрь |
| Оказание услуг по сбору, транспортированию и обезвреживанию медицинских отходов класса Б для нужд учреждений здравоохранения Омской области. | ноябрь |
| Поставка медицинских расходных материалов для стерилизации | май, ноябрь |
| Поставка контейнеров для острого инструментария | март, сентябрь |
| Поставка перчаток | апрель, октябрь |
| Поставка медицинских расходных материалов для респираторной поддержки | апрель, ноябрь |
| Поставка шприцов для насосов | март, сентябрь |
| Поставка перевязочных материалов 1 (бинты, салфетки, повязки с ЛП) | март, октябрь |
| Поставка перевязочных материалов 2 (эластичные бинты, бинт гипсовый, лейкопластырь простой) | март, октябрь |
| Поставка перевязочных материалов 3 (вата, ватные шарики) | март, октябрь |
| Поставка мешков для крови (102-2) | март, октябрь |
| Поставка мочеприемников | март, ноябрь |
| Поставка медицинских изделий для оказания хирургической помощи | июнь, декабрь |
| Поставка расходных материалов для дренирование | май, сентябрь |
| Поставка реагентов (стандартные эритроциты, карты) | март, октябрь |
| Поставка медицинских изделий для оказания скорой медицинской помощи (зонды, катетеры урологические) | март, сентябрь |
| Поставка расходных материалов для катетеризации | апрель, октябрь |
| Поставка системы для вливаний | май /июнь, ноябрь/декабрь |
| Поставка системы для насосов | май /июнь, ноябрь/декабрь |
| Поставка шприцов общего назначения | май, ноябрь |
| Поставка расходных материалов для инфузионной терапия | май /июнь, ноябрь/декабрь |
| Поставка инструментов колющих 1 – (иглы для пункции) | апрель, ноябрь |
| Поставка игл для спинальной анестезии | апрель, ноябрь |
| Поставка инструментов колющих 2 (иглы инъекционные) | май /июнь, ноябрь/декабрь |
| Поставка расходных материалов для лаборатории 1 (красители, реагенты для анализаторов) | апрель, октябрь |
| Поставка расходных материалов для лаборатории 2 (стандартные эритроциты, карты) | апрель, ноябрь |
Поставка расходных материалов для патологоанатомических отделений 1 (стекла, красители, парафин и т. д.) д.) | апрель, ноябрь |
| Поставка расходных материалов для патологоанатомических отделений (лезвия, иглы) | апрель, ноябрь |
| Расходные материалы для лаборатории 3 (стекла, наконечники, спиртовка и т.п) | май, ноябрь |
| Поставка расходных материалов для лучевой диагностики | март, сентябрь |
| Поставка шовного материала | май, декабрь |
| Поставка гемостатического материала | май, декабрь |
| Поставка марли | апрель, октябрь |
Упакованных красных кровяных телец — обзор
Упакованные красные кровяные клетки (концентрат красных кровяных клеток) Переливание
Упакованные красные кровяные клетки (PRBC) используются для улучшения способности крови переносить кислород и восстановления объема крови. Единицы готовят из цельной крови путем удаления большей части плазмы (среднее значение гематокрита составляет 70%). Эта процедура снижает объем трансфузии и изоагглютининовую нагрузку. Каждая единица обычно содержит примерно 200 мл эритроцитов, 70 мл плазмы и 100 мл дополнительного питательного раствора (например,например, цитрат [как антикоагулянт], фосфат, декстроза и АТФ). Клиническая цитратная токсичность (гипокальциемия из-за хелатирования кальция) возникает редко, возникает только при массивных переливаниях крови (например, обменных переливаниях) и поддается лечению добавками кальция. Длительное хранение вызывает утечку калия в плазму, которая обычно клинически незначительна. Кровь следует вливать через фильтр (170–260 мкм) для удаления мусора, образующегося при хранении. 1, 2
Переливание обычно проводится, если симптомы анемии или кровопотери серьезны и дальнейшее промедление может привести к значительной инвалидности или смерти.Избранные показания для переливания включают острое кровотечение, химиотерапию высокими дозами, тяжелые недоношенности, серповидно-клеточную анемию (например, секвестрацию селезенки, тяжелый острый грудной синдром), большую талассемию, апластическую анемию, чистую аплазию эритроцитов и тяжелую аутоиммунную гемолитическую анемию (с использованием наиболее совместимый блок). 2 Переливание 10–15 мл / кг PRBC у ребенка повышает концентрацию гемоглобина на 2–3 г / дл и гематокрит на 6–9% (таблица 132-2). 1, 5 Переливание обычно проводится в дозе 15 мл / кг в течение 2–4 часов.Для восполнения острой кровопотери может потребоваться более быстрое переливание крови. Если предполагается переливание небольших количеств (например, младенцам), единицу можно разделить на несколько аликвот.
2 Переливание 10–15 мл / кг PRBC у ребенка повышает концентрацию гемоглобина на 2–3 г / дл и гематокрит на 6–9% (таблица 132-2). 1, 5 Переливание обычно проводится в дозе 15 мл / кг в течение 2–4 часов.Для восполнения острой кровопотери может потребоваться более быстрое переливание крови. Если предполагается переливание небольших количеств (например, младенцам), единицу можно разделить на несколько аликвот.
PRBC с пониженным содержанием лейкоцитов получают путем пропускания устройства через фильтр, который удаляет от 85% до 90% лейкоцитов; процедура часто выполняется во время забора крови. Этот тип продукта вызывает меньше негемолитических лихорадочных реакций, которые опосредуются антителами против антигенов лейкоцитов донора, а также цитокинами, образующимися при хранении компонентов.Этот продукт также вызывает меньше аллоиммунизации и передачи вируса (например, цитомегаловируса). Он показан пациентам, которые нуждаются в хроническом переливании крови (например, детям, получающим химиотерапию или страдающим гемоглобинопатией) или имевшим ранее контакт с антигенами крови (например, повторнородящим женщинам). 1
Облученные PRBC получают путем воздействия на устройство 2500 сГр излучения. Это лечение инактивирует Т-клетки донора, что снижает риск реакции «трансплантат против хозяина» у реципиента.Этот тип продукта рекомендуется пациентам с ослабленным иммунитетом (например, детям, получающим химиотерапию). 1
Промытые PRBC получают промыванием эритроцитов 0,9% NaCl, который удаляет большую часть плазмы. Этот тип продукта используется для пациентов, у которых есть тяжелые аллергические реакции (например, кашель, хрипы, опухшие губы и крапивница) на переливание крови, несмотря на введение антигистаминных препаратов. Антитела иммуноглобулина Е против белков донорской плазмы опосредуют эту неблагоприятную реакцию.Этот продукт также используется для пациентов с дефицитом иммуноглобулина A (IgA), у которых развились антитела IgA. 2
2
Биохимические повреждения накопления, встречающиеся в необлученных и облученных эритроцитах: краткий обзор
Эритроциты претерпевают серию биохимических колебаний в течение 35–42-дневного периода хранения при температуре от 1 ° C до 6 ° C. Насос натрия / калия обездвиживается, вызывая снижение внутриклеточного калия с повышением уровня натрия в цитоплазме, снижение уровня глюкозы и ацидоз в результате низкого уровня pH.Хрупкость хранящихся эритроцитов вызывает образование микрочастиц, содержащих гемоглобин, и высвобождение бесклеточного гемоглобина, что может усложнять переливание крови. Перекисное окисление липидов, окислительный стресс структур 3-го диапазона и другие морфологические и структурные молекулярные изменения также приводят к сфероэхиноцитам и осмотической хрупкости. Эти изменения, которые проявляются в эритроцитах во время периода хранения, называются «повреждениями накопления». Хорошо задокументировано, что гамма-облучение усугубляет накопительные поражения, и сообщения о повышенных уровнях калия, приводящих к побочным реакциям, наблюдаемым у новорожденных и младенцев, вызывают особую озабоченность.Однако существует удивительно мало систематических исследований, сравнивающих in vitro повреждений хранения облученных и необлученных концентратов эритроцитов, и было высказано предположение, что влияние накопленных повреждений на концентрат эритроцитов с пониженным содержанием лейкоцитов (RBCC) является неполным. В обзоре исследуются повреждения накопления в эритроцитах и их побочные эффекты в связи с переливанием крови.
1. Введение
Переливания эритроцитов необходимы при лечении анемии, вызванной различными патологиями или кровотечением, вызванным травмой или хирургическим вмешательством [1].Во всем мире в 2013 году было собрано около 107 миллионов единиц цельной крови, из которых 65% переливаний крови в странах с низким уровнем доходов были проведены детям в возрасте до 5 лет, в то время как пациенты старше 65 лет составили примерно 76% переливаний в странах с высоким уровнем доходов. [2]. В то время как миллионы цельной крови и продуктов эритроцитов переливаются ежегодно, концентраты эритроцитов (RBCC) по-прежнему являются наиболее часто переливаемым компонентом.
[2]. В то время как миллионы цельной крови и продуктов эритроцитов переливаются ежегодно, концентраты эритроцитов (RBCC) по-прежнему являются наиболее часто переливаемым компонентом.
В научном сообществе постоянно ведутся споры между людьми, стремящимися увеличить временные рамки между сдачей крови и переливанием, и теми, кто опасается эффективности и безопасности хранимой крови.Хотя большинство клиницистов согласны с тем, что дегенерация крови и клеточных компонентов происходит сразу же после их изъятия из руки донора, пациенты, нуждающиеся в переливании, зависят от безопасности и эффективности крови и компонентов крови [3].
После Первой мировой войны (1914–1918) появилась технология для хранения эритроцитов в охлажденных условиях в течение коротких периодов времени с использованием цитрата натрия в качестве антикоагулянта. Начало Второй мировой войны (1939–1945) и разработка антикоагулянта, содержащего раствор кислота-цитрат-декстроза (ACD), который значительно уменьшил необходимый объем антикоагулянта, привели к тому, что охлажденная кровь хранилась в течение 21 дня, и банки крови стали реальность [4].Это позволило переливать увеличенные объемы крови, увеличить срок хранения и снизить токсичность цитратов у пациентов. Впоследствии дальнейшие успехи в хранении донорских эритроцитов стали возможны с введением фосфатов и аденина, которые позволили увеличить период хранения единиц цельной крови. Эти достижения побудили научное сообщество разработать аддитивные растворы, которые не только продлят срок хранения, но и сохранят качество концентрата эритроцитов во время хранения.
Внедрение компонентной терапии, при которой эритроциты отделяются от плазмы центрифугированием, и разработка консервантов, содержащих физиологический раствор, маннит, глюкозу и аденин (например, SAGM), которые добавлялись к отделенным эритроцитам, увеличили период хранения красного клетки концентрируются до 42 дней при хранении при температуре от 1 ° C до 6 ° C [5]. Добавление физиологического раствора и маннита снижает скорость гемолиза, а глюкоза обеспечивает субстрат энергетического пути, в то время как аденин поддерживает уровни АТФ. Стандартный раствор присадки для эритроцитов, используемый в Европе, — SAGM. В Южной Африке западный прибрежный регион использует SAGM, тогда как внутренние районы используют ADSOL (раствор, состоящий из аденина, декстрозы, хлорида натрия и маннита). Учреждения переливания крови в Америке используют AS-1 и AS-5 в качестве дополнительных растворов, в то время как третий дополнительный раствор, который будет лицензирован, — это AS-3. Хотя аддитивный раствор AS-3 представляет собой физиологический раствор, аденин и глюкозу, он также содержит фосфат и цитрат, поскольку является вариантом SAGM.Следует отметить, что ни один из дополнительных растворов не имеет большого преимущества перед другим, поскольку фрагментация или везикуляция эритроцитов все еще происходит в обоих растворах, хотя сообщалось, что профиль мембранного белка RBCC, хранящегося в AS-3, кажется, быть лучше, чем хранится в САГМ [6].
Стандартный раствор присадки для эритроцитов, используемый в Европе, — SAGM. В Южной Африке западный прибрежный регион использует SAGM, тогда как внутренние районы используют ADSOL (раствор, состоящий из аденина, декстрозы, хлорида натрия и маннита). Учреждения переливания крови в Америке используют AS-1 и AS-5 в качестве дополнительных растворов, в то время как третий дополнительный раствор, который будет лицензирован, — это AS-3. Хотя аддитивный раствор AS-3 представляет собой физиологический раствор, аденин и глюкозу, он также содержит фосфат и цитрат, поскольку является вариантом SAGM.Следует отметить, что ни один из дополнительных растворов не имеет большого преимущества перед другим, поскольку фрагментация или везикуляция эритроцитов все еще происходит в обоих растворах, хотя сообщалось, что профиль мембранного белка RBCC, хранящегося в AS-3, кажется, быть лучше, чем хранится в САГМ [6].
Наиболее распространенная практика банков крови включает сбор примерно 450–575 мл цельной крови в сборный мешок, содержащий раствор цитрат-фосфат-декстрозы (CPD) в качестве антикоагулянта.Единица цельной крови не является обычно переливаемым продуктом, поскольку факторы свертывания крови и тромбоциты обесцениваются в течение нескольких часов после сдачи крови, и, следовательно, срок годности составляет 35 дней по сравнению с 42-дневным сроком годности других продуктов эритроцитов. Цельную кровь в основном используют для пациентов, страдающих массивным кровотечением или когда необходимы неонатальные обменные переливания крови [7]. Обильное кровотечение у взрослого определяется как переливание более 10 единиц RBCC в течение 24 часов, что приблизительно равно общему объему крови или замещение более 50% общего объема крови с использованием продуктов крови в течение 3-часового периода.
Независимо от этиологии (хирургическая, травматическая или акушерская) пациенту больницы скорой помощи с массивным кровотечением требуется введение большого объема продуктов крови в течение короткого времени для поддержания гемостаза и удовлетворительного кровообращения, поскольку они часто попадают в больницу с тяжелым кровотечением. многофакторная ранняя коагулопатия, вызванная травмой (ETIC), связанная со смертностью. Гиперфибринолиз и системная антикоагуляция, наблюдаемые при ETIC, могут быть связаны с повреждением ткани в результате хирургического вмешательства или травмы, что приводит к местному или системному высвобождению тканевого фактора, вызывающего активацию путей коагуляции, и именно эта активация вызывает синдром диссеминированного внутрисосудистого свертывания крови. [8].Возникающая в результате анемия из-за массивного кровотечения вызывает снижение первичного гемостаза, что приводит к нарушению адгезии и агрегации тромбоцитов. Текущий протокол лечения, используемый для пациентов с кровотечением и травмой, представляет собой упакованный в равных частях концентрат эритроцитов, плазму и тромбоциты (т.е. соотношение переливаний 1: 1: 1), но эта смесь компонентов не является цельной кровью, поскольку она также содержит ± 180 мл. добавленных растворов консервантов, таких как маннит, декстроза, фосфат натрия, аденин, бикарбонат натрия, хлорид натрия и лимонная кислота.Хотя свежая цельная кровь также содержит консервирующий раствор, его количество меньше, и преимущество использования этого продукта по сравнению с компонентной терапией заключается в уменьшении общего объема переливаемого препарата, а также в сохранении функции тромбоцитов в одной единице [9].
многофакторная ранняя коагулопатия, вызванная травмой (ETIC), связанная со смертностью. Гиперфибринолиз и системная антикоагуляция, наблюдаемые при ETIC, могут быть связаны с повреждением ткани в результате хирургического вмешательства или травмы, что приводит к местному или системному высвобождению тканевого фактора, вызывающего активацию путей коагуляции, и именно эта активация вызывает синдром диссеминированного внутрисосудистого свертывания крови. [8].Возникающая в результате анемия из-за массивного кровотечения вызывает снижение первичного гемостаза, что приводит к нарушению адгезии и агрегации тромбоцитов. Текущий протокол лечения, используемый для пациентов с кровотечением и травмой, представляет собой упакованный в равных частях концентрат эритроцитов, плазму и тромбоциты (т.е. соотношение переливаний 1: 1: 1), но эта смесь компонентов не является цельной кровью, поскольку она также содержит ± 180 мл. добавленных растворов консервантов, таких как маннит, декстроза, фосфат натрия, аденин, бикарбонат натрия, хлорид натрия и лимонная кислота.Хотя свежая цельная кровь также содержит консервирующий раствор, его количество меньше, и преимущество использования этого продукта по сравнению с компонентной терапией заключается в уменьшении общего объема переливаемого препарата, а также в сохранении функции тромбоцитов в одной единице [9].
В производственной лаборатории единицу цельной крови центрифугируют в закрытой стерильной системе, что приводит к максимальному удалению плазмы. Основные компоненты разделены, так что разные продукты могут принести пользу нескольким получателям.Добавочный раствор, SAGM, содержится в прикрепленном дополнительном мешке и добавляется к упакованным эритроцитам (единица концентрата эритроцитов). Удаление лейкоцитов снижает количество лейкоцитов на 70–80% по сравнению с исходной упаковкой для сбора. Объем RBCC составляет примерно 300 мл, включая антикоагулянт. В Южной Африке RBCC обычно получают путем удаления лейкоцитарного слоя. Клинические показания для переливания RBCC включают острую кровопотерю, превышающую 30% объема крови, анемию, акушерское кровотечение или пациентов, перенесших операцию. Согласно клиническим испытаниям, изучающим переливание продуктов эритроцитов, переливание RBCC рекомендуется, когда уровень гемоглобина взрослого пациента составляет менее 7 г / дл с поддерживающим гемоглобином от 7 до 9 г / дл, но это ограничительное переливание триггер не обязательно применим ко всем кардиологическим пациентам [10].
Согласно клиническим испытаниям, изучающим переливание продуктов эритроцитов, переливание RBCC рекомендуется, когда уровень гемоглобина взрослого пациента составляет менее 7 г / дл с поддерживающим гемоглобином от 7 до 9 г / дл, но это ограничительное переливание триггер не обязательно применим ко всем кардиологическим пациентам [10].
Руководство по показаниям для переливания крови постоянно пересматривается с момента появления компонентной терапии, где «10/30» (уровень гемоглобина, поддерживаемый на уровне 10 г / дл или уровни гематокрита ≥30%), возможно, является одним из старейших. показания.Shander et al. предоставить краткое изложение текущих рекомендаций по переливанию крови в соответствии с Американской ассоциацией банков крови, Обществом интенсивной терапии, Коллегией американских патологов и Американским обществом анестезиологов, включая Общество сердечно-сосудистых анестезиологов, Общество торакальных хирургов и Итальянское общество. трансфузиологии и иммуногематологии. Сходства, хотя некоторые из них сомнительны, указывают на то, что переливание крови следует проводить, скорее, для избежания ишемии и улучшения общих результатов пациента путем ограничения количества аллогенных доноров, вместо того, чтобы сосредоточиться на поддержании уровней концентрации гемоглобина пациента для улучшения практики переливания [11] .Тем не менее, сообщалось, что, хотя эти рекомендации продвигают передовую практику переливания крови, они не устраняют такие осложнения переливания, как инфекционные и иммунологические проблемы или неблагоприятные трансфузионные реакции, вызывающие смертность, например гемолитические трансфузионные реакции, перегрузка кровообращения при переливании крови и связанные с переливанием повреждения легких. . Кроме того, ранняя повторная операция из-за сильной кровопотери связана с острой почечной недостаточностью, тромботической эмболией, инфарктом миокарда и повышенной смертностью, поэтому лучшая практика переливания крови сама по себе может быть не лучшей клинической практикой [12].
Плазма и лейкоцитарный слой (богатый тромбоцитами, лейкоцитами и ретикулоцитами) впоследствии извлекаются из RBCC и разделяются на разные, но еще прикрепленные сателлитные мешки. Люминесцентный слой может быть объединен и использован для получения концентратов случайных донорских тромбоцитов, в то время как отделенная плазма может использоваться для производства свежезамороженной плазмы и криопреципитата или отправлена на фракционирование для переработки в концентраты факторов свертывания и коллоиды плазмы, такие как альбумин, стабилизированная сыворотка человека или иммуноглобулины [7].
Было замечено, что больным младенцам, нуждающимся в хирургическом вмешательстве или из-за кровотечения, может потребоваться переливание большого количества сохраненных эритроцитов, а переливание эритроцитов, содержащих повышенный уровень калия, было связано с гиперкалиемией миокарда и неонатальной аритмией [13, 14 ]. Для снижения затрат и потерь и для обеспечения оптимальной пользы для новорожденных и младенцев учреждения по переливанию крови производят концентраты детских эритроцитов (PRBCC) и концентраты детских красных кровяных телец (IRBCC).PRBCC образуется, когда единица эритроцитов в аддитивном растворе фильтруется через фильтр для удаления лейкоцитов и поровну делится между пакетом SAGM и транспортной упаковкой объемом 130 мл на единицу, в то время как IRBCC поровну делятся между 4 переносными пакетами после фильтрация с объемом примерно 55 мл на единицу. Дополнительный мешок для переноса и лейкоцитарный фильтр стерильно состыкованы с упаковкой. Блоки IRBCC обрабатываются для новорожденных, включенных в программу ограниченного воздействия на доноров (LDEP), где предполагается, что у недоношенных детей с низкой массой тела при рождении менее 1500 г предполагается несколько переливаний [15, 16].
Продукт красных кровяных телец может оставаться в упаковке и использоваться в качестве RBCC, или он может быть дополнительно очищен путем уменьшения лейкоцитов с использованием методологии фильтрации (блок RBCC с предварительным хранением).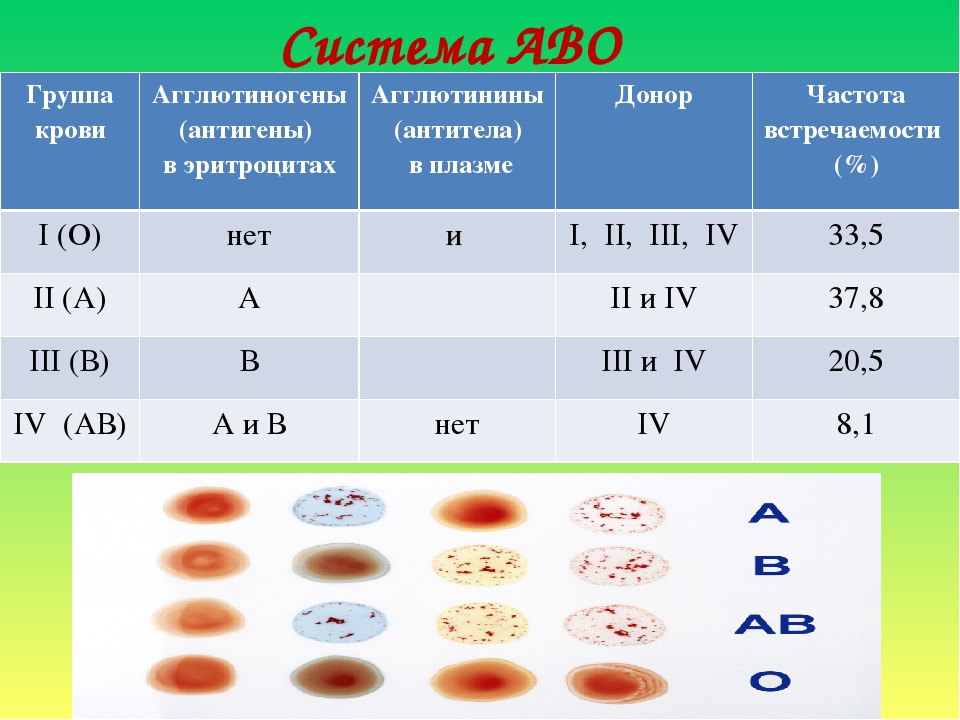 Многие страны первого мира приняли политику универсального снижения лейкоцитов (ULR), поскольку считается, что фильтрованные эритроциты ограничивают лихорадочные негемолитические трансфузионные реакции, предотвращают передачу цитомегаловируса (ЦМВ) при переливании крови, уменьшают послеоперационные инфекции и снижают концентрацию гемолиза в плазме.В Южной Африке, однако, рекомендуется избирательное использование этих концентратов, поскольку реализация политики ULR значительно увеличит затраты, и все еще существуют некоторые разногласия относительно некоторых заявленных преимуществ. У Южной Африки есть и другие основные проблемы со здоровьем, такие как эскалация пандемии вируса иммунодефицита человека (ВИЧ), и, хотя авторы признают преимущества реализации политики ULR, стоимость индивидуального донорского тестирования нуклеиновых кислот на ВИЧ огромна по сравнению с 4-, Тестирование NAT мини-бассейнов с 8, 16 или 96 образцами, используемое в США.Кроме того, истощение лейкоцитов может не подавлять передачу пациенту варианта болезни Крейтцфельдта-Якоба, а также не была продемонстрирована реактивация вирусных инфекций (ВИЧ и ЦМВ) в стандартных нелейкоцитарных компонентах [17]. Многие фильтры, используемые для удаления лейкоцитов из RBCC, удаляют лейкоциты, но исследования с использованием грызунов показывают, что удаляется только 40–70% инфекционности, и, если сохраняется адекватная инфекционность, она может передаваться реципиенту [18] . Рандомизированное клиническое исследование с участием пациентов с травмами продемонстрировало отсутствие разницы в инфекционной заболеваемости или смертности при переливании лейкоцитов, сниженных до хранения, по сравнению с лейкоцитарно-сниженным RBCC [19].
Многие страны первого мира приняли политику универсального снижения лейкоцитов (ULR), поскольку считается, что фильтрованные эритроциты ограничивают лихорадочные негемолитические трансфузионные реакции, предотвращают передачу цитомегаловируса (ЦМВ) при переливании крови, уменьшают послеоперационные инфекции и снижают концентрацию гемолиза в плазме.В Южной Африке, однако, рекомендуется избирательное использование этих концентратов, поскольку реализация политики ULR значительно увеличит затраты, и все еще существуют некоторые разногласия относительно некоторых заявленных преимуществ. У Южной Африки есть и другие основные проблемы со здоровьем, такие как эскалация пандемии вируса иммунодефицита человека (ВИЧ), и, хотя авторы признают преимущества реализации политики ULR, стоимость индивидуального донорского тестирования нуклеиновых кислот на ВИЧ огромна по сравнению с 4-, Тестирование NAT мини-бассейнов с 8, 16 или 96 образцами, используемое в США.Кроме того, истощение лейкоцитов может не подавлять передачу пациенту варианта болезни Крейтцфельдта-Якоба, а также не была продемонстрирована реактивация вирусных инфекций (ВИЧ и ЦМВ) в стандартных нелейкоцитарных компонентах [17]. Многие фильтры, используемые для удаления лейкоцитов из RBCC, удаляют лейкоциты, но исследования с использованием грызунов показывают, что удаляется только 40–70% инфекционности, и, если сохраняется адекватная инфекционность, она может передаваться реципиенту [18] . Рандомизированное клиническое исследование с участием пациентов с травмами продемонстрировало отсутствие разницы в инфекционной заболеваемости или смертности при переливании лейкоцитов, сниженных до хранения, по сравнению с лейкоцитарно-сниженным RBCC [19].
Несмотря на то, что имеется обширная литература, касающаяся RBCC с пониженным содержанием лейкоцитов, имеется меньше данных о влиянии гамма-облучения на концентраты красных кровяных клеток с пониженным содержанием лейкоцитов. Американская ассоциация по пищевым продуктам и лекарствам (FDA) рекомендует, чтобы в системе крови через 24 часа после переливания должно было присутствовать минимум 75% извлеченных эритроцитов [15]. Гамма-облучение усугубляет накопление, и повышенные уровни калия сверх уровней, наблюдаемых в необлученных продуктах красных кровяных телец, из-за просачивания лактатдегидрогеназы и ионов калия, вызванных воздействием облучения, вызывают особую озабоченность.Гамма-облучение показано, когда у пациента есть риск развития связанного с переливанием трансплантата против хозяина (TA-GVHD) из-за воздействия компонентов эритроцитов, содержащих жизнеспособные лимфоциты, путем переливания [18]. TA-GVHD — редкое осложнение при переливании крови, и, хотя оно может быть фатальным, использование гамма-излучения защищает уязвимых пациентов. Повреждающее воздействие гамма-излучения на компоненты крови в значительной степени ограничивается эритроцитами и не оказывает значительного влияния на функцию гранулоцитов и тромбоцитов.
Гамма-облучение усугубляет накопление, и повышенные уровни калия сверх уровней, наблюдаемых в необлученных продуктах красных кровяных телец, из-за просачивания лактатдегидрогеназы и ионов калия, вызванных воздействием облучения, вызывают особую озабоченность.Гамма-облучение показано, когда у пациента есть риск развития связанного с переливанием трансплантата против хозяина (TA-GVHD) из-за воздействия компонентов эритроцитов, содержащих жизнеспособные лимфоциты, путем переливания [18]. TA-GVHD — редкое осложнение при переливании крови, и, хотя оно может быть фатальным, использование гамма-излучения защищает уязвимых пациентов. Повреждающее воздействие гамма-излучения на компоненты крови в значительной степени ограничивается эритроцитами и не оказывает значительного влияния на функцию гранулоцитов и тромбоцитов.
2. Биохимические повреждения при хранении
Хорошо известно, что определенные биохимические изменения происходят в течение 35–42 дней хранения эритроцитов при температуре от 1 ° C до 6 ° C. Биохимическая структура красных кровяных телец (эритроцитов) изменяется из-за анаэробного гликолиза (клеточного метаболизма), и эти изменения связаны с периодом хранения.
2.1. pH
Продолжающийся гликолиз происходит, когда кровь хранится в пластиковом пакете. Аденозиндезаминаза вызывает распад аденозина с образованием инозина и аммиака, но не считается клинически значимым.Увеличение протонов вызывает снижение уровня pH и, как следствие, изменение гликолитического метаболизма. Снижение pH вызывает снижение уровня 2,3-дифосфоглицерата с одновременным всплеском производства аденотрифосфата (АТФ). Гликолиз замедляется, и по мере накопления кислоты уровни АТФ снижаются, и форма красных кровяных телец постепенно изменяется от дискоидных до эхиноцитарных образований. Это изменение в образовании эритроцитов исчезает, когда запасенная кровь омолаживается, и обращается вспять, когда кровь нагревается.Процесс омоложения — это когда эритроциты хранятся в питательном растворе с нейтральным pH [20]. Накопление молочной кислоты и белков появляется в красных клетках после 14 дней хранения из-за гликолитического метаболизма. Сообщалось, что снижение уровня pH и повышение концентрации лактата и калия может произойти в течение нескольких часов после хранения, в то время как другие изменения могут проявиться через несколько недель [21].
Накопление молочной кислоты и белков появляется в красных клетках после 14 дней хранения из-за гликолитического метаболизма. Сообщалось, что снижение уровня pH и повышение концентрации лактата и калия может произойти в течение нескольких часов после хранения, в то время как другие изменения могут проявиться через несколько недель [21].
2.2. 2,3 DPG
2,3-Дифосфоглицерат (2,3 DPG) является регулятором ферментов гемоглобина и помогает транспортировать кислород к тканям организма.Снижение уровня pH приводит к увеличению деградации 2,3 DPG. Это вызывает увеличение кислородного сродства гемоглобина, что приводит к смещению кривой диссоциации кислорода влево, что приводит к снижению поступления кислорода в периферические ткани. В случае гипоксии кривая диссоциации кислорода смещает доставку вправо, тем самым увеличивая транспорт кислорода к тканям. После 42-дневного периода хранения единица эритроцитов может потерять более 90% своей концентрации 2,3 DPG [5, 19, 22].Хотя уровни 2,3 DPG могут стать неопределяемыми в течение 2 недель хранения, уровни нормализуются в течение 72 часов после переливания без каких-либо необратимых исходов, и это не считается клинически значимым [21, 23].
Хотя многострановые руководящие принципы рекомендуют выдавать эритроциты возрастом менее 5 дней пациентам, подвергающимся массивным переливаниям, пациентам, которым были выполнены процедуры обмена эритроцитов, или пациентам в шоке, которые не могут увеличить свой сердечный выброс [7, 16, 17, 24] Многие ретроспективные исследования демонстрируют различные противоречивые исходы, включая переливание более раннего RBCC, что безопаснее, чем свежая кровь, отсутствие разницы между переливанием свежего или более старого RBCC или патологические клинические состояния, возникающие в результате переливания более старой крови.Хотя было установлено, что существует определенная разница между свежей и старой кровью, клиническое значение остается неопределенным, и поэтому начало проспективных двойных слепых рандомизированных клинических испытаний может разрешить продолжающиеся споры [25].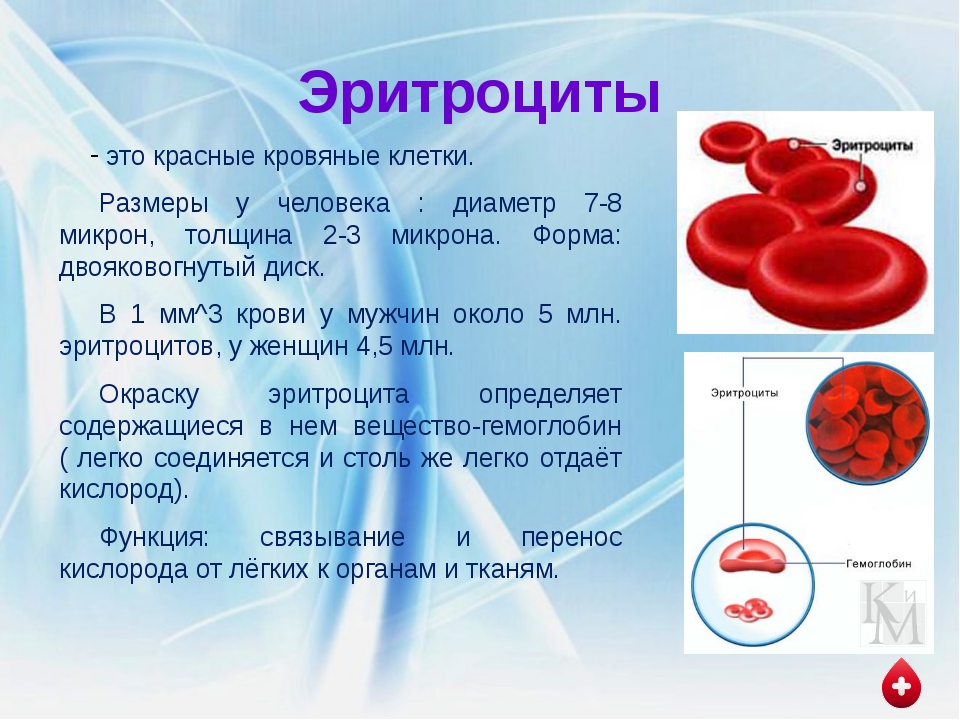 В недавнем двойном слепом рандомизированном клиническом исследовании (Возраст эритроцитов у недоношенных детей {ARIPI}) сравнивали переливание свежей крови (среднее хранение 5, 1 день) с использованием более старой крови (среднее хранение 14, 6 дней) в недоношенным новорожденным с массой тела при рождении менее 1250 г, чтобы продемонстрировать снижение неонатальной заболеваемости, связанной с органной недостаточностью или дисфункцией органов, а также с серьезными внутрибольничными инфекциями.Исследователи пришли к выводу, что не было никакой разницы в клинических исходах при переливании свежей крови недоношенным новорожденным с очень низким весом при рождении по сравнению с переливанием более старой крови [26]. Однако это исследование вызвало некоторые опасения относительно того, что использование старой крови для переливания не влияет на некротизирующий энтероколит, частое заболевание у недоношенных детей. Кроме того, соблюдалась либеральная практика переливания, поскольку уровни гемоглобина не были указаны до переливания, хотя каждый ребенок получил примерно 5 аликвот RBCC примерно по 14 мл на аликвоту, и, таким образом, результаты исследования могут быть затруднены для учреждений, использующих более консервативную практику переливания. .Кроме того, более старая кровь, используемая для переливания новорожденных, имела среднее время хранения 14, 6 дней, тогда как средний срок хранения RBCC в американских центрах составляет около 18 дней [27]. Целью другого рандомизированного клинического исследования было определить, влияет ли срок хранения крови, используемой для переливания, на клинические исходы у пациентов, перенесших кардиохирургические операции. Результаты исследования продолжительности хранения эритроцитов (RECESS) продемонстрировали результаты, аналогичные результатам клинического исследования ARIPI. Никаких различий в отношении побочных реакций на переливание крови, изменений показателей мультиорганной дисфункции или смертности на 28 день не наблюдалось при использовании либо свежих лейкоцитов с пониженным содержанием лейкоцитов (хранимых в течение 10 дней или меньше), либо при переливании более старых RBCC (хранящихся на 21 день или более) в кардиологические пациенты, нуждающиеся в хирургическом вмешательстве [28].
В недавнем двойном слепом рандомизированном клиническом исследовании (Возраст эритроцитов у недоношенных детей {ARIPI}) сравнивали переливание свежей крови (среднее хранение 5, 1 день) с использованием более старой крови (среднее хранение 14, 6 дней) в недоношенным новорожденным с массой тела при рождении менее 1250 г, чтобы продемонстрировать снижение неонатальной заболеваемости, связанной с органной недостаточностью или дисфункцией органов, а также с серьезными внутрибольничными инфекциями.Исследователи пришли к выводу, что не было никакой разницы в клинических исходах при переливании свежей крови недоношенным новорожденным с очень низким весом при рождении по сравнению с переливанием более старой крови [26]. Однако это исследование вызвало некоторые опасения относительно того, что использование старой крови для переливания не влияет на некротизирующий энтероколит, частое заболевание у недоношенных детей. Кроме того, соблюдалась либеральная практика переливания, поскольку уровни гемоглобина не были указаны до переливания, хотя каждый ребенок получил примерно 5 аликвот RBCC примерно по 14 мл на аликвоту, и, таким образом, результаты исследования могут быть затруднены для учреждений, использующих более консервативную практику переливания. .Кроме того, более старая кровь, используемая для переливания новорожденных, имела среднее время хранения 14, 6 дней, тогда как средний срок хранения RBCC в американских центрах составляет около 18 дней [27]. Целью другого рандомизированного клинического исследования было определить, влияет ли срок хранения крови, используемой для переливания, на клинические исходы у пациентов, перенесших кардиохирургические операции. Результаты исследования продолжительности хранения эритроцитов (RECESS) продемонстрировали результаты, аналогичные результатам клинического исследования ARIPI. Никаких различий в отношении побочных реакций на переливание крови, изменений показателей мультиорганной дисфункции или смертности на 28 день не наблюдалось при использовании либо свежих лейкоцитов с пониженным содержанием лейкоцитов (хранимых в течение 10 дней или меньше), либо при переливании более старых RBCC (хранящихся на 21 день или более) в кардиологические пациенты, нуждающиеся в хирургическом вмешательстве [28].
2.3. ATP
Прогрессирующая потеря аденозинтрифосфата (АТФ) хорошо документирована в отношении морфологических изменений и деформируемости эритроцитов в течение периода хранения. АТФ является не только источником внутриклеточной энергии, но, когда АТФ высвобождается из эритроцита, он стимулирует выработку оксида азота, что приводит к расширению сосудов в условиях гипоксии. Снижение концентрации АТФ во время хранения вызывает также уменьшение клеточных реакций, требующих энергии, например распределения фосфолипидов в мембране, активного транспорта и антиоксидантных реакций.Было указано, что уровень АТФ снижается на 60% после более чем 5 недель хранения [19]. Постоянное снижение концентрации АТФ и закисление приводит к необратимому изменению формы эритроцитов, поскольку появляются выступы на поверхности эхиноцитов. Фосфолипидный бислой теряет асимметрию и происходит отслаивание микровезикул [20].
2.4. Ионы калия и натрия
Кровь, хранящаяся при температуре от 1 ° до 6 ° C, снижает скорость клеточного метаболизма и потребность в энергии, что позволяет хранить кровь от 35 до 42 дней.Это приводит к неработоспособности натрий-калиевого насоса и, следовательно, позволяет ионам калия выходить из клетки, а ионам натрия проходить через полупроницаемую мембрану. На пациентах в критическом состоянии было продемонстрировано, что уровни натрия вернутся к нормальным уровням в течение 24 часов после переливания крови, тогда как уровни калия стабилизируются примерно через 4 дня [21, 22]. Уровень внеклеточного калия в хранимой крови увеличивается ежедневно примерно на 1 мэкв / л. с более высокими концентрациями, наблюдаемыми в первые дни хранения [20].Повышенный уровень калия в эритроцитах может привести к аритмии при переливании новорожденным или младенцам больших объемов сохраненной крови [14, 22].
2,5. Плазменный гемолиз
Из-за более длительного периода хранения мембрана эритроцитов претерпевает как биохимические, так и морфологические изменения. Эти изменения называются повреждениями накопления, и таким биохимическим показателем является гемолиз плазмы или процентный гемолиз. Гемолиз эритроцитов (эритроцитов) может происходить во время сбора из-за бактериального загрязнения, транспортировки, хранения, дефицита донорских эритроцитов, наличия лейкоцитов в нефильтрованных эритроцитах, механического повреждения во время процесса фильтрации или из-за повышенного уровня витамина С или пенициллина. в доноре [29].
Эти изменения называются повреждениями накопления, и таким биохимическим показателем является гемолиз плазмы или процентный гемолиз. Гемолиз эритроцитов (эритроцитов) может происходить во время сбора из-за бактериального загрязнения, транспортировки, хранения, дефицита донорских эритроцитов, наличия лейкоцитов в нефильтрованных эритроцитах, механического повреждения во время процесса фильтрации или из-за повышенного уровня витамина С или пенициллина. в доноре [29].
Было показано, что взаимодействие гемоглобина плазмы с оксидом азота вызывает эндотелиальную дисфункцию и является фактором риска сужения сосудов, адгезии лейкоцитов и внутрисосудистого тромбоза [30]. Высвобождение пероксидазы водорода и протеаз лейкоцитами, присутствующими в нефильтрованной крови, может вызвать лизис эритроцитов во время периода хранения. Признаки гемолиза в плазме или суспендированной жидкости могут указывать на то, что эритроциты были либо разорваны, либо это может быть связано с потерей связанного с мембраной гемоглобина в микровезикулах, обнаруженных на клеточной поверхности интактных клеток.Добавление стабилизаторов мембран, например маннита и цитрата, может уменьшить гемолиз. Сообщалось, что, хотя средний процент гемолиза RBCC, хранящегося в ADSOL (AS-1), был ниже, чем у его аналогов, хранящихся в SAGM, разница не была статистически значимой [31].
Самый простой подход к оценке наличия гемолиза в отделении эритроцитов до выдачи блока из банка крови или перед переливанием — это наблюдение, но этот визуальный осмотр часто вводит в заблуждение, поскольку приводит к завышенной оценке уровней гемолиза [32 ].Также сообщалось, что изменение цвета на розовый / красный из-за гемолиза, наблюдаемого либо в плазме, либо в суспендированной жидкости, часто может быть связано с уровнем гемолиза в плазме, составляющим всего 25 г / дл (± 0,09% гемолиза в плазме), и в нормальных условиях это единицы выбрасываются без надобности. Поэтому рекомендуется включить меры контроля качества для определения точности гемолиза плазмы с использованием фотометрических или спектрофотометрических методов на случайных единицах или перед утилизацией единицы эритроцитов [33].
Клинические последствия гемолиза эритроцитов для перелитого человека очень серьезны и могут привести к окислительно-восстановительному повреждению тканей, эндотелия или проксимальных канальцев почек, в то время как прокоагулянтные и провоспалительные поверхности появляются из-за инфузии микровезикул, которые влияют на микроциркуляцию. и, следовательно, влияет на системную гемодинамику [34]. Предыдущие исследования показали, что пациенты с сердечно-сосудистыми патологиями или патологиями кровообращения должны тщательно рассмотреть возможность использования реологически скомпрометированных эритроцитов из-за гемодинамического риска [1, 23, 25, 34].
Поскольку наличие гемолиза является поводом для беспокойства, руководящие принципы, продиктованные Советом Европы, предусматривают, что средний уровень гемолиза должен быть менее 0,8%. FDA внесло поправки в свой стандарт в отношении средней концентрации гемолиза, добавив «правило 95/95». Это правило гласит, что, помимо достижения стандартной концентрации гемолиза в плазме менее 1%, учреждения по переливанию крови должны теперь продемонстрировать, что 95% их продуктов эритроцитов соответствуют стандарту, статистически достигая 95% времени [21, 35]. ].Хорошо задокументировано, что концентрация гемолиза возрастает в течение периода хранения, но из-за жестких стандартов контроля качества до, во время и после обработки вместе с обученным персоналом процентные уровни гемолиза большинства RBCC не превышают предписанные пределы [33 , 34].
2.6. Лейкоциты с пониженным содержанием эритроцитов
Лейкоциты, обнаруженные в аллогенных продуктах эритроцитов, редко приносят терапевтическую пользу пациенту, но, как известно, они увеличивают скорость клеточного повреждения и вызывают неблагоприятные трансфузионные реакции у реципиентов.Эти побочные реакции включают аллоиммунизацию к человеческим лейкоцитарным антигенам (HLA), негемолитическую лихорадочную трансфузионную реакцию (NHFTR), связанное с переливанием повреждение легких (TRALI) и иммуномодулирующие эффекты, которые включают возможную послеоперационную инфекцию, послеоперационную смертность или рецидив рака [36, 37] .
Лейкоциты также могут рассматриваться как переносчики инфекционных патогенов, например вируса Эпштейна-Барра, цитомегаловируса и Т-лимфотропного вируса I / II человека. Установлено, что В-лимфоциты являются переносчиками прионов, вызывающих вариант болезни Крейтцфельда-Якоба [37].Сообщалось, что использование эритроцитов с пониженным содержанием лейкоцитов снижает частоту полиорганной недостаточности у пациентов, перенесших сосудистые или онкологические операции, и сокращает время пребывания в больнице на 2, 4 дня, а также снижает смертность пациентов, перенесших онкологические операции на желудочно-кишечном тракте. Среднее сокращение на 2, 4 дня на пациента значительно сократит расходы национальной больницы [38]. Британские данные по гемонадзору демонстрируют, что использование фильтрованных компонентов эритроцитов снижает частоту связанной с переливанием крови реакции трансплантат против хозяина.
Следует отметить, однако, что использование только лейкорезидированных эритроцитов для предотвращения TA-GvHD не рекомендуется, поскольку эритроциты, используемые для переливания, должны быть отфильтрованы и облучены, чтобы предотвратить это серьезное и часто смертельное заболевание [39].
Фильтры, используемые для истощения лейкоцитов, легко доступны, и фильтрация RBCC может быть подготовлена у постели пациента во время переливания, перед хранением (поточная фильтрация) или после удаления лейкоцитарного слоя и плазмы (предварительное хранение или 24- час истечения срока годности продукта).Истощение лейкоцитов путем фильтрации лучше всего проводить в технологической лаборатории службы переливания крови, поскольку это обеспечивает лучший контроль качества. Рекомендуется фильтровать кровь вскоре после сбора и / или обработки, поскольку гранулоциты фрагментируются и дегранулируют во время хранения, что может вызвать NHFTR или антигенпрезентирующие клетки, представляющие антигены классов I и II главного комплекса гистосовместимости (MHC), что приводит к аллоиммунизации. Сообщалось, что лейкоцитарные антитела, связанные с TRALI, возможно, нацелены на антигены HLA (класс II) и аллоантигены нейтрофилов.В опосредованном антителами TRALI антитело, вызывающее TRALI у пациента, обычно распознается у повторнородящих женщин-доноров, но этих доноров нельзя исключать, так как это существенно уменьшит донорский пул [40]. FDA рекомендует, чтобы отфильтрованная единица крови содержала менее 5 × 10 6 лейкоцитов (WBC) и удерживала приблизительно 85% исходных RBC. Пациенты стимулируются к выработке антител против переливаемых антигенов гистосовместимости, когда количество лейкоцитов превышает 5-логарифмическое значение, и, таким образом, чтобы предотвратить первичную аллоиммунизацию, FDA установило это правило.Они также предлагают проводить тестирование контроля качества на 1% отфильтрованных единиц, из которых в 100% не должно быть более 5 × 10 6 лейкоцитов.
Сообщалось, что лейкоцитарные антитела, связанные с TRALI, возможно, нацелены на антигены HLA (класс II) и аллоантигены нейтрофилов.В опосредованном антителами TRALI антитело, вызывающее TRALI у пациента, обычно распознается у повторнородящих женщин-доноров, но этих доноров нельзя исключать, так как это существенно уменьшит донорский пул [40]. FDA рекомендует, чтобы отфильтрованная единица крови содержала менее 5 × 10 6 лейкоцитов (WBC) и удерживала приблизительно 85% исходных RBC. Пациенты стимулируются к выработке антител против переливаемых антигенов гистосовместимости, когда количество лейкоцитов превышает 5-логарифмическое значение, и, таким образом, чтобы предотвратить первичную аллоиммунизацию, FDA установило это правило.Они также предлагают проводить тестирование контроля качества на 1% отфильтрованных единиц, из которых в 100% не должно быть более 5 × 10 6 лейкоцитов.
Прикроватная фильтрация должна быть последним вариантом использования, поскольку адекватные процедуры контроля качества не могут быть выполнены на прикроватных фильтрах, снижающих лейкоциты. Прикроватная фильтрация требует медленной скорости потока, что снижает эффективность фильтра. Фильтры, которые в настоящее время используются в большинстве учреждений по переливанию крови, обеспечивают снижение лейкоцитов с уровнем 3 log [41].
Увеличение концентрации лактатдегидрогеназы (ЛДГ), истощение глюкозы и гемолиз с понижением pH было зарегистрировано при сравнении RBCC с низким содержанием лейкоцитов, хранящимся в SAGM, с его аналогом RBCC с истощенным лейкоцитами. Этот результат показывает, что присутствие лейкоцитов в блоке RBCC было источником более высокой скорости гемолиза [37]. Уменьшение лейкоцитов за счет фильтрации в продуктах красных кровяных телец не только минимизировало осложнения при переливании крови у пациентов, подвергшихся воздействию аллогенной крови, но также уменьшило возникновение бактериального загрязнения, например, Yersinia enterocolitica в компонентах красных кровяных клеток [23, 42] , и наблюдалось снижение послеоперационных инфекций [35, 41].
В результате преимуществ, но несмотря на дополнительные расходы, RBCC с пониженным содержанием лейкоцитов стала стандартным компонентом переливания крови во многих странах, за исключением развивающихся стран, где это не является рентабельным. Германия ввела фильтрованные эритроциты в качестве основного компонента с 2001 года, тогда как в Южной Африке рекомендуется выборочное использование этих концентратов [17].
2.7. Облученные эритроциты
Несмотря на пониженную концентрацию лейкоцитов в единицах эритроцитов, небольшое количество лейкоцитов остается в упаковке, и это обычно не представляет проблемы для пациентов со здоровой иммунной системой, если они не получают назначенную / направленную донацию.Продукты эритроцитов облучают, чтобы снизить риск связанной с переливанием крови реакции «трансплантат против хозяина» (TA-GvHD) [43, 44].
TA-GvHD — редкая, но фатальная неблагоприятная реакция при переливании крови, возникающая в результате клональной пролиферации и приживления жизнеспособных донорских Т-лимфоцитов, и может возникать у пациентов с ослабленным иммунитетом или у пациентов, которым перелили кровь от доноров, гомозиготных по общему человеческому лейкоцитарному антигену (HLA). гаплотипы. Гамма-облучение нацелено на лимфоцитарные нуклеиновые кислоты, но при этом также повреждает нелимфоидные клетки.При облучении наблюдается заметное изменение свойств эритроцитов. Эти изменения включают перекисное окисление липидов из-за активных форм кислорода (АФК), нарушается целостность клеточной мембраны, ускоряется просачивание ионов калия, изменяются внутриклеточные нуклеотиды, снижается эластичность и деформируемость клеток [39]. В литературе сообщается о повышении концентрации калия, лактатдегидрогеназы и гемоглобина в плазме в облученных продуктах эритроцитов [43, 44].Из-за повреждений накопления, возникающих во время облучения, увеличивается гемолиз in vitro и , и, следовательно, при переливании облученных эритроцитов восстановление in vivo снижается, но это не считается клинически значимым, если только пациенты не имеют почечной недостаточности или начало гиперкалиемии.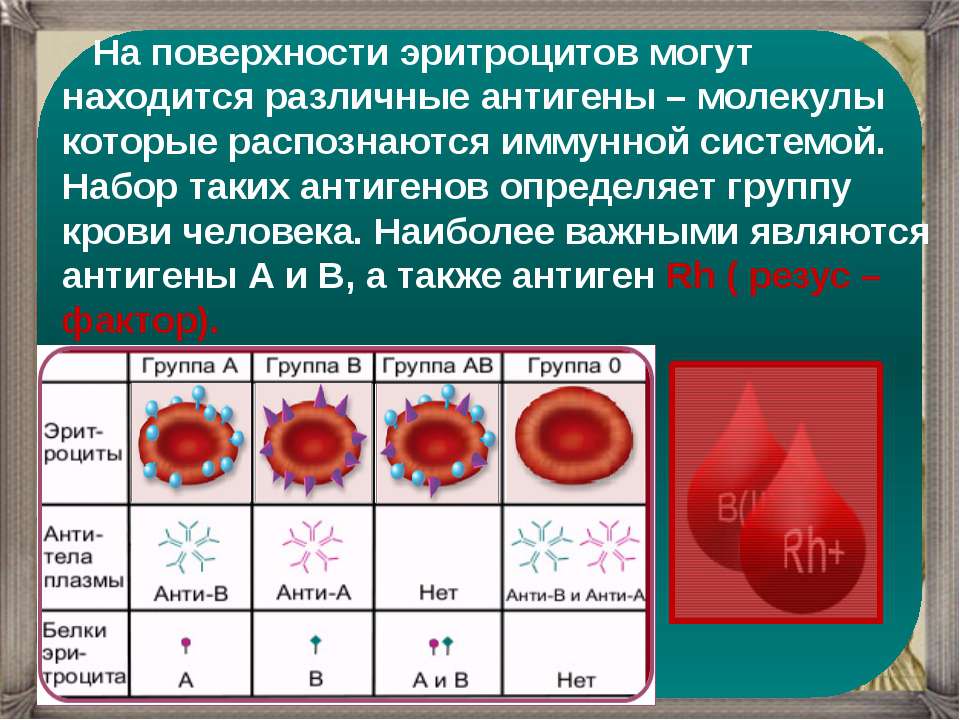 Сообщалось, что дети более подвержены сердечно-сосудистой патологии из-за гиперкалиемии, чем взрослые [45]. Неонатальную гиперкалиемию можно предотвратить с помощью средства сохранения клеток для промывания облученного продукта эритроцитов новорожденных, перенесших операцию искусственного кровообращения [43].Также рекомендуется, чтобы новорожденным с риском гиперкалиемии, требующим внутриматочных или обменных переливаний, осуществляли переливание в течение 24 часов после облучения эритроцитами. Гамма-облучение продуктов рекомендуется при внутриматочных переливаниях, обменных переливаниях, переливаниях родственникам первой степени родства, недоношенным новорожденным с массой тела менее 1200 г, пациентам с патологиями врожденного иммунодефицита, такими как синдром ДиДжорджи, синдром Вискотта-Олдрича, всем реципиентам аллогенных трансплантатов костного мозга. , тем, кто подвергается забору стволовых клеток для последующей аутологичной реинфузии, и пациентам, прошедшим агрессивную химиотерапию.В настоящее время гамма-облучение является одобренным методом профилактики TA-GvHD [46].
Сообщалось, что дети более подвержены сердечно-сосудистой патологии из-за гиперкалиемии, чем взрослые [45]. Неонатальную гиперкалиемию можно предотвратить с помощью средства сохранения клеток для промывания облученного продукта эритроцитов новорожденных, перенесших операцию искусственного кровообращения [43].Также рекомендуется, чтобы новорожденным с риском гиперкалиемии, требующим внутриматочных или обменных переливаний, осуществляли переливание в течение 24 часов после облучения эритроцитами. Гамма-облучение продуктов рекомендуется при внутриматочных переливаниях, обменных переливаниях, переливаниях родственникам первой степени родства, недоношенным новорожденным с массой тела менее 1200 г, пациентам с патологиями врожденного иммунодефицита, такими как синдром ДиДжорджи, синдром Вискотта-Олдрича, всем реципиентам аллогенных трансплантатов костного мозга. , тем, кто подвергается забору стволовых клеток для последующей аутологичной реинфузии, и пациентам, прошедшим агрессивную химиотерапию.В настоящее время гамма-облучение является одобренным методом профилактики TA-GvHD [46].
Американское FDA и канадское руководство установили, что максимальный срок хранения облученных эритроцитов составляет 28 дней; Государственное управление по санитарному надзору за качеством пищевых продуктов и медикаментов Китая (SFDA) установило срок 35 дней [47], в то время как Совет Европы рекомендует, чтобы облучение эритроцитов с пониженным содержанием лейкоцитов не проводилось более 14 дней после донорства и не должно храниться дольше 14 дней после облучения.Что касается дозы облучения, Совет Европы устанавливает от 25 Гр до 40 Гр в любом месте пакета, тогда как американское FDA рекомендует не менее 15 Гр в любом месте пакета, в то время как 25 Гр должно быть доставлено в середину пакета. сумка [39]. Южная Африка соблюдает руководящие принципы, установленные Советом Европы в отношении истечения срока годности облученных эритроцитов, но доза облучения составляет от 25 до 50 Гр там, где нацелена на центр контейнера [47].
Имеющиеся данные о воздействии облученных продуктов эритроцитов ограничены, так как было проведено мало систематических исследований, на этих устройствах не проводится контроль качества, и существует множество доступных руководств относительно облучения.Следовательно, невозможно предсказать наличие облученных накоплений эритроцитов.
3. Обсуждение
В то время как учреждения по переливанию крови имеют определенные руководящие принципы, определяющие приемлемые параметры метаболических изменений, происходящих в продуктах красных кровяных телец во время хранения, литература по их гамма-облученным аналогам менее обширна.
Было обнаружено множество различий в исследованиях, которые оценивали биохимические повреждения накопления и клиническое влияние накопительных повреждений у тяжелых больных взрослых или педиатрических пациентов, например, неоднородное распределение (с использованием свежей и старой крови), приготовление продуктов крови, дизайн исследования, совокупность образцов, несоответствие в дифференциации свежей и старой крови, разнообразие руководств по облучению, а также различные используемые среды для хранения или консерванты, не задокументированные, небольшой размер образца и в основном ограниченный ретроспективными наблюдениями.Следует также отметить, что, хотя использование продуктов эритроцитов с пониженным содержанием лейкоцитов является обычной практикой во многих странах первого мира, это не глобальная практика.
4. Заключение
Клиническое влияние накопленных повреждений на выживаемость эритроцитов у перелитых пациентов является спорным, и поэтому доказательства, подтверждающие необходимость более короткого периода хранения, неудовлетворительны. Существует относительно немного систематических исследований, сравнивающих метаболические изменения in vitro и , происходящие в облученных концентратах красных кровяных телец, и существует потребность в рандомизированных контролируемых исследованиях для изучения влияния накопленных повреждений на смертность и заболеваемость. Как только они начнутся, возможно, будет дан ответ на этот очень обсуждаемый вопрос.
Как только они начнутся, возможно, будет дан ответ на этот очень обсуждаемый вопрос.
5. Рекомендации
Хотя результаты клинических испытаний RECESS и ARIPI показывают, что нет различий в отношении заболеваемости или смертности пациентов, переливающих свежую кровь, по сравнению со старой кровью, на возникновение повреждений накопления эритроцитов могут влиять подготовка клеточных компонентов, выделенных из донорской цельной крови. Округа и отделения переливания крови в разных регионах не используют один и тот же раствор антикоагулянта, такой как SAGM, AS-3, CPD или CPDA-1, и это также может повлиять на возникновение повреждений накопления.Таким образом, результаты, полученные в результате этих испытаний, следует тщательно изучить, прежде чем применять их в качестве политики переливания крови. Другое рандомизированное контролируемое исследование стандартного переливания по сравнению с использованием более свежих эритроцитов в интенсивной терапии (TRANSFUSE) в настоящее время продолжается и будет определять, снизит ли использование самой свежей крови, доступной для переливания, вместо стандартной более старой крови, смертность у тяжелобольных пациентов в отделении интенсивной терапии. единицы измерения.
Принимая во внимание указанные выше оговорки и несоответствия, наблюдаемые в отношении повреждений при хранении, возникающих в необлученных и облученных компонентах эритроцитов, рекомендуется начать более систематические исследования.Несмотря на то, что проспективные рандомизированные контролируемые исследования могут оказаться сложными из-за сложности накопительных повреждений, разнообразия патофизиологии пациентов и различий от донора к донору, эти исследования должны следовать аналогичной схеме при изучении эффекта in vivo накопительных поражений на смертность и заболеваемость пациентов.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
Использование, побочные эффекты, процедуры и результаты
Ширина распределения эритроцитов (RDW) — это одно из чисел или индексов кровяных телец, которое включается как часть общего анализа крови (CBC) и описывает изменение размера эритроцитов в образце крови. Более высокий RDW означает, что размер эритроцитов больше, чем ожидалось. RDW может быть очень полезным для различения разных типов анемии, особенно если присутствует более одного типа анемии.
Более высокий RDW означает, что размер эритроцитов больше, чем ожидалось. RDW может быть очень полезным для различения разных типов анемии, особенно если присутствует более одного типа анемии.
Однако даже когда показатели крови, такие как количество эритроцитов, в норме, RDW может быть ценным тестом. Например, с его помощью можно прогнозировать дефицит железа у беременных еще до развития анемии (дефицит железа увеличивает риск как для матери, так и для ребенка).Это также может быть полезно при оценке риска сердечных заболеваний или рака, и некоторые врачи считают, что это может быть тест, который оценивает общее самочувствие.
Существуют ограничения при оценке RDW, например, после переливания крови. RDW также может называться шириной распределения эритроцитов или RDW-SD (тест стандартного отклонения).
Дэвид Сильверман / Getty ImagesНазначение
Ширина распределения эритроцитов (RDW) выполняется как часть общего анализа крови и, следовательно, является часто выполняемым тестом, который используется как для скрининга здоровых людей, так и для оценки широкого спектра заболеваний.
Бывают случаи, когда врачи могут специально изучить значение RDW:
- с симптомами анемии, такими как головокружение или утомляемость
- , чтобы помочь диагностировать причины анемии (большие различия в размере клеток или высокий RDW могут иметь место, когда присутствует более одного типа анемии)
- для проверки людей, у которых в анамнезе имеется заболевание эритроцитов, такое как талассемия
- с заболеванием сердца (повышенный RDW — сильный предиктор возможной сердечной недостаточности)
- для скрининга на ранний дефицит железа у беременных до развития анемии
- для скрининга на ранний дефицит витамина B12 и фолиевой кислоты до того, как в крови будут обнаружены другие признаки
- , чтобы знать, когда необходимы дальнейшие анализы крови (мазок периферической крови)
- в качестве вспомогательного средства для оценки риска заболеваний (сердечных заболеваний, рака и др.
 ) Или определения прогноза
) Или определения прогноза
Расчет
RDW может быть представлен как стандартное отклонение (SD) или коэффициент вариации (CV), но RDW-CV является наиболее распространенным.Одно стандартное отклонение объема эритроцитов, деленное на MCV, умноженное на 100.
Значение
RDW используется для описания степени изменения размера эритроцитов, а термин анизоцитоз используется для описания этого изменения. Другими словами, если говорить о значительном анизоцитозе в мазке крови, это будет означать, что эритроциты значительно различаются по размеру.
Эритроциты обычно довольно однородны по размеру, и увеличение вариабельности или анизоцитоза (увеличение RDW) может означать несколько вещей.Высокий RDW может быть признаком некоторых типов анемии, а также общим признаком воспаления в организме.
Ограничения
Если RDW составлен после переливания крови, он не будет точно отражать RDW клеток человека. Если лаборатория использует кровь с антикоагулянтом EDTA вместо цитратной крови, показание будет ложно высоким. Поскольку RDW-CV рассчитывается с использованием MCV, ошибка в MCV приведет к ошибке в RDW.
Подобные тесты
Изменение размера эритроцитов также можно заметить визуально, посмотрев на мазок периферической крови на предмет морфологии, хотя этот тест обычно проводится после общего анализа крови для выявления отклонений.
Дополнительные тесты
Поскольку RDW выполняется как часть CBC, число указывается вместе с несколькими другими значениями, и обычно используется комбинация результатов, а не только RDW. К ним относятся количество клеток крови каждого типа и другие показатели эритроцитов.
- Эритроциты (эритроциты)
- Лейкоциты (лейкоциты)
- Тромбоциты
- Гемоглобин и гематокрит
- Средний корпускулярный объем (MCV) или мера размера красных кровяных телец
- Средняя концентрация корпускулярного гемоглобина (MCHC) или показатель концентрации гемоглобина в определенном объеме эритроцитов
- Средний корпускулярный гемоглобин (MCH), который соответствует MCV и в целом имеет небольшое значение
- Средний объем тромбоцитов (MPV), который представляет собой средний объем тромбоцитов, который может дать ключ к разгадке многих заболеваний
Дополнительные тесты
В дополнение к общему анализу крови, другие тесты, которые могут быть назначены для оценки анемии, включают подсчет ретикулоцитов, мазок крови на морфологию, исследования железа и многое другое.
Риски и противопоказания
Поскольку RDW является частью простого анализа крови, рисков очень мало. В редких случаях у людей может наблюдаться кровотечение в месте прокола, синяк (гематома) или инфекция.
Перед испытанием
Перед выполнением RDW (CBC) нет никаких особых ограничений в питании или активности. Вам понадобится страховая карточка, и вам будет полезно предоставить своему врачу любые предыдущие результаты анализа крови для сравнения.
Во время теста
Общий анализ крови может быть проведен как в больнице, так и во многих клиниках.Перед забором крови лаборант очистит пораженную область (обычно руку) антисептиком и наложит жгут, чтобы вену было легче увидеть. Затем она введет иглу через кожу в вену. Когда игла введена, вы можете почувствовать острый (но короткий) укус, а некоторые люди могут почувствовать головокружение или слабость.
После того, как образец удален, игла удаляется и давление на колотую рану. Затем накладывается повязка, чтобы сохранить чистоту и уменьшить кровотечение.
После испытания
Как только у вас будет кровь, вы сможете вернуться домой. Возможные побочные эффекты могут включать:
- Кровотечение. Иногда область, где была взята кровь, продолжает кровоточить, хотя это чаще всего встречается у тех, кто принимает препараты для разжижения крови или страдает нарушением свертываемости крови. Чаще всего это можно решить с помощью давления, но если кровотечение не проходит, следует обратиться к врачу.
- Гематома. В редких случаях на месте забора крови может образоваться большой синяк. Это, опять же, чаще встречается у тех, кто принимает антикоагулянты, например, антиагреганты.
- Инфекция. Существует очень небольшой риск того, что инфекция может развиться в результате попадания бактерий на коже в организм во время забора крови.
Интерпретация результатов
Если с вашей клиникой связана лаборатория, чаще всего вы получите результаты вскоре после их завершения. В некоторых случаях образец крови будет отправлен в лабораторию, и ваш врач позвонит и сообщит результаты, когда они будут доступны.
В некоторых случаях образец крови будет отправлен в лабораторию, и ваш врач позвонит и сообщит результаты, когда они будут доступны.
Когда вы получите свои результаты, полезно узнать точные цифры, в том числе ваш RDW. Как обсуждается ниже, RDW может предоставить важную информацию, даже если остальные тесты вашего CBC являются нормальными.
Эталонный диапазон
Референсные диапазоны для RDW могут несколько отличаться в зависимости от лаборатории, проводящей тест. Нормальные эритроциты в среднем составляют от 6 до 8 микрометров в диаметре.RDW оценивает изменение размеров ячеек и выражается в процентах. Нормальный диапазон RDW составляет примерно от 11,8 до 15,6 процента, и это число часто увеличивается с возрастом.
Нормальная RDW с анемией
Примеры анемий, при которых RDW чаще всего бывает нормальной, включают:
- Талассемия (некоторые виды)
- Анемия хронического заболевания
- Болезнь печени
- Алкогольная анемия
- Апластическая анемия
Высокий RDW
Несколько типов анемии, связанной с повышенным RDW, включают:
- Железодефицитная анемия, включая раннюю недостаточность
- Дефицит витамина B12 и фолиевой кислоты
- Смешанные анемии
- Серповидно-клеточная анемия
- Миелофиброз
- Болезнь холодовых агглютининов
Совместное использование RDW и MCV
Использование комбинации RDW и MCV очень полезно для дифференциации некоторых типов анемии, которые иначе было бы трудно отличить друг от друга.Например, и железодефицитная анемия, и талассемия обычно связаны с низким MCV (микроцитарная анемия), но эти два состояния лечат по-разному. Проверка RDW может помочь различить их.
Точно так же мегалобластные анемии (такие как дефицит витамина B12 и фолиевой кислоты) и немегалобластные анемии (например, анемия, связанная с заболеванием печени) связаны с высоким MCV (макроцитарными анемиями), но опять же лечатся по-разному. В этом случае мегалобластные анемии обычно имеют высокую RDW, а немегалобластные — низкую RDW, что помогает провести различие.
В этом случае мегалобластные анемии обычно имеют высокую RDW, а немегалобластные — низкую RDW, что помогает провести различие.
RDW также может быть очень полезным при смешанных анемиях. Например, комбинация дефицита железа (микроцитарная анемия) и фолат-дефицитной анемии (макроцитоз) может иметь нормальный MCV (нормоцитарную анемию), но RDW будет очень высоким.
Ниже приведены примеры условий, которые могут указывать ставки RDW и MCV. Важно отметить, что есть исключения из этих общих правил — например, иногда анемия при хроническом заболевании связана с низким MCV, а иногда железодефицитная анемия показывает нормальное MCV.
- Высокий RDW и низкий MCV: Железодефицитная анемия, серповидноклеточная анемия, бета-талассемия или гемоглобин H
- Высокий RDW и нормальный MCV: Ранняя железодефицитная анемия, ранний дефицит B12 / фолиевой кислоты, кровопотеря (хроническая) или гемолиз
- High RDW и High MCV: Дефицит витамина B12, дефицит фолиевой кислоты, иммунная гемолитическая анемия, или эта комбинация часто встречается у новорожденных
- Нормальная RDW и низкая MCV: Анемия хронического заболевания, талассемия, признак гемоглобина E
- Нормальная RDW и Нормальная MCV: Кровопотеря (острая), анемия, вызванная заболеванием почек, некоторые аномальные гемоглобины или сфероцитоз
- Нормальная RDW и высокая MCV: Апластическая анемия, заболевание печени, злоупотребление алкоголем, некоторые лекарства приводят к этой комбинации (например, химиотерапия или противовирусные препараты)
Другие тесты
В дополнение к общему анализу крови, другие тесты, которые могут быть выполнены для выявления анемии, включают:
- Подсчет ретикулоцитов: Подсчет ретикулоцитов помогает разделить анемии на анемии, связанные с недостаточным образованием эритроцитов (нормальное количество ретикулоцитов), и анемии, при которых наблюдается потеря или разрушение эритроцитов (кровопотеря или гемолиз) которые обычно связаны с высоким количеством ретикулоцитов.
 .
. - Мазок крови : В мазке периферической крови образец крови просматривается под микроскопом. Помимо возможности визуализировать различия в размере и форме, другие результаты могут включать клетки-мишени, ядросодержащие эритроциты, фрагментированные эритроциты (с гемолизом) и многое другое.
- Исследования железа: Железо и железосвязывающая способность сыворотки и / или ферритин сыворотки могут определять запасы железа в организме.
- Витамин B12: При подозрении на дефицит витамина B12 будет определен уровень витамина B12.
- Электрофорез гемоглобина : Это исследование может обнаружить некоторые (но не все) типы талассемии.
- Исследование костного мозга: Для определения типов клеток в костном мозге и запасов железа может быть сделана аспирация и / или биопсия костного мозга.
Использование без анемии для RDW
RDW может быть очень полезным числом, даже если нет признаков анемии (если количество эритроцитов и уровень гемоглобина в норме).
RDW может прогнозировать общий риск смерти у людей старше 45 лет (люди с высоким RDW с большей вероятностью умрут раньше, чем те, у кого RDW ниже).
За последние несколько лет было проведено множество исследований, посвященных прогностической ценности RDW при широком спектре заболеваний. Некоторые из них включают:
- Заболевание сердца : RDW, по-видимому, является сильным предиктором сердечной недостаточности у людей с сердечными заболеваниями, а также предсказывает риск развития сердечных заболеваний у людей с высоким кровяным давлением. Исследование 2014 года показало, что люди с очень высоким RDW (в верхних 5 процентах) на 71 процент чаще страдают сердечным приступом, чем те, у кого RDW ниже.Высокий RDW также может помочь предсказать риск сердечных заболеваний у людей, инфицированных ВИЧ,
- Рак: Исследования рассматривали роль RDW при раке несколькими различными способами.
 При некоторых типах рака (таких как рак крови, рак легких и рак толстой кишки) высокий RDW может означать худший прогноз.
При некоторых типах рака (таких как рак крови, рак легких и рак толстой кишки) высокий RDW может означать худший прогноз.
С другой стороны, исследователи изучили потенциал RDW для прогнозирования риска рака у людей, которые в настоящее время не болеют этим заболеванием.Например, они обнаружили дозозависимую связь между высокими значениями RDW у мужчин и женщин в постменопаузе и будущим риском рака.
Для людей, которые проходят обследование на предмет непреднамеренной потери веса, высокий RDW увеличивал вероятность того, что потеря веса была вызвана раком.
- Хирургия : Исследования, посвященные различным типам хирургии, показали, что RDW может прогнозировать риск осложнений после операции, до такой степени, что было указано, что RDW важна для хирургов-ортопедов.
- Сон: Высокая RDW связана с некоторыми нарушениями сна, такими как апноэ во сне, а также повышена у тех, кто слишком мало или слишком много спит или работает посменно.
- Диабет: Люди с повышенным RDW, по-видимому, имеют больший риск развития диабета.
Эта область исследований (изучение роли RDW в оценке состояний, отличных от состояний крови) является довольно новой, и ожидается, что будет доступно больше информации, чтобы лучше понять потенциальные преимущества использования RDW в будущем.
- Воспалительные / аутоиммунные состояния: Повышенная RDW была связана с рядом воспалительных и аутоиммунных состояний, от волчанки до аутоиммунного тиреоидита.
Продолжение
Последующее тестирование в случае отклонения RDW от нормы будет зависеть от многих факторов. Обязательно обсудите свои результаты со своим врачом, и он / она должен обеспечить дальнейшее наблюдение.
Слово от Verywell
Ширина распределения эритроцитов (RDW) является ценным инструментом при оценке различных типов анемии и может иметь широкий спектр применения, даже если количество эритроцитов у человека в норме. В дополнение к условиям, упомянутым выше, некоторые утверждают, что RDW может быть мерой общего благополучия.
В дополнение к условиям, упомянутым выше, некоторые утверждают, что RDW может быть мерой общего благополучия.
На данный момент неизвестно, какое значение будет иметь этот тест во многих условиях, но примечательно, что такие простые тесты, как эти, которые можно легко упустить из виду, могут предоставить важную информацию, на которую следует обратить внимание.
Продолжительность жизни эритроцитов человека, измеренная с помощью дыхательного теста Левитта с CO с помощью недавно разработанного автоматического прибора.
Продолжительность жизни эритроцитов (RBC) означает продолжительность времени, в течение которого эритроциты выживают в кровотоке после того, как они высвобождаются из костного мозга.Характеристики выживаемости эритроцитов полезны как в клинических, так и в исследовательских целях. Обычно упоминаемая продолжительность жизни нормальных эритроцитов взрослого человека, составляющая около 120 дней, была получена из времени выживания перелитых аллогенных эритроцитов, которое было определено методом дифференциальной агглютинации, введенным Уинифредом Эшби [1-4] в 1919 году. Используются три стандартных метода для измерения продолжительности жизни аутологичных эритроцитов, а именно стабильного изотопа 15 N-глицина, радиоактивного изотопа 51 Cr и маркировки биотина.
Для метода мечения 15 N-глицином для определения продолжительности жизни эритроцитов, который был разработан в когортном исследовании [5, 6], указана доза 15 N-глицина, азотистого предшественника порфириновых колец в геме. , принимается перорально. Новорожденные эритроциты, продуцируемые в костном мозге, содержат гем, меченный введенным 15 N-глицином. Концентрация изотопа гема в периферической крови быстро повышается по мере высвобождения вновь меченых эритроцитов, остается стабильной в течение определенного периода времени, пока меченые эритроциты находятся в обращении, а затем резко снижается после этого по мере отмирания меченой партии эритроцитов. Интервал времени между фазами быстрого увеличения и быстрого уменьшения считается показателем средней продолжительности жизни эритроцитов. Для метода мечения 51 Cr, который был разработан в популяционном исследовании [7–9], берется небольшой образец периферической венозной крови, инкубируется с радиоактивным Na 2 51 CrO 4 , а затем повторно -введен обратно в кровообращение. 51 Cr прочно, но нековалентно связывается с гемоглобином. Поскольку циркулирующая кровь содержит эритроциты разного возраста, повторно введенные 51 Cr-меченых клеток умирают в течение определенного периода времени, а не все сразу.Следовательно, скорость, с которой исчезает радиоактивность 51 C, может использоваться для оценки продолжительности жизни эритроцитов. Наконец, в методике мечения биотином, который выполняется с помощью протокола повторной перфузии, аналогичного тому, который используется для мечения 51 Cr [10–12], эритроциты метят биотином, поскольку он ковалентно связывается с белками мембран эритроцитов. После вторичного связывания связанного с эритроцитами биотина со стрептавидином, конъюгированным с флуорохромом, количество меченных биотином эритроцитов можно определить с помощью проточной цитометрии. Преимущество теста с маркировкой биотина состоит в том, что он не связан с радиационным воздействием, что позволяет использовать его у беременных женщин и новорожденных.
Интервал времени между фазами быстрого увеличения и быстрого уменьшения считается показателем средней продолжительности жизни эритроцитов. Для метода мечения 51 Cr, который был разработан в популяционном исследовании [7–9], берется небольшой образец периферической венозной крови, инкубируется с радиоактивным Na 2 51 CrO 4 , а затем повторно -введен обратно в кровообращение. 51 Cr прочно, но нековалентно связывается с гемоглобином. Поскольку циркулирующая кровь содержит эритроциты разного возраста, повторно введенные 51 Cr-меченых клеток умирают в течение определенного периода времени, а не все сразу.Следовательно, скорость, с которой исчезает радиоактивность 51 C, может использоваться для оценки продолжительности жизни эритроцитов. Наконец, в методике мечения биотином, который выполняется с помощью протокола повторной перфузии, аналогичного тому, который используется для мечения 51 Cr [10–12], эритроциты метят биотином, поскольку он ковалентно связывается с белками мембран эритроцитов. После вторичного связывания связанного с эритроцитами биотина со стрептавидином, конъюгированным с флуорохромом, количество меченных биотином эритроцитов можно определить с помощью проточной цитометрии. Преимущество теста с маркировкой биотина состоит в том, что он не связан с радиационным воздействием, что позволяет использовать его у беременных женщин и новорожденных.
Вышеупомянутые методы имеют несколько основных недостатков. Во-первых, они требуют множественных венесекций. Во-вторых, эти многократные процедуры должны проводиться в течение как минимум нескольких недель, а в некоторых случаях и нескольких месяцев. В-третьих, гематологическое стабильное состояние должно поддерживаться в течение всего периода измерения, потому что любые колебания могут изменить обнаруженную продолжительность жизни. Эти недостатки делают все три метода маркировки неудобными как для исследований на животных, так и для клинической практики.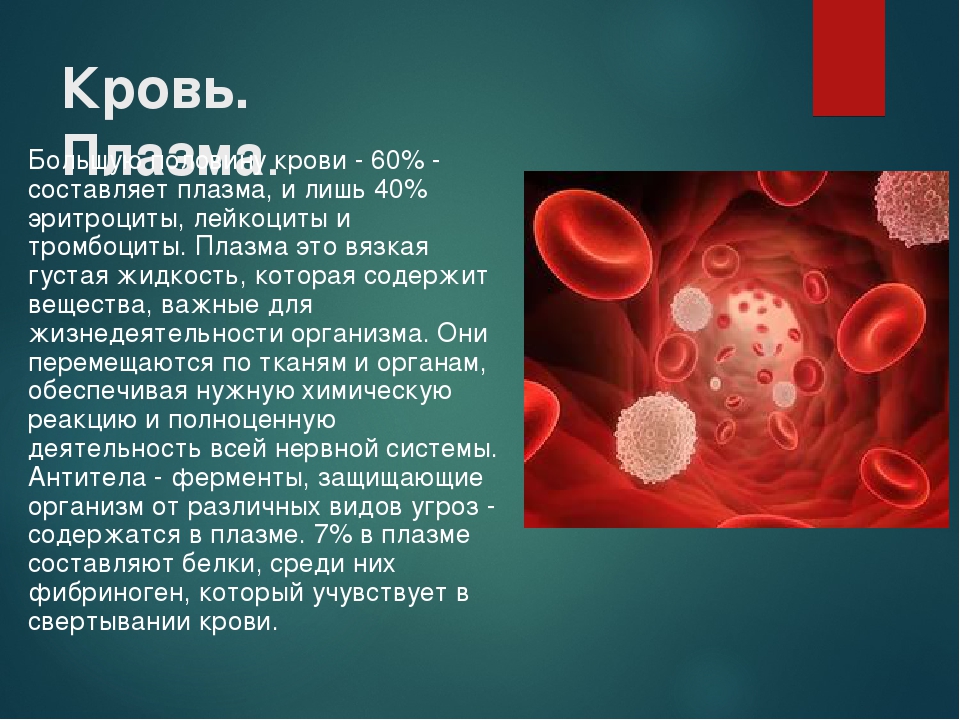
Эндогенный СО образуется в основном в результате окисления гема, которое происходит во время деградации гемоглобина после разрыва эритроцитов [13-15]. Еще в 1966 году Courn и др. [16] сообщили, что скорость выработки эндогенного CO является точным показателем выживаемости эритроцитов по сравнению со стандартом метода 51 Cr-мечения у пациентов с гемолитической анемией. Однако метод Курнса требует сложного протокола повторного дыхания и измерения общего объема крови, что непрактично в клинической практике.В результате использование показателей повышенного содержания CO в выдыхаемом воздухе ограничивалось в основном качественной оценкой гемолитической анемии у педиатрических пациентов [17–19].
В 1992 году исследовательская группа Левитта [20, 21] разработала первый быстрый дыхательный тест на CO, который можно было использовать для расчета продолжительности жизни эритроцитов на основе выдыхаемого альвеолярного эндогенного CO и концентрации гемоглобина в крови. Сообщается, что дыхательный тест Левитта с CO дает количественную оценку статуса выживаемости эритроцитов [20–30]. Более того, было показано, что тест Левитта подходит для использования за пределами измерений в установившемся режиме; действительно, это остается единственным доступным методом для оценки краткосрочных колебаний разрушения эритроцитов [31].Доступна упрощенная версия дыхательного теста Левитта с CO, известная как модифицированный дыхательный тест Левитта с CO [21]. Однако измерения проб газа в модифицированном дыхательном тесте Левитта с CO по-прежнему требуют ряда сложных инструментов, которыми должны управлять квалифицированные специалисты. Кроме того, исследования модифицированного дыхательного теста Левитта с CO были ограничены небольшими размерами выборок [20–30].
С долгосрочной целью облегчить внедрение дыхательного теста на CO для повседневного использования в клинической практике, мы разработали полностью автоматизированный прибор, основанный на принципе дыхательного теста Левитта, с которым можно эффективно работать после ограниченного обучения. Наш недавно разработанный прибор продемонстрировал надежность измерения газообразного CO с низкой концентрацией и продолжительности жизни эритроцитов в исследованиях на мелких животных [32, 33]. Целью этого исследования было оценить надежность метода дыхательного теста Левитта с CO с помощью нашего недавно разработанного автоматического прибора. В частности, мы проверили (1) соответствует ли среднее значение нормальной продолжительности жизни эритроцитов, полученное с помощью автоматического прибора, стандартному приближению 120 дней, и (2) можно ли использовать этот новый прибор для определения сокращенной продолжительности жизни эритроцитов у пациентов с гемолитической анемией. .
Наш недавно разработанный прибор продемонстрировал надежность измерения газообразного CO с низкой концентрацией и продолжительности жизни эритроцитов в исследованиях на мелких животных [32, 33]. Целью этого исследования было оценить надежность метода дыхательного теста Левитта с CO с помощью нашего недавно разработанного автоматического прибора. В частности, мы проверили (1) соответствует ли среднее значение нормальной продолжительности жизни эритроцитов, полученное с помощью автоматического прибора, стандартному приближению 120 дней, и (2) можно ли использовать этот новый прибор для определения сокращенной продолжительности жизни эритроцитов у пациентов с гемолитической анемией. .
2.1. Субъекты исследования
Первый эксперимент был разработан, чтобы оценить, соответствует ли среднее значение нормальной продолжительности жизни эритроцитов, полученное с помощью недавно разработанного инструмента, стандартному приближению 120 дней. Была набрана группа из 104 некурящих здоровых субъектов, включая 46 детей медицинского персонала Медицинского центра женщин и детей Гуанчжоу и 58 взрослых сотрудников Университета Шэньчжэня. Возраст участников варьировался от 7 до 70 лет (среднее ± стандартное отклонение (SD), 21.5 ± 11,4 года). Таким образом, в группе здоровых были подгруппы юношества (диапазон 7–17 лет; 10,6 ± 2,6 года) и взрослого (диапазон 18–70 лет; 30,1 ± 7,6 лет). В группу здоровых вошли 56 женщин (53,8%), в том числе 21 девушка и 35 женщин. У всех субъектов не было хронических заболеваний в анамнезе и аномальных признаков физического осмотра. Никто не страдал острым заболеванием и не принимал лекарства в течение 8 недель до или во время исследования. Все 104 субъекта имели нормальные концентрации гемоглобина в крови (диапазон 120–168 гл -1 ), уровни гематокрита, средние объемы эритроцитов, распределение эритроцитов, количество ретикулоцитов, результаты теста на осмотическую хрупкость эритроцитов, результаты теста Кумбса, результаты электрофореза гемоглобина и эритроциты. уровни активности глюкозо-6-фосфатдегидрогеназы.Кроме того, у всех 104 субъектов были нормальные результаты рутинных клинических тестов (кровь, моча и стул), а также нормальные результаты тестов функции печени и почек. Критериями исключения были тяжелые хронические сердечно-легочные заболевания, острые заболевания или неотложные медицинские потребности, беременность, кормление грудью, переливание крови в течение 3 недель после исследования, участие в другом клиническом исследовании в предшествующие 3 месяца, а также активное курение, тяжелое пассивное курение или другое аналогичное воздействие загрязнения воздуха в течение 24 ч до испытания.
уровни активности глюкозо-6-фосфатдегидрогеназы.Кроме того, у всех 104 субъектов были нормальные результаты рутинных клинических тестов (кровь, моча и стул), а также нормальные результаты тестов функции печени и почек. Критериями исключения были тяжелые хронические сердечно-легочные заболевания, острые заболевания или неотложные медицинские потребности, беременность, кормление грудью, переливание крови в течение 3 недель после исследования, участие в другом клиническом исследовании в предшествующие 3 месяца, а также активное курение, тяжелое пассивное курение или другое аналогичное воздействие загрязнения воздуха в течение 24 ч до испытания.
Для второго эксперимента, предназначенного для проверки способности дыхательного теста с помощью прибора выявлять аномально короткую продолжительность жизни эритроцитов, группа из 91 некурящих пациента с хронической гемолитической анемией, в том числе 89 пациентов с талассемией, 1 с наследственным сфероцитозом и 1 с аутоиммунной гемолитической анемией. Профиль группы по возрасту (21,5 ± 11,4 года) и полу (мужчина / женщина = 54/37) был сопоставим с профилем нашей группы здоровых субъектов. Хроническая гемолитическая анемия была диагностирована на основании истории болезни каждого пациента, результатов физикального обследования и стандартных лабораторных данных.У всех 91 пациента в группе гемолитической анемии концентрация гемоглобина в крови была ниже 120 г / л -1 (диапазон 38,0-105,0 г / л -1 ), повышенное разрушение эритроцитов и компенсаторная пролиферация эритроидов. Талассемия подтверждена электрофорезом гемоглобина и генетическим анализом. Наследственный сфероцитоз был подтвержден на основании присутствия эритроцитов сферической формы (≥10% эритроцитов) в мазке периферической крови и положительного семейного анамнеза, а аутоиммунная гемолитическая анемия была подтверждена положительными результатами прямого антиглобулинового теста и нормальными титрами холодного агглютинина в сыворотке крови. Критерии исключения были такими же, как и в группе здоровых.
Критерии исключения были такими же, как и в группе здоровых.
Протоколы исследования (регистрационный номер CHiCTR-DDD17011592) были одобрены наблюдательными советами Медицинского университета Нанфань и Медицинского центра женщин и детей Гуанчжоу. Эксперименты проводились в соответствии с Хельсинкской декларацией. Перед участием в исследовании было получено письменное информированное согласие от каждого взрослого субъекта и от одного из родителей каждого несовершеннолетнего субъекта.
2.2. Отбор проб
Пробы альвеолярного воздуха отбирали утром (8.00–11.30) без поста. Вкратце, после глубокого вдоха каждый испытуемый задерживал дыхание на 10 с, а затем выдыхал в систему сбора через мундштук (рис. 1 (A)). Система сбора удаляет первые 300 мл газа мертвого пространства, а затем автоматически направляет последующий альвеолярный воздух в мешок для сбора из фольги. При необходимости процедуру повторяли до тех пор, пока отобранная проба воздуха не достигла емкости сборных мешков 1000 мл. Заполненный мешок отсоединяли и запечатывали.Образцы атмосферы были собраны сразу после взятия пробы дыхания. Образцы альвеолярного воздуха и атмосферы хранили при комнатной температуре и анализировали в течение 5 дней. В тот же день, что и отбор проб альвеолярного воздуха, были отобраны пробы крови из периферических вен для рутинного измерения гемоглобина.
Увеличить Уменьшить Сбросить размер изображения
Рис. 1. Экспериментальная установка. (A) Система сбора проб дыхания. (B) Обзор структуры средств измерений.
Загрузить рисунок:
Стандартный образ Изображение высокого разрешения2.3. Приборы и измерения
Наш недавно разработанный автоматизированный прибор (ELS TESTER, Seekya Biotec Co. Ltd, Шэньчжэнь, Китай) определяет альвеолярную эндогенную концентрацию CO с помощью недисперсной инфракрасной спектроскопии с парными альвеолярными пробами и пробами газа воздуха и использует это измерение в качестве основы. для определения продолжительности жизни эритроцитов по формуле Левитта [20, 21, 32, 33]. Конструкция прибора показана на рисунке 1 (B).Предел обнаружения прибора для CO составляет 150 частей на миллиард с точностью ± 50 частей на миллиард и точностью в пределах 50 частей на миллиард. Инструмент прост в эксплуатации. Проще говоря, оператор прибора подключает парные воздушно-альвеолярные пробы газа к впускным отверстиям, вводит данные о концентрации гемоглобина в крови испытуемых, а затем нажимает кнопку пуска, запуская прибор для выполнения серии автоматических измерений, включающих следующие шаги. Во-первых, качество взятого альвеолярного образца проверяется путем измерения его концентрации CO 2 , которая используется в качестве индикатора разведения альвеолярного образца.Небольшой объем альвеолярного воздуха закачивается в камеру обнаружения CO 2 и измеряется цифровое напряжение в инфракрасном свете (длина волны, 4,26 мкм, м). Цифровое напряжение преобразуется в концентрацию CO 2 с помощью предварительно введенной калибровочной кривой, полученной для стандартных образцов газа CO 2 (кривая напряжения / концентрации CO 2 ). Разбавленными считаются только образцы альвеолярного газа, содержащие <5% CO 2 . Во-вторых, чтобы исключить молекулы, которые могут помешать инфракрасному обнаружению CO, анализируемый газ направляется в систему устранения помех с абсорбирующей смесью, состоящей в основном из натриевого асбеста.Поглощенные интерференционные молекулы — это в основном H 2 O и CO 2. В-третьих, для определения разницы концентраций CO в альвеолярном и атмосферном воздухе используется метод парных измерений. Два образца без помех последовательно закачиваются в камеру обнаружения CO, и цифровое напряжение измеряется в инфракрасном свете (длина волны, 4,65 мкм, м). Цифровая разность напряжений между парными отсчетами получается вычитанием. Эта цифровая разность напряжений затем преобразуется в разность концентраций CO, которая записывается как эндогенная альвеолярная концентрация CO с помощью предварительно введенной калибровочной кривой, полученной с серией парных стандартных образцов газа CO с известными концентрациями (кривая разности напряжений / разницы концентраций CO ).
для определения продолжительности жизни эритроцитов по формуле Левитта [20, 21, 32, 33]. Конструкция прибора показана на рисунке 1 (B).Предел обнаружения прибора для CO составляет 150 частей на миллиард с точностью ± 50 частей на миллиард и точностью в пределах 50 частей на миллиард. Инструмент прост в эксплуатации. Проще говоря, оператор прибора подключает парные воздушно-альвеолярные пробы газа к впускным отверстиям, вводит данные о концентрации гемоглобина в крови испытуемых, а затем нажимает кнопку пуска, запуская прибор для выполнения серии автоматических измерений, включающих следующие шаги. Во-первых, качество взятого альвеолярного образца проверяется путем измерения его концентрации CO 2 , которая используется в качестве индикатора разведения альвеолярного образца.Небольшой объем альвеолярного воздуха закачивается в камеру обнаружения CO 2 и измеряется цифровое напряжение в инфракрасном свете (длина волны, 4,26 мкм, м). Цифровое напряжение преобразуется в концентрацию CO 2 с помощью предварительно введенной калибровочной кривой, полученной для стандартных образцов газа CO 2 (кривая напряжения / концентрации CO 2 ). Разбавленными считаются только образцы альвеолярного газа, содержащие <5% CO 2 . Во-вторых, чтобы исключить молекулы, которые могут помешать инфракрасному обнаружению CO, анализируемый газ направляется в систему устранения помех с абсорбирующей смесью, состоящей в основном из натриевого асбеста.Поглощенные интерференционные молекулы — это в основном H 2 O и CO 2. В-третьих, для определения разницы концентраций CO в альвеолярном и атмосферном воздухе используется метод парных измерений. Два образца без помех последовательно закачиваются в камеру обнаружения CO, и цифровое напряжение измеряется в инфракрасном свете (длина волны, 4,65 мкм, м). Цифровая разность напряжений между парными отсчетами получается вычитанием. Эта цифровая разность напряжений затем преобразуется в разность концентраций CO, которая записывается как эндогенная альвеолярная концентрация CO с помощью предварительно введенной калибровочной кривой, полученной с серией парных стандартных образцов газа CO с известными концентрациями (кривая разности напряжений / разницы концентраций CO ). В-четвертых, любые эндогенные альвеолярные образцы, которые оказались разбавленными (т.е. имеющие <5% CO 2 ), нормализуются до статуса 5% CO 2 . Наконец, продолжительность жизни эритроцитов рассчитывается по формуле Левитта (см. Ниже) на основе параметров предварительно рассчитанной концентрации гемоглобина и скорректированной (при необходимости) эндогенной альвеолярной концентрации CO. Прибор сообщает следующие данные для субъекта: альвеолярный CO 2 , эндогенный альвеолярный CO и продолжительность жизни эритроцитов.
В-четвертых, любые эндогенные альвеолярные образцы, которые оказались разбавленными (т.е. имеющие <5% CO 2 ), нормализуются до статуса 5% CO 2 . Наконец, продолжительность жизни эритроцитов рассчитывается по формуле Левитта (см. Ниже) на основе параметров предварительно рассчитанной концентрации гемоглобина и скорректированной (при необходимости) эндогенной альвеолярной концентрации CO. Прибор сообщает следующие данные для субъекта: альвеолярный CO 2 , эндогенный альвеолярный CO и продолжительность жизни эритроцитов.
2.4. Формула Левитта
Метаболический СО образуется преимущественно путем превращения α -метенового углерода порфиринового кольца в СО во время катаболизма гема в билирубин; деградация гемоглобина из умирающих эритроцитов составляет большую часть оборота гема [15].Следовательно, объем производства CO отражает оборот RBC. Поскольку CO полностью выводится через легкие, образцы легочного газа можно использовать для измерения выработки CO [15]. Основываясь на этих принципах, команда Левитца [20] разработала простой неинвазивный дыхательный тест на углекислый газ для оценки продолжительности жизни эритроцитов у людей в 1992 году. Этот тест был изменен той же командой в 2003 году [21]. Эндогенный компонент CO альвеолярного дыхания определяется путем вычитания атмосферного P CO из альвеолярного Pco. Продолжительность жизни эритроцитов (в днях) рассчитывалась на основе измерений CO по следующей формуле, которая приравнивает среднюю продолжительность жизни эритроцитов к общей емкости CO из гемоглобина, деленной на количество CO, выделяемое за день.
где [Hb] — концентрация гемоглобина в мкг / мл -1 , V b — общий объем крови, 22 400 — молярное количество CO в миллилитрах, а 4 — количество молей связанного CO. на каждый моль гемоглобина. В знаменателе endoPco — это альвеолярная концентрация CO в ppm, V t — это объем альвеолярной вентиляции в состоянии покоя, 0,7 — приблизительная доля продукции CO, полученная в результате круговорота циркулирующего гемоглобина, 64 400 — молекулярная масса гемоглобина, 1440 — количество минут в 1 дне. Поскольку объем крови и альвеолярная вентиляция в состоянии покоя имеют тенденцию напрямую зависеть от площади альвеолярной поверхности и имеют примерно одинаковые величины, когда объем крови выражается в миллилитрах, а вентиляция выражается в миллилитрах в минуту, эти два значения в этом уравнении сводятся на нет. Следовательно, уравнение можно упростить до следующего выражения, которое мы называем формулой Левитта.
Поскольку объем крови и альвеолярная вентиляция в состоянии покоя имеют тенденцию напрямую зависеть от площади альвеолярной поверхности и имеют примерно одинаковые величины, когда объем крови выражается в миллилитрах, а вентиляция выражается в миллилитрах в минуту, эти два значения в этом уравнении сводятся на нет. Следовательно, уравнение можно упростить до следующего выражения, которое мы называем формулой Левитта.
2,5. Статистика
Данные, полученные от нормальной группы субъектов, выражены в виде средних значений ± стандартное отклонение, а коэффициенты вариации были рассчитаны путем деления стандартных отклонений на соответствующие средние значения.Нормальность данных определялась методом моментов. Средние значения продолжительности жизни RBC сравнивались по полу и возрастным группам с тестами студентов t . Коэффициенты корреляции определялись с помощью теста корреляции Спирмена. Нормальным диапазоном значений считалось 95% диапазона набора данных с нормальным распределением.
Для подтверждения диагноза гемолитической анемии мы использовали кривые рабочих характеристик приемника (ROC), чтобы установить оптимальное значение различения. Степень точности диагноза рассчитывалась как количество правильно диагностированных случаев, деленное на общее количество (нормальных и гемолитических) субъектов.
Средняя концентрация CO 2 в альвеолярном образце у 104 здоровых субъектов составила 5,8 ± 0,6%, а у 91 пациента с гемолитической анемией — 6,1 ± 2,5% ( t = 12,016, P > 0,05). Двадцать образцов (9,6%) содержали <5,0% CO 2 , в том числе 11 (10,6%) от здоровых субъектов (диапазон 4,12–4,94% CO 2 ) и 9 (9,9%) от пациентов с гемолитической анемией (диапазон 3,54% –4,94% CO 2 , P > 0,05), и поэтому считались разбавленными.Результаты по эндогенной альвеолярной концентрации CO были нормализованы до статуса 5,0% CO 2 в этих разбавленных образцах. Ни один образец не содержал более 7,0% CO 2 . Качество образцов было удовлетворительным.
Ни один образец не содержал более 7,0% CO 2 . Качество образцов было удовлетворительным.
Средняя эндогенная альвеолярная концентрация CO составила 1,8 ± 0,5 частей на миллион у здоровых субъектов и 5,9 ± 3,2 частей на миллион у пациентов с гемолитической анемией ( t = 12,016, P <0,0001). Продолжительность жизни эритроцитов, определенная по формуле Левитта для каждого отдельного пациента, показана на рисунке 2.Обратите внимание, что между наборами данных двух групп нет перекрытия.
Увеличить Уменьшить Сбросить размер изображения
Рис. 2. График разброса данных о продолжительности жизни эритроцитов. Продолжительность жизни эритроцитов, наблюдаемая у 104 здоровых субъектов (светлые кружки), была постоянно выше, чем у 91 пациента с хронической гемолитической анемией (закрашенные кружки).
Загрузить рисунок:
Стандартный образ Изображение высокого разрешения3.1. Нормальная продолжительность жизни эритроцитов
Средняя продолжительность жизни эритроцитов, наблюдаемая в группе здоровых добровольцев, составляла 126 ± 26 дней (диапазон 82–215 дней; коэффициент вариации = 0,21). Средняя продолжительность жизни эритроцитов существенно не различалась между детьми и взрослыми, а также между мужчинами и женщинами (таблица 1). Продолжительность жизни эритроцитов не коррелировала с возрастом ( r = 0,05). Было подтверждено, что данные имеют нормальное распределение; 95% диапазона (75–177 дней) было в пределах 1,96 стандартного отклонения от среднего. Не было точек данных о продолжительности жизни эритроцитов менее 75 дней, но было четыре точки данных (3.8%) превышали 177 дней (т. Е. 184 дня, 187 дней, 189 дней и 216 дней).
Таблица 1. Продолжительность жизни эритроцитов у здоровых людей существенно не различалась в зависимости от возраста и пола.
3.2. Диагностическая эффективность гемолитической анемии
Продолжительность жизни эритроцитов у пациентов с гемолитической анемией была значительно короче, чем у здоровых субъектов (29 ± 14 дней против 126 ± 26 дней, p = 0.001). Анализ кривой ROC показал, что оптимальный порог различения между группами нормальной и гемолитической анемии составлял 75 дней, временной интервал, который совпадал с нижней границей 95% диапазона значений нормальной группы. Используя это пороговое значение, диагностическая точность гемолитической анемии в нашей выборке исследования составила 100%.
В этом исследовании мы использовали недавно разработанный прибор, основанный на принципах дыхательного теста Левитта, для измерения продолжительности жизни эритроцитов у 109 здоровых субъектов и 91 пациента с хронической гемолитической анемией.У здоровых субъектов средняя продолжительность жизни эритроцитов составляла 126 дней с 95% диапазоном включения 75–177 дней. Среднее значение, полученное для группы здоровых людей, было очень близко к значениям, полученным ранее классическими стандартными методами (таблица 2). Насколько нам известно, это самая большая выборка данных измерения продолжительности жизни эритроцитов, полученных у здоровых людей, которая должна быть представлена на сегодняшний день. Мы обнаружили, что продолжительность жизни эритроцитов у пациентов с гемолитической анемией была значительно короче, чем у здоровых людей. Используя границу 75 дней, мы получили диагностическую точность гемолитической анемии в 100% в нашей выборке исследования.Результаты показывают, что подход Левитта к тесту дыхания на СО, реализованный в нашем недавно разработанном приборе, надежен для измерения продолжительности жизни эритроцитов у детей и взрослых.
Таблица 2. Значения продолжительности жизни эритроцитов, указанные в литературе для здоровых людей.
| Срок службы эритроцитов, дней | |||||
|---|---|---|---|---|---|
| Исследование [ссылка] | № | Диапазон | Среднее | SD | Метод |
| Эшби, 1921 [2] | 1 | 110 | 110 | – | Метод Эшби а |
| Callender et al 1945 [3] | 3 | – | 120 | – | Метод Эшби w3.org/1999/xlink»> а |
| Шемин и Риттенберг 1946 [5] | 1 | 127 | 127 | – | 15 Метка N-глицина |
| Khera et al 2015 [6] | 9 | 99–129 | 113 | 11 | 15 Метка N-глицина |
| Ebaugh et al 1953 [7] | 9 | 94–115 | – | – | 51 Этикетка Cr a |
| Моллисон и Гарби 1971 [8] | 22 | – | 115 | – | 51 Этикетка Cr |
| Bentley et al 1974 [9] | 13 | 81–151 | 110 | 21 | 51 Этикетка Cr |
| Franco et al 1998 [10] | «> 4 | 67–120 | – | – | Метка биотина |
| Коэн и др. 2008 [11] | 6 | 38.4–59,5 б | 50,7 | 6,9 | Метка биотина |
| Mock et al 2011 [12] | 8 | 70–140 | 115 | 8 | Метка биотина |
| Дым и др. 2003 [21] | 40 | 73–175 | 122 | 22 | Дыхательный тест на углекислый газ |
| Настоящее исследование | 104 | 82–215 | 126 | 26 | Дыхательный тест на CO |
a Аллогенное переливание крови группы О. b Время выживания эритроцитов, выраженное как средний возраст эритроцитов, который составляет примерно половину продолжительности жизни. — Не сообщили.
— Не сообщили.
За последнее столетие для измерения продолжительности жизни эритроцитов человека использовались различные методы. Первый точный метод определения продолжительности жизни эритроцитов был основан на новых знаниях о системе групп крови ABO, введенных Винифредом Эшби в 1919 году [1, 2]. В то время было широко распространено мнение, что безъядерные эритроциты хрупки с ограниченной продолжительностью жизни, возможно, 2–3 недели [4, 34].Эшби использовал антисыворотку против A и против B для измерения продолжительности жизни эритроцитов типа O, которые были перелиты реципиентам с анемией типа A или типа B, и наблюдал гораздо более длительное время выживания эритроцитов, чем ожидалось. Действительно, был зарегистрирован один случай, когда мужчина продолжал демонстрировать признаки переливания эритроцитов через 110 дней после переливания крови от кровотечения, в то же время находясь в хорошем состоянии [4]. Хотя наблюдения Эшби были спорными в течение многих лет, в конечном итоге они полностью подтвердились. В 1945 году, используя метод дифференциальной агглютинации Эшби, Каллендер и др. [3] пришли к выводу из математического анализа данных, полученных от группы из трех Rh-положительных студентов-медиков, которые добровольно согласились пройти забор крови и замещение перелитой крови равного объема, что Эритроциты живут примерно 120 дней.С момента разработки высокоспецифичных методов изотопных индикаторов, таких как тесты маркировки 15 N-глицина и 51 Cr, эта продолжительность жизни стала широко принятой как нормальная средняя продолжительность жизни эритроцитов человека. Тем не менее, первые эксперименты по выживанию эритроцитов, проведенные с помощью метода Эшби, по-прежнему считаются важной вехой в исследованиях физиологии эритроцитов [34]. Действительно, как показано в таблице 2, нормальная средняя продолжительность жизни эритроцитов человека, полученная с помощью модифицированного дыхательного теста Левитта, составляла 122 дня в исходном исследовании [21] и 126 дней в настоящем исследовании. Значения, полученные с помощью дыхательных тестов, согласуются с предыдущими результатами, полученными с помощью метода дифференциальной агглютинации Эшби, и результатами тестов, полученными с помощью сложных стандартных методов маркировки.
Значения, полученные с помощью дыхательных тестов, согласуются с предыдущими результатами, полученными с помощью метода дифференциальной агглютинации Эшби, и результатами тестов, полученными с помощью сложных стандартных методов маркировки.
Нормальный диапазон продолжительности жизни эритроцитов человека, полученный в настоящем исследовании (75–177 дней), сопоставим с диапазонами, полученными на основе стандартных методов маркировки (70–140 дней) [10–12]. Однако, как показано в таблице 2, фактический зарегистрированный диапазон продолжительности жизни эритроцитов у здоровых субъектов с помощью дыхательного теста Левитта (73–215 дней) больше, чем тот, который основан на стандартных методах маркировки (67–151 день).К этому явлению можно применить три объяснения. Во-первых, это может быть связано с принципами, лежащими в основе различных методов измерения. CO, измеренный в дыхательных тестах, происходит из-за неэффективного эритропоэза в костном мозге и разрушения периферических циркулирующих эритроцитов, так что продолжительность жизни эритроцитов является средним значением этих двух компонентов разрушения эритроцитов [16, 35, 36]. В исследованиях маркировки 15 N-глицина или 14 C-глицина эритроциты маркируются во время их производства в костном мозге и могут дифференцироваться в короткоживущие и долгоживущие клеточные популяции.Присутствие очень короткоживущих клеток или неэффективный эритропоэз в костном мозге покажет отчетливое раннее снижение концентрации метки крови до фазы плато, и эти очень короткоживущие клетки не включаются в расчет продолжительности жизни эритроцитов с помощью этих методов [ 6, 37]. Между тем, исследования популяционной маркировки, такие как 51 Cr или биотин, отражают эритроциты всех возрастов в периферическом кровообращении без влияния эритропоэза в костном мозге. Во-вторых, разница в диапазоне может быть связана с размером выборки.Использование гораздо более крупных выборок населения в исследованиях дыхательных тестов, чем в исследованиях стандартных методов маркировки, могло выявить больший диапазон межиндивидуальных вариаций. Трудно проводить исследования на больших выборках здоровых добровольцев со стандартными методами маркировки, потому что этот процесс является громоздким и трудоемким, требующим недель или даже месяцев (таблица 2). Фактически, самый большой размер выборки здоровых добровольцев в описанных исследованиях маркировки составлял всего 22. В большинстве других было не более 10 участников.Рекомендуемый нормальный диапазон 70–140 дней был получен в результате исследования маркировки биотина с участием только 8 здоровых взрослых [10–12]. В-третьих, во время сбора, хранения и измерения проб дыхания могут возникнуть ошибки и отклонения. В настоящем исследовании не было точек данных о продолжительности жизни эритроцитов менее 75 дней, но четыре точки данных (3,8%) превышали 177 дней (т.е. 184 дня, 187 дней, 189 дней и 216 дней). Согласно формуле Левитта, чем ниже измеряемая концентрация CO, тем дольше будет продолжительность жизни эритроцитов.В результате данные о чрезвычайно долгом сроке службы эритроцитов могут быть артефактами утечки газа пробы. Для решения этого вопроса необходимы дальнейшие исследования.
Трудно проводить исследования на больших выборках здоровых добровольцев со стандартными методами маркировки, потому что этот процесс является громоздким и трудоемким, требующим недель или даже месяцев (таблица 2). Фактически, самый большой размер выборки здоровых добровольцев в описанных исследованиях маркировки составлял всего 22. В большинстве других было не более 10 участников.Рекомендуемый нормальный диапазон 70–140 дней был получен в результате исследования маркировки биотина с участием только 8 здоровых взрослых [10–12]. В-третьих, во время сбора, хранения и измерения проб дыхания могут возникнуть ошибки и отклонения. В настоящем исследовании не было точек данных о продолжительности жизни эритроцитов менее 75 дней, но четыре точки данных (3,8%) превышали 177 дней (т.е. 184 дня, 187 дней, 189 дней и 216 дней). Согласно формуле Левитта, чем ниже измеряемая концентрация CO, тем дольше будет продолжительность жизни эритроцитов.В результате данные о чрезвычайно долгом сроке службы эритроцитов могут быть артефактами утечки газа пробы. Для решения этого вопроса необходимы дальнейшие исследования.
Наблюдались гендерные и возрастные различия в количестве периферических эритроцитов и концентрации гемоглобина, причем более высокие значения наблюдались у мужчин и у младенцев. Однако связанные с полом и возрастом физиологические вариации показателей эритроцитов, включая средний корпускулярный объем, средний корпускулярный гемоглобин и среднюю концентрацию корпускулярного гемоглобина, не были зарегистрированы [38].Однако эти факторы не были проанализированы при измерении продолжительности жизни эритроцитов, возможно, из-за ограниченного размера когорт исследования. Мы не наблюдали доказательств связи продолжительности жизни эритроцитов с полом или возрастом в нашем исследовании. Исследования, в которых использовались стандартные методы, показали более короткую продолжительность жизни эритроцитов у младенцев (включая новорожденных), чем у взрослых, даже при аллогенных трансфузиях от взрослого ребенку [39–42]. Это явление может отражать большую потребность в обновлении эритроцитов у младенцев из-за их относительно высокой скорости метаболизма.Однако необходимы дальнейшие исследования, чтобы выяснить, как продолжительность жизни эритроцитов развивается в процессе развития. Минимальный возраст участников нашего исследования составлял 7 лет; младенцы и дети ясельного возраста не были включены из-за проблем с выборкой.
Это явление может отражать большую потребность в обновлении эритроцитов у младенцев из-за их относительно высокой скорости метаболизма.Однако необходимы дальнейшие исследования, чтобы выяснить, как продолжительность жизни эритроцитов развивается в процессе развития. Минимальный возраст участников нашего исследования составлял 7 лет; младенцы и дети ясельного возраста не были включены из-за проблем с выборкой.
Сокращение продолжительности жизни эритроцитов — фундаментальная характеристика гемолитической анемии. Как показано на рисунке 1, между нашими здоровыми и анемичными группами не было перекрытия и очень значительного разделения. Это наблюдение согласуется с выводами предыдущих отчетов [16, 20, 21].Используя 75-дневное значение отсечения, указанное в нашем анализе кривой ROC, мы смогли получить 100% диагностическую точность для гемолитической анемии. Такие отличные результаты подтверждают, что продолжительность жизни эритроцитов действительно является золотым стандартом для диагностики гемолиза. Кроме того, они убедительно свидетельствуют о том, что простые, быстрые и надежные дыхательные тесты Левитта на CO достаточно удобны для регулярной клинической практики.
Помимо теоретического принципа, ключевым фактором в определении точности дыхательного теста Левитта на СО для оценки продолжительности жизни эритроцитов является точное измерение эндогенного альвеолярного СО при очень низкой концентрации.Хотя инфракрасная спектроскопия для измерения CO очень чувствительна, она уязвима для помех от H 2 O и CO 2 [43]. В дополнение к исключению H 2 O и CO 2 из образца, мы приняли следующие инновационные меры для нашего прибора для повышения точности измерения: (1) автоматическая промывка измерительной камеры очищающим газом для устранения загрязнения перед каждым вводится образец; (2) парное измерение воздухоальвеолярных проб газа для устранения ошибок подсчета, вызванных дрейфом уровня постоянного тока и фоновым шумом; (3) мониторинг и корректировка разбавления альвеолярного газа во время сбора образца на основе измерений концентрации CO 2 для альвеолярного образца. Кроме того, встроенная система автоматизации упрощает работу с прибором для непрофессионалов. Вместе с предыдущими исследованиями на животных [32, 33], настоящие результаты демонстрируют, что новый разработанный инструмент, протестированный здесь, достиг своих целей.
Кроме того, встроенная система автоматизации упрощает работу с прибором для непрофессионалов. Вместе с предыдущими исследованиями на животных [32, 33], настоящие результаты демонстрируют, что новый разработанный инструмент, протестированный здесь, достиг своих целей.
Основным ограничением этого исследования было отсутствие стандартных методов (например, 15 N-глицин, 51 Cr или мечение биотина) для сравнений внутри субъектов. Однако средняя нормальная продолжительность жизни эритроцитов, полученная с помощью нашего дыхательного теста у здоровых субъектов, согласуется с данными, полученными с помощью стандартных методов, и было показано, что пациенты с хронической гемолитической анемией имеют значительно более короткую продолжительность жизни эритроцитов без какого-либо перекрытия с нормальным диапазоном субъектов.Следовательно, эти результаты убедительно свидетельствуют о том, что нынешняя методология определения дыхания на CO является точной и что наш прибор надежен. Еще одним ограничением этого исследования является то, что в исследование не включались очень маленькие дети из-за трудностей с взятием проб дыхания. Наконец, для точного определения концентрации гемоглобина в крови, одного из параметров расчета продолжительности жизни эритроцитов, требуется отдельный инвазивный анализ крови. В будущем было бы идеально разработать прибор нового поколения, который сможет неинвазивно определять как альвеолярный углекислый газ, так и гемоглобин крови.
Продолжительность жизни эритроцитов человека, измеренная с помощью дыхательного теста Левитта на CO с помощью нашего недавно разработанного автоматического прибора, согласуется с заявленными значениями, полученными с помощью более сложных и трудоемких методов. Тест обеспечил четкое и надежное различие между нормальной продолжительностью жизни эритроцитов у здоровых субъектов и сокращенной продолжительностью жизни эритроцитов у пациентов с гемолитической анемией. Хотя продолжительность жизни эритроцитов имеет известное диагностическое значение при гемолитической анемии, измерение продолжительности жизни эритроцитов редко используется в рутинной клинической практике из-за громоздкости и трудоемкости классических методов.Простая, быстрая и точная методика дыхательного теста на CO, основанная на принципе анализа CO Левитта, например, рассмотренная в этом исследовании, позволяет легко проводить измерения эритроцитов в клинических условиях.
Авторы благодарят Хун Ли, Суй-Сун Чжу, Цзэ-Линь Лю и Цзя-Лян Хуан за их вклад в эти исследования.
Hou-De Zhang, Qi-Fa Liu, Yong-Jian Ma и Tie-Zhen Ye разработали дизайн исследования, проанализировали данные, написали рукопись и внесли равный вклад в эту работу.Фань-И Мэн, И-Вэнь Чжоу, Го-Пан Ю, Цзян-Пин Ян, Хуа Цзян, Цюань-Ши Ван, Гуй-Пин Ли, Юн-Цян Цзи, Го-Лян Чжу и Ли-Тао Ду. исследовать. Кун-Мей Цзи проанализировал данные и отредактировал рукопись.
Юн-Цзянь Ма, Хоу-Де Чжан, Го-Лян Чжу, Ли-Тао Ду и Юн-Цян Цзи внесли свой вклад в разработку нового инструмента. У других авторов нет конкурирующих интересов.
Исследование спонсировалось Инновационным фондом для технологических фирм Министерства науки и технологий КНР (NO.13C1217, Код. 10c26214424838).
Плазма, тромбоциты и цельная кровь
Плазма — жидкая часть крови; наши красные и белые кровяные тельца и тромбоциты находятся во взвешенном состоянии в плазме, когда они перемещаются по нашему телу.
- Цвет: Желтоватый
- Срок годности: 1 год
- Условия хранения: Замороженный
- Основные области применения: Пациенты с ожогами, шок, нарушения свертываемости крови
Плазма крови выполняет несколько важных функций в нашем организме, несмотря на то, что примерно на 92% состоит из воды.(Плазма также содержит 7% жизненно важных белков, таких как альбумин, гамма-глобулин и антигемофильный фактор, и 1% минеральных солей, сахаров, жиров, гормонов и витаминов.) Она помогает нам поддерживать удовлетворительное кровяное давление и объем и обеспечивает жизненно важные белки. для свертывания крови и иммунитета. Он также переносит электролиты, такие как натрий и калий, в наши мышцы и помогает поддерживать правильный pH (кислотно-щелочной баланс) в организме, который имеет решающее значение для функционирования клеток.
Плазма получается путем отделения жидкой части крови от клеток.Плазма замораживается в течение 24 часов после сдачи, чтобы сохранить ценные факторы свертывания крови. Затем его хранят до одного года и при необходимости размораживают.
Плазма обычно переливается пациентам с травмами, ожогами и шоком, а также людям с тяжелым заболеванием печени или с недостаточностью нескольких факторов свертывания крови.
Производные плазмы
В некоторых случаях пациентам вместо этого требуются производные плазмы. Это концентраты определенных белков плазмы, полученные с помощью процесса, известного как фракционирование.Производные обрабатывают теплом и / или моющим средством на основе растворителя для уничтожения определенных вирусов, например вирусов, вызывающих ВИЧ, гепатит В и С.
Производные плазмы включают:
- Концентрат фактора VIII
- Концентрат фактора IX
- Антиингибиторский комплекс коагуляции (AICC)
- Альбумин
- Иммунные глобулины, включая резус-иммунный глобулин
- Концентрат антитромбина III
- Концентрат ингибитора альфа-1-протеиназы
Пожертвование AB Plasma
При сборе плазмы Красный Крест ищет доноров типа AB.Плазма AB собирается только в некоторых центрах пожертвований Красного Креста.
Подробнее о пожертвовании плазмы AB »
Эритрограмма | eClinpath
Эритрограмма или эритрон включает все тесты, оценивающие эритроциты, включая следующие:
- Оценка количества эритроцитов : гематокрит (HCT) или объем упакованных клеток (PCV), концентрация гемоглобина, количество эритроцитов. Подсчет клеток (гематокрит или объем упакованных клеток, количество эритроцитов и гемоглобин) обычно интерпретируется аналогичным образом, хотя в медицине человека измерение гемоглобина является предпочтительным измерением массы красных кровяных телец.
- Индексы эритроцитов : средний клеточный / корпускулярный объем (MCV), средний клеточный гемоглобин (MCH), средняя концентрация клеточного гемоглобина (MCHC), ширина распределения эритроцитов (RDW). Они интерпретируются вместе с изменениями количества эритроцитов. Если пациент страдает анемией, эти показатели могут быть полезными ориентирами для определения причины анемии.
- Регенерация : количество ретикулоцитов (процентное и абсолютное). Они обычно выполняются только у собак и кошек. Регенерация оценивается у других видов путем полуколичественного определения связанных изменений эритроцитов во время исследования мазка крови (количество макроцитов у лошадей, верблюдов и жвачных животных), степени полихромазии (верблюды, жвачные животные).
- Морфологические особенности эритроцитов : Они могут дать ключ к разгадке патогенеза основного заболевания или могут идентифицировать причину анемии, включая паразитов.
HCT / PCV
Хотя эти термины используются как синонимы, на самом деле они представляют собой разные способы измерения доли крови, состоящей из эритроцитов. Оба показателя выражаются в процентах от крови (единицы СИ — л / л).
Гематокрит (HCT)
Гематокрит — это фактически рассчитанное значение, полученное с помощью современных автоматических гематологических анализаторов.Это произведение среднего объема клеток (MCV) и количества эритроцитов (RBC), которые измеряются непосредственно анализатором (см. Ниже). Следовательно, если есть какие-либо неточности в измерении количества MCV или RBC, HCT будет отражать эти неточности.
HCT (%) = (MCV x RBC) ÷ 10
Объем упакованных ячеек (PCV)
PCV — это значение, непосредственно измеренное при центрифугировании крови в пробирке для микрогематокрита в центрифуге для микрогематокрита.PCV измеряется как высота столба эритроцитов в пробирке для микрогематокрита после центрифугирования. Это самый быстрый и доступный способ измерения эритроцитарного компонента крови. В отличие от HCT, на это измерение влияет улавливание плазмы и способ упаковки эритроцитов в колонке. Упаковка красных кровяных телец зависит от вида — для упаковки эритроцитов у жвачных животных требуется больше времени, чем у собак, кошек и лошадей. Таким образом, микрогематокритные пробирки вращаются в течение 10 минут у жвачных животных по сравнению с 3 минутами у других видов.
- Исследование «критической пробирки» также может предоставить субъективную информацию о цвете и прозрачности плазмы (желтуха, гемолиз, липемия) и размере «лейкоцитарной пленки» (которая содержит лейкоциты и тромбоциты).
- Кроме того, при желании можно надрезать и разбить пробирку, чтобы удалить плазму для рефрактометрической оценки белка или выдавить лейкоцитную пленку для получения мазка. «Мазок лейкоцитарной пленки» имеет то преимущество, что дает концентрированный препарат ядерных клеток, который может быть полезен при поиске потенциально значимых типов клеток с низкой заболеваемостью (например,г., тучные клетки).
Гемоглобин
Концентрация гемоглобина (Hgb) выражается в граммах гемоглобина на децилитр крови (г / дл) и измеряется после лизирования красных кровяных телец in vitro . Поскольку эритроциты на 33% состоят из гемоглобина, концентрация гемоглобина в цельной крови обычно составляет около одной трети HCT (т.е. средняя концентрация корпускулярного гемоглобина или MCHC составляет 33%). Это зависит от вида, потому что у верблюдов больше гемоглобина в эритроцитах (MCHC 45%).
Количество эритроцитов
Подсчет эритроцитов в рутинном клиническом анализе крови — это концентрация эритроцитов, выраженная в миллионах / мкл цельной крови. Хотя подсчет эритроцитов может быть выполнен вручную, это отнимает много времени и является неточным. Автоматический подсчет чаще всего выполняется с использованием «импедансных» или электронных счетчиков, которые мы используем для подсчета клеток в жидкостях организма. Количество эритроцитов также можно подсчитать с помощью рассеяния лазерного света (проточная цитометрия). Это метод, используемый гематологическим анализатором Корнельского университета.
MCV
Средний объем клеток (MCV) указывает объем «среднего» эритроцита в образце. Он выражается в фемтолитрах (фл; 10 -15 литров). Традиционно MCV рассчитывался на основе гематокрита или PCV и количества эритроцитов, рассчитываемого по следующей формуле:
MCV (fL) = (HCT / PCV ÷ RBC) x 10
Современные автоматические гематологические анализаторы обеспечивают более точное измерение MCV, , на основе фактического объема клетки при ее прохождении через лазер (новые лазерные гематологические анализаторы) или электронный луч (методы «импеданса» ).Количество лазерного света, рассеянного в прямом направлении, или амплитуда импульсов, создаваемых в электронном поле, когда клетки проходят через детектор, эквивалентны объему клетки, который усредняется на основе количества клеток, проанализированных прибором. При использовании методов, основанных на импендансе, инструменты также «направляют» рассеяние или импульсы, разделяя их на каналы, представляющие относительные диапазоны размера ячейки . С помощью лазерных методов с анализаторами серии ADVIA ® запатентованный алгоритм, основанный на свойствах светорассеяния Ми, может разделять эритроциты на различные категории на основе MCV (макроцитарный, нормоцитарный, микроцитарный) и концентрации гемоглобина (гипохромный, нормохромный, гиперхромный) , хотя это было оптимизировано для эритроцитов человека, а не для различных эритроцитов, которые мы видим у разных видов животных.
МСН
MCH или средний клеточный гемоглобин представляет собой абсолютное количество гемоглобина в средних эритроцитах в образце. Единицы измерения — пикограммы (пг) на ячейку. MCH рассчитывается на основе концентрации гемоглобина (Hgb) и количества эритроцитов с использованием следующего уравнения:
MCH (пг) = (Hgb x 10) ÷ RBC
Это значение обычно соответствует среднему объему клеток, поскольку оно зависит от объема эритроцитов и, как правило, является менее полезным показателем, чем MCV или MCHC, которые мы используем для характеристики анемии (например,грамм. микроцитарная гипохромная). Например, низкий уровень MCH может быть связан с меньшим размером, чем нормальные клетки с нормальной концентрацией Hb или клетками нормального размера с более низкой, чем нормальная концентрация Hb. Лучше знать значения объема клеток (MCV) и концентрации Hb (Hgb) напрямую. Гематологические анализаторы на основе лазера также предоставляют результаты для содержания гемоглобина в интактных эритроцитах, то есть оно измеряется непосредственно по рассеянию света лазера под большим углом по сравнению с расчетным значением. Это называется корпускулярным гемоглобином или CH и обычно эквивалентно MCH, если что-то не мешает измерению гемоглобина анализатором, например.грамм. липемия. Липемия ложно увеличивает концентрацию гемоглобина, что приводит к ложному увеличению MCH и MCHC (см. Ниже). Оптически измеренные значения CH и CHCM более точны при этой настройке. Если значения MCH и MCHC неточные, например, при липемии, вместо MCH и MCHC будут сообщаться значения CH и CHCM, в противном случае эти оптически измеренные значения не отображаются на стандартной гемограмме. Для получения дополнительной информации об этом методе измерения обратитесь к странице гемоглобина или MCHC.
MCHC
MCHC — средняя концентрация клеточного гемоглобина, выраженная в г / дл.Его можно рассчитать по концентрации гемоглобина (Hgb) и HCT или PCV по следующей формуле:
MCHC (г / дл) = (Hgb ÷ PCV / HCT) x 100
Нормальное значение MCHC составляет около 33%. Популяции эритроцитов со значениями ниже референсного интервала можно назвать «гипохромными». Это может произойти при сильно регенеративной анемии, когда увеличенная популяция ретикулоцитов с низким содержанием Hb «снижает» среднее значение (при этом сценарии можно ожидать увеличения MCV).Низкий MCHC может также возникать при железодефицитной анемии, когда микроцитарные гипохромные эритроциты образуются в результате нехватки железа для поддержки синтеза гемоглобина. Значения MCHC на значительно выше референсного интервала физиологически невозможны из-за ограничений растворимости Hb. Однако проблемы анализа, связанные с пробами, могут привести к ложно завышенным значениям. Липемия или другие причины помутнения лизата могут вызывать ложно высокие концентрации гемоглобина, что увеличивает кажущийся MCHC.При этих настройках вместо этого мы сообщаем среднюю концентрацию корпускулярного гемоглобина (CHCM), измеренную оптически с помощью нашей машины. Однако красные кровяные тельца животных семейства Camillidae (верблюды, ламы, альпаки) действительно имеют более высокий MCHC (около 40-45 жидких жидкостей) по сравнению с таковыми у обычных домашних животных. Это возможно из-за более высокой растворимости молекулы Hb в этих разновидностях.
RDW
Ширина распределения эритроцитов (RDW) — это показатель вариации объема эритроцитов в популяции эритроцитов.Это параметр, предоставляемый автоматическими гематологическими анализаторами, и электронный эквивалент анизоцитоза или изменения размера эритроцитов, который оценивается по мазку (хотя последний показывает диаметр уплощенных клеток в сравнении с объемом клеток в растворе, обнаруженным гематологическим анализатором. ). Математически это коэффициент вариации объема эритроцитов, т.е.
RDW (%) = (Стандартное отклонение ÷ среднее) объем ячейки x 100
Высокий RDW указывает на то, что эритроциты более изменчивы по объему, чем обычно.Это может быть связано с наличием эритроцитов меньшего или большего размера или комбинацией любого из этих сценариев. Например, повышенное количество незрелых эритроцитов во время регенеративного ответа на анемию увеличит RDW, потому что незрелые безъядерные эритроциты больше нормальных. И наоборот, наличие повышенного количества более мелких клеток (например, при железодефицитной анемии) также увеличивает RDW. Причину высокого RDW можно выявить при исследовании мазка крови на наличие малых или больших эритроцитов.Обратите внимание, что небольшое количество эритроцитов меньшего или большего размера может увеличивать RDW до того, как на гемограмме можно будет увидеть увеличение или уменьшение среднего объема клеток (MCV). RDW в пределах референсных интервалов дает мало информации об изменении размера эритроцитов. RDW ниже референтного интервала не является клинически значимым результатом.
Ретикулоцитов
Ретикулоциты — это молодые безъядерные эритроциты, которые содержат больше РНК, чем зрелые эритроциты (они содержат очень мало РНК).Важно идентифицировать эти незрелые эритроциты, поскольку их присутствие в крови в достаточном количестве указывает на то, что костный мозг реагирует на анемию, и указывает на то, что анемия возникает не из-за дефекта продуцирования костного мозга, а из-за потери (кровоизлияния) или разрушения эритроцитов. (гемолиз). Эти незрелые эритроциты можно количественно определить путем определения их РНК, которая может быть осаждена суправитальными красителями (например, новым метиленовым синим) или окрашена красителями ДНК / РНК, например тиазоловый апельсин. Ретикулоциты количественно определяют как процент от общего количества эритроцитов (процент ретикулоцитов) или как абсолютное количество ретикулоцитов (произведение процента и количества эритроцитов).Если они содержат много РНК, синий цвет РНК может компенсировать красный цвет гемоглобина в этих клетках, придавая им пурпурный оттенок при окрашивании обычными гематологическими красителями (например, красителем Райта или Diff-quik). Затем их называют полихроматофилами, и степень полихромазии может использоваться как быстрая оценка реакции костного мозга на анемию у большинства видов. Количественное определение ретикулоцитов (%, абсолютное) проводится только у собак и кошек. Более подробную информацию о ретикулоцитах можно найти в разделе «Оценка регенерации».
nRBC
Ядерные эритроциты также являются незрелыми эритроцитами, которые можно увидеть в крови в различных ситуациях, включая повреждение костного мозга, регенеративную реакцию или у некоторых здоровых животных. ЯРБК считаются (независимо от метода, т.е. вручную или автоматически) как лейкоциты, потому что мы считаем ядра, а не клетки. По этой причине полученное количество лейкоцитов (с помощью анализатора или гемоцитометра) на самом деле представляет собой количество ядер, которое включает лейкоциты и nRBC. Полученное количество ядер необходимо скорректировать с учетом количества nRBC в кровотоке.Чтобы скорректировать «количество лейкоцитов» или количество ядер, количество nRBC на 100 лейкоцитов регистрируется во время дифференциального подсчета лейкоцитов при выполнении исследования мазка крови. Затем производится корректировка:
Скорректированные лейкоциты (тыс. / Мкл) = полученное количество ядерных клеток x (100 ÷ [nRBC + 100])
Морфология эритроцитов
Эритроциты оцениваются на морфологические изменения и наличие эритропаразитов, которые оцениваются частично. Эти изменения могут дать ключ к пониманию основных заболеваний или сами по себе являются диагностическими и перечислены ниже.Необходимы навыки и опыт, чтобы правильно определить значительный пойкилоцитоз и отличить его от артефактических изменений, вызванных неправильным обращением с образцом и / или техникой получения мазка.
- Форма (пойкилоциты): Акантоциты, эхиноциты, эксцентроциты, кератоциты, шистоциты, сфероциты, овалоциты, клетки-мишени, стоматоциты. Полуколичественно оценивается как мало, умеренно или много. Некоторые из этих изменений более важны, чем другие, например, акантоциты и шистоциты указывают на фрагментационное повреждение, тогда как кератоциты и эксцентроциты указывают на повреждение окислителем (наряду с тельцами Хайнца).Большое количество сфероцитов обычно наблюдается при иммуноопосредованной гемолитической анемии. Напротив, эхиноциты часто являются артефактами.
- Размер : Макроциты, микроциты. Полуколичественно оценивается как мало, умеренно или много. Анизоцитоз (изменение размера) полуколичественно определяется как легкий, умеренный или выраженный.
- Цвет : гипохромазия (слишком мало гемоглобина), полихромазия (незрелые клетки, содержащие РНК или ретикулоциты). Полуколичественно оценивается как легкое, умеренное или выраженное. Призрачные клетки также могут быть определены частично (немного, умеренно, много).
- Включения : сидероциты (железо), базофильная штриховка (РНК), тельца Хауэлла-Джолли (оставшиеся ядра), тельца Хайнца (окисленный гемоглобин). Полуколичественно оценивается как мало, умеренно или много.
- Образцы : Агглютинация (отмеченная как присутствующая или отсутствующая), образование круговых движений. Образование руло частично определяется как слабое, умеренное или заметное.
- Инфекционные агенты : например, Бабезия, Анаплазма. Полу-количественно определяется как немного, умеренное или много.
Лаборатория крови
Введение
Кровь обеспечивает механизм, с помощью которого питательные вещества, газы и отходы могут переноситься по всему телу. Он состоит из ряда клеток, взвешенных в жидкой среде, известной как плазма. Клетки крови состоят из эритроцитов, тромбоцитов и лейкоцитов или лейкоцитов. Эритроциты отвечают за транспортировку газов,
Клетки крови важны, потому что они представляют собой легко доступную популяцию, морфология, биохимия и экология которой могут указывать на общее состояние пациента или ключи к диагностике заболевания.По этой причине в клинической медицине обычно используются общий анализ крови (ОАК) и дифференциальный подсчет лейкоцитов. Очень важно уметь распознавать нормальные клетки крови и отличать патологические клетки от нормальных вариантов.
Идентификация клеток крови основана в первую очередь на наблюдениях за наличием или отсутствием ядра и цитоплазматических гранул. Другими полезными характеристиками являются размер клеток, размер и форма ядер, внешний вид хроматина и окраска цитоплазмы.Таблица в конце этого раздела объясняет, на что обращать внимание, чтобы определить составные клетки мазка крови.
Эритроциты
Эритроциты, или красные кровяные тельца, безусловно, являются преобладающим типом клеток в мазке крови. Они выглядят как двояковогнутые диски одинаковой формы и размера (7,2 мкм), в которых отсутствуют органеллы и гранулы. Красные кровяные тельца имеют характерный розовый цвет из-за высокого содержания гемоглобина. Центральная бледная область каждого эритроцита связана с вогнутостью диска.На этом слайде также видно несколько тромбоцитов, которые играют решающую роль в каскаде свертывания крови.
Нейтрофилы
Нейтрофилы — безусловно, самые многочисленные лейкоциты. Они характеризуются ядром, которое разделено на три-пять долей, которые соединены тонкими тяжами. Цитоплазма нейтрофилов окрашивается в бледно-розовый цвет. Его первичные (более крупные) гранулы содержат кислые гидролазы и катионные белки, а его вторичные (более мелкие) гранулы содержат различные антимикробные вещества, используемые для уничтожения бактерий, которые они фагоцитируют во время острого воспалительного ответа.
Эозинофилы
Эозинофилы крупнее нейтрофилов и отличаются двулопастным ядром и большими красными или оранжевыми гранулами одинакового размера. Эти гранулы содержат основной основной белок, который высвобождается для уничтожения организмов, слишком больших для фагоцитоза, таких как паразиты и гельминты (черви). Эозинофилы составляют от 1 до 3% от общего количества лейкоцитов в крови человека.
Базофилы
Базофилы занимают промежуточное положение по размеру между нейтрофилами и эозинофилами и имеют простые или двулопастные ядра.Они содержат множество крупных гранул фиолетового цвета, которые могут различаться по размеру и форме. Эти гранулы содержат гистамин, который высвобождается, чтобы вызвать вазоактивный ответ при реакциях гиперчувствительности, и гепарин, который является антикоагулянтом. Базофилы не фагоцитируют.
Лимфоциты
Лимфоциты могут быть маленькими или большими. Маленький лимфоцит примерно такого же размера, как эритроцит, и содержит темное ядро с тонким ободком окружающей цитоплазмы. Лимфоциты не содержат видимых гранул.

 Предназначены для определения групп крови АВО перекрестным методом на основе комбинации методов агглютинации и гель-фильтрации в технологии ID-System. Стандартные эритроциты ID-DiaCell ABO (2х10мл) ДиаСелл А1, ДиаСелл В — каждый из реагентов включает в себя один флакон с готовой к использованию 0.8% суспензией эритроцитов: ДиаСелл А1 приготовлен из эритроцитов А1 Rh положительного донора, ДиаСелл В приготовлен из эритроцитов В Rh положительного донора. Количество данного реагента рассчитано на 200 исследований. Регистрация изделия медицинского назначения в соответствии с требованиями в РФ. Инструкции по применению реагентов на русском языке. В 1 наборе 2 флакона со стандартными эритроцитами А, со стандартными эритроцитами В по 10 мл.
ID ДиаСелл ABO A1, В (ID-DiaCell AB0 A1, B)
Предназначены для определения групп крови АВО перекрестным методом на основе комбинации методов агглютинации и гель-фильтрации в технологии ID-System. Стандартные эритроциты ID-DiaCell ABO (2х10мл) ДиаСелл А1, ДиаСелл В — каждый из реагентов включает в себя один флакон с готовой к использованию 0.8% суспензией эритроцитов: ДиаСелл А1 приготовлен из эритроцитов А1 Rh положительного донора, ДиаСелл В приготовлен из эритроцитов В Rh положительного донора. Количество данного реагента рассчитано на 200 исследований. Регистрация изделия медицинского назначения в соответствии с требованиями в РФ. Инструкции по применению реагентов на русском языке. В 1 наборе 2 флакона со стандартными эритроцитами А, со стандартными эритроцитами В по 10 мл.
ID ДиаСелл ABO A1, В (ID-DiaCell AB0 A1, B) Предназначены для скрининга антиэритроцитарных aнтител на основе методов агглютинации и гель фильтрации в технологии ID-System. Каждый из флаконов № I, II, III содержит готовую к использованию 0.8% суспензию эритроцитов. Для приготовления суспензий были отобраны эритроциты доноров группы крови 0(I), типированные по антигенам эритроцитов: Rh2(D), Rh3©, Rh4(E), Rh5©, RH5(e), RH8(Cw), KEL1(K), KEL2(k), KEL4(Kpb), FY1(Fya), FY2(Fyb), JK1(Jka), JK2(Jkb), LE1(Lea), LE2(Leb), MNS1(M), MNS2(N), MNS3(S), MNS4(s), P1(P), LU1(Lua), LU2(Lub). Количество данного реагента рассчитано на 200 исследований. Регистрация изделия медицинского назначения в соответствии с требованиями в РФ. Инструкции по применению реагентов на русском языке. В 1 наборе 3 флакона по 10 мл.
ID ДиаСелл I-II-III (ID-DiaCell I-II-III)
Предназначены для скрининга антиэритроцитарных aнтител на основе методов агглютинации и гель фильтрации в технологии ID-System. Каждый из флаконов № I, II, III содержит готовую к использованию 0.8% суспензию эритроцитов. Для приготовления суспензий были отобраны эритроциты доноров группы крови 0(I), типированные по антигенам эритроцитов: Rh2(D), Rh3©, Rh4(E), Rh5©, RH5(e), RH8(Cw), KEL1(K), KEL2(k), KEL4(Kpb), FY1(Fya), FY2(Fyb), JK1(Jka), JK2(Jkb), LE1(Lea), LE2(Leb), MNS1(M), MNS2(N), MNS3(S), MNS4(s), P1(P), LU1(Lua), LU2(Lub). Количество данного реагента рассчитано на 200 исследований. Регистрация изделия медицинского назначения в соответствии с требованиями в РФ. Инструкции по применению реагентов на русском языке. В 1 наборе 3 флакона по 10 мл.
ID ДиаСелл I-II-III (ID-DiaCell I-II-III)

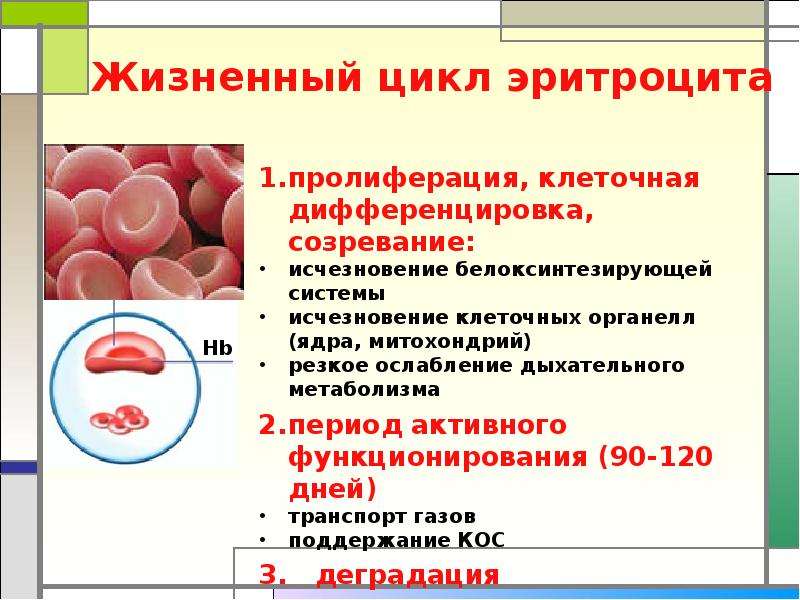
 ) Или определения прогноза
) Или определения прогноза .
.