Новые клинические рекомендации по диагностике, классификации и лечению хронической болезни почек KDIGO 2013 года « Omnibus rebus
Официально опубликованы давно ожидаемые рекомендации по диагностике и лечению хронической болезни почек международного консорциума KDIGO, которые содержат новую классификацию ХБП на основании сочетанного определения степени снижения скорости клубочковой фильтрации и выраженности альбуминурии/протеинурии, уточняют критерии направления больного к нефрологу, а также определяют ряд мероприятий по профилактике и нефропротективному лечению.
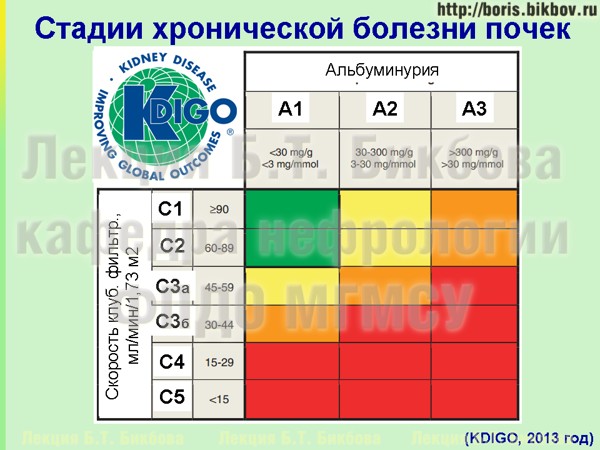
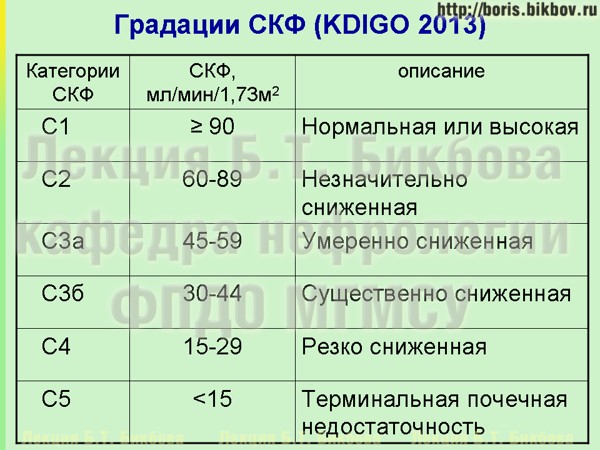
Градации степени снижения скорости клубочковой фильтрации по классификации KDIGO
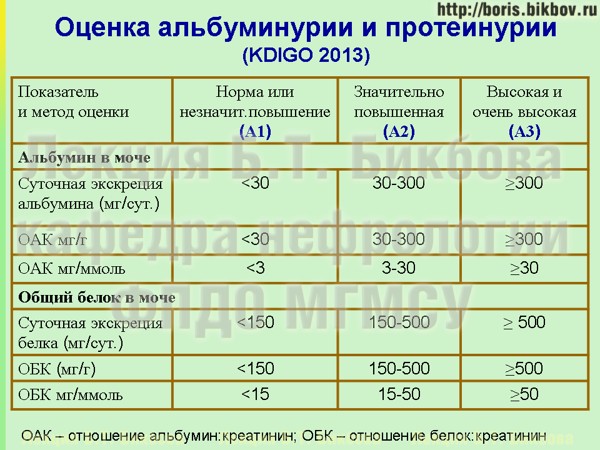
Градации выраженности альбуминурии и протеинурии по классификации KDIGO
Формулировка диагноза хронической болезни почек по классификации KDIGO

В настоящее время доступна только англоязычная версия клинических рекомендаций, дополнительных материалов и таблиц. При цитировании рекомендаций следует использовать ссылку «Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney international, Suppl.2013; 3: 1–150».
Часть клинических рекомендаций KDIGO по применению рентгеноконтрастных препаратов и ряда лекарственных средств освещена в статье по препаратам с потенциально нефротоксическим действием.
Важные аспекты комплексного лечения пациентов с ХБП изложены лекциях по принципам назначения лекарств и научно-обоснованным подходам к немедикаментозному лечению хронической болезни почек.
В 2013 году также официально утверждены Российские национальные рекомендации по профилактике, скринингу, диагностике и лечению хронической болезни почек.
Янв 20th, 2013
Метки: KDIGO, бесплатный полнотекстовый доступ, клинические руководства, нефрология, хроническая болезнь почек
Разделы: Нефрология
Острое повреждение почек
«Чудес не бывает, но должны же они когда-нибудь случаться!» Станислав Лец
ОПРЕДЕЛЕНИЕ
Острое повреждение почек (ОПП) — быстрое снижение функции почек, приводящее к невозможности поддерживать водный, электролитный и кислотно-щелочной гомеостаз (UK Renal Association).Эпидемиология острого повреждения почек
Kolhe N, et al. Int J Clin Pract. 2016;70:330–9.
ФАКТОРЫ РИСКА ОСТРОГО ПОВРЕЖДЕНИЯ ПОЧЕК
• Сердечная недостаточность.• Сепсис.
• Гиповолемия.
• Нефротоксичные лекарства (20%): НПВП, аминогликозиды, ванкомицин, амфотерицин В, контрасты, циклоспорин, ИАПФ, БРА.
• Хроническая болезнь почек (рСКФ <60 мл/мин/1.73 м²).
• Болезнь периферических артерий.
• Болезнь печени.
• Диабет.
• Возраст >75 лет.
Причины острого повреждения почек
Вне палаты интенсивной терапии. Clin Pract Nephr. 2006;2:364–77.
ЭТИОЛОГИЯ
• Преренальное: гиповолемия, снижение сердечного выброса, почечная вазоконстрикция/вазодилатация (ИАПФ, БРА, НПВП), окклюзия почечной артерии.• Ренальное: острый канальцевый некроз, острые тубулоинтерстициальные болезни, внутриканальцевая обструкция, болезни клубочков и микрососудов.
• Постренальное: камни, сгустки крови, папиллярный некроз, болезни мочевого пузыря, уретры, простаты.
Виды острого повреждения почек
Hou S, et al, 1983; Kaufman J, et al, 1991.
ДИАГНОСТИЧЕСКИЕ КРИТЕРИИ (KDIGO)
Острое повреждение почек диагностируется при наличии одного из критериев:• повышение креатинина плазмы на ≥26.5 мкмоль/л от исходного уровня за 48 ч или
• повышение креатинина плазмы в 1.5 раза от исходного уровня, которое точно или возможно произошло в течение недели или
Острая болезнь почек диагностируется при наличии одного из критериев:
• острое повреждение почек или
• рСКФ <60 мл/мин/1.73 м² в течение <3 мес или
• снижение рСКФ более 35% или повышение креатинина плазмы >50% в течение <3 мес или
• структурное повреждение почек.
Морфология при остром кортикальном некрозе
Haymanj, Wikimedia Commons.
ДИАГНОСТИКА
• Креатинин плазмы.• Объем выделяемой мочи, водный баланс.
• Калий, натрий, мочевина, рН плазмы.
• Анализ мочи.
• Посев мочи, крови (при необходимости).
• Сонография почек.
• Биопсия почек.
Морфология при остром тубулярном некрозе
Уплощение эпителия, потеря ядер, в просвете канальцев обломки клеток.
СТАДИИ ОСТРОГО ПОВРЕЖДЕНИЯ ПОЧЕК (AKIN)
1 стадия• Прирост креатинина плазмы ≥26.5 мкмоль/л или в 1.5–1.9 раза.
• Выделение мочи <0.5 мл/кг/ч >6 ч подряд.
2 стадия
• Прирост креатинина плазмы в 2.0–2.9 раза.
• Выделение мочи <0.5 мл/кг/ч >12 ч.
3 стадия
• Прирост креатинина плазмы ≥3 раз или >353 мкмоль/л или заместительная терпия.
• Выделение мочи <0.3 мл/кг/ч >24 ч или анурия >12 ч.
Критерии острого повреждения почек и морфология
ГНП — гломерулонефрит с полулуниями, ОБП — острая болезнь почек, ОТИН — острый тубулоинтерстициальный нефрит, ОТН — острый тубулярный некроз, ТМА — тромботическая микроангиопатия. Chu R, et al. CJASN. 2014;9:1175–82.
ОСТРЫЕ ОСЛОЖНЕНИЯ
• Гиперкалиемия (>6 ммоль/л).• Ацидоз.
• Отек легких.
• Перикардит.
Исходы острого повреждения почек после выписки (USRDS)
ОПП — острое повреждение почек, ТПН — терминальная почечная недостаточность.
ФОРМУЛИРОВКА ДИАГНОЗА
Ds: ИБС: Сепсис, катетер-ассоциированный, вызванный Staph. aureus, острое повреждение почек, 2 стадия. [N17.9]Ds: Острое повреждение почек, ассоциированное с диклофенаком, 2 стадия. Гиперкалиемия, АВ блокада 3–4:1 с гипотензией. [N14.0]
Фоновый Ds: Гипертоническая болезнь. ХБП С3а.
Ds: ИБС: стабильная стенокардия III ФК. Ангиопластика передней межжелудочковой артерии голометаллическим стентом, осложненная контрастной нефропатией, ОПП 1 стадия. [I20.8]
Ds: Острое повреждение почек, ассоциированное с гентамицином, 2 стадия. [Y40.5]
Течение острого повреждения почек
Vanmassenhove J, et al. The Lancet. 2017;389(10084):2139–51.
ЛЕЧЕНИЕ
• Адекватное введение жидкости: 500 мл (250 мл при сердечной недостаточной в анамнезе).• Инотропные препараты/вазопрессоры (вазопрессин, норадреналин, добутамин, допамин): при выраженной гипотензии и шоке.
• Диуретики: не влияют на выживаемость, показаны при перегрузке объемом.
• Отказ от нефротоксичных препаратов.
• 25–35 ккал/кг/сут и до 1.7 г/кг/сут аминокислот при гиперкатаболическом состоянии и заместительной терапии.
• Коррекция вводимых лекарств в соответствии с измененной функцией почек.
• Гемодиализ.
Ранняя и поздняя заместительная терапия (AKIKI)
Ранняя заместительная терапия при 3 стадии ОПП сразу, поздняя по показаниям. Gaudry S, et al. N Engl J Med. 2016;375:122–33.
ЖИЗНЕУГРОЖАЮЩИЕ ПОКАЗАНИЯ К ЗАМЕСТИТЕЛЬНОЙ ТЕРАПИИ
• Отек легких.• Гипокалиемия >6.5 ммоль/л.
• Уремические осложнения: перикардит, энцефалопатия, кровотечение …
ПРОФИЛАКТИКА
• Активное лечение основного заболевания.• Введение 1 л 0.9% р-ра NaCl до и через 12 ч после контраста. При очень высоком риске можно заменить на натрия бикарбонат (1 л 5% глюкозы + 150 ммоль/л бикарбоната, 3 мл/кг/ч в течение 1 ч до введения контраста и 1 мл/кг/ч в течение 6 ч после.
• Отказ от нефротоксичных препаратов у пациентов с факторами риска ОПП.
причины, симптомы, диагностика и лечение
ОПП (острое почечное повреждение) – патологическое состояние, спровоцированное внезапной потерей мочевыводящей системы способности функционировать. ОПП диагностируют, если патология формируется за непродолжительное время (не более нескольких недель). Основное проявление ОПП – накопление в организме продуктов распада с включением азотистых компонентов. Это явление называется азотемией.
Нюансы и категории
Спровоцировать ОПП может травма, перенесенное хирургическое вмешательство или патология. Известны случаи, когда функционирование органа слабело в силу генетических предпосылок, переданных по наследству болезней. Разработана объединяющая в себе все известные случаи острого почечного повреждения классификация. Основной признак для деления случаев на группы – механизм формирования патологического состояния.
Если состояние объясняется нарушением кровотока в почках, диагностируют преренальное ОПП. При проблемах оттока урины, объясняющихся патологией, устанавливают постренальное ОПП. Наконец, ренальное – это такой тип патологии, который объясняется повреждениями ткани почек. Спровоцировать их могут очаги воспаления или иные агрессивные факторы. В медицине ренальное повреждение известно под альтернативным термином «паренхиматозное». Это наименование отражает суть явления – страдает почечная паренхима, ее структура нарушается под влиянием внешних явлений.
Что провоцирует патологию?
Известно несколько причин, способных привести к ОПП. При определении конкретных, свойственных случаю, их обязательно фиксируют в личной карте пациента, в истории болезни. Острое почечное повреждение преренального типа, как установили врачи, обычно формируется при недостаточности кровотока в почках. Привести к этому могут различные патологические состояния, включая понижение объема крови, единовременно находящейся в сосудистой системе. Такое вероятно на фоне острой потери крови или при сильной рвоте, инфекционном поражении кишечника с диареей – эти состояния могут привести к утере жидких фракций крови. Определенные риски сопряжены с употреблением мочегонных. Если пациент неправильно применяет препараты, через почки возможна потеря некоторого объема крови. Спровоцировать такую проблему может неадекватная работа надпочечниковой коры или перитонит, травма, сильный ожог, панкреатит в острой форме – на фоне таких состояний нарушается отток жидкостей.
Закодированное шифром N17 в МКБ-10 острое почечное повреждение может наблюдаться, если нарушается работа сердечной мышцы. При резком угнетении ее способности сокращаться страдает кровеносная система, что может стать причиной преренального ОПП. Патология сопровождается уменьшением объемов выбрасываемой за один сократительный акт крови. Нередко это наблюдается на фоне инфаркта, клапанного заболевания, миокардита. Спровоцировать ОПП может аритмия в тяжелой форме или легочная тромбоэмболия.
Факторы и причины: продолжая тему
Возможно острое почечное повреждение по причине снижения сосудистого тонуса в этом органе. Спровоцировать явление может заражение крови, наркоз или излишне активное употребление препаратов для снижения давления. В ряде случаев ОПП объясняется патологическими артериальными сокращениями, объясняющимися избыточностью содержания кальция в организме. Есть риск развития ОПП на фоне употребления лекарственных средств из группы циклоспоринов, а также препаратов, содержащих норадреналин, лекарств «Такролимус», «Амфотерицин В».
Известны случаи, когда острое почечное повреждение развивалось из-за печеночного цирроза, приведшего к гепаторенальному синдрому. В некоторых случаях причина состояния – сбои проходимости в сосудистой системе почек. Это может провоцироваться венозной, артериальной окклюзией. Такие риски свойственны больным атеросклерозом, васкулитом в системной форме. Повышен риск ОПП на фоне эмболии, тромбоза, сосудистой аневризмы. При выявлении первопричины состояния следует рассмотреть возможность внешнего давления на сосуд.
Известны случаи, когда причиной ОПП становился слишком высокий уровень вязкости жидкости в кровеносной системе. Это возможно при патологиях крови: миеломе, заболевании Вальденстрема, полицитемии.
Этиология: ренальная форма
Эта разновидность острого почечного повреждения у детей и взрослых может сформироваться по причине патологического состояния клубочков почек и небольших артерий, находящихся в органе. Из синдромов, способных спровоцировать ОПП, стоит упомянуть васкулит, гломерулонефрит, преэклампсию. Повышены риски у лиц, страдающих красной волчанкой. В определенном проценте случаев ОПП можно связать со склеродермией. Почечная паренхима может пострадать при диссеминированном свертывании крови внутри сосудов, при росте холестериновой концентрации, сопровождающейся формированием кристаллов. Эти элементы наносят вред структурам почек.
Преренальное острое почечное повреждение может со временем привести к ренальному. К примеру, нередко такое наблюдается при продолжительных сбоях кровотока в почках, не корректируемых медикаментозными методами. Это приводит к перфузии. Аналогичное явление могут вызвать токсические эффекты различных соединений: циклоспорина, веществ, используемых для рентгеновских исследований, антибиотиков. Повышен риск ОПП при применении препаратов химиотерапии для лечения злокачественного новообразования. В ряде случаев отравляющий эффект наблюдается со стороны соединений, формирующихся в человеческом организме в ходе нормальных реакций: белковых структур, миоглобина и некоторых других. С опасностями связаны случаи, когда нарушаются процессы метаболизма или вывода из организма опасных веществ, что приводит к росту концентрации.
Инфекции и патологии
Проведение КТ почек при подозрении на ОПП наверняка поможет подтвердить этот диагноз или опровергнуть, а также уточнить, по какой причине нарушение сформировалось. Известно, что в ряде случаев к нему приводят очаги воспаления. Повышена опасность ОПП при пиелонефрите в острой форме, заражении грибками из рода Кандида, а также при инфицировании цитомегаловирусом. Возможно влияние аллергического ответа организма. Чаще это наблюдается при приеме пациентом антимикробных препаратов бета-лактамного типа, диуретиков, «Каптоприла», «Рифампицина». Опасности связаны с терапевтическим курсом нестероидных противовоспалительных медикаментов, «Триметоприма» и лекарств из группы сульфаниламидов.
При подозрении на ОПП необходимо срочно обратиться к доктору. Первая мера – вызов врача-уролога на дом. Специалист соберет анамнез и определит, необходима ли госпитализация. Предположить, что симптомы указывают на ОПП, можно, если у пациента ранее был установлен саркоидоз – он может стать причиной формирования гранулем в почечной паренхиме, что провоцирует ОПП. Еще одна возможная предпосылка – инфильтрация атипичными структурами почечных тканей при лимфоме, лейкемии.
Редкие случаи: нюансы ОПП
Известны такие ситуации, когда причину острого почечного повреждения выявить не удавалось. При этом в карте пациента указывают идиопатическую форму патологического состояния. Даже проводимое с применением самых современных аппаратов КТ почек не дает точного представления о спровоцировавших паренхиматозное ОПП явлениях. Нюансы корректировки состояния при этом определяют исходя из особенностей развития патологии.
Известны случаи, когда требовался вызов врача-уролога на дом по причине сбоев в работе почек на фоне использования «Метотрексата», «Индинавира». Госпитализация и исследование состояния пациента могут подтвердить ОПП, вызванное формированием в канальцах почек кристаллов. Соединения, поступающие с упомянутыми лекарственными средствами, изредка могут переходить в твердую форму. Такие риски сопряжены и с использованием сульфаниламидных антимикробных препаратов, щавелевой кислоты. В некоторой степени опасно парентеральное применение «Ацикловира».
Также к числу редко встречающихся факторов относятся некротические кортикальные процессы, нефропатия на фоне употребления низкокачественных медикаментов и пищевых добавок. Изредка острое почечное повреждение наблюдается на фоне нефропатии, вызванной препаратами с варфарином, фосфатами. ОПП возможно:
- если у пациента удалили единственную почку;
- при отторжении трансплантированного органа.
Этиология: постренальное ОПП
На эту причину могут указывать нефротические отеки, а также иные патологические состояния, позволяющие заподозрить неправильный отток урины. Спровоцировать ОПП могут почечные патологии, в частности, формирование камней в мочеточнике. Причина явления, состав камней от случая к случаю варьируются достаточно сильно. Кроме камней, замедлить продвижение урины и заблокировать отток жидкости может сгусток крови, наружное давление со стороны опухоли или фиброзное перерождение тканей. Определенные риски связаны с неправильными действиями хирурга, если при операции мочеточник перевязали или пересекли без необходимости к этому.
В ряде случаев ОПП объясняется нейрогенным мочевым пузырем. При таком состоянии наблюдаются сбои в работе нервной системы, ответственной за сокращения, расслабление стенок пузыря. Знать, к какому врачу обращаться с почками (к урологу), необходимо, если установлено заболевание предстательной железы – оно с определенной степенью вероятности может спровоцировать ОПП, требующее срочной квалифицированной помощи. Чаще всего к такому исходу приводит доброкачественное разрастание органа, хотя в ряде случаев патология связана со злокачественной опухолью.
Проявления и нюансы
Несмотря на столь большое разнообразие причин, клиническая картина в большинстве случаев сходная. Признаки, симптомы болезней почек у женщин и мужчин, безусловно, отличаются, что в определенной степени влияет на проявления ОПП. В общем случае пациент ощущает себя слабым, его тошнит и рвет, ослабевает аппетит, ухудшается работоспособность. Наблюдается состояние общего отравления организма. В некоторых случаях путается сознание. Сокращаются объемы выделяемой урины вплоть до полного отсутствия жидкости. Олигурия во многом зависит от патогенеза случая. Так, из статистики известно, что при преренальной форме олигурия наблюдается в каждом втором случае.
Основной признак, симптом болезней почек у женщин, мужчин, провоцирующие постренальное ОПП – анурия. Наиболее типично это случаям, когда нарушение мочевого передвижения произошло в нижней части системы вывода урины из организма. Диурез отсутствует полностью. При ренальной форме при сходной первопричине объемы урины сохраняются на прежнем уровне или увеличиваются.
Шаг за шагом
Принято говорить о четырех стадиях острого почечного повреждения. Первая – начальный период. Его длительность – с момента начала влияния агрессивного фактора до проявления первичной симптоматики патологии. Как правило, длительность этапа – в пределах 24 часов.
Второй шаг – понижение диуреза. Он наблюдается не при всякой форме заболевания (зависит от причин, провоцирующих ОПП). Длительность периода – до 14 суток.
Третья стадия – полиурия. Начинается в момент, когда агрессивный фактор исключается, длится, пока восстанавливается работоспособность почек. В этот период становятся больше объемы выводимой из организма урины. Продолжительность этапа зависит от длительности первых двух шагов. Полиурия у большинства пациентов фиксируется в течение нескольких недель. Активность диуреза указывается на восстановление печной функциональности, но одновременно сигнализирует о высоком риске дегидратации. Необходимо контролировать употребляемые больным в пищу объемы жидкости.
Наконец, последний шаг – выздоровление. Его длительность достигает нескольких месяцев. Период завершается, когда функциональность органа полностью восстанавливается.
Нюансы этапов
В редких случаях диагностируется только два первых этапа заболевания. Это свойственно ситуации, когда пациент не получает квалифицированной помощи врачей. ОПП при таком развитии положения приводит к хронической недостаточности работы почек.
Уточнение состояния
В первую очередь врач осмотрит пациента и опросит на предмет симптомов, а также оценит информацию из истории болезни. Далее наступает этап лабораторных, инструментальных исследований. Сперва берут образцы крови для биохимического изучения, урину. Заподозрить ОПП можно при повышении креатининового уровня и концентрации мочевины. Возможны проявления ацидоза или повышенное содержание калия. Учитывают, что скорость фильтрации через почечные клубочки не дает точного представления о тяжести патологического состояния. Чтобы определить динамику состояния, необходимо регулярно проверять креатининовый уровень и диурез.
Снижение диуреза при ООП приводит к повышению концентрации калия до 6,5 ммоль/л и более. При превышении указанного параметра избыток калия становится опасным для жизни человека. Вместе с этим наблюдается выше уровня содержание фосфата при сниженных показателях кальция. Это указывает на рабдомиолиз, то есть нарушение функционирования мышечных тканей. Если анализ позволяет уточнить рост миоглобина, КФК, можно с уверенностью говорить о нарушении работы мышечных тканей. Такие показатели указывают на продолжительное сдавление почек.
При хронической недостаточности работы почек возможна анемия. Если при ОПП анализы подтверждают такой синдром, можно предположить острую кровопотерю.
Изучение урины
К критериям острого почечного повреждения относится высокий удельный вес урины: параметр превышает 1,025 г/мл в случае преренальной формы. При ренальной чаще диагностируется изостенурия. В урине можно выявить протеиновые фракции, объясняющиеся воспалительными процессами. Такое особенно типично для картины гломерулонефрита. В осадке урины возможно обнаружение аномальных элементов. Их специфика нередко помогает установить, что именно стало причиной ОПП в конкретном случае.
В посвященных диагностике острого почечного повреждения рекомендациях можно увидеть информацию о правилах трактовки наличия канальцевых клеток в урине: это позволяет предположить ренальный тип патологии. Наличие эритроцитов, клеточных цилиндров указывает на гломерулонефрит. Содержание лейкоцитов позволяет заподозрить острый пиелонефрит. На постренальное патологическое состояние указывают свежие эритроциты в выделениях.
Что делать?
Основная задача терапевтического курса – максимально быстрое исключение фактора, спровоцировавшего ОПП. Во внушительном проценте случаев только избавление от агрессивного явления уже становится достаточной мерой для выздоровления. Это свойственно, в частности, ОПП на фоне нефротоксических препаратов.
При остром почечном повреждении клинические рекомендации включают контроль водного баланса. Важно отслеживать потребляемые объемы жидкости и проверять вес. Не реже раза в сутки выявляют креатининовый уровень и иные значимые параметры крови. При тяжелом течении требуется заместительная терапия: необходимо очищать кровеносную систему от продуктов обменных реакций.
Основная задача доктора – обеспечить пациенту все условия для нормализации почечной функциональности. Если больной следует указаниям доктора, вероятность полного излечения оценивается в 95%. В то же время важно помнить о риске летального исхода. Это в большей степени свойственно случаю, когда ОПП формируется на фоне тяжелого заболевания, а также у человека в преклонном возрасте. Для детей выше среднего оценивается вероятность осложнений.
Предупреждение ОПП
Первая и основная мера предупреждения ОПП – выявление и адекватная корректировка любой почечной патологии, которая может стать причиной острого почечного повреждения. Необходимо уделять внимание всем состояниям, заболеваниям, по причине которых может снизиться объем крови в кровеносной системе.
При повышенной вероятности развития ОПП важно контролировать диурез, снимать показатели раз в 24 часа или чаще. Следует проверять качество крови на предмет концентрации продуктов метаболизма. При необходимости использовать токсичные для почек лекарственные препараты их назначают особенно аккуратно, только в условиях, когда можно постоянно отслеживать состояние больного. Если есть более безопасная альтернатива, необходимо прибегнуть к ней.
Нюансы состояния
Одна из основных особенностей ОПП – продолжительность терапевтического курса. Только лишь заместительная терапия – зачастую недостаточный подход для стабилизации и улучшения итогов лечения. При ОПП важно уделять внимание корректировке баланса электролитов, поддержанию иммунитета, а также правильному питанию больного в период выздоровления. Из медицинской статистики известно, что ОПП особенно часто встречается среди пациентов интенсивной терапии, а также поступивших в реанимацию лиц. Для этой категории особенно высока вероятность летального исхода. По некоторым оценкам, для указанных групп уровень смертности при ОПП достигает 60%. Чтобы минимизировать такой исход, важно правильно подобрать момент начала лечения, дозировку препаратов, выбор метода контроля свертываемости крови.
Как считают ученые, в последнее время нет существенных прорывов в изучении ОПП и разработке методов борьбы с этим состоянием. Очищение крови, поддержка состояния больного питательными компонентами, корректировка баланса электролитов, патофизиология синдрома и применение допплерометрии требуют более детального и глубокого изучения. Предположительно, именно разработка этих аспектов позволит в будущем добиться серьезного прогресса в лечении ОПП.
ОПП: очищение крови как залог успешности терапии
Разработка новой концепции очищения крови, как предполагают специалисты, поможет добиться серьезного прогресса в лечении ОПП. Теории, доказавшие свою истинность, объясняют, что именно через эффективный подход к очистке крови можно снизить экспрессию медиаторов воспаления. При этом проработка результативных методик восстановления гомеостаза гарантирует наилучшие исходы случаю. Воспалительные процессы объединяют огромное количество медиаторов, и модулирование посредством работы с отдельными компонентами в настоящее время не показывает желаемого итога. Заместительная терапия с исключением медиаторов воспаления, в том числе токсинов микробов, считается наиболее перспективным методом лечения ОПП.
Важные шаги в исследовании этой темы сделаны в последние полтора десятилетия. Работы в указанном направлении не останавливаются, что позволяет надеяться на формирование принципиально новых и эффективных подходов к корректировке ОПП. Стоит отметить: исследования в этом направлении одновременно ведут несколько крупных медицинских институтов в разных странах мира, что позволяет надеяться на скорое достижение результатов.
Острое почечное повреждение в периоперационном периоде
Острое повреждение почек (ОПП) — относительно новое понятие (внедрено в практику с 2012 г.), которое на сегодняшний день трактуют как быстрое снижение функции почек (в течение 48 ч) с нарастанием абсолютных значений креатинина сыворотки крови на 26,5 мкмоль/л или более, относительным повышением концентрации креатинина, равным или превышающим 50% (т. е. в 1,5 раза) по сравнению с исходным уровнем, либо как документированную олигурию при диурезе менее 0,5 мл/кг массы тела/ч в течение 6 ч.
Частота ОПП с каждым годом нарастает, особенно у пациентов, подвергающихся тяжелым хирургическим вмешательствам. В рутинной практике значение острой почечной патологии часто недооценивается, что может приводить к повышению летальности. Общепризнанные алгоритмы профилактики и лечения ОПП отсутствуют.
Формирование представлений об остром почечном повреждении
Первое описание синдрома почечной недостаточности, трактуемого как «неспособность почек выделять мочу» (ischuria renalis), было сделано W. Heberden в 1802 г. в его труде «Commentaries on the History and Cure of Diseases».
В 1827 г. R. Bright в работе «Reports of Medical Cases» впервые описал основные симптомы почечной недостаточности. С тех пор сочетание отеков, альбумина в моче и олигурии стали называть болезнью Брайта. В 1892 г. W. Osier в статье «The Principles and Practice of Medicine» впервые разграничил хроническую и острую болезнь почек.
Во время Первой мировой войны было описано уже более 35 000 случаев стрептококк-ассоциированного острого нефрита, сопровождавшегося выраженными отеками, альбуминурией, который N. Raw в 1915 г. назвал «траншейным» нефритом, и это показало огромную значимость проблемы.
В период Второй мировой войны (в 1941 г.) Е. Bywaters и D. Beal подробно описали в British Medical Journal нарушение функции почек при «crush»-синдроме (синдроме длительного сдавливания).
Впервые же термин «острая почечная недостаточность (ОПН)» ввел американский физиолог Homer W. Smith в публикации «The Kidney: Structure and Function in Health and Disease» в 1951 г. В течение последующих 50 лет появилось около 35 различных определений ОПН, что, конечно, вносило определенную сумятицу в разработку проблемы и сохраняло чувство неудовлетворенности у имевших к ней отношение специалистов.
Поэтому неслучайно в 2000 г. по инициативе С. Ronco, J. A. Kellum, R. Mehta создана организация ADQI (Acute Dealysis Quality Initiative), целью которой было: а) упорядочить имеющиеся данные по данной проблематике, б) разработать единый подход к формулировке понятия почечной дисфункции, в) предложить критерии для ее стратификации. В мае 2004 г. ADQI предложила определять почечную дисфункцию на основе подъема уровня креатинина в сыворотке крови и снижения темпа диуреза.
Также предложена классификация RIFLE, в которой степени нарушения функции почек были разделены по тяжести — Risk (риск), Injury (повреждение), Failure (недостаточность), двум исходам — Loss (потеря функции) и End Stage Kidney Disease (терминальная почечная недостаточность). Стадии тяжести (их три) зависели от уровня креатинина сыворотки крови и количества выделяемой мочи. Исходы (потеря функции и терминальная почечная недостаточность) определяли по продолжительности отсутствия функции почек. С тех пор многие специалисты стали применять эту шкалу в исследованиях для оценки частоты возникновения и исходов острого нарушения функции почек.
Система критериев RIFLE неплохо себя зарекомендовала на практике, хотя бы в отношении предсказания исходов у пациентов с острой почечной дисфункцией. Однако оказалось, что эта система не лишена недостатков. Много вопросов вызвало наличие в классификации классов R (риск) и Е (терминальная почечная недостаточность ТПН). Например, риск развития какого-либо заболевания или патологического состояния — не само это состояние или заболевание, а терминальная почечная недостаточность (ТПН) (класс Е) исход, а никак не сама ОПН. Эти и некоторые другие соображения побудили к поиску модификаций классификационной системы острой патологии почек.
В сентябре 2004 г. ADQI в тесном сотрудничестве с ASN (Американским обществом нефрологов — American Society of Nephrology), ISN (Международным обществом нефрологов — International Society of Nephrology), Национальной почечной организацией США (NKF — National Kidney Foundation) на конгрессе ESICM (European Society of Intensive Care Medicine) в Виченце (Италия) предложили шире смотреть на проблему нарушения почечной функции, предложив новую концепцию — концепцию острого повреждения почек (АК1/ОПП). Тогда же была создана группа экспертов различных специальностей AKIN (Acute Kidney Injury Network), которым надлежало проводить дальнейшую разработку проблемы острого почечного повреждения (ОПП).
Первые результаты деятельности данной группы были представлены на конференции AKIN в Амстердаме (Нидерланды) в 2005 г., когда были предложены усовершенствованное определение и классификация ОПП уже без учета классов повреждения почек и опоры на стандартизированную скорость клубочковой фильтрации.
Согласно предложению AKIN, ОПП определялось как «быстрое снижение функции почек (в течение 48 ч), предполагающее нарастание абсолютных значений креатинина сыворотки крови на 26,5 мкмоль/л или более, относительное повышение концентрации креатинина, равное или превышающее 50% (т. е. в 1,5 раза) по сравнению с исходным уровнем, либо как документированная олигурия при диурезе менее 0,5 мл/кг массы тела/ч в течение 6 часов».
Термин ОПП был призван акцентировать внимание на возможность обратимости повреждения почек в большинстве случаев. Окончательную модификацию классификация приобрела в 2012 г. в редакции руководства по ОПП KDIGO (Kidney Disease Improving Global Outcomes) и с тех пор активно используется как нефрологами, так и реаниматологами всего мира.
Частота встречаемости ОПП среди пациентов отделений реанимации и интенсивной терапии (ОРИТ) высока. Так, по данным J. Case, она составляет от 20 до 50%, чаще всего выступая в качестве одного из проявлений синдрома множественной органной дисфункции у пациентов с сепсисом. Присоединение почечного повреждения свидетельствует о большой вероятности летального исхода. По данным Е. Hoste, почечная дисфункция с потребностью в заместительной почечной терапии (ЗПТ) увеличивает смертность до 50%.
Исследования, связанные с проблематикой острого повреждения почек, в последнее время сфокусированы на лучшем понимании причин и механизмов развития ОПП, своевременной идентификации пациентов с высоким риском почечной дисфункции, поиске биомаркеров для ранней диагностики ОПП, а также совершенствовании стратегии по предупреждению и лечению ОПП.
Выявление пациентов с высоким риском развития ОПП
Идентификация пациентов с высоким риском развития ОПП способствует ранней диагностике повреждения почек, оптимизации фармакотерапии с исключением применения нефротоксичных лекарственных препаратов, более взвешенному подходу к применению рентгеноконтрастных методов исследования, прогнозированию неблагоприятных последствий у пациентов, подвергающихся кардиохирургическим вмешательствам.
В частности, риск послеоперационного ОПП зависит от характера и продолжительности операции, длительности применения влияющих на функцию почек препаратов, стабильности показателей гемодинамики. Возраст и хроническая болезнь почек (ХБП) — два часто сопутствующих преморбидных фактора риска развития ОПП. В послеоперационном периоде риск повышается пропорционально снижению уровня скорости клубочковой фильтрации.
Клинические и биохимические факторы риска ОПП четко не стратифицированы. Оценка риска с помощью биомаркеров также детально не разработана. Известно, что хирургическая травма, искусственное кровообращение приводят к высвобождению биологических повреждающих агентов (цитокинов, перекисных радикалов и ионов свободного железа), которые, в свою очередь, стимулируют выработку тубулярными клетками протеинов, вовлеченных в механизмы защиты и повреждения клеток.
Например, тканевый ингибитор металлопротеиназ (TIMP-2) и инсулиноподобный фактор, связывающий белок (IGFBP7), индуцируют остановку клеточного цикла G1, который, как предполагается, предотвращает преждевременное саморазрушение клеток (подвергающихся апоптозу), в том числе тубулярного эпителия.
NGAL (липокалин, ассоциированный с желатиназой нейтрофилов) и гепсидин вовлечены в регуляцию уровня свободного железа и влияют на степень ОПП. L-FABP (L-тип белка, связывающий жирные кислоты) в основном экспрессируется в тканях с активным метаболизмом жирных кислот. Его главная функция — участие во внутриклеточном транспорте длинноцепочечных жирных кислот, подвергающихся бета-окислению в митохондриях. L-FABP вырабатывается на фоне высокого содержания перекисных радикалов с целью блокирования их негативного влияния. Сигнальная молекула KIM-1 (Kidney Injury Molecule-1, молекула повреждения почек) — трансмембранный гликопротеин, экспрессируется в клетках проксимальных канальцев после их ишемического или токсического повреждения. Он регулирует процессы регенерации поврежденного эпителия.
Эти протеины можно определить в моче, и на сегодня многочисленные исследования отвели им роль биомаркеров имеющейся (т. е. состоявшейся) острой патологии почек. Однако их оценка в сочетании с факторами риска может помочь и в прогнозировании развития почечного повреждения.
Например, сочетание данных по мочевым маркерам TIMP-2, IGFBP7 с факторами риска, такими как возраст более 65 лет, мужской пол, ожирение (индекс массы тела > 40 кг/м2), имеющиеся ХБП, заболевания печени, хроническая сердечная недостаточность, хроническая артериальная недостаточность, сахарный диабет, артериальная гипертензия, злокачественные новообразования, хроническая обструктивная болезнь легких, анемия, гипоальбуминемия, убедительно предсказывают ОПП после кардиохирургических операций. Возможность точно прогнозировать ОПП проверена и с помощью оценки содружественных изменений NGAL и L-FABP. KIM-1 и IL-18 в комбинации также позволяют оценить риск тяжелого ОПП.
Принципы периоперационного ведения пациентов, находящихся в группе риска ОПП
Основными факторами, вносящими вклад в развитие почечной дисфункции, являются микроциркуляторная ишемия, системный и локальный воспалительный ответ, ведущие к снижению возможностей биоэнергетической адаптации клетки, нарушению регуляции метаболических процессов, остановке цикла клеточного деления.
Контроль и стабильность показателей гемодинамики — важнейший аспект ведения пациентов с риском ОПП, связанного с хирургическими вмешательствами. Показана связь между тяжестью и длительностью интраоперационной гипотензии и развитием ОПП. Гипотензия является веским, независимым фактором развития острой почечной патологии, и ее следует избегать.
Эта концепция подтверждена результатами исследования SEPSISPAM, где поддержание среднего артериального давления (САД) на уровне 80-85 мм рт. ст. у пациентов с сепсисом с хронической артериальной гипертензией в анамнезе снижало потребность в ЗПТ по сравнению с контрольной группой, где САД поддерживалось на уровне 65-70 мм рт. ст.
Несмотря на отсутствие четкого значения САД, обеспечивающего поддержание адекватной перфузии почек и, следовательно, эффективную гломерулярную фильтрацию, известно, что высокие значения САД у пациентов с гипертензией в анамнезе в меньшей степени ассоциированы с развитием ОПП. Безопасные значения артериального давления необходимо подбирать индивидуально для каждого пациента.
Снижение его в периоперационный период (по сравнению с показателями до операции) особенно пагубно влияет на пациентов с нарушенной ауторегуляцией: старшая возрастная группа, ХБП и хроническая артериальная гипертензия; пациенты, принимающие ингибиторы ангиотензинпревращающего фермента и блокаторы ангиотензина-2. Блокируя локальное действие брадикининов, ответственных за вазоконстрикцию отводящей артериолы клубочка, они способствуют снижению СКФ, усугубляя почечную дисфункцию.
Периоперационная оптимизация гемодинамики может иметь хороший ренопротективный эффект, однако оптимальные подходы к ее стабилизации не разработаны. Противоречивыми остаются данные о роли инфузионной терапии в улучшении перфузии почек и их функции, хотя инфузионную терапию широко используют с целью предупреждения и терапии периоперационной гипотензии.
Сочетание инфузионной терапии с вазопрессорными препаратами при ориентированном на сердечный выброс контроле гемодинамики остается популярным. Однако большинство исследований такого подхода не показывают значительного снижения осложнений и 30-суточной смертности в послеоперационном периоде среди пациентов общехирургического профиля.
Замечено, что такая стратегия инфузионной терапии в конечном итоге не снижает объем вводимых растворов, и в реальной жизни у пациентов в критическом состоянии имеет место перегрузка инфузией, на фоне которой часто фиксируют ухудшение почечной функции в связи с нарастанием венозного застоя.
Показано, что рестриктивная стратегия инфузии имеет меньшую связь с развившейся впоследствии почечной дисфункцией, нежели либеральный протокол инфузионной поддержки. В то же время исследование ProCESS (Protocolized Саге for Early Septic Shock) установило, что развитие ОПП у пациентов с септическим шоком не ассоциировано со стандартным протоколом инфузионной терапии и гемотрансфузии, а также с применением вазопрессоров.
Довольно полно изучена связь между повреждением тубулярного эпителия и снижением СКФ. Сниженная реабсорбция хлоридов в клетках поврежденного почечного эпителия обусловливает повышение их доставки к macula densa и, соответственно, приводит к вазоконстрикции приводящей артериолы, что и обусловливает снижение клубочковой фильтрации. Такая тубулогломерулярная взаимосвязь теоретически может быть прервана применением почечных вазодилататоров, например, натрийуретическим пептидом (ANP) и фенолдопамом.
Результаты одного моноцентрового рандомизированного исследования показали, что введение небольших доз ANP предотвращало развитие ОПП после больших хирургических вмешательств, однако для введения данного метода в рутинную практику необходимо проведение дополнительных исследований. Предполагаемый положительный эффект при использовании фенолдопама был опровергнут в ходе большого мультицентрового исследования, в котором введение этого препарата при кардиохирургических вмешательствах не привело к снижению частоты ОПП и потребности в ЗПТ.
Проводимые исследования по оценке эффективности инотропных препаратов не выявили их какого-либо нефропротективного эффекта. Оценка других фармакологических и нефармакологических средств и мер (селективных ренальных вазодилататоров, аденозина, статинов, эндокринной и противовоспалительной терапии, терапия CD4+CD25+FoxP3 Treg-клетками, а также ишемическое прекондиционирование) пока не показали существенного преимущества в рутинной клинической практике по профилактике и терапии ОПП.
Применение препаратов с нефротоксичным действием также часто приводит к развитию ОПП, особенно если их используют у пациентов с высоким риском развития почечной дисфункции. Это, однако, не означает полного исключения их из программ терапии, если они абсолютно необходимы для лечения пациента, но коррекция при этом дозировок с переоценкой роли средств при появлении признаков ОПП должна проводиться обязательно.
Ранняя диагностика ОПП играет ключевую роль для достижения благоприятного исхода. В идеале это могло бы быть достигнуто с помощью мониторинга функции почек в режиме реального времени, что позволило бы избегать осложнений. В настоящее время диагностика ОПП, как было отмечено выше, базируется на изменении уровня креатинина и/или на снижении темпа диуреза, т. е. на двух показателях, имеющих низкую специфичность или фиксирующихся с запозданием.
Вводимые в связи с этим в мире автоматические электронные системы тревоги, срабатывающие при выявлении повышенного уровня креатинина у пациента или при снижении скорости клубочковой фильтрации (т. н. e-alert), завоевывают популярность, так как показывают свою эффективность. Проводимые исследования оценивают влияние этих систем на содержание лечебного процесса, частоту осложнений, медико-экономическую составляющую.
Как было отмечено выше, хорошие результаты показало использование биомаркеров почечного повреждения. Лучше всего зарекомендовали себя TIMP-2 и IGFBP7. Созданный на их основе набор для экспресс-диагностики ОПП (NephroCheck) широко используется за рубежом в практике интенсивной терапии. Текущей задачей является формирование на основе биомаркеров шкал оценки риска, стратификации и прогнозирования ОПП.
Подходы к терапии ОПП
Консенсусной является стратегия, описанная в KDIGO 2012 г. Она сводится к коррекции гиповолемии, поддержанию адекватных гемодинамических показателей, коррекции гипергликемии, исключению нефротоксичных препаратов.
В настоящее время нет стандартной лекарственной терапии для лечения повреждения и блокирования мальадаптивного пути репарации после эпизода ОПП, хотя текущие исследования показывают хорошие клинические эффекты от применения щелочной фосфатазы, малых интерферирующих РНК, аналогов а-меланоцит стимулирующего гормона, костного морфогенетического белка. Возможно, наиболее зарекомендовавшие себя препараты найдут свое место в рутинной клинической практике. В рамках коррекции гиповолемии с помощью инфузионной терапии в современной практике несколько исследований показали важность не только качества инфузионных растворов, но их количества.
В 10-15% случаев пациентам в критическом состоянии с ОПП требуется проведение ЗПТ. Критерии инициации острого диализа хорошо известны, их можно разделить на абсолютные и относительные.
Подходы к ЗПТ у пациентов с проявлениями множественной органной дисфункции отработаны в меньшей степени. Сегодня в большинстве случаев предпочтение отдается не интермиттирующей (проводимой дискретно), а продолжительной заместительной почечной терапии. Она лучше переносится гемодинамически нестабильными больными, а также пациентами с острым повреждением головного мозга; характеризуется лучшим прогнозом восстановления после ОПП.
В настоящий момент идет поиск взаимосвязи значений различных биомаркеров и критериев инициации и оценки ЗПТ. Считаются спорными вопросы эффективности при раннем и позднем ее начале, о рациональной продолжительности ее проведения, а также о моменте прекращения ЗПТ. В отсутствие рандомизированного клинического исследования, дизайн которого удовлетворил бы разных специалистов, это решение принимается врачом анестезиологом-реаниматологом, исходя из конкретной клинической ситуации, хотя и с опорой на рекомендации KDIGO.
Они предполагают использование дозы эффлюэнта 20-25 мл/кг/ч для продолжительной ЗПТ и Kt/V = 3,9 для интермиттирующей, применение для продолжительной ЗПТ антикоагулянтной терапии с преимущественным использованием цитратной антикоагуляции.
Долгое время более высокая стоимость продолжительной ЗПТ по сравнению с интермиттирующим гемодиализом существенно снижала распространенность методик в реанимационной практике, однако последние оценки как за рубежом, так и в России совокупной финансово-экономической составляющей с учетом осложнений и конечных исходов показали значительное преимущество продолжительных методик.
Стратегии ведения пациентов после ОПП
Более половины пациентов ОРИТ имеют клинические признаки ОПП, что по частоте сходно со встречаемостью дыхательной недостаточности, и гораздо большие популяции пациентов с клиникой шока (33%) или ОРДС (10%). Должен или нет нефролог начинать курировать ведение пациента в период его нахождения в ОРИТ, до сих пор остается предметом дискуссии.
Однако данные наблюдений за отдаленными осложнениями у пациентов, перенесших ОПП, свидетельствуют о высокой в дальнейшем ассоциации почечной дисфункции со смертностью от сердечно-сосудистых заболеваний, большом риске развития повторных эпизодов ОПП и перехода в ХБП с подключением уже программного гемодиализа.
Все это, несомненно, подводит к выводу о необходимости тесного взаимодействия анестезиологов-реаниматологов со специалистами-нефрологами для дальнейшей обсервации пациентов, перенесших ОПП, после их выписки из ОРИТ, с целью оценки остаточной функции почек, стратификации рисков, подбора необходимой терапии.
Заключение
ОПП является частой патологией у пациентов в ОРИТ. Большое число и тяжесть отдаленных последствий после эпизода перенесенной дисфункции почек заставляют пристальнее относиться как к профилактике ОПП в период госпитализации, так и к разработке стратегии ведения пациентов после выписки из стационара.
Современный подход к проблеме включает разработку критериев стратификации рисков развития ОПП с учетом клинического состояния пациента, преморбидного фона, выработанной терапевтической стратегии. Большие надежды возлагаются на новые биомаркеры почечного повреждения не только с целью постановки диагноза ОПП, выработки критериев инициации и модальности ЗПТ, но и как возможных предикторов почечной дисфункции и ее последующих осложнений.
Ряд исследований по разработке фармакологической терапии ОПП показал обнадеживающие результаты, и, возможно, разработанные на их основе препараты в последующем займут достойное место в клинической практике.
Полушин Ю.С.
2018 г.
