| 85. Геморрагический шок в акушерской практике. Этиология, патогенез. Лечение, профилактика. Геморрагический шок – кризис микро- и макроциркуляции, возникающий в результате массивной кровопотери, выражающийся резким несоответствием ОЦК объему сосудистого русла, снижением сердечного выброса, тканевой перфузии и сопровождающийся острой гипоксией жизненно важных органов и, как следствие, полиорганной недостаточностью. Этиология – см. причины акушерских кровотечений Патогенез При кровопотере ˂ 500-700 мл (10% ОЦК) происходит компенсация в микроциркуляторном русле за счет повышения тонуса веносных сосудов (АД,ЧСС и перфузия тканей существенно не меняются) При кровопотере ˃ 500-700 мл (˃10 % ОЦК) – гиповолемия, включаются компенсаторные механизмы: повышение тонуса СНС, повышение выброса катехоламинов, АКТГ, АДГ, активация РААС. В результате повышается ЧСС, задерживается жидкость в кровеносном русле, возникает спазм периферических сосудов, т.е. происходит Клиника 3 стадии (знать наизусть!) I стадия: компенсированный геморрагический шок (кровопотеря 700-1500 мл, 15-25% ОЦК) Легкая гипотония (снижение АД на 15-20 мм рт. ст. от исходного) Умеренная тахикардия (до 100 уд/мин) Умеренная олигурия (до 20-40 мл/час) (норма: ˃50 мл/час) (определяется при катетеризации мочевого пузыря) ЧДД – 25-30 в минуту Шоковый индекс 0,5-1,0 Незначительное снижение ЦВД (норма – 50-120 мм вод.  ст.) ст.) II стадия: декомпенсированный обратимый (кровопотеря 1500-2000 мл, 25-40% ОЦК) Резкая слабость Головокружение Цианоз, бледность, мраморность кожных покровов (вследствие нарушения микроциркуляции) Критические значения АД (90-70 мм рт.ст.) Резкое снижение пульсового давления Тахикардия до 120-140 уд/мин, аритмия Выраженная олигурия (15-20 мл/час) Одышка: ЧДД 35-40 в минуту Шоковый индекс ˃1,0 Резкое снижение ЦВД III стадия – декомпенсированный необратимый (кровопотеря ˃2000 мл, ˃40% ОЦК) Отсутствие сознания Резкая бледность, мраморность кожных покровов АД ˂ критических цифр Тахикардия ˃140 уд/мин Пульс не пальпируется Анурия Легочная недостаточность (дыхание Чейн-Стокса) Лечение геморрагического шока (осуществляется командой специалистов: акушер-гинеколог, анестезиолог-реаниматолог, врач-лаборант) Цели: (все мероприятия выполняются быстро и одновременно!) Остановка кровотечения Анестезия Выведение из шока (инфузионно-трансфузионная терапия) Принципы: При кровопотере ≥1500 мл – срочная экстирпация матки! Чем раньше начнется возмещение кровопотери, тем меньше потребуется инфузионных сред. Эффект лечения геморрагического шока наиболее благоприятен, если в первые часы введено 70% требуемого количяества крови Все мероприятия проводятся на фоне ИВЛ вследствие прогрессирующей легочной недостаточности При наличии исходных нарушений гомеостаза используется СЗП (свежезамороженная плазма) уже на ранних этапах лечения.  Выбор инфузионных сред зависит от объема кровопотери (знать наизусть!)
При массивной кровопотере: Транексам Ингибиторы протеаз НовоСэвен — рекомбинантный фактор свертывания VIIа (90-100 мкг/кг каждые 2 часа до остановки кровотечения) Перфторан – синтетический кровезаменитель с функцией переноса кислорода При плановых операция КС необходимо: Иметь запасы СЗП, эр.массы, других препаратов крови Готовность к перевязке внутренних подвздошных артерий (выполняется сосудистым хирургом) Перфторан, НовоСэвен Предоперационное введение транексама по 5 мл в 200 мл физ.раствора в/в капельно за 30 мин до лапаротомии Dostları ilə paylaş: | ||||
геморрагический шок — словарь ветеринарных терминов — ВЦ Зоовет
Геморрагический шок (разновидность гиповолемического шока) обусловлен некомпенсированной кровопотерей — уменьшением ОЦК на 20% и более.
Классификация • Лёгкой степени (потеря 20% ОЦК) • Средней степени (потеря 20–40% ОЦК) • Тяжёлой степени (потеря более 40% ОЦК).
Компенсаторные механизмы • Секреция АДГ • Секреция альдостерона и ренина • Секреция катехоламинов.
Физиологические реакции • Снижение диуреза • Вазоконстрикция • Тахикардия.
Патогенез. Адаптацию больного к кровопотере во многом определяют изменения ёмкости венозной системы (содержащей у здорового человека до 75% объёма крови). Однако возможности для мобилизации крови из депо ограничены: при потере более 10% ОЦК начинает падать ЦВД и уменьшается венозный возврат к сердцу. Возникает синдром малого выброса, приводящий к снижению перфузии тканей и органов. В ответ появляются неспецифические компенсаторные эндокринные изменения. Освобождение АКТГ, альдостерона и АДГ приводит к задержке почками натрия, хлоридов и воды при одновременном увеличении потерь калия и уменьшении диуреза. Результат выброса эпинефрина и норэпинефрина — периферическая вазоконстрикция. Из кровотока выключаются менее важные органы (кожа, мышцы, кишечник), и сохраняется кровоснабжение жизненно важных органов (мозг, сердце, лёгкие), т.е. происходит централизация кровообращения. Вазоконстрикция приводит к глубокой гипоксии тканей и развитию ацидоза. В этих условиях протеолитические ферменты поджелудочной железы поступают в кровь и стимулируют образование кининов. Последние повышают проницаемость сосудистой стенки, что способствует переходу воды и электролитов в интерстициальное пространство. В результате в капиллярах происходит агрегация эритроцитов, создающая плацдарм для образования тромбов. Этот процесс непосредственно предшествует необратимости шока.
• Компенсированный обратимый шок. Объём кровопотери не превышает 25% (700–1300 мл). Тахикардия умеренная, АД либо не изменено, либо незначительно понижено. Запустевают подкожные вены, снижается ЦВД.
 Возникает признак периферической вазоконстрикции: похолодание конечностей. Количество выделяемой мочи снижается наполовину (при норме 1–1, 2 мл/мин).
Возникает признак периферической вазоконстрикции: похолодание конечностей. Количество выделяемой мочи снижается наполовину (при норме 1–1, 2 мл/мин).• Декомпенсированный обратимый шок. Объём кровопотери составляет 25–45% (1300–1800 мл). Частота пульса достигает 120–140 в минуту. Систолическое АД снижается ниже 100 мм рт.ст., уменьшается величина пульсового давления. Возникает выраженная одышка, отчасти компенсирующая метаболический ацидоз путём дыхательного алкалоза, но способная быть также признаком шокового лёгкого. Усиливаются похолодание конечностей, акроцианоз. Появляется холодный пот. Скорость выделения мочи — ниже 20 мл/ч.
Здоровья Вам и Вашим питомцам!
Возврат к списку
стадии, допустимая кровопотеря, действия врачей
Во всем мире главной причиной материнской смертности в акушерстве являются массивная кровопотеря и геморрагический шок. В ее структуре они занимают около 25%. Послеродовые кровотечения более 500 мл крови по статистике составляют в среднем до 6% всех случаев беременности, тяжелые послеродовые кровотечения, к которым относятся потери крови более 1000 мл, — около 2%.
Каковы причины и клинические рекомендации при геморрагическом шоке, который в числе причин материнской смертности находится на 2-3 месте?
Акушерские причины развития геморрагического шока
Геморрагический шок представляет собой неспецифическую реакцию организма, комплекс изменений, развивающихся в ответ на острую и массивную, патологическую потерю крови и характеризующихся синдромом малого выброса, снижением тканевой перфузии (микроциркуляции и кровоснабжения), полиорганной и полисистемной недостаточностью.
Что означают термины «патологическая» и «массивная»? В целях оценки угрозы состоянию конкретной женщины и в качестве одного из главных критериев определения процессов в организме во время кровотечения используется процентный показатель объема потерянной крови относительно массы тела. Кровопотеря является:
- Физиологической, если этот показатель составляет 0,5%. У женщин, масса тела которых 70 кг, — это 350 мл.
- Пограничной патологической — от 0,6% до 1%, что приблизительно составляет от 400 до 700 мл.
- Патологической — от 1,1% до 1,5% (приблизительно 800 – 1000 мл).
- Массивной — превышает 1,5%, что составляет в среднем более 1 литра. В этом случае всегда происходит развитие геморрагического шока.
Последний способен развиваться и при патологической кровопотере в случаях неадекватного наркоза, тяжелых гестозов и при ряде других патологических состояниях.
Кровотечения при беременности чаще всего могут возникать в третьем триместре, непосредственно во время родов и в раннем периоде после родов. В соответствии с рекомендациями ВОЗ допустимая кровопотеря во время естественных родов должна составлять не более 500 мл, что составляет приблизительно 0,5% массы тела роженицы, а при проведении кесарева сечения — не более 1000 мл.
Подробнее о причинах и опасностях кровотечений в различные периоды беременности и родов, можно прочитать в наших соответствующих статьях, — кровотечения:
Превышение этих объемных показателей расценивается как патологическая кровопотеря. Кроме того, при потере крови, масса которой превышает 1,5% массы тела женщины или свыше 15% объема циркулирующей крови характеризуется понятием «массивная кровопотеря». Последняя и представляет собой главную причину материнской смертности.
Таким образом, причина развития геморрагического шока — кровопотери, составляющие свыше 1 000 мл, или превышающие 1,5% массы тела женщины, или более 15% объема циркулирующей крови. Кровотечениями, угрожающими жизни женщины являются такие, при которых:
- Потеря составляет до 100% объема циркулирующей крови.

- Скорость кровотечения составляет 1,5 мл в 1 мин на 1 кг массы тела, или около 150 мл в 1 мин.
- Одномоментный объем потери превышает около 1,5-2 л, что составляет приблизительно 25-35% объема циркулирующей крови.
Наиболее частыми причинами в акушерстве, приводящими к геморрагическому шоку, являются:
- преждевременная отслойка нормально расположенной плаценты;
- предлежание плаценты;
- приращение или частичное плотное прикрепление плаценты;
- разрыв матки или родовых путей;
- гипотония или атония матки в раннем периоде после родов;
- задержка частей или всего последа в полости матки;
- дефекты гемостаза врожденного характера — коагулопатии врожденного характера;
- наличие в матке мертвого плода;
- эмболия околоплодными водами;
- прерывание эктопической беременности;
- прием антикоагулянтов;
- наличие печеночной недостаточности.
Патогенез геморрагического шока в акушерстве
Патогенез, или механизм развития, представляет собой реакцию организма на кровопотерю, протекающую в соответствии со следующими фазами:
- Компенсация.
- Декомпенсация.
- Геморрагический шок.
- Развитие синдрома диссеминированного внутрисосудистого свертывания.
Смысл этой реакции организма заключается в том, что при значительных кровотечениях происходит резкое уменьшение объема циркулирующей крови, что является причиной несоответствия между емкостью русла сосудистой сети и оставшимся в ней объемом крови, уменьшения возврата последней к сердцу и снижения сердечного выброса.
Результатом этого является раздражение соответствующих барорецепторов с последующей защитной реакцией организма в виде активации симпато-адреналовой системы и выбросом ею в кровь биологически активных веществ катехоламинов. Последние вызывают:
- увеличение силы и частоты сердечных сокращений, то есть увеличение сердечного выброса;
- генерализованный спазм сосудов, преимущественно капилляров и артериол, что способствует уменьшению общего внутрисосудистого объема;
- спазм артериол приводит к уменьшению притока крови к периферическим тканям, открытию артерио-венозных шунтов и централизации кровообращения, а в результате прекапиллярного спазма происходит снижение гидростатического давления в сети капилляров, способствующее возврату в сосудистое русло межклеточной жидкости.

Недостаток плазменных белков, утраченных в результате кровопотери, восполняется благодаря перемещению лимфы в сеть венозных сосудов, чему способствует низкое давление в последних. Ишемия (снижение кровоснабжения) в почках и надпочечниках, возникшие в результате периферического сосудистого спазма, стимулирует секрецию альдостерона и глюкокортикостероидных гормонов.
Все это приводит к задержке в организме ионов натрия и жидкости, уменьшению выделения мочи, переходу жидкости из тканей в русло крови (гемодилюция, то есть увеличение объема внутрисосудистой жидкости за счет разбавления ее собственной жидкостью), расщепления в печени гликогена и повышение концентрации глюкозы в крови.
Все описанные выше механизмы являются компенсаторными. Они направлены на повышение кровяного давления, усиление сердечного выброса, компенсанцию объема жидкости в сосудах, обеспечение тканевого кровоснабжения (перфузия тканей) и т. д., позволяющими организму без возникновения геморрагического шока определенное время обеспечивать жизненно важные органы (мозг и сердце) кислородом и питательными веществами.
Такие изменения характеризуются как нарушение макроциркуляции. Они помогают организму без развития шока «справиться» с кровопотерей, составляющей 15% объема циркулирующей крови (около 700 мл). В случае превышения допустимых объемов кровопотери или наличия еще и сопутствующих заболеваний, проведения неадекватной анестезии и т. д. может возникнуть срыв, нарушение компенсаторных механизмов организма с развитием шокового состояния.
Геморрагический шок является критическим состоянием. Патогенез геморрагического шока является продолжением вышеописанных механизмов в результате наступившего кризисного состояния следующих систем:
- макроциркуляторной сосудистой системы;
- микроциркуляторной сосудистой системы;
- кровоостанавливающей системы с развитием синдрома диссеминированного внутрисосудистого свертывания.
Патогенез этого критического состояния (упрощенно) является продолжением предыдущих изменений в организме.
Макроциркуляторный кризис
Возникает в результате снижения объема циркулирующей крови, развивающегося из-за кровопотери, уменьшения объема венозной крови, подлежащей возврату к сердцу, следствием чего является и соответствующее снижение сердечного выброса, снижение артериального давления. В компенсаторных целях (упрощенно) происходит увеличение частоты сокращений сердца и увеличение сосудистого периферического сопротивления.
Кризис микроциркуляторной системы
Характеризуется спазмом сосудов прекапиллярной сети и, как следствие, крайней степенью нарушения перфузии тканей, клеточной гипоксией и ацидозом. На смену спазму прекапилляров приходит их паралитическое расширение, в результате чего в капиллярном русле возникает повышение гидростатического давления.
Кроме того, из-за гипоксии и действия увеличенных концентраций таких биологически активных веществ, как гистамин, серотонин, брадикинин, простагландины, цитокины, лактаты и т. д. возникает увеличение проницаемости стенки капилляров. Вследствие этих причин жидкая фракция крови пропотевает из просвета капилляров в межклеточное пространство окружающих тканей, что ведет к вторичному снижению объема циркулирующей крови, ее депонированию и секвестрации.
Кризис свертывающей системы крови
Проявляется синдромом диссеминированного внутрисосудистого свертывания крови, коагулопатическими кровотечениями. В конечном итоге, механизмы развития геморрагического шока приводят к полиорганной недостаточности, заключающейся в необратимых деструктивных процессах на уровне клеток.
Проявлением их являются формирование острых язв и локальные некрозы слизистых оболочек желудка, кишечника, сопровождающиеся кровотечениями, локальные некрозы ткани печени, почек, поджелудочной железы, печеночная, острая почечная и надпочечниковая недостаточность, развитие энцефалопатии и нарушений функции легких и миокарда.
Возникающие нарушения проявляются снижением артериального и центрального венозного давления, слабым и очень частым пульсом (нитевидный), одышкой, спутанным сознанием, психическими нарушениями, бледностью и «мраморностью» кожных покровов и резко сниженным количеством выделяемой мочи или отсутствием последней.
Несмотря на то, что геморрагический шок в акушерстве развивается при кровопотере, превышающей 1% массы тела женщины, что составляет в среднем больше 1 литра, непосредственно угрожающим для ее жизни фактором считается массивная кровопотеря. Однако симптоматика шока и даже полное его развитие возможны и при потере даже 800 мл крови в случаях наличия гестоза, неадекватного обезболивания родовой деятельности, на фоне ее слабости или серьезной экстрагенитальной патологии.
Клиническая классификация
Действия медицинского персонала, необходимая помощь при геморрагическом шоке в акушерстве находятся в прямой зависимости от стадии его развития, или, другими словами, степени тяжести. Существует классификация, основанная на снижении показателя объема циркулирующей крови (ОЦК). Снижение на 20% определяется как шок легкой степени, на 35-40% — средней степени, на 40% и более — тяжелой степени. В этих случаях особое значение приобретает скорость потери крови.
Еще одна классификация основана на определении шокового индекса Альговера, который в норме должен быть меньше 1 (единицы). Он определяется путем деления числа сердечных сокращений на систолический показатель артериального давления. Стадия, или степень шока, определяется как легкая при индексе от 1 до 1,1, средняя — 1,5, тяжелая —2, крайне тяжелая — 2,5.
В практических целях для определения тяжести состояния пациентки и решения вопроса о том, какая неотложная помощь именно в данном конкретном случае должна быть оказана, используются перечисленные показатели с учетом клинико-лабораторных данных.
При этом различают следующие стадии геморрагического шока:
- I стадия (легкая) — компенсированный шок;
- II стадия (средняя) — декомпенсированный обратимый;
- III стадия (тяжелая) — декомпенсированный необратимый, или терминальный.
Рассмотрим их более подробно.
I стадия
Соответствует периоду кризиса макроциркуляции и представляет собой стадию централизации кровообращения. Ее развитие происходит при кровопотере, которая не превышает 20% объема циркулирующей крови, что составляет приблизительно 1 л. Индекс Альговера составляет от 0,5 и выше.
Ее развитие происходит при кровопотере, которая не превышает 20% объема циркулирующей крови, что составляет приблизительно 1 л. Индекс Альговера составляет от 0,5 и выше.
Среди клинической симптоматики преобладают признаки изменения функциональных нарушений деятельности сердечно-сосудистой системы. К ним относятся «запустение» периферических вен конечностей, бледность кожных покровов и слизистых оболочек, умеренное повышение как систолического, так и диастолического артериального давления, иногда их незначительное снижение, умеренное увеличение числа сердечных сокращений (до 100-110), незначительное увеличение частоты дыхания (до 20 в 1 мин.), возможно незначительное снижение диуреза.
II стадия
Характеризуется углублением расстройства кровообращения и нарастающим истощением компенсаторно-приспособительных механизмов. Она соответствует кризису микроциркуляции и развивается при среднем дефиците объема циркулирующей крови 35% (20-40%). При этом объем кровопотери составляет около 1-2 л, а индекс Альговера достигает 1,5 и выше.
Клиническая симптоматика имеет тенденцию к дальнейшему ухудшению: на фоне беспокойства, повышенной возбудимости, бледности кожных покровов появляются акроцианоз (цианотичность губ, ногтей, мочек ушей), холодный пот, одышка до 24-30 дыханий в 1 мин., систолическое артериальной давление снижается до 100-90 мм. рт. ст., а диастолическое — остается незначительно повышенным, число сердечных сокращений достигает 120 в 1 мин., диурез уменьшается до 20-30 мл в 1 час. Появляются соответствующие изменения на ЭКГ, снижается центральное венозное давление, в анализе крови отмечаются незначительное снижение гемоглобина, уменьшение числа эритроцитов (до 3 х 1012/л), гематокрита.
Кроме того, возможно появление признаков нарушения свертываемости крови — отсутствие свертывания вытекающей из матки крови, рвота содержимым желудка, имеющим коричневатую окраску (цвет «кофейной гущи»), кровоизлияния на слизистых оболочках и кожных покровах (в местах инъекций, кожных складок и т. д.).
д.).
III стадия
Представляет собой терминальную фазу кризиса гемостатической системы, необратимое состояние нарушения компенсаторно-приспособительных механизмов организма. Она развивается при дефиците объема циркулирующей крови свыше 40%, что составляет около 2 л кровопотери при шоковом индексе 2 и выше.
Отмечается психомоторное возбуждение и спутанность сознания, позже развиваются сонливость и кома. Кожные покровы холодные, бледные с выраженной «мраморностью», температура тела на 2-3 градуса ниже нормы. Одышка увеличивается до 30-40 в 1 мин и более, возможно нарушение ритма дыхания. Частота сердечных сокращений превышает 120-140 в 1 мин. Центральное венозное давление резко снижено или отрицательное, но при развитии сердечной недостаточности, наоборот, оно выше нормы и даже высокое. Число эритроцитов в анализе крови не превышает 2,5 х 1012/л, гематокрит достигает 25% и меньше, мочеотделение от 15 до 5 мл в 1 час вплоть до ее полного отсутствия, отмечается развитие ДВС-синдрома.
Лечение и профилактика
Лечение осуществляется акушер-гинекологом обязательно вместе с анестезиологом-реаниматологом. В необходимых случаях к оказанию помощи этими специалистами привлекается и врач-гематолог. Начало проведения лечения должно быть комплексным, максимально ранним и быстрым и осуществляться с обязательным учетом текущего состояния и его главной причины.
Основные принципы лечения патологического состояния в акушерстве:
- Выведение пациентки из шокового состояния одновременно с проведением лечебных мероприятий по надежному прекращению кровотечения.
- Проведение инфузионно-трансфузионной терапии путем переливания кристаллоидных солевых растворов, эритромассы, свежезамороженной плазмы, аутокрови, коллоидных препаратов и др. При возмещении объема циркулирующей крови ориентируются примерно на объем кровопотери. Если она составляет приблизительно 1 л, объем введения растворов должен превышать ее в 1,5 раза, 1,5 л — в 2 раза, более 1,5 л — в 2,5 раза.
 Основные задачи инфузионно-трансфузионной терапии — это восстановление и поддержание на адекватном уровне таких показателей, как объем циркулирующей крови, кислородный транспорт и снабжение кислородом тканей, показателей свертывающей системы крови, кислотно-основного состояния и баланса электролитов.
Основные задачи инфузионно-трансфузионной терапии — это восстановление и поддержание на адекватном уровне таких показателей, как объем циркулирующей крови, кислородный транспорт и снабжение кислородом тканей, показателей свертывающей системы крови, кислотно-основного состояния и баланса электролитов. - Коррекция кислотно-щелочного состояния крови.
- Введение глюкокортикостероидных и антигистаминных препаратов.
- Проведение профилактики ДВС-синдрома или лечение уже начавшегося его развития путем введения криопреципитата, тромбоконцентрата, антифибринолитиков, свежезамороженной плазмы и др.
- Нормализация процессов микроциркуляции, функции печени и почек путем введения спазмолитических препаратов (Трентал, Эуфиллин, Пентоксифиллин), гепатопротекторов, мочегонных средств и т. д.
- Проведение гемофильтрации, плазмофереза, гемодиализа.
- Другие экстренные противошоковые и лечебных мероприятий.
В клинических «Протоколы по оказанию неотложной помощи в акушерской практике» прописан алгоритм действий персонала в случаях поступления женщин с кровотечением, которое осложнено шоковым состоянием. Этот алгоритм предусматривает быстрые и слаженные действия персонала различных отделений.
В приемном отделении роддома осуществляются:
- Совместный осмотр и оценка общего состояния акушер-гинекологом, анестезиологом-реаниматологом, врачом-трансфузиологом и заведующими соответствующих отделений.
- Обеспечение доступа к кровеносной системе путем катетеризации одной из доступных периферических вен. С этой целью используется периферический катетер с возможно максимальным диаметром. Начинается проведение инфузионной терапии кристаллоидными растворами с резервной щелочностью (стерофундин, трисоль и др.), а при сниженном артериальном давлении — препараты гидроксиэтилкрахмала, желатиновые растворы (гелофузин).
- Одновременное проведение минимального объема обследований (определение группы и резус-фактора крови, общих анализов крови и мочи, коагулограммы и т.
 д.), а также заказ одногрупных эритромассы и свежезамороженной плазмы.
д.), а также заказ одногрупных эритромассы и свежезамороженной плазмы. - Введение желудочного зонда (при необходимости) и внутривенно Церукала в целях предотвращения аспирации желудочного содержимого.
- Оценка адекватности дыхания пациентки, проходимости дыхательных путей, ингаляция кислорода через маску или (при необходимости) интубация трахеи с дальнейшим проведением искусственной вентиляции легких.
- Транспортировка в родильно-операционный блок на каталке.
В родильно-операционном блоке:
- Проводится катетеризация центральной вены в целях проведения инфузионно-трансфузионной терапии и контроля показателей центрального венозного давления. При технических затруднениях катетеризации центральной вены проводится дополнительная катетеризация 2 – 3-х периферических вен.
- Вводится катетер в мочевой пузырь в целях контроля диуреза.
- Оценивается общее состояние и состояние гемодинамики, а также осуществляется проведение базовых исследований.
- При наличии признаков дыхательной недостаточности (сатурация ниже 90%) и продолжающегося кровотечения проводится интубация трахеи с дальнейшей искусственной вентиляцией легких.
- Проведение вагинального исследования при приготовленной (развернутой) операционной, во время которого уточняются диагноз, объем потери крови и акушерская ситуация в целях определения способа родоразрешения с дальнейшим его экстренным проведением.
- Осуществляется проведение инфузионно-трансфузионной терапии в соответствии с объемами кровопотери и стадией шока.
- Вводятся свежезамороженная плазма, глюкокортикостероидные препараты, а также Гордокс или Контрикал внутривенно в целях предупреждения развития ДВС-синдрома.
- Согревание пациентки.
- Экстренное проведение операции кесарева сечения.
В раннем послеоперационном периоде
Алгоритм лечения заключается в:
- Трансфузии эритроцитарной массы в случае гемоглобина крови у женщины меньше 70 г/л.

- Инфузионной терапии, расчет которой осуществляется с учетом суточных физиологических потребностей под контролем выделения мочи (не меньше 30 мл в 1 час) и величины центрального венозного давления.
- Проведении профилактики тромбоэмболий. С этой целью при нормальной свертываемости крови через 6 часов после родов или кесарева сечения вводятся антикоагулянты — гепарин или его фракционированные производные (фраксипарин, клексан, фрагмин или другие).
- Прекращении искусственной вентиляции легких и экстубации трахеи при условии полного выведения из шокового состояния, восстановления сознания и тонуса мышц пациентки, ее адекватном спонтанном дыхании, стабилизации гемодинамических показателей.
- Проведении внутривенного курса антибиотиками и антибактериальными препаратами посредством цефалоспоринов последнего поколения с метронидазолом или защищенных пенициллинов.
- Проведении своевременного повторного хирургического вмешательства (релапаротомии) в случае повторного кровотечения, с коллегиальным решением вопроса о характере повторной операции. В этих случаях кровотечение может быть остановлено путем перевязки подвздошных артерий (внутренних) или проведения гистерээктомии.
- Очень важным фактором является постоянная готовность учреждения к оказанию экстренной помощи, поскольку гораздо легче предупредить развитие шокового состояния у женщины, чем бороться с ним и его последствиями.
Методы профилактики геморрагического шока
В акушерстве они включают:
- Знание причин патологического состояния и выявление факторов риска еще в период диспансеризации в женской консультации.
- Квалифицированное обслуживание персоналом всех уровней и доскональное знание алгоритма оказания помощи в родильном доме, начиная от приемного покоя и заканчивая послеоперационной палатой.
- Готовность врачей, акушерок и медицинских сестер к оказанию неотложной помощи при кровотечениях на любом этапе.
- Постоянная готовность к проведению специфических мер помощи при кровотечении не только персонала, но и соответствующего оборудования, инструментария, медикаментозных средств, необходимых для быстрого проведения диагностических мероприятий, интенсивной терапии или реанимации.

Чрезвычайно важным является правильное руководство персоналом в целях согласованности его действий, осуществления быстрого и четкого оказания лечебно-диагностической помощи.
Обильное кровотечение при травме • LITFL • CCC Trauma
Пересмотрена и доработана 5 августа 2015 г.
ОБЗОР
Цели управления
- «НАЙТИ кровотечение, ОСТАНОВИТЕ кровотечение»
- Быстрое и эффективное восстановление объема крови
- Поддержание функционального состава крови для сохранения функции крови:
— гемостаз, кислородная переносимость, онкотическое давление и биохимия
Критическое кровотечение является серьезным опасное для жизни кровотечение, которое может потребовать массивного переливания крови.
ИСТОЧНИК КРОВОТЕЧЕНИЯ
Удобно рассматривать травмы 6 регионов, на которые может приходиться большая кровопотеря:
- «Улица»: кожа головы и внешние источники (особенно маленькие дети)
- Грудь
- Живот
- Длинные кости (особенно бедра)
- Таз
- Забрюшинное пространство
Не ищите удовлетворения и соглашайтесь на одно место кровотечения … Будьте внимательны и систематичны.
«Думайте SCALPER при обнаружении кровотечения»
ПОДХОД К УПРАВЛЕНИЮ КРОВОТЕЧЕНИЕМ
Всякий раз, когда вы думаете «остановить кровотечение», думайте «исправьте коагулопатию»
Тактика остановки кровотечения:
- Обратитесь за помощью пораньше (например,грамм. хирург, терапевт, анестетик, отделение интенсивной терапии)
- Найдите причину
- Первоначальные меры, такие как:
— Прямое давление и подъем,
— Марля, пропитанная адреналином, гемостатические повязки
— Редукция и наложение шины на переломы длинных костей и таза
— Жгуты - Инвазивные меры, такие как:
— швы
— тампонада, тампонада или катетер Фолея с надутым баллоном
— перевязка сосудов
— прижигание
— интервенционная радиология
— хирургическое вмешательство по борьбе с повреждениями РУКОВОДСТВО ПО ДАВЛЕНИЮТрадиционное обучение ATLS считало, что:
- Если пальпируется только пульс сонной артерии, систолическое артериальное давление (САД) составляет 60-70 мм рт.
 Ст.
Ст. - Если пульс сонной и бедренной артерий пальпируется, САД составляет 70-80 мм рт. САД> 80 мм рт. ст.
На самом деле импульсы теряются в таком порядке (радиальный, затем бедренный, затем сонный), но САД, при котором они исчезают, варьируется и часто ниже, чем советует ATLS.Таким образом, руководство ATLS будет иметь тенденцию к завышению артериального давления.
КЛАССИФИКАЦИЯ СТАДИИ ГЕМОРРАГИЧЕСКОГО ШОКА
Самый простой способ запомнить категории — это подумать о счетах в игре в теннис:
Любовь — 15-30-40 — игра окончена (> 40)
Эти этапы описаны в ATLS следующим образом:
- Класс 1
- Кровопотеря: до 750 мл или 15% объема крови
- Частота сердечных сокращений: <100 / мин
- Артериальное давление: нормальное
- Пульсовое давление (мм рт. Ст.): Нормальное / повышенное
- Частота дыхания: 14 -20 / мин
- Диурез:> 30 мл / ч
- ЦНС: слегка тревожный
- ЧСС минимально повышена или нормальна (<100) Как правило, нет изменений артериального давления, пульсового давления или частоты дыхания.
- Класс 2
- Кровопотеря: 750-1500 мл или 15-30% объема крови
- Частота сердечных сокращений: 100-120 / мин
- Артериальное давление: нормальное
- Пульсовое давление (мм рт. Ст.): Пониженное
- Респираторные органы скорость: 20-30 / мин
- Моча: 20-30 мл / ч
- ЦНС: легкая тревога
- Класс 3
- Кровопотеря: 1500-2000 мл или 30-40% объема крови
- Частота сердечных сокращений : 120-140 / мин
- Артериальное давление: пониженное
- Пульсовое давление (мм рт. Ст.): Пониженное
- Частота дыхания: 30-40 / мин
- Диурез: 5-15 мл / ч
- ЦНС: тревога, спутанность сознания
- Класс 4
- Кровопотеря:> 2000 мл или> 40% объема крови
- Частота сердечных сокращений:> 140 / мин
- Артериальное давление: пониженное
- Пульсовое давление (мм рт.
 Ст.): Пониженное
Ст.): Пониженное - Частота дыхания:> 35 / мин
- Моча: незначительная
- ЦНС: спутанность сознания, вялость
К сожалению, классические стадии геморрагического шока (а-ля ATLS) имеют ограниченное клиническое значение в реальном мире из-за:
- Различия в компенсации за разные виды травм (например,грамм. тупая травма по сравнению с проникающей травмой)
- Возраст (например, притупление физиологических реакций у пожилых)
- Сопутствующие заболевания
- Лекарства (например, бета-блокада может скрыть шок, предотвращая тахикардию)
Кроме того, брадикардия (а не тахикардия) часто наблюдается при сильное кровотечение:
- Согласно одной из теорий, существует 2 фазы реакции на кровотечение:
— начальный выброс катахоламинов с тахикардией, за которым следует
— последующая брадикардия неопределенного механизма (парасимпатически опосредованная?) - Но также, похоже, есть группа пациентов, которые имеют относительную брадикардию — им не удается установить исходную тахикардию.Некоторые также отметили, что брадикардия чаще встречается при острой быстрой кровопотере (Thomas and Dixon, 2004).
- Некоторые объясняют брадикардию стимуляцией блуждающего нерва в результате стимуляции брюшины при внутрибрюшном кровоизлиянии, но брадикардия наблюдалась и при проникающей травме конечности (Thompson et al, 1990).
СМЕРТЕЛЬНАЯ ТРИАДА И ОСТРАЯ КОАГУЛОПАТИЯ ТРАВМЫ / ШОКА
Смертельная триада:
- Гипотермия
- Коагулопатия
- Ацидоз
Эти три фактора вызывают и способствуют острой коагулопатии травмы / шока (ACoTS) , которая приводит к обширному кровотечению и является его результатом.
- Они питаются друг другом, так что кровотечение вызывает еще большее кровотечение.
- Это теоретическое обоснование реанимации по борьбе с повреждениями (см.
 Ниже).
Ниже).
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ГИПОТЕРМИИ
Предотвратить и лечить переохлаждение можно с помощью следующих средств:
- Агрессивная реанимация продуктами крови
- Используйте подогретые жидкости (например, подогреватель жидкости уровня 1)
- Bair Hugger или теплые одеяла
- Сведите к минимуму воздействие
- Повысьте температуру окружающей среды
- Непрерывный мониторинг температуры
КОНТРОЛЬ ПОВРЕЖДЕНИЯ РЕАССИТАЦИЯ
Реанимация с контролем повреждений (DCR) — это систематический подход к ведению пациента с травмой с тяжелыми травмами, который начинается в отделении неотложной помощи и продолжается в операционной и отделении интенсивной терапии (ICU)
- DCR направлен на поддержание циркулирующего объема, контроль кровотечения и коррекцию «летальной триады» коагулопатии, ацидоза и гипотермии до тех пор, пока не будет проведено окончательное вмешательство.
- DCR состоит из 3 компонентов:
- ранняя гемостатическая реанимация
- хирургическая коррекция повреждений
- Если пальпируется только пульс сонной артерии, систолическое артериальное давление (САД) составляет 60-70 мм рт.
допустимая гипотензия
- Допустимая гипотензия или минимальная нормотония направлена на избежание чрезмерного введения жидкости (и связанных с этим проблем гемодилюции, перегрузки жидкостью и разрушения сгустка).Обычно рекомендуется целевое САД от 80 до 100 мм рт.
- Поскольку перфузия важнее артериального давления, альтернативной стратегией (как EMCrit) является достижение САД> 65 мм рт. Ст. Вместе с хорошим радиальным пульсом и формой пульсовой волны оксиметрии. Если АД слишком высокое, используйте титрованные аликвоты фентанила (например, 25 мкг внутривенно) для обеспечения симпатолиза, а также обезболивания.
Гемостатическая реанимация
- направлено на предотвращение или облегчение острой коагулопатии травмы и осложнений агрессивной реанимации кристаллоидной жидкостью при поддержании циркулирующего объема
- включает раннее использование продуктов крови в соотношении, аналогичном соотношению цельной крови
Операция по борьбе с повреждениями
- Хирургия по борьбе с повреждениями — это ограниченные хирургические вмешательства, которые служат для остановки кровотечения и сведения к минимуму заражения до тех пор, пока у пациента не появится достаточный физиологический резерв для проведения окончательных вмешательств.

- Стратегия направлена на то, чтобы взять под контроль «смертельную триаду», чтобы пациент мог переносить дальнейшую операцию, когда ему или ей станет лучше.
КРИСТАЛЛОИДНАЯ ВОССТАНОВЛЕНИЕ
Традиционное обучение ATLS заключается в инициировании жидкостной реанимации с помощью 1-2 л кристаллоидов, таких как физиологический раствор или сложный лактат натрия (раствор Хартмана).
Возможные недостатки этого подхода включают:
- коагулопатия разведения
- нарушение доставки кислорода из-за анемии разведения
- гипотермия
- ухудшение метаболического ацидоза (особенно гиперхлоремический неанионный метаболический ацидоз из-за нормального введения физиологического раствора)
- смещение сгустка и кровотечение из-за повышения артериального давления
являются частью обоснования гемостатической реанимации при большом кровотечении при травме.
Ссылки и ссылки
ЛИТФЛ
Журнальные статьи и учебники
- Bickell WH, Wall Jr MJ, et al. Немедленная и отсроченная жидкостная реанимация у гипотензивных пациентов с проникающими повреждениями торса. N Engl J Med. 1994; 331: 1105 [Полный текст]
- Deakin CD, Low JL. Точность расширенных рекомендаций по жизнеобеспечению при травмах для прогнозирования систолического артериального давления с использованием сонных, бедренных и лучевых импульсов: обсервационное исследование.BMJ. 2000 16 сентября; 321 (7262): 673-4. PMC27481.
- Duchesne JC, et al. Реанимационные мероприятия по борьбе с повреждениями: от отделения неотложной помощи до операционной. Am Surg 2011; 2: 201-6. PMID: 21337881
- Guly HR, Bouamra O, Little R, Dark P, Coats T, Driscoll P, Lecky FE. Проверка достоверности классификации гиповолемического шока ATLS. Реанимация. 2010 сентябрь; 81 (9): 1142-7. PMID: 20619954.
- Poulton TJ. Парадигма ATLS не работает. Ann Emerg Med. 1988 Январь; 17 (1): 107.
 PMID: 3337405.
PMID: 3337405. - Томас I, Диксон Дж.Брадикардия при остром кровотечении. BMJ. 2004 21 февраля; 328 (7437): 451-3. PMC344269.
- Томпсон Д., Адамс С.Л., Барретт Дж. Относительная брадикардия у пациентов с изолированной проникающей травмой живота и изолированной травмой конечности. Ann Emerg Med. 1990 Март; 19 (3): 268-75. PMID: 2310066.
FOAM и веб-ресурсы
Крис — реаниматолог и специалист по ЭКМО в отделении интенсивной терапии Альфреда в Мельбурне. Он также является руководителем инноваций Австралийского центра инноваций в области здравоохранения при Альфреде здравоохранения и клиническим адъюнкт-профессором Университета Монаша.Он является соучредителем сети преподавателей-клиницистов Австралии и Новой Зеландии (ANZCEN) и руководит программой инкубатора преподавателей-клиницистов ANZCEN. Он входит в совет директоров Фонда интенсивной терапии и является экзаменатором первой части Медицинского колледжа интенсивной терапии. Он является всемирно признанным педагогом-клиницистом, стремящимся помочь врачам учиться и улучшать клинические показатели отдельных лиц и коллективов.
После получения степени доктора медицины в Оклендском университете он продолжил аспирантуру в Новой Зеландии, а также на Северной территории Австралии, Перте и Мельбурне.Он прошел стажировку в области интенсивной терапии и неотложной медицины, а также аспирантуру по биохимии, клинической токсикологии, клинической эпидемиологии и профессиональному медицинскому образованию.
Он активно участвует в использовании трансляционного моделирования для улучшения ухода за пациентами и проектирования процессов и систем в Alfred Health. Он координирует образовательные и симуляционные программы отделения интенсивной терапии Альфреда и ведет образовательный веб-сайт отделения INTENSIVE. Он создал курс «Critically Ill Airway» и преподает на многих курсах по всему миру.Он является одним из основателей движения FOAM (Бесплатное медицинское образование с открытым доступом) и соавтором litfl. com, подкаста RAGE, курса реаниматологии и конференции SMACC.
com, подкаста RAGE, курса реаниматологии и конференции SMACC.
Его одно большое достижение — это то, что он отец двоих замечательных детей.
В Твиттере он @precordialthump.
| ИНТЕНСИВНЫЙ | RAGE | Реаниматология | SMACC
Геморрагический шок: история болезни, патофизиология, эпидемиология
Автор
Джон Удеани, доктор медицины, FAAEM Доцент, кафедра неотложной медицины, Медицинский и научный университет Чарльза Дрю, Калифорнийский университет, Лос-Анджелес, медицинская школа Дэвида Геффена
Джон Удеани, доктор медицины, FAAEM является членом следующие медицинские общества: Американская академия неотложной медицины, Американский колледж врачей неотложной помощи
Раскрытие информации: нечего раскрывать.
Специальная редакционная коллегия
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Получил зарплату от Medscape за работу. для: Medscape.
Роберт Л. Шеридан, доктор медицины Заместитель начальника штаба, начальник ожоговой хирургии, Больница Шрайнерс Бернс; Доцент кафедры хирургии отделения травм и ожогов, Массачусетская больница общего профиля и Гарвардская медицинская школа
Роберт Л. Шеридан, доктор медицины, является членом следующих медицинских обществ: Американская академия педиатрии, Американская ассоциация хирургии травм , Американская ожоговая ассоциация, Американский колледж хирургов
Раскрытие информации: Получен исследовательский грант от: Детских больниц Шрайнерс; Physical Sciences Inc, Mediwound.
Главный редактор
Джон Гейбель, доктор медицины, магистр, доктор наук, AGAF Заместитель председателя и профессор отделения хирургии отделения желудочно-кишечной медицины, профессор отделения клеточной и молекулярной физиологии Медицинской школы Йельского университета; Директор хирургических исследований хирургического отделения больницы Йель-Нью-Хейвен; Член Американской гастроэнтерологической ассоциации; Член Королевского медицинского общества
Джон Гейбель, доктор медицинских наук, магистр, доктор наук, AGAF является членом следующих медицинских обществ: Американской гастроэнтерологической ассоциации, Американского физиологического общества, Американского общества нефрологов, Ассоциации академической хирургии, Международного общества нефрологов. , Нью-Йоркская академия наук, Общество хирургии пищеварительного тракта
, Нью-Йоркская академия наук, Общество хирургии пищеварительного тракта
Раскрытие: Ничего не раскрывать.
Дополнительные участники
Льюис Дж. Каплан, доктор медицинских наук, FACS, FCCM, FCCP Профессор хирургии, отделение травм, критической хирургической помощи и неотложной хирургии, отделение хирургии Медицинской школы Перельмана при Университете Пенсильвании; Начальник отделения интенсивной хирургической помощи, Медицинский центр по делам ветеранов Филадельфии
Льюис Дж. Каплан, доктор медицинских наук, FACS, FCCM, FCCP является членом следующих медицинских обществ: Американской ассоциации хирургии травм, Американского колледжа хирургов, Ассоциации академических наук. Хирургия, Ассоциация хирургического образования, Государственное медицинское общество Коннектикута, Восточная ассоциация хирургии травм, Международное общество травматологической анестезии и интенсивной терапии, Общество по улучшению управления кровью, Общество интенсивной терапии, Общество хирургической инфекции
Раскрытие: ничего раскрывать.
Геморрагический шок — ScienceDirect
Цель: Рассмотреть клинические аспекты геморрагического шока и дать рекомендации по терапии.
Опции: Раннее распознавание геморрагического шока и своевременное систематическое вмешательство помогут избежать неблагоприятных исходов.
Результаты: Разработать руководящие принципы для помощи в раннем распознавании геморрагического шока и проведения реанимационных мероприятий организованным и научно обоснованным образом.
Доказательства: Ссылки в Medline были запрошены с использованием термина MeSH «геморрагический шок». Были рассмотрены все статьи, опубликованные в дисциплинах акушерства и гинекологии, хирургии, травмах, реанимации, анестезии, фармакологии и гематологии с 1 января 1990 г. по 31 августа 2000 г., а также основные учебники из этих областей.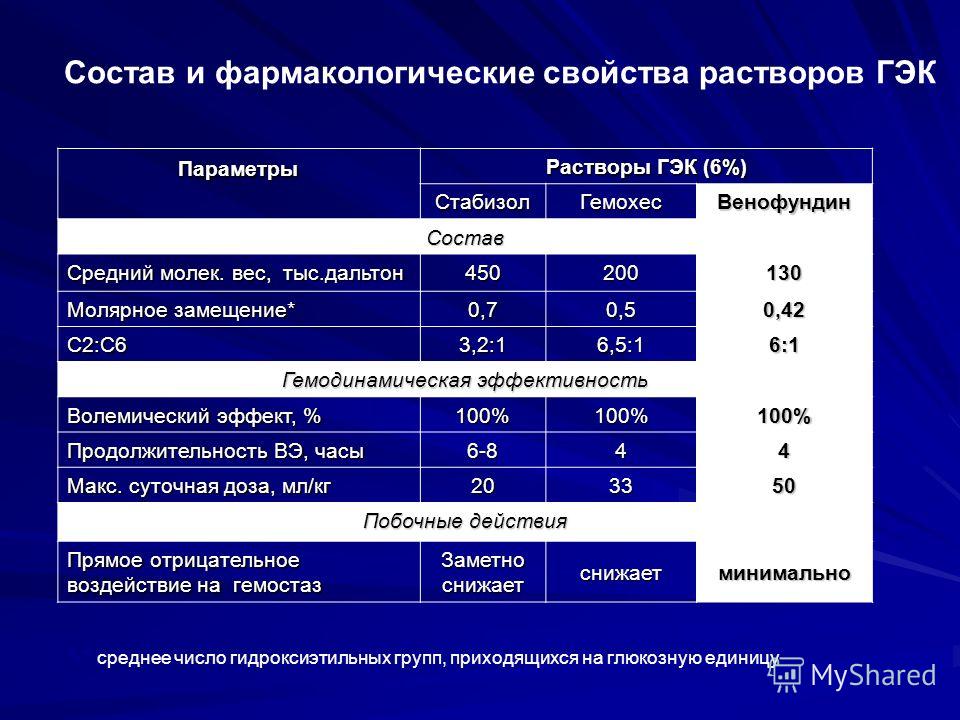 Также были получены и проанализированы избранные ссылки из этих статей и глав книг. Уровень доказательности был определен с использованием критериев, описанных Канадской целевой группой по периодическому обследованию состояния здоровья.
Также были получены и проанализированы избранные ссылки из этих статей и глав книг. Уровень доказательности был определен с использованием критериев, описанных Канадской целевой группой по периодическому обследованию состояния здоровья.
Рекомендации:
- 1.
Клиницисты должны быть знакомы с клиническими признаками геморрагического шока. (III-B)
- 2.
Клиницисты должны быть знакомы со стадиями геморрагического шока. (III-B)
- 3.
Клиницисты должны оценить риск геморрагического шока каждой женщины и соответствующим образом подготовиться к процедуре. (III-B)
- 4.
Реанимация после геморрагического шока должна включать адекватную оксигенацию.(II-3A)
- 5.
Реанимация после геморрагического шока должна включать восстановление циркулирующего объема путем установки двух внутривенных инъекций большого диаметра и быстрой инфузии сбалансированного кристаллоидного раствора. (I-A)
- 6.
Изотонические кристаллоидные или коллоидные растворы могут использоваться для замещения объема при геморрагическом шоке (I-B). В лечении геморрагического шока (I-E) нет места гипотоническим растворам декстрозы.
- 7.
Переливание компонентов крови показано, когда недостатки были документально подтверждены клинической оценкой или гематологическими исследованиями (II-2B).Их следует подогревать и вводить через фильтрованные трубопроводы физиологическим раствором, без добавок и лекарств (II-3B).
- 8.
Вазоактивные агенты редко показаны при лечении геморрагического шока и должны рассматриваться только тогда, когда объемное замещение завершено, кровотечение остановлено и гипотензия продолжается. Их следует проводить в отделениях интенсивной терапии с помощью многопрофильной бригады. (III-B)
- 9.
Соответствующая реанимация требует постоянной оценки ответа на терапию, включая клиническую оценку, а также гематологические, биохимические и метаболические оценки.
 (III-B)
(III-B)- 10.
При геморрагическом шоке рекомендуется быстрое распознавание и остановка источника кровотечения с одновременным проведением реанимационных мероприятий. (III-B)
Подтверждение: Это руководство было рассмотрено Комитетом по клинической практике акушерства и одобрено Исполнительным комитетом и Советом Общества акушеров и гинекологов Канады.
Спонсоры: Общество акушеров и гинекологов Канады.
Геморрагический шок — обзор
4.1 Геморрагический шок и ишемия-реперфузионная травма
Геморрагический шок — это опасное для жизни состояние, связанное с травматическим повреждением, с расчетным уровнем смертности 55,9 на каждые 100000 человек (Sawant, Tharakan, Hunter, & Чайлдс, 2014). Основная проблема реанимации пациентов с геморрагическим шоком заключается в том, что внутривенные жидкости, вводимые для восстановления центрального объема жидкости и кровяного давления, выходят из микроциркуляции.Следствием образовавшегося отека является гипоперфузия конечных органов и полиорганная недостаточность. Травматические повреждения, которые приводят к полиорганной недостаточности, составляют 51–60% смертей, связанных с травмами (Dewar, Moore, Moore, & Balogh, 2009).
Наша лаборатория исследовала влияние геморрагического шока и реанимации (HSR), острой алкогольной интоксикации и их комбинации на микрососудистую барьерную функцию брыжейки кишечника (Doggett, Alves, Yuan, & Breslin, 2017; Doggett & Breslin, 2014). ), который, как было показано, особенно подвержен ишемическому повреждению после геморрагического шока (Hollenberg, 2011).Используя модель HSR на крысах, мы обнаружили, что алкогольная интоксикация усугубляет индуцированную HSR гипотензию и повышенную проницаемость микрососудов для альбумина. Механизм повышенной проницаемости может быть частично объяснен дезорганизацией VE-кадгерина в межклеточных соединениях между эндотелиальными клетками после травмы или алкогольной интоксикации (Doggett & Breslin, 2014). Внутривенное введение биоактивного липидного сфингозин-1-фосфата (S1P) было протестировано как фармакологическое вмешательство во время реанимации, чтобы проверить, можно ли его использовать для ослабления эффектов комбинированной алкогольной интоксикации и HSR (Doggett et al., 2017). S1P представляет собой эндогенный биоактивный липид, продуцируемый клеточными мембранами, и предыдущие сообщения показали, что S1P усиливает барьерную функцию в культивируемых эндотелиальных клетках и изолированных микрососудах крыс и снижает гиперпроницаемость микрососудов in vivo в легких мыши (Adamson et al., 2010; Sammani et al. др., 2010; Синглтон, Дудек, Чан и Гарсия, 2005). Мы провели дозозависимое исследование эффективности S1P и обнаружили, что S1P, вводимый в дозе 0,1 мг / кг во время реанимации, значительно снижает комбинированную гиперпроницаемость микрососудов для альбумина, вызванную HSR и алкогольной интоксикацией.Этот эффект отразился на среднем артериальном давлении, которое было значительно повышено после реанимации у крыс, получавших S1P, по сравнению с контрольной группой (Doggett et al., 2017).
Внутривенное введение биоактивного липидного сфингозин-1-фосфата (S1P) было протестировано как фармакологическое вмешательство во время реанимации, чтобы проверить, можно ли его использовать для ослабления эффектов комбинированной алкогольной интоксикации и HSR (Doggett et al., 2017). S1P представляет собой эндогенный биоактивный липид, продуцируемый клеточными мембранами, и предыдущие сообщения показали, что S1P усиливает барьерную функцию в культивируемых эндотелиальных клетках и изолированных микрососудах крыс и снижает гиперпроницаемость микрососудов in vivo в легких мыши (Adamson et al., 2010; Sammani et al. др., 2010; Синглтон, Дудек, Чан и Гарсия, 2005). Мы провели дозозависимое исследование эффективности S1P и обнаружили, что S1P, вводимый в дозе 0,1 мг / кг во время реанимации, значительно снижает комбинированную гиперпроницаемость микрососудов для альбумина, вызванную HSR и алкогольной интоксикацией.Этот эффект отразился на среднем артериальном давлении, которое было значительно повышено после реанимации у крыс, получавших S1P, по сравнению с контрольной группой (Doggett et al., 2017).
Апоптотическая передача сигналов также предположительно вносит вклад в HSR-индуцированную дисфункцию барьера эндотелиальных клеток в серии исследований Чайлдса и его коллег. Вслед за HSR увеличение проапоптотического белка Bh4 BAK в мезентериальном микроциркуляторном русле инициирует опосредованную митохондриями внутреннюю апоптотическую передачу сигналов с увеличением количества активных форм кислорода и высвобождением апоптогенного белка цитохрома c .Это приводит к активации эффекторной каспазы-3 и последующему расщеплению и разрушению слипшихся белков, что приводит к увеличению проницаемости параклеточных эндотелиальных клеток. Кроме того, трансфекция пептида BAK на модели крыс приводила к увеличению проницаемости микрососудов за счет активации каспазы-3 (Childs, Tharakan, Hunter, Tinsley, & Cao, 2007). В последующем исследовании они исследовали, какой митохондриальный комплекс, вовлеченный в цепь переноса электронов, отвечает за образование АФК и повышенную проницаемость. Используя культивированные эндотелиальные клетки микрососудов легких крыс, они обнаружили, что ингибирование комплекса III митохондриальной цепи переноса электронов приводит к снижению BAK-индуцированного образования ROS и высвобождения цитохрома c , а также к ослаблению проницаемости микрососудов. Ингибирование других комплексов и цитоплазматических ферментов не показало защиты от BAK-индуцированного образования ROS и гиперпроницаемости эндотелия, подтверждая роль митохондриально-опосредованной внутренней апоптотической активации сигнализации в разрушении эндотелиального барьера за счет увеличения ROS и высвобождения цитохрома c (Childs, Tharakan, Хантер, Исонг и Лиггинс, 2008 г.).
Используя культивированные эндотелиальные клетки микрососудов легких крыс, они обнаружили, что ингибирование комплекса III митохондриальной цепи переноса электронов приводит к снижению BAK-индуцированного образования ROS и высвобождения цитохрома c , а также к ослаблению проницаемости микрососудов. Ингибирование других комплексов и цитоплазматических ферментов не показало защиты от BAK-индуцированного образования ROS и гиперпроницаемости эндотелия, подтверждая роль митохондриально-опосредованной внутренней апоптотической активации сигнализации в разрушении эндотелиального барьера за счет увеличения ROS и высвобождения цитохрома c (Childs, Tharakan, Хантер, Исонг и Лиггинс, 2008 г.).
Ишемия / реперфузия (I / R), вызванная геморрагическим шоком, вызывает провоспалительные сигналы в эндотелиальных клетках посткапиллярных венул. Данные исследований с использованием гипоксии и реоксигенации на монослоях эндотелиальных клеток в качестве модели повреждения I / R предполагают, что усиление движения лейкоцитов в этих микрососудах является результатом повышенной экспрессии различных молекул адгезии эндотелиальных клеток на поверхности как лейкоцитов, так и эндотелия (Ichikawa et al., 1997).Было показано, что ишемия и реперфузионное повреждение на изолированной модели легкого крысы увеличивают проницаемость и вес легких с активацией молекулы адгезии CD31 (Chiang, Chuang, & Liu, 2011). Продукция ROS, индуцированная деполяризацией мембран эндотелиальных клеток, также участвует в воспалении I / R и экстравазации лейкоцитов. Уменьшение кровотока — это механический стимул, воспринимаемый комплексом, состоящим из молекулы адгезии PECAM, рецепторов VEGF и VE-кадгерина, который находится в кавеолах эндотелиальных клеток (Chatterjee, Nieman, Christie, & Fisher, 2014).Активация этого комплекса приводит к деполяризации мембраны эндотелиальных клеток и последующей генерации ROS, которая нарушает целостность соединения эндотелиальная клетка-клетка и нарушает эндотелиальный барьер, приводя к повышенной проницаемости (Gilmont et al. , 1998).
, 1998).
Эндотелиальный гликокаликс — еще один важный компонент сосудистого эндотелия, который разрушается во время геморрагического шока и травмы I / R . Гликокаликс состоит из протеогликанов, молекул гликозаминогликанов и гликопротеинов и расположен на просветной стороне кровеносных сосудов, охватывая мембрану эндотелиальных клеток (Reitsma, Slaaf, Vink, van Zandvoort, & oude Egbrink, 2007).Ранние исследования установили, что эндотелиальный гликокаликс является важным фактором проницаемости микрососудов (Henry & Duling, 1999; Vink & Duling, 2000). Например, ферментативное удаление гликокаликса в капиллярах миокарда крысы вызывает отек миокарда (van den Berg, Vink, & Spaan, 2003). Некоторые исследования показали деградацию эндотелиального гликокаликса после ишемического реперфузионного повреждения, а также после продолжительной модели геморрагического шока и реанимации с фиксированным давлением (Kozar et al., 2011; Mulivor & Lipowsky, 2002). Однако в большинстве исследований гликокаликс оценивался на основании посмертных изображений, полученных с помощью электронной микроскопии. Совсем недавно Торрес Филхо и др. показали уменьшение толщины гликокаликса микрососудов in vivo при геморрагической гипотензии. Используя модель кровотечения фиксированного объема на крысах, они показали значительное вызванное кровотечением уменьшение на 59% толщины гликокаликса в венулах скелетных мышц по сравнению с контрольными крысами, и что венулы с наибольшим снижением гликокаликса показали наибольшее снижение местного кровотока. (Торрес Филью, Торрес, Сондин, Поликратис и Дубик, 2013 г.).В более недавнем исследовании, в котором они проверяли эффективность семи различных реанимационных жидкостей после кровотечения фиксированного объема, они обнаружили отрицательную корреляцию между проницаемостью микрососудов и толщиной гликокаликса, и что уровни в плазме компонентов гликокаликса синдекана-1 и гепарансульфата были положительными. коррелирует с проницаемостью микрососудов (Torres Filho, Torres, Salgado, & Dubick, 2016), предполагая важную роль гликокаликса в функции эндотелиального барьера во время кровотечения и реанимации.
Исследования, проведенные доктором Торресом Филью и другими, показали, что реанимация свежезамороженной плазмой (СЗП) и свежей цельной кровью после геморрагического шока коррелирует с эндотелиальным восстановлением гликокаликса и его компонента синдекана-1 (Sdc-1) ( Торрес Филхо и др., 2016). Другая группа продемонстрировала специфический вклад Sdc-1 в опосредованную FFP защиту в эндотелии легких. Обработка FFP усиливала экспрессию Sdc-1 на монослоях легочных эндотелиальных клеток.Когда экспрессия Sdc-1 подавлялась, проницаемость была выше, и формирование стрессовых волокон было очевидным при обработке FFP. В том же исследовании на модели геморрагического шока (HS) проницаемость микрососудов легких была значительно увеличена по сравнению с фиктивным контролем. При сравнении реанимации с применением лактатных звонарей (LR) и FFP, FFP показала уменьшение утечки микрососудов (Peng et al., 2013). Мыши Sdc1 — / — также показали повышенную проницаемость легких после HS, однако лечение FFP не показало преимущества по сравнению с реанимацией LR.Потеря Sdc1 in vivo также не приводила к различию между LR и FFP в снижении показателей легочного повреждения и маркеров воспаления после кровотечения. Кроме того, мыши Sdc1 — / — продемонстрировали значительное увеличение экспрессии легочного синдекана-4 после реанимации HS и FFP по сравнению с животными, реанимированными с помощью LR, показывая, что другие члены семейства синдеканов могут компенсировать потерю Sdc1 для поддержания целостность гликокаликса. Эти результаты подтверждают роль компонентов гликокаликса в модуляции опосредованной FFP защиты легочного эндотелиального барьера после геморрагического шока (Peng et al., 2013).
Ведение неконтролируемого геморрагического шока | Анестезиология
КРОВОЛЕЧЕНИЕ остается основной причиной ранней смерти после травм. Недавний обзор всех последовательных смертей в травматологическом центре уровня 1 показал, что необратимый шок с повреждением центральной нервной системы или без него составлял 37% всех причин смерти.1 Реанимация жертв гипотонии основана на том, что необходимо обеспечить адекватную перфузию жизненно важных органов. быть восстановленным как можно скорее.Однако одним из побочных эффектов большинства методов увеличения перфузии органов является повышенное кровяное давление, которое перед лицом неконтролируемого кровотечения может усилить кровотечение и иметь неблагоприятные последствия, которые могут перевесить потенциальные преимущества улучшения перфузии. Реанимация пациентов с геморрагическим шоком в основном концентрируется на введении жидкости, при этом продолжаются дискуссии о времени, объеме и характере используемого раствора. Использование вазопрессоров, хотя и не рекомендуется в качестве терапии первой линии у пациентов с геморрагическим шоком, может помочь быстро восстановить артериальное давление до желаемого уровня, ограничивая при этом объем вводимой жидкости.В этом выпуске Anesthesiology Poloujadoff et al. 2 исследовали влияние норэпинефрина в сочетании с инфузией физиологического раствора на краткосрочную выживаемость у анестезированных кетамином крыс, перенесших неконтролируемый геморрагический шок. Используя хорошо известную экспериментальную модель, авторы красиво показали, что введение промежуточной дозы норэпинефрина в сочетании с жидкостями при гипотензивной или нормотензивной реанимации приводит к улучшению краткосрочной выживаемости.Интересно, что все животные, получавшие более высокую дозу норадреналина, погибли, как и животные, перенесшие нормотензивную реанимацию с использованием только жидкостей.
Основная цель жидкостной реанимации от неконтролируемого геморрагического шока — увеличить доставку кислорода к жизненно важным органам для поддержания жизнеспособности, но не увеличить кровотечение перед гемостазом. Оптимальную жидкость для этой ограниченной жидкостной реанимации еще предстоит определить.Среди почти изотонических кристаллоидов появляется все больше экспериментальных доказательств того, что раствор Рингера с лактатом превосходит физиологический раствор для реанимации неконтролируемого геморрагического шока и может быть связан с улучшением выживаемости.3,4 Хотя тип жидкости может иметь значение, он кажется еще более важным. для адаптации количества вводимой жидкости в соответствии с заранее определенными клиническими конечными точками («контролируемая» реанимация) 5
У пациентов с геморрагическим шоком текущие международные рекомендации по реанимации рекомендуют использование вазопрессоров при неизбежной электрической активности без пульса или брадиасистолическом ритме.В модели травмы печени с неконтролируемым и иначе смертельным геморрагическим шоком у свиней, имитирующих эти состояния, вазопрессин, но не адреналин, или жидкостная реанимация увеличивают краткосрочную выживаемость.6,7 В аналогичной модели реанимация гипертоническим гиперонкотическим гидроксиэтилкрахмалом небольшого объема в сочетании с любым норадреналин или вазопрессин приводили к сходным показателям выживаемости, гемодинамическому профилю и восстановлению энергетического метаболизма мозга.8 Однако использование вазопрессоров также может иметь потенциальные преимущества при реанимации после ранних стадий геморрагического шока.Они увеличивают венозный возврат к сердцу за счет своего воздействия на тонус венозных сосудов. Они могут быть эффективными при лечении сосудорасширяющего компонента гипотензии. Их использование также может помочь быстро восстановить кровяное давление до желаемого уровня, ограничивая при этом объем вводимой жидкости, что может представлять особый интерес, когда кровоизлияние связано с черепно-мозговой травмой. В этих условиях есть экспериментальные доказательства того, что стратегия реанимации, сочетающая в себе жидкости и вазопрессоры, улучшала результат по сравнению с использованием только жидкостей или вазопрессоров.9,10 Результаты исследования Poloujadoff et al. 2 соответствуют этим наблюдениям.
В этих различных моделях геморрагического шока, с ассоциированной черепно-мозговой травмой или без нее, вазопрессин не продемонстрировал явного превосходства над катехоламинами, характеризующимися выраженными α-адренергическими свойствами, такими как фенилэфрин или норадреналин. Вазопрессин восстанавливает тонус сосудов при вазоплегическом шоке с помощью по крайней мере четырех известных механизмов: активация сосудистых рецепторов V1, модуляция аденозинтрифосфат-чувствительных каналов K + , модуляция оксида азота и усиление адренергических и других сосудосуживающих агентов (таких как ангиотензин II). ) агенты.Из-за его возможного воздействия на сократимость миокарда и коронарную сосудистую сеть, его использование в контексте геморрагического шока следует использовать только в ситуациях, не отвечающих на замещение объема и катехоламиновые вазопрессоры11
.Как подчеркнули Полужадофф и др. , 2 анестетики могут влиять на сердечно-сосудистую реакцию на кровотечение у экспериментальных животных. Большинство анестетиков блокируют симпатическую реакцию на стресс в зависимости от дозы.Однако симпатическая система играет важную роль в перераспределении кровотока от органов с относительно низкой потребностью в кислороде, таких как внутренняя область и кожа, в ткани с высокой метаболической потребностью, такие как мозг и сердце. Это перераспределение кровотока позволяет организму регулировать извлечение кислорода, когда доставка кислорода к тканям снижается. Блокируя симпатическую реакцию на стресс, анестетики могут изменять этот компенсаторный механизм, тем самым снижая устойчивость экспериментальных животных к кровотечению.Кетамин, обладающий косвенными симпатомиметическими свойствами, в меньшей степени влиял на способность тканей извлекать кислород. Эти наблюдения могли объяснить благоприятные эффекты кетамина в различных моделях геморрагического шока по сравнению с другими анестетиками.
Хотя он требует клинической проверки, подход, предложенный Poloujadoff et al. 2 выглядит довольно привлекательно. Действительно, комбинированное использование жидкостей и вазоконстрикторов для восстановления и поддержания заданного целевого давления перфузии в соответствии с состоянием пациента может быть более эффективным подходом, снижая при этом риски побочных эффектов, связанных с применением каждого вида лечения по отдельности.
| Определение (MEDLINEPLUS) | Кровотечение — это потеря крови. Это может произойти внутри или вне тела. Кровотечение может быть реакцией на порез или другую рану. Это также может быть результатом травмы внутренних органов. Есть много ситуаций, в которых может произойти кровотечение.Под кожей кровоточит синяк. Некоторые инсульты вызваны кровотечением в головном мозге. Другое кровотечение, такое как желудочно-кишечное кровотечение, кровохарканье или вагинальное кровотечение, может быть симптомом заболевания. Обычно при кровотечении в крови образуются сгустки, останавливающие кровотечение. Сильное кровотечение может потребовать оказания первой помощи или обращения в отделение неотложной помощи. Если у вас нарушение свертываемости крови, в вашей крови обычно не образуются сгустки. |
| Определение (NCI_NCI-GLOSS) | В медицине — потеря крови из поврежденных сосудов.Кровоизлияние может быть внутренним или внешним и обычно включает сильное кровотечение за короткое время. |
| Определение (NCI) | Кровоток из разорванного кровеносного сосуда. |
| Определение (MSH) | Кровотечение или утечка крови из сосуда. |
| Определение (CSP) | утечка крови из сосудов; кровотечение. |
| Концепции | Патологическая функция ( T046 ) |
| MSH | D006470 |
| ICD9 | 459.0 |
| ICD10 | R58 |
| SnomedCT | 123106001, 303123004, 155459009, 195511004, 131148009, 50960005 |
| LNC | LA7418-2, LA7441-4 |
| Английский | Кровоизлияния, Кровотечение, Кровоизлияние, БДУ КРОВОТЕЧЕНИЯ, БДУ КРОВОТЕЧЕНИЯ, Кровоизлияние БДУ, Кровоизлияние неуточненное, Кровоизлияние БДУ, кровоизлияние, кровотечение (диагноз), кровотечение (симптом), кровотечение, Кровотечение, кровотечение неуточненное, кровотечение неуточненное, кровотечение неуточненное Рубец, Кровоизлияние (БДУ), Термин кровоизлияния, Кровоизлияние [заболевание / обнаружение], проблема с кровотечением, проблемы с кровотечением, кровотечения, кровоизлияния, кровотечение, кровотечение, кровопотеря, Кровоизлияние БДУ (нарушение), кровотечение (нарушение), кровотечение БДУ (нарушение) , КРОВОТЕЧЕНИЕ, КРОВОТЕЧЕНИЕ, Экстравазация крови, Кровопотеря, Кровотечение, Кровотечение (морфологическая аномалия), Кровотечение (обнаруженное), кровь; экстравазация, экстравазация; кровь, кровотечение, БДУ, Кровотечение, БДУ, Кровоизлияние, БДУ, кровотечение-ПРЕКРАЩЕННОЕ-, кровотечение |
| Итальянский | Stravaso di sangue, Emorragia NAS, Emorragia (NAS), Emorragia terminale, Emorragia, non specificata, Fuoriuscita di sangue dai vasi sanguigni, Fuoriuscita di sangue, Perdita ematica, NAS, Sanguinamento, Emorragia |
| Голландский | niet-gespecificeerde bloeding, hem, bloedingsperiode, bloeding, niet-gespecificeerde hemorragie, bloedverlies (NAO), геморрагия NAO, геморрагия (NAO), bloed; экстравазация, экстравазия; кровоизлияние, экстравазионное кровоизлияние, геморрагия, кровотечение |
| Французский | Hémorragie SAI, Hémorragie, non précisée, Hém, Hémorragie terminée, Effusion sanguine SAI, HEMORRAGIE SAI, Extravasation sanguine, Hémorragie, Saignement |
| Немецкий | Blutung, unspezifisch, Hem, Bluten, Blutverlust (NNB), Blutung (NNB), Blutung, term, Blutung NNB, BLUTUNG NNB, Austritt von Blut, Blutung, Hämorrhagie |
| Португальский | Hemorragia NE, Heme, Perda de sangue NE, Hemorragia de termo, HEMORRAGIA NE, Extravasão de sangue, Hemorragia, Sangramento |
| Испанский | Pérdida de sangre (NEOM), Hemorragia NEOM, Hemorragia no especificada, Hem, Hemorragia (NEOM), HEMORRAGIA SE, sangrante (Concepto no activo), Haemorrhage NOS, геморрагия, SAI, sangrante, геморрагия, SAI Sangrado, extravasación de sangre, геморрагия (anomalía morfológica), геморрагия (hallazgo), геморрагия, sangrado, Extravasación sanguínea, Hemorragia, Sangramiento |
| Японский | 出血 NOS, 出血 (NOS), 血液 溢出, ケ ツ エ キ イ ツ シ ュ ツ, シ ュ ッ ケ ツ, シ ュ ッ ケ ツ NOS, ケ ツ エ キ イ ッ シ ュ, シ ュ ッ, シ ュ ッ |
| Шведский | Blödning |
| Чешский | hemoragie, krvácení, Ztráta krve z (NOS), Krevní výron, Krvácení, blíže neurčené, Krvácení (NOS), Krvácení, Hem, Krvácení NOS |
| финский | Веренвуото |
| Русский | ГЕМОРРАГИИ, КРОВОТЕЧЕНИЯ, КРОВОИЗЛИАНИЯ, ГЕМОРРАГИИ, КРОВОИЗЛИЯНИЯ, КРОВОТЕЧЕНИЯ |
| Хорватский | КРВАРЕНЬЕ |
| латышский | Не переведено [Кровоизлияние] |
| Польский | Krwotok |
| Венгерский | Vérzés k.m.n., Vérz, Vérzés, Vérzés (k.m.n.), Haemorrhagia, nem meghatározott, Hem, Vérzés ideje, Vérzés, nem meghatározott, Vér extravasatio, Vérvesztés, 9057 k.m.n. |
| Норвежский | Blødning, Hemoragi, Blødninger |
Клинические особенности и лечение геморрагического шока
Элизабет Галлимор Практикующий врач, занимающийся клиническими исследованиями, Онкологический центр Клаттербриджа NHS Foundation Trust Clinical Trials, Уиррал, АнглияВ этой статье обсуждаются клинические особенности геморрагического шока и стратегии, используемые для лечения этого состояния, с уделением особого внимания имеющимся симптомам, классификациям, компенсаторным механизмам, физиологическим изменениям и вмешательствам медсестер.Геморрагический шок — это состояние пониженной перфузии тканей в результате недостаточной доставки кислорода и питательных веществ, необходимых для функционирования клеток. Состояние является вторичным по отношению к большой кровопотере, часто связанной с травмой или осложнениями после хирургических или медицинских процедур. Очень важно выявить и остановить источник неконтролируемого кровотечения. Из-за опасного для жизни характера состояния важно, чтобы геморрагический шок был своевременно выявлен и без промедления было начато соответствующее лечение.
Стандарт сестринского дела . 30, 1, 51-60. doi: 10.7748 / ns.30.1.51.e9955
Переписка Экспертная оценкаВсе статьи проходят внешнее двойное слепое рецензирование и проверяются на плагиат с помощью автоматизированного программного обеспечения.
Поступила: 02.02.2015
Принята к печати: 10 июня 2015 г.
Хотите узнать больше?
Подписаться на безлимитный доступ
Попробуйте доступ на 1 месяц всего за 1 фунт стерлингов и получите:
В ваш пакет подписки входит:- Полный доступ к стандарту ухода.



 Основные задачи инфузионно-трансфузионной терапии — это восстановление и поддержание на адекватном уровне таких показателей, как объем циркулирующей крови, кислородный транспорт и снабжение кислородом тканей, показателей свертывающей системы крови, кислотно-основного состояния и баланса электролитов.
Основные задачи инфузионно-трансфузионной терапии — это восстановление и поддержание на адекватном уровне таких показателей, как объем циркулирующей крови, кислородный транспорт и снабжение кислородом тканей, показателей свертывающей системы крови, кислотно-основного состояния и баланса электролитов. д.), а также заказ одногрупных эритромассы и свежезамороженной плазмы.
д.), а также заказ одногрупных эритромассы и свежезамороженной плазмы.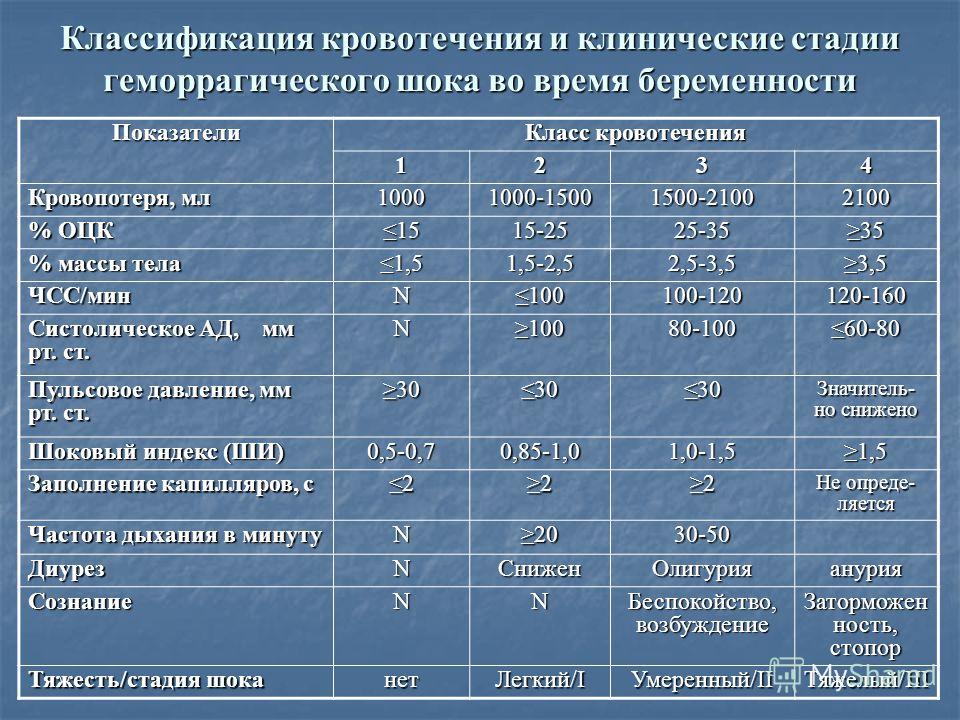

 Ст.
Ст. Ст.): Пониженное
Ст.): Пониженное Ниже).
Ниже).
 PMID: 3337405.
PMID: 3337405. (III-B)
(III-B)