Чем отличается гемоглобин от миоглобина?
Миоглоби́н — кислород-связывающий белок скелетных мышц и мышцы сердца.Миоглобин скелетных мышц и миоглобин миокарда (сердечной мышцы) слегка различны по аминокислотной последовательности. В практической медицине этот факт используется для определения диагноза инфаркта миокарда по появлению специфического «сердечного» изотипа миоглобина (равно как и «сердечных» изотипов некоторых мышечных ферментов) в крови.
В нормальных условиях, в отсутствие повреждения или воспаления мышечной ткани, миоглобин в кровь не попадает.
Подобно гемоглобину, миоглобин высокотоксичен при его нахождении в свободном состоянии в плазме крови: крупные молекулы миоглобина могут закупоривать канальцы почек и приводить к их некрозу; конкурируя с гемоглобином эритроцитов за связывание с кислородом в лёгких и не выполняя функцию отдавания кислорода тканям, свободный миоглобин ухудшает кислородное снабжение тканей и приводит к развитию тканевой гипоксии.
Самоотравление организма свободным миоглобином и как следствие острая почечная недостаточность и тканевая гипоксия — одна из главных причин смерти при синдроме длительного сдавливания (крэш-синдром) , встречающемся при тяжелых травмах со сдавлением или размозжением значительных количеств мышечной ткани.
Гемоглоби́н (от греч. haima — кровь и лат. globus — шар) — сложный железосодержащий белок эритроцитов животных и человека, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани.
Главная функция гемоглобина состоит в транспорте дыхательных газов. В капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином. Током крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются к органам и тканям, где кислорода мало, здесь необходимый для протекания окислительных процессов кислород освобождается из связи с гемоглобином. Кроме того, гемоглобин способен связывать в тканях небольшое количество диоксида углерода (CO2) и освобождать его в лёгких. Монооксид углерода (CO) связывается с гемоглобином крови прочнее, чем кислород, образуя метгемоглобин (metHb, от мета… и гемоглобин, иначе гемиглобин или ферригемоглобин) . Таким образом, блокируется процессы транспортировки кислорода. В метгемоглобине железо гема находится в комплексе или в трёхвален
Миоглобин сравнение с гемоглобином — Справочник химика 21
Особые свойства молекулы гемоглобина, которые делают его столь эффективным переносчиком кислорода в крови, легче всего уяснить из сравнения миоглобина и гемоглобина в отношении их сродства к кислороду. На рис. 8-16 показаны кривые насыщения кислородом для гемоглобина и миоглобина, характе- [c.206]После установления совпадения по матрице, показанной на рис. 9.5, б, можно рассчитать с помощью процедуры, описанной выше для сравнения миоглобина с гемоглобином, кумулятивные вероятности, а следовательно, стандартную значимость родства. [c.237]
Крахмал, но в нем хорошо разделяются веш,ества, молекулярные веса которых лежат в пределах от 100 до 1000. Крахмал, разбухший при нагревании в воде примерно в 3 раза по сравнению с первоначальным размером частиц, становится проницаемым для более крупных молекул, таких, как инсулин, миоглобин и гемоглобин. Аминокислоты движутся через колонку, наполненную крахмалом, примерно в такой же последовательности, как при разделении на слабом катионообменнике однако этот ионообменный эффект можно устранить, используя для элюирования растворы соответствующей ионной силы. Партридж [17] обратил внимание на то, что сами ионообменные смолы обладают свойствами молекулярных сит, что повышает избирательность разделения.
Для сравнения также даны радиусы инерции против молекулярной массы для некоторых типичных глобулярных белков — лизоцима (Lys), миоглобина (Mb) и гемоглобина (НЬ). Наклон прямой этой зависимости составляет 1 / 3, что характерно для гомологичного ряда белков глобулярной компактной формы. (Глобулярная компактная конформация белков вовсе не означает их сферической формы и допускает определенные вариации аксиального отношения эквивалентного эллипсоида вращения) [c.96]
Поскольку основной интерес заключается не в вероятности получения самих сумм. М, а в вероятности того, что полученная сумма уИ будет означать родство, необходимо сравнивать совокупную вероятность (сумму всех вероятностей) всех сумм, больших или равных М, с совокупной вероятностью всех сумм, меньших М. Последняя кумулятивная вероятность может быть положена равной 1,0, поскольку представляют интерес только высокие значения М, т. е. низкие кумулятивные вероятности всех сумм, больших или равных М, и поскольку сумма обоих типов кумулятивных вероятностей равна 1,0. Распределение кумулятивных вероятностей всех сумм, больших или равных М, приведено на рис. 9.5. При сравнении миоглобина кашалота с а-цепью гемоглобина человека эта кумулятивная вероятность достигает 2 10 [598], что на восемь порядков больше рассчитанной выше априорной вероятности. [c.235]
Миоглобин — дыхательный пигмент мышечных клеток позвоночных и беспозвоночных животных, так же как и гемоглобин, имеет в качестве простетической группы протогем. Однако в отличие от гемоглобина простетическая группа миоглобина содержит только один атом железа и, следовательно, на молекулу белка приходится только один гем. Молекулярный вес миоглобина 17 000, и он имеет более простое строение в сравнении с гемоглобином. Белки миоглобинов отличны по своим свойствам от белков, входящих в состав гемоглобинов. Гемоглобин и миогло-
О принадлежности миоглобина и цепей гемоглобина к одному семейству белков свидетельствует также сравнение аминокислотных последовательностей миоглобина кашалота и а- и Р-цепей гемоглобина лошади. Как показано на рис. 8-11, во всех трех цепях имеются 27 эквивалентных положений, в которых находятся идентичные аминокислотные остатки кроме того, в других 40 положениях обнаруживаются близкие по своим свойствам остатки аминокислот, например аспарагиновая и глутаминовая кислоты, или изолейцин и валин. Таким образом, и здесь мы видим, что в аминокислотных последовательностях гомологичных белков имеется ряд инвариантных аминокислотных остатков и что для
Разница между гемоглобином и гемоглобином | Разница Между
Ключевая разница: Основное различие между гемоглобином и гемоглобином состоит в том, что нет никакой разницы. Гемоглобин, также известный как гемоглобин, представляет собой белок, который присутствует в эритроцитах. Это содержит железо и является тем, что фактически дает эритроциту свой красный цвет. Его основная функция — транспортировка кислорода к клеткам. Основное различие между гемоглобином и гемоглобином состоит в том, что нет никакой разницы. Обе эти вариации имени даны одной и той же вещи. Гемоглобин, также известный как гемоглобин, представляет собой белок, который присутствует в эритроцитах. Это содержит железо и является тем, что фактически дает эритроциту свой красный цвет. Эритроциты, в свою очередь, дают крови красный цвет. Следовательно, гемоглобин непосредственно ответственен за красный цвет крови.
Гемоглобин, состоящий из эритроцитов, лейкоцитов и тромбоцитов, которые все находятся в плазме крови — вот что составляет кровь. Основная функция эритроцитов — это транспортировка питательных веществ и кислорода к клеткам и удаление отходов и углекислого газа; процесс, гемоглобин которого является сложной частью. Белая кровяная клетка помогает бороться с инфекциями и лечить организм. Тромбоциты помогают крови свернуться. Плазма помогает в транспортировке этих клеток, а также в транспортировке различных растворенных белков, глюкозы, факторов свертывания крови, антител, минеральных ионов, гормонов и углекислого газа. В дополнение к этому, кровь также помогает регулировать температуру, баланс pH и водный баланс.
Название гемоглобин или гемоглобин происходит от того факта, что этот белок состоит из гем и белка глобина. Каждая молекула гемоглобина состоит из четырех молекул гема, каждая из которых окружена цепью глобина, что в общей сложности составляет четыре цепочки глобина в молекуле. Каждый из четырех атомов железа входит в центр каждой из четырех молекул гема.
Основная функция гемоглобина заключается в переносе и переносе кислорода из легких в клетки организма. Молекула кислорода поглощается гемом в гемоглобине, который обратимо сочетается с ним. Затем гемоглобин перемещается из легких в различные части тела, когда он достигает клетки, он выделяет кислород и затем улавливает углекислый газ, который выделяется в легкие. Гемоглобин также переносит регулирующую молекулу оксида азота в клетки и выделяет ее одновременно с кислородом.
Поскольку транспортировка кислорода является одной из основных задач крови, гемоглобин является очень важным аспектом эритроцитов. Фактически, гемоглобин составляет около 96% от массы сухого содержимого эритроцитов и около 35% от общего количества эритроцитов, включая воду. В каждой эритроците присутствуют миллионы молекул гемоглобина, а в крови присутствуют миллионы эритроцитов.Есть много людей, которые страдают от низкого гемоглобина. Существуют различные причины низкого гемоглобина, такие как дефицит железа, дефицит витамина С или фолиевой кислоты. Низкий гемоглобин является серьезным заболеванием, потому что гемоглобин непосредственно ответственен за транспортировку кислорода из легких к остальным клеткам организма.
Сравнение между гемоглобином и гемоглобином:
Гемоглобин / Гемоглобин | |
Описание | Гемоглобин или гемоглобин — это железосодержащий белок в эритроцитах, который помогает переносить кислород из легких к остальным клеткам организма. |
Часть | Эритроцит, который является частью крови, которая является частью кровеносной системы |
Состоит из |
|
цвет | Красный, из-за наличия железа. Это то, что дает эритроциты, следовательно, кровь ее цвет. |
функция |
|
7.Миоглобин и гемоглобин. Конформационные изменения и кооперативные взаимодействия субъединиц гемоглобина. Эффект Бора. Роль 2,3 –бифосфоглицерата.
Два белка – гемоглобин1 и миоглобин – часто называют дыхательными ферментами (рис. 1). Оба этих вещества выполняют роль переносчиков при дыхании: гемоглобин – основной компонент красных кровяных телец2 (эритроцитов), переносящих по артериям кислород из легких к тканям;миоглобин – красный белок в мышцах, принимающий кислород от гемоглобина и хранящий его таме до того момента, когда он потребуется для окисления пищевых веществ. Эти процессы в организме сопряжены с одновременным переносом углекислого газа, переправляемого из тканей в легкие, в основном в виде бикарбоната. Перенос бикарбоната и углекислого газа идет также при содействии гемоглобина.
Миоглобин и гемоглобин представляют собой белки, соединенные с железосодержащим пигментом – гемом3 (рис. 2). Белковая часть миоглобина содержит около 2500 атомов углерода, азота, кислорода, водорода и серы, соединенных друг с другом в длинную цепь, образующую своего рода корзинку вокруг группы гема. Все 2500 атомов молекулы миоглобина подчинены единственному атому железа, расположенному в центре гема, они обеспечивают обратимое взаимодействие железа с молекулами кислорода.
Было установлено, что гем приобретает способность переносить кислород лишь при условии, если его окружает и защищает специфический белок – глобин (сам по себе гем не связывает кислород). Обычно при соединении кислорода с железом один или более электронов необратимо переходят с атомов железа на атомы кислорода. Иными словами, происходит химическая реакция. Экспериментально было доказано, что миоглобин и гемоглобин обладают уникальной способностью обратимо связывать O2 без окисления гемового Fe2+ в Fe3+. Таким образом, процесс дыхания, который на первый взгляд кажется столь простым, на самом деле осуществляется благодаря взаимодействию многих видов атомов в гигантских молекулах чрезвычайной сложности.
Проблемой молекулярного механизма дыхания, а в связи с этим выяснением строения гемоглобина и миоглобина на протяжении долгого времени занимались английские ученые М.Перутц и Дж.Кендрю. Взаимодействие указанных соединений с субстратом – кислородом – было детально выяснено прежде всего на основе рентгеноструктурного анализа высокого разрешения.
Эффект
Вериго-Бора (синонимы —
эффект Вериго, эффект Бора) —
зависимость степени диссоциации оксигемоглобина от
величины
Важная особенность анаэробного гликолиза в эритроцитах по сравнению с другими клетками — присутствие в них фермента бисфосфоглицератмутазы. Бисфосфоглицератмутаза катализирует образование 2,3-бисфосфоглицерата из 1,3-бисфосфоглицерата (рис. 14-3). Образующийся только в эритроцитах 2,3-бисфосфоглицерат служит важным аллостерическим регулятором связывания кислорода гемоглобином
8. Ферменты, особенности ферментативного катализа (механизм выполнения ферментом каталитической функции, энергетический барьер реакции, энергия активации, образование фермент-субстратного комплекса). Единицы активности ферментов
Ферме́нты, или энзи́мы — обычно белковые молекулы или молекулы РНК (рибозимы) или их комплексы, ускоряющие (катализирующие) химические реакции в живых системах. Реагенты в реакции, катализируемой ферментами, называются субстратами, а получающиеся вещества — продуктами. Ферменты специфичны к субстратам (АТФаза катализирует расщепление только АТФ, а киназа фосфорилазы фосфорилирует только фосфорилазу).
Ферментативный катализ (биокатализ), ускорение биохимических реакций при участии белковых макромолекул. называемых ферментами (энзимами). Ферментативный катализ — разновидность катализа, хотя термин «ферментация» (брожение)известен с давних времен, когда еще не было понятия химического катализа.
Единицы активности ферментов.1) За единицу активности фермента (Uunit, англ.) принимают такое количество фермента, которое катализирует превращение 1 мкмоля S (суб страта) за 1 мин. при оптимальных условиях (1U= 1 мкмоль/мин.)
2) В системе СИ активность выражают в каталах: 1 катал – количество фермента, катали зирующее превращение 1 моля S за 1 сек. при оптимальных условиях (1кат.=1 моль/с)
3)Удельнаяактивность определяется количеством единиц ферментативной активности, которое приходится на 1 мг белка в биологическом объекте (U/мг белка)
2.3. Строение гемоглобина
В разные периоды жизни зародыша и ребёнка активно работают различные гены, ответственные за синтез нескольких полипептидных цепей глобина. Выделяют 6 субъединиц: α, β, γ, δ, ε, ζ. Первая и последняя из них включают по 141, а остальные по 146 аминокислотных остатков. Друг от друга они отличаются не только количеством мономеров, но и их составом. Однако принцип образования вторичной структуры у всех цепей однотипен: они все сильно (до 75% длины) спирализованы за счёт водородных связей. Альфа-цепи включают 7, а бета, гамма, дельта – 8 спирализованных фрагментов, чередующихся с аморфными участками. Компактная укладка в пространстве подобного образования приводит к возникновению третичной структуры; причем при этом создаётся карман, куда и вкладывается гем. Возникший комплекс сохраняется с помощью приблизительно 60 гидрофобных взаимодействий между белком и простетической группой. Естественно, что в образовании углубления принимают активное участие гидрофобные аминокислоты (фенилаланин, валин, лейцин). Подобная глобула объединяется с 3 сходными субъединицами, используя для этого бисульфидные мостики и ковалентные взаимодействия (четвертичная структура). Получается белок, составленный из 4 полипептидных цепей (гетерогенный тетрамер), имеющий форму тетраэдра.
В зависимости от характера включённых протомеров различают следующие виды нормальных гемоглобинов (Hb). В первые 20 суток существования эмбриона в ретикулоцитах образуется Hb P (Primitive) в виде двух вариантов: Hb Gower 1, состоящего из дзета- и эпсилон-цепей, соединенных попарно, и Hb Gower 2, в котором дзета-последовательности уже заменены на альфа. Переключение генеза одного вида цепей на другой осуществляется медленно: вначале появляются отдельные клетки, продуцирующие иной вариант. Они дают стимул клонам новых клеток, синтезирующих другой вид полипептида. Позднее эти клетки начинают преобладать и постепенно вытесняют старые.
На 8-й неделе жизни зародыша включается синтез гемоглобина F = α2 γ2, по мере же приближения акта родов появляются ретикулоциты, содержащие Hb A = α2β2. На его долю у здорового взрослого человека приходится 96 – 98% от общей массы этого белка. Кроме того, в отдельных эритроцитах присутствуют гемоглобины Hb A2 = α2δ2 (1,5 – 3%) и фетальный (обычно не больше 1%). Однако в некоторых регионах, в том числе и у аборигенов Забайкалья концентрация последнего вида повышается до 4% (в норме).
2.4. Формы гемоглобина
Описаны следующие формы данного гемопротеида.
а) Дезоксигемоглобин – свободная от газов форма протеина.
б) Оксигемоглобин – продукт включения кислорода в молекулу белка:
α22О2 β22О2
Интересно, что первоначальное связывание кислорода с одной субъединицей ускоряет присоединение последующих молекул (положительный кооперативный эффект). Одна молекула Hb способна удерживать 4 молекулы газа.
Структуры дезокси- и оксиHb несколько отличны. При отсутствии кислорода ферроион в гемоглобине имеет координационное число 5, связан c 4 атомами азота протопорфирина и с третичным атомом азота имидазольного кольца остатка гистидина белковой субъединицы. Шестое координационное место в оксигемоглобине способен занять только молекулярный кислород. Образованию этой связи благоприятствует высокая электронно-донорная способность порфириновой сопряженной системы и имидазола. Структура белка в Hb такова, что она экранирует подход к атому Fe (II) всех других молекул, имеющихся в крови, и своевременно регулирует его донорно-акцепторные свойства.
в) Исключение составляют токсиканты – яды крови, к которым относят и монооксид углерода. Проникая с атмосферным воздухом в лёгкие, СО быстро преодолевает альвеолярно-капиллярную мембрану, растворяется в плазме крови, диффундирует в эритроциты и вступает во взаимодействие с дезоки- и окси-Hb:
HbО2 + СО
HbСО + О2
или Hb + СО
HbСО

Образовавшийся карбоксигемоглобин не способен присоединять к себе кислород, а угарного газа может связывать 4 молекулы.
г) Важным производным Hb является метгемоглобин, в молекуле которого атом железа находится в степени окисления 3+ (в виде ферри-иона). Такая форма гемопротеида образуется при действии на него различных окислителей (оксидов азота, нитробензола, нитроглицерина, хлоратов, метиленового синего и др.), в результате в крови уменьшается количество функционально важного оксиHb, что нарушает доставку кислорода к тканям, вызывая в них развитие гипоксии.
д) Особенности строения концевых аминокислот в цепях глобина позволяют им реагировать с моносахаридами, в первую очередь, с глюкозой. В настоящее время выделяют несколько подвидов Hb A (от 0 до 1c), в которых к валину бета-цепей прикреплены олигосахариды. Особенно легко реагирует последний подвид гемопротеида. У образовавшегося при этом без участия фермента гликозилированного гемоглобина меняется его сродство к кислороду. Это объясняется тем, что присоединившаяся к белку глюкоза занимает место 2,3-ДФГК, что тормозит подкисление среды и тем самым противодействует диссоциации оксигемоглобина. В норме на долю подобной формы Hb приходится не более 5% от его общего количества. При сахарном диабете его концентрация возрастает в 2-3 раза, что благоприятствует возникновению тканевой гипоксии.
94. Синтез гема и гемоглобина. Регуляция этих процессов. Вариации первичной структуры и свойств гемоглобина. Гемоглобинопатии.
Гем синтезируется во всех тканях, но с наибольшей скоростью в костном мозге и печени (рис. 13-2). В костном мозге гем необходим для синтеза гемоглобина в ретикулоцитах, в гепатоцитах — для образования цитохрома Р450.
Первая реакция синтеза гема — образование 5-аминолевулиновой кислоты из глицина и сук-цинил-КоА (рис. 13-3) идёт в матриксе митохондрий, где в ЦТК образуется один из субстратов этой реакции — сукцинил-КоА. Эту реакцию катализирует пиридоксальзависимый фермент аминолевулинатсинтаза.
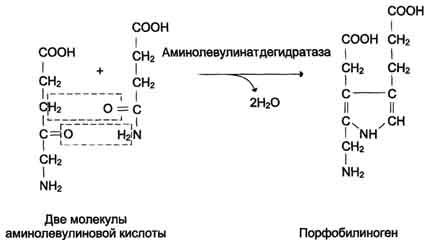
Из митохондрий 5-аминолевулиновая кислота поступает в цитоплазму. В цитоплазме проходят промежуточные этапы синтеза гема: соединение 2 молекул 5-аминолевулиновой кислоты молекулу порфобилиногена (рис. 13-4), дезаминированиепорфобилиногена с образованием гидроксиметилбилана, ферментативное превращение гидроксиметилбилана в молекулу уропор-фобилиногена III, декарбоксилирование последнего с образованием копропорфириногена III. Гидроксиметилбилан может также нефермента-тивно превращаться в уропорфириноген I, который декарбоксилируется в копропорфирино-ген I. Из цитоплазмы копропорфириноген III опять поступает в митохондрии, где проходят заключительные реакции синтеза гема. В результате двух последовательных окислительных реакций копропорфириноген III превращается в протопорфириноген IX, а протопорфириноген IX — в Протопорфирин IX. Фермент феррохела-таза, присоединяя к протопорфирину IX двухвалентноелентное железо, превращает его в гем (рис. 13-2). Источником железа для синтеза гема служит депонирующий железо белок ферритин. Синтезированный гем, соединяясь с α и β-полипепептидными цепями глобина, образует гемоглобин. Гем регулирует синтез глобина: при снижении скорости синтеза гема синтез глобина в ретикулоцитах тормозится.
Донором железа служит депонирующий железо в клетках белок ферритин.
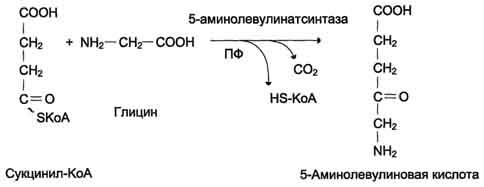
Рис. 13-3. Реакция образования 5-аминолевулиновой кислоты.
Регуляция биосинтеза гема
Регуляторную реакцию синтеза гема катализирует пиридоксальзависимый фермент аминолевулинатсинтаза. Скорость реакции регулируется аллостерически и на уровне трансляции фермента.
Аллостерическим ингибитором и корепрессором синтеза аминолевулинатсинтазы является гем (рис. 13-5).
В ретикулоцитах синтез этого фермента на этапе трансляции регулирует железо. На участке инициации мРНК, кодирующей фермент, имеется последовательность нуклеотидов, образующая шпилечную петлю, которая называется железочувствительным элементом (от англ, iron-responsiveelement, IRE) (рис. 13-6).
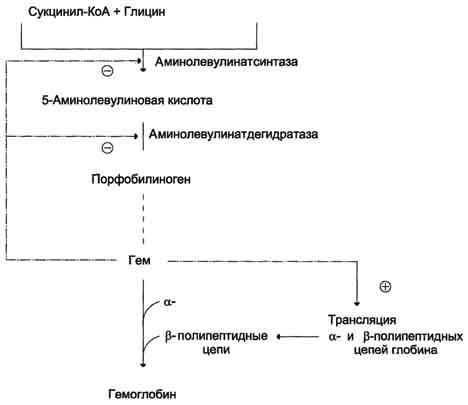
Рис. 13-5. Регуляция синтеза гема и гемоглобина. Гем по принципу отрицательной обратной связи ингибирует аминолевулинатсинтазу и аминолевулинатдегидратазу и является индуктором трансляции α- и β-цепей гемоглобина.
При высоких концентрациях железа в клетках оно образует комплекс с остатками цистеина регуляторного железосвязывающего белка. Взаимодействие железа с регуляторным железосвязывающим белком вызывает снижение сродства этого белка к IRE-элементу мРНК, кодирующей аминолевулинатсинтазу, и продолжение трансляции (рис. 13-6, А). При низких концентрациях железа железосвязывающий белок присоединяется к железо-чувствительному элементу, находящемуся на 5′-нетранслируемом конце мРНК, и трансляция аминолевулинатсинтазы тормозится (рис. 13-6, Б).
Аминолевулинатдегидратаза также аллостерически ингибируется гемом, но так как активность этого фермента почти в 80 раз превышает активность аминолевулинатсинтазы, то это не имеет большого физиологического значения.
Дефицит пиридоксальфосфата и лекарственные препараты, которые являются его структурными аналогами, снижают активность аминолевулинатсинтазы.
Альфа-полипептидная цепь заканчивается комбинацией аминокислот валина-лейцина, а бета-полипептидная цепь — комбинацией валина-гистидина-лейцина. Альфа- и бета-полипептидные цепи в гемоглобиновой молекуле не размещены линейно, как это выглядит на первый взгляд из данных,это первичная структура .
Гемоглобинопатии группа наследственных гемолитических анемий, обусловленных нарушениями первичной структуры гемоглобина (качественные гемоглобинопатии) или синтеза глобиновых цепей (количественные гемоглобинопатии).
Гемоглобин человека
Гемоглобин – сложный железосодержащий белок, относится к классу гемопротеинов. Выполняет две важные функции:
перенос кислорода из легких к периферическим тканям;
участие в переносе СО2и протонов из периферических тканей в легкие.
Производные гемоглобина
Молекула гемоглобина взаимодействует с различными лигандами, образуя производныегемоглобина.
Дезоксигемоглобин– ННb– не связанный с кислородом и содержащий гем с двухвалетным железомFe2+.
Оксигемоглобин – ННbO2– полностью оксигенированный гемоглобин, связанный с четырьмя молекулами кислорода.
Карбгемоглобин– ННbCO2– гемоглобин, связанный с СО2. Выполняет функцию выведения СО2из тканей к легким. Соединение нестойкое, легко диссоциирует в легочных капиллярах. Этим путем выводится до 10-15% СО2.
Карбоксигемоглобин – ННbСО – образуется при отравлении оксидом углерода (II). Сродство гемоглобина к СО примерно в 300 раз выше, чем к кислороду, при этом гемоглобин теряет способность связывать кислород и наступает смерть от удушья.
Метгемоглобин –MetHb– образуется при действии окислителей (нитрит натрия, нитробензол). Содержит железо в трехвалентной формеFe3+и теряет способность к переносу кислорода. В норме образуется небольшое количество метгемоглобина – примерно 0,5 % в сутки.
Варианты гемоглобина в онтогенезе
Количество и состав фракций гемоглобина изменяется в процессе онтогенеза. Все гемоглобины представляют собой тетрамеры, построенные из разного набора субъединиц (α, β, γ, δ) и преимущественно образуются на разных этапах развития организма человека – от эмбрионального до взрослого состояния. Различают следующие физиологические типы гемоглобинов: примитивный гемоглобин НbР, фетальный гемоглобинHbF(fetus– плод), гемоглобин взрослыхHbA,HbA2,HbA3(adultus– взрослый).
Примитивный гемоглобин – синтезируется в эмбриональном желточном мешке через несколько недель после оплодотворения. Состоит из двух α- и двух ε-цепей (2α, 2ε). Через две недели после формирования печени плода в ней начинает синтезироватьсяHbF, который к шести месяцам полностью замещает НbР.
Фетальный гемоглобин– синтезируется в печени и костном мозге плода до периода его рождения. Состоит из двух α- и двух γ-цепей (2α, 2γ). Характеризуется более высоким сродством к кислороду и обеспечивает эффективную доставку кислорода к эмбриону из системы кровообращения матери.HbFявляется главным типом гемоглобина плода. Кровь новорожденного содержит до 80%HbF, но к концу 1-го года жизни он почти целиком заменяется наHbA. В крови взрослого человека присутствует в минимальном количестве – до 1,5% от общего количества гемоглобина.
Гемоглобин А– основной гемоглобин взрослого человека (96 % от общего количества). Начинает синтезироваться в клетках костного мозга уже на 8-м месяце развития плода.HbAсостоит из двух α- и двух β-цепей.
Минорные гемоглобины:
HbA2 — 2α2δ, в крови взрослого человека примерно 2,6 %HbA2. Обладает большим сродством к кислороду.
HbA3— 2α2β, однако имеются изменения в строении β-цепей по сравнению сHbA.Появляется в крови в небольших количествах при старении.
