Кровь
КРОВЬ, жидкая соединительная ткань, циркулирующая в кровеносной системе позвоночных животных и человека. Состоит из жидкого межклеточного вещества (плазмы) и взвешенных в нём клеток (форменных элементов). Основные функции крови: дыхательная (перенос кислорода из лёгких к тканям и углекислого газа от тканей к лёгким), питательная и выделительная (перенос питательных веществ к тканям и удаление продуктов обмена веществ), регуляторная (перенос гормонов, поддержание гомеостаза, терморегуляции), защитная (участие в иммунных реакциях).
Объём крови у взрослого человека в среднем 5 л (у мужчин) и ок. 4 л (у женщин). Жидкая часть (плазма) составляет 55 % общего объёма крови; содержит до 90 % воды, 7–8 % белка, остальные 2–3 % – минеральные соли, глюкоза, липиды, гормоны, ферменты, витамины и др. Соли плазмы участвуют в поддержании осмотического давления и постоянного уровня рН. При большой потере крови в клинике используют физиологический раствор – водный раствор солей, соответствующий по концентрации плазме.
Форменные элементы крови (эритроциты, лейкоциты, тромбоциты и др.) составляют 45 % общего её объёма; у взрослого человека формируются и развиваются из немногочисленных стволовых клеток костного мозга (см. Кроветворение).
Эритроциты (красные кровяные клетки) представляют собой безъядерные клетки диам. 7,5 мкм, имеющие форму двояковогнутого диска. Содержат дыхательный пигмент – гемоглобин, обеспечивающий газообмен клеток. В 1 мм3
крови в норме содержится 3,9–5,0 млн. эритроцитов.Лейкоциты (белые кровяные клетки) бесцветны, имеют ядро, способны активно передвигаться и проникать сквозь стенки капилляров. Морфологически и физиологически лейкоциты очень неоднородны. По структуре подразделяются на зернистые (гранулоциты) и незернистые (агранулоциты). К зернистым относятся нейтрофилы, эозинофилы, базофилы, тучные клетки; к незернистым – лимфоциты, моноциты.
Морфологически и физиологически лейкоциты очень неоднородны. По структуре подразделяются на зернистые (гранулоциты) и незернистые (агранулоциты). К зернистым относятся нейтрофилы, эозинофилы, базофилы, тучные клетки; к незернистым – лимфоциты, моноциты.
Каждому типу зернистых лейкоцитов свойственны определённые функции. Нейтрофилы (составляют 50–70 % общего числа лейкоцитов) играют главную роль при врождённом иммунитете (участвуют в острых воспалительных реакциях), способны к фагоцитозу, основные компоненты гноя. Эозинофилы (1–3 %) также способны к фагоцитозу, участвуют в защите от паразитарных организмов. Базофилы (ок. 1 %) не способны к фагоцитозу, играют основную роль при аллергических реакциях. Тучные клетки (в крови находятся их предшественники, которые, оседая в различных тканях, становятся тучными клетками) играют важную роль в развитии 
Незернистые клетки – лимфоциты (20–40 %) обеспечивают иммунный ответ, т. е участвуют в распознавании «своей» и «чужой» субстанций, специфически направленно уничтожают или нейтрализуют чужеродный агент (антиген), после контакта с которым остаётся иммунологическая память, когда при повторной встрече с этим же агентом развитие иммунного ответа наступает быстрее и эффективнее (специфический иммунитет). Лимфоциты морфологически однотипны, но различаются по функциям и белковым маркёрам на их клеточной мембране. Это В-лимфоциты, Т-лимфоциты и натуральные киллеры (NK-клетки). В-лимфоциты дифференцируются в плазматиче-ские клетки, производящие антитела, и в В-клетки памяти. Т-лимфоциты окончательно специализируются в вилочковой железе, после чего выполняют функции цитотоксиче-ских Т-лимфоцитов и Т-хелперов (Т-помощников). Т-лимфоциты участвуют в защитных реакциях при иммунодефицитах, онкологических, аутоиммунных, вирусных заболеваниях; Т-хелперы после распознавания антигена дают сигнал В-лимфоцитам для их дальнейшей дифференцировки в плазматические клетки. Т-лимфоциты после контакта с антигенами дифференцируются в Т-клетки памяти. NK-клетки – небольшая группа лимфоцитов, на своей мембране не несут белковых маркёров, и их основная функция – уничтожение опухолевых клеток. В 1 мм3 крови в норме содержится 4–9 тыс. лейкоцитов.
Т-лимфоциты после контакта с антигенами дифференцируются в Т-клетки памяти. NK-клетки – небольшая группа лимфоцитов, на своей мембране не несут белковых маркёров, и их основная функция – уничтожение опухолевых клеток. В 1 мм3 крови в норме содержится 4–9 тыс. лейкоцитов.
Моноциты (1–6 %) циркулируют в крови 8 ч и, оседая в тканях, становятся
Тромбоциты (кровяные пластинки) – клетки овальной формы диам. 3–4 мкм. Способны склеиваться между собой и приклеиваться к сосудистой стенке. При повреждении кровеносных сосудов участвуют в образовании тромба, который закрывает просвет сосуда, останавливая кровотечение. В 1 мм3 крови в норме содержится 180–320 тыс. тромбоцитов.
По иммуногенетическим свойствам различают 4 группы крови: 0(I), А(II), B(III), AB(IV). Группа крови определена генетически и не изменяется в течение всей жизни. Учитывается при переливании крови, т. к. несовместиместь по антигенным маркёрам эритроцитов и сывороточным антителам может привести к летальному исходу.
Учитывается при переливании крови, т. к. несовместиместь по антигенным маркёрам эритроцитов и сывороточным антителам может привести к летальному исходу.
О способности к фагоцитозу и фагоцитарной активности ядерных эритроцитов холоднокровных (на примере Rana ridibunda и Cyprinus carpio) Текст научной статьи по специальности «Фундаментальная медицина»
УДК 591-111-7
О СПОСОБНОСТИ К ФАГОЦИТОЗУ И ФАГОЦИТАРНОЙ АКТИВНОСТИ ЯДЕРНЫХ ЭРИТРОЦИТОВ ХОЛОДНОКРОВНЫХ (НА ПРИМЕРЕ RANA RIDIBUNDA И CYPRINUS CARPIO)
ABOUT ABILITY TO PHAGOCYTOSIS AND PHAGOCYTIC ACTIVITY IN POIKILOTHERM ANIMALS’ NUCLEAR ERYTHROCYTES (WITH REFERENCE TO RANA RIDIBUNDA AND CYPRINUS CARPIO)
С.Д. Чернявских 1, До Хыу Кует 1, И.С. Буковцова 1, Во Ван Тхань 1 2 S.D. Chernyavskikh 1, Do Huu Quyet 1, I.S. Bukovtsova 1, Vo Van Thanh 1 2
1 Белгородский государственный национальный исследовательский университет, Россия, 308015, г. Белгород,
Белгород,
ул. Победы, 85
ул. Ан Зыонг Выонг, 280
1 Belgorod State National Research University, 85 Pobedy St, Belgorod, 308015, Russia 2 Ho Chi Minh city University of Education, 280 An Duong Vuong St, Ward 4, Dist. 5, Ho Chi Minh City, 70000, Vietnam
E-mail: [email protected]
Аннотация. Методами растровой электронной и световой микроскопии выявлена способность ядерных эритроцитов холоднокровных к фагоцитозу микроорганизмов. Установлена более высокая фагоцитарная активность красных клеток крови лягушки озерной к Saccaromyces cerevisiae по сравнению с Bacillus subtilis и Clostridium pasteurianum.
Resume. By scanning electron and light microscopy, the ability of nuclear erythrocytes to phagocytose microorganisms in poikilotherms was revealed. It’s been established the highest ability of Rana ridibunda red blood cells to phagocytose Saccaromyces cerevisiae in comparison with Bacillus subtilis and Clostridium pasteurianum. It’s been shown that phagocytic index and phagocytic number of digested yeast cells is higher for nuclear red blood cells of Rana ridibunda than Cyprinus carpio.
Ключевые слова: ядерные эритроциты, адгезия, поглощение, фагоцитоз, фагоцитарная активность.
Key words: nuclear red blood cells, adhesion, absorption, phagocytosis, phagocytic activity.
Введение
Согласно представлениям общей и эволюционной физиологии, распределение функций между клетками крови сводится к тому, что эритроциты обеспечивают транспорт кислорода, а лейкоциты играют защитную роль [Заварзин, 1953; Исабаева, Пономарева, 1981; Иржак, 1983; Ерюхин и др. , 1989; Федорова, 2001]. Неспецифическая защита против чужеродных агентов осуществляется фагоцитирующими клетками — макрофагами и полиморфноядерными лейкоцитами [Friemel, Brock, 1986].
, 1989; Федорова, 2001]. Неспецифическая защита против чужеродных агентов осуществляется фагоцитирующими клетками — макрофагами и полиморфноядерными лейкоцитами [Friemel, Brock, 1986].
Для реализации фагоцитарной функции у белых клеток крови имеется мембранный резерв, заложенный в складчатости плазмалеммы [Головко, 2010]. Резерв плазмалеммы используется макро- и микрофагами на образование фагосом, формирование псевдоподий при амёбоидном движении [Каппуччинелли, 1982; Bagge, Braide, 1982; Gennis, 1989] и другие функции.
Одним из основных этапов фагоцитарного процесса является миграция фагоцитов [Ерюхин и др., 1989; Федорова, Левин, 2001; Fedorova et al., 2008]. В литературе имеется немало работ, посвященных оценке локомоционной активности белых клеток крови [Маянский, Маянский, 1983; Козинец и др., 2001]. Изучены особенности спонтанной и стимулированной разными веществами миграции лейкоцитов при изменённых и патологических состояниях организма [Федорова, Левин,
2001]. При этом важную роль при движении клеток вышеназванного пула играет перестройка структурных компонентов актинового цитоскелета [Fulton, 1983; Bennett, Baines, 2001; Землянских, Денисова, 2009].
При этом важную роль при движении клеток вышеназванного пула играет перестройка структурных компонентов актинового цитоскелета [Fulton, 1983; Bennett, Baines, 2001; Землянских, Денисова, 2009].
Целью работы было определение способности к фагоцитозу и оценка фагоцитарной активности ядерных эритроцитов холоднокровных (на примере Cyprinus carpio и Rana ridibunda).
Объекты и методы исследования
В работе использовали периферическую кровь, взятую у наркотизированных эфиром сазана (C. carpio) (30 особей) и лягушки озёрной (R. ridibunda) (30 особей). Объектами исследования служили ядерные эритроциты. Забор крови у сазана осуществляли из хвостовой вены, у лягушки — из сердца. В качестве антикоагулянта использовали гепарин (10 ед./мл).
Полученную кровь центрифугировали 4 мин. при 400 g, удаляли плазму и лейкоциты. Эритроциты разбавляли изотоническим раствором NaCl (0.8% для сазана и 0.6% для лягушки) в соотношении 1:200.
Суспензию красных клеток крови с объектами фагоцитарной реакции (1:50) помещали в пробирки и инкубировали при комнатной температуре в течение 15 мин. В качестве объектов фагоцитоза использовали микроорганизмы: бактерии Bacillus subtilis и Clostridium pasteurianum, а также грибы Saccaromyces cerevisiae [Воробьев, 2001; Глик, Пастернак, 2002; Сиротин, 2004].
Методом растровой электронной микроскопии (РЭМ) определяли адгезию микроорганизмов к ядерным эритроцитам. Полученные суспензии наносили на стеклянные подложки с углеродным напылением. Оценку поверхности клеток крови и объектов фагоцитоза проводили на сканирующем электронном микроскопе Quanta 200 в режиме низкого вакуума.
Методом световой микроскопии определяли способность ядерных эритроцитов к поглощению и перевариванию микроорганизмов. С этой целью по окончании инкубации на стеклянные подложки наносили полученные суспензии (высота слоя составляла около 1 мм) и высушивали на воздухе в течение 45-60 мин. Клетки с микроорганизмами фиксировали метанолом и окрашивали азур-эозином по Романовскому.
Для оценки фагоцитарной активности эритроцитов на полученных препаратах подсчитывали процент фагоцитирующих клеток (фагоцитарный индекс) и среднее число поглощенных частиц (фагоцитарное число) [Меньшиков, Бедулева, 2001]. При подсчете использовали объектив с увеличением х100.
При подсчете использовали объектив с увеличением х100.
Полученные результаты обрабатывали методами вариационной статистики с использованием специальных программ на персональном компьютере. Достоверность различий определяли по t-критерию Стъюдента.
Результаты исследования
Методом РЭМ выявлены адгезионные контакты микроорганизмов (S. cerevisiae, C. pasteurianum и B. subtilis) с ядерными эритроцитами C. carpio и R. ridibunda. На рисунке 1 показана адгезия S. cerevisiae к красной клетке крови сазана.
Рис. 1. Электронная микрофотография адгезирующего к Saccaromyces cerevisiae эритроцита сазана: 1 — эритроцит, 2 — S. cerevisiae Fig. 1. Electron micrograph of adhering to the Saccharomyces cerevisiae carp erythrocyte:
1 — erythrocyte, 2 — S. cerevisiae
cerevisiae
Методом световой микроскопии установлено, что ядерные эритроциты сазана и лягушки способны не только к адгезии, но и к поглощению, а также перевариванию микроорганизмов (рис. 2 а-в, 3).
Рис. 2. Фагоцитоз Saccaromyces cerevisiae эритроцитами сазана (увеличение xioo): 1 — эритроцит; 2 — S. cerevisiae; 3 — образование фагосомы; 4 — фагосома; 5 — частично
переваренные объекты фагоцитоза Fig. 2. Phagocytosis of Saccaromyces cerevisiae by carp’s erythrocytes (zoom xioo): 1 — erythrocytes; 2 — S. cerevisiae; 3 — phagosome formation; 4 — phagosome; 5 — partially
digested sites of phagocytosis
Рис. 3. Фагоцитоз Saccaromyces cerevisiae эритроцитом и лейкоцитом лягушки:
1 — эритроцит; 2 — лейкоцит; 3 — S. cerevisiae Fig. 3. Phagocytosis of Saccaromyces cerevisiae by frog’s erythrocytes and leukocytes: 1 — erythrocyte; 2 — leukocyte; 3 — S. cerevisiae
cerevisiae Fig. 3. Phagocytosis of Saccaromyces cerevisiae by frog’s erythrocytes and leukocytes: 1 — erythrocyte; 2 — leukocyte; 3 — S. cerevisiae
Мембрана эритроцита C. carpio в месте контакта с S. cerevisiae втягивается и объект погружается вглубь клетки (см. рис. 2а). Этот процесс соответствует началу стадии поглощения, так как непрерывность плазматической мембраны над инвагина-ционным каналом еще не восстановлена. Показано образование обособленной от наружной мембраны вакуоли, содержащей фагоцитированную частицу (см. рис. 2в).
У эритроцита лягушки также происходит образование фагоцитарной вакуоли (см. рис. 3). В цитоплазме некоторых эритроцитов выявляются мелкие частицы (см. рис. 2б).
В таблице представлены результаты фагоцитарной активности ядерных эритроцитов подопытных холоднокровных.
Таблица
Фагоцитарная активность ядерных эритроцитов Cyprinus carpio и Rana ridibunda
Table
Phagocytic activity of nuclear erythrocytes in Cyprinus carpio and Rana ridibunda
Вид животного Изучаемый показатель, ед. изм. Объект фагоцитоза
изм. Объект фагоцитоза
Clostridium pasteurianum Saccaromyces cerevisiae Bacillus subtilis
Cyprinus carpio Фагоцитарный индекс, % 33-60±i.76 38.66±i.85 32.50±2.50
Фагоцитарное число, отн. ед. i.04±0.03 i.i0±0.02 i.06±0.03
Rana ridibunda Фагоцитарный индекс, % 34-50±i.64 49-75±2.39 а, б 36.00±2.00 в
Фагоцитарное число, отн. ед. i.0i±0.04 i.24±0.02 а, б i.0i±0.02 в
Примечание: а — статистически достоверные различия по сравнению с Cyprinus carpio; б — статистически достоверные различия по сравнению с Clostridium pasteurianum; в -статистически достоверные различия по сравнению с Bacillus subtilis (p<0.05).
При сравнительном анализе полученных данных установлено, что эритроциты Я. ridibunda наиболее активно поглощают 5. еетеутае. Фагоцитарный индекс красных
ridibunda наиболее активно поглощают 5. еетеутае. Фагоцитарный индекс красных
клеток крови лягушек в отношении C. pasteurianum и B. subtilis ниже на 30.7 и 27.6%, фагоцитарное число — на 18.5 и 18.5% по сравнению с дрожжевыми клетками. В свою очередь, у сазана по сравнению с лягушкой процент фагоцитирующих эритроцитов в отношении S. cerevisiae ниже на 22.3, среднее число поглощенных частиц — на 11.3%.
Обсуждение результатов
Выявленные методом РЭМ реакции рецепции объекта с плазмалеммой, согласно И.И. Мечникову [1954], соответствуют стадии аттракции, т. е. тесного сближения фагоцитирующей клетки и располагающегося на ее поверхности объекта фагоцитоза. В более поздних исследованиях вышеуказанные явления относят к стадии адсорбции, которая характеризуется специфическим взаимодействием частицы с рецептором или электростатической или хемотаксической аттракцией [Алов и др. , 1969; Федорова, 2001].
, 1969; Федорова, 2001].
Образование фагоцитарной вакуоли у эритроцита лягушки (см. рис. 3), связано с транслокацией плазматической мембраны в соответствии с размером и формой поглощаемой частицы [Федорова, Левин, 2001]. Выявленные в цитоплазме некоторых эритроцитов мелкие частицы (см. рис. 2б), предположительно могут быть частично переваренными объектами фагоцитоза [Галактионов, 2005].
Таким образом, начавшаяся при адгезионном контакте чужеродной частицы и фагоцита активация плазматической мембраны завершается процессом поглощения микроорганизма и его перевариванием, что доказывает способность ядерных эритроцитов холоднокровных к фагоцитозу.
Более высокая фагоцитарная активность к дрожжевым клеткам у эритроцитов лягушки по сравнению с красными клетками крови сазана может быть связана, во-первых, с наличием у Земноводных видового иммунитета, так как основными местами обитания дрожжевых клеток является почва, поверхность плодов и листьев и в меньшей степени — природные воды [Воробьев и др. , 2001; Глик, Пастернак, 2002], являющиеся средой обитания рыб. Во-вторых, ядерные эритроциты лягушки — более крупные клетки [Головко, 2010] с большим мембранным резервом [Fedorova et al., 2012], который, как было сказано выше, может использоваться фагоцитами на образование фагосом.
, 2001; Глик, Пастернак, 2002], являющиеся средой обитания рыб. Во-вторых, ядерные эритроциты лягушки — более крупные клетки [Головко, 2010] с большим мембранным резервом [Fedorova et al., 2012], который, как было сказано выше, может использоваться фагоцитами на образование фагосом.
Известно, что взаимодействие между фагоцитом и объектом фагоцитоза имеет гидрофобный характер [Меньшиков, Бедулева, 2001]. Поэтому некоторые микроорганизмы, к числу которых относятся C. pasteurianum и B. subtilis, в качестве механизма защиты имеют полисахаридную капсулу [Лысак, 2005], которая снижает гидрофобность и эффективность адгезии [Меньшиков, Бедулева, 2001]. Этим может быть обусловлена более низкая фагоцитарная активность ядерных эритроцитов лягушки к бактериям по сравнению с дрожжевыми клетками.
Выводы
1. Ядерные эритроциты холоднокровных животных, в частности Cyprinus carpio и Rana ridibunda, являются способными к фагоцитозу клетками.
2. Фагоцитарная активность красных клеток крови лягушки озерной выше к Saccaromyces cerevisiae по сравнению с Bacillus subtilis и Clostridium pasteurianum.
3. Фагоцитарный индекс и фагоцитарное число в отношении дрожжевых клеток у ядерных эритроцитов R. ridibunda выше, чем у C. carpio.
Список литературы References
1. Алов И.А., Брауде А.И., Аспиз М.Е. 1969. Основы функциональной морфологии клетки. М., Медицина, 344.
Alov I.A., Braude A.I., Aspiz M.E. 1969. Osnovy funkcional’noj morfologii kletki [Basics of functional morphology of cells]. Moscow, Medicina, 344. (in Russian)
2. Воробьев А.А., Кривошеник Ю.С., Быков А.С. 2001. Основы микробиологии, вирусологии и иммунологии.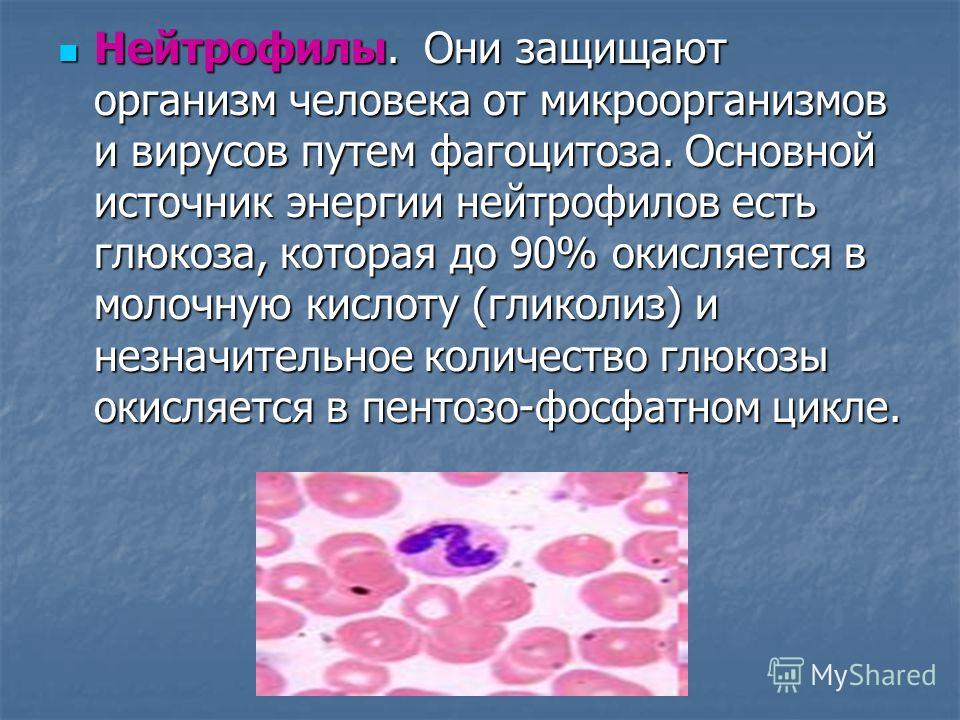 М., Мастерство, 221.
М., Мастерство, 221.
Vorob’ev A.A., Krivoshenik Ju.S., Bykov A.S. 2001. Osnovy mikrobiologii, virusologii i immunologii [Fundamentals of Microbiology, Virology and Immunology]. Moscow, Masterstvo, 221. (in Russian)
3. Галактионов В.Г. 2005. Эволюционная иммунология. М., Академкнига, 408.
Galaktionov V.G. 2005. Jevoljucionnaja immunologija [Evolutionary immunology]. Moscow,
Akademkniga, 408. (in Russian)
4. Глик Б., Пастернак Д. 2002. Молекулярная биотехнология. М., Мир, 585.
Glik B., Pasternak D. 2002. Molekuljarnaja biotehnologija [Molecular biotechnology]. Moscow, Mir, 585. (in Russian)
5. Головко С.И. 2010. Сравнительная характеристика мембранного резерва ядерных клеток крови позвоночных животных. Дис. … канд. биол. наук. Ярославль, ЯГПУ, 120 с.
Golovko S.I. 2010. Sravnitel’naja harakteristika membrannogo rezerva jadernyh kletok krovi pozvonochnyh zhivotnyh [Comparative characteristics of the membrane reserve in nuclear blood cells of vertebrates]. Dis. … cand. biol. scienes. Jaroslavl’, JaGPU, 120. (in Russian)
6. Ерюхин И.А., Белый В.Я., Вагнер В.К. 1989. Воспаление как общебиологическая реакция: на основе модели острого перитонита. Л., Наука, 262.
Erjuhin I.A., Belyj V.Ja., Vagner V.K. 1989. Vospalenie kak obshhebiologicheskaja reakcija: na osnove modeli ostrogo peritonita [Inflammation as a general biological reaction: based on the model of acute peritonitis]. Leningrad, Nauka, 262. (in Russian)
7. Заварзин А.А. 1953. Очерки эволюционной гистологии крови и соединительной ткани. Избранные труды. Л., Изд-во АН СССР, 717.
Zavarzin A.A. 1953. Ocherki jevoljucionnoj gistologii krovi i soedinitel’noj tkani. Izbrannye trudy [Essays in Evolutionary histology of blood and connective tissue]. Leningrad, AN SSSR, 717. (in Russian)
8. Землянских Н.Г., Денисова О.Н. 2009. Изменения в мембранно-цитоскелетном комплексе эритроцитов, индуцированные диметилсульфоксидом, полиэтиленгликолем и низкой температурой. Биофизика, 54 (4): 693-703.
Zemlianskikh N.G., Denisova O.N. 2009. Changes in erythrocyte membrane-cytoskeleton complex, induced by dimethyl sulfoxide, polyethylene glycol, and low temperature. Biofizika [Biophysics], 54 (4): 693-703. (in Russian)
9. Иржак Л.И. 1983. Эволюция системы крови. В кн.: Руководство по физиологии. Эволюционная физиология. Ч. 2. Л., Наука: 262-300.
Irzhak L.I. 1983. Evolution of the blood system. In: Rukovodstvo po fiziologii. Ch. 2. Jevoljucionnaja fiziologija [Guide on Physiology. P. 2. Evolutionary physiology]. Leningrad, Nauka: 262 -300. (in Russian)
10. Исабаева В.А., Пономарева Т.А. 1981. Кровь и её функции в адаптации. В кн.: Экологическая физиология животных. Ч. 2. Физиологические системы в процессе адаптации и факторы среды обитания. Л.,: 5-67.
Isabaeva V.A., Ponomareva T.A. 1981. The blood and its functions in the adaptation. In: Jekologicheskaja fiziologija zhivotnyh. Ch. 2. Fiziologicheskie sistemy v processe adaptacii i faktory sredy obitanija [Environmental physiology of animals. P. 2. Physiological systems in the process of adaptation and environmental factors]. Leningrad: 5-67. (in Russian)
11. Каппуччинелли П. 1982. Подвижность живых клеток. М., Мир, 126.
Kappuchchinelli P. 1982. Podvizhnost’ zhivyh kletok [Mobility of living cells]. Moscow, Mir,
126. (in Russian)
12. Козинец Г.И. и др. 2001. Кровь и инфекция. М., Триада-фарм, 456.
Kozinec G.I. i dr. 2001. Krov’ i infekcija [Blood and infection]. Moscow, Triada-farm, 456. (in Russian)
13. Лысак В.В. 2005. Микробиология. Мн., БГУ, 261.
Lysak V.V. 2005. Mikrobiologija [Microbiology]. Minsk, BGU, 261. (in Russian)
14. Маянский А.Н., Маянский Д.Н. 1983. Очерки о нейтрофиле и макрофаге. Новосибирск, Наука, 256.
Majanskij A.N., Majanskij D.N. 1983. Ocherki o nejtrofile i makrofage [Essays on neutrophils and macrophages]. Novosibirsk, Nauka, 256. (in Russian)
15. Меньшиков И.В., Бедулева Л.В. 2001. Основы иммунологии. Лабораторный практикум. Ижевск, 136.
Men’shikov I.V., Beduleva L.V. 2001. Osnovy immunologii. Laboratornyj praktikum [Fundamentals of Immunology. Laboratory practical work]. Izhevsk, 136. (in Russian)
16. Мечников И.И. 1954. Лекции по сравнительной патологии воспаления. М.
Mechnikov I.I. 1954. Lekcii po sravnitel’noj patologii vospalenija [Lectures in comparative pathology of inflammation]. Moscow. (in Russian)
17. Сиротин А.А. 2004. Практикум по микробиологии. Белгород, Изд-во БелГУ, 78. Sirotin A.A. 2004. Praktikum po mikrobiologii [Practical work on microbiology]. Belgorod,
Izd-vo BelGU, 78. (in Russian)
18. Федорова М.З. 2001. Реактивность лейкоцитов крови при различных функциональных нарушениях. Автореф. дис. … канд. биол. наук. Ярославль, 68.
Fedorova M.Z. 2001. Reaktivnost’ lejkocitov krovi pri razlichnyh funkcional’nyh narushenijah [The reactivity of leukocytes in various functional disorders]. Abstract. dis. … cand. biol. sciences. Jaroslavl’, 68. (in Russian)
19. Федорова М.З., Левин В.Н. 2001. Спонтанная миграция нейтрофилов крови в смешанной популяции лейкоцитов и ее изменения под влиянием веществ аутоплазмы при различных функциональных состояниях организма. Клиническая лабораторная диагностика, 5:16-19.
Fedorova M.Z., Levin V.N. 2001. Spontaneous migration of neutrophils in the mixed population of white blood cells and its changes under the influence of substances of autoplasma at various functional conditions of the organism. Klinicheskaja laboratornaja diagnostika [Clinical Laboratory Diagnostics], 5: 16-19. (in Russian)
20. Чернявских С.Д., Федорова М.З., Кует Д.Х., Тхань В.В., Забиняков Н.А. 2011. Миграционная активность гемоцитов позвоночных животных при различной температуре. Научные ведомости БелГУ. Естественные науки, 14 (3): 150-154.
Chernyavskikh S.D., Fedorova M.Z., Do Huu Quyet, Vo Van Thanh, Zabinyakov N.A. 2011. Migration activity of blood cells of vertebrate animals at different temperatures. Nauchnye vedomosti BelGU. Estestvennye nauki [Belgorod State University Scientific Bulletin. Natural sciences], 14 (3): 150-154. (in Russian)
21. Bagge U., Braide M. 1982. Leukocyte plugging of capillaries in vivo. In: White Blood Cells. Morphology and Rheology as Related to Function. The Hague, Martinus Nijhoff: 89-94.
22. Bennett V., Baines A.J. 2001. Spectrin and ankyrin-based pathways: metazoan inventions for integrating cells into tissues. Physiological Reviews, 81 (3): 1353-1392.
23. Fedorova M.Z. et al. 2008. Comparative evaluation of the locomotion activity of vertebrates’ blood cells. Biological motility. Achievements and perspectives, Pushchino, 212-213.
24. Fedorova M.Z., Golovko S.I., Chernyavskikh S.D. 2012. Comparative evaluation of morphofunctional organization of vertebrate nuclear blood cells. Journal of Evolutionary Biochemistry and Physiology, 48 (2): 177-181.
24. Friemel H., Brock J. 1976. Grundlagen der Immunologie. Academic-Verlag, Berlin, 177.
25. Fulton A. B. 1984. The Cytoskeleton: Cellular Architecture and Choreography. Springer,
80.
26. Gennis R.B. 1989. Biomembranes, Molecular structure and function. Springer Verlag, New York, 533.
27. Chernyavskikh S.D., Fedorova M.Z., Vo Van Thanh, Do Huu Quyet. 2012. Reorganization of actin cytoskeleton of nuclear erythrocytes and leukocytes in fish, frogs, and birds during migration. Cell and Tissue Biology, 54 (5): 412-416.
Лейкоциты — урок. Биология, Человек (8 класс).
Лейкоциты —белые ядросодержащие клетки крови. В \(1\) мм³ крови содержится обычно \(4\)–\(9\) тыс. лейкоцитов, но при некоторых болезнях их количество может заметно увеличиваться.
Основная функция белых кровяных клеток — защита организма от разных чужеродных объектов.
Продолжительность жизни этих клеток разная, но в среднем они живут всего несколько дней. Разрушение лейкоцитов происходит в селезёнке.
Известно несколько видов лейкоцитов. Они отличаются особенностями строения и выполняемыми функциями.
Часть лейкоцитов может захватывать и уничтожать различные чужеродные частицы. Лейкоциты способны к активному амебоидному движению и могут переходить через стенку капилляров и проникать в ткани, где они поглощают и переваривают чужеродные частицы. Лейкоциты также защищают от переродившихся раковых клеток.
Способность лейкоцитов захватывать чужеродные частицы впервые была обнаружена русским учёным Ильёй Ильичом Мечниковым (создателем фагоцитарной теории иммунитета). И. И. Мечников назвал открытое
явление фагоцитозом, а способные к фагоцитозу лейкоциты — фагоцитами («пожирателями»).
Фагоцитоз — поглощение твёрдых частиц пищи клеткой.
Если чужеродных тел проникло в организм очень много, то фагоциты, поглощая их, сильно увеличиваются в размерах и в конце концов разрушаются. При этом освобождаются вещества, вызывающие местную воспалительную реакцию, которая сопровождается отёком, повышением температуры и покраснением поражённого участка. Эти вещества также привлекают новые лейкоциты к месту внедрения чужеродных тел. Гной, который образуется в тканях при воспалении, — это скопление погибших лейкоцитов.
Другие лейкоциты (лимфоциты) вырабатывают особые белки (антитела), которые распознают и связывают (обезвреживают) чужеродные клетки и вырабатываемые ими вредные для организма вещества (токсины). Чужеродные частицы теряют свои вредоносные способности и болезнь не развивается.
Образование антител происходит с участием особого вида лейкоцитов, встречающихся не только в крови, но и в лимфе. Поэтому их называют лимфоцитами.
Т–лимфоциты способны связываться с антигенами чужеродных частиц и вызывать их разрушение. В–лимфоциты выделяют химические вещества — антитела. Антитела, присоединяясь к антигенам, ускоряют их захват фагоцитами, либо приводят к химическому разрушению или склеиванию и осаждению антигенов.
Обычно антитела действуют против возбудителя одного заболевания (например, против возбудителя кори). Наличие в крови антител к возбудителю определённой болезни создаёт невосприимчивость организма к повторным заболеваниям этой болезнью.
Именно благодаря B-лимфоцитам (клеткам памяти при иммунном ответе) у человека появляется иммунитет к перенесённым заболеваниям (единожды проконтактировав с болезнетворным агентом (бактерией, вирусом, химическим соединением), эти клетки запоминают агент и приспосабливаются к его устранению). И именно благодаря им возможен эффект от вакцинации (прививок).
При нарушении образования лимфоцитов человек лишается защиты от инфекции.
Источники:
http://festival.1september.ru/articles/588083/
http://www.tiensmed.ru/news/eritrociti1.html
http://www.rlsnet.ru/books_book_id_2_page_38.htm
Форменные элементы крови | Параграф 16
«Биология. Человек. 9 класс». А.С. Батуев и др.
Вопрос 1.
Форменные элементы крови — это эритроциты, лейкоциты, тромбоциты.
Вопрос 2.
Эритроциты — это красные кровяные клетки; у млекопитающих и человека они не содержат ядра. Имеют двояковогнутую форму; диаметр их примерно 7—8 мкм. Суммарная поверхность всех эритроцитов примерно в 1500 раз больше поверхности тела человека. В 1 мм3 крови их содержится 4—5 млн (5,1—5,4 млн у мужчин и 4,6—4,8 млн у женщин). Общая площадь поверхности эритроцитов взрослого человека составляет около 3800 м2. Благодаря своей форме Образуются они в красном костном мозге и выполняют дыхательную функцию — транспортируют кислород и частично углекислый газ; Транспортная функция эритроцитов обусловлена тем, что в них содержится белок гемоглобин, в состав которого входит двухвалентное железо. Отсутствие ядра освобождает место для гемоглобина, благодаря которому эритроциты выполняют функцию транспорта кислорода в организме. Эритроциты очень эластичны, поэтому легко проходят по узким капиллярам. Количество эритроцитов в крови увеличивается при гипоксии (недостатке кислорода) и уменьшается при анемии. Эритроциты — это долгоживущие клетки крови: они живут 30—120 дней.
Основная функция эритроцитов — перенос кислорода из легких в ткани и диоксида углерода из тканей в легкие. Красные кровяные тельца образуются в костном мозге плоских костей, продолжительность их жизни — 100—120 дней. Затем эритроциты разрушаются в селезенке и в печени.
Снижение концентрации кислорода в окружающем воздухе (например, в условиях высокогорья) ведет к увеличению числа эритроцитов и концентрации гемоглобина в крови, что имеет большое приспособительное значение.
Вопрос 3.
Гемоглобин в легких присоединяет кислород, образуя непрочное соединение оксигемоглобин. В тканях кислород отщепляется от гемоглобина и используется клетками. Освободившийся гемоглобин соединяется с углекислым газом, превращаясь в карбоксигемоглобин. В легких углекислый газ отщепляется от гемоглобина и выводится из организма вместе с выдыхаемым воздухом.
Вопрос 4.
Угарный газ (СО) образует устойчивое соединение с гемоглобином, что препятствует транспорту кислорода в организме. Это приводит к тяжелому отравлению и, если вовремя не оказать человеку помощь, он может умереть.
Вопрос 5.
Основная функция лейкоцитов — защита организма от болезнетворных микробов. Фагоцитоз — процесс переваривания лейкоцитами микробов и различных чужеродных частиц. Лейкоциты уничтожают также отмершие клетки организма.
Вопрос 6.
Причины малокровия:
а) большие кровопотери;
б) отравление ядами животных;
в) нарушение функций кроветворных органов;
г) перенесенные заболевания (малярия).
Вопрос 7.
И. И. Мечников открыл явление фагоцитоза и разработал фагоцитарную теорию иммунитета, за что получил Нобелевскую премию.
Клетки крови и их значение
1. Эритроциты — это красные кровяные клетки; диаметр их примерно 7—8 мкм. Суммарная поверхность всех эритроцитов примерно в-1500 раз больше поверхности тела человека. Живут 100-120 дней.
Количество в 1 мм3: 4-5 млн.
Строение: у млекопитающих и человека они не содержат ядра. Имеют двояковогнутую форму;
Функция: транспортируют кислород и частично углекислый газ посредством гемоглобина.
Место образования: образуются они в красном костном мозге. В селезёнке — запас на случай кровопотери.
2. Тромбоциты — это кровяные пластинки, самые мелкие форменные элементы. Диаметр их клеток составляет 2-5 мкм. Живут 8-11 дней.
Количество в 1 мм3: 250-400 тыс.
Строение: плоские безъядерные клетки неправильной округлой формы.
Функция: oсновная функция тромбоцитов — участие в свертывании крови, так как при их разрушении в плазму выходят факторы свертывания. При тромбоцитопении (снижении числа тромбоцитов) свертываемость крови снижается.
Место образования: образуются они в красном костном мозге.
3. Лейкоциты — бесцветные ядерные клетки крови человека и животных. Диаметр их клеток составляет 2-14 мкм. Продолжительность их жизни составляет от одного дня до нескольких лет. Они делятся на 5 типов, различающихся по строению, функциям и месту образования: лимфоциты, моноциты, нейтрофилы, базофилы и эозинофилы. Нейтрофилы, моноциты и эозинофилы способны к фагоцитозу, их еще называют фагоцитами.
Количество в 1 мм3: 5-8 тыс.
Строение: бесцветные амебообразные клетки. Они содержат ядра и по размеру больше эритроцитов.
Функция: Защита организма от болезнетворных микробов путём фагоцитоза (фагоциты). Выработка антител, создание иммунитета (лейкоциты).
Место образования: образуются они в красном костном мозге, селезёнке, лимфатических узлах.
Микрофагоциты: искусственные иммунные клетки | Нанотехнологии Nanonewsnet
Люди часто спрашивают о примерах тех уникальных возможностей, которые нанороботы могут принести медицине. Правда ли, что некоторые простые вещи, исполняемые нанороботами, не могут быть реализованы с помощью биотехнологий?
Респироциты – искусственные красные клетки крови – один из ответов на этот вопрос. Их функциональность во много раз превосходит существующие эритроциты: это и возможность переносить больше кислорода, чем природный аналог, и высокая долговечность, и возможность перепрограммирования (что вообще в данное время не может реализовать биотехнология), и высокое быстродействие. В живых системах быстродействие играет основную роль. Наномедицина предлагает мощные инструменты для борьбы с человеческими заболеваниями и для потенциального улучшения человеческого организма. Выполненные из алмазоида медицинские нанороботы могут внести улучшения возможностей нашего организма выше природных. Клоттоциты, например, заменяя «родные» человеческие тромбоциты достигают прекращения кровотечения (искусственный быстродействующий гемостазис) за 1 секунду, причем кровотечение может быть довольно обширным (физическое повреждение тканей) или небольшим внутренним. При этом концентрация искусственных тромбоцитов меньше натуральных в 100 раз. То есть, клоттоциты в 10000 раз эффективней природного аналога, т.к. время нормального тромбогенеза колеблется от 5 до 17 минут.
Рассмотрим далее еще одну составляющую «механизированной крови» – механических фагоцитов или микрофагоцитов. На самом деле, микрофагоцитами можно назвать целый класс нанофагоцитов. Различные представители этого класса выполняли бы различные функции в организме – от линии первого реагирования в крови (внутривенные) до внутритканевых и внутрицереброспинных. Но общая цель подобных устройств – уничтожение микробиологических патогенов, найденных в организме человека, используя метод «перевари-и-выброси», детально описанный автором в [1]. Полная версия инженерного описания микрофагоцитов может быть прочитана в [4], ресурс на английском языке.
Сепсис, известный также как заражение крови – это наличие в крови патогенных микроорганизмов. Если размножение микроорганизмов не контролировать, то инфекция будет прогрессировать. Бактеремия – наличие бактерий в кровеносной системе человека. Хоть в крови и много веществ, которыми могут питаться бактерии, однако кровь обычно не содержит микроорганизмов (бактерий). Основная противомикробная защита кровеносной системы – циркулирующие нейтрофилы и моноциты (белые кровяные тельца), способные к фагоцитозу (захвату и перевариванию других клеток) и продукции иммуноглобулина, формируя иммунный ответ.
Однако, несмотря на это, в кровеносной системе человека может присутствовать небольшое количество бактерий. Чистка зубов, например, вызывает небольшое их движение в гнездах, что приводит к попаданию микроорганизмов, находящихся в ротовой полости, в кровеносную систему [5]. Бактерии также могут попадать в кровь через раны на коже, деснах, языке [6]. Бактерии также попадают в кровь в течении хирургических операций, лечения зубов, а также после инъекций, цитоскопии, анализа крови и даже при замене клапана сердца на искусственный [6]. Эти бактерии обычно уничтожаются лейкоцитами (а также ретикулоэндотелиальными фагоцитами печени, легких и лимфатической системы). Однако некоторое количество вирулентных (вредных для человека, смертоносных) бактерий все же могут обойти естественную защиту. Центр Здравоохранения утверждает, что около ~25,000 граждан США ежегодно умирают от бактериального сепсиса. В настоящее время используют ряд антибиотиков для подавления сепсиса, принимая их в количестве нескольких миллиграмм в день. Такой метод лечения длится иногда недели или даже месяцы для того, чтобы уничтожить патогенные бактерии, такие, как, например, Pseudomonas aeruginosa или Salmonella.
Комплекс наноустройств, способный быстро очищать кровь человека от патогенов при сравнительно небольшой концентрации нанороботов, был бы желательным дополнением в современном терапевтическом арсенале. Такой робот назовем микрофагоцитом, или искусственным механическим белым кровяным телом.
Микрофагоцит – это сфероидальное наномедицинское устройство, состоящее из 610 биллионов точно расположенных атомов, плюс около 150 биллионов молекул газа или воды, когда резервуары устройства будут заполнены. Размеры наноробота – 3.4 мкм в диаметре вдоль главной оси, и 2.0 мкм вдоль оси, перпендикулярной к главной. Такие размеры дают наноустройству возможность беспрепятственно проникать в мельчайшие капилляры, диаметр которых ~4 мкм [1]. Его сравнительно большой для наноустройства объем (12.1056 мкм3) дает возможнть разместить внутри наноробота два пустых внутренних резервуара объемом 4 мкм3. Наноустройство потребляет 100–200 пВт (пикоВатт) мощности при работе и может полностью «переварить» микробов, находящихся во внутреннем резервуаре наноустройства со скоростью 2 мкм3 за 30-секундный цикл. Как и в предыдущих проектах нанороботов (прим. перев. – проектах Роберта Фрайтаса) [2], для того, чтобы гарантировать надежную работу наноустройства, микрофагоцит спроектирован с десятикратным запасом по всем основным характеристикам, исключая большие пассивные структурные элементы (такие, например, как корпус). Масса «пустого» устройства – 12.2 пикограмм (см. рис. 1).
Рис. 1 Предполагаемый вид микрофагоцита (взято из Наномедицинской Галереи Института Предвиденья), автор: Vik Olliver
Опишем работу наноустройства. В течение каждого цикла операций, выполняемых устройством, патогенная бактерия прилипает к поверхности наноробота, как муха на липкую ленту, благодаря специальным обратимым «присоединительным гнездам» [1]. Затем телескопические наноманипуляторы, изготовленные по примеру «руки робота», выдвигаются из специальных гнезд на поверхности микрофагоцита и, достигнув жесткого прикрепления к мембране бактерии, транспортируют микроорганизм к входному порту на передней части устройства, где бактерия оказывается в умертвительном резервуаре объемом 2 мкм3 (см. рис. 2). После интенсивного механического перемалывания бактерии (или бактерий) органические остатки выдавливаются специальным поршнем в «дигестальный» резервуар объемом 2 мкм3, где остатки перевариваются с помощью запрограммированной последовательности 40 специально сконструированных энзимов, которые сменяются около шести раз. В результате полученные остатки будут представлять собой простые аминокислоты, мононуклеотиды, глицерин, воду, жирные кислоты и простые сахара, абсолютно безвредные для организма человека. Далее они выбрасываются в кровеносную систему пациента. Все эти операции происходят в течение 30-секундного цикла.
Рис. 2 Микрофагоцит, захватывающий бактерию для фагоцитоза (взято из Наномедицинской Галереи Института Предвиденья), автор: Forrest Bishop
Этот протокол, названный автором «перевари-и-выброси», [1] практически идентичен процессам переваривания и фагоцитоза, которые используют натуральные фагоциты. Однако искусственный процесс фагоцитоза будет намного быстрее и чище – продукты механических микрофагоцитов не будут содержать вредных для человека веществ. Например, всем известные макрофаги после фагоцитоза патогенных микроорганизмов выбрасывают в кровь биологически активные вещества [7], в то время как продукты фагоцитоза микрофагоцитов будут биологически неактивными и не представляющими угрозу для человека.
Обычные фагоциты больше по объему в 100–1000 раз, чем искусственные, при этом они потребляют на фагоцитоз столько же энергии. Например, изменение теплоэнергии от обычных человеческих нейтрофилов при фагоцитозе составляет 19 пикоВатт. Это число растет с увеличением частиц, которые захвачены фагоцитом [8]. Т-лимфоцит объемом около 400 мкм3 при иммунном ответе потребляет ~45 пикоВатт [9].
Захват микроорганизмов натуральными фагоцитами длится недолго – порядка нескольких минут; зато полный цикл переваривания и экскреции может длиться часами. В то время как макрофаги могут захватить и переварить около ~25% их объема в час [10], механические микрофагоциты могут обработать ~2000% своего объема в час. Это значит, что механические фагоциты эффективнее обычных в ~80 раз. Другими словами, аналогичный объем нанороботов может переварить патогенные бактерии в 80 раз быстрее натуральных фагоцитов.
Жизненный цикл многих естественных фагоцитов (например, нейтрофилов), колеблется от нескольких часов в крови или нескольких дней в тканях. В одном эксперименте [11] 1–100 патогенов S. aureus или S. faecalis bacteria были помещены к отдельному нейтрофилу, который уничтожил большую их часть при такой высокой концентрации. При повышении концентрации патогенов (100:1) нейтрофилы могли уничтожить около 9 S. aureus bacteria за цикл фагоцитоза, в то время как нейтрофилы при хроническом заболевании грануломатозе могут уничтожить около 14 S. faecalis bacteria за цикл фагоцитоза. Для сравнения, один механический микрофагоцит может уничтожить до ~3000 микроорганизмов P. aeruginosa bacteria в день, при этом жизненный цикл механических устройств практически не ограничен.
Рис. 3 Микрофагоцит по сравнению с эритроцитом (взято из Наномедицинской Галереи Института Предвиденья), автор: Forrest Bishop
В более детальном описании микрофагоцитов [4] представлена простая математическая модель фармакокинетических свойств определенной дозы устройств, инъектированных в человеческую кровеносную систему. Результаты математической модели были следующими: при терапевтической дозе наноустройств в 1-теработ (1012 устройств) можно устранить легкую бактеремию (0.1×106 патогенных единиц (ПЕ) на 1 мл) от 5.4×108 ПЕ в кровеносной системе человека, до <1 ПЕ за 460–5400 секунд (8–90 мин), если при этом необходимо 1–10 столкновений бактерии с микрофагоцитом для достижения «прилипания» патогена к поверхности наноробота.
Средняя бактеремия (100×106 ПЕ/мл) будет устранена за 620–7300 сек (10–120 мин). При этом необходимо заметить, что 1-теработ внутривенная доза ( ~ 12 см3 инъекция) микрофагоцитов, составит концентрацию наноустройств в крови взрослого человека (нанокрит) Nнанокрит ~ 0.2%, выделяя тепловой энергии около 100–200 Вт, что составляет максимальную терапевтическую дозу по теплогенному действию на организм для медицинских наноустройств [1].
В то время как микрофагоциты могут полностью устранить сепсис за минуты или часы, естественные защиты организма (даже подкрепленные антибиотиками) могут достичь того же результата за недели или даже месяцы. Поэтому иммунитет, построенный на микрофагоцитах, будет в ~1000 более быстродействующим, чем естественные защиты.
Еще одно полезное сравнение: многие антибактериальные агенты (например, против E. coli) могут повысить LD50 этого патогена ~500-раз, используя антибиотики [12] или ~850-раз, используя антитела [13]. Например, LD50 млекопитающих для E. coli составляет ~0.1–1×106 ПЕ/мл, а в присутствии антибиотиков это число возрастает до ~108 ПЕ/мл. Используя 1-теработ терапевтическую дозу микрофагоцитов, даже такая высокая концентрация бактерий в кровеносной системе, как ~1011 ПЕ/мл (~20% крови при этом будет заражено микроорганизмами объемом ~2 мкм3), может контролироваться микрофагоцитами, что дает суммарную эффективность в ~1000 раз перед естественными фагоцитами. И эта эффективность будет достигнута с помощью наномедицины.
С минимальными дополнениями к конструкции микрофагоцит может быть использован для лечения боевой токсемии – распространения в человеческом теле патогенов, вырабатываемых бактериями. Например, у подопытных обезьян наблюдался септический шок с использованием бактерии E. coli с концентрацией 425×106 ПЕ/мл. При этом концентрация патогенного бактериального липополисахарида (ЛПС) в их крови выросла от 0.076 нанограмм/мл (нормальное количество) до максимальной концентрации 1.130 нг/мл [14]. При проведении другого исследования, уровень эндотоксина, в течение бактериальной инфекции, вырос от 0.2 до 2 нг/мл в крови подопытной свиньи [15]. Для устранения ~2 нг/мл ЛПС эндотоксина из крови [16], необходимо изолирование и энзимная переработка ~8×1014 ЛПС молекул из кровяного объема в ~5400 см3, или около ~800 ЛПС молекул на 1 наноустройство, предполагая терапевтическую дозу в 1 теработ модифицированных нанофагоцитов..
Высокая смертность (от 30%-50%) связана с реакцией пациента на ЛПС, которые провоцируют производство цитокинов IL-1beta и IL-6, которые вызывают неконтролируемое воспаление в тканях и дисфункцию органов [17]. Мы уже упоминали, что малые концентрации (~нг/мл) молекул ЛПС производятся бактериями живущими в человеческом теле, однако уничтожение бактерий с помощью антибиотиков оставляет в крови большое количество ЛПС (до ~105 нг/мл [17]). Использование искусственных микрофагоцитов предполагает полное «переваривание» бактерий, включая уничтожение мембранных ЛПС. Поэтому микрофагоциты представляют антимикробную терапию, не производящую септического шока.
Если перед внедрением микрофагоцитов в кровь пациента она уже содержит большое количество воспалительных цитокинов, то необходимо произвести первичную противовоспалительную терапию, внедрив в кровь пациента наноустройства класса респироцитов [2] (например, фармацитов [1]) для удаления молекул цитокинов. Такой совместный подход уже обсуждался в [1, 18]. Внутривенная терапевтическая доза фармацитов микронных размеров в размере 1-теработ (каждый наноробот имеет ~105 молекулярных сортирующих роторов и резервуар объемом ~0.5 мкм3 для хранения цитокинов) может понизить содержание цитокинов в крови от ~100 нг/мл [210] (~3×10– 9 молекул/нм3) до нормального уровня ~10 пг/мл [211] (~3×10– 13 молекул /нм3) в течение ~200 секунд, используя для хранения молекул ~0.1% от объема резервуаров наноустройств. Удаление ~105 нг/мл молекул ЛПС займет ~100% объема резервуаров фармацитов.
Микрофагоциты будут также полезны при лечении менингитов цереброспинной жидкости и респираторных заболеваний. Нанороботы также могут устранить такие небактериальные патогены, как вирусы, микроскопические паразиты и пр. Вне человеческого тела микрофагоциты могут служить для очищения биологически опасных сред, токсических органических материалов и пр.
Благодарности
Автор выражает благодарность C.Christopher Hook, M.D., Stephen S. Flitman, M.D., Ronald G. Landes, M.D., а также Forrest Bishop, Robert J. Bradbury, and Ralph C. Merkle, за полезные комментарии к ранним версиям этой статьи.
Отчет IMM № 25 (оригинал находится здесь: http://www.imm.org/…/Rep025.html)
Автор: Robert A. Freitas Jr., ведущий исследователь IMM
Сайт Роберта Фрайтаса: http://www.rfreitas.com/
Перевод Свидиненко Юрия
Ссылки
- Robert A. Freitas Jr., Nanomedicine, Volume I: Basic Capabilities, Landes Bioscience, Georgetown, TX, 1999. See at: http://www.nanomedicine.com/.
- Robert A. Freitas Jr., «Exploratory Design in Medical Nanotechnology: A Mechanical Artificial Red Cell,» Artificial Cells, Blood Substitutes, and Immobil. Biotech. 26(1998):411–430. See at: http://www.foresight.org/…rocytes.html.
- Robert A. Freitas Jr., «Clottocytes: Artificial Mechanical Platelets,» Foresight Update No. 41, 30 June 2000, pp. 9–11. See at: http://www.imm.org/…/Rep018.html.
- Robert A. Freitas Jr., «Microbivores: Artificial Mechanical Phagocytes using Digest and Discharge Protocol,» March 2001; see at: http://www.zyvex.com/…bivores.html.
- John Heritage, «Septicaemia and Endocarditis,» Laboratory and Scientific Medicine, MICR3290 Medical Microbiology, University of Leeds, November 1996; see at: http://www.leeds.ac.uk/…eptendo.html.
- Robert Berkow, Mark H. Beers, Andrew J. Fletcher, eds., The Merck Manual of Medical Information, Merck Research Laboratories, Whitehouse Station NJ, 1997.
- E.F. Fincher, L. Johannsen, L. Kapas, S. Takahashi, J.M. Krueger, «Microglia digest Staphylococcus aureus into low molecular weight biologically active compounds,» Am. J. Physiol. 271(July 1996):R149-R156.
- H. Hayatsu, T. Miyamae, M. Yamamura, «Heat production as a quantitative parameter of phagocytosis,» J. Immunol. Methods 109(9 May 1988):157–160.
- Augusto Cogoli, Birgitt Bechler, Marianne Cogoli-Greuter, Sue B. Criswell, Helen Joller, Peter Joller, Elisabeth Hunzinger, Ottfried Muller, «Mitogenic signal transduction in T lymphocytes in microgravity,» J. Leukocyte Biol. 53(May 1993):569–575; Dennis A. Carson, «Chapter 94. Composition and biochemistry of lymphocytes and plasma cells,» in Ernest Beutler, Marshall A. Lichtman, Barry S. Coller, Thomas J. Kipps, eds., William’s Hematology, Fifth Edition, McGraw-Hill, New York, 1995, pp. 916–921.
- Robert K. Murray, Daryl K. Granner, Peter A. Mayes, Victor W. Rodwell, Harper’s Biochemistry, 23rd Edition, Appleton & Lange, Norwalk CT, 1993.
- J.E. Repine, C.C. Clawson, «Quantitative measurement of the bactericidal capability of neutrophils from patients and carriers of chronic granulomatous disease,» J. Lab. Clin. Med. 90(September 1977):522–528.
- S.E. Bucklin, D.C. Morrison, «Bacteremia versus endotoxemia in experimental mouse leukopenia — role of antibiotic chemotherapy,» J. Infect. Dis. 174(December 1996):1249–1254.
- J. Colino, I. Outschoorn, «The form variation of the capsular polysaccharide K1 is not a critical virulence factor of E. coli in a neonatal mouse model of infection,» Microb. Pathog. 27(October 1999):187–196.
- B.C. Wessels, M.T. Wells, S.L. Gaffin, J.G. Brock-Utne, P. Gathiram, L.B. Hinshaw, «Plasma endotoxin concentration in healthy primates and during E. coli-induced shock,» Crit. Care Med. 16(June 1988):601–605.
- O. Rokke, A. Revhaug, B. Osterud, K.E. Giercksky, «Increased plasma levels of endotoxin and corresponding changes in circulatory performance in a porcine sepsis model: the effect of antibiotic administration,» Prog. Clin. Biol. Res. 272(1988):247–262.
- L. Aussel, R. Chaby, K. Le Blay, J. Kelly, P. Thibault, M.B. Perry, M. Caroff, «Chemical and serological characterization of the bordetella hinzii lipopolysaccharides,» FEBS Lett. 485(17 November 2000):40–46.
- J.T.M. Frieling, J.A. Mulder, T. Hendriks, J.H.A.J. Curfs, C.J. van der Linden, R.W. Sauerwein, «Differential Induction of Pro- and Anti-Inflammatory Cytokines in Whole Blood by Bacteria: Effects of Antibiotic Treatment,» Antimicrob. Agents Chemother. 41(July 1997):1439–1443.
- Robert A. Freitas Jr., «Nanopyrexia,» Foresight Update No. 43, 30 December 2000, pp. 14–16. See at: http://www.imm.org/…/Rep022.html.
- J. Hulkkonen, P. Laippala, M. Hurne, «A rare allele combination of the interleukin-1 gene complex is associated with high interleukin-1b plasma levels in healthy individuals,» Eur. Cytokine Netw. 11(April 2000):251–255.
ФЕНОТИПИЧЕСКАЯ ГЕТЕРОГЕННОСТЬ НЕЙТРОФИЛОВ: НОВЫЕ АНТИМИКРОБНЫЕ Х АРАКТЕРИСТИКИ И ДИАГНОСТИЧЕСКИЕ ТЕХНОЛОГИИ | Андрюков
Нейтрофилы, или полиморфнонуклеарные нейтрофилы (ПМН) (polymorphonuclear neutrophils, PMN), являются наиболее многочисленным пулом лейкоцитов и основными клеточными компонентами врожденной иммунной системы человеческого организма и обладают как противоинфекционной, так и провоспалительной функцией [1—4]. Традиционно считалось, что нейтрофилы являются относительно гомогенной популяцией терминально дифференцированных лейкоцитов, что эти клетки, в отличие от лимфоцитов и моноцитов, обладают ограниченной универсальностью и пластичностью [1]. Однако полученные в последние годы данные показали, что ПМН представляют собой фенотипический гетерогенный пул и обладают высокой морфологической и функциональной вариабельностью [2, 3], что позволяет рассматривать нейтрофилы в качестве как важных модуляторов воспаления, так и активных эффекторов иммунных реакций [3, 4].
Еще в 1920 г. высказывались сомнения насчет гомогенности этого лейкоцитарного пула, основанные на сведениях, что циркулирующие нейтрофилы могут демонстрировать значительные различия в функциях, таких как фагоцитоз, синтез белка и окислительный обмен (цит. по [2]). Однако до недавнего времени лишь ограниченное количество исследований касалось фенотипических различий ПМН, и только благодаря обнаружению высокоспецифичных нейтрофильных маркеров стало возможным разделить эту субпопуляцию клеток на подмножества [2—4].
Целью настоящего обзора является обобщить основные концепции фенотипической и функциональной гетерогенности нейтрофилов с позиции их функций и роли в развитии физиологических и патологических реакций. Особое внимание будет уделено диагностической и иммуномодулирующей стратегиям.
Нейтрофилы: созревание и жизненный цикл
В нормальных условиях нейтрофилы образуются в костном мозге из морфологически неидентифицируемых гемопоэтических стволовых клеток, способных пролиферировать и дифференцироваться в белые и красные кровяные клетки и клетки — предшественники миелопоэза (гранулоцитарно-макрофагальная колониеобразующая единица (КОЕ-ГМ) гранулоци- тарная колониеобразующая единица (КОЕ-Г) [3, 5—7]. Деление и созревание этих клеток стимулируются факторами роста (интерлейкинами, гранулоцитарно- макрофагальным колониестимулирующим фактором (ГМ-КСФ) и гранулоцитарным КСФ — основными цитокинами, регулирующим гранулопоэз в норме через рецептор гранулоцитарного колониестимулирующего фактора, что приводит к формированию миелоидных пулов делящихся клеток (миелобластов, промиелоцитов и миелоцитов) и нейтрофилов, которые в процессе дифференцировки утратили способность к делению (метамиелоцитов, палочкоядерных и сегментоядерных гранулоцитов). Неделящийся пул составляет основную массу гранулоцитарного костномозгового резерва, превышающий по численности клетки, циркулирующие в периферической крови, в 30—70 раз [5, 8, 9]. Основные функции костномозгового резерва — поддерживать гомеостаз гранулоцитов («гомеостатический гранулопоэз»), циркулирующих в крови, и мобилизовать дополнительное количество клеток («экстренный гранулопоэз») при возникающей необходимости (воспаление, инфекции, рак и другие) [10, 11]. О значении гранулопоэза для организма говорит тот факт, что клетки миелоидных пулов занимают около 2/3 объема костного мозга [10].
Для поддержания гомеостаза уровня нейтрофилов других клеток в периферической крови пролиферация и дифференцировка клеток-предшественников жестко регулируется и контролируется несколькими внутренними и внешними факторами. Например, в нишах костного мозга гемопоэтические стволовые клетки сохраняются посредством взаимодействия мембранных β-интегринов с остеобластами и внеклеточным матриксом [4, 12, 13].
После созревания ПМН попадают в периферический кровоток (5х1010—1011 клеток в сутки), мигрируют в ткани, где они выполняют свои антимикробные функции. Соответственно, эквивалентное количество стареющих нейтрофилов должно быть удалено из кровообращения для сохранения гомеостаза. Нейтрофильный гомеостаз в периферической крови строго регулируется благодаря многокомпонентному механизму поддержания баланса между ростом ПМН, их дифференцировкой и элиминацией [4, 12]. Этот баланс обеспечивает выполнение этими клетками многочисленных функций с помощью фенотипической пластичности [3, 13]. Нарушение гомеостаза периферических нейтрофилов влияет на врожденный и адаптивный иммунитет, может привести к возникновению опасных для жизни инфекций, аутоиммунным или онкологическим заболеваниям.
На протяжении всей их жизни нейтрофилы по мере созревания претерпевают фенотипические переходы, которые могут быть продиктованы местным микроокружением в кровообращении и периферических тканях. Во время развития и созревания нейтрофилы проходят ряд последовательных стадий до формирования генерации зрелых нейтрофилов [12, 13]. Гранулопоэтическая популяция нейтрофилов в костном мозге делится на 3 различных пула: стволовых клеток, митотический и постмитотический. Пул стволовых клеток состоит из недифференцированных полипотентных клеток-предшественников. Митотический пул представлен миелоидными клетками-предшественниками, такими как миелобласты, промиелоциты, метамиелоциты и миелоциты. Постмитотический пул состоит из метамиелоцитов и палочкоядерных нейтрофилов. Наконец, зрелые нейтрофилы являются полностью дифференцированной клеточной генерацией, которая выходит из костного мозга и циркулирует в периферической крови.
По мере созревания и на разных стадиях диффе- ренцировки в цитоплазме нейтрофилов появляются гранулы (азурофильные, специфические и желати- назные) и секреторные пузырьки, которые содержат антимикробные пептиды и ферменты: эластазы, мие- лопероксидазы, кателицидины, дефензины и матрикс- ные металлопротеиназы, являющиеся эффективным инструментом для реализации антибактериальных стратегий ПМН [2, 10, 12].
Гранулярный аппарат нейтрофилов необходим для выполнения ими своей роли при врожденном иммунном ответе. Биологические молекулы, входящие в состав гранул, реагируют на окружающие сигналы, стимулирующие миграцию нейтрофилов к очагу инфекции и фагоцитоз вторгающихся микробов, инициируют генерацию активных форм кислорода из НАДФН-оксидазы, протеаз и антимикробных пептидов, которые, действуя совместно, создают агрессивную внутрифагосомальную среду и вызывают микробную эрадикацию [10, 13—16].
Важность образования активных форм кислорода проявляется при хронических гранулематозных заболеваниях с дефектной окислительной функцией ПМН. Для этих пациентов характерны частые рецидивирующие бактериальные и грибковые инфекции [4, 12, 14].
Являясь важными эффекторами иммунной системы, нейтрофилы ведут постоянный мониторинг организма, выявляя признаки микробных инфекций. После их обнаружения они мигрируют через эндотелий кровеносных сосудов в очаг инфекции или воспаления с помощью механизма, известного как каскад адгезии лейкоцитов (в котором принимают также участие селектины, лиганды и интегрины), и убивают вторгшиеся микроорганизмы [2, 5, 15, 16].
Миграция нейтрофилов в ткани имеет решающее значение для защиты от микробных инфекций. Важность этой функции проявляется у больных с дефектами адгезии этих клеток, что приводит к нарушению их миграции через эндотелий кровеносных сосудов. Такие больные страдают от множественных бактериальных инфекций из-за неспособности нейтрофилов к фагоцитозу [17, 18].
После выполнения своей функции в тканях нейтро- филы подвергаются апоптозу или элиминируются посредством фагоцитоза резидентными макрофагами и дендритными клетками. Запрограммированная гибель нейтрофилов — апоптоз — критичный процесс, модулирующий их количество и функции, запуская каскад противовоспалительных реакций и снижения продукции нейтрофилов [3, 17, 19—21].
В настоящее время признаны три основные проти- вомикробные стратегии нейтрофилов: фагоцитоз, дегрануляция, и формирование нейтрофильных внеклеточных ловушек (neutrophil extracellular traps, NETs) (рис. 1). NETs представляют собой защитный механизм, впервые описанный как средство улавливания и уничтожения бактерий и других патогенов [11, 22, 23]. Осуществляя такого рода внеклеточный киллинг микроорганизмов, нейтрофилы погибают через NETosis [11, 24].
Рисунок 1. Антибактериальные стратегии нейтрофилов: 1 — фагоцитоз; 2 — дегрануляция; 3 — нейтрофильные ловушки (рисунок авторов, световая микроскопия)
Figure 1. Anfibacferial strategies of neutrophils: I — phagocytosis; 2 — degranulation; 3 — neutrophilic traps (the authors’ picture, light microscopy)
Для выпуска сети активированные нейтрофилы претерпевают драматические морфологические изменения. Через минуты после активации они сплющиваются и крепко прикрепляются к субстрату. В течение следующего часа ядро теряет свои дольки, происходит деконденсация хроматина, а внутренние и внешние ядерные мембраны постепенно отделяются друг от друга. Одновременно гранулы распадаются. Через 1 ч ядерная оболочка дезагрегируется в везикулы, а нук- леоплазма и цитоплазма образуют гомогенную массу. Наконец, клетки округляются и, по-видимому, сжимаются до тех пор, пока клеточная мембрана не разрывается, а внутренняя часть клетки выбрасывается во внеклеточное пространство, образуя NETs [25].
Эти противомикробные стратегии до настоящего времени считались единственной функцией нейтро- филов. Однако недавние исследования биологии этих клеток показали, что они обладают разнообразным набором функциональных реакций, которые выходят за рамки простого уничтожения микроорганизмов [17, 18, 25].
Широкий спектр функциональных ответов нейтро- филов индуцируется активацией транскрипции и изменениями в экспрессии поверхностных молекул и их активности. Эти фенотипические изменения обычно обнаруживаются только в подгруппе нейтрофилов, что позволяет предположить наличие гетерогенных фенотипов этих клеток [3, 17, 19, 26].
Гетерогенность нейтрофилов
Теория гетерогенности нейтрофилов зародилась более 50 лет назад, когда была предложена концепция маргинального пула нейтрофилов [4, 19, 27], либо прикрепленных к сосудам, либо находящихся полностью вне циркуляционного русла. Они могут быть мобилизованы при стимуляции [5, 28]. Эксперименты проводились с использованием радиоактивной метки нейтрофилов и помогли определить в качестве резервуаров для них селезенку, печень и костный мозг, так как требуется меньше времени для прохождения через эти органы. Вопрос о легких в качестве резервуара для нейтрофилов остается открытым [12, 26, 29]. При оценке гетерогенности нейтрофилов могут быть исследованы такие параметры, как функции клеток, маркеры клеточной поверхности, зрелость, плотность и локализация. Концепция подмножества нейтрофилов справедлива при заболевании раком, инфекционном процессе, аутоиммунитете, воспалении и репарации [27, 28].
В нормальных условиях нейтрофилы остаются в кровообращении всего несколько часов, прежде чем начинают мигрировать в ткани [30]. В течение этого времени нейтрофилы, по-видимому, меняют свой фенотип. Наблюдения каждые 4 часа за циркулирующими у здоровых мышей нейтрофилами в течение дня, показали, что эти клетки меняют свою морфологию и фенотип [21, 30, 31].
Известно много описанных фенотипов нейтрофилов, но в литературе приводится отличная друг от друга информация, поскольку в каждом опыте исследовались разные функции, использовались различные методы изучения, виды ткани, биомаркеры [32, 33].
J.M. Adrover и соавт. [22] обратили внимание на циркадные ритмы изменения функционализации нейтрофилов. Недавно вышедшие из костного мозга нейтрофилы («свежие» клетки) претерпевали несколько метаболических изменений, которые накапливались до начала миграции из кровотока в ткани. Авторы назвали эти изменения в фенотипе гранулоцитов в отсутствие воспаления старением [22].
Нейтрофилы считаются дифференцированными клетками, которые прогрессируют от незрелых форм в костном мозге до циркуляции зрелых неактивных клеток. При последующей активации во время воспалительных состояний они перемещаются из сосудов в ткани и выполняют свои функции (например фагоцитоз, производство активных форм кислорода и уничтожение бактерий) [34]. Нейтрофилы могут быстро изменять свои характеристики и манеру поведения по мере активации, созревания или изменения внешней среды [35]. Кроме того, активность нейтро- филов в ответ на различные медиаторы при остром или хроническом воспалительном процессе может продлить жизнь клетки, дать возможность произвести альтернативные эффекторные и иммунорегуляторные молекулы [34, 35].
Наконец, нейтрофилы играют совершенно полярные роли в различных врожденных иммунных реакциях, возникающих в ответ на стерильную травму, инфекцию, рак, а также в реакциях аутоиммунитета. Поэтому неудивительно, что нейтрофилы с многочисленными разновекторными функциями были идентифицированы в последние годы в разных условиях [33, 36, 37].
Такая пластичность функций нейтрофилов, отмеченная и российскими учеными [32], побудила исследователей изучить область фенотипической и функциональной гетерогенности нейтрофилов, как это было сделано для лимфоцитов [38]. Появилась возможность вычленить регуляторные, супрессорные, провоспали- тельные, воспалительные, противоопухолевые, про- опухолевые и гибридные субпопуляции нейтрофилов [39]. Помимо классического антагонистического участия в антимикробных реакциях, нейтрофилы также играют значительную роль в модуляции различных типов раковых опухолей.
Фенотипическая гетерогенность нейтрофилов при раке
В вопросах влияния на опухолевый процесс нейтрофилы в течение длительного времени были обделены вниманием исследователей по сравнению с другими иммунокомпетентными клетками [39, 40]. Одной из причин этого, по-видимому, является небольшая продолжительность жизни гранулоцитов, которая, как считалось, слишком мала (в среднем 7 ч в циркулирующей крови и еще около 5 суток в тканях), чтобы влиять на прогрессию рака [41].
Однако в публикации М. Kurashige и соавт. [41] были подтверждены результаты экспериментальных исследований Y. Sawanobori и соавт. [42] с использованием молекулярных маркеров, которые позволили пересмотреть и эти фундаментальные положения [41, 42].
Экспериментальные исследования, выполненные на животных, показали, что продолжительность жизни тканевых нейтрофилов увеличивается на несколько дней в опухолях, микроокружение которых способствует их выживанию как локально, так и системно. Установлено, что средний период продолжительности жизни циркулирующих нейтрофилов у больных раком увеличен до 5,4 дня [44, 45], что более чем в 20 раз больше, чем было обнаружено ранее [44], и расценено исследователями как следствие передачи сигналов опухолевыми цитокинами на Г-КСФ [42].
Использование современных молекулярно-генетических инструментов позволило получить новые данные об участии ПМН на всех стадиях процесса канцерогенеза: от инициации опухолевого генотипа до инвазивного роста и метастазирования злокачественной опухоли [39, 40, 46]. По результатам этих исследований установили ведущую роль нейтрофилов в канцерогенезе, связанную с их способностью изменять поведение других иммунокомпетентных клеток в развитии опухолевого процесса [46].
Изменения функций нейтрофилов и их фенотипическая гетерогенность при раке являются в настоящее время наиболее изученными и наиболее интересными метаморфозами. Эти клетки крови играют важную и противоречивую роль в развитии раковых опухолей, что отражено в ряде современных обзоров [39, 40, 43, 46-49].
Этот функциональный дуализм нейтрофилов по отношению к опухолям в течение длительного времени был предметом споров, в которых оппоненты приводили убедительные доказательства в пользу как про-, так и противоопухолевой роли этих гранулоцитов. Это привело к возникновению гипотезы о неоднородности популяции ПМН и существовании нескольких субпопуляций, функции которых при раковых опухолях могут значительно отличаться. На всех этапах развития рака нейтрофилы формируют разные клеточные фенотипы, которые выполняют разновекторные функции. Установлено, что эти гранулоциты в организме опосредуют про- (клеточный фенотип N2) и противоопухолевые реакции (фенотип N1), которые вызывают прогрессию или ингибирование опухолевых клеток [47, 48].
С одной стороны, клетки N2 способствуют росту опухоли [39, 47], ангиогенезу — новообразованию в опухоли сети кровеносных сосудов [49] и активируют метастазирование опухолевых клеток [48], индуцируя иммунодепрессию [40] и инициируя подготовку тканей к раковой колонизации — создание предметастатической ниши [50]. С другой стороны, клетки N1 проявляют противоопухолевую активность, уничтожая раковые клетки непосредственно [51, 52] либо через антителозависимую цитотоксичность, ограничивающую распространение опухоли [33, 40, 46].
Индукция этих фенотипов ПМН регулируется сигналами, исходящими от раковых или стромаль- ных клеток из микроокружения опухоли, связана как с местными, так и системными реакциями и в настоящее время является предметом пристального внимания и изучения исследователей [33, 39, 46, 49].
Мы сосредоточимся на регуляции поведения ПМН сигналами, исходящими из микроокружения опухоли, а также на диагностическом и терапевтическом потенциале гетерогенных фенотипов миелоидных клеток. Чем же обусловлен этот функциональный дуализм нейтрофилов по отношению к раковым опухолям? В последние годы установлено, что вектор про- опухолевой активности этих клеток зависит от двух условных типов подмножеств ПМН в зависимости от их плотности: высокой (HDN, от англ. high density neutrophils), обеспечивающих противоопухолевую защиту организма (соответствует фенотипу N1), и низкой (LDN, low density neutrophils) — с проопухолевой и иммунодепрессирующей активностью (соответствует фенотипу N2), а также отношением этих клеточных фенотипов [53-56].
В практике выделения нейтрофильных кластеров HDN и LDN для последующего изучения их функциональных характеристик применяются несколько протоколов, включающих в себя сбор и очистку клеток крови человека или мыши [53, 55, 56] (рис. 2). В основе всех методов — выделение гранулоцитов путем градиентного центрифугирования разведенной периферической крови (1:5) с полисахаридами соответствующей плотности (Histopaque-1077, перколл или фи- колл — 3 мл). Кровь забирается с гепаринатом лития, эритроциты перед центрифугированием лизируются. Центрифугирование проводится при 1600 g в течение 20 мин (1000 g /30 мин) [53, 57].
Рисунок 2. Выделение нейтрофилов высокой (HDN) и низкой (LDN) плотности из периферической крови методом градиентного центрифугирования (рисунок авторов, пояснения в тексте)
Figure 2. Isolation of neutrophils of a high (HDN) and low (LDN) density from peripheral blood by gradient centrifugation (the authors’ picture, explanations in the text)
От вариаций протоколов зависит чистота выделенных клеточных фракций HDN и LDN, которые могут быть дополнительно обогащены при использовании специфических нейтрофильных антител, магнитных бус и разделительных колонок [53, 55, 56].
В последние годы интерес к субпопуляциям высокой и низкой плотности в контексте их проопухолевой активности значительно увеличился, появляется все больше данных о важной роли этих клеточных фенотипов в биологии опухолевого роста, а также механизмах регуляции раковыми клетками индукции N2-нейтрофилов [39, 53, 58, 59].
В связи с этим концепции о терминальной дифференцировке ПМН и их функциях, ограниченных антимикробной защитой и участием в воспалениях, постепенно пересматриваются [39, 47-49, 53, 59, 60]. Например, было установлено [53, 59], что у здоровых мышей более 95 % нейтрофилов в крови представлены клетками высокой плотности (N1), в то время как при возникновении злокачественной опухоли (рак молочной железы, легких, мезотелиома) у них возникала активная генерация нейтрофилов низкой плотности (N2), которые становились доминирующей циркулирующей субпопуляцией. При этом в костном мозге было достаточно много HDN, и увеличение соотношения субпопуляций в пользу LDN не было следствием простого медуллярного истощения клеток высокой плотности [53].
Аналогичная картина наблюдалась и у больных опухолями различной локализации. При этом и у мышей, и у людей доминирующая субпопуляция LDN была неоднородной и состояла из зрелых и незрелых клеток, в то время как фенотип HDN был однородным и представлен только зрелыми клетками [49, 53].
Механизмы, с помощью которых опухоли индуцируют N2-нейтропоэз, до конца не изучены, хотя в ряде исследований была показана активация клеток-пред- шественников гранулопоэза (ГМ-КСФ и Г-КСФ) и прогностическое значение отношения численности LDN- кластера гранулоцитов к лимфоцитам при нескольких типах злокачественных новообразований [51, 52].
Недавние исследования R. Kanamaru и соавт. [9] показали, что внеклеточные ловушки (NETs), высвобожденные нейтрофилами LDN-кластера, выделенными из перитонеального лаважа у больных, прооперированных по поводу рака желудка, не только не уничтожали свободные раковые клетки, но и активировали их пролиферацию после прикрепления к NETs [9].
Один из механизмов индукции образования N2-нейтрофилов, выявленный указанными исследователями, связан со стимулирующим влиянием микроокружения опухоли, точнее, с трансформирующим фактором роста-β, который индуцирует созревание в костном мозге и миграцию в ткани проопухолевого фенотипа нейтрофилов N2, изменяя локальное соотношение гранулоцитов N2:N1 в пользу первых.
Функциональная дифференциация нейтрофилов приводит к появлению различных фенотипов под влиянием конкретных опухолевых факторов, среди которых наиболее изученными являются трансформирующий фактор роста-β, Г-КСФ и интерферон-β.
Таким образом, в дополнение к классическим антимикробным стратегиям, в последние годы был охарактеризован ряд других функций нейтрофилов, что вызвало большой интерес врачей и биологов в мире. Многочисленные свидетельства того, что разные фенотипы нейтрофилов обнаружены в различных тканях и при различных патологических состояниях, позволяют предположить, что действительно существуют подмножества нейтрофилов [39, 47—49, 53, 59]. Однако отсутствие прямых экспериментальных доказательств, основанных на многократных исследованиях, не дает основания утверждать о наличии гетерогенных подгрупп нейтрофилов. Поэтому большинство практикующих врачей и гематологов считают этот клеточный пул относительно гомогенной популяцией с минимальным фенотипическим и функциональным разнообразием [48, 49, 57, 58]. Среди причин этого заблуждения тот факт, что исследования нейтрофилов все еще в значительной степени определяются их морфологией [59, 60].
Недавно выявленные с помощью градиентного центрифугирования факты наличия нейтрофилов разной плотности и их разновекторного участия в физиологических и патологических состояниях организма, возможно, вызовут смену парадигмы о функциональной гомогенности нейтрофилов [50].
Пока же приведенные в обзоре результаты исследований вызывают ряд вопросов относительно фенотипической специализации нейтрофилов. Бывают ли эти клетки запрограммированными на определенный фенотип уже до выхода из костного мозга в периферическую кровь, или высокая пластичность позволяет им трансформироваться в определенные субпопуляции уже в тканях? Возможно ли перепрограммировать уже имеющиеся фенотипы? По-прежнему остается актуальной проблема поиска надежных молекулярных маркеров, позволяющих эффективно дифференцировать фенотипы нейтрофилов, установить степень их диагностической специфичности при различных патологиях. И, наконец, обозначить перспективы определения нейтрофилов как терапевтической стратегии в иммунопатологии. В любом случае, полученные результаты выявляют потенциальные направления, на которые могут быть направлены терапевтические и диагностические стратегии усиления противоопухолевой нейтрофильной активности для раннего выявления и ограничения опухолевого роста.
1. de Oliveira S., Rosowski E.E., Huttenlocher A. Neutrophil migration in infection and wound repair: going forward in reverse. Nature Reviews Immunology. 2016; 16(6): 378. DOI: 10.1038/nri.2016.49
2. Wang J., Hossain M., Thanabalasuriar A., et al. Visualizing the function and fate of neutrophils in sterile injury and repair. Science. 2017; 358(6359): 111–6. DOI: 10.1126/science.aam9690
3. Jones H. R., Robb C. T., Perretti M., et al. The role of neutrophils in inflammation resolution. Seminars in immunology. Academic Press. 2016; 289(2): 137–45. DOI: 10.1016/j.smim.2016.03.007
4. Kaur M., Singh D. Neutrophil chemotaxis caused by chronic obstructive pulmonary disease alveolar macrophages: the role of CXCL8 and the receptors CXCR1/CXCR2. Journal of Pharmacology and Experimental Therapeutics. 2013; 347(1): 173–80. DOI: 10.1124/jpet.112.201855
5. Андрюков Б.Г., Сомова Л.М., Дробот Е.И., Матосова Е.В. Антимикробные стратегии нейтрофилов при инфекционной патологии. Клин. лаб. диагностика. 2016; 12(61): 825–33. DOI: 10.18821/0869-2084-2016-61- 12-825-833
6. Wirths S., Stefanie Bugl S., Kopp H.-G. Steady-state neutrophil homeostasis is a demand-driven process. Cell Cycle. 2013; 12(5): 709–10. DOI: 10.4161/cc.23859
7. Cain D.W., Ueda Y., Holl T.M., et al. A comparison of “steady-state” and “emergency” granulopoiesis: evidence of a single pathway for neutrophil production. The Journal of Immunology, 2009; 182 (1): 87–95.
8. Cowland J.B., Borregaard N. Granulopoiesis and granules of human neutrophils. Immunological reviews. 2016; 273(1): 11–28. DOI: 10.1111/imr.12440/
9. Kanamaru R., Ohzawa H., Miyato H., et al. Neutrophil Extracellular Traps Generated by Low Density Neutrophils Obtained from Peritoneal Lavage Fluid Mediate Tumor Cell Growth and Attachment. J Vis Exp. 2018; 138. DOI: 10.3791/58201
10. Witko-Sarsat V., Pederzoli-Ribeil M., Hirsch E., et. al. Regulating neutrophil apoptosis: new players enter the game. Trends Immunol. 2011; 32: 117–24. DOI: 10.1016/j.it.2011.01.001
11. Luo D., McGettrick H.M., Stone P.C., et al. The roles of Integrins of Human Neutrophils after their migration through endothelium into intestinal matrix. PLOS One. 2015; 10(2): e0118593. DOI: 10.1371/journal.pone.0118593
12. Steinberg B.E., Grinstein S. Unconventional roles of the NADPH oxidase: signaling, ion homeostasis, and cell death. Science’s STKE. 2007; 2007(379): pe11. DOI: 10.1126/stke.3792007pe11
13. Marini O., Costa S., Bevilacqua D., et al. Mature CD10+ and immature CD10-neutrophils present in G-CSF-treated donors display opposite effects on T cells. Blood. 2016; 04: 713206. DOI: 10.1182/blood-2016-04-713206
14. Dopico X. C., Evangelou M., Ferreira R. C., et al. Widespread seasonal gene expression reveals annual differences in human immunity and physiology. Nature communications. 2015; 6: 7000. DOI: 10.1038/ncomms8000
15. Kim M. H., Yang D., Kim M., et al. A late-lineage murine neutrophil precursor population exhibits dynamic changes during demand-adapted granulopoiesis. Scientific reports. 2017; 7: 39804. DOI: 10.1038/srep39804
16. Garlichs C.D., Eskafi S., Cicha I., et al. Delay of neutrophil apoptosis in acute coronary syndromes. Journal of leukocyte biology. 2004; 75(5): 828–35. DOI: 10.1189/jlb.0703358
17. Summers C., Singh N. R., White J. F., et al. Pulmonary retention of primed neutrophils: a novel protective host response, which is impaired in the acute respiratory distress syndrome. Thorax. 2014; thoraxjnl-2013-204742. DOI: 10.1136/ thoraxjnl-2013-204742
18. Матосова Е.В., Андрюков Б.Г. Морфофункциональная характеристика защитных механизмов нейтрофилов при бактериальных инфекциях и их вклад в патогенез провоспалительных реакций. Гематология и трансфузиология. 2017; 62(4): 223–9. DOI: 10.18821/0234-5730-2017-62-4-223-229
19. Jorgensen I., Rayamajhi M., Miao E.A. Programmed cell death as a defence against infection. Nature reviews immunology. 2017; 17(3): 151. DOI: 10.1038/ nri.2016.147
20. Jorgensen I., Lopez J.P., Laufer S.A., et al. IL-1β, IL-18, and eicosanoids promote neutrophil recruitment to pore-induced intracellular traps following pyroptosis. European journal of immunology. 2016; 46(12): 2761–6. DOI: 10.1002/ eji.201646647
21. Rodriguez F.M., Novak I.T.C. What about the neutrophil’s phenotypes? Hematol Med Oncol. 2017; 2: 1–6. DOI: 10.15761/HMO.1000130
22. Adrover J.M., Nicolás-Ávila J.A., Hidalgo A. Aging: a temporal dimension for neutrophils. Trends Immunol. 2016; 37: 334–45. DOI: 10.1016/j.it.2016.03.005
23. Brinkmann V., Zychlinsky A. Neutrophil extracellular traps: is immunity the second function of chromatin? J Cell Biol. 2012; 198(5): 773–83. DOI: 10.1083/ jcb.201203170
24. Silvestre-Roig C., Hidalgo A., Soehnlein O. Neutrophil heterogeneity: implications for homeostasis and pathogenesis. Blood. 2016 127:2173-2181 DOI: 10.1182/blood-2016-01-688887
25. Horckmans M., Ring L., Duchene J., et al. Neutrophils orchestrate postmyocardial infarction healing by polarizing macrophages towards a reparative phenotype. Eur Heart J. 2017; 38: 187–97. DOI: 10.1093/eurheartj/ehw002
26. Hellebrekers P., Vrisekoop N., Koenderman L. Neutrophil phenotypes in health and disease. Eur J Clin Invest. 2018; 48 Suppl 2: e12943. DOI: 10.1111/ eci.12943
27. Sagiv J.Y., Voels S., Granot Z. Isolation and Characterization of Low- vs HighDensity Neutrophils in Cancer. Methods Mol Biol. 2016; 1458: 179–93. DOI: 10.1007/978-1-4939-3801-8_13
28. Kuhns D.B., Priel D.A.L., Chu J., et al. Isolation and Functional Analysis of Human Neutrophils. Curr Protoc Immunol. 2015; 111: 7.23.1–16. DOI: 10.1002/0471142735.im0723s111
29. Deniset J.F., Kubes P. Neutrophil heterogeneity: Bona fide subsets or polarization states? J Leukoc Biol. 2018; 103(5): 829–38. DOI: 10.1002/JLB.3RI0917- 361R
30. Mortaz E., Alipoor S.D., Adcock I.M., et al. Update on Neutrophil Function in Severe Inflammation. Front Immunol. 2018; 9: 2171. DOI: 10.3389/ fimmu.2018.02171
31. Bekkering S., Torensma R. Another look at the life of a neutrophil. World J Hematol 2013; 2(2): 44–58. DOI: 10.5315/wjh.v2.i2.44
32. Нестерова И.В., Колесникова Н.В., Чудилова Г.А. и др. Новый взгляд на нейтрофильные гранулоциты: переосмысление старых догм. Часть 1. Инфекция и иммунитет. 2018; 7(3): 219–30. DOI: 10.15789/2220-7619- 2017-3-219-230
33. Galdiero M. R., Bonavita E., Barajon I., et al. Tumor associated macrophages and neutrophils in cancer. Immunobiology. 2013; 218(11): 1402–10. DOI: 10.1016/j.imbio.2013.06.003
34. Lai Guan Ng. Neutrophil: A mobile fertilizer J Exp Med. 2019; 216(1): 4–6. DOI: 10.1084/jem.20182059
35. Mishalian I., Granot Z., Fridlender Z.G. The diversity of circulating neutrophils in cancer. Immunobiology. 2017; 222(1): 82–8. DOI: 10.1016/j. imbio.2016.02.001
36. McCracken J.M., Allen L.A.H. Regulation of Human Neutrophil Apoptosis and Lifespan in Health and Disease. J Cell Death. 2014; 7: 15–23. DOI: 10.4137/ JCD.S11038
37. Je Lin Sieow, Sin Yee Gun, Siew Cheng Wong The Sweet Surrender: How Myeloid Cell Metabolic Plasticity Shapes the Tumor Microenvironment. Front Cell Dev Biol. 2018; 6: 168. DOI: 10.3389/fcell.2018.00168
38. Sionov R.V., Fridlender Z.G., Granot Z. The multifaceted roles neutrophils play in the tumor microenvironment. Cancer Microenviron. 2014; 8(3):125–58.
39. Coffelt S.B., Wellenstein M.D., de Visser K.E. Neutrophils in cancer: neutral no more. Nature Reviews Cancer. 2016; 16(7): 431. DOI: 10.1038/nrc.2016.52/
40. Swierczak A., Mouchemore K.A., Hamilton J.A., Anderson R.L. Neutrophils: important contributors to tumor progression and metastasis. Cancer Metastasis Rev. 2015; 34(4): 735–51. DOI: 10.1007/s10555-015-9594-9
41. Kurashige M., Kohara M., Ohshima K., et al. Origin of cancer-associated fibrobla sts and tumor-associated macrophages in humans after sex-mismatched bone marrow transplantation. Commun Biol. 2018; 1: 131.
42. Sawanobori Y., Ueha S., Kurachi M., et al. Chemokine-mediated rapid tur nover of myeloid-derived suppressor cells in tumor-bearing mice. Blood. 2008; 111(12): 5457–66. DOI: 10.1182/blood-2008-01-136895
43. Granot Z., Henke E., Comen E.A., et al. Tumor entrained neutrophils inhibit seeding in the premetastatic lung. Cancer Cell. 2011; 20(3): 300–14.
44. Shaul M.E., Levy L., Sun J., et al. Tumor-associated neutrophils display a distinct N1 profile following TGFβ modulation: A transcriptomics analysis of pro- vs. antitumor TANs. Oncoimmunology. 2016; 5(11): e1232221. DOI: 10.1080/2162402X.2016.1232221
45. Skendros P., Mitroulis I., Ritis K. Autophagy in Neutrophils: From Granulopoiesis to Neutrophil Extracellular Traps. Front Cell Dev Biol. 2018; 6: 109.
46. Rosales C. Neutrophil: A Cell with Many Roles in Inflammation or Several Cell Types? Front Physiol. 2018; 9: 113. DOI: 10.3389/fphys.2018.00113
47. Uribe-Querol E., Rosales C. Neutrophils in Cancer: Two Sides of the Same Coin. J Immunol Res. 2015; 2015: 983698. DOI: 10.1155/2015/983698
48. Sag iv J. Y., Michaeli J., Assi S., et al. Phenotypic diversity and plasticity in circulating neutrophil subpopulations in cancer. Cell reports. 2015; 10(4): 562–73. DOI: 10.1016/j.celrep.2014.12.039
49. Lee W., Ko S.Y., Mohamed M.S., et al. Neutrophils facilitate ovarian cancer premetastatic niche formation in the omentum. J Exp Med. 2019; 216(1): 176–94. DOI: 10.1084/jem.20181170
50. Granot Z, Jablonska J. Distinct Functions of Neutrophil in Cancer and Its Regulation. Mediators Inflamm. 2015; 701067. DOI: 10.1155/2015/701067
51. Lopez-Lago M.A., Posner S., Thodima V.J., et al. Neutrophil chemokines secreted by tumor cells mount a lung antimetastatic response during renal cell carcinoma progression. Oncogene, 2013; 32(14): 1752–60.
52. Hong C.W. Current Understanding in Neutrophil Differentiation and Heterogeneity. Immune Netw. 2017; 17(5): 298–306.
53. Liu Y., Yue Hu, Gu F., et al. Phenotypic and clinical characterization of low density neutrophils in patients with advanced lung adenocarcinoma. Oncotarget. 2017; 8(53): 90969–78. DOI: 10.18632/ oncotarget. 18771
54. Carmona-Rivera C., Kaplan M.J. Low-density granulocytes: a distinct class of neutrophils in systemic autoimmunity. Semin. Immunopathol. 2013; 35: 455–63. DOI: 10.1007/s00281-013-0375-7
55. Wright H. L., Makki F. A., Moots R. J., et al. Low-density granulocytes: functionally distinct, immature neutrophils in rheumatoid arthritis with altered properties and defective TNF signaling. Journal of leukocyte biology. 2017; 101(2): 599–611. DOI: 10.1189/jlb.5A0116-022R.
56. Hallett M. B. The Neutrophil: Cellular Biochemistry and Physiology. CRC Press; 2017.
57. Erpenbeck L., Schön M.P. Neutrophil extracellular traps: protagonists of cancer progression? Oncogene. 2017; 36(18): 2483. DOI: 10.1038/onc.2016.406
58. Porta C., Sica A., Riboldi E. Tumor-associated myeloid cells: new understandings on their metabolic regulation and their influence in cancer immunotherapy. FEBS J. 2018; 285(4): 717–33. DOI: 10.1111/febs.14288
59. Khadge S., Sharp J.G., McGuire T.R., et al. Immune regulation and anticancer activity by lipid inflammatory mediators. Int Immunopharmacol. 2018; 65: 580–92. DOI: 10.1016/ j. intimp.2018.10.026
Кровь, форменные элементы. Иммунитет. Тканевая совместимость
Взаимосвязь между всеми структурами организма обеспечивает его внутренняя среда, которая представлена кровью, лимфой и тканевой жидкостью.
Организм человека способен сохранять постоянство внутренней среды, или гомеостаз.
Кровь движется по системе замкнутых сосудов, но способна проникать через тонкие стенки капилляров в пространство между клетками и образовывать тканевую жидкость. Она окружает клетки, снабжает их кислородом и питательными веществами, из клеток в тканевую жидкость выделяются углекислый газ и ненужные организму продукты обмена, которые при накоплении могут нанести вред.
Далее часть тканевой жидкости возвращается в кровь, а часть — попадает в лимфатические сосуды и образует лимфу, которая по лимфатическим сосудам оттекает от органов. В лимфатических сосудах и узлах с лимфой происходят определённые изменения, после которых она вновь возвращается в кровеносное русло, объединяясь с кровью. Так замыкается круг циркуляции жидкостей в нашем организме.
Кровь — жидкая подвижная соединительная ткань внутренней среды организма, которая циркулирует в замкнутой системе кровеносных сосудов. По кровеносным сосудам передвигается не вся кровь, а только её часть. Большая часть крови находится в депо (например, в селезёнке, печени, лёгких и коже) и пополняет кровоток, когда возникает необходимость в восстановлении объёма циркулирующей по сосудам крови.
Кровь состоит из жидкой части плазмы, и взвешенных в ней клеток крови (форменных элементов). На клетки крови приходится от около 40 процентов объёма крови, а остальной объём (60 процентов) составляет плазма.
Плазма крови — это желтоватая полупрозрачная жидкость, которая на 90 % состоит из воды.
Форменные элементы крови представлены у человека эритроцитами (красными кровяными клетками), лейкоцитами (белыми кровяными клетками) и тромбоцитами (кровяными пластинками). Все они образуются в красном костном мозге.
Эритроциты — красные клетки крови, не имеющие ядра. Они составляют основную часть форменных элементов. Они обеспечивают каждый орган, ткань, клетку необходимым для жизни кислородом и уносят от них углекислый газ, который при накоплении может нанести вред. Эритроциты не случайно имеют форму двояковогнутого диска и не имеют ядра — это увеличивает площадь их поверхности, благодаря чему они связывают и переносят кислород.
Более чем на 90 % эритроциты заполнены гемоглобином — пигментом, который придаёт крови красный цвет. Гемоглобин образован активной группой гемом и белком глобином. В состав гема входит железо в степени окисления плюс два. Атомы железа способны образовывать химический комплекс с кислородом.
Эритроциты живут около ста двадцати суток. По мере старения, проходя через мелкие кровеносные сосуды печени или селезёнки, эритроциты погибают.
Тромбоциты — уплощённые безъядерные пластинки. Они участвуют в свёртывании крови и восстановлении целостности стенки сосуда после повреждения. Тромбоциты циркулируют в крови в течение пяти — семи дней, а затем разрушаются в селезёнке.
При повреждении кровеносных сосудов нестойкие кровяные пластинки — тромбоциты — разрушаются.
При этом в плазму крови выделяется особое вещество, под влиянием которого происходит цепь химических реакций, в результате которых растворимый белок плазмы крови фибриноген превращается в нерастворимый — фибрин. Он имеет вид тонких нитей, которые образуют густую сеть. В её ячейках застревают форменные элементы и формируется сгусток крови, или тромб, который закрывает рану.
Лейкоциты — белые клетки крови, которые, в отличие от всех остальных форменных элементов, содержат ядро. Они так же, как и другие форменные элементы, образуются в красном костном мозге.
Лейкоциты могут быть зернистыми и незернистыми.
Основная функция лейкоцитов — защита организма от инфекций, чужеродных белков и инородных тел, проникших в организм и способных нанести вред. В отличие от эритроцитов, которые никогда не покидают русла кровеносных сосудов, лейкоциты, как правило, функционируют за пределами кровеносного и лимфатического русла — в тканях.
Один лейкоцит может поглотить около двадцати бактерий. Если чужеродное тело по своим размерам превышает лейкоцит, то они накапливаются вокруг и образуют барьер. Переваривая инородное тело, лейкоциты гибнут. В результате образуется гнойник, который через какое-то время прорывается, и его содержимое выводится во внешнюю среду.
Поглощение и переваривание лейкоцитами различных микроорганизмов и чужеродных веществ называется фагоцитозом (что в переводе с греческого слова «фагос» означает «пожиратель»). Такие лейкоциты называются фагоцитами.
Вспомним основные функции крови.
Терморегуляторная функция заключается в том, что кровь поглощает тепло в органах, которые его вырабатывают, и переносит его по всему организму, обеспечивая постоянную температуру тела.
Газотранспортная функция заключается в транспорте кислорода из лёгких в ткани и углекислого газа в обратном направлении.
Питательная функция заключается в переносе питательных веществ (глюкозы, аминокислот, солей, витаминов) от органов пищеварительной системы к тканям.
Выделительная функция связана с доставкой конечных продуктов обмена к органам выделения.
Регуляторная функция состоит в переносе гормонов и других биологически активных веществ, которые влияют и регулируют деятельность отдельных органов и тканей.
Очень важна для организма защитная функция крови. В ней находятся лейкоциты и особые белки, которые осуществляют борьбу с чужеродными телами и защищают наш организм от различных инфекций.
Получается, что практически все функции крови направлены на поддержание постоянства состава и внутренней среды организма. Учитывая это, их можно объединить в одну, едва ли не самую важную функцию — гомеостатическую.
На протяжении всей жизни человека в его организм пытаются проникнуть чужеродные агенты, например бактерии и вирусы. Первым барьером, который они встречают на своём пути, является кожа и слизистые оболочки. В выделениях потовых и сальных желёз кожи, слёзной жидкости и слюне содержатся вещества, которые губительны для многих микроорганизмов.
Болезни, которые возникают в результате воздействия на организм болезнетворных микроорганизмов и передаются от больного человека к здоровому, называются инфекционными.
В ответ на воздействие болезнетворных агентов в организме человека начинается воспалительный процесс. Его основные признаки — повышение температуры тела и изменение состава крови, может появиться покраснение и отёк повреждённого участка.
Если все же бактерии и вирусы смогли проникнуть внутрь организма, то они встречают на своём пути второе препятствие — иммунную систему. Это группа органов, участвующих в образовании иммунных клеток. Давайте вспомним, какие органы входят в её состав. Это красный костный мозг, вилочковая железа (или тимус), селезёнка, лимфатические сосуды и узлы.
Чужеродные организмы, попавшие внутрь тела, вызывают иммунную реакцию.
Все вещества, которые воспринимаются организмом как чужие и вызывают иммунный ответ, называются антигенами. Это, например, вирусы, бактерии, чужеродные вещества и клетки.
В крови человека присутствуют белки, которые способны связываться с возбудителями заболеваний — это антитела. Взаимодействуя с антигенами, антитела препятствуют их размножению и обезвреживают выделяемые ими токсические вещества.
Антитела обладают способностью избирательно связываться с конкретными видами антигенов, т. е. они могут уничтожать только те антигены, против которых были выработаны. Такая форма иммунитета называется специфической. Основную роль в данной иммунной реакции играют защитные вещества, выделяющиеся в плазму крови, поэтому данный вид иммунитета называется ещё и гуморальным.
Выделяют также клеточный иммунитет, при котором уничтожение чужеродных тел осуществляют клетки, например лейкоциты путём фагоцитоза. Такая форма иммунитета называется неспецифической, потому что фагоциты действуют на различные антигены.
Существует насколько видов иммунитета.
Естественный видовой, или наследственный, иммунитет передаётся по наследству и характеризуется невосприимчивостью организмов одного вида к возбудителям, вызывающим заболевания у других видов. Например, человек никогда не болеет собачьей чумкой и многими другими болезнями, которые встречаются у животных.
Естественный приобретённый иммунитет формируется в течение жизни человека. Он подразделяется на плацентарный и постинфекционный.
Когда антитела из крови беременной женщины через плаценту попадают к ребёнку, у него формируется невосприимчивость к тому или иному заболеванию. Это плацентарный иммунитет.
Постинфекционный иммунитет формируется после болезни. В крови человека остаются антитела против возбудителя болезни, которую он перенёс.
Иммунитет можно выработать искусственно. Например, при активной иммунизации человеку вводят вакцину — ослабленных, убитых возбудителей. Вакцина вызывает заболевание в лёгкой форме, при этом в организме образуются защитные антитела. Такой иммунитет стойкий и сохраняется годами.
При пассивной иммунизации заболевшему человеку вводят сыворотку крови переболевших людей. В такой сыворотке уже есть готовые иммунные тела против возбудителя болезни.
Тканевая совместимость
Вы помните, что основную часть форменных элементов крови составляют красные безъядерные клетки двояковогнутой формы — эритроциты. На мембране эритроцитов располагаются особые вещества — антигены, или агглютиногены, А и Б.
В плазме крови растворены антитела, или агглютинины, альфа (α) и бэта (β). Например, когда происходит взаимодействие антигена А и антитела альфа, несколько эритроцитов сближается и склеивается между собой. Происходит их агглютинация ― склеивание эритроцитов. Такого происходить не должно, поэтому у человека в течение первого года жизни образуются антитела к тем антигенам, которых нет в его собственных эритроцитах. Например, если эритроциты имеют антиген А, то будут образовываться антитела бэта.
В зависимости от того, какие антигены и антитела присутствуют в крови человека, выделяют четыре группы крови — первую, вторую, третью и четвёртую. В течение всей жизни человека его группа крови не меняется.
Рассмотрим, какие антигены и антитела содержат данные группы крови. На мембране эритроцитов людей, имеющих первую группу крови, антигенов нет, значит в плазме крови присутствуют антитела альфа и бэта. На мембране эритроцитов людей со второй группой крови находятся антигены А, значит в плазме растворены антитела бэта. У людей с третьей группой крови соответственно антигены Б и антитела альфа. У людей с четвертой группой крови на мембране эритроцитов располагаются антигены А и Б, а антитела отсутствуют.
Наличие антигенов или их отсутствие в эритроцитах дало основание называть эту систему групп крови А-Б-ноль. Первая группа крови — нулевая, вторая — А, третья группа — Б и четвёртая — А-Б.
При переливании если эритроциты донора содержат, например, антигены А, а плазма крови реципиента (получающего кровь) ― антитела бэта, то переливание пройдёт успешно. Если же эритроциты донора содержат антиген А, а плазма крови реципиента ― антитела альфа, то произойдёт агглютинация эритроцитов.
Людям с первой группой крови можно переливать кровь только этой же группы. Кровь первой группы можно переливать людям всех групп, т. к. в их эритроцитах нет антигенов и донорские эритроциты в крови реципиента не склеиваются. Поэтому людей с первой группой крови называют универсальными донорами.
Люди с четвёртой группой крови принимают кровь всех групп, поэтому их называют универсальными реципиентами. Тем, у кого кровь относится ко второй или третьей группе, можно переливать кровь своей или первой группы.
К индивидуальным признакам крови относится также присутствие в эритроцитах особого белка — резус-фактора. Кровь, в которой имеется этот антиген, называется резус-положительной, в которой его нет — резус-отрицательной.
Напомним, что осложнения возникают также, если повторно переливать людям с резус-отрицательной кровью резус-положительную кровь. А также в том случае, если женщина с резус-отрицательной кровью вынашивает плод, который унаследовал от отца резус-положительную кровь. В этом случае фрагменты эритроцитов плода попадают в кровь матери, и в ней начинают вырабатываются антитела. Эти антитела проникают в организм плода и разрушают его эритроциты. Если первая беременность обычно протекает без осложнений, то итогом второй может быть гибель плода.
Фагоцитоз — обзор | ScienceDirect Topics
Фагоцитоз
Фагоцитоз — это рецепторно-опосредованное, актин- и АТФ-зависимое явление, которое запускается связыванием частиц или организмов со специфическими рецепторами плазматической мембраны (Silverstein et al ., 1977). Актин собирается вокруг частицы, когда лиганды, экспрессируемые частицей, связываются с определенным классом рецепторов клеточной поверхности. Управляемые F-актином псевдоподы поглощают частицу, которая затем интернализуется в цитоплазматической фагосоме.Манноза, β-глюкан, Fc, рецепторы скавенджера и комплемента могут передавать сигналы, необходимые для фагоцитарной интернализации (Brown, 1995).
Члены семейства rho GTPases участвуют в актин-опосредованных перестройках cyto-skel et al. , которые происходят одновременно с захватом частиц. Различные GTPases могут участвовать в разных типах фагоцитоза. Например, фагоцитоз FcR опосредуется Cdc42 и Rac1 (Cox et al ., 1997), тогда как фагоцитоз, опосредованный рецептором комплемента, зависит от Rho (Caron and Hall, 1998).Однако точные роли этих GTPases остаются неясными. Одно недавнее исследование продемонстрировало роль Cdc42 и Rac1 в привлечении F-актина к фагоцитарной чашке (Cox et al ., 1997), другое предполагает, что Cdc42 и Rac1 не участвуют в привлечении F-актина, а скорее служат различные функции в формировании фагоцитарной чашки. Ингибирование Cdc42 приводило к образованию структур, подобных плечу, поддерживающих лиганды в виде частиц, в то время как ингибирование Rac1 приводило к заключению лигандов в виде частиц в тонкие выступы мембраны, которые не сливались (Massol et al ., 1998).
В фагоцитоз вовлечены дополнительные регуляторные пути. FcR-ассоциированный фагоцитоз включает в себя зависимый от тирозинкиназы путь. Некоторые цитоскелетные белки, включая паксиллин, которые связаны с ранними фагосомами, являются субстратами тирозинкиназы, которые фосфорилируются в ответ на лигирование рецептора Fc (Greenberg et al. ., 1994)
Фагоцитоз обеспечивает средство для интернализации широкого диапазона рецепторов. -связанные антигенные лиганды.ДК кажутся специально сконструированными для интернализации и презентации фагоцитарных лигандов, о чем свидетельствует наблюдение, что антигенпрезентирующая способность ДК намного выше для адсорбированного на гранулах антигена, чем для растворимой формы антигена (Scheicher et al ., 1995. ). Действительно, DC демонстрируют замечательную эффективность в генерации эпитопов MHC класса II, полученных в результате фагоцитоза клеточных фрагментов. Фагоцитоз молекул MHC класса II I-E из клеточных фрагментов был в 1000-10 000 раз более эффективным при образовании комплексов MHC класса II-пептид, чем поглощение предварительно обработанного пептида I-E (Inaba et al ., 1998). Более того, резидентные лимфоидные DCs фагоцитируют короткоживущие мигрирующие DCs и представляют антигены, интернализованные этими мигрирующими DCs (Inaba et al ., 1998). Важность и последствия этого явления, вероятно, отражают тот факт, что частицы, например клетки и бактерии являются наиболее физиологичными формами антигенных DC, с которыми они сталкиваются в течение своей жизни.
Хотя существует много различий между механизмами, управляющими фагоцитозом и рецепторно-опосредованным эндоцитозом, ряд статей показал несколько взаимных сходств.Dynamin-2, динамин GTPase, участвующий в рецептор-опосредованном эндоцитозе, также необходим для фагоцитоза (Gold et al ., 1999). При эндоцитозе динамин действует на стадии расщепления образования везикул, покрытых клатрином. Во время фагоцитоза динамин-2 был обнаружен на образующихся фагосомах. Хотя не совсем ясно, как динамин-2 действует в окончательном почковании формирующихся фагоцитарных вакуолей, он, по-видимому, функционирует в этом процессе. Ингибирование динамина-2 через экспрессию его доминантно-негативной мутации блокировало расширение мембраны вокруг частиц (Gold et al ., 1999). Роль динамина-2 и, возможно, Rho GTPases может указывать на участие продолжающегося ремоделирования мембран и движения пузырьков в фагоцитозе.
Фагоциты — Фагоцитарные клетки — TeachMePhysiology
Фагоциты — это тип лейкоцитов, которые используют фагоцитоз для поглощения бактерий, инородных частиц и умирающих клеток для защиты организма. Они связываются с патогенами и усваивают их в фагосоме, которая подкисляется и сливается с лизосомами, чтобы разрушить их содержимое.
Они являются ключевым компонентом врожденной иммунной системы. Есть три основных группы фагоцитов: моноциты и макрофаги, гранулоциты и дендритные клетки, каждая из которых выполняет несколько разные функции в организме.
В этой статье рассматриваются различные фагоциты, присутствующие в организме, их структура , , где они находятся, , и клинические состояния , которые могут быть результатом их дефицита.
Моноциты
Моноциты — это тип фагоцитов, обнаруженных в кровотоке.Они циркулируют по телу, и когда ткань инфицирована или воспалена, они могут покинуть кровоток и попасть в ткань.
В ткани они дифференцируются в макрофагов , которые образуют основную резидентную популяцию фагоцитов в нормальных тканях. Моноциты фагоцитируют, но поскольку большинство инфекций происходит в тканях, способность моноцитов дифференцироваться является особенно важной. При наличии определенного набора сигналов моноциты также могут дифференцироваться в дендритные клетки в тканях.
Моноциты — это наибольших фагоцитов типа , с фасолью , имеющей форму ядра , если смотреть под микроскопом.
Рис. 1. Электронная микрофотография, показывающая моноцит, окруженный эритроцитами. [/ caption]Макрофаги
Макрофаги происходят из моноцитов и обнаруживаются в тканях. Они играют важную роль в качестве первого механизма защиты при фагоцитозе клеточного мусора , микробов и любых других чужеродных веществ.
Они также помогают инициировать адаптивный иммунный ответ, представляя антигены Т-клеткам и секретирующие факторы, чтобы вызвать воспаление и привлечь другие клетки.
Макрофаги могут называться по-разному в зависимости от их местоположения: микроглия присутствует в ЦНС, а клетки Купфера находятся в печени.
Рис. 2. Диаграмма, показывающая расположение клеток Купфера в печени. [/ caption]Дендритные клетки
Основная функция дендритных клеток — связующее звено между врожденной и адаптивной иммунными системами.Как незрелые дендритные клетки они перемещаются в кровотоке, мигрируют через ткани и постоянно отбирают образцы патогенов, которые они находят посредством макропиноцитоза .
После фагоцитоза клетка становится зрелой и мигрирует в периферический лимфоидный орган, такой как лимфатический узел, селезенка или ассоциированную с кишечником лимфоидную ткань, чтобы представить антиген Т-клетке. Затем это активирует Т-лимфоциты, чтобы инициировать адаптивный иммунный ответ.
Дендритные клетки можно распознать по присутствию множественных цитоплазматических выступов на их поверхности, что придает им большое отношение площади поверхности к объему, что способствует тесному контакту с множеством клеток.Эти процессы похожи на дендриты нейронов, давшие название дендритным клеткам.
Рис. 3. Дендритные клетки (окрашены зеленым), расположенные в эпителии роговицы. [/ caption]Гранулоциты
Гранулоциты представляют собой группу фагоцитов с плотными гранулами в их цитоплазме и включают нейтрофилы, эозинофилы и базофилы.
Нейтрофилы являются наиболее фагоцитарными из этих клеток: они являются наиболее многочисленными лейкоцитами и могут быть идентифицированы по их гранулярной цитоплазме и дольчатым ядрам (обычно 2-5 долек).Они образуются из миелоидных стволовых клеток, обнаруженных в костном мозге.
Обычно они обнаруживаются в кровотоке, но во время острой фазы инфекции они являются одними из первых воспалительных клеток, которые достигают места заражения. Они особенно специализируются на уничтожении внутриклеточных патогенов за счет цитоплазматических гранул токсичными веществами, такими как антимикробные пептиды, ферменты и активные формы кислорода.
Нейтрофилы являются короткоживущими клетками и обычно умирают после фагоцитоза и использования их гранул — умирающие или мертвые нейтрофилы составляют основную часть гноя, наблюдаемого при инфекции.Нейтрофилы также важны для индукции воспаления и рекрутирования воспалительных клеток за счет высвобождения цитокинов и других воспалительных факторов.
Рис. 4. Электронная микрофотография нейтрофилов на мазке крови. [/ caption][старт-клинический]
Клиническая значимость — нейтропения
Нейтропения — это низкое количество нейтрофилов (фагоцитов), обычно определяемое как менее 1,5 x 10 9 / л . Нейтропения подвергает пациентов высокому риску инфекций, поскольку они являются ключевым компонентом врожденного иммунитета.Если пациенты страдают нейтропенией и плохо себя чувствуют, им срочно требуются антибиотики широкого спектра действия из-за риска развития септического шока.
Причины нейтропении разнообразны:
- Острая нейтропения (менее 2 недель) может быть результатом вирусной инфекции (ВИЧ, ЦМВ, ВЭБ, грипп)
- Хроническая нейтропения может быть следствием аутоиммунных заболеваний (СКВ), дефицита B12 / фолиевой кислоты, гематологических нарушений (лейкемия, лимфома, миелома), приема лекарств или этнической принадлежности (доброкачественной у некоторых людей афро-карибского или ближневосточного происхождения)
Если пациенты не плохо себя чувствуют и не лихорадят, учитывайте этническую принадлежность и изучите историю приема лекарств.Запрос мазка крови может выявить инфекцию, аутоиммунные состояния или лимфопролиферативные нарушения. Другие исследования, которые могут быть полезны, включают вирусную серологию и аутоантитела .
Если единственной аномалией является изолированная нейтропения, гематологическая злокачественная опухоль является относительно необычным объяснением. Пациентов следует направлять при подозрении на серьезное заболевание, прогрессирование или развитие других аномалий клеток крови.
Рис. 5. Мазок крови пациента с нейтропенией показывает только один нейтрофил.[/подпись][окончание клинической]
лейкоцитов и тромбоцитов | Анатомия и физиология
Цели обучения
К концу этого раздела вы сможете:
- Опишите общую характеристику лейкоцитов
- Классифицировать лейкоциты по их происхождению, их основным структурным особенностям и их основным функциям
- Обсудить наиболее распространенные злокачественные новообразования с участием лейкоцитов
- Определите происхождение, основную структуру и функцию тромбоцитов
Лейкоцит , широко известный как лейкоцит (или WBC), является основным компонентом защиты организма от болезней.Лейкоциты защищают организм от вторжения микроорганизмов и клеток тела с мутированной ДНК, а также убирают мусор. Тромбоциты необходимы для восстановления кровеносных сосудов, когда они были повреждены; они также обеспечивают факторы роста для исцеления и восстановления. См. Рисунок 1 в эритроцитах для получения сводной информации о лейкоцитах и тромбоцитах.
Характеристика лейкоцитов
Хотя лейкоциты и эритроциты происходят из гемопоэтических стволовых клеток костного мозга, они сильно отличаются друг от друга во многих существенных отношениях.Например, лейкоцитов гораздо меньше, чем эритроцитов: обычно их всего от 5000 до 10 000 на µ л. Они также больше, чем эритроциты, и являются единственными сформированными элементами, которые представляют собой полные клетки, обладающие ядром и органеллами. И хотя существует только один тип эритроцитов, существует множество типов лейкоцитов. У большинства из этих типов продолжительность жизни намного короче, чем у эритроцитов, у некоторых — всего несколько часов или даже несколько минут в случае острой инфекции.
Одной из наиболее отличительных характеристик лейкоцитов является их движение. В то время как эритроциты проводят свои дни, циркулируя в кровеносных сосудах, лейкоциты обычно покидают кровоток, чтобы выполнять свои защитные функции в тканях организма. Для лейкоцитов сосудистая сеть — это просто дорога, по которой они путешествуют, и вскоре с нее сворачивают, чтобы достичь своего истинного пункта назначения. По прибытии им часто дают разные названия, например, макрофаг или микроглия, в зависимости от их функции.Как показано на рисунке 1, они покидают капилляры — мельчайшие кровеносные сосуды — или другие мелкие сосуды в результате процесса, известного как эмиграция (от латинского «удаление») или diapedesis (dia- = «сквозной»; — pedan = «прыгать»), в котором они протискиваются через соседние клетки в стенке кровеносного сосуда.
Рис. 1. Лейкоциты выходят из кровеносного сосуда и затем перемещаются через соединительную ткань дермы к месту раны. Некоторые лейкоциты, такие как эозинофилы и нейтрофилы, характеризуются как гранулярные лейкоциты.Они выделяют из своих гранул химические вещества, уничтожающие болезнетворные микроорганизмы; они также способны к фагоцитозу. Моноцит, агранулярный лейкоцит, дифференцируется в макрофаг, который затем фагоцитирует патогены.
После выхода из капилляров некоторые лейкоциты занимают фиксированные позиции в лимфатической ткани, костном мозге, селезенке, тимусе или других органах. Другие будут перемещаться по тканевым пространствам очень похоже на амеб, непрерывно расширяя свои плазматические мембраны, иногда свободно блуждая, а иногда двигаясь в направлении, в котором их привлекают химические сигналы.Это привлечение лейкоцитов происходит из-за положительного хемотаксиса (буквально «движение в ответ на химические вещества»), явления, при котором поврежденные или инфицированные клетки и близлежащие лейкоциты издают эквивалент химического звонка «911», привлекая больше лейкоцитов к месту. . В клинической медицине дифференциальные подсчеты типов и процентного содержания лейкоцитов часто являются ключевыми показателями при постановке диагноза и выборе лечения. Они имеют решающее значение для защиты организма от болезней.Это полные клетки с ядром и органеллами. Они могут входить в кровеносные сосуды и выходить из них, что называется диапедезом . Они могут двигаться амебоидным движением, что означает, что они изменят форму, протискиваясь сквозь ткани. Они могут реагировать на химические вещества, выделяемые поврежденными тканями, известную как хемотаксис .
Классификация лейкоцитов
Когда ученые впервые начали наблюдать окрашенные препараты крови, быстро стало очевидно, что лейкоциты можно разделить на две группы в зависимости от того, содержит ли их цитоплазма хорошо видимые гранулы:
- Гранулярные лейкоциты содержат большое количество гранул в цитоплазме.Они включают нейтрофилы, эозинофилы и базофилы (вы можете увидеть их происхождение от миелоидных стволовых клеток на Рисунке 1 в разделе «Производство сформированных элементов»).
- Хотя в агранулярных лейкоцитах не полностью отсутствуют гранулы, их гораздо меньше и они менее очевидны. Агранулярные лейкоциты включают моноциты, которые созревают в макрофаги, которые являются фагоцитами, и лимфоциты, которые возникают из линии лимфоидных стволовых клеток.
Гранулированные лейкоциты
Мы рассмотрим гранулярные лейкоциты в порядке от наиболее частых до наименее распространенных.Все они вырабатываются красным костным мозгом и имеют короткий срок жизни от нескольких часов до нескольких дней. Обычно они имеют лопастное ядро и классифицируются в зависимости от того, какой тип красителя лучше всего выделяет их гранулы (рис. 2).
Рис. 2. Нейтрофил имеет маленькие гранулы, окрашенные в светло-сиреневый цвет, и ядро с двумя-пятью долями. Гранулы эозинофила немного больше и окрашены в красновато-оранжевый цвет, а его ядро состоит из двух-трех долей. Базофил имеет большие гранулы от темно-синего до пурпурного цвета и двухлопастное ядро.
Самый распространенный из всех лейкоцитов, нейтрофилов , обычно составляет 50–70 процентов от общего количества лейкоцитов. Их диаметр составляет 10–12 µ м, что значительно больше, чем у эритроцитов. Их называют нейтрофилами, потому что их гранулы наиболее отчетливо видны с химически нейтральными пятнами (ни кислотными, ни основными). Гранулы многочисленны, но довольно мелкие и обычно имеют светло-сиреневый оттенок. Ядро имеет отчетливо выраженную лопастную форму и может иметь от двух до пяти долей, число которых увеличивается с возрастом клетки.Старые нейтрофилы имеют увеличивающееся количество долей и часто называются полиморфноядерными , (ядро с множеством форм) или просто «полисами». У молодых и незрелых нейтрофилов появляются доли, известные как «полосы».
Нейтрофилы быстро реагируют на очаг инфекции и являются эффективными фагоцитами, предпочитающими бактерии. Их гранулы включают лизоцим , фермент, способный лизировать или разрушать стенки бактериальных клеток; окислители, такие как перекись водорода; и , дефенсины, , белки, которые связываются с плазматическими мембранами бактерий и грибов и прокалывают их, так что содержимое клеток выходит наружу.Аномально высокое количество нейтрофилов указывает на инфекцию и / или воспаление, особенно вызванное бактериями, но также обнаруживается у ожоговых пациентов и других людей, испытывающих необычный стресс. Ожоговая травма увеличивает распространение нейтрофилов для борьбы с инфекцией, которая может возникнуть в результате разрушения кожного барьера. Низкое количество может быть вызвано токсичностью лекарства и другими нарушениями и может повысить восприимчивость человека к инфекции.
Эозинофилы обычно составляют 2–4 процента от общего количества лейкоцитов.Они также имеют диаметр 10–12 µ м. Гранулы эозинофилов лучше всего окрашиваются кислотным красителем, известным как эозин. Ядро эозинофила обычно имеет от двух до трех долей, и при правильном окрашивании гранулы будут иметь отчетливый красный или оранжевый цвет.
Гранулы эозинофилов включают молекулы антигистаминов, которые противодействуют активности гистаминов, воспалительных химических веществ, продуцируемых базофилами и тучными клетками. Некоторые гранулы эозинофилов содержат молекулы, токсичные для паразитических червей, которые могут проникать в организм через покровы или когда человек ест сырую или недоваренную рыбу или мясо.Эозинофилы также способны к фагоцитозу и особенно эффективны, когда антитела связываются с мишенью и образуют комплекс антиген-антитело. Высокое содержание эозинофилов типично для пациентов, страдающих аллергией, заражением паразитарными червями и некоторыми аутоиммунными заболеваниями. Низкое количество может быть связано с токсичностью лекарств и стрессом.
Базофилы — наименее распространенные лейкоциты, обычно составляющие менее одного процента от общего количества лейкоцитов. Они немного меньше нейтрофилов и эозинофилов и составляют 8–10 µ м в диаметре.Гранулы базофилов лучше всего окрашиваются основными (щелочными) красителями. Базофилы содержат большие гранулы, которые окрашиваются в темно-синий цвет, и настолько распространены, что могут затруднить просмотр двухлепесткового ядра.
В целом базофилы усиливают воспалительную реакцию. Они разделяют эту черту с тучными клетками. В прошлом тучные клетки считались базофилами, покидающими кровообращение. Однако, похоже, это не так, поскольку два типа клеток развиваются из разных клонов.
Гранулы базофилов выделяют гистамины, способствующие воспалению, и гепарин, препятствующий свертыванию крови.Высокое количество базофилов связано с аллергией, паразитарными инфекциями и гипотиреозом. Низкие показатели связаны с беременностью, стрессом и гипертиреозом.
Агранулярные лейкоциты
Агранулярные лейкоциты содержат более мелкие и менее заметные гранулы в своей цитоплазме, чем гранулярные лейкоциты. Ядро простой формы, иногда с выемкой, но без отчетливых долей. Существует два основных типа агранулоцитов: лимфоциты и моноциты (см. Рисунок 1 в разделе «Производство сформированных элементов»).
Лимфоциты — единственный сформированный элемент крови, который возникает из лимфоидных стволовых клеток. Хотя изначально они образуются в костном мозге, большая часть их последующего развития и размножения происходит в лимфатических тканях. Лимфоциты являются вторым по распространенности типом лейкоцитов, на их долю приходится около 20–30 процентов всех лейкоцитов, и они необходимы для иммунного ответа. Диапазон размеров лимфоцитов довольно обширен: одни авторитетные источники признают два класса размеров, а другие — три.Как правило, крупные клетки имеют размер 10–14 мкм мкм и имеют меньшее соотношение ядра и цитоплазмы и большее количество гранул. Меньшие клетки обычно имеют размер 6–9 µ м с большим объемом ядра до цитоплазмы, создавая эффект «ореола». Некоторые клетки могут выходить за пределы этих диапазонов, на 14–17 µ м. Это открытие привело к классификации трех размеров.
Три основные группы лимфоцитов включают естественные клетки-киллеры, В-клетки и Т-клетки. Естественные клетки-киллеры (NK) способны распознавать клетки, которые не экспрессируют «собственные» белки на своей плазматической мембране или содержат чужеродные или аномальные маркеры.Эти «чужие» клетки включают раковые клетки, клетки, инфицированные вирусом, и другие клетки с атипичными поверхностными белками. Таким образом, они обеспечивают генерализованный неспецифический иммунитет. Более крупные лимфоциты обычно являются NK-клетками.
В-клетки и Т-клетки, также называемые В-лимфоцитами и Т-лимфоцитами , играют важную роль в защите организма от конкретных патогенов (болезнетворных микроорганизмов) и участвуют в формировании специфического иммунитета. Одна форма В-клеток (плазматические клетки) продуцирует антитела или иммуноглобулины, которые связываются со специфическими чужеродными или аномальными компонентами плазматических мембран.Это также называется гуморальным (жидкостным) иммунитетом. Т-клетки обеспечивают иммунитет на клеточном уровне, физически атакуя чужеродные или больные клетки. Ячейка памяти представляет собой множество как В-, так и Т-клеток, которые образуются после воздействия патогена и быстро реагируют на последующие воздействия. В отличие от других лейкоцитов, клетки памяти живут много лет. В-клетки подвергаются процессу созревания в костном мозге, тогда как Т-клетки подвергаются созреванию в тимусе. Этот участок процесса созревания дает название В- и Т-клеткам.Функции лимфоцитов сложны и будут подробно рассмотрены в главе, посвященной лимфатической системе и иммунитету. Более мелкие лимфоциты являются либо В-, либо Т-клетками, хотя они не могут быть дифференцированы в нормальном мазке крови.
Аномально высокое количество лимфоцитов характерно для вирусных инфекций, а также для некоторых типов рака. Аномально низкое количество лимфоцитов характерно для длительных (хронических) заболеваний или иммуносупрессии, в том числе вызванных ВИЧ-инфекцией и лекарственными препаратами, которые часто включают стероиды.
Моноциты происходят из миелоидных стволовых клеток. Обычно они составляют 2–8 процентов от общего количества лейкоцитов. Их обычно легко узнать по крупному размеру 12–20 µ м, а также по зубчатым или подковообразным ядрам. Макрофаги — это моноциты, которые покинули кровообращение и фагоцитируют мусор, чужеродные патогены, изношенные эритроциты и многие другие мертвые, изношенные или поврежденные клетки. Макрофаги также выделяют антимикробные дефенсины и хемотаксические химические вещества, которые привлекают другие лейкоциты к месту инфекции.Некоторые макрофаги занимают фиксированные места, тогда как другие блуждают в тканевой жидкости.
Аномально высокое количество моноцитов связано с вирусными или грибковыми инфекциями, туберкулезом, некоторыми формами лейкемии и другими хроническими заболеваниями. Аномально низкие показатели обычно вызваны подавлением костного мозга.
Жизненный цикл лейкоцитов
Большинство лейкоцитов имеют относительно короткую продолжительность жизни, обычно измеряемую часами или днями. Производство всех лейкоцитов начинается в костном мозге под влиянием спинномозговой жидкости и интерлейкинов.Вторичное производство и созревание лимфоцитов происходит в определенных областях лимфатической ткани, известных как зародышевые центры. Лимфоциты полностью способны к митозу и могут производить клоны клеток с идентичными свойствами. Эта способность позволяет человеку сохранять иммунитет на протяжении всей жизни ко многим угрозам, с которыми он сталкивался в прошлом.
Нарушения лейкоцитов
Лейкопения — это состояние, при котором вырабатывается слишком мало лейкоцитов. Если это состояние выражено, человек может быть не в состоянии предотвратить болезнь.Чрезмерная пролиферация лейкоцитов известна как лейкоцитоз . Хотя количество лейкоцитов велико, сами клетки часто нефункциональны, что подвергает человека повышенному риску заболевания.
Лейкоз — это рак, пораженный большим количеством лейкоцитов. Он может включать только один конкретный тип лейкоцитов либо из миелоидной линии (миелоцитарный лейкоз), либо из лимфоидной линии (лимфолейкоз). При хроническом лейкозе зрелые лейкоциты накапливаются и не умирают.При остром лейкозе наблюдается перепроизводство молодых незрелых лейкоцитов. В обоих случаях клетки не функционируют должным образом.
Лимфома — это форма рака, при которой массы злокачественных Т- и / или В-лимфоцитов накапливаются в лимфатических узлах, селезенке, печени и других тканях. Как и при лейкемии, злокачественные лейкоциты не функционируют должным образом, и пациент уязвим для инфекции. Некоторые формы лимфомы имеют тенденцию к медленному прогрессированию и хорошо поддаются лечению. Другие, как правило, быстро прогрессируют и требуют агрессивного лечения, без которого они быстро заканчиваются смертельным исходом.
Лейкоцитоз — это увеличение лейкоцитов, нормальный ответ на инфекцию.
Инфекционный мононуклеоз вызывается вирусом Эпштейна-Барра (EBV), поражает В-лимфоциты, которые увеличиваются в размерах и напоминают моноциты; Симптомы включают жар, головную боль, усталость, боль в горле и увеличение лимфатических узлов.
Тромбоциты
Иногда вы можете видеть тромбоциты, называемые тромбоцитами , но поскольку это название предполагает, что они являются типом клеток, это не совсем точно.Тромбоцит — это не клетка, а скорее фрагмент цитоплазмы клетки, называемый мегакариоцитом , который окружен плазматической мембраной. Мегакариоциты происходят от миелоидных стволовых клеток (см. Рис. 1 в разделе «Производство сформированных элементов») и имеют большие размеры, обычно 50–100 µ м в диаметре, и содержат увеличенное лопастное ядро. Как отмечалось ранее, тромбопоэтин, гликопротеин, секретируемый почками и печенью, стимулирует пролиферацию мегакариобластов, которые превращаются в мегакариоциты.
Рис. 3. Тромбоциты происходят из клеток, называемых мегакариоцитами.
Они остаются в ткани костного мозга (рис. 3) и в конечном итоге образуют отростки-предшественники тромбоцитов, которые проходят через стенки капилляров костного мозга, высвобождая в кровоток тысячи цитоплазматических фрагментов, каждый из которых окружен кусочком плазматической мембраны. Эти заключенные фрагменты представляют собой тромбоциты. Каждый мегакароцит выделяет 2000–3000 тромбоцитов в течение своей жизни. После высвобождения тромбоцитов остатки мегакариоцитов, которые представляют собой немного больше, чем ядро клетки, потребляются макрофагами.
Тромбоциты относительно небольшие, 2–4 µ м в диаметре, но многочисленные, обычно 150 000–160 000 на µ л крови. После попадания в кровоток примерно одна треть мигрирует в селезенку для хранения для последующего высвобождения в ответ на любой разрыв кровеносного сосуда. Затем они активируются для выполнения своей основной функции — ограничения кровопотери. Тромбоциты сохраняются всего около 10 дней, затем фагоцитируются макрофагами.
Тромбоциты имеют решающее значение для гемостаза, остановки кровотока после повреждения сосуда.Они также выделяют различные факторы роста, необходимые для роста и восстановления тканей, особенно соединительной ткани. Настои концентрированных тромбоцитов в настоящее время используются в некоторых методах лечения для стимуляции заживления.
Заболевания тромбоцитов
Тромбоцитоз — это состояние, при котором слишком много тромбоцитов. Это может вызвать образование нежелательных тромбов (тромбоз), потенциально смертельное заболевание. При недостаточном количестве тромбоцитов, называемом тромбоцитопенией , кровь может не свернуться должным образом, что может привести к чрезмерному кровотечению. Гемофилия — наследственное нарушение свертываемости крови (отсутствуют нормальные факторы свертывания и кровь не свертывается). Тромбоз — сгусток в неповрежденном сосуде, чаще встречается в венах. Эмболия — это состояние сгустка, который отрывается и перемещается по кровеносным сосудам (эмбол) и может застрять в жизненно важных органах (мозг, сердце, легкие) и лишать эти органы кислорода, что может привести к смерти.
Рисунок 4. Лейкоциты. (Микрофотографии предоставлены Медицинской школой Риджентс Мичиганского университета © 2012)
Практический вопрос
Просмотрите веб-микроскопы Мичиганского университета и более подробно изучите слайды крови.Функция Webscope позволяет перемещать слайды, как на механическом столике. Вы можете увеличивать и уменьшать увеличение. Есть возможность рассмотреть каждый из лейкоцитов индивидуально после того, как вы попытаетесь идентифицировать их по первым двум мазкам крови. Кроме того, есть несколько вопросов с несколькими вариантами ответов.
Умеете ли вы распознавать и идентифицировать различные формованные элементы? Делать это нужно будет систематически, сканируя по изображению. Стандартный метод — использовать сетку, но с этим ресурсом это невозможно.Попробуйте составить простую таблицу с каждым типом лейкоцитов, а затем сделать отметку для каждого идентифицированного вами типа клеток. Попытайтесь классифицировать не менее 50, а возможно, и 100 различных ячеек. Основываясь на процентном соотношении клеток, которое вы подсчитываете, представляют ли цифры нормальный мазок крови или что-то кажется ненормальным?
Покажи ответЭто должен быть нормальный мазок крови.
Обзор главы
Лейкоциты участвуют в защите организма. Они выдавливаются из стенок кровеносных сосудов в результате эмиграции или диапедеза, затем могут перемещаться через тканевую жидкость или прикрепляться к различным органам, где они борются с патогенными организмами, больными клетками или другими угрозами для здоровья.Гранулярные лейкоциты, которые включают нейтрофилы, эозинофилы и базофилы, происходят из миелоидных стволовых клеток, как и агранулярные моноциты. Другие агранулярные лейкоциты, NK-клетки, B-клетки и T-клетки, возникают из линии лимфоидных стволовых клеток. Самыми многочисленными лейкоцитами являются нейтрофилы, которые первыми реагируют на инфекции, особенно бактерии. Около 20–30 процентов всех лейкоцитов составляют лимфоциты, которые имеют решающее значение для защиты организма от конкретных угроз. Лейкемия и лимфома — это злокачественные новообразования, в которых участвуют лейкоциты.Тромбоциты — это фрагменты клеток, известных как мегакариоциты, которые обитают в костном мозге. В то время как многие тромбоциты хранятся в селезенке, другие попадают в кровоток и необходимы для гемостаза; они также производят несколько факторов роста, важных для восстановления и заживления.
Самопроверка
Ответьте на вопросы ниже, чтобы увидеть, насколько хорошо вы понимаете темы, затронутые в предыдущем разделе.
Вопросы о критическом мышлении
- Одним из наиболее частых побочных эффектов химиотерапии рака является разрушение лейкоцитов.Перед очередным плановым курсом химиотерапии пациент сдает анализ крови, называемый абсолютным количеством нейтрофилов (АНН), который показывает, что его количество нейтрофилов составляет 1900 клеток на микролитр. Сможет ли его медицинская бригада продолжить курс химиотерапии? Почему?
- Больной поступил в ожоговое отделение накануне вечером с тяжелым ожогом левой верхней конечности и плеча. Анализ крови показывает, что у него лейкоцитоз. Почему это ожидаемый результат?
- Количество нейтрофилов ниже 1800 клеток на микролитр считается ненормальным.Таким образом, ДРП этого пациента находится на нижней границе нормального диапазона, и нет причин откладывать химиотерапию. В клинической практике большинству пациентов назначают химиотерапию, если их ЧСС выше 1000.
- Любой сильный стресс может увеличить количество лейкоцитов, что приведет к лейкоцитозу. Ожог особенно склонен к увеличению пролиферации лейкоцитов, чтобы предотвратить инфекцию, что представляет собой значительный риск, когда нарушается барьерная функция кожи.
Глоссарий
агранулярных лейкоцитов: лейкоцитов с небольшим количеством гранул в цитоплазме; в частности, моноциты, лимфоциты и NK-клетки
В-лимфоциты: (также В-клетки) лимфоцитов, которые защищают организм от определенных патогенов и тем самым обеспечивают специфический иммунитет
базофилов: гранулоцитов, окрашиваемых основным (щелочным) красителем и хранящих гистамин и гепарин
дефенсинов: антимикробных белков, высвобождаемых из нейтрофилов и макрофагов, которые создают отверстия в плазматических мембранах для уничтожения клеток
диапедез: (также эмиграция) процесс, при котором лейкоциты проталкиваются через соседние клетки в стенке кровеносного сосуда и попадают в ткани
эмиграция: (также диапедез) процесс, при котором лейкоциты проталкиваются через соседние клетки в стенке кровеносного сосуда и попадают в ткани
эозинофилов: гранулоцитов, окрашиваемых эозином; они выделяют антигистаминные препараты и особенно активны против паразитических червей
гранулярных лейкоцитов: лейкоцитов с большим количеством гранул в их цитоплазме; в частности, нейтрофилы, эозинофилы и базофилы
лейкоз: рак с участием лейкоцитов
лейкоциты: (также лейкоциты) бесцветные, ядерные клетки крови, основная функция которых заключается в защите организма от болезней
лейкоцитоз: чрезмерная пролиферация лейкоцитов
лейкопения: продукция лейкоцитов на ниже нормы
лимфоцитов: агранулярных лейкоцитов линии лимфоидных стволовых клеток, многие из которых обладают специфическим иммунитетом
лимфома: форма рака, при которой массы злокачественных Т- и / или В-лимфоцитов накапливаются в лимфатических узлах, селезенке, печени и других тканях
лизоцим: пищеварительный фермент с бактерицидными свойствами
мегакариоцитов: клеток костного мозга, производящих тромбоциты
ячейка памяти: лимфоцитов типа B или T, которые образуются после воздействия патогена
моноцитов: агранулярных лейкоцитов линии миелоидных стволовых клеток, которые циркулируют в кровотоке; тканевые моноциты — макрофаги
естественных киллеров (NK): цитотоксических лимфоцитов, способных распознавать клетки, которые не экспрессируют «собственные» белки на своей плазматической мембране или которые содержат чужеродные или аномальные маркеры; обеспечивают генерализованный, неспецифический иммунитет
нейтрофилов: гранулоцитов, окрашиваемых нейтральным красителем и являющихся наиболее многочисленными лейкоцитами; особенно активен против бактерий
полиморфно-ядерный: с лопастным ядром, как видно в некоторых лейкоцитах
положительный хемотаксис: процесс, при котором клетка движется в направлении химических стимулов
Т-лимфоциты: (также Т-клетки) лимфоцитов, которые обеспечивают иммунитет на клеточном уровне, физически атакуя чужеродные или больные клетки
тромбоцитов: тромбоцитов, один из форменных элементов крови, состоящий из фрагментов клеток, отколовшихся от мегакариоцитов
тромбоцитопения: состояние, при котором слишком мало тромбоцитов, приводящее к аномальному кровотечению (гемофилия)
тромбоцитоз: состояние, при котором слишком много тромбоцитов, приводящее к аномальному свертыванию (тромбозу)
Фагоцитоз эритроцитов проксимальным канальцем почки крысы
Берман I (1967) Ультраструктура эритробластических островков и ретикулярных клеток в костном мозге мышей.JUltrastruct Res 17: 291–313
Google Scholar
Bessis MC (1973) Живые клетки крови и их ультраструктура. Спрингер, Нью-Йорк, стр. 98
Google Scholar
Carone FA, Peterson DR, Oparil S, Pullman TN (1979) Почечный канальцевый транспорт и катаболизм белков и пептидов. Почки Int 16: 271–278
Google Scholar
Christensen EI (1976) Быстрое поглощение и переваривание белка в лизосомах проксимальных канальцев.Почки Int 10: 301–310
Google Scholar
Clyne DH, Brendstrup L, First MR, Pesce AJ, Finkel PN, Pollak VE, Pirani CL (1974) Почечные эффекты внутрибрюшинной инъекции цепи каппа. Индукция кристаллов в почечных канальцевых клетках. Lab Invest 31: 131–142
Google Scholar
Collet AJ, Petrik P (1971) Электронно-микроскопическое исследование эритрофагоцитоза in vivo альвеолярными макрофагами кошки.I. Ранний период: гемолиз. Z Zellforsch 116: 464–476
Google Scholar
Эдвардс В.Д., Саймон Г.Т. (1970) Ультраструктурные аспекты разрушения эритроцитов в нормальной селезенке крысы. J Ultrastruct Res 33: 187–201
Google Scholar
Ericsson JLE (1965) Транспорт и переваривание гемоглобина в проксимальных канальцах. II. Электронная микроскопия. Lab Invest 14: 16–39
Google Scholar
Essner E (1960) Электронно-микроскопическое исследование эритрофагоцитоза.J Biophys Biochem Cytol 7: 329–338
Google Scholar
Карновский М.Ю. (1965) Фиксатор формальдегид-глутарового альдегида высокой осмоляльности для использования в электронной микроскопии. J Cell Biol 27: 137 (резюме)
Google Scholar
Luft JH (1961) Усовершенствования методов заливки эпоксидной смолой. J Biophys Biochem Cytol 9: 409–414
Статья CAS PubMed Google Scholar
Maack T, Johnson V, Kau ST, Figueiredo J, Sigulem D (1979) Почечная фильтрация, транспорт и метаболизм низкомолекулярных белков: обзор.Почки Int 16: 251–270
Google Scholar
Maunsbach AB (1973) Ультраструктура проксимального канальца. В: Orloff J, Berliner RW (eds) Справочник по физиологии, Раздел 8: Почечная физиология. Американское физиологическое общество, Вашингтон, округ Колумбия, стр. 31
Google Scholar
McCoy RC, Tisher CC (1979) Патология первичных заболеваний клубочков. В: Barley LE, Gottschalk CW (eds) Strauss and Welt’s болезни почек, третье издание.Little, Brown and Company, Бостон, стр. 585
Google Scholar
Miller F, Palade GE (1964) Литическая активность в каплях абсорбции почечного белка. Электронно-микроскопическое цитохимическое исследование. J Cell Biol 23: 519–552
Google Scholar
Мягкая Г., Врелинг-Синделарова Х. (1976) Эритрофагоцитоз клетками трофобластного эпителия плаценты овцы на разных сроках беременности.Acta Anat 95: 234–248
Google Scholar
Мягкая G, Schellens JPM, Vreeling-Sindelarova H (1979) Лизосомный распад эритроцитов в плаценте овцы. Ультраструктурное исследование. Cell Tissue Res 197: 79–94
Google Scholar
Пеше А.Дж., Клайн Д.Х., Поллак В.Е., Кант С.К. (1980) Взаимодействие белков в канальцах почек. Clin Biochem 13: 209–215
Google Scholar
Петрик П., Колле А.Дж. (1971) Электронно-микроскопическое исследование эритрофагоцитоза in vivo альвеолярными макрофагами кошки.II. Поздний период: пищеварение. ZZellforsch 116: 477–486
Google Scholar
Pictet R, Orci L, Forssmann WG, Girardier L (1969) Электронно-микроскопическое исследование фиксированной перфузией селезенки. II. Переносят клетки и эритрофагоцитоз. Z Zellforsch 96: 400–417
Google Scholar
Platt H (1963) Поглощение твердых частиц и коллоидных материалов клетками эпидермиса.Дж. Патол Бакт 86: 113–122
Google Scholar
Рабинович М. (1970) Распознавание фагоцитов. В: van Furth R (ed) Мононуклеарные фагоциты. FA Davis Company, Филадельфия, стр. 299
Google Scholar
Reynolds ES (1963) Использование цитрата свинца при высоком pH в качестве электронно-непрозрачного красителя в электронной микроскопии. J Cell Biol 17: 208–212
Статья CAS PubMed Google Scholar
Рифкинд Р.А. (1965) Анемия тела Хайнца: украинское структурное исследование.II. Секвестрация и разрушение эритроцитов. Кровь 26: 433–448
Google Scholar
Simon GT, Burke JS (1970) Электронная микроскопия селезенки. III. Эритролейкофагоцитоз. Am J Pathol 58: 451–469
Google Scholar
Tisher CC, Cirksena WJ, Arstila AU, Trump BF (1969) Субклеточная локализация натрия в нормальных и поврежденных проксимальных канальцах почки крысы.Am J Pathol 57: 231–251
Google Scholar
Трамп Б.Ф., Тишер С.К., Саладино А.Дж. (1969) Нефрон в здоровье и болезнях. В: Bittar EE, Bittar N (eds) Биологические основы медицины, Том VI. Academic Press, Лондон, Нью-Йорк, стр. 387
Google Scholar
Wakefield JS, Hicks RM (1974) Эритрофагоцитоз эпителиальными клетками мочевого пузыря. J Cell Sci 15: 555–573
Google Scholar
Weed RI, Reed CF (1966) Мембранные изменения, ведущие к разрушению эритроцитов.Am J Med 41: 681–698
Google Scholar
Уитли Д.Н. (1968) Клеточное поглощение эритроцитов. Br J Exp Pathol 49: 541–543
Google Scholar
Zeligs JD (1977) Ультраструктура деградации эритроцитов эпителиальными клетками щитовидной железы in vivo. Am J Pathol 89: 85–104
Google Scholar
Zeligs JD, Wollman SH (1977) Ультраструктура эритрофагоцитоза и деления красных кровяных телец эпителиальными клетками щитовидной железы in vivo.J Ultrastruct Res 59: 57–69
Google Scholar
Эволюционирующие эритроциты: красные кровяные клетки как модуляторы врожденного иммунитета
Эритроциты — это самый распространенный тип клеток в организме человека, их количество составляет от 20 до 30 триллионов и на их долю приходится почти 70% от общего количества клеток в среднем взрослого человека. (1). Эритропоэз начинается с дифференцировки мультипотентных гемопоэтических стволовых клеток в костном мозге, которые затем дают предшественники, коммитированные эритроидом.На заключительных стадиях процесса, известных как терминальный эритропоэз, ядро и другие органеллы вытесняются. Эти энуклеированные ретикулоциты затем попадают в кровоток для завершения процесса своего созревания (2). После продолжительности жизни ~ 120 дней эритроциты очищаются макрофагами в селезенке и печени (3).
Важно отметить, что млекопитающие — единственные позвоночные, у которых эритроциты энуклеированы в зрелом состоянии. Экструзия ядра и других органелл происходит через серию сложных стадий, включая конденсацию хроматина, почкование и митофагию (2, 4).Считается, что потеря эритроидного ядра облегчила эволюцию эндотермии у млекопитающих, поскольку она позволила эритроцитам еще больше специализироваться для эффективного газообмена (4).
В классической литературе эритроциты человека долгое время считались простыми переносчиками кислорода. Однако появляется все больше данных, свидетельствующих о том, что эти клетки также играют важную роль во врожденной иммунной системе (5–7). С эволюционной точки зрения участие эритроцитов человека в врожденном иммунитете не должно вызывать удивления, поскольку ядерные эритроциты птиц, земноводных и рыб активно участвуют в иммунном ответе посредством выработки цитокиноподобных факторов, активации генов вирусного ответа и секвестрация патогенов через поверхностное связывание или фагоцитоз (8–20).Несмотря на удаление органелл во время эритропоэза и последующую неспособность осуществлять транскрипцию и трансляцию, эритроциты млекопитающих сохраняют способность взаимодействовать с эндогенными и экзогенными воспалительными молекулами в крови. Исследования последних нескольких десятилетий показывают, что, как и их эволюционные аналоги, эти клетки сохраняют способность связываться и взаимодействовать с различными воспалительными молекулами, включая хемокины, нуклеиновые кислоты и патогены, тем самым регулируя и модулируя иммунные ответы.Внутренние компоненты эритроцитов, такие как гемоглобин и гем, также являются серьезными аспектами врожденного иммунитета, способными генерировать противомикробные реактивные формы кислорода (АФК) для защиты от вторжения гемолитических микробов, а также способствовать патологическим воспалительным и аутоиммунным ответам. Наконец, участие эритроцитов во взаимодействиях хозяин-патоген может сделать их критически важными в контексте сепсиса и септического шока, состояния нерегулируемой реакции хозяина на инфекцию, когда организм перегружен эндотоксинами и другими медиаторами воспаления.Более глубокое понимание функции эритроцитов, вероятно, будет иметь жизненно важное значение для выяснения путей, которыми эти клетки вносят вклад в патогенез множества острых и хронических заболеваний.
Эволюционные перспективы
Происхождение эритроцитов.
В ходе эволюции клеточные компоненты крови претерпели функциональную специализацию. Считается, что самые ранние клетки крови были относительно универсальными, участвовавшими как в фагоцитозе, так и в доставке питательных веществ.Однако они не выполняли функцию транспорта кислорода (21, 22). До появления кровеносных систем мелкие беспозвоночные обеспечивали оксигенацию тканей только за счет простой диффузии; этот механизм до сих пор наблюдается у примитивных животных, таких как губки, книдарии и плоские черви (21, 23). Позже появление более крупных планов тела потребовало более эффективных механизмов доставки кислорода, что привело к эволюции все более сложных систем кровообращения (23) и различных дыхательных пигментов, переносящих кислород (24, 25).Гемоглобин, по-видимому, возник первым среди них, за ним следуют гемеритрины, гемоцианины моллюсков и, в конечном итоге, гемоцианины членистоногих (25). Хотя гемоглобин, вероятно, начинался как свободно плавающий белок, появление клеток, инкапсулирующих пигмент (т.е. эритроцитов), по-видимому, произошло вскоре после этого (24, 25). Все современные позвоночные [за заметным исключением белокровных ледяных рыб из семейства Channichthyidae (26)] осуществляют доставку кислорода посредством циркулирующих эритроцитов, богатых гемоглобином (24).Подобные клетки спорадически наблюдаются и у многих групп беспозвоночных, включая иглокожих, форонид, кольчатых червей, немертин и моллюсков (25, 27). Эритроциты могли возникнуть отдельно в нескольких ветвях животных или однажды до расхождения типов животных, хотя точная эволюционная история остается нерешенной (21, 22, 27).
Эритроциты позвоночных, не являющихся млекопитающими.
Эритроциты позвоночных, не являющихся млекопитающими, являются ядросодержащими, за редкими исключениями у рыб (28) и земноводных (29, 30).Кроме того, как и многие другие кроветворные клетки, эритроциты немлекопитающих непосредственно участвуют в иммунном ответе. У рыб (8, 16), земноводных (19) и птиц (9, 13) эритроциты активно подвергаются транскрипции и продукции белка в ответ на сигналы окружающей среды. В частности, эритроциты атлантического лосося ( Salmo salar L. ) увеличивают транскрипцию Ag-презентирующих генов и генов вирусного ответа во время ортореовирусной инфекции рыб и повышают регуляцию IFN-α в ответ на вирус инфекционной анемии лосося, что способствует устойчивости хозяина (10, 11 ).Эритроциты полосатой рыбы-клюва ( Oplegnathus fasciatus ), по-видимому, координируют иммунную функцию с лейкоцитами, повышая регуляцию еще 338 генов при инкубации с лейкоцитами и ЛПС по сравнению с одним ЛПС (18). Кроме того, как куриные, так и форелевые эритроциты выделяют цитокиноподобные факторы после воздействия грибковых АГ (8, 9) и экспрессируют функциональные рецепторы распознавания образов (включая TLR и белки распознавания пептидогликана) на своей поверхности (14, 31). Примечательно, что эритроциты форели даже участвуют в фагоцитозе патогенных дрожжей ( Candida albicans ) (12).
Наконец, эритроциты форели и цыплят образуют клеточные скопления, известные как розетки, которые ускоряют разрушение патогенов макрофагами (12, 17). Поведение эритроцитов рыб и птиц резко контрастирует с поведением эритроцитов человека, которое, как известно, наблюдается в тяжелых случаях малярии Plasmodium falciparum . Розетение в этом контексте характеризуется не как защитный механизм человеческого хозяина, а скорее как механизм вирулентности малярийного паразита (20).Инфицированные эритроциты, прикрепляющиеся к неинфицированным эритроцитам и эндотелиальным клеткам, приводят к секвестрации клеток крови в пораженных органах, что, особенно при локализации в ткани головного мозга, связано со смертностью (20). Возможно, что это розеточное поведение было заимствовано малярийным паразитом или что это неадаптивное следствие эволюционно законсервированного механизма секвестрации патогенов.
Эритроциты млекопитающих.
Млекопитающие — единственные позвоночные с энуклеированными эритроцитами в гомеостатических условиях (рис.1). Интересно, однако, что ядросодержащие эритроциты иногда наблюдаются у людей во время патологических состояний, что составляет поразительное исключение и позволяет предположить, что энуклеированные эритроциты не являются обязательным признаком физиологии млекопитающих (32–34). Эритроциты млекопитающих также лишены эндоплазматической сети, рибосом и митохондрий, поскольку процессы раннего развития уничтожают эти типично жизненно важные органеллы (2). Было высказано предположение, что делеция ядер и органелл в зрелых эритроцитах, возможно, позволила увеличить отношение площади поверхности к объему, способствуя повышению эффективности газообмена (35–37).Кроме того, эта функция позволила повысить емкость клеточного гемоглобина (4), повысить гибкость и улучшить способность проходить через мелкие капилляры (15, 37).
РИСУНОК 1.Сравнение иммунологических свойств эритроцитов у позвоночных. Эритроциты низших позвоночных (т.е. рыб, земноводных, рептилий и птиц) зарождаются в зрелом состоянии. Известно, что эритроциты рыб и птиц активно подвергаются транскрипции и трансляции, продуцируют и высвобождают цитокины, образуют розетки для изоляции патогенов и, в случае форели, фагоцитируют патогены.Хотя активность эритроцитов у рептилий и земноводных изучена хуже, вполне вероятно, что они сохраняют многие из этих характеристик, учитывая, что они сохранялись на филогенетическом расстоянии от рыб до птиц. Несмотря на отсутствие ядер и органелл, эритроциты млекопитающих (и человека) сохраняют способность влиять на врожденный иммунитет. Все эритроциты содержат гемоглобин, который участвует в защите хозяина, генерируя антимикробные АФК.
Возможно, энуклеация эритроцитов произошла в ответ на снижение концентрации кислорода в атмосфере Земли (35) или из-за повышенных метаболических требований эндотермии (37).В соответствии с последней гипотезой, эритроциты сравнительно больше у эктотермных, филогенетически низших организмов, таких как рыбы и герпети (36, 38). Экструзия митохондрий в эритроцитах млекопитающих также может приводить к снижению продукции повреждающих АФК (39). Это привлекательная гипотеза, учитывая, что человеческие эритроциты генерируют обширные свободные радикалы даже без митохондрий, что требует их обширного арсенала защитных антиоксидантных молекул и ферментов (40). Однако эритроциты птиц демонстрируют более низкий уровень окислительного стресса в крови и аналогичное содержание клеточного гемоглобина по сравнению с млекопитающими, несмотря на то, что они сохраняют как функциональные митохондрии, так и ядра (4, 41), что указывает на то, что присутствие митохондрий и ядер в эритроцитах не обязательно является барьером. для эндотермии.Поскольку эндотермия возникла отдельно у птиц и млекопитающих, можно ожидать, что ее сопровождали альтернативные наборы физиологических адаптаций.
Независимо от конкретных факторов давления, вызывающих потерю органелл в эритроцитах млекопитающих, изменение, по-видимому, было эволюционным компромиссом: выбор в пользу большей респираторной специализации, утрата ключевых клеточных компонентов сделали эритроциты млекопитающих более пассивными участниками, чем у других позвоночных.Без рибосом или генома эритроциты млекопитающих неспособны к передаче сигнала, транскрипции генов или синтезу нового белка и, следовательно, не могут вносить вклад в иммунный ответ посредством продукции de novo иммунологически активных сигнальных молекул. Однако есть убедительные доказательства того, что эритроциты млекопитающих остаются ключевыми участниками врожденного иммунитета. Несмотря на потерю внутренних органелл, эритроциты млекопитающих экспрессируют большое количество рецепторов клеточной поверхности, которые опосредуют их взаимодействия как с эндогенными, так и с экзогенными агентами в крови (42), обеспечивая им обширную способность к поглощению или секвестрации циркулирующих молекул, влияющих на иммунитет. функция.
Гемоглобин и гем.
Среди респираторных пигментов гемоглобин — самый древний (25). Циркулирующий гемоглобин, по-видимому, возник из локализованных в тканях гемоглобинов примитивных животных, таких как турбеллярийные платигельминты (25). Хотя перенос кислорода является их основной функцией, гемоглобин и свободный гем также участвуют во врожденном иммунном ответе.
Поскольку гемоглобин является богатым источником железа для метаболизма бактерий (43–45), микробные захватчики выработали как гемолитические токсины, так и высокоаффинные улавливающие системы для доступа к нему (46–48).В ответ гемоглобин хозяина обеспечивает контратаку: активированный внеклеточными протеазами вирулентных бактерий, пептид испускает бактерицидные АФК в непосредственной близости от микробов (49). Исследования показывают, что как α, так и β субъединицы гемоглобина содержат сайты связывания с высоким сродством для LPS, иммуностимулирующего эндотоксина, присутствующего в мембранах грамотрицательных бактерий. Когда ЛПС связывается с гемоглобином, он стимулирует окислительно-восстановительную активность пептида и приводит к образованию антимикробных свободных радикалов (50).Кроме того, было показано, что присутствие гемоглобина усиливает продукцию цитокинов макрофагами в присутствии ЛПС, а также усиливает связывание ЛПС макрофагами (51). Наконец, микромолярные концентрации фрагментов гемоглобина достаточны для подавления роста дрожжей и бактерий (как грамположительных, так и грамотрицательных) за счет продукции АФК, при этом не демонстрируя токсического воздействия на клетки крови человека (52).
Иммунологические функции респираторных глобинов широко распространены в животном мире.Беспозвоночные подковообразные крабы ( Tachypleus tridentatus ) содержат голубоватую кровь, богатую гемоцианином, бесклеточным белком, который переносит кислород через кровь многих моллюсков и членистоногих. У этих животных гемоцианин аналогичным образом генерирует АФК в ответ на микробное заражение (49, 53). Антимикробные свойства глобинов настолько универсальны, что клещ крупного рогатого скота ( Boophilus microplus ) может присваивать фрагменты гемоглобина своего хозяина для использования в собственном кишечнике (54). Помимо их функции в газообмене, использование респираторных пигментов в качестве элементов врожденного иммунитета было реализовано на многих этапах эволюции (12, 25, 53).
Хотя гемоглобин может обеспечивать антимикробную защиту в гомеостатических условиях, исследования показывают, что он имеет противоположный эффект при патологических состояниях. В частности, когда система перегружена эндотоксином, как в случае тяжелого сепсиса, повышенные уровни бесклеточного гемоглобина связаны с повышенной смертностью (55, 56). Интересно, что i.p. инъекция глобина оказала защитное действие на мышей с эндотоксемией (55), тогда как внутривенное введение инъекция гемоглобина мышам с эндотоксемией резко увеличила уровень смертности (56).И хотя сам по себе глобин снижает продукцию TNF макрофагами в присутствии LPS, тем самым ослабляя иммунный ответ на эндотоксин, гемоглобин фактически стимулирует продукцию TNF макрофагами и запускает высвобождение провоспалительных цитокинов в тех же условиях (55). Противоречивый характер литературы по гемоглобину, по-видимому, связан с дуалистическими свойствами самой молекулы гемоглобина, в которой глобины ослабляют иммунный ответ (55, 57), тогда как гем усиливает его (58, 59).Эти эффекты, вероятно, связаны со способностью глобина убирать избыток свободного гема во время эндотоксемии, что приводит к ослаблению иммунной активации. Напротив, если гем воспалительный, инъекция гемоглобина может усугубить этот эффект.
Гем также был охарактеризован как мощный опасный сигнал in vitro, способный активировать опосредованную NF-κB экспрессию провоспалительных белков (включая IL-1 и TNF-α), генерацию внутриклеточных ROS, 100-кратное увеличение транскрипции провоспалительные гены и высвобождение макрофагами TNF-α и IL-1 (60).Было высказано предположение, что свободный гем не может причинить вред сам по себе, а скорее оказывает вредное воздействие только в присутствии других иммуномодуляторов (61). Однако другие продемонстрировали, что свободный гем является независимым активатором TLR4 (62), стимулируя секрецию TNF-α, ROS и лейкотриена B4 из макрофагов (59, 62) и высвобождение высокоподвижного блока 1 группы (HMGB1) из гепатоцитов. ядра (58).
Эритроциты человека и врожденная иммунная система
Связывание хемокинов.
Ряд исследований показал, что эритроциты выполняют множество функций, помимо транспорта кислорода (6, 7, 63, 64) (Таблица I). Одним из важных иммуномодулирующих свойств эритроцитов человека является их способность связывать широкий спектр хемокинов (рис. 2). Одним из основных локусов связывания является рецептор Duffy Ag для хемокинов (DARC), который был впервые обнаружен Дарбонном и его коллегами (7). Эта работа продемонстрировала, что эритроциты действуют как сток для CXCL8, тем самым инактивируя CXCL8-зависимый градиент хемокинов и предотвращая рекрутирование нейтрофилов (7).Даффи связывает и другие иммуномодулирующие белки с высоким сродством, включая дополнительные хемокины CXC и CC, помимо CXCL8 (6, 63). В экспериментах in vitro Lee et al. (63) продемонстрировали, что в крови, лишенной эритроидов, Даффи демонстрирует более высокие уровни хемокинов в плазме после воздействия ЛПС, что дополнительно указывает на участие Даффи в поглощении хемокинов. Это эволюционно законсервированная особенность DARC, поскольку мыши с нокаутом по Даффи обнаруживают более высокие концентрации хемокинов (то есть MIP-2 и KC) в сосудистом пространстве легких (63).Некоторые предполагают, что секвестрация воспалительных молекул рецепторами на поверхности эритроцитов снижает иммунный ответ за счет ослабления передачи сигналов нейтрофилов (7). Такая ингибирующая система может дать селективное преимущество, поскольку чрезмерная стимуляция иммунной системы может вызвать чрезмерное воспаление и привести к повреждению тканей.
Таблица I. Двойственная природа эритроцитов в функции врожденного иммунитета и ее значение для болезненных состояний человека РИСУНОК 2.Обзор связывающей активности эритроцитов человека.По часовой стрелке сверху слева. Эритроциты связывают хемокины через DARC, модулируя рекрутирование нейтрофилов и активацию иммунной системы. Недавние исследования показали, что эритроциты способны связывать и поглощать мтДНК через TLR9. Пока не известно, может ли эритроидный TLR9 также поглощать другие фрагменты ДНК, богатые CpG (например, бактериальную ДНК). Лизированные эритроциты могут выделять гем и гемоглобин во внеклеточную среду. Вблизи вторгающихся микробов гемоглобин может связывать ЛПС и генерировать токсичные АФК, которые действуют в защите хозяина.Однако высвобождение свободного гема во время воспаления может привести к чрезмерной активации иммунной системы, что приведет к повреждению или смерти клеток. GYPA был идентифицирован как потенциальный рецептор-ловушка на поверхности эритроцитов человека, функционирующий для изоляции патогенов и облегчения их удаления из кровообращения.
Однако альтернативная модель широко распространенного связывания хемокинов с помощью DARC может фактически привести к поддержанию уровней хемокинов в крови, поскольку хемокины будут оставаться в циркуляции, а не выводиться из организма.В поддержку этой точки зрения, мыши дикого типа Даффи содержат значительно более высокие концентрации хемокинов в крови, чем мыши с нокаутом Даффи (64). Вышеупомянутые эксперименты Дарбонна, которые пришли к выводу, что связывание хемокинов является поверхностным и легко обратимым, также могут указывать на возможность устойчивой иммунной активации, поскольку рецепторы эритроцитов могут попеременно связываться и высвобождать свои субстраты в тканевом микроокружении.
Эти две модели эритроцитарной регуляции уровней хемокинов в крови можно назвать гипотезой поглощения (т.например, связывание эритроцитов с хемокинами служит для ослабления иммуноактивирующих сигналов) и гипотезы резервуара (т.е. связывание эритроцитов предотвращает клиренс хемокина, тем самым продлевая период полужизни хемокина в крови). Хотя сначала эти модели кажутся противоречивыми, они не могут быть взаимоисключающими: Fukuma et al. (64) предположили, что эритроциты действительно поглощают хемокины из участков воспаления, но в конечном итоге высвобождают их в ответ на снижение концентрации хемокинов в плазме, эффективно поддерживая гомеостаз.
Связывание нуклеиновой кислоты.
В дополнение к регулированию хемокинов недавние исследования демонстрируют, что эритроциты также способны связывать другой класс молекул с потенциалом опосредовать воспалительные реакции: нуклеиновые кислоты. В частности, наша недавняя работа была сосредоточена на способности эритроцитов связывать ДНК, полученную из митохондрий (мтДНК) (5). Митохондрии представляют собой значительный эндогенный резервуар потенциально воспалительных нуклеиновых кислот, которые выбрасываются в кровоток во время нормального обновления клеток активированными иммунными клетками и во время гибели клеток.Подобно ДНК их бактериальных предков, мтДНК богата иммуностимулирующими мотивами CpG и инициирует провоспалительную передачу сигналов посредством прямого связывания CpG-содержащих областей ДНК с TLR9. Кроме того, известно, что мтДНК активирует инфламмасому (65, 66), а цитозольная мтДНК является мощным индуктором STING (стимулятор генов IFN), белка ER, который воспринимает вторичный мессенджер клетки, продуцируемый в ответ на цитозольную дцДНК (67–70 ) и циклических динуклеотидов бактериального происхождения (67, 71). Растущее количество литературы вовлекает эти молекулярные паттерны, связанные с повреждением митохондрий (DAMP), в патогенез множества заболеваний, включая аутоиммунитет, рак, сердечно-сосудистые заболевания, травмы и критические заболевания (72–76).
Мы недавно сообщили, что человеческие эритроциты экспрессируют TLR9, потенциально обеспечивая человеческие эритроциты способностью очищать или буферизовать потенциально воспалительные нуклеиновые кислоты в кровотоке (5). Хотя в неэритроидных клетках TLR9 транспортируется в эндолизосомные компартменты и расщепляется лизосомными катепсинами, чтобы инициировать передачу сигналов врожденного иммунитета (77–79), остается неизвестным, подвергается ли поверхностный TLR9 эритроида расщеплению и передаче сигналов после связывания мтДНК. Мы обнаружили, что TLR9-положительные эритроциты связывают и изолируют циркулирующую внеклеточную мтДНК, а исследования на мышах in vivo показали, что потеря этой функции приводит к усиленному повреждению легких во время состояний воспаления (5).Кроме того, эритроциты поглощали ДНК CpG из эндотелиальных клеток микрососудов человека in vitro, что может служить для ослабления активации эндотелиального TLR9 (5).
Примечательно, что существует значительная гетерогенность в экспрессии эритроидного TLR9 как между людьми, так и внутри них (5). Некоторые люди экспрессируют относительно высокий процент эритроидного TLR9, тогда как другие практически не экспрессируют. Даже у тех, кто действительно экспрессирует эритроидный TLR9, рецептор присутствует только во фракции общей популяции эритроцитов.Тем не менее, из-за огромного количества эритроцитов в циркуляции [от 20 до 30 триллионов у среднего взрослого человека (1)] даже небольшая часть TLR9-положительных клеток будет иметь невероятный потенциал для влияния на системную функцию или модуляции поражения органов.
Мы только начинаем понимать, каким образом связывание нуклеиновых кислот эритроцитами влияет на системную функцию. Как и в случае связывания хемокинов с эритроцитами, удаление нуклеиновых кислот может иметь противоречивые эффекты на воспаление. В некоторых случаях эритроциты могут ослаблять воспаление в компартменте легких, удаляя мтДНК из эндотелиальных клеток; однако, учитывая тесный механический контакт между эритроцитами и эндотелием микрососудов, эритроциты, связывающие мтДНК, также могут усугублять воспаление, случайно представляя воспалительные молекулы иммунным или эндотелиальным клеткам.Кроме того, связывание мтДНК вызывает образование зубцов на мембране эритроцитов, что может привести к ускоренному клиренсу аномальных эритроцитов или захвату эритроцитов в микроциркуляторном русле.
Хотя недавние результаты согласуются с моделью, в которой эритроциты поглощают митохондриальные DAMPs из легочного компартмента, динамика поглощения мтДНК может быть более тонкой. Возможно, что, как и в случае с Duffy Ag и хемокинами, которые он связывает, связывание мтДНК может действовать как защитный или патологический механизм, причем точное воздействие в значительной степени зависит от условий местного микроокружения.
Пока не известно, способны ли эритроциты также поглощать другие типы нуклеиновых кислот. Однако недавние данные свидетельствуют о том, что РНК вируса Зика может сохраняться в эритроцитах во время хранения (80). Недавнее открытие многочисленных TLR (в том числе TLR3) в транскриптоме ретикулоцитов млекопитающих предлагает потенциальный механизм, с помощью которого может происходить это связывание, и указывает на то, что еще другие TLR и поглотители нуклеиновых кислот могут быть обнаружены на поверхности зрелых эритроцитов человека (81). . Кроме того, связывание вирусного материала с эритроцитами может иметь важное значение для патогенеза заболевания, а также может иметь значение в отношении безопасного хранения и переливания крови.
Связывание с патогенами.
Известно, что эритроциты человека не только связываются с эндогенными молекулами, такими как мтДНК и хемокины, но и связываются с патогенами. Несомненно, наиболее печально известный и эволюционно значимый патоген эритроцитов принадлежит к роду Plasmodium , группе простейших, вызывающих малярию. Эти патогены оказали самое сильное эволюционное давление на геном человека за последние тысячелетия (82).
Каждый вид Plasmodium развил особые механизмы прикрепления к человеческим эритроцитам. P. vivax и P. knowlesi прикрепляются через вышеупомянутый DARC (83, 84), что делает присутствие Даффи настолько дезадаптивным в регионах с высоким уровнем малярии, что почти все западноафриканцы и 68% афроамериканцев демонстрируют отрицательный по Даффи фенотип (85). Ясно, что преимущества, связанные со способностью Даффи поглощать хемокины, были незначительны по сравнению с ее пагубными эффектами в присутствии малярии, что привело к распространению аллеля, дающего Даффи негативность.
Самый опасный из малярийных паразитов человека, P.falciparum , проникает в эритроциты после присоединения к гликофорину A (GYPA), B или C (86, 87). Хотя люди, дефицитные по любому из типов гликофорина, проявляют повышенную устойчивость к P. falciparum , GYPA парадоксальным образом остается наиболее распространенным поверхностным белком эритроцитов у людей (12, 42, 88). Полный дефицит GYPA эритроцитов является жизнеспособным, но чрезвычайно редким фенотипом, что позволяет предположить, что отсутствие GYPA должно иметь определенную цену (42) или что присутствие GYPA должно обеспечивать достаточную пользу, чтобы преодолеть избирательное давление, оказываемое P.falciparum. В противном случае, P. falciparum , по-видимому, привело бы к массовому исчезновению GYPA в малярийных регионах.
GYPA может действовать как рецептор-ловушка, направляя патогены из важных тканей в селезенку, чтобы облегчить их разрушение макрофагами (42). В поддержку этой гипотезы многие патогены, связывающие гликофорины человека (например, реовирус, грипп C, Sendai, Mycoplasma pneumoniae , Escherichia coli и Ureaplasma urealyticum ), сами по себе не инфицируют эритроциты (42).Это также может помочь объяснить, почему GYPA сохраняется на поверхности эритроцитов, несмотря на давление отбора со стороны P. falciparum . Таким образом, разработка вирусных рецепторов-ловушек на эритроцитах для облегчения адсорбции и предотвращения инвазии ядерных клеток представляет собой потенциально многообещающий подход к выведению патогенов из кровотока. Действительно, было показано, что такой подход ослабляет инфекцию вируса Коксаки B на мышиных моделях (89).
К сожалению, не всякая ложная адсорбция дает желаемый эффект.Примечательно, что эритроциты человека связывают вирионы ВИЧ-1, и это связывание приводит к 100-кратному увеличению вирусной инфекционности (90). Кроме того, связывание ВИЧ-1 с DARC на эритроцитах поддерживает жизнеспособность вируса и представляет вирусные частицы CD4-положительным Т-клеткам, хотя эти результаты обсуждались в литературе (91–95). Поэтому в некоторых случаях активность связывания эритроцитов может способствовать заражению транс- и другими вирусами. Как и в случае связывания хемокинов и мтДНК, местные условия в кровотоке и специфические взаимодействия между вирусными лигандами и их рецепторами хозяина могут в конечном итоге определять, окажется ли связывание патогенов эритроцитов полезным или пагубным для хозяина.
Эритроциты в контексте современной медицины
Критическое заболевание.
Учитывая их способность взаимодействовать как с экзогенными, так и с эндогенными воспалительными молекулами, эритроциты, вероятно, играют важную роль в контексте критического заболевания (рис. 3). Во время сепсиса кровообращение переполняется избыточными бесклеточными нуклеиновыми кислотами, патогенами и хемокинами, которые, как было показано, связываются с эритроцитами. Таким образом, любая потеря функции эритроцитов может резко изменить реакцию хозяина и внести свой вклад в патогенез этих состояний.
РИСУНОК 3.Системная модель вовлечения эритроцитов в критическое заболевание. В базовых условиях эритроциты вносят вклад в иммунный гомеостаз, связываясь и улавливая мтДНК через TLR9. Во время травм обширная гибель клеток приводит к повышению уровня бесклеточной мтДНК. TLR9-положительные эритроциты поглощают эти нуклеиновые кислоты. Эритроциты, связывающие мтДНК, становятся зубчатыми (т. Е. Деформируются), что может либо ускорять их удаление из кровотока, либо запускать активацию эндотелиальных клеток.Несвязанная мтДНК может взаимодействовать с иммунными клетками, что приводит к усилению воспаления. При сепсисе кровообращение перегружено как бактериальной, так и мтДНК, а также свободным гемом (не показан). Остается неизвестным, снижается ли мтДНК-связывающая способность эритроцитов во время сепсиса.
Исследования показывают, что физические и химические изменения действительно происходят в эритроцитах в периоды сепсиса и эндотоксемии (96). Септический шок снижает уровень 2,3-бисфосфоглицерата в эритроцитах, делает их менее деформируемыми и снижает их способность пересекать микрососуды (96–98).
Зазубренность мембраны эритроцитов — еще один потенциально важный компонент патологии сепсиса. Эта клеточная деформация, по-видимому, является следствием связывания мтДНК (5), и повышенные уровни внеклеточной мтДНК во время сепсиса, вероятно, увеличивают частоту образования эритроцитов. Мы предполагаем, что образование зубцов может ускорить выведение и обмен эритроцитов, что потенциально может привести к снижению количества эритроцитов и анемии. Наконец, зубчатые эритроциты также могут быть вовлечены в воспаление, органную недостаточность, ишемию тканей и окклюзию сосудов, которые являются центральными для фенотипа сепсиса.
Кроме того, эритроциты тяжелобольных пациентов с травмой демонстрируют сниженную способность поглощать мтДНК (5). Это может иметь большое значение для патогенеза тяжелого сепсиса, поскольку недавние исследования пришли к выводу, что повышенные уровни мтДНК в плазме во время критического заболевания прогнозируют смертность (99, 100). Утрата способности поглощать может быть связана с насыщением эритроидных рецепторов TLR9 из-за большого количества избыточных нуклеиновых кислот в циркуляции или с клеточным повреждением, наносимым эритроцитами во время воспалительных состояний.Остается неизвестным, способствует ли секвестрация дефектных нуклеиновых кислот эритроцитами развитию поражения легких или других органов во время сепсиса. Кроме того, будущие исследования должны быть направлены на определение того, обладает ли эритроидный TLR9 способностью связывать бактериальную ДНК CpG в дополнение к мтДНК, поскольку это может потенциально пролить свет на компоненты патогенеза заболевания.
Бесклеточный гем также является важным фактором в контексте критических состояний. В состояниях инфекции или воспаления свободный гем может действовать как DAMP, способствуя чрезмерному воспалению, повреждению тканей и даже смерти восприимчивых хозяев (58, 59).Были идентифицированы различные поглотители свободного гема, и снижение уровня этих поглотителей гема также связано с повышенной смертностью (58). Один из таких поглотителей гема, гемоксигеназа-1 (HO-1), катаболизирует свободный гем и активируется после воздействия LPS (101). Хотя окись углерода, продуцируемая катаболизмом гема HO-1, может быть источником передачи сигналов ROS и окислительного стресса, общие эффекты системы HO-1 / CO являются противовоспалительными из-за ее снижения TNF-α, IL-8. , а также уровни MIP-1β и активация IL-12 (101).Было показано, что HO-1 защищает людей с тяжелым сепсисом, предполагая, что повышенные уровни циркулирующего свободного гема являются центральными в патогенезе этого состояния (58). Кроме того, низкие уровни гемопексина, связывающего гемопексин (HPX), связаны с повышенной смертностью во время сепсиса, а введение HPX во время септического шока снижает вероятность смерти (58).
Тяжелобольные пациенты склонны к развитию острого респираторного дистресс-синдрома, опасного для жизни синдрома, характеризующегося нарушением альвеолярного эндотелиально-эпителиального барьера, что приводит к утечке белковой жидкости в воздушное пространство, потере эластичности легких, гипоксии и дыхательной недостаточности ( 102).В доклинических моделях повреждения легких потеря эритроцитов DARC увеличивала воспаление легких и рекрутирование нейтрофилов в воздушном пространстве (103, 104). В соответствии с этими выводами Kangelaris et al. (105) сообщили, что афроамериканские пациенты, обладающие полиморфизмом гена, который отменяет экспрессию эритроидного DARC, были связаны с повышенным на 17% риском смертности от острого респираторного дистресс-синдрома по сравнению с пациентами европейского происхождения. Тем не менее, афроамериканские пациенты с эритроидным DARC чувствовали себя так же, как и европейские американские пациенты (105).Таким образом, возможно, что сниженная функция поглощения хемокинов эритроцитами во время критического заболевания может усугубить воспаление у восприимчивых хозяев.
Малярия.
В контексте малярии свободный гем образуется в результате переваривания гемоглобина паразитами. Чтобы защитить себя от цитотоксического действия гема, паразиты P. falciparum превращают это соединение в нерастворимые кристаллы, известные как гемозоин. Сам гемозоин иммунологически инертен; однако он покрывается малярийной ДНК и впоследствии представляет ДНК хозяину TLR9, тем самым усиливая врожденный иммунный ответ (106).Важен ли эритроидный TLR9 в патогенезе малярии, еще предстоит выяснить.
Появление ядросодержащих эритроцитов при болезненных состояниях.
Наконец, стоит отметить многочисленные задокументированные случаи циркуляции ядерных эритроцитов (ЯРБК) у взрослых людей с тяжелыми заболеваниями (32, 33). Это крайне ненормальный фенотип, так как ЯРБК обычно наблюдаются только в периферическом кровотоке плодов и новорожденных (32), но они наблюдаются у 10–30% пациентов в критическом состоянии (34).В этих случаях прогноз для пациентов неблагоприятный, более 50% людей умирают в больнице. Присутствие NRBC в крови было охарактеризовано как независимый предиктор смертности, обычно предвещая смерть в течение 1–3 недель (33).
Учитывая то, что известно об иммунологических функциях ядерных эритроцитов у позвоночных, не являющихся млекопитающими, есть соблазн предположить, что повторное появление этой эволюционно древней особенности у людей может служить функциональной цели. Например, NRBC могут представлять собой последнюю попытку вытеснить как можно больше иммунологически активных клеток в кровоток в попытке преодолеть опасное для жизни повреждение.Хотя это весьма предположительно, дальнейшие исследования могут выявить ранее неизвестную иммунную активность человеческих эритроцитов.
CD47 на экспериментально стареющих эритроцитах мышей ингибирует фагоцитоз после опосредованного рецептором Fcγ, но не опосредованного рецептором скавенджера распознавания макрофагами | Кровь
Удаление стареющих эритроцитов (эритроцитов) из кровотока — это избирательный процесс, опосредованный в основном макрофагами в печени и селезенке. 1 На поверхности стареющих эритроцитов появляются несколько молекулярных структур, которые могут быть задействованы в качестве лигандов при распознавании макрофагами. Макрофаги могут либо непосредственно распознавать эти лиганды, либо распознавание может зависеть от связывания мостиковых белков плазмы, которые могут взаимодействовать с лигандами эритроцитов. 2-7 Как таковые, эти лиганды RBC могут включать изменения углеводных фрагментов белка, 8 потерю асимметрии фосфолипидов плазматической мембраны, 9-11 и / или кластеризацию полосы 3 с последующим связыванием комплемента или антител. 12-14 Фагоцитоз макрофагами может, например, индуцироваться после лигирования рецепторов, таких как рецепторы Fcγ (FcγR), рецепторы комплемента или рецепторы скавенджеров (SR). 15-17 FcγR распознает Fc-часть иммуноглобулина G (IgG), связанную с клеткой-мишенью, что приводит к быстрому фагоцитозу опсонизированной IgG мишени. SR составляют большое семейство рецепторов с широкой лиганд-связывающей способностью, где наиболее известными лигандами являются полианионные молекулы, такие как белки, полирибонуклеотиды, полисахариды и липиды. 16 «Измененные» молекулы-хозяева (например, окисленный липопротеин низкой плотности [oxLDL]) могут распознаваться большинством SR, тогда как другие лиганды более специфично взаимодействуют с SR. 16 Окислительное повреждение, вероятно, является одной из важных причин старения эритроцитов и воздействия лигандов, связанных со старением. 13,18 RBC, окисленные in vitro (Ox-RBCs), эффективно фагоцитируются макрофагами в отсутствие дальнейшей опсонизации, процесс, который, как было показано, ингибируется oxLDL или другими лигандами SR, такими как фукоидан, сульфат декстрана или поли-I как in vivo, так и in vitro. 4,7,19 Было высказано предположение, что фагоцитоз Ox-RBCs зависит от сыворотки крови, 6 и включает распознавание фосфатидилсерина (PS) на поверхности RBC. 9,10
Макрофагальный фагоцитоз клеток-мишеней-хозяев регулируется балансом между передачей сигналов через профагоцитарные рецепторы (например, FcγR или рецепторы комплемента) и ингибирующие рецепторы. Распознавание гликопротеина CD47 на клеточной поверхности белком, регулирующим сигнал ингибиторного рецептора альфа (SIRPα), подавляет фагоцитоз неопсонизированных эритроцитов, а также IgG или опсонизированных комплементом эритроцитов как in vivo, так и in vitro. 20-23 CD47 высоко экспрессируется в эритроцитах, но повсеместно экспрессируется большинством клеток организма, а также может негативно регулировать фагоцитоз тромбоцитов и лейкоцитов. 24-26 Количество CD47 на поверхности клетки регулирует фагоцитоз макрофагов, поскольку опсонизированные IgG эритроциты от CD47 +/- мышей (экспрессирующих около 50% нормальных уровней CD47) поглощаются быстрее, чем дикие. типа (WT) эритроцитов, но медленнее, чем CD47 — / — эритроцитов. 27 Мы показали, что ингибирующий фагоцитоз эффект CD47 не проявляется в апоптотических ядросодержащих клетках, где CD47 группируется в участки на поверхности апоптотических клеток и отделяется от профагоцитарных лигандов, таких как PS или кальретикулин. 25
Хотя было обнаружено, что более старые циркулирующие эритроциты экспрессируют пониженные уровни CD47, 28,29 мало что известно о функции CD47 во время старения эритроцитов и в регуляции макрофагального фагоцитоза стареющих эритроцитов. Таким образом, целью настоящего исследования было изучить роль CD47 в регуляции макрофагального фагоцитоза экспериментально стареющих эритроцитов.
Анти-мышиные CD47 mAb miap430 30 (мышиный IgG2a), mAb против FcγR 2.4G2 и антитела против мышиных эритроцитов / Band 3 mAb 34-3C (мышиный IgG2a; любезно предоставлены доктором Shozo Izui, Женевский университет, Женева, Швейцария), полученные от аутоиммунных мышей NZB 31 , были очищены от супернатантов гибридом путем осаждения сульфатом аммония. и хроматография белков A / G (Amersham Pharmacia, Piscataway, NJ). Функциональное блокирующее mAb 63 CD36 (мышиный IgA) и SR-A mAb 2F8 (мышиный IgG2a) были получены от Chemicon-Millipore (Molsheim, Франция) и Hycult Biotechnology (Uden, Нидерланды), соответственно.Cy3-конъюгированный козий антимышиный IgG был от Jackson ImmunoResearch Europe (Ньюмаркет, Соединенное Королевство). Аннексин V, конъюгированный с флуоресцеинизотиоцианатом (FITC), был от ImmunoTools (Фризойте, Германия). Ингибиторы SB203580, PD98059, генистеин, LY294002, PP2 и PP3 были от Calbiochem (Дармштадт, Германия). QIFIKIT для количественного определения IgG, связанного с клеточной поверхностью, был получен от Dako Cytomation (Glostrup, Дания). Забуференный фосфатом физиологический раствор Дульбекко (PBS), среда Игла, модифицированная Дульбекко (DMEM), пенициллин, стрептомицин и фетальная телячья сыворотка (FCS) были от Invitrogen (Стокгольм, Швеция).Пицеатаннол, фукоидан, декстрансульфат, хондроитинсульфат, каррагинан, поли-I, поли-C, поли-A, FITC-конъюгированный антимышиный IgG и все другие реагенты были от Sigma-Aldrich (Сент-Луис, Миссури).
Предполагается, что перекисное окисление мембранных липидов является общей чертой старых эритроцитов in vivo. 1 Таким образом, для изучения фагоцитоза Ox-RBC мы использовали хорошо зарекомендовавший себя метод окисления RBC in vitro с использованием CuSO 4 и аскорбиновой кислоты. 4,7,34 Используя клетки WT, мы обнаружили, что Ox-RBC эффективно фагоцитируются с помощью RPM, тогда как необработанные RBC фагоцитируются только в ограниченной степени (Рисунок 1A). Хотя фагоцитоз Ox-RBCs был примерно в 10 раз менее эффективным при BMM, чем при RPM, Ox-RBC фагоцитировался значительно больше, чем необработанные RBC, также посредством BMM (Рисунок 1B). Удаление сыворотки отменило фагоцитоз Ox-RBC с помощью RPM (рис. 1C) и BMM (данные не показаны). Предварительная инкубация Ox-RBC в среде, содержащей сыворотку, перед добавлением к макрофагам в бессывороточных условиях не приводила к фагоцитозу, что позволяет предположить, что компоненты сыворотки, способствующие фагоцитозу, не связываются с RBC (данные не показаны).
Рисунок 1
Макрофагальный фагоцитоз Ox-RBCs зависит от сыворотки и SR. Фагоцитоз Ox-RBC, обработанных Cu / аскорбатом (), или PBS-обработанных RBC (□), с помощью RPM (A) или макрофагов, полученных из костного мозга (B). (C) Фагоцитоз Ox-RBC с помощью RPM сильно ингибируется в отсутствие FCS. (D) Макрофагальный фагоцитоз Ox-RBCs ингибируется лигандами SR декстрансульфатом (100 мкг / мл), фукоиданом (100 мкг / мл), каррагинаном (100 мкг / мл) и поли-I (50 мкг / мл). , но не лигандами, не относящимися к SR, поли-А (50 мкг / мл), поли-С (50 мкг / мл) или хондроитинсульфатом (100 мкг / мл).(E) Функциональные блокирующие антитела к SR-A или CD36 (25 мкг / мл) не ингибируют фагоцитоз Ox-RBC с помощью RPM. (F) Фагоцитоз Ox-RBC не нарушается в присутствии 10% истощенной по IgG FCS. На панелях D-F под контролем понимается инкубация в среде DMEM с 10% FCS. В экспериментах по фагоцитозу эритроциты инкубировали с прикрепленными макрофагами в течение 60 минут при 37 ° C. После лизиса непищевых эритроцитов и фиксации / окрашивания количество проглоченных эритроцитов подсчитывали в 200-300 макрофагах на покровное стекло и выражали как индекс фагоцитоза (количество проглоченных эритроцитов / 100 макрофагов).Данные представляют собой средние значения плюс или минус SEM для 3-6 отдельных экспериментов. * P <0,05 и ** P <0,01, по сравнению с контролем, с использованием теста Стьюдента t для парных сравнений.
Рисунок 1
Макрофагальный фагоцитоз Ox-RBCs зависит от сыворотки и SR. Фагоцитоз Ox-RBC, обработанных Cu / аскорбатом (), или PBS-обработанных RBC (□), с помощью RPM (A) или макрофагов, полученных из костного мозга (B). (C) Фагоцитоз Ox-RBC с помощью RPM сильно ингибируется в отсутствие FCS.(D) Макрофагальный фагоцитоз Ox-RBCs ингибируется лигандами SR декстрансульфатом (100 мкг / мл), фукоиданом (100 мкг / мл), каррагинаном (100 мкг / мл) и поли-I (50 мкг / мл). , но не лигандами, не относящимися к SR, поли-А (50 мкг / мл), поли-С (50 мкг / мл) или хондроитинсульфатом (100 мкг / мл). (E) Функциональные блокирующие антитела к SR-A или CD36 (25 мкг / мл) не ингибируют фагоцитоз Ox-RBC с помощью RPM. (F) Фагоцитоз Ox-RBC не нарушается в присутствии 10% истощенной по IgG FCS. На панелях D-F под контролем понимается инкубация в среде DMEM с 10% FCS.В экспериментах по фагоцитозу эритроциты инкубировали с прикрепленными макрофагами в течение 60 минут при 37 ° C. После лизиса непищевых эритроцитов и фиксации / окрашивания количество проглоченных эритроцитов подсчитывали в 200-300 макрофагах на покровное стекло и выражали как индекс фагоцитоза (количество проглоченных эритроцитов / 100 макрофагов). Данные представляют собой средние значения плюс или минус SEM для 3-6 отдельных экспериментов. * P <0,05 и ** P <0,01, по сравнению с контролем, с использованием теста Стьюдента t для парных сравнений.
SR макрофагов участвуют в распознавании окислительно поврежденных эритроцитов. 4,7,19 Таким образом, мы затем изучили, был ли зависимый от сыворотки фагоцитоз Ox-RBC посредством RPM чувствительным к панели известных лигандов SR. 16,35 Фагоцитоз Ox-RBCs ингибировался фукоиданом, декстрансульфатом, поли-I и каррагинаном, но не лигандами, не относящимися к SR, поли-A, поли-C или хондроитинсульфатом (рис. 1D).Поскольку SR-лиганды, которые ингибируют поглощение Ox-RBC, могут связываться с SR-A, 16 , мы изучили роль SR-A с использованием функционального блокирующего mAb 2F8. Предварительная инкубация RPM с mAb 2F8 не влияла на поглощение Ox-RBC (рис. 1E). Функциональное блокирующее антитело (mAb 63) против CD36 также не влияло на фагоцитоз (рис. 1E). Кроме того, на фагоцитоз не влияли ни Arg-Gly-Asp-Ser (RGDS), ни Arg-Gly-Glu-Ser (RGES), что исключало участие интегринов (данные не показаны).Чтобы исследовать, были ли FcγR важны для сывороточно-зависимого фагоцитоза Ox-RBC, мы также использовали 10% истощенную по IgG FCS и обнаружили, что фагоцитоз не был затронут по сравнению с таковым в 10% необработанной FCS (рис. 1F). Кроме того, обработка макрофагов FcγR-блокирующим mAb 2.4G2 не подавляла сывороточно-зависимый фагоцитоз (данные не показаны).
Открытие того, что CD47 может ингибировать FcγR-опосредованный фагоцитоз, но не опосредованный SR фагоцитоз, предполагает, что функция CD47 на Ox-RBC может быть нарушена или что поглощение SR может быть устойчивым к CD47-опосредованному ингибированию.Чтобы проверить это, мы сравнили фагоцитоз опсонизированных IgG необработанных WT или CD47 — / — эритроцитов с фагоцитозом опсонизированных IgG WT или CD47 — / — Ox-RBC. Имеются убедительные доказательства того, что природные антитела, распознающие стареющие эритроциты in vivo, распознают Band 3. 38 Таким образом, мы использовали mAb 34-3C против мыши Band 3 для опсонизации, mAb, которое индуцирует фагоцитоз эритроцитов как in vivo, так и in vitro и демонстрирует усиление связывание со старыми мышиными эритроцитами in vivo. 23,28,31 В присутствии сыворотки фагоцитоз опсонизированных IgG WT Ox-RBCs был увеличен по сравнению с необработанными WT RBC в равной степени опсонизированными (84,3 ± 8,0 против 52,3 ± 0,5 RBC / 100 макрофагов, соответственно; P <0,05) (рис. 4А). Фагоцитоз IgG-опсонизированных эритроцитов CD47 — / — был сильно увеличен как для необработанных эритроцитов, так и для Ox-RBC по сравнению с равноопсонизированными соответствующими эритроцитами дикого типа ( P <0,001 и P <0,01 соответственно; Рисунок 4A).Эксперименты, представленные на фиг. 4A, проводились в присутствии сыворотки, что означает, что фагоцитоз Ox-RBC, вероятно, зависел как от SR, так и от FcγR. Поэтому, чтобы конкретно изучить, как CD47 на Ox-RBC влияет на FcγR-опосредованный фагоцитоз, мы провели аналогичные эксперименты в отсутствие сыворотки. Как и ожидалось, бессывороточные условия существенно не влияли на фагоцитоз опсонизированных IgG необработанных эритроцитов (фиг. 4A, B). Однако в отсутствие сыворотки фагоцитоз опсонизированных IgG WT Ox-RBCs был снижен до уровней, наблюдаемых с необработанными WT RBCs (фиг. 4B).Равная опсонизация необработанных WT или CD47 — / — RBC (Рисунок 4C, D) или WT или CD47 — / — Ox-RBCs (Рисунок 4E, F) была подтверждена проточной цитометрией. Используя калибровочные шарики и проточную цитометрию, мы также определили, что этот уровень опсонизации привел к отложению 31 310 плюс-минус 1696 молекул IgG / RBC. Таким образом, хотя CD47 на Ox-RBC не влияет на SR-зависимый фагоцитоз, он все же может ингибировать FcγR-опосредованный фагоцитоз.
Рисунок 4
CD47 на Ox-RBC эффективно ингибирует FcγR-опосредованный фагоцитоз. необработанных эритроцитов или Ox-RBC от мышей WT (□) или CD47 — / — мышей (■) опсонизировали mAb 34-3C, промывали и инкубировали с RPM (A) в присутствии 10% FCS. или (B) в отсутствие FCS в течение 30 минут при 37 ° C. После лизиса непереваренных эритроцитов определяли фагоцитоз, как описано в легенде к рисунку 1. Данные представляют собой средние значения плюс или минус SEM для 4 отдельных покровных стекол на группу в одном репрезентативном эксперименте из 3. Необработанных эритроцитов дикого типа (C), необработанных CD47 — / — эритроцитов (D), WT Ox-RBC (E) и CD47 — / — Ox-RBC (F) анализировали проточной цитометрией для подтверждения равной опсонизации с использованием FITC антимышиных IgG.* P <.05; ** P <0,01; и *** P <0,001, используя тест Стьюдента t для парных сравнений. нс означает, что не имеет значения.
Рисунок 4
CD47 на Ox-RBC эффективно ингибирует опосредованный FcγR фагоцитоз. необработанных эритроцитов или Ox-RBC от мышей WT (□) или CD47 — / — мышей (■) опсонизировали mAb 34-3C, промывали и инкубировали с RPM (A) в присутствии 10% FCS. или (B) в отсутствие FCS в течение 30 минут при 37 ° C.После лизиса непереваренных эритроцитов определяли фагоцитоз, как описано в легенде к рисунку 1. Данные представляют собой средние значения плюс или минус SEM для 4 отдельных покровных стекол на группу в одном репрезентативном эксперименте из 3. Необработанных эритроцитов дикого типа (C), необработанных CD47 — / — эритроцитов (D), WT Ox-RBC (E) и CD47 — / — Ox-RBC (F) анализировали проточной цитометрией для подтверждения равной опсонизации с использованием FITC антимышиных IgG. * P <.05; ** P <0,01; и *** P <.001, используя тест Стьюдента t для парных сравнений. нс означает, что не имеет значения.
RBC от CD47 +/- мышей экспрессируют примерно на 50% меньше CD47 по сравнению с WT RBC, 27,32 , что приводит к эффекту дозы гена CD47 с точки зрения ингибирования FcγR. 27 Старые эритроциты в кровотоке также экспрессируют пониженные уровни CD47. 28,29 Поэтому мы сравнили фагоцитоз опсонизированных IgG WT, CD47 +/- или CD47 — / — Ox-RBC.Как в присутствии, так и в отсутствие сыворотки фагоцитоз CD47 +/- Ox-RBC был значительно повышен по сравнению с фагоцитозом Ox-RBC дикого типа, но значительно снижен по сравнению с CD47 — / — Ox-RBCs (Рисунок 5). Подобно данным, представленным на Фигуре 4, поглощение WT и CD47 +/- Ox-RBC было значительно снижено в отсутствие сыворотки. Таким образом, CD47 на Ox-RBC сохраняет способность дозозависимо ингибировать FcγR-опосредованный фагоцитоз.
Фиг. 5
Эффект дозы гена CD47 на ингибирование FcγR-опосредованного фагоцитоза Ox-RBC. Ox-RBC от WT (□), CD47 +/- () или CD47 — / — (■) мышей опсонизировали mAb 34-3C, промывали и инкубировали с RPM в присутствие или отсутствие 10% FCS в течение 30 минут при 37 ° C. После лизиса непищевых эритроцитов определяли фагоцитоз, как описано в легенде к Фигуре 1.Равная опсонизация была подтверждена после мечения опсонизированных эритроцитов FITC против мышиного IgG с использованием проточной цитометрии, показав следующие значения средней интенсивности флуоресценции (MFI): WT Ox-RBCs = 135,1, CD47 +/- Ox-RBCs = 134,0 и CD47 — / — Ox-RBCs = 134,4. Данные представляют собой среднее значение плюс или минус SEM для 4 отдельных покровных стекол на группу в одном репрезентативном эксперименте. * P <.05; ** P <0,01; и *** P <0,001, используя тест Стьюдента t для парных сравнений.нс означает, что не имеет значения.
Фиг. 5
Влияние дозы гена CD47 на ингибирование FcγR-опосредованного фагоцитоза Ox-RBC. Ox-RBC от WT (□), CD47 +/- () или CD47 — / — (■) мышей опсонизировали mAb 34-3C, промывали и инкубировали с RPM в присутствие или отсутствие 10% FCS в течение 30 минут при 37 ° C. После лизиса непереваренных эритроцитов определяли фагоцитоз, как описано в легенде к фиг. 1. Равную опсонизацию подтверждали после мечения опсонизированных эритроцитов антимышиным IgG FITC с использованием проточной цитометрии, показывающей следующие значения средней интенсивности флуоресценции (MFI): Ox-RBCs = 135.1, CD47 +/- Ox-RBCs = 134,0 и CD47 — / — Ox-RBCs = 134,4. Данные представляют собой среднее значение плюс или минус SEM для 4 отдельных покровных стекол на группу в одном репрезентативном эксперименте. * P <.05; ** P <0,01; и *** P <0,001, используя тест Стьюдента t для парных сравнений. нс означает, что не имеет значения.
Макрофагальный фагоцитоз нормальных эритроцитов отрицательно регулируется CD47.Результаты настоящего исследования показывают, что фагоцитоз экспериментально стареющих эритроцитов также может отрицательно регулироваться CD47 на эритроцитах. Однако то, так ли это, по-видимому, определяется тем, как макрофаги распознают эритроциты. Мы обнаружили, что фагоцитоз Ox-RBCs сильно зависит от сыворотки и включает распознавание SR, на которое не влияет CD47 на RBC. Напротив, несмотря на пониженную подвижность CD47 в плазматической мембране Ox-RBC, CD47 все еще может ингибировать FcγR-опосредованный фагоцитоз практически в той же степени, что и необработанные RBC.
Старение эритроцитов связано с несколькими физическими и химическими изменениями, такими как повышенная плотность, потеря липидной асимметрии, накопление продуктов перекисного окисления липидов в плазматической мембране, образование антигенов стареющих клеток и повышенное количество иммуноглобулинов и фактора комплемента C3b на поверхность клетки. 1,14 Хотя физические изменения стареющих эритроцитов могут снизить их фильтруемость через узкие проходы и привести к последующему гемолизу, большинство стареющих эритроцитов распознаются и фагоцитируются макрофагами в селезенке и печени. 1 Механизмы распознавания и поглощения стареющих эритроцитов макрофагами еще полностью не изучены, но могут включать механизмы, описанные для взаимодействия макрофагов с апоптотическими клетками в целом. 39,40 Перекисное окисление липидов увеличивается со временем при старении эритроцитов. 1,41,42 Таким образом, окисление создает поверхностные лиганды RBC, которые могут распознаваться макрофагами с помощью механизмов, аналогичных распознаванию oxLDL. 4 Окисление эритроцитов in vitro приводит к образованию альдегидов и сшиванию мембранных белков, перекисному окислению липидов и, возможно, также конъюгации липидных фрагментов с белками и деградации белков. 4,5 OxLDL и другие лиганды SR (например, поли-I, фукоидан и сульфат декстрана) могут ингибировать распознавание макрофагами Ox-RBC, 4,7,19 , что мы подтвердили в настоящем исследовании. Сиалосахаридные цепи гликофорина, которые, как было обнаружено, образуют кластеры или агрегируют в мембране стареющих эритроцитов, представляют собой один кандидат на лиганд для распознавания окисленных или старых эритроцитов SR макрофагами. 43 Однако точная природа SRs и лигандов RBC, участвующих в распознавании и поглощении Ox-RBCs, до сих пор полностью не изучена.Основываясь на ингибиторах SR, способных вмешиваться в фагоцитоз Ox-RBC, SR-A может быть одним из кандидатов. 16 Однако дефицит SR-A не влияет на поглощение Ox-RBC in vivo или in vitro, 7,44 , что согласуется с нашими выводами о том, что блокирующие SR-A антитела не ингибируют фагоцитоз Ox-RBC. in vitro. Другой SR, CD36, может функционировать как рецептор для PS, 16 , но наши эксперименты с блокирующим антителом CD36 не показали влияния на поглощение Ox-RBC.Таким образом, специфические SR макрофагов, опосредующие поглощение Ox-RBCs, все еще необходимо идентифицировать.
Мы обнаружили, что фагоцитоз Ox-RBC критически зависит от сыворотки. Действительно, было показано, что белки сыворотки, такие как комплемент или IgG, участвуют в поглощении стареющих эритроцитов. 6,12 Однако, поскольку мы использовали инактивированную нагреванием сыворотку, белки комплемента, скорее всего, не участвовали в наших экспериментах. Хотя мы обнаружили, что стимулирующий фагоцитоз эффект сыворотки связан с белками сыворотки более 100 кДа (M.O. and P.-A.O., неопубликованные данные, февраль 2008 г.), маловероятно, что сывороточный IgG может быть важным, поскольку мы обнаружили, что ни IgG-истощенная сыворотка, ни анти-FcγR антитела не устраняют фагоцитоз Ox-RBC. Последнее наблюдение согласуется с предыдущим отчетом с использованием Ox-RBC и RPM. 4 Наши данные также показывают, что фактор (факторы), способствующий фагоцитозу в сыворотке, не связывается с поверхностью Ox-RBC, поскольку предварительная инкубация RBC с сывороткой не приводила к фагоцитозу в бессывороточных условиях.Таким образом, точная природа белков сыворотки, способствующих фагоцитозу, требует дальнейшего изучения.
Интересно, что несмотря на известную функцию CD47 по ингибированию рецептора комплемента или FcγR-опосредованного фагоцитоза в макрофагах, мы обнаружили, что WT и CD47 — / — Ox-RBC одинаково хорошо поглощаются макрофагами. Подавляющее большинство молекул CD47, по-видимому, свободно подвижны внутри плазматической мембраны эритроцитов мыши, и было высказано предположение, что свободно подвижный пул CD47 может потребоваться для генерации сигналов ингибирования фагоцитоза в месте контакта с макрофагом. 36,37 Наши настоящие данные подтверждают предыдущие выводы, указывающие на высокую способность CD47 образовывать кластеры на поверхности эритроцитов после перекрестного связывания антител. Однако кластеризация CD47 была гораздо менее очевидной на Ox-RBC, возможно, из-за опосредованного окислением образования альдегидов и сшивания мембранных белков. Таким образом, если бы подвижность CD47 в плазматической мембране была бы важна для ингибирования фагоцитоза, мы могли бы ожидать повышенного поглощения опсонизированных IgG WT Ox-RBCs по сравнению с опсонизированными необработанными RBC.Тот факт, что CD47 может ингибировать FcγR-опосредованный фагоцитоз необработанных эритроцитов или Ox-RBC практически в одинаковой степени, убедительно свидетельствует о мощной ингибирующей функции, несмотря на пониженную подвижность CD47 в плазматической мембране. Кроме того, эти данные также исключают, что на ингибирующую фагоцитоз функцию CD47 влияет окисление мембранных белков или липидов эритроцитов.
Недавние сообщения показали, что CD47 теряется из эритроцитов во время хранения 45,46 , а исследования на мышах также показали, что более старые циркулирующие эритроциты экспрессируют меньше CD47 на своей поверхности. 28,29 Было высказано предположение, что потеря CD47 в старых эритроцитах может быть одним из факторов, облегчающих их удаление из кровотока. Однако наши настоящие результаты показывают, что роль CD47 в этом процессе может зависеть от того, как стареющие эритроциты взаимодействуют с макрофагами. По крайней мере, для сывороточно-зависимых профагоцитарных механизмов, которые требуют распознавания SR, но действуют независимо от комплемента или IgG, наличие или отсутствие CD47, по-видимому, не имеет значения. С другой стороны, когда стареющие эритроциты опсонизируются IgG, защитная роль CD47 становится очевидной.Действительно, мы обнаружили, что фагоцитоз IgG-опсонизированных Ox-RBCs в зависимости от дозы гена ингибируется с помощью CD47, что хорошо согласуется с нашими ранее опубликованными данными о FcγR-опосредованном фагоцитозе необработанных RBC. 27 У людей клетки с дефицитом Band 3 и клетки Rhnull имеют очень мало или совсем не содержат CD47, а циркулирующие клетки с дефицитом Band 3 покрыты большим количеством IgG с увеличением возраста клеток. 47,48 Возникает соблазн предположить, что сочетание повышенной опсонизации IgG и снижения экспрессии CD47 делает эти клетки более склонными к элиминации макрофагами.Циркулирующие антитела, в основном антитела против Band 3, связываются со стареющими эритроцитами in vivo, возможно, в результате агрегации Band 3 в плазматической мембране стареющих эритроцитов. 12,13 Однако в литературе существуют большие расхождения в отношении количества IgG, которые, как сообщается, связывают стареющие эритроциты in vivo, что может быть результатом методологических различий. Таким образом, при использовании фракционирования по плотности для разделения предположительно стареющих эритроцитов было сообщено, что только несколько сотен молекул IgG связываются с каждым эритроцитом. 49 С другой стороны, с помощью биотинилирования in vivo было обнаружено, что до 10 000 молекул IgG могут связываться с каждым стареющим эритроцитом. 50 Эти числа следует сравнить с примерно 30 000 молекул IgG, связанных с опсонизированными IgG эритроцитами, используемыми в наших анализах фагоцитоза in vitro, чтобы получить надежные результаты в отношении FcγR-опосредованного фагоцитоза. Возникает вопрос, может ли низкий уровень опсонизации, происходящий in vivo, индуцировать эффективный FcγR-опосредованный фагоцитоз как таковой. Более вероятно, что анти-Band 3, связанный со стареющими эритроцитами, потребует отложения C3b / C3bi для возникновения фагоцитоза. 51 Поэтому интересно отметить, что CD47 также может ингибировать фагоцитоз опсонизированных комплементом эритроцитов. 22
Фагоцитоз стареющих эритроцитов, вероятно, зависит от нескольких отдельных механизмов, действующих параллельно, и все они зависят от изменений клеточной поверхности, связанных с процессом старения эритроцитов. Фагоцитоз посредством FcγR включает Src-опосредованное фосфорилирование тирозина иммунорецепторных тирозиновых мотивов активации (ITAM), привлечение тирозинкиназы Syk и последующую активацию киназы PI3 и путей MAPK. 15,52 Мы обнаружили, что поглощение, опосредованное FcγR и SR, было чувствительным к ингибиторам Syk, киназы PI3, MAPK и тирозинкиназ. Однако только FcγR-опосредованное, но не SR-опосредованное поглощение также было чувствительным к ингибитору киназы Src-семейства PP2, что позволяет предположить, что Syk активируется альтернативными механизмами во время поглощения Ox-RBC. Хотя результаты настоящего и предыдущих исследований показывают, что SR-A не участвует в поглощении Ox-RBCs, 7,44 , интересно отметить, что SR-A-опосредованный эндоцитоз AcLDL нечувствителен к ингибированию Src с помощью PP2. 53 Хотя задействованные профагоцитарные рецепторы могут различаться, события передачи сигнала, которые, как было установлено, важны для поглощения Ox-RBC посредством RPM в настоящем исследовании, согласуются с описанными для поглощения апоптотических Т-клеток той же популяцией макрофагов. 54
В заключение, наши открытия расширяют предыдущие знания о CD47 и его функции по подавлению фагоцитоза эритроцитов, включая экспериментально стареющие эритроциты.Хотя CD47 может сильно ингибировать опосредованный FcγR фагоцитоз Ox-RBC, SR-опосредованный фагоцитоз Ox-RBC не ингибируется CD47. Таким образом, в зависимости от точных рецепторов профагоцитов, задействованных в макрофаге, CD47 на стареющих эритроцитах может в большей или меньшей степени влиять на опосредование ингибирования фагоцитоза.
Затраты на публикацию этой статьи были частично оплачены за счет оплаты страницы. Таким образом, и исключительно для того, чтобы указать на этот факт, данная статья помечена как «реклама» в соответствии с разделом 18 USC 1734.
Эритроциты, инфицированные плазмодием, индуцируют секрецию IGFBP7 с образованием розеток типа II и избегают фагоцитоза
[Примечание редакции: план авторов по исправлениям был одобрен, и авторы подали официальную пересмотренную заявку.]
Ниже приводится довольно длинный «список» ключевых проблем, связанных как с экспериментальными подходами, так и с интерпретацией данных.
1) Наблюдение за тем, что IGFB7, высвобождаемый из моноцитов и линии клеток моноцитов THP-1, опосредует розетку, основано на интерпретации данных, показанных на Фигуре 3 (нейтрализующие антитела) и экспериментах по нокдауну гена (Фиг.8).Что касается эксперимента с нейтрализующими антителами, похоже, что отсутствует надлежащий контроль. Авторы включили изотипические контроли, но не заявили, были ли контроли в концентрациях, аналогичных анти-IGFB7 Ab. Кроме того, контроль IgG направлен против NID1, а не является неспецифическим IgG. Было бы полезно показать розетку без CSMT на рисунке, чтобы обеспечить основу. Возможно, что различия в эффекте Abs не связаны с блокировкой конкретных рецепторов, а скорее отражают различия в свойствах Abs.
Все использованные в работе антитела имели рабочую концентрацию 25 мкг / мл, включая изотипические контроли. Приносим извинения за упущение этого вопроса. Мы добавили информацию соответственно:
«… Специфичность ингибирования розетки антителами была подтверждена экспериментами с использованием контрольных изотипов антител при той же рабочей концентрации (25 мкг / мл) (Рисунок 7 — приложение к рисунку 1A)».
Контроли изотипа были включены, чтобы исключить неспецифичность антител.Как показано на нашей фигуре 7 — рисунок в приложении 1A, присутствие этих контрольных изотипов антител не влияло на способность IGFBP7 вызывать большее розетение, и присутствие только этих изотипов антител не оказывало значительных изменений в скорости розеток. Использование anti-NID1 в эксперименте также действовало как внутренний контроль для эксперимента из-за его отрицательного эффекта.
Мы добавили скорости розетки без CSMT (контроль) на всех графиках рисунка 3.
Мы не согласны с тем, что наблюдаемый эффект не был связан со специфическим блокированием рецепторов, поскольку мы включили в эксперименты правильные типы изотипов антител.Пожалуйста, обратитесь к рисунку 7 — приложение к рисунку 1A для этого и к таблице основных ресурсов для антител, которые мы использовали в этом исследовании.
2) IGFB7 был идентифицирован как фактор, который опосредует розетку, но неясно, проявляет ли IGFB7 такую же чувствительность к теплу, что и активность надосадочной жидкости (рис. 1). Авторы не проводили никаких экспериментов, которые показали бы, являются ли концентрации IGFB7, обнаруженные в супернатанте клеток THP1, аналогичными тем, которые опосредуют розетку.
Эксперименты на рисунке 2D (тот, который включал тепловую обработку супернатанта культуры) показали, что тепловая обработка снижает, но не полностью ослабляет эффект розетки-стимуляции супернатанта, демонстрируя участие нескольких игроков в розеточной стимуляции. Мы не пытались утверждать, что IGFBP7 термостабилен. Это был процесс расшифровки игроков розеточной стимуляции с нуля. Мы провели эксперимент по термообработке (рисунки 4E-F), чтобы показать, что стимулирующий розетку эффект нашей рекомбинантной суспензии IGFBP7 не связан с потенциальным небелковым загрязнением продукта, что также подразумевает, что белок не является термостабильным.Это также соответствует картине (рис. 2D), что существует такая большая разница в стимуляции розетки (P = 0,0009) между ненагреваемым и нагретым отсеками, поскольку IGFBP7 является основным участником этого явления.
Мы действительно выполнили количественное определение IGFBP7, секретируемого THP-1, в культуральный супернатант (рис. 8B). Воздействие на паразитов 1x 10 5 клеток THP-1 в течение 24 часов было достаточным, чтобы стимулировать эти клетки к секреции большего количества IGFBP7 (от исходного уровня ~ 10 нг / мл до ~ 20 нг / мл). Супернатант культуры, который мы использовали для анализа розетки, состоял из 1х 10 6 клеток.
Рисунок 1 B: добавлены аутологичные лейкоциты. Почему это важно для аутологичных клеток? Если розетка была настолько зависимой, как авторы пытаются заявить о IGFBP7, это не должно иметь значения, являются ли это аутологичными или гетерологичными клетками?
В начале эксперимента мы вообще ничего не знали о IGFBP7 и изо всех сил старались спланировать эксперименты, которые минимизировали бы мешающие факторы как можно лучше. Поэтому мы использовали аутологичные клетки.Но впоследствии мы использовали клетки от здоровых доноров (рис. 1C) и все же увидели рост розетки. Следовательно, после этого потребность в аутологичных клетках была снята.
Рисунок 1C: Это аутологичные клетки?
Рисунок 1C: 3 донора и 4 паразита должны дать 12 точек данных, но только 10 нанесены на график.
Использовано 3 донора на 3 паразитов (9 участков). Вскоре после эксперимента мы получили клетки от другого донора, и в тот день сотрудник случайно разморозил P.falciparum [RDM00036, как указано в материалах и методах], который не был использован для ее исследования малярии vivax. Следовательно, мы набрали донорские клетки и нежелательные P. falciparum и получили график 10 th на графике.
На рис. 1D отсутствует статистическая проверка.
Мы действительно выполнили двусторонний дисперсионный анализ с помощью теста множественного сравнения Тьюки для этого. Ставить звездочки на решетке было слишком грязно. Поэтому мы помещаем звездочки в условные обозначения фигур, поскольку все паразиты показали одинаковую степень значимости (в пределах одной и той же категории звездочки) для всех сравнений.
3) Другая проблема связана со вторым важным выводом, а именно, что фактор фон Виллебранда и тромбоспондин-1 необходимы для воздействия рекомбинантного IGFB7 на розетку. Вовлечение этих двух факторов должно происходить, когда они добавляются в насыщающих концентрациях. В противном случае каждый фактор мог бы действовать через один и тот же механизм. Таким образом, необходимо продемонстрировать зависимость доза-ответ для фактора фон Виллебранда и тромбоспондина и розеток.
Мы провели такие эксперименты с эффектом доза-эффект для VWF (рис. 7D) и TSP-1 (рис. 7F), зафиксировав дозу IGFBP7 на уровне 100 нг / мл.Фактически, именно в ходе эксперимента на рисунке 7D мы поняли, что в этом участвует еще один игрок, полученный из сыворотки. И с помощью эксперимента на фиг. 7F, фиксируя рабочие концентрации IGFBP7 и VWF, мы проверили эффект TSP-1 при 10 нг / мл и 500 нг / мл. Мы определили рабочие концентрации VWF и TSP-1 на основе обзора литературы. У здоровых людей уровни VWF в сыворотке колеблются от 0,48 до 1,24 МЕ / мл, тогда как у людей с основными патологическими состояниями уровни VWF могут быть намного выше (> 300 МЕ / мл) (Terpos et al., 2013; Kasritis et al., 2016). Поэтому мы установили рабочие концентрации VWF на уровне 2 МЕ / мл. Диапазон зарегистрированных концентраций TSP-1 в сыворотке крови у здоровых людей сильно различается, при этом в одном исследовании сообщалось о диапазоне от 0 до 12060 нг / мл (Rouanne et al., 2016). Уровни TSP-1 в сыворотке крови здоровых людей, полученные в другом исследовании, варьировались в зависимости от статуса ожирения, при этом у лиц, не страдающих ожирением, уровни TSP-1 в сыворотке крови составляли 162,7 ± 34,5 нг / мл, а у лиц с ожирением — уровни TSP-1 в сыворотке крови, равные 162,7 ± 34,5 нг / мл. 220.9 ± 46,7 нг / мл (Liu et al., 2015). Перед экспериментом на Фигуре 7F мы уже обнаружили, что третий игрок, полученный из сыворотки, требовался только в низкой концентрации, где даже 2% обогащенной сывороткой среды RPMI1640 было достаточно для поддержки опосредованного IGFBP7 розетирования. Имея эту информацию, в эксперименте использовались две рабочие концентрации TSP-1, то есть 10 нг / мл и 500 нг / мл.
На протяжении всей рукописи авторы говорят о «сывороточных факторах». Но единственное, что я могу найти, когда речь идет о сборе крови, — это гепарин лития.Это означает плазма , а не сыворотка . Так действительно ли эта статья посвящена плазменным факторам?
Мы собрали паразитосодержащие упакованные клетки крови, которые не должны быть коагулированы вакутейнерами с антикоагулянтом лития и гепарином. Но для приготовления культуральной среды (такой же, как экспериментальная среда) мы используем простые пробирки, которые позволяют крови свертываться, затем собирают сыворотку и используют в качестве обогащения для RPMI1640. Впоследствии, когда мы заменили сыворотку на Альбумакс в качестве обогащения среды, стимуляция розетки, опосредованная IGFBP7, не наблюдалась.Следовательно, «сывороточный фактор» — подходящее слово для использования в этом контексте.
Рисунок 3: В целом P. vivax дает намного больше розеток, чем P. falciparum . Какое этому объяснение?
Похоже, это свойство высокой розетки распространено среди популяции P. vivax или, по крайней мере, в Таиланде. Об этом сообщили Chotivanich et al. два десятилетия назад (Chotivanich et al., 1998) и нашей группой несколько лет назад (Lee et al., 2014). Мы не знаем причины этого. Это может быть признаком географического происхождения, но, скорее всего, он является общим признаком для P. vivax , поскольку розетка обычно обнаруживается и у P. vivax из Нового Света (Marin-Menendez et al. ., 2013, PLoS Negl Trop Dis 7: e2155).
4) В экспериментах по изучению чувствительности к ферментам (трипсин на рисунке 5 и гепариназа на рисунке 6) авторы не удаляют фермент перед тестированием на розетку. Кроме того, авторы сообщают о влиянии концентрации фермента, а не активности фермента.Используемые ферменты не являются чистыми, поэтому необходимо учитывать неспецифические эффекты.
Мы не согласны с рецензентом. Мы упомянули этапы стирки в разделе «Материалы и методы». Анализ розеток проводили в условиях, свободных от этих ферментов. Сообщение о концентрации трипсина в работах, связанных с розеточными лигандами Plasmodium spp. всегда делалось таким образом (Crabb et al., 1997, Cell 89: 287). Поскольку представленные на рынке растворы ферментов не являются 100% трипсином, представление значений веса / объема на основе расчетов после обращения к информационному листу продукта должно быть лучшим способом представления.Мы понимаем, что при использовании растворов трипсина может существовать основной риск неспецифичности. Следовательно, мы использовали другие подходы для расшифровки вовлеченных розеточных лигандов.
5) Авторы используют широкий спектр линий паразитов и изолятов от пациентов, и в полученных результатах наблюдается значительная неоднородность. Необходимо лучше объяснить рациональность использования различных лабораторных изолятов. Также следует уточнить, что клинические изоляты, скорее всего, являются клональными.
Наше намерение состояло в том, чтобы получить данные, которые могут максимально точно представить фактическую популяцию паразитов, которую мы изучали, поэтому мы использовали клинические изоляты. Однако в ходе этого исследования количество случаев быстро уменьшилось. Многие основные лабораторные линии паразитов, которые в течение многих лет культивировались на средах, обогащенных Альбумаксом, утратили способность к розетке. Хотя некоторые из них смогли показать розетку после длительного периода культивирования в средах, обогащенных сывороткой (например,грамм. 3D7, CS2), скорость их розеток всегда была на низком уровне без очистки субпопуляции, образующей розетки (которая нам не нужна, поскольку такая очистка может не отражать фактическую популяционную динамику паразитов) в каждом цикле культивирования. Поэтому мы решили адаптировать как можно больше клинических изолятов к условиям культивирования in vitro и использовали их для экспериментов в этом исследовании.
Мы не знаем и не можем предполагать, как делает обозреватель, что культуры, полученные из клинических изолятов, являются клональными, поскольку мы не оценивали уровень их клональности.
6) Паразит, экспрессирующий VAR2CSA — могут ли авторы подтвердить, что он экспрессировал VAR2CSA? А как насчет CS2_WT?
Для линий паразитов, экспрессирующих VAR2CSA NF54, VAR2CSA_WT и NF54_T934D, было выполнено секвенирование для проверки целостности VAR2CSA и наличия ожидаемых мутаций. Пожалуйста, обратитесь к рисунку 4 недавно опубликованной статьи (Dorin-Semblat et al., 2019) для получения более подробной информации.
Для CS2_WT мы провели анализ трипсина. Схема переваривания такая же, как и для Var2CSA (антитело против САР) (изображение ответа автора 1).Поскольку это фактически часть другого исследования, мы не хотим включать этот рисунок в качестве рисунка или дополнительного рисунка для этой рукописи.
7) На рисунке 5D клинический изолят имеет очень низкую розетку по сравнению со многими другими использованными изолятами. Могут ли авторы предположить, почему это может быть так?
Эксперимент на рис. 5D был проведен на поздних стадиях цикла, которые, как объяснено в рукописи, являются стадией развития, на которой PfEMP1 является единственным поверхностно экспрессируемым розеточным лигандом.Хотя поверхностная экспрессия уже инициируется на этой стадии развития, поверхностная экспрессия розеточных лигандов достигает оптимального состояния только через несколько часов (поздняя стадия трофозоитов). Следовательно, скорость розетания IRBC в этом эксперименте (в котором использовались поздние кольцевые стадии по сравнению с остальными экспериментами, в которых использовались зрелые / поздние стадии) была ниже.
8) Линия экспрессии VAR2CSA особенно бедна розеткой. Это говорит о том, что на уровни розеток может влиять экспрессированный PfEMP1.Было бы интересно, если бы авторы могли дать некоторое представление об этом. Например, чем отличается FVT402 от 3D7 или MK183?
Мы согласны с рецензентами, что это важный и интересный аспект, учитывая, что 3D7 является линией паразитов африканского происхождения, тогда как FVT402 и MKK183 — это тайские изоляты. Мы полагаем, что это выходит за рамки текущего исследования, поскольку объединение всей этой информации в одну рукопись будет слишком сложным и отвлечет от основного фокуса этой работы: розетки, опосредованной IGFBP7.
9) Авт. Предполагают, что PfEMP1 является лигандом паразита, который обеспечивает это розетение через TSP1. Однако очевидно, что уровни розеток различаются между изолятами и линиями.
Различные изоляты и линии могут иметь разную насыщенность / уровни IRBC, экспрессируемого на поверхности PfEMP1. Это может быть одной из причин наблюдаемых различий в скорости розеток. Кроме того, сыворотки, которые мы использовали для обогащения среды, а также эритроциты, которые мы использовали при культивировании, были от разных людей.Они могут способствовать наблюдаемым вариациям. На протяжении многих лет мы изо всех сил старались использовать постоянные условия и материалы для экспериментов. Однако это аспекты, которые мы не можем контролировать. Тем не менее, важно подчеркнуть, что в совокупности TSP-1 и VWF способствуют опосредованному IGFBP7 розетированию в тестируемых изолятах и линиях.
10) На рис. 6 авторы показывают, что на розетку влияют клинические изоляты, и на нее влияет me анти-CR1. Этот результат несколько удивителен, поскольку он предполагает, что все паразиты экспрессируют CR1-связывающий PfEMP1.Разве это не только подмножество PfEMP1, связывающее CR1? Могут ли авторы это объяснить?
Не все набранные изоляты P. falciparum показали сильное розеточное ингибирование антителами против CR1. Однако некоторые показали резкое снижение скорости образования розеток антителами. В совокупности набор данных показал значительную разницу. Возможной причиной может быть неспецифическое ингибирование, такое как стерическое затруднение. Однако здесь это маловероятно, поскольку наши данные из P.vivax показали, что одно и то же антитело незначительно влияет на скорость их розетения. Наш шаблон набора данных по-прежнему укладывается в утверждение, что только подмножество PfEMP1 розетки через привязку CR1.
11) На рисунке 7 и в подразделе «Кофакторы сывороточного происхождения при IGFBP7-опосредованном розетке» авторы, по-видимому, утверждают, что крупные белки удалялись с помощью фильтра 0,45 микрон. Заявление неточно. Более вероятно, что авторы удаляют крупные белковые агрегаты.
Мы благодарим рецензента за это, это было исправлено:
«Все описанные выше эксперименты проводились с использованием среды, обогащенной человеческой сывороткой на 20%. Однако фильтрация сыворотки через фильтр 0,45 мкм отменила индуцированное IGFBP7 розетение (рис. 7A). Эти результаты показали, что другие белковые агрегаты или мультимеры большого размера, полученные из сыворотки, могут потребоваться для опосредованного IGFBP7 эффекта розетения ».
12) В эксперименте, изображенном на рисунке 8, отсутствуют элементы управления.Эксперименты по нокдауну, опосредованному лентивирусными векторами, требуют контроля нецелевых эффектов. Необходимо иметь два вектора shRNA, нацеленных на разные последовательности одного и того же гена. Авторы представляют только одну. Также может возникнуть некоторая путаница в отношении техники, поскольку в подразделе «Нокдаун экспрессии IGFBP7 с помощью THP-1 с использованием трансдукции РНКи» говорится, что использовалась миРНК, и правильным термином должно быть шРНК.
Изменено:
«… клетки THP-1 трансдуцировали shRNA лентивирусными векторами, специфичными…»
13) Пытаясь быть краткими и краткими, авторы приводят очень мало экспериментальных деталей — особенно касающихся того, как эксперимент решает конкретный вопрос в основном тексте.Это очень затрудняет понимание работы тем, кто не является экспертом в данной области. Хотя в разделе «Материалы и методы» представлена вся необходимая информация, он очень подробный и поэтому затрудняет и утомляет поиск нужной информации. Например, «использование зимозана А» для многих читателей не предоставит релевантной информации для интерпретации результатов. Другие опасения возникли по поводу ясности всей рукописи. Ниже приведены несколько примеров, которые могут сбить с толку.При проверке того, содержит ли бесклеточный супернатант биологически активное вещество, необходимо исследовать серийные разведения, а затем использовать для химической характеристики разведения, приводящие к 50% активности. Если фактор высококонцентрирован в надосадочной жидкости, потери из-за температуры, например, могут не наблюдаться. Пожалуйста, измените предложение в подразделе «Влияние супернатантов культур THP-1 и фракционирование супернатантов», так как оно сбивает с толку.
Мы последовали совету и добавили больше «мостов», чтобы объяснить или оправдать необходимость последующих экспериментов, которые были проведены после предыдущих.
Мы добавили краткое описание зимозана A:
«… Мы предположили, что опосредованное IGFBP7 розетение может быть стратегией, используемой паразитами для предотвращения фагоцитоза. Чтобы проверить это, мы провели контрольный эксперимент с использованием зимозана А (комплекс белок-углевод, полученный из клеточной стенки дрожжей, обычно используемый в анализах фагоцитоза) и показали, что IGFBP7 сам по себе не подавляет фагоцитозную способность THP-1 (рис. 8E). . »
Внесены изменения:
«Фракционирование CSMT на водную и липидную фракции показало, что факторы, стимулирующие розетку, находились в водной фракции (рис. 2А).Впоследствии мы дополнительно фракционировали водную фракцию на фракции с высокой и низкой молекулярной массой (с пороговым значением 30 кДа). Обе водные субфракции индуцировали розетку у P. falciparum и P. vivax (рисунки 2B и 2C), демонстрируя, что стимуляция розетки опосредована множественными секретируемыми гидрофильными факторами, преимущественно размером ≤ 30 кДа (особенно для P . falciparum ) ».
14) Наконец, есть возражение против характеристики розетки, изучаемой здесь, как розетки «типа II» и отличия ее от розетки «типа I».В разделе «Введение» авторы пишут: «Мы также показали, что опосредованное IGFBP7 розетирование отличалось от ранее описанного розетения (определяемого здесь как розетирование типа I), где оно (мы называем розеткой типа II) требовало появления дополнительных сывороточных факторов. , в дополнение к взаимодействию между лигандом паразитарного происхождения на поверхности IRBC и рецептором на поверхности URBC ». Потребность в сывороточных факторах при розетке была описана ранее. Например, Стивенсон и его коллеги провели обширные исследования α-2-макроглобулина, который сам по себе может вызывать розетку, в то время как другим белкам требуется несколько факторов вместе, чтобы быть эффективными.Не могли бы авторы пересмотреть этот момент и просто назвать розетку «типом II» просто розеткой?
Причина, по которой мы переопределяем розетки как «тип I» и «тип II», заключается в том, что классический тип I — это розетка, включающая прямое взаимодействие между розеточным лигандом и розеточным рецептором. Однако розетка типа II включает другие факторы, которые объединяют розеточный лиганд и рецептор, без которых скорость розетки будет снижена до базовых уровней, вносимых розетками типа I.Подчеркнем, что мы не претендуем на роль первооткрывателей этого явления. В самом деле, как обсуждается в рукописи, фактор комплемента d, а также макроглобулин, упомянутый рецензентом, также являются стимуляторами розетки. Однако эти факторы не являются ни лигандами, ни рецепторами, которые сами по себе тоже могут образовывать стабильные розетки. Следовательно, мы думаем, что важно различать два типа розеток.
Комментарий авторов о том, что они фактически использовали сыворотку, а не плазму, сбивает меня с толку и заставляет меня усомниться в результатах относительно фактора фон Виллебранда.
а) Когда образуется сыворотка, кровь свертывается. Активируются тромбоциты, активируются факторы свертывания и используется фактор фон Виллебранда. Итак, сколько же ФВ остается в сыворотке крови? Обычно, когда VWF измеряется у людей, он всегда измеряется в плазме. Часто в литературе у людей возникают трудности с разделением сыворотки и плазмы, как, например, в Ogawa et al., 2001, где заголовок содержит «сыворотка», но когда я читаю в Материалах и методах, что на самом деле использовалось, это плазма.Также в статье Kastritis et al., 2016 они говорят об «сывороточных уровнях VWF» в заголовке, но когда я читал материалы и методы, они использовали HemosIL, для функционирования которого требуется плазма.
В данной статье авторы не показали, что в их сыворотке есть какой-либо VWF, они просто утверждают, что наблюдаемый эффект вызван действием антител против VWF. И это антитело (кроличий поликлональный 6994) распознает как бычий, так и человеческий VWF. Итак, как мы узнаем, что антитело не вступает в перекрестную реакцию с чем-то еще в анализе?
б) Они использовали Альбумакс II, который содержит <1% IgG.В Альбумаксе I содержится менее 0,1% IgG, что означает, что, вероятно, в Альбумаксе II присутствует почти 1% IgG. Существуют ли также другие более крупные белки, такие как фактор Виллебранда? Альбумакс производится из бычьей сыворотки. Если в сыворотке крови человека все еще должно быть некоторое количество VWF, в чем я сомневаюсь, исходя из вышеизложенных соображений, он также может присутствовать в Альбумаксе.
Итак, в заключение, если авторы собираются и дальше утверждать, что есть эффект из-за VWF, я хотел бы видеть его измеренным в их культуральной среде.
Мы количественно оценили уровни VWF в средах, используемых в этом исследовании. Мы взяли образцы сывороток двух основных источников сыворотки и подготовили питательные среды. Результаты представлены на Рисунке 7 — в приложении к рисунку 1B. Уровень VWF в нашей обогащенной сывороткой среде был адекватным (выше 0,125 МЕ / мл), чтобы поддерживать опосредованное IGFBP7 розетение. Среда, обогащенная альбумаксом, и простая среда показали уровень VWF (если таковой имеется), который был ниже предела обнаружения набора для ELISA (2.56 x 10 -5 МЕ / мл). Мы также включили эту информацию в текст:
«… Наконец, мы количественно оценили количество VWF, необходимое для облегчения опосредованного IGFBP7 розетирования. При добавлении IGFBP7 и TSP-1 в среду, дополненную Альбумаксом, достаточно низкого уровня VWF, равного 0,125 МЕ / мл, для значительного увеличения скорости розетки с оптимальным приростом, достигнутым при 0,5 МЕ / мл (рис. 7G). Фактически, среда с 20% -ным обогащением сыворотки, которую мы использовали для этого исследования, содержала VWF выше 0.125 МЕ / мл (Рисунок 7 — приложение к рисунку 1B) ».
Мы хотели бы воспользоваться этой возможностью, чтобы не согласиться с комментарием о том, что сыворотка не содержит VWF. В буклете набора для ELISA, который мы использовали, сыворотка также отмечена как один из подходящих образцов для VWF. Исходя из предложенного разведения, сыворотка кажется лучше, чем плазма, для восстановления низкого уровня VWF.
Кроме того, было проведено сравнение количественного определения VWF с использованием плазмы и сыворотки, и уровни VWF в плазме и сыворотке не показали значительной разницы (P = 0.752) (Kovacevic et al., 2019. Atherosclerosis, 290 , 31-36. Doi: 10.1016 / j.atherosclerosis.2019.09.003).
Контрольные эксперименты по детонации в THP1
Как и было обещано в предыдущем раунде опровержения, мы также провели трансдукцию кшРНК, чтобы отключить неродственный ген (гликофорин C) на THP-1, используя те же лентивирусные векторы с той же молекулярной основой, произведенные той же компанией (Sigma), что и контроль. На экспрессию IGFBP7 с помощью GlyC-KD THP-1 не влияет нокдаун GlyC, и клетки секретируют больше IGFBP7 при воздействии паразитов.
Кроме того, мы также количественно оценили уровень IGFBP7 в культуральном супернатанте THP-1-WT, IGFBP7-KD-THP-1 и GlyC-KD-THP-1 и использовали их для анализа розетки на P. falciparum. , наряду с использованием в эксперименте антитела против IGFBP7 человека. Мы переписали раздел, чтобы включить его в текст:
«Клетки THP-1 трансдуцировали shRNA лентивирусными векторами, специфичными для IGFBBP7, и векторами, специфичными для неродственного белка, гликофорина C. Нетрансдуцированные клетки служили дикими типами (THP-1_WT).[…] Важно отметить значительную разницу между группами супернатантов культур «THP-1_WT_URBC» и «THP-1_WT_IRBC» (P = 0,0018), а также «GlyC-KD_THP-1_URBC» и «GlyC-KD_THP-1_IRBC» (P = 0,0013), но не между «IGFBP7-KD_THP-1_URBC» и «IGFBP7-KD THP-1_IRBC» (P = 0,6011) убедительно свидетельствует о том, что IGFBP7 может быть одним из ключевых продуктов, секретируемых моноцитарными клетками в ответ на воздействие паразитов, тогда как другие факторы, участвующие в стимуляции розетки, могут секретироваться на исходном уровне с присутствием паразитов или без них (Рисунок 8 — приложение к рисунку 2B).”
https://doi.org/10.7554/eLife.51546.sa2 .