Анализ крови СОЭ | Норма скорости оседания эритроцитов
Показания для сдачи анализа
Кровь является одним из самых информативных ресурсов человеческого организма. Отправив ее на лабораторное исследование можно с высокой точностью диагностировать подавляющее большинство заболеваний. Клинический анализ содержит множество показателей, каждый из которых отражает определенный процесс и функцию, служит важным диагностическим критерием. Однако несмотря на изобилие обследований, самым распространённым и востребованным в клинике МедАрт служит общий анализ крови СОЭ.
Скорость оседания эритроцитов — это важнейший показатель, нередко подтверждающий присутствие воспаления или прочей патологии (в острой и скрытой стадии). Механизм этого анализа достаточно прост, поэтому для получения результата не нужно тратить несколько дней. Эритроциты намного тяжелее плазмы и прочих клеточных элементов, в связи с чем, разместив кровь в вертикально размещённой пробирке, спустя определенный промежуток времени на дне ёмкости образуется специфичный осадок, а вверху появится полупрозрачная жидкость.
Это полностью природное явление, которое возникает в результате воздействия силы тяжести. Эритроциты могут слипаться между собой, формируя целые колонии, оседающие на дне сильно быстрее отдельных элементов. Это объясняется большей массой, что может говорить о наличии проблемы.
Как подготовиться к сдаче анализа
СОЭ входит в список стандартных показателей, которые отображаются во всех исследованиях крови (общих и клинических). Однако особое внимание ему уделяется в следующих ситуациях:
- Подтверждение диагноза
- Профилактическое обследование
- Оценка эффективности назначенного лечения
- Инфекционные и воспалительные патологии
- Аутоиммунные расстройства
- Опухоли (злокачественные и доброкачественные) любой локализации
Многие патологии внутренних органов просекают бессимптомно и нередко выявление отклонения СОЭ от нормы становится поводом начать более детальную диагностику, благодаря чему удаётся определить проблему на ранних этапах и начать эффективное лечение. Чаще всего, после нахождения каких-либо отклонений назначается дополнительный биохимический анализ, позволяющий более детально изучить кровяное русло.
Чаще всего, после нахождения каких-либо отклонений назначается дополнительный биохимический анализ, позволяющий более детально изучить кровяное русло.
Как проводится исследование
Точность этого диагностического метода зависит от многих нюансов: правильная подготовка к сдаче, профессионализм работника лаборатории и качество реагентов. При соблюдении этих условий можно гарантировать получение максимально достоверного результата. И если на последние 2 пункта человек, сдающий кровь, повлиять не может, то подготовительный этап полностью зависит от него. Несмотря на то, что в этом случае не требуется специальная и сложная подготовка, есть ряд обязательных общих правил, которых настоятельно рекомендуется придерживаться.
В первую очередь, за 1 день до сдачи необходимо отказаться от распития алкогольных напитков, а также воздержаться от приема пищи за 4-5 часов. Допускается только питье обычной воды. Также, за час до анализа рекомендуется отказаться от курения.
Во-вторых, если пациент принимает (на постоянной основе или только в данный момент) какие-либо лекарственные препараты, то об этом необходимо заблаговременно сообщить врачу. Некоторые медикаменты могут искажать результаты, из-за чего их приём может быть приостановлен и восстановлен после сдачи крови. В третьих, накануне процедуры не стоит посещать спортивные или тренажёрные залы. Также стоит воздержаться от сильных физических нагрузок и избегать эмоциональных стрессов.
Если же вы сомневаетесь в чем-то, то просто позвоните нам по данному номеру +375(29) 666-30-96 либо запишитесь на консультацию к врачу с помощью нашей онлайн формы.
Как подготовиться
Длительность анализа не превышает 5-10 минут. Как правило, процедура сопровождается незначительной болезненностью и дискомфортом в области прокола, но неприятные ощущения проходят очень быстро. Если необходима капиллярная кровь, то прежде, чем проколоть третий или четвёртый палец левой руки, кожа в этом месте обрабатывается спиртовым ватным шариком. После этого, при помощи специального медицинского лезвия, осуществляется небольшой надрез на подушечке пальца (его глубина не превышает 3 миллиметров). Полученная капля крови утилизируемая стерильной салфеткой, посла чего лаборант проступаете к сбору биоматериала. Собрав нужное количество, раневая поверхность смазывается антисептиком, а на место проколах прикладывается ватка со спиртом.
После этого, при помощи специального медицинского лезвия, осуществляется небольшой надрез на подушечке пальца (его глубина не превышает 3 миллиметров). Полученная капля крови утилизируемая стерильной салфеткой, посла чего лаборант проступаете к сбору биоматериала. Собрав нужное количество, раневая поверхность смазывается антисептиком, а на место проколах прикладывается ватка со спиртом.
Если анализ предусматривает взятие биоматериала из вены, то предплечье пациента стягивается медицинским жгутом или ремешком, после чего он должен немного поработать кулаком (сжать и разжать) для лучшего сосудистого наполнения. Место предполагаемого прокола обрабатывается спиртовой салфеткой, после чего в выбранный сосуд вводится игла, к которой подсоединяется пробирка для накопления выпущенной крови. Набрав достаточное количество биоматериала, игла извлекается, а к ране прикладывается ватка со спиртом.
Для подсчета СОЭ в биологический материал помещается антикоагулянт, не допускающий свертывание. Затем она отправляется в вертикально расположенную ёмкость на 60 минут. Так как удельный вес эритроцитов превышает вес плазмы, сила тяжести спускают их на дно ёмкости. Из-за этого в пробирке образуется 2 видимых слоя: верхний (бесцветная плазма) и нижний (эритроцитарные скопления). Затем лаборант осуществляет замер верхнего слоя. Показатель, соответствующий отметке между эритроцитами и плазменной зоной на пробирочной шкале — это СОЭ (указывается в мм/ч).
Затем она отправляется в вертикально расположенную ёмкость на 60 минут. Так как удельный вес эритроцитов превышает вес плазмы, сила тяжести спускают их на дно ёмкости. Из-за этого в пробирке образуется 2 видимых слоя: верхний (бесцветная плазма) и нижний (эритроцитарные скопления). Затем лаборант осуществляет замер верхнего слоя. Показатель, соответствующий отметке между эритроцитами и плазменной зоной на пробирочной шкале — это СОЭ (указывается в мм/ч).
Сегодня применяется 2 основных способа выявления СОЭ:
- Метод Панченкова. Капилляр разделяется ровно на сто отделений, позже в него добавляется 5% цитрат натрия до уровня «Р». Затем капилляр наполняется биоматериалом до буквы «К». Полученная смесь смешивается и устанавливается вертикально. Оценивание проводится спустя 60 минут.
- Метод Вестергрена. Здесь используется венозная кровь, перемешиваемая с цитратом натрия 3,8% в отношении 4:1. Допускается её смешение с трилот Б с последующим добавлением цитрата натрия или физ раствора в количестве 4:1.
 Исследование осуществляется в пробирках, оснащённых шкалой в 200 мм. Результат оценивается через 60 минут. Эта методика используется повсеместно, а ее принципиальной отличительной чертой является тип применяемых пробирок и мерной шкалы.
Исследование осуществляется в пробирках, оснащённых шкалой в 200 мм. Результат оценивается через 60 минут. Эта методика используется повсеместно, а ее принципиальной отличительной чертой является тип применяемых пробирок и мерной шкалы.
Несмотря на совпадение результатов этих способов, метод Вестергрена славится большей чувствительностью к превышению показателя СОЭ, в связи с чем он считается высокоточным и информативным.
Расшифровка анализа крови MCH
Существует три возможных варианта исхода: соответствие нормальным показателям, увеличение или уменьшение скорости эритроцитарного оседания. Они все имеют свои особенности и план дальнейших действий.
Показатели нормы MCH
Цифра варьируется у разного от пола и возраста. Для новорожденных (до 1 месяца) СОЭ составляет от 1 до 2 мм/ч. Эти границы объясняются пониженной белковой концентрацией. От 1 месяца до полугода он составляет от 12 до 17 мм/ч. Это резкое увеличение нормы объясняется возрастными процессами, возникающими в подрастающем организме.
Так как вязкость крови имеет несколько половых отличий, то норма СОЭ будет различной для мужчин и женщин. У представительниц прекрасного пола от 10 до 50 лет допустимыми границами являются 0-20 мм/ч, а от 50 лет — от 0 до 30 мм/ч. Цифра может изменяться во время беременности, что служит нормальным явлением, но требует контроля лечащего врача. У мужчин от 10 до 50 лет этот показатель должен составлять от 0 до 15 мм/ч, а старше 50 лет — от 0 до 20 мм/ч.
| Возраст, лет | Норма СОЭ |
|---|---|
| Ребенок до 1 месяца | 1-2 мм/ч |
| Ребенок 1 месяц — 6 месяцев | 12-17 мм/ч |
| Ребенок до 10 лет | 1-10 мм/ч |
| Женщина 10-50 | 0-20 мм/ч |
| Женщина старше 50 | 0-30 мм/ч |
| Мужчина 10-50 | 0-15 мм/ч |
| Мужчина старше 50 | 0-20 мм/ч |
На конечный результат оказывает влияние множество факторов: неправильная подготовка, волнение, приём лекарственных препаратов и многое другое. Помимо этого, значение может зависть даже от времени дня. Как правило, максимум определяется около полудня.
Помимо этого, значение может зависть даже от времени дня. Как правило, максимум определяется около полудня.
Повышение СОЭ
Подобный результат может обуславливаться следующими патологиями:
- Инфекция или воспаление.
- Заболевания соединительной ткани (РА, СКВ, васкулит и т.д.).
- Ожоговая болезнь.
- Новообразования разной этиологии и локализации.
- Инфаркт миокарда. В постинфарктном периоде максимум наступает спустя примерно 7 дней (в таком случае вам необходимо обратиться к сосудистому хирургу).
- Анемии. Для этих болезней характерно снижение эритроцитов и повышение скорости их оседания.
- Травмирование.
- Амилоидоз (патология, характеризующаяся формированием патологического белка — амилоида).
Несмотря на несоответствие нормальным границам, если общий анализ крови СОЭ показал увеличение этого показателя, это не обязательно указывает на присутствие проблемы. Такой результат возникает и у здоровых лиц: у женщин во время менструального цикла, в период беременности или у лиц с лишним весом.
Также это возникает при приёме ряда лекарственных веществ, поэтому нужно заранее проконсультироваться с врачом.
Понижение СОЭ
Сниженная скорость оседания эритроцитов нередко сигнализирует о присутствии расстройств водно-солевого обмена или активной мышечной дистрофии. Нередко это симптом эритроцитоза, лейкоцитоза, наследственного сфероцитоза, гепатитов и ДВС-синдрома. Кроме этого, подобный результат характерен для полицитемии и приводящих к ней состояний (ХСН или поражение лёгочной системы). Низкая СОЭ также может быть следствием голодания, вегетарианства, приема ряда стероидных гормонов, а также часто выявляется в 1 и 2 триместре беременности.
Сдать анализ СОЭ а также пройти другие гематологические исследования вы сможете в нашем медицинском центре МедАрт. С помощью современного оборудования вы сможете узнать абсолютно точные показатели, а высококвалифицированные работники грамотно проконсультируют вас по тому или иному вопросу.
Что показывает высокое СОЭ в анализе крови у женщин после 50 лет, повышенное СОЭ у ребенка
Аббревиатура СОЭ означает «скорость оседания эритроцитов», измеряемая миллиметрами в час. (В старых справочниках этот анализ назывался РОЭ). В основе исследования лежит процесс, обусловленный гравитационными силами. Поскольку эритроциты тяжелее других элементов крови, они первыми выпадают в осадок. Их подсчет в вертикально установленной пробирке через час и является основой анализа.
(В старых справочниках этот анализ назывался РОЭ). В основе исследования лежит процесс, обусловленный гравитационными силами. Поскольку эритроциты тяжелее других элементов крови, они первыми выпадают в осадок. Их подсчет в вертикально установленной пробирке через час и является основой анализа.
Скорость, с которой эритроциты опускаются на дно, зависит от многих факторов, как физиологических, так и патологических. Значения СОЭ отличаются в зависимости от возраста, пола. Изменения показателей возможны в связи с особенностями питания, прохождением пациентом курса лечения определенными видами медикаментозных препаратов, кортикостероидами, противовоспалительными средствами.
Знать, что показывает высокое СОЭ, особенно важно, так как превышение нормативов наиболее часто свидетельствует в пользу развития того или иного заболевания. Высокие цифры СОЭ могут свидетельствовать о наличии в организме онкопатологии, воспалительного процесса, инфекционного, ревматологического, анемии. Показатель будет превышать норму при инфаркте миокарда, травме, аллергии, беременности.
Несмотря на то, что СОЭ – неспецифичный показатель, диагностическая ценность исследования огромна. Она обусловлена его высокой чувствительностью. Изменение данного показателя отмечается уже на ранних стадиях развития патологического процесса, когда другие анализы еще не являются информативными, остаются в норме. Повышенный показатель СОЭ в анализе крови является поводом к продолжению обследования, уточнению ситуации.
Почему значение параметра повышается
Причины, почему значение параметра СОЭ повышается у женщин в норме:
- менструальный период;
- применение оральных контрацептивов;
- беременность;
- послеродовый период.
У женщины после 50 лет увлечение СОЭ связано с гормональной перестройкой организма при приближении климакса.
У ребенка значение показателя СОЭ зависит от его возраста. У новорожденного максимальное значение – 2,8 мм/ч, что связано с очень низкой концентрацией белка в крови, и значит, отсутствием условий у эритроцитов для быстрого оседания. Поскольку с развитием ребенка вязкость крови увеличивается, к 14 годам этот показатель у девочек становится – 2-15 мм/ч, у мальчиков – 1-10 мм/ч.
Поскольку с развитием ребенка вязкость крови увеличивается, к 14 годам этот показатель у девочек становится – 2-15 мм/ч, у мальчиков – 1-10 мм/ч.
Расшифровка анализа
Все нормативные показатели СОЭ имеются в специальной таблице, где они указаны в соответствии с полом и возрастом. При этом интерпретировать полученный ответ должен только врач, поскольку результат проведенного исследования может варьировать в любую сторону в зависимости от физиологических или патологических процессов. Для оценки ситуации специалист будет учитывать целый круг сопутствующих факторов. При этом нужно знать, что у 5% жителей Земли анализ показывает высокое СОЭ без видимых причин.
| Возраст | Норма, мм/ч |
| до 13 лет | 4-12 мм/ч |
| 13-18 лет | 3-18 мм/ч |
| 18-30 лет | 2-15 мм/ч |
| 30-40 лет | 2-20 мм/ч |
| 40-50 лет | 0-26 мм/ч |
| 50-60 лет | 0-26 мм/ч |
| после 60 лет | 2-55 мм/ч |
| При беременности | до 45 мм/ч |
Болезнь или норма? О чем расскажет СОЭ
Клинический анализ крови стоит на первом месте в перечне обязательных методов оценки нашего здоровья и имеет важное значение для выявления целого ряда заболеваний. Несмотря на то что кровь здорового человека стремится к постоянству своего количественного и качественного состава, в повседневной практике врачи отмечают те или иные его колебания. Это касается и скорости оседания эритроцитов (СОЭ). И хотя грамотная интерпретация общего анализа крови находится в компетенции врача, некое общее представление о гематологических показателях поможет в случае чего своевременно обратиться к специалисту. Что же скрывается за аббревиатурой «СОЭ» и стоит ли волноваться, если результат не совпадает с нормой?
Несмотря на то что кровь здорового человека стремится к постоянству своего количественного и качественного состава, в повседневной практике врачи отмечают те или иные его колебания. Это касается и скорости оседания эритроцитов (СОЭ). И хотя грамотная интерпретация общего анализа крови находится в компетенции врача, некое общее представление о гематологических показателях поможет в случае чего своевременно обратиться к специалисту. Что же скрывается за аббревиатурой «СОЭ» и стоит ли волноваться, если результат не совпадает с нормой?
 Нормальное значение этого показателя зависит от возраста, пола и некоторых физиологических состояний организма (например, беременности, менструации). У взрослого человека СОЭ может колебаться в довольно широких пределах: 0 — 15 мм/ч у мужчин и 0 — 20 мм/ч у женщин, что связано с гендерными и другими отличиями химического состава крови и уровня ее вязкости. Во время беременности (начиная с 5–й недели) и в послеродовый период значения СОЭ увеличиваются до 20 — 25 мм/ч, а у людей пожилого возраста могут достигать 30 мм/ч и выше.
Нормальное значение этого показателя зависит от возраста, пола и некоторых физиологических состояний организма (например, беременности, менструации). У взрослого человека СОЭ может колебаться в довольно широких пределах: 0 — 15 мм/ч у мужчин и 0 — 20 мм/ч у женщин, что связано с гендерными и другими отличиями химического состава крови и уровня ее вязкости. Во время беременности (начиная с 5–й недели) и в послеродовый период значения СОЭ увеличиваются до 20 — 25 мм/ч, а у людей пожилого возраста могут достигать 30 мм/ч и выше.В ряде случаев рост СОЭ сверх нормы связан с наличием вредных привычек (курения, пристрастия к алкоголю), характером питания (низкокалорийной
диетой или, наоборот, перееданием), индивидуальными особенностями организма. Скажем, по некоторым данным, почти у 5% населения планеты от рождения ускорена реакция оседания эритроцитов, однако каких–либо явных патологических причин для этого нет. Поэтому, если вы получили результат анализа с повышенным уровнем СОЭ, в первую очередь следует исключить влияние перечисленных выше факторов. В противном случае слишком быстрое выпадение эритроцитов в осадок — знак развития одного или даже нескольких воспалительных (в том числе инфекционных) заболеваний: вирусного гепатита, гриппа, пневмонии, пиелонефрита, ревматизма, артрита и т.д. Ведь воспалительные процессы в организме человека приводят к накоплению в крови особых белковых молекул, ускоряющих реакцию склеивания эритроцитов. Другими причинами высокой СОЭ могут быть перенесенные травма или хирургическое вмешательство, анемия, патология почек или щитовидной железы, злокачественные опухоли, прием некоторых медикаментов (эстрогенов, оральных контрацептивов). Пониженный (близкий к нулю) уровень СОЭ встречается относительно редко и обусловлен прежде всего хроническими заболеваниями сердца и печени, избыточной продукцией красных клеток крови, лечением аспирином, преднизолоном и т.д.
В противном случае слишком быстрое выпадение эритроцитов в осадок — знак развития одного или даже нескольких воспалительных (в том числе инфекционных) заболеваний: вирусного гепатита, гриппа, пневмонии, пиелонефрита, ревматизма, артрита и т.д. Ведь воспалительные процессы в организме человека приводят к накоплению в крови особых белковых молекул, ускоряющих реакцию склеивания эритроцитов. Другими причинами высокой СОЭ могут быть перенесенные травма или хирургическое вмешательство, анемия, патология почек или щитовидной железы, злокачественные опухоли, прием некоторых медикаментов (эстрогенов, оральных контрацептивов). Пониженный (близкий к нулю) уровень СОЭ встречается относительно редко и обусловлен прежде всего хроническими заболеваниями сердца и печени, избыточной продукцией красных клеток крови, лечением аспирином, преднизолоном и т.д.Чтобы результаты анализа (в особенности развернутого) были достоверными, сдавать кровь для исследования желательно натощак или по меньшей мере не ранее чем через 4 часа после еды, исключив накануне повышенные физические нагрузки, стресс и волнение, а также прием алкоголя. И помните: только на основании показателя СОЭ правильный диагноз поставить невозможно — для этого необходимо участие врача–специалиста и, как правило, более углубленное обследование.
И помните: только на основании показателя СОЭ правильный диагноз поставить невозможно — для этого необходимо участие врача–специалиста и, как правило, более углубленное обследование.
Владимир ХРЫЩАНОВИЧ, доктор медицинских наук
Советская Белоруссия, 22 ноября 2018
Поделитесь
Сдать анализ крови на СОЭ (скорость оседания эритроцитов) в лаборатории KDL
Скорость оседания эритроцитов (СОЭ) — неспецифический показатель; назначается, как правило, вместе с общим анализом крови. Этот тест не является диагностическим признаком конкретного заболевания, не должен использоваться для скрининга бессимптомных пациентов. Реакция оседания эритроцитов во многом зависит от изменения состава белков крови при физиологических и патологических процессах в организме.
В каких случаях обычно назначают исследование СОЭ?
Чаще всего скорость оседания эритроцитов используется как маркер воспалительного процесса. В случае острых инфекционных и воспалительных заболеваний СОЭ быстро повышается (также как и другой маркер воспаления – С- реактивный белок) после выздоровления СОЭ может оставаться умеренно повышенной еще некоторое время (когда С- реактивный белок уже приходит в норму).
В случае острых инфекционных и воспалительных заболеваний СОЭ быстро повышается (также как и другой маркер воспаления – С- реактивный белок) после выздоровления СОЭ может оставаться умеренно повышенной еще некоторое время (когда С- реактивный белок уже приходит в норму).
Воспаление зависит от иммунного ответа организма. Воспалительная реакция может быть острой, возникнуть после травмы, хирургической операции или инфекции. В других случаях воспаление может быть длительным (хроническим) и сопровождать такие состояния, как аутоиммунные или онкологические заболевания.
Что именно определяется в процессе анализа?
Если образец крови поместить в специальную узкую трубку, то можно с течением времени увидеть, что клетки крови (эритроциты) оседают на дно, а над ними появляется слой прозрачной плазмы. Это процесс происходитт с определенной постоянной скоростью. Если в крови присутствуют белки воспалительного ответа, такие как С-реактивный белок или фибриноген, то клетки красной крови оседают быстрее. При определении СОЭ фактически измеряется скорость падения (оседания) эритроцитов в крови.
При определении СОЭ фактически измеряется скорость падения (оседания) эритроцитов в крови.
Что означают результаты теста?
Случайное выявление повышенного значения СОЭ в анализе крови у пациентов без жалоб не имеет клинического значения, в этом случае целесообразно повторное исследование СОЭ через 2-3 недели.
Стойкое значительное повышение СОЭ, повторяющееся в нескольких последовательных анализах, служит лабораторным диагностическим критерием при некоторых системных воспалительных (ревматических) заболеваниях: ревматоидный артрит, гигантоклеточный артериит, ревматическая полимиалгия.
Обычно используется международный метод определения СОЭ по Вестергрену. Значение верхней границы нормальных значений СОЭ зависит от возраста пациента и его пола. Индивидуальная норма для пациента рассчитывается по следующей формуле: у женщин СОЭ (мм/час) = (возраст в годах+10)/2; у мужчин СОЭ (мм/час) = (возраст в годах)/2. Эту методику определения нормальных значений не применяют для беременных женщин, СОЭ во время беременности обычно повышена.
Обычный срок выполнения теста
Обычно результат СОЭ можно получить в течение 1-2 дней
Нужна ли специальная подготовка к анализу?
Специальная подготовка не требуется. Подробнее про условия сдачи можно прочитать в разделе «Подготовка»
Что такое СОЭ
Скорость оседания эритроцитов (СОЭ) – показатель, определение которого входит в общий анализ крови. Это неспецифический лабораторный скрининговый тест, изменение которого может служить косвенным признаком текущего воспалительного или иных патологических процессов, таких как злокачественные опухоли и диффузные заболевания соединительной ткани
ФАКТОРЫ, ВЛИЯЮЩИЕ НА ПОКАЗАТЕЛЬ СОЭ
Показатель СОЭ меняется в зависимости от множества физиологических и патологических факторов.
Значения СОЭ у женщин несколько выше, чем у мужчин.
Изменения белкового состава крови при беременности ведут к повышению СОЭ в этот период.
Снижение содержания эритроцитов (анемия) в крови приводит к ускорению СОЭ и, напротив, повышение содержания эритроцитов в крови замедляет скорость седиментации.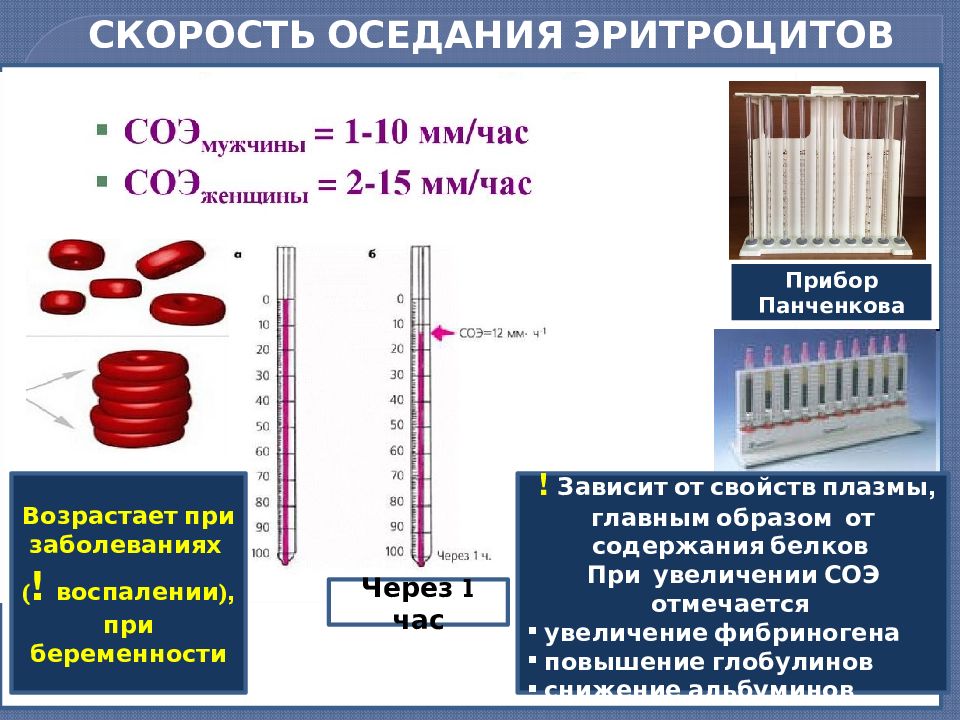
В течение дня возможно колебание значений, максимальный уровень отмечается в дневное время.
Основным фактором, влияющим на образование «монетных столбиков» при оседании эритроцитов является белковый состав плазмы крови.
Острофазные белки, адсорбируясь на поверхности эритроцитов, снижают их заряд и отталкивание друг от друга, способствуют образованию монетных столбиков и ускоренному оседанию эритроцитов.
Повышение белков острой фазы, например, С-реактивного белка, гаптоглобина, альфа-1-антитрипсина, при остром воспалении приводит к повышению СОЭ.
При острых воспалительных и инфекционных процессах изменение скорости оседания эритроцитов отмечается через 24 ч после повышения температуры и увеличения числа лейкоцитов.
При хроническом воспалении повышение СОЭ обусловлено увеличением концентрации фибриногена и иммуноглобулинов.
Некоторые морфологические варианты эритроцитов также могут оказывать влияние на СОЭ. Анизоцитоз и сфероцитоз ингибируют агрегацию эритроцитов. Макроциты имеют заряд, соответствующий их массе, и оседают быстрее.
Анизоцитоз и сфероцитоз ингибируют агрегацию эритроцитов. Макроциты имеют заряд, соответствующий их массе, и оседают быстрее.
При анемии дрепаноциты оказывают влияние на СОЭ так, что даже при воспалении СОЭ не возрастает.
ПРИЧИНЫ ИЗМЕНЕНИЯ ПОКАЗАТЕЛЕЙ СОЭ
Нормальные значение СОЭ
Зависит от пола и возраста:
- у новорожденных СОЭ очень замедленна — около 2мм, что связано с высокой величиной гематокрита и низким содержанием глобулинов
- к 4 неделям СОЭ слегка ускоряется
- к 2 годам она достигает 4-17 мм
- у взрослых и детей старше 10 лет СОЭ составляет от 2 до 10 мм для мужчин и от 2 до 15 мм для женщин, что может быть объяснено разным уровнем андрогенных стероидов
- у пожилых людей нормальный уровень СОЭ колеблется в пределах от 2 до 38 у мужчин и от 2 до 53 у женщин.
Повышение значения СОЭ
Наиболее частой причиной повышения СОЭ является увеличение содержания в плазме крупнодисперсных белков (фибриногена, a- и g-глобулинов, парапротеинов), а также уменьшение содержания альбуминов. Крупнодисперсные белки обладают меньшим отрицательным зарядом. Адсорбируясь на отрицательно заряженных эритроцитах, они уменьшают их поверхностный заряд и способствуют сближению эритроцитов и более быстрой их агломерации.
Крупнодисперсные белки обладают меньшим отрицательным зарядом. Адсорбируясь на отрицательно заряженных эритроцитах, они уменьшают их поверхностный заряд и способствуют сближению эритроцитов и более быстрой их агломерации.
- Инфекции, воспалительные заболевания, деструкция тканей.
- Другие состояния, приводящие к повышению содержания фибриногена и глобулинов в плазме, такие, как злокачественные опухоли, парапротеинемии (например, макроглобулинемия, множественная миелома).
- Инфаркт миокарда.
- Пневмония.
- Заболевания печени — гепатит, циррозы печени, рак и др., ведущие к выраженной диспротеинемии, иммунному воспалению и некрозам ткани печени.
- Заболевания почек (особенно сопровождающиеся нефротическим синдромом (гипоальбуминемия) и другие).
- Коллагенозы.
- Заболевания эндокринной системы (диабет).
- Анемии (СОЭ увеличивается в зависимости от тяжести), различные травмы.
- Беременность.

- Отравления химическими агентами.
- Пожилой возраст.
- Интоксикации.
- Травмы, переломы костей.
- Состояние после шока, операционных вмешательств.
Наиболее значительное повышение СОЭ (до 50–80 мм/ч) чаще всего наблюдается при:
- парапротеинемических гемобластозах — миеломная болезнь, болезнь Вальденстрема
- заболеваниях соединительной ткани и системных васкулитах — системная красная волчанка, узелковый периартериит, склеродермия и др.
Понижение значения СОЭ
- сгущение крови
- ацидоз
- Полицитемия.
- Серповидноклеточная анемия.
- Сфероцитоз.
- Гипофибриногенемия.
- Гипербилирубинемия.
- Голодание, снижение мышечной массы.
- Прием кортикостероидов.
- Беременность (особенно 1 и 2 семестр).
- Вегетарианская диета.

- Гипергидратация.
- Миодистрофии.
- Выраженные явления недостаточности кровообращения
Наиболее частой причиной значительного уменьшения СОЭ является увеличение вязкости крови при заболеваниях и синдромах, сопровождающихся увеличением числа эритроцитов (эритремия, вторичные эритроцитозы).
ЗАКЛЮЧЕНИЕ
В заключение необходимо заметить, что, несмотря на широкое применение в клинической практике, определение СОЭ имеет ограниченное диагностическое значение. Вместе с тем, большинство авторитетных экспертов в области клинической медицины, однозначно указываю на то, что диагностические возможности этого метода используются далеко не полностью, и основная проблема для практики отечественных КДЛ лежит в плоскости методических особенностей постановки теста. Представленные два метода, метод Панченкова и метод Вестергрена для определения СОЭ, очень нужные методы, ведь с помощью них можно подтвердить различные воспаления. Но нужно быть внимательным, ведь для исследований нужно соблюдать четкое выполнение правил анализа с использованием современных разработок, не только улучшающих качество результатов теста, но и существенно повышающих безопасность пациента и персонала при взятии проб крови. В ближайшем будущем планируется выпуск многопараметрических смарт-карт, наряду с СОЭ позволяющих оценивать фактор анемии, фактор агрегации, вязкость, индекс гематокрита и индекс гемоглобина.
Но нужно быть внимательным, ведь для исследований нужно соблюдать четкое выполнение правил анализа с использованием современных разработок, не только улучшающих качество результатов теста, но и существенно повышающих безопасность пациента и персонала при взятии проб крови. В ближайшем будущем планируется выпуск многопараметрических смарт-карт, наряду с СОЭ позволяющих оценивать фактор анемии, фактор агрегации, вязкость, индекс гематокрита и индекс гемоглобина.
Выводы:
СОЭ — неспецифический лабораторный показатель крови, изменение СОЭ может служить косвенным признаком текущего воспалительного процесса и является актуальным до настоящего времени;
При исследовании СОЭ различными методами получаются разные результаты;
Показатель СОЭ из венозной крови значительно выше, чем из капиллярной крови;
Метод Панченкова технологически устарел, занимает больше времени, чем другие методы определения СОЭ;
При выполнении СОЭ методом Панченкова сложнее соблюдать санитарно – эпидемиологический режим.
Заведующий клинико-диагностической лабораторией Татьяна Шах
Скорость оседания эритроцитов (СОЭ) | Лека-Фарм
Тест, оценивающий скорость разделения крови на плазму и эритроциты. Скорость разделения в основном определяется степенью их агрегации, т. е. способностью слипаться друг с другом.
Синонимы русские
Реакция оседания эритроцитов, РОЭ, СОЭ.
Синонимы английские
Erythrocyte sedimentation rate, Sed rate, Sedimentation rate, Westergren sedimentation rate.
Метод исследования
Метод капиллярной фотометрии.
Единицы измерения
Мм/ч (миллиметр в час).
Какой биоматериал можно использовать для исследования?
Венозную, капиллярную кровь.
Как правильно подготовиться к исследованию?
- Исключить из рациона алкоголь в течение 24 часов до анализа.
-
Не принимать пищу в течение 2-3 часов перед исследованием (можно пить чистую негазированную воду).

- Прекратить приём лекарственных препаратов за 24 часа перед исследованием (по согласованию с врачом).
- Исключить физическое и эмоциональное перенапряжение в течение 30 минут до анализа.
- Не курить в течение 30 минут до сдачи крови.
Общая информация об исследовании
Определение скорости оседания эритроцитов (СОЭ) – непрямой метод выявления воспалительного, аутоиммунного или онкологического заболевания. Оно проводится на образце венозной или капиллярной крови, в которую добавлено вещество, позволяющее ей не сворачиваться (антикоагулянт). При исследовании методом Панченкова кровь помещают в тонкую стеклянную или пластиковую пробирку и наблюдают за ней в течение часа. В это время эритроциты (красные кровяные клетки), как имеющие большую удельную массу, оседают, оставляя над собой столбик прозрачной плазмы. По расстоянию от верхней границы плазмы до эритроцитов и вычисляют СОЭ. В норме эритроциты оседают медленно, оставляя совсем немного чистой плазмы. Для данного метода используется аппарат Панченкова, состоящий из штатива и капиллярных пипеток со шкалой 100 мм.
Для данного метода используется аппарат Панченкова, состоящий из штатива и капиллярных пипеток со шкалой 100 мм.
При капиллярной фотометрии (автоматические анализаторы ROLLER, TEST1) используется кинетический метод «остановленной струи». В начале анализа происходит запрограммированное перемешивание пробы в целях дезагрегирования эритроцитов. Неэффективная дезагрегация или наличие микросгустков могут повлиять на конечный результат, т. к. анализатор фактически измеряет кинетику агрегации эритроцитов. При этом измерение происходит в диапазоне от 2 до 120 мм/ч. Результаты измерения СОЭ данным методом имеют высокую корреляцию с методом Вестергрена, являющимся эталонным для определения СОЭ, и одинаковые с ним референсные значения.
Результаты, получаемые при использовании метода капиллярной фотометрии, в области нормальных значений совпадают с результатами, получаемыми при определении СОЭ методом Панченкова. Однако метод капиллярной фотометрии более чувствителен к повышению СОЭ, и результаты в зоне повышенных значений выше результатов, получаемых методом Панченкова.
Повышение уровня патологических белков, находящихся в жидкой части крови, а также некоторых других белков (так называемых острофазовых, появляющихся при воспалении) способствует «склеиванию» эритроцитов. Из-за этого они оседают быстрее и СОЭ увеличивается. Получается, что любое острое или хроническое воспаление может приводить к повышению СОЭ.
Чем меньше эритроцитов, тем быстрее они оседают, поэтому у женщин СОЭ выше, чем у мужчин.
Для чего используется исследование?
-
Для диагностики заболеваний, связанных с острым или хроническим воспалением, включая инфекции, онкологические заболевания и аутоиммунные болезни. Определение СОЭ – чувствительный, но один из наименее специфичных лабораторных анализов, так как само по себе ее повышение не позволяет определить источник воспаления, кроме того, оно может происходить не только из-за воспаления. Именно поэтому анализ на СОЭ, как правило, используется в сочетании с другими исследованиями.

Когда назначается исследование?
-
При проведении диагностики и мониторинга:
- воспалительных заболеваний,
- инфекционных заболеваний,
- онкологических заболеваний,
- аутоиммунных заболеваний.
- При проведении профилактических обследований совместно с другими исследованиями (общим анализом крови, лейкоцитарной формулой и др.).
Что означают результаты?
Референсные значения
| Пол | Возраст | Референсные значения |
| Мужской | до 15 лет | 2 — 20 мм/ч |
| от 15 до 50 лет | 2 — 15 мм/ч | |
| старше 50 лет | 2 — 20 мм/ч | |
| Женский | до 50 лет | 2 — 20 мм/ч |
| старше 50 лет | 2 — 30 мм/ч |
Результаты данного анализа необходимо интерпретировать с учетом клинических данных, истории заболевания, а также других анализов.
Причины повышения СОЭ
- Инфекционные заболевания (чаще бактериальной причины). СОЭ может повышаться как при острых, так и при хронических инфекционных заболеваниях.
- Воспалительные заболевания.
- Болезни соединительной ткани (ревматоидный артрит, системная красная волчанка, системная склеродермия, васкулиты).
- Воспалительные заболевания кишечника (болезнь Крона, неспецифический язвенный колит).
-
Онкологические заболевания:
- Миеломная болезнь. Как правило, сопровождается очень высоким уровнем СОЭ, потому что при ней в большом количестве синтезируются патологические белки, которые вызывают образование эритроцитарных «монетных столбиков».
-
Болезнь Ходжкина – злокачественное заболевание лимфатических узлов. Показатель СОЭ обычно используется не для постановки диагноза, а для контроля за течением и эффективностью лечения уже диагностированного заболевания.

- Рак различных локализаций, особенно гемобластозы. Считается, что крайне высокий уровень СОЭ свидетельствует о распространении опухоли за пределы первичного очага (т. е. о метастазах).
- Инфаркт миокарда. При нем происходит повреждение сердечной мышцы, что вызывает системный воспалительный ответ и, соответственно, повышение СОЭ. После инфаркта СОЭ достигает пика примерно через неделю.
- Анемии. Уменьшение количества эритроцитов может приводить к увеличению скорости их оседания.
- Ожоги, травмы.
- Амилоидоз – заболевание, связанное с накоплением в тканях патологического белка.
Причины снижения СОЭ
- Болезни, сопровождающиеся изменением формы эритроцитов, такие как серповидно-клеточная анемия или наследственный сфероцитоз (они затрудняют оседание эритроцитов).
-
Полицитемия (увеличение количества эритроцитов) и состояния, которые к ней приводят, такие как, например, хроническая сердечная недостаточность или заболевания легких.

Что может влиять на результат?
- СОЭ, как правило, повышается во время беременности и менструации.
- Оральные контрацептивы, теофиллин, прием витамина А могут увеличивать СОЭ.
- Прием кортикостероидов и введение альбумина способны снижать СОЭ.
Важные замечания
- Тест на СОЭ – один из наименее специфичных лабораторных анализов – увеличение СОЭ может наблюдаться при многих заболеваниях, и по одному этому показателю нельзя поставить диагноз.
- Иногда СОЭ может значительно повышаться у здоровых людей.
- Нормальная СОЭ не исключает онкологического заболевания или болезней соединительной ткани.
Также рекомендуется
- С-реактивный белок (количественно)
- Ревматоидный фактор
- Общий анализ крови (без лейкоцитарной формулы и СОЭ)
- Лейкоцитарная формула
Кто назначает исследование?
Терапевт, онколог, гематолог, инфекционист.
Сдать анализ СОЭ (Cкорость Оседания Эритроцитов, ESR)
Метод определения Смотрите в описании.Важно! Результаты, полученные методами Панченкова и Вестергрена, совпадают в области нормальных значений, в зоне повышенных значений результаты, полученные методом Вестергрена обычно выше, чем полученные методом Панченкова.
Исследуемый материал Смотрите в описании
Доступен выезд на дом
Онлайн-регистрацияСОЭ – неспецифичный маркер воспаления.
Синонимы: Реакция оседания эритроцитов; РОЭ.
Westergren sedimentation rate; Erythrocyte Sedimentation Rate; ESR; Sed Rate; Sedimentation Rate.
Краткое описание исследования СОЭ
Неспецифический показатель, отражающий изменения белкового состава плазмы крови. В основном, используется для диагностики воспалительных состояний и мониторинга их течения. Классический принцип измерения СОЭ заключается в том, что, при помещении определенного объема крови, смешанного с цитратом натрия, в вертикально стоящую пробирку или капилляр, эритроциты под влиянием силы тяжести будут оседать вниз, тогда как силы отталкивания, возникающие между отрицательно заряженными мембранами эритроцитов, будут этому оседанию препятствовать.
Величина СОЭ измеряется как высота столбика плазмы над форменными элементами, образовавшегося за 1 час.
Соответственно, единицы измерения СОЭ – миллиметры в час (мм/час). При появлении в плазме крови большого количества белков острой фазы воспаления, к которым относят фибриноген, С-реактивный белок, альфа- и гамма-глобулины и др. , или парапротеинов, сила отталкивания между эритроцитами снижается, и эритроциты оседают быстрее. На скорость оседания эритроцитов также оказывают влияние их морфология (пойкилоцитоз эритроцитов исследуемой пробы приводит к занижению СОЭ, сглаживание формы эритроцитов, напротив, может СОЭ ускорять), а также величина гематокрита (снижение гематокрита приводит к завышению СОЭ). При острых воспалительных заболеваниях СОЭ обычно повышается спустя сутки после начала заболевания, тогда как нормализация этого показателя после выздоровления происходит медленнее, и может занять от нескольких дней до двух, и более, недель. Также в современной лабораторной практике применяются модифицированные методики измерения СОЭ, позволяющие ускорить и автоматизировать выполнение этого теста. С помощью математического алгоритма результаты, полученные этими методами, приводятся к шкалам классических методов (по Вестергрену и по Панченкову), и так же выдаются в привычных единицах, мм/час. В ИНВИТРО для выполнения исследования СОЭ используется три методики: СОЭ из венозной крови выполняют из отдельных пробирок с цитратом натрия, с использованием автоматического анализатора СОЭ SRS II (Greiner Bio-One, Австрия).
, или парапротеинов, сила отталкивания между эритроцитами снижается, и эритроциты оседают быстрее. На скорость оседания эритроцитов также оказывают влияние их морфология (пойкилоцитоз эритроцитов исследуемой пробы приводит к занижению СОЭ, сглаживание формы эритроцитов, напротив, может СОЭ ускорять), а также величина гематокрита (снижение гематокрита приводит к завышению СОЭ). При острых воспалительных заболеваниях СОЭ обычно повышается спустя сутки после начала заболевания, тогда как нормализация этого показателя после выздоровления происходит медленнее, и может занять от нескольких дней до двух, и более, недель. Также в современной лабораторной практике применяются модифицированные методики измерения СОЭ, позволяющие ускорить и автоматизировать выполнение этого теста. С помощью математического алгоритма результаты, полученные этими методами, приводятся к шкалам классических методов (по Вестергрену и по Панченкову), и так же выдаются в привычных единицах, мм/час. В ИНВИТРО для выполнения исследования СОЭ используется три методики: СОЭ из венозной крови выполняют из отдельных пробирок с цитратом натрия, с использованием автоматического анализатора СОЭ SRS II (Greiner Bio-One, Австрия). В тех случаях, когда это невозможно, исследование может быть выполнено микрометодом (TEST1, Alifax, Италия) или по Панченкову из ЭДТА-стабилизированной крови.
В тех случаях, когда это невозможно, исследование может быть выполнено микрометодом (TEST1, Alifax, Италия) или по Панченкову из ЭДТА-стабилизированной крови.
Сравнение методов определения СОЭ, используемых в ИНВИТРО
| Название метода | Принцип | Анализатор/ручная методика | Шкала |
| СОЭ по Вестергрену | Измерение высоты столбика плазмы над форменными элементами | SRS II | 0 – 200 мм/час |
| СОЭ по Панченкову | Измерение высоты столбика плазмы над форменными элементами | Ручная методика | 0 – 100 мм/час |
| Микрометод | Измерение скорости агрегации эритроцитов в проточной камере | TEST1 | 0 – 200 мм/час |
Исследуемый материал
Венозная кровь – отдельная пробирка с цитратом/ЭДТА-стабилизированная цельная кровь.
Капиллярная кровь – цельная кровь, стабилизированная ЭДТА.
Из капиллярной крови СОЭ выполняют только по методу Панченкова (шкала измерения – 100 мм). В любом случае, методика, по которой было проведено исследование, указывается при выдаче результата.
Что следует учесть при определении СОЭ
В клинических исследованиях не была показана эффективность определения СОЭ при скрининге индивидуумов без каких-либо симптомов заболевания. С одной стороны, нормальные уровни СОЭ не всегда исключают острое заболевание, с другой – повышение СОЭ часто возвращается к нормальному уровню через несколько месяцев без установления какого-либо диагноза. Уровень СОЭ меняется в зависимости от многих физиологических факторов. Значения СОЭ у женщин несколько выше, чем у мужчин. Изменения белкового состава крови при беременности ведут к повышению СОЭ. В течение дня возможно колебание значений, максимальный уровень отмечается в дневное время.
С какой целью определяют СОЭ в крови
Тест часто применяют в скрининговых исследованиях, в мониторинге течения и контроле эффективности лечения воспалительных и инфекционных заболеваний, обычно в комплексе с общим анализом крови.
Что может повлиять на результат исследования СОЭ
Несоблюдение правил подготовки к исследованию может повлиять на результаты теста.
Литература
- Алан Г. Б. Клиническое руководство Тица по лабораторным тестам //М.: Лабора. – 2013. – Т. 1280.
- Александрова Е. Н., Новиков А. А., Насонов Е. Л. Лабораторная диагностика ревматических заболеваний //Лабораторная служба. – 2015. – №. 2. – С. 44-58.
- Долгов В. В., Меньшиков В. В. Клиническая лабораторная диагностика. Национальное руководство //М.: ГЭОТАР-Медиа. – 2016. – С. 688.
- Хотим Е. Н., Жигальцов А. М., Кумара А. Синдром ускоренной СОЭ в практике врача: интерпретация и вопросы тактики //Журнал Гродненского государственного медицинского университета. – 2015. – №. 1 (49).
- Lapić I., Rogić D., Plebani M. Erythrocyte sedimentation rate is associated with severe coronavirus disease 2019 (COVID-19): a pooled analysis //Clinical Chemistry and Laboratory Medicine (CCLM). – 2020. – Т. 58. – №. 7. – С. 1146-1148.
- Lippi G., Plebani M. Cytokine “storm”, cytokine “breeze”, or both in COVID-19? //Clinical Chemistry and Laboratory Medicine (CCLM). – 2020. – Т. 1. – №. ahead-of-print.
- Материалы фирмы-производителя реагентов.
Проанализированный SRR (мм ч 1) для TC Zoe 0000 UTC 27 декабря 2002: (a) 1DVAR T b …
Контекст 1
… OA SD, когда апостериорный QC не применяется (раздел 2f) увеличивается в несколько раз меньше, чем в 2 раза для трехканального набора данных (включая наиболее непрозрачные профили), в то время как SD для пятиканального набора данных немного увеличивается. На рис. 5а показаны проанализированные поля SRR для TC Zoe. На рис. 5d для сравнения также показаны результаты поиска PATER SRR. …
Контекст 2
… сильно привлекает наблюдений. OA SD, когда апостериорный QC не применяется (раздел 2f), увеличивается в несколько раз меньше, чем в 2 раза для трехканального набора данных (включая наиболее непрозрачные профили), в то время как SD для пятиканального набора данных увеличивается. немного. На рис. 5а показаны проанализированные поля SRR для TC Zoe. На рис. 5d для сравнения также показаны результаты поиска PATER SRR. Анализируемое поле SRR намного ближе к наблюдениям, чем первое предположение (рис.5в). Обратите внимание, что показаны только SRR, превышающие 0,1 мм ч 1. Получение LWP с использованием алгоритма поиска Weng and Grody (1994) довольно хорошо согласуется с анализируемым полем (не …
Context 3
… 2 для трехканального набора данных (включая наиболее непрозрачный профессиональный — files), в то время как SD для пятиканального набора данных немного увеличивается. На рисунке 5a показаны проанализированные поля SRR для TC Zoe. На рисунке 5d для сравнения также показаны результаты поиска PATER SRR.Анализируемое поле SRR намного ближе к наблюдениям, чем первое предположение (рис. 5в). Обратите внимание, что показаны только SRR, превышающие 0,1 мм ч 1. Извлечение LWP с использованием алгоритма извлечения Weng and Grody (1994) довольно хорошо согласуется с анализируемым полем (не показано). Наконец, большие приросты IWV в диапазоне от 20 до 15 кг м 2 являются результатом ассимиляции T b. Влажность повышается (понижается) …
Контекст 4
… профилей (96,7% для случая Зои и 96,7% для случая Зои).32% по делу Чаба). В результате получения аналогичных ошибок для полей наблюдения и фона ассимиляция более слабая и дает меньшие приращения IWV, которые теперь составляют от 12,0 до 8,0 кг м 2 для случая Zoe. Это более слабое усвоение данных отражается и на анализируемом поле SRR (рис. 5б). Статистические данные оценки, приведенные в таблице 2, подтверждают, что анализируемое поле LWP очень похоже на поле эксперимента SOE. Для случая 1DVAR LOE Zoe отношения среднего и стандартного отклонения нормированной влажности увеличиваются к значениям температуры (отношение около 3.5 для среднего значения и 5 для SD) больше, чем у 1DVAR …
Контекст 5
… эксперимент 1DVAR SRR, точек меньше, поскольку профили с фоновым SRR менее 0,0001 мм ч 1 не рассматриваются. На рисунке 5c показан анализируемый SRR из SRR 1DVAR. Область, где SRR больше 6 мм ч 1, намного больше, когда SRR ассимилируется вместо T b. …
Контекст 6
… фон SRR менее 0,0001 мм h 1 не учитывается.На рисунке 5c показан анализируемый SRR из SRR 1DVAR. Область, где SRR больше 6 мм ч 1, намного больше, когда SRR ассимилируется вместо T b. Поскольку SRR — это наблюдаемое, которое усваивается, также ожидается, что анализируемые поля больше согласуются с этими наблюдениями (рис. 5d). Эквивалентная ошибка (фоновая ошибка, спроецированная в пространство наблюдения) также может быть вычислена с помощью 1DVAR SRR и показана на рис. 10a (логарифмическая шкала для эквивалентной ошибки) и 10b (линейная шкала для эквивалентной ошибки) для меньшей области Zoe (т.е.е., от 20 ° ю.ш.-19 ° с.ш. до 139 ° в.д.-179 ° з.д.). Эквивалентная ошибка увеличивается с SRR, и …
Контекст 7
… как для эквивалентной ошибки T b (рис. 9), имеет большой разброс около 4 мм h 1, который уменьшается для большего SRR. Фактически, когда схема глубокой конвекции исключена в H (x) (рис. 10c), разброс значительно уменьшается, как это было в случае эквивалентной ошибки T b (не показано). При сравнении эквивалентной ошибки SRR (рис. 10a) с ошибкой PATER SRR (рис. 5a в Mahfouf et al.2005), можно сделать вывод, что ассимиляция SRR будет сильно взвешена по отношению к наблюдениям для SRR менее 8 мм ч 1, в то время как для SRR более 8 мм ч 1 веса, приданные фону и наблюдениям (по крайней мере, в линейном или слабо нелинейный смысл) стать …
Контекст 8
… удельная влажность тождественно равна нулю. Это не относится к пространству яркостной температуры, где производная T b по влажности обычно отлична от нуля.Для случая Zoe, например, SRR был создан для 654 профилей с максимальным значением 2,93 мм ч 1 в 1DVAR T b LOE. Пример образования осадков можно увидеть на рис. 5а в географической области между 10 ° -5 ° южной широты и …
Границы | Контроль детоксикации бактериального сульфита с помощью консервативных и специфичных для конкретных видов регулирующих органов
Введение
Сульфит — это высокореактивный оксианион серы, который встречается как у про-, так и у эукариот как побочный продукт разложения соединений серы или внешнего воздействия сульфита (Kappler and Enemark, 2015; Kappler and Schwarz, 2016).Свободный сульфит может повредить белки, ДНК и липиды за счет образования аддуктов, а сульфитокисляющие ферменты (SOE) обнаружены почти во всех формах жизни (Zhang et al., 2011; Kappler and Enemark, 2015; Kappler and Schwarz, 2016). . Интересно, что хотя SOE позвоночных и растений, как было показано, являются механизмами детоксикации, которые защищают клетки от серного стресса, у бактерий SOE в основном описываются как элементы энергосберегающих путей, например, во время хемолитотрофии (Hänsch et al., 2007; Саймон и Кронек, 2013; Капплер и Шварц, 2016).
Рост бактерий на сероорганических соединениях и хемолитотрофный рост на неорганических соединениях серы приводит к образованию значительных количеств сульфита, и структурное и функциональное разнообразие бактериальных сульфитдегидрогеназ, которые осуществляют этот процесс, было хорошо установлено (Kappler, 2008, 2011; Kappler и Шварц, 2016). Напротив, сравнительно мало известно о том, как регулируется экспрессия этих ферментов, что является ключом к раскрытию их клеточной и физиологической роли.
В то время как у некоторых бактерий, таких как Deinococcus radiodurans, гены SOE, по-видимому, всегда сильно экспрессируются (D’errico et al., 2006), у многих бактерий SOE имеют сложные регуляторные паттерны, где активация обычно происходит в присутствии метаболизируемых серных субстратов, но активность может также подвергаться индукции, зависящей от фазы роста, и демонстрировать различные уровни базовой экспрессии у разных бактериальных штаммов и видов (Kappler et al., 2000, 2001; Wilson and Kappler, 2009; Bastiat et al., 2012).
У некоторых бактерий пара сигма-фактор / антисигма-фактор (ASF) внецитоплазматическая функция (ECF) кодируется непосредственно перед генами, кодирующими SOE, и предполагается, что она участвует в регуляции экспрессии SOE (Kappler et al., 2001; Wilson и Kappler, 2009; Bastiat et al., 2012). Регуляция генов на основе сигма-фактора ECF по существу контролируется ASF, которая изолирует сигма-фактор в отсутствие активирующего сигнала. Участие сигма-фактора ECF в регуляции гена SOE было подтверждено в недавнем исследовании штамма Sinorhizobium meliloti GMI11495 (Bastiat et al., 2012). В см. meliloti GMI11495, SOE-ассоциированный сигма-фактор ECF RpoE4 был индуцирован во время стационарной фазы роста и был идентифицирован как ключевой регулятор гена sorT , который кодирует Sm. meliloti SorT SOE (Wilson, Kappler, 2009; Bastiat et al., 2012). Работа также обнаружила, что второй сигма-фактор ECF, RpoE1, играет роль в индукции экспрессии sorT во время роста на таурине, но не в присутствии тиосульфата, второго идентифицированного субстрата, активирующего RpoE4.На основе этих результатов была предложена модель, в которой во время стационарной фазы и во время роста при таурине активация sorT происходит под действием как RpoE4, так и RpoE1, в то время как во время роста при активации тиосульфатом экспрессии sorT требуется только действие RpoE4. Было высказано предположение, что молекулярный сигнал, воспринимаемый RpoE4, является сульфитом, поскольку сульфит накапливается в культурах штаммов, несущих мутации в гене sorT .
Мы ранее описали присутствие генов, кодирующих сигма-факторы ECF, перед SOE-кодирующими оперонами для двух почвенных бактерий, штамма Sinorhizobium meliloti 1021 и Starkeya novella (Рисунок 1; Kappler et al., 2001; Уилсон и Капплер, 2009). Обе эти бактерии являются α-протеобактериями порядка Rhizobiales, но принадлежат к семействам Rhizobiaceae и Xanthobacteraceae соответственно. см. meliloti и St. novella обладают способностью разлагать сероорганические соединения и неорганические соединения серы, содержат различные типы SOE, гомодимерный SorT и гетеродимерный SorAB (Kappler et al., 2000; Kappler and Bailey, 2005; Mcgrath et al. al., 2015), а также демонстрируют различные модели регулирования SOE (Kappler et al., 2001; Уилсон и Капплер, 2009; Low et al., 2011). В то время как в St. novella активность SorAB SOE практически не обнаруживается в отсутствие разлагаемых соединений серы (∼0,05 Ед / мг, рис. 1 и дополнительная таблица S1), в Sm. meliloti 1021 Активность SOE всегда обнаруживается при базальных уровнях 0,7–1 Ед / мг (рис. 1 и дополнительная таблица S1; Kappler et al., 2001; Wilson and Kappler, 2009). Это отличается как от паттерна активности SOE в St. novella , так и от наблюдений, сделанных для экспрессии гена SOE в Sm.meliloti , штамм GMI11495, Bastiat et al. (2012).
Рис. 1. Регуляция экспрессии гена SOE в Sm на основе сигма-фактора ECF. meliloti 1021 и Св. новелла . (A) Схематическое изображение Sm. meliloti rpoE4 / sorT и St. novella sigE / sorAB , что подчеркивает сходство расположения генов. (B) Анализы репортерного гена, показывающие способность SmRpoE4 и SnSigE активировать промоторы родственных генов, кодирующих SOE, sorT и sorA .Показанные контроли тестируют активность слияния промоторных генов в отсутствие специфического фактора транскрипции (белые столбцы) и способность факторов транскрипции увеличивать экспрессию гена lacZ без промотора в pMu2385 (метка: pMu2385) соответственно. Положительные взаимодействия между тестовыми промоторами и сигма-факторами приводят к увеличению активности бета-галактозидазы, двухфакторный дисперсионный анализ: ∗∗∗∗ p <0,0001. (C) Изменения активности SOE, зависимые от углерода и серы, в Sm.meliloti 1021 и St. novella , выделяя различные режимы базальной регуляции. Активность ферментов определяли в клеточных экстрактах из культур, выращенных до поздней фазы экспоненциального роста на указанных субстратах, с использованием анализов на основе феррицианида ( Sm. Meliloti SorT) или цитохрома c ( St. novella SorAB). Выбранные субстраты для роста отражают различные предпочтения бактерий в отношении субстратов. (D) In vivo индукция слияний промотора sorT — gfp mut2 в Sm.meliloti растет на средах с различными субстратами для выращивания. Изменения флуоресценции соответствуют изменениям активности SOE, показанным в (C) . Данные в (B, C) представляют собой средние значения по меньшей мере трех повторных анализов ( n = 3 биологических повторения), полосы ошибок представляют собой стандартное отклонение. Сокращения: АЧС, антисигма фактор; Азу, азурин; cyt.c, цитохром c ; Форма., Формиат; Glc, -глюкоза; МеОН, метанол; MSA, метансульфоновая кислота; н.о., не определено; нет данных, непригодный; Тау, таурин; TS, тиосульфат.
Здесь мы использовали Sm. meliloti 1021 и St. novella для исследования сохранения регуляторных паттернов SOE у разных видов, сигнальных молекул, запускающих экспрессию SOE, и для определения того, является ли регуляция экспрессии SOE двумя сигма-факторами ECF уникальной для Sm. meliloti штаммов. Наши исследования показывают, что активация генов, кодирующих SOE, запускается именно присутствием сульфита у обоих видов, что делает окисление сульфита реакцией на бактериальный стресс и сводит на нет основную роль в сохранении энергии.Основной способ регуляции SOE у обоих видов зависел от родственных сигма-факторов ECF SmRpoE4 и SnSigE. Дополнительная, перекрывающаяся регуляторная цепь, зависящая от RpoE1-подобного сигма-фактора ECF, также была обнаружена у обоих видов, но соответствующие сигма-факторы RpoE1 нацелены на разные промоторы в оперонах сигма-фактора SOE и ECF (промотор Sm. Meliloti rpoE4 , St промотор novella sorA ). Кроме того, активация на основе RpoE1 была основана на видоспецифичных стимулах и, по-видимому, объясняет только сравнительно небольшую часть индукции SOE в очень специфических условиях.Филогенетический анализ выявил по крайней мере три клады сигма-факторов ECF, обнаруженных в ассоциации с генами SOE, один из которых на сегодняшний день не изучен и состоит из видов, которые, по-видимому, не имеют гомолога RpoE1, что делает регуляцию родственным сигма-фактором ECF основным способом Регулирование ГП.
Материалы и методы
Бактериальные штаммы, плазмиды, среды и условия роста
Бактериальные штаммы и плазмиды, использованные в этом исследовании, перечислены в дополнительной таблице S2. Штаммы E. coli обычно выращивали в аэробных условиях на среде Luria Bertani (LB) (Ausubel et al., 2005) при 37 ° C. Starkeya novella DSMZ506 T и Sinorhizobium meliloti штамм 1021 культивировали аэробно либо на среде TYS (Beringer, 1974), либо на модифицированной среде DSMZ № 69 при 30 ° C (Wilson and Kappler, 2009). В базальную среду DSMZ 69 добавляли 80 мМ метанола, 20 или 40 мМ тиосульфата, 20 мМ тетратионата, 10 мМ глюкозы, 20 мМ формиата, 20 мМ метансульфоновой кислоты, 20 мМ таурина или комбинации этих соединений.Где применимо, в питательную среду добавляли следующие антибиотики (мкг / мл): E. coli : ампициллин и канамицин 100, гентамицин и тетрациклин 10, триметоприм 30; см. meliloti : стрептомицин 25, тетрациклин 5, канамицин 200.
Методы молекулярной биологии
Стандартные методы использовались повсюду (Ausubel et al., 2005). Наборы для подготовки плазмид PureLink Quick и для очистки ПЦР (Life Technologies) использовали для очистки плазмидной ДНК, продуктов ПЦР и препаративных ферментов рестрикции, рестрикционные ферменты были от Life Technologies, ДНК-лигаза Т4 от Promega.GoTaq green Mastermix (Promega) использовали для всех стандартных реакций ПЦР, полимеразы Pfu (Stratagene) или Phusion (Finnzymes) использовали для всех приложений клонирования и для создания зондов для анализов EMSA. Олигонуклеотидные праймеры (дополнительная таблица S3) были от Life Technologies или IDT DNA technologies.
Для экспериментов по экспрессии генов культуры выращивали до фазы раннего / среднего экспоненциального роста на среде 69, содержащей глюкозу или метанол, перед добавлением соединений серы (20 мМ таурин, 20 мМ тиосульфат или 1 мМ сульфит).Для экспериментов по индукции гена SOE образцы для выделения РНК (2 мл) отбирали непосредственно перед добавлением соединений ( t = 0) и через 15, 30, 60, 90, 120 и 180 минут после добавления. Все образцы консервировали с помощью реагента RNAProtect Bacteria (Qiagen), РНК выделяли с помощью набора Illustra RNAspin mini (GE Biosciences) и хранили при -80 °. гДНК удаляли обработкой ДНКазой (TurboDNA free, Life Technologies), все образцы тестировали на отсутствие гДНК с помощью ПЦР-амплификации гена 16S рДНК.кДНК получали из 500 нг свободной от ДНК РНК с использованием ферментов Superscript III или IV (Life Technologies) и случайных гексамерных праймеров.
Количественная ОТ-ПЦР с использованием основной смеси SYBR green (Applied Biosystems) была проведена и проанализирована, как в Ang et al. (2017). Конечный реакционный объем составлял 10 мкл, и использовали 384-луночные планшеты. Для настройки реакций использовали рабочую станцию epMotion (Eppendorf), данные собирали с помощью термоциклера Quantstudio 6 (Life Technologies).Экспрессию гена нормализовали до экспрессии гена 16S, эффективность ПЦР определяли с использованием LinReg (Ramakers et al., 2003).
сайтов начала транскрипции определяли с использованием системы Life Technologies 5’RACE в соответствии с инструкциями производителя. Для секвенирования ДНК в Австралийском центре генетических исследований лошадей (Университет Квинсленда) использовался BigDye v3.1 (Applied Biosystems). В экспериментах EMSA использовали Dig-Gelshift Kit v2 (Roche Applied Science). В реакциях EMSA использовали буфер, содержащий 40 мМ HEPES pH 7.9, 60 мМ KCl, 1 мМ MgCl 2 , 12% глицерин и 1 мМ DTT (Rhodes et al., 1997), ядро РНК-полимеразы (Epicenter), 0,25 пмоль DIG-меченного зонда, 20 пмоль очищенного SnSigE, лосось ДНК сперматозоидов или poly d [IC] (Sigma-Aldrich) были добавлены, если применимо. Реакции связывания инкубировали в течение 40 минут при 28 ° C перед разделением на 5% акриламидном геле 0,5 × TBE при 4 ° C с последующим блоттингом и детектированием в соответствии с инструкциями производителя.
Создание нокаутных мутаций генов
Плазмиды с нокаутом гена pKnock-Km- rpoE4 и pKnock-Km- sorT были созданы путем вставки фрагментов гена 300–400 п.н. в вектор pKnock-Km (Алексеев, 1999).Электрокомпетент См. Клетки meliloti получали с использованием 200 мл культур на основе TYS, выращенных при 30 ° C, 200 об / мин до OD 600 ∼0,4–0,6. Клетки собирали центрифугированием (4000 × г, , 4 ° C, 15 мин), дважды промывали в 50 мл стерильной воды перед ресуспендированием в 1 мл стерильного 10% глицерина. К аликвоте этих клеток 100 мкл добавляли 0,5–1 мкг плазмидной ДНК с последующей электропорацией (2500 В, 25 мкФ, 400 Ом, кювета 2 мм) с использованием генопульсора Bio-RAD. Электропорированные клетки помещали в 1 мл TYS и инкубировали при 30 ° C при встряхивании в течение 12 часов перед посевом на селективную среду. St. novella не поддается генетическим манипуляциям (Davidson and Summers, 1983; Davidson et al., 1985; Kappler et al., Неопубликовано), что исключает аналогичные эксперименты с этой бактерией.
Биохимические методы и производство рекомбинантных белков
SDS-PAGE выполняли, как в Laemmli (1970). Экстракты клеток небольшого объема (2–3 мл) для ферментных анализов получали из культур (10–20 мл), выращенных до средней / поздней фазы экспоненциального роста с использованием BugBuster Mastermix (Novagen).Анализы активности SOE проводили, как у Kappler et al. (2000), Wilson and Kappler (2009) и Low et al. (2011) с феррицианидом или цитохромом c в качестве акцепторов электронов для SOE из Sm. meliloti и St. novella соответственно. Концентрацию сульфита в питательной среде определяли с использованием фуксина, как у Гранта (1947). Полимеразы Pfu (Stratagene) и Phusion (Finnzymes) были использованы для амплификации фрагментов генов с высокой точностью, например, гены Sn sigE и Sm rpoE и промоторные области для клонирования в pQE30 (Qiagen, Sn sigE ) или pProex HTB (Life Technologies, Sm rpoE4 , Sm rpoE1 , Sn rpoE1 ) или для клонирования промоторных областей в pMU2385 или для использования в экспериментах EMSA.Все плазмиды экспрессии белка тестировали на успешную экспрессию белка в небольших экспериментах по экспрессии. 6xHis SnSigE экспрессировали в DH5α при 30 ° C с использованием 1 мМ IPTG с последующей инкубацией в течение 4 часов перед сбором. Рекомбинантный белок очищали в нативных условиях с использованием смолы Ni-NTA (Qiagen) в соответствии с инструкциями производителя или после рефолдинга из телец включения с использованием протоколов Burgess (1996) и Burgess (2009). В неденатурирующих условиях 6xHis SnSigE очищали совместно с E.coli РНК-полимераза.
Анализы репортерных генов
Активностьбета-галактозидазы, присутствующей в клетках E. coli , несущих слияния тестируемых промоторов с без промоторного гена lacZ в pMU2385 (Praszkier et al., 1992), и второй плазмиды, экспрессирующей соответствующие сигма-факторы, определяли с использованием метода Kidd et al. (2005). Плазмиды для экспрессии сигма-фактора были такими же, что и для очистки белка. Плазмиды без вставок использовали для контрольных реакций, которые тестируют либо активность промоторов в отсутствие фактора транскрипции, либо способность сигма-фактора изменять экспрессию гена lacZ без промотора pMU2385.Используемые фрагменты промотора имели размер от 300 до 500 п.н. и располагались непосредственно перед кодирующими областями. E. coli культур для анализов репортерных генов инокулировали из ночных культур в 5 мл LB, выращенных при 37 ° C до OD 600 ∼ 0,4–0,6. Клетки собирали и ресуспендировали в 1xPBS перед использованием в ферментных анализах (Kidd et al., 2005). Все анализы повторяли по крайней мере один раз и проводили в трех экземплярах для каждого повтора, активность ферментов указывалась в единицах Миллера.
Для мониторинга in vivo активности промотора SOE те же фрагменты промотора, которые использовались в pMU2385, были клонированы в pBluescript- gfpmut2 с последующим субклонированием всей кассеты экспрессии в pRK415 (Ditta et al., 1985) для переноса в См. meliloti , как описано выше. Активность in vivo слияния промоторных генов с gfpmut2 была обнаружена с помощью эпифлуоресцентной или конфокальной лазерной микроскопии на установке для микроскопии SCMB в культурах, выращенных до средней экспоненциальной фазы на среде DSMZ 69 с добавлением или без добавления соединения серы.
Филогенетические анализы
белковых гомологов SnSigE и SmRpoE4 были идентифицированы с использованием алгоритма BLAST (Altschul et al., 1997). При анализе генной среды для сигма-факторов ECF26 использовались данные, доступные в общедоступных базах данных (например, GenBank), программный пакет Vector Nti Advance 11 (Life Technologies) использовался для отображения и сравнения данных последовательностей. База данных Mist (версия 2.0) (Ulrich and Zhulin, 2007) использовалась для подтверждения обнаружения сигма-факторов ECF в геномах модельных организмов, инструмент ECF finder использовался для проверки классификации последовательностей сигма-факторов.Полный список последовательностей сигма-факторов доступен в дополнительной таблице S4. Полноразмерные белковые последовательности были выровнены. ClustalW впоследствии проанализировали в MEGA 7.0 (Tamura et al., 2011), филогенетические деревья были построены с использованием алгоритмов Neighbor Joining (NJ), Minimum Evolution (ME), UPGMA и Maximum Likelihood (ML). Все анализы предполагали одинаковые скорости эволюции аминокислотных последовательностей. NJ, ME и UPGMA использовали пуассоновскую модель замещения и попарного удаления пробелов / отсутствующих данных, в то время как анализ ML использовал модель Джонса-Тейлора Торнтона и частичное удаление пробелов / отсутствующих данных.Тестирование устойчивости проводилось методом начальной загрузки с 500 циклами повторной выборки. Последовательности, принадлежащие к группам 12 и 15 ECF, как определено в Staron et al. (2009) использовались в качестве контрольных групп (дополнительная таблица S4). Все эти последовательности явно располагались на отдельных ветвях за пределами трех проанализированных групп ECF (данные не показаны). Консенсусный профиль промотора ECF26 был получен с использованием набора инструментов MEME для анализа последовательности на основе мотивов (Bailey et al., 2009). В частности, glam2 использовался для создания консенсусного профиля и логотипа промотора, glam2scan использовался для поиска общедоступных последовательностей генома на предмет наличия этого профиля, tomtom использовался для сравнения этого профиля с базой данных продорической регуляции генов (версия 8.9) (Muench et al., 2003; Gupta et al., 2007; Frith et al., 2008).
Результаты
Регулирование окисления сульфита на основе сигма-фактора ECF в
Sinorhizobium meliloti 1021 и Starkeya novellaБазовая характеристика показала, что в St. novella и Sm. meliloti 1021 котранскрибируются сигма-фактор ECF и родственные гены, кодирующие ASF, расположенные выше генов, кодирующих SOE (дополнительный рисунок S1), и анализы репортерного гена (рисунок 1) подтвердили специфическую индукцию как Sm_ sorT , так и Sm_ Промоторы rpoE4 за счет сигма-фактора SmRpoE4 (индукция в 260 и 16 раз соответственно) и способность сигма-фактора SnSigE связываться и индуцировать экспрессию промотора Sn_ sorA (индукция в 129 раз), но не Sn_ промотор sigE (рисунок 1 и дополнительный рисунок S2).
Картирование сайтов старта транскрипциис помощью 5’RACE показало, что в соответствии с этим наблюдением промотор Sn_ sigE не имеет консенсуса (-35 GGAAT, -10 CGTC), обнаруженного перед Sm sorT , Sn sorA и Sm rpoE4 гены (дополнительный рисунок S1). Этот консенсус по существу совпадает с консенсусом, определенным для генов sorT и rpoE4 Sm. meliloti GMI11495 (Bastiat et al., 2012; Schlüter et al., 2013), однако мы заметили, что расстояние между элементами -10 и -35 отличается на 1 п.н. между некоторыми промоторами, что может изменять относительную силу промотора (дополнительный рисунок). S1).Биоинформатические поиски St. novella и Sm. meliloti 1021 (Galibert et al., 2001; Kappler et al., 2012) не выявили дополнительных генов с сильным соответствием этой согласованной последовательности.
Как уже указывалось во введении, индукция активности SOE в зависимости от источника углерода и серы у обеих бактерий ограничивалась субстратами, которые могут давать сульфит либо посредством абиотических процессов в среде (например, тиосульфат), либо в результате разложения под действием бактерии (SM: таурин, SN: тиосульфат и тетратионат) (рисунок 1 и дополнительная таблица S1).Промотор Sm_ sorT GFP mut2 fusion введен в Sm. meliloti 1021 подтвердил эту модель индукции гена sorT in vivo , при этом флуоресценция GFP была самой сильной для ростовой среды, содержащей таурин или одновременно глюкозу и тиосульфат (рис. 1).
Сульфит — это молекулярный сигнал, индуцирующий экспрессию SOE в обоих
Sm. meliloti и Св. новеллаМолекулярный сигнал, воспринимаемый парами сигма-фактора типа ECF / ASF, которые регулируют экспрессию гена SOE, может быть либо источником метаболизируемой серы, если индукция была вызвана разложением определенного субстрата, либо самим сульфитом, если основной целью реакции SOE является для детоксикации сульфита. см. meliloti и St. novella , экспоненциально растущие на глюкозосодержащих средах, подвергались действию таурина, тиосульфата или сульфита, что показало немедленное сильное увеличение экспрессии Sm sorT и Sn sorA только в ответ на воздействие сульфита ( Рисунок 2 и дополнительный рисунок S3). Это увеличение экспрессии генов sorA и sorT было временным и длилось не более 2 часов после воздействия, что соответствует относительно низкой концентрации сульфитного заражения (1 мМ), выбранной для предотвращения токсичности и быстрого химического и ферментативного обмена. сульфита в растворе (Kappler et al., 2000; Уилсон и Капплер, 2009).
Рис. 2. Кратное изменение экспрессии генов сигма-фактора SOE и ECF после воздействия сульфита, таурина и тиосульфата в Sm. meliloti 1021 и Св. новелла 506 T . Слева: См. meliloti индукция экспрессии гена, Верх : индукция гена sorT SOE, Нижний : индукция гена сигма-фактора rpoE4 ECF. Справа: Индукция экспрессии гена St. novella , Вверху : индукция гена sorA SOE, Внизу : индукция гена сигма-фактора rpoE4 ECF. Данные представлены как среднее значение и стандартное отклонение по крайней мере трех анализов. Данные об экспрессии лежащих в основе генов показаны на дополнительном рисунке S3. Двухфакторный дисперсионный анализ изменений в отн. нормализованная экспрессия гена по сравнению со значением t = 0 показала, что для добавления сульфита изменения были статистически значимыми (альфа = 0.05) от т = 15 мин (Sm) и т = 30 мин (Sn) с p = 0,0032 ( ∗∗ ) (Sn, 30 мин) до p <0,0001 ( ∗∗ ∗∗ ) для всех других значений, для добавления тиосульфата от т = 30 мин (Sm) и т = 60 мин (Sn) с p <0,0001 ( ∗∗∗∗ ) для всех точек данных, для таурина все значения не были значимыми, за исключением Sm 120 мин, p = 0,0232 ( ∗ ) и 180 минут ( p <0.0001, ∗∗∗∗ ). Для наглядности значения p на рисунке не показаны.
Добавление тиосульфата также вызывает индукцию экспрессии гена Sm_ sorT / Sn_ sorA , которая, однако, занимает около 60–120 минут до пика, в то время как воздействие таурина вызывает повышение экспрессии гена Sm sorT после> 120 минут. мин инкубации, в то время как никакого эффекта не наблюдалось для St. novella , который не может метаболизировать таурин (Kappler et al., 2012; рис. 2).Эти наблюдения согласуются с тем, что сульфит является сигналом, который индуцирует экспрессию гена SOE у обоих видов. В то время как См. meliloti не может метаболизировать тиосульфат, добавление тиосульфата к среде для выращивания DSMZ69 приводит к абиотическому производству сульфита (∼120–160 мкМ) (Wilson and Kappler, 2009), что объясняет индукцию гена Sm_ sorT на основе тиосульфата. выражение у этого вида. Напротив, тиосульфат также является основным субстратом для хемолитотрофного роста St. novella , а St.novella , ферментный комплекс, разрушающий тиосульфат, который приводит к образованию сульфита, всегда экспрессируется на высоких уровнях (Kappler and Nouwens, 2013), что делает возможным быстрое разложение тиосульфата. Это объясняет сильную активацию экспрессии гена Sn_ sorA , наблюдаемую в St. novella после добавления тиосульфата. Напротив, расщепление таурина под действием S. meliloti , которое также приводит к образованию сульфита (Cook and Denger, 2002), является индуцибельным процессом и будет производить сульфит только после производства ферментов, разлагающих таурин, и разложения значительных количеств таурина, что согласуется с наблюдаемым запаздыванием в 120 мин до того, как наблюдалась индукция для Sm_ sorT .
Участие множества регуляторных цепей в контроле экспрессии гена SOE сохраняется у всех видов бактерий
Несмотря на то, что сульфит является обычным молекулярным сигналом, вызывающим экспрессию гена SOE в Sm. meliloti и St. novella , что касается базальных уровней активности, паттерны экспрессии для SOE SmSorT и SnSorAB четко различаются (рис. в См.meliloti (Bastiat et al., 2012), у St. novella только родственный сигма-фактор ECF, SnSigE, может участвовать в регуляции экспрессии SOE. Чтобы установить, присутствует ли регуляция двумя сигма-факторами ECF, мы сначала проверили, существует ли гомолог сигма-фактора SmRpoE1 в St. novella . Выявленная пара SnRpoE1-ASF кодируется генами Snov_0992 / 0993, и SnRpoE1 способен активировать промотор Snov_0990 (Sn_ duf305 ), гена, кодирующего белок, содержащий домен неизвестной функции (DUF305), в то время как область 270 п.н. непосредственно перед геном Sn rpoE1 (Snov_0992) не показали активации (не показано).Промотор Snov_0990 (Sn_ duf305 ), вероятно, также контролирует экспрессию гена Snov_0991, который кодирует белок повтора пропеллера YVTN-бета, от которого ген Snov_0990 отделен только 12 п.н.
В анализах репортерных генов SnRpoE1 индуцировал сильную экспрессию промоторов Sn_ duf305 и Sn_ sorA , но не Sn_ sigE p, в то время как SnSigE сильно индуцировал Sn_ sorA p, а также показал слабую способность индуцировать Sn_ duf305 p активность (рисунок 3).
Рисунок 3. Анализы репортерного гена, исследующие активацию промотора Sm. meliloti и St. novella ECF сигма-факторы SmRpoE4 / SnSigE и Sm / SnRpoE1. (А) См. meliloti RpoE4 и RpoE1 активация Sm. meliloti rpoE4 , sorT , rpoE1 промоторы (слева) и St. novella SigE и SnRpoE1 Активация промоторов St. novella sigE , sorA и duf305 (справа) . (B) SmRpoE4 / SnSigE и Sm / SnRpoE1-опосредованная регуляция видов промоторов гена SOE и сигма-фактора ECF. Активация промоторов St. novella Sm. meliloti ECF сигма-факторы (слева) и активация Sm. Промоторы meliloti от St. novella ECF sigma Factors (справа) . Данные представлены как средние значения и стандартное отклонение по крайней мере трех анализов. В статистическом анализе использовался двухфакторный дисперсионный анализ, сравнивающий данные для каждого промотора с отрицательным контролем (сигма-фактор отсутствует). ∗∗∗∗ p <0,0001, ∗∗∗ p = 0,0006; ∗∗ p = 0,0093; ∗ p = 0,0106.
Эксперименты по сопоставлению с SmRpoE1 выявили сильную индукцию промотора Sm_ rpoE4 и очень низкий уровень индукции промотора Sm_ sorT , в то время как только SmRpoE4 продемонстрировал сильную индукцию промотора Sm_ sorT (Рисунок 3).
Интересно, что Sm. meliloti RpoE1 и RpoE4 сигма-факторы также могли взаимодействовать с тремя St.Здесь тестировали промоторы novella (рис. 3). SmRpoE4 индуцировал низкий уровень активности промотора Sn_ sorA и средний уровень экспрессии промотора Sn_ duf305 , в то время как SmRpoE1, аналогично SnRpoE1, приводил к высоким уровням активации Sn_ sorA p и Sn_ duf305 p, в то время как наблюдались изменения активности Sn_ sigE p.
Напротив, SnSigE и SnRpoE1 не смогли распознать Sm. meliloti sorT, промоторы гена rpoE4 или rpoE1 (рис. 3).Способность SmRpoE1 к межвидовой перекрестной регуляции была подтверждена с использованием слияния промотора Sn_ sorA -GFP mut2 , введенного в Sm. meliloti , где даже на средах, содержащих только глюкозу, т. е. в неиндуцирующих условиях, наблюдалась сильная флуоресценция (дополнительный рисунок S4). Постоянная активность промотора Sn_ sorA в Sm. meliloti 1021 (фиг. 3 и дополнительный рисунок S4) предполагает, что в этом штамме SmRpoE1 был активен во всех испытанных условиях.
SnRpoE1, вероятно, контролирует второй, реагирующий на тетратионат регуляторный контур, который может активировать экспрессию Sn
sorAB в определенных условиях ростаЗатем мы проанализировали экспрессию генов SOE, сигма-фактора и ASF в St. novella , выращенных на глюкозе (гетеротрофный рост), метаноле (рост соединения C1), тиосульфате и тетратионате (оба хемолитоавтотрофного роста). Данные по экспрессии генов подтвердили сильную индукцию экспрессии гена sorA в присутствии тиосульфата (~ 18 отн.к уровням глюкозы) также отражается на активности ферментов (Рисунки 1, 4). Гены Sn sigE и Sn rpoE1 экспрессировались на сходных уровнях, при этом уровни экспрессии гена сигма-фактора значительно превышали (∼10 ×) уровни соответствующей родственной АЧС (SnSigE ASF: Snov_3267, SnRpoE1 ASF: Snov_0993). Экспрессия Sn rpoE1 и связанных генов (Snov_0990-0993) была низкой в образцах глюкозы, метанола и тиосульфата, что указывает на то, что RpoE1, вероятно, не был активен в этих условиях.Однако во время роста на тетратионате произошла активация SnRpoE1, о чем свидетельствуют высокие уровни экспрессии гена Snov_0991, который связан с геном, кодирующим белок Snov_0990 DUF305, используемый в исследованном промоторе (рис. 4). Поскольку анализы репортерного гена с SnRpoE1 показали сильные взаимодействия с промотором Sn_ sorA , это предполагает, что in vivo во время роста на тетратионате SnRpoE1 может активировать транскрипцию Sn_ sorA . Однако нельзя исключить вклад чувствительного к сульфиту сигма-фактора SnSigE в экспрессию Sn_ sorA на тетратионате, поскольку это путь разложения тетратионата в St.novella неизвестна и может привести к образованию сульфита, который вызовет реакцию SnSigE. Таким образом, это предполагает, что регуляторный паттерн St. novella SorAB SOE в основном зависит от активации родственного сигма-фактора SnSigE.
Рисунок 4. Активность SOE и экспрессия генов, связанных с сигма-фактором SOE и ECF, в Sm. meliloti WT и Sm. meliloti Δ rpoE 4 штаммов (A, B) и в St.новелла WT (C) . (A) Зависимые от фазы роста изменения активности SOE в Sm. meliloti WT и Sm. meliloti Δ rpoE 4 по глюкозе, таурину, глюкозе и тиосульфату. (B) Экспрессия генов, связанных с SmRpoE4 и SmRpoE1, в Sm. meliloti WT (белый) Sm. meliloti Δ rpoE 4 (серый) во время роста на глюкозе или таурине. (C) Экспрессия генов, связанных с генами, кодирующими SnSigE и SnRpoE1, в St. novella WT в различных условиях роста. Сокращения: Glc, глюкоза; TS, тиосульфат; ТТ, тетратионат. Рост с ТС и ТТ в качестве субстрата проходил в хемолитоавтотрофных условиях. Все данные представлены как средние значения и стандартные отклонения по крайней мере трех повторных определений. Для анализа данных использовался двухфакторный дисперсионный анализ. ∗∗∗∗ p <0,0001, ∗∗∗ p = 0.0002–0,0005, ∗∗ p = 0,013, ∗ p = 0,0101–0,0362.
Мутации в Sm
rpoE4 или Sm sorT не изменяют фенотипы роста и не обнаруживают активацию SmRpoE4, зависящую от фазы ростаПостоянная активация сигма-фактора RpoE1 ECF в Sm. meliloti 1021, на что указывает постоянная активация Sn_ sorA p (дополнительный рисунок S4), вероятно, влияет на паттерны экспрессии sorT и rpoE 4 связанных генов, и мы оценили это с помощью Sm.meliloti 1021 штаммы с нокаутом гена sorT или rpoE4 . Все штаммы показали одинаковые темпы роста, причем рост на таурине был медленнее, чем на средах, содержащих глюкозу, на которых, что интересно, Sm. meliloti Штамм ΔrpoE4 показал немного сниженный рост ( p <0,01) (таблица 1 и дополнительная фигура S2), хотя это не имело место в присутствии таурина.
Таблица 1. Темпы роста S.melilot WT и мутантные штаммы в разных условиях.
Уровни активности фермента SorT в Sm. meliloti 1021 WT , как и ожидалось, с низкой активностью для глюкозосодержащих сред и высокой активностью, когда в качестве субстратов использовались таурин или глюкоза и тиосульфат (фигура 4 и дополнительная фигура S5). Напротив, в Sm постоянно присутствовали только базальные уровни активности SorT ∼0,2–0,3 Ед / мг. meliloti ΔrpoE4 , а у штамма Sm.meliloti Δ sorT , как и ожидалось, активности не обнаружено. Во всех испытанных условиях активность SmSorT SOE была максимальной во время экспоненциального роста, тогда как в стационарной фазе уровни активности SorT были снижены на 20-40% по сравнению с экспоненциальным ростом (рисунок 4 и дополнительный рисунок S5). Это также верно для среды, содержащей глюкозу, где индукция, зависящая от стационарной фазы, из-за повышенного внутреннего образования сульфита должна была быть наиболее очевидной в результате отсутствия субстрата для роста, генерирующего сульфит.
Базальная активность, наблюдаемая в штамме с нокаутом rpoE4 , вероятно, является результатом слабого взаимодействия SmRpoE1 с промотором Sm_ sorT , наблюдаемого в анализах репортерного гена. Сравнительно более высокие базальные уровни экспрессии sorT в Sm. meliloti 1021 WT (0,7–1,0 Ед / мг, дополнительная таблица S1), вероятно, обусловлен активацией промотора Sm_ rpoE4 с помощью SmRpoE1, что наблюдалось в экспериментах in vitro .
Анализ экспрессии генов в Sm. meliloti 1021 WT и Sm. meliloti Δ rpoE 4 штаммов соответствовали ожиданиям для оперонов rpoE4 и sorT . Максимальная экспрессия гена Sm sorT происходила в присутствии тиосульфата, в то время как во время роста на глюкозе наблюдались только низкие уровни экспрессии Sm sorT (Фиг.4). Sm rpoE4 и ген родственного антисигма-фактора SMc_04050 экспрессировались на низких, но почти постоянных уровнях, независимо от ростовой среды, при этом экспрессия ASF снижалась до ~ 12-17% от уровней экспрессии Sm rpoE4 (Рисунок 4 и дополнительный рисунок S6. ).
Такой же паттерн экспрессии наблюдался также для Sm rpoE1 и SMc_01420 (RpoE1 ASF), где, несмотря на общие очень высокие уровни экспрессии гена во всех условиях, экспрессия ASF была снижена на ∼80–85%, в то время как экспрессия ассоциированного гена SMc_01418 была высокой на всем протяжении и очень мало изменялась в зависимости от условий роста (рис. 4).
Для нокаутного штамма Sm rpoE4 паттерны экспрессии генов в области гена Sm rpoE1 не были затронуты, в то время как экспрессия Sm rpoE4 и SMc_04050 отсутствовала.Экспрессия Sm sorT была снижена до базовых уровней, подтверждая результаты ферментных анализов (фиг. 4 и дополнительные рисунки S5, S6).
Из дополнительных генов, предложенных Bastiat et al., Как часть регулона SmRpoE1. (2012) только SMc_02154 продемонстрировал значительную экспрессию, при этом уровни экспрессии и паттерны были аналогичны тем, которые наблюдались для самого Sm rpoE1 . Напротив, гены, которые, как предполагается, контролируются SmRpoE4 ( SMc04164 , SMc00821 и SMc00108 ), были экспрессированы на очень низких уровнях повсюду и не показали изменений между Sm.meliloti WT и Sm. meliloti Δ rpoE 4 штаммов, что указывает на то, что они не подлежат прямой регуляции с помощью SmRpoE4 в Sm. meliloti 1021 (Рисунок 4 и дополнительный рисунок S6).
Обсуждение
Окисление сульфита является важным процессом для всех бактерий, которые разлагают соединения серы как источники углерода или энергии, и здесь мы показали, что, несмотря на четко различающиеся типы метаболизма серы, наличие структурно различных SOE и различные модели базальной регуляции SOE, Основной механизм регуляции SOE сохраняется у двух разных видов почвенных бактерий, Sm.meliloti и St. novella (Kappler, Bailey, 2005; Mcgrath et al., 2015).
У обоих видов индукция экспрессии гена SOE запускается сульфитом и в основном зависит от соответствующего родственного сигма-фактора ECF. С сульфитом в качестве триггера индукция экспрессии SOE у обоих видов специфична для субстратов, которые приводят к образованию сульфита либо посредством абиотических процессов (например, тиосульфат), либо метаболизируются с сульфитом в качестве промежуточного продукта (Sn: тиосульфат и, возможно, тетратионат, Sm: таурин. ).Индукция экспрессии гена SOE была тесно связана с присутствием сульфита, продуцируемого извне или в результате энергосберегающих метаболических процессов во время экспоненциального роста, и мы не нашли доказательств значительной экспрессии гена SOE во время стационарной фазы роста в результате усиленных процессов внутреннего пищеварения. . Поэтому мы предлагаем упрощенную модель активации SOE, которая, вероятно, применима ко многим видам бактерий, где сигма-факторы ECF обнаруживаются выше или ниже генов, кодирующих SOE, и где регулирование в основном зависит от присутствия сульфита, который приводит к высвобождению родственные сигма-факторы ECF из их соответствующих ASF по еще неизвестному механизму (Рисунок 5 и дополнительные рисунки S7, S10).
Рисунок 5. Модель регуляции гена SOE (A, B) и филогенетическое дерево, показывающее различные группы сигма-факторов ECF, связанных с генами, кодирующими SOE (C) . (A) Консервативный способ регуляции экспрессии гена SOE родственными сигма-факторами ECF. (B) Регуляция экспрессии гена SOE двумя контурами регуляции сигма-фактора ECF — величина ответа и индукционный сигнал, по-видимому, видоспецифичны. (C) Соседнее дерево сигма-факторов ECF, принадлежащих к группе 26 ECF с группами 12 и 15 ECF, использовало эталоны в качестве групп.Три группы сигма-факторов ECF, связанных с SOE, обозначены более толстыми линиями и метками: St. novella, SigE и Sm. meliloti RpoE4 выделены более крупным шрифтом и подчеркиванием. Значения начальной загрузки даны как процент сохранения за 500 репликаций. Сокращения: АЧС, антисигма фактор; SigE, сигма-фактор ECF, связанный с SOE-геном; Ген SOE, ген, кодирующий фермент, окисляющий сульфит; Мишень RpoE1, ген, контролируемый сигма-фактором RpoE1 ECF; сплошные стрелки указывают на положительное регулирование, а толщина стрелки указывает уровень активации; Пунктирные стрелки / пунктирные и пунктирные стрелки — предполагаемые взаимодействия или взаимодействия, которые не были согласованы между исследуемыми здесь организмами.Пунктирные линии: взаимодействие родственных сигма-факторов SOE с их собственными промоторами, которые не всегда присутствуют; точки и тире: активация SOE-ассоциированных генов на основе RpoE1, не все из них реализуются у каждого изучаемого здесь вида (дополнительный рисунок S8).
Дополнительный уровень сложности может быть добавлен к регуляции гена SOE за счет наличия второй регуляторной цепи, которая включает сигма-факторы ECF типа RpoE1. Сигма-факторы RpoE1 как из Sm. meliloti и St.novella были способны взаимодействовать либо с промоторами генов, кодирующих SOE, и / или с промоторами родственных сигма-факторов ECF (SmRpoE4 / SnSigE) in vitro , но сила взаимодействия и предпочтения промоторов четко различались между видами (рис. ). В то время как SnRpoE1 сильно активировал промотор Sn_ sorA , но не взаимодействовал с промотором Sn_ sigE , SmRpoE1 был способен в первую очередь активировать Sm_ rpoE4 p и, в гораздо меньшей степени, промотор Sm_ sorT .Это указывает на то, что в St. novella , где этот сигма-фактор никогда не изучался, RpoE1 может оказывать свое действие путем прямой активации промотора Sn_ sorA , тогда как в Sm. meliloti Основанная на RpoE1 регуляция будет происходить в основном за счет активации экспрессии Sm rpoE4 . Таким образом, SnRpoE1 может быть ответственным за активацию экспрессии гена Sn sorA , когда в ростовой среде присутствует активирующий субстрат SnRpoE1, тетратионат.
В См.meliloti , штамм 1021 SmRpoE1, по-видимому, постоянно активируется, а также сверхэкспрессируется (рисунки 1, 4 и дополнительный рисунок S4), подтверждая, что укорочение C-конца гена, кодирующего SnRpoE1 ASF (SMc_01420), обнаруженное в более ранних исследованиях, отменяет его способность эффективно секвестр RpoE1 (Schlüter et al., 2013). Однако постоянная активация SmRpoE1 ясно продемонстрировала, что SMRpoE1 способен активировать экспрессию гена Sm sorT in vivo , и объясняет необычную высокую базальную активность SOE, присутствующую в этом штамме (Рисунок 1).В см. meliloti GMI11495, где, как и у большинства Sm. meliloti , SmRpoE1 ASF не усечен, экспрессия гена Sm sorT на основе RpoE1 наблюдалась только в присутствии таурина (Bastiat et al., 2012).
В целом, хотя RpoE1-опосредованная регуляция экспрессии гена SOE присутствует у обоих видов, конкретные условия, при которых требуется этот регуляторный контур, значительно различаются, как и величина и режим регуляции гена SOE у двух видов.Поэтому мы предполагаем, что регуляция на основе RpoE1 является вторичным механизмом регуляции гена SOE, который необходимо будет изучить в контексте метаболизма серы, присутствующего у видов, которые содержат как RpoE4 / SigE-подобные, так и RpoE1-подобные сигма-факторы ECF (рис. Рисунок S7).
В итоге мы представили обновленную модель активации экспрессии гена SOE сигма-факторами ECF, которая показывает, что присутствие сульфита является основным драйвером экспрессии гена SOE у двух видов α-протеобактерий, которые представляют разные типы бактериального метаболизма серы. и что совместная регуляция экспрессии гена SOE вторым сигма-фактором ECF происходит у обоих видов, но использует разные механизмы регуляции.Гены сигма-фактора ECF, обнаруженные в непосредственной близости от генов, кодирующих SOE, встречаются по крайней мере в трех филогенетически различных бактериальных группах, две из которых содержат α-протеобактерии (группа 1 — общие и связанные с растениями почвенные бактерии, такие как Rhodobacterales и Rhizobiales, группа 2 — в основном морские Rhodobacterales), а третий содержит исключительно виды β-протеобактерий (группа 3 — в основном последовательности Burkholderiales, группа 3a Delftia sp., Comamonas sp. и Bordetella sp., группа 3b: Acidovorax sp., Thauera sp. и Burkholderia sp.; всего 130 последовательностей во всех трех группах) (Рисунок 5 и дополнительные рисунки S8, S9). Консенсусная последовательность промотора (-35 GGAAT и -10 CGTC) (дополнительная фигура S1) идентифицирована в Sm. meliloti и St. novella (представители групп 1a и 1b соответственно) присутствовали перед SOE-кодирующими генами из филогенетических групп 1 и 2 (оба кластера α-протеобактерий).Существует сильное сходство между предсказанным консенсусом для сигма-фактора SmRpoE1 (Schlüter et al., 2013) и консенсусом промоторов, обнаруженным выше SOE-кодирующих генов, что может объяснять наблюдаемую совместную регуляцию. Эта консенсусная последовательность промотора, по-видимому, не присутствует выше любой из последовательностей гена SOE группы 3, и эти три группы также можно различить на основе расположения гена, кодирующего сигма-фактор ECF, относительно гена, кодирующего SOE (дополнительный рисунок S10). .
Наш филогенетический анализ также предполагает, что рекрутирование сигма-факторов ECF в области гена SOE могло происходить как минимум дважды, поскольку сигма-факторы ECF группы 3 только отдаленно связаны с теми, которые обнаружены в исследуемых здесь группах 1 и 2 α-Proteobacterial. (~ 40% идентичности аминокислот), и предварительные исследования также показывают, что не существует близкого гомолога сигма-факторов RpoE1 ECF у видов группы 3. Учитывая большое количество известных групп сигма-факторов ECF (Staron et al., 2009) вполне вероятно, что существуют дополнительные группы связанных с SOE сигма-факторов ECF, и будущие исследования должны быть сосредоточены на них, а также на регулировании SOE у бактерий, которые, как известно, содержат SOE, не связанные с сигма-факторами ECF. Дальнейшая работа также необходима для понимания молекулярных деталей восприятия сульфита ASF и высвобождения / активации секвестрированного сигма-фактора, а также регуляции сигма-факторов ECF, таких как SnSigE, которые не подлежат ауторегуляции.
Авторские взносы
YT, CZ, MN, LO’R, RD, LR и YW выполнили экспериментальную работу.SB внесла свой вклад в биоинформатический анализ. YT, RD и LO внесли свой вклад в написание рукописи. Великобритания контролировала студенческие эксперименты и отвечала за подготовку окончательной рукописи и рисунков.
Финансирование
Эта работа была поддержана грантом (DP0878525) и стипендией Австралийского исследовательского совета для Великобритании и грантом сообщества DoE / Joint Genome Institute на секвенирование (CSP_787087) для Великобритании и SB. MN получил стипендию от факультета будущего (Фонд Шлюмберже).
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы хотели бы поблагодарить Александра Буй за помощь в некоторых аспектах анализа репортерных генов.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https: // www.frontiersin.org/articles/10.3389/fmicb.2019.00960/full#supplementary-material
Сноски
- www.ncbi.nlm.nih.gov
- http://ecf.g2l.bio.uni-goettingen.de:8080/ECFfinder/
- http://meme.nbcr.net/
Список литературы
Алексеев, М. Ф. (1999). Серия pKNOCK мобилизуемых суицидных векторов с широким кругом хозяев для нокаута гена и направленной вставки ДНК в хромосому грамотрицательных бактерий. BioTechniques 26, 824–826.
PubMed Аннотация | Google Scholar
Альтшул С. Ф., Мэдден Т. Л., Шаффер А. А., Чжан Дж., Чжан З., Миллер В. и др. (1997). Gapped BLAST и PSI-BLAST: новое поколение программ поиска по базам данных белков. Nucleic Acids Res. 25, 3389–3402. DOI: 10.1093 / nar / 25.17.3389
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Анг, В. К., Махбоб, М., Дуиб, Р., и Капплер, У. (2017).Окисление соединений серы и совместная ассимиляция углерода в галогеналкалифильных окислителях серы Thioalkalivibrio по сравнению с и Thioalkalimicrobium aerophilum . Res. Microbiol. 168, 255–265. DOI: 10.1016 / j.resmic.2016.12.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Осубель, Ф. М., Брент, Р., Кингстон, Р. Э., Мур, Д. Д., Сейдман, Дж. Г., Смит, Дж. А. и др. (2005). «Текущие протоколы в молекулярной биологии», в Current Protocols in Molecular Biology , ed.К. Янссен (Хобокен, Нью-Джерси: John Wiley & Sons Inc.).
Google Scholar
Бейли, Т. Л., Боден, М., Буск, Ф. А., Фрит, М., Грант, К. Э., Клементи, Л. и др. (2009). MEME Suite: инструменты для обнаружения и поиска мотивов. Nucleic Acids Res. 37, W202 – W208. DOI: 10.1093 / nar / gkp335
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bastiat, B., Sauviac, L., Picheraux, C., Rossignol, M., and Bruand, C. (2012). Sinorhizobium meliloti сигма-факторы RpoE1 и RpoE4 активируются в стационарной фазе в ответ на сульфит. PLoS One 7: e50768. DOI: 10.1371 / journal.pone.0050768
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Берджесс Р. Р. (1996). Очистка избыточно продуцированных сигма-факторов РНК-полимеразы Escherichia coli путем солюбилизации телец включения и рефолдинга из сакозила. Methods Enzymol. 273, 145–149. DOI: 10.1016 / s0076-6879 (96) 73014-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Берджесс, Р.Р. (2009). Рефолдинг солюбилизированных белков телец включения. Methods Enzymol. 463, 259–282. DOI: 10.1016 / S0076-6879 (09) 63017-2
CrossRef Полный текст | Google Scholar
Дэвидсон, М.С., Рой, П., и Саммерс, А.О. (1985). Транспозиционный мутагенез Thiobacillus novellus и Thiobacillus vs. Заявл. Environ. Microbiol. 49, 1436–1441.
PubMed Аннотация | Google Scholar
Дэвидсон, М.С., Саммерс, А.О. (1983). Плазмиды с широким спектром хозяев функционируют в роду Thiobacillus. Заявл. Environ. Microbiol. 46, 565–572.
Google Scholar
Д’эррико, Г., Ди Салле, А., Ла Кара, Ф., Росси, М., и Каннио, Р. (2006). Идентификация и характеристика новой бактериальной сульфитоксидазы без гем-связывающего домена из Deinococcus radiodurans . J. Bacteriol. 188, 694–701. DOI: 10.1128 / jb.188.2.694-701.2006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дитта, Г., Шмидхаузер, Т., Якобсон, Э., Лу, П., Лян, Х. У., Финли, Д. Р. и др. (1985). Плазмиды, относящиеся к вектору широкого круга хозяев, pRK 290, полезны для клонирования генов и для мониторинга экспрессии генов. Плазмида 13, 149–153. DOI: 10.1016 / 0147-619x (85) -x
CrossRef Полный текст | Google Scholar
Фрит, М. К., Сондерс, Н. Ф. У., Кобе, Б., и Бейли, Т. Л. (2008). Обнаружение мотивов последовательностей с произвольными вставками и делециями. PLoS Comput. Биол. 4: e1000071.DOI: 10.1371 / journal.pcbi.1000071
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Галиберт Ф., Финан Т., Лонг С., Пулер А., Абола П., Ампе Ф. и др. (2001). Составной геном симбионта бобовых Sinorhizobium meliloti . Наука 293, 668–672. DOI: 10.1126 / science.1060966
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Грант, В. М. (1947). Колориметрическое определение диоксида серы. Ind.Англ. Chem. Анальный. Редактировать. 19, 345–346. DOI: 10.1021 / ac60005a023
CrossRef Полный текст | Google Scholar
Гупта С., Стаматояннопулос Дж., Бейли Т. и Нобл В. (2007). Количественная оценка сходства между мотивами. Genome Biol. 8: R24.
Google Scholar
Капплер У. (2008). «Бактериальные сульфитдегидрогеназы — ферменты только для хемолиттрофов?» В Microbial Sulfur Metabolism , ред. К. Даля и К. Г. Фридриха (Берлин: Springer), 151–169.DOI: 10.1007 / 978-3-540-72682-1_13
CrossRef Полный текст | Google Scholar
Капплер У. и Бейли С. (2005). Молекулярная основа внутримолекулярного переноса электрона в сульфитокисляющих ферментах раскрывается структурой высокого разрешения гетеродимерного комплекса каталитической субъединицы молибдоптерина и субъединицы цитохрома типа c . J. Biol. Chem. 280, 24999–25007. DOI: 10.1074 / jbc.m503237200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Капплер, У., Беннетт, Б., Ретмайер, Дж., Шварц, Г., Дойцманн, Р., Мсеван, А.Г. и др. (2000). Сульфит: цитохром c оксидоредуктаза из Thiobacillus novellus — очистка, характеристика и молекулярная биология гетеродимерного члена семейства сульфитоксидаз. J. Biol. Chem. 275, 13202–13212. DOI: 10.1074 / jbc.275.18.13202
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Капплер, У., Давенпорт, К., Битсон, С., Лукас, С., Lapidus, A., Copeland, A., et al. (2012). Полная последовательность генома факультативно хемолитоавтотрофного и метилотрофного штамма типа альфа-Proteobacterium Starkeya novella (ATCC 8093T). Стенд. Genomic Sci. 7, 44–58. DOI: 10.4056 / sigs.3006378
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Капплер, У., Фридрих, К.Г., Трупер, Х.Г., и Даль, К. (2001). Доказательства двух путей окисления тиосульфата в Starkeya novella (ранее Thiobacillus novellus ). Arch. Microbiol. 175, 102–111. DOI: 10.1007 / s002030000241
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Капплер У., Ноувенс А. С. (2013). Метаболическая адаптация и трофические стратегии почвенных бактерий — С1-метаболизм и хемолитотрофия серы в Starkeya novella . Фронт. Microbiol. 4: 304. DOI: 10.3389 / fmicb.2013.00304
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Капплер, У., и Шварц, Г. (2016). «Семейство сульфитоксидаз молибденовых ферментов», в Molybdenum and Tungsten Enzymes , ред. Р. Хилле, К. Шульцке и М. Л. Кирк (Кембридж: Королевское химическое общество), 240–273. DOI: 10.1039 / 9781782623915-00240
CrossRef Полный текст | Google Scholar
Кидд, С. П., Поттер, А. Дж., Апичелла, М. А., Дженнингс, М. П., и Максуан, А. Г. (2005). NmlR Neisseria gonorrhoeae : новый окислительно-восстановительный фактор транскрипции из семейства MerR. Мол. Microbiol. 57, 1676–1689. DOI: 10.1111 / j.1365-2958.2005.04773.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лэммли, У.К. (1970). Расщепление структурного белка при сборке головки бактериофага Т4. Природа 227, 680–685. DOI: 10.1038 / 227680a0
CrossRef Полный текст | Google Scholar
Лоу, Л., Килмартин, Дж. Р., Бернхард, П. В., и Капплер, У. (2011). Как «атипичные» сульфитдегидрогеназы связаны с клеточным метаболизмом? — Взаимодействие между сульфитдегидрогеназой SorT и малыми окислительно-восстановительными белками. Фронт. Microbiol. 2:58. DOI: 10.3389 / fmicb.2011.00058
CrossRef Полный текст | Google Scholar
Макграт, А. П., Лэминг, Э. Л., Касас Гарсия, Г. П., Квансакул, М., Гусс, Дж. М., Тревелла, Дж. И др. (2015). Структурные основы межбелкового переноса электрона при окислении сульфита бактерий. eLife 4: e09066. DOI: 10.7554 / eLife.09066
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мюнх, Р., Хиллер, К., Барг, Х., Хельдт, Д., Linz, S., Wingender, E., et al. (2003). PRODORIC: прокариотическая база данных регуляции генов. Nucleic Acids Res. 31, 266–269. DOI: 10.1093 / nar / gkg037
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Praszkier, J., Wilson, I. W., and Pittard, A.J. (1992). Мутации, влияющие на трансляционную связь между генами rep миниплазмиды IncB. J. Bacteriol. 174, 2376–2383. DOI: 10.1128 / jb.174.7.2376-2383.1992
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рамакерс, К., Руйтер, Дж. М., Депрез, Р. Х. Л. и Мурман, А. Ф. М. (2003). Не требующий допущений анализ количественных данных полимеразной цепной реакции (ПЦР) в реальном времени. Neurosci. Lett. 339, 62–66. DOI: 10.1016 / s0304-3940 (02) 01423-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Родс Д., Файролл Л. и Крейтон Т. Э. (1997). «Анализ последовательностей ДНК-связывающих белков», в Protein Function , ed. Б. Д. Хеймс (Оксфорд: IRL Press), 215–244.
Google Scholar
Schlüter, J.-P., Reinkensmeier, J., Barnett, M.J., Lang, C., Krol, E., Giegerich, R., et al. (2013). Глобальное картирование сайтов старта транскрипции и промоторных мотивов в симбиотической α-протеобактерии Sinorhizobium meliloti 1021. BMC Genomics 14: 156. DOI: 10.1186 / 1471-2164-14-156
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Саймон Дж. И Кронек П. М. Х. (2013). «Глава вторая — микробное сульфитное дыхание», в Advances in Microbial Physiology , ed.К. П. Роберт (Кембридж, Массачусетс: Academic Press), 45–117. DOI: 10.1016 / b978-0-12-410515-7.00002-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Старон А., София Х. Дж., Дитрих С., Ульрих Л. Э., Лизеганг Х. и Машер Т. (2009). Третий столп бактериальной передачи сигнала: классификация семейства белков сигма-фактора экстрацитоплазматической функции (ECF). Мол. Microbiol. 74, 557–581. DOI: 10.1111 / j.1365-2958.2009.06870.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тамура, К., Петерсон, Д., Петерсон, Н., Стечер, Г., Ней, М., и Кумар, С. (2011). MEGA5: анализ молекулярной эволюционной генетики с использованием методов максимального правдоподобия, эволюционного расстояния и максимальной экономии. Мол. Биол. Evol. 28, 2731–2739. DOI: 10.1093 / molbev / msr121
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ульрих, Л. Е., Жулин, И. Б. (2007). MiST: база данных по трансдукции микробных сигналов. Nucleic Acids Res. 35, D386 – D390.
Google Scholar
Поглощениежелеза, опосредованное связыванием H-ферритина с рецептором TIM-2 в клетках мыши
Abstract
Ферритин специфически и насыщенно связывается с различными типами клеток, и недавно было клонировано несколько рецепторов ферритина.TIM-2 является специфическим рецептором H-ферритина (HFt) у мышей. TIM-2 является членом семейства белков Т-клеточного иммуноглобулина и муцинового домена (TIM) и играет важную роль в иммунитете. Экспрессия TIM-2 за пределами иммунной системы указывает на то, что этот рецептор может иметь более широкие роли. Мы проверили, может ли связывание ферритина с TIM-2 служить механизмом доставки железа. TIM-2 трансфицировали в нормальные (TCMK-1) клетки почек мыши, где он соответствующим образом экспрессировался на поверхности клетки.HFt метили 55 Fe и 55 Fe-HFt инкубировали с TIM-2-положительными клетками или контролями. 55 Поглощение Fe-HFt наблюдалось только в TIM-2-положительных клетках. Поглощение HFt также наблюдалось в B-клетках A20, которые экспрессируют эндогенный TIM-2. Уровни TIM-2 не повышались хелатированием железа. Поглощение 55 Fe-HFt было специфическим и зависело от температуры. HFt, захваченный TIM-2-положительными клетками, прошел через эндосому и в конечном итоге попал в лизосомный компартмент, что отличает путь HFt от пути трансферрина, классического носителя для доставки клеточного железа.Железо, доставленное после связывания HFt с TIM-2, попало в цитозоль и стало метаболически доступным, что привело к увеличению уровней эндогенного внутриклеточного ферритина. Мы пришли к выводу, что TIM-2 может функционировать как путь захвата железа.
Образец цитирования: Han J, Seaman WE, Di X, Wang W, Willingham M, Torti FM, et al. (2011) Поглощение железа, опосредованное связыванием H-ферритина с рецептором TIM-2 в клетках мыши. PLoS ONE 6 (8): e23800. https://doi.org/10.1371 / journal.pone.0023800
Редактор: Мартин В. Бречбиль, Национальный институт здравоохранения, Соединенные Штаты Америки
Поступила: 19 мая 2011 г .; Принята к печати: 25 июля 2011 г .; Опубликовано: 19 августа 2011 г.
Авторские права: © 2011 Han et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Эта работа была частично поддержана грантами Национальных институтов здравоохранения (R01 AI061164 [WES], R01 DK071892 [SVT] и R37 DK42412 [FMT]). Спонсор не принимал участия в планировании исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что конкурирующих интересов не существует.
Введение
Ферритин — это повсеместно распространенный белок, в основном известный своей ролью в хранении железа и детоксикации [1], [2].Он состоит из двух типов субъединиц, называемых H и L; двадцать четыре из них собираются, чтобы сформировать белок ферритин. Соотношение субъединиц в собранном белке определяется типом ткани, а также модулируется экзогенными стимулами [1]. Субъединица H ферритина обладает ферроксидазной активностью [3] и способствует окислению железа, тогда как субъединица L способствует зародышеобразованию железа в центральном ядре. До 4500 атомов железа могут храниться в нетоксичной, но биодоступной форме в центральной полости белка ферритина.
Ферритин посттранскрипционно регулируется железом посредством действия регуляторных белков железа (IRP), которые действуют как репрессоры трансляции ферритина (см. [4], [5] для обзора). Когда уровни внутриклеточного железа повышаются, IRP инактивируются, и мРНК ферритина транслируется. IRP также контролируют уровни рецептора трансферрина 1 (TfR1), белка, который опосредует захват железа, связанного с трансферрином, основным источником железа в клетках млекопитающих. В случае TfR1 регуляция IRP дестабилизирует мРНК TfR1 в условиях восполнения запасов железа.Напротив, мРНК и белок TfR1 увеличиваются в условиях истощения запасов железа, например, индуцированного хелатором железа.
Ферритин существует в нескольких компартментах и помимо своей классической роли во внутриклеточном хранении железа выполняет функции. Ферритин присутствует в цитозоле большинства клеток, а также в ядре или митохондриях некоторых типов клеток. Кроме того, ферритин присутствует в кровотоке млекопитающих, и его уровни могут резко увеличиваться при воспалении и раке [6], [7], [8].Роль внеклеточного ферритина остается неопределенной. Экзогенный ферритин оказывает иммуносупрессивное действие, подавляя функцию лимфоцитов [9], [10], [11] и влияя на передачу сигнала, опосредованную хемокиновым рецептором [12]. Ферритин также действует как провоспалительная сигнальная молекула в звездчатых клетках печени [13] и подавляет антиангиогенные эффекты кининогена [14]. Экзогенный ферритин также может служить средством доставки железа. Например, ферритин, выделяемый клетками Купфера, эффективно поглощается гепатоцитами [15], а ферритин, секретируемый макрофагами, служит источником железа для клеток-предшественников эритроидов [16].
Ферритин специфически и насыщенно связывается с различными типами клеток [10], [17], [18], [19], [20], [21], и недавно были клонированы несколько рецепторов ферритина. TIM-2 мыши был первым клонированным рецептором ферритина [22]. Это специфический рецептор для HFt (т.е. ферритина, состоящего из субъединицы H), он присутствует в В-клетках зародышевого центра, эпителиальных клетках желчных протоков печени и клетках дистальных канальцев почек почек, а также в олигодендроцитах мыши [23]. Поскольку олигодендроциты не экспрессируют рецептор трансферрина (который отвечает за поглощение железа в большинстве клеток млекопитающих), предполагается, что TIM-2 является основным механизмом захвата железа этими клетками [23].Другим рецептором ферритина на клеточной поверхности является Scara5, рецептор скавенджера мыши [24]. В отличие от TIM-2, который является рецептором HFt, Scara5 предпочтительно связывает LFt (ферритин, богатый субъединицей L). Scara5 играет важную роль в органогенезе почек и служит средством доставки железа к капсулярным клеткам почек во время развития [24]. Единственным рецептором ферритина, идентифицированным на сегодняшний день в клетках человека, является рецептор трансферрина 1, который связывает как HFt, так и трансферрин [25].
Последствия связывания ферритина с его рецептором TIM-2 не оценивались.TIM-2 является членом семейства белков Т-клеточного иммуноглобулина и муцинового домена (TIM) [26] и играет важную роль в иммунитете [27]. Мыши с дефицитом TIM-2 имеют повышенный иммунный ответ Th3, и они демонстрируют усиление воспаления легких после аллергического заражения [28]. Эктопическая экспрессия TIM-2 также нарушает индукцию NFAT и AP-1 в Т-клетках in vitro [29]. Однако экспрессия TIM-2 за пределами иммунной системы указывает на то, что этот рецептор может иметь более широкие роли.Например, TIM-2 регулирует дифференцировку гепатоцитов плода мыши [30].
В этом исследовании мы проверили, может ли связывание ферритина с TIM-2 служить механизмом доставки железа в клетки за пределами мозга. Мы наблюдали, что нагруженный железом HFt поглощается TIM-2-положительными клетками через эндоцитарный путь с доставкой в лизосомы. Железо, доставляемое по этому пути, становится метаболически доступным, что приводит к повышению уровня внутриклеточного ферритина. Мы пришли к выводу, что ферритин может доставлять железо к клеткам, экспрессирующим TIM-2.
Материалы и методы
Химические вещества и клеточные культуры
Сульфат аммония железа, нитрилотриуксусная кислота (NTA), сульфат аммония железа, оксид фениларсина (PAO) и мышиный апо-трансферрин были приобретены у Sigma (Сент-Луис, Миссури). 55 FeCl 3 был приобретен у Perkin Elmer (Фремонт, Калифорния). Линия эпителиальных клеток почек мыши TCMK-1 и линия В-клеток мыши A20 были получены из Американской коллекции типовых культур (ATCC, Rockville, MD).Клетки TCMK-1 поддерживали в бессывороточной полной среде PC-1, закупленной у Lonza (Allendale, NJ), с добавлением 100 единиц / мл пенициллина, 100 мкг / мл стрептомицина и 2 мМ глутамина. Клетки A20 поддерживали в среде RPMI 1640 от Invitrogen (Карлсбад, Калифорния) с добавлением 2 мМ L-глутамина, 1,5 г / л бикарбоната натрия, 4,5 г / л глюкозы, 10 мМ HEPES, 1,0 мМ пирувата натрия, 0,05 мМ 2-меркаптоэтанола. и 10% фетальной бычьей сыворотки (Invitrogen [Карлсбад, Калифорния]). Клетки инкубировали в увлажненной атмосфере, содержащей 5% CO 2 , при 37 ° C.
Создание стабильных клонов TIM-2
КлеткиTCMK-1 из ATCC трансфицировали содержащими TIM-2 и пустыми векторными плазмидами (BSR-α-FLAG [22]). Через 24 часа в среду для клональной селекции добавляли 1000 мкг / мл G418. После отбора стабильные клоны поддерживали в среде, содержащей 350 мкг / мл G418.
Проточная цитометрия
Один миллион клеток А20 собирали и промывали PBS. Клетки блокировали инактивированной сывороткой AB человека (Innovative Research [Нови, Мичиган]) в течение 30 минут, а затем инкубировали с 1-2 мкг биотин-связанного моноклонального антитела против TIM-2 [22] в 1% BSA (Sigma Aldrich [ Санкт-ПетербургLouis, Missouri]) / PBS в течение 1 часа при 4 ° C в отсутствие проницаемых агентов. После инкубации клетки промывали PBS, а затем инкубировали со стрептавидином, связанным с аллофикоцианином (APC), в течение 1 часа. Клетки промывали и анализировали на проточном цитометре FACS Aria (Becton Dickinson) с использованием аналитического программного обеспечения Diva и DakoCyotamination Summit 4.3.
Иммунопреципитация
Клетки лизировали в буфере для лизиса (0,12% Triton X-100, 0,15 M NaCl, 2,0 мМ триэтаноламина, pH 7,8, 2.5 мкМ CaCl 2 , 1 мкМ MgSO 4 , 0,01% азид натрия), содержащие только что добавленные 1 мкг / мл апротинина, 0,5 мкг / мл лейпептина, 1 мМ PMSF и 1 мМ вандат. Лизаты инкубировали 2–3 часа на льду и осветляли центрифугированием при 16000 x g в течение 20 минут при 4 ° C. Шестьдесят мкг белка использовали для иммунопреципитации и 15 мкг для вестерн-блоттинга. Для иммунопреципитации белковые экстракты инкубировали с моноклональными антителами против TIM-2 [22] и шариками с белком G [Invitrogen, CA] при 4 ° C в течение ночи.Затем шарики трижды промывали буфером FROP (150 мМ NaCl, 5 мМ CHAPS, 50 мМ Tris-HCl, pH 8,0), суспендировали в загрузочном буфере 2xSDS, денатурировали нагреванием и разделяли на 12% геле SDS-PAGE. Гель переносили на нитроцеллюлозную мембрану и подвергали блоттингу на белок TIM-2 с использованием кроличьих поликлональных антител против TIM-2 [22], затем конъюгированные с HRP анти-кроличьи IgG и инкубацию с хемилюминесцентным субстратом (SuperSignal West Pico, Thermo Scientific). Предварительно окрашенные стандарты (полноразмерные маркеры молекулярной массы «радуга», № по каталогу RPN800E, GE Healthcare Life Sciences [Piscataway, NJ]) использовали для оценки молекулярных масс.
Очистка рекомбинантного ферритина H и загрузка железа
Мышиный HFt продуцировали в E. coli и очищали, как описано [31]. Эндотоксин удаляли адсорбцией на иммобилизованном полимиксине B (Detoxi-Gel TM, Pierce Chemical Co.) в соответствии с методами производителя. Удаление эндотоксина подтверждали с помощью анализа лизата амебоцитов limulus (QCL-1000, Cambrex Bio Science). Чтобы загрузить железо в ферритин, 450 мкМ сульфата двухвалентного аммония добавляли к 50 мкг / мл H-ферритина, разбавленного 0.1 M HEPES pH 6,0 [32]. Поглощение железа контролировали спектрофотометрически при 310 нм. Для маркировки рекомбинантного HFt мыши с помощью 55 Fe, 125 мкКи 55 FeCl 3 добавляли к 50 мкг / мл HFt в буфере, содержащем 20 мкМ лимонной кислоты, 2 мМ аскорбата и 0,1 М HEPES (pH 6,0). После этого добавляли 450 мкМ немеченого сульфата двухвалентного аммония и инкубировали в течение дополнительного часа. Затем образец диализовали в 0,1 М HEPES при 4 ° C в течение ночи [33]. Конечное соотношение железо: ферритин составляло приблизительно 2000 ± 1, как было определено анализом феррозина [34].Удельная активность Fe-ферритина 55 варьировала для разных препаратов, и прямые сравнения всегда проводились с использованием одной и той же партии Fe-ферритина 55 . Ферритин фильтровали через шприц-фильтр 0,45 мкм перед использованием культуры клеток.
ОТ-ПЦР в реальном времени
ПЦР в реальном времени выполняли на системе обнаружения последовательностей ABI Prism 7000 (Applied Biosystems, Foster City, CA), как описано [35]. Для количественной оценки использовали метод стандартной кривой. Тотальную РНК выделяли с использованием реагента Trizol в соответствии с инструкциями производителя.30 мкг РНК обрабатывали 35U ДНКазой I (Promega) в течение 30 мин при 37 ° C. После расщепления ДНКазой I РНК очищали с использованием набора Absolutely RNA RT-PCR Miniprep (Stratagene) в соответствии с протоколом производителя. При синтезе кДНК использовали праймер oligodT. β-актин измеряли в качестве внутреннего контроля. Праймеры для ПЦР были разработаны с помощью программного обеспечения IDT PrimerQuest (Intergrated DNA Technologies, Inc.). Прямой праймер для мышиного TIM-2 был: 5′-CCAACACCAGCACACACAGAGACCT-3 ‘, а обратный праймер был: 5′-TGGCTTCTGTGGAGGGATTACTTCA-3’.
Наблюдение под электронной микроскопией
Всего 3 × 10 6 TIM-2 или векторных трансфектантов помещали на чашки для культивирования клеток диаметром 100 мм и оставляли для прикрепления в течение ночи перед добавлением 150 мкг HFt (полностью насыщенного железом). Клетки фиксировали 2,5% глютеральдегидом и 2% осмия, обезвоживали в этаноле, соскребали и помещали в пробирку для микроцентрифуги. Образцы пропитывали смолой, разрезали на срезы 80 нм, окрашивали 33% цитратом свинца и просматривали с помощью просвечивающего электронного микроскопа Philips 400 (Эйндховен, Нидерланды) при 60 кВ.
Биотинилирование ферритина и захват ферритина с использованием гранул стрептавидина
250 мкг HFt метили биотином с использованием набора EZ-Link Sulfo-NHS-LC-Biotin (Pierce Chemical Co., IL) в соответствии с протоколом, предоставленным производителем. Биотинилированный HFt диализовали в PBS в течение ночи при 4 ° C. 125 мкКи 55 Fe загружали в биотинилированный HFt, как описано выше, и биотинилированный- 55 Fe-HFt затем диализовали в 0,1 М HEPES в течение ночи. Три миллиона TIM-2 или векторных трансфектантов помещали в чашки для культивирования клеток диаметром 100 мм и оставляли для прикрепления в течение ночи.Два мкг / мл биотинилированного- 55 Fe-HFt (приблизительно 4 нМ) добавляли в каждый планшет и инкубировали при 37 ° C в течение 2 часов. Затем планшеты промывали 3 раза PBS и помещали в питательную среду. Клетки и среды собирали через 0, 2, 4, 8, 24 и 48 ч после инкубации с биотинилированным — 55 Fe-HFt. Лизаты клеток получали путем гомогенизации в буфере для лизиса цельных клеток (25 мМ Трис pH 7,4, 1% Тритон X-100, 1% SDS, 1% дезоксихолат натрия, 150 мМ NaCl, 2 мкг / мл апротинина, 1 мМ PMSF, полная протеаза. ингибитор [Рош]) в течение 5 секунд.Образцы осветляли центрифугированием при 12000 x g при 4 ° C в течение 15 минут. Биотин- 55 Fe-HFt иммунопреципитировали из супернатанта путем инкубации с гранулами, конъюгированными со стрептавидином (Streptavidin –APC [Jackson Immuno Research, PA]), с последующим вестерн-блоттингом для HFt с использованием поликлональных анти-HFt антител [35]. Экстракты, обедненные биотинилированным ферритином при инкубации с гранулами стрептавидина, использовали для вестерн-блоттинга эндогенного HFt.
Результаты
TIM-2 опосредует захват железа, связанного с ферритином
Чтобы проверить, может ли TIM-2 участвовать в захвате железа, мы использовали линию эпителиальных клеток почек мышей TCMK-1.Поскольку эти клетки не экспрессируют детектируемый эндогенный TIM-2, они обеспечивают чистый фон, на котором можно конкретно оценить вклад TIM-2 в ферритин-зависимое поглощение железа. Клетки TCMK трансфицировали вектором экспрессии TIM-2 или пустым векторным контролем и отбирали стабильные трансфектанты. Экспрессию TIM-2 в трансфектантах исследовали как на уровне белка, так и на уровне мРНК (рис. 1). Как и ожидалось, некоторые трансфектанты TIM-2 экспрессировали TIM-2, но TIM-2 не был обнаружен в векторных контролях, как измерено с помощью вестерн-блоттинга (рис. 1A) или RT-PCR в реальном времени (рис. 1B).
Фигура 1. Трансфицированные клетки TCMK-1 экспрессируют TIM-2.
A: Стабильные трансфектанты исследовали на экспрессию белка TIM-2 иммунопреципитацией с последующим вестерн-блоттингом. В. Положительный клон TIM-2 (№ 3) и трансфектант контрольного вектора (№ 3) тестировали на экспрессию мРНК TIM-2 с помощью ОТ-ПЦР в реальном времени (средние значения и стандартное отклонение, n = 4).
https://doi.org/10.1371/journal.pone.0023800.g001
Чтобы подтвердить, что TIM-2 надлежащим образом отображается на клеточной поверхности трансфицированных клеток, мы использовали проточную цитометрию.Мы сравнили уровни TIM-2 на клеточной поверхности в трансфектантах с клетками A20, клеточной линией лимфоцитов мыши, которая экспрессирует эндогенный TIM-2, а также с клетками A20, которые были трансфицированы вектором экспрессии TIM-2 для увеличения экспрессии TIM-2. 2 [22]. Как и ожидалось, клетки A20 экспрессировали эндогенный TIM-2, и это увеличивалось в клетках A20, трансфицированных TIM-2 (фиг. 2). Как показано на фиг. 2, экспрессия TIM-2 на клеточной поверхности клеток TCMK-TIM-2 была значительно выше, чем в векторном контроле, и того же порядка величины, что и в клетках A20, экспрессирующих эндогенный TIM-2.Иммунопреципитация подтвердила, что уровни TIM-2 в необработанных трансфектантах TCMK-TIM-2 были приблизительно эквивалентны уровням эндогенного TIM-2 в необработанных клетках A20 (фиг. 2C).
Рис. 2. TIM-2 присутствует на клеточной поверхности трансфицированных клеток.
A: Проточную цитометрию проводили на непроницаемых трансфектантах TCMK TIM-2 и трансфектантах контрольных векторов. B: Проточная цитометрия выполнялась на клетках A20 (лимфоциты мыши, которые экспрессируют эндогенный TIM-2) и клетках A20, трансфицированных TIM-2 для сверхэкспрессии.Клетки инкубировали с моноклональным антителом против TIM-2 (100 мкг / мл), а затем с FITC-связанным вторичным антителом против мыши (100 мкг / мл). Первичные антитела не включали в контроль. C: TIM-2 иммунопреципитировали из клеток TCMK, трансфицированных TIM-2, и из клеток A20 и анализировали вестерн-блоттингом. Дорожки были получены из одного и того же блота, экспонированного в течение одного и того же периода времени; промежуточные нерелевантные полосы были вырезаны.
https://doi.org/10.1371/journal.pone.0023800.g002
Чтобы проверить, может ли TIM-2 на клеточной поверхности функционировать как механизм поглощения ферритинового железа, рекомбинантный HFt был помечен 55 Fe.TCMK-TIM-2 и векторные контроли инкубировали с 55 Fe-HFt при 37 ° C. Клетки собирали через определенные промежутки времени, промывали и включали. 55 Было измерено Fe. Как показано на фиг. 3A, захват железа увеличивался в зависимости от времени в трансфектантах TIM-2. Поглощения в векторных контролях не наблюдалось. Поглощение клетками TIM-2 было специфическим и могло эффективно конкурировать с 100-кратным молярным избытком немеченого ферритина (фиг. 3B). 55 Fe-HFt также поглощался клетками A20, и поглощение ингибировалось ферритином (рис.3С).
Фигура 3. Специфическое поглощение HFt клетками, экспрессирующими TIM-2.
A. HFt метили 55 Fe и инкубировали при конечной концентрации 4 нМ при 37 ° C с TIM-2-положительными клетками TCMK или векторными контролями TCMK. B. Клетки TIM-2 TCMK инкубировали с 55 Fe-HFt в присутствии или в отсутствие 100-кратно немеченого насыщенного железом HFt. C. Клетки A20 инкубировали в течение 30 минут с 55 Fe-HFt в присутствии или в отсутствие 100-кратного немеченого HFt.Показаны средние значения и стандартные отклонения трех определений в одном эксперименте. Эксперимент повторили 3 раза с аналогичными результатами.
https://doi.org/10.1371/journal.pone.0023800.g003
Экспрессия TIM-2 не увеличивается при хелатировании железа
Поскольку переносчики железа часто регулируются железом [36], мы спросили, реагируют ли уровни TIM-2 на изменения уровней экзогенного железа. Сначала мы исследовали последовательность TIM-2 на наличие канонического элемента, реагирующего на железо (IRE).Этот элемент присутствует в нетранслируемых областях мРНК, кодирующих белки захвата, хранения и экспорта железа, и служит сайтом-мишенью для связывания IRP. В TIM-2 не было обнаружено канонической IRE-подобной последовательности (данные не показаны).
Затем мы непосредственно измерили влияние измененных уровней железа на экспрессию эндогенного TIM-2 в клетках A20. Клетки либо оставляли необработанными, либо обрабатывали 1 мМ цитратом трехвалентного аммония, 10 мкМ дефероксамином (DFO, хелатор железа) или 50 мкМ DFO в течение 24 часов, а экспрессию TIM-2 оценивали с помощью вестерн-блоттинга.Одновременно измеряли экспрессию TfR1 в качестве контроля эффектов лечения железом. Как показано на фиг. 4, обработка железом снижала TfR1, тогда как обработка хелатором железа DFO увеличивала TfR1, как и ожидалось. Напротив, не было значительного эффекта DFO на TIM-2, и железо, по-видимому, увеличивало, а не уменьшало TIM-2. Эти результаты показывают, что TIM-2 не регулируется статусом железа так же, как TfR1.
Рисунок 4. Эндогенный TIM-2 не регулируется хелатированием железа.
Тройные копии культур клеток A20 инкубировали с контрольной средой или средой, содержащей 1 мМ цитрат трехвалентного аммония (FAC), 10 мкМ дефероксиамин (DFO) или 50 мкМ дефероксиамин в течение 24 часов. Клетки собирали и экспрессию TIM-2 и TfR1 анализировали вестерн-блоттингом. GAPDH использовался в качестве контроля загрузки. B. Интенсивность изображения трех определений, показанных на (A), была определена количественно и нормализована к GAPDH; показаны средние и стандартные отклонения. Эксперимент был повторен 3 раза независимо с аналогичными результатами.
https://doi.org/10.1371/journal.pone.0023800.g004
Захват ферритина TIM-2 происходит по эндоцитарному пути
Чтобы отследить судьбу железосодержащего ферритина после поглощения клетками TCMK TIM-2, мы использовали электронную микроскопию, которая позволяет визуализировать ферритин благодаря его электронно-плотному железному ядру. Как показано на фиг.5, когда клетки TIM-2 инкубировали с насыщенным железом HFt в течение 15 минут при 37 ° C, HFt наблюдали в покрытых ямках и эндосомах (фиг.5C и 5D). Через 120 минут ферритин появился в лизосомах (рис. 5E). Поглощение ферритина зависело от температуры и резко снижалось при 4 ° C (рис. 6A – C). Эти наблюдения предполагают, что поглощение ферритина опосредовано эндоцитарным путем. Чтобы подтвердить этот результат, мы измерили поглощение 55 Fe-HFt в присутствии ингибитора эндоцитоза, оксида фениларсина (PAO). Как показано на фиг. 6D, опосредованное ферритином поглощение железа было полностью заблокировано в клетках, обработанных 10 мкМ PAO.
Рис. 5. HFt, связанный с TIM-2, направляется к эндосомам и лизосомам.
A. TCMK-TIM-2 и векторные контроли инкубировали с нагруженным железом HFt в течение 15 и 120 минут при 37 ° C и наблюдали с помощью электронной микроскопии. A. Клетки TCMK-TIM-2 без добавления HFt. B. Трансфектанты векторов, обработанные нагруженным железом HFt при 37 ° C в течение 120 минут. C. HFt в ранних эндосомах клеток TCMK-TIM-2 после 15 минут инкубации с нагруженным железом HFt при 37 ° C. D. HFt в эндосомах или мультивезикулярных тельцах после 15 минут инкубации с клетками TCMK-TIM-2 при 37 ° C.E. HFt в лизосомах после 120 минут инкубации с клетками TCMK-TIM-2 при 37 ° C. Стрелки указывают HFt с железом. 55000-кратное увеличение. Масштабная линейка равна 0,36 мкм.
https://doi.org/10.1371/journal.pone.0023800.g005
Рисунок 6. Поглощение HFt TIM-2 зависит от температуры.
A. Клетки TCMK TIM-2 инкубировали без HFt при 37 ° C. B. Клетки TCMK-TIM-2 предварительно охлаждали и инкубировали на льду в течение 2 часов в присутствии HFt, насыщенного железом. C. Клетки TCMK-TIM-2 инкубировали с насыщенным железом HFt при 37 ° C в течение 2 часов.Масштабная линейка равна 0,36 мкм. D. Трансфектанты TIM-2 инкубировали с 55 Fe-HFt в присутствии или в отсутствие 10 мкМ фениларсиноксида (PAO), ингибитора эндоцитоза. Показаны средние значения и стандартные отклонения трех определений. Эксперимент был повторен 3 раза независимо с аналогичными результатами.
https://doi.org/10.1371/journal.pone.0023800.g006
Внутриклеточное железо, высвобождаемое из HFt, поступает в биодоступный пул
Чтобы проследить судьбу HFt-связанного железа в клетках, мы приготовили биотинилированный HFt, пометили его 55 Fe и инкубировали с клетками TCMK-TIM-2 в течение двух часов.Затем клетки промывали и измеряли биотинилированный HFt и связанную с ним радиоактивность методом вытягивания с использованием гранул стрептавидина. 55 Fe в клеточном лизате, обедненном биотинилированным HFt, также измеряли. Как показано на Фигуре 7A, в этих условиях железо высвобождается из экзогенного (биотинилированного) ферритина и переносится в клеточную фракцию. Высвобождение железа происходило одновременно с деградацией биотинилированного ферритина, что соответствовало процессингу через лизосомы (рис. 5). Чтобы проверить, стало ли железо, высвобождаемое из экзогенного ферритина, стало биологически доступным, мы измерили уровни эндогенного ферритина, поскольку этот белок трансляционно регулируется железом [1].Как показано на Фигуре 7B, высвобождение железа из экзогенно поставляемого (биотинилированного) ферритина сопровождалось увеличением эндогенного ферритина. Кинетика увеличения эндогенного ферритина была аналогична описанной ранее после деградации ферритина в лизосомах [37]. Эти результаты предполагают, что 55 Fe, высвобождаемое из HFt, доставленного через TIM-2, способно проникать в биологически доступный пул, повышать уровни внутриклеточного ферритина и изменять статус клеточного железа.
Рис. 7. Железо входит в метаболически доступный пул после TIM-2-опосредованного поглощения HFt.
Трансфектанты TCMK TIM-2 инкубировали с 4 нМ биотинилированным 55 Fe-HFt при 37 ° C в течение 2 часов. Клетки промывали 3 раза PBS и затем меняли на нормальную среду для роста. Лизаты клеток получали через 0, 2, 4, 8, 24, 48 часов, и биотин- 55 Fe-HFt осаждали инкубацией с гранулами, конъюгированными со стрептавидином. Экстракты, лишенные экзогенного биотинилированного ферритина после инкубации с гранулами стрептавидина, использовали для оценки эндогенного HFt. А . 55 Fe в биотинилированном HFt и клеточная фракция, обедненная биотинилированным HFt. Показаны средние значения и стандартные отклонения трех определений. Б . Биотинилированный HFt и эндогенный ферритин обнаруживали вестерн-блоттингом. GAPDH использовался в качестве контроля загрузки.
https://doi.org/10.1371/journal.pone.0023800.g007
Discussion
Ранее мы продемонстрировали, что TIM-2 служит специфическим рецептором HFt в клетках мыши [22].Представленные здесь результаты демонстрируют, что железо, связанное с HFt, может служить источником клеточного железа в В-клетках мыши или в клетках почек мыши, которые экспрессируют TIM-2. После поглощения TIM-2-положительными клетками HFt переходит в эндосомы и впоследствии попадает в лизосомы (рис. 5). Этот путь отличается от классического пути доставки железа, включающего опосредованное трансферрином поглощение железа через TfR1, при котором трансферрин рециркулирует на поверхность клетки после высвобождения железа в эндосоме. Тем не менее, железо, высвобождаемое из ферритина, попадает в метаболически доступный пул и способно активировать синтез эндогенного ферритина (рис.7).
Наша работа согласуется с другими сообщениями, демонстрирующими как способность ферритина проникать в лизосомы, так и служить источником железа. Например, недавняя работа показала, что хелатирование железа может индуцировать проникновение цитозольного ферритина в лизосомы, где он подвергается деградации [38]. Обработка клеток катионным ферритином аналогичным образом приводила к доставке ферритина в лизосомы, высвобождению железа и индукции цитозольного синтеза ферритина [37]. В клетках человека TfR1 служит рецептором для HFt [25] и может функционально замещать TIM-2 [22].Рецептор-опосредованное поглощение HFt аналогичным образом направляет ферритин в лизосомы в этих клетках [25]. В совокупности эти результаты предполагают существование механизма перемещения железа из лизосомы в цитозоль. Кандидаты в транспортные механизмы, которые могут опосредовать отток железа из лизосом, были недавно идентифицированы [39], [40].
Взаимосвязь между TIM2 и Scara5, др. Недавно идентифицированным рецептором ферритина, который участвует в доставке железа во время развития [24], неясно.В отличие от TIM-2, который избирательно связывает HFt, Scara5 связывает LFt. Подобно нашим результатам с TIM-2, Scara5 опосредует эндоцитоз ферритина и последующую доставку железа в клетки. Было высказано предположение, что Scara5 может функционально замещать TfR1 в выбранных тканях почек во время развития [24]. Связь между экспрессией Scara5 и TIM-2 не исследовалась. У развивающихся мышей Scara5 экспрессируется в стромальных и капсульных клетках почек, а также в дыхательных путях, развивая аорту, мышечные пучки и эпителий гонад [24]; у взрослых мышей Scara5 экспрессируется в эпителиальных клетках семенников, мочевого пузыря, трахеи, надпочечников, кожи, легких и яичников [41].Это пространственное распределение демонстрирует небольшое перекрытие с TIM-2, который экспрессируется во взрослых B-клетках, эпителиальных клетках желчных протоков, почечных канальцах и олигодендроцитах, что позволяет предположить, что у взрослых паттерны экспрессии этих рецепторов ферритина в значительной степени независимы. Однако потребуется дальнейшая работа, чтобы определить, проявляют ли Scara5 и TIM-2 какие-либо временные или функциональные отношения.
Остается определить, вносит ли путь TIM-2 существенный вклад в импорт железа.Наши результаты показывают, что TIM-2 может опосредовать поглощение ферритина и связанного с ним железа; однако количество железа, доставляемого в клетки по этому пути, будет зависеть от содержания железа в ферритине, которое может варьироваться более чем на 2 порядка [42].
Возможно, что содержание железа в ферритине может влиять на окончательный клеточный эффект TIM-2. Например, ферритин проявляет иммуносупрессивные эффекты, подавляя пролиферацию Т- и В-клеток и дифференцировку миелоидных клеток [9], [11], [43], [44].Поскольку лимфоциты экспрессируют TIM-2, было высказано предположение, что этот антипролиферативный эффект ферритина может быть опосредован через TIM-2 [44]. Мы предполагаем, что если ферритин содержит мало железа или совсем не содержит железа, он может служить сигнальной молекулой, вызывающей такие антипролиферативные или апоптотические [45] эффекты. В качестве альтернативы, если связанный с рецептором ферритин содержит железо, он может служить источником железа для поддержки пролиферации клеток. Ранее предполагалось, что доставка железа через ферритин происходит в развивающейся почке [24], а также в опосредованной макрофагами доставке железа, связанного с ферритином, к предшественникам эритроидов [16].Наши результаты показывают, что TIM-2 может функционировать как механизм доставки железа, но для выяснения обстоятельств, при которых этот механизм активируется, потребуются дальнейшие исследования.
Хотя специфическое связывание ферритина с поверхностью клеток неоднократно подтверждалось документально [21], [46], [47], [48], [49], [50], источник ферритина, который связывается с TIM-2 и другим ферритином рецепторы in vivo остаются неизвестными. В наших экспериментах клетки подвергались воздействию 4 нМ ферритина, что находится в пределах диапазона, обнаруженного в сыворотке крови пациентов с перегрузкой железом и другими воспалительными состояниями, такими как болезнь Стилла, гемофагоцитарный синдром и т. Д.[51]. Однако большинство субъединиц ферритина сыворотки больше похоже на ферритин L, чем на ферритин H [52], [53], и, поскольку TIM-2 предпочтительно связывает HFt, неясно, является ли ферритин сыворотки вероятным источником ферритинового лиганда для TIM. -2. Тем не менее, ферритин представляет собой белок из 24 субъединиц, и большинство природных ферритинов являются гетерополимерами как H, так и L-субъединиц. Поскольку количество субъединиц H, необходимых для эффективного связывания TIM-2, еще не определено, белки ферритина, которые содержат преобладающее количество субъединиц L, могут, тем не менее, связываться с TIM-2.Кроме того, в сыворотке присутствует небольшое количество ферритина, богатого субъединицами H, и его количество может увеличиваться при определенных патологических состояниях [53], [54]. Альтернативный потенциальный источник ферритина — местная секреция. Например, макрофаг, который может служить источником циркулирующего ферритина [53], также может секретировать ферритин локально [16], [55], и это может служить паракринным источником ферритина для поглощения TIM-2. Действительно, HFt был идентифицирован как растворимый лиганд, секретируемый линиями клеток макрофагов во время клонирования TIM-2 [22].HFt также выделяется гепатоцитами [45]. Дальнейшие исследования потребуются для отслеживания физиологического источника лиганда HFt.
Наши результаты показывают, что экспрессия TIM-2 не увеличивается хелатированием железа (рис. 4). Это отличает TIM-2 от других путей захвата железа. Например, TfR1, который обеспечивает Tf-зависимое поглощение железа, и DMT-1, который обеспечивает транспорт двухвалентного железа, посттранскрипционно регулируются статусом железа [4]. Для этих транспортеров регуляция опосредуется элементами IRE на 3′-конце мРНК.Наша проверка последовательности не выявила очевидных элементов-кандидатов IRE в последовательности TIM-2. Однако, поскольку элементы IRE могут демонстрировать существенное расхождение в первичной последовательности [56], мы не можем исключить наличие неканонического элемента IRE в TIM-2. Отсутствие ответа TIM-2 на хелатирование железа, которое мы наблюдали, отличается от наблюдений на олигоденодроцитах, в которых экспрессия TIM-2, как сообщается, регулируется железом [23]. Олигодендроциты не имеют TfR1, который опосредует захват железа [23], могут сильно зависеть от пути TIM-2 и могут иметь альтернативные механизмы регуляции, не обнаруженные в других типах клеток.Напротив, в клетках A20 захват железа опосредуется двумя путями: классическим путем TfR1 [57] и путем TIM-2, описанным здесь. Возможно, что несвязанная регуляция TfR1 и TIM-2 может допускать дифференциальную активацию этих путей. Например, в клетках A20 (и других клетках, которые экспрессируют как TfR1, так и TIM-2) TIM-2 может служить резервным путем, который может реагировать на изменения HFt в окружающей среде независимо от статуса клеточного железа.
Благодарности
Мы благодарим Кена Гранта и основной центр микроскопии онкологического центра Университета Уэйк-Форест за помощь с электронной микроскопией.
Вклад авторов
Задумал и спроектировал эксперименты: SVT WES FMT. Проведены эксперименты: JH XD WW. Проанализированы данные: MW. Предоставленные реагенты / материалы / инструменты анализа: WES. Написал статью: JH SVT FMT WES.
Ссылки
- 1. Torti FM, Torti SV (2002) Регулирование генов ферритина и белка. Кровь 99: 3505–3516.
- 2. Arosio P, Ingrassia R, Cavadini P (2009) Ферритины: семейство молекул для хранения железа, антиокисления и многого другого.Biochim Biophys Acta 1790: 589–599.
- 3. Клегг Г.А., Фиттон Дж. Э., Харрисон П. М., Треффри А. (1980) Ферритин: молекулярная структура и механизмы хранения железа. Prog Biophys Mol Biol 36: 56–86.
- 4. Rouault TA (2006) Роль белков, регулирующих железо, в гомеостазе железа и заболеваниях млекопитающих. Nat Chem Biol 2: 406–414.
- 5. Muckenthaler MU, Galy B, Hentze MW (2008) Системный гомеостаз железа и регуляторная сеть железо-чувствительного элемента / железо-регуляторного белка (IRE / IRP).Анну Рев Нутр 28: 197–213.
- 6. Torti SV, Torti FM (1994) Железо и ферритин при воспалении и раке. Adv Inorg Biochem 10: 119–137.
- 7. Konijn AM, Carmel N, Levy R, Hershko C (1981) Синтез ферритина при воспалении. II. Механизм повышенного синтеза ферритина. Br J Haematol 49: 361–370.
- 8. Arad I, Konijn AM, Linder N, Goldstein M, Kaufmann NA (1988) Уровни ферритина в сыворотке у недоношенных детей после нескольких переливаний крови.Am J Perinatol 5: 40–43.
- 9. Gray CP, Franco AV, Arosio P, Hersey P (2001) Иммуносупрессивные эффекты ферритина тяжелой цепи, полученного из меланомы, зависят от стимуляции выработки IL-10. Int J Cancer 92: 843–850.
- 10. Fargion S, Fracanzani AL, Cislaghi V, Levi S, Cappellini MD, et al. (1991) Характеристики мембранного рецептора H-ферритина человека. Переливание гематоловой крови Curr Stud. С. 164–170.
- 11. Мацнер Ю., Хершко С., Поллиак А., Конийн А. М., Изак Г. (1979) Подавляющее действие ферритина на функцию лимфоцитов in vitro.Br J Haematol 42: 345–353.
- 12. Li R, Luo C, Mines M, Zhang J, Fan GH (2006) Chemokine CXCL12 индуцирует связывание тяжелой цепи ферритина с хемокиновым рецептором CXCR4, изменяет передачу сигналов CXCR4 и индуцирует фосфорилирование и ядерную транслокацию тяжелой цепи ферритина. J Biol Chem 281: 37616–37627.
- 13. Ruddell RG, Hoang-Le D, Barwood JM, Rutherford PS, Piva TJ, et al. (2009) Ферритин действует как провоспалительный цитокин посредством регулируемой железо-независимой протеинкиназой C zeta / ядерного фактора kappaB передачи сигналов в звездчатых клетках печени крыс.Гепатология 49: 887–900.
- 14. Коффман Л.Г., Парсонейдж Д., Д’Агостино Р., Торти FM, Торти С.В. (2009) Регулирующие эффекты ферритина на ангиогенез. Proc Natl Acad Sci U S A 106: 570–575.
- 15. Sibille JC, Kondo H, Aisen P (1988) Взаимодействие между изолированными гепатоцитами и клетками Купфера в метаболизме железа: возможная роль ферритина как белка-носителя железа. Гепатология 8: 296–301.
- 16. Leimberg MJ, Prus E, Konijn AM, Fibach E (2008) Макрофаги функционируют как источник железа ферритина для культивируемых предшественников эритроидов человека.J Cell Biochem 103: 1211–1218.
- 17. Adams PC, Powell LW, Halliday JW (1988) Выделение рецептора ферритина печени человека. Гепатология 8: 719–721.
- 18. Moss D, Powell LW, Arosio P, Halliday JW (1992) Эффект пролиферации клеток на экспрессию рецептора H-ферритина в Т-лимфоидных (MOLT-4) клетках человека. J Lab Clin Med 120: 239–243.
- 19. Таками М., Мизумото К., Касуя И., Кино К., Суссман Х. Х. и др. (1986) Плацентарный рецептор ферритина человека.Biochim Biophys Acta 884: 31–38.
- 20. Hulet SW, Menzies S, Connor JR (2002) Связывание ферритина в развивающемся мозге мыши следует паттерну, аналогичному миелинизации, и на него не влияет мутация jimpy. Dev Neurosci 24: 208–213.
- 21. Hulet SW, Hess EJ, Debinski W, Arosio P, Bruce K и др. (1999) Характеристика и распределение сайтов связывания ферритина в мозге взрослых мышей. J Neurochem 72: 868–874.
- 22. Чен Т.Т., Ли Л., Чунг Д.Х., Аллен С.Д., Торти С.В. и др.(2005) TIM-2 экспрессируется на B-клетках, в печени и почках и является рецептором эндоцитоза H-ферритина. J Exp Med 202: 955–965.
- 23. Todorich B, Zhang X, Slagle-Webb B, Seaman WE, Connor JR (2008) Tim-2 является рецептором H-ферритина на олигодендроцитах. J Neurochem 107: 1495–1505.
- 24. Ли Дж.Й., Парагас Н., Нед Р.М., Цю А., Вилтард М. и др. (2009) Scara5 представляет собой рецептор ферритина, опосредующий доставку железа без трансферрина. Dev Cell 16: 35–46.
- 25.Ли Л., Фанг С.Дж., Райан Дж.С., Ниеми Е.К., Леброн Дж. А. и др. (2010) Связывание и захват H-ферритина опосредуются рецептором трансферрина-1 человека. Proc Natl Acad Sci U S A 107: 3505–3510.
- 26. Kuchroo VK, Umetsu DT, DeKruyff RH, Freeman GJ (2003) Семейство генов TIM: новые роли в иммунитете и болезнях. Nat Rev Immunol 3: 454–462.
- 27. Родригес-Мансанет Р., ДеКрюфф Р., Кучро В.К., Умецу Д.Т. (2009) Костимулирующая роль молекул ТИМ.Immunol Rev 229: 259–270.
- 28. Rennert PD, Ichimura T., Sizing ID, Bailly V, Li Z, et al. (2006) Т-клетки, домен Ig, мыши с дефицитом гена муцина-домена-2 обнаруживают новый механизм регуляции иммунных ответов Th3 и воспаления дыхательных путей. J Immunol 177: 4311–4321.
- 29. Knickelbein JE, de Souza AJ, Tosti R, Narayan P, Kane LP (2006) Передний край: ингибирование активации Т-клеток с помощью TIM-2. J Immunol 177: 4966–4970.
- 30. Ватанабе Н., Танака М., Судзуки К., Куманого А., Кикутани Н. и др.(2007) Tim2 экспрессируется в гепатоцитах плода мышей и регулирует их дифференцировку. Гепатология 45: 1240–1249.
- 31. Rucker P, Torti FM, Torti SV (1997) Рекомбинантный ферритин: модуляция стехиометрии субъединиц в бактериальных системах экспрессии. Protein Eng 10: 967–973.
- 32. Santambrogio P, Levi S, Cozzi A, Rovida E, Albertini A и др. (1993) Производство и характеристика рекомбинантных гетерополимеров H- и L-цепей ферритина человека. J Biol Chem 268: 12744–12748.
- 33. Леви С., Луцзаго А., Чезарени Дж., Коцци А., Франческинелли Ф. и др. (1988) Механизм поглощения железа ферритином: активность H-цепи и делеционное картирование сайта феррооксидазы. Исследование поглощения железа и феррооксидазной активности печени человека, рекомбинантных ферритинов H-цепи и двух мутантов с делецией H-цепи. J Biol Chem 263: 18086–18092.
- 34. Fish WW (1980) Быстрый колориметрический микрометод для количественного определения комплексного железа в биологических образцах.Методы в энзимологии 158: 357–365.
- 35. Wang W, Di X, D’Agostino RB, Torti SV, Torti FM (2007) Избыточная емкость системы белков, регулирующих железо. J Biol Chem 282: 24650–24659.
- 36. Aisen P, Enns C, Wessling-Resnick M (2001) Химия и биология метаболизма железа в эукариотах. Int J Biochem Cell Biol 33: 940–959.
- 37. Radisky DC, Kaplan J (1998) Железо в цитозольном ферритине может быть переработано через лизосомную деградацию в человеческих фибробластах.Biochem J 336 (Pt 1): 201–205.
- 38. Де Доменико I, Уорд Д.М., Каплан Дж. (2009) Конкретные хелаторы железа определяют путь разложения ферритина. Кровь 114: 4546–4551.
- 39. Донг XP, Ченг X, Миллс Э., Деллинг М., Ван Ф. и др. (2008) Связанный с муколипидозом тип IV белок TRPML1 является эндолизосомным каналом высвобождения железа. Nature 455: 992–996.
- 40. Соэ-Лин С., Апте СС, Андриопулос Б., Эндрюс М.С., Шранцхофер М. и др.(2009) Nramp1 способствует эффективному рециклированию железа макрофагами после эритрофагоцитоза in vivo. Proc Natl Acad Sci U S A 106: 5960–5965.
- 41. Jiang Y, Oliver P, Davies KE, Platt N (2006) Идентификация и характеристика мышиного SCARA5, нового рецептора мусорщика класса A, который экспрессируется популяциями эпителиальных клеток. J Biol Chem 281: 11834–11845.
- 42. Честин Н.Д., Харрисон П.М. (1999) Минерализация ферритина: эффективное средство хранения железа.J Struct Biol 126: 182–194.
- 43. Broxmeyer HE, Williams DE, Geissler K, Hangoc G, Cooper S и др. (1989) Подавляющие эффекты in vivo очищенного рекомбинантного человеческого H-субъединицы (кислого) ферритина на миелопоэз мышей. Кровь 73: 74–79.
- 44. Recalcati S, Invernizzi P, Arosio P, Cairo G (2008) Новые функции для белка хранения железа: роль ферритина в иммунитете и аутоиммунитете. J Autoimmun 30: 84–89.
- 45. Бресген Н., Оленшлагер I, Фидлер Б., Вахт Н., Зак С. и др.(2007) Ферритин — медиатор апоптоза? J Cell Physiol 212: 157–164.
- 46. Мейрон-Хольц Э.Г., Вайсман Б., Кабанчик З.И., Фибах Э., Руо Т.А. и др. (1999) Регулирование внутриклеточного метаболизма железа в предшественниках эритроидов человека с помощью интернализованного внеклеточного ферритина. Кровь 94: 3205–3211.
- 47. Mack U, Powell LW, Halliday JW (1983) Обнаружение и выделение рецептора печеночной мембраны для ферритина. J Biol Chem 258: 4672–4675.
- 48.Ramm GA, Britton RS, O’Neill R, Bacon BR (1994) Идентификация и характеристика рецептора тканевого ферритина на активированных липоцитах крысы. Дж. Клин Инвест 94: 9–15.
- 49. Андерсон Г.Дж., Фолк В.П., Аросио П., Мосс Д., Пауэлл Л.В. и др. (1989) Идентификация сайтов связывания субъединиц H- и L-ферритина на Т- и В-лимфоидных клетках человека. Br J Haematol 73: 260–264.
- 50. Fargion S, Arosio P, Fracanzani AL, Cislaghi V, Levi S и др. (1988) Характеристики и экспрессия сайтов связывания, специфичных для H-цепи ферритина, на линиях клеток человека.Кровь 71: 753–757.
- 51. Кнович М.А., Стори Дж. А., Коффман Л.Г., Торти С.В., Торти FM (2009) Ферритин для клинициста. Кровь Откровение 23: 95–104.
- 52. Santambrogio P, Cozzi A, Levi S, Arosio P (1987) G-пептид ферритина сыворотки человека распознается антителами к субъединице L-ферритина и конканавалином-A. Br J Haematol 65: 235–237.
- 53. Коэн Л.А., Гутьеррес Л., Вайс А., Лейхтманн-Бардуого Ю., Чжан Д.Л. и др. (2010) Сывороточный ферритин поступает в основном из макрофагов неклассическим секреторным путем.Кровь.
- 54. Cazzola M, Arosio P, Bellotti V, Bergamaschi G, Dezza L и др. (1985) Иммунологическая реактивность сывороточного ферритина у пациентов со злокачественными новообразованиями. Тумори 71: 547–554.
- 55. Юань XM, Li W, Baird SK, Carlsson M, Melefors O (2004) Секреция ферритина железными макрофагами и влияние липопротеинов. Free Radic Res 38: 1133–1142.
- 56. dos Santos CO, Dore LC, Valentine E, Shelat SG, Hardison RC и др. (2008) Железо-чувствительный элемент, подобный стебле-петле, регулирует мРНК альфа-гемоглобин-стабилизирующего белка.J Biol Chem 283: 26956–26964.
- 57. Барабанова Ю.А., Кан Х.К., Мён Дж., Кан Б., Бишоп Г.А. и др. (2004) Роль трансмембранной области класса II главного комплекса гистосовместимости в презентации антигена и внутриклеточном перемещении. Иммунология 111: 165–172.
Управляемый рост двумерных микроструктур перовскита
Двумерные (2D) перовскиты Раддлесдена – Поппера с высокой энергией связи экситонов и высокой устойчивостью к окружающей среде недавно привлекли большое внимание в связи с их многообещающим потенциалом для оптоэлектронных приложений.Контролируемый рост двумерных перовскитов желаемой формы будет иметь решающее значение для улучшения характеристик оптоэлектронных устройств на основе двумерных перовскитов. Однако расследование по этому поводу все еще находится в зачаточном состоянии. Здесь мы сообщаем об управляемом синтезе 2D (C 4 H 9 NH 3 ) 2 PbI 4 микроструктур в форме бабочки, (C 4 H 9 NH 3 ) 2 (CH 3 NH 3 ) Pb I C 4 H 9 NH 3 ) 2 PbI 4 / (C 4 H NH ) 2 (CH 3 NH 3 ) Pb 2 I 7 микроструктуры квадратной формы, полученные методом обработки раствора.Мы систематически исследовали влияние подложки, массового соотношения и температуры кристаллизации на эволюцию морфологии микроструктур 2D перовскита в исходном состоянии. Изображения с помощью атомно-силовой микроскопии (АСМ) и оптической микроскопии (ОМ) показывают, что размер и толщина полученных продуктов положительно коррелируют с их соотношением масс и отрицательно коррелируют с их температурой кристаллизации. Картины дифракции рентгеновских лучей (XRD), флуоресцентные изображения, температурно-зависимая фотолюминесценция (PL) и исследования поглощения подтверждают кристаллические структуры и оптические свойства синтезированных двумерных микроструктур перовскита правильной формы.Наши исследования обеспечивают простой метод управляемого синтеза двумерных микроструктур перовскита без использования очень токсичных растворителей и, таким образом, предлагают платформу для исследования оптических свойств и свойств переноса заряда двумерных перовскитных материалов для дальнейшего проектирования новых архитектур устройств с улучшенными характеристиками.
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент… Что-то пошло не так. Попробуй еще раз?Пористый металлорганический каркас на основе меди (ii) для эффективного и быстрого улавливания токсичных оксоанионных загрязнителей из воды
Эффективное и селективное улавливание токсичных оксоанионов очень желательно для экологического извлечения и удаления опасных отходов.Это остается важной задачей и привлекло значительное внимание ученых из-за их вредного воздействия на экосистему и здоровье человека. Здесь пористый катионный металлорганический каркас (MOF), а именно [Cu 3 Cl (L) (H 2 O) 2 ] · Cl · 4DMA · 8H 2 O ( 1 ), был синтезирован (H 4 L = 1,4,8,11-тетразациклотетрадекан- N , N ′, N ′ ′, N ′ ′ ‘-Тетраметилен-коричная кислота и DMA = N , N ‘ -диметилацетамид). 1 показывает высокую стабильность в водном растворе и представляет собой выдающийся пример, который способен эффективно улавливать экологически токсичный Cr 2 O 7 2- и MnO 4 анионы. Кроме того, удаление анионов Cr 2 O 7 2- и MnO 4 — из воды также было исследовано в присутствии других конкурирующих анионов.
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент… Что-то пошло не так. Попробуй еще раз?Произошла ошибка при настройке вашего пользовательского файла cookie
Произошла ошибка при настройке вашего пользовательского файла cookieЭтот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
.

 Во-вторых, если пациент принимает (на постоянной основе или только в данный момент) какие-либо лекарственные препараты, то об этом необходимо заблаговременно сообщить врачу. Некоторые медикаменты могут искажать результаты, из-за чего их приём может быть приостановлен и восстановлен после сдачи крови. В третьих, накануне процедуры не стоит посещать спортивные или тренажёрные залы. Также стоит воздержаться от сильных физических нагрузок и избегать эмоциональных стрессов.
Во-вторых, если пациент принимает (на постоянной основе или только в данный момент) какие-либо лекарственные препараты, то об этом необходимо заблаговременно сообщить врачу. Некоторые медикаменты могут искажать результаты, из-за чего их приём может быть приостановлен и восстановлен после сдачи крови. В третьих, накануне процедуры не стоит посещать спортивные или тренажёрные залы. Также стоит воздержаться от сильных физических нагрузок и избегать эмоциональных стрессов.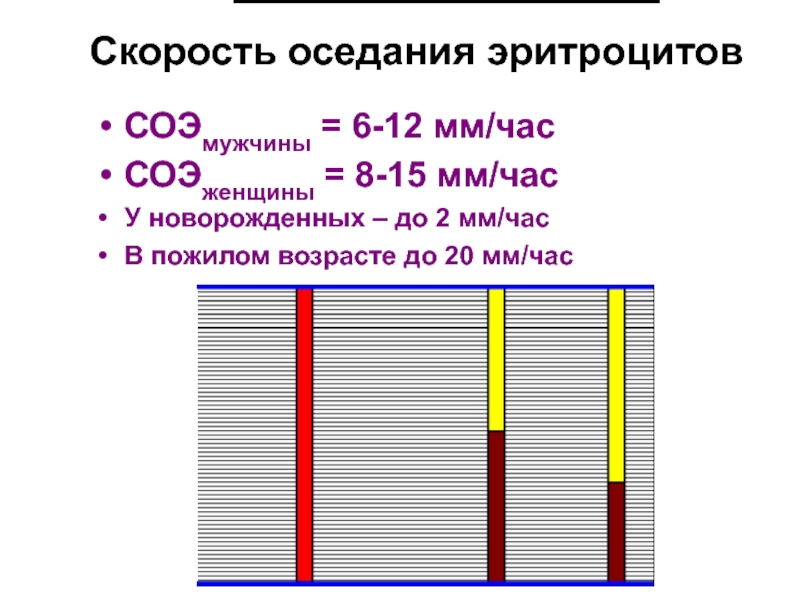 Исследование осуществляется в пробирках, оснащённых шкалой в 200 мм. Результат оценивается через 60 минут. Эта методика используется повсеместно, а ее принципиальной отличительной чертой является тип применяемых пробирок и мерной шкалы.
Исследование осуществляется в пробирках, оснащённых шкалой в 200 мм. Результат оценивается через 60 минут. Эта методика используется повсеместно, а ее принципиальной отличительной чертой является тип применяемых пробирок и мерной шкалы. Также это возникает при приёме ряда лекарственных веществ, поэтому нужно заранее проконсультироваться с врачом.
Также это возникает при приёме ряда лекарственных веществ, поэтому нужно заранее проконсультироваться с врачом.